Мыши, у которых вырабатываются связывающие белки, содержащие vl-домены - RU2612903C2
Код документа: RU2612903C2
Чертежи








Описание
ОБЛАСТЬ ТЕХНИКИ
Предоставляются подобные иммуноглобулинам белки, включающие константную область тяжелой цепи иммуноглобулина, слитую с вариабельным доменом легкой цепи иммуноглобулина, а также связывающие белки, содержащие вариабельный домен легкой цепи иммуноглобулина, слитый с константным доменом легкой цепи, и вариабельный домен легкой цепи иммуноглобулина, слитый с константным доменом тяжелой цепи. Также предоставляются клетки, экспрессирующие такие связывающие белки, мыши, у которых они вырабатываются, и имеющие к ним отношение способы и композиции.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Антитела обычно включают тетрамерную структуру, содержащую две идентичные тяжелые цепи, каждая из которых включает константную область тяжелой цепи (CH), слитую с вариабельным доменом тяжелой цепи (VH), и объединена с константной областью легкой цепи (CL), слитой с вариабельным доменом легкой цепи (VL). В случае типичного IgG человека размер молекулы антитела составляет от приблизительно 150 кДа до приблизительно 170 кДа (например, в случае IgG3, который включает более длинную шарнирную область), в зависимости от субкласса IgG (например, IgG1, IgG3, IgG4) и (варьирующей) длины вариабельной области.
В типичном антителе VH- и VL-домены объединяются с образованием сайта связывания, который связывает антиген-мишень.
По этой причине свойства антитела, касающиеся аффинности и специфичности, могут в значительной степени зависеть от характеристик VH- и VL-доменов. В типичных антителах у людей и у мышей VH-домены соединяются в пары с VL-доменами или λ, или κ. Однако также известно, что можно создать VL-домены, которые специфически связывают антиген-мишень в отсутствие когнатного VH-домена (например, VH-домена, который в природе представлен в рамках антитела и объединяется с конкретным VL-доменом), и что можно выделить VH-домены, которые специфически связывают антиген-мишень в отсутствие когнатного VL-домена. Таким образом, значительное разнообразие связывающих белков на основе иммуноглобулинов предоставляет, как правило, рекомбинация, приводящая к конкретному VH или VL (и соматической гипермутации, если она происходит), а также комбинация пары когнатных VH/VL-доменов. Была бы целесообразной разработка композиций и способов, в которых используются другие источники разнообразия.
В данной области техники существует необходимость в связывающих белках на основе структур иммуноглобулинов, включая вариабельные области иммуноглобулинов, такие как вариабельные области легких цепей, и включая связывающие белки, которые демонстрируют расширенное разнообразие по сравнению с традиционными антителами. Также существует необходимость в дополнительных способах и животных для выработки полезных связывающих белков, включая связывающие белки, которые включают разнообразные последовательности вариабельных областей легких цепей иммуноглобулинов. Также необходимы пригодные формы связывающих белков на основе иммуноглобулинов, которые обеспечивают расширенное многообразие связывающих белков, из которых выбирают, и расширенное многообразие вариабельных доменов иммуноглобулинов, в том числе композиции и способы для создания соматически мутированных и клонально отобранных вариабельных доменов иммуноглобулинов для использования, например, для создания терапевтических средств для человека.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте описываются связывающие белки, которые включают вариабельные домены иммуноглобулинов, которые происходят от вариабельных доменов легких цепей (т.е. каппа (κ) и/или лямбда (λ)) иммуноглобулинов, но не из вариабельных доменов тяжелых цепей полноразмерных иммуноглобулинов. Также предоставляются способы и композиции для выработки связывающих белков, включающие генетически модифицированных мышей.
В одном аспекте предоставляются конструкции нуклеиновых кислот, клетки, эмбрионы, мыши и способы для выработки белков, которые включают одну или более последовательностей вариабельных областей легких цепей κ и/или λ иммуноглобулинов и последовательность константной области тяжелой цепи иммуноглобулина, включая белки, которые включают вариабельный домен легкой λ или κ человека и последовательность константной области тяжелой цепи человека или мыши.
В одном аспекте предоставляется мышь, содержащая кодирующий тяжелую цепь иммуноглобулина локус, включающий замену одного или более генных сегментов «variable region» (VH), генных сегментов «diversity» тяжелой цепи (DH) и генных сегментов «joining» тяжелой цепи (JH) в эндогенном мышином локусе, кодирующем тяжелые цепи, одним или более генными сегментами вариабельной области легкой цепи (VL) и одним или более генными сегментами «joining region» легкой цепи (JL).
В одном аспекте предоставляется мышь, содержащая кодирующий тяжелые цепи иммуноглобулинов локус, включающий замену всех или по существу всех генных сегментов VH, DH и JH одним или более генных сегментов VL и одним или более генных сегментов JL для образования последовательности генного сегмента VL в эндогенном локусе, кодирующем тяжелые цепи (VLH-локусе), причем VLH-локус способен к рекомбинированию с эндогенным геном CH мыши с образованием реаранжированного гена, который происходит от генного сегмента VL, генного сегмента JL и эндогенного гена CHмыши.
В одном варианте осуществления сегменты VL являются человеческими сегментами VL. В одном варианте осуществления сегменты JL являются человеческими сегментами JL. В конкретном варианте осуществления сегменты VL и JLявляются человеческими VL- и JL-сегментами.
В одном варианте осуществления все или по существу все генные сегменты VH, DH и JH заменены по меньшей мере шестью генными сегментами Vκ человека и по меньшей мере одним генным сегментом Jκ. В одном варианте осуществления все или по существу все генные сегменты VH, DH и JH заменены по меньшей мере 16 генными сегментами Vκ человека (Vκ человека) и по меньшей мере одним генным сегментом Jκ. В одном варианте осуществления все или по существу все генные сегменты VH, DH и JH заменены по меньшей мере 30 генными сегментами Vκ человека и по меньшей мере одним генным сегментом Jκ. В одном варианте осуществления все или по существу все генные сегменты VH, DH и JH заменены по меньшей мере 40 генными сегментами Vκ человека и по меньшей мере одним генным сегментом Jκ. В одном варианте осуществления по меньшей мере один генный сегмент Jκ включает два, три, четыре или пять генных сегментов Jκ человека.
В одном варианте осуществления VL-сегменты являются Vκ-сегментами человека. В одном варианте осуществления сегменты Vκ человека включают 4-1, 5-2, 7-3, 2-4, 1-5 и 1-6. В одном варианте осуществления Vκ-сегменты включают 3-7, 1-8, 1-9, 2-10, 3-11, 1-12, 1-13, 2-14, 3-15, 1-16. В одном варианте осуществления Vκ-сегменты человека включают 1-17, 2-18, 2-19, 3-20, 6-21, 1-22, 1-23, 2-24, 3-25, 2-26, 1-27, 2-28, 2-29 и 2-30. В одном варианте осуществления Vκ-сегменты человека включают 3-31, 1-32, 1-33, 3-34, 1-35, 2-36, 1-37, 2-38, 1-39 и 2-40.
В одном варианте осуществления VL-сегменты являются Vκ-сегментами человека и включают 4-1, 5-2, 7-3, 2-4, 1-5, 1-6, 3-7, 1-8, 1-9, 2-10, 3-11, 1-12, 1-13, 2-14, 3-15 и 1-16. В одном варианте осуществления Vκ-сегменты, кроме того, включают 1-17, 2-18, 2-19, 3-20, 6-21, 1-22, 1-23, 2-24, 3-25, 2-26, 1-27, 2-28, 2-29 и 2-30. В одном варианте осуществления Vκ-сегменты, кроме того, включают 3-31, 1-32, 1-33, 3-34, 1-35, 2-36, 1-37, 2-38, 1-39 и 2-40.
В одном варианте осуществления VL-сегменты являются Vλ-сегментами человека и включают фрагмент кластера A локуса, кодирующего легкие цепи λ человека. В конкретном варианте осуществления фрагмент кластера A локуса, кодирующего легкие цепи λ человека, простирается от hVλ3-27 до hVλ3-1 включительно.
В одном варианте осуществления VL-сегменты включают фрагмент кластера В локуса, кодирующего легкие цепи λ человека. В конкретном варианте осуществления фрагмент кластера В локуса, кодирующего легкие цепи λ человека, простирается от hVλ5-52 до hVλ1-40 включительно.
В одном варианте осуществления VL-сегменты включают последовательность для вариабельной области легкой цепи λ человека, которая включает геномный фрагмент кластера А и геномный фрагмент кластера B. В одном варианте осуществления последовательность для вариабельной области легкой цепи λ человека включает по меньшей мере один генный сегмент кластера A и по меньшей мере один генный сегмент кластера B.
В одном варианте осуществления сегменты VLвключают по меньшей мере один генный сегмент кластера B и по меньшей мере один генный сегмент кластера C.
В одном варианте осуществления VL-сегменты включают hVλ 3-1, 4-3, 2-8, 3-9, 3-10, 2-11 и 3-12. В конкретном варианте осуществления VL-сегменты включают непрерывную последовательность локуса, кодирующего легкие цепи λ, которая простирается от Vλ3-12 до Vλ3-1. В одном варианте осуществления непрерывная последовательность включает по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 hVλ. В конкретном варианте осуществления hVλ включают 3-1, 4-3, 2-8, 3-9, 3-10, 2-11 и 3-12. В конкретном варианте осуществления hVλ включают непрерывную последовательность локуса, кодирующего легкие цепи λ, которая простирается от Vλ3-12 до Vλ3-1.
В одном варианте осуществления hVλ включают 13-28 или более hVλ. В конкретном варианте осуществления hVλ включают 2-14, 3-16, 2-18, 3-19, 3-21, 3-22, 2-23, 3-25 и 3-27. В конкретном варианте осуществления hVλ включают непрерывную последовательность локуса, кодирующего легкие цепи λ, которая простирается от Vλ3-27 до Vλ3-1.
В одном варианте осуществления VL-сегменты включают 29-40 hVλ. В конкретном варианте осуществления VL-сегментывключают непрерывную последовательность локуса, кодирующего легкие цепи λ, которая простирается от Vλ3-29 до Vλ3-1, и непрерывную последовательность локуса, кодирующего легкие цепи λ, которая простирается от Vλ5-52 до Vλ1-40. В конкретном варианте осуществления все или по существу все последовательности между hVλ1-40 и hVλ3-29 у генетически модифицированной мыши по существу состоят из последовательности для λ человека размером приблизительно 959 п.о., обнаруживаемой в природе (например, в популяции людей), расположенной 3’ от генного сегмента hVλ1-40 (3’ от 3’ нетранслируемого участка), рестрикционного сайта (например, PI-SceI), за которым следует последовательность для λ человека размером приблизительно 3431 п.о., расположенная 5’ от генного сегмента hVλ3-29, обнаруживаемая в природе.
В одном варианте осуществления Jκ является Jκ человека и выбирается из группы, состоящей из Jκ1, Jκ2, Jκ3, Jκ4, Jκ5 и их комбинации. В конкретном варианте осуществления Jκ включает с Jκ1 до Jκ5 включительно.
В одном варианте осуществления VL-сегменты являются Vλ-сегментами человека, а генный сегмент Jκ включает RSS со спейсером из 12 п.о., причем RSS располагается непосредственно на 5’-конце генного сегмента Jκ. В одном варианте осуществления генные сегменты VLявляются Vλ человека, и VLH-локус включает два или более генных сегментов Jκ, при этом каждый из них включает RSS со спейсером из 12 п.о., причем RSS располагается непосредственно на 5’-конце каждого генного сегмента Jκ.
В конкретном варианте осуществления VL-сегментывключают следующие друг за другом генные сегменты κ человека, охватывающие локус κ человека от Vκ4-1 до Vκ2-40 включительно, а сегменты JL включают следующие друг за другом генные сегменты, охватывающие локус κ человека от Jκ1 до Jκ5 включительно.
В одном варианте осуществления, в котором VL-сегментами являются Vλ-сегменты, и между VL-сегментами и J-сегментами не присутствует DH-сегмент, VL-сегменты фланкированы 3’ (т.е. соседствуют с 3’-конца с) имеющей спейсер из 23 п.о. RSS, а Jκ-сегменты, в случае их присутствия, или Jλ-фрагменты, в случае их присутствия, фланкированы 5’ (т.е. соседствуют с 5’-конца с) имеющей спейсер из 12 п.о. RSS.
В одном варианте осуществления, в котором генными сегментами V являются генные сегменты Vκ, и между генными сегментами V и генными сегментами J не присутствует DH-сегмент, каждый из генных сегментов Vκ соседствует с 3’-конца с имеющей спейсер из 12 п.о. RSS, а каждый из сегментов Jκ, в случае их присутствия, или сегментов Jλ, в случае их присутствия, соседствует с 5’-конца с имеющей спейсер из 23 п.о. RSS.
В одном варианте осуществления мышь содержит реаранжированный ген, который происходит от генного сегмента VL, генного сегмента JL и эндогенного мышиного гена CH. В одном варианте осуществления реаранжированный ген является соматически мутированным. В одном варианте осуществления реаранжированный ген включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более N-добавлений. В одном варианте осуществления число N-добавлений и/или соматических мутаций, отмечаемых в реаранжированном гене, происходящем от VL-сегмента и JL-сегмента, превышает в 1,5 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раз или по меньшей мере в 5 раз число N-добавлений и/или соматических мутаций, отмечаемых в реаранжированном гене вариабельного домена легкой цепи (происходящем от того же генного сегмента VL и того же генного сегмента JL), который подвергается реаранжировке в эндогенном локусе для легких цепей. В одном варианте осуществления реаранжированный ген находится в B-клетке, которая специфически связывает представляющий интерес антиген, причем B-клетка связывает представляющий интерес антиген с KD в низком наномолярном диапазоне или ниже (например, с KD, составляющей 10 нМ или меньше). В конкретном варианте осуществления VL-сегмент, JL-сегмент или оба эти сегмента являются генными сегментами человека. В конкретном варианте осуществления VL- и JL-сегменты являются генными сегментами κ человека. В одном варианте осуществления мышиный ген CH выбирают из IgM, IgD, IgG, IgA и IgE. В конкретном варианте осуществления мышиный IgG выбирают из IgG1, IgG2A, IgG2B, IgG2C и IgG3. В другом конкретном варианте осуществления мышиным IgG является IgG1.
В одном варианте осуществления мышь содержит B-клетку, в которой вырабатывается с локуса на хромосоме B-клетки связывающий белок, по существу состоящий из четырех полипептидных цепей, причем эти четыре полипептидных цепи по существу состоят из (a) двух идентичных полипептидов, которые включают эндогенную мышиную CH-область, слитую с VL; и (b) двух идентичных полипептидов, которые включают эндогенную мышиную CL-область, слитую с VL-областью, которая является когнатной по отношению к VL-области, которая слита с мышиной CH-областью и, в одном варианте осуществления, является VL-областью человека (например, κ человека). В одном варианте осуществления VL-областью, слитой с эндогенной CH-областью, является VL-область человека. В конкретном варианте осуществления VL-областью человека, слитой с мышиной CH-областью, является Vκ-область. В конкретном варианте осуществления VL-область человека, слитая с мышиной CH-областью, идентична V-области, кодируемой реаранжированной нуклеотидной последовательностью легкой цепи зародышевого типа человека. В конкретном варианте осуществления VL-область человека, слитая с мышиной CH-областью, включает две, три, четыре, пять, шесть или более соматических гипермутаций. В одном варианте осуществления VL-область человека, слитая с мышиной CH-областью, кодируется реаранжированным геном, который включает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более N-добавлений.
В одном варианте осуществления по меньшей мере 50% всех молекул IgG, которые вырабатываются у мыши, включают полипептид, который включает СН-область изотипа IgG и VL-область, причем длина указанного полипептида составляет не более 535, 530, 525, 520 или 515 аминокислот. В одном варианте осуществления по меньшей мере 75% всех молекул IgG включают полипептид, описанный в этом параграфе. В одном варианте осуществления по меньшей мере 80%, 85%, 90% или 95% всех молекул IgG включают полипептид, описанный в этом параграфе. В конкретном варианте осуществления все молекулы IgG, которые вырабатываются у мыши, включают полипептид, длина которого не превышает длину полипептида, описанного в этом параграфе.
В одном варианте осуществления у мыши вырабатывается связывающий белок, включающий первый полипептид, который включает эндогенную мышиную CH-область, слитую с вариабельным доменом, кодируемым реаранжированным генным сегментом V человека и генным сегментом J, но не генным сегментом DH, и второй полипептид, который включает эндогенную мышиную CL-область, слитую с V-доменом, кодируемым реаранжированным генным сегментом V человека и генным сегментом J, но не генным сегментом DH, и связывающий белок специфически связывает антиген с аффинностью в микромолярном, наномолярном или пикомолярном диапазоне. В одном варианте осуществления J-сегментом является J-сегмент человека (например, генный сегмент κ человека). В одном варианте осуществления V-сегментом человека является Vκ-сегмент человека. В одном варианте осуществления вариабельный домен, который слит с эндогенной мышиной CH-областью, включает большее число соматических мутаций, чем вариабельная область, которая слита с эндогенной мышиной CL-областью; в конкретном варианте осуществления вариабельная область, слитая с эндогенной мышиной CH-областью, включает больше в приблизительно 1,5, 2, 3, 4 или 5 раз или более соматических мутаций, чем V-область, слитая с эндогенной мышиной CL-областью; в конкретном варианте осуществления V-область, слитая с мышиной CH-областью, включает больше на по меньшей мере 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 или более соматических мутаций, чем V-область, слитая с эндогенном мышиной CL-областью. В одном варианте осуществления V-область, слитая с мышиной CH-областью, кодируется реаранжированным геном, который включает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более N-добавлений.
В одном варианте осуществления мышь экспрессирует связывающий белок, включающий первый вариабельный домен легкой цепи (VL1), слитый с последовательностью константной области тяжелой цепи иммуноглобулина, и второй вариабельный домен легкой цепи (VL2), слитый с константной областью легкой цепи иммуноглобулина, причем VL1 включает число соматических гипермутаций, которое превышает в приблизительно 1,5 -приблизительно 5 раз число соматических гипермутаций, присутствующих в VL2. В одном варианте осуществления число соматических гипермутаций в VL1 больше в приблизительно 2 - приблизительно 4 раза, чем в VL2. В одном варианте осуществления число соматических гипермутаций в VL1 больше в приблизительно 2 - приблизительно 3 раза, чем в VL2. В одном варианте осуществления VL1 кодируется последовательностью, которая включает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более N-добавлений.
В одном аспекте предоставляется генетически модифицированная мышь, которая экспрессирует иммуноглобулин, который по существу состоит из следующих полипептидов: одних двух идентичных полипептидов, каждый из которых по существу состоит из CH-области, слитой с вариабельным доменом, который происходит от генных сегментов, которые по существу состоят из генного сегмента VL и генного сегмента JL, и других двух идентичных полипептидов, каждый из которых по существу состоит из CL-области, слитой с вариабельным доменом, который происходит от генных сегментов, которые по существу состоят из сегмента VL и сегмента JL.
В конкретном варианте осуществления два идентичных полипептида, которые содержат CH-область, содержат мышиную CH-область.
В конкретном варианте осуществления два идентичных полипептида, которые содержат CL-область, содержат мышиную CL-область.
В одном варианте осуществления вариабельным доменом, слитым с CL-областью, является вариабельный домен, который является когнатным по отношению к вариабельному домену, слитому с CH-областью.
В одном варианте осуществления вариабельный домен, который слит с эндогенной мышиной CH-областью, включает большее число соматических гипермутаций, чем вариабельный домен, который слит с эндогенной мышиной CL-областью; в конкретном варианте осуществления вариабельный домен, слитый с эндогенной мышиной CH-областью, включает больше в приблизительно 1,5, 2, 2,5, 3, 3,5, 4, 4,5 или 5 раз или более соматических гипермутаций, чем вариабельный домен, слитый с эндогенной мышиной CL-областью. В одном варианте осуществления вариабельный домен, слитый с эндогенной мышиной CL-областью, кодируется геном, который включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более N-добавлений.
В одном варианте осуществления один или более V-сегментов и J-сегментов являются генными сегментами человека. В конкретном варианте осуществления как V-сегменты, так и J-сегменты являются генными сегментами κ человека. В другом конкретном варианте осуществления как V-сегменты, так и J-сегменты являются генными сегментами λ человека. В одном варианте осуществления V-сегменты и J-сегменты независимо выбирают из генных сегментов κ человека и λ человека. В конкретном варианте осуществления V-сегментами являются Vκ-сегменты, а J-сегментами являются Jλ-сегменты. В другом конкретном варианте осуществления V-сегментами являются Vλ-сегменты, а J-сегментами являются Jκ-сегменты.
В одном варианте осуществления одним или более вариабельных доменов, слитых с CL-областью, и вариабельных доменов, слитых с CH-областью, являются вариабельные домены человека. В конкретном варианте осуществления вариабельными доменами человека являются Vκ-домены человека. В другом конкретном варианте осуществления вариабельными доменами человека являются Vλ-домены человека. В одном варианте осуществления домены человека независимо выбирают из человеческих Vκ- и Vλ-доменов. В конкретном варианте осуществления вариабельным доменом человека, слитым с CL-областью, является Vλ-домен человека, а вариабельным доменом человека, слитым с CH-областью, является Vκ-домен человека. В другом варианте осуществления вариабельным доменом человека, слитым с CL-областью, является Vκ-домен человека, а вариабельным доменом человека, слитым с CH, является Vλ-домен человека.
В одном варианте осуществления генный сегмент VL одних двух идентичных полипептидов выбирают из Vλ-сегмента человека и Vκ-сегмента человека. В одном варианте осуществления VL-сегмент других двух идентичных полипептидов выбирают из Vλ-сегмента человека и Vκ-сегмента человека. В конкретном варианте осуществления VL-сегментом одних двух идентичных полипептидов является Vκ-сегмент человека, а VL-сегмент других двух идентичных полипептидов выбирают из Vκ-сегмента человека и Vλ-сегмента человека. В конкретном варианте осуществления VL-сегментом одних двух идентичных полипептидов является Vλ-сегмент человека, а VL-сегментдругих двух идентичных полипептидов выбирают из Vλ-сегмента человека и Vκ-сегмента человека. В конкретном варианте осуществления VL-сегментом человека одних двух идентичных полипептидов является Vκ-сегмент человека, и VL-сегментом человекадругих двух идентичных полипептидов является Vκ-сегмент человека.
В одном варианте осуществления IgG мыши включает связывающий белок, вырабатываемый в ответ на антиген, причем связывающий белок включает полипептид, который по существу состоит из вариабельного домена и CH-области, причем вариабельный домен кодируется нуклеотидной последовательностью, которая по существу состоит из реаранжированного VL-сегмента и реаранжированного J-сегмента, и связывающий белок специфически связывает эпитоп антигена с KD в микромолярном, наномолярном или пикомолярном диапазоне.
В одном аспекте предоставляется мышь, у которой все или по существу все IgG, вырабатываемые ею в ответ на антиген, включают тяжелую цепь, которая включает вариабельный домен, причем вариабельный домен кодируется реаранжированным геном, происходящим от генных сегментов, которые по существу состоят из генного сегмента V и генного сегмента J. В одном варианте осуществления реаранжированный ген включает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более N-добавлений.
В одном варианте осуществления V-сегментом является VL-сегмент. В одном варианте осуществления легкую цепь выбирают из легкой цепи κ и легкой цепи λ. В конкретном варианте осуществления легкой цепью является легкая цепь κ. В конкретном варианте осуществления V-сегментом является V-сегмент человека. В конкретном варианте осуществления V-сегментом является Vκ-сегмент человека, а J-сегментом является Jκ-сегмент человека.
В одном варианте осуществления J-сегментом является JL-сегмент. В одном варианте осуществления легкую цепь выбирают из легкой цепи κ и легкой цепи λ. В конкретном варианте осуществления легкой цепью является легкая цепь κ. В конкретном варианте осуществления J-сегментом является J-сегмент человека. В другом варианте осуществления J-сегментом является JH-сегмент. В конкретном варианте осуществления тяжелой цепью является тяжелая цепь мышиного происхождения. В другом конкретном варианте осуществления тяжелая цепь происходит от человека.
В одном варианте осуществления вариабельный домен тяжелой цепи, который создан на основе не более чем V-сегмента и J-сегмента, является соматически мутированным вариабельным доменом.
В одном варианте осуществления вариабельный домен тяжелой цепи, который создан на основе не более чем V-сегмента и J-сегмента, слит с мышиной CH-областью.
В конкретном варианте осуществления все или по существу все IgG, вырабатываемые у мыши в ответ на антиген, включают вариабельный домен, который происходит от не более чем одного V-сегмента человека и не более чем одного J-сегмента человека, и вариабельный домен слит с константной областью IgG мыши, и IgG, кроме того, включает легкую цепь, которая включает VL-домен человека, слитый с CL-областью мыши. В конкретном варианте осуществления VL-домен, слитый с CL-областью мыши, происходит от Vκ-сегмента человека и Jκ-сегмента человека. В конкретном варианте осуществления VL-домен, слитый с CL-областью мыши, происходит от Vλ-сегмента человека и Jλ-сегмента человека.
В одном аспекте предоставляется мышь, у которой вырабатывается IgG, включающий первый CDR3 в полипептиде, включающем CH-область, и второй CDR3 в полипептиде, включающем CL-область, причем каждый и первый CDR3, и второй CDR3 независимо происходит от не более чем двух генных сегментов, причем два генных сегмента по существу состоят из генного сегмента VL и генного сегмента JL. В одном варианте осуществления CDR3 в полипептиде, включающем CH-область, включает последовательность, которая происходит от нуклеотидной последовательности CDR3, включающей 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10 или более N-добавлений.
В одном варианте осуществления VL-сегмент и JL-сегмент являются генными сегментами человека. В одном варианте осуществления VL-сегмент и JL-сегмент являются генными сегментами κ. В одном варианте осуществления VL-сегмент и JL-сегмент являются генными сегментами λ.
В одном аспекте предоставляется мышь, у которой вырабатывается IgG, включающий первый CDR3 в первом полипептиде, включающем CH-область, и второй CDR3 во втором полипептиде, включающем CL-область, причем каждый и первый CDR3, и второй CDR3 включает последовательность аминокислот, в которой более чем 75% аминокислот происходят от генного сегмента V. В одном варианте осуществления CDR3 в полипептиде, включающем CH-область, включает последовательность, которая происходит от нуклеотидной последовательности CDR3, включающей 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10 или более N-добавлений.
В одном варианте осуществления более чем 80%, более чем 90% или более чем 95% аминокислот первого CDR3 и более чем 80%, более чем 90% или более чем 95% аминокислот второго CDR3 происходят от VL-сегмента.
В одном варианте осуществления не более чем две аминокислоты первого CDR3 происходят от генного сегмента, отличного от VL-сегмента. В одном варианте осуществления не более чем две аминокислоты второго CDR3 происходят от генного сегмента, отличного от VL-сегмента. В конкретном варианте осуществления не более чем две аминокислоты первого CDR3 и не более чем две аминокислоты второго CDR3 происходят от генного сегмента, отличного от VL-сегмента. В одном варианте осуществления CDR3 IgG не включает аминокислотную последовательность, происходящую от генного сегмента D. В одном варианте осуществления CDR3 первого полипептида не включает последовательность, происходящую от D-сегмента.
В одном варианте осуществления V-сегментом является генный сегмент V человека. В конкретном варианте осуществления V-сегментом является генный сегмент Vκ человека.
В одном варианте осуществления первый и/или второй CDR3 содержат по меньшей мере одну, две, три, четыре, пять или шесть соматических гипермутаций. В одном варианте осуществления первый CDR3 кодируется последовательностью нуклеиновой кислоты, которая включает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более N-добавлений.
В одном варианте осуществления первый CDR3 по существу состоит из аминокислот, происходящих от генного сегмента VLчеловека и генного сегмента JLчеловека, и второй CDR3 по существу состоит из аминокислот, происходящих от генного сегмента VL человека и генного сегмента JLчеловека. В одном варианте осуществления первый CDR3 происходит от последовательности нуклеиновой кислоты, которая включает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более N-добавлений. В одном варианте осуществления первый CDR3 происходит от не более чем двух генных сегментов, причем не более чем двумя генными сегментами являются генный сегмент Vκ человека и генный сегмент Jκ; и второй CDR3 происходит от не более чем двух генных сегментов, причем не более чем двумя генными сегментами являются генный сегмент Vκ человека и генный сегмент J, выбираемый из Jκ-сегмента человека, Jλ-сегмента человека и JH-сегмента человека. В одном варианте осуществления первый CDR3 происходит от не более чем двух генных сегментов, причем не более чем двумя генными сегментами являются Vλ-сегмент человека и J-сегмент, выбираемый из Jκ-сегмента человека, Jλ-сегмента человека и JH-сегмента человека.
В одном аспекте предоставляется мышь, у которой вырабатывается IgG, который не содержит аминокислотную последовательность, происходящую от генного сегмента DH, причем IgG включает первый полипептид, содержащий первый VL-домен, слитый с мышиной CL-областью, и второй полипептид, содержащий второй VL-домен, слитый с мышиной CH-областью, при этом первый VL-домен и второй VL-домен не являются идентичными. В одном варианте осуществления первый и второй VL-домены происходят от различных V-сегментов. В другом варианте осуществления первый и второй VL-домены происходят от различных J-сегментов. В одном варианте осуществления первый и второй VL-домены происходят от идентичных V- и J-сегментов, причем второй VL-домен включает большее число соматических гипермутаций, чем первый VL-домен.
В одном варианте осуществления первый и второй VL-домены независимо выбирают из VL-доменов человека и мыши. В одном варианте осуществления первый и второй VL-домены независимо выбирают из Vκ- и Vλ-доменов. В конкретном варианте осуществления первый VL-домен выбирают из Vκ-домена и Vλ-домена, а вторым VL-доменом является Vκ-домен. В другом конкретном варианте осуществления Vκ-доменом является Vκ-домен человека.
В одном аспекте предоставляется мышь, у которой все или по существу все IgG, вырабатываемые ею, по существу состоят из легкой цепи, содержащей первый VL-домен человека, слитый с мышиным CL-доменом, и тяжелой цепи, содержащей второй VL-домен человека, слитый с мышиным CH-доменом.
В одном варианте осуществления VL-доменом человека, слитым с мышиным CH-доменом, является Vκ-домен человека.
В одном варианте осуществления первый и второй VL-домены человека не являются идентичными.
В одном аспекте предоставляется мышь, у которой по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или приблизительно 100% иммуноглобулинов G, вырабатываемые у нее, по существу состоят из димера (a) первого полипептида, который по существу состоит из VL-домена иммуноглобулина и CL-области иммуноглобулина, и (b) второго полипептида длиной не более чем 535 аминокислот, причем второй полипептид по существу состоит из CH-области и V-домена, в котором отсутствует последовательность, происходящая от генного сегмента DH.
В одном варианте осуществления длина второго полипептида составляет приблизительно 435-535 аминокислот. В конкретном варианте осуществления длина второго полипептида составляет приблизительно 435-530 аминокислот. В конкретном варианте осуществления длина второго полипептида составляет приблизительно 435-525 аминокислот. В конкретном варианте осуществления длина второго полипептида составляет приблизительно 435-520 аминокислот. В конкретном варианте осуществления длина второго полипептида составляет приблизительно 435-515 аминокислот.
В одном варианте осуществления в приблизительно 90% или более IgG, вырабатываемых у мыши, второй полипептид имеет длину, составляющую не более чем приблизительно 535 аминокислот.
В одном варианте осуществления в приблизительно 50% или более IgG, вырабатываемых у мыши, второй полипептид имеет длину, составляющую не более чем приблизительно 535 аминокислот. В одном варианте осуществления в приблизительно 50% или более IgG, вырабатываемых у мыши, второй полипептид имеет длину, составляющую не более чем приблизительно 530, 525, 520, 515, 510, 505, 500, 495, 490, 485, 480, 475, 470, 465, 460, 455 или 450 аминокислот. В одном варианте осуществления приблизительно 60%, 70%, 80%, 90% и 95% или более IgG, вырабатываемых у мыши, имеют указанную длину. В конкретном варианте осуществления все или по существу все IgG, вырабатываемых у мыши, имеют указанную длину.
В одном варианте осуществления V-доменом второго полипептида является VL-домен. В конкретном варианте осуществления V-домен второго полипептида выбирают из Vκ- и Vλ-домена. В конкретном варианте осуществления V-доменом второго полипептида является Vκ- или Vλ-домен человека.
В одном аспекте предоставляется мышь, которая экспрессирует с нуклеотидной последовательности в ее зародышевых клетках полипептид, который включает вариабельную последовательность легкой цепи (например, V- и/или J-последовательность), DH-последовательность и константную область тяжелой цепи.
В одном варианте осуществления мышь экспрессирует полипептид с эндогенного мышиного локуса, кодирующего тяжелые цепи, который включает замену всех или по существу всех функциональных эндогенных мышиных генных сегментов, используемых при образовании генов вариабельных областей тяжелых цепей, множеством генных сегментов человека в эндогенном мышином локусе, кодирующем тяжелые цепи.
В одном варианте осуществления полипептид включает последовательность VL, происходящую от генного сегмента Vλ или Vκ, полипептид включает CDR3, происходящий от генного сегмента DH, и полипептид включает последовательность, происходящую от генного сегмента JH, или Jλ, или Jκ.
В одном варианте осуществления мышь включает эндогенный мышиный локус, кодирующий тяжелые цепи иммуноглобулинов, включающий замену всех функциональных генных сегментов VH одним или более генных сегментов Vλ человека, причем с каждым из одного или более Vλ-сегментов человека соседствует с 3’-конца имеющая спейсер из 23 п.о. сигнальная последовательность, по которой происходит рекомбинация, (RSS), причем сегменты Vλ функционально связаны с DH-сегментом человека и мыши, с которым соседствует 5’ и 3’ имеющая спейсер из 12 п.о. RSS; сегмент DH функционально связан с J-сегментом, который соседствует 5’ с имеющей спейсер из 23 п.о. RSS, которая является подходящей для рекомбинирования с имеющей спейсер из 12 п.о. RSS, с которой соседствует DH-сегмент; причем сегменты V, DH и J функционально связаны с последовательностью нуклеиновой кислоты, кодирующей константную область тяжелой цепи.
В одном варианте осуществления мышь включает эндогенный мышиный локус, кодирующий тяжелые цепи иммуноглобулинов, включающий замену всех функциональных генных сегментов VH одним или более генных сегментов Vκ человека, каждый из которых соседствует с 3’-конца с имеющей спейсер из 12 п.о. сигнальной последовательностью, по которой происходит рекомбинация, (RSS), причем V-сегменты функционально связаны с DH-сегментом человека и мыши, который соседствует и 5’, и 3’ с имеющей спейсер из 23 п.о. RSS; DH-сегмент функционально связан с J-сегментом, который соседствует с 5’-конца с имеющей спейсер из 12 п.о. RSS, которая является подходящей для рекомбинирования с имеющей спейсер из 23 п.о. RSS, с которой соседствует сегмент DH; причем генные сегменты V, DH и J функционально связаны с последовательностью нуклеиновой кислоты, кодирующей константную область тяжелой цепи.
В одном варианте осуществления константной областью тяжелой цепи является эндогенная мышиная константная область тяжелой цепи. В одном варианте осуществления последовательность нуклеиновой кислоты кодирует последовательность, выбираемую из CH1, шарнирной области, CH2, CH3 и их комбинации. В одном варианте осуществления одна или более из CH1, шарнирной области, CH2 и CH3 являются человеческими.
В одном варианте осуществления мышь включает эндогенный мышиный локус, кодирующий тяжелые цепи иммуноглобулинов, включающий замену всех функциональных генных сегментов VH множеством генных сегментов Vλ или Vκ человека, каждый из которых соседствует 3’ с имеющей спейсер из 23 п.о. RSS, множеством DH-сегментов человека, которые соседствуют и с 3’, и с 5’-конца с имеющей спейсер из 12 п.о. RSS, множеством J-сегментов человека (JH, или Jλ, или Jκ), которые соседствует и с 3’, и с 5’-конца с имеющей спейсер из 23 п.о. RSS, причем локус включает эндогенную мышиную последовательность константной области, выбираемую из CH1, шарнирной области, CH2, CH3 и их комбинации. В конкретном варианте осуществления мышь содержит все или по существу все функциональные человеческие сегменты Vλ или Vκ, все или по существу все функциональные человеческие сегменты DH и все или по существу все сегменты JH или Jλ или Jκ человека.
В одном варианте осуществления мышь экспрессирует антигенсвязывающий белок, включающий (a) полипептид, который включает последовательность легкой цепи человека, связанную с последовательностью константной области тяжелой цепи, включающей мышиную последовательность; и (b) полипептид, который включает вариабельную область легкой цепи человека, связанную с последовательностью константной области легкой цепи человека или мыши. В конкретном варианте осуществления последовательность легкой цепи является последовательностью легкой цепи человека, и при воздействии протеазы, которая способна к расщеплению антитела на Fc и Fab, образуется полностью человеческий Fab, который включает по меньшей мере четыре CDR легкой цепи, причем по меньшей мере четыре CDR легкой цепи выбирают из последовательностей λ, последовательностей κ и их комбинации. В одном варианте осуществления Fab включает по меньшей мере пять CDR легкой цепи. В одном варианте осуществления Fab включает шесть CDR легкой цепи. В одном варианте осуществления по меньшей мере один CDR Fab включает последовательность, происходящую от Vλ-сегмента или Vκ-сегмента, и по меньшей мере один CDR, кроме того, включает последовательность, происходящую от D-сегмента. В одном варианте осуществления по меньшей мере одним CDR является CDR3, и CDR происходит от Vκ-сегмента человека, D-сегмента человека и Jκ-сегмента человека.
В одном варианте осуществления полипептид включает вариабельную область, происходящую от генного сегмента Vλ или Vκ человека, генного сегмента DH человека и генного сегмента JH или Jλ или Jκ человека. В конкретном варианте осуществления последовательность константной области тяжелой цепи происходит от последовательности CH1 человека и мышиной последовательности CH2 и мышиной последовательности CH3.
В одном аспекте предоставляется мышь, которая содержит в своих зародышевых клетках нереаранжированный генный сегмент Vκ или Vλ человека, функционально связанный с генным сегментом J человека и последовательностью константной области тяжелой цепи, причем мышь экспрессирует содержащий VL связывающий белок, который включает Vκ-домен человека, слитый с константной областью тяжелой цепи, и причем мышь демонстрирует популяцию B-клеток селезенки, которые экспрессируют содержащий VL связывающий белок, - CD19+ B-клетки, включая промежуточные B-клетки (CD19+IgMвысокийIgDсредний) и зрелые В-клетки (CD19+IgMсреднийIgDвысокий).
В одном аспекте предоставляется мышь, которая содержит в своих зародышевых клетках нереаранжированный генный сегмент Vκ или Vλ человека, функционально связанный с генным сегментом J человека и последовательностью константной области тяжелой цепи, причем в В-клетке мыши экспрессируется иммуноглобулин, который включает вариабельный домен легкой цепи, слитый с константной областью тяжелой цепи, причем в популяции лимфоцитов в костном мозге выявляется популяция про/пре-B-клеток, численность которой приблизительно равна численности популяции про/пре-В-клеток у мыши дикого типа (лимфоцитов в костном мозге).
В одном варианте осуществления мыши содержат по меньшей мере 6 нереаранжированных генных сегментов hVκ и один или более нереаранжированных генных сегментов hJκ, и мыши содержат популяцию обнаруживаемых в дискриминационном окне, соответствующем лимфоцитам, и IgM+ клеток селезенки, экспрессирующих содержащий VL связывающий белок, причем размер этой популяции составляет по меньшей мере 75% такового популяции обнаруживаемых в дискриминационном окне, соответствующем лимфоцитам, и IgM+ клеток селезенки у мыши дикого типа.
В одном варианте осуществления у мышей выявляется популяция IgD+ клеток и IgM+ клеток, которые являются обнаруживаемыми в дискриминационном окне, соответствующем зрелым B-клеткам, (CD19+) спленоцитами, в общем составляющих приблизительно 90%; в одном варианте осуществления популяция IgD+ клеток и IgM+ клеток, которые являются обнаруживаемыми в дискриминационном окне, соответствующем зрелым B-клеткам, (CD19+) спленоцитами, у модифицированной мыши является приблизительно такой же по численности (например, в пределах 10% или в пределах 5%), что и общее число IgD+ клеток и IgM+ клеток, которые являются обнаруживаемыми в дискриминационном окне, соответствующем зрелым B-клеткам, (CD19+) спленоцитами, у мыши дикого типа.
В одном аспекте предоставляется мышь, которая экспрессирует белок иммуноглобулин с модифицированного эндогенного локуса для тяжелых цепей в ее зародышевых клетках, причем в модифицированном эндогенном локусе для тяжелых цепей отсутствует функциональный генный сегмент VH мыши, и локус включает нереаранжированные генные сегменты VL и нереаранжированные генные сегменты J, причем нереаранжированные генные сегменты VL и нереаранжированные генные сегменты J функционально связаны с последовательностью константной области тяжелой цепи; причем белок иммуноглобулин по существу состоит из первого полипептида и второго полипептида, причем первый полипептид включает последовательность легкой цепи иммуноглобулина и последовательность константной области тяжелой цепи иммуноглобулина, а второй полипептид включает вариабельный домен легкой цепи иммуноглобулина и константную область легкой цепи.
В одном аспекте предоставляется мышь, которая экспрессирует белок иммуноглобулин, причем в белке иммуноглобулине отсутствует вариабельный домен тяжелой цепи, и белок иммуноглобулин содержит первый вариабельный домен, происходящий от гена легкой цепи, и второй вариабельный домен, происходящий от гена легкой цепи, причем первый вариабельный домен и второй вариабельный домен являются когнатными по отношению друг к другу, причем первый и второй вариабельные домены легкой цепи не являются идентичными, и причем первый и второй вариабельные домены легкой цепи объединяются и после объединения специфически связывают представляющий интерес антиген.
В одном аспекте предоставляется мышь, у которой вырабатывается на основе нереаранжированных генных сегментов в ее зародышевых клетках белок иммуноглобулин, включающий вариабельные области, которые целиком происходят от генных сегментов, которые по существу состоят из нереаранжированных генных сегментов человека, причем белок иммуноглобулин включает последовательность константной области легкой цепи иммуноглобулина и последовательность константной области тяжелой цепи иммуноглобулина, выбранную из группы, состоящей из CH1, шарнирной области, CH2, CH3 и их комбинации.
В одном аспекте предоставляется мышь, у которой вырабатывается на основе нереаранжированных генных сегментов в ее зародышевых клетках белок иммуноглобулин, включающий вариабельные области, причем все CDR3 всех вариабельных областей создаются полностью из генных сегментов VL и JL, и необязательно содержат одну или более соматических гипермутаций, например, одно или более N-добавлений.
В одном аспекте предоставляется мышь, у которой вырабатывается соматически мутированный белок иммуноглобулин, происходящий от нереаранжированных генных сегментов для вариабельных областей легких цепей человека в зародышевых клетках мыши, причем в белке иммуноглобулине отсутствует CDR, которая включает последовательность, происходящую от генного сегмента D, причем белок иммуноглобулин включает первый CDR3 в вариабельном домене легкой цепи, слитом с константной областью легкой цепи, включает второй CDR3 в вариабельном домене легкой цепи, слитом с константной областью тяжелой цепи, и причем второй CDR3 происходят от реаранжированной последовательности вариабельной области легкой цепи, которая содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более N-добавлений.
В одном аспекте предоставляется описываемая здесь мышь, которая содержит функционально молчащий локус, кодирующий легкие цепи, выбираемый из локуса λ, локуса κ и их комбинации. В одном варианте осуществления мышь имеет частичную или полную делецию локуса λ и/или κ, так что локус λ и/или κ является нефункциональным.
В одном аспекте предоставляется мышиный эмбрион, содержащий клетку, которая содержит модифицированный иммуноглобулиновый локус, описываемый здесь. В одном варианте осуществления мышь является химерой, и по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% клеток эмбриона содержат модифицированный иммуноглобулиновый локус, описываемый здесь. В одном варианте осуществления по меньшей мере 96%, 97%, 98%, 99% и 99,8% клеток эмбриона содержат модифицированный иммуноглобулиновый локус, описываемый здесь. В одном варианте осуществления эмбрион содержит клетку-хозяина и клетку, происходящую из донорной эмбриональной стволовой клетки, причем клетка, происходящая из донорной эмбриональной стволовой клетки, включает модифицированный иммуноглобулиновый локус, описываемый здесь. В одном варианте осуществления эмбрион представляет собой эмбрион-хозяин на стадии 2, 4, 8, 16, 32 или 64 клеток или бластоциста и дополнительно включает донорную эмбриональную стволовую клетку, включающую модифицированный иммуноглобулиновый локус, описываемый здесь.
В одном аспекте предоставляется мышь или клетка, созданная с использованием конструкции нуклеиновой кислоты, описываемой здесь.
В одном аспекте предоставляется мышь, созданная с использованием описываемой здесь клетки. В одном варианте осуществления клеткой является мышиная стволовая клетка.
В одном аспекте предоставляется применение мыши, описываемой здесь, для получения последовательности нуклеиновой кислоты, кодирующей последовательность первой вариабельной области легкой цепи иммуноглобулина человека (VL1), которая является когнатной по отношению к последовательности второй вариабельной области легкой цепи иммуноглобулина человека (VL2), причем VL1, слитая с константной областью легкой цепи иммуноглобулина человека, (полипептид 1), представлена вместе с VL2, слитой с константной областью тяжелой цепи иммуноглобулина человека, (полипептидом 2), в виде димера полипептид 1/полипептид 2, с образованием антитела с VL1-VL2.
В одном аспекте предоставляется применение мыши, описываемой здесь, для получения последовательности нуклеиновой кислоты, кодирующей последовательность вариабельной области легкой цепи иммуноглобулина человека, которая слита с последовательностью константной области тяжелой цепи иммуноглобулина человека, причем последовательность нуклеиновой кислоты кодирует полипептид VL-CH человека, причем полипептид VL-CH человека представлен в виде димера, и причем димер является представленным в отсутствие легкой цепи иммуноглобулина (например, в отсутствие легкой цепи λ или κ человека). В одном варианте осуществления димер VL-CH специфически связывает представляющий интерес антиген в отсутствие легкой цепи λ и в отсутствие легкой цепи κ.
В одном аспекте предоставляется применение мыши, описываемой здесь, для получения последовательности нуклеиновой кислоты, кодирующей весь или часть вариабельного домена иммуноглобулина. В одном варианте осуществления вариабельным доменом иммуноглобулина является Vλ- или Vκ-домен человека.
В одном аспекте предоставляется применение мыши, описываемой здесь, для создания полностью человеческого Fab (включающего первый VL человека, слитый с константной областью легкой цепи человека, и второй VL человека, слитый с последовательностью константной области тяжелой цепи человека) или полностью человеческого F(ab)2.
В одном аспекте предоставляется применение мыши, описываемой здесь, для создания иммортализованной линии клеток. В одном варианте осуществления иммортализованная линия клеток включает последовательность нуклеиновой кислоты, кодирующую Vλ- или Vκ-домен человека, функционально связанную с последовательностью нуклеиновой кислоты, которая включает последовательность нуклеиновой кислоты константной области мыши.
В одном аспекте предоставляется применение мыши, описываемой здесь, для создания гибридомы и квадрогибридомы.
В одном аспекте предоставляется клетка, содержащая модифицированный иммуноглобулиновый локус, описываемый здесь. В одном варианте осуществления клетку выбирают из тотипотентной клетки, плюрипотентной клетки, индуцированной плюрипотентной клетки (iPS) и эмбриональной стволовой клетки. В конкретном варианте осуществления клеткой является мышиная клетка, например мышиная эмбриональная стволовая клетка. В одном варианте осуществления клетка является гомозиготной по модифицированному иммуноглобулиновому локусу.
В одном аспекте предоставляется клетка, содержащая последовательность нуклеиновый кислоты, кодирующую первый полипептид, который включает первую соматически мутированную последовательность Vκ или Vλ человека, слитую с последовательностью константной области тяжелой цепи человека.
В одном варианте осуществления клетка, кроме того, содержит вторую полипептидную цепь, которая включает вторую соматически мутированную последовательность Vκ или Vλ человека, слитую с последовательностью константной области легкой цепи человека.
В одном варианте осуществления последовательность Vκ или Vλ человека первого полипептида является когнатной по отношению к последовательности Vκ или Vλ человека второго полипептида.
В одном варианте осуществления Vκ или Vλ первого полипептида и Vκ или Vλ человека второго полипептида после объединения специфически связывают представляющий интерес антиген. В конкретном варианте осуществления первый полипептид включает вариабельный домен, по существу состоящий из Vκ человека, а второй полипептид включает вариабельный домен, состоящий из Vκ человека, который является когнатным по отношению Vκ человека первого полипептида, а последовательностью константной области человека является последовательность IgG.
В одном варианте осуществления клетку выбирают из клетки CHO, клетки COS, клетки 293, клетки HeLa и клетки сетчатки человека, экспрессирующей вирусную последовательность нуклеиновой кислоты (например, клетки PERC.6TM).
В одном аспекте предоставляется соматическая клетка мыши, содержащая хромосому, которая содержит генетическую модификацию, описываемую здесь.
В одном аспекте предоставляется зародышевая клетка мыши, содержащая последовательность нуклеиновой кислоты, которая содержит генетическую модификацию, описываемую здесь.
В одном аспекте предоставляется плюрипотентная, индуцированная плюрипотентная или тотипотентная клетка, происходящая от описываемой здесь мыши. В конкретном варианте осуществления клеткой является мышиная эмбриональная стволовая клетка.
В одном аспекте предоставляется применение описываемой здесь клетки для создания мыши, клетки или выработки терапевтического белка (например, антитела или другого антигенсвязывающего белка).
В одном аспекте предоставляется конструкция нуклеиновой кислоты, которая включает генный сегмент DH человека, который соседствует 5’ и 3’ с имеющей спейсер из 23 п.о. RSS. В конкретном варианте осуществления конструкция нуклеиновой кислоты включает плечо, которое гомологично геномной последовательности человека, включающей генный сегмент Vκ человека. В одном варианте осуществления таргетирующая конструкция включает все или по существу все генные сегменты DH человека, каждый из которых соседствует 3’ и 5’ с имеющей спейсер из 23 п.о. RSS.
В одном аспекте предоставляется конструкция нуклеиновой кислоты, которая включает генный сегмент Jκ человека, который соседствует 5’ с имеющей спейсер из 12 п.о. RSS. В конкретном варианте осуществления конструкция нуклеиновой кислоты содержит первое плечо, которое гомологично геномной последовательности человека, включающей генный сегмент DH, которая соседствует 5’ и 3’ с имеющей спейсер из 23 п.о. RSS. В одном варианте осуществления конструкция нуклеиновой кислоты содержит второе плечо, которое гомологично геномной последовательности человека, включающей генный сегмент J, или которое гомологично последовательности константной области тяжелой цепи мыши, или которое гомологично межгенной последовательности J-C, находящейся 5’ от последовательности константной области тяжелой цепи мыши.
В одном аспекте предоставляется конструкция нуклеиновой кислоты, которая включает сегмент Vλ человека, который соседствует 3’ с имеющей спейсер из 23 п.о. RSS, сегмент DH человека, который соседствует 5’ и 3’ с имеющей спейсер из 12 п.о. RSS, и J-сегмент человека, выбираемый из Jκ-сегмента, который соседствует 5’ с имеющей спейсер из 23 п.о. RSS, Jλ-сегмента человека, который соседствует 5’ с имеющей спейсер из 23 п.о. RSS, и JH-сегмента человека, который соседствует 5’ с имеющей спейсер из 23 п.о. RSS. В одном варианте осуществления конструкция содержит плечо, которое гомологично последовательности константной области мыши, мышиной межгенной последовательности J-C и/или последовательности Vλ человека.
В одном варианте осуществления конструкция нуклеиновой кислоты включает последовательность вариабельной области легкой цепи λ человека, которая включает фрагмент кластера A локуса, кодирующего легкие цепи λ человека. В конкретном варианте осуществления фрагмент кластера A локуса, кодирующего легкие цепи λ человека, простирается от hVλ3-27 до hVλ3-1 включительно.
В одном варианте осуществления конструкция нуклеиновой кислоты включает последовательность вариабельной области легкой цепи λ человека, которая включает фрагмент кластера В локуса, кодирующего легкие цепи λ человека. В конкретном варианте осуществления фрагмент кластера В локуса, кодирующего легкие цепи λ человека, простирается от hVλ5-52 до hVλ1-40 включительно.
В одном варианте осуществления конструкция нуклеиновой кислоты включает последовательность вариабельной области легкой цепи λ человека, которая включает геномный фрагмент кластера A и геномный фрагмент кластера B. В одном варианте осуществления последовательность вариабельной области легкой цепи λ человека включает по меньшей мере один генный сегмент кластера A и по меньшей мере один генный сегмент кластера B.
В одном варианте осуществления последовательность вариабельной области легкой цепи λ человека включает по меньшей мере один генный сегмент кластера B и по меньшей мере один генный сегмент кластера C.
В одном аспекте предоставляется конструкция нуклеиновой кислоты, включающая DH-сегмент человека, который соседствует 5’ и 3’ с имеющей спейсер из 23 п.о. RSS, обычно обнаруживаемой в природе как RSS, фланкирующая или Jκ, JH, Vλ или VH-сегмент. В одном варианте осуществления конструкция нуклеиновой кислоты содержит первое плечо, гомологичное межгенной области V-J человека или гомологичное геномной последовательности человека, включающей генный сегмент V человека. В одном варианте осуществления конструкция нуклеиновой кислоты содержит второе плечо, гомологичное последовательности константной области тяжелой цепи человека или мыши. В конкретном варианте осуществления последовательность константной области тяжелой цепи человека или мыши выбирают из последовательности CH1, шарнирной области, CH2, CH3 и их комбинации. В одном варианте осуществления конструкция нуклеиновой кислоты включает генный сегмент J человека, фланкированный 5’ имеющей спейсер из 12 п.о. RSS. В одном варианте осуществления конструкция нуклеиновой кислоты содержит второе плечо, которое гомологично генному сегменту J человека, фланкированному 5’ имеющей спейсер из 12 п.о. RSS. В одном варианте осуществления генный сегмент J выбирают из Jκ человека, Jλ человека и JHчеловека.
В одном аспекте предоставляется конструкция нуклеиновой кислоты, включающая сегмент DH человека, который соседствует 5’ и 3’ с имеющей спейсер из 23 п.о. RSS, и последовательность, распознаваемую сайт-специфической рекомбиназой, например, последовательность, распознаваемую такой сайт-специфической рекомбиназой, как Cre, Flp или белок Dre.
В одном аспекте предоставляется конструкция нуклеиновой кислоты, которая включает Vλ-сегмент человека или Vκ-сегмент человека, DH-сегмент, который соседствует 5’ и 3’ с имеющей спейсер из 12 или 23 п.о. RSS, и J-сегмент человека с имеющей спейсер из 12 или 23 п.о. RSS, причем имеющая спейсер из 12 или 23 п.о. RSS расположена непосредственно 5’ от J-сегмента человека (т.е. относительно направления транскрипции). В одном варианте осуществления конструкция включает Vλ человека, который соседствует 3’ с имеющей спейсер из 23 п.о. RSS, DH-сегмент человека, который соседствует 5’ и 3’ с имеющей спейсер из 12 п.о. RSS, и Jκ-сегмент человека, который соседствует 5’ с имеющей спейсер из 23 п.о. RSS. В одном варианте осуществления конструкция включает Vκ человека, который соседствует 3’ с имеющей спейсер из 12 п.о. RSS, DH-сегмент человека, который соседствует 5’ и 3’ с имеющей спейсер из 23 п.о. RSS, и Jλ-сегмент человека, который соседствует 5’ с имеющей спейсер из 12 п.о. RSS.
В одном аспекте предоставляется таргетирующий вектор, включающий (a) первое таргетирующее плечо и второе таргетирующее плечо, причем первое и второе таргетирующие плечи независимо выбирают из таргетирующих плеч человека и мыши, причем таргетирующие плечи направляют вектор к эндогенному или модифицированному локусу, кодирующему V-области иммуноглобулинов; и (b) непрерывную последовательность генных сегментов VL человека или непрерывную последовательность генных сегментов VL человека и по меньшей мере один генный сегмент Jκ, причем непрерывную последовательность выбирают из группы, состоящей из (i) hVκ4-1 - hVκ1-6 и Jκ1, (ii) hVκ4-1 - hVκ1-6 и Jκ1-Jκ2, (iii) hVκ4-1 - hVκ1-6 и Jκ1-Jκ3, (iv) hVκ4-1 - hVκ1-6 и Jκ1-Jκ4, (V) hVκ4-1 - hVκ1-6 и Jκ1-Jκ5, (vi) hVκ3-7 - hVκ1-16, (vii) hVκ1-17-hVκ2-30, (viii) hVκ3-31-hVκ2-40 и (ix) их комбинации.
В одном варианте осуществления таргетирующие плечи, которые направляют вектор к эндогенному или модифицированному иммуноглобулиновому локусу, являются идентичными или по существу идентичными последовательности в эндогенном или модифицированном иммуноглобулиновом локусе.
В одном аспекте предоставляется применение описываемой здесь конструкции нуклеиновой кислоты для создания мыши, клетки или выработки терапевтического белка (например, антитела или другого антигенсвязывающего белка).
В одном аспекте предоставляется применение описываемой здесь конструкции нуклеиновой кислоты из мыши, описываемой здесь, для создания линии клеток для производства терапевтического средства для человека. В одном варианте осуществления терапевтическим средством для человека является связывающий белок, включающий последовательность вариабельной области легкой цепи человека (например, происходящую от Vλ-сегмента человека или Vκ-сегмента человека), слитую с константной последовательностью тяжелой цепи человека. В одном варианте осуществления терапевтическое средство для человека включает первый полипептид, который представляет собой легкую цепь λ или κ иммуноглобулина человека, и второй полипептид, который включает вариабельную последовательность легкой цепи λ или κ человека, слитую с последовательностью константной области тяжелой цепи человека.
В одном аспекте предоставляется экспрессионная система, включающая клетку млекопитающего, трансфицированную ДНК-конструкцией, которая кодирует полипептид, который включает соматически мутированный VL-домен человека, слитый с CH-доменом человека.
В одном варианте осуществления экспрессионная система, кроме того, включает нуклеотидную последовательность, которая кодирует VL-домен иммуноглобулина, слитый с CL-доменом человека, причем VL-домен, слитый с CL-доменом человека, является легкой цепью, когнатной по отношению к VL-домену, слитому с CH-доменом человека.
В одном варианте осуществления клетку млекопитающего выбирают из клетки CHO, клетки COS, клетки Vero, клетки 293 и клетки сетчатки, которая экспрессирует вирусный ген (например, клетки PER.C6TM).
В одном аспекте предоставляется способ получения связывающего белка, включающий получение нуклеотидной последовательности, кодирующей VL-домен, из гена, кодирующего VL-область, слитую с CH-областью, из клетки мыши, описываемой здесь, и клонирование нуклеотидной последовательности, кодирующей последовательность VL-области, в рамке считывания с геном, кодирующим CH-область человека, для образования последовательности для связывающего белка, экспрессию последовательности для связывающего белка в подходящей клетке.
В одном варианте осуществления мышь иммунизируют, используя представляющий интерес антиген, и VL-область, слитая с CH-областью, специфически связывает (например, с KD в микромолярном, наномолярном или пикомолярном диапазоне) эпитоп представляющего интерес антигена. В одном варианте осуществления нуклеотидная последовательность, кодирующая VL-область, слитую с CH-областью, является соматически мутированной у мыши.
В одном варианте осуществления подходящую клетку выбирают из B-клетки, гибридомы, квадрогибридомы, клетки CHO, клетки COS, клетки 293, клетки HeLa и клетки сетчатки человека, экспрессирующей вирусную последовательность нуклеиновой кислоты (например, клетку PERC.6TM).
В одном варианте осуществления CH-область включает изотип IgG человека. В конкретном варианте осуществления IgG человека выбирают из IgG1, IgG2 и IgG4. В другом конкретном варианте осуществления IgG человека является IgG1. В другом конкретном варианте осуществления IgG человека является IgG4. В другом конкретном варианте осуществления IgG4 человека является модифицированный IgG4. В одном варианте осуществления модифицированный IgG4 включает замену в шарнирной области. В конкретном варианте осуществления модифицированный IgG4 включает замену в аминокислотном остатке 228 по сравнению с IgG4 человека дикого типа, с нумерацией в соответствии с EU-индексом номенклатуры Kabat. В конкретном варианте осуществления заменой в аминокислотном остатке 228 является замена S228P, с нумерацией в соответствии с EU-индексом номенклатуры Kabat.
В одном варианте осуществления клетка, кроме того, включает нуклеотидную последовательность, кодирующую VL-домен легкой цепи, который является когнатным по отношению к VL-домену, слитому с CH-областью, и способ, кроме того, включает экспрессию нуклеотидной последовательности, кодирующей когнатный VL-домен, слитый с Cκ- или Cλ-доменом человека.
В одном аспекте предоставляется способ создания генетически модифицированной мыши, включающий замену в эндогенном мышином локусе, кодирующем тяжелые цепи, одного и более генных сегментов, используемых при образовании генов вариабельных областей тяжелых цепей иммуноглобулинов мыши, одним или более генных сегментов, используемых при образовании генов вариабельных областей легких цепей иммуноглобулинов человека. В одном варианте осуществления осуществляют замену всех или по существу всех функциональных сегментов, используемых при образовании генов вариабельных областей тяжелых цепей иммуноглобулинов мыши, (т.е. VH-, DH- и JH-сегментов), одним или более функциональных сегментов, используемых при образовании генов вариабельных областей легких цепей человека (т.е. VL- и JL-сегментов). В одном варианте осуществления осуществляют замену всех или по существу всех функциональных VH-, DH- и JH-сегментов мыши на все или по существу все Vλ- или Vκ-сегменты человека и по меньшей мере один Jλ- или Jκ-сегмент. В конкретном варианте осуществления замена включает все или по существу все функциональные Jλ- или Jκ-сегменты человека.
В одном аспекте предоставляется способ создания мыши, которая экспрессирует полипептид, который включает последовательность, происходящую от сегмента Vλ или Vκ и/или сегмента Jλ или Jκ человека, слитую с константной областью тяжелой цепи мыши, включающий замену эндогенных сегментов, используемых при образовании генов вариабельных областей тяжелых цепей иммуноглобулинов мыши, (VH, DH, и JH), по меньшей мере одним Vλ- или Vκ-сегментом человека и по меньшей мере одним Jλ- или Jκ-сегментом человека, причем замену осуществляют в плюрипотентной, индуцированной плюрипотентной или тотипотентной клетке мыши для образования генетически модифицированной клетки-предшественника мыши; генетически модифицированную клетку-предшественник мыши вводят мыши-хозяину; и мышь-хозяина, содержащую генетически модифицированную клетку-предшественник, вынашивают для развития в мышь, содержащую геном, происходящий от генетически модифицированной клетки-предшественника мыши. В одном варианте осуществления хозяином является эмбрион. В конкретном варианте осуществления хозяина выбирают из зародыша мыши до морулы (например, стадии 8 или 4 клеток), тетраплоидного эмбриона, агрегата эмбриональных клеток или бластоцисты.
В одном аспекте предоставляется способ создания генетически модифицированной мыши, описываемой здесь, включающий введение посредством переноса в ядро нуклеиновой кислоты, содержащей описываемую здесь модификацию, в клетку и поддержание клетки в подходящих условиях (например, включающих культивирование клетки и вынашивание эмбриона, включающего эту клетку, суррогатной матерью) для развития в мышь, описываемую здесь.
В одном аспекте предоставляется способ создания модифицированной мыши, включающий модифицирование, как здесь описывается, мышиной эмбриональной стволовой клетки или плюрипотентной или тотипотентной или индуцированной плюрипотентной мышиной клетки с включением одного или более нереаранжированных сегментов, используемых при образовании генов вариабельных областей легких цепей иммуноглобулинов, функционально связанных с последовательностью константной области тяжелой цепи иммуноглобулина, культивирование эмбриональной стволовой клетки, введение подвергнутой культивированию эмбриональной стволовой клетки в эмбрион-хозяина для образования химерного эмбриона и введения химерного эмбриона в подходящего хозяина-мышь для развития в модифицированную мышь. В одном варианте осуществления одним или более нереаранжированных сегментов, используемых при образовании генов вариабельных областей легких цепей иммуноглобулинов, являются генные сегменты λ или κ человека. В одном варианте осуществления один или более нереаранжированных сегментов, используемых при образовании генов вариабельных областей легких цепей иммуноглобулинов, включают Vλ- или Vκ-сегменты человека и один или более Jλ-, Jκ- или JH-сегментов. В одном варианте осуществления последовательностью гена константной области тяжелой цепи является последовательность человека, выбираемая из последовательности CH1, шарнирной области, CH2, CH3 и их комбинации. В одном варианте осуществления один или более нереаранжированных сегментов, используемых при образовании генов вариабельных областей легких цепей иммуноглобулинов, заменяют все или по существу все функциональные эндогенные мышиные сегменты, используемые при образовании генов вариабельных областей тяжелых цепей иммуноглобулинов, в эндогенном мышином локусе, кодирующем тяжелые цепи, а последовательностью константной области тяжелой цепи является мышиная последовательность, включающая CH1, шарнирную область, CH2 и CH3.
В одном аспекте предоставляется вариабельная область (VR) иммуноглобулина (например, включающая последовательность VLчеловека, слитую с JL, или JH, или DH и JH, или DH и JL человека), созданная в мыши, как здесь описывается. В конкретном варианте осуществления VR иммуноглобулина происходит от генного сегмента человека зародышевого типа, выбираемого Vκ-сегмента и Vλ-сегмента, причем VR кодируется реаранжированной последовательностью мыши, причем реаранжированная последовательность является соматически гипермутированной. В одном варианте осуществления реаранжированная последовательность включает 1-5 соматических гипермутаций. В одном варианте осуществления реаранжированная последовательность включает по меньшей мере 6, 7, 8, 9 или 10 соматических гипермутаций. В одном варианте осуществления реаранжированная последовательность включает более чем 10 соматических гипермутаций. В одном варианте осуществления реаранжированная последовательность слита с одной или более последовательностей константных областей тяжелых цепей человека или мыши (например, выбираемых из CH1, шарнирной области, CH2, CH3 человека или мыши и их комбинации).
В одном аспекте предоставляется аминокислотная последовательность вариабельного домена иммуноглобулина - связывающего белка, выработанного у мыши, описываемой здесь. В одном варианте осуществления VR слита с одной или более последовательностей константных областей тяжелых цепей человека или мыши (например, выбираемых из CH1, шарнирной области, CH2, CH3 человека или мыши и их комбинации).
В одном аспекте предоставляется вариабельный домен легкой цепи, кодируемый последовательностью нуклеиновой кислоты, полученной от описываемой здесь мыши.
В одном аспекте предоставляется антитело или его антигенсвязывающий фрагмент (например, Fab, F(ab)2, scFv), которое было выработано у описываемой здесь мыши или происходит от последовательности, созданной в мыши, описываемой здесь.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
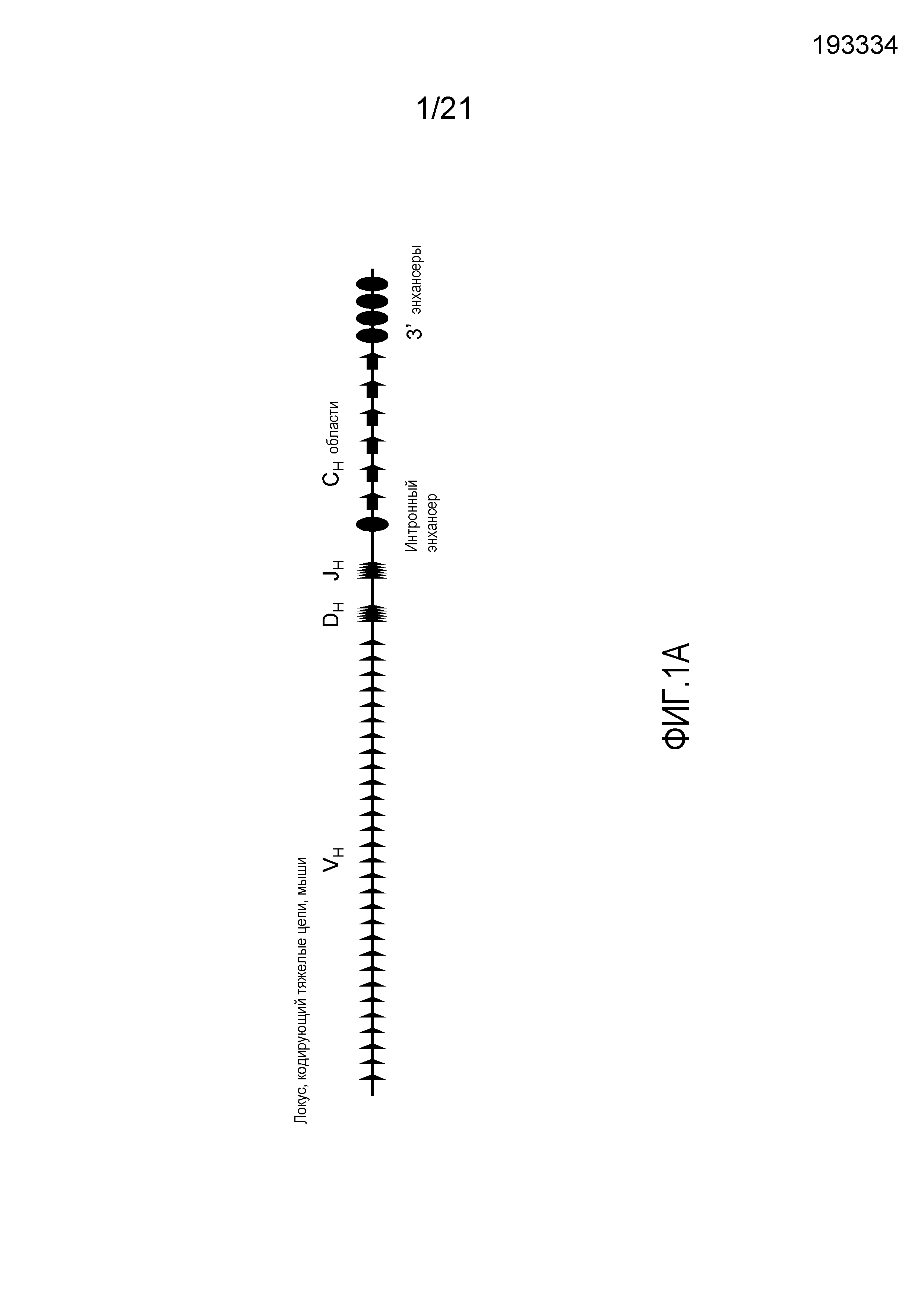
На фиг.1A демонстрируется схема (не в масштабе) мышиного локуса, кодирующего тяжелые цепи. Длина локуса, кодирующего тяжелые цепи мыши, составляет приблизительно 3 Мб, и он содержит приблизительно 200 генных сегментов VH, 13 генных сегментов DH и 4 генных сегмента JH, а также энхансеры (Enh) и последовательности константных областей тяжелых цепей (CH).
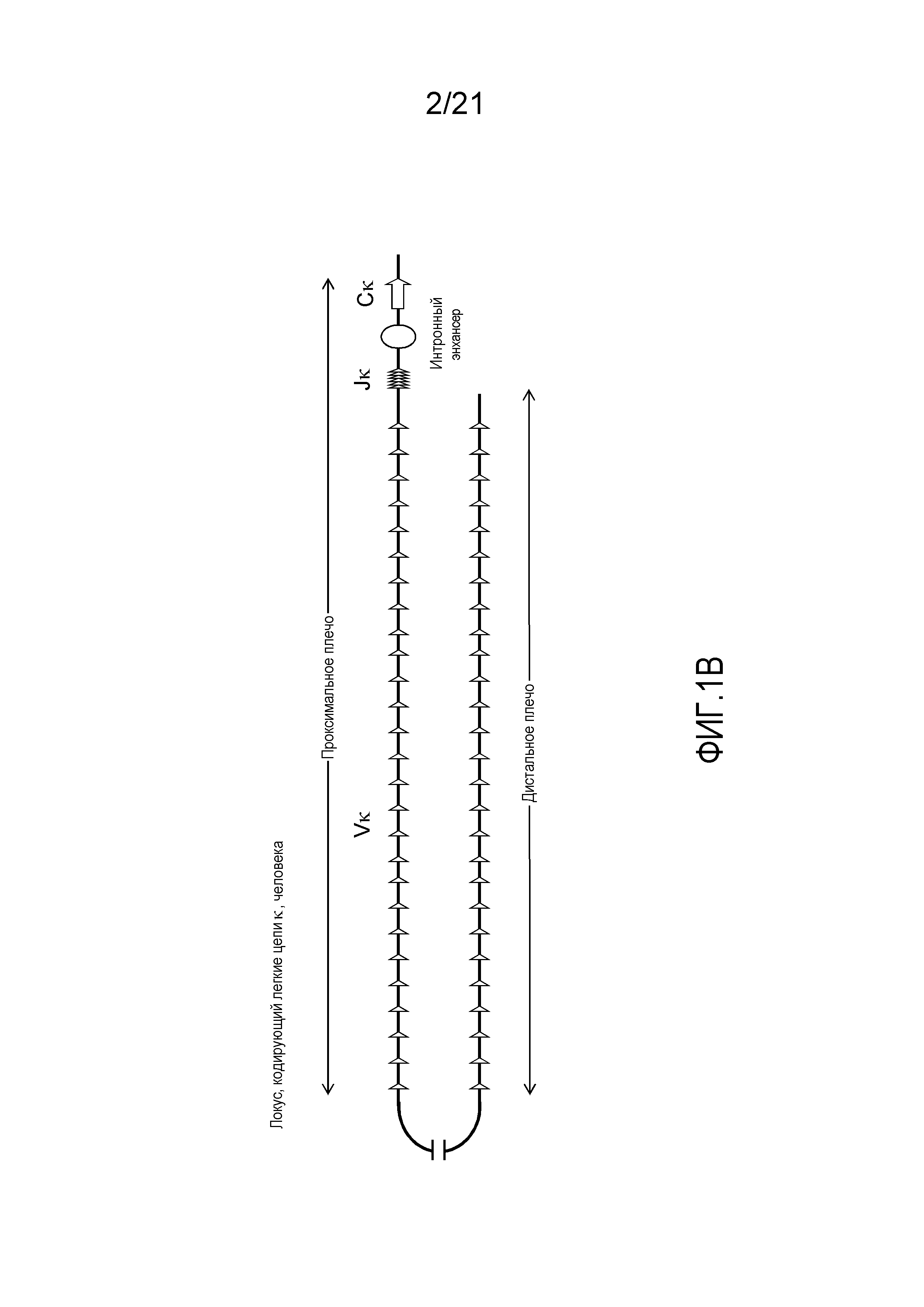
На фиг.1В демонстрируется схема (не в масштабе) локуса, кодирующего легкие цепи κ, человека. Локус, кодирующий легкие цепи κ, человека дублируется в дистальном и проксимальном контингах противоположной полярности, охватывающих приблизительно 440 т.п.о. и 600 т.п.о., соответственно. Между двумя контингами находится ДНК размером приблизительно 800 т.п.о., которая, как полагают, не содержит генные сегменты Vκ. Локус, кодирующий легкие цепи κ, человека содержит приблизительно 76 генных сегментов Vκ, 5 генных сегментов Jκ, интронный энхансер (Enh) и одну последовательность константной области (Cκ).
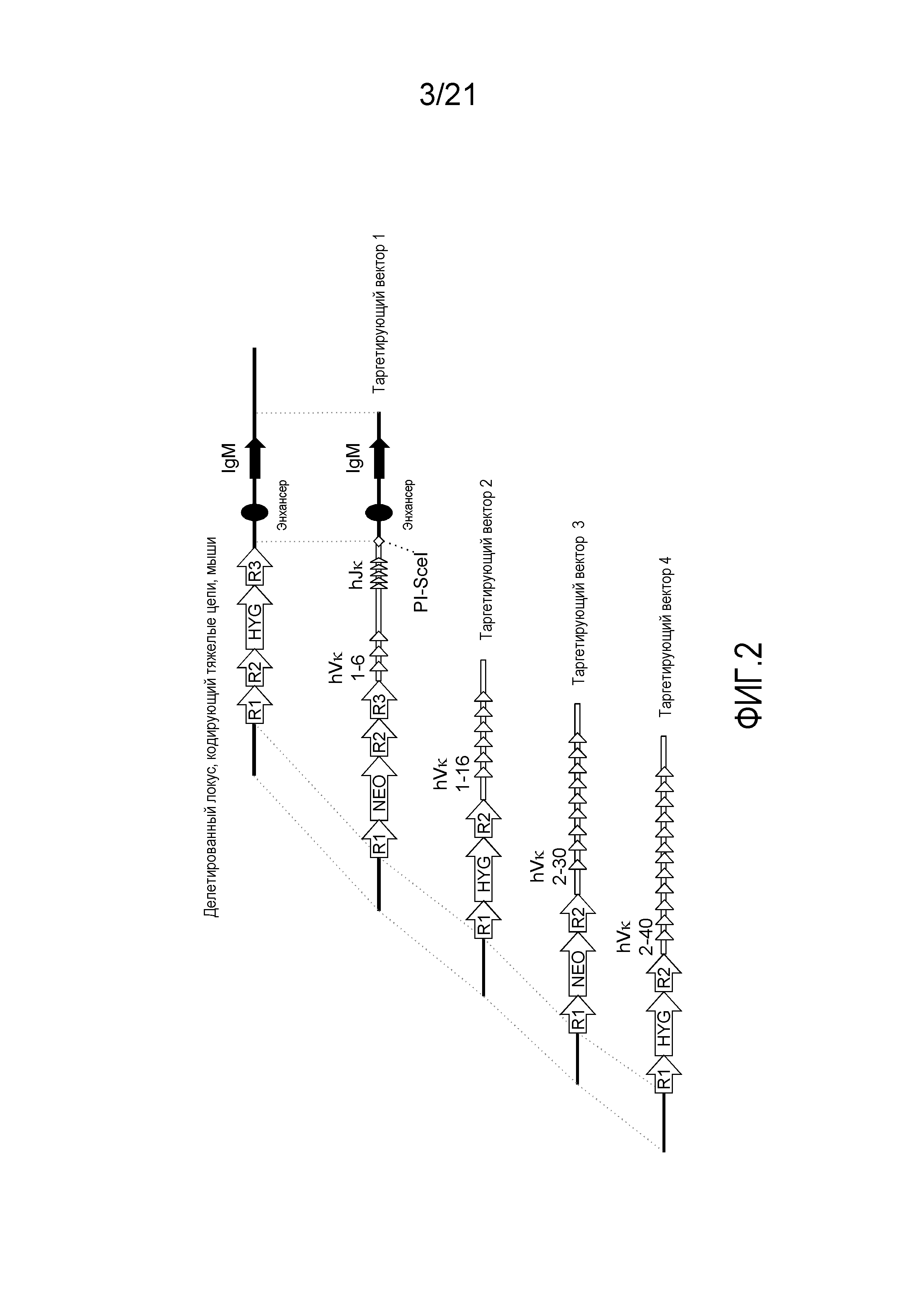
На фиг.2 представлена стратегия таргетирования для последовательного встраивания 40 генных сегментов Vκ человека и 5 генных сегментов Jκ человека в мышиный локус, кодирующий тяжелые цепи. Представлены кассеты устойчивости к гигромицину (HYG) и неомицину (NEO) вместе с сайтами распознавания рекомбиназой (R1, R2 и т.д.).
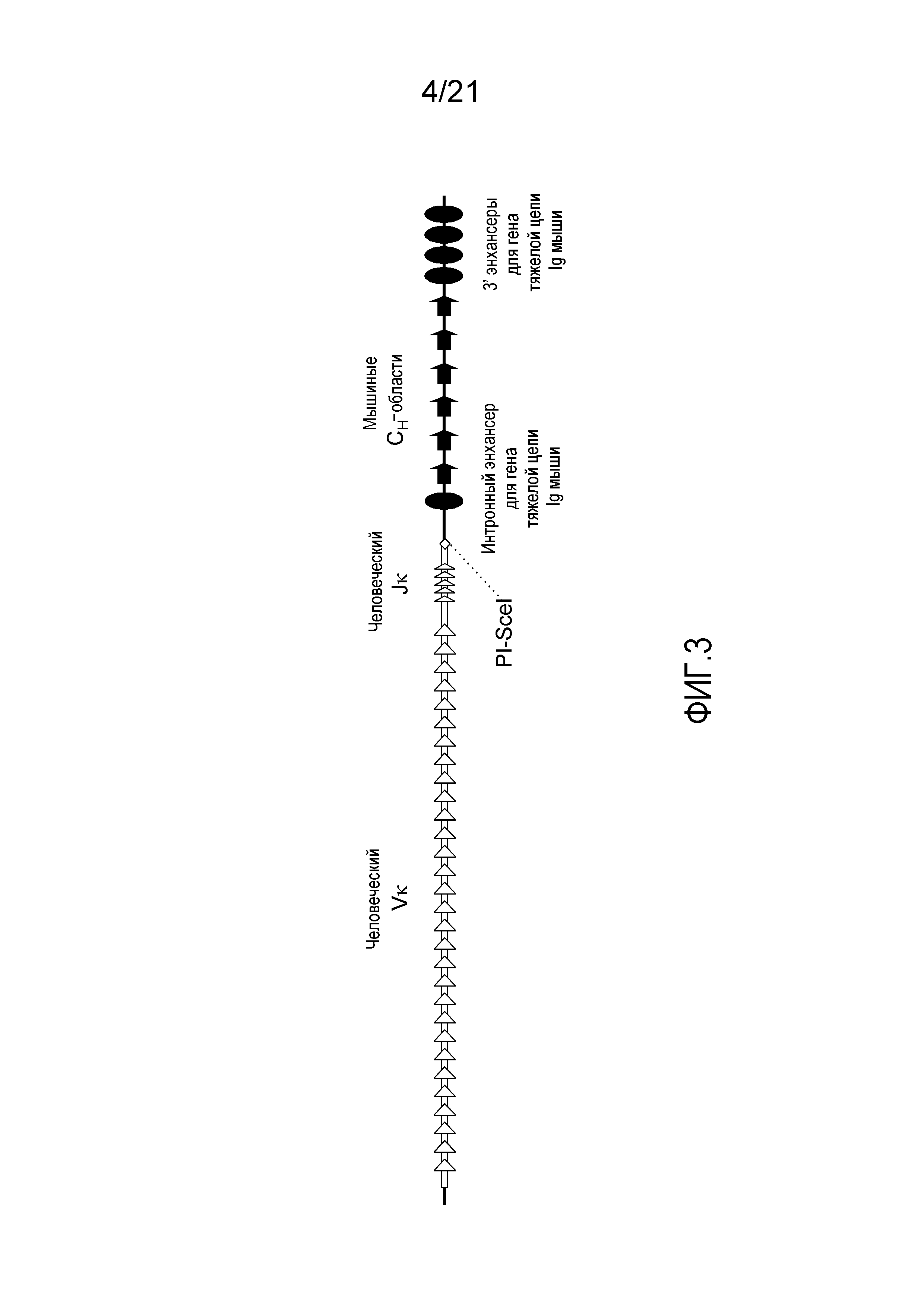
На фиг.3 представлен модифицированный мышиный локус для тяжелых цепей, включающий генные сегменты Vκ и Jκ человека, функционально связанные с мышиными CH-областями.
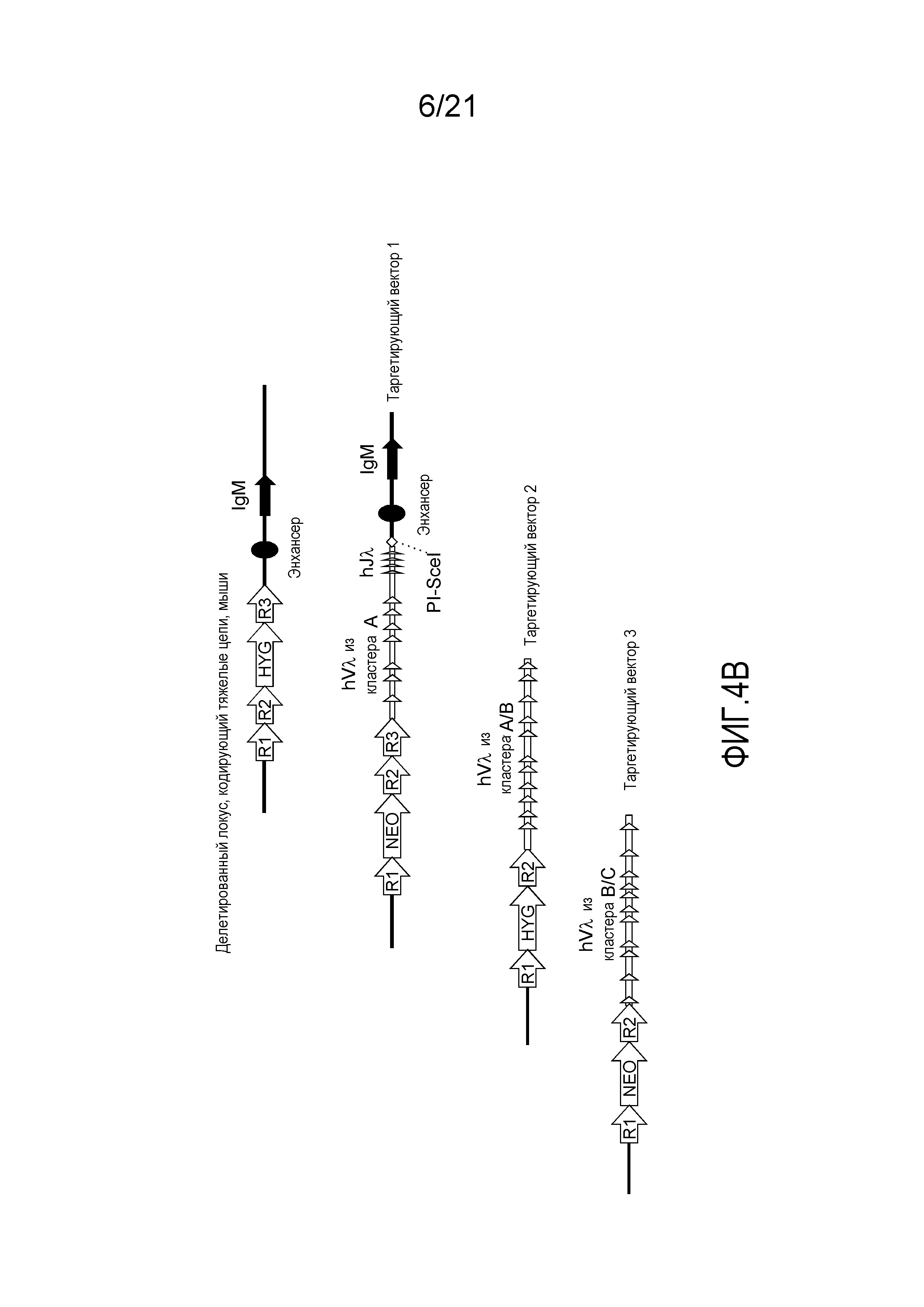
На фиг.4А представлена приводимая в качестве примера стратегия таргетирования для последовательного встраивания Vλ человека и одного генного сегмента Jλ человека в мышиный локус, кодирующий тяжелые цепи. Представлены кассеты устойчивости к гигромицину (HYG) и неомицину (NEO) вместе с сайтами распознавания рекомбиназой (R1, R2 и т.д.).
На фиг.4В представлена приводимая в качестве примера стратегия таргетирования для последовательного встраивания Vλ человека и четырех генных сегментов Jλ человека в мышиный локус, кодирующий тяжелые цепи. Представлены кассеты устойчивости к гигромицину (HYG) и неомицину (NEO) вместе с сайтами распознавания рекомбиназой (R1, R2 и т.д.).
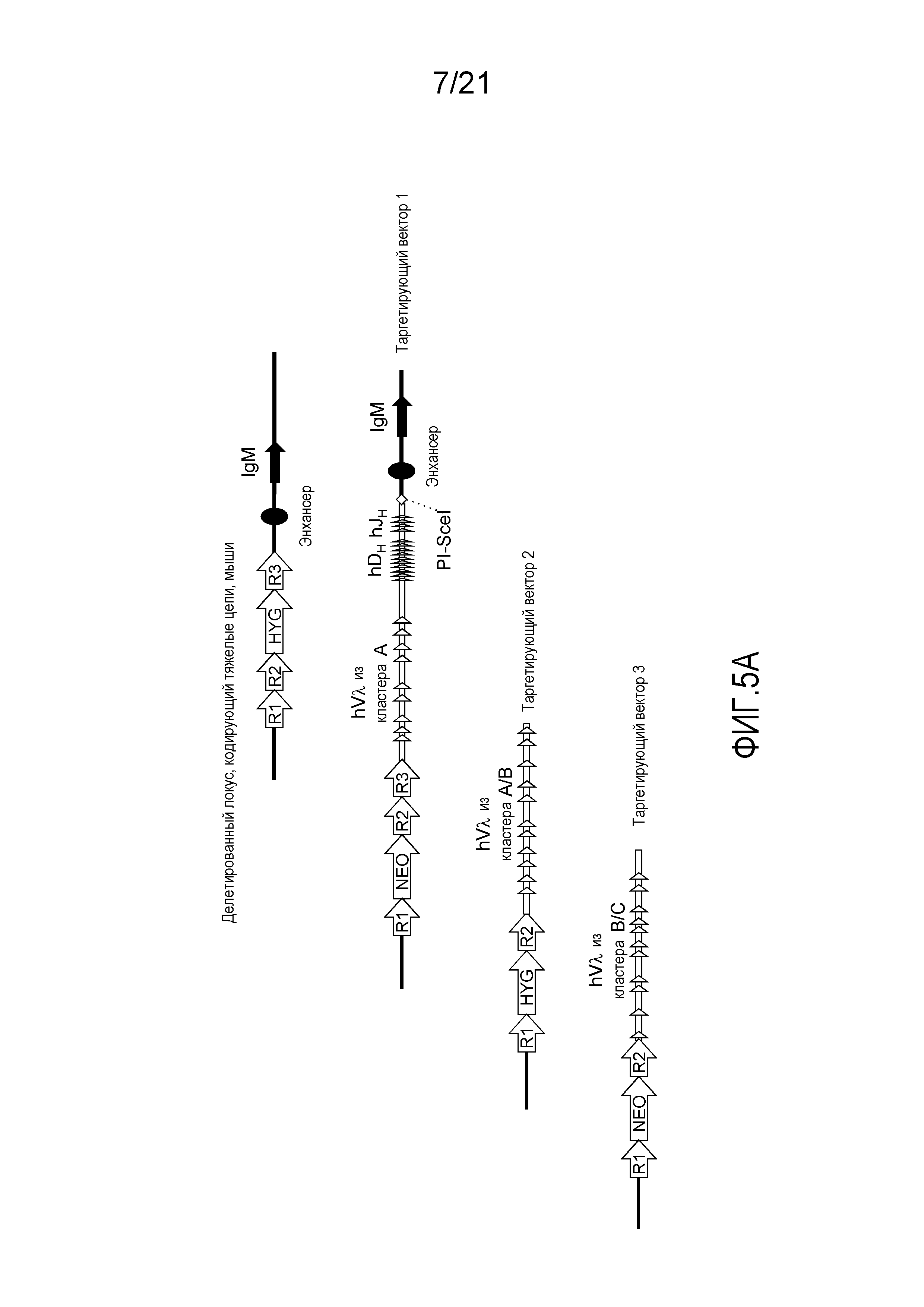
На фиг.5А представлена приводимая в качестве примера стратегия таргетирования для последовательного встраивания генных сегментов Vλ человека, DH человека и JH человека в мышиный локус, кодирующий тяжелые цепи. Представлены кассеты устойчивости к гигромицину (HYG) и неомицину (NEO) вместе с сайтами распознавания рекомбиназой (R1, R2 и т.д.).
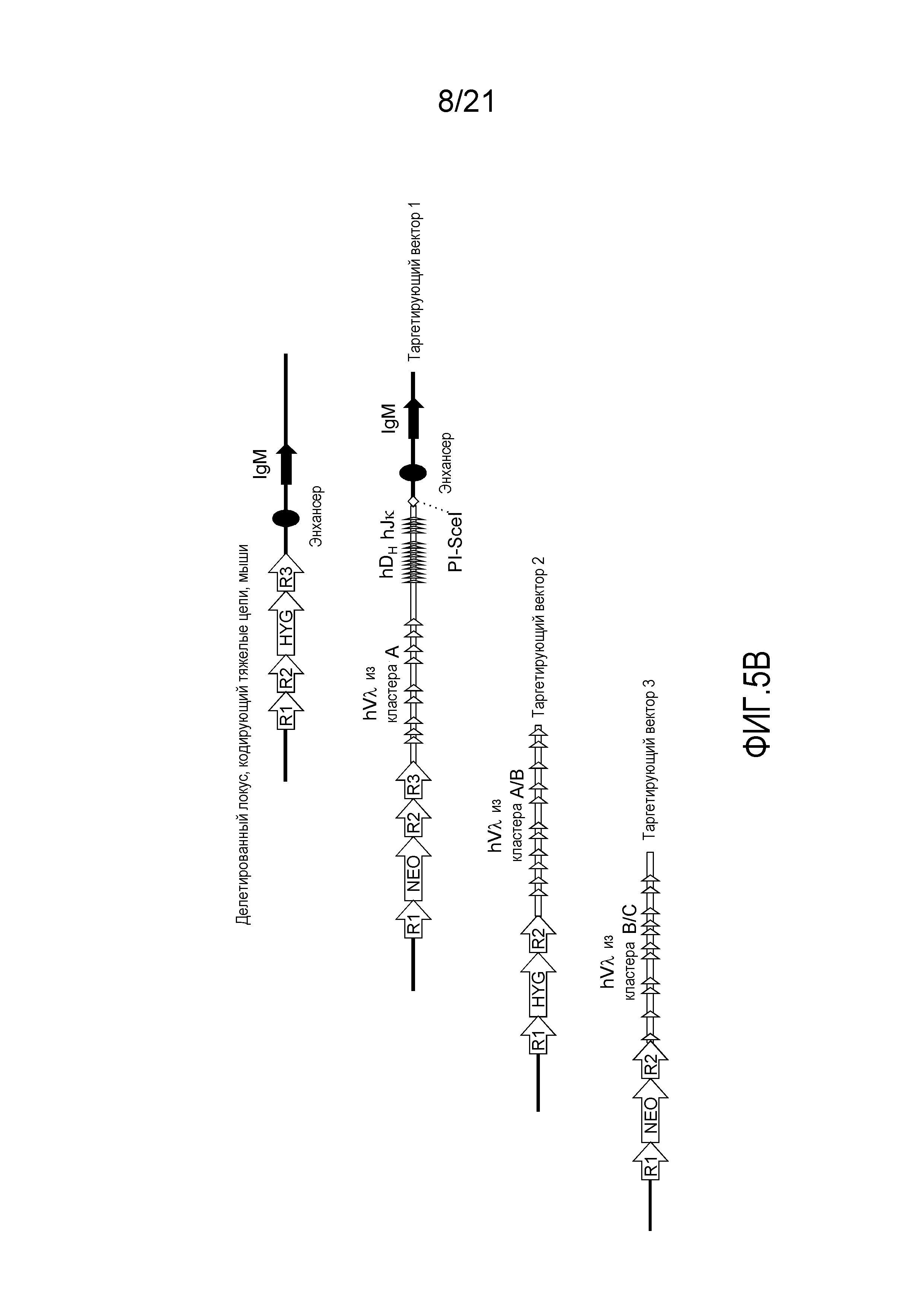
На фиг.5В представлена приводимая в качестве примера стратегия таргетирования для последовательного встраивания генных сегментов Vλ человека, DH человека и Jκ человека в мышиный локус, кодирующий тяжелые цепи. Представлены кассеты устойчивости к гигромицину (HYG) и неомицину (NEO) вместе с сайтами распознавания рекомбиназой (R1, R2 и т.д.).
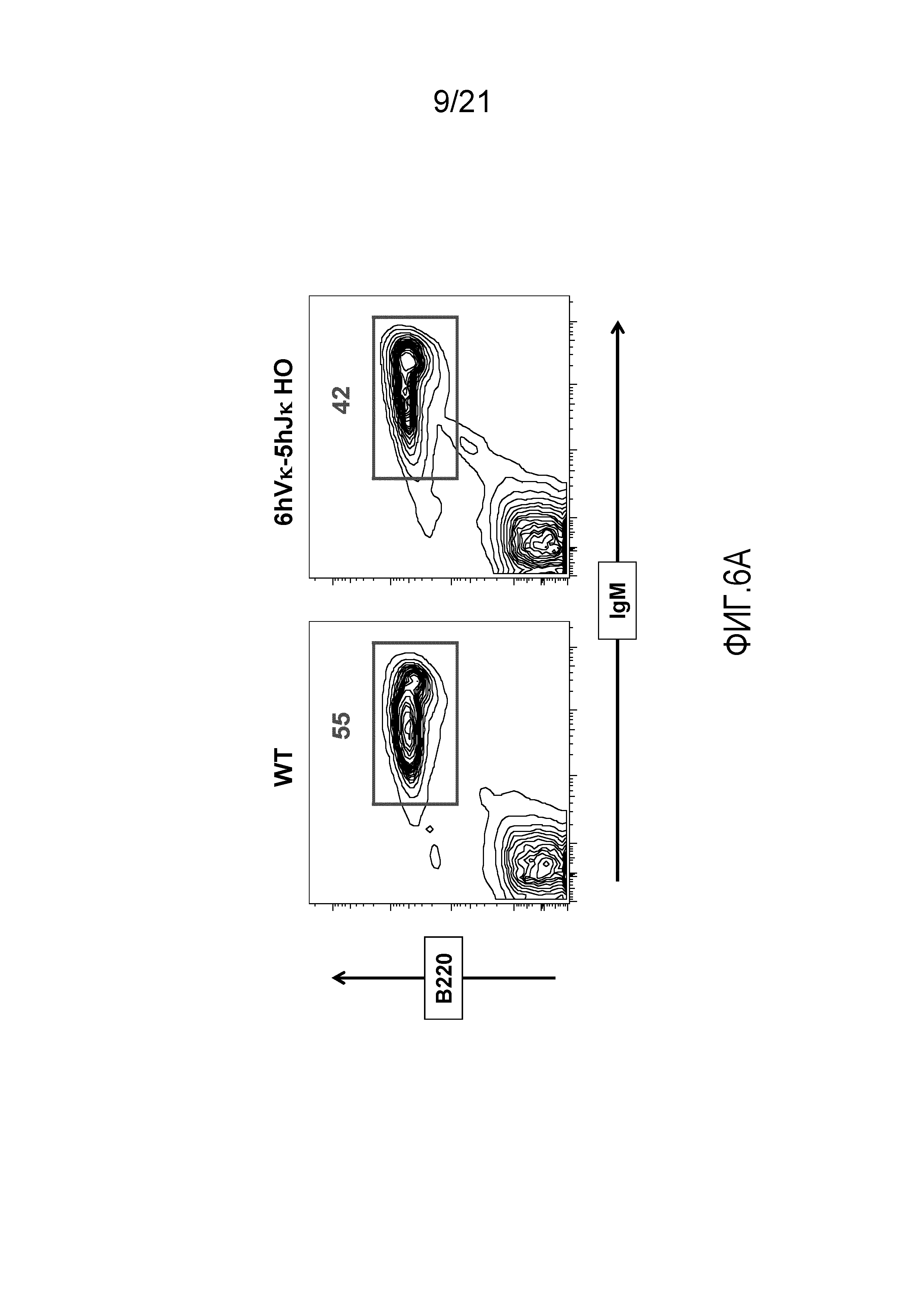
На фиг.6A представлены контурные изображения спленоцитов, окрашенных на предмет выявления экспрессии на поверхности B220 и IgM, у репрезентативной мыши дикого типа (WT) и репрезентативной мыши, гомозиготной по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO).
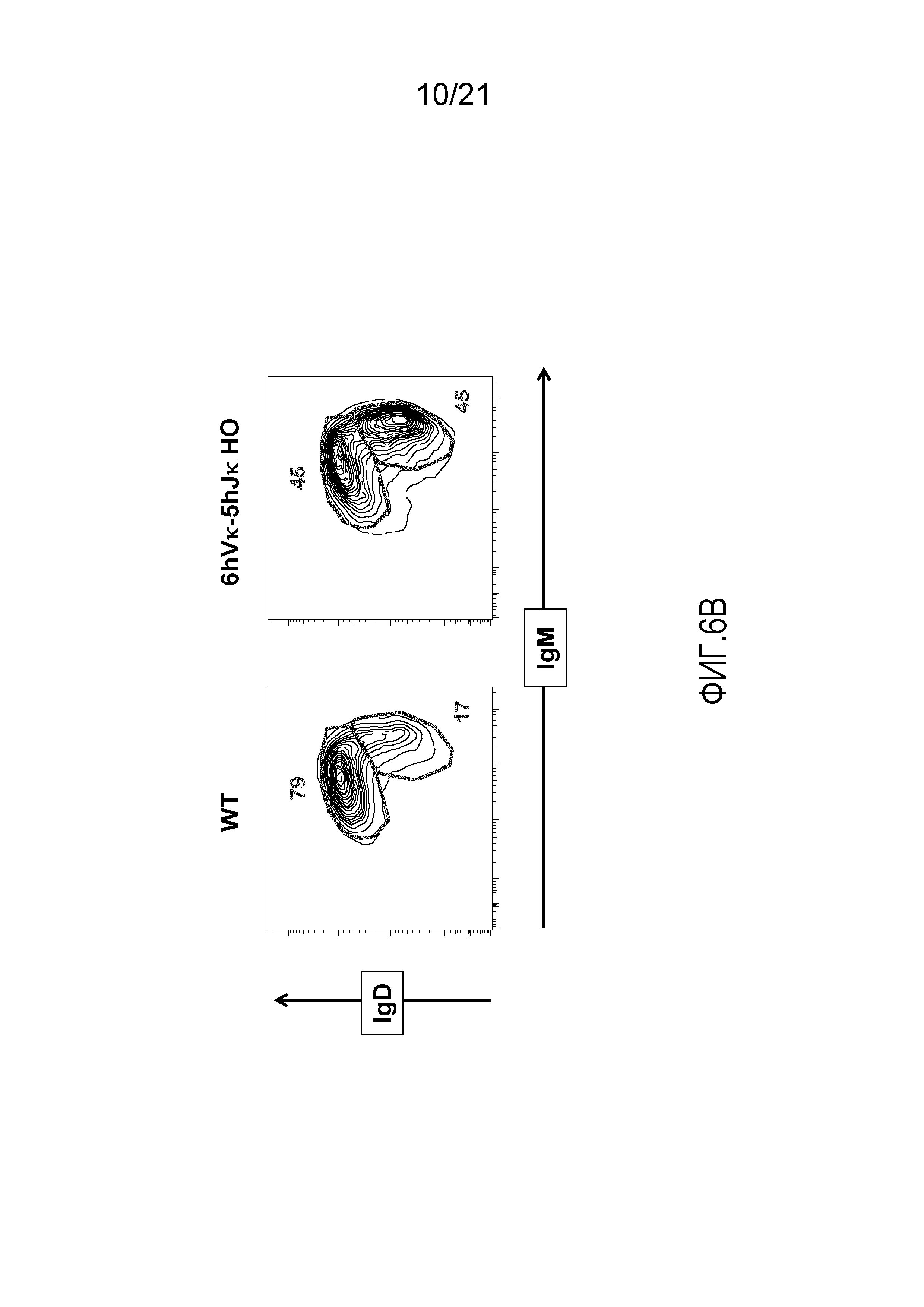
На фиг.6В представлены контурные изображения спленоцитов, обнаруживаемых в дискриминационном окне, соответствующем CD19+ B-клеткам, и окрашенных на предмет выявления иммуноглобулина D (IgD) и иммуноглобулина M (IgM), у репрезентативной мыши дикого типа (WT) и репрезентативной мыши, гомозиготной по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO).
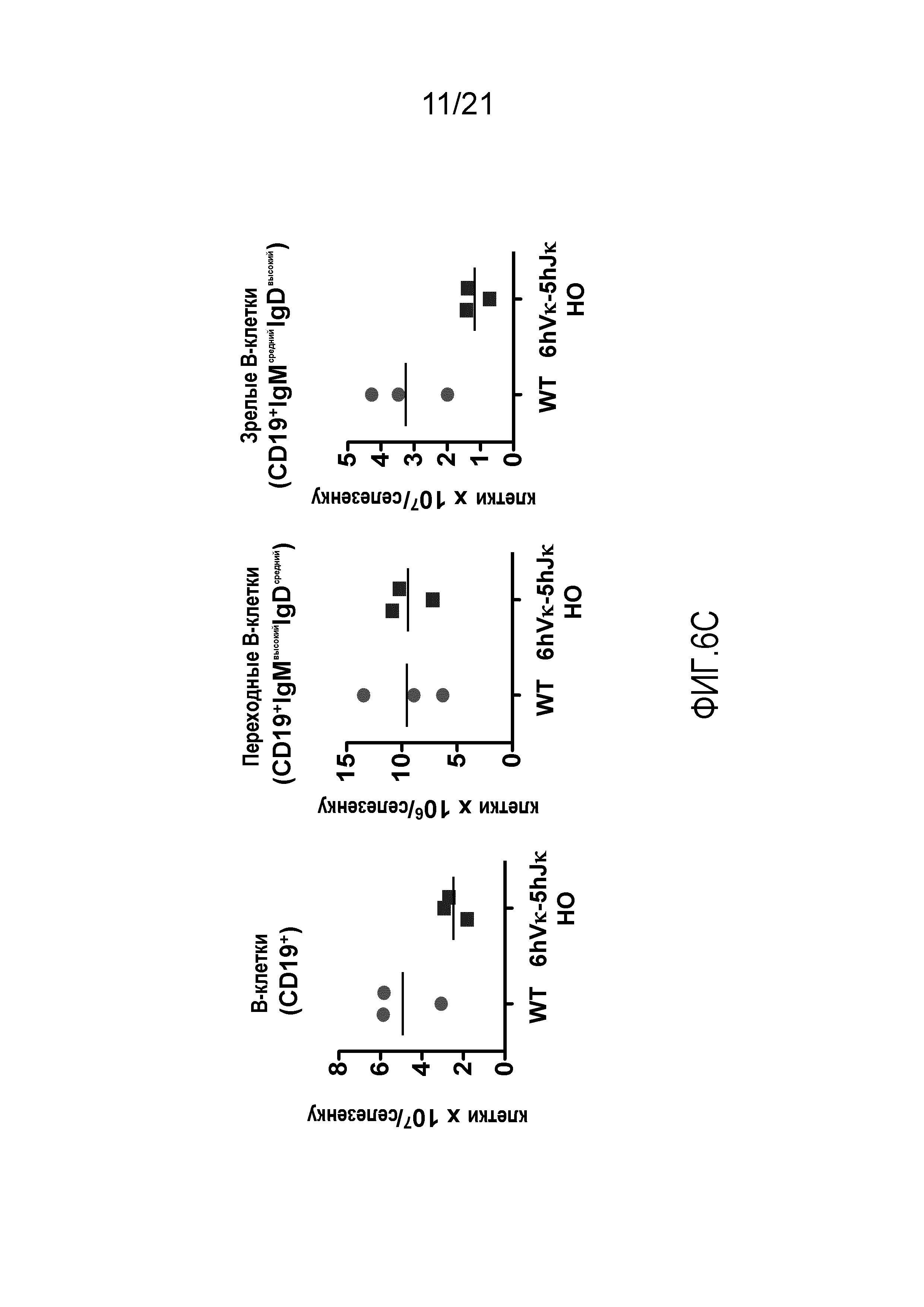
На фиг.6C продемонстрировано общее количество CD19+B-клеток, переходных B-клеток (CD19+IgMвысокийIgDсредний) и зрелых B-клеток (CD19+IgMсреднийIgDвысокий) в селезенках, полученных от мышей дикого типа (WT) и мышей, гомозиготных по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO).
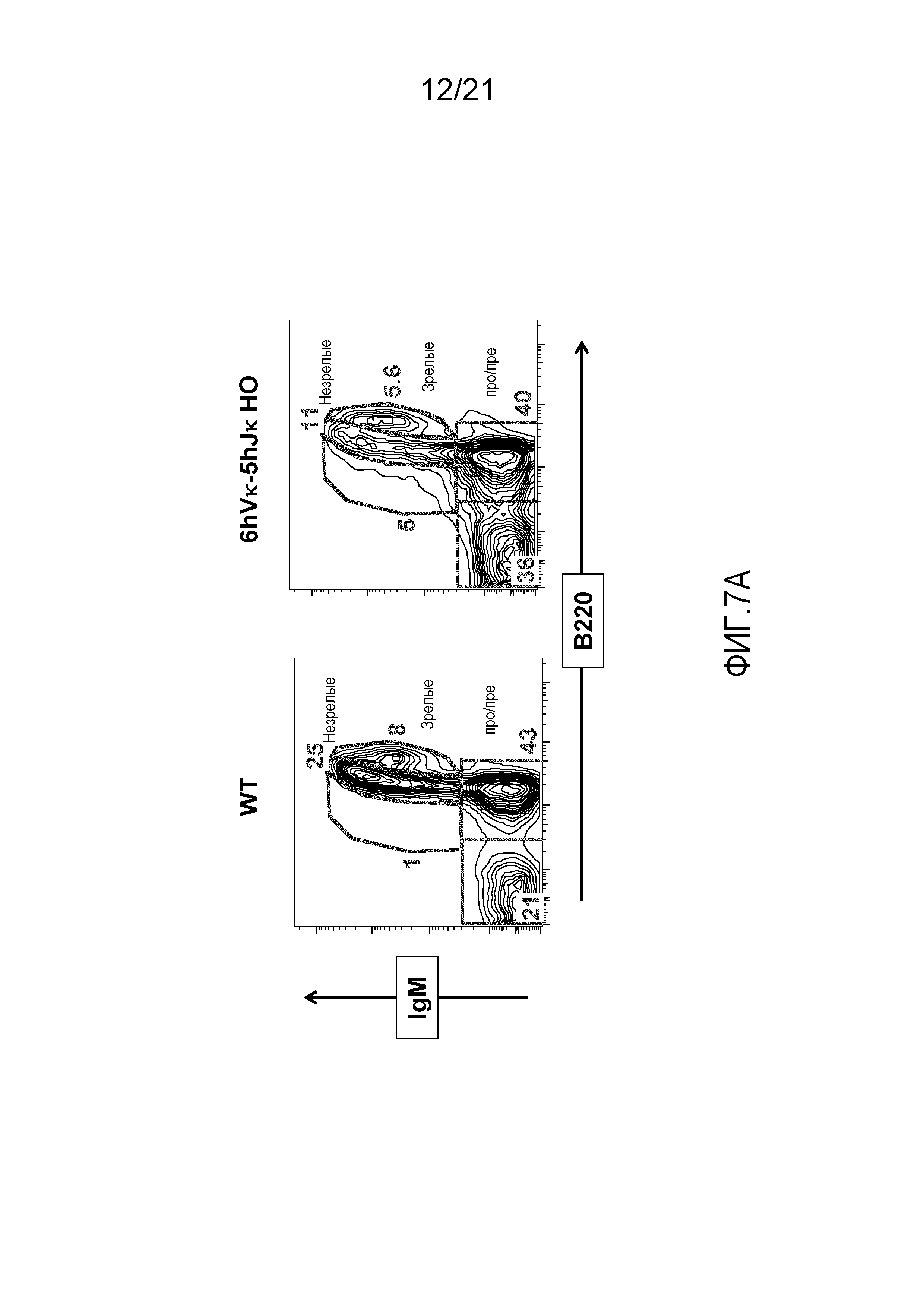
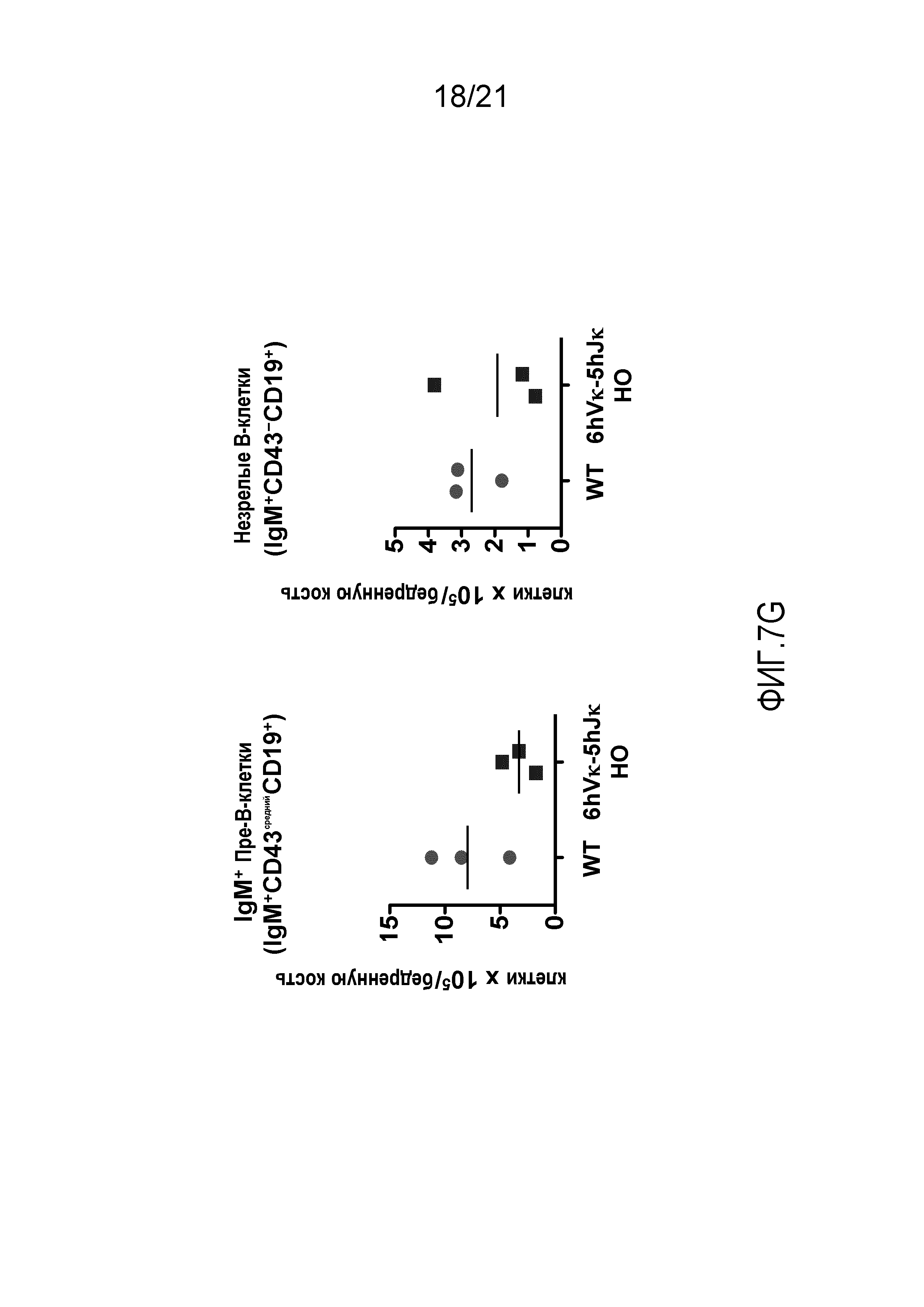
На фиг.7A представлены контурные изображения клеток костного мозга в дискриминационных окнах, соответствующих синглетам, окрашенных на предмет выявления иммуноглобулина M (IgM) и B220, у мыши дикого типа (WT) и мыши, гомозиготной по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO). В каждом точечном элементе изображения отмечены незрелые, зрелые и про/пре-B-клетки.
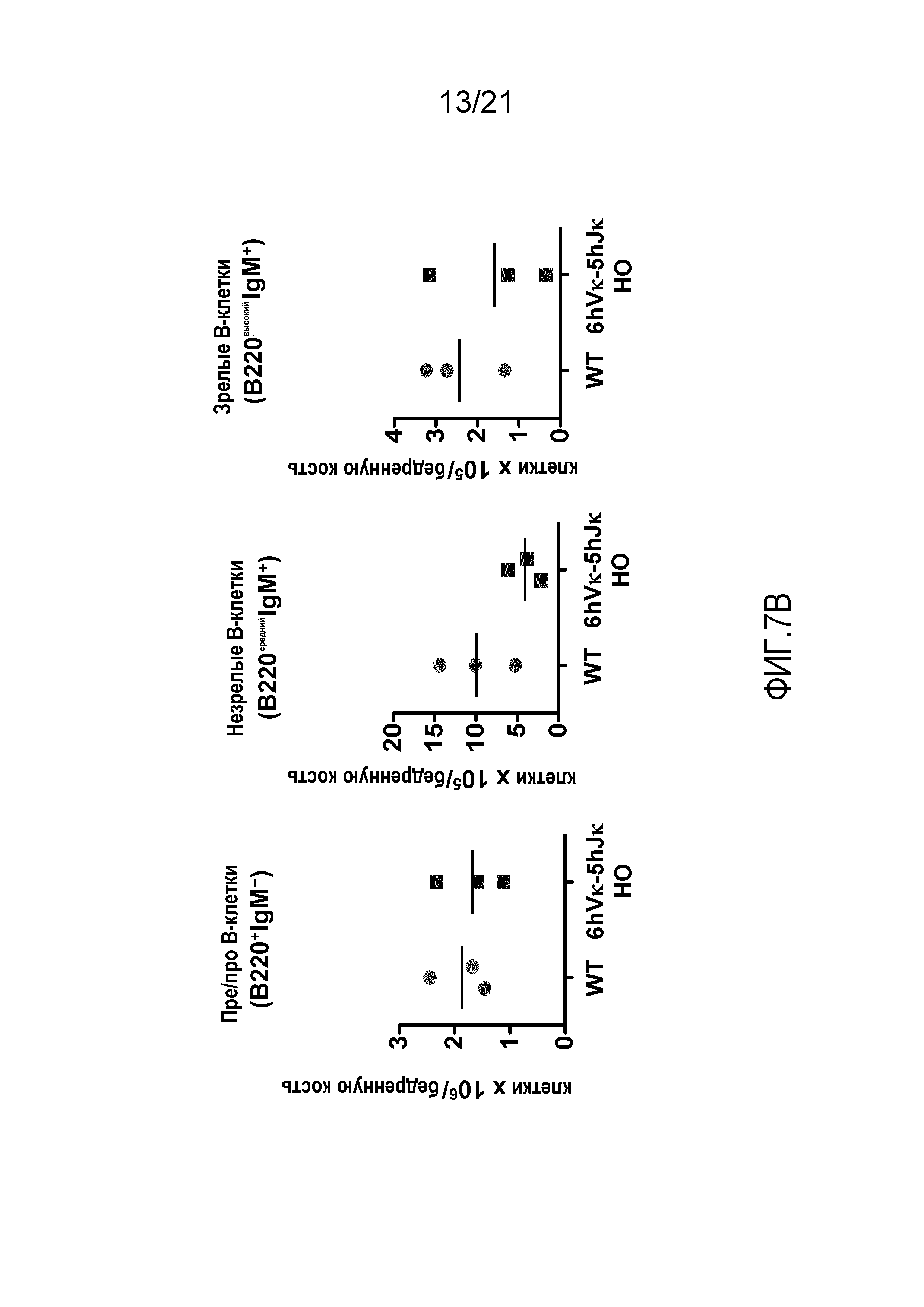
На фиг.7В продемонстрировано общее количество пре/про-В-клеток (B220+IgM-), незрелых (B220среднийIgM+) и зрелых (B220высокийIgM+) B-клеток в костном мозге, выделенном из бедренных костей мышей дикого типа (WT) и мышей, гомозиготных по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO).
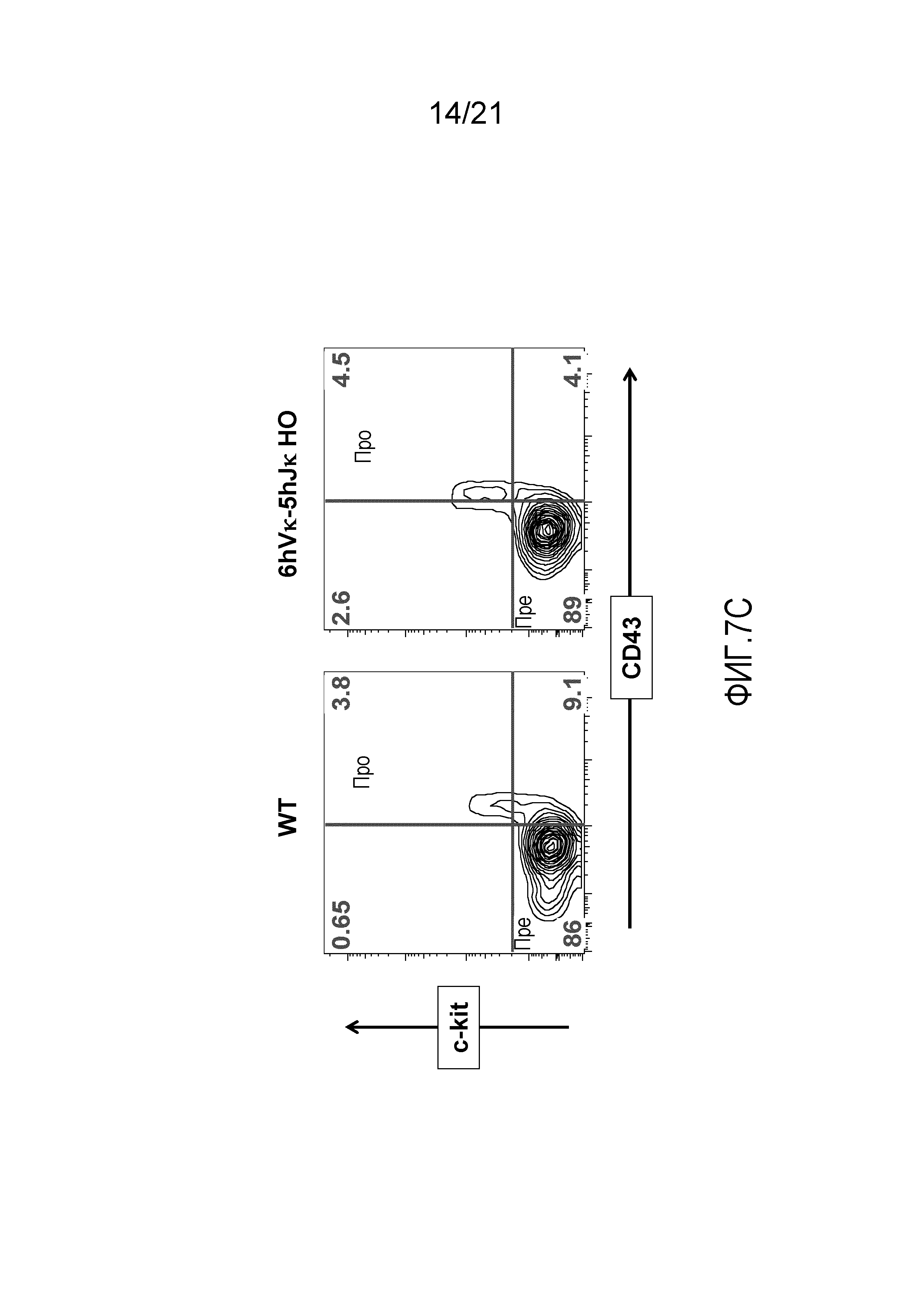
На фиг.7С представлены контурные изображения клеток костного мозга, обнаруживаемых в дискриминационном окне, соответствующем CD19+, и окрашенных на предмет выявления ckit+ и CD43+, у мыши дикого типа (WT) и мыши, гомозиготной по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO). В каждом точечном элементе изображения отмечены про- и пре-B-клетки.
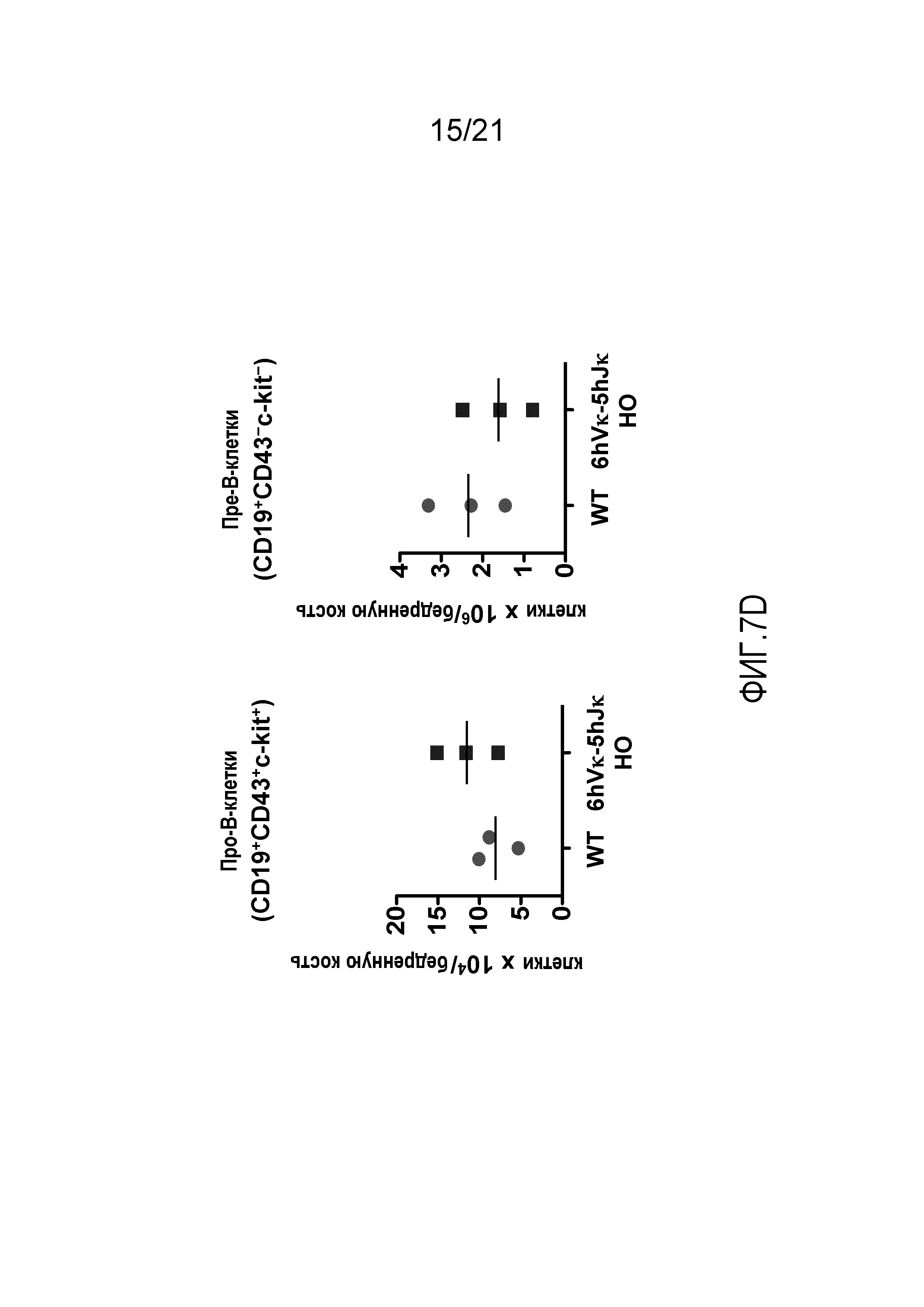
На фиг.7D продемонстрировано количество про-В-клеток (CD19+CD43+ckit+) и пре-В-клеток (CD19+CD43-ckit-) в костном мозге, полученном из бедренных костей мышей дикого типа (WT) и мышей, гомозиготных по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO).
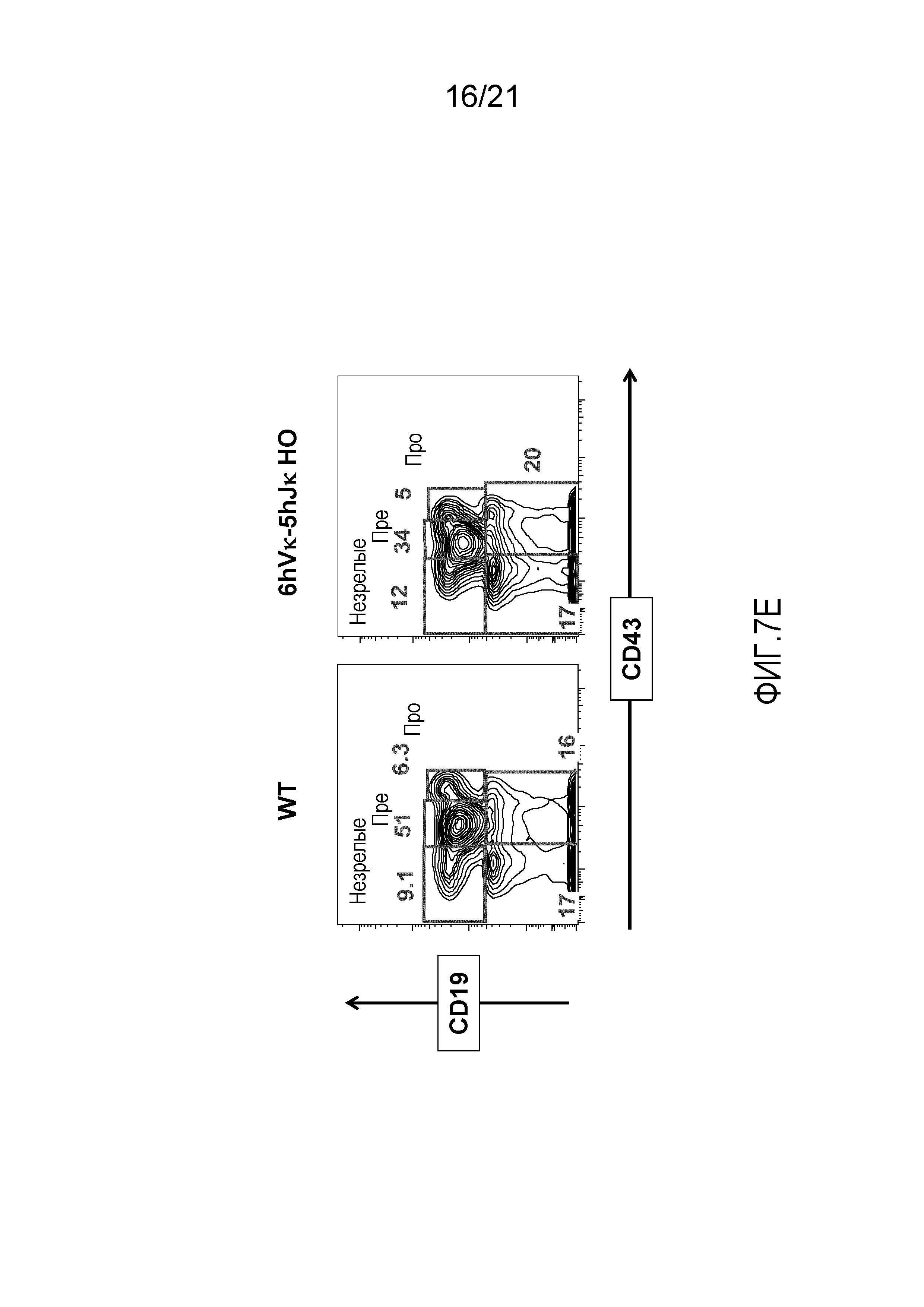
На фиг.7Е представлены контурные изображения клеток костного мозга в дискриминационных окнах, соответствующих синглетам, окрашенных на предмет выявления CD19 и CD43, у мыши дикого типа (WT) и мыши, гомозиготной по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO). В каждом точечном элементе изображения отмечены незрелые, пре- и про-B-клетки.
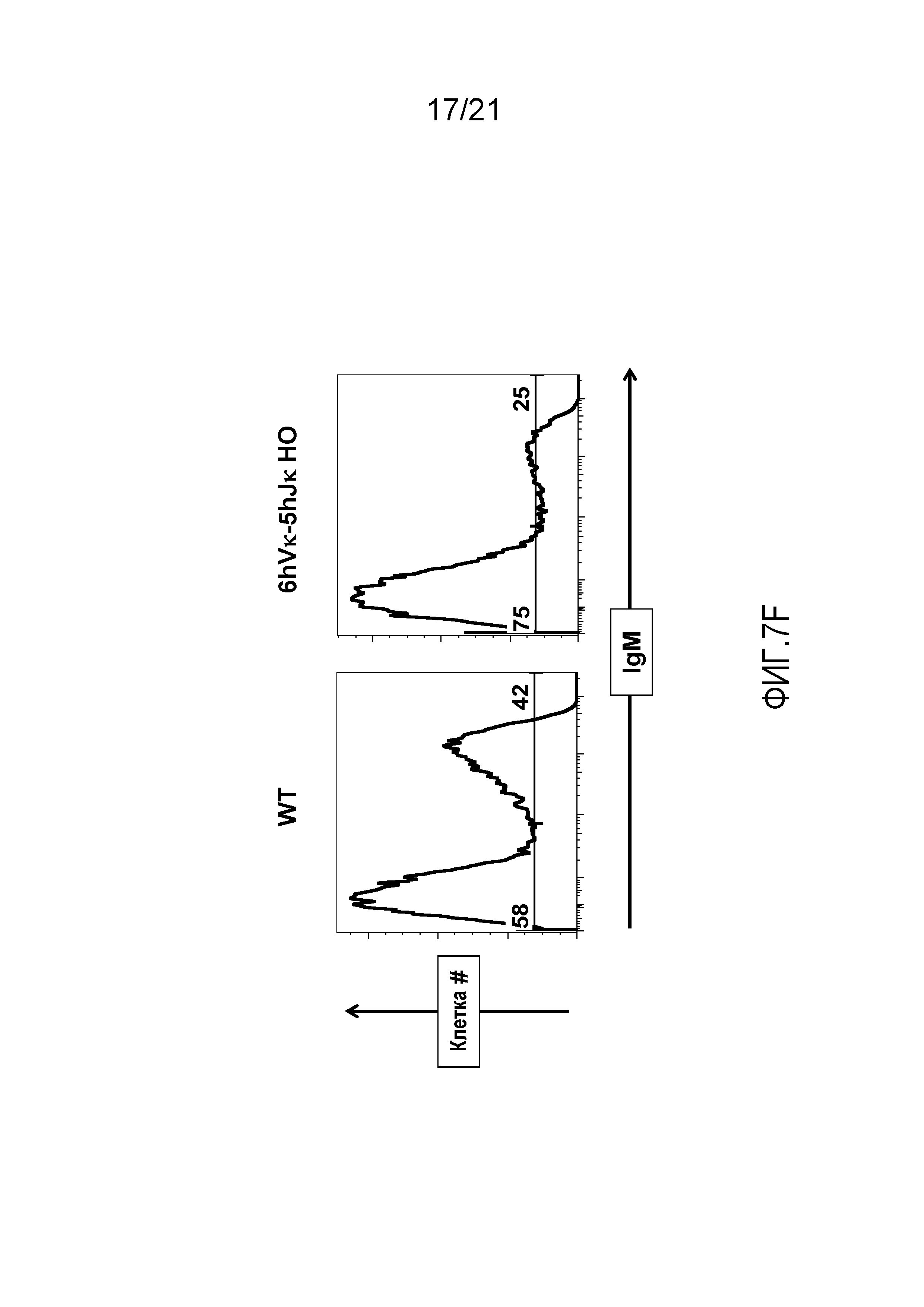
На фиг.7F представлены гистограммы клеток костного мозга, обнаруживаемых в дискриминационном окне, соответствующем пре-В-клеткам (CD19+CD43средний), и экспрессирующих иммуноглобулин M (IgM), у мыши дикого типа (WT) и мыши, гомозиготной по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO).
На фиг.7G продемонстрировано количество IgM+ пре-B-клеток (CD19+IgM+CD43средний) и незрелых B-клеток (CD19+IgM+CD43-) в костном мозге, полученном из бедренных костей мышей дикого типа (WT) и мышей, гомозиготных по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, расположенным в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO).
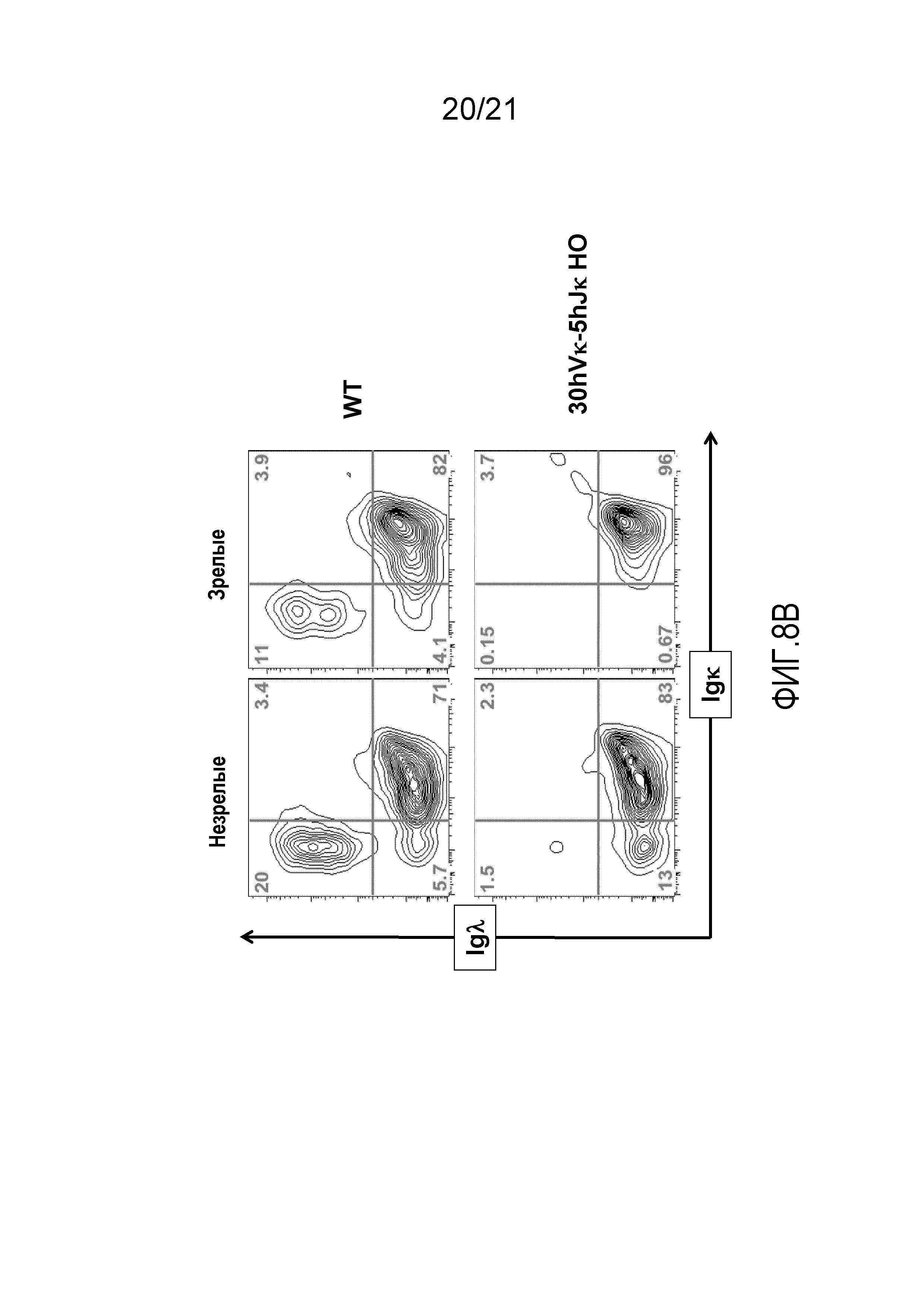
На фиг.8A представлены контурные изображения спленоцитов, обнаруживаемых в дискриминационном окне, соответствующем CD19+, и окрашенных на предмет выявления экспрессии Igλ+ и Igκ+, у мыши, содержащей локус для тяжелых цепей дикого типа и замену эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека, (WT) и мыши, гомозиготной по тридцати генным сегментам hVκ и пяти генным сегментам Jκ в эндогенном локусе для тяжелых цепей и замене эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека, (30hVκ-5hJκ HO).
На фиг.8В представлены контурные изображения клеток костного мозга в дискриминационных окнах, соответствующих незрелым (B220среднийIgM+) и зрелым (B220высокийIgM+) B-клеткам, окрашенных на предмет выявления экспрессии Igλ и Igκ, выделенных из бедренных костей мыши, содержащей локус для тяжелых цепей дикого типа и замену эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека, (WT) и мыши, гомозиготной по тридцати генным сегментам hVκ и пяти генным сегментам Jκ в эндогенном локусе для тяжелых цепей и замене эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека, (30hVκ-5hJκ HO).
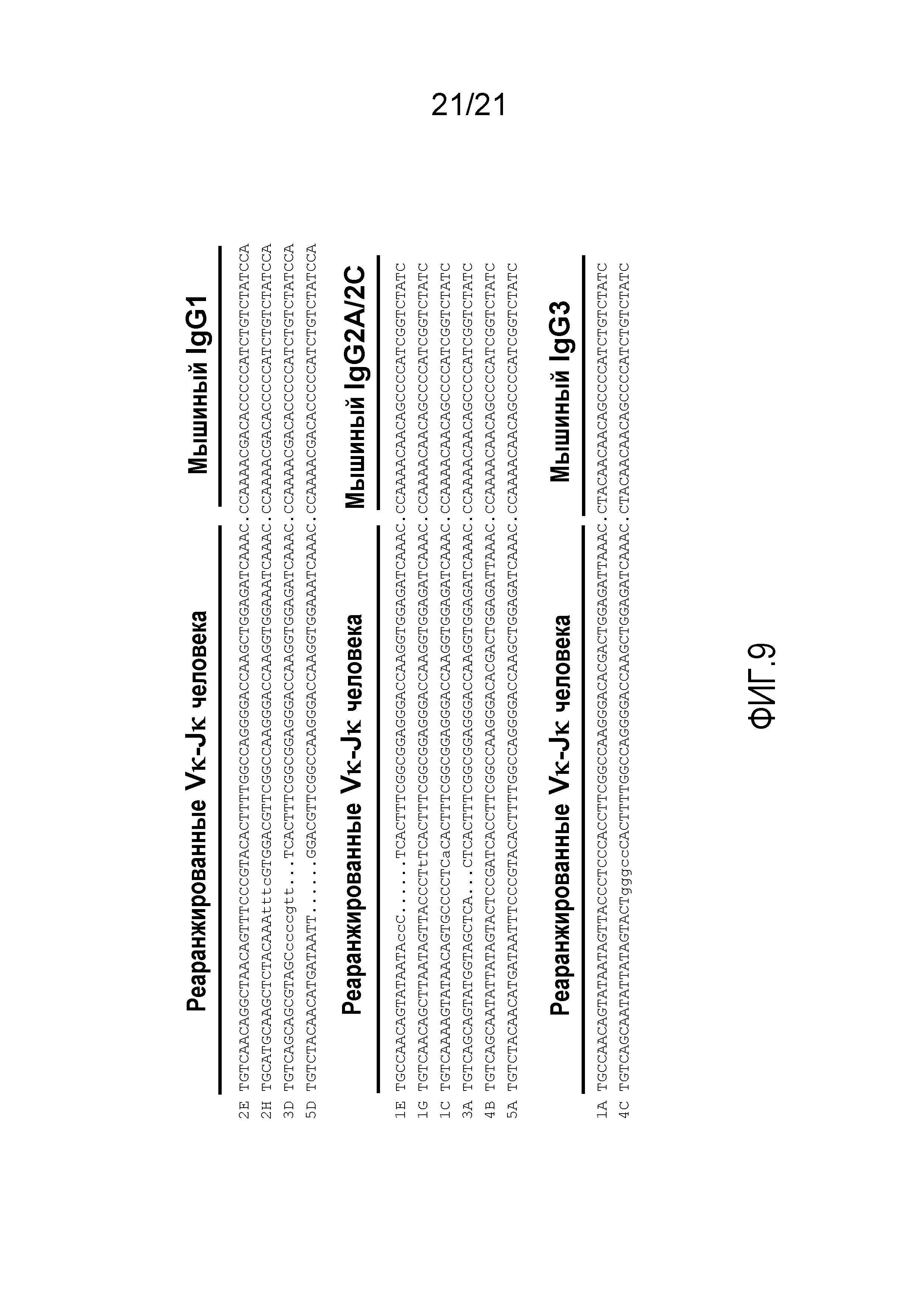
На фиг.9 представлено совмещение нуклеотидных последовательностей соединения Vκ-Jκ-mIgG в двенадцати независимых клонах, полученных с помощью ОТ-ПЦР, амплифицированных из РНК спленоцитов необученных мышей, гомозиготных по тридцати генным сегментам hVκ и пяти генным сегментам Jκ в мышином локусе для тяжелой цепи и замене эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека. Представленные строчными буквами основания означают основания не зародышевого типа, являющиеся следствием либо мутации и/или N-добавления во время рекомбинации. Искусственные интервалы (точки) включены для правильного совмещения каркасной области 4 и указывают на совмещение нуклеотидной последовательности для тяжелой цепи IgG мыши в случае клонов, полученных с использованием праймеров для IgG1, IgG2a/c и IgG3.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Выражение «биспецифический связывающий белок» включает связывающий белок, способный к селективному связыванию двух или более эпитопов. Биспецифические связывающие белки включают два различных полипептида, которые включают первый вариабельный домен легкой цепи (VL1), слитый с первой CH-областью, и второй вариабельный домен легкой цепи (VL2), слитый со второй CH-областью. Обычно первая и вторая CH-области являются идентичными, или они отличаются одной или более аминокислотными заменами (например, как описано здесь). VL1 и VL2 специфически связывают различные эпитопы - либо двух различных молекул (например, антигенов), либо одной и той же молекулы (например, одного и того же антигена). Если биспецифический связывающий белок селективно связывает два различных эпитопа (первый эпитоп и второй эпитоп), аффинность VL1 в отношении первого эпитопа будет, как правило, на по меньшей мере один-два или три или четыре порядка величины ниже аффинности VL1 в отношении второго эпитопа, и наоборот по отношению к VL2. Эпитопы, узнаваемые биспецифическим связывающим белком, могут быть на одной и той мишени или на различных мишенях (например, в одном и том же антигене или в различных антигенах). Биспецифические связывающие белки можно создать, например, посредством объединения VL1 и VL2, которые распознают различные эпитопы одного и того же антигена. Например, последовательности нуклеиновых кислот, кодирующие последовательности VL, которые распознают различные эпитопы одного и того же антигена, можно слить с последовательностями нуклеиновых кислот, кодирующими различные CH-области, и такие последовательности можно экспрессировать в клетке, которая экспрессирует легкую цепь иммуноглобулина, или можно экспрессировать в клетке, которая не экспрессирует легкую цепь иммуноглобулина. Типичный биспецифический связывающий белок имеет две тяжелые цепи, каждая из которых содержит три CDR легкой цепи, за которыми следует (от N-конца к C-концу) CH1-домен, шарнирная область, CH2-домен и CH3-домен, и легкую цепь иммуноглобулина, которая или не придает специфичность связывания с антигеном, но которая может объединяться с каждой из тяжелых цепей, или которая может объединяться с каждой из тяжелых цепей и может связывать один или более эпитопов, с которыми связывается VL1 и/или VL2, или которая может объединяться с каждой из тяжелых цепей и делает возможным связывание одной или обеих тяжелых цепей с одним или обоими эпитопами или содействует такому связыванию.
Следовательно, двумя общими типами биспецифических связывающих белков являются (1) VL1-CH(димер) и (2) VL1-CH:легкая цепь + VL2-CH:легкая цепь, причем легкие цепи являются одинаковыми или различными. В любом случае CH (т.е. константная область тяжелой цепи) может быть дифференциально модифицированной (например, чтобы дифференциально связываться с белком A, увеличивать период полужизни в кровяном русле и т.д.), как здесь описывается, или может быть одинаковой.
Термин «клетка», при использовании в связи с экспрессией последовательности, включает любую клетку, которая является подходящей для экспрессии рекомбинантной последовательности нуклеиновой кислоты. Клетки включают клетки прокариот и эукариот (одноклеточных или многоклеточных), бактериальные клетки (например, штаммы E. coli, Bacillus spp., Streptomyces spp. и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), клетки растений, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусами клетки насекомых, Trichoplusia ni и т.д.), клетки животных, не относящихся к человеку, клетки человека, B-клетки или слияния клеток, такие как, например, гибридомы или квадрогибридомы. В некоторых вариантах осуществления клеткой является клетка человека, обезьяны, человекообразной обезьяны, хомяка, крысы или мыши. В некоторых вариантах осуществления клетка является эукариотической и выбирается из следующих клеток: CHO (например, CHO K1, DXB-11 CHO, Veggie-CHO), COS (например, COS-7), клетки сетчатки, Vero, CV1, клетки почки (например, HEK293, 293 EBNA, MSR 293, MDCK, HaK, BHK), HeLa, HepG2, WI38, MRC 5, Colo205, HB 8065, HL-60, (например, BHK21), Jurkat, Daudi, A431 (эпидермальной), CV-1, U937, 3T3, L-клетки, клетки C127, SP2/0, NS-0, MMT 060562, клетки Сертоли, клетки BRL 3A, клетки HT1080, миеломной клетки, опухолевой клетки и линии клеток, происходящей из вышеупомянутой клетки. В некоторых вариантах осуществления клетка включает один или более вирусных генов, например клетка сетчатки, которая экспрессирует вирусный ген (например, клетка PER.C6TM).
Термин «когнатный», при использовании в смысле «когнатный по отношению к», например, первый VL-домен, который является «когнатным по отношению ко» второму VL-домену, как предполагается, включает ссылку на связь между двумя VL-доменами одного и того же связывающего белка, вырабатываемого у мыши в соответствии с настоящим изобретением. Например, мышь, которая является генетически модифицированной в соответствии с вариантом осуществления настоящего изобретения, например, мышь, содержащая локус, кодирующий тяжелые цепи, в котором VH-, DH- и JH-сегменты заменены VL- и JL-сегментами, вырабатывает подобные антителам связывающие белки, которые имеют две идентичные полипептидные цепи, образованные из одной и той же мышиной CH-области (например, изотипа IgG), слитой с первым VL-доменом человека, и две идентичные полипептидные цепи, образованные из одной и той же CL-области, слитой со вторым VL-доменом человека. Во время клональной селекции в мыши первый и второй VL-домены человека отбираются с помощью процесса клональной селекции с появлением вместе в рамках одного подобного антителу связывающего белка. Таким образом, первый и второй VL-домены, которые появляются вместе, в результате процесса клональной селекции, в одной подобной антителу молекуле, называют «когнатными». Напротив, VL-домен, который появляется в первой подобной антителу молекуле, и VL-домен, который появляется во второй подобной антителу молекуле, не являются когнатными, кроме случаев, когда первая и вторая подобные антителам молекулы имеют идентичные тяжелые цепи (т.е. кроме случаев, когда VL-домен, слитый с первой константной областью тяжелой цепи человека, и VL-домен, слитый со второй константной областью тяжелой цепи человека, являются идентичными).
Выражение «определяющая комплементарность область», или термин «CDR», включает аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты генов иммуноглобулинов организма, которая обычно (т.е. у животного дикого типа) обнаруживается между двумя каркасными областями в вариабельной области легкой или тяжелой цепи молекулы иммуноглобулина (например, антитела или T-клеточного рецептора). CDR может кодироваться, например, последовательностью зародышевого типа или реаранжированной или нереаранжированной последовательностью, и, например, «необученной» или зрелой B-клеткой или T-клеткой. В некоторых случаях (например, в случае CDR3) CDR может кодироваться двумя или более последовательностей (например, последовательностей зародышевого типа), которые не являются непрерывными (например, в нереаранжированной последовательности нуклеиновой кислоты), но являются непрерывными в последовательности нуклеиновой кислоты B-клетки, например, в результате сплайсинга или соединения последовательностей (например, V-D-J рекомбинации с образованием CDR3 тяжелой цепи).
Выражение «генный сегмент» или «сегмент» включает ссылку на иммуноглобулиновые генные сегменты V (L илиH) или D или J (L илиH), которые включают нереаранжированные последовательности в иммуноглобулиновых локусах (например, у людей и мышей), которые могут принимать участие в реаранжировке (опосредуемой, например, эндогенными рекомбиназами) с образованием реаранжированной последовательности V/J или V/D/J. Кроме случаев, оговоренных особо, V-, D- и J-сегменты содержат сигнальные последовательности, по которым происходит рекомбинация, (RSS) которые допускают рекомбинацию V/J или рекомбинацию V/D/J по правилу 12/23. Кроме случаев, оговоренных особо, сегменты, кроме того, включают последовательности, с которыми они связаны в природе, или их функциональные эквиваленты (например, в случае V-сегментов промотор(-ы) и лидерную последовательность(-и)).
Выражение «тяжелая цепь», или «тяжелая цепь иммуноглобулина», включает последовательность константной области тяжелой цепи иммуноглобулина любого организма и, кроме особо оговоренных случаев, включает вариабельный домен тяжелой цепи (VH). VH-домены включают три CDR тяжелой цепи и четыре каркасные области (FR), кроме особо оговоренных случаев. Фрагменты тяжелых цепей включают CDR, CDR и FR и их комбинации. Типичная тяжелая цепь по существу состоит из следующих доменов (от N-конца к C-концу): вариабельный домен, CH1-домен, шарнирная область, CH2-домен, CH3-домен и необязательно CH4-домен (например, в случае IgM или IgE) и трансмембранный (M) домен (например, в случае связанного с мембраной иммуноглобулина на лимфоците). Константная область тяжелой цепи является областью тяжелой цепи, которая простирается (от N-конца к C-концу) от внешней части FR4 к C-концу тяжелой цепи. Выражение «константная область тяжелой цепи» будет охватывать константные области тяжелых цепей с незначительными девиациями, например, усечениями одной, двух, трех или нескольких аминокислот с C-конца, а также константные области тяжелых цепей с модификациями последовательности, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 заменами аминокислот. Замены аминокислот могут быть сделаны в одном или более положений, выбираемых из, например, (со ссылкой на EU-нумерацию остатков константной области иммуноглобулина, например, константной области IgG человека) 228, 233, 234, 235, 236, 237, 238, 239, 241, 248, 249, 250, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 297, 298, 301, 303, 305, 307, 308, 309, 311, 312, 315, 318, 320, 322, 324, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 337, 338, 339, 340, 342, 344, 356, 358, 359, 360, 361, 362, 373, 375, 376, 378, 380, 382, 383, 384, 386, 388, 389, 398, 414, 416, 419, 428, 430, 433, 434, 435, 437, 438 и 439.
Например, но не в качестве ограничения, константную область можно модифицировать для демонстрации ею увеличенного времени полужизни в сыворотке крови (по сравнению с такой же константной областью тяжелой цепи без указанной модификации(-ий)) и иметь модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или T), 254 (например, S или T) и 256 (например, S/R/Q/E/D или T); или модификацию в положении 428 и/или 433 (например, L/R/SI/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434. В другом примере модификация может включать модификацию 428L (например, M428L) и 434S (например, N434S); 428L, 259I (например, V259I) и модификацию 308F (например, V308F); 433K (например, H433K) и модификацию в положении 434 (например, 434Y); модификацию в положении 252, 254 и 256 (например, 252Y, 254T и 256E); модификацию 250Q и 428L (например, T250Q и M428L); модификацию в положении 307 и/или 308 (например, 308F или 308P).
Выражение «легкая цепь» включает последовательность константной области легкой цепи (CL) иммуноглобулина любого организма и, кроме особо оговоренных случаев, включает легкие цепи κ и λ человека. Вариабельные домены легкой цепи (VL) типично включают три CDR легкой цепи и четыре каркасные области (FR), кроме особо оговоренных случаев. Как правило, полноразмерная легкая цепь (VL+CL) включает, от амино-конца к карбоксильному концу, VL-домен, который включает FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, и CL-область. Легкие цепи (VL+CL), которые могут использоваться вместе с этим изобретением, включают, например, те, которые не связывают селективно ни первый, ни второй (в случае биспецифических связывающих белков) эпитоп, селективно связываемый связывающим белком (например, эпитоп(-ы), селективно связываемый VL-доменом, слитым с CH-доменом). VL-домены, которые не связывают селективно эпитоп(-ы), связываемый VL, который слит с CH-доменом, включают те, которые можно идентифицировать посредством скрининга на предмет наиболее часто используемых легких цепей в существующих библиотеках антител (необработанных библиотеках или созданных с помощью компьютерного моделирования), причем легкие цепи по существу не вмешиваются в аффинность и/или селективность эпитопсвязывающих доменов связывающих белков. Подходящие легкие цепи включают те, которые могут связывать (сами по себе или в комбинации с когнантным по отношению к ним VL, слитым с CH-областью) эпитоп, который специфически связывает VL, слитый с CH-областью.
Выражение «микромолярный диапазон», как подразумевается, означает 1-999 мкМ; выражение «наномолярный диапазон», как подразумевается, означает 1-999 нМ; выражение «пикомолярный диапазон», как подразумевается, означает 1-999 пМ.
Термин «не относящиеся к человеку животные», как подразумевается, включает любое позвоночное животное, такое как круглоротые, костная рыба, хрящевая рыба, такая как акулы и скаты, амфибии, рептилии, млекопитающие и птицы. Подходящие не относящиеся к человеку животные включают млекопитающих. Подходящие млекопитающие включают не относящихся к человеку приматов, коз, овец, свиней, собак, коров и грызунов. Подходящих не относящихся к человеку животных выбирают из семейства грызунов, включающего крысу и мышь. В одном варианте осуществления не относящимися к человеку животными являются мыши.
Мыши, нуклеотидные последовательности и связывающие белки
Предоставляются связывающие белки, которые кодируются элементами иммуноглобулиновых локусов, причем связывающие белки включают константные области тяжелых цепей иммуноглобулинов, слитые с вариабельными доменами легких цепей иммуноглобулинов. Кроме того, предоставляется множество стратегий для генетической модификации локуса, кодирующего тяжелые цепи иммуноглобулинов, у мыши, чтобы он кодировал связывающие белки, которые содержат элементы, кодируемые локусами для легких цепей иммуноглобулинов. Такие генетически модифицированные мыши представляют собой источник для создания уникальных популяций связывающих белков, которые имеют структуру иммуноглобулина, однако же демонстрируют расширенное разнообразие по сравнению с традиционными антителами.
Описываемые здесь аспекты, имеющие отношение к связывающим белкам, включают связывающие белки, которые кодируются модифицированными иммуноглобулиновыми локусами, которые модифицированы из условия, чтобы генные сегменты, которые обычно (т.е. у животного дикого типа) кодируют вариабельные домены легких цепей иммуноглобулинов (или их части), были функционально связаны с нуклеотидными последовательностями, которые кодируют константные области тяжелых цепей. После реаранжировки генных сегментов для легких цепей получается реаранжированная нуклеотидная последовательность, которая включает последовательность, кодирующую вариабельный домен легкой цепи, слитую с последовательностью, кодирующей константную область тяжелой цепи. Эта последовательность кодирует полипептид, который имеет вариабельный домен легкой цепи иммуноглобулина, слитый с константной областью тяжелой цепи. Таким образом, в одном варианте осуществления полипептид по существу состоит из, от N-конца к C-концу, VL-домена, CH1-области, шарнирной области, CH2-области, CH3-области и необязательно CH4-области.
У модифицированной мыши, описываемой здесь, вырабатываются такие связывающие белки, которые также содержат когнатную легкую цепь, причем в одном варианте осуществления когнатная легкая цепь соединяется в пару с полипептидом, описанным выше, с образованием связывающего белка, который подобен антителу, но связывающий белок включает VL-область - а не VH-область - слитую с CH-областью.
В различных вариантах осуществления у модифицированных мышей вырабатываются связывающие белки, которые включают VL-область, слитую с CH-областью (гибридную тяжелую цепь), причем VL-область гибридной тяжелой цепи демонстрирует повышенную степень соматических гипермутаций. В этих вариантах осуществления такое повышение отмечается по сравнению с VL-областью, которая слита с CL-областью (легкой цепью). В некоторых вариантах осуществления в VL-области гибридной тяжелой цепи выявляется больше в приблизительно 1,5, 2, 2,5, 3, 3,5, 4, 4,5 или 5 раз или более соматических мутаций, чем в VL-области, слитой с CL-областью. В некоторых вариантах осуществления у модифицированных мышей в ответ на антиген выявляется популяция связывающих белков, которые включают VL-область гибридной тяжелой цепи, причем в этой популяции связывающих белков выявляется больше в среднем в приблизительно 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5 раз или более соматических мутаций в VL-области гибридной тяжелой цепи, чем у мыши дикого типа в ответ на тот же антиген. В одном варианте осуществления соматические гипермутации в VL-области гибридной тяжелой цепи включают одно или более или два или более N-добавлений в CDR3.
В различных вариантах осуществления связывающие белки включают вариабельные домены, кодируемые последовательностями для легких цепей иммуноглобулинов, которые включает большее число N-добавлений, чем это число, отмечаемое в природе для последовательностей легких цепей, реаранжированных из эндогенного локуса, кодирующего легкие цепи, например, в случае связывающего белка, включающего константную область тяжелой цепи мыши, слитую с вариабельным доменом, происходящим от генных сегментов VL человека и генных сегментов J (L илиН) человека, причем сегменты V и J человека подвергаются реаранжировке с образованием реаранжированного гена, который включает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более N-добавлений.
В различных вариантах осуществления у мыши настоящего изобретения вырабатываются связывающие белки, которые в среднем меньше антител дикого типа (т.е. антител, которые имеют VH-домен), и обладают преимуществами, связанными с меньшим размером. Меньший размер получается, по меньшей мере отчасти, благодаря отсутствию аминокислотной последовательности, кодируемой DH-сегментом, обычно присутствующей в VH-домене. Меньший размер может также получиться при образовании CDR3, которая происходит, например, от Vκ-сегмента и Jκ-сегмента.
В другом аспекте предоставляется мышь и способ для обеспечения популяции связывающих белков, имеющих соматически гипермутированные VL-домены, например, соматически гипермутированные Vκ-домены человека и, например, Vκ-домены человека, кодируемые реаранжированными генами вариабельных областей легких цепей κ, которые включают 1-10 или более N-добавлений. В одном варианте осуществления, в отсутствие VH-сегмента для создания разнообразия антител, у мыши настоящего изобретения будут образовываться связывающие белки, например, в ответ на введение антигена, V-домены которых будут исключительно или в значительной степени VL-доменами. Процесс клональной селекции у мыши, следовательно, ограничивается селекцией только или в значительной степени из связывающих белков, которые имеют VL-домены, а не VH-домены. Соматические гипермутации VL-доменов будут частными, или значительно более частными (например, в 2-5 раз или более), чем у мышей дикого типа (у которых также мутируются VL-домены с некоторой степенью частоты). Процесс клональной селекции у мыши настоящего изобретения будет создавать обладающие высокой аффинностью связывающие белки из модифицированного иммуноглобулиного локуса, включая связывающие белки, которые специфически связывают эпитоп с аффинностью в наномолярном или пикомолярном диапазоне. Последовательности, которые кодируют такие связывающие белки, могут использоваться для получения терапевтических связывающих белков, содержащих вариабельные области человека и константные области человека, используя соответствующую экспрессионную систему.
В других вариантах осуществления можно создать мышь в соответствии с настоящим изобретением, у которой локусы, кодирующие тяжелые цепи и/или легкие цепи иммуноглобулинов, являются неполноценными, сделаны нефункциональными, или выключены, и мыши можно ввести полностью человеческие или химерные человеческие-мышиные трансгены, причем по меньшей мере один из трансгенов содержит модифицированный локус для тяжелых цепей (например, содержащий генные сегменты для легких цепей, функционально связанные с одной или более генных последовательностей для тяжелых цепей). У такой мыши могут также вырабатываться связывающие белки, описываемые здесь.
В одном аспекте предоставляется способ расширения разнообразия, в том числе посредством соматической гипермутации или N-добавлений в VL-домене, включающий установку функциональной связи нереаранжированного генного сегмента VL и нереаранжированного генного сегмента J с последовательностью гена CH мыши, подвергание животного воздействию представляющего интерес антигена и выделение из животного реаранжированной и соматически гипермутированной последовательности гена VL/J животного, причем реаранжированная последовательность гена VL/J слита с нуклеотидной последовательностью, кодирующей CH-область иммуноглобулина.
В одном варианте осуществления константной областью тяжелой цепи иммуноглобулина, слитой с гипермутированной VL, является IgM; в другом варианте осуществления - IgG; в другом варианте осуществления - IgE; в другом варианте осуществления - IgA.
В одном варианте осуществления VL-домен с соматическими гипермутациями и переключением класса содержит больше в приблизительно 2-5 раз или более соматических гипермутаций, чем в случае подвергнутого реаранжировке и переключению класса антитела, содержащего последовательность VL, которая функционально связана с последовательностью CL. В одном варианте осуществления число отмечаемых соматических гипермутаций в соматически гипермутированном VL-домене приблизительно равно числу таких мутаций в VH-домене, экспрессированном с гена VH, слитого с областью CH.
В одном аспекте предоставляется способ получения обладающего высокой аффинностью VL-домена человека, включающий подвергание мыши настоящего изобретения воздействию представляющего интерес антигена, допуск развития у мыши иммунного ответа против представляющего интерес антигена и выделение из мыши соматически мутированного, подвергнутого переключению класса VL-домена человека, который специфически связывает представляющий интерес антиген с высокой аффинностью.
В одном варианте осуществления KD связывающего белка, включающего соматически мутированный, подвергнутый переключению класса VL-домен человека, находится в наномолярном или пикомолярном диапазоне.
В одном варианте осуществления связывающий белок по существу состоит из димера полипептида, причем полипептид по существу состоит из соматически мутированного, подвергнутого переключению класса связывающего белка, включающего VL-домен человека, слитый с CH-областью человека.
В одном варианте осуществления связывающие белки по существу состоят из димера полипептида и двух легких цепей, причем полипептид по существу состоит из соматически мутированного, подвергнутого переключению класса связывающего белка, содержащего VL-домен человека, слитый с CH-областью человека; и причем каждый полипептид димера объединяется с когнатной легкой цепью, включающей когнатный VL-домен легкой цепи и CL-область человека.
В одном аспекте предоставляется способ соматического гипермутирования последовательности гена VL человека, включающий установление функциональной связи генного сегмента VL человека и генного сегмента JL человека с эндогенным геном CHмыши в эндогенном мышином локусе, кодирующем тяжелые цепи иммуноглобулинов, подвергание мыши воздействию представляющего интерес антигена и получение из мыши соматически гипермутированной последовательности гена VL человека, которая связывает представляющий интерес антиген.
В одном варианте осуществления способ, кроме того, включает получение от мыши последовательности гена VL легкой цепи, которая является когнатной по отношению к соматически гипермутированной последовательности гена VL человека, которая связывает представляющий интерес антиген.
Содержащие VL связывающие белки с последовательностями DH
В различных аспектах мыши, включающие нереаранжированный генный сегмент VL и нереаранжированный генный сегмент J (например, L или H), также содержат нереаранжированный генный сегмент DH, который способен к рекомбинированию с J-сегментом с образованием реаранжированный последовательности D/J, которая в свою очередь способна к реаранжировке с VL-сегментом с образованием реаранжированной последовательности вариабельной области, происходящей от (a) VL-сегмента, (b) DH-сегмента и (c) сегмента J (например, L или H), причем реаранжированная последовательность вариабельной области функционально связана с последовательностью константной области тяжелой цепи (например, выбираемой из последовательности CH1, шарнирной области, CH2, CH3 и их комбинации; например, функционально связана с последовательностью CH1, шарнирной области, CH2 и CH3 мыши или человека).
В различных аспектах мыши, содержащие нереаранжированные сегменты VL человека и сегменты J, которые также содержат D-сегмент человека, применимы, например, в качестве источника расширенного разнообразия последовательностей CDR3. Обычно последовательности CDR3 возникают в легких цепях в результате V/J рекомбинации, а в тяжелых цепях в результате V/D/J рекомбинации. Дополнительное разнообразие обеспечивается с помощью добавлений нуклеотидов, которые происходят во время рекомбинации (например, N-добавлений), а также в результате соматической гипермутации. Относящиеся к связыванию свойства, придаваемые последовательностями CDR3, как правило, ограничиваются теми, которые придают последовательность CDR3 легкой цепи, последовательность CDR3 тяжелой цепи и комбинацию последовательностей CDR3 легкой и тяжелой цепей, при соответствующих обстоятельствах. Однако в случае мышей, описываемых здесь, в наличии имеется дополнительный источник разнообразия благодаря относящимся к связыванию свойствам, придаваемым в результате комбинации первого CDR3 легкой цепи (в полипептиде тяжелой цепи) и второго CDR3 легкой цепи (в полипептиде легкой цепи). Возможно дополнительное разнообразие, поскольку первый CDR3 легкой цепи может содержать последовательность, происходящую от генного сегмента D, исходя из мыши, описываемой здесь, которая содержит нереаранжированный V-сегмент из локуса для V-областей легких цепей, функционально связанный с D-сегментом и функционально связанный с J-сегментом (L или H), используя конструирование RSS, как здесь наставляют.
Другим источником разнообразия являются N- и/или P-добавления, которые случаются при рекомбинациях V(L)/J или V(L)/D/J, которые возможны у описываемых здесь мышей. Таким образом, описываемые здесь мыши не только обеспечивают отличный источник разнообразия (легкая цепь-легкая цепь), но также дополнительный источник разнообразия благодаря добавлению, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более N-добавлений в реаранжированный ген V(L)/J или реаранжированный ген V(L)/D/J у описываемой здесь мыши.
В различных аспектах использование генного сегмента D, функционально связанного с генным сегментом J и генным сегментом VL, обеспечивает расширенное разнообразие. Для функциональной связи DH-сегмента в этом случае будет необходимо, чтобы D-сегмент был способен к рекомбинированию с J-сегментом, с которым он излагается. Таким образом, будет необходимо, чтобы с D-сегментом соседствовала 3’ RSS, которая сочетается с RSS, расположенной непосредственно 5’ от J-сегмента, чтобы D-сегмент и J-сегмент могли подвергаться реаранжировке. Кроме того, для D-сегмента будет требоваться подходящая RSS, расположенная непосредственно 5’, которая сочетается с RSS, расположенной непосредственно 3’ от V-сегмента, чтобы реаранжированный сегмент D/J и сегмент V могли подвергаться реаранжировке с образованием гена, кодирующего вариабельный домен.
RSS, или сигнальная последовательность, по которой происходит рекомбинация, включает консервативную гептамерную (из семи пар оснований) последовательность нуклеиновой кислоты, отделенную с помощью 12 пар оснований (п.о.) или 23 пар оснований (п.о.) неконсервативной последовательности от консервативной нонамерной последовательности нуклеиновой кислоты. RSS используются рекомбиназами для достижения соединения иммуноглобулиновых генных сегментов во время процесса реаранжировки по правилу 12/23. В соответствии с правилом 12/23 генный сегмент, который соседствует с RSS, имеющей спейсер из 12 п.о. (неконсервативных), подвергается реаранжировке с генным сегментом, соседствующим с RSS, имеющим спейсер из 23 п.о. (неконсервативных); т.е. реаранжировки между генными сегментами, каждый из который имеет RSS со спейсером из 12 п.о., или каждый из которых имеет RSS со спейсером из 23 п.о., как правило, не наблюдается.
В случае локуса, кодирующего легкие цепи λ, генные сегменты Vλ фланкированы 3’ (относительно направления транскрипции последовательности V) RSS, имеющей спейсер из 23 п.о., а генные сегменты Jλ фланкированы 5’ (относительно направления транскрипции последовательности J) RSS, имеющей спейсер из 12 п.о. Таким образом, сегменты Vλ и Jλ фланкированы RSS, которые являются сочетаемыми в соответствии с правилом 12/23 и, следовательно, способны к рекомбинированию во время реаранжировки.
Однако в локусе κ в организме дикого типа каждый функциональный Vκ-сегмент фланкирован 3’ RSS, имеющей спейсер из 12 п.о. По этой причине Jκ-сегменты имеют спейсеры из 23 п.о., расположенные непосредственно с 5’-конца Jκ-сегмента. В локусе, кодирующем тяжелые цепи, генные сегменты VH соседствуют 3’ с RSS, имеющей спейсер из 23 п.о., за которой следует DH-сегмент, соседствующий 5’ и 3’ со спейсером из 12 п.о., и JH-сегменты, каждый со спейсером из 23 п.о., расположенным непосредственно с 5’-конца JH-сегмента. В локусе, кодирующем тяжелые цепи, сначала происходит рекомбинация D/J, опосредуемая находящейся 3’ от DHRSS со спейсером из 12 п.о. и находящейся 5’ от JH RSS со спейсером из 23 п.о., с получением промежуточной реаранжированной последовательности D-J, имеющей RSS, расположенную непосредственно с 5’-конца, которая имеет спейсер из 12 п.о. Реаранжированный сегмент D-J, имеющий RSS со спейсером из 12 п.о., расположенную непосредственно с 5’-конца, затем подвергается реаранжировке с VH-сегментом, имеющим RSS со спейсером из 23 п.о., расположенную непосредственно с 3’-конца, с образованием реаранжированной последовательности V/D/J.
В одном варианте осуществления в локусе, кодирующем тяжелые цепи, используется Vλ-сегмент вместе с генным сегментом J, который представляет собой Jλ-сегмент, причем Vλ-сегмент включает RSS, расположенную непосредственно с 3’-конца последовательности Vλ, и RSS включает спейсер из 23 п.о., а J-сегментом является Jλ-сегмент с RSS, расположенной непосредственно с 5’-конца, имеющей спейсер из 12 п.о. (например, обнаруживаемой в природе).
В одном варианте осуществления в локусе, кодирующем тяжелые цепи, используется Vλ-сегмент вместе с генным сегментом J, который представляет собой генный сегмент Jκ или JH, причем с последовательностью Vλ соседствует с ее 3’-конца RSS, включающая спейсер из 23 п.о., а c сегментом Jκ или JH соседствует с его 5’-конца RSS, включающая спейсер из 12 п.о.
В одном варианте осуществления в локусе, кодирующем тяжелые цепи, используется Vλ-сегмент вместе с генным сегментом DH и генным сегментом J. В одном варианте осуществления Vλ-сегмент включает RSS, расположенную непосредственно с 3’-конца последовательности Vλ, имеющую спейсер из 23 п.о.; DH-сегмент включает RSS, расположенную непосредственно с 5’-конца и с 3’-конца последовательности DH, имеющую спейсер из 12 п.о.; а J-сегмент имеет RSS, расположенную непосредственно с 5’-конца, имеющую спейсер из 23 п.о., причем J-сегмент выбирают из Jλ, Jκ и JH.
В одном варианте осуществления в локусе, кодирующем тяжелые цепи, используется Vκ-сегмент вместе с генным сегментом J (без промежуточного D-сегмента), причем Vκ-сегмент имеет RSS, расположенную непосредственно с 3’-конца Vκ-сегмента, которая включает спейсер из 12 п.о., а непосредственно с 5’-конца J-сегмента расположена имеющая спейсер из 23 п.о. RSS, а Jκ-сегмент выбирают из Jκ-сегмента, Jλ-сегмента и JH-сегмента. В одном варианте осуществления V-сегмент и/или J-сегмент являются человеческими.
В одном варианте осуществления в локусе, кодирующем тяжелые цепи, используется Vκ-сегмент вместе с D-сегментом и J-сегментом, причем Vκ-сегмент имеет RSS, расположенную непосредственно с 3’-конца Vκ-сегмента, которая включает спейсер из 12 п.о., непосредственно с 5’-конца и с 3’-конца D-сегмента расположена имеющая спейсер из 23 п.о. RSS, а непосредственно с 5’-конца J-сегмента расположена имеющая спейсер из 12 п.о. RSS. В одном варианте осуществления J-сегмент выбирают из Jκ-сегмента, Jλ-сегмента и JH-сегмента. В одном варианте осуществления V-сегмент и/или J-сегмент являются человеческими.
J-сегмент с RSS, имеющей спейсер из 23 п.о., расположенной непосредственно с его 5’-конца, или Jκ- или JH-сегмент с RSS, имеющей спейсер из 12 п.о., расположенной непосредственно с его 5’-конца, создают, используя любой способ, подходящий для получения последовательностей нуклеиновых кислот, который известен в данной области техники. Способом, подходящим для создания J-сегмента, имеющего RSS, расположенную непосредственно 5’, которая имеет выбранный спейсер (например, или 12 п.о., или 23 п.о.), является химический синтез нуклеиновой кислоты, включающей гептамер, нонамер и выбранный спейсер, и ее слияние с последовательностью J-сегмента, которая является или химически синтезированной, или клонированной из подходящего источника (например, источника последовательностей человека), и использование слитых последовательности J-сегмента и RSS в таргетирующем векторе для направления RSS-J в подходящее место.
D-сегмент с имеющей спейсер из 23 п.о. RSS, расположенной непосредственно 5’ и 3’, создают, используя любой способ, известный в данной области техники. Один способ включает химический синтез расположенной 5’ RSS со спейсером из 23 п.о. и последовательности D-сегмента и расположенной 3’ RSS со спейсером из 23 п.о. и размещение фланкированного RSS D-сегмента в подходящий вектор. Вектор может быть направлен на замену одного или более мышиных D-сегментов D-сегментом человека с последовательностями RSS со спейсерами из 12 п.о., расположенными непосредственно с 5’- и 3’-концов, или направлен на встраивание, например, в гуманизированный локус в положение между V-сегментом человека и J-сегментом человека или мыши.
Подходящие нонамеры и гептамеры для конструирования RSS известны в данной области техники (например, см. Janeway’s Immunobiology, 7th ed., Murphy et al., (2008, Garland Science, Taylor & Francis Group, LLC) на стр. 148, фиг.4.5, который включен посредством ссылки). Подходящие неконсервативные последовательности спейсеров включают, например, последовательности спейсеров, наблюдаемые в последовательностях RSS в иммуноглобулиновых локусах человека или мыши.
Биспецифические связывающие белки
Описываемые здесь связывающие белки и кодирующие их нуклеотидные последовательности могут использоваться для создания полиспецифических связывающих белков, например, биспецифических связывающих белков. В первом аспекте первый полипептид, по существу состоящий из первого VL-домена, слитого с CH-областью, может объединяться со вторым полипептидом, по существу состоящим из второго VL-домена, слитого с CH-областью. Если первый VL-домен и второй VL-домен специфически связывают различные эпитопы, можно создать биспецифическую связывающую молекулу, используя два VL-домена. CH-области могут быть одинаковыми или различными. В одном варианте осуществления, например, одна из CH-областей может быть модифицированной для исключения области связывания с белком A, тогда как другая константная область тяжелой цепи не является модифицированной таким образом. Эта конкретная компоновка упрощает выделение биспецифического связывающего белка, например, из смеси гомодимеров (например, гомодимеров первого или второго полипептида).
В одном аспекте описываемые здесь способы и композиции используют для создания биспецифических связывающих белков. В этом аспекте каждый из первого VL, который слит с CH-областью, и второго VL, который слит с CH-областью, независимо клонируют в рамке считывания с последовательностью IgG человека того же изотипа (например, IgG1, IgG2, IgG3 или IgG4 человека). Первый VL специфически связывает первый эпитоп, а второй VL специфически связывает второй эпитоп. Первый и второй эпитопы могут быть в различных антигенах или в одном и том же антигене.
В одном варианте осуществления изотип IgG - CH-области, слитой с первым VL, и изотип IgG - CH-области, слитой со вторым VL, являются одинаковыми, но отличаются тем, что один изотип IgG включает по меньшей мере одну аминокислотную замену. В одном варианте осуществления по меньшей мере одна аминокислотная замена делает тяжелую цепь, содержащую замену, неспособной или по существу неспособной к связыванию белка A по сравнению с тяжелой цепью, в которой отсутствует замена.
В одном варианте осуществления первая CH-область включает первый CH3-домен IgG человека, выбираемого из IgG1, IgG2 и IgG4; а вторая CH-область включает второй CH3-домен IgG человека, выбираемого из IgG1, IgG2 и IgG4, причем второй CH3-домен включает модификацию, которая уменьшает или аннулирует связывание второго CH3-домена с белком A.
В одном варианте осуществления второй CH3-домен включает модификацию 435R, с нумерацией в соответствии с EU-индексом номенклатуры Kabat. В другом варианте осуществления второй CH3-домен включает дополнительно модификацию 436F, с нумерацией в соответствии с EU-индексом номенклатуры Kabat.
В одном варианте осуществления вторым CH3-доменом является такой домен IgG1 человека, который включает модификацию, выбранную из группы, состоящей из D356E, L358M, N384S, K392N, V397M и V422I, с нумерацией в соответствии с EU-индексом номенклатуры Kabat.
В одном варианте осуществления вторым CH3-доменом является такой домен IgG2 человека, который включает модификацию, выбранную из группы, состоящей из N384S, K392N и V422I, с нумерацией в соответствии с EU-индексом номенклатуры Kabat.
В одном варианте осуществления вторым CH3-доменом является такой домен IgG4 человека, который включает модификацию, выбранную из группы, состоящей из Q355R, N384S, K392N, V397M, R409K, E419Q и V422I, с нумерацией в соответствии с EU-индексом номенклатуры Kabat.
В одном варианте осуществления связывающий белок включает CH-область, имеющую одну или более модификаций, указанных здесь, причем эта константная область связывающего белка является неиммуногенной или по существу неиммуногенной у человека. В конкретном варианте осуществления CH-области включают аминокислотные последовательности, которые не представляют иммуногенный эпитоп у человека. В другом конкретном варианте осуществления связывающий белок включает CH-область, которая не обнаруживается в тяжелой цепи человека дикого типа, и CH-область не включает последовательность, которая создает T-клеточный эпитоп.
ПРИМЕРЫ
Следующие примеры предоставляются для описания того, каким образом приготовить и использовать способы и композиции настоящего изобретения, и, как предполагается, не ограничивают объем того, что авторы настоящего изобретения рассматривают в качестве изобретения. Кроме случаев, оговоренных особо, температура указана в градусах Цельсия, а давление - около или вблизи атмосферного.
Пример I
Введение генных сегментов для легких цепей в локус, кодирующий тяжелые цепи
Различные таргетирующие конструкции были созданы, используя технологию генетической инженерии VELOCIGENE® (см., например, патент США № 6586251 и Valenzuela, D.M., Murphy, A.J., Frendewey, D., Gale, N.W., Economides, A.N., Auerbach, W., Poueymirou, W.T., Adams, N.C., Rojas, J., Yasenchak, J., Chernomorsky, R., Boucher, M., Elsasser, A.L., Esau, L, Zheng, J., Griffiths, J.A., Wang, X., Su, H., Xue, Y., Dominguez, M.G., Noguera, I., Torres, R., Macdonald, L.E., Stewart, A.F., DeChiara, T.M., Yancopoulos, G.D. (2003). High-throughput engineering of the mouse genome coupled with high-resolution expression analysis. Nat Biotechnol 21, 652-659) для модифицирования библиотек фрагментов генома мыши, созданных с использованием бактериальных искусственных хромосом (BAC). Мышиную ДНК в BAC подвергали модификации с помощью гомологичной рекомбинации для инактивации эндогенного мышиного локуса, кодирующего тяжелые цепи, посредством таргетированного делетирования генных сегментов VH, DH и JH для последующей вставки последовательностей нереаранжированных генов легких цепей κ зародышевого типа человека (верхняя часть фиг.2).
Вкратце, мышиный локус, кодирующий тяжелые цепи, делетировали в ходе двух последовательных процессов таргетирования, используя опосредуемую рекомбиназой рекомбинацию. Первый процесс таргетирования включал мишень на 5’-конце мышиного локуса, кодирующего тяжелые цепи, используя таргетирующий вектор, включающий в направлении от 5’ к 3’ 5’ гомологичное мышиной ДНК плечо, сайт распознавания рекомбиназой, кассету устойчивости к неомицину и 3’ гомологичное плечо. 5’ и 3’ гомологичные плечи содержали последовательность, находящуюся 5’ от мышиного локуса, кодирующего тяжелые цепи. Второй процесс таргетирования включал мишень на 3’-конце мышиного локуса, кодирующего тяжелые цепи, в районе генных сегментов JH, используя второй таргетирующий вектор, который содержал в направлении от 5’ к 3’ 5’ гомологичное мышиной ДНК плечо, 5’ сайт распознавания рекомбиназой, второй сайт распознавания рекомбиназой, кассету устойчивости к гигромицину, третий сайт распознавания рекомбиназой и 3’ гомологичное мышиной ДНК плечо. 5’ и 3’ гомологичные плечи содержали последовательность, фланкирующую мышиные генные сегменты JH, и 5’ интронный энхансер и константные области. Положительные эмбриональные стволовые клетки, содержащие модифицированный локус для тяжелых цепей, подвергнутые таргетированию с использованием обоих таргетирующих векторов (описанных выше), подтверждали с помощью определения кариотипа. ДНК затем выделяли из дважды таргетированных эмбриональных стволовых клеток и подвергали обработке рекомбиназой, опосредующей тем самым делецию геномной ДНК из мышиного локуса, кодирующего тяжелые цепи, между 5’ сайтом распознавания рекомбиназой в первом таргетирующем векторе и 5’ сайтом распознавания рекомбиназой во втором таргетирующем векторе, оставляющей один сайт распознавания рекомбиназой и кассету устойчивости к гигромицину, фланкированную двумя сайтами распознавания рекомбиназой (см. верхнюю часть фиг.2). Таким образом, был создан модифицированный локус для тяжелых цепей, содержащий интактные гены CH, для последовательного встраивания генных сегментов κ человека зародышевого типа точным образом, используя таргетирующие векторы, описанные выше.
Были сконструированы четыре отдельных таргетирующих вектора для последовательного встраивания 40 генных сегментов Vκ человека и пяти генных сегментов Jκ человека в инактивированный мышиный локус для тяжелых цепей (описанный выше), используя стандартные молекулярные методы, признанные в данной области техники (фиг.2). Генные сегменты κ человека, используемые для конструирования четырех таргетирующих конструкций, обнаруживаются в природе в проксимальном континге локуса, кодирующего легкие цепи κ, человека зародышевого типа (фиг.1B и таблица 1).
Был сконструирован фрагмент размером ~110499 п.о. геномной ДНК человека, содержащий первые шесть генных сегмента Vκ человека и пять генных сегментов Jκ человека, который содержал сайт PI-SceI на расстоянии 431 п.о. 3’ от генного сегмента Jκ5. Другой сайт PI-SceI был сконструирован на 5’-конце геномного фрагмента размером ~7852 п.о., содержащего интронный энхансер гена тяжелой цепи мыши, район переключения на IgM (Sμ) и ген константной области IgM мышиного локуса, кодирующего тяжелые цепи. Этот мышиный фрагмент использовали в качестве 3’ гомологичного плеча, посредством лигирования с фрагментом человека размером ~110,5 т.п.о., которое создавало 3’ соединение, содержащее, в направление от 5’ к 3’, ~110,5 т.п.о. геномной последовательности локуса, кодирующего легкие цепи κ человека, содержащей первые шесть следующих друг за другом генных сегментов Vκ и пять генных сегментов Jκ, сайт PI-SceI, ~7852 п.о. последовательности для тяжелой цепи мыши, содержащей мышиный интронный энхансер, Sμ и ген константной области IgM мыши. 5’ от генного сегмента Vκ1-6 человека находились дополнительные 3710 п.о. последовательности κ человека до начала 5’ гомологичного мышиной ДНК плеча, которое содержало 19752 п.о. мышиной геномной ДНК, соответствующей последовательности, находящейся 5’ от мышиного локуса, кодирующего тяжелые цепи. Между 5’ гомологичным плечом и началом последовательности κ человека находилась кассета устойчивости к неомицину, фланкированная тремя сайтами распознавания рекомбиназой (см. таргетирующий вектор 1, фиг.2). Конечный таргетирующий вектор для первого встраивания последовательности κ человека включал, в направлении от 5’ к 3’, 5’ гомологичное плечо, содержащее ~20 т.п.о. мышиной геномной последовательности, находящейся 5’ от локуса, кодирующего тяжелые цепи, первый сайт распознавания рекомбиназой (R1), кассету устойчивости к неомицину, второй сайт распознавания рекомбиназой (R2), третий сайт распознавания рекомбиназой (R3), ~110,5 т.п.о. геномной последовательности κ человека, содержащей первые шесть следующих друг за другом генных сегментов Vκ человека и пять генных сегментов Jκ человека, сайт PI-SceI, и 3’ гомологичное плечо, содержащее ~8 т.п.о. мышиной геномной последовательности, включающей интронный энхансер, Sμ и ген константной области IgM мыши (см. фиг.2, таргетирующий вектор 1). Гомологичная рекомбинация при использовании этого таргетирующего вектора создавала модифицированный мышиный локус для тяжелых цепей, содержащий шесть генных сегментов Vκ человека и пять генных сегментов Jκ человека, функционально связанных с эндогенными мышиными генами константных областей тяжелых цепей, который, после рекомбинирования, приводил к образованию гибридной тяжелой цепи (т.е. Vκ-домена человека и мышиной CH-области).
Введение десяти дополнительных генных сегментов Vκ человека в гибридный локус для тяжелых цепей. Был сконструирован второй таргетирующий вектор для введения 10 дополнительных генных сегментов Vκ человека в модифицированный мышиный локус для тяжелых цепей, описанный выше (см. фиг.2, таргетирующий вектор 2). Фрагмент генома человека размером 140058 п.о., содержащий 12 следующих друг за другом генных сегментов Vκ человека из локуса, кодирующего легкие цепи κ человека, был создан с 5’ гомологичным плечом, содержащим мышиную геномную последовательность, находящуюся 5’ от мышиного локуса, кодирующего тяжелые цепи, и 3’ гомологичным плечом, содержащим геномную последовательность для κ человека. 5’ от генного сегмента Vκ1-16 человека находились дополнительные 10170 п.о. последовательности для κ человека до начала 5’ гомологичного мышиной ДНК плеча, которое было одинаковым с 5’ гомологичным плечом, использованным для конструирования таргетирующего вектора 1 (см. фиг.2). Между 5’ гомологичным плечом и началом последовательности для κ человека находилась кассета устойчивости к гигромицину, фланкированная сайтами распознавания рекомбиназой. 3’ гомологичное плечо включало перекрытие размером 31165 п.о. с геномной последовательностью для κ человека, соответствующее эквивалентному 5’-концу фрагмента размером ~110,5 т.п.о. геномной последовательности для κ человека таргетирующего вектора 1 (фиг.2). Конечный таргетирующий вектор для встраивания 10 дополнительных генных сегментов Vκ человека включал, в направлении от 5’ к 3’, 5’ гомологичное плечо, содержащее ~20 т.п.о. мышиной геномной последовательности, находящейся 5’ от локуса, кодирующего тяжелые цепи, первый сайт распознавания рекомбиназой (R1), кассету устойчивости к гигромицину, второй сайт распознавания рекомбиназой (R2) и ~140 т.п.о. геномной последовательности для κ человека, содержащей 12 следующих друг за другом генных сегментов Vλ человека, ~31 т.п.о. из которых перекрываются с 5’-концом последовательности для κ человека таргетирующего вектора 1 и служат в качестве 3’ гомологичного плеча в случае этой таргетирующей конструкции. Гомологичная рекомбинация при использовании этого таргетирующего вектора создавала модифицированный мышиный локус для тяжелых цепей, содержащий 16 генных сегментов Vκ человека и пять генных сегментов Jκ человека, функционально связанных с мышиными генами константных областей тяжелых цепей, который, после рекомбинирования, приводил к образованию гибридной тяжелой цепи.
Введение четырнадцати дополнительных генных сегментов Vκ человека в гибридный локус для тяжелых цепей. Был сконструирован третий таргетирующий вектор для введения 14 дополнительных генных сегментов Vκ человека в модифицированный мышиный локус для тяжелых цепей, описанный выше (см. фиг.2, таргетирующий вектор 3). Фрагмент генома человека размером 160579 п.о., содержащий 15 следующих друг за другом генных сегментов Vκ человека, был создан с 5’ гомологичным плечом, содержащим мышиную геномную последовательность, находящуюся 5’ от мышиного локуса, кодирующего тяжелые цепи, и 3’ гомологичным плечом, содержащим геномную последовательность для κ человека. 5’ от генного сегмента Vκ2-30 человека находились дополнительные 14687 п.о. последовательности для κ человека до начала 5’ гомологичного мышиной ДНК плеча, которое было одинаковым с 5’ гомологичным плечом, использованным для конструирования двух возникших ранее таргетирующих векторов (описанных выше, см. также фиг.2). Между 5’ гомологичным плечом и началом последовательности для κ человека находилась кассета устойчивости к неомицину, фланкированная сайтами распознавания рекомбиназой. 3’ гомологичное плечо включало перекрывание размером 21275 п.о. с геномной последовательностью для κ человека, соответствующее эквивалентному 5’-концу фрагмента размером ~140 т.п.о. геномной последовательности для κ человека таргетирующего вектора 2 (фиг.2). Конечный таргетирующий вектор для встраивания 14 дополнительных генных сегментов Vκ человека включал, в направлении от 5’ к 3’, 5’ гомологичное плечо, содержащее ~20 т.п.о. мышиной геномной последовательности, находящейся 5’ от локуса, кодирующего тяжелые цепи, первый сайт распознавания рекомбиназой (R1), кассету устойчивости к неомицину, второй сайт распознавания рекомбиназой (R2) и ~161 т.п.о. геномной последовательности для κ человека, содержащей 15 генных сегментов Vκ человека, ~21 т.п.о. из которых перекрываются с 5’-концом последовательности для κ человека таргетирующего вектора 2 и служат в качестве 3’ гомологичного плеча в случае этой таргетирующей конструкции. Гомологичная рекомбинация при использовании этого таргетирующего вектора создавала модифицированный мышиный локус для тяжелых цепей, содержащий 30 генных сегментов Vκ человека и пять генных сегментов Jκ человека, функционально связанных с мышиными генами константных областей тяжелых цепей, который, после рекомбинирования, приводил к образованию гибридной тяжелой цепи.
Введение десяти дополнительных генных сегментов Vκ в гибридный локус для тяжелых цепей. Был сконструирован четвертый таргетирующий вектор для введения 10 дополнительных генных сегментов Vκ человека в модифицированный мышиный локус для тяжелых цепей, описанный выше (см. фиг.2, таргетирующий вектор 4). Фрагмент генома человека размером 90398 п.о., содержащий 16 следующих друг за другом генных сегментов Vκ человека, был создан с 5’ гомологичным плечом, содержащим мышиную геномную последовательность, находящуюся 5’ от мышиного локуса, кодирующего тяжелые цепи, и 3’ гомологичным плечом, содержащим геномную последовательность для κ человека. 5’ от генного сегмента Vκ2-40 человека находились дополнительные 8484 п.о. последовательности для κ человека до начала 5’ гомологичного мышиной ДНК плеча, которое было одинаковым с 5’ гомологичным плечом возникших ранее таргетирующих векторов (описанных выше, см. также фиг.2). Между 5’ гомологичным плечом и началом последовательности для κ человека находилась кассета устойчивости к гигромицину, фланкированная сайтами распознавания рекомбиназой. 3’ гомологичное плечо включало перекрытие размером 61615 п.о. с геномной последовательностью для κ человека, соответствующее эквивалентному 5’-концу фрагмента размером ~160 т.п.о. геномной последовательности для κ человека таргетирующего вектора 3 (фиг.2). Конечный таргетирующий вектор для встраивания 10 дополнительных генных сегментов Vκ человека включал, в направлении от 5’ к 3’, 5’ гомологичное плечо, содержащее ~20 т.п.о. мышиной геномной последовательности, находящейся 5’ от локуса, кодирующего тяжелые цепи, первый сайт распознавания рекомбиназой (R1), кассету устойчивости к гигромицину, второй сайт распознавания рекомбиназой (R2) и ~90 т.п.о. геномной последовательности для κ человека, содержащей 16 генных сегментов Vκ человека, ~62 т.п.о. из которых перекрываются с 5’-концом последовательности для κ человека таргетирующего вектора 3 и служат в качестве 3’ гомологичного плеча в случае этой таргетирующей конструкции. Гомологичная рекомбинация при использовании этого таргетирующего вектора создавала модифицированный мышиный локус для тяжелых цепей, содержащий 40 генных сегментов Vκ человека и пять генных сегментов Jκ человека, функционально связанных с мышиными генами константных областей тяжелых цепей, который, после рекомбинирования, приводил к образованию гибридной тяжелой цепи (фиг.3).
Используя подход, схожий с описанным выше подходом, создаются другие комбинации вариабельных доменов легких цепей человека в связи с константными областями тяжелых цепей. Дополнительные вариабельные домены легких цепей могут происходить от генных сегментов Vλ и Jλ человека (фиг.4A и 4B).
Локус, кодирующий легкие цепи λ человека, распространяется на 1000 т.п.о. и содержит свыше 80 генов, которые кодируют сегменты V или J. Среди 70 генных сегментов Vλ локуса, кодирующего легкие цепи λ человека, где-нибудь 30-38, по-видимому, являются функциональными генными сегментами в соответствии с опубликованными сообщениями. 70 последовательностей Vλ организованы в три кластера, все из которых содержат различные члены отдельных групп семейства генов V, (кластеры A, B и C). В локусе, кодирующем легкие цепи λ человека, больше половины всех наблюдаемых Vλ-доменов кодируются генными сегментами 1-40, 1-44, 2-8, 2-14 и 3-21. Существует семь генных сегментов Jλ, только четыре из которых рассматриваются в качестве, как правило, функциональных Jλ генных сегментов - Jλ1, Jλ2, Jλ3 и Jλ7. В некоторых аллелях пара генных сегментов пятый Jλ-Cλ является, как сообщают, псевдогеном (Cλ6). Включение множества генных сегментов Jλ человека в гибридный локус для тяжелых цепей, как описывается здесь, создают с помощью de novo синтеза. Геномный фрагмент, содержащий множество генных сегментов Jλ человека в конфигурации зародышевого типа, создают, таким образом, вместе с множеством генных сегментов Vλ человека и допускают обычную рекомбинацию V-J в связи с константной областью тяжелой цепи.
Соединение вариабельных доменов легких цепей с константными областями тяжелых цепей представляет собой потенциально богатый источник разнообразия в случае создания уникальных, содержащих VL связывающих белков с VL-областями человека у не относящихся к человеку животных. Использование этого разнообразия локуса, кодирующего легкие цепи λ человека (или локуса κ человека, описанного выше) у мышей, приводит к созданию уникальных гибридных тяжелых цепей и обуславливает другой размер связывающих белков в иммунном репертуаре генетически модифицированных животных и их последующее применение в качестве платформы следующего поколения для создания терапевтических средств.
Кроме того, генные сегменты DH и JH (или Jκ) человека могут быть включены вместе с генными сегментами или Vκ, или Vλ человека для конструирования новых гибридных локусов, которые будут обуславливать, после рекомбинирования, новые созданные вариабельные домены (фиг.5A и 5B). В этом последнем случае для создания комбинаций генных сегментов, которые в норме не содержатся в одном локусе, потребуется особое внимание к сигнальным последовательностям, по которым происходит рекомбинация, (RSS), которые связаны с соответствующими генными сегментами, чтобы могла достигаться нормальная рекомбинация после их объединения в одном локусе. Известно, что, например, рекомбинация V(D)J определяется консервативными некодирующими последовательностями ДНК, известными как гептамерные или нонамерные последовательности, которые обнаруживаются рядом с каждым генным сегментом в точном положении, по которому происходит рекомбинация. Между этими некодирующими последовательностями ДНК находятся неконсервативные спейсерные районы, длина которых составляет или 12, или 23 пар оснований (п.о.). Как правило, рекомбинация происходит только в генных сегментах, находящихся на одной и той же хромосоме, и те генные сегменты, которые фланкированы спейсером из 12 п.о., могут соединяться с генным сегментом, фланкированным спейсером из 23 п.о., т.е. по правилу 12/23, хотя в небольшой части антител отмечалось соединение двух генных сегментов DH(каждый из которых фланкирован спейсерами из 12 п.о.). Для допуска рекомбинации между генными сегментами, которые в норме не имеют сочетаемых спейсеров, (например, Vκ и DH или DH и Jλ), синтезируют уникальные, сочетаемые спейсеры в положениях, находящихся рядом с желаемыми генными сегментами, для создания уникальных гибридных тяжелых цепей, которые делают возможной успешную рекомбинацию для образования уникальных тяжелых цепей, содержащих вариабельные области легких цепей.
Таким образом, использование намеченной в общих чертах стратегии для включения генных сегментов для легких цепей κ человека в эндогенный локус, кодирующий тяжелые цепи, позволяет использовать другие комбинации генных сегментов для легких цепей λ человека, а также специфические для тяжелых цепей человека генные сегменты (например, DH и JH) и их комбинации.
Пример II
Идентификация таргетированных эмбриональных стволовых клеток, содержащих генные сегменты для легких цепей человека в эндогенном локусе, кодирующем тяжелые цепи
Таргетированную ДНК в BAC, полученную в вышеприведенных примерах, использовали при электропорации мышиных эмбриональных стволовых клеток для создания модифицированных эмбриональных стволовых клеток для создания химерных мышей, которые экспрессируют содержащие VL связующие белки (т.е. генные сегменты для легких цепей κ человека, функционально связанные с генами константных областей тяжелых цепей мыши). Эмбриональные стволовые клетки, содержащие вставку нереаранжированных генных сегментов для легких цепей κ человека, идентифицировали с помощью количественного анализа с использованием ПЦР, TAQMAN® (Lie and Petropoulos, 1998. Curr. Opin. Biotechnology 9: 43-48). Были разработаны группы специфических праймеров и зондов для вставки последовательностей κ человека и связанных с ними кассет устойчивости, утраты последовательностей для тяжелых цепей мыши и сохранения мышиных последовательностей, фланкирующих эндогенный локус, кодирующий тяжелые цепи.
Эмбриональные стволовые клетки, содержащие генные сегменты для легких цепей κ человека, можно подвергнуть трансфекции конструкцией, экспрессирующей рекомбиназу, для удаления любой нежелательной кассеты устойчивости, введенной в результате вставки таргетирующей конструкции, содержащей генные сегменты κ человека. Необязательно кассету устойчивости можно удалить посредством скрещивания с мышами, которые экспрессируют рекомбиназу (например, патент США № 6774279). Необязательно кассету устойчивости сохраняют у мышей.
Пример III
Создание и анализ мышей, экспрессирующих содержащие VL связывающие белки
Таргетированные эмбриональные стволовые клетки, описанные выше, использовали в качестве донорных эмбриональных стволовых клеток и вводили мышиному эмбриону на стадии 8 клеток с помощью метода VELOCIMOUSE® (см., например, патент США № 7294754 и Poueymirou, W.T., Auerbach, W., Frendewey, D., Hickey, J.F., Escaravage, J.M., Esau, L., Dore, AT., Stevens, S., Adams, N.C., Dominguez, M.G., Gale, N.W., Yancopoulos, G.D., DeChiara, T.M., Valenzuela, D.M. (2007). F0 generation mice fully derived from gene-targeted embryonic stem cells allowing immediate phenotypic analyses. Nat Biotechnol 25, 91-99). VELOCIMICE® (мыши поколения F0, полностью происходящие из донорной эмбриональной стволовой клетки), независимо содержащие генные сегменты κ человека в мышином локусе, кодирующем тяжелые цепи, идентифицировали посредством генотипирования, используя модификацию анализа аллелей (Valenzuela et al., выше), с помощью которой выявлялось присутствие уникальных генных сегментов κ человека в эндогенном локусе, кодирующем тяжелые цепи (выше). Генотипированию подвергали детенышей, и детенышей, гетерозиготных по гибридному локусу для тяжелых цепей, отбирали для определения характеристик экспрессии содержащих VL связывающих белков.
Проточная цитометрия. Введение генных сегментов для легких цепей κ человека в мышиный локус, кодирующий тяжелые цепи, осуществляли с использованием линии эмбриональных стволовых клеток F1 (F1H4; Valenzuela et al. 2007, выше), происходящей из 129S6/SvEvTac и C57BL/6NTac гетерозиготных эмбрионов, которая дополнительно содержала in situ замену мышиных генных сегментов для легких цепей κ генными сегментами для легких цепей κ человека (патент США № 6596541). Генные сегменты Vκ зародышевого типа человека таргетируются в аллель 129S6, которую имеет гаплотип IgMa, тогда как немодифицированную мышиную аллель C576BL/6N имеет гаплотип IgMb. Эти аллельные формы Ig можно распознать с помощью проточной цитометрии, используя антитела, специфические для полиморфизмов, обнаруживаемых в аллелях IgMa или IgMb. Гетерозиготных мышей, содержащих генные сегменты для легких цепей κ человека в эндогенном локусе, кодирующем тяжелые цепи, описанные в примере I, исследовали в отношении экспрессии содержащих VLчеловека связывающих белков, используя проточную цитометрию.
Вкратце, осуществляли забор крови у групп мышей (n=6 в каждой группе), и кровь растирали, используя предметные стекла. В качестве контрольных групп использовали мышей C57BL/6 и Balb/c. После лизиса эритроцитов с помощью буфера для лизиса ACK (Lonza Walkersville) клетки ресуспендировали в буфере для окрашивания для FACS BD Pharmingen и блокировали с использованием антитела против мышиного CD16/32 (BD Pharmingen). Лимфоциты окрашивали с использованием конъюгата анти-мышиный IgMb-FITC (BD Pharmingen), конъюгата анти-мышиный IgMa-PE (BD Pharmingen), антитела против мышиного CD19 (клона 1D3; BD Biosciences) и антитела против мышиного CD3 (17A2; BIOLEGEND®) с последующей фиксацией с использованием BD CYTOFIXTM, все в соответствии с инструкциями производителей. Конечные клеточные осадки ресуспендировали в буфере для окрашивания и анализировали, используя программное обеспечение BD FACSCALIBURTM и BD CELLQUEST PROTM. В таблице 2 представлены средние значения в виде процента для B-клеток (CD19+), T-клеток (CD3+), экспрессии гибридной тяжелой цепи (CD19+IgMa+) и тяжелой цепи дикого типа (CD19+IgMb+), отмечаемой в группах животных, содержащих каждую генетическую модификацию.
В схожем эксперименте B-клеточное содержимое компартментов селезенки, крови и костного мозга мышей, гомозиготных по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, функционально связанным с геном константной области тяжелой цепи мыши (описанным в примере I, фиг.2), анализировали в отношении движения в ходе всего развития B-клеток, используя проточную цитометрию различных маркеров клеточной поверхности.
Вкратце, две группы (n=3 в случае каждой группы, самок возрастом 8 недель) мышей дикого типа и мышей, гомозиготных по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека, функционально связанным с геном константной области тяжелой цепи мыши, умерщвляли, и собирали кровь, селезенки и костный мозг. Кровь собирали в пробирки Microtainer с EDTA (BD Biosciences). Костной мозг получали из бедренных костей посредством смывания струей полной среды RPMI (среды RPMI, дополненной фетальной телячьей сывороткой, пируватом натрия, Hepes, 2-меркаптоэтанолом, заменимыми аминокислотами и гентамицином). Эритроциты в препаратах селезенки и костного мозга лизировали с использованием буфера для лизиса ACK (Lonza Walkersville) с последующей промывкой полной средой RPMI.
Клетки (1×106) инкубировали с антителом против мышиного CD16/CD32 (2.4G2, BD) на льду в течение десяти минут, а затем метили в течение тридцати минут на льду с использованием следующей смеси антител: анти-мышиный FITC-CD43 (1B11, BIOLEGEND®), PE-ckit (2B8, BIOLEGEND®), PeCy7-IgM (II/41, EBIOSCIENCE®), PerCP-Cy5.5-IgD (11-26c.2a, BIOLEGEND®), APC-eFluor 780-B220 (RA3-6B2, EBIOSCIENCE®), APC-CD19 (MB19-1, EBIOSCIENCE®). Костный мозг: незрелые B-клетки (B220среднийIgM+), зрелые B-клетки (B220высокийIgM+), про-B-клетки (CD19+ckit+CD43+), пре-B-клетки (CD19+ckit-CD43-), пре-B-клетки (CD19+CD43среднийIgM+/-), незрелые B-клетки (CD19+CD43-IgM+/-). Кровь и селезенка: B клетки (CD19+), зрелые B-клетки (CD19+IgMсреднийIgDвысокий), переходные/незрелые B-клетки (CD19+IgMвысокийIgDсредний).
После окрашивания клетки промывали и окрашивали в 2% формальдегиде. Данные получали в проточном цитометре LSRII и анализировали с использованием программного обеспечения FLOWJOTM (Tree Star, Inc.). На фиг.6A, 6B и 6C представлены результаты для компартмента селезенки. На фиг.7A-7G представлены результаты для компартмента костного мозга. Результаты, полученные для кровяного компартмента каждой группы мышей, были схожими с результатами для компартмента селезенки каждой группы (не представленные данные).
В схожем эксперименте B-клеточное содержимое компартментов селезенки, крови и костного мозга мышей, гомозиготных по тридцати генным сегментам Vκ человека и пяти генным сегментам Jκ человека, функционально связанным с геном константной области тяжелой цепи мыши (описанным в примере I, фиг.2), анализировали в отношении движения в ходе всего развития B-клеток, используя проточную цитометрию различных маркеров клеточной поверхности.
Вкратце, две группы (n=3 в случае каждой группы, самок возрастом 6 недель) мышей, содержащих локус для тяжелых цепей дикого типа и замену эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека, (WT) и мышей, гомозиготных по тридцати генным сегментам hVκ и пяти генным сегментам Jκ и замене эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (30hVκ-5hJκ HO), умерщвляли, и собирали селезенки и костный мозг. Костный мозг и спленоциты готовили для окрашивания различных маркеров клеточной поверхности (как описано выше).
Клетки (1×106) инкубировали с антителом против мышиного CD16/CD32 (2.4G2, BD) на льду в течение десяти минут, а затем метили в течение тридцати минут на льду с использованием наборов антител для костного мозга или спленоцитов. Набор антител для костного мозга: анти-мышиный FITC-CD43 (1B11, BIOLEGEND®), PE-ckit (2B8, BIOLEGEND®), PeCy7-IgM (II/41, EBIOSCIENCE®), APC-CD19 (MB19-1, EBIOSCIENCE®). Набор антител для костного мозга и селезенки: анти-мышиный FITC-Igκ (187.1 BD Biosciences), PE-Igλ (RML-42, BIOLEGEND®), PeCy7-IgM (II/41, EBIOSCIENCE®), PerCP-Cy5.5-IgD (11-26c.2a, BIOLEGEND®), Pacific Blue-CD3 (17A2, BIOLEGEND®), APC-B220 (RA3-6B2, EBIOSCIENCE®), APC-H7-CD19 (ID3, BD). Костный мозг: незрелые B-клетки (B220среднийIgM+), зрелые B-клетки (B220высокийIgM+), про-B-клетки (CD19+ckit+CD43+), пре-B-клетки (CD19+ckit-CD43-), незрелые Igκ+ B-клетки (B220среднийIgM+Igκ+Igλ-), незрелые Igλ+ B-клетки (B220среднийIgM+Igκ-Igλ+), зрелые Igκ+ B-клетки (B220высокийIgM+Igκ+Igλ-), зрелые Igλ+ B-клетки (B220высокийIgM+Igκ-Igλ+). Селезенка: B-клетки (CD19+), зрелые B-клетки (CD19+IgDвысокийIgMсредний), переходные/незрелые B-клетки (CD19+IgDсреднийIgMвысокий). Костный мозг и селезенка: Igκ+ B-клетки (CD19+Igκ+Igλ-), Igλ+ B-клетки (CD19+Igκ-Igλ+).
После окрашивания клетки промывали и окрашивали в 2% формальдегиде. Данные получали в проточном цитометре LSRII и анализировали с использованием программного обеспечения FLOWJOTM (Tree Star, Inc.). Результаты продемонстрировали схожие характеры окрашивания и популяции клеток для всех трех компартментов по сравнению с мышами, гомозиготными по шести генным сегментам Vκ человека и пяти генным сегментам Jκ человека (описанными выше). Однако у этих мышей выявлено уменьшение экспрессии эндогенной легкой цепи λ в компартментах и селезенки, и костного мозга (фиг.8A и 8B, соответственно), несмотря на интактность эндогенного локуса, кодирующего легкие цепи λ, у этих мышей. Это может свидетельствовать о неспособности реаранжированных доменов легких цепей κ человека, в связи с константными областями тяжелых цепей, к объединению в пары или объединению с доменами легких цепей λ мыши, приводя к исключению Igλ+ клеток.
Экспрессия изотипа. Тотальный и поверхностный (т.е. связанный с мембраной) иммуноглобулин M (IgM) и иммуноглобулин G1 (IgG1) определяли в случае мышей, гомозиготных по локусам, кодирующим вариабельные области тяжелых цепей и легких цепей κ человека (гуманизированных мышей VELCO IMMUNE®, см. патент США № 7105348), и мышей, гомозиготных по шести генным сегментам Vκ человека и 5 генным сегментам Jκ человека в эндогенном локусе, кодирующем тяжелые цепи (6hVκ-5hJκ HO), с помощью количественного анализа с использованием ПЦР, используя зонды TAQMAN® (как описано выше в примере II).
Вкратце, CD19+ B-клетки очищали из селезенок групп мышей (n = 3-4 мышам в каждой группе), используя микрошарики с антителом против мышиного CD19 (Miltenyi Biotec) в соответствии с инструкциями производителя. Тотальную РНК выделяли, используя набор RNEASYTM Mini kit (Qiagen). Геномную ДНК удаляли, используя обработку на колонке не содержащей РНКазу ДНКазой (Qiagen). Приблизительно 200 нг мРНК обратно транскрибировали в кДНК, используя набор для синтеза первой цепи кДНК (Invitrogen), а затем амплифицировали с использованием смеси TAQMAN® Universal PCR Master Mix (Applied Biosystems), используя систему для выявления последовательностей ABI 7900 (Applied Biosystems). Уникальные комбинации праймеры/зонды использовали для определения, в частности, экспрессии всех, поверхностных (т.е. трансмембранных) и секретируемых форм изотипов IgM и IgG1 (таблица 3). Относительную экспрессию приводили к константной области легкой цепи κ мыши (mCκ).
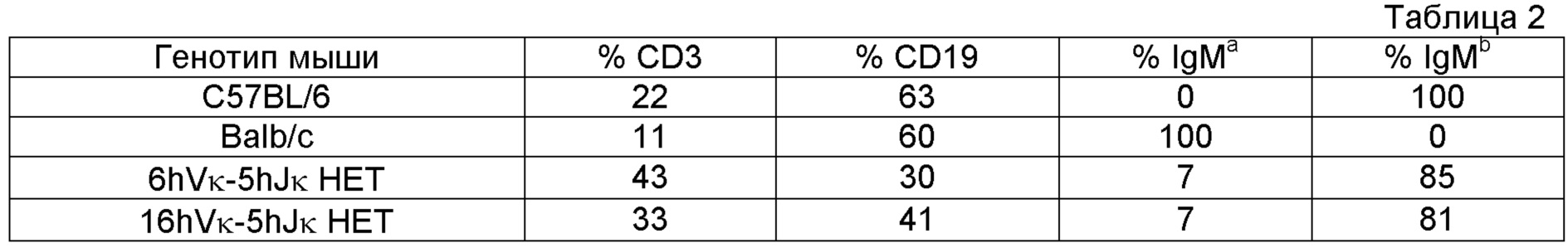
Результаты количественного анализа с использованием ПЦР TAQMAN® показали уменьшение тотального IgM и тотального IgG1. Однако отношение секретируемых форм к поверхностным формам IgM и IgG1 оказалось нормальным по сравнению с гуманизированными мышами VELCOIMMUNE® (не представленные данные).
Использование генных сегментов κ человека и анализ соединений Vκ-Jκ. «Необученных» мышей, гомозиготных по тридцати генным сегментам hVκ и пяти генным сегментам Jκ и замене эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (30hVκ-5hJκ HO), анализировали в отношении уникальных реаранжировок Vκ-Jκ человека в мышиной тяжелой цепи (IgG) с помощью полимеразной цепной реакции с использованием обратной транскриптазы (ОТ-ПЦР), используя РНК, выделенную из спленоцитов.
Вкратце, селезенки собирали и обрызгивали 10 мл RPMI-1640 (Sigma) с 5% HI-FBS в стерильных одноразовых мешках. Каждый мешок, содержащий одну селезенку, затем помещали в STOMACHERTM (Seward) и гомогенизировали при средней установке в течение 30 секунд. Гомогенизированные селезенки фильтровали, используя 0,7 мкм сито для клеток, а затем осаждали с использованием центрифуги (1000 оборотов/мин в течение 10 минут), и эритроциты лизировали в BD PHARM LYSETM (BD Biosciences) в течение трех минут. Спленоциты разводили RPMI-1640 и снова подвергали центрифугированию, а затем ресуспендированию в 1 мл PBS (Irvine Scientific). РНК выделяли из осажденных спленоцитов, используя стандартные методы, известные в данной области техники.
ОТ-ПЦР выполняли на РНК из спленоцитов, используя праймеры, специфические для генных сегментов Vκ человека и мышиного IgG. Праймер для IgG мыши был разработан из условия, чтобы он был способен к амплификации РНК, происходящей от всех изотипов IgG мыши. Продукты ПЦР очищали из геля и клонировали в вектор pCR2.1-TOPO TA (Invitrogen) и секвенировали с использованием праймеров: M13 прямого (GTAAAACGAC GGCCAG; SEQ ID NO: 16) и M13 обратного (CAGGAAACAG CTATGAC; SEQ ID NO: 17), находящихся в пределах вектора в положениях, фланкирующих сайт клонирования. Использование генных фрагментов Vκ и Jκ человека среди двенадцати отобранных клонов представлено в таблице 4. На фиг.9 представлена нуклеотидная последовательность соединения hVκ-hJκ-mIgG для двенадцати отобранных клонов, полученных с помощью ОТ-ПЦР.
Как показано в этом примере, у мышей, гомозиготных по шести генным сегментам Vκ человека и пяти генных сегментам Jκ человека или гомозиготных по тридцати генным сегментам Vκ человека и пяти генным сегментам Jκ человека, функционально связанным с геном константной области тяжелой цепи мыши, выявлена экспрессия вариабельных областей легких цепей человека из модифицированного локуса для тяжелых цепей, содержащего генные сегменты для вариабельных областей легких цепей в своей конфигурации зародышевого типа. У этих мышей наблюдали движение на протяжении различных стадий развития B-клеток, что указывает на множество эффективных процессов рекомбинирования, в которые вовлечены генные сегменты для вариабельных областей легких цепей из эндогенного локуса для тяжелых цепей, и экспрессию таких гибридных тяжелых цепей (т.е. вариабельной области легкой цепи человека, связанной с константной областью тяжелой цепи) в качестве части репертуара антител.
Пример IV
Размножение мышей, экспрессирующих содержащие VL связывающие белки
Для создания нового поколения содержащих VL связывающих белков мышей, содержащих нереаранжированные генные сегменты κ человека, можно скрестить с другой мышью, содержащей делецию другой эндогенной аллели тяжелой цепи. Полученное таким образом потомство экспрессировало бы только гибридные тяжелые цепи, как описано в примере I. Скрещивание выполняют стандартными методами, признанными в данной области техники, и, альтернативно, коммерческие компании, например, Jackson Laboratory. Линии мышей, содержащие локус для гибридных тяжелых цепей, скринируют на предмет присутствия уникальных гибридных тяжелых цепей и отсутствие традиционных мышиных тяжелых цепей.
Альтернативно, мышей, содержащих нереаранжированные генные сегменты κ человека в мышином локусе для тяжелых цепей, можно подвергнуть оптимизации посредством скрещивания с другими мышами, содержащими одну или более делеций в мышиных локусах для легких цепей (κ и λ). Полученное таким образом потомство экспрессировало бы антитела, содержащие только уникальные тяжелые цепи κ человека, как описано в примере I. Скрещивание так же выполняют стандартными методами, признанными в данной области техники, и, альтернативно, коммерческие компании, например, Jackson Laboratory. Линии мышей, содержащие локус для гибридных тяжелых цепей и одну или более делеций в мышиных локусах для легких цепей, скринируют на предмет присутствия уникальных гибридных тяжелых цепей, содержащих домены легких цепей κ и константные домены тяжелых цепей мыши, и отсутствие эндогенных мышиных легких цепей.
Мышей, содержащих нереаранжированный локус для гибридных тяжелых цепей, также скрещивают с мышами, которые содержат замену эндогенного мышиного локуса, кодирующего вариабельные области легких цепей κ, человеческим локусом, кодирующим вариабельные области легких цепей κ (см. патент США № 6596541, Regeneron Pharmaceuticals, The VELOCIMMUNE® Humanized Mouse Technology). Гуманизированная мышь VELOCIMMUNE® содержит, отчасти, геном, включающий последовательности для вариабельных областей легких цепей κ человека, функционально связанные с эндогенными мышиными локусами для константных областей тяжелых цепей, так что мышь продуцирует антитела, включающие вариабельный домен легкой цепи κ человека и мышиный константный домен тяжелой цепи, в ответ антигенную стимуляцию. ДНК, кодирующую вариабельные области легких цепей антител, можно выделить и функционально связать с ДНК, кодирующей константные области легких цепей человека. Затем ДНК можно экспрессировать в клетке, способной экспрессировать полностью человеческую легкую цепь антитела. При подходящей схеме скрещивания получают мышей, содержащих замену эндогенной мышиной ДНК для легких цепей κ локусом для легких цепей κ человека и нереаранжированный локус для гибридных тяжелых цепей. Уникальные содержащие VL связывающие белки, содержащие соматически мутированные Vκ-домены человека, можно выделить после иммунизации представляющим интерес антигеном.
Пример V
Создание содержащих VL связывающих белков
После скрещивания мышей, которые содержат нереаранжированный локус для гибридных тяжелых цепей, с различным линиями, содержащими модификации и делеции других эндогенных Ig локусов (описанными в примере IV), отобранных мышей можно иммунизировать представляющим интерес антигеном.
Как правило, гуманизированной мыши VELOCIMMUNE®, содержащей по меньшей мере один локус для гибридных тяжелых цепей, вводят антиген, и клетки (такие как B-клетки) извлекают из животного (например, из селезенки или лимфатических узлов). Клетки можно слить с линией клеток миеломы для приготовления имммортализованных линий гибридомных клеток, и такие линии гибридомных клеток подвергают скринингу и отбору для идентификации линий гибридомных клеток, которые продуцируют антитела, содержащие гибридные тяжелые цепи, специфические для антигена, использованного для иммунизации. ДНК, кодирующую Vκ-области человека гибридных тяжелых цепей, можно выделить и связать с желаемыми константными областями, например, тяжелой цепи и/или легкой цепи. Вследствие присутствия генных сегментов Vκ человека, слитых с константными областями тяжелых цепей мыши, продуцируется уникальный репертуар белков, подобных антителам, и разнообразие иммуноглобулинового репертуара значительно расширяется в результате создания уникальной формы антител. Это придает дополнительный уровень разнообразия антигенспецифическому репертуару после иммунизации. Результирующие клонированные последовательности антител можно впоследствии продуцировать в клетке, такой как клетка CHO. Альтернативно, ДНК, кодирующую антигенспецифические, содержащие VL связывающие белки или вариабельные домены, можно выделить непосредственно из антигенспецифических лимфоцитов (например, B-клеток).
В начале выделяют содержащие VL связывающие белки с высокой аффинностью, содержащие Vκ-область человека и мышиную константную область. Как описано выше, содержащие VL связывающие белки характеризуют и отбирают по желательным свойствам, включающим аффинность, селективность, эпитоп и т.д. Мышиные константные области заменяют желаемыми человеческими константными областями для создания уникальных полностью человеческих, содержащих VL связывающих белков, содержащих соматически мутированные Vκ-домены человека из нереаранжированного локуса для гибридных тяжелых цепей настоящего изобретения. Подходящие константные области человека включают, например, таковые IgG1 или IgG4 дикого типа или модифицированного IgG1 или IgG4 или, альтернативно, Cκ или Cλ.
Отдельные когорты мышей, содержащих замену эндогенного мышиного локуса для тяжелых цепей шестью генными сегментами Vκ человека и пятью генными сегментами Jκ человека (как описано в примере I) и замену эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека, были подвергнуты иммунизации белком - рецептором клеточной поверхности человека (антигеном X). Антиген X вводят непосредственно в подушечку задней стопы мышей с использование шести последовательных инъекций каждые 3-4 дня. Два-три микрограмма антигена X смешивают с 10 мкг олигонуклеотида CpG (каталожный # tlrl-modn - олигонуклеотид ODN1826; InVivogen, San Diego, CA) и 25 мкг Adju-Phos (геля фосфата алюминия в качестве адъюванта, каталожный # H-71639-250; Brenntag Biosector, Frederikssund, Denmark) до инъекции. Всего делают шесть инъекций до окончательной отмены антигена, которую выполняют за 3-5 дней до умерщвления. Осуществляют отборы крови после 4-й и 6-й инъекции, и за продукцией антител следят с помощью стандартного антигенспецифического иммуноанализа.
После достижения желаемого иммунного ответа спленоциты собирают и сливают с мышиными миеломными клетками для сохранения их жизнеспособности и образования линий гибридомных клеток. Линии гибридомных клеток подвергают скринингу и отбору для идентификации линий клеток, которые продуцируют специфические для антигена X связывающие белки, содержащие VL. Используя этот метод, получено несколько специфических для антигена X связывающих белов, содержащих VL (т.е. связывающих белков, обладающих Vκ-доменами человека в связи с константными доменами тяжелых и легких цепей мыши).
Альтернативно, связывающие белки, содержащие VL, против антигена X выделяют непосредственно из антиген-положительных B-клеток без слияния с миеломными клетками, как описано в заявке на патент США 2007/0280945A1, которая, в частности, включена сюда посредством ссылки в своем полном объеме. Используя этот способ, было получено несколько полностью человеческих связывающих белков, содержащих VL, против антигена X (т.е. антител, обладающих Vκ-доменами человека и константными доменами человека).
Использование генных сегментов κ человека. Для анализа структуры продуцируемых связывающих белков, содержащих VL, против антигена X нуклеиновые кислоты, кодирующие Vκ-домены человека (и тяжелых, и легких цепей связывающих белков, содержащих VL), были клонированы и секвенированы, используя адаптированные способы на основе тех, которые описаны в US 2007/0280945A1 (выше). На основе последовательностей нуклеиновых кислот и предсказанных аминокислотных последовательностей антител было определено использование генных сегментов для вариабельной области гибридной тяжелой цепи отобранных связывающих белков, содержащих VL, полученных из иммунизированных мышей (описанных выше). В таблице 5 определено использование генных сегментов Vκ и Jκ человека, исходя из отобранных связывающих белков, содержащих VL, против антигена X, которое указывает на то, что у мыши в соответствии с настоящим изобретением вырабатываются антигенспецифические связывающие белки, содержащие VL, из множества генных сегментов Vκ и Jκ человека, благодаря множеству реаранжировок в эндогенных локусах для тяжелых цепей и легких цепей κ, оба из которых содержат нереаранжированные генные сегменты Vκ и Jκ. Генные сегменты Vκ человека подвергались реаранжировке со множеством Jκ-сегментов человека с созданием уникальных антигенспецифических связывающих белков, содержащих VL.
Иммуноферментный твердофазный анализ (ELISA). Содержащие VL человека связывающие белки, индуцированные против антигена X, исследовали в отношении их способности блокировать связывание природного лиганда антигена X (лиганда Y) в анализе ELISA.
Вкратце, 96-луночные планшеты покрывали лигандом в концентрации, составляющей 2 мкг/мл, разведенным в PBS, и инкубировали в течение ночи с последующей промывкой четыре раза PBS с 0,05% Tween-20. Затем планшеты блокировали с использованием PBS (Irvine Scientific, Santa Ana, CA), содержащего 0,5% (масс./об.) BSA (Sigma-Aldrich Corp., St. Louis, MO), в течение одного часа при комнатной температуре. В отдельном планшете супернатанты, содержащие связывающие белки, содержащие VL, против антигена X, разводили буфером в соотношении 1:10. Фиктивный супернатант с теми же компонентами содержащих VL связывающих белков использовали в качестве отрицательного контроля. Экстраклеточный домен (ECD) антигена X был конъюгирован с Fc-частью мышиного IgG2a (антиген X-mFc). Антиген X-mFc добавляли до конечной концентрации, составляющей 0,150 нМ, и инкубировали в течение одного часа при комнатной температуре. Затем добавляли смесь содержащий VL связывающий белок/антиген X-mFc в планшет, содержащий лиганд Y, и осуществляли инкубацию в течение одного часа при комнатной температуре. Выявление антигена X-mFc, связанного с лигандом Y, осуществляли с помощью пероксидазы хрена (HRP), конъюгированной с антителом против пента-His (Qiagen, Valencia, CA), и проявляли с помощью стандартной колориметрической реакции, используя тетраметилбензидин (TMB) в качестве субстрата (BD Biosciences, San Jose, CA), с нейтрализацией серной кислотой. Оптическую плотность считывали при ОП450 в течение 0,1 сек. Фоновую оптическую плотность образца без антигена X вычитали из всех образцов. Процент блокировки рассчитывали для >250 (трех 96-луночных планшетов) антиген X-специфических, содержащих VL связывающих белков посредством деления MFI каждого образца за вычетом фона на скорректированное значение для отрицательного контроля, умножая на 100, и вычета результирующего значения из 100.
Результаты показали, что несколько содержащих VL связывающих белков, выделенных из мышей, иммунизированных антигеном X, специфически связывали экстраклеточный домен антигена X, слитый с Fc-частью мышиного IgG2a (не представленные данные).
Определение аффинности. Равновесные константы диссоциации (KD) для отобранных супернатантов, содержащих антиген X-специфические, содержащие VL связывающие белки, определяли с помощью SPR (поверхностного плазмонного резонанса), используя инструментальное средство BIACORETM T100 (GE Healthcare). Все данные были получены, используя HBS-EP (10 мМ HEPES, 150 мМ NaCl, 0,3 мМ EDTA, 0,05% поверхностно-активного вещества P20, pH 7,4) в качестве подвижного буфера и буфера для образцов, при 25°C.
Вкратце, содержащие VL связывающие белки из образцов неочищенных супернатантов улавливали на поверхности сенсорного чипа CM5, подвергнутой дериватизации с помощью высокой концентрации антител против Fc человека, используя стандартную химию сочетания с аминами. Во время стадии улавливания супернатанты пропускали по всей поверхности с антителом против Fc человека со скоростью потока, составляющей 3 мкл/мин, в течение всего 3 минут. За стадией улавливания следовала инъекция или подвижного буфера, или анализа в концентрации, составляющей 100 нМ, в течение 2 минут со скоростью потока, составляющей 35 мкл/мин. За диссоциацией антитела от захваченного связывающего белка, содержащего VL, следили в течение 6 минут. Захваченный связывающий белок, содержащий VL, удаляли с помощью инъекции в течение короткого времени 10 мМ глицина, pH 1,5. Ко всем сенсограммам обращались дважды в результате вычитания сенсограмм, исходя из инъекций буфера, из сенсограмм для аналитов, исключая тем самым артефакты, вызванные диссоциацией содержащего VL связывающего белка от улавливающей поверхности. Данные, относящиеся к связыванию каждого содержащего VL связывающего белка, подгоняли к модели связывания в соотношении 1:1 с переносом массы, используя программное обеспечении для оценки BIAcore T100 версии 2.1.
Аффинности связывания тридцати четырех отобранных связывающих белков, содержащих VL, варьировали, при этом все они продемонстрировали KD в наномолярном диапазоне (1,5-130 нМ). Кроме того, приблизительно 70% отобранных связывающих белков, содержащих VL, (23 из 34), продемонстрировали одноцифровую наномолярную аффинность. Определения T1/2 для этих отобранных связывающих белков, содержащих VL, указали на диапазон от приблизительно 0,2 до 66 минут. Из тридцати четырех связывающих белков, содержащих VL, шесть продемонстрировали составляющую менее чем 3 нМ аффинность к антигену X (1,53, 2,23, 2,58, 2,59, 2,79 и 2,84). Данные по аффинности соответствуют связывающим белкам, содержащим VL, являющимся результатом основанных на комбинировании объединений реаранжированных вариабельных доменов легких цепей человека с константными областями тяжелых и легких цепей (описанных в таблице 4), обладающим высокой аффинностью, клонально отобранным и соматически мутированным. Связывающие белки, содержащие VL, вырабатываемые у мышей, описываемых здесь, включают коллекцию разнообразных обладающих высокой аффинностью уникальных связывающих белков, которые демонстрируют специфичность в отношении одного или более эпитопов антигена X.
В другом эксперименте отобранные связывающие белки, содержащие VL человека, индуцированные против антигена X, были исследованы в отношении их способности блокировать связывание природного лиганда антигена X (лиганда Y) с антигеном X в анализе на основе шариков LUMINEX® (не представленные данные). Результаты показали, что, помимо специфического связывания экстраклеточного домена антигена X с аффинностями в наномолярном диапазоне (описанного выше), отобранные связывающие белки, содержащие VL, также способны к связыванию антигена X яванского макака (Macaca fascicularis).
Реферат
Изобретение относится к области биотехнологии и иммунологии. Предложена мышь для продукции цепи иммуноглобулина. Мышь способна продуцировать цепь иммуноглобулина, включающую вариабельный домен легкой цепи, слитый с константным доменом тяжелой цепи, и содержит в своих зародышевых клетках первый нереаранжированный Vκ-сегмент легкой цепи человека и нереаранжированный Jκ-сегмент человека, функционально связанный с эндогенной нуклеотидной последовательностью константной области тяжелой цепи мыши в эндогенном мышином локусе тяжелой цепи. При этом первый нереаранжированный Vκ генный сегмент легкой цепи человека и нереаранжированный Jκ генный сегмент человека заменяют все функциональные эндогенные VH генные сегменты тяжелой цепи мыши, все функциональные эндогенные DH генные сегменты мыши и все функциональные эндогенные JH генные сегменты тяжелой цепи мыши в эндогенном мышином локусе тяжелой цепи. Также описано применение такой мыши для продукции антитела. 8 н. и 14 з.п. ф-лы, 21 ил., 5 табл., 5 пр.

Комментарии