Отличные от человека животные, содержащие гуманизированный ген фактора активации в-клеток - RU2670016C1
Код документа: RU2670016C1
Чертежи

























Описание
Ссылка на родственную заявку
По настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на патент США №61/905983, поданной 19 ноября 2013 г., полное содержание которой включено в настоящий документ посредством ссылки.
Включение посредством ссылки перечня последовательностей
Перечень последовательностей в формате текстового файла ASCII, названного как 31015_6800_SEQ.txt и размером 22 килобайт, созданный 5 ноября 2014 г. и представленный ведомству США по патентам и товарным знакам посредством EFS-Web, включен в настоящий документ посредством ссылки.
Предшествующий уровень техники настоящего изобретения
Аутоиммуннитет приводит к тому, что естественные механизмы организма для предотвращения нападения его иммунной системы на свои собственные клетки и ткани разрушаются. Заболевания, нарушения и состояния, вызванные разрушением, а также возникающие в результате аберрантных самонаправленных иммунных реакций, называются аутоиммунными заболеваниями. Показательные примеры аутоиммунных заболеваний, нарушений и состояний включают в себя сахарный диабет, системную красную волчанку (СКВ), ревматоидный артрит (РА) и некоторые аллергии. Аутоиммунные заболевания оцениваются как заболевания, находящиеся среди десяти ведущих причин смертности. Инвестиции в развитие способов лечения аутоиммунных заболеваний находится в многомиллиардном диапазоне, выраженном в долларах, и критические системы in vivo для исследования, разработки и проверки потенциальных терапевтических средств необходимы для обеспечения безопасности и эффективности лечения. Кроме того, такие системы in vivo необходимы при определении того, могут ли новые способы лечения вызывать длительное улучшение у пациентов и, возможно, даже излечивать от многих заболеваний, которые остаются нерешенными. Такие системы in vivo также служат источником для анализов кроветворной и иммунной системы человека, связанных с функциями in vivo, выявления новых способов лечения и вакцин.
Краткое раскрытие настоящего изобретения
Настоящее изобретение включает в себя признание того, что желательно получение подвергнутого генной инженерии отличного от человека животного для обеспечения улучшенных систем аутоиммунных заболеваний in vivo, чтобы обеспечить исследование, разработку и проверку новых и существующих потенциальных лекарственных средств. Настоящее изобретение охватывает также признание того, что желательно получение подвергнутого генной инженерии отличного от человека животного для обеспечения улучшенной активации и выживаемости человеческих лимфоцитов (например, В-клеток) после иммунизации и после приживления человеческих гемопоэтических стволовых клеток или В-клеток от доноров-людей. Настоящее изобретение также охватывает признание того, что отличные от человека животные, содержащие гуманизированный ген Baff и/или иным образом экспрессирующие, содержащие или производящие человеческий или гуманизированный белок Baff, желательны, например, для применения при приживлении человеческих гемопоэтических стволовых клеток или В-клеток от доноров-людей.
Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению экспрессирует полипептид Baff, содержащий внеклеточную часть белка BAFF человека, связанную с внутриклеточной частью мышиного белка Baff.
Согласно некоторым вариантам осуществления внеклеточная часть белка BAFF человека кодируется экзонами с 3 по 6 гена BAFF человека.
Согласно некоторым вариантам осуществления экзоны с 3 по 6 гена BAFF человека по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентичны экзонам с 3 по 6 гена BAFF человека, который представлен в таблице 3. Согласно некоторым вариантам осуществления экзоны с 3 по 6 гена BAFF человека на 100% идентичны экзонам с 3 по 6 гена BAFF человека, который представлен в таблице 3.
Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению обнаруживаемым образом не экспрессирует полноразмерный эндогенный белок Baff. Согласно некоторым вариантам осуществления отличное от человека животное представляет собой грызуна и обнаруживаемым образом не экспрессирует полноразмерный белок Baff грызуна. Согласно некоторым вариантам осуществления отличное от человека животное представляет собой мышь и обнаруживаемым образом не экспрессирует полноразмерный белок Baff мыши, последовательность которого представлена в таблице 3.
Согласно некоторым вариантам осуществления полипептид Baff согласно настоящему изобретению экспрессируется из генетически модифицированного гена Baff в эндогенном отличном от человеческого локусе Baff. Согласно некоторым определенным вариантам осуществления генетически модифицированный ген Baff содержит отличный от человеческого экзон 1 Baff. Согласно некоторым определенным вариантам осуществления генетически модифицированный ген Baff содержит отличный от человеческого экзон 2 Baff. Согласно некоторым определенным вариантам осуществления генетически модифицированный ген Baff содержит отличный от человеческого экзон 7 Baff, полностью или частично. Согласно некоторым определенным вариантам осуществления генетически модифицированный ген Baff содержит отличный от человеческого экзон 1 и экзон 2 Baff. Согласно некоторым определенным вариантам осуществления генетически модифицированный ген Baff содержит отличный от человеческого экзон 1 Baff отличный от человеческого экзон 2 Baff отличный от человеческого экзон 7 Baff, полностью или частично, или их комбинацию. Согласно различным вариантам осуществления отличный от человеческого экзон 7 Baff частично содержит отличную от человеческой 3' нетранслируемую область (UTR) Baff и отличный от человеческого сигнал полиаденилирования Baff.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрено отличное от человека животное, содержащее генетически модифицированный ген Baff который содержит один или несколько экзонов человеческого гена BAFF (т.е. гуманизированный ген Baff), функционально связанных с промотором Baff. Согласно некоторым вариантам осуществления промотор Baff согласно настоящему изобретению представляет собой отличный от человеческого промотор Baff. Согласно некоторым вариантам осуществления промотор BAFF согласно настоящему изобретению представляет собой человеческий промотор Baff.
Согласно некоторым вариантам осуществления гуманизированный ген Baff согласно настоящему изобретению содержит экзоны с 3 по 6 гена BAFF человека. Согласно некоторым определенным вариантам осуществления гуманизированный ген Baff дополнительно содержит отличный от человеческого экзон 1 Baff. Согласно некоторым определенным вариантам осуществления гуманизированный ген Baff дополнительно содержит отличный от человеческого экзон 2 Baff. Согласно некоторым определенным вариантам осуществления гуманизированный ген BAFF дополнительно содержит отличный от человеческого экзон 7 Baff полностью или частично. Согласно некоторым определенным вариантам осуществления гуманизированный ген Baff содержит отличные от человеческого экзон 1, экзон 2 Baff и отличный от человеческого экзон 7 Baff полностью или частично. Согласно различным вариантам осуществления отличный от человеческого экзон 7 Baff частично содержит отличную от человеческой 3' нетранслируемую область (UTR) Baff и отличный от человеческого сигнал полиаденилирования Baff.
Согласно некоторым вариантам осуществления экзоны с 3 по 6 гена BAFF человека по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентичны экзонам с 3 по 6 гена BAFF человека, который представлен в таблице 3. Согласно некоторым вариантам осуществления экзоны с 3 по 6 гена BAFF человека на 100% идентичны экзонам с 3 по 6 гена BAFF человека, который представлен в таблице 3.
Согласно различным вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой грызуна. Согласно некоторым определенным вариантам осуществления грызуна согласно настоящему изобретению выбирают из мыши или крысы.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрен гуманизированный локус Baff (или ген), содержащий один или несколько экзонов отличного от человеческого гена Baff функционально связанных с одним или несколькими экзонами гена BAFF человека.
Согласно некоторым вариантам осуществления гуманизированный локус Baff (или ген) согласно настоящему изобретению содержит отличные от человеческих экзоны 1 и 2 Baff функционально связанные с экзонами с 3 по 6 BAFF человека. Согласно некоторым определенным вариантам осуществления гуманизированный локус Baff (или ген) дополнительно содержит отличные от человеческих 5' и 3' нетранслируемые области (UTR), фланкирующие отличный от человеческого экзон 1 Baff и человеческий экзон 6 BAFF.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрен полипептид Baff, кодируемый описанным в настоящем документе гуманизированным локусом или геном Baff.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрена клетка или ткань, выделенная из описанного в настоящем документе отличного от человека животного. Согласно некоторым вариантам осуществления клетку выбирают из астроцита, дендритной клетки, лимфоцита (например, В или Т-клетки), моноцита, нейтрофилов и стромальной клетки. Согласно некоторым вариантам осуществления ткань выбирают из жировой ткани, мочевого пузыря, головного мозга, молочной железы, костного мозга, глаза, сердца, кишечника, почки, печени, легкого, лимфатического узла, мышцы, поджелудочной железы, плазмы, сыворотки крови, кожи, селезенки, желудка, вилочковой железы, семенников, яйцеклетки и/или их комбинации.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрена выделенная отличная от человеческой (например, грызуна) клетка или ткань, геном которой содержит ген Baff (или локус), содержащий один или несколько экзонов отличного от человеческого гена Baff функционально связанного с одним или несколькими экзонами гена BAFF человека. Согласно некоторым определенным вариантам осуществления в настоящем изобретении предусмотрена выделенная отличная от человеческой (например, грызуна) клетка или ткань, геном которой содержит ген Baff (или локус), содержащий отличные от человеческих экзоны 1 и 2 Baff функционально связанные с экзонами с 3 по 6 BAFF человека, причем ген Baff (или локус) дополнительно содержит отличные от человеческих нетранслируемые области (UTR) 5' и 3', фланкирующие отличный от человеческого экзон 1 Baff и отличный от человеческого экзон 6 BAFF. Согласно некоторым вариантам осуществления ген Baff (или локус) содержит последовательность, которая кодирует полипептид BAFF, который содержит остатки с 142 по 285 белка BAFF человека.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрена отличная от человеческой эмбриональная стволовая (ЭС) клетка, геном которой содержит описанный в настоящем документе ген Baff (или локус). Согласно некоторым определенным вариантам осуществления ЭС клетка содержит ген Baff который кодирует внеклеточную часть человеческого белка BAFF, связанную с внутриклеточной частью мышиного белка BAFF. Согласно некоторым определенным вариантам осуществления ЭС клетка содержит ген Baff который содержит экзоны с 3 по 6 гена BAFF человека. Согласно некоторым определенным вариантам осуществления ЭС клетка представляет собой ЭС клетку грызуна. Согласно некоторым вариантам осуществления отличная от человеческой ЭС клетка согласно настоящему изобретению представляет собой ЭС клетку мыши или крысы.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрено применение описанной в настоящем документе отличной от человеческой эмбриональной стволовой клетки для получения отличного от человека животного. Согласно некоторым определенным вариантам осуществления отличная от человеческой эмбриональная стволовая клетка представляет собой мышиную и используется для получения мыши, содержащей описанный в настоящем документе ген Baff.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрен отличный от человеческого эмбрион, содержащий, сделанный из, полученный из или произведенный из отличной от человеческой эмбриональной стволовой клетки, которая содержит описанный в настоящем документе ген Baff. Согласно некоторым вариантам осуществления отличный от человеческого эмбрион согласно настоящему изобретению представляет собой эмбрион грызуна. Согласно некоторым вариантам осуществления описанный в настоящем документе эмбрион грызуна представляет собой эмбрион мыши или крысы.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрен способ получения отличного от человека животного, которое экспрессирует белок Baff из гуманизированного гена Baff в эндогенном локусе Baff, причем белок Baff содержит человеческую последовательность, причем способ предусматривает следующие стадии: направленное воздействие на эндогенный ген Baff (или локус) в отличной от человеческой эмбриональной стволовой (ЭС) клетке геномным фрагментом, содержащим человеческую нуклеотидную последовательность, которая кодирует белок BAFF человека полностью или частично, получение модифицированной отличной от человеческой эмбриональной стволовой (ЭС) клетки, содержащей гуманизированный ген Baff в эндогенном локусе Baff который содержит указанную человеческую последовательность, а также создание отличного от человека животного с использованием указанной модифицированной эмбриональной стволовой (ЭС) клетки.
Согласно некоторым вариантам осуществления указанная человеческая нуклеотидная последовательность содержит экзоны с 3 по 6 гена BAFF человека. Согласно некоторым вариантам осуществления указанная человеческая нуклеотидная последовательность содержит экзоны с 3 по 6 гена BAFF человека, которые по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентичны экзонам с 3 по 6 гена BAFF человека, который представлен в таблице 3. Согласно некоторым определенным вариантам осуществления указанная человеческая нуклеотидная последовательность содержит экзоны с 3 по 6 гена BAFF человека, которые на 100% идентичны экзонам с 3 по 6 гена BAFF человека, который представлен в таблице 3.
Согласно некоторым вариантам осуществления указанная нуклеотидная последовательность человека кодирует аминокислотные остатки с 142 по 285 белка BAFF человека. Согласно некоторым вариантам осуществления указанная человеческая нуклеотидная последовательность кодирует аминокислотные остатки 142-295 белка BAFF человека, которые по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентичны аминокислотным остаткам 142-295 белка BAFF человека, который представлен в таблице 3. Согласно некоторым определенным вариантам осуществления указанная человеческая нуклеотидная последовательность кодирует аминокислотные остатки 142-295 белка BAFF человека, которые на 100% идентичны аминокислотным остаткам 142-295 белка BAFF человека, который представлен в таблице 3.
Согласно некоторым вариантам осуществления в настоящем изобретении представлена мышь или крыса, созданная или полученная (или получаемая) посредством описанного в настоящем документе способа. Согласно некоторым определенным вариантам осуществления мышь или крыса, созданная или полученная (или получаемая) посредством описанного в настоящем документе способа, обнаруживаемым образом не экспрессирует полноразмерный эндогенный (например, мыши или крысы) белок Baff.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрен способ обеспечения мыши, геном которой содержит ген Baff, который кодирует внеклеточную часть белка BAFF человека, связанную с внутриклеточной частью мышиного белка BAFF, причем указанный способ предусматривает модификацию генома мыши таким образом, чтобы он содержал ген Baff, который кодирует внеклеточную часть белка BAFF человека, связанную с внутриклеточной частью белка BAFF мыши, таким образом обеспечивая указанную мышь. Согласно некоторым вариантам осуществления ген Baff представляет собой описанный в настоящем документе ген Baff Согласно некоторым вариантам осуществления ген Baff представляет собой ген, который кодирует белок, последовательность которого отражает гуманизированный белок Baff, который представлен в таблице 3. Согласно некоторым определенным вариантам осуществления ген Baff содержит экзоны с 3 по 6 гена BAFF человека.
Согласно различным вариантам осуществления гуманизированный ген Baff согласно настоящему изобретению содержит экзоны 3, 4, 5 и 6 гена BAFF человека. Согласно различным вариантам осуществления внеклеточная часть гуманизированного белка Baff согласно настоящему изобретению содержит аминокислоты, соответствующие остаткам 142-295 белка BAFF человека, который представлен в таблице 3. Согласно некоторым определенным вариантам осуществления гуманизированный белок Baff согласно настоящему изобретению содержит последовательность гуманизированного белка Baff, который представлен в таблице 3. Согласно различным вариантам осуществления гуманизированный ген Baff согласно настоящему изобретению функционально связан с мышиным промотором Baff.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрен способ приживления человеческих клеток у мыши, причем способ предусматривает следующие стадии: обеспечение мыши, геном которой содержит ген Baff который кодирует внеклеточную часть белка BAFF человека, связанную с внутриклеточной частью мышиного белка Baff (описанного в настоящем документе), и трансплантация одной или нескольких человеческих клеток мыши. Согласно некоторым определенным вариантам осуществления способ дополнительно предусматривает стадию оценки приживления одной или нескольких человеческих клеток у мыши. Согласно некоторым определенным вариантам осуществления стадия оценки предусматривает сравнение приживления одной или нескольких человеческих клеток с приживлением в одной или нескольких мышах дикого типа или в одной или нескольких мышах, геном которых не содержит ген Baff который кодирует внеклеточную часть белка BAFF человека, связанную с внутриклеточной частью белка Baff мыши.
Согласно некоторым определенным вариантам осуществления человеческие клетки представляют собой гемопоэтические стволовые клетки. Согласно некоторым определенным вариантам осуществления клетки человека представляют собой В-клетки человека.
Согласно некоторым вариантам осуществления клетки человека трансплантируют внутривенно. Согласно некоторым вариантам осуществления клетки человека трансплантируют внутрибрюшинно. Согласно некоторым вариантам осуществления клетки человека трансплантируют подкожно.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрены способы идентификации или проверки лекарственного средства или вакцины, причем способ предусматривает стадии доставки лекарственного средства или вакцины описанному в настоящем документе отличному от человека животному, а также контроля одного или нескольких иммунных ответов на лекарственное средство или вакцину, профиль безопасности лекарственного средства или вакцины или воздействие на заболевание или состояние. Согласно некоторым вариантам осуществления контроль профиля безопасности предусматривает определение того, проявляет ли отличное от человека животное нежелательное явление или неблагоприятную реакцию в результате доставки лекарственного средства или вакцины. Согласно некоторым вариантам осуществления нежелательное явление или неблагоприятную реакцию выбирают из заболеваемости, смертности, изменения массы тела, изменения содержания одного или нескольких ферментов (например, печени), изменения массы одного или нескольких органов, потери функции (например, сенсорных, моторных, органных и т.д.), повышенной восприимчивости к одному или нескольким заболеваниям, изменения в геноме отличного от человека животного, увеличения или уменьшения потребления пищи и осложнения одного или нескольких заболеваний.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрено применение отличного от человека животного согласно настоящему изобретению в разработке лекарственного средства или вакцины для применения в медицине, такой как использование в качестве лекарственного средства.
Согласно различным вариантам осуществления отличные от человека животные согласно настоящему изобретению представляют собой грызунов, предпочтительно мышь или крысу.
Используемые в настоящей заявке термины "около" и "приблизительно" используются в качестве эквивалентов. Любые цифры, используемые в настоящей заявке, с или без около/приблизительно предназначены для покрытия любых нормальных колебаний, оцененных специалистом в соответствующей области техники.
Другие особенности, цели и преимущества настоящего изобретения очевидны в подробном описании, которое следует ниже. Следует понимать, однако, что подробное описание с указанием вариантов осуществления настоящего изобретения дается только в качестве иллюстрации, но не ограничения. Различные изменения и модификации в пределах объема настоящего изобретения станут очевидными специалистам в настоящей области техники из подробного описания.
Краткое описание графических материалов
Включенные в настоящий документ графические материалы, которые содержат следующие фигуры, представлены только для целей иллюстрации, а не ограничения.
На фиг. 1 показана блок-схема, без соблюдения масштаба, геномной организации мышиных и человеческих генов фактора активации В-клеток (BAFF). Экзоны пронумерованы под каждым экзоном.
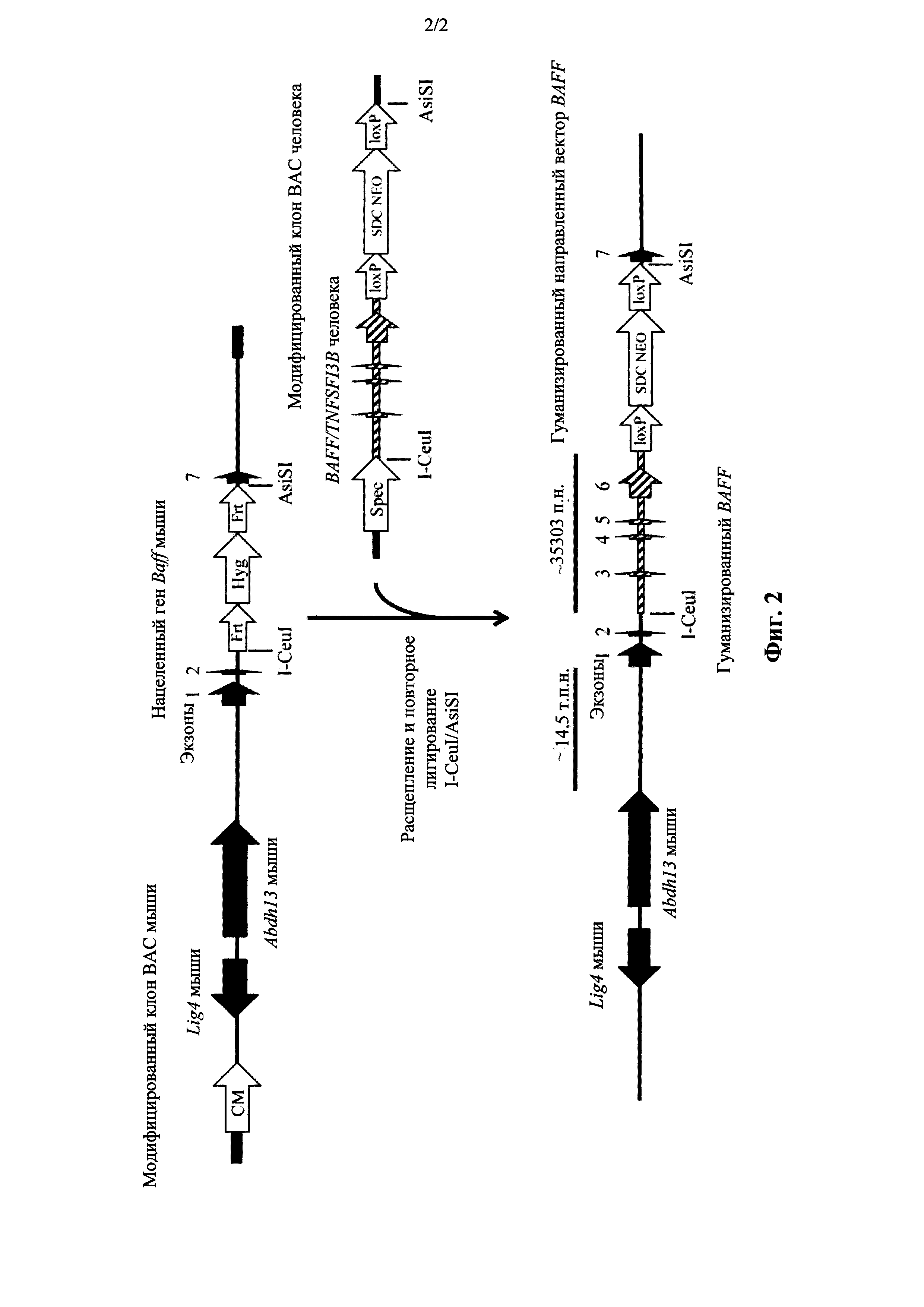
На фиг. 2 показана блок-схема, без соблюдения масштаба, иллюстративного способа гуманизации отличного от человеческого гена фактора активации В-клеток (Baff). Отличные от человеческих последовательности показаны в виде закрашенных черных условных обозначений. Человеческие последовательности показаны в виде незакрашенных диагонально зачерченных условных обозначений. СМ: селекционная кассета с геном устойчивости к хлорамфениколу. Hyg: селекционная кассета с геном устойчивости к гигромицину. SDC NEO: самоудаляющаяся селекционная кассета с геном устойчивости к неомицину. Spec: селекционная кассета с геном устойчивости к спектиномицину. Frt: последовательность сайта направленного распознавания рекомбиназой Flp. LoxP: последовательность сайта направленного распознавания рекомбиназой Cre. Указаны сайты распознавания ферментами рестрикции (например, AsiSI, I-CeuI и т.п.).
Определения
Настоящее изобретение не ограничивается конкретными способами, а также описанными экспериментальными условиями, так как такие способы и условия могут варьировать. Кроме того, следует понимать, что используемая в настоящем документе терминология предназначена для целей описания только определенных вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения определяется формулой изобретения.
Если не указано иное, все используемые в настоящем документе термины и фразы предусматривают те значения, которыми термины и фразы характеризуются в настоящей области техники, если иное четко не указано или явно не следует из контекста, в котором используется этот термин или фраза. Хотя любые способы и материалы, подобные или эквивалентные описанным в настоящем документе, могут быть использованы на практике или при тестировании настоящего изобретения, конкретные способы и материалы описаны ниже. Все упомянутые публикации включены в настоящий документ посредством ссылки.
Используемый в настоящем документе термин "приблизительно" применительно к одному или нескольким представляющим интерес значениям относится к значению, которое сходно с указанным эталонным значением. Согласно некоторым вариантам осуществления термин "приблизительно" или "около" относится к диапазону значений, попадающих в диапазон 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или меньше в любом направлении (больше или меньше, чем) от заявленного эталонного значения, если иное не указано или иным образом не очевидно из контекста (кроме случаев, когда такое количество будет превышать 100% от возможного значения).
Используемый в настоящем документе термин "биологически активный" относится к характеристике любого средства, которое обладает активностью в биологической системе, in vitro или in vivo (например, в организме). Например, такое средство, которое, если присутствует в организме, оказывает биологическое влияние внутри этого организма, считается биологически активным. Согласно конкретным вариантам осуществлениям, в которых белок или полипептид представляет собой биологически активный, часть этого белка или полипептида, который разделяет по меньшей мере одну биологическую активность белка или полипептида, как правило, называют "биологически активной" частью.
Используемый в настоящем документе термин "сравнимый" относится к двум или более средствам, объектам, ситуациям, наборам условий и т.п., которые могут не быть идентичными друг другу, но которые достаточно близки, чтобы обеспечить сравнение между ними таким образом, чтобы могли быть сделаны обоснованные выводы на основе наблюдаемых различий или сходств. Специалистам в настоящей области техники будет понятно, в контексте, какая степень идентичности требуется в тех или иных обстоятельствах для двух или более таких средств, объектов, ситуаций, наборов условий и т.д., чтобы считаться сопоставимыми.
Термин "консервативный", используемый в настоящем документе для описания консервативной аминокислотной замены, относится к замене аминокислотного остатка другим аминокислотным остатком, содержащим R группу боковой цепи со сходными химическими свойствами (например, зарядом или гидрофобностью). В общем случае, консервативная аминокислотная замена не будет существенно изменять функциональные свойства представляющего интерес белка, например, способность рецептора связываться с лигандом. Примеры групп аминокислот, содержащих боковые цепи со сходными химическими свойствами, включают в себя такие алифатические боковые цепи, как глицин, аланин, валин, лейцин и изолейцин; такие алифатические-гидроксильные боковые цепи, как серии и треонин; такие амидсодержащий боковые цепи, как аспарагин и глутамин; такие ароматические боковые цепи, как фенилаланин, тирозин и триптофан; такие основные боковые цепи, как лизин, аргинин, гистидин, и такие кислотные боковые цепи, как аспарагиновая кислота и глутаминовая кислота; и такие серосодержащие боковые цепи, как цистеин и метионин. Консервативные группы аминокислотных замен включают в себя, например, валин/лейцин/изолейцин, фенилаланин/тирозин, лизин/аргинин, аланин/валин, глутамат/аспартат и аспарагин/глутамин. Согласно некоторым вариантам осуществления консервативная аминокислотная замена может представлять собой замену любого нативного остатка в белке на аланин, как используется, например, в сканирующем аланином мутагенезе. Согласно некоторым вариантам осуществления консервативная замена представляет собой замену, которая характеризуется положительным значением в матрице логарифмического правдоподобия РАМ250, раскрытой в Gonnet et al. (1992) Exhaustive Matching of the Entire Protein Sequence Database, Science 256:1443-45, включенной в настоящий документ посредством ссылки. Согласно некоторым вариантам осуществления замена считается "умеренно консервативной", если она характеризуется неотрицательным значением в матрице логарифмического правдоподобия РАМ250.
Используемый в настоящем документе термин "нарушение" относится к результату события, которое прерывает (например, посредством гомологичной рекомбинации) ДНК. Согласно некоторым вариантам осуществления нарушение может достигать или представлять собой делецию, инверсию, модификацию, замещение, замену или любую их комбинацию последовательности(ей) ДНК. Согласно некоторым вариантам осуществления нарушение может достигать или представлять собой введение мутации, такой как миссенс, нонсенс, или мутации со сдвигом рамки, или любой их комбинации в кодирующей последовательности(ях) в ДНК. Согласно некоторым вариантам осуществления нарушение может происходить в гене или локусе гена, эндогенном по отношению к клетке. Согласно некоторым вариантам осуществления вставки могут включать в себя вставку целых генов или фрагментов генов, например, экзонов, в эндогенный сайт в клетке или геноме. Согласно некоторым вариантам осуществления вставки могут вводить последовательности, которые представляют собой точку начала репликации, отличную от таковой эндогенной последовательности, в которую они вставлены. Согласно некоторым вариантам осуществления нарушение может повышать экспрессию и/или активность гена или продукта гена (например, кодируемого геном белка). Согласно некоторым вариантам осуществления нарушение может уменьшать экспрессию и/или активность гена или продукта гена. Согласно некоторым вариантам осуществления нарушение может изменять последовательность гена или продукта гена (например, кодированного белка). Согласно некоторым вариантам осуществления нарушение может укорачивать или фрагментировать ген или продукт гена (например, кодированный белок). Согласно некоторым вариантам осуществления нарушение может удлинять ген или генный продукт; согласно некоторым таким вариантам осуществления нарушение может достигать сборки слитого белка. Согласно некоторым вариантам осуществления нарушение может влиять на содержание, но не активность гена или продукта гена. Согласно некоторым вариантам осуществления нарушение может влиять на активность, но не на содержание гена или продукта гена. Согласно некоторым вариантам осуществления нарушение может не оказывать существенного влияния на содержание гена или продукта гена. Согласно некоторым вариантам осуществления нарушение может не оказывать существенного влияния на активность гена или продукта гена. Согласно некоторым вариантам осуществления нарушение может не оказывать никакого существенного влияния ни на содержание, ни на активность гена или продукта гена.
Используемое в настоящем документе выражение "эндогенный локус" или "эндогенный ген" относится к генетическому локусу, найденному в исходном или эталонном организме до введения нарушения (например, описанной в настоящем документе делеции, вставки, инверсии, модификации, замещения, замены или их комбинации). Согласно некоторым вариантам осуществления эндогенный локус характеризуется последовательностью, обнаруживаемой в природе. Согласно некоторым вариантам осуществления эндогенный локус представляет собой локус дикого типа. Согласно некоторым вариантам осуществления эталонный организм, который содержит описанный в настоящем документе эндогенный локус, представляет собой организм дикого типа. Согласно некоторым вариантам осуществления эталонный организм, который содержит описанный в настоящем документе эндогенный локус, представляет собой сконструированный организм. Согласно некоторым вариантам осуществления эталонный организм, который содержит описанный в настоящем документе эндогенный локус, представляет собой выведенный в лабораторных условиях организм (дикого типа или сконструированный).
Выражение "эндогенный промотор" относится к промотору, который естественным образом связан, например, в диком организме, с эндогенным геном.
Используемый в настоящем документе термин "гетерологичный" относится к средству или объекту из другого источника. Например, при использовании по отношению к полипептиду, гену или генному продукту или наличию в конкретной клетке или организме термин уточняет, что соответствующий полипептид, ген или генный продукт 1) был сконструирован человеком; 2) был введен в клетку или организм (или в его предшественника) человеком (например, с помощью генной инженерии) и/или 3) не естественным образом производится или присутствует в соответствующей клетке или организме (например, соответствующем типе клетки или типе организма).
Используемый в настоящем документе термин "клетка-хозяин" относится к клетке, в которую была введена гетерологичная (например, экзогенная) нуклеиновая кислота или белок. Специалисты в настоящей области техники после прочтения настоящего описания поймут, что такие термины относятся не только к конкретной изучаемой клетке, но также используются для обозначения потомства этой клетки. Поскольку некоторые модификации могут происходить в последующих поколениях вследствие либо мутации, либо воздействий окружающей среды, такое потомство может, на самом деле, не быть идентичным исходной клетке, но, как понятно специалистам в настоящей области техники, быть по-прежнему включенным в объем используемого в настоящем документе термина "клетка-хозяин". Согласно некоторым вариантам осуществления клетка-хозяин представляет собой или содержит прокариотическую или эукариотическую клетку. В общем случае, клетка-хозяин представляет собой любую клетку, которая подходит для получения и/или произведения гетерологичной нуклеиновой кислоты или белка, независимо от царства, к которому относится клетка. Иллюстративные клетки, которые могут быть использованы в качестве клеток-хозяев в соответствии с настоящим изобретением, включают в себя клетки прокариот и эукариот (одноклеточных или многоклеточных), бактериальные клетки (например, штаммы Е. coli, Bacillus spp., Streptomyces spp. и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, S. cerevisiae, С. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, клетки инфицированных бакуловирусом насекомых, Trichoplusia ni и т.п.), клетки отличных от человека животных, человеческие клетки или слияния клеток, такие как, например, гибридомы или квадромы. Согласно некоторым вариантам осуществления клетка представляет собой клетку человека, мартышки, обезьяны, хомяка, крысы или мыши. Согласно некоторым вариантам осуществления клетка представляет собой эукариотическую и выбрана из следующих клеток: СНО (например, СНО K1, DXB-11 СНО, Veggie-CHO), COS (например, COS-7), клетка сетчатки глаза, Vero, CV1, клетка почки (например, НЕК293, 293 EBNA, MSR 293, MDCK, НаК, ВНК), HeLa, HepG2, WI38, MRC 5, Colo205, НВ 8065, HL-60, (например, ВНК21), Jurkat, Daudi, А431 (эпидермальные), CV-1, U937, 3Т3, L клетка, С127 клетка, SP2/0, NS-0, ММТ 060562, клетка Сертоли, клетка BRL 3А, клетка НТ1080, клетка миеломы, клетка опухоли и линия клеток, полученная из вышеупомянутой клетки. Согласно некоторым вариантам осуществления клетка содержит один или несколько вирусных генов, например, клетка сетчатки глаза, которая экспрессирует вирусный ген (например, клетка PER.C6™). Согласно некоторым вариантам осуществления клетка-хозяин представляет собой или содержит выделенную клетку. Согласно некоторым вариантам осуществления клетка-хозяин представляет собой часть ткани. Согласно некоторым вариантам осуществления клетка-хозяин представляет собой часть организма.
Термин "гуманизированный" используется в настоящем документе в соответствии с его понимаемым в настоящей области техники значением для обозначения нуклеиновых кислот или белков, структуры которых (т.е. нуклеотидные или аминокислотные последовательности) включают в себя части, которые соответствуют по существу или полностью версиям соответствующих нуклеиновых кислот или белков, которые встречаются в природе у отличных от человека животных и которые отличны от соответствующих версий, которые встречаются в природе у людей, а также включают в себя части, структуры которых отличаются от тех, которые присутствуют в версиях отличных от человека животных и вместо этого более близко соответствуют сопоставимым структурам в человеческих версиях. Согласно некоторым вариантам осуществления "гуманизированный" ген представляет собой ген, который кодирует полипептид, содержащий по существу аминокислотную последовательность, как и таковая у человеческого полипептида (например, человеческий белок или его часть, например, характерная его часть). В качестве лишь одного примера: в случае мембранного рецептора, "гуманизированный" ген может кодировать полипептид с внеклеточной частью, аминокислотная последовательность которой идентична или по существу идентична таковой человеческой внеклеточной части, и оставшаяся последовательность которой идентична или по существу идентична таковой отличного от человеческого (например, мышиного) полипептида. Согласно некоторым вариантам осуществления гуманизированный ген содержит по меньшей мере часть последовательности ДНК человеческого гена. Согласно некоторым вариантам осуществления гуманизированный ген содержит всю последовательность ДНК, обнаруживаемую в человеческом гене. Согласно некоторым вариантам осуществления гуманизированный белок характеризуется аминокислотной последовательностью, которая содержит часть, которая представлена в человеческом белке. Согласно некоторым вариантам осуществления гуманизированный белок характеризуется аминокислотной последовательностью, вся последовательность которой обнаруживается в человеческом белке. Согласно некоторым вариантам осуществления (включая в себя, например, некоторые, в которых гуманизированный белок содержит аминокислотную последовательность, вся последовательность которой обнаруживается в человеческом белке) гуманизированный белок экспрессируется из эндогенного локуса отличного от человека животного, эндогенный локус которого соответствует гомологу или ортологу соответствующего кодирующего белок гена человека.
Термин "идентичность", используемый в настоящем документе в связи со сравнением последовательностей, относится к идентичности, определенной с помощью любого из нескольких различных алгоритмов, известных в настоящей области техники, которые могут быть использованы для измерения идентичности нуклеотидной и/или аминокислотной последовательностей. Согласно некоторым вариантам осуществления идентичности, описанные в настоящем документе, определяются с помощью выравнивания ClustalW в. 1.83 (медленно) с использованием штрафа за внесение пропуска в последовательность 10,0, штрафа за удлинение пропуска в последовательности 0,1 и с использованием матрицы подобия Гонне (MACVECTOR™ 10.0.2, MacVector Inc., 2008). Используемый в настоящем документе термин "идентичность" относится к общему родству между полимерными молекулами, например, между молекулами нуклеиновых кислот (например, молекулами ДНК и/или молекулами РНК) и/или между молекулами полипептида. Согласно некоторым вариантам осуществления полимерные молекулы считаются "по существу идентичными" друг к другу, если их последовательности идентичны по меньшей мере на 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%. Как будет понятно специалистам в настоящей области техники, доступны различные алгоритмы, которые позволяют сравнивать последовательности, чтобы определить их степень гомологии, включая в себя путем разрешения пропусков указанной длины в одной последовательности по отношению к другой, при рассмотрении которых остатки "соответствуют" друг другу в различных последовательностях. Расчет процента идентичности между двумя последовательностями нуклеиновых кислот, например, может быть выполнен путем выравнивания двух последовательностей с целью оптимального сравнения (например, могут быть введены пробелы в одной или обеих из первой и второй последовательностей нуклеиновых кислот для оптимального выравнивания и несоответствующие последовательности могут не учитываться для целей сравнения). Согласно некоторым вариантам осуществления длина последовательности, выровненной для сравнения, составляет по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по существу 100% от длины исходной последовательности. Нуклеотиды в соответствующих нуклеотидных положениях затем сравниваются. Когда положение в первой последовательности занято тем же нуклеотидом, что и соответствующее положение во второй последовательности, то молекулы представляют собой идентичные в данном положении. Процент идентичности между двумя последовательностями представляет собой функцию числа идентичных положений последовательностей, принимая во внимание количество пропусков и длину каждого пропуска, который должен быть введен для оптимального выравнивания двух последовательностей. Репрезентативные алгоритмы и компьютерные программы, применимые в определении процента идентичности между двумя нуклеотидными последовательностями, включают в себя, например, алгоритм Миллера-Маерса (CABIOS, 1989, 4: 11-17), который был включен в программу ALIGN (версия 2.0) с использованием таблицы весов замены остатков РАМ120, штрафа за удлинение пропуска 12 и штрафа за пропуск 4. Процент идентичности между двумя нуклеотидными последовательностями можно, альтернативно, определить, например, с помощью программы GAP в программном пакете GCG, используя матрицу NWSgapdna.CMP.
Используемый в настоящем документе термин "выделенный" относится к веществу и/или частице, которая была (1) отделена по меньшей мере от некоторых из компонентов, с которыми она была связана, когда первоначально производилась (в природе и/или в экспериментальных условиях), и/или (2) разработана, произведена, приготовлена и/или изготовлена человеком. Выделенные вещества и/или частицы могут быть отделены от приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или более чем приблизительно 99% других компонентов, с которыми они первоначально были связаны. Согласно некоторым вариантам осуществления выделенные средства характеризуются чистотой, составляющей приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или более чем приблизительно 99%. Используемое в настоящем документе вещество представляет собой "чистое", если оно по существу свободно от других компонентов. Согласно некоторым вариантам осуществления, как будет понятно специалистам в настоящей области техники, вещество может все еще считаться "выделенным" или даже "чистым" после комбинации с некоторыми другими компонентами, такими как, например, один или несколько носителей или наполнителей (например, буфер, растворитель, вода и т.д.); согласно таким вариантам осуществления процент выделения или чистоты вещества рассчитывается без учета таких носителей или вспомогательных веществ. В качестве лишь одного из примеров: согласно некоторым вариантам осуществления биологический полимер, такой как полипептид или полинуклеотид, который встречается в природе, считается "выделенным", когда а) в силу своего происхождения или источника происхождения не связан с некоторыми или всеми компонентами, которые сопровождают его в естественном состоянии в природе; b) он по существу свободен от других полипептидов или нуклеиновых кислот от вида, который производит его в природе; с) экспрессируется или иным образом находится в сочетании с компонентами из клетки или другой системы экспрессии, которая не представляет собой от вида, который производит его в природе. Так, например, согласно некоторым вариантам осуществления полипептид, который химически синтезирован или синтезирован в клеточной системе, отличной от той, которая производит его в природе, считается "выделенным" полипептидом. Альтернативно или дополнительно, согласно некоторым вариантам осуществления полипептид, который был подвергнут одной или нескольким техникам очистки, может рассматриваться как "выделенный" полипептид в той степени, что он был отделен от других компонентов а) с которыми он связан в природе и/или b) с которыми он был связан, когда первоначально производился.
Используемое в настоящем документе выражение "отличное от человека животное" относится к позвоночному организму, который не представляет собой человека. Согласно некоторым вариантам осуществления отличное от человека животное представляет собой круглоротое, костную рыбу, хрящевую рыбу (например, акулу или ската), амфибию, рептилию, млекопитающее или птицу. Согласно некоторым вариантам осуществления отличное от человека млекопитающее представляет собой примата, козу, овцу, свинью, собаку, корову или грызуна. Согласно некоторым вариантам осуществления отличное от человека животное представляет собой грызуна, такого как крыса или мышь.
Используемое в настоящем документе выражение "нуклеиновая кислота" в самом широком смысле относится к любому соединению и/или веществу, которое включено или может быть включено в олигонуклеотидную цепь. Согласно некоторым вариантам осуществления нуклеиновая кислота представляет собой соединение и/или вещество, которое может быть включено в олигонуклеотидную цепь посредством фосфодиэфирной связи. Как будет ясно из контекста, согласно некоторым вариантам осуществления "нуклеиновая кислота" относится к одному или нескольким отдельным остаткам нуклеиновых кислот (например, нуклеотидов и/или нуклеозидов); согласно некоторым вариантам осуществления "нуклеиновая кислота" относится к олигонуклеотидной цепи, содержащей отдельные остатки нуклеиновых кислот. Согласно некоторым вариантам осуществления "нуклеиновая кислота" представляет собой или содержит РНК; согласно некоторым вариантам осуществления "нуклеиновая кислота" представляет собой или содержит ДНК. Согласно некоторым вариантам осуществления нуклеиновая кислота представляет собой, содержит или состоит из одного или нескольких природных остатков нуклеиновых кислот. Согласно некоторым вариантам осуществления нуклеиновая кислота представляет собой, содержит или состоит из одного или нескольких аналогов природного остатка нуклеиновых кислот. Согласно некоторым вариантам осуществления аналог нуклеиновой кислоты отличается от природного остатка нуклеиновой кислоты тем, что он не использует фосфодиэфирный остов. Например, согласно некоторым вариантам осуществления нуклеиновая кислота представляет собой, содержит или состоит из одной или нескольких "пептидных нуклеиновых кислот", которые известны в настоящей области техники, и содержит пептидные связи вместо фосфодиэфирных связей в основном остове, рассматриваемые в рамках настоящего изобретения. Альтернативно или дополнительно, согласно некоторым вариантам осуществления нуклеиновая кислота содержит одну или несколько фосфоротиоатных и/или 5'-N-фосфорамидатных связей, а не фосфодиэфирные связи. Согласно некоторым вариантам осуществления нуклеиновая кислота представляет собой, содержит или состоит из одного или нескольких природных нуклеозидов (например, аденозина, тимидина, гуанозина, цитидина, уридина, дезоксиаденозина, дезокситимидина, деоксигуанозина и дезоксицитидина). Согласно некоторым вариантам осуществления нуклеиновая кислота представляет собой, содержит или состоит из одного или нескольких нуклеозидных аналогов (например, 2-аминоаденозина, 2-тиотимидина, инозина, пирролпиримидина, 3-метиладенозина, 5-метилцитидина, С-5 пропинилцитидина, С-5 пропинилуридина, 2-аминаденозина, С5-бромуридина, С5-фторуридина, С5-иодуридина, С5-пропинилуридина, С5-пропинилцитидина, С5-метилцитидина, 2-аминаденозина, 7-деазааденозина, 7-деазагуанозина, 8-аксоаденозина, 8-оксогуанозина, O(6)-метилгуанина, 2-тиоцитидина, метилированных оснований, интеркалированных оснований, а также их комбинации). Согласно некоторым вариантам осуществления нуклеиновая кислота содержит один или несколько модифицированных Сахаров (например, 2'-фторрибозу, рибозу, 2'-дезоксирибозу, арабинозу и гексозу) по сравнению с таковыми в природных нуклеиновых кислотах (т.е., содержит один или несколько аналогов натурального нуклеозидного сахара). Согласно некоторым вариантам осуществления нуклеиновая кислота характеризуется нуклеотидной последовательностью, которая кодирует функциональный генный продукт, такой как РНК или белок. Согласно некоторым вариантам осуществления нуклеиновая кислота характеризуется нуклеотидной последовательностью, которая включает в себя один или несколько интронов. Обычным специалистам в настоящей области техники будет понятно, что в настоящей области техники доступны и известны различные технологии производства нуклеиновых кислот. Например, согласно некоторым вариантам осуществления нуклеиновые кислоты получают способом, выбранным из группы, состоящей из выделения из природного источника, ферментативного синтеза путем полимеризации на основе комплементарной матрицы (in vivo или in vitro), размножения в рекомбинантной клетке или системе, химического синтеза, а также их комбинаций. Согласно некоторым вариантам осуществления нуклеиновая кислота представляет собой по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, ПО, 120, 130, 140, 150, 160, 170, 180, 190, 20, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000 или более остатков в длину. Согласно некоторым вариантам осуществления нуклеиновая кислота представляет собой одноцепочечную; согласно некоторым вариантам осуществления нуклеиновая кислота представляет собой частично или полностью двухцепочечную (т.е. содержит по меньшей мере две отдельные цепочки нуклеиновой кислоты, последовательности которых включают в себя дополнительные элементы, которые гибридизуются друг с другом). Согласно некоторым вариантам осуществления нуклеиновая кислота характеризуется нуклеотидной последовательностью, содержащей по меньшей мере один элемент, который кодирует или комплементарен последовательности, которая кодирует полипептид. Согласно некоторым вариантам осуществления нуклеиновая кислота обладает ферментативной активностью.
Используемое в настоящем документе выражение "функционально связанный" относится к физическому сопоставлению (например, в трехмерном пространстве) компонентов или элементов, которые взаимодействуют, прямо или косвенно, друг с другом или иным образом координируют друг с другом, чтобы участвовать в биологическом событии, при этом сопоставление достигает такого взаимодействия и/или координации или допускает его. В качестве лишь одного примера: контрольная последовательность (например, последовательность контроля экспрессии) в нуклеиновой кислоте называется "функционально связанной" с кодирующей последовательностью, если она расположена по отношению к кодирующей последовательности таким образом, что ее наличие или отсутствие влияет на экспрессию и/или активность кодирующей последовательности. Согласно многим вариантам осуществления термин "функционально связанный" предусматривает ковалентную связь соответствующих компонентов или элементов друг с другом. Специалистам в настоящей области техники будет очевидно, однако, что согласно некоторым вариантам осуществления ковалентная связь не требуется для достижения эффективной функциональной связи. Например, согласно некоторым вариантам осуществления последовательности нуклеиновых кислот контроля, которые функционально связаны с кодирующими последовательностями, которые они контролируют, представляют собой смежные с представляющим интерес геном. Альтернативно или дополнительно, согласно некоторым вариантам осуществления одна или несколько таких контрольных последовательностей действует в транс или на расстоянии для контроля представляющей интерес кодирующей последовательности. Согласно некоторым вариантам осуществления используемый в настоящем документе термин "последовательность контроля экспрессии" относится к полинуклеотидным последовательностям, которые необходимы и/или достаточны для влияния на экспрессию и процессинг кодирующих последовательностей, с которыми они лигированы. Согласно некоторым вариантам осуществления последовательности контроля экспрессии могут представлять собой или включать в себя соответствующие последовательности инициации транскрипции, терминации, промоторные и/или энхансерные; эффективные сигналы процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (например, консенсусная последовательность Kozak); последовательности, которые повышают стабильность белка; и/или, согласно некоторым вариантам осуществления, последовательности, которые усиливают секрецию белка. Согласно некоторым вариантам осуществления одна или несколько контрольных последовательностей представляют собой преимущественно или исключительно активные в конкретной клетке-хозяине или организме. В качестве лишь одного примера: у прокариот контрольные последовательности, как правило, включают в себя промотор, сайт связывания рибосомы и последовательность терминации транскрипции; у эукариот, согласно многим вариантам осуществления, контрольные последовательности, как правило, включают в себя промоторы, энхансеры и/или последовательности терминации транскрипции. Обычным специалистам в настоящей области техники будет понятно из контекста, что, согласно многим вариантам осуществления, термин "контрольные последовательности" относится к компонентам, присутствие которых необходимо для экспрессии и процессинга, и согласно некоторым вариантам осуществления включает в себя компоненты, присутствие которых представляет собой преимущественное для экспрессии (включая в себя, например, лидерные последовательности, направленные последовательности и/или последовательности партнера слияния).
Используемый в настоящем документе термин "полипептид" относится к любой полимерной цепи аминокислот. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность, которая встречается в природе. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность, которая не встречается в природе. Согласно некоторым вариантам осуществления полипептид содержит аминокислотную последовательность, которая сконструирована, разработана и/или произведена человеком.
Используемый в настоящем документе термин "рекомбинантный" предназначен для обозначения полипептидов (например, описанных в настоящем документе белков-факторов активации В-клеток), которые были разработаны, сконструированы, получены, экспрессированы, созданы или выделены рекомбинантными способами, такими, как полипептиды, экспрессированные с использованием рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина, полипептиды, выделенные из рекомбинантной комбинаторной библиотеки полипептидов человека (Hoogenboom H.R., (1997) TIB Tech. 15:62-70; Azzazy H., and Highsmith W.E., (2002) Clin. Biochem. 35:425-445; Gavilondo J.V., and Larrick J.W. (2002) BioTechniques 29:128-145; Hoogenboom H., and Chames P. (2000) Immunology Today 21:371-378), антитела, выделенные из животного (например, мыши), которое представляет собой трансгенное для генов иммуноглобулина человека (смотрите, например, Taylor, L.D., et al. (1992) Nucl. Acids Res. 20:6287-6295; Kellermann S-A., and Green L.L. (2002) Current Opinion in Biotechnology 13:593-597; Little M. et al (2000) Immunology Today 21:364-370) или полипептиды, полученные, экспрессированные, созданные или выделенные любыми другими средствами, которые предполагают использование сплайсинга элементов выбранных последовательностей друг с другом. Согласно некоторым вариантам осуществления один или несколько из таких элементов выбранной последовательности встречается в природе. Согласно некоторым вариантам осуществления один или несколько из таких элементов выбранной последовательности разработан in silico. Согласно некоторым вариантам осуществления один или несколько таких элементов выбранной последовательности представляет собой результат мутагенеза (например, in vivo или in vitro) известного элемента последовательности, например, из природного или синтетического источника. Например, согласно некоторым вариантам осуществления рекомбинантный полипептид состоит из последовательностей, обнаруженных в геноме представляющего интерес организма-источника (например, человека, мыши и т.п.). Согласно некоторым вариантам осуществления рекомбинантный полипептид содержит аминокислотную последовательность, которая представляет собой результат мутагенеза (например, in vitro или in vivo, например, у отличного от человека животного), так что аминокислотные последовательности рекомбинантных полипептидов представляют собой последовательности, которые при происхождении от последовательностей полипептидов и связанные с ними, не могут существовать в природе в геноме отличного от человека животного in vivo.
Термин "замещение" используется в настоящем документе для обозначения процесса, посредством которого "замещаемая" последовательность нуклеиновой кислоты (например, ген), найденная в локусе-хозяине (например, в геноме), удаляется из этого локуса, а другая "замещающая" нуклеиновая кислота помещается на ее место. Согласно некоторым вариантам осуществления замещаемая последовательность нуклеиновой кислоты и замещающая последовательности нуклеиновой кислоты сравнимы друг с другом в том, что, например, они гомологичны друг другу и/или содержат соответствующие элементы (например, кодирующие белок элементы, регулирующие элементы и т.п.). Согласно некоторым вариантам осуществления замещаемая последовательность нуклеиновой кислоты включает в себя одно или несколько из следующего: промотор, энхансер, донорный сайт сплайсинга, реципиентный сайт сплайсинга, интрон, экзон, нетранслируемая область (UTR); согласно некоторым вариантам осуществления замещающая последовательность нуклеиновой кислоты включает в себя одну или несколько кодирующих последовательностей. Согласно некоторым вариантам осуществления замещающая последовательность нуклеиновой кислоты представляет собой гомолог замещаемой последовательности нуклеиновой кислоты. Согласно некоторым вариантам осуществления замещающая последовательность нуклеиновой кислоты представляет собой ортолог замещаемой последовательности. Согласно некоторым вариантам осуществления замещающая последовательность нуклеиновой кислоты представляет собой или содержит человеческую последовательность нуклеиновой кислоты. Согласно некоторым вариантам осуществления, включая в себя те, в которых замещающая последовательность нуклеиновой кислоты представляет собой или содержит человеческую последовательность нуклеиновой кислоты, замещаемая последовательность нуклеиновой кислоты представляет собой или содержит последовательность грызуна (например, последовательность мыши). Помещенная таким образом последовательность нуклеиновой кислоты может включать в себя одну или несколько регуляторных последовательностей, которые представляют собой часть последовательности-источника нуклеиновой кислоты, используемой для получения помещенной таким образом последовательности (например, промоторы, энхансеры, 5'-или 3'-нетранслируемые области и т.п.). Например, согласно различным вариантам осуществления замещение представляет собой замену эндогенной последовательности гетерологичной последовательностью, которая приводит к получению генного продукта из последовательности нуклеиновой кислоты, таким образом помещенного (содержащего гетерологичную последовательность), но не экспрессию эндогенной последовательности; замещение представляет собой замещение эндогенной геномной последовательности последовательностью нуклеиновой кислоты, которая кодирует белок, который характеризуется аналогичной функцией, что и белок, кодируемый эндогенной последовательностью (например, эндогенная геномная последовательность кодирует белок Baff, а фрагмент ДНК кодирует один или несколько белков BAFF человека). Согласно различным вариантам осуществления эндогенный ген или его фрагмент замещается соответствующим человеческим геном или его фрагментом. Соответствующий человеческий ген или его фрагмент представляет собой человеческий ген или фрагмент, который представляет собой ортолог или по существу аналогичен или идентичен по структуре и/или функции эндогенному гену или его фрагменту, который замещается.
Используемое в настоящем документе выражение "фактор активации В-клеток" или "BAFF" или "Baff' относится к лиганду семейства некроза опухолей, например, лиганду семейства TNF. BAFF представляет собой связанный с мембраной белок типа II, который может быть высвобожден в виде растворимого лиганда при протеолитическом процессинге в сайта расщепления фурина. Белки BAFF могут образовывать мультимеры (например, таймеры), в зависимости от условий рН. Эта характеристика может быть важной для связывания с рецептором. BAFF экспрессируется на поверхности клетки и служит в качестве регуляторного белка, участвующего во взаимодействиях между белками мембранной поверхности на клетках иммунной системы, например, В-клетках. Несколько вариантов, включая в себя варианты, представляющие собой результат альтернативных событий сплайсинга, были описаны у субъектов-людей, а также у грызунов. В качестве иллюстрации, нуклеотидные и аминокислотные последовательности генов BAFF мыши и человека, приведены в таблице 3. Специалистам в настоящей области техники при чтении настоящего раскрытия будет понятно, что один или несколько эндогенных генов Baff в геноме (или все) могут быть заменены одним или несколькими гетерологичными генами Baff (например, полиморфными вариантами, подвидами или мутантами, генами из другого вида, гуманизированными формами и т.п.).
Используемый в настоящем документе термин "экспрессирующая BAFF клетка" относится к клетке, которая экспрессирует лиганд фактора активации В-клеток. Согласно некоторым вариантам осуществления экспрессирующая BAFF клетка экспрессирует лиганд фактора активации В-клеток на своей поверхности. Согласно некоторым вариантам осуществления белок BAFF экспрессируется на поверхности клетки в количестве, достаточном, чтобы опосредовать межклеточные взаимодействия посредством белка BAFF, экспрессированного на поверхности клетки. Согласно некоторым вариантам осуществления экспрессирующая BAFF клетка экспрессирует лиганд фактора активации В-клеток в растворимой форме (т.е. не на поверхности клетки). Иллюстративные экспрессирующие BAFF клетки включают в себя без ограничения астроциты, дендритные клетки, моноциты, нейтрофилы и стромальные клетки. BAFF взаимодействует с рецепторами, обнаруженными преимущественно на линиях В-клеток, и участвует в активации и выживании В-клеток. Согласно некоторым вариантам осуществления отличные от человека животные согласно настоящему изобретению демонстрируют регулирование иммунных клеток посредством гуманизированных лигандов Baff, экспрессируемых на поверхности еще одних клеток отличного от человека животного. Согласно некоторым вариантам осуществления отличные от человека животные согласно настоящему изобретению способствуют долгосрочному выживанию В-клеток у отличных от человека животных, которые содержат гетерологичные гемопоэтические стволовые клетки (например, человека). Согласно некоторым вариантам осуществления отличные от человека животные согласно настоящему изобретению способствуют долгосрочной выживаемости антигенспецифических В-клеток у отличных от человека животных, которые содержат гетерологичные гемопоэтические стволовые клетки (например, человека).
Используемый в настоящем документе термин "по существу" относится к качественному состоянию проявляемой полной или почти полной величине или степени представляющей интерес характеристики или свойства. Специалисту в настоящей области биологии будет понятно, что биологические и химические явления редко, если когда-либо, идут к завершению и/или переходят к законченности или достигают абсолютного результата или избегают его. Термин "по существу", таким образом, используется в настоящем документе, чтобы захватить потенциальный недостаток, присущий многим биологическим и химическим явлениям.
Используемое в настоящем документе выражение "существенная гомология" относится к сравнению между последовательностями аминокислот или нуклеиновых кислот. Как будет понятно специалистам в настоящей области техники, две последовательности, как правило, считаются "по существу гомологичными", если они содержат гомологичные остатки в соответствующих положениях. Гомологичные остатки могут представлять собой идентичные остатки. Альтернативно, гомологичные остатки могут представлять собой не идентичные остатки с соответствующим образом аналогичными структурными и/или функциональными характеристиками. Например, как хорошо известно специалистам в настоящей области техники, некоторые аминокислоты, как правило, классифицируются как "гидрофобные" или "гидрофильные" аминокислоты и/или как содержащие "полярные" или "неполярные" боковые цепи. Замену одной аминокислоты на другую того же типа часто можно рассматривать как "гомологичную" замену. Типичные категории аминокислот представлены в таблице 1 и 2.
Как хорошо известно в настоящей области техники, последовательности аминокислот или нуклеиновых кислот могут быть сопоставлены с использованием любого из множества алгоритмов, включая в себя те, которые доступны в коммерческих компьютерных программах, таких как BLASTN для нуклеотидных последовательностей и BLASTP, содержащая пробелы BLAST и PSI-BLAST для аминокислотных последовательностей. Примеры таких программ описаны в Altschul, et al, Basic local alignment search tool, J. Mol. Biol, 215(3): 403-410, 1990; Altschul, et al, Methods in Enzymology; Altschul, et al, "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs", Nucleic Acids Res. 25:3389-3402, 1997; Baxevanis, et al, Bioinformatics: A Practical Guide to the Analysis of Genes and Proteins, Wiley, 1998 и Misener, et al, (eds.), Bioinformatics Methods and Protocols (Methods in Molecular Biology, Vol. 132), Humana Press, 1999. В дополнение к идентификации гомологичных последовательностей упомянутые выше программы, как правило, обеспечивают индикацию степени гомологии. Согласно некоторым вариантам осуществления две последовательности считаются по существу гомологичными, если по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более из их соответствующих остатков гомологичны на соответствующем фрагменте остатков. Согласно некоторым вариантам осуществления соответствующий фрагмент представляет собой полную последовательность. Согласно некоторым вариантам осуществления соответствующий фрагмент составляет по меньшей мере 9, 10, 11, 12, 13, 14, 15, 16, 17 или более остатков. Согласно некоторым вариантам осуществления соответствующий фрагмент включает в себя смежные остатки вдоль всей последовательности. Согласно некоторым вариантам осуществления соответствующий фрагмент включает в себя прерывистые остатки вдоль всей последовательности. Согласно некоторым вариантам осуществления соответствующий фрагмент составляет по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50 или более остатков.


Используемое в настоящем документе выражение "по существу идентичный" относится к сравнению аминокислотных последовательностей или последовательностей нуклеиновых кислот. Как будет понятно специалистам в настоящей области техники, две последовательности, как правило, рассматриваются как "по существу идентичные", если они содержат идентичные остатки в соответствующих положениях. Как хорошо известно в настоящей области техники, аминокислотные последовательности или последовательности нуклеиновых кислот могут быть сравнены с использованием любого из множества алгоритмов, включая в себя те, которые доступны в коммерческих компьютерных программах, таких как BLASTN для нуклеотидных последовательностей и BLASTP, содержащая пробелы BLAST и PSI-BLAST для аминокислотных последовательностей. Примеры таких программ описаны в Altschul, et al., Basic local alignment search tool, J. Mol. Biol., 215(3): 403-410, 1990; Altschul, et al., Methods in Enzymology; Altschul et al., Nucleic Acids Res. 25:3389-3402, 1997; Baxevanis et ah, Bioinformatics: A Practical Guide to the Analysis of Genes and Proteins, Wiley, 1998; and Misener, et al., (eds.), Bioinformatics Methods and Protocols (Methods in Molecular Biology, Vol. 132), Humana Press, 1999. В дополнение к идентификации идентичных последовательностей, упомянутые выше программы, как правило, обеспечивают индикацию степени идентичности. Согласно некоторым вариантам осуществления две последовательности считаются по существу идентичными, если по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более их соответствующих остатков идентичны на соответствующем фрагменте остатков. Согласно некоторым вариантам осуществления соответствующий фрагмент представляет собой полную последовательность. Согласно некоторым вариантам осуществления соответствующий фрагмент составляет по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50 или более остатков.
Используемое в настоящем документе выражение "направленный вектор" или "направленный конструкт" относится к полинуклеотидной молекуле, которая содержит направленную область. Направленная область содержит последовательность, которая идентична или по существу идентична последовательности в клетке-мишени, ткани-мишени или животном-мишени, и предусматривает интеграцию направленного конструкта в положение в геноме клетки, ткани или животного с помощью гомологичной рекомбинации. Также включены направленные области, которые направленно воздействуют с использованием сайтов распознавания сайт-специфической рекомбиназы (например, сайты LoxP или Frt). Согласно некоторым вариантам осуществления направленный конструкт согласно настоящему изобретению дополнительно содержит представляющую особый интерес последовательность нуклеиновой кислоты или ген, селективный маркер, контрольные и/или регуляторные последовательности и другие последовательности нуклеиновых кислот, которые позволяют рекомбинации происходить опосредовано через экзогенное добавление белков, которые помогают или содействуют рекомбинации с участием таких последовательностей. Согласно некоторым вариантам осуществления направленный конструкт согласно настоящему изобретению дополнительно содержит представляющий интерес ген, полностью или частично, причем представляющий интерес ген представляет собой гетерологичный ген, который кодирует белок полностью или частично, который характеризуется аналогичной функцией, что и белок, кодируемый эндогенной последовательностью.
Используемый в настоящем документе термин "вариант" относится к объекту, который указывает на значительную структурную идентичность эталонному объекту, но структурно отличается от эталонного объекта наличием или содержанием одного или нескольких химических фрагментов по сравнению с эталонным объектом. Согласно многим вариантам осуществления вариант также функционально отличается от эталонного объекта. В общем, определенный объект рассматривается как "вариант" эталонного объекта основываясь на его степени структурной идентичности с эталонным объектом. Как будет понятно специалистам в настоящей области техники, любой биологический или химический эталонный объект характеризуется определенными характерными структурными элементами. Вариант, по определению, представляет собой отдельный химический объект, который разделяет одну или несколько таких характерных структурных элементов. В качестве лишь нескольких примеров: небольшая молекула может содержать характерный сердцевинный структурный элемент (например, макроциклическую сердцевину) и/или один или несколько характерных боковых фрагментов, так что вариант малой молекулы представляет собой тот, который характеризуется сердцевинным структурным элементом и характерными боковыми фрагментами, но отличается другими боковыми фрагментами и/или типами присутствующих связей (одинарными против двойной, Ε против Ζ и т.п.) в пределах сердцевины, полипептид может содержать характерный элемент последовательности, состоящий из множества аминокислот с соответствующими положениями по отношению друг к другу в линейном или трехмерном пространстве и/или способствующих определенной биологической функции, нуклеиновая кислота может содержать характерный элемент последовательности, состоящий из множества нуклеотидных остатков с обозначенными положениями по отношению к другому в линейном или трехмерном пространстве. Например, вариантный полипептид может отличаться от эталонного полипептида в результате одного или нескольких отличий в аминокислотной последовательности и/или одного или нескольких отличий в химических фрагментах (например, углеводах, липидах и т.п.), ковалентно присоединенных к полипептидному остову. Согласно некоторым вариантам осуществления вариантный полипептид демонстрирует общую идентичность последовательности с эталонным полипептидом, которая составляет по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 99%. Альтернативно или дополнительно, согласно некоторым вариантам осуществления вариантный полипептид не разделяет по меньшей мере один характерный элемент последовательности с эталонным полипептидом. Согласно некоторым вариантам осуществления эталонный полипептид характеризуется одной или несколькими биологическими активностями. Согласно некоторым вариантам осуществления вариантный полипептид характеризуется наличием одного или нескольких видов биологической активности эталонного полипептида. Согласно некоторым вариантам осуществления вариантный полипептид не характеризуется наличием одной или нескольких биологических активностей эталонного полипептида. Согласно некоторым вариантам осуществления вариантный полипептид показывает пониженный уровень одной или нескольких биологических активностей по сравнению с эталонным полипептидом. Согласно многим вариантам осуществления представляющий интерес полипептид считается "вариантом" исходного или эталонного полипептида, если представляющий интерес полипептид содержит аминокислотную последовательность, которая идентична исходной, за исключением небольшого числа изменений последовательности в конкретных положениях. Как правило, менее 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% остатков в варианте заменены по сравнению с исходным. Согласно некоторым вариантам осуществления вариант содержит 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 замененный остаток по сравнению с исходным. Часто, вариант содержит очень небольшое количество (например, менее 5, 4, 3, 2 или 1) замененных функциональных остатков (т.е. остатков, которые участвуют в определенной биологической активности). Кроме того, вариант, как правило, содержит не более чем 5, 4, 3, 2 или 1 добавление или делецию и часто не содержит добавлений или делеций, по сравнению с исходным. Кроме того, любые добавления или делеции составляют, как правило, менее чем приблизительно 25, приблизительно 20, приблизительно 19, приблизительно 18, приблизительно 17, приблизительно 16, приблизительно 15, приблизительно 14, приблизительно 13, приблизительно 10, приблизительно 9, приблизительно 8, приблизительно 7, приблизительно 6 и, как правило, составляют менее чем приблизительно 5, приблизительно 4, приблизительно 3 или приблизительно 2 остатка. Согласно некоторым вариантам осуществления исходный или эталонный полипептид представляет собой полипептид природного происхождения. Как будет понятно специалистам в настоящей области техники, множество вариантов конкретного представляющего интерес полипептида, как правило, можно найти в природе, в частности, когда представляющий интерес полипептид представляет собой полипептид-инфекционный патоген.
Используемый в настоящем документе термин "вектор" относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Согласно некоторым вариантам осуществления векторы способны к экстра-хромосомной репликации и/или экспрессии нуклеиновых кислот, к которым они прикреплены в клетке-хозяине, такой как эукариотическая и/или прокариотическая клетка. Векторы, способные направлять экспрессию функционально связанных генов, называются в настоящем документе как "экспрессирующие векторы".
Используемый в настоящем документе термин "дикого типа" характеризуется своим понимаемым в настоящей области техники значением, которое относится к объекту, характеризующемуся структурой и/или активностью, обнаруживаемой в природе в "нормальном" (в отличие от мутантного, патологического, измененного и т.п.) состоянии или контекста. Обычным специалистам в настоящей области техники будет понятно, что гены и полипептиды дикого типа часто существуют в нескольких различных формах (например, аллелях).
Подробное описание настоящего изобретения
В настоящем изобретении предусмотрены, помимо всего прочего, улучшенные и/или сконструированные отличные от человека животные, характеризующиеся наличием гуманизированного генетического материала, кодирующего белок-фактор активации В-клеток (например, Baff). Согласно некоторым вариантам осуществления такие отличные от человека животные применимы, например, для оценки приживления трансплантата, активации В-клеток и выживаемости антигенспецифических В-клеток после иммунизации. Предполагается, что такие отличные от человека животные обеспечивают улучшение в активации В-клеток и выживаемости антигенспецифических В-клеток после иммунизации после трансплантации гемопоэтических стволовых клеток человека. Таким образом, настоящее изобретение особенно применимо для поддержания гемопоэтических клеток человека у отличных от человека животных. В частности, настоящее изобретение охватывает гуманизацию гена Baff грызуна, приводя к экспрессии гуманизированного белка на поверхности плазматической мембраны клеток отличного от человека животного. Такие гуманизированные белки обладают способностью распознавать трансплантированные человеческие клетки с помощью захвата гуманизированных белков и лигандов/рецепторов Baff, присутствующих на поверхности трансплантированных клеток человека. Согласно некоторым вариантам осуществления отличные от человека животные согласно настоящему изобретению способны принимать трансплантированные гематопоэтические клетки человека; согласно некоторым вариантам осуществления такие отличные от человека млекопитающие развивают и/или характеризуются наличием иммунной системы, содержащей клетки человека. Согласно некоторым вариантам осуществления гуманизированные белки Baff содержат последовательность, кодируемую экзонами с 3 по 6 гена BAFF человека. Согласно некоторым вариантам осуществления отличные от человека животные согласно настоящему изобретению содержат генетически модифицированный ген Baff, который содержит генетический материал от отличного от человека животного и гетерологичного вида (например, человека). Согласно некоторым вариантам осуществления отличные от человека животные согласно настоящему изобретению содержат гуманизированный ген Baff, причем гуманизированный ген Baff содержит экзоны 3, 4 и 5 гена BAFF человека. Согласно некоторым вариантам осуществления настоящего изобретения экспрессия гуманизированного белка Baff находится под контролем отличного от человеческого генетического материала Baff (например, отличного от человеческого промотора Baff).
Различные аспекты настоящего изобретения подробно описаны в следующих разделах. Использование разделов не предназначено для ограничения настоящего изобретения. Каждый раздел может относиться к любому аспекту настоящего изобретения. В настоящей заявке использование "или" означает "и/или", если не указано иное.
Ген фактора активации В-клеток (BAFF)
Фактор активации В-клеток (BAFF или Baff) представляет собой представителя надсемейства лигандов фактора некроза опухолей (TNF) и экспрессируется многими различными типами клеток, включая в себя без ограничения астроциты, клеточные линии В-клеток, дендритные клетки, моноциты, нейтрофилы и стромальные клетки. BAFF (также известный как представитель надсемейства лиганда фактора некроза опухоли 13С, TNFSF13C, BAFF, BLYS, CD257, DTL, TALL-1, TALL1, THANK, TNFSF20 и ZTNF4) экспрессируется на поверхности клетки как трансмембранный белок типа II и может быть высвобожден в растворимой форме посредством расщепления на консенсусном сайте расщепления фурином после протеолиза. Растворимый BAFF может существовать в нескольких формах (например, таймеры, 60-меры) в зависимости от значения рН. Структура гена для BAFF у мышей и человека незначительно отличается тем, что первый содержит дополнительный экзон. У людей экзон 1 кодирует трансмембранный домен, экзон 2 кодирует сайт расщепления фурином и экзоны с 3 по 6 кодируют домен TNF, который ответственен за связывание рецептора. У мышей экзон 1 кодирует трансмембранный домен, экзон 2 кодирует сайт расщепления фурином, экзон 3 кодирует дополнительные аминокислоты между сайтом расщепления фурином и доменом TNF и экзоны 4-7 кодируют домен TNF. Как для мыши, так и для человека альтернативные варианты сплайсинга приводят к удалению внутренней части белка, что дает вариант, называемый "дельта-BAFF" (или ABAFF). У людей пропускается экзон 3, в то время как у мышей пропускается экзон 4. ABAFF все еще экспрессируется на поверхности клеток, однако, высвобождение растворимой формы, как сообщается, предотвращается. Рецепторы для BAFF, о которых сообщалось, включают в себя, в первую очередь, BAFF-рецептор (BAFF-R), но также включают в себя трансмембранный активатор и партнер кальциевого модулятора и лиганда циклофилина (TACI) и антиген созревания В-клеток (ВСМА). BAFF связывается как с BAFF-R, так и TACI с сильной аффинностью, тогда как BAFF связывается с ВСМА со слабой аффинностью.
Роль Baff, в частности, была исследована в отношении его роли в активации и дифференцировки В-клеток. Например, было обнаружено повышенное содержание Baff у трансгенных мышей с гиперэкспрессией мышиного Baff, что способствовало выживаемости, толерантности и спасению В-клеток с аффинностью к аутоантигенам, содействуя тем самым секреции аутоантител (Ota et al., 2010, J. Immunol. 185:4128-4136).
Последовательности BAFF
Иллюстративные последовательности BAFF для человека и мыши приведены в таблице 3. Для последовательностей кДНК идущие подряд экзоны разделены чередующимся подчеркнутым текстом. Для белковых последовательностей предсказанные трансмембранные области подчеркнуты.



Отличные от человека животные с гуманизированным Baff
Предусмотрены отличные от человека животные, которые экспрессируют генетически модифицированные (например, гуманизированные) белки Baff на поверхности клеток (например, дендритных клеток) отличных от человека животных. В частности, в настоящем изобретение предусмотрены отличные от человека животные, которые экспрессируют генетически модифицированные (например, гуманизированные) белки Baff на поверхности своих клеток, белки кодируются и/или экспрессируются из генетической модификации эндогенного локуса отличного от человека животного, который кодирует белок Baff. Подходящие примеры, описанные в настоящем документе, включают в себя грызунов, в частности, мышей.
Генетически модифицированный ген Baff согласно некоторым вариантам осуществления содержит генетический материал от гетерологичного вида (например, человека), причем генетически модифицированный ген Baff кодирует белок Baff, который содержит кодированную часть генетического материала от гетерологичных видов. Согласно некоторым вариантам осуществления генетически модифицированный ген Baff согласно настоящему изобретению содержит геномную ДНК гетерологичного вида, который соответствует внеклеточной части белка Baff, который экспрессируется на плазматической мембране клетки. Также предусмотрены отличные от человека животные, отличные от человеческих эмбрионы, клетки и направленные конструкты для получения отличных от человека животных, отличных от человеческих эмбрионов и клеток, содержащих указанный генетически модифицированный ген Baff.
Согласно некоторым вариантам осуществления эндогенный ген Baff удаляют. Согласно некоторым вариантам осуществления эндогенный ген Baff изменяют, причем часть эндогенного гена Baff замещают на гетерологичную последовательность (например, последовательность Baff человека, полностью или частично). Согласно некоторым вариантам осуществления весь или по существу весь эндогенный ген Baff замещают гетерологичным геном (например, геном BAFF человека). Согласно некоторым вариантам осуществления часть гетерологичного гена Baff встраивают в эндогенный отличный от человеческого ген Baff. Согласно некоторым вариантам осуществления гетерологичный ген представляет собой ген человека.
Отличное от человека животное согласно настоящему изобретению содержит человеческий ген BAFF полностью или частично в эндогенном отличном от человеческого локусе Baff. Таким образом, такие отличные от человека животные могут быть описаны, как содержащие гуманизированный ген Baff. Замещенный, вставленный или модифицированный эндогенный ген Baff (т.е. гуманизированный ген Baff) может быть обнаружен с использованием различных способов, включающих в себя, например, ПЦР, вестерн-блоттинг, саузерн-блоттинг, полиморфизм длин рестрикционных фрагментов (ПДРФ) или анализ появления или потери аллеля.
Согласно различным вариантам осуществления гуманизированный ген Baff в соответствии с настоящим изобретением включает в себя ген Baff который содержит третий, четвертый, пятый и шестой экзон, у каждого из которых последовательность по меньшей мере на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более) идентична третьему, четвертому, пятому и шестому экзону, которые представлены в гене BAFF человека в таблице 3.
Согласно различным вариантам осуществления гуманизирований ген Baff в соответствии с настоящим изобретением включает в себя ген Baff, который содержит нуклеотидную кодирующую последовательность (например, последовательность кДНК), которая по меньшей мере на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более) идентична нуклеотидам 692-2671, которые представлены в последовательности кДНК BAFF человека таблицы 3.
Согласно различным вариантам осуществления гуманизированный белок Baff, производимый отличным от человека животным согласно настоящему изобретению, содержит внеклеточную часть, характеризующуюся последовательностью, которая по меньшей мере на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%), 94%, 95%, 96%, 97%, 98%, 99% или более) идентична внеклеточной части белка BAFF человека, который представлен в таблице 3.
Согласно различным вариантам осуществления гуманизированный белок Baff, производимый отличным от человека животным согласно настоящему изобретению, содержит внеклеточную часть, характеризующуюся последовательностью, которая по меньшей мере на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%», 95%, 96%, 97%, 98%, 99% или более) идентична аминокислотным остаткам 142-285, которые представлены в белке BAFF человека таблицы 3.
Согласно различным вариантам осуществления гуманизированный белок Baff, производимый отличным от человека животным согласно настоящему изобретению, характеризуется аминокислотной последовательностью, которая по меньшей мере на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более) идентична аминокислотной последовательности гуманизированного белка Baff, который представлен в таблице 3.
Согласно различным вариантам осуществления гуманизированный белок Baff, производимый отличным от человека животным согласно настоящему изобретению, характеризуется аминокислотной последовательностью, которая по меньшей мере на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более) идентична аминокислотной последовательности белка BAFF человека, который представлен в таблице 3.
Предусмотрены композиции и способы получения отличных от человека животных, которые экспрессируют гуманизированный белок Baff, включая в себя специфические полиморфные формы или аллельные варианты (например, с различиями в одной аминокислоте, альтернативные варианты сплайсинга и т.д.), включая в себя композиции и способы получения отличных от человека животных, которые экспрессируют такие белки из человеческого промотора и человеческой регуляторной последовательности или, необязательно, из отличного от человеческого промотора и отличной от человеческой регуляторной последовательности. Согласно некоторым вариантам осуществления также предусмотрены композиции и способы получения отличных от человека животных, которые экспрессируют такие белки из эндогенного промотора и эндогенной регуляторной последовательности. Способы предусматривают вставку генетического материала, кодирующего человеческий белок BAFF, полностью или частично, в точном месте в геноме отличного от человека животного, которое соответствует эндогенному гену Baff, тем самым создавая гуманизированный ген Baff который экспрессирует белок BAFF, который представляет собой человеческий полностью или частично. Согласно некоторым вариантам осуществления способы предусматривают вставку геномной ДНК, соответствующей экзонам с 3 по 6 гена BAFF человека, в эндогенный ген Baff отличного от человека животного, тем самым создавая гуманизированный ген, который кодирует белок Baff, который содержит человеческую часть, содержащую аминокислоты, кодируемые вставленными экзонами.
Подход с гуманизированным геном Baff использует относительно минимальную модификацию эндогенного гена и приводит к естественной опосредованной Baff сигнальной трансдукции у отличного от человека животного согласно различным вариантам осуществления, так как геномная последовательность гена Baff модифицируется в одном фрагменте и поэтому сохраняет нормальную функциональность, включая в себя необходимые регуляторные последовательности. Таким образом, согласно таким вариантам осуществления модификация гена Baff не влияет на другие окружающие гены или другие эндогенные гены Baff. Кроме того, согласно различным вариантам осуществления модификация не влияет на сборку функционального трансмембранного белка на плазматической мембране и поддерживает нормальную ассоциацию со своими рецепторами посредством связывания и взаимодействия внеклеточной части с данным рецептором, на который не влияет модификация.
Схематическая иллюстрация (без соблюдения масштаба) эндогенных мышиных и человеческих генов BAFF представлена на фиг. 1. Схематическая иллюстрация (без соблюдения масштаба) гуманизированного гена BAFF представлена на фиг. 2. Как показано, геномную ДНК, содержащую экзоны с 3 по 6 гена BAFF человека, встраивают в эндогенный мышиный ген Baff с помощью направленного конструкта. Эта геномная ДНК содержит участок гена, который кодирует внеклеточную часть (например, остатки аминокислот 142-285) белка BAFF человека, отвечающего за связывание лиганда.
Отличное от человека животное (например, мышь), характеризующееся наличием гуманизированного гена Baff может быть получено любым способом, известным в настоящей области техники. Например, может быть получен направленный вектор, который вводит ген BAFF человека, полностью или частично, с селективным маркерным геном. На фиг. 2 показан геном мыши, содержащий вставку экзонов с 3 по 6 человеческого гена BAFF. Как показано, направленный конструкт содержит уникальные 5' и 3' сайты рестрикционной нуклеазы, которые позволяют точно вводить генетический материал человека, содержащий экзоны с 3 по 6 гена BAFF человека. Направленный конструкт также содержит самоудаляющуюся селекционную кассету с геном устойчивости к лекарственному средству (например, ген устойчивости к неомицину, фланкированный с обеих сторон последовательностями LoxP; смотрите US 8354389 и US 8518392, оба из которых включены в настоящий документ посредством ссылки), которая находится 3' от генетического материала, содержащего экзоны с 3 по 6 гена BAFF человека. После расщепления и лигирования экзоны с 3 по 6 гена BAFF человека встраиваются в эндогенный мышиный ген Baff который был специально сконструирован, чтобы принять человеческую последовательность, содержащуюся в направленном векторе. В результате создается гуманизированный ген Baff в клетке или отличном от человека животном, которое экспрессирует гуманизированный белок Baff, который содержит аминокислоты, кодируемые экзонами с 3 по 6 гена BAFF человека. Селекционная кассета с геном устойчивости к лекарственному средству будет удалена зависимым от развития способом, т.е. потомство, полученное от мышей, клетки зародышевой линии которых содержат описанный выше гуманизированный ген Baff, будут терять селективный маркер из дифференцированных клеток в процессе развития.
Отличные от человека животные согласно настоящему изобретению могут быть получены, как описано выше или с использованием способов, известных в настоящей области техники, чтобы содержать дополнительные человеческие или гуманизированные гены, часто в зависимости от предполагаемого использования отличного от человека животного. Генетический материал таких дополнительных человеческих или гуманизированных генов может быть введен путем дополнительного изменения генома клеток (например, эмбриональных стволовых клеток), содержащих описанные выше генетические модификации или с помощью известных в настоящей области техники способов селекции с другими генетически модифицированными линиями по желанию. Согласно некоторым вариантам осуществления отличных от человека животных согласно настоящему изобретению получают таким образом, чтобы они дополнительно содержали один или несколько человеческих или гуманизированных генов, выбранных из BAFF-R, TACI и ВСМА. Согласно некоторым вариантам осуществления отличных от человека животных согласно настоящему изобретению получают таким образом, чтобы они дополнительно содержали человеческий или гуманизированный ген индуцирующего пролиферацию лиганда (APRIL). Согласно некоторым вариантам осуществления отличных от человека животных согласно настоящему изобретению получают таким образом, чтобы они дополнительно содержали человеческий или гуманизированный связанный с TNF слабый индуктор апоптоза (TWEAK). Согласно некоторым вариантам осуществления отличные от человека животные согласно настоящему изобретению содержат описанный в настоящем документе гуманизированный ген Baff и генетический материал от гетерологичных видов (например, людей), причем генетический материал кодирует, полностью или частично, один или несколько гетерологичных белков, выбранных из BAFF-R, TACI, ВСМА, APRIL и TWEAK.
В дополнение к мышам, характеризующимся наличием описанных в настоящем документе гуманизированных генов Baff в настоящем документе также предусмотрены другие генетически модифицированные отличные от человека животные, которые содержат гуманизированные гены Baff. Согласно некоторым вариантам осуществления такие отличные от человека животные содержат гуманизированный ген Baff, функционально связанный с последовательностью эндогенного промотора Baff. Согласно некоторым вариантам осуществления такие отличные от человека животные экспрессируют гуманизированный белок BAFF из эндогенного локуса Baff причем гуманизированный белок Baff содержит аминокислотные остатки 142-285 человеческого белка BAFF.
Такие отличные от человека животные могут быть выбраны из группы, состоящей из мыши, крысы, кролика, свиньи, крупного рогатого скота (например, коровы, быка, буйвола), оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макака-резуса). Для отличных от человека животных, у которых подходящие генетически модифицируемые ЭС клетки не всегда доступны, применяются другие способы для получения отличного от человека животного, содержащего описанные в настоящем документе генетические модификации. Такие способы предусматривают, например, модификацию генома отличных от ЭС клеток (например, фибробластов или индуцированных плюрипотентных клеток), а также использование переноса ядер для передачи модифицированного генома в подходящую клетку, например, ооцит, и выращивание модифицированной клетки (например, модифицированного ооцита) в отличном от человека животном в подходящих условиях для образования эмбриона.
Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой млекопитающее. Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой небольшое млекопитающее, например, надсемейства Dipodoidea или Muroidea. Согласно некоторым вариантам осуществления генетически модифицированное животное согласно настоящему изобретению представляет собой грызуна. Согласно некоторым вариантам осуществления грызуна согласно настоящему изобретению выбирают из мыши, крысы и хомяка. Согласно некоторым вариантам осуществления грызуна согласно настоящему изобретению выбирают из надсемейства Muroidea. Согласно некоторым вариантам осуществления генетически модифицированное животное согласно настоящему изобретению представляет собой животное из семейства, выбранного из Calomyscidae (например, мышеподобные хомяки), Cricetidae (например, хомяк, крысы и мыши Нового мира, полевки), Muridae (истинные мыши и крысы, песчанки, колючие мышей, хохлатые крысы), Nesomyidae (рипидомисы, скальные крысы, хвостатые крысы, Малагасийские крысы и мыши), Platacanthomyidae (например, колючий сони) и Spalacidae (например, слепыш, бамбуковые крысы и цокоры). Согласно некоторым определенным вариантам осуществления генетически модифицированного грызуна согласно настоящему изобретению выбирают из истинной мыши или крысы (семейство Muridae), песчанки, колючей мыши и хохлатой крысы. Согласно некоторым определенным вариантам осуществления генетически модифицированная мышь согласно настоящему изобретению представляет собой мышь из семейства Muridae. Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой грызуна. Согласно некоторым определенным вариантам осуществления грызуна согласно настоящему изобретению выбирают из мыши и крысы. Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой мышь.
Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой грызуна, который представляет собой мышь линии C57BL, выбранной из C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr и C57BL/01a. Согласно некоторым определенным вариантам осуществления мышь согласно настоящему изобретению представляет собой линию 129, выбранную из группы, состоящей из линии 129Р1, 129Р2, 129РЗ, 129X1, 129S1 (например, 129S1/SV, 129Sl/SvIm), 129S2, 129S4, 129S5, 129S9/SvEvH, 129/SvJae, 129S6 (129/SvEvTac), 129S7, 129S8, 129T1, 129T2 (смотрите, например, Festing et al., 1999, Mammalian Genome 10:836; Auerbach et al., 2000, Biotechniques 29(5): 1024-1028, 1030, 1032). Согласно некоторым определенным вариантам осуществления генетически модифицированная мышь согласно настоящему изобретению представляет собой сочетание указанной выше линии 129 и указанной выше линии C57BL/6. Согласно некоторым определенным вариантам осуществления мышь согласно настоящему изобретению представляет собой сочетание указанных выше линий 129 или сочетание указанных выше линий BL/6. Согласно некоторым определенным вариантам осуществления описанная в настоящем документе линия 129 сочетания представляет собой линию 129S6(129/SvEvTac). Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению представляет собой линию BALB, например, линию BALB/c. Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению представляет собой сочетание линии BALB и другой указанной выше линии.
Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой крысу. Согласно некоторым определенным вариантам осуществления крысу согласно настоящему изобретению выбирают из крысы линии Вистар, линии LEA, линии Спраг Доули, линии Фишер, F344, F6 и Dark Agouti. Согласно некоторым определенным вариантам осуществления описанная в настоящем документе линия крыс представляет собой смесь из двух или более линий, выбранных из группы, состоящей из Вистар, LEA, Спраг Доули, Фишер, F344, F6 и Dark Agouti.
Способы использования отличных от человека животных, характеризующихся наличием гуманизированных генов BAFF
Сообщалось о трансгенных по Baff отличных от человека животных (например, мышах) (Mackay et al., 1999, J. Exp.Med. 190(11):1697-1710; Khare et al., 2000, PNAS 97(7):3370-3375; Gavin et al., 2005, J. Immunol. 175:319-328). Таких животных использовали в различных анализах для определения молекулярных аспектов экспрессии, функции и регуляции BAFF. Тем не менее, они не без ограничения. Например, использование трансгенных по Baff мышей было ограничено из-за сверхэкспрессии мышиного Baff (например, полноразмерного Baff или ABaff). Сверхэкспрессия Baff у трансгенных мышей приводит к нескольким аномалиям В-клеток, характеризующихся, в частности, чрезмерным накоплением и активацией В-клеток и аутоиммунным заболеванием из-за пролиферации аутореактивных В-клеток. В некоторых случаях, трансгенные мыши, сверхэкспрессирующие мышиный BAFF, характеризуются повышенным содержанием сывороточного иммуноглобулина (например IgM, IgG, IgE и т.д.). Кроме того, трансгенные мыши со сверхэкспрессией мышиного Baff демонстрируют другие аномалии, такие как гломерулонефрит. Таким образом, молекулярные аспекты опосредованной BAFF биологической функции и путей передачи сигналов не были использованы у трансгенных мышей.
Отличные от человека животные согласно настоящему изобретению обеспечивают улучшенную систему in vivo и источник биологических материалов (например, клеток), экспрессирующих BAFF человека, которые применимы для множества анализов. Согласно различным вариантам осуществления отличных от человека животных согласно настоящему изобретению используют для разработки терапевтических средств, которые направленно воздействуют на BAFF и/или модулируют опосредованные BAFF пути передачи сигналов. Согласно различным вариантам осуществления мышей согласно настоящему изобретению используются для скрининга и разработки потенциальных терапевтических средств (например, антител), которые связываются с BAFF человека. Согласно различным вариантам осуществления отличных от человека животных согласно настоящему изобретению используют для определения профиля связывания антагонистов и/или агонистов гуманизированного Baff на поверхности клетки описанного в настоящем документе отличного от человека животного.
Согласно различным вариантам осуществления отличных от человека животных согласно настоящему изобретению используют для измерения терапевтического эффекта блокирования или модулирования сигнальной трансдукции BAFF (например, фосфорилирования) и влияния на экспрессию гена в результате клеточных изменений. Согласно различным вариантам осуществления отличных от человека животных согласно настоящему изобретению используют для измерения терапевтического эффекта блокирования или модулирования человеческих сигнальных путей BAFF-BAFFR, BAFF-TACI и/или BAFF-BCMA, например, модулирования опосредованной NF-κB транскрипции ДНК. Согласно различным вариантам осуществления отличное от человека животное согласно настоящему изобретению или выделенные из отличного от человека животного клетки подвергаются воздействию потенциального терапевтического средства, которое связывается с белком BAFF человека на поверхности клетки отличного от человека животного и после последующего периода времени их анализируют на предмет воздействия на зависимые от BAFF процессы, например, активацию В-клеток, регулирование количества специфических подмножеств В-клеток в различных компартментах (например, селезенке, костном мозге, лимфатическом узле и т.д.), выживание аутореактивных В-клеток и активацию NF-κB.
Отличные от человека животные согласно настоящему изобретению экспрессируют гуманизированный белок Baff, таким образом, могут быть получены клетки, клеточные линии и клеточные культуры, чтобы служить в качестве источника гуманизированного Baff для использования в анализах связывания и функциональных анализах, например, для анализа связывания или функции антагониста или агониста BAFF, в частности, когда антагонист или агонист представляет собой специфический для последовательности или эпитопа BAFF человека. Согласно различным вариантам осуществления гуманизированный белок Baff, экспрессированный описанным в настоящем документе отличным от человека животным, может содержать вариантную аминокислотную последовательность. Сообщалось о вариантных белках BAFF человека, содержащих вариации, связанные с остатками связывающих лигандов. Согласно различным вариантам осуществления отличные от человека животные согласно настоящему изобретению экспрессируют гуманизированный вариант белка Baff. Согласно различным вариантам осуществления вариант представляет собой полиморфный в аминокислотном положении, связанном со связывающим лигандом. Согласно различным вариантам осуществления отличных от человека животных согласно настоящему изобретению используют для определения влияния лиганда, связывающего посредством взаимодействия с полиморфным вариантом BAFF человека. Согласно некоторым определенным вариантам осуществления отличные от человека животные согласно настоящему изобретению экспрессируют сплайс вариант белка BAFF человека, который представлен в таблице 3.
Клетки отличных от человека животных согласно настоящему изобретению могут быть выделены и использованы на специально подобранной основе или могут поддерживаться в культуре в течение многих поколений. Например, клетки из отличных от человека животных согласно настоящему изобретению могут быть использованы в разнообразных известных в настоящей области техники клеточных анализах. Согласно различным вариантам осуществления клетки из отличного от человека животного согласно настоящему изобретению иммортализуют и поддерживают в культуре до бесконечности (например, в серийных культурах).
Согласно различным вариантам осуществления клетки и/или отличные от человека животные согласно настоящему изобретению используются в анализе выживаемости и/или пролиферации (например, с использованием В или Т-клеток) для скрининга и разработки потенциальных терапевтических средств, которые модулируют BAFF человека. Выживание аутореактивных В-клеток играет важную роль в хронической патологии аутоиммунных заболеваний, таких как, например, системная красная волчанка (СКВ), поэтому, потенциальные модуляторы BAFF (например, антагонисты) могут быть идентифицированы, охарактеризованы и разработаны с использованием клеток отличных от человека животных согласно настоящему изобретению и/или описанного в настоящем документе отличного от человека животного. Согласно некоторым вариантам осуществления клетки и/или отличные от человека животные согласно настоящему изобретению используются в анализе выживаемости для определения количества антигенспецифических В-клеток в плазме в присутствии и в отсутствие BAFF.
Согласно различным вариантам осуществления клетки и/или отличные от человека животные согласно настоящему изобретению используются в различных схемах иммунизации для определения опосредованной BAFF функции в иммунной реакции на антиген. Согласно некоторым вариантам осуществления потенциальные лекарственные средства, которые связываются с одной или несколькими функциями BAFF человека или блокируют их, подвергаются определению характеристик в отличном от человека животном согласно настоящему изобретению. Подходящие измерения включают в себя различные клеточные анализы, анализы пролиферации, анализ сывороточного иммуноглобулина (например, титра антител), анализы цитотоксичности, характеристику лиганд-рецепторных взаимодействий (анализы иммунопреципитации). Согласно некоторым вариантам осуществления отличные от человека животные согласно настоящему изобретению используются для характеристики опосредованных BAFF функций, регулирующих иммунный ответ на антиген. Согласно некоторым вариантам осуществления антиген связан с аутоиммунным заболеванием или состоянием. Согласно некоторым вариантам осуществления антиген представляет собой исследуемый антигена (например, овальбумин или OVA). Согласно некоторым вариантам осуществления антиген представляет собой мишень, связанную с заболеванием или состоянием, которому подвергается один или несколько нуждающихся в лечении пациентов-людей.
Согласно различным вариантам осуществления отличные от человека животные согласно настоящему изобретению используются в анализах сыворотки крови для определения титра производства аутоантител с двухцепочечной ДНК (дцДНК) для тестирования фармакотоксикологических аспектов потенциальных лекарственных средств, которые направленно воздействуют на BAFF человека. Согласно некоторым вариантам осуществления производство аутоантител с двухцепочечной ДНК (дцДНК) отличных от человека животных согласно настоящему изобретению представляет собой результат одного или нескольких аутоиммунных заболеваний или состояний, индуцированных у отличного от человека животного.
Согласно различным вариантам осуществления клетки и/или отличные от человека животные согласно настоящему изобретению используются для характеристики репертуара и/или специфичности антител, производимых при иммунном ответе на антиген. Согласно некоторым вариантам осуществления иммунный ответ характеризуется производством аутоантител, которые представляют собой специфические для одного или нескольких тканей отличного от человека животного согласно настоящему изобретению. Согласно некоторым вариантам осуществления терапевтический потенциал соединений или биологических средств для модуляции зависимой от BAFF регуляции репертуара В-клеток характеризуется и/или развивается у отличного от человека животного согласно настоящему изобретению.
Согласно различным вариантам осуществления отличные от человека животные согласно настоящему изобретению используются для сенсибилизации одним или несколькими антигенами для определения терапевтического потенциала соединений или биологических средств для модуляции зависимой от BAFF регуляции иммунного ответа, включая в себя без ограничения специфические зависимые от Т-клеток и зависимые от В-клеток реакции на данный антиген.
Согласно различным вариантам осуществления отличные от человека животные согласно настоящему изобретению используются в экспериментах по трансплантации или адоптивному переносу для определения терапевтического потенциала соединений или биологических средств для модуляции зависимой от BAFF регуляции новых лимфоцитов и их иммунной функции. Согласно различным вариантам осуществления отличным от человека животным согласно настоящему изобретению трансплантируют В-клетки человека.
Согласно различным вариантам осуществления клетки отличных от человека животных согласно настоящему изобретению используют в Т-клеточных анализах для определения терапевтического потенциала соединений или биологических средств для модуляции зависимой от BAFF регуляции зависимой от Т-клеток реакции и функции. Иллюстративные Т-клеточные анализы включают в себя без ограничения ELISpot, внутриклеточное окрашивание цитокинов, рестрикцию главного комплекса гистосовместимости (МНС), анализы вирусной супрессии, анализы цитотоксичности, анализы пролиферации и анализы супрессии регуляторных Т-клеток.
Согласно различным вариантам осуществления клетки отличных от человека животных согласно настоящему изобретению используют в анализах роста опухолевых клеток для определения терапевтического потенциала соединений или биологических средств для модуляции зависимой от BAFF регуляции и/или стимулирования роста опухолевых клеток.
Согласно различным вариантам осуществления аутоиммунное заболевание или состояние индуцируется у одного или нескольких отличных от человека животных согласно настоящему изобретению для обеспечения системы in vivo для определения терапевтического потенциала соединений или биологических средств для модуляции зависимой от BAFF регуляции одной или нескольких функций аутоиммунного заболевания или состояния. Согласно некоторым вариантам осуществления аутоиммунное заболевание представляет собой воспалительное заболевание, например, артрит (например, коллаген-индуцированный артрит, CIA).
Отличные от человека животные согласно настоящему изобретению обеспечивают систему in vivo для анализа и тестирования лекарственного средства или вакцины. Согласно различным вариантам осуществления потенциальное лекарственное средство или вакцина может быть введена одному или нескольким отличным от человека животным согласно настоящему изобретению с последующим мониторингом отличных от человека животных для определения одного или нескольких иммунных ответов на лекарственное средство или вакцину, профиля безопасности лекарственного средства или вакцины или воздействия на заболевания или состояние. Иллюстративные способы, используемые для определения профиля безопасности, включают в себя измерения токсичности, оптимальной концентрации дозы, эффективности лекарственного средства или вакцины, а также возможные факторы риска. Такие лекарственные средства или вакцины могут быть улучшены и/или разработаны в таких отличных от человека животных.
Отличные от человека животные согласно настоящему изобретению обеспечивают систему in vivo для разработки и определения характеристик потенциальных лекарственных средств для применения при злокачественной опухоли. Согласно различным вариантам осуществления отличным от человека животным согласно настоящему изобретению могут быть имплантированы опухоли с последующим введением потенциального лекарственного средства. Опухоль может оставаться в организме достаточный период времени, чтобы закрепиться в одном или нескольких местах у отличного от человека животного. Пролиферация опухолевых клеток, рост и т.д. могут быть измерены как до, так и после введения потенциального лекарственного средства. Цитотоксичность потенциального лекарственного средства также может быть при необходимости измерена у отличного от человека животного.
Отличные от человека животные согласно настоящему изобретению обеспечивают улучшенную систему in vivo выяснения механизмов межклеточного взаимодействия клеток человека через адоптивный перенос. Согласно различным вариантам осуществления отличным от человека животным согласно настоящему изобретению может быть имплантирован опухолевый ксенотрансплантат, после чего отличным от человека животным может быть выполнена вторая имплантация проникающих в опухоль лимфоцитов посредством адоптивного переноса для определения эффективности в ликвидации солидных опухолей или других злокачественных образований. Такие эксперименты могут быть выполнены с человеческими клетками (например, В-клеточными лимфомами) благодаря исключительному присутствию BAFF человека без конкуренции с эндогенным Baff отличного от человека животного. Кроме того, способы лечения и лекарственные средства для использования при ксенотрансплантации могут быть улучшены и/или разработаны в таких отличных от человека животных.
Отличные от человека животные согласно настоящему изобретению обеспечивают улучшенную систему in vivo для поддержания и развития человеческих гемопоэтических стволовых клеток через приживление. Согласно различным вариантам осуществления отличные от человека животные согласно настоящему изобретению обеспечивают улучшенное развитие и поддержание стволовых клеток человека в отличном от человека животном. Согласно различным вариантам осуществления увеличенные популяции дифференцированных В- и Т-клеток человека наблюдаются в крови, костном мозге, селезенке и тимусе отличного от человека животного. Согласно различным вариантам осуществления отличные от человека животные согласно настоящему изобретению обеспечивают увеличение уровня приживления гемопоэтических стволовых клеток человека, по сравнению с отличными от человека животными, которые экспрессируют эндогенный отличный от человеческого Baff и гетерологичный (человеческий) BAFF.
Отличные от человека животные согласно настоящему изобретению обеспечивают улучшенную систему in vivo для поддержания и развития В-клеток человека (например, от людей-доноров) через приживление. Согласно различным вариантам осуществления отличные от человека животные согласно настоящему изобретению обеспечивают улучшенное развитие и поддержание В-клеток человека у отличного от человека животного. Согласно различным вариантам осуществления увеличенные популяции дифференцированных В-клеток человека после иммунизации наблюдаются в одном или нескольких из следующего: кровь, костный мозг, селезенка или лимфатический узел отличного от человека животного. Согласно различным вариантам осуществления отличные от человека животные согласно настоящему изобретению обеспечивают увеличение уровня приживления В-клеток человека, по сравнению с отличными от человека животными, которые экспрессируют эндогенный отличный от человеческого Baff.
ПРИМЕРЫ
Следующие примеры предусмотрены для того, чтобы описать специалистам в настоящей области техники, как можно осуществить и применить способы и композиции согласно настоящему изобретению, и не предназначены для ограничения объема того, что авторы изобретения считают своим изобретением. Если не указано иное, температура указана в градусах Цельсия, а давление равно или близко к атмосферному.
Пример 1. Гуманизация эндогенного отличного от человеческого гена фактора активации В-клеток (Baff)
В этом примере показаны иллюстративные способы гуманизации эндогенного гена, кодирующего фактор активации В-клеток (Baff) у отличного от человека животного, такого как грызун (например, мышь). Человеческий BAFF, как известно, существует в нескольких вариантных (или аллельных) формах. Описанные в настоящем примере способы могут быть использованы для гуманизации эндогенного гена Baff отличного от человека животного с использованием любого человеческого варианта (или аллеля) или комбинации человеческих вариантов (или аллелей, или фрагментов аллелей) в качестве желаемого. В этом примере ген BAFF человека, который представлен в клоне CTD-2355nl8 бактериальной искусственной хромосомы (ВАС) используется для гуманизации эндогенного гена Baff мыши.
Направленный вектор для гуманизации внеклеточной области гена Baff был сконструирован с использованием технологии VELOCIGENE® (смотрите, например, патент США №6586251 и Valenzuela et al., High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, 2003, Nature Biotech. 21(6):652-659). Иллюстративный процесс гуманизации эндогенного гена Baff мыши представлен на фиг. 2.
Вкратце, человеческий клон CTD-2355n18 бактериальной искусственной хромосомы (ВАС) (Invitrogen) модифицировали для удаления 3' фланкирующей области гена BAFF человека, начиная приблизительно с 206 п.н. 3' гена BAFF человека. Модификацию выполняли путем гомологичной рекомбинации в бактериальных клетках с использованием направленного вектора, содержащего самоудаляющуюся кассету с геном устойчивости к неомицину, фланкированную сайтами узнавания рекомбиназой (например, LoxP; смотрите US 8354389 и US 8518392, оба из которых включены в настоящий документ посредством ссылки), и уникальный сайт рестрикции AsiSI, расположенный на 3' кассеты. Полученный в результате модифицированный клон ВАС модифицировали на второй стадии гомологичной рекомбинации в клетках бактерий с использованием кассеты с геном устойчивости к спектиномицину для удаления последовательности 5' гена BAFF человека и экзонов 1, 2 и приблизительно 3146 п. н. интрона 2. Кассета с геном устойчивости к спектиномицину содержала уникальный сайт I-CeuI 3' кассеты с геном устойчивости к спектиномицину. Таким образом, дважды модифицированный клон ВАС человека содержал, от 5' к 3': кассету с геном устойчивости к спектиномицину, сайт I-CeuI, приблизительно 35303 п.н. геномной последовательности человека, содержащей большую часть интрона 2 BAFF человека, экзоны с 3 по 6 BAFF человека и приблизительно 206 п. н. человеческой последовательности 3' экзона 6 BAFF человека, и самоудаляющуюся кассету с геном устойчивости к неомицину, фланкированную сайтами LoxP, и 3' сайт AsiSI.
Отдельно мышиный клон RP23-351L20 ВАС (Invitrogen) модифицировали для специфической вставки модифицированного человеческого клона ВАС, описанного выше. На первой стадии кассету с геном устойчивости к гигромицину, фланкированную сайтспецифическими сайтами узнавания рекомбиназой (например, Frt) использовали для удаления последовательности, содержащей экзоны 3-6 и часть экзона 7 гена Baff мыши. 3'UTR и сигнал полиаденилирования сохраняли. Кассета с геном устойчивости к гигромицину включала в себя уникальные сайты рестрикции I-CeuI и AsiSI на фланкирующих 5'- и 3'-концах, соответственно. Гомологичная рекомбинация в бактериальных клетках с кассетой с геном устойчивости к гигромицину приводила к удалению ~25148 п.н. в гене Baff мыши, соответствующих экзонам 3-7, оставляя нетронутыми ~3069 п.н. интрона 2 Baff мыши. 3'-конец кассеты с геном устойчивости к гигромицину нацеливали приблизительно на середину 3' UTR гена Baff мыши (экзона 7) в клоне RP23-351L20 ВАС. Модифицированный клон ВАС мыши, содержащий делецию экзонов 3-6 и 7 (частично) Baff мыши после гомологичной рекомбинации с кассетой с геном устойчивости к гигромицину, модифицировали на второй стадии с использованием модифицированного клона ВАС человека с делецией экзонов 1-2 ~3146 п.н. и интрона 2 BAFF человека. Это было достигнуто за счет уникальных сайтов рестрикции ферментами общих для двух модифицированных клонов ВАС. Каждый модифицированный клон ВАС расщепляли с помощью I-CeuI и AsiSI для производства совместимых липких фрагментов (фиг. 2). Окончательный направленный вектор, полученный посредством лигирования совместимых фрагментов рестрикции, содержал от 5' к 3': мышиную геномную последовательность, содержащую гены Lig4 и Abdhl3 мыши, ~14,5 т.п.н. мышиной геномной последовательности, экзоны 1 и 2 гена Baff мыши, ~3069 п.н. интрона 2 гена Baff мыши, сайт I-CeuI, ~35,3 т.п.н. человеческой геномной последовательности, содержащей экзоны от 3 до 6 гена BAFF человека, самоудаляющуюся кассету с геном устойчивости к неомицину, фланкированную сайтами узнавания рекомбиназой, сайт AsiSI, часть экзона 7 Baff мыши, который включал 3'UTR и сигнал полиаденилирования, и мышиную геномную последовательность 3' гена Baff мыши.
Окончательный направленный вектор использовали для электропорации в BALB-Rag2-/-IL2Rγc-/- (DKO) мышиные эмбриональные стволовые (ЭС) клетки для создания модифицированных ЭС клеток, содержащих ген Baff в эндогенном локусе Baff, который представляет собой гуманизированный от приблизительно середины интрона 2 гена Baff мыши (~3000 п.н. 3' донорского сайта сплайсинга) до приблизительно 100 п.н. 3' сайта полиаденилирования гена BAFF человека, который был вставлен приблизительно посередине 3'UTR гена мыши Baff (фиг. 1). Положительные ЭС клетки-мишени, содержащие гуманизированный ген BAFF, идентифицировали с помощью анализа (Valenzuela et ah, выше), который обнаруживал наличие последовательности BAFF человека и подтверждал потерю мышиных последовательностей Baff В таблице 4 представлены праймеры и зонды, которые использовали для подтверждения гуманизации описанного выше эндогенного гена Baff. hBAFF: BAFF человека; mBaff. Baff мыши.
Положительные клоны ЭС клеток затем использовали для имплантации самкам мышей с использованием способа VELOCIMOUSE® (смотрите, например, US 7294754 и Poueymirou et al., F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses, 2007, Nature Biotech. 25(1):91-99), чтобы произвести потомство детенышей, содержащих вставку экзонов с 3 по 6 гена BAFF человека в эндогенный ген Baff мыши. Мыши, несущие гуманизацию экзонов с 3 по 6 эндогенного гена Baff, вновь подтверждались, подвергаясь идентификации посредством генотипирования выделенной из хвоста ДНК с использованием модификации аллельного анализа (Valenzuela et al., выше), который обнаруживал присутствие последовательностей гена BAFF человека. Детенышей генотипируют, и когорты животных, гетерозиготных по гуманизированному генному конструкту Baff, выбирают для определения характеристик.


Эквиваленты
После описанных таким образом нескольких аспектов по меньшей мере одного варианта осуществления настоящего изобретения, специалистам в настоящей области техники должно быть понятно, что различные изменения, модификации и усовершенствования будут очевидны специалистам в настоящей области техники. Такие изменения, модификации и усовершенствования предназначены для того, чтобы быть частью настоящего раскрытия, и предназначены, чтобы находиться в пределах характера и объема настоящего изобретения. Соответственно, вышеприведенное описание и графические материалы представлены только в качестве примера, а настоящее изобретение подробно описано в формуле изобретения, которая следуют далее.
Использование порядковых терминов, таких как "первый", "второй", "третий" и т.д., в формуле изобретения для модификации элемента формулы само по себе не подразумевает какой-либо приоритет, первоочередность или порядок одного элемента формулы изобретения над другим или временный порядок, в котором выполняются действия способа, а используется лишь в качестве меток, чтобы отличить один элемент формулы изобретения, характеризующийся определенным названием, от другого элемента, характеризующегося таким же названием (но для использования порядкового термина), чтобы различать элементы формулы изобретения.
Неопределенные артикли единственного числа, используемые в настоящем документе в описании и в формуле изобретения, если явно не указано обратное, следует понимать как включающие в себя множественное число. Формула изобретения или описания, которые включают в себя "или" между одним или несколькими представителями группы, рассматриваются удовлетворяющими, если один, более одного или все представители группы присутствуют, используются или иным образом имеют отношение к данному продукту или процессу, если не указано иное или иным образом не очевидно из контекста. В настоящем изобретении предусмотрены варианты осуществления, в которых только один представитель группы присутствует, используется или иным образом имеет отношение к данному продукту или процессу. В настоящем изобретении также предусмотрены варианты осуществления, в которых более одного или все представители группы присутствуют, используются или иным образом имеют отношение к данному продукту или процессу. Кроме того, следует понимать, что настоящее изобретение охватывает все варианты, комбинации и перестановки, в которых одно или несколько ограничений, элементов, пунктов, описательных терминов и т.д. из одного или нескольких из приведенных пунктов формулы изобретения вводится в другой пункт, в зависимости от того же обоснования пункта (или, по мере необходимости, любого другого пункта), если не указано иное или если для специалиста в настоящей области техники не будет очевидно, что возникает противоречие или несоответствие. Там, где элементы представлены в виде списков (например, в группе Маркуша или аналогичном формате), следует понимать, что каждая подгруппа элементов также раскрыта и что любой элемент(ы) может быть удален из группы. Следует понимать, что, в общем случае, когда настоящее изобретение или аспекты настоящего изобретения представляют собой/упоминаются как содержащие конкретные элементы, признаки и т.п., некоторые варианты осуществления настоящего изобретения или аспекты настоящего изобретения состоят или по существу состоят из таких элементов, признаков и т.п.В целях упрощения эти варианты осуществления не в каждом случае были конкретно и однозначно представлены в настоящем документе. Следует также понимать, что любой вариант осуществления или аспект настоящего изобретения может быть явно исключен из формулы изобретения, независимо от того, изложено ли конкретное исключение в спецификации.
Специалистам в настоящей области техники будут понятны типичные нормы отклонения или погрешности, относящиеся к значениям, полученным в анализах или других способах, описанных в настоящем документе.
Публикации, веб-сайты и другие справочные материалы, упоминаемые в настоящем документе для описания предпосылок настоящего изобретения и предоставления дополнительной информации о своей практике, включены в настоящий документ посредством ссылки.
Реферат
Изобретение относится к области биохимии, в частности к генетически модифицированному животному-грызуну, экспрессирующему гуманизированный белок Baff, а также к способу его получения. Геном вышеуказанного генетически модифицированного животного-грызуна содержит замещение геномного фрагмента эндогенного гена Baff грызуна на человеческий геномный фрагмент, содержащий экзоны 3-6 гена BAFF человека, с образованием гуманизированного гена Baff. Также раскрыты эмбриональная стволовая клетка, а также эмбрион вышеуказанного грызуна. Изобретение также относится к способу трансплантации клеток человека вышеуказанному грызуну. Изобретение позволяет эффективно получать животное-грызуна, экспрессирующего гуманизированный белок Baff. 5 н. и 8 з.п. ф-лы, 2 ил., 4 табл., 1 пр.

Комментарии