Отличные от человека животные, экспрессирующие антитела с общей легкой цепью - RU2614859C2
Код документа: RU2614859C2
Чертежи












Описание
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к генетически модифицированной мыши, экспрессирующей антитела с общей легкой цепью с человеческими вариабельными/мышиными константными участками, связанной с различными тяжелыми цепями с человеческими вариабельными/мышиными константными участками. Настоящее изобретение относится к способу получения биспецифического человеческого антитела из генных последовательностей человеческого вариабельного участка В-клеток мыши.
Предшествующий уровень техники настоящего изобретения
Антитела обычно содержат гомодимерный компонент из тяжелых цепей, причем каждый мономер в виде тяжелой цепи связан с идентичной легкой цепью. Антитела с гетеродимерным компонентом из тяжелых цепей (например, биспецифические антитела) подходят в качестве терапевтических антител. Но получение биспецифических антител с подходящим компонентом в виде легкой цепи, который может удовлетворительно связываться с каждой из тяжелых цепей биспецифического антитела, оказалось проблематичным.
В соответствии с одним подходом легкая цепь может быть выбрана при помощи изучения статистических данных по частоте использования для всех вариабельных доменов легкой цепи, идентификации наиболее часто используемой легкой цепи в человеческих антителах и соединение такой легкой цепи in vitro с двумя тяжелыми цепями различной специфичности.
В соответствии с другим подходом легкая цепь может быть выбрана при помощи выявления последовательностей легких цепей в фаг-дисплейной библиотеке (например, фаг-дисплейной библиотеке, содержащей последовательности вариабельного участка легкой цепи человека, например, библиотека человеческого scFv) и отбора наиболее часто используемого вариабельного участка легкой цепи из библиотеки. Легкая цепь затем может быть протестирована на двух представляющих интерес тяжелых цепях.
В соответствии с другим подходом легкая цепь может быть выбрана посредством анализа фаг-дисплейной библиотеки вариабельных последовательностей легкой цепи с применением вариабельных последовательностей тяжелых цепей обеих представляющих интерес тяжелых цепей в качестве зондов. Легкая цепь, которая связывается с вариабельными последовательностями обеих тяжелых цепей, может быть выбрана в качестве легкой цепи для тяжелых цепей.
В соответствии с другим подходом возможная легкая цепь может быть выровнена с когнатными легкими цепями тяжелых цепей, и модификации осуществляют в легкой цепи для более точного совпадения характеристик последовательностей, общих для когнатных легких цепей обеих тяжелых цепей. Если необходимо минимизировать вероятность иммуногенности, то такие модификации предпочтительно приводят в результате к последовательностям, которые присутствуют в известных последовательностях легких цепей человека, с тем, чтобы при протеолитическом процессинге было маловероятно образование Т-клеточного эпитопа, исходя из известных в данной области техники параметров и способов оценки вероятности иммуногенности (т.е. in silico, а также мокрые анализы).
Все указанные выше подходы основаны на способах in vitro, которые характеризуются рядом a priori ограничений, например, идентичность последовательностей, способность связываться с конкретными предварительно отобранными тяжелыми цепями и т.д. В данной области техники существует потребность в композициях и способах, которые не основываются на манипуляциях с условиями in vitro, но которые вместо этого задействуют более биологически чувствительные подходы создания связывающихся с человеческим эпитопом белков, которые включают общую легкую цепь.
Сущность изобретения
Настоящее изобретение относится к генетически модифицированным мышам, которые экспрессируют вариабельные домены тяжелой и легкой цепи иммуноглобулина человека, причем мыши имеют ограниченный репертуар вариабельных доменов легкой цепи. Настоящее изобретение относится к биологической системе для создания вариабельного домена легкой цепи, который связывается и экспрессируется с разнообразным репертуаром вариабельных доменов человеческих тяжелых цепей со зрелой аффинностью. Настоящее изобретение относится к способам создания содержащих иммуноглобулиновые вариабельные домены связывающих белков, предусматривающим иммунизацию мышей, которые имеют ограниченный репертуар иммуноглобулиновых легких цепей, представляющим интерес антигеном и использование генной последовательности вариабельного участка иммуноглобулина мыши в связывающемся белке, который специфично связывает представляющий интерес антиген. Способы предусматривают способы получения вариабельных доменов тяжелых цепей иммуноглобулина человека, подходящие для применения при получении мультиспецифических антиген-связывающих белков.
Настоящее изобретение относится к генетически сконструированным мышам, у которых имеет место отбор подходящих вариабельных доменов тяжелой цепи иммуноглобулина человека со зрелой аффинностью, полученных из репертуара неперестроенных генных сегментов вариабельного участка тяжелой цепи человека, причем человеческие иммуноглобулиновые вариабельные домены тяжелой цепи со зрелой аффинностью связываются и экспрессируются с одним вариабельным доменом легкой цепи человека, полученным с одного генного сегмента вариабельного участка легкой цепи человека. Настоящее изобретение относится к генетически сконструированным мышам, которые предлагают выбор двух генных сегментов вариабельного участка легкой цепи человека.
Настоящее изобретение относится к генетически сконструированным мышам, у которых экспрессируется ограниченный репертуар вариабельных доменов легкой цепи человека или отдельный вариабельный домен легкой цепи человека из ограниченного репертуара генных сегментов вариабельного участка легкой цепи человека. Мышей генетически конструируют так, чтобы они включали отдельный неперестроенный генный сегмент вариабельного участка легкой цепи человека (или два генных сегмента вариабельного участка легкой цепи человека), который перестраивается с образованием перестроенного гена вариабельного участка легкой цепи человека (или двух перестроенных генов вариабельных участков легкой цепи), которые экспрессируются в отдельную легкую цепь (или которые экспрессируются в любую из двух или обе легкие цепи). Перестроенные вариабельные домены легкой цепи человека способны образовывать пары с множеством выбранных мышами тяжелых цепей человека со зрелой аффинностью, причем вариабельные участки тяжелой цепи специфично связывают различные эпитопы.
Настоящее изобретение относится к генетически сконструированным мышам, у которых экспрессируется ограниченный репертуар вариабельных доменов легкой цепи человека или отдельный вариабельный домен легкой цепи человека из ограниченного репертуара последовательностей вариабельных участков легкой цепи человека. Мышей генетически конструируют так, чтобы они включали отдельную V/J последовательность легкой цепи человека (или две V/J последовательности), с которой экспрессируется вариабельный участок отдельной легкой цепи (или с которой экспрессируется любой один или оба вариабельных участка). Содержащая вариабельную последовательность легкая цепь способна образовывать пары с множеством клонально отбираемых мышами человеческих тяжелых цепей со зрелой аффинностью, причем вариабельные участки тяжелой цепи специфично связывают различные эпитопы.
В соответствии с одним аспектом настоящее изобретение относится к генетически модифицированной мыши, которая содержит отдельный генный сегмент вариабельного (VL) участка легкой цепи иммуноглобулина человека, который может перестраиваться с человеческим генным сегментом J (выбранным из одного или множества сегментов JL) и кодировать VL домен легкой цепи иммуноглобулина человека. В соответствии с другим аспектом мышь содержит не более двух генных сегментов VL, каждый из которых может перестраиваться с человеческим генным сегментом J (выбранным из одного или множества сегментов JL) и кодировать человеческий VL домен иммуноглобулиновой легкой цепи.
В соответствии с одним вариантом осуществления отдельный генный сегмент VL человека является функционально связанным с генным сегментом JL человека, выбранным из Jκ1, Jκ2, JκS, Jκ4 И Jκ5, причем отдельный генный сегмент VL человека может перестраиваться с образованием последовательности, кодирующей ген вариабельного участка легкой цепи, с любым из одного или нескольких генных сегментов JL человека.
В соответствии с одним вариантом осуществления генетически модифицированная мышь содержит локус легкой цепи иммуноглобулина, которая не содержит эндогенный генный сегмент VL мыши, который может перестраиваться с образованием гена иммуноглобулиновой легкой цепи, причем локус VL содержит отдельный генный сегмент VL человека, который может перестраиваться с тем, чтобы кодировать участок VL гена легкой цепи. В соответствии с отдельным вариантом осуществления генный сегмент VL человека представляет собой генный сегмент Vκ1-39Jκ5 человека или генный сегмент Vκ3-2Jκ1 человека. В соответствии с одним вариантом осуществления генетически модифицированная мышь содержит VL локус, который не содержит эндогенный генный сегмент VL мыши, который может перестраиваться с образованием гена легкой цепи иммуноглобулина, причем локус VL содержит не более двух генных сегментов VL человека, которые могут перестраиваться с тем, чтобы кодировать участок VL гена легкой цепи. В соответствии с отдельным вариантом осуществления не более 2 генных сегментов VL человека представляют собой генный сегмент Vκ1-39Jκ5 человека и генный сегмент Vκ3-20Jκ1 человека.
В соответствии с одним аспектом настоящее изобретение относится к генетически модифицированной мыши, которая содержит отдельный перестроенный (V/J) вариабельный участок (VL) легкой цепи иммуноглобулина человека (т.е. участок VL/JL); который кодирует человеческий VL домен легкой цепи иммуноглобулина. В соответствии с другим аспектом мышь содержит не более двух перестроенных участков VL человека, которые способны кодировать человеческий VL домен иммуноглобулиновой легкой цепи.
В соответствии с одним вариантом осуществления VL участок является перестроенной последовательностью Vκ1-39/J человека или последовательностью Vκ3-20/3 человека. В соответствии с одним вариантом осуществления JL сегмент человека перестроенной последовательности VL/JL выбирают из Jκ1, Jκ2, JκS, Jκ4 И Jκ5. В соответствии с конкретным вариантом осуществления VL участок представляет собой последовательность Vκ1-39Jκ5 человека или последовательность Vκ3-20Jκ1 человека. В соответствии с конкретным вариантом осуществления мышь имеет как последовательность Vκ1-39Jκ5 человека, так и последовательность Vκ3-20Jκ1 человека.
В соответствии с одним вариантом осуществления генный сегмент VL человека является функционально связанным с человеческой или мышиной лидерной последовательностью. В соответствии с одним вариантом осуществления лидерная последовательность является мышиной лидерной последовательностью. В соответствии с конкретным вариантом осуществления мышиная лидерная последовательность является мышиной лидерной последовательностью Vκ3-7. В соответствии с конкретным вариантом осуществления лидерная последовательность является функционально связанной с неперестроенным генным сегментом VL человека. В соответствии с конкретным вариантом осуществления лидерная последовательность является функционально связанной с неперестроенной последовательностью VL/JL человека.
В соответствии с одним вариантом осуществления генный сегмент VL является функционально связанным с промоторной последовательностью иммуноглобулина. В соответствии с одним вариантом осуществления промоторной последовательностью является промоторная последовательность человека. В соответствии с конкретным вариантом осуществления иммуноглобулиновым промотором человека является промотор Vκ3-15 человека. В соответствии с конкретным вариантом осуществления промотор является функционально связанным с неперестроенным генным сегментом VL человека. В соответствии с конкретным вариантом осуществления промотор является функционально связанным с неперестроенной последовательностью VL/JL человека.
В соответствии с одним вариантом осуществления локус легкой цепи содержит лидерную последовательность, фланкированную по 5' (по отношению к направлению транскрипции генного сегмента VL) иммуноглобулиновым промотором человека и фланкированную по 3' генным сегментом VL человека, который перестраивается с сегментом J человека и кодирует домен VL реверсивной химерной легкой цепи, содержащей константный участок (CL) эндогенной легкой цепи мыши. В соответствии с конкретным вариантом осуществления генный сегмент VL находится в локусе Vκ мыши, а мышиный CL является мышиным Сκ.
В соответствии с одним вариантом осуществления локус легкой цепи содержит лидерную последовательность, фланкированную по 5' (по отношению к направлению транскрипции генного сегмента VL) иммуноглобулиновым промотором человека и фланкированную по 3' перестроенным участком VL человека (VL/JL последовательность) и кодирует домен VL реверсивной химерной легкой цепи, содержащей константный участок (CL) эндогенной легкой цепи мыши. В соответствии с конкретным вариантом осуществления перестроенная последовательность VL/JL человека находится в мышином локусе каппа (κ), а мышиный CL является мышиным Сκ.
В соответствии с одним вариантом осуществления локус VL модифицированной мыши является локусом легкой цепи κ, и локус легкой цепи κ содержит интронный энхансер κ мыши, 3' энхансер κ мыши или как интронный энхансер, так и 3' энхансер.
В соответствии с одним вариантом осуществления мышь содержит нефункциональный локус иммуноглобулиновой легкой цепи лямбда (λ). В соответствии с конкретным вариантом осуществления локус легкой цепи λ, содержит делецию одной или нескольких последовательностей локуса, причем одна или несколько делеций делает локус легкой цепи Λ не способным к перестройке с образованием гена легкой цепи. В соответствии с другим вариантом осуществления удалены все или практически все генные сегменты VL локуса легкой цепи λ.
В соответствии с одним вариантом осуществления мышь производит легкую цепь, которая содержит подвергнутый соматической мутации домен VL, происходящий от генного сегмента VL человека. В соответствии с одним вариантом осуществления легкая цепь содержит подвергнутый соматической мутации домен VL, происходящий от генного сегмента VL человека, и Сκ участок мыши. В соответствии с одним вариантом осуществления мышь не экспрессирует легкую цепь λ.
В соответствии с одним вариантом осуществления генетически модифицированная мышь способна к соматической гипермутации последовательности участка VL человека. В соответствии с конкретным вариантом осуществления мышь содержит клетку, которая содержит перестроенный ген легкой цепи иммуноглобулина, происходящий от генного сегмента VL человека, который может перестраиваться и кодировать VL домен, и ген перестроенной легкой цепи иммуноглобулина содержит подвергнутый соматической мутации домен VL.
В соответствии с одним вариантом осуществления мышь содержит клетку, которая экспрессирует легкую цепь, включающую подвергнутый соматической мутации домен VL человека, связанный с Cκ мыши, причем легкая цепь связывается с тяжелой цепью, содержащей подвергнутый соматической мутации домен VH, происходящий от генного сегмента VH человека, а тяжелая цепь содержит константный участок (СН) тяжелой цепи мыши. В соответствии с конкретным вариантом осуществления тяжелая цепь содержит СН1 мыши, шарнир мыши, СН2 мыши и СН3 мыши. В соответствии с конкретным вариантом осуществления тяжелая цепь содержит СН1 человека, шарнир, СН2 мыши и СН3 мыши.
В соответствии с одним вариантом осуществления мышь содержит замену эндогенных генных сегментов VH мыши одним или несколькими генными сегментами VH человека, причем генные сегменты VH человека функционально связаны с геном СН участка мыши так, чтобы у мыши перестраивались генные сегменты VH человека и экспрессировалась реверсивная химерная иммуноглобулиновая тяжелая цепь, которая содержит домен VH человека и СН мыши. В соответствии с одним вариантом осуществления 90-100% неперестроенных генных сегментов VH мыши заменены по меньшей мере одним неперестроенным генным сегментом VH человека. В соответствии с конкретным вариантом осуществления все или практически все эндогенные генные сегменты VH мыши заменены по меньшей мере одним неперестроенным генным сегментом VH человека. В соответствии с одним вариантом осуществления замена осуществляется по меньшей мере 19, по меньшей мере 39 или по меньшей мере 80 или 81 неперестроенными генными сегментами VH человека. В соответствии с одним вариантом осуществления замена осуществляется по меньшей мере 12 функциональными неперестроенными генными сегментами VH человека, по меньшей мере 25 функциональными неперестроенными генными сегментами VH человека или по меньшей мере 43 функциональными неперестроенными генными сегментами VH человека. В соответствии с одним вариантом осуществления мышь содержит замену всех мышиных сегментов DH и JH по меньшей мере одним неперестроенным сегментом DH человека и по меньшей мере одним неперестроенным сегментом JH человека. В соответствии с одним вариантом осуществления по меньшей мере один неперестроенный сегмент DH человека выбран из 1-1, 1-7, 1-26, 2-8, 2-15, 3-3, 3-10, 3-16, 3-22, 5-5, 5-12, 6-6, 6-13, 7-27 и их комбинации. В соответствии с одним вариантом осуществления по меньшей мере один неперестроенный сегмент JH человека выбран из 1, 2, 3, 4, 5, 6 и их комбинации. В соответствии с конкретным вариантом осуществления один или несколько генных сегментов VH человека выбраны из 1-2, 1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53, 4-31, 4-39, 4-59, 5-51 и 6-1 генного сегмента VH человека и их комбинации.
В соответствии с одним вариантом осуществления мышь содержит В-клетку, которая экспрессирует связывающий белок, который специфично связывает представляющий интерес антиген, причем связывающий белок содержит легкую цепь, полученную в результате перестройки Vκ1-39Jκ5 человека или перестройки Vκ3-20/Jκ1 человека, и причем клетка содержит перестроенный ген тяжелой цепи иммуноглобулина, полученной в результате перестройки генных сегментов VH человека, выбранных из генного сегмента 1-69, 25, 3-13, 3-23, 3-30, 3-33, 3-53, 4-39, 4-59 и 5-51. В соответствии с одним вариантом осуществления один или несколько генных сегментов VH человека перестраиваются с генным сегментом JH тяжелой цепи человека, выбранным из 1, 2, 3, 4, 5 и 6. В соответствии с одним вариантом осуществления один или несколько генных сегментов VH и JH человека перестраиваются с генным сегментом DH человека, выбранным из 1-1, 1-7, 1-26, 2-8, 2-15, 3-3, 3-10, 3-16, 3-22, 5-5, 5-12, 6-6, 6-13 и 7-27. В соответствии с конкретным вариантом осуществления ген легкой цепи имеет 1, 2, 3, 4 или 5 или более соматических гипермутаций.
В соответствии с одним вариантом осуществления мышь содержит В-клетку, которая содержит перестроенную генную последовательность вариабельного участка иммуноглобулиновой тяжелой цепи, содержащей участок VH/DH/JH, выбранный из 2-5/6-6/1, 2-5/3-22/1, 3-13/6-6/5, 3-23/2-8/4, 3-23/3-3/4, 3-23/3-10/4, 3-23/66/4, 3-23/7-27/4, 3-30/1-1/4, 3-30/1-7/4, 3-30/3-3/3, 3-30/3-3/4, 3-30/3-22/5, 3-30/5-5/2, 3-30/5-12/4, 3-30/6-6/1, 3-30/6-6/3, 3-30/6-6/4, 3-30/6-6/5, 3-30/6-13/4, 3-30/7-27/4, 3-30/7-27/5, 3-30/7-27/6, 3-33/1-7/4, 3-33/2-15/4, 4-39/1-26/3, 4-59/3-16/3, 4-59/3-16/4, 4-59/3-22/3, 5-51/3-16/6, 5-51/5-5/3, 5-51/6-13/5, 3-53/1-1/4, 1-69/6-6/5 и 1-69/6-13/4. В соответствии с конкретным вариантом осуществления В-клетка экспрессирует связывающий белок, содержащий вариабельный участок тяжелой цепи иммуноглобулина человека, гибридизованный с константным участком тяжелой цепи мыши, и вариабельный участок легкой цепи иммуноглобулина человека, гибридизованный с константным участком легкой цепи мыши. В соответствии с одним вариантом осуществления перестроенный участок VL человека является последовательностью Vκ1-39Jκ5 человека, и у мыши экспрессируется реверсивная химерная легкая цепь, содержащая (i) VL домен, полученный с последовательности VL/JL человека, и (ii) CL мыши; причем легкая цепь связана с реверсивной химерной тяжелой цепью, содержащей (i) СН мыши и (ii) подвергнутый соматической мутации домен VH человека, полученный с генного сегмента VH человека, выбранного из генного сегмента 1-2, 1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53, 4-31, 4-39, 4-59, 5-51 и 6-1 VH человека и их комбинации. В соответствии с одним вариантом осуществления у мыши экспрессируется легкая цепь, которая подвергнута соматической мутации. В соответствии с одним вариантом осуществления CL представляет собой Сκ мыши. В соответствии с конкретным вариантом осуществления генный сегмент VH человека выбран из генного сегмента 2-5, 3-13, 3-23, 3-30, 4-59, 5-51 и 1-69. В соответствии с конкретным вариантом осуществления подвергнутый соматической мутации домен VH человека содержит последовательность, полученную от сегмента DH, выбранного из 1-1. 1-7, 1-26, 2-8, 2-15, 3-3, 3-10, 3-16, 3-22, 5-5, 5-12, 6-6, 6-13 и 7-27. В соответствии с конкретным вариантом осуществления подвергнутый соматической мутации домен VH человека содержит последовательность, полученную от сегмента JH, выбранного из 1, 2, 3, 4, 5 и 6. В соответствии с конкретным вариантом осуществления подвергнутый соматической мутации домен VH человека кодируется перестроенной последовательностью VH/DH/JH человека, выбранной из 2-5/6-6/1, 2-5/3-22/1, 3-13/6-6/5, 3-23/2-8/4, 3-23/3-3/4, 3-23/3-10/4, 3-23/6-6/4, 3-23/7-27/4, 3-30/1-1/4, 3-30/1-7/4, 3-30/3-3/4, 3-30/3-22/5, 3-30/5-5/2, 3-30/5-12/4, 3-30/6-6/1, 3-30/6-6/3, 3-30/6-6/4, 3-30/6-6/5, 3-30/6-13/4, 3-30/7-27/4, 3-30/7-27/5, 3-30/7-27/6, 4-59/3-16/3, 4-59/3-16/4, 4-59/3-22/3, 5-51/5-5/3, 1-69/6-6/5 и 1-69/6-13/4.
В соответствии с одним вариантом осуществления мышь содержит В-клетку, которая экспрессирует связывающий белок, который специфично связывает представляющий интерес антиген, причем связывающий белок содержит легкую цепь, полученную в результате перестройки Vκ1-39Jκ5 человека, и причем клетка содержит перестроенную генную последовательность вариабельного участка тяжелой цепи иммуноглобулина, содержащую участок VH/DH/JH, выбранный из 2-5/3-22/1, 3-13/6-6/5, 3-23/2-8/4, 3-23/6-6/4, 3-23/7-27/4, 3-30/1-1/4, 3-30/3-3/4, 3-30/5-5/2, 3-30/7-27/6, 1-69/6-6/5 и 1-69/6-13/4. В соответствии с конкретным вариантом осуществления В-клетка экспрессирует связывающий белок, содержащий вариабельный участок тяжелой цепи иммуноглобулина человека, гибридизованный с константным участком тяжелой цепи мыши, и вариабельный участок легкой цепи иммуноглобулина человека, гибридизованный с константным участком легкой цепи мыши.
В соответствии с одним вариантом осуществления перестроенный участок VL человека является последовательностью Vκ3-20Jκ1 человека, и у мыши экспрессируется реверсивная химерная легкая цепь, содержащая (i) домен VL, полученный с перестроенной последовательности VL/JL человека и (ii) CL мыши; причем легкая цепь связана с реверсивной химерной тяжелой цепью, содержащей (i) СН, мыши и (ii) подвергнутый соматической мутации домен VH человека, полученный с генного сегмента VH человека, выбранного из генного сегмента 1-2, 1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53, 4-31, 4-39, 4-59, 5-51 и 6-1 VH человека и их комбинации. В соответствии с одним вариантом осуществления у мыши экспрессируется легкая цепь, которая подвергнута соматической мутации. В соответствии с одним вариантом осуществления CL представляет собой Сκ мыши. В соответствии с конкретным вариантом осуществления генный сегмент VH человека выбран из генного сегмента 3-30, 3-33, 3-53, 4-39 и 5-51. В соответствии с конкретным вариантом осуществления подвергнутый соматической мутации домен VH человека содержит последовательность, полученную от сегмента DH, выбранного из 1-1, 1-7, 1-26, 2-15, 3-3, 3-16 и 6-13. В соответствии с конкретным вариантом осуществления подвергнутый соматической мутации домен VH человека содержит последовательность, полученную от сегмента JH, выбранного из 3, 4, 5 и 6. В соответствии с конкретным вариантом осуществления подвергнутый соматической мутации домен VH человека кодируется перестроенной последовательностью VH/DH/JH человека, выбранной из 3-30/1-1/4, 3-30/3-3/3, 3-33/1-7/4, 3-33/2-15/4, 4-39/1-26/3, 5-51/3-16/6, 5-51/6-13/5 и 3-53/1-1/4.
В соответствии с одним вариантом осуществления мышь содержит В-клетку, которая экспрессирует связывающий белок, который специфично связывает представляющий интерес антиген, причем связывающий белок содержит легкую цепь, полученную в результате перестройки Vκ3-20Jκ1 человека, и причем клетка содержит перестроенную генную последовательность вариабельного участка тяжелой цепи иммуноглобулина, содержащую участок VH/DH/JH, выбранный из 3-30/3-3/3, 3-33/1-7/4, 3-33/2-15/4 и 3-53/1-1/4. В соответствии с конкретным вариантом осуществления В-клетка экспрессирует связывающий белок, содержащий вариабельный участок тяжелой цепи иммуноглобулина человека, гибридизованный с константным участком тяжелой цепи мыши, и вариабельный участок легкой цепи иммуноглобулина человека, гибридизованный с константным участком легкой цепи мыши.
В соответствии с одним вариантом осуществления мышь содержит как перестроенную последовательность Vκ1-39Jκ5 человека, так и перестроенную последовательность Vκ3-20Jκ1 человека, и у мыши экспрессируется реверсивная химерная легкая цепь, содержащая (i) домен VL, полученный с последовательности Vκ1-39Jκ5 человека или последовательности Vκ3-20Jκ1 человека, и (ii) CL мыши; причем легкая цепь связана с реверсивной химерной тяжелой цепью, содержащей (i) СН, мыши и (ii) подвергнутый соматической мутации VH человека, полученный от генного сегмента VH человека, выбранного из генного сегмента 1-2, 1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53, 4-31, 4-39, 4-59, 5-51 и 6-1 VH человека и их комбинации. В соответствии с одним вариантом осуществления у мыши экспрессируется легкая цепь, которая подвергнута соматической мутации. В соответствии с одним вариантом осуществления CL представляет собой Сκ мыши.
В соответствии с различными вариантами осуществления вариабельный участок тяжелой цепи иммуноглобулина человека, гибридизованный с константным участком тяжелой цепи мыши, и вариабельный участок легкой цепи иммуноглобулина человека, гибридизованный с константным участком легкой цепи мыши, экспрессируемым В-клеткой, являются когнатными у мыши. В соответствии с различными вариантами осуществления экспрессируемые мышью химерная легкая цепь и химерная тяжелая цепь являются когнатными у мыши.
В соответствии с одним вариантом осуществления 90-100% эндогенных неперестроенных генных сегментов VH мыши заменены по меньшей мере одним неперестроенным генным сегментом VH человека. В соответствии с конкретным вариантом осуществления все или практически все эндогенные неперестроенные генные сегменты VH мыши заменены по меньшей мере одним неперестроенным генным сегментом VH человека. В соответствии с одним вариантом осуществления замена осуществляется по меньшей мере 18, по меньшей мере 39, по меньшей мере 80 или 81 неперестроенными генными сегментами VH человека. В соответствии с одним вариантом осуществления замена осуществляется по меньшей мере 12 функциональными неперестроенными генными сегментами VH человека, по меньшей мере 25 функциональными неперестроенными генными сегментами VH человека или по меньшей мере 43 неперестроенными генными сегментами VH человека.
В соответствии с одним вариантом осуществления генетически модифицированной мышью является линия C57BL, в соответствии с конкретным вариантом осуществления, выбранная из C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr, C57BL/01a. В соответствии с конкретным вариантом осуществления генетически модифицированная мышь является комбинацией вышеупомянутой линии 129 с вышеупомянутой линией C57BL/6. В соответствии с другим конкретным вариантом осуществления мышь является комбинацией вышеупомянутых линий 129 или комбинацией вышеупомянутых линий BL/6. В соответствии с конкретным вариантом осуществления линия 129 из комбинации является линией 129S6 (129/SvEvTac).
В соответствии с одним вариантом осуществления у мыши экспрессируется реверсивное химерное антитело, содержащее легкую цепь, которая содержит Сκ мыши и подвергнутый соматической мутации домен VL человека, полученный от перестроенной последовательности Vκ1-39Jκ5 человека или перестроенной последовательности Vκ3-20Jκ1 человека, и тяжелую цепь, которая содержит СН мыши и подвергнутый соматической мутации домен VH человека, полученный с генного сегмента VH человека, выбранного из генного сегмента 1-2, 1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53, 4-31, 4-39, 4-59, 5-51 и 6-1 VH человека, причем у мыши не экспрессируется полностью мышиное антитело и не экспрессируется полностью человеческое антитело. В соответствии с одним вариантом осуществления мышь содержит локус легкой цепи κ, который содержит замену эндогенных генных сегментов легкой цепи κ мыши перестроенной последовательностью Vκ1-39Jκ5 человека или перестроенной последовательностью Vκ3-20Jκ1 человека и содержит замену всех или практически всех эндогенных генных сегментов VH мыши полным или практически полным репертуаром генных сегментов VH человека.
В соответствии с одним аспектом настоящее изобретение относится к мыши, у которой экспрессируется иммуноглобулиновая легкая цепь с перестроенной последовательностью иммуноглобулиновой легкой цепи в зародышевой линии мыши, причем иммуноглобулиновая легкая цепь содержит вариабельную последовательность человека.
В соответствии с одним вариантом осуществления у зародышевой линии мыши отсутствует функционально неперестроенный генный сегмент V иммуноглобулиновой легкой цепи. В соответствии с одним вариантом осуществления у зародышевой линии мыши отсутствует функционально неперестроенный генный сегмент J иммуноглобулиновой легкой цепи.
В соответствии с одним вариантом осуществления зародышевая линия мыши содержит не более одной, не более двух или не более трех перестроенных последовательностей (V/J) легкой цепи.
В соответствии с одним вариантом осуществления перестроенная последовательность V/J содержит последовательность легкой цепи κ. В соответствии с конкретным вариантом осуществления последовательность легкой цепи κ представляет собой последовательность легкой цепи человека κ. В соответствии с конкретным вариантом осуществления последовательность легкой цепи κ выбирают из последовательности Vκ1-39/J человека, последовательности Vκ3-20/J человека и их комбинаций. В соответствии с конкретным вариантом осуществления последовательность легкой цепи представляет собой последовательность Vκ1-39Jκ5 человека. В соответствии с конкретным вариантом осуществления последовательность легкой цепи представляет собой последовательность Vκ3-20Jκ1 человека.
В соответствии с одним вариантом осуществления мышь дополнительно содержит в своей зародышевой линии последовательность, выбранную из интронного энхансера к мыши, 5' по отношению к перестроенной иммуноглобулиновой последовательности легкой цепи, 3' энхансера к и их комбинации.
В соответствии с одним вариантом осуществления мышь содержит неперестроенный генный сегмент VH человека, неперестроенный генный сегмент DH человека и неперестроенный генный сегмент JH человека, причем указанные генные сегменты VH, DH и JH могут перестраиваться с образованием вариабельной генной последовательности тяжелой цепи иммуноглобулина, функционально связанной с константной генной последовательностью тяжелой цепи. В соответствии с одним вариантом осуществления мышь содержит множество генных сегментов VH, DH и JH человека. В соответствии с конкретным вариантом осуществления генные сегменты VH, DH и JH человека заменяют эндогенные генные сегменты VH, DH и JH мыши в эндогенном локусе тяжелой цепи иммуноглобулина мыши. В соответствии с конкретным вариантом осуществления мышь содержит замену всех или практически всех функциональных генных сегментов VH, DH и JH мыши на все или практически все функциональные генные сегменты VH, DH и JH человека.
В соответствии с одним вариантом осуществления у мыши экспрессируется иммуноглобулиновая легкая цепь, которая содержит константную последовательность мыши. В соответствии с одним вариантом осуществления у мыши экспрессируется иммуноглобулиновая легкая цепь, которая содержит константную последовательность человека.
В соответствии с одним вариантом осуществления у мыши экспрессируется иммуноглобулиновая тяжелая цепь, которая содержит мышиную последовательность, выбранную из последовательности СН1, шарнирной последовательности, последовательности СН2, последовательности СН3 и их комбинации.
В соответствии с одним вариантом осуществления у мыши экспрессируется иммуноглобулиновая тяжелая цепь, которая содержит человеческую последовательность, выбранную из последовательности СН1, шарнирной последовательности, последовательности СН2, последовательности СН3 и их комбинации.
В соответствии с одним вариантом осуществления перестроенная последовательность тяжелой цепи иммуноглобулина в зародышевой линии мыши находится в эндогенном локусе легкой цепи иммуноглобулина мыши. В соответствии с конкретным вариантом осуществления перестроенная последовательность легкой цепи иммуноглобулина в зародышевой линии мыши заменяет все или практически все последовательности V и J легкой цепи мыши в эндогенном локусе легкой цепи иммуноглобулина мыши.
В соответствии с одним аспектом настоящее изобретение относится к мышиной клетке, которая выделена из описываемой в настоящем документе мыши. В соответствии с одним вариантом осуществления клетка представляет собой ES клетку. В соответствии с одним вариантом осуществления клетка представляет собой лимфоцит. В соответствии с одним вариантом осуществления лейкоцит представляет собой В-клетку.
В соответствии с одним вариантом осуществления В-клетка экспрессирует химерную тяжелую цепь, включающую вариабельный домен, полученный с генного сегмента человека, и легкую цепь, полученную с перестроенной последовательности Vκ1-39/J человека, перестроенной последовательности Vκ3-20/J человека или их комбинации; причем вариабельный домен тяжелой цепи гибридизирован с константным участком мыши или человека.
В соответствии с одним вариантом осуществления настоящее изобретение относится к В-клетке мыши, которая выделена из описываемой в настоящем документе мыши, причем В-клетка экспрессирует химерную тяжелую цепь, полученную с перестроенной последовательности VH/DH/JH человека, выбранной из 2-5/3-22/1, 3-13/6-6/5, 3-23/2-8/4, 3-23/6-6/4, 3-23/7-27/4, 3-30/1-1/4, 3-30/3-3/4, 3-30/5-5/2, 3-30/7-27/6, 1-69/6-6/5 и 1-69/6-13/4; и химерную легкую цепь, полученную с перестроенной последовательности Vκ1-39Jκ5 человека; причем вариабельный домен гибридизован с константным участком мыши, и вариабельный домен легкой цепи гибридизован с константным участком мыши.
В соответствии с одним вариантом осуществления настоящее изобретение относится к В-клетке мыши, которая выделена из описываемой в настоящем документе мыши, причем В-клетка экспрессирует химерную тяжелую цепь, полученную с перестроенной последовательности VH/DH/JH человека, выбранной из 3-30/3-3/3, 3-33/1-7/4, 3-33/2-15/4 и 3-53/1-1/4; и химерную легкую цепь, полученную с перестроенной последовательности Vκ3-20Jκ1 человека; причем вариабельный домен гибридизован с константным участком мыши, и вариабельный домен легкой цепи гибридизован с константным участком мыши.
В соответствии с различными вариантами осуществления химерные тяжелая и легкая цепи, экспрессируемые В-клеткой, выделенной из описываемой в настоящем документе мыши, являются когнатными у мыши.
В соответствии с одним аспектом настоящее изобретение относится к гибридоме, причем гибридому получают с помощью В-клетки описываемой в настоящем документе мыши. В соответствии с конкретным вариантом осуществления В-клетка получена от описываемой в настоящем документе мыши, которая была иммунизирована иммуногеном, содержащим представляющий интерес эпитоп, и В-клетка экспрессирует связывающий белок, который связывает представляющий интерес эпитоп, связывающий белок имеет подвергнутый соматической мутации домен VH человека, полученный от перестроенной Vκ1-39Jκ5 человека или перестроенной Vκ3-20Jκ1 человека и CL мыши.
В соответствии с одним вариантом осуществления настоящее изобретение относится к гибридоме, которую получают при помощи В-клетки описываемой в настоящем документе мыши, причем гибридома экспрессирует химерную тяжелую цепь, полученную от перестроенной последовательности VH/DH/JH человека, выбранной из 2-5/3-22/1, 3-13/6-6/5, 3-23/2-8/4, 3-23/6-6/4, 3-23/7-27/4, 3-30/1-1/4, 3-30/3-3/4, 3-30/5-5/2, 3-30/7-27/6, 1-69/6-6/5 и 1-69/6-13/4; и химерную легкую цепь, полученную от перестроенной последовательности Vκ1-39Jκ5 человека; причем вариабельный домен гибридизован с константным участком мыши, и вариабельный домен легкой цепи гибридизован с константным участком мыши.
В соответствии с одним вариантом осуществления настоящее изобретение относится к гибридоме, которую получают при помощи В-клетки описываемой в настоящем документе мыши, причем гибридома экспрессирует химерную тяжелую цепь, полученную от перестроенной последовательности VH/DH/JH человека, выбранной из 3-30/3-3/3, 3-33/1-7/4, 3-33/2-15/4 и 3-53/1-1/4; и химерную легкую цепь, полученную от перестроенной последовательности Vκ320Jκ1 человека; причем вариабельный домен гибридизован с константным участком мыши, и вариабельный домен легкой цепи гибридизован с константным участком мыши.
В соответствии с различными вариантами осуществления химерные тяжелая и легкая цепи, экспрессируемые гибридомой, которую получают при помощи В-клетки описываемой в настоящем документе мыши, являются когнатными у гибридомы. В соответствии с различными вариантами осуществления химерные тяжелая и легкая цепи, экспрессируемые гибридомой, которую получают при помощи В-клетки описываемой в настоящем документе мыши, являются когнатными у В-клетки мыши.
В соответствии с одним аспектом настоящее изобретение относится к эмбриону мыши, причем эмбрион содержит донорную ES-клетку, которая получена от описываемой в настоящем документе мыши.
В соответствии с одним аспектом настоящее изобретение относится к таргетирующему (нацеливающему) вектору, содержащему от 5' к 3' в направлении транскрипции относительно последовательностей 5' и 3' гомологичных плечей мыши в векторе, 5' гомологичное плечо мыши, иммуноглобулиновый промотор человека или мыши, лидерную последовательность человека или мыши и участок VL человека, выбранный из перестроенной Vκ1-39Jκ5 человека или перестроенной Vκ3-20Jκ1 человека, и 3' гомологичное плечо мыши. В соответствии с одним вариантом осуществления 5' и 3' гомологичные плечи направляют вектор на последовательность, 5' по отношению к энхансерной последовательности, которая присутствует на 5' и проксимально к гену Сκ мыши. В соответствии с одним вариантом осуществления промотор представляет собой промотор генного сегмента вариабельного участка иммуноглобулина человека. В соответствии с конкретным вариантом осуществления промотором является промотор Vκ3-15 человека. В соответствии с одним вариантом осуществления лидерная последовательность представляет собой мышиную лидерную последовательность. В соответствии с конкретным вариантом осуществления мышиная лидерная последовательность представляет собой мышиную лидерную последовательность Vκ3-7.
В соответствии с одним аспектом настоящее изобретение относится к описанному в настоящем документе таргетирующему вектору, но вместо 5' гомологичного плеча мыши промотор человека или мыши фланкирован по 5' сайтом узнавания сайт-специфической рекомбиназой (SRRS), и вместо 3' гомологичного плеча мыши участок VL человека фланкирован по 3' посредством SRRS.
В соответствии с одним аспектом реверсивное химерное антитело производится описанной в настоящем документе мышью, причем реверсивное химерное антитело содержит легкую цепь, содержащую VL человека и CL, мыши, и тяжелую цепь, содержащую VH человека и СН мыши.
В соответствии с одним аспектом настоящее изобретение относится к способу получения антитела, который предусматривает экспрессию в отдельной клетке (а) первой генной последовательности VH иммунизированной мыши, которая описана в настоящем документе, гибридизованной с генной последовательностью СН человека; (b) генной последовательности VL иммунизированной мыши, которая описана в настоящем документе, гибридизованной с генной последовательностью CL человека; и (c) поддержание клетки в условиях, достаточных для экспрессии полностью человеческого антитела, и выделение антитела. В соответствии с одним вариантом осуществления клетка содержит вторую генную последовательность VH второй иммунизированной мыши, которая описана в настоящем документе, гибридизованную с генной последовательностью СН человека, первая генная последовательность VH кодирует домен VH, который распознает первый эпитоп, а вторая генная последовательность VH кодирует домен VH, который распознает второй эпитоп, причем первый эпитоп и второй эпитоп не являются идентичными.
В соответствии с одним аспектом настоящее изобретение относится к способу получения эпитоп-связывающего белка, который предусматривает воздействие на описанную в настоящем документе мышь иммуногеном, который содержит представляющий интерес эпитоп, поддержание мыши в условиях, достаточных для выработки мышью иммуноглобулиновой молекулы, которая специфично связывает представляющий интерес эпитоп, и выделение иммуноглобулиновой молекулы, которая специфично связывает представляющий интерес эпитоп; причем эпитоп-связывающий белок содержит тяжелую цепь, которая содержит подвергнутый соматической мутации VH человека и СН мыши, связанный с легкой цепью, содержащей CL мыши и VL человека, полученный от перестроенной Vκ1-39Jκ5 человека или перестроенной Vκ3-20Jκ1 человека.
В соответствии с одним аспектом настоящее изобретение относится к клетке, которая экспрессирует эпитоп-связывающий белок, причем клетка содержит: (а) нуклеотидную последовательность человека, кодирующую домен VL человека, которая получена от перестроенной Vκ1-39Jκ5 человека или перестроенной Vκ3-20Jκ1 человека, причем нуклеотидная последовательность человека гибридизована (непосредственно или с помощью линкера) с кДНК последовательностью константного домена легкой цепи иммуноглобулина человека (например, ДНК-последовательностью константного домена к человека), и (b) первую нуклеотидную последовательность VH человека, кодирующую VH домен человека, которая получена от первой нуклеотидной последовательности VH человека, причем первая нуклеотидная последовательность VH человека гибридизована (непосредственно или с помощью линкера) с кДНК-последовательностью константного домена тяжелой цепи иммуноглобулина человека; причем эпитоп-связывающий белок распознает первый эпитоп. В соответствии с одним вариантом осуществления эпитоп-связывающий белок связывает первый эпитоп с константой диссоциации ниже 10-6 М, ниже 10-8 М, ниже 10-9 М, ниже 10-10 М, ниже 10-11 Мили ниже 10-12 M.
В соответствии с одним вариантом осуществления клетка содержит вторую нуклеотидную последовательность человека, кодирующую второй домен VH человека, причем вторая последовательность человека гибридизована (непосредственно или с помощью линкера) с кДНК-последовательностью константного домена тяжелой цепи иммуноглобулина человека, и причем второй VH домен человека не распознает специфично первый эпитоп (например, имеет константу диссоциации, например, 10-6М, 10-5 М, 10-4 М или выше), и причем эпитоп-связывающий белок распознает первый эпитоп и второй эпитоп, и причем каждая из первой и второй иммуноглобулиновых тяжелых цепей связана с идентичной легкой цепью из (а).
В соответствии с одним вариантом осуществления второй VH домен связывает второй эпитоп с константой диссоциации ниже 10-6 М, ниже 10-7 М, ниже 10-8 М, ниже 10-9 М, ниже 10-10 М или ниже 10-11 М.
В соответствии с одним вариантом осуществления эпитоп-связывающий белок содержит первую иммуноглобулиновую тяжелую цепь и вторую иммуноглобулиновую тяжелую цепь, каждая из которых связана с идентичной легкой цепью, полученной от перестроенного участка VL человека, выбранного из Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека, причем первая тяжелая цепь иммуноглобулина связывает первый эпитоп с константой диссоциации в наномолярном-пикомолярном диапазоне, вторая тяжелая цепь иммуноглобулина связывает второй эпитоп с константой диссоциации в наномолярном-пикомолярном диапазоне, первый эпитоп и второй эпитоп не являются идентичными, первая тяжелая цепь иммуноглобулина не связывает второй эпитоп или связывает второй эпитоп с константой диссоциации, слабее микромолярного диапазона (например, миллимолярный диапазон), вторая тяжелая цепь иммуноглобулина не связывает первый эпитоп или связывает первый эпитоп с константой диссоциации, слабее микромолярного диапазона (например, миллимолярный диапазон), и один или несколько из VL, VH первой тяжелой цепи иммуноглобулина и VH второй тяжелой цепи иммуноглобулина подвергнуты соматической мутации.
В соответствии с одним вариантом осуществления первая тяжелая цепь иммуноглобулина содержит связывающий белок А остаток, а у второй тяжелой цепи иммуноглобулина отсутствует связывающий белок А остаток.
В соответствии с одним вариантом осуществления клетку выбирают из СНО, COS, 293, HeLa и клетки сетчатки, экспрессирующей последовательность вирусной нуклеиновой кислоты (например, клетка PERC.6™).
В соответствии с одним аспектом настоящее изобретение относится к реверсивному химерному антителу, содержащему VH человека и константный домен тяжелой цепи мыши, VH человека и константный домен легкой цепи мыши, причем антитело получают при помощи способа, который предусматривает описанную в настоящем документе иммунизацию мыши иммуногеном, содержащим эпитоп, а антитело специфично связывает эпитоп иммуногена, которым иммунизировали мышь. В соответствии с одним вариантом осуществления домен VL подвергнут соматической мутации. В соответствии с одним вариантом осуществления домен VH подвергнут соматической мутации. В соответствии с одним вариантом осуществления как домен VL, так и домен VH подвергнуты соматической мутации. В соответствии с одним вариантом осуществления VL связан с доменом Сκ мыши.
В соответствии с одним аспектом настоящее изобретение относится к мыши, содержащей генный сегмент VH человека, заменяющий все или практически все генные сегменты VH мыши в эндогенном локусе тяжелой цепи мыши; не более одной или двух перестроенных последовательностей VL/JL легкой цепи человека, выбранных из перестроенной Vκ1-39/J и перестроенной Vκ3-20/J или их комбинации, заменяющих все генные сегменты легкой цепи мыши; причем вариабельные генные сегменты тяжелой цепи человека связаны с константным геном мыши, и перестроенные последовательности легкой цепи человека связаны с константным геном человека или мыши.
В соответствии с одним аспектом ES-клетка мыши содержит замену всех или практически всех вариабельных генных сегментов тяжелой цепи мыши на вариабельные генные сегменты тяжелой цепи человека и не более одной или двух перестроенных последовательностей VL/JL легкой цепи человека, причем вариабельные генные сегменты тяжелой цепи человека связаны с константным геном тяжелой цепи иммуноглобулина человека, и перестроенные последовательности VL/JL легкой цепи человека связаны с константным геном иммуноглобулиновой легкой цепи мыши или человека. В соответствии с конкретным вариантом осуществления константный ген легкой цепи является константным геном мыши.
В соответствии с одним аспектом настоящее изобретение относится к антиген-связывающему белку, произведенному описанной в настоящем документе мышью. В соответствии с конкретным вариантом осуществления антиген-связывающий белок содержит вариабельный участок тяжелой цепи иммуноглобулина человека, гибридизованный с константным участком мыши, и вариабельный участок легкой цепи иммуноглобулина человека, полученный с генного сегмента Vκ1-39 или генного сегмента Vκ3-20, причем константный участок легкой цепи является константным участком мыши.
В соответствии с одним аспектом настоящее изобретение относится к полностью человеческому антиген-связывающему белку, получаемому из генной последовательности вариабельного участка иммуноглобулина от описываемой в настоящем документе мыши, причем антиген-связывающий белок содержит полностью человеческую тяжелую цепь, содержащую вариабельный участок человека, полученный с последовательности описываемой в настоящем документе мыши, и полностью человеческую легкую цепь, содержащую Vκ1-39 или Vκ3-20В соответствии с одним вариантом осуществления вариабельный участок легкой цепи содержит от одной до пяти соматических мутаций. В соответствии с одним вариантом осуществления вариабельный участок легкой цепи является когнатным вариабельным участком легкой цепи, который образует пару в В-клетке мыши с вариабельным участком тяжелой цепи.
В соответствии с одним вариантом осуществления полностью человеческий антиген-связывающий белок содержит первую тяжелую цепь и вторую тяжелую цепь, причем первая тяжелая цепь и вторая тяжелая цепь содержат неидентичные вариабельные участки, независимо полученные от описываемой в настоящем документе мыши, и причем каждая из первой и второй тяжелых цепей экспрессируются клеткой-хозяином, ассоциируется с легкой цепью человека, полученной из генного сегмента Vκ1-39 или генного сегмента Vκ3-20В соответствии с одним вариантом осуществления первая тяжелая цепь содержит первый вариабельный участок тяжелой цепи, который специфично связывает первый эпитоп первого антигена, а вторая тяжелая цепь содержит второй вариабельный участок тяжелой цепи, который специфично связывает второй эпитоп второго антигена. В соответствии с конкретным вариантом осуществления первый антиген и второй антиген различаются. В соответствии с конкретным вариантом осуществления первый антиген и второй антиген являются одинаковыми, а первый эпитоп и второй эпитоп не являются идентичными; в соответствии с конкретным вариантом осуществления связывание первого эпитопа первой молекулой связывающего белка не блокирует связывание второго эпитопа второй молекулой связывающего белка.
В соответствии с одним аспектом полностью человеческий связывающий белок, полученный от человеческой иммуноглобулиновой последовательности от описываемой в настоящем документе мыши, содержит первую тяжелую цепь иммуноглобулина и вторую тяжелую цепь иммуноглобулина, причем первая тяжелая цепь иммуноглобулина содержит первый вариабельный участок, который не идентичен вариабельному участку второй тяжелой цепи иммуноглобулина, и причем первая тяжелая цепь иммуноглобулина содержит связывающуюся с белком А дикого типа детерминанту, а у второй тяжелой цепи отсутствует связывающаяся с белком А дикого типа детерминанта. В соответствии с одним вариантом осуществления первая тяжелая цепь иммуноглобулина связывает белок А в изолированных условиях, а вторая тяжелая цепь иммуноглобулина не связывает белок А или связывает белок А по меньшей мере в 10 раз, сто раз или тысячу раз слабее, чем первая тяжелая цепь иммуноглобулина связывает белок А в изолированных условиях. В соответствии с конкретным вариантом осуществления первая и вторая тяжелая цепи являются изотипами IgG1, причем вторая тяжелая цепь включает модификацию, выбранную из 95R (EU 435R), 96F (EU 436F) и их комбинации, и причем у первой тяжелой цепи такая модификация отсутствует.
В соответствии с одним аспектом настоящее изобретение относится к способу получения биспецифического антиген-связывающего белка, предусматривающему воздействие на первую описываемую в настоящем документе мышь представляющим интерес первым антигеном, который содержит первый эпитоп, воздействие на вторую описываемую в настоящем документе мышь представляющим интерес вторым антигеном, который содержит второй эпитоп, предоставление возможности каждой из первой и второй мыши дать иммунные ответы на представляющие интерес антигены, определение у первой мыши вариабельного участка первой тяжелой цепи человека, который связывает первый эпитоп представляющего интерес первого эпитопа, определение у второй мыши вариабельного участка второй тяжелой цепи человека, который связывает второй эпитоп представляющего интерес второго антигена, получение первого гена полностью тяжелой цепи человека, который кодирует первую тяжелую цепь, которая связывает первый эпитоп представляющего интерес первого антигена, получение второго гена полностью тяжелой цепи человека, который кодирует вторую тяжелую цепь, которая связывает второй эпитоп представляющего интерес второго антигена, экспрессию первой тяжелой цепи и второй тяжелой цепи В-клетке, которая экспрессирует отдельную полностью человеческую легкую цепь, полученную от генного сегмента Vκ1-39 человека или Vκ3-20 человека, с образованием биспецифического антиген-связывающего белка и выделение биспецифического антиген-связывающего белка.
В соответствии с одним вариантом осуществления первый антиген и второй антиген не являются идентичными.
В соответствии с одним вариантом осуществления первый антиген и второй антиген являются идентичными, а первый эпитоп и второй эпитоп не являются идентичными. В соответствии с одним вариантом осуществления связывание вариабельного участка первой тяжелой цепи с первым эпитопом не блокирует связывание вариабельного участка второй тяжелой цепи со вторым эпитопом.
В соответствии с одним вариантом осуществления первый антиген выбирают из растворимого антигена и антигена клеточной поверхности (например, опухолевого антигена), а второй антиген подразумевает рецептор клеточной поверхности. В соответствии с конкретным вариантом осуществления рецептор клеточной поверхности является иммуноглобулиновым рецептором. В соответствии с конкретным вариантом осуществления иммуноглобулиновый рецептор является Fc-рецептором. В соответствии с одним вариантом осуществления первый антиген и второй антиген являются одним и тем же рецептором клеточной поверхности, а связывание первой тяжелой цепи с первым эпитопом не блокирует связывание второй тяжелой цепи со вторым эпитопом.
В соответствии с одним вариантом осуществления вариабельный домен легкой цепи в легкой цепи содержит от 2 до 5 соматических мутаций. В соответствии с одним вариантом осуществления вариабельный домен легкой цепи является подвергнутой соматической мутации когнатной легкой цепью, экспрессируемой в В-клетке первой или второй иммунизированной мыши с вариабельным доменом либо первой, либо второй тяжелой цепи.
В соответствии с одним вариантом осуществления первая полностью человеческая тяжелая цепь несет аминокислотную модификацию, которая уменьшает ее аффинность к белку А, а вторая полностью человеческая тяжелая цепь не содержит модификацию, которая уменьшает ее аффинность к белку А.
В соответствии с одним аспектом настоящее изобретение относится к антителу или биспецифическому антителу, содержащему вариабельный домен тяжелой цепи человека, полученный в соответствии с настоящим изобретением. В соответствии с другим аспектом настоящее изобретение относится к применению описываемой в настоящем документе мыши для получения полностью человеческого антитела или полностью человеческого биспецифического антитела.
В соответствии с одним аспектом описываемые в настоящем документе генетически модифицированная мышь, эмбрион или клетка содержат локус легкой цепи κ, который сохраняет эндогенные регуляторные или управляющие элементы, например, интронный энхансер κ мыши, 3' энхансер κ мыши или как интронный энхансер, так и 3' энхансер, причем регуляторные или управляющие элементы облегчают соматическую мутацию и созревание аффинности экспрессируемой последовательности локуса легкой цепи κ.
В соответствии с одним аспектом настоящее изобретение относится к мыши, которая содержит популяцию В-клеток, характеризуемую наличием иммуноглобулиновых легких цепей, полученных от не более одного или не более двух перестроенных или неперестроенных генных сегментов V и J иммуноглобулиновой легкой цепи, причем мышь имеет соотношение легких цепей κ:λ, которое является приблизительно таким же, как у мыши, которая содержит последовательность дикого типа, комплементарную генным сегментам V и J иммуноглобулиновой легкой цепи.
В соответствии с одним вариантом осуществления иммуноглобулиновые легкие цепи получают от не более одного или не более двух перестроенных генных сегментов V и J иммуноглобулиновой легкой цепи. В соответствии с конкретным вариантом осуществления легкие цепи получают от не более одного перестроенного генного сегмента V и J легкой цепи иммуноглобулина.
В соответствии с одним вариантом осуществления мышь имеет соотношение легких цепей κ:λ, которое приблизительно составляет от 55:1 до 75:1, от 60:1 до 70:1, от 63:1 до 68:1 или приблизительно от 65:1 до 67:1 по сравнению с мышью, которая содержит последовательность дикого типа, комплементарную генным сегментам V и J легкой цепи иммуноглобулина. В соответствии с конкретным вариантом осуществления мышь имеет соотношение легких цепей κ:λ, которое составляет 66:1 по сравнению с мышью, которая содержит последовательность дикого типа, комплементарную генным сегментам V и J легкой цепи иммуноглобулина. В соответствии с одним вариантом осуществления легкие цепи иммуноглобулина, полученные от не более одного или не более двух перестроенных или неперестроенных генных сегментов V и J легкой цепи иммуноглобулина, включают в себя генные сегменты Vκ и Jκ человека, выбранные из Vκ1-39 человека, Vκ3-20 человека, Jκ1 человека и Jκ5 человека. В соответствии с конкретным вариантом осуществления легкие цепи иммуноглобулина получены от отдельной последовательности легкой цепи человека, содержащей последовательность Vκ1-39 человека.
В соответствии с одним вариантом осуществления мышь имеет соотношение легких цепей κ:λ, которое приблизительно составляет от 18:1 до 23:1 или приблизительно от 19:1 до 22:1 по сравнению с мышью, которая содержит последовательность дикого типа, комплементарную генным сегментам V и J легкой цепи иммуноглобулина. В соответствии с одним вариантом осуществления мышь имеет соотношение легких цепей κ:λ, которое составляет 21:1 по сравнению с мышью, которая содержит последовательность дикого типа, комплементарную генным сегментам V и J легкой цепи иммуноглобулина. В соответствии с одним вариантом осуществления мышь имеет соотношение легких цепей κ:λ, которое составляет 20:1 по сравнению с мышью, которая содержит последовательность дикого типа, комплементарную генным сегментам V и J легкой цепи иммуноглобулина. В соответствии с одним вариантом осуществления иммуноглобулиновые легкие цепи, полученные от не более одного или не более двух перестроенных или неперестроенных генных сегментов V и J легкой цепи иммуноглобулина, включают в себя генные сегменты Vκ и Jκ человека, выбранные из Vκ1-39 человека, Vκ3-20 человека, Jκ1 человека и Jκ5 человека. В соответствии с конкретным вариантом осуществления легкие цепи иммуноглобулина получены от отдельной последовательности легкой цепи человека, содержащей последовательность Vκ3-20 человека.
В соответствии с одним аспектом настоящее изобретение относится к описываемой в настоящем документе мыши, у которой экспрессируется легкая цепь иммуноглобулина, полученная от не более одной или не более двух последовательностей Vκ/Jκ человека, причем мышь содержит замену всех или практически всех эндогенных генных сегментов вариабельного участка тяжелой цепи мыши на один или несколько генных сегментов вариабельного участка тяжелой цепи человека, и мышь имеет соотношение (a) CD19+ В-клеток, которые экспрессируют иммуноглобулин с легкой цепью λ, к (b) CD19+ В-клеткам, которые экспрессируют иммуноглобулин с легкой цепью κ, составляющее приблизительно 1 к приблизительно 20.
В соответствии с одним вариантом осуществления у мыши экспрессируется отдельная легкая цепь κ, полученная от последовательности Vκ1-39Jκ5 человека, и соотношение CD19+ В-клеток, которые экспрессируют иммуноглобулин с легкой цепью λ, к CD19+ В-клеткам, которые экспрессируют иммуноглобулин с легкой цепью κ, составляет приблизительно 1 к приблизительно 20; в соответствии с одним вариантом осуществления соотношение составляет приблизительно 1 к по меньшей мере приблизительно 66; в соответствии с конкретным вариантом осуществления соотношение составляет приблизительно 1 к 66.
В соответствии с одним вариантом осуществления у мыши экспрессируется отдельная легкая цепь κ, полученная от последовательности Vκ3-20Jκ5 человека, и соотношение CD19+ В-клеток, которые экспрессируют иммуноглобулин с легкой цепью λ, к CD19+В-клеткам, которые экспрессируют иммуноглобулин с легкой цепью κ, составляет приблизительно 1 к приблизительно 20; в соответствии с одним вариантом осуществления соотношение составляет приблизительно 1 к приблизительно 21. В соответствии с конкретным вариантом осуществления соотношение составляет 1 к 20 или 1 к 21.
В соответствии с одним аспектом настоящее изобретение относится к генетически модифицированной мыши, у которой экспрессируется отдельная перестроенная легкая цепь κ, причем мышь содержит функциональный локус легкой цепи λ, и причем мышь экспрессирует популяцию В клеток, которая содержит Igκ+ клетки, у которых экспрессируется легкая цепь κ, полученная от той же отдельной перестроенной легкой цепи κ. В соответствии с одним вариантом осуществления процент Igκ+Igλ+ В-клеток у мыши является приблизительно таким же, как и у мыши дикого типа. В соответствии с конкретным вариантом осуществления процент Igκ+Igλ+ В-клеток у мыши составляет от приблизительно 2 до приблизительно 6 процентов. В соответствии с конкретным вариантом осуществления процент Igκ+Igλ+ В-клеток у мыши, у которой отдельная перестроенная легкая цепь κ получена от последовательности Vκ1-39Jκ5, составляет от приблизительно 2 до приблизительно 3; в соответствии с конкретным вариантом осуществления - приблизительно 2,6. В соответствии с конкретным вариантом осуществления процент Igκ+Igλ+ В-клеток у мыши, у которой отдельная перестроенная легкая цепь κ получена от последовательности Vκ3-20Jκ1, составляет от приблизительно 4 до приблизительно 8; в соответствии с конкретным вариантом осуществления - приблизительно 6.
В соответствии с одним аспектом настоящее изобретение относится к генетически модифицированной мыши, причем у мыши экспрессируется отдельная перестроенная легкая цепь κ, полученная от генного сегмента Vκ и Jκ человека, причем у мыши экспрессируется популяция В-клеток, которая содержит отдельную легкую цепь κ, полученную от отдельной перестроенной последовательности легкой цепи κ, причем генетически модифицированная мышь не была наделена устойчивостью к соматическим гипермутациям. В соответствии с одним вариантом осуществления по меньшей мере 90% экспрессируемых на В-клетке мыши легких цепей к имеют от по меньшей мере одной до по меньшей мере пяти соматических гипермутаций.
В соответствии с одним аспектом настоящее изобретение относится к генетически модифицированной мыши, которая модифицирована с целью экспрессии отдельной легкой цепи κ, полученной от не более одной или не более двух перестроенных последовательностей легкой цепи κ, причем мышь демонстрирует частоту использования легкой цепи κ, которая приблизительно в два раза или более, по меньшей мере в три раза или более, или по меньшей мере в четыре раза или более больше, чем частота использования легкой цепи κ, демонстрируемая мышью дикого типа, или больше, чем частота использования легкой цепи κ, демонстрируемая той же линией, которая содержит репертуар дикого типа генных сегментов легкой цепи κ. В соответствии с конкретным вариантом осуществления у мыши экспрессируется отдельная легкая цепь κ с не более одной перестроенной последовательности легкой цепи κ. В соответствии с конкретным вариантом осуществления перестроенная последовательность легкой цепи κ выбрана из последовательности Vκ1-39Jκ5 и Vκ3-20Jκ1. В соответствии с одним вариантом осуществления перестроенная последовательность легкой цепи κ является последовательностью Vκ1-39Jκ5. В соответствии с одним вариантом осуществления перестроенная последовательность легкой цепи κ является последовательностью Vκ3-20Jκ1.
В соответствии с одним аспектом настоящее изобретение относится к генетически модифицированной мыши, у которой экспрессируется отдельная легкая цепь κ, полученная от не более одной или не более двух перестроенных последовательностей легкой цепи κ, причем мышь демонстрирует частоту использования легкой цепи κ, которая приблизительно в 100 раз или более, по меньшей мере приблизительно в 200 раз или более, по меньшей мере приблизительно в 300 раз или более, по меньшей мере приблизительно в 400 раз или более, по меньшей мере приблизительно в 500 раз или более, по меньшей мере приблизительно в 600 раз или более, по меньшей мере приблизительно в 700 раз или более, по меньшей мере приблизительно в 800 раз или более, по меньшей мере приблизительно в 900 раз или более, по меньшей мере приблизительно в 1000 раз или более превосходит частоту использования той же легкой цепи κ, демонстрируемую мышью, несущей полный или практически полный локус легкой цепи κ человека. В соответствии с конкретным вариантом осуществления у мыши, несущей полный или практически полный локус легкой цепи κ человека, отсутствует функциональная неперестроенная последовательность легкой цепи κ мыши. В соответствии с конкретным вариантом осуществления у мыши экспрессируется отдельная легкая цепь κ с не более одной перестроенной последовательности легкой цепи κ. В соответствии с одним вариантом осуществления мышь содержит одну копию перестроенной последовательности легкой цепи κ (например, гетерозигота). В соответствии с одним вариантом осуществления мышь содержит две копии перестроенной последовательности легкой цепи κ (например, гомозигота). В соответствии с конкретным вариантом осуществления перестроенная последовательность легкой цепи κ выбрана из последовательности Vκ1-39Jκ5 и Vκ3-20Jκ1. В соответствии с одним вариантом осуществления перестроенная последовательность легкой цепи κ является последовательностью Vκ1-39Jκ5. В соответствии с одним вариантом осуществления перестроенная последовательность легкой цепи κ является последовательностью Vκ3-20Jκl.
В соответствии с одним аспектом настоящее изобретение относится к генетически модифицированной мыши, у которой экспрессируется отдельная легкая цепь, полученная от не более одной или не более двух перестроенных последовательностей легкой цепи, причем легкая цепь у генетически модифицированной мыши демонстрирует уровень экспрессии, который в от по меньшей мере 10 раз до приблизительно 1000 раз, от 100 раз до приблизительно 1000 раз, от 200 раз до приблизительно 1000 раз, от 300 раз до приблизительно 1000 раз, от 400 раз до приблизительно 1000 раз, от 500 раз до приблизительно 1000 раз, от 600 раз до приблизительно 1000 раз, от 700 раз до приблизительно 1000 раз, от 800 раз до приблизительно 1000 раз или от 900 раз до приблизительно 1000 раз выше, чем экспрессия той же перестроенной легкой цепи, демонстрируемая мышью, несущей полный или практически полный локус легкой цепи. В соответствии с одним вариантом осуществления легкая цепь содержит человеческую последовательность. В соответствии с конкретным вариантом осуществления человеческая последовательность является последовательностью κ. В соответствии с одним вариантом осуществления человеческая последовательность является последовательностью λ. В соответствии с одним вариантом осуществления легкая цепь является полностью человеческой легкой цепью.
В соответствии с одним вариантом осуществления уровень экспрессии характеризуют при помощи количественной оценки мРНК транскрибируемой последовательности легкой цепи и сравнения ее с транскрибируемой последовательностью легкой цепи мыши, несущей полный или практически полный локус легкой цепи.
В соответствии с одним аспектом настоящее изобретение относится к генетически модифицированной мыши, у которой экспрессируется отдельная легкая цепь κ, полученная от не более одной или не более двух перестроенных последовательностей легкой цепи κ, причем мышь после иммунизации антигеном имеет сывороточный титр, который сравним с титром иммунизированной тем же антигеном мыши дикого типа. В соответствии с конкретным вариантом осуществления у мыши экспрессируется отдельная легкая цепь κ с не более одной перестроенной последовательности легкой цепи κ. В соответствии с одним вариантом осуществления сывороточный титр характеризуется как общий иммуноглобулин. В соответствии с конкретным вариантом осуществления сывороточный титр характеризуется как титр по IgM. В соответствии с конкретным вариантом осуществления сывороточный титр характеризуется как титр по IgG. В соответствии с конкретным вариантом осуществления перестроенная последовательность легкой цепи κ выбрана из последовательности Vκ1-39Jκ5 и Vκ3-2Jκ1. В соответствии с одним вариантом осуществления перестроенная последовательность легкой цепи κ является последовательностью Vκ1-39Jκ5. В соответствии с одним вариантом осуществления перестроенная последовательность легкой цепи κ является последовательностью Vκ3-20Jκ1.
В соответствии с одним аспектом настоящее изобретение относится к генетически модифицированной мыши, у которой экспрессируется множество тяжелых цепей иммуноглобулина, связанных с отдельной легкой цепью. В соответствии с одним вариантом осуществления тяжелая цепь содержит человеческую последовательность. В соответствии с различными вариантами осуществления человеческая последовательность выбрана из вариабельной последовательности, CH1, шарнира, СН2, СН3 и их комбинации. В соответствии с одним вариантом осуществления отдельная легкая цепь содержит человеческую последовательность. В соответствии с различными вариантами осуществления человеческая последовательность выбрана из вариабельной последовательности, константной последовательности и их комбинации. В соответствии с одним вариантом осуществления мышь содержит дезактивированный эндогенный иммуноглобулиновый локус, и у нее экспрессируется тяжелая цепь и/или легкая цепь с трансгенной или внехромосомной эписомы. В соответствии с одним вариантом осуществления мышь содержит замену в эндогенном мышином локусе некоторых или всех генных сегментов эндогенной тяжелой цепи мыши (т.е. V, D, J), и/или некоторых или всех константных последовательностей эндогенной тяжелой цепи мыши (например, CH1, шарнир, СН2, СН3 или их комбинацию), и/или некоторых или всех последовательностей эндогенной легкой цепи мыши (например, V, J, константный участок или их комбинацию) на одну или несколько последовательностей иммуноглобулина человека.
В соответствии с одним аспектом настоящее изобретение относится к мыши, подходящей для получения антител, которые имеют одинаковую легкую цепь, причем все или практически все получаемые у мыши антитела экспрессируются с одинаковой легкой цепью. В соответствии с одним вариантом осуществления легкая цепь экспрессируется с эндогенного локуса легкой цепи.
В соответствии с одним аспектом настоящее изобретение относится к способу получения легкой цепи антитела человека, предусматривающему получение от описываемой в настоящем документе мыши последовательности легкой цепи и последовательности тяжелой цепи и использование последовательности легкой цепи и последовательности тяжелой цепи при получении антитела человека. В соответствии с одним вариантом осуществления антитело человека является биспецифическим антителом.
Любой из описанных в настоящей документе вариантов осуществления и аспектов могут быть использованы совместно друг с другом, если не указано иное или иное не очевидно из контекста. Другие варианты осуществления станут понятны специалистам в данной области техники из обзора последующего описания.
Краткое описание чертежей
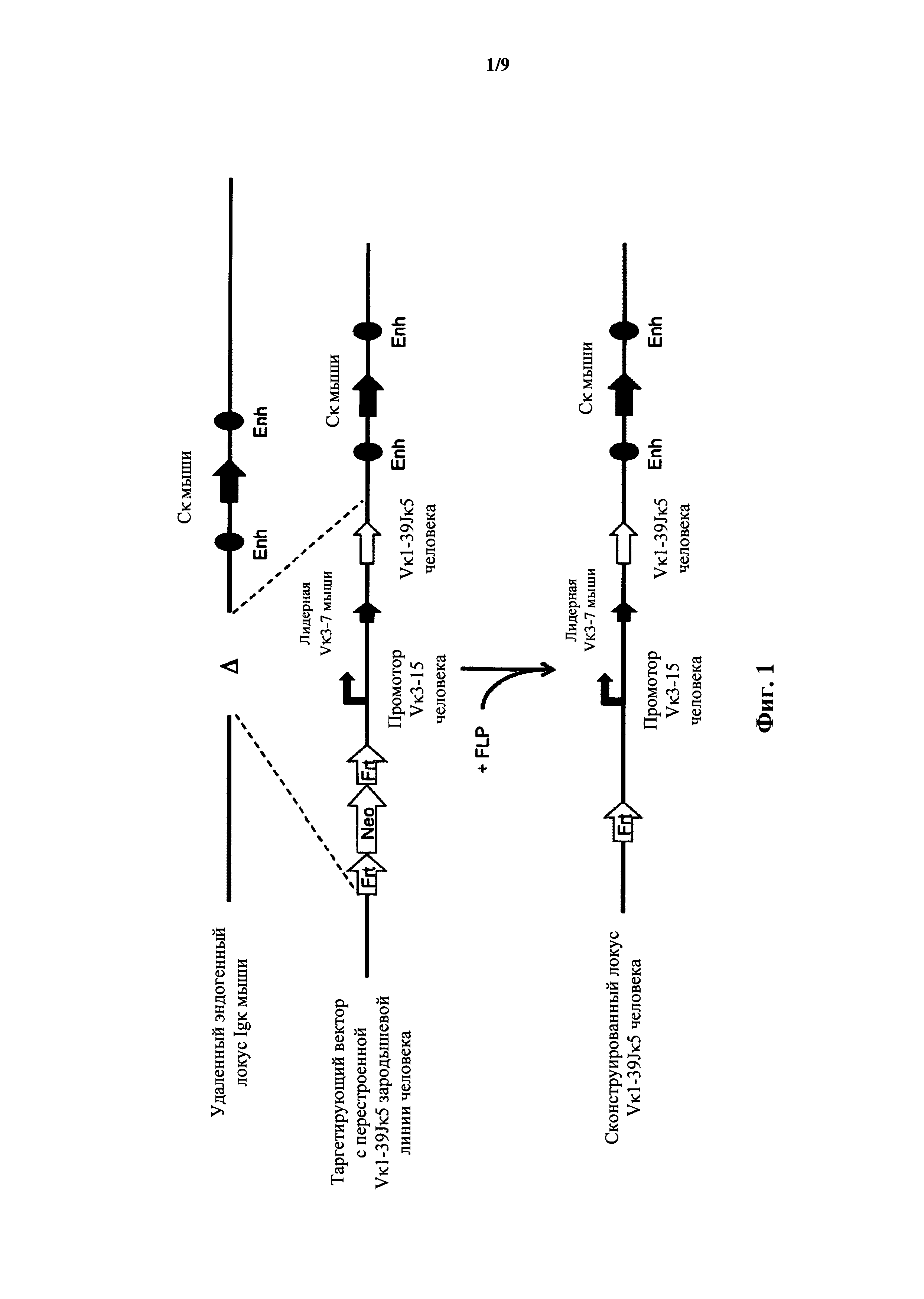
Фиг.1 иллюстрирует целенаправленную стратегию замены генных сегментов вариабельного участка эндогенной легкой цепи иммуноглобулина мыши на генный участок Vκ1-39Jκ5 человека.
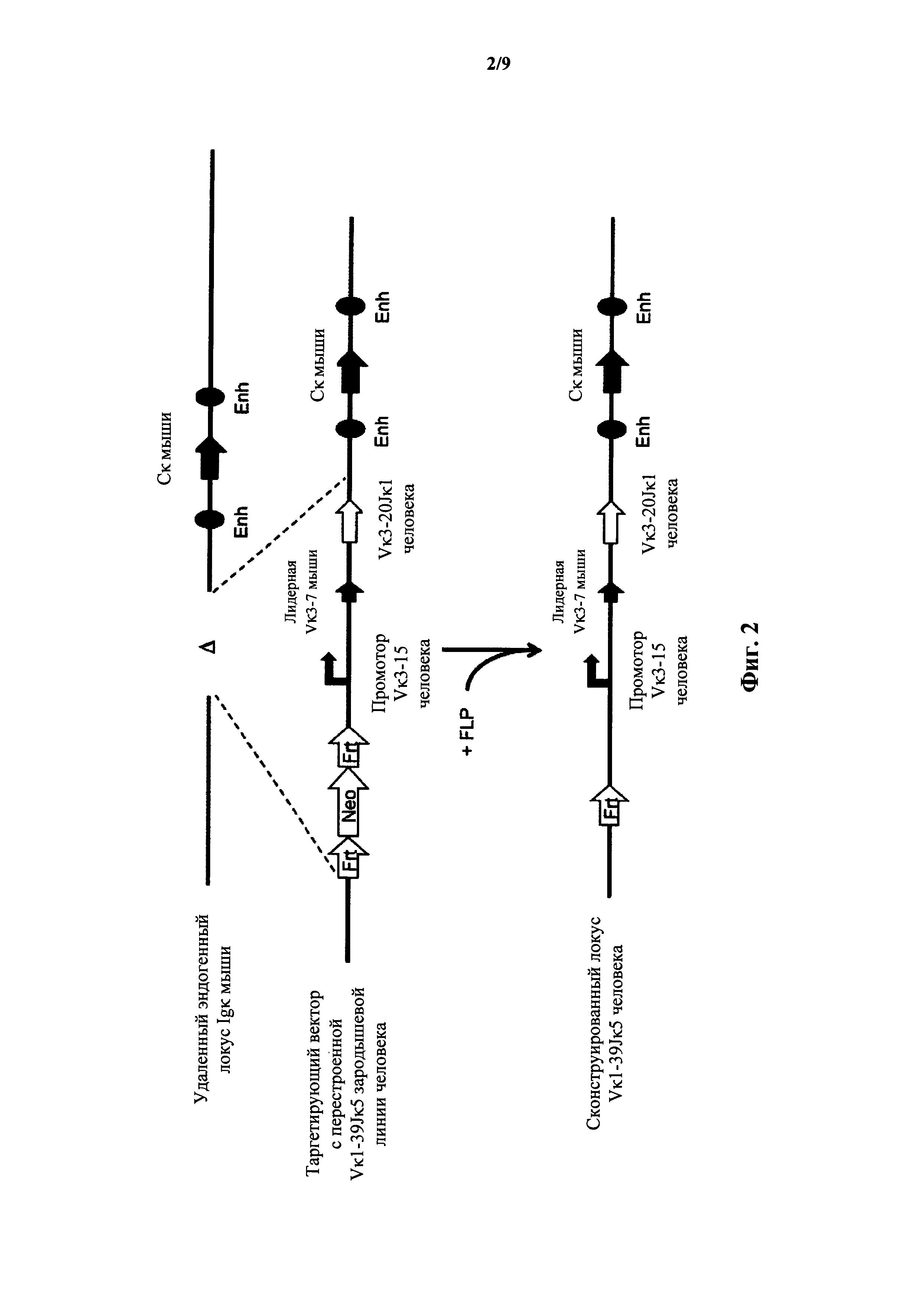
Фиг.2 иллюстрирует целенаправленную стратегию замены генных сегментов вариабельного участка эндогенной легкой цепи иммуноглобулина мыши на генный участок Vκ3-20Jκ1 человека.
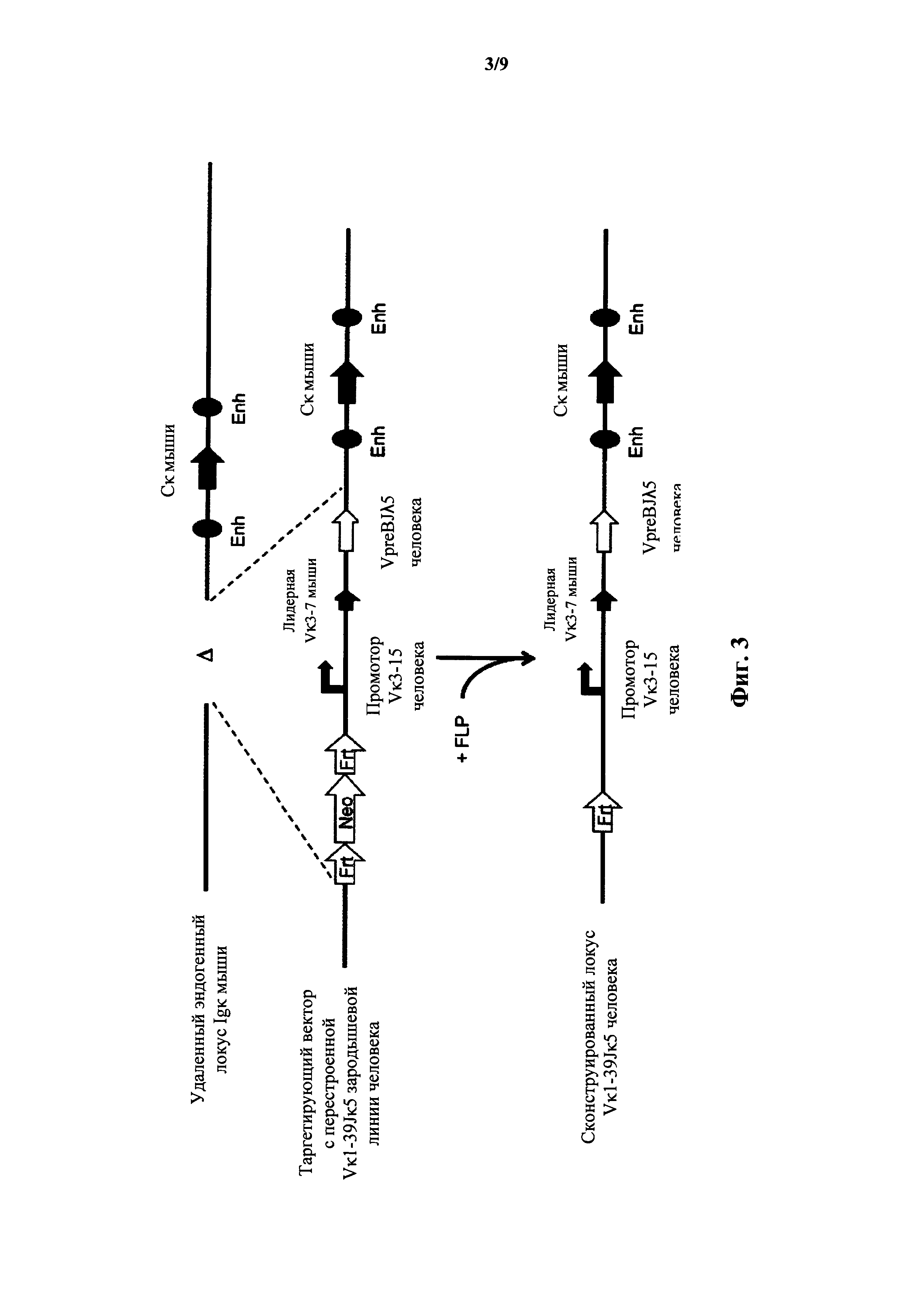
Фиг.3 иллюстрирует целенаправленную стратегию замены генных сегментов вариабельного участка эндогенной легкой цепи иммуноглобулина мыши на генный участок VpreB/Jλ5 человека.
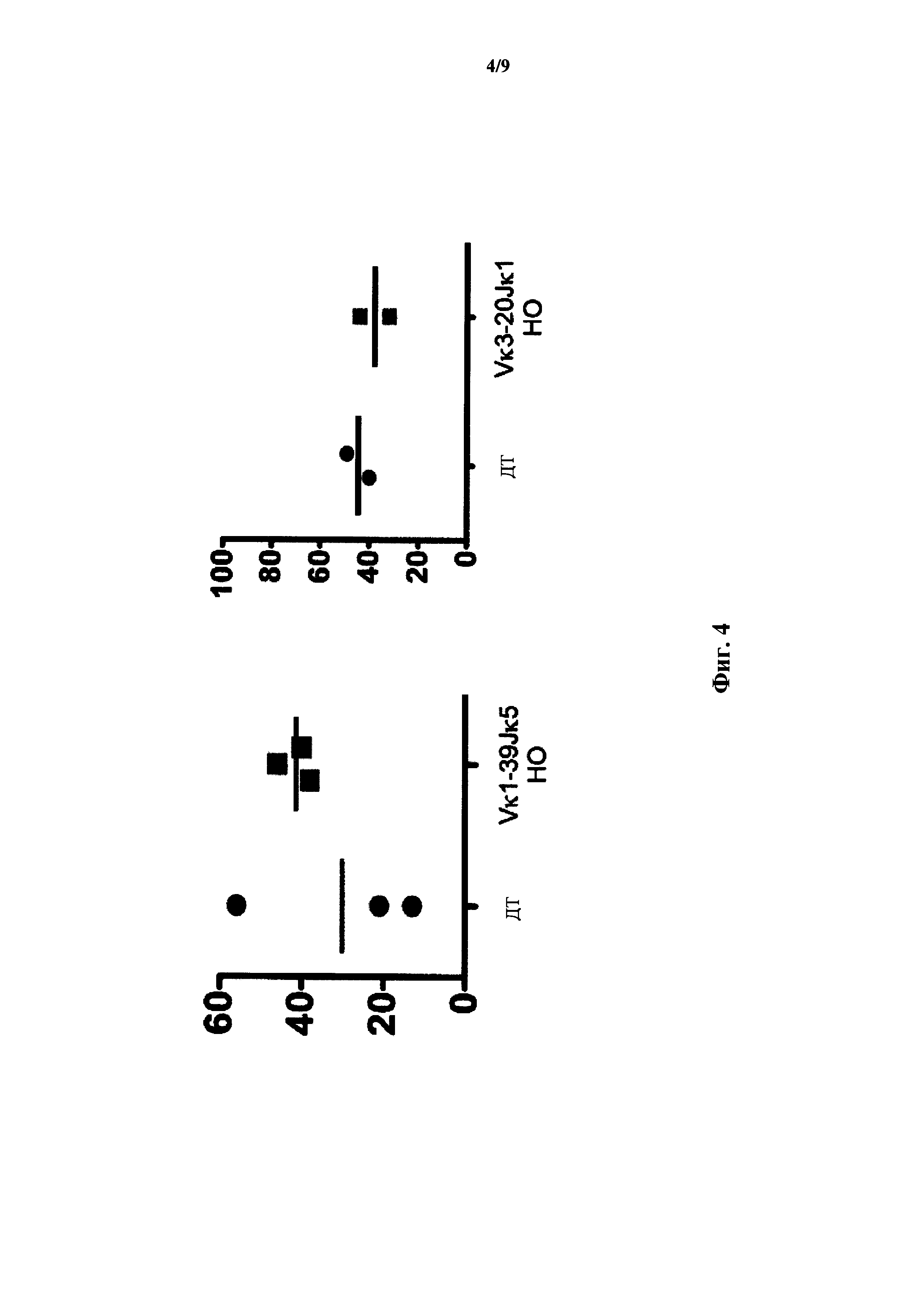
На фиг.4 показан процент CD19+ В-клеток (ось y) из периферической крови для мышей дикого типа (ДТ), мышей, гомозиготных по сконструированному участку (Vκ1-39Jκ5 НО) перестроенной легкой последовательности Vκ1-39Jκ5 человека, и мышей, гомозиготных по сконструированному участку (Vκ3-2Jκ1 НО) перестроенной легкой цепи Vκ3-20Jκ1 человека.
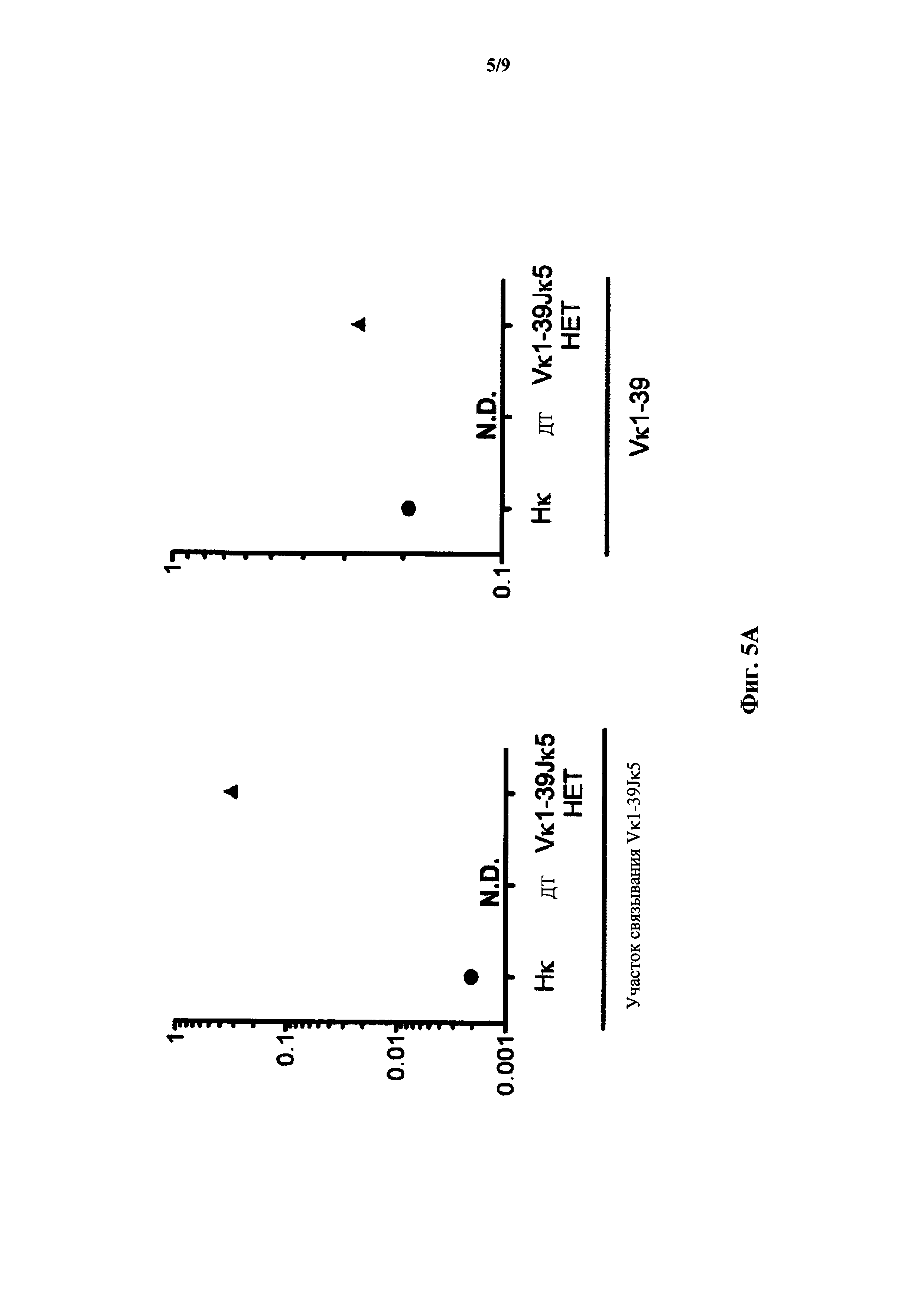
На фиг.5А показана относительная экспрессия мРНК (ось y) полученной от Vκ1-39 легкой цепи по результатам количественного ПЦР-анализа с применением зондов, специфичных к участку связыванию со сконструированным участком (зонд связывания с Vκ1-39Jκ5) перестроенной легкой цепи Vκ1-39Jκ5 человека и генного сегмента Vκ1-39 (зонд Vκ1-39) человека у мыши, гомозиготной по замене эндогенных генных сегментов Vκ и Jκ на генные сегменты (Нκ) Vκ и Jκ человека, у мыши дикого типа (ДТ) и мыши, гетерозиготной по сконструированному участку (Vκ1-39Jκ5 НЕТ) перестроенной легкой цепи Vκ1-39Jκ5 человека. Сигналы нормализованы по экспрессии Сκ мыши. N.D.: не выявлено.
На фиг.5В показана относительная экспрессия мРНК (ось y) полученной от Vκ1-39 легкой цепи по результатам количественного ПЦР-анализа с применением зондов, специфичных к участку связывания со сконструированным участком (зонд связывания с Vκ1-39Jκ5) перестроенной легкой цепи Vκ1-39Jκ5 человека и генного сегмента Vκ1-39 (зонд Vκ1-39) человека у мыши, гомозиготной по замене эндогенных генных сегментов Vκ и Jκ на генные сегменты (Нκ) Vκ и Jκ человека, у мыши дикого типа (ДТ) и мыши, гомозиготной по сконструированному участку (Vκ1-39Jκ5 НО) перестроенной легкой цепи Vκ1-39Jκ5 человека. Сигналы нормализованы по экспрессии Сκ мыши.
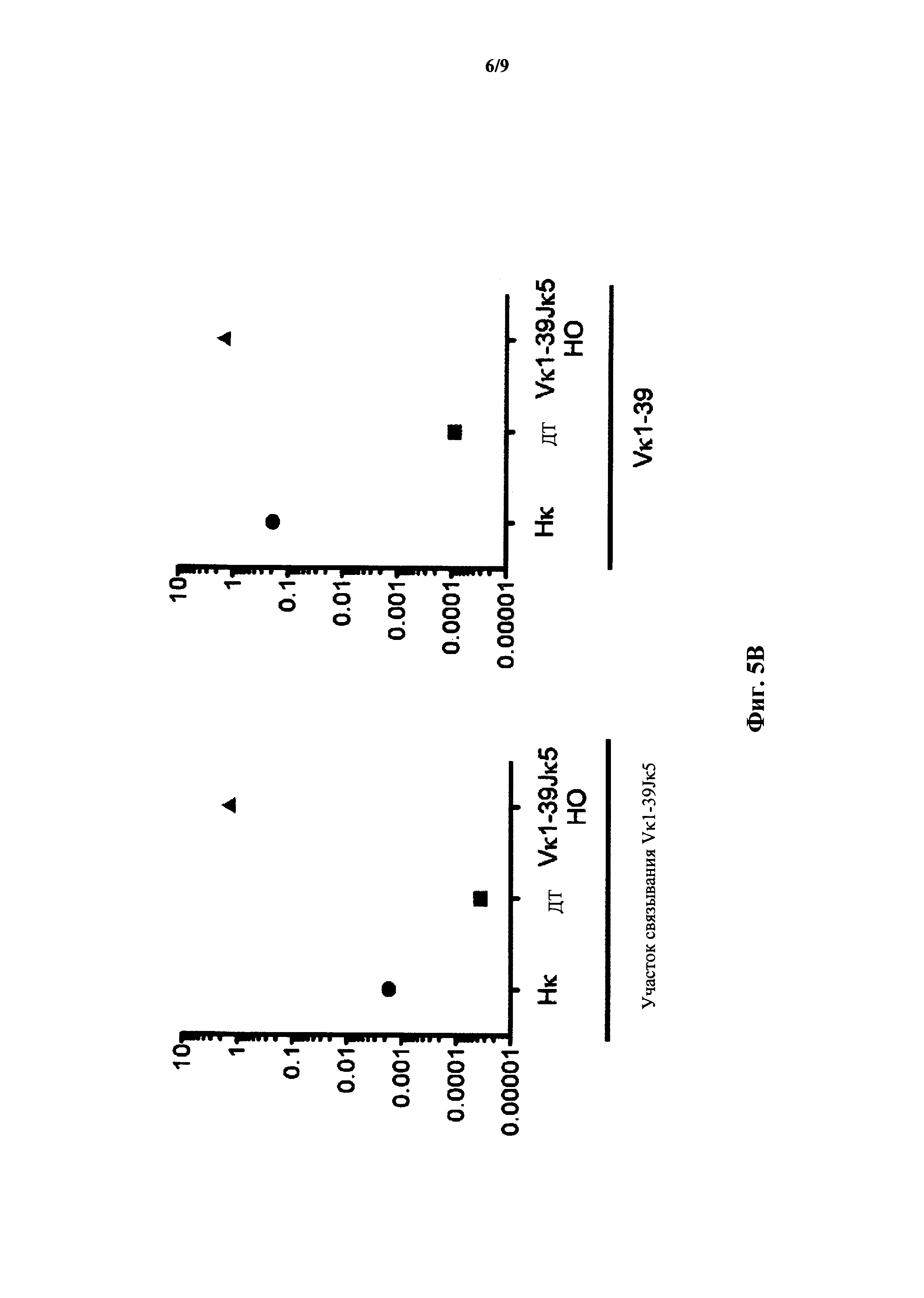
На фиг.5С показана относительная экспрессия мРНК (ось y) полученной от Vκ3-20 легкой цепи по результатам количественного ПЦР-анализа с применением зондов, специфичных к участку связывания со сконструированным участком (зонд связывания с Vκ1-39Jκ1) перестроенной легкой цепи Vκ3-2Jκ1 человека и генного сегмента Vκ3-20 (зонд Vκ3-20) человека у мыши, гомозиготной по замене эндогенных генных сегментов Vκ и Jκ на генные сегменты (Нκ) Vκ и Jκ человека, у мыши дикого типа (ДТ) и мыши, гетерозиготной (НЕТ) и гомозиготной (НО) по сконструированному участку перестроенной легкой цепи Vκ3-2Jκ1 человека. Сигналы нормализованы по экспрессии Сκ мыши.
На фиг.6А показан титр IgM (слева) и IgG (справа) для дикого типа (ДТ; N=2) и мышей, гомозиготных по сконструированному участку перестроенной легкой цепи Vκ1-39Jκ5 человека (Vκ1-39Jκ5 НО; N=2) и иммунизированных β-галоксидазой.
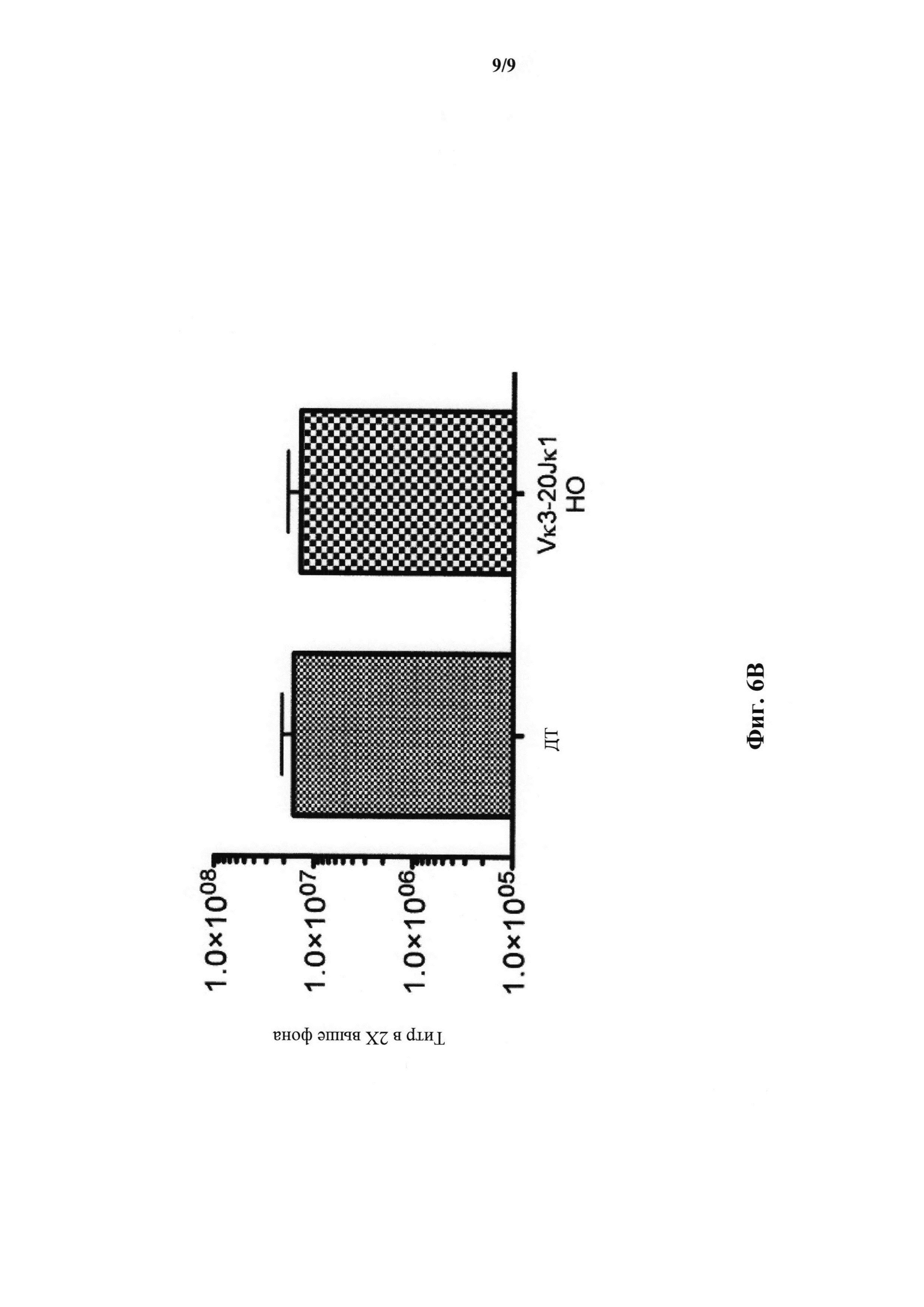
На фиг.6В показан титр общего иммуноглобулина (IgM, IgG, IgA) для дикого типа (ДТ; N=5) и мышей, гомозиготных по сконструированному участку перестроенной легкой цепи Vκ3-2Jκ1 человека (Vκ3-2Jκ1 НО; N=5) и иммунизированных β-галоксидазой.
Подробное раскрытие настоящего изобретения
Настоящее изобретение не ограничивается конкретными способами и описанными экспериментальными условиями, в связи с этим способы и условия могут варьировать. Также следует понимать, что используемая в настоящем документе терминология предназначена с целью описания конкретных вариантов осуществления и не подразумевается как ограничивающая, поскольку объем настоящего изобретения определяется формулой изобретения.
Если не указано иное, все применяемые в настоящем документе термины и фразы включают значения, которые термины и фразы получили в данной области техники, если явно не упоминается иное или явно не очевидно из контекста, в котором используется термин или фраза. Несмотря на то, что при практическом осуществлении или на этапе тестирования настоящего изобретения способы и материалы могут быть использованы сходные или эквивалентные описываемым в настоящем документе, теперь будут описаны конкретные способы и материалы. Все упомянутые публикации, таким образом, включены в настоящий документ с помощью ссылки.
Применяемый в настоящем документе термин ʺантителоʺ включает иммуноглобулиновые молекулы, содержащие четыре полипептидные цепи, две тяжелые цепи (Н) и две легкие цепи (L), связанные между собой дисульфидными связями. Каждая тяжелая цепь содержит вариабельный участок (VH) тяжелой цепи и константный участок (СН) тяжелой цепи. Константный участок тяжелой цепи содержит три домена, СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельный участок (VL) легкой цепи и константный участок (CL) легкой цепи. Участки VH и VL могут быть дополнительно подразделены на участки гипервариабельности, так называемые определяющие комплементарность участки (CDR), чередующиеся с участками, которые более консервативные, называемые каркасными участками (FR). Каждый VH и VL содержит три CDR и четыре FR, расположенные от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (CDR тяжелой цепи могут быть сокращены как HCDR1, HCDR2 и HCDR3; CDR легкой цепи могут быть сокращены как LCDR1, LCDR2 и LCDR3). Термин ʺвысокоаффинноеʺ антитело относится к антителу, которое характеризуется KD по отношению к его целевому эпитопу, составляющей приблизительно 10-9 М или ниже (например, приблизительно 1×10-9 М, 1×10-10 М, 1×10-11 М или приблизительно 1×10-12 М). В соответствии с одним вариантом осуществления KD измеряют при помощи поверхностного плазменного резонанса, например, BIACORE™; в соответствии с другим вариантом осуществления KD измеряют при помощи ELISA.
Фраза ʺбиспецифическое антителоʺ включает антитело, способное избирательно связывать два или более эпитопов. Биспецифические антитела обычно содержат две неидентичные тяжелые цепи, причем каждая тяжелая цепь специфично связывает отличный эпитоп - любой на двух различных молекулах (например различные эпитопы на двух различных иммуногенах), либо на одной молекуле (например, различные эпитопы на одном иммуногене). Если биспецифическое антитело способно выборочно связываться с двумя различными эпитопами (первый эпитоп и второй эпитоп), аффинность первой тяжелой цепи κ первому эпитопу обычно будет по меньшей мере на один-два или три, или четыре, или более порядков ниже, чем аффинность первой тяжелой цепи ко второму эпитопу, и наоборот. Специфично связываемые биспецифическим антителом эпитопы могут находиться на одной или на различных мишенях (например, на одном белке или различных белках). Биспецифические антитела могут быть получены, например, путем объединения тяжелых цепей, которые распознают различные эпитопы одного иммуногена. Например, последовательности нуклеиновой кислоты, кодирующие вариабельные последовательности тяжелой цепи, которые распознают различные эпитопы одного иммуногена, могут быть гибридизированы с последовательностями нуклеиновой кислоты, кодирующими те же или другие константные участки тяжелой цепи, и такие последовательности могут быть экспрессированы в клетке, которая экспрессирует иммуноглобулиновую легкую цепь. Типичное биспецифическое антитело имеет две тяжелые цепи, каждая из которых имеет три CDR тяжелой цепи, за которыми следуют (от N-конца к С-концу) домен СН1, шарнир, домен СН2 и домен СН3, и иммуноглобулиновую легкую цепь, которая либо не придает эпитоп-связывающую специфичность, но которая может связываться с каждой тяжелой цепью, либо которая может связываться с каждой тяжелой цепью и которая может связывать один или несколько эпитопов, связываемых эпитоп-связывающими участками тяжелой цепи, либо которая может связываться с каждой тяжелой цепью и делает возможным связывание или одной, или обеих тяжелых цепей с одним или обоими эпитопами.
Термин ʺклеткаʺ включает любую клетку, которая подходит для экспрессии рекомбинантной последовательности нуклеиновой кислоты. Клетки включают клетки прокариот и эукариот (одноклеточных или многоклеточных), бактериальные клетки (например, штаммы Е.coli, Bacillus spp., Streptomyces spp. и т.д.), микробактериальные клетки, грибные клетки, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусом клетки насекомых, Trichoplusia ni и т.д.), клетки животных, за исключением человека, человеческие клетки или гибриды клеток, такие как, например, гибридомы или квадрогибридомы. В соответствии с некоторыми вариантами осуществления клетка является клеткой человека, мартышки, примата, хомяка, крысы или мыши. В соответствии с некоторыми вариантами осуществления клетка является эукариотической, и ее выбирают из следующих клеток: СНО (например, СНО K1, DXB-11 СНО, Veggie-CHO), COS (например, COS-7), клетки сетчатки, Vero, CV1, почки (например, НЕК293, 293 EBNA, MSR 293, MDCK, HaK, ВНК), HeLa, HepG2, WI38, MRC 5, Colo205, HB 8065, HL-60, (например, ВНК21), Juncat, Daudi, A431 (эпидермальной), CV-1, U937, 3Т3, клетки L, клетки С127, SP2/0, NS-0, MMT 060562, клетки Сертоли, клетки BRL ЗА, клетки НТ1080, миеломной клетки, опухолевой клетки и линии клеток, полученной от упомянутой выше клетки. В соответствии с некоторыми вариантами осуществления клетка содержит один или несколько вирусных генов, например, клетка сетчатки, которая экспрессирует вирусный ген (например, клетка PER.C6™).
Фраза ʺопределяющий комплементарность участокʺ или термин ʺCDRʺ включает аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты иммуноглобулиновых генов организма, которая в норме (т.е. у животного дикого типа) находится между двумя каркасными участками в вариабельном участке легкой или тяжелой цепи иммуноглобулиновой молекулы (например, антитела или Т-клеточного рецептора). CDR может кодироваться, например, последовательностью зародышевой линии или перестроенной или неперестроенной последовательностью и, например, наивной или зрелой В-клеткой или Т-клеткой. CDR может быть подвергнут соматической мутации (например, отличаться от последовательности, закодированной в зародышевой линии животного), гуманизирован и/или модифицирован аминокислотными заменами, вставками или делециями. При некоторых обстоятельствах (например, для CDR3) CDR могут кодироваться двумя или более последовательностями (например, последовательностями зародышевой линии), которые не являются смежными (например, в неперестроенной последовательности нуклеиновой кислоты), но являются смежными в последовательности нуклеиновой кислоты В-клетки, например, в результате сплайсинга или соединения последовательностей (например, рекомбинация V-D-J с образованием CDR3 тяжелой цепи).
Термин ʺконсервативныйʺ, при использовании для описания консервативной замены аминокислоты, включает замену аминокислотного остатка другим аминокислотным остатком с R-группой боковой цепи со сходными химическими свойствами (например, заряд или гидрофобность). В целом, консервативная замена аминокислоты не будет практически изменять представляющие интерес функциональные свойства белка, например способность вариабельного участка специфично связывать целевой эпитоп с требуемой аффинностью. Примеры групп аминокислот, которые имеют боковые цепи со сходными химическими свойствами, включают алифатические боковые цепи, такие как глицин, аланин, валин, лейцин и изолейцин; алифатически-гидроксильные боковые цепи, такие как серии и треонин; амид-содержащие боковые цепи, такие как аспарагин и глутамин; ароматические боковые цепи, такие как фенилаланин, тирозин и триптофан; основные боковые цепи, такие как лизин, аргинин и гистидин; кислотные боковые цепи, такие как аспарагиновая кислота и глутаминовая кислота; и серосодержащие боковые цепи, такие как цистеин и метионин. Группы консервативных замен аминокислот включают, например, валин/лейцин/изолейцин, фенилаланин/тирозин, лизин/аргинин, аланин/валин, глутамат/аспартат и аспарагин/глютамин. В соответствии с некоторыми вариантами осуществления консервативная замена аминокислот может быть заменой любого интактного остатка в белке на аланин, который используется, например, в сканирующем аланином мутагенезе. В соответствии с некоторыми вариантами осуществления консервативную замену осуществляют так, чтобы она имела положительное значение в матрице логарифмического правдоподобия РАМ250, раскрытой в работе Gonnet et. al. (1992) Exhaustive Matching of the Entire Protein Sequence Database, Science 256: 1443-45, включенной, таким образом, при помощи ссылки. В соответствии с некоторыми вариантами осуществления замена является умеренно консервативной заменой, причем замена имеет неотрицательное значение в матрице логарифмического правдоподобия РАМ250.
В соответствии с некоторыми вариантами осуществления положения остатков в иммуноглобулиновой легкой цепи или тяжелой цепи отличаются по одной или нескольким консервативным заменам аминокислот. В соответствии с некоторыми вариантами осуществления положения остатков в иммуноглобулиновой легкой цепи, или тяжелой цепи, или их функциональных фрагментах (например, фрагмент, который делает возможной экспрессию и секрецию из, например, В-клетки) не идентичны легкой цепи, аминокислотная последовательность которой приведена в настоящем документе, но отличается одной или нескольким консервативными заменами аминокислот.
Фраза ʺэпитоп-связывающий белокʺ включает белок по меньшей мере с одним CDR и, который способен избирательно распознавать эпитоп, например, способен связывать эпитоп с KD, которая является приблизительно одномикромолярной или менее (например, KD, которая составляет приблизительно 1×10-6 М, 1×10-7 М, 1×10-9 М, 1×10-9 М, 1×10-10 М, 1×10-11 М или приблизительно 1×10-12 М). Терапевтические эпитоп-связывающие белки (например, терапевтические антитела) зачастую нуждаются в KD, которая находится в наномолярном или пикомолярном диапазоне.
Фраза ʺфункциональный фрагментʺ включает фрагменты эпитоп-связывающих белков, которые могут экспрессироваться, секретироваться и специфично связываться с эпитопом с KD в микромолярном, наномолярном или пикомолярном диапазоне. Специфичное распознавание включает наличие KD, которая находится по меньшей мере в микромолярном диапазоне, наномолярном диапазоне или пикомолярном диапазоне.
Термин ʺзародышевая линияʺ включает отсылку к кодирующей иммуноглобулин последовательности нуклеиновой кислоты в не подвергнутой соматической мутации клетке, например, не подвергнутой соматической мутации В-клетке, или предшественнике В-клетки, или гемопоэтической клетке.
Фраза ʺтяжелая цепьʺ или ʺиммуноглобулиновая тяжелая цепьʺ включает последовательность константного участка иммуноглобулиновой тяжелой цепи из любого организма. Вариабельные домены тяжелой цепи включают три CDR тяжелой цепи и четыре FR-участка, если не указано иное. Фрагменты тяжелых цепей включают CDR, CDR и FR и их комбинации. Типичная тяжелая цепь имеет после вариабельного домена (от N-конца к С-концу) домен СН1, шарнир, домен СН2 и домен СН3. Функциональный фрагмент тяжелой цепи включает фрагмент, который способен специфично распознавать эпитоп (например, распознавать эпитоп с KD в микромолярном, наномолярном или пикомолярном диапазоне), который способен экспрессироваться и секретироваться из клетки и который содержит по меньшей мере один CDR.
Термин ʺидентичностьʺ при использовании в сочетании с последовательностью включает идентичность, определенную при помощи ряда известных в данной области техники различных алгоритмов, которые могут быть использованы для измерения идентичности нуклеотидной и/или аминокислотной последовательности. В соответствии с некоторыми описанными в настоящем документе вариантами осуществления идентичности определяют при помощи выравнивания ClustalW v.1.83 (медленного) с использованием штрафа за открытие гэпа 10,0, штрафа за продолжение гэпа 0,1 и с применением матрицы подобия Gonnet (MACVECTOR™ 10.0.2, Mac Vector Inc., 2008). Отрезок последовательностей, сравниваемый в отношении идентичности последовательностей, будет зависеть от конкретных последовательностей, но в случае константного домена легкой цепи отрезок должен содержать последовательность достаточной длины для сворачивания в константный домен легкой цепи, который может самостоятельно связываться с образованием традиционного константного домена легкой цепи, например, может образовывать две бета складки, содержащие бета тяжи, и может взаимодействовать по меньшей мере с одним доменом СН1 человека или мыши. В случае домена СН1 отрезок последовательности должен содержать последовательность достаточной длины для сворачивания в домен СН1, который может образовывать две бета складки, содержащие бета тяжи, и может взаимодействовать по меньшей мере с одним константным доменом легкой цепи мыши или человека.
Фраза ʺиммуноглобулиновая молекулаʺ включает две иммуноглобулиновые тяжелые цепи и две иммуноглобулиновые легкие цепи. Тяжелые цепи могут быть идентичными или различными, и легкие цепи могут быть идентичными или различными.
Фраза ʺлегкая цепьʺ включает последовательность иммуноглобулиновой легкой цепи из любого организма и, если не указано иное, включает легкие цепи κ и λ человека и VpreB, а также суррогатные легкие цепи. Вариабельные домены (VL) легкой цепи обычно включают три CDR легкой цепи и четыре каркасных участка (FR), если не указано иное. Обычно легкая цепь полной длины включает, от амино-конца к карбокси-концу, домен VL, который включает FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, и константный домен легкой цепи. Легкие цепи включат цепи, например, которые избирательно не связывают либо первый, либо второй эпитоп, избирательно связываемый эпитоп-связывающим белком, в котором они присутствуют. Легкие цепи также включают цепи, которые связывают и распознают, или способствуют связыванию и распознаванию тяжелой цепью, один или несколько эпитопов, избирательно связываемых эпитоп-связывающим белком, в котором они присутствуют. Общими легкими цепями являются цепи, которые получены от перестроенной последовательности Vκ1-39Jκ5 человека или перестроенной последовательности Vκ3-20Jκ1 человека, и включают подвергнутые соматической мутации (например, с созревшей аффинностью) версии.
Фраза ʺмикромолярный диапазонʺ предназначена для обозначения 1-999 микромолярного диапазона; фраза ʺнаномолярный диапазонʺ предназначена для обозначения 1-999 наномолярного диапазона; фраза ʺпикомолярный диапазонʺ предназначена для обозначения 1-999 пикомолярного диапазона.
Фраза ʺподвергнутый соматической мутацииʺ включает отсылку к последовательности нуклеиновой кислоты из В-клетки, у которой произошло переключение классов, причем последовательность нуклеиновой кислоты иммуноглобулинового вариабельного участка (например, вариабельного домена тяжелой цепи или, в том числе, последовательности CDR или FR тяжелой цепи) у В-клетки с переключенным классом не идентична последовательности нуклеиновой кислоты у В-клетки до переключения классов, как, например, различие последовательности нуклеиновой кислоты CDR или каркасного участка между В-клеткой, у которой не произошло переключение классов, и В-клеткой, у которой произошло переключение классов. ʺПодвергнутый соматической мутацииʺ включает отсылку к последовательностям нуклеиновой кислоты от В-клеток со зрелой аффинностью, которые не идентичны соответствующим последовательностям иммуноглобулиновых вариабельных участков у В-клеток, которые не характеризуются зрелой аффинностью (т.е. последовательностям в геноме клеток зародышевой линии). Фраза ʺподвергнутый соматической мутацииʺ также включает отсылку к последовательности нуклеиновой кислоты иммуноглобулинового вариабельного участка от В-клетки после воздействия на В-клетку представляющим интерес эпитопом, причем последовательность нуклеиновой кислоты отличается от соответствующей последовательности нуклеиновой кислоты до воздействия на В-клетку представляющим интерес эпитопом. Фраза ʺподвергнутый соматической мутацииʺ относится к последовательностям антител, которые были образованы у животного, например, мыши с последовательностями нуклеиновой кислоты вариабельного участка иммуноглобулина человека, в ответ на иммуногенный стимул и которые являются следствием процессов отбора, наследственно протекающих в таком животном.
Термин ʺнеперестроенныйʺ по отношению к последовательности нуклеиновой кислоты охватывает последовательности нуклеиновой кислоты, которые существуют у зародышевой линии животной клетки.
Фраза ʺвариабельный доменʺ охватывает аминокислотную последовательность иммуноглобулиновой легкой или тяжелой цепи (модифицированной, при необходимости), которая содержит следующие аминокислотные участки в последовательности от N-конца к С-концу (если не указано иное): FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Общая легкая цепь
Предварительные попытки получения подходящих мультиспецифических эпитоп-связывающих белков, например биспецифических антител, осложнялись рядом трудностей, которые часто имеют общую парадигму: in vitro отбор или манипуляция с последовательностями для рационального конструирования или для конструирования посредством метода проб и ошибок подходящего формата для парной структуры гетеродимерного биспецифического иммуноглобулина человека. К сожалению, большинство, если не все, подходы по конструированию in vitro обеспечивают, преимущественно, ad hoc исправления, которые подходят, если вовсе подходят, для отдельных молекул. С другой стороны, способы in vivo использования сложных организмов для отбора подходящих парных структур, которые могут подтолкнуть к созданию терапевтических средств для человека, не были реализованы.
В целом, нативные мышиные последовательности зачастую не являются хорошим источником для последовательностей терапевтических средств для человека. По меньшей мере по этой причине создание иммуноглобулиновых вариабельных участков тяжелой цепи мыши, которые образуют пару с общей легкой цепью человека, имеет ограниченную практическую ценность. По методу проб и ошибок может быть затрачено больше попыток по конструированию in vitro с тем, чтобы попытаться гуманизировать вариабельные последовательности тяжелой цепи мыши, в то же время надеясь сохранить специфичность и аффинность эпитопа, одновременно сохраняя способность образовывать пару с общей легкой цепью человека, с неопределенным результатом. В конце такого способа конечный продукт может сохранять некоторую специфичность и аффинность и связываться с общей легкой цепью, но в перспективе будет, вероятно, сохраняться высокий риск иммуногенности для человека.
Таким образом, подходящая мышь для получения терапевтических средств для человека могла бы включать подходящий большой репертуар генных сегментов вариабельного участка тяжелой цепи человека вместо эндогенных генных сегментов вариабельного участка тяжелой цепи человека. Генные сегменты вариабельного участка тяжелой цепи человека должны быть способны перестраиваться и рекомбинировать с эндогенным константным доменом тяжелой цепи мыши с образованием реверсивной химерной тяжелой цепи (т.е. тяжелой цепи, содержащей человеческий вариабельный домен и мышиный константный участок). Тяжелая цепь должна быть способна к переключению класса и соматической гипермутации с тем, чтобы мыше был доступен соответственно большой репертуар вариабельных доменов тяжелой цепи для отбора одного, который может связываться с ограниченным репертуаром вариабельных участков легкой цепи человека.
Мышь, у которой происходит отбор общей легкой цепи для множества тяжелых цепей, обладает практической ценностью. В соответствии с различными вариантами осуществления антитела, которые экспрессируются в мыше, которая может экспрессировать только общую легкую цепь, будут иметь тяжелые цепи, которые могут связываться и экспрессироваться с идентичной или практически идентичной легкой цепью. Это особенно полезно при получении биспецифических антител. Например, такая мышь может быть иммунизована первым иммуногеном для получения В-клетки, которая экспрессирует специфично связывающее первый эпитоп антитело. Например, мышь (или генетически сходная мышь) может быть иммунизована вторым иммуногеном для получения В-клетки, которая экспрессирует специфично связывающее второй эпитоп антитело. Вариабельные участки тяжелых цепей могут быть клонированы из В-клеток, и они экспрессируются с тем же константным участком тяжелой цепи и той же легкой цепью, и экспрессированы В-клетке с получением биспецифического антитела, причем компонент легкой цепи биспецифического антитела был отобран мышью для связывания и экспрессии с компонентом легкой цепи.
Авторы сконструировали мышь для получения иммуноглобулиновых легких цепей, которые будут соответственно создавать пару с достаточно отличающимся семейством тяжелых цепей, включающим тяжелые цепи, вариабельные участки которых отклоняются от последовательностей зародышевой линии, например, вариабельные участки с созревшей аффинностью или подвергнутые соматической мутации. В соответствии с различивши вариантами осуществления мышь задумана для создания пары вариабельных доменов легкой цепи человека и вариабельных доменов тяжелой цепи человека, которые содержат соматические мутации, таким образом делая возможным существование пути получения высокоаффинных связывающих белков, пригодных для применения в качестве терапевтических средств для человека.
Генетически сконструированная мышь в результате длительного и сложного процесса отбора антитела внутри организма производит биологически подходящие отборы при создании пар разнообразной коллекции вариабельных доменов тяжелой цепи человека с ограниченным числом вариантов легкой цепи человека. Для успешного осуществления поставленной цели мышь конструируют так, чтобы она имела ограниченное количество вариантов вариабельного домена легкой цепи человека в сочетании с широким разнообразием вариантов вариабельного домена тяжелой цепи человека. При стимуляции иммуногеном мышь максимизирует количество решений в своем репертуаре для разработки антитела к иммуногену, ограниченное, большей частью или исключительно, числом вариантов легких цепей в ее репертуаре. В соответствии с различными вариантами осуществления это предусматривает предоставление мыше возможности осуществления подходящих и совместимых соматических мутаций вариабельного домена легкой цепи, которые, тем не менее, будут совместимы с относительно большим разнообразием вариабельных доменов тяжелой цепи человека, в том числе, в частности, с подвергнутыми соматической мутации вариабельными доменами тяжелой цепи человека.
Для получения ограниченного репертуара вариантов легкой цепи мышь конструируют так, чтобы сделать ее способность создавать или перестраивать нативный вариабельный домен легкой цепи мыши нефункциональной или практически нефункциональной. Это может быть достигнуто, например, путем удаления генных сегментов вариабельного участка легкой цепи мыши. Эндогенные локусы мыши затем могут быть модифицированы при помощи предпочтительного подходящего экзогенного генного сегмента вариабельного участка легкой цепи, функционально связанного с эндогенным константным доменом легкой цепи мыши таким образом, чтобы экзогенные генные сегменты вариабельного участка человека могли комбинироваться с эндогенным геном константного участка легкой цепи мыши и образовывать ген перестроенной реверсивной химерной легкой цепи (с вариабельным участком человека и константным участком мыши). В соответствии с различными вариантами осуществления вариабельный участок легкой цепи может быть подвергнут соматической мутации. В соответствии с различными вариантами осуществления для минимизации способности вариабельного участка легкой цепи подвергаться соматическим мутациям у мыши сохраняют соответствующий энхансер(ы). Например, при модификации локуса легкой цепи κ мыши с целью замены эндогенных генных сегментов легкой цепи κ мыши на генные сегменты легкой цепи κ человека интронный энхансер κ мыши и энхансер 3' κ мыши сохраняют функциональными или неразрушенными.
Настоящее изобретение относится к генетически сконструированной мыши, у которой экспрессируется ограниченный репертуар реверсивных химерных (с вариабельным участком человека и константным участком мыши) легких цепей, связанных с разнообразными реверсивными химерными (с вариабельным участком человека и константным участком мыши) тяжелыми цепями. В соответствии с различными вариантами осуществления эндогенные генные сегменты легкой цепи κ мыши удаляют и замещают одним участком (или двумя участками) перестроенной легкой цепи человека, функционально связанным с эндогенным геном Сκ мыши. В соответствии с вариантами осуществления для максимизации соматической гипермутации участка перестроенной легкой цепи человека сохраняют интронный энхансер κ мыши и энхансер 3' κ мыши. В соответствии с различными вариантами осуществления мышь также содержит нефункциональный локус легкой цепи λ, или его делецию, или делецию, которая делает локус не способным создать легкую цепь λ.
Настоящее изобретение относится к генетически сконструрованной мыши, которая, в соответствии с различными вариантами осуществления, содержит локус вариабельного участка легкой цепи, причем не содержит эндогенные генные сегменты VL и JL легкой цепи мыши и содержит перестроенный вариабельный участок легкой цепи человека, в соответствии с одним вариантом осуществления перестроенная последовательность VL/JL человека, функционально связана с константным участком мыши, причем локус может подвергаться соматической гипермутации, и причем локус экспрессирует легкую цепь, содержащую последовательность VL/JL человека, связанную с константным участком мыши. Таким образом, в соответствии с различными вариантами осуществления локус содержит энхансер 3' κ мыши, который коррелирует с нормальным, или дикого типа, уровнем соматической гипермутации.
Генетически сконструированная мышь в соответствии с различными вариантами осуществления при иммунизации представляющим интерес антигеном образует В-клетки, которые демонстрируют многообразие перестроек вариабельных участков тяжелой цепи иммуноглобулина человека, которые экспрессируются и функционируют с одной или с двумя перестроенными легкими цепями, в том числе варианты осуществления, в соответствии с которыми одна или две легкие цепи содержат вариабельные участки легкой цепи человека, которые содержат, например, от 1 до 5 соматических мутаций. В соответствии с различными вариантами осуществления экспрессированные таким образом легкие цепи человека могут связываться и экспрессироваться с любым экспрессируемым в мыше вариабельным участком тяжелой цепи иммуноглобулина человека.
Эпитоп-связывающие белки, связывающие несколько эпитопов.
Описанные в настоящем изобретении композиции и способы могут быть использованы для получения связывающих белков, которые связывают несколько эпитопов с высоким уровнем аффинности, например, биспецифических антител. Преимущества настоящего изобретения включают способность отбирать подходящие, с высокой связывающей способностью (например, с созревшей аффинностью) иммуноглобулиновые цепи тяжелых цепей, каждая из которых будет связываться с отдельной легкой цепью.
Синтез и экспрессия биспецифических связывающих белков были проблематичны, отчасти, в связи с трудностями, связанными с определением подходящей легкой цепи, которая может связываться и экспрессироваться с двумя различными тяжелыми цепями, и, отчасти, в связи с трудностями выделения. Описываемые в настоящем документе способы и композиции предусматривают генетически модифицированную мышь для отбора, посредством отличных от естественных процессов, подходящей легкой цепи, которая может связываться и экспрессироваться с несколькими тяжелыми цепями, включая тяжелые цепи, которые подвергнуты соматической мутации (например, со зрелой аффинностью). Последовательности VL и VH человека из подходящих В-клеток иммунизированных описываемых в настоящем документе мышей, у которых экспрессируются антитела со зрелой аффинностью, обладающие реверсивными химерными тяжелыми цепями (т.е. с вариабельным участком человека и константным участком мыши) могут быть определены и клонированы в рамке вектора экспрессии с подходящей генной последовательностью константного участка человека (например, IgG1 человека). Могут быть получены два таких конструкта, причем каждый конструкт кодирует вариабельный домен тяжелой цепи человека, который связывает отличный эпитоп. Один VLs человека (например, Vκ1-39Jκ5 человека или Vκ3-2Jκ1 человека) в последовательности зародышевой линии или из В-клетки, причем последовательность подверглась соматической мутации, может быть слит в рамке с подходящим геном константного участка человека (например, константным геном κ человека). Такие три конструкта полностью человеческих тяжелых или легких цепей могут быть размещены в подходящей для экспрессии клетке. Клетка будет экспрессировать два основных вида: гомодимерную тяжелую цепь с идентичной легкой цепью и гетеродимерную тяжелую цепь с идентичной легкой цепью. Для обеспечения легкого разделения таких основных видов одну из тяжелых цепей модифицируют с опущением связывающейся с белком А детерминанты, получая в результате аффинность гомодимерного связывающего белка, отличную от гетеродимерного связывающего белка. Композиции и способы, которые направлены на решение этой проблемы, описаны в USSN 12/832838, поданной 25 июня 2010 года, под заголовком ʺReadily Isolated Bispecific Antibodies with Native Immunoglobulin Format,ʺ опубликованной как US 2010/0331527 А1, таким образом, включенной в настоящий документ при помощи ссылки.
В соответствии с одним аспектом настоящее изобретение относится к описываемому в настоящем документе эпитоп-связывающему белку, причем последовательности VL и VH человека получают от описываемых в настоящем документе мышей, которые были иммунизированы антигеном, содержащим представляющий интерес эпитоп.
В соответствии с одним вариантом осуществления настоящее изобретение относится к эпитоп-связывающему белку, который содержит первый и второй полипептид, причем первый полипептид содержит от N-конца к С-концу первый эпитоп-связывающий участок, который избирательно связывает первый эпитоп, за которым следует константный участок, который содержит первый участок СН3 человеческого IgG, выбранного из IgG1, IgG2, IgG4 и их комбинаций; и второй полипептид содержит от N-конца к С-концу второй эпитоп-связывающий участок, который избирательно связывает второй эпитоп, за которым следует константный участок, который содержит второй участок СН3 человеческого IgG, выбранного из IgG1, IgG2, IgG4 и их комбинации, причем второй участок СН3 содержит модификацию, которая уменьшает или предотвращает связывание второго домена СН3 с белком А.
В соответствии с одним вариантом осуществления второй участок СН3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R, по нумерации EU). В соответствии с другим вариантом осуществления второй участок СН3 дополнительно содержит модификацию Y96F (IMGT; Y436F по EU).
В соответствии с одним вариантом осуществления второй участок СН3 получен от модифицированного IgG1 человека и дополнительно содержит модификацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L358M, N384S, K392N, V397M и V422I по EU).
В соответствии с одним вариантом осуществления второй участок СН3 получен от модифицированного IgG2 человека и дополнительно содержит модификацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT; N384S, K392N и V422I по EU).
В соответствии с одним вариантом осуществления второй участок СН3 получен от модифицированного IgG4 человека и дополнительно содержит модификацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU).
Один способ получения эпитоп-связывающего белка, который связывает несколько эпитопов, предусматривает иммунизацию первой мыши по настоящему изобретению антигеном, который содержит первый представляющий интерес эпитоп, причем мышь содержит эндогенный локус вариабельного участка иммуноглобулиновой легкой цепи, который не содержит эндогенный VL мыши, который может перестраиваться и формировать легкую цепь, причем в эндогенном локусе вариабельного участка иммуноглобулиновой легкой цепи мыши есть отдельный перестроенный участок VL человека, функционально связанный с эндогенным геном константного участка легкой цепи мыши, и перестроенный участок VL человека выбирают из Vκ1-39Jκ5 человека и Vκ3-20Jκ1 человека, и эндогенные генные сегменты VH мыши были замены полностью или частично на генные сегменты VH человека так, чтобы иммуноглобулиновые тяжелые цепи, производимые мышью, представляли собой исключительно или практически тяжелые цепи, которые содержат вариабельные домены человека и константные домены мыши. При иммунизации такая мышь будет производить реверсивное химерное антитело, содержащее только один из двух вариабельных доменов легкой цепи человека (например, один из Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека). После выявления В-клетки, которая кодирует VH, связывающий представляющий интерес эпитоп, нуклеотидная последовательность VH (и, необязательно, VL) может быть восстановлена (например, при помощи ПЦР) и клонирована в конструкте экспрессии в рамке с последовательностью подходящего константного домена иммуноглобулина человека. Этот процесс может быть повторен для выявления второго домена VH, связывающего второй эпитоп, и вторая генная последовательность VH может быть восстановлена и клонирована в вектор экспрессии в рамке с последовательностью второго подходящего константного домена иммуноглобулина. Первый и второй иммуноглобулиновые константные домены могут иметь сходный или отличный изотип, и один из иммуноглобулиновых константных доменов (но не другой) может быть модифицирован как описано в настоящем документе или в патентном документе US 2010/0331527 А1, и эпитоп-связывающий белок может быть экспрессирован в подходящей клетке и выделен по его отличительной, по сравнению с гомодимерным эпитоп-связывающим белком, аффинности к белку А, например, как описано в патентном документе US 2010/0331527 А1.
В соответствии с одним вариантом осуществления настоящее изобретение относится к способу получения биспецифического эпитоп-связывающего белка, предусматривающему определение первой нуклеотидной последовательности VH человека (VH1) со зрелой аффинностью (например, содержащей одну или несколько соматических гипермутаций) у описываемой в настоящем документе мыши, определение второй нуклеотидной последовательности VH человека (VH2) со зрелой аффинностью (например, содержащей одну или несколько соматических гипермутаций) у описываемой в настоящем документе мыши, клонирование VH1 в рамке с тяжелой цепью человека без модификации детерминанты к белку А, как описано в US 2010/0331527 А1, для образования тяжелой цепи 1 (НС1), клонирование VH2 в рамке с тяжелой цепью человека, содержащей детерминанту к белку А, как описано в US 2010/0331527 А1, с образованием тяжелой цепи 2 (НС2), введение содержащего НС1 вектора экспрессии и такого же или другого содержащего НС2 вектора экспрессии В-клетку, причем клетка также экспрессирует легкую цепь иммуноглобулина человека, которая содержит человеческий Vκ1-39/человеческий Jκ5 или человеческий Vκ3-20/человеческий Jκ1, гибридизированный с константным доменом легкой цепи человека, предоставление клетке возможности экспрессии биспецифического эпитоп-связывающего белка, содержащего кодируемый VH1 домен VH и кодируемый VH2 домен VH, и выделение биспецифического эпитоп-связывающего белка по его отличительной, по сравнению с моноспецифическим гомодимерным эпитоп-связывающим белком, способности связывать белок А. В соответствии с конкретным вариантом осуществления НС1 является IgG1, a НС2 является IgG1, который содержит модификацию H95R (IMGT; H435R по EU) и дополнительно содержит модификацию Y96F (IMGT; Y436F по EU). В соответствии с одним вариантом осуществления кодируемый VH1 домен VH, кодируемый VH2 домен VH или как первый, так и второй подвергнуты соматической мутации.
Гены VH человека, которые экспрессируются с общим VL человека
Ряд вариабельных участков человека из антител со зрелой аффинностью, выработанных против четырех различных антигенов, экспрессировали либо с их когнатной легкой цепью, либо по меньшей мере с одной легкой цепью человека, выбранной из Vκ1-39Jκ5 человек, Vκ3-20Jκ1 человека или VpreBJλ5 человека (см. пример 1). Касательно антител к каждому из антигенов, подвергнутые соматической мутации высокоаффинные тяжелые цепи от различных генных семейств успешно образовывали пары с перестроенными участками Vκ1-39Jκ5 и Vκ3-20Jκ1 зародышевой линии человека и секретировались из клеток, экспрессирующих тяжелую и легкую цепи. Касательно доменов Vκ1-39Jκ5 и Vκ3-20Jκ1, хорошо экспрессировались домены VH, полученные от следующих генных семейств VH: 1-2, 1-8, 1-24, 25, 3-7, 3-9, 3-11,3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 4-31, 4-39, 4-59, 5-51 и 6-1. Таким образом, мышь, которая сконструирована для экспрессии ограниченного репертуара доменов VL человека с одной из Vκ1-39Jκ5 и Vκ3-20Jκ1 или с них обеих, будет давать разнообразную популяцию подвергнутых соматической мутации доменов VH человека с локуса VH, модифицированного с заменой генных сегментов VH мыши на генные сегменты VH человека.
Мыши, генетически сконструированные для экспрессии реверсивных химерных (с вариабельным участком человека и константным участком мыши) иммуноглобулиновых тяжелых цепей, связанных с отдельной перестроенной легкой цепью (например, Vκ1-39/J или Vκ3-20/J), при иммунизации представляющим интерес антигеном давали В-клетки, которые содержали многообразие перестроек VH человека и экспрессировали многообразие высокоаффинных антиген-специфичных антител с множеством свойств в отношении их способности блокировать связывание антигена с его лигандом и в отношении их способности связывать варианты антигена (см. примеры 5-10).
Таким образом, описываемые в настоящем документе мыши и способы пригодны при получении и отборе вариабельных доменов тяжелой цепи иммуноглобулина человека, в том числе подвергнутых соматической мутации вариабельных доменов тяжелой цепи иммуноглобулина человека, которые являются результатом множества перестроек и демонстрируют широкое разнообразие свойств аффинности (включая демонстрацию KD приблизительно наномолярного порядка или меньше), широкое разнообразие свойств специфичности (включая связывание с различными эпитопами одного антигена) и которые связываются или экспрессируются с одинаковым или практически одинаковым вариабельным участком легкой цепи иммуноглобулина человека.
Следующие примеры приведены для описания того, как специалистам в данной области техники создавать и применять способы и композиции по настоящему изобретению, и не предназначены для ограничения объема того, что авторы рассматривают в качестве настоящего изобретения. Были предприняты попытки обеспечения достоверности в отношении используемых числовых показателей (например, количества, температура и т.д.), но необходимо принимать в учет некоторые экспериментальные погрешности и отклонения. Если не указано иное, части являются частями по массе, молекулярная масса является средней молекулярной массой, температура указана по Цельсию, и давление является атмосферным или близким к атмосферному.
Примеры
Следующие примеры приведены для описания того, как создавать и применять способы и композиции по настоящему изобретению, и не предназначены для ограничения объема того, что авторы рассматривают в качестве настоящего изобретения. Если не указано иное, температура указана по Цельсию, и давление является атмосферным или близким к атмосферному.
Пример 1
Определение участков VH человека, которые связываются с отобранными участками VL человека
Систему экспрессии in vitro конструировали для определения того, может ли отдельная перестроенная легкая цепь зародышевой линии человека совместно экспрессироваться с тяжелыми цепями человека из антиген-специфических антител человека.
Известны способы получения антител человека у генетически модифицированных мышей (см., например, патентный документ US 6596541, Regeneron Pharmaceuticals, VELOCIMMUNE®). Технология VELOCIMMUNE® предусматривает получение генетически модифицированной мыши с геномом, содержащим гены вариабельных участков тяжелой и легкой цепей человека, функционально связанные с эндогенными локусами константного участка мыши, так, чтобы мышь в ответ на стимуляцию антигеном вырабатывала антитело, содержащее вариабельный участок человека и константный участок мыши. ДНК, кодирующая вариабельные участки тяжелой и легкой цепей антител, получаемых от мыши VELOCIMMUNE®, являются полностью человеческими. Сначала, выделяли высокоаффинные химерные антитела с вариабельным участком человека и константным участком мыши. Как описано ниже, антитела характеризовали и выбирали по требуемым характеристикам, в том числе аффинности, специфичности, эпитопу и т.д. Константный участок мыши заменяли требуемым константным участком человека с получением полностью человеческого антитела, содержащего отличный от IgM изотип, например, дикого типа или модифицированный IgG1, IgG2, IgG3 или IgG4. В то время как отобранный константный участок может различаться в зависимости от конкретного применения, за характеристики высокоаффинного связывания с антигеном и специфичности к мишени ответственен вариабельный участок.
Мышь VELOCIMMUNE® иммунизировали фактором роста, который стимулирует ангиогенез (антиген С), а антиген-специфичные антитела человека выделяли и секвенировали для использования гена V при помощи стандартных общепризнанных в данной области техники методик. Отобранные антитела клонировали в константные участки легкой цепи и тяжелой цепи человека, и 69 тяжелых цепей отбирали для создания пар с одной из трех легких цепей человека: (1) когнатная легкая цепь κ, соединенная с константным участком κ, (2) перестроенный Vκ1-39Jκ5 зародышевой линии человека, соединенный с константным участком κ человека, или (3) перестроенный Vκ3-20Jκ1 зародышевой линии человека, соединенный с константным участком κ человека. Каждую пару тяжелой цепи и легкой цепи совместно трансфицировали в клетки СНО-К1 с применением стандартных методик. Наличие антитела в супернатанте определяли с помощью антитела к IgG человека в анализе ELISA. Титр антитела (нг/мл) определяли для каждой пары тяжелая цепь/легкая цепь и титры с различными перестроенными легкими цепями зародышевой линии сравнивали с титрами, полученными с исходной молекулой антитела (т.е. тяжелой цепью, образовавшей пару с когнатной легкой цепью) и рассчитывали процент у титра нативной молекулы (таблица 1). VH: вариабельный ген тяжелой цепи. ND: отсутствие экспрессии, выявляемое при текущих экспериментальных условиях.
В похожем эксперименте мышей VELOCIMMUNE® иммунизировали несколькими различными антигенами, а отобранные тяжелые цепи антиген-специфичных антител человека тестировали на их способность создавать пары с различными перестроенными легкими цепями зародышевой линии человека (которые описаны выше). Используемые в этом эксперименте антигены включали фермент, вовлеченный в гомеостаз холестерина (антиген А), сывороточный гормон, вовлеченный в регуляцию глюкозного гомеостаза (антиген В), фактор роста, который стимулирует ангиогенез (антиген С), и рецептор клеточной поверхности (антиген D). Антиген-специфичные антитела выделяли из мышей каждой группы иммунизации и клонировали и секвенировали вариабельные участки тяжелой цепи и легкой цепи. Из последовательности тяжелой и легкой цепей определяли частоту использования гена V, и образовывали пару из отобранных тяжелых цепей либо с их когнатной легкой цепью, либо с перестроенным участком Vκ1-39Jκ5 зародышевой линии человека. Каждую пару тяжелая/легкая цепь совместно трансфицировали в клетки СНО-К1 и определяли наличие антитела в супернатанте при помощи антитела к IgG человека в анализе ELISA. Титр антитела (мкг/мл) определяли для каждой парной структуры тяжелая цепь/легкая цепь, а титры с различными перестроенными легкими цепями зародышевой линии человека сравнивали с титрами, полученными с исходной молекулой антитела (т.е. тяжелой цепью, образовавшей пару с когнатной легкой цепью), и рассчитывали процент у титра нативной молекулы (таблица 2). VH: вариабельный ген тяжелой цепи. Vκ: вариабельный ген легкой цепи κ. ND: отсутствие экспрессии, выявляемое при текущих экспериментальных условиях.
Полученные в этих экспериментах результаты демонстрировали, что подвергнутые соматической мутации высокоаффинные тяжелые цепи из различных генных семейств способны создавать пары с перестроенными участками Vκ1-39Jκ5 и Vκ3-20Jκ1 зародышевой линии человека и секретируются из клетки в виде нормальной молекулы антитела. Как показано на таблице 1, титр антитела повышался для приблизительно 61% (42 из 69) тяжелых цепей при образовании пары с перестроенной легкой цепью Vκ1-39Jκ5 человека и приблизительно для 29% (20 из 69) тяжелых цепей при образовании пары с перестроенной легкой цепью Vκ3-20Jκ1 человека по сравнению с когнатной легкой цепью исходного антитела. Для приблизительно 20% (14 из 69) тяжелых цепей обе перестроенные легкие цепи зародышевой линии человека давали повышение экспрессии по сравнению с когнатной легкой цепью исходного антитела. Как показано в таблице 2, перестроенный участок Vκ1-39Jκ5 зародышевой линии человека давал повышение экспрессии нескольких тяжелых цепей, специфичных к ряду различных классов антигенов, по сравнению с когнатной легкой цепью исходных антител. Титр антитела был более чем в два раза выше для приблизительно 35% (15/43) тяжелых цепей по сравнению с когнатной легкой цепью исходных антител. Для двух тяжелых цепей (315 и 316) повышение составляло более чем в десять раз по сравнению с исходным антителом. У всех тяжелых цепей, которые демонстрировали повышение экспрессии по отношению к когнатной легкой цепи исходного антитела, тяжелые цепи третьего семейства (VH3) являются сверхвыраженными по сравнению с другими генными семействами вариабельных участков тяжелых цепей. Это демонстрирует благоприятное родство тяжелых цепей VH3 человека для создания пар с перестроенными легкими цепями Vκ1-39Jκ5 и Vκ3-20Jκ1 зародышевой линии человека.
Пример 2
Получение локуса перестроенной легкой цепи зародышевой линии.
Различные таргетирующие векторы перестроенной легкой цепи зародышевой линии человека получали при помощи технологии VELOCIGENE® (см., например, патент США №6586251 и работу Valenzuela et.al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis. Nature Biotech. 21(6):652-659) для модификации геномных клонов 302g12 и 254m04 бактериальной искусственной хромосомы (ВАС) у мыши (Invitrogen). При помощи таких двух клонов ВАС конструировали геномные конструкты с включением отдельного участка перестроенной легкой цепи зародышевой линии человека и вставляли в локус эндогенной легкой цепи κ человека, который предварительно модифицировали с удалением эндогенных вариабельных генных сегментов и генных сегментов участков связывания κ.
Построение таргетирующих векторов перестроенной легкой цепи зародышевой линии человека. Три различных участка перестроенной легкой цепи зародышевой линии человека получали при помощи стандартных общепризнанных в данной области техники методик молекулярной биологии. Применяемые для построения таких трех участков вариабельные генные сегменты человека, включали перестроенную последовательность Vκ1-39Jκ5 человека, перестроенную последовательность Vκ3-20Jκ1 человека и перестроенную последовательность VpreBJλ5 человека.
Сегмент ДНК, содержащий экзон 1 (кодирующий лидерный пептид) и интрон 1 гена Vκ3-7 мыши, получали при помощи ДНК-синтеза de novo (Integrated DNA Technologies). Встраивали часть от 5' нетранслируемого участка до природного сайта рестрикции B1pI. Экзоны генов Vκ1-39 и Vκ3-20 человека амплифицировали при помощи ПЦР из геномных библиотек ВАС человека. Прямые праймеры имели 5' удлиняющий сегмент, содержащий акцепторный сайт сплайсинга интрона 1 гена Vκ3-7 мыши. Обратный праймер, применяемый для ПЦР последовательности Vκ1-39 человека, включал удлиняющий сегмент, кодирующий Jκ5 человека, в то время как обратный праймер, применяемый для ПЦР последовательности Vκ3-20 человека, включал удлиняющий сегмент, кодирующий Jκ1 человека. Последовательность VpreBJλ5 человека получали при помощи ДНК-синтеза de novo (Integrated DNA Technologies). Часть интрона Jκ-Cκ человека, включающую сайт донора сплайсированного фрагмента, амплифицировали при помощи ПЦР с плазмиды pBS-296-HA18-PISceI. Прямой ПЦР-праймер включал удлиняющий сегмент, кодирующий часть последовательности либо Jκ5, либо Jκ1, либо Jλ5 человека. Обратный праймер включал сайт PI-Scel, который предварительно конструировали в интроне.
Экзон 1/интрон 1 Vκ3-7 мыши, экзоны вариабельных легких цепей человека, фрагменты интрона Jκ-Cκ человека склеивали вместе при помощи ПЦР с перекрывающимися праймерами, расщепляли при помощи BIpI и PI-Scel и лигировали в плазмиду pBS-296-HA18-PISceI, которая содержала промотор из вариабельного генного сегмента Vκ3-15 человека. Кассету с гигромициновым маркером и Lox системой в плазмиде pBS-296-HA18-PISceI заменяли на кассету с гигромициновым маркером и FRT системой, фланкированной сайтами NotI и AscI. Фрагмент NotI/PI-Scel этой плазмиды лигировали в модифицированную ВАС 254m04 мыши, которая содержала часть интрона Jκ-Cκ мыши, экзона Сκ мыши и приблизительно 75 т.о. геномной последовательности ниже локуса к мыши, что давало 3' гомологичное плечо для гомологичной комбинации в ES клетках мыши. Фрагмент NotI/AscI этой ВАС затем лигировали в модифицированную ВАС 302g12 мыши, которая содержала кассету с неомициновым маркером и FRT системой и приблизительно 23 т.о. геномной последовательности выше эндогенного локуса к для гомологичной рекомбинации в ES клетках мыши.
Таргетирующий вектор перестроенного Vκ1-39Jκ5 зародышевой линии человека (фиг.1). Сайты фермента рестрикции вводили на 5' и 3' концах сконструированной вставки легкой цепи для клонирования в таргетирующий вектор: сайт AscI на 5' конце и сайт PI-Scel на 3' конце. В пределах сайта 5' AscI и сайта 3' PI-Scel таргетирующий конструкт от 5' к 3' включал 5' гомологичное плечо, содержащее последовательность, 5' по отношению к эндогенному локусу легкой цепи κ мыши, полученную из клона ВАС 302g12 мыши, гена устойчивости к неомицину с системой FRT, геномную последовательность, включающую промотор Vκ3-15 человека, лидерную последовательность вариабельного генного сегмента Vκ3-7 мыши, интронную последовательность вариабельного генного сегмента Vκ3-7 мыши, открытую рамку считывания перестроенного участка Vκ1-39Jκ5 зародышевой линии человека, геномную последовательность, содержащую часть интрона Jκ-Cκ человека, и 3' гомологичное плечо, содержащее 3' последовательность эндогенного генного сегмента Jκ5 мыши, полученную из клона ВАС 254m04 мыши (фигура 1, средина). Гены и/или последовательности выше локуса эндогенной легкой цепи κ мыши и ниже большей части 3' генного сегмента Jκ (например, эндогенный 3' энхансер) не модифицировались таргетирующим конструктом (см. фигуру 1). Последовательность сконструированного локуса Vκ1-39Jκ1 человека показана в SEQ ID NO:1.
Нацеленную вставку перестроенного участка Vκ1-39Jκ5 зародышевой линии человека в ДНК ВАС подтверждали с помощью полимеразной цепной реакции (ПЦР) с применением праймеров, расположенных на последовательностях в пределах перестроенного участка легкой цепи зародышевой линии человека. Если кратко, интронную последовательность, 3' по отношению к лидерной последовательности Vκ3-7 мыши, подтверждали с применением праймеров ULC-m1 F (AGGTGAGGGT ACAGATAAGT GTTATGAG; SEQ ID NO:2) и ULC-m1R (TGACAAATGC CCTAATTATA GTGATCA; SEQ ID NO:3). Открытую рамку считывания перестроенного участка Vκ1-39Jκ5 зародышевой линии человека подтверждали при помощи праймеров 1633-h2F (GGGCAAGTCA GAGCATTAGC A; SEQ ID NO:4) и 1633-h2R (TGCAAACTGGATGCAGCATA G; SEQ ID NO:5). Кассету с неомициновым маркером подтверждали при помощи праймеров neoF (GGTGGAGAGG CTATTCGGC; SEQ ID NO:6) и neoR (GAACACGGCG GCATCAG; SEQ ID NO:7). ДНК нацеленной ВАС затем применяли для электропорации мышиных ES-клеток для создания модифицированных ES-клеток для получения химерных мышей, у которых экспрессируется перестроенный участок Vκ1-39Jκ5 зародышевой линии человека.
Положительные клоны ES-клеток подтверждали при помощи скрининга TAQMAN™ и кариотипирования с применением зондов, специфичных к представляющему интерес сконструированному участку Vκ1-39Jκ5 легкой цепи, вставленному в эндогенный локус. Если кратко, зонд neoP (TGGGCACAAC AGACAATCGG CTG; SEQ ID NO:8), который связывается в пределах неомицинового маркерного гена, зонд ULC-m1P (CCATTATGAT GCTCCATGCC TCTCTGTTC; SEQ ID NO:9), который связывается в пределах интронной последовательности, 3' по отношению к лидерной последовательности Vκ3-7 мыши, и зонд 1633h2P (ATCAGCAGAA ACCAGGGAAA GCCCCT; SEQ ID NO:10), который связывается в пределах открытой рамки считывания перестроенного Vκ1-39Jκ5 зародышевой линии человека. Положительные клоны ES-клеток затем применяли для имплантации самкам мышей с получением выводка потомства, экспрессирующего участок легкой цепи Vκ1-39Jκ5 зародышевой линии.
Альтернативно, ES-клетки, несущие перестроенный участок легкой цепи Vκ1-39Jκ5 зародышевой линии человека, трансфицировали при помощи конструкта, который экспрессирует FLP, с тем, чтобы удалить кассету с неомициновым маркером и FRT системой, введенную при помощи таргетирующего конструкта. Необязательно, кассету с неомициновым маркером удаляли при помощи скрещивания с мышами, которые экспрессировали рекомбиназу FLP (например, патент США №6774279). Необязательно, кассету с неомициновым маркером сохраняли у мышей.
Таргетирующий вектор перестроенного Vκ3-20Jκ1 зародышевой линии человека (фиг.2). Аналогичным образом, сконструированный локус легкой цепи, экспрессирующий участок Vκ3-20Jκ1 зародышевой линии человека, получали при помощи таргетирующего конструкта, включающего, от 5' к 3', 5' гомологичное плечо, содержащее последовательность, 5' по отношению к эндогенному локусу легкой цепи κ мыши, полученную из клона ВАС 302g12 мыши, ген устойчивости к неомицину с FRT системой, геномную последовательность, включающую промотор Vκ3-15 человека, лидерную последовательность вариабельного генного сегмента Vκ3-7 мыши, интронную последовательность вариабельного генного сегмента Vκ3-7 мыши, открытую рамку считывания перестроенного участка Vκ3-20Jκ1 зародышевой линии человека, геномную последовательность, содержащую часть интрона Jκ-Cκ человека, и 3' гомологичное плечо, содержащее 3' последовательность эндогенного генного сегмента Jκ5 мыши, полученную из клона ВАС 254m04 мыши (фигура 1, средина). Последовательность сконструированного локуса Vκ3-20Jκ1 человека показана в SEQ ID NO:11.
Нацеленную вставку перестроенного участка Vκ3-20Jκ1 зародышевой линии человека в ДНК ВАС подтверждали с помощью полимеразной цепной реакции (ПЦР) с применением праймеров, расположенных на последовательностях в пределах перестроенного участка Vκ3-20Jκ легкой цепи зародышевой линии человека. Если кратко, интронную последовательность, 3' по отношению к лидерной последовательности Vκ3-7 мыши, подтверждали с применением праймеров ULC-m1F (SEQ ID NO:2) и ULC-m1R (SEQ ID NO:3). Открытую рамку считывания перестроенного участка Vκ3-20Jκ1 зародышевой линии человека подтверждали при помощи праймеров 1635-h2F (TCCAGGCACC CTGTCTTTG; SEQ ID NO:12) и 1635-h2R (AAGTAGCTGC TGCTAACACT CTGACT; SEQ ID NO:13). Кассету с неомициновым маркером подтверждали при помощи праймеров neoF (SEQ ID NO:6) и neoR (SEQ ID NO:7). ДНК нацеленной ВАС затем применяли для электропорации мышиных ES-клеток для создания модифицированных ES-клеток для получения химерных мышей, у которых экспрессируется перестроенная легкая цепь Vκ3-20Jκ1 зародышевой линии человека.
Положительные клоны ES-клеток подтверждали при помощи скрининга TAQMAN™ и кариотипирования с применением зондов, специфичных к представляющему интерес сконструированному участку Vκ3-20Jκ1 легкой цепи, вставленному в эндогенный локус легкой цепи κ. Если кратко, зонд neoP (SEQ ID NO:8), который связывается в пределах неомицинового маркерного гена, зонд ULC-m1P (SEQ ID NO:9), который связывается в пределах лидерной последовательности Vκ3-7 мыши, и зонд 1635h2P (AAAGAGCCAC CCTCTCCTGC AGGG; SEQ ID NO:14), который связывается в пределах открытой рамки считывания Vκ3-20Jκ1 человека. Положительные клоны ES-клеток затем использовали для имплантации самкам мышей. Получали выводок потомства, экспрессирующего участок легкой цепи Vκ3-20Jκ1 зародышевой линии человека.
Альтернативно, ES-клетки, несущие участок легкой цепи Vκ3-20Jκ1 зародышевой линии человека, могут быть трансфицированы при помощи конструкта, который экспрессирует FLP, с тем, чтобы удалить кассету с неомициновым маркером и FRT системой, введенную при помощи таргетирующего конструкта. Необязательно, кассета с неомициновым маркером может быть удалена при помощи скрещивания с мышами, которые экспрессировали рекомбиназу FLP (например, патент США №6774279). Необязательно, кассету с неомициновым маркером сохраняли у мышей.
Таргетирующий вектор перестроенного VpreBJλ5 зародышевой линии человека (фиг.3). Аналогичным образом, сконструированный локус легкой цепи, экспрессирующий участок VpreBJλ5 зародышевой линии человека, получали при помощи таргетирующего конструкта, включающего, от 5' к 3', 5' гомологичное плечо, содержащее последовательность, 5' по отношению к эндогенному локусу легкой цепи κ мыши, полученную из клона ВАС 302g12 мыши, ген устойчивости к неомицину с FRT системой, геномную последовательность, включающей промотор Vκ3-15 человека, лидерную последовательность вариабельного генного сегмента Vκ3-7 мыши, интронную последовательность вариабельного генного сегмента Vκ3-7 мыши, открытую рамку считывания перестроенного участка VpreBJλ5 зародышевой линии человека, геномную последовательность, содержащую часть интрона Jκ-Cκ человека, и 3' гомологичное плечо, содержащее 3' последовательность эндогенного генного сегмента Jκ5 мыши, полученную из клона ВАС 254m04 мыши (фигура 3, средина). Последовательность сконструированного локуса VpreBJλ5 человека показана в SEQ ID NO:15.
Нацеленную вставку перестроенного участка VpreBJλ5 зародышевой линии человека в ДНК ВАС подтверждали с помощью полимеразной цепной реакции (ПЦР) с применением праймеров, расположенных на последовательностях в пределах перестроенного участка легкой цепи VpreBJλ5 зародышевой линии человека. Если кратко, интронную последовательность, 3' по отношению к лидерной последовательности Vκ3-7 мыши, подтверждали с применением праймеров ULC-m1F (SEQ ID NO:2) и ULC-m1R (SEQ ID NO:3). Открытую рамку считывания перестроенного участка VpreBJλ5 зародышевой линии человека подтверждали при помощи праймеров 1616-h1 F (TGTCCTCGGC CCTTGGA; SEQ ID NO:16) и 1616-MR (CCGATGTCAT GGTCGTTCCT; SEQ ID NO:17). Кассету с неомициновым маркером подтверждали при помощи праймеров neoF (SEQ ID NO:6) и neoR (SEQ ID NO:7). ДНК нацеленной ВАС затем применяли для электропорации мышиных ES-клеток для создания модифицированных ES-клеток для получения химерных мышей, у которых экспрессируется перестроенная легкая цепь VpreBJλ5 зародышевой линии человека.
Положительные клоны ES-клеток подтверждали при помощи скрининга TAQMAN™ и кариотипирования с применением зондов, специфичных к представляющему интерес сконструированному участку VpreBJλ5 легкой цепи, вставленному в эндогенный локус легкой цепи κ. Если кратко, зонд neoP (SEQ ID NO:8), который связывается в пределах неомицинового маркерного гена, зонд ULC-m1P (SEQ ID NO:9), который связывается в пределах лидерной последовательности IgVκ3-7 мыши, и зонд 1616МР (ACAATCCGCC TCACCTGCAC CCT; SEQ ID NO:18), который связывается в пределах открытой рамки считывания VpreBJλ5 человека. Положительные клоны ES-клеток затем применяли для имплантации самкам мышей с получением выводка потомства, экспрессирующего участок легкой цепи зародышевой линии.
Альтернативно, ES-клетки, несущие перестроенный участок легкой цепи VpreBJλ5 зародышевой линии человека, трансфицировали при помощи конструкта, который экспрессирует FLP, с тем, чтобы удалить кассету с неомициновым маркером и FRT системой, введенную при помощи таргетирующей конструкции. Необязательно, кассету с неомициновым маркером удаляли при помощи скрещивания с мышами, которые экспрессировали рекомбиназу FLP (например, патент США №6774279). Необязательно, кассету с неомициновым маркером сохраняли у мышей.
Пример 3
Получение мышей, экспрессирующих отдельную перестроенную легкую цепь человека
Подвергнутые целенаправленному воздействию описанные выше ES-клетки, применяли в качестве донорных ES-клеток и вводили в эмбрион мыши на стадии 8-клеток согласно способу VELOCIMOUSE® (см., например, патент США №7294754 и Poueymirou et.al. (2007) FO generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech. 25(1):91-99. VELOCIMICE®, независимо несущие сконструированный участок легкой цепи Vκ1-39Jκ5 зародышевой линии человека, участок легкой цепи Vκ3-20Jκ1 или участок легкой цепи VpreBJλ определяли при помощи генотипирования с помощью модификации аллельного анализа (Valenzuela et.al., ранее), посредством которого выявляют наличие уникального перестроенного участка легкой цепи зародышевой линии человека.
Потомство генотипировали и мышонка, гетерозиготного или гомозиготного по уникальному перестроенному участку легкой цепи зародышевой линии человека, выбирали для характеристики экспрессии перестроенного участка легкой цепи зародышевой линии человека.
Проточная цитометрия. Экспрессию перестроенного участка легкой цепи человека в нормальном репертуаре антител у мышей с общей легкой цепью проверяли при помощи анализа экспрессии κ и λ иммуноглобулина в спленоцитах и периферической крови мыши с общей легкой цепью. Суспензии клеток из собранных селезенок и периферической крови дикого типа (n=5), гетерозиготных по общей легкой цепи Vκ1-39Jκ5 (n=3), гомозиготных по общей легкой цепи Vκ1-39Jκ5 (n=3), гетерозиготных по общей легкой цепи Vκ3-20Jκ1 (n=2) и гомозиготных по общей легкой цепи Vκ3-20Jκ1 (n=2) мышей получали при помощи стандартных способов и красили с CD19+, Igλ+, и Igκ+, с применением флуоресцентно меченных антител (BD Pharmigen).
Если кратко, 1×106 клеток инкубировали с антителом к CD16/CD32 мыши (клон 2,4G2, BD Pharmigen) на льду в течение 10 минут, после чего метили следующим коктейлем с антителами в течение 30 минут на льду: конъюгированное с АРС антитело к CD19 мыши (клон 1D3, BD Pharmigen), конъюгированное с PerCP-Cy5,5 антитело к CD3 мыши (клон 17А2, BioLegend), конъюгированное с FITC антитело к Igκ мыши (клон 187,1, BD Pharmigen), конъюгированное с РЕ антитело к Igλ мыши (клон RML-42, BioLegend). После окрашивания клетки промывали и фиксировали в 2% формальдегиде. Получение данных осуществляли на проточном цитометре LSRII и анализировали при помощи FlowJo. Установка дискриминационного окна: общие В-клетки (CD19+CD3-), Igκ+ В-клетки (Igκ+Igλ-CD19+CD3-), Igκ+ В-клетки (Igκ+Igλ+CD19+CD3-). Собранные данные из крови и образцов спленоцитов демонстрировали сходные результаты. В таблице 3 приведен процент положительных CD19+ В-клеток из периферической крови одной иллюстративной мыши из каждой группы, которые являются Igκ+, Igλ+ или Igλ+Igκ+. Проценты CD19+ В-клеток в периферической крови от мышей дикого типа и мышей, гомозиготных по общей легкой цепи либо Vκ1-39Jκ5, либо Vκ3-20Jκ1, показаны на фиг.4.
Экспрессия общих легких цепей. Экспрессию каждой общей легкой цепи (Vκ1-39Jκ5 и Vκ3-20Jκ1) анализировали у гетерозиготных и гомозиготных мышей при помощи количественного ПЦР-анализа (например, TAQMAN™).
Если кратко, CD19+ В-клетки очищали из селезенок дикого типа мышей, гомозиготных по замене локусов вариабельного участка легкой цепи κ и тяжелой цепи мыши на соответствующие локусы (Нκ) вариабельного участка легкой цепи κ и тяжелой цепи человека, а также мышей, гомозиготных и гетерозиготных по каждому перестроенному участку (Vκ1-39Jκ5 или Vκ3-20Jκ1) легкой цепи человека при помощи микроносителей с мышиным CD19 (Miltenyi Biotec) согласно инструкциям производителя. Общую РНК очищали из CD19+ В-клеток при помощи набора RNeasy Mini (Qiagen) согласно инструкциям производителя, а геномную РНК удаляли путем обработки на колонках ДНКазой в отсутствии рибонуклеаз (Qiagen). 200 нг мРНК обратно транскрибировали в кДНК при помощи набора First Stand cDNA Synthesis (Invitrogen) и полученную кДНК амплифипировали с мастер-миксом ПЦР Taqman Universal (Applied Biosystems). Все реакции осуществляли при помощи системы определения последовательностей ABI 7900 (Applied Biosystems) с применением праймеров и зондов Taqman MGB, охватывающих (1) участок связывания Vκ-Jκ для обеих общих легких цепей, (2) отдельно ген Vκ (т.е. Vκ1-39 и Vκ3-20) и (3) участок Сκ мыши. В таблице 4 изложены последовательности используемых в этом анализе праймеров и зондов. Относительную экспрессию нормализовали к экспрессии участка Сκ мыши. Результаты показаны на фиг.5А, 5В и 5С.
Специфичные к антигену антитела с общей легкой цепью. Мышей с общей легкой цепью, несущих общую легкую цепь либо Vκ1-39Jκ5, либо Vκ3-20Jκ1 в эндогенном локусе легкой цепи κ мыши, иммунизировали β-галактозидазой и измеряли титр антител.
Если кратко, β-галактозидазу (Sigma) эмульгировали во вспомогательном веществе titermax (Sigma) согласно инструкциям производителя. Дикий тип (n=7), гомозиготы по общей легкой цепи Vκ1-39Jκ5 (n=2) и гомозиготы по общей легкой цепи Vκ3-20Jκ1 (n=5) иммунизировали посредством подкожной инъекции 100 мкг эмульсии β-галактозидаза/Titermax. Мьппей стимулировали подкожной инъекцией два раза с интервалом 3 недели, 50 мкг эмульсии β-галактозидаза/Titermax. После второго стимула собирали кровь у анестезированных мышей при помощи забора из ретроорбитального синуса в пробирки для отделения сыворотки (BD Biosciences) согласно инструкциям производителя. Для измерения антител IgM или IgG к β-галактозидазе планшеты для ELISA (Nunc) покрывали 1 мкг/мл β-галактозидазы в течение ночи при 4°С. Избыточный антиген смывали перед блокировкой PBS посредством 1% BSA в течение одного часа при комнатной температуре. Серийные разведение сыворотки вносили в планшеты и инкубировали в течение одного часа при комнатной температуре перед промыванием. Планшеты затем инкубировали с конъюгированным с HRP антителом к IgM (Southern Biotech) или к IgG (Southern Biotech) в течение одного часа при комнатной температуре. После очередного промывания планшеты проявляли с субстратом ТМВ (BD Biosciences). Реакции останавливали при помощи 1 Н серной кислоты и при OD450 считывали при помощи спектрофотометра для прочтения планшетов Victor X5 (Perkin Elmer). Данные анализировали на GraphPad Prism и рассчитывали сигнал как разведение сыворотки, превышающее в два раза фон. Результаты показаны на фиг.6А и 6В.
Как показано в настоящем примере, соотношение В-клеток κ/λ как в селезеночных, так и в периферических компартментах мышей с общими легкими цепями Vκ1-39Jκ5 и Vκ3-20Jκ1 демонстрировали близкую к дикому типу картину (таблица 3 и фиг.4). Мыши с общей легкой цепью VpreBJλ5, однако, демонстрировали меньше периферических В-клеток, из которых приблизительно 1-2% экспрессировали сконструированный участок легкой цепи человека (данные не указаны). Уровни экспрессии перестроенных участков легкой цепи человека Vκ1-39Jκ5 и Vκ3-20Jκ1 из эндогенного локуса легкой цепи κ оценивали при сравнении с эндогенным локусом легкой цепи κ, содержащим полную замену генных сегментов Vκ и Jκ мыши на генные сегменты Vκ и Jκ человека (фиг.5А, 5В и 5С). Уровни экспрессии перестроенного участка легкой цепи человека VpreBJλ.5 демонстрировали одинаково высокую экспрессию с эндогенного локуса легкой цепи κ как у гетерозиготных, так и у гомозиготных мышей (данные не указаны). Это демонстрирует то, что при прямой конкуренции с мышиными λ, к или обоими эндогенными локусами легкой цепи отдельная перестроенная последовательность VL/JL человека может дать экспрессию с лучшим уровнем, чем у дикого типа, с эндогенного локуса легкой цепи κ и привести к нормальной частоте В-клеток в селезенке или крови. Кроме того, наличие сконструированного локуса легкой цепи κ, имеющего последовательность либо Vκ1-39Jκ5 человека, либо Vκ3-20Jκ1 человека, хорошо переносилось мышами и, по видимому, функционирует по типу дикого типа, представляя значительную часть репертуара легкой цепи в гуморальном компоненте иммунного ответа (фиг.6А и 6В).
Пример 4
Выведение мышей, экспрессирующих отдельную перестроенную легкую цепь зародышевой линии человека
В этом примере описано несколько других линий генетически модифицированных мышей, которые могут быть выведены до любой из описываемых в настоящем документе мышей с общей легкой цепью для создания множества линий генетически модифицированных мышей, несущих в себе множество генетически модифицированных иммуноглобулиновых локусов.
Нокаут (КО) эндогенного Igλ. Для оптимизации частоты использования сконструированных локусов легкой цепи мышей, несущих один из перестроенных участков легкой цепи зародышевой линии человека, скрещивали с другой мышью, содержащей делецию в эндогенном локусе легкой цепи λ. Таким образом, полученное потомство будет экспрессировать в качестве единственной собственной легкой цепи перестроенный участок легкой цепи зародышевой линии человека, который описан в примере 2. Выведение осуществляли посредством стандартных общепринятых в данной области техники методик и, альтернативно, с участием коммерческого предприятия, специализирующегося на разведении животных (например. The Jackson Laboratory). Линии мышей, несущие сконструированный локус легкой цепи и делецию эндогенного локуса легкой цепи λ, подвергали скринингу на наличие уникального участка легкой цепи и отсутствие эндогенных легких цепей λ, мыши.
Гуманизированный эндогенный локус тяжелой цепи. Мыши, несущие сконструированный локус легкой цепи зародышевой линии человека, скрещивали с мышами, которые содержали замену эндогенного локуса вариабельного гена тяжелой цепи мыши на локус вариабельного гена тяжелой цепи человека (см. патент США №6596541; мышь VELOCIMMUNE®, Regeneron Pharmaceuticals, Inc.). Мышь VELOCIMMUNE® содержит геном, содержащий вариабельные участки тяжелой цепи человека, функционально связанные с эндогенными локусами константного участка мыши так, чтобы мышь вырабатывала антитела, содержащие вариабельный участок тяжелой цепи человека и константный участок тяжелой цепи мыши в ответ на стимуляцию антигеном. ДНК, кодирующая вариабельные участки тяжелых цепей антител, выделяли и функционально связывали с ДНК, кодирующей константные участки тяжелой цепи человека. ДНК затем экспрессировали в клетке, способной экспрессировать полностью человеческую тяжелую цепь из антитела.
Получали мышей, несущих замену эндогенного локуса VH мыши на локус VH человека и отдельный перестроенный участок VL зародышевой линии человека в эндогенном локусе легкой цепи κ. При иммунизации представляющим интерес антигеном получали реверсивные химерные антитела, содержащие подвергнутые соматическом мутации тяжелые цепи (VH человека и СН мыши) с отдельной легкой цепью человека (VL человека и CL мыши). Определяли нуклеотидные последовательности VH и VL экспрессирующих антитела В-клеток, а полностью человеческие антитела получали при помощи гибридизации нуклеотидных последовательностей VH и VL с нуклеотидными последовательностями СН и CL человека в подходящей системе экспрессии.
Пример 5
Получение антител от мышей, экспрессирующих тяжелые цепи человека и перестроенный участок легкой цепи зародышевой линии человека.
После выведения мышей, которые содержат сконструированный участок легкой цепи человека, до различных требуемых линий, содержащих модификации и делеции других эндогенных локусов Ig (которые описаны в примере 4), отобранные мыши могут быть иммунизированы представляющим интерес антигеном.
В целом, мышь VELOCIMMUNE®, содержащую один из отдельных перестроенных участков легкой цепи зародышевой линии человека, стимулировали антигеном, а лимфатические клетки (такие как В-клетки) выделяли из сыворотки животных. Лимфатические клетки гибридизировали с линией клеток миеломы с получением линий иммортализованных гибридомных клеток, и такие линии гибридомных клеток подвергали скринингу и отбору для выявления линий гибридомных клеток, которые вырабатывают антитела, содержащие вариабельные участки тяжелых цепей человека и перестроенные легкие цепи зародышевой линии человека, которые специфичны к использованному для иммунизации антигену. ДНК, кодирующую вариабельные участки тяжелых цепей и легких цепей, выделяли и связывали с требуемыми изотипическими константными участками тяжелой цепи и легкой цепи. Вследствие наличия эндогенных последовательностей мыши и любых дополнительных действующих в цис-положении элементов, присутствующих в эндогенном локусе, отдельная легкая цепь каждого антитела может быть подвергнута соматической мутации. Это добавляет дополнительное разнообразие в репертуар антигенной специфичности, включающий отдельную легкую цепь и различные последовательности тяжелой цепи. Полученные в результате последовательности клонированных антител впоследствии экспрессируются в клетке, такой как клетка СНО. Альтернативно, ДНК, кодирующую антиген-специфичные химерные антитела или вариабельные домены легкой цепи и тяжелых цепей, определяли непосредственно из антиген-специфичных лимфоцитов.
Сначала выделяли высокоаффинные химерные антитела с вариабельным участком человека и константным участком мыши. Как описано выше, антитела характеризовали и отбирали по требуемым характеристикам, в том числе аффинности, специфичности, эпитопу и т.д. Константный участок мыши заменяли на требуемый константный участок человека с получением полностью человеческого антитела, содержащего подвергнутую соматической мутации тяжелую цепь человека и отдельную легкую цепь, полученную от перестроенного участка легкой цепи зародышевой линии человека по настоящему изобретению. Подходящие константные участки человека включают, например, IgG1 или IgG4 дикого типа или модифицированный IgG1 или IgG4.
Отделенные группы мышей VELOCIMMUNE®, содержащих замену эндогенного локуса тяжелой цепи мыши на генные сегменты VH, DH и JH человека и замену эндогенного локуса легкой цепи κ мыши либо на сконструированный участок легкой цепи Vκ1-39Jκ5 зародышевой линии человека, либо на сконструированный участок легкой цепи Vκ3-20Jκ1 зародышевой линии человека (описанные выше), иммунизировали белком рецептора клеточной поверхности человека (антигеном Е). Антиген Е вводили непосредственно в подушечку задней лапки мышей посредством шести последовательных инъекций каждые 3-4 дня. От двух до трех микрограмм антигена Е смешивали с 10 мкг олигонуклеотида CpG (номер по каталогу: tlrl-modn - ODN1826 oligonucleotide; InVivogen, Сан-Диего, Калифорния) и 25 мкг Adju-Phos (гелеобразное вспомогательное вещество с фосфатом алюминия, номер по каталогу Н-71639-250; Brenntag Biosector, Фредерикссунн, Дания) непосредственно перед введением инъекции. Всего давали шесть инъекций перед конечным вторичным иммунным ответом, которому давали развиться в течение 3-5 дней перед умерщвлением. Собирали кровь после 4-й и 6-й инъекции, а иммунный ответ посредством антител отслеживали при помощи стандартного иммуноанализа по специфичности к антигену.
При достижении требуемого иммунного ответа забирали спленоциты и гибридизировали с клетками миеломы мыши для сохранения их жизнеспособности и образования линий гибридомных клеток. Линии гибридомных клеток подвергали скринингу и отбирали для выявления линий клеток, которые вырабатывают специфичные к антигену Е антитела с общей легкой цепью. С помощью такой методики получали несколько специфичных к антигену Е антител с общей легкой цепью (т.е. антител, обладающих вариабельными доменами тяжелой цепи человека, таким же вариабельным доменом легкой цепи человека и константными доменами мыши).
Альтернативно, антитела к антигену Е с общей легкой цепью выделяли непосредственно из антиген-положительных В-клеток без гибридизации с клетками миеломы, как описано в заявке на патент США №2007/0280945 А1, таким образом отдельно включенной в настоящий документ при помощи ссылки в полном ее объеме. С помощью настоящего способа получали несколько полностью человеческих антител к антителу Е с общей легкой цепью (т.е. антител, обладающих вариабельными доменами тяжелой цепи человека, участком либо сконструированной легкой цепи Vκ1-39Jκ5 человека, либо сконструированной легкой цепи Vκ3-2Jκ1 человека и константными доменами человека).
Биологические свойства иллюстративных антител к антигену Е с общей легкой цепью, полученных в соответствии со способами из настоящего примера, описаны подробно в изложенных ниже разделах.
Пример 6
Частота использования генного сегмента тяжелой цепи у антиген-специфичных антител с общей легкой цепью.
Для анализа структуры полученных антител к антигену Е с общей легкой цепью человека клонировали и секвенировали нуклеиновые кислоты, кодирующие вариабельные участки тяжелой цепи антитела. Из последовательностей нуклеиновых кислот и расчетных аминокислотных последовательностей антител определяли частоту использования гена для вариабельного участка тяжелой цепи (HCVR) отобранных антител с общей легкой цепи, полученных от иммунизированных мышей VELOCIMMUNE®, содержащих участок либо сконструированной легкой цепи Vκ1-39Jκ5 человека, либо сконструированной легкой цепи Vκ3-20Jκ1 человека. Результаты показаны в таблицах 5 и 6, которые демонстрируют, что мыши по настоящему изобретению вырабатывают антиген-специфичные антитела с общей легкой цепью из множества генных сегментов тяжелой цепи человека, вследствие ряда перестроек, при использовании любой мыши, у которой экспрессируется легкая цепь только с Vκ1-39-человека, или легкая цепь, полученная от Vκ3-20 человека. Генные сегменты VH человека из 2, 3, 4 и 5 семейств перестраивались с рядом сегментов DH человека и сегментов JH человека с образованием антиген-специфичных антител.
Пример 7
Определение блокирующей способности антиген-специфичных антител с общей легкой цепью при помощи анализа LUMINEX™
Девяносто восемь выработанных к антигену Е антител с общей легкой цепью человека тестировали на их способность блокировать связывание естественного лиганда антигена Е (лиганд Y) с антигеном Е в анализе с применением микроносителей.
Внеклеточный домен (ECD) антигена Е конъюгировали с двумя эпитопными метками туе и 6Х гистидиновой меткой (антиген E-mmH) и соединяли по аминной группе с карбоксилированными микрогранулами в концентрации 20 мкг/мл в буфере MES. Смесь инкубировали в течение двух часов при комнатной температуре с последующей дезактивацией микроносителей посредством 1М трис, рН 8, за чем следовало промывание в PBS с 0,05% (объем/объем) твин-20 Затем микроносители блокировали посредством PBS (Irvine Scientific/Санта-Ана, Калифорния), содержащего 2% (вес/объем) BSA (Sigma-Aldrich Corp., Сент-Луис, Миссури). В 96-луночном планшете с фильтром супернатанты, содержащие специфичные антигену Е антитела к общей легкой цепью, разводили 1:15 в буфере. Готовили отрицательный контроль, содержащий суррогатный супернатант со сходными компонентами среды, как у супернатанта с антителами. Меченные антигеном Е микроносители добавляли к супернатантам и инкубировали в течение ночи при 4°С. Биотинилированный белок лиганда Y добавляли до конечной концентрации 0,06 нМ и инкубировали в течение двух часов при комнатной температуре. Выявление биотинилированного лиганда Y, связанного с мечеными антиген E-myc-myc-6His микроносителями, осуществляли при помощи R-фикоэритрина, конъюгированного со стрептавидином (Moss Inc, Пасадена, Мэриленд) с последующим измерением в анализаторе на основе проточной цитометрии LUMINEX™. Из всех образцов вычитали фоновую среднюю интенсивность флуоресценции (MFI) образца без лиганда Y. Процент блокирования рассчитывали путем деления MFI с вычтенным фоном каждого образца на откорректированное значение отрицательного контроля, умножая на 100 и вычитая полученное значение из 100.
В сходном эксперименте те же 98 выработанных к антигену А антител с общей легкой цепью человека тестировали на их способность блокировать связывание антигена Е с меченными лигандом Y микроносителями.
Если кратко, лиганд Y связывали по аминогруппе с карбоксилированным микрогранулами в концентрации 20 мкг/мл, разведенными в буфере MES. Смесь инкубировали два часа при комнатной температуре с последующей дезактивацией микроносителей посредством 1М трис, рН 8, за чем следовало промывание в PBS с 0,05% (объем/объем) твин-20Затем микроносители блокировали посредством PBS (Irvine Scientific/Санта-Ана, Калифорния), содержащего 2% (вес/объем) BSA (Sigma-Aldrich Corp., Сент-Луис, Миссури). В 96-луночном планшете с фильтром супернатанты, содержащие специфичные к антигену Е антитела с общей легкой цепью, разводили 1:15 в буфере. Готовили отрицательный контроль, содержащий суррогатный супернатант со сходными компонентами среды, как у супернатанта с антителами. Биотинилированный антиген E-mmH добавляли до конечной концентрации 0,42 нМ и инкубировали в течение ночи при 4°С. Затем к смеси антитело/антиген Е добавляли меченные лигандом Y микроносители и инкубировали в течение двух часов при комнатной температуре. Выявление биотинилированного антигена E-mmH, связанного с микроносителями с лигандом Y, осуществляли при помощи R-фикоэритрина, конъюгированного со стрептавидином (Moss Inc, Пасадена, Мэриленд) с последующим измерением в анализаторе на основе проточной цитометрии LUMINEX™. Из всех образцов вычитали фоновую среднюю интенсивность флуоресценции (MFI) образца без антигена Е. Процент блокирования рассчитывали путем деления MFI с вычтенным фоном каждого образца на откорректированное значение отрицательного контроля, умножая на 100 и вычитая полученное значение из 100.
На таблицах 7 и 8 показан процент блокирования для всех 98 протестированных в обоих анализах LUMINEX™ антител к антигену Е с общей легкой цепью. ND: не выявляемое при текущих экспериментальных условиях.
В первом описанном выше эксперименте LUMINEX™ 80 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ1-39Jκ5, тестировали на их способность блокировать связывание лиганда Y с меченными антигеном Е микроносителями. Из этих 80 антител с общей легкой цепью 68 демонстрировали >50% блокирование, в то время как 12 демонстрировали <50% блокирование (6 с 25-50% блокированием и 6 с <25% блокированием). Для 18 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ3-20Jκ1, 12 демонстрировали >50% блокирование, в то время как 6 демонстрировали <50% блокирование (3 с 25-50% блокированием и 3 с <25% блокированием) связывания лиганда Y с меченными антигеном Е микроносителями.
Во втором описанном выше эксперименте LUMINEX™ 80 этих же антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ1-39Jκ5, тестировали на их способность блокировать связывание антигена Е с меченными антигеном Е микроносителями. Из этих 80 антител с общей легкой цепью 36 демонстрировали >50% блокирование, в то время как 44 демонстрировали <50% блокирование (27 с 25-50% блокированием и 17 с <25% блокированием). Для 18 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ3-20Jκ1, 1 демонстрировало >50% блокирование, в то время как 17 демонстрировали <50% блокирование (5 с 25-50% блокированием и 12 с <25% блокированием) связывания антигена Е с меченными лигандом Y микроносителями.
По данным таблиц 7 и 8 установили, что описанные в таблицах 5 и 6 перестройки давали специфичные к антигену Е антитела с общей легкой цепью, которые блокировали связывание лиганда Y с его когнатным рецепторным антигеном Е с различными степенями эффективности, что согласовывается с результатами по антителам к антигену Е с общей легкой цепью из таблиц 5 и 6, включающих антитела с перекрывающейся и не перекрывающейся специфичностью эпитопа в отношении антигена Е.
Пример 8
Определение блокирующей способности антиген-специфичных антител общей легкой цепи при помощи анализа ELISA
Выработанные к антигену Е антитела с общей легкой цепью человека тестировали на их способность блокировать связывание антигена Е с покрытой лигандом Y поверхностью в анализе ELISA.
Лиганд Y наносили на 96-луночные планшеты в концентрации 2 мкг/мл с разведением в PBS и инкубировали в течение ночи с последующим промыванием четыре раза в PBS с 0,05% твин-20. Затем планшет блокировали посредством PBS (Irvine Scientific/Санта-Ана, Калифорния), содержащего 0,5% (вес/объем) BSA (Sigma-Aldrich Corp., Сент-Луис, Миссури), в течение одного часа при комнатной температуре. В отдельном планшете супернатанты, содержащие антитела к антигену Е с общей легкой цепью, разводили 1:10 в буфере. Суррогатный супернатант с теми же компонентами антител использовали в качестве отрицательного контроля. Антиген Е-mmH (описанный выше) добавляли до конечной концентрации 0,150 нМ и инкубировали в течение одного часа при комнатной температуре. Затем в содержащий лиганд Y планшет добавляли смесь антитело/антиген E-mmH и инкубировали в течение одного часа при комнатной температуре. Выявление антигена E-mmH, связавшегося с лигандом Y, осуществляли с помощью пероксидазы хрена (HRP), конъюгированной с антителом к пяти-His (Qiagen, Валенсия, Калифорния) и проявляли с помощью стандартной колориметрической реакции с применением тетраметилбензидинового (ТМВ) субстрата (BD Biosciences, Сан-Хосе, Калифорния), нейтрализованного серной кислотой. Показатель поглощение считывали при OD450 в течение 0,1 секунды. Из всех образцов вычитали показатель фонового поглощения образца без антигена Е. Процент блокирования рассчитывали путем деления MFI с вычтенным фоном каждого образца на откорректированное значение отрицательного контроля, умножая на 100 и вычитая полученное значение из 100.
На таблицах 9 и 10 показан процент блокирования для всех 98 протестированных в анализе ELISA антител к антигену Е с общей легкой цепью. ND: не выявляемое при текущих экспериментальных условиях.
Как описано в настоящем примере, из 80 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ1-39Jκ5, протестированных на их способность блокировать связывание антигена Е с покрытой лигандом Y поверхностью, 22 демонстрировали >50% блокирование, в то время как 58 демонстрировали <50% блокирование (20 с 25-50% блокированием и 38 с <25% блокированием). Для 18 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ3-20Jκ1, одно демонстрировало >50% блокирование, в то время как 17 демонстрировали <50% блокирование (5 с 25-50% блокированием и 12 с <25% блокированием) связывания антигена Е с покрытой лигандом Y поверхностью.
Эти результаты также согласуются с результатами для пула специфичных к антигену Е антител с общей легкой цепью, содержащего антитела с перекрывающимися и неперекрывающимися специфичностями к эпитопам в отношении антигена Е.
Пример 9
Определение аффинности по BIACORE™ для антиген-специфичных антител с общей легкой цепью
Равновесные константы диссоциации (KD) для отобранных супернатантов с антителами определяли с помощью SPR (поверхностный плазменный резонанс) с применением устройства Т100 BIACORE™ (GE Healthcare). Все данные получали с помощью HBS-EP (10 мМ Hepes, 150 мМ NaCl, 0,3 мМ ЭДТА, 0,05% поверхностно-активное вещество Р20, рН 7,4) в качестве как подвижного буфера, так и буфера для образца, при 25°С. Производили захват антител из неочищенных образцов супернатанта на поверхности сенсорного чипа СМ5, предварительно дериватизированной высокой плотностью антител к Fc человека, с применением стандартных химических способов связывания по аминогруппе. В ходе этапа захвата супернатанты вводили по поверхности с антителами к Fc человека со скоростью потока 3 мкл/мин в течение всего 3 минут. После этапа захвата вводили либо подвижный буфер, либо аналит с концентрацией 100 нМ в течение 2 минут при скорости потока 35 мкл/мин. Диссоциацию антигена от захваченного антитела отслеживали в течение 6 минут. Захваченное антитело удаляли быстрым введением 10 мМ глицина, рН 1,5. Все сенсограммы сопоставили по отношению к двум контрольным путем вычитания сенсограмм, полученных в результате введений буфера, из сенсограмм для аналита, таким образом удаляя артефакты, вызванные диссоциацией антитела от поверхности захвата. Данные по связыванию для каждого антитела аппроксимировали с моделью связывания 1:1 при помощи массового переноса с применением программного обеспечения BIAcore T100 Evaluation software v2.1. Результаты показаны в таблицах 11 и 12.
Аффинности связывания антител с общей легкой цепью, содержащих показанные в таблицах 5 и 6 перестройки, варьировали, причем почти все демонстрировали KD в наномолярном диапазоне. Данные по аффинности согласовываются с данными для антител с общей легкой цепью, полученных в результате комбинаторного связывания описанных в таблицах 5 и 6 перестроенных вариабельных доменов, являющихся высокоаффинными, клонально отобранными и подвергнутыми соматической мутации. В сочетании с ранее показанными данными, описанные в таблицах 5 и 6 антитела с общей легкой цепью представляют собой коллекцию разнообразных высокоаффинных антител, которые демонстрируют специфичность к одному или нескольким эпитопам на антигене Е.
Пример 10
Определение специфичностей связывания антиген-специфичных антител с общей легкой цепью при помощи анализа LUMINEX™
Отобранные антитела к антигену Е с общей легкой цепью тестировали на их способность связываться с ECD антигена Е и вариантами ECD антигена Е, в том числе ортолога яванского макака (антиген Е Mf), который отличается от человеческого белка примерно в 10% его аминокислотных остатков; делеционного мутанта антигена Е без последних 10 аминокислот с С-конца ECD (антиген Е-АСТ); и двух мутантов, содержащих аланиновую замену в предполагаемых местоположениях взаимодействия с лигандом Y (антиген Е-Ala1 и антиген Е-Ala2). Белки антигена Е получали в клетках СНО и каждый из них содержал С-концевую метку myc-myc-His.
Для исследований связывания белок или варианты белок антигена Е с ECD (описанные выше) из 1 мл культуральной среды захватывали путем инкубирования в течение 2 часов при комнатной температуре с 1×106 микроносителей-микрогранул (LUMINEX™) с нанесенным посредством ковалентного связывания моноклональным антителом к myc (MAb 9E10, линия клеток гибридомы CRL-1729™; АТСС, Манассас, Вирджиния). Затем микроносители перед использованием промывали посредством PBS. Супернатанты, содержащие антитела к антигену Е с общей легкой цепью, разводили 1:4 в буфере и вносили в 96-луночные планшеты с фильтром. В качестве отрицательного контроля использовали суррогатный супернатант без антитела. Микроносители, содержавшие захваченные белки антигена Е, затем вносили в образцы с антителами (3000 микрогранул на лунку) и инкубировали в течение ночи при 4°С. Через день микроносители образцов промывали и связавшиеся антитела с общей легкой цепью выявляли с помощью конъюгированного с R-фикоэритрином антитела к IgG человека. Интенсивность флуоресценции микроносителей (примерно 100 микроносителей, подсчитанных на каждый образец антитела, связывающегося с каждым белком антигена Е) измеряли с помощью анализатора на основе проточной цитометрии LUMINEX™ и регистрировали медианную интенсивность флуоресценции (MFI) для по меньшей мере 100 подсчитанных микроносителей на взаимодействие микроноситель/антитело. Результаты показаны в таблицах 13 и 14.
Супернатанты с антителом к антигену Е с общей легкой цепью демонстрировали высокоспецифичное связывание с микроносителями с присоединенным ECD антигена Е. Для этих микроносителей суррогатные супернатанты отрицательного контроля давали в результате пренебрежимо малый сигнал (<10 MFI) при объединении с образцом микроносителей с ECD антигена Е, в то время как супернатанты, содержавшие антитела к антигену Е с общей легкой цепью, демонстрировали сильный сигнал связывания (средняя MFI 2627 для 98 супернатантов с антителами; MFI>500 для 91/98 образцов антител).
В качестве меры способности отобранных антител к антигену Е с общей легкой цепью выявлять различные эпитопы на ECD антигена Е определяли относительное связывание антител с вариантами. Все четыре варианта антигена Е захватывали при помощи микроносителей с антителами к myc LUMINEX™, как описано выше для исследований связывания с ECD нативного антигена Е, и определяли соотношения относительного связывания (МFIварианта/MFIECD антигена E). У показанных в таблицах 12 и 13 98 протестированных супернатантов с антителами с общей легкой цепью средние соотношения (МFIварианта/MFIECD антигена E) отличались для каждого варианта, вероятно отражая различные количестве захвата белков на микроносителях (средние соотношения, составляющие 0,61, 2,9, 2,0 и 1,0 для ДСТ антигена Е, Ala1 антигена Е, Ala2 антигена Е и антигена Е Mf, соответственно). Для каждого варианта белка связывание с подгруппой из 98 протестированных антител с общей легкой цепью демонстрировало сильно сниженное связывание, что указывает на чувствительность к мутации, которой характеризуется данный вариант. Например, 19 из образцов антител с общей легкой цепью связывались с антигеном Е Mf с МFIварианта/MFIECD антигена E<8%. Поскольку многие в этой группе включают антитела с высокой или умеренно высокой аффинностью (5 с KD<5 нМ, 15 с KD<50 нМ), то вероятно, что более низкий сигнал для этой группы скорее является результатом чувствительности к различиям последовательностей (эпитопов) между ECD нативного антигена Е и данным вариантом, чем более низких аффинностей.
Эти данные доказывают, что описанные в таблицах 5 и 6 антитела с общей легкой цепью представляют собой разнообразную группу специфичных к антигену Е антител с общей легкой цепью, которые специфично распознают несколько эпитопов на антигене Е.
Реферат
Изобретение относится к области биотехнологии и генетической инженерии. Описана генетически модифицированная мышь, причем у мыши экспрессируется репертуар иммуноглобулиновых легких цепей, характеризуемый ограниченным числом вариабельных доменов легкой цепи. Также описаны мыши, у которых экспрессируется только один или несколько вариабельных доменов иммуноглобулиновой легкой цепи из ограниченного репертуара у их зародышевой линии. Описаны способы получения вариабельных участков легкой цепи мышей, в том числе человеческих вариабельных участков легкой цепи и способы получения человеческих вариабельных участков, подходящих для применения в мультиспецифических связывающих белках, например биспецифических антителах. 10 н. и 21 з.п. ф-лы, 9 ил., 14 табл., 10 пр.

Комментарии