Новая форма il33, мутировавшие формы il33, антитела, анализы и способы их применения - RU2736299C2
Код документа: RU2736299C2
Чертежи

















































Описание
[1] Настоящее раскрытие относится к новым формам IL-33; новым мутантам IL-33; связывающим белкам, таким как антитела, специфические в отношении любого из указанных белков, в частности, связывающим белкам, способным модулировать количество указанной присутствующей формы; композициям, содержащим белок или связывающий белок, такой как антитело в соответствии с настоящим раскрытием; и применению любого из них, в частности, в терапии, например, в лечении или предупреждении воспалительного заболевания. Раскрытие в данном документе также распространяется на анализы для идентификации и/или количественной оценки различных форм IL-33.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[2] Интерлейкин-33 (IL-33), также называемый IL-1F11, является представителем семейства IL-1 цитокинов, которые стимулируют образование клеток, цитокинов и иммуноглобулинов, характерных для иммунного ответа второго типа. IL-33 представляет собой белок из 270 аминокислот, состоящий из двух доменов: гомеодомена и цитокинового (IL-1-подобного) домена. Гомеодомен содержит сигнал ядерной локализации (NLS). IL-33 опосредует передачу сигнала через ST2, рецептор, экспрессируемый на клетках Th2, мастоцитах и широком спектре других типов клеток.
[3] Schmitz et al. впервые идентифицировали IL-33 в качестве лиганда для орфанного рецептора ST2 (также называемого IL-1R4) (Schmitz et al., Immunity 23(5)479-90 (2005)). Рецептор IL-33 образован из гетеродимерных молекул. ST2 и вспомогательный белок IL-1R (IL-1RAcP) димеризуются с образованием рецептора IL-33 (ST2:IL-1RAcP). IL-1RAcP представляет собой общий компонент рецепторов для IL-1α, IL-1β, IL-1F6, IL1F8 и IL1F9. IL-1RAcP не требуется для связывания, но является критически важным для передача сигнала. TIR-домен рецептора IL-33 привлекает MyD88 и TRAF6, и сигнал рецептора приводит к активации NFκB и МАР-киназного путей (Oboki et al., Allergology International 59:143-160 (2010)). Рецептор IL-33 может потенциально ассоциироваться с другими рецепторами, и сообщалось, что он взаимодействует с c-kit на мастоцитах (Drube et al., Blood 115:3899-3906 (2010)).
[4] Недавно было показано, что IL-33 связывается со вторым гетеродимерным рецепторным комплексом к IL-33: ST2 также образует комплекс с другой молекулой семейства IL-1R, "IL-1R-подобным рецептором, содержащим одну молекулу Ig" (SIGIRR) (также называемой Toll IL-1R8 (TIR8)) с образованием ST2:SIGIRR. Считается, что SIGIRR/TIR8 выступает в качестве отрицательного регулятора иммунных ответов, опосредованных IL-1R и Toll-подобным рецептором (TLR) (Garlanda et al., Trends Immunol. 30:439-46 (2009)). В отличие от ST2:IL-1RAcP, ST2:SIGIRR, по всей видимости, выступает в качестве отрицательного регулятора IL-33 (Oboki et al. (2010)).
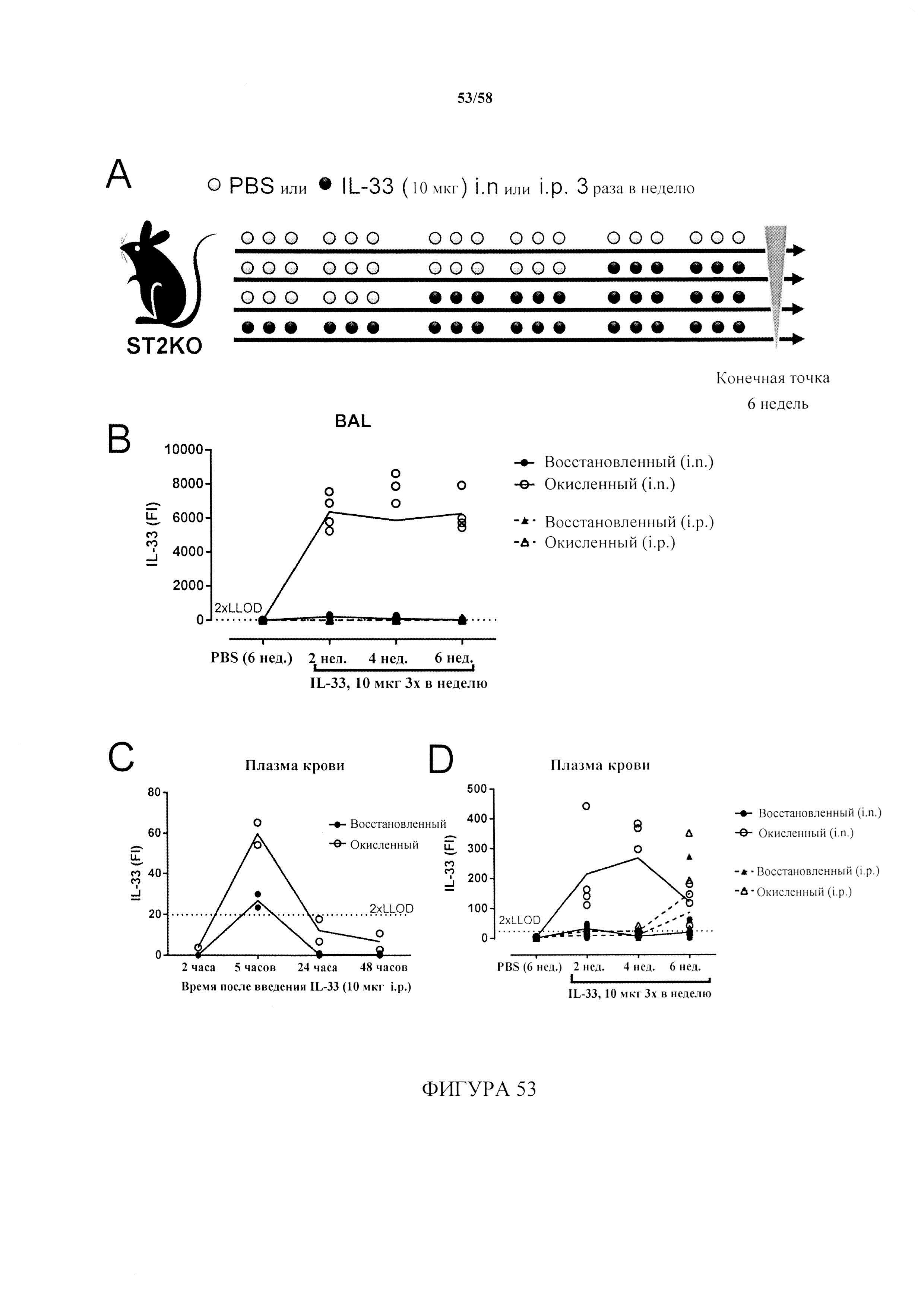
[5] Единственным известным лигандом рецептора ST2 является IL-33 (см., например, Schmitz et al., Immunity 23(5)479-90 (2005); Chackerian et al., J. Immunol. 179(4):2551-5 (2007)). Рецептор ST2 экспрессируется на базовом уровне клетками Th2 и мастоцитами, причем известно, что оба типа клеток являются важными медиаторами аллергической астмы. Внеклеточная форма IL-33 стимулирует клетки-мишени путем связывания с ST2 и затем активирует NFκB и МАР-киназный пути, что приводит к ряду функциональных ответов, включая выработку цитокинов и хемокинов. Считается, что растворимый ST2 (sST2) является рецептором-ловушкой, предупреждающим передачу сигнала с участием IL-33.
[6] Было обнаружено, что IL-33 конститутивно экспрессируется в гладкой мускулатуре и в эпителии бронхов у человека. Экспрессия может индуцироваться под действием IL-1β и TNF-α в фибробластах легких и дермы (Schmitz et al. (2005)). Уровни растворимого белка ST2 и мРНК/белка IL-33 повышены в сыворотке крови и тканях от пациентов с астмой (Oboki et al., Allergology International 59:143-160 (2010)).
[7] In vivo IL-33 индуцирует экспрессию IL-4, IL-5 и IL-13 и приводит к тяжелым патологическим изменениям в органах, выстланных слизистой оболочкой. Введение IL-33 мышам оказывает сильные воспалительные эффекты, включая выраженную эозинофилию крови, повышенные уровни IL-5 и IgE в сыворотке крови и гиперплазию бокаловидных клеток на поверхностях слизистых оболочек (Schmitz et al. (2005)). Внутрибрюшинное или интраназальное введение IL-33 мышам приводило к индукции эозинофильного воспаления в слизистых оболочках легких и кишечника посредством IL-13- и STAT6-зависимых путей (Oboki et al. (2010)). Соответственно, IL-33 может играть роль в аллергических заболеваниях, таких как астма и другие воспалительные заболевания дыхательных путей.
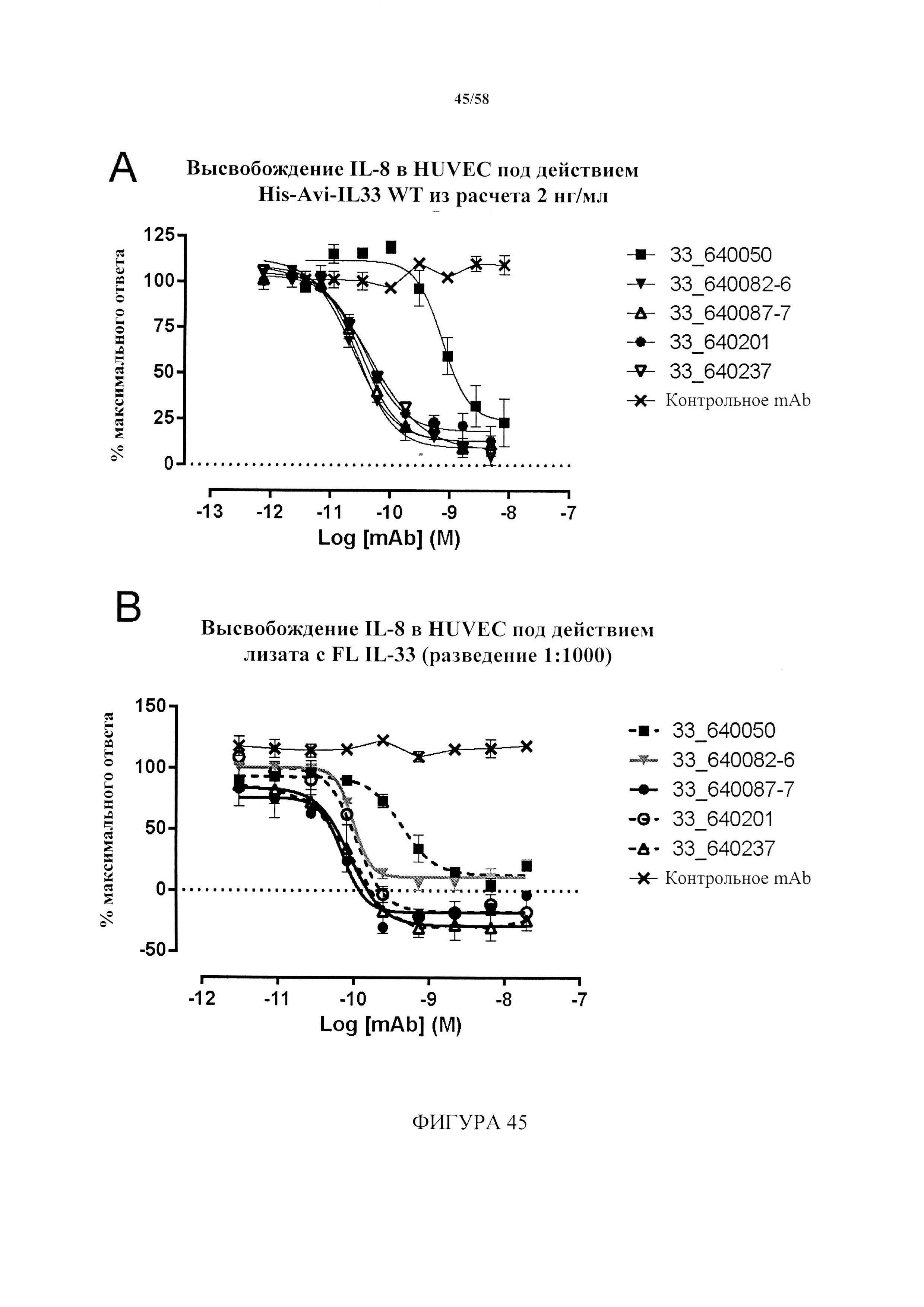
[8] В некоторых сообщениях в литературе высказывается предположение, что бокаловидные клетки секретируют CXCL8/IL-8, и их число повышается под действием IL-33 посредством ST2R-ERK-пути, что предполагает механизм усиленного воспаления дыхательных путей в дыхательных путях больного астмой, связанный с метаплазией бокаловидных клеток (Clin Exp Allergy. 2014 Apr; 44(4):540-52)
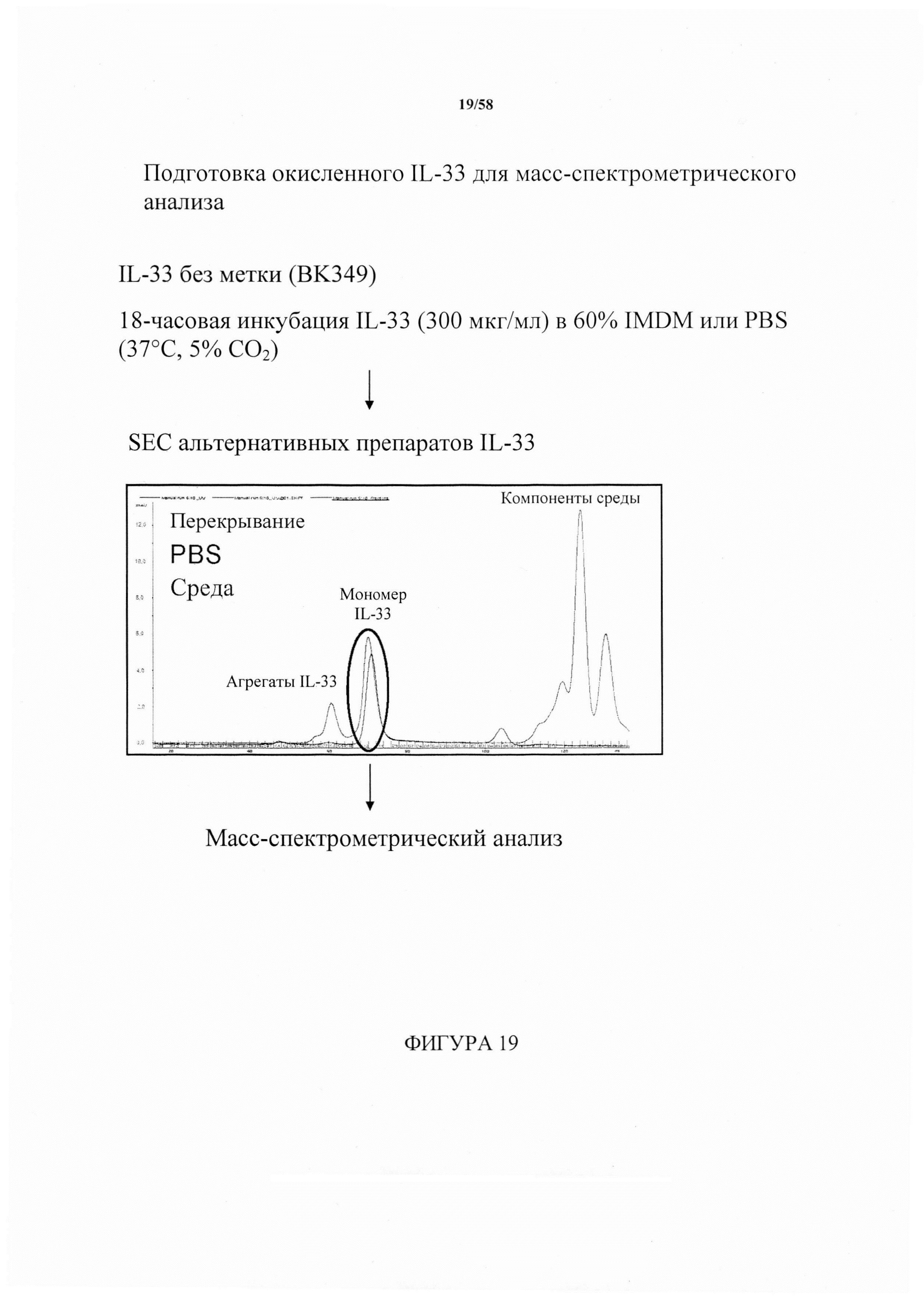
[9] Следовательно, возник интерес к IL-33 в качестве терапевтической мишени. Однако на данный момент терапевтические преимущества блокирования данной терапевтической мишени установлены еще не полностью. Авторы настоящего изобретения впервые установили, что IL-33 существует в восстановленной форме (также обозначаемой в данном документе как redIL-33) и окисленной форме. Авторы настоящего изобретения впервые охарактеризовали окисленную форму IL-33, как описано в данном документе. In vitro и in vivo исследования авторов настоящего изобретения показали, что исчезновение redIL-33 (восстановленной формы) коррелирует с появлением окисленного IL-33. В физиологических жидкостях in vitro redIL-33 быстро окислялся с образованием формы с дисульфидными связями. Окисленная форма (также обозначаемая в данном документе как IL-33-DSB) содержит по меньшей мере одну (например, две) дисульфидные связи между остатками цистеина, выбранными из группы Cys208, Cys 227, Cys 232 и Cys259 (пронумерованы в соответствии с полноразмерным IL-33 человека, как раскрыто в UniProt O97560, остатки 112-270 из которого изложены в пределах SEQ ID NO. 632). Ранее было не понятно, что коммерчески доступные анализы, по-видимому, преимущественно обнаруживают эту окисленную форму. Следовательно, авторам настоящего изобретения необходимо было разработать анализы для селективного обнаружения redIL-33, который обеспечивает взаимодействие с ST2 и управляет биологической активностью, ассоциированной с высвобождением IL-33.
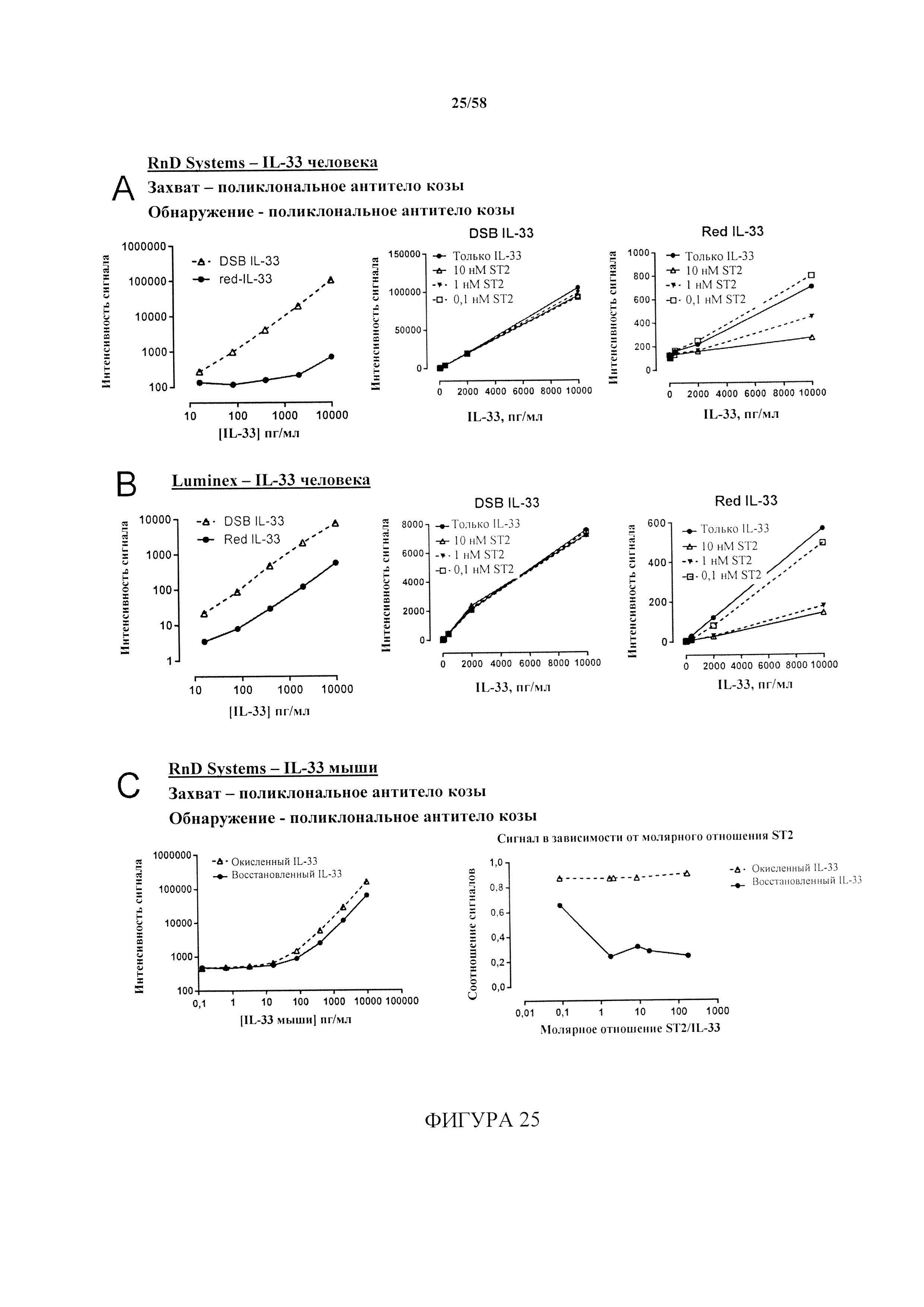
[10] Восстановленная форма, по-видимому, является активной формой белка, приводящей к сигнальному каскаду, и в действительности оказалось, что восстановленная форма in vivo превращается в окисленную форму в качестве механизма завершения передачи сигнала посредством ST2. Авторы настоящего изобретения обнаружили, что redIL-33 связывает ST2 (фиг. 24А). В отличие от этого, для IL-33-DSB не показано связывание ST2 (фиг. 24В). Это привело авторов настоящего изобретения к гипотезе, что окисление in vivo может представлять собой механизм выключения активности IL-33-ST2. Кроме того, авторы настоящего изобретения впервые установили, что окисленная форма IL-33 (IL-33-DSB) связывается с рецептором конечных продуктов усиленного гликирования (RAGE) и передает сигналы посредством этого альтернативного пути (фиг. 56).
[11] Авторы настоящего изобретения полагают, что данное понимание можно использовать для создания более эффективных терапевтических средств. В одном варианте осуществления авторы настоящего изобретения идентифицировали антитело, которое преимущественно связывает окисленную форму, но, неожиданным образом, ослабляет активность восстановленной формы, фактически катализируя преобразование восстановленной формы в окисленную форму. Преимущественно этот механизм просто усиливает in vivo механизм завершения передачи сигнала посредством ST2.
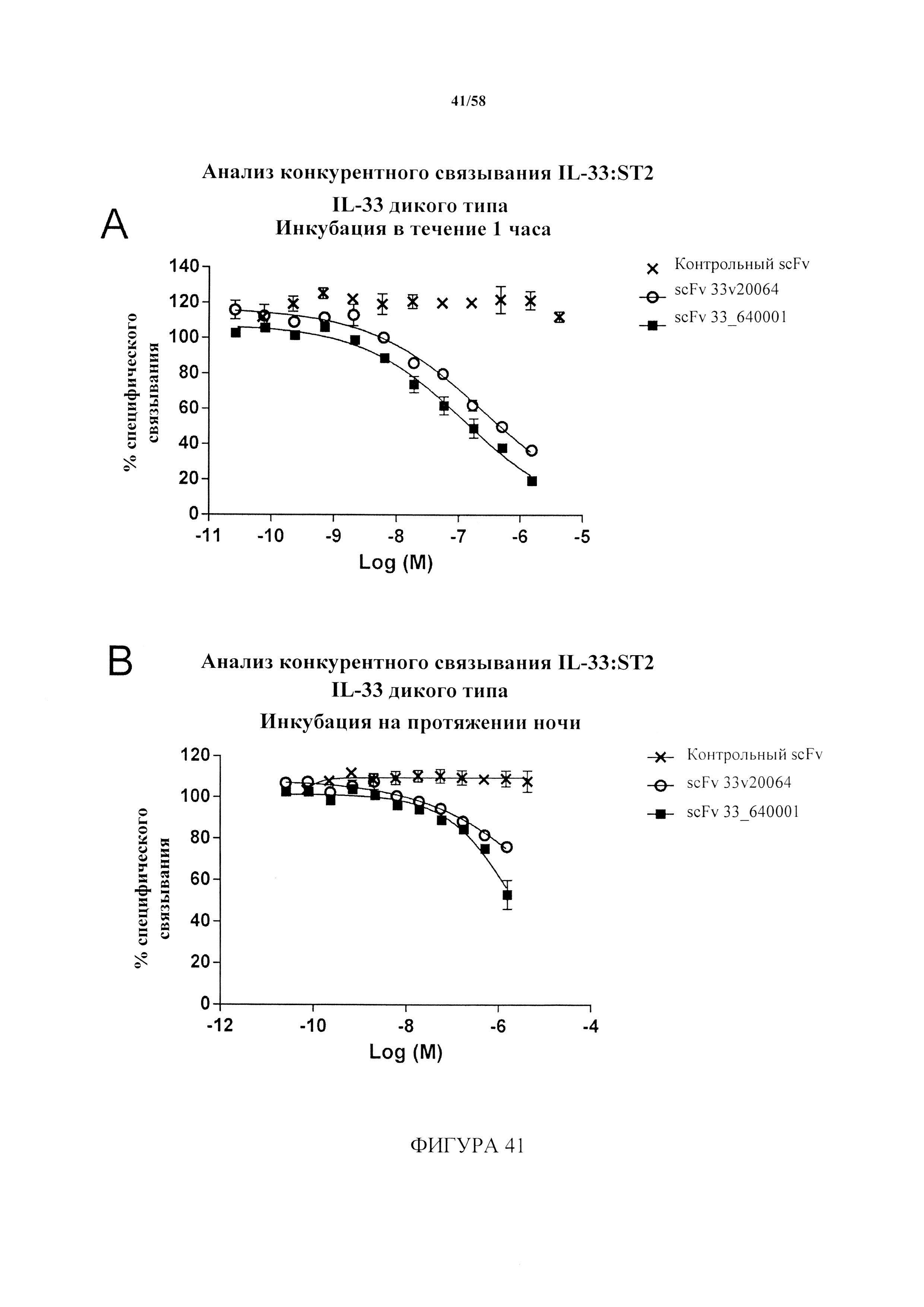
[12] В другом варианте осуществления авторы настоящего изобретения идентифицировали антитело, которое преимущественно связывает восстановленную форму IL-33 (redIL-33), с фемтомолярной аффинностью, и ослабляет и/или ингибирует IL-33-опосредованную передачу сигнала посредством ST2. Данное антитело впервые обеспечило механизм лечения или предупреждения IL-33/ST2-опосредованных воспалительных ответов.
[13] В еще одном дополнительном варианте осуществления антитела по настоящему изобретению могут ослаблять или ингибировать ранее нераспознанный путь передачи сигнала для IL-33-DSB посредством RAGE и любые эффекты, опосредованные IL-33/RAGE. Антитела по настоящему изобретению могут действовать путем связывания IL-33-DSB напрямую и ослабления или ингибирования взаимодействия лиганд/рецептор с RAGE или, альтернативно, могут связываться с redIL-33 и предупреждать или снижать его преобразование в IL-33-DSB, тем самым опосредованно ослабляя или ингибируя взаимодействие лиганда/рецептора с RAGE.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[14] Таким образом, в первом аспекте представлен выделенный IL-33 в восстановленной форме (redIL-33) или его связывающий фрагмент.
[15] В одном аспекте представлен выделенный белок IL-33, стабилизированный в восстановленной форме с помощью модификации, которая предупреждает образование дисульфидных мостиков между нативными остатками цистеина. Такие модификации могут включать делецию одного или нескольких цистеиновых остатков, мутации, при которых один или несколько нативных остатков цистеина замещаются альтернативной аминокислотой, и/или конъюгацию с химической структурной единицей.
[16] В одном варианте осуществления представлена мутированная форма IL-33, описанная в данном документе, в частности, как показано в SEQ ID NO: 634-648.
[17] В одном варианте осуществления химическая структурная единица представляет собой биотин, который снижает или устраняет способность redIL-33 превращаться в IL-33-DSB.
[18] В одном аспекте представлен мутантный IL-33, где один или несколько остатков цистеина замещены аминокислотой, отличной от цистеина, например, где один, два, три, четыре или больше остатков цистеина, выбранных из Cys-208, Cys-227, Cys-232 и Cys-259, замещены, например, аминокислотой, такой как серин. В одном варианте осуществления цистеиновый остаток независимо выбран из Cys-208, Cys-227, Cys-232 и Cys-259. Таким образом, в одном варианте осуществления мутант в соответствии с настоящим раскрытием не способен образовывать одну или обе дисульфидные связи в IL-33-DSB.
[19] В одном варианте осуществления настоящее раскрытие относится к выделенной связывающей молекуле, которая ослабляет активность redIL-33, включая его стабилизированную форму в соответствии с настоящим раскрытием, например, ингибирует указанную активность. В одном варианте осуществления ослабление происходит посредством специфического связывания redIL-33. В одном варианте осуществления ослабление происходит посредством связывания IL-33-DSB и, например, катализирования или ускорения преобразования redIL-33 в IL-33-DSB.
[20] В одном варианте осуществления ослабление подавляет или выключает ST2-зависимую передачу сигнала.
[21] В определенных вариантах осуществления связывающая молекула, или антитело, или их антигенсвязывающий фрагмент по настоящему раскрытию ингибируют управляемую IL-33 выработку цитокинов, например, в мастоцитах.
[22] В одном варианте осуществления ослабление подавляет или предупреждает высвобождение IL-5, образованного в результате пути ST2.
[23] В одном варианте осуществления ослабление подавляет или предупреждает активацию эозинофилов.
[24] В одном варианте осуществления ослабление подавляет или предупреждает высвобождение NFκB. В одном варианте осуществления ослабление подавляет или предупреждает высвобождение IL-4. В одном варианте осуществления ослабление подавляет или предупреждает высвобождение IL-6. В одном варианте осуществления ослабление подавляет или предупреждает высвобождение IL-8. В одном варианте осуществления ослабление подавляет или предупреждает высвобождение IL-13.
[25] В определенных вариантах осуществления связывающая молекула, или антитело, или их антигенсвязывающий фрагмент по настоящему раскрытию ослабляют или ингибируют IL-33/RAGE-опосредованную передачу сигнала. Ослабление или ингибирование RAGE-опосредованной передачи сигнала может усиливать миграцию эпителиальных клеток относительно такой, которая наблюдается при немодулированном управляемом IL-33 воспалительном ответе (см. фиг. 58). Такая усиленная миграция эпителиальных клеток может играть роль в восстановлении тканей и заживление ран, в частности, в легочной ткани, такой как эпителий легких.
[26] В одном варианте осуществления настоящее раскрытие относится к выделенной связывающей молекуле, которая специфически связывается с redIL-33 или связывающим фрагментом redIL-33.
[27] В одном варианте осуществления настоящее раскрытие относится к выделенной связывающей молекуле, которая специфически связывается с redIL-33 и ингибирует его связывание с ST2.
[28] В одном варианте осуществления настоящее раскрытие относится к выделенной связывающей молекуле, которая специфически связывается с redIL-33 и ингибирует передачу сигнала с участием redIL-33 путем физического блокирования взаимодействия IL-33 с его рецептором.
[29] В одном варианте осуществления настоящее раскрытие относится к молекуле, которая связывает IL-33 и катализирует преобразование redIL-33 в IL-33-DSB, тем самым подавляя или выключая передачу сигнала с участием ST2.
[30] В одном варианте осуществления настоящее раскрытие относится к связывающей молекуле с конкурентным механизмом действия.
[31] В одном варианте осуществления настоящее раскрытие относится к связывающей молекуле с аллостерическим механизмом действия.
[32] В некоторых вариантах осуществления связывающая молекула по настоящему изобретению предусматривает антитело или его антигенсвязывающий фрагмент.
[33] В следующей формуле используется однобуквенный аминокислотный код.
[34] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I):

где Х представляет собой аминокислоту, например, S или N, как, например, S.
[35] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH2 формулы (II):

где
X1 представляет собой A, G или S, в частности, А или G, как, например. А;
Х2 представляет собой A, D, G, N, S, в частности. A, D или S, как, например, S;
Х3 представляет собой А, D или G, в частности, А или G, как, например, G
Х4 отсутствует или представляет собой D, в частности, отсутствует;
Х5 отсутствует или представляет собой G, в частности, отсутствует;
Х6 представляет собой D, I или S, в частности, I или S, как, например, S;
Х7 представляет собой D, F, G или S, в частности, D или G, как, например, G;
Х8 представляет собой D, G, Q, S, Т, в частности, G, Q или Т, как, например, G;
Х9 представляет собой R или S, в частности, S;
Х10 представляет собой Р или Т, в частности, Р;
Х11 представляет собой Н или Y, в частности, Y; и
X12 представляет собой Р или S, в частности, S.
[36] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH3 формулы (III):

где
X13 представляет собой A, D, Н, L или Q, в частности, D или Q, как, например, D;
Х14 представляет собой K или L, в частности, K;
X15 представляет собой F или W, в частности, F;
X16 представляет собой I или М, в частности, М;
X17 представляет собой Q или Е, в частности, Q;
X18 представляет собой L или N, в частности, L;
X19 представляет собой W или Y, в частности, W;
Х20 представляет собой A, G или V, в частности, G; и
Х21 представляет собой F или L, в частности, F.
[37] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I) и CDRH2 формулы (II), как определено выше.
[38] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I) и CDRH3 формулы (III), как определено выше.
[39] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH2 формулы (II) и CDRH3 формулы (III), как определено выше.
[40] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), и CDRH2 формулы (II), и CDRH3 формулы (III), как определено выше.
[41] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRL1 формулы (IV):

где
Х22 представляет собой аминокислоту, например, R или G, в частности, R; и
Х23 представляет собой аминокислоту, например, М или I, в частности, М.
[42] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRL2 формулы (V):

где
Х24 представляет собой аминокислоту, например, Q или R, в частности, R.
[43] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRL3 формулы (VI):

где
Х25 представляет собой Е, G или Q, в частности, G или Q, как, например, G;
Х26 представляет собой I, K, L или W, в частности, L или W, как, например, W;
Х27 представляет собой A, D, K, Q, R или V, в частности, D или K, как, например, K;
Х28 представляет собой А, D, K, Q или S, в частности, Q или S, как, например, S;
X29 представляет собой D, N или S, в частности, D или S, как, например, D;
Х30 представляет собой D, S или Т, в частности, D или S, как, например, D;
Х31 отсутствует или представляет собой Т, в частности, отсутствует;
Х32 представляет собой G или Р в частности, G; и
Х33 представляет собой I или V в частности, V.
[44] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRL1 формулы (IV) и CDRL2 формулы (V), как определено выше.
[45] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRL1 формулы (IV) и CDRL3 формулы (VI), как определено выше.
[46] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRL2 формулы (V) и CDRL3 формулы (VI), как определено выше.
[47] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRL1 формулы (IV), и CDRL2 формулы (V), и CDRL3 формулы (VI), как определено выше.
[48] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I) и CDRL1 формулы (IV).
[49] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I) и CDRL2 формулы (V).
[50] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I) и CDRL3 формулы (VI).
[51] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH2 формулы (II) и CDRL1 формулы (IV).
[52] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH2 формулы (II) и CDRL2 формулы (V).
[53] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH2 формулы (II) и CDRL3 формулы (VI).
[54] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH3 формулы (III) и CDRL1 формулы (IV).
[55] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH3 формулы (III) и CDRL2 формулы (V).
[56] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH3 формулы (III) и CDRL3 формулы (VI).
[57] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II) и CDRL1 формулы (IV).
[58] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II) и CDRL2 формулы (V).
[59] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II) и CDRL3 формулы (VI).
[60] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH3 формулы (III) и CDRL1 формулы (IV).
[61] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH3 формулы (III) и CDRL2 формулы (V).
[62] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH3 формулы (II) и CDRL3 формулы (VI).
[63] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH2 формулы (II), CDRH3 формулы (III) и CDRL1 формулы (IV).
[64] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH2 формулы (II), CDRH3 формулы (III) и CDRL2 формулы (V).
[65] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH2 формулы (II), CDRH3 формулы (II) и CDRL3 формулы (VI).
[66] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II), CDRH3 формулы (III) и CDRL1 формулы (IV).
[67] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II), CDRH3 формулы (III) и CDRL2 формулы (V).
[68] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II), CDRH3 формулы (II) и CDRL3 формулы (VI).
[69] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II), CDRH3 формулы (III), CDRL1 формулы (IV) и CDRL2 формулы (V).
[70] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II), CDRH3 формулы (III), CDRL1 формулы (IV) и CDRL3 формулы (VI).
[71] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II), CDRH3 формулы (II), CDRL2 формулы (V) и CDRL3 формулы (VI).
[72] В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, содержит CDRH1 формулы (I), CDRH2 формулы (II), CDRH3 формулы (II), CDRL1 формулы (IV), CDRL2 формулы (V) и CDRL3 формулы (VI).
[73] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит 3 CDR, например, в вариабельной области тяжелой цепи, независимо выбранные из SEQ ID NO: 3, 4, 5, 13, 14, 15, 23, 24, 25, 33, 34, 35, 43, 44, 45, 53, 54, 55, 63, 64, 65, 73, 74, 75, 83, 84, 85, 93, 94, 95, 103, 104, 105, 113, 114, 115, 153, 154, 155, 163, 164, 165, 173, 174, 175, 183, 184, 185, 193, 194, 195, 203, 204, 205, 213, 214, 215, 223, 224, 225, 233, 234, 235, 243, 244, 245, 253, 254, 255, 263, 264, 265, 273, 274, 275, 283, 284, 285, 293, 294, 295, 303, 304, 305, 313, 314, 315, 353, 354, 355, 363, 364, 365, 373. 374, 375, 383, 384, 385, 393, 394, 395, 403, 404, 405, 413, 414, 415, 453, 454, 455, 463, 464, 465, 473, 474, 475, 483, 484, 485, 493, 494, 495, 503, 504, 505, 513, 514, 515, 553, 554, 555, 563, 564, 565, 573, 574,575,583, 584 и 585.
[74] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит 3 CDR, например, в вариабельной области легкой цепи, независимо выбранные из SEQ ID NO: 8, 9, 10, 18, 19, 20, 28, 29, 30, 38, 39, 40, 48, 49, 50, 58, 59, 60, 68, 69, 70, 78, 79, 80, 88, 89, 90, 98, 99, 100, 108, 109, 118, 119, 120. 158, 159, 160, 168, 169, 170, 178, 179, 180, 188, 189, 190, 198, 199, 200, 208, 209, 210, 218, 219, 220, 228, 229, 230, 238, 239, 240, 248, 249, 250, 258, 259, 260, 268, 269, 270, 278, 279, 280, 288, 289, 290, 298, 299, 300 308, 309, 310, 318, 319, 320, 328, 329, 330, 338, 339, 340, 348, 349, 350, 358, 359, 360, 368, 369 370 378, 379, 380, 388, 389, 390, 398, 399, 400, 408, 409, 410, 418, 419, 420, 428, 429, 430, 438, 439, 440, 448, 449, 450, 458, 459, 460, 468, 469, 470, 478, 479, 480, 488, 489, 490, 498, 499, 500 508, 509, 510, 518, 519, 520, 528, 529, 530, 538, 539, 540, 548, 549, 550, 558, 559, 560, 568, 569, 570, 578, 579, 580, 588, 589 и 590.
[75] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит 3 CDR, например, в вариабельной области тяжелой цепи, независимо выбранные из SEQ ID NO: 3, 4, 5, 13, 14, 15, 23, 24, 25, 33, 34, 35, 43, 44, 45, 53, 54, 55, 63, 64, 65, 73, 74, 75, 83, 84, 85, 93, 94, 95, 103, 104, 105, 113, 114, 115, 153, 154, 155, 163, 164, 165, 173, 174, 175, 183, 184, 185, 193, 194, 195, 203, 204, 205, 213, 214, 215, 223, 224, 225, 233, 234, 235, 243, 244, 245, 253, 254, 255, 263, 264, 265, 273, 274, 275, 283, 284, 285, 293, 294, 295, 303, 304, 305, 313, 314, 315, 353, 354, 355, 363, 364, 365, 373, 374, 375, 383, 384, 385, 393, 394, 395, 403, 404, 405, 413, 414, 415, 453, 454, 455, 463, 464, 465, 473, 474, 475, 483, 484, 485, 493, 494, 495, 503, 504, 505, 513, 514, 515, 553, 554, 555, 563, 564, 565, 573, 574, 575, 583, 584 и 585, и 3 CDR, например, в вариабельной области легкой цепи, независимо выбранные из SEQ ID NO: 8, 9, 10, 18, 19, 20, 28, 29, 30, 38, 39, 40, 48, 49, 50, 58, 59, 60, 68, 69, 70, 78, 79, 80, 88, 89, 90, 98, 99, 100, 108, 109, 118, 119, 120, 158, 159, 160, 168, 169, 170, 178, 179, 180, 188, 189,190, 198, 199, 200, 208, 209, 210, 218, 219, 220, 228, 229, 230, 238, 239, 240, 248, 249, 250, 258, 259, 260, 268, 269, 270, 278, 279, 280, 288, 289, 290, 298, 299, 300 308, 309, 310, 318, 319, 320, 328, 329, 330, 338, 339, 340, 348, 349, 350, 358, 359, 360, 368, 369 370 378, 379, 380, 388, 389, 390, 398, 399, 400, 408, 409, 410, 418, 419, 420, 428, 429, 430, 438, 439, 440, 448, 449, 450, 458, 459, 460, 468, 469, 470, 478, 479, 480, 488, 489, 490, 498, 499, 500 508, 509, 510, 518, 519, 520, 528, 529, 530, 538, 539, 540, 548, 549, 550, 558, 559, 560, 568, 569, 570, 578, 579, 580, 588, 589 и 590.
[76] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 3, 4 и 5, например, SEQ ID NO: 3 и 4, SEQ ID NO: 3 и 5 или SEQ ID NO: 4 и 5, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 3 для CDRH1, SEQ ID NO: 4 для CDRH2 и SEQ ID NO: 5 для CDRH3.
[77] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 13, 14 и 15, например, SEQ ID NO: 13 и 14, SEQ ID NO: 13 и 15 или SEQ ID NO: 14 и 15, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 13 для CDRH1, SEQ ID NO: 14 для CDRH2 и SEQ ID NO: 15 для CDRH3.
[78] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 23, 24 и 25, например, SEQ ID NO: 23 и 24, SEQ ID NO: 23 и 25 или SEQ ID NO: 24 и 25, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 23 для CDRH1, SEQ ID NO: 24 для CDRH2 и SEQ ID NO: 25 для CDRH3.
[79] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 33, 34 и 35, например, SEQ ID NO: 33 и 34, SEQ ID NO: 33 и 35 или SEQ ID NO: 34 и 35, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 33 для CDRH1, SEQ ID NO: 34 для CDRH2 и SEQ ID NO: 35 для CDRH3.
[80] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 43, 44 и 45, например, SEQ ID NO: 43 и 44, SEQ ID NO: 43 и 45 или SEQ ID NO: 44 и 45, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 43 для CDRH1, SEQ ID NO: 44 для CDRH2 и SEQ ID NO: 45 для CDRH3.
[81] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 53, 54 и 55, например, SEQ ID NO: 53 и 54, SEQ ID NO: 53 и 55 или SEQ ID NO: 54 и 55, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 53 для CDRH1, SEQ ID NO: 54 для CDRH2 и SEQ ID NO: 55 для CDRH3.
[82] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 63, 64 и 65, например, SEQ ID NO: 63 и 64, SEQ ID NO: 63 и 65 или SEQ ID NO: 64 и 65, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 63 для CDRH1, SEQ ID NO: 64 для CDRH2 и SEQ ID NO: 65 для CDRH3.
[83] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 73, 74 и 75, например, SEQ ID NO: 73 и 74, SEQ ID NO: 73 и 75 или SEQ ID NO: 74 и 75, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 73 для CDRH1, SEQ ID NO: 74 для CDRH2 и SEQ ID NO: 75 для CDRH3.
[84] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 83, 84 и 85, например, SEQ ID NO: 83 и 84, SEQ ID NO: 83 и 85 или SEQ ID NO: 84 и 85, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 83 для CDRH1, SEQ ID NO: 84 для CDRH2 и SEQ ID NO: 85 для CDRH3.
[85] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 93, 94 и 95, например, SEQ ID NO: 93 и 94, SEQ ID NO: 93 и 95 или SEQ ID NO: 94 и 95, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 93 для CDRH1, SEQ ID NO: 94 для CDRH2 и SEQ ID NO: 95 для CDRH3.
[86] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 103, 104 и 105, например, SEQ ID NO: 103 и 104, SEQ ID NO: 103 и 105 или SEQ ID NO: 104 и 105, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 103 для CDRH1, SEQ ID NO: 104 для CDRH2 и SEQ ID NO: 105 для CDRH3.
[87] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 113, 114 и 115, например, SEQ ID NO: 113 и 114, SEQ ID NO: 113 и 115 или SEQ ID NO: 114 и 115, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 113 для CDRH1, SEQ ID NO: 114 для CDRH2 и SEQ ID NO: 115 для CDRH3.
[88] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 123, 124 и 125, например, SEQ ID NO: 123 и 124, SEQ ID NO: 123 и 125 или SEQ ID NO: 124 и 25, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 123 для CDRH1, SEQ ID NO: 124 для CDRH2 и SEQ ID NO: 125 для CDRH3.
[89] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 133, 134 и 135, например, SEQ ID NO: 133 и 134, SEQ ID NO: 133 и 135 или SEQ ID NO: 134 и 135, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 133 для CDRH1, SEQ ID NO: 134 для CDRH2 и SEQ ID NO: 135 для CDRH3.
[90] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 143, 144 и 145, например, SEQ ID NO: 143 и 144, SEQ ID NO: 143 и 145 или SEQ ID NO: 144 и 145, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 143 для CDRH1, SEQ ID NO: 144 для CDRH2 и SEQ ID NO: 145 для CDRH3.
[91] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 153, 154 и 155, например, SEQ ID NO: 153 и 154, SEQ ID NO: 153 и 155 или SEQ ID NO: 154 и 155, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 153 для CDRH1, SEQ ID NO: 154 для CDRH2 и SEQ ID NO: 155 для CDRH3.
[92] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 163, 164 и 165, например, SEQ ID NO: 163 и 164, SEQ ID NO: 163 и 165 или SEQ ID NO: 164 и 165, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 163 для CDRH1, SEQ ID NO: 164 для CDRH2 и SEQ ID NO: 165 для CDRH3.
[93] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 173, 174 и 175, например, SEQ ID NO: 173 и 174, SEQ ID NO: 173 и 175 или SEQ ID NO: 174 и 175, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 173 для CDRH1, SEQ ID NO: 174 для CDRH2 и SEQ ID NO: 175 для CDRH3.
[94] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 183, 184 и 185, например, SEQ ID NO: 183 и 184, SEQ ID NO: 183 и 185 или SEQ ID NO: 184 и 185, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 183 для CDRH1, SEQ ID NO: 184 для CDRH2 и SEQ ID NO: 185 для CDRH3.
[95] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 193, 194 и 195, например, SEQ ID NO: 193 и 194, SEQ ID NO: 193 и 95 или SEQ ID NO: 194 и 195, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 193 для CDRH1, SEQ ID NO: 194 для CDRH2 и SEQ ID NO: 195 для CDRH3.
[96] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 203, 204 и 205, например, SEQ ID NO: 203 и 204, SEQ ID NO: 203 и 205 или SEQ ID NO: 204 и 205, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 203 для CDRH1, SEQ ID NO: 204 для CDRH2 и SEQ ID NO: 205 для CDRH3.
[97] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 213, 214 и 215, например, SEQ ID NO: 213 и 214, SEQ ID NO; 213 и 215 или SEQ ID NO: 214 и 215, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 213 для CDRH1, SEQ ID NO: 214 для CDRH2 и SEQ ID NO: 215 для CDRH3.
[98] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 223, 224 и 225, например, SEQ ID NO: 223 и 224, SEQ ID NO: 223 и 225 или SEQ ID NO: 224 и 225, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 223 для CDRH1, SEQ ID NO: 224 для CDRH2 и SEQ ID NO: 225 для CDRH3.
[99] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 233, 234 и 235, например, SEQ ID NO: 233 и 234, SEQ ID NO: 233 и 235 или SEQ ID NO: 234 и 235, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 233 для CDRH1, SEQ ID NO: 234 для CDRH2 и SEQ ID NO: 235 для CDRH3.
[100] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 243, 244 и 245, например, SEQ ID NO: 243 и 244, SEQ ID NO: 243 и 245 или SEQ ID NO: 244 и 245, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 243 для CDRH1, SEQ ID NO: 244 для CDRH2 и SEQ ID NO: 245 для CDRH3.
[101] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 253, 254 и 255, например, SEQ ID NO: 253 и 254, SEQ ID NO: 253 и 255 или SEQ ID NO: 254 и 255, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 253 для CDRH1, SEQ ID NO: 254 для CDRH2 и SEQ ID NO: 255 для CDRH3.
[102] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 263, 264 и 265, например, SEQ ID NO: 263 и 264, SEQ ID NO: 263 и 265 или SEQ ID NO: 264 и 265, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 263 для CDRH1, SEQ ID NO: 264 для CDRH2 и SEQ ID NO: 265 для CDRH3.
[103] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 273, 274 и 275. например, SEQ ID NO: 273 и 274, SEQ ID NO: 273 и 275 или SEQ ID NO: 274 и 275, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 273 для CDRH1, SEQ ID NO: 274 для CDRH2 и SEQ ID NO: 275 для CDRH3.
[104] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 283, 284 и 285, например, SEQ ID NO: 283 и 284, SEQ ID NO: 283 и 285 или SEQ ID NO: 284 и 285, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 283 для CDRH1, SEQ ID NO: 284 для CDRH2 и SEQ ID NO: 285 для CDRH3.
[105] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 293, 294 и 295, например, SEQ ID NO: 293 и 294, SEQ ID NO: 293 и 295 или SEQ ID NO: 294 и 295, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 293 для CDRH1, SEQ ID NO: 294 для CDRH2 и SEQ ID NO: 295 для CDRH3.
[106] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 303, 304 и 305, например, SEQ ID NO: 303 и 304, SEQ ID NO: 303 и 305 или SEQ ID NO: 304 и 305, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 303 для CDRH1, SEQ ID NO: 304 для CDRH2 и SEQ ID NO: 305 для CDRH3.
[107] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 313, 314 и 315, например, SEQ ID NO: 313 и 314, SEQ ID NO: 313 и 315 или SEQ ID NO: 314 и 315, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 313 для CDRH1, SEQ ID NO: 314 для CDRH2 и SEQ ID NO: 315 для CDRH3.
[108] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 323, 324 и 325, например, SEQ ID NO: 323 и 324, SEQ ID NO: 323 и 325 или SEQ ID NO: 324 и 325, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 323 для CDRH1, SEQ ID NO: 324 для CDRH2 и SEQ ID NO: 325 для CDRH3.
[109] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 333, 334 и 335, например, SEQ ID NO: 333 и 334, SEQ ID NO: 333 и 335 или SEQ ID NO: 334 и 335, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 333 для CDRH1, SEQ ID NO: 334 для CDRH2 и SEQ ID NO: 335 для CDRH3.
[110] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 343, 344 и 345, например, SEQ ID NO: 343 и 344, SEQ ID NO: 343 и 345 или SEQ ID NO: 344 и 345, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 343 для CDRH1, SEQ ID NO: 344 для CDRH2 и SEQ ID NO: 345 для CDRH3.
[111] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 353, 354 и 355, например, SEQ ID NO: 353 и 354, SEQ ID NO: 353 и 355 или SEQ ID NO: 354 и 355, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 353 для CDRH1, SEQ ID NO: 354 для CDRH2 и SEQ ID NO: 355 для CDRH3.
[112] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 363, 364 и 365, например, SEQ ID NO: 363 и 364, SEQ ID NO: 363 и 365 или SEQ ID NO: 364 и 365, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 363 для CDRH1, SEQ ID NO: 364 для CDRH2 и SEQ ID NO: 365 для CDRH3.
[113] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 373, 374 и 375, например, SEQ ID NO: 373 и 374, SEQ ID NO: 373 и 375 или SEQ ID NO: 374 и 375, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 373 для CDRH1, SEQ ID NO: 374 для CDRH2 и SEQ ID NO: 375 для CDRH3.
[114] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 383, 384 и 385, например, SEQ ID NO: 383 и 384, SEQ ID NO: 383 и 385 или SEQ ID NO: 384 и 385, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 383 для CDRH1, SEQ ID NO: 384 для CDRH2 и SEQ ID NO: 385 для CDRH3.
[115] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 393, 394 и 395, например, SEQ ID NO: 393 и 394, SEQ ID NO: 393 и 395 или SEQ ID NO: 394 и 395, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 393 для CDRH1, SEQ ID NO: 394 для CDRH2 и SEQ ID NO: 395 для CDRH3.
[116] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 403, 404 и 405, например, SEQ ID NO: 403 и 404, SEQ ID NO: 403 и 405 или SEQ ID NO: 404 и 405, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 403 для CDRH1, SEQ ID NO: 404 для CDRH2 и SEQ ID NO: 405 для CDRH3.
[117] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 413, 414 и 415, например, SEQ ID NO: 413 и 414, SEQ ID NO: 413 и 415 или SEQ ID NO: 414 и 415, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 413 для CDRH1, SEQ ID NO: 414 для CDRH2 и SEQ ID NO: 415 для CDRH3.
[118] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 423, 424 и 425, например, SEQ ID NO: 423 и 424, SEQ ID NO: 423 и 425 или SEQ ID NO: 424 и 425, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 423 для CDRH1, SEQ ID NO: 424 для CDRH2 и SEQ ID NO: 425 для CDRH3.
[119] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 433, 434 и 435, например, SEQ ID NO: 433 и 434, SEQ ID NO: 433 и 435 или SEQ ID NO: 434 и 435, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 433 для CDRH1, SEQ ID NO: 434 для CDRH2 и SEQ ID NO: 435 для CDRH3.
[120] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 443, 444 и 445, например, SEQ ID NO: 443 и 444, SEQ ID NO: 443 и 445 или SEQ ID NO: 444 и 445, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 443 для CDRH1, SEQ ID NO: 444 для CDRH2 и SEQ ID NO: 445 для CDRH3.
[121] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 453, 454 и 455, например, SEQ ID NO: 453 и 454, SEQ ID NO: 453 и 455 или SEQ ID NO: 454 и 455, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 453 для CDRH1, SEQ ID NO: 454 для CDRH2 и SEQ ID NO: 455 для CDRH3.
[122] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 463, 464 и 465, например, SEQ ID NO: 463 и 464, SEQ ID NO: 463 и 465 или SEQ ID NO: 464 и 465, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 463 для CDRH1, SEQ ID NO: 464 для CDRH2 и SEQ ID NO: 465 для CDRH3.
[123] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 473, 474 и 475, например, SEQ ID NO: 473 и 474, SEQ ID NO: 473 и 475 или SEQ ID NO: 474 и 475, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 473 для CDRH1, SEQ ID NO: 474 для CDRH2 и SEQ ID NO: 475 для CDRH3.
[124] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 483, 484 и 485, например, SEQ ID NO: 483 и 484, SEQ ID NO: 483 и 485 или SEQ ID NO: 484 и 485, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 483 для CDRH1, SEQ ID NO: 484 для CDRH2 и SEQ ID NO: 485 для CDRH3.
[125] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 493, 494 и 495, например, SEQ ID NO: 493 и 494, SEQ ID NO: 493 и 495 или SEQ ID NO: 494 и 495, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 493 для CDRH1, SEQ ID NO: 494 для CDRH2 и SEQ ID NO: 495 для CDRH3.
[126] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 503, 504 и 505, например, SEQ ID NO: 503 и 504, SEQ ID NO: 503 и 505 или SEQ ID NO: 504 и 505, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 503 для CDRH1, SEQ ID NO: 504 для CDRH2 и SEQ ID NO: 505 для CDRH3.
[127] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 513, 514 и 515, например, SEQ ID NO: 513 и 514, SEQ ID NO: 513 и 515 или SEQ ID NO: 514 и 515, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 513 для CDRH1, SEQ ID NO: 514 для CDRH2 и SEQ ID NO: 515 для CDRH3.
[128] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 523, 524 и 525, например, SEQ ID NO: 523 и 524, SEQ ID NO: 523 и 525 или SEQ ID NO: 524 и 525, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 523 для CDRH1, SEQ ID NO: 524 для CDRH2 и SEQ ID NO: 525 для CDRH3.
[129] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 533, 534 и 535, например, SEQ ID NO: 533 и 534, SEQ ID NO: 533 и 535 или SEQ ID NO: 534 и 535, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 533 для CDRH1, SEQ ID NO: 534 для CDRH2 и SEQ ID NO: 535 для CDRH3.
[130] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 543, 544 и 545, например, SEQ ID NO: 543 и 544, SEQ ID NO: 543 и 545 или SEQ ID NO: 544 и 545, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 543 для CDRH1, SEQ ID NO: 544 для CDRH2 и SEQ ID NO: 545 для CDRH3.
[131] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 553, 554 и 555, например, SEQ ID NO: 553 и 554, SEQ ID NO: 553 и 555 или SEQ ID NO: 554 и 555, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 553 для CDRH1, SEQ ID NO: 554 для CDRH2 и SEQ ID NO: 555 для CDRH3.
[132] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 563, 564 и 565, например, SEQ ID NO: 563 и 564, SEQ ID NO: 563 и 565 или SEQ ID NO: 564 и 565, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 563 для CDRH1, SEQ ID NO: 564 для CDRH2 и SEQ ID NO: 565 для CDRH3.
[133] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 573, 574 и 575, например, SEQ ID NO: 573 и 574, SEQ ID NO: 573 и 575 или SEQ ID NO: 574 и 575, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 573 для CDRH1, SEQ ID NO: 574 для CDRH2 и SEQ ID NO: 575 для CDRH3.
[134] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 583, 584 и 585, например, SEQ ID NO: 583 и 584, SEQ ID NO: 583 и 585 или SEQ ID NO: 584 и 585, как, например, вариабельная область тяжелой цепи содержит SEQ ID NO: 583 для CDRH1, SEQ ID NO: 584 для CDRH2 и SEQ ID NO: 585 для CDRH3.
[135] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 8, 9 и 10, например, SEQ ID NO: 8 и 9, SEQ ID NO: 8 и 10 или SEQ ID NO: 9 и 10, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 8 для CDRL1, SEQ ID NO: 9 для CDRL2 и SEQ ID NO: 10 для CDRL3.
[136] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 18, 19 и 20, например, SEQ ID NO: 18 и 19, SEQ ID NO: 18 и 20 или SEQ ID NO: 19 и 20, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 18 для CDRL1, SEQ ID NO: 19 для CDRL2 и SEQ ID NO: 20 для CDRL3.
[137] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 28, 29 и 30, например, SEQ ID NO: 28 и 29, SEQ ID NO: 28 и 30 или SEQ ID NO: 29 и 30, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 28 для CDRL1, SEQ ID NO: 29 для CDRL2 и SEQ ID NO: 30 для CDRL3.
[138] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 38, 39 и 40, например, SEQ ID NO: 38 и 39, SEQ ID NO: 38 и 40 или SEQ ID NO: 39 и 40, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 38 для CDRL1, SEQ ID NO: 39 для CDRL2 и SEQ ID NO: 40 для CDRL3.
[139] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 48, 49 и 50, например, SEQ ID NO: 48 и 49, SEQ ID NO: 48 и 50 или SEQ ID NO: 49 и 50, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 48 для CDRL1, SEQ ID NO: 49 для CDRL2 и SEQ ID NO: 50 для CDRL3.
[140] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 58, 59 и 60, например, SEQ ID NO: 58 и 59, SEQ ID NO: 58 и 60 или SEQ ID NO: 59 и 60, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 58 для CDRL1, SEQ ID NO: 59 для CDRL2 и SEQ ID NO: 60 для CDRL3.
[141] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 68, 69 и 70, например, SEQ ID NO: 68 и 69, SEQ ID NO: 68 и 70 или SEQ ID NO: 69 и 70, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 68 для CDRL1, SEQ ID NO: 69 для CDRL2 и SEQ ID NO: 70 для CDRL3.
[142] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 78, 79 и 80, например, SEQ ID NO: 78 и 79, SEQ ID NO: 78 и 80 или SEQ ID NO: 79 и 80, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 78 для CDRL1, SEQ ID NO: 79 для CDRL2 и SEQ ID NO: 80 для CDRL3.
[143] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 88, 89 и 90, например, SEQ ID NO: 88 и 89, SEQ ID NO: 88 и 90 или SEQ ID NO: 89 и 90, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 88 для CDRL1, SEQ ID NO: 89 для CDRL2 и SEQ ID NO: 90 для CDRL3.
[144] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 98, 99 и 100, например, SEQ ID NO: 98 и 99, SEQ ID NO: 98 и 100 или SEQ ID NO: 99 и 100, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 98 для CDRL1, SEQ ID NO: 99 для CDRL2 и SEQ ID NO: 100 для CDRL3.
[145] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 108, 109 и 110, например, SEQ ID NO: 108 и 109, SEQ ID NO: 108 и 110 или SEQ ID NO: 109 и 110, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 108 для CDRL1, SEQ ID NO: 109 для CDRL2 и SEQ ID NO: 110 для CDRL3.
[146] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 118, 119 и 120, например, SEQ ID NO: 118 и 119, SEQ ID NO: 118 и 120 или SEQ ID NO: 119 и 120, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 118 для CDRL1, SEQ ID NO: 119 для CDRL2 и SEQ ID NO: 120 для CDRL3.
[147] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 128, 129 и 130, например, SEQ ID NO: 128 и 129, SEQ ID NO: 128 и 130 или SEQ ID NO: 129 и 130, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 128 для CDRL1, SEQ ID NO: 129 для CDRL2 и SEQ ID NO: 130 для CDRL3.
[148] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 138, 139 и 140, например, SEQ ID NO: 138 и 139, SEQ ID NO: 138 и 140 или SEQ ID NO: 139 и 140, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 138 для CDRL1, SEQ ID NO: 139 для CDRL2 и SEQ ID NO: 140 для CDRL3.
[149] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 148, 149 и 150, например, SEQ ID NO: 148 и 149, SEQ ID NO: 148 и 150 или SEQ ID NO: 149 и 150, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 148 для CDRL1, SEQ ID NO: 149 для CDRL2 и SEQ ID NO: 120 для CDRL3.
[150] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 158, 159 и 160, например, SEQ ID NO: 158 и 159, SEQ ID NO: 158 и 160 или SEQ ID NO: 159 и 160, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 158 для CDRL1, SEQ ID NO: 159 для CDRL2 и SEQ ID NO: 160 для CDRL3.
[151] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 168, 169 и 170, например, SEQ ID NO: 168 и 169, SEQ ID NO: 168 и 170 или SEQ ID NO: 169 и 170, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 168 для CDRL1, SEQ ID NO: 169 для CDRL2 и SEQ ID NO: 170 для CDRL3.
[152] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 178, 179 и 180, например, SEQ ID NO: 178 и 179, SEQ ID NO: 178 и 180 или SEQ ID NO: 179 и 180, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 178 для CDRL1, SEQ ID NO: 179 для CDRL2 и SEQ ID NO: 180 для CDRL3.
[153] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 188, 189 и 190, например, SEQ ID NO: 188 и 189, SEQ ID NO: 188 и 190 или SEQ ID NO: 189 и 190, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 188 для CDRL1, SEQ ID NO: 189 для CDRL2 и SEQ ID NO: 190 для CDRL3.
[154] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 198, 199 и 200, например, SEQ ID NO: 198 и 199, SEQ ID NO: 198 и 200 или SEQ ID NO: 199 и 200, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 198 для CDRL1, SEQ ID NO: 199 для CDRL2 и SEQ ID NO: 200 для CDRL3.
[155] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 208, 209 и 210, например, SEQ ID NO: 208 и 209, SEQ ID NO: 208 и 210 или SEQ ID NO: 209 и 210, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 208 для CDRL1, SEQ ID NO: 209 для CDRL2 и SEQ ID NO: 210 для CDRL3.
[156] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 218, 219 и 220, например, SEQ ID NO: 218 и 219, SEQ ID NO: 218 и 220 или SEQ ID NO: 219 и 220, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 218 для CDRL1, SEQ ID NO: 219 для CDRL2 и SEQ ID NO: 220 для CDRL3.
[157] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 228, 229 и 230, например, SEQ ID NO: 228 и 229, SEQ ID NO: 228 и 230 или SEQ ID NO: 229 и 230, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 228 для CDRL1, SEQ ID NO: 229 для CDRL2 и SEQ ID NO: 230 для CDRL3.
[158] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 238, 239 и 240, например, SEQ ID NO: 238 и 239, SEQ ID NO: 238 и 240 или SEQ ID NO: 239 и 240, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 238 для CDRL1, SEQ ID NO: 239 для CDRL2 и SEQ ID NO: 240 для CDRL3.
[159] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 248, 249 и 250, например, SEQ ID NO: 248 и 249, SEQ ID NO: 248 и 250 или SEQ ID NO: 249 и 250, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 248 для CDRL1, SEQ ID NO: 249 для CDRL2 и SEQ ID NO: 220 для CDRL3.
[160] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 258, 259 и 260, например, SEQ ID NO: 258 и 259, SEQ ID NO: 258 и 260 или SEQ ID NO: 259 и 260, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 258 для CDRL1, SEQ ID NO: 259 для CDRL2 и SEQ ID NO: 260 для CDRL3.
[161] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 268, 269 и 270, например, SEQ ID NO: 268 и 269, SEQ ID NO: 268 и 270 или SEQ ID NO: 269 и 270, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 268 для CDRL1, SEQ ID NO: 269 для CDRL2 и SEQ ID NO: 270 для CDRL3.
[162] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 278, 279 и 280, например, SEQ ID NO: 278 и 279, SEQ ID NO: 278 и 280 или SEQ ID NO: 279 и 280, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 278 для CDRL1, SEQ ID NO: 279 для CDRL2 и SEQ ID NO: 280 для CDRL3.
[163] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 288, 289 и 290, например, SEQ ID NO: 288 и 289, SEQ ID NO: 288 и 290 или SEQ ID NO: 289 и 290, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 288 для CDRL1, SEQ ID NO: 289 для CDRL2 и SEQ ID NO: 290 для CDRL3.
[164] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 298, 299 и 300, например, SEQ ID NO: 298 и 299, SEQ ID NO: 298 и 300 или SEQ ID NO: 299 и 300, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 298 для CDRL1, SEQ ID NO: 299 для CDRL2 и SEQ ID NO: 300 для CDRL3.
[165] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 308, 309 и 310, например, SEQ ID NO: 308 и 309, SEQ ID NO: 308 и 310 или SEQ ID NO: 309 и 310, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 308 для CDRL1, SEQ ID NO: 309 для CDRL2 и SEQ ID NO: 310 для CDRL3.
[166] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 318, 319 и 320, например, SEQ ID NO: 318 и 319, SEQ ID NO: 318 и 320 или SEQ ID NO: 319 и 320, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 318 для CDRL1, SEQ ID NO: 319 для CDRL2 и SEQ ID NO: 320 для CDRL3.
[167] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 328, 329 и 330, например, SEQ ID NO: 328 и 329, SEQ ID NO: 328 и 330 или SEQ ID NO: 329 и 330, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 328 для CDRL1, SEQ ID NO: 329 для CDRL2 и SEQ ID NO: 330 для CDRL3.
[168] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 338, 339 и 340, например, SEQ ID NO: 338 и 339, SEQ ID NO; 338 и 340 или SEQ ID NO: 339 и 340, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 338 для CDRL1, SEQ ID NO: 339 для CDRL2 и SEQ ID NO: 340 для CDRL3.
[169] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 348, 349 и 350, например, SEQ ID NO: 348 и 349, SEQ ID NO: 348 и 350 или SEQ ID NO: 349 и 350, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 348 для CDRL1, SEQ ID NO: 349 для CDRL2 и SEQ ID NO: 320 для CDRL3.
[170] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 358, 359 и 360, например, SEQ ID NO: 358 и 359, SEQ ID NO: 358 и 360 или SEQ ID NO: 359 и 360, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 358 для CDRL1, SEQ ID NO: 359 для CDRL2 и SEQ ID NO: 360 для CDRL3.
[171] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 368, 369 и 370, например, SEQ ID NO: 368 и 369, SEQ ID NO: 368 и 370 или SEQ ID NO: 369 и 370, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 368 для CDRL1, SEQ ID NO: 369 для CDRL2 и SEQ ID NO: 370 для CDRL3.
[172] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 378, 379 и 380, например, SEQ ID NO: 378 и 379, SEQ ID NO: 378 и 380 или SEQ ID NO: 379 и 380, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 378 для CDRL1, SEQ ID NO: 379 для CDRL2 и SEQ ID NO: 380 для CDRL3.
[173] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 388, 389 и 390, например, SEQ ID NO: 388 и 389, SEQ ID NO: 388 и 390 или SEQ ID NO: 389 и 390, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 388 для CDRL1, SEQ ID NO: 389 для CDRL2 и SEQ ID NO: 390 для CDRL3.
[174] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 398, 399 и 400, например, SEQ ID NO: 398 и 399, SEQ ID NO: 398 и 400 или SEQ ID NO: 399 и 400, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 398 для CDRL1, SEQ ID NO: 399 для CDRL2 и SEQ ID NO: 400 для CDRL3.
[175] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 408, 409 и 410, например, SEQ ID NO: 408 и 409, SEQ ID NO: 408 и 410 или SEQ ID NO: 409 и 410, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 408 для CDRL1, SEQ ID NO: 409 для CDRL2 и SEQ ID NO: 410 для CDRL3.
[176] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 418, 419 и 420, например, SEQ ID NO: 418 и 419, SEQ ID NO: 418 и 420 или SEQ ID NO: 419 и 420, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 418 для CDRL1, SEQ ID NO: 419 для CDRL2 и SEQ ID NO: 420 для CDRL3.
[177] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 428, 429 и 430, например, SEQ ID NO: 428 и 429, SEQ ID NO: 428 и 430 или SEQ ID NO: 429 и 430, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 428 для CDRL1, SEQ ID NO: 429 для CDRL2 и SEQ ID NO: 430 для CDRL3.
[178] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 438, 439 и 440, например, SEQ ID NO: 438 и 439, SEQ ID NO: 438 и 440 или SEQ ID NO: 439 и 440, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 438 для CDRL1. SEQ ID NO: 439 для CDRL2 и SEQ ID NO: 440 для CDRL3.
[179] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 448, 449 и 450. например, SEQ ID NO: 448 и 449, SEQ ID NO: 448 и 450 или SEQ ID NO: 449 и 450, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 448 для CDRL1, SEQ ID NO: 449 для CDRL2 и SEQ ID NO: 420 для CDRL3.
[180] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 458, 459 и 460, например, SEQ ID NO: 458 и 459, SEQ ID NO: 458 и 460 или SEQ ID NO: 459 и 460, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 458 для CDRL1, SEQ ID NO: 459 для CDRL2 и SEQ ID NO: 460 для CDRL3.
[181] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 468, 469 и 470, например, SEQ ID NO: 468 и 469, SEQ ID NO: 468 и 470 или SEQ ID NO: 469 и 470, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 468 для CDRL1, SEQ ID NO: 469 для CDRL2 и SEQ ID NO: 470 для CDRL3.
[182] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 478, 479 и 480, например, SEQ ID NO: 478 и 479, SEQ ID NO: 478 и 480 или SEQ ID NO: 479 и 480, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 478 для CDRL1, SEQ ID NO: 479 для CDRL2 и SEQ ID NO: 480 для CDRL3.
[183] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 488, 489 и 490, например, SEQ ID NO: 488 и 489, SEQ ID NO: 488 и 490 или SEQ ID NO: 489 и 490, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 488 для CDRL1, SEQ ID NO: 489 для CDRL2 и SEQ ID NO: 490 для CDRL3.
[184] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 498, 499 и 500, например, SEQ ID NO: 498 и 499, SEQ ID NO: 498 и 500 или SEQ ID NO: 499 и 500, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 498 для CDRL1, SEQ ID NO: 499 для CDRL2 и SEQ ID NO: 500 для CDRL3.
[185] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 508, 509 и 510, например, SEQ ID NO: 508 и 509, SEQ ID NO: 508 и 510 или SEQ ID NO: 509 и 510, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 508 для CDRL1, SEQ ID NO: 509 для CDRL2 и SEQ ID NO: 510 для CDRL3.
[186] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 518, 519 и 520, например, SEQ ID NO: 518 и 519, SEQ ID NO: 518 и 520 или SEQ ID NO: 519 и 520, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 518 для CDRL1, SEQ ID NO: 519 для CDRL2 и SEQ ID NO: 520 для CDRL3.
[187] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 528, 529 и 530, например, SEQ ID NO: 528 и 529, SEQ ID NO: 528 и 530 или SEQ ID NO: 529 и 530, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 528 для CDRL1, SEQ ID NO: 529 для CDRL2 и SEQ ID NO: 530 для CDRL3.
[188] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 538, 539 и 540, например, SEQ ID NO: 538 и 539, SEQ ID NO: 538 и 540 или SEQ ID NO: 539 и 540, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 538 для CDRL1, SEQ ID NO: 539 для CDRL2 и SEQ ID NO: 540 для CDRL3.
[189] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 548, 549 и 550, например, SEQ ID NO: 548 и 549, SEQ ID NO: 548 и 550 или SEQ ID NO: 549 и 550, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 548 для CDRL1, SEQ ID NO: 549 для CDRL2 и SEQ ID NO: 520 для CDRL3.
[190] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 558, 559 и 560, например, SEQ ID NO: 558 и 559, SEQ ID NO: 558 и 560 или SEQ ID NO: 559 и 560, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 558 для CDRL1, SEQ ID NO: 559 для CDRL2 и SEQ ID NO: 560 для CDRL3.
[191] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 568, 569 и 570, например, SEQ ID NO: 568 и 569, SEQ ID NO: 568 и 570 или SEQ ID NO: 569 и 570, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 568 для CDRL1, SEQ ID NO: 569 для CDRL2 и SEQ ID NO: 570 для CDRL3.
[192] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 578, 579 и 580, например, SEQ ID NO: 578 и 579, SEQ ID NO: 578 и 580 или SEQ ID NO: 579 и 580, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 578 для CDRL1, SEQ ID NO: 579 для CDRL2 и SEQ ID NO: 580 для CDRL3.
[193] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR, выбранный из SEQ ID NO: 588, 589 и 590, например, SEQ ID NO: 588 и 589, SEQ ID NO: 588 и 590 или SEQ ID NO: 589 и 590, как, например, вариабельную область легкой цепи, содержащую SEQ ID NO: 588 для CDRL1, SEQ ID NO: 589 для CDRL2 и SEQ ID NO: 590 для CDRL3.
[194] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 103 для CDRH1, SEQ ID NO: 104 для CDRH2 и SEQ ID NO: 105 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 108, 109 и 120, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 108 для CDRL1, SEQ ID NO: 109 для CDRL2 и SEQ ID NO: 120 для CDRL3.
[195] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 113 для CDRH1, SEQ ID NO: 114 для CDRH2 и SEQ ID NO: 115 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 118, 119 и 120, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 118 для CDRL1, SEQ ID NO: 119 для CDRL2 и SEQ ID NO: 120 для CDRL3.
[196] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 123 для CDRH1, SEQ ID NO: 124 для CDRH2 и SEQ ID NO: 125 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 128, 129 и 130, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 128 для CDRL1, SEQ ID NO: 129 для CDRL2 и SEQ ID NO: 130 для CDRL3.
[197] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 133 для CDRH1, SEQ ID NO: 134 для CDRH2 и SEQ ID NO: 135 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 138, 139 и 140, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 138 для CDRL1, SEQ ID NO: 139 для CDRL2 и SEQ ID NO: 140 для CDRL3.
[198] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 143 для CDRH1, SEQ ID NO: 144 для CDRH2 и SEQ ID NO: 145 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 148, 149 и 150, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 148 для CDRL1, SEQ ID NO: 149 для CDRL2 и SEQ ID NO: 150 для CDRL3.
[199] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 153 для CDRH1, SEQ ID NO: 154 для CDRH2 и SEQ ID NO: 155 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 158, 159 и 160, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 158 для CDRL1, SEQ ID NO: 159 для CDRL2 и SEQ ID NO: 160 для CDRL3.
[200] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 163 для CDRH1, SEQ ID NO: 164 для CDRH2 и SEQ ID NO: 165 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 168, 169 и 170, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 168 для CDRL1, SEQ ID NO: 169 для CDRL2 и SEQ ID NO: 170 для CDRL3.
[201] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 173 для CDRH1, SEQ ID NO: 174 для CDRH2 и SEQ ID NO: 175 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 178, 179 и 180, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 178 для CDRL1, SEQ ID NO: 179 для CDRL2 и SEQ ID NO: 180 для CDRL3.
[202] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 183 для CDRH1, SEQ ID NO: 184 для CDRH2 и SEQ ID NO: 185 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 188, 189 и 190, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 188 для CDRL1, SEQ ID NO: 189 для CDRL2 и SEQ ID NO: 190 для CDRL3.
[203] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 193 для CDRH1, SEQ ID NO: 194 для CDRH2 и SEQ ID NO: 195 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 198, 199 и 200, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 198 для CDRL1, SEQ ID NO: 199 для CDRL2 и SEQ ID NO: 200 для CDRL3.
[204] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 203 для CDRH1, SEQ ID NO: 204 для CDRH2 и SEQ ID NO: 205 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 208, 209 и 220, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 208 для CDRL1, SEQ ID NO: 209 для CDRL2 и SEQ ID NO: 220 для CDRL3.
[205] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 213 для CDRH1, SEQ ID NO: 214 для CDRH2 и SEQ ID NO: 215 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 218, 219 и 220, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 218 для CDRL1, SEQ ID NO: 219 для CDRL2 и SEQ ID NO: 220 для CDRL3.
[206] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 223 для CDRH1, SEQ ID NO: 224 для CDRH2 и SEQ ID NO: 225 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 228, 229 и 230, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 228 для CDRL1, SEQ ID NO: 229 для CDRL2 и SEQ ID NO: 230 для CDRL3.
[207] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 233 для CDRH1, SEQ ID NO: 234 для CDRH2 и SEQ ID NO: 235 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 238, 239 и 240, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 238 для CDRL1, SEQ ID NO: 239 для CDRL2 и SEQ ID NO: 240 для CDRL3.
[208] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 243 для CDRH1, SEQ ID NO: 244 для CDRH2 и SEQ ID NO: 245 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 248, 249 и 250, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 248 для CDRL1, SEQ ID NO: 249 для CDRL2 и SEQ ID NO: 250 для CDRL3.
[209] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 253 для CDRH1, SEQ ID NO: 254 для CDRH2 и SEQ ID NO: 255 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 258, 259 и 260, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 258 для CDRL1, SEQ ID NO: 259 для CDRL2 и SEQ ID NO: 260 для CDRL3.
[210] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 263 для CDRH1, SEQ ID NO: 264 для CDRH2 и SEQ ID NO: 265 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 268, 269 и 270, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 268 для CDRL1, SEQ ID NO: 269 для CDRL2 и SEQ ID NO: 270 для CDRL3.
[211] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 273 для CDRH1. SEQ ID NO: 274 для CDRH2 и SEQ ID NO: 275 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 278, 279 и 280, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 278 для CDRL1, SEQ ID NO: 279 для CDRL2 и SEQ ID NO: 280 для CDRL3.
[212] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 283 для CDRH1, SEQ ID NO: 284 для CDRH2 и SEQ ID NO: 285 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 288, 289 и 290, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 288 для CDRL1, SEQ ID NO: 289 для CDRL2 и SEQ ID NO: 290 для CDRL3.
[213] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 293 для CDRH1, SEQ ID NO: 294 для CDRH2 и SEQ ID NO: 295 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 298, 299 и 300, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 298 для CDRL1, SEQ ID NO: 299 для CDRL2 и SEQ ID NO: 300 для CDRL3.
[214] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 303 для CDRH1, SEQ ID NO: 304 для CDRH2 и SEQ ID NO: 305 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 308, 309 и 320, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 308 для CDRL1, SEQ ID NO: 309 для CDRL2 и SEQ ID NO: 320 для CDRL3.
[215] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 313 для CDRH1, SEQ ID NO: 314 для CDRH2 и SEQ ID NO: 315 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 318, 319 и 320, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 318 для CDRL1, SEQ ID NO: 319 для CDRL2 и SEQ ID NO: 320 для CDRL3.
[216] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 323 для CDRH1, SEQ ID NO: 324 для CDRH2 и SEQ ID NO: 325 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 328, 329 и 330, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 328 для CDRL1, SEQ ID NO: 329 для CDRL2 и SEQ ID NO: 330 для CDRL3.
[217] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 333 для CDRH1, SEQ ID NO: 334 для CDRH2 и SEQ ID NO: 335 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 338, 339 и 340, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 338 для CDRL1, SEQ ID NO: 339 для CDRL2 и SEQ ID NO: 340 для CDRL3.
[218] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 343 для CDRH1, SEQ ID NO: 344 для CDRH2 и SEQ ID NO: 345 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 348, 349 и 350, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 348 для CDRL1, SEQ ID NO: 349 для CDRL2 и SEQ ID NO: 350 для CDRL3.
[219] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 353 для CDRH1, SEQ ID NO: 354 для CDRH2 и SEQ ID NO: 355 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 358, 359 и 360, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 358 для CDRL1, SEQ ID NO: 359 для CDRL2 и SEQ ID NO: 360 для CDRL3.
[220] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 363 для CDRH1, SEQ ID NO: 364 для CDRH2 и SEQ ID NO: 365 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 368, 369 и 370, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 368 для CDRL1, SEQ ID NO: 369 для CDRL2 и SEQ ID NO: 370 для CDRL3.
[221] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 373 для CDRH1, SEQ ID NO: 374 для CDRH2 и SEQ ID NO: 375 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 378, 379 и 380, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 378 для CDRL1, SEQ ID NO: 379 для CDRL2 и SEQ ID NO: 380 для CDRL3.
[222] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 383 для CDRH1, SEQ ID NO: 384 для CDRH2 и SEQ ID NO: 385 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 388, 389 и 390, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 388 для CDRL1, SEQ ID NO: 389 для CDRL2 и SEQ ID NO: 390 для CDRL3.
[223] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 393 для CDRH1, SEQ ID NO: 394 для CDRH2 и SEQ ID NO: 395 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 398, 399 и 400, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 398 для CDRL1, SEQ ID NO: 399 для CDRL2 и SEQ ID NO: 400 для CDRL3.
[224] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 403 для CDRH1, SEQ ID NO: 404 для CDRH2 и SEQ ID NO: 405 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 408, 409 и 420, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 408 для CDRL1, SEQ ID NO: 409 для CDRL2 и SEQ ID NO: 420 для CDRL3.
[225] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 413 для CDRH1, SEQ ID NO: 414 для CDRH2 и SEQ ID NO: 415 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 418, 419 и 420, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 418 для CDRL1, SEQ ID NO: 419 для CDRL2 и SEQ ID NO: 420 для CDRL3.
[226] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 423 для CDRH1, SEQ ID NO: 424 для CDRH2 и SEQ ID NO: 425 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 428, 429 и 430, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 428 для CDRL1, SEQ ID NO: 429 для CDRL2 и SEQ ID NO: 430 для CDRL3.
[227] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 433 для CDRH1, SEQ ID NO: 434 для CDRH2 и SEQ ID NO: 435 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 438, 439 и 440, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 438 для CDRL1, SEQ ID NO: 439 для CDRL2 и SEQ ID NO: 440 для CDRL3.
[228] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 443 для CDRH1, SEQ ID NO: 444 для CDRH2 и SEQ ID NO: 445 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 448, 449 и 450, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 448 для CDRL1, SEQ ID NO: 449 для CDRL2 и SEQ ID NO: 450 для CDRL3.
[229] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 453 для CDRH1, SEQ ID NO: 454 для CDRH2 и SEQ ID NO: 455 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 458, 459 и 460, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 458 для CDRL1, SEQ ID NO: 459 для CDRL2 и SEQ ID NO: 460 для CDRL3.
[230] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 463 для CDRH1, SEQ ID NO: 464 для CDRH2 и SEQ ID NO: 465 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 468, 469 и 470, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 468 для CDRL1, SEQ ID NO: 469 для CDRL2 и SEQ ID NO: 470 для CDRL3.
[231] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 473 для CDRH1, SEQ ID NO: 474 для CDRH2 и SEQ ID NO: 475 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 478, 479 и 480, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 478 для CDRL1, SEQ ID NO: 479 для CDRL2 и SEQ ID NO: 480 для CDRL3.
[232] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 483 для CDRH1, SEQ ID NO: 484 для CDRH2 и SEQ ID NO: 485 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 488, 489 и 490, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 488 для CDRL1, SEQ ID NO: 489 для CDRL2 и SEQ ID NO: 490 для CDRL3.
[233] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 493 для CDRH1, SEQ ID NO: 494 для CDRH2 и SEQ ID NO: 495 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 498, 499 и 500, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 498 для CDRL1, SEQ ID NO: 499 для CDRL2 и SEQ ID NO: 500 для CDRL3.
[234] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 503 для CDRH1, SEQ ID NO: 504 для CDRH2 и SEQ ID NO: 505 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 508, 509 и 520, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 508 для CDRL1, SEQ ID NO: 509 для CDRL2 и SEQ ID NO: 520 для CDRL3.
[235] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 513 для CDRH1, SEQ ID NO: 514 для CDRH2 и SEQ ID NO: 515 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 518, 519 и 520, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 518 для CDRL1, SEQ ID NO: 519 для CDRL2 и SEQ ID NO: 520 для CDRL3.
[236] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 523 для CDRH1, SEQ ID NO: 524 для CDRH2 и SEQ ID NO: 525 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 528, 529 и 530, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 528 для CDRL1, SEQ ID NO: 529 для CDRL2 и SEQ ID NO: 530 для CDRL3.
[237] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 533 для CDRH1, SEQ ID NO: 534 для CDRH2 и SEQ ID NO: 535 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 538, 539 и 540, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 538 для CDRL1, SEQ ID NO: 539 для CDRL2 и SEQ ID NO: 540 для CDRL3.
[238] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 543 для CDRH1, SEQ ID NO: 544 для CDRH2 и SEQ ID NO: 545 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 548, 549 и 550, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 548 для CDRL1, SEQ ID NO: 549 для CDRL2 и SEQ ID NO: 550 для CDRL3.
[239] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 553 для CDRH1, SEQ ID NO: 554 для CDRH2 и SEQ ID NO: 555 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 558, 559 и 560, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 558 для CDRL1, SEQ ID NO: 559 для CDRL2 и SEQ ID NO: 560 для CDRL3.
[240] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 563 для CDRH1, SEQ ID NO: 564 для CDRH2 и SEQ ID NO: 565 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 568, 569 и 570, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 568 для CDRL1, SEQ ID NO: 569 для CDRL2 и SEQ ID NO: 570 для CDRL3.
[241] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 573 для CDRH1, SEQ ID NO: 574 для CDRH2 и SEQ ID NO: 575 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 578, 579 и 580, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 578 для CDRL1, SEQ ID NO: 579 для CDRL2 и SEQ ID NO: 580 для CDRL3.
[242] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO: 583 для CDRH1, SEQ ID NO: 584 для CDRH2 и SEQ ID NO: 585 для CDRH3, и по меньшей мере один CDR в вариабельной области легкой цепи, независимо выбранный из SEQ ID NO: 588, 589 и 590, в частности, вариабельную область легкой цепи, содержащую SEQ ID NO: 588 для CDRL1, SEQ ID NO: 589 для CDRL2 и SEQ ID NO: 590 для CDRL3.
[243]
[244] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 2, например, в качестве вариабельной области в тяжелой цепи.
[245] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 7, например, в качестве вариабельной области в легкой цепи.
[246] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 2 и вариабельную область легкой цепи под SEQ ID NO: 7.
[247] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 12, например, в качестве вариабельной области в тяжелой цепи.
[248] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 17, например, в качестве вариабельной области в легкой цепи.
[249] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 12 и вариабельную область легкой цепи под SEQ ID NO: 17.
[250] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 22, например, в качестве вариабельной области в тяжелой цепи.
[251] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 27, например, в качестве вариабельной области в легкой цепи.
[252] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 22 и вариабельную область легкой цепи под SEQ ID NO: 27.
[253] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 32, например, в качестве вариабельной области в тяжелой цепи.
[254] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 37, например, в качестве вариабельной области в легкой цепи.
[255] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 32 и вариабельную область легкой цепи под SEQ ID NO: 37.
[256] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 52, например, в качестве вариабельной области в тяжелой цепи.
[257] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 57, например, в качестве вариабельной области в легкой цепи.
[258] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 52 и вариабельную область легкой цепи под SEQ ID NO: 57.
[259] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 62, например, в качестве вариабельной области в тяжелой цепи.
[260] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 67, например, в качестве вариабельной области в легкой цепи.
[261] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 62 и вариабельную область легкой цепи под SEQ ID NO: 67.
[262] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 72, например, в качестве вариабельной области в тяжелой цепи.
[263] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 77, например, в качестве вариабельной области в легкой цепи.
[264] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 72 и вариабельную область легкой цепи под SEQ ID NO: 77.
[265] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 82, например, в качестве вариабельной области в тяжелой цепи.
[266] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 87, например, в качестве вариабельной области в легкой цепи.
[267] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 82 и вариабельную область легкой цепи под SEQ ID NO: 87.
[268] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 92, например, в качестве вариабельной области в тяжелой цепи.
[269] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 97, например, в качестве вариабельной области в легкой цепи.
[270] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 92 и вариабельную область легкой цепи под SEQ ID NO: 97.
[271] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 102, например, в качестве вариабельной области в тяжелой цепи.
[272] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 107, например, в качестве вариабельной области в легкой цепи.
[273] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 102 и вариабельную область легкой цепи под SEQ ID NO: 107.
[274] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 112, например, в качестве вариабельной области в тяжелой цепи.
[275] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 117, например, в качестве вариабельной области в легкой цепи.
[276] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 112 и вариабельную область легкой цепи под SEQ ID NO: 117.
[277] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 122, например, в качестве вариабельной области в тяжелой цепи.
[278] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 127, например, в качестве вариабельной области в легкой цепи.
[279] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 122 и вариабельную область легкой цепи под SEQ ID NO: 127.
[280] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 132, например, в качестве вариабельной области в тяжелой цепи.
[281] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 137, например, в качестве вариабельной области в легкой цепи.
[282] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 132 и вариабельную область легкой цепи под SEQ ID NO: 137.
[283] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 152, например, в качестве вариабельной области в тяжелой цепи.
[284] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 157, например, в качестве вариабельной области в легкой цепи.
[285] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 152 и вариабельную область легкой цепи под SEQ ID NO: 157.
[286] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 162, например, в качестве вариабельной области в тяжелой цепи.
[287] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 167, например, в качестве вариабельной области в легкой цепи.
[288] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 162 и вариабельную область легкой цепи под SEQ ID NO: 167.
[289] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 172, например, в качестве вариабельной области в тяжелой цепи.
[290] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 177, например, в качестве вариабельной области в легкой цепи.
[291] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 172 и вариабельную область легкой цепи под SEQ ID NO: 177.
[292] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 182, например, в качестве вариабельной области в тяжелой цепи,
[293] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 187, например, в качестве вариабельной области в легкой цепи.
[294] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 182 и вариабельную область легкой цепи под SEQ ID NO: 187.
[295] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 192, например, в качестве вариабельной области в тяжелой цепи.
[296] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 197, например, в качестве вариабельной области в легкой цепи.
[297] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 192 и вариабельную область легкой цепи под SEQ ID NO: 197.
[298] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 202, например, в качестве вариабельной области в тяжелой цепи.
[299] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 207, например, в качестве вариабельной области в легкой цепи.
[300] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 202 и вариабельную область легкой цепи под SEQ ID NO: 207.
[301] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 212, например, в качестве вариабельной области в тяжелой цепи.
[302] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 217, например, в качестве вариабельной области в легкой цепи.
[303] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 212 и вариабельную область легкой цепи под SEQ ID NO: 217.
[304] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 222, например, в качестве вариабельной области в тяжелой цепи.
[305] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 227, например, в качестве вариабельной области в легкой цепи.
[306] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 222 и вариабельную область легкой цепи под SEQ ID NO: 227.
[307] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 232, например, в качестве вариабельной области в тяжелой цепи.
[308] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 237, например, в качестве вариабельной области в легкой цепи.
[309] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 232 и вариабельную область легкой цепи под SEQ ID NO: 237.
[310] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 242, например, в качестве вариабельной области в тяжелой цепи.
[311] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 247, например, в качестве вариабельной области в легкой цепи.
[312] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 242 и вариабельную область легкой цепи под SEQ ID NO: 247.
[313] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 252, например, в качестве вариабельной области в тяжелой цепи.
[314] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 257, например, в качестве вариабельной области в легкой цепи.
[315] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 252 и вариабельную область легкой цепи под SEQ ID NO: 257.
[316] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 262, например, в качестве вариабельной области в тяжелой цепи.
[317] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 267, например, в качестве вариабельной области в легкой цепи.
[318] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 262 и вариабельную область легкой цепи под SEQ ID NO: 267.
[319] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 272, например, в качестве вариабельной области в тяжелой цепи.
[320] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 277, например, в качестве вариабельной области в легкой цепи.
[321] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 272 и вариабельную область легкой цепи под SEQ ID NO: 277.
[322] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 282, например, в качестве вариабельной области в тяжелой цепи.
[323] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 287, например, в качестве вариабельной области в легкой цепи.
[324] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 282 и вариабельную область легкой цепи под SEQ ID NO: 287.
[325] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 292, например, в качестве вариабельной области в тяжелой цепи.
[326] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 297, например, в качестве вариабельной области в легкой цепи.
[327] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 292 и вариабельную область легкой цепи под SEQ ID NO: 297.
[328] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 302, например, в качестве вариабельной области в тяжелой цепи.
[329] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 307, например, в качестве вариабельной области в легкой цепи.
[330] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 302 и вариабельную область легкой цепи под SEQ ID NO: 307.
[331] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 312, например, в качестве вариабельной области в тяжелой цепи.
[332] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 317, например, в качестве вариабельной области в легкой цепи.
[333] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 312 и вариабельную область легкой цепи под SEQ ID NO: 317.
[334] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 322, например, в качестве вариабельной области в тяжелой цепи.
[335] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 327, например, в качестве вариабельной области в легкой цепи.
[336] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 322 и вариабельную область легкой цепи под SEQ ID NO: 327.
[337] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 332, например, в качестве вариабельной области в тяжелой цепи.
[338] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 337, например, в качестве вариабельной области в легкой цепи.
[339] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 332 и вариабельную область легкой цепи под SEQ ID NO: 337.
[340] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 352, например, в качестве вариабельной области в тяжелой цепи.
[341] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 357, например, в качестве вариабельной области в легкой цепи.
[342] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 352 и вариабельную область легкой цепи под SEQ ID NO: 357.
[343] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 362, например, в качестве вариабельной области в тяжелой цепи.
[344] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 367, например, в качестве вариабельной области в легкой цепи.
[345] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 362 и вариабельную область легкой цепи под SEQ ID NO: 367.
[346] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 372, например, в качестве вариабельной области в тяжелой цепи.
[347] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 377, например, в качестве вариабельной области в легкой цепи.
[348] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 372 и вариабельную область легкой цепи под SEQ ID NO: 377.
[349] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 382, например, в качестве вариабельной области в тяжелой цепи.
[350] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 387, например, в качестве вариабельной области в легкой цепи.
[351] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 382 и вариабельную область легкой цепи под SEQ ID NO: 387.
[352] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 392, например, в качестве вариабельной области в тяжелой цепи.
[353] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 397, например, в качестве вариабельной области в легкой цепи.
[354] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 392 и вариабельную область легкой цепи под SEQ ID NO: 397.
[355] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 402, например, в качестве вариабельной области в тяжелой цепи.
[356] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 407, например, в качестве вариабельной области в легкой цепи.
[357] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 402 и вариабельную область легкой цепи под SEQ ID NO: 407.
[358] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 412, например, в качестве вариабельной области в тяжелой цепи.
[359] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 417, например, в качестве вариабельной области в легкой цепи.
[360] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 412 и вариабельную область легкой цепи под SEQ ID NO: 417.
[361] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 422, например, в качестве вариабельной области в тяжелой цепи.
[362] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 427, например, в качестве вариабельной области в легкой цепи.
[363] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 422 и вариабельную область легкой цепи под SEQ ID NO: 427.
[364] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 432, например, в качестве вариабельной области в тяжелой цепи.
[365] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 437, например, в качестве вариабельной области в легкой цепи.
[366] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 432 и вариабельную область легкой цепи под SEQ ID NO: 437.
[367] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 452, например, в качестве вариабельной области в тяжелой цепи.
[368] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 457, например, в качестве вариабельной области в легкой цепи.
[369] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 452 и вариабельную область легкой цепи под SEQ ID NO: 457.
[370] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 462, например, в качестве вариабельной области в тяжелой цепи.
[371] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 467, например, в качестве вариабельной области в легкой цепи.
[372] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 462 и вариабельную область легкой цепи под SEQ ID NO: 467.
[373] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 472, например, в качестве вариабельной области в тяжелой цепи.
[374] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 477, например, в качестве вариабельной области в легкой цепи.
[375] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 472 и вариабельную область легкой цепи под SEQ ID NO: 477.
[376] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 482, например, в качестве вариабельной области в тяжелой цепи.
[377] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 487, например, в качестве вариабельной области в легкой цепи.
[378] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 482 и вариабельную область легкой цепи под SEQ ID NO: 487.
[379] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 492, например, в качестве вариабельной области в тяжелой цепи.
[380] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 497, например, в качестве вариабельной области в легкой цепи.
В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 492 и вариабельную область легкой цепи под SEQ ID NO: 497.
[381] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 502, например, в качестве вариабельной области в тяжелой цепи.
[382] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 507, например, в качестве вариабельной области в легкой цепи.
[383] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 502 и вариабельную область легкой цепи под SEQ ID NO: 507.
[384] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 512, например, в качестве вариабельной области в тяжелой цепи.
[385] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 517, например, в качестве вариабельной области в легкой цепи.
[386] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 512 и вариабельную область легкой цепи под SEQ ID NO: 517.
[387] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 522, например, в качестве вариабельной области в тяжелой цепи.
[388] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 527, например, в качестве вариабельной области в легкой цепи.
[389] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 522 и вариабельную область легкой цепи под SEQ ID NO: 527.
[390] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 532, например, в качестве вариабельной области в тяжелой цепи.
[391] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 537, например, в качестве вариабельной области в легкой цепи.
[392] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 532 и вариабельную область легкой цепи под SEQ ID NO: 537.
[393] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 552, например, в качестве вариабельной области в тяжелой цепи.
[394] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 557, например, в качестве вариабельной области в легкой цепи.
[395] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 552 и вариабельную область легкой цепи под SEQ ID NO: 557.
[396] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 562, например, в качестве вариабельной области в тяжелой цепи.
[397] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 567, например, в качестве вариабельной области в легкой цепи.
[398] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 562 и вариабельную область легкой цепи под SEQ ID NO: 567.
[399] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 572, например, в качестве вариабельной области в тяжелой цепи.
[400] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 577, например, в качестве вариабельной области в легкой цепи.
[401] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 572 и вариабельную область легкой цепи под SEQ ID NO: 577.
[402] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 582, например, в качестве вариабельной области в тяжелой цепи.
[403] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 587, например, в качестве вариабельной области в легкой цепи.
[404] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 582 и вариабельную область легкой цепи под SEQ ID NO: 587.
[405] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 592, например, в качестве вариабельной области в тяжелой цепи.
[406] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 594, например, в качестве вариабельной области в легкой цепи.
[407] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 592 и вариабельную область легкой цепи под SEQ ID NO: 59.
[408] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 596, например, в качестве вариабельной области в тяжелой цепи.
[409] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 598, например, в качестве вариабельной области в легкой цепи.
[410] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 596 и вариабельную область легкой цепи под SEQ ID NO: 598.
[411] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 600, например, в качестве вариабельной области в тяжелой цепи.
[412] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 602, например, в качестве вариабельной области в легкой цепи.
[413] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 600 и вариабельную область легкой цепи под SEQ ID NO: 602.
[414] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 604, например, в качестве вариабельной области в тяжелой цепи.
[415] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 606, например, в качестве вариабельной области в легкой цепи.
[416] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 604 и вариабельную область легкой цепи под SEQ ID NO: 606.
[417] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 608, например, в качестве вариабельной области в тяжелой цепи.
[418] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 610, например, в качестве вариабельной области в легкой цепи.
[419] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 608 и вариабельную область легкой цепи под SEQ ID NO: 610.
[420] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 612, например, в качестве вариабельной области в тяжелой цепи.
[421] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 614, например, в качестве вариабельной области в легкой цепи.
[422] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 612 и вариабельную область легкой цепи под SEQ ID NO: 614.
[423] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 616, например, в качестве вариабельной области в тяжелой цепи.
[424] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 618, например, в качестве вариабельной области в легкой цепи.
[425] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 616 и вариабельную область легкой цепи под SEQ ID NO: 618.
[426] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 620, например, в качестве вариабельной области в тяжелой цепи.
[427] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 622, например, в качестве вариабельной области в легкой цепи.
[428] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 620 и вариабельную область легкой цепи под SEQ ID NO: 622.
[429] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 624, например, в качестве вариабельной области в тяжелой цепи.
[430] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область под SEQ ID NO: 626, например, в качестве вариабельной области в легкой цепи.
[431] В одном варианте осуществления связывающая молекула по настоящему раскрытию содержит вариабельную область тяжелой цепи под SEQ ID NO: 624 и вариабельную область легкой цепи под SEQ ID NO: 626.
[432] В другом варианте осуществления настоящее раскрытие относится к выделенному антителу или его антигенсвязывающему фрагменту, которые специфически связываются с IL-33, содержащим VH и VL, где VH имеет аминокислотную последовательность, которая по меньшей мере на 90%, например, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентична VH, раскрытой выше, например, под SEQ ID NO: 182 или SEQ ID NO 616.
[433] В другом варианте осуществления настоящее раскрытие относится к выделенному антителу или его антигенсвязывающему фрагменту, которые специфически связываются с IL-33, содержащим VH и VL, где VH, раскрытая выше, например, под SEQ ID NO: 182 или SEQ ID NO 616, имеет последовательность с 1, 2, 3 или 4 аминокислотами в рамке, независимо замещенными другой аминокислотой или удаленными.
[434] В другом варианте осуществления настоящее раскрытие относится к выделенный антителу или его антигенсвязывающему фрагменту, которые специфически связываются с IL-33, содержащим VH и VL, где VL имеет аминокислотную последовательность, которая по меньшей мере на 90%, например, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентична VL, раскрытой выше, например, под SEQ ID NO: 187 или SEQ ID NO 618.
[435] В другом варианте осуществления настоящее раскрытие относится к выделенному антителу или его антигенсвязывающему фрагменту, которые специфически связываются с IL-33, содержащим VH и VL, где VL, раскрытая выше, например, под SEQ ID NO: 187 или SEQ ID NO 618, имеет последовательность с 1, 2, 3 или 4 аминокислотами в рамке, независимо замещенными другой аминокислотой или удаленными.
[436] В другом варианте осуществления настоящее раскрытие относится к выделенному антителу или его антигенсвязывающему фрагменту, которые специфически связываются с IL-33, содержащим VH и VL, где VH имеет аминокислотную последовательность, которая по меньшей мере на 90%, например, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентична VH, раскрытой выше, например, под SEQ ID NO: 182 или SEQ ID NO. 616, и VL имеет аминокислотную последовательность, которая по меньшей мере на 90%, например, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентична VL, раскрытой выше, например, под SEQ ID NO: 187 или SEQ ID NO 618.
[437] В другом варианте осуществления настоящее раскрытие относится к выделенному антителу или его антигенсвязывающему фрагменту, которые специфически связываются с IL-33, содержащим VH и VL, где VH, раскрытая выше, например, под SEQ ID NO: 182 или SEQ ID NO 616, имеет последовательность с 1, 2, 3 или 4 аминокислотами в рамке, которые независимо замещены другой аминокислотой или удалены, а VL, раскрытая выше, например, под SEQ ID NO: 187 или SEQ ID NO 618, имеет последовательность с 1, 2, 3 или 4 аминокислотами в рамке, которые независимо замещены другой аминокислотой или удалены.
[438] В одном варианте осуществления представлены антитело или связывающий фрагмент, которые перекрестно блокируют связывающую молекулу, например, антитело или связывающий фрагмент в соответствии с настоящим раскрытием, в частности, где указанное антитело или связывающий фрагмент связываются с тем же эпитопом, что и молекула, раскрытая в данном документе.
[439] В некоторых вариантах осуществления связывающая молекула, или антитело, или их антигенсвязывающий фрагмент представляет собой антитело человека, химерное антитело или гуманизированное антитело. В некоторых вариантах осуществления связывающая молекула, или антитело, или их антигенсвязывающий фрагмент представляет собой встречающееся в природе антитело, scFv-фрагмент, Fab-фрагмент, F(ab')2-фрагмент, минитело, диатело, триатело, тетратело или одноцепочечное антитело. В некоторых вариантах осуществления связывающая молекула, или антитело, или их антигенсвязывающий фрагмент представляют собой моноклональное антитело.
[440] В другом варианте осуществления настоящее раскрытие относится к полинуклеотиду, кодирующему связывающую молекулу, или антитело, или их антигенсвязывающий фрагмент по настоящему раскрытию, в частности, как описано в данном документе. В определенных вариантах осуществления полинуклеотид кодирует VH антитела или его антигенсвязывающего фрагмента по настоящему раскрытию. В определенных вариантах осуществления, полинуклеотид кодирует VL антитела или его антигенсвязывающего фрагмента по настоящему раскрытию.
[441] В некоторых вариантах осуществления настоящее раскрытие относится к вектору, содержащему полинуклеотид по настоящему раскрытию.
[442] В некоторых вариантах осуществления настоящее раскрытие относится к композиции, содержащей полинуклеотид или вектор по настоящему раскрытию.
[443] В другом варианте осуществления представлена клетка-хозяин, содержащая полинуклеотид или вектор по настоящему раскрытию.
[444] В другом варианте осуществления настоящее раскрытие в данном документе относится к способу получения антитела к IL-33 или его антигенсвязывающего фрагмента, включающему культивирование клетки-хозяина по настоящему раскрытию и извлечение указанного антитела или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления настоящее раскрытие относится к антителу к IL-33 или его антигенсвязывающему фрагменту, полученным с помощью способа по настоящему раскрытию.
[445] В другом варианте осуществления настоящее раскрытие относится к фармацевтической композиции, содержащей связывающую молекулу, или антитело, или их антигенсвязывающий фрагмент по настоящему раскрытию и носитель.
[446] В другом варианте осуществления настоящее раскрытие относится к способу лечения субъекта с воспалительным состоянием, включающему введение указанному субъекту эффективного количества антитела или антигенсвязывающего фрагмента в соответствии с настоящим раскрытием, которые ингибируют управляемую IL-33 выработку цитокинов.
[447] В другом варианте осуществления представлен способ лечения субъекта с воспалительным состоянием, включающий введение связывающей молекулы по настоящему раскрытию или композиции, содержащей ее.
[448] В одном аспекте представлена связывающая молекула по настоящему раскрытию или композиция, содержащая ее, для применения в лечении, например, воспалительного состояния, в частности, описанного в данном документе.
[449] В одном варианте осуществления представлено применение связывающей молекулы по настоящему раскрытию или композиции, содержащей ее, в производстве лекарственного препарата для лечения или предупреждения воспалительного состояния.
[450] В одном варианте осуществления воспалительное состояние выбрано из астмы, хронического обструктивного заболевания легких (COPD), хронического риносинусита, фибропролиферативного заболевания (например, фиброза легких), легочной эозинофилии, злокачественного новообразования плевры, ревматоидного артрита, коллагеноза сосудов, атеросклероза сосудов, крапивницы, воспалительного заболевания кишечника (например, болезни Крона или целиакии), системной красной волчанки, прогрессирующего системного склероза, гранулематоза Вегнера, септического шока и болезни Бехчета.
[451] В некоторых вариантах осуществления воспалительное состояние представляет собой аллергическое нарушение, например, астму, хронический риносинусит, пищевую аллергию, экзему или дерматит, в частности, астму, такую как рефракторная астма (также называемая тяжелой астмой).
[452] В некоторых вариантах осуществления воспалительный ответ или состояние наблюдается в дыхательных путях указанного субъекта.
[453] В одном варианте осуществления воспалительный ответ или состояние наблюдается в гладкой мускулатуре.
[454] В другом варианте осуществления настоящее раскрытие относится к способу предупреждения воспалительного ответа у субъекта, включающему введение указанному субъекту эффективного количества антитела или его антигенсвязывающего фрагмента, которые связывают IL-33 и не блокируют связывание IL-33 с ST2, при этом передача сигнала с участием ST2 снижается.
[455] В другом варианте осуществления настоящее раскрытие относится к способу предупреждения воспалительного ответа у субъекта, включающему введение указанному субъекту эффективного количества антитела или антигенсвязывающего фрагмента в соответствии с настоящим раскрытием, которые ингибируют управляемую IL-33 выработку цитокинов.
[456] В другом варианте осуществления настоящее раскрытие относится к способу предупреждения воспалительного ответа у субъекта, включающему введение указанному субъекту эффективного количества связывающей молекулы, или антитела, или их антигенсвязывающего фрагмента по настоящему раскрытию.
[457] В другом варианте осуществления настоящее раскрытие относится к способу идентификации терапевтического антитела или его антигенсвязывающего фрагмента, включающему выбор антитела или его антигенсвязывающего фрагмента, которые связываются с IL-33, где указанное антитело или его антигенсвязывающий фрагмент не блокируют связывание IL-33 с ST2 и ингибируют управляемую IL-33 выработку цитокинов.
[458] В одном варианте осуществления представлена иммунизация хозяина с помощью redIL-33, например, стабилизированного в восстановленной форме, или его мутанта, который характеризуется пониженной способностью образовывать дисульфидные связи, в частности, пониженной способностью образовывать дисульфидную связь в одном или нескольких местоположениях, независимо выбранных из Cys-208, Cys-227, Cys-232 и Cys-259. В одном варианте осуществления способ дополнительно включает стадии скрининга антител, полученных из хозяина, например, использования функциональных анализов и выделения и/или репликации по меньшей мере вариабельных областей по меньшей мере одного из указанных антител.
[459] В варианте осуществления представлено применение redIL-33, например, стабилизированного в восстановленной форме, или его мутанта, который характеризуется пониженной способностью образовывать дисульфидные связи, в частности, пониженной способностью образовывать дисульфидную связь в одном или нескольких местоположениях, независимо выбранных из Cys-208, Cys-227, Cys-232 и Cys-259, для идентификации ингибитора передачи сигнала с участием ST2, в частности, антитела или его связывающего фрагмента, специфических в отношении redIL-33. В одном варианте осуществления применение предусматривает поиск в библиотеке, например, библиотеке фагового дисплея антител, с использованием указанного белка или его активного фрагмента.
[460] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящему раскрытию не ингибирует передачу сигнала с участием NFκB.
[461] В одном варианте осуществления представлен способ идентификации или создания связывающей молекулы по настоящему раскрытию с применением redIL-33 или мутанта по настоящему раскрытию (совместно обозначаемым в данном документе как белок по настоящему раскрытию). В одном варианте осуществления способ включает стадию поиска в библиотеке с помощью белков по настоящему раскрытию для идентификации связывающей молекулы. В одном варианте осуществления способ включает иммунизацию хозяина с помощью белка по настоящему раскрытию.
[462] В одном варианте осуществления представлен эпитоп из IL-33, который связывается связывающей молекулой, такой как антитело или его связывающий фрагмент, раскрытые в данном документе, в частности, каталитический эпитоп, т.е. эпитоп, связывание которого увеличивает скорость преобразования восстановленной формы IL-33 в окисленную форму.
[463] В другом варианте осуществления настоящее раскрытие относится к способу обнаружения экспрессии redIL-33 в образце.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
[464] "Выделенный", как используется в данном документе, относится к белку в неприродном окружении, в частности, выделенному из природного источника, например, данный термин не включает ни белок in vivo, ни белок в образце, взятом из организма человека или животного. Как правило, белки будут находиться в носителе, таком как жидкость или среда, или могут быть составленными, замороженными или лиофилизированными, и все эти формы могут охватываться выражением "выделенный" в соответствующих случаях. В одном варианте осуществления выделенный не относится к белку, находящемуся в геле, например, геле, используемом в вестерн-блоттинг анализе или подобных.
[465] Белок IL-33, как используется в данном документе, относится к интерлейкину 33, в частности, белку интерлейкина 33 млекопитающих, например, белку человека, депонированному в UniProt под номером O95760. Однако с учетом результатов, полученных авторами настоящего изобретения, понятно, что этот объект не является единственной молекулой, а существует как восстановленная и окисленная форма. С учетом быстрого окисления восстановленной формы in vivo, например, за период от 5 минут до 40 минут, и in vitro, в большинстве случаев ссылки на IL-33 из предшествующего уровня техники фактически представляют собой ссылки на окисленную форму. Кроме того, коммерческие анализы, по всей видимости, количественно оценивают эту окисленную форму.
[466] Окисленный IL-33, IL-33-DSB (с дисульфидными связями) и DSB IL-33 применяют в данном документе взаимозаменяемо.
[467] Окисленный IL-33, как используется в данном документе, относиться к белку, различимому в качестве отдельной полосы, например, с помощью вестерн-блоттинг анализа в невосстанавливающих условиях, в частности, масса которого на 4 Да меньше, чем у соответствующей восстановленной формы. В частности, он относится к белку с одной или двумя дисульфидными связями между остатками цистеина, независимо выбранными из остатков цистеина 208, 227, 232 и 259. В одном варианте осуществления окисленный IL-33 не демонстрирует связывания с ST2.
[468] Восстановленный IL-33 и redIL-33 используются в данном документе взаимозаменяемо.
[469] Восстановленный IL-33, как используется в данном документе, относится к форме IL-33, которая связывается с ST2 и запускает ST2-зависимую передачу сигнала. В частности, остатки цистеина 208, 227, 232 и 259 восстановленной формы не связаны дисульфидными связями. Активный фрагмент redIL-33, как используется в данном документе, относится к фрагменту, характеризующемуся активностью, сопоставимой с таковой redIL-33, например, аналогичной степенью ST2-зависимой передачи сигнала. В одном варианте осуществления активный фрагмент характеризуется 20, 30 40, 50, 60, 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% активности полноразмерного redIL-33.
[470] ST-2-зависимая передача сигнала, как используется в данном документе, относится к системе IL-33/ST2, где распознавание IL-33 с помощью ST2 содействует димеризации с IL1-RAcP на поверхности клетки и внутриклеточному привлечению компонентов рецепторного комплекса MyD88, TRAF6 и IRAK1-4 к внутриклеточному домену TIR. Таким образом, ST-2-зависимую передачу сигнала можно прерывать путем нарушения взаимодействия IL-33 с ST2 или, альтернативно, путем прерывания взаимодействия с IL-1RAcP.
[471] "Стабилизированный в восстановленной форме", как используется в данном документе, относится к модификации, которая стимулирует белки принимать восстановленную форму или оставаться в ней или предупреждает образование окисленного IL-33.
[472] В одном варианте осуществления стабилизация осуществляется путем конъюгации с химической структурной единицей, например, путем биотинилирования. redIL-33 подвергается монобиотинилированию под воздействием -SH-реактивного реагента биотин-ВМСС (доступен от Thermo scientific) при нейтральном рН. Анализ, выполненный авторами настоящего изобретения, дает основание предполагать, что биотинилирование происходит по Cys208. Биотинилирование в данном положении, по-видимому, блокирует и/или снижает окисление белка. Не желая ограничиваться какой-либо теорией, анализ т silico, выполненный авторами настоящего изобретения, дает основание предполагать, что Cys208 является потенциальным инициатором процессов, требуемых для изменений конформации и окисления белка.
[473] В одном варианте осуществления стабилизация представляет собой биотинилирование по Cys208.
[474] В одном варианте осуществления Cys208 замещен аминокислотой, такой как серин. В одном варианте осуществления Cys227 замещен аминокислотой, такой как серии. В одном варианте осуществления Cys232 замещен аминокислотой, такой как серин. В одном варианте осуществления Cys259 замещен аминокислотой, такой как серин. В одном варианте осуществления Cys208 и 227 независимо замещены аминокислотой, такой как серин. В одном варианте осуществления Cys208 и 232 независимо замещены аминокислотой, такой как серин. В одном варианте осуществления Cys208 и 259 независимо замещены аминокислотой, такой как серин. В одном варианте осуществления Cys208, 227 и 232 независимо замещены аминокислотой, такой как серин. В одном варианте осуществления Cys208, 227 и 259 независимо замещены аминокислотой, такой как серин. В одном варианте осуществления Cys208, 232 и 259 независимо замещены аминокислотой, такой как серин. В одном варианте осуществления Cys227, 232 и 259 независимо замещены аминокислотой, такой как серин. В одном варианте осуществления Cys208, 227,232 и 259 независимо замещены аминокислотой, такой как серин.
[475] Мутация, как используется в данном документе, относится к изменению в аминокислотной последовательности или изменению в полинуклеотидной последовательности, так что кодируемая полинуклеотидом аминокислота становится другой или достигается некое другое конкретное отличие, например, функциональное. В частности, изменение может включать делецию или замену аминокислотного остатка. Оптимизация кодонов или избыточность генетического кода не представляют собой мутацию в контексте настоящей заявки.
[476] Мутация, как правило, будет применяться в данном документе, когда имеет место изменение аминокислотной или полинуклеотидной последовательностей нативного белка или белка дикого типа, в то время как вариант будет использоваться в данном документе при обсуждении изменений с получением новых последовательностей.
[477] Нативный, как используется в данном документе, относится к объекту, такому как аминокислота, который обнаруживается в последовательности дикого типа или иным образом встречается в природе.
[478] Конъюгированный, как используется в данном документе, относится к связи, соединяющей два объекта или фрагмента, например, связи, такой как ковалентная связь.
[479] Объект, как используется в данном документе, относится к "элементу", молекуле, фрагменту, атому, компоненту и т.п.
[480] Химическая структурная единица представляет собой молекулу или фрагмент типа, полученного с помощью синтетических химических способов.
[481] В одном варианте осуществления стабилизация осуществляется с помощью мутации белка IL-33, например, точковой мутации, в частности, замещения одной или нескольких аминокислот цистеинов альтернативной аминокислотой, например, серином. Альтернативная аминокислота, как используется в данном контексте, относится к аминокислоте, отличной от цистеина. В одном варианте осуществления аминокислота представляет собой аминокислоту, не встречающуюся в природе. В одном варианте осуществления аминокислота представляет собой встречающуюся в природе аминокислоту. В одном варианте осуществления аминокислота является белковой. В одном варианте осуществления аминокислота представляет собой серин, который является преимущественным, поскольку это замена является консервативной, и, как правило, активность белка после данной замены сохраняется.
[482] Стабилизация redIL-33 важна, поскольку она закрепляет форму IL-33 в активной конформации, которую, в свою очередь, можно применять в качестве инструмента для выявления связывающих молекул, которые ослабляют активность белка. В одном варианте осуществления стабилизированный белок используют для осуществления поиска в библиотеке молекул, такой как фаговая библиотека антител или синтетические библиотеки антител. В одном варианте осуществления стабилизированный белок используют для иммунизации хозяина, тем самым впервые обеспечивается возможность получения антител, специфических в отношении восстановленной формы.
[483] "Ослабляет активность", как используется в данном документе, относится к снижению соответствующей активности или прекращению соответствующей активности. Как правило, ослабление и ингибирование используются в данном документе взаимозаменяемо, если из контекста явно не следует иное.
[484] В одном варианте осуществления ослабление осуществляют путем связывания redIL-33. В одном варианте осуществления связывающая молекула, такая как антитело или его связывающий фрагмент, является специфической в отношении redIL-33, то есть она характеризуется большей аффинностью в отношении redIL-33, чем в отношении окисленной формы, например, в 1, 2, 3, 4, 5 раз большей аффинностью или более. Она обозначается в данном документе как специфическое в отношении redIL-33 антитело.
[485] В одном варианте осуществления специфическое в отношении redIL-33 антитело осуществляет связывание таким образом, что оно пространственно блокирует связывание с рецептором ST2.
[486] В одном варианте осуществления специфическое в отношении redIL-33 антитело осуществляет связывание таким образом, что оно пространственно блокирует связывание с рецептором IL-1RAcP.
[487] В одном варианте осуществления специфическое в отношении redIL-33 антитело осуществляет связывание таким образом, что оно аллостерически блокирует связывание с рецептором ST2.
[488] В одном варианте осуществления специфическое в отношении redIL-33 антитело осуществляет связывание таким образом, что оно аллостерически блокирует связывание с рецептором IL-1RAcP.
[489] В одном варианте осуществления специфическое в отношении redIL-33 антитело осуществляет связывание таким образом, что оно аллостерически блокирует передачу сигнала через рецептор ST2, но может связывать ST2 и/или IL-1RAcP.
[490] В одном варианте осуществления антитело связывает окисленную форму IL-33 и катализирует преобразование восстановленной формы в окисленную форму. Не желая ограничиваться какой-либо теорией, полагают, что вследствие связывания окисленной формы равновесие процесса изменяется в сторону преобразования в окисленную форму.
[491] Следует отметить, что форма единственного числа объекта относится к одному или нескольким таким объектам; например, подразумевается, что "антитело к IL-33" означает одно или несколько антител к IL-33. В связи с этим, формы единственного числа, термины "один или несколько" и "по меньшей мере один" могут использоваться в данном документе взаимозаменяемо.
[492] Подразумевается, что используемый в данном документе термин "полипептид" охватывает "полипептид" в единственном числе, а также "полипептиды" во множественном числе и относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также известными как пептидные связи). Термин "полипептид" относится к любой цепи или цепям из двух или более аминокислот и не обозначает конкретную длину продукта. Таким образом, пептиды, дипептиды, трипептиды, олигопептиды, "аминокислотная цепь" или любой другой термин, используемый для обозначения цепи или цепей из двух или более аминокислот, включены в определение "полипептид", и термин "полипептид" можно применять вместо любого из этих терминов или взаимозаменяемо с любым из них. Также подразумевается, что термин "полипептид" обозначает продукты постэкспрессионных модификаций полипептида, включая без ограничения гликозилирование, ацетилирование, фосфорилирование, амидирование, получение производных с помощью известных защитных/блокирующих групп, протеолитическое расщепление или модификацию с помощью аминокислот, не встречающихся в природе. Полипептид может быть получен из природного биологического источника или создан с помощью рекомбинантной технологии, но не обязательно получен путем трансляции определенной последовательности нуклеиновой кислоты. Он может быть получен любым способом, в том числе путем химического синтеза.
[493] Полипептиды с определенной трехмерной структурой называются свернутыми, а полипептиды, не обладающие определенной трехмерной структурой, а способные принимать большое число различных конформаций, называются несвернутыми. Используемый в данном документе термин "гликопротеин" относится к белку, связанному по меньшей мере с одним углеводным компонентом, присоединенным к белку посредством кислородсодержащей или азотсодержащей боковой цепи аминокислотного остатка, например, серинового остатка или аспарагинового остатка.
[494] Подразумевается, что "выделенный" полипептид или его фрагмент, вариант или производное обозначают полипептид, который не находится в своем природном окружении. Не требуется какой-либо конкретный уровень очистки. Например, выделенный полипептид может быть извлечен из своей нативной или естественной окружающей среды. Полученные рекомбинантным путем полипептиды и белки, экспрессируемые в клетках-хозяевах, считаются выделенными для целей настоящего раскрытия, поскольку представляют собой нативные или рекомбинантные полипептиды, которые были отделены, фракционированы или частично или в значительной степени очищены с помощью любой подходящей методики.
[495] Белок, как используется в данном документе, относится к полипептиду со вторичной и третичной структурой.
[496] Также в качестве полипептидов по настоящему раскрытию включены фрагменты, производные, аналоги или варианты приведенных выше полипептидов и любая их комбинация.
[497] Термины "фрагмент," "вариант," "производное" и "аналог", например, относящиеся к белку или полипептиду по настоящему раскрытию, таким как антитела к IL-33 или полипептиды антител по настоящему раскрытию, включают любые полипептиды, которые сохраняют по меньшей мере некоторую степень антигенсвязывающих свойств соответствующих антитела или полипептида антитела по настоящему раскрытию. Фрагменты полипептидов по настоящему раскрытию включают фрагменты, полученные в результате протеолиза, а также фрагменты, полученные в результате делеции, в дополнение к специфическим фрагментам антител, обсуждаемым в другом месте данного документа. Варианты антител к IL-33 и полипептидов антител по настоящему раскрытию включают фрагменты, описанные выше, а также полипептиды с измененной аминокислотной последовательностью вследствие аминокислотных замен, делеций или вставок. Варианты могут быть встречающимися в природе или не встречающимися в природе. Варианты, не встречающиеся в природе, могут быть получены при помощи методик мутагенеза, известных из уровня техники.
[498] Вариантные полипептиды могут содержать консервативные или неконсервативные аминокислотные замены, делеции или добавления. Вариантные полипептиды также могут обозначаться в данном документе как "аналоги полипептидов". Используемое в данном документе выражение "производное", например, антитела к IL-33 или полипептида антитела, относится к заявленному полипептиду с одним или несколькими остатками, химически дериватизированными путем осуществления реакции с функциональной боковой группой. Также в качестве "производных" включены те пептиды, которые содержат одно или несколько производных встречающихся в природе аминокислот из двадцати стандартных аминокислот. Например, пролин может быть заменен 4-гидроксипролином; лизин может быть заменен 5-гидроксилизином; гистидин может быть заменен 3-метилгистидином; серин может быть заменен гомосерином; и лизин может быть заменен орнитином. Производные антител к IL-33 и полипептидов антител по настоящему раскрытию могут включать полипептиды, которые были изменены таким образом, чтобы проявлять дополнительные признаки, не обнаруживаемые на эталонном антителе или полипептиде антитела по данному раскрытию.
[499] Подразумевается, что термин "полинуклеотид" охватывает нуклеиновую кислоту в единственном числе, а также нуклеиновые кислоты во множественном числе и относится к выделенной молекуле или конструкции нуклеиновой кислоты, например, матричной РНК (мРНК) или плазмидной ДНК (пДНК). Полинуклеотид может содержать обычную фосфодиэфирную связь или необычную связь (например, амидную связь, такую как встречается в пептидных нуклеиновых кислотах (PNA)). Термин "нуклеиновая кислота" относится к любому одному или нескольким сегментам нуклеиновой кислоты, например, фрагментам ДНК или РНК, присутствующим в полинуклеотиде. Под "выделенной" нуклеиновой кислотой или полинуклеотидом подразумевается молекула нуклеиновой кислоты, ДНК или РНК, которые были извлечены из их нативной окружающей среды. Например, рекомбинантный полинуклеотид, кодирующий связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, содержащийся в векторе, считается выделенным для целей настоящего раскрытия. Дополнительные примеры выделенного полинуклеотида включают рекомбинантные полинуклеотиды, содержащиеся в гетерологичных клетках-хозяевах, или очищенные (частично или в значительной степени) полинуклеотиды в растворе. Выделенные молекулы РНК включают в себя in vivo или in vitro РНК-транскрипты полинуклеотидов по настоящему раскрытию. Выделенные полинуклеотиды или нуклеиновые кислоты в соответствии с настоящим раскрытием дополнительно включают в себя такие молекулы, полученные синтетически. Кроме того, полинуклеотид или нуклеиновая кислота могут представлять собой или содержать регуляторный элемент, такой как промотор, сайт связывания рибосомы или терминатор транскрипции.
[500] Используемое в данном документе выражение "кодирующая область" представляет собой часть нуклеиновой кислоты, состоящую из кодонов, транслируемых в аминокислоты. Хотя "стоп-кодон" (TAG, TGA или ТАА) не транслируется в аминокислоту, он может считаться частью кодирующей области, однако любые фланкирующие последовательности, например, промоторы, сайты связывания рибосомы, терминаторы транскрипции, интроны и т.п., не составляют часть кодирующей области. Две или более кодирующие области по настоящему раскрытию могут присутствовать в одной полинуклеотидной конструкции, например, на одном векторе, или в отдельных полинуклеотидных конструкциях, например, на отдельных (различных) векторах. Кроме того, любой вектор может содержать одну кодирующую область или может содержать две или более кодирующие области, например, один вектор может отдельно кодировать вариабельную область тяжелой цепи иммуноглобулина и вариабельную область легкой цепи иммуноглобулина. Кроме того, вектор, полинуклеотид или нуклеиновая кислота по настоящему раскрытию могут кодировать гетерологичные кодирующие области, как слитые, так и неслитые с нуклеиновой кислотой, кодирующей антитело к IL-33 или его фрагмент, вариант или производное. Гетерологичные кодирующие области включают без ограничения специализированные элементы или мотивы, как, например, кодирующие секреторный сигнальный пептид или гетерологичный функциональный домен.
[501] В определенных вариантах осуществления полинуклеотид или нуклеиновая кислота представляют собой ДНК. В случае ДНК полинуклеотид, содержащий нуклеиновую кислоту, которая кодирует полипептид, обычно может содержать промотор и/или другие элементы контроля транскрипции или трансляции, функционально связанные с одной или несколькими кодирующими областями. Функциональная связь наблюдается тогда, когда кодирующая область для продукта гена, например, полипептида, связана с одной или несколькими регуляторными последовательностями таким образом, что экспрессия продукта гена находится под влиянием или контролем регуляторной последовательности(ей). Два фрагмента ДНК (такие как область, кодирующая полипептид, и промотор, связанный с ней) являются "функционально связанными", если индуцирование функции промотора приводит к транскрипции мРНК, кодирующей требуемый продукт гена, и если природа связи между двумя фрагментами ДНК не препятствует способности последовательностей, регулирующих экспрессию, управлять экспрессией продукта гена или не препятствует способности ДНК-матрицы транскрибироваться. Таким образом, промоторная область будет функционально связанной с нуклеиновой кислотой, кодирующей полипептид, если промотор способен вызывать транскрипцию данной нуклеиновой кислоты. Промотор может представлять собой промотор, специфический в отношении клеток, который приводит к значительной транскрипции ДНК только в предопределенных клетках. Другие элементы контроля транскрипции, помимо промотора, например, энхансеры, операторы, репрессоры и сигналы терминации транскрипции, могут быть функционально связанными с полинуклеотидом для управления транскрипцией, специфической в отношении клеток. Подходящие промоторы и другие области, осуществляющие контроль транскрипции, раскрыты в данном документе.
[502] Разнообразные области, осуществляющие контроль транскрипции, известны специалистам в данной области. Они включают без ограничения области, осуществляющие контроль транскрипции, функционирующие в клетках позвоночных, такие как без ограничения промоторные и энхансерные сегменты цитомегаловирусов (промотор генов немедленного раннего ответа вместе с интроном-А), вируса обезьян 40 (промотор гена раннего ответа) и ретровирусов (таких как вирус саркомы Рауса). Другие области контроля транскрипции включают таковые, происходящие из генов позвоночных, таких как ген актина, белка теплового шока, бычьего гормона роста и β-глобина кролика, а также другие последовательности, способные контролировать экспрессию генов в эукариотических клетках. Дополнительные подходящие области, осуществляющие контроль транскрипции, включают тканеспецифические промоторы и энхансеры, а также лимфокин-индуцируемые промоторы (например, промоторы, индуцируемые интерферонами или интерлейкинами).
[503] Аналогично, разнообразные элементы контроля трансляции, известны специалистам в данной области. Они включают без ограничения сайты связывания рибосомы, кодоны инициации и терминации трансляции и элементы, происходящие от пикорнавирусов (в частности, участок внутренней посадки рибосомы или IRES, также называемый CITE-последовательность).
[504] В других вариантах осуществления полинуклеотид по настоящему раскрытию представляет собой РНК, например, в форме матричной РНК (мРНК).
[505] Кодирующие области полинуклеотидов и нуклеиновых кислот по настоящему раскрытию могут быть ассоциированы с дополнительными кодирующими областями, которые кодируют секреторные или сигнальные пептиды, которые управляют секрецией полипептида, кодируемого полинуклеотидом по настоящему раскрытию. Согласно гипотезе сигнальной последовательности, белки, секретируемые клетками млекопитающих, имеют сигнальный пептид или секреторную лидерную последовательность, которые отщепляются от зрелого белка после начала экспорта растущей белковой цепи через гранулярный эндоплазматический ретикулум. Специалистам в данной области известно, что полипептиды, секретируемые клетками позвоночных, обычно имеют сигнальный пептид, слитый с N-концом полипептида, который отщепляется от полного или "полноразмерного" полипептида с образованием секретированной или "зрелой" формы полипептида. В определенных вариантах осуществления применяют нативный сигнальный пептид, например, сигнальный пептид тяжелой цепи или легкой цепи иммуноглобулина, или функциональное производное такой последовательности, которое сохраняет способность управлять секрецией полипептида, функционально связанного с ним. Альтернативно, можно применять гетерологичный сигнальный пептид млекопитающих или его функциональное производное. Например, лидерную последовательность дикого типа можно заменять на лидерную последовательность тканевого активатора плазминогена (ТРА) человека или β-глюкуронидазы мыши.
[506] Выражения "связывающая молекула" или "антигенсвязывающая молекула" по настоящему раскрытию относятся в своем наиболее широком смысле к молекуле, которая специфически связывает антигенную детерминанту. В одном варианте осуществления связывающая молекула специфически связывается с IL-33, в частности, redIL-33 или IL-33-DSB. В другом варианте осуществления связывающая молекула по настоящему раскрытию представляет собой антитело или его антигенсвязывающий фрагмент.
[507] В другом варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере один CDR тяжелой или легкой цепи из молекулы эталонного антитела. В другом варианте осуществления связывающая молекула по настоящему раскрытию содержит по меньшей мере шесть CDR из одной или нескольких молекул эталонных антител.
[508] Настоящее раскрытие относится к определенным антителам к IL-33 или их антигенсвязывающим фрагментам, вариантам или производным.
[509] Антитело, как используется в данном документе, относится к молекуле иммуноглобулина, обсуждаемой подробнее ниже, в частности, к полноразмерному антителу или молекуле, предусматривающей полноразмерное антитело, например, молекулу DVD-Ig и т.п.
[510] Связывающий фрагмент представляет собой эпитоп/антигенсвязывающий фрагмент фрагмента антитела, например, предусматривающий связывание, в частности, содержащий 6 CDR, как, например, 3 CDR в вариабельной области тяжелой цепи и 3 CDR в вариабельной области легкой цепи.
[511] Если конкретно не ссылаются на антитела полного размера, такие как встречающиеся в природе антитела, термин "антитела к IL-33" охватывает антитела полногоразмера, а также антигенсвязывающие фрагменты, варианты, аналоги или производные таких антител, например, встречающиеся в природе молекулы антител или иммуноглобулинов, или сконструированные молекулы антител, или фрагменты, которые связывают антиген способом, аналогичным молекулам антител.
[512] Используемые в данном документе выражения "антитела человека" или "полностью человеческие антитела" включают антитела с аминокислотной последовательностью иммуноглобулина человека, и включают антитела, выделенные из библиотек иммуноглобулинов человека или из животных, трансгенных по одному или нескольким иммуноглобулинам человека и не экспрессирующих эндогенные иммуноглобулины. Полностью человеческие антитела, в частности, желательны для терапевтического лечения пациентов-людей. Антитела человека могут быть получены с помощью ряда способов, известных из уровня техники, включая способы фагового дисплея с применением библиотек антител, полученных на основании последовательностей иммуноглобулинов человека, как описано в Vaughan et al., Nat. Biotech. 74:309-314 (1996), Sheets et al., Proc. Nat'l. Acad. Sci. 95:6157-6162 (1998), Hoogenboom and Winter, J. Mol. Biol. 227:381 (1992), и Marks et al., J. Mol. Biol. 222:581 (1991)). Методики получения и применения фаговых библиотек антител также описаны, например, в патентах США №№5969108, 6172197, 5885793, 6521404; 6544731; 6555313; 6582915; 6593081; 6300064; 6653068; 6706484 и 7264963, а также Rothe et al., J. Mol. Biol., 376:1382 (2008) (каждый из которых включен посредством ссылки во всей своей полноте). Кроме того, как известно из уровня техники, антитела человека можно получать с помощью трансгенных мышей, которые не способны к экспрессии функциональных эндогенных иммуноглобулинов, но которые могут экспрессировать гены иммуноглобулинов человека. Обзор этой технологии см. в Lonberg and Huszar, Int. Rev. Immunol. 13:65-93 (1995). "Антитела человека" или "полностью человеческие антитела" также включают антитела, содержащие по меньшей мере вариабельный домен тяжелой цепи или по меньшей мере вариабельные домены тяжелой цепи и легкой цепи, где вариабельный домен(ы) имеют аминокислотную последовательность вариабельного домена(ов) иммуноглобулина человека.
[513] "Антитела человека" или "полностью человеческие антитела" также включают "антитела человека" или "полностью человеческие антитела", описанные выше, которые содержат, фактически состоят или состоят из вариантов (в том числе производных) молекул антител (например, VH-областей и/или VL-областей), описанных в данном документе, при этом антитела или их фрагменты иммуноспецифически связываются с полипептидом IL-33 или его фрагментом или вариантом в соответствии с настоящим раскрытием.
[514] Для введения мутаций в нуклеотидную последовательность, кодирующую антитело человека к IL-33, можно применять стандартные методики, известные специалистам в данной области, включая без ограничений сайт-направленный мутагенез и ПЦР-опосредованный мутагенез, которые приводят к аминокислотным заменам. В одном варианте осуществления в вариантах (включая производные) закодировано менее 50 аминокислотных замен, менее 40 аминокислотных замен, менее 30 аминокислотных замен, менее 25 аминокислотных замен, менее 20 аминокислотных замен, менее 15 аминокислотных замен, менее 10 аминокислотных замен, менее 5 аминокислотных замен, менее 4 аминокислотных замен, менее 3 аминокислотных замен или менее 2 аминокислотных замен относительно эталонной VH-области, CDRH1, CDRH2, CDRH3, VL-области, CDRL1, CDRL2 или CDRL3.
[515] В определенных вариантах осуществления аминокислотные замены представляют собой консервативными аминокислотные замены, дополнительно обсуждаемые ниже. Альтернативно, мутации можно вводить случайным образом по длине всей кодирующей последовательности или ее части, как, например, путем насыщающего мутагенеза, и полученных мутантов можно подвергать скринингу в отношении биологической активности для идентификации мутантов, сохраняющих активность (например, способность связывать полипептид IL-33, например, человека, примата, мыши, или любую комбинацию IL-33 человека, примата и мыши). Такие варианты (или их производные) "антител человека" или "полных антител человека" также можно обозначать как антитела человека или полные антитела человека, которые являются "оптимизированными" или "оптимизированными для связывания антигена" и включают без ограничения антитела, которые характеризуются улучшенной аффинностью к антигену, антитела с измененной специфичностью в отношении антигена или антитела с ослаблением факторов структурной неустойчивости.
[516] Основные структуры иммуноглобулинов в системах позвоночных относительно хорошо изучены. См., например, Harlow et al. (1988) Antibodies: A Laboratory Manual (2nd ed.; Cold Spring Harbor Laboratory Press).
[517] Как будет более подробно обсуждаться ниже, термин "иммуноглобулин" предусматривает разнообразные широкие классы полипептидов, которые можно разграничивать с помощью методов биохимии. Специалистам в данной области будет понятно, что тяжелые цепи классифицируют как гамма, мю, альфа, дельта или эпсилон (γ, μ, α, δ, ε), при этом у них существует несколько подклассов (например, γ1-γ4). Именно природа данной цепи определяет "класс" антитела, такой как IgG, IgM, IgA, IgG или IgE соответственно. Подклассы иммуноглобулинов (изотипы) например, IgG1, IgG2, IgG3, IgG4, IgA1 и т.д., хорошо охарактеризованы и, как известно, обусловливают функциональную специализацию. Модифицированные варианты каждого из этих классов и изотипов легко различит специалист в данной области в свете настоящего раскрытия и, соответственно, они все входят в объем настоящего раскрытия. Хотя дальнейшее обсуждение в целом будет направлено на молекулы иммуноглобулина класса IgG, все классы иммуноглобулинов, безусловно, входят в объем настоящего раскрытия. Что касается IgG, стандартная молекула иммуноглобулина содержит два идентичных полипептида легкой цепи с молекулярным весом примерно 23000 Дальтон и два идентичных полипептида тяжелой цепи с молекулярным весом 53000-70000. Четыре цепи, как правило, соединены дисульфидными связями в "Y"-образную конфигурацию, где легкие цепи охватывают тяжелые цепи, начинаясь от раздвоенного конца "Y" и продолжаясь на вдоль всей вариабельной области.
[518] Легкие цепи классифицируют как каппа или лямбда (κ, λ). Тяжелая цепь каждого класса может быть связана либо с легкой каппа-цепью, либо с легкой лямбда-цепью. Обычно легкая и тяжелая цепи ковалентно связаны друг с другом, а "хвостовые" участки двух тяжелых цепей связаны друг с другом ковалентными дисульфидными связями или нековалентными связями, когда иммуноглобулины получают с помощью гибридом, В-клеток или с помощью клеток-хозяев, сконструированных методом генной инженерии. В тяжелой цепи аминокислотные последовательности расположены от N-конца на раздвоенных концах Y-образной конфигурации до С-конца в нижней части каждой цепи.
[519] Основание антитела "Y" называется Fc- (кристаллизуемый фрагмент) областью и состоит из двух тяжелых цепей, которые составлены двумя или тремя константными доменами в зависимости от класса антитела. Вследствие этого, Fc-область связывается со специфическим классом Fc-рецепторов и другими молекулами иммунной системы, как, например, белками системы комплемента. Как легкая, так и тяжелая цепи разделены на области, обладающие структурной и функциональной гомологией. Термины "константный" и "вариабельный" применяются в функциональном отношении. В связи с этим следует принять во внимание, что вариабельные домены частей как легкой (Vλ или Vκ), так и тяжелой (VH) цепей определяют распознавание антигена и специфичность в его отношении. Напротив, константные домены легкой цепи (CL) и тяжелой цепи (СН1, СН2 или СН3) обусловливают важные биологические свойства, такие как секреция, перенос через плаценту, связывание с Fc-рецепторами, связывание с комплементом и т.п. Традиционно нумерация доменов константной области возрастает по мере удаления от антигенсвязывающего сайта или амино-конца антитела. N-концевая часть представляет собой вариабельную область, а на С-концевой части находится константная область; СН3- и CL-домены фактически содержат карбокси-конец тяжелой и легкой цепи, соответственно.
[520] Как указано выше, вариабельная область позволяет антителу селективно распознавать эпитопы антигенов и специфически связывать их. Это значит, что VL-домен и VH-домен или подмножество определяющих комплементарность участков (CDR) в пределах данных вариабельных доменов антитела объединены с образованием вариабельной области, которая определяет трехмерный антигенсвязывающий сайт. Эта четвертичная структура антитела приводит к образованию антигенсвязывающего сайта на конце каждого плеча Y. В частности, антигенсвязывающий сайт определяется тремя CDR на каждой из VH- и VL-цепей. В некоторых случаях, например, определенные молекулы иммуноглобулина, полученные из видов верблюдовых или сконструированные на основе иммуноглобулинов верблюдовых, полная молекула иммуноглобулина может состоять только из тяжелых цепей без легких цепей. См., например, Hamers-Casterman et al., Nature 363:446-448 (1993).
[521] Во встречающихся в природе антителах шесть "определяющих комплементарность участков" или "CDR", имеющихся в каждом антигенсвязывающем домене, представляют собой короткие, несмежные последовательности аминокислот, которые расположены определенным образом для образования антигенсвязывающего домена в момент, когда антитело приобретает свою трехмерную конфигурацию в водной окружающей среде. Для остальных аминокислот антигенсвязывающих доменов, называемые "каркасными" областями, характерна меньшая степень межмолекулярной изменчивости. Каркасные области преимущественно принимают β-складчатую конформацию, а CDR образуют петли, которые соединяются с β-складчатой структурой и в некоторых случаях образуют ее часть. Таким образом, функцией каркасных областей является образование остова, который обеспечивает позиционирование CDR в правильной ориентации с помощью нековалентных взаимодействий между цепями. Антигенсвязывающий домен, образованный позиционированными CDR, образует поверхность, комплементарную эпитопу иммунореактивного антигена. Эта комплементарная поверхность содействует нековалентному связыванию антитела с его когнатным эпитопом. Аминокислоты, составляющие CDR и каркасные области соответственно, специалист в данной области может без труда идентифицировать для любого рассматриваемого вариабельного домена тяжелой или легкой цепи, поскольку они были точно определены (см. ниже).
[522] В случае, когда есть два или более определения термина, который применяется и/или принят в данной области техники, подразумевается, что определение термина, используемого в данном документе, включает все такие значения, если явно не указано иное. Специфический пример представляет применение термина "определяющий комплементарность участок" ("CDR") для описания несмежных антигенсвязывающих сайтов, встречающихся в пределах вариабельной области полипептидов как тяжелой, так и легкой цепи. Эта конкретная область была описана в Kabat et al, U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" (1983) и в Chothia et al, J. Mol Biol 196:901-917 (1987), которые включены в данный документ посредством ссылки, где определения предусматривают перекрывание или подмножества аминокислотных остатков при сравнении друг с другом. Тем не менее, подразумевается, что применение одного из двух определений для обозначения CDR антитела или его вариантов находится в пределах объема термина, как определяется и применяется в данном документе. Соответствующие аминокислотные остатки, которые охватываются CDR, как определено согласно каждой из упомянутых выше ссылок, приведены ниже в таблице 1 для сравнения. Точное число остатков, которые охватываются конкретным CDR, будет варьировать в зависимости от последовательности и размера CDR. Специалисты в данной области могут обычным образом определить, какие остатки составляют конкретный CDR, с учетом аминокислотной последовательности вариабельной области антитела.

[523] Kabat et al. также определили систему нумерации последовательностей вариабельного домена, которую можно применять к любому антителу. Специалист в данной области может однозначно соотнести эту систему "нумерации по Kabat" с любой последовательностью вариабельного домена, без использования каких-либо экспериментальных данных, помимо самой последовательности. Как используется в данном документе, "нумерация по Kabat" относится к системе нумерации, изложенной в Kabat et al., (1983) U.S. Dept. of Health and Human Services, "Sequence of Proteins of Immunological Interest". Если не указано иное, то ссылки на нумерацию специфических положений аминокислотных остатков в антителе к IL-33 или его антигенсвязывающем фрагменте, варианте или производном по настоящему раскрытию приведены в соответствии с системой нумерации по Rabat.
[524] Антитела или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию включают без ограничения поликлональные, моноклональные, мультиспецифические, мышиные, человеческие, гуманизированные, приматизированные или химерные антитела, одноцепочечные антитела, эпитоп-связывающие фрагменты, например. Fab, Fab' и F(ab')2, Fd, Fv, одноцепочечные Fv (scFv), Fv с дисульфидными связями (sdFv), фрагменты, содержащие либо VL-домен, либо VH-домен, фрагменты, полученные с помощью экспрессионной библиотеки Fab, и антиидиотипические (anti-Id) антитела (включая, например, anti-Id антитела к антителам к IL-33, раскрытые в данном документе). Молекулы ScFv известны из уровня техники и описаны, например, в патенте США №5892019. Молекулы иммуноглобулина или антител по настоящему раскрытию могут принадлежать к молекулам иммуноглобулина любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2 и т.д.) или подкласса.
[525] Используемый в данном документе термин "часть тяжелой цепи" предусматривает аминокислотные последовательности, полученные из тяжелой цепи иммуноглобулина. Полипептид, содержащий часть тяжелой цепи, содержит по меньшей мере одно из: СН1-домена, шарнирного домена (например, верхней, средней и/или нижней шарнирной области), СН2-домена, СН3-домена или их варианта или фрагмента. Например, связывающий полипептид для применения в настоящем раскрытии может содержать полипептидную цепь, содержащую СН1-домен; полипептидную цепь, содержащую СН1-домен, по меньшей мере часть шарнирного домена и СН2-домен; полипептидную цепь, содержащую СН1-домен и СН3-домен; полипептидную цепь, содержащую СН1-домен, по меньшей мере часть шарнирного домена и СН3-домен, или полипептидную цепь, содержащую СН1-домен, по меньшей мере часть шарнирного домена, СН2-домен и СН3-домен. В другом варианте осуществления полипептид по настоящему раскрытию содержит полипептидную цепь, содержащую СН3-домен. Кроме того, у связывающего полипептида для применения в настоящем раскрытии может отсутствовать по меньшей мере часть СН2-домена (например, весь СН2-домен или его часть). Как изложено выше, специалисту в данной области будет понятно, что данные домены (например, части тяжелой цепи) можно модифицировать таким образом, чтобы они отличались по аминокислотной последовательности от встречающейся в природе молекулы иммуноглобулина.
[526] У определенных антител к IL-33 или их антигенсвязывающих фрагментов, вариантов или производных, раскрытых в данном документе, части тяжелой цепи одной полипептидной цепи мультимера идентичны таковым на второй полипептидной цепи мультимера. Альтернативно, мономеры, содержащие часть тяжелой цепи, по настоящему раскрытию, не являются идентичными. Например, каждый мономер может содержать отличный сайт связывания мишени, при этом образуется, например, биспецифическое антитело.
[527] Части тяжелой цепи связывающей молекулы для применения в способах диагностики и лечения, раскрытых в данном документе, могут быть получены из различных молекул иммуноглобулинов. Например, часть тяжелой цепи полипептида может содержать CH1-домен, полученный из молекулы IgG1, и шарнирную область, полученную из молекулы IgG3. В другом примере часть тяжелой цепи может содержать шарнирную область, полученную частично из молекулы IgG1 и частично из молекулы IgG3. В другом примере часть тяжелой цепи может содержать химерную шарнирную область, полученную частично из молекулы IgG1 и частично из молекулы IgG4.
[528] Используемый в данном документе термин "часть легкой цепи" включает аминокислотные последовательности, полученные из легкой цепи иммуноглобулина, например, легкой каппа- или лямбда-цепи. Предпочтительно часть легкой цепи содержит по меньшей мере один из VL- или CL-домена.
[529] Антитела к IL-33 или их антигенсвязывающие фрагменты, варианты или производные, раскрытые в данном документе, могут быть описаны или определены с точки зрения эпитопа(ов) или части(ей) антигена, например, полипептида-мишени, раскрытого в данном документе (например, полноразмерного или зрелого IL-33), который они распознают или специфически связывают. Часть полипептида-мишени, которая специфически взаимодействует с антигенсвязывающим доменом антитела, представляет собой "эпитоп" или "антигенную детерминанту". Полипептид-мишень может содержать один эпитоп, но обычно содержит по меньшей мере два эпитопа и может включать любое количество эпитопов, в зависимости от размера, конформации и типа антигена. Кроме того, следует отметить, что "эпитоп" на полипептиде-мишени может представлять собой или может содержать элементы, не имеющие полипептидную природу, например, эпитоп может содержать углеводную боковую цепь.
[530] Полагают, что минимальный размер пептидного или полипептидного эпитопа для антитела составляет приблизительно четыре-пять аминокислот. Пептидные или полипептидные эпитопы предпочтительно содержат по меньшей мере семь, более предпочтительно по меньшей мере девять и наиболее предпочтительно от по меньшей мере от приблизительно 15 до приблизительно 30 аминокислот. Поскольку CDR может распознавать антигенный пептид или полипептид в их третичной форме, аминокислоты, составляющие эпитоп, не должны быть смежными, и в некоторых случаях они могут даже не находиться на одной и той же пептидной цепи. Пептидный или полипептидный эпитоп, распознаваемый антителами к IL-33 по настоящему раскрытию, может содержать последовательность, состоящую из по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, более предпочтительно по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 25 или от приблизительно 15 до приблизительно 30 смежных или несмежных аминокислот IL-33.
[531] Под "специфически связывает", как правило, подразумевают, что антитело связывается с эпитопом посредством своего антигенсвязывающего домена и что связывание предполагает некоторую степень комплементарности между антигенсвязывающим доменом и эпитопом. Согласно данному определению говорят, что антитело "специфически связывается" с эпитопом, когда оно связывается с таким эпитопом посредством своего антигенсвязывающего домена с большей легкостью, чем если бы оно связывалось со случайным, неродственным, эпитопом. Термин "специфичность" используется в данном документе для обозначения относительной аффинности, с которой определенное антитело связывается с определенным эпитопом. Например, могут полагать, что антитело "А" может характеризоваться более высокой специфичностью в отношении данного эпитопа, чем антитело "В", или могут говорить, что антитело "А" связывается с эпитопом "С" с более высокой специфичностью, чем та, которой он характеризуется в отношении эпитопа "D."
[532] В одном варианте осуществления антитело или его связывающий фрагмент преимущественно связывает IL-33. Под "преимущественно связывает" подразумевают, что антитело специфически связывается с эпитопом с большей легкостью, чем если бы оно связывалось с родственным, сходным, гомологичным или аналогичным эпитопом. Таким образом, антитело, которое " преимущественно связывается" с данным эпитопом, будет с большей вероятностью связываться с этим эпитопом, чем с родственным эпитопом, несмотря на то, что такое антитело может вступать в перекрестную реакцию с родственным эпитопом.
[533] В качестве неограничивающего примера может считаться, что антитело преимущественно связывается с первым эпитопом, если оно связывает указанный первый эпитоп с константой диссоциации (KD), которая меньше KD антитела для второго эпитопа. В другом неограничивающем примере может считаться, что антитело преимущественно связывает первый антиген, если оно связывает первый эпитоп с аффинностью, величина которой по меньшей мере на один порядок меньше, чем Ко антитела для второго эпитопа. В другом неограничивающем примере может считаться, что антитело преимущественно связывает первый эпитоп, если оно связывает первый эпитоп с аффинностью, величина которой по меньшей мере на два порядка меньше, чем KD антитела для второго эпитопа.
[534] В другом неограничивающем примере может считаться, что антитело преимущественно связывает первый эпитоп, если оно связывает первый эпитоп со скоростью диссоциации (k(off)), которая меньше k(off) антитела для второго эпитопа. В другом неограничивающем примере может считаться, что антитело преимущественно связывает первый эпитоп, если оно связывает первый эпитоп с аффинностью, величина которой по меньшей мере на один порядок меньше, чем k(off) антитела для второго эпитопа. В другом неограничивающем примере может считаться, что антитело преимущественно связывает первый эпитоп, если оно связывает первый эпитоп с аффинностью, величина которой по меньшей мере на два порядка меньше, чем k(off) антитела для второго эпитопа.
[535] В одном варианте осуществления можно сказать, что антитело или его антигенсвязывающий фрагмент, вариант или производное в соответствии с настоящим раскрытием связывают полипептид-мишень, раскрытый в данном документе (например, IL-33, например, человека, примата, мыши, или любую комбинацию IL-33 человека, примата и мыши), или его фрагмент или вариант со скоростью диссоциации (k(off)), которая меньше или равна 5 Х 10-1 с-1, 10-1 с-1, 5 Х 10-2 c-1, 10-2 с-1, 5 Х 10-3 с-1 или 10-3 с-1. Например, можно сказать, что антитело по настоящему раскрытию связывает полипептид-мишень, раскрытый в данном документе (например, IL-33, например, человека, примата, мыши, или любую комбинацию IL-33 человека, примата и мыши), или его фрагмент или вариант со скоростью диссоциации (k(off)), которая меньше или равна 5 Х 10-4 с-1, 10-4 c-1, 5 X 10-5 с-1 или 10-5 с-1, 5 Х 10-6 с-1, 10-6 с-1, 5 Х 10-7 c-1 или 10-7 с-1.
[536] В одном варианте осуществления можно сказать, что антитело или его антигенсвязывающий фрагмент, вариант или производное, раскрытые в данном документе, связывают полипептид-мишень, раскрытый в данном документе (например, IL-33, например, человека, примата, мыши, или любую комбинацию IL-33 человека, примата и мыши), или его фрагмент или вариант со скоростью ассоциации (k(on)), которая больше или равна 103 М-1 c-1, 5 Х 103 М-1 c-1, 104 М-1 c-1 или 5 Х 104 М-1 с-1. Например, можно сказать, что антитело по настоящему раскрытию связывает полипептид-мишень, раскрытый в данном документе (например, IL-33, например, человека, примата, мыши, или любую комбинацию IL-33 человека, примата и мыши), или его фрагмент или вариант со скоростью ассоциации (k(on)), которая больше или равна 105 M-1 с-1, 5 Х 105 М-1 с-1, 106М-1 c-1, или 5 Х 106 M-1 с-1, или 107 M-1 с-1.
[537] Подразумевается, что перекрестная реактивность, как используется в данном документе, обозначает ситуацию, при которой связывающие молекулы, например, антитела или их связывающие фрагменты, связывают один и тот же эпитоп или перекрывающиеся эпитопы. Конкурентное ингибирование связывания, как используется в данном документе, представляет собой форму перекрестной реактивности.
[538] Говорится, что антитело конкурентно ингибирует связывание эталонного антитела с данным эпитопом, если оно преимущественно связывается с этим эпитопом в такой степени, что оно в некоторой степени блокирует связывание эталонного антитела с эпитопом. Конкурентное ингибирование может быть определено с помощью любого способа, известного из уровня техники, например, твердофазных анализов, таких как конкурентные ELISA-анализы, усиленные диссоциацией лантанидные флуоресцентные иммунологические анализы (DELFIA®, Perkin Elmer) и анализы связывания радиоактивного лиганда. Может говориться, что антитело конкурентно ингибирует связывание эталонного антитела с данным эпитопом по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60% или по меньшей мере на 50%.
[539] Используемый в данном документе термин "аффинность" относится к показателю силы связывания индивидуального эпитопа с CDR молекулы иммуноглобулина. См., например, Harlow et al. (1988) Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 2nd ed.), страницы 27-28. Используемый в данном документе термин "авидность" относится к общей стабильности комплекса между популяцией иммуноглобулинов и антигеном, то есть к функциональной силе комбинирования смеси иммуноглобулинов с антигеном. См., например, Harlow на страницах 29-34. Авидность связана как с аффинностью индивидуальных молекул иммуноглобулинов в популяции в отношении специфических эпитопов, а также с валентностями иммуноглобулинов и антигена. Например, взаимодействие между бивалентным моноклональным антителом и антигеном с высокоповторяющейся структурой эпитопа, такой как полимер, характеризовалось бы высокой авидностью.
[540] Антитела к IL-33 или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию также можно описывать или определять с точки зрения их перекрестной реактивности. Используемый в данном документе термин "перекрестная реактивность" относится к способности антитела, специфического в отношении одного антигена, реагировать со вторым антигеном; он является показателем родства между двумя различными антигенными веществами. Таким образом, антитело является перекрестно реактивным, если оно связывается с эпитопом, отличным от того, который индуцировал его образование. Эпитоп, приводящий к перекрестной реакции, как правило, содержит много тех же комплементарных структурных признаков индуцирующего эпитопа, а в некоторых случаях действительно может соответствовать лучше, чем оригинальный эпитоп.
[541] Например, определенные антитела характеризуются некоторой степенью перекрестной реактивности, с которой они связывают родственные, но не идентичные эпитопы, например, эпитопы, характеризующиеся по меньшей мере 95%, по меньшей мере 90%, по меньшей мере 85%, по меньшей мере 80%, по меньшей мере 75%, по меньшей мере 70%, по меньшей мере 65%, по меньшей мере 60%, по меньшей мере 55% и по меньшей мере 50% идентичностью (рассчитанной с помощью способов, известных из уровня техники и описанных в данном документе) относительно эталонного эпитопа. Может говориться, что антитело характеризуется небольшой перекрестной реактивностью или ее отсутствием, если оно не связывает эпитопы, характеризующиеся менее чем 95%, менее чем 90%, менее чем 85%, менее чем 80%, менее чем 75%, менее чем 70%, менее чем 65%, менее чем 60%, менее чем 55% и менее чем 50% идентичностью (рассчитанной с помощью способов, известных из уровня техники и описанных в данном документе) относительно эталонного эпитопа. Можно полагать, что антитело является "высокоспецифическим" в отношении определенного эпитопа, если оно не связывает никакой другой аналог, ортолог или гомолог этого эпитопа.
[542] Связывающие молекулы к IL-33, например, антитела или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию, можно также описывать или определять точки зрения их аффинности связывания с полипептидом по настоящему раскрытию, например, IL-33, например, человека, примата, мыши, или любой комбинации IL-33 человека, примата и мыши. Предпочтительные аффинности связывания включают такие, которые характеризуются константой диссоциации или Kd, составляющей менее 5×10-2 М, 10-2 М, 5×10-3 М, 10-3 М, 5×10-4 М, 10-4 М, 5×10-5 М, 10-5 М, 5×10-6 М, 10-6 М, 5×10-7 М, 10-7 М, 5×10-8 М, 10-8 М, 5×10-9 М, 10-9 М, 5×10-10 М, 10-10 М, 5×10-11 М, 5×10-12 М, 10-12 М, 5×10-13 М, 10-13 М, 5×10-14 М, 10-14 М, 5×10-15 М или 10-15 М.
[543] Антитела к IL-33 или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию могут быть "мультиспецифическими", например, биспецифическими, триспецифическими или с большей мультиспецифичностью, что означает, что они распознают и связываются с двумя или более различными эпитопами, присутствующими на одном или нескольких различных антигенах (например, белках) одновременно. Таким образом, является ли антитело к IL-33 "моноспецифическим" или "мультиспецифическим", например, "биспецифическим", определяется количеством различных эпитопов, с которыми реагирует связывающий полипептид. Мультиспецифические антитела могут быть специфическими в отношении различных эпитопов полипептида-миишени, описанного в данном документе, или они могут быть специфическими в отношении полипептида-мишени, а также в отношении гетерологичного эпитопа, такого как гетерологичный полипептид или твердый материал подложки.
[544] Используемый в данном документе термин "валентность" относится к количеству потенциальных связывающих доменов, например, антигенсвязывающих доменов, присутствующих в связывающем полипептиде или связывающей молекуле к IL-33, например, антителе или его антигенсвязывающем фрагменте. Каждый связывающий домен специфически связывает один эпитоп. Если связывающий полипептид или связывающая молекула к IL-33 содержит более одного связывающего домена, каждый связывающий домен может специфически связывать один и тот же эпитоп, в случае антитела с двумя связывающими доменами, которое называется "бивалентное моноспецифическое," или различные эпитопы, в случае антитела с двумя связывающими доменами, которое называется "бивалентное биспецифическое". Антитело или его антигенсвязывающий фрагмент также может быть биспецифическим и бивалентным в отношении каждого вида специфичности (так называемые "биспецифические четырехвалентные антитела"). В другом варианте осуществления можно создавать четырехвалентные миниантитела или антитела с удаленными доменами.
[545] Биспецифические бивалентные антитела и способы их получения описаны, например, в патентах США №№5731168; 5807706; 5821333 и опубликованных заявках на патент США №№2003/020734 и 2002/0155537, раскрытия всех из которых включены в данный документ посредством ссылки. Биспецифические четырехвалентные антитела и способы их получения описаны, например, в WO 02/096948 и WO 00/44788, раскрытия обоих из которых включены в данный документ посредством ссылки. См., в целом, публикации согласно РСТ WO 93/17715; WO 92/08802; WO 91/00360; WO 92/05793; Tutt et al., J. Immunol. 147:60-69 (1991); патенты США №№4474893; 4714681; 4925648; 5573920; 5601819; Kostelny et al., J. Immunol. 148: 1547-1553 (1992).
[546] Как указывалось ранее, структуры субъединиц и трехмерная конфигурация константных областей иммуноглобулинов различных классов хорошо известны. Используемый в данном документе термин "VH-домен" предусматривает амино-концевой вариабельный домен тяжелой цепи иммуноглобулина, а термин "СН1-домен" предусматривает первый (наиболее близкий к амино-концу) домен константной области тяжелой цепи иммуноглобулина. СН1-домен примыкает к VH-домену и является амино-концевым по отношению к шарнирной области тяжелой цепи молекулы иммуноглобулина.
[547] Используемый в данном документе термин "СН2-домен" предусматривает часть молекулы тяжелой цепи, продолжающуюся, например, от примерно остатка 244 до остатка 360 антитела согласно традиционным схемам нумерации (остатки 244-360 согласно системе нумерации по Kabat и остатки 231-340 согласно EU-системе нумерации; см. Kabat ЕА et al.). СН2-домен уникален тем, что он не образует тесную пару с другим доменом. Наоборот, две N-сцепленные разветвленные углеводные цепи размещены между двумя СН2-доменами интактной нативной молекулы IgG. Также хорошо подтверждено документально, что СН3-домен продолжается от СН2-домена до С-конца молекулы IgG и содержит приблизительно 108 остатков.
[548] Используемый в данном документе термин "шарнирная область" предусматривает часть тяжелой цепи молекулы, которая присоединяет СН1-домен к СН2-домену. Эта шарнирная область содержит приблизительно 25 остатков и является гибкой, что, таким образом, позволяет двум N-концевым антигенсвязывающим областям двигаться независимо. Шарнирные области можно подразделять на три отдельные домена: верхний, средний и нижний шарнирные домены (Roux et al., J. Immunol. 767:4083 (1998)).
[549] Используемый в данном документе термин "дисульфидная связь" предусматривает ковалентную связь, образованную между двумя атомами серы. Аминокислота цистеин содержит тиольную группу, которая может образовывать дисульфидную связь или мостик со второй тиольной группой. В большинстве встречающихся в природе молекул IgG СН1-и CL-области связаны дисульфидной связью, а две тяжелые цепи связаны двумя дисульфидными связями в положениях, соответствующих 239 и 242 согласно системе нумерации по Kabat (положение 226 или 229 согласно EU-системе нумерации).
[550] Используемый в данном документе термин "химерное антитело" будет означать любое антитело, где иммунореактивная область или или сайт получены или происходят от первого вида, а константная область (которая может быть интактной, неполной или модифицированной в соответствии с настоящим раскрытием) получена от второго вида. В определенных вариантах осуществления целевая связывающая область или сайт будут происходить от источника, не являющегося человеком (например, от мыши или примата), а константная область является человеческой.
[551] Используемый в данном документе термин "сконструированное антитело" будет относиться к антителу человека, в котором вариабельный домен либо тяжелой, либо легкой цепи или обеих изменен с помощью замещения по меньшей мере одной аминокислоты. В одном варианте осуществления замещение аминокислоты в остатках каркасных областей будет снижать потенциальную иммуногенность путем изменения остатков каркасной области на остатки из последовательности зародышевого типа. В другом варианте осуществления, замещение аминокислоты либо в каркасной области, либо в CDR, может убирать потенциальную структурную неустойчивость, которая может приводить к неустойчивости, агрегации или гетерогенности продукта. Примеры нежелательной неустойчивости включают неспаренные остатки цистеина (которые могут приводить к перестановке дисульфидных связей или образованию различных сульфгидрильных аддуктов), сайты N-сцепленного гликозилирования (приводящие к неоднородности структуры и активности), а также сайты дезамидирования (например, NG, NS), изомеризации (DG), окисления (доступный метионин) и гидролиза (DP). В другом варианте осуществления аминокислотная замена CDR и остатков каркасных областей с помощью подходов либо направленного, либо случайного мутагенеза может приводить к получению антител с усиленными характеристиками связывания, активности или специфичности. В другом варианте осуществления "сконструированное антитело" относится к антителу, в котором вариабельный домен любо в тяжелой, либо в легкой цепи или обеих изменен путем по меньшей мере частичной замены одной или нескольких CDR из антитела с известной специфичностью и, при необходимости, путем частичной замены каркасной области и изменения последовательности. Хотя CDR могут быть получены из антитела того же класса или даже подкласса, что и антитело, из которого получены каркасные области, предусматривается, что CDR будут получены из антитела другого класса и предпочтительно из антитела от другого вида.
[552] Используемый в данном документе термин "гуманизированное антитело" будет относиться к молекуле антитела, полученной из антитела от отличного от человека вида (также обозначаемого в данном документе как донорное антитело), которое связывает требуемый антиген, содержащей один или несколько определяющих комплементарность участков (CDR) из отличного от человека вида и каркасную область из молекулы иммуноглобулина человека (также называемого в данном документе как акцепторное антитело). Для передачи антигенсвязывающей способности одного вариабельного домена другому может не потребоваться замещение всех CDR полным комплектом CDR из донорного вариабельного домена. Наоборот, может потребоваться перенос только тех остатков, которые необходимы для поддержания активности целевого сайта связывания.
[553] Дополнительно следует учесть, что каркасные области в пределах вариабельного домена в тяжелой или легкой цепи, или обеих, гуманизированного антитела могут содержать исключительно остатки, происходящие от последовательности человека, в таком случае эти каркасные области гуманизированного антитела называются "полностью человеческие каркасные области". Альтернативно, один или несколько остатков каркасной области(ей) донорного вариабельного домена могут быть сконструированы в пределах соответствующего положения в человеческой каркасной области(ях) из вариабельного домена в тяжелой или легкой цепи, или обеих, гуманизированного антитела, при необходимости, для поддержания соответствующего связывания или для усиления связывания с антигеном IL-33. Человеческая каркасная область, которая была сконструирована таким образом, следовательно будет содержать смесь остатков человеческой и донорной каркасных областей, и она обозначается в данном документе как "частично человеческая каркасная область".
[554] Например, гуманизацию антитела к IL-33 можно фактически выполнять с помощью способов, известных из уровня техники (например, способа Winter и сотрудников (Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); Verhoeyen et al., Science 239:1534-1536 (1988)), путем замены на последовательности CDR грызуна или мутантные последовательности CDR грызуна соответствующих последовательностей антитела человека к IL-33. См. также патенты США №№5225539; 5585089; 5693761; 5693762; 5859205; включенные в данный документ посредством ссылки. Полученное гуманизированное антитело к IL-33 будет содержать по меньшей мере один CDR грызуна или мутантный CDR грызуна в пределах полностью человеческих каркасных областей вариабельного домена тяжелой и/или легкой цепи гуманизированного антитела. В некоторых случаях остатки в пределах каркасных областей одного или нескольких вариабельных доменов гуманизированного антитела к IL-33 замещены соответствующими остатками, не принадлежащими последовательностям человека (например, грызуна) (см., например, патенты США №№5585089; 5693761; 5693762 и 6180370), в таком случае полученное гуманизированное антитело к IL-33 будет содержать частично человеческие каркасные области в пределах вариабельного домена тяжелой и/или легкой цепи.
[555] Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в реципиентном антителе или в донорном антителе. Данные модификации проводят для дополнительного улучшения характеристик антител (например, для получения требуемой аффинности). В целом, гуманизированное антитело будет содержать практически все из по меньшей мере одного, и, как правило, двух вариабельных доменов, в которых все или в практически все CDR соответствуют таковым иммуноглобулина, отличного от иммуноглобулина человека, и все или практически все каркасные области представляют собой таковые из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, таковую из иммуноглобулина человека. Для более подробной информации см. Jones et al., Nature 327:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992); включенные в данный документ посредством ссылки. Соответственно, такое "гуманизированное" антитело может предусматривать антитела, где намного меньшая часть, чем интактный человеческий вариабельный домен был заменен соответствующей последовательностью из вида, отличного от человека. На практике гуманизированные антитела, как правило, представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки каркасных областей замещены остатками из аналогичных сайтов в антителах грызунов. См., например, патенты США №№5225539; 5585089; 5693761; 5693762; 5859205. См. также патент США №6180370 и международную публикацию №WO 01/27160, где раскрыты гуманизированные антитела и методики получения гуманизированных антител с улучшенной аффинностью в отношении предопределенного антигена.
[556] Используемые в данном документе термины "связанный", "слитый" или "слияние" применяются взаимозаменяемо. Эти термины относятся к соединению вместе двух или более элементов или компонентов с помощью любых способов, включая способы химической конъюгации или рекомбинации. "Слияние внутри рамки" относится к соединению двух или более полинуклеотидных открытых рамок считывания (ORF) с образованием непрерывной более длинной ORF таким образом, чтобы сохранялась правильная трансляционная рамка считывания исходных ORF. Таким образом, рекомбинантный белок слияния представляет собой единый белок, содержащий два или более сегментов, которые соответствуют полипептидам, кодируемым исходными ORF (при этом такие сегменты обычно не соединены подобным образом в природе). Несмотря на то, что полученная таким образом рамка считывания является непрерывной на всем протяжении слитых сегментов, сегменты могут быть физически или пространственно разделены с помощью, например, линкерной последовательности внутри рамки. Например, полинуклеотиды, кодирующие CDR вариабельной области иммуноглобулина, могут быть слитыми внутри рамки, но разделены полинуклеотидом, кодирующим по меньшей мере одну каркасную область иммуноглобулина или дополнительные области CDR, при условии, что "слитые" CDR транслируются совместно в виде части непрерывного полипептида.
[557] В контексте полипептидов "линейная последовательность" или "последовательность" представляет собой порядок аминокислот в полипептиде в направлении от амино-конца к карбокси-концу, при котором остатки, являющиеся соседними относительно друг друга в последовательности, являются смежными в первичной структуре полипептида.
[558] Термин "экспрессия", используемый в данном документе, относится к процессу, с помощью которого ген обеспечивает выработку биохимического вещества, например, полипептида. Процесс предусматривает любое проявление функционального присутствия гена в клетке, включая без ограничений нокдаун гена, а также как временную экспрессию, так и стабильную экспрессию. Он предусматривает без ограничений транскрипцию гена в матричную РНК (мРНК) и трансляцию такой мРНК в полипептид(ы). Если требуемый конечный продукт представляет собой биохимическое вещество, то экспрессия предусматривает образование такого биохимического вещества и любых предшественников. Экспрессия гена приводит к образованию "продукта гена". Как используется в данном документе, продуктом гена может быть либо нуклеиновая кислота, например, матричная РНК, образуемая при транскрипции гена, либо полипептид, который транслируется из транскрипта. Продукты генов, описанные в данном документе, дополнительно включают нуклеиновые кислоты с посттранскрипционными модификациями, например, полиаденилированием, или полипептиды с посттрансляционными модификациями, например, метилированием, гликозилированием, добавлением липидов, связью с другими белковыми субъединицами, протеолитическим расщеплением и т.п.
[559] Используемые в данном документе термины "лечить" или "лечение" относятся как к терапевтическому лечению, так и профилактическим или предупреждающим мерам, где целью является предупреждение или замедление (уменьшение) нежелательного физиологического изменения или нарушения, такого как прогрессирование воспалительного состояния. Благоприятные или требуемые клинические результаты включают без ограничения ослабление симптомов, уменьшение степени тяжести заболевания, стабилизированное (т.е. не ухудшающееся) состояние заболевания, задержку или замедление прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (либо частичную, либо полную), независимо от того, поддается она обнаружению или нет. "Лечение" может также означать увеличение продолжительности жизни по сравнению с ожидаемой продолжительностью жизни в том случае, если лечение не получают. К нуждающимся в лечении относятся те, у кого уже есть состояние или нарушение, а также те, кто предрасположен к состоянию или нарушению, или те, у кого нужно предупреждать развитие состояния или нарушения.
[560] Под "субъектом", или "индивидом", или "животным", или "пациентом", или "млекопитающим" подразумевается любой субъект, в частности, субъект-млекопитающее, у которого требуется определить диагноз, прогноз или который требует лечения. Субъекты-млекопитающие включают людей, одомашненных животных, сельскохозяйственных и зоопарковых животных, используемых в спорте или домашних животных, таких как собаки, кошки, морские свинки, кролики, крысы, мыши, лошади, крупный рогатый скот, коровы и т.д.
[561] Используемые в данном документе фразы, такие как "субъект, который сможет получить пользу от введения антитела к IL-33" и "животное, нуждающееся в лечении", предусматривают субъектов, таких как субъекты-млекопитающие, которые получат пользу от введения антитела к IL-33, применяемого, например, для обнаружения полипептида IL-33 (например, для процедуры диагностики), и/или от лечения, т.е. временного облегчения или предупреждения заболевания, с применением антитела к IL-33.
II. Описание полипептида-мишени
[562] Используемые в данном документе термины "IL-33" и "полипептид IL-33" применяются взаимозаменяемо. В определенных вариантах осуществления IL-33 является полноразмерным. В другом варианте осуществления IL-33 представляет собой зрелый усеченный IL-33 (аминокислоты 112-270). Недавние исследования свидетельствуют о том, что полноразмерный IL-33 является активным (Cayrol and Girard, Proc Natl Acad Sci USA 706(22):9021-6 (2009); Hayakawa et al., Biochem Biophys Res Commun 387(1):218-22 (2009); Talabot-Ayer et al., J Biol Chem. 284(29): 19420-6 (2009)). Однако, процессированный или усеченный на N-конце IL-33, включающий без ограничения 72-270, 79-270, 95-270, 99-270, 107-270, 109-270, 111-270, 112-270, может характеризоваться усиленной активностью (Lefrancais 2012, 2014). В других вариантах осуществления IL-33 может включать полноразмерный IL-33, его фрагмент, или мутантный или вариантный полипептид IL-33, где фрагмент IL-33 или вариантный полипептид IL-33 сохраняют некоторые или все функциональные свойства активного IL-33.
[563] IL-33 человека представляет собой белок из 270 аминокислот (№ доступа 095760), состоящий из двух доменов: гомеодомена и цитокинового (IL-1-подобного) домена. Гомеодомен содержит сигнал ядерной локализации (NLS). IL-33 первоначально идентифицировали как ген "DVS27", который был активирован в суженных артериях головного мозга после субарахноидального кровоизлияния (Onda et al., J. Cereb. Blood Flow Metab. 19:1279-88 (1999)), и как "ядерный фактор из наружных эндотелиальных венул (NF-HEV)", который экспрессируется в ядрах эндотелиальных клеток (Baekkevold et al., Am. J. Pathol 163:69-79 (2003)). IL-33 (также называемый IL-1F11) в настоящее время рассматривается как 11-й представитель семейства IL-1 цитокинов, которое также включает IL-α, IL1β и IL-18. См. Oboki et al., Allergology International 59:143-160 (2010).
[564] Schmitz et al. впервые идентифицировали IL-33 как лиганд орфанного рецептора ST2 (также называемого IL-1R4) (Schmitz et al., Immunity 23(5)479-90 (2005)). Единственным известным лигандом рецептора ST2 является IL-33 (Schmitz et al. (2005)). Рецептор IL-33 образован из гетеродимерных молекул, состоящих из ST2 и вспомогательного белка IL-1R (IL-1RAcP). IL-1RAcP представляет собой общий компонент рецепторов для IL-1α, IL-1β, IL-1F6, IL1F8 и IL1F9. IL-33 связывается с рецептором IL-33, который представляет собой димер из ST2 и IL-1RAcP. IL-1RAcP не требуется для связывания, но является критически важным для передача сигнала. TIR-домен рецептора IL-33 привлекает MyD88 и TRAF6, и сигнал рецептора приводит к активации NFκB и МАР-киназного путей (Oboki et al. (2010)). Рецептор IL-33 потенциально может ассоциироваться с другими рецепторами, и сообщалось, что он перекрестно активирует рецепторную тирозинкиназу c-Kit в мастоцитах человека и мыши (Drube et al., Blood 775:3899-906 (2010)). Структурной основой для данной перекрестной активации является образование комплекса между c-Kit, ST2 и IL-1RAcP. C-Kit и IL-1RAcP взаимодействуют конститутивно, а ST2 присоединяется к данному комплексу после связывания лиганда.
[565] Недавно было показано, что IL-33 связывается со вторым гетеродимерным рецепторным комплексом к IL-33. ST2 образует комплекс с другой молекулой семейства IL1R, "IL-1R-подобным рецептором, содержащим одну молекулу Ig" (SIGIRR) (также называемым Toll IL-1R8 (TIR8)). Считается, что SIGIRR/TIR8 выступает в качестве отрицательного регулятора иммунных ответов, опосредованных IL-1R и Toll-подобным рецептором (TLR) (Garlanda et al., Trends Immunol. 30:439-46 (2009)). В отличие от ST2:IL-1RAcP, ST2:SIGIRR, по всей видимости, выступает в качестве отрицательного регулятора IL-33.
[566] ST2 экспрессируется на базовом уровне клетками Th2 и мастоцитами, причем известно, что оба типа клеток являются важными медиаторами аллергической астмы. IL-33 способен стимулировать их (и различные другие клетки) для продукции целого ряда функциональных ответов, включая цитокины и хемокины.
Антитела к IL-33
[567] В определенных вариантах осуществления связывающие молекулы, например, антитела или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию, например, антитела IL330065, IL330099, IL330101, IL330107, IL33149, и IL330180, и 33_640076-4В, 33_640081-АВ; 33_640082-6В, 33_640082-7В, 33_640084-2В, 33_640086-6В, 33_640087-7В, 33_640201-2В, и 33_640237-2В, связываются с IL-33 и ингибируют IL-33 - управляемое высвобождение цитокинов из мастоцитов, эндотелиальных клеток и пролиферацию клеток TF-1.
[568] В определенных вариантах осуществления антитела по настоящему раскрытию включают антитела к IL-33 или их антигенсвязывающие фрагменты, варианты или производные, которые связываются с IL-33, например, антитела IL3 30065, IL3 30099, IL330101, IL330107, IL33149, и IL330180 и 33_640076-4В, 33_640081-АВ; 33_640082-6В, 33_640082-7В, 33_640084-2В, 33_640086-6В, 33_640087-7В, 33_640201-2В и 33_640237-2В. В определенных вариантах осуществления антитела к IL-33 связывают IL-33 человека, примата, мыши или любую комбинацию IL-33 человека, примата и мыши. В определенных вариантах осуществления антитела к IL-33 ингибируют управляемую IL-33 выработку цитокинов.
[569] В одном варианте осуществления в настоящем раскрытии представлена выделенная связывающая молекула, например, антитело или его антигенсвязывающий фрагмент, которая специфически связывается с тем же эпитопом IL-33, что и антитело IL330065, IL330099, IL330101, IL330107, IL33149 или IL330180 и 33_640076-4В, 33_640081-АВ; 33_640082-6В, 33_640082-7В, 33_640084-2В, 33_640086-6В, 33_640087-7В, 33_640201-2В и 33_640237-2В. В другом варианте осуществления в настоящем раскрытии представлена выделенная связывающая молекула, например, антитело или его антигенсвязывающий фрагмент, которые специфически связываются с IL-33 и конкурентно ингибируют антитело IL330065, IL330099, IL330101, IL330107, IL33149 или IL330180 и 33_640076-4В, 33_640081-AB; 33_640082-6B, 33_640082-7B, 33_640084-2B, 33_640086-6B, 33_640087-7B, 33_640201-2B и 33_640237-2B от специфического связывания с IL-33, например, человека, примата, мыши, или любой комбинацией IL-33 человека, примата и мыши.
[570] В определенных вариантах осуществления связывающая молекула по настоящему раскрытию имеет аминокислотную последовательность, которая характеризуется по меньшей мере 75%, 80%, 85%, 88%, 89%, 90%, 91%, 92%, 93%, 94% или 95% идентичностью последовательности с аминокислотной последовательностью в молекуле эталонного антитела к IL-33. В дополнительном варианте осуществления связывающая молекула обладает по меньшей мере 96%, 97%, 98%, 99% или 100% идентичностью последовательности с эталонным антителом. В определенных вариантах осуществления эталонное антитело представляет собой IL330065, IL330099, IL330101, IL330107, IL33149 или IL330180 и 33_640076-4В, 33_640081-АВ; 33_640082-6В, 33_640082-7В, 33_640084-2В, 33_640086-6В, 33_640087-7В, 33_640201-2В и 33_640237-2В.
[571] В другом варианте осуществления в настоящем раскрытии представлено выделенное антитело или его антигенсвязывающий фрагмент, содержащие, состоящие фактически из или состоящие из вариабельного домена тяжелой цепи иммуноглобулина (VH-домен), где по меньшей мере один CDR из VH-домена имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или идентична участкам CDR1, CDR2 или CDR3 из CDR VH, раскрытых выше, где антитело- или его антигенсвязывающий фрагмент, содержащие кодируемый VH-домен, специфически или преимущественно связываются с IL-33. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[572] В другом варианте осуществления в настоящем раскрытии представлено выделенное антитело или его антигенсвязывающий фрагмент, содержащие, состоящие фактически из или состоящие из вариабельного домена тяжелой цепи иммуноглобулина (VH-домен), где по меньшей мере один CDR из VH-домена имеет аминокислотную последовательностью, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или идентична CDR VH, раскрытым выше, где антитело или его антигенсвязывающий фрагмент, содержащие кодируемый VH-домен, специфически или преимущественно связываются с IL-33. В определенных вариантах осуществления выделенное антитело дополнительно содержит вариабельный домен легкой цепи иммуноглобулина (VL-домен). В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[573] В другом варианте осуществления в настоящем раскрытии представлено выделенное антитело или его антигенсвязывающий фрагмент, содержащие, состоящие фактически из или состоящие из вариабельного домена тяжелой цепи иммуноглобулина (VH-домен), где по меньшей мере один CDR из VH-домена имеет аминокислотную последовательность, идентичную, за исключением 1, 2, 3, 4 или 5 консервативных аминокислотных замен, CDR VH, раскрытым выше, где антитело или его антигенсвязывающий фрагмент, содержащие кодируемый VH-домен, специфически или преимущественно связываются с IL-33. В определенных вариантах осуществления выделенное антитело дополнительно содержит VL-домен. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[574] В другом варианте осуществления в настоящем раскрытии представлено выделенное антитело или его антигенсвязывающий фрагмент, содержащие, состоящие фактически из или состоящие из VH-домена, который имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности VH под SEQ ID NO: 2, 12, 22, 32, 42 или 52, где антитело или его антигенсвязывающий фрагмент, содержащие кодируемый VH-домен, специфически или преимущественно связываются с IL-33. В определенных вариантах осуществления выделенное антитело дополнительно содержит VL-домен. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[575] В другом варианте осуществления в настоящем раскрытии представлено выделенное антитело или его антигенсвязывающий фрагмент, содержащие, состоящие фактически из или состоящие из вариабельного домена легкой цепи иммуноглобулина (VL-домен), где по меньшей мере один CDR из VL-домена имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или идентична участку CDR1, CDR2 или CDR3 из SEQ аминокислотных последовательностей VH, раскрытых выше, где антитело или его антигенсвязывающий фрагмент, содержащие кодируемый VL-домен, специфически или преимущественно связываются с IL-33. В определенных вариантах осуществления выделенное антитело дополнительно содержит VH-домен. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[576] В другом варианте осуществления в настоящем раскрытии представлено выделенное антитело или его антигенсвязывающий фрагмент, содержащие, состоящие фактически из или состоящие из вариабельного домена легкой цепи иммуноглобулина (VL-домен), где по меньшей мере один CDR из VL-домена имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или идентична CDR VL, раскрытым выше, где антитело или его антигенсвязывающий фрагмент, содержащие кодируемый VL-домен, специфически или преимущественно связываются с IL-33. В определенных вариантах осуществления выделенное антитело дополнительно содержит VH-домен. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[577] В другом варианте осуществления в настоящем раскрытии представлено выделенное антитело или его антигенсвязывающий фрагмент, содержащие, состоящие фактически из или состоящие из вариабельного домена легкой цепи иммуноглобулина (VL-домен), где по меньшей мере один CDR из VL-домена имеет аминокислотную последовательность, идентичную, за исключением 1, 2, 3, 4 или 5 консервативных аминокислотных замен, CDR VL, раскрытым выше, где антитело или его антигенсвязывающий фрагмент, содержащие кодируемый VL-домен, специфически или преимущественно связываются с IL-33. В определенных вариантах осуществления выделенное антитело дополнительно содержит VH-домен. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[578] В дополнительном варианте осуществления настоящее раскрытие включает выделенное антитело или его антигенсвязывающий фрагмент, содержащие, состоящие фактически из или состоящие из VL-домена, который имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности VL, раскрытой выше, где антитело или его антигенсвязывающий фрагмент, содержащие кодируемый VL-домен, специфически или преимущественно связываются с IL-33. В определенных вариантах осуществления выделенное антитело дополнительно содержит VH-домен. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[579] Подходящие биологически активные варианты антител к IL-33 по настоящему раскрытию можно применять в способах по настоящему раскрытию. Такие варианты будут сохранять требуемые свойства связывания исходного антитела к IL-33. Способы получения вариантов антител в целом доступны из уровня техники.
[580] Способы мутагенеза и внесения изменений в нуклеотидную последовательность хорошо известны из уровня техники. См., например, Walker and Gaastra, eds. (1983) Techniques in Molecular Biology (MacMillan Publishing Company, New York); Kunkel, Proc. Natl. Acad. Sci. USA 52:488-492 (1985); Kunkel et al., Methods Enzymol. 754:367-382 (1987); Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (Cold Spring Harbor, N.Y.); патент США №4873192 и ссылки, процитированные в нем; включенные в данный документ посредством ссылки. Руководство по соответствующим аминокислотным заменам, которые не влияют на биологическую активность представляющего интерес полипептида, можно найти в модели Dayhoff et al. (1978) в Atlas of Protein Sequence and Structure (Natl. Biomed. Res. Found., Washington, D.C.), c. 345-352, включенном в данный документ посредством ссылки во всей свое полноте. В модели Dayhoff et al. применяется матрица сходства аминокислот на основе закрепившихся точковых мутаций (РАМ) (матрица РАМ 250) для определения подходящих консервативных аминокислотных замен. Консервативные замены, такие как обмен одной аминокислоты на другую с аналогичными свойствами, могут быть предпочтительными. Примеры консервативных аминокислотных замещений, изложенных в матрице РАМ 250 из модели Dayhoff et al., включают без ограничения Gly↔Ala, Val↔Ile↔Leu, Asp↔Glu, Lys↔Arg, Asn↔Gln и Phe↔Trp↔Tyr.
[581] При конструировании вариантов связывающей молекулы к IL-33, например, антитела или его антигенсвязывающего фрагмента, представляющих интерес полипептидов, осуществляют такие модификации, при которых варианты продолжают обладать требуемыми свойствами, например, способностью специфического связывания с IL-33, и в определенных вариантах осуществления отсутствием блокирования связывания IL-33 с ST2. Очевидным является то, что любые мутации, осуществляемые в ДНК, кодирующей вариантный полипептид, не должны вытеснять последовательность за пределы рамки считывания и предпочтительно не будут создавать области комлементарности, которые смогли бы образовывать вторичную структуру мРНК.
[582] Способы измерения специфичности связывания связывающей молекулы к IL-33, например, антитела или его антигенсвязывающего фрагмента, включают без ограничения стандартные анализы конкурентного связывания, ELISA-анализы, анализы BIACORE, функциональные анализы, такие как анализы пролиферации или высвобождения фактора и т.п. См., например, такие анализы, раскрытые в WO 93/14125; Shi et al., Immunity 73:633-642 (2000); Kumanogoh et al., J Immunol 769:1375-1381 (2002); Watanabe et al., J Immunol 767:4321-4328 (2001); Wang et al., Blood 97:3498-3504 (2001); и Giraudon et al., J Immunol 772(2):1246-1255 (2004), все из которых включены в данный документ посредством ссылки.
[583] Как обсуждается в данном документе, если какой-либо конкретный полипептид, включая константные области, CDR, VH-домены или VL-домены, раскрытые в данном документе, по меньшей мере на 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100% идентичен другому полипептиду, % идентичности можно определять с применением способов и компьютерных программ/программного обеспечения, известных из уровня техники, таких как без ограничения программа BESTFIT (Wisconsin Sequence Analysis Package, версия 8 для Unix, Genetics Computer Group, University Research Park, 575 Science Drive, Мэдисон, Висконсин, 53713). В BESTFIT применяется алгоритм локальной гомологии из Smith and Waterman (1981) Adv. Appl. Math. 2:482-489, для поиска наилучшего сегмента гомологии между двумя последовательностями. При применении BESTFIT или любой другой программы для выравнивания последовательностей для определения того, является ли конкретная последовательность, например, на 95% идентичной эталонной последовательности в соответствии с настоящим раскрытием, параметры устанавливают, разумеется, таким образом, чтобы процентная доля идентичности рассчитывалась по всей длине эталонной полипептидной последовательности, и чтобы допускались до 5% гэпов в гомологии от общего числа аминокислот в эталонной последовательности.
[584] Для целей настоящего раскрытия процентная идентичность последовательности может быть определена с применением алгоритма поиска гомологии Смита-Уотермана с применением поиска аффинного гэпа со штрафом за открытие гэпа 12 и штрафом за продолжение гэпа 2, матрица BLOSUM 62. Алгоритм поиска гомологии Смита-Уотермана изложен в Smith and Waterman (1981) Adv. Appl. Math. 2:482-489. Например, вариант может отличаться от эталонного антитела к IL-33 (например, IL330065, IL330099, IL330101, IL330107, IL33149, или IL330180) всего лишь 1-30 аминокислотными остатками, всего лишь 1-15 аминокислотными остатками, всего лишь 1-10 аминокислотными остатками, всего лишь 6-10, всего лишь 5, всего лишь 4, 3, 2, или даже 1 аминокислотным остатком.
[585] Точная химическая структура полипептида, способного к специфическому связыванию IL-33 и сохраняющего требуемую активность, зависит от ряда факторов. Поскольку в молекуле присутствуют ионизируемые амино- и карбоксильные группы, конкретный полипептид может быть получен в виде кислой или основной соли или в нейтральной форме. Все такие препараты, которые сохраняют свою биологическую активность при помещении в подходящие условия окружающей среды, включены в определение антител к IL-33, как используется в данном документе. Кроме, того первичная аминокислотная последовательность полипептида может быть дополнена путем получения производных с применением сахарных компонентов (гликозилирование) или с помощью других дополнительных молекул, таких как липиды, фосфат, ацетильные группы и т.п. Она также может быть дополнена путем конъюгации с сахаридами. Определенные аспекты таких дополнений осуществляются посредством систем посттрансляционного процессинга продуцирующего хозяина; другие такие модификации могут быть введены in vitro. В любом случае такие модификации включены в определение антитела к IL-33, используемое в данном документе, при условии, что требуемые свойства антитела к IL-33 не нарушены. Ожидается, что такие модификации могут количественно или качественно влиять на активность, либо усиливая, либо снижая активность полипептида в различных анализах. Кроме того, отдельные аминокислотные остатки в цепи можно модифицированы путем окисления, восстановления или другого получения производных, а полипептид можно расщеплять с получением фрагментов, которые сохраняют активность. Такие изменения, которые не нарушают желаемых свойств (например, специфичность связывания IL-33, аффинность связывания и сопутствующая активность, например, способность ингибировать IL-33-управляемое высвобождение цитокинов из мастоцитов, эндотелиальных клеток и пролиферация клеток TF-1), не исключают последовательность полипептида из определения представляющих интерес антител к IL-33, используемых в данном документе.
[586] В уровне техники представлено достаточное количество методических указаний, касающихся получения и применения вариантов полипептида. При получении связывающей молекулы к IL-33, например, антитела или его антигенсвязывающего фрагмента, вариантов, специалист в данной области может с легкостью определить, какие модификации нуклеотидной или аминокислотной последовательности в нативном белке приведут к получению варианта, который является подходящим для применения в качестве терапевтически активного компонента фармацевтической композиции, применяемой в способах по настоящему раскрытию.
[587] Известно, что варианты Fc-области (например, аминокислотные замены, и/или добавления, и/или делеции) могут усиливать или ослаблять эффекторную функцию антитела и могут изменять фармакокинетические свойства (например, время полужизни) антитела. Например, см. патент США №6737056 В1 и публикацию заявки на патент США №2004/0132101 А1, в которой раскрыты мутации Fc, оптимизирующие связывание антитела с Fc-рецепторами.
[588] В определенных антителах к IL-33 Fc-часть можно подвергать мутированию для снижения эффекторной функции с применением методик, известных из уровня техники. Например, изменение домена константной области, например, с помощью точковой мутации или аминокислотных замен, может снижать связывание Fc-рецептором циркулирующего модифицированного антитела, тем самым минимизируя опосредованный эффекторными клетками или системой комплемента клиренс или разрушение клеток, экспрессирующих или презентирующих мишень. Например, один конкретный набор замен, тройная мутация L234F/L235E/P331S ('ТМ'), вызывает значительное снижение активности связывания молекул IgG1 человека с C1q, CD64, CD32A и CD16 человека. См., например, Oganesyan et al., Acta Crystallogr D Biol Crystallogr. 64:700-704 (2008).
[589] В других случаях возможно, что модификации константной области, предусмотренные в настоящем раскрытии, увеличивают время полужизни в сыворотке крови. Время полужизни белков, содержащих Fc-области, в сыворотке крови может быть увеличено путем повышения аффинности связывания Fc-области с FcRn. Термин "время полужизни антитела", используемый в данном документе, означает фармакокинетическое свойство антитела, которое представляет собой показатель среднего времени существования молекул антител после их введения. Время полужизни антитела можно выражать как время, требуемое для выведения 50 процентов известного количества иммуноглобулина из организма пациента (или другого млекопитающего) или его конкретного компартмента, например, как измерено в сыворотке крови, т.е., время полужизни в крови или в других тканях. Время полужизни может варьировать среди разных иммуноглобулинов или классов иммуноглобулинов. В целом, увеличение времени полужизни антитела приводит к увеличению среднего времени удержания в кровотоке введенного антитела.
[590] Увеличение времени полужизни позволяет уменьшить количество лекарственного средства, принимаемого пациентом, а также снизить частоту введения. Для увеличения времени полужизни антитела в сыворотке крови в антитело (в особенности во фрагмент антитела) может вводиться эпитоп, связывающий рецептором реутилизации, как известно из уровня техники. Используемый в данном документе термин "эпитоп, связывающий рецептором реутилизации" относится к эпитопу Fc-участка молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который отвечает за увеличение in vivo времени полужизни в сыворотке крови молекулы IgG. Антитела с увеличенными значениями времени полужизни также могут быть получены при помощи модификации аминокислотных остатков, идентифицированных как вовлеченные во взаимодействие между Fc и рецептором FcRn. Например, введение тройной мутации M252Y/S254T/T256E ('YTE') в СН2-домен молекул иммуноглобулина G человека (IgG) вызывает увеличение их связывания с неонатальным Fc-рецептором человека (FcRn). См. патент США №7083784, содержание которого включено в данный документ посредством ссылки во всей своей полноте.
[591] Кроме того, в некоторых вариантах осуществления, Fc-область содержит модификацию (например, аминокислотные замены, аминокислотные вставки, аминокислотные делеции) в одном или нескольких положениях, выбранных из группы, состоящей из 234, 235, 236, 237, 238, 239, 240, 241, 243, 244, 245, 247, 251, 252, 254, 255, 256, 262, 263, 264, 265, 266, 267, 268, 269, 279, 280, 284, 292, 296, 297, 298, 299, 305, 313, 316, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 339, 341, 343, 370, 373, 378, 392, 416, 419, 421, 440 и 443, пронумерованных согласно EU-индексу, изложенному в Kabat. Необязательно Fc-область может содержать не встречающийся в природе аминокислотный остаток в дополнительных и/или альтернативных положениях, известных из уровня техники.
[592] В других вариантах осуществления Fc-область содержит по меньшей мере одну замену, выбранную из группы, состоящей из 234D, 234Е, 234N, 234Q, 234Т, 234Н, 234Y, 234I, 234V, 234F, 235А, 235D, 235R, 235W, 235Р, 235S, 235N, 235Q, 235Т, 235Н, 235Y, 235I, 235V, 235F, 236Е, 239D, 239Е, 239N, 239Q, 239F, 239Т, 239Н, 239Y, 240I, 240А, 240Т, 240М, 241W, 241 L, 241Y, 241Е, 241 R. 243W, 243L 243Y, 243R, 243Q, 244Н, 245А, 247L, 247V, 247G, 251F, 252Y, 254Т, 255L, 256Е, 256М, 262I, 262А, 262Т, 262Е, 263I, 263А, 263Т, 263М, 264L, 264I, 264W, 264Т, 264R, 264F, 264М, 264Y, 264Е, 265G, 265N, 265Q, 265Y, 265F, 265V, 265I, 265L, 265Н, 265Т, 266I, 266А, 266Т, 266М, 267Q, 267L, 268Е, 269Н, 269Y, 269F, 269R, 270Е, 280А, 284М, 292Р, 292L, 296Е, 296Q, 296D, 296N, 296S, 296Т, 296L, 296I, 296Н, 269G, 297S, 297D, 297Е, 298Н, 298I, 298Т, 298F, 299I, 299L, 299А, 299S, 299V, 299Н, 299F, 299Е, 305I, 313F, 316D, 325Q, 325L, 325I, 325D, 325Е, 325А, 325Т, 325V, 325Н, 327G, 327W, 327N, 327L, 328S, 328М, 328D, 328Е, 328N, 328Q, 328F, 328I, 328V, 328Т, 328Н, 328А, 329F, 329Н, 329Q, 330K, 330G, 330Т, 330С, 330L, 330Y, 330V, 330I, 330F, 330R, 330Н, 331G, 331А, 331L, 331М, 331F, 331W, 331K, 331Q, 331Е, 331S, 331V, 331I, 331С, 331Y, 331H, 331R, 331N, 331D, 331Т, 332D, 332S, 332W, 332F, 332Е, 332N, 332Q, 332Т, 332Н, 332Y, 332А, 339Т, 370Е, 370N, 378D, 392Т, 396L, 416G, 419Н, 421K, 440Y и 434W, пронумерованных согласно EU-индексу, изложенному в Kabat. Необязательно, Fc-область может содержать дополнительные и/или альтернативные не встречающиеся в природе аминокислотные остатки, известные из уровня техники.
[593] В дополнительных вариантах осуществления Fc-область содержит по меньшей мере одну модификацию (например, аминокислотные замены, аминокислотные вставки, аминокислотные делеции) в одном или нескольких положениях, выбранных из группы, состоящей из 234, 235 и 331. В некоторых вариантах осуществления не встречающиеся в природе аминокислоты выбраны из группы, состоящей из 234F, 235F, 235Y и 331S. В данном документе представлен вариант Fc, где Fc-область содержит по меньшей мере одну не встречающуюся в природе аминокислоту в одном или нескольких положениях, выбранных из группы, состоящей из 239, 330 и 332. В некоторых вариантах осуществления не встречающиеся в природе аминокислоты выбраны из группы, состоящей из 239D, 330L и 332Е.
[594] В других вариантах осуществления Fc-область содержит по меньшей мере одну не встречающуюся в природе аминокислоту в одном или нескольких положениях, выбранных из группы, состоящей из 252, 254 и 256. В определенных вариантах осуществления не встречающиеся в природе аминокислоты выбраны из группы, состоящей из 252Y, 254Т и 256Е, как описано в патенте США №7083784, содержание которого включено в данный документ посредством ссылки во всей своей полноте.
[595] Еще несколько модификаций константной области можно применять для модификации дисульфидных связей или олигосахаридных компонентов, что дает возможность увеличения локализации в связи с повышенной специфичностью по отношению к антигену или гибкостью антитела. Полученный физиологический профиль, биодоступность и другие биохимические эффекты модификаций, такие как биораспределение и время полужизни в сыворотке крови, можно легко измерить и оценить количественно с применением хорошо известных иммунологических методик без проведения лишних экспериментов.
[596] Антитела к IL-33 по настоящему раскрытию также включают производные, которые являются модифицированными, например, путем ковалентного присоединения к антителу молекулы любого типа таким образом, чтобы ковалентное присоединение не препятствовало специфическому связыванию антитела с его когнатным эпитопом. Например, но не в качестве ограничения, производные антитела включают антитела, которые были модифицированы, например, путем гликозилирования, ацетилирования, пегилирования, фосфорилирования, амидирования, получения производных с помощью известных защитных/блокирующих групп, протеолитического расщепления, связывания с клеточным лигандом или другим белком и т.д. Любую из многочисленных химических модификаций можно проводить с помощью известных методик, включающих без ограничения специфическое химическое расщепление, ацетилирование, формилирование и т.д. Кроме того, производное может содержать одну или несколько неклассических аминокислот.
[597] "Консервативная аминокислотная замена" представляет собой замену, при котором аминокислотный остаток замещается аминокислотным остатком, имеющим боковую цепь с аналогичным зарядом. Семейства аминокислотных остатков, имеющих боковые цепи с аналогичными зарядами, были определены в уровне техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Альтернативно, мутации можно вводить случайным образом по длине всей кодирующей последовательности или ее части, как, например, путем насыщающего мутагенеза, и полученных мутантов можно подвергать скринингу в отношении биологической активности для идентификации мутантов, сохраняющих активность (например, способность связывать полипептид IL-33).
[598] Например, возможно вводить мутации только в каркасные области или только в CDR-области молекулы антитела. Введенные мутации могут представлять собой молчащие или нейтральные миссенс-мутации, т.е. не оказывающие или оказывающие небольшой эффект на способность антитела к связыванию антигена. Эти типы мутаций могут быть применимы для оптимизации частоты использования кодона или улучшения выработки антител гибридомой. Альтернативно, ненейтральные миссенс-мутации могут изменять способность антитела к связыванию антигена. По-видимому, большинство молчащих и нейтральных миссенс-мутации локализованы в каркасных областях, тогда как большинство ненейтральных миссенс-мутации, по-видимому, локализованы в CDR, хотя это не является обязательным требованием. Специалист в данной области будет способен разработать и протестировать мутантные молекулы с желаемыми свойствами, такими как отсутствие изменения активности связывания с антигеном или изменение активности связывания (например, улучшения активности связывания с антигеном или изменение специфичности антитела, или усиленная стабильность/однородность конечной молекулы). После мутагенеза кодируемый белок можно экспрессировать обычным образом, и функциональную и/или биологическую активность кодируемого белка (например, способность иммуноспецифически связывать по меньшей мере один эпитоп полипептида IL-33) можно определять с применением методик, описанных в данном документе, или с помощью стандартного модифицирования методик, известных из уровня техники.
[599] В определенных вариантах осуществления антитела по настоящему раскрытию можно оптимизировать путем модификации остатков каркасных областей, локализованных в области/зоне Верньера, или остатков, предположительно поддерживающих структуры областей CDR (см., например, Foote, J. and G. Winter, J Mol. Biol. 224,2: 487-99 (1992); Padlan, E.A., Mol. Immunol 31.3: 169-217 (1994)). В некоторых вариантах осуществления эти модификации могут быть сконструированы с помощью ПЦР-опосредованного сайт-направленного мутагенеза с применением стандартных способов молекулярной биологии. Модифицированные антитела можно тестировать в отношении аффинности связывания, как раскрыто в данном документе. В другом варианте осуществления также может быть выполнена дополнительная оптимизация, например, возвратные мутации или созревание аффинности путем внедрения аминокислотных замен в области CDR или путем сайт-направленного мутагенеза.
[600] В определенных вариантах осуществления антитела к IL-33 по настоящему раскрытию содержат по меньшей мере один оптимизированный определяющий комплементарность участок (CDR). Под "оптимизированным CDR" подразумевается, что CDR был модифицирован и оптимизирован за счет последовательностей, выбранных на основании устойчивой или улучшенной аффинности связывания и/или активности в отношении IL-33, что передается антителу к IL-33, содержащему оптимизированный CDR. "Активность в отношении IL-33" может включать, например, активность, которая модулирует одну или несколько из следующих активностей, ассоциированных с IL-33, например, управляемое IL-33 высвобождение цитокинов из мастоцитов, эндотелиальных клеток и пролиферацию клеток TF-1; высвобождение медиаторов (например, цитокина или хемокина) из базофилов, эозинофилов, клеток Th2, NK, NKT, макрофагов или дендритных клеток; модулирование рецепторов клеточной поверхности; модулирование презентации антигена; или любую другую активность, ассоциированную с IL-33. К активности в отношении IL-33 можно также относить снижение числа случаев возникновения или тяжести заболеваний, ассоциированных с экспрессией и/или высвобождением IL-33, включая без ограничения определенные типы воспалительных состояний, например, аллергическое нарушение, такое как астма или другой воспалительный ответ в дыхательных путях субъекта. Модификации могут включать замену аминокислотных остатков в пределах CDR, так что антитело к IL-33 сохраняет специфичность в отношении антигена IL-33 и характеризуется улучшенной аффинностью связывания и/или улучшенной активностью в отношении IL-33.
IV. Полинуклеотиды, кодирующие антитела к IL-33
[601] В настоящем раскрытии также представлены молекулы нуклеиновой кислоты, кодирующие антитела к IL-33 по настоящему раскрытию, или их антигенсвязывающие фрагменты, варианты или производные.
[602] В одном варианте осуществления в настоящем раскрытии представлен выделенный полинуклеотид, содержащий, состоящий фактически из или состоящий из нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи иммуноглобулина (VH-домен), где по меньшей мере один CDR из VH-домена кодируется последовательностью нуклеиновой кислоты, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или идентична полинуклеотидной последовательности CDRH 1, 2, или 3 из VH-кодирующей последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 11, 21, 31, 41, 51, 61, 71, 81, 91, 101, 111, 121, 131, 141, 151, 161, 171, 181, 191, 201, 211, 221, 231, 241, 251, 261, 271, 281, 291, 301, 311, 321, 331, 341, 351, 361, 371, 381, 391, 401, 411, 421, 431, 441, 451, 461, 471, 481, 491, 501, 511, 5421, 531, 541, 551, 561, 571 и 581. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[603] В других вариантах осуществления в настоящем раскрытии представлен выделенный полинуклеотид, содержащий, состоящий фактически из или состоящий из нуклеиновой кислоты, кодирующей VH-домен иммуноглобулина, где последовательность по меньшей мере одного CDR из VH-домена выбрана из группы, состоящей из: (а) последовательности CDRH1, содержащей аминокислотную последовательность, изложенную под SEQ ID NO: 3, 13, 23, 33, 43, 53, 63, 73, 83, 93, 103, 113, 123, 133, 143, 153, 163, 173, 183, 193, 203, 213, 223, 233, 243, 253, 263, 273, 283, 293, 303, 313, 323, 333, 343, 353, 363, 373, 383, 393, 403, 413, 423, 433, 443, 453, 463, 473, 483, 493, 503, 513, 5423, 533, 543, 553, 563, 573 и 583; (b) последовательности CDRH2, содержащей аминокислотную последовательность, изложенную под SEQ ID NO: 4, 14, 24, 34, 44, 54, 64, 74, 84, 94, 104, 114, 124, 134, 144, 154, 164, 174, 184, 194, 204, 214, 224, 234, 244, 254, 264, 274, 284, 294, 304, 314, 324, 334, 344, 354, 364, 374, 384, 394, 404, 414, 424, 434, 444, 454, 464, 474, 484, 494, 504, 514, 5424, 534, 544, 554, 564, 574 и 584, и (с) последовательности CDRH3, содержащей аминокислотную последовательность, изложенную под SEQ ID NO: 5, 15, 25, 35, 45, 55, 65, 75, 85, 95, 105, 115, 125, 135, 145, 155, 165, 175, 185, 195, 205, 215, 225, 235, 245, 255, 265, 275, 285, 295, 305, 315, 325, 335, 345, 355, 365, 375, 385, 395, 405, 415, 425, 435, 445, 455, 465, 475, 485, 495, 505, 515, 5425, 535, 545, 555, 565, 575 и 585. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[604] В дополнительном варианте осуществления в настоящем раскрытии представлен выделенный полинуклеотид, содержащий, состоящий фактически из или состоящий из нуклеиновой кислоты, кодирующей VH-домен, который имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична эталонной полипептидной последовательности VH-домена, содержащей SEQ ID NO: 2, 12, 22, 32, 42, 52, 62, 72, 82, 92, 102, 112, 122, 132, 142, 152, 162, 172, 182, 192, 202, 212, 222, 232, 242, 252, 262, 272, 282, 292, 302, 312, 322, 332, 342, 352, 362, 372, 382, 392, 402, 412, 422, 432, 442, 452, 462, 472, 482, 492, 502, 512, 5422, 532, 542, 552, 562, 572 и 582, где антитело к IL-33, содержащее кодируемый VH-домен, специфически или преимущественно связывается с IL-33. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[605] В одном варианте осуществления в настоящем раскрытии представлен выделенный полинуклеотид, содержащий, состоящий фактически из или состоящий из нуклеиновой кислоты, кодирующей вариабельный домен легкой цепи иммуноглобулина (VL-домен), где по меньшей мере один CDR из VL-домена кодируется последовательностью нуклеиновой кислоты, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или идентична полинуклеотидной последовательности CDRL 1, 2, или 3 из VL-кодирующей последовательности, выбранной из группы, состоящей из SEQ ID NO: 6, 16, 26, 36, 46, 56, 66, 76, 86, 96, 106, 116, 126, 136, 146, 156, 166, 176, 186, 196, 206, 216, 226, 236, 246, 256, 266, 276, 286, 296, 306, 316, 326, 336, 346, 356, 366, 376, 386, 396, 406, 416, 426, 436, 446, 456, 466, 476, 486, 496, 506, 516, 5426, 536, 546, 556, 566, 576 и 586. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[606] В других вариантах осуществления в настоящем раскрытии представлен выделенный полинуклеотид, содержащий, состоящий фактически из или состоящий из нуклеиновой кислоты, кодирующей VL-домен иммуноглобулина, где последовательность по меньшей мере одного CDR из VL-домена выбрана из группы, состоящей из: (а) последовательности CDRL1, содержащей аминокислотную последовательность, изложенную под SEQ ID NO: 8, 18, 28, 38, 48, 58, 68, 78, 88, 98, 108, 118, 128, 138, 148, 158, 168, 178, 188, 198, 208, 218, 228, 238, 248, 258, 268, 278, 288, 298, 308, 318, 328, 338, 348, 358, 368, 378, 388, 398, 408, 418, 428, 438, 448, 458, 468, 478, 488, 498, 508, 518, 5428, 538, 548, 558, 568, 578 и 588, (b) последовательности CDRL2, содержащей аминокислотную последовательность, изложенную под SEQ ID NO: 9, 19, 29, 39, 49, 59, 69, 79, 89, 99, 109, 119, 129, 139, 149, 159, 169, 179, 189, 199, 209, 219, 229, 239, 249, 259, 269, 279, 289, 299, 309, 319, 329, 339, 349, 359, 369, 379, 389, 399, 409, 419, 429, 439, 449, 459, 469, 479, 489, 499, 509, 519, 5429, 539, 549, 559, 569, 579 и 589, и (с) последовательности CDRL3, содержащей аминокислотную последовательность, изложенную под SEQ ID NO: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 5420, 530, 540, 550, 560, 570, 580 и 590. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[607] В дополнительном варианте осуществления в настоящем раскрытии предусмотрен выделенный полинуклеотид, содержащий, состоящий фактически из или состоящий из нуклеиновой кислоты, кодирующей VL-домен, который имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична эталонной полипептидной последовательности VL-домена, содержащей SEQ ID NO: 7, 17, 27, 37, 47, 57, 67, 77, 87, 97, 107, 117, 127, 137, 147, 157, 167, 177, 187, 197, 207, 217, 227, 237, 247, 257, 267, 277, 287, 297, 307, 317, 327, 337, 347, 357, 367, 377, 387, 397, 407, 417, 427, 437, 447, 457, 467, 477, 487, 497, 507, 517, 5427, 537, 547, 557, 567, 577 и 587, где антитело к IL-33, содержащее кодируемый VL-домен, специфически или преимущественно связывается с IL-33. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибируют управляемую IL-33 выработку цитокинов.
[608] Любой из полинуклеотидов, описанных выше, может также содержать дополнительные нуклеиновые кислоты, кодирующие, например, сигнальный пептид для управления секрецией кодируемого полипептида, константные области антитела, описанные в данном документе, или другие гетерологичные полипептиды, описанные в данном документе. Также, как более подробно описано в другом месте данного документа, в настоящем раскрытии предусмотрены композиции, содержащие один или несколько полинуклеотидов, описанных выше.
[609] В одном варианте осуществления в настоящем раскрытии предусмотрены композиции, содержащие первый полинуклеотид и второй полинуклеотид, где указанный первый полинуклеотид кодирует VH-домен, описанный в данном документе, и где указанный второй полинуклеотид кодирует VL-домен, описанный в данном документе. В частности, композицию, которая содержит, состоит фактически из или состоит из полинуклеотида, кодирующего VH-домен, изложенного под SEQ ID NO: 1, 11, 21, 31, 41, 51, 61, 71, 81, 91, 101, 111, 121, 131, 141, 151, 161, 171, 181, 191, 201, 211, 221, 231, 241, 251, 261, 271, 281, 291, 301, 311, 321, 331, 341, 351, 361, 371, 381, 391, 401, 411, 421, 431, 441, 451, 461, 471, 481, 491, 501, 511, 5421, 531, 541, 551, 561, 571 или 581, и полинуклеотида, кодирующего VL-домен, например, полинуклеотида, кодирующего VL-домен, изложенного под SEQ ID NO: 66, 16, 26, 36, 46, 56, 66, 76, 86, 96, 106, 116, 126, 136, 146, 156, 166, 176, 186, 196, 206, 216, 226, 236, 246, 256, 266, 276, 286, 296, 306, 316, 326, 336, 346, 356, 366, 376, 386, 396, 406, 416, 426, 436, 446, 456, 466, 476, 486, 496, 506, 516, 5426, 536, 546, 556, 566, 576 или 586.
[610] В настоящем раскрытии также предусмотрены фрагменты полинуклеотидов по настоящему раскрытию, как описано в других частях данного документа. Кроме того, полинуклеотиды, которые кодируют полипептиды слияния, Fab-фрагменты и другие производные, как описано в данном документе, также предусматриваются в настоящем раскрытии.
[611] Полинуклеотиды можно получать или производить с помощью любого способа, известного из уровня техники. Например, если известна нуклеотидная последовательность для антитела, полинуклеотид, кодирующий антитело, можно собрать из химически синтезированных олигонуклеотидов (например, как описано в Kutmeier et al., BioTechniques 17:242 (1994)), что, вкратце, предусматривает синтез перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей антитело, гибридизацию и лигирование этих олигонуклеотидов и затем амплификацию лигированных олигонуклеотидов с помощью ПЦР.
[612] Альтернативно, полинуклеотид, кодирующий антитело к IL-33 или его антигенсвязывающий фрагмент, вариант или производное по настоящему раскрытию, можно получать на основании нуклеиновой кислоты из подходящего источника. Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело, недоступен, а последовательность, кодирующая молекулу антитела, известна, то нуклеиновую кислоту, кодирующую антитело, можно синтезировать химически или получить из подходящего источника (например, из библиотеки кДНК, кодирующей антитела, или библиотеки кДНК, образованной из любой ткани или любых клеток, экспрессирующих антитела или другие антитела к IL-33, или, например, гибридомных клеток, выбранных для экспрессии антитела, или нуклеиновой кислоты, предпочтительно РНК с поли-А, выделенной из таковых)) с помощью ПЦР-амплификации с применением синтетических праймеров, которые гибридизируются с 3'- и 5'-концами последовательности, или посредством клонирования с помощью олигонуклеотидного зонда, специфического для конкретной последовательности гена, для идентификации, например, кДНК-клона из библиотеки кДНК, который кодирует антитело или другое антитело к IL-33. Амплифицированные нуклеиновые кислоты, полученные с помощью ПЦР, затем можно клонировать в реплицируемые клонирующие векторы с помощью любого способа, хорошо известного из уровня техники.
[613] Как только нуклеотидная последовательность и соответствующая аминокислотная последовательность антитела к IL-33 или его антигенсвязывающего фрагмента, варианта или производного определена, можно проводить манипуляции с его нуклеотидной последовательностью с применением хорошо известных из уровня техники способов манипуляции с нуклеотидными последовательностями, например, методик рекомбинантных ДНК, сайт-направленного мутагенеза, ПЦР и т.д. (см., например, методики, описанные в Sambrook et al. (1990) Molecular Cloning, A Laboratory Manual (2nd ed.; Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.) и Ausubel et al., eds. (1998) Current Protocols in Molecular Biology (John Wiley & Sons, NY), оба из которых включены в данный документ посредством ссылки во всей своей полноте), с получением антител с отличающейся аминокислотной последовательностью, например, для получения аминокислотных замен, делеций и/или вставок.
[614] Полинуклеотид, кодирующий связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, вариант или производное, можно составить из любого полирибонуклеотида или полидезоксирибонуклеотида, который может представлять собой немодифицированную РНК или ДНК или модифицированную РНК или ДНК. Например, полинуклеотид, кодирующий антитело к IL-33 или его антиген связывающий фрагмент, вариант или производное, может состоять из одно- и двухнитевой ДНК, ДНК, которая представляет собой смесь одно- и двухнитевых областей, одно- и двухнитевой РНК и РНК, которая представляет собой смесь одно- и двухнитевых областей, гибридных молекул, содержащих ДНК и РНК, которые могут быть однонитевыми или, более типично, двухнитевыми, или смеси одно- и двухнитевых областей. Кроме того, полинуклеотид, кодирующий связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, вариант или производное, может состоять из трехнитевых областей, содержащих РНК или ДНК или как РНК, так и ДНК. Полинуклеотид, кодирующий связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, вариант или производное, может также содержать одно или несколько модифицированных оснований или остовы ДНК или РНК, модифицированные для стабильности или в других целях. "Модифицированные" основания включают, например, тритилированные основания и нетипичные основания, такие как инозин. В ДНК и РНК можно осуществлять целый ряд модификаций; таким образом, "полинуклеотид" охватывает химически, ферментативно или метаболически модифицированные формы.
[615] Выделенный полинуклеотид, кодирующий неприродный вариант полипептида, полученного из иммуноглобулина (например, части тяжелой цепи или части легкой цепи иммуноглобулина), можно создать путем введения одной или нескольких нуклеотидных замен, добавлений или делеций в нуклеотидную последовательность иммуноглобулина таким образом, чтобы одна или несколько аминокислотных замен, добавлений или делеций были введены в кодируемый белок. Мутации можно внедрять посредством стандартных методик, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Предпочтительно консервативные аминокислотные замещения осуществляют по одному или нескольким остаткам несущественных аминокислот.
V. Белки слияния и конъюгаты антител
[616] Как более подробно обсуждается в другом месте данного документа, связывающие молекулы к IL-33, например, антитела по настоящему раскрытию или их антигенсвязывающие фрагменты, варианты или производные, могут дополнительно рекомбинантно сливать с гетерологичным полипептидом на N- или С-конце или химически конъюгированными (включая ковалентный и нековалентный тип конъюгации) с полипептидами или другими композициями. Например, антитела к IL-33 могут быть рекомбинантно слиты или конъюгированы с молекулами, применимыми в качестве меток в анализах обнаружения, и эффекторными молекулами, такими как гетерологичные полипептиды, лекарственные средства, радионуклиды или токсины. См., например, публикации согласно РСТ WO 92/08495; WO 91/14438; WO 89/12624; патент США №5314995 и ЕР 396387.
[617] Антитела к IL-33 по настоящему раскрытию или их антигенсвязывающие фрагменты, варианты или производные могут включать производные, которые являются модифицированными, т.е. путем ковалентного присоединения любого типа молекулы к антителу таким образом, чтобы ковалентное присоединение не предотвращало связывание антитела с IL-33. Например, но не в качестве ограничения, производные антитела включают антитела, которые были модифицированы, например, путем гликозилирования, ацетилирования, пегилирования, фосфорилирования, амидирования, получения производных с помощью известных защитных/блокирующих групп, протеолитического расщепления, связывания с клеточным лигандом или другим белком и т.д. Любую из многочисленных химических модификаций можно проводить с помощью известных методик, включающих без ограничения специфическое химическое расщепление, ацетилирование, формилирование и т.д. Кроме того, производное может содержать одну или несколько неклассических аминокислот.
[618] Связывающие молекулы к IL-33, например, антитела по настоящему раскрытию или их антигенсвязывающие фрагменты, варианты или производные, могут состоять из аминокислот, соединенных друг с другом пептидными связями или модифицированными пептидными связями, т.е. изостерами пептидных связей, и они могут содержать аминокислоты, отличные от 20 аминокислот, закодированных в генах. Например, антитела к IL-33 могут быть модифицированы с помощью естественных процессов, таких как посттрансляционный процессинг, или с помощью методик химической модификации, которые хорошо известны из уровня техники. Такие модификации хорошо описаны в базовых источниках и в более подробных монографиях, а также в многочисленной исследовательской литературе. Модификации могут встречаться в любом месте связывающей молекулы к IL-33, включая пептидный остов, боковые цепи аминокислот и амино- или карбоксильные конец, или в компонентах, таких как углеводы. Будет понятно, что одинаковый тип модификаций может присутствовать в одинаковой или отличающейся степени в нескольких местах в данной связывающей молекуле к IL-33. Также данная связывающая молекула к IL-33 может содержать много типов модификаций. Связывающие молекулы к IL-33 могут быть разветвленными, например, в результате убиквитинирования, и они могут быть циклическими, с разветвлением или без него. Циклическая, разветвленная и разветвленная циклическая связывающая молекула к IL-33 может быть получена в результате посттрансляционных естественных процессов или может быть получена с помощью синтетических способов. Модификации включают ацетилирование, ацилирование, АДФ-рибозилирование, амидирование, ковалентное присоединение флавина, ковалентное присоединение компонента-гема, ковалентное присоединение нуклеотида или производного нуклеотида, ковалентное присоединение липида или производного липида, ковалентное присоединение фосфатидилинозитола, перекрестное сшивание, циклизацию, образование дисульфидной связи, деметилирование, образование ковалентных поперечных связей, образование цистеина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликозилирование, образование заякоривания GPI, гидроксилирование, иодирование, метилирование, миристиолирование, окисление, пегилирование, протеолитический процессинг, фосфорилирование, пренилирование, рацемизацию, селеноилирование, сульфатирование, опосредованное транспортной РНК добавление аминокислот к белкам, как, например, аргинилирование, и убиквитинирование. (См., например, Proteins-Structure and Molecular Properties, Т.E. Creighton, W.H. Freeman and Company, NY; 2nd ed. (1993); Johnson, ed. (1983) Posttranslational Covalent Modification of Proteins (Academic Press, NY), pgs. 1-12; Seifter et al., Meth. Enzymol. 182:626-646 (1990); Rattan et al., Ann. NY Acad. Sci. 663:48-62 (1992)).
[619] В настоящем раскрытии также представлены белки слияния, содержащие антитело к IL-33 или его антигенсвязывающий фрагмент, вариант или производное, и гетерологичный полипептид. Гетерологичный полипептид, с которым слито антитело, может быть применимым для функционирования или применимым для нацеливания на клетки, экспрессирующие полипептид IL-33.
[620] В одном варианте осуществления белок слияния по настоящему раскрытию содержит, состоит фактически из или состоит из полипептида с аминокислотной последовательностью любого одного или нескольких VH-доменов антитела по настоящему раскрытию или аминокислотной последовательностью любого одного или нескольких VL-доменов антитела по настоящему раскрытию или его фрагментов или вариантов и последовательности гетерологичного полипептида.
[621] В другом варианте осуществления белок слияния для применения в способах диагностики и лечения, раскрытых в данном документе, содержит, состоит фактически из или состоит из полипептида с аминокислотной последовательностью любого одного, двух, трех CDR из VH-домена антитела к IL-33 или его фрагментов, вариантов или производных или аминокислотной последовательностью одного, двух, трех CDR из VL-домена антитела к IL-33 или его фрагментов, вариантов или производных и последовательности гетерологичного полипептида.
[622] В одном варианте осуществления белок слияния содержит полипептид с аминокислотной последовательностью по меньшей мере одного VH-домена антитела к IL-33 по настоящему раскрытию и аминокислотной последовательностью по меньшей мере одного VL-домена антитела к IL-33 по настоящему раскрытию или его фрагментов, производных или вариантов, и последовательность гетерологичного полипептида. Предпочтительно VH- и VL-домены белка слияния соответствуют антителу из одного источника (или scFv-, или Fab-фрагменту), которое специфически связывает по меньшей мере один эпитоп IL-33.
[623] В еще одном варианте осуществления белок слияния для применения в способах диагностики и лечения, раскрытых в данном документе, содержит полипептид с аминокислотной последовательностью любого одного, двух, трех или более CDR из VH-домена антитела к IL-33 и аминокислотной последовательностью любого одного, двух, трех или более CDR из VL-домена антитела к IL-33 или его фрагментов или вариантов и последовательность гетерологичного полипептида. Предпочтительно два, три, четыре, пять, шесть или более CDR из VH-домена или VL-домена соответствуют антителу из одного источника (или scFv-, или Fab-фрагменту) по настоящему раскрытию. Молекулы нуклеиновой кислоты, кодирующие данные белки слияния, также охватываются настоящим раскрытием.
[624] Иллюстративные белки слияния, о которых сообщалось в литературе, включают слияния с Т-клеточным рецептором (Gascoigne et al., Proc. Natl. Acad. Sci. USA 54:2936-2940 (1987)); CD4 (Capon et al., Nature 537:525-531 (1989); Traunecker et al., Nature 559:68-70 (1989); Zettmeissl et al., DNA Cell Biol. USA 9:347-353 (1990); и Byrn et al., Nature 544:667-670(1990)); L-селектином (хоминг-рецептор) (Watson et al., J. Cell. Biol. 750:2221-2229 (1990); и Watson et al., Nature 349:164-167 (1991)); CD44 (Aruffo et al., Cell 67:1303-1313 (1990)); CD28 и B7 (Linsley et al., J. Exp. Med. 173:721-730 (1991)); CTLA-4 (Lisley et al., J. Exp. Med. 174:561-569 (1991)); CD22 (Stamenkovic et al., Cell 66:1333-1344 (1991)); рецептором TNF (Ashkenazi et al., Proc. Natl. Acad. Sci. USA 88:10535-10539 (1991); Lesslauer et al., Eur. J. Immunol. 27:2883-2886 (1991); и Peppel et al., J. Exp. Med. 774:1483-1489 (1991)); и рецептором IgE (Ridgway and Gorman, J. Cell. Biol. Vol. 135, Abstract No. 1448 (1991)).
[625] Как обсуждается в других местах данного документа, связывающие молекулы к IL-33, например, антитела по настоящему раскрытию или их антигенсвязывающие фрагменты, варианты или производные, можно сливать с гетерологичными полипептидами для увеличения времени полужизни полипептидов in vivo или для применения в иммунологических анализах с использованием способов, известных из уровня техники. Например, в одном варианте осуществления PEG можно конъюгировать с антителами к IL-33 по настоящему раскрытию для увеличения их времени полужизни in vivo. См. Leong et al., Cytokine 76:106 (2001); Adv. in Drug Deliv. Rev. 54:531 (2002); или Weir et al., Biochem. Soc. Transactions 30:512 (2002).
[626] Более того, связывающие молекулы к IL-33, например, антитела по настоящему раскрытию или их антигенсвязывающие фрагменты, варианты или производные, можно сливать с маркерными последовательностями, такими как пептид, для облегчения их очистки или обнаружения. В предпочтительных вариантах осуществления маркерная аминокислотная последовательность представляет собой гексагистидиновый пептид, такой как метка, представленная в векторе pQE (QIAGEN, Inc., 9259 Eton Avenue, Чатсуорт, Калифорния, 91313) среди прочих, многие из которых доступны коммерчески. Как описано в Gentz et al., Proc. Natl. Acad. Sci. USA 56:821-824 (1989), например, гексагистидин предусмотрен для удобной очистки белка слияния. Другие пептидные метки, пригодные для очистки, включают без ограничения "НА"-метку, которая соответствует эпитопу, полученному из белка гемагглютинина вируса гриппа (Wilson et al., Cell 37:161 (1984)), и "flag''-метку.
[627] Белки слияния могут быть получены с применением способов, которые хорошо известны из уровня техники (см., например, патенты США №№5136964 и 5225538). Точное место, в котором производят слияние, может быть выбрано экспериментальным путем для оптимизации характеристик секреции или связывания белка слияния. ДНК, кодирующую белок слияния, затем трансфицируют в клетку-хозяина для экспрессии.
[628] Связывающие молекулы к IL-33, например, антитела по настоящему раскрытию или их антигенсвязывающие фрагменты, варианты или производные, можно применять в неконъюгированной форме или их можно конъюгировать по меньшей мере с одной из целого ряда молекул, например, для улучшения терапевтических свойств молекулы, для облегчения обнаружения мишени, или для визуализации, или терапии пациента. Связывающие молекулы к IL-33, например, антитела по настоящему раскрытию или их антигенсвязывающие фрагменты, варианты или производные, можно метить или конъюгировать или перед очисткой, или после очистки, или во время выполнения очистки.
[629] В частности, антитела к IL-33 по настоящему раскрытию или их антигенсвязывающие фрагменты, варианты или производные можно конъюгировать с терапевтическими средствами, пролекарствами, пептидами, белками, ферментами, вирусами, липидами, модификаторами биологического ответа, фармацевтическими средствами или PEG.
[630] Специалистам в данной области будет понятно, что конъюгаты могут также быть собраны при помощи разнообразных методик в зависимости от выбранного средства, "подлежащего конъюгированию. В примеру, конъюгаты с биотином получают, например, путем проведения реакции связывающего полипептида с активированным сложным эфиром биотина, таким как биотин-N-гидроксисукцинимидный сложный эфир. Аналогично, конъюгаты с флуоресцентным маркером можно получать в присутствии связывающего средства, например, средств, перечисленных в данном документе, или путем реакции с изотиоцианатом, предпочтительно флуоресцеин-изотиоцианатом. Конъюгаты антител к IL-33 по настоящему раскрытию или их антигенсвязывающих фрагментов, вариантов или производных получают аналогичным способом.
[631] Настоящее раскрытие дополнительно охватывает связывающие молекулы к IL-33, например, антитела по настоящему раскрытию или их антигенсвязывающие фрагменты, варианты или производные, конъюгированные с диагностическим или терапевтическим средством. Антитела к IL-33, включая их антигенсвязывающие фрагменты, варианты и производные, можно применять в диагностических целях, например, для отслеживания развития или прогрессирования заболевания в качестве части процедуры клинического тестирования для определения, например, эффективности данного лечения и/или режима предупреждения. Например, обнаружение можно облегчать путем объединения антитела к IL-33 или его антигенсвязывающего фрагмента, варианта или производного с обнаруживаемым веществом. Примеры обнаруживаемых веществ включают различные ферменты, простетические группы, флуоресцентные вещества, люминесцентные вещества, биолюминесцентные вещества, радиоактивные вещества, испускающие позитроны металлы с применением различных видов позитронно-эмиссионной томографии и ионы нерадиоактивных парамагнитных металлов. См., например, патент США №4741900 относительно ионов металлов, которые можно конъюгировать с антителами для применения в качестве диагностических средств в соответствии с настоящим раскрытием. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных веществ включают умбеллиферон, флуоресцеин, флуоресцеин-изотиоцианат, родамин, флуоресцеин-дихлортриазиниламин, дансилхлорид или фикоэритрин; пример люминесцентного вещества включает люминол; примеры биолюминесцентных вещества включают люциферазу, люциферин и экворин, а примеры подходящих радиоактивных веществ включают125I,131I,131In,90Y или99Тс.
[632] Связывающая молекула к IL-33, например, антитело или его антигенсвязывающий фрагмент, вариант или производное, также можно метить с возможностью обнаружения путем присоединения его к хемилюминесцентному соединению. Присутствие связывающей молекулы к IL-33, меченной хемилюминесцентным веществом, затем определяют путем обнаружения присутствия люминесценции, которая возникает в ходе химической реакции. Примерами особенно применимых соединений для хемилюминесцентного мечения являются люминол, изолюминол, сложный ароматический эфир акридиния, имидазол, соль акридиния и сложный эфир оксалата.
[633] Одним из способов, с помощью которых антитело к IL-33 или его антигенсвязывающий фрагмент, вариант, или производное можно метить с возможностью обнаружения, является связывание их с ферментом и применение связанного продукта в иммуноферментном анализе (EIA) (Voller, A., "The Enzyme Linked Immunosorbent Assay (ELISA)" Microbiological Associates Quarterly Publication, Walkersville, Md.; Diagnostic Horizons 2:1-7 (1978); Voller et al., J. Clin. Pathol. 37:507-520 (1978); Butler, Meth. Enzymol. 75:482-523 (1981); Maggio, ed. (1980) Enzyme Immunoassay, CRC Press, Boca Raton, Fla.; Ishikawa et al., eds. (1981) Enzyme Immunoassay (Kgaku Shoin, Tokyo). Фермент, который связан с антителом к IL-33, будет вступать в реакцию с соответствующим субстратом, предпочтительно хромогенным субстратом, таким образом, чтобы образовался химический фрагмент, который можно обнаруживать, например, с помощью спектрофотометрических, флуориметрических или визуальных средств. Ферменты, которые можно применять для мечения антитела с возможностью обнаружения, включают без ограничения малатдегидрогеназу, стафилококковую нуклеазу, изомеразу дельта-5-стероидов, алкогольдегидрогеназу дрожжей, альфа-глицерофосфат, дегидрогеназу, триозафосфатизомеразу, пероксидазу хрена, щелочную фосфатазу, аспарагиназу, глюкооксидазу, бета-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкозо-6-фосфатдегидрогеназу, глюкоамилазу и ацетилхолинэстеразу. Кроме того, обнаружение можно осуществлять с помощью колориметрических способов, в которых применяют хромогенный субстрат для фермента. Кроме того, обнаружение можно осуществлять с помощью флуоресцентных методов, при которых излучающие флуоресценцию металлы, такие как 152Eu или другие из группы лантанидов, непосредственно или опосредованно связаны с антителом к IL-33. Обнаружение также можно осуществлять путем визуального сравнения степени ферментативной реакции субстрата в сравнении с аналогичным образом подготовленными стандартами.
[634] Обнаружение можно также осуществлять с применением целого ряда других иммунологических анализов. Например, при радиоактивном мечении связывающей молекулы к IL-33, например, антитела, или его антигенсвязывающего фрагмента, варианта или производного, можно обнаруживать связывающую молекулу путем применения радиоиммунологического анализа (RIA) (см., например, Weintraub (March, 1986) Principles of Radioimmunoassays, Seventh Training Course on Radioligand Assay Techniques (The Endocrine Society), который включен в данный документ посредством ссылки). Радиоактивный изотоп можно обнаруживать с помощью применения в том числе без ограничения счетчика гамма-излучения, сцинтилляционного счетчика или ауторадиографии.
[635] Связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, вариант или производное, также можно метить с возможностью обнаружения с применением излучающих флуоресценцию металлов, таких как 152Eu, или других из группы лантанидов. Эти металлы можно присоединять к связывающей молекуле с применением таких хелатирующих групп для металлов как диэтилентриаминпентауксусная кислота (DTPA) или этилендиаминтетрауксусная кислота (EDTA).
[636] Методики конъюгирования различных фрагментов с антителом (например, антителом к IL-33) или его антигенсвязывающим фрагментом, вариантом или производным хорошо известны, см., например, Amon et al. (1985) "Monoclonal Antibodies for Immunotargeting of Drugs in Cancer Therapy" в Monoclonal Antibodies and Cancer Therapy, ed. Reisfeld et al. (Alan R. Liss, Inc.), pp. 243-56; Hellstrom et al. (1987) "Antibodies for Drug Delivery" в Controlled Drag Delivery, ed. Robinson et al. (2nd ed.; Marcel Dekker, Inc.), pp. 623-53); Thorpe (1985) "Antibody Carriers of Cytotoxic Agents in Cancer Therapy: A Review" в Monoclonal Antibodies '84: Biological and Clinical Applications, ed. Pinchera et al., pp. 475-506; "Analysis, Results, and Future Prospective of the Therapeutic Use of Radiolabeled Antibody in Cancer Therapy" в Monoclonal Antibodies for Cancer Detection and Therapy, ed. Baldwin et al., Academic Press, pp. 303-16 (1985); и Thorpe et al. (1982) "The Preparation and Cytotoxic Properties of Antibody-Toxin Conjugates," Immunol. Rev. 62:139-58.
VI. Экспрессия полипептидов антител
[637] Последовательности ДНК, которые кодируют легкую и тяжелую цепи антитела, можно получать либо совместно, либо раздельно, с применением обратной транскриптазы и ДНК-полимеразы согласно хорошо известным способам. ПГДР можно запускать с помощью консенсусных праймеров для константной области или с помощью более специфических праймеров на основе опубликованных последовательностей ДНК и аминокислотных последовательностей тяжелой и легкой цепей. Как обсуждалось выше, ПЦР также можно применять для выделения ДНК-клонов, кодирующих легкую и тяжелую цепи антител. В этом случае можно осуществлять скрининг библиотек с помощью консенсусных праймеров или более крупных гомологичных зондов, таких как зонды для константных областей мыши.
[638] ДНК, как правило, плазмидную ДНК, можно выделять из клеток с применением методик, известных из уровня техники, подвергать рестрикционному картированию и секвенированию в соответствии со стандартными, хорошо известными методиками, подробно изложенными, например, в вышеприведенных источниках литературы, касающихся методик рекомбинантных ДНК. Разумеется, согласно настоящему раскрытию в любой момент времени в ходе способа выделения или последующего анализа ДНК может быть синтетической.
[639] После проведения манипуляции с выделенным генетическим материалом для обеспечения антител к IL-33 или их антигенсвязывающих фрагментов, вариантов или производных по настоящему раскрытию полинуклеотиды, кодирующие антитело к IL-33, как правило, вставляют в вектор экспрессии для введения в клетки-хозяева, которые можно применять для получения требуемого количества антитела к IL-33.
[640] Для рекомбинантной экспрессии антитела или его фрагмента, производного или аналога, например, тяжелой или легкой цепи антитела, которое связывается с целевой молекулой, описанной в данном документе, например, IL-33, требуется конструирование вектора экспрессии, содержащего полинуклеотид, который кодирует антитело. После получения полинуклеотида, кодирующего молекулу антитела, или тяжелую или легкую цепь антитела, или его часть (предпочтительно содержащую вариабельный домен тяжелой или легкой цепи) по настоящему изобретению, можно получить вектор для выработки молекулы антитела посредством технологии рекомбинантных ДНК с применением методик, хорошо известных из уровня техники. Таким образом, способы получения белка посредством экспрессии полинуклеотида, содержащего нуклеотидную последовательность, кодирующую антитело, описаны в данном документе. Способы, которые хорошо известны специалистам в данной области, можно применять для конструирования векторов экспрессии, содержащих кодирующие последовательности для антитела и соответствующие сигналы контроля транскрипции и трансляции. Эти способы включают, например, in vitro методики рекомбинантных ДНК, методики синтеза и генетическую рекомбинацию in vivo. В настоящем раскрытии, таким образом, представлены реплицируемые векторы, содержащие нуклеотидную последовательность, кодирующую молекулу антитела по настоящему изобретению, или его тяжелую или легкую цепь, или вариабельный домен тяжелой или легкой цепи, функционально связанную с промотором. Такие векторы могут содержать нуклеотидную последовательность, кодирующую константную область молекулы антитела (см., например, публикацию согласно РСТ WO 86/05807; публикацию согласно РСТ WO 89/01036 и патент США №5122464), а вариабельный домен антитела можно клонировать в такой вектор для экспрессии всей тяжелой или легкой цепи.
[641] Термин "вектор" или "вектор экспрессии" применяется в данном документе для обозначения векторов, применяемых в соответствии с настоящим раскрытием в качестве носителя для введения в клетку-хозяина и экспрессии в ней требуемого гена. Как известно специалистам в данной области, такие векторы можно легко выбрать из группы, состоящей из плазмид, фагов, вирусов и ретровирусов. Векторы, совместимые с настоящим раскрытием, в целом, будут содержать селектируемый маркер, соответствующие сайты рестрикции для облегчения клонирования требуемого гена, и будут обладать способностью проникать в эукариотические или прокариотические клетки и/или реплицироваться в них.
[642] Для целей настоящего раскрытия можно использовать множество векторных систем экспрессии. Например, в одном классе векторов используются элементы ДНК, которые получены от вирусов животных, таких как вирус папилломы крупного рогатого скота, вирус полиомы, аденовирус, вирус коровьей оспы, бакуловирус, ретровирусы (RSV, MMTV или MOMLV) или вирус SV40. Другие включают применение полицистронных систем с внутренними сайтами связывания рибосомы. Дополнительно можно осуществлять селекцию клеток, в хромосомы которых интегрировалась ДНК, путем введения одного или нескольких маркеров, которые обеспечивают возможность селекции трансфицированных клеток-хозяев. Маркер может обеспечивать прототрофность для ауксотрофного хозяина, устойчивость к биоцидам (например, к антибиотикам) или устойчивость к тяжелым металлам, таким как медь. Ген селектируемого маркера может быть либо непосредственно связан с последовательностями ДНК, которые подлежат экспрессии, либо вводиться в ту же клетку путем котрансформации. Для оптимального синтеза мРНК могут также потребоваться дополнительные элементы. Эти элементы могут включать сигнальные последовательности, сигналы для сплайсинга, а также промоторы, участвующие в транскрипции, энхансеры и сигналы терминации.
[643] В особенно предпочтительных вариантах осуществления клонируемые гены вариабельных областей вставляют в вектор экспрессии в добавление к генам константных областей тяжелой и легкой цепей (предпочтительно, человека), синтезированным, как обсуждалось выше. Разумеется, в настоящем раскрытии можно применять любой вектор экспрессии, который может вызывать экспрессию в эукариотических клетках. Примеры подходящих векторов включают без ограничений плазмиды pcDNA3, pHCMV/Zeo, pCR3.1, pEF 1/His, pIND/GS, pRc/HCMV2, pSV40/Zeo2, pTRACER-HCMV, pUB6/V5-His, pVAX1 и pZeoSV2 (доступны от Invitrogen, Сан-Диего, Калифорния) и плазмиду pCI (доступна от Promega, Мэдисон, Висконсин). В целом, скрининг больших количеств трансформированных клеток для выявления тех, которые экспрессируют тяжелые и легкие цепи иммуноглобулина на достаточно высоких уровнях, является стандартными экспериментами, которые можно проводить, например, с помощью роботизированных систем.
[644] В общем, после подготовки вектора или последовательности ДНК, кодирующей мономерную субъединицу антитела к IL-33, вектор экспрессии можно вводить в соответствующую клетку-хозяина. Введение плазмиды в клетку-хозяина можно осуществлять с помощью различных методик, хорошо известных специалистам в данной области. Они включают, без ограничений, трансфекцию (в том числе электрофорез и электропорацию), слияние протопластов, осаждение фосфатом кальция, слияние клеток с ДНК в оболочке, микроинъекцию и инфицирование интактным вирусом. См. Ridgway (1988) "Mammalian Expression Vectors" в Vectors, ed. Rodriguez and Denhardt (Баттервортс, Бостон, Массачусетс), Chapter 24.2, pp. 470-472. Как правило, введение плазмиды в хозяина осуществляют посредством электропорации. Клетки-хозяева, содержащие конструкцию для экспрессии, выращивают в условиях, подходящих для выработки легких цепей и тяжелых цепей, и анализируют в отношении белкового синтеза тяжелой и/или легкой цепи. Иллюстративные методики анализа включают твердофазный иммуноферментный анализ (ELISA), радиоиммунологический анализ (RIA) или анализ с применением клеточного сортера с активацией флуоресценции (FACS), иммуногистохимический анализ и т.п.
[645] Вектор экспрессии переносят в клетку-хозяина с помощью стандартных методик, и трансфицированные клетки затем культивируют с помощью стандартных методик с получением антитела для применения в способах, описанных в данном документе. Таким образом, в настоящем раскрытии предусмотрены клетки-хозяева, содержащие полинуклеотид, кодирующий антитело по настоящему раскрытию, или его тяжелую или легкую цепь, функционально связанный с гетерологичным промотором. В предпочтительных вариантах осуществления в случае экспрессии антител с двумя цепями векторы, кодирующие обе тяжелую и легкую цепи можно совместно экспрессировать в клетке-хозяине для экспрессии целой молекулы иммуноглобулина, как подробно описано ниже.
[646] Используемое в данном документе выражение "клетки-хозяева" относится к клеткам, которые несут векторы, сконструированные с применением методик рекомбинантных ДНК и кодирующие по меньшей мере один гетерологичный ген. В описаниях способов выделения антител из рекомбинантных хозяев термины "клетка" и "культура клеток" применяются взаимозаменяемо для обозначения источника антитела, если явно не указано иное. Другими словами, извлечение полипептида из "клеток" может означать извлечение либо из осажденных центрифугированием целых клеток, либо из культуры клеток, содержащей как среду, так и суспендированные клетки.
[647] Чтобы экспрессировать молекулы антитела для применения в способах, описываемых в данном документе, можно использовать целый ряд систем хозяин-вектор экспрессии. Такие системы хозяин-вектор экспрессии представлены носителями, с помощью которых кодирующие последовательности, представляющие интерес, можно получать и затем очищать, но также представлены клетками, которые, будучи трансформированными или трансфицированными с помощью подходящих нуклеотидных кодирующих последовательностей, могут экспрессировать молекулу антитела по настоящему изобретению in situ. Они включают без ограничения микроорганизмы, такие как бактерии (например, Е. coli, В. subtilis), трансформированные с помощью рекомбинантных векторов экспрессии на основе ДНК бактериофага, плазмидной ДНК или космидной ДНК, содержащих кодирующие последовательности для антитела; дрожжи (например, Saccharomyces, Pichid), трансформированные рекомбинантными векторами экспрессии в дрожжах, содержащими кодирующие последовательности для антитела; системы клеток насекомых, инфицированные рекомбинантными векторами экспрессии на основе вируса (например, бакуловируса), содержащими кодирующие последовательности для антитела; системы растительных клеток, инфицированные рекомбинантными векторами экспрессии на основе вируса (например, вируса мозаики цветной капусты, CaMV; вируса табачной мозаики, TMV) или трансформированные с помощью рекомбинантных векторов экспрессии на основе плазмиды (например, Ti-плазмиды), содержащих кодирующие последовательности для антитела; или системы клеток млекопитающих (например, клетки COS, СНО, BLK, 293, 3Т3), несущие рекомбинантные конструкции для экспрессии, содержащие промоторы, полученные из генома клеток млекопитающих (например, промотор гена металлотионеина) или из вирусов млекопитающих (например, промотор гена позднего ответа аденовируса; промотор вируса коровьей оспы 7,5K). Для экспрессии молекулы рекомбинантного антитела применяют предпочтительно бактериальные клетки, такие как Escherichia coli, и более предпочтительно эукариотические клетки, в частности для экспрессии полной молекулы рекомбинантного антитела. Например, клетки млекопитающих, такие как клетки яичников китайского хомячка (СНО), совместно с вектором, таким как главный промоторный элемент гена средне-раннего ответа из цитомегаловируса человека, являются эффективной системой экспрессии для антител (Foecking et al., Gene 43:101 (1986); Cockett et al., Bio/Technology 8:2 (1990)).
[648] Линия клеток-хозяев, применяемая для экспрессии белка, зачастую происходит из млекопитающих; специалисты в данной области преимущественно могут определить конкретные линии клеток-хозяев, которые наилучшим образом подходят для экспрессии в них требуемого продукта гена. Иллюстративные линии клеток-хозяев включают без ограничения СНО (клетки яичника китайского хомячка), DG44 и DUXB13 (линии клеток яичников китайского хомячка, DHFR-отрицательные), HELA (клетки карциномы шейки матки человека), CVI (линия клеток почки обезьяны), COS (производное CVI с Т-антигеном SV40), VERY, ВНК (клетки почки детеныша хомячка), MDCK, 293, WI38, R1610 (фибробласты китайского хомячка), BALBC/3T3 (фибробласты мыши), HAK (линия клеток почки хомячка), SP2/0 (клетки миеломы мыши), P3x63-Ag3.653 (клетки миеломы мыши), BFA-1c1BPT (эндотелиальные клетки крупного рогатого скота), RAJI (лимфоциты человека) и 293 (клетки почки человека). Линии клеток-хозяев обычно доступны из коммерческих служб, Американской коллекции тканевых культур или из опубликованной литературы.
[649] Кроме того, можно выбрать такой штамм клеток-хозяев, который модулирует экспрессию вставленных последовательностей или модифицирует и осуществляет процессинг продукта гена определенным требуемым образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут быть важны для функционирования белка. Различные клетки-хозяева имеют характерные и специфические механизмы посттрансляционного процессинга и модификаций белков, а также продуктов генов. Можно выбрать подходящие линии клеток или системы экспрессии в хозяине для обеспечения правильной модификации и процессинга экспрессируемого чужеродного белка. В связи с этим можно применять эукариотические клетки-хозяева, которые обладают клеточным аппаратом для надлежащего процессинга первичного транскрипта, гликозилирования и фосфорилирования продукта гена.
[650] Для долгосрочной выработки рекомбинантных белков с высоким выходом предпочтительной является стабильная экспрессия. Например, можно сконструировать линии клеток, которые стабильно экспрессируют молекулу антитела. Вместо применения векторов экспрессии, которые содержат вирусные точки начала репликации, клетки-хозяева можно трансформировать с помощью ДНК, контролируемой подходящими элементами контроля экспрессии (например, последовательностями промотора, энхансера, терминаторов транскрипции, сайтов полиаденилирования и т.д.), и содержащей селектируемый маркер. После введения чужеродной ДНК сконструированным клеткам можно позволить расти в течение 1-2 суток на обогащенной среде, а затем их переносят на селективную среду. Селектируемый маркер в рекомбинантной плазмиде придает устойчивость к селекции и позволяет клеткам стабильно интегрировать плазмиду в свои хромосомы и расти с образованием очагов, которые, в свою очередь, можно клонировать, и количество которых можно увеличить с получением линий клеток. Этот способ можно преимущественно применять для конструирования линий клеток, в которых происходит стабильная экспрессия молекулы антитела.
[651] Можно применять целый ряд систем для селекции, в том числе без ограничений можно использовать гены тимидинкиназы вируса простого герпеса (Wigler et al., Cell 13:223 (1977)), гипоксантин-гуанинфосфорибозилтрансферазы (Szybalska and Szybalski, Proc. Natl. Acad. Sci. USA 48:202 (1992)) и аденинфосфорибозилтрансферазы (Lowy et al., Cell 22:817 1980) в tk-, hgprt- или aprt-клетках соответственно. Также можно применять устойчивость к антиметаболитам в качестве основы для селекции по следующим генам: dhfr, который придает устойчивость к метотрексату (Wigler et al., Natl. Acad. Sci. USA 77:357 (1980);

[652] Уровни экспрессии молекулы антитела можно повышать посредством амплификации вектора (для обзора см. Bebbington and Hentschel (1987) "The Use of Vectors Based on Gene Amplification for the Expression of Cloned Genes in Mammalian Cells in DNA Cloning" (Academic Press, NY) Vol. 3. Если маркер в векторной системе, экспрессирующей антитело, является амплифицируемым, то при повышении уровня ингибитора, присутствующего в культуре клеток-хозяев, будет повышаться число копий маркерного гена. Поскольку амплифицируемая область связана с геном антитела, выработка антитела будет также повышаться (Crouse et al., Mol. Cell. Biol. 3:257 (1983)).
[653] Выработка in vitro позволяет увеличить масштаб с получением больших количеств требуемых полипептидов. Методики культивирования клеток млекопитающих в условиях тканевой культуры известны из уровня техники и предусматривают гомогенную суспензионную культуру, например, в аэролифтном реакторе или в реакторе с непрерывным перемешиванием, или иммобилизированную или захваченную культуру клеток, например, в полых волокнах, микрокапсулах, на агарозных микрогранулах или в керамических картриджах. Если необходимо и/или требуется, растворы полипептидов можно очищать с помощью общепринятых способов хроматографии, например, гель-фильтрационной, ионнообменной хроматографии, хроматографии на DEAE-целлюлозе или (иммуно-)аффинной хроматографии, например, после предпочтительного биосинтеза синтетической шарнирной области полипептида или перед или вслед за этапом HIC-хроматографии, описанным в данном документе.
[654] Гены, кодирующие антитела к IL-33 или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию, также можно экспрессировать в клетках, не являющихся клетками млекопитающих, таких как клетки насекомых, бактерий, или дрожжей, или растений. Бактерии, которые легко захватывают нуклеиновые кислоты, включают представителей семейства Enterobacteriaceae, таких как штаммы Escherichia coli или Salmonella; Bacillaceae, таких как Bacillus subtilis, Pneumococcus; Streptococcus и Haemophilus influenzae. Дополнительно следует иметь в виду, что если гетерологичные полипептиды экспрессируются в бактериях, они, как правило, входят в состав телец-включений. Гетерологичные полипептиды необходимо выделять, очищать и затем собирать в функциональные молекулы. Если требуются тетравалентные формы антител, субъединицы затем будут подергаться самосборке в тетравалентные антитела (WO 02/096948A2).
[655] В случае бактериальных систем можно преимущественно выбирать целый ряд векторов экспрессии в зависимости от предполагаемого применения экспрессируемой молекулы антитела. Например, если необходимо получить большое количество такого белка для получения фармацевтических композиций на основе молекулы антитела, могут быть желательны векторы, которые управляют экспрессией высоких уровней продуктов в виде белков слияния, которые легко очистить. Такие векторы включают без ограничения вектор экспрессии pUR278 для Е. coil (Ruther et al., EMBO J. 2:1791 (1983)), в котором кодирующая последовательность для антитела может быть отдельно лигирована в вектор внутрь рамки с областью, кодирующей lacZ, таким образом, что вырабатывается белок слияния; векторы pIN (Inouye and Inouye, Nucleic Acids Res. 73:3101-3109 (1985); Van Heeke и Schuster, J. Biol. Chem. 24:5503-5509 (1989)) и т.п. Векторы pGEX также можно применять для экспрессии чужеродных полипептидов в виде белков слияния с глутатион-S-трансферазой (GST). В целом, такие белки слияния являются растворимыми, и их можно легко очищать из лизированных клеток посредством адсорбции и связывания с матрицей на основе глутатион-агарозных гранул с последующим элюированием в присутствии свободного глутатиона. Векторы pGEX разработаны таким образом, что они включают сайты расщепления для протеаз тромбина или фактора Ха, так что клонируемый целевой продукт гена можно высвобождать из GST-фрагмента.
[656] В дополнение к прокариотам также можно применять эукариотические микроорганизмы. Saccharomyces cerevisiae, или обыкновенные пекарские дрожжи, являются наиболее часто применяемыми эукариотическими микроорганизмами, хотя широко доступен целый ряд других штаммов, например, Pichiapastoris.
[657] Для экспрессии в Saccharomyces широко применяется, например, плазмида YRp7 (Stinchcomb et al.. Nature 282:39 (1979); Kingsman et al., Gene 7:141 (1979); Tschemper et al., Gene 70:157 (1980)). Эта плазмида уже содержит ген TRP1, который обеспечивает селектируемый маркер для мутантного штамма дрожжей, у которого отсутствует способность расти в отсутствие триптофана, например, №44076 в АТСС или РЕР4-1 (Jones, Genetics 55:12 (1977)). Наличие повреждения trp1 в качестве характеристики генома дрожжевых клеток-хозяев в таком случае обеспечивает эффективную среду для выявления трансформации путем выращивания в отсутствие триптофана.
[658] В системе на основе клеток насекомых, как правило, в качестве вектора для экспрессии чужеродных генов применяют вирус ядерного полиэдроза Autographa calif arnica (AcNPV). Вирус растет в клетках Spodoptera frugiperda. Кодирующую последовательность для антитела можно отдельно клонировать в несущественные области вируса (например, ген полиэдрина) и поместить под контроль промотора AcNPV (например, промотора гена полиэдрина).
[659] После рекомбинантной экспрессии связывающей молекулы по настоящему раскрытию она может быть очищена с помощью любого способа, известного из уровня техники для очистки молекулы иммуноглобулина, например, с помощью хроматографии (например, ионообменной, аффинной, в частности, по аффинности в отношении специфического антигена после хроматографии с белком А и эксклюзионной колоночной хроматографии), центрифугирования, очистки на основе неодинаковой растворимости или с помощью любой другой стандартной методики для очистки белков. Альтернативно, предпочтительный способ для увеличения аффинности антител по настоящему раскрытию раскрыт в публикации заявки на патент США №2002 0123057 A1.
[660]
VII. Способы лечения с применением терапевтических антител к IL-33
[661] Способы по настоящему раскрытию направлены на применение связывающих молекул к IL-33, например, антител, в том числе их антигенсвязывающих фрагментов, вариантов и производных, для лечения пациентов с заболеванием, ассоциированным с экспрессией IL-33 или с клетками, экспрессирующими IL-33. Под "клетками, экспрессирующими IL-33" подразумевают клетки, экспрессирующие антиген IL-33. Способы для обнаружения экспрессии IL-33 в клетках хорошо известны из уровня техники и включают без ограничения методики ПЦР, иммуногистохимию, проточную цитометрию, вестерн-блоттинг, ELISA и т.п.
[662] Хотя нижеследующее обсуждение относится к способам диагностики и лечения различных заболеваний и нарушений с помощью антитела к IL-33 по настоящему раскрытию, способы, описанные в данном документе, также применимы к антигенсвязывающим фрагментам, вариантам и производным данных антител к IL-33, которые сохраняют требуемые свойства антител к IL-33 по настоящему раскрытию, например, способность специфически связывать IL-33 и нейтрализовать патогенную активность IL-33.
[663] В одном варианте осуществления лечение предусматривает применение или введение связывающей молекулы к IL-33, например, антитела или его антигенсвязывающего фрагмента по настоящему раскрытию, субъекту или пациенту, или применение или введение связывающей молекулы к IL-33 в выделенную ткань или линию клеток от субъекта или пациента, где субъект или пациент имеет заболевание, симптом заболевания или предрасположенность к заболеванию. В другом варианте осуществления также предполагается, что лечение предусматривает применение или введение фармацевтической композиции, содержащей связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент по настоящему раскрытию, субъекту или пациенту или применение или введение фармацевтической композиции, содержащей связывающую молекулу к IL-33, в выделенную ткань или линию клеток от субъекта или пациента, который имеет заболевание, симптом заболевания или предрасположенность к заболеванию.
[664] Связывающие молекулы к IL-33, например, антитела или их связывающие фрагменты по настоящему раскрытию применимы для лечения различных воспалительных состояний. Под "противовоспалительной активностью" подразумевают снижение уровня воспалительного ответа у клетки, экспрессирующей IL-33 и, следовательно, уменьшение воспаления в ткани, которые возникают в ходе терапии. Например, терапия с помощью по меньшей мере одного антитела к IL-33 вызывает физиологический ответ, например, снижение воспалительного ответа, что является благоприятным с точки зрения лечения болезненных состояний, ассоциированных с клетками, экспрессирующими IL-33 у человека.
[665] В одном варианте осуществления настоящее раскрытие относится к связывающим молекулам к IL-33, например, антителам или их связывающим фрагментам в соответствии с настоящим раскрытием, для применения в качестве лекарственного препарата, в частности, для применения в лечении или профилактике воспалительного ответа или для применения в лечении воспалительного состояния, например, астмы или COPD. В определенных вариантах осуществления связывающую молекулу к IL-33, например, антитело или его связывающий фрагмент по настоящему раскрытию, применяют для лечения аллергического нарушения. В определенных вариантах осуществления связывающую молекулу к IL-33, например, антитело или его связывающий фрагмент по настоящему раскрытию, применяют для лечения воспалительного ответа в дыхательных путях субъекта или пациента.
[666] В соответствии со способами по настоящему раскрытию по меньшей мере одну связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, как определено в другом месте данного документа, применяют для стимуляции положительного терапевтического ответа применительно к воспалительному ответу. Под "положительным терапевтическим ответом" применительно к лечению воспаления подразумевается ослабление заболевания на фоне противовоспалительной активности данных связывающих молекул, например, антител или их фрагментов, и/или ослабление симптомов, ассоциированных с заболеванием. То есть может наблюдаться противовоспалительный эффект, предупреждение дальнейшего воспаления, и/или снижение существующего воспаления, и/или уменьшение одного или нескольких симптомов, ассоциированных с заболеванием. Таким образом, например, ослабление заболевания можно охарактеризовать как полный ответ. Под "полным ответом" подразумевается отсутствие клинически обнаруживаемого заболевания при нормализации результатов любых ранее проведенных тестов. Такой ответ должен сохраняться в течение по меньшей мере одного месяца после лечения в соответствии со способами по настоящему раскрытию. Альтернативно, ослабление заболевания может быть классифицировано как представляющее собой частичный ответ.
[667] Связывающие молекулы к IL-33, например, антитела или их антигенсвязывающие фрагменты, описанные в данном документе, могут также найти применение в лечении воспалительных заболеваний и иммунодефицитов или нарушений иммунной системы, которые ассоциированы с клетками, экспрессирующими IL-33. Воспалительные заболевания характеризуются воспалением и разрушением ткани или их комбинацией. Под "противовоспалительной активностью" подразумевают снижение или предупреждение воспаления. "Воспалительное заболевание" включает любой воспалительный, опосредованный иммунной системой процесс, где инициирующее явление или мишень иммунного ответа включают чужеродный антиген(ы), в том числе, например, аллоантигены, ксеноантигены, вирусные антигены, бактериальные антигены, неизвестные антигены или аллергены. В одном варианте осуществления воспалительное заболевание представляет собой воспалительное нарушение в дыхательных путях, например, астму или COPD.
[668] Астма считается распространенным воспалительным заболеванием дыхательных путей, которое характеризуется, например, вариабельными и рецидивирующими симптомами, обратимой обструкцией дыхательных путей и бронхоспазмом. Симптомы астмы могут включать свистящее дыхание, кашель, стеснение в груди и одышку. Симптомы могут запускаться под действием аллергенов или раздражителей. Астму можно классифицировать как атопическую (экзогенную) или неатопическую (эндогенную), в зависимости от того, вызваны симптомы аллергенами (атопическая) или нет (неатопическая). Резкое обострение астмы обычно называется "приступ астмы". Дополнительные признаки, которые могут возникать в ходе приступа астмы, включают вовлечение вспомогательных дыхательных мышц (грудинно-ключично-сосцевидной и лестничной мышц шеи), при это может иметь место парадоксальный пульс (пульс который является более слабым при вдохе и более сильным при выдохе) и чрезмерное наполнение воздухом грудной клетки. Голубой цвет кожи и ногтей может возникать вследствие недостатка кислорода.
[669] В соответствии со способами по настоящему раскрытию по меньшей мере одну связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, как определено в другом месте данного документа, применяют для стимуляции положительного терапевтического ответа применительно к лечению или предупреждению воспалительного заболевания. Под "положительным терапевтическим ответом" применительно к воспалительному заболеванию подразумевают ослабление заболевания на фоне противовоспалительной активности и т.п. данных антител и/или ослабление симптомов, ассоциированных с заболеванием. Это означает, что может наблюдаться снижение воспалительного ответа, в том числе без ограничения сниженная секреция воспалительных цитокинов, молекул адгезии, протеаз, иммуноглобулинов, их комбинаций и т.п., повышенная выработка противовоспалительных белков, снижение количества аутореактивных клеток, повышение иммунной толерантности, ингибирование выживания аутореактивных клеток, снижение апоптоза, снижение миграции эндотелиальных клеток, повышение спонтанной миграции моноцитов, снижение и/или уменьшение одного или нескольких симптомов, опосредованных стимуляцией клеток, экспрессирующих IL-33. Такие положительные терапевтические ответы не ограничены путем введения.
[670] Клинический ответ можно оценивать с использованием скрининговых методик, таких как сканирование с помощью магнитно-резонансной томографии (MRI), рентгенография, сканирование с помощью компьютерной томографии (СТ), проточная цитометрия или анализ с применением клеточного сортера с активацией флуоресценции (FACS), гистологическое исследование, макропатологическое исследование и биохимический анализ крови, в том числе без ограничения изменения, обнаруживаемые с помощью ELISA, RIA, хроматографии и т.п. В дополнение к этим положительным терапевтическим ответам, субъект, подвергаемый терапии с использованием связывающей молекулы к IL-33, например, антитела или его антигенсвязывающего фрагмента, может испытывать благоприятный эффект в виде ослабления симптомов, ассоциированных с заболеванием.
[671] Связывающие молекулы к IL-33, например, антитела или их связывающие фрагменты по настоящему раскрытию, можно применять в комбинации с любыми известными видами терапии воспалительных заболеваний, включая любое средство или комбинацию средств, которые, как известно, являются применимыми, или которые применялись или в настоящее время применяются для лечения воспалительных заболеваний, например, астмы или COPD. Средства, применяемые для лечения астмы, подразделяются на два общих класса: симптоматические лекарственные препараты, применяемые для лечения острых симптомов; и лекарственные препараты долгосрочного контроля, применяемые для предупреждения дальнейшего обострения. Быстродействующие виды лечения включают, например, агонист бета-2-адренорецепторов кратковременного действия (SABA) (например, сальбутамол); антихолинергические лекарственные препараты (например, ипратропия бромид), агонисты адренергических рецепторов (например, эпинефрин). Виды лечения с долгосрочным контролем включают, например, глюкокортикоиды (например, флутиказона пропионат); агонист бета-2-адренорецепторов длительного действия (LABA); антагонисты лейкотриенов (например, зарифлукаст) и стабилизаторы мастоцитов (например, кромолин натрия). Быстродействующие виды лечения и виды лечения с долгосрочным контролем зачастую вводятся путем ингаляции.
[672] Таким образом, если комбинированные виды терапии предусматривают введение связывающей молекулы к IL-33 в комбинации с введением другого терапевтического средства, способы по настоящему раскрытию охватывают совместное введение, применение отдельных составов или единого фармацевтического состава, а также последовательное введение в любом порядке. В некоторых вариантах осуществления по настоящему раскрытию антитела к IL-33, описанные в данном документе, вводят в комбинации с противовоспалительными лекарственными средствами, где антитело или его антигенсвязывающий фрагмент и терапевтическое средство(а) можно вводить последовательно, в любом порядке, или одновременно (т.е., совместно или в пределах одного периода времени).
[673] Дополнительный вариант осуществления настоящего раскрытия представляет собой применение связывающей молекулы к IL-33, например, антител или их антигенсвязывающих фрагментов, для диагностического мониторинга уровней белка в ткани как части процедуры клинического тестирования, например, для определения эффективности данной схемы лечения. Например, обнаружение можно облегчить путем связывания антитела с обнаруживаемым веществом. Примеры обнаруживаемых веществ включают различные ферменты, простетические группы, флуоресцентные вещества, люминесцентные вещества, биолюминесцентные вещества и радиоактивные вещества. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных веществ включают умбеллиферон, флуоресцеин, флуоресцеин-изотиоцианат, родамин, флуоресцеин-дихлортриазиниламин, дансилхлорид или фикоэритрин; пример люминесцентного вещества включает люминол; примеры биолюминесцентных веществ включают люциферазу, люциферин и экворин; а примеры подходящих радиоактивных веществ включают125I,131I,35S или3H.
VIII. Фармацевтические композиции и способы введения
[674] Способы получения и введения связывающей молекулы к IL-33, например, антител или их антигенсвязывающих фрагментов, вариантов или производных по настоящему раскрытию, субъекту нуждающемуся в этом, хорошо известны специалистам в данной области или могут быть легко определены ими. Путь введения связывающей молекулы к IL-33, например, антитела или его антигенсвязывающего фрагмента, варианта или производного, может быть, например, пероральным, парентеральным, ингаляционным или местным. Термин "парентеральный", как используется в данном документе, включает, например, внутривенное, внутриартериальное, внутрибрюшинное, внутримышечное, подкожное, ректальное или вагинальное введение. Хотя все эти формы введения явно подразумеваются как находящиеся в пределах объема настоящего раскрытия, другим примером формы для введения будет раствор для инъекций, в частности, для внутривенной или внутриартериальной инъекции или капельного вливания. Обычно подходящая фармацевтическая композиция по настоящему раскрытию может содержать буфер (например, ацетатный, фосфатный или цитратный буфер), поверхностно-активное вещество (например, полисорбат), необязательно стабилизирующее средство (например, альбумин человека), и т.д. Однако в других способах, совместимых с идеями данного документа, связывающие молекулы к IL-33, например, антитела или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию, могут доставляться непосредственно в место локализации нежелательной популяции клеток, увеличивая тем самым воздействие терапевтического средства на пораженную заболеванием ткань. В одном варианте осуществления введение осуществляется непосредственно в дыхательные пути, например, посредством ингаляции или интраназального введения.
[675] Как обсуждается в данном документе, связывающие молекулы к IL-33, например, антитела, или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию, можно вводить в фармацевтически эффективном количестве для т vivo лечения заболеваний, опосредованных клетками, экспрессирующими IL-33, таких как определенные типы воспалительных заболеваний. В этом отношении следует иметь в виду, что раскрытые связывающие молекулы по настоящему раскрытию будут составлять таким образом, чтобы облегчать введение и способствовать стабильности активного средства. Предпочтительно фармацевтические композиции в соответствии с настоящим раскрытием содержат фармацевтически приемлемый, нетоксичный, стерильный носитель, такой как физиологический солевой раствор, нетоксичные буферы, консерванты и т.п. Для целей настоящей заявки фармацевтически эффективное количество связывающей молекулы к IL-33, например, антитела или его антигенсвязывающего фрагмента, варианта или производного, конъюгированного или неконъюгированного, будет означать количество, достаточное для достижения эффективного связывания с мишенью и для достижения положительного эффекта, например, для облегчения симптомов заболевания или состояния или для обнаружения вещества или клетки.
[676] Фармацевтические композиции, применяемые в настоящем раскрытии, могут содержать фармацевтически приемлемые носители, в том числе, например, воду, ионообменные вещества, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозу натрия, полиакрилаты, воски, блок-сополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин.
[677] Препараты для введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей представляют собой пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Водные носители включают, например, воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевой раствор и буферные среды. В настоящем раскрытии фармацевтически приемлемые носители включают без ограничения 0,01-0,1 М и предпочтительно 0,05 М фосфатный буфер или 0,8% солевой раствор. Другие общие среды-носители для парентерального введения включают растворы фосфата натрия, раствор Рингера с декстрозой, растворы декстрозы и хлорида натрия, лактатный раствор Рингера или нелетучие масла. Среды-носители для внутривенного введения включают жидкость и растворы с добавками питательных веществ, растворы с добавками электролитов, как, например, на основе растворов Рингера с декстрозой и т.п. Также могут присутствовать консерванты и другие добавки, такие как, например, противомикробные средства, антиоксиданты, хелатирующие средства и инертные газы и т.п.
[678] Более конкретно, фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы (в случае растворимости в воде) или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов или дисперсий. В таких случаях композиция должна быть стерильной и жидкой до такой степени, чтобы ее легко было вводить с помощью шприца. Она должна быть стабильной в условиях производства и хранения и предпочтительно будет защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, путем применения покрытия, такого как лецитин, путем поддержания необходимого размера частиц, в случае дисперсии, и путем применения поверхностно-активных веществ. Подходящие составы для применения в терапевтических способах, раскрытых в данном документе, описаны в Remington's Pharmaceutical Sciences (Mack Publishing Co.) 16th ed. (1980).
[679] Предотвращения действия микроорганизмов можно достигать с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях будет предпочтительным включить в композицию средства, придающие изотоничность, например, сахара, полиспирты, такие как маннит, сорбит, или хлорид натрия. Длительное всасывание инъекционных композиций может обеспечиваться включением в композицию средства, которое замедляет всасывание, например, моностеарата алюминия и желатина.
[680] В любом случае стерильные инъекционные растворы можно приготовить путем помещения активного соединения (например, антитела к IL-33 или его антигенсвязывающего фрагмента, варианта или производного, отдельно или в комбинации с другими активными средствами) в необходимое количество подходящего растворителя с одним или комбинацией ингредиентов, перечисленных в данном документе, при необходимости, с последующей стерилизацией фильтрованием. Обычно дисперсии получают путем помещения активного соединения в стерильную среду-носитель, которая содержит основную дисперсионную среду и необходимые другие ингредиенты из вышеперечисленных. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительные способы получения представляют собой вакуумную сушку и сублимационную сушку, которые приводят к получению порошка активного ингредиента и любого дополнительного требуемого ингредиента из их предварительно простерилизованного фильтрованием раствора. Препараты для инъекций обрабатывают, заполняют ими контейнеры, такие как ампулы, пакеты, бутыли, шприцы или флаконы, и запечатывают в асептических условиях в соответствии со способами, известными из уровня техники. Кроме того, препараты можно упаковывать и реализовывать в форме набора. Такие готовые изделия предпочтительно будут иметь этикетки или листки-вкладыши, на которых указано, что соответствующие композиции применимы для лечения субъекта, страдающего от заболевания или нарушения или предрасположенного к ним.
[681] Составы для парентерального введения могут представлять собой однократную болюсную дозу, инфузионную или ударную болюсную дозу, за которой следует поддерживающая доза. Эти композиции можно вводить с конкретным фиксированным или переменным интервалами, например, раз в день или по мере необходимости.
[682] Определенные фармацевтические композиции, применяемые в настоящем раскрытии, можно вводить перорально в виде приемлемой лекарственной формы, включающей, например, капсулы, таблетки, водные суспензии или растворы. Определенные фармацевтические композиции также можно вводить при помощи назального аэрозоля или путем ингаляции. Такие композиции можно получать в виде растворов в солевом растворе с использованием бензилового спирта или других подходящих консервантов, стимуляторов абсорбции для повышения биодоступности и/или других традиционных солюбилизирующих или диспергирующих средств.
[683] Количество связывающей молекулы к IL-33, например, антитела или его фрагмента, варианта или производного, которые можно объединять с веществами-носителями для получения единичной лекарственной формы, будут варьировать в зависимости от субъекта, подвергаемого лечению, и конкретного способа введения. Композицию можно вводить в виде однократной дозы, многократных доз или в течение установленного периода времени в виде инфузии. Схемы дозирования также можно корректировать для обеспечения оптимального требуемого ответа (например, терапевтического или профилактического ответа).
[684] В соответствии с объемом настоящего раскрытия антитела к IL-33 или их антиген -связывающие фрагменты, варианты или производные по настоящему раскрытию можно вводить человеку или другому животному в соответствии с упомянутыми выше способами лечения в количестве, достаточном для получения терапевтического эффекта. Антитела к IL-33 или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию можно вводить такому человеку или другому животному в традиционной лекарственной форме, полученной путем объединения антитела или его антигенсвязывающего фрагмента по настоящему раскрытию с традиционными фармацевтически приемлемыми носителем или разбавителем в соответствии с известными методиками. Специалисту в данной области техники следует принимать во внимание, что форму и характер фармацевтически приемлемого носителя или разбавителя определяют количество активного ингредиента, с которым их объединяют, путь введения и другие хорошо известные переменные. Специалистам в данной области, кроме того, будет понятно, что смесь, содержащая один или несколько видов связывающих молекул к IL-33, например, антител или их антигенсвязывающие фрагментов, вариантов или производных по настоящему раскрытию, может оказаться особенно эффективной.
[685] Под "терапевтически эффективными дозой или количеством" или "эффективным количеством" подразумевают количество связывающей молекулы к IL-33, например, антитела или его антигенсвязывающего фрагмента, которое при введении приводит к положительному терапевтическому ответу с точки зрения лечения пациента с заболеванием или состоянием, подлежащими лечению.
[686] В настоящем раскрытии также представлено применение связывающей молекулы к IL-33, например, антитела или его антигенсвязывающего фрагмента, варианта или производного, в производстве лекарственного препарата для лечения воспалительного заболевания, включая, например, астму или COPD.
[687] В настоящем раскрытии также представлено применение связывающей молекулы к IL-33, например, антитела по настоящему раскрытию или его антигенсвязывающего фрагмента, варианта или производного, в производстве лекарственного препарата для лечения субъекта при лечении воспалительного заболевания, где лекарственный препарат применяют в отношении субъекта, который ранее проходил лечение с помощью по меньшей мере одного другого вида терапии. Под "ранее проходил лечение" или "предшествующим лечением" подразумевается, что субъект получил один или несколько других видов терапии (например, проходил лечение с помощью по меньшей мере одного другого вида противовоспалительной терапии) перед получением лекарственного препарата, содержащего связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, вариант или производное. Выражения "ранее проходил лечение" или "предшествующее лечение" предусматривают субъектов, которые проходили лечение с помощью по меньшей мере одного другого вида терапии в пределах 2 лет, в пределах 18 месяцев, в пределах 1 года, в пределах 6 месяцев, в пределах 2 месяцев, в пределах 6 недель, в пределах 1 месяца, в пределах 4 недель, в пределах 3 недель, в пределах 2 недель, в пределах 1 недели, в пределах 6 дней, в пределах 5 дней, в пределах 4 дней, в пределах 3 дней, в пределах 2 дней или даже в пределах 1 дня до начала лечения с помощью лекарственного препарата, содержащего связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, вариант или производное. Не является обязательным, чтобы субъект реагировал на предшествующее лечение с помощью предшествующего вида терапии или видов терапии. Таким образом, субъект, который получает лекарственный препарат, содержащий связывающую молекулу к IL-33, например, антитело или его антигенсвязывающий фрагмент, вариант или производное, мог либо реагировать, либо мог не реагировать на предшествующее лечение с помощью предшествующего вида терапии или на один или несколько предшествующих видов терапии, если предшествующее лечение включало несколько видов терапии.
IX. Диагностика
[688] В настоящем раскрытии дополнительно представлен диагностический способ, применимый в ходе диагностики заболеваний, опосредованных клетками, экспрессирующими IL-33, таких как определенные типы воспалительных заболеваний, в том числе, например, астма, который предусматривает измерение уровня экспрессии белка или транскрипта IL-33 в ткани, или других клетках, или жидкости организма, полученных от индивидуума, и сравнение измеренного уровня экспрессии с стандартным уровнем экспрессии IL-33 в нормальной ткани или жидкости организма, причем повышение уровня экспрессии по сравнению со стандартом указывает на нарушение.
[689] Антитела к IL-33 по настоящему раскрытию и их антигенсвязывающие фрагменты, варианты и производные можно применять для анализа уровней белка IL-33 в биологическом образце с применением классических иммуногистологических способов, известных специалистам в данной области (например, см. Jalkanen, et al., J. Cell. Biol. 707:976-985 (1985); Jalkanen et al., J. Cell Biol. 105:3087-3096 (1987)). Другие способы на основе антител, пригодные для обнаружения экспрессии белка IL-33, включают иммунологические анализы, такие как твердофазный иммуноферментный анализ (ELISA), иммунопреципитация или вестерн-блоттинг. Подходящие анализы более подробно описаны в другом месте данного документа.
[690] Под "анализом уровня экспрессии полипептида IL-33" подразумевается качественное или количественное измерение или оценка уровня полипептида IL-33 в первом биологическом образце либо напрямую (например, путем определения или оценки абсолютного уровня белка), либо относительно (например, путем сравнения с уровнем ассоциированного с заболеванием полипептида во втором биологическом образце). Предпочтительно уровень экспрессии полипептида IL-33 в первом биологическом образце измеряют или оценивают и сравнивают со стандартным уровнем полипептида IL-33, при этом стандартный определяют на основании второго биологического образца, полученного от индивидуума, не имеющего нарушения, или определяют путем усреднения уровней от группы индивидуумов, не имеющих нарушения. Как будет понятно в данной области техники, после того как "стандартный" уровень полипептида IL-33 становится известен, его можно применять многократно в качестве стандарта для сравнения.
[691] Под "биологическим образцом" подразумевается любой биологический образец, полученный от индивидуума, линии клеток, культуры ткани или другого источника клеток, потенциально экспрессирующих IL-33. Способы получения биоптатов тканей и жидкостей организма от млекопитающих хорошо известны в данной области техники.
X. Иммунологические анализы
[692] Связывающие молекулы к IL-33, например, антитела или их антигенсвязывающие фрагменты, варианты, или производные по настоящему раскрытию, можно анализировать в отношении иммуноспецифического связывания с помощью любого способа, известного из уровня техники. Анализы связывания можно выполнять в виде анализов прямого связывания или в виде анализов конкурентного связывания. Иммунологические анализы, которые можно применять, включают без ограничения ELISA (твердофазный иммуноферментный анализ), вестерн-блоттинг, иммуноцитохимию, иммунопреципитацию, аффинную хроматографию, интерферометрию биослоя. Octet, ForteBio) и биохимические анализы, такие как усиленные диссоциацией лантанидные флуоресцентные Иммунологические анализы (DELFIA®, Perkin Elmer), анализы ферстеровского резонансного переноса энергии (FRET) (например, гомогенный анализ флуоресценции с временным щзрешением (HTRF®, Cis Biointemational) и анализы связывания радиоактивного лиганда и многие другие. Связывание можно также обнаружить в клеточных анализах, например, с помощью проточной цитометрии и технологии флуоресцентного микрообъемного анализа (FMAT®, Applied Biosystems). В анализе прямого связывания антитело-кандидат тестируют в отношении связывания с антигеном IL-33. Анализ конкурентного связывания, наоборот, оценивает способность антитела-кандидата конкурировать с известным антителом к IL-33, или фрагментом, или другим соединением, таким как ST2, которые связываются с IL-33. Такие анализы являются обычными и хорошо известны из уровня техники (см., например, Ausubel et al., eds, (1994) Current Protocols in Molecular Biology (John Wiley & Sons, Inc., NY) Vol. 1, который в полном объеме включен в данный документ посредством ссылки во всей своей полноте). Иллюстративные иммунологические анализы вкратце описаны ниже (но не подразумеваются как ограничивающие).
[693] Протоколы иммунопреципитации, как правило, включают лизирование популяции клеток в буфере для лизиса, таком как буфер RIPA (1% NP-40 или Triton Х-100, 1% дезоксихолата натрия, 0,1% SDS, 0,15 М NaCl, 0,01 М фосфата натрия при рН 7,2, 1% Trasylol), дополненный протеинфосфатазой и/или ингибиторами протеазы (например, EDTA, PMSF, апротинином, ванадатом натрия), добавление антитела, представляющего интерес, в лизат клеток, инкубирование в течение некоторого времени (например, 1-4 часа) при 4°С, добавление сефарозных гранул с белком А и/или белком G в лизат клеток, инкубирование в течение приблизительно часа или более при 4°С, промывание гранул в буфере для лизиса и ресуспендирование гранул в SDS/буфере для образцов. Способность антитела, представляющего интерес, приводить к иммунопреципитации конкретного антигена можно оценить, например, с помощью вестерн-блоттинг анализа. Специалист в данной области будет располагать необходимой информацией о параметрах, которые можно модифицировать для повышения связывания антитела с антигеном и снижения фонового шума (например, путем предварительной очистки лизата клеток с помощью сефарозных гранул). Для дополнительного обсуждения протоколов иммунопреципитации см., например, Ausubel et al., eds, (1994) Current Protocols in Molecular Biology (John Wiley & Sons, Inc., NY) Vol. 1 в разделе 10.16.1.
[694] Вестерн-блоттинг анализ, как правило, предусматривает подготовку образцов белка, электрофорез образцов белка в полиакриламидном геле (например, 8%-20% SDS-PAGE в зависимости от молекулярного веса антигена), перенос образца белка с полиакриламидного геля на мембрану, такую как нитроцеллюлоза, PVDF или нейлон, блокирование мембраны в блокирующем растворе (например, PBS с 3% BSA или обезжиренное молоко), промывку мембраны в отмывочном буфере (например, PBS-Tween 20), блокирование мембраны с помощью первичного антитела (антитела, представляющего интерес), разведенного в блокирующем буфере, промывку мембраны в отмывочном буфере, блокирование мембраны с помощью вторичного антитела (которое распознает первичное антитело, например, антитело к иммуноглобулину человека), конъюгированного с ферментативным субстратом (например, пероксидазой хрена или щелочной фосфатазой) или радиоактивной молекулой (например,32P или125I), разведенными в блокирующем буфере, промывку мембраны в буфере для отмывки и обнаружение присутствия антигена. Специалист в данной области будет располагать необходимой информацией о параметрах, которые можно модифицировать для повышения обнаруживаемого сигнала и для снижения фонового шума. Для дополнительного обсуждения протоколов вестерн-блоттинга см., например, Ausubel et al., eds, (1994) Current Protocols in Molecular Biology (John Wiley & Sons, Inc., NY) Vol. 1 в разделе 10.8.1.
[695] Варианты ELISA включают подготовку антигена, покрытие лунки 96-луночного микротитрационного планшета антигеном, добавление антитела, представляющего интерес, конъюгированного с обнаруживаемым соединением, таким как ферментативный субстрат (например, пероксидаза хрена или щелочная фосфатаза), в лунку, а также инкубирование в течение некоторого времени и обнаружение присутствия антигена. В некоторых вариантах ELISA антитело, представляющее интерес, не должно быть конъюгировано с обнаруживаемым соединением; вместо этого можно добавлять в лунку второе антитело (которое распознает антитело, представляющее интерес), конъюгированное с обнаруживаемым соединением. Кроме того, вместо покрытия лунки антигеном, лунка может быть покрыта антителом. В этом случае второе антитело, конъюгированное с обнаруживаемым соединением, можно добавлять после добавления антигена, представляющего интерес, в покрытую лунку. Специалист в данной области будет располагать необходимой информацией о параметрах, которые можно модифицировать для увеличения обнаруживаемого сигнала, а также других вариаций ELISA, известных из уровня техники. Для дополнительного обсуждения вариантов ELISA см., например, Ausubel et al., eds, (1994) Current Protocols in Molecular Biology (John Wiley & Sons, Inc., NY) Vol. 1 в разделе 13.2.1.
[696] Антитела к IL-33 или их антигенсвязывающие фрагменты, варианты или производные по настоящему раскрытию, кроме того, можно использовать в гистологических исследованиях, а именно в анализах иммунофлуоресценции, иммунуом анализе с применением электронной микроскопии или анализах, отличных от иммунологических, для обнаружения in situ белка IL-33 или его консервативных вариантов или пептидных фрагментов. Обнаружение in situ можно осуществлять путем забора гистологического образца у пациента и применения в отношении него меченного антитела к IL-33 или его антигенсвязывающего фрагмента, варианта или производного, предпочтительно применения путем покрытия биологического образца меченным антителом (или фрагментом). Благодаря применению такой процедуры можно определить не только присутствие белка IL-33 или его консервативных вариантов или пептидных фрагментов, но также и его распределение в исследуемой ткани. Используя настоящее раскрытие, специалисты обычной квалификации в данной области техники без труда поймут, что любой из широкого спектра гистологических способов (таких как процедуры окрашивания) можно модифицировать для того, чтобы добиться такого обнаружения in situ.
[697] Иммунологические анализы и анализы, не относящиеся к иммунологическим, в отношении продуктов гена IL-33 или их консервативных вариантов или пептидных фрагментов, как правило, будут предусматривать инкубирование образца, такого как биологическая жидкость, экстракт ткани, свежесобранные клетки, или лизаты клеток, которых инкубировали в культуре клеток, в присутствии меченного с возможностью обнаружения антитела, способного связываться с IL-33 или его консервативными вариантами или пептидными фрагментами, и обнаружение связанного антитела с помощью любой из множества методик, хорошо известных из уровня техники.
[698] Биологический образец можно приводить в контакт или иммобилизировать на твердофазной подложке или носителе, таком как нитроцеллюлоза или другая твердая подложка, которые способны иммобилизировать клетки, частицы клеток или растворимые белки. Затем подложку можно промывать подходящими буферами с последующей обработкой меченным с возможностью обнаружения антителом к IL-33 или его антигенсвязывающим фрагментом, вариантом или производным. Затем твердофазную подложку можно промывать буфером второй раз для удаления несвязавшегося антитела. Необязательно антитело после этого метят. Затем количество связавшейся метки на твердой подложке можно выявлять с помощью традиционных способов.
[699] Под "твердофазной подложкой или носителем" подразумевают любую подложку, способную связывать антиген или антитело. Хорошо известные подложки или носители включают стекло, полистирол, полипропилен, полиэтилен, декстран, нейлон, амилазы, природные и модифицированные целлюлозы, полиакриламиды, габбро и магнетит. Для целей настоящего раскрытия носитель по природе может быть либо растворимым в некоторой степени, либо нерастворимым. Материал для подложки может иметь практически любую возможную структурную конфигурацию при условии, что связавшаяся молекула способна связываться с антигеном или антителом. Таким образом, конфигурация подложки может быть сферической, как у гранулы, или цилиндрической, как внутренняя поверхность пробирки, или наружная поверхность стержня. Альтернативно, поверхность может быть плоской, как лист, индикаторная полоска и т.д. Предпочтительные подложки включают полистирольные гранулы. Специалистам в данной области будут известны многие другие подходящие носители для связывания антитела или антигена, или они будут иметь возможность установить их при осуществлении стандартных экспериментов.
[700] Жидкофазный анализ связывания можно также выполнять с применением подходящих способов, известных из уровня техники, в качестве примера, но без ограничения, анализов ферстеровского резонансного переноса энергии (FRET) (например, гомогенной флуоресценции с временным разрешением (HTRF®, Cis Biointernational). HTRF®-анализ представляет собой технологию гомогенного анализа, в которой используется резонансный перенос энергии флуоресценции между донорным и акцепторным флуорофором, которые находятся в непосредственной близости (Mathis, G., din Chem 41(9):1391-7(1995)). Этот анализ можно применять для измерения взаимодействия макромолекул при помощи прямого или непрямого присоединения одной из молекул, представляющих интерес, к донорному флуорофору, например, криптату европия (Еu3+), и присоединения другой молекулы, представляющей интерес, к акцепторному флуорофору, например, XL665 (стабильный сшитый аллофикоцианин). Возбуждение донорной молекулы приводит к испусканию флуоресценции. Энергия, полученная в результате этого испускания, может переноситься к акцепторному флуорофору при нахождении в непосредственной близости от донорного флуорофора, что приводит к испусканию специфической долгоживущей флуоресценции.
[701] Активность связывания данной партии антитела к IL-33 или его антигенсвязывающего фрагмента, варианта или производного можно определить в соответствии с хорошо известными способами. Специалисты в данной области техники смогут определить рабочие и оптимальные условия анализа для каждого определения с использованием стандартных экспериментов.
[702] Существуют разнообразные способы, доступные для измерения аффинности взаимодействия антитело-антиген, но относительно немного для определения констант скорости. Большинство способов основаны на мечении антитела или антигена, что неизбежно усложняет стандартные измерения и вносит неточности в измеряемые значения количеств.
[703] Аффинность связывания антитела с антигеном и скорость диссоциации взаимодействия антитело-антиген можно определять с помощью анализа конкурентного связывания. Одним примером анализа конкурентного связывания является радиоиммунологический анализ, предусматривающий инкубацию меченного антигена (например,3Н или125I) с антителом, представляющим интерес, в присутствии возрастающих количеств немеченного антигена и обнаружение антитела, связавшегося с меченным антигеном. Аффинность антитела, представляющего интерес, в отношении конкретного антигена и скорости диссоциации связывания можно определить на основании данных с помощью анализа графика Скэтчарда. Конкуренцию со вторым антителом также можно определить с помощью радиоиммунологических анализов. В этом случае антиген инкубируют с антителом, представляющим интерес, конъюгированным с меченным соединением (например,3Н или125I), в присутствии возрастающих количеств немеченного второго антитела.
[704] Поверхностный плазменный резонанс (SPR), осуществляемый на BIACORE®, предлагает ряд преимуществ в сравнении с традиционными способами измерения аффинности взаимодействий антитело-антиген: (i) отсутствует необходимость в мечении антитела или антигена; (ii) антитела не нужно предварительно очищать, супернатант культуры клеток можно применять напрямую; (iii) обеспечивается возможность измерений в реальном времени, что дает возможность быстрого полуколичественного сравнения взаимодействий с различными моноклональными антителами, и этих измерений достаточно для большинства целей оценки; (iv) биоспецифическую поверхность можно регенерировать, так что серию различных моноклональных антител можно легко сравнивать в идентичных условиях; (v) аналитические процедуры полностью автоматизированы, и можно осуществлять обширные серии измерений без вмешательства пользователя. BIAapplications Handbook, версия АВ (переиздана в 1998 году), BIACORE®, кодовый №BR-1001-86; BIAtechnology Handbook, версия АВ (переиздана в 1998 г.), BIACORE®, кодовый № BR-1001-84. Для исследований связывания на основе SPR требуется, чтобы один участник из пары связывания был иммобилизирован на поверхности сенсора. Иммобилизированный партнер связывания называется лиганд. Партнер связывания в растворе называется аналит. В некоторых случаях лиганд прикреплен к поверхности опосредованно через связывание с другой иммобилизированной молекулой, которую называют молекулой захвата. SPR-ответ отражает изменение массовой концентрации на поверхности детектора по мере того, как происходит связывание или диссоциация аналитов.
[705] Работающие на принципе SPR измерения BIACORE® в реальном времени отслеживают взаимодействия, непосредственно когда они происходят. Методика хорошо подходит для определения кинетических параметров. Легко осуществлять ранжирование сравнительной аффинности, и из данных сенсограмм можно получать как кинетические константы, так и константы аффинности.
[706] Если аналит инъецируют в виде дискретного импульса над поверхностью с лигандом, полученную сенсограмму можно разделить на три главные фазы: (i) ассоциация аналита с лигандом во время инъекции образца; (ii) равновесие или стационарное состояние во время инъекции образца, при котором скорость связывания аналита уравновешена диссоциацией из комплекса; (iii) диссоциация аналита с поверхности во время протекания буфера.
[707] Фазы ассоциации и диссоциации предоставляют информацию о кинетике взаимодействия аналит-лиганд (ka и kd, скорости образования комплекса и диссоциации, kd/ka=KD). Фаза равновесия предоставляет информацию об аффинности взаимодействия аналит-лиганд (KD).
[708] Программное обеспечение BIAevaluation предоставляет обширные возможности для построения кривых при помощи как численного интегрирования, так и алгоритмов глобального подбора. С помощью соответствующего анализа данных отдельные константы скорости и аффинности для взаимодействия можно получить на основании простых исследований с помощью BIACORE®. Значения аффинности, которые могут быть измерены с помощью этой методики, находятся в очень широком диапазоне, варьируя от мМ до пМ.
[709] Другой пример такого способа включает измерение равновесной константы диссоциации "KD" с применением анализа кинетического исключения, который можно выполнять, например, с применением устройства KinExa (Sapidyne Instruments). Вкратце, жидкофазную равновесную константу диссоциации Kо антител к IL33 можно определять путем предварительного смешивания варьирующих концентраций антитела с IL-33 до достижения равновесия. Количество свободного антитела затем измеряют с применением KinExa путем захвата свободного антитела с применением покрытых IL-33 гранул, смывания несвязанного материала и обнаружения связанного антитела с применением флуоресцентно меченного видоспецифического антитела. Количество свободного антитела, обнаруженного при каждой концентрации IL-33, наносят на график в зависимости от концентрации IL-33 и программное обеспечение KinExa применяют для подсчета равновесной константы диссоциации (KD).
[710] Способы и реагенты, подходящие для определения характеристик связывания данного выделенного антитела или его антигенсвязывающего фрагмента или его измененного/мутантного производного (обсуждается ниже), известны из уровня техники и/или коммерчески доступны. Оборудование и программное обеспечение, разработанные для таких кинетических анализов, являются коммерчески доступными (например, BIAcore, программное обеспечение BIAevaluation, GE Healthcare; программное обеспечение KinExa, Sapidyne Instruments).
[711] Специфичность в отношении эпитопа является важной характеристикой моноклонального антитела. Картирование эпитопов с помощью BIACORE®, в отличие от традиционных методик с применением радиоиммунологического анализа, ELISA или других способов на основе адсорбции на поверхности, не требует мечения или очищения антител и позволяет осуществлять тесты на специфичность в отношении нескольких сайтов с применением последовательности нескольких моноклональных антител. Дополнительно, большое число анализов можно проводить автоматически.
[712] В парных экспериментах по связыванию тестируется способность двух mAb к одновременному связыванию с одним и тем же антигеном. mAb, направленные против отдельных эпитопов, будут связываться независимо, тогда как mAb, направленные против идентичных или близкородственных эпитопов, будут мешать друг другу связываться. Эти эксперименты по связыванию, осуществляемые с помощью BIACORE®, не вызывают затруднений при проведении.
[713] Например, можно применять молекулу захвата для связывания первого mAb, a затем последовательное добавление антигена и второго mAb. На сенсограммах будет выявляться: (1) какое количество антигена связывается с первым mAb, (2) до какой степени второе mAb связывается с антигеном, прикрепленным к поверхности, (3) если второе mAb не связывается, изменяет ли результаты парного теста изменение порядка проведения на обратный.
[714] Пептидное ингибирование представляет собой другую методику, применяемую для картирования эпитопов. Этот способ может дополнять парные исследования связывания антител и может соотносить функциональные эпитопы со структурными признаками, когда известна первичная последовательность антигена. Пептиды или фрагменты антигена тестируют в отношении ингибирования связывания различных mAb с иммобилизованным антигеном. Полагают, что пептиды, мешающие связыванию данного mAb, являются родственными по структуре с эпитопом, определяемым этим mAb.
[715] При осуществлении настоящего раскрытия на практике будут использоваться, если не указано иное, традиционные методики клеточной биологии, культивирования клеток, молекулярной биологии, биологии трансгенных организмов, микробиологии, рекомбинантных ДНК и иммунологии, которые находятся в пределах компетентности специалиста в данной области. Такие методики в полном объеме объясняются в литературе.
[716].
[717] Все цитируемые в данном документе ссылки включены в данный документ посредством ссылки во всей своей полноте.
[718] Следующие примеры предлагаются в качестве иллюстрации, но не в качестве ограничения.
ОПИСАНИЕ ФИГУР
[719] Фигура 1. Показан HTRF-анализ в отношении связывания IL33-ST2 человека в присутствии препаратов неочищенной периплазмы с scFv. Лунка, содержащая антитело IL330004, выделена.
[720] Фигура 2. Показана нейтрализация IL33 человека и макака-крабоеда с помощью препаратов очищенных scFv в HTRF-анализе с IL33-ST2.
[721] Фигура 3. Показана нейтрализация IL33 человека и макака-крабоеда с помощью препаратов очищенных IgG в HTRF-анализе с IL33-ST2.
[722] Фигура 4. Показана нейтрализация IL33 человека с помощью препаратов очищенных IgG в анализе передачи сигнала с участием NFkB.
[723] Фигура 5 Показано обнаружение эндогенного IL-33 в клетках гладкой мускулатуры бронхов с помощью иммунофлуоресцентного окрашивания с помощью антитела к IL-33, IL330004 (правая панель), в сравнении с отрицательным контролем, CAT-002 (левая панель).
[724] Фигура 6. Показаны данные по связыванию на основании одного планшета, подвергнутого скринингу в отношении IL-33 человека, IL-33 макака-крабоеда и инсулина.
Одно специфическое связывающее вещество с перекрестной реактивностью в отношении IL-33 человека/макака-крабоеда показано в лунке С4, а в лунках А12 и В12 содержится контрольный клон связывания IL-33.
[725] Фигура 7А. Показана нейтрализующая активность антител в анализе пролиферации TF-1.
[726] Фигура 7В. Показана нейтрализующая активность антител в анализе выработки IL-6 в HUVEC.
[727] Фигура 8. Показана нейтрализующая активность антител в анализе выработки цитокинов в мастоцитах.
[728] Фигура 9. Показано связывание антитела к IL-33 (IL330065, IL330101, IL330107 и IL330149) с полноразмерным IL-33 человека с помощью вестерн-блоттинга.
[729] Фигура 10. Показана нейтрализующая активность антител к IL-33, IL330065 и IL330101, в отношении выработки IL-6 и IL-13 в мастоцитах, стимулируемой лизатами клеток с полноразмерным IL-33.
[730] Фигура 11А. показан HTRF®-анализ конкурентного связывания рецептор-лиганд в присутствии антител IL330065, IL330099, IL330101, IL330107, IL33149 и IL330180.
[731] Фигура 11В. Показан анализ транслокации (p65/RelA) NFkB в Huvec в присутствии антител IL330065, IL330099, IL330101, IL330107 и IL330149.
[732] Фигура 12А. Показано конкурентное связывание препаратов очищенных scFv и mAb IL330101 при связывании с биотинилированным IL-33 человека.
[733] Фигура 12В. Показано конкурентное связывание препаратов очищенных scFv и mAb IL330180 при связывании с биотинилированным IL-33 человека.
[734] Фигура 13. Показано конкурентное связывание scFv IL330259 и mAb IL330101 при связывании с биотинилированным IL-33 человека.
[735] Фигура 14А. Показано конкурентное связывание IgG IL330259 и mAb IL330101 при связывании с биотинилированным IL-33 человека.
[736] Фигура 14В. Показано конкурентное связывание антител и mAb H338L293 при связывании с биотинилированным IL-33 человека.
[737] Фигура 15. Показана нейтрализующая активность антител в анализах выработки IL-6 в HUVEC или мастоцитах.
[738] Фигура 16. Показан анализ Шилда IL330388 и H338L293 при анализе выработки IL-6 в мастоцитах.
[739] Фигура 17. Показана активность IL-33 человека, биотинилированного по цистеину IL-33 или IL-33, предварительно обработанного средой для культивирования клеток, измеренная в анализах передачи сигнала (30 минут) и анализе выработки IL-6 (18-24 часов) в HUVEC.
[740] Фигура 18. Показан SDS-PAGE IL-33 человека, биотинилированной молекулы человека или мыши в восстанавливающих или невосстанавливающих условиях, перед или после обработки с помощью среды Дульбекко, модифицированной Исковым (IMDM).
[741] Фигура 19. Показана очистка IL-33 человека, обработанного средой для культивирования клеток, с помощью SEC.
[742] Фигура 20. Показана масса исходного вещества IL-33, обработанного PBS в сравнении со средой, как определено с помощью LC-MS. У IL-33, обработанного IMDM, показана потеря 4 Да в сравнении с молекулой, обработанной PBS, что соответствует образованию двух дисульфидных связей.
[743] Фигура 21. Показано картирование дисульфидных связей в IL-33 человека, обработанном средой. Данные согласовывались с образованием двух дисульфидных мостиков.
[744] Фигура 22А. Показан анализ с помощью SDS-PAGE высококонцентрированных redIL-33 и DSB IL-33 для ЯМР-анализа
[745] Фигура 22В. Показан ЯМР-анализ гетероядерной многоквантовой когерентности (HMQC) с перекрыванием HMQC-спектров1H-15N у15N-меченного IL-33 человека в случае redIL-33 и DSB IL-33.
[746] Фигура 22С. Показан круговой дихроизм (CD) в близком УФ-диапазоне.
[747] Фигура 22D. Показаны ключевые признаки IL-33 (Trp193, остатки цистеина и сайт связывания ST2), указанные в пределах известной структуры IL-33.
[748] Фигура 22Е. Показан круговой дихроизм (CD) в дальнем УФ-спектре.
[749] Фигура 23. Показан анализ водородно-дейтериевого обмена у redIL-33 и DSB IL-33. Отличия во включении дейтерия картированы на опубликованной структуре IL-33.
[750] Фигура 24. Показано связывание redIL-33 или DSB IL-33 с ST2.
[751] Фигура 25. Показано исследование трех коммерческих ELISA-анализов в отношении IL-33 для обнаружения форм redIL-33 и DSB IL-33.
[752] Фигура 26. Показаны ELISA-анализы, которые являются специфическими в отношении обнаружения redIL-33.
[753] Фигура 27. Показана зависимость от времени сигнала IL-33 человека при инкубации в среде для культивирования клеток (IMDM) или сыворотке крови человека. Формы redIL-33 или DSB IL-33 измеряли с помощью ELISA или вестерн-блоттинга.
[754] Фигура 28. Показан анализ BALF от гуманизированных мышей с IL-33, собранной в различные моменты времени после интраназальной провокационной пробы с помощью Alternaria, с применением комбинации из нескольких ELISA-анализов. Анализы (А) от Millipore, (В) от R&D system и (С) с применением IL330425/sST2-биотин применяли для измерения IL-33 в присутствии или в отсутствие sST2 (графики слева). Сигналы в присутствии sST2 (сигнал от восстановленной фракции IL-33 исключали) сравнивали со стандартным IL-33 с дисульфидными связями для количественной оценки уровней IL-33 с дисульфидными связями. Сигнал восстановленного IL-33 рассчитывали как разницу сигнала между измерениями IL-33 в присутствии и в отсутствие ST2 при количественной оценке в сравнении со стандартным восстановленным IL-33. Оценки для восстановленного IL-33 показаны на графиках справа.
[755] Фигура 29. Показан анализ BALF от мышей BALB/c дикого типа, собранной в различные моменты времени после интраназальной провокационной пробы с помощью Alternaria. ELISA в отношении IL-33 мыши (R&D systems) применяли для измерения IL-33 в присутствии или в отсутствие sST2 (IL-33 мыши, обработанный средой, применяли в качестве стандартной кривой). Сигналы в присутствии sST2 (сигнал от восстановленной фракции IL-33 исключали) сравнивали со стандартным IL-33 мыши, обработанным средой, для количественной оценки уровней окисленного IL-33. Сигнал восстановленного IL-33 рассчитывали как разницу сигнала между измерениями IL-33 в присутствии и в отсутствие ST2 при количественной оценке в сравнении со стандартным восстановленным IL-33 мыши.
[756] Фигура 30А. Показаны относительные единицы флуоресценции через 100 минут инкубации 5 мкМ антитела с 20 мкМ IL33 при 25°С в присутствии 8х оранжевого красителя SYPRO. В присутствии H338L293 к IL-33, но не IL330004 или контрольного mAb, повышенный сигнал флуоресценции указывает на разворачивание белка.
[757] Фигура 30В. Показаны относительные единицы флуоресценции в динамике по времени после инкубации различных концентраций H338L293 с 20 мкМ IL33 при 25°С в присутствии 8х оранжевого красителя SYPRO. Сигнал флуоресценции повышался с повышением концентрации антитела.
[758] Фигура 30С. Показан анализ IL-33 с помощью SDS-PAGE. В случае предварительной инкубации IL-33 с H338L293, но не с контрольным mAb или без mAb, повышалось присутствие более быстро движущейся формы IL-33 с дисульфидными связями в невосстанавливающих условиях.
[759] Фигура 31. Показана зависимость от времени нейтрализации передачи сигнала с участием NFkB, простимулированной IL-33, с помощью mAb H338L293 в HLJVEC.
[760] Фигура 32. Показано ингибирование сигнала FRET, образуемого при связывании IL-33 человека и ST2 человека, с помощью возрастающих концентраций H338L293 в условиях прямой конкуренции или после предварительной инкубации с IL-33.
[761] Фигура 33. Показано картирование эпитопов для H338L293. На верхней панели показан SEC-анализ комплексов IL33:IgG с H338L293 перед и после расщепления трипсином. На нижней панели показан усеченный пептид, который, как было определено, сильно связывается с H338L293, закрашенным черным в пределах структуры IL-33, описанной у Lingel et al 2009.
[762] Фигура 34. Показана активность передачи сигнала с участием NFkB у IL-33 (IL33-01) дикого типа и мутантов IL-33 с заменой цистеина на серии перед и после обработки в течение 18 часов с помощью среды для культивирования клеток, IMDM.
[763] Фигура 35. Показано, что IL33-11 характеризуется большей эффективностью, чем IL33-01 (WT) in vitro и in vivo.
[764] Фигура 36. Показано перекрывание HMQC-спектров1H-15N для 0,1 мМ IL33-01 и IL33-11, меченных15N, нанесенных на график красным и черным цветами соответственно.
Указано расположение значимых остатков. Данные указывают на сдвиги пиков вокруг С208 и С259, как и ожидалось. Однако наблюдается большее число сдвигов пиков, чем ожидалось, от Т185 до А196, что может указывать на изменение конформации.
[765] Фигура 37. Показана зависимость от времени нейтрализующей активности scFv 33v20064 в отношении IL-33 в HTRF-анализе связывания IL33-ST2.
[766] Фигура 38. Показана зависимость от времени нейтрализующей активности IgG 33v20064 в отношении IL-33 в HTRF-анализе связывания IL33-ST2.
[767] Фигура 39. Показана нейтрализация с помощью антитела выработки IL-6 в HUVEC, простимулированных с помощью IL-33 дикого типа или мутантного IL-33.
[768] Фигура 40. Показано ингибирование сигнала FRET, образуемого при связывании биотинилированного IL-33-01 человека с 33v20064, меченного DyLight, с помощью возрастающих концентраций тестируемых белков. Ингибирование сигнала соответствует относительной аффинности связывания 33v20064 с тестируемым белком.
[769] Фигура 41. Показана зависимость от времени нейтрализующей активности scFv варианта зародышевого типа 33_640001 в сравнении с исходным 33v20064 в отношении IL-33 в HTRF-анализе связывания IL33-ST2.
[770] Фигура 42. Показана нейтрализация с помощью антитела выработки IL-8 в HUVEC, простимулированных с помощью усеченного (112-270) или полноразмерного (1-270) IL-33.
[771] Фигура 43. Показано влияние белков, связывающих IL-33, на преобразование redIL-33BDSBIL-33.
[772] Фигура 44. Показано ингибирование сигнала FRET, образуемого при связывании биотинилированного IL-33 человека или макака-крабоеда с mAb 33_640117, с помощью возрастающих концентраций тестируемых белков в различные моменты времени.
Ингибирование сигнала соответствует относительной аффинности связывания 33v20064 с тестируемым белком.
[773] Фигура 45. Показана нейтрализация с помощью антитела выработки IL-8 в HUVEC, простимулированных с помощью усеченного (112-270) или полноразмерного (1-270) IL-33.
[774] Фигура 46. Показано, что H338L293 дозозависимо ингибирует индуцируемую введением Alternaria (ALT) выработку IL-5 в BAL и эозинофилию у мышей BALB/c дикого типа. Тестируемые вещества дозировали интраназально (10, 30 или 100 мг/кг, как указано в скобках) в момент - 2 часа до провокационной пробы с помощью 25 мкг ALT.
BALF собирали через 24 часа после провокационной пробы с помощью ALT и анализировали на присутствие IL-5 (фигура 46А) и эозинофилов (фигура 46В). Значимый эффект тестируемых веществ определяли с применением однофакторного ANOVA с критерием множественного сравнения Бонферрони. ***р<0,001, ~~р<0,01 по сравнению с контрольным mAb (n=4-8). В качестве положительного контроля применяли ловушку для IL-33 мыши.
[775] Фигура 47. Показано, что H338L293 (30 мг/кг) и ловушка для IL-33 мыши (10 мг/кг), но не IL330004 (30 мг/кг), ингибируют индуцированную ALT выработку IL-5 в BAL у гуманизированных мышей с IL-33. Тестируемые вещества дозировали интраназально в момент -2 часа до провокационной пробы с помощью 25 мкг ALT. BALF собирали через 24 часа после провокационной пробы с помощью ALT и анализировали на присутствие IL-5. Значимый эффект тестируемых веществ определяли с применением однофакторного ANOVA с критерием множественного сравнения Бонферрони. ***р<0,001, **р<0,01 (n=4).
[776] Фигура 48. Показано, что 33_640050 дозозависимо ингибирует индуцированную Alternaria выработку IL-5 в BAL у гуманизированных мышей с IL-33. Тестируемые вещества дозировали внутрибрюшинно (0,3, 3 или 30 мг/кг, как указано в скобках) в момент - 24 часа до провокационной пробы с помощью 25 мкг Alternaria. BALF собирали через 24 часа после провокационной пробы с помощью ALT и анализировали на присутствие IL-5. Значимый эффект тестируемых веществ определяли с применением однофакторного ANOVA с критерием множественного сравнения Бонферрони. ***р<0,001, **р<0,01 (n=4-5).
[777] Фигура 49А. Показан эффект антител в FRET-анализе связывание IL33-ST2.
[778] Фигура 49В. Показан эффект антител на стимулируемое IL-33 высвобождение IL-8 из Huvec.
[779] Фигура 50. Показана специфичность mAb в отношении IL-33 от различных видов или других представителей семейства IL-1 с применением FRET-анализа на основании (А) IL33/33_640087-7B или (В) 33_640237-2В.
[780] Фигура 51. Показан эффект антител на высвобождение IL-8 из Huvec, простимулированных с помощью лизата из легких человека.
[781] Фигура 52. Показано, что 33_640087-7В дозозависимо ингибирует индуцированную Alternaria выработку IL-5 в BAL у гуманизированных мышей с IL-33.
[782] Фигура 53А. План эксперимента пилотного исследования in vivo для изучения потенциала активности IL-33, независимой от ST2.
[783] Фигура 53В. Анализ воздействия IL-33 человека в жидкости BAL после повторных введений IL-33 человека мышам BALB/c.
[784] Фигура 53С. Анализ воздействия IL-33 в плазме крови после однократного внутрибрюшинного введения IL-33 человека (10 мкг).
[785] Фигура 53D. Анализ воздействия IL-33 в плазме крови после повторных введений IL-33 человека мышам BALB/c.
[786] Фигура 54. Показаны типичные окрашенные Н&Е парафиновые срезы легочной ткани от мышей, которым вводили (A) PBS или (В) IL-33 интраназально в течение 6 недель.
[787] Фигура 55. Показана активность ядерной транслокации (А) р-р38 МАРК или (В) p-STAT5 в Huvec в ответ на восстановленный IL-33 или DSB IL-33.
[788] Фигура 55С. Вестерн-блоттинг анализ в отношении р-р38 МАРК, p-JAK2 и р-STAT5 в Huvec, простимулированных в течение 15 минут с помощью восстановленного IL-33 или DSB IL-33.
[789] Фигура 56А. Показано связывание RAGE-Fc с восстановленным или DSB IL-33 при ELISA.
[790] Фигура 56В. Показано ингибирование ответа с pSTAT5 на DSB IL-33 в Huvec с помощью RAGE-Fc или mAb к RAGE.
[791] Фигура 56С. Показано ингибирование ответа с pSTAT5 на DSB IL-33 в Huvec с помощью mAb к RAGE.
[792] Фигура 57. Показан эффект антитела к IL-33 в сравнении с антителом к ST2 на ответ с pSTAT5 в Huvec.
[793] Фигура 58. Показан эффект mAb к IL-33, mAb к ST2 или mAb к RAGE на индуцированное IL-33 ингибирование миграции клеток А549 в сравнении с (А) восстановленным IL-33 и (В) DSB IL-33.
Краткое описание последовательностей













ПРИМЕРЫ
Пример 1. Выделение антител к IL-33
Клонирование, экспрессия и очистка зрелого IL-33 от человека, мыши и макака-крабоеда
[794] Белковые последовательности IL-1RAcP и ST2 получали из Swiss Prot. Для выделения и идентификации scFv-антител к IL-33 молекулы кДНК, кодирующие зрелый компонент IL-33, синтезировали с помощью ПЦР с удлинением праймера и клонировали в pJexpress404 (DNA 2.0). Номера доступа, соответствующие информации о последовательности в базе данных для IL-33 человека и мыши показаны в таблице 2. Поскольку последовательности от макака-крабоеда были недоступны, то, исходя из высокой гомологии между макаком-крабоедом и макаком-резусом, последовательность от макака-резуса (№ доступа ENSMMUT00000030043) применяли для разработки праймеров, эффективных для амплификации кодирующей последовательности гена IL-33 у макака-крабоеда. Последовательность гена макака-резуса выравнивали с последовательностью кДНК IL-33 человека (№ доступа NM_033439), это продемонстрировало, что последовательность от макака-резуса была неправильно собрана и был пропущен экзон 1. Был проведен поиск BLAST в последовательности генома макака-резуса с применением экзона 1 человека, и был идентифицирован совпадающий экзон 1 из последовательности макака-резуса. Для амплификации экзона 1 разрабатывали дополнительные праймеры.
[795] Последовательность, кодирующую зрелый IL-33, модифицировали таким образом, чтобы она содержала эпитопную метку FLAG®-10xhis (DYKDDDDKAAHHHHHHHHHH; SEQ ID NO. 627) на С-конце белка. SEQ ID NO, соответствующие зрелым IL-33 человека, макака-крабоеда и мыши с меткой Flag®-His, показаны в таблице 2.

[796] Векторы трансформировали в компетентные клетки BL21 (DE3) (Merck Biosciences, 69450) и экспрессию индуцировали с помощью 1 мМ IPTG. Собранные клетки лизировали с помощью Bugbuster (Merck Biosciences, 70584) и экспрессированный белок очищали с применением аффинной хроматографии с Ni-NTA (колонка Histrap HP: GE Healthcare, 17-5248-02) с последующей эксклюзионной хроматографией (колонка Superdex 75: GE Healthcare, 17-1068-01).
Модификации белков
[797] IgG и модифицированные рецепторные белки, применяемые в данном документе, подвергали биотинилированию через свободные амины с применением сульфо-NHS-LC-биотина EZ-link (Thermo/Pierce, 21335). Биотиновый реагент растворяли в безводном диметилформамиде, а растворы белков на основе PBS доводили до рН ~8 с помощью 1 М NaHCO3 в D-PBS (фосфатно-солевой буфер Дульбекко). Белки IL-33, применяемые в данном документе, биотинилировали через свободные остатки цистеина с применением биотина-ВМСС EZ-link (Perbio/Pierce, № продукта 21900). Биотиновый реагент растворяли в безводном диметилформамиде и смешивали с растворами белка в PBS. Включение метки во всех случаях оценивали с помощью масс-спектрометрии MALDI-TOF и непрореагировавшие реагенты очищали с помощью замены буфера с применением одноразовых колонок Sephadex G25, уравновешенных PBS. Для биотинилирования конечные концентрации белков определяли по поглощению при 280 нм с применением коэффициентов экстинкции, рассчитанных на основании аминокислотных последовательностей.
Отборы
[798] Для отборов применяли большую библиотеку одноцепочечных Fv (scFv) антител человека, основанную на генах вариабельной (V) области, выделенных из В-клеток человека от взрослых не подвергавшихся воздействию доноров и клонированных в фагмидный вектор на основе нитевидного фага М13 (Hutchings, С., "Generation of


[799] Вкратце, фаговые частицы с scFv инкубировали с биотинилированным рекомбинантным IL-33 в растворе (биотинилированным через свободные остатки цистеина с применением биотина-ВМСС EZ-link (Perbio/Pierce, № продукта 21900)). Частицы инкубировали с 100 нМ биотинилированного рекомбинантного IL-33 в течение 2 часов. Затем ScFv, связанные с антигеном, захватывали на покрытых стрептавидином парамагнитных гранулах (Dynabeads®, M-280), следуя рекомендациям производителя. Несвязанные фаги отмывали посредством серии циклов отмывки с применением PBS-Tween. Удерживаемые на антигене фаговые частицы элюировали, инфицировали ими бактерий и высвобождали для следующего раунда отбора. Как правило, таким образом осуществляли два или три раунда отбора.
Идентификация специфических в отношении IL-33 связывающих веществ в ELISA с применением фагов
[800] Репрезентативное количество индивидуальных клонов из числа результатов отбора после двух или трех раундов отбора, описанных выше, выращивали в 96-луночных планшетах. Одноцепочечные Fv-фрагменты подвергали дисплею на фаговых частицах и тестировали в анализе связывания для определения перекрестной реактивности и специфичности на панели из рекомбинантных антигенов IL-33 человека, мыши и макака-крабоеда. Образцы супернатантов с scFv, подвергнутыми фаговому дисплею, получали в 96-луночных планшетах с глубокими лунками следующим образом. 5 мкл культуры из каждой лунки 96-луночного основного планшета переносили в культуральный планшет Greiner с глубокими лунками, содержащий 500 мкл среды 2TYAG (2TY + 100 мкг/мл ампициллина + 2% глюкозы), и инкубировали в течение 5 часов при 37°С, 280 об./мин. Затем добавляли фаг-помощник K07 М13 (разведенный до 1,5×1011 КОЕ/мл в 2TYAG) из расчета 100 мкл/лунка и планшет инкубировали при 37°С, 150 об./мин. для обеспечения инфицирования. Планшет центрифугировали при 3200 об./мин. в течение 10 минут и супернатант удаляли. Осадки из бактерий ресуспендировали в 500 мкл/лунка 2TYAK (2TY + 100 мкг/мл ампициллина + 50 мкг/мл канамицина) и планшет инкубировали на протяжении ночи при 25°С, 280 об./мин. Утром в каждую лунку добавляли по 500 мкл 6% (вес/объем) порошка обезжиренного молока в 2х PBS и планшет инкубировали в течение 1 часа при комнатной температуре. Затем планшет центрифугировали при 3200 об./мин. в течение 10 минут и блокированные супернатанты с подвергнутыми фаговому дисплею scFv применяли напрямую в экспериментах ELISA.
[801] Для определения ЕС50, как правило, очищенные IgG разводили 3-кратно в 3% (вес/объем) порошке сухого молока in PBS (PBS-M) с получением 11 точек концентрации. 96-луночные полипропиленовые планшеты Greiner (Greiner, 650201) применяли для приготовления разведении. В целом, каждое разведение готовили в двух повторностях. Разведения IgG оставляли для блокирования в PBS-M в течение 1 часа при комнатной температуре перед применением напрямую в экспериментах ELISA.
[802] Анализы связывания IL-33 представляли собой ELISA на основе планшета, проводимые по сути следующим образом. В таблице 3 выше показаны антигены, применяемые для этих экспериментов. Не все антигены применяли в каждом эксперименте, но во всех случаях тестировали антиген IL-33 человека, мыши и макака-крабоеда. Соответствующие контрольные антигены (бычий инсулин, а также IL-4Rα с FLAG®-His, при необходимости) также применяли для тестирования в отношении неспецифического связывания. Кроме бычьего инсулина все антигены были биотинилированными (см. подраздел 1.1. выше) и все получали с применением экспрессии в бактериях. Способ получения IL-4Rα с FLAG®-His, который применяли в качестве контрольного антигена, описан в WO/2010/070346.
[803] Планшеты со стрептавидином (Thermo Scientific, AB-1226) покрывали биотинилированным антигеном из расчета 0,5 мкг/мл в PBS и инкубировали на протяжении ночи при 4°С. Планшеты промывали 3х с помощью PBS и блокировали с помощью 300 мкл/лунка блокирующего буфера (PBS-M) в течение 1 часа. Планшеты промывали 1х с помощью PBS и добавляли блокированные образцы по 50 мкл/лунка на 1 час при комнатной температуре. Планшеты промывали 3х с помощью PBS-T (PBS + 1% (объем/объем) Tween-20) и добавляли реагенты для обнаружения [антитело к IgG человека, конъюгированное с HRP (Sigma, A0170) или антитело к M13-HRP (Amersham, 27-9421-01) для обнаружения IgG или scFv, подвергнутые фаговому дисплею соответственно] при разведении 1:5000 из расчета 500 мкл/лунка в PBS-M на 1 час при комнатной температуре. Планшеты промывали 3х с помощью PBS-T и проявляли с помощью ТМВ, 50 мкл/лунка (Sigma, T0440). Реакцию блокировали с помощью 50 мкл/лунка 0,1 М H2SO4 перед считыванием на планшет-ридере EnVision™ или аналогичном оборудовании при 450 нм.
[804] Кривые дозовой зависимости наносили на график для титраций IgG с применением программного обеспечения для вычерчивания кривой Prism (Graphpad). Считалось, что scFv, подвергнутые фаговому дисплею, связывают антиген IL-33, если поглощение при 450 нм составляло >0,5, а поглощение такого же образца контролей (инсулин и IL-4Rα с Flag®-His) составляло <0,2.
Клонирование, экспрессия и очистка ECD ST2 от человека и мыши
[805] Молекулы кДНК, кодирующие внеклеточные домены (ECD) ST2 от человека и мыши, синтезировали с помощью ПЦР-клонирования с удлинением праймера и клонировали в pDONR221 (Invitrogen, 12536-017). Применяли последовательности ST2 человека и мыши из базы данных (см. таблицу 4). Клоны кДНК ECD ST2 в pDONR221 переносили в векторы для экспрессии в клетках млекопитающих, pDEST12.2, с применением фермента LR Gateway Clonase II согласно инструкциям производителя. Вектор pDEST12.2 был модифицирован таким образом, чтобы он содержал кодирующую область для Fc из IgG1 человека, полигистидиновую (His6) метку внутри рамки со вставленным геном, представляющим интерес, и также путем вставки точки начала репликации oriP из вектора рСЕР4, обеспечивающей возможность эписомной репликации плазмиды после трансфекции в линии клеток, экспрессирующие продукт гена EBNA-1 (такие как клетки HEK293-EBNA).

[806] Экспрессированные ST2.Fc-белки в супернатантах от клеток HEK293-EBNA очищали с применением аффинной хроматографии с белком А (колонка HiTrap с белком А (GE Healthcare, 17-0402-01)) с последующей эксклюзионной хроматографией (колонка Superdex 200 (GE Healthcare, 17-1069-01)).
Ингибирование связывания IL-33 с ST2 под действием неочищенных scFv
[807] Репрезентативное количество индивидуальных клонов из числа результатов отбора после двух или трех раундов отбора, описанных выше, выращивали в 96-луночных планшетах. ScFv экспрессировали в периплазме бактерий (Kipriyanov, et al. J Immunol Methods 200(1-2): 69-77 (1997)) и подвергали скринингу в отношении их ингибиторной активности в анализе связывания IL-33:ST2 на основе гомогенного FRET (резонансный перенос энергии флуоресценции) HTRF® (гомогенный анализ флуоресценции с временным разрешением, Cisbio International). В данном анализе образцы конкурировали с ST2.Fc человека или мыши за связывание с IL-33 человека, макака-крабоеда или мыши с меткой FLAG®-His.
[808] HTRF®-анализ представляет собой технологию гомогенного анализа, в которой используется резонансный перенос энергии флуоресценции между донорным и акцепторным флуорофором, которые находятся в непосредственной близости (Mathis, et al., din Chem 41(9):1391-7 (1995)). Этот анализ можно применять для измерения взаимодействия макромолекул с помощью прямого или непрямого присоединения одной из молекул, представляющих интерес, к донорному флуорофору, криптату европия (Eu3+), и присоединения другой молекулы, представляющей интерес, к акцепторному флуорофору XL665 (стабильный сшитый аллофикоцианин). Возбуждение молекулы криптата (при 337 нм) приводило к испусканию флуоресценции при 620 нм. Энергия, полученная в результате этого испускания, переносилась к XL665, находящемуся в непосредственной близости от криптата, что приводило к испусканию специфической долгоживущей флуоресценции (при 665 нм) от XL665. Измеряли специфические сигналы как донора (при 620 нм), так и акцептора (при 665 нм), что обеспечило возможность расчета соотношения 665/620 нм, что вводит поправку на присутствие окрашенных соединений в анализе.
[809] Образцы неочищенных scFv к IL-33 тестировали в отношении ингибирования связывания IL-33 с меткой FLAG®-His с ST2-Fc путем добавления 10 микролитров каждого разведения тестируемого образца антитела в 384-луночный малообъемный планшет для анализа (Costar, 3676). Следующим шагом готовили раствор, содержащий 2 нМ ST2-Fc человека или мыши и 3 нМ средства для обнаружения на основе антитела к Fc человека, меченного криптатом (Cisbio International, 61HFCKLB), и 5 микролитров смеси добавляли в планшет для анализа. За этим следовало добавление 5 микролитров раствора, содержащего 1,2 нМ IL-33 человека, макака-крабоеда или мыши с меткой FLAG®-His в комбинации с 20 нМ средства для обнаружения на основе антитела к FLAG®, меченного XL665 (Cisbio International, 61FG2XLB). Все разведения осуществляли в буфере для анализа, содержащем 0,8 М фторида калия (BDH 103444T) и 0,1% бычьего сывороточного альбумина (BSA, Sigma A9576) в PBS Дульбекко (Invitrogen, 14190185). Планшеты для анализа инкубировали в течение 1 часа при комнатной температуре, а затем 16 часов при 4°С перед считыванием флуоресценции с временным разрешением при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer).
[810] Данные анализировали путем расчета соотношения 665/620 нм, а затем значений % дельта F для каждого образца. Соотношение 665/620 нм применяли для введения поправки на интерференцию в образце с применением уравнения 1:

Затем для каждого образца рассчитывали % дельта F с применением уравнения 2:

[811] Отрицательный контроль (неспецифическое связывание) определяли путем замещения тестируемого образца на 150 нМ раствора IL-33 человека или мыши без метки (Axxora, ALX522-098 человека, ALX-522-101 мыши), приготовленного в буфере для разведения, состоящем из PBS Дульбекко (Invitrogen, 14190185), содержащего 0,1% бычьего сывороточного альбумина (BSA, Sigma A9576).
[812] Значения % дельта F затем использовали для расчета % специфического связывания, как описано в уравнении 3:

[813] Значения IC50 определяли с применением программного обеспечения GraphPad Prism путем вычерчивания кривой с применением четырехпараметрического логистического уравнения (уравнение 4).
Уравнение 4:

Y представляет собой специфическое связывание.
Y начинается на нижнем значении и идет к верхнему значению в форме сигмоидальной кривой.
[814] На фигуре 1 показано ингибирование сигнала FRET, образуемого при связывании IL-33 человека с ST2 человека, с помощью неочищенных экстрактов периплазмы с scFv при скрининге в один момент времени. Конечная концентрация экстракта периплазмы составляла 50% объем/объем. Лунка В04 (неочищенные scFv IL330004) показывает пример 'хита', а колонка 12 содержит контрольные лунки, как указано.
Ингибирование связывания IL-33 с ST2 под действием очищенных scFv
[815] Клоны одноцепочечных Fv, которые показали ингибиторный эффект в отношении взаимодействия IL-33: ST2 в качестве неочищенных экстрактов периплазмы или продемонстрировали требуемый профиль перекрестной реактивности в отношении требуемых видов и профиль специфичности с помощью экспериментов связывания фагов выше, подвергали секвенированию ДНК (Osbourn, et al. Immunotechnology 2(3): 181-96 (1996); Vaughan, et al. Nat Biotechnol 14(3):309-14 (1996)). Уникальные scFv снова экспрессировали в бактериях и очищали с помощью аффинной хроматографии (как описано в WO 01/66754). Эффективности этих образцов определяли путем конкурентного анализа серии разведении очищенного препарата в сравнении с ST2.Fc человека или мыши в отношении связывания с IL-33 человека, макака-крабоеда или мыши с меткой FLAG®-His, как описано выше. Препараты очищенных scFv, которые были способны ингибировать взаимодействие IL-33:ST2 в большей степени, чем отрицательный контроль, отбирали для преобразования в формат IgG (например, scFv-антитела IL330002, IL330004, IL330020 и IL330071).
[816] Фигура 2А: показано ингибирование сигнала FRET, образуемого при связывании IL-33 человека с ST2 человека, с помощью возрастающих концентраций scFv-антител к IL-33, IL330002, IL330004, IL330020 и IL330071, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[817] Фигура 2В: показано ингибирование сигнала FRET, образуемого при связывании IL-33 макака-крабоеда с ST2 человека, с помощью возрастающих концентраций scFv-антител к IL-33, IL330002, IL330004, IL330020 и IL330071, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
Идентификация антител-партнеров для IL330004
[818] Экстракты периплазмы с scFv тех клонов, которые продемонстрировали положительное связывание с IL-33 человека в ELISA с применением фагов, подвергали скринингу с помощью анализа Octet (система Octet RED 384) для идентификации антитела, которое связывало IL-33 одновременно с IL330004. Образцы чистых препаратов периплазмы захватывали на биосенсоре с никель-NTA и осуществляли последовательное связывание IL-33 (200 нМ), а затем IL330004 (200 нМ). Биосенсоры регенерировали для сведения к минимуму применения. Сенсоры регенерировали в глицине (10 мМ, рН 1,7), нейтрализовали в буфере (PBS + 1 мг/мл (0,1%) BSA + 0,02% Tween-20) и повторно загружали NiS04 (10 мМ) для пополнения запасов никеля на поверхности биосенсора. Были идентифицированы IL330425 и IL330428, и их преобразовывали в формат антитела в виде целого иммуноглобулина G1 (IgG1).
Переформатирование scFv в IgG1
[819] Клоны с одноцепочечными Fv, характеризующиеся требуемыми свойствами, исходя из анализов связывания IL-33:ST2, а также панель из scFv, подвергнутых фаговому дисплею, с требуемой специфичностью на основании экспериментов по связыванию преобразовывали в формат антитела в виде целого иммуноглобулина G1 (IgG1), фактически как описано в Persic et al. (Gene 187(1):9-18 (1997)) со следующими модификациями. Фрагмент OriP включали в векторы экспрессии для облегчения использования клеток СНО для временной трансфекции и для обеспечения возможности эписомной репликации. Вариабельный домен тяжелой цепи (VH) клонировали в вектор (pEU1.3), содержащий константные домены тяжелой цепи человека и регуляторные элементы для экспрессии целой тяжелой цепи IgG1 в клетках млекопитающих. Аналогично, вариабельный домен легкой цепи (VL) клонировали в вектор (pEU4.4) для экспрессии константных доменов легкой цепи (лямбда) человека, который содержал регуляторные элементы для экспрессии целой легкой цепи IgG в клетках млекопитающих. Для получения IgG векторы, экспрессирующие тяжелую и легкую цепь IgG, трансфицировали в клетки млекопитающих СНО для временной трансфекции (Daramola et al. Biotechnol Prog 30(1):132-41 (2014)). IgG экспрессировались и секретировались в среду. Собранный материал фильтровали перед очисткой, затем IgG очищали с использованием хроматографии с белком А. Супернатанты культуры загружали на колонку соответствующего размера с белком A Ceramic (BioSepra) и промывали с помощью 50 мМ Tris-HCl, рН 8,0, 250 мМ NaCl. Связанный IgG элюировали из колонки с помощью 0,1 М цитрата натрия (рН 3,0) и нейтрализовали добавлением Tris-HCl (рН 9,0). В элюированном материале осуществляли замену буфера на PBS с применением колонок Nap10 (Amersham, №17-0854-02) и концентрацию IgG определяли спектрофотометрически с применением коэффициента экстинкции на основании аминокислотной последовательности IgG (Mach et al., Anal. Biochem. 200(1):74-80 (1992)). Очищенные IgG анализировали в отношении агрегации и разрушения с применением SEC-HPLC и SDS-PAGE. SEQ ID NO, соответствующие различным областям антител IL330002, IL330004, IL330020, IL330071, IL330125 и IL330126, показаны в таблице 5.


Ингибирование связывания IL-33 с ST2 под действием очищенных IgG
[820] Способность антител к IL-33 ингибировать связывание IL-33 с меткой FLAG®-His с рецептором ST2 оценивали в биохимическом HTRF®-анализе конкурентного связывания (гомогенный анализ флуоресценции с временным разрешением, Cisbio International), принципы которого описаны выше.
[821] Активность препаратов очищенных IgG определяли путем конкурентного анализа серии разведении очищенных IgG в сравнении с биотинилированным ST2.Fc человека или мыши в отношении связывания с IL-33 человека, макака-крабоеда или мыши с меткой FLAG®-His.
[822] Образцы очищенных или неочищенных антител к IL-33 тестировали в отношении ингибирования связывания IL-33 с меткой FLAG®-His с ST2-Fc путем добавления 10 микролитров каждого разведения тестируемого образца антитела в 384-луночный малообъемный планшет для анализа (Costar, 3676). Следующим шагом готовили раствор, содержащий 4 нМ ST2-Fc человека или мыши и 20 нМ средства для обнаружения на основе стрептавидина, меченного XL665 (Cisbio International, 611SAXLB), и 5 микролитров смеси добавляли в планшет для анализа. За этим следовало добавление 5 микролитров раствора, содержащего 1,2 нМ IL-33 человека, макака-крабоеда или мыши с меткой FLAG®-His в комбинации с 1,72 нМ средства для обнаружения на основе антитела к FLAG®, меченного криптатом (Cisbio International, 61FG2KLB). Все разведения осуществляли в буфере для анализа, состоящем из PBS Дульбекко (Invitrogen, 14190185), содержащего 0,8 М фторида калия (BDH 103444T) и 0,1% BSA (Sigma A9576). Планшеты для анализа инкубировали в течение 2 часов при комнатной температуре, а затем 16 часов при 4°С перед считыванием флуоресценции с временным разрешением при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer).
[823] Данные анализировали, как описано выше, с применением уравнений 1-3.
[824] Отрицательный контроль (неспецифическое связывание) определяли путем замещения тестируемого образца на 100 нМ раствора небиотинилированного ST2, приготовленного в буфере для разведения, состоящем из PBS Дульбекко (Invitrogen, 14190185), содержащего 0,1% бычьего сывороточного альбумина (BSA, Sigma A9576).
[825] Репрезентативные значения эффективности (IC50) очищенных IgG-антител IL330002, IL330004, IL330020, IL330071, IL330125 и IL330126 показаны в таблице 6.

[826] Было показано, что все препараты очищенных IgG (т.е. IL330002, IL330004, IL330020, IL330071, IL330125 и IL330126) ингибируют взаимодействие IL-33 человека: ST2 человека. Фигура 3А: показано ингибирование сигнала FRET, образуемого при связывании IL-33 человека с ST2 человека, с помощью возрастающих концентраций IgG1-антител к IL-33, IL330002, IL330004, IL330020, IL330071, IL330125 и IL330126, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[827] Также было показано, что препараты IgG, IL330002, IL330004 и IL330071, ингибируют взаимодействие IL-33 макака-крабоеда: ST2 человека. Фигура 3В: показано ингибирование сигнала FRET, образуемого при связывании IL-33 макака-крабоеда с ST2 человека, с помощью возрастающих концентраций IgG1-антител к IL-33, IL330002, IL330004, IL330020 и IL330071, IL330125 и IL330126, где ось х представляет собой концентрацию антитела в виде молярной концентрации, а ось у представляет собой процент специфического связывания. Ингибирование не было обнаружено в случае анализа конкурентного связывания IL-33 мыши с FLAG®-His + ST2-Fc мыши под действием любого из тестируемых антител выше.
Ингибирование передачи сигнала с участием NFκB в репортерных клетках Hela-ST2 под действием IgG
[828] Анализ на основании репортера применяли для оценки ингибирования передачи сигнала с участием NFκB, индуцированной IL-33, под действием антител к IL-33, IL330002, IL330004, IL330020, IL330071, IL330125 и IL330126, с применением клеток Hela, которые трансфицировали совместно с помощью ST2 и конструкции с люциферазным репортером, реагирующим на NFκB. Клетки подвергали воздействию IL-33 в присутствии или в отсутствие тестируемого антитела, и передачу сигнала с участием NFκB обнаруживали путем измерения активности люциферазы, образуемой впоследствии. Клетки Hela, содержащие конструкцию с люциферазным репортером, были получены от Panomics. Последовательность ST2 человека клонировали в лентивирусный вектор от System Biosciences. Лентивирусные частицы получали в клетках Ad293 (Stratagene) и применяли для трансдукции клеток Hela с люциферазным репортером.
[829] В анализе на основании репортера стимуляция рецептора ST2 с помощью IL-33 приводила к активации пути передачи сигнала с участием NFκB и при посредстве промотора NFκB запускала экспрессию фермента люциферазы. После лизиса клеток добавляли субстрат для люциферазы, который подвергается химической реакции в присутствии люциферазы с образованием люминесцирующего продукта. Количество света, обнаруживаемого в лизате клеток, оценивали количественно с применением планшет-ридера Envision (PerkinElmer) и применяли в качестве прямого показателя IL-33-опосредованной передачи сигнала с участием NFκB.
[830] Трансфицированные клетки Hela поддерживали в среде, содержащей гигромицин В, для поддержания стабильной экспрессии рецептора. Клетки подвергали воздействию IL-33 в присутствии или в отсутствие тестируемого антитела, и передачу сигнала с участием NFκB обнаруживали путем измерения активности люциферазы, образуемой впоследствии.
[831] Трансфицированные клетки Hela высевали из расчета 1×104 клеток/лунка (50 микролитров на лунку) в среду для культивирования DMEM (Invitrogen, 41966), содержащую 10% объем/объем фетальной бычьей сыворотки (термоинактивированной) и 100 микрограммов на мл гигромицина В (Invitrogen 10687-010), в 384-луночные планшеты с черными стенками, покрытые поли-D-лизином (Greiner, 781946). Планшеты инкубировали при 37 градусах Цельсия, 5% СО2 в течение 18-24 часов и затем культуральную среду аккуратно отсасывали из лунок перед добавлением тестируемых образцов.
[832] Серийные разведения образцов готовили путем разведения в среде для культивирования DMEM (Invitrogen 41966), содержащей 10% объем/объем FBS (термоинактивированной) и 100 микрограммов на мл гигромицина В (Invitrogen, 10687-010). По пятнадцать микролитров тестируемого образца добавляли к клеткам в двух повторностях. IL-33 с FLAG®-His разводили до 0,6 нМ в среде для культивирования DMEM (Invitrogen, 41966), содержащей 10% объем/объем FBS (термоинактивированной) и 100 микрограммов на мл гигромицина В (Invitrogen 10687-010), и 15 микролитров добавляли к клеткам и тестируемым образцам. Эта концентрация представляла значение ЕС50 ответа клеток с репортером на IL-33 с FLAG®-His (геометрическое среднее 0,32 нМ, 95% доверительный интервал 0,25-0,40 нМ, n=5). Фоновый ответ определяли путем добавления 30 микролитров среды для культивирования DMEM (Invitrogen, 41966), содержащей 10% объем/объем FBS (термоинактивированной) и 100 микрограммов на мл гигромицина В (Invitrogen, 10687-010). Планшеты инкубировали при 37 градусах Цельсия, 5% CO2 в течение 4 часов и при комнатной температуре в течение 1 часа.
[833] Для измерения выработки люциферазы в ответ на передачу сигнала с участием NFκB 30 микролитров буфера для лизиса Bright Glo® в комбинации с субстратом для люциферазы (Promega, E2620) добавляли в планшет и инкубировали при комнатной температуре в течение 5 минут. Люминесценцию, которая является результатом окисления субстрата люциферазой, считывали с применением планшет-ридера EnVision (PerkinElmer).
[834] Значения относительных световых единиц (RLU) затем использовали для расчета % специфического ответа, как описано в уравнении 5:

[835] Значения IC50 определяли с применением программного обеспечения GraphPad Prism путем вычерчивания кривой с применением четырехпараметрического логистического уравнения (уравнение 4).
[836] Было показано, что препараты очищенных IgG-антител, IL330002, IL330004, IL330020, IL330071, IL330125 и IL330126, ингибируют управляемую NFκB люциферазную активность с репрезентативными значениями эффективности (IC50), показанными в таблице 7.

[837] На фигуре 4А показано ингибирование активности NFκB в анализе на основании люциферазного-NFκB репортера под действием антител к IL-33, IL330002, IL330004, IL330020, IL330071, IL330125 и IL330126, в сравнении с IgG отрицательного контроля.
Ингибирование передачи сигнала с участием NFκB в Huvec под действием IgG
[838] Передачу сигнала с участием NFκB в эндотелиальных клетках пупочной вены человека (Huvec) в ответ на IL-33 оценивали по ядерной транслокации субъединицы p65/RelA NFκB, обнаруживаемой с помощью иммунофлуоресцентного окрашивания. Визуализацию и количественную оценку интенсивности окрашивания ядер осуществляли на ридере ArrayScan VTi HCS (Cellomics).
[839] Huvec получали от Cambrex и поддерживали в полной среде ЕВМ-2 (Lonza) в соответствии с рекомендованным протоколом. Huvec собирали из колб с помощью аккутазы (РАА, № L11-007) и высевали из расчета 1×104/100 мкл/лунка в среду для культивирования [ЕВМ-2 (Lonza, № СС-3156) с набором EGM-2 SingleQuot, содержащим добавки и факторы роста (Lonza, № СС-4176)], в 96-луночные планшеты с черными стенками, прозрачным плоским дном, покрытые коллагеном I (Greiner), и инкубировали при 37°С, 5% CO2 в течение 18-24 часов. По прошествии этого времени среду отсасывали, оставляя монослой клеток интактным, и заменяли на тестируемые в анализе образцы, подготовленные, как описано ниже.
[840] Тестируемые образцы очищенных IgG (в двух повторностях) разводили до требуемой концентрации в полной среде для культивирования в 96-луночных полипропиленовых планшетах с U-образным дном (Greiner, 650201). IL-33 (Adipogen) готовили в полной среде для культивирования, смешанной с соответствующим тестируемым антителом, с получением конечной концентрации IL-33, составляющей 1 нг/мл, в общем объеме 120 мкл/лунка. Все образцы инкубировали в течение 30 минут при 37°С, перед перенесением 100 мкл смеси IL-33/антитело в планшет для анализа. После 30-минутной инкубации при 37°С среду отсасывали, оставляя монослой клеток интактным, и клетки фиксировали в течение 15 минут с помощью 3,7% раствора формальдегида, который был предварительно нагрет до 37°С. Фиксатор отсасывали и клетки дважды промывали с помощью PBS из расчета 100 мкл/лунка.
[841] Клетки окрашивали в отношении NFκB с применением набора для анализа NFκB Cellomics (Thermo Scientific, №8400492) в соответствии с инструкциями производителя. Вкратце, клетки пермеабилизировали в течение 15 минут при комнатной температуре, блокировали в течение 15 минут и окрашивали в течение 1 часа с помощью раствора первичных антител в объеме 50 мкл. Планшеты промывали х 2 в блокирующем буфере и окрашивали в течение 1 часа при комнатной температуре с помощью раствора вторичных антител, который включал краситель для ядер Hoechst, а также вторичное антитело. Планшеты промывали х 2 в PBS. Клетки хранили в конченом объеме PBS из расчета 150 мкл/лунка и покрывали черной, блокирующей свет пленкой (Perkin Elmer, №6005189) до считывания на ридере ArrayScan VTi HCS. Интенсивность окраски ядер рассчитывали с применением подходящего алгоритма. Данные анализировали с применением программного обеспечения Graphpad Prism. Значения IC50 определяли путем вычерчивания кривой с применением четырехпараметрического логистического уравнения (уравнение 4).
[842] На фигуре 4В показано ингибирование активности NFκB в анализе транслокации NFκB в Huvec под действием антитела к IL-33, IL330004, в сравнении с IgG1-антителом к NIP отрицательного контроля, NIP228. Ядерная транслокация p65/RelA NFκB ингибировалась под действием антитела IL330004. При тестировании в качестве очищенного IgG рассчитали, что IC50 для антитела IL330004 составляет 12 нМ.
Расчет аффинности связывания для антитела к IL-33 с применением BIAcore
[843] Аффинность связывания образцов очищенных IgG в качестве иллюстративных партнеров по связыванию с IL-33 человека и макака-крабоеда определяли с помощью поверхностного плазменного резонанса с применением биосенсора BIAcore 2000 (BIAcore АВ), фактически как описано в Karlsson et al., J Immunol Methods 145(1-2):229-40 (1991). Вкратце, белок G' (Sigma Aldrich, P4689) ковалентно связывали на поверхности сенсорного чипа СМ5 с применением стандартных реагентов для аминного связывания в соответствии с инструкциями производителя (BIAcore). Поверхность с белком G' применяли для захвата очищенных антител к IL-33 через Fc-домен с обеспечением поверхностной плотности, составляющей примерно 290 RU на цикл. Растворы IL-33 человека или макака-крабоеда, приготовленные в буфере HBS-EP (BIAcore АВ), в диапазоне концентраций от 600 нМ до 18,75 нМ, пропускали над поверхностью сенсорного чипа. Поверхность регенерировали с применением двух промывок 10 мМ раствором глицина с рН 1,7 и рН 1,5 между каждым введением антитела. Полученные сенсограммы оценивали с применением программного обеспечения BIAevaluation 3.1 и аппроксимировали к модели связывания Ленгмюра 1:1 с получением данных по относительному связыванию. Результаты связывания (KD, Ka и Kd) для связывания антител IL330002 и IL330004 с IL-33 человека или макака-крабоеда показаны в таблице 8.


Связывание антител к IL-33 с внутриклеточным IL-33
[844] В отборе и исследованиях активности, описанных выше, применяли рекомбинантный зрелый IL-33 (аминокислоты 112-270) или IL-33 из коммерческих источников. Исследования позволяют предположить, что полноразмерный IL-33 также может быть активным (Cayrol et al., Proc Nati Acad Sci USA 106(22):9021-6 (2009); Hayakawa et al., Biochem Biophys Res Commun 387(1):218-22 (2009); Talabot-Ayer et al., J Biol Chem. 284(29): 19420-6 (2009)). Связывание антител с полноразмерным ("нативным") IL-33 определяли с помощью иммунофлуоресцентного окрашивания первичных клеток гладкой мускулатуры бронхов (BSMC).
[845] BSMC получали от Cambrex и поддерживали на полной среде для выращивания гладкомышечных клеток (SmBM®, Lonza) в соответствии с инструкциями производителя. Клетки собирали из колб с помощью аккутазы (РАА, № L11-007) и высевали из расчета 2×104/100 мкл/лунка в среду для культивирования [SMBM (Lonza, № СС-3181) с набором SMGM SingleQuot, содержащим добавки и факторы роста (Lonza, № СС-4149)] в 96-луночные планшеты с черными стенками, прозрачным плоским дном, покрытые коллагеном I (Greiner), и инкубировали при 37°С, 5% СО2 в течение 18-24 часов. По прошествии этого времени среду отсасывали, оставляя монослой клеток интактным, и клетки фиксировали в течение 15 минут с помощью 3,7% раствора формальдегида, который был предварительно нагрет до 37°С. Фиксатор отсасывали и клетки дважды промывали с помощью PBS из расчета 100 мкл/лунка. Клетки пермеабилизировали в течение 15 минут при комнатной температуре с применением буфера для пермеабилизации (Thermo Scientific, №8400492), промывали х 2 в PBS и блокировали с помощью PBS/1% BSA (Sigma, № А9576) из расчета 100 мкл/лунка в течение 30-60 минут при комнатной температуре. Блокирующий буфер отбрасывали и замещали на титр антител к IL-33 или соответствующих антител изотипического контроля, которые были разведены в блокирующем буфере, на 1 час при комнатной температуре.
[846] Планшеты промывали х 2 в PBS и окрашивали в течение 1 часа при комнатной температуре с помощью раствора вторичных антител, который включал краситель Hoechst (10 мг/мл; Thermo Scientific), разведенный 1:10000, а также вторичное антитело (антитело к IgG человека (H+L), конъюгированное с Alexa Fluor® 488, из расчета 2 мг/мл; Invitrogen, № А11013), разведенное 1:1000. Планшеты промывали трижды в PBS. Клетки хранили в конченом объеме PBS из расчета 150 мкл/лунка и покрывали черной, блокирующей свет пленкой (Perkin Elmer, №6005189) до визуализации на ридере ArrayScan VTi HCS.
[847] Экспрессию IL-33 в культивируемых BSMC подтверждали с помощью коммерческого поликлонального антитела (R&D Systems, № AF3625), обнаруживаемого с помощью антитела к IgG козы (H+L), конъюгированного с Alexa Fluor® 488, из расчета 2 мг/мл; Invitrogen, № A11055). На фигуре 5 показано обнаружение эндогенного IL-33 в клетках гладкой мускулатуры бронхов с помощью иммунофлуоресцентного окрашивания с помощью антитела к IL-33, IL330004 (правая панель), в сравнении с отрицательным контролем, CAT-002 (левая панель). При применении антитела IL330004 показано явное окрашивание ядер BSMC, что соответствует ожидаемой локализации полноразмерного IL-33 и что было обнаружено с помощью коммерческого pAb.
Пример 2. Выделение и идентификация scFv-антител к IL-33
Идентификация специфических в отношении IL-33 связывающих веществ в ELISA с применением фагов
[848] Регенты и методы отбора были такими, как описано в примере 1. Одноцепочечные Fv-фрагменты подвергали дисплею на фаговых частицах и тестировали в качестве неочищенных препаратов в скрининге в один момент времени с помощью ELISA. Считалось, что scFv, подвергнутые фаговому дисплею, связывают антиген IL-33, если поглощение при 450 нм составляло >0,5, а поглощение такого же образца контролей (инсулин и IL-4Rα с Flag®-His) составляло <0,1-0,2.
[849] На фигуре 6 показаны данные по связыванию на основании одного планшета, подвергнутого скринингу в отношении IL-33 человека, IL-33 макака-крабоеда и инсулина. Одно специфическое связывающее вещество с перекрестной реактивностью в отношении IL-33 человека/макака-крабоеда показано в лунке С4, а в лунках А12 и В12 содержится контрольный клон связывания IL-33.
Идентификация связывающих веществ для IL-33 с помощью анализа конкурентного связывания с IL33305B от Axxora
[850] Анализ конкурентного связывания с IL33305B от Axxora представляет собой гомогенный анализ, в котором используется технология анализа флуоресценции в микрообъемах (FMAT). В анализе оценивали ингибирование связывания mAb IL33305B от Axxora (Axxora/Adipogen, № AG-20А-0041-С050) с рекомбинантным биотинилированным IL-33 человека с Flag®-His в присутствии неочищенных образцов супернатантов с scFv или очищенных scFv и IgG в 384-луночном формате.
[851] ScFv экспрессировали в периплазме бактерий и подвергали скринингу в отношении их ингибиторной активности в FMAT-анализе конкурентного связывания эпитопов в сравнении с известным биологически активным mAb IL33305B. Биотинилированный IL-33 иммобилизировали на покрытых стрептавидином гранулах (Spherotec, № SVP-60-5) и взаимодействие с Ab IL33305B от Axxora обнаруживали с применением антитела козы к иммуноглобулину мыши, меченного Alexafluor®-647 (Molecular Probes, A21236). Система FMAT представляет собой макроконфокальное устройство для визуализации, которое измеряет красную флуоресценцию, ассоциированную с гранулами.
[852] Планшеты считывали на ридере Cellular Detection system 8200 от Applied Biosystems. Гелий-неоновый возбуждающий лазер фокусируется в пределах глубины 100 мкм на дне лунки, сканируя площадь 1 мм2. Гранулы оседают на дне лунки, и после возбуждения лазером при 633 нм те гранулы, с которыми связался флуорофор (при этом локальная концентрация флуорофора является относительно высокой по сравнению с несвязанным флуорофором), испускают сигнал при 650-685 нм, который измеряют с применением РМТ1. Несвязанный флуорофор в растворе находится за пределами глубины возбуждения или при относительно небольшой локальной концентрации и, таким образом, не испускает значимого сигнала. Образцы ScFv или IgG, которые эффективно блокируют связывание IL33305B с IL-33, следовательно, будут вызывать снижение количество комплексов гранула:IL-33:IL33305B:антитело к иммуноглобулину мыши, меченное Alexafluor®-647, на дне лунки, что будет приводить к снижению измеряемой флуоресценции.
Для постановки анализа готовили следующие реагенты.
(1) Смесь IL33305B и антитела к иммуноглобулину мыши с AF647, IL33305B, разводили до 2,25 нМ в буфере для анализа [PBS (Gibco, 14190-094), содержащий 0,1% BSA (Sigma, № A9576) и 0,1% Tween-20 (Sigma, P2287)] и смешивали с антителом к иммуноглобулину мыши с AF647, разведенным до 2 мкг/мл (конечная концентрация 400 нг/мл) в буфере для анализа.
(2) Смесь IL-33 и гранул, 2,5 нМ биотинилированного IL-33 человека с FLAG®-His добавляли в 0,0095% вес/объем раствор гранул со стрептавидином в буфере для анализа и инкубировали с вращением при комнатной температуре в течение 1 часа - перед применением эти частицы центрифугировали при 2000 об./мин. в течение 15 минут и ресуспендировали в исходном объеме буфера для анализа.
(3) Подготовка образцов, образцы неочищенных супернатантов с scFv получали в 96-луночных планшетах с глубокими лунками. 5 мкл культуры из каждой лунки 96-луночного основного планшета переносили в культуральный планшет Greiner с глубокими лунками, содержащий 900 мкл среды 2TY + 100 мкг/мл ампициллина + 0,1% глюкозы и инкубировали в течение 5 часов при 37°С, 280 об./мин. Затем добавляли 10 мМ IPTG в TY из расчета 100 мкл/лунка и планшет инкубировали на протяжении ночи при 30°С, 280 об./мин. Следующим утром планшет центрифугировали при 3200 об./мин. в течение 15 минут. Для высокопроизводительного скрининга супернатанты с scFv из планшета с глубокими лунками переносили напрямую в планшет для анализа с достижением конечной концентрации, составляющей 20%.
[853] Для определения IC50, как правило, очищенные scFv или IgG разводили 3-кратно в буфере для анализа, в двух повторностях, с получением 11 точек концентрации. 96-луночные полипропиленовые планшеты Greiner (Greiner, 650201) применяют для приготовления разведении.
[854] В колонки 1-22 в 384-луночном черном планшете с прозрачным дном и несвязывающей поверхностью (Costar, №3655) добавляли следующее: 10 мкл образца, 20 мкл смеси IL33305 В/антитело к иммуноглобулину мыши с AF647 и 20 мкл смеси IL-33/гранулы. Во всех случаях общий объем в лунке составлял 40 мкл. Контроли, которые обычно применяли в данных экспериментах, включали: смесь IL-33/гранулы, а также добавленное антитело к иммуноглобулину мыши с AF647 (неспецифическое связывание); смесь IL330305B/антитело к иммуноглобулину мыши AF647, а также смесь IL-33/гранулы (общее связывание). Планшеты запечатывали и инкубировали в течение четырех часов при комнатной температуре в темноте и затем считывали на ридере Cellular Detection system 8200 от Applied Biosystems. Данные анализировали с помощью алгоритма по скорости, при этом дискриминационное окно устанавливали как соотношение цветов <0,4, размер <15 и число импульсов в минуту 20. Хиты на основании образцов неочищенных супернатантов с scFv определяли как показывающие 50% или более высокое ингибирование сигнала по сравнению с контрольными лунками с общим связыванием. Кривые дозовой зависимости наносили на график для титраций очищенных scFv и IgG с применением программного обеспечения для вычерчивания кривой Prism (Graphpad).
Переформатирование scFv в IgG1
[855] scFv, которые проявили требуемый профиль перекрестной реактивности в отношении видов и профиль специфичности, как определено с помощью экспериментов по связыванию scFv, подвергнутых фаговому дисплею, или показали ингибиторный эффект в отношении конкурентного связывания эпитопов в сравнении с Il33305B от Axxora (как описано выше), подвергали секвенированию ДНК (Osbourn et al., Immunotechnology 2(3):181-96 (1996); Vaughan et al., Nat. Biotechnol. 14(3):309-14 (1996)). Вначале scFv с требуемыми свойствами преобразовывали в формат антитела в виде целого иммуноглобулина G1 (IgG1) или изотопического IgG1 ТМ без эффекторной функции (Fc-последовательность IgG1, включающую мутации L234F, L235E и P331S), как описано в примере 1. SEQ ID NO, соответствующие различным областям антител IL330065, IL330099, IL330101, IL330107, IL33149 и IL330180, показаны в таблице 9.


Анализ связывания для IgG
[856] Перекрестную реактивность в отношении видов у антитела к IL-33 определяли с применением ELISA на основе планшета. Планшеты со стрептавидином (Thermo Scientific, АВ-1226) покрывали с помощью биотинилированного антигена из расчета 0,5 мкг/мл в PBS. Связывание препаратов очищенных IgG обнаруживали с помощью антитела к IgG человека, конъюгированного с HRP (Sigma, A0170). Данные ЕС50 для кривых связывания показаны в таблице 10.


Было определено, что IL330180 связывается с IL-33 человека, но не с IL-33 макака-крабоеда или мыши в формате scFv, подвергнутых фаговому дисплею
Ингибирование функциональных ответов IL-33 под действием антител к IL-33
Ингибирование пролиферации клеток TF-1 под действием IgG
[857] Анализ жизнеспособности клеток применяли для оценки ингибирования индуцированной IL-33 пролиферации/выживания клеток TF-1 под действием антител к IL-33. Анализ жизнеспособности клеток на основе люминесценции CellTiter-Glo® (Promega) представляет собой гомогенный способ для определения количества жизнеспособных клеток в культуре, исходя из - количественной оценки присутствующего АТР, что сигнализирует о присутствии метаболически активных клеток. Клетки подвергали воздействию IL-33 в присутствии или в отсутствие тестируемого антитела. Жизнеспособность клеток измеряли с помощью CellTiter-Glo после 72-часовой стимуляции с помощью IL-33.
[858] В частности, анализ пролиферации применяли для оценки ингибирования индуцированной IL-33 пролиферации клеток TF-1 под действием антител к IL-33. Клетки TF-1 были получены в дар от R&D Systems и поддерживались в соответствии с инструкциями производителя. Среда для анализа содержала RPMI-1640 с GLUTAMAX I (Invitrogen, 61870), содержащей 5% фетальной бычьей сыворотки (термоинактивированная, гамма-облученная), 1% пирувата натрия (Sigma, S8636), 1-2% пенициллина/стрептомицина (Invitrogen, 15140-122). Перед каждым анализом клетки TF-1 осаждали центрифугированием при 300xg в течение 5 минут, среду удаляли отсасыванием и затем клетки ресуспендировали в среде для анализа. Этот процесс повторяли дважды с клетками, ресуспендированными из расчета конечной концентрации 2×105 клеток/мл в среде для анализа. Тестируемые растворы IgG (в двух повторностях) титровали до требуемого диапазона концентраций в среде для анализа в 96-луночных полипропиленовых планшетах с U-образным дном (Greiner, 650201) и переносили по 50 мкл в 96-луночные планшеты с плоским дном, обработанные для культур тканей (Costar, №3598). Рекомбинантный IL-33 человека (Alexis, ALX-522-098-3010) добавляли к соответствующим титрациям тестируемого антитела с получением общего объема, составляющего 100 мкл/лунка. Затем 100 мкл суспензии клеток добавляли к 100 мкл IL-33 или смеси IL-33 и антитела с получением общего объема анализа, составляющего 200 мкл/лунка, и общего количества клеток, составляющего 20000 на лунку. В анализе применяли конченую концентрацию IL-33 для анализа, составляющую 100 нг/мл, которая была выбрана в качестве дозы, которая давала примерно 80% максимального пролиферативного ответа. Планшеты инкубировали в течение 72 часов при 37°С и 5% CO2. 100 мкл супернатанта аккуратно отбирали из планшетов для анализа. По 100 мкл CellTiter-Glo (Promega, G7571), восстановленного в соответствии с инструкциями производителя, добавляли из расчета на лунку. Планшеты встряхивали на планшетном шейкере при 500 об./мин. в течение 5 минут и люминесценцию считывали на планшет-ридере EnVision (PerkinElmer). Данные анализировали с применением программного обеспечения Graphpad Prism. Значения IC50 определяли путем вычерчивания кривой с применением трех- или четырехпараметрического логистического уравнения.
[859] Для тех антител, которые достигали кривых полного ингибирования, рассчитывали значения IC50, и они обобщены в таблице 11 ниже. Препараты очищенных IgG были способны ингибировать пролиферацию TF-1 в ответ на IL-33. На фигуре 7А показан процент ингибирования под действием IL330065 и IL330101 (в сравнении с контрольным mAb и hST2/Fc) в анализе пролиферации TF-1, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложена процентная доля максимального ответа.
Ингибирование высвобождения IL-6 из Huvec под действием антител к IL-33
[860] Анализ высвобождения цитокинов применяли для оценки ингибирования индуцированной IL-33 выработки IL-6 в эндотелиальных клетках пупочной вены человека (Huvec) под действием антител к IL-33. Клетки подвергали воздействию IL-33 в присутствии или в отсутствие тестируемого антитела.
[861] Huvec получали от Cambrex и поддерживали в полной среде ЕВМ-2 (Lonza) в соответствии с протоколом производителя. Клетки собирали из колб с помощью аккутазы (РАА, № L11-007) и высевали из расчета 1×104/100 мкл/лунка в среду для культивирования (ЕВМ-2 (Lonza, № СС-3156) с набором EGM-2 SingleQuot, содержащим добавки и факторы роста (Lonza, № СС-4176)) в 96-луночные планшеты с плоским дном, обработанные для культур тканей (Costar, №3598), инкубировали при 37°С, 5% СО2 в течение 18-24 часов. По прошествии этого времени среду отсасывали, оставляя монослой клеток интактным, и заменяли на тестируемые в анализе образцы, обсуждаемые ниже.
[862] Тестируемые растворы очищенных IgG (в двух повторностях) разводили до требуемой концентрации в полной среде для культивирования в 96-луночных полипропиленовых планшетах с U-образным дном (Greiner, 650201). IL-33 (Adipogen) готовили в полной среде для культивирования, смешанной с соответствующим тестируемым антителом, с получением конечной концентрации IL-33, составляющей 30 нг/мл. Все образцы инкубировали в течение 30 минут при комнатной температуре перед перенесением 120 мкл смеси IL-33/антитело в планшет для анализа. После 18-24-часовой инкубации содержание IL-6 измеряли в супернатантах от клеток с помощью ELISA (R&D Systems, DY206), адаптированного для считывания европия. Черные планшеты Fluro-Nunc Maxisorp (VWR, №437111) покрывали с помощью 50 мл антитела захвата, промывали три раза с помощью PBS-Tween (0,01%) с применением автоматического устройства для отмывки планшетов (Biotek) и блокировали с помощью PBS/1% BSA (Sigma, № А9576) из расчета 250 мкл/лунка в течение 1-2 часов при комнатной температуре. Планшеты промывали, как описано выше, и инкубировали с 50 мкл супернатантов из анализа с мастоцитами в течение 1-2 часов при комнатной температуре. После 3Х промывки с помощью PBS-Tween планшеты инкубировали с антителом обнаружения (50 мкл/лунка) в соответствии с инструкциями производителя. ELISA-планшеты промывали трижды в PBS-Tween, а стрептавидин-европий (PerkinElmer, 1244-360) разводили 1:1000 в буфере для анализа DELFIA® (PerkinElmer, 4002-0010) и добавляли из расчета 50 мкл/лунка на 45-60 минут при комнатной температуре. Затем планшеты промывали 7 раз в буфере для отмывки DELFIA перед добавлением усиливающего раствора (PerkinElmer, 4001-0010) из расчета 50 мкл/лунка и анализировали с применением флуорометрии с временным разрешением (возбуждение 340 нм, испускание 615 нм). Данные анализировали с применением программного обеспечения Graphpad Prism. Значения IC50 определяли путем вычерчивания кривой с применением трех- или четырехпараметрического логистического уравнения. Для тех антител, которые достигали кривых полного ингибирования, рассчитывали значения IC50, и они обобщены в таблице 11 ниже. Препараты очищенных IgG (IgG1 или IgG1-TM) антител IL330065, IL330099, IL330101, IL330107, IL330149 и IL330180 ингибировали выработку IL-6 в сравнении с контрольными антителами. На эффективность иллюстративных партнеров по связыванию фактически не влияло присутствие мутаций в Fc-последовательности IgG1 ТМ (L234F, L235E и P331S), и в данных, которые показаны, объединена информация для обоих форматов. На фигуре 7В показан процент максимального высвобождения IL-6 в случае IL330065 и IL330101 (в сравнении с ST2-Fc человека, pAb к IL33, AF3625 (R & D Systems) и контрольного mAb), где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложена процентная доля максимального ответа.
Ингибирование высвобождения цитокинов мастоцитами человека
[863] Анализ высвобождения цитокинов применяли для оценки ингибирования индуцированной IL-33 выработки IL-6 в мастоцитах человека под действием антител к IL33. В дополнение к IL-6 в супернатантах от клеток измеряли содержание других цитокинов (IL-5, IL-6, IL-8, IL-10, IL-13, GM-CSF и TNFα) с применением альтернативного DuoSet ELISA или мультиплексного анализа Mesoscale Discovery.
[864] Мастоциты человека получали с помощью in vitro дифференцировки CD133 + клеток-предшественников в пупочной крови (Lonza, № 2С-108), фактически как описано в Andersen et al. (J Immunol Methods 336:166-174 (2008)). Клетки-предшественники оттаивали в соответствии с инструкциями производителя и культивировали in vitro в бессывороточной среде для размножения (StemSpan, №09650), дополненной 1% пенициллина/стрептомицина (Invitrogen, 15140-122) и факторами роста: 100 нг/мл фактора роста стволовых клеток (Peprotech, № AF-300-07) и 50 нг/мл IL-6 (Peprotech, № AF-200-6) в течение 8 недель. В дополнение 1 нг/мл IL-3 (R&D Systems, №203-IL) включали в среду для культивирования на протяжении первых трех недель. На всем протяжении клетки поддерживали при <5×105/мл.
[865] Мастоциты культивировали на протяжении ночи в среде для анализа (StemSpan, №09650; 1% пенициллина/стрептомицина (Invitrogen, 15140-122) и 100 нг/мл фактора роста стволовых клеток (Peprotech, № AF-300-07)) перед воздействием IL-33 в присутствии или в отсутствие тестируемого антитела.
[866] В случае анализов высвобождения цитокинов клетки извлекали, осаждали (150g в течение 10 минут) и ресуспендировали в среде для анализа (StemSpan, №09650, 1% пенициллина/стрептомицина (Invitrogen, 15140-122) и 100 нг/мл фактора роста стволовых клеток (Peprotech, № AF-300-07)). Клетки возвращали в колбу и культивировали в течение 18-24 часов до постановки анализа. Для оценки образцов тестируемые растворы IgG (в двух повторностях) титровали до требуемого диапазона концентраций в среде для анализа в 96-луночных полипропиленовых планшетах с U-образным дном (Greiner, 650201) и по 50 мкл тестируемых растворов переносили в 96-луночные планшеты с плоским дном, обработанные для культур тканей (Costar, №3598). 50 мкл рекомбинантного IL-33 человека (Adipogen, №522-098-3010), разведенного в среде для анализа до 90 нг/мл, добавляли к соответствующим титрациям тестируемого антитела с получением общего объема, составляющего 100 мкл/лунка. Затем 50 мкл суспензии клеток (1,5×105) добавляли к 100 мкл IL-33 или смеси IL-33 и антитела с получением общего объема анализа, составляющего 150 мкл/лунка, и общего количества клеток, составляющего 5×104 на лунку. В анализе применяли конечную концентрацию IL-33 для анализа, составляющую 30 нг/мл, выбранную в качестве дозы, которая давала примерно 50-80% максимального цитокинового ответа. Планшеты инкубировали в течение 18-24 часов при 37°С и 5% CO2.
[867] Содержание IL-6 измеряли в супернатантах от клеток с помощью ELISA (R&D Systems, DY206), адаптированного для считывания европия. Черные планшеты Fluro-Nunc Maxisorp (VWR, №437111) покрывали с помощью 50 мл антитела захвата, промывали три раза с помощью PBS-Tween (0,01%) с применением автоматического устройства для отмывки планшетов (Biotek) и блокировали с помощью PBS/1% BSA (Sigma, № А9576) из расчета 250 мкл/лунка в течение 1-2 часов при комнатной температуре. Планшеты промывали, как описано выше, и инкубировали с 50 мкл супернатантов из анализа с мастоцитами в течение 1-2 часов при комнатной температуре. После 3Х промывки с помощью PBS-Tween планшеты инкубировали с антителом обнаружения (50 мкл/лунка) в соответствии с инструкциями производителя. ELISA-планшеты промывали трижды в PBS-Tween, а стрептавидин-европий (PerkinElmer, 1244-360) разводили 1:1000 в буфере для анализа DELFIA® (PerkinElmer, 4002-0010) и добавляли из расчета 50 мкл/лунка на 45-60 минут при комнатной температуре. Затем планшеты промывали 7 раз в буфере для отмывки DELFIA перед добавлением усиливающего раствора (PerkinElmer, 4001-0010) из расчета 50 мкл/лунка и анализировали с применением флуорометрии с временным разрешением (возбуждение 340 нм, испускание 615 нм). Данные анализировали с применением программного обеспечения Graphpad Prism. Значения IC50 определяли путем вычерчивания кривой с применением трех- или четырехпараметрического логистического уравнения.
[868] На фигуре 8А показано снижение выработки IL-6 под действием возрастающих концентраций антител IL330065, IL330099, IL330101, IL330107, IL33149 и IL330180, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен % максимального ответа. Препараты очищенных IgG тестируемых антител были способны ингибировать активность IL-6 в сравнении с контрольными антителами. На эффективность иллюстративных партнеров по связыванию фактически не влияло присутствие мутаций в Fc-последовательности IgG1 TM (L234F, L235E и P331S), и в данных объединена информация для обоих форматов. Результаты IC50 для анализа пролиферации TF-1, выработки IL-6 в HUVEC и выработки IL-6 в мастоцитах показаны в таблице 11.

[869] Дополнительные цитокины (IL-5, IL-6, IL-8, IL-10, IL-13 и GM-CSF) в супернатантах от клеток обнаруживали с применением демонстрационного 10-плексного анализа для определения цитокинов человека Meso-Scale Diagnostics (№ K15002B-1) в соответствии с инструкциями производителя. Содержание цитокинов измеряли в супернатантах от клеток с помощью ELISA, адаптированного для считывания европия, с применением протокола, аналогичного ELISA для определения IL-6, описанного выше.
[870] Было показано, что мастоциты вырабатывают целый ряд цитокинов после стимуляции с помощью IL-33 (демонстрационный 10-плексный анализ для определения цитокинов человека Meso-Scale Diagnostics № K15002B-1; R&D Systems, № DY213). На фигурах 8B-F показано ингибирование управляемой IL-33 выработки GM-CSF, IL10, IL-8, IL-13 и IL-5 соответственно. Эти результаты показывают, что антитела IL330065, IL330101, IL330107 и IL330149 были способны ингибировать управляемую IL-33 выработку всех цитокинов, содержание которых измеряли.
Связывание и нейтрализация нативного полноразмерного IL-33
[871] В отборе и исследованиях активности, описанных выше, применяли рекомбинантный зрелый IL-33 (аминокислоты 112-270), полученный в лаборатории, или IL-33 из коммерческих источников. Полноразмерный IL-33 также может быть активным (Cayrol et al., Proc Nati Acad Sci USA 106(22):9021-6 (2009); Hayakawa et al., Biochem Biophys Res Commun 387(1):218-22 (2009); Talabot-Ayer et al., J Biol Chem. 284(29): 19420-6 (2009)). Для оценки связывания антител с полноразмерным IL-33 полноразмерный IL-33 клонировали и экспрессировали в клетках HEK293-EBNA. Как описано ниже, было показано, что выбранные антитела связываются с полноразмерным IL-33, как определено с помощью вестерн-блоттинга.
Клонирование и экспрессия полноразмерного IL-33 человека
[872] Молекулу кДНК, кодирующую полноразмерный (FL) IL-33 от человека (номер доступа в Swiss Prot O95760, аминокислоты 1-270), синтезировали с помощью ПЦР-клонирования с удлинением праймера и клонировали в pDONR221 (Invitrogen, 12536-017), и его переносили в вектор для экспрессии в клетках млекопитающих pDEST12.2 (Invitrogen) с применением фермента LR Gateway Clonase II в соответствии с инструкциями производителя (Invitrogen, 12538-120). Вектор pDEST12.2 был модифицирован, чтобы содержать точку начала репликации oriP из вектора рСЕР4 (Invitrogen), что обеспечивает возможность эписомной репликации плазмиды после трансфекции в линии клеток, экспрессирующие продукт гена EBNA-1 (такие как клетки HEK293-EBNA). Клетки HEK293-EBNA трансфицировали с помощью липофектамина 2000 (Invitrogen, 11668-019). Клетки, экспрессирующие FL HuIL-33 (и ложно-трансфицированные контроли), лизировали с применением обработки ультразвуком в присутствии ингибиторов протеазы (Roche, 05892791001).
Вестерн-блоттинг анализ лизатов клеток, экспрессирующих полноразмерный IL-33 человека
[873] Белки из лизатов клеток подвергали денатурации и восстанавливали с помощью буфера для образцов с SDS и DTT перед разделением с помощью SDS-PAGE электрофореза и переноса на нитроцеллюлозные мембраны. Мембраны блокировали с помощью 5% нежирного сухого молока в PBS-T в течение 1 ч, инкубировали с первичным антителом (0,5 мкг на мл) в течение 1 ч, промывали трижды в PBS-T, затем инкубировали в течение 1 ч с помощью вторичного антитела, конъюгированного с HRP (антитело козы к IgG человека (Sigma, А0170) в разведении 1 в 10000) и промывали три раза в PBS-T. HRP обнаруживали с помощью Amersham ECL с реагентом для обнаружения (GE healthcare, RPN2132). Размеры устанавливали путем сравнения миграции с таковой у Magic Mark XP (Invitrogen, LC5602). На фигуре 9 показано связывание антител к IL-33 (IL330065, IL330101, IL330107 и IL330149) с полноразмерным IL-33 человека с помощью вестерн-блоттинга.
Нейтрализация цитокиновых ответов мастоцитов на лизат клеток с полноразмерным IL-33
[874] Клетки HEK293-EBNA, экспрессирующие полноразмерный (FL) HuIL-33 (и ложнотрансфицированные контроли), собирали через 24 часа после трансфекции с помощью аккутазы (РАА, № L11-007). Клетки разводили до 5×107/мл с помощью PBS и гомогенизировали в течение 30 секунд с применением гомогенизатора для тканей. Клеточный дебрис удаляли с помощью центрифугирования. Мастоциты стимулировали с помощью лизатов клеток при различных концентрациях. Стимуляцию выработки цитокинов наблюдали только в случае лизатов клеток, трансфицированных с помощью полноразмерного IL-33, а не в случае лизата ложно-трансфицированных клеток. Концентрацию лизата, которая приводила к стимуляции субмаксимального высвобождения цитокинов (примерно ЕС50), выбирали для исследований нейтрализации под действием антитела.
[875] Для анализов высвобождения цитокинов мастоциты культивировали на протяжении ночи в среде для анализа (StemSpan, №09650; 1% пенициллина/стрептомицина (Invitrogen, 15140-122) и 100 нг/мл фактора роста стволовых клеток (Peprotech, № AF-300-07)) перед воздействием FL HuIL-33 в присутствии или в отсутствие тестируемого антитела. Выработку IL-6 и IL-13 обнаруживали с помощью ELISA анализируемых супернатантов через 18-24 часов. Подробное описание протокола было описано выше (пример 2-0007).
[876] На фигуре 10 показан эффект антител к IL-33, IL330065 и IL330101, в отношении выработки IL-6 и IL-13 в мастоцитах, стимулируемой лизатами клеток от клеток, трансфицированных с помощью полноразмерного IL-33. Препараты очищенных IgG были способны ингибировать выработку IL-6 (фигура 10А) и IL-13 (фигура 10В), индуцированную лизатами клеток с полноразмерным IL-33.
Неконкурентный механизм действия антител к IL-33
Ингибирование связывания IL-33 с ST2 под действием очищенных IgG
[877] Способность антител к IL-33 ингибировать связывание IL-33 с меткой Flag®-His с рецептором ST2 оценивали в биохимическом HTRF®-анализе конкурентного связывания (гомогенный анализ флуоресценции с временным разрешением, Cisbio International), полное описание способов которого приведено в примере 1.
[878] На фигуре 11А показаны результаты специфического связывания для HTRF®-анализа конкурентного связывания рецептор-лиганд с помощью возрастающих концентраций антител IL330065, IL330099, IL330101, IL330107, IL33149 и IL330180. Эти результаты показывают, что антитела IL330065, IL330099, IL330101, IL330107, IL33149 и IL330180 не являются конкурентными ингибиторами взаимодействия IL-33: ST2.
Ингибирование передачи сигнала с участием NFkB в Huvec под действием IgG
[879] Передачу сигнала с участием NFkB в Huvec в ответ на IL-33 оценивали по ядерной транслокации субъединицы p65/RelA NFkB, обнаруживаемой с помощью иммунофлуоресцентного окрашивания, как описано в примере 1.
[880] На фигуре 11В показана транслокация NFkB в Huvec с помощью возрастающих концентраций антител IL330065, IL330099, IL330101, IL330107 и IL330149. Эти результаты показывают, что IL330065, IL330099, IL330101, IL330107 и IL330149 не ингибировали ядерную транслокацию 65/RelA NFkB в Huvec, простимулированных с помощью IL-33, через 30 минут после стимуляции. Эти результаты согласуются с тем, что антитела IL330065, IL330099, IL330101, IL330107, IL33149 и IL330180 не смогли ингибировать связывание IL-33 с ST2.
Эпитоп-специфичная сортировка антител к IL-33 в HTRF®-анализах конкурентного связывания эпитопов
[881] Способность антител конкурировать с mAb IL330101 или mAb IL330180 за связывание с биотинилированным IL-33 человека оценивали в биохимическом HTRF®-(гомогенный анализ флуоресценции с временным разрешением, Cisbio International) анализе конкурентного связывания эпитопов.
[882] HTRFP®-анализы конкурентного связывания эпитопов, описанные ниже, применяли для измерения связывания лидерного антитела в формате IgG с биотинилированным IL-33. Тестируемые образцы scFv, которые распознают эпитоп, аналогичный таковому, который распознает лидерное антитело, будет конкурировать с лидерным антителом за связывание с IL-33, что ведет к снижению сигнала анализа.
[883] Образцы очищенных scFv-антител к IL-33 тестировали в отношении ингибирования связывания биотинилированного IL-33 человека лидерным антителом путем добавления 5 микролитров каждого разведения тестируемого образца антитела в 384-луночный малообъемный планшет для анализа (Costar, 3673). Следующим шагом готовили раствор, содержащей 8 нМ IL330180 IgG1 или 12 нМ IL330101 IgG1 и 40 нМ средства для обнаружения на основе антитела к Fc человека (Cisbio International, 61HFXLB), и 2,5 микролитров добавляли в планшет для анализа. За этим следовало добавление 2,5 микролитров раствора, содержащего 4 нМ (для анализа конкурентного связывания эпитопов с IL330180) или 18 нМ (для анализа конкурентного связывания эпитопов с IL330101) биотинилированного IL-33 человека (Axxora, AG-40B-0038; биотинилированный) и 4,65 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB). Все разведения осуществляли в буфере для анализа, состоящем из PBS Дульбекко (Invitrogen, 14190185), содержащего 0,8 М фторида калия (BDH, 103444T) и 0,1% бычьего сывороточного альбумина (BSA, Sigma А9576). Планшеты для анализа инкубировали в течение 2 часов при комнатной температуре, а затем 16 часов при 4°С перед считыванием флуоресценции с временным разрешением при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer). Данные анализировали с применением уравнений 1-3, как описано ранее. Отрицательный контроль (неспецифическое связывание) определяют путем замещения комбинации биотинилированный IL-33/криптат стрептавидина на средство для обнаружения на основе криптата стрептавидина в отдельности.
[884] Результаты анализа конкурентного связывания эпитопов для IL330101 и IL330180 показаны на фигурах 8А и 8В соответственно. На фигуре 12А показано конкурентное связывание IL330101 scFv, IL330107 scFv, IL330149 scFv, IL330065 scFv, нерелеватного scFv и scFv IL330180 с mAb IL330101 при связывании с биотинилированным IL-33 человека. Эти результаты показывают, что IL330101 scFv, IL330107 scFv, IL330149 scFv приводят к конкурентному ингибированию связывания IL330101 с биотинилированным IL-33 человека.
[885] На фигуре 12В показано конкурентное связывание IL330180, IL330101, IL330149, IL330065 и нерелевантного scFv с mAb IL330180 при связывании с биотинилированным IL-33 человека, которое оценивали в биохимическом HTRF®-анализе. Эти результаты показывают, что IL330101, IL330149 и IL330065 не приводят к конкурентному ингибированию связывания IL330180 с биотинилированным IL-33 человека.
[886] Эпитоп-специфичная сортировка с применением данного способа показала три панели антител, охватывающие IL330101, IL330107 и IL330149 в панели 1, IL330065 в панели 2 и IL330180 в панели 3, как подробно отражено в таблице 12.

Пример 3. Оптимизация Ab к IL-33, IL330101
Созревание аффинности
[887] IL330101 оптимизировали с применением подхода направленного мутагенеза и отборов на основе аффинности с применением фагового дисплея. Большие фаговые библиотеки scFv, полученных из лидерного клона, создавали с помощью олигонуклеотид-направленного мутагенеза определяющих комплементарность участков 2 и 3 (CDR2 и CDR3) вариабельной области тяжелой цепи (VH) и CDR3 легкой цепи (VL) с применением стандартных методик молекулярной биологии, как описано (Clackson Т. and Lowman H.B. Phage Display - A Practical Approach, 2004. Oxford University Press). Библиотеки подвергали отборам на основе аффинности с применением фагового дисплея, чтобы отобрать варианты с более высокой аффинностью в отношении IL-33 человека и мыши. Процедуры отбора осуществляли, фактически как описано ранее (Thompson, J et al. J Mol Biol, 1996. 256: p. 77-88) с применением реагентов, описываемых в примерах 1 и 2. Вкратце, фаговые частицы с scFv инкубировали с рекомбинантным биотинилированным IL-33 человека в растворе (Adipogen; биотинилированный, как описано в разделе Модификации белков в пределах примера 1). Затем фаги с ScFv, связавшимися с антигеном, захватывали на покрытых стрептавидином парамагнитных гранулах (Dynabeads® M-280), следуя рекомендациям производителя. Затем отобранные фаговые частицы с scFv высвобождали, как описано ранее (Osbourn, J.K., et al. Immunotechnology, 1996. 2(3): p. 181-96), и процесс отбора повторяли в присутствии сменяющихся и понижающихся концентраций биотинилированного IL-33 человека или мыши - обычно от 500 нМ до 500 пМ за четыре раунда отбора.
Ингибирование связывания IL-33 с mAb под действием неочищенных scFv
[888] Репрезентативное количество индивидуальных клонов из числа результатов отбора выращивали в 96-луночных планшетах. ScFv экспрессировали в периплазме бактерий (Kipriyanov, et al. J Immunol Methods 200(1-2): 69-77 (1997)) и подвергали скринингу в отношении их ингибиторной активности в анализе связывания IL-33:mAb на основе гомогенного FRET (резонансный перенос энергии флуоресценции) HTRF® (гомогенный анализ флуоресценции с временным разрешением, Cisbio International). В данном анализе образцы конкурировали с IL330101 IgG за связывание с биотинилированным IL-33 человека или IL-33 мыши с FLAG®-His. Такие анализы конкурентного связывания эпитопов основаны на том принципе, что образец тестируемого антитела, которое распознает эпитоп, аналогичный таковому, который распознает IgG к IL-33, будет конкурировать с IgG за связывание с биотинилированным IL-33, что ведет к снижению сигнала анализа.
[889] Образцы неочищенных scFv к IL-33 тестировали на ингибирование связывания биотинилированного IL-33 человека или мыши с FLAG®-His с IL330101 путем добавления 5 микролитров образца в 384-луночный малообъемный планшет для анализа (Costar, 3673). Следующим шагом готовили раствор, содержащей 12 нМ IL330101, объединенного с 40 нМ средства для обнаружения на основе антитела к Fc человека, меченного XL665 (Cisbio International, 61HFCXLB), для анализа с IL-33 человека, и готовили раствор, содержащий 2 нМ IL330101 в комбинации с 40 нМ средства для обнаружения на основе антитела к Fc человека, меченного XL665 (Cisbio International, 61HFCXLB), для анализа с молекулой мыши. 2,5 микролитров добавляли в планшеты для анализа. За этим следовало добавление 2,5 микролитра раствора, содержащего 18 нМ биотинилированного IL-33 человека (Adipogen, AG-40B-0038) в комбинации с 4,6 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB), в случае анализа с молекулой человека, или раствора, содержащего 2 нМ биотинилированного IL-33 мыши с FLAG®-His в комбинации с 4,6 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB), в случае анализа с молекулой макака-крабоеда. Все разведения осуществляли в буфере для анализа, содержащем 0,8 М фторида калия (VWR, 26820.236) и 0,1% бычьего сывороточного альбумина (BSA, РАА, K05-013) в PBS Дульбекко (Invitrogen, 14190185). Планшеты для анализа инкубировали в течение 4 часов при комнатной температуре, а затем 16 часов при 4 градусах Цельсия и флуоресценцию с временным разрешением считывали при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer). Данные анализировали путем расчета соотношения 665/620 нм, а затем значений % дельта F для каждого образца. Соотношение 665/620 нм применяли для введения поправки на интерференцию в образце с применением уравнения 1. Затем для каждого образца рассчитывали % дельта F с применением уравнения 2. Отрицательный контроль (неспецифическое связывание) определяли путем замещения биотинилированного IL-33 в комбинации со средством для обнаружения на основе криптата стрептавидина на средство для обнаружения на основе криптата стрептавидина в отдельности. Значения % дельта F затем использовали для расчета % специфического связывания, как описано в уравнении 3.
[890] Поскольку анализ конкурентного связывания эпитопов достиг своего предела чувствительности, для тестирования образцов неочищенных scFv применяли анализ с применением промежуточного оптимизированного mAb IL330259. Образцы неочищенных антител к IL-33 тестировали в отношении ингибирования связывания биотинилированного IL-33 человека или биотинилированного IL-33 мыши с FLAG®-His меченным DyLight IL330259 путем добавления 5 микролитров каждого образца в 384-луночный малообъемный планшет для анализа (Costar, 3673). Следующим шагом готовили раствор, содержащий 20 нМ меченного DyLight IL330259, в случае анализа с IL-33 человека, и готовили раствор, содержащий 4 нМ меченного DyLight IL330259, в случае анализа с молекулой мыши, и по 2,5 микролитра добавляли с планшеты для анализа (мечение IgG проводили с применением набора (Thermo Scientific, 53051) согласно инструкциям производителя). За этим следовало добавление 2,5 микролитра раствора, содержащего 20 нМ биотинилированного IL-33 человека (Adipogen, AG-40B-0038) или 1,6 нМ биотинилированного IL-33 мыши с FLAG®-His в комбинации с 6 нМ средства обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB). Все разведения осуществляли в буфере для анализа, содержащем 0,8 М фторида калия (VWR, 26820.236) и 0,1% бычьего сывороточного альбумина (BSA, РАА, K05-013) в PBS Дульбекко (Invitrogen, 14190185). Планшеты для анализа инкубировали в течение 4 часов при комнатной температуре, а затем 16 часов при 4 градусах Цельсия и флуоресценцию с временным разрешением считывали при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer). Данные анализировали путем расчета соотношения 665/620 нм, а затем значений % дельта F для каждого образца. Соотношение 665/620 нм применяли для введения поправки на интерференцию в образце с применением уравнения 1. Затем для каждого образца рассчитывали % дельта F с применением уравнения 2. Отрицательный контроль (неспецифическое связывание) определяли путем замещения биотинилированного IL-33 в комбинации со средством для обнаружения на основе криптата стрептавидина на средство для обнаружения на основе криптата стрептавидина в отдельности. Значения % дельта F затем использовали для расчета % специфического связывания, как описано в уравнении 3.
Ингибирование связывания IL-33 с mAb под действием очищенных scFv
[891] Клоны одноцепочечных Fv, которые показывали больший ингибиторный эффект в отношении взаимодействия IL-33:mAb в качестве неочищенных экстрактов периплазмы по сравнению с IL330101, подвергали секвенированию ДНК (Osbourn, et al. Immunotechnology 2(3):181-96 (1996); Vaughan, et al. Nat Biotechnol 14(3):309-14 (1996)). Уникальные scFv снова экспрессировали в бактериях и очищали с помощью аффинной хроматографии (как описано в WO 01/66754). Эффективности данных образцов определяли путем анализа конкуренции серии разведении очищенного препарата в сравнении с IL330101 IgG при связывании с биотинилированным IL-33 человека, биотинилированным IL-33 мыши с меткой FLAG®-His или биотинилированного IL-33 макака-крабоеда с FLAG®-His, как описано выше, но с добавлением анализа с биотинилированным IL-33 макака-крабоеда с FLAG®-His (биотинилированный IL-33 макака-крабоеда с FLAG®-His добавляли из расчета концентрации 12 нМ).
[892] Фигура 13: показано ингибирование сигнала FRET, образуемого при связывании биотинилированного IL-33 человека с IL330101, с помощью возрастающих концентраций scFv-антител к IL-33, IL330101, IL330259, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[893] Препараты очищенных scFv, которые были способны ингибировать взаимодействие IL-33:mAb в большей степени, чем IL330101, отбирали для преобразования в формат IgG. Способ экспрессии и очистки IgG описан в примере 1.
[894] Поскольку анализ конкурентного связывания эпитопов достиг своего предела чувствительности, для тестирования образцов очищенных scFv применяли анализ с применением промежуточного оптимизированного mAb (IL330259). Образцы очищенных антител к IL-33 тестировали в отношении ингибирования связывания IL330259 с биотинилированным IL-33 человека, биотинилированным IL-33 мыши с FLAG®-His или биотинилированным IL-33 макака-крабоеда с FLAG®-His, как описано выше, с добавлением анализа с биотинилированным IL-33 макака-крабоеда с FLAG®-His (биотинилированный IL-33 макака-крабоеда с FLAG®-His добавляли из расчета концентрации 12 нМ).
[895] На основании последовательности и данных конкурентного связывания эпитопов выбранные VH и VL из числа результатов подвергали рекомбинации с помощью стандартных методик молекулярной биологии с получением библиотек, в которых клоны содержали последовательности VH и VL, объединенные в пары случайным образом (например, библиотеки CDR2 VH/CDR3 VL и CDR3 VH/CDR3 VL). В качестве альтернативы последовательности CDR3 VH и CDR3 VL объединяли в пары случайным образом и рекомбинировали со специфическими последовательностями CDR2 VH, отобранными из пула улучшенных вариантов, с получением библиотек, в которых все три CDR не принадлежали исходному антителу. Как правило, для идентификации последовательностей scFv с улучшенными показателями кинетики осуществляли пять раундов отбора на аффинность с применением понижающихся и сменяющихся концентраций биотинилированного IL-33 человека и мыши, от 10 нМ до 10 пМ, в отношении всех рекомбинантных библиотек. В качестве альтернативы рекомбинантные библиотеки отбирали с применением фиксированной концентрации биотинилированного IL-33 (например, 1 нМ, 100 пМ или 300 пМ) в присутствии 1000х небиотинилированного IL-33 с возрастающими промежутками времени (например 30 минут, 1 час, 2 часа или 4 часа) за четыре раунда отбора - процесс, известный из уровня техники как отбор на основании 'скорости диссоциации' или 'конкурентный' отбор - для идентификации scFv с улучшенными показателями кинетики.
[896] Образцы вновь подвергали скринингу в HTRF®-анализе конкурентного связывания эпитопов в отношении способности ингибировать связывание меченого huIL-33 с исходным антителом IL330101 или антителом IL330259 с оптимизированным CDR2 VH, как описано ранее. ScFv, которые показывали значительно усиленный ингибиторный эффект по сравнению с IL330101, подвергали секвенированию ДНК и уникальные варианты получали в виде очищенного scFv для дальнейшего определения характеристик. Ингибиторные scFv преобразовывали в формат антитела в виде целого иммуноглобулина G1 (IgG1), как описано в примере 1.
[897] В качестве альтернативы последовательности индивидуальных уникальных CDR2 VH, CDR3 VH и CDR3 VL подвергали специфической и рациональной рекомбинации и получали в виде IgG напрямую. В данном примере IgG тестировали в отношении улучшенных показателей кинетики без какого-либо дополнительного отбора на аффинность.
[898] Антитела с улучшенными показателями кинетики идентифицировали, исходя из всех стратегий, и в качестве примера приведены IL330259, IL330377, IL330388, IL330396, IL330398 и H338L293.
[899] Аминокислотные последовательности VH- и VL-доменов исходного антитела IL330101 и оптимизированного антитела к IL-33 выравнивали с известными последовательностями зародышевой типа человека в базе данных IMGT (Lefranc, M. P. et al. Nucl. Acids Res. 2009. 37 (Database issue): D1006-D1012), и ближайшая последовательность зародышевой типа была идентифицирована по сходству последовательностей. Для VH-домена из антитела IL330101 эта линия представляла собой IGHV3-21/IGHJ2. Для VL-домена таковой являлась IGLV3-25/IGLJ3. Без учета остатков Верньера (Foote, J., et al. J Mol Biol, 1992. 224: p. 487), которые оставляли без изменений, в каркасных участках VH-доменов изменения не требовались, а в каркасных участках VL-доменов требовалось 4 изменения (V3E, Т5М, A45V и V104L; нумерация по Kabat). Эти положения были изменены, как указано, с применением стандартных методик сайт-направленного мутагенеза с помощью соответствующих мутагенных праймеров. Антитела, которые подвергали введению остатков из последовательностей зародышевого типа таким образом, которые в перечне последовательностей приводятся с суффиксом 'fgl'. SEQ ID NO, соответствующие различным областям антител IL330259, H338L293, IL330377, IL330388, IL330396 и IL330398, показы в таблице 13.


Ингибирование связывание IL-33 с mAb под действием очищенных IgG
[900] Способность антител к IL-33 ингибировать связывание биотинилированного IL-33 человека, биотинилированного IL-33 мыши с FLAG®-His или IL-33 макака-крабоеда с FLAG®-His с меченным DyLight IL330101 IgG оценивали в биохимическом HTRF®-анализе (гомогенный анализ флуоресценции с временным разрешением, Cisbio International) конкурентного связывания.
[901] Образцы очищенных антител к IL-33 тестировали в отношении ингибирования связывания биотинилированного IL-33 человека, биотинилированного IL-33 мыши с FLAG®-His или биотинилированного IL-33 макака-крабоеда с FLAG®-His меченным DyLight IL330101 путем добавления 5 микролитров каждой концентрации образца в 384-луночный малообъемный планшет для анализа (Costar, 3673). Следующим шагом готовили раствор, содержащий 40 нМ меченного DyLight IL330101, и по 2,5 микролитра добавляли в планшеты для анализа (мечение проводили с применением набора (Thermo Scientific, 53051) согласно инструкциям производителя). За этим следовало добавление 2,5 микролитра раствора, содержащего 40 нМ биотинилированного IL-33 человека (Adipogen, AG-40B-0038), 2,5 нМ биотинилированного IL-33 мыши с FLAG®-His или 12 нМ биотинилированного IL-33 макака-крабоеда с FLAG®-His в комбинации с 4,6 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB). Все разведения осуществляли в буфере для анализа, содержащем 0,8 М фторида калия (VWR, 26820.236) и 0,1% бычьего сывороточного альбумина (BSA, РАА, K05-013) в PBS Дульбекко (Invitrogen, 14190185). Планшеты для анализа инкубировали в течение 4 часов при комнатной температуре, а затем 16 часов при 4 градусах Цельсия и флуоресценцию с временным разрешением считывали при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer). Данные анализировали путем расчета соотношения 665/620 нм, а затем значений % дельта F для каждого образца. Соотношение 665/620 нм применяли для введения поправки на интерференцию в образце с применением уравнения 1. Затем для каждого образца рассчитывали % дельта F с применением уравнения 2. Отрицательный контроль (неспецифическое связывание) определяли путем замещения биотинилированного IL-33 в комбинации со средством для обнаружения на основе криптата стрептавидина на средство для обнаружения на основе криптата стрептавидина в отдельности. Значения % дельта F затем использовали для расчета % специфического связывания, как описано в уравнении 3.
[902] Фигура 14А: показано ингибирование сигнала FRET, образуемого при связывании биотинилированного IL-33 человека с IL330101, с помощью возрастающих концентраций IgG1-антител к IL-33, IL330101, IL330259, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[903] Поскольку анализ конкурентного связывания эпитопов достиг своего предела чувствительности, для тестирования образцов очищенных IgG применяли анализ с применением промежуточного оптимизированного mAb IL330259. Его проводили так, как описано для тестирования очищенных scFv.
[904] Поскольку анализ конкурентного связывания эпитопов с IL330259 достиг своего предела чувствительности, для тестирования образцов очищенных IgG применяли третий анализ с применением оптимизированного mAb (H338L293). Образцы очищенных антител к IL-33 тестировали в отношении ингибирования связывания биотинилированного IL-33 человека, биотинилированного IL-33 макака-крабоеда с FLAG®-His или биотинилированного IL-33 мыши с FLAG®-His меченным DyLight H338L293 путем добавления 5 микролитров каждого образца в 384-луночный малообъемный планшет для анализа (Costar, 3673). Следующим шагом готовили раствор, содержащий 20 нМ меченного DyLight H338L293, и по 2,5 микролитра добавляли в планшеты для анализа (мечение проводили с применением набора (Thermo Scientific, 53051) согласно инструкциям производителя). За этим следовало добавление 2,5 микролитра раствора, содержащего 4 нМ биотинилированного IL-33 человека (Adipogen, AG-40B-0038), 0,8 нМ биотинилированного IL-33 мыши с FLAG®-His или 1,6 нМ биотинилированного IL-33 макака-крабоеда с FLAG®-His в комбинации с 4,6 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB). Все разведения осуществляли в буфере для анализа, содержащем 0,8 М фторида калия (VWR, 26820.236) и 0,1% бычьего сывороточного альбумина (BSA, РАА, K05-013) в PBS Дульбекко (Invitrogen, 14190185). Планшеты для анализа инкубировали в течение 4 часов при комнатной температуре, а затем 16 часов при 4°С и флуоресценцию с временным разрешением считывали при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer). Данные анализировали путем расчета соотношения 665/620 нм, а затем значений % дельта F для каждого образца. Соотношение 665/620 нм применяли для введения поправки на интерференцию в образце с применением уравнения 1. Затем для каждого образца рассчитывали % дельта F с применением уравнения 2. Отрицательный контроль (неспецифическое связывание) определяли путем замещения биотинилированного IL-33 в комбинации со средством для обнаружения на основе криптата стрептавидина на средство для обнаружения на основе криптата стрептавидина в отдельности. Значения % дельта F затем использовали для расчета % специфического связывания, как описано в уравнении 3.
[905] Фигура 14В: показано ингибирование сигнала FRET, образуемого при связывании биотинилированного IL-33 человека с H338L293, с помощью возрастающих концентраций IgG1-антител, H338L293, IL330396 и IL330388, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
Ингибирование выработки IL-6 в Huvec под действием антител к IL-33
[906] Антитела оценивали в отношении способности ингибировать стимулированную IL-33 выработку IL-6 в Huvec, как описано в примере 2.
[907] На фигуре 15А показано снижение выработки IL-6 под действием возрастающих концентраций антител (IL330101, IL330377, H338L293, IL330388, IL330396, IL330398), где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен % максимального ответа. Препараты очищенных IgG из антител ингибировали активность IL-6 максимум на ~70% в сравнении с коммерческим поликлональным антителом, которое ингибировало на 100%.
Ингибирование выработки IL-6 в мастоцитах под действием антител к IL-33
[908] Антитела оценивали в отношении способности ингибировать стимулированную IL-33 выработку IL-6 в мастоцитах, происходящих из пупочной крови человека, как описано в примере 2
[909] На фигуре 15В показано снижение выработки IL-6 под действием возрастающих концентраций антител (IL330101, H338L293, IL330388, IL330396), где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен % максимального ответа. Препараты очищенных IgG из антител ингибировали активность IL-6 на 100% в сравнении с антителом отрицательного контроля.
[910] Результаты IC50 для выработки IL-6 в HUVEC и выработки IL-6 в мастоцитах показаны в таблице 14.

Фармакологические свойства антител
[911] Выработку IL-6 в мастоцитах, полученных из пупочной крови, индуцировали под действием возрастающих концентраций IL-33 (Adipogen) с применением способа, описанного в примере 2. Этот анализ дозовой зависимости проводили в присутствии возрастающих концентраций H338L293 или IL330388 с получением кривой дозовой зависимости IL-33 со сдвигом вправо. Значения ЕС50 для IL-33 в отсутствие и в присутствии антитела рассчитывали с применением программного обеспечения GraphPad PRISM (Ла-Хойя, Калифорния, США) и рассчитывали соотношение доз (DR). Данные наносили на график как log М [антитела] (ось х) в сравнении с log [DR-1] (ось у). Это явно показывает неконкурентный профиль (изогнутый график), характерный для аллостерического модулятора. Для исследования этого данные из каждого эксперимента нормализовали и объединяли в единый набор данных. Аллостерическую модель подбирали с применением программного обеспечения Prism Graphpad и установленных Kb и значения альфа. Значения альфа были аналогичны у обоих изученных лидерных антител, показавших значение альфа, составляющее ~0,02 (т.е. максимальное снижение аффинности/эффективности IL-33 при связывании антитела является ~50-кратным). Функциональную аффинность (Kb) можно было установить для H338L293 (~4,2 нМ) и IL330388 (~1,7 нМ).
[912] На фигуре 16 показан анализ Шилда IL330388 и H338L293 при анализе выработки IL-6 в мастоцитах. Оба антитела проявляли профиль аллостерического модулятора.
Расчет аффинности связывания для антител к IL-33 с применением BIAcore
[913] Аффинность связывания иллюстративных партнеров по связыванию в виде образцов очищенных IgG с IL-33 человека, макака-крабоеда или мыши определяли посредством аффинности в растворе с применением BIAcore 2000 (GE healthcare). Биотинилированный на поверхности IL33 иммобилизовали на покрытом стрептавидином сенсорном чипе (GE healthcare; № по кат. BR-1000-32). Антитела к IL33 инкубировали с различными концентрациями немеченного IL33 и уравновешивали при 25°С в течение 48 часов. Количество свободного антитела определяли путем пропускания образцов над чипом с IL33 и измерения ответа в сравнении со стандартной кривой для антитела. Значения аффинности определяли с применением подбора аффинности в растворе в программном обеспечении BIAevaluation. Аффинности связывания антител IL330101, H338L293, IL330388, IL330396 с IL-33 человека, макака-крабоеда или мыши показаны в таблице 15.


Пример 4. Окислительно-восстановительная регуляция IL-33
Реагенты
[914] кДНК, кодирующую зрелый компонент IL-33 человека (аминокислоты 112-270); номер доступа (Swiss-Prot) O95760, синтезировали с помощью ПЦР с удлинением праймера и клонировали в pJexpress404 (DNA 2.0). Кодирующую последовательность модифицировали таким образом, чтобы она содержала 10xhis, Avitag и сайт расщепления для протеазы фактор-Ха (MHHHHHHHHHHAAGLNDIFEAQKIEWHEAAIEGR) на N-конце белка. IL33-01 с N-концевыми метками His10/Avitag (WT, SEQ ID 632) получали путем трансформации клеток BL21(DE3) E.coli. Трансформированные клетки культивировали в среде для аутоиндукции (Overnight Express™ Autoinduction System 1, Merck Millipore, 71300-4) при 37°C в течение 18 часов перед тем, как клетки собирали центрифугированием и хранили при -20°С. Клетки ресуспендировали в BugBuster (Merck Millipore, 70921-5), содержащем таблетки со смесью ингибиторов протеазы cOmplete (Roche, 11697498001), 2,5 Ед./мл нуклеазы-бензоазы (Merck Millipore, 70746-3) и 1 мг/мл рекомбинантного лизоцима. Лизат клеток очищали от примесей центрифугированием при 75000 xg в течение 2 часов при 4°С. Белки IL-33 очищали из супернатанта с помощью аффинной хроматографии с никелем в 50 мМ фосфате натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазоле, с элюированием при помощи 50 мМ фосфата натрия, рН 8,0, 300 мМ NaCl, 250 мМ имидазола. IL-33 дополнительно очищали с помощью эксклюзионной хроматографии с применением колонки Superdex 75 10/300 GL в фосфатно-солевом буфере, рН 7,4. Пиковые фракции анализировали посредством SDS-PAGE. Фракции, содержащие чистый IL-33, объединяли и концентрацию измеряли путем измерения на Nanodrop А280. Конечные образцы анализировали посредством SDS-PAGE.
[915] Для получения IL-33, освобожденного от метки (BK349), IL33-01 с N-концевой меткой His10/Avitag инкубировали с 10 единицами фактора Ха (GE healthcare 27-0849-01) на мг белка в буфере 2xDPBS при RT в течение 1 часа. IL33 без метки очищали с применением SEC-хроматографии в 2xDPBS на колонке S75 (GE healthcare 28-9893-33) при скорости потока, составляющей 1 мл/мин.
[916] Другие реагенты, перечисленные в таблице 16, получали, как описано в примере 1.

Модификации белков
[917] IgG и модифицированные рецепторные белки, применяемые в данном документе, биотинилировали через свободные амины с применением сульфо-NHS-LC-биотина EZ link (Thermo/Pierce, 21335), как описано в примере 1. Белки IL-33, применяемые в данном документе, биотинилировали через свободные остатки цистеина с применением биотина-ВМСС EZ-link (Perbio/Pierce, № продукта 21900).
IL-33 быстро теряет активность in vitro
[918] Активность IL-33 измеряли в анализах передачи сигнала (30 минут) и анализе выработки IL-6 (18-24 часов) в HUVEC, описание способов которых приведено в примерах 1 и 2 соответственно.
[919] На фигуре 17 показана активность IL-33 человека, биотинилированного по цистеину IL-33 или IL-33, предварительно обработанного средой для культивирования клеток, измеренная в анализах передачи сигнала (30 минут) и анализе выработки IL-6 (18-24 часов) в HUVEC. На фигуре 17А показано сравнение активности IL-33 человека (Adipogen), измеряемой в анализах с NFkB или IL-6, где на оси х отложена концентрация IL-33 человека в виде молярной концентрации, а на оси у отложен процент максимального ответа. IL-33 был значительно менее активным в анализах на протяжении ночи в сравнении с короткими (30-минутными) анализами. IL-33 человека с Flag®-His, биотинилированный через цистеиновые остатки, не терял активность при сравнении коротких (30-минутных) и более длинных (на протяжении ночи) анализов (фигура 17В). Для исследования этого явления IL-33 (BK349) подвергали предварительной обработке в течение 18 часов с помощью среды для культивирования клеток (ЕВМ-2 (Lonza, № СС-3156) с набором EGM-2 SingleQuot, содержащим добавки и факторы роста (Lonza, № СС-4176)) и затем сравнивали с необработанным IL-33 в отношении способности индуцировать передачу сигнала с участием NFkB. IL-33, который был предварительно обработан средой для культивирования, проявлял значительную потерю активности (фигура 17С).
Анализ IL-33 с помощью SDS-PAGE
[920] Для исследования потенциальных изменений в белке IL-33 обработанные с помощью PBS/0,1% бычьего сывороточного альбумина (BSA) или среды Дульбекко, модифицированной Исковым (IMDM), IL-33 человека (BK349 или IL-33 человека с Flag®-His) и IL-33 мыши с Flag®-His анализировали с помощью SDS-PAGE-электрофореза в восстанавливающих или невосстанавливающих условиях. Образцы вливали в 1х буфер для введения в гель NuPAGE (Invitrogen) и подвергали денатурации при 90°С в течение 3 мин. Восстановленные образцы содержали 2% бета-меркаптоэтанола. Образцы прогоняли на мини-гелях NuPAGE Novex с 12% Bis-Tris (Invitrogen) с подвижным буфером MOPS (Invitrogen) в соответствии с инструкциями производителя. Восстановленные и невосстановленные образцы прогоняли на отдельных гелях. В каждую дорожку загружали по 500 нг IL-33. Гели промывали 3х по 5 мин. на качающейся платформе с помощью ddH20 и затем окрашивали в течение 1 часа с применением EzBlue (реагент для окрашивания геля на основе кумасси бриллиантового голубого G-250, Sigma G1041). Гели обесцвечивали с помощью dH2O и сканировали с применением сканера Epson.
[921] На фигуре 18 показан SDS-PAGE IL-33 человека или мыши в восстанавливающих или невосстанавливающих условиях, перед или после обработки с помощью среды Дульбекко, модифицированной Исковым (IMDM). Отличия в кажущейся молекулярной массе IL-33 после обработки с помощью IMDM наблюдали только в невосстанавливающих условиях, что подразумевает присутствие модификаций, связанных с окислением-восстановлением, у обоих IL-33 человека и мыши. На фигуре 18А показано отличие в кажущейся молекулярной массе IL-33 человека (BK349) после обработки с помощью IMDM, которое наблюдалось только в невосстанавливающих условиях. На фигуре 18В показан IL-33 человека с Flag®-His, небиотинилированный в сравнении с биотинилированным в невосстанавливающих условиях. Отличия в кажущейся молекулярной массе наблюдали для IL-33 с Flag®-His, но не для биотинилированного по цистеину IL-33 с Flag®-His после обработки с помощью IMDM. На фигуре 18С показано отличие в кажущейся молекулярной массе IL-33 мыши с Flag®-His после обработки с помощью IMDM, которое наблюдалось только в невосстанавливающих условиях.
Масс-спектрометрический анализ и картирование дисульфидных связей
[922] Обработанную средой форму IL-33 человека очищали для дальнейшего анализа. IL-33 человека (BK349) инкубировали с 60% среды IMDM или в PBS при конечной концентрации белка, составляющей 300 мкг/мл, в течение 18 часов при 37°С. Через 18 часов IL33, обработанный средой, очищали от компонентов среды с применением эксклюзионной хроматографии (SEC) на колонке S75 16:600 Superdex (GE healthcare 28-9893-33) в 2xDPBS с применением FPLC-системы AKTAxpress (GE healthcare). Пиковые фракции анализировали с помощью SDS-PAGE и чистые фракции, не содержащие агрегаты, объединяли и анализировали с помощью LC-MS.
[923] На фигуре 19 показана очистка IL-33 человека, обработанного IMDM, с помощью SEC. Фракцию мономеров собирали для дальнейшего анализа.
LC-MS
[924] Обращенно-фазовый (RP) LC-MS-анализ осуществляли с применением системы Acquity UPLC, сопряженной с квадрупольным времяпролетным (QToF) масс-спектрометром Synapt G1 (Waters, Милфорд, США). 1 мкг очищенного белка, разведенного в 10 мМ Tris HCl, рН 8, из расчета 1 мг/мл, инъецировали в аналитическую колонку ВЕН300 С4, 50 мм × 2,1 мм, размер частиц 1,7 мкм, поддерживаемую при 65°С (Waters, Милфорд, США). Белок элюировали при постоянной скорости потока, составляющей 0,15 мл/мин., с применением 5-минутного бинарного градиента; концентрацию растворителя В первоначально повышали от 5 до 95% за 1 минуту, снижали до 20% за 2 минуты и возвращали к 5% за следующие 2 минуты. Колонку очищали перед следующей инъекцией путем периодической смены высокой (95%) и низкой (5%) концентрации растворителя В в течение 5 минут. Растворитель А (вода) и В (ацетонитрил) дополняли 0,01% (объем/объем) трифторуксусной кислоты и 0,1% (объем/объем) муравьиной кислоты. Спектры получали в диапазоне 500-4500 масса/заряд. Ключевые параметры устройства включали режим ионизации +ve, напряжение источника: 3,4 кВ, напряжение на пробоотборном конусе: 50 В, температура источника: 140°С, температура десольватации: 400°С. BioPharmaLynx (Waters, Милфорд, США) применяли для деконволюции диапазонов зарядов.
[925] На фигуре 20 показана масса исходного вещества IL-33, обработанного PBS в сравнении с IMDM, как определено с помощью LC-MS. У IL-33, обработанного IMDM, показана потеря 4 Да в сравнении с IL-33, обработанным PBS, что соответствует образованию двух дисульфидных связей.
Картирование дисульфидных связей
[926] Для каждого образца 50 мкг белка готовили из расчета 3 мг/мл в буфере, содержащем 100 мМ фосфат натрия, 1 мМ N-этилмалеимид, рН 7,0, и инкубировали в течение 20 минут при комнатной температуре. Высушенные образцы ресуспендировали в 7 М гуанидине HCl, 100 мМ NaCl, 10 мМ фосфате натрия и инкубировали при 37°С в течение 30 минут. Денатурированный белок разводили до 0,3 мг/мл и расщепляли с помощью Glu-C при соотношении E:S, составляющем 1:50, в 2 М гуанидине, 100 мМ фосфате натрия, 0,1 мМ EDTA, рН 7,0, при 37°С. Через 2 часа добавляли вторую такую же аликвоту Lys-C. После дополнительных 2 часов продукт расщепления разделили; для анализа в восстановленном состоянии продукт расщепления инкубировали с 50 мМ дитиотреитолом в течение 15 мин. при комнатной температуре. Восстановленные и невосстановленные образцы анализировали с помощью RP LC-MS с применением Acquity UPLC, сопряженной с QToF-масс-спектрометром Synapt G2 (Waters, Милфорд, США). Для каждого образца 5 мкг продукта расщепления под действием Lys-C инъецировали в аналитическую колонку ВЕН300 С18, 150 мм × 2,1 мм, размер частиц 1,7 мкм, поддерживаемую при 55°С (Waters, Милфорд, США). Пептиды элюировали при постоянной скорости потока, составляющей 0,2 мл/мин., с применением 75-минутного бинарного градиента; концентрацию растворителя В повышали от 0% до 35%. Колонку очищали перед следующей инъекцией путем периодической смены высокой (95%) и низкой (5%) концентрации растворителя В в течение 5 минут. Растворитель А (вода) и В (ацетонитрил) дополняли 0,02% (объем/объем) трифторуксусной кислоты. Спектры получали в диапазоне 50-2000 масса/заряд с применением независимого от данных режима сбора и обработки данных. Низко- и высокоэнергетические спектры обрабатывали с применением BioPharmaLynx (Waters, Милфорд, США).
[927] На фигуре 21 показано картирование дисульфидных связей в IL-33 человека, обработанном IMDM. На фигуре 21А показаны объединенные, подвергнутые деконволюции масс-спектры на основании анализа DSB IL-33 с помощью пептидного картирования невосстановленных и восстановленных образцов после расщепления под действием Lys-C. На фигуре 21В показаны выделенные спектры цистеин-содержащих пептидов. Пептиды, присущие только восстановленным и невосстановленным образцам, выделены зеленым и голубым цветом соответственно. Данные согласовывались с образованием двух дисульфидных мостиков. Одна идентифицированная молекула характеризовалась мостиками между остатками цистеина С208-С249 и С227-С232 соответственно. Однако главный пик не был выделен, и могут существовать другие молекулы. На фигуре 21С показаны последовательности пептидов с дисульфидными связями с помощью анализа IL-33 с дисульфидными связями с помощью пептидного картирования в невосстановленной и восстановленной форме, после расщепления под действием Lys-C. Дисульфидные связи изображены как два дефиса (--). Ошибочные расщепления под действием Lys-C обозначены квадратными скобками.
ЯМР-анализ IL-33 с дисульфидными связями
[928] Исходя из описанной структуры IL-33 (Lingel, A. et al. Structure 17, 1398-1410 (2009); Liu, X. et al. Proc. Natl. Acad. Sci. U.S.A. 110, 14918-14923 (2013)), цистеиновые остатки не находятся в достаточно непосредственной близости, чтобы образование дисульфидных связей происходило без значительного изменения конформации. Для исследования этого осуществляли ЯМР-анализ гетероядерной многоквантовой когерентности (HMQC).
Получение белков15N-IL-33
[929] ДНК, кодирующую IL-33 дикого типа с N-концевой 6His-меткой и сайтом расщепления для протеазы TEV (SEQ ID. 633), применяли для трансформации клеток BL21 Gold E.coli. Трансформированные клетки культивировали при 37°С в минимальной среде М9, дополненной порошком15N-IsoGro™ из расчета 5 г/л, до тех пор, пока они не достигали значения OD 600 нм, составляющего от 0,6 до 0,8, в этот момент экспрессию белка индуцировали путем добавления 100 мМ IPTG. Культивирование продолжали при 18°С в течение дополнительных 20 часов, перед тем как клетки собирали центрифугированием и хранили при -80°С. Клетки ресуспендировали в 50 мМ фосфате натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазоле, 5 мМ бета-меркаптоэтаноле, содержащих таблетки с ингибиторами протеазы cOmplete (Roche, 11697498001), 2,5 Ед./мл нуклеазы-бензоазы (Merck Millipore, 70746-3) и 1 мг/мл рекомбинантного лизоцима. Ресуспендированные клетки лизировали с применением клеточного дезинтегратора Constant Systems при 25 kpsi и очищали от примесей центрифугированием при 75000 xg в течение 2 часов при 4°С. IL-33 очищали из супернатанта с помощью аффинной хроматографии с никелем в 50 мМ фосфате натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазоле, 5 мМ бета-меркаптоэтаноле с элюированием при помощи 50 мМ фосфата натрия, рН 8,0, 300 мМ NaCl, 250 мМ имидазола, 5 мМ бета-меркаптоэтанола. Элюированный белок инкубировали с протеазой TEV и диализировали в 50 мМ фосфат натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазол, 5 мМ бета-меркаптоэтанол при 4°С. Белок, освобожденный от метки, отделяли от нерасщепленного IL-33 с помощью аффинной хроматографии с никелем в 50 мМ фосфат натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазол, 5 мМ бета-меркаптоэтанол. IL-33 дополнительно очищали с помощью эксклюзионной хроматографии с применением колонки HiLoad 16/60 Superdex 75 (GE healthcare) в 20 мМ фосфате натрия, рН 6,5, 100 мМ NaCl, 5 мМ бета-меркаптоэтаноле с применением FPLC-системы AKTAxpress (GE healthcare). Пиковые фракции анализировали посредством SDS-PAGE.
[930] Фракции, содержащие чистый IL-33, объединяли и концентрацию измеряли с помощью измерения на Nanodrop А280. Для ЯМР-анализа белок концентрировали с применением концентратора-центрифуги Amicon с границей отсечения по молекулярной массе 10000 до конечной концентрации, составляющей 9,5 мг/мл.
[931] Очищенный меченный15N белок в PBS, рН 7,4, инкубировали с 60% среды IMDM при конечной концентрации белка, составляющей 0,28 мг/мл, в течение 18 часов при 37°С. Через 18 часов белок концентрировали с применением концентратора-центрифуги Amicon с границей отсечения по молекулярной массе 10000 до концентрации, составляющей 0,8 мг/мл. Затем белок очищали с помощью эксклюзионной хроматографии с применением HiLoad 16/60 Superdex 75 в PBS, рН 7,4. Пиковые фракции анализировали с помощью SDS-PAGE и чистые фракции, не содержащие агрегаты, объединяли. Наконец, для ЯМР-анализа белок концентрировали с применением концентратора-центрифуги Amicon с границей отсечения по молекулярной массе 10000 до концентрации, составляющей 1,8 мг/мл (100 мкМ).
ЯМР-анализ
[932] ЯМР-спектры регистрировали при 298 K на спектрометре Bruker Avance 600 МГц под управлением Topspin 2.3, оснащенном 5 мм криодатчиком TCI с градиентами вдоль оси Z. Образец15N-меченного IL33 WT готовили, как описано, с добавлением 5% оксида дейтерия, чтобы обеспечить стабилизацию образца. Иллюстративные корреляционные спектры1H-15N получали с использованием последовательности импульсов SOFAST-HMQC (Schanda, Р; Brutscher, В; Very fast two-dimensional NMR spectroscopy for real-time investigation of dynamic events in proteins on the time scale of seconds, J. Am. Chem. Soc. (2005) 127, 8014-5) с (F2×F1) 1024×64 комплексных точек (в состоянии - режим TPPI), шириной полосы качания 9615×1460 Гц, временем сбора и обработки данных 53,4 мс × 43,8 мс.
[933] На фигуре 22А показан анализ с помощью SDS-PAGE IL33 WT, обработанного IMDM. Показаны результаты SDS-PAGE восстановленного и невосстановленного IL33 WT, обработанного IMDM, перед и после концентрирования для ЯМР.
[934] На фигуре 22В показан ЯМР-анализ IL33 WT. Перекрывание HMQC-спектров1Н-15N для 0,1 мМ15N-меченного IL33 WT до и после обработки средой IMDM нанесено на график черным и красным цветами соответственно. Сравнение двух спектров указывает на совершенно иную и менее упорядоченную структуру после обработки IMDM.
Спектроскопия кругового дихроизма (CD).
[935] Для подтверждения изменения конформации и дополнительного исследования проводили анализ с помощью спектроскопии кругового дихроизма (CD). CD-анализ в дальнем УФ-диапазоне и ближнем УФ-диапазоне осуществляли на устройстве Jasco-815 (Истон, Мэриленд). В случае CD в дальнем УФ-диапазоне спектры регистрировали на протяжении диапазона длин волны 180-260 нм в кювете с длиной оптического пути 1 мм при концентрации образца, составляющей 0,14 мг/мл и 0,12 мг/мл соответственно для redIL-33 и DSB IL-33, при 20°С в буферном растворе, содержащеим 10 мМ фосфат, рН=6,9. В случае CD в ближнем УФ-диапазоне спектры регистрировали на протяжении диапазона длин волны 260-350 нм в кювете с длиной оптического пути 10 мм при концентрации образца, составляющей 1,38 мг/мл и 0,89 мг/мл соответственно для redIL-33 и DSB IL-33, при 20°С в буферном растворе DPBS. CD-спектры буферного раствора регистрировали и вычитали из всех спектров образцов для внесения поправки на устройство, кювету и фоновые эффекты. Для деконволюции спектров в элементы вторичной структуры использовали программное обеспечение CD Pro.
[936] Фигура 22С. Спектроскопия кругового дихроизма (CD) в близком УФ-диапазоне. Спектры регистрировали на протяжении диапазона длин волны 260-350 нм. Конечные спектры представляли собой усреднение 4 изображений. Ароматические аминокислоты и полосы поглощения дисульфидных связей адаптировали на основании Kelly (Kelly S.М. et al. How to study proteins by Circular Dichroism. Biochimica et Biophysica Acta, 1751, 119-139 (2005)). Отличие, наблюдаемое в эллиптичности вблизи поглощения Trp, согласуется с изменением окружения одиночного триптофана (W193), что демонстрирует изменения в третичной структуре этой области у восстановленного и DSB IL-33. Отличие в интенсивности вблизи 260 нм согласуется с введением дополнительных хромофоров вследствие образования дисульфидной связи.
Фигура 22D. Ключевые признаки IL-33. Trp193, остатки цистеина и сайт связывания ST2 (Liu, X. et al. Structural insights into the interaction of IL-33 with its receptors. Proc. Natl. Acad. Sci. U.S.A. 110, 14918-14923 (2013)) указаны в пределах известной структуры IL-33 (Lingel 2009)
[937] Фигура 22Е. Спектроскопия кругового дихроизма (CD) в дальнем УФ-диапазоне. Спектры регистрировали на протяжении диапазона длин волны 190-260 нм. Конечные спектры представляли собой усреднение 8 изображений. Спектры в дальнем УФ-диапазоне согласуются с преимущественно β-складчатой вторичной структурой, обнаруженной ранее у данного семейства белков (Chang В.S. et al, Formation of an active dimer during storage of interleukin-1 receptor antagonist in aqueous solution. Biophysical Journal. 71, 3399-3406 (1996); Craig S. et al. Conformation, Stability and folding of Interleukin1β. Biochemistry. 26, 3570-3576 (1987); Hailey K.L. et al. Pro-interleukin (IL)-1β shares a core region of stability as compared with mature IL-1β while maintaining a distinctly different configurational landscape. J. Biol. Chem. 284. 26137-26148 (2009); Hazudat D. et al. Purification and characterisation of Human Recombinant Precursor Interleukin 1β. J. Biol. Chem. 264, 1689-1693 (1989); Meyers C.A. et al, Purification and characterization of Human recombinant interleukin-1β. J. Biol. Chem. 262, 11176-11181 (1987)). Спектры значительно отличаются, что демонстрирует изменение вторичной структуры DSB IL-33 по сравнению с восстановленным IL-33.
[938] CD-спектры указывают на значительное изменение конформации между формами IL-33. Спектры redIL-33 согласовывались с опубликованными данными. Спектры DSB-IL-33 согласовывались со структурированным белком, который отличался от восстановленной формы. Для картирования областей, которые могли быть наиболее видоизмененными у восстановленной и DSB-IL-33, осуществляли масс-спектрометрию с водород-дейтериевым обменом.
[939] Масс-спектрометрия с водород-дейтериевым обменом (HDX-MS).
[940] Белки разводили до 3,5 мкМ в фосфатно-солевом буфере, рН 7,4. Этот исходный раствор применяли для запуска экспериментов по мечению путем 10-кратного разведения с помощью дейтерированного (10 мМ фосфат натрия, pD 6,6) водного растворителя. Первоначальные эксперименты по картированию проводили, чтобы соотнести молекулы из масс-спектров с последовательностями пептидов, полученных под действием пепсина из IL33. Это выполняли, в значительной степени, как описано21. Вкратце, протонированный разведенный белок смешивали 1:1 с раствором для блокирования (100 мМ фосфат калия, рН 2,55, 0,1 М ТСЕР, 1°С), так что конечный рН смеси составлял 2,55. Подвергнутый блокированию белок инъецировали в Waters HDX Manager, содержащую колонку с иммобилизированным пепсином (2,0×30 мм; Poroszyme, Life Technologies), С18-колонку для захвата (VanGuard ACQUITY ВЕН 2,1×5 мм; Waters) и аналитическую С18-колонку (1,0×100 мм ACQUITY ВЕН; Waters). Подвижными фазами были 0,1% муравьиная кислота в H2O (А) и 0,1% муравьиная кислота в ACN (В), так что их рН составлял 2,55. Белок наносили на колонку с пепсином и колонку для захвата в буфере А со скоростью 100 мкл/мин. и элюировали из аналитической колонки с помощью линейного градиента 3-40% В при скорости 40 мкл/мин. Последовательности пептидов определяли на основании данных MSE-фрагментов с помощью Protein Lynx Global Server (Waters) 3.0.2 и DynamX 3.0 (Waters). Данные по мечению получали также, как данные по секвенированию, за исключением того, что масс-спектрометр был установлен только на получение MS-изображений. Данные на уровне пептидов анализировали в DynamX и MatLab (Mathworks).
На фигуре 23 показан анализ восстановленного и DSB IL-33 с помощью спектрометрии с водород-дейтериевым обменом (HX-MS). Фигура 23А. Сравнение частичного водородного обмена (на дейтерий) у восстановленного IL-33 (левая панель) и DSB IL-33 (правая панель). Данные нанесены на опубликованную структуру IL-33(lingel 2009) в обоих случаях для целей сравнения. Гэпы в перекрытии последовательностей, для которых нельзя было получить данные HX-MS, выделены синевато-серым цветом. Боковые цепи цистеиновых остатков показаны как палочки. На фигуре 23В показана структурная модель на основании разных данных HX-MS с наложенным сайтом связывания ST2 (красный и пурпурный).(Liu 2013) Темно-синий указывает на области с повышенным водородным обменом в DSB IL-33 относительно восстановленного IL-33. Сайт 1 связывания ST2 представляет собой область наибольшего отличия в H/D обмене, и, по-видимому, его структура была изменена.
Сравнение связывания восстановленного DSB и DSB IL-33 с ST2 (BIAcore)
[941] IL-33 с дисульфидными связями, по видимому, имеет структуру, которая очень сильно отличается от таковой у восстановленной ST2-связывающей формы IL-33 (фигура 22, 23), и переход в форму с дисульфидными связями был связан с потерей функциональной активности (фигура 17С). Для исследования этого форму IL-33 с дисульфидными связями тестировали в отношении способности связывать ST2 с помощью анализа BIAcore. Прямое связывание IL-33 с внеклеточным доменом ST2 определяли с помощью поверхностного плазмонного резонанса с применением BIAcore 2000 (GE healthcare). ST2 иммобилизировали посредством Fc-метки с применением антитела захвата к Fc человека (GE healthcare BR-1003-39) на сенсорном чипе СМ5 (GE healthcare BR-1003-99) с получением стабильной поверхности с примерно 150 RU. IL-33 пропускали над поверхностью при скорости 30 мкл/мин. в течение трех минут для определения значений скорости ассоциации. Диссоциацию измеряли путем пропускания буфера при скорости 30 мкл/мин. в течение 15 минут. Сенсограммы интерпретировали с применением программного обеспечения BIAevaluation и показатели кинетики определяли с применением сенсограмм с вычитанием двух контрольных значений с применением модели связывания 1:1 (Ленгмюр).
[942] На фигуре 24А показано связывание redIL-33 с ST2. Показаны сенсограммы от 7,8 нМ до 0,24 нМ, что дает KD, составляющую 0,2 нМ.
[943] На фигуре 24В показано связывание IL-33 с дисульфидными связями (IL33-DSB) с ST2. Показаны сенсограммы от 500 нМ до 0,24 нМ, при этом видимого связывания не наблюдали.
[944] Утрата связывания с ST2 и активности позволила высказать гипотезу, что окисление могло представлять собой механизм для прекращения активности IL-33 и ограничения продолжительности ST2-зависимых иммунных ответов in vivo.
Обнаружение форм IL-33
[945] Чтобы убедиться, что форма IL-33 с дисульфидными связями действительно существует in vivo, мы применяли три различные коммерческие анализы для обнаружения IL-33 (2 для IL-33 человека и один для IL-33 мыши). DuoSet ELISA для IL-33 человека и мыши (RnD Systems) преобразовывали в формат MSD (MesoScale Discovery, Роквилл, Мэриленд). Концентрации для покрытия антителами захвата были следующими: pAb к IL-33 мыши, 37,5 мкг/мл; pAb к IL-33 человека, 18 мкг/мл. Антитело захвата разводили в PBS с 0,03% Triton Х-100 и по 5 мкл наносили в виде пятна на стандартные планшеты для связывания (Meso Scale Discovery, Роквилл, Мэриленд) в центр каждой лунки и оставляли сушиться на протяжении ночи при комнатной температуре. Планшеты промывали х3 в PBS-Tween и блокировали с помощью 25 мкл разбавителя для анализа путем герметизации планшетов и инкубации в течение 30 минут при комнатной температуре со встряхиванием (450 об./мин.). По 25 мкл образцов или калибровочного стандарта, разведенных в разбавителе для анализа, переносили в блокированные планшеты для анализа, которые инкубировали в течение 2 часов при комнатной температуре со встряхиванием (450 об./мин.). Планшеты промывали х3 в PBS-Tween и добавляли 25 мкл реагента для обнаружения (антитело обнаружения со стрептавидин-SulfoTag, оба разведенные до 1 мкг/мл в разбавителе для антител). Планшеты запечатывали и инкубировали в течение 1 часа при RT со встряхиванием. Планшеты промывали х3 в PBS-Tween. Добавляли 150 мкл буфера для считывания Т, разведенного до 2Х в дистиллированной воде. Планшеты считывали в пределах 15 минут (Meso Scale Discovery, Роквилл, Мэриленд).
[946] Анализ для IL-33 человека от Millipore (№ по кат. HTH17MAG-14K, партия 2159117) осуществляли в соответствии с инструкциями производителя. Вкратце, стандарты и образцы IL-33 разводили в буфере для анализа и инкубировали с гранулами в течение 1 часа при комнатной температуре со встряхиванием (500 об./мин.), защищенными от света. Содержимое лунок удаляли и их промывали х2 с помощью 200 мкл буфера для отмывки. В лунку добавляли по 25 мкл антитела обнаружения и планшеты инкубировали в течение 1 часа при комнатной температуре. Добавляли 25 мкл стрептавидина-РЕ (без промывки) и планшеты инкубировали в течение дополнительных 30 минут со встряхиванием (850 об./мин.) и защитой от света. Содержимое лунок удаляли и их промывали х2 с помощью 200 мкл буфера для отмывки. Образцы ресуспендировали в 125 мкл буфера для анализа, накрывали и встряхивали при 850 об./мин. в течение 30 секунд. Образцы анализировали на Bio-Plex 200 (BioRad). Планшет считывали при низкой RP1, с подсчетом 50 гранул на область (область 44), с дублетными рамками обнаружения, установленными на 5000 (низкий) и 25000 (высокий).
[947] Фигура 25. Показано исследование трех коммерческих ELISA-анализов в отношении IL-33 для обнаружения форм восстановленного IL-33 и IL-33 с дисульфидными связями. Также показано воздействие ST2 на подавление сигнала анализа как для восстановленной формы, так и для формы с дисульфидными связями. На фигуре 25А и В показано, что два коммерческих анализа в отношении IL-33 человека преимущественно обнаруживают форму IL-33 с дисульфидными связями (IL33-DSB), что позволяет предположить, что она является основной молекулой, которую другие исследователи измеряли в ex vivo образцах от человека до настоящего времени. Сигнал анализа в случае 'восстановленного', но не окисленного/IL-33 с дисульфидными связями может элиминироваться при добавлении sST2. На фигуре 25С показан анализ в отношении IL-33 мыши, который обнаруживает как восстановленную, так и окисленную формы IL-33 мыши. Сигнал анализа в случае 'восстановленного', но не окисленного IL-33 может элиминироваться при добавлении sST2.
[948] Поскольку невозможно было идентифицировать коммерческий анализ, специфический в отношении восстановленной, активной для ST2 формы IL-33 человека, авторы настоящего изобретения разработали свои собственные новые анализы. mAb IL330425 (SEQ ID NO 62 и 67) или mAb IL330004 (SEQ ID NO 12 и 17) применяли в качестве антител захвата. Захваченный IL-33 обнаруживали с помощью биотинилированного sST2.Fc (R&D systems) или биотинилированного IL330425 (SEQ ID NO 62 и 67) соответственно. Антитело захвата разводили до 150 мкг/мл в PBS с 0,03% Triton Х-100, и по 5 мкл наносили в виде пятна на стандартные планшеты для связывания (Meso Scale Discovery, Роквилл, Мэриленд) в центр каждой лунки, и оставляли сушиться на протяжении ночи при комнатной температуре. Планшеты промывали х3 в PBS-Tween и блокировали с помощью 25 мкл разбавителя для анализа путем герметизации планшетов и инкубации в течение 30 минут при комнатной температуре со встряхиванием (450 об./мин.). По 25 мкл образцов или калибровочного стандарта, разведенных в разбавителе для анализа, переносили в блокированные планшеты для анализа, которые инкубировали в течение 2 часов при комнатной температуре со встряхиванием (450 об./мин.). Планшеты промывали 3Х в PBS-Tween и добавляли 25 мкл реагента для обнаружения (антитело обнаружения со стрептавидин-SulfoTag, оба разведенные до 1 мкг/мл в разбавителе для антител). Планшеты запечатывали и инкубировали в течение 1 часа при RT со встряхиванием. Планшеты промывали х3 в PBS-Tween. Добавляли 150 мкл буфера для считывания Т, разведенного до 2Х в дистиллированной воде. Планшеты считывали в пределах 15 минут (Meso Scale Discovery, Роквилл, Мэриленд).
[949] На фигуре 26А, В показаны ELISA-анализы, которые являются специфическими в отношении обнаружения восстановленного IL-33. Обнаружения формы с дисульфидными связями не наблюдали.
Зависимость от времени преобразования в форму IL-33 с дисульфидными связями
[950] Анализы, обнаруживающие различные формы IL-33, как описано выше, применяли для отслеживания зависимости от времени преобразования из redIL-33 в его форму с дисульфидными связями. 10 мкг/мл redIL-33, освобожденного от метки, инкубировали в 100% сыворотке крови человека, PBS/1% BSA или IMDM/1% BSA при 37°С. В моменты времени t=0, 15 минут, 30 минут, 1 час, 2 часа, 4 часа, 6 часов, 8 часов и 24 часа аликвоту в 10 мкл извлекали и добавляли к 90 мкл PBS/1% BSA (разведение 1 к 10 до 1 мкг/мл), полученное разделяли на аликвоты 3×30 мкл и подвергали быстрому замораживанию на сухом льду перед хранением при -80°С. Образец в момент t=0 также готовили свежим непосредственно перед ELISA-анализом в качестве контроля в отношении цикла замораживания/оттаивания. Образцы анализировали с применением MSD-анализа для цитокинов человека (R&D Systems) и анализа IL33004/IL330425-биотин, описанных выше, для измерения IL-33 с дисульфидными связями и восстановленного соответственно. Вместе эти анализы позволили отслеживать преобразование из восстановленной в форму IL-33 с дисульфидными связями.
[951] Для подтверждения результата ELISA образцы IL-33, собранные в зависимости от времени, анализировали с помощью вестерн-блоттинга. Образцы подвергали SDS-PAGE в восстанавливающих или невосстанавливающих условиях. Образцы вливали в 1х буфер для введения в гель NuPAGE (Invitrogen) и подвергали денатурации при 90°С в течение 3 минут. Восстановленные образцы содержали 2% бета-меркаптоэтанола. Образцы прогоняли на мини-гелях NuPAGE Novex с 12% Bis-Tris (Invitrogen) с подвижным буфером MOPS (Invitrogen) в соответствии с инструкциями производителя. Восстановленные и невосстановленные образцы прогоняли на отдельных гелях. В каждую дорожку загружали по 100 пг IL-33. Белки переносили на нитроцеллюлозные мембраны (Invitrogen, № по кат. IB3010-02) и обнаруживали посредством вестерн-блоттинга с pAb к IL-33 (R&D systems).
[952] На фигуре 27 показана зависимость от времени сигнала IL-33 человека при инкубации в IMDM или сыворотке крови человека. Фигура 27А. ELISA в отношении IL-33 (IL33004/IL330425-биотин и MSD-анализы в отношении цитокинов человека от R&D systems) применяли для обнаружения восстановленного и IL-33 с дисульфидными связями соответственно. Фигура 27В. Вестерн-блоттинг анализ применяли для обнаружения восстановленной формы и формы IL-33 с дисульфидными связями. Преобразование в форму IL-33 с дисульфидными связями происходило быстро, с 50% преобразованием за 1-2 часа. Исчезновение восстановленного IL-33 хорошо коррелировало с появлением окисленного IL-33 как в ELISA-анализе, так и в вестерн-блоттинг анализе.
Получение гуманизированных трансгенных мышей с IL-33
[953] Для изучения характеристик и времени существования эндогенного IL-33, применяли трансгенную мышь, у которой ген IL-33 мыши замещен на ген IL-33 человека. Гуманизированных трансгенных мышей с IL-33 получали, как описано ниже. Вкратце, фрагменты генома мыши (полученные из библиотеки C57BL/6J RPCIB-731 ВАС), фрагмент генома человека (полученный из библиотеки человека RPCIB-753 ВАС) и выбранные признаки (такие как сайты рекомбинации и селективные маркеры) объединяли с получением нацеливающего вектора (данные не показаны).
[954] Нацеливающий вектор линеаризовали с помощью BstBI и вводили с помощью электропорации в линию ES-клеток Balb/cJ (Balb/c.2) в TaconicArtemis и клоны ES-клеток отбирали с помощью пуромицина (положительная селекция) и ганцикловира (отрицательная селекция). Затем полученные устойчивые к пуромицину клоны ES-клеток подвергали скринингу с помощью комбинации ПРЦ- и Саузерн-блоттинг анализа для идентификации клонов ES, должным образом подвергнутых нацеливанию. Их размножали и замораживали в жидком азоте.
[955] После введения гормонов самок C57BL/6 с суперовуляцией скрещивали с самцами C57BL/6. Бластоцисты выделяли из матки в момент dpc 3,5. Для микроинъекции бластоцисты помещали в каплю DMEM с 15% FCS под минеральное масло. Пьезоэлектрическую пипетку для микроинъекции с плоским кончиком, имеющую внутренний диаметр 12-15 микрометров, применяли для инъекции 10-15 подвергнутых нацеливанию ES-клеток мышей BALB/c в каждую бластоцисту. После регенерации по 8 инъецированных бластоцист переносили в каждый рог матки самок NMRI с ложной беременностью на стадии 2,5 дня после коитуса. Химеризм измеряли у химер (G0) по вкладу ES-клеток в окраску шерсти хозяина C57BL/6 (белый/черный). Мышей с высокой степенью химеризма скрещивали с самками линии BALB/cJBomTac, мутантной по наличию гена Flp-рекомбиназы (линия с делецией Flp). Передачу зародышевой линии идентифицировали по цвету шерсти, что определяется присутствием белого потомства (G1), т.е. линии BALB/c. Действительную передачу зародышевой линии подтверждали с помощью ПЦР-генотипирования с применением праймеров, специфических в отношении подвергнутого нацеливанию аллеля (данные не показаны).
Существование окисленной/восстановленной форм IL-33 in vivo.
[956] Модели с применением индуцированного Alternaria alternata воспаления дыхательных путей у мышей были описаны ранее (Kouzaki et al. J. Immunol. 2011, 186: 4375-4387; Bartemes et al J Immunol, 2012, 188: 1503-1513). Самцов или самок мышей дикого типа или гуманизированных мышей с IL-33 (6-10 недель) подвергали краткосрочной анестезии с помощью изофлурана и им вводили либо 25 мкг экстракта Alternaria alternata (ALT) (Greer, Ленор, Северная Каролина), либо носитель интраназально в общем объеме 50 мкл. В несколько моментов времени после провокационной пробы с помощью ALT мышей подвергали терминальной анестезии с помощью пентобарбитала натрия перед проведением бронхоальвеолярного лаважа (BAL). Жидкость бронхоальвеолярного лаважа (BALF) собирали посредством лаважа (0,3 мл, 0,3 мл и 0,4 мл) через трахеальную канюлю. BALF центрифугировали и супернатант анализировали на присутствие окисленной/восстановленной форм IL-33 с применением анализов, описанных выше. Все операции проводили в соответствии со стандартами этических принципов и условий содержания животных Министерства внутренних дел Великобритании и на основании соответствующей лицензии проекта.
[957] На фигуре 28 показан анализ BALF от гуманизированных мышей с IL-33, собранной в различные моменты времени после интраназальной провокационной пробы с ALT, с применением комбинации из нескольких ELISA-анализов. Анализы (А) от Millipore, (В) от R&D system и (С) с применением IL330425/sST2-биотин применяли для измерения IL-33 в присутствии или в отсутствие sST2 (графики слева). Сигналы в присутствии sST2 (сигнал от восстановленной фракции IL-33 исключали) сравнивали со стандартным IL-33 с дисульфидными связями для количественной оценки уровней IL-33 с дисульфидными связями. Сигнал восстановленного IL-33 рассчитывали как разницу сигнала между измерениями IL-33 в присутствии и в отсутствие ST2 при количественной оценке в сравнении со стандартным восстановленным IL-33. Оценки для восстановленного IL-33 показаны на графиках справа. Во всех анализах показано, что высвобождаемый IL-33 находился преимущественно в его восстановленной форме, при этом максимальное содержание наблюдалось между 5 и 30 мин., после чего следовало быстрое снижение, и он становился не поддающимся обнаружению к 120 минуте. Напротив, IL-33-DSB постепенно повышался от момента времени 0, достигая пикового значения содержания на 30-120 минутах и исчезая к 24 часам. Эти данные согласуются с моделью, согласно которой IL-33 высвобождается в виде восстановленной формы и затем быстро окисляется in vivo до IL33-DSB.
[958] На фигуре 29 показан анализ BALF от мышей BALB/c дикого типа, собранной в различные моменты времени после интраназальной провокационной пробы с помощью ALT. Фигура 29A. ELISA в отношении IL-33 мыши (R&D systems) применяли для измерения IL-33 в присутствии или в отсутствие sST2 (IL-33 мыши, обработанный средой, применяли в качестве стандартной кривой). Фигура 29В. Сигналы в присутствии sST2 (сигнал от восстановленной фракции IL-33 исключали) сравнивали со стандартным IL-33 мыши, обработанным средой, для количественной оценки уровней окисленного IL-33. Сигнал восстановленного IL-33 рассчитывали как разницу сигнала между измерениями IL-33 в присутствии и в отсутствие ST2 при количественной оценке в сравнении со стандартным восстановленным IL-33 мыши. Данные показывают, что высвобождаемый IL-33 находился преимущественно в его восстановленной форме, при этом пик содержания наблюдался в 15 минут, после чего следовало быстрое снижение, и он становился не поддающимся обнаружению к 120 минуте. Напротив, IL-33-DSB постепенно повышался от момента времени 0, достигая пикового значения содержания на 45-60 минутах и исчезая к 24 часам. Эти данные согласуются с моделью, согласно которой IL-33 высвобождается в виде восстановленной формы и затем быстро окисляется in vivo до IL33-DSB.
Пример 5. Определение характеристик антител к IL-33
H338L293 вызывает изменение конформации
[959] Моноклональное антитело H338L293 (SEQ ID NO 182 и 187), получение которого описано в примерах 2 и 3, представляет собой аллостерический модулятор IL-33. IL-33 может значительно менять конформацию в форме с дисульфидными связями (как описано в примере 4). Следующие эксперименты демонстрируют, что mAb H338L293, по-видимому, дестабилизирует молекулу IL-33, стимулируя ее разворачивание и ускоряя преобразование в форму с дисульфидными связями. Реагенты и модификации белков, применяемые в данном документе, были такими, как описано в предыдущих примерах.
Анализ с оранжевым красителем Sypro
[960] Оранжевый краситель Sypro неспецифически связывается с гидрофобными поверхностями, и вода сильно блокирует флуоресценцию оранжевого красителя Sypro. Когда белок разворачивается, обнаженные гидрофобные поверхности связываются с красителем, что приводит к усилению флуоресценции. 5 мкМ антитела инкубировали с 20 мкМ redIL-33 при 25°С в присутствии 8х оранжевого красителя SYPRO, разведенного из 5000х исходного раствора (Life technologies, S-6650) в 1x DPBS. Флуоресценцию (возбуждение при 490 нм и испускание при 575 нм) измеряли каждую минуту с применением детектора в режиме реального времени Chromo4 (Bio-rad). Отмечали, что при инкубации redIL-33 с антителом H338L293, а не при инкубации redIL-33 или антитела отдельно, наблюдалось повышение сигнала флуоресценции, что указывает на разворачивание белка.
[961] На фигуре 30А показаны относительные единицы флуоресценции через 100 минут инкубации 5 мкМ антитела с 20 мкМ redIL33 при 25°С в присутствии 8х оранжевого красителя SYPRO. В присутствии H338L293 к redIL-33, но не IL330004 или контрольного mAb повышение сигнала флуоресценции указывает на разворачивание белка.
[962] На фигуре 30В показаны относительные единицы флуоресценции в динамике по времени после инкубации различных концентраций H338L293 с 20 мкМ redIL33 при 25°С в присутствии 8х оранжевого красителя SYPRO. Сигнал флуоресценции повышался с повышением концентрации антитела.
SDS-PAGE-электрофорез
[963] Для определения того, могло ли H338L293 влиять на образование дисульфидных связей у IL-33, IL-33 отслеживали в присутствии H338L293 путем сравнения анализа с помощью SDS-PAGE в восстанавливающих и невосстанавливающих условиях. 100 мкг/мл рекомбинантного IL-33112-270 человека (BK349) инкубировали в PBS/0,1% BSA, либо содержащем 1,5 мг/мл mAb H338L293 или mAb NIP228, либо не содержащем mAb. Образцы инкубировали в течение 20 ч при 37С в стандартном инкубаторе для культур тканей. Образцы, содержащие 1 мкг IL-33, анализировали с помощью SDS-PAGE на мини-гелях NuPAGE Novex с 12% Bis-Tris (Invitrogen) в восстанавливающих и невосстанавливающих условиях. Затем гели SDS-PAGE промывали 3×5 мин. в ddH20, инкубировали в EzBlue (Sigma G1041, средство для окрашивания белков на основе кумасси бриллиантового голубого G-250) в течение 1 ч. и обесцвечивали в ddH20 до тех пор, пока фоновый гель не становился прозрачным. Все стадии окрашивания гелей осуществляли при комнатной температуре на качающейся платформе. Гели визуализировали с применением цифрового сканера Epson.
[964] На фигуре 30С показан анализ IL-33 с помощью SDS-PAGE. В случае предварительной инкубации IL-33 с H338L293, но не с контрольным mAb или без mAb повышалось присутствие более быстро движущейся формы IL-33 с дисульфидными связями в невосстанавливающих условиях.
Ингибирование передачи сигнала с участием NFkB в Huvec под действием IgG
[965] Передачу сигнала с участием NFκB в эндотелиальных клетках пупочной вены человека в ответ на IL-33 оценивали по ядерной транслокации субъединицы p65/RelA NFkB, обнаруживаемой с помощью иммунофлуоресцентного окрашивания, как описано в примере 1. Клетки стимулировали с помощью различных концентраций IL-33 в присутствии нескольких концентраций тестируемого антитела H338L293 в течение либо 30 минут, либо 6 часов.
[966] На фигуре 31 показан эффект H338L293 в отношении простимулированной IL-33 транслокации NFkB у HUVEC. Эти результаты показывают, что как наблюдалось ранее, H338L293 не ингибировали ядерную транслокацию p65/RelA NFkB в Huvec, простимулированных с помощью IL-33, через 30 минут после стимуляции. Однако через 6 часов ингибирование наблюдалось. Результаты согласуются с тем, что H338L293 не смогло ингибировать связывание IL-33 с ST2 напрямую, но обладало способностью превращать IL-33 в форму, не связывающуюся с ST2, за несколько часов.
Ингибирование связывания IL-33 с ST2 под действием очищенных IgG
[967] Способность H338L293 ингибировать связывание IL-33 с меткой FLAG®-His с рецептором ST2 оценивали в биохимическом HTRF®-анализе конкурентного связывания (гомогенный анализ флуоресценции с временным разрешением, Cisbio International), как описано в примере 1. Тестировали два состояния. Во-первых, антитело и IL-33 добавляли в анализ одновременно, так же как и в примере 1. Как и ранее, препараты очищенных IgG были не способны ингибировать взаимодействие IL-33:ST2 при тестируемых концентрациях. Во-вторых, H338L293 предварительно инкубировали с IL-33 с меткой FLAG®-His в течение 18 часов перед добавлением в анализ. В этом случае наблюдали зависимое от концентрации ингибирование связывания IL-33:ST2. В совокупности эти данные согласуются с тем, что H338L293 преобразует IL-33 в форму, не связывающуюся с ST2, с течением времени.
[968] На фигуре 32 показано ингибирование сигнала FRET, образуемого при связывании IL-33 человека с ST2 человека, с помощью возрастающих концентраций H338L293, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания. Эти результаты показывают, что H338L293 ингибирует связывание IL-33 с ST2 только после длительной предварительной инкубации с лигандом.
Картирование эпитопов
[969] Была предпринята попытка картирования эпитопов для IgG H338L293, чтобы прояснить способ связывания IL-33 с этим IgG. Эксперименты с применением эксклюзионной хроматографии (SEC) осуществляли, чтобы пронаблюдать образование комплексов IL-33:IgG. Колонку BioSep-SES-S 2000 (300×7,4 мм, s/n 550331-4) уравновешивали с помощью PBS Дульбекко при скорости 0,5 мл мин-1 в HPLC-системе Agilent HP1100. Пики обнаруживали с применением сигнала 280 нм от диодно-матричного детектора (DAD). Эти исследования подтвердили, что образование комплекса антитело-антиген было довольно медленным, оно занимало по меньшей мере несколько часов. Как только проходило количество времени, достаточное для полного образования комплекса, к предварительно образованным комплексам IL-33:IgG добавляли трипсин, после чего следовал SEC-анализ. Расщепление под действием трипсина в течение 36 минут приводило к увеличению времени удерживания основного пика до 14,1 минуты (промежуточное значение между временем элюирования пика у не подвергнутых воздействию комплексов (13,6 мин.) и временем элюирования интактного IgG H338L292 (14,4 мин.)). Затем применяли способы масс-спектрометрии, чтобы идентифицировать минимальный эпитоп для IgG H338L293. Наблюдаемые MS-массы при исследовании на анализаторе MALDI-TOF от Shimadzu пика, захваченного через 14,1 мин., составляли 3209 и 4485,3 Да. Наблюдаемые MS-массы при исследовании на анализаторе ABI4800 MALDI-TOF составляли 3208,9 Да для пика с высокой интенсивностью, при этом также присутствовал вторичный пик с 4486,4 Да. Наблюдаемая масса родительского иона, составляющая 3206-3208 Да, и анализ на ABI4800 MS/MS-фрагментации родительских ионов с массой 3206 Да соответствовали прогнозируемому фрагменту IL-33, полученному под действием трипсина, MLMVTLSPTKDFWLHANNKEHSVELHK. Он находится в пределах общей первичной последовательности rIL-33 человека с Flag-His10 (SEQ ID NO. 627), как показано ниже: -

[970] Затем идентифицированный пептид вместе с усечением (LSPTKDFWLHANNKEHSVELHK) и скремблированными вариантами обоих синтезировали химически и применяли в подтверждающих исследованиях связывания Т100 Biacore (GE Healthcare). Белок G' (Sigma Aldrich, P4689) ковалентно связывали на поверхности сенсорного чипа СМ5 (GE Healthcare) с применением стандартных реагентов для аминного связывания в соответствии с инструкциями производителя. Поверхность с белком G' применяли для захвата H338L293 или ST2-Fc через Fc-домен с обеспечением поверхностной плотности, составляющей примерно 290 RU на цикл. Пептиды IL33, приготовленные в буфере HBS-EP+ при целом ряде концентраций, пропускали над поверхностью сенсорного чипа. Поверхность регенерировали с применением двух промывок 10 мМ раствором глицина с рН 1,7 и рН 1,5 между каждым введением антитела. Полученные сенсограммы оценивали с применением программного обеспечения для оценки Biacore Т100, версия 2.0.3 (GE Healthcare), и аппроксимировали к модели связывания Ленгмюра 1:1, с получением данных по относительному связыванию.
[971] Пептид полноразмерного синтетического эпитопа интенсивно связывался с IgG H338L293, но не с рецептором IL-33 (ST2-Fc). Оба полноразмерный и усеченный синтетические пептиды интенсивно связывались с H338L293, а скремблированные полноразмерная и усеченная варианты не связывались. Это является убедительным доказательством того, что фрагмент IL-33, идентифицированный при вырезании пептида, не является артефактом и представляет центральную зону эпитопа для H338L293. 0,625-20 нМ усеченного пептида пропускали над IgG H338L293 для определения аффинности. Получали подборы 1:1 хорошего качества, которые давали значение KD, составляющее 2,36 нМ.
[972] На фигуре 33 показано картирование эпитопов для H338L293. На верхней панели показан SEC-анализ комплексов IL33:IgG с H338L293 перед и после расщепления трипсином. На нижней панели показан усеченный пептид, который, как было определено, сильно связывается с H338L293, закрашенным черным в пределах структуры IL-33, описанной у Lingel et al 2009.
Пример 6. Мутанты IL-33 с Cys→Ser
[973] Для понимания роли четырех свободных остатков цистеина IL-33 человека в его преобразовании в форму с дисульфидными связями получали полную панель из всех возможных мутантов с заменой Cys-на-Ser. Большинство из этих мутантных молекул IL-33 демонстрировали аналогичную первоначальную активность в отношении ST2, сравнимую в таковой у IL-33 дикого типа. После инкубации в среде мутанты не проявляли более быструю миграцию в геле, что совпадало с отсутствием способности образовывать 2 дисульфидные связи. Однако утрата эффективности после обработки средой варьировала у разных мутантов.
Получение панели мутантов IL-33 с заменой цистеина на серии
[974] Молекулы кДНК, кодирующие зрелый компонент IL-33 человека (112-270); номер доступа (Swiss-Prot) O95760, и серию вариантов с мутацией 1, 2, 3 или 4 цистеиновых остатков в серии во всех комбинациях (всего 15) синтезировали с помощью ПЦР с удлинением праймеров и клонировали в pJexpress404 (DNA 2.0). Кодирующие последовательности IL-33 дикого типа (WT) и мутантного IL-33 модифицировали таким образом, чтобы они содержали 10xhis, Avitag и сайт расщепления для протеазы фактор-Ха (MHHHHHHHHHHAAGLNDIFEAQKIEWHEAAIEGR) на N-конце белков.
[975] ДНК, кодирующую мутанты IL-33, применяли для трансформации клеток BL21 Gold Е. coli. Трансформированные клетки культивировали при 37°С до тех пор, пока они не достигали значения OD 600 нм, составляющего 0,3-0,5. Затем культуры выращивали при 18°С до тех пор, пока они не достигали значения OD 600 нм, составляющего 0,6-0,8, в этот момент экспрессию белка индуцировали путем добавления 100 мМ IPTG. Культивирование продолжали при 18°С в течение дополнительных 20 часов, перед тем как клетки собирали центрифугированием и хранили при -80°С.
[976] Клетки ресуспендировали в 50 мМ фосфате натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазоле, 5 мМ бета-меркаптоэтаноле, содержащих таблетки с ингибиторами протеазы cOmplete (Roche, 11697498001), 2,5 Ед./мл нуклеазы-бензоазы (Merck Millipore, 70746-3) и 1 мг/мл рекомбинантного лизоцима. Ресуспендированные клетки лизировали с применением клеточного дезинтегратора Constant Systems при 25 kpsi и очищали от примесей центрифугированием при 75000 xg в течение 2 часов при 4°С. IL33 очищали из супернатанта с помощью аффинной хроматографии с никелем в 50 мМ фосфате натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазоле, 5 мМ бета-меркаптоэтаноле с элюированием при помощи 50 мМ фосфата натрия, рН 8,0, 300 мМ NaCl, 250 мМ имидазола, 5 мМ бета-меркаптоэтанола. IL33 дополнительно очищали с помощью эксклюзионной хроматографии с применением колонки Superdex 75 10/300 GL (GE Healthcare) в фосфатно-солевом буфере, рН 7,4. Пиковые фракции анализировали посредством SDS-PAGE. Фракции, содержащие чистый IL33, объединяли и концентрацию измеряли с помощью измерения на Nanodrop А280. Конечные образцы анализировали с помощью SDS PAGE и масс-спектрометрии интактного вещества. Белок подвергали быстрому замораживанию в жидком азоте.

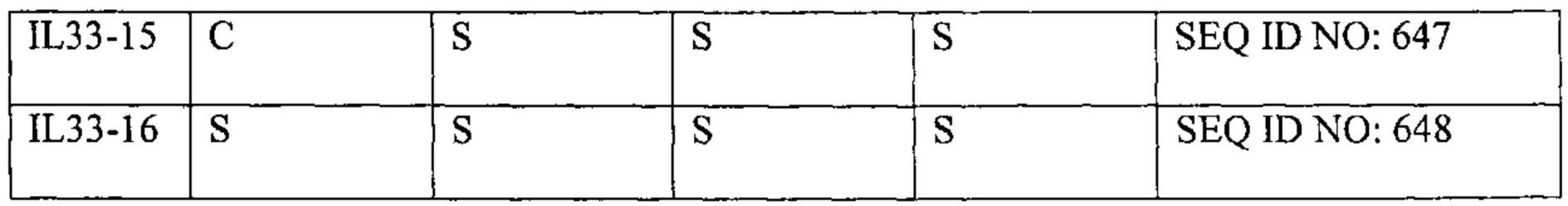
Активность мутантов IL-33 с Cys→Ser
[977] Чтобы проверить целостность белков, активность не подвергнутого обработке IL-33 дикого типа (IL33-01) и мутантов IL-33 измеряли в анализе ST2-зависимой передачи сигнала. Передачу сигнала с участием NFκB в эндотелиальных клетках пупочной вены человека (Huvec) в ответ на IL-33 оценивали по ядерной транслокации субъединицы p65/RelA NFkB, обнаруживаемой с помощью иммунофлуоресцентного окрашивания, как описано в примере 1. Чтобы изучить потерю активности после обработки средой для культивирования клеток, белки 01-16 IL-33 инкубировали на протяжении ночи в среде Дульбекко, модифицированной Исковым (IMDM), и оценивали в сравнении с не подвергнутыми обработке белками.


[978] На фигуре 34 показана активность мутантов IL-33 перед и после обработки в течение 18 часов с помощью IMDM. IL-33 дикого типа (IL33-01), который был предварительно обработан средой для культивирования, полностью утрачивал поддающуюся обнаружению активность. Все мутанты демонстрировали меньшую потерю эффективности, чем белок WT. Некоторые мутанты были полностью защищены от потери эффективности.
Высвобождение цитокинов мастоцитами человека
[979] Чтобы увидеть, являлись ли мутанты более активными в стимуляции последующих ответов в более отдаленные моменты времени in vitro, анализ выработки IL-6 мастоцитами на протяжении ночи применяли для измерения активности IL-33 человека дикого типа и выбранных мутантов. Способы анализа описаны в примере 2. В качестве примера приведены данные для IL33-11.
[980] На фигуре 35А показано, что IL33-11 обладает большей эффективностью, чем IL-33 WT в стимуляции выработки IL-6 мастоцитами человека. IL33-01 (WT) и IL33-11 без предварительной обработки применяли для стимуляции выработки IL-6 в мастоцитах, полученных из пуповинной крови человека, при различных концентрациях, на оси х отложена концентрация IL-33 в виде молярной концентрации, а на оси у отложен уровень IL-6, обнаруженный в супернатантах через 18 часов.
In vivo эффективность мутантного IL-33
[981] Самок мышей BALB/c (6-8 недель) подвергали краткосрочной анестезии с помощью изофлурана и им вводили либо 0,1-10 мкг IL-33 человека дикого типа (IL33-01, SEQ ID NO: 632), IL33-11 (SEQ ID NO: 643), либо носитель интраназально в общем объеме, составляющем 50 мкл. Через 24 часа после провокационной пробы с помощью ALT мышей подвергали терминальной анестезии с помощью пентобарбитала натрия перед проведением бронхоальвеолярного лаважа (BAL). BALF собирали и анализировали, как описано в примере 4.
[982] На фигуре 35В показано, что при интраназальном введении двойного мутанта IL33-11 требовалась только десятая часть белка в сравнении с нативным IL-33, чтобы вызывать эквивалентный ST2-зависимый ответ с IL-5. Это совпадает с длительной активностью мутанта, в отличие от более быстрой инактивации IL-33 дикого типа в среде легких мыши.
ЯМР-анализ IL33-11
[983] Чтобы исследовать отличия конформации IL33-11 и белка IL-33 человека дикого типа (IL33-01), осуществляли ЯМР-анализ.
Получение белков15N-IL-33
[984] ДНК, кодирующую IL-33 дикого типа с N-концевой 6His-меткой и сайтом расщепления для протеазы TEV (SEQ ID. 633), применяли для трансформации клеток BL21 Gold E.coli. Трансформированные клетки культивировали при 37°С в минимальной среде М9, дополненной порошком15N-IsoGro™ из расчета 5 г/л, до тех пор пока они не достигали значения OD 600 нм, составляющего от 0,6 до 0,8, в этот момент экспрессию белка индуцировали путем добавления 100 мМ IPTG. Культивирование продолжали при 18°С в течение дополнительных 20 часов, перед тем как клетки собирали центрифугированием и хранили при -80°С. Клетки ресуспендировали в 50 мМ фосфате натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазоле, 5 мМ бета-меркаптоэтаноле, содержащих таблетки с ингибиторами протеазы cOmplete (Roche, 11697498001), 2,5 Ед./мл нуклеазы-бензоазы (Merck Millipore, 70746-3) и 1 мг/мл рекомбинантного лизоцима. Ресуспендированные клетки лизировали с применением клеточного дезинтегратора Constant Systems при 25 kpsi и очищали от примесей центрифугированием при 75000 xg в течение 2 часов при 4°С. IL-33 очищали из супернатанта с помощью аффинной хроматографии с никелем в 50 мМ фосфате натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазоле, 5 мМ бета-меркаптоэтаноле с элюированием при помощи 50 мМ фосфата натрия, рН 8,0, 300 мМ NaCl, 250 мМ имидазола, 5 мМ бета-меркаптоэтанола. Элюированный белок инкубировали с протеазой TEV и диализировали в 50 мМ фосфат натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазол, 5 мМ бета-меркаптоэтанол при 4°С. Белок, освобожденный от метки, отделяли от нерасщепленного IL-33 с помощью аффинной хроматографии с никелем в 50 мМ фосфат натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазол, 5 мМ бета-меркаптоэтанол. IL-33 дополнительно очищали с помощью эксклюзионной хроматографии с применением колонки HiLoad 16/60 Superdex 75 (GE healthcare) в 20 мМ фосфате натрия, рН 6,5, 100 мМ NaCl, 5 мМ бета-меркаптоэтаноле с применением FPLC-системы AKTAxpress (GE healthcare). Пиковые фракции анализировали посредством SDS-PAGE. Фракции, содержащие чистый IL-33, объединяли и концентрацию измеряли с помощью измерения на Nanodrop А280. Для ЯМР-анализа белок концентрировали с применением концентратора-центрифуги Amicon с границей отсечения по молекулярной массе 10000 до конечной концентрации, составляющей 1,8 мг/мл (100 мкМ).
ЯМР-анализ
[985] ЯМР-спектры регистрировали при 298 K на спектрометре Bruker Avance 600 МГц под управлением Topspin 2.3, оснащенном 5 мм криодатчиком TCI с градиентами вдоль оси Z. Образец15N-меченного IL33 WT готовили, как описано, с добавлением 5% оксида дейтерия, чтобы обеспечить стабилизацию образца. Иллюстративные корреляционные спектры1H-15N получали с использованием последовательности импульсов SOFAST-HMQC (Schanda, Р; Brutscher, В; Very fast two-dimensional NMR spectroscopy for real-time investigation of dynamic events in proteins on the time scale of seconds, J. Am. Chem. Soc. (2005) 127, 8014-5) с (F2×F1) 1024×64 комплексных точек (в состоянии - режим TPPI), шириной полосы качания 9615×1460 Гц, временем сбора и обработки данных 53,4 мс × 43,8 мс.
[986] На фигуре 36 показано перекрывание HMQC-спектров1H-15N для 0,1 мМ IL33-01 и IL33-11, меченных15N, нанесенных на график красным и черным цветами соответственно. Указано расположение значимых остатков. Данные указывают на сдвиги пиков вокруг С208 и С259, как и ожидалось. Однако наблюдается большее число сдвигов пиков, чем ожидалось, от Т185 до А196, что может указывать на изменение конформации.
Пример 7. Выделение и идентификация антител к IL-33 с применением IL33-11
[987] Мутантные белки IL-33 Cys→Ser стабилизировали IL-33 в его восстановленной форме и характеризовались конформациями, отличающимися от такой дикого типа (как описано в примере 6). Мутантные белки могут обеспечивать доступность других эпитопов для антител или более длительную долговечность/стабильность эпитопов и, следовательно, могут быть применимы для выделения нейтрализующих антител к IL-33, в частности, к восстановленной форме IL-33. В данном примере устойчивый к окислению мутантный белок IL33-11 применяется для выделения антител к IL-33 с помощью фагового дисплея.
Рекомбинантные белки
[988] IL33-01 с N-концевой меткой His10/Avitag (WT, SEQ ID NO. 632), IL33-11 с N-концевой меткой
[989] IL33-11 с His10/Avitag (C208S, C259S, SEQ ID 643) и IL-33 макака-крабоеда с N-концевой меткой His10/Avitag (SEQ ID 649) получали путем трансформации клеток BL21(DE3) Е. coli. Трансформированные клетки культивировали в среде для аутоиндукции (Overnight Express™ Autoinduction System 1, Merck Millipore, 71300-4) при 37°C в течение 18 часов перед тем, как клетки собирали центрифугированием и хранили при -20°С. Клетки ресуспендировали в BugBuster (Merck Millipore, 70921-5), содержащем таблетки со смесью ингибиторов протеазы cOmplete (Roche, 11697498001), 2,5 Ед./мл нуклеазы-бензоазы (Merck Millipore, 70746-3) и 1 мг/мл рекомбинантного лизоцима. Лизат клеток очищали от примесей центрифугированием при 75000 xg в течение 2 часов при 4°С. Белки IL-33 очищали из супернатанта с помощью аффинной хроматографии с никелем в 50 мМ фосфате натрия, рН 8,0, 300 мМ NaCl, 20 мМ имидазоле, с элюированием при помощи 50 мМ фосфата натрия, рН 8,0, 300 мМ NaCl, 250 мМ имидазола. IL-33 дополнительно очищали с помощью эксклюзионной хроматографии с применением колонки Superdex 75 10/300 GL в фосфатно-солевом буфере, рН 7,4. Пиковые фракции анализировали посредством SDS-PAGE. Фракции, содержащие чистый IL-33, объединяли и концентрацию измеряли с помощью измерения на Nanodrop А280. Конечные образцы анализировали посредством SDS-PAGE.
[990] Вектор с ST2 человека, описанный в примере 1, модифицировали таким образом, чтобы он содержал ECD ST2 человека с С-концевой меткой Flag-His (SEQ ID NO 650).

Модификации белков
[991] Белки, содержащие мотив последовательности Avitag (GLNDIFEAQKIEWHE), биотинилировали с применением фермента биотин-лигазы (BirA) (Avidty, Bulk BirA) в соответствии с протоколом производителя. Все IgG и модифицированные белки без Avitag, применяемые в данном документе, биотинилировали через свободные амины с применением сульфо-NHS-LC-биотина EZ link (Thermo/Pierce, 21335), как описано в примере 1.
Отборы
[992] Отборы осуществляли, фактически как описано в примере 1, но с применением мутантных белков IL33-11, C208S, C259S. Вкратце, фаговые частицы с scFv инкубировали с биотинилированным рекомбинантным IL-33-11 в растворе (биотинилированный через Avi-метку). Частицы инкубировали с 100 нМ биотинилированного рекомбинантного IL33-11 в течение 2 часов. Затем ScFv, связанные с антигеном, захватывали на покрытых стрептавидином парамагнитных гранулах (Dynabeads®, М-280), следуя рекомендациям производителя. Несвязанные фаги отмывали посредством серии циклов отмывки с применением PBS-Tween. Удерживаемые на антигене фаговые частицы элюировали, инфицировали ими бактерий и высвобождали для следующего раунда отбора. Еще два раунда отборов осуществляли в присутствии понижающихся концентраций биотинилированного IL33-11 (50 нМ и 25 нМ).
Ингибирование связывания IL-33 с ST2 под действием неочищенных scFv
[993] Репрезентативное количество индивидуальных клонов из числа результатов отбора после двух или трех раундов отбора, описанных выше, выращивали в 96-луночных планшетах. ScFv экспрессировали в периплазме бактерий (Kipriyanov, et al. J Immunol Methods 200(1-2): 69-77 (1997)) и подвергали скринингу в отношении их ингибиторной активности в анализе связывания IL-33:ST2 на основе гомогенного FRET (резонансный перенос энергии флуоресценции) HTRF® (гомогенный анализ флуоресценции с временным разрешением, Cisbio International). Фактически способы были аналогичны описываемым в примере 1. В данном анализе образцы конкурировали с ST2 человека с меткой FLAG®-His за связывание с биотинилированным IL33-01 человека (IL33-01, SEQ ID No. 632) (дикий тип) или биотинилированным IL33-11 человека (IL33-11, SEQ ID No. 643).
[994] Образцы неочищенных антител к IL-33 тестировали в отношении ингибирования связывания биотинилированного IL-33 с ST2 с меткой FLAG®-His путем добавления 5 микролитров каждого разведения тестируемого образца антитела в 384-луночный малообъемный планшет для анализа (Costar, 3673). Следующим шагом готовили раствор, содержащий 4 нМ ST2 человека с меткой FLAG®-His и 5 нМ средства для обнаружения на основе антитела к FLAG®, меченного XL665 (Cisbio International, 61FG2XLB), и 2,5 микролитра смеси добавляли в планшет для анализа. За этим следовало добавление 2,5 микролитра раствора, содержащего 2,4 нМ биотинилированного IL33-01 или IL33-11 человека в комбинации с 1,5 нМ средства обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB). Все разведения осуществляли в буфере для анализа, содержащем 0,8 М фторида калия (VWR, 26820.236) и 0,1% бычьего сывороточного альбумина (BSA, РАА, K05-013) в PBS Дульбекко (Invitrogen, 14190185). Планшеты для анализа инкубировали в течение 1 часа при комнатной температуре и флуоресценцию с временным разрешением считывали при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer). Планшеты инкубировали в течение дополнительных 16 часов (на протяжении ночи) при температуре 4 градуса Цельсия и снова считывали флуоресценцию с временным разрешением. Отрицательный контроль (неспецифическое связывание) определяли путем замещения биотинилированного IL33-01 или IL33-11 человека в комбинации со средством для обнаружения на основе криптата стрептавидина на средство для обнаружения на основе криптата стрептавидина в отдельности. Данные анализировали, как описано в примере 1.
Ингибирование связывания IL-33 с ST2 под действием очищенных scFv
[995] Клоны одноцепочечных Fv, которые показывали ингибиторный эффект в отношении взаимодействия IL-33:ST2 в качестве неочищенных экстрактов периплазмы в оба момента времени, подвергали секвенированию ДНК (Osbourn, et al. Immunotechnology 2(3):181-96 (1996); Vaughan, et al. Nat Biotechnol 14(3):309-14 (1996)). Уникальные scFv снова экспрессировали в бактериях и очищали с помощью аффинной хроматографии (как описано в WO 01/66754). Эффективности этих образцов определяли путем конкурентного анализа серии разведений очищенного препарата в сравнении с ST2 человека с меткой FLAG® в отношении связывания с биотинилированным IL33-01 или биотинилированным IL33-11, как описано выше. Планшеты для анализа инкубировали в течение 1 часа при комнатной температуре (1-часовая инкубация), или планшеты для анализа инкубировали в течение 1 часа при комнатной температуре, а затем 16 часов при 4 градусах Цельсия (инкубация в течение ночи). Препараты очищенных scFv, которые были способны ингибировать взаимодействие IL-33:ST2 в оба момента времени, отбирали для преобразования в формат IgG.
[996] Фигура 37А: показано ингибирование сигнала FRET после 1-часовой инкубации, образуемого при связывании IL-33-01 человека с ST2 человека, с помощью возрастающих концентраций scFv-антитела к IL-33, 33v20064, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[997] Фигура 37В: показано ингибирование сигнала FRET после 1-часовой инкубации, образуемого при связывании IL33-11 с ST2 человека, с помощью возрастающих концентраций scFv-антитела к IL-33, 33v20064, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[998] Фигура 37С: показано ингибирование сигнала FRET после инкубации на протяжении ночи, образуемого при связывании IL-33-01 человека с ST2 человека, с помощью возрастающих концентраций scFv-антитела к IL-33, 33v20064, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[999] Фигура 37D: показано ингибирование сигнала FRET после инкубации на протяжении ночи, образуемого при связывании IL33-11 с ST2 человека, с помощью возрастающих концентраций scFv-антитела к IL-33, 33v20064, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
Переформатирование scFv в IgG1
[1000] Препараты очищенных scFv, которые были способны ингибировать взаимодействие IL-33:ST2, преобразовывали в формат антитела в виде целого иммуноглобулина G1 (IgG1), как описано в примере 1. С антителами, которые приводили к ингибированию в аналогичной или большей степени, чем IL330004 (пример 1, SEQ ID No. 12 и 17), проводили дальнейший анализ. Примером таких антител является 33v20064. SEQ ID NO, соответствующие различным областям антитела 33v20064, показаны в таблице 20.

Ингибирование связывания IL-33 с ST2 под действием очищенных IgG
[1001] Способность антител к IL-33 ингибировать связывание биотинилированного IL-33-01 с с рецептором ST2 с меткой FLAG®-His оценивали в в биохимическом HTRF®-анализе конкурентного связывания (гомогенный анализ флуоресценции с временным разрешением, Cisbio International), принципы которого описаны выше. Активность препаратов очищенных IgG определяли путем конкурентного анализа серии разведений очищенных IgG в сравнении с ST2 человека с меткой FLAG®-His в отношении связывания с биотинилированным IL-33-01 человека (SEQ ID No. 632).
[1002] Фигура 38А: показано ингибирование сигнала FRET после 1-часовой инкубации, образуемого при связывании IL-33 человека с ST2 человека, с помощью возрастающих концентраций IgG1-антитела 33v20064, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[1003] Фигура 38В: показано ингибирование сигнала FRET после инкубации на протяжении ночи, образуемого при связывании IL-33 человека с ST2 человека, с помощью возрастающих концентраций IgG1-антитела 33v20064, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
Ингибирование выработки IL-6 в Huvec под действием IgG
[1004] 33v20064 оценивали в отношении ингибирования стимулированной IL-33 выработки IL-6 в HUVEC, описание способов анализов приведено в примере 2. IL-33 человека дикого типа с His-Avi (IL33-01, SEQ ID No. 632) (30 нг/мл) или мутантный IL-33 с His-Avi (IL33-11, SEQ ID No. 643) (30 нг/мл) применяли для стимуляции HUVEC в присутствии варьирующих концентраций тестируемых антител.
[1005] Фигура 39А: показано ингибирование выработки IL-6 в стимулированных IL33-01 (WT) HUVEC под действием антитела 33v20064 в сравнении с IL330004 и IgG1-антителом отрицательного контроля к NIP, NIP228, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент максимального ответа. 33v20064 показало частичное ингибирование ответа на IL-33 WT при высоких концентрациях антитела, в то время как IL330004 не показало эффект.
[1006] Фигура 39В: показано ингибирование выработки IL-6 в стимулированных IL33-11 HUVEC под действием антитела 33v20064 в сравнении с IL330004 и IgG1-антителом отрицательного контроля к NIP, NIP228, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент максимального ответа. 33v20064 показало более полное ингибирование выработки IL-6, простимулированной мутантным IL33-11, в сравнении с IL330004.
Перекрестная реактивность антител к IL-33
[1007] Перекрестную реактивность антитела к IL-33, 33v20064, определяли с применением анализа связывания IL-33:mAb на основе гомогенного FRET (резонансный перенос энергии флуоресценции) HTRF® (гомогенный анализ флуоресценции с временным разрешением, Cisbio International). В данном анализе образцы конкурировали с биотинилированным IL-33-01 человека (SEQ ID No. 632) за связывание с меченным DyLight IgG 33v20064.

[1008] IL-33 человека, макака-крабоеда и мыши с FLAG®-His (описаны в примере 1) тестировали в отношении ингибирования связывания IL-33 человека с меченным DyLight 33v20064 путем добавления 5 микролитров каждого разведения образца IL-33 в 384-луночный малообъемный планшет для анализа (Costar, 3673). Следующим шагом готовили раствор, содержащий 20 нМ меченного DyLight 33v20064, и по 2,5 микролитра добавляли в планшет для анализа (мечение проводили с применением набора (Innova Biosciences, 326-0010) согласно инструкциям производителя). За этим следовало добавление 2,5 микролитра раствора, содержащего 1,2 нМ биотинилированного IL-33-01 человека в комбинации с 1,5 нМ средства обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB). Все разведения осуществляли в буфере для анализа, содержащем 0,8 М фторида калия (VWR, 26820.236) и 0,1% бычьего сывороточного альбумина (BSA, РАА, K05-013) в PBS Дульбекко (Invitrogen, 14190185). Планшеты для анализа инкубировали в течение 1 часа при комнатной температуре и флуоресценцию с временным разрешением считывали при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer). Данные анализировали путем расчета соотношения 665/620 нм, а затем значений % дельта F для каждого образца. Соотношение 665/620 нм применяли для введения поправки на интерференцию в образце с применением уравнения 1. Затем для каждого образца рассчитывали % дельта F с применением уравнения 2. Отрицательный контроль (неспецифическое связывание) определяли путем замещения биотинилированного IL-33 человека в комбинации со средством для обнаружения на основе криптата стрептавидина на средство для обнаружения на основе криптата стрептавидина в отдельности. Значения % дельта F затем использовали для расчета % специфического связывания, как описано в уравнении 3. Значения IC50 определяли с применением программного обеспечения GraphPad Prism путем вычерчивания кривой с применением четырехпараметрического логистического уравнения (уравнение 4). Эти результаты продемонстрировали, что 33v20064 перекрестно реагирует с IL-33 макака-крабоеда. Однако 33v20064 не показало конкуренции в случае IL-33 мыши.
[1009] Фигура 40А: показано ингибирование сигнала FRET, образуемого при связывании биотинилированного IL-33-01 человека с меченным DyLight 33v20064, с помощью возрастающих концентраций тестируемых белков, где на оси х отложена концентрация тестируемого образца в виде молярной концентрации, а на оси у отложен процент специфического связывания. Ингибирование сигнала FRET наблюдали в случае IL-33 человека и макака-крабоеда, но не мыши.
Селективность антител к IL-33
[1010] Селективность антитела к IL-33, 33v20064, определяли с применением анализа связывания IL-33:mAb на основе гомогенного FRET (резонансный перенос энергии флуоресценции) HTRF® (гомогенный анализ флуоресценции с временным разрешением, Cisbio International). В данном анализе образцы конкурировали с биотинилированным IL-33-01 человека с His-Avi (SEQ ID No. 632) за связывание меченным DyLight IgG 33v20064 дикого типа. IL-1-альфа человека и IL-1-бета человека тестировали в отношении ингибирования связывания биотинилированного IL-33-01 меченным DyLight 33v20064, как описано выше. Эти результаты продемонстрировали, что 33v20064 не показывал конкуренции в случае IL-1-альфа или IL-1-бета человека.
[1011] Фигура 40В: показано ингибирование сигнала FRET, образуемого при связывании биотинилированного IL-33-01 человека с меченным DyLight 33v20064, с помощью возрастающих концентраций тестируемых белков, где на оси х отложена концентрация тестируемого образца в виде молярной концентрации, а на оси у отложен процент специфического связывания. Ингибирование сигнала FRET не наблюдали в случае IL-1-альфа или IL-1-бета человека.
Пример 8. Оптимизация Ab к IL-33, 33v20064
Введение остатков из последовательностей зародышевого типа в каркасные области 33v20064
[1012] Аминокислотные последовательности VH- и VL-доменов исходного антитела 33v20064 выравнивали с известными последовательностями зародышевого типа человека в базе данных IMGT (Lefranc, М.P. et al. Nucl. Acids Res. 2009. 37 (Database issue): D1006-D1012), и ближайшая последовательность зародышевой типа была идентифицирована по сходству последовательностей. Для VH-доменов из антитела 33v20064 эта линия представляла собой IGHV3-23*01. Для VL-доменов таковой являлась IGLV3-1. Введение остатков из последовательностей зародышевого типа осуществляли в 33v20064 до процесса созревания аффинности. Без учета остатков Верньера (Foote 1992), которые оставляли не измененными, в каркасных областях VL-доменов 33v20064 было 6 остатков, которые отличались от таковых в последовательностях зародышевого типа, 5 из которых вернули в исходное состояние, исходя из самой близкой последовательности зародышевого типа с применением способа мутагенеза по Кункелю (Clackson, Т. and Lowman, Н.В. Phage Display - A Practical Approach, 2004. Oxford University Press) с помощью подходящих мутагенных праймеров. Продуктом данного введения остатков из последовательностей зародышевого типа было 33_640001. Номера ID последовательностей описаны в таблице 22.


Ингибирование связывания IL-33 с ST2 под действием очищенных scFv
[1013] Активность 33_640001 сравнивали с его исходным антителом, не подвергнутым введению остатков из последовательностей зародышевого типа, 33v20064. Способность scFv-антител ингибировать связывание биотинилированного IL-33 человека с His Avi (IL33-01, SEQ ID No. 632) с рецептором ST2 с меткой FLAG®-His оценивали в в биохимическом HTRF®-анализе конкурентного связывания (гомогенный анализ флуоресценции с временным разрешением), как описано в примере 7.
[1014] Фигура 41А: показано ингибирование сигнала FRET после 1-часовой инкубации, образуемого при связывании IL-33 человека с ST2 человека, с помощью возрастающих концентраций scFv-антител, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания. 33_640001 обладал активностью, которая была эквивалентна таковой его исходного антитела, не подвергнутым введению остатков из последовательностей зародышевого типа.
[1015] Фигура 41В: показано ингибирование сигнала FRET после инкубации на протяжении ночи, образуемого при связывании IL-33 человека с ST2 человека, с помощью возрастающих концентраций scFv-антител, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания. 33_640001 обладал активностью, которая была эквивалентна таковой его исходного антитела, не подвергнутым введению остатков из последовательностей зародышевого типа.
Созревание аффинности
[1016] 33v20064 оптимизировали с применением подхода направленного мутагенеза и отборов на основе аффинности с применением фагового дисплея. Большие библиотеки фагов с scFv, полученные из исходного антитела, подвергнутого введению остатков из последовательностей зародышевого типа (33_640001), получали с помощью олигонуклеотид-направленного мутагенеза определяющего комплементарность участка-3 (CDR3) вариабельной области тяжелой (VH) и CDR3 легкой (VL) цепи с применением стандартных методик молекулярной биологии, как описано (Clackson 2004). В случае CDR3 VH два положения Верньера, предшествующие CDR, определенным по Kabat (т.е. положения 93 и 94 в VH), также предусматривали для потенциальной оптимизации в подходе нацеленного мутагенеза. Библиотеки подвергали отборам с фаговым дисплеем на основе аффинности, чтобы выбрать варианты с более высокой аффинностью в отношении IL-33 человека. Эти отборы осуществляли либо путем чередования антигенов, биотинилированного IL-33 человека дикого типа с His-Avi (IL33-01, SEQ ID NO. 632) и биотинилированного мутантного IL-33 с His Avi (IL33-11, SEQ ID NO. 643), в последовательных раундах, либо с помощью одного антигена, биотинилированного IL33-11, во всех раундах. Отборы осуществляли, фактически как описано ранее (Thompson 1996). Вкратце, фаговые частицы с scFv инкубировали с рекомбинантным биотинилированным антигеном в растворе. Затем фаги с ScFv, связавшимися с антигеном, захватывали на покрытых стрептавидином парамагнитных гранулах (Dynabeads® М-280), следуя рекомендациям производителя. Затем отобранные фаговые частицы с scFv высвобождали, как описано ранее (Osbourn, J.K., et al. Immunotechnology, 1996. 2(3): p. 181-96), и процесс отбора повторяли в присутствии понижающихся концентраций биотинилированного антигена - обычно от 50 нМ до 10 пМ за пять раундов отбора.
[1017] 33v20064 также оптимизировали с применением технологии рибосомного дисплея, фактически как описано в Hanes et al. (Hanes, J., et al. Methods in Enzymology, 2000. 328: p. 404-30). В качестве шаблона для конструирования библиотеки и преобразования в формат рибосомного дисплея для последующих отборов применяли исходный клон scFv, 33v20064. Для эффективной транскрипции в мРНК на уровне ДНК к 5'-концу добавляли промотор Т7. На уровне мРНК конструкция содержала сайт связывания прокариотической рибосомы (последовательность Shine-Dalgarno). На 3'-конце одной цепи удаляли стоп-кодон и добавляли часть гена gIII (ген III) бактериофага М13, выполняющего роль спейсера между образующимся полипептидом scFv и рибосомой (Hanes 2000).
[1018] Библиотеку рибосомного дисплея, полученную на основании исходной (33v20064) scFv-конструкции, получали с помощью случайного мутагенеза с применением набора для ПЦР (полимеразная цепная реакция) со случайным мутагенезом Diversify™ (BD Biosciences), следуя рекомендациям производителя. Условия для такой ПЦР с внесением ошибок (ЕР) были выбраны таким образом, чтобы ввести в среднем 8,1 изменение нуклеотида на 1000 пар оснований (в соответствии с производителем). Затем полученную ЕР-библиотеку применяли в отборах с рибосомным дисплеем на основе аффинности (Hams 2000). scFv экспрессировали in vitro с применением системы (Т7) для крупномасштабного получения РНК RiboMAX™ (Promega), в соответствии с протоколом производителя и системы трансляции без прокариотических клеток на основе экстрактов из E.coli. Полученные комплексы scFv-антитело-рибосома - мРНК (ARM) инкубировали в растворе с антигеном, биотинилированным IL-33 человека, при этом либо с чередующимися антигенами, биотинилированным IL33-01 и биотинилированным IL33-11, в последовательных раундах, либо с одним антигеном, биотинилированным IL-33-11, во всех раундах. Специфически связанные тройные комплексы (IL-33:ARM) захватывали на покрытых стрептавидином парамагнитных гранулах (Dynabeads® М-280), следуя рекомендациям производителя (Dynal), тогда как несвязанные ARM отмывали. мРНК, кодирующую связанные scFv, затем восстанавливали посредством ПЦР с обратной транскрипцией (RT-PCR). Процесс отбора повторяли на полученной популяции в течение дополнительных раундов отбора с применением понижающихся концентраций биотинилированного IL-33 человека (от 100 нМ до 100 пМ за 5 раундов) с целью обогащения и тем самым отбора клонов с более высокой аффинностью в отношении IL-33. Результаты раундов отбора 3, 4 и 5 субклонировали в pCantab6 (McCafferty, J., et al. Appl Biochem Biotechnol, 1994. 47(2-3): p.157.) и улучшенные клоны идентифицировали, как описано ниже.
Ингибирование связывания IL-33 с mAb под действием неочищенных scFv
[1019] Репрезентативное количество индивидуальных клонов из числа результатов отбора выращивали в 96-луночных планшетах. ScFv экспрессировали в периплазме бактерий (Kipriyanov, et al. J Immunol Methods 200(1-2): 69-77 (1997)) и подвергали скринингу в отношении их ингибиторной активности в анализе связывания IL-33:mAb на основе гомогенного FRET (резонансный перенос энергии флуоресценции) HTRF® (гомогенный анализ флуоресценции с временным разрешением, Cisbio International). В данном анализе образцы конкурировали с меченным DyLight IgG 33v20064 за связывание с биотинилированным IL-33-01 с His Avi (SEQ ID NO. 632) или биотинилированным IL-33 макака-крабоеда с His Avi (SEQ ID NO. 649). Такие анализы конкурентного связывания эпитопов основаны на том принципе, что образец тестируемого антитела, которое распознает эпитоп, аналогичный таковому, который распознает меченое IgG к IL-33, будет конкурировать с меченым IgG за связывание с биотинилированным IL-33, что ведет к снижению сигнала анализа.
[1020] Образцы неочищенных антител к IL-33 тестировали в отношении ингибирования связывания биотинилированного IL33-01 (человека) с His-Avi или биотинилированного IL-33 макака-крабоеда с His-Avi меченным DyLight 33v20064 путем добавления 5 микролитров образца в 384-луночный малообъемный планшет для анализа (Costar, 3673). Следующим шагом готовили раствор, содержащий 2,4 нМ меченного DyLight 33v20064, в случае анализа с IL-33 человека, и готовили раствор, содержащий 6 нМ меченного DyLight 33v20064, в случае анализа с молекулой макака-крабоеда, и по 2,5 микролитра добавляли с планшеты для анализа (мечение проводили с применением набора (Innova Biosciences, 326-0010) согласно инструкциям производителя). За этим следовало добавление 2,5 микролитра раствора, содержащего 0,8 нМ биотинилированного IL-33-01 человека в комбинации с 0,75 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB), в случае анализа с молекулой человека, или раствора, содержащего 4 нМ биотинилированного IL-33 макака-крабоеда в комбинации с 1,5 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB), в случае анализа с молекулой макака-крабоеда. Все разведения осуществляли в буфере для анализа, содержащем 0,8 М фторида калия (VWR, 26820.236) и 0,1% бычьего сывороточного альбумина (BSA, РАА, K05-013) в PBS Дульбекко (Invitrogen, 14190185). Планшеты для анализа инкубировали в течение 1 часа при комнатной температуре и флуоресценцию с временным разрешением считывали при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer). Данные анализировали путем расчета соотношения 665/620 нм, а затем значений % дельта F для каждого образца. Соотношение 665/620 нм применяли для введения поправки на интерференцию в образце с применением уравнения 1. Затем для каждого образца рассчитывали % дельта F с применением уравнения 2. Отрицательный контроль (неспецифическое связывание) определяли путем замещения биотинилированного IL-33 в комбинации со средством для обнаружения на основе криптата стрептавидина на средство для обнаружения на основе криптата стрептавидина в отдельности. Значения % дельта F затем использовали для расчета % специфического связывания, как описано в уравнении 3.
[1021] Поскольку анализ конкурентного связывания эпитопов достиг своего предела чувствительности, для тестирования образцов неочищенных scFv применяли анализ с применением промежуточного оптимизированного mAb 33_640027. Данный анализ был фактически таким, как описано в случае конкурентного анализа с 33v20064, со следующими модификациями: готовили 20 нМ меченного DyLight 33_640027 и 2,5 микролитра добавляли в планшеты для анализа. За этим следовало добавление 2,5 микролитра раствора, содержащего 0,32 нМ биотинилированного IL-33-01 человека в комбинации с 0,75 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB), в случае анализа с молекулой человека, или раствора, содержащего 0,8 нМ биотинилированного IL-33 макака-крабоеда в комбинации с 1,5 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB), в случае анализа с молекулой макака-крабоеда.
Ингибирование связывания IL-33 с mAb под действием очищенных scFv
[1022] Клоны одноцепочечных Fv, которые показывали ингибиторный эффект в отношении взаимодействия IL-33:mAb в качестве неочищенных экстрактов периплазмы, подвергали секвенированию ДНК (Osbourn, et al. Immunotechnology 2(3): 181-96 (1996); Vaughan, et al. Nat Biotechnol 14(3):309-14 (1996)). Уникальные scFv снова экспрессировали в бактериях и очищали с помощью аффинной хроматографии (как описано в WO 01/66754). Образцы очищенных антител к IL-33 тестировали на эффективность ингибирования путем конкурентного анализа серии разведений очищенного препарата в сравнении с меченным DyLight IgG 33v20064 или меченным DyLight IgG 33_640027 в отношении связывания с биотинилированным IL33-01 с His-Avi, биотинилированным IL33-11 с His-Avi или биотинилированным IL-33 макака-крабоеда с His-Avi. Способы были такими, как описано в в предыдущем разделе.

Переформатирование scFv в IgG1
[1023] Клоны одноцепочечных Fv с требуемыми свойствами, исходя из анализов связывания IL-33:mAb, преобразовывали в формат антитела в виде целого иммуноглобулина G1 (IgG1), как описано в примере 1. Они включали антитела 33_640027 (получено на основании отборов ЕР-библиотеки) и 33_640047, 33_640050 (получено на основании отборов библиотеки блок-мутагенеза CDR3 VH), SEQ ID NO, соответствующие различным областям этих антител, показаны в таблице 24.


Ингибирование связывание IL-33 с mAb под действием очищенных IgG
[1024] Способность антител к IL-33 ингибировать связывание биотинилированного IL33-01 с His-Avi, биотинилированного IL33-11 с His-Avi или биотинилированного IL-33 макака-крабоеда с His-Avi с меченным DyLight IgG 33v20064 или меченным DyLight IgG 33_640027 оценивали в в биохимическом HTRF®-анализе конкурентного связывания (гомогенный анализ флуоресценции с временным разрешением, Cisbio International), как описано. IgG с требуемыми свойствами, исходя из анализов связывания IL-33:mAb, отбирали для дополнительного анализа.
Ингибирование выработки IL-8 в Huvec под действием IgG
[1025] Анализ высвобождения цитокинов применяли для оценки ингибирования индуцированной IL-33 выработки IL-8 в эндотелиальных клетках пупочной вены человека (Huvec) под действием антител к IL-33. Клетки подвергали воздействию IL-33 в присутствии или в отсутствие тестируемого антитела или ST2.Fc (R&D systems), фактически как описано в примере 2 с минимальными модификациями. Тестируемые растворы очищенных IgG (в двух повторностях) разводили до требуемой концентрации в полной среде для культивирования. IL-33 с N-концевыми His-Avi (IL33-01, SEQ ID NO 632) готовили в полной среде для культивирования, смешанной с соответствующим тестируемым антителом, с получением конечной концентрации IL-33, составляющей 2 нг/мл. Все образцы инкубировали в течение 30 минут при комнатной температуре перед перенесением смеси IL-33/антитело в планшет для анализа. После 18-24-часовой инкубации содержание IL-8 измеряли в супернатантах от клеток с помощью ELISA (R&D Systems, DY208), адаптированного для считывания европия, как описано в примере 2. Данные анализировали с применением программного обеспечения Graphpad Prism. Значения IC50 определяли путем вычерчивания кривой с применением четырехпараметрического логистического уравнения. Рассчитывали значения IC50, и они обобщены в таблице 25 ниже.
[1026] На фигуре 42А показаны HUVEC, простимулированные с помощью IL33-01 в присутствии 33v20064, 33_640050, ST2-Fc человека или контрольного mAb, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложена процентная доля максимального ответа (выработка IL-8).
Нейтрализация полноразмерного IL-33 млекопитающих
[1027] Полноразмерный IL-33 также является активным (Cayrol et al., Proc Natl Acad Sci USA 106(22):9021-6 (2009); Hayakawa et al., Biochem Biophys Res Commun 357(1):218-22 (2009); Talabot-Ayer et al., J Biol Chem. 284(29): 19420-6 (2009)).
Для оценки способности антител нейтрализовать полноразмерный IL-33 клетки HEK293-EBNA, экспрессирующие полноразмерный (FL) HuIL-33 (и ложно-трансфицированные контроли), собирали через 24 часа после трансфекции с помощью аккутазы (РАА, № L11-007). Клетки разводили до 1×108/мл с помощью PBS и гомогенизировали в течение 30 секунд с применением гомогенизатора для тканей. Клеточный дебрис удаляли с помощью центрифугирования. HUVEC стимулировали с помощью лизатов клеток при различных концентрациях. Стимуляцию выработки цитокинов наблюдали только в случае лизатов клеток, трансфицированных с помощью полноразмерного IL-33, а не в случае лизата ложно-трансфицированных клеток. Концентрацию лизата 1:1000, которая приводила к стимуляции субмаксимального высвобождения цитокинов (примерно ЕС50), выбирали для исследований нейтрализации под действием антитела. Эксперименты осуществляли как описано выше. Рассчитывали значения IC50, и они обобщены в таблице 25 ниже.
[1028] На фигуре 42В показаны HUVEC, простимулированные с помощью лизатов клеток с полноразмерным IL33 в присутствии 33v20064, 33_640050, ST2-Fc человека или контрольного mAb, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложена процентная доля максимального ответа (выработка IL-8).
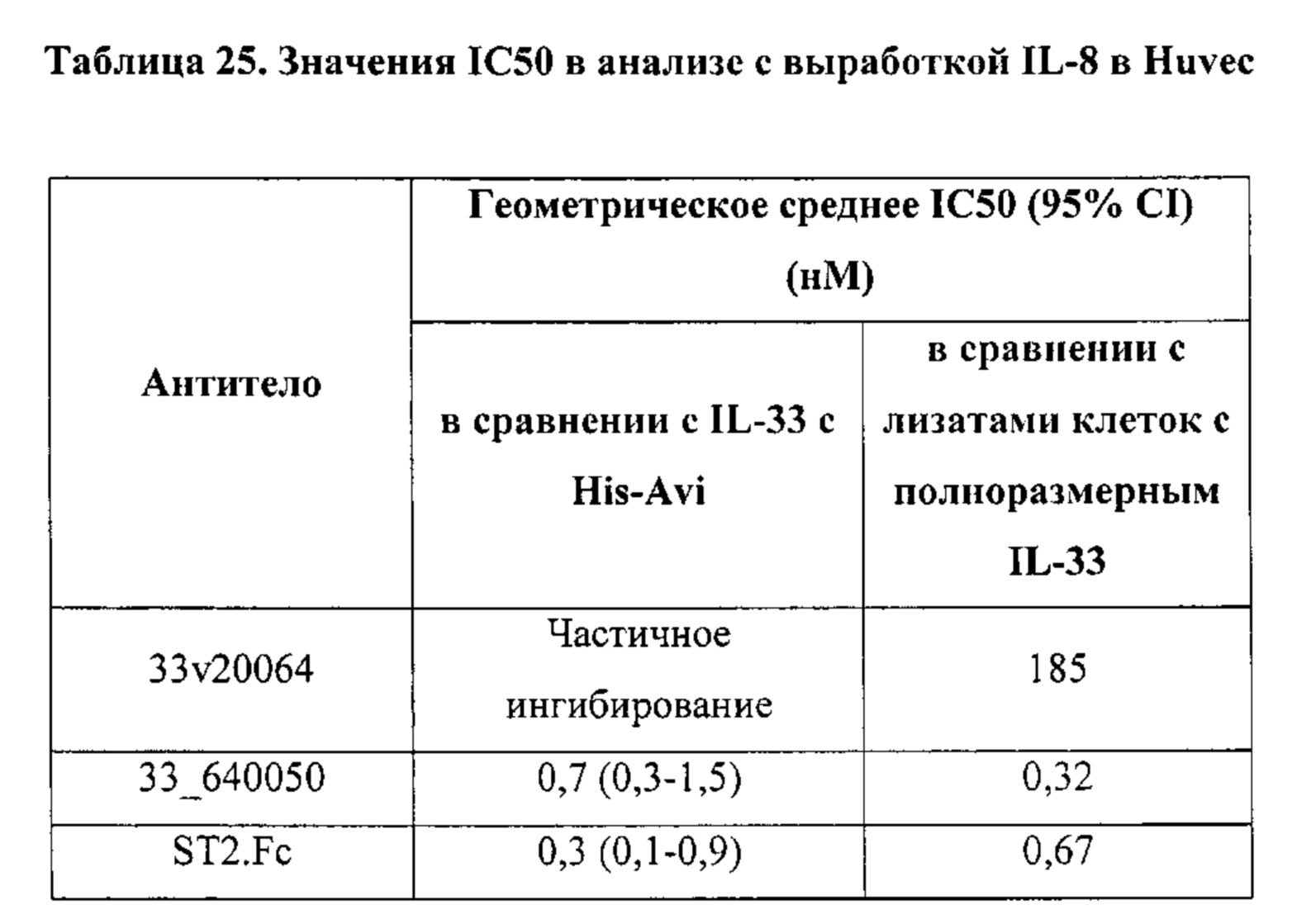
Предупреждение образования формы IL-33 с дисульфидными связями под действием IgG
[1029] IL-33-01 (0,14 нМ или 3 нг/мл) инкубировали в IMDM или PBS, обе содержали 1% BSA, в присутствии или в отсутствие антител (25 мкг/или) или ST2-Fc человека (105 мкг/мл) в течение 0-24 часов при 37°С, 5% СО2. В различные моменты времени аликвоты извлекали и вносили в предварительно охлажденный планшет, содержащий PBS или sST2 (конечная концентрация 10,5 мкг/ил). sST2 вводили в контрольное mAb и необработанные образцы при сборе для прекращения продолжения реакции окисления IL-33. Образцы разделяли на аликвоты в предварительно замороженных 96-луночных планшетах и хранили при -80°С. ELISA в отношении IL-33 человека осуществляли в соответствии с инструкциями производителя (R&D Systems, № по кат. DY3625, № партии 1362797), замещая стрептавидин-HRP системой обнаружения DELFIA (Perkin Elmer) и далее. Вкратце, черные 96-луночные планшеты Maxisorp покрывали с помощью антитела захвата из расчета 50 мкл на лунку на протяжении ночи при комнатной температуре.
Планшеты промывали 3Х с помощью 300 мкл 0,05% Tween-20 в PBS и блокировали с помощью 150 мкл 1% BSA в PBS в течение 1 часа при комнатной температуре. Планшеты промывали 3Х и в планшеты добавляли образцы или стандарты из расчета 50 мкл на лунку на 2 часа при комнатной температуре со встряхиванием (400 об./мин.). Планшеты промывали 3Х и в планшеты добавляли антитела обнаружения из расчета 50 мкл на лунку на 2 часа при комнатной температуре со встряхиванием (400 об./мин.). Планшеты промывали, как указано ранее, и в планшет добавляли стрептавидин-европий из расчета 50 мкл на лунку, разведенный 1 к 1000 в буфере для анализа DELFIA, на 40 минут при комнатной температуре, защите от света, со встряхиванием (400 об./мин.). Планшеты промывали 7Х с помощью буфера для отмывки DELFIA из расчета 300 мкл на лунку. В планшет добавляли усиливающий раствор DELFIA (предварительно нагретый до комнатной температуры) из расчета 50 мкл на лунку. После 10 минут инкубации при комнатной температуре, защите от света флуоресценцию измеряли с применением планшет-ридера EnVision (PerkinElmer). Анализ стандартов и интерполяцию данных осуществляли в Microsoft Excel с последующим анализом, проводимым с помощью программного обеспечения GraphPad Prism.
[1030] Как обсуждалось в примере 4, фигура 24А, данный ELISA обеспечивает обнаружение преимущественно IL-33 с дисульфидными связями (IL33-DSB) в пределах диапазона концентраций IL-33, измеряемых в данном эксперименте. ELISA применяют в данном документе, чтобы отслеживать преобразование IL-33 в его форму с дисульфидными связями в присутствии тестируемых антител.
[1031] На фигуре 43 показано преобразование IL33-01 в его форму с дисульфидными связями (IL33-DSB) во время инкубации в IMDM (фигура 43А) или PBS (фигура 43В) в присутствии или в отсутствие тестируемых антител, где на оси х отложено время в часах, а на оси у отложена концентрация IL-33-DSB. IL330004 и 33v20064 замедляют скорость преобразования IL-33 в IL33-DSB. 33_640050 и ST2.Fc предотвращают преобразование в IL-33-DSB за протестированный период времени.
Рекомбинация полезных мутаций и дальнейшая оптимизация
[1032] С целью получения дальнейших улучшений аффинности полезные мутации, идентифицированные на основании предыдущих последовательностей отбора и скрининга, рекомбинировали различными способами, либо посредством подхода простого добавления, либо посредством подхода с рекомбинационной библиотекой с дальнейшими отборами.
[1033] Анализы последовательностей позволили предположить, что существуют две одиночные 'горячие точки' мутаций, которые преобладали во многих последовательностях лидерных антител; I98M в CDR3 VH и Q50R в CDR2 VL (нумерация по Kabat). Эти две мутации прививали на конструкцию с 33_640001, чтобы получить новое антитело, 33_640036, с применением стандартных методик молекулярной биологии. При дальнейшей рекомбинации VH из 33_640047 объединяли в пару с VL из 33_640036 с получением антитела 33_640117. Здесь приведены примеры рекомбинации последовательностей с применением подхода добавления. SEQ ID NO показаны в таблице 26.

[1034] Кроме того, результаты отборов из библиотек блок-мутагенеза, охватывающих области CDR3 VH и CDR3 VL, показали улучшения аффинности и надлежащее разнообразие последовательностей, и их, таким образом, рекомбинировали с применением подхода популяционного клонирования. Результаты раунда 3 отбора рекомбинировали с образованием библиотек, в которых клоны содержали индивидуально рандомизованные последовательности CDR3 VH и CDR3 VL, пары которых были образованы случайным образом. Эти рекомбинированные библиотеки CDR3 VH/CDR3 VL затем применяли в отборах с рибосомным дисплеем либо с чередующимися антигенами, биотинилированным IL-33 человека дикого типа с His-Avi (IL33-01, SEQ ID NO. 632) и биотинилированным мутантным IL-33 с His-Avi (IL33-11, SEQ ID NO. 643) в последовательных раундах, либо с одним антигеном, биотинилированным IL33-11 с His-Avi, во всех раундах. Отборы осуществляли, фактически как описано для библиотек индивидуальных CDR3 в присутствии понижающихся концентраций биотинилированного антигена - от 50 нМ до 30 пМ за пять раундов отбора.
[1035] Неочищенные экстракты периплазмы, содержащие scFv, готовили из репрезентативного количества индивидуальных scFv из числа результатов отбора рекомбинированных библиотек CDR3 VH/CDR3 VL. Способность антител к IL-33 ингибировать связывание биотинилированного IL33-01 с His-Avi или биотинилированного IL-33 макака-крабоеда с His-Avi с меченным DyLight IgG 33v20064 или меченным DyLight IgG 33_640027 оценивали в биохимическом HTRF® - анализе конкурентного связывания (гомогенный анализ флуоресценции с временным разрешением, Cisbio International), как описано. Варианты scFv, которые показали значительно улучшенный ингибиторный эффект при сравнении с исходным scF и лидерными молекулами, полученными путем предварительной рекомбинации, подвергали секвенированию ДНК, и уникальные рекомбинированные варианты получали в виде очищенного scFv и тестировали, как описано в предыдущем разделе.
[1036] В качестве примеров оптимизированных антител, полученных на основании этих рекомбинированных библиотек, приведены 33_640076, 33_640081, 33_640082, 33_640084, 33_640086 и 33_640087. SEQ ID NO этих антител показаны в таблице 27.


[1037] Дополнительные случайные мутации вводили в вариабельные области этих антител в формате scFv во время процедур отбора с рибосомным дисплеем вследствие повторяемых раундов ПРЦ-амплификаций. Эти события добавлялись к разнообразию последовательностей в результатах отбора, но зачастую были нежелательными, когда они встречались в каркасных областях. Поэтому случайные мутации, которые встречались в каркасных областях 33_640076, 33_640081, 33_640082, 33_640084, 33_640086 и 33_640087, заменяли обратно на остатки из последовательностей зародышевого типа в IgG-конструкциях, как описано в примере 3 с применением стандартных методик молекулярной биологии. Такие случайные мутации, которые встречались в любом CDR или в остатках Верньера, примыкающих к CDR (например, положения 27, 28, 29, 30, 93 и 94 в VH согласно нумерации по Kabat), оставляли не измененными. В качестве дополнительной стратегии для повышения аффинности одновременно на конструкции прививали ранее идентифицированную 'горячую точку' (мутацию Q50R в CDR2 VL). Антитела, полученные в результате введения остатков из последовательностей зародышевого типа и модификаций путем привития горячих точек, были названы 33_640076-1, 33_640081-А, 33_640082-2, 33_640084-2, 33_640086-2 и 33_640087-2, в соответствии с их исходными антителами 33_640076, 33_640081, 33_640082, 33_640084, 33_640086 и 33_640087 соответственно. SEQ ID NO. этих антител показаны в таблице 28.


Оптимизация дополнительных CDR
[1038] В качестве дальнейшей стратегии повышения аффинности оптимизировали дополнительные CDR. Большие библиотеки фагов с scFv, полученные из исходного антитела, подвергнутого введению остатков из последовательностей зародышевого типа (33_640001), получали с помощью олигонуклеотид-направленного мутагенеза CDR1 и CDR2 вариабельной области тяжелой (VH) и CDR1 и CDR2 легкой (VL) цепей с применением стандартных методик молекулярной биологии, как описано (Clackson 2004). Отборы и скрининг осуществляли, как описано для библиотек CDR3 VHVL. Наиболее улучшенные варианты антител получали из библиотеки CDR2 VH. В качестве примеров приводятся 33_640166, 33_640169, 33_640170. SEQ ID NO этих антител показаны в таблице 29.


[1039] В качестве добавочной стратегии для достижения дальнейших улучшений аффинности последовательности CDR2 VH из 33_640166, 33_640169 и 33_640170 прививали на IgG-конструкции 33_640076-1, 33_640082-2, 33_640086-2 и 33_640087-2 с применением стандартных способов молекулярной биологии. В качестве примеров антител, полученных в результате таких рекомбинаций, приведены 33_640076-4, 33_640082-4, 33_640082-6, 33_640082-7, 33_640086-6 и 33_640087-7. Источники получения последовательности и SEQ ID NO показаны в таблице 30.



[1040] Рекомбинацию полезных последовательностей CDR3 VH/ CDR3 VL и CDR2 VH также осуществляли с применением подхода популяционного клонирования и отбора. Результаты раунда 3 отбора на основании библиотек блок-мутагенеза, охватывающих область CDR2 VH, рекомбинировали с результатами раунда 3 рекомбинированной библиотеки CDR3 VH/CDR3 VL в подходе популяционного клонирования с применением стандартных методик молекулярной биологии. Результаты отбора, содержащие большие количества вариантов scFv, рекомбинировали с образованием библиотек, в которых клоны содержали образовавшие пары случайным образом последовательности, полученные из отборов CDR3 VH/CDR3 VL и CDR2 VH. Отборы осуществляли, как описано для библиотек индивидуальных CDR3 VHVL в присутствии понижающихся концентраций биотинилированного антигена - как правило, от 3 нМ до 3 пМ за пять раундов отбора. Неочищенные экстракты периплазмы, содержащие scFv из репрезентативного количества индивидуальных scFv из числа результатов отбора, подвергали скринингу в биохимических HTRF®-анализах, как описано для библиотек CDR3 VHVL. Варианты ScFv, которые показывали значительно улучшенный ингибиторный эффект при сравнении с исходным scFv и лидерными молекулами, полученными путем предварительной рекомбинации, подвергали секвенированию ДНК.
[1041] Поскольку анализ конкурентного связывания эпитопов с использованием 33_640027 достиг своего предела чувствительности, для тестирования образцов очищенных scFv применяли анализ с применением 33_640117. Данный анализ был фактически таким, как описано в случае конкурентного анализа с 33v20064, со следующими модификациями: готовили 2,5 нМ меченного DyLight 33_640117 и 2,5 микролитра добавляли в планшеты для анализа. За этим следовало добавление 2,5 микролитра раствора, содержащего 0,12 нМ биотинилированного IL-33-01 человека в комбинации с 0,75 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB), в случае анализа с молекулой человека, или раствора, содержащего 0,24 нМ биотинилированного IL-33 макака-крабоеда в комбинации с 1,5 нМ средства для обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB), в случае анализа с молекулой макака-крабоеда. Флуоресценцию считывали после инкубации в течение одного часа и на протяжении ночи. С образцами, которые обладали наибольшей активностью в оба момента времени, проводили переформатирование в IgG.
[1042] Уникальные рекомбинированные варианты оценивали в качестве очищенных scFv и затем наиболее активные scFv отбирали и преобразовывали в формат IgG1, как описано в примере 1. В качестве примеров антител, полученных из этих рекомбинантных библиотек, приведены 33_640201 и 33_640237. Случайные мутации, которые были введены в каркасные области 33_640201 и 33_640237 во время отборов с рибосомным дисплеем, заменяли обратно на остатки из последовательностей зародышевого типа, как описано ранее в данном разделе, и соответствующие антитела, подвергнутые введению остатков из последовательностей зародышевого типа, получили название 33_640201-2 и 33_640237-2 соответственно. SEQ ID этих антител показаны в таблице 31.


[1043] Данные по антителам, оптимизированным в отношении CDR3 VH/CDR3 VL и CDR2 VH с помощью похода рациональной рекомбинации или популяционного подхода, приведены в качестве примеров для 33_640082-6, 33_640087-7, 33_640201 и 33_640237 на фигурах 44 и 45.
Ингибирование связывание IL-33 с mAb под действием очищенных IgG
[1044] Способность антител к IL-33 ингибировать связывание биотинилированного IL-33
человека с His-Avi или IL-33 макака-крабоеда с His-Avi с меченным DyLight IgG 33_640117 оценивали в биохимическом HTRF® - анализе конкурентного связывания (гомогенный анализ флуоресценции с временным разрешением, Cisbio International), как описано.
[1045] На фигуре 44А показано ингибирование сигнала FRET после 1-часовой инкубации, образуемого при связывании биотинилированного IL-33 человека (IL33-01) с меченным DyLight IgG 33_640117, с помощью возрастающих концентраций антител 33v20064, 33_640050, 33_640082-6, 33_640087-7, 33_640201 и 33_640237, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[1046] На фигуре 44В показано ингибирование сигнала FRET после инкубации на протяжении ночи, образуемого при связывании биотинилированного IL-33 человека (IL33-01) с меченным DyLight IgG 33 640117, с помощью возрастающих концентраций антител 33v20064, 33_640050, 33_640082-6, 33_640087-7, 33_640201 и 33_640237, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
[1047] На фигуре 44С показано ингибирование сигнала FRET после 1-часовой инкубации, образуемого при связывании биотинилированного IL-33 макака-крабоеда с His Avi с меченным DyLight IgG 33_640117, с помощью возрастающих концентраций антител 33v20064, 33_640050, 33_640082-6, 33_640087-7, 33_640201 и 33_640237, где на оси x отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.

Ингибирование выработки IL-8 в Huvec под действием IgG
[1048] IgG тестировали в анализе выработки IL-8 в Huvec. Клетки подвергали воздействию IL-33 с N-концевыми His-Avi (IL33-01, SEQ ID NO 632) или лизата клеток с полноразмерным IL-33 млекопитающих (лизат с FL-IL33) в присутствии или в отсутствие тестируемого антитела, как описано ранее. Рассчитывали значения IC50, и они обобщены в таблице 33 ниже.
[1049] На фигуре 45А показаны HUVEC, простимулированные с помощью IL33-01 в присутствии тестируемых антител 33_640050, 33_640082-6, 33_640087-7, 33_640201 и 33_640237, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложена процентная доля максимального ответа (выработка IL-8).
[1050] На фигуре 45В показаны HUVEC, простимулированные с помощью лизата клеток с полноразмерным IL33 в присутствии тестируемых антител 33_640050, 33_640082-6, 33_640087-7, 33_640201 и 33_640237, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложена процентная доля максимального ответа (выработка IL-8).

Введение остатков из последовательностей зародышевого типа в последовательность IGLJ
[1051] Аминокислотные последовательности каркасных областей VL антител 33_640076-4, 33_640081-А, 33_640082-6, 33_640082-7, 33_640084-2, 33_640086-6, 33_640087-7, 33_640201-2 и 33_640237-2 выравнивали с известными последовательностями зародышевого типа IGLJ человека в базе данных IMGT (Lefranc, М. P. et al. Nucl. Acids Res. 2009. 37 (Database issue): D1006-D1012), и ближайшая последовательность зародышевой типа была идентифицирована по сходству последовательностей. Для всех этих антител она представляла собой IGLJ2, которая имеет отличие в одну аминокислоту относительно антител в положении 104 области VL (нумерация по Kabat). Этот остаток заменяли обратно на остаток из последовательности зародышевого типа, как описано в примере 3 с применением стандартных методов молекулярной биологии. Полученные антитела были названы 33_640076-4В, 33_640081-АВ, 33_640082-6В, 33_640082-7В, 33_640084-2В, 33_640086-6В, 33_640087-7В, 33_640201-2В и 33_640237-2В, в соответствии с их исходной линией 33_640076-4, 33_640081-А, 33_640082-6, 33_640082-7, 33_640084-2, 33_640086-6, 33_640087-7, 33_640201-2 и 33_640237-2 соответственно. SEQ ID областей VH и VL этих антител показаны в таблице 34.
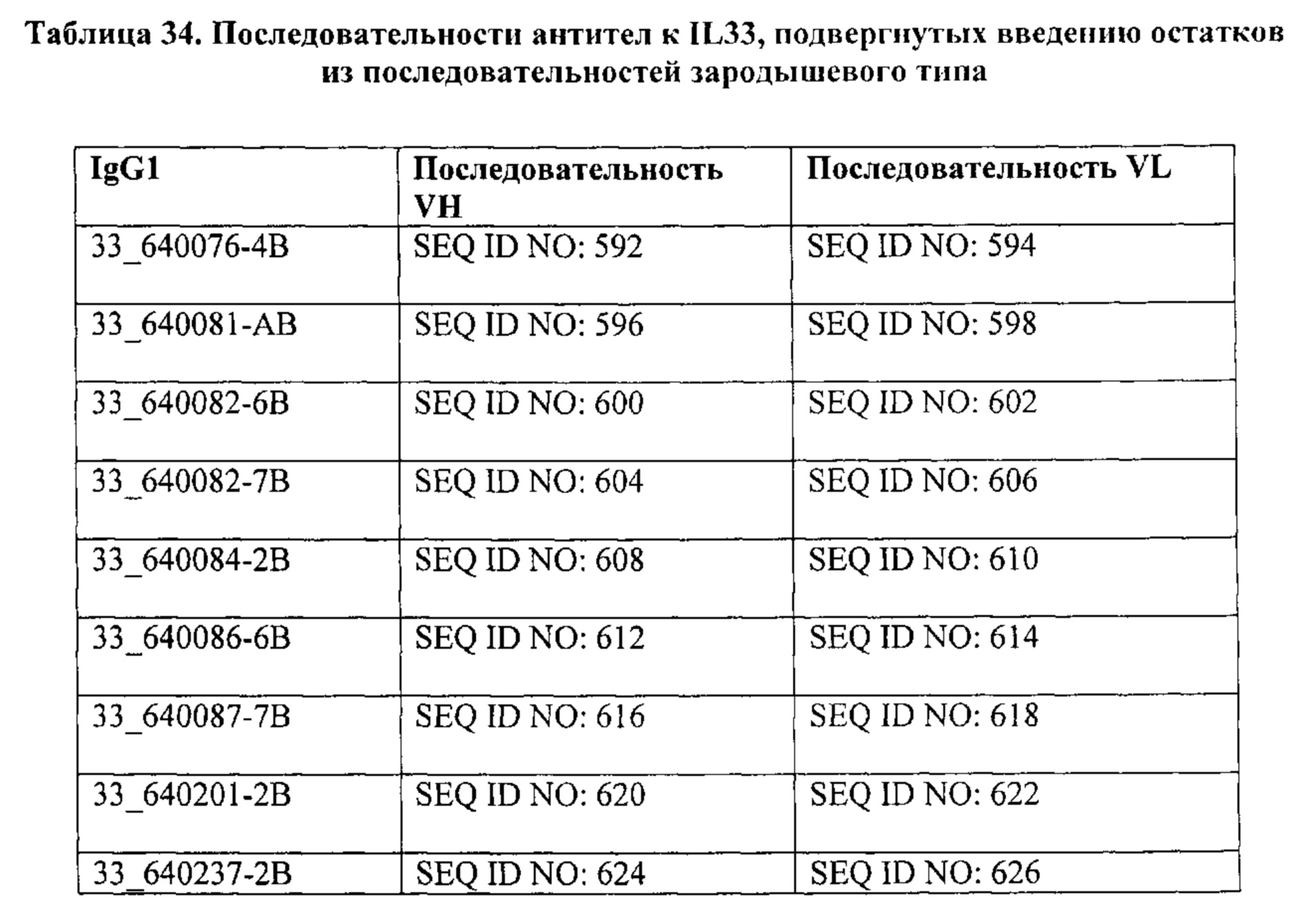
Пример 9. In vivo модель воспаления дыхательных путей
Клонирование, экспрессия и очистка ловушки для цитокина IL-33
[1052] Белковые последовательности IL-1RAcP мыши и ST2 мыши получали из Swiss Prot (номера доступа Q61730 и Р14719 соответственно). Ловушку для цитокина IL-33 мыши разрабатывали на основании Economides et al. 2003, и она состояла из аминокислот 1-359 Q61730 и аминокислот 27-332 Р14719, слитых с Fc-частью IgG1 человека. Белковые последовательности подвергали кодон-оптимизации (Geneart) и клонировали в pDEST12.2, OriP-белки секретировались из клеток в среду с использованием нативных сигнальных пептидов из IL-1RAcP. Для экспрессии в клетках СНО линкер Gateway удаляли с помощью ПЦР с перекрывающимися праймерами. Вектор экспрессии ловушки трансфицировали в клетки млекопитающих СНО для временной экспрессии. Ловушка для IL-33 мыши экспрессировалась и секретировалась в среду. Собранный материал объединяли и фильтровали перед очисткой с применением хроматографии с белком А. Супернатанты культуры загружали на 5-мл колонку Hitrap с белком A (GE Healthcare) и промывали с помощью 1xDPBS, связанную ловушку элюировали из колонки с применением 0,1 М цитрата натрия (рН 3,0) и нейтрализовали добавлением Tris-HCl (рН 9,0). Элюированный материал далее очищали с помощью SEC в 1xDPBS с применением колонки S200 16:600 Superdex (GE healthcare) и концентрацию определяли спектрофотометрически с применением коэффициента экстинкции на основании аминокислотной последовательности (Mach et al, Anal. Biochem. 200(1):74-80 (1992)).
Гуманизированные мыши с IL-33
[1053] Способы получения гуманизированных мышей с IL-33 были описаны ранее в примере 4. Гуманизированных мышей применяют в моделях воспаления дыхательных путей и/или аллергического воспаления, чтобы оценить эффект антител к IL-33 человека.
In vivo модель воспаления дыхательных путей
[1054] Модели с применением индуцированного Alternaria alternata (ALT) воспаления дыхательных путей у мышей были описаны ранее (Kouzaki et al. J. Immunol. 2011, 186: 4375-4387; Bartemes et al J Immunol, 2012, 188: 1503-1513). Эндогенный IL-33 высвобождается быстро после воздействия ALT и запускает IL-33-зависимую выработку IL-5 и эозинофилию в легких. Самцов или самок мышей дикого типа или гуманизированных мышей с IL-33 (6-10 недель) подвергали краткосрочной анестезии с помощью изофлурана и им вводили либо 25 мкг экстракта ALT (Greer, Ленор, Северная Каролина), либо носитель интраназально в общем объеме, составляющем 50 мкл. Мышей обрабатывали внутрибрюшинно или интраназально с помощью тестируемых веществ: IgG IL330004 (SEQ ID NO 12 и 17), IgG H338L293 (SEQ ID NO 182 и 187), ловушки для IL-33 мыши, 33_640050 (SEQ ID NO 302 и 307), IgG изотопического контроля (NIP228) или носителя (PBS, 10 мл/кг) за 24 часа (в случае внутрибрюшинной обработки) или за 2 часа (в случае интраназальной обработки) до интраназальной провокационной пробы с помощью ALT. Через 24 часа после провокационной пробы с помощью ALT мышей подвергали терминальной анестезии с помощью пентобарбитала натрия перед проведением кровопускания и бронхоальвеолярного лаважа (BAL). Жидкость бронхоальвеолярного лаважа (BALF) собирали посредством лаважа (0,3 мл, 0,3 мл и 0,4 мл) через трахеальную канюлю. BALF центрифугировали, клетки подсчитывали (общее количество клеток с помощью FACS (FacsCALIBER, BD)) и супернатант анализировали в отношении содержания цитокинов с помощью ELISA (Meso Scale Discovery, Роквилль, Мэриленд). Дифференциальные подсчеты клеток (200 клеток/предметное стекло) осуществляли на цитоспиновых препаратах, окрашенных с помощью Diff-Quik (Fisher Scientific, Великобритания). Все операции проводили в соответствии со стандартами этических принципов и условий содержания животных Министерства внутренних дел Великобритании и на основании соответствующей лицензии проекта.
[1055] На фигуре 46 показано, что H338L293 дозозависимо ингибирует индуцируемую введением ALT выработку IL-5 в BAL и эозинофилию у мышей BALB/c дикого типа. Тестируемые вещества дозировали интраназально (10, 30 или 100 мг/кг, как указано в скобках) в момент -2 часа до провокационной пробы с помощью 25 мкг ALT. BALF собирали через 24 часа после провокационной пробы с помощью ALT и анализировали на присутствие IL-5 (фигура 46А) и эозинофилов (фигура 46В). Значимый эффект тестируемых веществ определяли с применением однофакторного ANOVA с критерием множественного сравнения Бонферрони. ***р<0,001, ~~р<0,01 по сравнению с контрольным mAb (n=4-8). В качестве положительного контроля применяли ловушку для IL-33 мыши.
[1056] На фигуре 47 показано, что H338L293 (30 мг/кг) и ловушка для IL-33 мыши (10 мг/кг), но не IL330004 (30 мг/кг), ингибируют индуцированную ALT выработку IL-5 в BAL у гуманизированных мышей с IL-33. Тестируемые вещества дозировали интраназально в момент -2 часа до провокационной пробы с помощью 25 мкг ALT. BALF собирали через 24 часа после провокационной пробы с помощью ALT и анализировали на присутствие IL-5. Значимый эффект тестируемых веществ определяли с применением однофакторного ANOVA с критерием множественного сравнения Бонферрони. ***р<0,001,**р<0,01 (n=4).
[1057] На фигуре 48 показано, что 33_640050 дозозависимо ингибирует индуцированную Alternaria выработку IL-5 в BAL у гуманизированных мышей с IL-33. Тестируемые вещества дозировали внутрибрюшинно (0,3, 3 или 30 мг/кг, как указано в скобках) в момент -24 часа до провокационной пробы с помощью 25 мкг Alternaria. BALF собирали через 24 часа после провокационной пробы с помощью ALT и анализировали на присутствие IL-5. Значимый эффект тестируемых веществ определяли с применением однофакторного ANOVA с критерием множественного сравнения Бонферрони. ***р<0,001, **р<0,01 (n=4-5).
Пример 10. Определение характеристик антител к IL-33
Ингибирование связывания IL-33 с ST2 под действием очищенных IgG
[1058] Способность антител к IL-33 ингибировать связывание биотинилированного IL33-01 с рецептором ST2 с меткой FLAG®-His оценивали в биохимическом HTRF®-анализе конкурентного связывания (гомогенный анализ флуоресценции с временным разрешением, Cisbio International), принципы которого описаны выше. Активность препаратов очищенных IgG определяли путем конкурентного анализа серии разведений очищенных IgG в сравнении с ST2 человека с меткой FLAG®-His в отношении связывания с биотинилированным IL33-01 человека (SEQ ID No. 632).
[1059] Фигура 49А: показано ингибирование сигнала FRET после инкубации на протяжении ночи, образуемого при связывании IL-33 человека с ST2 человека, с помощью возрастающих концентраций антител 33v20064, 33_640087-7, 33_640087-7В, 33_640050 и 33_640237-2В, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложен процент специфического связывания.
Ингибирование выработки IL-8 в Huvec под действием IgG
[1060] IgG тестировали в анализе выработки IL-8 в Huvec. Клетки подвергали воздействию IL-33 с N-концевыми His-Avi (IL33-01, SEQ ID NO 632) в присутствии или в отсутствие тестируемого антитела, как описано ранее. Рассчитывали значения IC50, и они обобщены в таблице 35 ниже. Данные показывают, что введение остатков из последовательностей зародышевого типа в последовательность IGLJ не оказывало никакого воздействия на эффективность антитела.
[1061] На фигуре 49 В показаны HUVEC, простимулированные с помощью IL33-01 в присутствии тестируемых антител 33_640087-7, 33_640087-7В, 33_640237-2 и 33_640237-2В, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложена процентная доля максимального ответа (выработка IL-8).

Селективность и перекрестная реактивность антител к IL-33
[1062] Селективность и перекрестную реактивность подвергнутых введению остатков из последовательностей зародышевого типа антител к IL-33 определяли с применением анализа связывания IL-33:mAb на основе гомогенного FRET (резонансный перенос энергии флуоресценции) HTRF® (гомогенный анализ флуоресценции с временным разрешением, Cisbio International). В данном анализе образцы конкурировали с биотинилированным IL-33-01 человека (SEQ ID NO 632) за связывание с меченным DyLight IgG 33_640087-7В (SEQ ID NO 618 и 618) или IgG 33_640237-2В (SEQ ID NO 624 и 626).
[1063] IL-33 человека, макака-крабоеда и мыши с FLAG®-His (описаны в примере 1 и таблице 21), IL-1-альфа и IL-1-бета человека (R&D Systems) (таблица 21) или IL-33 крысы (GenScript) тестировали в отношении ингибирования связывания IL-33 человека с меченным DyLight650 33_640087-7В или меченным DyLight650 33_640237-2В путем добавления 5 микролитров каждого разведения образца в 384-луночный малообъемный планшет для анализа (Costar, 3673). Следующим шагом готовили раствор, содержащий 1,2 нМ меченного DyLight650 33_640087-7В или 33_640237-2В, и по 2,5 микролитра добавляли в планшет для анализа (мечение проводили с применением набора (Innova Biosciences, 326-0010) согласно инструкциям производителя). За этим следовало добавление 2,5 микролитра раствора, содержащего 0,12 нМ биотинилированного IL-33-01 человека в комбинации с 0,75 нМ средства обнаружения на основе криптата стрептавидина (Cisbio International, 610SAKLB). Все разведения осуществляли в буфере для анализа, содержащем 0,8 М фторида калия (VWR, 26820.236) и 0,1% бычьего сывороточного альбумина (BSA, РАА, K05-013) в PBS Дульбекко (Invitrogen, 14190185). Планшеты для анализа инкубировали в течение 4 часов при комнатной температуре, а затем 18 часов при 4 градусах Цельсия и флуоресценцию с временным разрешением считывали при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (Perkin Elmer). Данные анализировали путем расчета соотношения 665/620 нм, а затем значений % дельта F для каждого образца. Соотношение 665/620 нм применяли для введения поправки на интерференцию в образце с применением уравнения 1. Затем для каждого образца рассчитывали % дельта F с применением уравнения 2. Отрицательный контроль (неспецифическое связывание) определяли путем замещения биотинилированного IL-33 человека в комбинации со средством для обнаружения на основе криптата стрептавидина на средство для обнаружения на основе криптата стрептавидина в отдельности. Значения % дельта F затем использовали для расчета % специфического связывания, как описано в уравнении 3. Значения IC50 определяли с применением программного обеспечения GraphPad Prism путем вычерчивания кривой с применением четырехпараметрического логистического уравнения (уравнение 4). Эти результаты продемонстрировали, что 33_640087-7В и 33_640237-2В перекрестно реагируют с IL-33 макака-крабоеда, но не с IL-33 мыши, IL-33 крысы, IL-1-альфа человека или IL-1-бета человека.
[1064] Фигура 50А: показано ингибирование сигнала FRET, образуемого при связывании биотинилированного IL-33-01 человека с меченным DyLight 33_640087-7В (SEQ ID NO 618 и 618), с помощью возрастающих концентраций тестируемых белков, где на оси х отложена концентрация тестируемого образца в виде молярной концентрации, а на оси у отложен процент специфического связывания. Ингибирование сигнала FRET наблюдали в случае IL-33 человека и макака-крабоеда, но не случае IL-33 мыши или крысы, IL-1-альфа человека или IL-1-бета человека.
[1065] Фигура 50В: показано ингибирование сигнала FRET, образуемого при связывании биотинилированного IL-33-01 человека с меченным DyLight 33_640237-2В (SEQ ID NO 624 и 626), с помощью возрастающих концентраций тестируемых белков, где на оси х отложена концентрация тестируемого образца в виде молярной концентрации, а на оси у отложен процент специфического связывания. Ингибирование сигнала FRET наблюдали в случае IL-33 человека и макака-крабоеда, но не случае IL-33 мыши или крысы, IL-1-альфа человека или IL-1-бета человека.
Нейтрализация эндогенного IL-33 в анализе с выработкой IL-8 в HUVEC
[1066] Чтобы определить, были ли способны антитела нейтрализовать эндогенный IL-33, ткань легких человека применяли для обеспечения источника эндогенного белка IL-33. Исследование было одобрено Комитетом по этике в ходе исследований NRES Восточной Англии (Cambridge East) (номер документа

[1067] На фигуре 51 показаны HUVEC, простимулированные с помощью лизата легкого человека в присутствии тестируемых антител 33_640050 и 33_640087-7В в сравнении с sST2, где на оси х отложена концентрация антитела в виде молярной концентрации, а на оси у отложена процентная доля максимального ответа (выработка IL-8). sST2 ингибировал ответ с IL-8 максимум на приблизительно 70%, что позволяет предположить, что большая часть, но не вся, выработка IL-8 управляется эндогенным IL-33, находящимся в лизате легкого. Оба антитела ингибировали ответ с IL-8 аналогично sST2, что демонстрирует их способность связывать и нейтрализовать эндогенный IL-33.
In vivo модель воспаления дыхательных путей
[1068] Способы получения гуманизированных мышей с IL-33 были описаны ранее в примере 4. Гуманизированных мышей применяли в качестве модели индуцированного Altemaria alternata (ALT) воспаления дыхательных путей, как описано в примере 9, чтобы оценить эффект 33_640087-7В. Самцов или самок мышей дикого типа или гуманизированных мышей с IL-33 (6-10 недель) подвергали краткосрочной анестезии с помощью изофлурана и им вводили либо 25 мкг экстракта ALT (Greer, Ленор, Северная Каролина), либо носитель интраназально в общем объеме, составляющем 50 мкл. Мышей обрабатывали внутрибрюшинно с помощью тестируемых веществ: IgG 33_640087-7В (SEQ ID NO 618 и 618), IgG изотопического контроля (NIP228) или носителя (PBS, 10 мл/кг) за 24 часа до интраназальной провокационной пробы с помощью ALT. Через 24 часа после провокационной пробы с помощью ALT мышей подвергали терминальной анестезии с помощью пентобарбитала натрия перед проведением кровопускания и бронхоальвеолярного лаважа (BAL). Жидкость бронхоальвеолярного лаважа (BALF) собирали посредством лаважа (0,3 мл, 0,3 мл и 0,4 мл) через трахеальную канюлю. BALF центрифугировали и супернатант анализировали в отношении содержания цитокинов с помощью ELISA (Meso Scale Discovery, Роквилль, Мэриленд). Все операции проводили в соответствии со стандартами этических принципов и условий содержания животных Министерства внутренних дел Великобритании и на основании соответствующей лицензии проекта.
[1069] На фигуре 52 показано, что 33_640087-7В дозозависимо ингибирует индуцированную Alternaria выработку IL-5 в BAL у гуманизированных мышей с IL-33. Тестируемые вещества дозировали внутрибрюшинно (0,1, 1,3 или 10 мг/кг, как указано в скобках) в момент -24 часа до провокационной пробы с помощью 25 мкг Alternaria. BALF собирали через 24 часа после провокационной пробы с помощью ALT и анализировали на присутствие IL-5. Значимый эффект тестируемых веществ определяли с применением однофакторного ANOVA с критерием множественного сравнения Бонферрони. ***р<0,001, **р<0,01 (n=5-6).
Пример 11. Аффинность антител к IL-33
[1070] Аффинность фрагмента (Fab) антитела к IL-33 в отношении рекомбинантного IL33 человека определяли с применением отслеживания взаимодействия в режиме реального времени с помощью BIACORE™ и при равновесии с применением KinExA™ для 33_640087-7В. В случае обеих методологий белок IL33 человека очищали с помощью SEC-HPLC, чтобы обеспечить качество антигена, и также поступали с Fab в случае анализа Biacore.
Анализ аффинности с помощью Biacore
[1071] Fab-фрагменты получали посредством расщепления папаином полноразмерного IgG1 и очищали с помощью SEC. Аффинность фрагмента антитела (Fab) измеряли с применением Biacore Т100 при 25°С. Стрептавидин ковалентно иммобилизировали на поверхности чипа С1 с применением методики стандартного аминного связывания при концентрации, составляющей 4 мкг/мл в 10 мМ ацетате натрия, рН 4,5. Как правило, достигали конечной плотности стрептавидина на поверхности в диапазоне 115-170 RU. Рекомбинантный, биотинилированный с помощью ферментов IL-33 человека (получен в лаборатории) титровали на поверхность чипа со стрептавидином при 4 мкг/мл в буфере HBS-EP+, чтобы обеспечить ~30 RU связывания Fab при насыщении (Rmax). Этот низкий уровень связывания аналита гарантировал минимальные эффекты массопереноса.
[1072] Fab IL-33 серийно разводили от 5 нМ до 78 пМ в буфере HBS-EP+ и пропускали над чипом при скорости 50 мкл/мин., при 3 минутах ассоциации и до 30 минут диссоциации. Множественные инъекции только буфера проводили при таких же условиях, чтобы обеспечить возможность двойного вычитания контроля из конечных наборов сенсограмм, которые анализировали с применением программного обеспечения BiaEval (версия 2.0.1). Поверхность чипа полностью регенерировали с помощью импульсной подачи 3 М MgCl2.
[1073] Аффинность ST2-Flag-His10 (SEQ. ID NO 650), экспрессированного в клетках HEK-EBNA, в отношении IL-33 человека определяли с помощью BIACORE™ с применением таких же способов, как и описанные выше.


Анализ аффинности KinExA
[1074] Чтобы подтвердить высокую аффинность, обнаруженную в SPR-анализе, использовали анализы кинетического исключения (KinExA). KinExA все больше отдают предпочтение при определении взаимодействий белок:белок с более высокими аффинностями, в особенности находящихся в диапазоне от пМ до суб-пМ, где методики с биосенсорами на основе поверхности достигают своих практических ограничений (Rathanaswami Р, Roalstad S, Roskos L, Qiaojuan JS, Lackie S, Babcook J. Demonstration of an in vivo generated sub-picomolar affinity fully human monoclonal antibody to interleukin-8. Biochemical and Biophysical Research Communications. 2005; 334: 1004-1013).
[1075] Аффинность антитела 33_640087-7B измеряли с помощью анализов кинетического исключения, осуществляемых на KinExA 3200. Гранулы для измерения готовили путем смешивания 200 мг сухих гранул UltraLink Biosupport Azlactone с 110 мкг IL-33 (как указано ранее) в 2,5 мл 50 мМ гидрокарбоната натрия, рН 8,4, при комнатной температуре в течение 2 часов при постоянном перемешивании. Гранулы ополаскивали и блокировали с помощью 10 мг/мл BSA в 1 М Tris, рН 8,7. Перед применением гранулы ресуспендировали в D-PBS, 0,02% азиде натрия. Равновесные смеси 33_640087-7B/IL-33 готовили в буфере для образцов, состоящем из 1 мг/мл BSA, 0,02% азида натрия в DPBS (PBS Дульбекко). Применяли две разные концентрации IgG с варьирующими концентрациями IL-33, 5 пМ 33_640087-7В с IL-33, серийно разведенным от 125 пМ до 61 фМ, и 500 фМ 33_640087-7В с IL-33, серийно разведенным от 62,5 пМ до 15 фМ, оба исследования проводили с контролями с нулевым уровнем IL-33. Флуоресцентный вторичный реагент для обнаружения представлял собой конъюигированное с Alexa Fluor 647 антитело козы к Fc человека, разведенное в 1 мг/мл BSA, 0,02% азиде натрия, 0,1% Tween 20 в DPBS. Образцы прогоняли на KinExA, при этом помещенном в термостат, установленный на 25°С. Данные анализировали с применением программного обеспечения KinExA Pro, версия 4.1.11.
[1076] Анализы KinExA указывают, что 33_640087-7В характеризуется KD<142 фМ (фемтомолярная) в отношении IL-33 человека (таблица 37).

Пример 12. Активность окисленного IL-33
Пилотное исследование in vivo для изучения активности окисленного IL-33
[1077] В примере 4 (см. также Cohen, Е.S. et al. Oxidation of the alarmin IL-33 regulates ST2-dependent inflammation. Nat. Commun. 6:8327 doi: 10.1038/ncomms9327 (2015)) описано обнаружение окисленной формы IL-33 с дисульфидными связями (DSB IL-33) и показано, что эта форма не связывается ST2. Для исследования того, обладает ли окисленный IL-33 альтернативной активностью, независимой от ST2, мышей с дефицитом по ST2 обрабатывали внутрибрюшинно или интраназально с помощью повторных доз IL-33 человека в течение 2, 4 или 6 недель. Гистологический анализ осуществляли на нескольких тканях.
[1078] Мышей с дефицитом по ST2 получали, как описано ранее (Townsend, M.J., Fallon, P.G., Matthews, D.J., Jolin, H.E., and McKenzie, A.N.J. (2000). T1/ST2-defwient mice demonstrate the importance of T1/ST2 in developing primary T helper cell type 2 responses. J. Exp. Med. 191, 1069-1076). Самок мышей с дефицитом по ST2 (12 недель) подвергали краткосрочной анестезии с помощью изофлурана и вводили либо 10 мкг IL-33 с N-концевыми His-Avi (IL33-01, SEQ ID NO 632; номер партии CCH168, уровни эндотоксина 0,03 ЕЭ/мг), либо носитель (PBS) интраназально в общем объеме, составляющем 50 мкл. Альтернативно, IL-33 или носитель вводили путем i.p. инъекции. Этот процесс повторяли 3 х в неделю на протяжении в общей сложности 18 обработок. Мышам, которых обрабатывали с помощью IL-33 на протяжении только 2 или 4 недель, вводили PBS в течение первых 4 или 2 недель введения доз, до получения IL-33.
[1079] Через 24 часа после последней обработки мышей подвергали терминальной анестезии с помощью пентобарбитала натрия перед проведением кровопускания и бронхоальвеолярного лаважа (BAL). Кровь собирали путем взятия крови из сердца с применением промытого EDTA шприца. Гематологический анализ крови выполняли с применением Прибора для гематологического анализа Sysmex XTVet. Остальную кровь центрифугировали и экстрагировали плазму. Жидкость бронхоальвеолярного лаважа (BALF) собирали посредством лаважа (0,3 мл, 0,3 мл и 0,4 мл) через трахеальную канюлю. Клетки в BAL подсчитывали (общее число клеток в BAL с помощью проточного цитометра (MACSquant, Miltenye Biotec) и BALF центрифугировали, чтобы отделить супернатант, который анализировали на содержание цитокинов с помощью ELISA (Meso Scale Discovery, Роквилль, Мэриленд). Дифференциальные подсчеты клеток (200 клеток/предметное стекло) осуществляли на цитоспиновых препаратах, окрашенных с помощью Diff-Quik (Fisher Scientific, Великобритания). После лаважа с помощью PBS в легкие накачивали 10% нейтральный забуференный формалин (NBF) путем инфузии через трахею для сохранения структуры легких и их фиксировали погружением в NBF в течение 24-48 часов. Затем фиксированные образцы легкого разрезали в поперечном направлении на 4 равных поперечных среза, перед тем как обработать с помощью серии спиртов, ксилола и твердого парафина. Наконец, после этого поперечные срезы заливали в блоки из твердого парафина. Нарезали гистологические срезы толщиной 4 мкм и их окрашивали с помощью гематоксилина и эозина (Н&Е) для анализа и балльной оценки воспаления. Все операции проводили в соответствии со стандартами этических принципов и условий содержания животных Министерства внутренних дел Великобритании и на основании соответствующей лицензии проекта.
[1080] Для исследования воздействия IL-33, введенного с помощью внутрибрюшинного или интраназального путей, IL-33 человека измеряли в BALF и плазме с применением анализа в отношении IL-33 человека от Millipore (№ по кат. HTH17MAG-14K, партия 2159117), как описано в примере 4. Способность sST2-Fc снижать сигнал анализа применяли для определения присутствия связывания ST2 (восстановленная форма) в сравнении с отсутствием связывания ST2 (окисленная форма) с IL-33. После интраназальных введений IL-33 постоянно обнаруживали в BALF и плазме в конечные точки 2, 4 и 6 недель. Большая часть обнаруженного IL-33 представляла собой окисленную форму. После однократного внутрибрюшинного введения IL-33 обнаруживали временно в плазме через 5 часов после введения дозы, но он не поддавался обнаружению через 24 часа. После повторных введений IL-33 IL-33 человека непостоянно обнаруживали в BALF или плазме в конечные точки 2, 4 или 6 недель. Эти данные указывают на то, что самое лучшее системное воздействие окисленного IL-33 достигается благодаря интраназальному введению доз.
[1081] Фигура 53А. План эксперимента пилотного исследования in vivo. Мышей с дефицитом по ST2 обрабатывали внутрибрюшинно или интраназально с помощью повторного введения IL-33 человека или носителя (PBS) в течение 6 недель (n=3-4 на группу). Ткани, BALF и сыворотку крови собирали через 24 часа после последнего введения IL-33.
[1082] Фигура 53В. Анализ воздействия IL-33 человека в жидкости BAL после повторных введений IL-33 человека мышам BALB/c. Содержание IL-33 человека измеряли в BALF от мышей, обработанных как описано на фигуре 53А, где на оси х показаны группа обработки, а на оси у показан сигнала анализа в отношении IL-33 человека в условных единицах. IL-33 обнаруживали в BALF только после интраназального введения дозы. Оказалось, что обнаруженный IL-33 является преимущественно окисленным (отсутствие связывания ST2).
[1083] Фигура 53С. Анализ воздействия IL-33 в плазме крови после однократного внутрибрюшинного введения IL-33 человека (10 мкг). Содержание IL-33 человека измеряли в плазме крови через 2, 5, 24 и 48 часов после введения, где на оси х показан момент времени анализа, а на оси у показан сигнал анализа в отношении IL-33 человека в условных единицах. IL-33 обнаруживали временно в плазме крови через 5 часов после введения дозы, но он не поддавался обнаружению через 24-48 часов.
[1084] Фигура 53D. Анализ воздействия IL-33 в плазме крови после повторных введений IL-33 человека мышам BALB/c. IL-33 человека измеряли в плазме крови от мышей, обработанных как описано на фигуре 53А, где на оси х показаны группа обработки, а на оси у показан сигнала анализа в отношении IL-33 человека в условных единицах. IL-33 обнаруживали в плазме крови только после интраназального введения дозы. Оказалось, что обнаруженный IL-33 является преимущественно окисленным (отсутствие связывания ST2).
[1085] Гистологический анализ осуществляли на нескольких тканях. У мышей, обработанных с помощью IL-33 человека, не было выявлено никаких существенных аномалий в печени, головном мозге, селезенке, коже, желудке, лимфоузле или сердце при сравнении с контрольными животными. В легком периваскулярное воспаление с повышенным числом лимфоцитов присутствовало у обработанных IL-33 мышей в сравнении с контрольными животными только в группе интраназального введения и только после 6 недель обработки. Это согласуется с наибольшим воздействием окисленного IL-33 (фигура 53). В заключение, обработка KO-мышей по ST2 с помощью IL-33 повышает наличие периваскулярного лимфоцитарного инфильтрата в легких у мышей, обработанных IL-33, в сравнении с контрольными животными. Эта патология может быть опосредована окисленным IL-33.
[1086] На фигуре 54А показаны типичные окрашенные Н&Е парафиновые срезы легочной ткани от мышей, которым вводили PBS интраназально в течение 6 недель (n=3).
[1087] На фигуре 54В показаны типичные окрашенные Н&Е парафиновые срезы легочной ткани от мышей, которым вводили IL-33 интраназально в течение 6 недель (n=4)
Анализ пути в легком мыши, обработанной IL-33
[1088] Чтобы понять пути, модулируемые окисленным IL-33 в легком мыши, приводящие к наблюдаемому воспалительному ответу, микроматричный анализ осуществляли на легочной ткани от животных, которых в течение 6 недель обрабатывали PBS или 6 недель обрабатывали IL-33.
[1089] Образцы легочной ткани от 7 мышей ST2KO (3 вводили дозы PBS и 4 вводили дозы IL33-01, как описано выше) собирали и сразу помещали в 350 мкл буфера RLT (Qiagen, №79216). Затем ткань разрушали с применением Qiagen TissueLyser (Qiagen, №85300) в соответствии с протоколом производителя и РНК очищали с применением набора для волокнистой ткани RNeasy (Qiagen, №74704). РНК, очищенную с помощью этого набора, затем концентрировали с применением микроколонок RNeasy (Qiagen, №74004) в соответствии с протоколом производителя. Затем РНК амплифицировали в однонитевую ДНК с применением набора Affymetrix GeneChip WT Plus Reagent (Affymetrix, №902513) и гибридизировали на генных чипах Mouse Transcriptome 1.0 (МТА1.0) (Affymetrix, №900720), промывали на Affymetrix Fluidics Station и сканировали на Affymetrix Genechip Scanner 3000 7G. Затем данные обрабатывали с помощью Affymetrix Expression Console. Данные анализировали в Microsoft Excel и сортировали по генам, для которых по меньшей мере у 2 из 4 мышей, обработанных IL33, наблюдали более чем ±1,2-кратное изменение сигнала в сравнении со средним значением контрольной группы. Перечень отсортированных генов превращали в KEGG ID с применением Biological Database Network (BioDBnet v2.1) и анализировали с помощью анализа пути KEGG (www.kegg.jp; KEGG Mapper v2.5). Те же самые гены, которые анализировали с помощью пути KEGG, также анализировали с применением Ingenuity Pathway Analysis (IPA) (Qiagen). С помощью IPA-анализа было высказано предположение о путях, связанных с клеточным циклом, которые оказались модулированы. Примеры генов перечислены в таблице 38.

Передача сигнала с участием DSB IL-33 в Huvec
[1090] Чтобы выяснить, можно ли наблюдать ответ на окисленный (DSB) IL-33 человека в клетках человека, исследовали стимуляцию клеток человека in vitro. В микроматричном анализе на мышах была показана активация путей, связанных с клеточным циклом, и, следовательно, исследовали передачу сигнала с участием р38 МАР-киназы и JAK-STAT. Эндотелиальные клетки пупочной вены человека (Huvec) культивировали в соответствии с инструкциями производителя и стимулировали с помощью восстановленного или DSB IL-33. Ядерную транслокацию р-р38 MAPK или p-STAT5 обнаруживали с помощью иммунофлуоресцентного окрашивания. Визуализацию и количественную оценку интенсивности окрашивания ядер осуществляли на ридере ArrayScan VTi HCS (Cellomics). Анализ был фактически таким, как описанный для ядерной транслокации p65/RelA NFkB, но со следующими модификациями.
[1091] В случае анализа в отношении р-р38 MAPK Huvec высевали из расчета 1×104/75 мкл/лунка в среду для культивирования [ЕВМ-2 (Lonza, № СС-3156) с набором EGM-2 SingleQuot, содержащим добавки и факторы роста (Lonza, № СС-4176)] в 96-луночные планшеты с черными стенками, прозрачным плоским дном, покрытые коллагеном I (Greiner, №655956), и инкубировали при 37°С, 5% СО2 в течение 18-24 часов. Тестируемые образцы восстановленного или DSB IL-33 (в двух повторностях) разводили до требуемой концентрации в полной среде для культивирования в 96-луночных полипропиленовых планшетах с U-образным дном (Greiner, 650201) и по 75 мкл вносили в планшеты с Huvec, чтобы инициировать стимуляцию. После 15- или 30-минутной инкубации аналитической смеси при 37°С клетки фиксировали в течение 15 минут в 3,7% растворе формальдегида (путем добавления 50 мкл 16% раствора, который был предварительно нагрет до 37°С). Фиксатор отсасывали и клетки дважды промывали с помощью PBS из расчета 100 мкл/лунка. Клетки окрашивали на р-р38 с помощью антитела к фосфо-р38 (Cell signalling, №9211S) при разведении 1:250. Вкратце, клетки пермеабилизировали в течение 15 минут при комнатной температуре, блокировали в течение 15 минут и окрашивали в течение 1 часа с помощью раствора первичных антител в объеме 50 мкл. Планшеты промывали х 2 в блокирующем буфере и окрашивали в течение 1 часа при комнатной температуре с помощью раствора вторичного антитела (меченное DyLight 488 антитело козы к IgG кролика; ThermoFisher Scientific, №35552, при разведении 1:400) и красителя для ядер Hoechst (ThermoFisher Scientific, №62249 при разведении 1:10000). Планшеты промывали х 2 в PBS. Клетки хранили в конченом объеме PBS из расчета 150 мкл/лунка и покрывали черной, блокирующей свет пленкой (Perkin Elmer, №6005189) до считывания на ридере ArrayScan VTi HCS. Интенсивность окраски ядер рассчитывали с применением подходящего алгоритма. Данные анализировали с применением программного обеспечения Graphpad Prism.
[1092] В случае анализа в отношении pSTAT5 Huvec высевали из расчета 1×104/75 мкл/лунка в среду для культивирования [ЕВМ-2 (Lonza, № СС-3156) с набором EGM-2 SingleQuot, содержащим добавки и факторы роста (Lonza, № СС-4176)], в 96-луночные планшеты с черными стенками, прозрачным плоским дном, покрытые коллагеном I (Greiner, №655956), и инкубировали при 37°С, 5% СО2 в течение 18-24 часов. После этого полную среду отсасывали, клетки промывали 2х в 100 мкл PBS/лунка, PBS отсасывали и 75 мкл обедненной среды [ЕВМ-2 (Lonza, № СС-3156) с пенициллином/стрептавидином] добавляли в каждую лунку. Затем клетки инкубировали при 37°С, 5% СО2 в течение 18 часов. Тестируемые образцы восстановленного или DSB IL-33 (в двух повторностях) разводили до требуемой концентрации в обедненной среде в 96-луночных полипропиленовых планшетах с U-образным дном (Greiner, 650201) и по 75 мкл вносили в планшеты с Huvec, чтобы инициировать стимуляцию. После 15- или 30-минутной инкубации аналитической смеси при 37°С клетки фиксировали в течение 15 минут в 3,7% растворе формальдегида (путем добавления 50 мкл 16% раствора, который был предварительно нагрет до 37°С). Фиксатор отсасывали и клетки дважды промывали с помощью PBS из расчета 100 мкл/лунка. Клетки окрашивали на p-STAT5 с помощью антитела кролика к фосфо-STATS, С71Е5 (Cell Signalling, №9314S), при разведении 1:250, которое обнаруживали, как описано выше.
[1093] Восстановленный IL-33 запускал передачу сигнала с участием р-р38 MAPK, которой не наблюдалось при окислении в DSB-форму (фигура 55А), что было аналогично ранее описанному случаю передачи сигнала с участием NFkB (примеры 4-6). Однако DSB IL-33, а не восстановленный IL-33, запускал передачу сигнала с участием p-STAT5 (фигура 55В). Таким образом, наблюдали явное переключение активации пути передачи сигнала после преобразования IL-33 человека из восстановленной в DSB-форму, что позволяет предположить, что DSB IL-33 может характеризоваться активностью, отличной от известных путей IL-33.
[1094] Чтобы подтвердить результат анализов ядерной транслокации, передачу сигнала с участием IL-33 определяли с помощью вестерн-блоттинг анализа. Huvec стимулировали, как указано выше, с помощью восстановленного или DSB IL-33 (3 нг/мл) в течение 15 минут. Затем клетки промывали дважды в охлажденном на льду PBS и лизировали с помощью 250 мкл буфера RIPA (Pierce, №89901), содержащего ингибиторы протеаз HALT (Pierce, №78430). Образцы подвергали SDS-PAGE в восстанавливающих условиях. Образцы смешивали 3:1 с 4х буфером для введения в гель NuPAGE (Invitrogen) и подвергали денатурации при 90°С в течение 3 минут. Восстановленные образцы содержали 2% бета-меркаптоэтанола. Образцы прогоняли на мини-гелях NuPAGE Novex с 4-12% Bis-Tris (Invitrogen) с подвижным буфером MOPS (Invitrogen) в соответствии с инструкциями производителя. Белки переносили на нитроцеллюлозные мембраны (Invitrogen, № по кат. IB3010-02) и обнаруживали с помощью вестерн-блоттинга с помощью антитела кролика к фосфо-р38 MAPK (Cell signalling, №9211S), антитела кролика к фосфо-STAT5, С71Е5 (Cell Signalling, №9314S), или антитела кролика к p-JAK2 (Cell Signalling, №3771S). Первичные антитела обнаруживали с помощью антитела к иммуноглобулину кролика, конъюгированного с HRP (Cell Signalling, №7074), и визуализировали с применением реагента ECL (Thermo Scientific, №34096).
[1095] На фигуре 55А показана активность ядерной транслокации р-р38 MAPK в Huvec в ответ на восстановленный IL-33 или DSB IL-33 (IL33-01, предварительно обработанный средой IMDM), где на оси х показана концентрация IL-33, а на оси у показан сигнал ядерной транслокации в условных единицах. Зависимый от концентрации сигнал наблюдали в случае восстановленного, но не окисленного IL-33.
[1096] На фигуре 55В показана ядерная транслокация p-STAT5 в Huvec в ответ на восстановленный IL-33 или DSB IL-33 (IL33-01, предварительно обработанный средой IMDM), где на оси х показана концентрация IL-33, а на оси у показан сигнал ядерной транслокации в условных единицах. Зависимый от концентрации сигнал наблюдали в случае DSB, но не восстановленного IL-33.
[1097] Фигура 55С. Вестерн-блоттинг анализ в отношении р-р38 MAPK, p-JAK2 и р-STAT5 в Huvec, простимулированных в течение 15 минут с помощью восстановленного IL-33 или DSB IL-33 (IL33-01, предварительно обработанный средой IMDM). Активацию р-р38 MAPK обнаруживали после стимуляции с помощью восстановленного, но не DSB IL-33. Активацию p-JAK2 и p-STAT5 обнаруживали после стимуляции с помощью DSB IL-33, но не восстановленного IL-33.
Передача сигнала с участием DSB IL-33 опосредована через рецептор конечных продуктов усиленного гликирования (RAGE)
[1098] Чтобы понять пути, модулируемые DSB IL-33 в Huvec, Huvec культивировали, как описано ранее, высевали из расчета 1×106 клеток/лунка в 6-луночный планшет, обработанный для культур тканей (Nunc 140675). После инкубации на протяжении ночи клетки стимулировали с помощью DSB IL-33 в течение 2 или 6 часов. Клетки собирали в 350 мкл буфера RLT (Qiagen, №79216). РНК очищали с применением набора RNeasy Micro (Qiagen, №74004) в соответствии с протоколом производителя. Затем РНК амплифицировали в однонитевую ДНК с применением набора Affymetrix GeneChip WT Plus Reagent (Affymetrix, №902513) и гибридизировали на генных чипах Human Genome U133A 2.0 (U133A 2.0) (Affymetrix, №900469), промывали на Affymetrix Fluidics Station и сканировали на Affymetrix Genechip Scanner 3000 7G. Затем данные обрабатывали с помощью Affymetrix Expression Console и сортировали по генам, для которых наблюдали более, чем ±1,8-кратное изменение сигнала в сравнении с необработанным контролем. Наблюдали изменения экспрессии лишь небольшого числа генов (таблица 39). Несмотря на это, ограниченную панель генов анализировали с применением Ingenuity Pathway Analysis (IPA) (Qiagen), который позволил предположить передачу сигнала с участием EIF2 в момент времени 2 часа и передачу сигнала с участием AGER в момент времени 6 часов. Теоретически, это позволяет предположить активацию пути с участием утилизирующего рецептора/рецептора конечных продуктов усиленного гликирования (RAGE).


[1099] Рецептор конечных продуктов усиленного гликирования (RAGE) представляет собой мультилигандный рецептор, который принадлежит к суперсемейству иммуноглобулинов и распознает целый ряд лигандов, включая бокс 1 группы с высокой подвижностью (HMGB-1), семейство белков S100, конечные продукты усиленного гликирования (AGE) и фибриллярные материалы с β-складчатой структурой. Полагают, что он вовлечен в оксидативный стресс, и была определена его связь с патогенезом многочисленных заболеваний.
[1100] Чтобы оценить, взаимодействует ли DSB напрямую с RAGE, анализ в формате ELISA применяли для изучения связывания RAGE с восстановленным IL-33 в сравнении с DSB IL-33 (фигура 56А). Восстановленный или DSB IL-33 с N-концевыми His-Avi (IL33-01, SEQ ID NO 632) биотинилировали, как описано в примере 7. Планшеты со стрептавидином (Thermo Scientific, АВ-1226) покрывали с помощью биотинилированного антигена из расчета 50 мкг/мл в PBS и инкубировали при комнатной температуре в течение 1 часа. Планшеты промывали 3х с помощью PBS-T (PBS +1% (объем/объем) Tween-20) и блокировали с помощью блокирующего буфера из расчета 300 мкл/лунка (PBS с 1% BSA (Sigma, А9576)) в течение 1 часа. Планшеты промывали 3х с помощью PBS-T. RAGE-Fc (R&D Systems, №1145-RG) разводили в блокирующем буфере, вносили в покрытые IL-33 или контрольные (без IL-33) лунки и инкубировали при комнатной температуре в течение 1 часа. RAGE-Fc обнаруживали с помощью антитела к IgG человека, конъюгированного с HRP (Sigma, А0170), разведенного 1:5000 в блокирующем буфере, 50 мкл/лунка, в течение 1 часа при комнатной температуре. Планшеты промывали 3х с помощью PBS-T и проявляли с помощью ТМВ, 50 мкл/лунка (Sigma, Т0440). Реакцию блокировали с помощью 50 мкл/лунка 0,1 М H2SO4 перед считыванием на планшет-ридере EnVision™ или аналогичном оборудовании при 450 нм.
[1101] Для дальнейшего подтверждения взаимодействия DSB IL-33 с RAGE оценивали способность RAGE-Fc или антител к RAGE ингибировать ST2-независимую передачу сигнала с участием pSTAT5 в Huvec. С этой целью варьирующие концентрации DSB IL-33 (IL33-01, обработанный IMDM) применяли для стимуляции Huvec в соответствии с протоколом, описанным выше, в присутствии или в отсутствие RAGE-Fc (R&D Systems, №1145-RG), ST2-Fc (R&D Systems, №523-ST), mAb к RAGE (из WO 2008137552) или контрольных реагентов. Нейтрализация DSB IL-33 с помощью RAGE-Fc (фигура 56В) или нейтрализация рецептора с помощью mAb к RAGE (фигура 56С) могли полностью ингибировать сигнал pSTAT5.
[1102] Фигура 56А. Связывание RAGE-Fc с поверхностью планшета с восстановленным IL-33 или DSB при ELISA, где на оси х показана концентрация RAGE-Fc, а на оси у показано поглощение при 450 нм. Данные показали повышенное связывание RAGE с DSB IL-33 в сравнении с восстановленным IL-33.
[1103] На фигуре 56В показан ответ с pSTAT5 на DSB IL-33 в Huvec в присутствии RAGE-Fc (50 мкг/мл), ST2-Fc (50 мкг/мл) или IgG1-антитела отрицательного контроля к NIP, NIP228 (50 мкг/мл). Передача сигнала с участием pSTAT5 полностью ингибировалась под действием RAGE-Fc, но не ST2-Fc или NIP228.
[1104] На фигуре 56С показан ответ с pSTAT5 на DSB IL-33 в Huvec в присутствии mAb к RAGE, m4F4 (10 мкг/мл), или IgG1-антитела мыши отрицательного контроля (10 мкг/мл). Передача сигнала с участием pSTAT5 полностью ингибировалась под действием m4F4, но не контрольного антитела mAb.
Предупреждение активности DSB IL-33 с помощью антител к IL-33
[1105] Как описано в примере 8, антитела, которые связывают IL-33, могут предотвращать окисление IL-33 в DSB-форму (фигура 43А). Оценивали способность антител к IL-33 предотвращать передачу сигнала с участием pSTAT5 в Huvec.
[1106] Фиксированные концентрации 33_640087-7В (SEQ ID NO 616 и 618), антитела к ST2 (Ab2 из WO 2013/173761; SEQ ID 85 и SEQ ID 19) и mAb изотопического контроля готовили в IMDM и затем комбинировали (100 мкл с 100 мкл) с титрацией WT IL-33 (также приготовленной в IMDM) в 96-луночных планшетах с U-образным дном.
Планшеты инкубировали при 37°С и 5% CO2 на протяжении ночи. По 75 мкл из каждой лунки этих планшетов для 'преинкубационной обработки' добавляли к 'истощенным' клеткам, подготовленным, как описано выше для анализа в отношении pSTAT5, и инкубировали при 37°С в течение 15 минут. Затем клетки дважды промывали в охлажденном на льду PBS и в каждую лунку добавляли по 100 мкл буфера для лизиса из набора Instant One для ELISA в отношении STAT5A/B от eBioscience (eBioscience, №85-86112-11). Затем измеряли активность pSTAT5 в лизатах клеток в соответствии с инструкциями производителя.
[1107] На фигуре 57 показан ответ с pSTAT5 в Huvec на IL-33, обработанный с помощью IMDM, в присутствии 33_640087-7В (10 мкг/мл) или mAb к ST2, Ab2 (10 мкг/мл), где на оси х отложена концентрация IL-33, а на оси у отложен сигнал pSTAT5. Передача сигнала с участием pSTAT5 полностью ингибировалась под действием 33_640087-7В, но не антитела к ST2, что подтверждает, что данный ответ является независимым от ST2.
Антитела к IL-33 ингибируют RAGE-зависимый ответ в эпителиальных клетках
[1108] RAGE экспрессируется на высоком уровне в клетках легочного эпителия. Линии клеток легочного эпителия оценивали в отношении зависимых от DSB IL-33 ответов. С этой целью клетки А549 культивировали в среде F12K (Gibco, №21127022), дополненной 1% пенициллина/стрептомицина и 10% FBS. Клетки собирали с помощью 0,5% трипсина-EDTA (Gibco, №15400-054), промывали и высевали в 96-луночные планшеты из расчета 1×105/клеток/лунка в среду для культивирования. Затем клетки инкубировали при 37°С, 5% СО2 в течение 24 часов. На следующий день полную среду удаляли, клетки промывали дважды в PBS и среду заменяли на 'истощенную' среду (среда F12K с 1% пенициллина/стрептавидина) и планшеты инкубировали в течение 24 часов при 37°С и 5% CO2.
[1109] Фиксированные концентрации 33_640087-7В (SEQ ID NO 616 и 618), антитела к ST2 (WO 2013/173761, Ab2 (SEQ ID 85 и SEQ ID 19)), антитела к RAGE m4F4 (из WO 2008137552) и mAb изотипического контроля готовили в IMDM и затем комбинировали (100 мкл с 100 мкл) с WT IL-33 (также приготовленным в IMDM) в 96-луночных планшетах с U-образным дном. Как клетки, так и планшеты для обработки инкубировали при 37°С и 5% СО2 на протяжении ночи. По 75 мкл из каждой лунки этих планшетов для 'преинкубационной обработки' добавляли к 'истощенным' клеткам, подготовленным, как описано выше, и планшеты инкубировали в течение 24 часов при 37°С и 5% СО2. Затем устанавливали 96-луночную систему трансвелл (Corning, № CLS3422-48EA) путем добавления 96-луночного планшета трансвелл на низкий связывающий 96-луночный планшет-приемник. 235 мкл полной среды (среды F12K, дополненной 10% FBS и 1% пенициллина/стрептавидина) вносили в нижнюю камеру системы трансвелл. Обработанные клетки А549 из каждой лунки 96-луночного планшета затем промывали в PBS, трипсинизировали для отделения, центрифугировали при 1000 об./мин. в течение 5 мин., ресуспендировали в 75 мкл 'истощенной' среды и вносили в верхнюю камеру системы трансвелл. Затем трансвелл-планшет инкубировали при 37°С, 5% СО2 в течение 16 часов. Среду затем удаляли как из верхней, так и из нижней камер и клетки удаляли из нижней камеры с применением 235 мкл трипсина. 100 мкл суспензии трипсин/клетки затем добавляли к 100 мкл Cell Titer Glo (Promega, №G7571). Титрацию свежих клеток А549 готовили в трипсине и добавляли к Cell Titer Glo из расчета 50:50 для получения стандартной кривой количества клеток. Затем планшеты инкубировали и считывали в соответствии с инструкциями производителя.
[1110] На фигуре 58А показана миграция клеток А549 после обработки с помощью IL33-01, инкубированного в присутствии 33_640087-7В (10 мкг/мл), mAb к ST2, Ab2, (10 мкг/мл) или mAb к RAGE, 4F4, где на оси х показаны условия предварительной обработки клеток, а на оси у отложено количество мигрировавших клеток. Данные демонстрируют, что предварительная обработка клеток А549 с помощью DSB IL-33 снижает последующую миграцию клеток. Данное ингибирование миграции отменялось под действием mAb к RAGE и 33_640087-7В, но не под действием антитела к ST2.
[1111] На фигуре 58В показана миграция клеток А549 после обработки с помощью DSB IL33-01, инкубированного в присутствии 33_640087-7В (10 мкг/мл) или mAb к ST2, Ab2, (10 мкг/мл), где на оси х показаны условия предварительной обработки клеток, а на оси у отложено количество мигрировавших клеток. Данные демонстрируют, что предварительная обработка клеток А549 с помощью DSB IL-33 снижает последующую миграцию клеток. Данное ингибирование миграции не отменялось под действием 33_640087-7В или антитела к ST2.
[1112] Вместе эти данные подтверждают, что 33_640087-7В ингибирует активность DSB-IL_33 путем предотвращения преобразования восстановленного IL-33 в DSB IL-33, а не путем нейтрализации DSB IL-33 напрямую, что согласуется с его способностью связывать только восстановленную, активную для ST2 форму IL-33.
Реферат
Изобретение относится к области биохимии, в частности к выделенному антителу или его антигенсвязывающему фрагменту, которое(ый) специфически связывается с белком IL-33 в восстановленной форме, к способу их получения, а также к их применению для лечения или предупреждения воспалительного состояния. Также раскрыт полинуклеотид, кодирующий вышеуказанное антитело или его фрагмент, а также вектор и клетка, его содержащие. Изобретение позволяет эффективно осуществлять лечение воспалительного состояния. 13 н. и 11 з.п. ф-лы, 58 ил., 39 табл., 12 пр.
Формула
Документы, цитированные в отчёте о поиске
Интерлейкин-13-связывающие белки

Комментарии