Получение антител из одних тяжелых цепей в трансгенных животных - RU2435784C2
Код документа: RU2435784C2
Чертежи
























Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к улучшенным способам для получения у трансгенных нечеловеческих млекопитающих разнообразного репертуара функциональных антител из одних тяжелых цепей со зрелой аффинностью в ответ на антигенную стимуляцию и их применениям. Изобретение также относится к получению разнообразного репертуара класс-специфических антител из одних тяжелых цепей из многочисленных локусов.
В частности, настоящее изобретение относится к способу получения человеческих антиген-специфических антител любого класса или комбинации классов из одних тяжелых цепей с высокой аффинностью и выделения и экспрессии полностью функциональных VH антигенсвязывающих доменов.
Также описаны антитела из одних тяжелых цепей, полученные с применением способов настоящего изобретения.
В следующем описании все номера положений аминокислотных остатков даны в соответствии с номенклатурой, разработанной Kabat et al., [1].
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Антитела
Структура антител хорошо известна в данном уровне техники. Большинство естественных антител являются тетрамерами, содержащими две тяжелые цепи и две легкие цепи. Тяжелые цепи связаны друг с другом дисульфидными связями между шарнирными участками, расположенными приблизительно посередине каждой тяжелой цепи. Легкая цепь связана с каждой тяжелой цепью на N-концевом домене шарнирного участка. Каждая легкая цепь в норме связана с соответствующей ей тяжелой цепью посредством дисульфидной связи около шарнирного участка.
Если молекула антитела правильно сложена, то каждая цепь складывается в ряд различных глобулярных доменов, связанных посредством более линейных пептидных последовательностей. Например, легкая цепь складывается из вариабельного (VL) и постоянного (CL) участков. Тяжелые цепи имеют единственный вариабельный участок (VH), первый постоянный участок (CH1), шарнирный участок и два или три дополнительных постоянных участка. Постоянные участки тяжелых цепей и шарнирный участок вместе образуют то, что обычно известно как постоянная область тяжелой цепи антитела. Взаимодействие вариабельных участков тяжелой (VH) и легкой (VL) цепи приводит к образованию антигенсвязывающей области (FV). Взаимодействию тяжелой и легкой цепей способствуют CH1 участок тяжелой цепи и Cκ или Cλ участок легкой цепи. Обычно для связывания антигена необходимы как VH, так и VL, хотя было показано, что димеры тяжелой цепи и аминоконцевых фрагментов сохраняют активность в отсутствие легкой цепи [2].
В пределах вариабельных участков как тяжелой (VH), так и легкой (VL) цепей некоторые короткие полипептидные сегменты показывают исключительную изменчивость. Данные сегменты называются гипервариабельными областями или гипервариабельными участками (CDR). Промежуточные сегменты называются каркасными областями (FR). В каждом из участков VH и VL существует три CDR (CDR1- CDR3).
У млекопитающих существует пять классов антител: IgA, IgD, IgE, IgG и IgM с четырьмя подтипами IgG и двумя подтипами IgA, присутствующими у людей.
www.drugresearcher.com

Классы антител отличаются своей физиологической функцией. Например, IgG играет основную роль в зрелом иммунном ответе. IgM вовлечен в связывающий комплемент и агглютинацию. IgA является основным классом антител секретов - слез, слюны, молозива, слизи - и, таким образом, играет роль в локальном иммунитете. Эффекторные функции естественных антител обеспечиваются постоянной областью тяжелой цепи.
IgA можно обнаружить в местах, содержащих слизь (например, в кишечнике, в дыхательных путях или в мочеполовом канале) и он предотвращает колонизацию слизистых мест патогенами. IgD функционирует главным образом в качестве антигенного рецептора на B-клетках. IgE связывается с аллергенами и запускает высвобождение гистамина из тучных клеток (лежащее в основе механизма аллергии), и также обеспечивает защиту от гельминтов (червей). IgG (в его четырех изотипах) обеспечивает большую часть основанного на антителах иммунитета от инвазивных патогенов. IgM экспрессируется на поверхности B-клеток и также в секретируемой форме с очень высокой склонностью к удалению патогенов из организма на ранних стадиях опосредованного B-клетками иммунитета (например, до того как будет в наличии достаточное количество IgG, для того чтобы удалить из организма патогены).
Нормальные человеческие B-клетки содержат единственный локус тяжелой цепи на 14 хромосоме, из которого вырабатывается посредством перестройки ген, кодирующий тяжелую цепь. У мыши локус тяжелой цепи располагается на 12 хромосоме. Нормальный локус тяжелой цепи содержит множество сегментов V-гена, ряд сегментов D-гена и ряд сегментов J-гена. Большая часть VH участка кодируется сегментом V-гена, а С-конец каждого VH участка кодируется сегментом D-гена и сегментом J-гена. VDJ реаранжировка в B-клетках, за которой следует созревание аффинности, обеспечивает каждый VH участок с его антигенсвязывающей специфичностью. Анализ последовательности нормальных H2L2 тетрамеров показывает, что разнообразие происходит преимущественно из-за комбинации VDJ перестройки и соматической сверхмутации [3]. Существует свыше 50 человеческих сегментов V-генов, присутствующих в геноме человека, из которых только 39 являются функциональными.
Вполне человеческие антитела H2L2 могут вырабатываться у трансгенных мышей в ответ на антигенную стимуляцию. У подобных трансгенных мышей содержится единственный человеческий локус тяжелой цепи и отдельный локус легкой цепи. Сопоставимые локусы тяжелой и легкой цепи мыши удаляются или подавляются таким образом, что вырабатываются только человеческие антитела в отсутствие антител мыши [4-10].
С появлением новых методик молекулярной биологии присутствие антитела из одних тяжелых цепей (лишенного легкой цепи) распознавали при пролиферативных нарушениях B-клеток у человека (болезнь тяжелых цепей) и в мышиных модельных системах. Анализ болезни тяжелых цепей на молекулярном уровне показал, что мутации и делеции на уровне генома могли бы привести к нецелесообразной экспрессии участка тяжелой цепи CH1, вызывая экспрессию антитела из одних тяжелых цепей, лишенного способности связывать легкую цепь [11, 12].
Было показано, что камелиды, в результате естественных генных мутаций, вырабатывают функциональные димеры IgG2 и IgG3 из одних тяжелых цепей, которые не способны связывать легкую цепь из-за отсутствия участка CH1, который опосредует связывание с легкой цепью [13]. Характерным признаком антитела камелида из одних тяжелых цепей является специфический набор VH участков камелида, который обеспечивает улучшенную растворимость относительно VH участков человека и нормального камелида. VH участки камелида в данном специфическом наборе обычно называются участками VHH.
Также было показано, что такие виды, как акула, вырабатывают семейство связывающих белков, подобных таким, как из одних тяжелых цепей, возможно связанных с рецептором T-клеток млекопитающих или с легкой цепью антитела [14].
Для получения антитела камелида из одних тяжелых цепей локус тяжелой цепи зародыша камелида содержит генные сегменты, кодирующие некоторые или все возможные постоянные области тяжелой цепи. В течение созревания реаранжированный VHHDJ связывающий участок сплайсируется на 5'-конце генного сегмента, кодирующего шарнирный участок, для того чтобы обеспечить реаранжированный ген, кодирующий тяжелую цепь, в которой отсутствует CH1 участок, и, следовательно, не способен связывать легкую цепь.
Участки VHH камелида содержат ряд характерных аминокислот в положениях 37, 44, 45 и 47 [49]. Считается, что данные консервативные аминокислоты являются важными для обеспечения растворимости в антителах из одних тяжелых цепей. Только определенные VH участки камелида являются VHH участками с улучшенными характеристиками растворимости. Они ограничиваются VH подсемейством и, таким образом, продуктивно реагируют только на ограниченный диапазон антигенов.
Моноклональные антитела из одних тяжелых цепей можно восстановить из B-клеток селезенки камелида стандартной технологией клонирования или из мРНК B-клеток посредством бактериофага или другой технологии индикации [18]. Антитела из одних тяжелых цепей, полученные из камелидов, обладают самой высокой аффинностью. Анализ последовательности мРНК, кодирующей антитело из одних тяжелых цепей, показывает, что разнообразие происходит преимущественно из-за комбинации VHHDJ перестройки и соматической сверхмутации [49], как это также наблюдается при получении нормальных тетрамерных антител.
Важным и общим признаком естественных VH участков камелида и человека является то, что каждый участок связывается в виде мономера независимо от димеризации с участком VL для оптимальной растворимости и связывающей аффинности.
В последнее время были разработаны способы получения антител из одних тяжелых цепей у трансгенных нечеловеческих млекопитающих (см. WO 02085945 и WO 02085944). Функциональное антитело из одних тяжелых цепей потенциально любого класса (IgM, IgG, IgD, IgA или IgE) и полученное из любого млекопитающего может вырабатываться у трансгенных нечеловеческих млекопитающих (предпочтительно мышей) в результате антигенной стимуляции. Предварительные исследования основывались на применении двух сегментов V-гена ламы и имели ответ с ограниченным репертуаром антител.
Janssens et al. [15] разработали способы получения антител из одних тяжелых цепей в трансгенных мышах. Данные антитела из одних тяжелых цепей имеют высокую связывающую аффинность в результате созревания антитела в B-клетках, могут быть получены в результате антигенной стимуляции и селектированы с применением установленной технологии гибридомы и могут вырабатываться в виде любого класса антител с отсутствующей легкой цепью (например, IgG, IgA, IgM) или в виде только VH связывающих участков. Данные антитела из одних тяжелых цепей были получены из локуса тяжелой цепи антитела в зародышевой (т.е. нереаранжированной) конфигурации, который содержал два сегмента VHH-гена (класс 3) ламы, соединенные со всеми сегментами D- и J-генов и сегментами гена, кодирующего все человеческие постоянные области. Сегменты гена, кодирующего каждую из постоянных областей, имели делецию CH1 участка, для того чтобы предотвратить связывание легких цепей. Кроме того, локус содержал антитело LCR на 3'-конце для того, чтобы обеспечить высокий уровень экспрессии в клетках B-клеточной линии. Данный локус был введен мышам микроинъекцией оплодотворенных яйцеклеток.
Получение продуктов, основанных на антителах
Получение продуктов, основанных на антителах, посредством генной инженерии, в частности получение человеческих или гуманизированных продуктов, основанных на антителах, привело к образованию новых классов лекарственных препаратов, диагностических средств и реагентов и, помимо этого, к возможности для новой отрасли производства, применения и создания материальных благ (см., www.leaddiscovery.co.uk). Продукты, основанные на антителах, обычно получают из естественных тетрамерных антител. Существует множество патентов и заявок, которые относятся к получению продуктов, основанных на антителах. Данные патенты и заявки относятся к способам получения (например, из трансгенных мышей), способам производства и продукт-специфическим веществам. Данные продукты, основанные на антителах, отличаются от полностью тетрамерных антител фрагментами антитела в единственной цепи Fv (scFv) молекул.
Продукты, основанные на антителах, будут представлять большую часть новых лекарственных препаратов, запущенных в 21 веке. Терапия моноклональных антител уже признается предпочтительным способом лечения ревматоидного артрита и болезни Крона, и существует впечатляющий прогресс в лечении рака. Продукты, основанные на антителах, также разрабатываются для лечения сердечно-сосудистых и инфекционных заболеваний. Самые распространенные на рынке продукты, основанные на антителах, распознают и связывают единственный хорошо определяемый эпитоп на лиганде мишени (например, TNFα).
В последнее время VH участки с высокой аффинностью были выбраны из случайных человеческих VH участков в библиотеках генов или получены из антитела из одних тяжелых цепей, полученного естественным путем из-за антигенной стимуляции камелидов, или получены из библиотек VH участков, составленных из камелидов. Данные VH участки с высокой аффинностью были включены в продукты, основанные на антителах. Данные VH участки, также называемые VHH участками, проявляют ряд отличий от классических VH участков, в частности ряд мутаций, которые обеспечивают улучшенную растворимость и стабильность тяжелых цепей при отсутствии легких цепей. Самым главным из данных изменений является наличие заряженной аминокислоты в 45 положении [16].
Ряд групп работали над получением антител из одних тяжелых цепей, полученных из естественных тетрамерных антител. Jaton et al. [2 и другие ссылки, приведенные в контексте данного документа] описывают выделение редуцированных компонентов тяжелой цепи очищенного, хорошо охарактеризованного антитела кролика с аффинностью, после чего следует последовательная ренатурация отдельных тяжелых цепей. Иммунологическая характеристика ренатурированных тяжелых цепей показала, что только гомодимер тяжелой цепи без легкой цепи способен связывать антиген.
Впоследствии Ward et al. [18] однозначно показали, что клонированные мышиные VH области, при экспрессии в виде растворимых белковых мономеров в экспрессионной системе E.coli, сохраняют способность связывать антиген с высокой аффинностью. Ward et al. [18] описывают выделение и исследование VH участков и излагают потенциальные коммерческие преимущества данного подхода по сравнению с классическим получением моноклональных антител (см. последний абзац). Они также признают, что VH участки, выделенные из тяжелых цепей, которые естественно связываются с легкой цепью, испытывают недостаток в растворимости естественных тетрамерных антител. Следовательно, Ward et al. [18] использовали понятие «адгезивный» для описания данных молекул и предположили, что данная «адгезивность» может быть обращена к структуре VH участков с улучшенными свойствами растворимости.
Улучшение растворимости VH было впоследствии обращено к применению комбинаций отобранных случайно и сайт-специфических подходов с использованием фагового дисплея. Например, Davies and Riechmann [17] и другие (см. WO 92/01047) включили некоторые признаки VH участков антител камелида из одних тяжелых цепей в комбинации с фаговым дисплеем, для того чтобы улучшить растворимость, в то же время сохраняя связывающую специфичность.
Отдельные исследования выделенных человеческих VH участков, полученных из фаговых библиотек, показали антиген-специфическое связывание VH участков, но данные VH участки, как оказалось, обладают низкой растворимостью. Кроме того, предположили, что селекция человеческих VH участков со специфичными связывающими характеристиками, показанными на фаговых структурах, могли бы образовывать структурные единицы для генно-инженерных антител [18].
Человеческие VH участки можно разработать для улучшения характеристик растворимости [19, 20] или растворимости можно достигнуть естественной селекцией in vivo [21]. Однако, поскольку VH связывающие участки были получены из фаговых библиотек, то истинная аффинность для антигена остается в от низкого микромолярного до высокого наномолярного диапазона несмотря на заявление способов улучшения аффинности, включая, например, способ случайного отбора «горячей точки» аффинности [22].
VH участки человека или камелида, полученные технологией фагового дисплея или альтернативной технологией, не имеют преимущества улучшенных характеристик в результате соматических мутаций и дополнительного многообразия, полученного посредством рекомбинации сегментов D- и J-генов в области CDR3 связывающего сайта нормального антитела. Некоторые VH(VHH) участки, хотя и проявляющие преимущества в растворимости относительно человеческих VH участков, могут оказаться антигенными для человека и, кроме того, страдают таким недостатком, что VH участки камелидов должны вырабатываться посредством иммунизации камелидов или посредством технологии фагового дисплея.
Полученные из фагов человеческие VH области являются тяжелыми в применении, так как они требуют много циклов пэннинга и последующего мутагенеза, для того чтобы достигнуть связывающих характеристик высокой аффинности. VHH участки камелидов требуют такой же тяжелой процедуры при выделении из фага или из подобных генных библиотек, или требуют иммунизации больших животных (лам или верблюдов, которые также вырабатывают классические антитела), неподдающихся классической технологии гибридомы. Кроме того, связывающие участки камелидов могут оказаться антигенными и требуют гуманизации.
Получение антител из одних тяжелых цепей у трансгенных нечеловеческих млекопитающих (см. WO 02085945 и WO 02085944) в результате антигенной стимуляции преодолевает многие из данных проблем.
Однако остается необходимость на данном уровне техники максимизировать разнообразие антител из одних тяжелых цепей и B-клеточный ответ in vivo и, в частности, получить функциональный репертуар класс-специфических человеческих антител из одних тяжелых цепей и функциональных VH участков, связывающих только тяжелые цепи, которые сохраняют максимальную антигенсвязывающую способность для использования в многообразии клинических, промышленных и исследовательских применений.
ИЗОБРЕТЕНИЕ
Настоящие изобретатели, на удивление, преодолели ограничения предыдущего уровня техники и показали, что репертуар ответа антител можно значительно расширить посредством увеличения числа локусов одних тяжелых цепей, присутствующих у трансгенного нечеловеческого млекопитающего, которые обычно вырабатывают класс-специфические антитела из одних тяжелых цепей.
Изобретение основывается на таком открытии, что поскольку трансгенное нечеловеческое млекопитающее обладает множественными локусами одних тяжелых цепей, то данные локусы подвергаются аллельному исключению. Следовательно, случайно выбирается и успешно рекомбинируется только один локус, приводя к получению антитела из одних тяжелых цепей. Множественные VH локусы тяжелых цепей, следовательно, можно применять в таком же трансгенном нечеловеческом млекопитающем, для того чтобы максимизировать репертуар и многообразие антител, получаемых из млекопитающего. При антигенном стимулировании трансгенное нечеловеческое млекопитающее «выбирает» локус, содержащий сегмент V-гена, который является наиболее подходящим для ответа на специфическую антигенную стимуляцию с исключением остальных локусов.
Антитела из одних тяжелых цепей, которые можно получить способами изобретения, проявляют высокую связывающую аффинность в результате того, что трансгенное нечеловеческое млекопитающее способно «выбирать» из ряда локусов, из которых сегменты V, D и J-генов реаранжируются, и могут происходить соматические мутации, в основном в отсутствие расширенной CDR3 петли. По существу, нормальное созревание B-клетки наблюдается при высоких уровнях антител из одних тяжелых цепей, присутствующих в выделенной плазме (при условии, что участок CH1 был выделен из всех классов антител, присутствующих в рекомбинантном локусе). Созревание B-клетки и секреция связанных димеров (например, IgG) или мультимеров (например, IgM) не зависит от присутствия или экспрессии генов легких цепей.
Соответственно, в первом аспекте настоящего изобретения обеспечивается способ получения VH антител из одних тяжелых цепей у трансгенного нечеловеческого млекопитающего, включающий стадию получения более одного гетерологического VH локуса тяжелых цепей у данного млекопитающего, причем каждый VH локус тяжелых цепей содержит один или более сегментов V-гена, один или более сегментов D-гена, один или более сегментов J-гена и сегмент гена, кодирующего постоянную область тяжелых цепей, которая при экспрессии не включает участок CH1, и экспрессирующего VH антитела из одних тяжелых цепей, по крайней мере, из одного из вышеназванных локусов.
Предпочтительно каждый VH локус тяжелых цепей содержит один или множество сегментов V-гена, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 45, 50 или 60 сегментов V-гена, которые могут быть получены из любых видов позвоночных.
В одном варианте осуществления каждый локус может содержать только один сегмент V-гена. Одновременно альтернативно данному варианту осуществления каждый сегмент V-гена отличается от всех других сегментов V-гена. В качестве второй альтернативы каждый сегмент V-гена идентичен всем другим сегментам V-гена. В качестве данной второй альтернативы остальные сегменты гена в каждом локусе могут быть одинаковыми или отличаться от сегментов гена во всех других локусах.
Таким образом, предусматривается, что нечеловеческое млекопитающее может содержать множество копий единственного VH локуса тяжелых цепей. Данный факт имеет преимущество оптимизации возможностей, что в B-клетке будет происходить продуктивная реаранжировка, таким образом, позволяя получение полезных антител из одних тяжелых цепей.
Если нечеловеческое млекопитающее содержит ряд различных VH локусов тяжелых цепей, то этот факт будет, кроме того, оптимизировать возможности получения антител из одних тяжелых цепей с необходимой специфичностью.
В другом варианте осуществления каждый локус содержит множество сегментов V-гена. В данном варианте осуществления сегменты V-гена в любом одном локусе могут быть все получены из организма одинаковых видов, например, все сегменты V-гена могут быть человеческого происхождения. В качестве альтернативы сегменты V-гена в любом одном локусе могут быть все получены из организмов разных видов, например некоторые сегменты V-гена из человека, а другие из камелидов или из акул.
Предпочтительны сегменты V-гена человеческого происхождения.
Понятие «сегмент V-гена» охватывает любой естественный сегмент V-гена, полученный из позвоночного, включая камелидов и человека. Сегмент V-гена должен быть способен рекомбинировать с сегментом D-гена, сегментом J-гена и сегментом гена, кодирующим постоянную (эффекторную) область тяжелых цепей (которая может содержать несколько экзонов, но исключает CH1 экзон), для того чтобы вырабатывать VH антитела из одних тяжелых цепей при экспрессии нуклеиновой кислоты.
Сегмент V-гена также содержит в своем составе любую генную последовательность, кодирующую гомолог, производное или белковый фрагмент, который способен рекомбинировать с сегментом D-гена, сегментом J-гена и сегментом гена, кодирующим постоянную область тяжелых цепей (содержащую один или более экзонов, но не CH1 экзон), для того чтобы вырабатывать антитела из одних тяжелых цепей, как определено в контексте данного документа. Сегмент V-гена можно, например, получить из локуса T-клеточного рецептора или локуса легкой цепи иммуноглобулина.
Предпочтительно множественные локусы тяжелых цепей данного изобретения содержат любое количество или комбинацию 39 функциональных сегментов человеческого V-гена и их генно-инженерных модификаций с улучшенными свойствами растворимости, распределенных по множественным локусам. Это возможно для любого количества локусов, например четыре локуса, содержащие восемь сегментов V-гена, плюс один локус, содержащий семь сегментов V-гена; семь локусов, содержащие четыре сегмента V-гена, плюс один локус, содержащий три сегмента V-гена; или тридцать девять локусов, содержащие по одному сегменту V-гена каждый.
Человеческие V-гены классифицируют на семь семейств, от VH1 до VH7, и отдельные гены пронумерованы в пределах каждого семейства. Частота, с которой применяется каждый ген, зависит от изменяющихся условий частного иммунного ответа. Например, гены семейства VH3 могут предпочтительно применяться по сравнению с генами семейства VH5 при ответе на бактериальные антигены. Следовательно, в дополнительном предпочтительном варианте осуществления изобретения было показано, что группы сегментов V-гена, применимые для получения ответа антитела на специфические антигены, располагаются группами в отдельных линиях трансгенных нечеловеческих млекопитающих. Сегменты V-гена могут располагаться группами в соответствии с семейством, или они могут располагаться группами в соответствии с индивидуальной функцией. Например, показывают, что если V-гены семейства VH3 являются применимыми для получения иммунного ответа на бактериальные антигены, то они могут применяться для получения трансгенного нечеловеческого млекопитающего, которое, в частности, применимо для получения антител из одних тяжелых цепей на бактериальные антигены. В качестве альтернативы, если показывают, что несколько индивидуальных генов из семейств VH3 и VH5 применимы для получения иммунного ответа на бактериальные антигены, то они могут располагаться группами вместе и применяться для получения трансгенного нечеловеческого млекопитающего, которое, в частности, применимо для получения антител из одних тяжелых цепей на бактериальные антигены.
В контексте настоящего изобретения понятие «гетерологический» означает нуклеотидную последовательность или локус, описанный в контексте данного документа, который не является эндогенным по отношению к млекопитающему, в котором находится.
«VH локус тяжелых цепей» в контексте настоящего изобретения относится к минимальному микролокусу, кодирующему VH участок, содержащий один или более сегментов V-гена, один или более сегментов D-гена и один или более сегментов J-гена, операционно связанному с одним или более генными сегментами, кодирующими эффекторные области тяжелых цепей (каждая без CH1 участка). Предпочтительно первоисточником изменчивости репертуара антител является область CDR3, образованная селекцией сегментов V, D и J-генов и V-D и D-J области стыка.
Преимуществом настоящего изобретения является то, что репертуар и разнообразие антител, полученных в реаранжированных последовательностях VH гена, можно максимизировать посредством применения множественных VH локусов тяжелых цепей в одном и том же трансгенном нечеловеческом млекопитающем. Janssens et al., 2006 [15] показали, что трансгенный локус, описанный выше, ведет себя подобно локусу нормального иммуноглобулина в том, что касается реаранжировки и аллельных исключений. Этот факт раскрывает возможность иметь множественные локусы в одном и том же животном (на разных хромосомах), для того чтобы максимизировать ряд возможных VH рекомбинаций посредством применения аллельного исключения. Каждый из трансгенных локусов содержал бы, вероятно, от одной до более сорока VH областей. Процесс аллельного исключения, который случайно выбирает один из локусов для начала рекомбинации, за которым идет следующий локус, если первая рекомбинация была непродуктивной, и т.д., пока не будет осуществлена продуктивная рекомбинация из одного из локусов, обеспечивал, вероятно, что фактически все VH области, присутствующие в комбинированных локусах, были бы частью общего процесса рекомбинации.
Janssens et al., [15] также на удивление обнаружили, что если многочисленные локусы тяжелых цепей в одном и том же трансгенном нечеловеческом млекопитающем расположены вместе на одной и той же хромосоме, то продуктивная реаранжировка и экспрессия антитела могут происходить из множественных локусов тяжелых цепей. В таких случаях последовательные клоны гибридомы являются поликлональными. Специалист в данной области примет во внимание, что это еще один механизм увеличения разнообразия антител.
В соответствии с другим аспектом изобретения обеспечивается способ, описанный в контексте данного документа, в котором присутствуют, по крайней мере, два или более VH локусов тяжелых цепей в трансгенном нечеловеческом млекопитающем, расположенных вместе на одной и той же хромосоме, тогда продуктивная реаранжировка и экспрессия антитела могут происходить из двух или более локусов одновременно.
Предпочтительно ряд локусов тяжелых цепей сначала будет введен отдельно трансгенному нечеловеческому млекопитающему, получая трансгенное нечеловеческое млекопитающее с единственным локусом тяжелых цепей. Данные животные затем будут скрещены, для получения потомства с множественными локусами тяжелых цепей, для того чтобы максимизировать ряд VH областей, приводя к максимальному разнообразию. Локусы также можно добавить посредством нового цикла трансгенеза. Новые локусы, вероятно, были бы введены в яйцеклетки, полученные из нечеловеческих млекопитающих, уже содержащих один или более гетерологических VH локусов тяжелых цепей. Устойчивая интеграция новых гетерологических VH локусов тяжелых цепей, вероятно, приводила бы к увеличению доступности VH областей, а следовательно, разнообразия. Устойчивая трансфекция ES клеток, полученных из нечеловеческих трансгенных млекопитающих, содержащих гетерологический VH локус тяжелых цепей с дополнительными гетерологическими VH локусами тяжелых цепей, обеспечивает альтернативный способ увеличения разнообразия в нечеловеческих млекопитающих (например, мышах), причем технологию ES клеток можно применять для трансгенеза посредством эмбрионального слияния и зародышевой инъекции.
Предпочтительно каждый отдельный локус тяжелых цепей будет присутствовать в виде единственной копии в геноме трансгенного нечеловеческого млекопитающего.
Кроме того, применение множественных сегментов V, D и J-генов обеспечивает дополнительное увеличение полученного репертуара и разнообразия антител. Последующая соматическая мутация осуществляется во время применения минимального локуса (микролокуса) без необходимости в локусах VL и LC (легкая цепь) антител.
В контексте настоящего изобретения понятия «сегмент D-гена» и «сегмент J-гена» включают естественные последовательности сегментов D и J-генов. Предпочтительно сегменты D и J-генов получают из тех же самых позвоночных, из которых получают сегмент V-гена. Например, если сегмент V-гена получают из человека, то сегменты D и J-генов с необходимой растворимостью или генно-инженерные также предпочтительно получают из человека. В качестве альтернативы сегменты V-гена можно получить, например, из камелида, а сегменты D и J-генов из человека или наоборот.
Понятия «сегмент D-гена» и «сегмент J-гена» также включают в себя производные, гомологи и их фрагменты до тех пор, пока получающийся в результате сегмент может рекомбинировать с остальными компонентами локуса тяжелой цепи антитела, описанного в контексте данного документа, для того чтобы получить антитело из одних тяжелых цепей, описанное в контексте данного документа. Сегменты D и J-генов могут быть получены из естественных источников или их можно синтезировать, применяя способы, хорошо известные специалистам в данной области техники и описанные в контексте данного документа. Сегменты V, D и J-генов способны к рекомбинации и предпочтительно подвергаются соматической мутации.
Сегменты D и J-генов предпочтительно получают только из видов позвоночных. Это могут быть любые виды позвоночных, но предпочтительным является человек.
Предпочтительно каждый VH локус тяжелых цепей содержит от одного до сорока (2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 16, 18, 20, 30 или 40) или более сегментов D-гена. Сегменты D-гена могут быть получены из любых видов позвоночных, но более предпочтительно, сегментами D-гена являются человеческие сегменты D-гена (обычно 25 функциональных сегментов D-гена).
Предпочтительно каждый VH локус тяжелых цепей содержит от одного до двадцати (2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18 или 20) или более сегментов J-гена. Сегменты J-гена могут быть получены из любых видов позвоночных, но более предпочтительно, сегментами J-гена являются человеческие сегменты J-гена (обычно 6 (шесть) сегментов J-гена).
Каждый VH локус тяжелых цепей может содержать одни и те же сегменты D и J-генов. В качестве альтернативы каждый VH локус тяжелых цепей может содержать различные комбинации сегментов D и J-генов. Например, если каждый VH локус тяжелых цепей содержит только один сегмент V-гена, и данный сегмент идентичен в каждом локусе, то это является благоприятным для применения различных комбинаций сегментов D и J-генов в каждом локусе для дополнительной оптимизации возможностей получения продуктивной реаранжировки. Однако, если каждый VH локус тяжелых цепей содержит один или более различных сегментов V-гена, то это может быть благоприятным для применения одних и тех же комбинаций сегментов D и J-генов в каждом локусе.
Предпочтительно VH локус тяжелых цепей содержит один или более сегментов V-гена, двадцать пять функциональных человеческих сегментов D-гена и шесть человеческих сегментов J-гена.
Каждый сегмент гена, кодирующий постоянную область тяжелой цепи, может содержать один или более экзонов постоянной области тяжелой цепи класса Cδ, Cγ1-4, Cµ, Cε или Cα1-2 при условии, что сегменты гена постоянной области тяжелой цепи не экспрессируют участок CH1. Сегменты гена постоянной области тяжелой цепи выбирают в зависимости от предпочтительного класса или необходимой смеси классов антител. Необязательно гетерологический локус тяжелой цепи является Cµ- и Cδ-дефицитным.
Таким образом, каждый VH локус тяжелых цепей может содержать сегмент гена, кодирующий, по крайней мере, одну постоянную область тяжелой цепи, обеспечивая эффекторные функции in vivo (например, IgG, IgM, IgA, IgE или IgD или их изотип), причем каждая постоянная область не включает участок CH1. Каждый локус может содержать только один сегмент гена, кодирующий одну конкретную постоянную область. Это будет благоприятным, если необходимы определенные эффекторные функции. В качестве альтернативы каждый локус может содержать более одного сегмента гена, причем каждый кодирует различные постоянные области. Это будет благоприятным, если нет необходимости в конкретных эффекторных функциях, так как это позволит получить многообразие классов антител из одних тяжелых цепей.
Каждый локус может содержать кодирующие постоянную область сегмент(ы) гена или каждый локус может иметь разные или разные комбинации кодирующего постоянную область сегмента(ов) гена.
Операционно постоянная область тяжелой цепи кодируется естественным или генно-инженерным сегментом гена, который способен рекомбинировать с сегментом V-гена, сегментом D-гена и сегментом J-гена в B-клетке.
В каждом антителе из одних тяжелых цепей постоянная область экспрессируется без участка CH1, так что может происходить получение антитела из одних тяжелых цепей. Экзоны CH1 можно удалить, так что постоянная область VH антитела из одних тяжелых цепей, описанная выше, не содержит функциональный участок CH1.
Включение класс-специфических постоянных областей тяжелых цепей при генной инженерии комплексов мультиспецифического связывания обеспечивает терапевтическую полезность эффекторной функции in vivo в зависимости от необходимой функциональности. Генная инженерия отдельных эффекторных областей может также привести к добавлению или удалению функциональности [23]. Таким образом, включение функциональности постоянной области IgA обеспечило бы вероятно улучшенное функционирование слизистой оболочки против патогенов [24], тогда как присутствие функциональности постоянной области IgG1 обеспечивает повышенную сывороточную устойчивость in vivo. Присутствие постоянных участков тяжелой цепи CH2 и CH3 обеспечивает основу для стабильной димеризации, которую можно наблюдать в естественных антителах, и обеспечивает сайты узнавания для посттрансляционного гликозилирования. Присутствие CH2 и CH3 также допускает вторичное узнавание антитела, если биспецифические и мультивалентные комплексы применяются в качестве реагентов и диагностических средств.
Например, антитела IgM, как известно, играют важную роль в активации макрофагов и пути активации комплемента. Благодаря непосредственной близости его сайтов связывания IgM имеет высокую авидность к патогенам, включая вирусы. Однако известно также, что IgM является тяжелым для применения в быстрых способах иммуноанализа, тогда как антитела IgG можно легко применять в данных способах. Для подобных применений было бы полезно выбрать предпочтительный класс антител, например, IgG или IgM.
Экспрессия всего или части гетерологического локуса тяжелой цепи Cγ без CH1 будет вырабатывать необязательно некоторые или все изотипы IgG в зависимости от изотипов IgG1, IgG2, IgG3 и IgG4, присутствующих в гетерологическом локусе IgG. В качестве альтернативы тяжелые цепи могут содержать Cε-гены. Полученную в результате молекулу IgE также можно было бы применять в терапии.
В качестве альтернативы можно получить выбранные смеси антител. Например, IgA и IgM можно получить, если постоянная область тяжелой цепи содержит Cα и Cμ-гены.
Предпочтительна постоянная область тяжелой цепи человеческого происхождения, в частности, если антитела из одних тяжелых цепей должны быть использованы для терапевтических применений у людей. В случае если антитела из одних тяжелых цепей должны быть использованы для ветеринарных целей, постоянную область тяжелых цепей предпочтительно получают из организма-мишени, позвоночного или млекопитающего, в или на котором нужно осуществить ветеринарную терапию.
При экспрессии каждая постоянная область тяжелой цепи не имеет участка CH1. Предпочтительно удаляют экзон CH1. Постоянные области Cµ и Cδ могут необязательно мутировать, удаляться или замещаться. Присутствие, например, IgM с функциональным участком CH1 ингибирует созревание B-клетки и, следовательно, ограничивает продуктивную экспрессию IgG из одних тяжелых цепей (без CH1) в пределах одного и того же локуса.
«Экзон постоянной области тяжелой цепи» («CH экзон»), определенный в контексте данного документа, включает последовательности естественных позвоночных, но особенно млекопитающих, CH экзоны. Он изменяется по класс-специфическому принципу. Например, IgG и IgA естественным образом лишены участка CH4. Понятие «CH экзон» также включает в себя производные, гомологи и их фрагменты, поскольку CH экзон способен образовывать функциональные антитела из одних тяжелых цепей, определенные в контексте данного документа, если он является компонентом постоянной области тяжелой цепи.
Необязательно, при наличии, CH4 или другие функциональные участки могут быть рекомбинированы или удалены в пределах трансгена, при условии, что подобный процесс не ингибирует внутриклеточный секреторный процесс, созревание B-клетки или связывающую активность полученного в результате антитела.
Эффекторные молекулы тяжелых цепей могут быть рекомбинированы, чтобы освободиться от функциональных участков, например карбоксиконцевых участков CH4, при условии, что рекомбинация не влияет на секреторные механизмы, предотвращающие объединение клеточных поверхностей, а следовательно, созревание B-клетки. Могут быть рекомбинированы дополнительные элементы в локусе, например, для того, чтобы улучшить гликозилирование или дополнительную функцию.
Соответственно гетерологический локус тяжелых цепей проектируется для получения предпочтительных классов или смесей антител из одних тяжелых цепей в зависимости от необходимого класса(ов) антител с нормальным по существу созреванием B-клетки. Применение сегментов V, D и J-генов и эффекторных областей камелида даст антитела камелида с признаками, типичными для антител камелида, такими как расширенные CDR3 петли. Применение человеческих сегментов V, D и J-генов даст человеческие антитела из одних тяжелых цепей, лишенные расширенной CDR3 петли.
«VH участок» в контексте настоящего изобретения относится к продукту экспрессии сегмента V-гена при рекомбинировании с сегментом D-гена и сегментом J-гена, определенными выше. Предпочтительно VH участок улучшил способность связывать антиген в результате VDJ рекомбинации и соматической мутации. Не существует зависимости от присутствия или отсутствия расширенной CDR3 петли, типичной для позвоночных камелидов. VH участок способен связывать антиген в виде мономера. Любая вероятность комбинирования с VL участком при экспрессии в виде части растворимого комплекса антитела из одних тяжелых цепей была исключена удалением экзона CH1 (см. [25]).
VH участок отдельно также может быть рекомбинирован с разнообразием белковых участков, чтобы получить гибридные белки для намеченных терапевтических и диагностических целей, например, с токсинами, ферментами и радиофармацевтическими средствами.
VH участок, кодирующий последовательности, можно получить из естественного источника или их можно синтезировать, применяя способы, хорошо известные специалистам в данной области техники.
Свойства VH участка можно изменить или улучшить селекцией или генной инженерией сегментов V, D и/или J-генов, которые кодируют последовательности с необходимыми характеристиками. Как определено выше, некоторые из 39 функциональных человеческих VH областей могут не подходить для получения антител из одних тяжелых цепей. Некоторые стадии были проведены на предыдущем уровне техники в попытках улучшить различные характеристики антител [26, 29]. Принимая во внимание специфические характеристики VH области, Dolk et al., [30] применили технологии фагового дисплея для получения антител из одних тяжелых цепей, показывающих улучшенную устойчивость в жестких условиях, связанных с шампунем против перхоти.
Трансгенное нечеловеческое млекопитающее предпочтительно представляет собой грызуна, такого как кролик, морская свинка, крыса или мышь. Мыши являются особенно предпочтительными. Другие млекопитающие, такие как козы, овцы, кошки, собаки или другие животные также могут применяться. Предпочтительно млекопитающее представляет собой мышь.
Предпочтительно трансгенных нечеловеческих животных получали, применяя только установленную технологию инъекции ооцитов. В случае если установлено, можно также применять технологию EC клеток или клонирование.
Преимущественно локусы тяжелой и необязательно легкой цепи антитела, эндогенные по отношению к млекопитающему, удаляют или подавляют при экспрессии антител из одних тяжелых цепей в соответствии со способами изобретения.
Способы получения антител из одних тяжелых цепей, описанные в приведенных выше аспектах изобретения, могут, в частности, применяться для получения антител для терапевтического применения к человеку, так как частое введение антител видам позвоночных, которые различаются по происхождению из источников антител, приводит к возникновению иммунного ответа на данные вводимые антитела. Антитела, полученные в соответствии с изобретением, имеют преимущество над антителами предыдущего уровня техники, на котором они являются по существу единственным или известным классом и предпочтительно человеческого происхождения. Антитела, полученные в результате комбинации VDJ рекомбинации и созревания аффинности in vivo, обладают высокой аффинностью.
Соответственно дополнительный аспект изобретения обеспечивает трансгенное нечеловеческое млекопитающее, содержащее более одного гетерологического локуса VH тяжелых цепей, определенных выше. Предпочтительно трансгенное нечеловеческое млекопитающее можно рекомбинировать, для того чтобы иметь уменьшенную способность получения антител, которые включают легкие цепи.
Клетки, вырабатывающие антитела можно получить из трансгенных нечеловеческих млекопитающих, определенных в контексте данного документа, и применять, например, в приготовлении гибридом для получения антител из одних тяжелых цепей, определенных в контексте данного документа. В дополнение или в качестве альтернативы последовательности нуклеиновой кислоты можно выделить из данных трансгенных нечеловеческих млекопитающих и применять для получения антител с VH участком одних тяжелых цепей или их биспецифичных/бифункциональных комплексов, применяя технологии рекомбинантной ДНК, которые хорошо известны специалистам в данной области техники.
В качестве альтернативы или в дополнение антиген-специфические антитела из одних тяжелых цепей можно получить иммунизацией трансгенного нечеловеческого млекопитающего, как определено выше.
Соответственно изобретение также обеспечивает способ получения антител из одних тяжелых цепей иммунизацией трансгенного нечеловеческого млекопитающего, определенного выше, антигеном. Антитела и их фрагменты можно выделить, охарактеризовать и получить, применяя прочно установившиеся способы, известные специалистам в данной области техники. Данные антитела имеют практическое применение в способах, описанных в PCT/GB2005/00292.
Изобретение описывается сейчас, только посредством примера, в следующем подробном описании, которое относится к следующим фигурам.
ФИГУРЫ
Фигура 1: Схематическое представление ДНК фрагментов, применяемых для получения трансгенных мышей. Два VHH экзона ламы связаны с человеческими сегментами гена тяжелой цепи разнообразия (D) и гена слияния (J), за которыми следуют человеческие гены постоянной области Cµ, Cδ, Cγ2 и Cγ3 и человеческая тяжелая цепь Ig3'LCR. Модификациями человеческих генов Cγ2 и Cγ3 были полное удаление экзона CH1 из генов Cγ2 и Cγ3 в конструкциях MGΔ и GΔ или также из Cµ в конструкции MΔGΔ. Присутствие двух Lox P сайтов (красный) в одном и том же направлении дает возможность удаления Cµ и Cδ-генов при Cre опосредованной рекомбинации. Присутствие Frt сайта (зеленый) дает возможность получения единственной копии трансгенной мыши из ряда трансгенов с множеством копий посредством Flp опосредованной рекомбинации.
Фигура 2: Панель A: Таблица проточного цитометрического анализа экспрессированных B лимфоцитов в процентном содержании положительных клеток B220/CD19 от всех клеток в различных органах. Панель B: Проточный цитометрический анализ популяций B-клеток wt, µMT, MGΔ/µMT, MΔGΔ/µMT и GΔ/µMT мышей в BM. Лимфоидные клетки запускали на основе прямого и непрямого зондирования, и экспрессия B220 и человеческого IgM или IgG показана на графиках. Данные показаны в виде точечных графиков. Для MGΔ µMT мышей фракцию B220+ запустили и проанализировали на экспрессию внутриклеточного (ic) человеческого Ig µ и γ H цепей, показанных в виде наложений гистограмм (красные линии) с фоновым окрашиванием клеток B220+ из µMT мышей (черные линии) в качестве контроля. Определяли процентные содержания положительных клеток. Панель C: Экспрессия MΔGΔ и GΔ трансгена восстанавливает пре-BCR и BCR функцию. Профили экспрессии определяемых маркеров во всех CD19+ фракциях из µMT мышей (про-B-клетки), в CD19+ фракциях поверхностного IgM (про-B/пре-B-клетки) и CD19+ фракциях поверхностного IgM+ (B-клетки) из мышей дикого типа, в CD19+ фракциях поверхностного человеческого IgM+ из MΔ-GΔ µMT мышей (B-клетки) и CD19+ фракциях поверхностного человеческого IgG+ из GΔ µMT мышей (B-клетки). ic-Ig κ = κ L цепь внутриклеточного Ig. Проточные цитометрические данные показаны на гистограммах. Показанные данные представляются от 3-8 животных, анализируемых в каждой группе. Панель D: Сравнительный анализ структуры последовательности ПЦР продуктов, полученных из BM кДНК, применяя VHH1 и VHH2 специфические праймеры в комбинации с человеческим праймером Cγ2, показывая VDJ рекомбинацию. Последовательности из GΔ. Зеленым показана идентичность последовательности.
Фигура 3: Панель A-E: ДНК FISH человеческого локуса GΔ с пятью копиями. Панель A: Удлиненное волокно хроматина из клеток легких трансгенной мыши GΔ линии 1, несущее пять интактных копий (1-5) GΔ локуса с примыкающими по бокам половиной локуса, содержащего LCR (красный) и половиной локуса, несущего VHH в J области (зеленый). Панель B: Удлиненное волокно хроматина FISH гибридомы (G20), полученное из B-клеток GΔ линии 1, причем одна копия реаранжирована (белая стрелка). Панель C: Неудлиненная ДНК FISH гибридомы Т1 с LCR зондом (красный). Панель D: Такая же, как и C, с зондом между VHH и D (зеленый). Панель E: наложение панелей C и E. Заметьте, что Т1 имеет четыре реаранжировки, наблюдаемые в виде потери 4 зеленых сигналов по сравнению с тем, что потери красных сигналов не было. Панель F: Предотвращается аллельное исключение у GΔ трансгенных мышей. Проточный цитометрический анализ мышиной поверхностной или внутриклеточной (ic)µH цепи и трансгенного человеческого IgG на все BM CD19+ клеточные фракции из определенных мышей. Данные показаны в виде точечных графиков, и даны процентные содержания клеток в определенных секторах. Показанные данные представляются от четырех мышей, анализируемых в пределах каждой группы.
Фигура 4: Анализ популяций B-клеток в селезенке wt, µMT, GΔ, MΔGΔ и MGΔ мышей. Показанные данные представляются от 4-8 мышей, анализируемых в пределах каждой группы. Панель A: Верх, FACS данные клеток селезенки, окрашенных для сравнения мышиного IgM, человеческого IgG, человеческого IgM с B220. Низ, проточный цитометрический анализ популяций B-клеток в селезенке. Лимфоидные клетки запускали на основе прямого и непрямого зондирования, и поверхностная экспрессия B220 и определенного Ig (верх) или профиль CD21/CD23 показан в виде точечных графиков, и даны процентные содержания в пределах определенных интервалов. CD21lowCD23low: незрелые B-клетки; CD21+CD23+: фолликулярные B-клетки; CD21highCD23low: B-клетки пограничной зоны. Панель B: Гистология селезенки wt, µMT, GΔ/µMT, MΔGΔ/µMT и MGΔ/µMT мышей. Иммуногистохимический анализ; 5 µm замороженные секции окрасили анти-B220 (голубой) для B-клеток и анти-CD1lc/N418 (коричневый) для дендритных клеток. Стрелки показывают расположение небольших кластеров B клеток в MGΔ селезенках. Панель C: Сравнительный анализ структуры последовательности ПЦР продуктов, полученных из пейеровых бляшек кДНК, применяя VHH1 и VHH2 специфические праймеры в комбинации с человеческим праймером Cγ2, показывая, что трансгенный локус подвергается гипермутации в CDRl и 2 областях. Последовательности из трансгенного локуса GΔ с делецией CHl. Панель D: Верх; FACS данные клеток селезенки, окрашенных анти-CD19 и анти-B220. Низ слева: Схематическое представление Flp рекомбинации in vivo посредством совмещения FlpeR трансгенной линии и FACS данных на клетках селезенки однокопийного рекомбинанта, полученного из GΔ линии 1 из пяти копий. Низ справа: Схематическое представление Cre рекомбинации in vivo посредством совмещения MGΔ линий с CAGCre трансгенной линией и дополнительных данных считывания FACS на клетках селезенки рекомбинанта, показывающее, что B клетка восстанавливается, как видно, в непосредственно полученных первоначальных GΔ линиях.
Фигура 5: Саузерн-блоттинг, показывающий отсутствие реаранжировки κ легкой цепи в GΔ/µMT (панель A) и MΔGΔ/µMT (панель B) трансгенных линиях. ДНК печени (L) и ДНК B-клетки (B) из wt мыши и двух GΔ или четырех MΔGΔ трансгенных мышей расщепляли рестриктазой Hind III и исследовали32P посредством радиомеченого Jκ зонда и карбоангидразного II (CAII) зонда. CAII зонд, который гибридизуется с бэндом из 4 т.п.н., применяли в качестве загрузочного контроля. ДНК печени прогнали, для того чтобы показать κ зародышевую конфигурацию (бэнд из 2,8 т.п.н.). Только wt B-клетки показали реаранжировку локуса κ, измеренную в виде уменьшения интенсивности фрагмента из 2,8 т.п.н. (30% оставшегося сигнала при сравнении с печенью).
Фигура 6: Образцы сыворотки, очищенные от G-белка или конкавалина из 6 различных GΔ линий (A, B), 4 различных MΔGΔ линий (C) и 2 различных MGΔ линий (E-G), в µMT фоновом прогоне в невосстановленных (A) и восстановленных условиях (B-G). Плотность трансгенного человеческого IgG (панели B, F) и IgM (панели C, D) согласуется с делецией CHl и отсутствием легких цепей. Мышиные легкие цепи κ были нормальной плотности (G). Человеческую сыворотку применяли в качестве положительного контроля. Панель D: Гранулометрическое фракционирование Суперозой-6 MΔGΔ сыворотки после введения в смесь контроля человеческого IgM в невосстановленных условиях. Каждую фракцию проанализировали посредством электрофореза на геле в восстановленных условиях. Фракции, собранные после колонки с Суперозой-6, слева (высокие MW) направо (низкие MW). Контролями являются только человеческая сыворотка (крайняя полоса слева) и мышиная сыворотка перед введением в смесь контрольной сыворотки человеческого IgM (полоса MΔGΔ сыворотки). Определены маркеры фагов.
Фигура 7: Панель A: Последовательности моноклонального антитела кДНК, специфические по отношению к столбнячному токсину; HSP70, rtTA и человеческому TNFα. Верхняя последовательность является зародышевой VHH2 последовательностью. CDR1, 2 и 3 и шарнирные участки определены последовательностью выше. Различные изотипы и классы показаны разными цветами справа. J области, которые применяют, показаны справа. Панель B: Примеры Вестерн-блоттинга, применяющие различные антитела из одних тяжелых цепей (гибридомы, сыворотки и sdAb). Левая панель анти-rtTA сыворотки и среды гибридомы, разбавленных 1/100 и 1/250, соответственно. Средняя панель, анти-DKTP сыворотка из wt и GΔ мышей, разбавленная 1/200 и 1/100, соответственно. Правая панель, анти-B.Pertussis (коклюш) sdAb против вакцины, содержащей антиген B.Pertussis (DKTP) или лишенной его (DTP, так как мы способны приобретать очищенный антиген B.Pertussis). Панели C и D: Иммуноокрашивание одного из Tet- на клеточных линиях, дополнительно трансфецированных плазмидой-маркером, который реагирует на присутствие rtTA экспрессией маркерного белка в цитоплазме51. Панель C показывает ядра, экспрессирующие rtTA (зеленый). Панель D показывает индуцированную доксициклином экспрессию маркерного белка в цитоплазме (красный) в ответ на rtTA и ядерное окрашивание клеток DAPI (голубой). Панель E: Пример BiaCore анализа анти-rtTA антитела. Определена аффинность.
Фигура 8: Панель A: Схематический чертеж локусов Ig с подобными камелидам сплайсинговыми мутациями. Две постоянные области человеческого IgG (Cγ2 и Cγ3) мутировали в первую очередь посредством изменения соединения G+1 на A+1, чтобы, как считают, привести к перескоку CH1 экзона в IgG HCAbs5 камелида, изображенного в виде Gγ2-S и Gγ3-S. Локус содержал две VHH области ламы, все D и JH области человека и человеческие Cµ, Cδ и Cγ2 и Cγ3 и LCR (см. также основной текст). Данные локусы вводили µMT трансгенным мышам и анализировали на экспрессию человеческих локусов. Панель B: Секвенирование кДНК человеческого IgG костного мозга (BM) из GS мышей показало, что VHH, рекомбинированные как с различными человеческими D, так и J сегментами были транскрибированы с Cγ2 постоянной областью. Однако экзон CH1 все еще присутствовал, исключая последние 16 пар оснований, которые были подвергнуты сплайсингу. Между тем, в настоящий момент сообщают об одинаковом критическим сайте соединения в CH1 экзоне у больного лейкозом из-за транзиции A на G в положении 4 интрона 1 [31]. Ни одна из MGS или GS линий не восстановила развитие B-клеток (не показано) в µMT мышах. Хотя транскрипционный/трансляционный механизм мышиных B-клеток может произвести реаранжированный VHH-γ2a дромедара [34, 60], наши данные показали, что кроме мутации замены G на A, для перескока CH1 экзона важными являются и другие признаки.
Фигура 9: Схематическое представление клонирования человеческих VH областей на различных локусах, как описано в примерах 3 и 4.
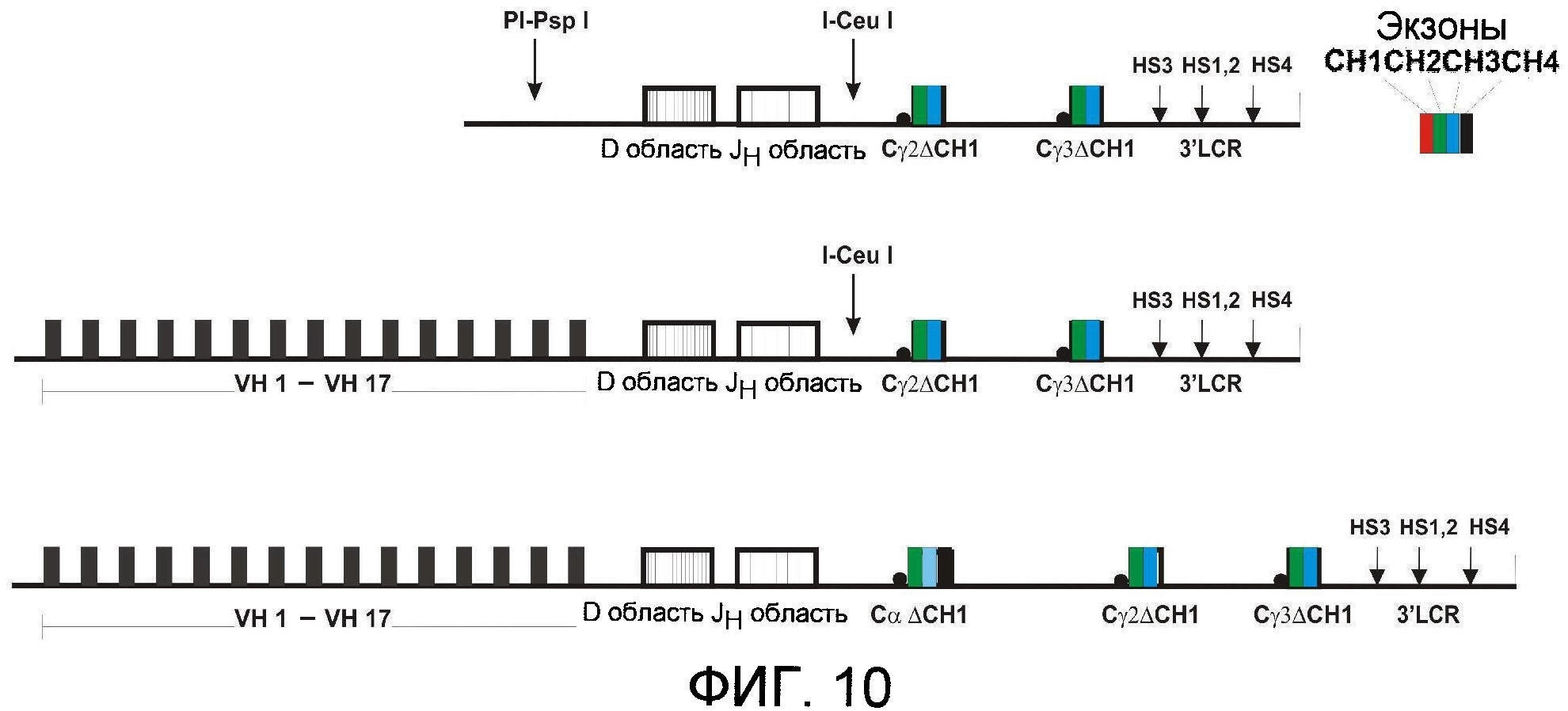
Фигуры 10 и 11: Примеры локусов тяжелых цепей, содержащих множественные сегменты VH гена, нетронутую D область, нетронутую JH область, Cγ2, Cγ3 и Cx области и 3' LCR.
Фигура 12: Показывает кариограмму с одним локусом, присоединенный к хромосоме 1 и одним локусом на хромосоме 8.
ПРИМЕРЫ
Пример 1 - Локус антител из одних тяжелых цепей является полностью функциональным у мышей и восприимчивым к аллельному исключению
Как обсуждается выше, Janssens et al. [15] разработали способы получения антител из одних тяжелых цепей у трансгенных мышей. За дополнительными подробностями способов и экспериментов, описанных в контексте данного документа, специалистам следует обратиться к Janssens et al. [15], которая включена в контекст данного документа путем ссылки.
Способы
Конструкции
Геномная космидная библиотека была создана из клеток периферической крови ламы, применяя стандартные способы. Два различных зародышевых VHH выбрали на основании их последовательности, открытой рамки считывания без стоп-кодона и присутствия гидрофильных аминокислотных кодонов в положениях 42, 50 и 52 согласно номенклатуре Лефранка [32] и один с, а другой без гидрофильной аминокислоты в положении 49. Один является идентичным IGHV1S1 (сопроводительный номер AF305944), а другой имеет 94% идентичность IGHV1S3 (сопроводительный номер AF305946). Два клона выбрали из человеческой геномной Pac библиотеки RPCI- 11 (BACPAC Recource Center, USA): клон 1065 N8, содержащий D и J области человеческих тяжелых цепей, Cµ и Cδ и клон 1115 N15, содержащий ген Cγ3. Bac клон 11771 из другой человеческой геномной библиотеки (Incyte Genomics, CA, USA) применяли в качестве источника гена Cγ2 и тяжелой цепи Ig LCR [33]. Применяя стандартные технологии, гены Cγ3 и Cγ2 субклонировали отдельно в pFastBac (Invitrogen). Единственной точечной мутации (G-A) [34] или полной делеции экзона CH1 достигали гомологичной рекомбинацией [35]. Аналогично сайты frt и lox P вводили перед Cµ областью переключения, а второй сайт lox P поместили перед Cγ2 областью переключения, получая в результате MGS или MGΔ.
Для того чтобы получить конструкции GS или GΔ, MGS или MGΔ вектор (Фигура 1), содержащий два VHH гена ламы, за которыми следуют человеческие области D и J тяжелых цепей, Cµ, Cδ и модифицированные человеческие Cγ2 и Cγ3 гены и 3' LCR, трансформировали в 16 294 Cre E.coli штамме44, давая GS или GΔ локус посредством Cre опосредованной рекомбинации (Фигура 1). MΔGΔ был получен из MGΔ делецией области CµCH1 посредством гомологичной рекомбинации.
Получение трансгенных мышей, скрещивание и генотипирование
Фрагменты из 220 т.п.н. MGS или MGΔ или MΔGΔ, фрагменты из 150 т.п.н. GS или GΔ (Фигура 1) очистили от векторных последовательностей и ввели в пронуклеусы оплодотворенных FVB X B16/µMT-/-яйцеклеток в концентрации 2 нг/мкл. Трансгенные локусы проверили на чистоту и количество копий посредством Саузерн-блоттинга хвостовой ДНК, применяя 5'- и 3'-концевые образцы. Трансгенные µMT+/- клетки-основатели размножили в виде линий в µMT-/- фон. Генотипирование проводили посредством ПЦР (30 циклов с денатурацией при 94°C в течение 45 с, отжигом при 60°C в течение 30 с и удлинением при 72°C в течение 1 мин 40 с), применяя следующие праймеры: Asp5'IgM fw: 5'-GCGGGTACCGAATGGTGGCAGGGATGGCTC-3' (SEQ ID NO: 1) в комбинации с Asp 3'IgG2 rv: 5'-CGCGGTACCCTGCGGTGTGGGACAGAGCTG-3' (SEQ ID NO: 2) для HLL-MD или с Asp3'IgM rv: 5'-CGCGGTACCACGGCCACGGCCACGCTGCTCGATTC-3' (SEQ ID NO: 3) для MGS и MIGMEMBINTRON1: fw: 5'-CCAGTCAATACTACTCGCTAAGATTC-3' (SEQ ID NO: 4) в комбинации с MIGMEMBEXON1 rv: 5'-CAGTGGTCCACAGTTTCTCAAAGC-3' (SEQ ID NO: 5) для µMT генотипа.
RT-PCR
Всю РНК выделили, применяя систему выделения РНК Ultraspec (Biotecx Laboratories, Houston). кДНК синтезировали, применяя обратную транскриптазу (Superscript II, Life technology) и олиго(dT)праймер. ПЦР осуществляли, применяя следующие праймеры: LVHHfw: 5'-AGACTCTCCTGTGCAGCCTCTGG-3' (SEQ ID NO: 6) в комбинации с HINGEIgG2rv: 5'CACTCGACACAACATTTGCGCTC-3' (SEQ ID NO: 7) или hIgMCH2rv: CACTTTGGGAGGCAGCTCAGC-3' (SEQ ID NO: 8). Амплификация происходила в течение 30 циклов с денатурацией при 94°C в течение 30 с, отжигом при 60°C в течение 30 с и удлинением при 72°C в течение l мин. Продукты ПЦР клонировали в pGEM T легком векторе (Promega) и секвенировали, применяя T7 или SP6 праймеры.
Проточный цитометрический анализ:
Одноклеточные суспензии приготовили из лимфоидных органов в ФБР, как описано ранее45. Приблизительно 1×106 клеток инкубировали с антителами в ФБР/0,5% бычьем сывороточном альбумине (BSA) в 96-луночных планшетах в течение 30 мин при 4°C. Клетки промывали дважды ФБР/0,5% BSA. Для каждого образца насчитали 3×104 результатов, применяя FACScan анализатор (Becton Dickinson, Sunnyvale, CA). Данные FACS были проанализированы, применяя программное обеспечение для компьютеров CellQuest, версия 1.0. Четырехцветный анализ был осуществлен на Becton Dickinson FACS Calibur. Большинство применяемых антител были описаны [36]; FITC конъюгированные античеловеческие IgG и античеловеческие IgM приобрели в Sigma (Zwijndrecht, NL).
Анализ реаранжировки гена Ig
Одноклеточные суспензии приготовили из селезенки и печени wt мышей MΔGΔ и GΔ трансгенных мышей. B-клетки положительно отделили, применяя MACS CD45 (B220) MicroBeads (Miltenyi Biotec, Germany), на препаративной центрифуге Automacs в соответствии с инструкциями производителя до чистоты ~90% [37]. Геномную ДНК расщепляли рестриктазой Hind III и проводили блоттинг на полиамидных фильтрах Hybond. Фильтр гибридизовали с32P радиомеченым Jκ зондом (полученным ПЦР амплификацией из геномной ДНК выше Jκ1 и Jκ5 областей) и32P радиомеченым карбоангидразным II (CAII) зондом. ДНК печени прогнали для того, чтобы показать сигналы зародышевой κ конфигурации (бэнд из 2,8 т.п.н.). Зонд CAII, который гибридизуется с бэндом из 4 т.п.н., применяли в качестве загрузочного контроля. Фильтры сканировали на Tyfoon 9200 (Amerscham Biosciences). Интенсивность зародышевого Jκ бэнда определяли количественно, применяя программное обеспечение Image Quant 5.2, нормировали относительно интенсивности загрузочного контроля и выражали в процентном содержании от контрольной ДНК печени (которая представляет собой 100%). ПЦР праймеры, применяемые на геномной ДНК из гибридом для амплификации различных явлений реаранжировок, были следующими:
IGHJ1R: 5'-CCAGTGCTGGAAGTATTCAGC-3' (SEQ ID NO: 9),
IGHJ2R: 5'-CAGAGATCGAAGTACCAGTAG-3' (SEQ ID NO: 10),
IGHJ3R: 5'-GGCCCCAGAYATCAAAAGCAT-3' (SEQ ID NO: 11),
IGHJ4R: 5'-GGCCCCAGTAGTCAAAGTAGT-3' (SEQ ID NO: 12),
IGHJ5R: 5'-CCCAGGRGTCGAACCAGTTGT-3' (SEQ ID NO: 13),
IGHJ6R: 5'-CCAGAACGTCCATRYMGTAGTA-3' (SEQ ID NO: 14).
DNA FISH анализ
Приготовление ДНК мишени: Клетки моноклональной гибридомы культивировали в DMEM/10% FCS и поместили в агарозу, как описано Heiskanen [38]. Легкие мыши GΔ трансгенной линии 1 собрали и приготовили одноклеточную суспензию. Помещенные в агарозу клетки обработали протеиназой K и рибонуклеазой H. Механически удлиненную ДНК приготовили на поли-L-лизиновых пластинах (Sigma), применяя микроволновую печь и край другой пластины.
Образцы: Для того чтобы определить реаранжированные и нереаранжированные копии GΔ трансгена, очищали фрагменты ДНК. Фрагмент SpeI из 2,3 т.п.н. и фрагмент SpeI-BssHII из 3,6 т.п.н. для гибридизации области между VHH и D, и фрагмент BamHI-SpeI из 5,9 т.п.н. или низкокопийная плазмида Bluescript, содержащая IgH 3'LCR (16 т.п.н.) для определения LCR. Образцы пометили посредством ник-трансляции с биотин-11-dUTP (Roche) или дигоксигенин-11-dUTP (Roche). Перед пипетированием образцов на пластины их денатурировали в течение 5 минут при 90°C, 5 минут на льду и 45 минут при 37°C. In situ гибридизация: Гибридизационная смесь, содержащая 50% формамид, 2×SSC, ДНК из молок лососевых (200 нг/мкл), 5×Denhardt's, 1 mM EDTA и 50 mM фосфата натрия, pH 7,0. Гибридизацию образцов осуществляли посредством пипетирования 25 мкл смеси на пластины и покрытием 24×32-мм покровным стеклом. Для денатурации образцов и последовательностей мишеней пластины помещали на нагретую до 80°C поверхность на 2 минуты. Образцы гибридизуются в течение ночи при 37°C в увлажнительной камере (увлажнитель представляет собой 50% формамид, 2×SSC). Постгибридизационные промывания осуществляли, как описано [39].
Иммунологическое определение гаптен-меченых зондов: Дигоксигениновый зонд определяли овечьим антидигоксигениновым антителом (1:500, Sigma), флуоресцин-конъюгированным rabbit-antisheep (1:500, Sigma) и флуоресцин-конъюгированным goat-anti-rabbit (1:500, Sigma). Биотиновый зонд определяли Texas Red конъюгированным авидином (1:500, Sigma) и биотин-конъюгированным goat-anti-avidin (1:500, Boehringer). Данную стадию повторили дважды. Все инкубации и промывания осуществляли, как описано48. После окрашивания пластины дегидратировали различными растворами этанола (70, 90 и 100%), 5 минут каждая стадия при комнатной температуре. Клетки или ДНК поместили в 25 мкл антифединговой среды для заключения Vectashield (Vector Laboratories). Визуализацию осуществляли посредством флуоресцентного микроскопа Leica DMRBE с применением 100× объектива.
Иммунизация и получение гибридомы
8-недельных мышей иммунизировали 5-20 мкг антигена со вспомогательным веществом Specol (IDDLO, Lelystadt, NL) или предварительно смешанного с вакциной DKTP подкожно на 0, 14, 28, 42 дни и интраперитонеально на 50 день. Кровь брали на 0, 14 и 45 дни. Клетки селезенки объединили с клеточными линиями миеломы Sp2-O-Agl4 (полученными от R.Haperen) на 56 день, применяя набор ClonalCellTMHY (StemCell Technologies, Canada) в соответствии с инструкциями производителя. Вакцину DKTP получили из Голландского Института Вакцин (Bilthoven, NL).
Конструкция sdAB библиотеки и скрининг
Всю РНК выделили из селезенок DKTP иммунизированных однокопийных GΔ и TNFα иммунизированных MΔGΔ мышей, применяя систему выделения РНК Ultraspec (Biotecx Laboratories Inc, Houston, Texas, USA). кДНК приготовили, применяя олиго(dT)праймер. Фрагменты ДНК, кодирующие фрагменты VHHDJ амплифицировали посредством ПЦР, применяя специфические праймеры: vh1 back Sfi I праймер [40-42] в комбинации с праймером hIgG2hingrev (5'-AATCTGGGCAGCGGCCGCCTCGACACAACATTTGCGCTC-3' (SEQ ID NO: 15)) или праймером CH2huIgMrev (5'-TGGGACGAAGACGGCCGCTTTGGGAGGCAGCTCGGCAAT-3' (SEQ ID NO: 16)). Амплифицированные VHHDJ (~400 пар оснований) расщепляли Sfi I/Not I, очищали на геле и клонировали в Sfi I/Not I расщепленном фагмидном pHEN производном векторе. Трансформация в TG1 электрокомпетентных клетках (Stratagene La Jolla, USA) внесла вклад в библиотеку человеческих антител с единственным участком. Осуществили два цикла селекции, применяя пэннинг на антигенах вакцины DKTP, адсорбированных на пластик (иммунотрубочки, покрытые неразбавленной вакциной) или очищенный человеческий TNFα (Biosource International, USA).
Иммуноцитохимия и Вестерн-блоттинг
Клетки tet-on клеточной линии, трансфецированные плазмидой-маркером, который реагирует на присутствие rtTA, выращивали на пластине. Через 24 часа после доксициклиновой индукции клетки зафиксировали в 4% параформальдегид/ФБР и сделали проницаемыми в 0,5% Triton-X-100/ФБР. HCAb против rtTA применяли в разбавлении 1:50, после чего следовало окрашивание goat anti human-IgG FITC (Sigma разбавление 1:500). Белок маркер определяли, как предварительно описано51. Вестерн-блоттинг проводили стандартно, применяя goat anti human IgG-HRP (Sigma, разбавление 1/2500), human IgM-HRP (Sigma, разбавление 1/2500).
Гель-фильтрация на Суперозе 6.
Гранулометрическое фракционирование сыворотки MΔGΔ мыши и человеческой контрольной сыворотки провели, применяя устройство AKTA FPLC (Amersham Biosciences, Piscataway NJ) с колонкой с Суперозой 6 10/30, уравновешенной 200 mM KCl/20 mM HEPES-KOH pH 7,9/1 mM MgC2/0,5 mM EGTA/20% глицерином. При скорости потока 100 мкл/мин фракции по 500 мкл собирали, осаждали 100% трихлоруксусной кислотой и анализировали посредством SDS-PAGE (при восстановленных условиях), после чего провели Вестерн-блоттинг.
BIAcore измерения
Эксперименты проводили на BIAcore 3000 биосенсоре поверхностного плазмонного резонанса (Biacore AB, Uppsala, Sweden). Очищенные белки иммобилизовали на CM5 сенсорный чип до уровня 3000 резонансных единиц (RU, произвольные единицы связывающего отклика) посредством стандартного набора NHS-EDC, поставленного производителем. Антитела пропустили над иммобилизованными антигенами при постоянной скорости потока 40 микрограммов на мл в 10 mM Hepes, pH 7,4, 150 mM NaCl, 2 mM EDTA, 0,005% Tween 20. Отклик при равновесии зарегистрировали и кривую фитинга применяли для получения равновесных констант диссоциации, применяя программное обеспечение производителя BIA evaluation.
Результаты
Камелидоподобная CH1 сплайсинговая мутация является достаточной для перескока экзона в человеческом локусе тяжелых цепей
Включает ли получение HCAb (IgG2 и IgG3) у камелидов IgM+ промежуточную стадию, неизвестно. Следовательно, мы впервые получили два гибридных человеческих локуса, один локус (MGS) с человеческими Cµ, Cδ, Cγ2 и Cγ3 постоянными областями и один локус только с человеческими Cγ2 и Cγ3 (Фигура 1) на µMT фоне [43]. Сначала были мутагенизированы Cγ области, таким образом, чтобы они содержали камелидные CH1 сплайсинговые мутации. MGS получали затем, что было показано, что µMT животные, которые почти полностью лишены B-клеток из-за делеции трансмембранного участка μ цепи гена [43], действительно имеют небольшую популяцию B-клеток, вырабатывая функциональные IgG, IgA и IgE в отсутствие мембраносвязанного IgM [44-46], наводя на мысль, что (некоторые) B-клетки развиваются без поверхностной экспрессии IgM. Вместо мутирования человеческих VH участков для улучшения VH растворимости [47, 48] ввели два VHH ламы. VHH области камелидов содержат ряд характеристических аминокислот в положениях 42, 49, 50 и 52 [49]. Первый VHH1 содержал все данные VHH отличительные аминокислоты, но для того, чтобы проверить важность растворимости в данном контрольно-проверочном эксперименте, другой VHH2 был лишен одной из данных критических аминокислот «растворимости», Gln (Q) вместо Glu (E) в положении 49. Мы выбираем положение 49, а не положение 50 (Arg, R), так как считается, что оно является дополнительно важным для вариабельной конъюгации легких цепей (VL)21. Локус также содержал все 5 человеческих D и J областей тяжелых цепей и контрольную область локуса (LCR) на 3'-конце локуса (Фигура 8). На удивление, сплайсинговая мутация не привела к правильному перескоку CH1 экзона в трансгенных мышах и недостатку экспрессии человеческого Ig (Фигура 8).
Анализ трансгенных мышей, содержащих человеческие локусы, лишенные CH1 области
Для того чтобы преодолеть проблему сплайсинга CH1, мы получили 3 новых конструкции (Фигура 1), все содержащие Cγ2 и Cγ3, из которых был удален CH1, один с Cµ и Cδ (MGΔ), один без Cµ и Cδ (GΔ) и один с сегментом Cµ, из которого был удален CH1 (MΔGΔ). Три MGΔ, шесть GΔ и четыре MΔGΔ линий трансгенных мышей с различными количествами копий (1-5 копий) получили на µMT фоне. Развитие B-клеток анализировали в костном мозге (BM) и селезенке. Мыши с различными количествами копий дали одинаковые результаты.
Экспрессия GΔ и MΔGΔ восстанавливает развитие B-клеток в µMT мышах
MGΔ мыши были неспособны восстанавливать развитие B-клеток на µMT фоне, тогда как GΔ и MΔGΔ конструкции эффективно восстанавливали развитие B-клеток. Восстановление B220/CD19 положительных клеток было между 30-100% в различных лимфоидных компартментах независимо от количества копий (Фигура 2A). Данный факт подтверждается проточной цитометрией BM с применением B220 в отношении человеческого IgM или человеческого IgG окрашивания (Фигура 2B). Мыши MΔGΔ содержат человеческий IgM, вырабатывающий клетки в BM, отсутствующий в диком типе или µMT мышах. Соответственно данные клетки не подвергались переключению классов, так как они не содержат человеческий IgG. Мыши GΔ содержат только человеческий IgG, экспрессирующий B-клетки. Мыши MGΔ содержат очень немного, если вообще содержат, B-клеток, которые экспрессируют человеческий Ig на клеточной поверхности, но примечательно, что часть B220 клеток экспрессируют внутриклеточный IgM, но не IgG (Фигура 2B). В отличие от мышей MΔGΔ и GΔ (см. ниже), мыши MGΔ экспрессируют легкие цепи мышиного Ig (Фигура 6G). Данные результаты показывают, что Cµ и Cγ-гены в различных конструкциях экспрессируются и убедительно наводят на мысль, что отсутствие CH1 является ключевым для клеточной поверхностной экспрессии антител, основанных на VHH.
Человеческие HCAb IgG и IgM функционально замещают мышиные (пре-)BCR в процессе развития B-клеток в BM
В процессе прогрессирования развития крупной циклирующей в малую покоящуюся пре-B-клетку экспрессия специфических маркеров клеточной поверхности подавляется пре-BCR-зависимым образом [36]. Для того чтобы исследовать способность человеческого HCAb функционально замещать пре-BCR, экспрессию различных маркеров проанализировали посредством FACS. Про-B-клетки экспрессируют высокие уровни цитоплазматических SLC, IL-7R и CD43, которые подавляются при экспрессии пре-BCR и отсутствуют в зрелых B-клетках (Фигура 2C, сравним про-B-клетки из µMT мышей и фракцию поверхностных IgM-про-B/пре-B клеток и фракцию поверхностных IgM+ B-клеток wt мышей).
Человеческие B-клетки Ig+ из MΔGΔ/µMT или GΔ/µMT мышей имеют низкие уровни SLC и IL-7R, показывая, что человеческие одноцепные IgG и IgM рецепторы функционально замещают мышиные пре-BCR при подавлении SLC и IL-7R. Для CD43 данный факт, оказывается, является положением только в GΔ мышах, но устойчивость экспрессии CD43 в MΔGΔ мышах могла бы иметь отношение к обнаружению увеличенной дифференцировки B-1 B-клеток в данных мышах. Аналогично индуцируется экспрессия CD2 и MHC класса II, как и при передаче сигналов нормальных пре-BCR. Уровни IL-2R/CD25, случайно индуцированные на пре-B-клеточной стадии, очень низкие в зрелых MΔGΔ или GΔ/µMT B-клетках и сравнимы с уровнями зрелых wt B-клеток (Фигура 2C). Кроме того, экспрессия ic Igκ не поддавалась обнаружению в зрелых MΔGΔ или GΔ/µMT B-клетках (Фигура 2C) и также не индуцировалась в in vitro BM культурах при удалении IL-7 через 5 дней после культивирования IL-7+ (не показано). В заключение человеческое HCAb, экспрессирующее популяции B-клеток у трансгенных MΔGΔ или GΔ мышей, состояло частично из клеток, которые вырабатывались в BM (HSAhigh и AA4.1/CD93high), а частично из клеток, которые созревали на периферии и являются рециркулирующими (HSAlow и CD93low), сравнимо с данными, полученными в нормальных мышах.
В совокупности данные результаты показывают, что человеческие HCAb IgG и IgM функционально замещают мышиные (пре-)BCR в процессе развития B-клеток по отношению к экспрессии регулируемых с развитием маркеров. L цепь Ig не индуцируется (см. ниже). Анализ кДНК BM РНК показывает применимость обоих VHH сегментов для VDJ рекомбинации, отсутствия CH1 и, что важно, большого разнообразия в области CDR3 (Фигура 2D).
Множественные реаранжировки и аллельное исключение
Ряд гибридом были получены из MΔGΔ и GΔ линий после иммунизации, в частности из пятикопийной GΔ линии 1 (см. ниже). Анализ последовательности показал, что могло происходить более одной реаранжировки в многокопийных GΔ локусах. Из 5 различных проанализированных 5-копийных гибридом одна (G20) реаранжировала одну копию, которая была внутри рамки считывания; две гибридомы (T7 и T12) имели 2 реаранжировки, каждая из обеих с одной вне рамки считывания; одна гибридома (T3) имела две реаранжировки внутри рамки считывания (J2 и J4); а одна гибридома (T1) имела 4 реаранжировки, две из которых внутри рамки считывания (J2 и J4).
Т1 и T3 экспрессируют две продуктивные мРНК, которые были подтверждены масс-спектрометрией секретируемых антител, точно подходящих кДНК (не показано). Также мы получили удлиненное волокно ДНК FISH и нормальную ДНК FISH на двух различных гибридомах: G20 (1 реаранжировка) и Т1 (4 реаранжировки), применяя определение каждой копии LCR зондом, и зонд, располагающийся между VHH и D сегментами, определяющий только нереаранжированные копии (Фигура 3A-E). Контрольные клетки легких показали пять полных копий плюс половину трансгена на любом конце (Фигура 3A) согласно картированию генов Саузерн-блоттинга (не показано), тогда как гибридомы действительно показывают одну и четыре реаранжированных копии в G20 и T1, соответственно (Фигура 3B, C-E). Таким образом, множественные копии могут успешно реаранжировываться в одном и том же аллеле. Затем мы задались вопросом, имеют ли HCAb локусы какое-нибудь преимущество (недостаток) относительно нормальных мышиных локусов и есть ли в локусах аллельное исключение. B220/CD19 положительные BM клетки трансгенных мышей GΔ линии 1 на wt фоне проанализировали на экспрессию человеческого IgG и мышиного IgM. Очевидно, что GΔ B-клетки экспрессируют либо мышиный Ig, либо человеческий Ig (Фигура 3F), показывая аллельное исключение.
Селезеночные B-клетки в GΔ, MΔGΔ и MGΔ трансгенных мышах
Для того чтобы определить эффект трансгенеза на дифференцировку B-клеток в μMT мышах, мы исследовали размеры субпопуляции B-клеток селезенки посредством проточной цитометрии, применяя профили CD21/CD23 (Фигура 4A). В GΔ мышах доли CD21lowCD23low незрелых B-клеток лежали в нормальных пределах, а клетки, экспрессирующие человеческий одноцепной IgG, были способны дифференцироваться как в B-клетки фолликулярной (FO; CD21+CD23+), так и пограничной области (MZ; CD21highCD23low). В MΔGΔ мышах фракции незрелых B-клеток увеличились, показывая, что дифференцирование клеток, экспрессирующих HCAb IgM, в FO и MZ8 B-клетки является немного замедленной. В данных селезенках уменьшенная экспрессия CD23 сопровождалась повышенными уровнями поверхностной экспрессии CD43 и CD5, показывающими дифференцировку в B-1 B-клеточном направлении. Некоторые из B-клеток, экспрессирующих человеческий IgM (также экспрессирующих мышиные легкие цепи, см. Фигуру 6), присутствующие в MGΔ трансгенных мышах, проявляли FO/MZ распределение таким образом, что было подобно распределению в трансгенных MΔGΔ мышах. MΔGΔ и GΔ, но не MGΔ мыши, имеют нормальную структуру селезенки, показывая расщепление T-клеточного скопления в периартериолярном лимфоцитном пласте (PALS), окруженном областями, обогащенными B-клетками, содержащими фолликулы и пограничные области, присутствующие на внешних границах белой пульпы селезенки (Фигура 4B).
Также они образуют зародышевые центры в фолликулах B-клеток вторичных лимфоидных тканей (не показано) сравнимо с wt в процессе образования антител, зависимых от T-клеток. Благодаря сверхмутации существуют области образования памяти и селекция, основанная на аффинности. В GΔ мышах положительные клетки человеческого IgG определяются в данных зародышевых центрах. Мы подтвердили сверхмутацию человеческих IgG генов посредством анализа кДНК из B-клеток, присутствующих в пейеровых бляшках (Фигура 4C). Применяют как VHHl, так и VHH2. В совокупности данные открытия показывают, что в GΔ и MΔGΔ трансгенных мышах незрелые B-клетки, которые мигрируют из BM, обладают способностью дифференцироваться в селезенке как на FO, так и на MZ B-клетки, и подвергаться соматической сверхмутации после антигенной стимуляции.
Однокопийные локусы эффективно восстанавливаются и отсутствие CH1 является существенным
Мыши GΔ линии 1 (Фигура 2A) содержали 5 копий GΔ локуса и, следовательно, существовала возможность, что эффективное восстановление относилось к ряду копий локуса. Однако однокопийная трансгенная линия, полученная из 5-копийной GΔ линии 1 Flp рекомбинацией посредством скрещивания с FlpeR линией23, восстановила развитие B-клеток до аналогичной степени (Фигура 4D, Фигура 2A). Было подтверждено, что одной копии локуса достаточно для восстановления и что присутствие постоянной области Cµ с участком CH1 является ингибирующим посредством удаления областей Cµ и Cδ из невосстанавливающей однокопийной линии MGΔ (линия 3) посредством Cre рекомбинации (скрещивание с cre экспрессирующей линией), приводящей к однокопийной GΔ линии (Фигура 4D). Предварительно невосстановленный локус дает такое же развитие B-клеток 9, как и другие линии. Таким образом, ряд копий не влияет на восстановление и присутствие CH1 в области Cµ ингибирует восстановление B-клеток (см. также ниже).
Локусы легких цепей мышиного Ig не реаранжируются в MΔGΔ и GΔ трансгенных мышах
Белки легких цепей мышиного Ig не определялись в MΔGΔ и GΔ мышах посредством Вестерн-блоттинга сыворотки (не показано, но см. Фигуру 2C и 6A) или посредством FACS, наводя на мысль, что гены мышиных легких цепей не реаранжируются. Данный факт был подтвержден сравнением плотностей зародышевых сигналов локуса Ig κ в ДНК из отсортированных фракций селезеночных B220+ клеток и клеток печени посредством Саузерн-блоттинга (Фигура 5A и B), которое показывает, что мышиные легкие цепи не реаранжируются, а остаются в зародышевой конфигурации. Однако легкие цепи определяются в некоторых клетках, экспрессирующих человеческий Ig, в MGΔ/µMT мышах (см. Фигуру 6G).
Таким образом, экспрессия человеческого HCAb на ранней стадии развития B-клеток в BM отсутствует, чтобы обеспечить сигнал, приводящий к реаранжировке легких цепей. В данном контексте HCAb имитируют BCR, а не пре-BCR, которые, вероятно, имеют отношение к их неспособности связывать псевдолегкие цепи в отсутствие CH1 [61].
Анализ сыворотки GΔ/µMT и MΔGΔ/µMT мышей.
Человеческий IgM присутствовал в MΔGΔ сыворотке, а человеческий IgG как в MΔGΔ, так и в GΔ мышиной сыворотке. В неиммунизированных взрослых животных человеческий IgM (<50 мкг/мл) и IgG (200-l000 мкг/мл) присутствуют в уровнях, сравнимых с уровнями, наблюдаемыми в нормальных мышах или трансгенных мышах, несущих локус нормального человеческого IgH [65]. Гель-электрофорез сыворотки всех шести GΔ мышей показал HCAb IgG с MW ~70 кД в невосстановленных и ~35 кД в восстановленных условиях, что соответствует димерам тяжелых цепей, лишенным легкой цепи, и каждой тяжелой цепи, лишенной CH1 экзона (Фигура 6A, B).
Сыворотка MΔGΔ мышей содержала мультимерный человеческий IgM из одних тяжелых цепей. В восстановленных условиях (Фигура 6C) все четыре линии содержали цепи IgM с MW таким же, как и человеческий контрольный IgM после вычитания MW CH1. Сыворотку также фракционировали (Фигура 6D горизонтальные фракции) в невосстановленных условиях, после чего каждую фракцию 10 проанализировали посредством гель-электрофореза в восстановленных условиях (Фиг.6D, вертикальные полосы). При сравнении с человеческим сывороточным пентамерным 900 кД IgM контролем трансгенный IgM разделяется на 600 кД, что соответствует тому, что он также является мультимерным и лишенным легких цепей и CH1. Таким образом, мыши MΔGΔ вырабатывают HCAb мультимерный IgM и димерный IgG, тогда как GΔ вырабатывают димерный IgG в сыворотке.
Анализ сыворотки мышей MGΔ
На периферии и в селезенке MGΔ/µMT линий почти нет B220 положительных клеток (<1% дикого типа) и только редкие небольшие кластеры B-клеток наблюдаются в селезенке (Фигура 4B). Небольшие количества человеческих IgM и IgG определяли в сыворотке только после очистки (Фигура 6E, F). Человеческий IgM в данных мышах был нормальной величины в восстановленных условиях, тогда как циркулирующий человеческий IgG был короче (наблюдаемый MW 35 кД соответствует CH1 делеции). Примечательно, что также определяли мышиные κ легкие цепи, предположительно связанные с человеческим IgM (Фигура 6G).
Человеческие IgM и IgG были ниже уровня детекции количественного анализа ELISA, но мы тем не менее проверили, могут ли MGΔ/µMT мыши реагировать на иммунизацию. Мышей иммунизировали человеческим фактором некроза опухолей α (TNF-α), и wt мыши вырабатывали сильный TNF-α специфический иммунный ответ, тогда как в двух применяемых мышах MGΔ линии 3 антигенспецифические человеческие IgG невозможно было определить посредством ELISA или Вестерн-блоттинга (не показано).
Иммунизация MΔGΔ и GΔ мышей приводит к получению антигенспецифических Ab
Мышей GΔ/µMT иммунизировали E.coli hsp70, DKTP (дифтерийный анатоксин (Diphteria), полный клеточный лизат Bordetella Pertussis, столбнячный анатоксин (Tetanus) и инактивированные полиовирусы типов 1, 2 и 3) и rtTA [50], тогда как мышей MΔGΔ иммунизировали человеческим TNFα. Из мышей с положительной иммунной сывороткой посредством ELISA выделили индивидуальные полные антитела, применяя гибридомы или однодоменные Ab (sdAb) посредством библиотек фагового дисплея.
αhsp70-, столбнячный анатоксин- и rtTA-специфические моноклональные антитела секвенировали после RT ПЦР РНК антител (Фигура 7A). Данный факт показал, что были получены как IgG2 (7 из 8), так и IgG3 (1 из 8) антитела (sdAb выделили из библиотеки IgG2). Применяли различные D и J области. VHH из 11 HCAb сверхмутировали, хотя и с невысокой частотой. Три hTNFα-специфических антитела (одна положительная IgM гибридома, Фигура 6 α-hTNFα #1 и два sdAb α-hTNFα #2&3), все, обладали различными сверхмутациями в области CDR2. При сравнении последовательностей всех 14 антител стало очевидно, что хоть и применяют все J области, область, подобная человеческой JH4, применяется наиболее часто. На удивление, все антитела содержали VHH2 ламы (с глутамином (Q), а не первоначальной глутаминовой кислотой в положении 49 [51]). Наконец, очевидно, что область CDR3 обеспечивает большую часть разнообразия27. Она варьируется между длиной в 10 и 20 аминокислот (в среднем 13,6 ак), очень похожей на длину, которая наблюдается обычно у лам и людей [52, 53]. Затем мы проверили, являются ли данные HCAb функциональными в обычных анализах, как например, гибридомного супернатанта и бактериальных периплазматических фракций sdAb (Фигура 7). Все антитела были положительными в анализе ELISA и все были положительными при определении антигена посредством Вестерн-блоттинга (например, α-DKTP и α-rtTA сыворотка и гибридомная среда и α-B.Pertussis sdAb, Фигура 7B). Также мы проверили α-rtTA IgG на иммуноцитохимию, применяя клеточную линию, трансфецированную rtTA экспрессирующей плазмидой (Фиг.7C, D). rtTA HC-IgG дает очень явное и специфическое ядерное окрашивание. Аффинность ряда антител была высокой, хотя некоторые (в частности, sdAb) были более низкими. Например, антитело α-rtTA, применяемое в иммуноцитохимии (Фигура 7C, D), было приблизительно 3 nM, как определено на BiaCore (Фигура 7E).
Выводы
В контексте данного документа мы сообщили об экспрессии модифицированных локусов HCAb, которые восстанавливают развитие B-клеток в µMT мышах, приводя к получению функциональных HCAb. Данных мышей можно иммунизировать для получения антиген-специфических HCAb. Как и у камелидов удаление CH1 является ключевым для секреции HCAb, но одной сплайсинговой мутации (обзор30) камелида на 3' границе CH1/интрон недостаточно для удаления CH1, таким образом, необходимо больше данной единственной точечной мутации, по крайней мере, в человеческом локусе. IgM с CH1 в комбинации с VHH блокирует развитие B-клеток, возможно вызванное недейственным соединением поверхности молекулы IgM в контексте пре-BCR. Однако мыши, экспрессирующие HCD-подобный человеческий µ белок, вырабатывают нормальные CD43-пре-B-клетки на SCID фоне независимо от λ5 [54]. Усеченные Cµ белки экспрессируются на поверхности B-клеток, не связывая L цепи и, как считают, имитируют пре-BCR передачу сигнала посредством самоагрегации [55].
Обычно BiP обеспечивает контроль укладки и соединения молекул антител посредством связывания с гидрофобными поверхностями Ig цепей, которые впоследствии принимают участие во внутрицепных контактах31. Присутствие гидрофильных аминокислот в FR2 VHH наиболее возможно предотвращает связывание BiP с VHH, которым не нужна (суррогат) легкая цепь для того, чтобы стать растворимыми. В то же время CH1 обеспечивает взаимодействие с BiP, который предполагается для удерживания тяжелых цепей в ER, пока соединение (замещение BiP легкой цепью) не будет полным. На уровне рецептора пре-B-клетки наши результаты наводят на мысль, что трансгенная µ тяжелая цепь, соединяющаяся с Vpre белком, в виде части суррогата легкой цепи (SLC) в нековалентном соединении с белком λ5, не могла бы возникнуть, если µ тяжелая цепь, содержащая участок CH1, связана с VHH. Таким образом, человеческий IgM в MGS и MGΔ трансгенных мышах походил бы в этом отношении на неполный пре-BCR-подобный комплекс, который, как известно, является недостаточным для передачи сигнала пролиферативного размножения и прогрессирования развития [56, 57]. Данный факт может объяснить, почему только 30% B220 положительных клеток в BM имеют внутриклеточный IgM (Фигура 2B). Присутствие некоторого количества зрелых B-клеток в селезенке данных мышей можно объяснить недавно описанным новым рецепторным комплексом, который содержит тяжелые цепи µ, но лишен какого-либо SLC или подходящих легких цепей [58].
Если CH1 отсутствует в Cγ2 и 3, и IgM удален из локуса, то происходит восстановление развития B-клеток, показывая, что IgG может функционально замещать IgM. IgG1 рецептор, экспрессированный далее на про-B-клеточной стадии, способен заменить IgM в обеспечении развития зрелых CD21 +B клеток в Rag2-/-мышах [59]. Недавно также было показано, что пре-реаранжированные IgG2a камелидов могли бы частично восстановить развитие B-клеток в одной из двух трансгенных мышей на µMT (и CΔ-/-) фоне13. В нашем случае IgM или IgG, лишенные CH1, восстанавливают развитие B-клеток в 10 из 10 независимых трансгенных мышиных линиях. Кроме того, мы не наблюдаем реаранжировки легкой цепи и приходим к заключению, что экспрессия легкой цепи не является необходимой для дальнейшей дифференцировки B-клеток. Различие в результатах, полученных в контексте данного документа, и результатов Zou et al. [60] можно объяснить уровнем экспрессии локуса тяжелых цепей (и, таким образом, передачи сигнала) благодаря включению LCR в наши конструкции. Наши результаты подтверждают, что усеченный белок μ тяжелых цепей, лишенных CH1 [61] или VH и CH1 [62], не может связываться с SLC и оказывается не в состоянии активировать реаранжировку κ гена.
5-копийная GΔ линия1 (и другие мультикопийные линии) восстанавливает развитие B-клеток до такой же степени, как и однокопийная линия, включенная в состав генома в том же самом положении. Примечательно, что в мультикопийных трансгенных локусах происходят одна или более реаранжировок (Фигура 3). Две гибридомы, происходящие из двух отдельных спленоцитов, дают два продуктивных HCAb транскрипта и белка. Данный результат подтверждает, что экспрессия двух антител в одной и той же B-клетке является нетоксичной [63]. Однако предсказание37, что двойные антителообразующие B-клетки проиграли бы в соперничестве с одинарными антителообразующими клетками при антигенной стимуляции, не было подкреплено нашим результатом открытия 2 двойных антителоэкспрессирующих клеток из 5 гибридом, полученных при антигенной стимуляции.
(Мультикопийный) локус подвергается аллельному исключению в мышах дикого типа, так как BM клетки экспрессируют либо мышиный, либо человеческий Ig на клеточной поверхности. Значительной популяции клеток, экспрессирующих оба Ig на клеточной поверхности, не существует (Фигура 3F, верхние панели). Возможно, более примечательным является ряд клеток, экспрессирующих мышиный в сравнении с человеческим Ig. В wt/5-копийной GΔ мыши есть три возможных аллеля, доступных для реаранжировки, два мышиных аллеля с одним Ig локусом и один аллель с пятью человеческими HCAb локусами. При случайном выборе человеческий аллель следовало бы выбирать только 1 из 3 раз.
Если некоторые количества локусов подсчитать, то человеческий локус был бы реаранжирован предпочтительно в 5 из 7 клеток. Однако эндогенное мышиное и трансгенное человеческое HCAb экспрессируются почти в равных степенях (44/38, Фигура 3F, нижние панели). Хотя данные количества пренебрегают возможными отклонениями от случайного применения V областей и возможным эффектом положения на трансгенный локус, они решительно наводят на мысль, что первый выбор является стохастическим выбором аллеля, за которым следует возможная реаранжировка множественных генов в аллеле.
Данный факт согласуется с тем фактом, что мы часто наблюдаем множественные реаранжировки GΔ локуса. Обычно продуктивная реаранжировка подавляет рекомбинацию, чтобы предотвратить реаранжировку другого аллеля. Однако множественные копии на трансгенном аллеле присутствуют на одном и том же открытом локусе и очевидно могут быть рекомбинированы до подавления RAG. Это было бы возможно, так как множественные реаранжировки происходят в одно и то же время или, если они включают пространственную компоненту ("компартмент"), то было бы достаточно времени, для того чтобы реаранжировать другой ген в данном локусе, так как это должно было бы завершиться до того, как подавляются RAG.
Только если реаранжировка является непродуктивной в wt мышах (нет передачи сигнала, и остаются RAG), то было бы достаточно времени, для того чтобы активироваться второму локусу, заменить первый локус и реаранжироваться. В пользу данного аргумента было бы наблюдение, что другие виды с множественными локусами на одной и той же хромосоме имеют больше клеток, экспрессирующих два Ab [64].
Важно, что данные эксперименты показывают, что HCAb локусы могут быть успешно экспрессированы в мыши. Антигенная стимуляция приводит к получению антигенспецифических человеческих HCAb с высокой аффинностью различного класса в зависимости от композиции локусов. Данные антитела экспрессируются на уровнях, сравнимых с уровнями экспрессии в нормальных мышах или других «нормальных» человеческих IgH трансгенных мышах [65]. До сих пор в наших экспериментах применялись только две вариабельные области, антитела с высокой аффинностью и разнообразной специфичностью успешно отделяли почти от всех совершенно посторонних белков, которые мы проверяли, показывая действенность и эффективность разнообразия, полученного посредством CDR3 [66]. Таким образом, наличие V(D)J рекомбинации и in vivo селекции обеспечивает ключевое преимущество над получением человеческих одноцепных фрагментов антител из фагмидных библиотек, применяя фаговый дисплей39. Легко можно получить гибридомы, которые значительно позволяют непосредственное клонирование и экспрессию полного человеческого HCAb или фрагмента sdAb без необходимости фагового дисплея и дополнительного скрининга.
Таким образом, данные мыши раскрывают совершенно новые возможности получения человеческих HCAb для клинических или других целей, в частности, с учетом того факта4, что HCAb могут распознавать эпитопы, которые являются едва антигенными для подходящих антител, такие как активные сайты ферментов. Ограниченный ряд вариабельных областей может объяснить, почему распознавались не все антигены; полио и дифтерийные белки не давали реакции в GΔ мышах, тогда как контрольные wt мыши давали. На удивление, все антитела имели VHH2 область ламы. Она не включает консервативную аминокислоту [67] в положении 49 в отличие от VHHl, которая действительно имеет данную аминокислоту и должна была быть более растворима.
Тем не менее, мы ожидаем, что добавление дополнительных вариабельных областей в локусе должно привести к ровному широкому репертуару. Пока является предпочтительным избегать множественных копий локуса на одном аллеле, преимущественным было бы получать мышей, содержащих множественные аллели, каждый из которых содержит одну копию различных VH областей, для того чтобы увеличить разнообразие. В подобных новых локусах один может применять либо естественные (человеческие) VH области, либо VH области, рекомбинированные для увеличения растворимости18 и конъюгации легких цепей.
В заключение мы показали, что антигенспецифическое HCAb с высокой аффинностью потенциально любого класса можно получить в мышах. Данная технология позволит получение вполне человеческого HCAb любого класса или их фрагменты в ответ на антигенную стимуляцию для применения в качестве терапевтических или диагностических средств для человека. Посредством применения локусов различных позвоночных наша технология также предусматривает получение зрелых антител с высокой аффинностью из любого позвоночного для применения в качестве реагентов, диагностических средств или для лечения животных.
Пример 2
Janssens et al. (2006) показали, что трансгенный VH локус рекомбинирует надлежащим образом для того, чтобы получить трансгенно кодированные антитела из одних тяжелых цепей, и что подобный локус является восприимчивым к аллельному исключению в присутствии эндогенного (мышиного) локуса иммуноглобулина из одних тяжелых цепей. Для того чтобы показать, что ряд VH трансгенных локусов, которые применяют для получения антител из одних тяжелых цепей, можно расширить посредством применения процесса аллельного исключения, скрестили двух трансгенных мышей, содержащих различные локусы из одних тяжелых цепей, что привело к потомству, содержащему оба локуса. Одна мышь содержала MGΔ локус (локус IgM и IgG, Janssens et al., 2006), тогда как другая содержала GΔ локус (только локус IgG, Janssens et al., 2006), обе мыши имеют μMT фон. Гибридомы получали из B-клеток дважды трансгенного потомства и выращивали в культуре посредством стандартных способов. Ряд полученных в результате отдельных моноклональных клеточных линий проанализировали посредством ПЦР и Саузерн-блоттинга, которые показали, что линии, содержащие продуктивно реаранжированный MGΔ локус, содержали нереаранжированный GΔ или непродуктивно реаранжированный GΔ локус. С другой стороны, клеточные линии, содержащие продуктивно реаранжированный GΔ локус, содержали нереаранжированный или непродуктивно реаранжированный MGΔ локус. Таким образом, в процессе рекомбинации применяется совокупность доступных VH областей.
Примеры 3 и 4
В предпочтительном варианте осуществления первого аспекта изобретения все из ряда функциональных человеческих VH областей умножаются посредством клонирования человеческих VH областей (или их модификаций) в многократно модифицированном человеческом локусе, содержащем полную DH область, полную JH область и комбинацию Cµ, Cγ2, Cγ3 и Cα областей и 3'LCR, применяя способы, описанные в предыдущем примере, известные на данном уровне техники (Janssens et al., 2006). Данную процедуру можно проводить, применяя множественные идентичные VH области в отдельных локусах или различные VH области в отдельных локусах. Различные локусы могут содержать идентичные области тяжелых цепей или различные области тяжелых цепей. Пример 3 для локуса с идентичными VH областями в локусах, которые имеют различную комбинацию областей тяжелых цепей, пример 4 для двух локусов с идентичными постоянными областями тяжелых цепей, но различными VH областями. Очевидно, что в обоих примерах можно было добавить дополнительные локусы.
Пример 3
Человеческие VH области выделяют посредством ПЦР амплификации человеческой геномной ДНК, применяя праймеры, которые являются специфическими для каждой выбранной VH из 39 возможных функциональных человеческих VH областей (в качестве альтернативы можно было бы применять или добавлять человеческие VL области или TCR V области или все их модификации, полученные посредством мутагенеза). Человеческие VH области клонируют в наборах в локусе, описанном в вышеупомянутом примере (Фигура 9), то есть содержащем человеческие DH плюс JH (или другие D и J области) и Cµ, Cγ2, Cγ3, каждая из которых лишена CH1 плюс 3'LCR. Область Cα, лишенную CH1, плюс области переключения будут клонировать отдельно в GΔ локусе (Фигура 10). Данный GΔ локус является модификацией первоначального локуса, в котором не содержатся lox сайты, VHH области ламы удалили посредством стандартной гомологичной рекомбинации, оставляя уникальный PI-PspI сайт (Фигура 10).
Функциональные VH области можно клонировать совместно с любым множеством в каждом локусе. Вначале 17 функциональных человеческих VH областей будут клонированы совместно в одном наборе, начиная с 2 клонированных генов наборе. К каждой из данных исходных конструкций будет добавлен второй набор посредством подходящей методики (например, применяя XhoI-SalI рестрикционное расщепление/лигирование, лигирование XhoI и SalI сходных сайтов разрушает и тот и другой). Наборы, содержащие 4, 4, 4, 3 и 2 будут объединены в один набор из 17 генов в BAC вектор. Очевидно, что данную процедуру можно было бы выполнить посредством объединения наборов, содержащих другие количества генов. Вышеупомянутый процесс можно прервать в любой момент, для того чтобы достигнуть необходимого количества VH областей или продолжить для достижения более высокого числа VH областей.
Полный набор (например, 17 генов) клонируют в модифицированном GΔ локусе в уникальном PI-PspI сайте. Область Cα будут клонировать в I-CeuI сайте данного локуса, что приведет к AΔGΔ локусу, способному вырабатывать Igα и IgG (Фигура 10). В качестве альтернативы можно было бы клонировать другие области тяжелых цепей.
Данные конечные локусы затем вводят в отдельных трансгенных мышей (предпочтительно с дефектным мышиным IgH локусом, таким как µMT), как описано в вышеупомянутом примере. Данные отдельные локусы применяют для того, чтобы получить отдельные мышиные линии, одну, которая должна была вырабатывать IgG, и одну, которая должна была вырабатывать IgA и/или IgG. Данных мышей впоследствии скрещивали для того, чтобы довести все доступные VH области до 34 в двух разных локусах. Скрещивание данных мышей до гомозиготности по обоим локусам создало бы 68 VH областей, доступных для рекомбинации. Наличие множественных копий интегрированного локуса увеличило бы, вероятно, это число еще больше. Анализ гибридом, полученных из B-клеток данных мышей, применяли бы, вероятно, для того, чтобы показать, что при наличии продуктивно реаранжированного локуса, другие локусы, которые были произведены, являются либо нереаранжированными, либо непродуктивно реаранжированными из-за аллельного исключения посредством стандартных процедур.
Пример 4
Различные наборы 1 или более VH областей, аналогично отделенные от областей, описанных выше (или их модификаций, полученных посредством мутагенеза), клонируются в двух отдельных локусах посредством такой же методики, какая описана выше. Данный факт, вероятно, приводил бы к двум разным GΔ локусам (или их модификациям, таким как добавление Cα). Данные локусы вводились бы в отдельных мышей, приводя к отдельным трансгенным линиям (например, 2 локуса, имеющие 10VH областей каждый, Фигура 11). Данных мышей впоследствии скрещивали бы для того, чтобы получить дважды трансгенных мышей, которые имели бы все VH области, применяемые свободно для процесса рекомбинации. Скрещивание данных мышей до гомозиготности по обоим локусам удвоило бы число VH областей, доступных для рекомбинации (Фигура 12, кариограмма с одним локусом, интегрированным в хромосоме 1 и одним локусом в хромосоме 8). Наличие множественных копий интегрированного локуса увеличило бы, вероятно, это число еще больше. Анализ гибридом, полученных из B-клеток данных мышей, применяли бы, вероятно, для того, чтобы показать, что при наличии продуктивно реаранжированного локуса другие локусы, которые были произведены, являются либо нереаранжированными, либо непродуктивно реаранжированными из-за аллельного исключения.
Вышеупомянутый процесс можно прервать в любой момент для того, чтобы достигнуть необходимого количества VH областей. D, JH и постоянные области будут добавлены к данным VH областям. Данные конечные локусы можно затем вводить в отдельных трансгенных мышей (предпочтительно с дефектным мышиным IgH локусом), как описано в вышеупомянутом примере. В качестве альтернативы положение lox сайтов позволяет выделение отдельных постоянных областей для того, чтобы получить отдельные локусы, которые содержат или только Cµ (IgM), или только Cγ2 и Cγ3 (IgG2 и IgG3), или только Cα (IgA), или их комбинации. Данные отдельные локусы применяют для того, чтобы получить отдельные мышиные линии, которые вырабатывали бы либо только человеческий IgM, либо только IgG, или только IgA, или их комбинации.
Ссылки
[1] Kabat, E., Wu, T.T., Perry, H.M., Gottesman, K.S., and Foeller, C. (1991) United States Public Health Services Publication No. 91-3242, National Institutes of Health, Bethesda, MD.
[2] Jaton et al., (1968) Biochemistry, 7, 4185-4195.
[3] Xu and Davies, (2000) Immunity, 13, 37-45.
[4] Jakobovits A. The long-awaited magic bullets: therapeutic human monoclonal antibodies from transgenic mice. Expert Opin. Investig. Drugs. 1998 Apr.; 7(4): 607-14. Links.
[5] Davis C.G., Jia X.C., Feng X., Haak-Frendscho M. Production of human antibodies from transgenic mice. Methods Mol. Biol. 2004; 248: 191-200.
[6] Kellermann S.A., Green L.L. Antibody discovery: the use of transgenic mice to generate human monoclonal antibodies for therapeutics. Curr. Opin. Biotechnol. 2002 Dec.; 13(6): 593-7. Links.
[7] EP 1690935.
[8] US 2005287630.
[9] WO 9634096.
[10] WO 9402602.
[11] Hendershot et al., (1987), J. Cell. Biol., 104, 761-767.
[12] Brandt et al., (1984), Mol. Cell. Biol., 4, 1270-1277.
[13] Hamers-Casterman et al., (1993), Nature, 363, 446-448.
[14] Stanfield et al., (2004), Science, 305, 1770-1773.
[15] Rick Janssens, Sylvia Dekker, Rudi W. Hendriks, George Panayotou, Alexandra van Remoortere, John Kong-a San, Frank Grosveld and Dubravka Drabek, Generation of heavy chain only antibodies in mice, Proc. Natl. Acad. USA 2006, 10; 103(41): 15130-5. Epub 2006 Oct. 2.
[16] de Genst et al., Dev. Comp. Immunol. 2006; 30: 187-98.
[17] Davies, J. and Riechmann L. Biotechnology (1995) vol. 13, 475-479. Antibody VH domains as small recognition units.
[18] Ward et al., (1989), Nature, 341, 544-546.
[19] Davies and Riechmann, (1996), Protein Eng., 9(6), 531-537.
[20] Lutz and Muyldermans, (1999), J. Immuno. Methods, 231, 25-38.
[21] Tanha et al., (2001), J. Biol. Chem., 276, 24774-24780.
[22] Yau et al., (2005), J. Immunol. Methods, 297, 213-224.
[23] Van Dijk and van der Winkel, Curr. Opin. Chem. Biol., (2001) Aug. 5 (4), 368-374.
[24] Leher et al., (1999), Exp. Eye. Res., 69, 75-84.
[25] Sitia et al., (1990), Cell, 60, 781-790.
[26] Jespers L., Schon O., Famm K., Winter G. (2004) Aggregation-resistant domain antibodies selected on phage by heat denaturation. Nat. Biotechnol. 22(9): 1161-5.
[27] Ravn P., Danielczyk A., Jensen K.B., Kristensen P., Christensen P.A., Larsen M., Karsten U., Goletz S. (2004) Multivalent scFv display of phagemid repertoires for the selection of carbohydrate-specific antibodies and its application to the Thomsen-Friedenreich antigen. J. Mol. Biol. 343(4): 985-96.
[28] Jespers L., Schon O., James L.C., Veprintsev D., Winter G. (2004) Crystal structure of HEL4, a soluble, refoldable human V(H) single domain with a germ-line scaffold. J. Mol. Biol. 337(4): 893-903.
[29] Dolk E., van Vliet C., Perez J.M., Vriend G., Darbon H., Ferrat G., Cambillau C., Frenken L.G., Verrips T. (2005) Induced refolding of a temperature denatured llama heavy-chain antibody fragment by its antigen. Proteins. 59(3): 555-64.
[30] Dolk E., van der Vaart M., Lutje Hulsik D., Vriend G., de Haard H., Spinelli S., Cambillau C., Frenken L., Verrips T. (2005) Isolation of llama antibody fragments for prevention of dandruff by phage display in shampoo. Appl. Environ Microbiol. 71(l): 442-50.
[31] Zhao, Y., Pan-Hammarstrom, Q., Zhao, Z., Wen, S. & Hammarstrom, L. Selective IgG2 deficiency due to a point mutation causing abnormal splicing of the Cgamma2 gene. Int. Immunol. 17, 95-101 (2005).
[32] Lefranc, M., Giudicelli, V., Ginestoux, C, Bodmer, J., Muller, W., Bontrop, R., Lemaitre, M., Malik, A., Barbie, V. and D. Chaume. 1999. IMGT, the international ImMunoGeneTics database Nucleic Acids. Res. 127: 209-212.
[33] Mills F., Harindranath N., Mitchell M. & Max E. Enhancer complexes located downstream of human C alpha genes. J. Exp. Med. 186, 845-58 (1997).
[34] Nguyen, V.K., Hamers, R., Wyns, L. & Muyldermans, S. Loss of splice consensus signal is responsible for the removal of the entire C(H)1 domain of the functional camel IGG2A heavy-chain antibodies. Mol. Immunol. 36, 515-24 (1999).
[35] Imam A., Patrinos G., de krom M., Bottardi S., Janssens R., Katsantoni E., Wai A., Sherratt D. & Grosveld F. Modification of human β-globin locus PAC clones by homologous recombination in E.coli. Nucleic Acids Res. 15, E65 (2001).
[36] Middendorp, S., Dingjan, G.M. & Hendriks, R.W. Impaired precursor B cell differentiation in Bruton's tyrosine kinase-deficient mice. J. Immunol. 168, 2695-703 (2002).
[37] Melamed D. and Nemazee D. Self-antigen does not accelerate immature B cell apoptosis, but stimulates receptor editing as a consequence of developmental arrest. Proc. Natl. Acad. Sci., 94, 9267-9272 (1997).
[38] Heiskanen M., Hellsten E., Kallioniemi O.P., Makela T.P., Alitalo K., Peltonen L., Palotie A. Visual mapping by fiber-FISH. Genomics 30, 31-36 (1995).
[39] Corput, M. and Grosveld, F. Fluorescence in situ hybridization analysis of transcript dynamics in cells Methods 25, 111-118 (2001).
[40] Van der Linden R., de Geus B., Stok W., Bos W., van Wassenaar D., Verrips T., Frenken L. Induction of immune response and molecular cloning of heavy chain repertoire of Lama glama. J. Immunol. Methods. 240, 185-195 (2000).
[41] Hoogenboom H.R., Griffiths A.D., Johnson K.S., Chiswell D.J., Hudson P., and Winter G. Multi-subunit proteins on the surface of filamentous phage: methodologies for displaying antibody (Fab) heavy and light chains. Nucleic Acids Research 19, 4133-4137 (1991).
[42] Dekker S., Toussaint W., Panayotou G., de Wit T., Visser P., Grosveld F., Drabek D. Intracellularly expressed single-domain antibody against p15 matrix protein prevents the production of porcine retroviruses. J. Virol., 77, 12132-9 (2003).
[43] Kitamura D., Roes J., Kuhn R. & Rajewsky K. A B cell-deficient mouse by targeted disruption of the membrane exon of the antibody mu chain gene. Nature 350, 423-6 (1991).
[44] Macpherson, A.J. et al. IgA production without mu or delta chain expression in developing B cells. Nat. Immunol. 2, 625-31 (2001).
[45] Orinska, Z. et al. Novel B cell population producing functional IgG in the absence of membrane IgM expression. Eur. J. Immunol. 32, 3472-80 (2002).
[46] Hasan, M., Polic, B., Bralic, M., Jonjic, S. & Rajewsky, K. Incomplete block of B cell development and antibody production in mice carrying the muMT mutation on the BALB/c background. Eur. J. Immunol. 32, 3463-71 (2002).
[47] Davies, J. and Riechmann, L. Single antibody domains as small recognition units: design and in vitro antigen selection of camelized, human VH domains with improved protein stability. Protein Eng. 9, 531-7 (1996).
[48] Riechmann, L. & Muyldermans, S. Single domain antibodies: comparison of camel VH and camelised human VH domains. J. Immunol. Methods 231, 25-38 (1999).
[49] De Genst E., Silence K., Ghahroudi M., Decanniere K., Loris R., Kinne J., Wyns L. & Muyldermans S. Strong in vivo maturation compensates for structurally restricted H3 loops in antibody repertoires. J. Biol. Chem. 280, 14114-21 (2005).
[50] Urlinger S., Baron U., Thellmann M., Hasan M.T., Bujard H. & Hillen W. Exploring the sequence space for tetracycline-dependent transcriptional activators: novel mutations yield expanded range and sensitivity. Proc. Natl. Acad. Sci. USA. 97, 7963-8 (2000).
[51] De Genst E., Silence K., Ghahroudi M., Decanniere K., Loris R., Kinne J., Wyns L. & Muyldermans S. Strong in vivo maturation compensates for structurally restricted H3 loops in antibody repertoires. J. Biol. Chem. 280, 14114-21 (2005).
[52] Vu, K.B., Ghahroudi, M.A., Wyns, L. & Muyldermans, S. Comparison of llama VH sequences from conventional and heavy chain antibodies. Mol. Immunol. 34, 1121-31 (1997).
[53] Zemlin, M. et al. Expressed murine and human CDR-H3 intervals of equal length exhibit distinct repertoires that differ in their amino acid composition and predicted range of structures. J. Mol. Biol. 334, 733-49 (2003).
[54] Corcos D., Iglesias A., Dunda O., Bucchini D., Jami J. Allelic exclusion in transgenic mice expressing a heavy chain disease-like human mu protein. Eur. J. Immunol. 21, 2711-6 (1991).
[55] Corcos D., Dunda O., Butor C., Cesbron J.Y., Lores P., Bucchini D., Jami J. Pre-B-cell development in the absence of lambda 5 in transgenic mice expressing a heavy chain disease protein. Curr. Biol. 5: 1140-8 (1995).
[56] Seidl, T., Rolink, A. & Melchers, F. The VpreB protein of the surrogate lightchain can pair with some mu heavy-chains in the absence of the lambda 5 protein. Eur. J. Immunol. 31, 1999-2006 (2001).
[57] Mundt, C., Licence, S., Shimizu, T., Melchers, F. & Martensson, I.L. Loss of precursor B cell expansion but not allelic exclusion in VpreB1/VpreB2 doubledeficient mice. J. Exp. Med. 193, 435-45 (2001).
[58] Su, Y.W. et al. Identification of a pre-BCR lacking surrogate light chain. J. Exp. Med. 198, 1699-706 (2003).
[59] Pogue, S.L. & Goodnow, C.C. Gene dose-dependent maturation and receptor editing of B cells expressing antibody (Ig)G1 or IgM/IgG1 tail antigen receptors. J. Exp. Med. 191, 1031-44 (2000).
[60] Zou, X. et al. Expression of a dromedary heavy chain-only antibody and B cell development in the mouse. J. Immunol. 175, 3769-79 (2005).
[61] Iglesias, A., Kopf, M., Williams, G.S., Buhler, B. & Kohler, G. Molecular requirements for the mu-induced light chain gene rearrangement in pre-B cells. Embo J. 10, 2147-55 (1991).
[62] Shaffer, A.L. & Schlissel, M.S. A truncated heavy chain protein relieves the requirement for surrogate light chains in early B cell development. J. Immunol. 159, 1265-75 (1997).
[63] Sonoda, E. et al. B cell development under the condition of allelic inclusion. Immunity 6, 225-33 (1997).
[64] Eason D.D., Litman R.T., Luer C.A., Kerr W., Litman G.W. Expression of individual antibody genes occurs in an unusual system consisting of multiple independent loci. Eur. J. Immunol. 34: 2551-8 (2004).
[65] Wagner S.D., Gross G., Cook G.P., Davies S.L., Neuberger M.S. Antibody expression from the core region of the human IgH locus reconstructed in transgenic mice using bacteriophage P1 clones. Genomics. 35, 405-14 (1996).
[66] Xu J.L., Davis M.M. Diversity in the CDR3 region of V(H) is sufficient for most antibody specificities. Immunity 13, 37-45 (2000).
[67] De Genst E., Saerens D., Muyldermans S., Conrath K. Antibody repertoire development in camelids. Dev. Comp. Immunol. 30, 187-98 (2006).
Реферат
Настоящее изобретение относится к биотехнологии. Описан способ получения VH антител, включающий стадии обеспечения более одного гетерологического VH локуса тяжелых цепей на разных хромосомах в данном млекопитающем. Причем каждый VH локус тяжелых цепей содержит один или более сегментов V-гена, один или более сегментов D-гена, один или более сегментов J-гена и сегмент гена, кодирующий постоянную область тяжелых цепей, которая при экспрессии не включает участок Сн1. В результате антигенной стимуляции только один локус продуктивно рекомбинируется в В-клетке, что приводит к получению VH антитела из одних тяжелых цепей и экспрессии указанного VH антитела из указанного продуктивно рекомбинировавшегося локуса. Изобретение позволяет расшить репертуар ответа антител. 4 н. и 28 з.п. ф-лы, 12 ил., 1 табл.
Формула
обеспечения более одного гетерологического VH локуса тяжелых цепей на разных хромосомах в данном млекопитающем, причем каждый VH локус тяжелых цепей содержит один или более сегментов V гена, один или более сегментов D гена, один или более сегментов J гена и сегмент гена, кодирующий постоянную область тяжелых цепей, которая при экспрессии не включает участок Сн1, и где в результате антигенной стимуляции только один локус продуктивно рекомбинируется в В-клетке, что приводит к получению VH антитела из одних тяжелых цепей и экспрессии указанного VH антитела из указанного продуктивно рекомбинировавшегося локуса.
получение В-клеточных гибридом;
селекцию клеток, экспрессирующих антигенспецифическое антитело из одних тяжелых цепей; и
выделение антигенспецифического рекомбинированного VH антитела из одних тяжелых цепей со зрелой аффинностью.

Комментарии