Животные, не являющиеся человеком, экспрессирующие экзогенную терминальную дезоксинуклеотидилтрансферазу - RU2753585C2
Код документа: RU2753585C2
Чертежи















Описание
РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США, имеющей серийный номер 62/345524, поданной 3 июня 2016 года, полностью включенной в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Животные, не являющиеся человеком, особенно мыши и крысы, оказались ценным источником терапевтических антител и могут являться источником других антигенсвязывающих молекул. Высокий уровень разнообразия рецепторов антигенов у таких животных, не являющихся человеком, повышает вероятность получения антигенсвязывающих молекул, обладающих желательными терапевтическими свойствами, после иммунизации. Соответственно, существует потребность в генетически модифицированных животных, не являющихся человеком, характеризующихся повышенным разнообразием рецепторов антигенов, в целях улучшения продукции терапевтических антигенсвязывающих молекул.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0003] В некоторых аспектах настоящего изобретения предложены генетически модифицированные животные, не являющиеся человеком, геном которых содержит экзогенную нуклеиновую кислоту, кодирующую терминальную дезоксинуклеотидилтрансферазу (TdT), а также способы получения и применения таких животных, не являющихся человеком. В некоторых вариантах реализации экзогенная TdT представляет собой TdT человека. В некоторых вариантах реализации экзогенная TdT имеет эндогенное происхождение для данного вида (например, экзогенная TdT с последовательностью, характерной для мыши, у мышей). В некоторых вариантах реализации животные, не являющиеся человеком, предложенные в настоящем изобретении, экспрессируют TdT, кодируемую экзогенной нуклеиновой кислотой, при развитии В-клеток, например, в про-В-клетках и/или в пре-В-клетках. В некоторых вариантах реализации животные, не являющиеся человеком, предложенные в настоящем изобретении, экспрессируют TdT, кодируемую экзогенной нуклеиновой кислотой, при развитии Т-клеток, например, в дважды отрицательных (DN) тимоцитах и/или в дважды положительных (DP) тимоцитах. В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, содержит множественные копии экзогенных нуклеиновых кислот, кодирующих TdT (например, по меньшей мере 2, 3, 4, 5, 6, 7 или 8 копий). В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, представляет собой млекопитающее, например, грызуна (например, мышь или крысу).
[0004] В некоторых вариантах реализации геном генетически модифицированного животного, не являющегося человеком, содержит вариабельную область иммуноглобулина, содержащую нереаранжированные сегменты генов вариабельной области иммуноглобулина человека (например, сегменты генов тяжелой цепи, сегменты генов κ-цепи, сегменты λ-цепи), функционально связанные с геном константной области иммуноглобулина (например, геном константной области тяжелой цепи, геном константной области κ-цепи, геном константной области λ-цепи). В некоторых вариантах реализации ген константной области представляет собой ген константной области человека, ген константной области мыши или ген константной области крысы. В некоторых вариантах реализации ген константной области имеет эндогенное происхождение. В некоторых вариантах реализации ген вариабельной области и ген константной области расположены в эндогенном локусе иммуноглобулина (например, локусе тяжелой цепи, локусе κ, локусе λ). В некоторых вариантах реализации генетически модифицированный организм животного, не являющегося человеком, экспрессирует антитела, содержащие вариабельный домен иммуноглобулина человека, происходящий от вариабельной области иммуноглобулина, и константный домен иммуноглобулина, кодируемый геном константной области иммуноглобулина. В некоторых вариантах реализации настоящего изобретения предложены способы применения такого генетически модифицированного животного, не являющегося человеком, для получения антитела, В-клетки, гибридомы или нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека.
[0005] В некоторых вариантах реализации геном генетически модифицированного животного, не являющегося человеком, содержит вариабельную область Т-клеточного рецептора (TCR), содержащую нереаранжированные сегменты гена вариабельной области TCR человека (например, сегменты гена TCRα, сегменты гена TCRβ, сегменты гена TCRγ, сегменты гена TCRδ), функционально связанные с геном константной области TCR (например, геном константной области TCRα, геном константной области TCRβ, геном константной области TCRγ, геном константной области TCRδ). В некоторых вариантах реализации ген константной области представляет собой ген константной области человека, ген константной области мыши или ген константной области крысы. В некоторых вариантах реализации ген константной области имеет эндогенное происхождение. В некоторых вариантах реализации ген вариабельной области и ген константной области расположены в эндогенном локусе TCR (например, локусе TCRα, локусе TCRβ, локусе TCRγ, локусе TCRδ). В некоторых вариантах реализации генетически модифицированный организм животного, не являющегося человеком, экспрессирует TCR, содержащий вариабельный домен TCR человека, происходящий от вариабельной области TCR, и константный домен TCR, кодируемый геном константной области TCR. В некоторых вариантах реализации настоящего изобретения предложены способы использования такого генетически модифицированного животного, не являющегося человеком, для получения TCR, Т-клетки, Т-клеточной гибридомы или нуклеиновой кислоты, кодирующей вариабельный домен TCR человека.
[0006] В некоторых вариантах реализации геном генетически модифицированного животного, не являющегося человеком, содержит вариабельную область иммуноглобулина, содержащую нереаранжированные сегменты генов вариабельной области иммуноглобулина человека (например, сегменты генов тяжелой цепи, сегменты генов κ-цепи, сегменты λ-цепи), функционально связанные с геном константной области TCR (например, геном константной области TCRα, геном константной области TCRβ, геном константной области TCRγ, геном константной области TCRδ). В некоторых вариантах реализации ген константной области представляет собой ген константной области человека, ген константной области мыши или ген константной области крысы. В некоторых вариантах реализации ген константной области имеет эндогенное происхождение. В некоторых вариантах реализации ген вариабельной области и ген константной области расположены в эндогенном локусе TCR (например, локусе TCRα, локусе TCRβ, локусе TCRγ, локусе TCRδ). В некоторых вариантах реализации генетически модифицированный организм животного, не являющегося человеком, экспрессирует химерный рецептор антигена (CAR), содержащий вариабельный домен иммуноглобулина человека, происходящий от вариабельной области иммуноглобулина, и константный домен TCR, кодируемый геном константной области TCR. В некоторых вариантах реализации настоящего изобретения предложены способы применения такого генетически модифицированного животного, не являющегося человеком, для получения CAR, Т-клетки, Т-клеточной гибридомы или нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека.
[0007] В некоторых вариантах реализации настоящего изобретения предложены способы получения животного, не являющегося человеком, описанного в настоящем документе, включая инженерию животных, не являющихся человеком, путем включения генетических модификаций, описанных в настоящем документе, в их эмбриональные линии. В некоторых вариантах реализации настоящего изобретения предложены ЭС-клетки животного, не являющегося человеком, содержащие генетические модификации, описанные в настоящем документе.
Краткое описание чертежей
[0008] На фигуре 1 изображена диаграмма типичного направленного вектора (без соблюдения масштаба), в котором часть гена Rag2 мыши заменена последовательностью ДНК, кодирующей короткую изоформу TdT человека (hTdTs). В типичных вариантах реализации вектор случайным образом встраивают в геном. Если маркировка на диаграмме не предполагает иного (например, для селективных кассет, сайтов loxP и т.д.), заполненные элементы и одинарные линии представляют собой последовательности мыши, а незаполненные элементы формы и двойные линии представляют собой последовательности человека. E1, E2 и т.д. представляют собой экзоны конкретных показанных генов, GFP - зеленый флуоресцентный белок, CM - ген устойчивости к хлорамфениколу, neo - ген устойчивости к неомицину. Области соединения 1-4 соответствуют областям соединения, указанным в таблице 1.
[0009] На фигуре 2 изображена диаграмма типичного направленного вектора (без соблюдения масштаба), в котором часть гена Rag2 мыши заменена последовательностью ДНК, кодирующей короткую изоформу TdT человека (hTdTs). В показанном варианте реализации вектор применяют для инсерции hTdT под контролем промотора RAG2 мыши в локус Ig каппа. Если маркировка на диаграмме не предполагает иного (например, для селективных кассет, сайтов loxP и т.д.), заполненные элементы и одинарные линии представляют собой последовательности мыши, а незаполненные элементы формы и двойные линии представляют собой последовательности человека. E1, E2 и т.д. представляют собой экзоны конкретных показанных генов, GFP - зеленый флуоресцентный белок, CM - ген устойчивости к хлорамфениколу, hyg - ген устойчивости к гигромицину. Области соединения 1-7 соответствуют областям соединения, указанным в таблице 2.
[0010] На фигуре 3 изображена диаграмма типичного направленного вектора (без соблюдения масштаба), используемого для инсерции последовательности ДНК, кодирующей TdT человека (hTdTs), под контролем промотора VH1-72 и энхансера Еμ в локус иммуноглобулина κ. Если маркировка на диаграмме не предполагает иного (например, для селективных кассет, сайтов loxP и т.д.), заполненные элементы и одинарные линии представляют собой последовательности мыши, а незаполненные элементы формы и двойные линии представляют собой последовательности человека. E1, E2 и т.д. представляют собой экзоны конкретных показанных генов, GFP - зеленый флуоресцентный белок, CM - ген устойчивости к хлорамфениколу, hyg - ген устойчивости к гигромицину. Области соединения 1-4 соответствуют областям соединения, указанным в таблице 3.
[0011] На фигуре 4 показана экспрессия мРНК hTdT в лимфоцитах мышей VELOCIMMUNE® TdT по сравнению с контрольными мышами VELOCIMMUNE®. Мыши VELOCIMMUNE® в настоящем документе представляют собой мышей, содержащих разнообразный репертуар нереаранжированных вариабельных (V(D)J) сегментов генов тяжелой цепи и легкой цепи каппа человека. Het обозначает гетерозиготную мышь, HO обозначает гомозиготную мышь.
[0012] На фигуре 5 приведен график, на котором показано разнообразие последовательностей hIgκ (количество уникальных последовательностей легкой цепи CDR3 на каждые 10000 прочтений секвенирования hIgκ) у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. Het обозначает гетерозиготную мышь, HO обозначает гомозиготную мышь.
[0013] На фигуре 6 приведен график, на котором показано распределение нематричных присоединений hIgκ у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. Het обозначает гетерозиготную мышь, HO обозначает гомозиготную мышь. «NT» - нуклеотиды.
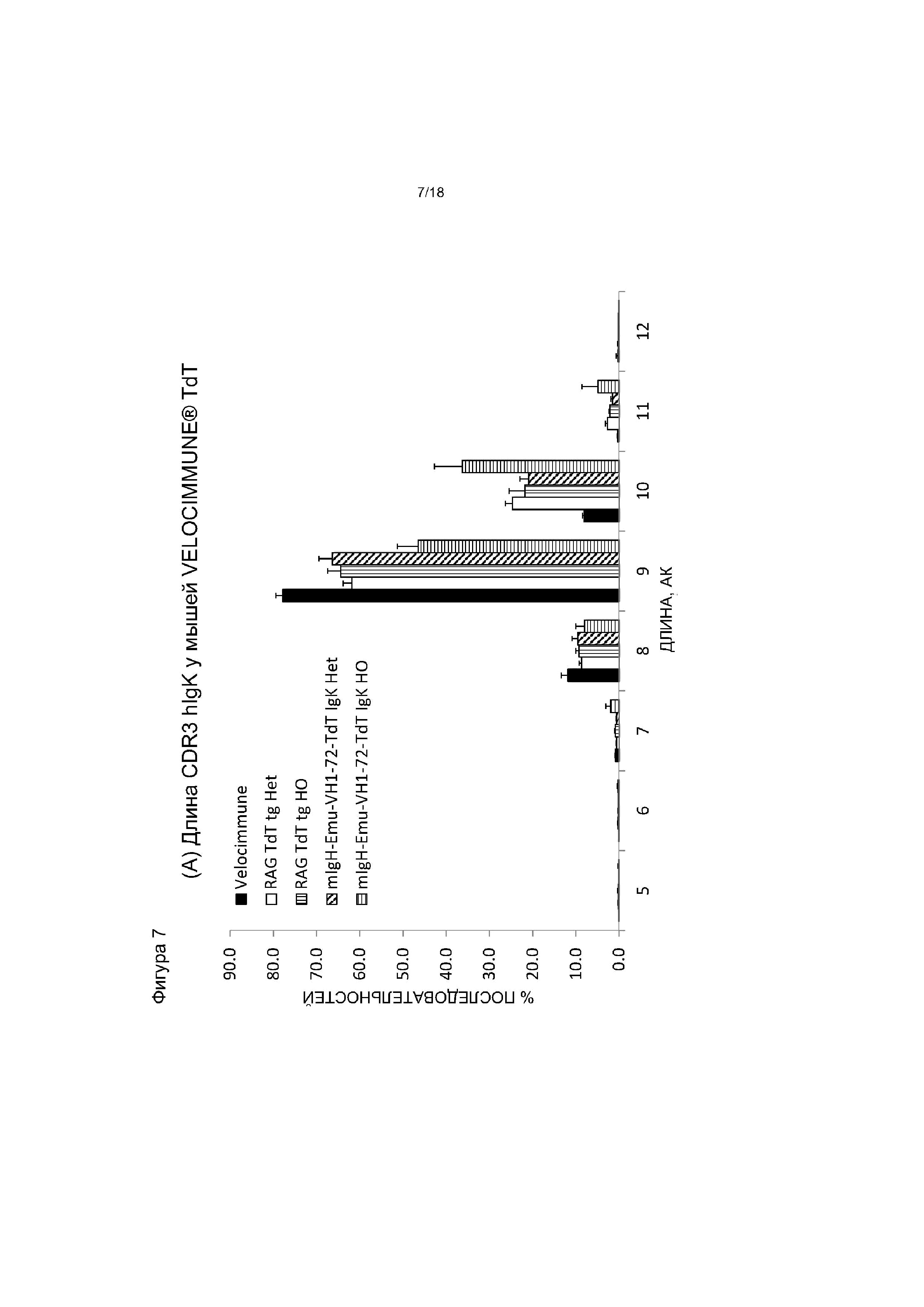
[0014] Фигура 7 содержит две панели. На панели (A) приведен график, на котором показано распределение длины hIgκ CDR3 у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. «АК» - аминокислота. На панели (B) приведен график, на котором показаны частоты длин экзонуклеазных делеций в 5'-области JK-сегментов у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. Het обозначает гетерозиготную мышь, HO обозначает гомозиготную мышь.
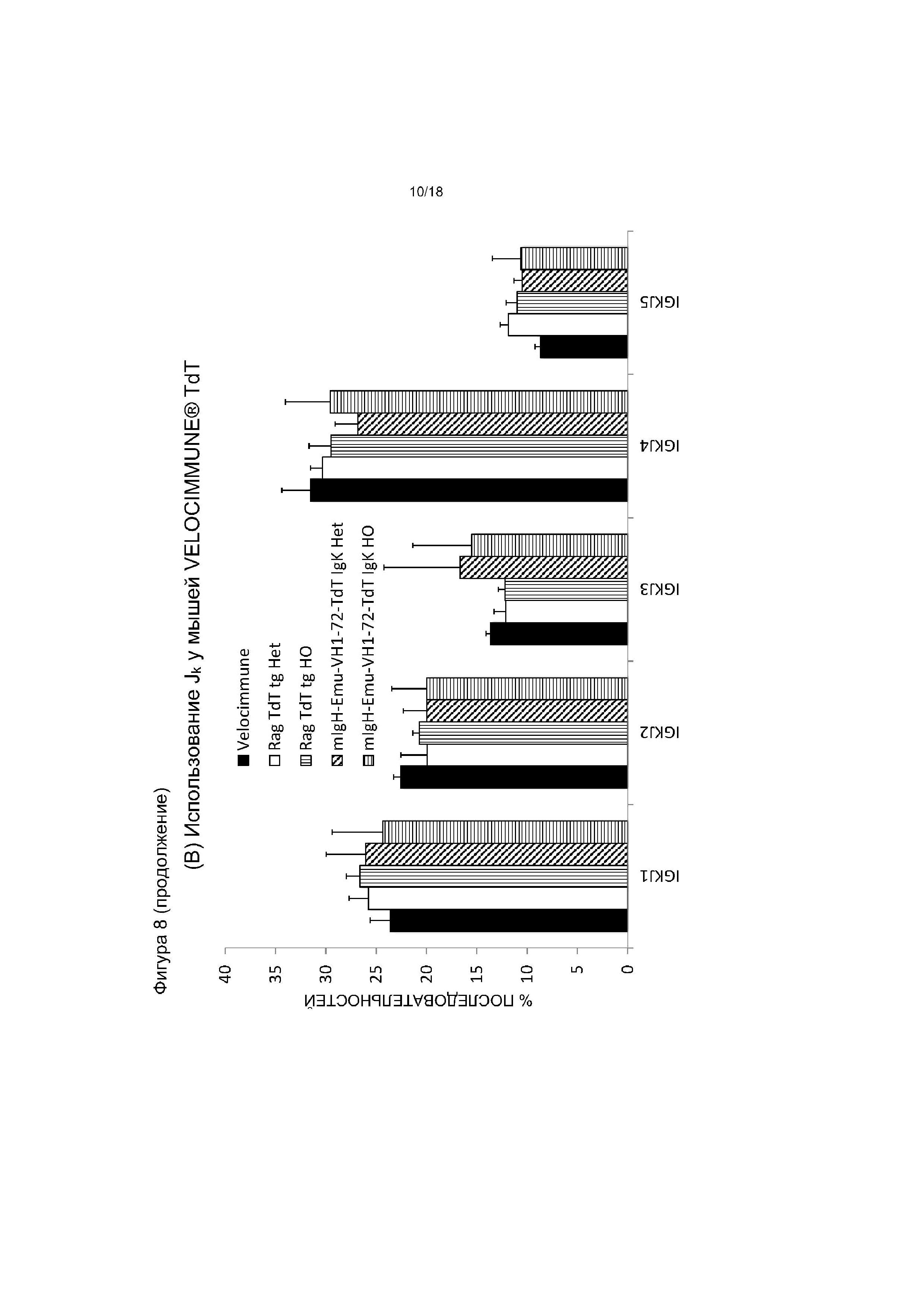
[0015] Фигура 8 содержит две панели. На панели (A) приведен график, на котором показано использование Vκ у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. На панели (В) приведен график, на котором показано использование Jκ у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. Het обозначает гетерозиготную мышь, HO обозначает гомозиготную мышь.
[0016] На фигуре 9 приведен график, на котором показано разнообразие последовательностей mIgλ (количество уникальных последовательностей легкой цепи CDR3 на каждые 10000 прочтений секвенирования mIgλ) у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. Het обозначает гетерозиготную мышь, HO обозначает гомозиготную мышь.
[0017] На фигуре 10 приведен график, на котором показано распределение нематричных присоединений mIgλ у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. Het обозначает гетерозиготную мышь, HO обозначает гомозиготную мышь. «NT» - нуклеотиды.
[0018] На фигуре 11 приведен график, на котором показано распределение длины mIgλ CDR3 у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. Het обозначает гетерозиготную мышь, HO обозначает гомозиготную мышь. «АК» - аминокислота.
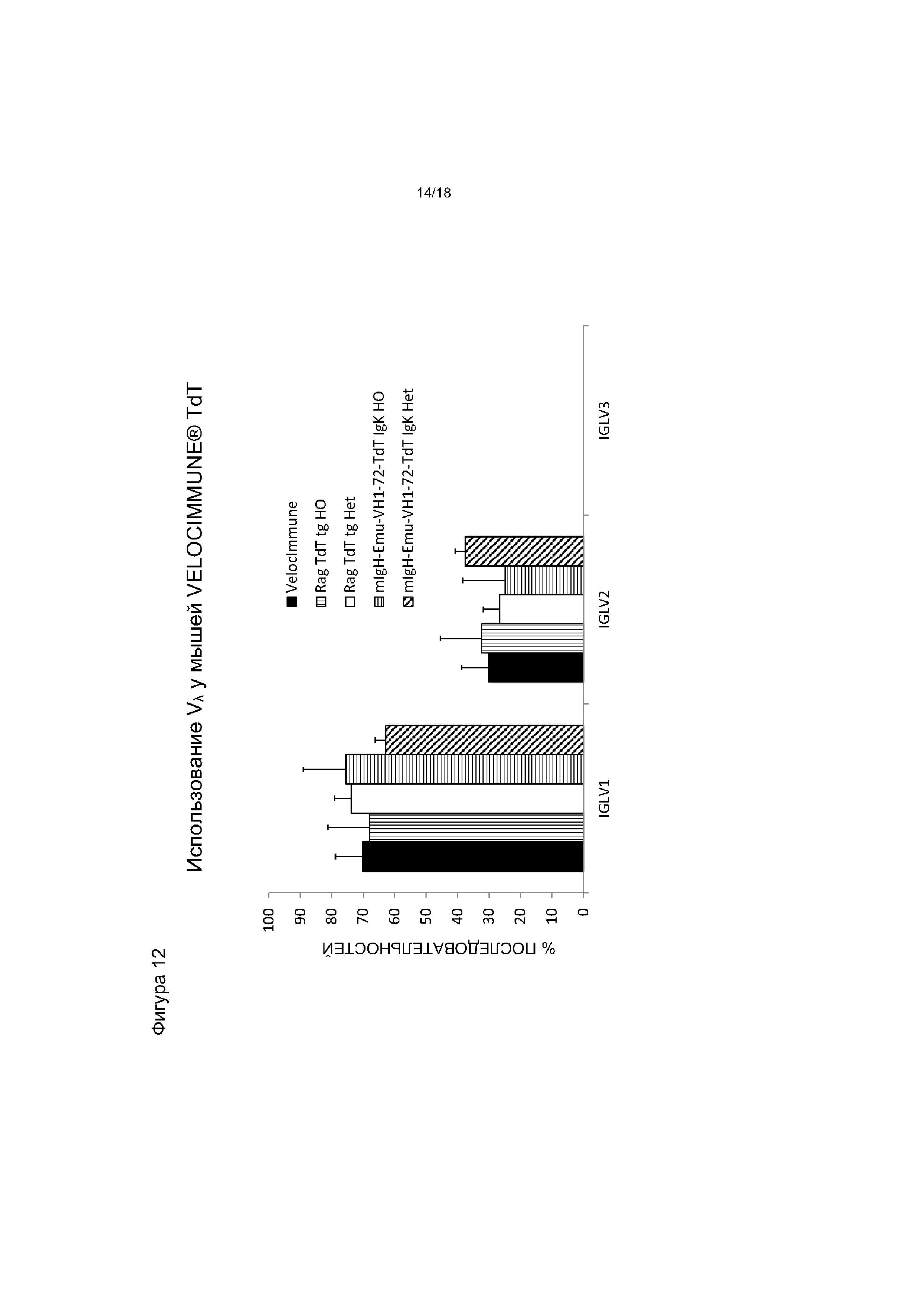
[0019] На фигуре 12 приведен график, на котором показано использование Vλ у мышей VELOCIMMUNE®, экспрессирующих hTdT, по сравнению с контрольными мышами VELOCIMMUNE®. Het обозначает гетерозиготную мышь, HO обозначает гомозиготную мышь.
[0020] На фигуре 13 приведен график, на котором показано разнообразие последовательностей hIgκ (количество уникальных последовательностей легкой CDR3 цепи на каждые 10000 прочтений секвенирования Igκ) у мышей с двойной легкой цепью (DLC; мышей, содержащих два нереаранжированных сегмента гена Vk человека и пять нереаранжированных сегментов гена Jk человека, а также разнообразный репертуар нереаранжированных сегментов генов V, D, и J тяжелой цепи человека), экспрессирующих hTdT (правая панель, гены hTdT представлены в соответствии с указаниями), по сравнению с мышами VELOCIMMUNE®, экспрессирующими hTdT (левая панель, гены hTdT представлены в соответствии с указаниями), и контрольными мышами DLC и VELOCIMMUNE®, не экспрессирующими hTdT. Het обозначает гетерозиготную по hTdT мышь, HO обозначает гомозиготную по hTdT мышь.
[0021] На фигуре 14 приведен график, на котором показано распределение нематричных присоединений hIgκ у мышей, экспрессирующих hTdT, по сравнению с контрольными мышами DLC, не экспрессирующими hTdT (DLC). Het обозначает гетерозиготную по hTdT мышь, HO обозначает гомозиготную по hTdT мышь. «NT» - нуклеотиды.
[0022] На фигуре 15 приведен график, на котором показано распределение длин hIgκ CDR3 у мышей DLC, экспрессирующих hTdT, по сравнению с контрольными мышами DLC, не экспрессирующими hTdT. Het обозначает гетерозиготную по hTdT мышь, HO обозначает гомозиготную по hTdT мышь.
[0023] На фигуре 16 приведены графики, на которых показано использование Vκ и Jκ у мышей DLC, экспрессирующих hTdT, по сравнению с контрольными мышами DLC, не экспрессирующими hTdT. Het обозначает гетерозиготную по hTdT мышь, HO обозначает гомозиготную по hTdT мышь. Использовали только двух разных мышей DLC Rag TdT tg (HO), которые изображены отдельно.
Подробное описание
Общая информация
[0024] В настоящем документе предложены способы и композиции, имеющие отношение к животным, не являющимся человеком, геном которых содержит экзогенную нуклеиновую кислоту, кодирующую TdT (например, TdT человека, мыши или крысы). В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, представляет собой млекопитающее, например, грызуна (например, мышь или крысу). В некоторых вариантах реализации геном животного, не являющегося человеком, содержит дополнительные модификации и поэтому экспрессирует антигенсвязывающие молекулы, содержащие вариабельные домены человека (например, антитела, TCR и/или CAR).
[0025] TdT представляет собой ДНК-полимеразу, катализирующую не зависящее от матрицы присоединение нуклеотидов (N-присоединение) в процессе образования области соединения при рекомбинации V(D)J, которая приводит к увеличению разнообразия рецепторов антигенов в B- и Т-лимфоцитах. В некоторых вариантах реализации настоящего изобретения предложены животные, не являющиеся человеком, экспрессирующие повышенный уровень TdT при развитии В-клеток и/или развитии Т-клеток по сравнению с соответствующими животными, не являющимися человеком (т.е. животными того же вида и линии, не являющимися человеком), геном которых не содержит экзогенной нуклеиновой кислоты, кодирующей TdT. В некоторых вариантах реализации настоящего изобретения предложены животные, не являющиеся человеком, экспрессирующие TdT на стадиях развития В-клеток и/или развития Т-клеток, во время которых соответствующие животные, не являющиеся человеком, геном которых не содержит экзогенной нуклеиновой кислоты, кодирующей TdT, не экспрессируют TdT (например, во время стадии пре-В-клетки). В некоторых вариантах реализации генетически модифицированные животные, не являющиеся человеком, описанные в настоящем документе, характеризуются повышенным разнообразием рецепторов антигенов (например, разнообразием антител, разнообразием TCR и/или разнообразием CAR) по сравнению с соответствующими животными, не являющимися человеком, геном которых не содержит экзогенной нуклеиновой кислоты, кодирующей TdT.
Определения
[0026] Формы единственного числа используются в настоящем документе для обозначения одного или более чем одного (т.е. по меньшей мере одного) грамматического объекта. В качестве примера, «элемент» означает один элемент или более одного элемента.
[0027] Подразумевается, что термин «аминокислота» охватывает все молекулы, природные или синтетические, которые содержат как аминогруппу, так и кислотную группу и могут входить в состав полимера природных аминокислот. Примеры аминокислот включают природные аминокислоты; их аналоги, производные и родственные соединения; аналоги аминокислот с вариантными боковыми цепями; и все стереоизомеры любого из вышеперечисленных соединений.
[0028] В настоящем документе термин «антитело» может относиться как к интактному антителу, так и к его антигенсвязывающему фрагменту. Интактные антитела представляют собой гликопротеины, содержащие по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, связанные друг с другом дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (для которой в настоящем документе используется сокращение VH) и константную область тяжелой цепи. Каждая легкая цепь содержит вариабельную область легкой цепи (для которой в настоящем документе используется сокращение VL) и константную область легкой цепи. Области VH и VL можно дополнительно подразделять на гипервариабельные области, которые называются областями, определяющими комплементарность (CDR), которые чередуются с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от N-конца к С-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Термин «антитело» также включает однодоменные антитела, антитела, содержащие только тяжелую цепь, антитела, содержащие сегменты вариабельного гена легкой цепи в тяжелой цепи, и т.д.
[0029] Термины «антигенсвязывающий фрагмент» и «антигенсвязывающая область» антигенсвязывающей молекулы (например, антитела, Т-клеточного рецептора (TCR), химерного рецептора антигена (CAR)) в настоящем документе относятся к одному или более из фрагментов антигенсвязывающей молекулы, сохраняющих способность связываться с антигеном. Антигенсвязывающий фрагмент может включать любой фрагмент антитела, TCR или CAR, который сохраняет по меньшей мере часть вариабельной области интактной антигенсвязывающей молекулы и способен связываться с антигеном. Примеры связывающих фрагментов, которые охватывает термин «антигенсвязывающий фрагмент», включают Fab, Fab', F(ab')2, Fv, scFv-фрагменты, дисульфид-связанные Fv, Fd, одноцепочечные антитела, растворимый TCR, одноцепочечный TCR, растворимый CAR, одноцепочечный CAR, выделенный CDRH3 (антитела или TCR) и другие антигенсвязывающие фрагменты, сохраняющие по меньшей мере часть вариабельной области интактной антигенсвязывающей молекулы, но не ограничиваются ими. Эти антигенсвязывающие фрагменты можно получить с использованием традиционных рекомбинантных и/или ферментативных методик и подвергать скринингу на предмет связывания антигена аналогично интактным антителам.
[0030] Термин «соответствующий» применительно к животному, не относящемуся к человеку, используется для описания особенностей контрольного животного того же вида, не являющегося человеком, и содержащего те же генетические модификации, что и субъект, не являющийся человеком, за исключением того, что животное-субъект, не являющееся человеком, экспрессирует экзогенную TdT, тогда как соответствующее животное, не являющееся человеком, не экспрессирует экзогенную TdT.
[0031] Термин «химерный рецептор антигена» или «CAR» в настоящем документе относится к антигенсвязывающему белку, содержащему антигенсвязывающий домен иммуноглобулина (например, вариабельный домен иммуноглобулина) и константный домен T-клеточного рецептора (TCR) или его фрагмент. «Константный домен» полипептида TCR в настоящем документе включает константный домен TCR, ближайший к мембране, и, кроме того, может включать трансмембранный домен TCR и/или цитоплазматический фрагмент TCR. Например, в некоторых вариантах реализации CAR представляет собой димер, содержащий первый полипептид, содержащий вариабельный домен тяжелой цепи иммуноглобулина, связанный с константным доменом TCRβ, и второй полипептид, содержащий вариабельный домен легкой цепи иммуноглобулина (например, вариабельный домен κ или λ), связанный с константным доменом TCRα. В некоторых вариантах реализации CAR представляет собой димер, содержащий первый полипептид, содержащий вариабельный домен тяжелой цепи иммуноглобулина, связанный с константным доменом TCRα, и второй полипептид, содержащий вариабельный домен легкой цепи иммуноглобулина (например, вариабельный домен κ или λ), связанный с константным доменом TCRβ.
[0032] Фраза «происходящий от» по отношению к реаранжированному гену вариабельной области или вариабельный домен, «происходящий от» нереаранжированной вариабельной области и/или нереаранжированных сегментов гена вариабельной области, относится к возможности обратного прослеживания последовательности реаранжированного гена вариабельной области или вариабельного домена до набора нереаранжированных сегментов гена вариабельной области, подвергшихся реаранжировке с образованием реаранжированного гена вариабельной области, экспрессирующего вариабельный домен (в соответствующих случаях - с учетом сплайс-различий и соматических мутаций). Например, соматическая мутация, которой подвергся реаранжированный ген вариабельной области, не меняет того факта, что он происходит от нереаранжированных сегментов гена вариабельной области.
[0033] Термин «локус» в настоящем документе относится к области на хромосоме, которая содержит набор связанных генетических элементов (например, генов, сегментов генов, регуляторных элементов). Например, нереаранжированный локус иммуноглобулина может содержать сегменты гена вариабельной области иммуноглобулина, один или более из генов константной области иммуноглобулина и связанные с ними регуляторные элементы (например, промоторы, энхансеры, переключающие элементы и т.д.), контролирующие рекомбинацию V(D)J и экспрессию иммуноглобулина, в то время как нереаранжированный локус TCR может содержать сегменты гена вариабельной области TCR, ген константной области TCR и связанные с ним регуляторные элементы (например, промоторы, энхансеры и т.д.), контролирующие рекомбинацию V(D)J и экспрессию TCR. Аналогичным образом, нереаранжированный локус CAR может содержать сегменты гена вариабельной области иммуноглобулина, ген константной области TCR и связанные с ним регуляторные элементы (например, промоторы, энхансеры и т.д.), контролирующие рекомбинацию V(D)J и экспрессию CAR. Локус может быть эндогенным или неэндогенным. Термин «эндогенный локус» относится к области на хромосоме, в которой конкретный генетический элемент обнаруживается в естественных условиях.
[0034] Нереаранжированные сегменты гена вариабельной области «функционально связаны» с непрерывным геном константной области, если нереаранжированные сегменты гена вариабельной области могут подвергаться реаранжировке с образованием реаранжированного гена вариабельной области, экспрессируемого совместно с геном константной области в виде полипептидной цепи антигенсвязывающего белка.
[0035] Термины «полинуклеотид» и «нуклеиновая кислота» используются на равных основаниях. Они относятся к полимерной форме нуклеотидов любой длины, как дезоксирибонуклеотидов, так и рибонуклеотидов или их аналогов. Полинуклеотиды могут обладать любой трехмерной структурой и выполнять любую функцию. Ниже приведены неограничивающие примеры полинуклеотидов: кодирующие или некодирующие области гена или фрагмента гена, локусы (локус), определенные на основании анализа сцепления, экзоны, интроны, матричная РНК (мРНК), транспортная РНК, рибосомная РНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК любой последовательности, выделенная РНК любой последовательности, нуклеотидные зонды и праймеры. Полинуклеотид может содержать модифицированные нуклеотиды, например, метилированные нуклеотиды, и аналоги нуклеотидов. Модификации структуры нуклеотидов (при их наличии) могут быть внедрены до или после сборки полимера. Полинуклеотид можно дополнительно модифицировать, например, путем конъюгации с меченым компонентом. Во всех последовательностях нуклеиновых кислот, представленных в настоящем документе, U-нуклеотиды взаимозаменяемы с T-нуклеотидами.
[0036] Термин «специфическое связывание» и «антигенная специфичность» в настоящем документе относится к способности антигенсвязывающей молекулы (например, антитела, TCR, CAR) связываться с заранее определенной мишенью, например, заранее определенным антигеном. Как правило, антигенсвязывающая молекула специфически связывается со своей заранее определенной мишенью со сродством, соответствующим значению KD, приблизительно равному 10-7 М или менее, и связывается с заранее определенной мишенью со сродством, соответствующим значению KD, по меньшей мере в 10 раз меньшему, по меньшей мере в 100 раз меньшему или по меньшей мере в 1000 раз меньшему, чем ее KD по отношению к неспецифической мишени (например, БСА, казеину). В некоторых вариантах реализации антигенсвязывающая молекула специфически связывается со своей заранее определённой мишенью со сродством, соответствующим значению KD, приблизительно равному 10-8 М или менее, 10-9 М или менее или 10-10 М или менее.
[0037] Термин «Т-клеточный рецептор» или «TCR» в настоящем документе относится к антигенсвязывающему белку, содержащему как антигенсвязывающий домен TCR (например, вариабельный домен TCR), так и по меньшей мере фрагмент константного домена TCR. «Константный домен» полипептида TCR в настоящем документе содержит константный домен TCR, ближайший к мембране, и, кроме того, может содержать трансмембранный домен TCR и/или цитоплазматический фрагмент TCR. В некоторых вариантах реализации TCR является растворимым TCR и не содержит трансмембранного домена TCR или цитоплазматического фрагмента TCR. Например, в некоторых вариантах реализации TCR представляет собой димер, содержащий первый полипептид, содержащий вариабельный домен TCRβ , связанный с константным доменом TCRβ (или его фрагментом), и второй полипептид, содержащий TCRα, связанный с константным доменом TCRα (или его фрагментом).
[0038] Термин «нереаранжированный» включает состояние локуса вариабельной области иммуноглобулина, TCR или CAR или сегментов гена вариабельной области, где V-сегменты гена и J-сегменты гена (для вариабельных областей тяжелой цепи или TCRβ, а также D-сегменты гена) поддерживаются по отдельности, но могут соединяться с образованием реаранжированного гена V(D)J («гена вариабельной области»), который содержит одиночные V, (D), J или репертуар V(D)J.
Генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки
[0039] В некоторых аспектах настоящего изобретения предложены животные, не являющиеся человеком, и ЭС-клетки, геном которых содержит экзогенную нуклеиновую кислоту, кодирующую TdT (например, TdT человека, мыши или крысы). В некоторых вариантах реализации геном животных, не являющихся человеком, и ЭС-клеток содержит дополнительные модификации, в том числе, например, модификации, которые приводят к экспрессии антигенсвязывающих молекул, содержащих вариабельные домены человека (например, антитела, TCR и/или CAR).
[0040] Генетически модифицированных животных, не являющихся человеком, и ЭС-клетки, предложенные в настоящем документе, можно получить с использованием любого подходящего способа, известного в данной области техники. Например, ЭС-клетки животных, не являющихся человеком, содержащие направленные генетические модификации, можно получить с использованием технологии VELOCIGENE®, описанной в патентах США № 6586251, 6596541, 7105348 и статье Valenzuela et al. (2003) “High-throughput engineering of the mouse genome coupled with high-resolution expression analysis” Nat. Biotech. 21(6): 652-659, а также публикации патента США № US 2014/0310828, каждый из которых включен в настоящий документ посредством ссылки. Направленные модификации также можно выполнить с использованием системы CRISPR/Cas, описанной, например, в патенте США № 9228208 и публикациях патентов США № US 2015-0159174 A1, US 2016-0060657 A1, US 2015-0376650 A1, US 2015-0376651 A1, US 2016-0046960 A1, US 2015-0376628 A1 и US 2016-0115486 A1, каждая из которых включена в настоящий документ посредством ссылки. Направленные модификации также можно выполнить с использованием мегануклеазы, описанной, например, в патентах США № 8703485, 8530214 и 8624000, каждый из которых полностью включен в настоящий документ посредством ссылки. Ненаправленные генетические модификации можно выполнить с использованием стандартных способов, применяемых в данной области техники, в том числе, например, описанных в патентах США № 6150584, 6114598, 5633425, 7501552, 6235883, 6998514 и 5776773, каждый из которых полностью включен в настоящий документ посредством ссылки.
[0041] ЭС-клетки, описанные в настоящем документе, затем можно применять для получения животного, не являющегося человеком, с использованием способов, известных в данной области техники. Например, ЭС-клетки животного, не являющегося человеком (мыши), описанные в настоящем документе, можно применять для получения генетически модифицированных мышей с использованием способа VELOCIMOUSE®, описанного в патенте США № 7294754 и источнике Poueymirou et al., Nature Biotech 25:91-99 (2007), каждый из которых включен в настоящий документ посредством ссылки. ЭС-клетки крысы можно применять для получения модифицированных крыс с использованием способа, описанного, например, в публикации патента США № US 2014/0310828, включенной в настоящий документ посредством ссылки. Полученных мышей или крыс можно скрещивать для получения гомозиготных особей. Несколько отдельных модификаций можно объединить в едином генетически модифицированном организме путем скрещивания животных, модифицированных по отдельности, или путем внесения дополнительных модификаций в уже модифицированную ЭС-клетку (например, с использованием способов, описанных в настоящем документе).
[0042] В некоторых вариантах реализации животное, не являющееся человеком, может представлять собой любое животное, не являющееся человеком. В некоторых вариантах реализации животное, не являющееся человеком, является позвоночным. В некоторых вариантах реализации животное, не являющееся человеком, является млекопитающим. В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, можно выбрать из группы, состоящей из мыши, крысы, кролика, свиньи, крупного рогатого скота (например, коровы, быка, буйвола), оленя, овцы, козы, ламы, курицы, кошки, собаки, хорька, примата (например, мартышки, макака-резуса). Если подходящие генетически модифицируемые ЭС-клетки животных, не являющихся человеком, недоступны, для получения животного, не являющегося человеком, несущего генетические модификации, описанные в настоящем документе, можно использовать другие способы. Такие способы включают, например, модификацию генома клетки, не являющейся ЭС-клеткой (например, фибробласта или индуцированной плюрипотентной клетки), использование переноса ядра для переноса модифицированного генома в подходящую клетку, например, ооцит, и вынашивание модифицированной клетки (например, модифицированного ооцита) в организме животного, не являющегося человеком, в подходящих условиях для образования эмбриона.
[0043] В некоторых вариантах реализации животное, не являющееся человеком, является млекопитающим. В некоторых вариантах реализации животное, не являющееся человеком, представляет собой небольшое млекопитающее, например, относящееся к надсемейству Dipodoidea или Muroidea. В некоторых вариантах реализации животное, не являющееся человеком, является грызуном. В некоторых вариантах реализации указанный грызун является мышью, крысой или хомяком. В некоторых вариантах реализации указанного грызуна выбирают из надсемейства Muroidea. В некоторых вариантах реализации животное, не являющееся человеком, относится к семейству, выбранному из Calomyscidae (например, к мышевидным хомякам), Cricetidae (например, хомякам, хлопковохомяковым, полевкам), Muridae (например, настоящим мышам и крысам, песчанкам, иглистым мышам, косматым хомякам), Nesomyidae (например, лазающим хомякам, скальным мышам, белохвостым хомякам, мадагаскарским хомякам), Platacanthomyidae (например, колючим соневидным хомякам) и Spalacidae (например, кротовым крысам, бамбуковым крысам и цокорам). В некоторых вариантах реализации указанного грызуна выбирают из настоящей мыши или крысы (семейства Muridae), песчанки, иглистой мыши и косматого хомяка. В некоторых вариантах реализации мышь является членом семейства Muridae. В некоторых вариантах реализации животное, не являющееся человеком, является грызуном. В некоторых вариантах реализации указанного грызуна выбирают из мыши и крысы. В некоторых вариантах реализации животное, не являющееся человеком, представляет собой мышь.
[0044] В некоторых вариантах реализации животное, не являющееся человеком, представляет собой мышь линии C57BL. В некоторых вариантах реализации линию C57BL выбирают из C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr и C57BL/Ola. В некоторых вариантах реализации животное, не являющееся человеком, представляет собой мышь линии 129. В некоторых вариантах реализации линию 129 выбирают из группы, состоящей из линии 129P1, 129P2, 129P3, 129X1, 129S1 (например, 129S1/SV, 129S1/SvIm), 129S2, 129S4, 129S5, 129S9/SvEvH, 129S6 (129/SvEvTac), 129S7, 129S8, 129T1, 129T2. В некоторых вариантах реализации генетически модифицированная мышь представляет собой комбинацию линии 129 и линии C57BL. В некоторых вариантах реализации мышь представляет собой комбинацию линий 129 и/или гибрид линий C57BL/6. В некоторых вариантах реализации линия 129 указанной комбинации представляет собой линию 129S6 (129/SvEvTac). В некоторых вариантах реализации мышь представляет собой мышь линии BALB (например, BALB/c). В некоторых вариантах реализации мышь представляет собой комбинацию линии BALB и другой линии (например, линии C57BL и/или линии 129). В некоторых вариантах реализации животные, не являющиеся человеком, предложенные в настоящем изобретении, могут представлять собой мышь, происходящую от любой комбинации вышеупомянутых линий.
[0045] В некоторых вариантах реализации настоящего изобретения предложенное животное, не являющееся человеком, представляет собой крысу. В некоторых вариантах реализации указанную крысу выбирают из крысы Wistar, линии LEA, линии Sprague Dawley, линии Fischer, F344, F6 и Dark Agouti. В некоторых вариантах реализации линия крысы представляет собой смесь двух или более линий, выбранных из группы, состоящей из Wistar, LEA, Sprague Dawley, Fischer, F344, F6 и Dark Agouti.
Животные, не являющиеся человеком, экспрессирующие экзогенную TdT
[0046] В некоторых аспектах настоящего изобретения предложены генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки, зародышевая линия и/или геном которых содержит последовательность нуклеиновой кислоты, кодирующую экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT). Дезоксинуклеотидилтрансфераза (TdT) представляет собой ДНК-полимеразу, которая катализирует независимое от матрицы добавление нуклеотидов (NP-присоединение) в процессе образования соединений при рекомбинации V(D)J, что приводит к увеличению разнообразия рецепторов антигенов у B и Т-лимфоцитов. Термины "добавление, независимое от матрицы", "нематричное присоединение" и "добавление в ДНК, не являющуюся эмбриональной", относятся к присоединению нуклеотидов, катализируемому TdT, и используются в настоящем документе на равных основаниях.
[0047] В некоторых вариантах реализации последовательность экзогенной TdT в геноме генетически модифицированного животного, не являющегося человеком, может быть получена от любого животного, кодирующего TdT или ортолог TdT. В некоторых вариантах реализации TdT представляет собой TdT позвоночного. В некоторых вариантах реализации TdT представляет собой TdT млекопитающего. В некоторых вариантах реализации TdT получена от млекопитающего, выбранного из группы, состоящей из мыши, крысы, кролика, свиньи, крупного рогатого скота (например, коровы, быка, буйвола), оленя, овцы, козы, ламы, курицы, кошки, собаки, хорька, примата (например, мартышки, макака-резуса) или человека. В некоторых вариантах реализации TdT имеет эндогенное происхождение (т.е. последовательность TdT представляет собой последовательность того же вида животных, что и генетически модифицированное животное, не являющееся человеком). В некоторых вариантах реализации TdT представляет собой TdT человека, TdT мыши или TdT крысы. В некоторых вариантах реализации последовательность нуклеиновой кислоты представляет собой геномную последовательность TdT (т.е. включает экзоны и интроны). В некоторых вариантах реализации последовательность нуклеиновой кислоты кодирует мРНК/кДНК TdT (т.е. экзоны одной или более из изоформ TdT).
[0048] TdT человека (hTdT) кодирует ген DNTT, который расположен на 10 хромосоме человека. Типичные последовательности геномной ДНК hTdT находятся в положении 96304328 - 96338564 последовательности с учетным номером NCBI NC_000010.11, включенной в настоящий документ посредством ссылки. Типичная последовательность мРНК изоформ hTdT представлена последовательностями с учетными номерами NCBI NM_001017520.1 и NM_004088.3, каждая из которых включена в настоящий документ посредством ссылки. Белковые последовательности, кодируемые этими изоформами, представлены последовательностями с учетными номерами NCBI NP_001017520.1 и NP_004079.3, соответственно, каждая из которых включена в настоящий документ посредством ссылки. Изоформы TdT включают короткую изоформу (hTdTS) и две длинные изоформы (hTdTL1 и hTdTL2). Последовательности этих трех изоформ представлены, например, в статье Thai and Kearney, Adv. Immunol. 86:113-36 (2005), включенной в настоящий документ посредством ссылки. В некоторых вариантах реализации экзогенная последовательность нуклеиновой кислоты кодирует hTdTS. В некоторых вариантах реализации экзогенная последовательность нуклеиновой кислоты кодирует hTdTL1. В некоторых вариантах реализации экзогенная последовательность нуклеиновой кислоты кодирует hTdTL2. В некоторых вариантах реализации организм, не являющийся человеком, содержит экзогенные последовательности нуклеиновых кислот, кодирующие множественные изоформы (например, как hTdTS, так и hTdTL2). В некоторых вариантах реализации организм, не являющийся человеком, содержит экзогенные последовательности нуклеиновых кислот, кодирующие все три изоформы человека (например, как hTdTS, так и hTdTL2).
[0049] TdT мыши (mTdT) кодирует ген Dntt, который расположен на 19 хромосоме мыши. Типичная последовательность геномной ДНК mTdT находится в положении 41029275-41059525 последовательности с учетным номером NCBI NC_000085.6, включенной в настоящий документ посредством ссылки. Типичные последовательности мРНК изоформ mTdT представлены последовательностями с учетными номерами NCBI NM_001043228.1 и NM_009345.2, каждая из которых включена в настоящий документ посредством ссылки. Белковые последовательности, кодируемые этими изоформами, представлены последовательностями с учетными номерами NCBI NP_001036693.1 и NP_033371.2, соответственно, каждая из которых включена в настоящий документ посредством ссылки.
[0050] TdT крысы (rTdT) кодирует ген Dntt, который расположен на 1 хромосоме крысы. Типичная последовательность геномной ДНК rTdT находится в положении 260289626-260321174 последовательности с учетным номером NCBI NC_005100.4, включенной в настоящий документ посредством ссылки. Типичная последовательность мРНК rTdT представлена последовательностью с учетным номером NCBI NM_001012461.1, включенной в настоящий документ посредством ссылки. Белковая последовательность, кодируемая этой мРНК, представлена последовательностью с учетным номером NCBI NP_001012479.1, включенной в настоящий документ посредством ссылки.
[0051] В некоторых вариантах реализации геном генетически модифицированного животного, не являющегося человеком, содержит множественные копии последовательности нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, содержит 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 копий последовательности нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 копий последовательности нуклеиновой кислоты, кодирующей экзогенную TdT.
[0052] В некоторых вариантах реализации последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально связана с одним или несколькими элементами контроля транскрипции (например, промотором и/или энхансером). В некоторых вариантах реализации элемент контроля транскрипции является конститутивным (т.е. универсальным) промотором. Примеры конститутивных промоторов включают промотор SV40, промотор ЦМВ, промотор аденовируса, промотор EF1, промотор β-актина, промотор EGR1, промотор EIF4A1, промотор FerH, промотор FerL, промотор GAPDH, промотор GRP78, промотор GRP94, промотор HSP70, промотор β-Kin, промотор PGK-1, промотор ROSA и промотор убиквитина B, но не ограничиваются ими. В некоторых вариантах реализации последовательность нуклеиновой кислоты функционально не связана с конститутивным промотором.
[0053] В некоторых вариантах реализации элемент контроля транскрипции индуцирует экспрессию кодируемой TdT во время развития В-клеток. В некоторых вариантах реализации элемент контроля транскрипции индуцирует экспрессию TdT в про-В-клетках и/или в пре-В-клетках. В некоторых вариантах реализации элемент контроля транскрипции представляет собой элемент контроля транскрипции (например, промотор и/или энхансер) гена, экспрессируемого при развитии В-клеток, в про-В-клетках и/или в пре-В-клетках. В некоторых вариантах реализации элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1, элемент контроля транскрипции RAG2, элемент контроля транскрипции тяжелой цепи иммуноглобулина, элемент контроля транскрипции легкой κ-цепи иммуноглобулина и/или элемент контроля транскрипции легкой λ-цепи иммуноглобулина. В некоторых вариантах реализации элемент контроля транскрипции имеет эндогенное происхождение. В некоторых вариантах реализации элемент контроля транскрипции является элементом контроля транскрипции мыши, элементом контроля транскрипции крысы или элементом контроля транскрипции человека. В некоторых вариантах реализации элемент контроля транскрипции представляет собой эндогенный элемент контроля транскрипции (например, последовательность нуклеиновой кислоты, кодирующую экзогенную TdT, вводят в геном животного, не являющегося человеком, в таком положении, что экспрессия экзогенной TdT по меньшей мере частично находится под контролем эндогенного элемента контроля транскрипции).В некоторых вариантах реализации элементы контроля транскрипции могут включать в себя элементы, регулирующие транскрипцию: RAG1, RAG2, λ5 , VpreB, CD34, CD45, AA4.1, CD45R, IL-7R, MHC II класса, CD10, CD19, CD38, CD20, CD40, промоторы и энхансеры V-сегментов различных генов легкой и тяжелой цепи иммуноглобулинов (см., например, список V-сегментов различных генов, перечисленных на веб-сайте International Immunogenetics Information System® - IMGT, imgt.org, например, промотор VH1-72 мыши и т.д.). Элементы контроля транскрипции могут включать элементы, происходящие от последовательностей человека, мыши, крысы или другого вида животных.
[0054] В некоторых вариантах реализации элемент контроля транскрипции индуцирует экспрессию кодируемой TdT во время развития Т-клетки. В некоторых вариантах реализации элемент контроля транскрипции индуцирует экспрессию TdT в двойных отрицательных (DN) CD4/CD8-тимоцитах и/или двойных положительных (DP) CD4/CD8-тимоцитах. В некоторых вариантах реализации элемент контроля транскрипции представляет собой элемент контроля транскрипции (например, промотор и/или энхансер) гена, экспрессируемого при развитии Т-клеток, в DN-тимоцитах и/или в DP-тимоцитах. В некоторых вариантах реализации элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1, элемент контроля транскрипции RAG2, элемент контроля транскрипции TCRα, элемент контроля транскрипции TCRβ, элемент контроля транскрипции TCRγ и/или элемент контроля транскрипции TCRδ. В некоторых вариантах реализации элемент контроля транскрипции имеет эндогенное происхождение. В некоторых вариантах реализации элемент контроля транскрипции является элементом контроля транскрипции мыши, элементом контроля транскрипции крысы или элементом контроля транскрипции человека. В некоторых вариантах реализации элемент контроля транскрипции представляет собой эндогенный элемент контроля транскрипции (например, последовательность нуклеиновой кислоты, кодирующую экзогенную TdT, вводят в геном животного, не являющегося человеком, в таком положении, что экспрессия экзогенной TdT по меньшей мере частично находится под контролем эндогенного элемента контроля транскрипции). В некоторых вариантах реализации элементы контроля транскрипции могут включать в себя элементы, регулирующие транскрипцию: RAG1, RAG2, Lck, ZAP-70, CD34, CD2, HSA, CD44, CD25, PTα, CD4, CD8, CD69, промоторы и энхансеры V-сегментов различных генов TCRα, TCRβ, TCRδ и TCRγ (см., например, список V-сегментов различных генов, перечисленных на веб-сайте International Immunogenetics Information System® - IMGT, imgt.org и т.д.) Элементы контроля транскрипции могут включать элементы, происходящие от последовательностей человека, мыши, крысы или другого вида животных.
[0055] В некоторых вариантах реализации нуклеиновая кислота, кодирующая TdT, расположена в геноме животного, не являющегося человеком, в геномном локусе гена, экспрессируемого при развитии В-клеток, в про-В-клетках и/или в пре-В-клетках, или проксимальнее него (например, в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 т.п.о.). В некоторых вариантах реализации последовательность нуклеиновой кислоты, кодирующая TdT, расположена в локусе легкой κ-цепи иммуноглобулина, локусе легкой λ-цепи иммуноглобулина, локусе тяжелой цепи иммуноглобулина, локусе RAG1 или локусе RAG2 или проксимальнее перечисленных локусов.
[0056] В некоторых вариантах реализации нуклеиновая кислота, кодирующая TdT, расположена в геномном локусе гена животного, не являющегося человеком, экспрессируемого при развитии Т-клеток, в DN-тимоцитах и/или в DP-тимоцитах или проксимальнее него (например, в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 т.п.о.). В некоторых вариантах реализации последовательность нуклеиновой кислоты, кодирующая TdT, расположена в локусе цепи TCRα, локусе цепи TCRβ, локусе цепи TCRγ, локусе цепи TCRδ, локусе RAG1 или локусе RAG2 или проксимальнее этих локусов.
[0057] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной экспрессией TdT в течение одной или нескольких стадий развития Т-клеток и/или В-клеток (например, в про-В-клетках, в пре-В-клетках, в DN-тимоцитах и/или в DP-тимоцитах) по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации генетически модифицированные животные, не являющиеся человеком, предложенные в настоящем изобретении, экспрессируют по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% 150%, 200%, 250%, 300%, 350%, 400%, 450% или на 500% больше TdT на одной или нескольких стадиях развития Т-клеток и/или В-клеток, чем соответствующее животное, не являющееся человеком.
[0058] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-J-соединений κ-цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижен по сравнению с долей V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений κ-цепи иммуноглобулина у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 κ-цепи иммуноглобулина по сравнению с соответствующим животным, не являющимся человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, несет по меньшей мере 900, 1000, 1100, 1200, 1300, 1400, 1500 или 1700 уникальных последовательностей CDR3 κ-цепи иммуноглобулина на 10000 последовательностей CDR3 κ-цепи иммуноглобулина.
[0059] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-J-соединений λ-цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижен по сравнению с долей V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений λ-цепи иммуноглобулина у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 λ-цепи иммуноглобулина по сравнению с соответствующим животным, не являющимся человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, несет по меньшей мере 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290 или 300 уникальных последовательностей CDR3 λ-цепи иммуноглобулина на 10000 последовательностей CDR3 λ-цепи иммуноглобулина.
[0060] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений тяжелой цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений тяжелой цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-D-соединений тяжелой цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений тяжелой цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-D-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-D-соединений тяжелой цепи иммуноглобулина у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 тяжелой цепи иммуноглобулина по сравнению с соответствующим животным, не являющимся человеком.
[0061] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений тяжелой цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений тяжелой цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей D-J-соединений тяжелой цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений тяжелой цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% D-J-соединений тяжелой цепи иммуноглобулина у животного содержат нематричные присоединения.
[0062] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRα, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRα, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-J-соединений цепи TCRα, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRα, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-J-соединений цепи TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRα, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRα, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRα, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRα, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRα, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRα, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRα, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRα, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений цепи TCRα у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 TCRα по сравнению с соответствующим животным, не являющимся человеком.
[0063] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRβ, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRβ, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-D-соединений цепи TCRβ, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRβ, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-D-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRβ, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRβ, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRβ, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRβ, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRβ, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRβ, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRβ, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRβ, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-D-соединений цепи TCRβ у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 цепи TCRβ по сравнению с соответствующим животным, не являющимся человеком.
[0064] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRβ, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRβ, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей D-J-соединений цепи TCRβ, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRβ, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей D-J-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRβ, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRβ, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRβ, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRβ, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRβ, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRβ, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRβ, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRβ, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% D-J-соединений цепи TCRβ у животного содержат нематричные присоединения.
[0065] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRγ, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRγ, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-J-соединений цепи TCRγ, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRγ, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-J-соединений цепи TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRγ, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRγ, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRγ, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRγ, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRγ, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRγ, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений цепи TCRγ, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений цепи TCRγ, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений цепи TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений цепи TCRγ у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 цепи TCRγ по сравнению с соответствующим животным, не являющимся человеком.
[0066] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRδ, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRδ, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-D-соединений цепи TCRδ, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRδ, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-D-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRδ, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRδ, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRδ, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRδ, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRδ, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRδ, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D-соединений цепи TCRδ, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D-соединений цепи TCRδ, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-D-соединений цепи TCRδ у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 цепи TCRδ по сравнению с соответствующим животным, не являющимся человеком.
[0067] В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRδ, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRδ, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей D-J-соединений цепи TCRδ, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRδ, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей D-J-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRδ, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRδ, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRδ, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRδ, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRδ, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRδ, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей D-J-соединений цепи TCRδ, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля D-J-соединений цепи TCRδ, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю D-J-соединений цепи TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% D-J-соединений цепи TCRδ у животного содержат нематричные присоединения.
[0068] В некоторых вариантах реализации эндогенные локусы TdT в организме, не являющемся человеком, являются интактными. В некоторых вариантах реализации эндогенные локусы TdT инактивированы. Например, в некоторых вариантах реализации эндогенные локусы TdT полностью или частично удалены таким образом, что организм, не являющийся человеком, не экспрессирует эндогенную TdT.
Животные, не являющиеся человеком, экспрессирующие антитела с вариабельными доменами человека и экзогенную TdT
[0069] В некоторых вариантах реализации зародышевая линия и/или геном генетически модифицированных животных, не являющихся человеком, и ЭС-клеток животных, не являющихся человеком, содержащих экзогенную TdT, описанных в настоящем документе, также содержит локус иммуноглобулина (экзогенный или эндогенный), содержащий вариабельную область иммуноглобулина, содержащую нереаранжированные сегменты гена вариабельной области иммуноглобулина человека и константную область иммуноглобулина, содержащую ген константной области иммуноглобулина, в котором нереаранжированные сегменты гена вариабельной области иммуноглобулина человека функционально связаны с геном константной области иммуноглобулина. В некоторых вариантах реализации зародышевая линия и/или геном животных, не являющихся человеком, и ЭС-клеток животных, не являющихся человеком, содержит несколько таких локусов иммуноглобулина. Например, в некоторых вариантах реализации зародышевая линия и/или геном генетически модифицированных животных, не являющихся человеком, и ЭС-клеток животных, не являющихся человеком, содержит по меньшей мере один локус иммуноглобулина, содержащий нереаранжированные сегменты гена вариабельной области тяжелой цепи человека, и по меньшей мере один локус иммуноглобулина, содержащий нереаранжированные сегменты гена вариабельной области легкой цепи человека (например, сегменты гена κ-цепи и/или сегменты гена λ-цепи). В некоторых вариантах реализации зародышевая линия и/или геном генетически модифицированных животных, не являющихся человеком, и ЭС-клеток животных, не являющихся человеком, содержит по меньшей мере один локус иммуноглобулина, содержащий нереаранжированные сегменты гена вариабельной области тяжелой цепи человека, по меньшей мере один локус иммуноглобулина, содержащий нереаранжированные сегменты гена вариабельной области κ-цепи человека и по меньшей мере один локус иммуноглобулина, содержащий нереаранжированные сегменты гена вариабельной области λ-цепи человека. В некоторых вариантах реализации зародышевая линия и/или геном генетически модифицированных животных, не являющихся человеком, например, генетически модифицированных мышей или крыс, содержит генетически модифицированные локусы иммуноглобулина (генетически модифицированные реаранжированные или нереаранжированные локусы иммуноглобулина), так что указанные мыши продуцируют антитела человека, гуманизированные, частично человеческие, обратные химерные (содержащие вариабельные области человека и константные области животного, не являющегося человеком) антитела.
[0070] Локусы иммуноглобулина, содержащие сегменты гена вариабельной области человека, известны в данной области техники и описаны, например, в патентах США № 5633425, 5770429, 5814318, 6075181, 6114498, 6150584, 6998514, 7795494, 7910798, 8232329, 8502018, 8697940, 8703485, 8754287, 8791323, 8907157, 9035128, 9145858 и 9206263, каждый из которых полностью включен в настоящий документ посредством ссылки, а также в публикациях патентов США № 2008/0098490, 2010/0146647, 2011/0195454, 2012/0167237, 2013/0145484, 2013/0167256, 2013/0219535, 2013/0326647, 2013/0096287, 2014/013275, 2014/093908 и 2015/0113668, каждая из которых полностью включена в настоящий документ посредством ссылки, и в публикациях PCT № WO2007117410, WO2008151081, WO2009157771, WO2010039900, WO2011004192, WO2011123708 и WO2014093908, каждая из которых полностью включена в настоящий документ посредством ссылки.
[0071] В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена тяжелой цепи, а ген константной области иммуноглобулина представляет собой ген константной области тяжелой цепи. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена легкой цепи, например, κ-цепи, а ген константной области иммуноглобулина представляет собой ген константной области тяжелой цепи.
[0072] В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена тяжелой цепи, а ген константной области иммуноглобулина представляет собой ген константной области κ-цепи. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена κ-цепи, а ген константной области иммуноглобулина представляет собой ген константной области κ-цепи. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена λ-цепи, а ген константной области иммуноглобулина представляет собой ген константной области κ-цепи. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена λ-цепи, а ген константной области иммуноглобулина представляет собой ген константной области λ-цепи.
[0073] В некоторых вариантах реализации вариабельная область иммуноглобулина содержит нереаранжированные сегменты гена вариабельной области тяжелой цепи Ig человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области Ig человека включают множество сегментов VHчеловека, один или более из сегментов DH человека и один или более из сегментов JH человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области Ig человека включают по меньшей мере 3 сегмента гена VH, по меньшей мере 18 сегментов гена VH, по меньшей мере 20 сегментов гена VH, по меньшей мере 30 сегментов гена VH, по меньшей мере 40 сегментов гена VH, по меньшей мере 50 сегментов гена VH, по меньшей мере 60 сегментов гена VH, по меньшей мере 70 сегментов гена VHили по меньшей мере 80 сегментов гена VH. В некоторых вариантах реализации нереаранжированные сегменты гена Ig человека включают все сегменты гена DH человека. В некоторых вариантах реализации нереаранжированные сегменты гена Ig человека включают все сегменты гена JH человека. Типичные вариабельные области, содержащие сегменты гена тяжелой цепи Ig, представлены, например, в статье Macdonald et al., Proc. Natl. Acad. Sci. USA 111:5147-52 и дополнительной информации, включенной в настоящий документ посредством ссылки. В некоторых вариантах реализации настоящего изобретения предложенные животные, не являющиеся человеком, несут укороченный локус тяжелой цепи иммуноглобулина, характеризующийся одним полиморфным сегментом гена VHчеловека, множеством сегментов гена DH и множеством сегментов гена JH (например, как описано в публикации патента США № 2013/0096287, включенной в настоящий документ посредством ссылки). В некоторых вариантах реализации сегмент гена VH представляет собой VH1-2 или VH1-69.
[0074] В различных вариантах реализации описанные в настоящем документе модификации локуса иммуноглобулина не влияют на репродуктивную способность животного, не являющегося человеком. В некоторых вариантах реализации локус тяжелой цепи содержит эндогенный ген Adam6a и/или ген Adam6b, и генетическая модификация не влияет на экспрессию и/или функцию эндогенного гена Adam6a и/или гена Adam6b. В некоторых вариантах реализации геном генетически модифицированного животного, не являющегося человеком, содержит эктопически расположенный ген Adam6a и/или ген Adam6b. Типичные животные, не являющиеся человеком, экспрессирующие экзогенный Adam6a и/или Adam6b, описаны в патентах США № 8642835 и 8697940, каждый из которых полностью включен в настоящий документ посредством ссылки.
[0075] В некоторых вариантах реализации сегменты гена вариабельной области тяжелой цепи иммуноглобулина человека подвергаются реаранжировке во время развития В-клеток с образованием реаранжированных генов вариабельной области тяжелой цепи человека в В-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-D-соединений тяжелой цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 тяжелой цепи иммуноглобулина по сравнению с соответствующим животным, не являющимся человеком.
[0076] В некоторых вариантах реализации вариабельная область иммуноглобулина содержит нереаранжированные сегменты гена вариабельной области κ-цепи Ig человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают множество сегментов Vκчеловека и один или более из сегментов Jκ человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают все сегменты Jκ человека. В некоторых вариантах реализации сегменты гена вариабельной области иммуноглобулина включают четыре функциональных сегмента Vκ и все сегменты Jκ человека. В некоторых вариантах реализации сегменты гена вариабельной области иммуноглобулина включают 16 функциональных сегментов Vκ и все сегменты Jκ человека (например, все функциональные сегменты Vκ и сегменты Jκчеловека). В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают все сегменты Vκ человека и все сегменты Jκ человека. Типичные вариабельные области, содержащие сегменты гена κ Ig, представлены, например, в статье Macdonald et al., Proc. Natl. Acad. Sci. USA 111:5147-52 и дополнительной информации, включенной в настоящий документ посредством ссылки. В некоторых вариантах реализации настоящего изобретения предложенные животные, не являющиеся человеком, содержат укороченный локус легкой цепи иммуноглобулина, характеризующийся не более чем двумя сегментами гена VL человека и множеством сегментов гена JL(например, мыши с двойной легкой цепью или DLC, описанные в публикации патента США № 2013/0198880, включенной в настоящий документ посредством ссылки). В некоторых вариантах реализации сегменты гена VLпредставляют собой сегменты гена Vκ. В некоторых вариантах реализации сегменты гена VLпредставляют собой сегменты гена Vλ. В некоторых вариантах реализации сегменты гена Vκ представляют собой IGKV3-20 и IGKV1-39.
[0077] В некоторых вариантах реализации сегменты гена вариабельной области κ-цепи иммуноглобулина человека подвергаются реаранжировке во время развития В-клеток с образованием реаранжированных генов вариабельной области κ-цепи человека в В-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-J-соединений κ-цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижен по сравнению с долей V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений κ-цепи иммуноглобулина у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 κ-цепи иммуноглобулина по сравнению с соответствующим животным, не являющимся человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, несет по меньшей мере 900, 1000, 1100, 1200, 1300, 1400, 1500 или 1700 уникальных последовательностей CDR3 κ-цепи иммуноглобулина на 10000 последовательностей CDR3 κ-цепи иммуноглобулина.
[0078] В некоторых вариантах реализации вариабельная область иммуноглобулина содержит нереаранжированные сегменты гена вариабельной области λ-цепи Ig человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают множество сегментов Vλчеловека и один или более из сегментов Jλ человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают все сегменты Jλ человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают все сегменты Jλ человека. Типичные вариабельные области, содержащие сегменты гена λ Ig, представлены, например, в публикациях патентов США № 2012/0073004 и 2002/0088016, каждая из которых включена в настоящий документ посредством ссылки.
[0079] В некоторых вариантах реализации сегменты гена вариабельной области λ-цепи иммуноглобулина человека подвергаются реаранжировке во время развития В-клеток с образованием реаранжированных генов вариабельной области λ-цепи человека в В-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-J-соединений λ-цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижен по сравнению с долей V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений λ-цепи иммуноглобулина у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 λ-цепи иммуноглобулина по сравнению с соответствующим животным, не являющимся человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, несет по меньшей мере 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290 или 300 уникальных последовательностей CDR3 λ-цепи иммуноглобулина на 10000 последовательностей CDR3 λ-цепи иммуноглобулина.
[0080] В некоторых вариантах реализации вариабельная область иммуноглобулина, содержащая нереаранжированные сегменты гена вариабельной области иммуноглобулина человека, также включает межгенные последовательности вариабельной области иммуноглобулина человека. В некоторых вариантах реализации вариабельная область иммуноглобулина включает межгенные последовательности вариабельной области Ig животного, не являющегося человеком (например, грызуна, крысы, мыши). В некоторых вариантах реализации межгенная последовательность имеет эндогенное происхождение.
[0081] В некоторых вариантах реализации зародышевая линия и/или геном организма, не являющегося человеком, содержит локус иммуноглобулина, содержащий реаранжированную вариабельную область тяжелой цепи (универсальную вариабельную область тяжелой цепи). В некоторых вариантах реализации реаранжированный ген вариабельной области тяжелой цепи Ig представляет собой реаранжированный ген вариабельной области тяжелой цепи Ig человека. Типичные реаранжированные вариабельные области тяжелой цепи Ig предложены в публикации патента США № 2014/0245468, включенной в настоящий документ посредством ссылки. В некоторых вариантах реализации организм, не являющийся человеком, содержащий универсальную вариабельную область тяжелой цепи, применяют для получения биспецифических антител.
[0082] В некоторых вариантах реализации зародышевая линия и/или геном организма, не являющегося человеком, содержит локус иммуноглобулина, содержащий реаранжированную вариабельную область легкой цепи (универсальную вариабельную область легкой цепи). В некоторых вариантах реализации реаранжированный ген вариабельной области легкой цепи Ig представляет собой реаранжированный ген вариабельной области легкой цепи Ig человека. Типичные реаранжированные вариабельные области легкой цепи Ig предложены, например, в публикациях патентов США № 2011/0195454, 2012/0021409, 2012/0192300, 2013/0045492, 2013/0185821, 2013/0302836, 2015/0313193, 2015/0059009 и 2013/0198879, включенных в настоящий документ посредством ссылки. В некоторых вариантах реализации организм, не являющийся человеком, содержащий универсальную вариабельную область легкой цепи (организм с "универсальной легкой цепью"), применяют для получения биспецифических антител.
[0083] В некоторых вариантах реализации зародышевая линия и/или геном организма, не являющегося человеком, содержит локус легкой цепи иммуноглобулина, содержащий ограниченный репертуар сегментов гена вариабельной области легкой цепи (например, двойную вариабельную область легкой цепи, содержащую два сегмента гена вариабельной области легкой цепи). В некоторых вариантах реализации сегменты гена вариабельной области легкой цепи в ограниченном репертуаре сегментов гена легкой цепи представляют собой сегменты гена легкой цепи человека. Типичные двойные вариабельные области легкой цепи предложены в публикации патента США № 2013/0198880, включенной в настоящий документ посредством ссылки. В некоторых вариантах реализации организм, не являющийся человеком, содержащий двойную вариабельную область легкой цепи, применяют для получения биспецифических антител.
[0084] В других вариантах реализации зародышевая линия и/или геном организма, не являющегося человеком, может содержать локус легкой цепи и/или тяжелой цепи иммуноглобулина, содержащий инсерции и/или замены кодонов гистидина, предназначенные для придания свойств рН-зависимого связывания с антителами, образующимися в таком организме, не являющемся человеком. В некоторых из таких вариантов реализации указанные инсерции и/или замены кодонов гистидина выполняют в нуклеотидных последовательностях, кодирующих CDR3. Такие различные локусы легких и/или тяжелых цепей иммуноглобулина предложены в патентах США № 9301510, 9334334, публикациях заявок на патенты США № 2013/0247236, 20140013456, включенных в настоящий документ посредством ссылок.
[0085] В некоторых вариантах реализации константная область иммуноглобулина содержит ген константной области тяжелой цепи. В некоторых вариантах реализации ген константной области тяжелой цепи представляет собой ген константной области тяжелой цепи человека. В некоторых вариантах реализации ген константной области тяжелой цепи имеет эндогенное происхождение. В некоторых вариантах реализации ген константной области тяжелой цепи представляет собой ген константной области мыши или ген константной области крысы. В некоторых вариантах реализации ген константной области представляет собой смесь последовательностей человека и животного, не являющегося человеком. Например, в некоторых вариантах реализации ген константной области кодирует область CH1 человека и область CH2 и/или CH3 животного, не являющегося человеком (например, имеющую эндогенное происхождение, мыши, крысы). В некоторых вариантах реализации ген константной области тяжелой цепи представляет собой ген константной области Cμ, Cδ, Cγ (Cγ1, Cγ2, Cγ3, Cγ4), Cα или Cε. В некоторых вариантах реализации ген константной области представляет собой эндогенный ген константной области. В некоторых вариантах реализации ген константной области кодирует мутированную область CH1, так что животное, не являющееся человеком, экспрессирует антитела, содержащие только тяжелую цепь (см., например, патент США № 8754287, публикацию заявки на патент США № 2015/0289489, включенные в настоящем документе посредством ссылки). В некоторых вариантах реализации, например, если целью является получение тяжелых цепей для изготовления биспецифических антител (например, в организмах с универсальной или двойной легкой цепью), Fc-домены тяжелых цепей содержат модификации для облегчения образования гетеродимеров тяжелой цепи и/или для ингибирования образования гомодимеров тяжелой цепи. Такие модификации предусмотрены, например, в патентах США № 5731168, 5807706, 5821333, 7642228 и 8679785 и в публикации патента США № 2013/0195849, каждый из которых включен в настоящий документ посредством ссылки.
[0086] В некоторых вариантах реализации константная область иммуноглобулина содержит ген константной области легкой цепи. В некоторых вариантах реализации ген константной области легкой цепи представляет собой ген константной области κ-цепи. В некоторых вариантах реализации ген константной области легкой цепи представляет собой ген константной области λ-цепи. В некоторых вариантах реализации ген константной области легкой цепи имеет эндогенное происхождение. В некоторых вариантах реализации ген константной области легкой цепи представляет собой ген константной области мыши или ген константной области крысы. В некоторых вариантах реализации ген константной области легкой цепи представляет собой смесь последовательностей человека и животного, не являющегося человеком.
[0087] В некоторых вариантах реализации вариабельная область иммуноглобулина, содержащая сегменты гена вариабельной области человека и ген константной области иммуноглобулина, с которым функционально связаны сегменты гена вариабельной области, расположены в эндогенном локусе иммуноглобулина. В некоторых вариантах реализации эндогенный локус иммуноглобулина представляет собой эндогенный локус тяжелой цепи. В некоторых вариантах реализации эндогенный локус иммуноглобулина представляет собой эндогенный локус κ-цепи. В некоторых вариантах реализации эндогенный локус иммуноглобулина представляет собой эндогенный локус λ-цепи. В некоторых вариантах реализации ген константной области, с которым функционально связаны сегменты гена вариабельной области человека, представляет собой эндогенный ген константной области.
[0088] В некоторых вариантах реализации один или более из эндогенных локусов иммуноглобулина или фрагмент одного или более из эндогенных локусов (например, вариабельной области и/или константной области) в геноме животного, не являющегося человеком, предложенного в настоящем изобретении, инактивирован. Эндогенные локусы генов вариабельной области иммуноглобулинов и их фрагменты можно инактивировать с применением любого способа, известного в данной области техники, включая делецию локуса или его фрагмента из генома организма, замену локуса или его фрагмента другой последовательностью нуклеиновой кислоты, инверсию фрагмента локуса и/или смещение фрагмента локуса в другое положение в геноме организма, не являющегося человеком, но не ограничиваясь ими. В некоторых вариантах реализации инактивация локуса является лишь частичной инактивацией. В некоторых вариантах реализации вариабельная область локуса инактивирована, однако константная область остается функциональной (например, поскольку она функционально связана с неэндогенными сегментами гена вариабельной области).
[0089] В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, содержит инактивированный эндогенный локус тяжелой цепи иммуноглобулина. В некоторых вариантах реализации эндогенный локус тяжелой цепи иммуноглобулина или его фрагмент инактивируют путем делеции, замены, смещения и/или инверсии по меньшей мере фрагмента эндогенной вариабельной области эндогенного локуса тяжелой цепи. В некоторых вариантах реализации удаленный, замещенный, смещенный и/или инвертированный по меньшей мере фрагмент вариабельной области эндогенного локуса тяжелой цепи содержит J-сегменты вариабельной области. В некоторых вариантах реализации эндогенный локус тяжелой цепи иммуноглобулина или его фрагмент инактивируют путем делеции, замены, смещения и/или инверсии по меньшей мере фрагмента эндогенной константной области эндогенного локуса тяжелой цепи. В некоторых вариантах реализации удаленный, замещенный, смещенный и/или инвертированный по меньшей мере фрагмент константной области эндогенного локуса тяжелой цепи содержит ген Cμ эндогенной константной области.
[0090] В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, содержит инактивированный эндогенный локус κ-цепи иммуноглобулина. В некоторых вариантах реализации эндогенный локус κ-цепи иммуноглобулина или его фрагмент инактивируют путем делеции, замены, смещения и/или инверсии по меньшей мере фрагмента эндогенной вариабельной области эндогенного локуса κ-цепи. В некоторых вариантах реализации удаленный, замещенный, смещенный и/или инвертированный по меньшей мере фрагмент вариабельной области эндогенного локуса κ-цепи содержит J-сегменты вариабельной области. В некоторых вариантах реализации эндогенный локус κ-цепи иммуноглобулина или его фрагмент инактивируют путем делеции, замены, смещения и/или инверсии по меньшей мере фрагмента эндогенной константной области эндогенного локуса κ-цепи. В некоторых вариантах реализации удаленный, замещенный, смещенный и/или инвертированный по меньшей мере фрагмент константной области эндогенного локуса κ-цепи содержит ген Cκ эндогенной константной области.
[0091] В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, содержит инактивированный эндогенный локус λ-цепи иммуноглобулина. В некоторых вариантах реализации эндогенный локус λ-цепи иммуноглобулина или его фрагмент инактивируют путем делеции, замены, смещения и/или инверсии по меньшей мере фрагмента эндогенной вариабельной области эндогенного локуса λ-цепи. В некоторых вариантах реализации по меньшей мере фрагмент по меньшей мере одного кластера V-J-C генов эндогенного локуса λ-цепи удаляют, заменяют, смещают и/или инвертируют. В некоторых вариантах реализации эндогенный локус λ-цепи иммуноглобулина или его фрагмент инактивируют путем делеции, замены, смещения и/или инверсии по меньшей мере фрагмента эндогенной константной области эндогенного локуса λ-цепи. В некоторых вариантах реализации удаленный, замещенный, смещенный и/или инвертированный по меньшей мере фрагмент константной области эндогенного локуса λ-цепи содержит ген Cλ эндогенной константной области.
[0092] В некоторых вариантах реализации настоящего изобретения предложенное генетически модифицированное животное, не являющееся человеком, экспрессирует антитела, содержащие вариабельные домены человека (например, вариабельный домен человека, происходящий от нереаранжированных сегментов гена вариабельной области человека, описанных в настоящем документе). В некоторых вариантах реализации вариабельный домен человека представляет собой вариабельный домен тяжелой цепи человека. В некоторых вариантах реализации антитела представляют собой антитела, содержащие только тяжелую цепь. В некоторых вариантах реализации вариабельный домен человека представляет собой вариабельный домен легкой цепи человека. В некоторых вариантах реализации антитела, продуцируемые животными, не являющимися человеком, содержат как вариабельные домены тяжелой цепи человека, так и вариабельные домены легкой цепи человека. В некоторых вариантах реализации указанные антитела содержат константные домены тяжелой цепи человека. В некоторых вариантах реализации указанные антитела содержат константные домены легкой цепи человека. В некоторых вариантах реализации константный домен тяжелой и/или легкой цепи имеет нечеловеческое происхождение. Например, в некоторых вариантах реализации константный домен тяжелой цепи имеет эндогенное происхождение. В некоторых вариантах реализации константный домен тяжелой цепи происходит от последовательности мыши или крысы. В некоторых вариантах реализации константный домен легкой цепи имеет эндогенное происхождение. В некоторых вариантах реализации константный домен легкой цепи происходит от последовательности крысы или мыши.
Животные, не являющиеся человеком, экспрессирующие Т-клеточные рецепторы с вариабельными доменами человека и экзогенную TdT
[0093] В некоторых вариантах реализации зародышевая линия и/или геном генетически модифицированных животных, не являющихся человеком, и ЭС-клеток животных, не являющихся человеком, содержащих экзогенную TdT, описанных в настоящем документе, также содержит локус TCR (экзогенный или эндогенный), содержащий вариабельную область TCR, содержащую нереаранжированные сегменты гена вариабельной области TCR человека и константную область TCR, содержащую ген константной области TCR, в котором нереаранжированные сегменты гена вариабельной области TCR человека функционально связаны с геном константной области TCR. В некоторых вариантах реализации зародышевая линия и/или геном различных генетически модифицированных животных, не являющихся человеком, например, генетически модифицированных мышей, содержит генетически модифицированные локусы Т-клеточного рецептора (генетически модифицированные локусы TCRα, β, γ и/или δ), так что указанные мыши экспрессируют Т-клеточные рецепторы человека, гуманизированные, частично человеческие, обратные химерные (содержащие вариабельные области человека и константные области животного, не являющегося человеком) Т-клеточные рецепторы. В одном варианте реализации типичное животное, не являющееся человеком, предложено в патенте США № 9113616 и в международной публикации № WO 2016/164492, включенной в настоящий документ посредством ссылки.
[0094] В некоторых вариантах реализации ген константной области TCR представляет собой ген константной области TCR животного, не являющегося человеком. В некоторых вариантах реализации ген константной области TCR представляет собой ген константной области грызуна, например, ген константной области крысы или ген константной области мыши. В некоторых вариантах реализации ген константной области имеет эндогенное происхождение. В некоторых вариантах реализации ген константной области TCR представляет собой ген константной области человека.
[0095] В некоторых вариантах реализации зародышевая линия и/или геном животных, не являющихся человеком, и ЭС-клеток животных, не являющихся человеком, содержит несколько таких локусов TCR. Например, в некоторых вариантах реализации зародышевая линия и/или геном генетически модифицированных животных, не являющихся человеком, и ЭС-клеток животных, не являющихся человеком, содержит по меньшей мере один локус TCR, содержащий нереаранжированные сегменты гена вариабельной области TCRα, и по меньшей мере один локус TCR, содержащий нереаранжированные сегменты гена вариабельной области TCRβ. В некоторых вариантах реализации зародышевая линия и/или геном генетически модифицированных животных, не являющихся человеком, и ЭС-клеток животных, не являющихся человеком, содержит по меньшей мере один локус TCR, содержащий нереаранжированные сегменты гена вариабельной области TCRγ человека, и по меньшей мере один локус TCR, содержащий нереаранжированные сегменты гена вариабельной области TCRδ человека.
[0096] В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области TCR человека представляют собой сегменты гена TCRα, а ген константной области TCR представляет собой ген константной области TCRα. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области TCR человека представляют собой сегменты гена цепи TCRβ, а ген константной области TCR представляет собой ген константной области TCRβ. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области TCR человека представляют собой сегменты гена цепи TCRγ, а ген константной области TCR представляет собой ген константной области TCRγ. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области TCR человека представляют собой сегменты гена цепи TCRδ, а ген константной области TCR представляет собой ген константной области TCRδ. Типичные вариабельные области, содержащие сегменты гена TCR человека, предложены, например, в патенте США № 9113616 и источнике Li et al., Nature Medicine 16:1029-1035 (2010), каждый из которых включен в настоящий документ посредством ссылки.
[0097] В некоторых вариантах реализации вариабельная область TCR содержит нереаранжированные сегменты гена вариабельной области TCRβ человека. В некоторых вариантах реализации сегменты гена вариабельной области TCRβ человека подвергаются реаранжировке во время развития Т-клеток с образованием реаранжированных генов вариабельной области TCRβ человека в Т-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRβ, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRβ, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-D-соединений TCRβ, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRβ, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-D- и/или D-J-соединений TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRβ, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRβ, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRβ, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRβ, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRβ, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRβ, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRβ, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRβ, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRβ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-D- и/или D-J-соединений TCRβ у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 цепи TCRβ по сравнению с соответствующим животным, не являющимся человеком.
[0098] В некоторых вариантах реализации вариабельная область TCR содержит нереаранжированные сегменты гена вариабельной области TCRα человека. В некоторых вариантах реализации сегменты гена вариабельной области TCRα человека подвергаются реаранжировке во время развития Т-клеток с образованием реаранжированных генов вариабельной области TCRα человека в Т-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRα, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRα, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-D-соединений TCRα, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRα, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-J-соединений TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRα, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRα, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRα, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRα, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRα, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRα, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRα, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRα, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRα у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений TCRα у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 TCRα по сравнению с соответствующим животным, не являющимся человеком.
[0099] В некоторых вариантах реализации вариабельная область TCR содержит нереаранжированные сегменты гена вариабельной области TCRδ человека. В некоторых вариантах реализации сегменты гена вариабельной области TCRδ человека подвергаются реаранжировке во время развития Т-клеток с образованием реаранжированных генов вариабельной области TCRδ человека в Т-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRδ, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRδ, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-D-соединений TCRδ, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRδ, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-D- и/или D-J-соединений TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRδ, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRδ, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRδ, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRδ, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRδ, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRδ, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений TCRδ, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений TCRδ, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений TCRδ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-D- и/или D-J-соединений TCRδ у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 цепи TCRδ по сравнению с соответствующим животным, не являющимся человеком.
[0100] В некоторых вариантах реализации вариабельная область TCR содержит нереаранжированные сегменты гена вариабельной области TCRγ человека. В некоторых вариантах реализации сегменты гена вариабельной области TCRγ человека подвергаются реаранжировке во время развития Т-клеток с образованием реаранжированных генов вариабельной области TCRγ человека в Т-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRγ, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRγ, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-D-соединений TCRγ, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRγ, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-J-соединений TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRγ, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRγ, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRγ, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRγ, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRγ, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRγ, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений TCRγ, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений TCRγ, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений TCRγ у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 2, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений TCRγ у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 цепи TCRγ по сравнению с соответствующим животным, не являющимся человеком.
[0101] В некоторых вариантах реализации вариабельная область TCR, содержащая нереаранжированные сегменты гена вариабельной области TCR человека, также включает межгенные последовательности вариабельной области TCR человека. В некоторых вариантах реализации вариабельная область TCR включает межгенные последовательности вариабельной области TCR животного, не являющегося человеком (например, грызуна, крысы, мыши). В некоторых вариантах реализации межгенные последовательности имеют эндогенное происхождение.
[0102] В некоторых вариантах реализации вариабельная область TCR, содержащая сегменты гена вариабельной области человека и ген константной области TCR, с которым функционально связаны сегменты гена вариабельной области, расположены в эндогенном локусе TCR. В некоторых вариантах реализации эндогенный локус TCR представляет собой эндогенный локус TCRα. В некоторых вариантах реализации эндогенный локус TCR представляет собой эндогенный локус TCRβ. В некоторых вариантах реализации эндогенный локус TCR представляет собой эндогенный локус TCRγ. В некоторых вариантах реализации эндогенный локус TCR представляет собой эндогенный локус TCRδ. В некоторых вариантах реализации ген константной области, с которым функционально связаны сегменты гена вариабельной области человека, представляет собой эндогенный ген константной области, например, соответствующую эндогенную константную область.
[0103] В некоторых вариантах реализации один или более из эндогенных локусов TCR или фрагмент одного или более из эндогенных локусов (например, вариабельной области и/или константной области) в геноме животного, не являющегося человеком, предложенного в настоящем изобретении, инактивирован. Эндогенные локусы генов вариабельной области TCR и их фрагменты можно инактивировать с применением любого способа, известного в данной области техники, включая делецию локуса или его фрагмента из генома организма, замену локуса или его фрагмента другой последовательностью нуклеиновой кислоты, инверсию фрагмента локуса и/или смещение фрагмента локуса в другое положение в геноме организма, не являющегося человеком, но не ограничиваясь ими. В некоторых вариантах реализации инактивация локуса является лишь частичной инактивацией. В некоторых вариантах реализации вариабельная область локуса инактивирована, однако константная область остается функциональной (например, поскольку она функционально связана с неэндогенными сегментами гена вариабельной области). Примеры инактивированных локусов TCR описаны, например, в статьях Mombaerts et al., Proc. Natl. Acad. Sci. USA 88:3084-3087 (1991) и Mombaerts et al., Nature 390:225-231 (1992), каждая из которых включена в настоящий документ посредством ссылки.
[0104] В некоторых вариантах реализации настоящего изобретения предложенное генетически модифицированное животное, не являющееся человеком, экспрессирует TCR, содержащий вариабельные домены человека (например, вариабельный домен человека, происходящий от нереаранжированных сегментов гена вариабельной области человека, описанных в настоящем документе). В некоторых вариантах реализации вариабельный домен человека представляет собой вариабельный домен TCRα человека. В некоторых вариантах реализации вариабельный домен человека представляет собой вариабельный домен TCRβ человека. В некоторых вариантах реализации вариабельный домен человека представляет собой вариабельный домен TCRγ человека. В некоторых вариантах реализации вариабельный домен человека представляет собой вариабельный домен TCRδ человека. В некоторых вариантах реализации TCR, продуцируемый животными, не являющимися человеком, содержит как вариабельные домены TCRα человека, так и вариабельные домены TCRβ человека. В некоторых вариантах реализации TCR, продуцируемый животными, не являющимися человеком, содержит как вариабельные домены TCRγ человека, так и вариабельные домены TCRδ человека. В некоторых вариантах реализации TCR, продуцируемый животными, не являющимися человеком, содержит как вариабельные домены TCRα человека, так и вариабельные домены TCRβ человека, и как вариабельные домены TCRγ человека, так и вариабельные домены TCRδ человека. В некоторых вариантах реализации указанные TCR содержат константные домены человека. В некоторых вариантах реализации константные домены имеют нечеловеческое происхождение. Например, в некоторых вариантах реализации константные домены имеют эндогенное происхождение. В некоторых вариантах реализации константные домены происходят от последовательностей мыши или крысы.
Животные, не являющиеся человеком, экспрессирующие химерные рецепторы антигенов (CAR) и экзогенную TdT
[0105] В некоторых аспектах настоящего изобретения предложены генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки животных, не являющихся человеком, содержащие экзогенную TdT, как описано в настоящем документе, а также локусы химерного рецептора антигена (CAR). Такие локусы CAR обычно содержат вариабельную область и константную область. Вариабельная область содержит нереаранжированные сегменты гена вариабельной области Ig человека, в то время как локус константной области содержит ген константной области TCR, причем сегменты гена вариабельной области Ig функционально связаны с геном константной области. В некоторых вариантах реализации ген константной области TCR представляет собой ген константной области TCR животного, не являющегося человеком. В некоторых вариантах реализации ген константной области TCR представляет собой ген константной области грызуна, например, ген константной области крысы или ген константной области мыши. В некоторых вариантах реализации ген константной области имеет эндогенное происхождение. В некоторых вариантах реализации ген константной области TCR представляет собой ген константной области человека.
[0106] В некоторых вариантах реализации локусы CAR, описанные в настоящем документе, расположены в эндогенных локусах TCR. Например, в некоторых вариантах реализации локус CAR, содержащий ген константной области TCRα, расположен в эндогенном локусе константной области TCRα. В некоторых вариантах реализации такой локус получают путем частичной или полной замены нереаранжированной вариабельной области TCRα нереаранжированной вариабельной областью Ig. В некоторых вариантах реализации локус CAR, содержащий ген константной области TCRβ, расположен в эндогенном локусе константной области TCRβ. В некоторых вариантах реализации такой локус получают путем частичной или полной замены нереаранжированной вариабельной области TCRβ нереаранжированной вариабельной областью Ig.
[0107] В некоторых вариантах реализации локус вариабельной области CAR содержит нереаранжированные сегменты гена вариабельной области Ig человека. Типичные локусы вариабельной области, содержащие сегменты гена вариабельной области человека, описаны в данной области техники. Например, такие локусы описаны в патентах США № 5633425, 5770429, 5814318, 6075181, 6114498, 6150584, 6998514, 7795494, 7910798, 8232329, 8502018, 8697940, 8703485, 8754287, 8791323, 8907157, 9035128, 9145858 и 9206263, каждый из которых полностью включен в настоящий документ посредством ссылки, а также в публикациях патентов США № 2008/0098490, 2010/0146647, 2011/0195454, 2012/0167237, 2013/0145484, 2013/0167256, 2013/0219535, 2013/0326647, 2014/013275, 2014/093908, 2015/0113668 и 2016/0081314, каждая из которых полностью включена в настоящий документ посредством ссылки, и в публикациях PCT № WO2007117410, WO2008151081, WO2009157771, WO2010039900, WO2011004192, WO2011123708, WO2014093908 и WO2016/044745, каждая из которых полностью включена в настоящий документ посредством ссылки.
[0108] В некоторых вариантах реализации локус вариабельной области CAR содержит нереаранжированные сегменты гена вариабельной области тяжелой цепи Ig человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области Ig человека включают множество сегментов VHчеловека, один или более из сегментов DH человека и один или более из сегментов JH человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области Ig человека включают по меньшей мере 3 сегмента гена VH, по меньшей мере 18 сегментов гена VH, по меньшей мере 20 сегментов гена VH, по меньшей мере 30 сегментов гена VH, по меньшей мере 40 сегментов гена VH, по меньшей мере 50 сегментов гена VH, по меньшей мере 60 сегментов гена VH, по меньшей мере 70 сегментов гена VHили по меньшей мере 80 сегментов гена VH. В некоторых вариантах реализации нереаранжированные сегменты гена Ig человека включают все сегменты гена DH человека. В некоторых вариантах реализации вариабельная область CAR дополнительно содержит сегменты гена вариабельной области TCRβ (например, сегменты гена V, D и/или J). В одном варианте реализации вариабельная область CAR дополнительно содержит дистальные сегменты гена TCR Vβ, например, сегмент гена Vβ31 TCR. В еще одном варианте реализации дистальные сегменты гена Vβ TCR, например, сегмент гена Vβ31 TCR, функционально инактивированы или удалены. В некоторых вариантах реализации нереаранжированные сегменты гена Ig человека включают все сегменты гена JH человека. Типичные вариабельные области, содержащие сегменты гена тяжелой цепи Ig, представлены, например, в статье Macdonald et al., Proc. Natl. Acad. Sci. USA 111:5147-52 и дополнительной информации, включенной в настоящий документ посредством ссылки.
[0109] В некоторых вариантах реализации сегменты гена вариабельной области тяжелой цепи иммуноглобулина человека подвергаются реаранжировке во время развития Т-клеток с образованием реаранжированных генов вариабельной области тяжелой цепи человека в Т-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-D-соединений тяжелой цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижена по сравнению с долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-D- и/или D-J-соединений тяжелой цепи иммуноглобулина у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 тяжелой цепи иммуноглобулина по сравнению с соответствующим животным, не являющимся человеком.
[0110] В некоторых вариантах реализации локус гена вариабельной области CAR, содержащий нереаранжированные сегменты гена вариабельной области тяжелой цепи Ig человека, также содержит межгенные последовательности вариабельной области тяжелой цепи Ig человека. В некоторых вариантах реализации локус гена вариабельной области CAR содержит межгенные последовательности вариабельной области тяжелой цепи Ig животного, не являющегося человеком (например, грызуна, крысы, мыши). В некоторых вариантах реализации локус гена вариабельной области CAR содержит межгенные последовательности вариабельной области TCRβ человека или животного, не являющегося человеком (например, грызуна, крысы, мыши). Например, в некоторых вариантах реализации нереаранжированная вариабельная область локуса CAR содержит один или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) генов трипсиногена (TRY) (например, генов и/или псевдогенов TRY, обычно присутствующих в локусе вариабельной области TCRβ). В некоторых вариантах реализации гены TRY являются генами животного, не являющегося человеком, например, генами TRY мыши. В некоторых вариантах реализации гены TRY мыши выбирают из группы, состоящей из Try1, Try2, Try3, Try4, Try5, Try6, Try7, Try8, Try9, Try10, Try11, Try12, Try13, Try14, Try15, Try16, Try17, Try18, Try19 и Try20. В некоторых вариантах реализации один или более из генов TRY расположены выше сегментов VH в нереаранжированной вариабельной области. В некоторых вариантах реализации один или более из генов TRY расположены ниже сегментов VH и выше сегментов DHв нереаранжированной вариабельной области. В некоторых вариантах реализации Try1-7 расположены выше сегментов VH нереаранжированной вариабельной области, а Try 8-20 расположены ниже сегментов VH и выше сегментов DHнереаранжированной вариабельной области. Дополнительная информация о генах TRY, расположенных в локусе TCRβ человека и/или мыши, представлена в статьях Glusman et al., Immunity 15:337-349 (2001) и Skok et al., Nature Immunology 8:378-387 (2007), каждая из которых включена в настоящий документ посредством ссылки. В некоторых вариантах реализации локус гена CAR содержит регуляторные элементы животного, не являющегося человеком (например, промоторы и/или энхансеры животного, не являющегося человеком). В некоторых вариантах реализации регуляторные элементы животного, не являющегося человеком, представляют собой регуляторные элементы грызуна (например, промоторы или энхансеры крысы или мыши). В некоторых вариантах реализации локус CAR содержит энхансер IgM (Eμ). В некоторых вариантах реализации энхансер IgM представляет собой Eμ животного, не являющегося человеком (например, Eμ грызуна, например, Eμ мыши или крысы).
[0111] В некоторых вариантах реализации локус вариабельной области CAR содержит нереаранжированные сегменты гена вариабельной области κ-цепи Ig человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают множество сегментов Vκчеловека и один или более из сегментов Jκ человека. В некоторых вариантах реализации сегменты гена вариабельной области иммуноглобулина включают четыре функциональных сегмента Vκ и все сегменты Jκ человека. В некоторых вариантах реализации сегменты гена вариабельной области иммуноглобулина включают 16 функциональных сегментов Vκ и все сегменты Jκ человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают все сегменты Vκ человека и все сегменты Jκ человека (например, все функциональные сегменты Vκ и сегменты Jκчеловека). Типичные вариабельные области, содержащие сегменты гена κ Ig, представлены, например, в статье Macdonald et al., Proc. Natl. Acad. Sci. USA 111:5147-52 и дополнительной информации, включенной в настоящий документ посредством ссылки. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают все сегменты Jκ человека. В некоторых вариантах реализации вариабельная область CAR дополнительно содержит сегменты гена вариабельной области TCRα (например, сегменты гена V и/или J).
[0112] В некоторых вариантах реализации сегменты гена вариабельной области κ-цепи иммуноглобулина человека подвергаются реаранжировке во время развития Т-клеток с образованием реаранжированных генов вариабельной области κ-цепи человека в Т-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-J-соединений κ-цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижен по сравнению с долей V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений κ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений κ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений κ-цепи иммуноглобулина у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 κ-цепи иммуноглобулина по сравнению с соответствующим животным, не являющимся человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, несет по меньшей мере 900, 1000, 1100, 1200, 1300, 1400, 1500 или 1700 уникальных последовательностей CDR3 κ-цепи иммуноглобулина на 10000 последовательностей CDR3 κ-цепи иммуноглобулина.
[0113] В некоторых вариантах реализации локус вариабельной области CAR содержит нереаранжированные сегменты гена вариабельной области λ-цепи Ig человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают множество сегментов Vλчеловека и один или более из сегментов Jλ человека. В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают все сегменты Vλ человека (например, все функциональные сегменты Vλ человека). В некоторых вариантах реализации нереаранжированные сегменты гена вариабельной области иммуноглобулина человека включают все сегменты Jλ человека. В некоторых вариантах реализации вариабельная область CAR дополнительно содержит сегменты гена вариабельной области TCRα (например, сегменты гена V и/или J). Типичные вариабельные области, содержащие сегменты гена λ Ig, представлены, например, в публикациях патентов США № 2012/0073004 и 2002/0088016, каждая из которых включена в настоящий документ посредством ссылки.
[0114] В некоторых вариантах реализации сегменты гена вариабельной области λ-цепи иммуноглобулина человека подвергаются реаранжировке во время развития Т-клеток с образованием реаранжированных генов вариабельной области λ-цепи человека в Т-клетках организма, не являющегося человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется пониженной долей V-J-соединений λ-цепи иммуноглобулина, не содержащих нематричные присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, не содержащих нематричные присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, понижен по сравнению с долей V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 1 N-присоединение, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 2 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 3 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, характеризуется повышенной долей V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, по сравнению с соответствующим животным, не являющимся человеком, геном которого не содержит нуклеиновой кислоты, кодирующей экзогенную TdT. В некоторых вариантах реализации доля V-J-соединений λ-цепи иммуноглобулина, содержащих по меньшей мере 4 N-присоединения, у генетически модифицированных животных, не являющихся человеком, предлагаемых в настоящем изобретении, превышает долю V-J-соединений λ-цепи иммуноглобулина у соответствующего животного, не являющегося человеком, по меньшей мере на 1% 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 30% или 40%. В некоторых вариантах реализации по меньшей мере 10%, 15%, 20%, 25%, 30%, 35% или 40% V-J-соединений λ-цепи иммуноглобулина у животного содержат нематричные присоединения. В некоторых вариантах реализации животное, не являющееся человеком, характеризуется по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 100% повышенной частотой уникальных последовательностей CDR3 λ-цепи иммуноглобулина по сравнению с соответствующим животным, не являющимся человеком. В некоторых вариантах реализации настоящего изобретения предлагаемое животное, не являющееся человеком, несет по меньшей мере 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290 или 300 уникальных последовательностей CDR3 λ-цепи иммуноглобулина на 10000 последовательностей CDR3 λ-цепи иммуноглобулина.
[0115] В некоторых вариантах реализации локус гена вариабельной области CAR, содержащий нереаранжированные сегменты гена вариабельной области легкой цепи Ig человека, также содержит межгенные последовательности вариабельной области легкой цепи Ig человека (например, межгенные последовательности вариабельной области κ-цепи и/или межгенные последовательности вариабельной области λ-цепи). В некоторых вариантах реализации локус гена вариабельной области CAR содержит межгенные последовательности вариабельной области легкой цепи (например, межгенные последовательности вариабельной области κ-цепи и/или межгенные последовательности вариабельной области λ-цепи) Ig животного, не являющегося человеком (например, грызуна, мыши, крысы). В некоторых вариантах реализации локус вариабельного гена CAR содержит межгенные последовательности вариабельной области TCRα человека или животного, не являющегося человеком (например, грызуна, крысы, мыши). В некоторых вариантах реализации локус гена CAR содержит регуляторные элементы животного, не являющегося человеком (например, промоторы и/или энхансеры животного, не являющегося человеком). В некоторых вариантах реализации регуляторные элементы животного, не являющегося человеком, представляют собой регуляторные элементы грызуна (например, промоторы или энхансеры крысы или мыши).
[0116] В некоторых вариантах реализации локус вариабельной области CAR представляет собой локус реаранжированной вариабельной области, содержащий ген вариабельной области тяжелой цепи Ig (универсальной вариабельной области тяжелой цепи). В некоторых вариантах реализации реаранжированный ген вариабельной области тяжелой цепи Ig представляет собой реаранжированный ген вариабельной области тяжелой цепи Ig человека. Использование универсальных вариабельных областей тяжелой цепи облегчает получение биспецифических антител, в которых по меньшей мере один антигенсвязывающий домен обладает специфичностью по отношению к комплексу пептид/МНС. Типичные реаранжированные вариабельные области тяжелой цепи Ig предложены в публикации патента США № 2014/0245468, включенной в настоящий документ посредством ссылки.
[0117] В некоторых вариантах реализации локус вариабельной области CAR представляет собой локус реаранжированной вариабельной области, содержащий ген вариабельной области легкой цепи Ig (универсальной вариабельной области легкой цепи). В некоторых вариантах реализации реаранжированный ген вариабельной области легкой цепи Ig представляет собой реаранжированный ген вариабельной области легкой цепи Ig человека. Использование универсальных вариабельных областей легкой цепи облегчает получение биспецифических антител, в которых по меньшей мере один антигенсвязывающий домен обладает специфичностью связывания по отношению к комплексу пептид/МНС. Типичные реаранжированные вариабельные области тяжелой цепи Ig предложены в публикации патента США № 2013/0185821, включенной в настоящий документ посредством ссылки.
Другие генетические модификации
[0118] В некоторых вариантах реализации генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки, описанные в настоящем документе, экспрессирующие экзогенную TdT, гуманизированные TCR или CAR, также экспрессируют и/или содержат в своих геномах локусы, кодирующие гуманизированные полипептиды α-цепи MHC I класса (например, гуманизированный HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-g, HLA-K и/или HLA-L). В некоторых вариантах реализации гуманизированный полипептид α-цепи MHC I класса является полностью человеческим. В некоторых вариантах реализации гуманизированный полипептид α-цепи MHC I класса содержит внеклеточный домен человека (например, α1, α2 и α3 домены человека) и цитоплазматический домен эндогенного происхождения. Гуманизированные полипептиды α-цепи MHC I класса, локусы, кодирующие гуманизированные полипептиды α-цепи MHC I класса и животные, не являющиеся человеком, экспрессирующие гуманизированные полипептиды α-цепи MHC I класса, описаны в публикациях патентов США № 2013/0111617, 2013/0185819 и 2014/0245467, каждая из которых включена в настоящий документ посредством ссылки.
[0119] В некоторых вариантах реализации генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки, описанные в настоящем документе, экспрессирующие экзогенную TdT, гуманизированные TCR или CAR, также экспрессируют и/или содержат в своем геноме локус, кодирующий гуманизированный β-2-микроглобулиновый полипептид. Гуманизированные β-2-микроглобулиновые полипептиды, локусы, кодирующие гуманизированные β-2-микроглобулиновые полипептиды, и животные, не являющиеся человеком, экспрессирующие гуманизированные β-2-микроглобулиновые полипептиды, описаны в публикациях патентов США № 2013/0111617 и 2013/0185819, каждая из которых включена в настоящий документ посредством ссылки.
[0120] В некоторых вариантах реализации генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки, описанные в настоящем документе, экспрессирующие экзогенную TdT, гуманизированные TCR или CAR, также экспрессируют и/или содержат в своих геномах локусы, кодирующие гуманизированные полипептиды α-цепи MHC II класса (например, гуманизированный HLA-DMA, HLA-DOA, HLA-DPA, HLA-DQA и/или HLA-DRA). В некоторых вариантах реализации гуманизированный полипептид α-цепи MHC II класса является полностью человеческим. В некоторых вариантах реализации гуманизированный полипептид α-цепи MHC II класса содержит внеклеточный домен человека и цитоплазматический домен эндогенного происхождения. Гуманизированные полипептиды α-цепи MHC II класса, локусы, кодирующие гуманизированные полипептиды α-цепи MHC II класса и животные, не являющиеся человеком, экспрессирующие гуманизированные полипептиды α-цепи MHC II класса, описаны в патентах США № 8847005 и 9043996 и публикации патента США № 2014/0245467, каждый из которых включен в настоящий документ посредством ссылки.
[0121] В некоторых вариантах реализации генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки, описанные в настоящем документе, экспрессирующие экзогенную TdT, гуманизированные TCR или CAR, также экспрессируют и/или содержат в своих геномах локусы, кодирующие гуманизированные полипептиды β-цепи MHC II класса (например, гуманизированный HLA-DMB, HLA-DOB, HLA-DPB, HLA-DQB и/или HLA-DRB). В некоторых вариантах реализации гуманизированный полипептид β-цепи MHC II класса является полностью человеческим. В некоторых вариантах реализации гуманизированный полипептид β-цепи MHC II класса содержит внеклеточный домен человека и цитоплазматический домен эндогенного происхождения. Гуманизированные полипептиды β-цепи MHC II класса, локусы, кодирующие гуманизированные полипептиды β-цепи MHC II класса и животные, не являющиеся человеком, экспрессирующие гуманизированные полипептиды β-цепи MHC II класса, описаны в патентах США № 8847005 и 9043996 и публикации патента США № 2014/0245467, каждый из которых включен в настоящий документ посредством ссылки.
[0122] Генетически модифицированных животных, не являющихся человеком, содержащих экзогенную TdT, локусы гуманизированного TCR и локусы гуманизированных MHC I и/или MHC II (MHC IIα/IIβ), можно получить путем скрещивания с использованием обычных способов; в качестве альтернативы, их можно получить путем гомологичной рекомбинации в ЭС-клетках, уже содержащих один или более из генетически модифицированных локусов (например, локусов гуманизированного TCR), и получения животного, не являющегося человеком, из указанных ЭС-клеток.
[0123] Генетически модифицированных животных, не являющихся человеком, содержащих экзогенную TdT, локусы гуманизированного CAR и локусы гуманизированных MHC I и/или MHC II (MHC IIα/IIβ), можно получить путем скрещивания с использованием обычных способов; в качестве альтернативы, их можно получить путем гомологичной рекомбинации в ЭС-клетках, уже содержащих один или более из генетически модифицированных локусов (например, локусов гуманизированных CAR), и получения животного, не являющегося человеком, из указанных ЭС-клеток.
[0124] В некоторых вариантах реализации генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки, описанные в настоящем документе, экспрессирующие экзогенную TdT, гуманизированные TCR или CAR, также экспрессируют и/или содержат в своем геноме локус, кодирующий гуманизированный полипептид α-цепи CD8. В некоторых вариантах реализации гуманизированный полипептид α-цепи CD8 является полностью человеческим. В некоторых вариантах реализации гуманизированный полипептид α-цепи CD8 содержит внеклеточный домен иммуноглобулина человека и цитоплазматический домен эндогенного происхождения. Гуманизированные полипептиды α-цепи CD8, локусы, кодирующие гуманизированные полипептиды α-цепи CD8, и животные, не являющиеся человеком, экспрессирующие гуманизированные полипептиды α-цепи CD8, описаны в публикации патента США № 2014/0245466, включенной в настоящий документ посредством ссылки.
[0125] В некоторых вариантах реализации генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки, описанные в настоящем документе, экспрессирующие экзогенную TdT, гуманизированные TCR или CAR, также экспрессируют и/или содержат в своем геноме локус, кодирующий гуманизированный полипептид β-цепи CD8. В некоторых вариантах реализации гуманизированный полипептид β-цепи CD8 является полностью человеческим. В некоторых вариантах реализации гуманизированный полипептид β-цепи CD8 содержит внеклеточный домен иммуноглобулина человека и цитоплазматический домен эндогенного происхождения. Гуманизированные полипептиды β-цепи CD8, локусы, кодирующие гуманизированные полипептиды β-цепи CD8, и животные, не являющиеся человеком, экспрессирующие гуманизированные полипептиды β-цепи CD8, описаны в публикации патента США № 2014/0245466, включенной в настоящий документ посредством ссылки.
[0126] В некоторых вариантах реализации генетически модифицированные животные, не являющиеся человеком, и ЭС-клетки, описанные в настоящем документе, экспрессирующие экзогенную TdT, гуманизированные TCR или CAR, также экспрессируют и/или содержат в своем геноме локус, кодирующий гуманизированный полипептид CD4. В некоторых вариантах реализации гуманизированный полипептид CD4 является полностью человеческим. В некоторых вариантах реализации гуманизированный полипептид CD4 содержит по меньшей мере один внеклеточный домен иммуноглобулина человека и цитоплазматический домен эндогенного происхождения. В некоторых вариантах реализации гуманизированный полипептид CD4 содержит по меньшей мере домен D1 иммуноглобулина человека, домен D2 иммуноглобулина человека, домен D3 иммуноглобулина человека и цитоплазматический домен эндогенного происхождения. В некоторых вариантах реализации гуманизированный полипептид CD4 содержит домен D1 иммуноглобулина человека, домен D2 иммуноглобулина человека, домен D3 иммуноглобулина человека, домен D4 иммуноглобулина эндогенного происхождения и цитоплазматический домен эндогенного происхождения. Гуманизированные полипептиды CD4, локусы, кодирующие гуманизированные полипептиды CD4, и животные, не являющиеся человеком, экспрессирующие гуманизированные полипептиды CD4, описаны в публикации патента США № 2014/0245466, включенной в настоящий документ посредством ссылки.
[0127] Генетически модифицированных животных, не являющихся человеком, содержащих экзогенную TdT, локусы гуманизированного TCR и локусы гуманизированных CD4 и/или CD8 (CD8α/CD8β), можно получить путем скрещивания с использованием обычных способов; в качестве альтернативы, их можно получить путем гомологичной рекомбинации в ЭС-клетках, уже содержащих один или более из генетически модифицированных локусов (например, локусов гуманизированного TCR), и получения животного, не являющегося человеком, из указанных ЭС-клеток.
[0128] Генетически модифицированных животных, не являющихся человеком, содержащих экзогенную TdT, локусы гуманизированного CAR и локусы гуманизированных CD4 и/или CD8 (CD8α/CD8β), можно получить путем скрещивания с использованием обычных способов; в качестве альтернативы, их можно получить путем гомологичной рекомбинации в ЭС-клетках, уже содержащих один или более из генетически модифицированных локусов (например, локусов гуманизированного CAR), и получения животного, не являющегося человеком, из указанных ЭС-клеток.
Способы применения генетически модифицированных животных, не являющихся человеком
[0129] В некоторых аспектах настоящего изобретения предложены способы применения генетически модифицированных животных, не являющихся человеком, описанных в настоящем документе, для получения антигенсвязывающих белков (например, антител, CAR, TCR), клеток, экспрессирующих такие антигенсвязывающие белки (например, В-клеток, Т-клетоу, В клеточных гибридом, Т-клеточных гибридом), и нуклеиновых кислот, кодирующих такие антигенсвязывающие белки или их фрагменты (например, вариабельные домены). В некоторых вариантах реализации настоящего изобретения предложены способы получения более разнообразных антигенсвязывающих белков (например, антител, CAR, TCR). В некоторых вариантах реализации настоящего изобретения предложены способы получения реаранжированных вариабельных областей антигенсвязывающих белков (например, антител, CAR, TCR), содержащих увеличенное количество присоединений нуклеотидов.
[0130] В некоторых вариантах реализации указанный способ включает воздействие антигена на генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и антител или их антигенсвязывающих фрагментов, содержащих вариабельные домены человека, так что указанное генетически модифицированное животное, не являющееся человеком, продуцирует антитело или его антигенсвязывающий фрагмент, содержащий вариабельный домен человека, специфичный по отношению к указанному антигену.
[0131] В некоторых вариантах реализации указанный способ включает воздействие антигена на генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и антител или их антигенсвязывающих фрагментов, содержащих вариабельные домены человека; и получение из указанного животного, не являющегося человеком, В-клетки, экспрессирующей антитело или его антигенсвязывающий фрагмент, содержащий вариабельный домен человека, специфичный по отношению к указанному антигену.
[0132] В некоторых вариантах реализации указанный способ включает воздействие антигена на генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и антител или их антигенсвязывающих фрагментов, содержащих вариабельные домены человека; получение из указанного животного, не являющегося человеком, В-клетки, экспрессирующей антитело или его антигенсвязывающий фрагмент, содержащий вариабельный домен человека, специфичный по отношению к указанному антигену; и получение гибридомы из указанной В-клетки.
[0133] В некоторых вариантах реализации указанный способ включает воздействие антигена на генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и антител или их антигенсвязывающих фрагментов, содержащих вариабельные домены человека; и получение из указанного животного, не являющегося человеком, нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, специфичный по отношению к указанному антигену.
[0134] В определенном варианте реализации указанный способ включает воздействие антигена на генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и антител или их антигенсвязывающих фрагментов, содержащих вариабельные домены человека; получение из указанного животного, не являющегося человеком, В-клетки, экспрессирующей антитело или его антигенсвязывающий фрагмент, содержащий вариабельный домен человека, специфичный по отношению к указанному антигену; необязательно, получение гибридомы из указанной В-клетки; и получение из указанной В-клетки или гибридомы нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, специфичный по отношению к указанному антигену.
[0135] В некоторых вариантах реализации указанный способ включает воздействие антигена на животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и антител или их антигенсвязывающих фрагментов, содержащих вариабельные домены человека; получение из указанного животного, не являющегося человеком, В-клетки, экспрессирующей антитело или его антигенсвязывающий фрагмент, содержащий вариабельный домен человека, специфичный по отношению к указанному антигену; необязательно, получение гибридомы из указанной В-клетки; получение из указанной В-клетки или гибридомы нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, специфичный по отношению к указанному антигену; функциональное связывание нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина, с нуклеиновой кислотой, кодирующей константный домен иммуноглобулина человека, в клетке-хозяине; и культивирование указанной клетки-хозяина в условиях, в которых клетка-хозяин экспрессирует антитело человека, содержащее вариабельный домен иммуноглобулина и константный домен иммуноглобулина.
[0136] В некоторых вариантах реализации указанный способ включает воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и TCR, содержащего вариабельные домены человека, так что указанный пептид презентируется на MHC у животного, не являющегося человеком; и получение из указанного генетически модифицированного животного, не являющегося человеком, Т-клетки, экспрессирующей TCR, специфичный по отношению к пептиду, презентируемому на MHC.
[0137] В некоторых вариантах реализации указанный способ включает воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и TCR, содержащего вариабельные домены человека, так что указанный пептид презентируется на MHC у животного, не являющегося человеком; получение из указанного генетически модифицированного животного, не являющегося человеком, Т-клетки, экспрессирующей TCR, специфичный по отношению к пептиду, презентируемому на MHC; и получение Т-клеточной гибридомы из указанной Т-клетки.
[0138] В некоторых вариантах реализации указанный способ включает воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и TCR, содержащего вариабельные домены человека, так что указанный пептид презентируется на MHC у животного, не являющегося человеком; получение из указанного генетически модифицированного животного, не являющегося человеком, Т-клетки, экспрессирующей TCR, специфичный по отношению к пептиду, презентируемому на MHC; и выделение нуклеиновой кислоты, кодирующей вариабельный домен TCR человека указанного TCR, из указанной Т-клетки.
[0139] В некоторых вариантах реализации указанный способ включает воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и TCR, содержащего вариабельные домены человека, так что указанный пептид презентируется на MHC у животного, не являющегося человеком; получение из указанного генетически модифицированного животного, не являющегося человеком, Т-клетки, экспрессирующей TCR, специфичный по отношению к пептиду, презентируемому на MHC; выделение нуклеиновой кислоты, кодирующей вариабельный домен указанного TCR, из указанной Т-клетки; и функциональное связывание нуклеиновой кислоты, кодирующей вариабельный домен TCR, с константным доменом TCR в клетке, так что указанная клетка экспрессирует TCR, содержащий вариабельный домен TCR и константный домен TCR.
[0140] В некоторых вариантах реализации указанный способ включает воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и CAR, содержащего вариабельные домены человека, так что указанный пептид презентируется на MHC у животного, не являющегося человеком; и получение из указанного генетически модифицированного животного, не являющегося человеком, Т-клетки, экспрессирующей CAR, специфичный по отношению к пептиду, презентируемому на MHC.
[0141] В некоторых вариантах реализации указанный способ включает воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на генетически модифицированное животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и CAR, содержащего вариабельные домены человека, так что указанный пептид презентируется на MHC у животного, не являющегося человеком; получение из указанного генетически модифицированного животного, не являющегося человеком, Т-клетки, экспрессирующей CAR, специфичный по отношению к пептиду, презентируемому на MHC; и получение Т-клеточной гибридомы из указанной Т-клетки.
[0142] В некоторых вариантах реализации указанный способ включает воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и CAR, содержащего вариабельные домены человека, так что указанный пептид презентируется на MHC у животного, не являющегося человеком; получение из указанного генетически модифицированного животного, не являющегося человеком, Т-клетки, экспрессирующей химерный рецептор антигена (CAR), специфичный по отношению к пептиду, презентируемому на MHC; и выделение нуклеиновой кислоты, кодирующей вариабельный домен TCR человека указанного CAR, из указанной Т-клетки.
[0143] В некоторых вариантах реализации указанный способ включает воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на животное, не являющееся человеком, описанное в настоящем документе, модифицированное в целях экспрессии экзогенной TdT и CAR, содержащего вариабельные домены человека, так что указанный пептид презентируется на MHC у животного, не являющегося человеком; получение из указанного генетически модифицированного животного, не являющегося человеком, Т-клетки, экспрессирующей химерный рецептор антигена (CAR), специфичный по отношению к пептиду, презентируемому на MHC; выделение нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека указанного CAR, из указанной Т-клетки; и функциональное связывание нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, с константным доменом иммуноглобулина человека в клетке, так что указанная клетка экспрессирует антитело, содержащее вариабельный домен иммуноглобулина человека и константный домен иммуноглобулина человека.
[0144] В некоторых вариантах реализации способы, описанные в настоящем документе, включают этап, на котором животное, не являющееся человеком, описанное в настоящем документе, подвергают воздействию антигена (иммунизированного) с целью индукции иммунного ответа (например, В-клеточного иммунного ответа и/или Т-клеточного иммунного ответа). В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, иммунизируют полноразмерным белковым антигеном или его фрагментом. Грызунов можно иммунизировать любым способом, известным в данной области техники (см., например, Harlow and Lane (1988) Antibodies: A Laboratory Manual 1988 Cold Spring Harbor Laboratory; Malik and Lillehoj (1994) Antibody Techniques, Academic Press, CA).
[0145] В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, подвергают воздействию антигена путем введения животному, не являющемуся человеком, вируса (например, ретровируса, аденовируса, вируса коровьей оспы или лентивируса), содержащего последовательность нуклеиновой кислоты, кодирующую антиген. Способы вирусной вакцинации предложены, например, в патентах США № 6001349, 8663622, 8691502, 8377688, а также источнике Precopio et al., JEM 204:1405-1416 (2007), каждый из которых полностью включен в настоящий документ посредством ссылки. В некоторых вариантах реализации животному, не являющемуся человеком, непосредственно вводят вирус. В некоторых вариантах реализации клетку (например, антигенпрезентирующую клетку, например, дендритную клетку) инфицируют вирусом in vitro или ex vivo, а затем вводят животному, не являющемуся человеком. В некоторых вариантах реализации вирус кодирует комплекс пептид/МНС (например, комплекс одноцепочечный пептид/МНС). Примеры вакцин на основе одноцепочечных пептидов/МНС приведены в статьях Truscott et al., J. Immunol. 178:6280-6289 (2007), EP1773383, Kim et al., Vaccine 30:2178-2186 (2012), Kim et al., J. Immunol. 184:4423-4430 (2010), каждая из которых включена в настоящий документ посредством ссылки.
[0146] В некоторых вариантах реализации генетически модифицированное животное, не являющееся человеком, подвергают воздействию антигена путем введения животному нуклеиновой кислоты, кодирующей антиген. В некоторых вариантах реализации животному, не являющемуся человеком, вводят нуклеиновую кислоту, кодирующую комплекс одноцепочечный пептид/МНС. Примеры вакцин на основе одноцепочечных пептидов/МНС приведены в статьях Truscott et al., J. Immunol. 178:6280-6289 (2007), EP1773383, Kim et al., Vaccine 30:2178-2186 (2012), Kim et al., J. Immunol. 184:4423-4430 (2010), каждая из которых включена в настоящий документ посредством ссылки. В некоторых вариантах реализации нуклеиновая кислота представляет собой ДНК-вектор. Доставку нуклеиновых кислот можно выполнять любым способом, известным в данной области техники, включая перенос гена, опосредованный вирусом, и перенос гена, опосредованный липосомами. Нужный полинуклеотид связывают с липосомой с образованием носителя для доставки гена, как описано, например, в патентах США № 6770291, 7001614, 6749863, 5512295 и 7112338, каждый из которых включен в настоящий документ посредством ссылки. В некоторых вариантах реализации нуклеиновая кислота представляет собой мРНК-вектор. Типичные способы получения и введения мРНК-векторов описаны, например, в патенте США № 8278036 и публикациях патента США № 2013/151736 и 2012/135805, каждая из которых включена в настоящий документ посредством ссылки.
[0147] В некоторых вариантах реализации антиген является антигеном высокого канцерогенного риска. Примеры антигенов высокого канцерогенного риска включают адипофилин, AIM-2, ALDH1A1, альфа-актинин-4, альфа-фетопротеин («АФП»), ALK, ANKRD30A, ARTC1, B-RAF, BAGE-1, BCLX (L), гибридный белок BCR-ABL b3a2, бета-катенин, BING-4, BIRC7, CA-125, CA9, CALCA, карциноэмбриональный антиген (“CEA”), CALR, CASP-5, CASP-8, CCR5, CD19, CD20, CD22, CD27, CD274, CD30, CD33, CD38, CD40, CD44, CD45, CD52, CD56, CD79, Cdc27, CDK12, CDK4, CDKN2A, CEA, CLEC12A, CLPP, COA-1, CPSF, CSNK1A1, CTAG1, CTAG2, циклин D1, циклин A1, гибридный белок dek-can, DKK1, EFTUD2, EGFR, вариант EGFR III, фактор элонгации 2, ENAH (hMena), Ep-CAM, EpCAM, EphA2, EphA3, эпителиальный опухолевый антиген (“ETA”), ERBB3, ERBB4, гибридный белок ETV6-AML1, EZH2, FCRL3, FGF5, FLT3-ITD, FN1, FOLR1, G250/MN/CAIX, GAGE-1,2,8, GAGE-3,4,5,6,7, GAS7, глипикан-3, GnTV, gp100/Pmel17, GPNMB, GM3, GPR112, IL3RA, HAUS3, гепсин, HER-2/neu, HERV-K-MEL, HLA-A11, HLA-A2, HLA-DOB, hsp70-2, IDO1, IGF2B3, IL13R-альфа-2, карбоксилэстеразу кишечника, K-ras, калликреин 4, KIF20A, KIT, KK-LC-1, KKLC1, KM-HN-1, KMHN1, также известный как CCDC110, KRAS, LAGE-1, гибридный белок LDLR-фукозилтрансфераза AS, ленгсин, LGR5, LMP2, МКСФ, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-C1, MAGE-C2, яблочный фермент, маммаглобин-A, MART2, MATN, MC1R, MCSP, mdm-2, ME1, мелан-A/MART-1, Meloe, мидкин, MMP-2, MMP-7, MUC1, MUC2, MUC3, MUC4, MUC5, MUC5AC, MUC16, муцин, MUM-1, MUM-2, MUM-3, миозин, миозин I класса, N-raw, NA88-A, neo-PAP, NFYC, NY-BR-1, NY-ESO-1/LAGE-2, OA1, OGT, OS-9, OX40, полипептид P, p53, PAP, PAX3, PAX5, PBF, PLAC1, PMEL, гибридный белок pml-RAR-альфа, полиморфный эпителиальный муцин (“PEM”), PPP1R3B, PRAME, PRDX5, PRLR, PSA, PSMA, PTPRK, RAB38/NY-MEL-1, RAGE-1, RBAF600, RET, RGS5, RhoC, RNF43, ROR1, RU2AS, SAGE, SART1, SART3, сецернин 1, SIRT2, SLAMF7, SLC39A6, SNRPD1, SOX10, Sp17, SPA17, SSX-2, SSX-4, STEAP1, STEAP2, сурвивин, гибридный белок SYT-SSX1 или -SSX2, TAG-1, TAG-2, теломеразу, TERT, TGF-бета-RII, антиген Tn, TMPRSS2, TNFRSF17, TPBG, TRAG-3, триозофосфатизомеразу, TRP-1/gp75, TRP-2, TRP2-INT2, тирозиназу, тирозиназу (“TYR”), UPK3A, ФРЭС, VTCN1, WT1, XAGE-1b/GAGED2a, но не ограничиваются ими. В некоторых вариантах реализации антиген представляет собой неоантиген.
[0148] В некоторых вариантах реализации антиген представляет собой антиген, экспрессируемый патогенным организмом, вызывающим инфекцию. В некоторых вариантах реализации патогенный организм представляет собой вирус, бактерию, гриб, гельминта или простейшее. Неограничивающие примеры вирусов включают ВИЧ, вирусы гепатита A, гепатита B, гепатита C, герпеса (например, ВПГ-1, ВПГ-2, ЦМВ, HAV-6, VZV, вирус Эпштейна-Барр), аденовирус, вирус гриппа, флавивирус, эховирус, риновирус, вирус коксаки, коронавирус, респираторно-синцитиальный вирус, вирус паротита, ротавирус, вирус кори, вирус краснухи, парвовирус, вирус коровьей оспы, HTLV, вирус денге, папилломавирус, вирус моллюска, полиовирус, вирус бешенства, вирус Джона Каннингема, вирус эбола и антиген вируса арбовирусного энцефалита.. В некоторых вариантах реализации паразит представляет собой возбудителя малярии. В некоторых вариантах реализации патогенный организм представляет собой Aspergillus, Brugia, Candida, Chlamydia, Coccidia, Cryptococcus, Dirofilaria, Gonococcus, Histoplasma, Klebsiella, Legionella, Leishmania, Meningococci, Mycobacterium, Mycoplasma, Paramecium, Pertussis, Plasmodium, Pneumococcus, Pneumocystis, Pseudomonas, Rickettsia, Salmonella, Shigella, Staphylococcus, Streptococcus, Toxoplasma и Vibriocholerae. Типичные виды включают Neisseria gonorrhea, Mycobacterium tuberculosis, Candida albicans, Candida tropicalis, Trichomonas vaginalis, Haemophilus vaginalis, Streptococcus sp. группы В, Microplasma hominis, Hemophilus ducreyi, Granuloma inguinale, Lymphopathia venereum, Treponema pallidum, Brucella abortus. Brucella melitensis, Brucella suis, Brucella canis, Campylobacter fetus, Campylobacter fetus intestinalis, Leptospira pomona, Listeria monocytogenes, Brucella ovis, Chlamydia psittaci, Trichomonas foetus, Toxoplasma gondii, Escherichia coli, Actinobacillus equuli, Salmonella abortus ovis, Salmonella abortus equi, Pseudomonas aeruginosa, Corynebacterium equi, Corynebacterium pyogenes, Actinobaccilus seminis, Mycoplasma bovigenitalium, Aspergillus fumigatus, Absidia ramosa, Trypanosoma equiperdum, Babesia caballi, Clostridium tetani, Clostridium botulinum; или гриб, например, Paracoccidioides brasiliensis; или другой патогенный организм, например, Plasmodium falciparum.
[0149] В некоторых вариантах реализации способов, описанных в настоящем документе, указанный способ включает этап получения Т-клеток и/или или В-клеток из генетически модифицированного животного, не являющегося человеком. В некоторых вариантах реализации любой способ, известный в данной области техники, можно применять для получения таких клеток. Например, такие Т-клетки и/или В-клетки можно получить из селезенки, лимфатических узлов и/или периферической крови животного. Такие Т-клетки и/или В-клетки можно подвергать скринингу на предмет специфичности связывания с использованием способов, доступных в данной области техники.
[0150] В некоторых вариантах реализации способы, описанные в настоящем документе, включают этап получения В-клеточной гибридомы из В-клетки. Способы, используемые для получения В-клеточной гибридомы, известны в данной области техники и описаны, например, в пособиях Harlow and Lane (1988) Antibodies: A Laboratory Manual 1988 Cold Spring Harbor Laboratory; Malik and Lillehoj (1994) Antibody Techniques, Academic Press, CA, включенных в настоящий документ посредством ссылок.
[0151] В некоторых вариантах реализации способы, описанные в настоящем документе, включают этап получения Т-клеточной гибридомы из Т-клетки. Способы, используемые для получения Т-клеточной гибридомы, известны в данной области техники и описаны, например, в источниках Hedrick et al., Cell 30:141-152 (1982) и Kruisbeek Curr. Protoc. Immunol. Chapter 3 (2001) и White et al., Methods in Molecular Biology 134:185-193 (2000), каждый из которых включен в настоящий документ посредством ссылки.
[0152] В некоторых вариантах реализации способы, предлагаемые в настоящем изобретении, включают этап выделения нуклеиновой кислоты, кодирующей вариабельную область Ig или TCR. В некоторых вариантах реализации способов, описанных в настоящем документе, для выделения нуклеиновой кислоты, кодирующей вариабельную область Ig или TCR, можно применять любой способ.
[0153] В некоторых вариантах реализации этап выделения нуклеиновой кислоты включает получение В-клеточной или Т-клеточной гибридомы из В-клеток или Т-клеток, соответственно, и выделение нуклеиновой кислоты из гибридомы. В некоторых вариантах реализации нуклеиновую кислоту выделяют с использованием амплификации нуклеиновых кислот. Например, в некоторых вариантах реализации способ амплификации нуклеиновых кислот представляет собой полимеразную цепную реакцию (ПЦР), лигазную цепную реакцию (LCR), амплификацию с вытеснением цепи (SDA), транскрипционно-опосредованную амплификацию (TMA), самоподдерживающуюся репликацию последовательностей (3SR), амплификацию на основе репликазы Qβ, амплификацию, основанную на последовательности нуклеиновых кислот (NASBA), цепную реакцию репарации (RCR), бумеранг-амплификацию ДНК (BDA) или амплификацию катящегося кольца (RCA).
[0154] В некоторых вариантах реализации нуклеиновую кислоту выделяют посредством секвенирования реаранжированного гена вариабельной области Ig или TCR в В-клетке, Т-клетке, В-клеточной гибридоме или Т-клеточной гибридоме и синтезе последовательности нуклеиновой кислоты, содержащей реаранжированный ген вариабельной области Ig или TCR. Примеры способов секвенирования нуклеиновой кислоты включают секвенирование с обрывом цепи, секвенирование лигированием, секвенирование посредством синтеза, пиросеквенирование, секвенирование с применением ион-чувствительных полупроводниковых датчиков, одномолекулярное секвенирование в реальном времени, 454-секвенирование и/или секвенирование по протоколу Dilute-N-Go, но не ограничиваются ими.
[0155] После получения фрагментов ДНК, кодирующих вариабельные области тяжелой и/или легкой цепи Ig, эти фрагменты ДНК можно дополнительно обработать с использованием стандартной технологии рекомбинантных ДНК, например, с целью преобразования генов вариабельной области в гены полноразмерной цепи антитела, гены Fab-фрагмента или ген scFv. При этих манипуляциях фрагмент ДНК, кодирующий вариабельную область, функционально связывают с другим фрагментом ДНК, кодирующим другой белок, например, константную область антитела или гибкий линкер. Термин «функционально связанный» в данном контексте предназначен для обозначения соединения двух фрагментов ДНК таким образом, что аминокислотные последовательности, кодируемые указанными двумя фрагментами ДНК, находятся в одной рамке считывания.
[0156] Выделенную ДНК, кодирующую вариабельную область тяжелой цепи, можно преобразовать в ген полноразмерной тяжелой цепи, функционально связав ДНК, кодирующую вариабельную область, с другой молекулой ДНК, кодирующей константный домен тяжелой цепи (CH1, CH2 и CH3). Последовательности генов константной области тяжелой цепи человека известны в данной области техники (см., например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, или Lefranc, The Immunoglobulin Handbook, London: Academic Press 2001), и фрагменты ДНК, охватывающие эти области, можно получить стандартной ПЦР-амплификацией. Константный домен тяжелой цепи может, например, представлять собой константный домен IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. В случае гена тяжелой цепи Fab-фрагмента ДНК, кодирующую VH, можно функционально связать с другой молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи.
[0157] Таким образом, в некоторых вариантах реализации способы, описанные в настоящем документе, включают этап функционального связывания последовательности нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи Ig, с последовательностью нуклеиновой кислоты, кодирующей константный домен тяжелой цепи Ig в клетке-хозяине, так что клетка-хозяин экспрессирует полипептид тяжелой цепи Ig, содержащий вариабельный домен тяжелой цепи Ig и константный домен тяжелой цепи Ig. В некоторых вариантах реализации указанный способ включает этап функционального связывания последовательности нуклеиновой кислоты, кодирующей вариабельный домен легкой цепи Ig, с последовательностью нуклеиновой кислоты, кодирующей константный домен легкой цепи Ig в клетке-хозяине, так что клетка-хозяин экспрессирует полипептид легкой цепи Ig, содержащий вариабельный домен легкой цепи Ig и константный домен тяжелой цепи Ig. В некоторых вариантах реализации указанный способ включает этап функционального связывания последовательности нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи Ig, с последовательностью нуклеиновой кислоты, кодирующей константный домен тяжелой цепи Ig в клетке-хозяине, и функционального связывания последовательности нуклеиновой кислоты, кодирующей вариабельный домен легкой цепи Ig, с последовательностью нуклеиновой кислоты, кодирующей константный домен легкой цепи Ig в клетке-хозяине, так что клетка-хозяин экспрессирует антитело, содержащее тяжелую цепь, содержащую вариабельный домен тяжелой цепи Ig и константный домен тяжелой цепи Ig, и легкую цепь Ig, содержащую вариабельный домен легкой цепи Ig и константный домен легкой цепи Ig. Вариабельные области Ig можно присоединять к константным областям Ig с использованием стандартных молекулярно-биологических методик, хорошо известных в данной области техники. В некоторых вариантах реализации можно использовать любую клетку-хозяина, способную экспрессировать полипептид иммуноглобулина. В некоторых вариантах реализации клетка представляет собой клетку CHO, клетку HEK-293, клетку BHK, клетку NS0, клетку SP2/0 или клетку Vero или клетку сетчатки, экспрессирующую вирусную нуклеотидную последовательность (например, клетку PERC.6™).
[0158] В некоторых вариантах реализации нуклеиновая кислота, кодирующая константную область тяжелой цепи, кодирует константный домен, который содержит модифицированный Fc-домен (например, мутацию, которая изменяет взаимодействие между Fc и Fc-рецептором). Например, в некоторых вариантах реализации константный домен содержит модификацию Fc-домена в положениях 235, 236, 237, 239, 265, 267, 268, 269, 270, 298, 326, 327, 330, 332, 350, 351, 366, 392, 394, 405 и/или 407 (с использованием системы нумерации ЕС). В некоторых вариантах реализации модификацию выбирают из группы, состоящей из L235A, G236E, G237F, S239E, S239D, D265E, D265S, S267E, S267D, S267G, H268E, H268D, E269L, D270N, D270E, S298A, K326A, K326D, A327H , A327V, A327L, A330I, A330S, I332E, T350V, L351Y, T366L, K392M, K392L, T394W, F405A и/или Y407V (с использованием системы нумерации ЕС). В некоторых вариантах реализации константный домен содержит несколько модификаций Fc-домена. В некоторых вариантах реализации множественные модификации выбирают из группы, состоящей из D270N/K326D, S239E/S298A/K326A/A327H, L235A/S239E/D265E/A327H, G236E/G237F/S239E, G237F/S239E/D265E, G327F/S239E/H268D, G236E/D270N/A327V/I332E, G237F/S239E/A327H, G237F/A327L/A330I, S239D/D265S/S298A/I332E, S239E/D265S/H268D/I332E, S239E/D265S/I332E, S239E/S267E/H268D, S239E/A327L/A330I, D265E/S267D/A330S, S267G/H268E/D270E, H268D/E269L/S298A/K326A/A327H, H268D//K326A/A327H. Дополнительные модификации Fc и комбинации модификаций Fc приведены в патентах США № 5624821, 5648260, 6528624, 6737056, 7122637, 7183387, 7297775, 7317091, 7,332,581, 7632497, 7662925, 7695936, 8093359, 8216805, 8218805, 8388955 и 8937158 и публикациях патентов США № 2005/0054832, 2006/0222653, 2006/0275282, 2006/0275283, 2007/0190063, 2008/0154025, 2009/0042291 2013/0108623 и 2013/0089541, каждая из которых включена в настоящий документ посредством ссылки.
Антигенсвязывающие белки
[0159] В определенных аспектах настоящего изобретения предложены антигенсвязывающие белки (например, антитела, TCR, CAR и их антигенсвязывающие фрагменты), получаемые и/или полученные в соответствии со способом, описанным в настоящем документе (например, с использованием животного, не являющегося человеком, описанного в настоящем документе).
[0160] В некоторых вариантах реализации настоящего изобретения предлагаемые антигенсвязывающие молекулы способны специфически связывать антиген-мишень с константой диссоциации не более 10-6, 10-7, 10-8 или 10-9 М. В некоторых вариантах реализации сродство связывания антигенсвязывающего белка с антигеном (выражаемое константой KD) по меньшей мере в 10 раз меньше, по меньшей мере в 100 раз меньше или по меньшей мере в 1000 раз меньше, чем сродство антигенсвязывающего белка к неспецифическому антигену. В некоторых вариантах реализации антигенсвязывающий белок связывается с комплексом пептид/МНС с константой диссоциации не более 10-6, 10-7, 10-8 или 10-9 М. В некоторых вариантах реализации сродство связывания антигенсвязывающего белка с комплексом пептид/MHC (выражаемое константой KD) по меньшей мере в 10 раз меньше, по меньшей мере в 100 раз меньше или по меньшей мере в 1000 раз меньше, чем сродство антигенсвязывающего белка к пептиду на том же белке MHC, презентирующем неспецифический антиген. В данной области техники известны стандартные анализы для оценки связывающей способности антигенсвязывающих белков, в том числе, например, твердофазный ИФА, вестерн-блоттинг и РИА. Кинетику связывания (например, сродство связывания) антигенсвязывающего белка также можно оценивать посредством стандартных анализов, известных в данной области техники, например, анализа Biacore.
[0161] В некоторых вариантах реализации антиген содержит эпитоп и/или является антигеном высокого канцерогенного риска. Примеры антигенов высокого канцерогенного риска включают адипофилин, AIM-2, ALDH1A1, альфа-актинин-4, альфа-фетопротеин («АФП»), ARTC1, B-RAF, BAGE-1, BCLX (L), гибридный белок BCR-ABL b3a2, бета-катенин, BING-4, CA-125, CALCA, карциноэмбриональный антиген (“CEA”), CASP-5, CASP-8, CD274, CD45, Cdc27, CDK12, CDK4, CDKN2A, CEA, CLPP, COA-1, CPSF, CSNK1A1, CTAG1, CTAG2, циклин D1, циклин A1, гибридный белок dek-can, DKK1, EFTUD2, фактор элонгации 2, ENAH (hMena), Ep-CAM, EpCAM, EphA3, эпителиальный опухолевый антиген (“ETA”), гибридный белок ETV6-AML1, EZH2, FGF5, FLT3-ITD, FN1, G250/MN/CAIX, GAGE-1,2,8, GAGE-3,4,5,6,7, GAS7, глипикан-3, GnTV, gp100/Pmel17, GPNMB, HAUS3, гепсин, HER-2/neu, HERV-K-MEL, HLA-A11, HLA-A2, HLA-DOB, hsp70-2, IDO1, IGF2B3, IL13R-альфа-2, карбоксилэстеразу кишечника, K-ras, калликреин 4, KIF20A, KK-LC-1, KKLC1, KM-HN-1, KMHN1, также известный как CCDC110, LAGE-1, гибридный белок LDLR-фукозилтрансфераза AS, ленгсин, МКСФ, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-C1, MAGE-C2, яблочный фермент, маммаглобин-A, MART2, MATN, MC1R, MCSP, mdm-2, ME1, мелан-A/MART-1, Meloe, мидкин, MMP-2, MMP-7, MUC1, MUC5AC, муцин, MUM-1, MUM-2, MUM-3, миозин, миозин I класса, N-raw, NA88-A, neo-PAP, NFYC, NY-BR-1, NY-ESO-1/LAGE-2, OA1, OGT, OS-9, полипептид P, p53, PAP, PAX5, PBF, гибридный белок pml-RAR-альфа, полиморфный эпителиальный муцин (“PEM”), PPP1R3B, PRAME, PRDX5, PSA, PSMA, PTPRK, RAB38/NY-MEL-1, RAGE-1, RBAF600, RGS5, RhoC, RNF43, RU2AS, SAGE, сецернин 1, SIRT2, SNRPD1, SOX10, Sp17, SPA17, SSX-2, SSX-4, STEAP1, сурвивин, гибридный белок SYT-SSX1 или -SSX2, TAG-1, TAG-2, теломеразу, TGF-бета-RII, TPBG, TRAG-3, триозофосфатизомеразу, TRP-1/gp75, TRP-2, TRP2-INT2, тирозиназу, тирозиназу (“TYR”), ФРЭС, WT1, XAGE-1b/GAGED2a, но не ограничиваются ими. В некоторых вариантах реализации антиген представляет собой неоантиген.
[0162] В некоторых вариантах реализации антиген содержит эпитоп и/или представляет собой антиген, экспрессируемый патогенным организмом, вызывающим инфекцию. В некоторых вариантах реализации патогенный организм представляет собой вирус, бактерию, гриб, гельминта или простейшее. Некоторые неограничивающие примеры вирусов включают вирусы ВПЧ, ВГВ, вирус гепатита C (ВГС), ретровирусы, например, вирус иммунодефицита человека (ВИЧ-1 и ВИЧ-2), вирусы герпеса, например, вирус Эпштейна-Барр (ВЭБ), цитомегаловирус (ЦМВ), ВПГ-1 и ВПГ-2, и вирус гриппа. В некоторых вариантах реализации паразит представляет собой возбудителя малярии. В некоторых вариантах реализации патогенный организм представляет собой Aspergillus, Brugia, Candida, Chlamydia, Coccidia, Cryptococcus, Dirofilaria, Gonococcus, Histoplasma, Leishmania, Mycobacterium, Mycoplasma, Paramecium, Pertussis, Plasmodium, Pneumococcus, Pneumocystis, Rickettsia, Salmonella, Shigella, Staphylococcus, Streptococcus, Toxoplasma и Vibriocholerae. Типичные виды включают Neisseria gonorrhea, Mycobacterium tuberculosis, Candida albicans, Candida tropicalis, Trichomonas vaginalis, Haemophilus vaginalis, Streptococcus sp. группы В, Microplasma hominis, Hemophilus ducreyi, Granuloma inguinale, Lymphopathia venereum, Treponema pallidum, Brucella abortus. Brucella melitensis, Brucella suis, Brucella canis, Campylobacter fetus, Campylobacter fetus intestinalis, Leptospira pomona, Listeria monocytogenes, Brucella ovis, Chlamydia psittaci, Trichomonas foetus, Toxoplasma gondii, Escherichia coli, Actinobacillus equuli, Salmonella abortus ovis, Salmonella abortus equi, Pseudomonas aeruginosa, Corynebacterium equi, Corynebacterium pyogenes, Actinobaccilus seminis, Mycoplasma bovigenitalium, Aspergillus fumigatus, Absidia ramosa, Trypanosoma equiperdum, Babesia caballi, Clostridium tetani, Clostridium botulinum; или гриб, например, Paracoccidioides brasiliensis; или другой патогенный организм, например, Plasmodium falciparum.
[0163] В некоторых вариантах реализации антиген содержит эпитоп и/или представляет собой белок, который является мишенью аутореактивной Т-клетки при воспалительном заболевании, отторжении трансплантата кожи или органа, реакции "трансплантат против хозяина" (РТПХ) или аутоиммунных заболеваниях. Примеры аутоиммунных заболеваний включают, например, гломерулярный нефрит, артрит, заболевание, подобное дилатационной кардиомиопатии, язвенный колит, синдром Шегрена, болезнь Крона, системные эритематозы, хронический ревматоидный артрит, рассеянный склероз, псориаз, аллергический контактный дерматит, полимиоз, пахидерму, узелковый периартериит, ревматическую лихорадку, витилиго обыкновенное, инсулинзависимый сахарный диабет, болезнь Бехчета, болезнь Хашимото, болезнь Аддисона, дерматомиозит, миастению гравис, синдром Рейтера, болезнь Грейвса, злокачественную анемию, синдром Гудпасчера, бесплодие, хронический активный гепатит, пемфигус, аутоиммунную тромбопеническую пурпуру и аутоиммунную гемолитическую анемию, активный хронический гепатит, болезнь Аддисона, антифосфолипидный синдром, атопическую аллергию, аутоиммунный атрофический гастрит, аутоиммунную ахлоргидрию, целиакию, синдром Кушинга, дерматомиозит, дискоидную волчанку, эритематоз, синдром Гудпасчера, тиреоидит Хашимото, идиопатическую атрофию надпочечников, идиопатическую тромбоцитопению, инсулинзависимый диабет, синдром Ламберта-Итона, волчаночный гепатит, некоторые случаи лимфопении, смешанное заболевание соединительной ткани, пемфигоид, вульгарный пемфигус, злокачественную анемию, белково-анафилактический увеит, узелковый полиартериит, полигландулярные аутосиндромы, первичный билиарный цирроз, первичный склерозирующий холангит, синдром Рейно, рецидивирующий полихондрит, синдром Шмидта, ограниченную склеродермию (или CREST-синдром), симпатическую офтальмию, системную красную волчанку, артериит Такаясу, височный артериит, тиреотоксикоз, инсулинрезистентность типа b, язвенный колит и гранулематоз Вегенера. Типичные белки, являющиеся мишенями аутореактивных Т-клеток, включают, например, p205, инсулин, тиреотропный гормон, тирозиназу, TRP1 и миелин.
[0164] В некоторых вариантах реализации антигенсвязывающий белок представляет собой антитело. В некоторых вариантах реализации антитела, предложенные в настоящем изобретении, содержат вариабельные домены тяжелой цепи человека. В некоторых вариантах реализации антитела содержат константные домены тяжелой цепи человека. В некоторых вариантах реализации антитела, предложенные в настоящем изобретении, содержат константный домен IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. Последовательности константных доменов тяжелой цепи человека известны в данной области техники (см., например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, или Lefranc, The Immunoglobulin Handbook, London: Academic Press 2001). В некоторых вариантах реализации антитела, предложенные в настоящем изобретении, не содержат константного домена тяжелой цепи или его фрагмента.
[0165] В некоторых вариантах реализации антитела, предложенные в настоящем изобретении, содержат модифицированный Fc-домен (например, мутацию, которая изменяет взаимодействие между Fc и Fc-рецептором). Например, в некоторых вариантах реализации антитела, предложенные в настоящем изобретении, содержат модификацию Fc-домена в положениях 235, 236, 237, 239, 265, 267, 268, 269, 270, 298, 326, 327, 330, 332, 350, 351, 366, 392, 394, 405 и/или 407 (с использованием системы нумерации ЕС). В некоторых вариантах реализации модификацию выбирают из группы, состоящей из L235A, G236E, G237F, S239E, S239D, D265E, D265S, S267E, S267D, S267G, H268E, H268D, E269L, D270N, D270E, S298A, K326A, K326D, A327H , A327V, A327L, A330I, A330S, I332E, T350V, L351Y, T366L, K392M, K392L, T394W, F405A и/или Y407V (с использованием системы нумерации ЕС). В некоторых вариантах реализации антитела содержат несколько модификаций Fc-домена. В некоторых вариантах реализации множественные модификации выбирают из группы, состоящей из D270N/K326D, S239E/S298A/K326A/A327H, L235A/S239E/D265E/A327H, G236E/G237F/S239E, G237F/S239E/D265E, G327F/S239E/H268D, G236E/D270N/A327V/I332E, G237F/S239E/A327H, G237F/A327L/A330I, S239D/D265S/S298A/I332E, S239E/D265S/H268D/I332E, S239E/D265S/I332E, S239E/S267E/H268D, S239E/A327L/A330I, D265E/S267D/A330S, S267G/H268E/D270E, H268D/E269L/S298A/K326A/A327H, H268D//K326A/A327H. Дополнительные модификации Fc и комбинации модификаций Fc приведены в патентах США № 5624821, 5648260, 6528624, 6737056, 7122637, 7183387, 7297775, 7317091, 7,332,581, 7632497, 7662925, 7695936, 8093359, 8216805, 8218805, 8388955 и 8937158 и публикациях патентов США № 2005/0054832, 2006/0222653, 2006/0275282, 2006/0275283, 2007/0190063, 2008/0154025, 2009/0042291 2013/0108623 и 2013/0089541, каждая из которых включена в настоящий документ посредством ссылки.
[0166] В некоторых вариантах реализации антитело представляет собой биспецифическое антитело. В некоторых вариантах реализации два антигенсвязывающих домена биспецифического антитела содержат различные вариабельные домены тяжелой цепи, но идентичные вариабельные домены легкой цепи. В некоторых вариантах реализации Fc-домены тяжелых цепей содержат модификации для облегчения образования гетеродимеров тяжелой цепи и/или для ингибирования образования гомодимеров тяжелой цепи. Такие модификации предусмотрены, например, в патентах США № 5731168, 5807706, 5821333, 7642228 и 8679785 и в публикациях патента США № 2013/0195849, каждый из которых включен в настоящий документ посредством ссылки.
[0167] В некоторых вариантах реализации антитела, предложенные в настоящем изобретении, содержат вариабельные домены легкой цепи человека. В некоторых вариантах реализации вариабельные домены легкой цепи представляют собой вариабельные домены легкой λ-цепи. В некоторых вариантах реализации вариабельные домены легкой цепи представляют собой вариабельные домены легкой κ-цепи. В некоторых вариантах реализации указанные антитела содержат константные домены легкой цепи человека. В некоторых вариантах реализации константные домены легкой цепи представляют собой константные домены легкой λ-цепи. В некоторых вариантах реализации константные домены легкой цепи представляют собой константные домены легкой κ-цепи. Последовательности константных доменов легкой цепи человека известны в данной области техники (см., например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, или Lefranc, The Immunoglobulin Handbook, London: Academic Press 2001).
[0168] В некоторых вариантах реализации антитела, описанные в настоящем документе, являются интактными антителами. В некоторых вариантах реализации антитела, описанные в настоящем документе, являются фрагментами антител, которые сохраняют способность к связыванию антигена. В некоторых вариантах реализации фрагмент антитела представляет собой Fab, Fab', F(ab')2 , Fv, scFv, Fv с дисульфидной связью, Fd, одноцепочечные антитела, выделенный CDRH3 или другой фрагмент антитела, которые сохраняют по меньшей мере фрагмент вариабельного домена интактного антитела.
[0169] В некоторых вариантах реализации антигенсвязывающий белок представляет собой CAR. В некоторых вариантах реализации CAR является мембраносвязанным. В некоторых вариантах реализации CAR является растворимым CAR (например, не содержит трансмембранного или цитоплазматического домена). В некоторых вариантах реализации такие CAR содержат первый полипептид CAR, содержащий вариабельный домен тяжелой цепи Ig и константный домен TCRβ, и второй полипептид CAR, содержащий вариабельный домен легкой цепи Ig (например, вариабельный домен κ-цепи Ig или вариабельный домен λ-цепи Ig) и константный домен TCRα. В некоторых вариантах реализации вариабельный домен тяжелой цепи Ig и/или вариабельный домен легкой цепи Ig представляют собой вариабельные домены Ig человека. В некоторых вариантах реализации константный домен TCRβ и/или константный домен TCRα представляют собой константные домены животного, не являющегося человеком (например, константные домены крысы или мыши). В некоторых вариантах реализации константный домен TCRβ и/или константный домен TCRα являются константными доменами человека.
[0170] В некоторых вариантах реализации антигенсвязывающий белок представляет собой TCR. В некоторых вариантах реализации TCR является мембраносвязанным. В некоторых вариантах реализации TCR является растворимым TCR (например, не содержит трансмембранного или цитоплазматического домена). В некоторых вариантах реализации такие TCR содержат первый полипептид TCR, содержащий вариабельный домен TCRβ и константный домен TCRβ, и второй полипептид TCR, содержащий вариабельный домен TCRα и константный домен TCRα. В некоторых вариантах реализации вариабельный домен TCRα и/или вариабельный домен TCRβ являются вариабельными доменами TCR человека. В некоторых вариантах реализации константный домен TCRβ и/или константный домен TCRα представляют собой константные домены животного, не являющегося человеком (например, константные домены крысы или мыши). В некоторых вариантах реализации константный домен TCRβ и/или константный домен TCRα являются константными доменами человека.
Фармацевтические композиции
[0171] В некоторых вариантах реализации настоящего изобретения предложена композиция, например, фармацевтическая композиция, содержащая по меньшей мере один агент, описанный в настоящем документе (например, антигенсвязывающую молекулу, описанную в настоящем документе, например, антитело, CAR или TCR, описанные в настоящем документе, полученные из животного, не являющегося человеком, описанного в настоящем документе), в составе с фармацевтически приемлемым носителем.
[0172] Фармацевтические композиции, предложенные в настоящем изобретении, можно специально составить для введения в твердой или жидкой форме, в том числе приспособленной для следующих вариантов применения: (1) перорального введения, например, в жидкой лекарственной форме для перорального введения (водного или неводного раствора или суспензии), в форме таблеток, например, для буккального, подъязычного и системного всасывания, болюсов, порошков, гранул, паст для нанесения на язык; или (2) парентерального введения, например, путем подкожной, внутримышечной, внутривенной или эпидуральной инъекции, например, в виде стерильного раствора или суспензии, или композиции с замедленным высвобождением.
[0173] Фармацевтические композиции, предложенные в настоящем изобретении, подходящие для парентерального введения, содержат один или более из агентов, описанных в настоящем документе, в комбинации с одним или более фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями или стерильными порошками, которые можно восстановить в виде стерильных растворов или дисперсий для инъекций непосредственно перед применением, которые могут содержать углеводы, спирты, антиоксиданты, буферы, бактериостатические агенты, растворенные вещества, придающие композиции изотоничные свойства по отношению к крови предполагаемого реципиента, или суспендирующие агенты или загустители.
[0174] Примеры подходящих водных и неводных носителей, которые можно применять в фармацевтических композициях, предлоденных в настоящем изобретении, включают воду, этанол, полиолы (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, например, оливковое масло и органические сложные эфиры для инъекций, например, этилолеат. Надлежащую текучесть можно поддерживать, например, путем использования материалов покрытий, например, лецитина, путем поддержания требуемого размера частиц в случае дисперсий и путем применения поверхностно-активных веществ.
[0175] В некоторых вариантах реализации композиции содержат антитело, TCR и/или CAR, описанные в настоящем документе, в концентрации, приводящей к массово-объемному соотношению, подходящему для желательной дозы. Антитело, TCR и/или CAR могут присутствовать в композиции в концентрации, составляющей по меньшей мере 1 мг/мл, по меньшей мере 5 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 15 мг/мл, по меньшей мере 20 мг/мл, по меньшей мере 25 мг/мл, по меньшей мере 30 мг/мл, по меньшей мере 35 мг/мл, по меньшей мере 40 мг/мл, по меньшей мере 45 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 55 мг/мл, по меньшей мере 60 мг/мл, по меньшей мере 65 мг/мл, по меньшей мере 70 мг/мл, по меньшей мере 75 мг/мл, по меньшей мере 80 мг/мл, по меньшей мере 85 мг/мл, по меньшей мере 90 мг/мл, по меньшей мере 95 мг/мл, по меньшей мере 100 мг/мл, по меньшей мере 105 мг/мл, по меньшей мере 110 мг/мл, по меньшей мере 115 мг/мл, по меньшей мере 120 мг/мл, по меньшей мере 125 мг/мл, по меньшей мере 130 мг/мл, по меньшей мере 135 мг/мл, по меньшей мере 140 мг/мл, по меньшей мере 150 мг/мл, по меньшей мере 200 мг/мл, по меньшей мере 250 мг/мл или по меньшей мере 300 мг/мл.
[0176] В некоторых вариантах реализации композиция при необходимости содержит одно или более из активных соединений по конкретному показанию, подвергаемому лечению, обычно обладающих дополнительной активностью, которые не оказывают нежелательного воздействия друг на друга. Такие дополнительные активные соединения, соответственно, присутствуют в комбинации в количествах, эффективных для достижения намеченной цели.
[0177] В некоторых вариантах реализации композиции получают смешиванием антитела, TCR и/или CAR, описанных в настоящем документе, с необязательными физиологически приемлемыми носителями, вспомогательными веществами или стабилизаторами, включая буферные агенты, сахариды, соли, поверхностно-активные вещества, солюбилизаторы, полиолы, разбавители, связующие вещества, стабилизаторы, соли, липофильные растворители, аминокислоты, хелаторы, консерванты и т.п. (Goodman and Gilman's The Pharmacological Basis of Therapeutics, 12th edition, L. Brunton, et al. и Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1999)), но не ограничиваясь ими, в форме лиофилизированных композиций или водных растворов с желательной конечной концентрацией. Приемлемые носители, вспомогательные вещества или стабилизаторы являются нетоксичными для реципиентов при используемых дозах и концентрациях и включают буферы, например, на основе гистидина, фосфата, цитрата, глицина, ацетата и других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (например, хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт, алкилпарабены, например, метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные полипептиды (менее 10 остатков); белки, например, сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, например, поливинилпирролидон; аминокислоты, например, глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая трегалозу, глюкозу, маннозу или декстрины; хелатирующие агенты, например, ЭДТА; углеводы, например, сахарозу, маннит, трегалозу или сорбит; солеобразующие противоионы, например, натрия; комплексы металлов (например, Zn-белковые комплексы); и/или неионогенные поверхностно-активные вещества, например, TWEEN, полисорбат 80, PLURONICS® или полиэтиленгликоль (ПЭГ).
[0178] В некоторых вариантах реализации буферный агент представляет собой гистидин, цитрат, фосфат, глицин или ацетат. Вспомогательное вещество-сахарид может представлять собой трегалозу, сахарозу, маннит, мальтозу или раффинозу. Поверхностно-активное вещество может представлять собой полисорбат 20, полисорбат 40, полисорбат 80 или Pluronic F68. Соль может представлять собой NaCl, KCl, MgCl2 или CaCl2.
[0179] В некоторых вариантах реализации композиция содержит буферный агент или регулятор рН для улучшенного контроля рН. рН такой композиции может составлять от приблизительно 3,0 до приблизительно 9,0, от приблизительно 4,0 до приблизительно 8,0, от приблизительно 5,0 до приблизительно 8,0, от приблизительно 5,0 до приблизительно 7,0, от приблизительно 5,0 до приблизительно 6,5, от приблизительно 5,5 до приблизительно 8,0, от приблизительно 5,5 до приблизительно 7,0 или от приблизительно 5,5 до приблизительно 6,5. В дополнительном варианте реализации рН такой композиции составляет приблизительно 3,0, приблизительно 3,5, приблизительно 4,0, приблизительно 4,5, приблизительно 5,0, приблизительно 5,1, приблизительно 5,2, приблизительно 5,3, приблизительно 5,4, приблизительно 5,5, приблизительно 5,6, приблизительно 5,7, приблизительно 5,8, приблизительно 5,9, приблизительно 6,0, приблизительно 6,1, приблизительно 6,2, приблизительно 6,3, приблизительно 6,4, приблизительно 6,5, приблизительно 6,6, приблизительно 6,7, приблизительно 6,8, приблизительно 6,9, приблизительно 7,0, приблизительно 7,5, приблизительно 8,0, приблизительно 8,5 или приблизительно 9,0. В конкретном варианте реализации рН композиции составляет приблизительно 6,0. Специалист в данной области должен понимать, что рН композиции обычно не должен равняться изоэлектрической точке конкретного антитела, TCR или CAR, который предполагается использовать в композиции. Обычно буферный агент представляет собой соль, полученную из органической или неорганической кислоты или основания. Типичные буферные агенты включают соли органических кислот, например, соли лимонной кислоты, аскорбиновой кислоты, глюконовой кислоты, угольной кислоты, винной кислоты, янтарной кислоты, уксусной кислоты или фталевой кислоты; трис, гидрохлорид трометамина или фосфатные буферы, но не ограничиваются ими. Кроме того, аминокислотные компоненты также могут вносить вклад в буферную емкость. Типичные аминокислотные компоненты, которые можно применять в композиции в качестве буферных агентов, включают глицин и гистидин, но не ограничиваются ими. В некоторых вариантах реализации буферный агент выбирают из гистидина, цитрата, фосфата, глицина и ацетата. В конкретном варианте реализации буферный агент представляет собой гистидин. В еще одном конкретном варианте реализации буферный агент представляет собой цитрат. В еще одном конкретном варианте реализации буферный агент представляет собой глицин. Чистота буферного агента должна составлять по меньшей мере 98% или по меньшей мере 99% или по меньшей мере 99,5%. Термин «чистота» в настоящем документе в контексте гистидина и глицина относится к химической чистоте гистидина или глицина, в том смысле, как этот термин используют в данной области техники, например, как описано в The Merck Index, 13th ed., O'Neil et al. ed. (Merck & Co., 2001).
[0180] В некоторых вариантах реализации композиция содержит гистидин в качестве буферного агента. В некоторых вариантах гистидин присутствует в композиции в концентрации, составляющей по меньшей мере приблизительно 1 мМ, по меньшей мере приблизительно 5 мМ, по меньшей мере приблизительно 10 мМ, по меньшей мере приблизительно 20 мМ, по меньшей мере приблизительно 30 мМ, по меньшей мере приблизительно 40 мМ, по меньшей мере приблизительно 50 мМ, по меньшей мере приблизительно 75 мМ, по меньшей мере приблизительно 100 мМ, по меньшей мере приблизительно 150 мМ или по меньшей мере приблизительно 200 мМ гистидина. В еще одном варианте реализации композиция содержит между приблизительно 1 мМ и приблизительно 200 мМ, между приблизительно 1 мМ и приблизительно 150 мМ, между приблизительно 1 мМ и приблизительно 100 мМ, между приблизительно 1 мМ и приблизительно 75 мМ, между приблизительно 10 мМ и приблизительно 200 мМ, между приблизительно 10 мМ и приблизительно 150 мМ, между приблизительно 10 мМ и приблизительно 100 мМ, между приблизительно 10 мМ и приблизительно 75 мМ, между приблизительно 10 мМ и приблизительно 50 мМ, между приблизительно 10 мМ и приблизительно 40 мМ, между приблизительно 10 мМ и приблизительно 30 мМ, между приблизительно 20 мМ и приблизительно 75 мМ, между приблизительно 20 мМ и приблизительно 50 мМ, между приблизительно 20 мМ и приблизительно 40 мМ или между приблизительно 20 мМ и приблизительно 30 мМ гистидина. В дополнительном варианте реализации композиция содержит приблизительно 1 мМ, приблизительно 5 мМ, приблизительно 10 мМ, приблизительно 20 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ, приблизительно 60 мМ, приблизительно 70 мМ, приблизительно 80 мМ, приблизительно 90 мМ, приблизительно 100 мМ, приблизительно 150 мМ или приблизительно 200 мМ гистидина. В конкретном варианте реализации композиция может содержать приблизительно 10 мМ, приблизительно 25 мМ или не содержать гистидина.
[0181] В некоторых вариантах реализации композиция содержит вспомогательное вещество-углевод. Вспомогательные вещества-углеводы могут действовать, например, в качестве агентов, повышающих вязкость, стабилизаторов, наполнителей, солюбилизирующих агентов и/или т.п. агентов. Вспомогательные вещества-углеводы обычно присутствуют в концентрации от приблизительно 1 до приблизительно 99% по массе или объему, например, от приблизительно 0,1% до приблизительно 20%, от приблизительно 0,1% до приблизительно 15%, от приблизительно 0,1% до приблизительно 5%, от приблизительно 5% до приблизительно 15%, от приблизительно 8% до приблизительно 10%, от приблизительно 10% до приблизительно 15%, от приблизительно 15% до приблизительно 20%, от 0,1% до 20%, от 5% до 15%, от 8% до 10%, от 10% до 15%, от 15% до 20%, от приблизительно 0,1% до приблизительно 5%, от приблизительно 5% до приблизительно 10% или от приблизительно 15% до приблизительно 20%. В других конкретных вариантах реализации вспомогательное вещество-углевод присутствует в концентрации 1% или 1,5% или 2% или 2,5% или 3% или 4% или 5% или 10% или 15% или 20%.
[0182] В некоторых вариантах реализации композиция содержит вспомогательное вещество-углевод. Вспомогательные вещества-углеводы, пригодные для применения в композициях, включают моносахариды, например, фруктозу, мальтозу, галактозу, глюкозу, D-маннозу, сорбозу и т.п.; дисахариды, например, лактозу, сахарозу, трегалозу, целлобиозу и т.п.; полисахариды, например, раффинозу, мелецитозу, мальтодекстрины, декстраны, крахмалы и т.п.; и альдиты, например, маннит, ксилит, мальтит, лактит, ксилит-сорбит (глюцит) и т.п., но не ограничиваются ими. В некоторых вариантах реализации вспомогательные вещества-углеводы для применения в композициях, предложенных в настоящем изобретении, выбирают из сахарозы, трегалозы, лактозы, маннита и раффинозы. В конкретном варианте реализации вспомогательное вещество-углевод представляет собой трегалозу. В еще одном конкретном варианте реализации вспомогательное вещество-углевод представляет собой маннит. В еще одном конкретном варианте реализации вспомогательное вещество-углевод представляет собой сахарозу. В еще одном конкретном варианте реализации вспомогательное вещество-углевод представляет собой раффинозу. Чистота вспомогательного вещества-углевода должна составлять по меньшей мере 98% или по меньшей мере 99% или по меньшей мере 99,5%.
[0183] В некоторых вариантах реализации композиция содержит трегалозу. В некоторых вариантах реализации композиция содержит по меньшей мере приблизительно 1%, по меньшей мере приблизительно 2%, по меньшей мере приблизительно 4%, по меньшей мере приблизительно 8%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 30% или по меньшей мере приблизительно 40% трегалозы. В еще одном варианте реализации композиция содержит от приблизительно 1% до приблизительно 40%, от приблизительно 1% до приблизительно 30%, от приблизительно 1% до приблизительно 20%, от приблизительно 2 до приблизительно 40%, от приблизительно 2 до приблизительно 30 %, от приблизительно 2% до приблизительно 20%, от приблизительно 4% до приблизительно 40%, от приблизительно 4% до приблизительно 30% или от приблизительно 4% до приблизительно 20% трегалозы. В дополнительном варианте реализации композиция содержит приблизительно 1%, приблизительно 2%, приблизительно 4%, приблизительно 6%, приблизительно 8%, приблизительно 15%, приблизительно 20%, приблизительно 30% или приблизительно 40% трегалозы. В конкретном варианте реализации композиция содержит приблизительно 4%, приблизительно 6% или приблизительно 15% трегалозы.
[0184] В некоторых вариантах реализации композиция содержит вспомогательное вещество. В конкретном варианте реализации композиция содержит по меньшей мере одно вспомогательное вещество, выбранное из: углевода, соли, поверхностно-активного вещества, аминокислоты, полиола, хелатирующего агента, эмульгатора и консерванта. В некоторых вариантах реализации композиция содержит соль, например, соль, выбранную из: NaCl, KCl, CaCl2 и MgCl2. В конкретном варианте реализации композиция содержит NaCl.
[0185] В некоторых вариантах реализации композиция содержит аминокислоту, например, лизин, аргинин, глицин, гистидин или соль аминокислоты. Композиция может содержать по меньшей мере приблизительно 1 мМ, по меньшей мере приблизительно 10 мМ, по меньшей мере приблизительно 25 мМ, по меньшей мере приблизительно 50 мМ, по меньшей мере приблизительно 100 мМ, по меньшей мере приблизительно 150 мМ, по меньшей мере приблизительно 200 мМ, по меньшей мере приблизительно 250 мМ, по меньшей мере приблизительно 300 мМ, по меньшей мере приблизительно 350 мМ или по меньшей мере приблизительно 400 мМ аминокислоты. В еще одном варианте реализации композиция может содержать между приблизительно 1 мМ и приблизительно 100 мМ, между приблизительно 10 мМ и приблизительно 150 мМ, между приблизительно 25 мМ и приблизительно 250 мМ, между приблизительно 25 мМ и приблизительно 300 мМ, между приблизительно 25 мМ и приблизительно 350 мМ, между приблизительно 25 мМ и приблизительно 400 мМ, между приблизительно 50 мМ и приблизительно 250 мМ, между приблизительно 50 мМ и приблизительно 300 мМ, между приблизительно 50 мМ и приблизительно 350 мМ, между приблизительно 50 мМ и приблизительно 400 мМ, между приблизительно 100 мМ и приблизительно 250 мМ, между приблизительно 100 мМ и приблизительно 300 мМ, между приблизительно 100 мМ и приблизительно 400 мМ, между приблизительно 150 мМ и приблизительно 250 мМ, между приблизительно 150 мМ и приблизительно 300 мМ или между приблизительно 150 мМ и приблизительно 400 мМ аминокислоты. В дополнительном варианте реализации композиция содержит приблизительно 1 мМ, 1,6 мМ, 25 мМ, приблизительно 50 мМ, приблизительно 100 мМ, приблизительно 150 мМ, приблизительно 200 мМ, приблизительно 250 мМ, приблизительно 300 мМ, приблизительно 350 мМ или приблизительно 400 мМ аминокислоты.
[0186] В некоторых вариантах реализации композиция содержит поверхностно-активное вещество. Термин «поверхностно-активное вещество» в настоящем документе относится к органическим веществам, содержащим амфипатические структуры; а именно, состоящим из групп с противоположными тенденциями растворимости, как правило, жирорастворимой углеводородной цепи и водорастворимой ионной группы. Поверхностно-активные вещества можно классифицировать в зависимости от заряда поверхностно-активной группы на анионные, катионные и неионогенные поверхностно-активные вещества. Поверхностно-активные вещества часто используются в качестве увлажняющих, эмульгирующих, солюбилизирующих и диспергирующих агентов для различных фармацевтических композиций и препаратов биологических материалов. Фармацевтически приемлемые поверхностно-активные вещества, например, полисорбаты (например , полисорбаты 20 или 80); полоксамеры (например, полоксамер 188); Triton; октилгликозид натрия; лаурил-, миристил-, линоил- или стеарилсульфобетаин; лаурил-, миристил-, линоил- или стеарилсаркозин; линоил-, миристил- или цетилбетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил- или изостеарамидопропилбетаин (например, лауроамидопропилбетаин); миристамидопропил-, пальмидопропил- или изостеарамидопропилдиметиламин; метилкокоилтаурат натрия или метилолеилтаурат натрия; а также ПАВ серии MONAQUA® (Mona Industries, Inc., Патерсон, штат Нью-Джерси, США), полиэтиленгликоль, полипропилгликоль и сополимеры этилен- и пропиленгликоля (например, PLURONICS® PF68 и т.д.) необязательно можно добавлять в композиции для снижения агрегации. В некоторых вариантах реализации композиция содержит полисорбат 20, полисорбат 40, полисорбат 60 или полисорбат 80. Поверхностно-активные вещества особенно полезны, если для введения композиции используют насос или пластиковый контейнер. Присутствие фармацевтически приемлемого поверхностно-активного вещества снижает склонность белка к агрегации. Композиции могут содержать полисорбат в концентрации от приблизительно 0,001 до приблизительно 1% или от приблизительно 0,001% до приблизительно 0,1% или от приблизительно 0,01% до приблизительно 0,1%. В других конкретных вариантах реализации композиции содержат полисорбат в концентрации 0,001% или 0,002% или 0,003% или 0,004% или 0,005% или 0,006% или 0,007% или 0,008% или 0,009% или 0,01% или 0,015% или 0,02%.
[0187] В некоторых вариантах реализации композиция содержит другие вспомогательные вещества и/или добавки, включая разбавители, связующие вещества, стабилизаторы, липофильные растворители, консерванты, адъюванты и т.п., но не ограничиваясь ими. Фармацевтически приемлемые вспомогательные вещества и/или добавки можно применять в композициях, предложенных в настоящем изобретении. В композиции для снижения агрегации необязательно можно добавлять распространенные вспомогательные вещества/добавки, например, фармацевтически приемлемые хелаторы (например, ЭДТА, DTPA или EGTA, но не ограничиваясь ими). Эти добавки особенно полезны, если для введения композиции используют насос или пластиковый контейнер.
[0188] В некоторых вариантах реализации композиция содержит консервант. В композиции необязательно можно добавлять консерванты, например, фенол, м-крезол, п-крезол, о-крезол, хлоркрезол, бензиловый спирт, нитрит фенилртути, феноксиэтанол, формальдегид, хлорбутанол, хлорид магния (например, в числе прочего, гексагидрат), алкилпарабен (метил-, этил-, пропил-, бутил- и т.п.), бензалконийхлорид, бензетонийхлорид, дегидроацетат натрия и тимеросал или их смеси в любой подходящей концентрации, например, от приблизительно 0,001 до приблизительно 5% или в любом диапазоне или значении концентрации в пределах указанного диапазона. Концентрация консерванта, используемого в композициях, представляет собой концентрацию, достаточную для воздействия на микроорганизмы. Такие концентрации зависят от выбранного консерванта; их легко может определить специалист в данной области техники.
[0189] В некоторых вариантах реализации композиция является изотоничной по отношению к крови человека, причем осмотическое давление композиций практически совпадает с осмотическим давлением крови человека. Осмотическое давление таких изотонических композиций обычно составляет от приблизительно 250 до приблизительно 350 мОсм. Изотоничность можно измерять, например, с использованием парофазного или криоскопического осмометра. Тоничность композиции регулируют с помощью модификаторов тоничности. «Модификаторы тоничности» представляют собой фармацевтически приемлемые инертные вещества, которые можно добавлять в композицию для обеспечения изотоничности композиции. Модификаторы тоничности, подходящие для композиций, предложенных в настоящем изобретении, включают сахариды, соли и аминокислоты, но не ограничиваются ими.
[0190] В некоторых вариантах реализации композиция представляет собой композицию, не содержащую пирогенных веществ, которая практически не содержит эндотоксинов и/или родственных пирогенных веществ. Эндотоксины включают токсины, которые содержатся внутри микроорганизма и высвобождаются только при разрушении или гибели микроорганизмов. Пирогенные вещества также включают вызывающие лихорадку термостабильные вещества внешней мембраны бактерий и других микроорганизмов. Вещества обоих этих типов могут вызывать лихорадку, гипотензию и шок при введении человеку. Из-за потенциальных вредоносных эффектов из растворов лекарственных средств для внутривенного введения следует удалять даже небольшие количества эндотоксинов. Управление по контролю качества пищевых продуктов и лекарственных средств США («FDA») установило верхний предел для внутривенных лекарственных средств, равный 5 эндотоксиновым единицам (ЭЕ) на дозу на килограмм массы тела за один одночасовой период (The United States Pharmacopeial Convention, Pharmacopeial Forum 26 (1):223 (2000)). При введении терапевтических белков в количестве от нескольких сотен до тысячи миллиграммов на килограмм массы тела, как это может иметь место в случае с рассматриваемыми белками (например, антителами), необходимо удалить даже следовые количества вредоносных и опасных эндотоксинов. В некоторых вариантах реализации уровни эндотоксинов и пирогенов в композиции составляют менее 10 ЭЕ/мг или менее 5 ЭЕ/мг или менее 1 ЭЕ/мг или менее 0,1 ЭЕ/мг или менее 0,01 ЭЕ/мг или менее 0,001 ЭЕ/мг.
[0191] При применении для введения in vivo композиция, описанная в настоящем документе, должна быть стерильной. Композицию можно стерилизовать с использованием различных способов стерилизации, в том числе стерильной фильтрацией, излучением и т.д. В некоторых вариантах реализации композицию стерилизуют фильтрацией с использованием предварительно стерилизованного 0,22-микронного фильтра. Стерильные композиции для инъекций можно составить в соответствии с традиционной фармацевтической практикой, описанной в пособии “Remington: The Science & Practice of Pharmacy”, 21st ed., Lippincott Williams & Wilkins, (2005). Композиции, содержащие рассматриваемые белки (например, антитела или TCR или CAR), например, описанные в настоящем документе, обычно следует хранить в лиофилизированной форме или в растворе. Предполагается, что стерильные композиции, содержащие рассматриваемые белки (например, антитело, TCR или CAR), помещают в контейнер с портом для стерильного доступа, например, пакет или флакон для внутривенного введения раствора с адаптером, который позволяет извлекать композицию, например, пробкой, прокалываемой иглой для подкожных инъекций. В некоторых вариантах реализации предложена композиция в виде предварительно заполненного шприца.
[0192] В некоторых вариантах реализации композиция представляет собой лиофилизированный состав. Термин «лиофилизированный» или «сублимированный» включает состояние вещества, подвергнутого процедуре сушки, например, лиофилизации, при которой было удалено по меньшей мере 50% влаги.
[0193] Независимо от выбранного пути введения, предложенные в настоящем изобретении агенты, которые можно использовать в подходящей гидратированной форме, и/или фармацевтические композиции агентов, предложенных в настоящем изобретении, составляют в виде фармацевтически приемлемых лекарственных форм обычными способами, известными специалистам в данной области техники.
Терапевтические способы
[0194] В некоторых аспектах настоящего изобретения предложены способы лечения заболевания или расстройства, включающие введение субъекту антигенсвязывающего белка (например, антитела, TCR и/или CAR, описанных в настоящем документе, например, полностью человеческого антитела, TCR или CAR). В некоторых вариантах реализации указанное антитело, TCR и/или CAR представляет собой антитело, TCR и/или CAR, полученные или получаемые с использованием способов, описанных в настоящем документе (например, с использованием животного, не являющегося человеком, описанного в настоящем документе).
[0195] В некоторых вариантах реализации настоящего изобретения предложены способы лечения рака у субъекта, включающие введение субъекту фармацевтической композиции, описанной в настоящем документе (например, фармацевтической композиции, содержащей антитело, описанное в настоящем документе, например, полностью человеческое антитело, TCR или CAR, описанные в настоящем документе, полученные из животного, не являющегося человеком, как описано в настоящем документе). В некоторых вариантах реализации способы, описанные в настоящем документе, можно применять для лечения любой раковой или предраковой опухоли. Онкологические заболевания, которые можно лечить способами и композициями, описанными в настоящем документе, включают раковые клетки мочевого пузыря, крови, кости, костного мозга, головного мозга, молочной железы, толстой кишки, пищевода, желудочно-кишечного тракта, десны, головы, почки, печени, легкого, носоглотки, шеи, яичника, предстательной железы, кожи, желудка, яичка, языка или матки, но не ограничиваются ими. Неограничивающие примеры различных гистологических типов рака включают: злокачественное новообразование; карциному; недифференцированную карциному; гигантоклеточную и веретеноклеточную карциному; мелкоклеточную карциному; папиллярную карциному; плоскоклеточную карциному; лимфоэпителиальную карциному; базально-клеточную карциному; пиломатриксную карциному; переходно-клеточную карциному; папиллярную переходно-клеточную карциному; аденокарциному; злокачественную гастриному; холангиокарциному; гепатоцеллюлярную карциному; комбинированную гепатоцеллюлярную карциному и холангиокарциному; трабекулярную аденокарциному; аденокистозную карциному; аденокарциному в аденоматозном полипе; аденокарциному, семейный коли-полипоз; плотную карциному; злокачественную карциноидную опухоль; бронхоальвеолярную аденокарциному; папиллярную аденокарциному; хромофобную карциному; ацидофильную карциному; оксифильную аденокарциному; базофильную карциному; язвенную аденокарциному; гранулярно-клеточную карциному; фолликулярную аденокарциному; папиллярную и фолликулярную аденокарциному; некапсулирующую склерозирующую карциному; карциному коры надпочечников; карциному эндометрия; карциному придатков кожи; апокринную аденокарциному; сальную аденокарциному; атерокарциному; мукоэпидермоидную карциному; цистаденокарциному; папиллярную цистаденокарциному; папиллярную серозную цистаденокарциному; муцинозную цистаденокарциному; муцинозную аденокарциному; перстневидноклеточную карциному; инфильтративно-протоковую карциному; медуллярную карциному; лобулярную карциному; воспалительную карциному; рак молочной железы Педжета; ацинарно-клеточную карциному; желёзисто-плоскоклеточную карциному; аденокарциному с плоскоклеточной метаплазией; злокачественную тимому; злокачественную опухоль стромы яичника; злокачественную текому; злокачественную гранулезоклеточную опухоль; злокачественную андробластому; карциному из клеток Сертоли; злокачественную опухоль из клеток Лейдига; злокачественную опухоль из жировых клеток; злокачественную параганглиому; злокачественную экстрамамиллярную параганглиому; феохромоцитому; гломангиосаркому; злокачественную меланому; беспигментную меланому; поверхностную распространяющуюся меланому; злокачественную меланому в гигантском пигментированном невусе; эпителиоидноклеточную меланому; злокачественный синий невус; саркому; фибросаркому; злокачественную фиброзную гистиоцитому; злокачественную миксому; липосаркому; лейомиосаркому; рабдомиосаркому; эмбриональную рабдомиосаркому; альвеолярную рабдомиосаркому; стромальную саркому; злокачественную смешанную опухоль; смешанную опухоль Мюллера; нефробластому; гепатобластому; карциносаркому; злокачественную мезенхимому; злокачественную опухоль Бреннера; злокачественную филлоидную опухоль; синовиальную саркому; злокачественную мезотелиому; дисгерминому; эмбриональную карциному; злокачественную тератому; злокачественную струму яичника; хориокарциному; злокачественную мезонефрому; гемангиосаркому; злокачественную гемангиоэндотелиому; саркому Капоши; злокачественную гемангиоперицитому; лимфангиосаркому; остеосаркому; юкстакортикальную остеосаркому; хондросаркому; злокачественную хондробластому; мезенхимальную хондросаркому; гигантоклеточную опухоль кости; саркому Юинга; злокачественную одонтогенную опухоль; амелобластическую одонтосаркому; злокачественную амелобластому; амелобластную фибросаркому; злокачественную пинеалому; хордому; злокачественную глиому; эпендимому; астроцитому; протоплазматическую астроцитому; фибриллярную астроцитому; астробластому; глиобластому; олигодендроглиому; олигодендробластомау; примитивную нейроэктодермальную опухоль; саркому мозжечка; ганглионевробластому; нейробластому; ретинобластому; ольфакторную нейрогенную опухоль; злокачественную менингиому; неврофибросаркому; злокачественную нейриллемому; злокачественную зернистоклеточную опухоль; злокачественную лимфому; болезнь Ходжкина; лимфому Ходжкина; парагранулему; мелкоклеточную лимфоцитарную злокачественную лимфому; крупноклеточную лимфоцитарную диффузную злокачественную лимфому; фолликулярную злокачественную лимфому; фунгоидную гранулёму; другие уточненные неходжкинские лимфомы; злокачественный гистиоцитоз; множественную миелому; тучноклеточную саркому; иммунопролиферативное заболевание тонкой кишки; лейкоз; лимфоидный лейкоз; плазмаклеточный лейкоз; эритролейкоз; лимфосаркомно-клеточный лейкоз; миелоидный лейкоз; базофильный лейкоз; эозинофильный лейкоз; моноцитарный лейкоз; тучноклеточный лейкоз; мегакариобластный лейкоз; миелоидную саркому; и волосатоклеточный лейкоз.
[0196] В некоторых вариантах реализации антитело, TCR или CAR в фармацевтической композиции, вводимой субъекту, обладает специфичностью связывания по отношению к эпитопу антигена высокого канцерогенного риска (например, эпитопу, экспрессируемому злокачественным заболеванием, подвергаемым лечению). Примеры антигенов высокого канцерогенного риска включают адипофилин, AIM-2, ALDH1A1, альфа-актинин-4, альфа-фетопротеин («АФП»), ARTC1, B-RAF, BAGE-1, BCLX (L), гибридный белок BCR-ABL b3a2, бета-катенин, BING-4, CA-125, CALCA, карциноэмбриональный антиген (“CEA”), CASP-5, CASP-8, CD274, CD45, Cdc27, CDK12, CDK4, CDKN2A, CEA, CLPP, COA-1, CPSF, CSNK1A1, CTAG1, CTAG2, циклин D1, циклин A1, гибридный белок dek-can, DKK1, EFTUD2, фактор элонгации 2, ENAH (hMena), Ep-CAM, EpCAM, EphA3, эпителиальный опухолевый антиген (“ETA”), гибридный белок ETV6-AML1, EZH2, FGF5, FLT3-ITD, FN1, G250/MN/CAIX, GAGE-1,2,8, GAGE-3,4,5,6,7, GAS7, глипикан-3, GnTV, gp100/Pmel17, GPNMB, HAUS3, гепсин, HER-2/neu, HERV-K-MEL, HLA-A11, HLA-A2, HLA-DOB, hsp70-2, IDO1, IGF2B3, IL13R-альфа-2, карбоксилэстеразу кишечника, K-ras, калликреин 4, KIF20A, KK-LC-1, KKLC1, KM-HN-1, KMHN1, также известный как CCDC110, LAGE-1, гибридный белок LDLR-фукозилтрансфераза AS, ленгсин, МКСФ, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-C1, MAGE-C2, яблочный фермент, маммаглобин-A, MART2, MATN, MC1R, MCSP, mdm-2, ME1, мелан-A/MART-1, Meloe, мидкин, MMP-2, MMP-7, MUC1, MUC5AC, муцин, MUM-1, MUM-2, MUM-3, миозин, миозин I класса, N-raw, NA88-A, neo-PAP, NFYC, NY-BR-1, NY-ESO-1/LAGE-2, OA1, OGT, OS-9, полипептид P, p53, PAP, PAX5, PBF, гибридный белок pml-RAR-альфа, полиморфный эпителиальный муцин (“PEM”), PPP1R3B, PRAME, PRDX5, PSA, PSMA, PTPRK, RAB38/NY-MEL-1, RAGE-1, RBAF600, RGS5, RhoC, RNF43, RU2AS, SAGE, сецернин 1, SIRT2, SNRPD1, SOX10, Sp17, SPA17, SSX-2, SSX-4, STEAP1, сурвивин, гибридный белок SYT-SSX1 или -SSX2, TAG-1, TAG-2, теломеразу, TGF-бета-RII, TPBG, TRAG-3, триозофосфатизомеразу, TRP-1/gp75, TRP-2, TRP2-INT2, тирозиназу, тирозиназу (“TYR”), ФРЭС, WT1, XAGE-1b/GAGED2a, но не ограничиваются ими. В некоторых вариантах реализации антиген представляет собой неоантиген.
[0197] В некоторых вариантах реализации настоящего изобретения предложены способы лечения субъекта, страдающего от инфекции, включая вирусную инфекцию, грибковую инфекцию, бактериальную инфекцию, гельминтную инвазию или протозойную инфекцию, включающие введение субъекту фармацевтической композиции, описанной в настоящем документе (например, фармацевтической композиции, содержащей антитело, TCR или CAR, описанные в настоящем документе, полученные из животных, не являющихся человеком, описанных в настоящем документе). Неограничивающие примеры вирусных инфекционных заболеваний включают заболевания, вызванные вирусами ВПЧ, ВГВ, вирусом гепатита C (ВГС), ретровирусами, например, вирусом иммунодефицита человека (ВИЧ-1 и ВИЧ-2), вирусами герпеса, например, вирусом Эпштейна-Барр (ВЭБ), цитомегаловирусом (ЦМВ), ВПГ-1 и ВПГ-2 и вирусом гриппа. Неограничивающим примером паразитарной инфекции является малярия. Неограничивающие примеры бактериальных, грибковых и других патогенных заболеваний включают заболевания, вызванные Aspergillus, Brugia, Candida, Chlamydia, Coccidia, Cryptococcus, Dirofilaria, Gonococcus, Histoplasma, Leishmania, Mycobacterium, Mycoplasma, Paramecium, Pertussis, Plasmodium, Pneumococcus, Pneumocystis, Rickettsia, Salmonella, Shigella, Staphylococcus, Streptococcus, Toxoplasma и Vibriocholerae. Типичные виды включают Neisseria gonorrhea, Mycobacterium tuberculosis, Candida albicans, Candida tropicalis, Trichomonas vaginalis, Haemophilus vaginalis, Streptococcus sp. группы В, Microplasma hominis, Hemophilus ducreyi, Granuloma inguinale, Lymphopathia venereum, Treponema pallidum, Brucella abortus. Brucella melitensis, Brucella suis, Brucella canis, Campylobacter fetus, Campylobacter fetus intestinalis, Leptospira pomona, Listeria monocytogenes, Brucella ovis, Chlamydia psittaci, Trichomonas foetus, Toxoplasma gondii, Escherichia coli, Actinobacillus equuli, Salmonella abortus ovis, Salmonella abortus equi, Pseudomonas aeruginosa, Corynebacterium equi, Corynebacterium pyogenes, Actinobaccilus seminis, Mycoplasma bovigenitalium, Aspergillus fumigatus, Absidia ramosa, Trypanosoma equiperdum, Babesia caballi, Clostridium tetani, Clostridium botulinum; или гриб, например, Paracoccidioides brasiliensis; или другой патогенный организм, например, Plasmodium falciparum.
[0198] В некоторых вариантах реализации антитело, TCR или CAR в фармацевтической композиции, вводимой субъекту, обладает специфичностью связывания по отношению к эпитопу антигена, экспрессируемому патогенным организмом, вызывающим инфекцию (например, эпитопу, экспрессируемому патогенным организмом, вызывающим инфекцию, подвергаемую лечению).
[0199] В некоторых вариантах реализации настоящего изобретения предложен способ лечения воспалительного заболевания, отторжения трансплантата кожи или органа, реакции "трансплантат против хозяина" (РТПХ) или аутоиммунных заболеваний, включающие введение субъекту фармацевтической композиции, описанной в настоящем документе (например, фармацевтической композиции, содержащей антитело, TCR или CAR, описанные в настоящем документе, полученные из животных, не являющихся человеком, как описано в настоящем документе). Примеры аутоиммунных заболеваний включают, например, гломерулярный нефрит, артрит, заболевание, подобное дилатационной кардиомиопатии, язвенный колит, синдром Шегрена, болезнь Крона, системные эритематозы, хронический ревматоидный артрит, рассеянный склероз, псориаз, аллергический контактный дерматит, полимиоз, пахидерму, узелковый периартериит, ревматическую лихорадку, витилиго обыкновенное, инсулинзависимый сахарный диабет, болезнь Бехчета, болезнь Хашимото, болезнь Аддисона, дерматомиозит, миастению гравис, синдром Рейтера, болезнь Грейвса, злокачественную анемию, синдром Гудпасчера, бесплодие, хронический активный гепатит, пемфигус, аутоиммунную тромбопеническую пурпуру и аутоиммунную гемолитическую анемию, активный хронический гепатит, болезнь Аддисона, антифосфолипидный синдром, атопическую аллергию, аутоиммунный атрофический гастрит, аутоиммунную ахлоргидрию, целиакию, синдром Кушинга, дерматомиозит, дискоидную волчанку, эритематоз, синдром Гудпасчера, тиреоидит Хашимото, идиопатическую атрофию надпочечников, идиопатическую тромбоцитопению, инсулинзависимый диабет, синдром Ламберта-Итона, волчаночный гепатит, некоторые случаи лимфопении, смешанное заболевание соединительной ткани, пемфигоид, вульгарный пемфигус, злокачественную анемию, белково-анафилактический увеит, узелковый полиартериит, полигландулярные аутосиндромы, первичный билиарный цирроз, первичный склерозирующий холангит, синдром Рейно, рецидивирующий полихондрит, синдром Шмидта, ограниченную склеродермию (или CREST-синдром), симпатическую офтальмию, системную красную волчанку, артериит Такаясу, височный артериит, тиреотоксикоз, инсулинрезистентность типа b, язвенный колит и гранулематоз Вегенера.
[0200] В некоторых вариантах реализации антитело, TCR или CAR в фармацевтической композиции, вводимой субъекту, обладает специфичностью связывания по отношению к мишени аутореактивной Т-клетки при заболевании, подвергаемом лечению (например, эпитопу, являющемуся мишенью аутореактивных Т-клеток при заболевании, подвергаемом лечению). Типичные белки, являющиеся мишенями аутореактивных Т-клеток, включают, например, p205, инсулин, тиреотропный гормон, тирозиназу, TRP1 и миелин.
[0201] Фармацевтические композиции, описанные в настоящем документе, можно доставлять с использованием любого подходящего пути введения, в том числе перорально, назально, например, в виде аэрозоля, ректально, интравагинально, парентерально, внутримышечно и местно, например, в виде порошков, мазей или капель, в том числе буккально и сублингвально. В некоторых вариантах реализации фармацевтические композиции доставляют генерализованно (например, посредством перорального или парентерального введения).
[0202] Фактические уровни дозировки активных ингредиентов в фармацевтических композициях, описанных в настоящем документе, можно варьировать, получая количество активного ингредиента, позволяющее эффективно достичь желательной реакции на лечение для конкретного пациента, композиции и способа введения, и не являющееся токсичным для пациента.
[0203] Выбранный уровень дозировки зависит от множества факторов, включая активность конкретного используемого агента, путь введения, время введения, скорость выделения или метаболизм конкретного используемого соединения, продолжительность лечения, другие лекарственные средства, соединения и/или материалы, применяемые в комбинации с конкретным используемым соединением, возраст, пол, вес, состояние, общее состояние здоровья и предыдущую историю болезни пациента, подвергаемого лечению, и аналогичные факторы, хорошо известные в медицине.
[0204] В некоторых вариантах реализации CAR и/или TCR, описанные в настоящем документе, применяют для Т-клеточной терапии. Например, в некоторых вариантах реализации Т-клетки, экспрессирующие CAR и/или TCR, описанные в настоящем документе, вводят субъекту с целью индукции Т-клеточного иммунного ответа у субъекта. Способы, которые можно применять для Т-клеточной терапии, описаны, например, в статьях Schumacher Nat. Rev. Immunol. 2:512-519 (2002) и Bitton et al., Frontiers in Bioscience 4:d386-393 (1999), каждая из которых включена в настоящий документ посредством ссылки.
[0205] В некоторых аспектах настоящего изобретения предложен способ индукции иммунного ответа (например, Т-клеточного иммунного ответа) у субъекта. В некоторых вариантах реализации указанный способ включает введение субъекту клетки (например, Т-клетки человека, например, CD4 Т-клетки или CD8 Т-клетки), экспрессирующей CAR или TCR, описанные в настоящем документе.
[0206] В некоторых вариантах реализации субъект является субъектом, нуждающимся в этом. В некоторых вариантах реализации субъект является субъектом, страдающим злокачественным заболеванием, или субъектом, инфицированным патогенным организмом. В таких вариантах реализации пептид в комплексе пептид/МНС, распознаваемом CAR или TCR, представляет собой пептид ракового антигена или пептид антигена, экспрессируемого патогенным организмом, вызывающим инфекцию.
[0207] В некоторых аспектах настоящего изобретения предложен способ ингибирования иммунного ответа у субъекта. В некоторых вариантах реализации указанный способ включает введение субъекту регуляторной Т-клетки (например, CD4+, CD-25+ и Foxp3+ регуляторной Т-клетки или Treg17-T-клетки), экспрессирующей описанный CAR или TCR.
[0208] В некоторых вариантах реализации субъект является субъектом, нуждающимся в этом, например, субъектом, страдающим аутоиммунным заболеванием. В таких вариантах реализации Т-клетка представляет собой регуляторную Т-клетку (т.е. Т-супрессор), а пептид в комплексе пептид/МНС, распознаваемом TCR или CAR, представляет собой аутоантиген, к которому у субъекта развивается аутоиммунный ответ.
Молекулы нуклеиновых кислот
[0209] В настоящем документе представлены молекулы нуклеиновых кислот, кодирующие антитела, TCR или CAR, описанные в настоящем документе, и/или фрагменты антител, TCR и CAR, описанные в настоящем документе. В некоторых вариантах реализации нуклеиновая кислота кодирует вариабельный домен антитела, TCR или CAR, описанного в настоящем документе. Молекулы нуклеиновой кислоты могут присутствовать, например, в целых клетках, в клеточном лизате или в частично очищенной или практически чистой форме.
[0210] В некоторых аспектах настоящего изобретения предложены нуклеиновые кислоты, кодирующие полипептид антитела, TCR и/или CAR, описанных в настоящем документе, или их фрагмента. Нуклеиновые кислоты могут присутствовать, например, в целых клетках, в клеточном лизате или в частично очищенной или практически чистой форме. Нуклеиновые кислоты, описанные в настоящем документе, можно получить с использованием стандартных молекулярно-биологических методик. Например, молекулы нуклеиновых кислот, описанные в настоящем документе, можно клонировать с использованием стандартных методик ПЦР или синтезировать химически. Для нуклеиновых кислот, кодирующих CAR, TCR или антитела, экспрессируемые гибридомами, можно получить кДНК, кодирующие каждую цепь антитела, TCR или CAR, продуцируемых гибридомой, с помощью стандартных методик ПЦР-амплификации или клонирования кДНК.
[0211] В некоторых вариантах реализации настоящего изобретения предложены векторы, содержащие молекулы нуклеиновой кислоты, описанные в настоящем документе. Термин «вектор» в настоящем документе относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Один из типов вектора представляет собой «плазмиду», которая относится к циклической двухцепочечной петле ДНК, в которую можно лигировать дополнительные сегменты ДНК. Еще один тип вектора представляет собой вирусный вектор, в котором дополнительные сегменты ДНК можно лигировать в геном вируса. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, содержащие бактериальный сайт инициации репликации, и эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) могут встраиваться в геном клетки-хозяина при введении в клетку-хозяина и, таким образом, реплицироваться вместе с геномом хозяина. Более того, некоторые векторы способны контролировать экспрессию генов. Такие векторы называются в настоящем документе «рекомбинантными экспрессирующими векторами» (или просто «экспрессирующими векторами»).
[0212] В некоторых вариантах реализации настоящего изобретения предложены клетки, содержащие описанную в настоящем документе нуклеиновую кислоту (например, нуклеиновую кислоту, кодирующую антитело, TCR или CAR, описанные в настоящем документе, или их фрагмент). Клетка может быть, например, прокариотической, эукариотической, клеткой млекопитающего, птицы, мыши и/или человека. В некоторых вариантах реализации нуклеиновая кислота, описанная в настоящем документе, функционально связана с элементом контроля транскрипции, например, промотором. В некоторых вариантах реализации клетка транскрибирует нуклеиновую кислоту, описанную в настоящем документе, и тем самым экспрессирует антитело, его антигенсвязывающий фрагмент или полипептид, описанный в настоящем документе. Молекулу нуклеиновой кислоты можно встроить в геном клетки, или она может являться внехромосомной.
[0213] Молекулы нуклеиновой кислоты, предложенные в настоящем изобретении, можно получить с использованием стандартных молекулярно-биологических методик. Например, молекулы нуклеиновых кислот, описанные в настоящем документе, можно клонировать с использованием стандартных методик ПЦР или синтезировать химически.
[0214] Для нуклеиновых кислот антител и CAR, описанных в настоящем документе, после получения фрагментов ДНК, кодирующих VH- и VL-сегменты, эти фрагменты ДНК можно дополнительно обработать с использованием стандартной технологии рекомбинантных ДНК, например, с целью преобразования генов вариабельной области в гены полноразмерной цепи антитела, гены Fab-фрагмента или ген scFv. В этих манипуляциях фрагмент ДНК, кодирующий VL или VH, функционально связывают с другим фрагментом ДНК, кодирующим другой белок, например, константную область антитела или гибкий линкер. Термин «функционально связанный» в данном контексте предназначен для обозначения соединения двух фрагментов ДНК таким образом, что аминокислотные последовательности, кодируемые указанными двумя фрагментами ДНК, находятся в одной рамке считывания.
[0215] Выделенную ДНК, кодирующую вариабельную область тяжелой цепи, можно преобразовать в ген полноразмерной тяжелой цепи путем функционального связывания ДНК вариабельной области тяжелой цепи с другой молекулой ДНК, кодирующей константные области тяжелой цепи (например, CH1, CH2 и CH3). Последовательности генов константной области тяжелой цепи человека известны в данной области техники (см., например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, или Lefranc, The Immunoglobulin Handbook, London: Academic Press 2001), и фрагменты ДНК, охватывающие эти области, можно получить стандартной ПЦР-амплификацией. Константная область тяжелой цепи может, например, представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. В случае гена тяжелой цепи Fab-фрагмента ДНК, кодирующую VH, можно функционально связать с другой молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи.
[0216] Выделенную ДНК, кодирующую вариабельную область легкой цепи, можно преобразовать в ген полноразмерной легкой цепи (а также ген легкой цепи Fab-фрагмента) путем функционального связывания ДНК вариабельной области легкой цепи с другой молекулой ДНК, кодирующей константную область легкой цепи. Последовательности генов константной области легкой цепи человека известны в данной области техники (см., например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, или Lefranc, The Immunoglobulin Handbook, London: Academic Press 2001), и фрагменты ДНК, охватывающие эти области, можно получить стандартной ПЦР-амплификацией. Константная область легкой цепи может представлять собой константную каппа- или лямбда-область.
ДОПОЛНИТЕЛЬНЫЕ ТИПИЧНЫЕ ВАРИАНТЫ РЕАЛИЗАЦИИ
[0217] В типичном варианте реализации 1 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, геном которого содержит последовательность нуклеиновой кислоты, кодирующую терминальную дезоксинуклеотидилтрансферазу человека (hTdT).
[0218] В типичном варианте реализации 2 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 1, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая hTdT, функционально связана с элементом контроля транскрипции.
[0219] В типичном варианте реализации 3 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 2, отличающееся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей hTdT, в про-В-клетках и/или в пре-В-клетках.
[0220] В типичном варианте реализации 4 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 2, отличающееся тем, что элемент контроля транскрипции выбран из группы, состоящей из элемента контроля транскрипции RAG1, элемента контроля транскрипции RAG2, элемента контроля транскрипции тяжелой цепи иммуноглобулина, элемента контроля транскрипции легкой κ-цепи иммуноглобулина и/или элемента контроля транскрипции легкой λ-цепи иммуноглобулина.
[0221] В типичном варианте реализации 5 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации 1-4, отличающееся тем, что указанное животное, не являющееся человеком, экспрессирует hTdT в про-В-клетках и/или пре-В-клетках.
[0222] В типичном варианте реализации 6 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 2, отличающееся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей hTdT, в двойных отрицательных (DN) CD4/CD8 тимоцитах и/или двойных положительных (DP) CD4/CD8 тимоцитах.
[0223] В типичном варианте реализации 7 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 2, отличающееся тем, что элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1, элемент контроля транскрипции RAG2, элемент контроля транскрипции TCRα, элемент контроля транскрипции TCRβ, элемент контроля транскрипции TCRγ и/или элемент контроля транскрипции TCRδ.
[0224] В типичном варианте реализации 8 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 1 по 7, отличающееся тем, что животное, не являющееся человеком, экспрессирует hTdT в DN тимоцитах и/или DP-тимоцитах.
[0225] В типичном варианте реализации 9 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 1 по 8, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая hTdT, расположена в локусе легкой κ-цепи иммуноглобулина, локусе легкой λ-цепи иммуноглобулина, локусе тяжелой цепи иммуноглобулина, локусе RAG1, локусе RAG2, локусе цепи TCRα, локусе цепи TCRβ, локусе цепи TCRγ и/или локусе цепи TCRδ.
[0226] В типичном варианте реализации 10 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 1 по 9, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая hTdT, функционально не связана с конститутивным элементом контроля транскрипции.
[0227] В типичном варианте реализации 11 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации 1-10, отличающееся тем, что hTdT не подвергается конститутивной экспрессии.
[0228] В типичном варианте реализации 12 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 1 по 11, отличающееся тем, что по меньшей мере 10% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0229] В типичном варианте реализации 13 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 12, отличающееся тем, что по меньшей мере 20% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0230] В типичном варианте реализации 14 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 12, отличающееся тем, что по меньшей мере 40% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0231] В типичном варианте реализации 15 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, геном которого содержит: последовательность нуклеиновой кислоты, кодирующую экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT); и вариабельную область иммуноглобулина, содержащую нереаранжированные сегменты гена вариабельной области иммуноглобулина человека, функционально связанные с геном константной области иммуноглобулина.
[0232] В типичном варианте реализации 16 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 15, отличающееся тем, что экзогенная TdT является TdT человека.
[0233] В типичном варианте реализации 17 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 15 или 16, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально связана с элементом контроля транскрипции.
[0234] В типичном варианте реализации 18 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 17, отличающееся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей экзогенную TdT в про-В-клетках и/или пре-В-клетках.
[0235] В типичном варианте реализации 19 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 17, отличающееся тем, что элемент контроля транскрипции выбран из группы, состоящей из элемента контроля транскрипции RAG1, элемента контроля транскрипции RAG2, элемента контроля транскрипции тяжелой цепи иммуноглобулина, элемента контроля транскрипции легкой κ-цепи иммуноглобулина и/или элемента контроля транскрипции легкой λ-цепи иммуноглобулина.
[0236] В типичном варианте реализации 20 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 19, отличающееся тем, что указанное животное, не являющееся человеком, экспрессирует экзогенную TdT в про-В-клетках и/или пре-В-клетках.
[0237] В типичном варианте реализации 21 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 17, отличающееся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей экзогенную TdT, в двойных отрицательных (DN) CD4/CD8 тимоцитах и/или двойных положительных (DP) CD4/CD8 тимоцитах.
[0238] В типичном варианте реализации 22 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 17, отличающееся тем, что элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1 или элемент контроля транскрипции RAG2.
[0239] В типичном варианте реализации 23 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 22, отличающееся тем, что животное, не являющееся человеком, экспрессирует экзогенную TdT в DN тимоцитах и/или DP тимоцитах.
[0240] В типичном варианте реализации 24 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 23, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, расположена в локусе легкой κ-цепи иммуноглобулина, локусе легкой λ-цепи иммуноглобулина, локусе тяжелой цепи иммуноглобулина, локусе RAG1, локусе RAG2, локусе цепи TCRα, локусе цепи TCRβ, локусе цепи TCRγ и/или локусе цепи TCRδ.
[0241] В типичном варианте реализации 25 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 24, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально не связана с конститутивным элементом контроля транскрипции.
[0242] В типичном варианте реализации 26 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 25, отличающееся тем, что экзогенная TdT не подвергается конститутивной экспрессии.
[0243] В типичном варианте реализации 27 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 26, отличающееся тем, что по меньшей мере 10% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0244] В типичном варианте реализации 28 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 27, отличающееся тем, что по меньшей мере 20% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0245] В типичном варианте реализации 29 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 27, отличающееся тем, что по меньшей мере 40% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0246] В типичном варианте реализации 30 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации 15-26, отличающееся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области тяжелой цепи человека.
[0247] В типичном варианте реализации 31 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 30, отличающееся тем, что ген константной области представляет собой ген константной области тяжелой цепи.
[0248] В типичном варианте реализации 32 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 31, отличающееся тем, что ген константной области тяжелой цепи представляет собой ген Cμ, ген Cδ, ген Cγ, ген Cεε или ген Cα.
[0249] В типичном варианте реализации 33 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее вариантам реализации 31 или 32, отличающееся тем, что ген константной области тяжелой цепи имеет эндогенное происхождение.
[0250] В типичном варианте реализации 34 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее вариантам реализации 31 или 32, отличающееся тем, что ген константной области тяжелой цепи является геном константной области мыши.
[0251] В типичном варианте реализации 35 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее вариантам реализации 31 или 32, отличающееся тем, что ген константной области тяжелой цепи является геном константной области крысы.
[0252] В типичном варианте реализации 36 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее вариантам реализации 31 или 32, отличающееся тем, что ген константной области тяжелой цепи является геном константной области человека.
[0253] В типичном варианте реализации 37 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее вариантам реализации 31 или 32, отличающееся тем, что ген константной области тяжелой цепи содержит домен CH1 человека и домены CH2 и CH3 животного, не являющегося человеком.
[0254] В типичном варианте реализации 38 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 37, отличающееся тем, что домены CH2 и CH3 животного, не являющегося человеком, имеют эндогенное происхождение.
[0255] В типичном варианте реализации 39 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 37, отличающееся тем, что домены CH2 и CH3 животного, не являющегося человеком, представляют собой домены CH2 и CH3 мыши.
[0256] В типичном варианте реализации 40 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 37, отличающееся тем, что домены CH2 и CH3 животного, не являющегося человеком, представляют собой домены CH2 и CH3 крысы.
[0257] В типичном варианте реализации 10 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее вариантам реализации 15-40, отличающееся тем, что в константной области тяжелой цепи иммуноглобулина, выбранного из IgG, IgA, IgE, IgD или их комбинации, у данного животного отсутствует функциональный домен CH1.
[0258] В типичном варианте реализации 20 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 31 по 41, отличающееся тем, что гены вариабельной области иммуноглобулина и константной области иммуноглобулина расположены в эндогенном локусе тяжелой цепи иммуноглобулина.
[0259] В типичном варианте реализации 43 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 30 по 42, геном которого дополнительно содержит вариабельную область иммуноглобулина, содержащую нереаранжированные сегменты гена вариабельной области легкой цепи человека, функционально связанные со вторым геном константной области иммуноглобулина.
[0260] В типичном варианте реализации 44 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 43, отличающееся тем, что сегменты гена вариабельной области иммуноглобулина человека, функционально связанные со вторым геном константной области иммуноглобулина, представляют собой сегменты гена вариабельной области κ-цепи человека.
[0261] В типичном варианте реализации 45 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 43, отличающееся тем, что сегменты гена вариабельной области иммуноглобулина человека, функционально связанные со вторым геном константной области иммуноглобулина, представляют собой сегменты гена вариабельной области λ-цепи человека.
[0262] В типичном варианте реализации 46 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 43 по 45, отличающееся тем, что второй ген константной области представляет собой ген константной области легкой цепи.
[0263] В типичном варианте реализации 47 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 46, отличающееся тем, что второй ген константной области является геном константной области κ-цепи.
[0264] В типичном варианте реализации 48 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 46, отличающееся тем, что второй ген константной области является геном константной области λ-цепи.
[0265] В типичном варианте реализации 49 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 43 по 48, отличающееся тем, что второй ген константной области имеет эндогенное происхождение.
[0266] В типичном варианте реализации 50 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 43 по 48, отличающееся тем, что второй ген константной области представляет собой ген константной области мыши.
[0267] В типичном варианте реализации 51 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 43 по 48, отличающееся тем, что второй ген константной области представляет собой ген константной области крысы.
[0268] В типичном варианте реализации 52 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 43 по 48, отличающееся тем, что второй ген константной области представляет собой ген константной области человека.
[0269] В типичном варианте реализации 53 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 43 по 52, отличающееся тем, что вариабельная область иммуноглобулина, функционально связанная со вторым геном константной области иммуноглобулина, расположена в эндогенном локусе легкой цепи иммуноглобулина.
[0270] В типичном варианте реализации 54 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 53, отличающееся тем, что второй ген константной области представляет собой ген константной области κ-цепи, а эндогенный локус легкой цепи иммуноглобулина является локусом κ-цепи иммуноглобулина.
[0271] В типичном варианте реализации 55 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 53, отличающееся тем, что второй ген константной области представляет собой ген константной области λ-цепи, а эндогенный локус легкой цепи иммуноглобулина является локусом λ-цепи иммуноглобулина.
[0272] В типичном варианте реализации 56 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 30 по 42, геном которого дополнительно содержит вариабельную область иммуноглобулина, содержащую реаранжированные сегменты гена вариабельной области легкой цепи (V/J) человека, функционально связанные со вторым геном константной области иммуноглобулина.
[0273] В типичном варианте реализации 57 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 56, отличающееся тем, что реаранжированные сегменты гена вариабельной области легкой цепи (V/J) человека, функционально связанные со вторым геном константной области иммуноглобулина, содержат сегменты гена Vκ, выбранные из Vκ1-39 и Vκ3-20, реаранжированные с сегментом гена Jκ.
[0274] В типичном варианте реализации 58 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 57, отличающееся тем, что геном указанного животного содержит вариабельную область легкой цепи иммуноглобулина, содержащую последовательность Vκ1-39/Jκ5 или Vκ3-20/Jκ1.
[0275] В типичном варианте реализации 59 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 30 по 42, геном которого дополнительно содержит вариабельную область иммуноглобулина, содержащую ограниченный репертуар сегментов гена вариабельной области (V и J) легкой цепи человека, функционально связанных со вторым геном константной области иммуноглобулина.
[0276] В типичном варианте реализации 60 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 59, отличающееся тем, что ограниченный репертуар сегментов гена вариабельной области (V и J) легкой цепи человека, функционально связанных со вторым геном константной области иммуноглобулина, содержит два сегмента V-гена и по меньшей мере два, предпочтительно пять, сегментов J-гена.
[0277] В типичном варианте реализации 61 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 60, отличающееся тем, что два сегмента V-гена представляют собой сегменты гена Vk1-39 и Vk3-20.
[0278] В типичном варианте реализации 62 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 29, отличающееся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области легкой цепи человека.
[0279] В типичном варианте реализации 63 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 62, отличающееся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области κ-цепи человека.
[0280] В типичном варианте реализации 64 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 63, отличающееся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области λ-цепи человека.
[0281] В типичном варианте реализации 65 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 62 по 64, отличающееся тем, что ген константной области представляет собой ген константной области легкой цепи.
[0282] В типичном варианте реализации 66 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 65, отличающееся тем, что ген константной области является геном константной области κ-цепи.
[0283] В типичном варианте реализации 67 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 65, отличающееся тем, что ген константной области является геном константной области λ-цепи.
[0284] В типичном варианте реализации 68 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 62 по 64, отличающееся тем, что ген константной области представляет собой ген константной области тяжелой цепи.
[0285] В типичном варианте реализации 69 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 62 по 68, отличающееся тем, что ген константной области имеет эндогенное происхождение.
[0286] В типичном варианте реализации 70 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 62 по 68, отличающееся тем, что ген константной области представляет собой ген константной области мыши.
[0287] В типичном варианте реализации 71 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 62 по 68, отличающееся тем, что ген константной области представляет собой ген константной области крысы.
[0288] В типичном варианте реализации 72 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 62 по 68, отличающееся тем, что ген константной области представляет собой ген константной области человека.
[0289] В типичном варианте реализации 73 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 62 по 72, отличающееся тем, что гены вариабельной области иммуноглобулина и константной области иммуноглобулина расположены в эндогенном локусе легкой цепи иммуноглобулина.
[0290] В типичном варианте реализации 74 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 73, отличающееся тем, что ген константной области представляет собой ген константной области κ-цепи, а эндогенный локус легкой цепи иммуноглобулина является локусом κ-цепи иммуноглобулина.
[0291] В типичном варианте реализации 75 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 73, отличающееся тем, что ген константной области представляет собой ген константной области λ-цепи, а эндогенный локус легкой цепи иммуноглобулина является локусом λ-цепи иммуноглобулина.
[0292] В типичном варианте реализации 76 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 75, отличающееся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина человеческого происхождения.
[0293] В типичном варианте реализации 77 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 75, отличающееся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина эндогенного происхождения.
[0294] В типичном варианте реализации 78 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 75, отличающееся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина, происходящие от последовательностей мыши.
[0295] В типичном варианте реализации 79 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 75, отличающееся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина, происходящие от последовательностей крысы.
[0296] В типичном варианте реализации 80 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 79, геном которого дополнительно содержит инактивированный эндогенный локус иммуноглобулина.
[0297] В типичном варианте реализации 81 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 80, отличающееся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус тяжелой цепи иммуноглобулина.
[0298] В типичном варианте реализации 82 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 81, отличающееся тем, что эндогенный локус тяжелой цепи иммуноглобулина инактивируют путем делеции по меньшей мере части вариабельной области эндогенного локуса тяжелой цепи.
[0299] В типичном варианте реализации 83 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 82, отличающееся тем, что делеция по меньшей мере части вариабельной области включает делецию сегментов J-гена вариабельной области.
[0300] В типичном варианте реализации 84 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 81, отличающееся тем, что эндогенный локус тяжелой цепи иммуноглобулина инактивируют путем делеции по меньшей мере части константной области эндогенного локуса тяжелой цепи.
[0301] В типичном варианте реализации 85 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 84, отличающееся тем, что делеция по меньшей мере части константной области включает делецию сегментов гена Cμ константной области.
[0302] В типичном варианте реализации 86 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 80, отличающееся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус κ-цепи иммуноглобулина.
[0303] В типичном варианте реализации 87 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 86, отличающееся тем, что эндогенный локус κ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части вариабельной области эндогенного локуса κ-цепи.
[0304] В типичном варианте реализации 88 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 87, отличающееся тем, что делеция по меньшей мере части вариабельной области включает делецию сегментов J-гена вариабельной области.
[0305] В типичном варианте реализации 89 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 86, отличающееся тем, что эндогенный локус κ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части константной области эндогенного локуса κ-цепи.
[0306] В типичном варианте реализации 90 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 89, отличающееся тем, что делеция по меньшей мере части константной области включает делецию сегментов гена Cκ константной области.
[0307] В типичном варианте реализации 91 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 80, отличающееся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус λ-цепи иммуноглобулина.
[0308] В типичном варианте реализации 92 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 91, отличающееся тем, что эндогенный локус λ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части кластера V-J-C эндогенного локуса λ-цепи.
[0309] В типичном варианте реализации 93 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 15 по 92, отличающееся тем, что нереаранжированные сегменты гена вариабельной области иммуноглобулина человека подвергаются реаранжировке при развитии В-клеток с получением реаранжированных генов вариабельной области в В-клетках животного, не являющегося человеком.
[0310] В типичном варианте реализации 94 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 93, отличающееся тем, что по меньшей мере 10% реаранжированных генов вариабельных областей содержат нематричные присоединения.
[0311] В типичном варианте реализации 95 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 93, отличающееся тем, что по меньшей мере 20% реаранжированных генов вариабельных областей содержат нематричные присоединения.
[0312] В типичном варианте реализации 96 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 93, отличающееся тем, что по меньшей мере 40% реаранжированных генов вариабельных областей содержат нематричные присоединения.
[0313] В типичном варианте реализации 97 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 93 по 96, отличающееся тем, что указанное животное экспрессирует антитела, содержащие вариабельный домен, кодируемый реаранжированным геном вариабельной области, и константный домен, кодируемый геном константной области.
[0314] В типичном варианте реализации 98 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации от 15 до 97, дополнительно содержащее функциональный эктопический ген Adam6 мыши.
[0315] В типичном варианте реализации 99 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, геном которого содержит последовательность нуклеиновой кислоты, кодирующую экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT); и вариабельную область Т-клеточного рецептора (TCR), содержащую нереаранжированные сегменты гена вариабельной области TCR человека, функционально связанные с геном константной области TCR.
[0316] В типичном варианте реализации 100 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 99, отличающееся тем, что экзогенная TdT представляет собой TdT человека.
[0317] В типичном варианте реализации 101 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 99 или 100, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально связана с элементом контроля транскрипции.
[0318] В типичном варианте реализации 102 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 101, отличающееся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей экзогенную TdT, в двойных отрицательных (DN) CD4/CD8 тимоцитах и/или двойных положительных (DP) CD4/CD8 тимоцитах.
[0319] В типичном варианте реализации 103 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 101, отличающееся тем, что элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1, элемент контроля транскрипции RAG2, элемент контроля транскрипции TCRα, элемент контроля транскрипции TCRβ, элемент контроля транскрипции TCRγ и/или элемент контроля транскрипции TCRδ.
[0320] В типичном варианте реализации 104 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 103, отличающееся тем, что животное, не являющееся человеком, экспрессирует экзогенную TdT в DN тимоцитах и/или DP тимоцитах.
[0321] В типичном варианте реализации 105 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 104, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, расположена в локусе RAG1, локусе RAG2, локусе цепи TCRα, локусе цепи TCRβ, локусе цепи TCRγ и/или локусе цепи TCRδ.
[0322] В типичном варианте реализации 106 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 105, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально не связана с конститутивным элементом контроля транскрипции.
[0323] В типичном варианте реализации 107 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 106, отличающееся тем, что экзогенная TdT не подвергается конститутивной экспрессии.
[0324] В типичном варианте реализации 108 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 107, отличающееся тем, что сегменты гена вариабельной области TCR человека представляют собой сегменты гена вариабельной области TCRα человека.
[0325] В типичном варианте реализации 109 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 107, отличающееся тем, что сегменты гена вариабельной области TCR человека представляют собой сегменты гена вариабельной области TCRβ человека.
[0326] В типичном варианте реализации 110 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 108, отличающееся тем, что ген константной области TCR представляет собой ген константной области TCRα.
[0327] В типичном варианте реализации 111 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 107, отличающееся тем, что ген константной области TCR представляет собой ген константной области TCRβ.
[0328] В типичном варианте реализации 112 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 111, отличающееся тем, что ген константной области TCR имеет эндогенное происхождение.
[0329] В типичном варианте реализации 113 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 111, отличающееся тем, что ген константной области TCR представляет собой ген константной области мыши.
[0330] В типичном варианте реализации 114 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 111, отличающееся тем, что ген константной области TCR представляет собой ген константной области крысы.
[0331] В типичном варианте реализации 115 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 111, отличающееся тем, что ген константной области TCR представляет собой ген константной области человека.
[0332] В типичном варианте реализации 116 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации от 99 до 115, отличающееся тем, что гены вариабельной области TCR и константной области TCR расположены в эндогенном локусе TCR.
[0333] В типичном варианте реализации 117 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации 99-108, 110, 112-115, отличающееся тем, что эндогенный локус TCR является эндогенным локусом TCRα.
[0334] В типичном варианте реализации 118 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации 99-107, 109, 111-115, отличающееся тем, что эндогенный локус TCR является эндогенным локусом TCRβ.
[0335] В типичном варианте реализации 119 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации от 99 до 118, отличающееся тем, что вариабельная область TCR содержит межгенные последовательности вариабельной области TCR человеческого происхождения.
[0336] В типичном варианте реализации 120 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации от 99 до 118, отличающееся тем, что вариабельная область TCR содержит межгенные последовательности вариабельной области TCR эндогенного происхождения.
[0337] В типичном варианте реализации 121 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 120, геном которого дополнительно содержит инактивированный эндогенный локус TCR.
[0338] В типичном варианте реализации 122 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 121, отличающееся тем, что инактивированный эндогенный локус TCR является локусом TCRα.
[0339] В типичном варианте реализации 123 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации осуществления 121, отличающееся тем, что инактивированный эндогенный локус TCR является локусом TCRβ.
[0340] В типичном варианте реализации 124 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 99 по 123, отличающееся тем, что нереаранжированные сегменты гена вариабельной области TCR человека подвергаются реаранжировке при развитии Т-клеток с получением реаранжированных генов вариабельной области TCR в Т-клетках животного, не являющегося человеком.
[0341] В типичном варианте реализации 125 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 124, отличающееся тем, что по меньшей мере 10% реаранжированных генов вариабельных областей содержат нематричные присоединения.
[0342] В типичном варианте реализации 126 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 124, отличающееся тем, что по меньшей мере 20% реаранжированных генов вариабельных областей содержат нематричные присоединения.
[0343] В типичном варианте реализации 127 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 124, отличающееся тем, что по меньшей мере 40% реаранжированных генов вариабельных областей содержат нематричные присоединения.
[0344] В типичном варианте реализации 128 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 124 по 127, отличающееся тем, что указанное животное экспрессирует TCR, содержащие вариабельный домен, кодируемый реаранжированным геном вариабельной области TCR, и константный домен, кодируемый геном константной области TCR.
[0345] В типичном варианте реализации 129 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, геном которого содержит: последовательность нуклеиновой кислоты, кодирующую экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT); и вариабельную область иммуноглобулина, содержащую нереаранжированные сегменты гена вариабельной области иммуноглобулина человека, функционально связанные с геном константной области TCR.
[0346] В типичном варианте реализации 130 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 129, отличающееся тем, что экзогенная TdT представляет собой TdT человека.
[0347] В типичном варианте реализации 131 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 129 или 130, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально связана с элементом контроля транскрипции.
[0348] В типичном варианте реализации 132 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 131, отличающееся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей экзогенную TdT, в двойных отрицательных (DN) CD4/CD8 тимоцитах и/или двойных положительных (DP) CD4/CD8 тимоцитах.
[0349] В типичном варианте реализации 133 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 131, отличающееся тем, что элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1, элемент контроля транскрипции RAG2, элемент контроля транскрипции TCRα, элемент контроля транскрипции TCRβ, элемент контроля транскрипции TCRγ и/или элемент контроля транскрипции TCRδ.
[0350] В типичном варианте реализации 134 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 131 по 132, отличающееся тем, что животное, не являющееся человеком, экспрессирует экзогенную TdT в DN тимоцитах и/или DP тимоцитах.
[0351] В типичном варианте реализации 135 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 134, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, расположена в локусе RAG1, локусе RAG2, локусе цепи TCRα, локусе цепи TCRβ, локусе цепи TCRγ и/или локусе цепи TCRδ.
[0352] В типичном варианте реализации 136 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 135, отличающееся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально не связана с конститутивным элементом контроля транскрипции.
[0353] В типичном варианте реализации 137 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 136, отличающееся тем, что экзогенная TdT не подвергается конститутивной экспрессии.
[0354] В типичном варианте реализации 138 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 137, отличающееся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области легкой цепи человека.
[0355] В типичном варианте реализации 139 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 138, отличающееся тем, что сегменты гена вариабельной области легкой цепи человека являются сегментами гена κ-цепи.
[0356] В типичном варианте реализации 140 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 138, отличающееся тем, что сегменты гена вариабельной области легкой цепи человека являются сегментами гена λ-цепи.
[0357] В типичном варианте реализации 141 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 138 по 140, отличающееся тем, что по меньшей мере 10% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0358] В типичном варианте реализации 142 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 141, отличающееся тем, что по меньшей мере 20% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0359] В типичном варианте реализации 143 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 141, отличающееся тем, что по меньшей мере 40% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0360] В типичном варианте реализации 144 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации со 129 по 137, отличающееся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области тяжелой цепи человека.
[0361] В типичном варианте реализации 145 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 143, отличающееся тем, что ген константной области TCR представляет собой ген константной области TCRα.
[0362] В типичном варианте реализации 146 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 145, отличающееся тем, что гены вариабельной области иммуноглобулина и константной области TCRα расположены в эндогенном локусе TCRα.
[0363] В типичном варианте реализации 147 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 144, отличающееся тем, что ген константной области TCR является геном константной области TCRβ.
[0364] В типичном варианте реализации 148 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 147, отличающееся тем, что вариабельная область иммуноглобулина и ген константной области TCRβ расположены в эндогенном локусе TCRβ.
[0365] В типичном варианте реализации 149 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 148, отличающееся тем, что ген константной области TCR имеет эндогенное происхождение.
[0366] В типичном варианте реализации 150 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 148, отличающееся тем, что ген константной области TCR представляет собой ген константной области мыши.
[0367] В типичном варианте реализации 151 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 148, отличающееся тем, что ген константной области TCR представляет собой ген константной области крысы.
[0368] В типичном варианте реализации 152 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 148, отличающееся тем, что ген константной области TCR представляет собой ген константной области человека.
[0369] В типичном варианте реализации 153 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 152, отличающееся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина человеческого происхождения.
[0370] В типичном варианте реализации 154 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 141 по 152, отличающееся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина эндогенного происхождения.
[0371] В типичном варианте реализации 155 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 141 по 152, отличающееся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина, происходящие от последовательностей мыши.
[0372] В типичном варианте реализации 156 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 141 по 152, отличающееся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина, происходящие от последовательностей крысы.
[0373] В типичном варианте реализации 157 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 141 по 155, геном которого дополнительно содержит инактивированный эндогенный локус иммуноглобулина.
[0374] В типичном варианте реализации 158 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 157, отличающееся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус тяжелой цепи иммуноглобулина.
[0375] В типичном варианте реализации 159 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 158, отличающееся тем, что эндогенный локус тяжелой цепи иммуноглобулина инактивируют путем делеции по меньшей мере части вариабельной области эндогенного локуса тяжелой цепи.
[0376] В типичном варианте реализации 160 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 159, отличающееся тем, что делеция по меньшей мере части вариабельной области включает делецию сегментов J-гена вариабельной области.
[0377] В типичном варианте реализации 161 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 158, отличающееся тем, что эндогенный локус тяжелой цепи иммуноглобулина инактивируют путем делеции по меньшей мере части константной области эндогенного локуса тяжелой цепи.
[0378] В типичном варианте реализации 162 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 161, отличающееся тем, что делеция по меньшей мере части константной области включает делецию сегментов гена Cμ константной области.
[0379] В типичном варианте реализации 163 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 157, отличающееся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус κ-цепи иммуноглобулина.
[0380] В типичном варианте реализации 164 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 163, отличающееся тем, что эндогенный локус κ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части вариабельной области эндогенного локуса κ-цепи.
[0381] В типичном варианте реализации 165 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 164, отличающееся тем, что делеция по меньшей мере части вариабельной области включает делецию сегментов J-гена вариабельной области.
[0382] В типичном варианте реализации 166 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 163, отличающееся тем, что эндогенный локус κ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части константной области эндогенного локуса κ-цепи.
[0383] В типичном варианте реализации 167 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 164, отличающееся тем, что делеция по меньшей мере части константной области включает делецию сегментов гена Cκ константной области.
[0384] В типичном варианте реализации 168 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 157, отличающееся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус λ-цепи иммуноглобулина.
[0385] В типичном варианте реализации 169 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 168, отличающееся тем, что эндогенный локус λ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части кластера V-J-C эндогенного локуса λ-цепи.
[0386] В типичном варианте реализации 170 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 129 по 169, отличающееся тем, что нереаранжированные сегменты гена вариабельной области иммуноглобулина человека подвергаются реаранжировке при развитии Т-клеток с получением реаранжированных генов вариабельной области иммуноглобулина в Т-клетках животного, не являющегося человеком.
[0387] В типичном варианте реализации 171 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 170, отличающееся тем, что по меньшей мере 10% реаранжированных генов вариабельных областей содержат нематричные присоединения.
[0388] В типичном варианте реализации 172 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 170, отличающееся тем, что по меньшей мере 20% реаранжированных генов вариабельных областей содержат нематричные присоединения.
[0389] В типичном варианте реализации 173 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 170, отличающееся тем, что по меньшей мере 40% реаранжированных генов вариабельных областей содержат нематричные присоединения.
[0390] В типичном варианте реализации 174 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 170 по 173, отличающееся тем, что указанное животное экспрессирует химерные рецепторы антигенов, содержащие вариабельный домен, кодируемый реаранжированным геном вариабельной области, и константный домен, кодируемый геном константной области TCR.
[0391] В типичном варианте реализации 175 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее любому из вариантов реализации с 1 по 174, отличающееся тем, что животное, не являющееся человеком, является млекопитающим.
[0392] В типичном варианте реализации 176 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 175, отличающееся тем, что млекопитающее является грызуном.
[0393] В типичном варианте реализации 177 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 176, отличающееся тем, что грызун представляет собой крысу или мышь.
[0394] В типичном варианте реализации 178 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 176, отличающееся тем, что грызун является мышью.
[0395] В типичном варианте реализации 179 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 176, отличающееся тем, что грызун является крысой.
[0396] В типичном варианте реализации 180 настоящего изобретения предложен способ, индуцирующий экспрессию антитела, содержащего вариабельный домен человека, причем указанный способ включает воздействие антигена на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 97, так что генетически модифицированное животное, не являющееся человеком, продуцирует антитело, содержащее вариабельную область человека, специфичную по отношению к антигену.
[0397] В типичном варианте реализации 181 настоящего изобретения предложен способ получения В-клетки, экспрессирующей антитело, содержащее вариабельный домен человека, причем указанный способ включает: (а) воздействие антигена на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 97; и (b) получение В-клетки, экспрессирующей антитело, содержащее вариабельный домен человека, специфичный по отношению к указанному антигену, из указанного животного, не являющегося человеком.
[0398] В типичном варианте реализации 182 настоящего изобретения предложен способ получения гибридомы, экспрессирующей антитело, содержащее вариабельный домен человека, причем указанный способ включает: (а) воздействие антигена на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 97; (b) получение В-клетки, экспрессирующей антитело, содержащее вариабельный домен человека, специфичный по отношению к указанному антигену, из указанного животного, не являющегося человеком; и (с) получение гибридомы из В-клетки, полученной на этапе (b).
[0399] В типичном варианте реализации 183 настоящего изобретения предложен способ получения нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, причем указанный способ включает: (а) воздействие антигена на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 97; и (b) получение нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, специфичный по отношению к указанному антигену, из указанного животного, не являющегося человеком.
[0400] В типичном варианте реализации 184 настоящего изобретения предложен способ получения нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, причем указанный способ включает: (а) воздействие антигена на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 97; (b) получение В-клетки, экспрессирующей антитело, содержащее вариабельный домен человека, специфичный по отношению к указанному антигену, из указанного животного, не являющегося человеком; (с) получение гибридомы из В-клетки, полученной на этапе (b); и (d) получение нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, специфичный по отношению к указанному антигену, из гибридомы.
[0401] В типичном варианте реализации 185 настоящего изобретения предложен способ получения антитела, содержащего вариабельный домен человека и константный домен человека, причем указанный способ включает: (а) воздействие антигена на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 97; (b) получение нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, специфичный по отношению к указанному антигену, из указанного животного, не являющегося человеком; (с) функциональное связывание нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина, с нуклеиновой кислотой, кодирующей константный домен иммуноглобулина человека, в клетке-хозяине; и (d) культивирование клетки-хозяина в условиях, в которых клетка-хозяин экспрессирует антитело человека, содержащее вариабельный домен иммуноглобулина и константный домен иммуноглобулина.
[0402] В типичном варианте реализации 186 настоящего изобретения предложен способ получения антитела, содержащего вариабельный домен человека и константный домен человека, специфичного по отношению к антигену, причем указанный способ включает: (а) воздействие антигена на животное, не являющееся человеком, соответствующее варианту реализации 97; (b) получение В-клетки, экспрессирующей антитело, содержащее вариабельный домен человека, специфичный по отношению к антигену, из указанного животного, не являющегося человеком; (с) получение гибридомы из В-клетки, полученной на этапе (b); (d) получение нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, специфичный по отношению к указанному антигену, из указанной гибридомы; (е) функциональное связывание нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина, с нуклеиновой кислотой, кодирующей константный домен иммуноглобулина человека, в клетке-хозяине; и (f) культивирование клетки-хозяина в условиях, в которых клетка-хозяин экспрессирует антитело человека, содержащее вариабельный домен иммуноглобулина и константный домен иммуноглобулина.
[0403] В типичном варианте реализации 187 настоящего изобретения предложен способ получения Т-клетки, экспрессирующей Т-клеточный рецептор (TCR), содержащий вариабельный домен человека, специфичный по отношению к пептиду, презентированному на МНС, причем указанный способ включает: (а) воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 128, так что пептид презентируется на MHC в организме указанного животного, не являющегося человеком; и (b) получение Т-клетки, экспрессирующей TCR, специфичный по отношению к пептиду, презентированному на МНС, из генетически модифицированного животного, не являющегося человеком, в соответствии с этапом (а).
[0404] В типичном варианте реализации 188 настоящего изобретения предложен способ получения Т-клеточной гибридомы, экспрессирующей Т-клеточный рецептор (TCR), содержащий вариабельный домен человека, специфичный по отношению к пептиду, презентированному на МНС, причем указанный способ включает: (а) воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 128, так что пептид презентируется на MHC в организме указанного животного, не являющегося человеком; (b) получение Т-клетки, экспрессирующей TCR, специфичный по отношению к пептиду, презентированному на МНС, из генетически модифицированного животного, не являющегося человеком, в соответствии с этапом (а); и (с) получение Т-клеточной гибридомы из Т-клетки, полученной на этапе (b).
[0405] В типичном варианте реализации 189 настоящего изобретения предложен способ получения нуклеиновой кислоты, кодирующей вариабельный домен Т-клеточного рецептора (TCR) человека, специфичный по отношению к пептиду, презентированному на МНС, причем указанный способ включает: (а) воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на животное, не являющееся человеком, соответствующее варианту реализации 128, так что пептид презентируется на MHC в организме указанного животного, не являющегося человеком; (b) получение Т-клетки, экспрессирующей TCR, специфичный по отношению к пептиду, презентированному на МНС, из генетически модифицированного животного, не являющегося человеком, в соответствии с этапом (а); и (с) выделение нуклеиновой кислоты, кодирующей вариабельный домен TCR человека, содержащийся в указанном TCR, из указанной Т-клетки.
[0406] В типичном варианте реализации 190 настоящего изобретения предложен способ получения Т-клеточного рецептора (TCR), содержащего вариабельный домен человека и константный домен человека, специфичного по отношению к пептиду, презентированному на МНС, причем указанный способ включает: (а) воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на животное, не являющееся человеком, соответствующее варианту реализации 128, так что пептид презентируется на MHC в организме указанного животного, не являющегося человеком; (b) получение Т-клетки, экспрессирующей TCR, специфичный по отношению к пептиду, презентированному на МНС, из генетически модифицированного животного, не являющегося человеком, в соответствии с этапом (а); (с) выделение нуклеиновой кислоты, кодирующей вариабельный домен TCR, содержащийся в указанном TCR, из указанной Т-клетки; и (d) функциональное связывание нуклеиновой кислоты, кодирующей вариабельный домен TCR, с константным доменом TCR в клетке, так что указанная клетка экспрессирует TCR, содержащий вариабельный домен TCR и константный домен TCR.
[0407] В типичном варианте реализации 191 настоящего изобретения предложен способ получения Т-клетки, экспрессирующей химерный рецептор антигена (CAR), содержащий вариабельный домен иммуноглобулина человека и константный домен иммуноглобулина, специфичный по отношению к пептиду, презентированному на МНС, причем указанный способ включает: (а) воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 174, так что пептид презентируется на MHC в организме указанного животного, не являющегося человеком; и (b) получение Т-клетки, экспрессирующей CAR, специфичный по отношению к пептиду, презентированному на МНС, из генетически модифицированного животного, не являющегося человеком, в соответствии с этапом (а).
[0408] В типичном варианте реализации 192 настоящего изобретения предложен способ получения Т-клеточной гибридомы, экспрессирующей химерный рецептор антигена (CAR), содержащий вариабельный домен TCR человека и константный домен иммуноглобулина, специфичный по отношению к пептиду, презентированному на МНС, причем указанный способ включает: (а) воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на генетически модифицированное животное, не являющееся человеком, соответствующее варианту реализации 174, так что пептид презентируется на MHC в организме указанного животного, не являющегося человеком; (b) получение Т-клетки, экспрессирующей CAR, специфичный по отношению к пептиду, презентированному на МНС, из генетически модифицированного животного, не являющегося человеком, в соответствии с этапом (а); и (с) получение Т-клеточной гибридомы из Т-клетки, полученной на этапе (b).
[0409] В типичном варианте реализации 193 настоящего изобретения предложен способ получения нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, специфичный по отношению к пептиду, презентированному на МНС, причем указанный способ включает: (а) воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на животное, не являющееся человеком, соответствующее варианту реализации 174, так что пептид презентируется на MHC в организме указанного животного, не являющегося человеком; (b) получение Т-клетки, экспрессирующей химерный рецептор антигена (CAR), специфичный по отношению к пептиду, презентированному на МНС, из генетически модифицированного животного, не являющегося человеком, в соответствии с этапом (а); и (с) выделение нуклеиновой кислоты, кодирующей вариабельный домен TCR человека, содержащийся в указанном CAR, из указанной Т-клетки.
[0410] В типичном варианте реализации 194 настоящего изобретения предложен способ получения антитела, содержащего вариабельный домен человека и константный домен человека, специфичного по отношению к пептиду, презентированному на МНС, причем указанный способ включает: (а) воздействие антигена, содержащего пептид, или нуклеиновой кислоты, кодирующей антиген, содержащий пептид, на животное, не являющееся человеком, соответствующее варианту реализации 174, так что пептид презентируется на MHC в организме указанного животного, не являющегося человеком; (b) получение Т-клетки, экспрессирующей химерный рецептор антигена (CAR), специфичный по отношению к пептиду, презентированному на МНС, из генетически модифицированного животного, не являющегося человеком, в соответствии с этапом (а); (с) выделение нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, содержащийся в указанном CAR, из указанной Т-клетки; и (d) функциональное связывание нуклеиновой кислоты, кодирующей вариабельный домен иммуноглобулина человека, с константным доменом иммуноглобулина человека в клетке, так что указанная клетка экспрессирует антитело, содержащее вариабельный домен иммуноглобулина человека и константный домен иммуноглобулина человека.
[0411] В типичном варианте реализации 195 настоящего изобретения предложен способ, соответствующий любому из вариантов реализации с 180 по 194, отличающийся тем, что животное, не являющееся человеком, является млекопитающим.
[0412] В типичном варианте реализации 196 настоящего изобретения предложен способ, соответствующий варианту реализации 195, отличающийся тем, что млекопитающее является грызуном.
[0413] В типичном варианте реализации 197 настоящего изобретения предложен способ, соответствующий варианту реализации 196, отличающийся тем, что грызун представляет собой крысу или мышь.
[0414] В типичном варианте реализации 198 настоящего изобретения предложено антитело, полученное в соответствии со способом, соответствующим варианту реализации 180, 185, 186 или 194.
[0415] В типичном варианте реализации 199 настоящего изобретения предложена клетка, полученная в соответствии со способом, соответствующим варианту реализации 181, 187 или 191.
[0416] В типичном варианте реализации 200 настоящего изобретения предложена гибридома, полученная в соответствии со способом, соответствующим варианту реализации 182, 188 или 192.
[0417] В типичном варианте реализации 201 настоящего изобретения предложена нуклеиновая кислота, полученная в соответствии со способом, соответствующим варианту реализации 183, 184, 189 или 193.
[0418] В типичном варианте реализации 202 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, геном которого содержит последовательность нуклеиновой кислоты, кодирующую терминальную дезоксинуклеотидилтрансферазу человека (hTdT).
[0419] В типичном варианте реализации 203 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 202, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая hTdT, функционально связана с элементом контроля транскрипции.
[0420] В типичном варианте реализации 204 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 203, отличающаяся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей hTdT, в про-В-клетках и/или в пре-В-клетках.
[0421] В типичном варианте реализации 205 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 203, отличающаяся тем, что элемент контроля транскрипции выбран из группы, состоящей из элемента контроля транскрипции RAG1, элемента контроля транскрипции RAG2, элемента контроля транскрипции тяжелой цепи иммуноглобулина, элемента контроля транскрипции легкой κ-цепи иммуноглобулина и/или элемента контроля транскрипции легкой λ-цепи иммуноглобулина.
[0422] В типичном варианте реализации 206 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 202 по 204, отличающаяся тем, что указанное животное, не являющееся человеком, экспрессирует hTdT в про-В-клетках и/или пре-В-клетках.
[0423] В типичном варианте реализации 207 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 203, отличающаяся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей hTdT, в двойных отрицательных (DN) CD4/CD8 тимоцитах и/или двойных положительных (DP) CD4/CD8 тимоцитах.
[0424] В типичном варианте реализации 208 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 203, отличающаяся тем, что элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1, элемент контроля транскрипции RAG2, элемент контроля транскрипции TCRα, элемент контроля транскрипции TCRβ, элемент контроля транскрипции TCRγ и/или элемент контроля транскрипции TCRδ.
[0425] В типичном варианте реализации 209 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 202 по 207, отличающаяся тем, что указанное животное, не являющееся человеком, происходящее от ЭС-клетки, экспрессирует hTdT в DN-тимоцитах и/или DP-тимоцитах.
[0426] В типичном варианте реализации 210 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 202 по 209, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая hTdT, расположена в локусе легкой κ-цепи иммуноглобулина, локусе легкой λ-цепи иммуноглобулина, локусе тяжелой цепи иммуноглобулина, локусе RAG1, локусе RAG2, локусе цепи TCRα, локусе цепи TCRβ, локусе цепи TCRγ и/или локусе цепи TCRδ.
[0427] В типичном варианте реализации 211 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 202 по 210, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая hTdT, функционально не связана с конститутивным элементом контроля транскрипции.
[0428] В типичном варианте реализации 212 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 202 по 211, отличающаяся тем, что hTdT не подвергается конститутивной экспрессии в организме указанного животного, не являющегося человеком, происходящего от ЭС-клетки животного, не являющегося человеком.
[0429] В типичном варианте реализации 213 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 202 по 212, отличающаяся тем, что по меньшей мере 10% V-J-соединений легкой цепи иммуноглобулина у указанного животного, не являющегося человеком, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0430] В типичном варианте реализации 214 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 213, отличающаяся тем, что по меньшей мере 20% V-J-соединений легкой цепи иммуноглобулина у указанного животного, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0431] В типичном варианте реализации 215 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 213, отличающаяся тем, что по меньшей мере 40% V-J-соединений легкой цепи иммуноглобулина у указанного животного, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0432] В типичном варианте реализации 216 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, геном которого содержит: последовательность нуклеиновой кислоты, кодирующую экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT); и вариабельную область иммуноглобулина, содержащую нереаранжированные сегменты гена вариабельной области иммуноглобулина человека, функционально связанные с геном константной области иммуноглобулина.
[0433] В типичном варианте реализации 217 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 216, отличающаяся тем, что экзогенная TdT представляет собой TdT человека.
[0434] В типичном варианте реализации 218 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 216 или 217, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально связана с элементом контроля транскрипции.
[0435] В типичном варианте реализации 219 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 218, отличающаяся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей экзогенную TdT, в про-В-клетках и/или в пре-В-клетках.
[0436] В типичном варианте реализации 220 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 218, отличающаяся тем, что элемент контроля транскрипции выбран из группы, состоящей из элемента контроля транскрипции RAG1, элемента контроля транскрипции RAG2, элемента контроля транскрипции тяжелой цепи иммуноглобулина, элемента контроля транскрипции легкой κ-цепи иммуноглобулина и/или элемента контроля транскрипции легкой λ-цепи иммуноглобулина.
[0437] В типичном варианте реализации 221 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 220, отличающаяся тем, что указанное животное, не являющееся человеком, происходящее от ЭС-клетки, экспрессирует экзогенную TdT в про-В-клетках и/или пре-В-клетках.
[0438] В типичном варианте реализации 222 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 218, отличающаяся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей экзогенную TdT, в двойных отрицательных (DN) CD4/CD8 тимоцитах и/или двойных положительных (DP) CD4/CD8 тимоцитах.
[0439] В типичном варианте реализации 223 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 218, отличающаяся тем, что элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1 или элемент контроля транскрипции RAG2.
[0440] В типичном варианте реализации 224 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 223, отличающаяся тем, что указанное животное, не являющееся человеком, происходящее от ЭС-клетки, экспрессирует экзогенную TdT в DN-тимоцитах и/или DP-тимоцитах.
[0441] В типичном варианте реализации 225 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 224, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, расположена в локусе легкой κ-цепи иммуноглобулина, локусе легкой λ-цепи иммуноглобулина, локусе тяжелой цепи иммуноглобулина, локусе RAG1, локусе RAG2, локусе цепи TCRα, локусе цепи TCRβ, локусе цепи TCRγ и/или локусе цепи TCRδ.
[0442] В типичном варианте реализации 226 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 225, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально не связана с конститутивным элементом контроля транскрипции.
[0443] В типичном варианте реализации 227 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 226, отличающаяся тем, что экзогенная TdT не подвергается конститутивной экспрессии в организме указанного животного, не являющегося человеком, происходящего от ЭС-клетки.
[0444] В типичном варианте реализации 228 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 227, отличающаяся тем, что по меньшей мере 10% V-J-соединений легкой цепи иммуноглобулина у указанного животного, не являющегося человеком, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0445] В типичном варианте реализации 229 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 228, отличающаяся тем, что по меньшей мере 20% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0446] В типичном варианте реализации 230 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 228, отличающаяся тем, что по меньшей мере 40% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0447] В типичном варианте реализации 231 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 227, отличающаяся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области тяжелой цепи человека.
[0448] В типичном варианте реализации 232 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 231, отличающаяся тем, что ген константной области является геном константной области тяжелой цепи.
[0449] В типичном варианте реализации 233 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 232, отличающаяся тем, что ген константной области тяжелой цепи представляет собой ген Cμ, ген Cδ, ген Cγ, ген Cε или ген Cα.
[0450] В типичном варианте реализации 234 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 232 или 233, отличающаяся тем, что ген константной области тяжелой цепи имеет эндогенное происхождение.
[0451] В типичном варианте реализации 235 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 232 или 233, отличающаяся тем, что ген константной области тяжелой цепи является геном константной области мыши.
[0452] В типичном варианте реализации 236 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 232 или 233, отличающаяся тем, что ген константной области тяжелой цепи является геном константной области крысы.
[0453] В типичном варианте реализации 237 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 232 или 233, отличающаяся тем, что ген константной области тяжелой цепи является геном константной области человека.
[0454] В типичном варианте реализации 238 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 232 или 233, отличающаяся тем, что ген константной области тяжелой цепи содержит домен CH1 человека и домены CH2 и CH3 животного, не являющегося человеком.
[0455] В типичном варианте реализации 239 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 238, отличающаяся тем, что домены CH2 и CH3 животного, не являющегося человеком, имеют эндогенное происхождение.
[0456] В типичном варианте реализации 240 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 238, отличающаяся тем, что домены CH2 и CH3 животного, не являющегося человеком, являются доменами CH2 и CH3 мыши.
[0457] В типичном варианте реализации 241 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 238, отличающаяся тем, что домены CH2 и CH3 животного, не являющегося человеком, являются доменами CH2 и CH3 крысы.
[0458] В типичном варианте реализации 242 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая вариантам реализации 216-241, отличающаяся тем, что в константной области тяжелой цепи иммуноглобулина, выбранного из IgG, IgA, IgE, IgD или их комбинации, у данного животного отсутствует функциональный домен CH1.
[0459] В типичном варианте реализации 243 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 232 по 242, отличающаяся тем, что гены вариабельной области иммуноглобулина и константной области иммуноглобулина расположены в эндогенном локусе тяжелой цепи иммуноглобулина.
[0460] В типичном варианте реализации 244 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 231 по 243, геном которой дополнительно содержит вариабельную область иммуноглобулина, содержащую нереаранжированные сегменты гена вариабельной области легкой цепи человека, функционально связанные со вторым геном константной области иммуноглобулина.
[0461] В типичном варианте реализации 245 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 244, отличающаяся тем, что сегменты гена вариабельной области иммуноглобулина человека, функционально связанные со вторым геном константной области иммуноглобулина, представляют собой сегменты гена вариабельной области κ-цепи человека.
[0462] В типичном варианте реализации 246 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 244, отличающаяся тем, что сегменты гена вариабельной области иммуноглобулина человека, функционально связанные со вторым геном константной области иммуноглобулина, представляют собой сегменты гена вариабельной области λ-цепи человека.
[0463] В типичном варианте реализации 247 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 244 по 246, отличающаяся тем, что второй ген константной области представляет собой ген константной области легкой цепи.
[0464] В типичном варианте реализации 248 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 247, отличающаяся тем, что второй ген константной области является геном константной области κ-цепи.
[0465] В типичном варианте реализации 249 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 247, отличающаяся тем, что второй ген константной области является геном константной области λ-цепи.
[0466] В типичном варианте реализации 250 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 244 по 249, отличающаяся тем, что второй ген константной области имеет эндогенное происхождение.
[0467] В типичном варианте реализации 251 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 244 по 249, отличающаяся тем, что второй ген константной области представляет собой ген константной области мыши.
[0468] В типичном варианте реализации 252 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 244 по 249, отличающаяся тем, что второй ген константной области представляет собой ген константной области крысы.
[0469] В типичном варианте реализации 253 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 244 по 249, отличающаяся тем, что второй ген константной области представляет собой ген константной области человека.
[0470] В типичном варианте реализации 254 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 244 по 253, отличающаяся тем, что вариабельная область иммуноглобулина, функционально связанная со вторым геном константной области иммуноглобулина, и второй ген константной области иммуноглобулина расположены в эндогенном локусе легкой цепи иммуноглобулина.
[0471] В типичном варианте реализации 255 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 254, отличающаяся тем, что второй ген константной области представляет собой ген константной области κ-цепи, а эндогенный локус легкой цепи иммуноглобулина является локусом κ-цепи иммуноглобулина.
[0472] В типичном варианте реализации 256 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 254, отличающаяся тем, что второй ген константной области представляет собой ген константной области λ-цепи, а эндогенный локус легкой цепи иммуноглобулина является локусом λ-цепи иммуноглобулина.
[0473] В типичном варианте реализации 257 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 231 по 243, геном которой дополнительно содержит вариабельную область иммуноглобулина, содержащую реаранжированные сегменты гена вариабельной области (V/J) легкой цепи человека, функционально связанные со вторым геном константной области иммуноглобулина.
[0474] В типичном варианте реализации 258 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 257, отличающаяся тем, что реаранжированные сегменты гена вариабельной области легкой цепи (V/J) человека, функционально связанные со вторым геном константной области иммуноглобулина, содержат сегменты гена Vκ, выбранные из Vκ1-39 и Vκ3-20, реаранжированные с сегментом гена Jκ.
[0475] В типичном варианте реализации 259 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 258, отличающаяся тем, что геном указанного животного содержит вариабельную область легкой цепи иммуноглобулина, содержащую последовательность Vκ1-39/Jκ5 или Vκ3-20/Jκ1.
[0476] В типичном варианте реализации 260 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 231 по 243, геном которой дополнительно содержит вариабельную область иммуноглобулина, содержащую ограниченный репертуар сегментов гена вариабельной области (V и J) легкой цепи человека, функционально связанных со вторым геном константной области иммуноглобулина.
[0477] В типичном варианте реализации 261 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 260, отличающаяся тем, что ограниченный репертуар сегментов гена вариабельной области (V и J) легкой цепи человека, функционально связанных со вторым геном константной области иммуноглобулина, содержит два сегмента V-гена и по меньшей мере два, предпочтительно пять, сегментов J-гена.
[0478] В типичном варианте реализации 262 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 261, отличающаяся тем, что два сегмента V-гена представляют собой сегменты гена Vk1-39 и Vk3-20.
[0479] В типичном варианте реализации 263 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 230, отличающаяся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области легкой цепи человека.
[0480] В типичном варианте реализации 264 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 263, отличающаяся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области κ-цепи человека.
[0481] В типичном варианте реализации 265 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 263, отличающаяся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области λ-цепи человека.
[0482] В типичном варианте реализации 266 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 263 по 265, отличающаяся тем, что ген константной области представляет собой ген константной области легкой цепи.
[0483] В типичном варианте реализации 267 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 266, отличающаяся тем, что ген константной области является геном константной области κ-цепи.
[0484] В типичном варианте реализации 268 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 266, отличающаяся тем, что ген константной области является геном константной области λ-цепи.
[0485] В типичном варианте реализации 269 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 263 по 265, отличающаяся тем, что ген константной области представляет собой ген константной области тяжелой цепи.
[0486] В типичном варианте реализации 270 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 263 по 269, отличающаяся тем, что ген константной области имеет эндогенное происхождение.
[0487] В типичном варианте реализации 271 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 263 по 269, отличающаяся тем, что ген константной области представляет собой ген константной области мыши.
[0488] В типичном варианте реализации 272 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 263 по 269, отличающаяся тем, что ген константной области представляет собой ген константной области крысы.
[0489] В типичном варианте реализации 273 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 263 по 269, отличающаяся тем, что ген константной области представляет собой ген константной области человека.
[0490] В типичном варианте реализации 274 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 263 по 273, отличающаяся тем, что гены вариабельной области иммуноглобулина и константной области иммуноглобулина расположены в эндогенном локусе легкой цепи иммуноглобулина.
[0491] В типичном варианте реализации 275 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 274, отличающаяся тем, что ген константной области представляет собой ген константной области κ-цепи, а эндогенный локус легкой цепи иммуноглобулина является локусом κ-цепи иммуноглобулина.
[0492] В типичном варианте реализации 276 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 274, отличающаяся тем, что ген константной области представляет собой ген константной области λ-цепи, а эндогенный локус легкой цепи иммуноглобулина является локусом λ-цепи иммуноглобулина.
[0493] В типичном варианте реализации 277 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 276, отличающаяся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина человеческого происхождения.
[0494] В типичном варианте реализации 278 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 276, отличающаяся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина эндогенного происхождения.
[0495] В типичном варианте реализации 279 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 276, отличающаяся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина, происходящие от последовательности мыши.
[0496] В типичном варианте реализации 280 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 276, отличающаяся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина, происходящие от последовательности крысы.
[0497] В типичном варианте реализации 281 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 280, геном которой дополнительно содержит инактивированный эндогенный локус иммуноглобулина.
[0498] В типичном варианте реализации 282 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 281, отличающаяся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус тяжелой цепи иммуноглобулина.
[0499] В типичном варианте реализации 283 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 282, отличающаяся тем, что эндогенный локус тяжелой цепи иммуноглобулина инактивируют путем делеции по меньшей мере части вариабельной области эндогенного локуса тяжелой цепи.
[0500] В типичном варианте реализации 284 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 283, отличающаяся тем, что делеция по меньшей мере части вариабельной области включает делецию сегментов J-гена вариабельной области.
[0501] В типичном варианте реализации 285 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 282, отличающаяся тем, что эндогенный локус тяжелой цепи иммуноглобулина инактивируют путем делеции по меньшей мере части константной области эндогенного локуса тяжелой цепи.
[0502] В типичном варианте реализации 286 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 285, отличающаяся тем, что делеция по меньшей мере части константной области включает делецию сегментов гена Cμ константной области.
[0503] В типичном варианте реализации 287 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 281, отличающаяся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус κ-цепи иммуноглобулина.
[0504] В типичном варианте реализации 288 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 287, отличающаяся тем, что эндогенный локус κ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части вариабельной области эндогенного локуса κ-цепи.
[0505] В типичном варианте реализации 289 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 288, отличающаяся тем, что делеция по меньшей мере части вариабельной области включает делецию сегментов J-гена вариабельной области.
[0506] В типичном варианте реализации 290 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 287, отличающаяся тем, что эндогенный локус κ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части константной области эндогенного локуса κ-цепи.
[0507] В типичном варианте реализации 291 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 290, отличающаяся тем, что делеция по меньшей мере части константной области включает делецию сегментов гена Cκ константной области.
[0508] В типичном варианте реализации 292 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 281, отличающаяся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус λ-цепи иммуноглобулина.
[0509] В типичном варианте реализации 293 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 292, отличающаяся тем, что эндогенный локус λ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части кластера V-J-C эндогенного локуса λ-цепи.
[0510] В типичном варианте реализации 294 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 216 по 293, отличающаяся тем, что нереаранжированные сегменты гена вариабельной области иммуноглобулина человека подвергаются реаранжировке при развитии В-клеток с получением реаранжированных генов вариабельной области в В-клетках животного, не являющегося человеком, происходящего от ЭС-клетки.
[0511] В типичном варианте реализации 295 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 294, отличающаяся тем, что по меньшей мере 10% реаранжированных генов вариабельных областей у животного, не являющегося человеком, содержат нематричные присоединения.
[0512] В типичном варианте реализации 296 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 294, отличающаяся тем, что по меньшей мере 20% реаранжированных генов вариабельных областей у животного, не являющегося человеком, содержат нематричные присоединения.
[0513] В типичном варианте реализации 297 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 294, отличающаяся тем, что по меньшей мере 40% реаранжированных генов вариабельных областей у животного, не являющегося человеком, содержат нематричные присоединения.
[0514] В типичном варианте реализации 298 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 294 по 297, отличающаяся тем, что указанное животное, происходящее от ЭС-клетки, экспрессирует антитела, содержащие вариабельный домен, кодируемый реаранжированным геном вариабельной области, и константный домен, кодируемый геном константной области.
[0515] В типичном варианте реализации 299 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, геном которой содержит последовательность нуклеиновой кислоты, кодирующую экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT); и вариабельную область Т-клеточного рецептора (TCR), содержащую нереаранжированные сегменты гена вариабельной области TCR человека, функционально связанные с геном константной области TCR.
[0516] В типичном варианте реализации 300 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 299, отличающаяся тем, что экзогенная TdT представляет собой TdT человека.
[0517] В типичном варианте реализации 301 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 299 или 300, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально связана с элементом контроля транскрипции.
[0518] В типичном варианте реализации 302 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 301, отличающаяся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей экзогенную TdT, в двойных отрицательных (DN) CD4/CD8 тимоцитах и/или двойных положительных (DP) CD4/CD8 тимоцитах.
[0519] В типичном варианте реализации 303 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 301, отличающаяся тем, что элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1, элемент контроля транскрипции RAG2, элемент контроля транскрипции TCRα, элемент контроля транскрипции TCRβ, элемент контроля транскрипции TCRγ и/или элемент контроля транскрипции TCRδ.
[0520] В типичном варианте реализации 304 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 303, отличающаяся тем, что указанное животное, не являющееся человеком, происходящее от ЭС-клетки, экспрессирует экзогенную TdT в DN-тимоцитах и/или DP-тимоцитах.
[0521] В типичном варианте реализации 305 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 304, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, расположена в локусе RAG1, локусе RAG2, локусе цепи TCRα, локусе цепи TCRβ, локусе цепи TCRγ и/или локусе цепи TCRδ.
[0522] В типичном варианте реализации 306 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 305, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально не связана с конститутивным элементом контроля транскрипции.
[0523] В типичном варианте реализации 307 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 306, отличающаяся тем, что экзогенная TdT не подвергается конститутивной экспрессии организмом указанного животного, не являющегося человеком, происходящего от ЭС-клетки.
[0524] В типичном варианте реализации 308 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 307, отличающаяся тем, что сегменты гена вариабельной области TCR человека представляют собой сегменты гена вариабельной области TCRα человека.
[0525] В типичном варианте реализации 309 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 307, отличающаяся тем, что сегменты гена вариабельной области TCR человека представляют собой сегменты гена вариабельной области TCRβ человека.
[0526] В типичном варианте реализации 310 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 308, отличающаяся тем, что ген константной области TCR представляет собой ген константной области TCRα.
[0527] В типичном варианте реализации 311 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 307 и 309, отличающаяся тем, что ген константной области TCR представляет собой ген константной области TCRβ.
[0528] В типичном варианте реализации 312 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 311, отличающаяся тем, что ген константной области TCR имеет эндогенное происхождение.
[0529] В типичном варианте реализации 313 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 311, отличающаяся тем, что ген константной области TCR представляет собой ген константной области мыши.
[0530] В типичном варианте реализации 314 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 311, отличающаяся тем, что ген константной области TCR представляет собой ген константной области крысы.
[0531] В типичном варианте реализации 315 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 311, отличающаяся тем, что ген константной области TCR представляет собой ген константной области человека.
[0532] В типичном варианте реализации 316 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации от 299 до 315, отличающаяся тем, что гены вариабельной области TCR и константной области TCR расположены в эндогенном локусе TCR.
[0533] В типичном варианте реализации 317 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации 299-308, 310, 313-315, отличающаяся тем, что эндогенный локус TCR является эндогенным локусом TCRα.
[0534] В типичном варианте реализации 318 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации 299-307, 309, 311-315, отличающаяся тем, что эндогенный локус TCR является эндогенным локусом TCRβ.
[0535] В типичном варианте реализации 319 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 318, отличающаяся тем, что вариабельная область TCR содержит межгенные последовательности вариабельной области TCR человеческого происхождения.
[0536] В типичном варианте реализации 320 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 318, отличающаяся тем, что вариабельная область TCR содержит межгенные последовательности вариабельной области TCR эндогенного происхождения.
[0537] В типичном варианте реализации 321 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 320, геном которой дополнительно содержит инактивированный эндогенный локус TCR.
[0538] В типичном варианте реализации 322 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 321, отличающаяся тем, что инактивированный эндогенный локус TCR является локусом TCRα.
[0539] В типичном варианте реализации 323 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 321, отличающаяся тем, что инактивированный эндогенный локус TCR является локусом TCRβ.
[0540] В типичном варианте реализации 324 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 299 по 323, отличающаяся тем, что нереаранжированные сегменты гена вариабельной области TCR человека подвергаются реаранжировке при развитии Т-клеток с получением реаранжированных генов вариабельной области TCR в Т-клетках животного, не являющегося человеком, происходящего от ЭС-клетки.
[0541] В типичном варианте реализации 325 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 324, отличающаяся тем, что по меньшей мере 10% реаранжированных генов вариабельных областей у животного, не являющегося человеком, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0542] В типичном варианте реализации 326 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 324, отличающаяся тем, что по меньшей мере 20% реаранжированных генов вариабельных областей у животного, не являющегося человеком, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0543] В типичном варианте реализации 327 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 324, отличающаяся тем, что по меньшей мере 40% реаранжированных генов вариабельных областей у животного, не являющегося человеком, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0544] В типичном варианте реализации 328 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 324 по 327, отличающаяся тем, что указанное животное, происходящее от ЭС-клетки, экспрессирует TCR, содержащие вариабельный домен, кодируемый реаранжированным геном вариабельной области TCR, и константный домен, кодируемый геном константной области TCR.
[0545] В типичном варианте реализации 329 настоящего изобретения предложено генетически модифицированное животное, не являющееся человеком, геном которого содержит: последовательность нуклеиновой кислоты, кодирующую экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT); и вариабельную область иммуноглобулина, содержащую нереаранжированные сегменты гена вариабельной области иммуноглобулина человека, функционально связанные с геном константной области TCR.
[0546] В типичном варианте реализации 330 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 329, отличающаяся тем, что экзогенная TdT представляет собой TdT человека.
[0547] В типичном варианте реализации 331 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 329 или 330, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально связана с элементом контроля транскрипции.
[0548] В типичном варианте реализации 332 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 331, отличающаяся тем, что элемент контроля транскрипции регулирует экспрессию последовательности нуклеиновой кислоты, кодирующей экзогенную TdT, в двойных отрицательных (DN) CD4/CD8 тимоцитах и/или двойных положительных (DP) CD4/CD8 тимоцитах.
[0549] В типичном варианте реализации 333 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 331, отличающаяся тем, что элемент контроля транскрипции представляет собой элемент контроля транскрипции RAG1, элемент контроля транскрипции RAG2, элемент контроля транскрипции TCRα, элемент контроля транскрипции TCRβ, элемент контроля транскрипции TCRγ и/или элемент контроля транскрипции TCRδ.
[0550] В типичном варианте реализации 334 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 333, отличающаяся тем, что указанное животное, не являющееся человеком, происходящее от ЭС-клетки, экспрессирует экзогенную TdT в DN-тимоцитах и/или DP-тимоцитах.
[0551] В типичном варианте реализации 335 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 334, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, расположена в локусе RAG1, локусе RAG2, локусе цепи TCRα, локусе цепи TCRβ, локусе цепи TCRγ и/или локусе цепи TCRδ.
[0552] В типичном варианте реализации 336 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 335, отличающаяся тем, что последовательность нуклеиновой кислоты, кодирующая экзогенную TdT, функционально не связана с конститутивным элементом контроля транскрипции.
[0553] В типичном варианте реализации 337 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 336, отличающаяся тем, что экзогенная TdT не подвергается конститутивной экспрессии в организмах указанных животных, не являющихся человеком, происходящих от ЭС-клетки.
[0554] В типичном варианте реализации 338 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 337, отличающаяся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области легкой цепи человека.
[0555] В типичном варианте реализации 339 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 338, отличающаяся тем, что по меньшей мере 10% V-J-соединений легкой цепи иммуноглобулина у указанного животного, не являющегося человеком, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0556] В типичном варианте реализации 340 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 339, отличающаяся тем, что по меньшей мере 20% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0557] В типичном варианте реализации 341 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 339, отличающаяся тем, что по меньшей мере 40% V-J-соединений легкой цепи иммуноглобулина у указанного животного содержат нематричные присоединения.
[0558] В типичном варианте реализации 342 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 338 по 341, отличающаяся тем, что сегменты гена вариабельной области легкой цепи человека представляют собой сегменты гена κ-цепи.
[0559] В типичном варианте реализации 343 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 338 по 341, отличающаяся тем, что сегменты гена вариабельной области легкой цепи человека представляют собой сегменты гена λ-цепи.
[0560] В типичном варианте реализации 344 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 337, отличающаяся тем, что сегменты гена вариабельной области иммуноглобулина человека представляют собой сегменты гена вариабельной области тяжелой цепи человека.
[0561] В типичном варианте реализации 345 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 343, отличающаяся тем, что ген константной области TCR представляет собой ген константной области TCRα.
[0562] В типичном варианте реализации 346 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 345, отличающаяся тем, что гены вариабельной области иммуноглобулина и константной области TCRα расположены в эндогенном локусе TCRα.
[0563] В типичном варианте реализации 347 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 344, отличающаяся тем, что ген константной области TCR является геном константной области TCRβ.
[0564] В типичном варианте реализации 348 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 347, отличающаяся тем, что вариабельная область иммуноглобулина и ген константной области TCRβ расположены в эндогенном локусе TCRβ.
[0565] В типичном варианте реализации 349 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 344, отличающаяся тем, что ген константной области TCR имеет эндогенное происхождение.
[0566] В типичном варианте реализации 350 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 348, отличающаяся тем, что ген константной области TCR представляет собой ген константной области мыши.
[0567] В типичном варианте реализации 351 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 348, отличающаяся тем, что ген константной области TCR представляет собой ген константной области крысы.
[0568] В типичном варианте реализации 352 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 348, отличающаяся тем, что ген константной области TCR представляет собой ген константной области человека.
[0569] В типичном варианте реализации 353 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 352, отличающаяся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина человеческого происхождения.
[0570] В типичном варианте реализации 354 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 340 по 352, отличающаяся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина эндогенного происхождения.
[0571] В типичном варианте реализации 355 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 341 по 352, отличающаяся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина, происходящие от последовательности мыши.
[0572] В типичном варианте реализации 356 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 341 по 352, отличающаяся тем, что вариабельная область иммуноглобулина содержит межгенные последовательности вариабельной области иммуноглобулина, происходящие от последовательности крысы.
[0573] В типичном варианте реализации 357 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 341 по 356, геном которой дополнительно содержит инактивированный эндогенный локус иммуноглобулина.
[0574] В типичном варианте реализации 358 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 357, отличающаяся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус тяжелой цепи иммуноглобулина.
[0575] В типичном варианте реализации 359 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 358, отличающаяся тем, что эндогенный локус тяжелой цепи иммуноглобулина инактивируют путем делеции по меньшей мере части вариабельной области эндогенного локуса тяжелой цепи.
[0576] В типичном варианте реализации 360 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 359, отличающаяся тем, что делеция по меньшей мере части вариабельной области включает делецию сегментов J-гена вариабельной области.
[0577] В типичном варианте реализации 361 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 358, отличающаяся тем, что эндогенный локус тяжелой цепи иммуноглобулина инактивируют путем делеции по меньшей мере части константной области эндогенного локуса тяжелой цепи.
[0578] В типичном варианте реализации 362 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 361, отличающаяся тем, что делеция по меньшей мере части константной области включает делецию сегментов гена Cμ константной области.
[0579] В типичном варианте реализации 363 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 357, отличающаяся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус κ-цепи иммуноглобулина.
[0580] В типичном варианте реализации 364 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 363, отличающаяся тем, что эндогенный локус κ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части вариабельной области эндогенного локуса κ-цепи.
[0581] В типичном варианте реализации 365 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 364, отличающаяся тем, что делеция по меньшей мере части вариабельной области включает делецию сегментов J-гена вариабельной области.
[0582] В типичном варианте реализации 366 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 365, отличающаяся тем, что эндогенный локус κ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части константной области эндогенного локуса κ-цепи.
[0583] В типичном варианте реализации 367 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 366, отличающаяся тем, что делеция по меньшей мере части константной области включает делецию сегментов гена Cκ константной области.
[0584] В типичном варианте реализации 368 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 357, отличающаяся тем, что инактивированный эндогенный локус иммуноглобулина представляет собой эндогенный локус λ-цепи иммуноглобулина.
[0585] В типичном варианте реализации 369 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 368, отличающаяся тем, что эндогенный локус λ-цепи иммуноглобулина инактивируют путем делеции по меньшей мере части кластера V-J-C эндогенного локуса λ-цепи.
[0586] В типичном варианте реализации 370 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 331 по 369, отличающаяся тем, что нереаранжированные сегменты гена вариабельной области иммуноглобулина человека подвергаются реаранжировке при развитии Т-клеток с получением реаранжированных генов вариабельной области иммуноглобулина в Т-клетках животного, не являющегося человеком, происходящего от ЭС-клетки.
[0587] В типичном варианте реализации 371 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 370, отличающаяся тем, что по меньшей мере 10% реаранжированных генов вариабельных областей у животного, не являющегося человеком, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0588] В типичном варианте реализации 372 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 370, отличающаяся тем, что по меньшей мере 20% реаранжированных генов вариабельных областей у животного, не являющегося человеком, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0589] В типичном варианте реализации 373 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 370, отличающаяся тем, что по меньшей мере 40% реаранжированных генов вариабельных областей у животного, не являющегося человеком, происходящего от ЭС-клетки, содержат нематричные присоединения.
[0590] В типичном варианте реализации 374 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 370 по 372, отличающаяся тем, что указанное животное, не являющееся человеком, происходящее от ЭС-клетки, экспрессирует химерные рецепторы антигенов, содержащие вариабельный домен, кодируемый реаранжированным геном вариабельной области, и константный домен, кодируемый геном константной области TCR.
[0591] В типичном варианте реализации 375 настоящего изобретения предложена генетически модифицированная ЭС-клетка, соответствующая любому из вариантов реализации с 202 по 374, дополнительно содержащая функциональный эктопический ген Adam6 мыши.
[0592] В типичном варианте реализации 376 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая любому из вариантов реализации с 202 по 375, отличающаяся тем, что животное, не являющееся человеком, является млекопитающим.
[0593] В типичном варианте реализации 377 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 376, отличающаяся тем, что млекопитающее является грызуном.
[0594] В типичном варианте реализации 378 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 377, отличающаяся тем, что грызун представляет собой крысу или мышь.
[0595] В типичном варианте реализации 379 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 377, отличающаяся тем, что грызун представляет собой мышь.
[0596] В типичном варианте реализации 380 настоящего изобретения предложена ЭС-клетка генетически модифицированного животного, не являющегося человеком, соответствующая варианту реализации 377, отличающаяся тем, что грызун представляет собой крысу.
[0597] В типичном варианте реализации 381 настоящего изобретения предложен способ получения генетически модифицированного животного, не являющегося человеком, включающий применение ЭС-клетки генетически модифицированного животного, не являющегося человеком, соответствующей любому из вариантов реализации с 202 по 380.
[0598] В типичном варианте реализации 382 настоящего изобретения предложен способ получения животного, не являющегося человеком, включающий генетическую инженерию животного, не являющегося человеком, с целью внедрения в его зародышевую линию последовательности нуклеиновой кислоты, кодирующей терминальную дезоксинуклеотидилтрансферазу человека (hTdT).
[0599] В типичном варианте реализации 383 настоящего изобретения предложен способ получения животного, не являющегося человеком, включающий генетическую модификацию, включающую инженерию животного, не являющегося человеком, с целью внедрения в его зародышевую линию последовательности нуклеиновой кислоты, кодирующей экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT); и вариабельной области иммуноглобулина, содержащей нереаранжированные сегменты гена вариабельной области иммуноглобулина человека, функционально связанные с геном константной области иммуноглобулина.
[0600] В типичном варианте реализации 385 настоящего изобретения предложен способ получения животного, не являющегося человеком, включающий генетическую модификацию, включающую инженерию животного, не являющегося человеком, с целью внедрения в его зародышевую линию последовательности нуклеиновой кислоты, кодирующей экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT); и вариабельной области Т-клеточного рецептора (TCR), содержащей нереаранжированные сегменты гена вариабельной области TCR человека, функционально связанные с геном константной области TCR.
[0601] В типичном варианте реализации 386 настоящего изобретения предложен способ получения животного, не являющегося человеком, включающий генетическую модификацию, включающую инженерию животного, не являющегося человеком, с целью внедрения в его зародышевую линию последовательности нуклеиновой кислоты, кодирующей экзогенную терминальную дезоксинуклеотидилтрансферазу (TdT); и вариабельной области иммуноглобулина, содержащей нереаранжированные сегменты гена вариабельной области иммуноглобулина человека, функционально связанные с геном константной области TCR.
[0602] В типичном варианте реализации 387 настоящего изобретения предложен способ, соответствующий любому из вариантов реализации с 382 по 385, отличающийся тем, что животное, не являющееся человеком, является млекопитающим.
[0603] В типичном варианте реализации 388 настоящего изобретения предложен способ, соответствующий варианту реализации 386, отличающийся тем, что млекопитающее является грызуном.
[0604] В типичном варианте реализации 389 настоящего изобретения предложен способ, соответствующий варианту реализации 387, отличающийся тем, что грызун представляет собой крысу или мышь.
[0605] В типичном варианте реализации 390 настоящего изобретения предложен способ, соответствующий варианту реализации 387, отличающийся тем, что грызун представляет собой мышь.
ПРИМЕРЫ
[0606] Изобретение дополнительно проиллюстрировано следующими неограничивающими примерами. Эти примеры изложены в целях содействия пониманию изобретения, но не предназначены и не должны трактоваться как ограничивающие его сферу применения. Примеры не включают подробное описание общепринятых способов, хорошо известных специалистам в данной области техники (методик молекулярного клонирования и т.д.). Если не указано иное, части представляют собой части по массе, молекулярная масса представляет собой среднюю молекулярную массу, температура указана по Цельсию, а давление равно одной атмосфере или близко к этому значению.
Пример 1: получение мышей, экспрессирующих TdT человека
[0607] Мышей, содержащих ген TdT человека в качестве случайного трансгена или с адресным размещением в локусе каппа-цепи иммуноглобулина, получили с использованием генно-инженерной технологии VELOCIGENE® (см., например, патент США № 6586251 и Valenzuela, DM, et al.(2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis. Nat. Biotech. 21(6): 652-659), согласно которой последовательности человека, полученные из библиотек BAC с использованием бактериальной гомологичной рекомбинации, применяют для создания крупных направленных векторов (LTVEC), содержащих геномные фрагменты локуса TdT человека, а в случае TdT, адресно размещенной в локусе IgK, - фланкированных плечами для адресного размещения LTVEC в локусе IgK в ЭС-клетках мыши. LTVEC линеаризовали и вводили в линию ЭС-клеток мыши посредством электропорации в соответствии с Valenzuela et al. Выполняли скрининг ЭС-клеток с использованием TAQMAN® для определения количества копий гена (для случайно встроенных трансгенов) или правильности адресного размещения в локусе IgK.
[0608] В качестве альтернативы, синтезировали кДНК короткой изоформы TdT человека (TdTS) de novo (Blue Heron Bio) и вставляли ее в направленный вектор для введения в ЭС-клетки, как описано выше.
[0609] Клоны ЭС-клеток с адресным размещением трансгена внедряли в эмбрионы мыши на 8-клеточной стадии (или ранее) способом VELOCIMOUSE® (Poueymirou, W.T. et al. (2007). F0 generation mice fully derived from gene-targeted embryonic stem cells allowing immediate phenotypic analyses. Nat. Biotech. 25: 91-99). VELOCIMICE® (мышей F0, полностью происходящих от донорной ЭС-клетки), несущих локус TdT человека, выявляли путем TAQMAN®-скрининга по анализу аллеля человека (Valenzuela et al.). Детенышей поколения F0 генотипировали и скрещивали до гомозиготности. Получали и фенотипировали мышей, гомозиготных по локусу TdT человека. Как специфически описано ниже в примере 1, мышей, несущих TdTS человека и нереаранжированные локусы легкой и тяжелой цепи человека, получали путем случайного внедрения трансгена TdTS человека или адресного размещения TdTS человека в локусе IgK мышей VELOCIMMUNE®, несущих функциональный эктопический ген Adam6 мыши. В то же время по меньшей мере для случайного внедрения трансгена TdTS человека таких животных также можно получать посредством, во-первых, получения ЭС-клеток, содержащих TdTS человека, как описано ниже, получения из них мышей и скрещивания мышей, несущих случайно встроенный локус TdTS человека, с мышами VELOCIMMUNE®, несущими функциональный эктопический ген Adam6 мыши.
Пример 1.1. Получение трансгена, экспрессирующего короткую изоформу TdT (TdTS) человека под контролем регуляторных элементов Rag мыши (Rag-TdT tg)
[0610] Вкратце, крупный направленный вектор (LTVEC), подробно показанный на фиг. 1, конструировали из клонов BAC мыши и человека, в которых ген Rag2 мыши (от стартового кодона ATG в экзоне 3 до стоп-кодона TGA в экзоне 3 замещали геном терминальной дезоксинуклеотидилтрансферазы (TdT или DNTT), кодирующим только короткую изоформу TdTS (от стартового кодона ATG в экзоне 1 до ~ 0,5 т.п.о. в направлении 3' от сигнала polyA в экзоне 13). Сайты сплайсинга РНК экзонов 7 и 12 TdT мутировали для предотвращения экспрессии длинных изоформ (TdTL1 и L2). В том же LTVEC ген Rag1 мыши от стартового кодона ATG в экзоне 2 до стоп-кодона TAA в экзоне 2 замещали кодирующей последовательностью усиленного зеленого флуоресцентного белка (EGFP) и сигнала LacZ 3'UTR-polyA. LTVEC содержал 130 т.п.о. вышележащих регуляторных последовательностей, расположенных в 5'-направлении от гена Rag2 мыши, и 8,8 т.п.о. вышележащих регуляторных последовательностей, расположенных в направлении 3' от гена Rag1 мыши, а также межгенную область Rag2-Rag1 размером 5,6 т.п.о.
[0611] LTVEC конструировали из BAC-клона RP23-374f10 мыши (Invitrogen/Life Technologies), несущего гены Rag2 и Rag1, и BAC-клона RP11-1070o2 человека (Invitrogen/Life Technologies), несущего ген TdT, с использованием стандартных молекулярно-биологических методик и методик рекомбинации, например, ПЦР, рестрикционного гидролиза/лигирования, изотермической сборки Гибсона, CRISPR/Cas9, бактериальной гомологичной рекомбинации и т.д . Конечный LTVEC содержал в направлении от 5' к 3': (1) кассету Loxp-pgkp-em7-neo-loxp для отбора в ЭС-клетках или бактериях, (2) 134069 п.о. геномной последовательности мыши, начинающейся за 129440 п.о. выше экзона 1 Ron2 и заканчивающейся за 25 п.о. от начала экзона 3 Rag2 (координаты в геноме мыши 2: 101495278-101629347 на основе сборки GRCm38), (3) 34573 п.о. геномной последовательности TdT человека, начиная со стартового кодона ATG в экзоне 1 и заканчивая за 514 п.о. в направлении 3' от сигнала polyA (координаты в геноме человека 10: 96304498-96339063 на основе сборки GRCh38); в гене TdT донорный сайт сплайсинга экзона 7 удаляли и замещали сайтом NotI для предотвращения экспрессии изоформы TdTL2, а акцепторный сайт сплайсинга экзона 12 удаляли для предотвращения экспрессии изоформы TdTL1 (подробное описание см. ниже), (4) сайт AsiSI; (5) 10742 п.о. геномной последовательности мыши (координаты в геноме GRCm38 2: 101630931-101641672), содержащие 3'-нетранслируемую область экзона 3 Rag2 (1599 п.о.), межгенную область Rag2/Rag1 размером 5753 п.о. и 3'-нетранслируемую область экзона 2 Rag1 (3390 п.о.), (6) сайт FseI, (7) 1068 п.о. на минус-цепи, содержащие 249 п.о. сигнала polyA LacZ и 793 п.о. кодирующей последовательности EGFP, (8) 13459 п.о. геномной последовательности мыши (координаты в GRCm38 2: 101644793-101658251) с Rag1 на минус-цепи, начиная с стартового кодона ATG в эксоне 2 Rag1 и заканчивая за 8750 п.о. в направлении 3' от сайта начала транскрипции Rag1 и (9) кассеты Em7-CM для отбора в бактериях (см. фиг. 1).
[0612] Подробнее, этапы клонирования с образованием двух модификаций гена TdT в целях предотвращения альтернативного сплайсинга с использованием экзонов 7 и 12 TdT (применяемых для получения длинных изоформ TdTL2 и TdTL1, соответственно), в то же время обеспечивающих сплайсинг транскрипта, кодирующего короткую изоформу TdTS, сконструировали из BAC-клона RP11-1070o2 с использованием BHR и лигирования:
(1) 13 п.о., включающих донорный сайт сплайсинга экзона 7 (GTCGGGTCGTGGT (SEQ ID NO:1), донорный сайт сплайсинга выделен подчеркиванием), удаляли и замещали сайтом NotI (GCGGCCGC (SEQ ID NO:2)). Это привело к получению перекрывающегося сайта SacII (CCGCGG (SEQ ID NO:3)), а
(2) акцепторный сайт сплайнсинга за 2 п.о. от экзона 12 удаляли.
[0613] Конечный LTVEC изображен на фиг. 1 с указанием приблизительных положений соединений различных последовательностей. Сводная информация об этих соединениях также приведена ниже в таблице 1.
Таблица 1: Соединения последовательностей Rag-TdT Tg LTVEC
[0614] Конечный LTVEC линеаризовали и вводили посредством электропорации в ЭС-клетки VELOCIMMUNE®, содержащие функциональный эктопический ген Adam6 мыши (см., например, патент США № 8642835, включенный в настоящий документ посредством ссылки). После отбора с помощью Neo ЭС-клетки подвергали TAQMAN®-скринингу для определения количества копий трансгена. Получили ЭС-клетки, содержащие одну копию, две копии или несколько копий трансгена Rag-TdT человека.
[0615] Сайт встраивания трансгена Rag-TdT определяли с помощью способов, известных в данной области техники. В одном варианте реализации сайт встраивания определяли с использованием полногеномного низкопорогового секвенирования спаренных концов генома мыши (библиотека секвенирования - подготовка библиотеки ДНК Nextera, Illumina, Sequence - Miseq, Illumina). Например, в одном случае определили, что трансген Rag-TdT встроился в виде двух тандемных копий в конфигурации "голова-хвост" между координатами 41130492 и 41130502 на 1 хромосоме (координаты в сборке GRCm38/mm10) без нарушения кодирующих областей.
Пример 1.2. Получение адресной инсерции короткой изоформы TdT (TdTS) человека в локус каппа-цепи иммуноглобулина под контролем регуляторных элементов Rag мыши (Rag-TdT IgK)
[0616] С целью получения мыши, несущей TdT человека под контролем регуляторных элементов Rag в локусе каппа-цепи иммуноглобулина мыши, к 5'- и 3'-концам конструкта, полученного в соответствии с описанием в примере 1.1 и на фиг. 1, присоединили плечи, гомологичные IgK мыши, для рекомбинации в ЭС-клетках. В общем случае плечи IgK мыши добавляли путем: (1) модификации BAC IgK мыши посредством бактериальной гомологичной рекомбинации с целью инсерции селективной кассеты (например, Hyg, Neo и т.д.), фланкированной сайтами рестриктаз I-CeuI и PI-SceI, и (2) инсерции конструкта TdT в ВАК IgK мыши посредством лигирования по I-CeuI и PI-SceI. Конечный LTVEC изображен на фиг. 2.
[0617] Этот конечный LTVEC содержал по направлению от 5' к 3': (1) кассету Spec для отбора в бактериях, (2) плечо, гомологичное 5'-последовательности мыши, размером 28591 п.о. (координаты в геноме GRCm38 6: 70725823-70754415), содержащее ген IgKc, 3'-энхансер IgK и последовательность для 3'-рекомбинации IgK (RS); плечо последовательности мыши заканчивалось за ~ 2,6 т.п.о. от 3'-конца RS, (3) сайт PI-SceI, (4) кассету loxp-UbCp-em7-hyg-loxp для отбора в ЭС-клетках или бактериях, (5) конструкт, описанный выше в примере 1.1 и на фиг. 1, содержащий гены промотор Rag2-TdTS человека и Rag1-EGFP, (6) сайт I-CeuI, (7) плечо, гомологичное 3'-последовательности мыши, размером 44700 п.о. (координаты в геноме GRCm38 6: 70754508-70799678) и (8) кассету CM для отбора в бактериях.
[0618] Конечный LTVEC изображен на фиг. 2 с указанием приблизительных положений соединений различных последовательностей. Сводная информация об этих соединениях также приведена ниже в таблице 2.
Таблица 2: Соединения последовательностей Rag-TdT IgK LTVEC
[0619] Полученный LTVEC линеаризовали и вводили посредством электропорации в ЭС-клетки VELOCIMMUNE®, содержащие функциональный эктопический ген Adam6 мыши (см., например, патент США № 8642835, включенный в настоящий документ посредством ссылки). После отбора по устойчивости к Hyg ЭС-клетки подвергали скринингу с помощью TAQMAN®-модификации анализа аллелей (Valenzuela et al, supra) с целью выявления клонов с правильным адресным размещением.
Пример 1.3. Получение случайной и адресной инсерции трансгена короткой изоформы TdT (TdTS) человека в локус каппа-цепи иммуноглобулина под контролем как интронного энхансера тяжелой цепи иммуноглобулина мыши (Eμ), так и промотора IgVH1-72 мыши (mIgH-Eμ-VH1-72-TdT tg и mIgH-Eμ-VH1-72-TdT IgK, соответственно)
[0620] Тот же ген TdTS человека, который использовали для получения Rag-TdT в примерах 1.1 и 1.2 (т.е. от стартового кодона ATG до приблизительно 514 п.о. от 3'-конца сигнала polyA), помещали под контроль энхансера Еμ мыши размером 689 п.о. и промотора IgVH1-72 мыши размером 303 п.о. Этот конструкт случайным образом встраивали в геном мыши либо адресно размещали в локусе K-цепи иммуноглобулина (IgK). Для адресного встраивания ген вставляли между теми же 5'- и 3'-последовательностями, гомологичными IgK мыши, которые использовали для получения LTVEC в примере 1.2.
[0621] Конкретнее, конечный LTVEC содержал в направлении от 5' к 3' (фиг. 3): (1) кассету Spec для отбора у бактерий, (2) плечо, гомологичное 5'-последовательности мыши, размером 28591 п.о. (координаты в геноме GRCm38 8: 70725823-70754415), содержащее ген константной области IgK (IgKc), 3'-энхансер IgK и последовательность для 3'-рекомбинации IgK (RS); плечо последовательности мыши заканчивалось за ~ 2,6 т.п.о. от 3'-конца RS, (3) сайт I-CeuI, (4) кассету loxp-UbCp-em7-hyg-loxp в обратной ориентации для отбора в ЭС-клетках или бактериях, (5) тот же ген TdTS человека размером 34573 п.о., который использовали выше в примерах, в обратной ориентации, (6) промотор IgHV1-72 мыши размером 303 п.о. в обратной ориентации (координаты в геноме GRCm38 12: 115758417-115758719), (7) энхансер Eμ мыши размером 689 п.о. (фрагмент EcoRI-XbaI, координаты в геноме GRCm38 12: 113427284-113427972) в обратной ориентации, (8) сайт PI-SceI, (9) плечо, гомологичное 3'-последовательности мыши, размером 44700 п.о. (координаты в геноме GRCm38 6: 70754508-70799678) и (10) кассету CM для отбора в бактериях.
[0622] Приблизительные положения соединений конкретных последовательностей переходов в конечном векторе изображены на фиг. 3, и их последовательности указаны ниже в таблице 3.
Таблица 3: Соединения последовательностей mIgH-Eμ-VH1-72-TdT IgK LTVEC
[0623] Полученный LTVEC линеаризовали и вводили посредством электропорации в ЭС-клетки VELOCIMMUNE®, содержащие функциональный эктопический ген Adam6 мыши (см., например, патент США № 8642835, включенный в настоящий документ посредством ссылки). После отбора по устойчивости к Hyg клоны ЭС-клеток подвергали TAQMAN®-скринингу на предмет правильности адресного размещения в локусе IgK мыши (для mIgH-Eμ-VH1-72-TdT IgK) или количества копий трансгена (для mIgH-Eμ-VH1-72-TdT tg).
Пример 1.4. Получение адресной инсерции в локус каппа-цепи иммуноглобулина, а также трансгенной TdTS человека из кДНК TdTS
[0624] В качестве альтернативы, синтезировали кДНК TdTS de novo (Blue Heron Bio) в виде фрагмента ДНК размером 3682 п.о. и вставляли ее в направленный вектор для введения в ЭС-клетки. Направленный вектор содержал в направлении от 5' к 3' сайт PI-SceI, интронный энхансер IgH мыши размером 689 п.о. (фрагмент EcoRI-XbaI), промотор VH1-72 мыши размером 303 п.о., кодирующую последовательность TdTS человека размером 1530 п.о. (NCBI RefSeq NM_004088) с интроном 2 размером 735 п.о., оставленным между экзонами 2 и 3 для интрон-опосредованного усиления экспрессии, 3'-нетранслируемую область/сигнал polyA TdT размером 340 п.о., сайты рестриктаз NotI и SalI для лигирования в кассету loxp-neo-loxp и сайт I-CeuI. Вектор вставляли между теми же 5'- и 3'-плечами, гомологичными IgK мыши, которые использовали для получения LTVEC в примере 1.2, и адресно встраивали в локус IgK или случайным образом встраивали в геном мыши.
[0625] Полученный LTVEC линеаризовали и вводили посредством электропорации в ЭС-клетки VELOCIMMUNE®, содержащие функциональный эктопический ген Adam6 мыши (см., например, патент США № 8642835, включенный в настоящий документ посредством ссылки). После отбора по устойчивости к Hyg клоны ЭС-клеток подвергали TAQMAN®-скринингу на предмет правильности адресного размещения в локусе IgK мыши (для версии с адресным встраиванием в IgK) или количества копий трансгена (для трансгенной версии).
Пример 1.5. Мыши, экспрессирующие TdTS человека
[0626] Как описано выше, после получения ЭС-клеток с правильным адресным размещением их вводили эмбрионы мши на 8-клеточной стадии (или ранее) способом VELOCIMOUSE®, подвергали скринингу при анализе аллелей и затем скрещивали до гомозиготности. Гетерозиготные или гомозиготные животные экспрессировали TdTS человека, а также антитела, содержащие вариабельные домены легких и тяжелых цепей человека и константные области мыши (поскольку эти мыши несли сегменты генов вариабельных областей легких и тяжелых цепей иммуноглобулина человека в эндогенных локусах IgK и IgH, соответственно: мыши VELOCIMMUNE®).
[0627] Получили и протестировали несколько версий мышей, несущих TdTS человека, а также мышей, несущих TdTS, случайно внедренную и адресно размещенную в IgK как под контролем промотора Rag, так и регуляторных элементов Eμ-VH1-72. Кроме того, получили версии с одним, двумя или несколькими копиями трансгена TdTS; а также версии, полученные из геномных последовательностей и кДНК-последовательностей TdT. Остальные примеры демонстрировали данные, полученные с использованием мышей, несущих трансген Rag-геномная TdTS (тандемная инсерция двух копий в 1 хромосому, как описано выше в примере 1.1) и Eμ-VH1-72-геномная TdTS, адресно размещенный в локусе IgK (пример 1.3).
[0628] Во-первых, мышей тестировали на предмет экспрессии TdT. ОТ-ПЦР использовали для амплификации транскриптов TdT из костного мозга контрольных особей VELOCIMMUNE®, VELOCIMMUNE® + трансген Rag-геномная TdTS или VELOCIMMUNE® + Eμ-VH1-72-геномная TdTS, адресно размещенный в локусе IgK мыши. Общую РНК использовали для обратной транскрипции с помощью обратной транскриптазы SUPESCRIPT® III (Life Technologies) и праймера Oligo-dT. ПЦР выполняли с использованием смеси SsoAdvanced™ Universal SYBR® Green Supermix с праймерами бета-актина (контроль), праймерами, разработанными для амплификации 1-2 экзонов, праймерами, разработанными для амплификации 4-6 экзонов, праймерами, разработанными для амплификации 7-9 экзонов, и праймерами, разработанными для амплификации 9-11 экзонов. Как показано на фиг. 4, наличие экзонов TdT человека обнаружили у обеих версий мышей, однако эти экзоны отсутствовали у контрольных мышей VELOCIMMUNE®.
Пример 2. Разнообразие соединений в каппа-цепи иммуноглобулина человека у мышей, несущих TdTS человека
[0629] Для оценки разнообразия репертуара последовательностей иммуноглобулина на различных моделях TdTS человека у мышей VELOCIMMUNE®, описанных выше в примере 1, последовательности IgK амплифицировали посредством 5'-RACE из селезенки различных мышей с использованием праймера константной цепи mIgK и секвенировали с использованием Illumina MiSeq.
[0630] Конкретнее, В-клетки селезенки положительно обогащали из общих спленоцитов путем магнитной сортировки клеток с использованием магнитных гранул с антителами против CD19 (мыши) и колонок MACS® (Miltenyi Biotech). Общую РНК выделяли из очищенных В-клеток селезенки с использованием набора для выделения РНК RNeasy Plus (Qiagen) в соответствии с инструкциями производителя. Обратную транскрипцию выполняли для получения кДНК, содержащей последовательности константной области Igκ, с использованием набора для амплификации кДНК SMARTer™ RACE (Clontech) и праймера, специфичного по отношению к Igκ (таблица 4). Во время этого процесса последовательность кДНК, обратно комплементарную 3'-концу праймера PE2-PIIA, присоединяли к 3'-концу вновь синтезированных кДНК. Затем очищенные Igκ-специфичные кДНК амплифицировали с помощью ПЦР 1 этапа с использованием праймера PE2-PIIA и праймера, специфичного по отношению к константной области Igκ, указанных в таблице 4. Продукты ПЦР размером 450-700 п.о. выделяли с использованием Pippin Prep (SAGE Science). Эти продукты дополнительно амплифицировали с помощью ПЦР 2 этапа с использованием праймеров, перечисленных в таблице 4 («XXXXXX» - последовательности индексов размером 6 п.о., позволяющих мультиплексировать образцы для секвенирования). Продукты ПЦР размером 400-700 п.о. выделяли, очищали и количественно определяли с помощью qPCR с использованием набора для количественной оценки библиотек KAPA (KAPA Biosystems) перед загрузкой в секвенатор Miseq (Illumina) для секвенирования с использованием наборов Miseq Reagent Kits v3 (600 циклов).
Таблица 4: Праймеры, использованные при подготовке библиотеки для секвенирования репертуара Igk
[0631] Для биоинформатического анализа необработанные последовательности Illumina демультиплексировали и фильтровали по качеству, длине и совершенного соответствия праймеру константной области каппа-цепи. Перекрывающиеся прочтения с парными концами объединяли и анализировали с использованием пользовательского внутреннего процесса. В этом процессе использовали локально установленную программу IgBLAST (NCBI, v.2.2.25+) для выравнивания реаранжированных последовательностей легкой цепи с базой данных эмбриональных последовательностей V- и J-генов человека. Реаранжировки считали продуктивными при отсутствии обнаружения стоп-кодонов и совпадении рамки считывания VJ-соединения и J-сегмента. В противном случае реаранжировки считали непродуктивными и исключали из анализа.
[0632] Последовательности CDR3 выделяли с использованием границ согласно международной информационной системе иммуногенетики (IMGT). Область соединения между аннотированными сегментами V и J классифицировали как P- и N-нуклеотиды. Из каждой последовательности выделяли область с присоединениями N/P и рассчитывали ее длину. Разнообразие репертуара антител рассчитывали путем анализа уникальных клонотипов. Разнообразие последовательностей определяли как количество уникальных последовательностей CDR3 в случайно выбранных 10000 прочтений.
[0633] На фиг. 5 показано, что в моделях TdTS человека у мышей обнаружено увеличение количества уникальных аминокислотных последовательностей CDR3 вплоть до 2-кратного по сравнению с мышами VELOCIMMUNE®, которые не несли TdTS человека. Увеличение разнообразия CDR3 наблюдали также на уровне нуклеотидов (данные не показаны). На фиг. 5 показаны только данные, полученные с использованием мышей, несущих две копии трансгена Rag-геномная TdTS (Rag TdT Tg) и Eμ-VH1-72-геномная TdTS, адресно размещенного в локусе IgK (mIgH- Eμ-VH1-72 TdT IgK) ( как гомозиготных, так и гетерозиготных версий), хотя аналогичные данные были получены и для других версий мышей (не показаны).
Пример 3. Увеличение количества присоединений в соматических последовательностях у мышей, несущих TdTS человека
[0634] Долю присоединений нуклеотидов в соматических последовательностях CDR3 (состоящих из фрагментов сегментов генов Vκ и Jκ) также определяли посредством секвенирования нового поколения, описанного выше в примере 2.
[0635] Как показано на фиг. 6, продемонстрировано, что приблизительно 45% соматических последовательностей гуманизированных легких каппа-цепей в В-клетках содержали присоединения у обеих версий мышей с гуманизированной TdTS, в то время как аналогичный показатель у мышей VELOCIMMUNE®, несущих функциональный эктопический ген Adam6 мыши, составлял приблизительно 10%. Анализ последовательностей легких цепей иммуноглобулина в клетках селезенки продемонстрировал наличие от 0 до 8 нематричных присоединений в легких цепях у мышей с TdTS человека (цифра 8 на фигуре включает последовательности с 8 или более нематричными присоединениями).
Пример 4. Длина CDR3 легкой цепи человека в иммуноглобулинах, полученных из мышей с TdTS человека
[0636] Последовательности CDR3 выделяли с использованием границ согласно международной информационной системе иммуногенетики (IMGT). Нематричные нуклеотиды определяли на основе известных последовательностей V и J легкой цепи.
[0637] Как показано на фиг. 7А, повышенное количество нематричных присоединений, наблюдаемое у двух версий мышей с TdTS человека, описанных выше в примерах 2 и 3, привело к увеличению длины CDR3 легкой каппа-цепи по сравнению с контролем (мышами VELOCIMMUNE®, несущими функциональный эктопический ген Adam6 мыши). Как показано на фиг. 7B, анализ последовательностей не выявил повышенной экзонуклеазной активности, влияющей на скорость укорачивания 5'-конца J-сегментов у мышей Rag-TdTS (в настоящем документе представлены только данные для гетерозиготных мышей) по сравнению с контролем (мышами VELOCIMMUNE®, несущими функциональный эктопический ген Adam6 мыши).
Пример 5. Использование сегментов генов Vκ и Jκ легкой цепи человека у мышей с TdTS человека
[0638] Как показано на фиг. 8А и 8В, внедрение TdTS человека у двух версий мышей, описанных выше в примерах 2 и 3, не оказывало существенного влияния на использование сегментов генов Vκ или Jκ по сравнению с мышами VELOCIMMUNE®, несущими функциональный эктопический ген Adam6 мыши.
Пример 6. Разнообразие соединений в локусе легкой лямбда-цепи иммуноглобулина и других локусах, подвергающихся реаранжировке, у мышей, несущих TdTS человека
[0639] В дополнение к локусу каппа-цепи иммуноглобулина человека, можно исследовать антиген-рецепторное разнообразие в других локусах B- (легкой λ-цепи, тяжелой цепи) и T- (α/β) лимфоцитов.
[0640] Например, при сравнении разнообразия соединений в легкой лямбда-цепи, содержащей C λ1, у мышей VELOCIMMUNE®, несущих функциональный эктопический ген Adam6 мыши, с такими же мышами VELOCIMMUNE®, дополнительно несущими трансгены TdT человека, описанные выше в примере 1, с использованием способа секвенирования, описанного в примере 2, и праймеров, перечисленных в таблице 5, наблюдали повышенное (приблизительно в 2 раза) разнообразие последовательностей лямбда-локуса мыши у трансгенных мышей (фиг. 9). Кроме того, наблюдали увеличение частоты нематричных присоединений в ламбда-цепи иммуноглобулина мыши (фиг. 10). Длина CDR3 лямбда-цепей у трансгенных мышей с TdT показана на фиг. 11. Наконец, между различными протестированными животными (фиг. 12) не наблюдалось различий в использовании V-гена лямбда-цепи мыши.
Таблица 5: Праймеры, использованные при подготовке библиотеки для секвенирования репертуара IgL-C1
[0641] Кроме мышей VELOCIMMUNE®, несущих нереаранжированные сегменты вариабельных генов тяжелой и легкой цепей человека, включая мышей, несущих функциональный эктопический ген Adam6 мыши, как описано выше (см., например, патенты США № 8878001; 9078418; 9125386, включенные в настоящий документ посредством ссылок), или мышей, несущих только нереаранжированные сегменты вариабельных генов тяжелой цепи человека или нереаранжированные сегменты вариабельных генов легкой цепи человека, можно получить других животных, несущих TdTS человека. Некоторые из таких животных включают животных, несущих вариабельную область лямбда-цепи человека в эндогенном локусе лямбда-цепи или каппа-цепи мыши (патенты США № 9035128; 9066502; 9163092; 9120662; 9029628; 9006511; 9012717), вариабельную область каппа-цепи человека в эндогенном локусе тяжелой цепи (см. например, публикацию заявки на патент США № 2012/0096572), локусы гуманизированных TCR-альфа-и бета (например, патент США № 9113616) и их различные пермутации, мышей с двойной легкой цепью и ее пермутациями (публикация заявки на патент США № 2013/0198880), мышей с универсальной легкой цепью и ее пермутациями (например , публикации заявок на патент США № 2011/0195454; 2013/018582), мышей с универсальной тяжелой цепью и ее пермутациями (например , патент США № 9204624), мышей, несущих замены гистидина в своем эмбриональном геноме (например, патенты США № 9334334 и 9301510, публикации заявок на патент США № 2013/0247236, 2014/0013456), мышей с химерными рецепторами антигенов (например, публикация заявки на патент США № 2016/0081314), мышей без домена CH1 (например, патент США № 8754287 и публикация заявки на патент США № 2015/0289489); все указанные источники включены в настоящий документ посредством ссылки. Любых таких животных, у которых желательно увеличить разнообразие соединений в легкой и/или тяжелой цепи (например, легкой и/или тяжелой цепи человека), можно получать путем внедрения в ЭС-клетки, включающие такие модификации, трансгена или адресной инсерции TdTS человека, описанной в настоящем документе. В случае мышей, получаемых из ЭС-клеток, содержащих случайным образом встроенный трансген TdTS (а также в случаях без модификации локуса IgK, например, при использовании гуманизированных локусов TCR мыши), таких животных также можно получать путем скрещивания с мышами, несущими различные вышеупомянутые модификации. Успешное внедрение аллеля TdTS в геном таких животных определяли, как описано выше, и влияние экспрессии TdTS человека на разнообразие соединений в различных локусах определяли, как описано выше. Кроме того, изучали влияние на немодифицированные локусы, подвергающиеся реаранжировке, например, эндогенные локусы иммуноглобулинов и Т-клеточных рецепторов мыши.
[0642] Один из таких примеров, в котором изучали влияние внедрения TdT на разнообразие соединений у мышей с двойной легкой цепью, представлен в примерах 7-10 ниже.
Пример 7. Разнообразие соединений в каппа-цепи иммуноглобулина человека у мышей с двойной легкой цепью (DLC), несущих TdTS человека
[0643] Мышей, несущих локус двойной легкой цепи и TdTS человека, получали путем скрещивания мышей VELOCIMMUNE®, несущих функциональный ген Adam6 мыши (см. патенты США № 8642835 и 8697940) и экзогенную TdTS человека, с мышами, несущими локус двойной легкой цепи (см. публикацию заявки на патент США № US 2013/0198880, включенную в настоящий документ посредством ссылки).
[0644] Для оценки разнообразия последовательностей репертуара иммуноглобулинов на моделях TdTS человека у мышей DLC, характеризующихся ограниченным количеством локусов Igκ и несущих лишь два нереаранжированных сегмента гена Vκ: IGVK3-20 и IGVK1-39 и пять нереаранжированных сегментов гена IGJK (см. заявку на патент США № US2013/0198880, включенную в настоящий документ посредством ссылки), последовательности Igκ амплифицировали посредством 5'-RACE из клеток селезенки различных мышей с использованием праймера для константной области mIgK и секвенировали с помощью Illumina MiSeq. В большинстве экспериментов использовали несколько мышей, гетерозиготных по Rag TdT Tg и гомозиготных по локусу DLC (Rag TdT tg (HET) DLC), и двух мышей, гомозиготных по Rag TdT Tg и гомозиготных по локусу DLC (Rag TdT tg (HO) DLC); данные для Rag TdT tg (HET) DLC представлены как среднее значение для всех тестируемых мышей, в то время как две мыши Rag TdT tg (HO) DLC показаны по отдельности.
[0645] Конкретнее, В-клетки селезенки положительно обогащали из общих спленоцитов путем магнитной сортировки клеток с использованием магнитных гранул с антителами против CD19 (мыши) и колонок MACS® (Miltenyi Biotech). Общую РНК выделяли из очищенных В-клеток селезенки с использованием набора для выделения РНК RNeasy Plus (Qiagen) в соответствии с инструкциями производителя. Обратную транскрипцию выполняли для получения кДНК, содержащей последовательности константной области Igκ, с использованием набора для амплификации кДНК SMARTer™ RACE (Clontech) и праймера, специфичного по отношению к Igκ (таблица 4). Во время этого процесса последовательность кДНК, обратно комплементарную 3'-концу праймера PE2-PIIA, присоединяли к 3'-концу вновь синтезированных кДНК. Затем очищенные Igκ-специфичные кДНК амплифицировали с помощью ПЦР 1 этапа с использованием праймера PE2-PIIA и праймера, специфичного по отношению к константной области Igκ, указанных в таблице 4. Продукты ПЦР размером 450-700 п.о. выделяли с использованием Pippin Prep (SAGE Science). Эти продукты дополнительно амплифицировали с помощью ПЦР 2 этапа с использованием праймеров, перечисленных в таблице 4 («XXXXXX» - последовательности индексов размером 6 п.о., позволяющих мультиплексировать образцы для секвенирования). Продукты ПЦР размером 400-700 п.о. выделяли, очищали и количественно определяли с помощью qPCR с использованием набора для количественной оценки библиотек KAPA (KAPA Biosystems) перед загрузкой в секвенатор Miseq (Illumina) для секвенирования с использованием наборов Miseq Reagent Kits v3 (600 циклов).
[0646] Для биоинформатического анализа необработанные последовательности Illumina демультиплексировали и фильтровали по качеству, длине и совершенного соответствия праймеру константной области каппа-цепи. Перекрывающиеся прочтения с парными концами объединяли и анализировали с использованием пользовательского внутреннего процесса. В этом процессе использовали локально установленную программу IgBLAST (NCBI, v.2.2.25+) для выравнивания реаранжированных последовательностей легкой цепи с базой данных эмбриональных последовательностей V- и J-генов человека. Реаранжировки считали продуктивными при отсутствии обнаружения стоп-кодонов и совпадении рамки считывания VJ-соединения и J-сегмента. В противном случае реаранжировки считали непродуктивными и исключали из анализа.
[0647] Последовательности CDR3 выделяли с использованием границ согласно международной информационной системе иммуногенетики (IMGT). Область соединения между аннотированными сегментами V и J классифицировали как P- и N-нуклеотиды (нематричные присоединения). Из каждой последовательности выделяли область с присоединениями N/P и рассчитывали ее длину. Разнообразие репертуара антител рассчитывали путем анализа уникальных клонотипов. Разнообразие последовательностей определяли как количество уникальных последовательностей CDR3 в случайно выбранных 10000 прочтений.
[0648] На фиг. 13 показано, что в моделях TdTS человека у мышей DLC обнаружено более чем 2-кратное увеличение количества уникальных аминокислотных последовательностей CDR3 по сравнению с мышами DLC, которые не несли внедренной TdTS человека.
Пример 8. Увеличение количества соматических присоединений у мышей DLC, несущих TdTS человека
[0649] Долю соматических присоединений нуклеотидов в CDR3 (состоящем из фрагментов сегментов генов Vκ и Jκ иммуноглобулина) в последовательностях иммуноглобулинов у мышей DLC с TdT также определяли посредством секвенирования нового поколения, описанного выше в примере 7.
[0650] Как показано на фиг. 14, продемонстрировано, что приблизительно половина гуманизированных легких каппа-цепей в В-клетках мышей DLC с гуманизированной TdTS (как HET, так и HO по TdT) содержали соматические присоединения, в то время как аналогичный показатель у контрольных мышей DLC( мышей DLC без внедренной TdT человека) составлял приблизительно 10%.
Пример 9. Длина CDR3 легкой цепи человека в иммуноглобулинах, полученных из мышей DLC, несущих TdTS человека
[0651] Последовательности CDR3 выделяли с использованием границ согласно международной информационной системе иммуногенетики (IMGT). Нематричные нуклеотиды определяли на основе известных последовательностей V и J легкой цепи.
[0652] Как показано на фиг. 15, повышенное количество нематричных присоединений, наблюдаемое у описанных мышей DLC с гуманизированной TdTS (как HET, так и HO), привело к увеличению длины CDR3 легкой каппа-цепи по сравнению с контролем (мышами DLC без внедренной TdT человека).
Пример 10. Использование сегментов генов Vκ и Jκ легкой цепи человека у мышей DLC, несущих TdTS человека
[0653] Как показано на фиг. 16, внедрение TdTS человека у мышей DLC не оказывало существенного влияния на использование сегментов генов Vκ или Jκ по сравнению с контрольными мышами DLC (мышами DLC без внедренной TdT человека).
Включение посредством ссылки
[0654] Все публикации, патенты и патентные заявки, упомянутые в настоящем документе, полностью включены в настоящий документ посредством ссылки, как если бы было специально указано, что каждая отдельная публикация, патент или патентная заявка включены в настоящий документ посредством ссылки. В случае конфликта приоритет будет иметь настоящая заявка, включая любые определения, приведенные в настоящем документе.
Эквиваленты
[0655] Специалисты в данной области техники должны понимать или смогут убедиться с использованием стандартных экспериментов в возможности реализации большого количества эквивалентов конкретных вариантов реализации настоящего изобретения, описанных в настоящем документе. Подразумевается, что такие эквиваленты подпадают под действие следующей формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> REGENERON PHARMACEUTICALS, INC.
<120> ЖИВОТНЫЕ, НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ, ЭКСПРЕССИРУЮЩИЕ ЭКЗОГЕННУЮ ТЕРМИНАЛЬНУЮ
ДЕЗОКСНУКЛЕОТИДИЛТРАНСФЕРАЗУ
<130> RPB-01325
<140> PCT/US2017/035731
<141> 02.06.2017
<150> 62/345 524
<151> 03.06.2016
<160> 25
<170> Версия PatentIn 3.5
<210> 1
<211> 13
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: Синтетический
олигонуклеотид
<400> 1
gtcgggtcgt ggt 13
<210> 2
<211> 8
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 2
gcggccgc 8
<210> 3
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 3
ccgcgg 6
<210> 4
<211> 99
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 4
tattgcgttt ttttaatcct ttcagataaa agacctattc acaatcaaaa atggatccac 60
cacgagcgtc ccacttgagc cctcggaaga agagacccc 99
<210> 5
<211> 108
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 5
gccctggctg agggaaattt tggaactccc aggctccaga cccattcttt gcgatcgctt 60
tagcaaaagc ccctcagact caggtatatt gctctctgaa tctacttt 108
<210> 6
<211> 107
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 6
ccaaaggaaa acacattggc aaataccaac ttctatgtgg agatcctatg gccggccggg 60
gatccagaca tgataagata cattgatgag tttggacaaa ccacaac 107
<210> 7
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 7
tcgaccagga tgggcaccac cccggtgaac agctcctcgc ccttgctcac catgttggct 60
aagctacctg ggaacaatgg gggggggggg gggagtcaag 100
<210> 8
<211> 139
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 8
catccttaca tctttgtcat cccctgtatc aacatggaaa ggcattaatg atctatgtcg 60
ggtgcggaga aagaggtaat gaaatggcaa ccggtataac ttcgtataat gtatgctata 120
cgaagttata tgcatggcc 139
<210> 9
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 9
ttcgtataat gtatgctata cgaagttatg tcgacctcga gggggggccc acctccagct 60
gccttacaga aaagcaaatg cttgcttgca acaatcacct 100
<210> 10
<211> 99
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 10
tattgcgttt ttttaatcct ttcagataaa agacctattc acaatcaaaa atggatccac 60
cacgagcgtc ccacttgagc cctcggaaga agagacccc 99
<210> 11
<211> 108
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 11
gccctggctg agggaaattt tggaactccc aggctccaga cccattcttt gcgatcgctt 60
tagcaaaagc ccctcagact caggtatatt gctctctgaa tctacttt 108
<210> 12
<211> 108
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 12
cccaaaggaa aacacattgg caaataccaa cttctatgtg gagatcctat ggccggccgg 60
ggatccagac atgataagat acattgatga gtttggacaa accacaac 108
<210> 13
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 13
tcgaccagga tgggcaccac cccggtgaac agctcctcgc ccttgctcac catgttggct 60
aagctacctg ggaacaatgg gggggggggg gggagtcaag 100
<210> 14
<211> 151
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 14
acctctgctg tgtctgcaag tttggcttgt tcctgcttct gatttttggg tctagacccc 60
cgggctcgat aactataacg gtcctaaggt agcgactcga gcataaccac tttcctgcta 120
tggatctgtt aaatatccgc caaaggccaa g 151
<210> 15
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 15
catccttaca tctttgtcat cccctgtatc aacatggaaa ggcattaatg tcgctacctt 60
aggaccgtta tagttaggcc ccccctcgag gtcgacataa cttcgtatag catacattat 120
acgaag 126
<210> 16
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 16
ggccatgcat ataacttcgt atagcataca ttatacgaag ttataccggt aaagaatggg 60
tctggagcct gggagttcca aaatttccct cagccagggc 100
<210> 17
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 17
cggggtctct tcttccgagg gctcaagtgg gacgctcgtg gtggatccat ggtgaggtcc 60
tgtgtgctca gtaactgtaa agagaacagt gatctcatgt 100
<210> 18
<211> 146
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 18
tagtttcccc aaacttaagt ttatcgactt ctaaaatgta tttagaattc tgccatttca 60
ttacctcttt ctccgcaccc gacatagata aagcttcata accactttcc tgctatggat 120
ctgttaaata tccgccaaag gccaag 146
<210> 19
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
праймер"
<400> 19
aagaagcaca cgactgaggc ac 22
<210> 20
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
праймер"
<400> 20
acactctttc cctacacgac gctcttccga tctggaagat ggatacagtt ggtgc 55
<210> 21
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
праймер"
<400> 21
gtgactggag ttcagacgtg tgctcttccg atctaagcag tggtatcaac gcagagt 57
<210> 22
<211> 68
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
праймер"
<220>
<221> модифицированное_основание
<222> (30)..(35)
<223> a, c, t, g, неизвестное или другое
<400> 22
aatgatacgg cgaccaccga gatctacacn nnnnnacact ctttccctac acgacgctct 60
tccgatct 68
<210> 23
<211> 64
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
праймер"
<220>
<221> модифицированное_основание
<222> (25)..(30)
<223> a, c, t, g, неизвестное или другое
<400> 23
caagcagaag acggcatacg agatnnnnnn gtgactggag ttcagacgtg tgctcttccg 60
atct 64
<210> 24
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
праймер"
<400> 24
caccagtgtg gccttgttag tctc 24
<210> 25
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<221> исходная
<223> / примечание = "Описание искусственной последовательности: синтетический
праймер"
<400> 25
acactctttc cctacacgac gctcttccga tctaaggtgg aaacagggtg actgatg 57
<---
Реферат
Изобретение относится к области биотехнологии, в частности к генетически модифицированной мыши, содержащей последовательность нуклеиновой кислоты, кодирующую терминальную дезоксинуклеотидилтрансферазу (TdT) человека, функционально связанную с элементом контроля транскрипции, и вариабельную область иммуноглобулина, а также к ее ЭС-клетке. Также раскрыто применение вышеуказанной ЭС-клетки мыши для получения генетически модифицированной мыши. Изобретение может быть эффективно использовано для индуцирования экспрессии антитела, содержащего вариабельный домен человека. 4 н. и 31 з.п. ф-лы, 16 ил., 5 табл., 10 пр.

Комментарии