Фермент лизосомальной болезни накопления - RU2741116C2
Код документа: RU2741116C2
Чертежи



































Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка истребует приоритет перед временной заявкой на патент США No. 61/343177 от 23 апреля 2010 г., временной заявкой на патент США No. 61/396376 от 26 мая 2010 г., временной заявкой на патент США No. 61/403011 от 9 сентября 2010 г., временной заявкой на патент США No. 61/456014 от 29 октября 2010 г., временной заявкой на патент США No. 61/432372 от 13 января 2011 г. Все содержание представленных выше документов включено сюда во всей своей полноте посредством ссылки.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
Дефицит лизосомальной кислой липазы (ЛКЛ) является очень редкой лизосомальной болезнью накопления (ЛБН), характеризующейся отсутствием распадов эфиров холестерина (ЭХ) и триглицеридов (ТГ) в лизосомах по причине недостатка фермента. Недостаток ЛКЛ напоминает другие лизосомальные болезни накопления с накоплением субстрата в ряде тканей и клеток различных типов. При недостатке ЛКЛ накопление субстрата наиболее выражено в клетках ретикулоэндотелиальной системы, включая купферовы клетки в печени, гистиоциты в селезенке и клетки собственной пластинки тонкого кишечника. Ретикулоэндотелиальные клетки экспрессируют рецептор маннозы/N-ацетилглюкозамина макрофага (также известен как рецептор маннозы макрофага или MMR, CD206), который опосредует связывание, захват клеток и лизосомальную интернализацию белков с N-гликанами, на конце которых находится манноза или GlcNAc, обеспечивая путь для потенциальной коррекции дефицита фермента в таких ключевых типах клеток.
Дефицит ЛКЛ представлен мультисистемным заболеванием, которое наиболее часто проявляется в виде осложнений со стороны желудочно-кишечного тракта, печени и сердечно-сосудистой системы и связано со значительной смертностью и заболеваемостью. Клинические эффекты дефицита ЛКЛ вызваны массивным накоплением материала липидов в лизосомах в целом ряде тканей, а также значительным нарушением механизмов гомеостаза липидов и холестерина, включая значительное усиление синтеза холестерина в печени. Дефицит ЛКЛ имеет, по меньшей мере, два фенотипа, представленные болезнью Вольмана (БВ) и болезнью накопления эфиров холестерина (БНЭХ).
Болезнь Вольмана является наиболее агрессивным проявлением дефицита ЛКЛ. Этот фенотип характеризуется проявлениями со стороны печени и желудочно-кишечного тракта, включая нарушение роста, нарушение абсорбции, стеаторею, существенную потерю веса и гепатомегалию. Болезнь Вольмана является быстро прогрессирующим и смертельным заболеванием, возникающим обычно в течение первого года жизни. Обзор сообщенных случаев указывает, что показатель выживаемости после 12-месячного возраста крайне необычен для пациентов с нарушением роста, вызванным дефицитом ЛКЛ в течение первого года жизни. В этой более агрессивной форме нарушение роста является предоминирующим клиническим признаком и является ключевым фактором ранней смертности. Вовлечение печени определяют по увеличению печени и повышению уровня трансаминаз, что очень часто отмечается у младенцев. Физические показатели включают вздутие живота, сопровождающееся гепатомегалией и спленомегалией, и рентгенографическое исследование часто выявляет кальцификацию надпочечников. Лабораторные анализы обычно выявляют повышенные уровни трансаминаз в сыворотке и отсутствие или существенное снижение активности фермента ЛКЛ. Также у пациентов отмечают повышенные уровни холестерина и триглицеридов в крови.
Используемые в настоящее время способы лечения болезни Вольмана крайне ограничены. Антибиотики вводят младенцам с пирексией и/или доказанным присутствием инфекции. Может быть назначена заместительная терапия стероидами для лечения недостаточности надпочечников и специализированное парентеральное питание, и при отсутствии доказательств того, что такие вмешательства предотвращают смерть, в настоящее время также неясно об их влиянии на краткосрочную выживаемость. Четыре пациента с дефицитом ЛКЛ были подвергнуты лечению и трансплантации костного мозга: все четыре пациента умерли по причине осложнений от процедуры в течение нескольких месяцев после трансплантации.
У пациентов с дефицитом ЛКЛ позднее могут проявляться предоминирующие поражения печени и сердечно-сосудистой системы, что часто называют болезнью накопления эфиров холестерина (БНЭХ). При БНЭХ в печени отмечают тяжелые нарушения со значительной гепатомегалией, некрозом гепатоцитов, повышением уровня трансаминаз, циррозом и фиброзом. По причине повышенных уровней ЭХ и ТГ, при дефиците ЛКЛ также отмечаются гиперлипидемия и ускоренный атеросклероз. В частности, в раннем возрасте описывают накопление жировых отложений в стенках артерий. Такие отложения сужают артериальный просвет, что может привести к окклюзии сосуда и повышению риска существенных сердечно-сосудистых явлений, включая инфаркт миокарда и инсульт. Проявление БНЭХ сильно варьирует у некоторых пациентов, которым диагноз не был поставлен до момента проявления осложнений во взрослом возрасте, в то время как у других дисфункция печени проявляется уже в раннем детстве. БНЭХ обуславливает короткую продолжительность жизни и по существу слабое здоровье; продолжительность жизни у пациентов с БНЭХ зависит от степени тяжести связанных осложнений.
Используемые в настоящее время способы лечения фенотипа БНЭХ сфокусированы на контроле накопления липидов посредством диеты, исключающей пищу с высоким содержанием холестерина и триглицеридов, супрессией синтеза холестерина и выработки аполипопротеина В посредством введения препаратов, понижающих уровни холестерина. Несмотря на то, что могут отмечаться определенные клинические улучшения, фоновые проявления заболевания сохраняются, и отмечается прогрессирование заболевания.
В большинстве случаев лечение дефицита ЛКЛ требует долгосрочного лечения. Кроме того, по причине высокой стоимости белковых лечебных препаратов, желательно введение минимально эффективного количества препарата для лечения дефицита ЛКЛ. Однако на сегодняшний момент не существует эффективной терапии для лечения дефицита ЛКЛ, в частности, для пациентов, страдающих от болезни Вольмана и БНЭХ. Следовательно, имеется крайняя необходимость в эффективной терапии с минимальной частотой введения для улучшения качества жизни пациентов. Также существует необходимость в создании платформы высокой экспрессии и робастной выработки белка, что может обеспечить выработку белков ЛКЛ, являющихся стабильными и эффективно направленными относительно лизосомального компартмента в клетках пораженных тканей у пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данной заявке описаны композиции с ЛКЛ, которые особенно подходят для использования в лечении, например, состояний, вызванных дефицитом ЛКЛ. Описанные здесь молекулы ЛКЛ содержат отдельные полисахаридные структуры, что обеспечивает эффективный и быстрый захват в лизосомах клеток при введении субъекту, например, субъекту человеку.
В одном аспекте описанные здесь композиции включают ЛКЛ человека, при этом значительный процент ЛКЛ человека содержит, по меньшей мере, одну молекулу гликана маннозо-6-фосфат, которая служит в качестве лиганда для интернализации рецептором маннозо-6-фосфата на поверхности клеток, находящихся, например, на гепатоцитах. В одном варианте воплощения изобретения 30% или более, например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, или по меньшей мере 99% ЛКЛ, содержащейся в композиции, содержит, по меньшей мере одну молекулу маннозо-6-фосфата. Молекула маннозо-6-фосфата может находиться, например, на структуре N-гликана, расположенной на одном или более остатках, выбранных из группы, состоящей из Asn15, Asn51, Asn80, Asn140, Asn252и Asn300 с последовательностью SEQ ID NO:2.
В другом аспекте изобретения описанные здесь композиции включают ЛКЛ человека, при этом значительный процент ЛКЛ человека не содержит молекулу сиалиновой кислоты в любой из своих N-гликановых структур, которые иногда могут влиять на интернализацию ферментов в клетках. В одном варианте воплощения изобретения 15% или менее, например, 10% или менее, 5% или менее, 2% или менее, 1% или менее, или по существу ни одной ЛКЛ, содержащейся в композиции, не содержит молекулу сиалиновой кислоты в любой из своих N-гликановых структур.
В другом аспекте изобретения описанные здесь композиции включают ЛКЛ человека, при этом значительный процент ЛКЛ человека не содержит молекулы фукозы в любой из своих N-гликановых структур. В одном варианте воплощения изобретения 50% или менее, например, 40% или менее, 30% или менее, 20% или менее, 10% или менее, 5% или менее, 2% или менее, 1% или менее, или по существу ни одной ЛКЛ, содержащейся в композиции, не содержат молекулу фукозы в любой из своих N-гликановых структур.
В еще одном аспекте изобретения описаны векторы, клетки-хозяева, системы экспрессии и соответствующие способы, подходящие для выработки композиций, содержащих ЛКЛ.
Как правило, ЛКЛ по изобретению, описанная и обсужденная в тексте данной заявки, представлена ЛКЛ человека. В одном варианте воплощения изобретения композиция, включающая ЛКЛ, включает зрелую ЛКЛ со следующей аминокислотной последовательностью:
sggkltavdpetnmnvseiisywgfpseeylvetedgyilclnriphgrknhsdkgpkpvvflqhglladssnwvtnlansslgfiladagfdvwmgnsrgntwsrkhktlsvsqdefwafsydemakydlpasinfilnktgqeqvyyvghsqgttigfiafsqipelakrikmffalgpvasvafctspmaklgrlpdhlikdlfgdkeflpqsaflkwlgthvcthvilkelcgnlcfllcgfnernlnmsrvdvytthspagtsvqnmlhwsqavkfqkfqafdwgssaknyfhynqsypptynvkdmlvptavwsgghdwladvydvnilltqitnlvfhesipewehldfiwgldapwrlynkiinlmrkyq (SEQ ID NO:2).
В другом варианте воплощения изобретения зрелая ЛКЛ имеет следующую аминокислотную последовательность:
gkltavdpetnmnvseiisywgfpseeylvetedgyilclnriphgrknhsdkgpkpvvflqhglladssnwvtnlansslgfiladagfdvwmgnsrgntwsrkhktlsvsqdefwafsydemakydlpasinfilnktgqeqvyyvghsqgttigfiafsqipelakrikmffalgpvasvafctspmaklgrlpdhlikdlfgdkeflpqsaflkwlgthvcthvilkelcgnlcfllcgfnernlnmsrvdvytthspagtsvqnmlhwsqavkfqkfqafdwgssaknyfhynqsypptynvkdmlvptavwsgghdwladvydvnilltqitnlvfhesipewehldfiwgldapwrlynkiinlmrkyq (SEQ ID NО:3).
В другом варианте воплощения изобретения зрелая ЛКЛ имеет следующую аминокислотную последовательность:
tavdpetnmnvseiisywgfpseeylvetedgyilclnriphgrknhsdkgpkpvvflqhglladssnwvtnlansslgfiladagfdvwmgnsrgntwsrkhktlsvsqdefwafsydemakydlpasinfilnktgqeqvyyvghsqgttigfiafsqipelakrikmffalgpvasvafctspmaklgrlpdhlikdlfgdkeflpqsaflkwlgthvcthvilkelcgnlcfllcgfnernlnmsrvdvytthspagtsvqnmlhwsqavkfqkfqafdwgssaknyfhynqsypptynvkdmlvptavwsgghdwladvydvnilltqitnlvfhesipewehldfiwgldapwrlynkiinlmrkyq (SEQ ID NO:4).
В другом варианте воплощения изобретения зрелая ЛКЛ имеет следующую аминокислотную последовательность:
avdpetnmnvseiisywgfpseeylvetedgyilclnriphgrknhsdkgpkpvvflqhglladssnwvtnlansslgfiladagfdvwmgnsrgntwsrkhktlsvsqdefwafsydemakydlpasinfilnktgqeqvyyvghsqgttigfiafsqipelakrikmffalgpvasvafctspmaklgrlpdhlikdlfgdkeflpqsaflkwlgthvcthvilkelcgnlcfllcgfnernlnmsrvdvytthspagtsvqnmlhwsqavkfqkfqafdwgssaknyfhynqsypptynvkdmlvptavwsgghdwladvydvnilltqitnlvfhesipewehldfiwgldapwrlynki inlmrkyq (SEQ ID NO:19).
В другом варианте воплощения изобретения зрелая ЛКЛ представляет собой смесь из, по меньшей мере, двух полипептидов, выбранных из группы, состоящей из: SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:19.
Изобретение также описывает композиции, которые содержат выделенные смеси полезных белковых молекул индивидуального типа, таких как описанных здесь белков, при этом одна или более белковых молекул, содержащихся в смеси, имеет специфическую олигосахаридную структуру, присоединенную, в частности, к описанной здесь олигосахаридной структуре. Например, изобретение описывает выделенные смеси молекул ЛКЛ, например, молекулы ЛКЛ человека, которые содержат молекулу ЛКЛ, гликозилированную одной или более следующими структурами от A-n до O-n:

Квадрат=N-ацетилглюкозамин
Черный квадрат =маннозо-6-фосфат
Круг=манноза
Черный круг=галактоза
Черный треугольник=фукоза
Согласно одному аспекту данного изобретения, композиция включает любой выделенный отдельный или комбинацию описанных выше полипептидов. В одном варианте воплощения изобретения композиция может быть представлена фармацевтической композицией, например, композицией, которая дополнительно включает фармацевтически приемлемые носители, такие как композиция, например, подходящая для введения субъекту (например, человеку, в частности, пациенту, страдающему или имеющему диагноз определенного состояния). Композиция может быть введена с использованием целого ряда путей, включая внутривенное введение. В другом варианте воплощения изобретения композиция может дополнительно включать второй агент. Такой агент может быть представлен медикаментом или агентом, который может влиять или модифицировать биологический процесс при введении субъекту. Например, второй агент может быть представлен иммуномодулятором. Такие агенты-иммуномодуляторы могут включать любой агент, который при введении вместе (т.е. введении в одно и то же время, или незадолго до или после) с любой из композиций ЛКЛ, описанных в тексте данной заявки, может влиять или снижать иммуногенность композиции ЛКЛ у субъекта (например, ритуксимаб или любое антитело, снижающее число В-клеток).
В финальном аспекте изобретения описаны способы и композиции для лечения симптомов, связанных с дефицитом ЛКЛ.
Дополнительные объекты и аспекты данного изобретения станут более очевидными после обзора детального описания, представленного ниже, в сочетании с сопроводительными фигурами и последовательностями.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 отображает аминокислотные последовательности ЛКЛ человека. Аминокислотная последовательность рекомбинантной чЛКЛ на 100% гомологична последовательности ЛКЛ человека, встречающейся в природе. Подчеркнута зрелая форма чЛКЛ.
Фиг. 2 отображает нуклеотидную последовательность рекомбинантной чЛКЛ, трансгена рчЛКЛ pALVIN-OVRl-I-hLAL-dSA.
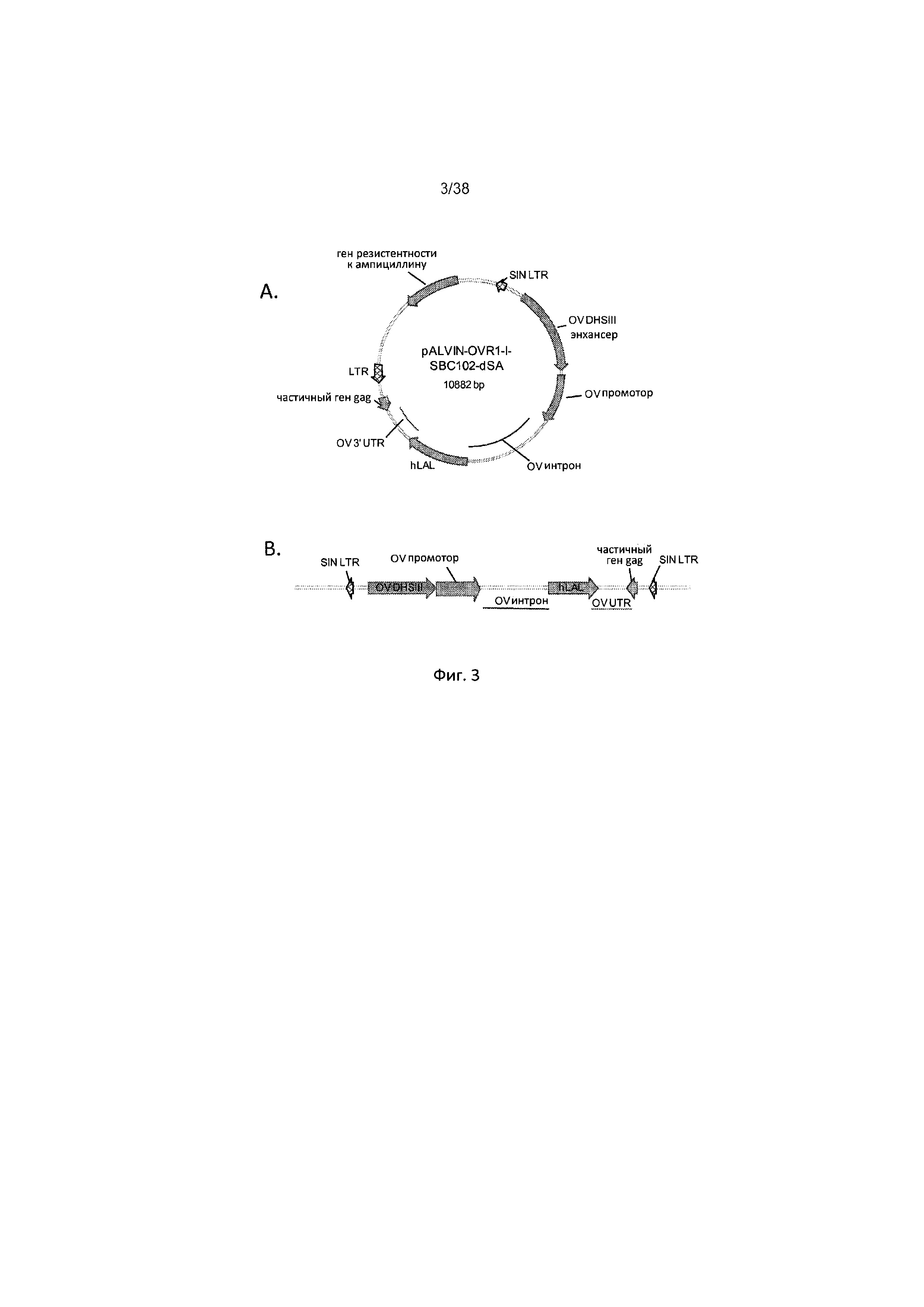
Фиг. 3А и 3В отображают диаграммы pALVIN-OVRl-I-hLAL-dSA и провирусного участка. Фиг. 3А отображает диаграмму ретровирусного вектора экспрессии ЛКЛ человека, используемого в выработке трансфицированных частиц (последовательность ДНК плазмиды приводится в Приложении А). Фиг. 3 отображает провирусный участок pALVIN-OVRl-I-hLAL-dSA, который был интегрирован в геном. SIN LTR - самоинактивирующийся длинный терминальный повтор; OV DHSIII - энхансер; DNase - гиперчувствительный участок III гена яичного альбумина; OV - интрон; 5' нетранслируемый участок яичного альбумина и интрон 1; hLAL - кДНК ЛКЛ человека; OV 3' UTR - 3' нетранслируемый участок гена яичного альбумина; partial gag - частичный ген gag; LTR - длинный концевой повтор.
Фиг. 4 отображает нуклеотидную последовательность pALVIN-OVRl-I-hLAL-dSA.
Фиг. 5 отображает нуклеотидную последовательность провирусного участка pALVIN-OVRl-I-hLAL-dSA, который был интегрирован в геном.
Фиг. 6 отображает нуклеотидную последовательность вектора pALVIN-OV-l.l-I.
Фиг. 7 отображает нуклеотидную последовательность адаптора rhLAL.
Фиг. 8 отображает нуклеотидную последовательность rhLAL, включая частичный промотор яичного альбумина.
Фиг. 9 отображает нуклеотидную последовательность промотора OVR1.
Фиг. 10 отображает схематически этапы, используемые для построения вектора pALVIN-OVR1 -I-hLAL-dSA.
Фиг. 11 отображает анализ ПЦР в режиме реального времени образцов ДНК крови, полученных из гемизиготного трансгенного потомства G1 XLL109. Сигналы от дупликатных образцов ДНК прогена гемизиготных G1 1LL7466 указаны кривыми линиями, которые инициируют повышение дельта Rn перед циклом 22. Показаны кривые для двух нетрансгенных генов; такие кривые остаются на уровне или возле исходной линии в течение, по меньшей мере, 34 циклов.
Фиг. 12A-D отображают Саузерн анализ цыплят G1, несущих трансген ALVIN-OVRl-I-hLAL-dSA. Фиг. 12А иллюстрирует схему интегрированного трансгена и фланкирующие геномные участки с известным положением сайта трансгена BlpI и прогнозируемым положением фланкирующих геномных сайтов BlpI. Положение зонда промотора OV и зонда кодирующей последовательности hLAL (зонда hLAL) указаны черными полосами. Положения полос 4.3 kb и 10.6 kb, определенных в ходе анализа по Саузерну, представлены наравне с прогнозируемыми размерами геномных и трансгенных участков полос 4.3 kb и 10.6 kb. Фиг. 12В отображает Саузерн-блоттинг геномной ДНК, расщепленной BlpI, и зондированной зондом OV. WT CTRL является геномной ДНК, выделенной у нетрансгенного цыпленка. ID номера трансгенов G1 указаны выше полос. Положение и размер (kb) молекулярного веса маркеров представлен с левой стороны блоттинга. Положение и размер определенного фрагмента трансгена (4.3 kb) и гена эндогенного яичного альбумина (4.1 kb) представлены в правой стороне от блоттинга. Фиг. 12С отображает Саузерн-блоттинг с зондом hLAL. Положение и размер определенного фрагмента трансгена (10.6 kb) представлен справа от блоттинга. Фиг. 12D отображает участок изображения с Фиг. 12В в большем масштабе для представления присутствия полос 4.1 и 4.3 kb.
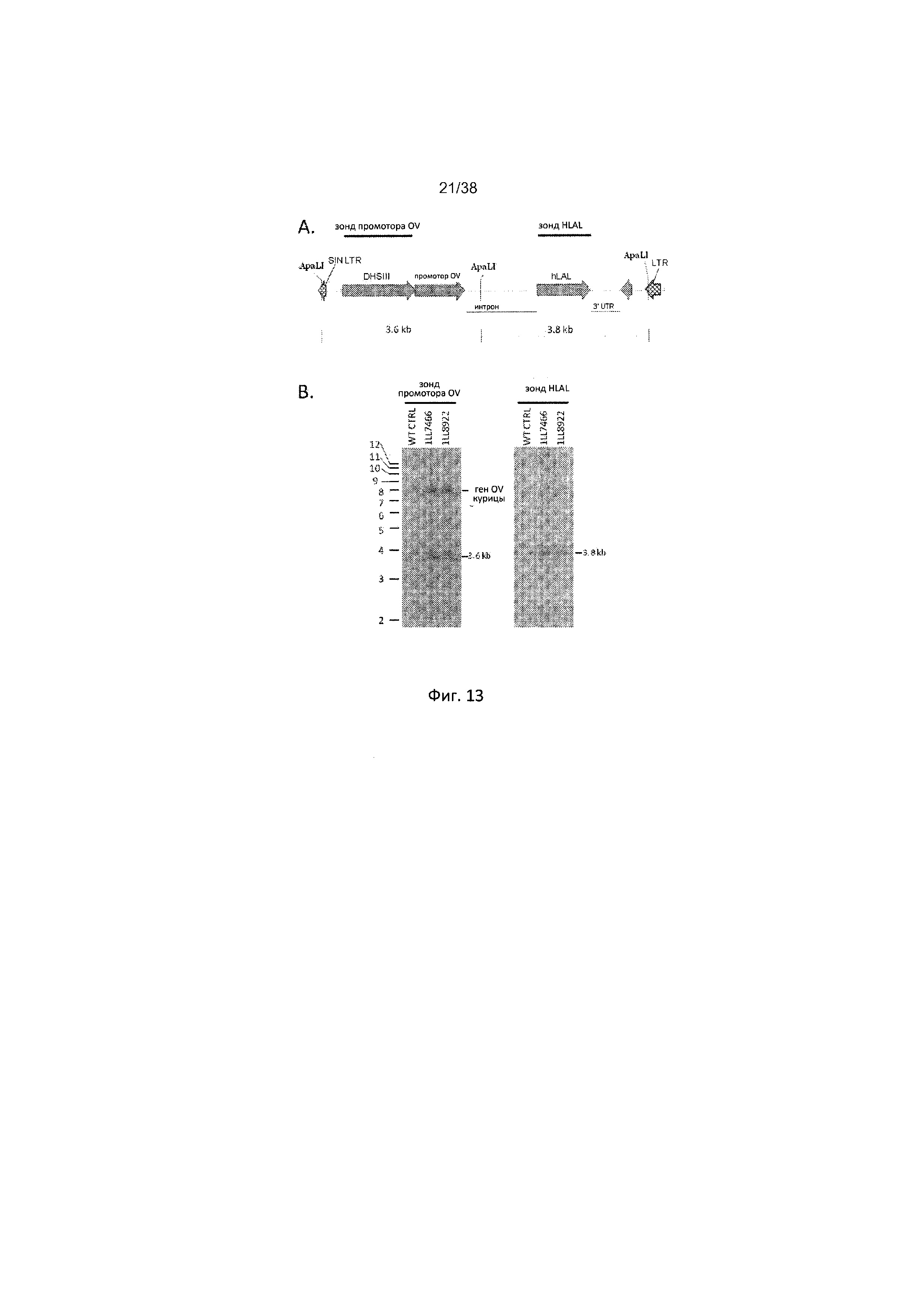
Фиг. 13А отображает схему трансгена ALVIN-OVRl-I-hLAL-dSA. Также представлен размер полос ApaLI, которые, как прогнозируется, должны определяться зондом OV и зондом hLAL. Фиг. 13В отображает схему анализа Саузерн-блоттинга трансгена ALVIN-OVRl-I-hLAL-dSA для подтверждения размера трансгена.
Саузерн-блоттинг геномной ДНК, расщепленной ApaLI, с использованием зонда OV (левая панель) или зонда hLAL (правая панель). WT CTRL является геномной ДНК, выделенной у нетрансгенного цыпленка. Над каждой полосой приводится номер ID для Gl. Положение и размер (kb) молекулярного веса маркеров представлен с левой стороны блоттинга. Положение и размер определенного фрагмента трансгена (зонд промотора OV, 3,6 kb; зонд hLAL, 3,8 kb) и гена эндогенного яичного альбумина (7,7 kb) представлены в правой стороне от блоттинга.
Фиг. 14 отображает клеточную линию трансгенных цыплят. Для каждого цыпленка указаны номер поколения (G0, G1 или G2), идентификационный номер, пол и дата вылупления. Все цыплята, кроме поколения G1, принадлежат к другим линиям.
Фиг. 15 отображает этапы очистки hLAL от яичного белка.
Фиг. 16 отображает N-гликаны, находящиеся в составе N-присоединенной гликозилированной структуры в ЛКЛ, полученной в соответствии с данным изобретением. Квадрат - N-ацетилглюкозамин; черный квадрат - маннозо-6-фосфат; круг - манноза; черный круг - галактоза; черный треугольник - фукоза.
Фиг. 17 отображает относительное положение прогнозируемых N-гликановых сайтов, указанных для полипептида ЛКЛ (стрелка) с последовательностью SEQ ID NO:1. Представлены N-гликаны, являющиеся структурными представителями, определенными для каждого сайта. Квадрат - N-ацетилглюкозамин; черный квадрат - маннозо-6-фосфат; круг - манноза; черный круг - галактоза; черный треугольник - фукоза.
Фиг. 18 отображает фосфорилированные N-гликаны, полученные с помощью ПНГазы и проанализированные с помощью MALDI-TOF. Указаны структуры.
Фиг. 19 отображает влияние дефосфорилирования ЛКЛ на время ретенции HPAEC-PAD относительно N-гликанов. ЛКЛ, полученная согласно изобретению, была дефосфорилирована бактериальной щелочной фосфатазой (верхняя панель) или не подвергалась воздействию (нижняя панель). Полученные N-гликаны были проанализированы с использованием HPAEC-PAD.
Фиг. 20 отображает со-локализацию рекомбинантной ЛКЛ человека (SBC-102) и лизосомального маркера в лизосомах клеток, исследованных с помощью конфокальной флуоресцентной микроскопии и режима последовательного сканирования.
Фиг. 21 отображает специфичность связывания рекомбинантной ЛКЛ человека (SBC-102) с рецептором GlcNAc/маннозы, что было оценено в ходе анализов конкурентного связывания с использованием клеточной линии макрофагов NR8383.
Фиг. 22 отображает активность рекомбинантной ЛКЛ человека в клетках с нормальным содержанием ЛКЛ и дефицитом ЛКЛ in vitro.
Фиг. 23 отображает влияние лечения рекомбинантной ЛКЛ человека (SBC-102) на массу внутренних органов у крыс с дефицитом ЛКЛ. Размер органов представлен в виде процента от массы тела, определенной в возрасте 8 недель у крыс ЛКЛ-/- и ЛКЛ+/+ после еженедельного введения носителя или SBC-102 в дозе 5 мг/кг в течение 4 недель.
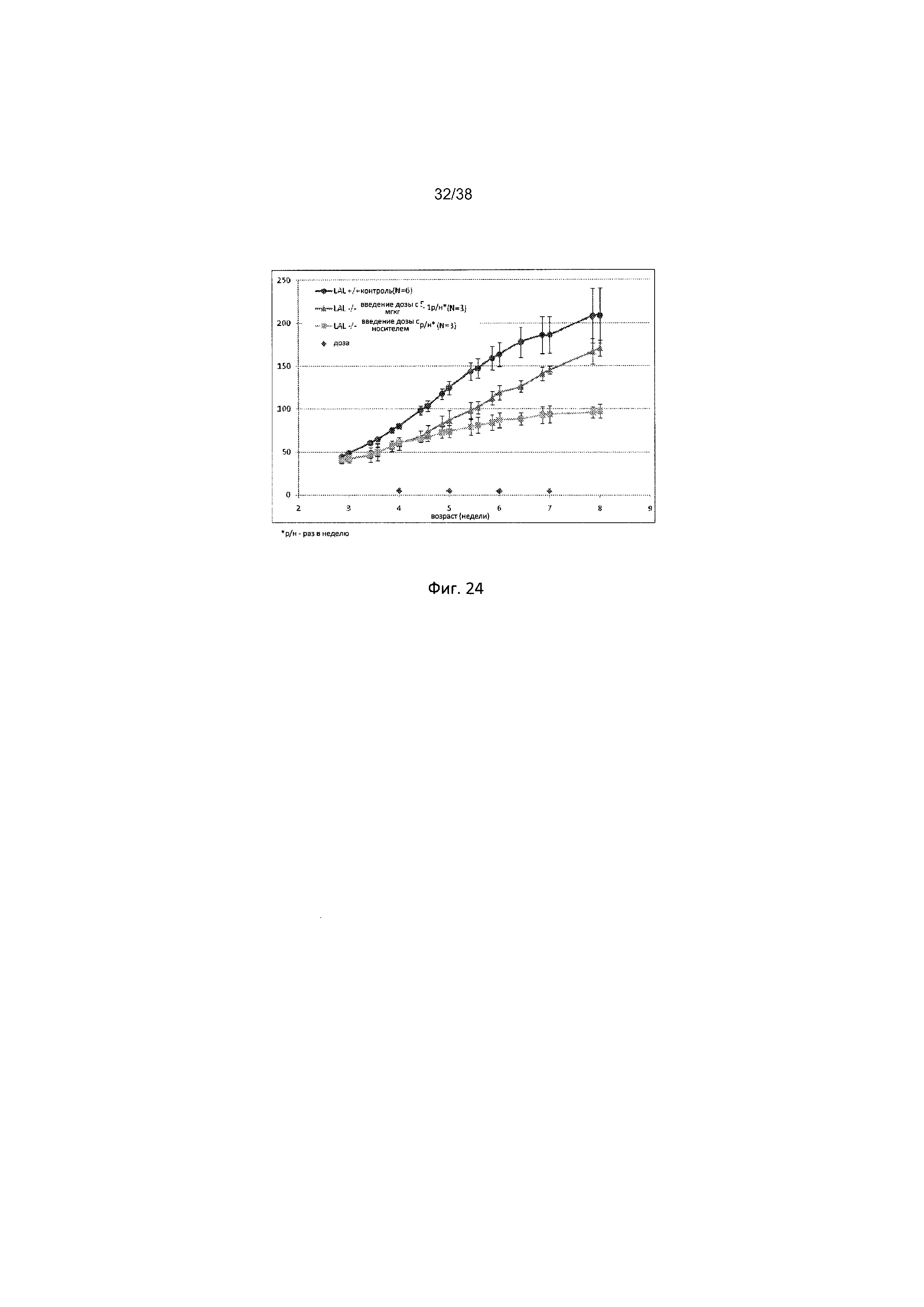
Фиг. 24 отображает массу тела у крыс дикого типа и крыс с дефицитом ЛКЛ после еженедельного введения носителя или SBC-102 в дозе 5 мг/кг-1 в течение 4 недель. Введение дозы указано на оси Х в виде ромбиков, начиная с 4 недели.
Фиг. 25 отображает уровни холестерина в печени, эфиров холестерина и триглицеридов в возрасте 8 недель у крыс WT и крыс с дефицитом ЛКЛ после еженедельного введения носителя или рекомбинантной ЛКЛ человека (SBC-102) в дозе 5 мг/кг-1 в течение 4 недель.
Фиг. 26 отображает процентное повышение массы тела у крыс с дефицитом ЛКЛ после 4-недельного введения рекомбинантной ЛКЛ человека (SBC-102) при указанных уровнях и графике, как это было определено в возрасте 8 недель.
Фиг. 27 отображает вес печени в виде процента от массы тела у крыс с дефицитом ЛКЛ после 4-недельного введения SBC-102 при указанных уровнях и графике, как это было определено в возрасте 8 недель.
Фиг. 28 отображает уровни эфира холестерина в тканях у крыс с дефицитом ЛКЛ после 4-недельного введения SBC-102 при указанных уровнях и графике, как это было определено в возрасте 8 недель.
Фиг. 29 отображает ежедневный прогресс в наборе массы тела у крыс, которым было введено 1 мг/кг ЛКЛ в неделю или 5 мг/кг ЛКЛ в неделю или 5 мг/кг ЛКЛ один раз в две недели.
Фиг. 30 отображает полное анатомо-патологическое исследование подвергшихся лечению животных, показывающее по существу нормализацию размера печени и цвет при рассечении (верхняя часть), а также гистопатологический анализ ткани печени на предмет ЛКЛ у крыс, подвергнутых лечению, который показал нормальные гистологические параметры печени в разительном контрасте относительно существенного накопления пенистых макрофагов у животных, подвергнутых лечению плацебо (нижняя часть).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В тексте данной заявки приводятся определенные термины для иллюстрации и определения значения и объема различных понятий, используемых для описания данного изобретения.
В контексте данного изобретения термин «приемлемый» относительно композиции, состава или ингредиента обозначает отсутствие какого-либо постоянного губительного действия на общее состояние здоровья субъекта, подвергнутого лечению.
В контексте данного изобретения термин «введение» или «вводить» обозначает предоставление рекомбинантной лизосомальной кислой липазы по изобретению субъекту, нуждающемуся в лечении.
Термин «нуклеиновая кислота или полинуклеотидная последовательность» включает, но не ограничивается, последовательности эукариотической мРНК, кДНК, геномной ДНК, синтезированной ДНК и РНК, включающие встречающиеся в природе нуклеотидные основания, такие как аденин, гуанин, цитозин, тимидин и урацил. Термин также включает последовательности с одним или несколькими модифицированными основаниями.
Термин «птица» в контексте данного изобретения обозначает любой вид, подвид или расу организма из таксономического класса птицы, такие как, но не ограничиваясь, курица, индейка, утка, гусь, перепел, фазаны, попугаи, зяблики, ястребы, вороны и бескилевые птицы, такие как страусы, эму и казуары. Термины включают различные известные породы Gallus gallus, или кур (например, белый леггорн, коричневый леггорн, полосатый плимутрок, суссекс, нью-гэмпширская, род-айлендская, австралорп, минорка, амрокс, калифорнийская серая), а также породы индеек, фазанов, перепелов, уток, страусов и другой домашней птицы, которую разводят на коммерческой основе. Они также включают отдельный организм птицы на всех стадиях развития, включая стадии эмбриона и плода.
Термин «терапевтические белки» или «фармацевтические белки» включают аминокислотную последовательность, которая в целом или частично составляет препарат.
Термин «кодирующая последовательность» или «открытая рамка считывания» обозначает полинуклеотид или последовательность нуклеиновых кислот, которая может быть транскрибирована и транслирована (в случае ДНК) или транслирована (в случае мРНК) в полипептид in vitro или in vivo при контроле соответствующих регуляторных последовательностей. Границы кодирующей последовательности определяются старт-кодоном трансляции на 5'-(амино) конце и стоп-кодоном трансляции на 3'-(карбоксильном) конце. Последовательность терминации транскрипции обычно располагается на 3'-конце кодирующей последовательности. Кодирующая последовательность может быть фланкирована на 5'- и/или 3'-концах нетранcлируемыми участками.
Термин «экзон» обозначает часть гена, которая, при транскрибировании в ядерном транскрипте, «экспрессируется» в цитоплазматической мРНК после удаления интронов или вставочных последовательностей путем ядерного сплайсинга.
Термины «контрольные последовательности» или «регуляторные последовательности» нуклеиновых кислот обозначают последовательности промотора, старт и стоп-кодонов трансляции, сайты связывания рибосом, сигналы полиаденилирования, последовательности терминации транскрипции, «левые» регуляторные домены, энхансеры и т.п., как это необходимо и достаточно для транскрипции и трансляции отдельной кодирующей последовательности в определенной клетке-хозяине. Примеры контрольных последовательностей, подходящие для эукариотических клеток, представлены промоторами, сигналами полиаденилирования и энхансерами. Необязательно, чтобы все такие контрольные последовательности присутствовали в рекомбинантном векторе, поскольку они необходимы для транскрипции и трансляции определенного присутствующего гена.
Термин «функционально или оперативно связанный» обозначает конфигурацию кодирующей и контрольной последовательностей для выполнения требуемой функции. Таким образом, контрольные последовательности, функционально связанные с кодирующей последовательностью, способны влиять на экспрессию кодирующей последовательности. Кодирующая последовательность функционально связана или находится под контролем участка регуляции транскрипции в клетку, когда ДНК полимераза связывается с последовательностью промотора и транскрибирует кодирующую последовательность в мРНК, которая может транскрибироваться в кодируемый белок. Контрольные последовательности не обязательно должны прилегать к кодирующей последовательности, поскольку они действуют как регулятор экспрессии. Таким образом, например, между последовательностью промотора и кодирующей последовательностью могут находиться нетранслируемые, но транскрибируемые последовательности, и последовательность промотора может считаться «функционально связанной» с кодирующей последовательностью.
Термины «гетерологичный» и «экзогенный» относительно последовательностей нуклеиновых кислот, таких как кодирующие последовательности и контрольные последовательности, обозначают последовательности, которые не связаны обычным образом с участком рекомбинантного вектора или с отдельным локусом хромосомы, и/или не связаны обычным образом с отдельной клеткой. Таким образом, «экзогенный» участок нуклеиновой кислоты вектора представлен идентифицируемым сегментом нуклеиновой кислоты в пределах или присоединен к другой молекуле нуклеиновой кислоты, которая в природе не находится во взаимосвязи с другой молекулой. Например, экзогенный участок вектора может включать кодирующую последовательность, фланкируемую последовательностями, не связанными с кодирующей последовательностью в природе. Другой пример экзогенной кодирующей последовательности представлен вектором, в котором кодирующая последовательность не представлена в природе (например, представлена синтетической последовательностью с кодонами, отличающимися от нативного гена). Подобным образом, клетка-хозяин, трансформированная вектором или нуклеиновой кислотой, не встречающейся обычно в клетке-хозяине, будет считаться экзогенной в целях данного изобретения.
В контексте данного изобретения термины «N-гликан», «олигосахарид», «олигосахаридная структура», «схема гликозилирования», «профиль гликозилирования» и «структура гликозилирования» имеют по существу одно и тоже значение и каждый термин обозначает одну или более структур, которые образованы из остатков сахаров и присоединены к гликозилированным белкам.
Термин «экзогенный белок» в контексте данного изобретения обозначает белок, не присутствующий естественным образом в отдельной ткани или клетке, и такой белок является продуктом экспрессии вектора экзогенной экспрессии или трансгена, или представлен белком, который не присутствует естественным образом в заданном количестве в отдельной ткани или клетке. Белок, являющийся экзогенным в яйце, представлен белком, который не присутствует обычным образом в яйце. Например, белок, экзогенный для яйца, может быть представлен белком, который присутствует в яйце в результате экспрессии кодирующей последовательности, присутствующей в трансгене животного, откладывающегося яйцо.
«Эндогенный ген» обозначает встречающийся в природе ген или его фрагмент, который обычно связан с отдельной клеткой.
Термин «ЛКЛ» обозначает «лизосомальная кислая липаза человека», «SBC-102» или «молекула лизосомальной кислой липазы человека», и такие термины в тексте данной заявки используются взаимозаменяемым образом.
Описанные здесь продукты экспрессии могут состоять из белкового материала с определенной химической структурой. Однако точная структура зависит от ряда факторов, в частности, химических модификаций, свойственных белкам. Например, поскольку все белки содержат ионизируемые амино и карбоксильные группы, белок может быть получен в форме кислой или основной соли, или в нейтральной форме. Первичная аминокислотная последовательность может быть получена с использованием молекул сахаров (гликозилирования) или других химических способов, включая ковалентное или ионное присоединение, например, липидов, фосфатных, ацетильных групп и т.п., что часто встречается при соединении с сахаридами. Такие модификации могут возникать in vitro или in vivo, при чем последнее возникает в клетке-хозяине посредством посттрансляционных систем процессинга. Такие модификации могут повышать или снижать биологическую активность молекулы, и такие модифицированные химическим образом молекулы также включены в объем данного изобретения.
Для специалистов в данной области станут очевидными альтернативные способы клонирования, амплификации, экспрессии и очистки. Репрезентативные способы описаны в Sambrook, Fritsch, and Maniatis, Molecular Cloning, a Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory (1989).
Термин «вектор» обозначает полинуклеотид, включающий одноцепочечную, двухцепочечную, кольцевую или сверхспиральную ДНК или РНК. Типичный вектор может состоять из следующих элементов, которые функционально связаны на соответствующих расстояниях для обеспечения экспрессии функционального гена: точка начала репликации, промотор, энхансер, 5' лидерная последовательность мРНК, сайт связывания рибосом, кассета нуклеиновой кислоты, сайты терминации и полиаденилирования и последовательности избирательных маркеров. Один или более таких элементов могут быть описаны в отдельных заявках на изобретение. Кассета нуклеиновых кислот может включать сайт рестрикции для вставки экспрессируемой последовательности нуклеиновой кислоты. В функциональном векторе кассета нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, которую необходимо экспрессировать, включая сайты начала и терминации трансляции. В вектор в некоторых случаях может быть включен интрон, например, с конца 5' относительно кодирующей последовательности. Вектор конструируют таким образом, что отдельная кодирующая последовательность расположена в векторе с соответствующими регуляторными последовательностями, а расположение и ориентирование кодирующей последовательности относительно контрольных последовательностей выполнено таким образом, что контрольная последовательность транскрибируется под «контролем» контрольной или регуляторной последовательностей. Модификация последовательностей, кодирующих отдельный белок, может оказаться желательной для достижения указанного конца. Например, в некоторых случаях может оказаться необходимым модифицировать последовательность таким образом, чтобы она была присоединена к контрольной последовательности с соответствующей ориентацией; или для поддержания рамки считывания. Контрольные последовательности и другие регуляторные последовательности могут быть лигированы с кодирующей последовательностью перед вставкой в вектор. С другой стороны, кодирующая последовательность может быть клонирована непосредственно в вектор экспрессии, который уже содержит контрольные последовательности и соответствующий сайт рестрикции, находящийся в пределах рамки считывания и под контролем контрольных последовательностей.
Термин «промотор» обозначает участок на ДНК, с которым связывается РНК-полимераза для инициации транскрипции гена. В некоторых вариантах воплощения изобретения промотор может быть модифицирован путем добавления или делеции последовательностей, или замены альтернативными последовательностями, включая встречающиеся в природе или синтезированные последовательности, а также последовательности, которые могут быть представлены комбинацией синтезированных и встречающихся в природе последовательностей. Большая часть эукариотических промоторов включает два типа последовательностей распознавания: ТАТА-бокс и «левые» элементы промотора. Первые располагаются кверху от сайта инициации транскрипции и задействованы в направлении РНК-полимеразы для инициации транскрипции в правильном месте, в то время как вторые определяют скорость транскрипции и находятся выше относительно ТАТА-бокса. Элементы энхансера могут также стимулировать транскрипцию от присоединенных промоторов, однако большинство функционирует эксклюзивно в клетке отдельного типа. Много элементов энхансера/промотора, полученных из вирусов, например, промотор SV40, промотор цитомегаловируса (CMV), промотор вируса саркомы Рауса (RSV) и промотор вируса мышиного лейкоза (MLV), активны в целом ряде клеточных типов и называются «вездесущими». С другой стороны, неконститутивные промоторы, такие как промотор вируса опухоли молочной железы у мыши (MMTV), также могут использоваться в данном изобретении. Последовательность нуклеиновой кислоты, вставленной в сайт клонирования, может иметь любую открытую рамку считывания, кодирующую интересующий полипептид, с условием, что кодирующая последовательность кодирует интересующий полипептид и в ней отсутствуют сплайс-сайты, которые могут блокировать выработку соответствующих молекул мРНК и/или продуцировать аберрантным образом соединенные или аномальные молекулы мРНК.
В контексте данного изобретения термин «фармацевтическая композиция» обозначает смесь описанных здесь соединений с другими химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие агенты, суспендирующие агенты, разрыхлители и/или вспомогательные вещества.
Термин «полученный из домашней птицы» или «полученный из птицы» обозначает композицию или вещество, полученное или произведенной птицей. Термин «домашняя птица» обозначает птиц, разводимых в домашних условиях, включая, но не ограничиваясь, кур, уток, индеек, перепелов и бескилевых. Например, термин «полученный от домашней птицы» может обозначать происхождение от кур, индеек и/или перепелов.
Термин «ретровирусная частица», «передающая частица» или «частица трансдукции» обозначает вирус, дефективный для репликации или компетентный для репликации, который способен переносить невирусную ДНК или РНК в клетку. В отдельном варианте воплощения изобретения ретровирусные частицы, используемые для получения трансгенных птиц в соответствии с изобретением, получают согласно описанию, представленному в патенте США No. 7524626 от 28 апреля 2009 г., описание которого включено сюда во всей своей полноте посредством ссылки.
Термины «трансформация», «трансдукция» и «трансфекция» обозначают введение полинуклеотида в бластодермальную клетку птицы. Термин «магнум» обозначает часть яйцевода между воронкой и местом сужения, содержащую клетки трубчатой железы, которые синтезируют и секретируют белок яичного белка.
Термин «трансген» обозначает гетерологичную последовательность нуклеотида, вставленную в геном птицы согласно изобретению. Термин «трансген» может специфическим образом обозначать экзогенную кодирующую последовательность, присоединенную к экзогенному промотору или другой регуляторной последовательности, полной нуклеотидной последовательности между двумя LTR ретровируса и/или LTR ретровируса и нуклеотидной последовательностью между LTR, при этом LTR принадлежит ретровирусу, используемому для введения трансгена.
Термин «оптимизированный» используют в контексте «оптимизированной кодирующей последовательности», при этом большая часть часто используемых кодонов для каждой отдельной аминокислоты, находящейся среди яичного альбумина белка яйца, лизоцима, овомукоида и овотрансферрина, используется для построения оптимизированной полинуклеотидной последовательности интерферона-a 2b человека (ИФН-a 2b), которая вставлена в векторы по данному изобретению. Более специфически, последовательность ДНК для оптимизированного ИФН-a 2b человека основана на использовании оптимизированного кодона яйцевода курицы и создана с использованием программы BACKTRANSLATE от Wisconsin Package, версия 9.1 (Genetics Computer Group Inc., Madison, Wis.) с таблицей кодонов, соответствующих белкам яичного альбумина, лизоцима, овомукоида и овотрансферрина курицы (Gallus gallus). Например, процентное использование четырех кодонов аминокислоты аланин в четырех белках яичного белка составляет 34% для GCU, 31% для GCC, 26% для GCA и 8% для GCG. Таким образом, GCU используют в качестве кодона для большинства аланинов в оптимизированной кодирующей последовательности. Векторы, содержащие ген для оптимизированного белка человека, используют для получения трансгенных птиц, которые экспрессируют в своих тканях и яйцах белок происхождения трансгенной птицы.
В контексте данного изобретения термин «субъект» обозначает млекопитающих и немлекопитающих. Примеры млекопитающих включают, но не ограничиваются, человека, шимпанзе, обезьян, крупный рогатый скот, лошадей, овец, коз, свиней; кроликов, собак, кошек, крыс, мышей, морских свинок и т.п.
В контексте данного изобретения термин «терапевтически эффективное количество» обозначает любое количество соединения, которое, в сравнении с соответствующим субъектом, который не получал данного количества, приводит к улучшению лечения, заживлению, профилактике или улучшению состояния при заболевании, нарушении или побочном эффекте, или снижению скорости прогрессирования заболевания или нарушения. Термин также включает количества, эффективные для повышения нормальной физиологической функции.
Термин «лечить», «лечение» или «излечивать» обозначает способы снижения, улучшения или уменьшения симптомов заболевания или состояния, профилактику дополнительных симптомов, улучшение или профилактику основных причин симптомов, ингибирование заболевания или состояния, остановку развития заболевания или состояния, выздоровление от заболевания или состояния, вызов регрессии заболевания или состояния, выздоравливание от состояния, вызванного заболеванием или состоянием, или остановку симптомов заболевания или состояния профилактическим и/или терапевтическим образом.
КОМПОЗИЦИИ ЛКЛ
Изобретение обычно описано композициями, включающими ферменты, используемые для лечения, например, лизосомальных болезней накопления. В одном аспекте изобретение описывает ферменты лизосомальной болезни накопления, такие как ЛКЛ, со схемой гликозилирования, обеспечивающей интернализацию молекулы в клетки различных типов. Такое изобретение описывает рекомбинантные белки человека, включая ЛКЛ в выделенной или очищенной форме. Выделение ферментов лизосомальной болезни накопления (таких как ЛКЛ) может сопровождаться способами, хорошо известными специалисту в данной области и используемыми для очистки белков.
В одном варианте воплощения изобретение описывает ферменты лизосомальной болезни накопления, включая, но не ограничиваясь, ЛКЛ с N-присоединенной схемой гликозилирования, описанной в тексте данной заявки.
В одном аспекте описанные здесь композиции включают ЛКЛ человека, при этом значительный процент ЛКЛ человека содержат молекулу гликана маннозо-6-фосфата, которая служит в качестве лиганда для интернализации рецептором маннозо-6-фосфата на поверхности клеток, находящихся, например, на гепатоцитах. В одном варианте воплощения изобретения 30% или более, например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере,70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 99% ЛКЛ, содержащейся в композиции, содержит по меньшей мере одну молекулу маннозо-6-фосфата. Молекула маннозо-6-фосфата может находиться, например, на структуре N-гликана, расположенной на одном или более остатках, выбранных из группы, состоящей из Asn15, Asn51, Asn80, Asn140, Asn252и Asn300 с последовательностью SEQ ID NO:2. Гликановые структуры, содержащие молекулы маннозо-6-фосфата, включают, например, G-n и H-n, представленные на Фиг. 16.
Рекомбинантная ЛКЛ человека по данному изобретению содержит множественные N-присоединенные цепи углеводов (например, примерно 5 или 6 цепей углеводов). N-присоединенные гликозилированные структуры на каждом из пяти или шести сайтов могут быть выбраны из A-n, B-n, C-n, D-n, E-n, F-n, G-n, H-n, I-n, J-n, K-n, L-n, M-n, N-n и O-n, как это представлено на Фиг. 16.
Кроме того, изобретение описывает смесь молекул ЛКЛ (например, более чем одна молекула ЛКЛ может присутствовать в смеси, при этом молекулы ЛКЛ имеют последовательности SEQ ID NO: 2, 3, 4 и 19), при этом некоторые или все молекулы ЛКЛ имеют одну или более гликозилированных структур, выбранных из Структуры A-n, Структуры B-n, Структуры C-n, Структуры D-n, Структуры E-n, Структуры F-n, Структуры G-n, Структуры H-n, Структуры I-n, Структуры J-n, Структуры K-n, Структуры L-n, Структуры M-n, Структуры N-n и Структуры O-n (Фиг. 16). В одном варианте воплощения изобретения смесь молекул лизосомальной кислой липазы очищается или выделяется, например, выделяется из яйца или очищается или выделяется из белка яйца, полученного у трансгенной птицы.
Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру A-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру B-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру C-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру D-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру E-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру F-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру G-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру H-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру I-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру J-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру K-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру L-n. Изобретение также описывает отдельную молекулу лизосомальной кислой липазы, включающую Структуру M-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру N-n. Изобретение также описывает отдельную молекулу ЛКЛ, включающую Структуру O-n.
N-присоединенные к ЛКЛ человека олигосахариды по данному изобретению не содержат терминальной сиалиновой кислоты и остатков галактозы. Т.е. только незначительные количества N-присоединенных олигосахаридных структур терминально сиалированы с присутствием нескольких остатков галактозы. Кроме того, на N-присоединенных олигосахаридных структурах описанной здесь ЛКЛ присутствует терминальный N-ацетилглюкозамин (GlcNAc). Таким образом, ЛКЛ, полученная по данному изобретению, может быть направлена на клетки, такие как моноциты, макрофаги и купферовские клетки.
Один аспект изобретения описывает композиции ЛКЛ, по существу не содержащей сиалиновой кислоты. В другом аспекте изобретения описанные здесь композиции включают рекомбинантную ЛКЛ человека, при этом значительный процент ЛКЛ человека не содержит молекулу сиалиновой кислоты в любой из своих N-гликановых структур, которые иногда могут влиять на интернализацию ферментов в клетках. В одном варианте воплощения изобретения 15% или менее, например, 10% или менее, 5% или менее, 2% или менее, 1% или менее, или по существу ни одного ЛКЛ, содержащегося в композиции, не содержат молекулу сиалиновой кислоты в любой из своих N-гликановых структурах.
В другом варианте воплощения изобретения примерно 95% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа сиалиновой кислоты. В другом варианте воплощения изобретения примерно 90% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа сиалиновой кислоты. В другом варианте воплощения изобретения примерно 80% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа сиалиновой кислоты. В другом варианте воплощения изобретения более чем примерно 70% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа сиалиновой кислоты.
В еще одном варианте воплощения изобретения по существу ни один из типов N-присоединенных к молекулам ЛКЛ олигосахаридных структур по изобретению не содержит сиалиновую кислоту. В другом варианте воплощения изобретения примерно 90% или более N-присоединенных олигосахаридов связано с молекулой ЛКЛ по изобретению и не содержит сиалиновой кислоты. Например, если присутствует 20 типов олигосахаридных структур, 18 или более структурных типов не содержат сиалиновой кислоты. В другом варианте воплощения изобретения примерно 80% или более N-присоединенных олигосахаридов связано с молекулой ЛКЛ по изобретению и не содержит сиалиновой кислоты. В другом варианте воплощения изобретения примерно 70% или более N-присоединенных олигосахаридов связано с молекулой ЛКЛ по изобретению и не содержит сиалиновой кислоты. В другом варианте воплощения изобретения примерно 60% или более N-присоединенных олигосахаридов связано с молекулой ЛКЛ по изобретению и не содержит сиалиновой кислоты. В другом варианте воплощения изобретения примерно 50% или более N-присоединенных олигосахаридов связано с молекулой ЛКЛ по изобретению и не содержит сиалиновой кислоты.
Согласно одному аспекту изобретения, описанная здесь ЛКЛ содержит высокие уровни терминального N-ацетилглюкозамина. В одном аспекте примерно 95% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению и содержит терминальный N-ацетилглюкозамин. В одном варианте воплощения изобретения примерно 90% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению и содержит терминальный N-ацетилглюкозамин. В другом варианте воплощения изобретения примерно 80% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению и содержит терминальный N-ацетилглюкозамин. В другом варианте воплощения изобретения примерно 70% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению и содержит терминальный N-ацетилглюкозамин. В одном варианте воплощения изобретения примерно 60% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению и содержит терминальный N-ацетилглюкозамин. В другом варианте воплощения изобретения примерно 50% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению и содержит терминальный N-ацетилглюкозамин.
В одном варианте воплощения изобретения все N-присоединенные структурные типы олигосахаридов, присутствующие на молекулах ЛКЛ по изобретению, содержат терминальный N-ацетилглюкозамин. В другом варианте воплощения изобретения примерно 90% или более N-присоединенных олигосахаридных структурных типов присутствует на молекулах ЛКЛ по изобретению и содержат терминальный N-ацетилглюкозамин. Например, если присутствует 20 типов олигосахаридных структур, 18 или более структурных типов не содержат терминальный N-ацетилглюкозамин. В другом варианте воплощения изобретения примерно 80% или более N-присоединенных олигосахаридных структурных типов присутствует на молекулах ЛКЛ по изобретению и содержат терминальный N-ацетилглюкозамин. В другом варианте воплощения изобретения примерно 70% или более N-присоединенных олигосахаридных структурных типов присутствует на молекулах ЛКЛ по изобретению и содержат терминальный N-ацетилглюкозамин. В другом варианте воплощения изобретения примерно 60% или более N-присоединенных олигосахаридных структурных типов присутствует на молекулах ЛКЛ по изобретению и содержат терминальный N-ацетилглюкозамин. В другом варианте воплощения изобретения примерно 50% или более N-присоединенных олигосахаридных структурных типов присутствует на молекулах ЛКЛ по изобретению и содержат терминальный N-ацетилглюкозамин.
В другом аспекте изобретения описанные здесь композиции включают ЛКЛ человека, при этом значительный процент ЛКЛ человека не содержит молекулы фукозы в любой из своих N-гликановых структур. В одном варианте воплощения изобретения 50% или менее, например, 50% или менее, 40% или менее, 30% или менее, 20% или менее, 10% или менее, 5% или менее, 2% или менее, 1% или менее, или по существу ни одной ЛКЛ, содержащейся в композиции, не содержат молекулу фукозы в любой из своих N-гликановых структурах.
В одном варианте воплощения изобретения фукоза по существу не присутствует в N-присоединенных олигосахаридных структурах ЛКЛ, полученной по изобретению. В другом варианте воплощения изобретения примерно 95% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. В другом варианте воплощения изобретения примерно 90% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. В другом варианте воплощения изобретения примерно 85% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. В другом варианте воплощения изобретения примерно 80% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. В другом варианте воплощения изобретения примерно 70% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. В другом варианте воплощения изобретения примерно 60% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. В другом варианте воплощения изобретения примерно 50% или более N-присоединенных олигосахаридов присутствует на ЛКЛ по изобретению, не содержа фукозы.
В одном варианте воплощения изобретения по существу ни один из типов N-присоединенных к молекулам ЛКЛ олигосахаридных структур по изобретению не содержит фукозы. В другом варианте воплощения изобретения примерно 95% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. Например, если присутствует 20 типов олигосахаридных структур, 19 или более структурных типов не содержат фукозы. В другом варианте воплощения изобретения примерно 90% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. В другом варианте воплощения изобретения примерно 85% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. В другом варианте воплощения изобретения примерно 80% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы. В другом варианте воплощения изобретения примерно 70% или более N-присоединенных олигосахаридов присутствует на отдельной молекуле ЛКЛ по изобретению, не содержа фукозы.
Как было указано выше, определенные моносахариды обильно присутствуют в молекулах ЛКЛ, полученных согласно данного изобретения. Общие проанализированные виды моносахаридов включают фукозу, N-ацетилгалактозамин, N-ацетилглюкозамин, галактозу, глюкозу, маннозу, маннозо-6-фосфат, N-ацетил нейраминовую кислоту и N-гликолил нейраминовую кислоту. Фукоза может присутствовать от примерно 0% до примерно 1% от общей композиции моносахаридов. N-ацетилгалактозамин может присутствовать от примерно 0% до примерно 1% от общей композиции моносахаридов. N-ацетилглюкозамин может присутствовать от примерно 35% до примерно 50% от общей композиции моносахаридов. Галактоза может присутствовать примерно в 1-10% от общей композиции моносахаридов. Глюкоза присутствует в 0% от общей композиции моносахаридов. Манноза присутствует от примерно 32% до примерно 50% от общей композиции моносахаридов. Маннозо-6-фосфат присутствует от примерно 1% до примерно 11% от общей композиции моносахаридов.
В одном варианте воплощения изобретения ЛКЛ получают согласно данного изобретения, и такая ЛКЛ не содержит ксилозы. Кроме того, принимая во внимание, что в ЛКЛ, полученной по данному изобретению, по существу не содержится N-ацетилгалактозамина (GalNac), один аспект изобретения включает композицию ЛКЛ, не содержащую О-присоединенного гликозилирования.
ЛКЛ имеет 6 потенциальных сайтов в своей аминокислотной последовательности для N-присоединенного гликозилирования, например, Asn36, Asn72, Asn101, Asn161, Asn273 и Asn321 с последовательностью SEQ ID NO: 1. Пять из них, а именно Asn36, Asn101 Asn161, Asn273 и Asn321, являются гликозилированными, в то время как Asn72 может быть агликозилированным или по существу агликозилированным (по существу агликозилированный обозначает, что в смеси молекул ЛКЛ несколько Asn72 являются гликозилированными в сравнении с любым Asn36, Asn101 Asn161, Asn273 и Asn321) (см. Фиг. 17). В соответствии с этим, один аспект изобретения описывает композицию ЛКЛ, которая агликозилирована и/или по существу агликозилирована в положении Asn72. ЛКЛ с гликозилированным Asn72 также включена в объем данного изобретения. Положения Asn, описанные в тексте данной заявки, основаны на аминокислотной последовательности ЛКЛ SEQ ID NO: 1. Специалистам в данной области станет очевидно, что нумерация Asn (т.е. положение аспарагина) может варьировать в зависимости от отдельной молекулы ЛКЛ и может быть легко определено в других молекулах ЛКЛ, например таких, последовательности которых представлены SEQ ID NO:2, 3, 4 и 19.
Молекулы ЛКЛ, полученные по данному изобретению, содержат N-гликановые структуры, включающие смесь би-, три- и тетраантеннарных структур с N-ацетилглюкозамином, маннозой и маннозо-6-фосфатом (М6Р) в качестве основных сахаров (Фиг. 16 и 17). Согласно одному аспекту изобретения, М6Р-мидифицированные N-гликаны располагаются, по меньшей мере, на Asn101, Asn161 и Asn273. Таким образом, один вариант данного изобретения включает композицию ЛКЛ с М6Р-модифицированными N-гликанами, располагающимися на любом Asn101, Asn161 или Asn273. В еще одном варианте воплощения изобретения описана композиция ЛКЛ, имеющая М6Р-модифицированные N-гликаны, располагающиеся на Asn273. В другом варианте воплощения данного изобретения описана композиция ЛКЛ с монофосфорилированными N-гликанами (М6Р), располагающимися на любом Asn101, Asn161 или Asn273. В еще одном варианте воплощения изобретения описана композиция ЛКЛ, имеющая монофосфорилированные N-гликаны, располагающиеся на Asn161и Asn273. В еще одном варианте воплощения данное изобретение описывает композицию ЛКЛ, имеющую монофосфорилированные N-гликаны, располагающиеся на Asn101и Asn273. В одном специфическом варианте воплощения изобретения ЛКЛ, полученная по данному изобретению, может содержать бифосфорилированную маннозу (бис-М6Р) в положении Asn101.
Молекулы ЛКЛ, полученные по данному изобретению, содержат пониженные уровни галактозы (например, «Gal»). Один аспект данного изобретения включает композицию ЛКЛ с терминальной галактозой в любом одном Asn36, Asn161 и Asn321. В еще одном варианте воплощения изобретения описана композиция ЛКЛ, имеющая терминальную галактозу, располагающуюся на Asn36и Asn161. В еще одном варианте воплощения изобретения описана композиция ЛКЛ, имеющая терминальную галактозу, располагающуюся на Asn161и Asn321. В еще одном варианте воплощения изобретения описана композиция ЛКЛ, имеющая терминальную галактозу, располагающуюся на Asn36и Asn321. В еще одном варианте воплощения изобретения описана композиция ЛКЛ, имеющая терминальную галактозу, располагающуюся на Asn36, Asn161и Asn321. В еще одном варианте воплощения изобретения описана композиция ЛКЛ, не содержащая терминальную галактозу.
В ЛКЛ в разных N-присоединенных сайтах гликозилирования находятся различные типы N-гликанов. N-гликозилированные структуры включают смесь би-, три- и тетраантеннарных структур с N-ацетилглюкозамином, маннозой и маннозо-6-фосфатом (М6Р) в качестве основных сахаров. В частности, в одном варианте воплощения изобретения ЛКЛ содержит N-гликановую структуру, выбранную из GlcNAc4Man3 GlcNAc2 или GallGlcNAc4Man3GlcNAc2 в первом N-присоединенном сайте гликозилирования (например, Asn36 с последовательностью SEQ ID NO:l). В другом варианте воплощения изобретения ЛКЛ не содержит гликозилирования или по существу агликозилирована во втором N-присоединенном сайте гликозилирования (например, Asn72 с последовательностью SEQ ID NO:l). В еще одном варианте воплощения изобретения ЛКЛ содержит Phos2Man7GlcNAc2 в третьем N-присоединенном сайте гликозилирования (например, Asn101 с последовательностью SEQ ID NO:l). В еще одном варианте воплощения изобретения ЛКЛ содержит N-гликановую структуру, выбранную из PhoslMan6GlcNAc2, GlcNAclPhoslMan6GlcNAc2, Man3GlcNAc2, GlcNAc2Man3GlcNAc2, GlcNAc3Man3GlcNAc2, GlcNAc4Man3GlcNAc2 или Gall GlcNAc4Man3GlcNAc2, в четвертом N-присоединенном сайте гликозилирования (например, Asn161 с последовательностью SEQ ID NO:l). В еще одном варианте воплощения изобретения ЛКЛ содержит N-гликановую структуру, выбранную из Man7GlcNAc2, Man8GlcNAc2, Man9GlcNAc2, PhoslMan8GlcNAc2 или PhoslMan9GlcNAc2, в пятом N-присоединенном сайте гликозилирования (например, Asn273 с последовательностью SEQ ID NO:l). В еще одном варианте воплощения изобретения ЛКЛ содержит N-гликановую структуру, выбранную из GlcNAc2Man3GlcNAc2, GlcNAc3Man3GlcNAc2, GlcNAc4Man3GlcNAc2, GallGlcNAc4Man3GlcNAc2, GlcNAc5Man3GlcNAc2, GallGlcNAc5Man3GlcNAc2, GlcNAc6Man3GlcNAc2 или GallGlcNAc6Man3GlcNAc2, в шестом N-присоединенном сайте гликозилирования (например, Asn321 с последовательностью SEQ ID NO:l).
Согласно определенным аспектам изобретения, композиции ЛКЛ включают ЛКЛ, гликозилированную в положениях Asn36, Asn72, Asn101 Asn161, Asn273 и Asn321 последовательности SEQ ID NO:l (или в соответствующих остатках аспарагина в последовательностях SEQ ID NO: 2, 3, 4 и 19) в одном N-гликане в указанном положении Asn, как это определено ниже:
a) в положении Asn36, GlcNAc4Man3GlcNAc2 или
GallGlcNAc4Man3GlcNAc2;
b) в положении Asn72, отсутствие гликозилирования;
c) в положении Asn101, Phos2Man7GlcNAc2;
d) в положении Asn161, PhoslMan6GlcNAc2,
GlcNAc 1 Phos 1 Man6GlcNAc2;
Man3GlcNAc2;
GlcNAc2Man3GlcNAc2;
GlcNAc3Man3GlcNAc2;
GlcNAc4Man3GlcNAc2 или
GallGlcNAc4Man3GlcNAc2;
e) в положении Asn273, Man7GlcNAc2,
Man8GlcNAc2,
Man9GlcNAc2,
PhoslMan8GlcNAc2, или
PhoslMan9GlcNAc2; и
f) в положении Asn321, GlcNAc2Man3GlcNAc2,
GlcNAc3Man3GlcNAc2,
GlcNAc4Man3GlcNAc2,
GallGlcNAc4Man3GlcNAc2,
GlcNAc5Man3GlcNAc2,
GallGlcNAc5Man3GlcNAc2,
GlcNAc6Man3GlcNAc2, или
GallGlcNAc6Man3GlcNAc2,
где Man=манноза,
GlcNAc=N-ацетилглюкозамин,
Phos=фосфат и
Gal=галактоза.
В одном варианте воплощения изобретения GallGlcNAc4Man3GlcNAc2 может находиться в качестве гликанового компонента в любом из положений Asn36, Asn161или Asn321в ЛКЛ, полученной по данному изобретению. В одном специфическом варианте воплощения изобретения GallGlcNAc4Man3GlcNAc2 может быть представлен в качестве гликанового компонента Asn36, Asn161и Asn321.
В ЛКЛ по данному изобретению Asn101 и Asn273 содержат повышенное количество маннозы от примерно 6 до примерно 10 молекул маннозы (MAN6-MAN10, как это описано в тексте данной заявки) в качестве основного компонента. В соответствии с этим, один аспект данного изобретения включает композицию ЛКЛ высоким содержанием маннозы в положении Asn101 или Asn273. В другом варианте воплощения изобретения композиция ЛКЛ по изобретению может включать N-гликановую структуру, имеющую, по меньшей мере, 6 манноз в положениях Asn101 или Asn273. В другом варианте воплощения изобретения композиция ЛКЛ содержит N-гликан, имеющий 7, 8 или 9 манноз в положениях Asn101 и Asn273. В еще одном варианте воплощения изобретения композиция ЛКЛ содержит 7, 8 или 9 манноз в положениях Asn101 и/или Asn273 и, по меньшей мере, одна манноза фосфорилирована.
Следует понимать, что сайты гликозилирования и число этих сайтов, связанных с описанными выше Asn, основаны на аминокислотной последовательности ЛКЛ с SEQ ID NO:1, и профили гликозилирования, описанные выше в контексте SEQ ID NO:1, также применимы к молекулам ЛКЛ с последовательностями SEQ ID NO:2, 3, 4 и 19, однако нумерация соответствующих Asn может варьировать в зависимости от молекулы ЛКЛ. Например, Asn36в SEQ ID NO:1 соответствует Asn15в SEQ ID NO:2, Asn13в SEQ ID NO:3, Asn10в SEQ ID NO:4 и Asn9в SEQ ID NO:19. Asn72 в SEQ ID NO:1 соответствует Asn51в SEQ ID NO:2, Asn49в SEQ ID NO:3, Asn46в SEQ ID NO:4 и Asn45в SEQ ID NO:19. Asn101в SEQ ID NO:1 соответствует Asn80в SEQ ID NO:2, Asn78в SEQ ID NO:3, Asn75в SEQ ID NO:4 и Asn74в SEQ ID NO:19. Asn161в SEQ ID NO:1 соответствует Asn140в SEQ ID NO:2, Asn138в SEQ ID NO:3, Asn135в SEQ ID NO:4 и Asn134в SEQ ID NO:19. Asn273в SEQ ID NO:1 соответствует Asn252в SEQ ID NO:2, Asn250в SEQ ID NO:3, Asn247в SEQ ID NO:4 и Asn246в SEQ ID NO:19. Asn321в SEQ ID NO:1 соответствует Asn300в SEQ ID NO:2, Asn298в SEQ ID NO:3, Asn295в SEQ ID NO:4 и Asn294в SEQ ID NO:19.
Например, в одном варианте воплощения изобретения ЛКЛ представлена в N-присоединенной форме, гликозилированной, по меньшей мере, в одном положении, выбранным из группы, состоящей из Asn15, Asn51, Asn80, Asn140, Asn252 и Asn300 последовательности SEQ ID NO:2. В другом варианте воплощения изобретения ЛКЛ представлена в N-присоединенной форме, гликозилированнойв положении Asn15, Asn80, Asn140, Asn252 и Asn300 последовательности SEQ ID NO:2. В другом варианте воплощения изобретения N-гликановые структуры SEQ ID NO:2 не содержат ксилозы, в то время как менее чем 15%, 10%, 5% или 1% N-гликановых структур содержат сиалиновую кислоту; менее чем 50%, 40%, 30%, 20%, 10%, 5% или 1% N-гликановых структур содержат фукозу; и, по меньшей мере, 30%, 50%, 60%, 70%, 80%, 90% и 95% N-гликановых структур содержат фосфорилированную маннозу (М6Р). S
В одном варианте воплощения изобретения ЛКЛ представлена в N-присоединенной форме, гликозилированной, по меньшей мере, в одном положении, выбранным из группы, состоящей из Asn13, Asn49, Asn78, Asn138, Asn250 и Asn298 последовательности SEQ ID NO:3. В другом варианте воплощения изобретения ЛКЛ представлена в N-присоединенной форме, гликозилированной в положении Asn13, Asn78, Asn138, Asn250 и Asn298 последовательности SEQ ID NO:3. В другом варианте воплощения изобретения N-гликановые структуры SEQ ID NO:3 не содержат ксилозы, в то время как менее чем 15%, 10%, 5% или 1% N-гликановых структур содержат сиалиновую кислоту; менее чем 50%, 40%, 30%, 20%, 10%, 5% или 1% N-гликановых структур содержат фукозу; и, по меньшей мере, 30%, 50%, 60%, 70%, 80%, 90% и 95% N-гликановых структур содержат фосфорилированную маннозу (М6Р).
В одном варианте воплощения изобретения ЛКЛ представлена в N-присоединенной форме, гликозилированной, по меньшей мере, в одном положении, выбранным из группы, состоящей из Asn10, Asn46, Asn75, Asn135, Asn247 и Asn295 последовательности SEQ ID NO:4. В другом варианте воплощения изобретения ЛКЛ представлена в N-присоединенной форме, гликозилированной в положении Asn10, Asn75, Asn135, Asn247 и Asn295 последовательности SEQ ID NO:4. В другом варианте воплощения изобретения N-гликановые структуры SEQ ID NO:4 не содержат ксилозы, в то время как менее чем 15%, 10%, 5% или 1% N-гликановых структур содержат сиалиновую кислоту; менее чем 50%, 40%, 30%, 20%, 10%, 5% или 1% N-гликановых структур содержат фукозу; и, по меньшей мере, 30%, 50%, 60%, 70%, 80%, 90% и 95% N-гликановых структур содержат фосфорилированную маннозу (М6Р).
В одном варианте воплощения изобретения ЛКЛ представлена в N-присоединенной форме, гликозилированной, по меньшей мере, в одном положении, выбранным из группы, состоящей из Asn9, Asn45, Asn74, Asn134, Asn246 и Asn294 последовательности SEQ ID NO:19. В другом варианте воплощения изобретения ЛКЛ представлена в N-присоединенной форме, гликозилированной в положении Asn9, Asn74, Asn134, Asn246 и Asn294 последовательности SEQ ID NO:19. В другом варианте воплощения изобретения N-гликановые структуры SEQ ID NO:4 не содержат ксилозы, в то время как менее чем 15%, 10%, 5% или 1% N-гликановых структур содержат сиалиновую кислоту; менее чем 50%, 40%, 30%, 20%, 10%, 5% или 1% N-гликановых структур содержат фукозу; и, по меньшей мере, 30%, 50%, 60%, 70%, 80%, 90% и 95% N-гликановых структур содержат фосфорилированную маннозу (М6Р).
Композиция по данному изобретению может быть получена с использованием целого ряда способов, включая использование трансгенных птиц, трансгенной рыбы, трансгенных млекопитающих, например, трансгенных коз или трансгенных растений, таких как табак и ряска (Lemna minor), а также определенные типы клеточных структур.
Данное изобретение также предусматривает композиции, включающие ПЭГилированные ЛКЛ. Описанный здесь фермент ЛКЛ может быть ПЭГилированным, как это описано, например, в публикации патента США No. 20070092486 от 26 апреля 2007 г., содержание которой включено сюда во всей своей полноте посредством ссылки.
В одном варианте воплощения изобретения представленная схема гликозилирования была получена посредством специализированных систем экспрессии, например, из клеток яйцевода птиц, например, клеток трубчатой железы. Например, было показано, что описанные здесь схемы гликозилирования присутствуют в ферментах лизосомальных болезней накопления, вырабатываемых в клетках яйцеводов птиц, таких как курица, согласно данного изобретения.
Белки, полученные в соответствии с изобретением, могут быть очищены из яичного белка с использованием любой подходящей процедуры очистки белка, известной специалисту в данной области. Например, ЛКЛ человека (чЛКЛ), полученная у трансгенных птиц согласно данного изобретения, может быть очищена от яичного белка с использованием способов очистки белка, известных специалисту в данной области. Пример протокола очистки ЛКЛ из яичного белка описан в Примерах.
Изобретение включает яйца и яичные белки, а также птиц (например, куриц, индеек и перепелов), несущих яйца и производящих яичный белок, содержащий молекулы лизосомальной кислой липазы по изобретению, включающей одну или более гликозилированных структур, описанных в тексте данной заявки.
ЭКСПРЕССИЯ ЛКЛ У ПТИЦ
Данное изобретение описывает векторы и способы для устойчивого введения экзогенных последовательностей нуклеиновых кислот в геном птиц для экспрессии требуемых белков, например, таких, которые бы совершенствовались (например, им придавалась повышенная эффективность) при добавлении маннозо-6-фосфата, такие как лизосомальные ферменты, включая, без ограничения, лизосомальную кислую липазу (ЛКЛ) и другие белки, такие как описанные в тексте данной заявки. В частности, получают трансгенных птиц, которые экспрессируют экзогенные последовательности в своих яйцеводах с депонированием экзогенных белков, таких как фармацевтические белки, в яйцах. Яйца птиц, содержащие такие экзогенные белки, также описаны в данном изобретении. Также описаны новейшие формы ЛКЛ, которые эффективным образом экспрессируются в яйцеводе трансгенных птиц и депонируются в яйцах птиц.
Один аспект данного изобретения описывает композиции, содержащие ЛКЛ, т.е. молекулы ЛКЛ, полученные согласно изобретению. В отдельном варианте воплощения изобретения ЛКЛ подвергается очистке или выделению. Например, ЛКЛ была очищена от содержимого твердой оболочки яиц, откладываемых трансгенной птицей. В одном отдельном варианте воплощения изобретения ЛКЛ представлена ЛКЛ человека. В одном варианте воплощения изобретения ЛКЛ по изобретению имеет схему гликозилирования, полученную из ЛКЛ, выработанную в клетках яйцевода птицы. Например, композиции могут содержать смесь молекул ЛКЛ, полученных у птиц, например, куриц, в соответствии с изобретением, и выделенных из яичного белка. В одном варианте воплощения изобретения композиции, содержащие ЛКЛ, представлены фармацевтическими композициями.
В одном аспекте изобретение описывает композиции, содержащие выделенные молекулы ЛКЛ, например, молекулы ЛКЛ человека, при этом ЛКЛ получена у птиц, которые содержат трансген, кодирующий ЛКЛ. В одном варианте воплощения изобретения ЛКЛ получают в клетке яйцевода (например, клетке трубчатой железы) трансгенной птицы (например, трансгенной курицы), и ЛКЛ выделяют из яичного белка трансгенной птицы. В одном варианте воплощения изобретения ЛКЛ гликозилируется в клетке яйцевода (например, клетке трубчатой железы) птицы, например, курицы.
В другом аспекте изобретения описаны способы получения экзогенных белков, таких как ферменты лизосомальной болезни накопления, например, ЛКЛ, в специфических тканях птиц. Такие экзогенные белки могут экспрессироваться в яйцеводе, клетках крови и/или других клетках и тканях птицы. В одном варианте воплощения изобретения трансгены вводят в эмбриональные бластодермальные клетки, например, на стадии Х, для получения трансгенной птицы, таким образом, экспрессируется требуемый белок в клетках трубчатой железы магнума яйцевода, секретируется в проток, депонируется в яичном белке твердой оболочки яиц. Полученная таким образом трансгенная птица может нести трансген в клетках зародышевой линии, обеспечивая передачу экзогенного трансгена своему потомству по правилам Менделя.
Данное изобретение охватывает способы получения экзогенного белка, такого как ЛКЛ, в яйцеводе птицы. Способы могут включать первый этап обеспечения вектора, содержащего кодирующую последовательность и промотор, функционально связанный с кодирующей последовательностью, таким образом промотор может влиять на экспрессию нуклеиновой кислоты в яйцеводе птицы. Трансгенные клетки и/или ткани могут быть получены при введении вектора в эмбриональные бластодермальные клетки птицы, которые были свежевыделены, находятся в культуре или в эмбрионе, таким образом, последовательность вектора включается в геном птицы. Из трансгенных клеток и/или ткани может быть получена зрелая трансгенная птица, экспрессирующая экзогенный белок, такой как ЛКЛ, в своем яйцеводе.
В одном аспекте изобретения получение трансгенной птицы сопровождается трансдукцией эмбриональных бластодермальных клеток с использованием репликационно-дефективных или репликационно-компетентных ретровирусных частиц, несущих трансген между 5' и 3' LTR ретровирусного вектора. Например, может использоваться ретровирусный вектор вируса лейкоза птиц (ALV) или ретровирусный вектор вируса лейкоза мышей (MLV), которые включают модифицированную плазмиду pNLB, содержащую экзогенный ген, вставленный ниже сегмента участка промотора. Копия РНК модифицированного ретровирусного вектора, упакованная в вирусные частицы, может использоваться для инфицирования эмбриональных бластодерм, развивающихся в трансгенных птиц.
Другой аспект данного изобретения описывает вектор, который включает кодирующую последовательность и промотор в функциональном и позиционном соотношении, таким образом, в яйцеводе птицы экспрессируется кодирующая последовательность. Такие векторы включают, но не ограничиваются, ретровирусный вектор вируса лейкоза птиц (ALV), ретровирусный вектор вируса лейкоза мышей (MLV) и вектор лентивируса. Кроме того, вектор может быть представлен последовательностью нуклеиновой кислоты, которая включает LTR ретровирусного вектора вируса лейкоза птиц (ALV), ретровирусного вектора вируса лейкоза мышей (MLV) или вектора лентивируса. Промотор достаточно эффективен для управления экспрессией кодирующей последовательности в яйцеводе птицы. Кодирующая последовательность кодирует экзогенный белок, который депонируется в яичном белке твердой скорлупы яйца. Таким образом, кодирующая последовательность кодирует экзогенные белки, которые можно получить у трансгенных птиц, такие как лизосомальная кислая липаза, полученная у трансгенных птиц (TPD ЛКЛ).
В одном варианте воплощения изобретения векторы, используемые в способах по изобретению, содержат промотор, который особенно подходит для экспрессии экзогенных белков у птиц и в их яйцах. Таким образом, экспрессия экзогенной кодирующей последовательности может возникать в яйцеводе и крови трансгенной птицы и в яичном белке яйца птицы. Промоторы включают, но не ограничиваются, промотор цитомегаловируса (CMV), промотор вируса рауш-саркомы (RSV), промотор Р-актина (например, промотор Р-актина курицы), промотор вируса лейкоза мыши (MLV), промотор вируса опухоли молочной железы мыши (MMTV), промотор яичного альбумина, промотор лизоцима, промотор кональбумина, промотор овомукоида, промотор овомуцина и промотор овотрансферрина. В некоторых случаях промотор может быть представлен сегментом, по меньшей мере, одного участка промотора, такого как сегмент яичного альбумина, лизоцима, кональбумина, овомукоида, овомуцина и участок промотора овотрансферрина. В одном варианте воплощения изобретения промотор представлен комбинацией или слиянием одного или более промоторов или слиянием участка одного или более промоторов, таких как промоторы яичного альбумина, лизоцима, кональбумина, овомукоида, овомуцина и овотрансферрина.
В одном варианте воплощения изобретения вектор включает кодирующую последовательность сигнального пептида, которая функционально связана с кодирующей последовательностью, таким образом, после трансляции в клетке, сигнальный пептид направляет секрецию экзогенного белка, экспрессированного вектором, такого как ЛКЛ человека, в яичный белок твердой оболочки яйца.
Один аспект данного изобретения описывает кодирующие последовательности для экзогенных белков, полученные согласно представленному здесь описанию, и такая кодирующая последовательность представлена кодоном, оптимизированным для экспрессии у птиц, например, у куриц. Оптимизация кодона может быть определена при использовании кодона для экспрессии, по меньшей мере, одного, и, преимущественного, более одного белка в клетке птицы (например, клетке курицы). Например, использование кодона может быть определено на основе последовательностей нуклеиновых кислот, кодирующих белки яичного альбумина, лизоцима, овомуцина и овотрансферрина курицы. Например, кодирующая последовательность ДНК для экзогенного белка может быть представлена оптимизированным кодоном с использованием программы the BACKTRANSLATE® от Wisconsin Package, версия 9.1 (Genetics Computer Group, Inc., Madison, WI), где приводится таблица кодонов для яичного альбумина, лизоцима, овомукоида и овотрансферрина курицы (Gallus gallus).
Один важный аспект данного изобретения описывает твердую оболочку яиц птиц (например, яйца куриц с твердой оболочкой), которые содержат экзогенный пептид или белок, включая, но не ограничиваясь, ЛКЛ человека. Экзогенный пептид или белок, такой как ЛКЛ человека, может кодироваться трансгеном трансгенной птицы. Очень часто экзогенный белок или пептид (например, ЛКЛ) гликозилирован. Белок может присутствовать в любом подходящем количестве. В одном варианте воплощения изобретения белок присутствует в количестве в диапазоне от примерно 0,01 мкг на яйцо с твердой оболочкой до примерно 1 г на яйцо с твердой оболочкой. В другом варианте воплощения изобретения белок присутствует в количестве в диапазоне от примерно 1 мкг на яйцо с твердой оболочкой до примерно 1 г на яйцо с твердой оболочкой. Например, белок может присутствовать в количестве в диапазон от примерно 10 мкг на яйцо с твердой оболочкой до примерно 1 г на яйцо с твердой оболочкой (например, диапазон от примерно 10 мкг на яйцо с твердой оболочкой до примерно 400 мг на яйцо с твердой оболочкой).
В одном варианте воплощения изобретения экзогенный белок по изобретению присутствует в яичном белке яйца. В одном варианте воплощения изобретения белок присутствует в количестве в диапазоне от примерно 1 нг на мл яичного белка до примерно 0,2 г на мл яичного белка. Например, белок может присутствовать в количестве в диапазоне от примерно 0,1 мкг на мл яичного белка до примерно 0,2 г на мл яичного белка (например, белок может присутствовать в количестве в диапазоне от примерно 1 мкг на мл яичного белка до примерно 100 мг на мл яичного белка). В одном варианте воплощения изобретения белок присутствует в количестве в диапазоне от примерно 1 мкг на мл яичного белка до примерно 50 мг на мл яичного белка. Например, белок может присутствовать в количестве в диапазоне от примерно 1 мкг на мл яичного белка до примерно 10 мг на мл яичного белка (например, белок может присутствовать в количестве в диапазоне от примерно 1 мкг на мл яичного белка до примерно 1 мг на мл яичного белка). В одном варианте воплощения изобретения белок присутствует в количестве более 0,1 мкг на мл яичного белка. В одном варианте воплощения изобретения белок присутствует в количестве более 0,5 мкг на мл яичного белка. В одном варианте воплощения изобретения белок присутствует в количестве более 1 мкг на мл яичного белка. В одном варианте воплощения изобретения белок присутствует в количестве более 1,5 мкг на мл яичного белка.
Птицы по изобретению, продуцирующие экзогенные белки, описанные в тексте данной заявки (например, ЛКЛ), развившиеся из бластодермальных клеток, в которые был введен вектор, являются поколением G0 и могут обозначаться как «основатели». Птицы-основатели обычно являются химерами относительно каждого вставленного трансгена. Таким образом, некоторые клетки трансгенной птицы G0 содержат трансген(-ы). Поколение G0 обычно гемизиготное относительно трансгена(-ов). Поколение G0 может быть размножено до нетрансгенных животных для получения трансгенного потомства G1, которые также гемизиготны относительно трансгена и содержат трансген(-ы) по существу во всех своих клетках. Гемизиготное потомство G1 может быть скрещено с нетрансгенными животными для получения гемизиготного потомства G2 или может быть скрещено между собой для получения потомства G2, гомозиготного на предмет трансгена. По существу все клетки птиц, положительных на трансген и полученных из потомства G1, содержат трансген (-ы). В одном варианте воплощения изобретения гемизиготное потомство G2 из одной и той же линии может быть скрещено с получением гомозиготного потомства G3 на предмет трансгена. В одном варианте воплощения изобретения гемизиготные животные G0 или G1, например, скрещиваются вместе с получением гомозиготного потомства G1, содержащего две копии трансгена(-ов) в каждой клетке животного. Это только немногочисленные примеры определенных способов скрещивания, и данное изобретение охватывает использование любого подходящего способа скрещивания, известного специалистам в данной области.
В одном варианте воплощения изобретение описывает выделенные ЛКЛ. Такая ЛКЛ, содержащаяся в композиции, может быть представлена выделенной ЛКЛ. Например, ЛКЛ может быть выделена из яичного белка. Выделенная ЛКЛ может быть представлена молекулами ЛКЛ, имеющими различные гликозилированные структуры среди молекул ЛКЛ.
Путем использования способов по данному изобретению, трансгены могут быть введены в эмбриональные бластодермальные клетки птиц для получения трансгенных куриц, трансгенных индеек, трансгенных перепелов и других видов птиц, несущих трансген в геномном материале своей линии клеток для получения белков по изобретению. Бластодермальные клетки обычно представлены клетками на стадии VII-XII или их эквивалентами, а в одном варианте воплощения изобретения находятся на стадии Х.
В тексте данной заявки описаны некоторые векторы, используемые в способах данного изобретения. В одном варианте воплощения изобретения кодирующая последовательность и промотор вектора располагаются между 5' и 3' LTR перед введением в бластодермальные клетки. В одном варианте воплощения изобретения вектор является ретровирусным, а кодирующая последовательность и промотор располагаются между 5' и 3' LTR ретровирусного вектора. В одном варианте воплощения изобретения LTR или ретровирусный вектор получают из вируса лейкоза птиц (ALV), вируса лейкоза мышей (MLV) или лентивируса.
В одном варианте воплощения изобретения векторы используют для трансфекции бластодермальных клеток и получения стабильной интеграции в геном птицы, содержащий кодирующую последовательность и промотор, находящиеся в функциональном и позициональном взаимоотношении для экспрессии кодирующей последовательности в клетках трубчатой железы магнума яйцевода птиц, при этом экзогенный белок, такой как лизосомальный фермент (например, ЛКЛ), депонируется в яичном белке яйца с твердой оболочкой.
Промотор в некоторых случаях может быть представлен сегментом участка промотора яичного альбумина, который достаточно велик для управления экспрессией кодирующей последовательности в клетках трубчатой железы. Разветвление промотора яичного альбумина и/или конденсация важных регуляторных элементов промотора яичного альбумина с сохранением последовательностей, необходимых для экспрессии в клетках трубчатой железы магнума яйцевода, в то же время будучи достаточно небольшими для легкого введения в векторы, включено в объем изобретения. В одном варианте воплощения изобретения может использоваться сегмент участка промотора яичного альбумина. Такой сегмент включает 5'-фланкирующий участок гена яичного альбумина.
Промотор также может быть представлен промотором, который в большей степени, но не полностью, специфичен для магнума, таким как промотор лизоцима. Промотор также может быть представлен промотором вируса опухоли молочной железы мыши (MMTV). С другой стороны, промотор может быть представлен конститутивным промотором (например, промотором цитомегаловируса (CMV), промотором вируса рауш-саркомы (RSV), промотором вируса лейкоза мыши (MLV) и т.д.). В одном варианте воплощения изобретения промотор представлен промотором цитомегаловируса (CMV), промотором MDOT, промотором вируса рауш-саркомы (RSV), промотором вируса лейкоза мыши (MLV), промотором вируса опухоли молочной железы мыши (MMTV), промотором яичного альбумина, промотором лизоцима, промотором кональбумина, промотором овомукоида, промотором овомуцина и/или промотором овотрансферрина. В некоторых случаях промотор может быть представлен сегментом, по меньшей мере, одного участка промотора, такого как сегмент яичного альбумина, лизоцима, кональбумина, овомукоида, овомуцина и участок промотора овотрансферрина.
В способе трансфекции бластодермальных клеток упакованный вектор на основе ретровируса используют для доставки вектора в эмбриональные бластодермальные клетки, таким образом, вектор интегрируется в геном птицы.
Ретровирусы, используемые для случайного встраивания трансгена в геном птицы, представлены репликационно-неспособным вирусом лейкоза птица (ALV), репликационно-неспособным вирусом лейкоза мыши (MLV) или лентивирусом. В одном варианте воплощения изобретения вектор pNLB модифицируют путем вставки участка промотора яичного альбумина и одного или более экзогенных генов между 5' и 3' длиннотерминальными повторами (LTR) генома ретровируса. Изобретение предусматривает, что любая кодирующая последовательность, расположенная книзу от промотора, активного в клетках трубчатой железы, может быть экспрессирована в клетках трубчатой железы. Например, промотор яичного альбумина может быть экспрессирован в клетках трубчатой железы яйцевода магнума, потому что промотор яичного альбумина направляет экспрессию белка яичного альбумина и активен в клетках трубчатой железы яйцевода.
Любые описанные здесь векторы также могут в некоторых случаях включать кодирующую последовательность, которая кодирует сигнальный пептид, направляющий секрецию белка, эскпрессированного кодирующей последовательностью вектора, из клеток трубчатой железы яйцевода. Данный аспект эффективным образом расширяет спектр экзогенных белков, которые могут депонироваться в яйцах птиц с использованием описанных здесь способов. Принимая во внимание, что экзогенные белки не секретируются иным образом, вектор, содержащий кодирующую последовательность, модифицирован для включения последовательности ДНК, содержащей примерно 60 bp, кодирующих сигнальный пептид гена лизоцима. Последовательность ДНК, кодирующая сигнальный пептид, вставляется в вектор таким образом, что она располагается на N-конце белка, кодируемого ДНК.
Другой аспект изобретения включает использование элементов участков внутренней посадки рибосомы (IRES) в любых векторах данного изобретения для обеспечения трансляции двух или более белков от бицистронной или полицистронной мРНК. Единицы IRES слиты с 5'-концами одной или более дополнительных кодирующих последовательностей, которые затем вставляются в векторы на конце оригинальной кодирующей последовательности, таким образом, кодирующие последовательности разделены одна от другой IRES.
В одном варианте воплощения изобретения при использовании IRES посттрансляционная модификация продукта облегчается, поскольку одна кодирующая последовательность может кодировать фермент, способный модифицировать продукт другой кодирующей последовательности. Например, первая кодирующая последовательность может кодировать коллаген, который будет гидроксилирован и активирован ферментом, кодируемым второй кодирующей последовательностью, при этом IRES используют так, как это принято в науке.
В другом аспекте кодирующие последовательности векторов, используемых в любом способе данного изобретения, описаны с 3'-нетранслируемыми участками (3' UTR) для придания стабильности полученной РНК. При добавлении 3' UTR к ретровирусному вектору, ориентация промотора, гена Х и 3' UTR в векторе должна быть представлена реверсивно, чтобы добавление 3' UTR не повлияло на транскрипцию геномной РНК полной длины. В одном варианте воплощения изобретения 3' UTR может быть получен из генов яичного альбумина или лизоцима, или любой 3' UTR функционален в клетках магнума, т.е. участке SV40.
В одном варианте воплощения изобретения для экспрессии кодирующей последовательности трансгена у птиц используют конститутивный промотор. В этом случае экспрессия не ограничивается магнумом; экспрессия также происходит в других тканях птицы (например, крови). Использование такого трансгена, который включает конститутивный промотор и кодирующую последовательность, особенно удобно для влияния или направления экспрессии белка в яйцеводе и последующей секреции белка в яйце.
Преобразующие частицы (т.е. трансфектированные частицы) получают для вектора и используют для определения соответствующей концентрации, которая может использоваться для инъецирования эмбрионов. Отверстия в яйцах птиц делают согласно способу Speksnijder (патент США No. 5897998, содержание включено сюда во всей своей полноте посредством ссылки), и в яйца вводят трансфектированные частицы. Яйца вылупляются в течение 21 дня после введения, и для размножения отбирают самцов птиц. Для скрининга петухов G0, содержащих в своей сперме трансген, ДНК экстрагируется из образцов спермы петухов. Петухи G0 с наивысшими уровнями трансгена в образцах спермы используются для скрещивания с нетрансгенными курами путем искусственного оплодотворения. Образцы ДНК крови подвергают скринингу на предмет присутствия трансгена. Сыворотка трансгенных петухов тестируется на предмет присутствия экзогенного белка. В случае подтверждения экзогенного белка, сперма трансгенных петухов используется для искусственного оплодотворения нетрансгенных кур. Впоследствии определенный процент потомства содержит трансген (например, более 50%). При присутствии экзогенного белка в яйцах, полученных по данному изобретению, белок может быть изолирован. Белок также может быть протестирован на биологическую активность.
Способы по изобретению, обеспечивающие получение экзогенного белка в яйцеводе птиц и получении яиц, содержащих экзогенный белок, включают дополнительный этап предоставления подходящего вектора и введения вектора в эмбриональные бластодермальные клетки, чтобы вектор был интегрирован в геном птиц. Последующий этап включает получение зрелого трансгенного самца птицы из трансгенных бластодермальных клеток, полученных на предыдущих этапах. Зрелые трансгенные птицы могут быть получены из клеток бластодермального эмбриона, которые были трансфицированы или в них был внесен вектор непосредственно в эмбрион. Полученный эмбрион развивается и цыпленку дают вырасти.
Трансгенная птица, полученная из бластодермальных клеток, называется основателем. Некоторые основатели будут нести трансген в клетках трубчатой железы своего яйцевода. Такие птицы будут экспрессировать экзогенный белок, кодируемый трансгеном в яйцеводе. Экзогенный белок, кроме яйцевода, также может быть экспрессирован в других тканях (например, крови). Если экзогенный белок содержит соответствующую сигнальную последовательность(-и), он будет секретироваться в протоке яйцевода и в белке яйца.
Некоторые основатели являются основателями зародышевой линии. Основатель зародышевой линии представлен основателем, несущим трансген в генетическом материале тканях зародышевой линии, и также может нести трансген в клетках трубчатой железы магнума яйцевода, которые экспрессируют экзогенный белок. Таким образом, согласно изобретению, трансгенная птица может иметь клетки трубчатой железы, экспрессирующие экзогенный белок, и потомство трансгенной птицы может также иметь клетки трубчатой железы магнума яйцевода, экспрессирующие экзогенный белок. С другой стороны, потомство экспрессирует фенотип, определенный по экспрессии экзогенного гена в специфической ткани(-ях) птицы. В одном варианте воплощения изобретения трансгенная птица представлена курицей или индейкой.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ
Имея возможность использования в терапии, терапевтические белки, полученные в соответствии с данным изобретением, могут вводиться в сырой форме, однако преимущественно их введение как части терапевтической композиции. Таким образом, дополнительно описаны фармацевтические композиции, включающие гликозилированные терапевтические белки, полученные у птицы, такие как ЛКЛ, или их фармацевтически приемлемые производные вместе с одним или более фармацевтически приемлемыми носителями, и, в некоторых случаях, другие терапевтические и/или профилактические ингредиенты и способы введения таких фармацевтических композиций. Носитель(-и) должны быть «приемлемыми» в смысле совместимости с другими ингредиентами композиции и не оказывать губительного действия на реципиента. Способы лечения пациента (например, количество введенного фармацевтического белка, частота введения и длительность периода лечения) с использованием фармацевтических композиций по изобретению могут быть определены с использованием стандартных способов, известных специалистам в данной области.
Композиции, включающие носители, включая композитные молекулы, разработаны общепринятыми способами (см., например, Remington's Pharmaceutical Sciences, 14th Ed., Mack Publishing Co., Easton, Pa.), содержание включено сюда во всей своей полноте посредством ссылки. Носитель может включать разбавитель. В одном варианте воплощения изобретения фармацевтический носитель может быть представлен жидкостью, а рекомбинантная ЛКЛ человека может быть в форме раствора. Фармацевтический носитель может быть представлен воском, жиром или спиртом. В одном варианте воплощения изобретения носитель на основе воска или жира не содержит эфир. В другом варианте воплощения изобретения фармацевтически приемлемый носитель может быть твердым веществом в форме порошка, лиофилизированного порошка или таблетки. В одном варианте воплощения изобретения носитель может включать липосому или микрокапсулу.
Фармацевтические композиции включают композиции, подходящие для введения путем инъекции, включая внутримышечное, подкожное и внутривенное введение. Фармацевтические композиции включают композиции, подходящие для перорального, ректального, назального, местного (включая буккальное и сублигвальное), вагинального или парентерального введения. Фармацевтические композиции также включают композиции для введения путем ингаляции или инсуффляции. Композиции, где это возможно, могут быть представлены удобным образом в виде дозированной лекарственной формы и могут быть получены с помощью любого способа, хорошо известного в фармации. Способы получения фармацевтических композиций обычно включают этап взаимосвязи терапевтического белка с жидкими носителями или тонкодисперсными твердыми носителями или обоими носителями, а затем, при необходимости, формовки продукта в требуемую композицию.
Фармацевтические композиции, подходящие для перорального введения, могут быть представлены удобным образом в виде дискретных единиц, таких как капсулы, саше или таблетки, каждая из которых содержит предварительно определенное количество активного действующего вещества; в виде порошка или гранул; в виде раствора; в виде суспензии; или в виде эмульсии. Активное действующее вещество также может быть представлено в виде болюсной дозы, электуария или пасты. Таблетки и капсулы для перорального введения могут содержать достаточное количество вспомогательных веществ, таких как связующие агенты, наполнители, лубриканты, дезинтегранты или смачивающие агенты. Таблетки также могут быть покрыты согласно известным в науке способам. Пероральные жидкие композиции могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для восстановления водой или другим подходящим носителем перед использованием. Такие жидкие композиции могут содержать соответствующие добавки, такие как суспендирующие агенты, эмульгаторы, неводные носители (которые могут включать съедобные масла) или консерванты.
ЛКЛ также может быть представлена в композиции для парентерального введения (например, путем введения, например, болюсной инъекции или продолжительной инфузии) и может быть представлена в лекарственной форме в ампулах, предварительно наполненных шприцах, контейнеров для инфузии небольшого объема или контейнеров с несколькими дозами с добавленным консервантом. Терапевтические белки могут быть введены, например, путем подкожной инъекции, внутримышечной инъекции и внутривенной инъекции или инфузии.
ЛКЛ может быть представлена в таких формах, как суспензии, растворы или эмульсии в масляном или жидком носителях, и может содержать формовочные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Также предусмотрено, что терапевтический белок может быть представлен в форме порошка, полученного путем асептической изоляции стерильного твердого вещества или путем лиофилизации из раствора, для восстановления подходящим носителем, например, стерильной, апирогенной водой, перед использованием.
Для внутривенных инфузий или введений ЛКЛ, полученная в соответствии с данным изобретением, может быть представлена в форме водной суспензии или раствора. Вспомогательные вещества, подходящие для использования в композиции для внутривенной инфузии или инъекции, могут включать одно из следующих веществ: тринатрия цитрат дегидрат, лимонная кислота и человеческий сывороточный альбумин.
Фармацевтическая композиция также может включать другие подходящие вспомогательные вещества, хорошо известные в науке для других продуктов для нарушений лизосомального накопления. рН ЛКЛ, полученной по данному изобретению, сохраняется между примерно 5,6 и 6,2. Преимущественно, рН композиции ЛКЛ составляет 5,9±0,2.
Для местного введения в эпидермис, терапевтические белки по изобретению, полученные согласно изобретению, могут быть представлены в виде мазей, кремов или лосьонов, или в виде накожного пластыря. Мази и крема могут в своем составе включать, например, водную или масляную основу с добавлением подходящего разжижающего и/или желирующего агентов. Лосьоны в своем составе могут включать маслянистую или водную основу и также могут содержать один или более эмульгаторов, стабилизаторов, диспергирующих агентов, суспендирующих агентов, разжижающих агентов или красителей.
Композиции, подходящие для местного введения во рту, включают леденцы, включающие активное действующее вещество с ароматизированным основанием, обычно сахарозой и камедью или трагакантом; пастилки, включающие активное действующее вещество на инертной основе, такой как желатин и глицерин или сахароза и камедь; и ополаскиватели для полости рта, включающие активное действующее вещество в подходящем жидком носителе.
Фармацевтические композиции, подходящие для ректального введения включают носитель, являющийся твердым веществом, и такие композиции представлены преимущественно в виде суппозиториев с однократной дозой. Подходящие носители включают масло какао и другие материалы, которые обычно используются в науке, и суппозитории могут быть образованы смесью активного действующего вещества со смягчающими или расплавляющими носителями с последующим смешиванием и формовкой в пресс-формах.
Композиции, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пены или спрея, содержащих, кроме активного действующего вещества, носители, которые известны в науке.
Для интраназального введения терапевтические белки по изобретению могут использоваться в виде жидкого спрея или диспергируемого порошка или в форме капель. Капли могут содержать водную или неводную основу, которая также включает один или более диспергирующих агентов, солюбилизаторов или суспендирующих агентов. Жидкие спреи поставляются удобным образом в упаковках под давлением.
Для введения путем ингаляции терапевтические белки по изобретению могут быть удобным образом представлены в виде инсуффлятора, небулайзера или упаковки под давлением или в виде другой удобной формы для доставки аэрозольного спрея.
Упаковки под давлением могут включать подходящий пропеллент, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае находящегося под давлением аэрозоля, единица дозы может быть определена путем размещения клапана для доставки в организм отмеренного количества.
Для введения путем ингаляции или инсуффляции терапевтические белки по изобретению могут быть представлены в форме композиции сухого порошка, например, смеси порошков соединений и подходящей порошковой базы, такой как лактоза или крахмал. Порошковая композиция может быть представлена в единице лекарственной формы, например, в капсулах или картриджах, или, например, желатиновых или блистерных упаковках, при этом порошок может вводиться с помощью ингалятора или инсуффлятора.
При необходимости, представленные выше композиции адаптируются для получения продолжительного высвобождения активного действующего вещества.
Описанные здесь фармацевтические композиции также могут содержать другие активные действующие вещества, такие как антибактериальные препараты или консерванты.
Кроме того, предусмотрено, что описанные здесь терапевтические белки могут использоваться в комбинации с другими терапевтическими агентами. Например, изобретение описывает способы предварительного лечения с использованием фармацевтически эффективной дозы антигистамина для сведения к минимуму или профилактики анафилактических реакций, вызванных инфузией. Например, антигистамин может быть представлен любым фармацевтически приемлемым антигистамином (например, дифенгидрамином), как это описано в данном изобретении и известно в науке. В одном варианте воплощения изобретения антигистамин вводят в дозе от примерно 1 мг до примерно 10 мг на кг массы тела. Например, антигистамин может быть введен в дозе примерно 5 мг на кг. В одном варианте воплощения изобретения антигистамин вводят в течение периода от примерно 10 минут до примерно 90 минут, например, от примерно 30 минут до примерно 60 минут, перед введением лизосомальной кислой липазы с использованием амбулаторной системы, присоединенной к сосудистому порту доступа. В одном варианте воплощения изобретения доза дифенгидрамина эффективно противодействует потенциальным анафилактическим реакциям инфузии.
Перед, во время или после введения ЛКЛ в случае ожидания анафилактической реакции или нежелательного иммунного ответа у пациента могут быть введены иммуносупрессанты, такие как антигистамины, кортикостероиды, сиролимус, воклоспорин, циклоспорин, метотрексат, антитела, направленные на рецептор ИЛ-2, антитела к Т-клеточному рецептору, антитела к ФНО-альфа или белки слияния (инфликсимаб, этанерцепт или адалимумаб), CTLA4-Ig (например, абатацепт) или антитела к ОХ-40.
Изобретение также предусматривает лечение, включающее введение композиций, содержащих ЛКЛ, в комбинации с одним или более агентами, понижающими уровень холестерина (например, ингибиторы HMG-CoA редуктазы). Неограничивающие примеры таких агентов включают: аторвастатин (Липитор® и Торваст®), флувастатин (Лескол®), ловастатин (Мевкор®, Алтокор®, Алтопрев®), питавастатин (Ливало®, Питава®), правастатин (Правахол®, Селектин®, Липостат®), розувастатин (Крестор®) и симвастатин (Зокор®, Липекс®).
Описанные композиции или белки могут использоваться для лечения различных состояний. Например, существуют состояния, принципы лечения которых известны специалисту в данной области. Данное изобретение предусматривает, что терапевтические белки (например, ЛКЛ), полученные в системе птиц и содержащие схему гликозилирования, полученную у птиц, могут использоваться для лечения таких состояний. Поэтому предусмотрено лечение состояний, которые, как известно, подвергаются лечению получаемыми общепринятыми способами терапевтическими белками путем использования терапевтических белков, полученных согласно изобретения. Например, ЛКЛ, полученная по изобретению, может использоваться для лечения состояний, возникших в результате или связанных с дефицитом ЛКЛ или недостатком (общее понятие «дефицит ЛКЛ»), таких как болезнь Вольмана и болезнь накопления эфиров холестерина (БНЭХ). Как это описано в тексте данной заявки, дефицит ЛКЛ также предусматривает состояния, при которых экспрессия ЛКЛ понижена как результат определенного состояния (например, генетической мутации), физиологических факторов или факторов среды, что приводит к снижению или дефициту ЛКЛ, вырабатываемой в организме. ЛКЛ, полученная по изобретению, также может использоваться для лечения других состояний, таких как атеросклероз, ожирение печени, неалкогольная жировая дистрофия печени, неалкогольный стеатогепатоз (НАСГ) и цирроз. ЛКЛ, полученная по изобретению, также может использоваться для лечения других состояний, таких как состояний, описанные в патенте США No. 6849257 от 1 февраля 2005 г. (содержание включено сюда во всей своей полноте посредством ссылки), публикации патента США No. 2009/0297496 от 3 декабря 2009 г.; публикации патента США No. 2004/0223960 от 11 ноября 2004 г.; публикации патента США No. 2007/0264249 от 15 ноября 2009 г., содержание которых (т.е. содержание всех четырех публикаций патентов) включено сюда во всей своей полноте посредством ссылки.
Также предусмотрено, что ЛКЛ, полученная по изобретению, может использоваться для лечения определенных специфических состояний, включающих панкреатит, например, хронический панкреатит и/или острый панкреатит, а также вызванное алкоголем панкреатическое поражение, такое как алкоголь-индуцированный панкреатит.
ЛКЛ, полученная по любому подходящему способу, такому как описанный здесь способ, предусмотрена для лечения заболеваний, вызванных алкоголь-индуцированным поражением клеток, включая, но не ограничиваясь, алкоголь-индуцированные поражения клеток, которые приводят к накоплению липидных эфиров в тканях организма, таких как, не ограничиваясь, печень, селезенка, кишечник и ткань сердечно-сосудистой системы. Изобретение также предусматривает лечение малабсорбции путем введения ЛКЛ.
Один аспект изобретения описывает способы лечения пациентов, включающие введение пациенту терапевтически эффективного количества композиции, включающий рекомбинантную ЛКЛ человека, как это описано в данной заявке. Пациент может страдать или иметь диагноз с любым количеством состояний, включая состояния, связанные с дефицитом ЛКЛ. В одном варианте воплощения изобретения терапевтически эффективное количество представлено количеством, которые повышает число красных кровяных клеток у пациента на необходимое количество. Предусмотрено, что ЛКЛ, полученная по изобретению, может использоваться для лечения хронической болезни почек, например, если ткани не производят лизосомальной кислой липазы.
Также предусмотрено, что ЛКЛ, полученная любым подходящим способом, может использоваться для лечения пациентов с болезнью Танжера и наследственной гипоальфалипопротеинемией. Болезнь Танжера/наследственная гипоальфалипопротеинемия связана с накоплением эфиров холестерина в макрофагах, что сопровождается гепатоспленомегалией и/или лимфаденопатией наряду с низкими уровнями липопротеинов высокой плотности (ЛВП), что может быть подвергнуто лечению путем введения ЛКЛ. Например, не желая ограничивать изобретение любой отдельной теорией или механизмом действия, считается, что нарушенная активность ЛКЛ снижает экспрессию ABCA1, а повышенная активность ЛКЛ, полученная путем введения ЛКЛ пациенту с болезнью Танжера/наследственной гипоальфалипопротеинемией, повысит экспрессию ABCA1 для преодоления эффектов гена ABCA1 с пониженной функциональной активностью как результат полиморфизма.
Для лечения состояния, как правило, вводимая доза может крайне варьировать в зависимости от известных факторов, таких как возраст, состояние здоровья и вес реципиента, тип конкурентного лечения, частота лечения и т.п. Обычно доза активного действующего вещества может составлять от примерно 0,0001 до примерно 10 мг на кг массы тела. Точная доза, частота введения и промежуток времени может быть определен специалистом в данной области для соответствующего терапевтического белка.
Кроме того, было установлено, что дозы 1 мг/кг и менее могут быть эффективными в лечении дефицита ЛКЛ. Данное изобретение описывает способы лечения состояний, включающие введение млекопитающему (например, пациенту, преимущественно, пациенту-человеку) терапевтически эффективной дозы лизосомальной кислой липазы от одного раза каждые 5 дней до одного раза каждые 25 дней, например, от одного раза каждые 7 дней до одного раза каждые 14 дней. В одном варианте воплощения изобретения доза лизосомальной кислой липазы вводится от примерно 0,1 мг до примерно 50 мг на кг массы тела, например, доза может составлять от примерно 1 мг до примерно 5 мг на кг.
В отдельном варианте воплощения изобретения описаны способы лечения состояния путем введения дозы лизосомальной кислой липазы от примерно 0,1 мг до 1,0 мг на кг массы тела в соответствии с любым режимом введения терапевтически эффективной дозы, таким, который описан в тексте данной заявки.
Изобретение описывает способы лечения любого осложнения дефицита ЛКЛ, которое может лечиться при введении терапевтически эффективной дозы ЛКЛ. В одном варианте воплощения изобретения малабсорция и нарушения роста могут быть подвергнуты лечению согласно описанных здесь способов. В другом варианте воплощения изобретения с использованием описанных здесь способов могут быть подвергнуты лечению осложнения, отмечаемые при дефиците ЛКЛ у пациентов, включая, но не ограничиваясь, гепатомегалию и дисфункцию печени.
Изобретение описывает лечение с использованием рекомбинантной ЛКЛ (например, рекомбинантной ЛКЛ человека), которая может быть получена с использованием любой подходящей системы экспрессии белка, трансгенных млекопитающих и птиц, как это принято в науке. Другие системы экспрессии белка могут включать, но не ограничиваться, культуру клеток, бактериальные и растительные системы.
Изобретение охватывает введение рекомбинантной ЛКЛ как часть фармацевтически приемлемой композиции любым путем, который позволит достичь необходимого терапевтического эффекта, как это должно быть определено специалистом в данной области. В одном варианте воплощения изобретения ЛКЛ может быть введена путем внутривенной инфузии в течение периода примерно пять часов. Например, инфузия может быть облегчена путем использованиям амбулаторной помпы для инфузий, присоединенной к сосудистому порту доступа (например, Port-a-Cath).
Изобретение также включает мониторинг клинических и патологических признаков состояний, например, болезни Вольмана и БНЭХ, у млекопитающих (например, пациента человека). В одном варианте воплощения изобретения оценка состоит из, но не ограничивается, следующего: анализ липидов, рентгенография грудной клетки, функциональные пробы печени, анализ стула, уровень мевалоновой кислоты в плазме, иммуногенность, уровень лизосомальной кислой липазы в плазме, уровень хитотриозидазы, PARC, портальная гипертензия, антропометрия, объем и характеристика печени, селезенки и желудочно-кишечного тракта с использованием, например, способа визуализации. Например, вышеуказанный способ визуализации может состоять из ультразвуковой, магнитно-резонансной визуализации, и ядерной магнитно-резонансной спектроскопии.
ПРИМЕРЫ
Данное изобретение дополнительно описано следующими примерами. Примеры представлены только в иллюстративных целях и не предназначены или не должны рассматриваться ограничивающими изобретение любым образом.
Пример 1
Построение вектора (pALVIN-OVRl-I-hLAL-dSA), несущего кодирующую последовательность рекомбинантной лизосомальной кислой липазы человека (rhLAL)
Нуклеотидная последовательность гена hLAL в векторе pALVIN-OVRl-I-hLAL-dSA кодирует белок, который идентичен аминокислотной последовательности белка, полученного с использованием гена лизосомальной кислой липазы человека (GenBank Accession, NP_000226) (ФИГ. 1). Транскрипция такой последовательности и последующая трансляция полученной мРНК приводит к образованию белка-предшественника из 399 аминокислот, который процессируется в зрелый белок из 378 аминокислот, идентичный ЛКЛ человека (GenBank Accession, NP_000226) (ФИГ. 1) с последовательностью SEQ ID NO:l. Экспрессия гена hLAL (см. ФИГ. 2, где указана последовательность кДНК) в данном Примере контролируется некодирующими элементами, полученными из гена яичного альбумина, включая энхансер, промотор, интрон и 5'- и 3'-нетранслируемые последовательности. Ген яичного альбумина продуцирует яичный альбумин, главный составляющий белок в яичном белке. Активность промотора яичного альбумина курицы крайне специфична в клетках яйцевода кур, вырабатывающих белок яйца; экспрессия в других тканях минимальна.
Для получения репликационно-дефективного ретровируса (RDR), стабильно интегрирующего трансген hLAL в геном основателя (XLL109), использовали плазмидный вектор pALVIN-OVRl-I-hLAL-dSA (ФИГ. 3A; нуклеотидная последовательность представлена на ФИГ. 4). Такой плазмидный вектор включает ретровирусные нуклеотидные последовательности, необходимые для упаковки РНК вируса, обратной транскрипции и интеграции, но не содержит интактные последовательности для генов gag, pol и env вируса. Способы для получения ретровирусного вектора и его применения в последующих трансгенных процедурах описаны в тексте данной заявки.
Ретровирусный участок pALVIN-OVRl-I-hLAL-dSA основан на векторе ALV pNLB. pNLB был модифицирован таким образом, что LTR являются самоинактивирующими (SIN) (ФИГ. 3B). Для достижения этого было удалено 273 bp из 3' LTR, которые включают энхансер и СААТ-бокс участка U3. Принимая во внимание, что инактивированный участок U3 на 3'-конце ретровирусной последовательности служит в качестве шаблона для нового участка U3, присутствующего на 5'-конце интегрированного провируса, также обычно инактивируют 5' LTR. Делеция последовательностей LTR в векторе SIN снижает интерференцию промотора относительно внутреннего промотора LTR и сводит к минимуму возможность рекомбинации последовательностей образовывать репликационно-компетентный ретровирус. Новый вектор называется pALVIN для вектора инактивации ALV.
Вниз от 5' LTR располагается часть кодирующих последовательностей gag и env, которые были принесены от вектора pNLB. В pALVIN-OVRl-I-hLAL-dSA остается небольшой участок (12%) последовательности белка-предшественника gag (55% последовательности зрелого пептида р19) и небольшой участок (1,7%) последовательности предшественника RAV2 (GenBank Accession, AF033808). Такие разветвленные участки gag и env неспособны вырабатывать функциональные белки, необходимые для создания репликационно-компетентного ретровируса (Cosset, 1991).
Контрольные элементы транскрипции и трансляции гена яичного альбумина курицы были вставлены в pALVIN для создания pALVIN-OV-l.l-I (последовательность представлена на ФИГ. 6; SEQ ID NO: 8). Первый участок pALVIN-OV-1.1-1 состоит из прилегающего участка гена яичного альбумина курицы, который включает 1.1 kb проксимальный участок промотора, первый экзон, первый интрон и часть 2го экзона. Следующий участок представлен спейсерным вставочным фрагментом, который занимает место кодирующих последовательностей белка яичного альбумина. После спейсера следует 3'-нетранслируемый участок (UTR) гена яичного альбумина курицы, который включает последовательности, облегчающие надлежащий процессинг мРНК, включая полиаденилирование. В целом, фрагмент спейсера замещается фрагментами ДНК, кодирующими требуемый белок в случае hLAL. Результат является вектором, обладающим биспецифическими элементами, способствующими регулируемой транскрипционной экспрессии и трансляции мРНК в яйцеводе трансгенных кур, что близко имитирует регулирование эндогенной мРНК яичного альбумина и обеспечивает высокую экспрессию интересующего белка в яичном белке.
Вектор pALVIN-OV-l.l-I включает первый интрон гена яичного альбумина. Принимая во внимание, что интрон подвержен сплайсингу во время выработки и упаковки генома ретровирусной РНК, мы вставили кассету экспрессии в противоположное место относительно LTR. В данном случае интрон не распознается ретровирусной РНК и упаковывается без сплайсинга. Для удобства все карты в данном документе представлены таким образом, чтобы LTR находился в противоположном положении, а кассета экспрессии - спереди или по часовой стрелке.
pALVIN-OV-l.l-I является вектором-основанием, в который была вставлена кодирующая последовательность (CDS) hLAL. В компании Integrated DNA Technologies, Coralville, Iowa, (см. ФИГ. 7 и 8; SEQ ID NO: 9 и 10) было синтезировано два фрагмента ДНК - адаптор hLAL и Syn hLAL - которые составляют hLAL CDS и последовательности, необходимые для совместимости с pALVIN-OV-l.l-I. Фрагмент 229 bp Hpal/BamHI адаптора hLAL и фрагмент 1113 bp BamHI/BstBI Syn hLAL были вставлены во фрагмент 7882 Hpal/BstBI pALVIN-OV-l.l-I, заместив тем самым спейсерный участок в hLAL CDS и создав pALVIN-OV-l.l-l-hLAL.
Было выявлено, что существует скрытый участок сплайсинга в антисмысловой цепи hLAL CDS, который предотвращает упаковку интактной ретровирусной РНК. Скрытый участок сплайсинга был удален путем изменения последовательности ДНК без изменения аминокислотной последовательности hLAL. Такое изменение было сделано с использованием амплификации полимеразной цепной реакцией участков от 232 до 534 pALVIN-OV-l.l-I-hLAL с праймером 5'-AGAAACTGAGAGTGTCTTAT-3' (SEQ ID NO: 12) и праймером 5'-TGACAGCTGTGGATCCAGAAACAAACATG-3' (SEQ ID NO: 13), создав ампликон 329 bp. Такой ампликон был расщеплен BamHI и SexAI и лигирован фрагментом 8940 bp BamHI/SexAI pALVIN-OV-l.l-I-hLAL для создания pALVIN-ОV-1.1 -I-hLAL-dSA.
Предполагаемый промотор/энхансер, который содержит сайт гиперчувствительности ДНКазы III (DHSIII) гена яичного альбумина курицы (от -3819 до -2169 относительно сайта старта промотора OV) (Kaye, Bellard et al. 1984) был вставлен в pALVIN-ОV-1.1-I-hLAL-dSA для создания pALVIN-OVRl-I-hLAL-dSA. Это было выполнено следующим образом: фрагмент ДНК, включающий энхансер DHSIII и проксимальный промотор 1.1 kb OV, названный промотором OVR1 (см. ФИГ. 9; и SEQ ID NO: 11) был выделен путем расщепления Xhol и BlpI. Для облегчения субклонирования, фрагмент адаптора PCR pSIN-OV-1.1-1 был получен путем ПЦР амплификации участка от 6752 до 7974 pALVIN-OV-l.l-I с праймерами 5'-GCCGCTCGAGCGAGGAATATAAAAAAATT-3' (SEQ ID NO: 14) и 5'-TCCGCGCACATTTCCCCGAA-3'(SEQ ID NO: 15) с последующим расщеплением NgoMI и Xhol. Фрагмент 2772 bp XhoI/BlpI промотора OVR1 и фрагмент 1067 bp NgoMI/XhoI PCR pSIN-OV-1.1-I были вставлены в фрагмент 7043 bp NgoMI/BlpI pALVIN-OV-l.l-I-hLAL-dSA, создав тем самым pALVIN-0VR1-I-hLAL-dSA (см. ФИГ. 10, где представлена схема получения pALVIN-0VRl-I-hLAL-dSA). Конструкция сегмента ретровирусного вектора, обозначенного как pALVIN (aka p AVIJCR-A395.22.3.1-KM или pALV-SIN) описана в заявке на патент США 2008/0064862.
Кроме того, также включено получение ЛКЛ в соответствии с изобретением и использование промотора и/или вектора, описанных в публикации патента США No. 2008/0064862 от 13 марта 2008 г., содержание которой включено сюда во всей своей полноте посредством ссылки.
Пример 2
Получение вирусной частицы
С использованием следующего способа ретровирусного трансгенеза был создан трансгенный самец-основатель линии G0 XLL109, несущий трансген hLAL в своем геноме. Репликационно-дефективные вирусные частицы, несущие вектор pALVIN-OVRl-I-hLAL-dSA, были получены путем временной трансфекции иммортализированной линии клеток фибробластов курицы. Такие фибробластные клетки курицы были одновременно трансфицированы тремя плазмидами pALVIN-OVRl-I-hLAL-dSA, pCMV-gag-pol и pCMV-VSV-G. pCMV-gag-pol, экспрессирующими гены gag и pol штамма RAVI вируса лейкоза птиц. pCMV-VSV-G экспрессирует белок оболочки вируса везикулярного стоматита. Спустя четыре часа после трансфекции, среда была заменена DMEM, дополненной 10% фетальной бычьей сывороткой, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина. Среда была собрана спустя 48 ч после трансфекции, профильтрована через фильтр 0,45 мкм (Millipore) и сконцентрирована путем ультрацентрифугирования. Концентрированный ретровирус, несущий трансген ALVIN-OVRl-I-hLAL-dSA, был собран и использовался в трансдукции эмбрионов на ранней стадии. Следует отметить, что, поскольку «р» обозначает форму плазмиды вектора, «р» отсутствует в обозначениях трансгена, как только трансген становится упакованным вектором или интегрированным трансгеном.
Пример 3
Трансгенез эмбриона
Интеграция кассеты экспрессии ALVIN-OVRl-I-hLAL-dSA в геном эмбриона была достигнута путем трансдукции эмбрионов на ранней стадии (Speksnijder and Ivarie, 2000). Свежеотложенные оплодотворенные яйца породы белый леггорн были получены от разводимой колонии птиц. В скорлупе было проделано отверстие для обеспечения доступа к эмбриону. В субгерминальную полость эмбриона было введено семь микролитров концентрированных репликационно-дефицитных частиц ретровируса, несущих описанную выше кассету экспрессии ALVIN-OVRl-I-hLAL-dSA. Яйца были заклеены горячим клеем и инкубированы с вылуплением при стандартных условиях. Прогения, полученная в результате таких инъекций, была помечена индивидуальными маркерами в помете для идентификации и возможности отслеживания. Образцы крови потомства были положительными на трансген при анализе ПЦР в режиме реального времени на предмет трансгена hLAL с использованием праймеров ПЦР, специфичных относительно кодирующей последовательности hLAL (как это описано ниже). Это позволило идентифицировать успешность процедуры трансгенеза. Анализ ПЦР в режиме реального времени на трансген hLAL использует химический набор Taqman® (Applied Biosystems). Прямые и обратные праймеры были представлены 5'-ACGACTGGCTTGCAGATGTCT-3' (SEQ ID NO: 16) и 5'-CCCCAAATGAAGTCAAGATGCT-3' (SEQ ID NO: 17), соответственно. Последовательность зонда Taqman® была представлена 5'-CCGGAATGCTCTCATGGAACACCAA- 3'(SEQ ID NO: 18) и была помечена FAM (в качестве излучателя) на 5'-конце и Iowa Black (в качестве гасителя) на 3'-конце. Праймеры, датчик и 1 мкл экстрагированной ДНК были добавлены к 30 мкл универсальной мастер-смеси Taqman® (Applied Biosystems). Контрольные реакции включали различные разведения плазмиды, несущей последовательность hLAL и ДНК куриц дикого типа (данные не указаны). Для системы ПЦР в режиме реального времени Applied Biosystems 7500 Fast использовали стандартные цикличные параметры.
Пример 4
Идентификация основателя G0
У половозрелых самцов была отобрана сперма, и ДНК была экстрагирована и проанализирована с использованием ПЦР в режиме реального времени на предмет hLAL. Число трансгенных копий в каждом образце было оценено с использованием известных стандартов (плазмиды, несущей ген hLAL), смешанных с отрицательной контрольной ДНК спермы. Содержание ДНК трансгенной кассеты у самца XLL109 было на уровне, который обеспечивает трансмиссию трансгена в данном потомстве, что было оценено путем ПЦР в режиме реального времени. Такой самец XLL109 был обозначен как трансгенный основатель G0 и был сведен с нетрансгенными курами для получения гемизиготных трансгенных цыплят G1.
Пример 5
Размножение и характеристика гемизиготных птиц G1
Потомство от трансгенного основателя XLL109 было протестировано на предмет присутствия трансгена в ДНК клеток крови с использованием анализа ПЦР в режиме реального времени на hLAL. Кровь была собрана от 1-2-недельного потомства, а ДНК была экстрагирована с использованием высокопроизводительного способа (Harvey et al., 2002). Для облегчения высокопроизводительного скрининга, ДНК не была подвергнута количественному анализу перед анализом Taqman. Как правило, 1 мкл ДНК содержит от 50 до 400 нг ДНК, что достаточно для получения положительного сигнала амплификации. В целом было протестировано 1322 цыплят, оплодотворенных XLL109, и у положительного потомства кровь была отобрана повторно и тестирована для подтверждения. Согласно результатам ПЦР, 22 потомка были положительными на трансген ALVIN-OVR1-I-hLAL-dSA. Пример результатов Taqman представлен на ФИГ. 11.
Пример 6
Идентификация и характеристика линии с высокой экспрессией
Одна из куриц G1 1LL7466 отложила яйца с существенно повышенными уровнями белка rhLAL в яичном белке в сравнении с другими курами G1. Для 1LL7466 был проведен Саузерн-блоттинг и оплодотворение самцами G1 для идентификации того, которые из самцов имеют такой же сайт интеграции, что и у кур с высокой экспрессией. Расщепление проводили с рекстриктазой, которая отщепляет только раз в трансгене (BlpI), а Саузерн-блоттинг был проведен с зондом, имеющим сегмент промотора яичного альбумина или кодирующей последовательности hLAL (Фиг. 12A-D). Положение 2-го сайта рестрикции, располагающегося во фланкирующем геномном участке, варьирует в зависимости от сайта интеграции. Таким образом, размер полосы BlpI, определенной зондом OV или зондом hLAL, является уникальным для каждой полученной линии.
Зонд OV выявил отдельную полосу 4.1 kb в ДНК, расщепленной Blpl и полученной у кур дикого типа, что соответствовало ожидаемому размеру сегмента BlpI в эндогенном гене яичного альбумина генома курицы (ФИГ. 12B и 12D). Вторая полоса 4.3 kb была определена у курицы 1LL7466, что соответствовало трансгенной полосе. У трех дополнительных сибсов-самок ILL 10409, 1LL10686 и 1LL12058 и трех дополнительных сибсов-самцов 1LL8922, 1LL9330 и ILL11217 имели полосу 4.3 kb, что указывало, что такие сибсы могут принадлежать к одной линии (ФИГ. 12B и 12D).
Как ожидалось, зонд hLAL не выявил полосы в ДНК у кур дикого типа, т.к. последовательность ДНК гена лизосомальной кислой липазы у кур и кодирующая последовательность рекомбинантной лизосомальной кислой липазы человека по существу дифференцированы, что не позволяет происходить гибридизации при условиях, используемых для данного Саузерн-блоттинга (ФИГ. 12С). Зонд hLAL выявил одиночную полосу ~10.6 kb в геномной ДНК, расщепленной Blpl и полученной у одних и тех же кур, которые были положительны на предмет полосы 4.3 kb, определенной зондом OV, что указывает на то, что такие 7 кур G1 имеют одинаковый сайт интеграции и, следовательно, принадлежат одной линии.
Каких-либо других полос не было определено, что указывает на то, что 1LL7466, ILL10409, 1LL10686, 1LL12058, 1LL8922, 1LL9330 и 1LL11217 имели одинаковый сайт интеграции.
Саузерн-блоттинг также показал, что трансген был интегрирован, т.к. полосы, определенные зондами OV и hLAL, имели разные размеры и их размер превышал размер, полученный только при наличии трансгена. На ФИГ. 12А отображена карта с прогнозируемой структурой интегрированного трансгена и положений сайтов BlpI во фланкируемых геномных участках.
Для подтверждения интактности трансгена, были проведены два этапа. Во-первых, кодирующая последовательность hLAL была выделена путем ПЦР из 1LL7466. Продукты ПЦР были секвенированы на обеих полосах от старт-кодона hLAL до стоп-кодона. Последовательность ДНК оказалась такой же, как и ожидалось, указывая на отсутствие изменений в последовательности ДНК кодирующих участков трансгена. Во-вторых, Саузерн-блоттинг был проведен с использованием рестриктазы ApaLI, расщепляющей интактный трансген на 2 сегмента, 3.6 и 3.8 kb (ФИГ. 13A). Полосы 3.6 и 3.8 kb были определены с использованием геномной ДНК, расщепленной ApaLI и полученной у Gl, что указывало на то, что трансген был интегрирован в полностью интактной форме (ФИГ. 13В).
Пример 7
Размножение и характеристика G2
На ФИГ. 14 отображена линия hLAL G2, полученных от одного основателя G0 XLL109. На стадии G1 трансген был охарактеризован относительно числа копий, целостности, последовательности hLAL и сайта интеграции, в результате чего было идентифицировано и охарактеризовано семь трансгенов G1 (четыре курицы и три петуха).
Размножение G2 сопровождалось искусственным оплодотворением нетрансгенных кур спермой, взятой у самцов G1 1LL8922, 1LL9330 и 1LL11217 (ФИГ. 14). Каждая оплодотворенная курица отложила яйца, и полученное потомство содержалось отдельно от другого потомства. Вылупленное потомство было тестировано на предмет присутствия трансгена hLAL с использованием ПЦР в режиме реального времени для hLAL. Принимая во внимание, что основатели G1 были гемизиготами относительно трансгена, ожидалось, что половина потомства будет трансгенным G2. Из 610 потомков G2, проанализированных на определенный момент времени, 330 или 54% были трансгенными.
Пример 8
Генетический анализ hLAL птиц
После идентификации каждой курицы G2 с использованием ПЦР hLAL в режиме реального времени и анализа ДНК крови, линия воспроизводителей была подвергнута следующим генетическим анализам: ген hLAL был подвергнут ПЦР амплификации с использованием ДНК крови и секвенирован для подтверждения 100% гомологичности с последовательностью человека; сайт интеграции трансгена был подтвержден путем интеграции сайта ПЦР, как это описано выше. Секвенироваие ПЦР и анализ сайта интеграции проводили на каждой курице в линии воспроизводителей <10; 10% цыплят (минимум 10) для линии воспроизводителей 11-100 кур; 5% цыплят (минимум 10) для линии воспроизводителей 101-1000 кур; 1% цыплят (минимум 50) для линии воспроизводителей 1001-10000 кур; 0,1% цыплят (минимум 100) для линии воспроизводителей >10001 кур. Подробные записи проводились на каждом этапе фазы роста и воспроизводства.
Пример 9
Очистка hLAL от яичного белка
Яичный белок (ЯБ), содержащий ЛКЛ, был солюбилизирован при рН 6 в течение ночи и очищен посредством центрифугирования (или глубокой фильтрации) с фильтром 0,2 мкм. ЯБ был скорректирован буфером 1 M NaOAc (pH 4) до pH 6.
Очищенный ЯБ был загружен в колонку Phenyl-HIC (ЯБ: размер колонки=2:1), в которой равновесие было установлено буфером 20 мМ фосфата/137 мМ NaCl (pH 6). После завершения загрузки, колонка была промыта буфером для установления равновесия и фосфатным буфером 5 мМ (рН 6). ЛКЛ была элюирована 30% пропиленгликолем с 5 мМ Трис буфером (рН 7,2).
Элюированная фракция ЛКЛ была приведена до рН 5 с использованием 1 М кислоты, а затем загружена в колонку GigaCap S (ЯБ:размер колонки=10:l). Равновесие в колонке было установлено с использованием буфера 50 мМ NaOAc (pH 5). После завершения загрузки, колонка была промыта буфером для установления равновесия. ЛКЛ была элюирована с использованием 50 мМ NaOAc/60 мМ NaCl (pH 5).
Фракция ЛКЛ из колонки GigaCap S была приведена до рН 6 с использованием буфера 1 М Трис и затем загружена в колонку Butyl-HIC (ЯБ:размер колонки=10:1). В колонке было установлено равновесие с использованием буфера 20 мМ фосфат/137 мМ NaCl (pH 6). После завершения загрузки, колонка была промыта буфером для установления равновесия и фосфатным буфером 5 мМ (рН 6). Чистая ЛКЛ была элюирована 50% пропиленгликолем с 5 мМ Трис буфером (рН 7,2). ФИГ. 15 отображает этапы очистки hLAL от яичного белка.
Пример 10
Углеводный анализ hLAL, полученной у трансгенных птиц
Олигосахаридные структуры были определены в ЛКЛ человека, полученной у птиц, путем использования следующего способа анализа, который должен быть хорошо известен специалистам в данной области.
200 мг было расщеплено трипсином и хемотрипсином в течение 18 ч при 37°C в 0,1 M Трис-HCl, pH 8,2, содержащем 1 мМ CaCl2. Продукты расщепления были обогащены и освобождены от загрязнения с использованием колонки с картриджем Sep-Pak C18. После обогащения, гликопептиды были расщеплены 2 мкл ПНГазы F (7,5 ед/мл) в 50 мкл буфера 20 мМ натрия фосфата, pH 7,5, в течение 18 ч при 37°C. Освобожденные олигосахариды были сепарированы от пептида и фермента путем пропускания их через колонку с картриджем Sep-Pak C18.
Фракция гликанов была растворена в диметилсульфоксиде и затем подвергнута перметилированию на основе способа Анумула и Тейлора (Anumula and Taylor, 1992). Реакция была потушена путем добавления воды, и пер-О-метилированные углеводы были экстрагированы дихлорметаном. Пер-О-метилированные гликаны были высушены в потоке азота.
Анализ MALDI/TOF-MS (времяпролетная масс-спектрометрия с лазерной ионизацией и десорбцией из жидкой матрицы) был проведен в рефлектор-положительном режиме ионизации с использованием альфа-дигидроксибензойной кислоты (DHBA, 20 мг/мл раствор в 50% метанол:вода) в качестве матрицы. Все спектры были получены с использованием Microflex LRF (Bruker).
Анализы MALDI-TOF-MS и ESI MS/MS (тандемная масс-спектрометрия с ионизацией электрораспылением) были проведены на олигосахаридах после высвобождения из пептидного остова и очистки, как это описано в науке. Образцы отдельных видов олигосахаридов также были расщеплены определенными ферментами, и продукты расщепления были проанализированы способом ВЭЖХ, как это описано в науке.
Считается, что существует примерно шесть N-присоединенных сайтов гликозилирования в ЛКЛ человека. См. Zschenker, et al (2005) J. Biochem., Vol 137, p 387-394, содержание чего включено сюда во всей своей полноте посредством ссылки. Данная ссылка также указывает, что в ЛКЛ человека может существовать О-присоединенный сайт гликозилирования. Идентифицированные N-присоединенные олигосахаридные структуры представлены на ФИГ. 16.
Данные показали, что большая часть или все такие структуры были выявлены в качестве N-присоединенной гликозилированной структуры в ЛКЛ, полученной согласно изобретению (ФИГ. 16). Например, как оказалось, A-n присоединен к ЛКЛ, полученной согласно изобретения. Например, О-n присоединен к ЛКЛ, полученной согласно изобретения. Например, по меньшей мере, один B-n, C-n и D-n присоединены к ЛКЛ, полученной согласно изобретения. Например, по меньшей мере, один E-n и F-n присоединены к ЛКЛ, полученной согласно изобретения. Например, по меньшей мере, один I-n и J-n присоединены к ЛКЛ, полученной согласно изобретения. Например, по меньшей мере, один K-n и L-n присоединены к ЛКЛ, полученной согласно изобретения. Например, по меньшей мере, один M-n и N-n присоединены к ЛКЛ, полученной согласно изобретения. Например, как оказалось, G-n присоединен к ЛКЛ, полученной согласно изобретения. Например, как оказалось, H-n присоединен к ЛКЛ, полученной согласно изобретения.
Пример 11
N-гликановые виды ЛКЛ, полученные у трансгенных птиц
Очищенные образцы ЛКЛ, полученные у трансгенных птиц (600 мкг/образец) были подвергнуты диализу с использованием диализатора Tube-O-Dialyzer (мембрана отсечения 4.0 кДа; G Biosciences) относительно наночистой воды при 4°C в течение 24 часов для удаления солей и других примесей. Наночистая вода была заменена четыре раза во время всего периода диализа.
После диализа каждый образец был поделен на три аликвоты: ~1/4 от веса образца для анализа на нейтральные и аминосахара, ~1/4 от веса образца для анализа на маннозо-6-фосфат, и ~ 1/2 от веса образца для анализа на профиль олигосахаридов. Аликвота, предназначенная для анализа на нейтральные и аминосахара, была гидролизирована 2 N трифторуксусной кислотой (ТФК) при 100°C в течение 4 часов, а аликвота для анализа на маннозо-6-фосфат была гидролизирована 6.75 N ТФК при 100°C в течение 1,5 ч. Затем гидролизаты были высушены благодаря N2, повторно растворены в 50 мкл H2О, подвергнуты воздействию ультразвуком в течение 7 минут на льду и перенесены в ампулу для инъекций. Образцы с нейтральными и аминосахарами были разбавлены 2 раза, поскольку пики, получаемые от исходно разбавленных гидролизатов, были слишком большими.
Смесь стандартов для нейтральных и аминосахаров, а также маннозо-6-фосфата с известным числом молей, была гидролизирована таким же самым образом в течение такого же самого времени, что и образцы. Для установления равновесия при калибровке было приготовлено четыре концентрации стандартной смеси нейтральных и аминосахаров (Fuc и GalNAc, 0,2, 0,4, 0,8 и 1,6 нмоль на 10 мкл; GlcNAc, 0,5, 1,0, 2,0 и 4,0 нмоль на 10 пл; Gal и Man, 0,3, 0,6, 1,2 и 2,4 нмоль на 10 пл; и Glc, 0,1, 0,2, 0,4 и 0,8 нмоль на 10 пл) и маннозо-6-фосфата (640, 1280, 2560, 5120 пикомоль на 10 пл). Число молей каждого сахара в образце было определено количественно путем линейной интерполяции из уравнения калибровки.
Нейтральные и аминосахара, а также маннозо-6-фосфат были проанализированы путем ВЭАОХ с использованием системы Dionex ICS3000, оснащенной градиентной помпой, электрохимическим детектором и автоматическим пробоотборником. Отдельные нейтральные и аминосахара, а также маннозо-6-фосфат был сепарированы аналитической колонкой Dionex CarboPac PA20 (3×150 мм) с аминоловушкой. Градиентные программы использовали растворители A, дегассированную наночистую воду и В, 200 мМ NaOH для нейтральных и аминосахаров, и С, 100 мМ NaOH и D, 1 M натрия ацетат в 100 мМ NaOH для маннозо-6-фосфата. Введение (10 мкл/впрыск) проводили каждые 40 минут для определения нейтрального и аминосахара, и каждые 35 минут для определения маннозо-6-фосфата. Все способы основывались на протоколах, описанных Hardy and Townsend (Hardy, M. R., and Townsend, R. R., "High-pH anion-exchange chromatography of glycoprotein-derived carbohydrates", 1994, Methods Enzymol. 230: 208-225). Контроль приборов и получение данных сопровождалось с использованием программного обеспечения Dionex chromeleon. Результаты приводятся в Таблице 1 ниже. Контрольный образец представлен овомукоидом, очищенным от ЯБ.

Структурные особенности ЛКЛ
ЛКЛ имеет 6 потенциальных сайтов в своей аминокислотной последовательности для N-присоединенного гликозилирования, а именно Asn36, Asn72, Asn101 Asn161, Asn273и Asn321. Пять из них Asn36, Asn101, Asn161, Asn273 и Asn321 были гликозилированы, в то время как Asn72 оставался агликозилированным или по существу агликозилированным (по существу агликозилированный обозначает смесь молекул ЛКЛ, в которой несколько Asn72 гликозилированы в сравнении с Asn36, Asn101, Asn161, Asn273 и Asn321). В соответствии с этим один аспект изобретения представлен ЛКЛ (например, ЛКЛ человека), которая агликозилирована и/или по существу агликозилирована в Asn72, а также получением и использованием такой ЛКЛ. Однако ЛКЛ с гликозилированным Asn72 также включена в объем данного изобретения. N-гликозилированные структуры преимущественно состоят из смеси би-, три- и тетраантеннарных структур с N-ацетилглюкозамином, маннозой и маннозо-6-фосфатом (М6Р) в качестве основных сахаров. Как оказалось, каждый сайт имеет характерный набор структур (Таблица 2 и ФИГ. 17), что составляет один аспект изобретения. Например, модифицированные М6Р N-гликаны расположены, по меньшей мере, в Asn101, Asn161 и Asn273. Нефосфорилированные структуры представлены типичными N-гликанами, расположенными на эндогенных белках яичного белка. Как это было определено по дефициту N-ацетилгалактозамина (GalNac), О-присоединенных гликанов не было выявлено. Сиалиновой кислоты также не было выявлено, что соответствует ранее определенным N-гликановым структурам других эндогенных и экзогенных белков, полученных в соответствии с изобретением. Изобретение включает ЛКЛ, гликозилированные одной или более описанными здесь структурами олигосахаридов.

Способы
Композиция моносахаридов, включая нейтральные, амино и М6Р сахара, была определена количественно и качественно путем амперометрии с использованием анионобменной хроматографии при высоком значении рН (HPAEC-PAD).
Структуры предоминирующих гликанов были определены с использованием данных, полученных от разных способов масс-спектрометрии (MALDI-TOF, NSI-MS/MS и LC-MS гликопептидов).
MALDI-TOF использовали для определения нейтральных N-гликанов, и такой способ был способен определить фосфорилированные N-гликаны (ФИГ. 18). Способ NSI-MS/MS использовали для определения природы меньших пиков спектра MALDI-TOF, некоторые из которых были свойственны фосфорилированным N-гликанам (ФИГ. 19). Попытки улучшения способности MALDI-TOF определить фосфорилированные N-гликаны были безуспешными.
LC/MS гликопептидов был способен определить нейтральные и фосфорилированные структуры, а также положение специфических структур в аминокислотной последовательности ЛКЛ (данные обобщены на ФИГ. 17 и в Таблице 2).
Для определения, какие пики на хроматограмме HPAEC-PAD вызваны фосфорилированными N-гликанами, ЛКЛ была обработана фосфатазой и проанализирована (Фигура 3). Пики в группах C и D снижали площадь под кривой (ППК), в то время как пик из группы А был более выступающий. Пики из группы В не изменяли пропорцию относительно других пиков. Основываясь на знании того, что время удерживания пропорционально степени заряда (благодаря фосфорилированию или сиалированию), было выявлено, что группа С состоит из N-гликанов с одним фосфатом (моно М6Р) и группа D состоит из N-гликанов с двумя фосфатами (бис-М6Р).
Время удерживания также было подвергнуто влиянию со стороны композиции и относительного структурного положения нейтральных и аминосахаридов. Такие примеры включают присутствие галактозы, присутствие делящего пополам GlcNac и степень замещения GlcNac. Такие факторы способствуют образованию множества пиков на хроматограмме HPAEC-PAD.
Пример 12
Анализ активности фермента in vitro, полученного в виде чЛАЛ у трансгенных птиц в составе яичного белка
Активность лизосомальной кислой липазы в яичном белке была определена с использованием анализа фторогенного субстрата 4-метилумбеллиферрил-олеата, как это по существу описано в Yan et al. (2006), American Journal of Pathology, Vol. 169, No. 3, p 916-926, содержание чего включено сюда во всей своей полноте посредством ссылки.
Был приготовлен маточный раствор 4-метилумбеллиферрил-олеата (4-MUO), состоящий из 2,5 мМ 4-MUO в 4% Тритон Х-100. Анализ был проведен тщательным образом в планшете для микротитрации, в каждую лунку которого было внесено 62,5 мкл 0,2 М натрия цитрата (рН 5,5) в 0,01% Твина 80, 12,5 кл образца яичного белка и 25 мкл 2,5 мМ 4-MUO. Изменения в флуоресценции отслеживалось в течение 30 минут при 37°C с использованием флуометрического планшет-ридера Bio-Tek Synergy HT (возбуждение при 360 нм и эмиссия при 460 нм). Перед анализом яичный белок, содержащий чЛКЛ, был разведен до концентрации фермента, что привело к линейной реакции, продолжающейся, по меньшей мере, в течение 30 минут. Реакция была остановлена 50 мкл 0,75 M Tris-HCl, pH 8,0, и с использованием указанного выше планшет-ридера (возбуждение при 360 нм и эмиссия при 460 нм) был измерен сигнал флуоресценции с конечной точкой.
Единицы активности были определены с использованием 4-метилумбеллиферрил в качестве стандарта. Одна единица (Ед) определяется как количество фермента, которое приводит к образованию 1 мкмоля 4-умбеллиферрила/мин в описанных выше условиях анализа. В качестве отрицательного контроля использовали яичный белок, не содержащий чЛКЛ.
Образцы яичного белка, которые были положительные на чЛКЛ, содержали от 1 Ед до 100 Ед активности на мл яичного белка. Был проанализирован яичный белок от 21 курицы G1. Яичный белок от 10 исследованных куриц имел положительную активность чЛКЛ.
Пример 13
Анализ in vitro ЛКЛ, полученной у трансгенных птиц
Способность ЛКЛ, выработанной в клетках яйцевода трансгенных птиц (указана как «SBC-102», «полученная у птиц ЛКЛ», «ЛКЛ» или «чЛКЛ»), связываться с клетками и подвергаться интернализации в лизосомальном компартменте была исследована in vitro с использованием макрофагов и фибробластов. При инкубации в клетках макрофагов была выявлена локализация SBC-102 с флуоресцирующей меткой в лизосомах. Такой эффект мог быть достигнут с использованием конкурента полисахарида маннозы, вовлекающего рецептор N-ацетилглюкозамина/маннозы (GlcNAc/mannose) в качестве механизма распознавания и захвата такими клетками. SBC-102 повышало связанную с клетками активность ЛКЛ в фибробластах человека с дефицитом ЛКЛ и нормальных фибробластах мыши после инкубации in vitro, что указывало на то, что воздействие SBC-102 может привести к значительной замене недостающей ферментативной активности.
Маннозо-6-фосфат (М6Р) присутствует в олигосахаридных структурах SBC-102, которые, как это было показано, участвуют в поставке лизосомальных ферментов в целый ряд клеточных типов посредством повсеместного рецептора М6Р.
ЛКЛ была очищена от яичного белка трансгенных кур. Oregon Green NHS был получен у Invitrogen™ (№0-10241). Из ATCC была получена линия макрофагов альвеол крыс NR8383 и линия фибробластов мыши NIH-3T3. Фибробласты с дефицитом ЛКЛ и наличием болезни Вольмана были получены у Coriell Institute для Medical Research, а LysoTracker® Red были представлены Invitrogen™.
Мечение фермента: 4 мг ЛКЛ, полученной у трансгенных птиц, в ФСБ было помечено Oregon Green согласно рекомендациям производителя, и реакция впоследствии была диализирована относительно ФСБ с последующей концентрацией.
Захват макрофагов: ЛКЛ с флуоресцентной меткой, полученная у трансгенных птиц (5 мкг/мл), и LysoTracker® Red были инкубированы с клетками NR8383 в течение 2 часов. Клетки были исследованы ко-фокальной флуоресцирующей микроскопией с использованием секвенциального режима сканирования при 488 нм, а затем при 514 нм.
Конкурентное ингибирование с маннаном: SBC-102 с флуоресцентной меткой (5 мкг/мл) и маннан были инкубированы с клетками NR8383 в течение 2 часов. Клетки были трипсинизированы, и захват ЛКЛ был измерен путем активированной флуоресценцирующей сортировкой клеток с использованием медианы интенсивности флуоресценции в качестве конечной точки.
Способность ЛКЛ, полученной у трансгенной птицы, быть захваченной и впоследствии быть включенной в лизосомы клеток-мишеней, была исследована с помощью линии клеток макрофагов NR8383. ЛКЛ с флуоресцентной меткой, полученная у трансгенных птиц, и лизосомальный маркер «LysoTracker® Red» (Invitrogen™) были инкубированы с клетками в течение 2 часов. Впоследствии была исследована со-локализация ЛКЛ, полученной у трансгенных птиц, и лизосомального маркера в лизосомах путем конфокальной флуоресцирующей микроскопии и режима секвенциального сканирования (ФИГ. 20). ЛКЛ была локализирована в лизосомах, что соответствуют подобным in vitro исследованиям с использованием рчЛКЛ из различных источников.
Специфичность связывания ЛКЛ, полученной у трансгенных птиц, с рецептором GlcNAc/манноза была оценена путем анализов конкурентного связывания с использованием клеточной линии макрофагов NR8383 (ФИГ. 21). ЛКЛ, полученная у трансгенных птиц, с флуоресцентной меткой (Oregon Green) в количестве 5 мкг/мл и различные концентрации содержащего маннозу олигосахарида, маннана, были совместно инкубированы с клетками в течение 2 часов. Относительное ингибирование захвата ЛКЛ, полученной у трансгенных птиц, маннаном, в сравнении с контролем без маннана, было количественно определено путем анализа сортировки активированных флуоресценцией клеток с использованием медианы интенсивности флуоресценции в качестве конечной точки. Отмечалось зависимое от дозы маннозы ингибирование связывания/захвата ЛКЛ, полученной у трансгенных птиц, что соответствовало взаимодействию ЛКЛ, полученной у трансгенных птиц:GlcNAcR.
Кроме того, опосредованный маннозо-6-фосфатом захват в клетках фибробластов был доказан путем экспериментов конкурентного связывания с маннозо-6-фосфатом (данные не указаны).
Способность ЛКЛ, полученной у трансгенных птиц, повышать активность ЛКЛ в клетках была исследована с использованием клеток с нормальным содержанием и дефицитом ЛКЛ in vitro. Фибробласты, выделенные у пациента с болезнью Вольмана, и нормальные фибробласты мыши (NIH-3T3) были инкубированы в присутствии ЛКЛ, полученной у трансгенных птиц, в концентрациях 0, 0,16 или 0,5 мкг/мл в течение 5 часов. Затем клетки были промыты для удаления неспецифического сигнала, и клеточные лизаты были проанализированы на предмет активности ЛКЛ с использованием субстрата 4-MUO. Эндогенная клеточно-ассоциированная активность была ниже в фибробластах Вольмана в сравнении с NIH-3T3, и в клетках обоих типов после инкубации с ЛКЛ, полученной у трансгенных птиц, отмечалось дозозависимое повышение активности (ФИГ. 22).
Пример 14
Анализ in vivo ЛКЛ, полученной у трансгенных птиц
Крысы линии Yoshida с дефицитом ЛКЛ (т.е. гомозиготные) (см. Kuriyama et al. (1990), Journal of Lipid Research, vol. 31, p 1605-1611; Nakagawa et al., (1995) Journal of Lipid Research, vol. 36, p 2212-2218; и Yoshida and Kuriyama (1990) Laboratory Animal Science, vol. 40, p 486-489) были подвергнуты воздействию SBC-102 (5 мг/кг, в/в) или плацебо один раз в неделю в течение 4 недель, начиная в возрасте 4 недель. Для каждого введения SBC-102 вводили в хвостовую вену крысы в двух равных дозах (2,5 мг/кг) с перерывом в 30 минут. Крысы и соответствующий по возрасту контроль дикого типа исследовали спустя одну неделю после конечной дозы. Анализы были проведены в трех повторностях.
Обширное патологоанатомическое обследование животных, подвергнутых лечению SBC-102, выявило нормализацию цвета печени, кроме снижения размера органа. Крысы, подвергнутые лечению SBC-102, имели нормальные гистологические показатели печени при разительном контрасте с существенным накоплением пенистых макрофагов у животных, которым вводили носитель (данные не указаны). Уровни аланина и аспартатаминотрансферазы в сыворотке, повышенные у крыс с ЛКЛ-/-, также были понижены у крыс, которым вводили SBC-102 (данные не указаны).
Масса внутренних органов и тканей была определена для каждой крысы, и данные представлены на ФИГ. 23. Размер органов представлен в виде процента от массы тела, определенной в возрасте 8 недель у крыс ЛКЛ-/- и ЛКЛ+/+ после еженедельного введения носителя или SBC-102 в дозе 5 мг/кг в течение 4 недель.
Масса тела крыс Yoshida, подвергнутых лечению SBC-102 или носителем, была сопоставлена с массой крыс дикого типа, как это указано на ФИГ. 24. SBC-102 (5 мг/кг) или носитель вводили путем в/в инъекции в виде однократной дозы или парных доз (вводимых в течение периода 4 часа) крысам ЛКЛ-/-. Крысы ЛКЛ+/+ служили в качестве однопометного контроля соответствующего возраста.
Пример 15
Анализ триглицеридов
Анализ триглицеридов проводили на ткани печени и селезенки, взятых у животных дикого типа, гомозиготным с введением плацебо и гомозиготным с введением SBC-102. Анализы уровня триглицеридов проводили с использованием стандартных способов (т.е. MBL International's Triglyceride Quantification Kit Catalog # JM-K622-100), и были проведены в трех повторностях.

Уровни субстрата в печени
ФИГ. 25 отображает уровни холестерина в печени, эфиров холестерина и триглицеридов в возрасте 8 недель у крыс WT и крыс с дефицитом ЛКЛ после еженедельного введения носителя или SBC-102 в дозе 5 мг/кг-1 в течение 4 недель.
Пример 16
Исследование реакции на дозу
Основываясь на представленных выше исследованиях, у крыс ЛКЛ-/- были изучены фармакодинамические (ФД) эффекты целого ряда доз и график введения доз (1 раз в неделю и 1 раз в две недели) ЛКЛ («SBC-102»). В ходе таких исследований SBC-102 вводили путем в/в инъекций в дозах 0,2, 1, 3 и 5 мг/кг 1 раз в 2 недели или 0,35, 1 и 5 мг/кг 1 раз в неделю в течение 1 месяца, начиная с возраста 4 недели. Результаты показали улучшение набора массы тела (BW) (ФИГ. 26), органомегалию (ФИГ. 27) и уровней субстрата в тканях (ФИГ. 28). С повышением дозы SBC-102 также были снижены уровни трансаминаз в сыворотке, при этом уровни достигали по существу уровней у дикого типа при использовании максимальных доз.
Пример 17
Введение рекомбинантной ЛКЛ на крысиной модели
Влияние повторной дозы рекомбинантной лизосомальной кислой липазы человека (ЛКЛ) на вес тела, уровни триглицеридов в тканях и холестерина, гепатомегалию, спленомегалию, лимфаденопатию, вес кишечника и другие параметры было оценено для крыс линии Donryu с дефицитом ЛКЛ, описанных Yoshida and Kuriyama (1990) Laboratory Animal Science, vol. 40, p 486-489 (see also Kuriyama et al. (1990) Journal of Lipid Research, vol. 31, p 1605-1611; Nakagawa et al., (1995) Journal of Lipid Research, vol. 36, p 2212-2218), содержание включено сюда во всей своей полноте посредством ссылки.
В возрасте 4 недель крысы линии Donryu, гомозиготные на предмет отсутствия ЛКЛ (ЛКЛ-/-), были распределены на группы с введением доз рекомбинантной ЛКЛ человека, полученной у трансгенных кур посредством системы яйцевода, или плацебо. Однопометные крысы дикого типа соответствующего возраста использовали в качестве контроля. Крысам ЛКЛ-/- введение доз проводили один раз в неделю в течение четырех недель (в целом 4 дозы) или один раз каждые две недели в течение четырех недель (в целом 2 дозы) путем введения в хвостовую вену в виде однократной дозы или двух равных доз с перерывом в 30 минут. Дозы ЛКЛ составили 1 мг/кг или 5 мг/кг. График введения доз представлен в Таблице 4. Крысам предварительно вводили дифенгидрамин (5 мг/кг) для противодействия потенциальной анафилактической реакции, и такая процедура основана на проводимых ранее экспериментах в моделях животных в ходе фермент-заместительной терапии для лечения болезни лизосомального накопления (Shull et al. (1994) Proceedings of the National Academy of Science,vol. 91, p.12937; Bielicki et al. (1999) The Journal of Biological Chemistry, 274, p.36335; Vogler et al. (1999) Pediatric Research, 45, p.838), содержание включено сюда во всей своей полноте посредством ссылки.
Фиг. 29 отображает ежедневный прогресс в наборе массы тела у крыс, которым было введено 1 мг/кг ЛКЛ в неделю или 5 мг/кг ЛКЛ в неделю или 5 мг/кг ЛКЛ один раз в две недели. На фигуре видно, что существует незначительное или вообще отсутствующее различие в терапевтическом эффекте между двумя разными дозами и частотой введения доз.

Анатомопатологическое исследование крыс ЛКЛ-/-, которым вводили рекомбинантную ЛКЛ
По завершении исследования, описанного в Примере 1, животные, участвующие в исследовании, были гуманным образом подвергнуты эвтаназии для проведения обширного анатомопатологического анализа, гистопатологии и клинической химии. Обширное вскрытие включало исследование внутренней поверхности тела, всех отверстий, а также черепной, грудной абдоминальной полости и их содержимого. Масса внутренних органов была определена для крыс, и органы и ткани были собраны и фиксированы в 10% нейтральном забуференном формалине. После фиксации ткани были обработаны, и были приготовлены и изучены гистологические слайды с окрашиванием гематоксилином и эозином.
Обширное анатомопатологическое исследование подвергнутых лечению животных выявило по существу нормализацию размера и цвета печени, как это указано на ФИГ. 30. Были определены соотношения между органами и массой тела, и было показано снижение относительного размера органа для печени, селезенки, ткани брыжейки, двенадцатиперстной кишки, тонкой кишки и подвздошной кишки у успешно пролеченных животных, которые были рассечены, в сравнении с крысами, подвергнутыми лечению плацебо (ФИГ. 23). Гистопатологический анализ ткани печени у крыс, подвергнутых лечению ЛКЛ, показал по существу нормальные гистологические показатели в разительном контрасте с существенным накоплением пенистых макрофагов у животных, подвергнутых лечению плацебо (ФИГ. 30).
Пример 18
Лечение болезни Вольмана (БВ) путем введения рекомбинантной ЛКЛ
В возрасте 7 недель пациент-женщина поступила в больницу по причине затруднения увеличения массы тела и плохого прогресса с момента рождения. На первичном физическом осмотре пациент весил 3,6 кг (вес при рождении 3,7 кг) и был худой со значительными кожными складками. Живот был вздут, отмечалась плотная гепатомегалия 6 см и плотная спленомегалия примерно 4 см. В паховой области были отмечены увеличенные лимфатические узлы, а мышечная активность была слабой.
Начальный уровень гемоглобина составил 9,2 гм, тромбоцитов 506000, и лейкоцитов 11550. Анализ мочи был нормальный, и пункции костного мозга выявили вакуолированные лимфоциты и многочисленные пенные клетки. Химический анализ сыворотки: общий уровень липидов 834 мг/100 мл, фосфолипиды 176 мг/100 мл, триглицериды 141 мг/100 мл, холестерин 129 мг/100 мл, билирубин 0,3 мг/100 мл, щелочная фосфатаза 9,0 Ед %, СГОТ 90 единиц, СГПТ 50 единиц, холинэстераза 20 единиц, азот мочевины 8,3 мг, сахар натощак 45 мг/100 мл. КТ сканирование живота показало гепатоспленомегалию или билатерально симметрично увеличенные надпочечники с кальцификацией.
Пациенту был хирургически имплантирован венозный порт доступа для введения доз. После присоединения порта к амбулаторному аппарату для инфузий, пациенту предварительно введено 1 мг/кг дифенгидрамина за 20 минут до инфузии ЛКЛ для противодействия потенциальным реакциям анафилаксии, вызванным инфузией. Затем пациенту вводили ЛКЛ в дозе 1 мг/кг в течение 5 часов путем внутривенной инфузии. Терапия была повторена один раз каждые 7 дней в течение неопределенного периода времени.
После двух недель введения первой дозы ЛКЛ, у пациента отмечалось значительное улучшение набора веса и нормализации размера основных органов брюшной полости, как это было определено ультразвуком. Лабораторные результаты показывают, что инфузия ЛКЛ восстанавливает активность лизосомальной кислой липазы у пациента и приводит к исправлению связанных аномалий.
Пример 19
Лечение болезни накопления эфиров холестерина (БНЭХ) путем введения рекомбинантной ЛКЛ
Мальчик в возрасте 3 лет с зудящей сыпью живота был обследован его педиатром. После обследования живота, была отмечена гепатомегалия, что было подтверждено ультразвуком. На данном этапе диагноз не был поставлен, и пациент подвергался периодическому мониторингу.
В возрасте 8 лет он поступил в больницу с гастроэнтеритом. Световая микроскопия биопсии печени показала повышенные уровни гликогена в цитоплазме и небольшие липидные капли в гепатоцитах. Электронная микроскопия выявила связанные с мембраной липидные капли с небольшими электронноплотными гранулами. Был поставлен рабочий диагноз болезни накопления гликогена III типа (гликогеноз), однако активность кожных фибробластов была нормальная.
В возрасте 10 лет гепатомегалия сохранялась, и была взята вторая биопсия печени. Световая микроскопия выявила измененную лобулярную структуру паренхимы печени с растянутыми гепатоцитами, содержащими цитоплазматические гранулы и вакуоли с небольшим перипортальным фиброзом. Активность фибробластной кислой липазы оказалась 7% от нормы, что подтверждает диагноз БНЭХ. Концентрации общего холестерина (ОХ) в плазме, триглицеридов (ТГ), липопротеина низкой плотности холестерина (ЛНП-Х) превышают 95% для данного возраста и пола и составляют 7,51, 3,24 и 5,58 ммоль/л, соответственно, в то время как уровень липопротеина высокой плотности холестерина в плазме (ЛВП-Х) ниже 5% при уровне 0,47 ммоль/л; у пациента была выявлена комбинированная гиперлипидемия (гиперхолестеринемия, гипертриглицеридемия, гипоальфалипопротеинемия и гипербеталипопротеинемия).
Пациенту был хирургически имплантирован венозный порт доступа для введения доз. После присоединения порта к амбулаторному аппарату для инфузий, пациенту предварительно введено 5 мг/кг дифенгидрамина за 20 минут до инфузии ЛКЛ для противодействия потенциальным реакциям анафилаксии, вызванным инфузией. Затем пациенту вводили ЛКЛ в дозе 5 мг/кг в течение 5 часов путем внутривенной инфузии. Терапия была повторена один раз каждые 14 дней в течение неопределенного периода времени.
После двух недель введения первой дозы ЛКЛ, у пациента отмечалось значительное улучшение набора веса и нормализации размера основных органов, как это было определено ультразвуком. Лабораторные результаты показывают, что инфузия ЛКЛ восстанавливает активность лизосомальной кислой липазы у пациента и приводит к исправлению связанных аномалий.
Пример 20
Описание и композиция лекарственного средства
Описанное здесь лекарственное вещество ЛКЛ («SBC-102») представлено рекомбинантной лизосомальной кислой липазой человека (рчЛКЛ), очищенной от яичного белка и полученной у трансгенных птиц Gallus. Вспомогательные вещества для SBC-102 подобны таковым, используемым для других продуктов для лечения нарушений лизосомального накопления (НЛН), представленных в настоящее время на рынке, и были выбраны для поддержания стабильности лекарственного средства.
SBC-102 является прозрачной, бесцветной, стерильной жидкостью, поставляемой в прозрачной ампуле из боросиликатного стекла типа I с пробкой из искусственного латекса (бутила) с покрытием FluroTec® и алюминиевой мембраной. SBC-102 поставляется в виде водного раствора, включающего SBC-102 (2 мг/мл), тринатрия цитрат дигидрат (13,7 мг/мл, Фармакопея США), лимонной кислоты моногидрат (1,57 мг/мл, Фармакопея США), человеческий сывороточный альбумин (10 мг/мл, Фармакопея США) и воду для инъекций (до финального объема, Фармакопея США). Значение pH для SBC-102 составляет 5,9±0,2. SBC-102 не содержит консервантов, и ампулы предназначены только для однократного использования.


Каждый пример в данной заявке предоставлен для пояснения изобретения, а не ограничения изобретения. Для специалистов в данной области будет очевидным, что в данное изобретение могут быть внесены различные модификации, комбинации, добавления, удаления и вариации без уменьшения объема и общей идеи изобретения. Например, проиллюстрированные или описанные признаки как часть одного варианта воплощения изобретения, могут использоваться в другом варианте воплощения изобретения для получения еще одного варианта воплощения изобретения. Данное изобретение охватывает подобные модификации, комбинации, добавления, делеции и вариации.
Все документы (например, патенты США, публикации патентов США, публикации), процитированные в указанной заявке, включены сюда посредством ссылки. Специалистам в данной области станут очевидны различные модификации и вариации данного изобретения без уменьшения объема и принципа изобретения.
В то время как данное изобретение было показано отдельным образом и описано с ссылками на примеры вариантов воплощения изобретения, специалистам в данной области будет понятно, что различные изменения в форме и деталях могут быть осуществлены без уменьшения объема изобретения, охватываемого прилагаемой формулой изобретения.
Реферат
Изобретение относится к биотехнологии и медицине и представляет собой выделенный рекомбинантный гликопротеин лизосомальной кислой липазы человека (рГЛКЛЧ), причем рГЛКЛЧ по существу состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:19, с N-гликанами, связанными с аспарагиновыми остатками (Asn), которые соответствуют Asn36, Asn101, Asn161, Asn273 и Asn321 последовательности SEQ ID NO:1, при условии, если N-гликаны не содержат сиаловой кислоты или фукозы, и при условии, если рГЛКЛЧ не содержат O-гликанов, и где N-гликаны, связанные с Asn остатками, которые соответствуют Asn36, Asn101, Asn161, Asn273 и Asn321 последовательности SEQ ID NO:1, представляют собой: a) в положении Asn36, GlcNAc4Man3GlcNAc2, или Gal1GlcNAc4Man3GlcNAc2; b) в положении Asn101, Phos2Man7GlcNAc2; b) в положении Asn161, Phos1Man6GlcNAc2; GlcNAc1Phos1Man6GlcNAc2; Man3GlcNAc2; GlcNAc2Man3GlcNAc2; GlcNAc3Man3GlcNAc2; GlcNAc4Man3GlcNAc2; или Gal1GlcNAc4Man3GlcNAc2; c) в положении Asn273, Man7GlcNAc2; Man8GlcNAc2; Man9GlcNAc2; Phos1Man8GlcNAc2; или Phos1Man9GlcNAc2; и d) в положении Asn321, GlcNAc2Man3GlcNAc2; GlcNAc3Man3GlcNAc2; GlcNAc4Man3GlcNAc2; Gal1GlcNAc4Man3GlcNAc2; GlcNAc5Man3GlcNAc2; Gal1GlcNAc5Man3GlcNAc2; GlcNAc6Man3GlcNAc2; или Gal1GlcNAc6Man3GlcNAc2; где Man = манноза, GlcNAc = N-ацетилглюкозамин, Phos = фосфат, и Gal = галактоза. Изобретение касается также фармацевтических композиций, включающих рекомбинантную лизосомальную кислую липазу человека. Изобретение применяется для эффективного лечения состояний, связанных с дефицитом лизосомальной кислой липазы. 2 н. и 10 з.п. ф-лы, 30 ил., 6 табл., 20 пр.
Формула
Документы, цитированные в отчёте о поиске
Молекула днк, кодирующая липазу человека, стимулируемую солями желчи

Комментарии