Трансген для получения рекомбинантного полипептида в молоке трансгенных коров, способ получения трансгенной коровы (варианты), молоко от трансгенной коровы, пищевой состав - RU2095414C1
Код документа: RU2095414C1
Чертежи





























Описание
Изобретение относится к продуцированию рекомбинантных полипептидов трансгенными коровами и к способам получения трансгенных млекопитающих (кроме человека), обладающих целевым фенотипом.
Существует огромная литература, относящаяся к
экспрессии гетерологичных генов в низших организмах, таких, как одноклеточные бактерии, дрожжи и нитевидные грибки, и в клетках высшего типа, таких, как клетки млекопитающих. Имеются также
многочисленные сообщения о создании трансгенных животных, большинство которых относится к созданию трансгенных мышей. См. например, патент США N 4736866 (трансгенная мышь с активированным онкогеном);
Andres A. et al, 1987, Proc. Natl. Acad. Sci. USA, 84, 1299 1303 (HA-RAS онкоген под контролем сывороточного кислотного белкового промотора); Schoenberger C.A. et al. 1987, Experientia, 43, 644 и
(1988) J.EMBO, 1, 169 175 (C-myc онкоген под контролем сывороточного кислотного белкового промотора); и Muller W.J. et al. 1988, Cell, 54, 105 115 (C-myc онкоген под контролем вирусного промотора
опухоли молочной железы мыши). Некоторыми лабораториями сообщалось о создании трансгенных свиней (Miller K.F. et al, 1989, J. Endocrin, 120, 481
488 (экспрессия гена человеческого или бычьего
гормона роста в трансгенной свинье); Vize P.D. et al. 1988, J. Cell. Sci, 90, 295 300 (слитый ген свиного гормона роста в трансгенных свиньях) и Ebert K. et al. 1988, Mol. Endocrin. 2, 277 283 (слитый
ген соматотропина MMLV-крысы в трансгенных свиньях), трансгенных овцах (Nancarrow et al. 1987, Theriogenology, 27, 263 (трансгенная овца с геном бычьего гормона роста); Clark A.J. et al. 1989,
Bio/Technology 1, 487 482 и Simons J. et al. 1988, Bio/-Technology, 6, 179 183 (человеческий фактор IX и α-1 антитрипсиновый CONA в овечьем организме) и кроликов (Hanover S.V. et al. 1987,
Deutsche Tierarztliche Wochenschrift, 94, 476 478 (создание трансгенных кроликов инъекцией маточного-глобинового-промjтора-CAT, встроенного в оплодотворенные овоциты кролика). В ряде сообщений также
предполагалось создание крупного рогатого скота (Wagner et al. 1984, Theriogenology, 21, 29 44), в одном из которых сообщалось о некоторых успехах в методах микроинъекций (Lohse J.K. et al. 1985,
Theriogenology, 23, 205). Однако в получении трансгенных коров был достигнут незначительный успех. Научные статьи, в которых четко показано реальное создание трансгенных коров, способных продуцировать
гетерологичный белок, в настоящее время неизвестны. И это несмотря на утверждение, что одна трансгенная корова была создана в Канаде и эта корова экспрессировала человеческий b-интерферон (Van Brunt,
J. 1988, Bio/Technology, 6, 1149 - 1155) и что в одном из случаев достигнута переходная экспрессия человеческого a-фетопротеина в печени и крови (Church R.B. 1986, Biotechnology News Watch, 6, (15),
4). В одной из ссылок сообщается о том, что вирус бычьей папилломы, вероятно, был интегрирован, но не экспрессирован в трансгенной корове (Roschlau et al. 1988, Arch. Tierz. Berlin, 31, 3 8). В
недавно появившейся статье суммированы успехи генной инженерии для домашнего скота (Pursel V.G. et al. 1989, Science, 244, 1281 1288).
Рядом лабораторий сообщалось о тканевоспецифичной экспрессии ДНК, кодирующей разнообразные белки в молочной железе, или продуцирование различных белков в молоке трансгенных мыши и овцы. Например, в работе Simmons J.P. et al. 1987, Nature, 328, 530 532 сообщается о микроинъекции геномного фрагмента в 16,2 kb, кодирующего b-лактоглобулин (БЛГ), включая 5'-последовательность в 4 kb, транскрипционное звено БЛГ в 4,9 kb и фланкирующую 3'-последовательность в 7,3 kb, в оплодотворенные яйца мыши. Согласно утверждениям авторов, БЛГ экспрессировался в молочных тканях, а продуцировался БЛГ с молоком трансгенной мыши в концентрации 3 23 мг/мл. Однако в случае встраивания в нетранслируемую 5'-область гена БЛГ кДНК, кодирующей человеческий фактор IX или человеческий a1-антитрипсин, и микроинъекции этой конструкции (Simmons J.P. et al. 1988, Bio/Technology, 6, 179 183), продуцирование фактора IX или α1-антитрипсина было значительно более низким (25 нг/мл для фактора IX и 10 мг/мл для α1-антитрипсина; см. Clark et al, 1989, Bio/Technology, 7, 487 492).
Имеется сообщение (Lee et al. 1988, Nucl. Acids Res. 16, 1027 1041) о микроинъекции аналогичным способом в оплодотворенные овоциты мыши геномного клона в 14 kb, состоящего из полного крысиного β-казеина в 7,5 kb, фланкирующей 5'-ДНК в 3,5 kb и фланкирующей 3'-ДНК. В этом случае, согласно сообщению, уровень экспрессии крысиного b-трансгена в лактирующей молочной железе трансгенной мыши находился в пределах 0,01 1% от эндогенного гена мышиного b-казеина.
Сообщается о продуцировании в молоке трансгенной мыши человеческого тканевого активатора плазминогена (т-ПА) на уровне 0,2 0,4 мкг/мл при экспрессии кДНК, кодирующей человеческий т-ПА, вместе с эндогенной секретирующей последовательностью под контролем 5'-последовательности в 2,6 kb гена мышиного сывороточного кислотного белка (Gordon K. et al. 1987, Bio/Technology, 5, 1183 1187). Последующие эксперименты с применением той же самой или аналогичной конструкции, как сообщается, показали продуцирование т-ПА у мышей разных линий в пределах от менее 20 нг т-ПА на мл молока до примерно 50 мкг/мл (Pittius C.W. et al. 1988, Proc. Natl. Aca. Sci. USA, 85, 5874 5878).
В патенте США N 4873316 (выдан 10 октября 1989 г.) раскрыто применение 5'-последовательности из гена бычьего aS1-казеина, включающей сигнальный пептид казеина и несколько кодонов казеина, слитых со зрелой т-ПА последовательностью. Трансгенная мышь, созданная с помощью данного конструкта, согласно сообщению, продуцировала в своем молоке 0,2 0,5 мкг/мл т-ПА слитого белка.
Кроме того, в ряде патентных публикаций сообщается о направленном продуцировании специфичных белков в молоке трансгенных мышей и овец (cм. например, европейский патент N 0264166, опубл. 20 апреля 1988 г.) (поверхностный антиген гепатита В и т-ПА гена под контролем промотора сывороточного кислотного белка для специфической экспрессии в тканях молочной железы мыши PCT публикация N WO 86/00239, опубл. 14.01.1988 г.); РСТ публикация WO 88/01648, опубл. 10 марта 1988 г. (трансгенная мышь с молочными секреторными клетками, содержащими рекомбинантную систему экспрессии, включающую ген бычьего a-лактальбумина, слитый с интерлейкином-2); Европейский пат. N 0279582, опубл. 24 августа 1988 г. (тканево-специфичная экспрессия хлорамфениколацетилтрансферазы под контролем крысиного b-казеинового промотора в трансгенной мыши) и PCT публикация N WO 88/10118, опубл. 29 декабря 1988 г. (трансгенные мыши и овцы, имеющие трансген, кодирующий бычий aS1-казеиновый промотор и сигнальную последовательность, слитые с т-ПА).
При рассмотрении состояния вопроса в области трансгенной технологии становится очевидной необходимость способов, позволяющих эффективно создавать трансгенных млекопитающих, в особенности трансгенных млекопитающих, отличных от трансгенных мышей.
Кроме того, очевидна необходимость в способах создания трансгенных коров, которые способны продуцировать рекомбинантные полипептиды, такие, как человеческие молочные белки и человеческие сывороточные белки в молоке.
К тому же технический результат изобретения заключается в создании трансгенных коров, способных продуцировать рекомбинантные полипептиды, которые остаются внутри клеток или секретируются внеклеточно, а также коров, способных продуцировать в молоке рекомбинантные полипептиды, такие, как человеческие молочные белки и человеческие сывороточные белки.
Кроме того, изобретение позволяет получить от трансгенных коров молоко, содержащее рекомбинантные полипептиды, и создать пищевые составы с добавкой рекомбинантных полипептидов из молока трансгенных коров, например детского питания с добавкой человеческого лактоферрина.
В заявке описано создание трансгенов, благодаря которым в молоке трансгенных коров продуцируются рекомбинантные полипептиды.
Таким образом, изобретение включает трансгены для получения рекомбинантных полипептидов в молоке трансгенных коров. Получение такого молока трансгенных коров, содержащего один или несколько рекомбинантных полипептидов, желательно потому, что благодаря этому рекомбинантные полипептиды, полученные таким образом, вообще не требуют очистки для потребления человеком. Трансген включает секреторную ДНК-последовательность, кодирующую секреторную сигнальную последовательность, действующую в секреторных клетках молочной железы, представляющих интерес коров и рекомбинантную ДНК-последовательность, кодирующую рекомбинантный полипептид. Указанные последовательности связаны друг с другом с образованием рабочей последовательности: секреторная последовательность рекомбинантная ДНК. С последовательностью секреторная последовательность рекомбинантная ДНК эффективно связана по меньшей мере одна регуляторная последовательность, обеспечивающая экспрессию секреторных клеток молочной железы коров. Трансген конструируют с помощью секреторной последовательности, которая способна направлять ДНК, содержащую трансген, в секреторных клетках молочной железы коров. В результате подобной экспрессии образуется такая форма рекомбинантного полипептида, которая секретируется из секреторных клеток молочной железы коров в молоко трансгенных коров.
Изобретение раскрывает способы создания таких трансгенных коров. Способ включает введение вышеуказанного трансгена в эмбриональную целевую клетку коровы, трансплантацию полученной в результате трансгенной эмбриональной целевой клетки родителю-реципиенту и выявление из потомства по меньшей мере одной телочки, способной продуцировать в своем молоке рекомбинантный полипептид.
Изобретение, кроме того, включает молоко от таких трансгенных коров, содержащее рекомбинантные полипептиды, и пищевые составы, содержащие трансгенное молоко в жидкой или сухой форме, а также пищевые составы с добавкой одного или нескольких рекомбинантных полипептидов из указанного трансгенного молока.
Помимо вышеперечисленного, изобретение включает трансгены, способные продуцировать рекомбинантные полипептиды в молоке трансгенных коров. Такие трансгены характеризуются тем, что имеют регуляторные последовательности экспрессии, обеспечивающие экспрессию ДНК, кодирующей рекомбинантный полипептид, в конкретном типе клеток или тканей, например, человеческого сывороточного альбумина в печени трансгенных коров. Если рекомбинантный полипептид должен секретироваться из таких целевых клеток или тканей, тогда секреторная ДНК-последовательность, кодирующая секреторную сигнальную последовательность, действующую в конкретных целевых клетках или тканях, связывается с рекомбинантной ДНК-последовательностью, кодирующей рекомбинантный полипептид, например, при секретировании человеческого сывороточного альбумина из печени коровы в сердечно-сосудистую систему.
В заявке описаны способы создания трансгенных млекопитающих (кроме человека) с целевым фенотипом. Способ заключается в первоначальном метилировании трансгена, способного создать целевой фенотип при введении в клетки трансгенного животного, например, трансформированием приемлемой бактерии, такой, как E. coli MM 294 плазмидой, содержащей трансген. Метилированный трансген затем вырезают и вводят в оплодотворенные овоциты животного с осуществлением интеграции в геном. Овоциты затем выращивают до предимплантационного эмбриона с репликацией генома каждого оплодотворенного овоцита. После этого из каждого предимплантационного эмбриона извлекают по меньшей мере одну клетку, которую обрабатывают и выделяют содержащуюся в ней ДНК. Каждую выделенную ДНК затем обрабатывают эндонуклеазой рестрикции, способной отщеплять метилированный трансген, но неспособной отщеплять неметилированную форму трансгена, образованного после интеграции в геномную ДНК и ее репликации. Те предимплантационные эмбрионы, которые имеют интегрированный трансген, содержат ДНК, устойчивую к расщеплению эндонуклеазой рестрикции в области, включающей трансген. Такая устойчивость к гидролизу, которую можно обнаружить электрофорезом продукта гидролиза после PCR-амплификации ДНК и гибридизации с меченым зондом, облегчает выявление успешного трансгенеза.
Специфическое воплощение вышеприведенного способа обнаружения раннего трансгенеза осуществляется в способе получения популяции трансгенного потомства с одинаковым фенотипом. В данном способе метилированный трансген вводят в оплодотворенные овоциты, которые выращивают до предимплантационных эмбрионов. Затем каждый предимплантационный эмбрион делят с образованием первого и второго полуэмбриона. Каждый первый полуэмбрион анализируют вышеприведенным способом на трансгенез. После обнаружения успешного трансгенеза в по меньшей мере одном из первых полуэмбрионов второй необработанный полуэмбрион, содержащий интегрированный трансген, клонируют с образованием множества трансгенных клонов бластоцитов и полубластоцитов, каждый из которых характеризуется одним и тем же генотипом. После этого трансгенные эмбрионы трансплантируют одной или нескольким самкам-реципиентам с получением популяции трансгенных животных с одинаковым генотипом.
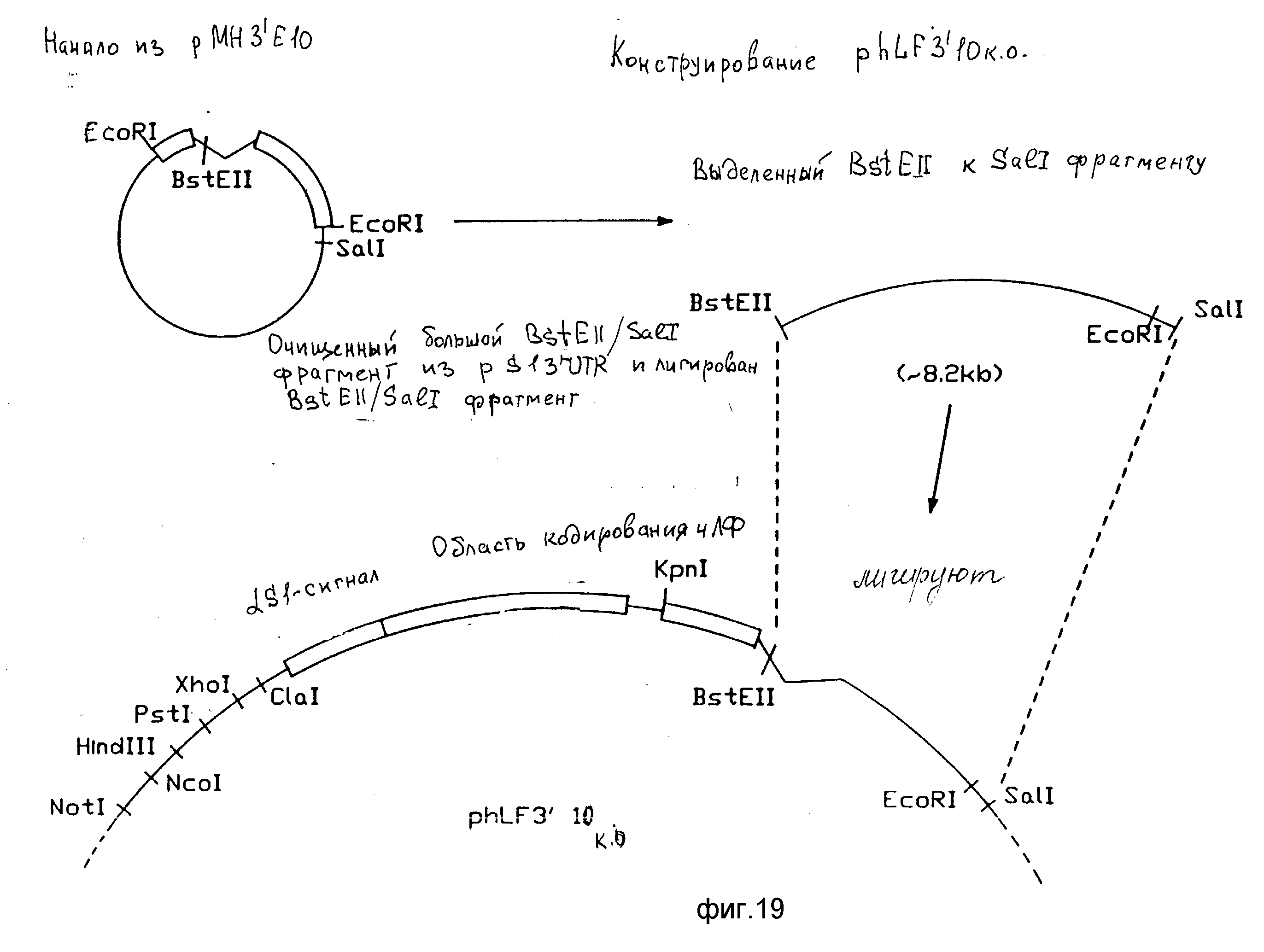
На фиг. 1-7 представлена ДНК (посл. ID N 1) и аминокислотная последовательность (посл. ID N 2) клона человеческого лактоферрина, происходящего из библиотеки кДНК молочной железы человека в том виде, в каком она приводится здесь, за исключением того, что последовательность между нуклеотидами 1557-1791 и 2050-2129 соответствует ранее опубликованной последовательности (Rado et al. 1987, Blood, 70, 989-993); на фиг. 8 9 - полная ДНК (посл. ID N 3) и аминокислотная последовательность (посл. ID N 4) человеческого лактоферрина, включая 5'- и 3'-нетранслируемые последовательности, а также полную сигнальную последовательность человеческого лактоферрина; на фиг. 10 карта рестрикции клона 5'-фланкирующей области гена бычьего aS1-казеина; на фиг. 11 карта рестрикции клона 3'-фланкирующей области гена бычьего aS1-казеина; на фиг. 12 14 конструкция pSI 3'5' CAT и pSI 5' CAT; на фиг. 15 pMN 1; на фиг. 16 21 конструирование векторов экспрессии, содержащих последовательности, кодирующие человеческий лактоферрин; на фиг. 22 геномная ДНК человеческого сывороточного альбумина, фрагменты, использованные для создания трансгенной мыши и содержащиеся в этой геномной ДНК, а также идентификация размеров фрагмента, которые должны быть получены в результате гидролиза геномной ДНК из трансгенной мыши рестрикционными ферментами BstE-II и Nco-I или Nco-I и Hindi-III; на фиг. 23 - альтернативный путь конструирования трансгена изобретения, кодирующего человеческий лактоферрин; на фиг. 24 конструирование плазмиды pPC, содержащей трансген, кодирующий белок C; на фиг. 25 ДНК-последовательность гибридного нитрона, применяемого при воплощении изобретения. Гибридная последовательность состоит из 5'-части интрона бычьего aS1-казеина и 3'-части интрона IgG. Местом стыка 5'- и 3'-части является HindIIIсайт.
"Млекопитающие (кроме человека)" означают всех млекопитающих, кроме человека, способных производить на свет "трансгенных млекопитающих (кроме человека)", имеющих "целевой фенотип". Подобные млекопитающие включают: приматов, кроме человека, мышей различных линий, коров различных пород, собак различных пород и так далее. Рекомендуемыми животными являются коровы, свиньи и овцы различных пород, наиболее предпочтительно коровы различных пород.
Целевые фенотипы для трансгенных млекопитающих включают, но без ограничения только ими: продуцирование рекомбинантных полипептидов в молоке самок трансгенных млекопитающих (кроме человека), продуцирование животных-моделей для изучения болезней, создание животных с более высокой сопротивляемостью к заболеваниям (например, заболеваниям молочной железы, таким, как мастит) и продуцирование рекомбинантных полипептидов в крови, моче или иных приемлемых биологических жидкостях или тканях животного. В рекомендуемых воплощениях изобретения описаны трансгенные коровы, способные продуцировать рекомбинантный человеческий лактоферрин, человеческий сывороточный альбумин и человеческий белок С в молоке лактирующих самок или человеческий сывороточный альбумин в печени трансгенного животного.
Трансгенных млекопитающих (кроме человека) получают введением "трансгена" в эмбриональную целевую клетку выбранного животного. В одном из аспектов изобретения трансген это ДНК- последовательность, способная создавать определенный фенотип при ее нахождении в клеточном геноме трансгенного млекопитающего (кроме человека). В специфичных воплощениях изобретения трансген представляет собой "рекомбинантную ДНК- последовательность", кодирующую "рекомбинантный полипептид". В таких случаях трансген способен экспрессировать рекомбинантный полипептид.
В применяемом здесь значении "рекомбинантный полипептид" (или кодирующая его рекомбинантная ДНК-последовательность) это либо "гетерологичный полипептид", либо "гомологичный полипептид". Гетерологичные полипептиды относятся к полипептидам, обычно не продуцируемым трансгенными животными. Примеры гетерологичных белков включают: человеческие молочные белки, такие, как лактоферрин, лизозим, секретируемые иммуноглобулины, лактоальбумин, стимулируемая липаза желчи и т.д. человеческие сывороточные белки, такие, как альбумин, иммуноглобулины, фактор VIII, фактор IX, белок C и т.д. и промышленные ферменты, такие, как протеазы, липазы, хитиназы и лигиназы из прокариотных и эукариотных источников. Последовательность рекомбинантной ДНК включает геномную или к-ДНК последовательность, кодирующую рекомбинантный полипептид.
При использовании рекомбинантных ДНК- последовательностей, кодирующих гетерологичные полипептиды, трансген может быть интегрирован в геном применяемых для трансгеноза животных произвольным образом. Как описано в примерах, трансгены, кодирующие человеческий лактоферрин, человеческий сывороточный альбумин и человеческий белок C, в сочетании с секреторной сигнальной последовательностью aS1-казеина под контролем последовательностей регуляции экспрессии aS1-казеина, были созданы для продуцирования и секретирования указанных гетерологичных полипептидов из молочной железы лактирующего млекопитающего в его молоко.
В применяемом здесь значении гомологичный полипептид это полипептид, эндогенный по отношению к конкретному трансгенному виду животного. Примеры эндогенных полипептидов для различных пород коров включают коровьи молочные белки, такие, как aS1, aS2, b- и k-казеин, b-лактоглобулин, лактоферрин, лизозим, холестерин-гидролаза, сывороточные белки, такие, как сывороточный альбумин и белковые гормоны, такие, как гормоны роста. При использовании ДНК- последовательности, кодирующей гомологичный полипептид, трансген рекомендуется вводить в геном применяемого для трансгенеза животного произвольным путем. Такое неупорядоченное введение дает трансгенное животное, которое имеет не только трансген, кодирующий эндогенный полипептид, но также и соответствующую эндогенную геномную ДНК- последовательность. Соответственно такое трансгенное млекопитающее (кроме человека) легко характеризуется увеличенным числом копий генов, кодирующих эндогенный полипептид. Кроме того, трансген, как правило, будет располагаться в положении, отличном от положения эндогенного гена.
При экспрессии ДНК, кодирующей полипептид, например, в коровах различных пород трансгенное животное отличается повышением количества гомологичного полипептида как в эндогенной ткани, так и в жидкости, в которой полипептид обычно обнаруживается, и/или присутствием гомологичного белка в ткани и/или биологической жидкости, в которых гомологичный полипептид либо обычно не содержится, либо продуцируется на значительно более низком уровне.
Так, например, коровья холестерин-гидролаза обычно присутствует в молозиве в первые 15 20 дней лактации. Этот природный эндогенный белок повышает вес теленка. Однако этот белок становится также гомологичным полипептидом, когда, например, его экспрессия в секретирующих клетках молочной железы осуществляется с помощью последовательностей регуляции экспрессии генов бычьего казеина, которые способствуют экспрессии гомологичного полипептида и за пределами обычного периода лактации. Таким образом, согласно одному из аспектов изобретения, экспрессия коровьей холестерин-гидролазы в молоке трансгенной коровы осуществляется рекомбинантной ДНК (либо кДНК, либо геномная ДНК) холестерин-гидролазы под контролем последовательностей регуляции экспрессии коровьего aSl-казеина. При использовании геномной рекомбинантной ДНК ее создают таким образом, что она обладает приемлемыми сайтами рестрикции (например, ClaI и SalI) у 5' и 3' конца структурного гена с тем, чтобы ее можно было встроить в соответствующую трансгенную геномную кассету (например, p-16 Kb, CS, приведенная в примере 15). Или же ДНК, кодирующую коровью холестерин-гидролазу и происходящую из кДНК, встраивают под контроль последовательности регуляции экспрессии коровьего aSl-казеина путем замены последовательностей человеческого лактоферрина в такой плазмиде, p 16, 8 HLF 3 (содержит гибридный интрон) или p16, 8 HLF 4 (содержит интрон гомологичного aSl-казеина). При использовании этих конкретных плазмид клон кДНК создают таким, что он обладает приемлемыми ClaI и SalI сайтами рестрикции с обоих концов рекомбинантной ДНК.
И еще один пример. Коровий лактоферрин обычно присутствует в коровьем молоке всего лишь в следовых количествах. Однако, если коровий лактоферрин экспрессируется под контролем других регуляторных последовательностей, например полученных из гена aSl -казеина, в молоке трансгенных коров лактоферрин присутствует в больших количествах. В другом примере трансген, включающий ДНК, кодирующую гомологичный бычий гормон роста, вводят в бычий геном для придания трансгенному животному более высоких ростовых характеристик. В других случаях гомологичные полипептиды включают, например, полипептид, который обычно у конкретных видов животных содержится внутри клеток, но который секретируется в молоко или иное внеклеточное пространство трансгенных видов животных, например в сердечно-сосудистую систему.
Каждый гетерологичный или гомологичный полипептид обладает характерной для него последовательностью аминокислот и нуклеиновых кислот. Необходимо указать, что такие последовательности включают их природные аллельные вариации и варианты, полученные рекомбинантными методами, в которых такие последовательности нуклеиновых кислот и полипептидные последовательности подвергаются модификации путем замещения, внедрения и/или делеции одного или нескольких нуклеотидов в таких нуклеиновых кислотах с целью вызвать замещение, вставку или делецию одного или нескольких аминокислотных остатков в рекомбинантном полипептиде.
Когда экспрессия ДНК трансгена необходима для создания целевого фенотипа, например для продуцирования рекомбинантного полипептида, в этом случае трансген обычно включает по меньшей мере 5', но предпочтительно дополнительно и 3' "последовательности регуляции экспрессии", каждая из которых эффективно связана с рекомбинантной или секреторно-рекомбинантной ДНК, определенных ниже. Подобные последовательности регуляции экспрессии, помимо регулирования транскрипции, вносят свой вклад в стабильность и обработку РНК по меньшей мере в той степени, в которой они также транскрибируются.
Такие последовательности регуляции экспрессии выбирают с целью создания тканево-специфичной или специфичной к клеточному типу экспрессии рекомбинантной или секреторно-рекомбинантной ДНК. После того как сделан выбор ткани или типа клетки для экспрессии, подбирают 5'- и, возможно, 3'- последовательность регуляции экспрессии. Как правило, такие последовательности регуляции экспрессии происходят из генов, которые экспрессируются в выбранной ткани или типе клетки. Рекомендуется, чтобы гены, из которых получены такие последовательности регуляции экспрессии, экспрессировались только по существу в нужных тканях или типах клеток, хотя вторичная экспрессия в другой ткани и/или клетках другого типа также приемлема, если эта экспрессия не оказывает неблагоприятного воздействия на трансгенное животное. Особенно рекомендуется использовать те последовательности регуляции экспрессии, которые эндогенны по отношению к подвергаемым обработке видам животных. Однако могут быть использованы также и последовательности регуляции экспрессии из других видов, например из генов человека. В некоторых случаях последовательности регуляции экспрессии и рекомбинантные ДНК-последовательности (геномные или кДНК) происходят из одного и того же источника, например обе происходят от коров или человека. В таких случаях последовательности регуляции экспрессии и рекомбинантная ДНК- последовательность гомологичны по отношению друг к другу. Или же последовательности регуляции экспрессии и рекомбинантные ДНК- последовательности получают от различных видов животных, например последовательность регуляции экспрессии от коровы, а рекомбинантная ДНК- последовательность от человека. В этом случае последовательность регуляции экспрессии и рекомбинантная ДНК-последовательность гетерологичны по отношению друг к другу. Ниже следует определение последовательности регуляции экспрессии из эндогенных генов. Сделанные определения также применимы к последовательностям регуляции экспрессии из неэндогенных гетерологичных генов.
В целом 5'-последовательность регуляции экспрессии включает транскрибируемую часть эндогенного гена в восходящем направлении от последовательности инициирования трансляции (5' нетрансляционная область, или 5' НТО) и те восходящие от нее фланкирующие последовательности, которые содержат функциональный промотор. В применяемом здесь значении "функциональный промотор" включает те необязательно транскрибируемые последовательности ДНК, которые обеспечивают связывание РНК-полимеразы с эндогенным геном с промотированием транскрипции. Такие последовательности обычно состоят из TATA-последовательности или рамки Хогнесса, как правило, расположенной за 25 - 30 нуклеотидов от сайта инициации транскрипции. Рамку Хогнесса часто также называют проксимальным фактором. Во многих случаях промотор дополнительно включает один или несколько дистальных факторов, расположенных в восходящем направлении от проксимального фактора (рамки Хогнесса) и необходимых для инициации транскрипции. Такие последовательности промотора, как правило, содержатся в пределах первых 100 200 нуклеотидов, расположенных в восходящем направлении от сайта инициации транскрипции, но могут простираться и вплоть до 500 600 нуклеотидов от сайта инициации транскрипции. Такие последовательности либо самоочевидны для специалиста, либо легко определяются стандартными методами. Подобные последовательности промотора сами по себе или в комбинации с 5' нетранслируемой областью называются здесь "проксимальные 5'- последовательности регуляции экспрессии".
Помимо таких проксимальных 5'-последовательностей регуляции экспрессии рекомендуется также, чтобы в трансген были включены дополнительно фланкирующие 5'-последовательности (далее называются "дистальными 5'-последовательностями регуляции экспрессии"). Такие дистальные 5'-последовательности регуляции экспрессии, как полагают, содержат один или несколько энхансеров и/или иных последовательностей, облегчающих экспрессию эндогенного гена и как следствие экспрессию рекомбинантной или секреторно-рекомбинантной последовательности ДНК, которая эффективно связана с дистальной и проксимальной 5'-последовательностями регуляции экспрессии. Размер дистальной 5'-последовательности регуляции экспрессии зависит от эндогенного гена, из которого происходит последовательность регуляции экспрессии. Однако, как правило, такие последовательности включают фланкирующие 5'-области примерно в 1 п.о. более предпочтительно в 16 п.о. и наиболее предпочтительно около 30 п.о. Oптимальный размер дистальной 5'-последовательности регуляции экспрессии, взятой из конкретного эндогенного гена, легко определяется изменением размера дистальной 5'-последовательности регуляции экспрессии с достижением максимальной экспрессии. В целом дистальная 5'-последовательность регуляции экспрессии будет не очень большой, чтобы не входить в примыкающий ген, и не будет включать ДНК- последовательности, неблагоприятно влияющие на уровень трансгенной экспрессии.
Кроме того, рекомендуется для усиления тканево-специфичной или специфичной к типу клеток экспрессии также включать 3'-последовательности регуляции экспрессии. Такие 3'-последовательности регуляции экспрессии включают 3'-проксимальные и 3'-дистальные последовательности регуляции экспрессии из соответствующего эндогенного гена. Проксимальная 3'-последовательность регуляции экспрессии включает транскрибируемую, но нетранслируемую ДНК, расположенную в нисходящем направлении от стоп-сигнала в рекомбинантной ДНК- последовательности (также называемой 3' нетранслируемой областью или 3' НТО). Подобные последовательности обычно оканчиваются у последовательности полиаденилирования (либо из эндогенного гена, либо из иного источника, такого, как SV 40) и у последовательностей, способных повлиять на устойчивость РНК. Как правило, 3' НТО состоит из 100 500 нуклеотидов в нисходящем направлении от трансляционного стоп-сигнала в гене, из которого регуляционная 3'-последовательность происходит. Дистальная 3'-последовательность регуляции экспрессии включает фланкирующие ДНК-последовательности в нисходящем направлении от проксимальной 3'- последовательности регуляции экспрессии. Некоторые из таких дистальных последовательностей транскрибируются, но не образуют часть мРНК, в то время как другие последовательности в этой дистальной 3'-последовательности регуляции экспрессии не транскрибируются вовсе. Подобные дистальные 3'-последовательности регуляции экспрессии, как полагают, содержат энхансер и/или другие усиливающие экспрессию последовательности. Полагают, что такие последовательности необходимы для эффективного полиаденилирования и содержат последовательности окончания транскрипции. Рекомендуется, чтобы подобные последовательности составляли примерно 2 kb, более предпочтительно 8 kb и наиболее предпочтительно около 15 kb от фланкирующей 3'-последовательности.
Хотя рекомендуется использование обеих 5'- и 3'-последовательностей регуляции экспрессии, тем не менее в некоторых воплощениях изобретения эндогенные 3'-последовательности регуляции экспрессии не применяют. В таких случаях для обеспечения полиаденилирования обычно применяют проксимальные 3'-последовательности регуляции экспрессии, обычно связанные с геномной ДНК, кодируемой рекомбинантной ДНК-последовательностью. Кроме того, могут быть также использованы дистальные регуляционные 3'-последовательности из геномной ДНК, кодирующей рекомбинантный полипептид, предпочтительно того же размера, что и у вышеуказанной эндогенной 3'-последовательности регуляции экспрессии. Необходимо указать, что в таких случаях кодируемый трансгеном рекомбинантный полипептид может включать либо геномную ДНК, либо происходящую из кДНК двунитевую ДНК. Как и в случае с 5'-последовательностями регуляции экспрессии, оптимальный размер 3'-последовательностей регуляции экспрессии может быть легко определен изменением размера фланкирующей 3'-последовательности с достижением максимальной экспрессии рекомбинантного полипептида. В целом дистальная регуляционная 3'-последовательность, происходящая или из эндогенного гена, или из гетерологичного гена, не будет простираться в примыкающий ген, из которого она происходит, и не должна включать какие-либо последовательности, оказывающие неблагоприятное воздействие на уровень трансгенной экспрессии.
Примеры последовательностей регуляции экспрессии приведены в табл. 1.
Рекомендуется, что помимо 5'- и 3'-последовательностей регуляции экспрессии и рекомбинантной ДНК (либо геномной, либо происходящей из кДНК) трансген изобретения также содержал "рекомбинантный интрон", который прерывает транскрибируемую, но не транслируемую 5'-область трансгена. Такие интроны могут происходить, например, из бычьего aS1-казеина и из человеческого лактоферрина. Такие применяемые здесь последовательности являются "гомологичными рекомбинантными интронами" в том, что 5'- и 3'- РНК сплайс-сигналы в таких рекомбинантных интронах те же, что и обычно обнаруживаемые в интроне из эндогенного или гетерологичного гена. Рекомбинантные интроны, однако, могут также представлять собой и "гибридный интрон". Такие гибридные интроны включают 5' РНК сплайс-сигнал и 3' РНК сплайс-сигнал из интронов различных источников. В отдельных аспектах изобретения такие гибридные интроны включают по меньшей мере одну "разрешающую РНК сплайс-последовательность". В применяемом здесь значении сигнал, разрешающий сплайсинг РНК, означает РНК сплайс-сигнальную последовательность, предпочтительно 3' РНК сплайс-сигнал из интрона, содержащийся в наборе фрагментов ДНК зародышевой линии, претерпевающей перегруппировку в ходе клеточной дифференциации. Примеры подобных генных наборов включают: иммуноглобулиновое супергенное семейство, в том числе иммуноглобулины и Т-клеточные антигенные рецепторы, а также набор генов главного комплекса гистосовместимости (ГКГ) и другие. К особенно рекомендуемым последовательностям, разрешающим сплайсинг, относятся те, которые получены из иммуноглобулинового набора, предпочтительно класса IgG и более предпочтительно те 3' сплайс-сигнальные последовательности, которые связаны с J C сегментной перегруппировкой тяжелых и легких цепей Ig, наиболее предпочтительно тяжелой цепи. Особенно рекомендуемая последовательность, разрешающая сплайсинг, состоит из той части последовательности, которая на фиг. 25 показана в нисходящем направлении от Hind III сайта. Рекомендуемый гибридный интрон состоит из полной последовательности, приведенной на фиг. 25, и включающей 5'-часть интрона из бычьего aS1-казеина и 3'-часть последовательности интрона тяжелой цепи IgG.
Такие гибридные интроны, содержащие сигналы, разрешающие сплайсинг РНК, рекомендуется применять, если рекомбинантная ДНК соответствует кДНК-последовательности. Как показано в примерах, при использовании 5'-последовательности регуляции экспрессии в 16 kb из гена aS1-казеина в сочетании c aS1-казеин-IgG гидридным нитроном для экспрессии кДНК человеческого лактоферрина, эффективно связанной с секреторной сигнальной последовательностью aS1-казеина, получена трансгенная мышь, продуцирующая примерно 1330 мкг/мл чЛФ в трансгенном молоке. Приведенное количество рекомбинантного полипептида заметно превосходит ранее сообщаемые количества продуцирования различных белков в молоке трансгенной мыши, которые обычно были меньше 10 мкг/мл, а в одном случае примерно 50 мкг/мл. И это также больше того максимума в 8 мкг/мл чЛФ, который продуцируется в нашем случае при использовании такого же трансгена, содержащего гомологичный бычий интрон, а не гибридный интрон.
Однако такие гибридные интроны не ограничиваются трансгенами, использующими кДНК- последовательности. Более того, гибридные интроны применимы также, когда рекомбинантный полипептид кодируется геномной последовательностью. Основываясь на результатах, полученных с рекомбинантной ДНК на основе кДНК и на общем предположении, что геномные ДНК-последовательности экспрессируются на более высоком уровне, чем происходящие из кДНК-последовательности, ожидается, что такие гибридные интроны, применяемые в сочетании с геномной рекомбинантной ДНК, еще более повысят уровень экспрессии по сравнению с тем, который может быть достигнут только с одной лишь геномной последовательностью.
Основываясь на вышеизложенном, очевидно, что рекомендуемые трансгены включают большую часть 5'- и 3'-последовательностей регуляции экспрессии. Более того, рекомбинантную ДНК рекомендуется получать от геномных клонов, которые могут быть длиной в десятки-сотни килооснований. Основываясь на существующей технологии клонирования и обработки ДНК, конструирование и микроинъекция трансгенов практически ограничена линейной формой ДНК длиной не более примерно 50 kb. Однако трансгены изобретения, в особенности те, длина которых превышает примерно 50 kb, могут быть легко созданы введением двух или более перекрывающихся фрагментов целевого трансгена в эмбриональную клетку-мишень. После введения перекрывающиеся фрагменты претерпевают гомологичную рекомбинацию, которая приводит к интеграции полностью перестроенного трансгена в геном клетки-мишени. В целом рекомендуется, чтобы такие перекрывающиеся фрагменты трансгена обладали 100%-ной гомологичностью в тех областях, которые перекрываются. Однако возможна и более низкая гомологичность последовательностей при условии осуществления эффективной гомологичной рекомбинации. Если между частями гомологичной последовательности все-таки существует негомологичность, рекомендуется, чтобы такая негомологичность не проходила через гомологичную последовательность, а была расположена в дискретных областях. Хотя всего лишь 14 пар оснований при 100%-ной гомологичности достаточно для гомологичной рекомбинации в клетках млекопитающего (Rubnitz J. and Subramani S. 1984, Mol. Cell. Biol. 4, 2253 - 2258), тем не менее рекомендуются более длинные части гомологичной последовательности, например, в 500 п. о. более предпочтительно в 1000 п.о. еще более предпочтительно в 2000 п.о. и наиболее предпочтительно в более чем 2000 п.о. для каждой части гомологичной последовательности.
Как показано в примерах, три перекрывающихся фрагмента человеческого сывороточного альбумина были микроинъецированы примерно равными молярными порциями в пронуклеус зигот мыши. Эти фрагменты успешно рекомбинировали и были интегрированы в геном мыши, что подтверждено анализом интегрированной ДНК методами Саузерн блотт-гибридизацией, детектированием РНК-транскрипта и человеческого сывороточного альбумина в сыворотке трансгенной мыши. Хотя созданный в результате трансген обладает длиной в 38 kb, практически не известен предел размера трансгена, который может быть образован с использованием более крупных и/или большего числа перекрывающихся фрагментов трансгена. В частности, ожидается, что при таком подходе могут быть образованы трансгены длиной 50 1000 kb, более предпочтительно 50 500 kb. Более того, применение гомологичной рекомбинации перекрывающихся фрагментов, как ожидается, будет плодотворно в создании более крупных трансгенных животных, таких, как трансгенные коровы различных пород, имеющих трансгены, несущие рекомбинантную ДНК, включающую геномную ДНК, которые никаким другим путем не могут быть введены в пронуклеус с образованием трансгенного животного. Ожидается, что такие геномные трансгены будут обеспечивать более высокие уровни экспрессии в трансгенных коровах по сравнению с трансгенами, кодирующими рекомбинантную кДНК.
При этом рекомбинантный полипептид должен секретироваться, и в данном случае "секреторная ДНК-последовательность", кодирующая сигнальный пептид функциональной секреции, должен быть операбельно связан с трансгеном, направляющим секрецию по одному или нескольким клеточным типам трансгенного животного. Секреторные ДНК- последовательности, как правило, происходят из генов, кодирующих секретируемые белки одного и того же вида животного. Рекомендуется, чтобы такие секреторные ДНК-последовательности происходили из генов, кодирующих полипептиды, секретируемые из клеточного типа, направленного на тканево-специфичную экспрессию, например секретирование молочных белков в клетках молочной железы. Однако секреторные ДНК-последовательности не ограничиваются только такими последовательностями. Могут быть также использованы секреторные ДНК- последовательности белков, секретируемых из других клеточных типов в пределах вида трансгенного животного. Например, нативная сигнальная последовательность гомологичного гена, кодирующего белок, секретируемый необязательно в молочных железах. Кроме того, могут быть также использованы "гетерологичные ДНК-последовательности", кодирующие сигнальные пептиды секреции от видов, отличных от трансгенных животных, например человеческий т-ПА, человеческий лактоальбумин и сигналы секреции из микробных генов, кодирующих секретируемые полипептиды, например, из дрожжей, нитевидных грибков и бактерий. В целом секреторная ДНК-последовательность может быть функционально определена, как любая ДНК-последовательность, которая при операбельном связывании с рекомбинантной ДНК кодирует сигнальный пептид, способный вызвать секрецию рекомбинантного полипептида.
В одном из рекомендуемых воплощений изобретения секреторную ДНК-последовательность, кодирующую секреторную сигнальную последовательность, действующую в секреторных клетках молочных желез коров, применяют, чтобы вызвать секрецию рекомбинантного полипептида в клетках молочной железы коровы. Секреторная ДНК- последовательность эффективно связана с рекомбинантной ДНК-последовательностью. Примеры таких секреторных ДНК-последовательностей включают ДНК-последовательности, кодирующие сигнальные последовательности коровьего aS1-казеина, мышиного лактоферрина и человеческого трансферрина. К рекомендуемым секреторным ДНК-последовательностям относится последовательность, кодирующая секреторную последовательность aS1-казеина коров различных пород. Применение данной секреторной ДНК-последовательности более подробно раскрывается в примерах.
"Операбельно связанный" в контексте связывания секреторной ДНК-последовательности с рекомбинантной ДНК-последовательностью означает, что секреторная ДНК-последовательность (включающая кодоны, кодирующие последовательность секреторного сигнального пептида) ковалентно соединена с рекомбинантной ДНК-последовательностью таким образом, что полученная секреторная рекомбинантная ДНК последовательность в направлении 5'-3' кодирует область секреторной сигнальной последовательности и рекомбинантный полипептид. Соответственно рамка считывания для секреторной последовательности и рекомбинантной ДНК- последовательности должна быть ковалентно связана таким образом, что существует открытая рамка считывания от 5'-конца мРНК-последовательности, образованной после транскрипции и обработки первичного РНК-транскрипта. Такая открытая рамка считывания в РНК содержит часть 5'-последовательности, кодирующей секреторный сигнальный пептид, и часть 3'-последовательности, кодирующей рекомбинантный полипептид. При такой конструкции рекомбинантный полипептид, образованный при экспрессии секреторной-рекомбинантной ДНК-последовательности, находится в форме, способной секретироваться из целевых клеток, экспрессирующих ДНК-последовательность. Сигнальный пептид, как правило, удаляется in vivo в ходе секреции с продуцированием внеклеточной формы рекомбинантного полипептида.
В предпочтительном воплощении изобретения секреторная-рекомбинантная ДНК-последовательность экспрессируется преимущественно в секреторных клетках молочных желез трансгенных коров. Такая тканево-специфичная экспрессия достигается в результате операбельного связывания ДНК- последовательностей, регулирующих специфичную экспрессию в молочных железах, с указанной секреторно-рекомбинантной ДНК-последовательностью. Подобные ДНК-последовательности, регулирующие специфичную экспрессию в молочных железах, связанные с указанной секреторной-рекомбинантной ДНК последовательностью, включают вышеупомянутые регуляционные последовательности, содержащиеся в различных генах коровы, преимущественно экспрессируемых в секреторных клетках молочных желез того же вида. Такие специфичные для молочных желез гены включают гены: aS1-казеина, aS2-казеина, b-казеина, K-казеина, a-лактальбумина и b -лактоглобулина. Рекомендуются последовательности регуляции экспрессии, происходящие из a S1-казеина, о чем более подробно говорится в примерах.
Как правило, трансгены изобретения, созданные для секретирования рекомбинантного полипептида в молоко трансгенной коровы, способны вызвать такое секретирование на уровне, значительно более высоком по сравнению с тем, что было ранее сообщено для трансгенных мышей и овец. При кодировании рекомбинантного полипептида рекомбинантной ДНК, соответствующей или происходящей из кДНК, молярная концентрация рекомбинантного полипептида предпочтительно выше 1 мкМ, более предпочтительно выше, чем примерно 100 мкМ, и наиболее предпочтительно выше 100 мкМ. Если рассматривать в перспективе уровень присутствующего в трансгенном молоке рекомбинантного полипептида, то количество рекомбинантного полипептида должно быть больше 50 мкг/мл, более предпочтительно более 500 мкг/мл и наиболее предпочтительно более 1000 мкг/мл (1 мг/мл).
Если трансген изобретения кодирует рекомбинантный полипептид, кодируемый рекомбинантной ДНК, происходящей или соответствующей геномной ДНК (или состоящей по существу из таких геномных последовательностей, то есть более 50% более предпочтительно более 75% и наиболее предпочтительно 90% кодонов, кодирующих рекомбинантный полипептид, происходят из геномных последовательностей), в этом случае молярные концентрации и содержание белка в молоке трансгенной коровы такие же, как и для кДНК или выше. Обычно молярная концентрация рекомбинантного полипептида в таком трансгенном молоке предпочтительно выше 50 мкМ, более предпочтительно выше 150 мкМ и наиболее предпочтительно выше 500 мкМ. Если рассматривать содержание белка в трансгенном молоке, то оно предпочтительно превышает 10 мг/мл, более предпочтительно превышает 2,5 мг/мл и наиболее предпочтительно превышает 5 мг/мл.
Вышеуказанные молярная концентрация и содержание белка в молоке трансгенной коровы будут колебаться в зависимости от молекулярной массы конкретного рекомбинантного полипептида. Особое преимущество продуцирования рекомбинантного полипептида с молоком трансгенной коровы заключается в том, что при этом могут продуцироваться полипептиды со сравнительно большой молекулярной массой, которые с трудом поддаются продуцированию в больших количествах в других системах, такие, как прокариотная система экспрессии. Хотя, согласно изобретению, любой рекомбинантный полипептид может быть продуцирован с молоком трансгенной коровы, в целом рекомендуется, чтобы молекулярная масса такого рекомбинантного полипептида превышала примерно 10000 Дальтон. Однако и другие рекомбинантные полипептиды с молекулярными массами выше 15000, выше 20000 и выше 60000 Дальтон могут быть также экспрессированы с молоком трансгенной коровы. Например, согласно изобретению, в молоке трансгенных коров могут быть легко продуцированы человеческий лизозим с молекулярной массой 17000 Дальтон и лактоферрин с молекулярной массой 79000 Дальтон. Таким образом, рекомбинантные полипептиды изобретения характеризуются широким спектром молекулярных масс.
Как следствие вышеприведенные молекулярные концентрации рекомбинантных полипептидов устанавливают при продуцировании рекомбинантных полипептидов с более высокой молекулярной массой. Такую установку проводят переводом молярной концентрации в количество продуцированного белка и регулированием молярных концентраций таким образом, что содержание рекомбинантного белка охватывается следующими предпочтительными концентрациями.
Большая часть прежних сообщений, относящихся к продуцированию с трансгенным молоком, касалась трансгенных мышей. Мышь, однако, обычно продуцирует 55-80 мг на мл молока. Корова, с другой стороны, обычно продуцирует 30-34 мг на мл. Поскольку чрезмерно высокий уровень продуцирования рекомбинантного полипептида может неблагоприятно подействовать на продуцирование эндогенного молочного белка и/или неблагоприятно воздействовать на секреторные молочные железы, рекомендуется, чтобы концентрация рекомбинантного полипептида составляла 3-50% от обычной концентрации коровьего молочного белка (например, 1-17 мг рекомбинантного полипептида на мл трансгенного молока), более предпочтительно 10-20% (например, 3-7 мг на мл) и наиболее предпочтительно 10-15% (например, 3-5 мг на мл) от обычного количества белка, продуцируемого с коровьим молоком. Такие предпочтительные интервалы определяют также рекомендуемый максимальный предел для вышеуказанного уровня белка, продуцированного с молоком трансгенной коровы.
Вышеуказанное связывание различных ДНК- последовательностей с образованием трансгена изобретения осуществляют стандартными методами, известными специалистам, или так, как указано здесь. После того как описанными способами конструируют трансген или перекрывающиеся фрагменты, кодирующие трансген, их используют для создания трансгенных животных.
Способы введения трансгенов или перекрывающихся фрагментов трансгена в эмбриональные клетки мишени включают микроинъекцию трансгена в пронуклеус оплодотворенных овоцитов или ядра ES-клеток животного. Такие способы хорошо известны специалистам для мышей. Или же трансген может быть введен животному инфицированием зигот ретровирусом, содержащим трансген (Jaenisch R. 1976, Proc. Natl. Acad. Sci. USA, 73, 1260-1264). Рекомендуемый способ заключается в микроинъекции оплодотворенных овоцитов. Согласно рекомендуемому способу, оплодотворенные овоциты вначале микроинъецируют стандартными методами. После этого их выращивают in vitro до момента получения "предимплантационного эмбриона". Рекомендуется, чтобы такой предимплантационный эмбрион содержал 16-150 клеток. Стадию эмбриона в 16-32 клеток обычно называют морула. Предимплантационные эмбрионы, содержащие более 32 клеток, обычно называются бластоцистами. Бластоцисты в целом характеризуются как демонстрирующие создание бластоцельной полости, обычно на стадии в 64 клетки. Способы выращивания оплодотворенных овоцитов до предимплантационной стадии включают разные методики [Gordon et al. 1984, Methods in Enzymology, 101, 414; Hogan et al. 1986, in Manipulating the Mouse Embryo, Cold Spring Harbor, N.Y. (для эмбриона мыши); Hammer et al. 1985, Nature, 315. 680 (для эмбрионов кролика и свиньи); Gandolfi et al. 1987, J. Reprod. Pert. 81, 23-28; Rexroad et al. 1988, J. Anim. Sci, 66, 947-953 (для эмбриона овцы); Eyestone W.h. et al. 1989, J. Reprod. Pert. 85, 715-720; Camous et al. 1984, J. Reprod. Pert. 72, 779-785; Heyman Y. et al. 1987, Theriogenology, 27, 5968 (для эмбриона коровы)] Такой предимплантационный эмбрион затем пересаживают соответствующей самке стандартными методами, которая рождает трансгенное или химерное животное в зависимости от стадии развития в момент введения трансгена. Как хорошо известно, могут быть выведены мозаичные животные с образованием чистой зародышевой линии трансгенных животных.
Поскольку частота введения трансгена часто низка, крайне желательно детектирование интеграции трансгена в предимплантационный эмбрион. В заявке раскрыты способы идентификации эмбрионов, в которых произошел трансгенез и имплантация которых приводит к созданию трансгенных животных. В таком способе из предимплантационного эмбриона удаляют одну или несколько клеток. При использовании равного деления рекомендуется не выращивать эмбрион после стадии морула (32 клетки). Деление предимплантационного эмбриона (Williams et al. 1986, Theriogenology, 22, 521-531) приводит к двум "полуэмбрионам" (полуморула или полубластоцит), один из которых способен к последующему развитию после имплантации соответствующей самке с развитием in utero. Хотя рекомендуется равное деление предимплантационного эмбриона, необходимо указать, что такой эмбрион преднамеренно или непреднамеренно может быть поделен и на неравные части на два полуэмбриона, необязательно состоящие из равного числа клеток. Все, что при этом необходимо, это чтобы один из эмбрионов, не подвергаемый анализу нижеприведенным способом, имел достаточное число клеток для нормального развития in utero. Не подвергаемый анализу полуэмбрион, для которого показана трансгенность, используют для создания популяции клонов трансгенных животных.
Один из каждых полуэмбрионов, образованных делением предимплантационного эмбриона, анализируют с целью определения, интегрирован ли трансген в геном организма. Каждый другой полуэмбрион составляют для последующей имплантации самке-реципиенту данного вида. В рекомендуемом методе детектирования трансгенеза на этой ранней стадии развития эмбриона используют полученные полуэмбрионы в сочетании с уникальной особенностью эндонуклеазы рестрикции Dpn I. Данный фермент распознает последовательность GATC в двунитевой ДНК, но только тогда, когда аденин в каждой цепи в пределах указанной последовательности метилирован у N-6. При использовании данного метода трансген, содержащий последовательность GATC, метилируют перед микроинъецированием путем переноса трансгена на соответствующей плазмиде при участии DAM+ штамма микроорганизма, такого, как E. coli MM 294, или непосредственным метилированием трансгена dam метилазой. Метилированный трансген (предпочтительно без каких-либо экзогенных последовательностей, таких, как плазмидный вектор) затем микроинъецируют в оплодотворенные овоциты (примерно 10-500 копий на пронуклеус, более предпочтительно 50-100 копий на пронуклеус). Полученные в результате оплодотворенные овоциты выращивают in vitro до предимплантационной стадии. В ходе этой ранней фазы роста и клеточного деления геномная ДНК реплицируется. Соответственно те копии метилированного трансгена, которые интегрированы в геном оплодотворенного овоцита, после репликации становятся неметилированными, в то время как любые неинтегрированные трансгены, которые все еще могут существовать после репликации, остаются метилированными (Lacks S. et al. 1977, J. Mol. Biol. 114, 153). Такой дифференцированный характер метилирования интегрированных в сравнении с неинтегрированными трансгенами позволяет идентифицировать, какой из оплодотворенных овоцитов обладает трансгеном, интегрированным в геном.
Идентификация предимплантационного эмбриона, содержащего интегрированный трансген, достигается анализом ДНК из каждого полуэмбриона. Такую ДНК обычно получают лизисом полуэмбриона и анализом выделенной в результате ДНК (Ninomiy T. et al. 1989, Molecular Reproduction and Development, 1, 242-248). Каждый образец ДНК обрабатывают ферментом Dpn I. После этого проводят реакцию полимеризации цепи с помощью полимеразы (Saiki et al. 1985, Science, 230, 1350-1354) с амплификацией всего или части трансгена. При амплификации полного трансгена для амплификации применяют два праймера удлинения, каждый из которых комплементарен противоположным нитям на разных концах трансгена. Однако, если амплифицируют не весь трансген, подбирают такие праймеры удлинения, что амплифицированный генный продукт перекрывает Dpn I сайт в трансгене. Если отщепления Dpn I не произошло, PCR-амплификация приводит к амплифицированным последовательностям заданного размера, в то время как праймер удлинения для тех трансгенов, которые не были расщеплены, не приводит к экспоненциальной амплификации. Как правило, Dpn I/PCR амплифицированную ДНК из полуэмбриона подвергают электрофорезу с последующей гибридизацией с меченым зондом, комплементарным к области трансгена между двумя праймерами удлинения. Это облегчает определение размера амплифицированных ДНК-последовательностей при наличии таковых и служит указанием на то, был ли трансген интегрирован в предимплантационный эмбрион, из которого получен полуэмбрион (далее называется "трансгенным полуэмбрионом"). В случае интеграции трансгена оставшийся необработанный трансгенный полуэмбрион трансплантируют родителю-реципиенту. После развития in utero трансгенное животное с целевым фенотипом, который придается интегрированным трансгеном, идентифицируют соответствующим методом in utеro или после рождения. Разумеется, в вышеприведенном методе могут быть использованы и другие эндонуклеазы рестрикции, способные расщеплять метилированные ДНК-последовательности, но неспособные расщеплять неметилированную форму последовательности распознавания.
Вышеприведенный метод с применением Dpn I требует присутствия в представляющем интерес трансгене последовательности GATC. В том случае, когда такая последовательность отсутствует, она может быть легко введена в трансген сайт-направленным мутагенезом (Kunkel T.A. 1985, Proc. Nail. Acad. Sci. 82, 488) или кассетным мутагенезом (Wells J.A. et al. 1985, Gene, 34, 315) при условии, что такой мутагенез не изменяет аминокислотной последовательности, кодируемой трансгеном (и не вызывает неуместных изменений в аминокислотной последовательности) и что любые созданные в результате кодоны функционируют в представляющем интерес трансгенном животном.
Вышеприведенные методы детектирования трансгенеза в предимплантационных эмбрионах представляют собой экономичные и сберегающие время методы создания трансгенных животных, поскольку их применение значительно уменьшает число беременностей, необходимых для продуцирования трансгенного животного, и значительно повышает вероятность того, что имплантированный эмбрион приведет к рождению трансгенного животного. Такие методы особенно важны для тех животных, у которых низкая частота трансгенеза, например для коров различных пород.
В альтернативном воплощении изобретения вышеприведенный метод детектирования трансгенеза в предимплантационных эмбрионах совмещен с этапами эмбрионного клонирования с целью создания популяции клонов трансгенных эмбрионов, которые впоследствии могут быть имплантированы самкам-реципиентам с продуцированием популяции клонов трансгенных животных, обладающих также одинаковым генотипом. В связи с этим необходимо указать, что трансгенные эмбрионы и/или трансгенные животные с одинаковым "генотипом" означает по существу идентичность геномной ДНК индивидуальных эмбрионов в популяции или индивидуумов в популяции животных. Тем не менее необходимо отметить, что в ходе митоза могут произойти разнообразные мутации, в результате которых могут возникнуть вариации в генотипе одной или нескольких клеток и/или животных. Таким образом, в популяции с одинаковым генотипом могут проявиться индивидуальные или субпопуляционные вариации.
После идентификации полуэмбриона, как трансгенного эмбриона, его клонируют. Эмбрионное клонирование может быть осуществлено различными путями. В одном из способов клонирования трансгенный полуэмбрион выращивают в той же или идентичной среде, что и применяемая для выращивания отдельных овоцитов до предимплантационной стадии. Образованный в результате "трансгенный эмбрион" (предпочтительно трансгенная морула) затем делят на "трансгенные полуэмбрионы", которые затем имплантируют самке-реципиенту с образованием популяции клонов двух трансгенных животных. Или же оба полученных полуэмбриона могут быть вновь выращены до предимплантационной стадии, поделены и опять выращены до стадии трансгенного эмбриона. Эту процедуру повторяют до тех пор, пока не будет получено необходимое число клонов трансгенных эмбрионов с одинаковым генотипом. Полученные трансгенные эмбрионы могут быть затем имплантированы самкам-реципиентам с продуцированием популяции клонов трансгенных животных.
В рекомендуемом способе клонирования трансгенный эмбрион клонируют ядерным переносом (Prather et al. 1988, Biol. Reprod. 37, 59 86; Roble et al. 1987, J. Anim. Sci. 64. 642-664). Согласно этому способу ядра трансгенного эмбриона трансплантируют в энуклеатированные овоциты, каждый из которых затем выращивают до стадии бластоциста. В этот момент трансгенные эмбрионы могут быть подвергнуты новому раунду клонирования с помощью ядерной трансплантации или же могут быть перенесены в родитель-реципиент для продуцирования трансгенного потомства с одинаковым генотипом.
Помимо вышеприведенных методов определения раннего трансгенеза, для обнаружения трансгенеза могут быть использованы и другие методы. Такие методы включают in utero и post oartum анализ ткани. Анализ in utero осуществляют несколькими методиками. В одной из них проводят трансвагинальную пункцию из полости амниона под эхоскопическим контролем (Bowgso et al. 1975, Bet. Res. 96, 124-127; Rumsey et al. 1974, J. Anim. Sci. 39, 386-391). При этом извлекают приблизительно 15-20 мл амниотической жидкости в интервале между 35-м и 100-м днем беременности. В указанном объеме амниотической жидкости содержится 1000 12000 клеток на мл, происходящих из урогенитального тракта, кожи и, возможно, легких развивающегося зародыша. Большая часть этих клеток мертва. Тем не менее такие клетки содержат геномную ДНК, которую подвергают PCR анализу на трансген как на показатель успешного трансгенеза. Или плодные клетки могут быть извлечены хорионной пункцией. Этот метод может быть проведен трансвагинально и под контролем эхоскопии. В этом методе для пункции плаценты животного-реципиента применяют иглу, в частности, для пунктирования плацентональных структур, фиксированных относительно стенок влагалища. Для коров такой отбор образца может быть осуществлен в пределах 60 дней беременности. Клетки хориона при необходимости отделяют от материнской ткани и подвергают PCR анализу на трансген, как показатель успешного трансгенеза.
Трансгенез может быть обнаружен и после рождения. В таких случаях интеграция трансгена может быть обнаружена биопсией приемлемой ткани, например, из уха или хвоста возможно трансгенного животного. Отбирают один-два сантиметра хвоста или пять-десять квадратных миллиметров уха с последующим саузерн блоттированием с зондом на трансген по методике Hogan et al. 1986, Manipulating the Mouse Embryo, Cold Spring Harbor Laboratory.
В том случае если рекомбинантный полипептид экспрессируется и секретируется в молоко трансгенной коровы, полученное в результате трансгенное молоко может быть использовано как таковое или же может быть подвергнуто дополнительной обработке для очистки рекомбинантного полипептида. Частично это зависит от содержащегося в трансгенном молоке рекомбинантного полипептида и конечного применения белка. Так, если рекомбинантный полипептид секретируется в трансгенное молоко для повышения питательной ценности коровьего молока, никакой дополнительной очистки, как правило, не требуется. Примером такой ситуации может служить пример, когда с коровьим молоком продуцируется человеческий лактоферрин в качестве добавки для контроля инфекций в кишечнике новорожденного человека и для улучшения усвоения железа. В других ситуациях может оказаться желательной частичная очистка с выделением конкретного полипептида из-за его питательной ценности. Так, например, человеческий лактоферрин, полученный в молоке трансгенной коровы, может быть частично очищен подкислением молока до pH 4-5 с осаждением казеинов. Растворимая фракция (сыворотка) содержит человеческий лактоферрин, который частично очищен.
Рекомбинантный полипептид, содержащийся в молоке трансгенной коровы, может быть также использован в пищевых составах. Особенно полезный пищевой состав представляет собой детское питание, содержащее один или несколько рекомбинантных полипептидов из трансгенного коровьего молока, которые либо питательны, либо обладают другими ценными свойствами. К примеру, детское питание, содержащее человеческий лактоферрин, обладает бактериостатическим действием, что помогает в борьбе с диареей у новорожденных. Аналогично рекомбинантные полипептиды, такие, как человеческий казеин и человеческий лизозим, могут быть также образованы в трансгенном коровьем молоке с приданием ему питательной ценности. В табл. 2 приведены компоненты обычного детского питания. Как показано в таблице, содержание белка колеблется в пределах 1,8-4,5 г на 100 ккал в питании. Таким образом, полный белок, включая рекомбинантный полипептид, должен охватываться значениями, основанными на существующих в США требованиях (см. табл. 2). Количество полного белка, включая рекомбинантный полипептид, может отличаться от вышеприведенных значений в зависимости от местных установок, где конкретное питание будет использоваться.
Помимо детского питания рекомбинантные полипептиды из трансгенного коровьего молока могут быть добавлены и в другие пищевые составы. Например, такие рекомбинантные полипептиды могут быть использованы в качестве добавок к обычным диетическим составам.
Если рекомбинантный полипептид предназначен для применения в фармацевтических целях, в этом случае прибегают к методам очистки, отвечающим такому применению. Подобные методы очистки зависят от конкретного подвергаемого очистке рекомбинантного полипептида, и они хорошо известны специалистам. Методы включают частичную очистку фракционированием казеинов с последующей хроматографией соответствующей фракции, содержащей рекомбинантный полипептид. Хроматографические методы включают: аффинную хроматографию, ионообменную хроматографию, гельфильтрацию и ВЭЖХ.
В описании представлен трансген для продуцирования человеческого лактоферрина (чЛФ) в молоке трансгенных коров. Человеческий лактоферрин представляет собой одноцепочечный гликопротеин, связывающий два иона железа (II). Секретируемый экзокринными железами (Mason et al. 1978, J. Clin. Path. 31, 316-327; Tenovuo et al. 1986, Infect. Immun. 51, 49-53) и полиморфоядерными нейтрофильными гранулоцитами (Mason et al. 1969, J. Exp. Med. 130, 643-658), этот белок функционирует как часть неспецифичной защитной системы хозяина путем ингибирования роста широкого спектра бактерий. ЧЛФ проявляет бактериостатическое действие путем образования хелатов с имеющимся в среде железом, делая этот важный металл недоступным для агрессивных микроорганизмов (Bullen et al. 1972, Br.Med. J. 1, 69-75; Griffiths et al. 1977, Infect. Immun. 15, 396-401; Spik et al. 1978, Immunology, 8, 663-671; Stuart et al. 1984, Int. J. Biochem. 16, 1043-1947). Этот эффект блокирован, если белок насыщен ионами железа (II). Некоторые исследования дают основание предполагать, что чЛФ оказывает непосредственное бактерицидное действие (Arnold et al. 1980, Infect. Immun. 28, 893-898; Arnold et al. 1977, Science, 197. 263-265; Arnold et al. 1981, Infect. Immun. 32, 655-660; Arnold et al. 1982, Infect. Immun. 35, 792-797; Bortner et al. 1986, Infect. Immun. 51, 373-377). Бактерицидное действие также ингибируется при насыщении белка железом. Никакого механизма бактерицидного действия чЛФ не было постулировано, хотя показано, что белок может повреждать внешнюю мембрану и изменять проницаемость внешней мембраны грамотрицательных бактерий (Ellison et al. 1988, Infect. Immun. 56, 2774-2781).
Лактоферрин является основным связывающим железо белком в молоке человека (присутствует в концентрации 1,5-1,7 мг/мл) и может принимать участие в адсорбции железа тонкой кишкой. Все присутствующее в грудном молоке железо, как полагают, связано с чЛФ и усваивается с очень высокой эффективностью (Hide D.W. et al. 1981, Arch. Dis. Child. 56, 172). Было постулировано, что высокое потребление связанного с чЛФ железа обусловлено наличием рецепторов в тонкой кишке. Были представлены данные, дающие основания предполагать существование этих рецепторов у обезьян резусов (Cox et al. 1979, Biochem. Biophys. Acta, 588, 120; Davidson L.A. et al. 1985, Fed. Proc. 18, 901). Существуют также свидетельства в пользу специфичных рецепторов лактоферрина в клетках слизистой тонкой кишки взрослого человека (Cox et al. 1979, Biochem. Biophys. Acta, 588, 120-128). Свободное железо было вовлечено в контроль над кишечной флорой (Mevissen-Verhage et al. 1985, Eur. J. Clin. Microbiol. 4, 14). В фекальных образцах вскармливаемых грудью младенцев по сравнению с младенцами, вскармливаемыми коровьим молоком с добавкой и без добавки железа, как показано, значительно понижено содержание бактерий кишечной группы, повышено содержание бифидобактерий и клостридий. Исследования in vitro молока человека показали его специфичное ингибирующее действие на E. coli (Brock et al. 1983, Infect, and Immunit. 40, 453). Для молока человека также показано специфичное ингибирующее действие на E. coli в тонкой кишке вследствие высокого содержания в нем связывающего железо белка, преимущественно чЛФ (Bullen et al. 1972, British Med. J. i, 69).
Таким образом, продуцирование человеческого лактоферрина в молоке трансгенной коровы может служить источником человеческого лактоферрина. Такой лактоферрин может быть выделен из трансгенного молока для приготовления составов. Или же трансгенное молоко может быть использовано целиком, предпочтительно после пастеризации в жидкой или сухой форме. Кроме того, полезное действие человеческого лактоферрина может быть усилено смешиванием человеческого лактоферрина или содержащего его трансгенного молока с человеческим лизозимом. Человеческий лизозим может быть одновременно продуцирован трансгенной коровой при введении одновременно с трансгеном чЛФ второго трансгена с созданием трансгенной коровы, способной продуцировать более одного рекомбинантного полипептида в трансгенном молоке. Или же трансгены могут быть введены корове последовательно. Если дело обстоит именно так, создают трансгенную корову с одним из трансгенов. После этого от трансгенной самки получают эмбрионные клетки, такие, как яйца и обрабатывают с введением второго трансгена, кодирующего второй полипептид. Яйца оплодотворяются с последующей микроинъекцией пронуклеуса полученной в результате зиготы. Необходимо подчеркнуть, что вышеприведенное сочетание более чем двух полипептидов в трансгенном коровьем молоке не ограничено вышеупомянутой комбинацией человеческого лактоферрина и лизозима. Таким образом, возможно создание трансгенных коров различных пород и получение трансгенного молока, причем таким трансгенным животным в трансгенном молоке продуцируется более одного рекомбинантного полипептида.
Определена полная аминокислотная последовательность чЛФ (Metz-Boutiqye et al. 1984, Eur. J. Biochem. 1451. 659-676). чЛФ включает два домена, каждый из которых имеет сайт связывания и N-связанный сайт гликозилирования. Эти домены отличаются гомологичностью по отношению друг к другу, что указывает на наследственную дупликацию гена и факт слияния. Кроме того, чЛФ имеет ярко выраженную гомологичность с другими членами семейства трансферринов (Metz-Boutique, supra, Pentecost et al. 1987, J. Biol. Chem. 262, 10134-10139). Расположение аминокислот, находящихся в сайтах связывания железа, определено рентгеноструктурной кристаллографией (Anderson et al. 1987, Proc. Natl. Acad. Sci. 84, 1769-1773). Частичная кДНК-последовательность для нейтрофильного чЛФ опубликована Rado et al. 1987, Blood, 70. 989 993. Имеется более чем 98% -ное соответствие между аминокислотной последовательностью, выведенной на основе кДНК, и тем, что было определено прямым анализом лактоферрина из молока человека. Недавно опубликованы данные о строении насыщенного железом лактоферрина и свободного от железа лактоферрина (Anderson et al. 1989, J. Mol. Biol. 209, 711-734: Anderson et al. 1990, Nature, 784 787).
В применяемом здесь значении "человеческий лактоферрин" означает полипептид с аминокислотной последовательностью по существу той, что приведена в работе Metz-Boutique et al. 1984, Eur. J. Biochem. 1451, 659-676 и показана на фиг. 8-9. Отмечаем, однако, что ранее определенная частичная аминокислотная последовательность человеческого лактоферрина обнаруживает ряд несоответствий между опубликованной последовательностью и тем, что получено. А именно существуют следующие несоответствия (номер аминокислоты соответствует последовательности фиг. 1-7, а в скобках указано положение ДНК, см. табл. 3).
Термин "человеческий лактоферрин", кроме того, включает аллельные вариации любой из этих последовательностей или рекомбинантные варианты человеческого лактоферрина, в которых одна или несколько аминокислот были модифицированы замещением, инсерцией или делецией одного или нескольких аминокислотных остатков.
В применяемом здесь значении "ДНК- последовательность человеческого лактоферрина" относится к ДНК-последовательности, кодирующей человеческий лактоферрин в вышеприведенном значении. Такая ДНК-последовательность человеческого лактоферрина может быть получена из библиотеки кДНК молочной железы человека или может происходить из генома человека. В примере 2 описано клонирование и нуклеотидная последовательность человеческого лактоферрина, происходящего из библиотеки кДНК молочной железы человека. ДНК-последовательность такого человеческого лактоферрина приведена на фиг. 1-9 и по существу соответствует последовательности, приведенной в работе Rado et al. 1987, Blood, 70. 989 993. Конструирование плазмид, содержащих способный экспрессироваться трансген, кодирующий чЛФ, описано в примерах. Одна из таких плазмид (cGP 1 HLF, иногда также называемая 16,8 HLF 3) содержит трансген, предназначенный для тканево-специфичной экспрессии в секреторных клетках молочной железы коровы.
Кроме того, в заявке описан трансген для получения человеческого сывороточного альбумина в молоке трансгенных коров. Человеческий сывороточный альбумин является сывороточным белком, содержащим 584 аминокислотных остатка (Minghetti et al. 1986, J. Biol. Chem. 261, 6747). Это наиболее распространенный белок сыворотки человека, который выполняет две очень важные физиологические функции. Сывороточный альбумин ответственен за примерно 80% общей осмотичности крови, а кроме того, разносит жирные кислоты между жировыми тканями.
Человеческий сывороточный альбумин применяют преимущественно для увеличения объема плазмы путем восстановления осмотического давления в сердечно-сосудистой системе. В настоящее время фракцию чСА, полученную термообработкой сыворотки, вливают большинству пострадавших от шока или травмы, включая большинство больных, подвергаемых сложным хирургическим операциям. В настоящее время чСА получают из плазмы крови человека в качестве побочного продукта процессов фракционирования крови для получения редких белков крови, таких, как факторы VIII и IX.
В применяемом здесь значении "человеческий сывороточный альбумин" означает аминокислотную последовательность, совпадающую с той, что приведена в работе Minghetti et al. ibid; Lawn et al. 1981, Nucl. Acids Res. 9, 6103. Это понятие также охватывает его вариации, включая рекомбинантные вариации человеческого сывороточного альбумина, в которых одна или несколько аминокислот были модифицированы замещением, инсерцией или делецией одного или нескольких аминокислотных остатков (Minghetti et al. 1986, J. Biol. ChEm. 261. 6747-6757). В некоторых случаях человеческий сывороточный альбумин может быть получен в молоке экспрессией трансгена, содержащего ДНК, кодирующую секреторную сигнальную последовательность чСА. Или же человеческий сывороточный альбумин может быть получен и секретирован клетками печени трансгенного животного с применением полностью гетерологичного трансгена, включающего геномную ДНК человека, кодирующую 5'-последовательность регуляции экспрессии, сигнал секреции человеческого сывороточного альбумина и структуральный ген, а также 3'-последовательность регуляции экспрессии. Как показано в примерах, содержащий такую гетерологичную последовательность трансген образуют гомологичной рекомбинацией in vivo перекрывающихся фрагментов трансгена с восстановлением гена чСА в трансгенном животном. Созданное таким путем трансгенное животное продуцирует человеческий сывороточный альбумин в своей сердечно-сосудистой системе.
В применяемом здесь значении "ДНК- последовательность человеческого сывороточного альбумина" означает ДНК-последовательность, кодирующую человеческий сывороточный альбумин в вышеприведенном определении. Такая ДНК- последовательность человеческого сывороточного альбумина может быть получена из l-HAI-HAI, l-HAL-3 W и lHAL-HI 4 методами Urano et al. 1986, J. Biol. Chem. 261. 3244-3251 и Urano et al. 1984, Gene, 32, 255-261 и приводимыми здесь в примерах.
ДНК-последовательность клонируют по методике примера 10, после чего обрабатывают с замещением на ген человеческого лактоферрина, закодированного в плазмиде cGP 1 HLF (также называемой p 16, 8 HLF 4). Из этой плазмиды получают трансген, содержащий 5'-последовательность регуляции экспрессии гена коровьего aS1-казеина в 16 kb, ДНК- последовательность человеческого сывороточного альбумина и фланкирующую 3'-область гена коровьего aS1-казеина в 8 kb. Такой трансген применяют для микроинъецирования в оплодотворенные овоциты коров различных пород. После раннего обнаружения трансгенеза бластоциты, содержащие трансген чСА, имплантируют самкам-реципиентам и ждут родов.
Пример 1. Конструирование зонда, специфичного для последовательностей коровьего aS1-казеина
A. Выделение хромосомной ДНК
Ткань
плаценты получают с бойни. Окружающую соединительную ткань удаляют и кусочки примерно в 30 г быстро замораживают в жидком N2. Хромосомную ДНК выделяют следующим образом. Ткань (30 г)
гомогенизируют (на льду) с 35 мл буфера 1, содержащего 300 мМ сахарозы, 60 мМ KCl, 15 мМ NaCl, 60 мМ Трис-HCl (pH 8,2), 0,5 мМ спермидина, 0,15 мМ спермина, 2 мМ ЭДТК, 0,5 мМ ЭГТК. Добавляют 65 мл
охлажденного на льду буфера 1, содержащего 1% NP 40, и смесь выдерживают 5 мин на льду. После центрифугирования 5 мин при 3000 x g осадок ополаскивают буфером 1, содержащим 1% NP 40. После повтора
стадии центрифугирования осадок вновь суспендируют в 5 мл буфера 1. Быстро добавляют 5 мл 0,5М ЭДТК. Конечный объем составляет 15 мл. Добавляют 0,15 мл 10%-ного раствора НДС. После перемешивания
добавляют PH-казу и T1 до конечной концентрации 0,4 мг/мл и 6 е/мл соответственно. После инкубирования 3 ч при 37oC добавляют протеиназу K до конечной концентрации 0,1 мг/мл. Полученную
смесь инкубируют 15 ч при 37oC. Затем смесь осторожно экстрагируют фенолом. Водную фазу отделяют и к ней добавляют 1/30 объема 3 М NaOAc (pH 5,2) и один объем изопропилового спирта. Осадок
(ДНК) ополаскивают 70% ным этанолом и медленно растворяют при 40oC в 0,5 мл 10 мМ Трис-HCl (pH 8), 1 мМ ЭДТК, при 4oC.
B. Амплификация последовательностей из
5'-фланкирующей области гена aS1-казеина
На основе последовательности, опубликованной в работе Yu-Lee et al. 1986, Nucl. Acids Res. 14, 1883-1902, синтезированы два ДНК-праймера. Праймер 1
расположен в положении 681 относительно основного сайта инициации транскрипции и имеет следующую последовательность:
5'-TCC ATG GGG GTC ACA AAG AAC TGG AC-3' (Seg. ID N 5)
Праймер 2
расположен в положении +164 относительно основного сайта инициации транскрипции и имеет следующую последовательность: 5'-TGA AGC TTG CTA ACA GTA TAT CAT AGG-3' (посл. ID. N 6). Первые восемь
нуклеотидов праймера не кодируются коровьим геномом, но содержат Hind III сайт рестрикции для облегчения последующего клонирования. Полученные праймеры гибридизуют с хромосомной ДНК и удлиняют в
присутствии дезоксинуклеотидов с помощью TAG-полимеразы. Спустя 3 мин смесь денатурируют одну минуту при 92oC, вновь гибридизуют 1,5 мин при 50oC и вновь инкубируют 2 мин при
повышенной температуре (68oC). Этот цикл повторяют 30 раз. После последнего цикла ДНК проверяют на наличие ожидаемых сайтов EcoRI. И размер фрагмента, и наличие сайта EcoRI соответствуют
ожидаемым. Затем фрагмент обрабатывают ферментом Кленова для репарации избыточных концов, обрабатывают киназой для присоединения фосфатных групп к концам фрагмента, инкубируют 10 мин при 65o
C с дезактивацией киназы и ферментов Кленова и, наконец, гидролизуют Hind III. Затем фрагмент субклонируют в pUC 19 (Yanisch-Perron et al. 1985, Gene, 33, 103 109), гидролизуют с помощью Smal и Hind
III. Формальное доказательство идентичности полученного фрагмента получено секвенированием частей этого субклона (после повторного клонирования в M 13 вектор). Определенная последовательность была
идентична опубликованной последовательности. Данный зонд затем был использован для отбора геномной библиотеки коровы с целью получения клонов, специфичных для последовательностей, фланкирующих
5'-область гена aS1-казеина.
C. Амплификация последовательностей из фланкирующей 3'-области гена aS1-казеина
Применен подход, аналогичный вышеприведенному. На основе
последовательности, опубликованной в работе Stewart et al. 1984, Nucl. Acids Res. 12, 3895-3907, синтезируют два праймера. 5'-праймер расположен сразу же в нисходящем направлении от кодирующей
последовательности, начинающейся в положении 713 кДНК-последовательности. Праймер имеет следующую последовательность:
5'- GAG GGA CTC CAC AGT TAT GG-3' (Seq. ID N. 7).
Другой
праймер расположен в положении 1070 кДНК-последовательности и имеет следующую последовательность:
5'- GCA CAC AAT TAT TTG ATA TG-3' (Seq. N. 8).
Полученные праймеры гибридизируют с хромосомной ДНК и область между обоими праймерами амплифицируют по вышеприведенной методике. Полученный фрагмент был примерно на 900 п.о. длиннее, чем ожидалось. Анализ последовательности показал, что между нуклеотидами 737 и 738 кДНК присутствует интрон указанного размера. Амплифицированный фрагмент обрабатывают полимеразой Кленова с репарацией избыточных концов и обрабатывают киназой с присоединением к концам фрагмента фосфатных групп. Затем фрагмент встраивают в pUC 19, предварительно обработанную с помощью Smal.
D. Отбор фаговой библиотеки
коровы для Фланкирующих последовательностей aS1-казеина
Коровья геномная библиотека, сконструированная в EMBL 3, получена от Dr. M.Groenen, Agricultural University, Wageningen, Netherlands, и
отобрана следующим образом. Титр частиц бактериофага определен на Escherichia coli MB 406 пермессивном штамме-хозяине (Stratagene Inc.). Для этого готовят несколько разбавлений фага в SM буфере (50 мМ
Трис-HCl с pH 7,5, 100 мМ NaCl, 10 мМ MgSO4 0,01% желатина) и смешивают с 200 мкл MB 406 (O.D.550 0,9); спустя 20 мин при 37oC покрывают 3 мл агарозы (среда
Луриа- Бертани, 0,8% агарозы), смесью покрывают LB-пластинки и инкубируют примерно сутки при 37oC.
Примерно 600000 фагов затем добавляют к 400 мл MB 406. Следующий этап заключается в переносе фага на нитроцеллюлозные фильтры. Пластины выдерживают 1 ч при 4oC. Нитроцеллюлозные фильтры (S&S) помещают на верхний слой агарозы и отмечают точное положение. После подъема фильтры замачивают в течение (1) 30 мин в денатурирующем буфере (1,5 М NaCl, 0,5 М NaOH), (2) 5 мин в нейтрализующем буфере (1,5 М NaCl, 0,5 М Трис-HCl с pH 8). После ополаскивания 2xSSPE (360 мМ NaCl, 20 мМ NaH2PO4 2 мМ ЭДТК) фильтры спекают 2 ч под вакуумом при 80oC.
Предгибридизацию фильтров проводят в буфере, содержащем 50% формамида, 5x раствора Денхардта (0,1% фиколла, 0,1% поливинилпирролидона, 0,1% бычьего сывороточного альбумина), 5xSSPE, 0,1% НДС и 100 мкг/мл ДНК денатурированной спермы лосося в течение 2 ч при 42oC. Гибридизацию осуществляют в том же буфере во встряхиваемой водяной бане при 42oC в течение примерно суток. Вышеописанный зонд метят с помощью набора неупорядоченного мечения праймера фирмы Boehringer Mannheim. После гибридизации в течение примерно суток фильтры при комнатной температуре трижды промывают 2xSSC, 0,1% НДС.
Пленки Кодак XAR облучают примерно сутки при 70oC амплифицирующими экранами (Dupont). Предполагаемые положительные образцы удаляют с пластин и помещают примерно на сутки в SM буфер при 4oC. Полученный продукт наносят на пластины вышеописанным способом и ДНК выделяют по методике получения лизата на пластинке (Maniatis T. et al. 1982. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor, N.Y.). К верхнему слою агарозы добавляют 5 мл SM буфера, после 2-часового осторожного встряхивания буфер удаляют и центрифугируют 10 мин при 4000 об/мин и 4oC. Надосадочную жидкость переносят в стерильные пробирки, добавляют РНКазуA и ДНКазуI (обе до конечной концентрации 1 мкг/мл) и все инкубируют 30 мин при 37oC. Добавляют один объем 20% полиэтиленгликоля, 2, 5 М раствора NaCl и выдерживают 1 ч на льду. Центрифугированием 30 мин при 4oC и 4000 об/мин получают осажденные частицы бактериофага. Частицы суспендируют в 500 мл SM буфера, добавляют НДС (конечная концентрация 0,1% ) и ЭДТК (конечная концентрация 5 мМ) и все инкубируют 15 мин при 68oC. Белок извлекают один раз экстрагированием фенолом и один раз хлороформом. Осаждение бактериофага осуществляют одним объемом изопропанола. Фаговую ДНК один раз промывают 70%-ным этанолом и растворяют в 50 мл буфера Трис-HCl (pH 7,5), 1 мМ ЭДТК.
Рестрикционный ферментивный анализ, электрофорез в геле агарозы, перенос ДНК с геля на нитроцеллюлозный фильтр и Саузерн блоттирование проводят стандартными методами (Maniatis et al. 1982, Molecular Cloning: A Laboratory Manual). Гибридизацию с зондами (см. ниже) проводят по той же методике, что и вышеприведенные условия отбора.
E. Выделение клонов, содержащих фланкирующую 5'-область
коровьего S1-казеина
Три предполагаемых клона идентифицированы применением зонда и методик, приведенных выше. После еще одного цикла отбора анализируют чистый рекомбинантный бактериофаг.
Гидролиз клонированной ДНК SalI. EcoRI и SalI/EcoRI (двойной гидролиз) и гибридизация с вышеописанным зондом показали наличие идентичных вставок во всех трех клонах. Вставка размером 18 kb (частичный
Sau3A фрагмент отрезанный SalI). Транскрипционная ориентация в клоне определена гибридизацией вышеописанных фрагментов рестрикции с вышеописанным зондом 1 и с Nco I-NsiIII фрагментом зонда 1. В
результате обнаружена область примерно 16 kb в восходящем направлении от начала транскрипции. В нисходящем направлении от начала транскрипции находились еще 1,9 к.п.о. Дополнительное секвенирование
области -103 +300 подтвердило идентичность клона. Анализ с этидиумбромидом описанных фрагментов рестрикции подтвердил ориентацию клона в EMBL векторе. Последующий анализ клона со следующими ферментами
рестрикции: NcoI, PstI, KpnI, BamHI, HindIII, BglII) позволил получить карту рестрикции фланкирующей 5'-области гена коровьего Si-казеина, приведенную на фиг.10.
F. Выделение клонов,
содержащих фланкирующую 3'-область коровьего aS1-казеина
С использованием ранее приведенной методики гибридизации с помощью зонда 3' aS1-казеина отобраны дубликатные нитроцеллюлозные фильтры
с начальной стадии нанесения бактериофага, использованной для выделения 5'-клонов. После двух циклов отбора идентифицировано 8 положительных клонов. Фаговая ДНК получена вышеприведенным методом.
Последующий гидролиз рестриктазами SaiI, EcoRI и SalI/EcoRI и гибридизация по Саузерну с 3' aS1-зондом показали идентичность вставок в семи из восьми клонов. Один клон, содержащий EcoRI вставку в 18,5
kb, подвергнут дальнейшему анализу с помощью ферментов рестрикции BsteII и BamHI. Карта рестрикции этого клона приведена на фиг.11.
Пример 2. Клонирование гена человеческого
лактоферрина
A. Материалы
Эндонуклеазы рестрикции, T4 лигаза и T7 полинуклеотидная киназы получены от фирмы Boehringer-Mannheim, New England или Biolabs или Bethesda Research
Laboratories. Радиоизотопы поставлены фирмой Amersham. кДНК библиотека молочной железы человека в бактериофаге l-gTll получена от фирмы Clontech, Inc. Palo Alto, Calif.
B. Выделение
гена человеческого лактоферрина
Библиотека молочной железы человека отобрана стандартным методом гибридизации бляшек (Maniatis et al. 1982, Molecular Cloning: A Laboratory Manual) с помощью
трех синтетических олигомеров. Два олигомера являются 30-мерами, соответствующими кДНК последовательности по Rado et al. supra, у аминокислот с положениями 436 445 и 682 691. Третий олигомер
представляет собой 21-мерный зонд "наилучшего угадывания", основанный на вырожденности кодона и кодирующий аминокислотную последовательность чЛФ между аминокислотными остатками 18 и 24. Соответственно
олигомеры имеют следующие последовательности:
(1) 5'- CTTGCTGTGGCGGTGGTTAGGAGATCAGAC-3' (Seg. ID N: 9)
(2) 5'- CTCCTGGAAGCCTGTGAATTCCTCAGGAAG-3' (Seg. ID N: 10)
(3)
5'- ACCAAGTGCTTCCAGTGGCAG-3' (Seg. ID N: 11).
Меченные радиоактивными изотопами зонды (Crouse et al. 1983, Methods Enzymol. 101. 78-98) использованы для отбора дубликатных фильтров. Фильтры промывают при конечной концентрации в 2 X SSC, 37oC.
C. Анализ нуклеотидной последовательности
Фрагменты ДНК выделяют с применением низкоплавкой агарозы
(Crouse et al. supra) и субклонируют в бактериофаг M 13 mp 18 или M 13 mp 19 (Messing et al. 1983, Methods Enzymol. 101, 20-78). Последовательность определяют с помощью фермента Секвеназы
(модифицированная T7 ДНК- полимераза) (Tabor et al. 1987, Proc. Natl. Acad. Sci. USA, 84, 4767-4771). Все реакции проводят в соответствии с инструкциями изготовителя (US Biochemicals).
Последовательность приведена на фиг. 1-7. Последовательность чЛФ гидролизуют с помощью HindIII и EcoRI (присутствуют в окружающих фаг последовательностях) и субклонируют в HindIII и EcoRI сайт
плазмиды pUC 19 с образованием pUS 119 Lacto 4,1. Данный клон содержит полную кодирующую последовательность зрелой формы чЛФ, но не имеет полной сигнальной последовательности.
Пример
3. Конструирование CAT векторов коровьего aS1-казеина
Для определения того, имеют ли полученные в примере 1 фрагменты aS1-казеина промотор и другие компоненты, необходимые для экспрессии
гетерологичного гена, конструируют экспрессионные плазмиды, содержащие различные количества фланкирующих 5'- и 3'-областей гена aS1-казеина. В данных векторных конструктах в качестве гетерологичного
гена применяют ген хлорамфениколацетилтрансферазы (CAT). CAT-ген применим для детектирования уровня экспрессии конструкта, содержащего гетерологичный ген, поскольку обычно не присутствует в клетках
млекопитающего и придает им легко определяемую ферментивную активность (Corman et al. 1983, Mol. Cell. Biol. 2, 1044-1051), который может быть количественно определен в клетках или в животном,
содержащих экспрессируемый ген.
А. ДНК-последовательности
Из фланкирующего геномного 5'-клона примера 1 PCR амплификацией выделяют в виде Nco I-HindIII фрагмент
(приблизительно 830 п.о.). aS1-казеиновый промотор размером 681 п.о. плюс первый некодирующий экзон, плюс первая прерывающая последовательность (интрон) примерно в 150 п.о. Данный фрагмент
идентифицирован как фрагмент 1 на фиг12. Последовательности праймеров состоят из:
5'-TCCATGGGGGTCACAAAGAACTGGAC-3' (Seg. ID N: 12) и
5' TGAAGCTTGCTAACAGTATATCATAGG-3' (Seg. ID N: 13),
о чем сделан вывод на основании последовательности, опубликованной Yu-Lee et al. 1986, Nuc. Acids Res. 14, 1883 1902.
Из коровьего фланкирующего геномного 3'- клона примера 1 PCR амплификацией выделена фланкирующая 3'-последовательность aS1-казеина примерно в 1,6 kb (фрагмент 2, фиг. 12). Данная область содержит ранее описанный сигнал сплайсинга в пределах нетранслируемой 3'-области гена aS1-казеина. Фрагмент 2 субклонирован в SmaI сайт плазмиды pUC19.
Последовательности праймера состоят из:
5'-GAGGGACTCCACAGTTATGG-3' (Seg, ID N: 14) и
5'-GCACACAATTATTTGATATG-3' (Seg. ID N: 15),
о чем сделан вывод на основании последовательности, опубликованной Stewart et al. 1984, Nucl. Acids Res. 12, 3895 3907.
Для получения pMH-I синтезирован и внедрен в pUC 18 вместе с уникальными сайтами рестрикции, фланкирующими обе стороны плазмиды, гибридный сигнал сплайсинга, содержащий 3' сплайс сайт гена иммуноглобулина (Bothwell et al. 1981, Cell, 24, 625-637). Данная плазмида приведена на фиг.15. Сайты NcoI и HindIII созданы такими, что лигирование с фрагментом 1 из бычьего 5' геномного клона приводит к функциональной гибридной сплайс-последовательности (фиг.25).
Последовательность полиаденилирования получена из вируса SV 40 в виде BamHI-DraI фрагмента (фрагмент 3 на фиг.12), выделенного из pRSVcat (Gorman C.M. et al. 1982, Proc. Natl. Acad. Sci, 19, 6777-6781).
Бактериальная последовательность, кодирующая CAT, субклонирована в pUC19 в виде PstI-BamHI фрагмента.
B. Конструирование pSl 3'5'CAT
Фрагмент 1aS1-казеинового промотора субклонирован в pMH-1 (фиг.15) между сайтами NcoI и HindIII с образованием pMHSl 5'flank.
Последовательность SV 40 полиаденилирования (фрагмент 3) субклонируют в виде BamHI-DraI фрагмента в pUC 19 сразу же за фланкирующей aS1- казеиновой 3'-последовательностью (фрагмент 2) с образованием pUC19 3' UTR/SV 40. Это позволило удалить непрерывный EcoRI-SalI фрагмент (содержащий фланкирующую 3'-последовательность и поли-(A) последовательность), который был субклонирован в pMH-1 с образованием pMHSl3'UTR (фиг.13), использованную впоследствии для конструирования pMHSI 3'UTR hlf, содержащей кодирующие человеческий лактоферрин последовательности.
EcoRI-SalI последовательность (фрагменты 2 и 3) субклонированы в EcoRI-SalI сайты pMHS15'flank с образованием pSl3'5'flank.
PstI-BamHI CAT фрагмент (фрагмент 4 на фиг.13) после дефосфорилирования BamHI сайта ферментом Кленова субклонируют в pSl 3'5'flank (фиг.13) между сайтами PstI и SmaI с образованием pSl3'5'CAT.
C. Конструирование pSl5'CAT
Фрагмент CAT (фрагмент 4 на фиг.13, PstI-BamHI) и SV40 фрагмент полиаденилированы (фрагмент 3 на фиг.12, BamHI-DraI) субклонируют в PstI и SmaI сайты pMHSl5'flank с образованием pSl5'CAT (фиг.14).
D. Анализ на продуцирование CAT
Каждую из полученных CAT-плазмид трансфектируют в клетки 293 S человека (Graham F.L. et al. 1977, J. Gen. Virol. 36, 59-72) методом соосаждения
фосфатом кальция (Gorman C.M. et al. 1983, Science, 221. 551; Graham F.L. et al. 1973, Virology, 52, 456-467). Клетки собирают спустя 44 ч после трансфекции и анализируют на CAT активность (Gorman
C.M. et al. 1982, Mol. Cell. Biol. 2, 1011; deCrombrugghe B. et al. 1973, Nature [London] 241, 237-251 в модификации Nordeen S. K. et al. 1987, DNA, 6, 173-178). Контрольная плазмида, экспрессирующая
CAT под действием мгновенного раннего промотора цитомегаловируса (Boshart M. et al. 1985, Cell, 41, 521), трансфектирована в 293 S клетки человека для анализа эффективности трансфекции.
В указанных клетках экспрессируют pSl3'5'CAT на уровне примерно в 30 - 100 раз ниже, чем для контрольной плазмиды, но достаточно выше фона. Анализ с применением праймера удлинения указал на инициацию транскрипции в ожидаемой области.
При трансфекции pSl5'CAT в 293S клетки также обнаружена экспрессия.
Пример 4. Коровий aS1-казеин/человеческий лактоферрин
экспрессионная космида cGP1HLF
A. Конструирование ДНК-последовательностей
Коровья aS1-казеиновая фланкирующая 5'-последовательность в 16 kb выделена из коровьей геномной библиотеки
(фаг GP1) в виде SalI-BglII
фрагмента. BglII сайт лежит в сочленении первого интрона и второго экзона гена a S1-казеина.
Сигнальную последовательность коровьего aS1-казеина (Stewart et al. 1984, Nucl. Acids Res. 12, 3895) получают из синтетической ДНК, синтезированной на синтезаторе Cylone Plus® (Millgen/Biosearch I), и она содержит полную сигнальную последовательность плюс Xhol и Cla I сайты, присоединенные к 5'-концу, и Nael к 3'- концу (фрагмент 8, фиг.16).
Расщепление pUC119 Lacto 4.1 ферментом EaeI раскрывает плазмиду точно у кодона для первой аминокислоты зрелого чЛФ. Обработка ферментом Кленова использована для заполнения в избыточном 5'-конце. Дальнейший гидролиз ферментами AccI и EcoRI дает два фрагмента: (a) EaeI AccI фрагмент, содержащий первые 243 п.о. зрелого чЛФ (фрагмент 5, фиг.18) и (Ь) смежный AccI EcoRI фрагмент (фрагмент 6, фиг. 18) размером 1815 п.о. содержащий всю оставшуюся кодирующую последовательность, кроме пяти концевых кодонов.
Получен синтетический линкер, содержащий последние пять кодонов чЛФ, начинающийся у EcoRI сайта и выходящий на четыре основания за стоп-кодон. К 3'-концу добавлен KpnI сайт (фрагмент 7 на фиг. 18).
Из геномной библиотеки коровы выделен EcoRI 3'-фрагмент в 8,5 kb (фиг. 11), содержащий последовательности, начинающиеся сразу же в нисходящем направлении от области кодирования αS1-казеина и BstEII сайта примерно за 350 п.о. от 5'-конца. Этот фрагмент субклонирован в pMH-1 по EcoRI сайту с образованием pMH 3'Е 10 SalI сайт примыкает к 3'- EcoRI сайту.
B. Конструирование cGP 1 HLF
В EcoRI-KpnI сайты pMH3'UTR (фиг. 16) субклонируют чЛФ 3'-линкер (фрагмент 7, фиг.18) с образованием
pMH3'UTRhLF2linker (фиг. 16).
Затем синтетическую сигнальную последовательность коровьего aS1-казеина (фрагмент 3) субклонируют в XhoI и SmaI сайты pMH3'UTRhLF2linker с образованием pSl 3'hLFl/2L (фиг.17).
Два кодирующих чЛФ фрагмента (фрагменты 5 и 6 на фиг.18) субклонируют в NaeI и EcoRI сайты pSl3'hLFl/2L (фиг.17) с образованием pSl3'UTRhLF (фиг. 18).
Из pMH 3'Е 10 выделяют большой 3'UTR фрагмент a S 1-казеина (фиг.16) в виде BstEII-SalI фрагмента и субклонируют в те же сайты pSl 3'UTRhLF с образованием phLF3'10 kb (фиг.19).
Космиду cGP1HLF получают в результате лигирования фрагментов (фиг.20):
(1) фланкирующую 5'-последовательность размером 16 kb из фага GP 1 (пример 1, фиг.10) модифицируют
присоединением двух линкерных адаптеров. Сайт SalI у 5'-конца лигируют с NotI-SalI линкером. Сайт BglII у 3'-конца лигируют с BglII-XhoI линкером;
(2) область кодирования чЛФ, фланкированную
у 5'-конца сигнальной последовательности aS1-казеина и у 3'-конца фланкирующей 3'-последовательностью aS1-казеина размером примерно 8,5 kb, выделяют из phLF3'10 kb в виде XhoI-SalI фрагмента. Сайт
SalI у 5'-конца лигируют с SalI-NotI линкером;
(3) космиду pWE15 (Stratagene, Inc.) переводят в линейную форму в присутствии NotI.
Фрагменты (1), (2) и (3) лигируют друг с другом и трансфектируют в бактерию с помощью лямбда-упакованных экстрактов (Stratagene, Inc.) с получением cGP1HLF.
Пример 5. Экспрессионные плазмиды коровьего aS1-казеина/чЛФ
A. Конструирование pSl3'5'hLF
HindIII-SalI фрагмент из pl3'UTRhLF субклонируют в те же сайты pMHSl5'flank с образованием pSl3'5'hLF (фиг.20). Полученная плазмида состоит из
последовательности промотора коровьего aS1-казеина размером 681 п.о. гибридного интрона aS1-казеин/IgG, сигнальной последовательности aS1-казеина, области кодирования чЛФ, фланкирующей
3'-последовательности aS1-казеина размером примерно 1,6 kb и последовательности области позднего полиаденилирования SV 40.
В. pSl5'hLF
Плазмиду pSl3'5'hLF (фиг. 20)
обрабатывают ферментами KpnI и BamHI на границе с фланкирующей 3'-последовательностью aS1-казеина размером 1,6 kb. Более крупный фрагмент вектора очищают, дефосфорилируют по Кленову и после
самолигации получают pSl5'hLF.
C. Радиоиммунный анализ на чЛФ
Обогащенную иммуноглобулином фракцию асцитной жидкости моноклональных антител к человеческому лактоферрину, не
вступающих в перекрестную реакцию с коровьим или мышиным белком, получают осаждением 50%-ным сульфатом аммония и соединением с CNBr-активированной сефарозой 4 B (20 мг белка на 1 г сефарозы). Шарики
сефарозы суспендируют (2 мг/мл) в фосфатном буферном солевом растворе (ПБС; 10 мМ фосфата натрия, 0,14 М NaCl, содержащего 10 мМ ЭДТК, 0,1% (мас. /об. ) Polylorene и 0,02% (мас./об.) NaN3,
pH 7,4). Суспензии сефарозы (0,3 мл) инкубируют 5 ч при комнатной температуре посредством вращения типа "голова над головой" с образцом (обычно 50 мкл) в полистирольных пробирках на 2 мл. Шарики
сефарозы затем промывают солевым раствором (5 раз по 1,5 мл) и инкубируют 16 ч при комнатной температуре с 50 мкл (1 кБк)125I-меченных, очищенных аффинной хроматографией поликлональных
антител кролика к человеческому лактоферрину вместе с 0,5 мл ПБС, 0,1% (мас./об.) Твин-20. После этого сефарозу вновь промывают солевым раствором (4 раза по 1,5 мл) и определяют связанную
радиоактивность. Результаты выражают в виде процента связывания добавленных меченных антител. Содержание лактоферрина в образцах выражают в наномолях с использованием в качестве стандарта очищенного
молочного лактоферрина человека (серийные разбавления в ПБС, 10 мл ЭДТК, 0,1% (мас./об.) Твин-20.
Повторные испытания стандарта в различных случаях выявили высокую воспроизводимость данного РИА, внутри- и межаналитические коэффициенты вариации были в интервале 5 10% Человеческий лактоферрин в количестве всего лишь 0,1 нанограмма легко обнаруживается таким РИА.
D.
Экспрессия в 293S клетках
Клетки 293S трансфектируют вышеуказанными чЛФ плазмидами по приведенной выше методике (1 мкг CMV-CAT плазмиды сотрансфектируют в качестве контроля эффективности
трансфекции). Через 44 ч после трансфекции из клеток удаляют среду и анализируют на чЛФ вышеприведенным методом, РНК выделена по методике Stryker et al. 1989, EMBO J. 8, 2669. Результаты могут быть
суммированы в виде следующего.
1. Эффективность трансфекции одинакова для двух чЛФ плазмид.
2. чЛФ экспрессируется в клетках и секретируется в среду. В обоих случаях содержание составляет примерно 0,4 мкг/мл среды при использовании 3x106 клеток.
3. Белок проявляет себя так же, как и чЛФ в образце молока человека реакцией дозы при определении количества связанных с125I-антилактоферрином антител.
4. На основании вестерн блоттинга белок имеет примерно тот же размер (80 кД), что и в образце молока человека.
5. на основании нозерн блоттинга чЛФ РНК, продуцируемая в клетках, имеет правильные размеры и ее содержание одинаково для обеих плазмид.
Полученные данные показывают, что эти две плазмиды способны экспрессировать чЛФ. По всем применяемым стандартам белок идентичен чЛФ, присутствующему в молоке человека. Действие гетерологичной сигнальной последовательности проявляется в том, что она промотирует секрецию белка из клеток в среду. A казеиновые регуляторные последовательности/использованные в данных плазмидах, промотируют экспрессию гетерологичного гена.
Пример 6. In vitro созревание, оплодотворение и выращивание коровьих овоцитов
Незрелые овоциты получают в больших количествах (400-600 в день)
отсасыванием фоликул из яичников, получаемых со скотобойни. Незрелые овоциты выращивают in vitro до момента, когда их можно оплодотворять. После "созревания" овоциты оплодотворяют спермой, также
созревавшей или "ставшей дееспособной" in vitro. Пронуклеус оплодотворенного овоцита затем инъецируют в трансген, кодирующий экспрессию и секрецию человеческого лактоферрина. Зиготы, полученные в
результате такого оплодотворения in vitro, затем выращивают до стадии морула или бластоциста (5-6 дней) в среде, приготовленной или "кондиционированной" тканями яйцевода. Затем бластоцисты переносят
нехирургическим путем реципиенту из крупного рогатого скота для продолжения беременности или анализируют вышеприведенным методом на интеграцию трансгена.
In vitro созревание (IVM). Яичники получают сразу же после забоя с местной скотобойни и из них извлекают овоциты. Или же овоциты получают от живого крупного рогатого скота хирургическим, эндоскопическим или трансвагинальным ультразвуковым путем. Во всех случаях овоциты отсасывают из фолликул яичника (диаметр 2-10 мм). После промывания овоциты помещают в среду созревания, состоящую из M199 с добавкой 10% плодной сыворотки теленка и инкубируют 24 ч при 39oC (Sirard et al. 1988, Biol. Reprod. 39, 546-552).
In vitro оплодотворение (IVF). Зрелые овоциты оплодотворяют свежей или размороженной спермой. Сперму готовят к оплодотворению, получая в начале популяции спермы, обогащенной по подвижности в результате разделения методом "всплывания" (Parrish et al. 1986, Theriogenology, 25. 591-600). Подвижную сперму затем вносят в среду оплодотворения, состоящую из модифицированного раствора Тайроуда (Parrish et al. 1986, supra) с добавкой гепарина для индукции вызревания спермы (Parrish et al. 1988, Biol. Reprod. 38. 1171-1180). Обретение дееспособности является конечным моментом процесса созревания спермы, существенным для оплодотворения. Сперму и овоциты совместно выдерживают 18 ч. Важным признаком данного метода IVF является то, что (в случае размороженной спермы) устойчивые, воспроизводимые результаты достигаются после того, как были определены оптимальные условия оплодотворения для конкретной семенной жидкости (Parrish et al. 1986, supra).
In vitro выращивание (IVC). Обычные системы выращивания, предназначенные для развития мышиной, кроличьей или человеческой яйцеклетки, не поддерживают развитие коровьего эмбриона после стадии в 8-16 клеток. Эта трудность преодолена предварительным кондиционированием тканью яйцевода среды для выращивания. Среда, кондиционированная тканью яйцевода, поддерживает коровий эмбрион после стадии в 8-16 клеток до стадии бластоциста in vitro (Eyestone and First, 1989, J. Reprod. Pert. 85, 715-720).
Доказана невосприимчивость коровьих эмбрионов к выращиванию in vitro. Это частично проистекает из существования "блока" к делению in vitro на стадии в 8-16 клеток. Такой блок может быть обойден выращиванием эмбрионов в яйцеводах кроликов (обзор см. Boland, 1984, Theriogenology, 21, 126-137) или овец (Willadeen, 1982, in "Mammalian Egg Transfer, E. Adams, ed. pp.185-210; Eyestone et al. 1987, Theriogenology, 28, 1-7). Однако такая альтернатива in vivo менее чем идеальна в том, что (1) требует содержания большого числа животных-реципиентов, (2) требует хирургического вмешательства для получения доступа в яйцеводы для переноса и вторичного хирургического вмешательства (или забоя) для извлечения эмбрионов, (3) редко когда удается извлечь все перенесенные эмбрионы и (4) доступ к эмбрионам в зоне выращивания для наблюдения или обработки полностью исключен. Отсутствие систем культивирования in vitro препятствовало развитию различных методов (таких, как перенос гена пронуклеусной инъекцией), мешая накоплению необходимой информации о хронологии и онтогенезе развития теленка и усложняя процесс выращивания эмбриона до стадии, достаточной для нехирургического переноса эмбриона и совместимой с методами криоконсервации (например, до стадии поздней бластоцисты).
Коровьи эмбрионы не поддавались попыткам их выращивания in vitro с преодолением "блока" в 8-16 клеток, пока Camous et al. 1984, J. Reprod. Fert. 72, 479-485 не показали возможность деления до 216 клеток при совместном выращивании эмбрионов с трофобластичной тканью.
Методика совместного выращивания была расширена применением ткани яйцевода на основании способности гомо- или гетерояйцевода поддерживать развития от зиготы до бластоцисты. Так, коровьи эмбрионы, выращиваемые совместно с тканью яйцевода или в среде, кондиционированной тканью яйцевода, развивались in vitro от зиготы до бластоцисты (Eyestone and First, 1989, J. Reprod. Fert. 85, 715-720; Eyestone W.H. 1989, "Factors affecting the development of early bovine embryos in vivo and in vitro" Ph. D. Thesis, University of Wisconsin). Бластоцисты были созданы в такой системе после сверховуляции и искусственного осеменения или in vitro в результате созревания и оплодотворения незрелых овоцитов. Созданные таким путем бластоцисты привели к беременности и рождению телят после переноса животным-реципиентам. Результаты см. в табл. 4.
Таким образом, при ежедневном начальном сборе в 500 овоцитов можно ожидать примерно 55 результативных беременностей.
Приготовление ткани яйцевода, совместное выращивание и кондиционирование среды
1. Получить яйцеводы коровы после забоя или сальпингэктомии.
2. Собрать ткань полости осторожным соскребанием стеклянной пластинкой свежего яйцевода.
3. Промыть ткань 5 раз в 10 мл модифицированного раствора тиродесгепеса (Parrish et al, 1988, Biol. Reprod. 38, 1171-1180).
4. Повторно суспендировать гранулу ткани в M199 + 10% плодной сыворотки теленка в отношении 1 объем ткани: 50 объемов среды.
5. Суспензия ткани может быть использована для совместного выращивания эмбриона.
6. Или же среда может быть кондиционирована в течение 48 ч. После центрифугирования суспензии надосадочная жидкость может быть использована в качестве среды для выращивания эмбриона. При желании кондиционированная среда может храниться при -70oC. При выращивании эмбриона кондиционированную среду следует использовать без разбавления (Eyestone, 1989, ibid).
Пример 7. Микроинъецирование чЛФ-трансгена в коровий пронуклеус
ДНК-фрагмент, содержащий звено экспрессии чЛФ, выделяют
из вектора с помощью соответствующих ферментов рестрикции и отделяют на геле агарозы. Фрагмент очищают электроэлюированием, экстракцией фенолом и хлороформом и осаждением этанолом (Maniatis et al.).
Фрагмент растворяют и диализуют в 10 мМ Трис-HCl, 0,1 мМ ЭДТК (pH 7,2) при концентрации 1 2 мкг/мл. Иглы для микроинъекций заполняют диализованным раствором ДНК.
Перед оплодотворением in vitro лишние клетки отделяют от яиц либо интенсивным перемешиванием 2 мин при максимальной скорости, либо прогонкой яиц несколько раз сверху вниз в стандартной микропипетке. Коровий пронуклеус в принципе инъецируют как мышиный пронуклеус (Hogan B. et al. 1986, in "Manipulating the mouse embryo". Cold Spring Harbor Laboratory) с дополнительным этапом центрифугирования с целью визуального осмотра пронуклеуса. Инъецирование проводят через 18-24 ч после оплодотворения. Время меняется в зависимости от используемого в качестве источника семени быка. Различные партии семени делают ядро видимым через различные промежутки времени.
Коровьи овоциты, созревшие и оплодотворенные in vitro, центрифугируют в пробирке Эппендорфа в 1 мл тиродес-гепесного раствора (Parrish, 1987) при 14500 g в течение 8 мин (Wall et al. 1985, Biol. Reprod. 32, 645-651). Эмбрионы переносят в капле тиродес-гепесного раствора на микроскопную пластинку, покрытую парафиновым маслом. С помощью гидравлической системы овоциты фиксируют в держателе яиц таким образом, что оба пронуклеуса становятся видимыми (используют интерференционно-контрастную или фазово-контрастную оптику). При необходимости овоциты вращают в держателе яиц для осмотра пронуклеуса. Затем через прозрачную зону, цитоплазму в пронуклеус вводят иглу. Небольшой объем в 1-3 пл инъецируют (содержит 20-100 копий ДНК) в пронуклеус с применением либо постоянного потока, либо пульсационного потока (применяют выключатель) раствора ДНК из иглы. Или же эмбрионы на стадии двух клеток центрифугируют вышеприведенным способом и ядра обоих бластомеров инъецируют вышеописанным способом. Затем инъецированные эмбрионы переносят в каплю среды для совместного культивирования по методике примера 6 для развития до стадии морула или бластоцисты.
Пример 8. Раннее обнаружение трансгенеза чЛФ- трансгена
После микроинъецирования конструкта в овоциты их выращивают. Подходящий сайт каждого эмбриона
расщепляют и подвергают лизису (King D. et al. 1988, Molecular Reproduction and Development, i, 57-62), протеолизу (Higuchi R. 1989, "Amplifications (A forum for PCR Users", 2, 1-3) и DPNI гидролизу.
PCR осуществляют по ранее приведенной методике (Ninomiy T. et al. 1979, Molecular Reprod, and Devel. 1, 242-248) сериями из двух праймеров: один в aS1, а другой в чЛФ кДНК последовательности. Например,
в PCR, где ведущим праймером (30-тимер) aS1-последовательности является последовательность:
ATG AAA CTT ATC CTC ACC TGT CTT GTG (Seg. ID N: 16),
обратным праймером (30-тимер) в
чЛФ- последовательности является последовательность GGG TTT TCG AGG GTG CCC CCG AGG ATG GAT (Seg. ID N: 17); (971-1000 на фиг. 1-7), будет создан фрагмент в 990 п.о. Фрагмент содержит неактивированный
DpNI сайт за счет потери аденозинметилирования за 934 п.о. от начала ведущего праймера.
Пример 9. Продуцирование чЛФ с молоком коров разных пород
Коровью морулу, развившуюся
из микроинъектированных овоцитов, расщепляют по методике Donahue (Donahue S. 1986, Genetic Engineering of Animals, ed. J. Warren Evans et al. Plenum). Половину морулы держат в культуре для развития в
бластоцисту. Другую половину подвергают ДНК анализу по методике примера 8. После того как результат анализа известен, морулу выдерживают в культуре для развития в бластоцисты или используют в качестве
источника для ядерного переноса в энуклеарные зиготы. Перенос бластоцистов в синхронизированные коровы осуществляют по методике Betteridge (Betteridge K. J. 1977, in "Embryo transfer in farm animals:
a review of techniques and applications).
чЛФ обнаруживают в молоке лактирующего трансгенного потомства с применением РИА по примеру 5.
Пример 10. Плазмиды,
экспрессирующие коровьего aS1-казеина/чCA
Для конструирования экспрессионного вектора для чCA применяют три перекрывающихся фаговых клона, содержащих полный ген чCA. Клоны обозначены как
lHAL-HA1, lHAL-3W и lHAL-H14. Клоны описаны в работах Urano et al. 1986, J. Biol. Chem. 261, 3244 3251; Urano et al. 1984, Gene, 32, 255 - 261. Последовательность гена плюс отдельные окружающие
области опубликованы в работе Minghetti et al. 1986, J. Biol. Chem. 261. 6747 6757. Единственный фаг, содержащий полный ген чCA, конструируют следующим образом.
Клон HA-1 обрабатывают BstEII и AhaII. Фрагмент примерно в 1400 п.о. простирающийся от положения 1784 (в первом экзоне, сразу же в нисходящем направлении от ATG) до 3181, выделяют и присоединяют синтетический линкер к BstEII сайту у 5'-конца, содержащего первые несколько аминокислот, выделенные рестриктазой BstEII, а также последовательность, окружающую ATG, и несколько обычных сайтов рестрикции. Данный фрагмент называют фрагментом #1.
Обрабатывают клон 3W в присутствии AhaII и SacI и выделяют фрагмент примерно 13,1 kb, простирающийся от положения 3181 до 16322, и синтетический линкер присоединяют к SacI сайту для облегчения клонирования в фаге EMBL3. Этот фрагмент назван фрагментом #1.
Эти два фрагмента лигируют и клонируют в фаге EMBL3. После идентификации правильного фага фрагмент, простирающийся в восходящем направлении сразу же после BstEII сайта (куда введены уникальные сайты рестрикции) до SacI сайта, отделяют от SacI SalI фрагмента (простирающегося от положения 16322 до - 21200), выделенного из клона H-14. Эти два фрагмента затем лигируют и клонируют в EMBL4.
После обработки ClaI (в восходящем направлении сразу же от вновь введенного BstEII сайта) и BamHI (в нисходящем направлении сразу же от SalI сайта в фаговой ДНК) этот новый клон дает фрагмент, содержащий полный ген чCA с фланкирующей 3'-последовательностью примерно 2,5 kb.
Для конструирования экспрессионного вектора для чCA космиду cGP1HLF частично гидролизуют в присутствии ClaI и BamHI. При этом удаляются сигнальная последовательность, кодирующая последовательность чCA, 3'-UTR и поли-(A) присоединяемая область αS1-казеина, а также небольшая область 3' гена казеина.
Все это лигируют с вышеописанным фрагментом чCA и полученную космиду называют cGP1HSA.
Образованный в результате экспрессионный вектор содержит: (1) последовательности промотора размером 16 kb, происходящие из гена aS1-казеина, (2) первый экзон и интрон этого гена, присутствующие в GP 1, (3) сигнальную последовательность чCA гена, полный геномный ген, кодирующий чCA, включая 2,5 kb в нисходящем направлении от этого гена, и (4) 8 kb от фланкирующей 3'-последовательности, происходящей из гена aS1-казеина.
Данный трансген применяют для создания трансгенных коров различных пород, продуцирующих чCA в молоке, путем, аналогичным применяемому для продуцирования чЛФ в молоке коров различных пород.
Пример 11. Очистка чCA из молока коров различных
пород
Выделение гетерологичных белков из молока облегчается, поскольку после осаждения казеина эти белки по большей части находятся в сывороточной фракции, менее загрязненной по сравнению с
получением белка в микробных клетках и других клеточных системах.
Для очистки чCA из коровьего молока рекомендуются хроматографические методы. При таком подходе достигаются лучшие выходы и более высокая чистота альбумина по сравнению с этанольным фракционированием (Curling, 1980, in: "Methods of Plasma Protein Fractionation", Curling, ed. Academic Press, London, UK; Curling et al. 1982, J. Parenteral. Sci. Technol. 36, 59; Berglof et al. and Martinache et al. 1982, Joint Meeting IHS-ISBT, Budapest). Специфическая транспортная роль чCA, а также его важная роль в поддержании межсосудистого осмотического давления также лучше сохраняются при хроматографической очистке (Steinbruch, 1982, Joint Meeting ISH-ISBT, Budapest).
Для выделения чCA, продуцируемого в молоке трансгенных коров, применяют следующие стадии.
1. Осаждение казеинов (примерно 80% молочного белка) и по существу всего молочного жира при pH 4,5 и/или добавлением химозина. Сывороточная фракция содержит альбумин.
2. Аффинная хроматография альбумина на Сибакрон-голубом 3 GA Сефароза CL-6 B (Harvey, 1980, in: "Methods of Plasma Protein Fractionation" op. cit. ). Эта стадия для удаления отличных от альбумина белков и уменьшения обрабатываемого объема примерно в 30 раз. Альбумин элюируют из такой матрицы 0.15 M NaCl и 20 мМ салицилата натрия при pH 7, 5.
3. Буферный обмен на Сефадексе G-25: обессоливание в 0,025M ацетат натрия, установление pH 5,2, с последующим фильтрованием.
4. Анионообменная хроматография на DEAE-Сефарозе CL-6B. Десорбция альбумина при pH 4,5.
5. Катионообменная хроматография на CM-Сефарозе CL-6B. Элюирование альбумина О,11 M ацетатом натрия при pH 5,5 и концентрирование альбумина из 6% -ного (мас./об.) раствора ультрафильтрованием.
6. Гель-фильтрация на Сефакрил S-200. Фракцию высокомолекулярного белка (например, полимеров альбумина, пирогенов) отбрасывают. Основную фракцию (мономерные альбумины) концентрируют ультрафильтрованием и вводят в составы.
Необходимо отметить, что стадии 3 6 по существу идентичны способу, приводимому Curling et al (Curling, 1980, op. cit. Curling et al. 1982, op. cit. Berglof et al. 1982, op. cit.) для очистки чCA из плазмы.
Пример 12. Трансгенная мышь, имеющая
трансген человеческого сывороточного альбумина (чCA), созданный гомологичной рекомбинацией
Для введения чCA-гена в трансгенную мышь используют три перекрывающихся геномных клона чCA:
(lHAL-HA1, lHAL-H14 и lHAL-3W, приведенных на фиг. 22 в соответствии с сообщением Urano et al. 1984, Gene, 32, 255-261 и Urano et al. 1986, J. Biol. Chem. 261, 3244-3251. Если вкратце, то геномную
библиотеку конструируют путем частичного гидролиза EcoRI рестриктазой фибробластной ДНК человека. Для клонов lHAL-H14 и lHAL-3W эта библиотека отобрана с помощью32P-меченных геномных
клонов человеческого альбумина путем гибридизации примерно сутки при 65oC в 1M NaCl, 50 мМ Трис-HCl (pH 8,0), 10 мМ ЭДТК, 0,1% НДС, 100 кг/мл гидродинамически фрагментированной ДНК спермы
лосося и 10x раствора Денхардта после предгибридизации в 3хSSC и 10х раствора Денхардта. После гибридизации фильтры промывают при 65oC в 0,2хSSC и 0,1% НДС. Выделение клона lHAL-HA1
проводят идентично, за исключением того, что для отбора библиотеки фибробласта человека применяют Bgl II-EcoRI фрагмент из 5'-конца lHAL-3W.
Эти три фаговых клона чCA используют для создания трех перекрывающихся линейных ДНК- фрагментов, которые в совокупности составляют полный ген чCA и фланкирующие области. Состоящий в основном из 5'-последовательности фрагмент I представляет EcoRI-EcoRI фрагмент, выделенный из lHAL-HA 1; средний фрагмент II представляет AcyI (=AhaII)-SacI фрагмент из lHAL-3W и состоящий в основном из 3'-последовательности фрагмент III представляет XhoI SalI фрагмент из lHAL-H14 (фиг.16-21). Фрагменты обрабатывают ДНК полимеразой Кленова и dNTP для заполнения избыточных липких концов. В некоторых опытах дефосфорилирования концевые фрагменты затем обрабатывают бактериальной щелочной фосфатазой с удалением 5'-фосфатных групп из каждого фрагмента. Перекрывающиеся фрагменты ДНК затем концентрируют и совместно инъецируют в пронуклеус самца оплодотворенных яиц мыши согласно опубликованным методам (Hogan et al. 1986, in "Manipulation The Mouse Embryo: A Laboratory Manual", Cold Spring Harbor Laboratory). В то время как число инъецируемых молекул менялось в пределах от ≈25 до ≈100, отношение отдельных фрагментов составляло примерно 1:1:1. Эмбрионы имплантируют в матку самки мыши по методике Hogan et al. supra.
Для анализа правильной гомологичной рекомбинации трех перекрывающихся фрагментов и интеграции возникшего трансгена в геном мыши геномную ДНК новорожденных мышат подвергают нижеследующему специфичному гидролизу с последующей гибридизацией по Саузерну с чCA кДНК зондами.
Bst EII: отрезает снаружи область гена чCA и дает полосу в 18 kb в случае правильной рекомбинации;
Nco I: отрезает перекрывающиеся области и дает полосы в 8 и 9,3 kb в случае правильной рекомбинации;
Nco I + Hind III: отрезает в нескольких положениях вне области перекрывания,
указывает на присутствие незатронутых фрагментов;
Hinc II: отрезает перекрывающиеся области, дает несколько полос, указывающих на правильность перегруппировки в этих частях.
В начальном опыте с 28 родившимися трансгенными животными для 22 показана правильная рекомбинация всех трех фрагментов. У 20 из этих 22 животных взята кровь на анализ присутствия белка чCA (радиоиммунный анализ). 15 из этих 20 животных показали экспрессию на уровне 0,5 5 мкг/мл. Ни одно животное, для которого не обнаружена рекомбинация и не являющееся трансгенным, не показало какой-либо экспрессии. С помощью блотирования РНК обнаружено только в двух случаях (две мыши с наиболее высоким уровнем белка) наличие полосы. В настоящее время осуществлено блотирование РНК, позволяющее определить присутствие мРНК (например, поли (A) + РНК). В результате применения обратной транскриптазы для синтеза кДНК с последующим PCR обнаружено соответствие между присутствием РНК и белка. Однако в этих опытах не удалось определить размер(ы) РНК.
Пример 13. Альтернативное конструирование трансгенов, кодирующих чЛФ
В данном примере описано конструирование двух
трансгенов чЛФ, один из которых содержит 5'-последовательность регуляции экспрессии aS1-казеина примерно в 16 kb (pGP1hLF (16 kb)), также называемый как p16,8HLF 4), а второй содержит
5'-последовательность регуляции экспрессии aS1-казеина примерно в 7,9 kb (pGP1hLF (8 kb), также называемый как p 8.8 HLF 4). Общая стратегия конструирования отражена на фиг.23.
Из фагового клона GP1 выделяют EcoRI-BglII фрагмент 1,8 kb (фрагмент C на фиг.23). Этот фрагмент простирается от положения -100 в сайте начала транскрипции во второй экзон гена aS1-казеина. BglII сайт находится в сочленении первого энтрона и второго экзона гена aS1-казеина. Содержащий сайт BglII 3'-конец лигируют с синтетическим BglII-ClaI линкером и субклонируют в плазмиде pUC19. Полученную плазмиду обозначают как pEBS.
Фрагмент B (фиг. 23) выделяют в виде EcoRI фрагмента и клонируют в EcoRI сайт pEBS. Фрагмент B включает последовательности от положения -7500 до положения -100 в сайте начала транскрипции в гене aS1-казеина. Образованную в результате плазмиду обозначают как pEB 3 S и она содержит комбинацию фрагментов B и C, то есть EcoRI-Cla I фрагмент в 8,9 kb, простирающийся от положения -7500 до положения +1400 сайта начала транскрипции. EcoRI-ClaI фрагмент в 8,9 kb из pEB 3 S, полученный полным гидролизом в присутствии ClaI и частичным гидролизом в присутствии EcoRI, выделяют и субклонируют в обработанную EcoRI-ClaI плазмиду pKUN2 (производное pKUN; Gene, 1986, 46, 269 276, содержит NotI сайт рестрикции) с образованием pNE3BS.
Из фага GP1 выделяют ClaI-EcoRI фрагмент в 8,5 kb (фрагмент A на фиг. 23), простирающийся от положения 1600 до положения -7500 сайта начала транскрипции. Затем фрагмент субклонируют в pUC19 и получают pSE. С применением синтетического нуклеотида вводят уникальный NotI сайт в ClaI сайт с разрушением в результате последнего. Полученную плазмиду обозначают как pNE.
Из pNE выделяют вставку в виде NotI-EcoRI фрагмента и вместе с EcoRI-ClaI вставкой из pNE3BS лигируют в вектор клонирования pKUN 2. Полученная плазмида pGP1 (D2ex) содержит aS1-казеиновый промотор в 16 kb плюс 5' конец гена, присоединенный к BglII сайту на границе второго экзона.
Конечную плазмиду (p 16,8HLF4), содержащую трансген, получают с использованием NotI-ClaI фрагмента из клона pGP I (D2ex) и Xho-Not I фрагмента из клона pHLF 3' 10 kb. Строение полученного трансгена то же, что и у ранее описанного трансгена.
В виде небольшой модификации данной плазмиды
осуществлено удаление из плазмиды SalI сайта в результате обработки SalI и внедрения линкера, содержащего NotI сайт. Затем SalI сайт вводят в нисходящем направлении сразу же после последовательности
чЛФ обработкой KpnI сайта в этом положении и добавлением следующего линкера:
5'-CGTCGACAGTAC-3' (Seg. ID N: 18)
CATGGCAGCTGT-5' (Seg. ID N: 19)
Таким образом,
последовательность чЛФ оказывается окруженной двумя уникальными сайтами рестрикции (ClaI и SaII) и может быть замещена любой рекомбинантной ДНК-последовательностью, имеющей ClaI сайт в 5'-конце и SalI
сайт в 3'-конце.
Сконструирован и другой трансген, идентичный вышеприведенному, за исключением того, что имеет только примерно 8 kb 5'-последовательности регуляции экспрессии aS1-казеина. Трансген конструируют отбором из pNE3BS NotI-ClaI фрагмента и его слиянием непосредственно с Xho-NotI фрагментом из клона pHLF3'10 kb. Полученную плазмиду обозначают как pGP1hLF (7 kb) (также называется, как p 8.8 HLF4).
Плазмиду 16,8hLF4 модифицируют введением в нее гибридного сплайс сигнала (aS1-казеин-IgG), описанного в примерах 3 и 5. Полученная плазмида обозначена как 16,8hLF3 и идентична 16,8hLF4, за исключением присутствия гибридного интрона вместо "натурального" казеинового интрона в 5'-UTR.
чЛФ сигнальная последовательность может быть также использована во всех кДНК-конструктах, раскрытых в данном описании, вместо казеиновой сигнальной последовательности. Это может быть сделано следующим образом. Получают синтетический олигомер, содержащий полную чЛФ сигнальную последовательность (фиг. 22-23) плюс ClaI сайт рестрикции в 5'-конце и EagI сайт рестрикции в 3'-конце. Эти сайты рестрикции граничат также с казеиновой сигнальной последовательностью в других плазмидах (например, p16,8hLF 4). Фрагмент, содержащий чЛФ кДНК, ограниченный ClaI и SalI сайтами, клонируют в pGEM7 (Stratagene, Inc.), содержащей ClaI и SalI сайт. Полученную плазмиду гидролизуют в присутствии ClaI и EagI и используют в качестве вектора для аккомодации ClaI-EagI фрагмента, содержащего последовательность чЛФ. Из положительных клонов выделяют кДНК в виде ClaI-SalI фрагмента и встраивают в гидролизованную ClaI и SalI плазмиду p16,8hLF4 с созданием p16,8hLF5. Аналогично этот Cla-Sal фрагмент, содержащий чЛФ-кДНК плюс сигнальная последовательность чЛФ, может быть внедрен в любой чЛФ кДНК вектор.
Пример 14. Продуцирование рекомбинантного человеческого лактоферрина в молоке трансгенной мыши
Трансгенную
мышь создают использованием нескольких охарактеризованных в примерах трансгенов. Применяемые трансгены указаны в табл. 5. В каждом случае 5'- и 3'-последовательности регуляции экспрессии происходили
из гена коровьего aS1-казеина, РНК сплайс сигнал в нетранслируемой 5'-области был либо из гена
aS1-казеина, либо гибридным казеин-IgG интроном.
Рекомбинантная ДНК в каждом случае происходила из кДНК-клонов.
Пример 15. Конструирование трансгенной кассеты для геномной рекомбинантной ДНК
Все описанные плазмиды содержат области, происходящие из
нетранскрибируемых областей a S1-казеина коровы (включая интроин). Если экспрессии подлежит геномный ген, уже содержащий нетранслируемые области и интроны, допускающие высокую экспрессию, в этом
случае рекомендуется применять экспрессионные кассеты, в которых фланкирующие области гена aS1-казеина эффективно связаны с нетранслируемыми областями подлежащего экспрессии гена. Такой экспрессионной
кассетой является p16kb, CS, и ее конструируют следующим образом. В качестве матрицы в PCR опытах применяют плазмиду pSl3'5'hLF. Эта плазмида содержит 680 п.о. последовательности промотора гена
aS1-казеина, а также его первый экзон. Остальная часть этой плазмиды для данного опыта не представляет интереса. Восходящий праймер расположен сразу же в восходящем направлении от вставки в плазмидную
часть (сразу же в восходящем направлении от NotI сайта рестрикции). Его последовательность: 5' CGA CGT TGT AAA ACG ACGG-3'.
Нисходящий праймер расположен в экзоне 1. Его
последовательность в точности соответствует первым 19 п.о. экзона, а кроме того, включает негибридизирующуюся область в 17 п.о. содержащую ClaI и SalI сайт. Праймер имеет следующую
последовательность:
5'-ATTGTCGACTTATCGATGGGTTGATCAAGGTGA-3'.
Амплифицированный фрагмент гидролизуют в присутствии NotI и SalI и лигируют с pKUN2 (см. пример 13). В полученной плазмиде (p-680CS) в результате соединены проксимальный фрагмент промотора от -680 до +19 плюс два сайта рестрикции сразу же в нисходящем направлении от этих 19 п.о.
Эту плазмиду гидролизуют в присутствии NotI (сразу же в восходящем направлении от -680) и NsiI (при -280) и используют в качестве вектора для лигирования с фрагментом, простирающимся от Not сайта (сразу же в восходящем направлении от -16 kb) до NsiI (-280), выделенным из p16,8hLF4 (пример 13). В этой плазмиде (p-16kb, CS), таким образом, соединены фрагмент промотора от ≈-16000 до +19. Плазмида может быть использована для вставки геномных генов, несущих свои собственные UTR's и поли (A)-сигнал. После введения геномного гена в виде ClaI-SalI фрагмента фланкирующая 3'- последовательность aS1-казеина может быть вставлена в виде SalI фрагмента.
Пример 16. Конструирование трансгена для продуцирования белка C
Геномная последовательность белка C опубликована в
работе Foster et al. 1985, Proc. Natl. Acad. Sci. USA 82, 4673-4677. Однако эта последовательность не включает первый экзон, идентифицированный с помощью кДНК- последовательности, опубликованной
Beckman et al. 1985, Nucl. Acids Res. 13, 5233-5247. Первый экзон белка C расположен в положении от -1499 до -1448 в последовательности по Foster. Трансген для экспрессии и секреции белка C в молоке
коров разных пород приведен на фиг. 24. Этот трансген конструируют следующим образом.
Геномную библиотеку человека в EMBL-3 (Клонотека) зондируют последовательностью, специфичной для белка C. Препарат очищенной фаговой ДНК, содержащей полный ген белка C, подвергают выделению. Фаг выделяют из штамма E. coli с Dam-фенотипом, такого, как штамм GM113. В результате получают клонированную ДНК, которая неметилирована, и, как таковая, может быть подвергнута расщеплению ClaI-сайтов рестрикции.
Выделяют ClaI-NheI фрагмент, простирающийся от +1333 до 11483 и обозначают его как фрагмент 1.
Плазмиду pGEM7 (Stratogene, Inc.) гидролизуют в присутствии SphI и SmaI. Область между ними заменяют соответствующей областью плазмиды pKUN (Gene, 1986,
46, 269-276). Полученную плазмиду обозначают как pGEM7A. Она характеризуется следующей картой рестрикции в соответствующей области:

Синтезируют два праймера. Праймер GP125 имеет следующую последовательность:

Праймер GP126 имеет следующую последовательность:

Праймер GP125 перекрывается с экзоном O (положение 654 675 гена белка C) и вводит ClaI сайт в нетранслируемую 5'-область. Экзон O это экзон, не идентифицированный Foster et al. Праймер GP126 перекрывает область от 1344 до 1315 гена белка c. Указанная область содержит ClaI сайт.
Область между положениями 654 и 1344 амплифицируют с использованием в качестве матрицы человеческой ДНК, или фаговой ДНК. Продукт амплификации гидролизуют в присутствии ClaI и клонируют в вектор pGEN7a с образованием pPCCC. Этот вектор размножают в dam-отрицательном штамме, таком, как GM113, и частично гидролизуют в присутствии ClaI (интерес представляют только плазмиды, обработанные ClaI в положении 1340) и полностью в присутствии XbaI. В полученный вектор клонируют ClaI-NheI фрагмент (фрагмент 1). Плазмиду обозначают как pPC. Ее строение показано на фиг. 24. Из этой плазмиды выделяют в виде ClaI-SalI фрагмента трансген белка C, который лигируют с p16 kb, CS (см. пример 15) с образованием трансгена, способного экспрессировать белок C с коровьим молоком, и обозначают эту плазмиду как p16 kb, CS, PC.
Содержащийся в плазмиде p16 Kb, CS, PC трансген обрабатывают NotI и используют для создания трансгенных коров различных пород вышеприведенными методами. Такие трансгенные животные способны продуцировать белок C в молоке.
Реферат
Использование: изобретение относится к продуцированию рекомбинантных полипептидов трансгенными коровами и способам получения трансгенных коров. Сущность изобретения: трансген для продуцирования рекомбинантного полипептида с молоком трансгенных коров различных пород включает по меньшей мере одну последовательность регуляции экспрессии, секреторную ДНК-последовательность, кодирующую секреторный сигнал, действующий в секреторных клетках молочных желез коровы, и рекомбинантную ДНК-последовательность, кодирующую рекомбинантные полипептиды. Способ получения трансгенных коров включает введение вышеуказанного трансгена в эмбриональную клетку-мишень коровы, трансплантацию образованной таким путем трансгенной эмбрионной клетки-мишени родительской корове-реципиенту и идентификацию по меньшей мере одной родившейся телочки, способной продуцировать рекомбинантный полипептид со своим молоком. Молоко от трансгенной коровы, содержащее рекомбинантный полипептид, продуцируемое трансгенной коровой, полученной согласно вышеописанному способу. Пищевой состав, включающий трансгенное молоко, содержащее рекомбинантный полипептид, продуцируемое трансгенной коровой. 5 с. и 30 з.п.ф-лы, 5 табл., 25 ил.


Комментарии