Способ удаления сероводорода и/или карбонилсульфида из газа - RU2162729C2
Код документа: RU2162729C2
Чертежи
Описание
Изобретение относится к способу удаления сероводорода и/или карбонилсульфида из газа с использованием сульфидокисляющих бактерий.
Международная заявка на патент WO 92/10270 раскрывает способ для очистки газа, содержащего сероводород, в котором газ подвергается промывке в газовом скруббере с очищающей щелочной жидкостью, используемая очищающая жидкость обрабатывается кислородом в аэробном реакторе в присутствии серуокисляющих бактерий, поток, вытекающий из аэробного реактора, вновь используется в качестве очищающей жидкости, а элементная сера, образующаяся при обработке кислородом, отделяется от вытекающего потока. Описанный способ пригоден для удаления сероводорода (H2S) и других восстановленных соединений серы, таких как меркаптаны и сероуглерод, или для удаления диоксида серы (SO2). Для удаления H2S pH поддерживается в пределах от 8 до 9 с использованием буферов. Используемые серуокисляющие бактерии включают класс Thiobacillus и Thiomicrospira.
Недостаток этого известного способа заключается в необходимости использования относительно больших количеств очищающей жидкости для эффективной абсорбции сероводорода. Этот известный способ также не подходит для удаления других H2S, таких как карбонилсульфид (COS).
В настоящее время найдено, что биологическая трансформация сульфида в элементную серу может быть реализована при высоких значениях pH с использованием селективных автотрофных сульфидокисляющих бактерий. В результате использования более высоких pH существенно уменьшаются необходимые количества очищающей жидкости, и поэтому необходимое оборудование может быть более компактным и менее дорогим. Используемые новые бактерии согласно настоящему изобретению эффективны при pH от 9 до примерно 11 и особенно эффективны при pH от 9.2 до 10.5. Особенно рекомендуемые к использованию бактерии применяются при оптимуме pH выше 9.0.
Биологическое окисление сероводорода и карбонилсульфида с использованием автотрофных алкалифильных бактерий преимущественно приводит к получению элементной серы с образованием в качестве побочного продукта некоторого количества тиосульфата.
Далее было показано, что тиосульфат может быть эффективно превращен в политионат при увеличении значения pH обработкой в присутствии кислорода или оксида азота с использованием тиосульфатокисляющих бактерий. Такие тиосульфатокисляющие бактерии включают такие известные окислители серы как бактерии из класса Thiobacillus и Thiomicrospira, или гетеротрофные бактерии. Используемый здесь термин политионат охватывает тритионат (S3O62-), тетратионат (S4O62-), и, возможно, более высокие политионаты (SnO62-, n>4) ионы. Поглощение H2 S, COS (карбонилсульфид) и других соединений серы очищающим раствором может быть усовершенствовано при использовании раствора, содержащего политионат-ионы, полученные этим способом, в результате чего эти загрязнения могут быть более эффективно удалены из газов и при помощи меньшего количества очищающей жидкости. Способ по существу приводит только к образованию твердой элементной серы. Одновременно может быть проведена необязательная бактериальная тиосульфатокисляющая обработка с сульфидокислительной обработкой - если кислород используется в качестве тиосульфат окислителя, но предпочтительнее проводить впоследствии окисление тиосульфата как отдельную стадию.
Способ согласно настоящему изобретению особенно подходит для очистки горючего (топливного) газа, каменноугольного газа, отходящего газа установки Клауса, газов химических производств, технологических газов и других газов, содержащих COS, и газов, находящихся под давлением. Примерами газов, находящихся под давлением, являются горючий газ (например, 30 бар) и природный газ (например, 70 бар).
Следствием использования относительно высоких значений pH является потребление меньшего количества очищающей жидкости для удаления соединений серы, чем в известных биологических способах. Необходимое количество очищающей жидкости может быть впоследствии уменьшено вследствие присутствия в очищающей жидкости политионата, что уменьшает уровень H2S/HS-/S2-/COS в жидкости. В сравнении с известными способами преимуществом в случае очистки газов под давлением является также потребность в относительно небольшом количестве очищающей воды и поэтому в меньшей энергии, которая должна быть израсходована на герметизацию очищающей воды.
Аэробная обработка сульфидсодержащей очищающей жидкости преимущественно проводится таким образом, чтобы образование элементной серы было максимальным. Это может быть достигнуто с использованием лимитированного количества кислорода, то есть, чаще всего, 0.5-0.8 моль кислорода на моль H2S/HS- или COS.
Бактерии, способные окислить сульфид при pH выше 9 могут быть получены, например, из содовых
озер, известными микробиологическими методами обогащения и очистки. Автотрофные сульфидокисляющие бактерии, используемые согласно настоящему изобретению, обладают одной или более из следующих
характеристик:
- грамотрицательные бактерии из β или γ подгруппы Proteobacteria;
- облигатные аутотрофы;
- способны окислить HS-, S0 и
S2O32-;
- оптимум pH - выше 9, обычно ниже 10.4, главным образом в области 9.5;
- нет роста H2 или C1-соединений;
- Нет денитрификации, способен ассимилировать NO2- и/или NO3, но не мочевину;
- оптимальные температуры - между 24 и 37oC;
- толерантность к NaCl и
Na2CO3/NaHCO3 до по крайней мере 50 г/л каждого.
Следующие бактерии являются представительными примерами таких автотрофных сульфидокисляющих бактерий.
Штамм AL-2:
Это грамотрицательные бактерии, которые могут быть любыми от коротких палочек до вибрионов (vibriods). Она подвижна с помощью единственного полярного
жгутика. На минеральном солевом тиосульфатном агаре в тиосульфате при pH 10 колонии могут быть размером до 3 мм в диаметре, они круглой формы, выпуклые и радиально-симметричные. Со временем они
становятся бело-желтыми из-за выделения серы. Штамм AL-2 может аккумулировать внутренние частицы серы. Он не содержит карбоксильных групп (carboxysomes). Его дезоксирибонуклеиновая кислота (ДНК) имеет
65.5 моль%. GC (Tm). По предварительным результатам 16S анализ рибонуклеиновой кислоты (РНК), штамм AL-2 принадлежит к γ-подгруппе Proteobacteria. Ее группа условно может быть названа
Thioalkalovibrio. Родственным ему классом является Thiomicrosiira, Methylomicrobium и Methylococcus.
Штамм AL-2 может окислять H2S, HS-, S0 и S2O32-; и S4O62-. Для S2O32- это дает выход 8-9 мг массы сухого вещества на ммоль субстрата. Он не стимулирует образования H2 или C1-соединений. Штамм не приводит к денитрификации. Он может использовать как источник азота NO2- и NO3-, но не NH4+, мочевину или другие органические соединения азота.
Область роста для штамма AL-2 - величины pH между 8 и 10.4 с оптимумом около 9.5. Его рост происходит в области температур 10-39oC с оптимумом около 28oC. Штамм обладает широкой толерантностью к NaCl (0-100 г/л) и карбонатам натрия (0-150 г/л). Штамм AL-2 был помещен в коллекцию культур - Delft Culture Collection - филиал Центрального Бюро Культур Плесени (Centraal Bureau voor Schimmelcultures), Delft, NL, номер LMD 96.55, где он доступен согласно Будапештскому Договору.
Штамм AL-3:
Это грамотрицательная палочка. Она подвижна из-за наличия помощи 1-3 полярных жгутиков. На минеральном солевом тиосульфатном агаре в тиосульфате при pH
10 колонии могут быть размером до 2 мм в диаметре, они круглой формы, выпуклые, радиально-симметричные, розоватые и прозрачные, без аккумуллированной серы. Штамм AL-3 не способен аккумулировать
внутренние частицы серы. Он содержит карбоксильные группы (carboxysomes). Его дезоксирибонуклеиновая кислота (ДНК) имеет 49.5 моль%. GC(Tm). По предварительным результатам 16S анализа рибонуклеиновой
кислоты (РНК) штамм AL-3 принадлежит к бета-подгруппе Proteobacteria. Ее группа условно может быть названа Thioalkalobacter. Родственным ей классом являются Thiomicrospira, Methylomicrobium и
Methylococcus.
Штамм AL-3 может окислить HS-, S0 и S2O32-. Для S2O32- это дает выход 4-4.5 мг массы сухого вещества на ммоль субстрата.
Он не может вызывать образования H2 или C1-соединений. Штамм не денитрифицирует. Он может ассимилировать NO2- и NO3-. Может быть незначительно использован NH4+, но не мочевина или другие органические соединения азота в качестве источника азота.
Области роста штамма AL-3 лежат в области pH от 8 и 10.4 с оптимумом около 9.5. Его рост происходит в области температур 12-41oC с оптимумом около 33oC. Штамм обладает широкой толерантностью к NaCl (0-70 г/л) и карбонатам натрия (0-60 г/л). Штамм AL-3 был помещен в коллекцию культур - Delft Culture Collection-, под номером LMD 95.63, где он доступен согласно Будапештскому Договору.
Другие штаммы, отличные от AL-2 и AL-3, имеющие по существу те же самые характеристики, что AL-2 и AL-3 и предположительно принадлежащие к тому же классу были выделены из различных содовых озер.
Ниже приведены характерные примеры алкалифильных гетеротрофных бактерий, способных окислить тиосульфат.
Штамм ChG 3-3
Штамм ChG 3-3 был
выделен из водной колонки Черного моря. Он является облигатным гетеротрофом.
Штамм ChG 3-3 является грамотрицательной, каталазо-позитивной подвижной палочкой. Для роста ему необходим NaCl. Штамм ChG 3-3 был изучен с использованием стандартных таксономических тестов. (API 20 NE), и проведено его сравнение с известными штаммами с использованием оперативно доступной базы данных. Родственные классы - Pseudomonas, Deleya и Halomonas. Наиболее близким найден Pseudomonas stutzeri I sensu stricto (84.3% подобия). Он однозначно является новым штаммом, который с этого времени будет называться Pseudomonas штаммом ChG 3-3. Он обладает моль% G+C 57.3.
Pseudomonas штамм ChG 3-3 растет в области pH между 7.3 и 10.5 с оптимумом около 8. Его рост происходит в области температур между 15 и 40oC с оптимумом около 20oC. Он не может расти при 50oC. Ему необходим карбонат и он будет расти в области концентраций 0.2-0.8 М. Pseudomonas штамм ChG 3-3 окисляет S2O32- в S4O62- без получения энергии от этой реакции. Чтобы это произошло, необходимо присутствие органического субстрата (например, ацетата).
Pseudomonas штамм ChG 3-3 был помещен в коллекцию культур - Delft Culture Collection - под вступительным номером LMD 96.32, где он доступен согласно Будапештскому Договору.
В предпочтительном варианте способа с использованием тиосульфатокисляющих бактерий очищающая жидкость обычно содержит по крайней мере 10 мкмоль/л политионата, предпочтительно по меньшей мере 100 мкмоль/л, но, главным образом, по меньшей мере 1 ммоль/л политионата. Для газов, находящихся под давлением, то есть под повышенным давлением по крайней мере в 10 бар, причем, следовательно, в этом случае и очищающая жидкость находится под повышенным давлением, концентрация политионата преимущественно составляет по крайней мере 10 ммоль/л, а в особых случаях (при давлениях порядка 100 бар или выше) 100 ммоль/л или более. Относительно упоминания в контексте концентрации политионата должно быть понятно, что имеется ввиду концентрация тритионата и тетратионата, включая концентрацию тиосульфата [SnO62-] + 1/2[S2O32-].
Тиосульфат вновь окисляется в политионат с
помощью бактерий в соответствии со следующей реакцией:
2S2O32- + 1/2O2 + 2H2O ---> SnO62- +
2OH- + S4-n (1)
Поэтому реализуется циклический процесс, который в принципе не нуждается в дозаправке тиосульфат/политионатом. Если это необходимо, то может быть
сохранена исходная концентрация тиосульфата, или можно достичь увеличения концентрации тиосульфата за счет окисления сульфида. Поэтому концентрация тиосульфата вначале и в течение процесса очистки
может быть увеличена прибавлением кислорода в очищающую жидкость током этого газа или каким-либо другим способом.
Следующие реакции вероятно играют определенную роль в удалении H2S или COS соответственно с помощью политионата:
H2S + OH- ---> SH- + H2O (2)
S4O62- +
SH- + OH- ---> S0 + 2S2O32- + H2O (3)
S4O62- + COS + OH-
---> S0 + 2S2O32- + C2O (4)
В щелочных условиях тетратионат далее реагирует следующим образом:
4S4O62- + 3OH- ---> 2S3O62- + 5S2O32- + 3H+ (5)
Тритионат реагирует с H2
S и COS:
S3O62- + HS- + OH- ---> S0 + S2O32- + SO32- + H2O (6)
S3O62- + COS + 2OH- ---> S0 + S2O32- + SO32- + CO2
+ H2O (7)
Тиосульфат также может образовываться химическим автоокислением или биологическим окислением сульфида по следующему уравнению:
2SH- + 2O2
---> H2O + S2O32- (8)
В результате присутствия политионата в очищающей жидкости H2S и COS сначала эффективно абсорбируются и в
газовом скруббере претерпевают превращение по уравнению (2) и (3). С применением способа согласно данному изобретению могут быть также рационально удалены такой очисткой и другие серусодержащие
соединения, такие как сероуглерод алкилмеркаптаны, диалкилсульфиды и диалкилдисульфиды, в частности сероуглерод и метилмеркаптан.
Автотрофное бактериальное превращение сульфида в серу предпочтительно проводится при величинах pH от больших 9 до 11, главным образом между 9.2 и 10.5. Необязательное гетеротрофное бактериальное превращение тиосульфата в политионат предпочтительно проводится при pH от 9 до 12, главным образом от 9.5 до 11, или даже при 10-11. Если это необходимо, величина pH регулируется прибавлением каустической соды или соды. Бактерии также способны использовать оксиды азота, такие как нитрат для окисления тиосульфата вместо кислорода. Как правило, среда содержит источник углерода, такой как ацетат, или другой органический субстрат для того, чтобы получить возможность для роста бактерий. Величина pH очищающей жидкости при прямом контакте с газами предпочтительно составляет от 8 до 11, главным образом выше 9 или даже от 9.5 до 10.5. Если это необходимо, величина pH может регулироваться током воды с более низким значением pH, например, с помощью ограниченного циркуляционного потока (a short-circuit stream) циклического процесса.
Образование серы до и в аэробном реакторе приводит к образованию суспензии серы, которая далее извлекается. Сера отделяется от вышеназванной суспензии и подвергается высушиванию и конечной очистке и может быть использована повторно.
Даже если очищаемый газ дополнительно к H2S содержит другие летучие соединения серы, такие как небольшие количества алкилмеркаптанов или сероуглерод, использованная для очистки жидкость, содержащая соединения серы, может непосредственно вводиться в аэробный реактор с сульфид-окисляющими бактериями. Если вышеназванные восстановленные соединения серы растворимы, то они описываются как "сульфид", но этот термин также следует понимать в значении других восстановленных соединений серы, таких как растворенный сероводород (H2S или HS-), дисульфид, полисульфид, тиокарбонаты, алкантиолаты и им подобные.
Если газ также содержит CO2, он будет также частично растворяться в очищающей жидкости. Абсорбированный углекислый газ в форме бикарбоната оказывает на очищающую жидкость полезное действие буфера. Если очищаемый газ также содержит сероуглерод и/или карбонилсульфид, то он может быть окончательно очищен от них способом согласно настоящему изобретению. Абсорбированные COS и CS2 переводятся в аэробном реакторе главным образом в карбонат и серу.
Используемый согласно настоящему изобретению газовый скруббер является скруббером обычного типа, обеспечивающим эффективный контакт в газовом скруббере между газовым потоком и очищающей жидкостью.
Используемые аэробные реакторы согласно настоящему изобретению могут быть любого подходящего типа. Предпочтительно использовать реакторы вертикального циркуляционного типа, такие, как описанные, например, в заявке на международный патент WO 94/29227, в котором используемый газ (в аэробном реакторе это обычно воздух) обеспечивает вертикальную циркуляцию.
Изобретение также относится к аппарату для осуществления описанного выше способа. Образцы такого аппарата изображены на сопроводительных схемах.
Описание схем.
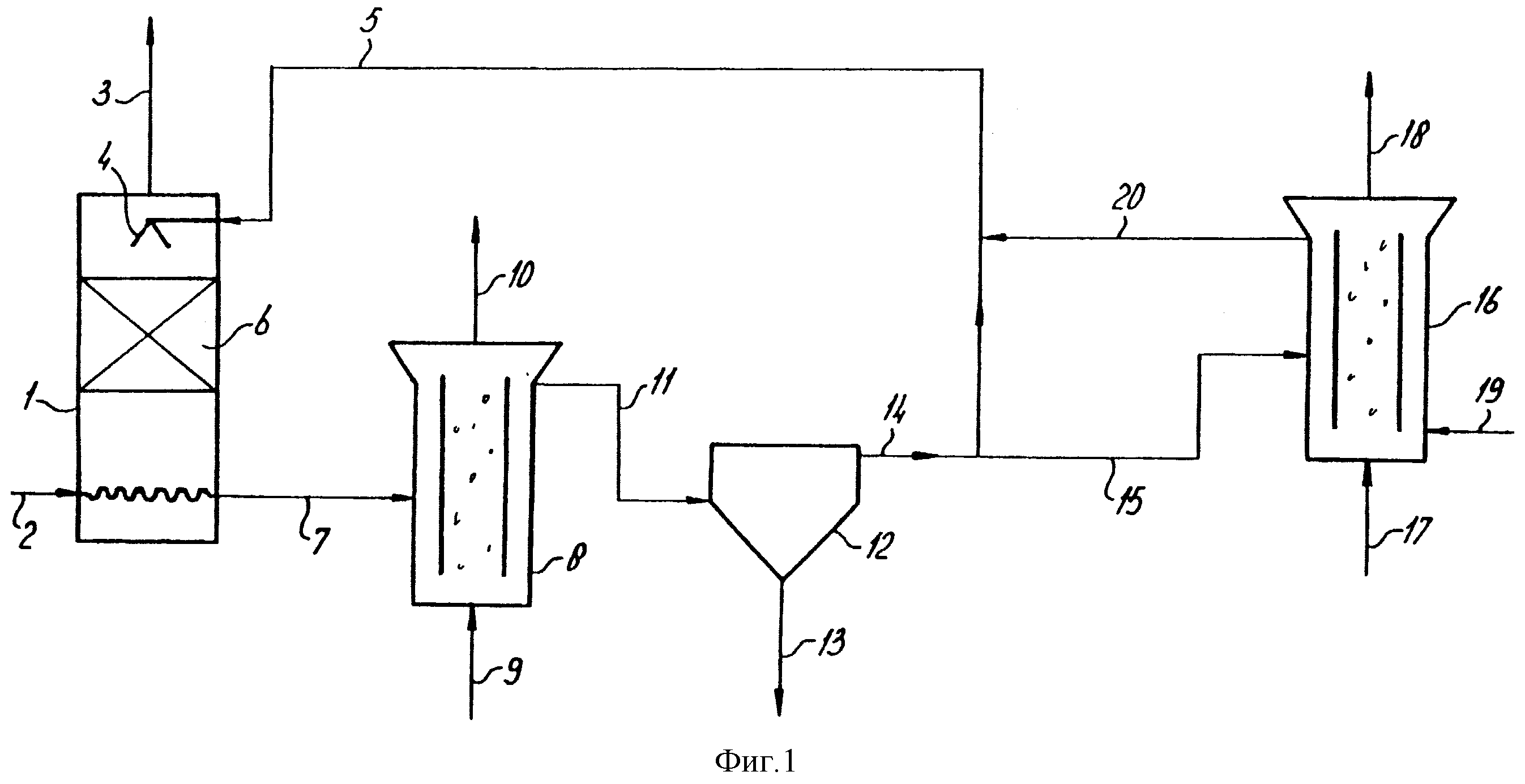
На схеме 1 согласно настоящему изобретению изображен аппарат для очистки газов, содержащих H2S и/или COS, с применением комбинированной автотрофной и гетеротрофной аэробной обработки. Газовый скруббер 1 снабжен входным трубопроводом 2 для загрязненного газа и выходным трубопроводом 3 для очищенного газа. Газовый скруббер снабжен распределительным устройством 4 для очищающей жидкости, которая подается по рециркуляционному трубопроводу 5, и реакционной зоной 6, которая гарантирует интенсивный контакт газа с жидкостью. По трубопроводу 7 подается загрузочная очищающая жидкость в аэробный реактор 8, который контролируемо снабжается воздухом снизу через газовый ввод 9. В аэробном реакторе 8 сульфид окисляется до элементной серы под действием сульфидокисляющей биомассы. Отработанный воздух удаляется через 10. Вытекающий из аэробного реактора по трубопроводу 11 поток проходит к сепаратору для удаления серы 12. Отделенный серный шлам удаляют через 13, а отработанные вытекающие потоки уходят из сепаратора через 14 и некоторые из них могут сразу загружаться в рециркуляционный трубопровод 5. По крайней мере часть вытекающего потока из 14 загружается через 15 в аэробный реактор 16, который также снабжен воздушным входом 17 и газовым выходом 18. В аэробном реакторе 16 тиосульфат окисляется в политионат тиосульфатокисляющей биомассой. Также имеется входной трубопровод 19 для источника питания (например, ацетата). Вытекающий из реактора поток подается через 20 и через возвратный трубопровод 5 назад в газовый скруббер 1.
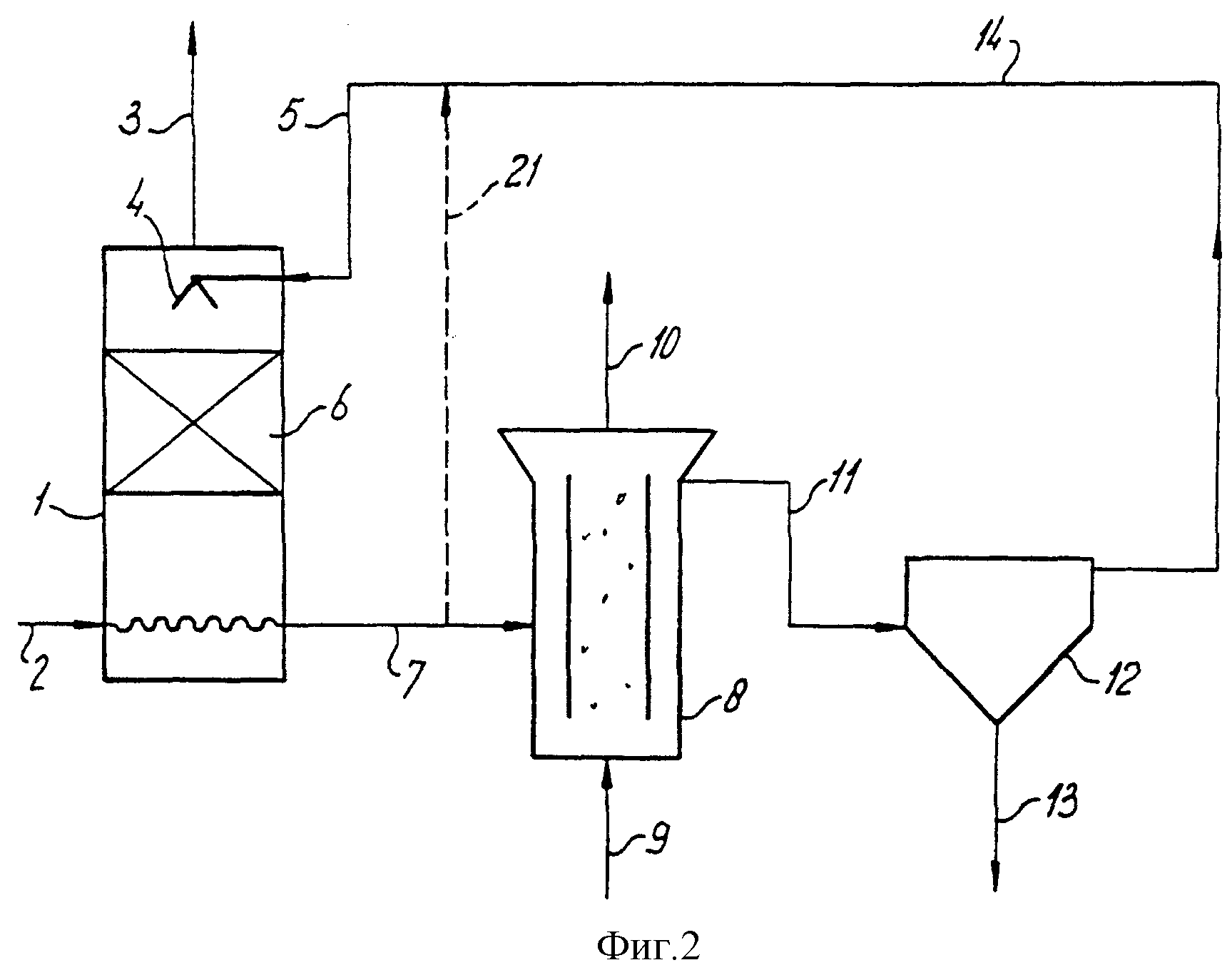
На схеме 2 изображен образец аппарата, в котором имеется только один аэробный реактор. Этот аппарат может быть использован для способа, в котором газ, предназначенный для очистки, содержит относительно низкие концентрации соединений серы и/или, в котором аэробная обработка с помощью автотрофных сульфидокисляющих бактерий, приводит к исключительно низким уровням содержания тиосульфата. Устройство этого аппарата тоже, что и на схеме 1, но с отсутствием второго аэробного реактора, содержащего тиосульфатокисляющие бактерии. Часть очищающей жидкости может быть направлена обратно непосредственно в газовый скруббер через короткую цепь 21.
Аппарат на схеме 2 может быть также использован в способе, в котором тиосульфатный реактор объединен с сульфидным реактором в реактор 8. В этом случае остаточный сульфид окисляется в нем до серы, а тиосульфат окисляется в политионат. Выбранный диапазон pH будет находиться, например, в области 9-10.
Реферат
Изoбpeтeниe относится к способу удаления сероводорода и/или карбонилсульфида из газа с использованием сульфидокисляющих бактерий. Газ очищают с помощью водной очищающей жидкости. Отработанную очищающую жидкость обрабатывают автотрофными сульфидокисляющими бактериями в присутствии кислорода при значениях рН, находящихся в области 9,0-10,4. При этом образуется элементарная сера, которую затем отделяют от обработанной очищающей жидкости. Обработанная очищающая жидкость может повторно быть использована на стадии очистки газа. Перед процессом рециркулирования очищающая жидкость может быть далее обработана гетеротрофными тиосульфатокисляющими бактериями, которые продуцируют политионат, который, в свою очередь, улучшает сульфидочищающую способность очищающей жидкости. 9 з.п.ф-лы, 2 ил.

Комментарии