Муриновая модель воспаления с делецией il33 n-концевого домена - RU2577988C2
Код документа: RU2577988C2
Чертежи





















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к животному, не являющемуся человеком, имеющему неполный N-концевой домен в гене IL-33. Здесь предлагается также применение указанного животного, не являющегося человеком, в качестве модели in vivo воспалительных заболеваний, главным образом в связи с методами отбора противовоспалительных соединений и с методами оценки и оптимизации фармакологических свойств определенного противовоспалительного соединения.
Цитокин интерлейкин 33 (IL-33) - это новейший представитель семейства интерлейкина 1 (IL-1). Благодаря своей ядерной локализации, он первоначально был описан как «ядерный фактор из верхнего эндотелия венул» («Nuclear Factor from High Endothelial Venules». IL-33 экспрессируется главным образом фибробластами и клетками гладкой мускулатуры эпителия, эндотелия и дыхательных путей. IL-33 - это лиганд для родственного рецептору IL-1 белка ST2. Рецептор ST2 экспрессируется почти во всех клетках врожденного иммунитета (тучных клетках, базофилах, эозинофилах, нейтрофилах, клетках - естественных киллерах (natural killer, NK) и макрофагах), а также в клетках NK T и T-хелперах 2 (Th2). Взаимодействие IL-33 с ST2 на клетках-мишенях может запускать экспрессию и секрецию про-воспалительных цитокинов, цитокинов Th1, Th2 и Th17 и экспрессию хемокинов, участвующих в осуществлении эффекторных функций Th1, Th2 и врожденного иммунитета (см. опубликованные статьи и Hicks et al., статья готовится к печати). IL-33 связывается со своим специфическим поверхностным рецептором через свой домен про-воспалительного цитокина. Кроме того, IL-33 имеет также N-концевой домен, содержащий типичный лейтмотив спираль-поворот-спираль для связывания с ДНК. В своей ядерной нерасщепленной форме IL-33 взаимодействует с гистонами 2A и 2B в гетерохроматине, способствуя компактизации хроматина и действуя как потенциальный репрессор транскрипции. Есть веские доказательства того, что IL-33 подобен другим ассоциированным с хроматином цитокинам (IL-1α и HMGB1), которые, как оказывается, осуществляют двойную функцию, регулируя репрессию транскрипции в ядре и осуществляя сигнальную функцию через классический рецептор, действуя как активный про-воспалительный цитокин. Поэтому было высказано предположение, что IL-33 может, подобно HMGB1, функционировать как сигнал опасности («alarmin») и принадлежит к более обширному семейству молекул из молекулярного набора, связанного с опасностью («damage-associated molecular pattern, DAMP).
Ось IL-33/ST2 играет центральную роль в патофизиологии воспалительных заболеваний человека, что подтверждается высокими уровнями их экспрессии в пораженных тканях. Повышенные уровни IL-33 и/или его растворимого рецептора ST2 наблюдаются у пациентов с ревматоидным артритом (RA), воспалением кишечника (IBD), псориазным и ядерным колитом, острой эозинофильной пневмонией, тяжелой астмой, идиопатическим легочным фиброзом, фиброзных заболеваниях печени, атопическим дерматитом, системным склерозом, аутоиммунными заболеваниями и травмами. Было установлено, что ось IL-33/ST2, подобно ее роли у человека, крайне важна и в мышиных моделях воспаления. IL-33 усиливает индуцированный коллагеном артрит (CIA), аллергический конъюнктивит и экспериментальный аутоиммунный энцефаломиелит (ЕАЕ). Было показано, что прерывание антителами сигнального действия IL-3/ST2 способствует рассасыванию аллергического воспаления дыхательных путей и вызванного блеомицином поражения легких. Недавно было также установлено, что IL-33 активируется в модели хронического воспаления кишечника у мышей с IBD (Oboki et al., PNAS 2010 107 (43) 18581-18586).
Сущность изобретения
Животным, не являющимся человеком, может быть любое животное, не являющееся человеком. Предпочтительно животное, не являющееся человеком, - это млекопитающее, более предпочтительно - грызун, такой, как крыса или мышь, наиболее предпочтительно животное, не являющееся человеком, - это мышь. В предпочтительном варианте осуществления животное, не являющееся человеком, - это мышь, а делеция в N-конце гена IL-33 представляет собой делецию всего домена связывания с ДНК в N-конце гена IL-33. Предпочтительно указанная делеция в N-конце гена IL-33 мыши представляет собой делецию аминокислот 1-67 в продукте экспрессии гена IL-33.
Животное, не являющееся человеком, может быть гетерозиготным или гомозиготным по N-концевой делеции IL-33. Предпочтительно животное, не являющееся человеком, гетерозиготно по N-концевой делеции IL-33.
Животное, не являющееся человеком, с недостаточностью в N-конце гена IL-33 согласно настоящему изобретению, проявляет типичные характеристики воспалительного заболевания. Например, мышь согласно настоящему изобретению имеет такие характеристики, как нормальные i рождаемость и рост до возраста приблизительно 3-4 месяца, затем появляются геморрагические поражения на ушах и периодически наблюдаемые крупные сгустки в грудной полости, уменьшение размера и появление общей картины заболевания. При патологическом обследовании у этих мышей обнаруживается воспаление многих органов, в том числе хронический многоочаговый миокардит; сильный хронический гнойный илеит с разрастанием стенок кишечника; хронический уретерит с выраженным гипернефрозом и атрофией почек, множественные многоочаговые и периваскулярные инфильтраты в легких, гиперплазия селезенки с активным распространением эозинофилов и макрофагов в органы иммунитета, легкие и кишечник.
Поскольку животное, не являющееся человеком, согласно настоящему изобретению проявляет воспалительный фенотип, оно полезно как модель воспаления in vivo. Животное, не являющееся человеком, с делецией в N-конце гена IL-33 может способствовать практическому выяснению причинной связи между дисфункциями гена IL-33 и воспалительными расстройствами и сделать возможным разработку адресованных терапевтических стратегий, нацеленных на снижение или прекращение аномальной сверхпродукции IL-33 у пациентов. Поскольку массированная продукция и секреция IL-33 во внеклеточное пространство является причиной такого острого воспалительного состояния, эта новая и уникальная модель на животном, не являющемся человеком, может быть использована также для оценки эффективности и действенности in vivo лекарств-кандидатов, действующих на IL-33, если известна перекрестная реактивность с IL-33 или его рецептором ST2 животного, не являющегося человеком. Поэтому во второй цели изобретения указанное испытуемое животное, не являющееся человеком, используется в качестве модели воспалительных заболеваний in vivo, в особенности для отбора противовоспалительных соединений. В одном из вариантов осуществления предлагается метод отбора противовоспалительных соединений, состоящий во введении соединения-кандидата животному, не являющемуся человеком, с делецией в N-конце IL-33 согласно настоящему изобретению. В одном из вариантов осуществления указанный метод включает: a) предоставление животного, не являющегося человеком, с делецией в N-конце IL-33, b) введение указанному животному, не являющемуся человеком, соединения-кандидата, c) сопоставление симптомов воспаления у указанного животного, не являющегося человеком, имеющего делецию в N-конце IL-33, с симптомами у животного, не являющегося человеком, имеющего делецию в N-конце IL-33, не получавшего указанное соединение, причем соединение, которое смягчает указанные симптомы воспаления, отобрано как противовоспалительное соединение.
Соединения-кандидаты включают (но не ограничиваются ими) небольшие молекулы, (поли)пептиды, (глико)протеины, антитела или фрагменты антител, поли- или олиго-нуклеотиды, нуклеозиды, липиды, их комбинации и их модифицированные производные.
Методы введения соединения-кандидата, подлежащего отбору, включают (но не ограничиваются ими) пероральное введение и парентеральное введение (например, внутривенное введение, внутрибрюшинное введение и интраназальное введение). В случае перорального введения средство-кандидат для введения может быть смешано с пищей.
Средство-кандидат может быть введено в комбинации с фармацевтически приемлемым общепринятым наполнителем (таким, как носитель и разбавитель) или с добавками. Кроме того, средство-кандидат может быть инкапсулировано в липосомы (например, положительно заряженные липосомы) или наночастицы или связано с ними и введено в таком виде.
Оценка может быть произведена, например, на основе ослабления или исчезновения симптомов воспаления, увеличения веса тела, исчезновения гипертрофии подвздошной кишки или подобных параметров, определяемых невооруженным глазом, путем определения веса тела, гистопатологического обследования (например, микроскопического наблюдения окрашенных тканей) и анализа FACS (см. далее раздел «Примеры»).
Используя подвергаемых исследованию животных с делецией в N-конце IL-33 или полученные из них клетки, можно идентифицировать лиганды или субстраты, связывающиеся с клеточным IL-33, модулирующие его, являющиеся его антагонистами или агонистами. Особенно интересны отборочные испытания противовоспалительных соединений, обладающих низкой токсичностью для человеческих клеток. Для этой цели можно использовать широкий набор анализов, включая исследования in vivo, определение локализации лекарств после введения, анализ с применением метки связывания белок-белок, анализ связывания белок-ДНК, анализ изменения электрофоретической подвижности, иммуноанализ связывания белка и подобные им. В зависимости от конкретного типа анализа, могут быть использованы либо целые животные, либо полученные из них клетки. Клетки могут быть только что получены из животного или могут быть иммортализованы в культуре.
В другом варианте осуществления изобретения указанная модель in vivo используется для оценки фармакологических эффектов - таких, как эффективность и действенность in vivo лекарств-кандидатов на основе IL-33. Поэтому в другом варианте осуществления изобретения предлагается метод оценки фармакологических эффектов лекарств-кандидатов, действующих на IL-33, причем указанный метод состоит во введении указанного лекарства-кандидата, действующего на IL-33, животному, не являющемуся человеком, с делецией в N-конце IL-33 согласно настоящему изобретению.
Настоящее изобретение относится также к потомкам животных, не являющихся человеком, с делецией в N-конце IL-33, как они предложены изобретением, полученным скрещиванием с таким же или иным генотипом. Предпочтительно потомок получен путем скрещивания с таким же генотипом. Указанный потомок содержит такую же делецию в N-конце IL-33, как и животное, не являющееся человеком, с делецией в N-конце IL-33, описанное выше. Дальнейшая цель изобретения состоит в использовании указанных потомков в качестве модели in vivo воспалительных заболеваний. В одном из вариантов осуществления указанные потомки используются в качестве модели in vivo для отбора противовоспалительных соединений. В другом варианте осуществления указанные потомки используются в качестве модели in vivo для оценки фармакологических эффектов противовоспалительного соединения.
Далее, настоящее изобретение относится к линии клеток или к первичной культуре клеток, полученным от животного, не являющегося человеком, с делецией в N-конце IL-33 или от его потомков, как описано выше.
Кроме того, настоящее изобретение также предоставляет ткань или эксплантат органа, или культуру из него, полученные от животного, не являющегося человеком, с делецией в N-конце IL-33 или от его потомков, как описано выше.
Настоящее изобретение также предоставляет ткань или клеточный экстракт, полученные от животного, не являющегося человеком, с делецией в N-конце IL-33 или от его потомков, как описано выше.
В другом варианте осуществления изобретения указанные выше линия клеток или первичная культура клеток, ткань или эксплантат органа, или культура из него, ткань или клеточный экстракт, полученные от животного, не являющегося человеком, с делецией в N-конце IL-33 или от его потомков, используются в качестве модели воспалительных заболеваний. В одном из вариантов осуществления указанная модель воспалительных заболеваний используется для отбора противовоспалительных соединений, в другом варианте осуществления указанная модель воспалительных заболеваний используется для оценки фармакологических эффектов противовоспалительного соединения, как намечено выше.
Методы создания животного, не являющегося человеком, с делецией в гене - такой, как делеция в N-конце гена IL-33, хорошо известны в данной области. Подходящие методы описаны, например, в Hogan B et al.: Manipulating the mouse embryo, A laboratory manual, 2nd Edition (1994), Cold Spring Harbor Laboratory Press.
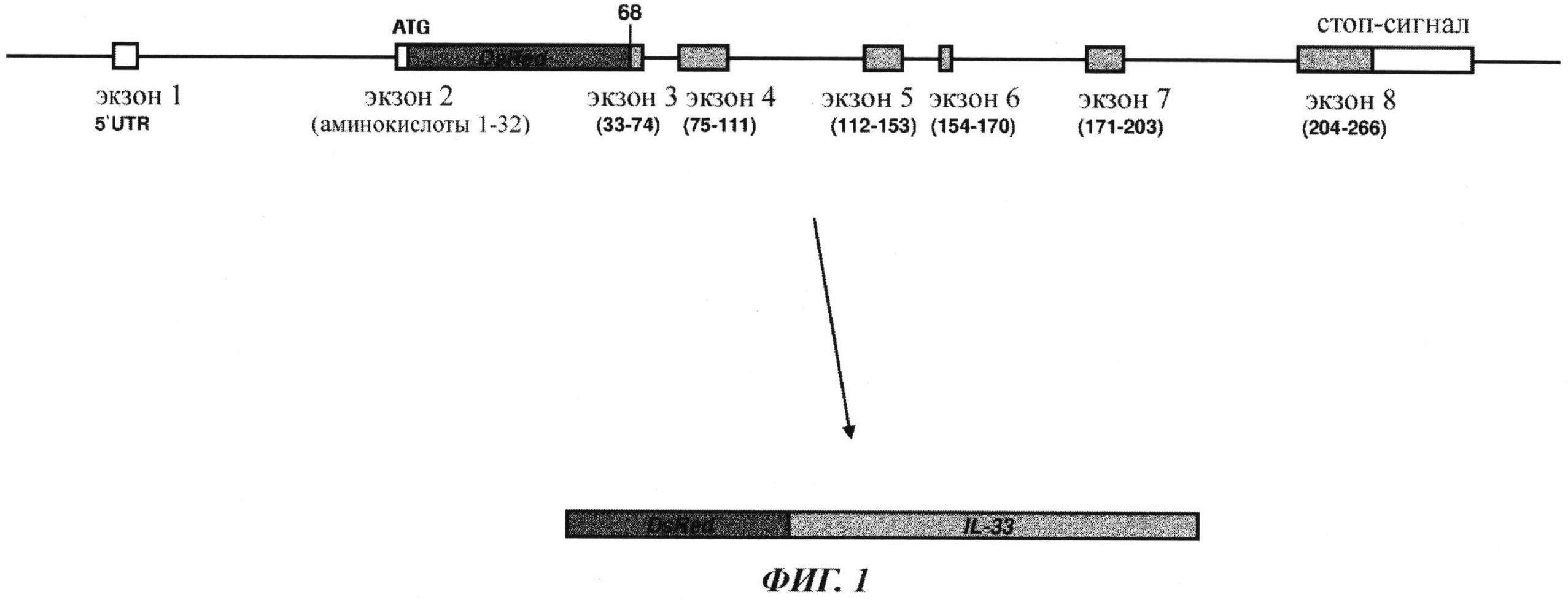
Термин «ген IL-33», как он использован здесь, относится в особенности к гену интерлейкина 33, известному также как DVS27; NF-HEV; NFEHEV; C9orf26; DKFZp586H0523; RP11-575C20.2; IL33, IL-1F11, 9230117N10Rik, RGD1311155 и подобные им. Указанный ген содержит N-концевой домен с предполагаемым лейтмотивом «спираль-поворот-спираль» связывания с ДНК и C-концевой домен цитокина. Ген IL33 консервативен у человека, шимпанзе, собаки, коровы, мыши и крысы. Для примера последовательность ДНК гена IL-33 мыши приведена в SEQ ID.NO.1. Термин «продукт экспрессии гена IL-33» относится к транслированному белку гена IL-33, то есть к белку IL-33.
Термин «делеция в N-конце IL-33», как он использован здесь, означает, что N-конец гена IL-33 полностью или частично модифицирован (например, замещен, делетирован, произведена добавка или вставка) или разрушен, причем продукт экспрессии гена IL-33 утратил полностью или частично N-концевой домен и/или не осуществляет функцию N-концевого домена. N-концевой домен, как он упомянут здесь, включает предполагаемый лейтмотив спираль-поворот-спираль, который отвечает за связывание с ДНК и ядерную локализацию IL-33. В предпочтительном варианте осуществления животное, не являющееся человеком, - это мышь, а аминокислоты 1-67 мышиного продукта экспрессии гена IL-33 (белок IL-33) модифицированы или разрушены.
Такое животное, не являющееся человеком, описано здесь как животное, не являющееся человеком, с делецией в N-конце IL-33 или животное, не являющееся человеком, с дефицитом в N-конце гена IL-33, или животное, не являющееся человеком, с нокаутом N-конца гена IL-33 и подобное этому. В одном особо предпочтительном варианте осуществлении указанная модификация N-конца гена IL-33 достигается путем нокаута кассетой DsRed, что приводит к делетированию N-концевой части гена IL-33. Соответственно указанное животное, не являющееся человеком, обозначается как животное DsRed-IL33/COOH, не являющееся человеком. Термин «дикий тип», как он использован здесь, относится к животному, не являющемуся человеком, имеющим ген IL-33 полной длины.
«Животное, не являющееся человеком», как оно описано здесь, относится к любому животному, которое не является человеком. Предпочтительно животное, не являющееся человеком, - млекопитающее, более предпочтительно - грызун, такой, как крыса или мышь, наиболее предпочтительно животное, не являющееся человеком, - это мышь.
Животное, не являющееся человеком, с делецией в N-конце IL-33, как оно описано выше, может быть использовано в качестве модели для лечения воспалительных заболеваний. Это позволяет исследовать действие соединений, потенциально не являющихся противовоспалительными, на воспалительное заболевание в модели in vivo у животного, не являющегося человеком. Поскольку трансгенное животное иммунотолерантно по отношению к трансгенным человеческим антителам mAb11, можно определить эффект длительного лечения терапевтическими антителами - такими, как, например, Mab11. Можно также проследить эффект внеклеточных уровней IL-33, а также развитие и кинетику воспалительного заболевания.
Термин «воспалительное заболевание», как он использован здесь, относится к любому снижению здоровья или условию ненормального функционирования, характеризующегося воспалением. В частности, термин «воспалительное заболевание», как он использован здесь, относится к заболеваниям, связанным с повышенным уровнем IL-33, например (но не ограничиваясь ими) к воспалению кишечника, ревматоидному артриту, крапивнице, атеросклерозу сосудов, псориазному колиту, язвенному колиту, острой эозинофильной пневмонии, тяжелой астме, идиопатическому легочному фиброзу, фиброзным болезням печени, атопическому дерматиту, системному склерозу, аутоиммунным заболеваниям и подобным им.
Термин «противовоспалительные соединения», как он использован здесь, означает любую молекулу со способностью ослаблять иммунные реакции, подробнее - влияя на биологическую активность IL-33. По существу «противовоспалительное соединение» включает (но не ограничивается ими) небольшие молекулы, (поли)пептиды, (глико)протеины, антитела или фрагменты антител, поли- или олигонуклеотиды, нуклеозиды, липиды, их комбинации и их модифицированные производные. «Противовоспалительное соединение» включает также молекулы, которые являются посредниками в РНК-интерференции, такие, как sh-РНК (shRNA), микро-РНК (microRNA), si-РНК (siRNA), антисмысловые олигонуклеотиды, «шпигельмеры» (РНК-подобные молекулы, содержащие L-рибозу), олигомеры липидонуклеиновых кислот (LNA) или пептидонуклеиновых кислот (PNA) или их комбинации. Предполагаемые противовоспалительные соединения, как они использованы здесь, описаны здесь как «лекарства-кандидаты, действующие на IL-33» или «соединения-кандидаты».
Краткое описание рисунков
Фиг.1a. Схематическое изображение направленной (адресованной) мутации в IL-33. Кассета DsRed была вставлена в стартовый кодон и соединена с IL-33 в положении аминокислоты 68 последнего.
Фиг.1b. Стратегия адресования. RFP - красный флуоресцентный белок; tm1 - адресованная мутация 1; wt - дикий тип; маркер - marker X (Roche); т.п.н. - 1 тысяча пар нуклеотидов; EcoRI - сайт рестрикционной эндонуклеазы; NeoR - селективная неомициновая кассета; треугольники - сайты Iox.
Фиг.2. Фенотип мышей с гетерозиготным нокаутом DsRedlL-33/COOH. Задержка роста, взъерошенная шерсть.
Фиг.3. Фенотип мышей с гетерозиготным нокаутом DsRedlL-33/COOH. Морфология органов.
Фиг.4. Фенотип мышей с гетерозиготным нокаутом DsRedlL-33/COOH. Морфология органов в сравнении с мышью дикого типа. SI: тонкая кишка; He: сердце; Th: тимус; Ki: почка; Lu: легкие; Sp: селезенка; Li: печень; Co*: сгусток крови в грудной полости.
Фиг.5. Фенотип мышей с гетерозиготным нокаутом DsRedlL-33/COOH. Гипертрофия подвздошной кишки. Препарат кишечника продольно вскрыт.
Фиг.6. Фенотип мышей с гетерозиготным нокаутом DsRedlL-33/COOH (DsRedlL-33/COOH-KI) согласно анализу методом FACS. Суспензии клеток указанных органов окрашивали антителами, специфичными к определенному поверхностному маркеру: CD45 (меченые APC-Cy7) - суммарные лейкоциты; CD11b (меченые аллофикоцианином, APC) - макрофаги; SiglecF (меченые фикоэритрином, PE) - эозинофилы; Gr1 (меченые PE-Cy7) - гранулоциты; F4/80 (меченые Alexa 488) - моноциты. Окрашенные клетки выявляли с помощью устройства FACS Canto I (BD Corp.) и анализировали с помощью программы FlowJo. По оси ординат: SiglecF, по оси абсцисс: F4/80. Рисунки показывают перекрывание красителей в различных популяциях клеток. Мыши с нокаутом DsRedlL-33/COOH имеют повышенное содержание эозинофилов, о чем свидетельствует высокая экспрессия SiglecF и F4/80 (см. маркированные популяции, Eos - эозинофилы).
Фиг.7. Фенотип мышей с гетерозиготным нокаутом DsRedlL-33/COOH. Уровни IL-33 в сыворотке.
Настоящее изобретение будет далее описано более детально типичными примерами, в предположении, что примеры не будут интерпретированы как примеры, ограничивающие область охвата настоящего изобретения.
Примеры
Пример 1. Создание адресованного вектора
Адресованный вектор (SEQ ID. NO.2) был создан с помощью рекомбинационной технологии, которая поставляется Gene Bridges GmbH, Heidelberg. Он содержит следующие элементы:
Адресованный вектор был использован для гомологической рекомбинации в клетках BALB/c ES. Позитивные клоны были идентифицированы с применением стратегии отбора методом ПЦР (последовательности олигонуклеотидов приведены ниже). После электропорации экспрессионной плазмиды Cre сайт-специфическая рекомбинация приводит к удалению in vitro селекционной неомициновой кассеты. После бластоцитной инъекции клонов клеток ES были выведены химерные животные, и препараты ДНК из биопсий поколений F1 и F2 были использованы для подтверждения идентичности направленных мутаций, а также для генотипирования с помощью ПЦР (ПЦРАВ, CD, EF и EFG на фиг.1b).
Олигонуклеотиды
Олигонуклеотид A: TAGAAAGAGCCCAGTGTTAAGC (SEQ ID. NO.3)
Олигонуклеотид B: GGCTTGCCCTCGCCCTCG (SEQ ID. NO.4)
Олигонуклеотид C: CACCTGCGACTTCAAGACC (SEQ ID. NO.5)
Олигонуклеотид D: ACGATTCCTTAGTGATGGGGC (SEQ ID. NO.6)
Олигонуклеотид E: GTTGCTTCTGATGACTTCAGG (SEQ ID. NO.7)
Олигонуклеотид F: GCAATAGCCCTTGCCAAGGC (SEQ ID. NO.8)
Олигонуклеотид G: TGCTGTTCCAGCCTCTGTTGG (SEQ ID. NO.9)
Пример 2. Создание мыши с нокаутом в N-конце IL-33
На основе линии Balb/c были созданы две генетически модифицированных мышиных модели со вставкой (knock-in). Первый мутант нацелен на замену в N-конце функции, подобной действию внутриклеточного фактора транскрипции, в той же рамке считывания на мономер флуорохрома DsRed (DsRed-IL33/COOH), с сохранением полного функционального домена цитокина (фиг.1). Второй мутант замещает домен про-воспалительного цитокина вставкой в рамке считывания флуорохрома DsRed с сохранением интактного домена связывания с ДНК (NH2/L33-DsRed).
Пример 3. Получение характеристик мыши с нокаутом в N-конце IL-33
Полученные геноинженерными методами гетерозиготные мутантные мыши, утратившие N-концевой домен IL-33, но сохранившие в цитоплазме активность про-воспалительного цитокина (DsRed-IL33/COOH) непредсказуемо погибают в возрасте около 4 месяцев. Явно нормальные при рождении, они постепенно заболевают и в конце концов погибают через 4-5 месяцев, степень нарушения их фенотипа оценивается приблизительно в 60%. В возрасте 3-4 месяцев у этих мутантов начинают проявляться кровоточащие изъязвления в ушах и раздувающиеся животы. При вскрытии трупов неоднократно наблюдаются обширная спленомегалия, гипертрофия подвздошной кишки, подразумевающая воспаление кишечника, присутствие больших сгустков в грудной полости и атрофия почек (фиг. с 2 по 5). Более детальное обследование различных органов методом FACS демонстрирует сильную эозинофилию в легких, селезенке, лимфатических узлах, пейеровых бляшках и периферической крови (фиг.6). Уровни содержания IL-33 в сыворотке определены у мышей с нокаутом DsRed-IL33/COOH (фиг.7).
Обсуждение
Авторами ранее было установлено, что интраназальное введение IL-33 вызывало обширное воспаление легких с появлением в полостях многоядерных гигантских клеток макрофагального происхождения (Hicks et al., готовится к печати). Подобно этому, IL-33 вызывает также гиперплазию костного мозга с крупным скоплением миелоидных/гранулоцитных клеток, что видно при гистопатологическом обследовании (Hicks et al., готовится к печати). Кроме того, высокие уровни растворимого IL-33 обнаруживаются в плазме периферической крови этих мышей, что дает веские основания предположить, что обнаруживаемые в мутантных животных DsRed-IL33/COOH иммунопатологические эффекты являются результатом постоянного присутствия в цитоплазме полностью активного цитокина DsRed-IL33/COOH и его возможного высвобождения во внеклеточный компартмент, что, как полагают, служит мощным сигналом для эндогенного DAMP.
Этот подобный «сигналу опасности» эффект нокаута N-концевого домена в IL-33 подобен, таким образом, иммуно-патологическим болезненным состояниям у человека (диагностика которых остается неизвестной), когда мощный сигнал опасности высвобождается после поражения тканей, некроза или аутоиммунной реакции. В пользу центральной роли IL-1α и IL-β в большом числе аутоиммунных заболеваний свидетельствуют возникновение острого воспаления многих органов у пациентов с гомозиготными мутациями или делениями в гене, кодирующем IL-1RA, и его блокада моноклональными антителами mAbs (Weber at al., Science signaling, 3, 2010). Возможно, генетические вариации IL-33 могут привести к сверхэкспрессии и/или секреции этого предполагаемого молекулярного «сигнала опасности», и он может участвовать в патогенезе ауто-воспалительных или аллергических заболеваний. Несомненно то, что недавно была продемонстрирована позитивная связь между полиморфными вариациями в гене IL-33 и повышенными уровнями IL-33 с восприимчивостью к поллинозу на японский кедр (Sakashita et al. Clin. Exp. Allergy Dec 2008).
Реферат
Изобретение относится к области биотехнологии и генной инженерии. Описана мышь, имеющая неполный N-концевой домен в гене IL-33. Мышь используется в качестве модели in vivo воспалительных заболеваний в отношении методов отбора противовоспалительных соединений и методов оценки и оптимизации фармакологических свойств определенного противовоспалительного соединения. Изобретение может быть использовано в области фармакологии и медицины. 8 н. и 4 з.п. ф-лы, 8 ил., 3 пр.
Формула
а) введение соединения-кандидата мыши по любому из п. 1 или 2 и
б) сопоставление симптомов воспаления у указанной мыши или указанного потомка с симптомами у мыши по п. 1 или 2, не получавших указанное соединение,
причем соединение, которое смягчает указанные симптомы воспаления, отобрано как противовоспалительное соединение.
Документы, цитированные в отчёте о поиске
Способ получения генетически модифицированного организма для скрининга биологически активных веществ

Комментарии