Направленная модификация генома крысы - RU2676708C2
Код документа: RU2676708C2
Чертежи

















































Описание
ССЫЛКА НА ПОДАНЫЙ ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ВИДЕ ТЕКСТОВОГО ФАЙЛА ЧЕРЕЗ СИСТЕМУ EFS WEB
[001] Официальная копия перечня последовательностей подана в электронном виде через систему EFS-Web как перечень последовательностей в файле формата ASCII, который назван 444701SEQLIST.TXT, создан 16 апреля 2014 г., имеет размер 15 килобайт, и подан одновременно со спецификацией. Перечень последовательностей, содержащийся в этом документе формата ASCII, является частью спецификации и в полном объеме включен в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[002] Выделенные нечеловеческие тотипотентные или плюрипотентные клетки, в частности, эмбриональные стволовые клетки крысы, которые способны поддерживать плюрипотентность после одной или более серийных генетических модификаций in vitro и которые способны передавать направленные генетические модификации последующим поколениям по зародышевой линии. Композиции и способы модификации представляющего интерес геномного локуса крысы посредством бактериальной гомологичной рекомбинации (БГР) в прокариотической клетке. Композиции и способы модификации представляющего интерес геномного локуса крысы с использованием большого таргетирующего вектора (LTVEC) в комбинации с эндонуклеазами. Композиции и способы получения генетически модифицированной крысы, содержащей одну или более направленных генетических модификаций.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[003] Несмотря на то, что крысы рассматриваются как важная система животных моделей, которая может воспроизводить патологическое исследование различных заболеваний человека, включая, но не ограничиваясь, сердечнососудистыми (например, гипертензия), метаболическими (например, ожирение, диабет), неврологическими (например, патологические состояния, вызывающие боль) и различными раковыми заболеваниями, применение крыс в моделировании заболеваний человека ограничено по сравнению с мышами частично из-за недоступности передаваемых по зародышевой линии плюрипотентных клеток крысы, которые могут поддерживать свою плюрипотентность после серий генетических модификаций in vitro, например, одной или более серийных электропораций, и частично из-за отсутствия эффективных технологий таргетинга, которые позволяют проводить введение или удаление больших последовательностей геномной ДНК или замену больших последовательностей эндогенной геномной ДНК экзогенными последовательностями нуклеиновой кислоты в плюрипотентных клетках крысы.
[004] В данной области техники существует потребность в композициях и способах, которые позволяют проводить точные направленные изменения в геноме крысы, которые могут раскрыть или расширить существующие области таргетного исследования и быстрее и проще проверять терапевтические агенты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[005] В данном изобретении представлены способы модификации представляющего интерес геномного локуса в плюрипотентной клетке посредством направленной генетической модификации. Такой способ включает (а) введение в плюрипотентную клетку большого таргетирующего вектора (LTVEC), содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом и 3'-гомологичным плечом, и (b) идентификацию генетически модифицированной плюрипотентной клетки, содержащей направленную генетическую модификацию в представляющем интерес геномном локусе, причем направленная генетическая модификация способна передаваться по зародышевой линии.
[006] В одном варианте реализации изобретения плюрипотентную клетку получают из нечеловеческого животного, включающего, но не ограничивающегося: грызуном, человеком, крысой, мышью, хомяком, кроликом, свиньей, быком, оленем, овцой, козой, курицей, кошкой, собакой, хорьком, приматом (например, мартышкой, макаком-резус), одомашненным млекопитающим или сельскохозяйственным млекопитающим, или любым другим представляющим интерес организмом.
[007] В одном варианте реализации изобретения плюрипотентная клетка представляет собой нечеловеческую плюрипотентную клетку. В одном варианте реализации изобретения нечеловеческая плюрипотентная клетка представляет собой плюрипотентную клетку млекопитающего. В одном варианте реализации изобретения плюрипотентная клетка млекопитающего представляет собой плюрипотентную клетку грызуна. В одном варианте реализации изобретения плюрипотентная клетка грызуна представляет собой плюрипотентную клетку крысы или мыши. В одном варианте реализации изобретения плюрипотентная клетка представляет собой человеческую индуцированную плюрипотентную стволовую (иПС) клетку.
[008] В одном варианте реализации изобретения плюрипотентная клетка представляет собой нечеловеческую оплодотворенную яйцеклетку на стадии одной клетки. В одном варианте реализации изобретения нечеловеческая оплодотворенная яйцеклетка представляет собой оплодотворенную яйцеклетку млекопитающего. В одном варианте реализации изобретения оплодотворенная яйцеклетка млекопитающего представляет собой оплодотворенную яйцеклетку грызуна на стадии одной клетки. В одном варианте реализации изобретения оплодотворенная яйцеклетка млекопитающего представляет собой оплодотворенную яйцеклетку крысы или мыши на стадии одной клетки.
[009] В некоторых вариантах реализации изобретения полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет по меньшей мере 10 т.н. В некоторых вариантах реализации изобретения полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет по меньшей мере 10 т.н., но менее 100 т.н., или полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет по меньшей мере 10 т.н., но менее 150 т.н. В других вариантах реализации изобретения размер полной совокупности 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 150 т.н., от около 10 т.н. до около 100 т.н., от около 10 т.н. до около 75 т.н., от около 20 т.н. до около 150 т.н., от около 20 т.н. до около 100 т.н., от около 20 т.н. до около 75 т.н., около 30 т.н. до около 150 т.н., от около 30 т.н. до около 100 т.н., от около 30 т.н. до около 75 т.н., около 40 т.н. до около 150 т.н., от около 40 т.н. до около 100 т.н., от около 40 т.н. до около 75 т.н., около 50 т.н. до около 150 т.н., от около 50 т.н. до около 100 т.н. или от около 50 т.н. до около 75 т.н., от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н. В одном варианте реализации изобретения размер делеции такой же или сходный с размером полной совокупности 5'- и 3'-гомологичных плечей LTVEC.
[0010] В некоторых таких вариантах реализации изобретения направленная генетическая модификация является биаллельной.
[0011] В некоторых вариантах реализации изобретения плюрипотентная клетка представляет собой плюрипотентную клетку крысы. В одном варианте реализации изобретения плюрипотентная клетка крысы представляет собой эмбриональную стволовую клетку крысы. В одном варианте реализации изобретения плюрипотентную клетку крысы получают из штамма DA или штамма ACI. В некоторых вариантах реализации изобретения плюрипотентная клетка крысы характеризуется экспрессией по меньшей мере одного маркера плюрипотентности, включающего Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, рецептор LIF, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинацию. В некоторых таких способах плюрипотентная клетка крысы характеризуется одним из более из следующих свойств: (а) отсутствие экспрессии одного или более маркеров плюрипотентности, включающих с-Myc, Ecat1 и/или Rexo1, (b) отсутствие экспрессии мезодермальных маркеров, включающих ген брахиурии и/или Bmpr2, (с) отсутствие экспрессии одного или более эндодермальных маркеров, включающих Gata6, Sox17 и/или Sox7 или (d) отсутствие экспрессии одного или более нейральных маркеров, включающих Nestin и/или Рах6. Такие способы обеспечивают полную совокупность 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н. или от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н., от около 120 т.н. до около 150 т.н. или от около 10 т.н., но менее около 150 т.н. В некоторых вариантах реализации изобретения полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет от около 16 т.н. до около 100 т.н. В других вариантах реализации изобретения размер полной совокупности 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 150 т.н., от около 10 т.н. до около 100 т.н., от около 10 т.н. до около 75 т.н., от около 20 т.н. до около 150 т.н., от около 20 т.н. до около 100 т.н., от около 20 т.н. до около 75 т.н., около 30 т.н. до около 150 т.н., от около 30 т.н. до около 100 т.н., от около 30 т.н. до около 75 т.н., около 40 т.н. до около 150 т.н., от около 40 т.н. до около 100 т.н., от около 40 т.н. до около 75 т.н., около 50 т.н. до около 150 т.н., от около 50 т.н. до около 100 т.н., от около 50 т.н. до около 75 т.н., от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н. В одном варианте реализации изобретения размер делеции такой же или сходный с размером полной совокупности 5'- и 3'-гомологичных плечей LTVEC.
[0012] Способы дополнительно обеспечивают то, что направленная генетическая модификация (а) содержит замену эндогенной последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты млекопитающего; (b) содержит делецию эндогенной последовательности нуклеиновой кислоты крысы; (с) содержит делецию эндогенной последовательности нуклеиновой кислоты крысы, причем диапазон делеции составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н. или от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 300 т.н., от около 300 т.н. до около 400 т.н., от около 400 т.н. до около 500 т.н., от около 500 т.н. до около 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н. или от около 2,5 м.н. до около 3 м.н.; (d) содержит экзогенную последовательность нуклеиновой кислоты в диапазоне от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.; (е) содержит экзогенную последовательность нуклеиновой кислоты, содержащую гомологичную или ортологичную последовательность нуклеиновой кислоты; (f) содержит химерную последовательность нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты человека и крысы; (g) в диапазоне от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.; (h) содержит условную аллель, фланкированную целевыми последовательностями сайт-специфических рекомбиназ, или (i) содержит репортерный ген, функционально связанный с промотором активным в клетке крысы.
[0013] В данном изобретении дополнительно представлен способ модификации представляющего интерес геномного локуса в плюрипотентной клетке крысы посредством направленной генетической модификации, причем представляющий интерес геномный локус содержит: (i) первую последовательность нуклеиновой кислоты, которая комплементарна 5'-гомологичному плечу крысы, и (ii) вторую последовательность нуклеиновой кислоты, которая комплементарна 3'-гомологичному плечу крысы. В некоторых таких вариантах реализации изобретения первая и вторая последовательность нуклеиновой кислоты разделена по меньшей мере 5 т.н. В некоторых вариантах реализации изобретения первая и вторая последовательность нуклеиновой кислоты разделены по меньшей мере 5 т.н., но менее 3 м.н. В некоторых таких способах первая и вторая последовательность нуклеиновой кислоты разделены по меньшей мере 5 т.н., но менее 10 т.н., по меньшей мере 10 т.н., но менее 20 т.н., по меньшей мере 20 т.н., но менее 40 т.н., по меньшей мере 40 т.н., но менее 60 т.н., по меньшей мере 60 т.н., но менее 80 т.н., по меньшей мере около 80 т.н., но менее 100 т.н., по меньшей мере 100 т.н., но менее 150 т.н., или по меньшей мере 150 т.н., но менее 200 т.н., по меньшей мере около 200 т.н., но менее около 300 т.н., по меньшей мере около 300 т.н., но менее около 400 т.н., по меньшей мере около 400 т.н., но менее около 500 т.н., по меньшей мере около 500 т.н., но менее около 1 м.н., по меньшей мере около 1 м.н., но менее около 1,5 м.н., по меньшей мере около 1,5 м.н., но менее около 2 м.н., по меньшей мере около 2 м.н., но менее около 2,5 м.н., по меньшей мере около 2,5 м.н., но менее около 3 м.н., по меньшей мере около 1 м.н., но менее около 2 м.н., по меньшей мере около 2 м.н., но менее около 3 м.н.
[0014] В некоторых вариантах реализации изобретения стадия введения дополнительно включает введение второй нуклеиновой кислоты, кодирующей нуклеазный агент, который способствует гомологичной рекомбинации между таргетирующей конструкцией и представляющим интерес геномным локусом в плюрипотентной клетке крысы. В некоторых таких вариантах реализации изобретения нуклеазный агент включает: (а) химерный белок, содержащий ДНК-связывающий домен на основе цинкового пальца, гибридизированный с эндонуклеазой FokI, или (b) химерный белок, содержащий подобную активатору транскрипции эффекторную нуклеазу (TALEN), гибридизированную с эндонуклеазой FokI.
[0015] В некоторых способах стадия введения дополнительно включает введение в плюрипотентную клетку крысы: (i) первой экспрессионной конструкции, содержащей первый промотор, функционально связанный с первой последовательностью нуклеиновой кислоты, кодирующей белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), (ii) второй экспрессионной конструкции, содержащей второй промотор, функционально связанный со второй последовательностью нуклеиновой кислоты, кодирующей геномную целевую последовательность, функционально связанную с гидовой РНК (гРНК), причем геномная целевая последовательность непосредственно фланкирована на 3'-конце последовательностью мотива, прилегающего к протоспейсеру (РАМ). В одном варианте реализации изобретения представляющий интерес геномный локус содержит нуклеотидную последовательность SEQ ID №: 1. В одном варианте реализации изобретения гРНК содержит третью последовательность нуклеиновой кислоты, кодирующую РНК (crRNA) коротких палиндромных повторов, регулярно расположенных группами (CRISPR), и трансактивирующую РНК CRISPR (tracrRNA). В другом варианте реализации изобретения геном плюрипотентной клетки крысы содержит целевой участок ДНК, комплементарный геномной целевой последовательности. В некоторых таких способах белок Cas представляет собой Cas9. В некоторых таких способах гРНК содержит (а) химерную РНК с последовательностью нуклеиновой кислоты SEQ ID №: 2 или (b) химерную РНК с последовательностью нуклеиновой кислоты SEQ ID №: 3. В некоторых таких способах crRNA содержит последовательность, представленную в SEQ ID №: 4, SEQ ID №: 5 или SEQ ID №: 6. В некоторых таких способах tracrRNA содержит последовательность, представленную в SEQ ID №: 7 или SEQ ID №: 8.
[0016] В данном изобретении дополнительно представлено геномный локус крысы, содержащий (i) инсерцию гомологичной или ортологичной последовательности нуклеиновой кислоты человека; (ii) замену эндогенной последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека или (iii) их комбинацию, причем геномный локус крысы способен передаваться по зародышевой линии. В другом таком геномном локусе крысы размер инсерции или замены составляет от около 5 т.н. до около 400 т.н. В другом таком геномном локусе крысы размер инсерции или замены составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н., от около 350 т.н. до около 400 т.н., от около 400 т.н. до около 800 т.н., от около 800 т.н. до 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н., от около 2,5 м.н. до около 2,8 м.н., от около 2,8 м.н. до около 3 м.н., по меньшей мере около 200 т.н., но менее около 300 т.н., по меньшей мере около 300 т.н., но менее около 400 т.н., по меньшей мере около 400 т.н., но менее около 500 т.н., по меньшей мере около 500 т.н., но менее около 1 м.н., по меньшей мере около 1 м.н., но менее около 2 м.н., по меньшей мере около 2 м.н., но менее около 3 м.н.
[0017] В данном изобретении дополнительно представлено способ создания гуманизированной крысы, включающий: (а) таргетинг представляющего интерес геномного локуса в плюрипотентной клетке крысы таргетирующей конструкцией, содержащей вставку нуклеиновой кислоты человека, с образованием генетически модифицированной плюрипотентной клетки крысы; (b) введение генетически модифицированной плюрипотентной клетки крысы в эмбрион-хозяин крысы и (с) вынашивание эмбриона-хозяина крысы суррогатной матерью; причем суррогатная мать воспроизводит потомство крыс, содержащее модифицированный геномный локус, который включает: (i) инсерцию последовательности нуклеиновой кислоты человека; (ii) замену последовательности нуклеиновой кислоты крысы в представляющем интерес геномном локусе гомологичной или ортологичной последовательностью нуклеиновой кислоты человека; (iii) химерную последовательность нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты человека и крысы или (iv) их комбинацию, причем модифицированный геномный локус способен передаваться по зародышевой линии.
[0018] В некоторых таких способах таргетирующая конструкция представляет собой большой таргетирующий вектор (LTVEC), а полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет по меньшей мере 10 т.н., но менее 100 т.н., или полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет по меньшей мере 10 т.н., но менее 150 т.н. В некоторых таких способах полная совокупность 5'- и 3'-гомологичных плечей таргетирующей конструкции составляет от около 10 т.н. до около 30 т.н., от около 20 т.н. до 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н. В некоторых таких способах последовательность нуклеиновой кислоты человека составляет по меньшей мере 5 т.н., но менее 400 т.н. В некоторых таких способах последовательность нуклеиновой кислоты человека составляет по меньшей мере 5 т.н., но менее 10 т.н., по меньшей мере 10 т.н., но менее 20 т.н., по меньшей мере 20 т.н., но менее 40 т.н., по меньшей мере 40 т.н., но менее 60 т.н., по меньшей мере 60 т.н., но менее 80 т.н., по меньшей мере около 80 т.н., но менее 100 т.н., по меньшей мере 100 т.н., но менее 150 т.н., по меньшей мере 150 т.н., но менее 200 т.н., по меньшей мере 200 т.н., но менее 250 т.н., по меньшей мере 250 т.н., но менее 300 т.н., по меньшей мере 300 т.н., но менее 350 т.н., или по меньшей мере 350 т.н., но менее 400 т.н. В других вариантах реализации изобретения размер полной совокупности 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 150 т.н., от около 10 т.н. до около 100 т.н., от около 10 т.н. до около 75 т.н., от около 20 т.н. до около 150 т.н., от около 20 т.н. до около 100 т.н., от около 20 т.н. до около 75 т.н., около 30 т.н. до около 150 т.н., от около 30 т.н. до около 100 т.н., от около 30 т.н. до около 75 т.н., около 40 т.н. до около 150 т.н., от около 40 т.н. до около 100 т.н., от около 40 т.н. до около 75 т.н., около 50 т.н. до около 150 т.н., от около 50 т.н. до около 100 т.н., от около 50 т.н. до около 75 т.н., от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н. В одном варианте реализации изобретения размер делеции такой же или сходный с размером полной совокупности 5'- и 3'-гомологичных плечей LTVEC.
[0019] В некоторых способах создания гуманизированной крысы плюрипотентная клетка крысы представляет собой эмбриональную стволовую (ЭС) клетку крысы. В некоторых таких способах плюрипотентную клетку крысы получают из штамма DA или штамма ACI. В некоторых таких способах плюрипотентная клетка крысы характеризуется экспрессией по меньшей мере одного маркера плюрипотентности, включающего Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, рецептор LIF, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 и/или их комбинацию. В некоторых таких способах плюрипотентная клетка крысы характеризуется одной или более из следующих особенностей: (а) отсутствие экспрессии одного или более маркеров плюрипотентности, включающих с-Myc, Ecat1 и/или Rexo1, (b) отсутствие экспрессии одного или более мезодермальных маркеров, включающих ген брахиурии и/или Bmpr2, (с) отсутствие экспрессии одного или более эндодермальных маркеров, включающих Gata6, Sox17 и/или Sox7 или (d) отсутствие экспрессии одного или более нейральных маркеров, включающих Nestin и/или Рах6.
[0020] В данном изобретении дополнительно представлено генетически модифицированную крысу, содержащую гуманизированный геномный локус, причем генетически модифицированная крыса содержит: (i) инсерцию гомологичной или ортологичной последовательности нуклеиновой кислоты человека; (ii) замену последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека в эндогенном геномном локусе гомологичной или ортологичной последовательности нуклеиновой кислоты человека; (iii) химерную последовательность нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты человека и крысы или (iv) их комбинацию, причем гуманизированный геномный локус способен передаваться по зародышевой линии. В некоторых таких генетически модифицированных крысах гуманизированный геномный локус содержит химерную последовательность нуклеиновой кислоты, включающую последовательность нуклеиновой кислоты человека и крысы.
[0021] В данном изобретении также представлены способы модификации целевого геномного локуса крысы посредством бактериальной гомологичной рекомбинации (БГР), они включают: введение в прокариотическую клетку большого таргетирующего вектора (LTVEC), содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем прокариотическая клетка содержит нуклеиновую кислоту крысы и способна экспрессировать рекомбиназу, которая опосредует БГР в целевом локусе и при этом полная совокупность 5'- и 3'-гомологичных плечей крысы LTVEC составляет по меньшей мере 10 т.н., но менее 100 т.н. или полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет по меньшей мере 10 т.н., но менее 150 т.н. В других вариантах реализации изобретения размер полной совокупности 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 150 т.н., от около 10 т.н. до около 100 т.н., от около 10 т.н. до около 75 т.н., от около 20 т.н. до около 150 т.н., от около 20 т.н. до около 100 т.н., от около 20 т.н. до около 75 т.н., около 30 т.н. до около 150 т.н., от около 30 т.н. до около 100 т.н., от около 30 т.н. до около 75 т.н., около 40 т.н. до около 150 т.н., от около 40 т.н. до около 100 т.н., от около 40 т.н. до около 75 т.н., около 50 т.н. до около 150 т.н., от около 50 т.н. до около 100 т.н. или от около 50 т.н. до около 75 т.н., от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н. В одном варианте реализации изобретения размер делеции такой же или сходный с размером полной совокупности 5'- и 3'-гомологичных плечей LTVEC.
[0022] В некоторых таких способах целевой локус нуклеиновой кислоты крысы содержит первую последовательность нуклеиновой кислоты, которая комплементарна 5'-гомологичному плечу, и вторую последовательность нуклеиновой кислоты, которая комплементарна 3'-гомологичному плечу крысы. В некоторых таких способах первая и вторая последовательность нуклеиновой кислоты разделены по меньшей мере 5 т.н., но менее 10 т.н., по меньшей мере 10 т.н., но менее 20 т.н., по меньшей мере 20 т.н., но менее 40 т.н., по меньшей мере 40 т.н., но менее 60 т.н., по меньшей мере 60 т.н., но менее 80 т.н., по меньшей мере около 80 т.н., но менее 100 т.н., по меньшей мере 100 т.н., но менее 150 т.н. или по меньшей мере 150 т.н., но менее 200 т.н., по меньшей мере около 200 т.н., но менее около 300 т.н., по меньшей мере около 300 т.н., но менее около 400 т.н., по меньшей мере около 400 т.н., но менее около 500 т.н., по меньшей мере около 500 т.н., но менее около 1 м.н., по меньшей мере около 1 м.н., но менее около 2 м.н., по меньшей мере около 2 м.н., но менее около 3 м.н.
[0023] В некоторых таких способах введение таргетирующего вектора в прокариотическую клетку приводит к: (i) делеции эндогенной последовательности нуклеиновой кислоты крысы из целевого геномного локуса; (ii) добавлению экзогенной последовательности нуклеиновой кислоты в целевой геномный локус; (iii) замене эндогенной последовательности нуклеиновой кислоты крысы экзогенной последовательности нуклеиновой кислоты в целевом локусе или (iv) их комбинации. В некоторых таких способах вставка нуклеиновой кислоты содержит (а) полинуклеотид, который гомологичен или ортологичен последовательности нуклеиновой кислоты крысы, в целевом геномном локусе или (b) условную аллель, фланкированную последовательностями распознавания сайт-специфической рекомбинации.
[0024] В данном изобретении дополнительно представлена прокариотическая клетка-хозяин, содержащая таргетирующий вектор, включающий вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем вставка нуклеиновой кислоты находится в диапазоне от около 5 т.до около 400 т.н. В некоторых прокариотических клетках-хозяевах размер вставки нуклеиновой кислоты составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от 350 т.н. до около 400 т.н. В некоторых прокариотических клетках-хозяевах прокариотическая клетка содержит ген рекомбиназы, функционально связанный с конститутивно активным промотором или индуцируемым промотором.
[0025] В данном изобретении также представлены способы модификации представляющего интерес геномного локуса в клетке посредством направленной генетической модификации, включающей введение в клетку
[0026] (а) большого таргетирующего вектора (LTVEC), содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем полная совокупность 5'- и 3'-гомологичных плечей крысы LTVEC составляет по меньшей мере 10 т.н. и
[0027] (b) (i) первой экспрессионной конструкции, содержащей первый промотор, функционально связанный с первой последовательностью нуклеиновой кислоты, кодирующей белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), (ii) второй экспрессионной конструкции, содержащей второй промотор, функционально связанный со второй последовательностью нуклеиновой кислоты, кодирующей геномную целевую последовательность, функционально связанную с гидовой РНК (гРНК); и идентификацию генетически модифицированной плюрипотентной клетки, содержащей направленную генетическую модификацию, в представляющем интерес геномном локусе.
[0028] В одном варианте реализации изобретения представляющий интерес геномный локус содержит нуклеотидную последовательность, представленную в SEQ ID №: 1, причем гРНК содержит третью последовательность нуклеиновой кислоты, кодирующую РНК коротких палиндромных повторов, регулярно расположенных группами (CRISPR) (crRNA), и трансактивирующую РНК CRISPR (tracrRNA), и при этом геном клетки содержит целевой участок ДНК, комплементарный геномной целевой последовательности. В некоторых таких способах белок Cas представляет собой Cas9. В таких способах клетка может быть плюрипотентной клеткой (такой как эмбриональная стволовая клетка) или прокариотической клеткой. В одном варианте реализации изобретения плюрипотентную клетку получают из нечеловеческого животного, нечеловеческого млекопитающего, грызуна, человека, крысы, мыши, хомяка, кролика, свиньи, быка, оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макака-резус), одомашненного млекопитающего или сельскохозяйственного млекопитающего, или любого другого целевого организма. В другом варианте реализации изобретения прокариотическую клетку получают из бактерий, таких как Е. coli.
[0029] В других вариантах реализации изобретения размер полной совокупности 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 150 т.н., от около 10 т.н. до около 100 т.н., от около 10 т.н. до около 75 т.н., от около 20 т.н. до около 150 т.н., от около 20 т.н. до около 100 т.н., от около 20 т.н. до около 75 т.н., около 30 т.н. до около 150 т.н., от около 30 т.н. до около 100 т.н., от около 30 т.н. до около 75 т.н., около 40 т.н. до около 150 т.н., от около 40 т.н. до около 100 т.н., от около 40 т.н. до около 75 т.н., около 50 т.н. до около 150 т.н., от около 50 т.н. до около 100 т.н. или от около 50 т.н. до около 75 т.н., от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н. В одном варианте реализации изобретения размер делеции такой же или сходный с размером полной совокупности 5'- и 3'-гомологичных плечей LTVEC.
[0030] В одном варианте реализации изобретения плюрипотентная клетка представляет собой нечеловеческую плюрипотентную клетку. В одном варианте реализации изобретения нечеловеческая плюрипотентная клетка представляет собой плюрипотентную клетку млекопитающего. В одном варианте реализации изобретения плюрипотентная клетка млекопитающего представляет собой плюрипотентную клетку грызуна. В одном варианте реализации изобретения плюрипотентная клетка грызуна представляет собой плюрипотентную клетку крысы или мыши. В одном варианте реализации изобретения плюрипотентная клетка представляет собой человеческую индуцированную плюрипотентную стволовую (иПС) клетку.
[0031] В одном варианте реализации изобретения плюрипотентная клетка представляет собой нечеловеческую оплодотворенную яйцеклетку на стадии одной клетки. В одном варианте реализации изобретения нечеловеческая оплодотворенная яйцеклетка представляет собой оплодотворенную яйцеклетку млекопитающего. В одном варианте реализации изобретения оплодотворенная яйцеклетка млекопитающего представляет собой оплодотворенную яйцеклетку грызуна на стадии одной клетки. В одном варианте реализации изобретения оплодотворенная яйцеклетка млекопитающего представляет собой оплодотворенную яйцеклетку крысы или мыши на стадии одной клетки.
[0032] В данном изобретении дополнительно предложена крыса или клетка крысы, содержащая направленную генетическую модификацию в ее геномный локус, причем геномный локус представляет собой локус рецептора гамма интерлейкина-2, локус АроЕ, локус Rag1, локус Rag2 или локус Rag2/Rag1, при этом направленная генетическая модификация включает: (а) делецию эндогенной последовательности нуклеиновой кислоты крысы в геномном локусе; (b) инсерцию гомологичной нуклеиновой кислоты, ортологичной нуклеиновой кислоты или химерной нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты человека и крысы или (с) их комбинацию. В такой крысе или клетке крысы направленная генетическая модификация является передаваемой по зародышевой линии крысы или крысе, воспроизведенной из клетки крысы.
[0033] В некоторых таких крысах или клетках крыс делеция эндогенной нуклеиновой кислоты крысы в геномном локусе составляет по меньшей мере около 10 т.н. или инсерция экзогенной последовательности нуклеиновой кислоты в геномный локус составляет по меньшей мере около 5 т.н.
[0034] В данном изобретении дополнительно предложена крыса или клетка крысы, для которой (а) направленная генетическая модификация в локусе рецептора гамма интерлейкина-2 приводит к уменьшению или потрере активности белка рецептора гамма интерлейкина-2; (b) направленная генетическая модификация в локусе АроЕ приводит к уменьшению или потере активности белка АроЕ; (с) направленная генетическая модификация в локусе Rag1 приводит к уменьшению или потере активности белка Rag1; (d) направленная генетическая модификация в локусе Rag2 приводит к уменьшению или потере активности белка Rag2 или (е) направленная генетическая модификация в локусе Rag2/Rag1 приводит к уменьшению или потере активности белка Rag2 и активности Rag1.
[0035] В некоторых вариантах реализации изобретения направленная генетической модификация локуса рецептора гамма интерлейкина-2 включает: (а) делецию целого кодирующего участка рецептора гамма интерлейкина-2 крысы или его части; (b) замену целого кодирующего участка рецептора гамма интерлейкина-2 крысы или его части кодирующим участком рецептора гамма интерлейкина-2 человека или его частью; (с) замену эктодомена кодирующего участка рецептора гамма интерлейкина-2 крысы эктодоменом рецептора гамма интерлейкина-2 человека или (d) по меньшей мере делецию размером 3 т.н. локуса рецептора гамма интерлейкина-2. У других таких крыс или клеток крыс направленная генетическая модификация локуса АроЕ включает: (а) делецию целого кодирующего участка АроЕ или его части или (b) по меньшей мере делецию размером 1,8 т.н. локуса АроЕ, содержащую кодирующий участок АроЕ.
[0036] В данном изобретении дополнительно предложена крыса или клетка крысы, в которой направленная генетическая модификация локуса Rag2 включает: (а) делецию целого кодирующего участка Rag2 или его части или (b) по меньшей мере делецию размером 5,7 т.н. локуса Rag2, содержащую кодирующий участок Rag2. В некоторых вариантах реализации изобретения направленная генетическая модификация локуса Rag2/Rag1 включает: (а) делецию целого кодирующего участка Rag2 или его части и делецию целого кодирующего участка Rag1 или его части или (b) делецию размером по меньшей мере 16 т.н. локуса Rag2/Rag1, содержащую кодирующий участок Rag2.
[0037] В данном изобретении дополнительно предложена крыса или клетка крысы, для которой: направленная генетическая модификация включает инсерцию экспрессионной кассеты, содержащей селективный маркер в локусе рецептора гамма интерлейкина-2, локусе АроЕ, локусе Rag1, локусе Rag2 или локусе Rag2/Rag1. У некоторых таких крыс или клетках крыс экспрессионная кассета содержит ген lacZ, функционально связанный с эндогенным промотором в геномном локусе, и промотор убиквитина человека, функционально связанный с селективным маркером.
[0038] В данном изобретении дополнительно предложена крыса или клетка крысы, в которой направленная генетическая модификация в локусе рецептора гамма интерлейкина-2, локусе АроЕ, локусе Rag1, локусе Rag2 или локусе Rag2/Rag1 включает инсерцию самоделетирующейся селекционной кассеты. У некоторых таких крыс или клеток крыс самоделетирующаяся селекционная кассета содержит ген селективного маркера, функционально связанный с промотором активным в клетке крысы, и ген рекомбиназы, функционально связанный со специфическим по мужским зародышевым клеткам промотором, причем самоделетирующаяся кассета фланкирована сайтами рекомбинационного распознавания, распознаваемыми рекомбиназой. У некоторых таких крыс или клеток крыс специфический по мужским зародышевым клеткам промотор представляет собой промотор протамина-1; ген рекомбиназы кодирует Cre, а сайты рекомбинационного распознавания являются сайтами loxP. В одном варианте реализации изобретения промотор протамина-1 представляет собой промотор протамина-1 мыши или крысы.
[0039] В данном изобретении дополнительно предложена крыса или клетка крысы, в которой инсерция экзогенной последовательности нуклеиновой кислоты в геномном локусе содержит репортерную нуклеиновую кислоту, функционально связанную с эндогенным промотором рецептора гамма интерлейкина-2, эндогенным промотором АроЕ, эндогенным промотором Rag1 или эндогенным промотором Rag2. У некоторых таких крыс или клеток крыс репортерная нуклеиновая кислота кодирует репортер, включающий β-галактозидазу, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, белок с улучшенной желтой флуоресценцией (EYFP), Emerald, белок с улучшенной зеленой флуоресценцией (EGFP), CyPet, белок с голубой флуоресценцией (CFP), Cerulean, T-Sapphire, люциферазу, щелочную фосфатазу или их комбинацию.
[0040] В данном изобретении дополнительно предложена клетка крысы, причем клетка крысы представляет собой плюрипотентную клетку крысы или эмбриональную стволовую (ЭС) клетку крысы. У некоторых таких клеток крысы плюрипотентная клетка крысы или эмбриональная стволовая (ЭС) клетка крысы (а) получена из штамма DA или штамма ACI; (b) характеризуется экспрессией по меньшей мере одного маркера плюрипотентности, включающего Dnmt3L, Eras, Err-beta, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, рецептор LIF, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинацию или (с) характеризуется одним или более из следующих свойств: (i) отсутствие экспрессии одного или более маркеров плюрипотентности, включающих с-Myc, Ecat1 и Rexo1, (ii) отсутствие экспрессии одного или более мезодермальных маркеров, включающих ген брахиурии и Bmpr2, (iii) отсутствие экспрессии одного или более эндодермальных маркеров, включающих Gata6, Sox17 и Sox7 или (iv) отсутствие экспрессии одного или более нейральных маркеров, включающих Nestin и Рах6.
[0041] В данном изобретении дополнительно представлен способ модификации целевого геномного локуса в локусе рецептора гамма интерлейкина-2, локусе АроЕ, локусе Rag1, локусе Rag2 или локусе Rag2/Rag1 в плюрипотентной клетке крысы, способ включает: (а) введение в плюрипотентную клетку крысы таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'- и 3'-гомологичным плечами крысы, гомологичными целевому геномному локусу и (b) идентификацию генетически модифицированной плюрипотентной клетки крысы, содержащей направленную генетическую модификацию в целевом геномном локусе, причем направленная генетическая модификация способна передаваться по зародышевой линии крысы, воспроизведенной из плюрипотентной клетки крысы. В некоторых таких способах таргетирующий вектор представляет собой большой таргетирующий вектор (LTVEC), в котором полная совокупность 5'- и 3'-гомологичных плечей крысы составляет по меньшей мере 10 т.н. В некоторых вариантах реализации изобретения полная совокупность 5'- и 3'-гомологичных плечей крысы составляет по меньшей мере 10 т.н., но менее 150 т.н. В некоторых вариантах реализации изобретения полная совокупность 5'- и 3'-гомологичных плечей крысы составляет по меньшей мере около 10 т.н., но меньше чем около 100 т.н. В некоторых вариантах реализации изобретения введение таргетирующего вектора в плюрипотентную клетку крысы приводит к: (i) делеции эндогенной последовательности нуклеиновой кислоты крысы в целевом геномном локусе; (ii) инсерции экзогенной последовательности нуклеиновой кислоты в целевой геномный локус или (iii) их комбинации.
[0042] В некоторых вариантах реализации изобретения делеция эндогенной нуклеиновой кислоты крысы в геномном локусе составляет по меньшей мере около 10 т.н.; делеция эндогенной последовательности нуклеиновой кислоты крысы в геномном локусе находится в диапазоне от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., или от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 300 т.н., от около 300 т.н. до около 400 т.н., от около 400 т.н. до около 500 т.н., от около 500 т.н. до около 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н. или от около 2,5 м.н. до около 3 м.н.; инсерция экзогенной последовательности нуклеиновой кислоты в геномном локусе составляет по меньшей мере 5 т.н. или инсерция экзогенной последовательности нуклеиновой кислоты находится в диапазоне от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.
[0043] В некоторых вариантах реализации изобретения (а) направленная генетическая модификация в локусе рецептора гамма интерлейкина-2 приводит к уменьшению или потере активности белка рецептора гамма интерлейкина-2; (b) направленная генетическая модификация в локусе АроЕ приводит к уменьшению или потере активности белка АроЕ; (с) направленная генетическая модификация в локусе Rag1 приводит к уменьшению или потере активности белка Rag1; (d) направленная генетическая модификация в локусе Rag2 приводит к уменьшению или потере активности белка Rag2 или (е) направленная генетическая модификация в локусе Rag2/Rag1 приводит к уменьшению или потере активности белка Rag2 и активности белка Rag1.
[0044] В некоторых вариантах реализации изобретения направленная генетической модификация в локусе рецептора гамма интерлейкина-2 включает (а) делецию целого кодирующего участка рецептора гамма интерлейкина-2 крысы или его части; (b) замену целого кодирующего участка рецептора гамма интерлейкина-2 крысы или его части кодирующим участком рецептора гамма интерлейкина-2 человека или его частью; (с) замену эктодомена кодирующего участка рецептора гамма интерлейкина-2 крысы эктодоменом рецептора гамма интерлейкина-2 человека или (d) по меньшей мере делецию размером 3 т.н. локуса рецептора гамма интерлейкина-2, содержащую кодирующий участок рецептора гамма интерлейкина-2.
[0045] В некоторых вариантах реализации изобретения направленная генетическая модификация в локусе АроЕ включает: (а) делецию целого кодирующего участка АроЕ или его части или (b) по меньшей мере делецию размером 1,8 т.н. локуса АроЕ, содержащую кодирующий участок АроЕ.
[0046] В некоторых вариантах реализации изобретения направленная генетическая модификация в локусе Rag2 включает: (а) делецию целого кодирующего участка Rag2 или его части или (b) по меньшей мере делецию размером 5,7 т.н. локуса Rag2, содержащую кодирующий участок Rag2. В других способах направленная генетическая модификация локуса Rag1/Rag2 включает: (а) делецию целого кодирующего участка Rag2 или его части и делецию целого кодирующего участка Rag1 или его части или (b) делецию размером по меньшей мере 16 т.н. локуса Rag2/Rag1, содержащую кодирующие участки Rag2 и Rag1.
[0047] В некоторых таких вариантах реализации изобретения для модификации целевого геномного локуса, вставка нуклеиновой кислоты содержит экспрессионную кассету, содержащую полинуклеотид, кодирующий селективный маркер. В некоторых таких вариантах реализации изобретения экспрессионная кассета содержит ген lacZ, функционально связанный с эндогенным промотором в геномном локусе, и промотор убиквитина человека, функционально связанный с геном селективного маркера.
[0048] В некоторых вариантах реализации изобретения вставка нуклеиновой кислоты содержит самоделетирующуюся селекционную кассету. В некоторых таких вариантах реализации изобретения самоделетирующаяся селекционная кассета содержит ген селективного маркера, функционально связанный с промотором активным в плюрипотентной клетке крысы, и полинуклеотид, кодирующий рекомбиназу, функционально связанную со специфическим по мужским зародышевым клеткам промотором, причем самоделетирующаяся кассета фланкирована сайтами рекомбинационного распознавания, распознаваемыми рекомбиназой. В некоторых таких вариантах реализации изобретения специфический по мужским зародышевым клеткам промотор представляет собой промотор протамина-1 или ген рекомбиназы кодирует Cre, а сайты рекомбинационного распознавания являются сайтами loxP. В некоторых вариантах реализации изобретения промотор протамина-1 представляет собой промотор протамина-1 мыши или крысы.
[0049] В других способах инсерция экзогенной последовательности нуклеиновой кислоты в геномном локусе содержит репортерную последовательность нуклеиновой кислоты, функционально связанную с эндогенным промотором рецептора гамма интерлейкина-2, эндогенным промотором АроЕ, эндогенным промотором Rag1 или эндогенным промотором Rag2. В некоторых таких вариантах реализации изобретения репортерная последовательность нуклеиновой кислоты кодирует репортер, включающий β-галактозидазу, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, белок с улучшенной желтой флуоресценцией (EYFP), Emerald, белок с улучшенной зеленой флуоресценцией (EGFP), CyPet, белок с голубой флуоресценцией (CFP), Cerulean, T-Sapphire, люциферазу, щелочную фосфатазу или их комбинацию.
[0050] В некоторых вариантах реализации изобретения для модификации целевой геномного локуса плюрипотентная клетка крысы применяется эмбриональная стволовая (ЭС) клетка крысы. В некоторых таких вариантах реализации изобретения плюрипотентная клетка крысы: (а) получена из штамма DA или штамма ACI; (b) характеризуется экспрессией маркера плюрипотентности, включающего Oct4, Sox2, щелочную фосфатазу или их комбинацию или (с) характеризуется одним или более из следующих свойств: (i) отсутствие экспрессии одного или более маркеров плюрипотентности, включающих с-Myc, Ecat1 и Rexo1, (ii) отсутствие экспрессии одного или более мезодермальных маркеров, включающих маркер брахиуриии Bmpr2, (iii) отсутствие экспрессии одного или более эндодермальных маркеров, включающих Gata6, Sox17 и Sox7 или (iv) отсутствие экспрессии одного или более нейральных маркеров, включающих Nestin и Рах6.
[0051] В некоторых вариантах реализации изобретения способ дополнительно включает идентификацию направленной генетической модификации в целевом геномном локусе, причем на стадии идентификации применяется количественный анализ для оценки модификации аллели (МОА) в целевом геномном локусе.
[0052] В некоторых вариантах реализации изобретения стадия введения дополнительно включает введение второй нуклеиновой кислоты, кодирующей нуклеазный агент, который способствует гомологичной рекомбинации между таргетирующим вектором и целевым геномным локусом в плюрипотентной клетке крысы. В некоторых таких вариантах реализации изобретения нуклеазный агент включает химерный белок, содержащий ДНК-связывающий домен на основе цинкового пальца, гибридизированный с эндонуклеазой FokI. Некоторые такие способы приводят к биаллельной модификации целевого геномного локуса.
[0053] В некоторых вариантах реализации изобретения стадия введения данного способа дополнительно включает введение в плюрипотентную клетку крысы: первой экспрессионной конструкции, содержащей первый промотор, функционально связанный с первой последовательностью нуклеиновой кислоты, кодирующей белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), и второй экспрессионной конструкции, содержащей второй промотор, функционально связанный со второй последовательностью нуклеиновой кислоты, кодирующей геномную целевую последовательность, функционально связанную с гидовой РНК (гРНК), причем геномная целевая последовательность непосредственно фланкирована на 3'-конце последовательностью мотива, прилегающего к протоспейсеру (РАМ). В одном варианте реализации изобретения геномная целевая последовательность содержит нуклеотидную последовательность, представленную в SEQ ID №: 1. В одном варианте реализации изобретения гРНК содержит третью последовательность нуклеиновой кислоты, кодирующую РНК (crRNA) коротких палиндромных повторов, регулярно расположенных группами (CRISPR), и трансактивирующую РНК CRISPR (tracrRNA). В некоторых таких вариантах реализации изобретения белок Cas представляет собой Cas9. В некоторых таких вариантах реализации изобретения (а) гРНК представляет собой химерную РНК с последовательностью нуклеиновой кислоты, представленной в SEQ ID №: 2; (b) гРНК представляет собой химерную РНК с последовательностью нуклеиновой кислоты, представленной в SEQ ID №: 3; (с) crRNA содержит последовательность, представленную в SEQ ID №: 4, SEQ ID №: 5, SEQ ID №: 6 или (d) tracrRNA содержит последовательность, представленную в SEQ ID №: 7 и/или SEQ ID №: 8.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0054] Патент или поданная заявка содержит по меньшей мере один рисунок, выполненный в цвете. Копии этого патента или опубликованной патентной заявки с цветной фигурой(ами) будут предоставлены Бюро по запросу и после уплаты необходимой пошлины.
[0055] На фиг. 1 изображено ЭСК крысы, которые растут в виде компактных сферических колоний, которых по стандартной методике снимали с поверхности и распределяли в чашке.
[0056] На фиг. 2A-D изображены различные маркеры плюрипотентности, экспрессированные ЭСК крысы: на А изображен Oct-4 (зеленый цвет); на В изображен Sox-2 (красный цвет); на С изображен DAPI (синий цвет); на D изображено наложение маркеров плюрипотентности, экспрессированных ЭСКк.
[0057] На фиг. 3 изображено то, что ЭСК крысы экспрессируют видимые по цвету уровни щелочной фосфатазы (маркер плюрипотентности)(слева), и показан кариотип линии DA.2B являющийся 42X,Y (справа). Кариотипирование проведено из-за того, что ЭСК крысы часто становятся тетраплоидными; поэтому, линии подвергали предварительному скринингу подсчетом распластанных метафазных хромосом, а линии с преимущественно нормальными значениями подсчета потом кариотипировали с соблюдением принятых норм.
[0058] На фиг. 4А-В представлены фотографии, показывающие результаты анализа количества хромосом ЭС клеток крысы линии ACI.G1.
[0059] На фиг. 5А-В представлены фотографии, показывающие результаты анализа количества хромосом ЭС клеток крысы линии DA.2B.
[0060] На фиг. 6А-В представлены фотографии, показывающие результаты анализа количества хромосом ЭС клеток крысы линии DA.C2.
[0061] На фиг. 7 изображен вид в увеличенном масштабе ЭСК крысы фиг. 1.
[0062] На фиг. 8 изображено получение химер методом инъекции в бластоцисты и передачу генома ЭСК крысы по зародышевой линии; химеры, полученные инъекцией в бластоцисты с использованием исходных ЭСК крысы ACI.G1; большое процентное содержание химер обычно обладает альбиносными мордами.
[0063] На фиг. 9 изображено потомство крысят F1 окраса агути с альбиносными однопометными животными, осеменненные химерой ACI/SD, обозначенной на фиг. 8 звездочкой (*).
[0064] На фиг. 10 представлено схематическое изображение локуса АроЕ крысы и отмечено серыми прямоугольниками сайт разрезания цинк-пальцевыми нуклеазами (ZFN1 и ZFN2). Темно-серыми прямоугольниками отмечены геномные участки, соответствующие 5'- и 3'-гомологичным плечам (5 т.н. и 5,4 т.н., соответственно). Экзон 1 гена АроЕ является некодирующим и показан в виде незаполненного прямоугольника в ближайшем положении к 5'-гомологичному плечу. Три интрона гена АроЕ отмечены в виде линий. Экзоны 2 и 3 включают кодирующие участки и показаны заполненными точками серыми прямоугольниками. Экзон 4 содержит как кодирующую так и некодирующую последовательности, как отмечено заполненными точками затемненным прямоугольником и незаполненным прямоугольником.
[0065] На фиг. 11 представлено сводные результаты эффективности таргетинга АроЕ при проведении его в присутствии цинк-пальцевых нуклеаз (ZFN1 или ZFN2).
[0066] На фиг. 12 изображен таргетинг локуса Rosa 26 крысы, который лежит между генами Setd5 и Thumpd3, как у мыши, с таким же расположением. На изображении А показана структура локуса Rosa 26 мыши. Транскрипты Rosa26 мыши содержат 2 или 3 экзона. На изображении В изображена структура локуса Rosa26 крысы; локус крысы содержит второй экзон 1 (Ex1b) в дополнение к экзону гомологичному экзону 1 мыши (Ex1a); у крысы третий экзон не был идентифицирован. На изображении С изображено намеченную аллель Rosa26 крысы; гомологичные плечи, размером 5 т.н. каждое, клонировали методом ПЦР с использованием геномной ДНК из ЭСКк DA; намеченные аллели содержат кассету с акцептором сплайсинга (SA)-lacZ-hUB-neo, заменяющим делецию размером 117 п.н. в интроне Rosa26 крысы.
[0067] На фиг. 13А изображено головной мозг контрольной крысы дикого типа возрастом 14 недель, который окрашивали X-gal. Головной мозг контрольного животного показал низкий уровень фонового окрашивания по LacZ (вид сверху).
[0068] На фиг. 13В изображено экспрессию LacZ в головном мозге rRosa26-гетерозиготной крысы (возрастом 14 недель). Репортер lacZ экспрессировался повсеместно во всем головном мозге rRosa26-гетерозиготного животного.
[0069] На фиг. 13С изображено сердце и тимус (вставка) контрольной крысы дикого типа возрастом 14 недель, которых обрабатывали X-gal. Сердце и тимус контрольного животного показали низкий уровень фонового окрашивания по LacZ.
[0070] На фиг. 13D изображено экспрессию LacZ в сердце и тимусе (вставка) rRosa26-гетерозиготной крысы возрастом 14 недель. Репортер lacZ экспрессировался повсеместно во всем сердце и тимусе rROSA26-гетерозиготного животного.
[0071] На фиг. 13Е изображены легкие контрольной крысы дикого типа возрастом 14 недель, которых обрабатывали X-gal. Легкие контрольного животного показали низкий уровень фонового окрашивания по LacZ.
[0072] На фиг. 13F изображено экспрессию LacZ в легких rRosa26-гетерозиготной крысы возрастом 14 недель. Репортер lacZ экспрессировался повсеместно по всем легким rRosa26-гетерозиготного животного.
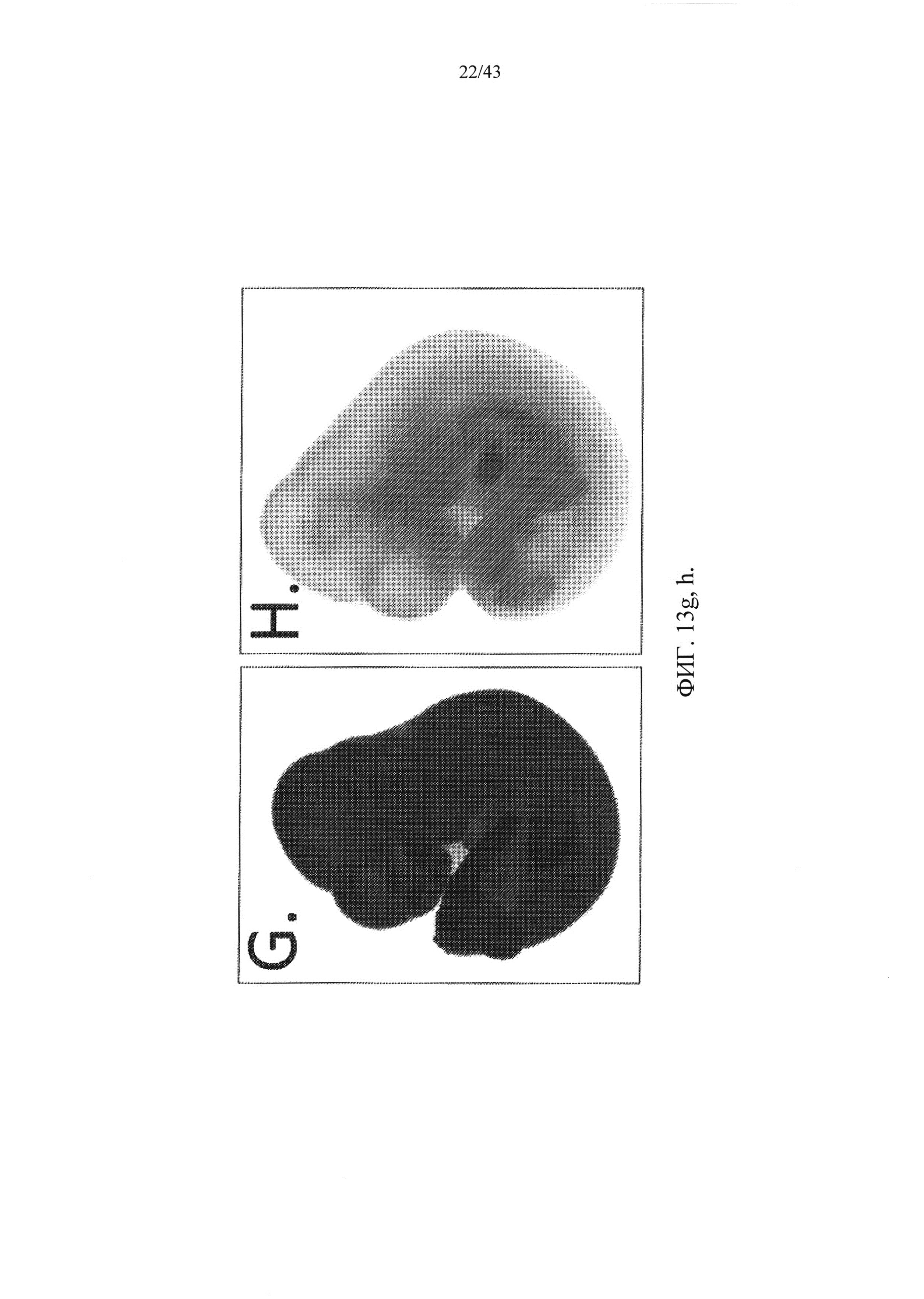
[0073] На фиг. 13G и Н изображено экспрессию LacZ в эмбрионах крысы Е12.5. В отличие от контрольного эмбриона дикого типа (Н), который показал низкий уровень фонового окрашивания по LacZ, rRosa26-гетерозиготный эмбрион выявил повсеместную экспрессию репортера LacZ во всем эмбрионе.
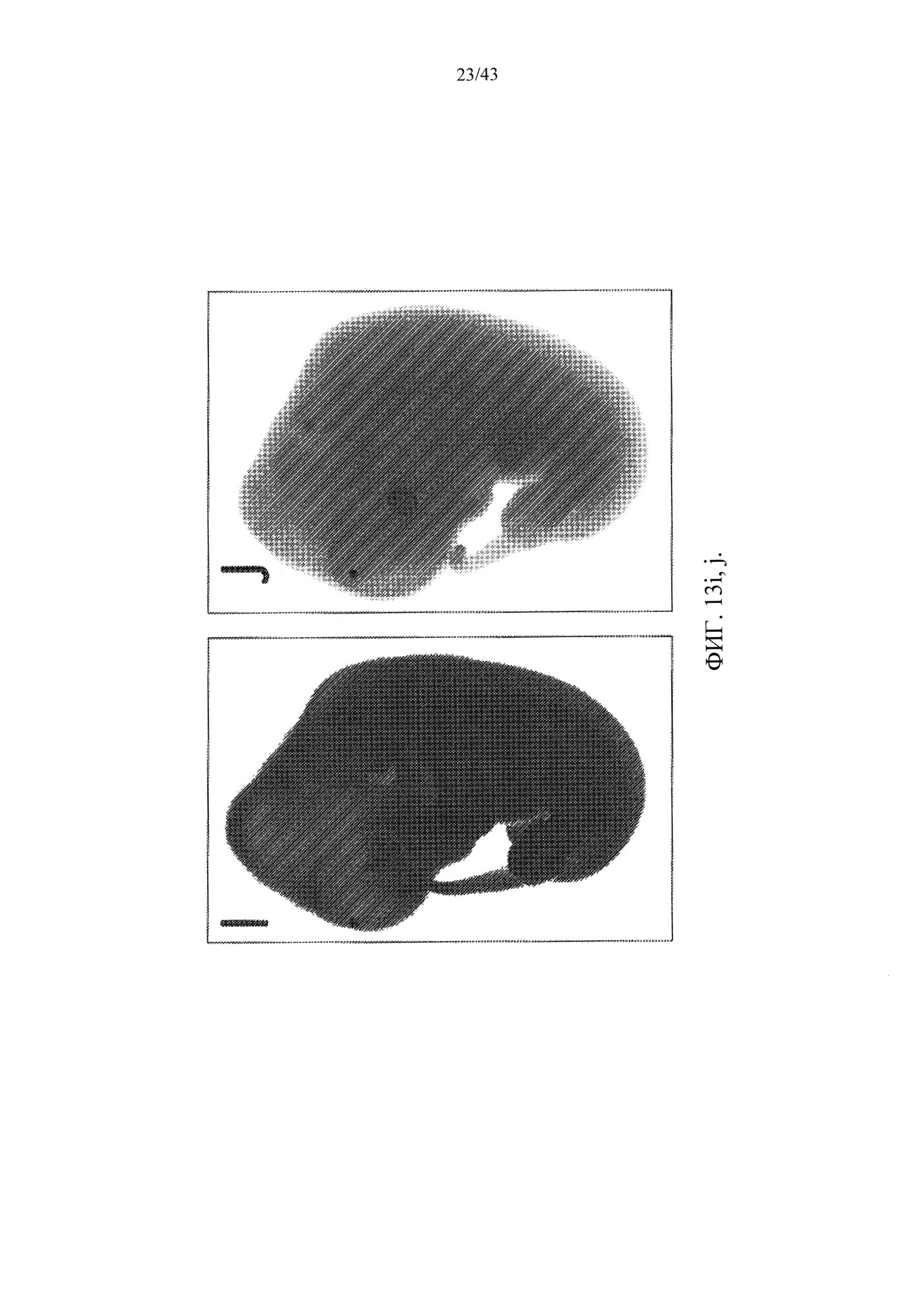
[0074] На фиг. 13I и J изображено экспрессию LacZ в эмбрионах крысы Е14.5. В отличие от контрольного эмбриона дикого типа (J), который показал низкий уровень фонового окрашивания по LacZ, rRosa26-гетерозиготный эмбрион крысы выявил повсеместную экспрессию репортера LacZ во всем эмбрионе.
[0075] Фиг. 14 иллюстрирует событие гомологичной или негомологичной рекомбинации, которое произошло внутри ЭС клетки крысы после электропорации таргетирующего вектора, содержащего селекционную кассету (кассета lacZ-neo).
[0076] Фиг. 15 иллюстрирует механизм, которым геном-редактирующие эндонуклеазы (например, ZFN и TALEN) вводят в целевую геномную последовательность двухцепочечный разрыв (ДЦР) и активируют негомологичное соединение концов (НГСК) в ЭС клетке.
[0077] Фиг. 16 иллюстрирует методику таргетинга генов, которая использует ZFN/TALEN для улучшения эффективности гомологичной рекомбинации таргетирующего вектора. ДЦР представляет двухцепочечный разрыв.
[0078] На фиг. 17 представлено сводные результаты получения химер и передачи по зародышевой линии модифицированного локуса АроЕ крысы. В направленной модификации принимали участие цинк-пальцевые нуклеазы.
[0079] На фиг. 18 представлено схематическое изображение события таргетинга IL2r-γ в комбинации с цинк-пальцевыми нуклеазами, которые направляют ZFN U и ZFN D. На фиг. отмечены сайты разрезания ZFN.
[0080] На фиг. 19 представлена эффективность таргетинга при таргетинге IL2r-γ в комбинации с системой CRISPR/Cas9.
[0081] На фиг. 20 представлено схематическое изображение локуса АроЕ крысы и таргетирующая плазмида. На верхнем схематическом изображении показана геномная структура локуса АроЕ крысы и геномные участки, соответствующие 5'- и 3'-гомологичным плечам (5 т.н. и 5,4 т.н., соответственно; темно-серые прямоугольники). Экзон 1 гена АроЕ является некодирующим и показан в виде незаполненного прямоугольника в ближайшем положении к 5'-гомологичному плечу. Три интрона гена АроЕ отмечены в виде линий. Экзоны 2 и 3 включают кодирующие участки и показаны заполненными точками серыми прямоугольниками. Экзон 4 содержит как кодирующую так и некодирующую последовательности, как отмечено заполненными точками затемненным прямоугольником и незаполненным прямоугольником. На нижнем изображении показана таргетирующая плазмида. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (5 т.н. и 5,4 т.н., соответственно). Таргетирующий вектор содержит репортерный ген (lacZ) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки). Самоделетирующаяся кассета содержит промотор мыши Prm1, функционально связанный с геном Crei, и селекционную кассету по лекарственному веществу, содержащую промотор убиквитина человека, функционально связанный с геном устойчивости к неомицину.
[0082] На фиг. 21 представлено схематическое изображение таргетинга локуса АроЕ в ЭС клетках крысы с использованием цинк-пальцевых нуклеаз и таргетирующего вектора, содержащего репортерный ген, и самоделетирующуюся кассету, содержащую промотор мыши Prm1, функционально связанный с геном Crei, и селекционную кассету по лекарственному веществу, содержащую промотор убиквитина человека, функционально связанный с геном устойчивости к неомицину.
[0083] На фиг. 22 представлено схематическое изображение локуса АроЕ крысы и большого таргетирующего вектора (LTVEC). На верхнем изображении показана геномная организация локуса АроЕ крысы и геномные участки, соответствующие 5'- и 3'-гомологичным плечам (45 т.н. и 23 т.н., соответственно; темно-серые прямоугольники). Экзон 1 АроЕ является некодирующим и показан в виде незаполненного прямоугольника в ближайшем положении к 5'-гомологичному плечу. Три интрона гена АроЕ отмечены в виде линий, а экзоны 2 и 3 включают кодирующие участки и показаны заполненными точками серыми прямоугольниками. Экзон 4 содержит как кодирующую так и некодирующую последовательности, как отмечено заполненными точками затемненным прямоугольником и незаполненным прямоугольником. На нижнем изображении показано LTVEC для модификации локуса АроЕ крысы. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (45 т.н. и 23 т.н., соответственно). LTVEC содержит репортерный ген (lacZ) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки), которая содержит промотор Prm1 мыши, функционально связанный с геном Crei, и селекционную кассету по лекарственному веществу, содержащую промотор убиквитина человека, функционально связанный с геном устойчивости к неомицину.
[0084] На фиг. 23 представлено схематическое изображение локуса АроЕ крысы и отмечено серыми прямоугольниками сайты разрезания цинк-пальцевыми нуклеазами (ZFN1 и ZFN2), использованные вместе с большим таргетирующим вектором (LTVEC) для усиления гомологичной рекомбинации между таргетирующим вектором и целевым когнатным хромосомальным участком.
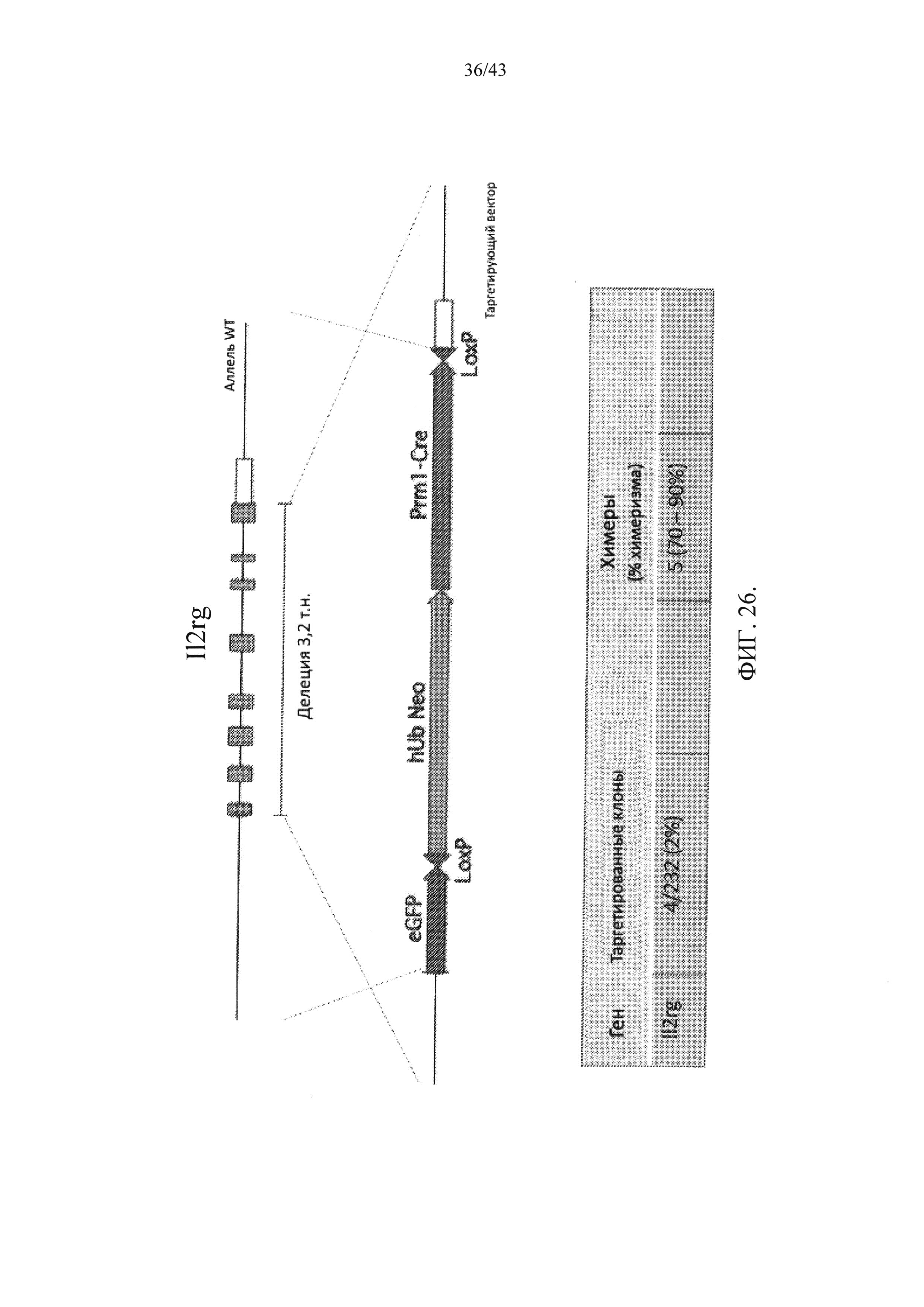
[0085] На фиг. 24 изображен локус IL2r-γ крысы, который разрушен делецией размером 3,2 т.н., инсерцией репортерного гена (eGFP) и самоделетирующейся кассетой, содержащей селекционную кассету по лекарственному веществу (hUb-neo) и ген Crei, функционально связанный с промотором Prm1 мыши.
[0086] На фиг. 25 представлена сводка результатов передачи по зародышевой линии таргетируемых линий эмбриональных стволовых клеток крысы.
[0087] На фиг. 26 представлено другое изображение локуса IL2r-γ крысы, который разрушен делецией размером 3,2 т.н., инсерцией репортерного гена (eGFP) и самоделетирующейся кассетой, содержащей селекционную кассету, включающую ген Crei, функционально связанный с промотором Prm1 мыши и селекционную кассету по лекарственному веществу (hUb-Neo).
[0088] На фиг. 27 представлено схематическое изображение локуса Rag2 крысы и большого таргетирующего вектора (LTVEC) для модификации локуса Rag2 крысы. На верхнем изображении показана геномная организация локуса Rag2 крысы и когнатные геномные участки, соответствующие 5'- и 3'-гомологичным плечам (48 т.н. и 15 т.н., соответственно; темно-серые прямоугольники). Rag2 содержит единственный экзон, отмеченный заполненным точками серым затемнением. На нижнем изображении представлен LTVEC. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (48 т.н. и 15 т.н., соответственно). LTVEC содержит репортерный ген (lacZ) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки), которая содержит промотор Prm1 крысы, функционально связанный с геном Crei, и селекционную кассету по лекарственному веществу, содержащую промотор убиквитина человека, функционально связанный с геном устойчивости к неомицину.
[0089] На фиг. 28 представлена геномная структура локуса Rag1/Rag2 крысы и геномные участки, удаленные таргетированием Rag2 (делеция Rag2) или двойным таргетированием Rag2/Rag1 (делеция Rag2/Rag1).
[0090] На фиг. 29 представлено схематическое изображение локусов Rag2 и Rag1 крысы и большого таргетирующего вектора (LTVEC) для модификации данных локусов. На верхнем изображении показана геномная организация локусов Rag1 и Rag2 крысы и когнатные геномные участки, соответствующие 5'- и 3'-гомологичным плечам (48 т.н. и 84 т.н., соответственно; темно-серые прямоугольники). Rag2 и Rag1 каждый содержит единственный экзон, отмеченный заполненным точками серым затемнением. На нижнем изображении представлен LTVEC. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (48 т.н. и 84 т.н., соответственно). LTVEC содержит репортерный ген (lacZ) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки), которая содержит промотор Prm1 крысы, функционально связанный с геном Crei, и селекционную кассету по лекарственному веществу, содержащую промотор убиквитина человека, функционально связанный с геном устойчивости к неомицину.
[0091] На фиг. 30 показано, что II2rg-/y МКПК не экспрессируют маркеры зрелых лимфоцитов. У 2 из 3 химер в периферической крови были обнаружены GFP-положительные лимфоциты.
[0092] На фиг. 31 представлено схематическое изображение локуса IL-2rg крысы и таргетирующая плазмида для полной гуманизации локуса IL-2rg крысы. На верхнем изображении показана геномная организация локуса IL-2rg крысы и когнатные геномные участки, соответствующие 5'- и 3'-гомологичным плечам (4,4 т.н. и 5,0 т.н., соответственно; темно-серые прямоугольники). На нижнем изображении представлена таргетирующая плазмида. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (4,4 т.н. и 5,0 т.н., соответственно). Таргетирующая плазмида содержит геномный участок IL-2rg человека, репортерный ген (GFP) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки), которая содержит промотор Prm1 мыши, функционально связанный с геном Crei, и селекционную кассету по лекарственному веществу, содержащую промотор убиквитина человека, функционально связанный с геном устойчивости к неомицину.
[0093] На фиг. 32 представлено схематическое изображение локуса IL-2rg крысы и таргетирующая плазмида для гуманизации эктодомена локуса IL-2rg крысы. На верхнем изображении показана геномная организация локуса IL-2rg крысы и когнатные геномные участки, соответствующие 5'- и 3'-гомологичным плечам (4,4 т.н. и 5,0 т.н., соответственно; темно-серые прямоугольники). На нижнем изображении представлена таргетирующая плазмида. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (4,4 т.н. и 5,0 т.н., соответственно). Таргетирующая плазмида содержит эктодомен геномного участка IL-2Rg человека, репортерный ген (GFP) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки), которая содержит промотор Prm1 мыши, функционально связанный с геном Crei, и селекционную кассету по лекарственному веществу, промотор убиквитина человека, функционально связанный с геном устойчивости к неомицину.
[0094] На фиг. 33 представлено результат выравнивания последовательностей белка IL-2rg человека (SEQ ID №: 20; NP 000197.1); белка IL-2rg крысы (SEQ ID №: 21; NP 543165.1) и химерного белка IL-2rg (SEQ ID №: 22), содержащего эктодомен IL-2rg человека, гибридизированный с остальной частью белка IL-2rg крысы. Соединение между IL-2rg человека и крысы отмечено вертикальной линией.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Глоссарий
[0095] Используемый в данном документе термин «эмбриональная стволовая клетка» или «ЭС клетка» включает полученную из эмбриона тотипотентную или плюрипотентную клетку, которая способна превращаться в любую ткань развивающегося эмбриона при введении ее в эмбрион. Используемый в данном документе термин «плюрипотентная клетка» включает недифференциированную клетку, которая обладает способностью развиваться в более чем один тип дифференциированных клеток.
[0096] Используемый в данном документе термин «гомологичная нуклеиновая кислота» включает последовательность нуклеиновой кислоты, которая является или идентичной или практически сходной с известной референсной последовательностью. В одном варианте реализации изобретения термин «гомологичная нуклеиновая кислота» применяется для описания последовательности, имеющей аминокислотную последовательность, которая является на по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или даже на 100% идентичной известной референсной последовательности.
[0097] Используемый в данном документе термин «ортологичная нуклеиновая кислота» включает последовательность нуклеиновой кислоты из одного вида, которая является функционально эквивалентной известной референсной последовательности у другого вида.
[0098] Используемый в данном документе термин «большой таргетирующий вектор» или «LTVEC» включает большие таргетирующие векторы для эукариотических клеток, которые получены из фрагментов клонированной геномной ДНК, большей чем обычно применяемые в других подходах, предполагающих проведение в эукариотических клетках таргетинга гомологичных генов. Примеры LTVEC, включают, но не ограничиваются, бактериальной гомологичной хромосомой (ВАС) и дрожжевой искусственной хромосомой (YAC).
[0099] Используемый в данном документе термин «модификация аллели» (МОА) включает модификацию конкретной последовательности ДНК гена(ов) одной аллели или хромосомного локуса (локусов) в геноме. Примеры «модификации аллели (МОА)», как описано в данном документе, включают, но не ограничиваются, делениями, заменами или инсерциями всего лишь одного нуклеотида или делениями более тысяч нуклеотидов, охватывающими представляющий интерес ген(ы) или хромосомный локус (локусы), а также любые и все возможные модификации между этими двумя крайними случаями.
[00100] Используемый в данном документе термин «сайт рекомбинации» включает нуклеотидную последовательность, которая распознается сайт-специфической рекомбиназой и которая может служить субстратом для события рекомбинации.
[00101] «Серийные» генетические модификации включают две или более модификаций, например, ЭС клетки крысы, проведенные независимо. К примеру, первую модификацию проводят в отношении генома ЭС клетки крысы, используя подходящую первую конструкцию нуклеиновой кислоты. Первая модификация может достигаться электропорацией или любым другим способом, известным в данной области техники. Потом в отношении того же генома ЭС клетки крысы проводят вторую модификацию, используя подходящую вторую конструкцию нуклеиновой кислоты. Вторая модификация может достигаться второй электропорацией или любым другим способом, известным в данной области техники. В различных вариантах реализации изобретения следующие за первой и второй генетическими модификациями той же ЭС клетки крысы, третья, четвертая, пятая, шестая и так далее, серийные модификации (следующие одна за другой) могут достигаться, используя, например, серийную электропорацию или любой другой способ (серийно), известный в данной области техники.
[00102] Используемый в данном документе термин «сайт-специфическая рекомбиназа» включает группу ферментов, которая может способствовать рекомбинации между «сайтами рекомбинации», когда два сайта рекомбинации физически разделены одной молекулой нуклеиновой кислоты или находятся на отдельных молекулах нуклеиновых кислот. Примеры «сайт-специфической рекомбиназы» включают, но не ограничиваются рекомбиназами Cre, Flp и Dre.
[00103] Термин «зародышевая линия» касательно последовательности нуклеиновой кислоты включает последовательность нуклеиновой кислоты, которая может передаваться потомству.
[00104] Фраза «тяжелая цепь» или «тяжелая цепь иммуноглобулина» включает последовательность тяжелой цепи иммуноглобулина, включая последовательность константного участка тяжелой цепи иммуноглобулина из любого организма. Если не указано иное, вариабельные домены тяжелой цепи включают три CDR и четыре FR участка тяжелой цепи. Фрагменты тяжелых цепей включают CDR, CDR и FR, и их комбинации. Типичная тяжелая цепь после вариабельного домена имеет (от N-конца до С-конца) домен CH1, шарнир, домен CH2 и домен CH3. Функциональный фрагмент тяжелой цепи включает фрагмент, который способен специфически распознавать эпитоп (например, распознающий эпитоп с KD в микромолярном, наномолярном или пикомолярном диапазонах), который способен экспрессироваться и секретироваться из клетки, и который содержит по меньшей мере один CDR. Вариабельные домены тяжелой цепи κодируются нуклеотидной последовательностью вариабельного участка, который в большинстве случаев содержит сегменты VH, DH и JH, полученные из репертуара сегментов VH, DH и JH, присутствующих в зародышевой линии. Последовательности, расположения и номенклатура сегментов V, D и J тяжелой цепи для различных организмов могут быть найдены в базе данных IMGT, которая доступна в Интернете во Всемирной компьютерной сети (www) по URL-адресу «imgt.org».
[00105] Фраза «легкая цепь» включает последовательность легкой цепи иммуноглобулина из любого организма, и если не указано иное, включает легкие цепи κаппа (κ) и лямбда (λ) человека и VpreB, а также суррогатные легкие цепи. Если не указано иное, вариабельные домены легкой цепи обычно включают три CDR и четыре каркасных участка (FR) легкой цепи. В большинстве случаев полноразмерная легкая цепь включает, от аминоконца до карбоксильного конца, вариабельный домен, который включает FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4 и аминокислотную последовательность константного участка легкой цепи. Вариабельные домены легкой цепи кодируются нуклеотидной последовательностью вариабельного участка легкой цепи, который в большинстве случаев содержит сегменты генов легкой цепи VL и легкой цепи JL, полученные из репертуара сегментов генов легкой цепи V и J, присутствующих в зародышевой линии. Последовательности, расположения и номенклатура сегментов генов V и J легкой цепи для различных организмов могут быть найдены в базе данных IMGT, которая доступна в Интернете во Всемирной компьютерной сети (www) по URL-адресу «imgt.org». Легкие цепи включают те, например, которые не связываются селективно ни с первым ни со вторым эпитопом, селективно связанным эпитопсвязывающим белком, в котором они выявлены. Легкие цепи также включают те, которые связывают и распознают, или помогают тяжелой цепи при связывании и распознавании одного или более эпитопов, селективно связанных эпитопсвязывающим белком, в котором они выявлены.
[00106] Фраза «функционально связанный» охватывает взаимосвязь, при которой функционально связанные компоненты функционируют предполагаемым для них способом. В одном случае, последовательность нуклеиновой кислоты, кодирующая белок, может быть функционально связана с регуляторными последовательностями (например, промотором, энхансером, сайленсерной последовательностью и т.д.) для того, чтобы сохранять надлежащую регуляцию транскрипции. В одном случае, последовательность нуклеиновой кислоты вариабельного участка иммуноглобулина (или сегментов V(D)J) может быть функционально связана с последовательностью нуклеиновой кислоты константного участка иммуноглобулина для того, чтобы обеспечить надлежащую рекомбинацию между последовательностями для последовательности тяжелой или легкой цепи иммуноглобулина.
1. Целевой локус, содержащий нуклеиновую кислоту крысы
[00107] В данном изобретении представлены различные способы и композиции, которые обеспечивают интеграцию по меньшей мере одной вставки нуклеиновой кислоты в целевой локус. Используемый в данном документе «представляющий интерес геномный локус» включает любой сегмент или участок ДНК в пределах генома, в который требуется интегрировать вставку нуклеиновой кислоты. Термины «представляющий интерес геномный локус» и «представляющий интерес целевой геномный локус» могут применяться взаимозаменяемо. Представляющий интерес геномный локус может быть нативным в отношении клетки или, альтернативно, может содержать гетерологичный или экзогенный сегмент ДНК, который интегрирован в геном клетки. Такие гетерологичные или экзогенные сегменты ДНК могут включать трансгены, экспрессионные кассеты, полинуклеотид, кодирующий селекционные маркеры или гетерологичные или экзогенные участки геномной ДНК. Термин «локус» в данном документе определен как сегмент ДНК в пределах геномной ДНК. Как описано в данном документе генетические модификации могут включать одну или более делеций из представляющего интерес локуса, добавлений в представляющий интерес локус, замену представляющего интерес локуса и/или их любые комбинации. Представляющий интерес локус может содержать кодирующие участки или некодирующие регуляторные участки.
[00108] Представляющий интерес геномный локус может дополнительно содержать любой компонент направленной системы интеграции, включающий, к примеру, сайт распознавания, селекционный маркер, раннее интегрированную вставку нуклеиновой кислоты, полинуклеотиды, кодирующие нуклеазные агенты, промоторы, и т.д. Альтернативно, представляющий интерес геномный локус может быть расположен в пределах дрожжевой искусственной хромосомы (YAC), бактериальной искусственной хромосомы (ВАС), человеческой искусственной хромосомы или любом другом сконструированной геномном участке, содержащемся в подходящей клетке-хозяине. В различных вариантах реализации изобретения намеченный локус может включать нативную, гетерологичную или экзогенную последовательность нуклеиновой кислоты из прокариота, эукариота, дрожжевой клетки, бактерии, нечеловеческого млекопитающего, грызуна, человека, крысы, мыши, хомяка, кролика, свиньи, быка, оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макака-резус), одомашненного млекопитающего или сельскохозяйственного млекопитающего, или любого другого представляющего интерес организма или их комбинацию.
[00109] В специальных вариантах реализации изобретения представляющий интерес геномный локус содержит целевой «нуклеиновой кислоты крысы». Такой участок содержит нуклеиновую кислоту из организма крысы, которая интегрирована в геном клетки.
[00110] Неограничивающие примеры целевого локуса включают геномный локус, который кодирует белок, экспрессируемый в В-клетке, геномный локус, который экспрессирует полипептид в незрелой В-клетке, геномный локус, который экспрессирует полипептид в зрелой В-клетке, локусы иммуноглобулина (Ig) или локусы рецепторов Т-клеток, включая, к примеру, локус рецептора альфа Т-клетки. Дополнительные примеры целевого геномного локуса включают локус FcER1a, локус TLR4, локус PRLR, локус Notch4, локус Accn2, локус Adamts5, локус TRPA1, локус FolH1, локус LRP5, локус рецептора IL2, включая, к примеру, локус рецептора гамма IL2 (IL2Rg), локус АроЕ, локус Rag1, локус Rag2, локус Rag1/Rag2 и локус ERBB4. Любой такой целевой локус может быть получен из организма крысы.
[00111] В одном варианте реализации изобретения целевой локус кодирует аминокислотную последовательность вариабельного участка тяжелой цепи иммуноглобулина млекопитающего. В одном варианте реализации изобретения целевой локус кодирует аминокислотную последовательность вариабельного участка тяжелой цепи иммуноглобулина крысы. В одном варианте реализации изобретения целевой локус содержит геномную последовательность ДНК, содержащую неперестроенную последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи иммуноглобулина крысы, мыши или человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина представляет собой последовательность нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина крысы, мыши или человека, выбранную из СН1, шарнира, СН2, СН3 и их комбинации. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка тяжелой цепи содержит СН1-шарнир-СН2-СН3. В одном варианте реализации изобретения целевой локус содержит перестроенную последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи иммуноглобулина крысы, мыши или человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина представляет собой последовательность нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина крысы, мыши или человека, выбранную из СН1, шарнира, СН2, СН3 и их комбинации. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка тяжелой цепи содержит СН1-шарнир-СН2-СН3.
[00112] В одном варианте реализации изобретения целевой локус содержит геномную последовательность ДНК, которая кодирует аминокислотную последовательность вариабельного участка легкой цепи иммуноглобулина млекопитающего. В одном варианте реализации изобретения геномная последовательность ДНК содержит неперестроенную последовательность нуклеиновой кислоты вариабельного участка легкой цепи λ и/или κ млекопитающего.
[00113] В одном варианте реализации изобретения геномная последовательность ДНК содержит перестроенную последовательность нуклеиновой кислоты вариабельного участка легкой цепи λ и/или κ млекопитающего. В одном варианте реализации изобретения неперестроенная последовательность нуклеиновой кислоты вариабельного участка легкой цепи λ или κ функционально связана с последовательностью нуклеиновой кислоты константного участка легкой цепи иммуноглобулина млекопитающего, выбранной из последовательности нуклеиновой кислоты константного участка легкой цепи λ и последовательности нуклеиновой кислоты константного участка легкой цепи κ. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка легкой цепи иммуноглобулина млекопитающего представляет собой последовательность нуклеиновой кислоты константного участка легкой цепи иммуноглобулина крысы. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка легкой цепи иммуноглобулина млекопитающего представляет собой последовательность нуклеиновой кислоты константного участка легкой цепи иммуноглобулина мыши. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка легкой цепи иммуноглобулина млекопитающего представляет собой последовательность нуклеиновой кислоты константного участка легкой цепи иммуноглобулина человека.
[00114] Используемый в данном документе локус АроЕ крысы, локус рецептора гамма интерлейкина-2 крысы (Il-2rg), локус Rag2 крысы, локус Rag1 крысы и/или локус Rag2/Rag1 крысы содержат соответствующие участки генома крысы, в которых расположен каждый из этих генов или комбинаций генов. Модифицирование любого из локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 крысы, локуса Rag2 крысы, локуса Rag1 крысы и/или комбинированного локуса Rag2/Rag1 крысы может включать любое требуемое изменение в данном локусе. Неограничивающие примеры модификации в данном локусе крысы обсуждаются в данном документе более подробно.
[00115] К примеру, в специальных вариантах реализации изобретения один или более из локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 крысы, локуса Rag2 и/или локуса Rag2/Rag1 могут модифицироваться таким образом, что активность и/или уровень кодированного белка АроЕ или белка рецептора гамма интерлейкина-2 или белка Rag1 или белка Rag2 или комбинации белков Rag1 и Rag2 уменьшается. В других вариантах реализации изобретения активность белка АроЕ, белка рецептора гамма интерлейкина-2, белка Rag1 или белка Rag2, или комбинации белков Rag1 и Rag2 отсутствует.
[00116] Под термином «уменьшается» подразумевается любое уменьшение уровня или активности гена/белка, кодируемого представляющим интерес локусом. К примеру, уменьшение активности может включать как (1) статистически значимое уменьшение общего уровня или активности данного белка (т.е., АроЕ, рецептора гамма интерлейкина-2, Rag1, Rag2 или комбинации Rag1 и Rag2), включая, к примеру, уменьшенный уровень или активность на 0,5%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 120% или больше по сравнению с соответствующим контролем. Методы анализа на уменьшение концентрации и/или активности любого из АроЕ, рецептора гамма интерлейкина-2, Rag1 и Rag2 хорошо известны данной области техники.
[00117] В других вариантах реализации изобретения один или более из локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 крысы, локуса Rag2 крысы, локуса Rag1 крысы и/или локуса Rag2/Rag1 крысы содержат такую модификацию, что активность и/или уровень кодированного полипептида АроЕ, полипептида рецептора гамма интерлейкина-2, полипептида Rag2, полипептида Rag1 или обоих полипептидов Rag1 и Rag2 увеличивается. Под термином «увеличивается» подразумевается любое увеличение уровня или активности гена/полипептида, кодируемого представляющим интерес локусом. К примеру, увеличение активности может включать как (1) статистически значимое увеличение общего уровня или активности данного белка (т.е., АроЕ, рецептора гамма интерлейкина-2, Rag1, Rag2 или комбинации Rag1 и Rag2), включая, к примеру, увеличенный уровень или активность на 0,5%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 120% или больше по сравнению с соответствующим контролем. Методы анализа на увеличение концентрации и/или активности любого из белков АроЕ, Rag1, Rag2 и рецептора гамма интерлейкина-2 хорошо известны данной области техники.
[00118] Генетическая модификация в локусе АроЕ крысы, локусе рецептора гамма интерлейкина-2 крысы, локусе Rag2 крысы, локусе Rag1 крысы и/или локусе Rag2/Rag1 крысы может включать делецию эндогенной последовательности нуклеиновой кислоты крысы в геномном локусе, инсерцию экзогенной нуклеиновой кислоты в геномный локус или их комбинацию. Делеция и/или инсерция может создаваться где-либо в пределах данного локуса, как обсуждается в других местах данного документа.
[00119] Дополнительные варианты реализации изобретения, представленные в данном документе, включают модификацию одного или более из локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 крысы, локуса Rag2 крысы, локуса Rag1 крысы и/или локуса Rag2/Rag1 крысы посредством замены части локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1 на соответствующую гомологичную или ортологичную часть локуса АроЕ, локуса рецептора гамма интерлейкина-2, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1 из другого организма.
[00120] В других вариантах реализации изобретения модификация одного или более из локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 крысы, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1, выполняемую посредством замены части локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 крысы и/или локуса Rag2 крысы и/или локуса Rag1 и/или локуса Rag2/Rag1 на вставку полинуклеотида, содержащую на своей полной длине по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% части локуса АроЕ, локуса рецептора гамма интерлейкина-2, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1, которая его заменяет.
[00121] Данная вставка полинуклеотида и/или соответствующего участка локуса крысы, который удаляется, может быть кодирующим участком, интроном, экзоном, нетранслируемым участком, регуляторным участком, промотором или энхансером или их любой комбинацией или их любой частью. Более того, данная вставка полинуклеотида и/или участка локуса крысы, который удаляется, может иметь любую требуемую длину, включающую, к примеру, в длину между 10-100 нуклеотидами, в длину 100-500 нуклеотидов, в длину нуклеотидов 500-1 т.н., в длину нуклеотидов от 1 т.н. до 1,5 т.н., в длину нуклеотидов от 1,5 т.н. до 2 т.н., в длину нуклеотидов от 2 т.н. до 2,5 т.н., в длину нуклеотидов от 2,5 т.н. до 3 т.н., в длину нуклеотидов от 3 т.н. до 5 т.н., в длину нуклеотидов от 5 т.н. до 8 т.н., в длину нуклеотидов от 8 т.н. до 10 т.н. или больше. В других случаях размер инсерции или замены составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н., от около 350 т.н. до около 400 т.н., от около 400 т.н. до около 800 т.н., от около 800 т.н. до 1 м.н., от около 300 т.н. до около 400 т.н., от около 400 т.н. до около 500 т.н., от около 500 т.н. до 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н., от около 2,5 м.н. до около 2,8 м.н., от около 2,8 м.н. до около 3 м.н. В других вариантах реализации изобретения данная вставка полинуклеотида и/или участка локуса крысы, который удаляется, составляет по меньшей мере 100, 200, 300, 400, 500, 600, 700, 800 или 900 нуклеотидов или по меньшей мере 1 т.н., 2 т.н., 3 т.н., 4 т.н., 5 т.н., 6 т.н., 7 т.н., 8 т.н., 9 т.н., 10 т.н., 11 т.н., 12 т.н., 13 т.н., 14 т.н., 15 т.н., 16 т.н. или больше.
[00122] Данная вставка полинуклеотида может быть получена из любого организма, включающего, к примеру, грызуна, крысу, мышь, хомяка, млекопитающего, нечеловеческого млекопитающего, человека, сельскохозяйственного животного или домашнего животного.
[00123] Как более подробно обсуждается в данном документе, представлены различные способы создания направленных модификаций любого из представляющего интерес локуса, включая, к примеру, направленные модификации в локусе АроЕ крысы, локусе рецептора гамма интерлейкина-2 крысы, локусе Rag2 крысы, локусе Rag1 крысы и/или локусе Rag2/Rag1 крысы. В данном изобретении дополнительно представлены генетически модифицированные крысы или генетически модифицированные плюрипотентные клетки крысы (например, ЭС клетки крысы), которые содержат делецию, инсерцию, замену и/или их любую комбинацию в локусе рецептора гамма интерлейкина-2 крысы, в локусе АроЕ крысы, в локусе Rag2 крысы, в локусе Rag1 крысы и/или в локусе Rag2/Rag1 крысы. Такие генетические модификации (включая полученные в результате отсутствия, уменьшения, увеличения или модуляции активности целевого локуса) также способны передаваться по зародышевой линии. В специальных вариантах реализации изобретения генетические модификации приводят к нокауту требуемого целевого локуса. Как обсуждается в других местах данного документа, такие крысы находят применение во множестве экспериментальных систем.
[00124] К примеру, использование нокаутов АроЕ (аполипопротеина Е) у крыс предлагает животную модель для изучения эндотелиальной функции, включая, но не ограничиваясь, изучение образования бляшек, транскрипционных изменений (секвенирование методом дробовика целого транскриптома (секвенирование РНК) и функционирования ex vivo. Более того, больший размер крыс облегчает все эти анализы и потенциально улучшает качество данных секвенирования РНК. АроЕ является важной транспортной молекулой и может транспортировать в кровотоке липиды, такие как холестерин. АроЕ также может функционировать в нервной системе, к примеру, для выведения β-амилоида из мозга. Модификации АроЕ вовлечены при различных патологических состояниях, включающих, к примеру, атеросклероз, гиперлипидемию и болезнь Альцгеймера. У животных с нокаутом АроЕ выявлено нарушение выведения липопротеинов из крови и развитие атеросклероза. Таким образом, животные с нокаутом АроЕ обеспечивают модель для исследования патологических состояний и/или процессов, таких как, к примеру, функционирование эндотелия, образование бляшек, транскрипционные изменения (секвенирование РНК), гиперлипидемия, атеросклероз и болезнь Альцгеймера. Анализы для измерения активности АроЕ хорошо известны в данной области техники. К примеру, уменьшение активности АроЕ может измеряться анализом уменьшения уровней АроЕ в образце крови, полученном у субъекта иммунологическими анализами, такими как ИФА или методиками иммуноблоттинга. Более того, больший размер крыс облегчает все эти анализы и улучшает качество данных.
[00125] RAG1 (ген активации рекомбинации 1) и RAG2 (ген активации рекомбинации 2) представляют собой ферменты, которые являются частью мультисубъединичного комплекса, имеющего рекомбинационную активность VDJ, и играют важную роль в перестройке и рекомбинации в лимфоцитах генов иммуноглобулинов и рецепторов Т-клеток. RAG1 и RAG2 индуцируют расщепление двухцепочечной ДНК для облегчения рекомбинации и соединения сегментов генов рецептора Т-клеток и рецептора В-клеток (т.е. иммуноглобулина). Нокаут RAG1 и/или RAG2 вызывает потерю у животных В-клеток и Т-клеток, приводя к тяжелому иммунодефициту. Животные с нокаутом RAG1 и/или RAG2 нашли применение, к примеру, в исследованиях ксенотрансплантатов (т.е. ксенотрансплантатов клеток человека у крыс), раковых заболеваний, разработке вакцин, аутоиммунных заболеваний, инфекционныз заболеваний и болезни «трансплантат против хозяина» (БТПХ). Различные анализы для измерения активности RAG1 и/или RAG2 хорошо известны в данной области техники и включают, к примеру, измерение эффективности рекомбинации или анализы на наличие или отсутствие у субъекта В-клеток и/или Т-клеток. Более того, больший размер крыс облегчает все эти анализы и потенциально улучшает качество данных.
[00126] Рецептор IL-2 (IL-2R) экспрессируется на поверхности определенных иммунных клеток и связывает цитокин интерлейкин-2 (IL-2). IL-2R представляет собой интегральный мембранный белок, содержащий по меньшей мере три отдельные цепи субъединиц, включающие, цепь альфа (IL-2Ra, CD25), цепь бета (IL-2Rb, CD122) и цепь гамма (IL2-Rg, CD132). Цепь рецептора гамма IL-2 (также именуемая IL2r-γ или IL2Rg) представляет собой обычную цепь гамма, которая совместно используется различными рецепторами цитокинов, включающими, к примеру, рецепторы IL-2, IL-4, IL-7, IL-9, IL-15 и IL-21. IL-2Rg содержит эктодомен на внешней клеточной поверхности клетки, который принимает участие в связывании лиганда, трансмембранный домен и внутриклеточный домен, который может взаимодействовать с различными молекулами для индукции внутриклеточных путей сигналов трансдукции. Ген Il2rg найден у млекопитающих на Х-хромосоме и определенные мутации в гене цепи гамма у людей могут вызывать Х-сцепленный тяжелый комбинированный иммунодефицит (XSCID), который характеризуется глубоким дефицитом Т-клеток. В дополнение к этому, эктодомен цепи гамма может быть защищенным трансмембранным рецептором и высвобожденным как растворимый рецептор цепи гамма. Растворимый рецептор цепи гамма может быть обнаружен в крови субъекта и может функционировать в отношении регулирования сигналинга цитокинов.
[00127] В некоторых вариантах реализации изобретения цепь IL-2Rg крысы заменяется цепью IL2-Rg человека таким образом, что организм крысы экспрессирует полную цепь IL-2Rg человека. В других случаях может быть необходимым заменить только эктодомен цепи IL-2Rg крысы эктодоменом цепи IL-2Rg человека. В таких случаях результирующая гуманизированная цепь IL-2Rg, экспрессирующаяся в организме крысы, содержит эктодомен человека с остальной частью молекулы, происходящей из организма крысы.
[00128] Полноразмерная гуманизация IL-2Rg целесообразна, поскольку крысы, обладающие таким модифицированным локусом, будут продуцировать IL-2Rg человека. Это даст возможность обнаруживать IL-2Rg человека у крыс антителами, специфическими к IL-2Rg человека. Эктогуманизация (т.е. замена эктодомена IL-2Rg крысы эктодоменом IL-2Rg человека) приведет к получению полипептида IL-2Rg, который будет связывать лиганды IL2-Rg человека, но поскольку цитоплазматический домен все же остается крысиным, его эктогуманизированная форма IL-2Rg также будет взаимодействовать с механизмом сигналинга крысы.
2. Модифицирование целевого локуса крысы
А. Таргетирующие векторы и вставка нуклеиновых кислот
i. Вставка нуклеиновой кислоты
[00129] Используемое в данном документе «вставка нуклеиновой кислоты» включает сегмент ДНК, который требуется интегрировать в целевой локус. В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит один или более представляющих интерес полинуклеотидов. В других вариантах реализации изобретения вставка нуклеиновой кислоты может содержать одну или более экспрессионных кассет. Данная экспрессионная кассета может содержать представляющий интерес полинуклеотид, полинуклеотид, кодирующий селекционный маркер и/или репортерный ген вместе с различными регуляторными компонента, которые влияют на экспрессию. Неограничивающие примеры представляющих интерес полинуклеотидов, селекционные маркеры и репортерные гены, которые могут быть включены во вставку нуклеиновой кислоты, подробно обсуждаются в других местах данного документа.
[00130] В специальных вариантах реализации изобретения вставка нуклеиновой кислоты может содержать нуклеиновую кислоту из организма крысы, которая может включать сегмент геномной ДНК, кДНК, регуляторный участок или их любую часть или комбинацию. В других вариантах реализации изобретения вставка нуклеиновой кислоты может содержать нуклеиновую кислоту из нечеловеческого млекопитающего, грызуна, человека, крысы, мыши, хомяка, кролика, свиньи, быка, оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макака-резус), одомашненного млекопитающего или сельскохозяйственного млекопитающего, или любого другого целевого организма. Как отмечено в данном документе более подробно, вставка нуклеиновой кислоты, применяемая в различных способах и композициях, может привести к «гуманизации» целевого локуса, содержащего нуклеиновую кислоту крысы.
[00131] В одном варианте реализации изобретения вставка нуклеиновой кислоты включает введение аллели методом «knock-in» из по меньшей мере одного экзона эндогенного гена. В одном варианте реализации изобретения вставка нуклеиновой кислоты включает введение аллели методом knock-in целого эндогенного гена (т.е. «обмен гена методом knock-in»).
[00132] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит регуляторный элемент, включающий, к примеру, промотор, энхансер или элемент связывания транскрипционного репрессора.
[00133] В дополнительных вариантах реализации изобретения вставка нуклеиновой кислоты содержит условную аллель. В одном варианте реализации изобретения условная аллель представляет собой мультифункциональную аллель, как описано в патенте США 2011/0104799, который включен в полном объеме посредством ссылки. В специальных вариантах реализации изобретения условная аллель содержит: (а) действующую последовательность в смысловой ориентации в отношении транскрипции целевого гена и селекционную кассету по лекарственному веществу в смысловой или антисмысловой ориентации; (b) представляющую интерес нуклеотидную последовательность (NSI) в антисмысловой ориентации и обусловленную модулем инверсии (COIN, в которой используется экзонразделяющий интрон и инвертируемый подобный ловушке генов модуль; см., к примеру, патент США 2011/0104799, который включен посредством ссылки в полном объеме) и (с) рекомбинируемые единицы, которые рекомбинируют при воздействии первой рекомбиназы с образованием условной аллели, у которой (i) отсутствует действующая последовательность и DSC и (ii) содержится NSI в смысловой ориентации и COIN в антисмысловой ориентации.
[00134] Вставка нуклеиновой кислоты находится в диапазоне от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.
[00135] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит делецию геномной последовательности ДНК крысы в диапазоне от около 1 т.н. до около 200 т.н., от около 2 т.н. до около 20 т.н. или от около 0,5 т.н. до около 3 м.н. В одном варианте реализации изобретения объем делеции геномной последовательности ДНК составляет более общей длины 5'-гомологичного плеча и 3'-гомологичного плеча. В одном варианте реализации изобретения объем делеции геномной последовательности ДНК находится в диапазоне от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 20 т.н. до около 30 т.н., от около 30 т.н. до около 40 т.н., от около 40 т.н. до около 50 т.н., от около 50 т.н. до около 60 т.н., от около 60 т.н. до около 70 т.н., от около 70 т.н. до около 80 т.н., от около 80 т.н. до около 90 т.н., от около 90 т.н. до около 100 т.н., от около 100 т.н. до около 110 т.н., от около 110 т.н. до около 120 т.н., от около 120 т.н. до около 130 т.н., от около 130 т.н. до около 140 т.н., от около 140 т.н. до около 150 т.н., от около 150 т.н. до около 160 т.н., от около 160 т.н. до около 170 т.н., от около 170 т.н. до около 180 т.н., от около 180 т.н. до около 190 т.н., от около 190 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н., от около 350 т.н. до около 400 т.н., от около 400 т.н. до около 800 т.н., от около 800 т.н. до 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н., до около 2,5 м.н., от около 2,5 м.н. до около 2,8 м.н., от около 2,8 м.н. до около 3 м.н., от около 200 т.н. до около 300 т.н., от около 300 т.н. до около 400 т.н., от около 400 т.н. до около 500 т.н., от около 500 т.н. до около 1 т.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н. или от около 2,5 м.н. до около 3 м.н.
[00136] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит инсерцию или замену последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека. В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит инсерцию или замену последовательности ДНК крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека в эндогенном локусе крысы, который содержит соответствующую последовательность ДНК крысы.
[00137] В одном варианте реализации изобретения генетическая модификация представляет добавление последовательности нуклеиновой кислоты. В одном варианте реализации изобретения добавленная нуклеотидная последовательность находится в диапазоне от 5 т.н. до 200 т.н.
[00138] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит генетическую модификацию в кодирующей последовательности. В одном варианте реализации изобретения генетическая модификация включает мутацию-делецию в кодирующей последовательности. В одном варианте реализации изобретения генетическая модификация включает слияние двух эндогенных кодирующих последовательностей.
[00139] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит инсерцию или замену последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека. В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит инсерцию или замену последовательности ДНК крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека в эндогенном локусе крысы, который содержит соответствующую последовательность ДНК крысы.
[00140] В одном варианте реализации изобретения генетическая модификация включает делецию некодирующей белок последовательности, но не включает делецию кодирующей белок последовательности. В одном варианте реализации изобретения делеция некодирующей белок последовательности включает делецию регуляторного элемента. В одном варианте реализации изобретения генетическая модификация включает делецию промотора. В одном варианте реализации изобретения генетическая модификация включает добавление промотора или регуляторного элемента. В одном варианте реализации изобретения генетическая модификация включает замену промотора или регуляторного элемента.
[00141] В одном варианте реализации изобретения последовательность нуклеиновой кислоты таргетирующего вектора может содержать полинуклеотид, который при интеграции в геном будет продуцировать генетическую модификацию участка локуса АроЕ крысы, причем генетическая модификация в локусе АроЕ приводит к уменьшению активности АроЕ, увеличению активности АроЕ или модуляции активности АроЕ. В одном варианте реализации изобретения создается нокаут АроЕ («нулевая аллель»).
[00142] В одном варианте реализации изобретения последовательность нуклеиновой кислоты таргетирующего вектора может содержать полинуклеотид, который при интеграции в геном будет продуцировать генетическую модификацию участка локуса рецептора интерлейкина-2 крысы, причем генетическая модификация в локусе рецептора интерлейкина-2 приводит к уменьшению активности рецептора интерлейкина-2. В одном варианте реализации изобретения создается нокаут рецептора интерлейкина-2 («нулевая аллель»).
[00143] В дополнительных вариантах реализации изобретения вставка нуклеиновой кислоты приводит к замене части локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 и/или локуса Rag2 и/или локуса Rag1 и/или локуса Rag2/Rag1 на соответствующую гомологичную или ортологичную часть локуса АроЕ, локуса рецептора гамма интерлейкина-2, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1 из другого организма.
[00144] В других вариантах реализации изобретения вставка нуклеиновой кислоты включает полинуклеотид, содержащий на своей полной длине по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% части локуса АроЕ, локуса рецептора гамма интерлейкина-2, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1, которая его заменяет.
[00145] Данная вставка полинуклеотида и соответствующий участок локуса крысы, который заменяется, может быть кодирующим участком, интроном, экзоном, нетранслируемым участком, регуляторным участком, промотором или энхансером или их любой комбинацией. Более того, данная вставка полинуклеотида и/или участка локуса крысы, который удаляется, может иметь любую требуемую длину, включающую, к примеру, в длину между 10-100 нуклеотидами, в длину 100-500 нуклеотидов, в длину нуклеотидов 500-1 т.н., в длину нуклеотидов от 1 т.н. до 1,5 т.н., в длину нуклеотидов от 1,5 т.н. до 2 т.н., в длину нуклеотидов от 2 т.н. до 2,5 т.н., в длину нуклеотидов от 2,5 т.н. до 3 т.н., в длину нуклеотидов от 3 т.н. до 5 т.н., в длину нуклеотидов от 5 т.н. до 8 т.н., в длину нуклеотидов от 8 т.н. до 10 т.н. или больше. В других случаях размер инсерции или замены составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н., от около 350 т.н. до около 400 т.н., от около 400 т.н. до около 800 т.н., от около 800 т.н. до 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н., от около 2,5 м.н. до около 2,8 м.н., от около 2,8 м.н. до около 3 м.н. В других вариантах реализации изобретения данная вставка полинуклеотида и/или участка локуса крысы, который удаляется, составляет по меньшей мере 100, 200, 300, 400, 500, 600, 700, 800 или 900 нуклеотидов или по меньшей мере 1 т.н., 2 т.н., 3 т.н., 4 т.н., 5 т.н., 6 т.н., 7 т.н., 8 т.н., 9 т.н., 10 т.н., 11 т.н., 12 т.н., 13 т.н., 14 т.н., 15 т.н., 16 т.н. или больше.
[00146] В одном варианте реализации изобретения промотор представляет собой конститутивно активный промотор.
[00147] В одном варианте реализации изобретения промотор представляет собой индуцируемый промотор. В одном варианте реализации изобретения индуцируемый промотор представляет собой химически регулируемый промотор. В одном варианте реализации изобретения химически регулируемый промотор представляет собой спирт-регулируемый промотор. В одном варианте реализации изобретения спирт-регулируемый промотор представляет собой промотор гена алькогольдегидрогеназы (alcA). В одном варианте реализации изобретения химически регулируемый промотор представляет собой тетрациклин-регулируемый промотор. В одном варианте реализации изобретения тетрациклин-регулируемый промотор представляет собой тетрациклин-чувствительный промотор. В одном варианте реализации изобретения тетрациклин-регулируемый промотор представляет собой тетрациклин-операторную последовательность (tetO). В одном варианте реализации изобретения тетрациклин-регулируемый промотор представляет собой промотор tet-On. В одном варианте реализации изобретения тетрациклин-регулируемый промотор представляет собой промотор tet-Off. В одном варианте реализации изобретения химически регулируемый промотор представляет собой стероид-регулируемый промотор. В одном варианте реализации изобретения стероид-регулируемый промотор представляет собой глюкокортикоидный рецептор крысы. В одном варианте реализации изобретения стероид-регулируемый промотор представляет собой рецептор эстрогеннов. В одном варианте реализации изобретения стероид-регулируемый промотор представляет собой рецептор экдизона. В одном варианте реализации изобретения химически регулируемый промотор представляет собой металл-регулируемый промотор. В одном варианте реализации изобретения металл-регулируемый промотор представляет собой металлопротеиновый промотор. В одном варианте реализации изобретения индуцируемый промотор представляет собой физически регулируемый промотор. В одном варианте реализации изобретения физически регулируемый промотор представляет собой температурорегулируемый промотор. В одном варианте реализации изобретения температурорегулируемый промотор представляет собой промотор теплового шока. В одном варианте реализации изобретения физически регулируемый промотор представляет собой светорегулируемый промотор. В одном варианте реализации изобретения светорегулируемый промотор представляет собой светоиндуцируемый промотор. В одном варианте реализации изобретения светорегулируемый промотор представляет собой светорепрессируемый промотор.
[00148] В одном варианте реализации изобретения промотор представляет собой тканеспецифический промотор. В одном варианте реализации изобретения промотор представляет собой нейронспецифический промотор. В одном варианте реализации изобретения промотор представляет собой промотор, специфический к глиям. В одном варианте реализации изобретения промотор представляет собой промотор, специфический к мышечным клеткам. В одном варианте реализации изобретения промотор представляет собой промотор, специфический к сердечным клеткам. В одном варианте реализации изобретения промотор представляет собой промотор, специфический к почечным клеткам. В одном варианте реализации изобретения промотор представляет собой промотор, специфический к костным клеткам. В одном варианте реализации изобретения промотор представляет собой промотор, специфический к эндотелиальным клеткам. В одном варианте реализации изобретения промотор представляет собой промотор, специфический к иммунным клеткам. В одном варианте реализации изобретения промотор иммунных клеток представляет собой промотор В-клеток. В одном варианте реализации изобретения промотор иммунных клеток представляет собой промотор Т-клеток.
[00149] В одном варианте реализации изобретения промотор представляет собой промотор, регулируемый в процессе развития организма. В одном варианте реализации изобретения промотор, регулируемый в процессе развития организма, является активным только во время эмбриональной стадии развития. В одном варианте реализации изобретения промотор, регулируемый в процессе развития организма, является активным только во взрослой клетке.
[00150] В некоторых вариантах реализации изобретения вставка нуклеиновой кислоты содержит нуклеиновую кислоту, фланкированную целевыми последовательностями сайт-специфической рекомбинации. Общепризнано, что когда целая вставка нуклеиновой кислоты может быть фланкирована такими целевыми последовательностями сайт-специфической рекомбинации, то любой участок или представляющий интерес отдельный полинуклеотид в пределах вставки нуклеиновой кислоты также может быть фланкирован такими сайтами. Сайт-специфическая рекомбиназа может быть введена в клетку любыми способами, включая введение рекомбиназного полипептида в клетку или введение полинуклеотида, кодирующего сайт-специфическую рекомбиназу в клетку-хозяина. Полинуклеотид, кодирующий сайт-специфическую рекомбиназу может быть расположен в пределах вставки нуклеиновой кислоты или в пределах отдельного полинуклеотида. Сайт-специфическая рекомбиназа может быть функционально связана с промотором активным в клетке, включающим, к примеру, индуцируемый промотор, промотор, который является эндогенным по отношению к клетке, промотором, который является гетерологичным по отношению к клетке, клеточноспецифическим промотором, тканеспецифическим промотором или промотором, специфическим к стадии развития. Целевые последовательности сайт-специфической рекомбинации, которые могут фланкировать вставку нуклеиновой кислоты или любой представляющий интерес полинуклеотид во вставке нуклеиновой кислоты, могут включать, но не ограничиваться, loxP, lox511, lox2272, lox66, lox71, loxM2, lox5171, FRT, FRT11, FRT71, attp, att, FRT, rox и их комбинацией.
[00151] В некоторых вариантах реализации изобретения сайты сайт-специфической рекомбинации фланкируют полинуклеотид, кодирующий селекционный маркер и/или репортерный ген, содержащийся в пределах вставки нуклеиновой кислоты. В таких случаях после интеграции вставки нуклеиновой кислоты в намеченный локус могут удаляться последовательности между сайтами сайт-специфической рекомбинации.
[00152] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит полинуклеотид, кодирующий селекционный маркер. Селекционный маркер может содержаться в селекционной кассете. Такие селекционные маркеры включают, но не ограничиваются, неомицинфосфотрансферазой (neor), гигромицин В-фосфотрансферазой (hygr), пуромицин-N-ацетилтрансферазой (puror), бластицидин S-дезаминазой (bsrr), ксантин/гуанин-фосфорибозилтрансферазой (gpt) или тимидинкиназой вируса простого герпеса (HSV-k) или их комбинацией. В одном варианте реализации изобретения полинуклеотид, кодирующий селекционный маркер функционально связан с промотором активным в клетке, клетке крысы, плюрипотентной клетке крысы или ЭС клетке крысы. При серийной укладке целевых полинуклеотидов в представляющий интерес намеченный локус, селекционный маркер может содержать сайт распознавания нуклеазным агентом, как отмечено выше. В одном варианте реализации изобретения полинуклеотид, кодирующий селекционный маркер фланкирован целевыми последовательностями сайт-специфической рекомбинации.
[00153] Вставка нуклеиновой кислоты может дополнительно содержать репортерный ген функционально связанный с промотором, причем репортерный ген кодирует репортерный белок, выбранный из группы, состоящей из или включающей: LacZ, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, белок с улучшенной желтой флуоресценцией (EYFP), Emerald, белок с улучшенной зеленой флуоресценцией (EGFP), CyPet, белок с голубой флуоресценцией (CFP), Cerulean, T-Sapphire, люциферазу, щелочную фосфатазу и/или их комбинацию. Такие репортерные гены могут быть функционально связаны с промотором, активным в клетке. Такие промоторы могут быть индуцируемым промотором, промотором, который является эндогенным по отношению к репортерному гену или клетке, промотором, который является гетерологичным по отношению к репортерному гену или клетке, клеточноспецифическим промотором, тканеспецифическим промотором или промотором, специфическим к стадии развития.
[00154] В одном варианте реализации изобретения нуклеионовокислотная вставка может содержать нуклеиновую кислоту млекопитающего, которая содержит геномный локус, который кодирует белок, экспрессируемый нервной системой, костной системой, пищеварительной системой, кровеносной системой, мышечной системой, респираторной системой, сердечно-сосудистой системой, лимфатической системой, эндокринной системой, мочевыделительной системой, репродуктивной системой или их комбинацией. В одном варианте реализации изобретения нуклеиновая кислота млекопитающего содержит геномный локус, который кодирует белок, экспрессируемый в костном мозге или клетке, полученной из костного мозга. В одном варианте реализации изобретения нуклеиновая кислота содержит геномный локус, который кодирует белок, экспрессируемый в клетке селезенки.
[00155] В одном варианте реализации изобретения нуклеиновая кислота млекопитающего содержит геномный локус, который кодирует белок, экспрессируемый нервной системой, костной системой, пищеварительной системой, кровеносной системой, мышечной системой, респираторной системой, сердечно-сосудистой системой, лимфатической системой, эндокринной системой, мочевыделительной системой, репродуктивной системой или их комбинацией. В одном варианте реализации изобретения нуклеиновая кислота млекопитающего содержит геномный локус, который кодирует белок, экспрессируемый в костном мозге или клетке, полученной из костного мозга. В одном варианте реализации изобретения нуклеиновая кислота содержит геномный локус, который кодирует белок, экспрессируемый в клетке селезенки. В одном варианте реализации изобретения геномный локус содержит геномную последовательность ДНК мыши, геномную последовательность ДНК крысы, геномную последовательность ДНК человека или их комбинацию. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК крысы и человека. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК мыши и человека. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК мыши и крысы. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК крысы, мыши и человека.
[00156] В одном варианте реализации изобретения геномный локус содержит геномную последовательность ДНК мыши, геномную последовательность ДНК крысы, геномную последовательность ДНК человека или их комбинацию. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК крысы и человека. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК мыши и человека. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК мыши и крысы. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК крысы, мыши и человека.
[00157] В одном варианте реализации изобретения генетическая модификация включает по меньшей мере одну вызывающую заболевание человека аллель гена человека. В одном варианте реализации изобретения заболевание человека представляет собой неврологическое заболевание. В одном варианте реализации изобретения заболевание человека представляет собой сердечнососудистое заболевание. В одном варианте реализации изобретения заболевание человека представляет собой заболевание почек. В одном варианте реализации изобретения заболевание человека представляет собой заболевание мышц. В одном варианте реализации изобретения заболевание человека представляет собой заболевание крови. В одном варианте реализации изобретения заболевание человека представляет собой раковое заболевание. В одном варианте реализации изобретения заболевание человека представляет собой заболевание иммунной системы.
[00158] В одном варианте реализации изобретения вызывающая заболевание человека аллель представляет собой доминантную аллель. В одном варианте реализации изобретения вызывающая заболевание человека аллель представляет собой рецессивную аллель. В одном варианте реализации изобретения вызывающая заболевание человека аллель содержит аллель с однонуклеотидным полиморфизмом (ОНП).
[00159] В одном варианте реализации изобретения генетическая модификация приводит к продукции мутантной формы белка с измененным свойством связывания, измененной локализацией, измененной экспрессией и/или измененным профилем экспрессии.
[00160] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит селекционную кассету. В одном варианте реализации изобретения селекционная кассета содержит последовательность нуклеиновой кислоты, кодирующую селективный маркер, причем последовательность нуклеиновой кислоты функционально связана с промотором активным в ЭС клетках крыс. В одном варианте реализации изобретения селективный маркер выбран из или содержит ген устойчивости к гигромицину или ген устойчивости к неомицину.
[00161] В одном варианте реализации изобретения нуклеиновая кислота содержит геномный локус, который кодирует белок, экспрессируемый в В-клетке. В одном варианте реализации изобретения нуклеиновая кислота содержит геномный локус, который кодирует белок, экспрессируемый в незрелой В-клетке. В одном варианте реализации изобретения нуклеиновая кислота содержит геномный локус, который кодирует белок, экспрессируемый в зрелой В-клетке.
[00162] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит регуляторный элемент. В одном варианте реализации изобретения регуляторный элемент представляет собой промотор. В одном варианте реализации изобретения регуляторный элемент представляет собой энхансер. В одном варианте реализации изобретения регуляторный элемент представляет собой элемент связывания транскрипционного репрессора.
[00163] В одном варианте реализации изобретения генетическая модификация включает делецию некодирующей белок последовательности, но не включает делецию кодирующей белок последовательности. В одном варианте реализации изобретения делеция некодирующей белок последовательности включает делецию регуляторного элемента. В одном варианте реализации изобретения генетическая модификация включает делецию регуляторного элемента. В одном варианте реализации изобретения генетическая модификация включает добавление промотора или регуляторного элемента. В одном варианте реализации изобретения генетическая модификация включает замену промотора или регуляторного элемента.
ii. Экспрессионные кассеты
[00164] В данном документе представлены полинуклеотиды или молекулы нуклеиновой кислоты, содержащие различные компоненты, задействованные в системе направленной геномной интеграции, представленной в данном документе (т.е. любой из или любая комбинация из нуклеазных агентов, сайтов распознавания, вставок нуклеиновых кислот, представляющих интерес полинуклеотидов, таргетирующих векторов, селекционных маркеров и других компонентов).
[00165] Термины «полинуклеотид», «полинуклеотидная последовательность», «последовательность нуклеиновой кислоты» и «фрагмент нуклеиновой кислоты» применяются в данном документе взаимозаменяемо. Эти термины охватывают нуклеотидные последовательности и им подобные. Полинуклеотид может быть полимером РНК или ДНК, который является одно- или двухцепочечным, который необязательно содержит синтетические, не встречающиеся в природе или измененные нуклеотидные основания. Полинуклеотид в форме полимера ДНК может быть составлен из одного или более сегментов кДНК, геномной ДНК, синтетической ДНК или их смеси. Полинуклеотиды могут содержать дезоксирибонуклеотиды и рибонуклеотиды, включающие как встречающиеся в природе молекулы и синтетические аналоги и любые комбинации из них. Полинуклеотиды, представленные в данном документе, также охватывают все формы последовательностей, включающие, но не ограничивающиеся, одноцепочечными формами, двухцепочечными формами, шпильками, структурами стебель-петля и тому подобными.
[00166] В данном изобретении дополнительно представлены рекомбинантные полинуклеотиды, содержащие различные компоненты системы направленной геномной интеграции. Термины «рекомбинантный полинуклеотид» и «конструкция рекомбинантной ДНК» примененяются в данном документе взаимозаменяемо. Рекомбинантная конструкция содержит искусственную или гетерологичную комбинацию последовательностей нуклеиновой кислоты, например, регуляторные и кодирующие последовательности, которые вместе не встречаются в природе. В других вариантах реализации изобретения рекомбинантная конструкции может содержать регуляторные последовательности и кодирующие последовательности, которые получены из различных источников, или регуляторные последовательности и кодирующие последовательности, полученные из того же источника, но упорядоченные способом, отличающимся от встречающегося в природе. Такая конъюнкция может применяться сама по себе или может применяться в сочетании с вектором. Если применяется вектор, тогда выбор вектора зависит от способа, который применяется для трансформации клеток-хозяев, как хорошо известно специалистам в данной области техники. К примеру, может применяться плазмидный вектор. В данном документе также представлены генетические элементы, необходимые для успешной трансформации, отбора и размножения клеток-хозяев, содержащих любой из выделенных фрагментов нуклеиновой кислоты. Скрининг может выполняться, в числе прочих, анализом ДНК по Саузерну, анализом экспрессии мРНК нозерн-блоттингом, анализом экспрессии белка иммуноблоттингом или фенотипическим анализом.
[00167] В специфических вариантах реализации изобретения один или более из компонентов системы направленной геномной интеграции, описанные в данном документе, могут быть представлены в экспрессионной кассете для экспрессии в прокариотической клетке, эукариотической клетке, бактериальной, дрожжевой клетке или клетке млекопитающего или другого организма или представляющего интерес типа клеток. Кассета может включать 5'- и 3'- регуляторные последовательности, функционально связанные с полинуклеотидом, представленным в данном документе. «Функционально связанный» включает взаимосвязь, при которой функционально связанные компоненты функционируют предполагаемым для них способом. К примеру, функциональная связь между целевым полинуклеотидом и регуляторной последовательностью (т.е. промотором) представляет собой функциональную связь, которая обеспечивает экспрессию представляющего интерес полинуклеотида. Функционально связаные элементы могут быть последовательными или непоследовательными. При применении по отношению к соединению двух кодирующих белки участков, функционально связанный означает, что кодирующие участки находятся в одной и той же рамке считывания. В другом случае, последовательность нуклеиновой кислоты, кодирующая белок, может быть функционально связана с регуляторными последовательностями (например, промотором, энхансером, сайленсерной последовательностью и т.д.) для того, чтобы сохранять надлежащую транскрипционную регуляцию. В одном случае, последовательность нуклеиновой кислоты вариабельного участка иммуноглобулина (или сегментов V(D)J) может быть функционально связана с последовательностью нуклеиновой кислоты константного участка иммуноглобулина для того, чтобы обеспечить надлежащую рекомбинацию между последовательностями для последовательности тяжелой или легкой цепи иммуноглобулина.
[00168] Кассета может дополнительно содержать по меньшей мере один дополнительный представляющий интерес полинуклеотид, который совместно вводится в организм. Альтернативно, на кассетах множественной экспрессии могут быть представлены дополнительные представляющие интерес полинуклеотиды. Такая экспрессионная кассета снабжена множеством сайтов транскрипции и/или сайтов рекомбинации для инсерции рекомбинантного полинуклеотида, который находится под транскрипционной регуляцией регуляторных участков. Экспрессионная кассета может дополнительно содержать гены селекционных маркеров.
[00169] Экспрессионная кассета может включать в направлении 5'-3' транскрипции, транскрипционный и трансляционный участок инициации (т.е. промотор), рекомбинантный полинуклеотид, представленный в данном документе, и транскрипционный и трансляционный участок терминации (т.е. участок терминации) функциональный в клетке млекопитающего или представляющей интерес клетке-хозяине. Регуляторные участки (т.е. промоторы, транскрипционные регуляторные участки и трансляционные участки терминации) и/или полинуклеотид, представленные в данном документе, могут быть нативными/аналогичными по отношению к клетки-хозяину или друг к другу. Альтернативно, регуляторные участки и/или полинуклеотид, представленные в данном документе, могут быть гетерологичными по отношению к клетки-хозяину или друг к другу. К примеру, промотор, функционально связанный с гетерологичным полинуклеотидом, походит из вида, отличающегося от вида, из которого получен полинуклеотид или, когда он получен из того же/аналогичного вида, один или оба являются практически модифицированными относительно их оригинальной формы и/или геномного локуса, или промотор не представляет собой нативный промотор для функционально связанного полинуклеотида. Альтернативно, регуляторные участки и/или рекомбинантный полинуклеотид, представленные в данном документе, могут быть полностью синтетическими.
[00170] Участок терминации может быть нативным по отношению к транскрипционному участку инициации, может быть нативным по отношению к функционально связанному рекомбинантному полинуклеотиду, может быть нативным по отношению к клетке-хозяину или может быть получен из другого источника (т.е., чужеродного или гетерологичного) по отношению к промотору, рекомбинантному полинуклеотиду, клетке-хозяину или любой их комбинацией.
[00171] При получении экспрессионной кассеты могут проводиться манипуляции с различными фрагментами ДНК таким образом, чтобы обеспечить надлежащую ориентацию последовательностей ДНК. С этой целью для соединения фрагментов ДНК могут применяться адаптеры и линкеры или могут использоваться другие манипуляции для обеспечения подходящих сайтов рестрикции, удаления избыточной ДНК, удаления сайтов рестрикции или тому подобного. Для этого может использоваться мутагенез in vitro, репарация с праймерами, рестрикция, отжиг, подстановки, например, транзиции и трансверсии.
[00172] В представленых в данном документе экспрессионных кассетах может применяться несколько промоторов. Промоторы могут быть выбраны на основе требуемого результата. Общепризнано, что разные варианты применения могут быть улучшены использованием в экспрессионных кассетах разных промоторов для модулирования профиля времени, расположения и/или уровня экспрессии представляющего интерес полинуклеотида. Такие экспрессионные конструкции, если требуется, также могут содержать промоторный регуляторный участок (например, обеспечивающий индукцию, конститутивный, регулируемый факторами окружающей среды или стадиями развития, или клеточно- или тканеспецифическую/селективную экспрессию), стартовый сайт инициации транскрипции, сайт связывания рибосомы, сигнал процессинга РНК, сайт терминации транскрипции и/или сигнал полиаденилирования.
[00173] Экспрессионная кассета, содержащая полинуклеотид, представленный в данном документе, также может содержать ген селекционного маркера для отбора трансформированных клеток. Гены селектируемых маркеров используются для отбора трансформированных клеток или тканей.
[00174] При необходимости, последовательности, применяемые в способах и композициях (т.е. представляющий интерес полинуклеотид, нуклеазный агент и т.д.) могут быть оптимизированы для увеличенной экспрессии в клетке. То есть, для улучшения экспрессии гены могут синтезироваться, используя кодоны, предпочтительные в данной представляющей интерес клетке, включая, к примеру, предпочтительные в организме млекопитающих кодоны, предпочтительные в организме человека кодоны, предпочтительные в организме мыши кодоны, предпочтительные в организме крысы кодоны и т.д.
[00175] Различные способы и композиции, представленные в данном документе, могут использовать селекционные маркеры. Различные селекционные маркеры могут применяться в способах и композициях, описанных в данном документе. Такие селекционные маркеры могут, к примеру, придавать устойчивость к антибиотику, такому как G418, гигромицин, бластоцидин, неомицин или пуромицин. Такие селекционные маркеры включают неомицинтрансферазу (neor), гигромицин В-фосфотрансферазу (hygr), пуромицин-N-ацетилтрансферазу (puror) и бластицидин S-дезаминазу (bsrr). В других вариантах реализации изобретения селекционный маркер функционально связан с индуцируемым промотором, а экспрессия селекционного маркера токсична для клетки. Неограничивающие примеры таких селекционных маркеров включают ксантин/гуанин-фосфорибозилтрансферазу (gpt), гипоксантин-гуанинфосфорибозилтрансферазу (HGPRT) или тимидинкиназу вируса простого герпеса (HSV-TK). Полинуклеотид, кодирующий селекционные маркеры, функционально связанные с промотором, активный в клетке.
iii. Таргетирующие векторы
[00176] Таргетирующие векторы применяются для введения вставки нуклеиновой кислоты в целевой локус нуклеиновой кислоты крысы. Таргетирующий вектор содержит вставку нуклеиновой кислоты и дополнительно содержит 5'- и 3'-гомологичное плечо, которое фланкировано вставкой нуклеиновой кислоты. Гомологичные плечи, которые фланкируют вставку нуклеиновой кислоты, соответствуют участкам в пределах целевого локуса нуклеиновой кислоты крысы. Для облегчения ссылки соответствующие когнатные геномные участки в пределах намеченного целевого геномного локуса в данном документе именуются как «целевые сайты». К примеру, таргетирующий вектор может содержать первую вставку нуклеиновой кислоты, фланкированную первым и вторым гомологичным плечом комплементарным первому и второму целевому сайту. По сути, таргетирующий вектор, таким образом, помогает интеграции вставки нуклеиновой кислоты в целевой локус нуклеиновой кислоты крысы посредством события гомологичной рекомбинации, которое происходит между гомологичными плечами и комплементарными целевыми сайтами в геноме клетки.
[00177] В одном варианте реализации изобретения целевой локус нуклеиновой кислоты крысы содержит первую последовательность нуклеиновой кислоты, которая комплементарна 5'-гомологичному плечу, и вторую последовательность нуклеиновой кислоты, которая комплементарна 3'-гомологичному плечу крысы. В одном варианте реализации изобретения первая и вторая последовательности нуклеиновых кислот разделены по меньшей мере 5 т.н. В другом варианте реализации изобретения первая и вторая последовательности нуклеиновых кислот разделены по меньшей мере 5 т.н., но менее 200 т.н. В одном варианте реализации изобретения первая и вторая последовательности нуклеиновых кислот разделены по меньшей мере 10 т.н. В одном варианте реализации изобретения первая и вторая последовательности нуклеиновой кислоты разделены по меньшей мере 20 т.н., по меньшей мере 30 т.н., по меньшей мере 40 т.н., по меньшей мере 50 т.н., по меньшей мере 60 т.н., по меньшей мере 70 т.н., по меньшей мере 80 т.н., по меньшей мере 90 т.н., по меньшей мере 100 т.н., по меньшей мере 110 т.н., по меньшей мере 120 т.н., по меньшей мере 130 т.н., по меньшей мере 140 т.н., по меньшей мере 150 т.н., по меньшей мере 160 т.н., по меньшей мере 170 т.н., по меньшей мере 180 т.н., по меньшей мере 190 т.н. или по меньшей мере 200 т.н. В дополнительных вариантах реализации изобретения первая и вторая последовательность нуклеиновой кислоты разделены по меньшей мере 5 т.н., но менее 10 т.н., по меньшей мере 5 т.н., но менее 3 м.н., по меньшей мере 10 т.н., но менее 20 т.н., по меньшей мере 20 т.н., но менее 40 т.н., по меньшей мере 40 т.н., но менее 60 т.н., по меньшей мере 60 т.н., но менее 80 т.н., по меньшей мере около 80 т.н., но менее 100 т.н., по меньшей мере 100 т.н., но менее 150 т.н., или по меньшей мере 150 т.н., но менее 200 т.н., по меньшей мере около 200 т.н., но менее около 300 т.н., по меньшей мере около 300 т.н., но менее около 400 т.н., по меньшей мере около 400 т.н., но менее около 500 т.н., по меньшей мере около 500 т.н., но менее около 1 м.н., по меньшей мере около 1,5 м.н., но менее около 2 м.н., по меньшей мере около 1 м.н., но менее около 1,5 м.н., по меньшей мере около 2 м.н., но менее около 2,5 м.н., по меньшей мере около 2,5 м.н., но менее около 3 м.н., или по меньшей мере около 2 м.н., но менее около 3 м.н.
[00178] Гомологичное плечо таргетирующего вектора может быть любой длины, которая достаточна для содействия событию гомологичной рекомбинации с соответствующим целевым сайтом, включая к примеру, по меньшей мере 5-10 т.н., 5-15 т.н., 10-20 т.н., 20-30 т.н., 30-40 т.н., 40-50 т.н., 50-60 т.н., 60-70 т.н., 70-80 т.н., 80-90 т.н., 90-100 т.н., 100-110 т.н., 110-120 т.н., 120-130 т.н., 130-140 т.н., 140-150 т.н., 150-160 т.н., 160-170 т.н., 170-180 т.н., 180-190 т.н., 190-200 т.н. в длину или больше. Как подробнее отмечено ниже, в больших таргетирующих векторах может применяться таргетирующие плечи большей длины. В специальном варианте реализации изобретения полная совокупность 5'-гомологичного плеча и 3'-гомологичного плеча составляет по меньшей мере 10 т.н. или полная совокупность 5'-гомологичного плеча и 3'-гомологичного плеча составляет по меньшей мере от 16 т.н. до около 100 т.н. или от около 30 т.н. до около 100 т.н. В других вариантах реализации изобретения размер полной совокупности 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 150 т.н., от около 10 т.н. до около 100 т.н., от около 10 т.н. до около 75 т.н., от около 20 т.н. до около 150 т.н., от около 20 т.н. до около 100 т.н., от около 20 т.н. до около 75 т.н., около 30 т.н. до около 150 т.н., от около 30 т.н. до около 100 т.н., от около 30 т.н. до около 75 т.н., около 40 т.н. до около 150 т.н., от около 40 т.н. до около 100 т.н., от около 40 т.н. до около 75 т.н., около 50 т.н. до около 150 т.н., от около 50 т.н. до около 100 т.н. или от около 50 т.н. до около 75 т.н., от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н. В одном варианте реализации изобретения размер делеции такой же или сходный с размером полной совокупности 5'- и 3'-гомологичных плечей LTVEC.
[00179] Если применяются нуклеазные агенты, то когнатные геномные участки, соответствующие 5'- и 3'-гомологичным плечам таргетирующего вектора являются «расположенными в достаточной близости» к нуклеазным целевым сайтам таким образом, чтобы способствовать прохождению события гомологичной рекомбинации между когнатными геномными участками и гомологичными плечами при одноцепочечном или двухцепочечном разрыве в сайте распознавания. К примеру, нуклеазные целевые сайты могут быть распложены где-либо между когнатными геномными участками, соответствующими 5'- и 3'-гомологичными плечами. В специальных вариантах реализации изобретения сайт распознавания непосредственно примыкает к по меньшей мере одному или обоим когнатным геномным участкам.
[00180] Используемые в данном документе гомологичное плечо и целевой сайт (т.е. когнатный геномный участок) являются «комплементными» или «комплементарными» друг другу, когда два участка разделяют достаточный уровень идентичности последовательностей друг к другу, чтобы выступать субстратами для реакции гомологичной рекомбинации. Под термином «гомология» понимают последовательности ДНК, которые являются идентичными или обладают идентичностью последовательностей к соответствующей или «комплементарной» последовательности. Идентичность последовательностей между данным целевым сайтом и соответствующим гомологичным плечом, обнаруженном на таргетирующем векторе, может иметь любую степень идентичности последовательностей, которая обеспечивает возможность прохождения гомологичной рекомбинации. К примеру, величина идентичности последовательности, разделяемой гомологичным плечом таргетирующего вектора (или его фрагмента) и целевым сайтом (или его фрагментом) может составлять по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности так, что последовательности проходят гомологичную рекомбинацию. Более того, комплементарный участок гомологии между гомологичным плечом и комплементарным целевым сайтом может иметь любую длину, которая достаточна для содействия гомологичной рекомбинации в расщепленном сайте распознавания. К примеру, данное гомологичное плечо и/или комплементарный целевой сайт может содержать комплементарные участки гомологии, которые составляют в длину по меньшей мере 5-10 т.н., 5-15 т.н., 10-20 т.н., 20-30 т.н., 30-40 т.н., 40-50 т.н., 50-60 т.н., 60-70 т.н., 70-80 т.н., 80-90 т.н., 90-100 т.н., 100-110 т.н., 110-120 т.н., 120-130 т.н., 130-140 т.н., 140-150 т.н., 150-160 т.н., 160-170 т.н., 170-180 т.н., 180-190 т.н., 190-200 т.н. или больше (как описано для векторов LTVEC, описанных в других местах данного документа), таким образом, что гомологичное плечо имеет достаточную гомологию для прохождения гомологичной рекомбинации с соответствующими целевыми сайтами в геноме клетки. Для облегчения ссылки, гомологичные плечи именуются в данном документе как 5'- и 3'-гомологичное плечо. Эта терминология относится к относительному положению гомологичных плечей в отношении вставки нуклеиновой кислоты в пределах таргетирующего вектора.
[00181] Следовательно, гомологичные плечи таргетирующего вектора разработаны комплементарными целевому сайту в намеченном локусе. Таким образом, гомологичные плечи могут быть комплементарными локусу, который нативный в отношении клетки или, альтернативно, они могут быть комплементарными участку гетерологичного или экзогенного сегмента ДНК, который интегрирован в геном клетки, включая, но не ограничиваясь, трансгенами, экспрессионными кассетами или гетерологичными и экзогенными участками геномной ДНК. Альтернативно, гомологичные плечи таргетирующего вектора могут быть комплементарными участку человеческой искусственной хромосомы или любому другому сконструированному геномному участку, содержащемуся в соответствующей клетке-хозяине. Дополнительно гомологичные плечи таргетирующего вектора могут быть комплементарными или быть полученными из участка библиотеки ВАС, библиотеки космид или библиотеки фага Р1. Таким образом, в специальных вариантах реализации изобретения гомологичные плечи таргетирующего вектора комплементарны геномному локусу крысы, который является нативным, гетерологичным или экзогенным по отношению к данной клетке. В дополнительных вариантах реализации изобретения гомологичные плечи комплементарны геномному локусу крысы, который не является таргетируемым при использовании общепринятого способа или может быть таргетированным только ошибочно или только с существенно низкой эффективностью, в отсутствии одноцепочечного или двухцепочечного разрыва, индуцированного нуклеазным агентом. В одном варианте реализации изобретения гомологичные плечи получены из синтетической ДНК.
[00182] В других вариантах реализации изобретения 5'- и 3'-гомологичные плечи комплементарны тому же геному, что и таргетируемый геном. В одном варианте реализации изобретения гомологичные плечи походят от родственного генома, например, таргетируемый геном представляет собой геном крысы первого штамма, а таргетирующие плечи походят от генома крысы второго штамма, причем первый штамм и второй штамм различаются. В других вариантах реализации изобретения гомологичные плечи походят от того же животного или походят от генома того же штамма, например, таргетируемый геном представляет собой геном крысы первого штамма, а таргетирующие плечи походят от генома крысы той же крысы или того же штамма.
[00183] Таргетирующий вектор (такой как большой таргетирующий вектор) также может содержать селекционную кассету или репортерный ген как обсуждается в других местах данного документа. Селекционная кассета может содержать последовательность нуклеиновой кислоты, кодирующую селекционный маркер, причем последовательность нуклеиновой кислоты функционально связана с промотором. Промотор может быть активный в представляющей интерес прокариотической клетке и/или активный в представляющей интерес эукариотической клетке. Такие промоторы могут быть индуцируемым промотором, промотором, который является эндогенным по отношению к репортерному гену или клетке, промотором, который является гетерологичным по отношению к репортерному гену или клетке, клеточноспецифическим промотором, тканеспецифическим промотором или промотором, специфическим к стадии развития. В одном варианте реализации изобретения селекционный маркер выбирают из или он включает неомицинфосфотрансферазу (neor), гигромицин В-фосфотрансферазу (hygr), пуромицин-N-ацетилтрансферазу (puror), бластицидин S-дезаминазу (bsrr), ксантин/гуанин-фосфорибозилтрансферазу (gpt) и тимидинкиназу вируса простого герпеса (HSV-k) и/или их комбинацию. Селекционный маркер таргетирующего вектора может фланкироваться 5'- и 3'-гомологичными плечами или находиться на 5'- или 3'-конце по отношению к гомологичным плечам.
[00184] В одном варианте реализации изобретения таргетирующий вектор (такой как большой таргетирующий вектор) содержит репортерный ген, функционально связанный с промотором, причем репортерный ген кодирует репортерный белок, выбранный из группы, состоящей из или включающей LacZ, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, белок с улучшенной желтой флуоресценцией (EYFP), Emerald, белок с улучшенной зеленой флуоресценцией (EGFP), CyPet, белок с голубой флуоресценцией (CFP), Cerulean, T-Sapphire, люциферазу, щелочную фосфатазу и/или их комбинацию. Такие репортерные гены могут быть функционально связаны с промотором, активным в клетке. Такие промоторы могут быть индуцируемым промотором, промотором, который является эндогенным по отношению к гену-репортеру или клетке, промотором, который является гетерологичным по отношению к репортерному гену или клетке, клеточноспецифическим промотором, тканеспецифическим промотором или промотором, специфическим к стадии развития.
[00185] В одном варианте реализации изобретения комбинированное применение таргетирующего вектора (включающего, к примеру, большой таргетирующий вектор) с нуклеазным агентом приводит к увеличению эффективности таргетинга по сравнению с применением одного таргетирующего вектора. В одном варианте реализации изобретения, когда применяется таргетирующий вектор в сочетании с нуклеазным агентом, эффективность таргетинга таргетирующего вектора увеличивается по меньшей мере в два раза, по меньшей мере в три раза или по меньшей мере в четыре раза по сравнению с тем, когда применяется один таргетирующий вектор.
[00186] Когда применяется таргетирующий вектор, конструкция вектора может быть такой, чтобы обеспечить инсерцию данной последовательности, которая составляет от около 5 т.н. до около 200 т.н., как описано в данном документе. В одном варианте реализации изобретения инсерция составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 30 т.н., от около 30 т.н. до около 40 т.н., от около 40 т.н. до около 50 т.н., от около 50 т.н. до около 60 т.н., от около 60 т.н. до около 70 т.н., от около 80 т.н. до около 90 т.н., от около 90 т.н. до около 100 т.н., от около 100 т.н. до около 110 т.н., от около 110 т.н. до около 120 т.н., от около 120 т.н. до около 130 т.н., от около 130 т.н. до около 140 т.н., от около 140 т.н. до около 150 т.н., от около 150 т.н. до около 160 т.н., от около 160 т.н. до около 170 т.н., от около 170 т.н. до около 180 т.н., от около 180 т.н. до около 190 т.н. или от около 190 т.н. до около 200 т.н., от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.
[00187] Когда применяется таргетирующий вектор, то конструкция вектора может быть такой, чтобы обеспечить замену данной последовательности, которая составляет от около 5 т.н. до около 200 т.н. или от около 5 т.н. до около 3,0 м.н., как описано в данном документе. В одном варианте реализации изобретения замена составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 30 т.н., от около 30 т.н. до около 40 т.н., от около 40 т.н. до около 50 т.н., от около 50 т.н. до около 60 т.н., от около 60 т.н. до около 70 т.н., от около 80 т.н. до около 90 т.н., от около 90 т.н. до около 100 т.н., от около 100 т.н. до около 110 т.н., от около 110 т.н. до около 120 т.н., от около 120 т.н. до около 130 т.н., от около 130 т.н. до около 140 т.н., от около 140 т.н. до около 150 т.н. или от около 150 т.н. до около 160 т.н., от около 160 т.н. до около 170 т.н., от около 170 т.н. до около 180 т.н., от около 180 т.н. до около 190 т.н., от около 190 т.н. до около 200 т.н., от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., или от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 300 т.н., от около 300 т.н. до около 400 т.н., от около 400 т.н. до около 500 т.н., от около 500 т.н. до около 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н. или от около 2,5 м.н. до около 3 м.н.
[00188] В одном варианте реализации изобретения таргетирующий вектор содержит ген сайт-специфической рекомбиназы. В одном варианте реализации изобретения ген сайт-специфической рекомбиназы кодирует рекомбиназу Cre. В одном варианте реализации изобретения ген рекомбиназы Cre представляет собой Crei, в котором два экзона, кодирующие рекомбиназу Cre, разделены интроном для предотвращения ее экспрессии в прокариотической клетке.
[00189] В одном варианте реализации изобретения ген рекомбиназы Cre дополнительно содержит сигнал ядерной локализации для облегчения локализации Cre (или любой рекомбиназы или нуклеазного агента) в ядро (например, ген представляет собой ген NL-Cre). В специальном варианте реализации изобретения ген рекомбиназы Cre дополнительно содержит сигнал ядерной локализации и интрон (например, NL-Crei).
[00190] В различных вариантах реализации изобретения подходящий промотор для экспрессии нуклеазного агента (включающего рекомбиназу Cre или Crei, обсужденную выше) выбирается из или включает Prm1, Blimp1, Gata6, Gata4, Igf2, Lhx2, Lhx5 и/или Рах3. В специальном варианте реализации изобретения промотор представляет собой промотор Gata6 или Gata4. Различные промоторы могут быть получены из любого организма, включающего, к примеру, грызуна, такого как мышь или крысу. В другом специальном варианте реализации изобретения промотор представляет собой промотор Prm1. В другом специальном варианте реализации изобретения промотор представляет собой промотор Prm1 крысы. В другом специальном варианте реализации изобретения промотор представляет собой промотор Prm1 мыши. В другом специальном варианте реализации изобретения промотор представляет собой промотор Blimp1 или его фрагмент, например, фрагмент размером 1 т.н. или 2 т.н. промотора Blimp1. См., к примеру, патент США 8697851 и опубликованную заявку США 2013-0312129, оба документа включены в данный документ в своей полноте посредством ссылки.
iv. Большие таргетирующие векторы
[00191] Используемый в данном документе термин «большой таргетирующий вектор» или «LTVEC» охватывает большие таргетирующие векторы, которые содержат гомологичные плечи, которые соответствуют и походят из последовательностей нуклеиновых кислот больших, чем обычно применяемые в других подходах, предполагающих проведение в клетках гомологичного таргетинга и/или включающих вставку нуклеиновых кислот, содержащих последовательности нуклеиновых кислот больших, чем обычно применяемые в других подходах, предполагающих проведение в клетках таргетинга с гомологичной рекомбинацией. К примеру, LTVEC дает возможность проводить модификацию больших локусов, которые не могут быть приемлемыми для традиционных таргетирующих векторов на основе плазмид из-за их ограничений в размерах. В специальных вариантах реализации изобретения гомологичные плечи и/или вставка нуклеиновой кислоты LTVEC содержит геномную последовательность эукариотической клетки. Размер LTVEC является слишком большим для возможности скрининга событий таргетинга общепринятыми анализами, например, сазерн-блоттингом или ПЦР длинных фрагментов (например, 1 т.н. - 5 т.н.). Примеры LTVEC, включают, но не ограничиваются, векторами, полученными из бактериальной искусственной хромосомы (ВАС), человеческой искусственной хромосомы или дрожжевой искусственной хромосомы (YAC). Неограничивающие примеры LTVEC и способы их создания описаны, например, в пат. США 6586251, 6596541, 7105348, заявке WO 2002/036789 (PCT/US01/45375) и пат. США 2013/0137101, каждый из которых включен в данный документ посредством ссылки.
[00192] LTVEC может иметь любую длину, включая, но не ограничиваясь длиной, от около 20 т.н. до около 400 т.н., от около 20 т.н. до около 30 т.н., от около 30 т.н. до 40 т.н., от около 40 т.н. до около 50 т.н., от около 50 т.н. до около 75 т.н., от около 75 т.н. до около 100 т.н., от около 100 т.н. до 125 т.н., от около 125 т.н. до около 150 т.н., от около 150 т.н. до около 175 т.н., около 175 т.н. до около 200 т.н., от около 200 т.н. до около 225 т.н., от около 225 т.н. до около 250 т.н., от около 250 т.н. до около 275 т.н. или от около 275 т.н. до около 300 т.н., от около 200 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н., от около 350 т.н. до около 400 т.н., от около 350 т.н. до около 550 т.н. В одном варианте реализации изобретения LTVEC составляет около 100 т.н.
[00193] В одном варианте реализации изобретения LTVEC содержит вставку нуклеиновой кислоты в диапазоне от около 5 т.н. до около 200 т.н., от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 30 т.н., от около 0.5 т.н. до около 30 т.н., от около 0.5 т.н. до около 40 т.н., от около 30 т.н. до около 150 т.н., от около 0.5 т.н. до около 150 т.н., от около 30 т.н. до около 40 т.н., от около 40 т.н. до около 50 т.н., от около 60 т.н. до около 70 т.н., от около 80 т.н. до около 90 т.н., от около 90 т.н. до около 100 т.н., от около 100 т.н. до около 110 т.н., от около 120 т.н. до около 130 т.н., от около 130 т.н. до около 140 т.н., от около 140 т.н. до около 150 т.н., от около 150 т.н. до около 160 т.н., от около 160 т.н. до около 170 т.н., от около 170 т.н. до около 180 т.н., от около 180 т.н. до около 190 т.н. или от около 190 т.н. до около 200 т.н., от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.
[00194] Когда применяется LTVEC, то конструкция вектора может быть такой, чтобы обеспечить замену данной последовательности, которая составляет от около 5 т.н. до около 200 т.н. или от около 5 т.н. до около 3 м.н., как описано в данном документе. В одном варианте реализации изобретения замена составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 30 т.н., от около 30 т.н. до около 40 т.н., от около 40 т.н. до около 50 т.н., от около 50 т.н. до около 60 т.н., от около 60 т.н. до около 70 т.н., от около 80 т.н. до около 90 т.н., от около 90 т.н. до около 100 т.н., от около 100 т.н. до около 110 т.н., от около 110 т.н. до около 120 т.н., от около 120 т.н. до около 130 т.н., от около 130 т.н. до около 140 т.н., от около 140 т.н. до около 150 т.н. или от около 150 т.н. до около 160 т.н., от около 160 т.н. до около 170 т.н., от около 170 т.н. до около 180 т.н., от около 180 т.н. до около 190 т.н., от около 190 т.н. до около 200 т.н., от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., или от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 300 т.н., от около 300 т.н. до около 400 т.н., от около 400 т.н. до около 500 т.н., от около 500 т.н. до около 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н. или от около 2,5 м.н. до около 3 м.н.
[00195] В одном варианте реализации изобретения гомологичные плечи LTVEC получены из библиотеки ВАС, библиотеки космид или библиотеки фага Р1. В других вариантах реализации изобретения гомологичные плечи получают из таргетируемого геномного локуса клетки и, в некоторых случаях, целевой геномный локус, для которого разработан LTVEC для таргетирования, не является таргетируемым с использованием общепринятого способа. В других вариантах реализации изобретения гомологичные плечи получены из синтетической ДНК.
[00196] В одном варианте реализации изобретения полная совокупность 5'-гомологичного плеча и 3'-гомологичного плеча в LTVEC составляет по меньшей мере 10 т.н. В других вариантах реализации изобретения полная совокупность 5'-и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н., от около 120 т.н. до около 140 т.н., от около 140 т.н. до около 160 т.н., от около 160 т.н. до около 180 т.н., от около 180 т.н. до около 200 т.н. В одном варианте реализации изобретения полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет от около 30 т.н. до около 100 т.н. В других вариантах реализации изобретения размер полной совокупности суммы 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 150 т.н., от около 10 т.н. до около 100 т.н., от около 10 т.н. до около 75 т.н., от около 20 т.н. до около 150 т.н., от около 20 т.н. до около 100 т.н., от около 20 т.н. до около 75 т.н., около 30 т.н. до около 150 т.н., от около 30 т.н. до около 100 т.н., от около 30 т.н. до около 75 т.н., около 40 т.н. до около 150 т.н., от около 40 т.н. до около 100 т.н., от около 40 т.н. до около 75 т.н., около 50 т.н. до около 150 т.н., от около 50 т.н. до около 100 т.н. или от около 50 т.н. до около 75 т.н., от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н. В одном варианте реализации изобретения размер делеции такой же или сходный с размером полной совокупности 5'- и 3'-гомологичных плечей LTVEC.
[00197] В других вариантах реализации изобретения диапазон 5'-гомологичного плеча составляет от около 5 т.н. до около 100 т.н. В одном варианте реализации изобретения диапазон 3'-гомологичного плеча составляет от около 5 т.н. до около 100 т.н. В других вариантах реализации изобретения полная совокупность 5'- и 3'-гомологичных плечей составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 30 т.н., от около 30 т.н. до около 40 т.н., от около 40 т.н. до около 50 т.н., от около 50 т.н. до около 60 т.н., от около 60 т.н. до около 70 т.н., от около 70 т.н. до около 80 т.н., от около 80 т.н. до около 90 т.н., от около 90 т.н. до около 100 т.н., от около 100 т.н. до около 110 т.н., от около 110 т.н. до около 120 т.н., от около 120 т.н. до около 130 т.н., от около 130 т.н. до около 140 т.н., от около 140 т.н. до около 150 т.н., от около 150 т.н. до около 160 т.н., от около 160 т.н. до около 170 т.н., от около 170 т.н. до около 180 т.н., от около 180 т.н. до около 190 т.н., от около 190 т.н. до около 200 т.н. или от около 30 т.н. до около 100 т.н., около 10 т.н. до около 30 т.н., около 20 т.н. до около 40 т.н., около 40 т.н. до около 60 т.н., около 60 т.н. до около 80 т.н., около 80 т.н. до около 100 т.н., около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н.
[00198] В одном варианте реализации изобретения LTVEC содержит вставку нуклеиновой кислоты, которая гомологична или ортологична последовательности нуклеиновой кислоты крысы, фланкированную гомологичными плечами LTVEC. В одном варианте реализации изобретения вставка последовательности нуклеиновой кислоты получена из вида, отличающегося от крысы. В одном варианте реализации изобретения вставка нуклеиновой кислоты, которая гомологична или ортологична последовательности нуклеиновой кислоты крысы, представляет собой нуклеиновую кислоту млекопитающего. В одном варианте реализации изобретения нуклеиновая кислота млекопитающего представляет собой нуклеиновую кислоту мыши. В одном варианте реализации изобретения нуклеиновая кислота млекопитающего представляет собой нуклеиновую кислоту человека. В одном варианте реализации изобретения вставка нуклеиновой кислоты представляет собой геномную ДНК. В одном варианте реализации изобретения вставка составляет от 5 т.н. до 200 т.н., как описано выше.
[00199] В одном варианте реализации изобретения LTVEC содержит селекционную кассету или репортерный ген. Как обсуждается в других местах данного документа, могут применяться различные формы селекционной кассеты и репортерного гена.
[00200] Как описано в других местах данного документа, LTVEC также может использоваться в способах, представленных в данном документе, в комбинации с нуклеазным агентом, который способствует гомологичной рекомбинации между таргетирующим вектором и целевым локусом нуклеиновой кислоты крысы в плюрипотентной клетке крысы.
[00201] В одном варианте реализации изобретения большой таргетирующий вектор (LTVEC) содержит ген сайт-специфической рекомбиназы. В одном варианте реализации изобретения ген сайт-специфической рекомбиназы кодирует рекомбиназу Cre. В одном варианте реализации изобретения ген рекомбиназы Cre представляет собой Crei, в котором два экзона, кодирующие рекомбиназу Cre, разделены интроном для предотвращения ее экспрессии в прокариотической клетке. В одном варианте реализации изобретения ген рекомбиназы Cre дополнительно содержит сигнал ядерной локализации для облегчения локализации Cre (или любой рекомбиназы или нуклеазного агента) в ядро (например, ген представляет собой ген NL-Cre). В специальном варианте реализации изобретения ген рекомбиназы Cre дополнительно содержит сигнал ядерной локализации и интрон (например, NL-Crei).
[00202] В различных вариантах реализации изобретения подходящий промотор для экспрессии нуклеазного агента (включающего рекомбиназу Cre или Crei, обсужденную выше) выбирается из или включает Prm1, Blimp1, Gata6, Gata4, Igf2, Lhx2, Lhx5 и/или Рах3. В специальном варианте реализации изобретения промотор представляет собой промотор Gata6 или Gata4. Различные промоторы могут быть получены из любого организма, включающего, к примеру, грызуна, такого как мышь или крысу. В другом специальном варианте реализации изобретения промотор представляет собой промотор Prm1. В другом специальном варианте реализации изобретения промотор представляет собой промотор Prm1 крысы. В другом специальном варианте реализации изобретения промотор представляет собой промотор Prm1 мыши. В другом специальном варианте реализации изобретения промотор представляет собой промотор Blimp1 или его фрагмент, например, фрагмент размером 1 т.н. или 2 т.н. промотора Blimp1. См., к примеру, патент США 8697851 и опубликованную заявку США 2013-0312129, оба документа включены в данный документ в своей полноте посредством ссылки.
[00203] В одном варианте реализации изобретения LTVEC содержит вставку нуклеиновой кислоты, которая может продуцировать делецию, добавление, замену или их комбинацию для участка локуса АроЕ крысы, локуса IL-2Rg, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1, как подробно описано в других местах данного документа. В специальных вариантах реализации изобретения генетическая модификация в локусе АроЕ приводит к уменьшению, увеличению или модификации активности АроЕ, активности IL-2Rg, активности Rag2, активности Rag1 и/или активности Rag2 и Rag1. В одном варианте реализации изобретения создается нокаут АроЕ и нокаут IL-2Rg, нокаут Rag2, нокаут Rag1, нокаут Rag2/Rag1. Как обсуждается ниже, нуклеазные агенты могут применяться с любой из таргетирующих систем LTVEC для таргетирования любого представляющего интерес геномного локуса.
v. Нуклеазные агенты и сайты распознавания нуклеазных агентов
[00204] Как подробно отмечено выше, нуклеазные агенты могут применяться в способах и композициях, описанных в данном документе, для содействия в модификации целевого локуса как в прокариотической клетке так и в плюрипотентной клетке крысы. Такой нуклеазный агент может способствовать гомологичной рекомбинации между таргетирующим вектором и целевым локусом. В одном варианте реализации изобретения нуклеазный агент включает эндонуклеазный агент.
[00205] Используемый в данном документе термин «сайт распознавания нуклеазным агентом» охватывает последовательность ДНК, в которой нуклеазным агентом индуцируется одноцепочечный разрыв или двухцепочечный разрыв. Сайт распознавания нуклеазным агентом по отношению к клетке может быть эндогенным (или нативным) или сайт распознавания по отношению к клетке может быть экзогенным. В специальных вариантах реализации изобретения сайт распознавания является экзогенным по отношению к клетке и поэтому не является встречающимся в природе в геноме клетки. В дополнительных вариантах реализации изобретения сайт распознавания является экзогенным по отношению к клетке и к представляющему интерес полинуклеотиду, который требуется расположить в целевом геномном локусе. В дополнительных вариантах реализации изобретения экзогенный или эндогенный сайт распознавания только один раз присутствует в геноме клетки-хозяина. В специальных вариантах реализации изобретения эндогенный или нативный сайт, который встречается только один раз в геноме является идентифицированным. Потом такой сайт может использоваться для разработки нуклеазных агентов, которые будут создавать одноцепочечный или двухцепочечный разрыв в эндогенном сайте распознавания.
[00206] Длина сайта распознавания может варьировать, и включает, к примеру, сайты распознавания, которые составляют в длину по меньшей мере 4, 6, 8, 10, 12, 14, 16, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70 или более нуклеотидов. В одном варианте реализации изобретения каждый мономер нуклеазного агента распознает сайт распознавания из по меньшей мере 9 нуклеотидов. В других вариантах реализации изобретения сайт распознавания составляет от около 9 до около 12 нуклеотидов в длину, от около 12 до около 15 нуклеотидов в длину, от около 15 до около 18 нуклеотидов в длину или от около 18 до около 21 нуклеотидов в длину и любую комбинацию из таких поддиапазонов (например, 9-18 нуклеотидов). Сайт распознавания может быть палиндромным так, что последовательность на одной цепи считывается так же, как и в противоположном направлении на комплементарной цепи. Общепризнано, что данный нуклеазный агент может связывать сайт распознавания и расщеплять этот сайт связывания или, альтернативно, нуклеазный агент может связываться с последовательностью, которая отличается от сайта распознавания. Более того, термин сайта распознавания охватывает как сайт связывания нуклеазного агента, а сайт одноцепочечного разрыва/расщепления не зависит от того находится ли сайт одноцепочечного разрыва/расщепления в пределах или за пределами сайта связывания нуклеазного агента. В другом варианте изобретения расщепление нуклеазным агентом может происходить в нуклеотидных положениях непосредственно напротив друг друга с образованием разреза с тупыми концами, в других случаях, разрезы могут производиться зигзагом с образованием одноцепочечных выступов, также называемые «липкими концами», которые могут быть 5'-выступами или 3'-выступами.
[00207] В способах и композициях, описанных в данном документе, может использоваться любой нуклеазный агент, который индуцирует одноцепочечный или двухцепочечный разрыв в требуемом сайте распознавания. Встречающийся в природе или нативный нуклеазный агент может применяться при условии, что нуклеазный агент индуцирует одноцепочечный или двухцепочечный разрыв в требуемом сайте распознавания. Альтернативно, может применяться модифицированный или сконструированный нуклеазный агент.«Сконструированный нуклеазный агент» включает нуклеазу, которая сконструирована (модифицирована или получена) из своей нативной формы для специфического распознавания и индукции одноцепочечного или двухцепочечного разрыва в требуемом сайте распознавания. Таким образом, сконструированный нуклеазный агент может происходить из нативного, встречающегося в природе нуклеазного агента или он может быть искусственно созданным или синтезированным. Модификация нуклеазного агента может быть столь малой, как одна аминокислота в белке агент расщепления или один нуклеотид в нуклеиновой кислоте агента расщепления. В некоторых вариантах реализации изобретения сконструированный нуклеазный агент индуцирует одноцепочечный или двухцепочечный разрыв в сайте распознавания, причем сайт распознавания не являлся последовательностью, которая могла быть распознанной нативным (несконструированным или немодифицированным) нуклеазным агентом. Создание одноцепочечного или двухцепочечного разрыва в сайте распознавания или другой ДНК может называться в данном документе «разрезание» или «расщепление» сайта распознавания или другой ДНК.
[00208] В данном изобретении также представлены активные варианты и фрагменты иллюстративных сайтов распознавания. Такие активные варианты могут обладать по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности к данному сайту распознавания, причем активные варианты сохраняют биологическую активность и, поэтому, способны распознаваться и расщепляться нуклеазным агентом последовательность-специфичным способом. Анализы для измерения двухцепочечного разрыва сайта распознавания нуклеазным агентом хорошо известны в данной области техники и обычно измеряется способность нуклеазы разрезать сайт распознавания.
[00209] Сайт распознавания нуклеазного агента может быть расположен где-либо в или вблизи целевого локуса. Сайт распознавания может распологаться в пределах кодирующего участка гена или в регуляторных участках, которые влияют на экспрессию гена. Таким образом, сайт распознавания нуклеазного агента может быть расположен в интроне, экзоне, промоторе, энхансере, регуляторном участке или любом не кодирующем белок участке.
[00210] В одном варианте реализации изобретения нуклеазный агент представляет собой подобную активатору транскрипции эффекторную нуклеазу (TALEN). TAL-эффекторные нуклеазы представляют собой класс последовательность-специфических нуклеаз, которые могут применяться для создания двухцепочечных разрывов в специфических целевых последовательностях в геноме прокариотического или эукариотического организма. TAL-эффекторные нуклеазы создают слиянием нативного или сконструированного эффектора, подобного активатору транскрипции (TAL), или его функциональной части, с каталическим доменом эндонуклеазы, такой как, к примеру, FokI. Уникальный модулярный домен TAL-эффекторного связывания ДНК позволяет разрабатывать белки потенциально с любой специфичностью распознавания данной ДНК. Таким образом, домены связывания ДНК TAL-эффекторных нуклеаз могут конструироваться для распознавания целевых сайтов специфических ДНК и, вследствие этого, использоваться для создания двухцепочечных разрывов в требуемых целевых последовательностях. См., WO 2010/079430; Morbitzer et al. (2010) PNAS 10.1073/pnas.1013133107; Scholze и Boch (2010) Virulence 1: 428-432; Christian et al. Genetics (2010) 186: 757-761; Li et al. (2010) Nuc. Acids Res. (2010) doi:10.1093/nar/gkq704 и Miller et al. (2011) Nature Biotechnology 29: 143-148; все из которых включены в данный документ посредством ссылки.
[00211] Примеры подходящих TAL-нуклеаз и способы получения подходящих TAL-нуклеаз, описаны, например, в патентной заявке США №2011/0239315 А1, 2011/0269234 А1, 2011/0145940 А1, 2003/0232410 А1, 2005/0208489 А1, 2005/0026157 А1, 2005/0064474 А1, 2006/0188987 А1 и 2006/0063231 А1 (каждая таким образом включена в данный документ посредством ссылки). В различных вариантах реализации изобретения TAL-эффекторные нуклеазы сконструированы таким образом, чтобы разрезать в или возле последовательности целевой нуклеиновой кислоты в, например, представляющем интерес геномном локусе, причем последовательность целевой нуклеиновой кислоты расположена в или возле последовательности, требующей модификации таргетирующим вектором. TAL-нуклеаза, подходящая для использования в различных способах и композициях, представленных в данном документе, включает специально разработанные для связывания на или возле последовательностей целевой нуклеиновой кислоты, требующей модификации таргетирующим вектором, как описано в данном документе.
[00212] В одном варианте реализации изобретения каждый мономер TALEN содержит 12-25 TAL-повторов, причем каждый TAL-повтор связывает подсайт размером 1 п.н. В одном варианте реализации изобретения нуклеазный агент представляет собой химерный белок, содержащий домен связывания ДНК на основе TAL-повтора, функционально связанный с независимой нуклеазой. В одном варианте реализации изобретения независимая нуклеаза представляет собой эндонуклеазу FokI. В одном варианте реализации изобретения нуклеазный агент содержит первый домен связывания ДНК на основе TAL-повтора и второй домен связывания ДНК на основе TAL-повтора, причем каждый из первого и второго домена связывания ДНК на основе TAL-повтора функционально связан с нуклеазой FokI, причем первый и второй домен связывания ДНК на основе TAL-повтора распознает две последовательные последовательности целевой ДНК в каждой цепи последовательности целевой ДНК, разделенной сайтом расщепления размером от около 6 п.н. до около 40 п.н., и при этом нуклеаза FokI димеризует и создает двухцепочечный разрыв в целевой последовательности.
[00213] В одном варианте реализации изобретения нуклеазный агент содержит первый домен связывания ДНК на основе TAL-повтора и второй домен связывания ДНК на основе TAL-повтора, причем каждый из первого и второго домена связывания ДНК на основе TAL-повтора функционально связан с нуклеазой FokI, причем первый и второй домен связывания ДНК на основе TAL-повтора распознает две последовательные последовательности целевой ДНК в каждой цепи последовательности целевой ДНК, разделенной сайтом расщепления размером 5 п.н. или 6 п.н., и при этом нуклеаза FokI димеризует и создает двухцепочечный разрыв.
[00214] Нуклеазный агент, применяемый в различных способах и композициях, описанных в данном документе, может дополнительно содержать цинк-пальцевую нуклеазу (ZFN). В одном варианте реализации изобретения каждый мономер ZFN содержит 3 или более доменов связывания ДНК на цинк-пальцевой основе, причем каждый домен связывания ДНК на цинк-пальцевой основе связывает подсайт размером 3 п.н. В других вариантах реализации изобретения ZFN представляет собой химерный белок, содержащий домен связывания ДНК на цинк-пальцевой основе, функционально связанный с независимой нуклеазой. В одном варианте реализации изобретения независимая эндонуклеаза представляет собой эндонуклеазу FokI. В одном варианте реализации изобретения нуклеазный агент содержит первую и вторую ZFN, причем каждая первая ZFN и вторая ZFN функционально связана с нуклеазой FokI, причем первая ZFN и вторая ZFN распознает две последовательные последовательности целевой ДНК в каждой цепи последовательности целевой ДНК, разделенной сайтом расщепления размером от около 6 п.н. до около 40 п.н. или сайтом расщепления размером от около 5 п.н. до около 6 п.н., и при этом нуклеаза FokI димеризует и создает двухцепочечный разрыв. См., к примеру, заявки US 20060246567; US 20080182332; US 20020081614; US 20030021776; WO/2002/057308 A2; US 20130123484; US 20100291048 и WO/2011/017293 А2, каждая из которых включена в данный документ посредством ссылки.
[00215] В одном таком варианте реализации способов, описанных в данном документе, нуклеазный агент включает (а) химерный белок, содержащий ДНК-связывающий домен на основе цинкового пальца, гибридизированный с эндонуклеазой FokI, или (b) химерный белок, содержащий подобную активатору транскрипции эффекторную нуклеазу (TALEN), гибридизированную с эндонуклеазой FokI.
[00216] В другом варианте реализации изобретения нуклеазный агент представляет собой мегануклеазу. Мегануклеазы классифицированы в четыре семейства на основе консервативных мотивов последовательностей, семейства представлены LAGLIDADG (SEQ ID №: 16), GIY-YIG, H-N-H и семействами His-Cys-бокса. Эти мотивы принимают участие в координации ионов металлов и гидролизе фосфодиэфирных связей. НЕазы примечательны благодаря их длинным сайтам распознавания и толерантностью к некоторым видам полиморфизма последовательностей в их ДНК-субстратах. Хорошо известны домены мегануклеаз, их структура и функция, см. к примеру статьи, Guhan и Muniyappa (2003) CritRev Biochem Mol Biol 38: 199-248; Lucas et al, (2001) Nucleic Acids Res 29: 960-9; Jurica и Stoddard, (1999) Cell Mol Life Sci 55: 1304-26; Stoddard, (2006) Q Rev Biophys 38: 49-95 и Moure et al, (2002) Nat Struct Biol 9: 764. В некоторых примерах используют встречающийся в природе вариант и/или сконструированное производное мегануклеазы. Хорошо известны способы модификации кинетики, взаимодействия кофакторов, экспрессии, оптимальных условий и/или специфичности сайта распознавания и скрининга по активности, см. к примеру, Epinat et al., (2003) Nucleic Acids Res 31: 2952-62; Chevalier et al., (2002) Mol Cell 10: 895-905; Gimble et al., (2003) Mol Biol 334: 993-1008; Seligman et al., (2002) Nucleic Acids Res 30: 3870-9; Sussman et al., (2004) J Mol Biol 342: 31-41; Rosen et al, (2006) Nucleic Acids Res 34: 4791-800; Chames et al, (2005) Nucleic Acids Res 33:e178; Smith et al, (2006) Nucleic Acids Res 34:e149; Gruen et al, (2002) Nucleic Acids Res 30:e29; Chen and Zhao, (2005) Nucleic Acids Res 33:e154; WO 2005105989; WO 2003078619; WO 2006097854; WO 2006097853; WO 2006097784 и WO 2004031346.
[00217] Любая мегануклеаза, которая может использоваться в данном документе, включает, но не ограничивается, I-SceI, I-SceII, I-SceIII, I-SceIV, I-SceV, I-SceVI, I-SceVII, I-CeuI, I-CeuAIIP, I-CreI, I-CrepsbIP, I-CrepsbIIP, I-CrepsbIIIP, I-CrepsbIVP, I-TliI, I-PpoI, PI-PspI, F-SceI, F-SceII, F-SuvI, F-TevI, F-TevII, I-AmaI, I-AniI, I-ChuI, I-CmoeI, I-CpaI, I-CpaII, I-CsmI, I-CvuI, I-CvuAIP, I-DdiI, I-DdiII, I-DirI, I-DmoI, I-HmuI, I-HmuII, I-HsNIP, I-LlaI, I-MsoI, I-NaaI, I-NanI, I-NcIIP, I-NgrIP, I-NitI, I-NjaI, I-Nsp236IP, I-PakI, I-PboIP, I-PcuIP, I-PcuAI, I-PcuVI, I-PgrIP, I-PobIP, I-PorI, I-PorIIP, I-PbpIP, I-SpBetaIP, I-ScaI, I-SexIP, I-SneIP, I-SpomI, I-SpomCP, I-SpomIP, I-SpomIIP, I-SquIP, I-Ssp6803I, I-SthPhiJP, I-SthPhiST3P, I-SthPhiSTe3bP, I-TdeIP, I-TevI, I-TevII, I-TevIII, I-UarAP, I-UarHGPAIP, I-UarHGPA13P, I-VinIP, I-ZbiIP, PI-MtuI, PI-MtuHIP PI-MtuHIIP, PI-PfuII, PI-PfuII, PI-PkoI, PI-PkoII, PI-Rma43812IP, PI-SpBetaIP, PI-SceI, PI-TfuI, PI-TfuII, PI-ThyI, PI-TliI, PI-TliII или любыми их активными вариантами или фрагментами.
[00218] В одном варианте реализации изобретения мегануклеаза распознает двухцепочечные последовательности ДНК из от 12 до 40 пар оснований. В одном варианте реализации изобретения мегануклеаза распознает в геноме одну точно совпадающую целевую последовательность. В одном варианте реализации изобретения мегануклеаза представляет собой нуклеазу хоуминга. В одном варианте реализации изобретения нуклеаза хоуминга представлена семейством LAGLIDADG (SEQ ID №: 16) нуклеаз хоуминга. В одном варианте реализации изобретения семейство LAGLIDADG (SEQ ID №: 16) нуклеаз хоуминга выбирают из I-SceI, I-CreI и I-Dmol.
[00219] Нуклеазные агенты могут дополнительно содержать рестрикционные эндонуклеазы, которые включают эндонуклеазы типа I, типа II, типа III и типа IV. Рестрикционные эндонуклеазы типа I и типа III распознают специфические сайты распознавания, но обычно расщепляют в вариабельном положении от сайта связывания нуклеаз, который может находиться на сотни пар оснований в сторону от сайта расщепления (сайта распознавания). В системах типа II рестрикционная активность независима от любой метилазной активности, а расщепление, как правило, происходит в специфических сайтах в или возле сайта связывания. Большинство ферментов типа II разрезает палиндромные последовательности, однако, ферменты типа IIa распознают непалиндромные сайты распознавания и расщепления за пределами сайта распознавания, ферменты типа IIb разрезают последовательности дважды на обоих концах за пределами сайта распознавания, а ферменты типа IIs распознают асимметричные сайты распознавания и расщепляют на одной стороне и на определенном расстоянии из около 1-20 нуклеотидов от сайта распознавания. Рестрикционные ферменты типа IV таргетируют метилированную ДНК. Рестрикционные ферменты дополнительно описаны и классифицированы, к примеру, в базе данных REBASE (веб-страница rebase.neb.com; Roberts et al., (2003) Nucleic Acids Res 31: 418-20), Roberts et al., (2003) Nucleic Acids Res 31: 1805-12 и Belfort et al, (2002) в Mobile DNA II, pp. 761-783, Eds. Craigie et al, (ASM Press, Washington, DC).
[00220] Нуклеазный агент, применяемый в различных способах и композициях, также может содержать систему CRISPR/Cas. В таких системах могут применять, к примеру, нуклеазу Cas9, которая в некоторых случаях является кодон-оптимизированной для требуемого типа клеток, в которых она должна экспрессироваться. В системе дополнительно применяется гибридизированная конструкция crRNA-tracrRNA, которая функционирует с кодон-оптимизированной Cas9. Эту одиночную РНК часто называют гидовой РНК или гРНК. В пределах гРНК часть crRNA идентифицируют как «целевую последовательность» для данного сайта распознавания, a tracrRNA часто называют «каркас». Вкратце, короткий фрагмент ДНК, содержащий целевую последовательность, вставляют в экспрессионную плазмиду гидовой РНК. Экспрессионная плазмида гРНК содержит целевую последовательность (в некоторых вариантах реализации изобретения приблизительно 20 нуклеотидов), форма последовательности tracrRNA (каркас), а также подходящий промотор, который активен в клетке, и необходимые элементы для надлежащего процессинга в эукариотических клетках. Многие системы основаны на специальных комплементарных олигонуклеотидах, которые рекомбинируют с образованием двухцепочечной ДНК, и потом клонируют в экспрессионную плазмиду гРНК. Экспрессионную кассету гРНК и экспрессионную кассету Cas9 потом вводят в клетку. См., например, статьи Mali Р et al. (2013) Science 2013 Feb 15; 339(6121): 823-6; Jinek M et al. Science 2012 Aug 17; 337(6096): 816-21; Hwang WY et al. Nat Biotechnol 2013 Mar; 31(3): 227-9; Jiang W et al. Nat Biotechnol 2013 Mar; 31(3): 233-9 и Cong L et al. Science 2013 Feb 15; 339(6121): 819-23, каждая из которых включена в данный документ посредством ссылки.
[00221] В одном варианте реализации изобретения способ модификации представляющего интерес геномного локуса в плюрипотентной клетке крысы дополнительно включает введение в плюрипотентную клетку крысы: (а) первой экспрессионной конструкции, содержащей первый промотор, функционально связанный с первой последовательностью нуклеиновой кислоты, кодирующей белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), (b) второй экспрессионной конструкции, содержащей второй промотор, функционально связанный с геномной целевой последовательностью, связанной с гидовой РНК (гРНК), причем геномная целевая последовательность фланкирована на 3'-конце последовательностью мотива, прилегающего к протоспейсеру (РАМ). В одном варианте реализации изобретения геномная целевая последовательность содержит нуклеотидную последовательность GNNNNNNNNNNNNNNNNNNNNGG (GN1-20GG; SEQ ID №: 1). В одном варианте реализации изобретения геномная целевая последовательность содержит SEQ ID NO: 23, в которой N в длину составляет между 1 и 20 нуклеотидами. В другом варианте реализации изобретения геномная целевая последовательность содержит в длину между 14 и 20 нуклеотидов SEQ ID №: 1.
[00222] В одном варианте реализации изобретения гРНК содержит третью последовательность нуклеиновой кислоты, кодирующую РНК (crRNA) коротких палиндромных повторов, регулярно расположенных группами (CRISPR), и трансактивирующую РНК CRISPR (tracrRNA). В специальных вариантах реализации изобретения белок Cas представляет собой Cas9.
[00223] В некоторых вариантах реализации изобретения гРНК содержит (а) химерную РНК с последовательностью нуклеиновой кислоты 5'-

-3' (SEQ ID №: 2) или (b) химерную РНК с последовательностью нуклеиновой кислоты 5'-GUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCG-3' (SEQ ID №: 3).
[00224] В другом варианте реализации изобретения crRNA содержит 5'-GUUUUAGAGCUAGAAAUAGCAAGUUAAAAU-3' (SEQ ID №: 4); 5'-GUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAG (SEQ ID №: 5) или 5'-GAGUCCGAGCAGAAGAAGAAGUUUUA-3' (SEQ ID №: 6).
[00225] В еще одних вариантах реализации изобретения tracrRNA содержит 5'-AAGGCUAGUCCG-3' (SEQ ID №: 7) или 5'-AAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU-3' (SEQ ID №: 8).
[00226] В одном варианте реализации изобретения белок Cas представляет собой белок Cas типа I. В одном варианте реализации изобретения белок Cas представляет собой белок Cas типа II. В одном варианте реализации изобретения белок Cas типа II представляет собой Cas9. В одном варианте реализации изобретения первая последовательность нуклеиновой кислоты кодирует кодон-оптимизированный белок Cas человека.
[00227] В одном варианте реализации изобретения первая нуклеиновая кислота содержит мутацию, которая разрушает по меньшей мере один аминокислотной остаток активных сайтов нуклеазы в белке Cas, причем мутантный белок Cas создает разрыв только в одной цепи участка целевой ДНК, и при этом мутация ослабляет негомологичную рекомбинацию по участку целевой ДНК.
[00228] В одном варианте реализации изобретения первая последовательность нуклеиновой кислоты, которая кодирует белок Cas, дополнительно содержит сигнал ядерной локализации (NLS). В одном варианте реализации изобретения сигнал ядерной локализации представляет собой сигнал ядерной локализации SV40.
[00229] В одном варианте реализации изобретения второй промотор, который управляет экспрессией геномной целевой последовательности и гидовая РНК (гРНК) представляет собой промотор РНК-полимеразы III. В одном варианте реализации изобретения промотор РНК-полимеразы III представляет собой промотор U6 человека. В одном варианте реализации изобретения промотор РНК-полимеразы III представляет собой промотор U6 полимеразы III крысы. В одном варианте реализации изобретения промотор РНК-полимеразы III представляет собой промотор U6 полимеразы III крысы.
[00230] В одном варианте реализации изобретения последовательности нуклеиновой кислоты, кодирующие crRNA и tracrRNA связаны посредством синтетической петли, причем при экспрессии crRNA и tracrRNA образуют дуплекс crRNA:tracrRNA.
[00231] В одном варианте реализации изобретения первая экспрессионная конструкция и вторая экспрессионная конструкция экспрессируются на той же плазмиде.
[00232] В одном варианте реализации изобретения первая и вторая экспрессионные конструкции вводятся вместе с LTVEC. В одном варианте реализации изобретения первая и вторая экспрессионные конструкции вводятся в течение некоторого времени отдельно от LTVEC.
[00233] В одном варианте реализации изобретения способ включает введение множества из второй конструкции и множества LTVEC для множественного редактирования различных целевых локусов, как описано в данном документе.
[00234] В данном изобретении также представлены активные варианты и фрагменты нуклеазных агентов (т.е. сконструированного нуклеазного агента). Такие активные варианты могут обладать по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 97%, 98%, 99% или больше идентичности последовательности к нативному нуклеазному агенту, причем активные варианты сохраняют способность разрезать в требуемом сайте распознавания и, поэтому, сохраняют активность индуцирования одноцепочечных или двухцепочечных разрывов. К примеру, любой из нуклеазных агентов, описанных в данном документе, может быть модифицирован из нативной последовательности эндонуклеазы и сконструирован для распознавания и индукции одноцепочечного или двухцепочечного разрыва в сайте распознавания, который не распознавался нативным нуклеазным агентом. Таким образом, в некоторых вариантах реализации изобретения сконструированная нуклеаза обладает специфичностью индукцировать одноцепочечный или двухцепочечный разрыв в сайте распознавания, который отличается от соответствующего нативного сайта распознавания нуклеазного агента. Анализы на активность индуцирования одноцепочечного или двухцепочечного разрыва хорошо известны и, в большинстве случаев, измеряют общую активность и специфичность эндонуклеазы на ДНК-субстратах, содержащих сайт распознавания.
[00235] Нуклеазный агент может быть введен в клетку любыми способами, известными в данной области техники. Полипептид, кодирующий нуклеазный агент, может быть непосредственно введен в клетку. Альтернативно, в клетку может быть введен полинуклеотид, кодирующий нуклеазный агент. Когда полинуклеотид, кодирующий нуклеазный агент, вводится в клетку, то нуклеазный агент может экспрессироваться в клетке транзиентно, обусловлено или конститутивно. Таким образом, полинуклеотид, кодирующий нуклеазный агент, может содержаться в экспрессионной кассете и быть функционально связанным с обусловленным промотором, индуцируемым промотором, конститутивным промотором или тканеспецифическим промотором. Такие представляющие интерес промоторы обсуждаются подробнее в других местах данного документа. Альтернативно, нуклеазный агент вводится в клетку в виде мРНК, кодирующую или содержащую нуклеазный агент.
[00236] В одном варианте реализации изобретения cRNA и tracrRNA экспрессируются как отдельные РНК-транскрипты.
[00237] В специальных вариантах реализации изобретения полинуклеотид, кодирующий нуклеазный агент, стабильно интегрирован в геном клетки и функционально связан с промотором, активным в клетке. В других вариантах реализации изобретения полинуклеотид, кодирующий нуклеазный агент находится в том же таргетирующем векторе, содержащем вставку нуклеиновой кислоты, тогда как в других случаях полинуклеотид, кодирующий нуклеазный агент, находится в векторе или плазмиде, которая отделена от таргетирующего вектора, содержащего вставку нуклеиновой кислоты.
[00238] Когда нуклеазный агент помещается в клетку посредством введения полинуклеотида, кодирующего нуклеазный агент, такой полинуклеотид, кодирующий нуклеазный агент, может быть модифицирован заместительными кодонами, имеющими большую частоту использования в представляющей интерес клетке, по сравнению с встречающейся в природе полинуклеотидной последовательностью, кодирующей нуклеазный агент. К примеру, полинуклеотид, кодирующий нуклеазный агент, может быть модифицирован заместительными кодонами, имеющими большую частоту использования в данной представляющей интерес прокариотической или эукариотической клетке, включающей бактериальною клетку, дрожжевую клетку, клетку человека, нечеловеческую клетку, клетку млекопитающего, клетку мыши, клетку крысы или любую другую представляющую интерес клетку-хозяина по сравнению с встречающейся в природе полинуклеотидной последовательностью.
[00239] В одном варианте реализации изобретения эндонуклеазный агент вводится вместе с LTVEC. В одном варианте реализации изобретения эндонуклеазный агент вводится в течение некоторого времени отдельно от LTVEC. В одном варианте реализации изобретения эндонуклеазный агент вводится перед введением LTVEC. В одном варианте реализации изобретения эндонуклеазный агент вводится в ЭС клетку крысы после введения LTVEC.
[00240] В одном варианте реализации изобретения эндонуклеазный агент представляет собой экспрессионную конструкцию, содержащую последовательность нуклеиновой кислоты, кодирующую эндонуклеазу, причем последовательность нуклеиновой кислоты функционально связана с промотором. В одном варианте реализации изобретения промотор представляет собой конститутивно активный промотор. В одном варианте реализации изобретения промотор представляет собой индуцируемый промотор. В одном варианте реализации изобретения промотор является активным в плюрипотентной клетке крысы. В одном варианте реализации изобретения эндонуклеазный агент представляет собой мРНК, кодирующую эндонуклеазу.
В. Способы интегрирования представляющего интерес полинуклеотида в целевой локус
[00241] В данном изобретении представлены способы модификации представляющего интерес целевого локуса. В одном варианте реализации изобретения целевой локус в плюрипотентной клетке крысы таргетируют для генетической модификации. Такой способ включает: (а) введение в плюрипотентную клетку крысы таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, и (b) идентификацию генетически модифицированной плюрипотентной клетки крысы, содержащей направленную генетическую модификацию в целевом локусе, причем направленная генетическая модификация способна передаваться по зародышевой линии. В специальных вариантах реализации изобретения полная совокупность 5'-гомологичного плеча и 3'-гомологичного плеча составляет по меньшей мере 10 т.н. и/или применяется большой таргетирующий вектор.
[00242] В других вариантах реализации изобретения размер полной совокупности суммы 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 150 т.н., от около 10 т.н. до около 100 т.н., от около 10 т.н. до около 75 т.н., от около 20 т.н. до около 150 т.н., от около 20 т.н. до около 100 т.н., от около 20 т.н. до около 75 т.н., около 30 т.н. до около 150 т.н., от около 30 т.н. до около 100 т.н., от около 30 т.н. до около 75 т.н., около 40 т.н. до около 150 т.н., от около 40 т.н. до около 100 т.н., от около 40 т.н. до около 75 т.н., около 50 т.н. до около 150 т.н., от около 50 т.н. до около 100 т.н. или от около 50 т.н. до около 75 т.н., от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до около 150 т.н. В одном варианте реализации изобретения размер делеции такой же или сходный с размером полной совокупности 5'- и 3'-гомологичных плечей LTVEC.
[00243] Плюрипотентная клетка крысы может быть эмбриональной стволовой клеткой крысы. В специальном варианте реализации изобретения (а) ЭС клетка крысы получена из штамма DA или штамма ACI или (b) ЭС клетка крысы характеризуется экспрессией маркера плюрипотентности, включающего Oct-4, Sox-2, щелочную фосфатазу или их комбинацию. В других случаях используемая эмбриональная стволовая клетка крысы включает ЭС клетку крысы, как описано в патентной заявке США №14/185103, поданной 20 февраля 2014 г., включенной в данный документ в полном объеме посредством ссылки.
[00244] Как описано в других местах данного документа, вставка нуклеиновой кислоты может быть любой последовательностью нуклеиновой кислоты. В неограничивающих вариантах реализации изобретения (а) вставка нуклеиновой кислоты содержит замену эндогенной последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты млекопитающего; (b) вставка нуклеиновой кислоты содержит делецию эндогенной последовательности нуклеиновой кислоты крысы; (с) вставка нуклеиновой кислоты содержит делецию эндогенной последовательности нуклеиновой кислоты крысы, причем делеция находится в диапазоне от 5 т.н. до 200 т.н. или от 5 т.н. до 3 м.н. (как подробно обсуждается в других местах данного документа); (d) вставка нуклеиновой кислоты содержит добавление экзогеной последовательности нуклеиновой кислоты (включая, к примеру, экзогенную последовательность нуклеиновой кислоты находящуюся в диапазонах от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.); (е) вставка нуклеиновой кислоты содержит экзогенную последовательность нуклеиновой кислоты, содержащую гомологичную или ортологичную последовательность нуклеиновой кислоты; (f) гомологичная или ортологичная последовательность нуклеиновой кислоты (а), причем последовательность нуклеиновой кислоты представляет собой последовательность нуклеиновой кислоты человека; (g) вставка нуклеиновой кислоты содержит гомологичную или ортологичную последовательность нуклеиновой кислоты (а), причем последовательность нуклеиновой кислоты представляет собой химерную последовательность нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты человека и крысы; (h) вставка нуклеиновой кислоты содержит экзогенную последовательность нуклеиновой кислоты (е), причем вставка нуклеиновой кислоты находится в диапазоне от около 5 т.н. до около 200 т.н.; (i) вставка нуклеиновой кислоты содержит условную аллель, фланкированную целевыми последовательностями сайт-специфических рекомбиназ; (j) вставка нуклеиновой кислоты содержит репортерный ген, функционально связанный с промотором; (k) вставка нуклеиновой кислоты содержит один или более неупорядоченных сегментов гена VH тяжелой цепи иммуноглобулина человека, один или более неперестроенных сегментов гена D тяжелой цепи иммуноглобулина человека и один или более неперестроенных сегментов гена JH тяжелой цепи иммуноглобулина человека, которые функционально связаны с последовательностью нуклеиновой кислоты константного участка тяжелой цепи грызуна; (l) вставка нуклеиновой кислоты содержит перестроенную последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи иммуноглобулина человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка тяжелой цепи грызуна; (m) вставка нуклеиновой кислоты содержит один или более неперестроенных сегментов гена Vκ или Vλ иммуноглобулина человека и один или более неперестроенных сегментов гена Jκ или Jλ иммуноглобулина человека, которые функционально связаны с последовательностью нуклеиновой кислоты константного участка легкой цепи λ или κ легкой цепи иммуноглобулина млекопитающего; (n) вставка нуклеиновой кислоты содержит перестроенную последовательность нуклеиновой кислоты вариабельного участка легкой цепи λ или κ человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка легкой цепи λ или κ легкой цепи иммуноглобулина млекопитающего; (о) последовательность нуклеиновой кислоты константного участка тяжелой цепи млекопитающего (k) и/или (l) содержит последовательность нуклеиновой кислоты константного участка крысы, последовательность нуклеиновой кислоты константного участка человека или их комбинацию или (р) нуклеиновая кислота константного участка легкой цепи λ или κ иммуноглобулина млекопитающего (m) и/или (n) содержит последовательность нуклеиновой кислоты константного участка крысы, последовательность нуклеиновой кислоты константного участка человека или их комбинацию.
[00245] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит один или более функциональных сегментов гена VH человека, содержащих VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-45, VH1-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-30-3, VH3-30-5, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-72, VH3-73, VH3-74, VH4-4, VH4-28, VH4-30-1, VH4-30-2, VH4-30-4, VH4-31, VH4-34, VH4-39, VH4-59, VH4-61, VH5-51, VH6-1, VH7-4-1, VH7-81 или их комбинацию.
[00246] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит один или более функциональных сегментов гена D человека, содержащих D1-1, D1-7, D1-14, D1-20, D1-26, D2-2, D2-8, D2-15, D2-21, D3-3, D3-9, D3-10, D3-16, D3-22, D4-4, D4-11, D4-17, D4-23, D5-12, D5-5, D5-18, D5-24, D6-6, D6-13, D6-19, D6-25, D7-27 или их комбинацию.
[00247] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит один или более функциональных сегментов гена JH, содержащих JH1, JH2, JH3, JH4, JH5, JH6 или их комбинацию. В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит один или более сегментов гена Vκ человека, содержащих Vκ4-1, Vκ5-2, Vκ7-3, Vκ2', Vκ1-5, Vκ1-6, Vκ3-7, Vκ1-8, Vκ1-9, Vκ2-10, Vκ3-11, Vκ1-12, Vκ1-13, Vκ2-14, Vκ3-15, Vκ1-16, Vκ1-17, Vκ2-18, Vκ2-19, Vκ3-20, Vκ6-21, Vκ1-22, Vκ1-23, Vκ2-24, Vκ3-25, Vκ2-26, Vκ1-27, Vκ2-28, Vκ2-29, Vκ2-30, Vκ3-31, Vκ1-32, Vκ1-33, Vκ3-34, Vκ1-35, Vκ2-36, Vκ1-37, Vκ2-38, Vκ1-39, Vκ2-40 или их комбинацию.
[00248] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит один или более сегментов гена Vλ, человека, содержащих Vλ3-1, Vλ4-3, Vλ2-8, Vλ3-9, Vλ3-10, Vλ2-11, Vλ3-12, Vλ2-14, Vλ3-16, Vλ2-1S, Vλ3-19, Vλ3-21, Vλ3-22, Vλ2-23, Vλ3-25, Vλ3-27 или их комбинацию.
[00249] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит один или более сегментов гена Jκ человека, содержащих Jκ1, Jκ2, Jκ3, Jκ4, Jκ5 или их комбинацию.
[00250] В специальных вариантах реализации изобретения при модификации целевого локуса в плюрипотентной клетке крысы генетическая модификация передается по зародышевой линии.
[00251] В одном варианте реализации изобретения вставка последовательности нуклеиновой кислоты содержит полинуклеотид, который при интеграции в геном будет продуцировать генетическую модификацию участка локуса АроЕ крысы, причем генетическая модификация в локусе АроЕ приводит к уменьшению активности АроЕ, увеличению активности АроЕ или модуляции активности АроЕ. В одном варианте реализации изобретения создается нокаут АроЕ.
[00252] В одном варианте реализации изобретения вставка последовательности нуклеиновой кислоты содержит полинуклеотид, который при интеграции в геном будет продуцировать генетическую модификацию участка локуса рецептора гамма интерлейкина-2 крысы, причем генетическая модификация в локусе рецептора гамма интерлейкина-2 крысы приводит к уменьшению активности рецептора интерлейкина-2, увеличению активности рецептора интерлейкина-2 или модуляции рецептора интерлейкина-2. В одном варианте реализации изобретения создается нокаут рецептора интерлейкина-2.
[00253] В другом варианте реализации изобретения вставка последовательности нуклеиновой кислоты содержит полинуклеотид, который при интеграции в геном будет продуцировать генетическую модификацию участка локуса Rag1 крысы, локуса Rag2 крысы и/или локуса Rag2/Rag1 крысы, причем генетическая модификация в локусе Rag1, Rag2 и/или Rag2/Rag1 приводит к уменьшению активности белка Rag1, Rag2 или Rag1 и Rag2, увеличению активности белка Rag1, Rag2 или Rag1 и Rag2 или модуляции активности белка Rag1, Rag2 или Rag1 и Rag2. В одном варианте реализации изобретения создается нокаут Rag1, Rag2 или Rag2/Rag1.
[00254] В дополнительных вариантах реализации изобретения вставка нуклеиновой кислоты приводит к замене части локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 и/или локуса Rag2 и/или локуса Rag1 и/или локуса Rag2/Rag1 на соответствующую ортологичную часть локуса АроЕ, локуса рецептора гамма интерлейкина-2, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1 из другого организма.
[00255] В других вариантах реализации изобретения вставка нуклеиновой кислоты включает полинуклеотид, содержащий на своей полной длине по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% части локуса АроЕ, локуса рецептора гамма интерлейкина-2, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1, которая его заменяет.
[00256] Данная вставка полинуклеотида и соответствующий участок локуса крысы, который заменяется, может быть кодирующим участком, интроном, экзоном, нетранслируемым участком, регуляторным участком, промотором или энхансером или их любой комбинацией. Более того, данная вставка полинуклеотида и/или участка локуса крысы, который заменяется, может иметь любую требуемую длину, включающую к примеру, в длину между 10-100 нуклеотидами, в длину 100-500 нуклеотидов, в длину нуклеотидов 500-1 т.н., в длину нуклеотидов от 1 т.н. до 1,5 т.н., в длину нуклеотидов от 1,5 т.н. до 2 т.н., в длину нуклеотидов от 2 т.н. до 2,5 т.н., в длину нуклеотидов от 2,5 т.н. до 3 т.н., в длину нуклеотидов от 3 т.н. до 5 т.н., в длину нуклеотидов от 5 т.н. до 8 т.н., в длину нуклеотидов от 8 т.н. до 10 т.н. или больше. В других случаях размер инсерции или замены составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н., от около 350 т.н. до около 400 т.н., от около 400 т.н. до около 800 т.н., от около 800 т.н. до 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н., от около 2,5 м.н. до около 2,8 м.н., от около 2,8 м.н. до около 3 м.н. В других вариантах реализации изобретения данная вставка полинуклеотида и/или участка локуса крысы, который заменяется, составляет по меньшей мере 100, 200, 300, 400, 500, 600, 700, 800, или 900 нуклеотидов или по меньшей мере 1 т.н., 2 т.н., 3 т.н., 4 т.н., 5 т.н., 6 т.н., 7 т.н., 8 т.н., 9 т.н., 10 т.н., 11 т.н., 12 т.н., 13 т.н., 14 т.н., 15 т.н., 16 т.н. или больше.
i. Способы модификации целевого локуса нуклеиновой кислоты крысы посредством бактериальной гомологичной рекомбинации (БГР)
[00257] В данном изобретении представлены способы и композиции модификации целевого локуса нуклеиновой кислоты крысы посредством бактериальной гомологичной рекомбинации (БГР) в прокариотической клетке. Такие способы находят применение в использовании бактериальной гомологичной рекомбинации в прокариотической клетке для генетической модификации целевого локуса нуклеиновой кислоты крысы для того, чтобы создать таргетирующий вектор. Такой таргетирующий вектор, содержащий генетически модифицированный целевой локус, может быть введен в эукариотическую клетку, к примеру, плюрипотентную клетку крысы. «Гомологичная рекомбинация» включает обмен фрагментами ДНК между двумя молекулами ДНК в сайтах кроссинговера в пределах участков гомологии. Таким образом, «бактериальная гомологичная рекомбинация» или «БГР» включает гомологичную рекомбинацию, которая происходит в бактериях.
[00258] В данном изобретении представлены способы модификации целевого локуса нуклеиновой кислоты крысы посредством бактериальной гомологичной рекомбинации (БГР), которые включают введение в прокариотическую клетку таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем прокариотическая клетка содержит нуклеиновую кислоту крысы и способна экспрессировать рекомбиназу, которая опосредует в целевом локусе БГР. Такие таргетирующие векторы могут включать любые таргетирующие векторы, описанные в данном документе.
[00259] В одном варианте реализации изобретения способ включает введение в прокариотическую клетку: (i) первой конструкции, содержащей нуклеиновую кислоту крысы, имеющую целевую последовательность ДНК; (ii) второй таргетирующей конструкции, содержащей вставку нуклеиновой кислоты, фланкированую 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, и (iii) третьей конструкции, кодирующей рекомбиназу, которая опосредует бактериальную гомологичную рекомбинацию. В одном варианте реализации изобретения первая, вторая и третья конструкция вводятся в прокариотическую клетку отдельно в течение некоторого времени. В одном варианте реализации изобретения прокариотическая клетка содержит нуклеиновую кислоту, которая кодирует рекомбиназу, а способ не требует введения третьей конструкции. В одном варианте реализации изобретения рекомбиназа экспрессируется под контролем индуцируемого промотора.
[00260] В одном варианте реализации изобретения первая конструкция, содержащая нуклеиновую кислоту крысы, получена из бактериальной искусственной хромосомы (ВАС) или дрожжевой искусственной хромосомы (YAC).
[00261] Может быть выбрана прокариотическая клетка, содержащая вставку нуклеиновой кислоты в целевом геномном локусе. Этот способ может серийно повторяться, как описано в данном документе, для обеспечения введения множественных вставок нуклеиновых кислот в таргетируемый локус крысы в прокариотической клетке. Как только целевой локус нуклеиновой кислоты крысы «встроен» в прокариотическую клетку, из прокариотической клетки может быть выделен таргетирующий вектор, содержащий модифицированный целевой локус крысы, и введен в целевой геномный локус в клетке млекопитающего (т.е. клетку крысы, плюрипотентную клетку крысы или эмбриональную стволовую клетку крысы).
[00262] Предпочтительные клетки крысы для получения таргетирующих векторов описаны в заявке США 14/185703, поданной 20 февраля 2014 г., содержание которой обобщено в данном документе. Эти клетки крысы представляют собой плюрипотентные клетки крысы способные поддерживать свою плюрипотентность после одной или более направленных генетических модификаций in vitro и которые способны передавать направленные генетические модификации по зародышевой линии.
[00263] Электропорированные плюрипотентные клетки крысы помещают на планшеты при высокой плотности для отбора устойчивых к лекарственному веществу клеток, содержащих таргетирующий вектор. Процесс отбора с применением лекарственного вещества удаляет большинство размещенных клеток (~99%), оставляя отдельные колонии, каждая из которых является клоном, полученным из единственной клетки. В оставшихся клетках, большинство клеток (~ 80-100%) содержит таргетирующий вектор (содержащий селекционную кассету по лекарственному веществу), интегрированный в геном в случайном положении. Поэтому, колонии по-отдельности отбирают и генотипируют для идентификации ЭС клеток крысы, включающих таргетирующий вектор в правильном геномном положении (например, используя анализ модификации аллели, описанный ниже).
[00264] Для генотипирования может применяться высокопроизводительный количественный анализ, называемый анализом модификации аллели (МОА). Такой анализ позволяет проводить крупномасштабный скрининг модифицированной(ых) аллели(ей) в исходной хромосоме после генетической модификации. Анализ МОА может выполняться посредством различных аналитических методик, включающих, но не ограничивающихся, количественным ПЦР, например, ПЦР в режиме реального времени (кПЦР). К примеру, ПЦР режиме реального времени включает применение первого набора праймеров, который распознает целевой локус, и второго набора праймеров, который распознает нецелевой референтный локус. В дополнение к этому, набор праймеров содержит флуоресцентный зонд, который распознает амплифицированную последовательность. В одном варианте реализации изобретения количественный анализ выполняется с использованием зондов Invader Probes®. В одном варианте реализации изобретения количественный анализ выполняется с использованием методик ММР assays®. В одном варианте реализации изобретения количественный анализ выполняется с использованием молекулярного маяка TaqMan®. В одном варианте реализации изобретения количественный анализ выполняется с использованием зондовой технологии Eclipse™. (См., к примеру, US 2005/0144655, который включен в данный документ в полном объеме посредством ссылки).
[00265] Отобранная плюрипотентная клетка крысы или ЭС клетки крысы, содержащие генетическую модификацию, потом могут вводиться в эмбрион-хозяин крысы, к примеру, эмбрион крысы на стадии преморулы или стадии бластоцисты и имплантироваться в матку суррогатной матери для получения крысы-основателя (крысы F0). Впоследствии, крыса-основатель может скрещиваться с крысой дикого типа для образования потомства F1 гетерозиготного по генетической модификации. Спаривание гетерозиготной крысы F1 может создавать потомство гомозиготное по генетической модификации. Спаривание гетерозиготной крысы F1 может создавать потомство гомозиготное по генетической модификации. В некоторых вариантах реализации изобретения различные генетические модификации целевых локусов, описанных в данном документе, могут проводиться с использованием большого таргетирующего вектора (LTVEC), как подробно описано в других местах данного документа. К примеру, LTVEC могут получать из ДНК бактериальной искусственной хромомсомы (ВАС) с использованием генно-инженерной технологии VELOCIGENE® (см., например, пат. США №6586251 и статью Valenzuela, D. М. et al. (2003), High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotechnology 21(6): 652-659, которые включены в данный документ в своей полноте посредством ссылки).
[00266] Использование бактериальной гомологичной рекомбинации (БГР) для создания большого таргетирующего вектора (LTVEC) преодолевает ограничения, связанные с плазмидами, по размещению большого геномного фрагмента ДНК и последующей низкой эффективности введения направленной модификации в эндогенный локус в плюрипотентных клетках крысы. При создании LTVEC может выполняться одна или более направленных генетических модификаций. Типичный LTVEC, продуцированный в прокариотической клетке, может содержать вставку нуклеиновой кислоты, которая несет геномную последовательность крысы с одной или более генетическими модификациями или экзогенную нуклеиновую кислоту (например, гомолог или ортолог нуклеиновой кислоты крысы), которая фланкирована гомологичными плечами крысы комплементарными специфическим геномным участкам.
[00267] В данном изобретении также представлены прокариотические клетки-хозяева, содержащие различные таргетирующие векторы, описанные в данном документе. Такие прокариотические клетки включают, но не ограничиваются, бактериями, такими как Е. coli. В одном варианте реализации изобретения прокариотическая клетка-хозяин содержит таргетирующий вектор, включающий вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем вставка нуклеиновой кислоты находится в диапазоне от около 5 т.до около 200 т.н.
[00268] Прокариотическая клетка-хозяин может дополнительно содержать нуклеиновую кислоту, которая кодирует рекомбиназный полипептид или нуклеиновую кислоту, которая кодирует рекомбиназный полипептид функционально связанный с индуцируемым промотором.
[00269] В данном изобретении дополнительно представлены различные способы и композиции, которые используют LTVEC, как описано в данном документе, в комбинации с прокариотической клеткой для того, чтобы продуцировать направленные генетические модификации. Такие композиции и способы обсуждаются в других местах данного документа.
[00270] В данном изобретении представлены способы модификации целевого локуса нуклеиновой кислоты посредством бактериальной гомологичной рекомбинации (БГР), которые включают введение в прокариотическую клетку таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом и 3'-гомологичным плечом, причем прокариотическая клетка содержит нуклеиновые кислоты, соответствующие 5'- и 3'-гомологичным плечам, а прокариотическая клетка способна экспрессировать рекомбиназу, которая опосредует в целевом локусе БГР. Такие таргетирующие векторы могут включать любые таргетирующие векторы, описанные в данном документе. Такие способы могут использовать LTVEC, как подробно обсуждается в данном документе, и дополнительно использовать систему CRISPR/Cas, как обсуждается в других местах данного документа.
ii. Способы модификации представляющего интерес целевого локуса в плюрипотентной клетке крысы
[00271] В данном изобретении дополнительно представлен способ модификации представляющего интерес целевого локуса в плюрипотентной клетке крысы посредством направленной генетической модификации, включающий (а) введение в плюрипотентную клетку крысы таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем полная совокупность 5'-гомологичного плеча и 3'-гомологичного плеча составляет по меньшей мере 10 т.н., и (b) идентификацию генетически модифицированной плюрипотентной клетки крысы, содержащей направленную генетическую модификацию в представляющем интерес целевом локусе. В одном варианте реализации изобретения полная совокупность 5'-гомологичного плеча и 3'-гомологичного плеча составляет по меньшей мере от около 16 т.н. до около 30 т.н. В специальных вариантах реализации изобретения направленная генетическая модификация способна передаваться по зародышевой линии. Такие таргетирующие векторы могут включать любые большие таргетирующие векторы, описанные в данном документе.
[00272] В одном аспекте изобретения представлен способ модификации представляющего интерес геномного локуса в плюрипотентной клетке крысы посредством направленной генетической модификации, включающий: (а) снабжение плюрипотентной клетки крысы, которая способна поддерживать свою плюрипотентность после по меньшей мере одной направленной генетической модификации ее генома и способна передавть направленную модификацию по зародышевой линии поколению F1; (b) введение большого таргетирующего вектора (LTVEC) в плюрипотентную клетку крысы, причем LTVEC содержит вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом и 3'-гомологичным плечом, при этом 5'-гомологичное плечо и 3'-гомологичное плечо содержит фрагмент геномной ДНК крысы, и (с) идентификацию генетически модифицированной плюрипотентной клетки крысы, содержащей направленную генетическую модификацию.
[00273] Для идентификации клеток, обладающих вставкой нуклеиновой кислоты, интегрированной в представляющий интерес целевой локус могут использоваться различные способы. Инсерция вставки нуклеиновой кислоты в представляющий интерес целевой локус приводит к «модификации аллели» Термин «модификация аллели» и способы обнаружения модифицированной аллели подробнее обсуждаются в других местах данного документа.
[00274] В одном аспекте изобретения представлен способ модификации представляющего интерес геномного локуса в плюрипотентной клетке крысы при участии опосредованного эндонуклеазой таргетинга гена, причем способ включает: (а) использование выделенной плюрипотентной клеткой крысы, которая способна передавать генетически модифицированный геном зародышевой линии поколения F1; (b) введение в плюрипотентную клетку крысы эндонуклеазного агента; причем эндонуклеазный агент создает одноцепочечный или двухцепочечный разрыв в целевой последовательности ДНК, расположенной в представляющем интерес геномном локусе, и при этом одноцепочечный или двухцепочечный разрыв в целевой последовательности ДНК в ЭС клетке крысы индуцирует: (i) опосредованную негомологичным соединением концов (НГСК) репарацию ДНК одноцепочечного или двухцепочечного разрыва, причем НГСК-опосредованная репарация ДНК создает мутантную аллель, содержащую инсерцию или делецию последовательности нуклеиновой кислоты в целевой последовательности ДНК, или (ii) опосредованную гомологичной рекомбинацией репарацию ДНК, которая приводит к восстановлению последовательности нуклеиновой кислоты дикого типа и (с) идентификацию представляющего интерес модифицированного геномного локуса.
[00275] В одном аспекте изобретения представлен способ модификации представляющего интерес геномного локуса в выделенной эмбриональной стволовой (ЭС) клетке крысы опосредованой нуклеазным агентом, включающий: (а) использование выделенной ЭС клетки крысы, которая способна передавать направленную генетическую модификацию зародышевой линии поколения F1; (b) введение в ЭС клетку крысы: (i) большого таргетирующего вектора (LTVEC), содержащего вставку нуклеиновой кислоты, фланкированной 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем вставка последовательности нуклеиновой кислоты составляет по меньшей мере 5 т.н., и (ii) эндонуклеазный агент, причем эндонуклеазный агент создает одноцепочечный или двухцепочечный разрыв целевой последовательности ДНК, расположенной в представляющем интерес геномном локусе и при этом целевая последовательность не представлена во вставке нуклеиновой кислоты, и (с) идентификацию направленной генетической модификации в эмбриональной стволовой (ЭС) клетке крысы.
[00276] В одном аспекте изобретения представлен способ модификации представляющего интерес геномного локуса в плюрипотентной клетке крысы с участием РНК-опосредованной геномной инженерии, способ включает: (а) использование плюрипотентной клеткой крысы, которая способна передавать генетически модифицированный геном зародышевой линии поколения F1; (b) введение в плюрипотентную клетку крысы: (i) первой экспрессионной конструкции, содержащей первый промотор, функционально связанный с первой последовательностью нуклеиновой кислоты, кодирующей белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), (ii) второй экспрессионной конструкции, содержащей второй промотор, функционально связанный с геномной целевой последовательностью, связанной с гидовой РНК (гРНК), причем геномная целевая последовательность фланкирована на 3'-конце последовательностью мотива, прилегающего к протоспейсеру (РАМ). В одном варианте реализации изобретения геномная целевая последовательность содержит нуклеотидную последовательность GNNNNNNNNNNNNNNNNNNNNGG (GN1-20GG; SEQ ID №: 1). В одном варианте реализации изобретения геномная целевая последовательность содержит SEQ ID NO: 1, в которой N в длину составляет между 14 и 20 нуклеотидами. В одном варианте реализации изобретения гРНК содержит третью последовательность нуклеиновой кислоты, кодирующую РНК (crRNA) коротких палиндромных повторов, регулярно расположенных группами (CRISPR), и четвертую последовательность нуклеиновой кислоты, кодирующей трансактивирующую РНК CRISPR (tracrRNA). В одном варианте реализации изобретения при экспрессии белок Cas образует комплекс CRISPR-Cas, содержащий crRNA и tracrRNA, и комплекс CRISPR-Cas создает одноцепочечный или двухцепочечный разрыв в целевой последовательности ДНК, расположенной в представляющем интерес геномном локусе, и при этом одноцепочечный или двухцепочечный разрыв в целевой последовательности ДНК в плюрипотентной клетке крысы индуцирует: (i) опосредованную негомологичным соединением концов (НГСК) репарацию ДНК одноцепочечного или двухцепочечного разрыва, созданного комплексом CRISPR-Cas, причем НГСК создает мутантную аллель, содержащую инсерцию или делецию последовательности нуклеиновой кислоты в целевой последовательности ДНК, или (ii) опосредованную гомологичной рекомбинацией репарацию ДНК, которая приводит к восстановлению последовательности нуклеиновой кислоты дикого типа и (с) идентификацию представляющего интерес модифицированного геномного локуса.
[00277] В одном варианте реализации изобретения плюрипотентная клетка крысы представляет собой индуцированную плюрипотентную стволовую (иПС) клетку крысы. В одном варианте реализации изобретения плюрипотентная клетка крысы представляет собой ограниченную в развитии клетку-предшественник.
[00278] В различных вариантах реализации изобретения присутствие одноцепочечного или двухцепочечного разрыва в сайте распознавания в селекционном маркере увеличивает эффективность и/или частоту рекомбинации между таргетирующим вектором (таким как LTVEC) и представляющим интерес таргетируемым локусом. В одном варианте реализации изобретения рекомбинация представляет собой гомологичную рекомбинацию. В другом варианте реализации изобретения рекомбинация представляет собой инсерцию путем негомологичного соединения концов. В различных вариантах реализации изобретения в присутствии одноцепочечного или двухцепочечного разрыва, эффективность таргетинга таргетирующего вектора (такого как LTVEC) в целевом геномном локусе является по меньшей мере около в 2 раза выше, по меньшей мере около в 3 раза выше, по меньшей мере около в 4 раза выше, чем в отсутствии одноцепочечного или двухцепочечного разрыва (при использовании, например, такого же таргетирующего вектора и таких же гомологичных плечей и соответствующих целевых сайтов в представляющем интерес геномном локусе, но в отсутствии добавочного нуклеазного агента, который создает одноцепочечный или двухцепочечный разрыв).
[00279] В одном варианте реализации изобретения направленная генетическая модификация в целевом локусе является биаллельной. Термином «биаллельный» обозначается то, что обе аллели гена содержат направленную генетическую модификацию. В некоторых вариантах реализации изобретения комбинированное применение таргетирующего вектора (включающего, к примеру, LTVEC) с нуклеазным агентом приводит в клетке к биаллельной направленной генетической модификации представляющего интерес геномного локуса по сравнению с применением одного таргетирующего вектора. Когда применяется таргетирующий вектор в сочетании с нуклеазным агентом, эффективность биаллельного таргетинга увеличивается по меньшей мере в два раза, по меньшей мере в три раза, по меньшей мере в четыре раза или больше по сравнению с тем, когда применяется один таргетирующий вектор. В дополнительных вариантах реализации изобретения эффективность биаллельного таргетинга составляет по меньшей мере 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 2%, 3%, 4% или 5% или выше.
[00280] В данном изобретении представлены композиции, которые включают использование генетически модифицированную крысу, имеющую направленную генетическую модификацию в локусе рецептора гамма интерлейкина-2 или в локусе АроЕ. Различные способы и композиции, представленные в данном документе, позволяют этим модифицированным локусам передаваться по зародышевой линии.
[00281] В специальных вариантах реализации изобретения генетически модифицированная крыса или генетически модифицированная плюрипотентная клетка крысы содержит геномный локус, имеющий направленную генетическую модификацию в геномном локусе рецептора гамма интерлейкина-2 или имеющий направленную генетическую модификацию в локусе АроЕ, причем геномный локус рецептора гамма интерлейкина-2 или локус АроЕ содержит: (i) делецию по меньшей мере части локуса рецептора гамма интерлейкина-2 или по меньшей мере части локуса АроЕ; (ii) инсерцию гетерологичной последовательности нуклеиновой кислоты в локус АроЕ или в локус рецептора гамма интерлейкина-2 или (iii) их комбинацию, причем генетически модифицированный геномный локус способен передаваться по зародышевой линии.
[00282] Дополнительно представлены способы, которые позволяют создавать такие генетически модифицированные крысы и такие генетически модифицированные плюрипотентные клетки крысы. Такие способы включают способ модификации геномного локуса АроЕ или локуса рецептора гамма интерлейкина-2 в плюрипотентной клетке крысы посредством направленной генетической модификации. Способ включает: (а) введение в плюрипотентную клетку крысы таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы по локусу АроЕ и 3'-гомологичным плечом крысы по локусу АроЕ, (b) идентификацию генетически модифицированной плюрипотентной клетки крысы, содержащей направленную генетическую модификацию в представляющем интерес геномном локусе АроЕ, причем направленная генетическая модификация способна передаваться по зародышевой линии.
[00283] Дополнительные способы включают: (а) введение в плюрипотентную клетку крысы таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы по локусу рецептора гамма интерлейкина-2 и 3'-гомологичным плечом крысы по локусу рецептора гамма интерлейкина-2, (b) идентификацию генетически модифицированной плюрипотентной клетки крысы, содержащей направленную генетическую модификацию в локусе рецептора гамма интерлейкина-2, причем направленная генетическая модификация способна передаваться по зародышевой линии.
iii. Способы интеграции представляющих интерес множественных полинуклеотидов в таргетируемый локус
[00284] В данном документе представлены различные способы и композиции, обеспечивающие направленную интеграцию представляющих интерес множественных полинуклеотидов с данным целевым локусом. Различные изложенные выше способы могут быть последовательно повторены для обеспечения направленной интеграции любого количества вставок нуклеиновых кислот в данный таргетируемый локус. Таким образом, представлены различные способы для инсерции по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше вставок нуклеиновых кислот в целевой локус. В конкретных вариантах реализации изобретения такие способы последовательной укладки обеспечивают реконструкцию больших геномных участков из клетки млекопитающего (т.е. человека, нечеловеческого организма, грызуна, мыши, обезьяны, крысы, хомяка, одомашненного млекопитающего или сельскохозяйственного животного) в таргетируемый локус. В таких случаях, перенос и реконструкция геномных участков, которые включают как кодирующие так и некодирующие участки, обеспечивает требуемую сохранность сложности данного участка путем сохранения, по меньшей мере частично, кодирующих участков, некодирующих участков и вариаций числа копий, найденных в нативном геномном участке. Таким образом, представлены различные способы, к примеру, способы создания «гетерологичных» или «экзогенных» геномных участков в любой клетке представляющего интерес млекопитающего или животного, в частности в прокариотической клетке-хозяине или в плюрипотентной клетке крысы или ЭС клетке крысы. В одном неограничивающем примере создается «гуманизированный» геномный участок в нечеловеческом животном (т.е. в крысе).
3. Гуманизированный геномный локус
[00285] В данном документе представлены различные способы и композиции, содержащие гуманизированный локус крысы. Используемым в данном документе, термином «гуманизированный» геномный локус обозначают участок нечеловеческого генома, содержащий по меньшей мере одну последовательность нуклеиновой кислоты человека. «Гуманизированный локус крысы» содержит участок ДНК крысы, который обладает вставленной в него последовательностью ДНК человека. Последовательность ДНК человека может быть встречающейся в природе последовательностью ДНК человека или она может быть модифицированной из ее нативной формы. В специальных вариантах реализации изобретения ДНК человека могут обладать по меньшей мере 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 95%, 99%, 97%, 98%, 99%, 97%, 98%, 99% или более идентичности последовательности к нативной последовательности человека. Если последовательность человека не является нативной последовательностью человека, то она по меньшей мере обладает большей идентичностью последовательностей по отношению к нативной последовательности человека, чем она обладает по отношению к ортологичной последовательности крысы. Более того, последовательность ДНК человека может содержать кДНК, участок геномной ДНК человека, некодирующий регуляторный участок или любую часть кодирующего, геномного или регуляторного участка ДНК человека. Последовательность ДНК человека, вставленная в локус крысы, может содержать любую вставку полинуклеотида, как описано в других местах данного документа. В специальных вариантах реализации изобретения последовательность ДНК человека ортологична целевому локусу крысы, тогда как в других случаях последовательность ДНК человека гомологична целевому локусу крысы.
[00286] В одном варианте реализации изобретения направленная генетическая модификация представляет собой инсерцию или замену эндогенной последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека. В одном варианте реализации изобретения направленная генетическая модификация содержит инсерцию или замену эндогенной последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека в эндогенном локусе крысы, который содержит соответствующую последовательность нуклеиновой кислоты крысы.
[00287] Способы создания гуманизированного локуса крысы (или крысы или клетки крысы, содержащей гуманизированный локус крысы) включают введение в целевой локус, содержащий нуклеиновую кислоту крысу, последовательности нуклеиновой кислоты человека. В одном варианте реализации изобретения представлен способ создания гуманизированной крысы. Такой способ включает (а) модификацию генома плюрипотентной клетки крысы таргетирующим вектором, содержащим вставку нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты человека с образованием клетки-донора; (b) введение клетки-донора в эмбрион-хозяин крысы и (с) вынашивание эмбриона-хозяина крысы суррогатной матерью; причем суррогатная мать воспроизводит потомство крыс, которое содержит последовательность нуклеиновой кислоты человека. В специальных вариантах реализации изобретения гуманизированный локус крысы способен передаваться по зародышевой линии. В дополнительном варианте реализации изобретения таргетирующий вектор включает большой таргетирующий вектор (LTVEC) и вставку нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты человека размером по меньшей мере 5 т.н.
[00288] В других способах гуманизированный локус крысы может быть создан модификацией целевого локуса нуклеиновой кислоты крысы посредством бактериальной гомологичной рекомбинации (БГР). Способ включает введение в прокариотическую клетку таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем вставка нуклеиновой кислоты содержит последовательность нуклеиновой кислоты человека, и при этом прокариотическая клетка содержит нуклеиновую кислоту крысы и способна экспрессировать рекомбиназу, которая опосредует в целевом локусе БГР.
[00289] Гуманизированный геномный локус крысы может содержать (а) инсерцию гомологичной или ортологичной последовательности нуклеиновой кислоты человека; (b) замену эндогенной последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека или (с) их комбинацию. В специальных вариантах реализации изобретения гуманизированный геномный локус крысы способен передаваться по зародышевой линии. В других вариантах реализации изобретения ортологичная последовательность человека заменяет соответствующую последовательность, найденную в организме крысы.
[00290] В способах и композициях, описанных в данном документе, может использоваться любая последовательность нуклеиновой кислоты человека. Неограниченные примеры последовательностей нуклеиновых кислот человека, которые могут использоваться в способах и композициях, подробно обсуждаются в других местах данного документа.
[00291] Последовательность нуклеиновой кислоты человека для инсерции в представляющем интерес локусе крысы может быть любого размера. В одном варианте реализации изобретения последовательность нуклеиновой кислоты человека может составлять от около 500 нуклеотидов до около 200 т.н., от около 500 нуклеотидов до около 5 т.н., от около 5 т.н. до около 200 т.н., от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 30 т.н., от около 30 т.н. до около 40 т.н., от около 40 т.н. до около 50 т.н., от около 60 т.н. до около 70 т.н., от около 80 т.н. до около 90 т.н., от около 90 т.н. до около 100 т.н., от около 100 т.н. до около 110 т.н., от около 120 т.н. до около 130 т.н., от около 130 т.н. до около 140 т.н., от около 140 т.н. до около 150 т.н., от около 150 т.н. до около 160 т.н., от около 160 т.н. до около 170 т.н., от около 170 т.н. до около 180 т.н., от около 180 т.н. до около 190 т.н. или от около 190 т.н. до около 200 т.н. В специальном варианте реализации изобретения последовательность нуклеиновой кислоты человека составляет по меньшей мере 5 т.н.
[00292] В одном варианте реализации изобретения представлен геномный локус крысы, в котором гомологичная или ортологичная последовательность нуклеиновой кислоты человека содержит (а) один или более неперестроенных сегментов гена VH тяжелой цепи иммуноглобулина человека, один или более неперестроенных сегментов гена D тяжелой цепи иммуноглобулина человека и один или более неперестроенных сегментов гена JH тяжелой цепи иммуноглобулина человека, которые функционально связаны с последовательностью нуклеиновой кислоты константного участка тяжелой цепи млекопитающего; (b) перестроенную последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связанную с последовательностью нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина млекопитающего; (с) один или более неперестроенных сегментов гена Vκ или Vλ иммуноглобулина человека и один или более неперестроенных сегментов гена Jκ или Jλ иммуноглобулина человека, которые функционально связаны с последовательностью нуклеиновой кислоты легкой цепи константного участка легкой цепи λ или κ иммуноглобулина млекопитающего или (d) перестроенную последовательность нуклеиновой кислоты вариабельного участка легкой цепи λ или κ иммуноглобулина человека функционально связанную с последовательностью нуклеиновой кислоты константного участка легкой цепи λ или κ легкой цепи иммуноглобулина млекопитающего.
[00293] В другом варианте реализации изобретения представлен геномный локус крысы, в котором (а) последовательность нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина млекопитающего представляет собой последовательность нуклеиновой кислоты константного участка крысы, последовательность нуклеиновой кислоты константного участка человека или их комбинацию или (b) последовательность нуклеиновой кислоты константного участка легкой цепи λ или κ легкой цепи иммуноглобулина млекопитающего представляет собой последовательность нуклеиновой кислоты константного участка крысы, последовательность нуклеиновой кислоты константного участка человека или их комбинацию.
[00294] В специальном варианте реализации изобретения представлен геномный локус крысы, в котором последовательность нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина выбрана из или содержит СН1, шарнир, СН2, СН3 и/или их комбинацию.
[00295] В одном варианте реализации изобретения геномный локус крысы содержит один или более функциональных сегментов гена VH человека, содержащих VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-45, VH1-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-30-3, VH3-30-5, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-72, VH3-73, VH3-74, VH4-4, VH4-28, VH4-30-1, VH4-30-2, VH4-30-4, VH4-31, VH4-34, VH4-39, VH4-59, VH4-61, VH5-51, VH6-1, VH7-4-1, VH7-81 или их комбинацию.
[00296] В одном варианте реализации изобретения геномный локус крысы содержит один или более функциональных сегментов гена D человека, содержащих D1-1, D1-7, D1-14, D1-20, D1-26, D2-2, D2-8, D2-15, D2-21, D3-3, D3-9, D3-10, D3-16, D3-22, D4-4, D4-11, D4-17, D4-23, D5-12, D5-5, D5-18, D5-24, D6-6, D6-13, D6-19, D6-25, D7-27 или их комбинацию.
[00297] В одном варианте реализации изобретения геномный локус крысы содержит один или более функциональных сегментов гена JH, содержащих JH1, JH2, JH3, JH4, JH5, JH6 и/или их комбинацию. В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит один или более сегментов гена Vκ человека, содержащих Vκ4-1, Vκ5-2, Vκ7-3, Vκ2', Vκ1-5, Vκ1-6, Vκ3-7, Vκ1-8, Vκ1-9, Vκ2-10, Vκ3-11, Vκ1-12, Vκ1-13, Vκ2-14, Vκ3-15, Vκ1-16, Vκ1-17, Vκ2-18, Vκ2-19, Vκ3-20, Vκ6-21, Vκ1-22, Vκ1-23, Vκ2-24, Vκ3-25, Vκ2-26, Vκ1-27, Vκ2-28, Vκ2-29, Vκ2-30, Vκ3-31, Vκ1-32, Vκ1-33, Vκ3-34, Vκ1-35, Vκ2-36, Vκ1-37, Vκ2-38, Vκ1-39, Vκ2-40 или их комбинацию.
[00298] В одном варианте реализации изобретения геномный локус крысы содержит один или более сегментов гена Vλ, человека, содержащих Vλ3-1, Vλ4-3, Vλ2-8, Vλ3-9, Vλ3-10, Vλ2-11, Vλ3-12, Vλ2-11, Vλ3-16, Vλ2-18, Vλ3-19, Vλ3-21, Vλ3-22, Vλ2-23, Vλ3-25, Vλ3-27 или их комбинацию.
[00299] В одном варианте реализации изобретения геномный локус крысы содержит один или более сегментов гена Jκ человека, содержащих Jκ1, Jκ2, Jκ3, Jκ4, Jκ5 или их комбинацию.
[00300] В еще одном другом варианте реализации изобретения представлен геномный локус крысы, который содержит гуманизированный геномный локус, содержащий последовательность нуклеиновой кислоты рецептора интерлейкина-2 (IL2R) или его вариант или фрагмент. В специальных вариантах реализации изобретения последовательность нуклеиновой кислоты IL2R содержит последовательность нуклеиновой кислоты рецептора альфа интерлейкина-2, рецептора бета интерлейкина-2 или рецептора гамма интерлейкина-2 или их варианты или фрагменты.
[00301] В дополнительных вариантах реализации изобретения геномный локус крысы включает гуманизированный геномный локус, содержащий часть локуса АроЕ человека, локуса рецептора гамма интерлейкина-2 человека, локуса Rag2 человека, локуса Rag1 человека и/или локуса Rag2/Rag1 человека, заменяющий соответствующую гомологичную или ортологичную часть локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 крысы, локуса Rag2 крысы, локуса Rag1 крысы и/или локуса Rag2/Rag1 крысы. В одном варианте реализации изобретения эктодомен IL-2Rg крысы заменяется эктодоменом IL-2Rg человека, с сохранением остальной молекулы, которая походит из организма крысы.
[00302] В другом варианте реализации изобретения представлена генетически модифицированная крыса, содержащая гуманизированный геномный локус. Такие генетически модифицированные крысы содержат (а) инсерцию гомологичной или ортологичной последовательности нуклеиновой кислоты человека; (b) замену последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека в эндогенном геномном локусе или (с) их комбинацию, в которой гуманизированный геномный локус способен передаваться по зародышевой линии.
[00303] В данном изобретении также представлены генетически модифицированные крысы, содержащие любой из различных гуманизированных геномных локусов, представленных в данном документе и описанных выше.
4. Представляющие интерес полинуклеотиды
[00304] В различных вставках нуклеиновых кислот могут содержаться любые представляющие интерес полинуклеотиды и тем самым быть интегрированными в целевой локус. Способы, описанные в данном документе, обеспечивают интеграцию в таргетируемый геномный локус по меньшей мере 1, 2, 3, 4, 5, 6 или более представляющих интерес полинуклеотидов.
[00305] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты при интеграции в целевой геномный локус может вводить в клетку одну или более генетических модификаций. Генетическая модификация может содержать делецию эндогенной последовательности нуклеиновой кислоты и/или добавление экзогенного или гетерологичного или ортологичного полинуклеотида в целевой геномный локус. В одном варианте реализации изобретения генетическая модификация содержит замену эндогенной последовательности нуклеиновой кислоты представляющим интерес экзогенным полинуклеотидом в целевом геномном локусе. Таким образом, способ, представленный в данном документе, обеспечивает создание генетической модификации, включающей нокаут, делецию, инсерцию, замену (метод «knock-in»), точечную мутацию, обмен домена, обмен экзона, обмен интрона, обмен регуляторной последовательности, обмен гена или их комбинацию. Такие модификации могут происходить при интеграции первой, второй, третьей, четвертой, пятой, шестой, седьмой или любых последующих вставок нуклеиновых кислот в целевой геномный локус.
[00306] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус может содержать последовательность, которая является нативной по отношению к клетке, в которую он введен; представляющий интерес полинуклеотид может быть гетерологичным по отношению к клетке, в которую он введен; представляющий интерес полинуклеотид может быть экзогенным по отношению к клетке, в которую он введен; представляющий интерес полинуклеотид может быть ортологичным о отношению к клетке, в которую он введен; или представляющий интерес полинуклеотид может происходить из отличающихся от клетки видов, в которую он введен. Используемый в данном документе термин «нативный» касательно последовательности, вставленной в целевой локус, означает последовательность, которая нативна по отношению к клетке, имеющей целевой локус, или нативна по отношению к клетке, из которой походит целевой локус (т.е. из организма крысы). Используемый в данном документе термин «гетерологичный» касательно последовательности включает последовательность, которая происходит из чужеродного вида или, если из того же вида, значительно отличается или модифицирована по отношению к ее нативной форме по составу и/или геномному локусу путем намеренного вмешательства человека. Используемый в данном документе термин «экзогенный» касательно последовательности означает последовательность, которая происходит из чужеродного вида. Представляющий интерес полинуклеотид может быть получен из любого представляющего интерес организма, включающего, но не ограничивающегося, нечеловеческим организмом, грызуном, хомяком, мышью, крысой, человеком, обезьяной, сельскохозяйственным млекопитающим или несельскохозяйственным млекопитающим. Представляющий интерес полинуклеотид может дополнительно содержать кодирующий участок, некодирующий участок, регуляторный участок или геномную ДНК. Таким образом, 1-ая, 2-ая, 3-я, 4-я, 5-я, 6-я, 7-я и/или любые последовательные вставки нуклеиновых кислот могут содержать такие последовательности.
[00307] В одном варианте реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус является нативным по отношению к последовательности нуклеиновой кислоты мыши, нуклеиновой кислоты человека, нечеловеческой нуклеиновой кислоты, нуклеиновой кислоты грызуна, нуклеиновой кислоты крысы, нуклеиновой кислоты хомяка, нуклеиновой кислоты обезьяны, нуклеиновой кислоты сельскохозяйственного млекопитающего или нуклеиновой кислоты несельскохозяйственного млекопитающего. В дополнительных вариантах реализации изобретения представляющий интерес полинуклеотид, интегрированный в целевой локус, представляет собой фрагмент геномной нуклеиновой кислоты. В одном варианте реализации изобретения геномная нуклеиновая кислота представляет собой геномную нуклеиновую кислоту мыши, геномную нуклеиновую кислоту человека, нечеловеческую нуклеиновую кислоту, нуклеиновую кислоту грызуна, нуклеиновую кислоту крысы, нуклеиновую кислоту хомяка, нуклеиновую кислоту обезьяны, нуклеиновую кислоту сельскохозяйственного млекопитающего или нуклеиновую кислоту несельскохозяйственного млекопитающего или их комбинацию.
[00308] В одном варианте реализации изобретения представляющий интерес полинуклеотид может иметь размер в диапазоне от около 500 нуклеотидов до около 200 т.н., как описано выше. Представляющий интерес полинуклеотид может составлять от около 500 нуклеотидов до около 5 т.н., от около 5 т.н. до около 200 т.н., от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 30 т.н., от около 30 т.н. до около 40 т.н., от около 40 т.н. до около 50 т.н., от около 60 т.н. до около 70 т.н., от около 80 т.н. до около 90 т.н., от около 90 т.н. до около 100 т.н., от около 100 т.н. до около 110 т.н., от около 120 т.н. до около 130 т.н., от около 130 т.н. до около 140 т.н., от около 140 т.н. до около 150 т.н., от около 150 т.н. до около 160 т.н., от около 160 т.н. до около 170 т.н., от около 170 т.н. до около 180 т.н., от около 180 т.н. до около 190 т.н. или от около 190 т.н. до около 200 т.н., от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.
[00309] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или вставленный в целевой геномный локус может кодировать полипептид, может кодировать микроРНК или он может содержать любые представляющие интерес регуляторные участки или некодирующие участки, включающие, к примеру, регуляторную последовательность, промоторную последовательность, энхансерную последовательность, последовательность связывания транскрипционного репрессора или делецию некодирующей белок последовательности, но не содержит делецию кодирующей белок последовательности. В дополнение к этому, представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или вставленный в целевой геномный локус может кодировать белок, экспрессируемый нервной системой, костной системой, пищеварительной системой, кровеносной системой, мышечной системой, респираторной системой, сердечно-сосудистой системой, лимфатической системой, эндокринной системой, мочевыделительной системой, репродуктивной системой или их комбинацией. В одном варианте реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или вставленный в целевой геномный локус кодирует белок, экспрессируемый в костном мозге или клетке, полученной из костного мозга. В одном варианте реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус кодирует белок, экспрессируемый в клетке селезенки. В дополнительных вариантах реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или вставленный в целевой локус кодирует белок, экспрессируемый в В-клетке, кодирует белок, экспрессируемый в незрелой В-клетке или кодирует белок, экспрессируемый в зрелой В-клетке.
[00310] Представляющий интерес полинуклеотид в пределах полинуклеотида-вставки может содержать часть локуса АроЕ, локуса IL-2-Rg, локуса Rag1, локуса Rag2 и/или локуса Rag2/Rag1. Такие части этих данных локусов обсуждаются в других местах данного документа, поскольку являются различными гомологичными и ортологичными участками из любого представляющего интерес организма, который может применяться.
[00311] В одном варианте реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или вставленный в целевой локус содержит геномную последовательность нуклеиновой кислоты, которая кодирует аминокислотную последовательность вариабельного участка тяжелой цепи иммуноглобулина. Фраза «тяжелая цепь» или «тяжелая цепь иммуноглобулина» описана в других местах данного документа.
[00312] В одном варианте реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус содержит геномную последовательность нуклеиновой кислоты, которая кодирует аминокислотную последовательность вариабельного участка тяжелой цепи иммуноглобулина человека.
[00313] В одном варианте реализации изобретения геномная последовательность нуклеиновой кислоты содержит один или более неперестроенных сегментов гена VH тяжелой цепи иммуноглобулина человека, один или более неперестроенных сегментов гена D тяжелой цепи иммуноглобулина человека и один или более неперестроенных сегментов гена JH тяжелой цепи иммуноглобулина человека, которые функционально связаны с последовательностью нуклеиновой кислоты константного участка тяжелой цепи млекопитающего. В одном варианте реализации изобретения геномная последовательность нуклеиновой кислоты содержит перестроенную последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи иммуноглобулина человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка тяжелой цепи млекопитающего. В одном варианте реализации изобретения геномная последовательность нуклеиновой кислоты содержит один или более неперестроенных сегментов гена Vκ или Vλ иммуноглобулина человека, один или более неперестроенных сегментов гена D иммуноглобулина человека и один или более неперестроенных сегментов гена Jκ или Jλ иммуноглобулина человека, которые функционально связаны с последовательностью нуклеиновой кислоты константного участка легкой цепи λ или κ легкой цепи иммуноглобулина млекопитающего. В одном варианте реализации изобретения геномная последовательность нуклеиновой кислоты содержит перестроенную последовательность нуклеиновой кислоты вариабельного участка легкой цепи λ или κ иммуноглобулина человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка легкой цепи λ или κ легкой цепи иммуноглобулина млекопитающего. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка тяжелой цепи содержит последовательность нуклеиновой кислоты константного участка крысы, последовательность нуклеиновой кислоты константного участка человека или их комбинацию. В одном варианте реализации изобретения нуклеиновая кислота константного участка легкой цепи λ или κ иммуноглобулина содержит последовательность нуклеиновой кислоты константного участка крысы, последовательность нуклеиновой кислоты константного участка человека или их комбинацию.
[00314] В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина выбрана из или содержит СН1, шарнир, СН2, СН3 и/или их комбинацию. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка тяжелой цепи содержит СН1-шарнир-СН2-СН3.
[00315] В одном варианте реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус содержит геномную последовательность нуклеиновой кислоты, которая кодирует аминокислотную последовательность вариабельного участка легкой цепи иммуноглобулина. Фраза «легкая цепь» включает последовательность легкой цепи иммуноглобулина из любого организма, она описана в других местах данного документа.
[00316] В одном варианте реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой геномный локус содержит геномную последовательность нуклеиновой кислоты, которая кодирует аминокислотную последовательность вариабельного участка легкой цепи иммуноглобулина человека.
[00317] В одном варианте реализации изобретения геномная последовательность нуклеиновой кислоты содержит один или более неперестроенных сегментов гена Vκ или Vλ иммуноглобулина человека, один или более неперестроенных сегментов гена D иммуноглобулина человека и один или более неперестроенных сегментов гена Jκ или Jλ иммуноглобулина человека, которые функционально связаны с последовательностью нуклеиновой кислоты константного участка легкой цепи λ или κ легкой цепи иммуноглобулина грызуна. В одном варианте реализации изобретения геномная последовательность нуклеиновой кислоты содержит перестроенную последовательность нуклеиновой кислоты вариабельного участка легкой цепи λ или κ иммуноглобулина человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка легкой цепи λ или κ легкой цепи иммуноглобулина грызуна. В одном варианте реализации изобретения последовательность нуклеиновой кислоты константного участка легкой цепи содержит последовательность нуклеиновой кислоты константного участка крысы, последовательность нуклеиновой кислоты константного участка человека или их комбинацию. В одном варианте реализации изобретения нуклеиновая кислота константного участка легкой цепи λ или κ иммуноглобулина содержит последовательность нуклеиновой кислоты константного участка крысы, последовательность нуклеиновой кислоты константного участка человека или их комбинацию.
[00318] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус может кодировать внеклеточный белок или лиганд рецептора. В специальных вариантах реализации изобретения кодируемый лиганд представляет собой цитокин. Представляющие интерес цитокины включают хемокин выбранный из или включающий CCL, CXCL, CX3CL и/или XCL. Цитокин может также включать фактор некроза опухолей (TNF). В других вариантах реализации изобретения цитокин представляет собой интерлейкин (IL). В одном варианте реализации изобретения интерлейкин выбран из или включает IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, IL-34, IL-35 и/или IL-36. В одном варианте реализации изобретения интерлейкин представляет собой IL-2. В специальных вариантах реализации изобретения такой представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой геномный локус получен из организма человека, в других специальных вариантах реализации изобретения он может содержать геномную последовательность человека.
[00319] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой геномный локус может кодировать аполипропротеин Е (АроЕ).
[00320] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус может кодировать цитоплазматический белок или мембранный белок. В одном варианте реализации изобретения мембраный белок представляет собой рецептор, такой как рецептор цитокинов, рецептор интерлейкинов, рецептор-альфа интерлейкина-2, рецептор бета интерлейкина-2, рецептор гамма интерлейкина-2 или рецептор тирозинкиназы. В других случаях представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус может содержать ортологичный или гомологичный участок целевого локуса.
[00321] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус может содержать полинуклеотид, кодирующий по меньшей мере участок рецептора Т-клеток, включая рецептор альфа Т-клеток. В специальных способах каждая из вставок нуклеиновых кислот содержит геномный участок локуса рецептора Т-клеток (т.е. локус рецептора альфа Т-клеток) таким образом, что при завершении серийной интеграции, часть или целый геномный локус рецептор Т-клеток оказывается интегрированным в целевой локус. Такие вставки нуклеиновых кислот могут содержать по меньшей мере один или более вариабельных сегментов или соединяющих сегментов локуса рецептора Т-клеток (т.е. локуса рецептора альфа Т-клеток). В дополнительных вариантах реализации изобретения представляющий интерес полинуклеотид, кодирующий участок рецептора Т-клеток может походить из, к примеру, кодирующего мутантный белок полинуклеотида млекопитающего, нечеловеческого млекопитающего, грызуна, мыши, крысы, человека, обезьяны, сельскохозяйственного млекопитающего или домашнего млекопитающего.
[00322] В других вариантах реализации изобретения представляющий интерес полинуклеотид, интегрированный в целевой локус, кодирует ядерный белок. В одном варианте реализации изобретения ядерный белок представляет собой ядерный рецептор. В специальных вариантах реализации изобретения такой представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус походит из организма человека, в других специальных вариантах реализации изобретения он может содержать геномную последовательность человека.
[00323] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой геномный локус может содержать в кодирующей последовательности генетическую модификацию. Такие генетические модификации включают, но не ограничиваются, мутацией-делецией кодирующей последовательности или слиянием двух кодирующих последовательностей.
[00324] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус может содержать полинуклеотид, кодирующий мутантный белок, включая, к примеру, мутантный белок человека. В одном варианте реализации изобретения мутантный белок характеризуется измененным свойством связывания, измененной локализацией, измененной экспрессией и/или измененным профилем экспрессии. В одном варианте реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус содержит по меньшей мере одну вызывающую заболевание аллель, включающую, к примеру, аллель неврологического заболевания, аллель сердечно-сосудистого заболевания, аллель заболевания почек, аллель заболевания мышц, аллель заболевания крови, аллель гена, вызывающего рак, или аллель заболевания иммунной системы. В таких случаях вызывающая заболевание аллель может быть доминантной аллелью или вызывающая заболевание аллель представляет собой рецессивную аллель. Более того, вызывающая заболевание аллель содержит аллель с однонуклеотидным полиморфизмом (ОНП). Представляющий интерес полинуклеотид, кодирующий мутантный белок, может походить из любого организма, включая, но не ограничиваясь, кодирующим мутантный белок полинуклеотидом млекопитающего, нечеловеческого млекопитающего, грызуна, мыши, крысы, человека, обезьяны, сельскохозяйственного млекопитающего или домашнего млекопитающего.
[00325] В одном варианте реализации изобретения генетическая модификация приводит к продукции мутантной формы белка с измененным свойством связывания, измененной локализацией, измененной экспрессией и/или измененным профилем экспрессии.
[00326] В одном варианте реализации изобретения генетическая модификация создает делецию, добавление, замену или их комбинацию в участке локуса АроЕ крысы, причем генетическая модификация в локусе АроЕ приводит к уменьшению активности АроЕ. В одном варианте реализации изобретения создается нокаут АроЕ.
[00327] В одном варианте реализации изобретения генетическая модификация создает делецию, добавление, замену или их комбинацию в участке локуса Rag1 крысы, причем генетическая модификация в локусе Rag1 приводит к уменьшению активности Rag1. В одном варианте реализации изобретения создается нокаут Rag1. В одном варианте реализации изобретения генетическая модификация создает делецию, добавление, замену или их комбинацию в участке локуса Rag2 крысы, причем генетическая модификация в локусе Rag2 приводит к уменьшению активности Rag2. В одном варианте реализации изобретения создается нокаут Rag2. В одном варианте реализации изобретения генетическая модификация создает делецию, добавление, замену или их комбинацию в участке локуса Rag1/Rag2 крысы, причем генетическая модификация в локусе Rag1/Rag2 приводит к уменьшению активности Rag1 и уменьшению активности Rag2. В одном варианте реализации изобретения создается нокаут Rag1/Rag2.
[00328] В одном варианте реализации изобретения генетическая модификация создает делецию, добавление, замену или их комбинацию в участке локуса рецептора гамма интерлейкина-2 крысы, причем генетическая модификация в локусе рецептора гамма интерлейкина-2 приводит к уменьшению активности рецептора гамма интерлейкина-2. В одном варианте реализации изобретения создается нокаут рецептора гамма интерлейкина-2.
[00329] Как обсуждается в других местах данного документа, дополнительные варианты реализации изобретения, представленные в данном документе, включают один или более из локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2 крысы, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1, модифицированных посредством замены части локуса АроЕ крысы, локуса рецептора гамма интерлейкина-2, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1 на соответствующую ортологичную часть локуса АроЕ, локуса рецептора гамма интерлейкина-2, локуса Rag2, локуса Rag1 и/или локуса Rag2/Rag1 из другого организма.
[00330] В одном варианте реализации изобретения создаются множественные генетические модификации. В одном варианте реализации изобретения генетическая модификация создает делецию, добавление, замену или их комбинацию в участке локуса рецептора гамма интерлейкина-2 крысы, причем генетическая модификация в локусе рецептора гамма интерлейкина-2 приводит к уменьшению активности рецептора гамма интерлейкина-2, а вторая генетическая модификация создает делецию, добавление, замену или их комбинацию в участке локуса Rag2 крысы, причем генетическая модификация в локусе Rag2 приводит к уменьшению активности Rag2. В одном варианте реализации изобретения создается нокаут рецептора гамма интерлейкина-2/Rag2. Такая крыса имеет фенотип SCID.
[00331] В одном варианте реализации изобретения нуклеиновая кислота млекопитающего содержит геномный локус, который кодирует белок, экспрессируемый нервной системой, костной системой, пищеварительной системой, кровеносной системой, мышечной системой, респираторной системой, сердечно-сосудистой системой, лимфатической системой, эндокринной системой, мочевыделительной системой, репродуктивной системой или их комбинацией. В одном варианте реализации изобретения нуклеиновая кислота млекопитающего содержит геномный локус, который кодирует белок, экспрессируемый в костном мозге или клетке, полученной из костного мозга. В одном варианте реализации изобретения нуклеиновая кислота содержит геномный локус, который кодирует белок, экспрессируемый в клетке селезенки. В одном варианте реализации изобретения геномный локус содержит геномную последовательность ДНК мыши, геномную последовательность ДНК крысы, геномную последовательность ДНК человека или их комбинацию. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК крысы и человека. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК мыши и человека. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК мыши и крысы. В одном варианте реализации изобретения геномный локус содержит, в любом порядке, геномные последовательности ДНК крысы, мыши и человека.
[00332] В одном варианте реализации изобретения вставка нуклеиновой кислоты содержит генетическую модификацию в кодирующей последовательности гена. В одном варианте реализации изобретения генетическая модификация включает мутацию-делецию в кодирующей последовательности. В одном варианте реализации изобретения генетическая модификация включает слияние двух эндогенных кодирующих последовательностей.
[00333] В одном варианте реализации изобретения генетическая модификация включает делецию некодирующей белок последовательности, но не включает делецию кодирующей белок последовательности. В одном варианте реализации изобретения делеция некодирующей белок последовательности включает делецию регуляторного элемента. В одном варианте реализации изобретения генетическая модификация включает добавление промотора. В одном варианте реализации изобретения генетическая модификация включает замену промотора или регуляторного элемента. В одном варианте реализации изобретения регуляторный элемент представляет собой энхансер. В одном варианте реализации изобретения регуляторный элемент представляет собой элемент связывания транскрипционного репрессора.
[00334] В одном варианте реализации изобретения генетическая модификация включает замену последовательности нуклеиновой кислоты человека, кодирующей мутантный белок человека. В одном варианте реализации изобретения генетическая модификация включает по меньшей мере одну вызывающую заболевание человека аллель гена человека. В одном варианте реализации изобретения заболевание человека представляет собой неврологическое заболевание. В одном варианте реализации изобретения заболевание человека представляет собой сердечно-сосудистое заболевание. В одном варианте реализации изобретения заболевание человека представляет собой заболевание почек. В одном варианте реализации изобретения заболевание человека представляет собой заболевание мышц. В одном варианте реализации изобретения заболевание человека представляет собой заболевание крови. В одном варианте реализации изобретения заболевание человека представляет собой раковое заболевание. В одном варианте реализации изобретения заболевание человека представляет собой заболевание иммунной системы. В одном варианте реализации изобретения вызывающая заболевание человека аллель представляет собой доминантную аллель. В одном варианте реализации изобретения вызывающая заболевание человека аллель представляет собой рецессивную аллель. В одном варианте реализации изобретения вызывающая заболевание человека аллель содержит аллель с однонуклеотидным полиморфизмом (ОНП).
[00335] Представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой локус может также содержать регуляторную последовательность, включающую, к примеру, промоторную последовательность, энхансерную последовательность или последовательность связывания транскрипционного репрессора. В специальных вариантах реализации изобретения представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты и/или интегрированный в целевой геномный локус содержит полинуклеотид, имеющий делецию некодирующей белок последовательности, но не включает делецию кодирующей белок последовательности. В одном варианте реализации изобретения делеция некодирующей белок последовательности включает делецию регуляторной последовательности. В другом варианте реализации изобретения делеция регуляторного элемента включает делецию промоторной последовательности. В одном варианте реализации изобретения делеция регуляторного элемента включает делецию энхансерной последовательности. Такой представляющий интерес полинуклеотид может походить из любого организма, включая, но не ограничиваясь, кодирующим мутантный белок полинуклеотидом млекопитающего, нечеловеческого млекопитающего, грызуна, мыши, крысы, человека, обезьяны, сельскохозяйственного млекопитающего или домашнего млекопитающего.
5. Способы введения последовательностей и создания трансгенных животных
[00336] Как отмечено выше, в данном документе представлены различные способы и композиции, обеспечивающие направленную интеграцию одного или более представляющих интерес полинуклеотидов в целевой локус. В таких системах применяют множество компонентов и, для удобства пользования в данном документе, термин «система направленной интеграции» в общем включает все компоненты, требуемые для интеграционного события (т.е. в неограничивающих примерах, это различные нуклеазные агенты, сайты распознавания, вставки ДНК-полинуклеотидов, таргетирующие векторы, целевой геномный локус и/или представляющие интерес полинуклеотиды).
[00337] Представленные в данном документе способы включают введение в клетку одного или более полинуклеотидов или полинуклеотидных конструкций, содержащих различные компоненты системы направленной геномной интеграции. «Введение» означает, презентацию клетке последовательности (полипептида или полинуклеотида) таким образом, что последовательность получает доступ ко внутреннему пространству клетки. Способы, представленные в данном документе, не зависят от конкретного способа введения любого компонента системы направленной геномной интеграции в клетку, заключающемся только в том, что полинуклеотид получает доступ во внутреннее пространство по меншей мере одной клетки. Способы введения полинуклеотидов в различные типы клеток известны в данной области техники и включают, но не ограничены, способами стабильной трансфекции, способами транзиентной трансфекции вирус-опосредованными способами.
[00338] В некоторых вариантах реализации изобретения клетки, используемые в способах и композициях, используют ДНК-конструкцию, стабильно встраиваемую в их геном. «Стабильно встраиваемый» или «стабильно вводимый» означает введение полинуклеотида в клетку таким образом, что последовательность нуклеотида интегрируется в геном клетки и способна наследоваться их потомством. Для стабильного встраивания ДНК-конструкций может использоваться любой протокол или различные компоненты системы направленной геномной интеграции.
[00339] Протоколы трансфекции, а также протоколы для введения в клетки полипептидов или последовательностей полинуклеотидов могут отличаться. Неограничивающие способы трансфекции включают основанные на химических методах способы трансфекции, которые включают применение липосом; наночастиц; фосфата кальция (Graham et al. (1973). Virology 52 (2): 456-67, Bacchetti et al. (1977) Proc Natl Acad Sci USA 74 (4): 1590-4 и Kriegler, M (1991). Transfer and Expression: A Laboratory Manual. New York: W.H. Freeman and Company, pp. 96-97); дендримеров или катионных полимеров, таких как ДЭАЭ-декстран или полиэтиленимин. Нехимические методы включают электропорацию, сонопорацию и оптическую трансфекцию. Трансфекция, основанная на использовании частиц, включает применение генной пушки, применение трансфекции с помощью магнитного воздействия (Bertram, J. (2006) Current Pharmaceutical Biotechnology 7, 277-28). Для трансфекции также могут применяться методы с применением вирусов.
[00340] В одном варианте реализации изобретения введение одного или более полинуклеотидов в клетку опосредовано электропорацией, внутриплазматической инъекцией, вирусной инфекцией, аденовирусом, лентивирусом, ретровирусом, трансфекцией, липидопосредованной трансфекцией или опосредовано использованием Nucleofection™.
[00341] В одном варианте реализации изобретения введение одного или более полинуклеотидов в клетку, дополнительно включает: встраивание экспрессионной конструкции, содержащей представляющую интерес последовательность нуклеиновой кислоты, функционально связанную с промотором. В одном варианте реализации изобретения промотор представляет собой конститутивно активный промотор. В одном варианте реализации изобретения промотор представляет собой индуцируемый промотор. В одном варианте реализации изобретения промотор является активным в эмбриональной стволовой клетке крысы.
[00342] В одном варианте реализации изобретения экспрессионная конструкция вводится вместе с LTVEC. В одном варианте реализации изобретения экспрессионная конструкция вводится в течение некоторого времени отдельно от LTVEC.
[00343] В одном варианте реализации изобретения введение одного или более полинуклеотидов в клетку может выполняться в течение некоторого времени множество раз. В одном варианте реализации изобретения введение одного или более полинуклеотидов в клетку выполняется в течение некоторого времени по меньшей мере два раза, в течение некоторого времени по меньшей мере три раза, в течение некоторого времени по меньшей мере четыре раза, в течение некоторого времени по меньшей мере пять раз, в течение некоторого времени по меньшей мере шесть раз, в течение некоторого времени по меньшей мере семь раз, в течение некоторого времени по меньшей мере восемь раз, в течение некоторого времени по меньшей мере девять раз, в течение некоторого времени по меньшей мере десять раз, по меньшей мере одиннадцать раз, в течение некоторого времени по меньшей мере двенадцать раз, в течение некоторого времени по меньшей мере тринадцать раз, в течение некоторого времени по меньшей мере четырнадцать раз, в течение некоторого времени по меньшей мере пятнадцать раз, в течение некоторого времени по меньшей мере шестнадцать раз, в течение некоторого времени по меньшей мере семнадцать раз, в течение некоторого времени по меньшей мере восемнадцать раз, в течение некоторого времени по меньшей мере девятнадцать раз или в течение некоторого времени по меньшей мере двадцать раз.
[00344] В одном варианте реализации изобретения нуклеазный агент вводится в клетку одновременно с таргетирующим вектором или большим таргетирующим вектором (LTVEC). Альтернативно, нуклеазный агент вводится в течение некоторого времени отдельно от таргетирующего вектора или LTVEC. В одном варианте реализации изобретения нуклеазный агент вводится перед введением таргетирующего вектора или LTVEC, тогда как в других вариантах реализации изобретения нуклеазный агент вводится после введения таргетирующего вектора или LTVEC.
[00345] В одном варианте реализации изобретения стадия скрининга включает количественный анализ для оценки модификации аллели (МОА) исходной хромосомы. В одном варианте реализации изобретения количественный анализ выполняется посредством количественной ПЦР. В одном варианте реализации изобретения количественная ПЦР представляет собой ПЦР в режиме реального времени (кПЦР). В одном варианте реализации изобретения ПЦР в режиме реального времени включает применение первого набора праймеров, который распознает целевой локус, и второго набора праймеров, который распознает нецелевой референтный локус. В одном варианте реализации изобретения набор праймеров содержит флуоресцентный зонд, который распознает амплифицированную последовательность. В одном варианте реализации изобретения количественный анализ выполняется посредством флуоресцентно-опосредованной гибридизации in situ (FISH). В одном варианте реализации изобретения количественный анализ выполняется посредством сравнительной геномной гибридизации. В одном варианте реализации изобретения количественный анализ выполняется посредством изотермической амплификации ДНК. В одном варианте реализации изобретения количественный анализ выполняется посредством изотермической амплификации ДНК. В одном варианте реализации изобретения количественный анализ выполняется посредством количественной гибридизации с иммобилизированным(и) зондом(ами). В одном варианте реализации изобретения количественный анализ выполняется с использованием зондов Invader Probes®. В одном варианте реализации изобретения количественный анализ выполняется с использованием методик ММР assays®. В одном варианте реализации изобретения количественный анализ выполняется с использованием молекулярного маяка TaqMan®. В одном варианте реализации изобретения количественный анализ выполняется с использованием зондовой технологии Eclipse™. (См., к примеру, US 2005/0144655, который включен в данный документ в полном объеме посредством ссылки).
[00346] Дополнительно представлен способ создания гуманизированной крысы, включающий: (а) модификацию генома плюрипотентной клетки крысы таргетирующим вектором, содержащим вставку нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты человека с образованием клетки-донора; (b) введение клетки-донора в эмбрион-хозяин крысы и (с) вынашивание эмбриона-хозяина крысы суррогатной матерью; причем суррогатная мать воспроизводит потомство крыс, которое содержит последовательность нуклеиновой кислоты человека. В одном варианте реализации изобретения клетка-донор вводится в эмбрион крысы-хозяина, который находится на стадии бластоцисты или на стадии преморулы (т.е. стадии 4 клеток или стадии 8 клеток). Более того, стадия (а) также может выполняться с большим таргетирующим вектором (LTVEC) и/или последовательностью нуклеиновой кислоты человека в длину по меньшей мере 5 т.н. В дополнительных вариантах реализации изобретения генетическая модификация способна передаваться по зародышевой линии.
[00347] Генетически модифицированные крысы могут создаваться с применением различных способов, описанных в данном документе. Такие способы включают (1) интеграцию одного или более представляющих интерес полинуклеотидов в целевой локус плюрипотентной клетки крысы для создания генетически модифицированной плюрипотентной клетки крысы, содержащей вставку нуклеиновой кислоты в таргетируемый геномный локус, применяя способы, описанные в данном документе; (2) отбор генетически модифицированной плюрипотентной клетки крысы, имеющей в целевом геномном локусе один или более представляющих интерес полинуклеотидов в целевом геномном локусе; (3) введение генетически модифицированной плюрипотентной клетки крысы в эмбрион-хозяин крысы и (4) имплантирование эмбриона-хозяина крысы, содержащего генетически модифицированную плюрипотентную клетку крысы, суррогатной матери. От генетически модифицированной плюрипотентной клетки крысы создается потомство. В одном варианте реализации изобретения клетка-донор вводится в эмбрион крысы-хозяина на стадии бластоцисты или на стадии преморулы (т.е. стадии 4 клеток или стадии 8 клеток). Создается потомство, которое способно передавать генетическую модификацию по зародышевой линии. Плюрипотентная клетка крысы может быть ЭС клеткой крысы, как обсуждается в других местах данного документа.
[00348] Для создания генетически модифицированных крыс также применяются методики ядерного переноса. Вкратце, способы ядерного переноса включают стадии: (1) удаления ядра ооцита; (2) выделение клетки-донора или ядра для соединения с ооцитом с удаленным ядром; (3) вставку клетки или ядра в ооцит с удаленным ядром для образования восстановленной клетки; (4) имплантирование восстановленной клетки в матку животного для образования эмбриона и (5) обеспечение развития эмбриона. В таких способах ооциты в большинстве случаев извлекают из умерщвленных животных, хотя они могут также выделяться из фаллопиевых труб и/или яичников живых животных. Ооциты перед удалением ядра могут созревать в различных средах, известных средним специалистам в данной области техники. Удаление ядра из ооцита может выполняться более способами, хорошо известными средним специалистам в данной области техники. Вставка клетки-донора или ядра в ооцит с удаленным ооцитом перед слиянием для образования восстановленной клетки обычно проводят микроинъекцией клетки-донора под блестящую оболочку яйцеклетки. Слияние может индуцироваться применением импульса постоянного электрического тока через поверхность контакта/слияния (электрослияние), воздействием на клетки способствующих слиянию химических реагентов, таких как полиэтиленгликоль или путем применения инактивированного вируса, такого как вирус Сендай. Восстановленная клетка, как правило, активируется электрическими и/или неэлектричискими средствами перед, во время и/или после слияния ядра-донора и ооцита-реципиента. Способы активизации включают электрические импульсы, химически индуцированный шок, проникновение со спермой, увеличение уровней двухвалентных катионов в ооците и снижение фосфорилирования клеточных белков (путем применения киназных ингибиторов) в ооците. Активированные восстановленные клетки или эмбрионы, как правило, культивируют в среде, известной средним специалистам в данной области техники, и потом переносят в матку животного. См., к примеру, заявки US 20080092249, WO/1999/005266 A2, US 20040177390, WO/2008/017234 A1 и патент США №7612250, каждая из которых включена в данный документ посредством ссылки.
[00349] В одном аспекте изобретения представлен способ создания генетически модифицированной крысы, включающий модификацию представляющего интерес геномного локуса в плюрипотентной клетке крысы, использование опосредованного эндонуклеазами таргетинга гена для введения модификации в представляющий интерес геномный локус крысы для образования модифицированной плюрипотентной клетки крысы, поддержание модифицированной плюрипотентной клетки крысы в условиях достаточных для сохранения плюрипотентности, использование модифицированной плюрипотентной клетки крысы в качестве клетки-донора для эмбриона-хозяина крысы и вынашивание эмбриона-хозяина, содержащего модифицированную плюрипотентную клетку крысы, суррогатной матерью, причем эмбрион-хозяин вынашивается суррогатной матерью и рождается генетически модифицированное потомство крыс.
[00350] В одном варианте реализации изобретения целевая последовательность расположена в интроне. В одном варианте реализации изобретения целевая последовательность расположена в экзоне. В одном варианте реализации изобретения целевая последовательность расположена в промоторе. В одном варианте реализации изобретения целевая последовательность расположена в промоторном регуляторном участке. В одном варианте реализации изобретения целевая последовательность расположена в энхансерном участке.
[00351] В одном варианте реализации изобретения стадия введения выполняется множество раз в течение некоторого времени с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности. В одном варианте реализации изобретения стадия выполняется в течение некоторого времени по меньшей мере два раза с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере три раза с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере четыре раза с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере пять раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере шесть раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере семь раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере восемь раз с использованием различных эндонуклеаз, которые распознают различные целевые последовательности, в течение некоторого времени по меньшей мере девять раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере десять раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере одиннадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере двенадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере тринадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере четырнадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере пятнадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере шестнадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере семнадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере восемнадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности, в течение некоторого времени по меньшей мере девятнадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности или в течение некоторого времени по меньшей мере двадцать раз с использованием различных эндонуклеаз, которые распознают отличающиеся целевые последовательности.
[00352] В одном варианте реализации изобретения стадия введения опосредована электропорацией, внутриплазматической инъекцией, аденовирусом, лентивирусом, ретровирусом, трансфекцией, липидопосредованной трансфекцией или опосредована использованием Nucleofection™.
[00353] В одном варианте реализации изобретения способ дополнительно включает введение экзогенной нуклеиновой кислоты в генетически модифицированную плюрипотентную клетку крысы. В одном варианте реализации изобретения экзогенная нуклеиновая кислота представляет собой трансген. В одном варианте реализации изобретения экзогенная нуклеиновая кислота вводится в эндогенный локус. В одном варианте реализации изобретения экзогенная нуклеиновая кислота вводится эктопически (например, в локус, отличающийся от своего эндогенного локуса).
[00354] В одном аспекте изобретения представлен способ создания генетически модифицированной крысы, включающий модификацию представляющего интерес геномного локуса в плюрипотентной клетке крысы, использование опосредованной РНК геномной инженерии для введения модификации в представляющий интерес геномный локус крысы для образования модифицированной плюрипотентной клетки крысы, поддержание модифицированной плюрипотентной клетки крысы в условиях достаточных для сохранения плюрипотентности, использование модифицированной плюрипотентной клетки крысы в качестве клетки-донора для эмбриона-хозяина крысы и вынашивание эмбриона-хозяина, содержащего модифицированную плюрипотентную клетку крысы, суррогатной матерью, причем эмбрион-хозяин вынашивается суррогатной матерью и рождается генетически модифицированное потомство крыс.
[00355] В одном варианте реализации изобретения способ обладает степенью таргетинга в диапазоне от около 2% до около 80%.
[00356] В одном варианте реализации изобретения способ включает совместное введение некоторого количества второй экспрессионной конструкции, содержащей различные геномные целевые последовательности для множественного редактирования отличающихся геномных локусов. В одном варианте реализации изобретения способ включает введение некоторого количества второй экспрессионной конструкции, содержащей различные геномные целевые последовательности для множественного редактирования отличающихся геномных локусов в течение некоторого времени.
[00357] В одном варианте реализации изобретения стадия введения выполняется множество раз в течение некоторого времени. В одном варианте реализации изобретения стадия введения (b) выполняется в течение некоторого времени по меньшей мере два раза, в течение некоторого времени по меньшей мере три раза, в течение некоторого времени по меньшей мере четыре раза, в течение некоторого времени по меньшей мере пять раз, в течение некоторого времени по меньшей мере шесть раз, в течение некоторого времени по меньшей мере семь раз, в течение некоторого времени по меньшей мере восемь раз, в течение некоторого времени по меньшей мере девять раз, в течение некоторого времени по меньшей мере десять раз, в течение некоторого времени по меньшей мере одиннадцать раз, в течение некоторого времени по меньшей мере двенадцать раз, в течение некоторого времени по меньшей мере тринадцать раз, в течение некоторого времени по меньшей мере четырнадцать раз, в течение некоторого времени по меньшей мере пятнадцать раз, в течение некоторого времени по меньшей мере шестнадцать раз, в течение некоторого времени по меньшей мере семнадцать раз, в течение некоторого времени по меньшей мере восемнадцать раз, в течение некоторого времени по меньшей мере девятнадцать раз, в течение некоторого времени по меньшей мере двадцать раз.
[00358] В одном варианте реализации изобретения первая экспрессионная конструкция и вторая экспрессионная конструкция экспрессируются на той же плазмиде.
[00359] В одном варианте реализации изобретения стадия введения опосредована электропорацией, внутриплазматической инъекцией, аденовирусом, лентивирусом, ретровирусом, трансфекцией, липидопосредованной трансфекцией или опосредована использованием Nucleofection™.
[00360] В одном варианте реализации изобретения способ дополнительно включает введение экзогенной нуклеиновой кислоты в плюрипотентную клетку крысы, содержащую мутантную аллель.
[00361] В одном варианте реализации изобретения экзогенная нуклеиновая кислота представляет собой трансген. В одном варианте реализации изобретения экзогенная нуклеиновая кислота вводится в эндогенный локус. В одном варианте реализации изобретения экзогенная нуклеиновая кислота располагается эктопически (например, в локусе, отличающемся от своего эндогенного локуса).
[00362] В одном варианте реализации изобретения способ дополнительно включает введение экзогенной нуклеиновой кислоты в генетически модифицированную плюрипотентную клетку крысы. В одном варианте реализации изобретения экзогенная нуклеиновая кислота представляет собой трансген. В одном варианте реализации изобретения экзогенная нуклеиновая кислота вводится в эндогенный локус. В одном варианте реализации изобретения экзогенная нуклеиновая кислота вводится эктопически (например, в локус, отличающийся от своего эндогенного локуса).
[00363] В одном аспекте изобретения предложен способ создания гуманизированной крысы, включающий модификацию генома плюрипотентной клетки крысы LTVEC, содержащего вставку, которая содержит последовательность человека размером по меньшей мере 5 т.н., и использующий в качестве клетки-донора плюрипотентную клетку крысы; введение клетки-донора в эмбрион-хозяин и вынашивание эмбриона-хозяина суррогатной матерью; причем суррогатная мать рождает потомство крыс, которое включает гуманизацию.
[00364] В данном изобретении представлены другие способы создания генетически модифицированной крысы, содержащей одну или более генетических модификаций в ее зародышевой линии, как описано в данном документе, включающие: (а) модификацию таргетируемого локуса крысы, содержащегося в прокариотической клетке, использующую различные способы, описанные в данном документе; (b) отбор модифицированной прокариотической клетки, содержащей генетическую модификацию в таргетируемом локусе крысы; (с) выделение генетически модифицированного таргетирующего вектора из генома модифицированной прокариотической клетки; (d) введение генетически модифицированного таргетирующего вектора в плюрипотентную клетку крысы для создания генетически модифицированной плюрипотентной клетки, содержащей вставку нуклеиновой кислоты в таргетируемый геномный локус; (е) отбор генетически модифицированной плюрипотентной клетки крысы; (f) введение генетически модифицированной плюрипотентной клетки крысы в эмбрион-хозяин крысы на стадии преморулы и (g) имплантирование эмбриона-хозяина крысы, содержащего генетически модифицированную плюрипотентную клетку крысы, суррогатной матери для получения поколения F0, полученного из генетически модифицированной плюрипотентной клетки крысы. В таких способах таргетирующий вектор может содержать большой таргетирующий вектор. Плюрипотентная клетка крысы может быть ЭС клеткой крысы. В дополнительных способах стадия выделения (с) дополнительно содержит (c1) линеаризацию генетически модифицированного таргетирующего вектора (т.е. генетически модифицированного LTVEC). В дополнительных вариантах реализации изобретения стадия введения (d) дополнительно содержит (d1) введение нуклеазного агента в плюрипотентную клетку крысы, как описано в данном документе. В одном варианте реализации изобретения стадии отбора (b) и/или (е) проводятся с применением селектирующего агента в отношении прокариотической или плюрипотентной клетки крысы, как описано в данном документе. В одном варианте реализации изобретения стадии отбора (b) и/или (е) проводятся посредством анализа модификации аллели (МОА), как описано в данном документе.
[00365] В данном изобретении представлены дополнительные способы модификации целевого геномного локуса клетки млекопитающего посредством бактериальной гомологичной рекомбинации (БГР) в прокариотической клетке, которые включают: (а) использование прокариотической клетки, содержащей целевой локус, включающий нуклеиновую кислоту крысы, (b) введение в прокариотическую клетку таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем вставка нуклеиновой кислоты содержит участок млекопитающего (включая, к примеру, ДНК-вставку человека) и (с) отбор таргетируемой прокариотической клетки, содержащей вставку нуклеиновой кислоты в целевой локус крысы, причем прокариотическая клетка способна экспрессировать рекомбиназу, которая опосредует БГР. Стадия (a1) может включать использование прокариотической клетки, содержащей целевой локус, включающий нуклеиновую кислоту крысы, содержащую первый полинуклеотид, включающий первый сайт распознавания первого нуклеазного агента, а стадия (b1) может дополнительно включать экспрессию в прокариотической клетке нуклеазного агента, который создает одноцепочечный или двухцепочечный разрыв в или возле первого сайта распознавания. Стадии (а)-(с) могут серийно повторяться, как описано в данном документе, для обеспечения введения множественных вставок нуклеиновых кислот в таргетируемый локус крысы в прокариотической клетке. Как только таргетируемый локус нуклеиновой кислоты крысы оказывается «встроен» в прокариотическую клетку, из прокариотической клетки может быть выделен таргетирующий вектор, содержащий модифицированный целевой локус крысы, и введен в целевой геномный локус в плюрипотентной клетке крысы. Плюрипотентные клетки крысы (т.е. ЭС клетки крысы), содержащие модифицированный геномный локус, могут потом быть превращены в генетически модифицированные крысы.
[00366] В некоторых вариантах реализации изобретения различные генетические модификации целевых геномных локусов, описанных в данном документе, могут проводиться сериями реакций гомологичной рекомбинации (РГР) в бактериальных клетках с использованием LTVEC, полученным из ДНК искусственной бактериальной хромосомы (ВАС), применяя технологию генетической инженерии VELOCIGENE® (см., например, пат. США №6586251 и статью Valenzuela, D.М. et al. (2003), High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotechnology 21(6): 652-659, которые включены в данный документ посредством ссылки в полном объеме).
[00367] В некоторых вариантах реализации изобретения таргетируемые ЭС клетки крысы, содержащие различные генетические модификации, как описано в данном документе, используются как вставки ЭС клеток и вводятся в эмбрион соответствующего организма на стадии преморулы, например, на стадии образования 8-клеток эмбриона мыши, посредством метода VELOCIMOUSE® (см., например, патенты US 7576259, US 7659442, US 7294754 и заявку US 2008-0078000 A1, все из которых включены в данный документ в полном объеме посредством ссылки). Эмбрион крысы, содержащий генетически модифицированные ЭС клетки крысы, инкубируют до достижения стадии бластоцисты и потом имплантируют в организм суррогатной матери для получения потомства F0. Крысы, несущие генетическую модифицированный геномный локус, могут быть идентифицированы посредством анализа модификации аллели (МОА), как описано в данном документе. Результирующее поколение F0 крысы, полученное от генетически модифицированных ЭС клеток крысы, скрещиваются с крысой дикого типа для получения потомства поколения F1. После генотипирования со специфическими праймерами и/или зондами, крысы F1, которые гетерозиготны по генетически модифицированному геномному локусу, скрещиваются друг с другом для получения крыс, которые гомозиготны по генетически модифицированному геномному локусу. Альтернативно, крыса-самка F0 и крыса-самец F0, каждая имеющая генетическую модификацию, могут скрещиваться для получения крыс F1, гомозиготных по генетической модификации.
[00368] В одном аспекте изобретения представлен генетически модифицированный геном крысы, содержащий направленную модификацию эндогенной последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью некрысиной нуклеиновой кислоты.
[00369] В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты составляет в длину от около 5 т.н. до около 200 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 5 т.н. до около 10 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 10 т.н. до около 20 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 20 т.н. до около 30 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 30 т.н. до около 40 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 40 т.н. до около 50 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 50 т.н. до около 60 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 60 т.н. до около 70 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 70 т.н. до около 80 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 80 т.н. до около 90 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 90 т.н. до около 100 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 100 т.н. до около 110 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 110 т.н. до около 120 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 120 т.н. до около 130 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 140 т.н. до около 150 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 150 т.н. до около 160 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 160 т.н. до около 170 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 170 т.н. до около 180 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 180 т.н. до около 190 т.н. В одном варианте реализации изобретения гомологичная или ортологичная последовательность некрысиной нуклеиновой кислоты находится в диапазоне от около 190 т.н. до около 200 т.н. Различные представляющие интерес полинуклеотиды, которые могут применяться во вставке нуклеиновой кислоты, описаны в других местах данного документа.
6. Клетки
[00370] В данном документе описаны различные способы и композиции применения в клетке системы таргетинга геномного локуса. В одном варианте реализации изобретения клетка представляет собой плюрипотентную клетку. В одном варианте реализации изобретения плюрипотентная клетка представляет собой нечеловеческую плюрипотентную клетку. В одном варианте реализации изобретения нечеловеческая плюрипотентная клетка представляет собой плюрипотентную клетку млекопитающего. В одном варианте реализации изобретения плюрипотентная клетка представляет собой индуцированную плюрипотентную стволовую (иПС) клетку человека.
[00371] В одном варианте реализации изобретения плюрипотентная клетка представляет собой плюрипотентную клетку крысы. В одном варианте реализации изобретения плюрипотентная клетка крысы представляет собой эмбриональную стволовую (ЭС) клетку крысы. В одном варианте реализации изобретения плюрипотентная клетка крысы представляет собой индуцированную плюрипотентную стволовую (иПС) клетку или ограниченную в развитии клетку-предшественника. В других вариантах реализации изобретения плюрипотентная клетка крысы способна сохранять свою плюрипотентность после по меньшей мере одной направленной генетической модификации своего генома и способна передавать направленную модификацию зародышевой линии поколения F1.
[00372] В одном варианте реализации изобретения плюрипотентная клетка представляет собой нечеловеческую оплодотворенную яйцеклетку на стадии одной клетки. В одном варианте реализации изобретения нечеловеческая оплодотворенная яйцеклетка представляет собой оплодотворенную яйцеклетку млекопитающего. В одном варианте реализации изобретения оплодотворенная яйцеклетка млекопитающего представляет собой оплодотворенную яйцеклетку грызуна на стадии одной клетки. В одном варианте реализации изобретения оплодотворенная яйцеклетка млекопитающего представляет собой оплодотворенную яйцеклетку крысы или мыши на стадии одной клетки.
[00373] Различные клетки, применяемые в способе и композициях, описанных в данном документе, также может включать прокариотические клетки, такие как бактериальная клетка, включающая Е. coli. В специальных вариантах реализации изобретения прокариотическая клетка представляет собой рекомбинационно компетентный штамм Е. coli. В одном варианте реализации изобретения прокариотическая клетка содержит нуклеиновую кислоту, которая кодирует рекомбиназу, тогда как в других случаях прокариотическая клетка не содержит нуклеиновую кислоту, которая кодирует рекомбиназу, а нуклеиновая кислота, кодирующая рекомбиназу вводится в прокариотическую клетку. В одном варианте реализации изобретения нуклеиновая кислота, кодирующая рекомбиназу, содержит ДНК или мРНК. В некоторых вариантах реализации изобретения нуклеиновая кислота, кодирующая рекомбиназу, представляет собой pABG. В одном варианте реализации изобретения рекомбиназа экспрессируется под контролем индуцируемого промотора. В одном варианте реализации изобретения экспрессия рекомбиназы контролируется арабинозой.
А. Эмбриональные стволовые (ЭС) клетки крысы
[00374] Как подробно отмечено выше, в различных композициях и способах, представленных в данном документе, могут применяться эмбриональные стволовые (ЭС) клетки крысы. В одном варианте реализации изобретения плюрипотентная клетка крысы представляет собой ЭС клетку крысы. В одном варианте реализации изобретения ЭС клетка крысы, получена из штамма крысы, представляющего штамм Вистар, штамм LEA, штамм Спрэга-Доули, штамм Фишера, F344, F6 и темный агути или ACI. В одном варианте реализации изобретения штамм крысы является смесью двух или больше штаммов, выбранных из группы, состоящей из Вистар, LEA, Спрэга-Доули, Фишера, F344, F6 и темного агути. В одном варианте реализации изобретения ЭС клетка крысы получена из имбредного штамма. В одном варианте реализации изобретения ЭС клетка крысы получена из штамма, выбранного из штамма DA или штамма ACI. В специальном варианте реализации изобретения ЭС клетка крысы получена из штамма ACI. В одном варианте реализации изобретения ЭС клетка крысы получена из бластоцисты крысы.
[00375] В других вариантах реализации изобретения ЭС клетка крысы характеризуется по меньшей мере одним маркером плюрипотентности. В специальных вариантах реализации изобретения ЭС клетка крысы характеризуется экспрессией маркера плюрипотентности, включающего Oct-4, Sox-2, щелочную фосфатазу или их комбинацию. В одном варианте реализации изобретения ЭС клетка крысы представляет собой мужскую ЭС клетку (XY) крысы или женскую ЭС клетку (XX) крысы.
[00376] В одном варианте реализации изобретения после от одной до 15 серийных генетических модификаций генетически модифицированные ЭС клетки крыс при воздействии среды для дифференциации способны дифференцировать на множество типов клеток.
[00377] В одном варианте реализации изобретения после от одной до 15 серийных генетических модификаций генетически модифицированные ЭС клетки крыс способны поддерживаться в культуре в недифференцированном состоянии. В одном варианте реализации изобретения генетически модифицированные и культивированные ЭС клетки крысы в недифференцированном состоянии, при использовании в качестве клеток-доноров в эмбрионе-хозяине крысы, заполняют эмбрион и образуют бластоцисту, содержащую от одной до пятнадцати генетических модификаций. В одном варианте реализации изобретения бластоциста, при имплантировании в организм суррогатной матери в условиях, подходящих для вынашивания, развивается в потомство F0 крыс, которое содержит от одной до 15 генетических модификаций.
[00378] В одном аспекте изобретения представлена выделенная ЭС клетка крысы, которая способна сохранять плюрипотентность после одной или более генетических модификаций in vitro и которая способна передавать генетически модифицированный геном зародышевой линии поколения F1.
[00379] В одном варианте реализации изобретения ЭС клетки крысы поддерживают свою плюрипотентность для развития во множество типов клеток после одной или более серийных генетических модификаций in vitro (например, двух, трех, четырех, пяти или шести или больше серийных генетических модификаций). В одном варианте реализации изобретения генетическая модификация опосредована электропорацией, внутриплазматической инъекцией, вирусной инфекцией, аденовирусом, лентивирусом, ретровирусом, трансфекцией, липидопосредованной трансфекцией или использованием Nucleofection™.
[00380] В одном варианте реализации изобретения ЭС клетки крысы поддерживают свою плюрипотентность для развития во множество типов клеток после одной цикла электропорации с экзогенной нуклеиновой кислотой. В одном варианте реализации изобретения ЭС клетки крысы поддерживают свою плюрипотентность для развития во множество типов клеток после 2-го, 3-го, 4-го, 5-го, 6-го, 7-го, 8-го, 9-го, 10-го, 11-го, 12-го, 13-го, 14-го или 15-го цикла электропорации с экзогенной нуклеиновой кислотой.
[00381] В других вариантах реализации изобретения ЭС клетки крысы применяются, как описано в патентной заявке США №14/185103, поданной 20 февраля 2014 г.и включенной в данный документ в полном объеме посредством ссылки.
[00382] Плюрипотентная клетка крысы, применяемая в различных способах и комбинациях, описанных в данном документе, могут быть охарактеризованы экспрессией по меньшей мере одного маркера плюрипотентности, включающего Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, рецептора LIF, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 и/или их комбинацию. В других случаях плюрипотентная клетка крысы, применяемая в различных способах и комбинациях, описанных в данном документе, характеризуется одной или более из следующих особенностей: (а) отсутствие экспрессии одного или более маркеров плюрипотентности, включающих с-Myc, Ecat1 и/или Rexo1, (b) отсутствие экспрессии одного или более мезодермальных маркеров, включающих ген брахиурии и/или Bmpr2, (с) отсутствие экспрессии одного или более эндодермальных маркеров, включающих Gata6, Sox17 и/или Sox7 или (d) отсутствие экспрессии одного или более нейральных маркеров, включающих Nestin и/или Рах6. Используемое в данном документе понятие «отсутствие экспрессии», поскольку оно относится к экспрессии маркера плюрипотентности, означает что экспрессия маркера плюрипотентности находится на уровне или ниже экспериментального фона, как определено для каждого отдельного эксперимента.
[00383] В одном неограничивающем варианте реализации изобретения ЭС клетки крысы, представленные в данном документе, обладают одним или болееболее из любого из следующих свойств:
[00384] (а) обладают компетенцией по зародышевой линии, означающей, что когда ЭС клетку крысы имплантируют в эмбрион-хозяин крысы, то геном линии ЭС клеток крысы передается потомству;
[00385] (b) обладают компетенцией по зародышевой линии после по меньшей мере одной направленной генетической модификации, означающей, что когда ЭС клетку крысы, имеющую направленную генетическую модификацию, имплантируют в эмбрион-хозяин крысы, то направленная генетическая модификация в пределах генома линии ЭС клеток крысы передается потомству; [00386] (с) обладают плюрипотентностью in vitro;
[00387] (d) обладают тотипотентностью in vitro;
[00388] (е) при культивировании in vitro легко прикрепляются к фидерному слою клеток;
[00389] (f) при культивировании in vitro образуют сферообразные колонии при размещении на фидерном слое клеток in vitro;
[00390] (g) поддерживают плюрипотентность при культивировании in vitro в условиях, включающих фидерный слой клеток, который не модифицирован генетически для экспрессии ингибирующего лейкемию фактора (LIF), причем культуральная среда содержит достаточную концентрацию LIF;
[00391] (h) поддерживают плюрипотентность при культивировании in vitro в условиях, включающих фидерный слой клеток, причем культуральная среда содержит LIF мыши или его активный вариант или фрагмент;
[00392] (i) включает молекулярную сигнатуру, которая характеризуется
[00393] i) экспрессией одного или более специфических для ЭС клеток крысы генов, включающих ассоциирующий белок адгезивных соединений (Ajap1), клаудин 5 (Cldn5), фактор 9 обмена гуаниновых нуклеотидов Cdc42 (Arhgef9), кальций/кальмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН-рецептор А4 (Epha4), белок щелевых соединений бета 5 (Gjb5), белок 1, подобный белку связывания инсулиноподобного фактора (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), лево/правоопределяющий фактор 1 (Lefty1), рецептор альфа ингибирующего лейкемию фактора (Lifr), рецептор 2 лизофосфатидиловой кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpnl8), гомеобокс 2 типа Caudal (Cdx2), белок 1 доменов фибронектина типа III и повтора анкирина (Fank1), бокс Е1 семейства Forkhead (тиреоидный фактор транскрипции 2) (Foxe1), родственный белку hairy/энхансеру разделения с мотивом YRPW белок 2 (Hey2), бокс Е1 семейства Forkhead (тиреоидный фактор транскрипции 2) (Foxe1), родственный белку hairy/энхансеру разделения с мотивом YRPW белок 2 (Hey2), фактор 1 связывания лимфоидного энхансера (Lef1), Sal-подобный белок 3 (Drosophila) (Sall3), SATB-гомеобокс 1 (Satb1), miR-632 или их комбинацию;
[00394] ii) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или больше специфических для ЭС клеток крысы генов, включающих ассоциирующий белок адгезивных соединений (Ajap1), клаудин 5 (Cldn5), фактор 9 обмена гуаниновых нуклеотидов Cdc42 (Arhgef9), кальций/кальмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН-рецептор А4 (Epha4), белок щелевых соединений бета 5 (Gjb5), белок 1, подобный белку связывания инсулиноподобного фактора (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), лево/правоопределяющий фактор 1 (Lefty1), рецептор альфа ингибирующего лейкемию фактора (Lift), рецептор 2 лизофосфатидиловой кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpn18), гомеобокс 2 типа Caudal (Cdx2), белок 1 доменов фибронектина типа III и повтора анкирина (Fank1), бокс Е1 семейства Forkhead (тиреоидный фактор транскрипции 2) (Foxe1), родственный белку hairy/энхансеру разделения с мотивом YRPW белок 2 (Hey2), бокс Е1 семейства Forkhead (тиреоидный фактор транскрипции 2) (Foxe1), родственный белку hairy/энхансеру разделения с мотивом YRPW белок 2 (Hey2), фактор 1 связывания лимфоидного энхансера (Lef1), Sal-подобный белок 3 (Drosophila) (Sall3), SATB-гомеобокс 1 (Satb1), miR-632 или их комбинацию;
[00395] iii) по меньшей мере 20-ти кратным увеличением экспрессии одного или более специфических для ЭС клеток крысы генов, как отражено в табл. 9, по сравнению с ЭС клеткой мыши F1H4;
[00396] iv) по меньшей мере 20-ти кратным увеличением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более специфических для ЭС клеток крысы генов, как отражено в табл. 9, по сравнению с ЭС клеткой мыши F1H4;
[00397] v) экспрессией одного или более специфических для ЭС клеток крысы генов, как отражено в табл. 10;
[00398] vi) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более специфических для ЭС клеток крысы генов, как отражено в табл. 10;
[00399] vii) по меньшей мере 20-ти кратным увеличением экспрессии одного или более специфических для ЭС клеток крысы генов, как изложено в табл. 10, по сравнению с ЭС клеткой мыши F1H4;
[00400] viii) по меньшей мере 20-ти кратным увеличением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более специфических для ЭС клеток крысы генов, как отражено в табл. 10, по сравнению с ЭС клеткой мыши F1H4;
[00401] ix) по меньшей мере 20-ти кратным уменьшением экспрессии одного или более специфических для ЭС клеток крысы генов, как отражено в табл. 8, по сравнению с ЭС клеткой мыши F1H4;
[00402] х) по меньшей мере 20-ти кратным уменьшением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более специфических для ЭС клеток крысы генов, как отражено в табл. 8, по сравнению с ЭС клеткой мыши F1H4;
[00403] xi) любой комбинацией экспрессии специфических для ЭС клеток крысы генов из подпунктов (i)-(x);
[00404] xii) относительным уровнем экспрессии маркеров плюрипотентности, как показано в табл. 11, для по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 из перечисленных маркеров плюрипотентности; См., колонку ранжирования маркеров плюрипотентности из табл. 11 по относительным уровням экспрессии;
[00405] xiii) относительным уровнем экспрессии мезодермальных маркеров, как показано в табл. 11, для по меньшей мере 2, 3 или 4 из перечисленных мезодермальных маркеров; См., колонку ранжирования мезодермальных маркеров в табл. 11 по относительным уровням экспрессии;
[00406] xiv) относительным уровнем экспрессии эндодермальных маркеров, как показано в табл. 11, для по меньшей мере 2, 3, 4, 5 или 6 из перечисленных эндодермальных маркеров; См., колонку ранжирования эндодермальных маркеров в табл. 11 по относительным уровням экспрессии;
[00407] xv) относительным уровнем экспрессии нейральных маркеров, как показано в табл. 11, для по меньшей мере 2 и 3 из перечисленных нейральных маркеров; См., колонку ранжирования нейральных маркеров в табл. 11 по относительным уровням экспрессии;
[00408] xvi) относительным уровнем экспрессии трофэктодермальных маркеров, как показано в табл. 11, из перечисленных трофэктодермальных маркеров. См., колонку ранжирования трофэктодермальных маркеров в табл. 11 по относительным уровням экспрессии;
[00409] xvii) любым относительным уровнем экспрессии одного или более (2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30) маркеров плюрипотентности, мезодермальных маркеров, эндодермальных маркеров, нейральных маркеров и/или трофэктодермальных маркеров, отраженных в табл. 11;
[00410] xviii) относительным уровнем экспрессии каждого из маркеров, отраженных в табл. 11;
[00411] xix) любой комбинацией из сигнатур, отраженных в подпунктах xii-xiix и/или
[00412] хх) любой комбинацией из сигнатур, отраженных в подпунктах i-xiix;
[00413] (j) обладают способностью воспроизводить крысы F0;
[00414] (k) способны субкультивироваться и поддерживаться в недифференцированном состоянии;
[00415] (l) обладают таким же количеством хромосом, что и нормальная клетка крысы;
[00416] (m) поддерживают плюрипотентность in vitro без необходимости обеспечения паракринного сигналинга LIF;
[00417] (n) обладают самообновлением, означающим, что они неограниченно делятся при сохранении плюрипотентности;
[00418] (о) ЭС клетки крысы экспрессируют по меньшей мере один маркер плюрипотентности, включающий Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, рецептор LIF, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 и/или их комбинацию;
[00419] (p) ЭС клетки крысы не экспрессируют один или более маркеров дифференциации, включающих с-Myc, Ecat1 и/или Rexo1;
[00420] (q) ЭС клетки крысы не экспрессируют один или более мезодермальных маркеров, включающих маркер брахиурии, Bmpr2 и/или их комбинацию;
[00421] (r) ЭС клетки крысы не экспрессируют один или более эндодермальных маркеров, включающих Gata6, Sox 17, Sox7 и/или их комбинацию и/или
[00422] (s) ЭС клетки крысы не экспрессируют один или более нейральных маркеров, включающих Nestin, Рах6 и/или их комбинацию.
[00423] Одно или более свойств, отмеченные в пунктах (a)-(s), могут быть представлены в ЭС клетках крысы, популяции ЭС клеток крысы или линии ЭС клеток крысы в способах и композициях, представленных в данном документе, причем ЭС клетки крысы не подвергли направленной генетической модификации. Более того, после одной или более генетических модификаций в целевом локусе крысы, как подробно описано выше, одно или несколько из свойств, отмеченных в пунктах (a)-(s), могут сохраняться ЭС клетками крысы после генетической модификации целевого локуса.
[00424] В одном варианте реализации изобретения ЭС клетка крысы проявляет эффективность гомологичной рекомбинации по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75% или по меньшей мере 80%.
[00425] В одном варианте реализации эффективность гомологичной рекомбинации при использовании ЭС клетки крысы превышает 4%.
[00426] В одном варианте реализации изобретения ЭС клетка крысы имеет время удвоения в диапазоне от 24 часов до 36 часов. В одном варианте реализации изобретения ЭС клетка крысы имеет время удвоения 25 часов.
[00427] В одном варианте реализации изобретения ЭС клетка крысы может пересеваться вплоть до по меньшей мере 15 раз в среде 2i (Millipore, кат. SF016-200). В одном варианте реализации изобретения ЭС клетка крысы может пересеваться по меньшей мере 14 раз в среде 2i (Millipore, кат. № SF016-200). В одном варианте реализации изобретения ЭС клетка крысы может пересеваться по меньшей мере 13 12, 11, 10, 9, 8, 7, 6 или 5 раз в среде 2i.
[00428] В одном варианте реализации изобретения при трансплантации в эмбрион крысы на стадии преморулы ЭС клетка крысы может обеспечить по меньшей мере 90% клеток в поколении F0. В одном варианте реализации изобретения при трансплантации в эмбрион крысы на стадии преморулы ЭС клетка крысы может обеспечить по меньшей мере 95%, 96%, 97%, 98% или 99% клеток в поколении F0.
[00429] В специальных вариантах реализации изобретения различные ЭС клетки крысы и линии клеток, используемые в различных способах и композициях, представленных в данном документе, применяются для создания направленной модификации в целевом локусе. ЭС клетка крысы, имеющая эти направленные генетические модификации, может быть компетентной по зародышевой линии, что означает, что когда ЭС клетку крысы, имеющую направленную генетическую модификацию, имплантируют в эмбрион-хозяин крысы, то направленная генетическая модификация ЭС клетки крысы передается потомству (т.е. популяции F1) Таким образом, в различных аспектах изобретения ЭС клетки крысы применяются в различных способах и композициях для получения высокой частоты или высокой эффективности передачи зародышевой линии клеточного генома крысы от ЭС клеток крысы, которая подверглась направленной генетической модификации. В различных вариантах реализации изобретения частота передачи зародышевой линии составляет более 1:600, более 1:500, более 1:400, более 1:300, более 1:200 и более 1:100. В различных вариантах реализации изобретения частота передачи зародышевой линии составляет более 1%, более 2%, более 3%, более 4%, более 5%, более 6%, более 7%, более 8%, более 9%, более 10%, более 16%, более 25%, более 50%, более 60%, более 65%, более 70%, более 75% или больше. В различных вариантах реализации изобретения частота передачи зародышевой линии находится в диапазоне от 9% до 16%. В различных аспектах изобретения процент потомства, полученного от доноров ЭСКк в поколении F1, составляет 1% или больше, 2% или больше, 3% или больше, 10% или больше, 20% или больше, 30% или больше, 40% или больше, 50% или больше, 60% или больше, от 3% до около 10% или больше; от 3% или больше до около 63%, от около 10% до около 30%, от около 10% до около 50%, от около 30% до около 70%, от около 30% до около 60%, от около 20% до около 40%, от около 20% до 65% или от около 40% до 70%. Таким образом, ЭС клетка крысы, которая имеет направленную генетическую модификацию, обладает способностью передавать свой геном популяции F1.
[00430] ЭС клетка крысы, которая имеет направленную генетическую модификацию, может быть плюрипотентной или тотипотентной. Для определения того является ли ЭС клетка крысы плюрипотентной могут применяться различные методы. К примеру, ЭС клетка может анализироваться на экспрессию различных плюрипотентных маркеров, включающих, но не ограниченных, Oct-4, Sox2, щелочной фосфатазой или их комбинацией. См. по различным методам анализа на наличие или уровень таких маркеров, к примеру, статьи Okamoto, K. et al., Cell, 60: 461-472 (1990), Scholer, H.R. et al., EMBO J. 9: 2185-2195 (1990)) и Nanog (Mitsui, K. et al., Cell, 113: 631-642 (2003), Chambers, I. et al., Cell, 113: 643-655 (2003). См., также фиг. 2 и 3, представленные в данном документе. Другие маркеры плюрипотентности включают, к примеру, наличие по меньшей мере 1, 2, 3, 4 или 5 маркеров плюрипотентности, включающих Nanog, Klf4, Dppa2, Fgf4, Rex1, Eras, Err-бета и/или Sall3. Другие маркеры плюрипотентности включают, к примеру, отсутствие по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 маркеров плюрипотентности, включающих маркер Т/брахиурии, Flk1, Nodal, Bmp4, Bmp2, Gata6, Sox 17, Hhex1, Sox7 и/или Рах6.
[00431] В специальных вариантах реализации изобретения экспрессия и/или уровень экспрессии этих маркеров могут определяться, используя ПЦР-РВ. Для определения уровня и/или наличия щелочной фосфатазы доступны различные наборы, включая, к примеру, набор для окрашивания тканей ALP (Sigma) и векторный набор красных субстратов щелочной фосфатазы I (Funakoshi) и тому подобные. Дополнительные анализы включают гибридизацию in situ, иммуногистохимические, иммунофлуоресцентные методы. В специальных вариантах реализации изобретения ЭС клетка крысы характеризуется экспрессией по меньшей мере одного маркера плюрипотентности, включающего, например, Oct-4, Sox-2, щелочную фосфатазу или их комбинацию, а предпочтительно все три этих маркера.
[00432] Различные ЭС клетки крыс, применяемые в способах и композициях, представленных в данном документе, способны поддерживать плюрипотентность и/или тотипотентность во время поддержания их в условиях культивирования in vitro. Таким образом, различные ЭС клетки крысы, представленные в данном документе, могут, в некоторых вариантах реализации изобретения, субкультивироваться все же сохраняясь в недифференцированном состоянии. Различные способы культивирования ЭС клеток крысы подробнее обсуждаются в других местах данного документа и в патентной заявке США №14/185103, поданной 20 февраля 2014 г., включенной в данный документ в полном объеме посредством ссыпки.
[00433] В некоторых вариантах реализации изобретения эмбриональная стволовая клетка крысы, используемая в данном документе, выделена из эмбриона крысы с применением различных методик выделения, очистки и размножения культур, которые подробно описаны в заявке США в патентной заявке США №14/185103, поданной 20 февраля 2014 г., включенной в данный документ в полном объеме посредством ссылки.
[00434] «Выделенная» ЭС клетка крысы или эмбрион крысы является удаленной из своего естественного окружения. Термин «выделенный» может означать свободный от 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99% составляющих с которыми компонент найден в своем естественном состоянии. Как используется в данном документе ЭС «линия клеток» крысы содержит популяцию выделенных клеток крысы, которые развились из единственной ЭС клетки крысы и, поэтому, популяция клеток в данной линии клеток имеет одинаковый генетический набор, отличающийся от мутаций или кариотипических изменений, происходящих во время размножения или во время направленных генетических модификаций. К примеру, ЭС клетки крысы могут характеризоваться высоким уровнем эуплоидности. Несмотря на это, в некоторых линиях клеток уровень эуплоидности составляет менее 100% из-за кариотипических изменений при размножении линии из единственной клетки. Более того, данная популяция ЭС клеток крысы может содержать по меньшей мере 1×103, 1×104, 1×105, 1×106, 1×107, 1×108, 1×109, или 1×1010 клеток или больше. Некоторые популяции клеток имеют достаточно клеток для того, чтобы позволить провести отбор требуемой модифицированной клетки, но не избыточно большое количество для того, чтобы уменьшить возможность мутаций или кариотипических изменений, образующихся в линии клеток. К примеру, некоторые популяции клеток имеют от 1×103 до 1×106 клеток.
[00435] Как обсуждается в других местах данного документа, представлены различные способы направленной генетической модификации линии ЭС клеток крысы. Когда осуществляются такие способы, то по меньшей мере одна клетка в линии ЭС клеток крысы содержит направленную генетическую модификацию. При использовании различных методик культивирования и/или отбора получают линии ЭС клеток крысы, имеющие одну или более требуемых направленных генетических модификаций.
[00436] В специальных вариантах реализации изобретения ЭС клетка крысы, популяция ЭС клетки крысы или линия ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) являются эуплоидными и, таким образом, имеют число хромосом, которое точно кратно гаплоидному числу. В дополнительном варианте реализации изобретения ЭС клетка крысы, популяция ЭС клеток крысы или линия ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) являются диплоидными и, таким образом, имеют два гаплоидных набора гомологичных хромосом. В отношении популяции ЭС клеток крысы или популяции клеток из данной популяции ЭС клеток крысы или линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% клеток в данной популяции являются эуплоидными и/или диплоидными. В других случаях, в отношении популяции ЭС клеток крысы или популяции клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% клеток в данной популяции являются эуплоидными и/или диплоидными.
[00437] В дополнительных вариантах реализации изобретения ЭС клетка крысы, популяция ЭС клеток крысы или линия ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) имеют 42 хромосомы. В отношении популяции ЭС клеток крысы или популяции клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% клеток в данной популяции имеют 42 хромосомы. В других случаях, в отношении популяции ЭС клеток крысы или популяции клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% клеток в данной популяции имеют 42 хромосомы.
[00438] В дополнительных вариантах реализации изобретения ЭС клетка крысы, популяция ЭС клеток крысы или линия ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию), представленные в данном документе, образуют сферообразные колонии при размещении на фидерном слое клеток in vitro. «Сферообразная» морфология скорее относится к форме колоний ЭС клеток крысы в культуре, чем к форме отдельных ЭС клеток. Колонии ЭС клеток крысы являются сферообразными. Колонии, которые легко присоединяются к фидерным клеткам становятся кольцевыми (имеют кольцеобразную морфологию). Свободно плавающие колонии являются сферообразными. Колонии ЭС клеток крысы являются сферообразными и очень компактными, что означает, что границы между клетками очень трудно увидеть. Край колонии является ярким и четким. Трудно различить отдельные ядра из-за того, что клетки очень малы (так что ядра занимают почти весь объем клетки). ЭС клетки мыши образуют продолговатые колонии и сильно присоединяются к фидерным клеткам. Морфология ЭСКм может отличаться в зависимости от штамма, например, колонии В6 являются более круглыми и более выпуклыми, чем колонии F1H4, но все же остаются более вытянутыми, чем ЭСКк. Колонии ЭС клеток человека являются более плоскими и более растянутыми, чем колонии ЭСКм. Быстрорастущие ЭС колонии крысы не являются плоскими и не напоминают колонии ЭС клеток человека.
[00439] В дополнительных вариантах реализации изобретения ЭС клетка крысы, популяция ЭС клеток крысы или линия ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) обладают кольцевой морфологией. Шкала морфологии кольца представлена ниже, когда значение 10 представляет идеальное кольцо, а значение 1 представляет эллипс.
[00440] Шкала морфологии кольца:
[00441] 10 = Кольцо со структурой, имеющей продольную ось и вертикальную ось, которые проходят через центр структуры, и имеют равную длину.
[00442] 9 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна из осей составляет между от 0,9999 до 0,9357 длины другой оси.
[00443] 8 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна из осей составляет между от 0,9357 до 0,875 длины другой оси.
[00444] 7 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна из осей составляет между от 0,875 до около 0,8125 длины другой оси.
[00445] 6 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна из осей составляет между от 0,8125 до 0,750 длины другой оси.
[00446] 5 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна из осей составляет между от 0,750 до 0,6875 длины другой оси.
[00447] 4 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна из осей составляет между от 0,6875 до 0,625 длины другой оси.
[00448] 3 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна из осей составляет между от 0,625 до 0,5625 длины другой оси.
[00449] 2 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр кольца, причем одна из осей составляет между от 0,5625 до 0,523 длины другой оси.
[00450] 1 = Эллипс, определенный имеющим продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна из осей составляет между от 0,523 до 0,500 длины другой оси.
[00451] В одном неограничивающем варианте реализации изобретения популяция ЭС клеток крысы или популяция клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) имеет по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% клеток в данной популяции, которые имеют значение кольцевой морфологии 10, 9 или 8. В других вариантах реализации изобретения популяция ЭС клеток крысы или популяция клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) имеет по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% клеток в данной популяции, которые имеют значение кольцевой морфологии 10, 9 или 8.
[00452] В другом неограничивающем варианте реализации изобретения популяция ЭС клеток крысы или популяция клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) имеет по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% клеток в данной популяции, которые имеют значение кольцевой морфологии 7, 6, 5, 4 или 3. В других неограничивающих вариантах реализации изобретения популяция ЭС клеток крысы или популяция клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) имеет по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% клеток в данной популяции, которые имеют значение кольцевой морфологии 7, 6, 5, 4 или 3.
[00453] В дополнительных вариантах реализации изобретения образуются сферообразные колонии, когда ЭС клетки крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию), размещены на фидерном слое клеток in vitro. Шкала морфологии сферы представлена ниже, когда значение 10 представляет идеальную сферу, а значение 1 представляет трехмерную эллиптическую структуру.
[00454] Шкала морфологии сферообразной структуры:
[00455] 10 = Сфера представляет собой структуру, имеющую ось X, ось Y и ось Z, каждая из которых проходит через центр структуры, и которые имеют равную длину.
[00456] 9 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из осей составляет между от 0,9999 до 0,9357 длины по меньшей мере одной из других осей.
[00457] 8 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из осей составляет между от 0,9357 до 0,875 длины по меньшей мере одной или обеих других осей.
[00458] 7 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из осей составляет между от 0,875 до 0,8125 длины по меньшей мере одной или обеих других осей.
[00459] 6 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из осей составляет между от 0,8125 до 0,750 длины по меньшей мере одной или обеих других осей.
[00460] 5 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из осей составляет от 0,750 до 0,6875 длины по меньшей мере одной или обеих других осей.
[00461] 4 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из осей составляет от 0,6875 до 0,625 длины по меньшей мере одной или обеих других осей.
[00462] 3 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из осей составляет между от 0,625 до 0,5625 длины по меньшей мере одной или обеих других осей.
[00463] 2 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из осей составляет между от 0,5625 до 0,523 длины по меньшей мере одной или обеих других осей.
[00464] 1 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из осей составляет между от 0,523 до 0,500 длины по меньшей мере одной или обеих других осей.
[00465] В одном неограничивающем варианте реализации изобретения популяция ЭС клеток крысы или популяция клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) имеет по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% колоний, которые образуются когда клетки размещают на фидерном слое клеток in vitro, имеют значение сферообразной морфологии 10, 9 или 8. В других вариантах реализации изобретения популяция ЭС клеток крысы или популяция клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) имеет по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% колоний, которые образуются когда клетки размещают на фидерном слое клеток in vitro, имеют значение сферообразной морфологии 10, 9 или 8.
[00466] В другом неограничивающем варианте реализации изобретения популяция ЭС клеток крысы или популяция клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) имеет по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% колоний, которые образуются когда клетки размещают на фидерном слое клеток in vitro, имеют значение сферообразной морфологии 7, 6, 5, 4 или 3. В других вариантах реализации изобретения популяция ЭС клеток крысы или популяция клеток из данной линии ЭС клеток крысы (которые не подверглись направленной генетической модификации и/или имеют направленную генетическую модификацию) имеет по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% колоний, которые образуются когда клетки размещают на фидерном слое клеток in vitro, имеют значение сферообразной морфологии 7, 6, 5, 4 или 3.
[00467] Данная ЭС клетка крысы, применяемая в различных способах и композициях, представленных в данном документе, может быть мужской (XY) ЭС клеткой крысы, популяцией мужских (XY) ЭС клеток крысы или линией мужских (XY) ЭС клеток крысы. В других вариантах реализации изобретения популяция ЭС клеток крысы или линия ЭС клеток крысы, применяемая в данном документе, может быть женской (XX) ЭС клеткой крысы, популяцией женских (XX) ЭС клеток крысы (XX) или линией женских (XX) ЭС клеток крысы. Любая такая ЭС клетка крысы, популяции ЭС клеток крысы или линия ЭС клеток крысы содержит эуплодию и/или диплодию, как описано выше.
[00468] Различные ЭС клетки крысы, применяемые в способах и композициях, могут быть получены из любого штамма крысы, включающего но не ограниченного, штаммом крысы ACI, штаммом крысы темный агути (DA), штаммом крысы Вистар, штаммом крысы LEA, штаммом крысы Спрэга-Доули (SD) или штаммом крысы Фишера, как Фишер F344 или Фишер F6. Различные ЭС клетки крысы также могут быть получены из штамма, который походит из смеси двух или более штаммов, перечисленный выше. В одном варианте реализации изобретения ЭС клетка крысы получена из штамма, выбранного из штамма DA или штамма ACI. В специальном варианте реализации изобретения ЭС клетка крысы получена из штамма ACI. Штамм крысы ACI характеризуется как имеющий черный окрас агути с белым животом и лапами и галотипом RT1av1. Такие штаммы доступны из множества источников, включающих лаборатории Харлан. В других вариантах реализации изобретения различные ЭС клетки крысы походят из штамма крысы темного окраса агути (DA), которые характеризуются как имеющие окрас агути и гаплотип RT1av1. Такие штаммы доступны из множества источников, включающих лаборатории Харлан и Чарльз Ривер. В дополнительном варианте реализации изобретения различные ЭС клетки крысы, применяемые в данном документе, походят из имбредного штамма крысы.
[00469] В специальных вариантах реализации изобретения линия ЭС клеток крысы походит из крысы ACI и включает ЭС клетку крысы ACI.G1, как подробно описано в патентной заявке США №14/185103, поданной 20 февраля 2014 г., включенной в данный документ в полном объеме посредством ссылки. В другом варианте реализации изобретения линия ЭС клеток крысы походит из крысы DA и включает линию ЭС клеток крысы DA.2B или линию ЭС клеток крысы DA.2C, как подробно описано в патентной заявке США №14/185103, поданной 20 февраля 2014 г., включенной в данный документ в полном объеме посредством ссылки.
[00470] Данная ЭС клетка крысы, представленная в данном документе, может быть получена из эмбриона крысы на различных стадиях развития эмбриона крысы. Эмбрион крысы, применяемый для получения ЭС клеток крысы, может быть эмбрионом на стадии морулы, эмбрионом на стадии бластоцисты или эмбрионом крысы на стадии развития между эмбрионом на стадии морулы и эмбрионом на стадии бластоцисты. Таким образом, в специальных вариантах реализации изобретения применяемый эмбрион крысы находится на или между стадиями Witschi 5 и 7. В других вариантах реализации изобретения применяемый эмбрион крысы находится на стадии Witschi 5, 6 или 7.
[00471] В одном варианте реализации изобретения ЭС клетка крысы получена из бластоцисты крысы. В других вариантах реализации изобретения ЭС клетка крысы получена из бластоцисты от крысы в состоянии суперовуляции. В других вариантах реализации изобретения ЭС клетки крысы получают из эмбриона на стадии образования 8-ми клеток, которого потом культивируют in vitro до тех пор, пока он разовьется до стадии морулы, стадии бластоцисты, эмбриона между стадиями Witschi 5 и 7 или в эмбриона на стадии Witschi 5, 6 или 7. Потом в такой момент эмбрионы размещают на планшетах. Эмбрионы на стадии морулы содержат компактный шар клеток без внутренней полости. Эмбрионы на стадии бластоцисты имеют видимую внутреннюю полость (бластоцель) и содержат внутреннюю клеточную массу (ВКМ). Клетки ВКМ образуют ЭС клетки.
В. Деривация и размножение эмбриональных стволовых (ЭС) клеток крысы
[00472] Способы деривации и размножения эмбриональных стволовых клеток крысы известны в данной области техники и описаны в патентной заявке США №14/185103, поданной 20 февраля 2014 г., включенной в данный документ в полном объеме посредством ссылки. В специальных вариантах реализации изобретения такие способы включают (а) использование культуры in vitro, содержащей фидерный слой клеток и популяцию выделенных эмбриональных стволовых (ЭС) клеток; (b) культивирование in vitro в условиях, которые достаточны для поддержания плюрипотентности и/или тотипотентности выделенных ЭС клеток крысы. Такие способы тем самым позволяют проводить размножение популяции ЭС клеток крысы и/или линии ЭС клеток крысы.
[00473] В данном изобретении представлены способы культивирования линии эмбриональных стволовых клеток крысы. Такие способы включают культивирование in vitro фидерного слоя клеток и линии ЭС клеток крысы, причем условия культивирования поддерживают плюрипотентность ЭС клеток крысы и включают среду, содержащую ингибирующий лейкемию фактор мыши (LIF) или его активный вариант или фрагмент. Способы могут дополнительно включать пересев и культивирование in vitro клеток линии ЭС клеток крысы, причем каждое последующее культивирование in vitro включает культивирование ЭС клеток крысы на фидерном слое клеток в условиях, которые поддерживают плюрипотентность ЭС клеток крысы и включают среду, содержащую LIF мыши или его активный вариант или фрагмент.
[00474] Культуральная среда, применяемая в различных способах и композициях, может поддерживать ЭС клетки крысы. Термины «поддержание» или «поддержка» относятся к стабильному сохранению по меньшей мере одного или более свойств или фенотипов ЭС клеток крысы, отмеченных в данном документе. Такие фенотипы могут включать поддержание плюрипотентности и/или тотипотентности, морфологии клеток, профилей экспрессии генов и других функциональных свойств стволовых клеток крыс, описанных в данном документе. Термин «поддерживать» также может охватывать размножение стволовых клеток или увеличение количества культивируемых стволовых клеток. Термин дополнительно предполагает культуральные условия, которые позволяют стволовым клеткам оставаться плюрипотентными, тогда как стволовые клетки могут или не могут продолжать деление и увеличиваться в количестве.
[00475] Термин «фидерная клетка» или «фидерный слой клеток» включает культуру клеток, которая растет in vitro и секретирует по меньшей мере один фактор в культуральной среде, которая используется для поддержания роста другой представляющей интерес клетки в культуре. Фидерные клетки, применяемые в данном документе, помогают поддерживать плюрипотентность ЭС клеток крыс и, в специальных вариантах реализации изобретения, одно или более других свойств или фенотипов, описанных в данном документе. Могут использоваться различные фидерные клетки, включающие, к примеру, эмбриональные фибробласты мыши, включая эмбриональные фибробласты мыши, полученные между 12-м и 16-м днями беременности. В специальных вариантах реализации изобретения фидерный слой клеток включает монослой митотически инактивированных эмбриональных фибробластов мыши (ЭФМ).
[00476] Культуры in vitro ЭС клеток крысы дополнительно содержат эффективное количество ингибирующего лейкемию фактора (LIF) или его активный вариант или фрагмент. Ингибирующий лейкемию фактор (LIF) принадлежит семейству рецепторов IL-6. LIF связывается с гетеродимерным мембранным рецептором, состоящим из LIF-специфичной субъединицы, gp190 или LIFR, и субъединицы gp130, которые предоставляются другим членам семейства IL-6. LIF ингибирует дифференциацию эмбриональных стволовых клеток у мышей и участвует в самообновлении стволовых клеток. LIF человека и мыши разделяют 79% гомологии последовательности и проявляют перекрестно-видовую активность. LIF крысы (rtLIF) представляет собой белок массой 22,1 кДа, содержащий 202 аминокислотных остатка, который проявляет 91% идентичности аминокислотной последовательности с мышинным LIF (Takahama et al. 1998). Эти шесть возможных сайтов аспарагинсвязанного гликозилирования (N-гликозилирование), которые являются консервативными среди полипептидов LIF из различных видов, и дополнительным сайтом Asn150, который специфичен для LIF крысы. Четвертичная структура LIF мыши и его функция дополнительно подробно описана в статьях Aikawa et al. (1998) Biosci. Biotechnol. Biochem. 62 1318-1325 и Senturk et al. (2005) Immunology of Pregnancy, editor Gil Mor., патенте США №5750654 и статье D Р Gearing (1987) EMBO Journal 1987-12-20, каждая из которых включена в данный документ в полном объеме посредством ссылки. О частичной последовательности LIF мыши сообщается на веб-сайте SwissProt под номером доступа Р09056.
[00477] Активность LIF мыши оценивается по его способности индуцировать дифференциацию клеток миелоидной лейкемии M1. Специфическая активность составляет 1×106 единиц/мл (№03-0011 по кат. Stemgent) и 1×107 единиц/мл (№03-0011-100 по кат. Stemgent), где 50 единиц определено как количество LIF мыши, требуемого для индукции дифференциации у 50% колоний M1 в 1 мл среды. См. также статьи Williams, R.L. et al. (1988) Nature 336: 684-687.; Metcalf, D. et al. (1988) Leukemia 2: 216-221; Niwa, H. et al. (2009) Nature 460: 118-122; Xu, J. et al. (2010) Cell Biol Int. 34: 791-797; Fukunaga, N. et al. (2010) Cell Reprogram. 12: 369-376 и Metcalf D. (2003) Stem Cells 21: 5-14, каждая из которых включена в данный документ в полном объеме посредством ссылки. «Эффективное количество LIF» включает концентрацию LIF, которая позволяет ЭС клеткам крысы из культуры in vitro сохранять недиференцированное плюрипотентное состояние. Различные маркеры, которые могут использоваться для анализа клеток, оставшихся в плюрипотентном состоянии, обсуждаются в других местах данного документа.
[00478] Полипептид LIF, применяемый в различных способах и композициях, представленных в данном документе, может быть получен из любого организма, включая млекопитающего, грызуна, человека, крысы или мыши. В одном варианте реализации изобретения полипептид LIF получен из организма мыши. В дополнительных вариантах реализации изобретения полипептид LIF мыши содержит аминокислотную последовательность, отраженную под номером доступа базы SwissProt: Р09056, которая включена в данный документ в полном объеме посредством ссылки, а также отражена в SEQ ID №: 9.
[00479] В других вариантах реализации изобретения может использоваться активный вариант или фрагмент полипептида LIF мыши, отраженный в SEQ ID №: 9 или под номером доступа базы SwissProt: Р09056. Такие активные варианты и фрагменты (включая активные варианты, обладающие по меньшей мере 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 95%, 99%, 97%, 98%, 99%, 97%, 98% или 99% идентичности последовательности к SEQ ID №: 9) дополнительно подробно обсуждаются в других местах данного документа.
[00480] Полипептид LIF или его активный вариант или фрагмент может использоваться в культуре in vitro различными способами. В одном варианте реализации изобретения эффективное количество полипептида LIF или его активного варианта или фрагмента добавляется в культуральную среду. В других вариантах реализации изобретения фидерные клетки генетически модифицировали для сверхэкспрессии полипептида LIF или его активного варианта или фрагмента. Такие фидерные клетки включают фидерные клетки, полученные из гамма-облученных или обработанных митомицином-С фибробластов мыши DIA-M, которые экспрессируют ассоциированный с матриксом LIF. Способы создания и использования таких генетически модифицированных фидерных клеток могут быть найдены, к примеру, в статьях см. Buehr t al. (2003) Biol Reprod 68: 222-229, Rathjen et al. (1990) Cell 62 1105-1115 и Buehr et al. (2008) Cell 135: 1287-1298, каждая из которых включена в данный документ посредством ссылки. Гетерологичный LIF, экспрессируемый в фидерных клетках, может походить из того же организма, что и фидерные клетки, или из организма, который отличается от организма фидерных клеток. В дополнение к этому, гетерологичный LIF, экспрессируемый в фидерных клетках, может походить из того же или отличающегося организма, чем ЭС клетки, поддерживаемые фидерными клетками.
[00481] В других вариантах реализации изобретения фидерные клетки, примененные в различных способах, описанных в данном документе, не являются генетически модифицированными для экспрессии гетерологичного полипептида LIF или его активного варианта или фрагмента. Таким образом, в конкретных вариантах реализации изобретения монослой митотически инактивированных эмбриональных фибробластов мыши, применяемый в способах, не был генетически модифицированным для экспрессии гетерологичного полипептида LIF.
[00482] В других вариантах реализации изобретения полипептид LIF или его активный вариант или фрагмент добавляется в культуральную среду. Если полипептид LIF добавляется в культуральную среду, то LIF может быть получен из любого организма, включая млекопитающего, грызуна, человека, крысу или мышь. В одном варианте реализации изобретения LIF, представленный в культуральной среде, получен из организма мыши. В дополнительных вариантах реализации изобретения полипептид LIF мыши содержит аминокислотную последовательность, отраженную в SEQ ID NO: 9. В других вариантах реализации изобретения может использоваться активный вариант или фрагмент полипептида LIF мыши, отраженный в SEQ ID NO:9. Такие активные варианты и фрагменты (включая активные варианты, обладающие по меньшей мере 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 95%, 99%, 97%, 98%, 99%, 97%, 98% или 99% идентичности последовательности к SEQ ID №: 9) дополнительно подробно обсуждаются в других местах данного документа.
[00483] В специальных вариантах реализации изобретения ЭС клетки крысы и линии ЭС клеток крысы, представленные в данном документе, поддерживают плюрипотентность in vitro без необходимости обеспечения паракринного сигналинга LIF.
[00484] В специальных вариантах реализации изобретения LIF или его активный вариант или фрагмент представлен в культуральной среде в любой концентрации, которая поддерживает ЭС клетки крысы. Полипептид LIF или его активный вариант или фрагмент представлен в культуральной среде в концентрации от около 25 Ед/мл до около 50 Ед/мл, от около 50 Ед/мл до около 100 Ед/мл, от около 100 Ед/мл до около 125 Ед/мл, от около 125 Ед/мл до около 150 Ед/мл, от около 150 Ед/мл до около 175 Ед/мл, от около 175 Ед/мл до около 200 Ед/мл, от около 200 Ед/мл до около 225 Ед/мл, от около 225 Ед/мл до около 250 Ед/мл, от около 250 Ед/мл до около 300 Ед/мл, от около 300 Ед/мл до около 325 Ед/мл, от около 325 Ед/мл до около 350 Ед/мл, от около 350 Ед/мл до около 400 Ед/мл, от около 400 Ед/мл до около 425 Ед/мл, от около 425 Ед/мл до около 450 Ед/мл, от около 450 Ед/мл до около 475 Ед/мл, от около 475 Ед/мл до около 500 Ед/мл, от около 75 Ед/мл до около 500 Ед/мл или больше. В других вариантах реализации изобретения полипептид LIF или его активный вариант или фрагмент представлен в культуральной среде в концентрации от около 25 Ед/мл до около 50 Ед/мл, от около 25 Ед/мл до около 100 Ед/мл, от около 75 Ед/мл до около 125 Ед/мл, от около 50 Ед/мл до около 150 Ед/мл, от около 90 Ед/мл до около 125 Ед/мл, от около 90 Ед/мл до около 110 Ед/мл, от около 80 Ед/мл до около 150 Ед/мл или от около 80 Ед/мл до около 125 Ед/мл. В специальных вариантах реализации изобретения полипептид LIF или его активный вариант или фрагмент представлен в культуральной среде в концентрации около 100 Ед/мл.
[00485] Если применяется LIF мыши, полипептид LIF мыши или его активный вариант или фрагмент, то он представлен в культуральной среде в любой концентрации, которая поддерживает ЭС клетки крысы. Полипептид LIF мыши или его активный вариант или фрагмент представлен в концентрации от около 25 Ед/мл до около 50 Ед/мл, от около 50 Ед/мл до около 100 Ед/мл, от около 100 Ед/мл до около 125 Ед/мл, от около 125 Ед/мл до около 150 Ед/мл, от около 150 Ед/мл до около 175 Ед/мл, от около 175 Ед/мл до около 200 Ед/мл, от около 200 Ед/мл до около 225 Ед/мл, от около 225 Ед/мл до около 250 Ед/мл, от около 250 Ед/мл до около 300 Ед/мл, от около 300 Ед/мл до около 325 Ед/мл, от около 325 Ед/мл до около 350 Ед/мл, от около 350 Ед/мл до около 400 Ед/мл, от около 400 Ед/мл до около 425 Ед/мл, от около 425 Ед/мл до около 450 Ед/мл, от около 450 Ед/мл до около 475 Ед/мл, от около 475 Ед/мл до около 500 Ед/мл, от около 75 Ед/мл до около 500 Ед/мл или больше. В других вариантах реализации изобретения полипептид LIF мыши или его активный вариант или фрагмент представлен в концентрации от около 25 Ед/мл до около 50 Ед/мл, от около 25 Ед/мл до около 100 Ед/мл, от около 75 Ед/мл до около 125 Ед/мл, от около 50 Ед/мл до около 150 Ед/мл, от около 90 Ед/мл до около 125 Ед/мл, от около 90 Ед/мл до около 110 Ед/мл, от около 80 Ед/мл до около 150 Ед/мл или от около 80 Ед/мл до около 125 Ед/мл. В специальных вариантах реализации изобретения полипептид LIF мыши или его активный вариант или фрагмент представлен в культуральной среде в концентрации около 100 Ед/мл.
[00486] Применяемая культуральная среда поддерживает ЭС клетки крысы. По этой причине, в специальных вариантах реализации изобретения культуральная среда, применяемая в различных способах и композициях, будет поддерживать плюрипотентность всех или большинства (т.е. более 50%) ЭС клеток крысы в линии клеток в течение периода по меньшей мере 5, 10 или 15 пассажей. В одном варианте реализации изобретения культуральная среда содержит одно или более соединений, которые помогают поддерживать плюрипотентность. В одном варианте реализации изобретения культуральная среда содержит ингибитор механизма MEK и ингибитор гликогенсинтазкиназы-3 (GSK-3). Среда может дополнительно содержать дополнительные компоненты, которые помогают поддерживать ЭС клетки, включающие к примеру, ингибиторы рецептора FGF, ингибиторы ROCK и/или ингибиторы ALK (рецептор TGFb). Неограничивающий пример ингибитора рецептора FGF включает PD184352. Неограничивающий пример ингибитора ROCK включает Y-27632, а неограничивающий пример ингибитора ALK (рецептор TGFb) включает А-83-01. В специальных вариантах реализации изобретения используется среда 2i с 10 мкМ ROCKi, при оттаивании криосохраненных ЭСКк или при пересеве ЭСКк после отделения трипсином.
[00487] В других вариантах реализации изобретения среда содержит комбинацию ингибиторов, включающих ингибитор механизма MEK и ингибитор гликогенсинтазкиназы-3 (GSK-3).
[00488] В одном неограничивающем варианте реализации изобретения культуральная среда содержит ингибитор гликогенсинтазкиназы-3 (GSK-3), включающий CHIR99021, и/или содержит ингибитор механизма MEK, включающий PD0325901. В других вариантах реализации изобретения среда содержит комбинацию ингибиторов, включающих CHIR99021 и PD0325901. Любое из этих соединений может быть получено, к примеру, из компании Stemgent. В специальных вариантах реализации изобретения CHIR99021 представлен в культуральной среде в концентрации от около 0,5 мкМ до около 3 мкМ, от около 0,5 мкМ до около 3,5 мкМ, от около 0,5 мкМ до около 4 мкМ, от около 0,5 мкМ до около 1 мкМ, от около 1 мкМ до около 1,5 мкМ, от около 1,5 мкМ до около 2 мкМ, от около 2 мкМ до около 2,5 мкМ, от около 2,5 до около 3 мкМ, от 3 мкМ до около 3,5 мкМ. В дополнительных вариантах реализации изобретения CHIR99021 представлен в культуральной среде в концентрации около 3 мкМ. В других вариантах реализации изобретения PD0325901 представлен в культуральной среде в концентрации от около 0,4 мкМ до около 1 мкМ, от около 0,4 мкМ до около 1,5 мкМ, от около 0,4 мкМ до около 2 мкМ, от около 0,4 мкМ до около 0,8 мкМ, от около 0,8 мкМ до около 1,2 мкМ, от около 1,2 мкМ до около 1,5 мкМ. В дополнительных вариантах реализации изобретения PD0325901 представлен в культуральной среде в концентрации около 1 мкМ. В специальных вариантах реализации изобретения CHIR99021 представлен в культуральной среде в концентрации около 3 мкМ, PD0325901 представлен в культуральной среде в концентрации около 1 мкМ.
[00489] В одном неограничивающем варианте реализации изобретения культуральная среда, применяемая в различных способах и композициях, описанных в данном документе, представляет собой среду 2i, которая содержит: основную среду DMEM/F12 (в концентрации 1х (50%)); нейробазальную среду (в концентрации 1х (50%)); пенициллин/стрептомицин (в концентрации 1%); L-глутамин (в концентрации 4 мМ); 2-меркаптоэтанол (в концентрации 0,1 мМ); добавку N2 (в концентрации 1х); добавку В27 (в концентрации 1x); LIF (в концентрации 100 Ед/мл); PD0325901 (ингибитор МЕК) (в концентрации 1 мкМ) и CHIR99021 (ингибитор GSK) (в концентрации 3 мкМ).
[00490] Дополнительная среда, которая может применяться, включает описанную в статьях Li et al. (2008) Cell 135: 1299-1310, Yamamoto et al. (2012) Transgenic Rats 21: 743-755, Ueda et al. (2008) PLoS ONE 3(6): e2800, Meek et al. (2010) PLoS ONE 4(12): e14225; Tong et al. (2010) Nature 467: 211-213; публикации патента США 2012/0142092, Buehr et al. (2008) Cell 135: 1287-1298, Li et al. (135) Cell 1299-1310, каждая из которых включена в данный документ в полном объеме посредством ссылки. При применении таких сред концентрация и источник LIF может быть модифицирован, как отмечено в данном документе. В специальных вариантах реализации изобретения различные культуральные среды применяются в комбинации с LIF мыши или его активным вариантом или фрагментом, а в дополнительных вариантах реализации изобретения различные культуральные среды содержат LIF мыши или его активный вариант или фрагмент в концентрации от около 50 Ед/мл до около 100 Ед/мл, от около 50 Ед/мл до около 150 Ед/мл или около 100 Ед/мл.
[00491] Температура культур ЭС клеток крысы, как для продукции линии ЭС клеток так и для культивирования и поддержания ЭС линии, как правило, составляет от около 35°С до около 37,5°С. В специальном варианте реализации изобретения температура составляет 37,0°С. Культура, как правило, поддерживается при 7,5% СО2.
7. Идентичность последовательностей
[00492] В способах и композициях, представленных в данном документе, применяются разные компоненты системы направленной геномной интеграции (т.е. нуклеазные агенты, сайты распознавания, вставки нуклеиновых кислот, представляющие интерес полинуклеотиды, таргетирующие векторы, селекционные маркеры и другие компоненты). Общепринято во всем описании, что некоторые компоненты системы направленной геномной интеграции могут иметь активные варианты и фрагменты. Такие компоненты включают, к примеру, нуклеазные агенты (т.е. сконструированные нуклеазные агенты), сайты распознавания нуклеазных агентов, представляющие интерес нуклеотиды, целевые сайты и соответствующие гомологичные плечи таргетирующего вектора. Биологическая активность для каждого из этих компонентов описана в других местах данного документа.
[00493] Используемая в данном документе «идентичность последовательностей» или «идентичность» в контексте двух последовательностей полинуклеотидов или полипептидов относится к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании на максимальное соответствие в определенном окне сравнения. Когда процентное значение идентичности последовательностей используется касательно белков, то под ним понимается, что положения остатков, которые не идентичны и часто отличаются консервативными аминокислотными заменами, в которых аминокислотные остатки замещены на другие аминокислотные остатки с подобными химическими свойствами (например, заряд или гидрофобность) и, поэтому, не изменяют функциональные свойства молекулы. Когда последовательности отличаются по консервативным заменам, то процент идентичности последовательностей может подбираться в сторону возрастания для коррекции по консервативной природе замены. Последовательности, которые отличаются по таким консервативным заменам называются имеющими «сходство последовательностей» или «сходство». Средства обеспечения такого подбора хорошо известны специалистам в данной области техники. Как правило, этот процесс вовлекает получение оценки консервативной замены как частного значения вместо полного несовпадения, таким образом увеличивая процентное значение идентичности последовательности. Таким образом, к примеру, если для идентичной аминокислоты дается значение 1, а для неконсервативной замены дается значение нуль, то для консервативной замены дается значение между нулем и 1. Рассчитывается оценка консервативных замен, например, как осуществлено в программе PC/GENE (Intelligenetics, г. Маунтин-Вью, Калифорния).
[00494] Используемое в данном документе «процентное значение идентичности последовательностей» означает величину, определяемую сравнением двух оптимально выровненных последовательностей в окне сравнения, причем для оптимального выравнивания двух последовательностей часть полинуклеотидной последовательности в окне сравнения может содержать добавления или делеции (т.е. гэпы) по сравнению с референтной последовательностью (которая не содержит добавлений или делеций). Процентное значение рассчитывается определением количества положений, в которых идентичное основание нуклеиновой кислоты или аминокислотный остаток, встречаемый в обеих последовательностях, дает количество совпавших положений делением количества совпавших положений на общее количество положений в окне сравнения и умножением результата на 100 для получения процентного значения идентичности последовательностей.
[00495] Если не указано иное, величины идентичности/сходства последовательностей, представленные в данном документе, получены с использованием программы GAP, версии 10, применяя следующие параметры: % идентичности и % сходства для нуклеотидной последовательности получены с использованием веса GAP равным 50 и веса длины равным 3 и оценочной матрицы nwsgapdna.cmp; % идентичности и % сходства для аминокислотной последовательности получены с использованием веса GAP равным 8 и веса длины равным 2 и оценочной матрицы BLOSUM62; или с использованием любой эквивалентной программы. «Эквивалентная программа» означает любую программу сравнения последовательностей, которая для любых двух рассматриваемых последовательностей выполняет выравнивание, обладающее идентичными совпадениями нуклеотидов или аминокислотных остатков и идентичным процентом идентичности последовательностей при сравнении с соответствующим выравниванием, выполненным программой GAP, версии 10.
[00496] Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, что обычно понимается средним специалистом в данной области техники, к которой относится это изобретение. Хотя также могут быть использованы на практике или при тестировании описанного изобретения способы и материалы, аналогичные или эквивалентные тем, которые описаны в данном документе, сейчас будут описаны предпочтительные способы и материалы. Все публикации, упомянутые в данном документе, включены в него посредством ссылки для раскрытия и описания способов и/или материалов, в связи с которыми цитируются указанные публикации.
[00497] Следует отметить, что используемое в данном документе и приложенной формуле изобретения, единственное число включает ссылки на множественное число, если из контекста с очевидностью не следует обратное. Все технические и научные термины, используемые в данном документе, имеют одинаковое значение.
[00498] Публикации, рассмотренные в настоящем документе, представлены лишь в отношении их описания до даты подачи настоящей заявки. Информацию в настоящем документе не следует толковать как признание того, что описанное изобретение не имеет права датировать такую публикацию более ранним числом из-за действия более раннего изобретения. Более того, представленные даты публикаций, могут отличаться от фактических дат публикаций, что может потребовать независимого подтверждения.
[00499] Описанное изобретение может быть осуществлено в других специальных формах без отступления от сути и его существенных признаков и, соответственно, ссылка должна быть сделана скорее на формулу изобретения, чем на предшествующее описание, как указывается в объеме изобретения.
[00500] Неограничивающие варианты реализации изобретения включают:
[00501] 1. Способ направленной модификации представляющего интерес геномного локуса в плюрипотентной клетке крысы, включающий (а) введение в плюрипотентную клетку крысы большого таргетирующего вектора (LTVEC), содержащего вставку нуклеиновой кислоты, фланкированную 5'-гомологичным плечом крысы и 3'-гомологичным плечом крысы, причем полная совокупность 5'-и 3'-гомологичных плечей составляет по меньшей мере 10 т.н., но менее 150 т.н. и (b) идентификацию генетически модифицированной плюрипотентной клетки крысы, содержащей направленную генетическую модификацию в представляющем интерес целевом локусе, причем направленная генетическая модификация способна передаваться по зародышевой линии.
[00502] 2. Способ по варианту реализации изобретения 1, отличающийся тем, что направленная генетическая модификация является биаллельной.
[00503] 3. Способ по варианту реализации изобретения 1 или 2, отличающийся тем, что плюрипотентная клетка крысы представляет собой эмбриональную стволовую (ЭС) клетку крысы.
[00504] 4. Способ по варианту реализации изобретения 1, 2 или 3, отличающийся тем, что плюрипотентную клетку крысы получают из штамма DA или штамма ACI.
[00505] 5. Способ по любому из вариантов реализации изобретения 1-4, отличающийся тем, что плюрипотентная клетка крысы характеризуется экспрессией по меньшей мере одного маркера плюрипотентности, включающего Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, рецептор LIF, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинацию.
[00506] 6. Способ по любому из вариантов реализации изобретения 1-4, отличающийся тем, что плюрипотентная клетка крысы характеризуется одним из более следующих свойств:
(а) отсутствие экспрессии одного или более маркеров плюрипотентности, включающих с-Myc, Ecat1 и/или Rexo1; (b) отсутствие экспрессии мезодермальных маркеров, включающих ген брахиурии и/или Bmpr2; (с) отсутствие экспрессии одного или более эндодермальных маркеров, включающих Gata6, Sox17 и/или Sox7 или (d) отсутствие экспрессии одного или более нейральных маркеров, включающих Nestin и/или Рах6.
[00507] 7. Способ по любому из вариантов реализации изобретения 1-6, отличающийся тем, что полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет от около 10 т.н. до около 30 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до 150 т.н.
[00508] 8. Способ по любому из вариантов реализации изобретения 1-6, отличающийся тем, что полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет от около 16 т.н. до около 150 т.н.
[00509] 9. Способ по любому из вариантов реализации изобретения 1-8, отличающийся тем, что направленная генетическая модификация включает: (а) замену эндогенной последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты; (b) делецию эндогенной последовательности нуклеиновой кислоты крысы; (с) делецию эндогенной последовательности нуклеиновой кислоты крысы, причем диапазон делеции составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., или от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 300 т.н., от около 300 т.н. до около 400 т.н., от около 400 т.н. до около 500 т.н., от около 500 т.н. до около 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н. или от около 2,5 м.н. до около 3 м.н.; (d) экзогенную последовательность нуклеиновой кислоты в диапазоне от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.; (е) экзогенную последовательность нуклеиновой кислоты, содержащую гомологичную или ортологичную последовательность нуклеиновой кислоты; (f) последовательность химерной нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты человека и крысы; (g) условную аллель, фланкированную целевыми последовательностями сайт-специфических рекомбиназ или (h) репортерный ген, функционально связанный с промотором активным в клетке крысы.
[00510] 10. Способ по любому из вариантов реализации изобретения 1-9, отличающийся тем, что представляющий интерес геномный локус содержит: (i) первую последовательность нуклеиновой кислоты, которая комплементарна 5'-гомологичному плечу крысы и (ii) вторую последовательность нуклеиновой кислоты, которая комплементарна 3'-гомологичному плечу крысы.
[00511] 11. Способ по варианту реализации изобретения 10, отличающийся тем, что первая и вторая последовательность нуклеиновой кислоты разделены по меньшей мере 5 т.н., но менее 3 м.н.
[00512] 12. Способ по варианту реализации изобретения 10, отличающийся тем, что первая и вторая последовательность нуклеиновой кислоты разделены по меньшей мере 5 т.н., но менее 10 т.н., по меньшей мере 10 т.н., но менее 20 т.н., по меньшей мере 20 т.н., но менее 40 т.н., по меньшей мере 40 т.н., но менее 60 т.н., по меньшей мере 60 т.н., но менее 80 т.н., по меньшей мере около 80 т.н., но менее 100 т.н., по меньшей мере 100 т.н., но менее 150 т.н., или по меньшей мере 150 т.н., но менее 200 т.н., по меньшей мере около 200 т.н., но менее около 300 т.н., по меньшей мере около 300 т.н., но менее около 400 т.н., по меньшей мере около 400 т.н., но менее около 500 т.н., по меньшей мере около 500 т.н., но менее около 1 м.н., по меньшей мере около 1 м.н., но менее около 1,5 м.н., по меньшей мере около 1,5 м.н., но менее около 2 м.н., по меньшей мере около 2 м.н., но менее около 2,5 м.н., или по меньшей мере около 2,5 м.н., но менее около 3 м.н.
[00513] 13. Способ по любому из вариантов реализации изобретения 1-12, отличающийся тем, что стадия введения (а) дополнительно включает введение второй нуклеиновой кислоты, кодирующей нуклеазный агент, который способствует гомологичной рекомбинации между таргетирующей конструкцией и представляющим интерес геномным локусом в плюрипотентной клетке крысы.
[00514] 14. Способ по варианту реализации изобретения 13, отличающийся тем, что нуклеазный агент включает (а) химерный белок, содержащий ДНК-связывающий домен на основе цинкового пальца, гибридизированный с эндонуклеазой FokI, или (b) химерный белок, содержащий подобную активатору транскрипции эффекторную нуклеазу (TALEN), гибридизированную с эндонуклеазой FokI.
[00515] 15. Способ по любому из вариантов реализации изобретения 1-12, отличающийся тем, что стадия введения (а) дополнительно содержит введение в плюрипотентную клетку крысы: (i) первой экспрессионной конструкции, содержащей первый промотор, функционально связанный с первой последовательностью нуклеиновой кислоты, кодирующей белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), (ii) второй экспрессионной конструкции, содержащей второй промотор, функционально связанный с геномной целевой последовательностью, связанной с гидовой РНК (гРНК), причем геномная целевая последовательность непосредственно фланкирована на 3'-конце последовательностью мотива, прилегающего к протоспейсеру (РАМ).
[00516] 16. Способ по варианту реализации изобретения 15, отличающийся тем, что представляющий интерес геномный локус содержит нуклеотидную последовательность SEQ ID №: 1.
[00517] 17. Способ по варианту реализации изобретения 15 или 16, отличающийся тем, что гРНК содержит третью последовательность нуклеиновой кислоты, кодирующую РНК (crRNA) коротких палиндромных повторов, регулярно расположенных группами (CRISPR), и трансактивирующую РНК CRISPR (tracrRNA).
[00518] 18. Способ по варианту реализации изобретения 15, 16 или 17, отличающийся тем, что белок Cas представляет собой Cas9.
[00519] 19. Способ по варианту реализации изобретения 15, 16, 17 или 18, отличающийся тем, что гРНК включает: (а) химерную РНК с последовательностью нуклеиновой кислоты SEQ ID №: 2 или (b) химерную РНК с последовательностью нуклеиновой кислоты SEQ ID №: 3.
[00520] 20. Способ по варианту реализации изобретения 17, отличающийся тем, что crRNA содержит SEQ ID №: 4; SEQ ID №: 5 или SEQ ID №: 6.
[00521] 21. Способ по варианту реализации изобретения 17, отличающийся тем, что tracrRNA содержит SEQ ID №: 7 или SEQ ID №: 8.
[00522] 22. Модифицированный геномный локус крысы, содержащий: (i) инсерцию гомологичной или ортологичной последовательности нуклеиновой кислоты человека; (ii) замену эндогенной последовательности нуклеиновой кислоты крысы гомологичной или ортологичной последовательностью нуклеиновой кислоты человека или (iii) их комбинацию, причем модифицированный геномный локус крысы способен передаваться по зародышевой линии.
[00523] 23. Модифицированный геномный локус крысы по варианту реализации изобретения 22, отличающийся тем, что размер инсерции или замены составляет от около 5 т.н. до около 400 т.н.
[00524] 24. Геномный локус крысы по варианту реализации изобретения 22, отличающийся тем, что размер инсерции или замены составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.
[00525] 25. Способ создания гуманизированной крысы, включающий: (а) таргетинг представляющего интерес геномного локуса в плюрипотентной клетке крысы таргетирующей конструкцией, содержащей нуклеиновую кислоту человека, с образованием генетически модифицированной плюрипотентной клетки крысы; (b) введение генетически модифицированной плюрипотентной клетки крысы в эмбрион-хозяин крысы и (с) вынашивание эмбриона-хозяина крысы суррогатной матерью; причем суррогатная мать воспроизводит потомство крыс, содержащее модифицированный геномный локус, который включает: (i) инсерцию последовательности нуклеиновой кислоты человека; (ii) замену последовательности нуклеиновой кислоты крысы в геномном локусе гомологичной или ортологичной последовательностью нуклеиновой кислоты человека; (iii) химерную последовательность нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты человека и крысы или (iv) их комбинацию, причем модифицированный геномный локус способен передаваться по зародышевой линии.
[00526] 26. Способ по варианту реализации изобретения 25, отличающийся тем, что таргетирующая конструкция представляет собой большой таргетирующий вектора (LTVEC), а полная совокупность 5'- и 3'-гомологичных плечей LTVEC составляет по меньшей мере 10 т.н., но менее 150 т.н.
[00527] 27. Способ по варианту реализации изобретения 26, отличающийся тем, что полная совокупность 5'- и 3'-гомологичных плечей таргетирующей конструкции составляет от около 10 т.н. до около 30 т.н., от около 20 т.н. до 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н. или от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 120 т.н. или от около 120 т.н. до 150 т.н.
[00528] 28. Способ по варианту реализации изобретения 25, 26 или 27, отличающийся тем, что последовательность нуклеиновой кислоты человека составляет по меньшей мере 5 т.н., но менее 400 т.н.
[00529] 29. Способ по варианту реализации изобретения 25, 26 или 27, отличающийся тем, что последовательность нуклеиновой кислоты человека составляет по меньшей мере 5 т.н., но менее 10 т.н., по меньшей мере 10 т.н., но менее 20 т.н., по меньшей мере 20 т.н., но менее 40 т.н., по меньшей мере 40 т.н., но менее 60 т.н., по меньшей мере 60 т.н., но менее 80 т.н., по меньшей мере около 80 т.н., но менее 100 т.н., по меньшей мере 100 т.н., но менее 150 т.н., по меньшей мере 150 т.н., но менее 200 т.н., по меньшей мере 200 т.н., но менее 250 т.н., по меньшей мере 250 т.н., но менее 300 т.н., по меньшей мере 300 т.н., но менее 350 т.н., или по меньшей мере 350 т.н., но менее 400 т.н.
[00530] 30. Способ по любому из вариантов реализации изобретения 25-29, отличающийся тем, что плюрипотентная клетка крысы представляет собой эмбриональную стволовую (ЭС) клетку крысы.
[00531] 31. Способ по любому из вариантов реализации изобретения 25-30, отличающийся тем, что плюрипотентную клетку крысы получают из штамма DA или штамма ACI.
[00532] 32. Способ по любому из вариантов реализации изобретения 25-31, отличающийся тем, что плюрипотентная клетка крысы характеризуется экспрессией по меньшей мере одного маркера плюрипотентности, включающего Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, рецептор LIF, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинацию.
[00533] 33. Способ по любому из вариантов реализации изобретения 25-31, отличающийся тем, что плюрипотентная клетка крысы характеризуется одной или более из следующих особенностей: (а) отсутствие экспрессии одного или более маркеров плюрипотентности, включающих с-Myc, Ecat1 и/или Rexo1, (b) отсутствие экспрессии одного или более мезодермальных маркеров, включающих ген брахиурии и/или Bmpr2, (с) отсутствие экспрессии одного или более эндодермальных маркеров, включающих Gata6, Sox17 и/или Sox7 или (d) отсутствие экспрессии одного или более нейральных маркеров, включающих Nestin и/или Рах6.
[00534] 34. Модифицированная крыса, содержащая гуманизированный геномный локус, причем гуманизированный геномный локус содержит: (i) инсерцию гомологичной или ортологичной последовательности нуклеиновой кислоты человека; (ii) замену последовательности нуклеиновой кислоты крысы в эндогенном геномном локусе гомологичной или ортологичной последовательностью нуклеиновой кислоты человека; (iii) химерную последовательность нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты человека и крысы или (iv) их комбинацию, причем гуманизированный геномный локус крысы способен передаваться по зародышевой линии.
[00535] 35. Крыса или клетка крысы, содержащая направленную генетическую модификацию в ее геномный локус, причем геномный локус представляет собой локус рецептора гамма интерлейкина-2, локус АроЕ, локус Rag1, локус Rag2 или локус Rag2/Rag1, причем направленная генетическая модификация включает: (а) делецию эндогенной последовательности нуклеиновой кислоты крысы в геномном локусе; (b) инсерцию гомологичной нуклеиновой кислоты, ортологичной нуклеиновой кислоты или химерной нуклеиновой кислоты, содержащей последовательность нуклеиновых кислот человека и крысы или (с) их комбинацию, при этом направленная генетическая модификация является передаваемой по зародышевой линии крысы или крысу воспроизводят из клетки крысы.
[00536] 36. Крыса или клетка крысы по варианту реализации изобретения 35, отличающаяся тем, что (а) делеция эндогенной нуклеиновой кислоты крысы в геномном локусе составляет по меньшей мере около 10 т.н. или (b) делеция эндогенной нуклеиновой кислоты крысы в геномном локусе составляет по меньшей мере от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., или от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 300 т.н., от около 300 т.н. до около 400 т.н., от около 400 т.н. до около 500 т.н., от около 500 т.н. до около 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н., от около 2,5 м.н. до около 3 м.н.; (с) инсерция экзогенной последовательности нуклеиновой кислоты в геномном локусе составляет по меньшей мере 5 т.н. или (d) инсерция экзогенной последовательности нуклеиновой кислоты в геномном локусе составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.
[00537] 37. Крыса или клетка крысы по варианту реализации изобретения 35 или 36, отличающаяся тем, что (а) направленная генетическая модификация в локусе рецептора гамма интерлейкина-2 приводит к уменьшению или потере активности белка рецептора гамма интерлейкина-2; (b) направленная генетическая модификация в локусе АроЕ приводит к уменьшению или потере активности белка АроЕ; (с) направленная генетическая модификация в локусе Rag1 приводит к уменьшению или потере активности белка Rag1; (d) направленная генетическая модификация в локусе Rag2 приводит к уменьшению или потере активности белка Rag2 или (е) направленная генетическая модификация в локусе Rag2/Rag1 приводит к уменьшению или потере активности белка Rag2 и активности Rag1.
[00538] 38. Крыса или клетка крысы по варианту реализации изобретения 35, 36 или 37, отличающаяся тем, что направленная генетической модификация локуса рецептора гамма интерлейкина-2 включает: (а) делецию целого кодирующего участка рецептора гамма интерлейкина-2 крысы или его части; (b) замену целого кодирующего участка рецептора гамма интерлейкина-2 крысы или его части кодирующим участком рецептора гамма интерлейкина-2 человека или его частью; (с) замену эктодомена кодирующего участка рецептора гамма интерлейкина-2 крысы эктодоменом рецептора гамма интерлейкина-2 человека или (d) по меньшей мере делецию размером 3 т.н. локуса рецептора гамма интерлейкина-2.
[00539] 39. Крыса или клетка крысы по любому из вариантов реализации изобретения 35-37, отличающаяся тем, что направленная генетическая модификация локуса АроЕ включает: (а) делецию целого кодирующего участка АроЕ или его части или (b) по меньшей мере делецию размером 1,8 т.н. локуса АроЕ, содержащую кодирующий участок АроЕ.
[00540] 40. Крыса или клетка крысы по любому из вариантов реализации изобретения 35-37, отличающаяся тем, что направленная генетическая модификация локуса Rag2 включает: (а) делецию целого кодирующего участка Rag2 или его части; (b) по меньшей мере делецию размером 5,7 т.н. локуса Rag2, содержащую кодирующий участок Rag2.
[00541] 41. Крыса или клетка крысы по любому из вариантов реализации изобретения 35-37, отличающаяся тем, что направленная генетическая модификация локуса Rag2/Rag1 включает: (а) делецию целого кодирующего участка Rag2 или его части и делецию целого кодирующего участка Rag1 или его части или (b) делецию размером по меньшей мере 16 т.н. локуса Rag2/Rag1, содержащую кодирующий участок Rag2.
[00542] 42. Крыса или клетка крысы по любому из вариантов реализации изобретения 35-41, отличающаяся тем, что направленная генетическая модификация включает инсерцию экспрессионной кассеты, содержащей селективный маркер в локусе рецептора гамма интерлейкина-2, локусе АроЕ, локусе Rag1, локусе Rag2 или локусе Rag2/Rag1.
[00543] 43. Крыса или клетка крысы по варианту реализации изобретения 42, отличающаяся тем, что экспрессионная кассета содержит ген lacZ, функционально связанный с эндогенным промотором в геномном локусе, и промотор убиквитина человека, функционально связанный с селективным маркером.
[00544] 44. Крыса или клетка крысы по любому из вариантов реализации изобретения 35-43, отличающаяся тем, что направленная генетическая модификация в локусе рецептора гамма интерлейкина-2, локусе АроЕ, локусе Rag1, локусе Rag2 или локусе Rag2/Rag1 включает инсерцию самоделетирующейся селекционной кассеты.
[00545] 45. Крыса или клетка крысы по варианту реализации изобретения 44, отличающаяся тем, что самоделетирующаяся селекционная кассета содержит ген селективного маркера, функционально связанный с промотором активным в клетке крысы, и ген рекомбиназы, функционально связанный со специфическим по мужским зародышевым клеткам промотором, причем самоделетирующаяся кассета фланкирована сайтами рекомбинационного распознавания, распознаваемыми рекомбиназой.
[00546] 46. Крыса или клетка крысы по варианту реализации изобретения 45, отличающаяся тем, что специфический по мужским зародышевым клеткам промотор представляет собой промотор протамина-1 или (b) ген рекомбиназы кодирует Cre, а сайты рекомбинационного распознавания являются сайтами loxP.
[00547] 47. Крыса или клетка крысы по любому из вариантов реализации изобретения 35-46, отличающаяся тем, что инсерция экзогенной последовательности нуклеиновой кислоты в геномном локусе содержит репортерную нуклеиновую кислоту, функционально связанную с эндогенным промотором рецептора гамма интерлейкина-2, эндогенным промотором АроЕ, эндогенным промотором Rag1 или эндогенным промотором Rag2.
[00548] 48. Крыса или клетка крысы по варианту реализации изобретения 47, отличающаяся тем, что репортерная нуклеиновая кислота кодирует репортер, включающий β-галактозидазу, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, белок с улучшенной желтой флуоресценцией (EYFP), Emerald, белок с улучшенной зеленой флуоресценцией (EGFP), CyPet, белок с голубой флуоресценцией (CFP), Cerulean, T-Sapphire, люциферазу, щелочную фосфатазу или их комбинацию.
[00549] 49. Клетка крысы по любому из вариантов реализации изобретения 35-48, отличающаяся тем, что клетка крысы представляет собой плюрипотентною клетку крысы или эмбриональную стволовую (ЭС) клетку крысы.
[00550] 50. Клетка крысы по варианту реализации изобретения 49, отличающаяся тем, что плюрипотентная клетка крысы или эмбриональная стволовая (ЭС) клетка крысы (а) получена из штамма DA или штамма ACI; (b) характеризуется экспрессией по меньшей мере одного маркера плюрипотентности, включающего Dnmt3L, Eras, Err-beta, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, рецептор LIF, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинацию или (с) характеризуется одним или более из следующих свойств: (i) отсутствие экспрессии одного или более маркеров плюрипотентности, включающих с-Myc, Ecat1 и/или Rexo1; (ii) отсутствие экспрессии одного или более мезодермальных маркеров, включающих ген брахиурии и/или Bmpr2; (iii) отсутствие экспрессии одного или более эндодермальных маркеров, включающих Gata6, Sox17 и/или Sox7 или (iv) отсутствие экспрессии одного или более нейральных маркеров, включающих Nestin и/или Рах6.
[00551] 51. Способ модификации целевого геномного локуса в локусе рецептора гамма интерлейкина-2, локусе АроЕ, локусе Rag1, локусе Rag2 или локусе Rag2/Rag1 в плюрипотентной клетке крысы, причем способ включает: (а) введение в плюрипотентную клетку крысы таргетирующего вектора, содержащего вставку нуклеиновой кислоты, фланкированную 5'- и 3'-гомологичными плечами крысы, гомологичными целевому геномному локусу, (b) идентификацию генетически модифицированной плюрипотентной клетки крысы, содержащей направленную генетическую модификацию в целевом геномном локусе, причем направленная генетическая модификация способна передаваться по зародышевой линии крысы, воспроизведенной из плюрипотентной клетки крысы.
[00552] 52. Способ по варианту реализации изобретения 51, отличающийся тем, что таргетирующий вектор представляет собой большой таргетирующий вектора (LTVEC), в котором полная совокупность 5'- и 3'-гомологичных плечей крысы составляет по меньшей мере 10 т.н., но менее 150 т.н.
[00553] 53. Способ по варианту реализации изобретения 51 или 52, отличающийся тем, что введение таргетирующего вектора в плюрипотентную клетку крысы приводит к: (i) делеции эндогенной последовательности нуклеиновой кислоты крысы в целевом геномном локусе; (ii) инсерции экзогенной последовательности нуклеиновой кислоты в целевой геномный локус или (iii) их комбинации.
[00554] 54. Способ по варианту реализации изобретения 53, отличающийся тем, что (а) делеция эндогенной нуклеиновой кислоты крысы в геномном локусе составляет по меньшей мере около 10 т.н. или (b) делеция эндогенной нуклеиновой кислоты крысы в геномном локусе составляет по меньшей мере от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., или от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 300 т.н., от около 300 т.н. до около 400 т.н., от около 400 т.н. до около 500 т.н., от около 500 т.н. до около 1 м.н., от около 1 м.н. до около 1,5 м.н., от около 1,5 м.н. до около 2 м.н., от около 2 м.н. до около 2,5 м.н., от около 2,5 м.н. до около 3 м.н.; (с) инсерция экзогенной последовательности нуклеиновой кислоты в геномном локусе составляет по меньшей мере 5 т.н. или (d) инсерция экзогенной последовательности нуклеиновой кислоты в геномном локусе составляет от около 5 т.н. до около 10 т.н., от около 10 т.н. до около 20 т.н., от около 20 т.н. до около 40 т.н., от около 40 т.н. до около 60 т.н., от около 60 т.н. до около 80 т.н., от около 80 т.н. до около 100 т.н., от около 100 т.н. до около 150 т.н., от около 150 т.н. до около 200 т.н., от около 200 т.н. до около 250 т.н., от около 250 т.н. до около 300 т.н., от около 300 т.н. до около 350 т.н. или от около 350 т.н. до около 400 т.н.
[00555] 55. Способ по любому из вариантов реализации изобретения 51-54, отличающийся тем, что (а) направленная генетическая модификация в локусе рецептора гамма интерлейкина-2 приводит к уменьшению или потере активности белка рецептора гамма интерлейкина-2; (b) направленная генетическая модификация в локусе АроЕ приводит к уменьшению или потере активности белка АроЕ; (с) направленная генетическая модификация в локусе Rag1 приводит к уменьшению или потере активности белка Rag1; (d) направленная генетическая модификация в локусе Rag2 приводит к уменьшению или потере активности белка Rag2 или (е) направленная генетическая модификация в локусе Rag2/Rag1 приводит к уменьшению или потере активности белка Rag2 и активности белка Rag1.
[00556] 56. Способ по любому из вариантов реализации изобретения 51-54, отличающийся тем, что направленная генетической модификация локуса рецептора гамма интерлейкина-2 включает: (а) делецию целого кодирующего участка рецептора гамма интерлейкина-2 крысы или его части; (b) замену целого кодирующего участка рецептора гамма интерлейкина-2 крысы или его части кодирующим участком рецептора гамма интерлейкина-2 человека или его частью; (с) замену эктодомена кодирующего участка рецептора гамма интерлейкина-2 крысы эктодоменом рецептора гамма интерлейкина-2 человека или (d) по меньшей мере делецию размером 3 т.н. локуса рецептора гамма интерлейкина-2, содержащую кодирующий участок рецептора гамма интерлейкина-2.
[00557] 57. Способ по любому из вариантов реализации изобретения 51-55, отличающийся тем, что направленная генетическая модификация локуса АроЕ включает: (а) делецию целого кодирующего участка АроЕ или его части или (b) по меньшей мере делецию размером 1,8 т.н. локуса АроЕ, содержащую кодирующий участок АроЕ.
[00558] 58. Способ по любому из вариантов реализации изобретения 51-55, отличающийся тем, что направленная генетическая модификация локуса Rag2 включает: (а) делецию целого кодирующего участка Rag2 или его части или (b) по меньшей мере делецию размером 5,7 т.н. локуса Rag2, содержащую кодирующий участок Rag2.
[00559] 59. Способ по любому из вариантов реализации изобретения 51-55, отличающийся тем, что направленная генетическая модификация локуса Rag1/Rag2 включает: (а) делецию целого кодирующего участка Rag2 или его части и делецию целого кодирующего участка Rag1 или его части или (b) делецию по меньшей мере размером 16 т.н. локуса Rag2/Rag1, содержащую кодирующие участки Rag2 и Rag1.
[00560] 60. Способ по любому из вариантов реализации изобретения 51-59, отличающийся тем, что вставка нуклеиновой кислоты содержит экспрессионную кассету, включающую полинуклеотид, кодирующий селективный маркер.
[00561] 61. Способ по варианту реализации изобретения 60, отличающийся тем, что экспрессионная кассета содержит ген lacZ, функционально связанный с эндогенным промотором в геномном локусе, и промотор убиквитина человека, функционально связанный с геном селективного маркера.
[00562] 62. Способ по любому из вариантов реализации изобретения 51-60, отличающийся тем, что вставка нуклеиновой кислоты содержит самоделетирующуюся селекционную кассету.
[00563] 63. Способ по варианту реализации изобретения 62, отличающийся тем, что самоделетирующаяся селекционная кассета содержит селективный маркер, функционально связанный с промотором активным в плюрипотентной клетке крысы, и полинуклеотид, кодирующий рекомбиназу, функционально связанную со специфическим по мужским зародышевым клеткам промотором, причем самоделетирующаяся селекционная кассета фланкирована сайтом рекомбинационного распознавания, распознаваемым рекомбиназой.
[00564] 64. Способ по варианту реализации изобретения 63, отличающийся тем, что (а) специфический по мужским зародышевым клеткам промотор представляет собой промотор протамина-1 или (b) ген рекомбиназы кодирует Cre, а сайты рекомбинационного распознавания являются сайтами loxP.
[00565] 65. Способ по варианту реализации изобретения 53, отличающийся тем, что инсерция экзогенной последовательности нуклеиновой кислоты в геномном локусе содержит репортерную последовательность нуклеиновой кислоты, функционально связанную с эндогенным промотором рецептора гамма интерлейкина-2, эндогенным промотором АроЕ, эндогенным промотором Rag1 или эндогенным промотором Rag2.
[00566] 66. Способ по варианту реализации изобретения 65, отличающийся тем, что репортерная последовательность нуклеиновой кислоты кодирует репортер, включающий β-галактозидазу, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, белок с улучшенной желтой флуоресценцией (EYFP), Emerald, белок с улучшенной зеленой флуоресценцией (EGFP), CyPet, белок с голубой флуоресценцией (CFP), Cerulean, T-Sapphire, люциферазу, щелочную фосфатазу или их комбинацию.
[00567] 67. Способ по любому из вариантов реализации изобретения 51-66, отличающийся тем, что плюрипотентная клетка крысы представляет собой эмбриональную стволовую (ЭС) клетку крысы.
[00568] 68. Способ по любому из вариантов реализации изобретения 51-67, отличающийся тем, что плюрипотентная клетка крысы (а) получена из штамма DA или штамма ACI или (b) характеризуется экспрессией маркера плюрипотентности, включающего Oct4, Sox2, щелочную фосфатазу или их комбинацию или (с) характеризуется одним или более из следующих свойств: (i) отсутствие экспрессии одного или более маркеров плюрипотентности, включающих с-Myc, Ecat1 и/или Rexo1; (ii) отсутствие экспрессии одного или более мезодермальных маркеров, включающих ген брахиурии и/или Bmpr2; (iii) отсутствие экспрессии одного или более эндодермальных маркеров, включающих Gata6, Sox17 и/или Sox7 или (iv) отсутствие экспрессии одного или более нейральных маркеров, включающих Nestin и/или Рах6.
[00569] 69. Способ по любому из вариантов реализации изобретения 51-68, дополнительно включающий идентификацию направленной генетической модификации в целевом геномном локусе, причем на стадии идентификации применяется количественный анализ для оценки модификации аллели (МОА) в целевом геномном локусе.
[00570] 70. Способ по любому из вариантов реализации изобретения 51-69, отличающийся тем, что стадия введения (а) дополнительно включает введение второй нуклеиновой кислоты, кодирующей нуклеазный агент, который способствует гомологичной рекомбинации между таргетирующим вектором и целевым геномным локусом в плюрипотентной клетке крысы.
[00571] 71. Способ по варианту реализации изобретения 70, отличающийся тем, что нуклеазный агент включает химерный белок, содержащий ДНК-связывающий домен на основе цинкового пальца, гибридизированный с эндонуклеазой FokI.
[00572] 72. Способ по варианту реализации изобретения 71, отличающийся тем, что способ приводит к биаллельной модификации целевого геномного локуса.
[00573] 73. Способ по любому из вариантов реализации изобретения 51-70, отличающийся тем, что стадия введения (а) дополнительно содержит введение в плюрипотентную клетку крысы: (i) первой экспрессионной конструкции, содержащей первый промотор, функционально связанный с первой последовательностью нуклеиновой кислоты, кодирующей белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), (ii) второй экспрессионной конструкции, содержащей второй промотор, функционально связанный с геномной целевой последовательностью, связанной с гидовой РНК (гРНК), причем геномная целевая последовательность непосредственно фланкирована на 3'-конце последовательностью мотива, прилегающего к протоспейсеру (РАМ).
[00574] 74. Способ по варианту реализации изобретения 73, отличающийся тем, что представляющий интерес геномный локус содержит нуклеотидную последовательность SEQ ID №: 1.
[00575] 75. Способ по варианту реализации изобретения 73 или 74, отличающийся тем, что гРНК содержит третью последовательность нуклеиновой кислоты, кодирующую РНК (crRNA) коротких палиндромных повторов, регулярно расположенных группами (CRISPR), и трансактивирующую РНК CRISPR (tracrRNA).
[00576] 76. Способ по варианту реализации изобретения 73, отличающийся тем, что белок Cas представляет собой Cas9.
[00577] 77. Способ по варианту реализации изобретения 73, 74 или 75, отличающийся тем, что гРНК включает: (а) химерную РНК с последовательностью нуклеиновой кислоты SEQ ID №: 2 или (b) химерную РНК с последовательностью нуклеиновой кислоты SEQ ID №: 3.
[00578] 78. Способ по варианту реализации изобретения 75, отличающийся тем, что crRNA содержит SEQ ID №: 4; SEQ ID №: 5 или SEQ ID №: 6.
[00579] 79. Способ по варианту реализации изобретения 75, отличающийся тем, что tracrRNA содержит SEQ ID №: 7 или SEQ ID №: 8.
ПРИМЕРЫ
[00580] Следующие примеры представлены для того, чтобы обеспечить специалистов в данной области техники полным раскрытием и описанием того, как выполнять и использовать настоящее изобретение, и они не предназначены ни для ограничения рамок того, что авторы считают своим изобретением, ни для того, что под ними подразумевается представление того, что эксперименты ниже являются всеми или единственными экспериментами. Были предприняты усилия для того, чтобы обеспечить точность в отношении используемых величин (например, количеств, температуры и т.д.), но должны учитываться определенные экспериментальные ошибки и отклонения. Если не указано иное, то доли представляют собой массовые доли, молекулярная масса представляет собой среднюю молекулярную массу, температура выражена в градусах С, а давление равно атмосферному или около него.
Пример 1. Деривация и определение свойств ЭС клеток крысы
1.1. Определение свойств ЭС клеток крысы
[00581] Как показано на фиг. 1, ЭСК крысы растут в виде компактных сферических колоний, которых по стандартной методике снимают с поверхности и распределяют на чашке (увеличенное изображение на фиг. 7). ЭСК крысы экспрессируют маркеры плюрипотентности, включающие Oct-4 (фиг. 2А) и Sox2 (фиг. 2В), и экспрессируют высокие уровни щелочной фосфатазы (фиг. 3, левое изображение). Кариотип линии DA.2B представляет собой 42X,Y (фиг. 3, правое изображение). ЭСК крысы часто становятся тетраплоидными; поэтому, линии подвергали предварительному скринингу подсчетом распластанных метафазных хромосом; линии с преимущественно нормальными значениями подсчета потом кариотипировали с соблюдением принятых норм.
[00582] Бластоцисты ACI отбирали у самок с суперовуляцией, полученных коммерческим путем. Бластоцисты DA культивировали из замороженных 8-ми клеточных эмбрионов, полученных коммерческим путем. Блестящую оболочку удаляли кислым раствором Тироде, а бластоцисты помещали на митотически инактивированные ЭФМ. Наросты собирали и размножали с использованием стандартных способов. Все бластоцисты помещали на планшеты, культивировали и размножали с использованием среды 2i (Li et al. (2008) Germline competent embryonic stem cells derived from rat blastocysts, Cell 135: 1299-1310; включена в данный документ в полном объеме посредством ссылки).

1.2. Получение крыс
[00583] Химерные крысы получали инъекцией бластоцист и передачей генома ЭСК крыс. Химеры получали микроинъекцией бластоцист, используя исходные ЭСК крысы ACI.G1, как показано на фиг. 8. Крысят F1 окраса агути с альбиносными однопометными животными, показанные на фиг. 9, осеменяли химерами ACI/SD, обозначенными на фиг. 8 звездочкой (*).
Передача зародышевой линии исходных ЭСК крысы.
[00584] Три линии эуплоидных ЭСК крысы оценивали на плюрипотентность путем микроинъекции в бластоцисты альбиносов SD. Химеры идентифицировали по цвету окраса агути, который указывал на влияние ЭСК крыс. Для каждой линии большинство химер передавали геном ЭСКк потомству F1 (табл. 2).

1.3. Деривация эмбриональных стволовых (ЭС) клеток крысы.
[00585] Протокол для суперовуляции, крысы
[00586] День 0: инъецирование сывороткой жеребой кобылы. В/Б, 20 Ед (0,4 мл).
[00587] День 1: Нет действия.
[00588] День 2: (через 46 часов): инъецирование ХГч, В/Б, 50 Ед (1 мл).
[00589] - подготовка одиночных спариваний самок.
[00590] День 3: проверка на наличие пробок. У самок выявлено образование пробок. Это - день 0,5.
[00591] День 6 (е3,5): Эвтанизация самок и вымывание эмбрионов.
[00592] Протокол для деривации ЭС клеток (суперовуляция)
[00593] День 0:
[00594] 1) Эвтанизация самок крыс СО2.
[00595] 2) Протирка передней брюшины 70% этанолом; используя ножницы, вскрывают переднею стенку тела для доступа к внутренним органам.
[00596] 3) Вырезают фаллопиевы трубы и рога матки и помещают их в чашку для культивирования тканей, содержащую теплую среду N2B27. Смывают насколько возможно кровь и переносят в новую чашку с N2B27.
[00597] 4) Используя шприц на 1 мл и тупую иглу 27 калибра, промывают средой рога матки и фаллопиевы трубы для извлечения бластоцистов в среду.
[00598] 5) Собирают бластоцисты обычной пипеткой и переносят на чашку для культивирования эмбрионов, содержащую KSOM + 2i (1 мкМ PD0325901, 3 мкМ CHIR99021). KSOM представляет собой среду для культивирования, производимую Millipore. Номер MR-106-D по каталогу.
[00599] 6) Культивирование в течение ночи при 37°; 7,5% СО2.
[00600] Протокол для деривации ЭС клеток (замороженные эмбрионы)
[00601] День 0:
[00602] 1) Оттаивание замороженных эмбрионов из 8-ми клеток (полученных коммерческим путем) в среде М2. Культивирование 10 минут при комнатной температуре.
[00603] 2) Перенос в KSOM + 2i и культивирование в течение ночи.
[00604] Протокол для деривации ЭС клеток (одинаковый для обоих вариантов)
[00605] День 1:
[00606] 1) Перенос эмбрионов с полостями в среду 2i и культивирование в течение ночи.
[00607] 2) Продолжение культивирования эмбрионов без полостей в KSOM + 2i.
[00608] День 2:
[00609] 1) Перенос всех оставшихся эмбрионов в среду 2i (независимо от того имеют ли они полости).
[00610] 2) Культивирование в течение ночи; продолжение культивирования предыдущих эмбрионов в среде 2i.
[00611] День 3:
[00612] 1) Перенос эмбрионов на 30-40 секунд в кислый раствор Тироде для удаления блестящей оболочки.
[00613] 2) 3х промывание эмбрионов в среде 2i для удаления кислого раствора Тироде.
[00614] 3) Внесение каждого эмбриона в отдельную лунку 96-луночного фидерного планшета (лунки содержат монослой митотически инактивированных эмбриональных фибробластов мыши (ЭФМ).
[00615] 4) Культивирование в течение ночи в среде 2i.
[00616] Дни 4-5:
[00617] 1) Мониторинг помещенных в планшеты эмбрионов на наличие нароста (аморфная недифференцированная масса клеток). Наросты готовы к переносу, когда они становятся приблизительно в два раза больше размера помещенных эмбрионов.
[00618] 2) Каждый день: удаление истощенной среды микропипеткой и замена ее свежей средой 2i.
[00619] 3) Перенос наростов в новые фидерные лунки:
[00620] а. Удаление истощенной среды и осторожное промывание лунки ФСБ.
[00621] b. Удаление ФСБ и добавление 30 мкл 0,05% трипсина; инкубирование в течение 10 минут.
[00622] с. Остановка реакции с трипсином добавлением 30 мкл 2i + 10% ФБС.
[00623] d. Осторожное отделение клеток микропипеткой и перенос всего содержимого лунки в новую лунку в 24-луночном фидерном планшете. Это пассаж 1 (П1).
[00624] е. Культивирование в течение ночи в среде 2i.
[00625] Дни 5-8: (период времени зависит от того насколько быстро растет линия).
[00626] 1) Замена среды каждый день (среда 2i) и мониторинг на присутствие колоний с морфологией ЭСК.
[00627] 2) Когда появляются колонии, продолжение культивирования до распространения колоний до ~ 50% заселенности поверхности.
[00628] 3) Трипсинизация и пересев колоний как указано раньше; размещение на фидерах, 1 лунка на линию в 6-луночной чашке. Это пассаж 2 (П2).
[00629] Дальнейшие действия:
[00630] 1) Непрерывная подпитка и мониторинг каждой линии до приблизительно 50% заселенности.
[00631] 2) Трипсинизация клеток в обычном порядке.
[00632] 3) Остановка действия трипсина 2i + 10% ФБС; осаждение клеток центрифугированием (5', 1200 об/мин в настольной центрифуге Beckman-Coulter).
[00633] 4) Удаление супернатанта аспирацией и осторожное ресуспендирование клеток в 400 мкл среды для замораживания (70% 2i, 20% ФБС, 10% ДМСО).
[00634] 5) Распределение клеток по 2 флаконам и замораживание при -80°. Это пассаж 3 (П3).
[00635] 6) Для долгосрочного хранения переносят флаконы в зону хранения с жидким N2.
[00636] Среду 2i готовили, как указано в табл. 3.


[00637] Материалы: Сывороточный гонадотропин жеребых кобыл (СГЖК).
[00638] Хорионический гонадотропин человека из мочи беременных (ХГЧ).
[00639] Самки крыс (возрастом 5-12 недель).
[00640] Самцы крыс (возрастом от 12 недель до 8 мес), по одному на клетку.
[00641] Шприцы/иглы.
[00642] Помещение для животных с освещением в период 6:00-18:00.
[00643] Методика:
[00644] День 1: 8:00-10:00 AM
[00645] Введение самкам 20 ME СГЖК (0,4 мл), В/Б.
[00646] Неиспользованный СГЖК выбрасывают.
[00647] День 3: 8:00-10:00 AM (48 часов после введения СГЖК).
[00648] Введение самкам 50 ME ХГЧ (1 мл), В/Б.
[00649] Помещают по одной самке на самца в клетку для спаривания.
[00650] Неиспользованный ХГЧ выбрасывают.
[00651] День 4: 8:00-10:00 AM (24 часа после введения ХГЧ).
[00652] Проверка самок на наличие пробок.
[00653] Поставщики гормонов
[00654] СГЖК: Sigma № G-4877 (1000 ME). Ресуспендируют в ФСБ до конечной [] 50 МЕ/мл. Хранение при -20° в аликвотах по 1 мл.
[00655] ХГЧ: Sigma № CG-5 (5000 ME). Ресуспендируют в ФСБ до конечной [] 50 МЕ/мл. Хранение при -20° в аликвотах по 1 мл.
1.4. Кариотипирование линий эмбриональных стволовых клеток крысы
[00656] Кариотипировали линии ЭС клеток крысы, полученные как описано в данном документе, а результаты собраны в табл. 4-7.
[00657]


[00658]

[00659]

[00660]


1.5. Электропорация вектора в эмбриональную стволовую клетку крысы
[00661] 1. Пересев ЭС клеток крысы за 24-48 часов до электропорации.
[00662] 2. Замена среды на RVG2i + ROCKi (10 мкМ Y-27632) за 24 часа до электропорации.
[00663] 3. Замена среды за 30' до трипсинизации.
[00664] 4. Отбор аликвоты ДНК, которой проводится электропорация.
[00665] 5. Подогрев ДНК до КТ в течение >10 мин.
[00666] 6. Прогрев ДНК в течение 5' при 62°С. Помещение ДНК на лед.
[00667] 7. Трипсинизированные клетки:
[00668] а. Сбор плавающих колоний. Промывка чашки для максимально возможного сбора плавающих колоний.
[00669] b. Осаждение колоний: 3' при 750 об/мин.
[00670] с. 1х промывка осадка 5-10 мл ФСБ и повторное центрифугирование/осаждение.
[00671] d. Удаление супернатанта аспирацией; добавление 500λ трипсина, 0,05% + 1% сыворотки петуха.
[00672] i. Не объединять более 1 колонии с чашки 10 см на пробирку. Если слишком много колоний собрано на дне пробирки при трипсинизации, они будут комковаться и большинство клеток будет потеряно.
[00673] е. Выдержка 4' при 37°С. Пипетирование колоний несколько раз для минимизации комкования.
[00674] f. Повторение стадий 1-2 X: Выдержка 4' при 37°.
[00675] g. Останавливают действие трипсина 500λ RVG2i + 10% ФБС.
[00676] 8. Осаждение клеток: 5' при 1200 об/мин.
[00677] 9. Ресуспендирование клеток в 10 мл ФСБ. Подсчет в двух аликвотах по 20λ для определения общего числа клеток.
[00678] 10. Осаждение клеток (5'/1200 об/мин); рассчитывают общее число клеток и суммарный объем ресуспендирования для достижения правильной концентрации клеток (целевое число/75 мкл буферного раствора для ЭП).
[00679] 11. Ресуспендирование в минимальном объеме буферного раствора для ЭП; измеряют общий объем и доводят до целевого объема буферным раствором для ЭП. Буферный раствор для электропорации продается компанией Millipore. № ES-003-D по каталогу. См. статью Valenzuela et al. (2003) Nature Biotechnology 21: 652-659, которая включена в данный документ посредством ссылки.
[00680] 12. Добавление 75λ клеток к 50λ ДНК; перенос 125λ клеток/раствор ДНК в одну лунку 48-луночной кюветы ВТХ.
[00681] а. Заполнение пустых лунок в том же столбце 125λ буферного раствора для ЭП.
[00682] 13. Однократная подача импульса в электропораторе ВТХ:
[00683] а. Настройки: 400 В; Ω; 100 мкФ (установки могут отличаться).
[00684] 14. Помещают кювету на лед на 15' для восстановления.
[00685] 15. Удаление клеток в 5 мл RVG2i + 10 мкМ ROCKi.
[00686] 16. Добавление в чашку 15 см с 20 мл RVG2i + 10 мкМ ROCKi. На чашке размещены ЭФМ с 2х neoR (или в зависимости от схемы другие ЭФМ). Селектируемый маркер neoR представляет собой ген неомицинфосфотрансферазы (neo) по статье Beck et al. (1982) Gene, 19: 327-36 или как описано в патенте США №7205148 или 6596541, каждая публикацияиз которых включена в данный документ посредством ссылки.
[00687] 17. Инкубация 4' при 37°. Начало отбора через 48 часов.
[00688] Применяемый ингибитор ROCK Y-27632.
1.6. Отбор направленной генетической модификации в эмбриональной стволовой клетке крысы.
[00689] 1. Пересев клеток за 24-48 часов до электропорации.
[00690] 2. Замена среды на RVG2i + ROCKi (10 мкМ Y-27632) за 24 часа до электропорации.
[00691] 3. Замена среды за 30' до трипсинизации.
[00692] 4. Отбор аликвоты ДНК, которой проводится электропорация.
[00693] 5. Подогрев ДНК до КТ в течение >10 мин.
[00694] 6. Прогрев ДНК в течение 5' при 62°С. Помещение ДНК на лед.
[00695] 7. Трипсинизированные клетки:
[00696] а. Сбор плавающих колоний. Промывка чашки для максимально возможного сбора плавающих колоний.
[00697] b. Осаждение колоний: 3' при 750 об/мин.
[00698] с. 1х промывка осадка 5-10 мл ФСБ и повторное центрифугирование/осаждение.
[00699] d. Удаление супернатанта аспирацией; добавление 500λ трипсина, 0,05% + 1% сыворотки петуха.
[00700] i. Не объединять более 1 колонии с чашки 10 см на пробирку. Если слишком много колоний собрано на дне пробирки при трипсинизации, они будут комковаться и большинство клеток будет потеряно.
[00701] е. Выдержка 4' при 37°С. Пипетирование колоний несколько раз для минимизации комкования.
[00702] f. Повторение 1-2 X: Выдержка 4' при 37°.
[00703] g. Останавливают действие трипсина 500λ RVG2i + 10% ФБС.
[00704] 8. Осаждение клеток: 5' при 1200 об/мин.
[00705] 9. Ресуспендирование клеток в 10 мл ФСБ. Подсчет в двух аликвотах по 20λ для определения общего числа клеток.
[00706] 10. Осаждение клеток (5'/1200 об/мин); рассчитывают общее число клеток и суммарный объем ресуспендирования для достижения правильной концентрации клеток (целевое число/75 мкл буферного раствора для ЭП).
[00707] 11. Ресуспендирование в минимальном объеме буферного раствора для ЭП; измерение общего объема и доведение до целевого объема буферным раствором для ЭП.
[00708] 12. Добавление 75λ клеток к 50λ ДНК; перенос 125λ клеток/раствор ДНК в одну лунку 48-луночной кюветы ВТХ.
[00709] а. Заполнение пустых лунок в том же столбце 125λ буферного раствора для ЭП.
[00710] 13. Однократная подача импульса в электропораторе ВТХ:
[00711] а. Настройки: 400 В; 100 мкФ (установки могут отличаться).
[00712] 14. Помещают кювету на лед на 15' для восстановления.
[00713] 15. Удаление клеток в 5 мл RVG2i + 10 мкМ ROCKi.
[00714] 16. Добавление в чашку 15 см с 20 мл RVG2i + 10 мкМ ROCKi. На чашке размещены ЭФМ с 2х neoR (или в зависимости от схемы другие ЭФМ).
[00715] 17. Инкубация 4' при 37°. Начало отбора через 48 часов.
[00716] 18. Протокол отбора G418 выполняют следующим образом:
[00717] а. День 2 (2-й день после ЭП): инкубирование клеток в среде 2i + G418, 75 мкг/мл.
[00718] b. День 3: инкубирование клеток в среде 2i без G418.
[00719] с. День 4: инкубирование клеток в среде 2i + G418, 75 мкг/мл.
[00720] d. День 5: инкубирование клеток в среде 2i без G418.
[00721] е. День 6: инкубирование клеток в среде 2i + G418, 75 мкг/мл.
[00722] f. День 7: инкубирование клеток в среде 2i без G418.
[00723] g. День 8: инкубирование клеток в среде 2i + G418, 75 мкг/мл.
[00724] h. День 9: инкубирование клеток в среде 2i без G418.
[00725] i. День 10: инкубирование клеток в среде 2i + G418, 75 мкг/мл.
[00726] j. День 11: инкубирование клеток в среде 2i без G418.
[00727] k. День 12: сбор колоний для размножения для скрининга. Каждую колонию отделяли в растворе 0,05% трипсина + 1% сыворотки петуха в течение 10 минут и потом помещали в 1 лунку 96-луночного фидерного планшета.
[00728] 19. Размножение колоний в течение 3 дней в среде 2i.
[00729] 20. Пересев клонов 1:1 в новые 96-луночные фидерные планшеты.
[00730] 21. Размножение клонов в течение 3 дней в среде 2i.
[00731] 22. Для каждого клона отделение колоний трипсином.
Замораживают 2/3 количества каждого клона и хранят при -80°; помещают оставшуюся 1/3 на планшеты с ламинином (96-луночные планшеты покрывали 10 мкг/мл ламинина).
[00732] 23. Когда планшеты с ламинином заполняются, осуществляют пересев для лаборатории скрининга для генотипирования клонов.
1.7. Молекулярная сигнатура эмбриональных стволовых клеток крысы.
[00733] Гены, перечисленные в табл. 8, в ЭС клетках крысы экспрессировались в 20 раз ниже, чем соответствующие гены в ЭС клетках мыши. Гены, перечисленные в табл. 9, в ЭС клетках крысы экспрессировались на уровнях в 20 раз выше, чем соответствующие гены в ЭС клетках мыши.
[00734] Данные на микрочипах в табл. 8 и 9 получены следующим образом. ЭС клетки крысы (ACI.G2 и DA.2B) и ЭС клетки мыши (F1H4) культивировали в среде 2i в течение 3 пассажей до заполнения поверхности. Клетки F1H4 культивировали на планшетах с покрытием желатином в отсутствии фидеров. ЭС клетки мыши F1H4 получали из гетерозиготных эмбрионов 129S6/SvEvTac и C57BL/6NTac (см., например, пат. США №7294754 и статью Poueymirou, W.T., Auerbach, W., Frendewey, D., Hickey, J.F., Escaravage, J.M., Esau, L., Dore, A.T., Stevens, S., Adams, N.C., Dominguez, M.G., Gale, N.W., Yancopoulos, G.D., DeChiara, T.M., Valenzuela, D.M. (2007), включенные в данный документ в полном объеме посредством ссылки).
[00735] Следующий протокол использовался для приготовления образцов: Пробирки Eppendorf на 1,5 мл маркировали обозначением ID образца. Клетки, выросшие на планшете, ополаскивали фосфатно-солевым буферным раствором (ФСБ) при 37°С. ФСБ удаляли и добавляли 300 мкл раствора Trizol®. Для разрушения клеток в растворе Trizol® (Life Technology) использовали скребок. Лизированные клетки собирали в пробирку Epperdorf на 1,5 мл в растворе Trizol®. В отношении клеток, выросших в суспензии, клетки ополаскивали ФСБ при 37°С и собирали в пробирку на 1,5 мл. Клетки центрифугировали; ФСБ удаляли и к клеткам добавляли 300 мкл раствора Trizol®. Мембраны клеток разрушали пипетированием. Образцы сортировали на FACS с отбором 10-105 клеток, объем концентрировали до объема менее 100 мкл. Добавляли 4 объема буферного раствора для лизиса РНК и перемешивали пипетированием. В отношении образца, к 80 мкл образца добавляли 320 мкл буферного раствора для лизиса РНК. Образцы хранили при -20°С.
[00736] Для измерения уровня экспрессии генов мыши и крысы использовали полное секвенирование РНК (RNA-Seq). Данные считывания секвенирования картировали с референтным геномом мыши и крысы программой Tophat и рассчитывали RPKM (количество фрагментов на тысячу пар нуклеотидов экзона на миллион картированных фрагментов) для генов мыши и крысы. Отбирали гомологичные гены на основании символа гена и потом применяли критерий Стьюдента (t-тест) для сравнения уровня экспрессии каждого гена между организмами мыши и крысы. В первой десятке генов с наибольшей экспрессией был miR-632, экспрессировавшийся в ЭСК крысы, но не экспрессировавшийся в ЭС клетках мыши. Хотя и не существует сравнительных данных по miR-632, основанных на уровне его экспрессии по сравнению с другими генами, экспрессировавшимися в ЭСК крысы, и не известна их функция в эмбриональном развитии, miR-632 выбран маркером для ЭС клеток крысы.
[00737]







[00738]



[00739]


[00740] Для ЭС клеток крысы также разработали дополнительную молекулярную сигнатуру, использующую маркеры/гены плюрипотентности. В табл. 11 представлен перечень генов и их ранги экспрессии по данныу определения профилей экспрессии РНК. мРНК выделяли из ЭС клеток крыс и уровень экспрессии различных маркеров сравнивали относительно друг друга. Термин «ранг» означает сравнительные уровни экспрессии отдельных генов: чем выше ранг (1 является наивысшим), тем выше экспрессия. К примеру, ранг Oct4 равный 13 означает что из всех проанализированных генов, он экспрессируется больше, чем все остальные кроме 12 генов. Фоновым значением в этом эксперименте было любое значение экспрессии ниже 30; 6107 генов обладали значениями экспрессии 30 или выше.
[00741]


Пример 2. Инактивация геномных локусов у крыс
2.1. Инактивация эндогенных геномных локусов с использованием эндонуклеазного агента
[00742] Для того, чтобы ввести мутантную аллель в эндогенный геномный локус крысы ЭС клеткам крысы, описанным в данном документе, проводят электропорацию с экспрессионными векторами (или мРНК), которые экспрессируют ZFN 1 и 2 (или TALEN 1 и 2). Эти белки связывают свои целевые последовательности на противоположных цепях, разделенных от около 6 п.н. до около 40 п.н. Создается двухцепочечный разрыв в пределах целевого локуса, который клетка пытается репарировать путем негомологичного соединения концов (НГСК). Во многих случаях НГСК приводит к созданию делеции, которая часто разрушает функционирование гена (чаще всего образованием мутации сдвига рамки считывания). Для того, чтобы идентифицировать положительный клон, содержащий мутантную аллель, клетки после электропорации помещают на планшет при низкой плотности, поскольку не проводится отбор с использованием лекарственных веществ. Колонии собирают и анализируют по целевому сайту для того, чтобы увидеть была ли создана мутация (например, используя анализ модификации аллели (МОА), описанный выше). Отобранные ЭС клетки, содержащие мутантную аллель, потом вводятся в эмбрион-хозяин крысы, к примеру, эмбрион крысы на стадии преморулы или стадии бластоцисты и имплантируются в матку суррогатной матери для получения крысы-основателя (крысы F0). Впоследствии, крыса-основатель скрещивается с крысой дикого типа для образования потомства F1 гетерозиготного по мутантной аллели. Спаривание гетерозиготной крысы F1 может создавать потомство гомозиготное по мутантной аллели.
2.2. Таргетинг ЭСК крысы для инактивации гена аполипопротеина Е (АроЕ) с использованием цинк-пальцевых нуклеаз
[00743] В цинк-пальцевых нуклеазах применяются специфические по последовательностям модулярные ДНК-связывающие домены для прямой эндонуклеазной активности по уникальной целевой последовательности в геноме. ZFN сконструированы как пара мономеров. Каждый мономер содержит неспецифический домен расщепления из эндонуклеазы FokI, гибридизированной с 3 или более цинк-пальцевыми ДНК-связывающими доменами. Каждый цинковый палец связывает подсайт из 3 п.н., а специфичность достигается комбинированными целевыми сайтами обоих мономеров. ZFN продуцируют двухцепочечные разрывы (ДЦР) в ДНК и мутации (инсерции или делеции) часто происходят при негомологичном связывании концов (НГСК). ДЦР также стимулируют гомологично-направленную репарацию (ГНР) путем гомологичной рекомбинации, когда последовательность-донор снабжена ZFN.
[00744] Такие ZFN применяли в комбинации с различными способами и композициями, описанными в данном документе, для улучшения эффективности таргетинга. Локус аполипопротеина Е (АроЕ) крысы таргетировали как описано в примере 3.2(a)(i), за исключением экспрессионных векторов, которые экспрессировали ZFN 1 и 2, также вводили в ЭС клетки крысы. См. фиг. 10, на которой представлено схематическое изображение таргетирующего события АроЕ в комбинации с rTZFN1P и rTZFN2P. Эффективность таргетинга определяли, как описано ниже в примере 6, а результаты показаны на фиг. 11. Неожиданно, эффективность таргетинга увеличилась в 8-10 раз.
[00745] Плазмидный таргетирующий вектор встраивали с самоделетирующейся под действием лекарственного вещества селекционной кассетой и геном lacZ в качестве репортерного гена. Достигалась хорошая эффективность таргетинга и получали высокий % химер. Цинк-пальцевые нуклеазы (ZFN) также испытывали в комбинации с таргетирующими векторами для проверки их влияния на улучшение эффективности таргетинга. Таргетирующий вектор совместно экспрессировался с экспрессионными векторами для 2 пар ZFN, которые разрезали локус АроЕ. Проводили электропорацию ЭСК клонов крысы как таргетирующим вектором так и набором ZFN, что показало эффективность таргетинга в 8-10 раз выше, чем при электропорации ЭС клонов крысы одним таргетирующим вектором. Более того, в около 2% клонов обнаружен биаллельный гомозиготный таргетинг. У двух из этих таргетированных клонов получили высокий % химер.
[00746] АроЕ-таргетированные (с помощью ZFN) клоны ЭСК крысы вводили микроинъекцией в бластоцисты SD, которые потом переносили псевдобеременным самкам-реципиентам SD с использованием стандартных методик. Химер идентифицировали по цвету окраса; самцы-химеры F0 скрещивали с самками SD. Зародышевую линию крысят F1 генотипировали на наличие таргетированной аллели АроЕ (фиг. 17). У двух из этих таргетированных клонов был высокий % химер.
[00747] Крысы с нокаутом АроЕ обеспечивают возможность для изучения различных типов нарушений и заболеваний. У людей аполипопротеин обнаружен в хиломикроне, ЛВП, ЛНП и ЛПОНП. АроЕ является незаменимым для нормального катаболизма богатых триглицеридами заменителей липопротеинов. Дефекты в АРОЕ приводят к многочисленным болезненным состояниям, включающим, к примеру, наследственную гиперхолестеринемию, гиперлипемию, беталипопротеинемию, наследственную дисбеталипопротеинемию, гиперлипопротеинемию III типа (ГЛП III), риск развития ишемической болезни сердца. Одну изоформу (АроЕ4) связывают с поздним проявлением наследственной или спорадичной болезни Альцгеймера, вероятно также с МС.
[00748] У мышей, как и людей, АроЕ главным образом обнаружен в ЛВП; он участвует в транспорте холестерина. АроЕ-дефектные мыши (2 независимых НО) обладают в 5 раз большим уровнем нормального холестерина в плазме; у них до возраста 3 месяцев развивается богатые пенными клетками отложения в проксимальной аорте (сравнимые с синдромом у человека).
[00749] Использование нокаутов АроЕ у крыс предлагает животную модель для изучения эндотелиальной функции, включая, но не ограничиваясь, изучением образования бляшек, транскрипционных изменений (секвенирование РНК) и функционирования ex vivo. Более того, больший размер крыс облегчает все эти анализы и потенциально улучшает качество данных секвенирования РНК.
2.3. Инактивация локуса рецептора гамма интерлейкина-2 крысы (IL2r-γ) с использованием цинк-пальцевых нуклеаз
[00750] Локус рецептора гамма интерлейкина-2 крысы (IL2r-γ) таргетировали, как описано в примере 3.3(a), за исключением экспрессионных векторов, которые экспрессировали ZFN U (ZFN прямого считывания) и ZFN D (ZFN обратного считывания), и также вводили в ЭС клетки крысы. На фиг. 18 представлено схематическое изображение таргетирующего события IL2r-γ в комбинации с ZFN U и ZFN D. Последовательность локуса IL2r-γ, которую связывают эти цинковые пальцы, отмечена на фиг. 18. Эффективность таргетинга определяли, как описано ниже в примере 3.3(a), а результаты показаны на фиг. 18. Вкратце, гомозиготно таргетированные клоны подтверждали методом ПЦР. Для пары ZFN1 получено: 173 мутантных клонов из 192 скринированных (90%), а для пары ZFN2 получено: 162 клона из 192 (84%) скринированных.
[00751] IL2r-γ-таргетированные (с помощью ZFN) клоны ЭСК крысы вводили микроинъекцией в бластоцисты SD, которые потом переносили псевдобеременным самкам-реципиентам SD с использованием стандартных методик. Химер идентифицировали по цвету окраса; самцы-химеры F0 скрещивали с самками SD. Зародышевую линию крысят F1 генотипировали на наличие таргетированной аллели IL2r-γ.
2.4. Инактивация локуса рецептора гамма интерлейкина-2 крысы (IL2r-γ) с использованием CRISPR/Cas9
[00752] Локус IL2r-γ крысы таргетировали как описано в примере 3.3(a), за исключением того, что систему CRTSPR/Cas9 также вводили в ЭС клетки крысы для содействия эффективности таргетинга. Применяли универсальные векторы SBI: System Biosciences Cas9 «SmartNuclease», а экспрессия Cas9 управлялась промотором CAG, EF1a, PGK или CMV. Специальную гРНК лигировали с вектором и экспрессировали под управлением промотора H1. Сконструировали 4 гРНК против I12rg. Эффективность таргетинга при применении различных гидовых РНК показана на фиг. 19.
Пример 3: Направленная модификация геномных локусов крысы
3.1. Таргетинг ЭСК крысы: локус Rosa 26 крысы.
[00753] Локус Rosa 26 крысы лежит между генами Setd5 и Thumpd3, как у мыши, с таким же расположением. Локус Rosa 26 крысы (фиг. 12, изображение В) отличается от локуса Rosa 26 мыши (фиг. 12, изображение А). Транскрипты Rosa26 мыши содержат 2 или 3 экзона. Локус крысы содержит 2-й экзон 1 (Ex1b) в дополнение к гомологичному экзону по отношению к экзону 1 мыши (Ex1a). У крысы 3-й экзон не был идентифицирован. Таргетинг аллели Rosa26 крысы отображен на фиг. 12 (внизу), когда гомологичные плечи, размером 5 т.н. каждое, клонировали методом ПЦР с использованием геномной ДНК из ЭСК крысы DA. Таргетированная аллель содержала кассету с акцептором сплайсинга (SA)-lacZ-hUB-neo, заменившую делецию размером 117 п.н. в интроне Rosa26 крысы.
[00754] Определяли эффективность таргетинга в локусе Rosa 26 крысы (табл. 12). Проводили электропорацию линеаризованного вектора в ЭСК крысы DA или ACI, а трансфецированные колонии культивировали в среде 2i + G418 с использованием стандартных методик. Отдельные колонии собирали и проводили скрининг с использованием анализа потери аллели (LOA) (Valenzuela, D. et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21: 652-660, включена в данный документ посредством ссылки).

[00755] Получение химер и передача зародышевой линии с использованием Rosa26-таргетированных клонов ЭСК крысы. Повторно подтвержденные Rosa26-таргетированные клоны ЭСК крысы вводили микроинъекцией в бластоцисты SD, которые потом переносили псевдобеременным самкам-реципиентам SD с использованием стандартных методик. Химер идентифицировали по цвету окраса; самцы-химеры F0 скрещивали с самками SD. Зародышевую линию (агути) крысят F1 генотипировали на наличие таргетированной аллели Rosa26. Девять из 22 крысят окраски агути генотипировали как гетерозиготных по локусу Rosa26 (табл. 13).

3.2.(a)(i). Таргетинг локуса аполипопротеина Е (АроЕ) крысы.
[00756] Локус аполипопротеина Е (АроЕ) крысы таргетировали для разрушения функционирования АроЕ. Таргетинг локуса АроЕ выполнен с использованием таргетирующего вектора, содержащего кассету lacZ-hUb-neo, фланкированную 5'- и 3'-гомологичными плечами, гомологичными локусу АроЕ. На фиг. 20 изображен генетически модифицированный локус АроЕ крысы, который разрушен делецией размером 1,8 т.н. и инсерцией кассеты lacZ-hUb-neo, которая дополнительно включает самоделетирующуюся Cre кассету, содержащую ген Crei, управляемый промотором протамина. Условия электропорации были следующими: 6 мкг ДНК; 2,05×106 клеток; 400 В; 200 мкФ: 342 V, 593 мкс; на чашке 15 см при 2х плотности neoR ЭФМ в среде 2i + 10 мкМ ROCKi.
[00757] Определили эффективность таргетинга в локусе АроЕ и данные показаны в табл. 14. Проводили электропорацию линеаризованного вектора в ЭСК крысы DA.2B, полученные от штамма DA, а трансфецированные колонии культивировали с использованием стандартных методик. Отдельные колонии собирали и проводили скрининг с использованием анализа потери аллели (LOA).

[00758] Провели получение химер и передачу зародышевой линии с использованием АроЕ-таргетированных клонов ЭСК крысы. АроЕ-таргетированные клоны ЭСК крысы вводили микроинъекцией в бластоцисты SD, которые потом переносили псевдобеременным самкам-реципиентам SD с использованием стандартных методик. Химер идентифицировали по цвету окраса; самцы-химеры F0 скрещивали с самками SD. Крысят F1 генотипировали на наличие таргетированной аллели АроЕ (табл. 15).

[00759] Дополнительные данные таргетинга для АроЕ также представлены на фиг. 21.
3.2.(a)(ii). Таргетинг АроЕ в организм крыс таргетирующим вектором
[00760] На фиг. 20 представлено схематическое изображение локуса АроЕ крысы и таргетирующей плазмиды. На верхнем схематическом изображении фиг. 20 показана геномная структура локуса АроЕ крысы и геномные участки, соответствующие 5'- и 3'-гомологичным плечам (5 т.н. и 5,4 т.н., соответственно; темно-серые прямоугольники). Экзон 1 АроЕ является некодирующим и показан в виде незаполненного прямоугольника в ближайшем положении к 5'-гомологичному плечу. 3 интрона АроЕ отмечены линиями, а экзоны 2 и 3 включают кодирующие участки и показаны заполненными точками серыми прямоугольниками. Экзон 4 содержит как кодирующую так и некодирующую последовательности, как отмечено заполненными точками затемненным прямоугольником и незаполненным прямоугольником.
[00761] Нижнее схематическое изображение на фиг. 20 представляет таргетирующий вектор. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (5 т.н. и 5,4 т.н., соответственно). Таргетирующий вектор содержит репортерный ген (lacZ) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки). Самоделетирующаяся кассета содержит ген Crei, функционально связанный с промотором мыши Prm1, и селекционную кассету, содержащую ген устойчивости к неомицину, функционально связанный с промотором убиквитина человека.
[00762] Ген Crei, содержит два экзона, кодирующие рекомбиназу Cre, которые разделены интроном (Crei) для предотвращения ее экспрессии в прокариотической клетке. См., к примеру, патент США 8697851 и опубликованную заявку США 2013-0312129, которые подробно описывают самоделетирующуюся кассету, и этим включены в данный документ в своей полноте посредством ссылки. Путем применения промотора Prm1 самоделетирующаяся кассета может быть удалена исключительно в мужских зародышевых клетках крыс F0. Проводили электропорацию таргетирующего вектора в ЭС клетки крысы, полученные в примере 1, и клетки помещали на чашку 15 см при 2х плотности устойчивых к неомицину ЭФМ в среде 2i + 10 мкМ ROCKi. Трансформированные ЭС клетки крысы культивировали, отбирали и поддерживали, как описано в примере 1.
[00763] Как показано в табл. 23, провели скрининг среди 384 колоний и получили 23 таргетированных клона. Эффективность таргетинга составила 5,99%. Инъецировали 3 клона в бластоцисты, как описано в данном документе в примере 1. Получили 3 клона, продуцировавшие химеры, и 2 из клонов передавали направленную модификацию по зародышевой линии.
3.2.(a)(iii). Таргетинг АроЕ в организм крыс таргетирующим вектором в комбинации с цинк-пальцевыми нуклеазами
[00764] Таргетирующий вектор, использованный в примере 3.2(a)(ii), применяли в комбинации с цинк-пальцевыми нуклеазами для таргетирования локуса АроЕ крысы. В табл. 16 представлены сводные данные по геномной организации локуса АроЕ крысы. Положения, показанные в табл. 16, взяты из сборки 5.0 референтной последовательности генома крысы (ENSMBL). АроЕ находится на хромосоме 1 на цепи (-).
[00765]


[00766] На фиг. 10 представлено схематическое изображение локуса АроЕ крысы и отмечено серыми прямоугольниками сайт разрезания ZFN1 и ZFN2. Сайт разрезания ZFN1 находится в экзоне 3, а сайт разрезания ZNF2 находится в интроне 3. Точное положение обоих сайтов ZFN отмечено в табл. 16. Темно-серыми прямоугольниками отмечены геномные участки, соответствующие 5'- и 3'-гомологичным плечам (5 т.н. и 5,4 т.н., соответственно). Экзон 1 АроЕ является некодирующим и показан в виде незаполненного прямоугольника в ближайшем положении к 5'-гомологичному плечу. Три интрона гена АроЕ отмечены в виде линий, а экзоны 2 и 3 включают кодирующие участки и показаны заполненными точками серыми прямоугольниками. Экзон 4 содержит как кодирующую так и некодирующую последовательности, как отмечено заполненными точками затемненным прямоугольником и незаполненным прямоугольником.
[00767] Примененный таргетирующий вектор был таким же, как в примере 3.2(а)(ii) и показан на фиг. 20. ZFN вводили в виде двух экспрессионных плазмид, каждая из которых содержит половину пары ZFN. Использовали 20 мкг плазмиды для синтеза ZFN1 и 20 мкг плазмиды для ZFN2. ZFN приобретали в компании Sigma. Экспрессия каждой ZFN управлялась промотором CMV.
[00768] Проводили электропорацию таргетирующего вектора в ЭС клетки крысы, полученные в примере 1, и клетки помещали на чашку 15 см при 2х плотности neoR ЭФМ в среде 2i + 10 мкМ ROCKi. Трансформированные ЭС клетки крысы культивировали, отбирали и поддерживали, как описано в примере 1.
[00769] Как показано в табл. 23, провели скрининг среди 384 колоний и получили 290 таргетированных клонов. Эффективность таргетинга составила 75,52%. Инъецировали 2 клона в бластоцисты как описано в данном документе в примере 1. Получили два клона, продуцировавших химеры, и один из клонов передавал направленную модификацию по зародышевой линии.
[00770] Более того, применение ZFN1 и ZFN2 привело к созданию 8 биаллельных таргетированных клонов с эффективностью 2,08%.
3.2.(b)(i). Направленная модификация локуса аполипопротеина Е (АроЕ) крысы с использованием большого таргетирующего вектора (LTC).
[00771] Таргетинг локуса АроЕ выполняли с использованием большого таргетирующего вектора (LTVEC), содержащего кассету lacZ-mouse Prm1-Crei, фланкированную к локусу АроЕ 5'-гомологичным плечом размером около 45 т.н. и к локусу АроЕ 3'-гомологичным плечом размером 23 т.н. На фиг. 22 изображен локус АроЕ крысы, в котором локус АроЕ разрушен делецией размером 1,83 т.н. и инсерцией гена lacZ и самоделетирующейся кассеты, содержащей кассету mPrm1-Crei и селекционную кассету hUb-neo. Способы, примененные в примере 3.2(a)(i), могут применяться для введения этого вектора в ЭС клетки крысы.
Пример 3.2.(b)(ii). Таргетинг локуса АроЕ крысы большим таргетирующим вектором (LTVEC).
[00772] На фиг. 22 представлено схематическое изображение локуса АроЕ крысы и большой таргетирующий вектор (LTEVC). На верхнем схематическом изображении фиг. 22 показана геномная организация локуса АроЕ крысы и геномные участки, соответствующие 5'- и 3'-гомологичным плечам (45 т.н. и 5,4 т.н., соответственно; темно-серые прямоугольники). Экзон 1 АроЕ является некодирующим и показан в виде незаполненного прямоугольника в ближайшем положении к 5'-гомологичному плечу. 3 интрона АроЕ отмечены линиями, а экзоны 2 и 3 включают кодирующие участки и показаны заполненными точками серыми прямоугольниками. Экзон 4 содержит как кодирующую так и некодирующую последовательности, как отмечено заполненными точками затемненным прямоугольником и незаполненным прямоугольником.
[00773] Нижнее схематическое изображение на фиг. 22 представляет LTVEC. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (45 т.н. и 23 т.н., соответственно). Таргетирующий вектор содержит репортерный ген (lacZ) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки), которая содержит ген Crei, функционально связанный с промотором Prm1 мыши, и селекционную кассету по лекарственному веществу, содержащую ген устойчивости к неомицину, функционально связанный с промотором убиквитина человека. Crei, содержит два экзона, кодирующие рекомбиназу Cre, которые разделены интроном (Crei) для предотвращения ее экспрессии в прокариотической клетке. См., к примеру, патент США 8697851 и опубликованную заявку США 2013-0312129, которые подробно описывают самоделетирующуюся кассету, и этим документы включены в своей полноте посредством ссылки. Применением промотора Prm1 мыши самоделетирующаяся кассета может быть удалена исключительно в мужских зародышевых клетках крысы F0.
[00774] Проводили электропорацию LTVEC в ЭС клетки крысы, полученные в примере 1, и клетки помещали на чашку 15 см при 2х плотности neoR ЭФМ в среде 2i + 10 мкМ ROCKi. Трансформированные ЭС клетки крысы культивировали, отбирали и поддерживали, как описано в примере 1.
[00775] Как показано в табл. 23, провели скрининг среди 288 колоний и получили 8 таргетированных клонов. Эффективность таргетинга составила 2,78%. Инъецировали 3 клона в эмбрион-хозяин на стадии бластоцисты, как описано в данном документе в примере 2, для получения химерных крыс (F0). Более того, был получен один биаллельный таргетированный клон, что обеспечивает биаллельную эффективность 0,35%.
3.2.(b)(iii). Таргетинг АроЕ в организм крыс большим таргетирующим вектором (LTVEC) в комбинации с цинк-пальцевыми нуклеазами
[00776] LTVEC, использованный в примере 3.2.(b)(ii), применяли в комбинации с цинк-пальцевыми нуклеазами для таргетирования локуса АроЕ крысы. В табл. 16 представлены сводные данные по геномной организации локуса АроЕ крысы, а показанные положения взяты из сборки 5.0 референтной последовательности генома крысы (ENSMBL).
[00777] На фиг. 23 представлено схематическое изображение локуса АроЕ крысы и отмечено серыми прямоугольниками сайт разрезания ZFN1 и ZFN2. Сайт разрезания ZFN1 находится в экзоне 3, а сайт разрезания ZNF2 находится в интроне 3. Точное положение обоих сайтов ZFN отмечено в табл. 16. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (45 т.н. и 23 т.н., соответственно). Экзон 1 гена АроЕ является некодирующим и показан в виде незаполненного прямоугольника в ближайшем положении к 5'-гомологичному плечу. Три интрона гена АроЕ отмечены в виде линий. Экзоны 2 и 3 включают кодирующие участки и показаны заполненными точками серыми прямоугольниками. Экзон 4 содержит как кодирующую так и некодирующую последовательности, как отмечено заполненными точками затемненным прямоугольником и незаполненным прямоугольником.
[00778] Примененный LTVEC был таким же, как в примере 3.2(b)(ii) и показан на фиг. 22. ZFN вводили в виде двух экспрессионных плазмид, каждая из которых содержит половину пары ZFN. Использовали 20 мкг плазмиды для синтеза ZFN 1 и 20 мкг плазмиды для ZFN2. ZFN приобретали в компании Sigma. Экспрессия каждой ZFN управлялась промотором CMV.
[00779] Проводили электропорацию таргетирующего вектора в ЭС клетки крысы, полученные в примере 1, и клетки помещали на чашку 15 см при 2х плотности neoR ЭФМ в среде 2i + 10 мкМ ROCKi. Трансформированные ЭС клетки крысы культивировали, отбирали и поддерживали, как описано в примере 1.
[00780] Как показано в табл. 23, провели скрининг среди 288 колоний и получили 16 таргетированных клонов. Эффективность таргетинга составила 5,56%. Инъецировали один клон в бластоцисты, как описано в данном документе в примере 2.
[00781] Более того, применение ZFN1 и ZFN2 привело к созданию одного биаллельного таргетированного клона с эффективностью 0,35%.
3.3(a). Таргетинг локуса рецептора гамма интерлейкина-2 крысы (IL2r-γ)
[00782] Локус рецептора гамма интерлейкина-2 крысы (IL2r-γ) таргетировали для разрушения функционирования IL2r-γ. IL2r-γ играет важную роль в сигналинге IL-2, IL-4, IL-7, IL-9, IL-15, IL-21 и мутации в IL2r-γ ассоциированы с тяжелыми дефектами в развитии Т-, В- и NK-клеток.
[00783] Таргетинг локуса IL2r-γ выполнен с использованием таргетирующего вектора, содержащего кассету eGFP-hUb-neo, фланкированную 5'- и 3'-гомологичными плечами, гомологичными локусу IL2r-γ. На фиг. 26 изображена геномная структура локуса IL2r-γ крысы, в которой локус IL2r-γ разрушен делецией размером 3,2 т.н. Таргетированный локус IL2r-γ также включал ген eGFP и самоделетирующуюся кассету, содержавшую Crei, функционально связанный с промотором мыши протамина 1, и селекционную кассету по лекарственному веществу, содержавшую промотор hUb, функционально связанный с геном устойчивости к неомицину.
[00784] Определили эффективность таргетинга в локусе IL2r-γ и данные показаны в табл. 17. Проводили электропорацию линеаризованного вектора в ЭСК крысы DA.2B, а трансфецированные колонии культивировали с использованием стандартных методик. Отдельные колонии собирали и проводили скрининг с использованием анализа потери аллели (LOA).

[00785] Провели получение химер и передачу зародышевой линии с использованием IL2r-γ-таргетированных клонов ЭСК крысы. IL2r-γ-таргетированные клоны ЭСК крысы вводили микроинъекцией в бластоцисты SD, которые потом переносили псевдобеременным самкам-реципиентам SD с использованием стандартных методик. Химер идентифицировали по цвету окраса; самцы-химеры F0 скрещивали с самками SD. Зародышевую линию крысят F1 генотипировали на наличие таргетированной аллели IL2r-γ (табл. 18).
[00786]

[00787] Дополнительно исследовали фенотип Il2rg-/Y химер №3. Мононуклеарные клетки периферической крови (МКПК) окрашивали антителами, которые распознают антигены в более лимфоидных линиях дифференцировки. У 2 из химер обнаружили GFP-положительные МКПК. Более того, клетки GFP+ были отрицательными по маркеру Т-клеток CD3 и были в основном отрицательны по маркеру В-клеток В220 и маркеру NK-клеток CD161a. См. фиг. 30. Малые дважды положительные популяции соответствуют опубликованному фенотипу мышей с нокаутом I12rg. Эти данные получили от химерной крысы, которая содержит клетки положительные по рецептору гамма IL2, а это может усложнить анализ фенотипа.
3.3(b). Направленная модификация локуса рецептора гамма интерлейкина-2 крысы (IL2r-γ)
[00788] Локус рецептора гамма интерлейкина-2 крысы (IL2r-γ) таргетировали для разрушения функционирования IL2r-γ в организме крыс. На фиг. 26 показана геномная структура локуса I12rg крысы и таргетирующий вектор, вводимый в локус. В качестве репортера выбрали eGFP так, чтобы иммунофенотип генетически модифицированных крыс мог быть проанализирован с использованием FACS. Использовали самоделетирующуюся кассету (hUb-Neo; Prm1-Cre) для удаления селекционной кассеты по лекарственному веществу и гена Cre исключительно в мужских зародышевых клетках крысы F0. В дополнение к этому, таргетирующий вектор был сконструирован для удаления всего кодирующего участка (около 3,2 т.н.) гена I12rg крысы.
[00789] Размер делеции ЭСК крысы подтверждали методом ПЦР с использованием праймеров, специфических к локусу I12rg крысы. При микроинъекции таргетированных клонов в эмбрионы-хозяева на стадии бластоцисты, получили высокое процентное содержание химер. Такие химеры готовили для воспроизводства. Для определения того, прошел ли таргетинг как ожидалось, у химер перед воспроизводством собирали периферическую кровь и посредством FACS анализировали фенотип иммунных клеток в периферической крови. Как показано на фиг. 30, в периферической крови 2 из 3 проверенных химер обнаружили GFP-положительные клетки (верхнее правое изображение) и химерные крысы содержали менее 1% Т-клеток, менее 1% В-клеток и менее 1% NK-клеток, которые положительны по GFP (т.е. это были клетки с НО Il2rg).
3.4(a). Таргетинг локуса Rag2 в организм крыс большим таргетирующим вектором (LTVEC)
[00790] В табл. 19 представлены сводные данные по геномной организации локуса Rag2 крысы, а показанные положения взяты из сборки 5.0 референтной последовательности генома крысы (ENSMBL). Rag2 находится на хромосоме 3 на цепи (+).
[00791]

[00792] На фиг. 27 представлено схематическое изображение локуса Rag2 крысы и большого таргетирующего вектора (LTVEC). На верхнем схематическом изображении фиг. 27 показана геномная организация локуса АроЕ крысы и геномные участки, соответствующие 5'- и 3'-гомологичным плечам (48 т.н. и 15 т.н., соответственно; темно-серые прямоугольники). Rag2 содержит единственный экзон, отмеченный заполненным точками серым затемнением.
[00793] Нижнее схематическое изображение на фиг. 27 представляет LTVEC. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (48 т.н. и 15 т.н., соответственно). LTVEC содержит репортерный ген (lacZ) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки). Самоделетирующаяся кассета содержит промотор мыши Prm1, функционально связанный с геном Crei, и селекционную кассету по лекарственному веществу, содержащую промотор убиквитина человека, функционально связанный с геном устойчивости к неомицину. Crei, содержит два экзона, кодирующие рекомбиназу Cre, разделенные интроном (Crei) для предотвращения ее экспрессии в прокариотической клетке. См., к примеру, патент США 8697851 и опубликованную заявку США 2013-0312129, которые подробно описывают самоделетирующуюся кассету и этим документы включены в своей полноте посредством ссылки. Применением промотора Prm1 мыши самоделетирующаяся кассета может быть удалена исключительно в мужских зародышевых клетках крыс F0.
[00794] Проводили электропорацию LTVEC в ЭС клетки крысы, полученные в примере 1, и клетки помещали на чашку 15 см при 2х плотности neoR ЭФМ в среде 2i + 10 мкМ ROCKi. Трансформированные ЭС клетки крысы культивировали и поддерживали, как описано в примере 1.
Колонии подвергли скринингу, как описано в других местах данного документа, и получили таргетированные клоны. Таргетированные клоны потом инъецировали в эмбрион-хозяин, как описано в других местах данного документа, для получения крысы F0.
3.4.(b). Таргетинг локуса Rag1 и Rag 2 в организм крыс
[00795] На фиг. 28 представлена геномная структура локуса Rag1/Rag2 крысы. CDS отмечает кодирующую последовательность, а серые прямоугольники представляют экзоны. Rag2 находится на цепи «плюс» с транскрипцией вправо. Rag2 находится на цепи «минус» с транскрипцией влево. М.п.н. = миллион пар нуклеотидов.
[00796] В табл. 20 представлены сводные данные по геномной организации локуса Rag2 и Rag1 крысы, а показанные положения взяты из сборки 5.0 референтной последовательности генома крысы (ENSMBL). Rag1 находится на хромосоме 3 на цепи (-).
[00797]

[00798] На фиг. 29 представлено схематическое изображение локуса Rag2 и Rag1 крысы и большого таргетирующего вектора (LTVEC). На верхнем схематическом изображении фиг. 29 показана геномная организация локусов Rag1 и Rag2 крысы и геномные участки, соответствующие 5'- и 3'-гомологичным плечам (48 т.н. и 84 т.н., соответственно; темно-серые прямоугольники). Rag2 и Rag 1 каждый содержит единственный экзон, отмеченный заполненным точками серым затемнением. Нижнее схематическое изображение на фиг. 29 представляет LTVEC. Темно-серыми прямоугольниками отмечены 5'- и 3'-гомологичные плечи (48 т.н. и 84 т.н., соответственно). LTVEC содержит репортерный ген (lacZ) и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки). Самоделетирующаяся кассета содержит промотор крысы Prm1, функционально связанный с геном Crei, и селекционную кассету по лекарственному веществу, содержащую промотор убиквитина человека, функционально связанный с геном устойчивости к неомицину. Crei, содержит два экзона, кодирующие рекомбиназу Cre, разделенные интроном (Crei) для предотвращения ее экспрессии в прокариотической клетке. См., к примеру, патент США 8697851 и опубликованную заявку США 2013-0312129, которые подробно описывают самоделетирующуюся кассету, и этим документы включены в своей полноте посредством ссылки. Применением промотора Prm1 крысы, который управляет экспрессией Crei исключительно в мужских зародышевых клетках, самоделетирующаяся кассета может быть удалена из мужских зародышевых клеток крыс F0.
[00799] Проводили электропорацию LTVEC в ЭС клетки крысы, полученные в примере 1, и клетки помещали на чашку 15 см при 2х плотности neoR ЭФМ в среде 2i + 10 мкМ ROCKi. Трансформированные ЭС клетки крысы культивировали и поддерживали, как описано в примере 1.
Колонии подвергли скринингу, как описано в других местах данного документа, и получили таргетированные клоны. Таргетированные клоны потом инъецировали в эмбрион-хозяин, как описано в других местах данного документа, для получения крысы F0.
Пример 4. Гуманизация
4.1. Гуманизация геномных локусов крысы
[00800] Гуманизацию геномных локусов крысы выполняют, используя ЭС клетки крысы, описанные в данном документе, которые способны поддерживать плюрипотентность после одной или более электропораций in vitro и которые способны передавать направленные генетические модификации последующим поколениям. В дополнение к этому, для того, чтобы обойти ограничения плазмид по размещению большого фрагмента геномной ДНК и преодоления низкой эффективности низкой эффективности введения направленной генетической модификации в эндогенный локус ЭС клеток крысы, одну или более направленных генетических модификаций проводят в бактериях, например, Е. coli, использованием бактериальной гомологичной рекомбинации (БГР) и применением большого таргетирующего вектора (LTVEC). LTVEC, описанный в данном документе, к примеру, содержит большой фрагмент эндогенной геномной последовательности крысы с одной или более модификациями или содержал экзогенную нуклеиновую кислоту (например, гомологичную или ортологичную нуклеиновую кислоту крысы), фланкированую гомологичными плечами крысы комплементарными специфическим геномным участкам.
4.2. Гуманизация иммуноглобулиновых локусов крысы
[00801] Гуманизацию эндогенного локуса тяжелой цепи иммуноглобулина крысы проводят удалением одной или более эндогенных последовательностей нуклеиновой кислоты тяжелой цепи иммуноглобулина крысы (например, одного или более сегментов эндогенного гена VH, одного или более сегментов гена D человека и одного или более сегментов гена JH) и введением в модифицированный локус иммуноглобулина таргетирующего вектора, например, большого таргетирующего вектора (LTVEC), содержащий: (i) одну или более неперестроенных последовательностей нуклеиновой кислоты вариабельного участка человека (например, один или более сегментов гена VH человека, один или более сегментов гена D человека и один или более сегментов гена JH человека) или один или более перестроенных последовательностей нуклеиновой кислоты вариабельного участка человека (например, один или более перестроенных сегментов гена V-D-J человека); (ii) селекционную кассету (например, ген устойчивости к неомицину, фланкированный сайтами loxP) и (iii) 5'- и 3'-гомологичные плечи крысы.
[00802] Вкратце, один или более сегментов эндогенного гена вариабельного участка тяжелой цепи иммуноглобулина (т.е. один или более сегментов гена VH, один или более сегментов гена D человека и один или более сегментов гена JH человека) в ВАС-клоне крысы удаляют или инактивируют таргетингом эндогенного локуса тяжелой цепи иммуноглобулина крысы селекционной кассетой, фланкированной гомологичными плечами крысы. Конкретнее, таргетирующий вектор конструируют так, чтобы он содержал селекционную кассету (например, ген устойчивости к неомицину, фланкированный сайтами loxP), фланкированную 5'- и 3'-гомологичными плечами крысы, которые комплементарны целевым геномным последовательностям крысы (например, последовательностям обратного и прямого считывания геномной ДНК крысы, охватывающие один или более сегментов гена VH крысы, один или более сегментов гена D человека и один или более сегментов гена JH человека).
[00803] Далее, выбирают бактериальные клетки, содержащие большой фрагмент геномной ДНК крысы, охватывающий локус тяжелой цепи иммуноглобулина крысы, и вводят им плазмиду (например, pABG), кодирующую рекомбиназу, функционально связанную с транзиентно индуцируемым промотором. Таргетирующий вектор, сконструированный выше, потом вводят в рекомбинационно компетентные бактериальные клетки. После электропорации, бактериальные клетки обрабатывают индуктором (например, арабинозидом) для инициации гомологичной рекомбинации между таргетирующим вектором и целевой геномной последовательностью крысы в ВАС-клоне. Трансформированные клетки помещают на планшет при высокой плотности и подвергают отбору под действием лекарственного вещества для обнаружения колоний, которые устойчивы к лекарственному веществу. Собирают устойчивые к лекарственному веществу колонии и подвергают их скринингу на наличие направленной модификации.
[00804] Для облегчения идентификации направленной генетической модификации применяют высокопроизводительный количественный анализ, называемый анализом модификации аллели (МОА), который позволяет проводить крупномасштабный скрининг модифицированной(ых) аллели(ей) в исходной хромосоме после генетической модификации. Анализ МОА может выполняться посредством различных аналитических методик, включающих, но не ограничивающихся, количественным ПЦР (кПЦР), например, ПЦР в режиме реального времени. К примеру, ПЦР режиме реального времени включает применение первого набора праймеров, который распознает целевой локус, и второго набора праймеров, который распознает нецелевой референтный локус. В дополнение к этому, набор праймеров может содержать флуоресцентный зонд, который распознает амплифицированную последовательность. Альтернативно, количественный анализ может выполняться посредством множества аналитических методик, включающих, но не ограниченных, флуоресцентно-опосредованной гибридизацией in situ (FISH), сравнительной геномной гибридизацией, изотермической амплификацией ДНК, количественной гибридизацией с иммобилизированным(и) зондом(ами), технологиями Invader Probes®, ММР assays®, молекулярных сэндвичей TaqMan® и зондовой технологией Eclipse™. (См., к примеру, US 2005/0144655, который включен в данный документ в полном объеме посредством ссылки).
[00805] Потом бактериальным клеткам, содержащим ВАС-клон модифицированной крысы, т.е. ВАС-клон, содержащий геномную последовательность ДНК крысы, в которой один или более сегментов эндогенного гена вариабельного участка тяжелой цепи (сегменты генов VH, D, и/или JH) удалены или инактивированы, проводят электропорацию большим таргетирующим вектором (LTVEC), содержащим: (i) одну или более неперестроенных последовательностей нуклеиновой кислоты вариабельного участка человека (например, один или более неперестроенных сегментов гена VH человека, один или более сегментов гена D человека и один или более JH человека) или одну или более перестроенных последовательностей нуклеиновой кислоты вариабельного участка человека (например, один или более перестроенных сегментов гена V-D-J человека).
[00806] Инициацию гомологичной рекомбинации в бактериальных клетках и отбор положительных клонов выполняют, как описано выше. Неперестроенные и перестроенные последовательности нуклеиновой кислоты вариабельного участка тяжелой цепи иммуноглобулина человека, при таргетировании в эндогенный локус тяжелой цепи иммуноглобулина, становятся функционально связанными с эндогенной последовательностью нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина крысы. Альтернативно, эндогенный локус константного участка тяжелой цепи крысы может быть инактивирован, к примеру, удалением одного или более сегментов гена константного участка тяжелой цепи (СН) крысы из эндогенного локуса константного участка тяжелой цепи, и может быть замещен последовательностью нуклеиновой кислоты константного участка тяжелой цепи человека.
[00807] Аналогичным образом, гуманизацию эндогенного локуса легкой цепи κ или λ иммуноглобулина крысы проводят удалением одной или более эндогенных последовательностей нуклеиновой кислоты вариабельного участка легкой цепи κ и/или λ иммуноглобулина крысы (например, одного или более сегментов эндогенного гена Vκ крысы и одного или более сегментов эндогенного гена Jκ крысы) и таргетингом модифицированного локуса легкой цепи иммуноглобулина таргетирующим вектором, например, большим таргетирующим вектором (LTVEC), содержащим: (i) одну или более неперестроенных последовательностей нуклеиновой кислоты вариабельного участка легкой цепи иммуноглобулина человека (например, один или более сегментов гена Vκ человека и один или более сегментов гена Jκ человека) или одну или более перестроенных последовательностей нуклеиновой кислоты вариабельного участка человека (например, один или более перестроенных сегментов гена Vκ-Jκ человека); (ii) селекционную кассету (например, ген устойчивости к неомицину, фланкированный сайтами loxP) и (iii) 5'- и 3'-гомологичные плечи крысы.
[00808] Неперестроенные и перестроенные последовательности нуклеиновой кислоты вариабельного участка легкой цепи иммуноглобулина человека, при таргетировании в эндогенный локус легкой цепи иммуноглобулина, становятся функционально связанными с эндогенной последовательностью нуклеиновой кислоты константного участка легкой цепи иммуноглобулина крысы.
[00809] Таким образом LTVEC продуцируется в бактериальных клетках, содержащих, к примеру, вставку нуклеиновой кислоты, которая содержит локус гуманизированной тяжелой цепи или легкой цепи иммуноглобулина крысы, в котором один или более сегментов эндогенного гена вариабельного участка тяжелой или легкой цепи крысы замещены одним или более сегментами гена вариабельного участка тяжелой или легкой цепи человека; и гомологичные плечи крысы (например, в диапазоне от 5 т.н. до 150 т.н.), комплементарные специфическим геномным целевым последовательностям. LTVEC, содержащий генетическую модификацию, описанную выше, потом линеаризируют и вводят электропорацией в ЭС клетки крысы. Электропорированные ЭС клетки крысы помещают на планшеты при высокой плотности для отбора устойчивых к лекарственному веществу клеток, содержащих таргетирующий вектор. Процесс отбора с применением лекарственного вещества удаляет большинство размещенных клеток (~99%), оставляя отдельные колонии, каждая из которых является клоном, полученным из единственной клетки. Среди оставшихся клеток большинство клеток (~ 80-100%) содержит таргетирующий вектор, интегрированный в геном в случайном положении. Поэтому, колонии по-отдельности отбирают и генотипируют для того, чтобы идентифицировать ЭС клетки крысы, содержащие таргетирующий вектор в правильном геномном положении (например, используя анализ модификации аллели (МОА), описанный выше).
[00810] Для того, чтобы увеличить направленную генетическую модификацию, ЭС клеткам крысы проводят электропорацию экспрессионными векторами (или мРНК), которые экспрессируют ZFN 1 и 2 (или TALEN 1 и 2) вместе с LTVEC. Гомологичные плечи таргетирующего вектора лежат за пределами целевого сайта ZFN, поэтому, таргетирующий вектор не расщепляется ZFN. Двухцепочечный разрыв, созданный ZFN, стимулирует гомологично направленную репарацию (ГНР), которая в иных случаях обеспечивает очень малое процентное содержание репараций, обычно происходящих в клетках млекопитающих (по сравнению с негомологичными соединениями концов; НГСК).
[00811] Альтернативно, экспрессионные векторы, содержащие CRISPR-ассоциированную нуклеазу типа II (например, Cas9), гидовую РНК (включая CRISPR-PHK (cr-RNA) и трансактивирующую CRISPR РНК (tracrRNA)), как описано в данном документе, могут вводиться в бактериальные клетки вместе с LTVEC для увеличения эффективности гомологичной рекомбинации в целевом геномном локусе. Электропорированные клетки помещают на планшет при высокой плотности и подвергают отбору под действием лекарственного вещества для обнаружения колоний, которые устойчивы к лекарственному веществу. Собирают устойчивые к лекарственному веществу колонии и подвергают их скринингу на наличие направленной модификации с использованием анализа модификации аллели (МОА), как описано в данном документе. После выполнения этих процедур, может быть достигнуто повышение эффективности таргетинга. К примеру, степень улучшения может быть малой (например, улучшение от 10% до 15%) или большой (например, улучшение от 10% до 80%).
[00812] Отобранные ЭС клетки крысы, содержащие направленную генетическую модификацию, потом вводятся в эмбрион-хозяин крысы, к примеру, эмбрион крысы на стадии преморулы или стадии бластоцисты и имплантируются в матку суррогатной матери для получения крысы-основателя (крысы F0).
Впоследствии, крыса-основатель скрещивается с крысой дикого типа для образования потомства F1 гетерозиготного по генетической модификации. Спаривание гетерозиготной крысы F1 может создавать потомство гомозиготное по генетической модификации.
4.3(a). Замена IL2rg крысы рецептором гамма IL2 человека
[00813] В табл. 21 представлены сводные данные по геномной организации локуса рецептора гамма интерлейкина 2 крысы, а показанные положения взяты из сборки 5.0 референтной последовательности генома крысы (ENSMBL). IL2rg находится на хромосоме X на цепи (-).
[00814]

[00815] Нижнее схематическое изображение на фиг. 26 представляет таргетирующий вектор для делеции IL2rg размером 3,2 т.н. Таргетирующий вектор содержит репортерный ген (eGFP), функционально связанный с эндогенным промотором и самоделетирующуюся кассету, фланкированную сайтами loxP (незаполненные стрелки). Самоделетирующаяся кассета содержит ген Crei, функционально связанный с промотором мыши Prm1, и селекционную кассету, содержащую ген устойчивости к неомицину, функционально связанный с промотором убиквитина человека.
[00816] Ген Crei, содержит два экзона, кодирующие рекомбиназу Cre, которые разделены интроном (Crei) для предотвращения ее экспрессии в прокариотической клетке. См., к примеру, патент США 8697851 и опубликованную заявку США 2013-0312129, которые подробно описывают самоделетирующуюся кассету, и этим включены в данный документ в своей полноте посредством ссылки. Применением промотора Prm1 мыши, может быть удалена экспрессионная кассета Cre и селекционная кассета по лекарственному веществу исключительно в мужских зародышевых клетках крыс F0. Проводили электропорацию таргетирующего вектора в ЭС клетки крысы, полученные в примере 1, и клетки помещали на чашку 15 см при 2х плотности устойчивых к неомицину ЭФМ в среде 2i + 10 мкМ ROCKi. Трансформированные ЭС клетки крысы культивировали, отбирали и поддерживали, как описано в примере 1.
[00817] Как показано в табл. 23, провели скрининг среди 168 колоний и получили 6 таргетированных клонов. Эффективность таргетинга составила 3,57%.
[00818] Инъецировали клоны в бластоцисты, как описано в данном документе в примере 1. Получили клоны, продуцировавшие крысы F0, и получили крысы F0, которые передавали направленную модификацию по зародышевой линии.
[00819] Пример 4.3(b). Замена эктодомена IL2rg крысы эктодоменом IL2rg человека
[00820] Полноразмерная гуманизация IL 2 целесообразна, поскольку крысы, обладающие таким модифицированным локусом, будут продуцировать I12rg человека; и это позволит поводить детекцию I12rg человека в организме крыс антителами специфическими к I12rg человека.
[00821] Эктогуманизация (т.е. замена эктодомена I12rg крысы эктодоменом I12rg человека) приведет к получению полипептида I12rg, который будет связывать лиганды человека I12rg, но поскольку цитоплазматический домен все же остается крысиным, его эктогуманизированная форма I12rg также будет взаимодействовать с механизмом сигналинга в организме крысы. На фиг. 33 представлено результат выравнивания последовательностей белка IL-2rg человека (SEQ ID №: 20; NP 000197.1); белка IL-2rg крысы (SEQ ID №: 21; NP 543165.1) и химерного белка IL-2rg (SEQ ID №: 22), содержащего эктодомен IL-2rg человека, гибридизированный с остальной частью белка IL-2rg крысы. Соединение между IL-2rg человека и крысы отмечено вертикальной линией.
[00822] В табл. 22 представлены сводные данные по геномной организации локуса рецептора гамма интерлейкина 2 крысы, а показанные положения взяты из сборки 5.0 референтной последовательности генома крысы (ENSMBL). IL2rg находится на хромосоме X на цепи (-). Дополнительно отмечено положение эктодомена IL2rg.
[00823]

[00824] Плазмидные таргетирующие векторы сконструировали для замены эктодомена кодирующего участка рецептора гамма интерлейкина 2 крысы эктодоменом человека как показано в Фигуре 31. Проводили электропорацию таргетирующего вектора в ЭС клетки крысы, полученные в примере 1, и клетки помещали на чашку 15 см при 2х плотности устойчивых к неомицину ЭФМ в среде 2i + 10 мкМ ROCKi. Трансформированные ЭС клетки крысы культивировали, отбирали и поддерживали, как описано в примере 1.
[00825] Как показано в табл. 23, провели скрининг среди 192 колоний и получили 13 таргетированных клонов. Эффективность таргетинга составила 6,77%.
[00826] Инъецировали клоны в бластоцисты, как описано в данном документе в примере 1. Получили клоны, продуцировавшие крысы F0, и получили крысы F0, которые передавали направленную модификацию по зародышевой линии.
Пример 5. Резюме
[00827] Таблица 23. Сводные данные по таргетингу крыс различными типами векторов и нуклеазными агентами обсуждались в примерах 3 и 4.
[00828]

[00829] Все опубликованные и патентные заявки, упомянутые в описании, являются характерными для уровня специалистов в той области, к которой относится это изобретение. Все опубликованные и патентные заявки включены в данный документ посредством ссыпок в том же объеме, как если бы каждая отдельная опубликованная или патентная заявка была специально и отдельно указана как включенная в данный документ посредством ссылки. Если иное не очевидно из контекста любого варианта реализации изобретения, аспекта, стадии или признака изобретения, то они могут использоваться в любой комбинации друг с другом. Ссылка на диапазон включает любые целые числа в пределах диапазона, любого поддиапазона в пределах диапазона. Ссылка на множественные диапазоны включает совокупности таких диапазонов.
Реферат
Изобретение относится к области биохимии, в частности к способу направленной модификации представляющего интерес геномного локуса в одной или более плюрипотентных клетках крысы, включающему введение в плюрипотентные клетки крысы большого таргетирующего вектора (LTVEC), содержащего вставку нуклеиновой кислоты, и идентификацию генетически модифицированной плюрипотентной клетки крысы, содержащей направленную генетическую модификацию в представляющем интерес геномном локусе, а также к способу создания гуманизированной крысы с использованием вышеуказанного способа модификации. Также раскрыт способ направленной модификации представляющего интерес геномного локуса в популяции плюрипотентных клеток крысы для получения генетически модифицированной крысы, включающий предоставление популяции плюрипотентных клеток крысы, получение клона плюрипотентной клетки крысы, введение указанного клона плюрипотентной клетки крысы в эмбрион-хозяина крысы и вынашивание указанного эмбриона-хозяина крысы. Изобретение позволяет эффективно получать генетически модифицированную крысу. 3 н. и 89 з.п. ф-лы, 33 ил., 23 табл., 5 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ генетической модификации интересующего эндогенного гена или хромосомного локуса (варианты) иего использование

Комментарии