Не являющиеся человеком животные с дефицитом дпнрнк - RU2721855C2
Код документа: RU2721855C2
Чертежи











Описание
С ПЕРЕКРЕСТНЫМИ ССЫЛКАМИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США №61/863147, поданной 7 августа 2013 г., которая включена в настоящий документ полностью посредством ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ВИДЕ ТЕКСТОВОГО ФАЙЛА ЧЕРЕЗ СЕТЬ EFS
[0002] Официальная копия перечня последовательностей была предоставлена в электронном виде через сеть EFS в виде перечня последовательностей в формате ASCII, с именем файла 448071SEQLIST.TXT, созданного 7 августа 2014 г. и имеющего размер 1 килобайт, и подается одновременно с настоящим описанием. Перечень последовательностей, содержащийся в указанном документе в формате ASCII, является частью настоящего описания и полностью включен в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0003] Не являющиеся человеком животные, не принадлежащие человеку клетки и ткани, дефицитные по одной или нескольким длинным некодирующим РНК («днРНК»), а также способы их получения. Не являющиеся человеком животные, которые содержат нефункциональные днРНК или нокаут одной или большего количества днРНК, и способы их получения. Генетически модифицированные не являющиеся человеком животные, у которых наблюдаются фенотипы, соответствующие преждевременному старению.
УРОВЕНЬ ТЕХНИКИ
[0004] Длинные некодирующие РНК (днРНК) и их подкласс, известный как длинные промежуточные некодирующие РНК (дпнРНК), включают приблизительно 15000 различных транскриптов у млекопитающих, напоминающих мРНК структурой, синтезом и характеристиками хроматина их генов. Функции или фенотипы, связанные с конкретными днРНК, неизвестны для подавляющего большинства идентифицированных днРНК. Считается, что некоторые днРНК принимают участие в контроле транскрипции в качестве активаторов или репрессоров транскрипции у животных; другие могут функционировать посттрансляционно или за счет какого-либо другого механизма. Соответственно, возможность манипулирования днРНК может обеспечить инструмент для получения представляющих интерес фенотипов, в зависимости от характеристик и функции днРНК. В данной области техники существует потребность в способах и композициях для манипуляции днРНК, и потребность в получении фенотипов не являющихся человеком животных путем манипуляций с днРНК.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] Предложены не являющиеся человеком животные, клетки, ткани и эмбрионы, которые содержат нефункциональные длинные некодирующие РНК (днРНК), в том числе, но не ограничиваясь указанным, нокауты одной или большего количества днРНК. Предложены способы и композиции для манипуляции экспрессией днРНК. Также предложены направленные композиции для направленных модификаций или нокаута днРНК. Предложены не являющиеся человеком животные, клетки и ткани, которые демонстрируют фенотип, связанный с отсутствием функции одной или большего количества днРНК.
[0006] Согласно одному аспекту предложено не являющееся человеком животное, в геноме которого содержится по меньшей мере один модифицированный локус днРНК, отличающийся тем, что указанный модифицированный локус днРНК включает мутацию с потерей функции в последовательности нуклеиновой кислоты, которая кодирует днРНК.
[0007] Согласно одному варианту реализации указанная днРНК представляет собой длинную межгенную некодирующую РНК (дпнРНК).
[0008] Согласно одному аспекту указанная мутация с потерей функции характеризуется разрушением или нокаутом по меньшей мере одной функции днРНК.
[0009] Согласно одному варианту реализации модифицированный локус днРНК включает удаление одного или большего количества экзонов, которые кодируют указанную днРНК или ее часть. Согласно одному аспекту разрушение или нокаут включает удаление одного или большего количества экзонов в составе локуса днРНК, начиная со второго экзона локуса днРНК; удаление одного или большего количества экзонов в составе локуса днРНК, начиная с первого экзона локуса днРНК; или удаление всей кодирующей области РНК локуса днРНК.
[00010] Согласно одному аспекту указанное разрушение или нокаут включает замену локуса днРНК или его части встраиваемой нуклеиновой кислотой. Согласно одному варианту реализации указанная встраиваемая нуклеиновая кислота содержит первую нуклеотидную последовательность, которая кодирует репортер. В некоторых из таких случаев указанная первая нуклеотидная последовательность функционально связана с промотором, который управляет экспрессией указанного репортера. Согласно одному варианту реализации указанную первую нуклеотидную последовательность, которая кодирует указанный репортер, размещают в локусе днРНК в функциональной связи с эндогенным промотором днРНК, при этом указанный эндогенный промотор днРНК управляет экспрессией указанной нуклеотидной последовательности. В таких случаях экспрессия указанной последовательности нуклеиновой кислоты подчиняется паттерну экспрессии днРНК. Согласно одному аспекту встраиваемая нуклеиновая кислота содержит консенсусную последовательность Козак. Согласно конкретному варианту реализации указанная первая нуклеотидная последовательность встраиваемой нуклеиновой кислоты содержит консенсусную последовательность Козак.
[00011] Согласно одному варианту реализации указанная встраиваемая нуклеиновая кислота также содержит вторую нуклеотидную последовательность, которая кодирует селектируемый маркер, при этом указанная вторая нуклеотидная последовательность функционально связана с промотором.
[00012] Согласно одному аспекту встраиваемая нуклеиновая кислота содержит участки сайт-специфической рекомбинации, фланкирующие сегмент, кодирующий репортер, и/или сегмент, кодирующий селектируемый маркер.
[00013] Согласно различным аспектам и вариантам реализации замена указанного локуса днРНК или его части включает замену одного или большего количества экзонов в составе локуса днРНК, начиная со второго экзона указанного локуса днРНК, встраиваемой нуклеиновой кислотой; замену одного или большего количества экзонов в составе локуса днРНК, начиная с первого экзона указанного локуса днРНК, встраиваемой нуклеиновой кислотой; или замену всей кодирующей области РНК локуса днРНК встраиваемой нуклеиновой кислотой.
[00014] Согласно одному варианту реализации предложенное в настоящем изобретении не являющееся человеком животное характеризуется одним или несколькими следующими фенотипами: (а) связанный с преждевременным старением фенотип; (b) перинатальная летальность; (с) дефект развития легких; (d) морфологический порок хвоста и задних конечностей; (е) потеря мышечной массы в одной или нескольких тканях; или (f) комбинация любых пунктов из (а)-(е).
[00015] Согласно одному аспекту у предложенного в настоящем изобретении не являющегося человеком животного имеется разрушение или нокаут днРНК Pint, и указанное не являющееся человеком животное характеризуется связанным с преждевременным старением фенотипом, включающим: (а) меньшую скорость роста по сравнению с контролем дикого типа; (b) снижение мышечной силы; (с) фиброз; (d) меньшее содержание жировой ткани в организме по сравнению с контролем дикого типа; (е) меньшую костную минеральную плотность и костную массу бедренной кости по сравнению с контролем дикого типа; (f) пониженную мышечную массу по сравнению с контролем дикого типа; (g) снижение средней продолжительности жизни; (h) лордокифоз; (i) атрофию органов; или (j) комбинацию любых пунктов из (a)-(i).
[00016] Согласно одному варианту реализации у предложенного в настоящем изобретении не являющегося человеком животного наблюдается дефект развития мозга. В некоторых из таких случаев днРНК представляет собой Pantr2, Kantr, Peril, Celrr, Pantr1, Crnde, lincenc1, Pint, lincppara или Tug1.
[00017] Согласно различным аспектам и вариантам реализации указанное не являющееся человеком животное представляет собой млекопитающее. Согласно различным аспектам и вариантам реализации указанное млекопитающее представляет собой грызуна, например, мышь, крысу или хомяка. Согласно различным аспектам и вариантам реализации указанное млекопитающее представляет собой вид овец, бычьих или свиней.
[00018] Согласно одному аспекту предложено генетически модифицированное не являющееся человеком животное, отличающееся тем, что указанная генетическая модификация приводит к потере функции днРНК.
[00019] Согласно одному аспекту предложено генетически модифицированное не являющееся человеком животное, отличающееся тем, что указанная генетическая модификация включает разрушение или нокаут одной или большего количества днРНК.
[00020] Согласно одному варианту реализации указанная генетическая модификация включает разрушение или нокаут по меньшей мере двух днРНК. Согласно одному варианту реализации указанная генетическая модификация включает разрушение или нокаут по меньшей мере трех, четырех, пяти или шести днРНК.
[00021] Согласно одному варианту реализации указанная генетическая модификация включает разрушение или нокаут одной или большего количества днРНК, и ген в составе локуса днРНК, кодирующий детектируемый фрагмент (репортер), функционально связанный с промотором разрушенной или нокаутированной днРНК. Согласно одному варианту реализации указанный ген, кодирующий детектируемый фрагмент (репортер), выбран из lacZ (кодирующего β--галактозидазу), GFP, eGFP, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, усиленного желтого флуоресцентного белка (EYFP), Emerald, CyPet, голубого флуоресцентного белка (CFP), церулеума, T-Sapphire, люциферазы, щелочной фосфатазы и их комбинации.
[00022] Согласно одному варианту реализации указанная генетическая модификация включает разрушение или нокаут одной или большего количества днРНК, и ген в составе локуса днРНК, кодирующий детектируемый фрагмент (репортер), функционально связанный с промотором, который управляет экспрессией указанного детектируемого фрагмента.
[00023] Согласно различным аспектам и вариантам реализации указанный детектируемый фрагмент включает любой репортерный ген, известный в данной области техники.
[00024] Согласно одному аспекту предложено генетически модифицированное не являющееся человеком животное, отличающееся тем, что указанная генетическая модификация включает разрушение последовательности нуклеиновой кислоты днРНК, кодирующей дпнРНК, выбранную из группы, состоящей из НОТAIR, HOTTIP, Hoxa11os (ранее называвшейся HoxA11as), Pantr1 (ранее называвшейся lincRNA-Brn1-a), Pantr2 (ранее называвшейся lincRNA-Brn1-b), Ptgs2os2 (ранее называвшейся lincRNA-Cox2), Eldr (ранее называвшейся Fabl и lincRNA-Egfr), Lincenc1 (ранее называвшейся lincRNA-Enc1), Мannr (ранее называвшейся lincRNA-Evi1), Fendrr (ранее называвшейся lincRNA-Foxf1), Halr1 (ранее называвшейся Haunt и lincRNA-HoxA1), Haglr (ранее называвшейся lincRNA-HoxD3), Celrr (ранее называвшейся Celr и lincRNA-Insig2), Crnde (ранее называвшейся lincRNA-Irx5), Kantr (ранее называвшейся Spasm и lincRNA-Jarid1c), Pint (ранее называвшейся linc-Pint и lincRNA-Mkln1), Trp53cor1 (ранее называвшейся lincRNA-p21), lineppara (ранее называвшейся lincRNA-Ppara), Peril (ранее называвшейся lincRNA-Sox2), Tug1 (ранее называвшейся lincRNA-Tug1) и их комбинации.
[00025] Согласно одному аспекту предложено генетически модифицированное не являющееся человеком животное, отличающееся тем, что указанная генетическая модификация включает разрушение или нокаут Pint (ранее называвшейся linc-Pint и lincRNA-Mkln1).
[00026] Согласно одному аспекту предложен локус нуклеиновой кислоты, где имеется разрушение днРНК. Согласно одному варианту реализации указанное разрушение включает нокаут указанной днРНК. Согласно одному варианту реализации указанное разрушение включает обеспечение функциональной связи гена, кодирующего детектируемый фрагмент, с промотором днРНК. Согласно одному варианту реализации указанное разрушение включает нокаут днРНК и обеспечение функциональной связи гена, кодирующего детектируемый фрагмент, с промотором указанной днРНК.
[00027] Согласно одному аспекту предложена конструкция нуклеиновой кислоты, содержащая по меньшей мере одну нацеливающую последовательность, которая нацеливает указанную конструкцию на локус, содержащий днРНК, при этом указанная конструкция способна нарушать транскрипцию указанной днРНК, нокаутировать указанную днРНК или заменять указанную днРНК.
[00028] Согласно одному варианту реализации указанная конструкция нуклеиновой кислоты также содержит детектируемый фрагмент (с добавлением промотора или без добавления промотора, который управляет экспрессией указанного детектируемого фрагмента). Согласно одному варианту реализации указанная конструкция нуклеиновой кислоты также включает селектируемый маркерный ген, управляемый промотором. Согласно одному варианту реализации указанная конструкция нуклеиновой кислоты содержит и детектируемый фрагмент (с собственным промотором или без собственного промотора), и селектируемый маркерный ген, управляемый промотором. Согласно одному варианту реализации указанный селектируемый маркер и/или указанный детектируемый фрагмент фланкированы с 5'- и 3'-стороны участками сайт-специфической рекомбинации, которые направляют исключение детектируемого фрагмента и/или селектируемого маркера.
[00029] Согласно одному варианту реализации предложен направленный вектор. Согласно одному аспекту указанный направленный вектор содержит встраиваемую нуклеиновую кислоту, фланкированную с 5'- и 3'-стороны гомологичными фрагментами, которые могут подвергаться гомологичной рекомбинации с представляющим интерес локусом днРНК. Согласно одному варианту реализации указанная встраиваемая нуклеиновая кислота направленного вектора содержит первую последовательность нуклеиновой кислоты, которая кодирует репортер. Согласно одному аспекту после гомологичной рекомбинации с представляющим интерес локусом днРНК указанную первую последовательность нуклеиновой кислоты, которая кодирует репортер, функционально связывают с эндогенным промотором, который управляет экспрессией днРНК в локусе днРНК. Согласно одному варианту реализации первая и/или вторая последовательность нуклеиновой кислоты встраиваемой нуклеиновой кислоты направленного вектора также содержит консенсусную последовательность Козак. Согласно одному варианту реализации указанный направленный вектор также содержит промотор, который управляет экспрессией указанного промотора.
[00030] Согласно одному аспекту указанная встраиваемая нуклеиновая кислота направленного вектора также содержит вторую последовательность нуклеиновой кислоты, которая кодирует селектируемый маркер, при этом указанная вторая нуклеиновая кислота функционально связана с промотором. Согласно одному варианту реализации указанный направленный вектор также содержит участки сайт-специфической рекомбинации, фланкирующие сегмент, кодирующий репортер, и/или сегмент, кодирующий селектируемую маркерную нуклеиновую кислоту.
[00031] Согласно одному аспекту предложено не являющееся человеком животное, у которого наблюдается связанный с преждевременным старением фенотип, при этом указанное не являющееся человеком животное содержит модификацию, которая обеспечивает нефункциональность Pint. Согласно одному варианту реализации указанная модификация представляет собой разрушение кодирующей РНК последовательности локуса Pint. Согласно одному варианту реализации указанная модификация представляет собой удаление всей кодирующей РНК последовательности локуса Pint. Согласно одному варианту реализации указанная модификация включает встраивание направленного вектора в локус Pint таким образом, что у указанного животного более не образуется функциональный Pint.
[00032] Согласно одному варианту реализации указанная модификация также включает детектируемый фрагмент в локусе Pint {например, репортерный ген с собственным промотором или без собственного промотора) и, необязательно, селектируемый маркер. Согласно одному варианту реализации указанный детектируемый фрагмент и/или селектируемый маркер фланкированы с 5'- и 3'-стороны участками сайт-специфической рекомбинации, которые направляют исключение детектируемого фрагмента и/или селектируемого маркера. Согласно одному варианту реализации у указанного не являющегося человеком животного также содержится и индуцируемая сайт-специфическая рекомбиназа, совместимая с участками сайт-специфической рекомбинации.
[00033] Согласно одному аспекту предложен(а) клетка, ткань или эмбрион не являющегося человеком животного, при этом в указанной клетке или ткани отсутствует последовательность нуклеиновой кислоты, которая кодирует функциональную дпнРНК, выбранную из группы, состоящей из НОТAIR, HOTTIP, Hoxa11os (ранее называвшийся HoxA11as), Pantr1 (ранее называвшейся lincRNA-Brn1-a), Pantr2 (ранее называвшейся lincRNA-Brn1-b), Ptgs2os2 (ранее называвшейся lincRNA-Cox2), Eldr (ранее называвшейся Fabl и lincRNA-Egfr), Lincencl (ранее называвшейся lincRNA-Enc1), Mannr (ранее называвшейся lincRNA-Evi1), Fendrr (ранее называвшейся lincRNA-Foxf1), Halr1 (ранее называвшейся Haunt и lincRNA-HoxA1), Haglr (ранее называвшейся Mdgt и linncRNA-HoxD3), Celrr (ранее называвшейся Celr и lincRNA-Insig2), Crnde (ранее называвшейся lincRNA-Irx5), Kantr (ранее называвшейся Spasm и lincRNA-Jarid1c), Pint (ранее называвшейся linc-Pint и lincRNA-Mkln1), Trp53cor1 (ранее называвшейся lincRNA-p21), lincppara (ранее называвшейся lincRNA-Ppara), Peril (ранее называвшейся lincRNA-Sox2), Tug1 (ранее называвшейся lincRNA-Tug1) и их комбинации.
[00034] Согласно одному варианту реализации в указанной клетке или ткани, в которой отсутствует последовательность нуклеиновой кислоты, которая кодирует функциональную дпнРНК, отсутствует функциональная Pint (ранее известная как lincRNA-Mlkn1).
[00035] Согласно одному аспекту предложена конструкция нуклеиновой кислоты, содержащая гомологичный фрагмент с 5'-стороны и гомологичный фрагмент с 3'-стороны, при этом указанные 5'- и 3'-гомологичные фрагменты нацелены на локус днРНК, и указанная конструкция способна нарушать транскрипцию указанной днРНК, нокаутировать указанную днРНК или заменять указанную днРНК.
[00036] Согласно различным аспектам и вариантам реализации нацеливающие конструкции, направленные на локус днРНК, содержат последовательность, выбранную из последовательности Козак, последовательности, кодирующей детектируемый фрагмент (например, репортер, например, репортер согласно описанию в настоящем документе; например, необязательно, с функционально связанным с ним промотором), последовательности нуклеиновой кислоты, кодирующей селектируемый маркер (например, с функционально связанным с ним промотором), и их комбинации. Согласно одному варианту реализации репортер и/или селектируемый маркер фланкированы участками сайт-специфической рекомбинации, расположенные таким образом, чтобы обеспечивать удаление последовательности нуклеиновой кислоты, кодирующей селектируемый маркерный ген, и/или последовательности нуклеиновой кислоты, кодирующей детектируемый фрагмент. Согласно одному варианту реализации указанная конструкция не содержит промотора, функционально связанного с детектируемым фрагментом.
[00037] Согласно одному аспекту предложен способ разрушения днРНК, включающий встраивание последовательности нуклеиновой кислоты в составе локуса днРНК, отличающийся тем, что указанное встраивание разрушает транскрипцию днРНК, удаляет одну или большее количество днРНК-кодирующих областей, или полностью удаляет кодирующую последовательность днРНК.
[00038] Согласно одному аспекту предложен способ получения не являющегося человеком животного, который включает разрушение или нокаут днРНК, включающий модификацию генома не являющегося человеком животного таким образом, что у указанного не являющегося человеком животного более не экспрессируется функциональный вариант указанной днРНК. Согласно одному варианту реализации указанный способ включает этап, задействующий направленный вектор для разрушения транскрипции указанной днРНК, для удаления одной или большего количества днРНК-кодирующих областей или удаления всей кодирующей последовательности указанной днРНК в геноме не являющегося человеком животного.
[00039] Согласно одному аспекту предложен способ получения не являющегося человеком животного, который включает нокаут функции днРНК, включающий модификацию генома плюрипотентной или тотипотентной клетки не являющегося человеком животного для разрушения транскрипции днРНК, для удаления одного или большего количества экзонов, кодирующих днРНК-кодирующие области, или для удаления всей кодирующей последовательности днРНК в геноме указанной клетки; применение указанной клетки в качестве донорной клетки и введение указанной донорной клетки в эмбрион-хозяина для формирования комплекса донорной клетки и эмбриона-хозяина; и вынашивание комплекса донорной клетки и эмбриона-хозяина подходящим не являющимся человеком животным в условиях, подходящих для гестации, при этом после гестации получают потомство, у которого содержится днРНК с нокаутированной функцией. Согласно одному варианту реализации указанное потомство скрещивают до гомозиготности для нокаута функции днРНК.
[00040] Согласно одному аспекту предложен способ получения не являющегося человеком животного, который включает нокаут функции днРНК, включающий модификацию генома соматической клетки или зародышевой клетки не являющегося человеком животного для разрушения транскрипции указанной днРНК, для удаления одной или большего количества днРНК-кодирующих областей, или для удаления всей кодирующей последовательности днРНК в геноме указанной клетки; использование генома указанной клетки в энуклеированной яйцеклетке для получения модифицированной яйцеклетке; вынашивание указанной модифицированной яйцеклетки подходящим суррогатным не являющееся человеком животным в условиях, подходящих для гестации; и получение потомства не являющегося человеком животного, у которого наблюдается нокаут днРНК. Согласно одному варианту реализации указанный потомство скрещивают до гомозиготности для нокаута функции днРНК.
[00041] Согласно одному варианту реализации предложен способ получения не являющегося человеком животного, содержащего генетическую модификацию по меньшей мере в одном локусе днРНК. Такой способ включает приведение плюрипотентной клетки в контакт с направленной конструкцией, содержащей встраиваемую нуклеиновую кислоту, фланкированную с 5'- и 3'-стороны гомологичными фрагментами; при этом указанная направленная конструкция подвергается гомологичной рекомбинации с локусом дпнРНК в геноме указанной клетки с формированием модифицированной плюрипотентной клетки; (b) введение модифицированной плюрипотентной клетки в эмбрион-хозяина; и (с) вынашивание эмбриона-хозяина суррогатной матерью, отличающееся тем, что указанная суррогатная мать дает потомство, у которого присутствует модифицированный локус днРНК, при этом указанная генетическая модификация приводит к потере функции по меньшей мере одной днРНК.
[00042] Согласно одному аспекту предложен способ модификации локуса днРНК в плюрипотентной клетке. Такой способ включает введение в плюрипотентную клетку направленной конструкции, содержащей встраиваемую нуклеиновую кислоту, фланкированную с 5'- и 3'-стороны гомологичными фрагментами, которые могут подвергаться гомологичной рекомбинации с локусом днРНК; и идентификацию модифицированной плюрипотентной клетки, содержащей направленную генетическую модификацию в локусе днРНК, при этом указанная генетическая модификация приводит к потере функции указанной днРНК. Согласно одному варианту реализации указанная плюрипотентная клетка представляет собой индуцированную плюрипотентную клетку (иПСК) человека.
[00043] Согласно различным аспектам и вариантам реализации модифицированные клетки включают, например, плюрипотентные клетки, индуцированные плюрипотентные клетки, стволовые клетки, эмбриональные стволовые клетки и т.п. Согласно конкретному варианту реализации указанная клетка представляет собой эмбриональную стволовую клетку (ЭСК). Согласно конкретному варианту реализации указанная ЭСК представляет собой ЭСК мыши или крысы.
[00044] Согласно различным аспектам и вариантам реализации не являющиеся человеком животные включают, например, виды овец, бычьих, свиней и мышиных. Согласно конкретному варианту реализации животное относится к виду мышиных, например, представляет собой мышь или крысу.
[00045] Включены также другие и дополнительные аспекты и варианты реализации, как будет понятно специалистам в данной области техники после прочтения настоящего описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00046] Файл настоящего патента или патентной заявки включает по меньшей мере один чертеж, выполненный в цвете. Копии указанного опубликованного патента или патентной заявки с цветным(м) чертежом(ами) будут предоставлены ведомством в случае запроса и уплаты соответствующей пошлины.
[00047] Фиг. 1 иллюстрирует стратегию направленного разрушения локуса гена Fendrr. Приведена частичная карта локуса Fendrr мыши дикого типа, в том числе экзоны 1-6. При гомологичной рекомбинации направленный вектор LTVEC заменял в общей сложности 19,2 Кб геномной последовательности Fendrr кассетой LacZ-неомициновой устойчивости, с введением последовательности Козак. Пустыми квадратами обозначены некодирующие экзоны. Красные и зеленые квадраты на геномном локусе Fendrr и в кассете LacZ/неомициновой устойчивости представляют собой гомологичные последовательности, используемые для нацеливания.
[00048] Фиг. 2 иллюстрирует пространственный и временной паттерн экспрессии репортерного гена LacZ в середине периода гестации содержащих целевые дпнРНК эмбрионов мыши А, Гетерозиготные эмбрионы е12.5, фиксированные и окрашенные на β--галактозидазу, наблюдался широкий спектр экспрессии введенного репортерного гена LacZ при развитии головного мозга и краниофациальной области (например, Pantr1 и Pantr2, Celrr и Haglr, см. также фиг. 9), нервной трубки (Pantr2, Halr1 и lincppara), спинной аорты (Celrr), сердца (Celrr, Haglr, см. также фиг. 9), легких (Fendrr), почек конечностей (HOTTIP, Hoxa11os и Mannr), передней кишки (HOTTIP, Hoxa11os и Fendrr), задней области и хвоста (HOTAIR, HOTTIP и Hoxa11os). Аналогичный анализ показал широко распространенный паттерн экспрессии lacZ у Tug1, тогда как экспрессия других репортерных генов может быть ограничена эпидермисом (Eldr), зачатками молочных желез (Lincenc1, см. также фиг. 9) или плакодой вибриссов (Trp53cor1, см. также фиг. 9). Приведенные примеры характерны по меньшей мере для пяти эмбрионов с подтвержденным генотипом в проекте с нокаутами дпнРНК. В, Паттерны экспрессии в выбранных гетерозиготных по дпнРНК (HOTTIP, Hoxa11os и Celrr) эмбрионах F1 на заданных стадиях (е9.5-е12.5) продемонстрировали, что экспрессия начинается на ранней стадии в ограниченном участке, а затем распространяется за пределы указанного исходного участка на более поздних стадиях. Экспрессия Celrr была ограничена головным мозгом на е9.5 и распространялась в спинной мозг к e12.5. Экспрессия Hoxa11os начиналась в развивающейся хвостовой почке и распространялась на всю каудальную область эмбриона, задние и передние конечности к e12.5. Экспрессия HOTTIP также начиналась в развивающейся хвостовой почке и затем наблюдалась в развивающихся дистальных аутоподах передней конечности и задней конечности к e11.5 и е12.5. Приведенные примеры характерны по меньшей мере для пяти эмбрионов с подтвержденным генотипом в проекте с нокаутами дпнРНК.
[00049] Фиг. 3 иллюстрирует экспрессию репортерного гена LacZ (синий) в головном мозге гетерозигот по дпнРНК поколения F0 в возрасте 6-8 недель. A, Celrr, распространенная экспрессия в сером веществе за исключением латерального мозжечка и вентрального моста; В, Crnde, экспрессия в холмиках (вид сверху, стрелка); С, Pantr1, экспрессируемый в неокортексе, обонятельной луковице, базальном переднем мозге и гипоталамусе; D, Pantr2, экспрессируемый в неокортексе, обонятельной луковице, мозжечке, гипоталамусе и базальном переднем мозге; Е, Lincenc1, экспрессируемый в неокортексе, частях мозжечка и медиальном гипоталамусе, в частности, с выраженным паттерном экспрессии в ольфакторной проекции и зонах ольфакторной проекции височной коры (вид снизу, красная стрелка); F, Pint, универсально экспрессируемый в сером веществе, особенно интенсивно экспрессируемый в гипоталамусе; G, linсрраrа, широко экспрессируемый в сером веществе, с особенно большой плотностью экспрессии в гипоталамусе; Н, Peril, экспрессия в средней линии гипоталамуса (вид снизу, указатель стрелки); I, Kantr, некоторая потенциальная экспрессия в глубоких слоях мозжечка (вид сверху, звездочка); и J, Tug1, экспрессия в сером веществе спинного мозга и незначительная экспрессия в сером веществе в большинстве структур, за исключением неокортекса. n=2 самца мышей с подтвержденным генотипом на проект с нокаутной дпнРНК.
[00050] На фиг. 4 видно, что повышенная экспрессия наблюдается Pint с 3 дня постнатального периода до возраста 8 недель. Экспрессия репортерного гена LacZ (синий цвет) через 3 дня, 3 недели и 8 недель у гетерозигот F0 показывает, что экспрессия Pint возрастает с возрастом. А, через 3 дня окрашивание на β--галактозидазу наблюдается только во фрагментах головного мозга, сухожилий и связок задних конечностей, и некоторых бронхиолах в легких (показаны стрелками). В, в возрасте 3 недель наблюдается усиленное окрашивание в головном мозге, задних конечностях, предсердиях сердца, легких и печени. С, к возрасту 8 недель во всех тканях головного мозга, скелетных мышц задних конечностей и грудной клетки, предсердий и миокарда, легких и печени наблюдается выраженное окрашивание β--галактозидазы, соответствующее повышенной экспрессии Pint. Приведенные примеры характерны для n>4 мышей на группу.
[00051] Фиг. 5 иллюстрирует связанный с преждевременным старением фенотип у нокаутных по Pint мышей. (А) У самцов мышей Pint-/- и Pint+/- наблюдается значимо меньшая скорость роста, чем у однопометных животных дикого типа (WT), и начинает наблюдаться значимое снижение массы тела в возрасте около 6 месяцев. Данные представлены на графиках в виде среднего +/- SEM, n>9 мышей для каждой группы. Значимость оценивали с применением однофакторного дисперсионного анализа ANOVA (*, Р<0,05; **, Р<0,005; ***, Р<0,001). (В) Анализ Каплана-Мейера для гомозиготных мышей, гетерозиготных мышей и мышей WT. У самцов мышей Pint-/- наблюдается значимое снижение выживания по сравнению с однопометными животными Pint+/- и дикого типа. Данные представлены на графиках в виде процента выживания в течение 1 года наблюдения. (С) Срезы дорсальной и вентральной кожи мышей Pint-/- по сравнению с однопометными животными Pint+/- и дикого типа. (D, Е, F и G) Оценка конституции в возрасте 12, 26 и 52 недели с помощью микро-КТ. (D, Е) У самцов мышей Pint-/- и Pint+/- наблюдается значимое снижение содержания жировой ткани в организме уже в возрасте 26 недель. У самок Pint-/- мышей наблюдается пониженное содержание жировой ткани в организме в старшем возрасте, заметное в возрасте 52 недели (***, P<0,001, однофакторный дисперсионный анализ ANOVA). (F, G) значимое снижение минеральной плотности ткани бедренной кости (BMD), наблюдаемое и у самцов, и у самок Pint-/- по сравнению с однопометными животными Pint+/- и дикого типа (*, Р<0,05; ***, Р<0,001, однофакторный дисперсионный анализ ANOVA). (Н) На полученных с помощью микро-КТ снимках виден выраженный лордокифоз (искривление позвоночного столба) у самцов и самок старшего возраста мышей Pint-/- по сравнению с однопометными животными дикого типа. (I) Приблизительно у 70% самцов и самок мышей Pint-/- развивался лордокифоз к возрасту 12 недель, по сравнению с 0-20% мышей Pint+/- и однопометных животных дикого типа. К возрасту 26 недель доля мышей Pint-/- с лордокифозом увеличивалась приблизительно до 90%; лордокифоз наблюдался приблизительно у 60% мышей Pint+/- при менее чем 20% у однопометных животных дикого типа, n>9 мышей на группу для всех зарегистрированных наблюдений.
[00052] Фиг. 6 иллюстрирует наблюдавшуюся у нокаутных по Fendrr мышей аномальную морфологию легких на стадии e13.5. А. Экспрессия репортерного гена LacZ на стадии е12.5 в нокаутных по Fendrr эмбрионах демонстрирует положительную экспрессию в лобно-носовой области (FN) морды, области аорта-гонады-мезонефрос (AGM) и в дыхательных путях, в том числе в легких (L) и трахее (Т). В. На срезах легких на стадии el3.5 выявлен аномальный, дезорганизованный, глобулярный фенотип долей у нокаутных животных при сравнении с гетерозиготами (Het).
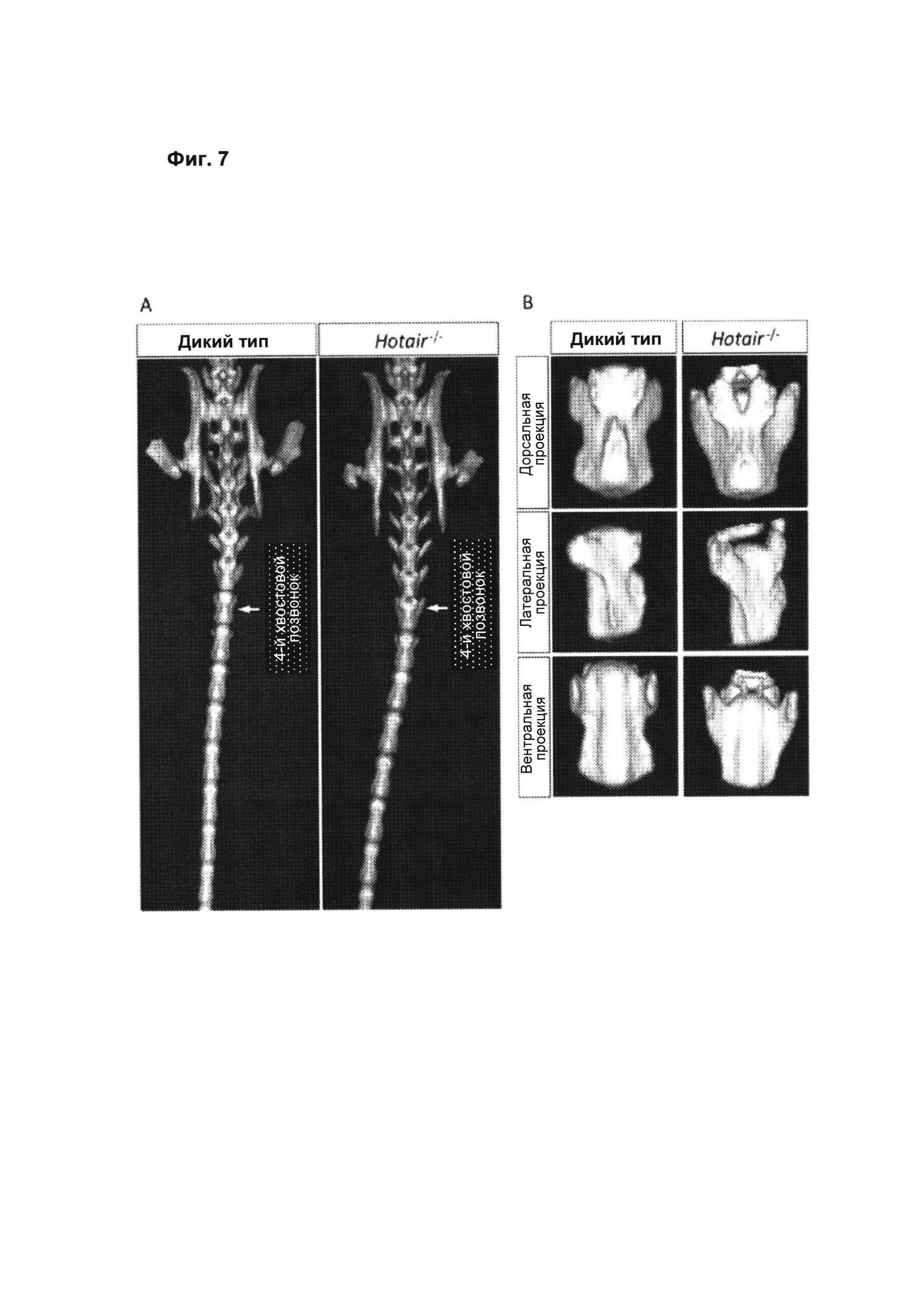
[00053] Фиг. 7 иллюстрирует гомеозисную трансформацию, наблюдаемую в 4-м хвостовом позвонке нокаутных по НОТAIR мышей. А. Визуализация крестцовой и каудальной области скелета мыши с помощью микроКТ выявляет гомеозисную трансформацию 4-го хвостового позвонка с образованием структуры, аналогичной структуре 3-го хвостового позвонка нокаутных по HOTAIR мышей. В. Сравнение дорсальной, латеральной и вентральной проекций 4-го хвостового позвонка мышей WT и нокаутных (КО) по HOTAIR выявляет структурную аномалию у КО, указывающую на гомеозисную трансформацию.
[00054] На фиг. 8 видно, что у нокаутных по HOTTIP мышей наблюдался фенотип с аномальным положением задних конечностей, пониженной силой захвата передних и задних конечностей и мышечной атрофией. А. У нокаутных по HOTTIP мышей наблюдалось необычное «поджимание» задних конечностей при подвешивании за хвост.WT, дикий тип; КО, нокаутные. В. Тест на выносливость на сетке выявил, что у нокаутных по HOTTIP мышей снижена способность удерживаться на перевернутой крышке проволочной клетки. n=5 мышей для каждой группы. С. У WT, Het и нокаутных мышей извлекали и взвешивали правую и левую ТА (переднюю большеберцовую), GA (икроножную) и Quad (четырехглавую) мышцы. Массу мышц нормируют по массе тела и вычисляют значение, включающее массу и правой, и левой мышц. Данные представлены как среднее +/- SEM, n=6 мышей для каждой группы. Значимое снижение массы мышц наблюдалась только у GA нокаутных по HOTTIP животных, как самцов, так и самок (данные для самцов не показаны). Звездочками указано значимое отличие массы мышц GA у КО по сравнению со всеми остальными контрольными группами (Р<0,01). D. Сравнение количества мышечных волокон GA у WT, Het и КО. У КО наблюдалось значимое снижение числа волокон. Значимость оценивали с применением однофакторного дисперсионного анализа ANOVA (Р<0,0001). Е. Сравнение средних значений площади поперечных срезов мышечных волокон. Поперечные срезы мышц GA окрашивали антителом против ламинина (Sigma) и измеряли. Заметные различия размеров между скелетными мышцами КО и контроля отсутствуют. n=6 мышей на группу для всех анализов мышц.
[00055] Фиг. 9 иллюстрирует высокоточное окрашивание в небольших зонах для четырех нокаутов дпнРНК, демонстрирующих высокоспецифические паттерны окрашивания: Специфические для середины гестации профили экспрессии lacZ для Peril, Ptgs2os2, Trp53cor1 и Lincenc1 (А) Профилирование репортера LacZ для Peril указывает на специфический нейрональный паттерн экспрессии, а также выраженную экспрессию в сердце и задней хвостовой области. (В) Экспрессия репортера lacZ гена Ptgs2os2 ограничена основанием развивающихся передних и задних конечностей. (С) Экспрессия репортера lacZ гена Trp53cor1 является специфической для развивающейся плакоды вибриссов в носовом отростке. Эмбрионы на стадии Е12.5 из одного помета отражают прогрессирование развития плакоды вибриссов на протяжении короткого периода времени. (D) Передние и задние конечности эмбрионов Lincenc1+/- отделяли для детекции экспрессии в зачатках молочной железы (указатели стрелок). Вид снизу эмбриона Lincenc1+/- на стадии Е12.5: экспрессия lacZ детектируется в пяти парах зачатков молочных желез.
[00056] Фиг. 10 иллюстрирует фенотип, характеризующийся утратой пяточной кости при нокаутах HOTTIP: Пороки развития скелета, наблюдаемые у мутантных по Hottip мышей. Помимо фенотипа скелетных мышц задней конечности у мышей Ноttip-/- также наблюдаются аномалии костей скелета, визуализируемые при проведении трехмерной микро-КТ. И у самцов, и у самок (С и F) мышей Hottip-/- укорочены пяточные кости (указаны стрелками) по сравнению с (А и D) WT и (В и Е) Hottip+/- однопометными контрольными животными.
[00057] На фиг. 11 приведена таблица (таблица 2) экспрессии репортера в эмбриональных и зрелых тканях для нокаутных днРНК в настоящем исследовании.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Терминология
[00058] Термин «эмбриональная стволовая клетка», или «ЭСК» включает происходящую из эмбриона тотипотентную или плюрипотентную клетку, которая способна вносить вклад в любую ткань развивающегося эмбриона при введении в эмбрион. Термин «плюрипотентная клетка» включает недифференцированную клетку, обладающую способностью к развитию более чем в один тип дифференцированных клеток.
[00059] Термин «большой направленный вектор» или «LTVEC» включает большие направленные векторы для эукариотических клеток, которые происходят из фрагментов клонированной геномной ДНК большего размера, чем размер обычно используемых при других подходах, предназначенных для осуществления таргетинга генов посредством гомологичной рекомбинации в эукариотических клетках. Примеры LTVEC включают, не ограничиваясь перечисленными, бактериальную гомологичную хромосому (ВАС) и дрожжевую искусственную хромосому (YAC).
[00060] Термин «участок рекомбинации» включает нуклеотидную последовательность, распознаваемую сайт-специфической рекомбиназой, которая может служить в качестве субстрата для рекомбинации.
[00061] Термин «сайт-специфическая рекомбиназа» включает группу ферментов, которые могут облегчать рекомбинацию между «участками рекомбинации». Примеры «сайт-специфической рекомбиназы» включают, не ограничиваясь перечисленными, рекомбиназы Сrе, Flp и Dre.
[00062] Термин «зародышевая линия» в отношении последовательности нуклеиновой кислоты включает последовательность нуклеиновой кислоты, которая может быть передана потомству.
[00063] Выражение «функционально связанный» означает, что компоненты соединены для совместного функционирования надлежащим образом. В одном случае последовательность нуклеиновой кислоты, кодирующая белок, может быть функционально связана с регуляторными последовательностями (например, последовательностью промотора, энхансера, сайленсера и т.п.) таким образом, чтобы сохранялась надлежащая регуляция транскрипции.
[00064] Термин «длинная некодирующая РНК» или «днРНК» в настоящем документе включает не кодирующий белок транскрипт размером более 200 нуклеотидов.
[00065] Термин «длинная межгенная некодирующая РНК» или «дпнРНК» в настоящем документе включает подгруппу днРНК. В настоящем документе дпнРНК не перекрываются с экзонами кодирующих белки областей генома.
[00066] Термин «локус» определен как сегмент ДНК в составе геномной ДНК. Например, локус днРНК представляет собой сегмент ДНК в составе геномной ДНК, который кодирует днРНК.
I. Композиции, включающие генетическую модификацию по меньшей мере одного локуса днРНК
[00067] Предложены не являющиеся человеком животные, клетки, ткани и эмбрионы, в которых наблюдается потеря функции днРНК, в том числе, но не ограничиваясь перечисленным разрушение или нокауты одной или большего количества днРНК. Предложены способы и композиции для манипулирования экспрессией днРНК. Также предложены направленные композиции для направленной модификации или нокаута днРНК. Предложены не являющиеся человеком животные, клетки и ткани, демонстрирующие фенотип, связанный с отсутствием функции одной или большего количества днРНК. Хотя в следующем ниже описании приведены ссылки на исследование определенных конкретных днРНК, указанные способы и композиции могут быть реализованы в отношении любых днРНК.
[00068] В настоящем изобретении предложены не являющиеся человеком животные, клетки, ткани и эмбрионы, содержащие направленную генетическую модификацию по меньшей мере в одном локусе длинной некодирующей РНК (днРНК). В таких случаях модифицированный локус днРНК включает мутацию с утратой функции в последовательности нуклеиновой кислоты, которая кодирует указанную днРНК. Также предложены клетки, ткани и эмбрионы, происходящие из не являющихся человеком животных, содержащие мутацию с потерей функции по меньшей мере одной днРНК.
[00069] Термин «потеря функции» в отношении днРНК может включать любую модификацию в локусе днРНК, которая приводит к снижению или утрате экспрессии днРНК, и/или снижению или утрате активности/функции днРНК. Уровень экспрессии днРНК может быть измерен прямо, например, путем анализа уровня указанной днРНК в клетке или организме.
[00070] В целом, уровень экспрессии и/или активность днРНК понижен, если уровень экспрессии указанной днРНК и/или уровень активности указанной днРНК статистически значимо ниже (р≤0,05) уровня для указанной днРНК в подходящей контрольной клетке или подходящем контрольном организме, который(ая) не был(а) генетически модифицирован(а) или мутирован(а) для ингибирования экспрессии и/или активности указанной днРНК. Согласно конкретным вариантам реализации концентрация и/или активность днРНК понижена по меньшей мере на 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более относительно контрольной(ого) клетки или организма, который(ая) не был(а) модифицирован(а) для понижения уровня и/или активности указанной днРНК.
[00071] В других случаях клетки или организмы, содержащие направленную генетическую модификацию, которая уменьшает уровень экспрессии и/или активность днРНК, выбирают с применением способов, включающих, не ограничиваясь перечисленными, анализ методом саузерн-блоттинга, секвенирование ДНК, ПЦР-анализ или фенотипический анализ. Такие клетки или организмы затем используют в различных способах и композициях, описанных в настоящем документе.
[00072] «Клетка-субъект» или «организм-субъект» представляет собой клетку или организм, подвергнутый генетическому изменению, например, генетической модификации, раскрытой в настоящем документе, или представляет собой клетку/организм, который происходит от таким образом измененной(ого) клетки/организма и содержит указанное изменение. «Контроль», или «контрольная клетка», или «контрольный организм» обеспечивает точку сравнения для измерения изменений в фенотипе клетки-субъекта или организма. Согласно одному варианту реализации контрольная(ый) клетка/организм максимально близко соответствует клетке/организму с генетической модификацией в днРНК, за исключением отсутствия указанной генетической модификации или мутации, приводящей к пониженной экспрессии и/или активности (например, соответствующие клетки могут происходить из той же линии клеток). В других случаях контрольная клетка/организм может включать, например: (а) клетку/организм дикого типа, т.е. с тем же генотипом, что и исходный материал для генетического изменения, которое привело к получению клетки/организма-субъекта; (b) клетку/организм с тем же генотипом, что и исходный материал, но генетически модифицированную(ый) нулевой конструкцией (т.е. конструкцией, не оказывающей известного эффекта на представляющий интерес признак, например, конструкцией, содержащий маркерный ген); (с) клетку/организм, которая(ый) представляет собой генетически не модифицированное потомство клетки/организма-субъекта (т.е. контрольная клетка и клетка-субъект происходят из одной линии клеток); (d) клетку/организм, генетически идентичную(ый) указанной(ому) клетке/организму-субъект, но не подвергающую(ий)ся воздействию условий или стимулов, индуцирующих экспрессию представляющего интерес гена; или (е) собственно клетку/организм-субъект, в условиях, при которых указанная генетическая модификация не приводит к изменению экспрессии представляющего интерес полинуклеотида.
[00073] Термин «животное» в отношении животных, клеток, тканей или эмбрионов включает млекопитающих, рыб и птиц. Млекопитающие включают, например, человека, не являющихся человеком приматов, обезьян, человекообразных обезьян, кошек, собак, лошадь, быка, оленя, бизона, овец, грызунов (например, мышей, крыс, хомяков, морских свинок), домашний скот (например, виды бычьих, такие как коровы, вол и т.п.; виды овец, например, овцы, козы и т.п.; и виды свиней, например, свиней и кабанов). Птицы включают, например, курицу, индейку, страуса, гусей, уток и т.п. Также включены одомашненные животные и сельскохозяйственные животные. Выражение «не являющееся человеком животное» в отношении животных, клеток, тканей или эмбрионов исключает человека.
[00074] Согласно одному варианту реализации указанное животное представляет собой не являющееся человеком животное. Согласно другому варианту реализации указанное не являющееся человеком животное представляет собой млекопитающее. Согласно другому варианту реализации указанное млекопитающее представляет собой грызуна. Согласно дополнительному варианту реализации указанный грызун представляет собой мышь, крысу или хомяка.
[00075] Генетические модификации согласно описанию в настоящем документе может включать одно или большее количество удалений в представляющем интерес локусе днРНК, добавлений в представляющем интерес локусе днРНК, замену представляющего интерес локуса днРНК и/или любую их комбинацию. Представляющий интерес локус может содержать кодирующие области или некодирующие регуляторные области.
[00076] Предложенные в настоящем изобретении генетические модификации нацелены на представляющий интерес локус днРНК. Потеря функции днРНК может быть обусловлена направленной генетической модификацией в гене днРНК (т.е. генетической модификацией в регуляторной области, кодирующей области, экзонах и/или интронах, и т.п.). Такие направленные модификации включают, не ограничиваясь перечисленными, добавления одного или большего количества нуклеотидов, удаления одного или большего количества нуклеотидов, замены одного или большего количества нуклеотидов, разрушение локуса днРНК, нокаут локуса днРНК или его части, нокин локуса днРНК или его части, замену эндогенной последовательности нуклеиновой кислоты днРНК или ее части гетерологичной последовательностью нуклеиновой кислоты, или их комбинацию. Согласно конкретным вариантам реализации по меньшей мере 1, 2, 3, 4, 5, 7, 8, 9, 10, 50, 100, 400 или большее количество нуклеотидов изменены для достижения направленной геномной модификации.
[00077] Согласно одному варианту реализации указанная мутация с потерей функции характеризуется разрушением или нокаутом по меньшей мере одной функции днРНК.
[00078] Локус днРНК может быть генетически модифицирован в любой области локуса таким образом, что указанная модификация приводит к потере функции указанной днРНК. Согласно одному варианту реализации указанная модификация локуса днРНК включает удаление всей кодирующей области днРНК или ее части. Согласно одному варианту реализации указанный модифицированный локус днРНК включает удаление одного или большего количества экзонов, которые кодируют указанную днРНК или ее часть. Согласно другому варианту реализации указанное удаление включает удаление одного или большего количества экзонов в составе локуса днРНК, начиная с первого экзона указанного локуса днРНК. Согласно другим вариантам реализации указанное удаление включает удаление одного или большего количества экзонов в составе локуса днРНК, начиная со второго экзона указанного локуса днРНК.
[00079] В некоторых случаях локус днРНК или его часть заменяют встраиваемой нуклеиновой кислотой. В таких случаях указанная замена может представлять собой замену всей кодирующей области РНК указанного локуса днРНК или его части встраиваемой нуклеиновой кислотой, замену одного или большего количества экзонов указанного локуса днРНК, встраиваемой нуклеиновой кислотой, замену одного или большего количества экзонов в составе локуса днРНК, начиная с первого экзона указанного локуса днРНК, встраиваемой нуклеиновой кислотой, или замену одного или большего количества экзонов в составе локуса днРНК, начиная со второго экзона, встраиваемой нуклеиновой кислотой.
[00080] В некоторых случаях встраиваемую нуклеиновую кислоту располагают в локусе днРНК таким образом, чтобы обеспечить ее функциональную связь с эндогенным промотором днРНК, так что указанный эндогенный промотор днРНК управляет экспрессией встраиваемой нуклеиновой кислоты. В таких случаях экспрессия указанной последовательности нуклеиновой кислоты подчиняется паттерну экспрессии днРНК.
[00081] Согласно одному варианту реализации указанный локус днРНК или его часть заменяют встраиваемой нуклеиновой кислотой, содержащей первую последовательность нуклеиновой кислоты, которая кодирует репортер. Например, в том случае, когда встраиваемая нуклеиновая кислота содержит репортерный ген и размещена в локусе днРНК в функциональной связи с промотором днРНК, экспрессия репортерного гена находится под управлением эндогенного промотора днРНК. Как вариант, встраиваемая нуклеиновая кислота встроена без обеспечения функциональной связи с эндогенным промотором днРНК. В таких случаях встраиваемая нуклеиновая кислота может содержать промотор. Согласно одному варианту реализации указанная встраиваемая нуклеиновая кислота содержит репортерный ген, функционально связанный с промотором, который управляет экспрессией указанного репортерного гена.
[00082] Согласно одному варианту реализации указанный локус днРНК или его часть заменяют встраиваемой нуклеиновой кислотой, содержащей вторую последовательность нуклеиновой кислоты, которая кодирует селектируемый маркер. В таких случаях указанная вторая последовательность нуклеиновой кислоты функционально связана с промотором, который управляет экспрессией селектируемого маркера.
[00083] Согласно другому варианту реализации указанный локус днРНК или его часть заменяют встраиваемой нуклеиновой кислотой, содержащей репортерный ген и селектируемый маркерный ген. В таких случаях указанный репортерный ген и/или указанный селектируемый маркерный ген может(гут) быть или не быть функционально связан с промотором.
[00084] В различных разделах настоящего документа предложены различные промоторы, которые могут использоваться в настоящих способах и композициях.
[00085] Такие генетические модификации (в том числе приводящие к снижению или модуляции экспрессии и/или активности целевой днРНК) также могут передаваться через зародышевую линию. Согласно конкретным вариантам реализации указанная генетические модификации приводят к нокауту требуемого целевого локуса. Такие не являющиеся человеком животные, например, находят применение в различных экспериментальных системах согласно описанию в различных разделах настоящего документа.
[00086] Например, нокауты днРНК обеспечивают модель на животных для исследования функции днРНК, роли в развитии и участия днРНК в различных клеточных путях и заболеваниях, в том числе, но не ограничиваясь перечисленным, в старении, в том числе преждевременном старении, развитии головного мозга, эмбриональном развитии, развитии легких, развитии скелета, развитии мышц, раковых заболеваниях или регуляции транскрипции.
[00087] Различные способы могут применяться для получения направленной генетической модификации и описаны в различных разделах настоящего документа.
А. днРНК
[00088] У не являющихся человеком животных, в клетках, тканях и эмбрионах, задействованных в предложенных в настоящем изобретении способах и композициях, имеется генетическая модификация, которая приводит к потере функции по меньшей мере одной днРНК. днРНК представляют собой длинные некодирующие РНК размером более 200 нуклеотидов. Подгруппа днРНК, длинные межгенные некодирующие РНК (дпнРНК), представлена межгенными РНК, и они не перекрываются с кодирующими белки областями.
[00089] С помощью предложенных в настоящем изобретении способов и композиций может быть модифицирован любой локус днРНК. Согласно одному варианту реализации указанное(ый,ая) генетически модифицированное не являющееся человеком животное, клетка, ткань или эмбрион содержит генетическую модификацию в днРНК. Согласно другому варианту реализации указанная днРНК представляет собой дпнРНК.
[00090] Неограничивающие примеры днРНК включают HOTAIR, HOTTIP, Hoxa11os (ранее называвшуюся HoxA11as), Pantr1 (ранее называвшуюся lincRNA-Brn1-a), Pantr2 (ранее называвшуюся lincRNA-Brn1-b), Ptgs2os2 (ранее называвшуюся lincRNA-Cox2), Eldr (ранее называвшуюся Fabl и lincRNA-Egfr), lincenc1 (ранее называвшуюся lincRNA-Enc1), Mannr (ранее называвшуюся lincRNA-Evi1), Fendrr (ранее называвшуюся lincRNA-Foxf1), Halr1 (ранее называвшуюся Haunt и lincRNA-HoxA1), Haglr (ранее называвшуюся Mdgt и lincRNA-HoxD3), Celrr (ранее называвшуюся Celr и lincRNA-Insig2), Crnde (ранее называвшуюся lincRNA-Irx5), Kantr (ранее называвшуюся Spasm и lincRNA-Jarid1c), Pint (ранее называвшуюся linc-Pint и lincRNA-Mkln1), Trp53cor1 (ранее называвшуюся lincRNA-p21), lincppara (ранее называвшуюся lincRNA-Ppara), Peril (ранее называвшуюся lincRNA-Sox2), Tug1 (ранее называвшуюся lincRNA-Tug1) или их комбинацию.
[00091] В настоящее время известно, что геном не исчерпывается кодирующими белки генами (Mattick, J.S. (2009), PLoS Genet 5: е1000459). Широкомасштабные полногеномные исследования экспрессии в клетках млекопитающих выявили, что приблизительно три четверти генома может экспрессироваться в виде РНК (Carninci, P., et al. (2005), Science 309: 1559-1563; Djebali, S., et al. (2012), Nature 489: 101-108; Kapranov, P., et al. (2007), Science 316: 1484-1488), и большинство транскриптов не кодируют белки. Среди некодирующих транскриптов присутствует неоднородный класс, известный как «длинные некодирующие РНК» (днРНК). Представленные приблизительно 15000 транскриптов из приблизительно 10000 геномных локусов в клетках человека (Derrien, Т., et al. (2012), Genome Res 22: 1775-1789.), днРНК и подкласс, известный как длинные промежуточные некодирующие РНК (дпнРНК) (Guttman, М., et al. (2009), Nature 458: 223-227; Khalil et al. (2009)) напоминают кодирующие белки мРНК структурой, синтезом и характеристиками хроматина их генов. Вопрос о том, распространяется ли указанное структурное сходство на функциональное разнообразие, как в случае белков, остается открытым.
[00092] Функциональные исследования индивидуальных днРНК идентифицировали их роли в инактивации Х-хромосомы (Marahrens, Y., et al. (1997), Genes Dev 11: 156-166), импринтинге (Leighton, P.A., et al. (1995), Nature 375: 34-39; Mohammad, F., et al. (2010), Development 137: 2493-2499; Sleutels, F., et al. (2002), Nature 415: 810-813; Takahashi, N., et al. (2009), Hum Mol Genet 18: 1879-1888), дифференциации сетчатки (Young, T.L., et al. (2005), Curr Biol 15: 501-512), и развитии сердца и стенки тела (Grote, P., et al. (2013), Dev Cell 24: 206-214). Исследования дпнРНК HOTAIR сначала выявили, что дпнРНК могли регулировать генную экспрессию в сайтах, далеких от их собственных сайтов транскрипции, направляя комплексы модификации хроматина (репрессионный комплекс Polycomb 2 в случае HOTAIR) в специфические геномные локусы (Rinn, J.L., et al. (2007), Cell 129: 1311-1323). Аналогичные механизмы действия были обнаружены для днРНК Xist в отношении инактивации Х-хромосомы (Zhao, J., et al. (2008), Science 322: 750-756) и для днРНК AIR и Kcnq1ot1 в отношении импринтинга. Указанные открытия предполагают более широкую роль днРНК в регуляции генной экспрессии, что подтверждается анализом соответствующих паттернов экспрессии дпнРНК и кодирующих белки генов, указывающим на участие дпнРНК в обширном спектре клеточных процессов и физиологии систем органов (Guttman et al. (2009)). Во многих недавних исследованиях днРНК были задействованы стратегии глобального генома, что позволило составить общую картину роли днРНК как класса. Для ответа на вопросы о том, являются ли эффекты днРНК на генную экспрессию белков широкими, слабыми, буферными или специфическими, прямыми и детерминативными, требуется исследование их индивидуальных ролей у живых животных.
[00093] В настоящем изобретении согласно приведенному ниже описанию предложены неограничивающие примеры генетических модификаций, приводящих к нокауту различных днРНК в модели на нокаутных мышах. Было проведено исследование генной экспрессии и фенотипов у нокаутных мышей для 20 генов дпнРНК, включающее профилирование LacZ, продемонстрировавшее разнообразные пространственно-временные паттерны тканеспецифической экспрессии; выявлены две нокаутные линии, в которых наблюдалась перинатальная летальность; также выявлены другие фенотипы, включая связанный с преждевременным старением фенотип, дефекты легких, скелета, головного мозга и мышц.
[00094] Чтобы приступить к исследованию функций днРНК у живых животных, были получены линии нокаутных мышей для 20 генов дпнРНК. Каждый мутантный аллель нес репортер lacZ, профилирование экспрессии которого выявляло широкий спектр пространственно-временных и тканеспецифических паттернов транскрипции у зрелых животных и в эмбрионах. У 6 из 18 гомозиготных нокаутных линий (приблизительно 33%) наблюдались прослеживаемые мутантные фенотипы, два из которых (11%) отличались перинатальной летальностью, и включали связанный с преждевременным старением фенотип, аберрантную морфологию головного мозга, легких, скелета, и изменения мышечных и глобальных паттернов генной экспрессии в мышцах, в совокупности указывающие на разнообразные роли указанного нового класса функциональных РНК в эмбриональном развитии и физиологии широкого спектра тканей и органов.
В. Генетическая модификация локуса днРНК
[00095] В настоящем изобретении предложены способы и композиции для генетической модификации по меньшей мере одного локуса днРНК у не являющегося человеком животного, в клетке, ткани или эмбрионе не являющегося человеком животного.
[00096] Генетическая модификация указанного представляющего интерес локуса днРНК может представлять собой любую модификацию указанного локуса, как подробно описано в различных разделах настоящего документа (т.е. удаление, вставку, замену и т.п.). В таких случаях генетическая модификация приводит к потере функции днРНК. Согласно одному варианту реализации указанная генетическая модификация включает разрушение или нокаут по меньшей мере одной днРНК.
i. Дизайн и конструирование нокаутных аллелей
[00097] Дизайн и конструирование модифицированного аллеля днРНК, например, нокаутного, осложняются рядом технических трудностей. Например, фактически отсутствуют данные о структурно-функциональных связях днРНК, а локус днРНК не содержит открытой рамки считывания. Таким образом, стратегии, обеспечивающие дизайн аллеля для модификации кодирующей белок последовательности, например, нокаута, могут быть неприменимы к днРНК. Кроме того, границы генов днРНК четко не определены, что также усложняет дизайн модифицированного аллеля днРНК, например, нокаутного. Неограничивающие примеры указанных технических трудностей и стратегий, используемых в настоящем изобретении для успешного преодоления указанных препятствий при дизайне нокаутов днРНК подробно описаны далее в настоящем документе.
[00098] Согласно одному примеру предложенные в настоящем изобретении способы и композиции применяли у мышей, используемых в качестве модельной системы. При этом, хотя приведенное ниже описание относится к мышам, в описанных в настоящем документе способах и композициях может использоваться любое не являющееся человеком животное, любая(ой) клетка, ткань или эмбрион.
[00099] С момента изобретения способа получения генетически модифицированных, так называемых «нокаутных» мышей приблизительно 25 лет назад мыши стали главной системой для исследования функций генов млекопитающих (Capecchi, M.R. (2001), Nat Med 7: 1086-1090; Evans, M.J. (2001), Nat Med 7: 1081-1083; Smithies, O. (2001), Nat Med 7: 1083-1086). За немногими исключениями, применение технологии нокаутных мышей как при исследованиях отдельных генов, так и в широкомасштабных международных проектах (Bradley, A., et al. (2012), Маmm Genome 23: 580-586) было сфокусировано на генах, кодирующих белки, однако в последнее время усилия, предпринимаемые для создания глобальных ресурсов данных по микроРНК нокаутных мышей (Prosser, Н.М., et al. (2011), Nat Biotechnol 29: 840-845) (mcmanuslab.ucsf.edu/microrna_knockout) демонстрируют значение применения указанной технологии для некодирующих РНК.
[000100] Однако применение технологии нокаутных мышей для днРНК, сопряжено с некоторыми техническими вопросами и трудностями. Большинство белков содержат элементы или домены, которые, как известно или по крайней мере предсказано, являются важными для их функционирования. Удаления кодирующих последовательностей указанных критически важных участков часто достаточно для получения нулевого аллеля. Аналогичным образом могут быть разработаны условные аллели, изолирующие критически важный экзон или экзоны для их последующего удаления с помощью воздействия тканеспецифической рекомбиназы. Поскольку к настоящему времени установлены структурно-функциональные связи всего лишь для нескольких днРНК, и отсутствует открытая рамка считывания в качестве ориентира, стратегии получения нокаутов, применимые к кодирующим белки генам, могут быть неприменимы к геномным локусам, которые кодируют днРНК. Хотя ситуация с аннотацией генов днРНК улучшилась (Derrien et al. (2012)), точные границы некоторых генов могут быть неопределенными, что может осложнять дизайн нокаутных аллелей. Высокоэффективным инструментом при применении у нокаутных мышей для кодирующих белки генов является замена целевого гена репортером, таким как, например, кодирующая последовательность β--галактозидазы или флуоресцентного белка, экспрессия которого управляется промотором целевого гена, с отражением таким образом пространственного и временного паттерна экспрессии у мыши. Неограничивающие примеры репортерных генов предложены в различных разделах настоящего документа.
[000101] Замена репортерного гена успешно применялась для некодирующих РНК, таких как хорошо изученный локус Gt(ROSA)26Sor (Zambrowicz, В.Р., et al. (1997), Proc Natl Acad Sci USA 94: 3789-3794), который кодирует днРНК, и ген малой некодирующей РНК miR-155 (Thai, Т.Н., et al. (2007), Science 316: 604-608), однако правила получения таких аллелей для днРНК возможно, нуждаются в доработке. Несмотря на указанные замечания, учитывая наличие тысяч идентифицированных днРНК, сейчас наступил наиболее подходящий момент для исследования возможности использования производительности технологии нокаутных мышей для указанного нового класса генов. С учетом указанной цели в настоящем документе описано создание линий нокаутных мышей для 20 дпнРНК, например, каждый из которых несет обеспечивающий абляцию гена делеционный аллель, например, с заменой β--галактозидазного репортера.
[000102] С применением способов и композиций, предложенных в настоящем изобретении, может быть модифицирован любой днРНК локус. Согласно одному варианту реализации днРНК представляет собой длинную промежуточную некодирующую РНК (дпнРНК). Неограничивающие примеры генов дпнРНК приведены в таблице 1, однако способы и композиции, предложенные в настоящем изобретении, могут применяться на практике в отношении любой днРНК.
[000103] В таблице 1 перечислены 20 генов дпнРНК на 10 разных хромосомах, которые были целевыми в настоящем исследовании, и 26 нокаутных делеционных аллелей, которые были получены. Для внесения мутаций были выбраны представители класса длинных промежуточных некодирующих РНК, поскольку гены дпнРНК по определению изолированы от соседних кодирующих белки генов, и их транскрипты не перекрываются (Guttman et al. (2009)). Указанное свойство позволило разработать схему удаления аллелей, обеспечивающую наименьшую вероятность влияния на экспрессию близлежащих генов. Целевые гены дпнРНК выбирали для отражения различных паттернов экспрессии (Cabili, M.N., et al. (2011), Genes Dev 25: 1915-1927; Khalil, A.M., et al. (2009), Proc Natl Acad Sci USA 106: 11667-11672), с фокусом на нейронной экспрессии, и с учетом их потенциальной вовлеченности в развитие и регуляцию генной экспрессии.


[000104] Стратегия дизайна нокаутных мутаций дпнРНК была ориентирована на достижение двух целей. Во-первых, были получены аллели, точно отражающие транскрипционную активность генов дпнРНК. Несмотря на многочисленные подтверждения тканеспецифической экспрессии дпнРНК (Cabili et al. (2011)), было желательно дополнить указанную базу знаний за счет получения более высокоточных паттернов экспрессии с помощью профилирования экспрессии lacZ, способного выявлять экспрессию в тканях и органах в пространственном и временном отношении, и обнаружить субдоменную и, в некоторых случаях клеточную специфичность, не обнаруживаемую в экспериментах с тканевыми препаратами. Кроме того, ни один из описанных в литературе нокаутных аллелей дпнРНК не содержал репортеров. Во-вторых, были получены обеспечивающие абляцию гена делеции, устранявшие синтез и функцию дпнРНК, так что любые фенотипы, связанные с указанными мутациями, обеспечивали получение информации относительно критически важных функций целевых ДНК. Размер нокаутных делеций варьировал от приблизительно 400 п.о. до 50 Кб, с удалением половины всех аннотированных экзонов. Для большинства остальных аллелей делеция начиналась во втором экзоне. Использование методов генной инженерии VelociGene® (Valenzuela, D.M., et al. (2003a), Nat Biotechnol 21: 652-659) для конструирования и применения больших направленных векторов на основе бактериальных искусственных хромосом (LTVEC) имело принципиальное значение, позволяя конструировать большие, обеспечивающие абляцию генов делеции, необходимые для обеспечения нулевого аллеля для указанного нового класса больших функциональных РНК.
[000105] О связях между структурой и функцией генов дпнРНК, которыми можно было бы руководствоваться при дизайне аллелей, известно немногое. Опыты с разрушением генов Gt(ROSA)26Sor (Zambrowicz et al., (1997)) и BIC (miR-155) (Thai et al. (2007)), позволили установить, что удаление и вставка после первого экзона может обеспечивать надежную тканеспецифическую экспрессию β--галактозидазы или других репортеров. Однако существует возможность, что указанная стратегия не обеспечит полностью нулевую мутацию, если гибридный транскрипт модифицированного аллеля сохраняет функциональную часть дпнРНК из 5'-фрагмента, закодированную в первом экзоне (Tsai, М.С., et al. (2010), Science 329, 689-693). Дизайн нокаутных аллелей, представленных в таблице 1, представлял собой, таким образом, компромисс между желанием получить мутацию с полной абляцией, которая обеспечит максимальную вероятность устранения функции дпнРНК, и задачей получения аллеля, обеспечивающего точный и информативный профиль генной экспрессии за счет β--галактозидазного репортера. Например, для гена HOTAIR были получены два аллеля, один из которых удалял практически всю РНК-кодирующую последовательность, и второй, удаление в котором начиналось во втором экзоне. Оба аллеля давали идентичные фенотипы (описанные ниже), однако только второй функционировал как репортер генной экспрессии.
[000106] В случае дпнРНК, которые расположены в непосредственной близости от кодирующего белки гена и могут иметь общий с ним дивергирующий промотор, начальную точку удаления задавали во втором экзоне, чтобы избежать возможного нарушения транскрипции соседнего гена. На фиг. 1 приведен такой пример для гена Fendrr (lincRNA-Foxf1). На диаграмме представлен пример дизайна элементов, общих для всех аллелей: направленное удаление всех или большинства последовательностей, кодирующих указанную дпнРНК, и замену кассетой, которая содержит последовательность из гена lacZ Е. coli, который кодирует β--галактозидазу, и кассетой (nеоr), которая экспрессирует неомицинфосфотрансферазу, для отбора устойчивых к G418 ЭСК колоний. Сайты распознавания рекомбиназы LoxP, которые обеспечивают опосредованное Сrе исключение перед фенотипическим анализом, фланкируют селективную кассету для отбора по устойчивости к лекарственным средствам. По причине отсутствия функциональной открытой рамки считывания для слияния с последовательностью lacZ, каждый аллель может нести стартовый кодон и консенсусную последовательность Козак (Kozak, М. (1987), Nucleic Acids Res 15, 8125-8148) для эффективной трансляции β--галактозидазного репортера. Неограничивающие примеры консенсусных последовательностей Козак представлены следующими: A/GCCRCCATGG (SEQ ID NO: 1) и GCCGCCRCCATGG (SEQ ID NO: 2), где R представляет собой или G.
[000107] Направленные векторы LTVEC вводили в ЭСК, и осуществляли скрининг для выявления надлежащим образом таргетированных клонов методом анализа утраты аллеля (Frendewey, D., et al. (2010), Methods Enzymol 476, 295-307).
[000108] Метод VelociMouse® (Poueymirou, W.T., et al. (2007), Nat Biotechnol 25, 91-99) применяли для инъецирования в эмбрионы на стадии 8 клеток для преобразования целевых ЭСК в происходящих полностью из ЭСК гетерозиготных мышей поколения F0, готовых для профилирования экспрессии lacZ или скрещивания для получения гомозигот. Более подробное описание способов получения нокаутных по днРНК животных приведено в примерах 1-13 в различных разделах настоящего документа.
ii. Профилирование экспрессии репортера
[000109] Согласно описанию в различных разделах настоящего документа генетическая модификация локуса днРНК может включать замену или вставку/добавление в локус днРНК или его часть встраиваемой нуклеиновой кислоты. В некоторых случаях указанная встраиваемая нуклеиновая кислота содержит репортерный ген. Согласно одному варианту реализации указанный репортерный ген помещают в локус днРНК с обеспечением его функциональной связи с эндогенным промотором днРНК. Такая модификация обеспечивает экспрессию репортерного гена под управлением эндогенного промотора днРНК. Как вариант, функциональную связь репортерного гена с эндогенным промотором днРНК не обеспечивают.
[000110] В способах и композициях, предложенных в настоящем изобретении, может быть использован любой репортер (или детектируемый фрагмент). Неограничивающие примеры репортеров включают, например, β--галактозидазу (кодируемую геном lacZ), зеленый флуоресцентный белок (GFP), усиленный зеленый флуоресцентный белок (eGFP), mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, усиленный желтый флуоресцентный белок (EYFP), Emerald, CyPet, голубой флуоресцентный белок (CFP), церулеум, T-Sapphire, люциферазу, щелочную фосфатазу или их комбинацию.
[000111] Нижеследующее описание представляет собой неограничивающий пример применения репортерного гена lacZ, кодирующего β--галактозидазу. Описанные в настоящем документе способы и композиции могут проводиться с любым репортерным геном.
[000112] Для изучения паттернов экспрессии 20-ти целевых генов дпнРНК применяли окрашивание X-gal на активность β--галактозидазы в целых эмбрионах или тотальных препаратах тканей и органов взрослых мышей. Целевые гены дпнРНК гены демонстрировали различные уникальные паттерны экспрессии репортерного гена (таблица 2 на фиг. 11), представленные в большинстве основных систем органов и типов тканей. Паттерны экспрессии репортеров показывают, что большинство дпнРНК транскрибируются в нескольких зрелых тканях, причем для одного гена, Pint, наблюдалась универсальная экспрессия во всех исследованных тканях. Экспрессия приблизительно одной трети генов дпнРНК была ограничена одним органом, например, головным мозгом в случае Pantr2, Kantr, и Haglr, легкими в случае Маnnr и Fendrr, мочеполовой системой в случае Eldr и грудной клеткой для Halr1. Для трех из генов дпнРНК, включая HOTAIR, Ptgs2os2 и Haglr, не наблюдается экспрессия в какой-либо зрелой ткани.
[000113] Эмбриональная экспрессия, по-видимому, является общим признаком дпнРНК. Исследование экспрессии β--галактозидазного репортера в гетерозиготных эмбрионах или в день 12.5 эмбрионального развития (Е12.5) или примерно в это время выявляло различные специфические паттерны для всех 20 целевых генов дпнРНК (Таблица 2 на фиг. 11, фиг. 2А). Профили экспрессии варьировали от универсального (Tug1) до строго ограниченного, например, эпидермального для Eldr, плакоды вибриссов для Trp53cor1 (фиг. 9) или зачатков молочных желез для Lincenc1 (фиг. 9). Пространственно-временные паттерны экспрессии HOTTIP и Hoxa11os, наблюдаемые в различных областях почек конечностей и хвоста, очень сходны с описанными для соседних кодирующих белки генов кластера НохА (Hostikka, S.L., и Capecchi, M.R. (1998), Mech Dev 70: 133-145; Lu, P., et al. (2008), Development 135: 1395-1405). Экспрессия HOTAIR в задней области хвостовой почки и половом бугорке, которая наблюдалась для β--галактозидазного репортера, была идентична определенной при помощи in situ гибридизации (Schorderet, P., Duboule, D. (2011), PLoS Genet 7: e1002071). Анализ окрашивания β--галактозидазы в разные моменты эмбрионального развития показал, что для экспрессия некоторых дпнРНК начинается на ранней стадии в ограниченном участке, а затем, на более поздних стадиях, распространяется за пределы указанного начального локуса (фиг. 2В), что, опять же, напоминает экспрессию белков Нох (Nagy, А. (2003) Manipulating the mouse embryo: a laboratory manual, Cold Spring Harbor, N.Y., Cold Spring Harbor Laboratory Press). Например, экспрессия генов HOTTIP и Hoxa11os начиналась в самой задней области эмбриона на стадии Е9.5, и позднее распространялась в почки конечностей. Аналогичным образом, исходная экспрессия Celrr в участке возле переднего конца эмбрионов на стадии Е9.5 сохранялась и распространялась на всю длину спинного мозга в течение следующих двух дней.
[000114] В соответствии с часто наблюдаемой экспрессией тканеспецифических днРНК человека в головном мозге (Derrien et al. (2012)), половина из 20-ти целевых генов дпнРНК мыши транскрипционно активны в головном мозге. Как и в случае эмбриональной экспрессии дпнРНК, паттерны в головном мозге (фиг. 3) были уникальными и варьировали от универсальной (lincppara и Pint) до строго ограниченной (Peril, Crnde и Kantr) экспрессии. Из 20 таргетированных генов дпнРНК только для Pint наблюдался глобальный паттерн экспрессии во всем организме, в основном ограниченный постнатальным периодом. Уникальным для Pint было наблюдаемое увеличение экспрессии с возрастом (фиг. 4). У 3-дневных новорожденных мышей транскрипционная активность Pint низкая (головной мозг) или недетектируемая (мышцы грудной клетки), однако затем она постепенно проявляется в возрасте 3 недель и становится выраженной и универсальной к возрасту 8 недель. Хотя интенсивность и временные характеристики экспрессии Pint в разных органах и тканях варьируют, общая тенденция заключается в постепенном увеличении экспрессии с рождения до стабилизации в зрелом возрасте. Указанный возрастной динамический паттерн экспрессии ранее не был известен; авторы настоящего изобретения не наблюдали сходных профилей в экспериментах с lacZ-профилированием для сотен нокаутированных кодирующих белки генов.
iii. Фенотипы
[000115] Генетическая модификация локусов днРНК может приводить к различным фенотипам у не являющихся человеком животных, предложенных в настоящем изобретении. Такие фенотипы могут включать, например, связанный с преждевременным старением фенотип, дефекты развития различных органов, в том числе головного мозга, скелета, мышц или легких, дефекты эмбрионального развития, перинатальную или эмбриональную летальность, утрату волосяного покрова, преждевременное прекращение роста, лордокифоз или аномальные позы.
[000116] Согласно одному варианту реализации не являющееся человеком животное, у которого содержится по меньшей мере одна модифицированная длинная некодирующая РНК (днРНК) согласно описанию в настоящем документе, характеризуется одним или несколькими из следующих фенотипов: (а) связанный с преждевременным старением фенотип; (b) перинатальная летальность; (с) дефект развития легких; (d) морфологический порок хвоста и задних конечностей; (е) потеря мышечной массы в одной или нескольких тканях; (f) дефект развития мозга; или (g) комбинация любых пунктов из (a)-(f).
[000117] Согласно одному варианту реализации генетическая модификация локуса днРНК приводит к летальности. В некоторых случаях модификация указанного локуса днРНК летальна в эмбриональном периоде. Согласно одному варианту реализации модификация указанного локуса днРНК приводит к перинатальной летальности. Согласно одному варианту реализации разрушение или нокаут днРНК Fendrr или днРНК Peril приводит к перинатальной летальности. Согласно другому варианту реализации разрушение или нокаут Haglr приводит к летальности.
[000118] Согласно одному варианту реализации генетическая модификация указанного локуса днРНК приводит к связанному с преждевременным старением фенотипу. У таких животных признаки преждевременного старения могут включать, например, медленный набор массы тела, более раннюю стабилизацию массы тела, преждевременное прекращение роста, лордокифоз, развивающийся к возрасту приблизительно 12 недель, тяжелый лордокифоз, развивающийся к возрасту приблизительно 26 недель, утрату шерсти в возрасте приблизительно шести месяцев, утрату мышечной силы задней конечности в возрасте приблизительно 6 месяцев, или комбинацию перечисленного. Согласно одному варианту реализации генетическая модификация, приводящая к связанному с преждевременным старением фенотипу, представляет собой разрушение или нокаут Pint. Согласно одному варианту реализации указанная днРНК представляет собой Pint, и указанное не являющееся человеком животное характеризуется связанным с преждевременным старением фенотипом, включающим: (а) меньшую скорость роста по сравнению с контролем дикого типа; (b) снижение мышечной силы; (с) фиброз; (d) меньшее содержание жировой ткани в организме по сравнению с контролем дикого типа; (е) меньшую костную минеральную плотность и костную массу бедренной кости по сравнению с контролем дикого типа; (f) пониженную мышечную массу по сравнению с контролем дикого типа; (g) снижение средней продолжительности жизни; (h) лордокифоз; (i) атрофию органов; или (j) комбинацию любых пунктов из (a)-(i).
[000119] Генетическая модификация с потерей функции указанного локуса днРНК может также приводить к дефекту развития мозга. Согласно одному варианту реализации указанная генетическая модификация, приводящая к связанному с преждевременным старением фенотипу, представляет собой разрушение или нокаут Pantr2, Kantr, Peril, Celrr, Pantr1, Crnde, lincenc1, Pint, lincppara или Tug1. Согласно конкретному варианту реализации указанная днРНК представляет собой Pantr2. Согласно другому конкретному варианту реализации указанная днРНК представляет собой Pint.
[000120] Выполняли фенотипический анализ различных примеров нокаутных по дпнРНК мышей, предложенных в настоящем изобретении; он описан далее в настоящем документе.
[000121] Резко выраженное возрастное увеличение экспрессии Pint во всем организме, выявляемое с помощью lacZ-профилирования (фиг. 4), указывает на возможную глобальную гомеостатическую роль Pint в поддержании нормального здоровья мышей по мере увеличения возраста. Для проверки указанной гипотезы путем скрещивания получали гомозиготный нокаутный аллель и наблюдали за мышами дикого типа (WT), гетерозиготными (Het) и гомозиготными нокаутными (КО) мышами от рождения до возраста 26 недель, и исследовали показатели роста и любые явные признаки болезненности или дефекта. У нокаутных по Pint мышей наблюдалась меньшая скорость набора массы тела по мере увеличения возраста, этап стабилизации массы тела достигался раньше и при значимо меньшей массе тела по сравнению с мышами дикого типа (WT) (фиг. 5А и В), что указывает на преждевременное прекращение роста. И у самцов, и у самок мышей КО и Het наблюдался характеризующийся медленным ростом фенотип, однако более выражен он был у самцов. Визуализация скелета индивидуальных мышей с помощью анализа методом микро-КТ по мере увеличения возраста выявляло появление лордокифоза приблизительно у 70% самцов и самок нокаутных по Pint мышей к возрасту 12 недель, а в возрасте 26 недель тяжелый лордокифоз наблюдался приблизительно у 90% нокаутных мышей (фиг. 5С и D). При этом всего у 10-20% мышей дикого типа (WT) в возрасте 26 недель наблюдался незначительный возрастной лордокифоз. Значимый лордокифоз не обнаруживался у мышей Pint Het до возраста 26 недель, что указывает на необычную возрастную гаплонедостаточность для Pint. У нокаутных мышей наблюдалась также возрастная утрата волосяного покрова в возрасте 6 месяцев, сильнее выраженная у самок (5 из 10 КО), чем у самцов (2 из 9), наблюдавшаяся только у одной гетерозиготной (Het) мыши и не наблюдавшаяся ни у одной мыши дикого типа (WT) в этом возрасте. Менее тяжелый фенотип, поджимание задних конечностей при подвешивании за хвост, отмечалось приблизительно у 2/3 нокаутных по Pint мышей в возрасте 6 месяцев (у 60% самок и 67% самцов) по сравнению с приблизительно 20% мышей дикого типа (WT) в этом возрасте. Указанный фенотип может указывать на возрастную утрату мышечной силы задней конечности (см. на фиг. 8 другой пример указанного фенотипа в нокаутной по HOTTIP линии). Спектр связанных с мутациями дефектов у нокаутных по Pint мышей указывает на связанный с преждевременным старением фенотип.
[000122] В двух (11%) из 19 нокаутных по дпнРНК линиях мышей, доведенных до гомозиготности путем скрещивания, Peril и Fendrr, наблюдалась перинатальная летальность (L.A. Goff et al., неопубликованные данные). Недавно был описан нокаут гена Fendrr (Grote et al. (2013)). Указанный аллель состоял из вставки элемента остановки транскрипции в первом экзоне. В эмбрионах, несущих гомозиготную мутацию Fendrr, Grote с коллегами (2013) наблюдали летальность приблизительно на стадии Е13.75, связанную с выраженной амниотической грыжей, снижением толщины вентральной стенки тела и пороком сердца, вызывавшим скопление крови в правом предсердии. Ни один из указанных фенотипов не наблюдался в описанной в настоящем документе нокаутной по Fendrr линии, отличающейся делецией размером 26 Кб с началом в экзоне 2 и концом в последнем аннотированном экзоне (фиг. 1). Окрашивание эмбрионов X-gal на стадии Е12.5 показало экспрессию lacZ в лобно-носовом отростке, верхних дыхательных путях, легких и задней области AGM (аорта-гонады-мезонефрос) (фиг. 6А), идентичную как в гетерозиготных (не показано), так и в гомозиготных эмбрионах. При отдельном рассмотрении развивающихся легких на стадии Е13.5 у нокаутных эмбрионов выявлены дефекты: доли легких были спавшими, имели глобулярную дезорганизованную структуру (фиг. 6В). Мыши, гомозиготные по нокаутному делеционному аллелю гена Fendrr, описанные в настоящем документе, доживали до рождения, однако вскоре погибали в результате явно выраженных проблем с дыханием. Перинатально летальный фенотип мутанта по Fendrr был идентичен фенотипу мышей с 2 разными фоновыми генотипами: описанного в настоящем документе гибрида фоновых генотипов C57B16NTac/129S6SvEvTac и мышей, полученных в результате дополнительного возвратного скрещивания с фоновым генотипом C57BL/6 в отдельной программе разведения.
[000123] Ряд мягко выраженных фенотипов также наблюдался у нокаутных по дпнРНК мышей, доживавших до зрелого возраста и демонстрировавших нормальное менделевское расщепление мутантных аллелей (L.A. Goff et al., неопубликованные данные). Кроме того, имеется выраженная корреляция между экспрессией lacZ и детектируемыми фенотипами для ряда нокаутированных генов дпнРНК, например, Pantr2, HOTAIR и HOTTIP. У мышей, гомозиготных по абляции гена Pantr2 (полное удаление кодирующей последовательности размером 6,5 Кб, таблица 1) наблюдается неправильное развитие коры головного мозга (интенсивное окрашивание в ЦНС), с пониженным количеством промежуточных клеток-предшественников и дефектами при миграции нейронов, влияющими на развитие проекционных нейронов верхнего слоя (L.A. Goff et al., неопубликованные данные). Удаление генов HOTAIR и HOTTIP (полная или частичная абляция генов, таблица 1) вызывало морфологические мальформации с полной пенетрантностью. У нокаутных по HOTAIR мышей наблюдалась очевидная гомеозисная трансформация 4-го хвостового позвонка, по-видимому, в анатомически сходный с 3-й хвостовым позвонком (фиг. 7) (специфическое транзиентное окрашивание lacZ в хвостовой почке). У нокаутных по HOTTIP мышей (демонстрировавших положительное окрашивание в эмбриональных почках конечностей) при подвешивании за хвост наблюдалась аномальная поза по сравнению с однопометными животными дикого типа (фиг. 8А). Указанная поведенческая патология сопровождалась потерей выносливости при захвате по оценке с применением теста, в ходе которого мышам необходимо удерживаться на перевернутой проволочной сетке. Животные дикого типа и мутанты HOTTIP Het удерживались на сетке в течение приблизительно одной минуты, тогда как нокаутные однопометные животные отпускали сетку в течение 10-20 секунд (фиг. 8В). Указанное очевидное снижение силы захвата связано с потерей массы икроножной мышцы, но не передней большеберцовой или четырехглавой мышцы (фиг. 8С). Наблюдалось приблизительно 40% снижение числа волокон икроножной мышцы, однако снижения среднего размера волокон указанной мышцы не отмечалось (фиг. 8D и Е). Помимо мышечных дефектов у нокаутных по HOTTIP мышей также обнаружены пороки развития скелета: укорочение длины пяточной кости задних конечностей (фиг. 10).
[000124] За последние несколько лет произошел прорыв в понимании некодирующего белки компонента генома, в частности, у млекопитающих. К классам некодирующих функциональных РНК, известных уже не одно десятилетие, рибосомальным, транспортным, малым ядерным, малым ядрышковым, малым цитоплазматическим РНК, РНК-компонентам РНКазы Р, РНКазы MRP и теломеразных ферментов, и недавно обнаруженным микроРНК и PIWI-ассоциированным piPHK, в настоящее время могут быть добавлены по меньшей мере 10000 представителей класса длинных некодирующих РНК (Carninci et al. (2005); Derrien et al. (2012); Djebali et al. (2012); Guttman et al. (2009); Kapranov et al. (2007)). По мере понимания представленности в геноме и экспрессии генов днРНК формируется следующая цель - установление их биологических функций. В качестве первого шага к решению этой задачи была использована технология нокаутных мышей, самый высокоэффективный инструмент для определения функций генов млекопитающих, для создания ресурса линий нокаутных мышей для 20 генов дпнРНК, выбранных на основании преимущественной экспрессии в нейрональных клеточных линиях и предполагаемой функции в ходе развития.
[000125] С учетом отсутствия сведений о структурно-функциональных связях дпнРНК, в данном начальном исследовании принципиальное значение имело получение нокаутных аллелей с делециями, в основном или полностью устранявшими кодирующий потенциал дпнРНК, для подтверждения того, что любые наблюдаемые фенотипы были обусловлены полностью нулевым аллелем. Неоднозначная и сложная аннотация многих локусов дпнРНК, с несколькими описанными транскриптами, возможно, образующимися за счет альтернативного сплайсинга или сайтов инициации транскрипции, усложняет дизайн нокаутных аллелей и затрудняет конструирование условных аллелей без риска получения гипоморфных эффектов. Новые данные о молекулярных характеристиках, важных для функции дпнРНК, должны будут направлять дизайн следующего поколения аллелей дпнРНК, обеспечивая более точно направленные модификации важных для функции последовательностей, а также усовершенствованные гибкие стратегии условной экспрессии.
[000126] Цель исследования описанных в настоящем документе нокаутов дпнРНК заключалась в получении аллелей, которые, помимо устранения функции, также отражали пространственно-временной паттерн экспрессии гена. Несмотря на отсутствие характерной для кодирующих белки генов открытой рамки считывания в качестве ориентира, были успешно разработаны аллели, отражавшие генную экспрессию для всех 20 целевых генов. Один из аллелей, экспрессировавших lacZ на взрослой стадии, был представлен Ptgs2os2 (см. фиг. 2А и фиг. 9, описывающие эмбриональную экспрессию), который, как известно, представляет собой одну из дпнРНК, наиболее выраженно индуцируемых воспалительными сигналами (Carpenter, S., et al. (2013), Sciencexpress 01 August 2013; Gunman et al. (2009)). В указанном исследовании не проводились эксперименты со стимуляцией, однако нокаутная по Ptgs2os2 линия предположительно должна представлять собой ценный ресурс для изучения того, что происходит с экспрессией дпнРНК при инфекции или других воспалительных повреждениях и какую биологическую роль она играет в указанном процессе.
[000127] Наблюдавшиеся разнообразие и специфичность паттернов генной экспрессии напоминали наблюдаемые для репортерных аллелей кодирующих белки генов. Эмбриональная экспрессия была характерным общим признаком практически всех исследованных генов дпнРНК. Это может указывать на общую роль дпнРНК в регуляции ключевых событий развития. Во время эмбрионального развития наблюдались изменяющиеся пространственно-временные паттерны, во многом сходные с паттернами белков НОХ (фиг. 2В), высокоспецифичная экспрессия, например, окрашивание плакоды вибриссов на Trp53cor1 и экспрессия в зачатках молочных желез для Lincenc1 (фиг. 2А и фиг. 9), универсальная экспрессия в зрелых тканях, например, для Pint (фиг. 4), и временные изменения паттернов экспрессии, например, качественные изменения, наблюдаемые для Celrr (фиг. 2В) в ходе эмбрионального развития, или ранее неизвестное количественное увеличение глобальной экспрессии с возрастом для Pint (фиг. 4). Поскольку было известно, что многие из выбранных для настоящего исследования генов дпнРНК экспрессируются в линиях нервных клеток, наблюдали специфическую для головного мозга экспрессию репортера (фиг. 3), однако профилирование lacZ обеспечивало более высокое разрешение и более богатую биологическую информацию по сравнению с анализами на основе клеток или срезов тканей.
[000128] Среди фенотипов, наблюдаемых в 19 нокаутных по дпнРНК линиях, гомозиготизированных путем скрещивания, летальность наблюдалась в двух случаях (11%), то есть с частотой, пожалуй, меньшей, чем можно было бы ожидать для нокаутов 20 случайным образом выбранных кодирующих белки генов. Довольно низкий показатель летальности в сочетании с мягкостью нелетальных фенотипов, наблюдаемых для HOTAIR (фиг. 6), HOTTIP (фиг. 7 и 8), Pantr2 (L.A. Goff et al., неопубликованные данные) и др. (М. Sauvageau et al., неопубликованные данные) и часто наблюдаемая эмбриональная экспрессия указывают на то, что дпнРНК могут буферизовать или модулировать генную экспрессию или другие процессы, а не выполнять отдельные значительные функции. Таким образом, дпнРНК могут быть сходны с другими некодирующими РНК меньшего размера, микроРНК, в том, что они также, возможно, разделяют с другими функциональными днРНК общие избыточные и перекрывающиеся мишени и функции.
[000129] Одна из целей настоящего исследования заключалась в получении, с применением общей аллельной стратегии и потенциала функциональных репортеров, ресурса нокаутных по дпнРНК линий мышей, которые могут использоваться в качестве субъектов для более досконального изучения экспрессии и фенотипических исследований. Добавление кассеты LacZ во всех случаях обеспечивало одновременное разрушение функции гена и исследование регуляции паттернов экспрессии дпнРНК с помощью окрашивания X-Gal. Указанные исследования выявляют динамические пространственные и временные паттерны экспрессии дпнРНК во время эмбриогенеза у мышей и на протяжении жизни взрослых животных, дают значимую информацию о характеристиках регуляции/функции указанного нового класса молекул in vivo и с большой точностью определяют области, где может проводиться поиск функции указанных генов. Указанное исследование может рассматриваться как модельное исследование для широкомасштабного проекта по получению мутаций всех представителей класса дпнРНК, аналогичного выполненному Международным консорциумом нокаутных мышей (International Knockout Mouse Consortium) для кодирующих белки генов (Bradley et al. (2012)).
II. Способы модификации локуса днРНК у не являющихся человеком животных
[000130] В настоящем изобретении предложены способы генетической модификации локуса днРНК у не являющихся человеком животных, в клетках, тканях или эмбрионах.
[000131] С применением способов предложенные в настоящем изобретении может быть модифицирован любой локус днРНК. Неограничивающие примеры генов днРНК включают HOTAIR, HOTTIP, Hoxa11os (ранее называвшийся HoxA11as), Pantr1 (ранее называвшийся lincRNA-Brn1-a), Pantr2 (ранее называвшийся lincRNA-Brn1-b), Ptgs2os2 (ранее называвшийся lincRNA-Cox2), Eldr (ранее называвшийся Fabl и lincRNA-Egfr), lincenc1 (ранее называвшийся lincRNA-Enc1), Mannr (ранее называвшийся lincRNA-Evi1), Fendrr (ранее назыавшийся lincRNA-Foxf1), Halr1 (ранее называвшийся Haunt и lincRNA-НохА1), Haglr (ранее называвшийся Mdgt и lincRNA-HoxD3), Celrr (ранее называвшийся Celr и lincRNA-Insig2), Crnde (ранее называвшийся lincRNA-Irx5), Kantr (ранее называвшийся Spasm и lincRNA-Jarid1c), Pint (ранее называвшийся linc-Pint и lincRNA-Mkln1), Trp53cor1 (ранее называвшийся lincRNA-p21), lincppara (ранее называвшийся lincRNA-Ppara), Peril (ранее называвшийся lincRNA-Sox2), Tug1 (ранее называвшийся lincRNA-Tug1) или их комбинацию.
[000132] Согласно одному варианту реализации предложен способ модификации представляющего интерес локуса днРНК в плюрипотентной клетке. Такой способ включает (а) введение в плюрипотентную клетку направленной конструкции, содержащей встраиваемую нуклеиновую кислоту, фланкированную с 5'- и 3'-стороны гомологичными фрагментами, которые могут подвергаться гомологичной рекомбинации с локусом днРНК; и (b) идентификацию модифицированной плюрипотентной клетки, содержащей направленную генетическую модификацию в локусе днРНК. В таких способах генетическая модификация приводит к потере функции указанной днРНК. Согласно одному варианту реализации указанный плюрипотентная клетка представляет собой эмбриональную стволовую клетку мыши или крысы. Согласно другому варианту реализации указанная плюрипотентная клетка представляет собой иПСК человека.
А. Направленные векторы и встраиваемые нуклеиновые кислоты
[000133] Также предложены направленные векторы или нацеливающие конструкции для использования в способах получения генетически модифицированных не являющихся человеком животных, не принадлежащих человеку клеток, тканей или эмбрионов, предложенных в настоящем изобретении.
[000134] Согласно одному варианту реализации предложен направленный вектор, который содержит встраиваемую нуклеиновую кислоту, фланкированную с 5'- и 3'-стороны гомологичными фрагментами, которые могут подвергаться гомологичной рекомбинации с представляющим интерес локусом днРНК.
[000135] Направленные векторы и примеры компонентов направленных векторов (т.е. встраиваемые нуклеиновые кислоты, представляющие интерес полинуклеотиды, экспрессионные кассеты и т.п.) подробно описаны далее в настоящем документе.
i. Встраиваемая нуклеиновая кислота
[000136] «Встраиваемая нуклеиновая кислота» или «встраиваемый полинуклеотид» содержит сегмент ДНК, который требуется встроить в целевой локус. Согласно одному варианту реализации указанная встраиваемая нуклеиновая кислота содержит один или большее количество представляющих интерес полинуклеотидов. Согласно другим вариантам реализации указанная встраиваемая нуклеиновая кислота может содержать одну или большее количество экспрессионных кассет. Та или иная экспрессионная кассета может содержать представляющий интерес полинуклеотид, полинуклеотид, кодирующий селективный маркер и/или репортерный ген наряду с различными регуляторными компонентами, оказывающими влияние на экспрессию.
[000137] Любой представляющий интерес полинуклеотид может содержаться в различных встраиваемых полинуклеотидах и таким образом быть интегрирован в целевой геномный локус. Раскрытые в настоящем документе способы обеспечивают по меньшей мере 1, 2, 3, 4, 5, 6 или большее количество представляющих интерес полинуклеотидов для встраивания в представляющий интерес целевой днРНК геномный локус.
[000138] Согласно одному варианту реализации содержащийся во встраиваемой нуклеиновой кислоте представляющий интерес полинуклеотид кодирует репортер. Согласно другому варианту реализации указанный представляющий интерес полинуклеотид кодирует селектируемый маркер.
[000139] Согласно одному варианту реализации указанный представляющий интерес полинуклеотид может быть фланкирован участками сайт-специфической рекомбинации. Согласно конкретному варианту реализации указанные участки сайт-специфической рекомбинации фланкируют сегмент, кодирующий репортер, и/или сегмент, кодирующий селектируемый маркер.
[000140] Неограничивающие примеры представляющих интерес полинуклеотидов, в том числе селективных маркеров и репортерных генов, которые могут быть включены в состав встраиваемой нуклеиновой кислоты, подробно обсуждаются в различных разделах настоящего документа.
[000141] Представляющий интерес полинуклеотид в составе встраиваемого полинуклеотида при интеграции в целевом локус днРНК может вносить в клетку одну или большее количество генетических модификаций. Указанная генетическая модификация может включать удаление эндогенной последовательности нуклеиновой кислоты и/или добавление экзогенного, или гетерологичного, или ортологичного полинуклеотида в целевой геномный локус. Согласно одному варианту реализации указанная генетическая модификация включает замену эндогенной последовательности нуклеиновой кислоты экзогенным представляющим интерес полинуклеотидом в целевом геномном локусе. Соответственно, способы, предложенные в настоящем изобретении обеспечивают получение генетической модификации, включающей нокаут, удаление, вставку, замену («нокин»), точечную мутацию, перестановку доменов, перестановку экзонов, перестановку интронов, перестановку регуляторных последовательностей, перестановку генов или комбинацию перечисленного в целевом локусе днРНК. Такие модификации могут происходить при интеграции первого, второго, третьего, четвертого, пятого, шестого, седьмого или любого из последующих встраиваемых полинуклеотидов в целевой геномный локус.
[000142] Представляющий интерес полинуклеотид, входящий в состав встраиваемого полинуклеотида и/или интегрируемый в целевой геномный локус, может содержать последовательность, нативную или гомологичную для клетки, в которую его встраивают; представляющий интерес полинуклеотид может быть гетерологичным для клетки, в которую его встраивают; представляющий интерес полинуклеотид может быть экзогенным для клетки, в которую его встраивают; представляющий интерес полинуклеотид может быть ортологичным для клетки, в которую его встраивают; или представляющий интерес полинуклеотид может происходить из вида, отличного от вида, к которому относится клетка, в которую его встраивают. Термин «гомологичный» в отношении последовательности представляет собой последовательность, нативную для клетки. Термин «гетерологичный» в отношении последовательности означает последовательность, происходящую из чужеродного вида, или, в том случае, если она принадлежит тому же виду, по существу модифицированную в отношении состава и/или геномного локуса в результате намеренного вмешательства человека нативную форму. Термин «экзогенный» в отношении последовательности означает последовательность, происходящую из чужеродного вида. Термин «ортологичный» означает полинуклеотид из одного вида, функционально эквивалентный известной референсной последовательности из другого вида (т.е. видовой вариант). Представляющий интерес полинуклеотид может происходить из любого представляющего интерес организма, в том числе, но не ограничиваясь перечисленным, прокариота, эукариота, не являющегося человеком животного, грызуна, хомяка, мыши, крысы, человека, обезьяны, птицы, сельскохозяйственного млекопитающего или не сельскохозяйственного млекопитающего. Представляющий интерес полинуклеотид может также содержать кодирующую область, некодирующую область, регуляторную область или геномную ДНК. Соответственно, 1-й, 2-й, 3-й, 4-й, 5-й, 6-й, 7-й и/или любой из последующих встраиваемых полинуклеотидов может содержать такие последовательности.
[000143] Согласно одному варианту реализации размер представляющего интерес полинуклеотида может варьировать от приблизительно 500 нуклеотидов до приблизительно 200 Кб согласно описанию выше. Размер указанного представляющего интерес полинуклеотида может составлять от приблизительно 500 нуклеотидов до приблизительно 5 Кб, от приблизительно 5 Кб до приблизительно 200 Кб, от приблизительно 5 Кб до приблизительно 10 Кб, от приблизительно 10 Кб до приблизительно 20 Кб, от приблизительно 20 Кб до приблизительно 30 Кб, от приблизительно 30 Кб до приблизительно 40 Кб, от приблизительно 40 Кб до приблизительно 50 Кб, от приблизительно 60 Кб до приблизительно 70 Кб, от приблизительно 80 Кб до приблизительно 90 Кб, от приблизительно 90 Кб до приблизительно 100 Кб, от приблизительно 100 Кб до приблизительно 110 Кб, от приблизительно 120 Кб до приблизительно 130 Кб, от приблизительно 130 Кб до приблизительно 140 Кб, от приблизительно 140 Кб до приблизительно 150 Кб, от приблизительно 150 Кб до приблизительно 160 Кб, от приблизительно 160 Кб до приблизительно 170 Кб, от приблизительно 170 Кб до приблизительно 180 Кб, от приблизительно 180 Кб до приблизительно 190 Кб, или от приблизительно 190 Кб до приблизительно 200 Кб.
[000144] Представляющий интерес полинуклеотид в составе встраиваемого полинуклеотида, и/или встраиваемый в целевой геномный локус, может кодировать полипептид, может кодировать РНК, может кодировать микроРНК, или может содержать любые представляющие интерес регуляторные области или некодирующие области, включая, например, регуляторную последовательность, промоторную последовательность, энхансерную последовательность, связывающую репрессор транскрипции последовательность, консенсусную последовательность Козак, старт-кодон или удаление не кодирующей белок последовательности, но не включает удаление кодирующей белок последовательности. Кроме того, представляющий интерес полинуклеотид в составе встраиваемого полинуклеотида, и/или встраиваемый в целевой геномный локус, может кодировать белок, экспрессируемый в нервной системе, костной системе, пищеварительной системе, кровеносной системе, мышечной системе, дыхательной системе, сердечно-сосудистой системе, лимфатической системе, эндокринной системе, мочевыделительной системе, репродуктивной системе или их комбинации.
[000145] Согласно одному варианту реализации встраиваемая нуклеиновая кислота содержит активированный (нокин) аллель по меньшей мере одного экзона эндогенного гена. Согласно одному варианту реализации встраиваемая нуклеиновая кислота содержит активированный (нокин) аллель всего эндогенного гена (т.е. «нокин при перестановке генов»).
[000146] Согласно одному варианту реализации встраиваемая нуклеиновая кислота содержит регуляторный элемент, в том числе, например, промотор, энхансер или связывающий транскрипционный репрессор элемент.
[000147] Согласно дополнительным вариантам реализации встраиваемая нуклеиновая кислота содержит условный аллель. Согласно одному варианту реализации указанный условный аллель представляет собой многофункциональный аллель согласно описанию в US 2011/0104799, полностью включенной в настоящий документ посредством ссылки. Согласно конкретным вариантам реализации указанный условный аллель содержит: (а) инициирующую последовательность в смысловой ориентации относительно транскрипции целевого гена, и селективную кассету для отбора по устойчивости к лекарственным средствам в смысловой или антисмысловой ориентации; (b) представляющую интерес нуклеотидную последовательность в антисмысловой ориентации (NSI) и «условный за счет инверсии» (((conditional by inversion))) модуль (COIN, который задействует расщепляющий экзон интрон и инвертируемый сходный с генной ловушкой модуль; см., например, US 2011/0104799, полностью включенную в настоящий документ посредством ссылки); и (с) рекомбинируемые единицы, рекомбинация которых происходит при воздействии первой рекомбиназой с образованием условного аллеля, который (i) не содержит инициирующей последовательности и DSC, и (ii) содержит NSI в смысловой ориентации и COIN в антисмысловой ориентации.
[000148] Согласно одному варианту реализации указанная встраиваемая нуклеиновая кислота содержит генетическую модификацию в кодирующей последовательности. Согласно одному варианту реализации указанная генетическая модификация включает мутацию удаления кодирующей последовательности. Согласно одному варианту реализации указанная генетическая модификация включает слияние двух эндогенных кодирующих последовательностей.
[000149] Согласно одному варианту реализации указанная генетическая модификация включает удаление не кодирующей белок последовательности, но не включает удаление кодирующей белок последовательности. Согласно одному варианту реализации удаление указанной не кодирующей белок последовательности включает удаление локуса днРНК или его части. Согласно одному варианту реализации указанный удаление указанной не кодирующей белок последовательности включает удаление регуляторного элемента. Согласно одному варианту реализации указанная генетическая модификация включает удаление промотора. Согласно одному варианту реализации указанная генетическая модификация включает добавление промотора или регуляторного элемента. Согласно одному варианту реализации указанная генетическая модификация включает замену промотора или регуляторный элемент.
[000150] Согласно одному варианту реализации последовательность нуклеиновой кислоты направленного вектора может содержать полинуклеотид, который при интеграции в геном обеспечивает генетическую модификацию области локуса днРНК млекопитающего, не являющегося человеком животного или не являющегося человеком млекопитающего, при этом указанная генетическая модификация в локусе днРНК приводит к потере функции днРНК. Согласно одному варианту реализации достигается нокаут днРНК («нулевой аллель). Согласно другому варианту реализации достигается разрушение в локусе днРНК.
[000151] Согласно дополнительным вариантам реализации встраиваемая нуклеиновая кислота обеспечивает замену части локуса днРНК млекопитающего, не являющегося человеком животного или не являющегося человеком млекопитающего, указанной встраиваемой последовательностью нуклеиновой кислоты. Согласно одному варианту реализации указанная встраиваемая последовательность нуклеиновой кислоты представляет собой репортерную последовательность нуклеиновой кислоты.
[000152] Определенный встраиваемый полинуклеотид и соответствующая заменяемая область локуса млекопитающего, не являющегося человеком животного или не являющегося человеком млекопитающего может представлять собой некодирующую область, кодирующую область, интрон, экзон, нетранслируемую область, регуляторную область, промотор или энхансер, или любую их комбинацию. Кроме того, длина определенного встраиваемого полинуклеотида и/или области удаляемого локуса млекопитающего, не являющегося человеком животного или не являющегося человеком млекопитающего может принимать любое требуемое значение, в том числе, например, может быть 10-100 нуклеотидов длиной, 100-500 нуклеотидов длиной, 500 - 1 Кб нуклеотидов длиной, 1 Кб - 1,5 Кб нуклеотидов длиной, 1,5 Кб - 2 Кб нуклеотидов длиной, 2 Кб - 2,5 Кб нуклеотидов длиной, 2,5 Кб - 3 Кб нуклеотидов длиной, 3 Кб - 5 Кб нуклеотидов длиной, 5 Кб - 8 Кб нуклеотидов длиной, 8 Кб - 10 Кб нуклеотидов длиной или более. В других случаях размер вставки или замены составляет от приблизительно 5 Кб до приблизительно 10 Кб, от приблизительно 10 Кб до приблизительно 20 Кб, от приблизительно 20 Кб до приблизительно 40 Кб, от приблизительно 40 Кб до приблизительно 60 Кб. Согласно другим вариантам реализации указанный определенный встраиваемый полинуклеотид и/или область удаляемого локуса млекопитающего, клетки человека или не являющегося человеком млекопитающего составляет по меньшей мере 100, 200, 300, 400, 500, 600, 700, 800 или 900 нуклеотидов, или по меньшей мере 1 Кб, 2 Кб, 3 Кб, 4 Кб, 5 Кб, 6 Кб, 7 Кб, 8 Кб, 9 Кб, 10 Кб, 11 Кб, 12 Кб, 13 Кб, 14 Кб, 15 Кб, 16 Кб, 17 Кб, 18 Кб, 19 Кб, 20 Кб, 25 Кб, 30 Кб, 35 Кб, 40 Кб, 45 Кб, 50 Кб или более.
[000153] Согласно одному варианту реализации встраиваемая нуклеиновая кислота встроена в представляющий интерес локус днРНК таким образом, что она функционально связана с эндогенным промотором днРНК. В таких случаях промотор днРНК управляет экспрессией встроенной последовательности нуклеиновой кислоты. Согласно одному варианту реализации указанная встраиваемая последовательность нуклеиновой кислоты представляет собой репортерную последовательность нуклеиновой кислоты.
[000154] В некоторых случаях встраиваемая нуклеиновая кислота содержит промотор. Согласно одному варианту реализации указанная встраиваемая нуклеиновая кислота содержит представляющий интерес полинуклеотид, функционально связанный с промотором, который управляет экспрессией представляющего интерес полинуклеотида. Согласно одному варианту реализации указанный представляющий интерес полинуклеотид содержит репортерную последовательность нуклеиновой кислоты. Согласно другому варианту реализации указанный представляющий интерес полинуклеотид содержит последовательность нуклеиновой кислоты селективного маркера.
[000155] Согласно одному варианту реализации указанный промотор представляет собой конститутивно активный промотор.
[000156] Согласно одному варианту реализации указанный промотор представляет собой индуцируемый промотор. Согласно одному варианту реализации указанный индуцируемый промотор представляет собой химически регулируемый промотор. Согласно одному варианту реализации указанный химически регулируемый промотор представляет собой регулируемый спиртами промотор. Согласно одному варианту реализации указанный регулируемый спиртами промотор представляет собой промотор гена алкогольдегидрогеназы (alcА). Согласно одному варианту реализации указанный химически регулируемый промотор представляет собой тетрациклин-регулируемый промотор. Согласно одному варианту реализации указанный тетрациклин-регулируемый промотор представляет собой тетрациклин-чувствительный промотор. Согласно одному варианту реализации указанный тетрациклин-регулируемый промотор представляет собой последовательность тетрациклинового оператора (tetO). Согласно одному варианту реализации указанный тетрациклин-регулируемый промотор представляет собой промотор tet-On. Согласно одному варианту реализации указанный тетрациклин-регулируемый промотор tet-Off. Согласно одному варианту реализации указанный химически регулируемый промотор представляет собой регулируемый стероидами промотор. Согласно одному варианту реализации указанный регулируемый стероидами промотор представляет собой промотор глюкокортикоидного рецептора крысы. Согласно одному варианту реализации указанный регулируемый стероидами промотор представляет собой промотор рецептора эстрогена. Согласно одному варианту реализации указанный регулируемый стероидами промотор представляет собой промотор рецептора экдизона. Согласно одному варианту реализации указанный химически регулируемый промотор представляет собой регулируемый металлом промотор. Согласно одному варианту реализации указанный регулируемый металлом промотор представляет собой промотор металлопротеина. Согласно одному варианту реализации указанный индуцируемый промотор представляет собой физически регулируемый промотор. Согласно одному варианту реализации указанный физически регулируемый промотор представляет собой регулируемый температурой промотор. Согласно одному варианту реализации указанный регулируемый температурой промотор представляет собой промотор белка теплового шока. Согласно одному варианту реализации указанный физически регулируемый промотор представляет собой регулируемый светом промотор. Согласно одному варианту реализации указанный регулируемый светом промотор представляет собой индуцируемый светом промотор. Согласно одному варианту реализации указанный регулируемый светом промотор представляет собой репрессируемый светом промотор.
[000157] Согласно одному варианту реализации указанный промотор представляет собой тканеспецифический промотор. Согласно одному варианту реализации указанный промотор представляет собой нейронспецифический промотор. Согласно одному варианту реализации указанный промотор представляет собой специфический глиальный промотор. Согласно одному варианту реализации указанный промотор представляет собой специфический для мышечных клеток промотор. Согласно одному варианту реализации указанный промотор представляет собой специфический для клеток сердца промотор. Согласно одному варианту реализации указанный промотор представляет собой специфический для почечных клеток промотор. Согласно одному варианту реализации указанный промотор представляет собой специфический для костных клеток промотор. Согласно одному варианту реализации указанный промотор представляет собой специфический для эндотелиальных клеток промотор. Согласно одному варианту реализации указанный промотор представляет собой специфический для иммунных клеток промотор. Согласно одному варианту реализации указанный специфический для иммунных клеток промотор представляет собой В-клеточный промотор. Согласно одному варианту реализации указанный специфический для иммунных клеток промотор представляет собой Т-клеточный промотор.
[000158] Согласно одному варианту реализации указанный промотор представляет собой регулируемый стадией развития промотор. Согласно одному варианту реализации указанный регулируемый стадией развития промотор активен только на стадии эмбрионального развития. Согласно одному варианту реализации указанный регулируемый стадией развития промотор активен только в зрелой клетке.
[000159] Согласно конкретным вариантам реализации промотор может быть выбран на основании клеточного типа. Соответственно, в эукариотической клетке, клетке млекопитающего, клетке не являющегося человеком млекопитающего, плюрипотентной клетке, не принадлежащей человеку плюрипотентной клетке, плюрипотентной клетке человека, ЭСК человека, взрослой стволовой клетке человека, ограниченной стадией развития клетке-предшественнике человека, иПСК человека, клетке человека, клетке грызуна, клетке крысы, клетке мыши, клетке хомяка, фибробласте или клетке СНО находят применение разные промоторы.
[000160] Согласно некоторым вариантам реализации встраиваемая нуклеиновая кислота содержит нуклеиновую кислоту, фланкированную целевыми последовательностями сайт-специфической рекомбинации. Известно, что такими целевыми последовательностями сайт-специфической рекомбинации может быть фланкирована как вся встраиваемая нуклеиновая кислота, так и любая область или индивидуальный представляющий интерес полинуклеотид в составе встраиваемой нуклеиновой кислоты. Сайт-специфическая рекомбиназа может быть введена в клетку любыми способами, в том числе путем введения полипептида рекомбиназы в указанную клетку или путем введения полинуклеотида, кодирующего указанную сайт-специфическую рекомбиназу, в клетку-хозяина. Полинуклеотид, кодирующий указанную сайт-специфическую рекомбиназу, может входить в состав встраиваемой нуклеиновой кислоты или в состав отдельного полинуклеотида. Указанная сайт-специфическая рекомбиназа может быть функционально связана с промотором, активным в указанной клетке, в том числе, например, индуцируемым промотором, промотором, эндогенным для указанной клетки, промотором, гетерологичным для указанной клетки, клеточно-специфическим промотором, тканеспецифическим промотором или специфическим для стадии развития промотором. Целевые последовательности сайт-специфической рекомбинации, которые могут фланкировать встраиваемую нуклеиновую кислоту или любой представляющий интерес полинуклеотид в указанной встраиваемой нуклеиновой кислоте могут включать, не ограничиваясь перечисленными, loxP, lох511, lох2272, lох66, lох71, lохМ2, lох5171, FRT, FRT11, FRT71, attp, att, FRT, rох или их комбинацию.
[000161] Согласно некоторым вариантам реализации участки сайт-специфической рекомбинации фланкируют полинуклеотид, кодирующий селективный маркер и/или репортерный ген, содержащийся в составе встраиваемой нуклеиновой кислоты. В таких случаях после интеграции встраиваемой нуклеиновой кислоты в целевой локус последовательности между участками сайт-специфической рекомбинации могут быть удалены.
[000162] Согласно одному варианту реализации указанная встраиваемая нуклеиновая кислота содержит полинуклеотид, кодирующий селективный маркер. Селективный маркер может содержаться в селективной кассете. Такие селективные маркеры включают, не ограничиваясь перечисленными, неомицинфосфотрансферазу (nеоr), гигромицин-В-фосфотрансферазу (hygr), пуромицин-N-ацетилтрансферазу (рurrr), бластицидин-S-дезаминазу (bsrr), ксантин-гуанинфосфорибозилтрансферазу (gpt) или тимидинкиназу вируса простого герпеса (ВПГ-к), или их комбинацию. Согласно одному варианту реализации полинуклеотид, кодирующий селективный маркер, функционально связан с промотором, активным в указанной клетке. Согласно одному варианту реализации указанный полинуклеотид, кодирующий селективный маркер, фланкирован целевыми последовательностями сайт-специфической рекомбинации.
[000163] Встраиваемая нуклеиновая кислота может также содержать репортерный ген, функционально связанный с промотором, при этом указанный репортерный ген кодирует репортерный белок, выбранный из группы, состоящей из или содержащий β--галактозидазу (кодируемую геном lacZ), GFP, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, усиленный желтый флуоресцентный белок (EYFP), Emerald, усиленный зеленый флуоресцентный белок (EGFP), CyPet, голубой флуоресцентный белок (CFP), церулеум, T-Sapphire, люциферазу, щелочную фосфатазу и/или их комбинацию. Такие репортерные гены могут быть функционально связаны с промотором, активным в указанной клетке. Такие промоторы могут быть представлены индуцируемым промотором, промотором, который является эндогенным для репортерного гена или клетки, промотором, который является гетерологичным для репортерного гена или клетки, клеточно-специфическим промотором, тканеспецифическим промотором или специфическим для стадии развития промотором.
[000164] Согласно одному варианту реализации указанная генетическая модификация включает удаление не кодирующей белок последовательности, но не включает удаление кодирующей белок последовательности. Согласно одному варианту реализации удаление указанной не кодирующей белок последовательности включает удаление локуса днРНК или его части. Согласно одному варианту реализации удаление указанной не кодирующей белок последовательности включает удаление регуляторного элемента. Согласно одному варианту реализации указанная генетическая модификация включает удаление регуляторного элемента. Согласно одному варианту реализации указанная генетическая модификация включает добавление промотора или регуляторного элемента. Согласно одному варианту реализации указанная генетическая модификация включает замену промотора или регуляторного элемента.
ii. Экспрессионные кассеты
[000165] В настоящем изобретении предложены полинуклеотиды или молекулы нуклеиновых кислот, содержащие различные компоненты, задействованные в системе направленной геномной интеграции, предложенной в настоящем изобретении для нацеливания на локус днРНК (т.е. любой компонент из нуклеазных агентов, сайтов распознавания, встраиваемых нуклеиновых кислот, представляющих интерес полинуклеотидов, репортерных последовательностей, направленных векторов, селективных маркеров и других компонентов, или любая их комбинация).
[000166] Термины «полинуклеотид», «полинуклеотидная последовательность», «последовательность нуклеиновой кислоты» и «фрагмент нуклеиновой кислоты» используются в настоящем документе взаимозаменяемо. Указанные термины охватывают нуклеотидные последовательности и т.п. Полинуклеотид может представлять собой полимер РНК или ДНК, одно- или двуцепочечный, который необязательно содержит синтетические, не встречающиеся в природе или измененные нуклеотидные основания. Полинуклеотид в форме полимера ДНК может быть представлен одним или большим количеством сегментов кДНК, геномной ДНК, синтетической ДНК или их смесью. Полинуклеотиды могут включать дезоксирибонуклеотиды и рибонуклеотиды, которые включают как встречающиеся в природе молекулы, так и синтетические аналоги, и любую их комбинацию. Предложенные в настоящем изобретении полинуклеотиды также охватывают все формы последовательностей в том числе, но не ограничиваясь перечисленным, одноцепочечные формы, двуцепочечные формы, шпилечные структуры, структуры типа «петля-на-стебле» и т.п.
[000167] Также предложены рекомбинантные полинуклеотиды, содержащие различные компоненты системы направленной геномной интеграции для нацеливания на локус днРНК. Термины «рекомбинантный полинуклеотид» и «рекомбинантная ДНК-конструкция» используются в настоящем документе взаимозаменяемо. Рекомбинантная конструкция содержит искусственную или гетерологичную комбинацию последовательностей нуклеиновых кислот, например, регуляторных и кодирующих последовательностей, не обнаруживаемых вместе в природе. Согласно другим вариантам реализации рекомбинантная конструкция может содержать регуляторные последовательности и кодирующие последовательности, происходящие из разных источников, или регуляторные последовательности и кодирующие последовательности, происходящие из одного источника, но расположенные отличным от наблюдаемого в природе образом. Такая конструкция может быть использована сама по себе или в сочетании с вектором. В случае, если используется вектор, выбор зависит от способа, который применяется для трансформации клеток-хозяев, как хорошо известно специалистам в данной области техники. Например, может быть использован плазмидный вектор. Также предложены генетические элементы, необходимые для успешной трансформации, отбора и размножения клеток-хозяев, содержащие любые из выделенных фрагментов нуклеиновых кислот, предложенных в настоящем изобретении. Скрининг осуществляют с применением саузерн-блоттинга ДНК, нозерн-блоттинга для анализа экспрессии мРНК, анализа экспрессии белков методом иммуноблоттинга или фенотипического анализа, и т.п.
[000168] Согласно конкретным вариантам реализации один или большее количество компонентов направленной системы геномной интеграции для нацеливания на локус днРНК, описанный в настоящем документе, могут содержаться в экспрессионной кассете для экспрессирования в прокариотической клетке, эукариотической клетке, бактериальной клетке, дрожжевой клетке или клетке млекопитающего, или другом представляющем интерес организме или типе клеток. Указанная кассета может включать 5'- и 3'-регуляторные последовательности, функционально связанные с полинуклеотидом, предложенном в настоящем изобретении. «Функционально связанный» включает взаимосвязь, при которой функционально связанные компоненты функционируют надлежащим образом. Например, функциональная связь между представляющим интерес полинуклеотидом и регуляторной последовательностью (т.е. промотором) представляет собой функциональную связь, которая обеспечивает экспрессию представляющего интерес полинуклеотида. Функционально связанные элементы могут быть смежными или несмежными. При использовании в отношении объединения двух кодирующих белки областей «функционально связанный» означает, что указанные кодирующие области находятся внутри одной рамки считывания. В другом случае последовательность нуклеиновой кислоты, кодирующая белок, может быть функционально связана с регуляторными последовательностями (например, последовательностью промотора, энхансера, сайленсера и т.п.) таким образом, чтобы сохранялась надлежащая регуляция транскрипции. Кассета может дополнительно содержать по меньшей мере один дополнительный представляющий интерес полинуклеотид для совместного введения в организм. Как вариант, указанный дополнительный представляющий интерес полинуклеотид может быть распределен по нескольким экспрессионным кассетам. Предложена такая экспрессионная кассета с совокупностью сайтов рестрикции и/или участков рекомбинации для встраивания рекомбинантного полинуклеотида таким образом, чтобы происходила регуляция его транскрипции регуляторными областями. Указанная экспрессионная кассета может дополнительно содержать селективные маркерные гены.
[000169] Экспрессионная кассета может включать, в направлении транскрипции 5'-3', область инициации транскрипции и трансляции (т.е. промотор), предложенный в настоящем изобретении рекомбинантный полинуклеотид, и область терминации транскрипции и трансляции (т.е. область терминации), функциональные в представляющей интерес клетке млекопитающего или клетке-хозяине. Регуляторные области (т.е. промоторы, области регуляции транскрипции, последовательность Козак и области терминации трансляции) и/или полинуклеотид, предложенные в настоящем изобретении, могут быть нативными/аналогичными относительно клетки-хозяин или друг относительно друга. Как вариант, регуляторные области и/или полинуклеотид, предложенные в настоящем изобретении, могут быть гетерологичными относительно клетки-хозяина или друг относительно друга. Например, промотор, функционально связанный с гетерологичным полинуклеотидом, происходит из вида, отличного от вида, от которого был получен указанный полинуклеотид, или, если указанные полинуклеотид и промотор происходят из одного вида/аналогичных видов, один из них или оба по существу модифицированы с изменением исходной формы и/или геномного локуса, или промотор не является нативным промотором для функционально связанного с ним полинуклеотида. Как вариант, регуляторные области и/или рекомбинантный полинуклеотид, предложенные в настоящем изобретении, могут быть полностью синтетическими.
[000170] Область терминации может быть нативной относительно области инициации транскрипции, может быть нативной относительно функционально связанного рекомбинантного полинуклеотида, может быть нативной относительно клетки-хозяина, или может происходить из другого источника (т.е. чужеродного или гетерологичного) относительно промотора, рекомбинантного полинуклеотида, клетки-хозяина или любой их комбинации.
[000171] При получении экспрессионной кассеты манипуляции с различными фрагментами ДНК могут производиться таким образом, чтобы обеспечить надлежащую ориентацию указанных последовательностей ДНК. С указанной целью могут применяться адаптеры или линкеры для соединения фрагментов ДНК, или могут проводиться другие манипуляции для обеспечения подходящих сайтов рестрикции, удаления лишней ДНК, удаления сайтов рестрикции или т.п. С этой целью может проводиться in vitro мутагенез, репарация с праймерами, рестрикция, отжиг, повторные замены, например, транзиции и трансверсии.
[000172] В предложенных в настоящем изобретении экспрессионных кассетах может использоваться ряд промоторов. Указанные промоторы могут быть выбраны на основании требуемого результата. Известно, что разные варианты применения могут быть усовершенствованы за счет применения разных промоторов в экспрессионных кассетах для модуляции временных характеристик, расположения и/или уровня экспрессии представляющего интерес полинуклеотида. Такие экспрессионные конструкции могут также содержать, при необходимости, промоторную регуляторную область (например, обеспечивающую индуцируемую, конститутивную, регулируемую условиями среды или этапом развития, или клеточно- или тканеспецифическую/селективную экспрессию), инициирующий транскрипцию участок, консенсусную последовательность Козак, участок связывания рибосомы, сигнал процессинга РНК, сайт терминации транскрипции и/или сигнал полиаденилирования.
[000173] Экспрессионная кассета, содержащая предложенные в настоящем изобретении полинуклеотиды, может также содержать селективный маркерный ген для отбора трансформированных клеток. Селектируемые маркерные гены используют для отбора трансформированных клеток или тканей.
[000174] В надлежащих случаях последовательности для применения в настоящих способах и композициях (т.е. представляющий интерес полинуклеотид, нуклеазный агент и т.п.) могут быть оптимизированы для повышения экспрессии в клетке, т.е. указанные гены могут быть синтезированы с использованием кодонов, предпочтительных для определенной представляющей интерес клетки, включая, например, предпочтительные для млекопитающих кодоны, предпочтительные для человека кодоны, предпочтительные для грызунов кодоны, предпочтительные для мыши кодоны, предпочтительные для крысы кодоны, предпочтительные для хомяка кодоны и т.п., для улучшения экспрессии.
[000175] В различных способах и композициях, предложенных в настоящем изобретении, могут быть задействованы селективные маркеры. Различные селективные маркеры могут быть использованы в способах и композициях, раскрытых в настоящем документе. Такие селективные маркеры могут, например, придавать устойчивость к антибиотику, например, G418, гигромицину, бластицидину, неомицину или пуромицину. Такие селективные маркеры включают неомицинфосфотрансферазу (nеоr), гигромицин-В-фосфотрансферазу (hygr), пуромицин-N-ацетилтрансферазу (puror), и бластицидин-S-дезаминазу (bsrr). Согласно дополнительным вариантам реализации указанный селективный маркер функционально связан с индуцируемым промотором и экспрессия указанного селективного маркера токсична для клетки. Неограничивающие примеры таких селективных маркеров включают ксантин-гуанинфосфорибозилтрансферазу (gpt), гипоксантингуанинфосфорибозилтрансферазу (HGPRT) или тимидинкиназу вируса простого герпеса (ВПГ-ТК). Полинуклеотид, кодирующий указанные селективные маркеры, функционально связывают с промотором, активным в указанной клетке.
iii. Направленные векторы
[000176] Направленные векторы используют для введения встраиваемой нуклеиновой кислоты в представляющий интерес локус днРНК нуклеиновой кислоты эукариот, не являющегося человеком животного, млекопитающего, не являющегося человеком млекопитающего, человека, грызуна, мыши, крысы или хомяка. Направленный вектор содержит встраиваемую нуклеиновую кислоту, а также 5'- и 3'-гомологичные фрагменты, фланкирующие указанную встраиваемую нуклеиновую кислоту. Указанные гомологичные фрагменты, фланкирующие встраиваемую нуклеиновую кислоту, соответствуют областям в составе целевого локуса днРНК нуклеиновой кислоты эукариот, не являющегося человеком животного, млекопитающего, не являющегося человеком млекопитающего, человека, грызуна, мыши, крысы или хомяка. Для удобства соответствующие когнатные геномные области в составе целевого геномного локуса называют «целевыми сайтами». Например, направленный вектор может содержать первую встраиваемую нуклеиновую кислоту, фланкированную первым и вторым гомологичными фрагментами, комплементарными первому и второму целевому сайтам. Соответственно, таким образом направленный вектор способствует интеграции встраиваемой нуклеиновой кислоты в целевой локус нуклеиновой кислоты за счет гомологичной рекомбинации, происходящей между гомологичными фрагментами и комплементарными целевыми сайтами в составе генома клетки.
[000177] Согласно одному варианту реализации указанный целевой локус нуклеиновой кислоты эукариот, млекопитающих, не являющегося человеком млекопитающего, человека, грызуна, мыши или хомяка содержит первую последовательность нуклеиновой кислоты, комплементарную 5'-гомологичному фрагменту, и вторую последовательность нуклеиновой кислоты, комплементарную 3'-гомологичному фрагменту. Согласно одному варианту реализации указанная первая и вторая последовательности нуклеиновых кислот разделены по меньшей мере 5 Кб. Согласно другому варианту реализации указанная первая и вторая последовательности нуклеиновых кислот разделены по меньшей мере 1 Кб, но менее чем 50 Кб. Согласно одному варианту реализации указанная первая и вторая последовательности нуклеиновых кислот разделены по меньшей мере 2 Кб. Согласно одному варианту реализации указанная первая и вторая последовательности нуклеиновых кислот разделены по меньшей мере 3 Кб, по меньшей мере 4 Кб, по меньшей мере 5 Кб, по меньшей мере 6 Кб, по меньшей мере 7b, по меньшей мере 8 Кб, по меньшей мере 9 Кб, по меньшей мере 10 Кб, по меньшей мере 15 Кб, по меньшей мере 20 Кб, по меньшей мере 30 Кб, по меньшей мере 40 Кб или по меньшей мере 50 Кб. Согласно другим дополнительным вариантам реализации указанная первая и указанная вторая последовательность нуклеиновой кислоты разделены по меньшей мере 1 Кб, но менее чем 2 Кб, по меньшей мере 2 Кб, но менее чем 3 Кб, по меньшей мере 4 Кб, но менее чем 5 Кб, по меньшей мере 5 Кб, но менее чем 6 Кб, по меньшей мере 6 Кб, но менее чем 7 Кб, по меньшей мере 7 Кб, но менее чем 8 Кб, по меньшей мере приблизительно 8 Кб, но менее чем 9 Кб, по меньшей мере 9 Кб, но менее чем 10 Кб, или по меньшей мере 10 Кб, но менее чем 15 Кб, по меньшей мере приблизительно 15 Кб, но менее чем приблизительно 20 Кб, по меньшей мере приблизительно 20 Кб, но менее чем приблизительно 30 Кб, или по меньшей мере приблизительно 40 Кб, но менее чем приблизительно 50 Кб.
[000178] Гомологичный фрагмент направленного вектора может иметь любую длину, достаточную для стимуляции гомологичной рекомбинации с соответствующим целевым сайтом, в том числе, например, может быть по меньшей мере 5-10 Кб, 5-15 Кб, 10-20 Кб, 20-30 Кб, 30-40 Кб, 40-50 Кб, 50-60 Кб, 60-70 Кб, 70-80 Кб, 80-90 Кб, 90-100 Кб, 100-110 Кб, 110-120 Кб, 120-130 Кб, 130-140 Кб, 140-150 Кб, 150-160 Кб, 160-170 Кб, 170-180 Кб, 180-190 Кб, 190-200 Кб длиной или более. Как будет более подробно описано ниже, большие направленные векторы могут задействовать направленные фрагменты большей длины. Согласно конкретному варианту реализации суммарный размер 5'-гомологичного фрагмента и 3'-гомологичного фрагмента составляет по меньшей мере 10 Кб, или суммарный размер 5'-гомологичного фрагмента и 3'-гомологичного фрагмента составляет по меньшей мере от приблизительно 16 Кб до приблизительно 100 Кб, или от приблизительно 30 Кб до приблизительно 100 Кб. Согласно другим вариантам реализации суммарный размер всех 5'- и 3'-гомологичных фрагментов LTVEC составляет от приблизительно 10 Кб до приблизительно 150 Кб, от приблизительно 10 Кб до приблизительно 100 Кб, от приблизительно 10 Кб до приблизительно 75 Кб, от приблизительно 20 Кб до приблизительно 150 Кб, от приблизительно 20 Кб до приблизительно 100 Кб, от приблизительно 20 Кб до приблизительно 75 Кб, от приблизительно 30 Кб до приблизительно 150 Кб, от приблизительно 30 Кб до приблизительно 100 Кб, от приблизительно 30 Кб до приблизительно 75 Кб, от приблизительно 40 Кб до приблизительно 150 Кб, от приблизительно 40 Кб до приблизительно 100 Кб, от приблизительно 40 Кб до приблизительно 75 Кб, от приблизительно 50 Кб до приблизительно 150 Кб, от приблизительно 50 Кб до приблизительно 100 Кб, или приблизительно 50 Кб до приблизительно 75 Кб, от приблизительно 10 Кб до приблизительно 30 Кб, от приблизительно 20 Кб до приблизительно 40 Кб, от приблизительно 40 Кб до приблизительно 60 Кб, от приблизительно 60 Кб до приблизительно 80 Кб, от приблизительно 80 Кб до приблизительно 100 Кб, от приблизительно 100 Кб до приблизительно 120 Кб, или от приблизительно 120 Кб до приблизительно 150 Кб. Согласно одному варианту реализации размер удаляемого участка идентичен или аналогичен суммарному размеру 5'- и 3'-гомологичных фрагментов LTVEC.
[000179] Гомологичный фрагмент и целевой сайт (т.е. когнатная геномная область) «дополняют» друг друга, или являются «комплементарными» друг относительно друга, если указанные две области обладают достаточным уровнем идентичности последовательностей друг относительно друга, чтобы функционировать в качестве субстратов для реакции гомологичной рекомбинации. Под «гомологией» понимаются последовательности ДНК, идентичные либо обладающие идентичностью последовательностей относительно соответствующей или «комплементарной» последовательности. Идентичность последовательностей между заданным целевым сайтом и соответствующим гомологичным фрагментом, наблюдаемая на указанном направленном векторе, может быть представлена идентичностью последовательностей любой степени, которая обеспечивает наступление гомологичной рекомбинации. Например, степень идентичности последовательностей гомологичного фрагмента направленного вектора (или его фрагмента) и целевого сайта (или его фрагмента) может составлять по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%, таким образом, что указанные последовательности подвергаются гомологичной рекомбинации. Кроме того, комплементарная область гомологии между гомологичным фрагментом и комплементарным целевым сайтом может иметь любую длину, достаточную для стимуляции гомологичной рекомбинации в расщепляемом сайте распознавания. Например, определенный гомологичный фрагмент и/или комплементарный целевой сайт может содержать комплементарные области гомологии, длина которых составляет по меньшей мере 5-10 Кб, 5-15 Кб, 10-20 Кб, 20-30 Кб, 30-40 Кб, 40-50 Кб, 50-60 Кб, 60-70 Кб, 70-80 Кб, 80-90 Кб, 90-100 Кб, 100-110 Кб, 110-120 Кб, 120-130 Кб, 130-140 Кб, 140-150 Кб, 150-160 Кб, 160-170 Кб, 170-180 Кб, 180-190 Кб, 190-200 Кб, от 200 Кб до 300 Кб или более (например, описанные для векторов LTVEC, описанных в различных разделах настоящего документа), так что указанный гомологичный фрагмент обладает достаточной степенью гомологии для того, чтобы подвергаться гомологичной рекомбинации с соответствующими целевыми сайтами в составе генома указанной клетки. Для удобства гомологичные фрагменты в настоящий документе называются 5'- и 3'-гомологичными фрагментами. Указанная терминология относится к относительному расположению гомологичных фрагментов в отношении встраиваемой нуклеиновой кислоты в составе направленного вектора.
[000180] Таким образом, гомологичные фрагменты направленного вектора сконструированы так, чтобы являться комплементарными в отношении целевого сайта в составе целевого локуса. Соответственно, указанные гомологичные фрагменты могут быть комплементарными в отношении локуса, нативного для клетки, или, как вариант, могут быть комплементарными в отношении области гетерологичного или экзогенного сегмента ДНК, который был интегрирован в геном указанной клетки, в том числе, но не ограничиваясь перечисленным, трансгенов, экспрессионных кассет, или гетерологичных или экзогенных областей геномной ДНК. Как вариант, гомологичные фрагменты направленного вектора могут быть комплементарными в отношении области искусственной хромосомы человека или любой другой сконструированной геномной области, содержащейся в подходящей клетке-хозяине. Также гомологичные фрагменты направленного вектора могут быть комплементарными в отношении области или происходить из области библиотеки ВАС, космидной библиотеки или библиотеки на основе фага Р1. Соответственно, согласно конкретным вариантам реализации гомологичные фрагменты направленного вектора являются комплементарными в отношении эукариотического геномного локуса, не принадлежащего человеку геномного локуса, геномного локуса млекопитающего, не являющегося человеком млекопитающего, человека, грызуна, мыши или крысы, нативного, гетерологичного или экзогенного для определенной клетки. Согласно одному варианту реализации указанные гомологичные фрагменты происходят из синтетической ДНК.
[000181] Направленный вектор (такой как большой направленный вектор) может также содержать селективную кассету или репортерный ген согласно описанию в различных разделах настоящего документа. Указанная селективная кассета может содержать последовательность нуклеиновой кислоты, кодирующую селективный маркер, при этом указанная последовательность нуклеиновой кислоты функционально связана с промотором согласно описанию в различных разделах настоящего документа. Указанный селективный маркер и/или репортерный ген направленного вектора может быть фланкирован с 5'- и 3'-стороны гомологичными фрагментами или обнаруживаться в 5' или 3'-направлении от гомологичных фрагментов.
[000182] Согласно одному варианту реализации направленный вектор содержит встраиваемую нуклеиновую кислоту, содержащую первую нуклеотидную последовательность, которая кодирует репортер. В некоторых случаях после гомологичной рекомбинации с представляющим интерес локусом днРНК указанную первую нуклеотидная последовательность, которая кодирует репортер, функционально связывают с эндогенным промотором, который управляет экспрессией днРНК в локусе днРНК. Согласно дополнительному варианту реализации указанная встраиваемая последовательность нуклеиновой кислоты направленного вектора содержит консенсусную последовательность Козак. В случаях, когда указанная встраиваемая нуклеиновая кислота содержит репортер, консенсусная последовательность Козак может быть функционально связана с последовательностью нуклеиновой кислоты, кодирующей указанный репортер.
[000183] Согласно другому варианту реализации встраиваемая нуклеиновая кислота направленного вектора содержит вторую нуклеотидную последовательность, которая кодирует селектируемый маркер. В некоторых случаях указанная вторая нуклеиновая кислота функционально связана с промотором.
[000184] Согласно одному варианту реализации указанная первая и/или вторая нуклеотидная последовательность встраиваемой нуклеиновой кислоты содержит консенсусную последовательность Козак.
[000185] Согласно одному варианту реализации указанный направленный вектор (такой как большой направленный вектор) содержит репортерный ген и/или селектируемый маркерный ген, функционально связанный с промотором согласно описанию в различных разделах настоящего документа. Такие репортерные гены и/или селектируемые маркерные гены могут быть функционально связаны с активным в указанной клетке промотором согласно описанию в различных разделах настоящего документа.
[000186] Согласно одному варианту реализации направленный вектор содержит ген сайт-специфической рекомбиназы. Согласно одному варианту реализации указанный ген сайт-специфической рекомбиназы кодирует рекомбиназу Сrе. Согласно одному варианту реализации указанный ген рекомбиназы Сrе представляет собой Crei, в котором два экзона, кодирующих рекомбиназу Сrе, разделены интроном для предотвращения экспрессии в прокариотической клетке. Согласно одному варианту реализации указанный ген сайт-специфической рекомбиназы кодирует рекомбиназу Dre.
[000187] Согласно одному варианту реализации указанный ген рекомбиназы Сrе также содержит сигнал ядерной локализации для облегчения локализации Сrе (или любого рекомбиназного или нуклеазного агента) в ядро (например, указанный ген представляет собой ген NL-Cre). Согласно конкретному варианту реализации ген рекомбиназы Сrе также содержит сигнал ядерной локализации и интрон (например, NL-Crei).
[000188] Согласно различным вариантам реализации подходящий промотор для экспрессии описанной выше рекомбиназы Сrе или Crei выбран из Prm1, Blimp1, Gata6, Gata4, Igf2, Lhx2, Lhx5 и/или Рах3, или содержит Prml, Blimpl, Gata6, Gata4, Igf2, Lhx2, Lhx5 и/или Рах3. Согласно конкретному варианту реализации указанный промотор представляет промотор Gata6 или Gata4. Различные промоторы могут происходить из любого организма, в том числе, например, грызуна, например, мыши или крысы, эукариота, не являющегося человеком млекопитающего, млекопитающего, человека или хомяка. Согласно другому конкретному варианту реализации указанный промотор представляет собой промотор Prm1. Согласно другому конкретному варианту реализации указанный промотор представляет собой промотор Prm1 мыши. Согласно другому конкретному варианту реализации указанный промотор представляет собой промотор Blimp1 или его фрагмент, например, фрагмент размером 1 Кб или 2 Кб промотора Blimp1. См., например, патент США №8697851 и опубликованную заявку на патент США 2013-0312129, которые полностью включены в настоящий документ посредством ссылки.
[000189] Согласно одному варианту реализации встраиваемая нуклеиновая кислота содержит нуклеотидную последовательность, фланкированную двумя участками сайт-специфической рекомбинации. Примеры участков сайт-специфической рекомбинации включают, не ограничиваясь перечисленными, lохР, lох511, lох2272, lох66, lох71, lохМ2, lох5171, FRT, FRT11, FRT71, attp, art, FRT, rox и их комбинацию.
iv. Большие направленные векторы
[000190] Термин «большой направленный вектор» или «LTVEC» включает большие направленные векторы, которые содержат гомологичные фрагменты которые соответствуют последовательностям нуклеиновых кислот и происходят из последовательностей нуклеиновых кислот большего размера, чем обычно используемые в других способах, предназначенных для осуществления гомологичного таргетинга в клетках, и/или содержат встраиваемые полинуклеотиды, содержащие последовательности нуклеиновых кислот большего размера, чем обычно используемые в других способах, предназначенных для осуществления гомологичной рекомбинации с целью таргетинга в клетках. Согласно конкретным вариантам реализации гомологичные фрагменты и/или встраиваемый полинуклеотид LTVEC содержит геномную последовательность эукариотической клетки. Размер LTVEC слишком велик для того, чтобы возможно было проведение скрининга в ходе таргетинга с применением стандартных анализов, например, саузерн-блоттинга и ПЦР длинных фрагментов (например, 1 Кб - 5 Кб). Примеры LTVEC включают, не ограничиваясь перечисленными, векторы, происходящие из бактериальной искусственной хромосомы (ВАС), искусственной хромосомы человека или дрожжевой искусственной хромосомы (YAC). Неограничивающие примеры LTVEC и способов их получения описаны, например, в патенте США №6586251, 6596541, 7105348, и WO 2002/036789 (PCT/US01/45375), каждый из которых включен в настоящий документ посредством ссылки.
[000191] LTVEC может иметь любую длину, в том числе, но не ограничиваясь перечисленным, по меньшей мере приблизительно 10 Кб, приблизительно 15 Кб, приблизительно 20 Кб, приблизительно 30 Кб, приблизительно 40 Кб, приблизительно 50 Кб, приблизительно 60 Кб, приблизительно 70 Кб, приблизительно 80 Кб, приблизительно 90 Кб, приблизительно 100 Кб, приблизительно 150 Кб, приблизительно 200 Кб, от приблизительно 10 Кб до приблизительно 15 Кб, от приблизительно 15 Кб до приблизительно 20 Кб, от приблизительно 20 Кб до приблизительно 30 Кб, от приблизительно 30 Кб до приблизительно 50 Кб, от приблизительно 50 Кб до приблизительно 300 Кб, от приблизительно 50 Кб до приблизительно 75 Кб, от приблизительно 75 Кб до приблизительно 100 Кб, от приблизительно 100 Кб до 125 Кб, от приблизительно 125 Кб до приблизительно 150 Кб, от приблизительно 150 Кб до приблизительно 175 Кб, от приблизительно 175 Кб до приблизительно 200 Кб, от приблизительно 200 Кб до приблизительно 225 Кб, от приблизительно 225 Кб до приблизительно 250 Кб, от приблизительно 250 Кб до приблизительно 275 Кб, или от приблизительно 275 Кб до приблизительно 300 Кб.
[000192] Согласно одному варианту реализации указанные гомологичные фрагменты LTVEC происходят из библиотеки ВАС, космидной библиотеки или библиотеки фага Р1. Согласно другим вариантам реализации указанный гомологичные фрагменты происходят из целевого геномного локуса днРНК указанной клетки, и в некоторых случаях нацеливание на целевой геномный локус, для которого используют специально сконструированный LTVEC, невозможно с применением стандартного способа. Согласно дополнительным вариантам реализации гомологичные фрагменты происходят из синтетической ДНК.
[000193] Согласно одному варианту реализации суммарный размер 5'-гомологичного фрагмента и 3'-гомологичного фрагмента в LTVEC составляет по меньшей мере 10 Кб. Согласно другим вариантам реализации размер 5'-гомологичного фрагмента варьирует от приблизительно 5 Кб до приблизительно 100 Кб. Согласно одному варианту реализации размер 3'-гомологичного фрагмента варьирует от приблизительно 5 Кб до приблизительно 100 Кб. Согласно другим вариантам реализации указанный суммарный размер 5'- и 3-гомологичных фрагмента составляют от приблизительно 5 Кб до приблизительно 10 Кб, от приблизительно 10 Кб до приблизительно 20 Кб, от приблизительно 20 Кб до приблизительно 30 Кб, от приблизительно 30 Кб до приблизительно 40 Кб, от приблизительно 40 Кб до приблизительно 50 Кб, от приблизительно 50 Кб до приблизительно 60 Кб, от приблизительно 60 Кб до приблизительно 70 Кб, от приблизительно 70 Кб до приблизительно 80 Кб, от приблизительно 80 Кб до приблизительно 90 Кб, от приблизительно 90 Кб до приблизительно 100 Кб, от приблизительно 100 Кб до приблизительно 110 Кб, от приблизительно 110 Кб до приблизительно 120 Кб, от приблизительно 120 Кб до приблизительно 130 Кб, от приблизительно 130 Кб до приблизительно 140 Кб, от приблизительно 140 Кб до приблизительно 150 Кб, от приблизительно 150 Кб до приблизительно 160 Кб, от приблизительно 160 Кб до приблизительно 170 Кб, от приблизительно 170 Кб до приблизительно 180 Кб, от приблизительно 180 Кб до приблизительно 190 Кб, или от приблизительно 190 Кб до приблизительно 200 Кб. Согласно одному варианту реализации размер удаления идентичен или аналогичен суммарному размеру 5'- и 3'-гомологичных фрагментов LTVEC.
[000194] Согласно одному варианту реализации указанный LTVEC содержит селективную кассету или репортерный ген, описанный(ую) в каких-либо разделах настоящего документа.
III. Способы введения последовательностей и получения трансгенных животных
[000195] Как отмечалось выше, в настоящем изобретении предложены способы и композиции для обеспечения направленной генетической модификации одного или большего количества локусов днРНК. Также подразумевается, что может быть реализована дополнительная направленная генетическая модификация. Такие системы, обеспечивающие указанные направленные генетические модификации, могут задействовать различные компоненты, и для удобства в настоящем документе термин «система направленной геномной интеграции» в общем включает все компоненты, необходимые для осуществления интеграции (т.е. различные нуклеазные агенты, сайты распознавания, встраиваемые полинуклеотиды ДНК, направленные векторы, целевой геномный локус и представляющие интерес полинуклеотиды).
[000196] Предложенные в настоящем изобретении способы включают введение в клетку одного или большего количества полинуклеотидов или полинуклеотидных конструкций, содержащих различные компоненты направленной системы геномной интеграции. «Введение» означает приведение последовательности (полипептида или полинуклеотида) в контакт с клеткой таким образом, что указанная последовательность получает доступ внутрь указанной клетки. Предложенные в настоящем изобретении способы не основаны на конкретном способе введения любого компонента направленной системы геномной интеграции в указанную клетку, за исключением того, что указанный полинуклеотид получает доступ внутрь по меньшей мере одной клетки. Способы введения полинуклеотидов в различные типы клеток известны в данной области техники и включают, не ограничиваясь перечисленными, методы стабильной трансфекции, методы транзиентной трансфекции и опосредованные вирусами методы.
[000197] Согласно некоторым вариантам реализации клетки, используемые в указанных способах и композициях, содержат ДНК-конструкцию, стабильно включенную в геном. «Стабильно включенный» или «стабильно введенный» означает введение полинуклеотида в клетку таким образом, что происходит интеграция указанной нуклеотидной последовательности в геном указанной клетки, и указанная последовательность может быть унаследована потомством указанной клетки. Для стабильного включения ДНК-конструкций или различных компонентов направленной системы геномной интеграции может применяться любой протокол.
[000198] Протоколы трансфекции, а также протоколы введения полипептидов или полинуклеотидных последовательностей в клетки могут варьировать. Неограничивающие способы трансфекции включают химические способы трансфекции, в том числе с применением липосом; наночастиц; фосфата кальция (Graham et al. (1973). Virology 52 (2): 456-67, Bacchetti et al. (1977) Proc Natl Acad Sci USA 7A (4): 1590-4; и Kriegler, M (1991). Transfer and Expression: A Laboratory Manual. New York: W.H. Freeman and Company, pp.96-97); дендримеры; или катионные полимеры, такие как ДЭАЭ-декстран или полиэтиленимин. Нехимические способы включают электропорацию; сонопорацию; и оптическую трансфекцию. Трансфекция на основе частиц включает применение генной пушки, магнитную трансфекцию (Bertram, J. (2006) Current Pharmaceutical Biotechnology 7, 277-28). Для трансфекции могут также применяться способы на основе вирусов.
[000199] Не являющиеся человеком животные могут быть получены с применением различных способов, раскрытых в настоящем документе. Такие способы включают (1) интеграцию одного или большего количества представляющих интерес полинуклеотидов в целевой геномный локус представляющей интерес днРНК плюрипотентной клетки не являющегося человеком животного для получения генетически модифицированной плюрипотентной клетки, содержащей встраиваемый полинуклеотид в целевом геномном локусе днРНК с применением способов, раскрытых в настоящем документе; (2) выбор генетически модифицированной плюрипотентной клетки, содержащей один или большее количество представляющих интерес полинуклеотидов в целевом геномном локусе днРНК; (3) введение указанной генетически модифицированной плюрипотентной клетки в эмбрион-хозяина не являющегося человеком животного, например, на стадии преморулы; и (4) имплантацию эмбриона-хозяина, содержащего указанную генетически модифицированную плюрипотентную клетку в организм суррогатной матери для получения поколения F0, происходящего из указанной генетически модифицированной плюрипотентной клетки. Аналогичные способы могут использоваться для нацеливания на требуемый целевой хромосомный локус. Указанное не являющееся человеком животное может представлять собой не являющееся человеком млекопитающее, грызуна, мышь, крысу, хомяка, обезьяну, сельскохозяйственное млекопитающее или домашнее млекопитающее, рыбу или птицу.
[000200] Плюрипотентная клетка может представлять собой ЭСК человека, не принадлежащую человеку ЭСК, ЭСК грызуна, ЭСК мыши, ЭСК крысы, ЭСК хомяка, ЭСК обезьяны, ЭСК сельскохозяйственного млекопитающего или одомашненного млекопитающего ЭСК. Согласно другим вариантам реализации указанная плюрипотентная клетка представляет собой не принадлежащую человеку клетку, клетку млекопитающего, клетку человека, клетку не являющегося человеком млекопитающего, плюрипотентную клетку человека, ЭСК человека, взрослую стволовую клетку человека, ограниченную стадией развития клетку-предшественника человека, иПСК человека, клетку грызуна, клетку крысы, клетку мыши, клетку хомяка. Согласно одному варианту реализации указанная направленная генетическая модификация приводит к потере функции днРНК.
[000201] Для получения не являющихся человеком животных могут также применяться техники ядерной передачи. Вкратце, способы ядерной передачи включают следующие этапы: (1) удаление ядра ооцита; (2) выделение донорной клетки или ядра для комбинирования с энуклеированным ооцитом; (3) встраивание клетки или ядра в энуклеированный ооцит для получения реконструированной клетки; (4) имплантация реконструированной клетки в матку животного для формирования эмбриона; и (5) обеспечение развития эмбриона. В таких способах ооциты обычно извлекают из тела мертвых животных, хотя они могут быть выделены также из яйцеводов и/или яичников живых животных. Созревание ооцитов перед удалением ядра может проходить в различных средах, известных специалистам в данной области техники. Удаление ядра ооцита может проводиться с применением ряда способов, хорошо известных специалистам в данной области техники. Встраивание донорной клетки или ядра в энуклеированный ооцит с получением реконструированной клетки обычно проводят путем микроинъекции донорной клетки под вителлиновый слой перед слиянием. Слияние может быть индуцировано путем пропускания электрического импульса постоянного тока через плоскость контакта/слияния (электрослияние), путем воздействия на указанные клетки способствующими слиянию химическими веществами, такими как полиэтиленгликоль, или с применением инактивированного вируса, например, вируса Сендай. Реконструированную клетку, как правило, активируют электрическим и/или неэлектрическим способом до, во время и/или после слияния донора ядра и ооцита-реципиента. Способы активации включают электрические импульсы, химически индуцированный шок, проникновение спермы, повышение уровней дивалентных катионов в ооците и снижение фосфорилирования клеточных белков (например, с применением ингибиторов киназ) в ооците. Активированные реконструированные клетки или эмбрионы, как правило, культивируют в среде, хорошо известной специалистам в данной области техники, и затем переносят в матку животного. См., например, US 20080092249, WO/1999/005266 A2, US 20040177390, WO/2008/017234 A1 и патент США №7612250, каждый из которых включен в настоящий документ посредством ссылки.
[000202] Предложены другие способы получения не являющегося человеком животного, содержащего в зародышевой линии один или большее количество генетических модификаций согласно описанию в настоящем документе, включающие: (а) модификацию целевого геномного локуса днРНК не являющегося человеком животного в прокариотической клетке, задействующую различные описанные в настоящем документе способы; (b) выбор модифицированной прокариотической клетки, содержащей генетическую модификацию в целевом геномном локусе; (с) выделение генетически модифицированного направленного вектора из генома модифицированной прокариотической клетки; (d) введение указанного генетически модифицированного направленного вектора в плюрипотентную клетку не являющегося человеком животного для получения генетически модифицированной плюрипотентной клетки, содержащей встраиваемую нуклеиновую кислоту в целевом геномном локусе днРНК; (е) выбор генетически модифицированной плюрипотентной клетки; (f) введение указанной генетически модифицированной плюрипотентной клетки в эмбрион-хозяина не являющегося человеком животного на стадии преморулы; и (g) имплантацию эмбриона-хозяина, содержащего генетически модифицированную плюрипотентную клетку, в организм суррогатной матери для получения поколения F0, происходящего из указанной генетически модифицированной плюрипотентной клетки. В таких способах направленный вектор может включать большой направленный вектор. Указанное не являющееся человеком животное может представлять собой не являющееся человеком млекопитающего, грызуна, мышь, крысу, хомяка, обезьяну, сельскохозяйственное млекопитающее или домашнее млекопитающее. Плюрипотентная клетка может представлять собой ЭСК человека, не принадлежащую человеку ЭСК, ЭСК грызуна, ЭСК мыши, ЭСК крысы, ЭСК хомяка, ЭСК обезьяны, ЭСК сельскохозяйственного млекопитающего или ЭСК домашнего млекопитающего. Согласно другим вариантам реализации указанная плюрипотентная клетка представляет собой не принадлежащую человеку клетку, клетку млекопитающего, клетку человека, клетку не являющегося человеком млекопитающего, плюрипотентную клетку человека, ЭСК человека, взрослую стволовую клетку человека, ограниченную стадией развития клетку-предшественника человека, иПСК человека, клетку человека, клетку грызуна, клетку крысы, клетку мыши, клетку хомяка. Согласно одному варианту реализации направленная генетическая модификация приводит к потере функции указанной днРНК.
[000203] В дополнительных способах этап выделения (с) также включает (c1) линеаризацию генетически модифицированного направленного вектора (т.е. генетически модифицированный LTVEC). Согласно другим дополнительным вариантам реализации указанный этап введения (d) также включает (d1) введение нуклеазного агента в плюрипотентную клетку для облегчения гомологичной рекомбинации. Согласно одному варианту реализации этапы выбора (b) и/или (е) проводят путем применения селектируемого агента согласно описанию в настоящем документе в прокариотической клетке или плюрипотентной клетке. Согласно одному варианту реализации этапы выбора (b) и/или (e) проводят с применением анализа для определения модификации аллеля (МОА) согласно описанию в настоящем документе.
[000204] Согласно некоторым вариантам реализации различные генетические модификации целевых геномных локусов согласно описанию в настоящем документе могут достигаться путем проведения серии реакций гомологичной рекомбинации (BHR) в бактериальных клетках с применением LTVEC, происходящего из ДНК бактериальной искусственной хромосомы (ВАС) с помощью генноинженерной технологии VELOCIGENE® (см., например, патент США №6586251 и Valenzuela, D.М. et al. (2003), Nature Biotechnology 21 (6): 652-659, которые полностью включены в настоящий документ посредством ссылки).
[000205] Согласно некоторым вариантам реализации плюрипотентные и/или тотипотентные клетки с целевыми днРНК, содержащие различные генетические модификации согласно описанию в настоящем документе, используют в качестве встраиваемых донорных клеток и вводят в эмбрион соответствующего организма на стадии преморулы, например, в эмбрион мыши на стадии 8 клеток, методом VELOCIMOUSE® (см., например, US 7576259, US 7659442, US 7294754 и US 2008-0078000 Al, все из которых полностью включены посредством ссылки в настоящий документ). Эмбрион не являющегося человеком животного, содержащий генетически модифицированные плюрипотентные и/или тотипотентные клетки, инкубируют до стадии бластоцисты и затем имплантируют в организм суррогатной матери для получения поколения F0. Согласно некоторым вариантам реализации таргетированные ЭСК млекопитающих, содержащие различные генетические модификации согласно описанию в настоящем документе, вводят в эмбрион на стадии бластоцисты. Не являющиеся человеком животные, несущие генетически модифицированный геномный локус (т.е. локус днРНК) могут быть идентифицированы с применением анализа для определения модификации аллеля (МОА) согласно описанию в настоящем документе. Полученное поколение F0 не являющихся человеком животных, происходящих из генетически модифицированных плюрипотентных и/или тотипотентных клеток, скрещивают с не являющимся человеком животным дикого типа для получения потомства поколения F1. После генотипирования со специфическими праймерами и/или зондами, не являющихся человеком животных F1, гетерозиготных по указанному генетически модифицированному геномному локусу, скрещивают друг с другом для получения потомства поколения F2 не являющегося человеком животного, гомозиготного по указанному генетически модифицированному геномному локусу.
[000206] Согласно одному варианту реализации предложен способ получения не являющегося человеком животного, включающий генетическую модификацию по меньшей мере в одном локусе днРНК. Такой способ включает: (а) приведение плюрипотентной клетки в контакт с направленной конструкцией, содержащей встраиваемую нуклеиновую кислоту, фланкированную с 5'- и 3'-стороны гомологичными фрагментами; при этом указанная направленная конструкция подвергается гомологичной рекомбинации локусом днРНК в геноме указанной клетки с формированием модифицированной плюрипотентной клетки; (b) введение модифицированной плюрипотентной клетки в эмбрион-хозяина; и (с) вынашивание эмбриона-хозяина суррогатной матерью, отличающееся тем, что указанная суррогатная мать дает потомство, содержащее модифицированный локус днРНК, причем указанная генетическая модификация приводит к потере функции по меньшей мере одной днРНК.
IV. Клетки
[000207] Различные описанные в настоящем документе способы задействуют систему нацеливания на геномный локус для модификации локуса днРНК в клетке. Такие клетки включают прокариотические клетки, например, бактериальные клетки, в том числе Е. coli, или эукариотические клетки, такие как клетки дрожжей, насекомых, амфибий, растений, или клетки млекопитающих, в том числе, но не ограничиваясь перечисленными, клетку мыши, клетку крысы, клетку хомяка, клетку кролика, клетку свинью, клетку бычьих, клетку оленя, клетку овцы, клетку козы, клетку курицы, клетку кошки, клетку собаки, клетку хорька, клетку примата (например, игрунки, макака-резуса) и т.п., и клетки одомашненных млекопитающих, или клетки сельскохозяйственных млекопитающих. Некоторые клетки не принадлежат человеку, в частности, клетки не являющихся человеком млекопитающих. Согласно некоторым вариантам реализации для млекопитающих, подходящие генетически модифицируемые плюрипотентные клетки которых не являются легкодоступными, используют другие способы перепрограммирования соматических клеток в плюрипотентные клетки, например, путем введения в соматические клетки комбинации индуцирующих плюрипотентность факторов, в том числе, но не ограничиваясь перечисленными, Oct3/4, Sox2, KLF4, Мус, Nanog, LIN28 и Glis1. В таких способах клетка может также представлять собой клетку млекопитающего, клетку человека, клетку не являющегося человеком млекопитающего, не принадлежащую человеку клетку, клетку грызуна, крысы, мыши, хомяка, фибробласт или любую другую клетку-хозяина. Согласно другим вариантам реализации указанная клетка представляет собой плюрипотентную клетку, индуцированную плюрипотентную стволовую клетку (иПСК), не принадлежащую человеку эмбриональную стволовую клетку (ЭСК). Такие клетки включают плюрипотентные клетки, в том числе, например, индуцированные плюрипотентные стволовые клетки (иПСК), иПСК человека, эмбриональные стволовые клетки (ЭСК) мыши, эмбриональные стволовые клетки (ЭСК) крысы, эмбриональные клетки (ЭСК) человека, или ограниченные стадией развития клетки-предшественники человек, эмбриональную стволовую клетку (ЭСК) грызуна, эмбриональную стволовую клетку (ЭСК) мыши или эмбриональную стволовую клетку (ЭСК) крысы.
[000208] Неограничивающие варианты реализации включают:
[000209] 1. Не являющееся человеком животное, в геноме которого содержится по меньшей мере один модифицированный локус длинной некодирующей РНК (днРНК), при этом указанный по меньшей мере один модифицированный локус днРНК содержит мутацию с потерей функции в последовательности нуклеиновой кислоты, которая кодирует днРНК.
[000210] 2. Не являющееся человеком животное согласно варианту реализации 1, отличающееся тем, что указанная днРНК представляет собой длинную промежуточную некодирующую РНК (дпнРНК).
[000211] 3. Не являющееся человеком животное согласно любому из вариантов реализации 1 или 2, отличающееся тем, что указанная мутация с потерей функции характеризуется разрушением или нокаутом по меньшей мере одной функции днРНК.
[000212] 4. Не являющееся человеком животное согласно варианту реализации 3, отличающееся тем, что указанный модифицированный локус днРНК включает удаление одного или большего количества экзонов, которые кодируют указанную днРНК или ее часть.
[000213] 5. Не являющееся человеком животное согласно варианту реализации 4, отличающееся тем, что указанное разрушение или нокаут включает (а) удаление одного или большего количества экзонов в составе локуса днРНК, начиная со второго экзона локуса днРНК; (b) удаление одного или большего количества экзонов в составе локуса днРНК, начиная с первого экзона локуса днРНК; или (с) удаление всей кодирующей области РНК локуса днРНК.
[000214] 6. Не являющееся человеком животное согласно варианту реализации 3, отличающееся тем, что указанное разрушение или нокаут включает замену локуса днРНК или его части встраиваемой нуклеиновой кислотой.
[000215] 7. Генетически модифицированное не являющееся человеком животное согласно варианту реализации 6, отличающееся тем, что указанная встраиваемая нуклеиновая кислота содержит первую нуклеотидную последовательность, которая кодирует репортер.
[000216] 8. Генетически модифицированное не являющееся человеком животное согласно варианту реализации 7, отличающееся тем, что указанная первая нуклеотидная последовательность функционально связана с промотором, который управляет экспрессией указанного репортера.
[000217] 9. Генетически модифицированное не являющееся человеком животное согласно варианту реализации 7, отличающееся тем, что указанная первая нуклеотидная последовательность, которая кодирует репортер, размещена в локусе днРНК в функциональной связи с эндогенным промотором днРНК, при этом указанный эндогенный промотор днРНК управляет экспрессией указанной нуклеотидной последовательности.
[000218] 10. Не являющееся человеком животное согласно варианту реализации 9, отличающееся тем, что экспрессия указанной последовательности нуклеиновой кислоты подчиняется паттерну экспрессии днРНК.
[000219] 11. Генетически модифицированное не являющееся человеком животное согласно варианту реализации 7, отличающееся тем, что указанная первая нуклеотидная последовательность содержит консенсусную последовательность Козак.
[000220] 12. Не являющееся человеком животное согласно любому из вариантов реализации 6-11, отличающееся тем, что указанная замена включает (а) замену одного или большего количества экзонов в составе локуса днРНК, начиная со второго экзона указанного локуса днРНК, встраиваемой нуклеиновой кислотой; (b) замену одного или большего количества экзонов в составе локуса днРНК, начиная с первого экзона указанного локуса днРНК, встраиваемой нуклеиновой кислотой; или (с) замену всей кодирующей области РНК локуса днРНК встраиваемой нуклеиновой кислотой.
[000221] 13. Не являющееся человеком животное согласно любому из вариантов реализации 6-12, отличающееся тем, что указанный репортер представляет собой что-либо из β--галактозидазы, зеленого флуоресцентного белка (GFP), усиленного зеленого флуоресцентного белка (eGFP), mPlurn, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, усиленного желтого флуоресцентного белка (EYFP), Emerald, CyPet, голубого флуоресцентного белка (CFP), церулеума, T-Sapphire, люциферазы, щелочной фосфатазы или их комбинации.
[000222] 14. Не являющееся человеком животное согласно любому из вариантов реализации 6-13, отличающееся тем, что указанная встраиваемая нуклеиновая кислота также содержит вторую последовательность нуклеиновой кислоты, которая кодирует селектируемый маркер, при этом указанная вторая последовательность нуклеиновой кислоты функционально связана с промотором.
[000223] 15. Не являющееся человеком животное согласно варианту реализации 14, отличающееся тем, что указанная встраиваемая нуклеиновая кислота содержит участки сайт-специфической рекомбинации, фланкирующие сегмент, кодирующий репортер, и/или сегмент, кодирующий селектируемый маркер.
[000224] 16. Не являющееся человеком животное согласно любому из вариантов реализации 1-15, отличающееся тем, что указанная днРНК включает Pint, Celrr, Crnde, Eldr, Fendrr, Halr1, Hotair, Hottip, Hoxa11os, Pantr1, Pantr2, Ptgs2os2, lincenc1, Trp53cor1, lincppara, Mannr, Haglr, Peril, Kantr, Tug1 или их комбинацию.
[000225] 17. He являющееся человеком животное согласно любому из вариантов реализации 1-15, отличающееся тем, что указанное не являющееся человеком животное характеризуется одним или несколькими следующими фенотипами: (а) связанный с преждевременным старением фенотип; (b) перинатальная летальность; (с) дефект развития легких; (d) морфологический порок хвоста и задних конечностей; (е) потеря мышечной массы в одной или нескольких тканях; или (f) комбинация любых пунктов из (а)-(е).
[000226] 18. Не являющееся человеком животное согласно варианту реализации 1, отличающееся тем, что указанная днРНК представляет собой Pint, а указанное не являющееся человеком животное характеризуется связанным с преждевременным старением фенотипом, включающим: (а) меньшую скорость роста по сравнению с контролем дикого типа; (b) снижение мышечной силы; (с) фиброз; (d) меньшее содержание жировой ткани в организме по сравнению с контролем дикого типа; (е) меньшую костную минеральная плотность и костную массу бедренной кости по сравнению с контролем дикого типа; (f) пониженную мышечную массу по сравнению с контролем дикого типа; (g) снижение средней продолжительности жизни; (h) лордокифоз; (i) атрофию органов; или (j) комбинацию любых пунктов из (a)-(i).
[000227] 19. Не являющееся человеком животное согласно любому из вариантов реализации 1-15, отличающееся тем, что у указанного не являющегося человеком животного наблюдается дефект развития мозга.
[000228] 20. Не являющееся человеком животное согласно варианту реализации 19, отличающееся тем, что указанная днРНК представляет собой Pantr2, Kantr, Peril, Celrr, Pantr1, Crnde, lincenc1, Pint, lincppara или Tug1.
[000229] 21. Генетически модифицированное не являющееся человеком животное согласно любому из вариантов реализации 1-20, отличающееся тем, что указанное не являющееся человеком животное представляет собой млекопитающее.
[000230] 22. Генетически модифицированное не являющееся человеком животное согласно варианту реализации 21, отличающееся тем, что указанное млекопитающее представляет собой грызуна.
[000231] 23. Генетически модифицированное не являющееся человеком животное согласно варианту реализации 22, отличающееся тем, что указанное млекопитающее представляет собой мышь, крысу или хомяка.
[000232] 24. Клетка, ткань или эмбрион, происходящий(ая) из не являющегося человеком животного согласно любому из вариантов реализации 1-23.
[000233] 25. Направленный вектор, содержащий встраиваемую нуклеиновую кислоту, фланкированную с 5'- и 3'-стороны гомологичными фрагментами, которые могут подвергаться гомологичной рекомбинации с представляющим интерес локусом днРНК.
[000234] 26. Направленный вектор согласно варианту реализации 25, отличающийся тем, что указанная встраиваемая нуклеиновая кислота содержит первую последовательность нуклеиновой кислоты, которая кодирует репортер.
[000235] 27. Направленный вектор согласно варианту реализации 26, отличающийся тем, что после осуществления гомологичной рекомбинации с представляющим интерес локусом днРНК указанная первая последовательность нуклеиновой кислоты, которая кодирует репортер, функционально связана с эндогенным промотором, который управляет экспрессией днРНК в локусе днРНК.
[000236] 28. Направленный вектор согласно любому из вариантов реализации 26-27, отличающийся тем, что указанный репортер представляет собой что-либо из β--галактозидазы, зеленого флуоресцентного белка (GFP), усиленного зеленого флуоресцентного белка (eGFP), mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, усиленного желтого флуоресцентного белка (EYFP), Emerald, CyPet, голубого флуоресцентного белка (CFP), церулеума, T-Sapphire, люциферазы, щелочной фосфатазы или их комбинации.
[000237] 29. Конструкция направленного вектора согласно любому из вариантов реализации 25-28, отличающаяся тем, что указанная встраиваемая нуклеиновая кислота также содержит вторую последовательность нуклеиновой кислоты, которая кодирует селектируемый маркер, при этом указанная вторая нуклеиновая кислота функционально связана с промотором.
[000238] 30. Направленный вектор согласно варианту реализации 29, дополнительно содержащий участки сайт-специфической рекомбинации, фланкирующие сегмент, кодирующий репортер, и/или сегмент, кодирующий селектируемую маркерную нуклеиновую кислоту.
[000239] 31. Направленный вектор согласно варианту реализации 26 или 29, отличающийся тем, что указанная первая и/или указанная вторая последовательность нуклеиновой кислоты дополнительно содержит консенсусную последовательность Козак.
[000240] 32. Направленный вектор согласно любому из вариантов реализации 25-31, отличающийся тем, что указанная встраиваемая нуклеиновая кислота также содержит промотор, который управляет экспрессией указанного репортера.
[000241] 33. Способ получения не являющегося человеком животного, включающий генетическую модификацию по меньшей мере в одном локусе днРНК, отличающийся тем, что указанный способ включает: (а) приведение плюрипотентной клетки в контакт с направленной конструкцией, содержащей встраиваемую нуклеиновую кислоту, фланкированную с 5'- и 3'-стороны гомологичными фрагментами; при этом указанная направленная конструкция подвергается гомологичной рекомбинации с локусом дпнРНК в геноме указанной клетки с формированием модифицированной плюрипотентной клетки; (b) введение модифицированной плюрипотентной клетки в эмбрион-хозяина; и (с) вынашивание эмбриона-хозяина суррогатной матерью, отличающееся тем, что указанная суррогатная мать дает потомство, содержащее модифицированный локус днРНК, при этом указанная генетическая модификация приводит к потере функции по меньшей мере одной днРНК.
[000242] 34. Способ согласно варианту реализации 33, отличающийся тем, что указанная днРНК представляет собой дпнРНК.
[000243] 35. Способ согласно любому из вариантов реализации 33-34, отличающийся тем, что указанная генетическая модификация включает разрушение или нокаут по меньшей мере одной функции днРНК.
[000244] 36. Способ согласно любому из вариантов реализации 33-35, отличающийся тем, что указанная днРНК содержит Pint, Celrr, Crnde, Eldr, Fendrr, Halr1, Hotair, Hottip, Hoxa11os, Pantr1, Pantr2, Ptgs2os2, lincenc1, Trp53cor1, lincppara, Mannr, Haglr, Peril, Kantr, Tug1 или их комбинацию.
[000245] 37. Способ модификации локуса днРНК в плюрипотентной клетке, включающий (а) введение в плюрипотентную клетку направленной конструкции, содержащей встраиваемую нуклеиновую кислоту, фланкированную с 5'- и 3'-стороны гомологичными фрагментами, которые могут подвергаться гомологичной рекомбинации с локусом днРНК; и (b) идентификацию модифицированной плюрипотентной клетки, содержащей направленную генетическую модификацию в локусе днРНК, причем указанная генетическая модификация приводит к потере функции указанной днРНК.
[000246] 38. Способ согласно варианту реализации 37, отличающийся тем, что указанная плюрипотентная клетка представляет собой иПСК человека.
[000247] 39. Способ согласно варианту реализации 37, отличающийся тем, что указанная плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку мыши или крысы.
[000248] 40. Способ согласно любому из вариантов реализации 37-39, отличающийся тем, что указанная днРНК включает Pint, Celrr, Crnde, Eldr, Fendrr, Halr1, Hotair, Hottip, Hoxa11os, Pantr1, Pantr2, Ptgs2os2, lincenc1, Trp53cor1, lincppara, Mannr, Haglr, Peril, Kantr, Tug1 или их комбинацию.
[000249] 41. Генетически модифицированное не являющееся человеком животное, отличающееся тем, что указанная генетическая модификация включает нокаут Pint.
[000250] 42. Генетически модифицированное не являющееся человеком животное согласно варианту реализации 41, который представляет собой грызуна.
[000251] 43. Генетически модифицированный грызун согласно варианту реализации 42, отличающийся тем, что указанный грызун выбран из мыши и крысы.
[000252] 44. Мышь, у которой наблюдается связанный с преждевременным старением фенотип, отличающаяся тем, что у указанной мыши имеется нокаут Pint.
[000253] 45. Мышь согласно варианту реализации 44, отличающаяся тем, что у указанной мыши наблюдается фенотип, выбранный из медленного набора массы тела, более ранней стабилизации массы тела, преждевременного прекращения роста, лордокифоза к возрасту 12 недель, тяжелого лордокифоза к возрасту 26 недель, утраты шерсти в возрасте шесть месяцев, утраты мышечной силы задних конечностей в возрасте 6 месяцев, и их комбинации.
[000254] 46. Генетически модифицированное не являющееся человеком животное, у которого имеется нокаут дпнРНК, выбранной из группы, состоящей из HOTAIR, HOTTIP, Hoxa11os, Pantr1, Pantr2, Ptgs2os2, Eldr, Lincenc1, Mannr, Fendrr, Halr1, Haglr, Celrr, Crnde, Kantr, Pint, Trp53cor1, lincppara, Haglr, Tug1 и их комбинации.
[000255] 47. Генетически модифицированная мышь согласно варианту реализации 46, представляющая собой грызуна.
[000256] 48. Генетически модифицированный грызун согласно варианту реализации 47, представляющий собой мышь или крысу.
ПРИМЕРЫ
Пример 1: Конструирование направленных векторов
[000257] Применяли методы VelociGene®, как было описано выше, которые обеспечивают быстрое и высокопроизводительное получение специально разработанных генных мутаций у мышей (Valenzuela, D.M., et al. (2003b), Nat Biotechnol 21: 652-659). Вкратце, большие направленные векторы BacVec (LTVEC) получали с применением клонов ВАС из мыши bMQ (129S7/SvEv Brd-Hprt b-m2) или библиотеки RP23 ВАС (Adams, D.J., et al. (2005), Genomics 86: 753-758). Репортер/селективная кассета lacZ/neor(фиг. 1) был идентичен кассете ZEN-Ub1, используемой для NIH КОМР (последовательность доступна по ссылке www.velocigene.com/komp/detail/10020), за исключением того, что аминоконцевой участок кодирующей последовательности β--галактозидазу в части lacZ был модифицирован и включал стартовый кодон ATG и консенсусную последовательность Козак (Kozak, М. (1987) Nucleic acids research 15: 8125-8148)).
Пример 2: Таргетинг ЭСК
[000258] Векторы LTVEC вводили в ЭСК VGF1 гибридов поколения F1 (129S6SvEvTac/C57BL6NTac) (Poueymirou et al. (2007); Valenzuela et al. (2003a)) с помощью устройства для многолуночной электропорации (Harvard Apparatus, Бостон, Массачусетс) в буфере для электропорации (Millipore) с 3,3×106 клеток, 0,67 мкг ДНК в объеме 0,125 мл, с последующим культивированием на желатинизированных планшетах размером 15 см. Селективную среду, содержащую G418, добавляли через 48 часов после электропорации и после этого ежедневно заменяли свежей. Лекарственно-устойчивые колонии собирали через 10 дней после электропорации, обрабатывали трипсином и культивировали в желатинизированных 96-луночных планшетах в течение по меньшей мере трех дней до экстрагирования и очищения ДНК. Надлежащим образом таргетированные клоны ЭСК идентифицировали методом анализа утраты аллеля (Frendewey et al. (2010), Methods in enzymology 476: 295-307; Valenzuela et al. (2003a), Nat. Biotechnol. 21: 652-659).
Пример 3: Получение дпнРНК мышей
[000259] Применяли метод VelociMouse® (Dechiara, Т.М., (2009), Methods Mol Biol 530: 311-324; Poueymirou et al. (2007), Nat. Biotechnol. 25: 91-99), в котором таргетированные ЭСК инъецировали в некомпактизированные эмбрионы Swiss Webster на стадии 8 клеток для получения происходящих полностью из ЭСК мышей поколения F0, несущих нокаутные мутации дпнРНК. Самцов VelociMice® использовали непосредственно для профилирования экспрессии lacZ или спаривали с самками C57BL/6NTac, для получения эмбрионов или взрослых мышей для lacZ-анализа или получения животных для разведения поколения F1, а фенотипические исследования проводили на мышах N2F1. Время спаривания рассчитывали, определяя утро выявления вагинальной пробки как день 0.5 (Е0.5)
Пример 4: Профилирование экспрессии LacZ
[000260] Для окрашивания тотальных препаратов собирали эмбрионы на стадии Е9.5 и Е14.5, промывали в ФСБ и инкубировали в течение 15-60 минут в свежем 0,2% растворе глутаральдегида. Эмбриональные желточные мешки собирали для генотипирования. После фиксации эмбрионы промывали свежим буфером и инкубировали в растворе для окрашивания с X-gal (1 мг/мл) при 37°C в течение 1-24 часов. После окрашивания ткани промывали свежим буфером, постфиксировали в 4% параформальдегиде и инкубировали в 70% этаноле в течение по меньшей мере 24 часов. Эмбрионы на стадиях Е9.5-е11.5 сразу фотографировали, а эмбрионы на стадии е12.5 и более поздних стадиях просветляли в серии растворов, содержащих возрастающие концентрации глицерина и уменьшающиеся количества 1% КОН в бидистиллированной воде (ddН2О). Фотографии получали с помощью стереомикроскопа Nikon SMZ800. Легкие эмбрионов Fendrr на стадии e13.5 препарировали для получения фотографий после просветления.
[000261] Для исследований на взрослых мышах у происходящих полностью из ЭСК мышей VelociMice® поколения F0 в возрасте 6-8 недель проводили глубокую анестезию и фиксировали животных путем перфузии сердца с применением раствора, содержащего 0,2% глутаральдегида/4% параформальдегида. Ткани головного мозга, грудной клетки, сердца, легких, печени, селезенки, желудка, почек, кишечника, мочеполовой системы, мышц и задних конечностей препарировали, промывали в ФСБ и постфиксировали в течение 30 минут в растворе с 0,2% глутаральдегида/4% параформальдегида. Затем ткани промывали и инкубировали в растворе для окрашивания с X-gal (1 мг/мл) в течение 1-24 часов при 37°C. После окрашивания ткани промывали свежим буфером, постфиксировали в 4% параформальдегиде, очищали в серии растворов 50%, 70% и 100% глицерина и фотографировали так же, как и эмбрионы.
Пример 5: Уход за животными и экспериментальные процедуры
[000262] Фенотипические исследования мышей N2F1 начинали в возрасте 6-8 недель. Для расчета времени спаривания авторы изобретения определяли утро выявления вагинальной пробки как день эмбрионального развития 0.5 (Е0.5). Нокаутных по дпнРНК и однопометных животных дикого типа наблюдали с момента рождения, отслеживая различные показатели развития (малорослость, дыхание, аномалии морды и конечностей, цвет кожи, положение, переворачивание и открытие глаз) до возраста приблизительно 6-8 недель, когда их помещают в условия 12-часового светового дня при температуре 69-74 F и 40-60% влажности для исследования. Все эксперименты начинали в возрасте 6-8 недель; все процедуры на животных проводили в соответствии с протоколами, одобренными институциональным комитетом по содержанию и использованию животных (IACUC) Regeneron Pharmaceuticals.
Пример 6: Анализ с помощью микро-КТ
[000263] Трехмерную визуализацию скелета проводили с применением системы микро-КТ визуализации in vivo Quantum FX microCT Pre-clinical In-Vivo Imaging System (Perkin Elmer). Мышей анестезировали ингаляцией смесью кислорода/изофлурана при скорости потока изофлурана 2,5 л/мин и скорости потока кислорода 1,5 л/мин. При сканировании анестезию поддерживали при скорости потока кислорода через носовой конус 0,25 л/мин. Изображения получали при 90 кВ и 160 мкА, с полем обзора 30 мм для задних конечностей и 60 мм для позвонков. Для анализа минеральной плотности костей, общего костного, безжирового и жирового объема, получали два последовательных изображения с полем обзора 60 мм для всего тела, исключая голову. Правую бедренную кость вручную извлекали для измерения минеральной плотности кости. Объем правой бедренной кости, общий объем безжировой и жировой ткани измеряли с применением программного обеспечения Analyze 11.0 (Mayo Clinic) и конвертировали в массу с учетом установленных плотностей. После сканирования мышей возвращали в клетку и отслеживали восстановление в соответствии в протоколами IACUC Regeneron.
Пример 7: Тест с подвешиванием за хвост
[000264] При подвешивании за хвост мыши группируются для безопасного приземления, распрямляя задние конечности; эту позу часто называют «разведением задних конечностей». Мышей подвешивали за хвост на протяжении 10 секунд и отслеживали какие-либо признаки фенотипа с аномальным поджиманием лап.
Пример 8: Тест на выносливость при захвате
[000265] В возрасте 5, 7 и 10 недель оценивали наличие у мышей признаки дефицита мышечной ткани по способности удерживаться на перевернутой проволочной сетке (толщина проволоки составляла приблизительно 2 мм). Мышей по отдельности помещали на проволочную сетку, которую аккуратно встряхивали, чтобы стимулировать животных удерживаться на сетке при ее переворачивании. Регистрировали время, по истечении которого мышь отпускала сетку (максимум до 60 секунд). Мышам предоставляли три попытки удержаться в течение максимально возможного времени, и указанное максимальное время регистрировали для статистического сравнения.
Пример 9: Гистология мышц и тканевого материала
[000266] Мышей умерщвляли путем ингаляции СО2 с последующим смещением шейных позвонков. Препарировали и взвешивали переднюю большеберцовую (ТА), четырехглавую и икроножную (GA) мышцы. Все собранные мышцы и органы замораживали и хранили при -80С для последующего исследования. Для гистологического исследования мышцы замораживали в ОСТ, изготавливали поперечные криосрезы толщиной 12 мкм для выявления латеральной и медиальной головки, камбаловидной мышцы и подошвенной мышцы. Смежные срезы окрашивали гематоксилин-эозином, ламинином и окрашивание медленных тяжелых цепей миозина (МНС). Цифровую визуализацию окрашивания проводили с применением Aperio Scanscope. Размеры и число волокон определяли с применением программного обеспечения Spectra. Все данные представляли как среднее +/- стандартная ошибка среднего (показана в виде планок погрешностей). Вариационный анализ (ANOVA) проводили с применением программы STATVIEW и/или PRTSM. Статистическую значимость устанавливали на уровне Р-значения < 0,05. Для проведения гистологического исследования кожи участки кожи с брюшной и спинной стороны выбривали, препарировали, фиксировали в 4% параформальдегиде (ПФА) в течение по меньшей мере 24 часов и переносили в 70% этанол. Заливку в парафин, изготовление срезов и окрашивание гематоксилином и эозином срезов кожи выполняли в Histoserv Labs, Inc., Джермантаун, Мэриленд.
Пример 10: Анализ кривых выживания Каплана-Мейера
[000267] Животных наблюдали в течение периода 52 недель и отслеживали признаки заболеваемости в соответствии с протоколами IACUC Regeneron. Умерщвление мышей в указанном исследовании до возраста 52 недели по причине тяжести клинических проявлений согласно нормативам не потребовалось. Строили кривые выживания и проводили логарифмический ранговый тест с применением программного обеспечения Graphpad PRISM 6.
Пример 11: Различные фенотипы и специфические паттерны транскрипции в 20 линиях мышей с аблированными дпнРНК
[000268] В ходе исследования 20 нокаутных линий мышей, разработанных для изучения биологических функций длинных промежуточных некодирующих РНК (дпнРНК), авторы изобретения обнаружили различные фенотипы, варьирующие от перинатальной летальности до дефектов, связанных с преждевременным старением и морфологическими и функциональными аномалиями в легких, скелете и мышцах. Каждый мутантный аллель нес репортер lacZ, профиль экспрессии которого отражал широкий спектр паттернов пространственно-временной и тканеспецифической транскрипции в эмбрионах и у взрослых животных, служившей источником информации для проведенных авторами фенотипических анализов и ориентиром для будущих исследований указанных генов. Настоящее исследование показало, что дпнРНК представляют собой новый класс кодируемых молекул, которые, подобно белкам, играют необходимые важные функциональные роли в эмбриональном развитии, физиологии и гомеостазе широкого ряда тканей и органов у млекопитающих.
[000269] В последнее время стало ясно, что доскональное понимание взаимосвязей генотипа и фенотипа у млекопитающих требует расширения исследований за рамки кодирующих белки генов с включением в него некодирующей части генома (Mattick JS (2009) PLoS genetics 5: e1000459). Широкомасштабные исследования полногеномной экспрессии в клетках млекопитающих выявили, что приблизительно три четверти генома может экспрессироваться в форме РНК (Kapranov Р, et al. (2007) Science 316: 1484-1488; Carninci P, et al. (2005) Science 309: 1559-1563; Djebali S, et al. (2012) Nature 489: 101-108), и большинство указанных транскриптов не кодируют белки. Среди некодирующих транскриптов присутствует неоднородный класс, известный как длинные некодирующие РНК (днРНК). Составляя приблизительно 15000 транскриптов из приблизительно 10000 геномных локусов в клетках человека (Derrien Т, et al. (2012) Genome Research 22: 1775-1789), днРНК и их подкласс, известный как длинные промежуточные некодирующие РНК (дпнРНК) (Guttman М, et al. (2009) Nature 458: 223-227; Khalil AM, et al. (2009) Proceedings of the National Academy of Sciences of the United States of America 106: 11667-11672), напоминают кодирующие белки мРНК структурой, синтезом и характером хроматина их генов. Вопрос о том, распространяется ли указанное структурное сходство на разнообразие функций, как в случае белков, остается открытым.
[000270] После создания первой нокаутной линии приблизительно 25 лет назад мыши стали главной системой для исследования функции генов млекопитающих (Capecchi MR (2001) Nat Med 7: 1086-1090; Evans MJ (2001) Nat Med 7: 1081-1083; Smithies О (2001) Nat Med 7: 1083-1086). За немногими исключениями, применение технология нокаутных мышей для исследований индивидуальных генов, а также в широкомасштабных международных проектах (www.knockoutmouse.org), было сфокусировано на кодирующих белки генах, однако предпринимаемые в последнее время усилия по созданию глобальных ресурсов микроРНК для нокаутных мышей (Prosser НМ, et al. (2011) Nature biotechnology 29: 840-845) (mcmanuslab.ucsf.edu/microrna_knockout) отражают ценность применения указанной технологии для некодирующих РНК. Был проведен ряд функциональная исследований индивидуальных днРНК путем разрушения генов у мышей, однако приблизительно половина их них была посвящена хорошо изученным днРНК, участвующим в одном взаимосвязанном биологическом явлении: инактивации X-хромосомы (Marahrens Y, et al. (1997) Genes & Development 11: 156-166; Sado T, et al. (2001) Development 128: 1275-1286) и соматическом хромосомном импринтинге (Leighton PA, et al. (1995) Nature 375: 34-39; Mohammad F, et al. (2010) Development 137: 2493-2499; Sleutels F, et al. (2002) Nature 415: 810-813; Takahashi N, et al. (2009) Human Molecular Genetics 18: 1879-1888).
[000271] Недавно было показано, что разрушение днРНК Fendrr мыши приводит к эмбриональной летальности, связанной с дефектами развития сердца и стенки тела (Grote Р, et al. (2013) Developmental Cell 24: 206-214). Однако делеционные или инсерционные мутации в кодирующих генах днРНК Gt(ROSA)26Sor (Zambrowicz BP, et al. (1997) Proceedings of the National Academy of Sciences of the United States of America 94: 3789-3794) или Malatl (Zhang B, et al. (2012) Cell Reports 2: 111-123) не приводило к детектируемым фенотипам. Растущее понимание структуры, экспрессии и функции генов днРНК предоставляет новые возможности для применения молекулярной генетики мыши для открытия биологических функций, связанных с указанным новым классом генов.
[000272] Применение технологии нокаутных мышей для днРНК, однако, сопряжено с некоторыми техническими трудностями. Для большинства белков или доменов известно или по меньшей мере предсказано соответствующее функциональное значение. Удаления кодирующих последовательностей критически важных участков часто достаточно для получения нулевого аллеля. Аналогичным образом могут быть разработаны условные аллели, изолирующие важный экзон или экзоны для последующего удаления за счет воздействия тканеспецифической рекомбиназой. Поскольку практически ни для каких днРНК, за редкими исключениями, не были к настоящему моменту установлены структурно-функциональные связи, а открытая рамка считывания, способная служить в качестве ориентира, отсутствует, нокаутные стратегии, доступные для кодирующих белки генов, могут быть неприменимы к геномным локусам, которые кодируют днРНК. Несмотря на то, что аннотация генов днРНК улучшается (Derrien Т, et al. (2012) Genome Research 22: 1775-1789), точные границы некоторых генов могут быть неопределенными, что может осложнять дизайн нокаутных аллелей. Высокоэффективным инструментом, используемым у нокаутных мышей для кодирующих белки генов, является замена целевого гена репортером, например, кодирующей последовательностью β--галактозидазы или флуоресцентного белка, экспрессия которого управляется промотором целевого гена, отражая таким образом пространственно-временной паттерн его экспрессии у мыши. Подстановка репортерного гена успешно применялась для некодирующих РНК, например, хорошо изученного локуса Gt(ROSA)26Sor (Zambrowicz BP, et al. (1997) Proceedings of the National Academy of Sciences of the United States of America 94: 3789-3794), который кодирует днРНК, и гена малой некодирующей РНК miR-155 (Thai ТН, et al. (2007) Science 316: 604-608), однако правила получения таких аллелей для днРНК, возможно, нуждаются в доработке. Несмотря на указанные замечания, учитывая наличие тысяч идентифицированных днРНК, сейчас наступил наиболее подходящий момент для использования производительности технологии нокаутных мышей для указанного нового класса генов. С учетом указанной цели авторы изобретения описали в настоящем документе унифицированный генетический подход для выявления функций двадцати дпнРНК путем создания линий нокаутных мышей, каждая из которых несет обеспечивающий абляцию гена делеционный аллель с подстановкой β--галактозидазного репортера.
Получение 20 линий мышей с удалениями дпнРНК и подстановкой репортерного гена
[000273] В таблице 1 представлены 20 генов дпнРНК на 10 разных хромосомах, которые были целевыми в настоящем исследовании, и 26 полученных нокаутных делеционных аллелей. Авторы изобретения выбрали для получения мутаций представителей класса длинных промежуточных некодирующих РНК, поскольку гены дпнРНК по определению отделены от соседних кодирующих белки генов, и их транскрипты не перекрываются (Guttman М, et al. (2009) Nature 458: 223-227). Указанное свойство позволило авторам разработать дизайн делеционных аллелей, обеспечивающий минимальную вероятность влияния на экспрессию близлежащих генов. Авторы изобретения выбирали целевые гены дпнРНК на основании отражения ими различных паттернов экспрессии (Khalil AM, et al. (2009) Proceedings of the National Academy of Sciences of the United States of America 106: 11667-11672; Cabili MN, et al. (2011) Genes & Development 25: 1915-1927), с фокусом на нейрональной экспрессии, и потенциального участия в развитии и регуляции генной экспрессии.
[000274] При выборе стратегии дизайна нокаутных мутаций дпнРНК авторы руководствовались двумя целями. Во-первых, авторы изобретения хотели получить аллели, точно отражающие транскрипционную активность генов дпнРНК. Хотя уже имелись данные о тканеспецифической экспрессии дпнРНК на основании исследований клеток и препаратов некоторых тканей (Cabili MN, et al. (2011) Genes & Development 25: 1915-1927), авторы изобретения намеревались дополнить указанную базу знаний, получив более точные паттерны экспрессии с помощью профилирования экспрессии lacZ, способного отражать экспрессию в тканях и органах как в пространственном, так и во временном отношении, с выявлением таким образом субдоменной и в некоторых случаях клеточной специфичности, не обнаруживаемой в ходе экспериментов срезов тканей. Во-вторых, авторы изобретения стремились получить обеспечивающие абляцию генов делеции, устранявшие синтез и функцию дпнРНК, чтобы любые фенотипы, связанные с указанными мутациями, были информативными в отношении важнейших функций целевых РНК.
[000275] Размер нокаутных делеций варьировал приблизительно от 400 п.о. до 50 Кб, с удалением половины всех аннотированных экзонов. Для большинства остальных аллелей делеция начиналась во втором экзоне. Использование методов VelociGene® (Valenzuela DM, et al. (2003) Nature Biotechnology 21: 652-659) для конструирования и применения больших направленных векторов на основе бактериальных искусственных хромосом (LTVEC) имело принципиальное значение, позволив авторам получить большие, обеспечивающие абляцию генов делеции, необходимые для надежного получения нулевого аллеля для указанного нового класса больших функциональных РНК.
[000276] О связях между структурой и функцией генов дпнРНК, которыми можно было бы руководствоваться при дизайне аллелей, известно немногое. Опыты с разрушением генов Gt(ROSA)26Sor (Zambrowicz BP, et al. (1997) Proceedings of the National Academy of Sciences of the United States of America 94: 3789-3794) и BIC (miR-155) (Thai TH, et al. (2007) Science 316: 604-608) позволили установить, что удаление и вставка после первого экзона может обеспечивать надежную тканеспецифическую экспрессию β--галактозидазы или других репортеров. Однако существует возможность, что указанная стратегия не обеспечит полностью нулевую мутацию, если гибридный транскрипт модифицированного аллеля сохраняет функциональную часть дпнРНК из 5'-фрагмента, кодируемого первым экзоном (Tsai МС, et al. (2010) Science 329: 689-693). Дизайн нокаутных аллелей, представленных в таблице 1, таким образом, представлял собой компромисс между желанием получить мутацию с полной абляцией, обеспечивающую максимальную вероятность устранения функции дпнРНК, и задачей получения аллеля, обеспечивающий точный и информативный профиль генной экспрессии за счет β--галактозидазного репортера. Например, для гена HOTAIR авторы получили два аллеля, один из которых удалял практически всю РНК-кодирующую последовательность, и второй, удаление в котором начиналось во втором экзоне. Оба аллеля давали идентичные фенотипы (описанные ниже), однако только второй функционировал как репортер генной экспрессии.
[000277] В случае дпнРНК, которые расположены в непосредственной близости от кодирующего белки гена и могут иметь общий с ним дивергирующий промотор, авторы задавали начальную точку удаления во втором экзоне, чтобы избежать возможного нарушения транскрипции соседнего гена. На фиг. 1 приведен такой пример для гена Fendrr. На диаграмме представлен дизайн элементов, общих для всех аллелей: направленное удаление всех или большинства последовательностей, кодирующих дпнРНК, и замена кассетой, которая содержит последовательность из гена lacZ Е. coli, кодирующую β--галактозидазу, и кассетой (nеоr), которая экспрессирует неомицинфосфотрансферазу для отбора устойчивых к G418 колоний ЭСК. Сайты распознавания рекомбиназы LoxP, которые обеспечивают опосредованное Сrе исключение перед фенотипическим анализом, фланкируют селективную кассету для отбора по устойчивости к лекарственным средствам. Поскольку отсутствует функциональная открытая рамка считывания, с которой можно было бы соединить последовательность lacZ, каждый аллель несет стартовый кодон и консенсусную последовательность Козак (Kozak М (1987) Nucleic acids research 15: 8125-8148) для эффективной трансляции β--галактозидазного репортера.
Специфические и разнообразные паттерны генной экспрессии дпнРНК, выявляемые с помощью профилирования репортера LacZ
[000278] Для изучения паттернов экспрессии 20-ти целевых генов дпнРНК авторы изобретения применяли окрашивание X-gal для определения β--галактозидазной активности в эмбрионах середины периода гестации и тотальных препаратах зрелых тканей и органов. Целевые гены дпнРНК демонстрировали различные уникальные паттерны экспрессии репортерных генов как в эмбрионах, так и у взрослых животных, представленные в большинстве основных систем органов и типов тканей (таблица 2 на фиг. 11). Например, в зрелых тканях экспрессия Pantr2, Kantr и Peril была ограничена головным мозгом; Mannr и Fendrr экспрессировались в легких; Eldr экспрессировался в мочеполовой системе; и Halr1 экспрессировался в грудной клетке. Один ген дпнРНК, Pint, демонстрировал универсальную экспрессию во всех тканях. Авторами изобретения не была детектирована экспрессия генов Hotair, Ptgs2os2 и Haglr в какой-либо из исследованных зрелых тканей.
[000279] Эмбриональная экспрессия, по-видимому, является общей характеристикой дпнРНК. Исследование экспрессии β-галактозидазного репортера в гетерозиготных эмбрионах в день эмбрионального развития 12.5 (Е12.5) или примерно на этой стадии выявляло различные специфические паттерны для всех 20 целевых генов дпнРНК (таблица 2 на фиг. 11, фиг. 2А). Профили экспрессии варьировали от универсальной (Tug1) до высокоспецифической, например, эпидермальной для Eldr, ограниченной плакодой вибриссов для Trp53cor1 (фиг. 9) или зачатками молочных желез для lincenc1 (фиг. 9). Пространственно-временные паттерны экспрессии Hottip и Hoxa11os, наблюдаемые в разных областях почек конечностей и хвоста, в значительной степени сходны с описанными для соседних кодирующих белки генов кластера НохА (Hostikka SL, Capecchi MR (1998) Mechanisms of Development 70: 133-145; Lu P, et al. (2008) Development 135: 1395-1405). Экспрессия Hotair в задней области хвостовой почки и половом бугорке, наблюдавшаяся для β-галактозидазного репортера, была идентична определенной с помощью in situ гибридизацией (Schorderet Р, Duboule D (2011) PLoS genetics 7: e1002071). Анализ окрашивания X-gal в разные моменты эмбрионального развития показал, что экспрессия некоторых генов дпнРНК начинается на ранней стадии в ограниченной участке, а затем, на более поздних стадиях, распространяется за пределы указанного начального локуса (фиг. 2В), что, опять же, напоминает экспрессию белков Нох (Nagy А (2003) Manipulating the mouse embryo: a laboratory manual. 3rd ed. Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory Press, pp. x, 764 p.). Например, экспрессия генов Hottip и Hoxa11os начиналась в самой задней области эмбриона на стадии Е9.5 и позднее распространялась в почки конечностей. Аналогичным образом, исходная экспрессия Celrr в участке возле переднего конца эмбрионов на стадии Е9.5 сохранялась и распространялась в нервную трубку в течение следующих двух дней.
[000280] В соответствии с часто наблюдаемой экспрессией тканеспецифических днРНК человека в головном мозге (Derrien Т, et al. (2012) Genome Research 22: 1775-1789), авторы изобретения обнаружили, что половина из 20-ти целевых генов дпнРНК мыши были транскрипционно активными в зрелом головном мозге. Как и в случае эмбриональной экспрессии дпнРНК, паттерны в головном мозге (фиг. 3) были уникальными и варьировали от универсальной (lincppara и Pint) до строго ограниченной специфическими структурами головного мозга (Peril, Crnde и Kantr).
Уникальное увеличение экспрессии Pint с возрастом коррелирует со связанным со старением фенотипом
[000281] Из 20 таргетированных генов дпнРНК только для Pint наблюдался паттерн глобальной экспрессии во всем организме, в основном ограниченный постнатальным периодом (таблица 2 на фиг. 11). Авторы изобретения наблюдали уникальное для Pint увеличение экспрессии с возрастом (фиг. 4). У новорожденных животных в 3-дневном возрасте транскрипционная активность Pint была низкой (головной мозг) или недетектируемой (мышцы грудной клетки), однако впоследствии постепенно проявлялась у мышей в возрасте 3 недель, и к возрасту 8 недель становилась выраженной и универсальной. Хотя выраженность и временные характеристики экспрессии Pint в разных органах и тканях варьировали, общая тенденция заключалась в постоянном увеличении экспрессии с момента рождения до стабилизации в зрелом возрасте. Насколько нам известно, указанный возрастной динамический паттерн экспрессии ранее не был известен. Авторы изобретения не наблюдали сходных профилей в экспериментах с lacZ-профилированием для сотен кодирующих белки генов (Valenzuela DM, et al. (2003) Nature Biotechnology 21: 652-659).
[000282] Резко выраженное возрастное увеличение экспрессии Pint во всем организме, выявляемое с помощью lacZ-профилирования (фиг. 4) указывает на возможную глобальную гомеостатическую роль Pint в поддержании нормального здоровья мышей по мере увеличения возраста. Для проверки указанной гипотезы авторы изобретения скрещивали мышей нокаутной по Pint линии до достижения гомозиготности и проводили долгосрочное исследование со сравнением гомозиготных (Pint-/-) мышей с однопометными контрольными животными дикого типа (WT) и гетерозиготными (Pint+/-). Мыши Pint-/- при рождении казались здоровыми и нормальными; однако в возрасте 3 месяцев у них начинали проявляться признаки фенотипа, характерного для раннего начала старения. Измерения массы тела показали, что как у самцов, так и у самок мышей Pint-/- наблюдалась меньшая скорость роста по сравнению с однопометными животными дикого типа, при этом указанный признак был более выраженным у самцов (фиг. 5А). К возрасту 1 года самцы мышей Pint-/- имели меньшую более чем на 30% массу тела, а самцы мышей Pint+/- имели меньшую на 15% массу тела по сравнению с однопометными животными дикого типа, тогда как самки Pint-/- имели меньшую на 27% массу тела (данные не показаны). Анализ Каплана-Мейера для сравнения гомозиготных мышей с гетерозиготными и WT самцами мышей (фиг. 5В) показал, что утрата Pint связана с неблагоприятными показателями выживаемости. Авторы изобретения не обнаружили признаков опухолей или очагов патологических изменений у мутантных мышей по мере увеличения возраста, однако у некоторых мышей Pint-/- развивались грыжи, в том числе выпячивание мечевидного отростка грудной клетки, связанное с истончением брюшной стенки (данные не показаны). Также наблюдался аномальный возрастной хватательный рефлекс задних конечностей при подвешивании мышей за хвост (данные не показаны). Тяжесть указанного фенотипа варьировала, но частота его встречаемости постепенно повышалась с возрастом, указывая на снижение мышечной силы (см. на фиг. 8 другой пример для нокаутной по Hottip линии). Авторы изобретения также наблюдали утрату волосяного покрова и у самцов, и у самок мышей (данные не показаны). Гистологический анализ срезов кожи брюшной и спинной стороны тела мышей Pint-/- выявлял фиброз и заметные отличия в развитии волосяных фолликулов наряду с резким уменьшением толщины подкожного жирового слоя (фиг. 5С).
[000283] Неинвазивный общий анализ организма с помощью рентгеновской микротомографии (микро-КТ) отдельных мышей с возрастом указывает на значимо более низкое содержание жировой ткани у самцов (фиг. 5D) и самок (фиг. 5Е) мышей Pint-/- по сравнению с однопометными животными дикого типа. Снижение общего содержания жировой ткани в организме предположительно вносило основной вклад в уменьшение массы тела с возрастом (фиг. 5А). У мышей Pint-/- также наблюдалась значимо меньшая минеральная плотность ткани бедренной кости по сравнению с животными дикого типа (WT) (фиг. 5F и 5G). Самцы мышей имели значимо меньшую безжировую массу тела в возрасте 52 недель. И самцы, и самки отличались значимо меньшей мышечной массой икроножного комплекса (GA) и передней большеберцовой мышцы (ТА) с возраста 26 недель (не показано). Визуализация скелета выявляла наличие тяжелого лордокифоза и у самцов, и у самок мышей Pint-/- по сравнению с животными дикого типа (WT) (фиг. 5Н). Приблизительно у 70% мышей Pint-/- в возрасте 12 недель и у 100% к возрасту 52 недель наблюдался лордокифоз (фиг. 51). При этом только у 10-20% мышей WT в возрасте 26 недель наблюдался незначительный лордокифоз и указанная частота не увеличивалась с возрастом. У мышей Pint+/- не развивался значимый лордокифоз до возраста 26 недель, что указывает на необычную возрастную гаплонедостаточность Pint. Спектр возрастных патологий у нокаутных по Pint мышей указывает на то, что Pint может быть важен для поддержания здоровья и предотвращения преждевременного старения при нормальном жизненном цикле у мышей.
Утрата Fendrr приводит к перинатальной летальности в результате респираторного дистресса
[000284] Из 20 линий нокаутных по дпнРНК мышей перинатальная летальность наблюдалась у мышей Perit-/- и Fendrr-/- Полученный авторами нокаутный аллель Fendrr включал делецию размером 26 Кб с началом в экзоне 2 и концом в последнем аннотированном экзоне (фиг. 1). Окрашивание с X-gal гомозиготных эмбрионов на стадии Е12.5 показало экспрессию lacZ в лобно-носовом отростке, верхних дыхательных путях, легких и задней области аорта-гонады-мезонефрос (AGM) (фиг. 6А), идентичную как у гетерозиготных (не показаны), так и у гомозиготных эмбрионов, указывающую на нормальный в целом органогенез. При отдельном рассмотрении развивающихся легких на стадии Е13.5 выявлены дефекты нокаутных эмбрионов легкие отличались малым размером, а доли имели глобулярную дезорганизованную структуру (фиг. 6В). Мыши, гомозиготные по делеции гена Fendrr, доживали до рождения, однако вскоре погибали в результате явно выраженных проблем с дыханием. Перинатально летальный фенотип мутантов по Fendrr был идентичен фенотипу мышей с 2 разными фоновыми генотипами: описанного в настоящем документе гибрида C57BL6/129 и мышей, полученных в результате дополнительного возвратного скрещивания с C57BL/6 в отдельной программе разведения (Sauvageau М, et al. (2013) Elife 2: е01749).
Утрата Hotair и Hottip приводит к морфологическим и функциональным дефектами скелета и мышц
[000285] Эмбриональное окрашивание X-gal для генов Hotair и Hottip указывало на ограниченную экспрессию в задних и дистальных частях почек конечностей (фиг. 2А). Делеции генов Hotair и Hottip вызывали морфологические мальформации хвоста и задних конечностей у взрослых мышей, что согласуется с указанными ограниченными стадией развития паттернами экспрессии. У Hotair-/- мышей авторы изобретения наблюдали очевидную гомеозисную трансформацию 4-го хвостового позвонка, который становился анатомически сходным с 3-й хвостовым позвонком (фиг. 7). У мышей Hottip-/-наблюдался аномальный хватательный рефлекс задних конечностей при подвешивании за хвост по сравнению с однопометными животными дикого типа (фиг. 8А). Указанная поведенческая патология сопровождалась потерей выносливости при захвате по оценке с применением теста, в ходе которого мышам необходимо было удерживаться на перевернутой проволочной сетке. Животные дикого типа и мутанты Hottip+/- удерживались в течение приблизительно одной минуты, тогда как их гомозиготные однопометные животные разжимали захват в течение 10-20 секунд (фиг. 8В). Указанное очевидное снижение силы захвата связано с потерей массы икроножной мышцы, но не передней большеберцовой или четырехглавой мышцы (фиг. 8С). Авторы изобретения наблюдали приблизительно 40% снижение числа мышечных волокон в икроножной мышце, однако снижения среднего размера волокон указанной мышцы не отмечалось (фиг. 8D и Е). Помимо мышечных дефектов у нокаутных по Hottip мышей авторы изобретения также обнаружили пороки развития скелета задних конечностей: укорочение пяточной кости (фиг. 10).
[000286] За последние несколько лет произошел прорыв в понимании не кодирующего белки компонента генома, в частности, у млекопитающих. К давно известным классам некодирующих функциональных РНК, таких как рибосомальные, транспортные, малые ядерные, малые ядрышковые, малые цитоплазматические РНК, РНК-компоненты РНКазы Р, РНКазы MRP, теломеразных ферментов, недавно обнаруженных микроРНК и PIWI-ассоциированных piPHK, в настоящее время могут быть добавлены по меньшей мере 15000 представителей класса длинных некодирующих РНК (Kapranov Р, et al. (2007) Science 316: 1484-1488; Carninci P, et al. (2005) Science 309: 1559-1563; Djebali S, et al. (2012) Nature 489: 101-108; Derrien T, et al. (2012) Genome Research 22: 1775-1789; Guttman M, et al. (2009) Nature 458: 223-227). По мере понимания представленности в геноме и экспрессии генов днРНК формируется следующая цель - установление их биологических функций. В качестве первого шага к решению этой задачи авторы изобретения использовали технологию генного таргетинга у мышей, самый высокоэффективный инструмент для определения функций генов млекопитающих, для создания ресурса линий нокаутных мышей для 20 генов дпнРНК (Sauvageau М, et al. (2013) Elife 2: е01749).
[000287] Структурно-функциональные связи дпнРНК изучены недостаточно. По этой причине принципиальное значение в указанном начальном исследовании имело получение нокаутных аллелей с делециями, в основном или полностью устранявшими кодирующий потенциал дпнРНК для обеспечения максимальной вероятности получения мутации с потерей функции. Неоднозначная и неполная аннотация многих локусов дпнРНК, с несколькими описанными транскриптами, возможно, образующимися за счет альтернативного сплайсинга или сайтов инициации транскрипции, усложняет дизайн нокаутных аллелей. Новые данные о молекулярных характеристиках, важных для функции дпнРНК, должны будут направлять дизайн следующего поколения аллелей дпнРНК, обеспечивая более точно направленные модификации важных для функции последовательностей, а также усовершенствованные гибкие стратегии условной экспрессии.
[000288] Главная цель настоящего исследования нокаутных дпнРНК состояла в получении аллелей, которые, помимо устранения функции, также отражали бы пространственно-временной паттерн экспрессии гена. Несмотря на отсутствие характерной для кодирования белков открытой рамки считывания, которая могла бы служить ориентиром, авторам удалось получить аллели, отражающие генную экспрессию, для всех 20 целевых генов. Одним из аллелей, не экспрессирующих lacZ в зрелом организме, являлся Ptgs2os2 (см. фиг. 2А и фиг. 9, эмбриональная экспрессия), который, как известно, представляет собой одну из дпнРНК, наиболее выраженно индуцируемых воспалительными сигналами (Guttman М, et al. (2009) Nature 458: 223-227; Carpenter S, et al. (2013) Science 341 (6147): 789-92). Нокаутная пo Ptgs2os2 линия оказалась ценным ресурсом для изучения того, что происходит с экспрессией дпнРНК при инфекции или других воспалительных повреждениях и какую биологическую роль она играет в процессе.
[000289] Один из критериев, применяемых авторами изобретения при отборе генов дпнРНК гены для таргетинга в настоящем исследовании, заключался в предположении об экспрессии в нервной ткани. Экспрессия репортера lacZ в зрелом головном мозге наблюдалась для 10 целевых генов, и каждый из них демонстрировал уникальный паттерн (фиг. 3), в диапазоне от выраженной экспрессии повсеместно в головном мозге (Pint) до незначительной экспрессии в сером веществе в большинстве структур (Tug1) и строго ограниченной экспрессии исключительно в холмиках (Crnde) или средней линии гипоталамуса (Peril). Разнообразие и специфичность паттернов генной экспрессии в головном мозге также были явно выражены в других тканях, и аналогичны наблюдавшимся нами для репортерных аллелей кодирующих белки генов. Обнаруженные авторами настоящего изобретения с помощью lacZ-профилирования паттерны экспрессии генов дпнРНК согласуются с данными о тканеспецифической экспрессии, обнаруженными с помощью экспериментов с количественным определением РНК в тканях мышей дикого типа (Sauvageau М, et al. (2013) Elife 2: е01749). До настоящего исследования, однако, высокой тканевой и клеточной специфичности генной экспрессии дпнРНК внимания не уделялось, поскольку существовавшие способы количественного определения не могли обеспечить профилирование по репортеру lacZ с высоким разрешением, для разных типов клеток (фиг. 2А).
[000290] Эмбриональная экспрессия представляла собой признак, общий для всех исследованных авторами генов дпнРНК. LacZ-профилирование обеспечило визуализацию целых эмбрионов с высоким разрешением, выявившую широкий спектр специфических паттернов, уникальных для каждой днРНК. Примеры включают высокоспецифичную экспрессию Trp53cor1, наблюдаемую в плакоде вибриссов и lincenc1 в зачатках молочных желез, эпидермальную экспрессию Eldr, экспрессию Hottip и Hoxa11os в почках конечностей и универсальную экспрессию Tug1 (фиг. 2А, фиг. 2В и фиг. 9). Указанные варьирующие паттерны могут указывать на общую роль дпнРНК в регуляции ключевых событий в ходе развития.
[000291] Другое преимущество lacZ-профилирования заключалось в том, что оно позволяет направлять и акцентировать внимание при дизайне фенотипических исследований. Например, строго ограниченные постериальной частью паттерны экспрессии у гетерозиготных эмбрионов Hotair и Hottip предполагают, что авторы изобретения могли наблюдать нокаутные фенотипы в постериальной части организма. В соответствии с этими ожиданиями авторы наблюдали очевидную гомеозисную трансформацию 4-го хвостового позвонка у мышей Hotair-/- (фиг. 6) и обнаружили аномалии задних конечностей, включавшие мышечную слабость и пороки развития скелета, у мышей Hottip-/- (фиг. 8 и фиг. 10). Гомеотический фенотип Hotair также наблюдался у мышей с другим нокаутным по Hotair аллелем (Н. Chang, из личной беседы). Авторы изобретения обнаружили, что экспрессия Fendrr у гетерозигот была ограничена легкими у взрослых мышей (таблица 2 на фиг. 11) и характерна для развивающихся дыхательных путей эмбрионов (фиг. 2А). Как, возможно, и следовало ожидать, у гомозигот по Fendrr наблюдался респираторный стресс и последующая перинатальная гибель в результате дефектов структурного созревания легких. Полученный авторами изобретения нокаутный по Fendrr фенотип напоминает редкое летальное нарушение развития легких у человека - альвеолярно-капиллярную дисплазию со смещением легочных вен (ACD/MPV), при котором у пациентов наблюдается неполноценное развитие долей легких и возникает респираторный дистресс новорожденных в течение нескольких минут или часов после рождения (Bishop NB, et al. (2011) American Journal of Respiratory and Critical Care Medicine 184: 172-179). По меньшей мере у одного пациента с ACD/MPV была описана делеция размером 11 Кб в гене FOXF1-AS1, гомологе Fendrr мыши у человека, экспрессируемом у человека в норме в легких новорожденных (Szafranski Р, et al. (2013) Genome Research 23: 23-33). Grote с коллегами (Grote P, et al. (2013), Developmental Cell 24: 206-214) описывают мутантную мышь с модификацией гена Fendrr, обуславливающей летальность в период, примерно соответствующий стадии Е13.75, связанную с выраженной амниотической грыжей, снижением толщины вентральной стенки тела и пороком сердца, приводящим к скоплению крови в правом предсердии. Авторы изобретения не наблюдали какого-либо из указанных фенотипов. Расхождения фенотипов могут объясняться разным дизайном аллелей. В настоящем изобретении в аллеле Fendrr экзон 2 удален до конца, чтобы избежать разрушения промотора, который может быть общим с соседним кодирующим белок геном Foxf1. Аллель Fendrr, полученный Grote с коллегами (Grote Р, et al. (2013), Developmental Cell 24: 206-214), состоял из вставки останавливающего транскрипцию элемента в первом экзоне и не содержал репортерного гена.
[000292] Наиболее примечательным из наблюдавшихся авторами паттернов экспрессии в зрелом возрасте был паттерн для Pint, в случае с которым наблюдалось увеличение распространенности и интенсивности окрашивания X-gal с увеличением возраста от новорожденных к зрелым животным (фиг. 4). Указанный явно выраженный возрастной паттерн побудил авторов провести долгосрочный анализ скорости роста и явных признаков аномалий здоровья. При сравнении с мышами WT авторы изобретения обнаружили, что с возрастом у мышей Pint-/- отмечаются прогрессирующая утрата волосяного покрова и признаки ослабления мышц, тяжелый лордокифоз, пониженные содержание жировой ткани в организме и минеральная плотность костей, меньшая скорость роста и пониженное выживание. Неожиданным образом указанные результаты наблюдались и у гетерозиготных мышей, однако были менее выраженными. Из указанного спектра возрастных фенотипов наряду с необычным увеличением генной экспрессии с возрастом следует, что критическая доза Pint может быть необходима для общего поддержания здоровья и тканевых функций при нормальном жизненном цикле у мышей, и они впервые указывают на потенциальную роль дпнРНК при физиологическом старении. В ходе недавнего исследования было показано, что Pint представляет собой непосредственную мишень р53, обеспечивая связь между путем р53 и эпигенетическим сайленсингом за счет действия репрессионного комплекса Polycomb 2 (PRC2) (Marin-Bejar et al., 2013). Растущий объем информации указывает на важнейшую роль р53 в клеточном старении и контроле возрастных изменений. Большой интерес могло бы представлять исследование регуляции Pint и его потенциального участия в р53-зависимом клеточном старении и возрастных изменениях организма. Такое исследование могло бы выявить ключевые механизмы процесса физиологического старения у млекопитающих с потенциальным клиническим значением при заболеваниях человека, в том числе связанных с возрастными изменениями и раковыми заболеваниями.
[000293] Цель организации настоящего исследования заключалась не только в том, чтобы пролить свет на функции 20 конкретных дпнРНК, гены которых были выбраны авторами изобретения для внесения мутаций, но и в достижении лучшего понимания общих характеристик днРНК как класса. Данная коллекция может служить основой для более масштабного проекта, направленного на получение мутаций многих других представителей семейства генов дпнРНК. Многие дпнРНК, как было показано, связаны с белками, участвующими в регуляции транскрипции на уровне хроматина. Это может указывать на широкую общую и избыточную функцию при генной экспрессии, напоминающую взаимозаменяемость микроРНК при поддержании тканеспецифических профилей генной экспрессии на постранскрипционном уровне. Однако полученные авторами настоящего изобретения результаты по всей видимости, указывают на иное положение вещей. Уникальные фенотипы и высокоспецифичные паттерны экспрессии, описанные в настоящем документе и у Sauvageau et al. (Sauvageau M, et al. (2013) Elife 2: e01749), говорят о специфических, прямых и детерминативных функциях дпнРНК. Хотя настоящее исследование является всего лишь начальным анализом полученной коллекции нокаутных мышей, оно представляет дпнРНК в качестве нового класса функциональных кодируемых молекул, которые, наподобие белков, выполняют разнообразные роли в эмбриональном развитии, физиологии и гомеостазе широкого ряда тканей и органов у млекопитающих.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Lai, Ka-Man Venus/Лай, Ка-Ман Венус
Gong, Guochun/Гонг, Гоочун
Rinn, John/Ринн, Джон
Frendewey, David/Френдеуэй, Дэвид
Valenzuela, David M./Валенсуэла, Дэвид М.
<120> lincRNA-Deficient Non-Human Animals/Не являющиеся человеком животные с дефицитом дпнРНК
<130> 57766-448071
<150> 61/863,147
<151> 2013-08-07
<160> 2
<170> FastSEQ для Windows Версия 4.0
<210> 1
<211> 10
<212> DNA/ДНК
<213> Искусственная последовательность
<220>
<223> Консенсусная последовательность Козак
<220>
<221> дополнительный признак
<222> 1, 4
<223> R представляет собой A или G
<400> 1
rccrccatgg 10
<210> 2
<211> 13
<212> DNA/ДНК
<213> Искусственная последовательность
<220>
<223> Консенсусная последовательность Козак
<220>
<221> дополнительный признак
<222> 7
<223> R представляет собой A или G
<400> 2
gccgccrcca tgg 13
<---
Реферат
Изобретение относится к области биохимии, в частности к грызуну для оценки потери функции длинной межгенной некодирующей РНК (дпнРНК), содержащему в своем геноме модифицированный эндогенный локус дпнРНК, способу его получения, а также к его клетке, ткани и эмбриону и способу их получения. Также раскрыты направленный вектор для модификации эндогенного локуса дпнРНК грызуна, а также способ модификации локуса дпнРНК. Изобретение также относится к способу для подтверждения, связан ли фенотип, демонстрируемый в модели на животном, нокаутном по локусу длинной межгенной некодирующей РНК (дпнРНК), с потерей функции дпнРНК, предусматривающему использование вышеуказанного грызуна. Изобретение позволяет эффективно оценивать потерю функции длинной межгенной некодирующей РНК. 11 н. и 52 з.п. ф-лы, 11 ил., 1 табл., 11 пр.

Комментарии