Модель несовместимой по hla гуманизированной мыши nsg с полученным от пациента ксенотрансплантатом - RU2757421C2
Код документа: RU2757421C2
Чертежи






















Описание
Ссылка на родственные заявки
Согласно настоящей заявке испрашивается приоритет даты подачи по статье 35 USC 119(e) в соответствии с предварительной заявкой на выдачу патента США с серийным № 62/183386, поданной 23 июня 2015 года, полное содержание которой тем самым включено посредством ссылки.
Предшествующий уровень техники настоящего изобретения
Иммунная система позвоночных является чрезвычайно сложной, и нарушения иммунной системы также сложны. Иммунная система позвоночных содержит врожденную иммунную систему и приобретенную иммунную систему. Врожденная иммунная система, также называемая неспецифической иммунной системой, включает в себя клетки, которые защищают организм неспецифическим образом. Врожденная иммунная система отличается от приобретенной иммунной системы, которая специфически распознает антигены и обеспечивает долгосрочную защиту. Врожденная иммунная система характеризуется антиген-независимым ответом, и воздействие врожденной иммунной системы не приводит к иммунологической памяти. Клетки врожденной иммунной системы включают в себя дендритные клетки, тучные клетки, макрофаги, естественные клетки-киллеры, нейтрофилы, базофилы и эозинофилы.
Из-за сложности иммунной системы позвоночных заболевания и дефекты зачастую трудно характеризовать и лечить. Существует постоянная потребность в моделях животных, которые позволяют изолировать аспекты иммунного ответа, что обеспечивает способы и композиции, применимые, например, для идентификации эффективных медицинских и фармацевтических методов лечения заболеваний и дефектов иммунной системы.
Иммунодефицитных мышей часто используют в качестве моделей роста и дифференцировки нормальных и патологических ксеногенных клеток. Иммунодефицитные мыши характеризуются одним или несколькими из отсутствия функциональных иммунных клеток, таких как T-клетки и B-клетки; дефекта репарации ДНК; дефекта перестройки генов, кодирующих антиген-специфические рецепторы на лимфоцитах; и отсутствия иммунных функциональных молекул, таких как IgM, IgG1, IgG2a, IgG2b, IgG3 и IgA. Иммунодефицитные мыши могут быть охарактеризованы одним или несколькими недостаточностями в вовлеченном в иммунную функцию гене, таком как Rag1 и Rag2 (Oettinger, M. A et al., Science, 248:1517-1523, 1990; и Schatz, D. G. et al., Cell, 59:1035-1048, 1989). Иммунодефицитные мыши могут иметь любой из этих или других дефектов, что приводит к патологической иммунной функции у мышей.
Особенно применимыми штаммами иммунодефицитных мышей являются NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, обычно называемый мышами NOD scid gamma (NSG), подробно описанный в Shultz et al., J. Immunol., 174:6477-6489, 2005; и NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ, Shultz et al., Clin. Exp. Immunol., 154(2):270-284, 2008, обычно называемый мышами NRG.
В некоторых экспериментах такие штаммы иммунодефицитных мышей являются гуманизированными путем прививки частей человеческой иммунной системы иммунодефицитной мыши. Такие модели гуманизированных мышей представляют собой особенно эффективные исследовательские инструменты. Хотя большинство экспериментальных исследований проводятся на грызунах, таких как мышь, результаты, предсказанные исследованиями на мышах, не всегда являются репрезентативными для реальных результатов у людей. Создание модели гуманизированной мыши позволяет изучать специфические для человека инфекции и методы лечения на мышах, что, таким образом, обеспечивает клинически значимые in vivo исследования человеческих клеток, тканей и иммунных систем без риска для больных.
Хотя имеются различные штаммы иммунодефицитных мышей, у каждого есть недостатки и ограничения в использовании. В частности, эффективное приживление ксеногенных стволовых клеток, таких как ксеногенные кроветворные стволовые клетки (HSC), у иммунодефицитных мышей требует облучения мыши-реципиента или кондиционирования с помощью радиомиметических лекарственных средств, таких как бусульфан. Облучение новорожденных мышей приводит к получению мелких хрупких мышей, а некоторые из облученных мышей умирают преждевременно. Кроме того, возникает проблема влияния облучения на кроветворение у обработанных животных. См., например, Nielsen et al., Blood, 110(3):1076-1077, 2007.
Таким образом, сохраняется потребность в способах и композициях для приживления ксеногенных кроветворных стволовых клеток у штаммов иммунодефицитных мышей и их применение.
Краткое раскрытие настоящего изобретения
Один аспект настоящего изобретения относится к гуманизированной иммунодефицитной мыши без ожирения с диабетом (NOD), при этом мышь (1) является гомозиготной по мутации scid; (2) характеризуется недостаточностью гамма-цепи рецептора IL-2; (3) имеет приживленные CD34+ человеческие кроветворные стволовые клетки (HSC); (4) инокулирована человеческим полученным от пациента ксенотрансплантатом (PDX); при этом HSC и PDX являются несовместимыми по HLA (например, только частично совместимыми или несовместимыми).
Согласно некоторым вариантам осуществления мутация scid представляет собой Cg-Prkdcscid.
Согласно некоторым вариантам осуществления недостаточность гамма-цепи рецептора IL-2 представляет собой генетическую нуль-мутацию, такую как Il2rgtm1Wjl. Согласно другим вариантам осуществления недостаточность гамма-цепи рецептора IL-2 представляет собой мутацию с усечением в гамма-цепи IL-2R (например, захватывающую внеклеточный или внутриклеточный домен).
Согласно некоторым вариантам осуществления мышью является NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ (т.е. NOD scid gamma (NSG)).
Согласно некоторым вариантам осуществления мышью является самка мышей NSG с дополнительно имплантированными хирургическим путем фрагментами вилочковой железы и печени человека, например, мышь hu-BLT NSG™ (мышь BLT или гуманизированная мышь BLT).
Согласно некоторым вариантам осуществления мыши прививают мононуклеарные клетки периферической крови человека, например, мышь hu-PBMC NSG™ (или гуманизированная PBMC мышь).
Согласно некоторым вариантам осуществления мышь, кроме того, содержит трансгены, конститутивно экспрессирующие человеческий интерлейкин-3 (IL-3), человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и/или человеческий стальной фактор (SF).
Согласно некоторым вариантам осуществления CD34+ HSC человека прививают посредством инъекции в хвостовую вену (предпочтительно мышь является самкой), инъекции в лицевую вену, внутрисердечной инъекции или внутрипеченочной инъекции.
Согласно некоторым вариантам осуществления CD34+ HSC человека прививают мыши возрастом приблизительно 2-4 недели, например, приблизительно 2 недели, 3 недели или 4 недели.
Согласно некоторым вариантам осуществления CD34+ HSC человека прививают мыши возрастом приблизительно 24-72 часа, например, приблизительно 24 часа, 36 часов, 48 часов, 60 часов, 72 часа или 90 часов.
Согласно некоторым вариантам осуществления CD34ig.+ HSC человека прививают после облучения всего тела мыши (например, дозой приблизительно 1, 2, 3, 4, 5, 10, 20, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200 или 1300 сГр, или дозой между любыми из двух упомянутых в данном документе доз, например, 100-300 сГр или 700-1300 сГр и т.п.).
Согласно некоторым вариантам осуществления человеческий PDX инокулируют мыши через приблизительно 2 недели после прививания мыши CD34+ HSC человека. Согласно некоторым вариантам осуществления человеческий PDX инокулируют мыши через приблизительно 12 недель после прививания мыши CD34+ HSC человека. Согласно некоторым вариантам осуществления человеческий PDX инокулируют мыши через приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 недель (или в пределах диапазона, определяемого двумя числовыми величинами) после прививания мыши CD34+ HSC человека.
Согласно некоторым вариантам осуществления человеческий PDX получают из первичного образца больного. Согласно некоторым вариантам осуществления человеческий PDX получают из помещенного в архив образца опухоли, который был подвергнут пассажу как ксенотрансплантат по меньшей мере на одном поколении. Согласно некоторым вариантам осуществления человеческий PDX характеризуется низким количеством пассажей, например, один раз был подвергнут пассажу как ксенотрансплантат или в культуре не более чем на 5, 4, 3, 2 или 1 поколении. Согласно некоторым вариантам осуществления человеческий PDX сохраняет генетическую и/или фенотипическую гетерогенность человеческой злокачественной опухоли, из которой он получен. Согласно некоторым вариантам осуществления человеческий PDX получают от не получавшего лечения больного. Согласно некоторым вариантам осуществления человеческий PDX получают от устойчивого к лечению больного.
Согласно некоторым вариантам осуществления человеческим PDX является один или несколько из PDX из опухоли PDX LIVETM, поддерживаемой и доступной в Jackson Laboratory. Jackson Laboratory предоставляет доступ к более широкому диапазону моделей полученных от пациента ксенотрансплантатов (PDX) злокачественной опухоли с меньшими количествами пассажей в виде коллекции мышей NSG с приживленной опухолью PDX LIVETM. Данную коллекцию легко доступных имеющихся в готовом виде опухолей PDX можно поддерживать в фоновой линии мышей NSG, и любой из PDX также может находиться в заявляемой несовместимой по HLA гуманизированной мыши с дефектом иммунной системы (например, NSG, NSGS, BLT и т.п.).
Например, согласно некоторым вариантам осуществления опухоль PDX представляет собой опухоль молочной железы, в том числе инвазивную протоковую карциному. Типичная опухоль молочной железы включает в себя TM00089, TM00095-TM00099, TM00103 и TM00129 (числа TM представляют ID модели PDX в базе данных Mouse Tumor Biology на «tumor dot informatics dot jax dot org slash mtbwi slash index dot do»). Согласно некоторым вариантам осуществления опухоль PDX представляет собой злокачественную опухоль легкого, такую как опухоль с мутациями в ALK, KRAS, TP53, EGFR или их комбинации. См. TM00046, TM00186, TM00192-TM00194, TM00200, TM00202-TM00204, TM00206, TM00208, TM00213, TM00214, TM00219, TM00222, TM00226, TM00233, TM00253, TM00302, TM00355, TM00784, TM00832. Согласно некоторым вариантам осуществления опухоль PDX представляет собой злокачественную опухоль мочевого пузыря (например, TM00015). Согласно некоторым вариантам осуществления опухоль PDX представляет собой злокачественную опухоль головного мозга (например, TM00058 и TM01087). Согласно некоторым вариантам осуществления опухоль PDX представляет собой злокачественную опухоль толстой кишки (например, TM00164 и TM00165). Согласно некоторым вариантам осуществления опухоль PDX представляет собой злокачественную опухоль яичника (например, TM00334, TM00335, TM00391).
Согласно некоторым вариантам осуществления человеческий PDX представляет собой ксенотрансплантат из злокачественной опухоли яичника, злокачественной опухоли легкого, такой как немелкоклеточная злокачественная опухоль легкого (NSCLC), злокачественной опухоли мочевого пузыря, лимфомы (такой как AML, CML, ALL, CLL, DLBCL (диффузная крупноклеточная В-клеточная лимфома)), злокачественной опухоли молочной железы, такой как трижды негативная злокачественная опухоль молочной железы (TNBC), злокачественной опухоли головного мозга, злокачественной опухоли поджелудочной железы, злокачественной опухоли предстательной железы, злокачественной опухоли толстой кишки, злокачественной опухоли прямой и толстой кишок, эндометриальной злокачественной опухоли, злокачественной опухоли желудка/GIST, печеночноклеточной злокачественной опухоли, почечной/ренальной злокачественной опухоли, злокачественной опухоли кожи (такой как меланома), карциномы мягких тканей, саркомы или линии раковых клеток.
Согласно некоторым вариантам осуществления человеческий PDX представляет собой ксенотрансплантат из опухоли/злокачественной опухоли, которая экспрессирует PD-L1 и/или PD-L2.
Согласно некоторым вариантам осуществления инокулируют приблизительно 0,5-10 × 106 клеток (например, приблизительно 1-9 × 106 клеток, приблизительно 2-8 × 106 клеток, приблизительно 3-7 × 106 клеток, приблизительно 4-6 × 106 клеток или приблизительно 5 × 106 клеток) человеческого PDX.
Согласно некоторым вариантам осуществления процентное содержание человеческих CD45+ клеток в периферической крови мыши достигает приблизительно 20-30% через приблизительно 50 дней после инокуляции PDX (или через приблизительно 9 недель после приживления HSC).
Согласно некоторым вариантам осуществления мыши вводят противораковое соединение. Например, противораковым соединением может быть 5-FU, авастин, цисплатин, карбоплатин, кейтруда, доцетаксел или их комбинация. Согласно некоторым вариантам осуществления противораковым соединением является химиотерапевтический реагент. Согласно некоторым вариантам осуществления противораковым соединением является доклиническое лекарственное средство. Согласно некоторым вариантам осуществления противораковым соединением является иммуномодулятор, такой как модулятор PD-1 или его лиганд/рецептор, или модулятор CTLA-4 или его лиганд/рецептор. Согласно некоторым вариантам осуществления противораковым соединением является средство против PD-1 и/или против PD-L1, такое как антитело против PD-1 и/или антитело против PD-L1.
Антитело против PD-1 блокирует взаимодействия между PD-1 и его лигандами, PD-L1 и PD-L2, цельное антитело против PD-L1 блокирует взаимодействия между PD-L1 и как PD-1, так и B7-1 (CD80), что вовлекается в понижающее модулирование T-клеточных ответов.
Некоторые ингибиторы PD-1 и PD-L1 проходят клиническое исследование на ранней и последней стадии клинических испытаний по обширной группе злокачественных опухолей. Какой-либо один или несколько из ингибиторов PD-1 и PD-L1 могут быть использованы в качестве противоракового средства в соответствии с настоящим изобретением.
Типичные средства против PD-L1 включают в себя следующие средства в таблице 1, а типичные средства против PD-1 включают в себя следующие в таблице 2, обе взяты из Dolan and Gupta, Cancer Control, 21(3):231-7, 2014 (включенной посредством ссылки).
Например, BMS-936559/MDX-1105 представляет собой полностью человеческое с высокой степенью аффинности иммуноглобулиновое (Ig) G4 моноклональное антитело против PD-L1. MPDL3280A представляет собой сконструированное человеческое моноклональное антитело против PD-L1. CT-011/пидилизумаб представляет собой гуманизированное IgG1 моноклональное антитело, которое связывается с PD-1. BMS-936558/MDX-1106/ниволумаб представляет собой полностью человеческое IgG4 моноклональное антитело против PD-1. Пембролизумаб представляет собой высокоселективное, гуманизированное IgG4-каппа моноклональное антитело с активностью против PD-1.
Таблица 1. Отдельные продолжающиеся клинические испытания лекарственных средств на основе антитела против PD-L1
Таблица 2. Отдельные продолжающиеся клинические испытания лекарственных средств на основе антитела против PD-1 при солидных опухолях
Согласно некоторым вариантам осуществления противораковым средством является антагонист CTLA-4, такой как антитело против CTLA-4 (например, ипилимумаб - одобренный FDA ингибитор CTLA-4 для лечения меланомы, тремелимумаб, ранее называвшийся тицилимумабом или CP-675,206, полностью человеческое моноклональное антитело IgG2, полученное компанией Pfizer и проходящее клинические испытания на людях, для лечения злокачественной опухоли).
Согласно некоторым вариантам осуществления противораковым средством является комбинация антагониста CTLA-4 и антагониста PD-1/антагониста PD-L1. Поскольку CTLA-4 и PD-1 регулируют различные ингибирующие иммунитет пути, одновременное ингибирование обоих ингибирующих иммунитет путей может быть более эффективным, чем ингибирование только одного.
CTLA-4 является ключевым ингибиторным белком клеточной поверхности на T-клетках, и рост злокачественной опухоли может быть ассоциирован с дисбалансом в естественных механизмах обратной связи, которые модулируют иммунных ответ. Например, опухоли могут подавлять костимуляторные пути для T-клеточной активации, в том числе CD28, CD40, OX40 и CD137. В качестве дополнения или в качестве альтернативы, опухоли могут активировать ингибиторные пути иммунных контрольных точек, в том числе LAG-3, CTLA-4 и B7-H3. Доклинические и/или клинические данные свидетельствуют о том, что запущенные злокачественные опухоли ассоциированы с пониженной T-клеточной экспрессией OX40, с уклонением опухоли от нормальной иммунной атаки за счет использования пути иммунной контрольной точки CTLA-4, с T-клеточной экспрессией CTLA-4, что ингибирует противоопухолевый ответ, ограничивая активацию и пролиферацию Т-клеток, с повышенной T-клеточной экспрессией иммунной контрольной точки LAG-3 (что таким образом усиливает ингибиторный эффект в отношении активации и функции Т-клеток), а также с экспрессией в опухолевых клетках B7-H3, что может нарушать опосредуемые Т-клетками иммунные ответы. Таким образом, заявляемая мышь может быть использована для определения того, можно ли путем активирования костимуляторных путей CD28, CD40, OX40 и/или CD137 или путем подавления ингибиторных путей иммунных контрольных точек LAG-3, CTLA-4 и/или B7-H3 лечить какие-либо из опухолей PDX.
Кроме механизмов, опосредуемых CTLA-4 и PD-1, опухоли также используют механизмы уклонения от иммунных ответов. Например, многочисленные миелоидные факторы роста высвобождаются в микроокружение многих опухолей с передачей сигнала к размножению незрелым миелоидным клеткам с уникальными иммуносупрессивными способностями, в том числе субпопуляциям миелоидных клеток, называемых ассоциированными с опухолью макрофагами (TAM). TAM составляют многочисленную популяцию лейкоцитов в солидных опухолях, что во многих условиях облегчает, а не ограничивает прогрессирование опухоли, например, за счет подавления активности TIL и усиления опухолевого ангиогенеза.
Регуляторные T-клетки (Treg) и Т-клетки-хелперы 2 типа (TH2), стимулируемые TAM, оказывают сильное иммуносупрессивное действие на опухоль. Эти клетки в норме ассоциированы с поддержанием иммунной толерантности.
Другие миелоидные клетки, обнаруживаемые в опухолях, включают в себя cупрессорные клетки миелоидного происхождения (MDSC), которые представляют гетерогенную группу незрелых клеток, включающих в себя предшественников макрофагов, гранулоциты и дендритные клетки, характеризующиеся своей способностью подавлять пролиферацию Т-клеток и стимулировать ангиогенез. MDSC используют ряд иммуносупрессивных механизмов для обеспечения избегания опухолями иммунитета, при этом большинство из их воздействий направлены на подавление T-клеток.
Другие популяции иммунных клеток, важные для иммунитета к опухоли, включают в себя дендритные клетки (DC) и натуральные клетки-киллеры (NK). DC представляют собой «профессиональные антиген-презентирующие клетки» и способны процессировать уникальные опухоль-специфические антигены для активирования T- и B-клеток. DC, поэтому, являются центральным предметом исследования, посвященных разработке противоопухолевых вакцин и размножению опухоль-специфических CTL ex vivo для последующей адоптивной иммунотерапии.
NK-клетки обладают уникальными рецепторами клеточной поверхности, которые важны для иммунного контроля за собственными тканями, и активности которых опосредуются связыванием с антиген-презентирующими молекулами HLA I класса, которые имеются в большинстве нормальных клеток и в опухолях. Опухоли, которые сохраняют экспрессию HLA I класса, уклоняются от опосредуемой NK-клетками цитотоксичности, но те, которые утрачивают способность к экспрессии, больше не распознаются NK-клетками как «свои» и уничтожаются. Соединения, которые способствуют активации NK-клеток, и средства адоптивной иммунотерапии, в которых используются аллогенные NK-клетки, представляют собой области активного доклинического и клинического исследования.
Согласно некоторым вариантам осуществления противораковым средством является антитело (например, моноклональное антитело или mAb) или его связывающий антиген фрагмент. Согласно некоторым вариантам осуществления антитело блокирует или усиливает взаимодействия лиганд-рецептор между клетками (например, между опухолевой клеткой и иммунной клеткой, такой как T-клетка, TAM, MDSC, DC, NK-клетка и т.п.). Согласно некоторым вариантам осуществления антитело действует как агонист или антагонист взаимодействий лиганд-рецептор между клетками (например, между опухолевой клеткой и иммунной клеткой, такой как T-клетка, TAM, MDSC, DC, NK-клетка и т.п.). Согласно некоторым вариантам осуществления антитело нацеливается на разрушение клеток путем зависимой от антитела клеточной цитотоксичности (ADCC). Согласно некоторым вариантам осуществления антитело доставляет нагрузки конъюгированного лекарственного средства в конкретные целевые клетки.
Согласно некоторым вариантам осуществления противораковым средством является генетически сконструированный лимфоцит, который экспрессирует обычные T-клеточные рецепторы или химерные антигенные рецепторы (CAR), которые могут быть использованы в адоптивной иммунотерапии с переносом клеток. Согласно некоторым вариантам осуществления генетически сконструированный лимфоцит представляет собой T-клетку, которая экспрессирует антитело против ассоциированного со злокачественной опухолью антигена, при этом антитело связано или слито с трансмембранным и/или передающим сигнал доменом CAR. Такие T-клетки могут быть использованы для адоптивной T-клеточной терапии.
Согласно некоторым вариантам осуществления противораковым средством является биспецифический привлекающий T-клетки активатор (BiTE), который содержит участки специфического связывания от двух антител, слитых в одну молекулу, для непосредственного связывания CTL с антигенами на опухолевых клетках с целью усиления киллинга опухоли.
Согласно некоторым вариантам осуществления противораковым средством являются реинфузированные TIL, размноженные ex vivo, при этом TIL генетически сконструированы для экспрессии T-клеточных рецепторов (TCR), которые являются специфическими для уникальных опухолевых антигенов. Согласно некоторым вариантам осуществления опухолью является злокачественная опухоль шейки матки, лимфома или лейкоз. Согласно некоторым вариантам осуществления противораковое средство дополнительно содержит ингибитор иммунной контрольной точки, например, антитело против CTLA-4, антитело против PD-1 или антитело против PD-L1.
Согласно некоторым вариантам осуществления противораковым средством является инфузия аллогенных донорских лимфоцитов (DLI) или инфузия аллогенных NK-клеток.
Согласно некоторым вариантам осуществления противораковым средством являются адоптивно перенесенные дендритные клетки, которые были примированы опухоль-специфическими антигенами перед одоптивным переносом.
Согласно некоторым вариантам осуществления противораковым средством является вакцина, содержащая опухоль-специфический антиген, при этом вакцина амплифицирует эндогенный опухоль-специфический T-клеточный ответ.
Согласно некоторым вариантам осуществления мышь является гомозиготной или гемизиготной по недостаточности гамма-цепи рецептора IL-2.
Другой аспект настоящего изобретения относится к способу создания гуманизированной иммунодефицитной без ожирения с диабетом мыши с полученным от пациента ксенотрансплантатом, при этом способ предусматривает (1) введение иммунодефицитной без ожирения с диабетом мыши CD34+ человеческих кроветворных стволовых клеток (HSC), при этом мышь (a) является гомозиготной по мутации scid и (b) характеризуется недостаточностью гамма-цепи рецептора IL-2; (2) инокулирование указанной мыши человеческого полученного от пациента ксенотрансплантата (PDX), при этом указанные HSC и указанный PDX являются несовместимыми по HLA.
Другой аспект настоящего изобретения относится к способу приживления ксеногенных стволовых клеток иммунодефицитной без ожирения с диабетом мыши с тяжелым комбинированным иммунодефицитом, предусматривающему введение мыши ксеногенных стволовых клеток.
Другой аспект настоящего изобретения относится к способу прогнозирования ранжирование эффективности множества противоопухолевых средств для лечения опухоли, при этом способ предусматривает (1) введение каждого из множества противоопухолевых средств в качестве отдельного средства заявляемой (с несовместимым по HLA PDX) мыши (например, мыши NSG) и определение эффективности, при этом PDX представляет собой опухоль; (2) сравнение и/или ранжирование эффективности каждого из множества противоопухолевых средств с прогнозированием тем самым ранжирования эффективности указанного множества противоопухолевых средств для лечения опухоли.
Другой аспект настоящего изобретения относится к способу тестирования комбинированной терапии для лечения опухоли с использованием двух или более кандидатных средств, при этом способ предусматривает (1) введение указанных двух или более кандидатных средств, либо в виде отдельного средства, либо в виде комбинации, мыши по пункту 1 и определение эффективности, при этом указанный PDX представляет собой указанную опухоль; (2) сравнение эффективности комбинации и эффективности отдельных средств, при этом более высокая эффективность комбинации по сравнению с аддитивной эффективностью отдельных средств указывает на превосходство комбинации.
Другой аспект настоящего изобретения относится к способу определения эффективности и/или безопасности режима дозирования для лечения опухоли с использованием средства, при этом способ предусматривает (1) введение указанного средства мыши по пункту 1, при этом указанный PDX представляет собой указанную опухоль, и при этом указанное средство вводят согласно указанному режиму дозирования (2) определение эффективности и/или безопасности.
Предполагается, что любой из описываемых в настоящем документе вариантов осуществления, в том числе описываемых только в примерах и описываемых только в одном аспекте настоящего изобретения, могут быть объединены с одним или несколькими другими вариантами осуществления, за исключением случаев, когда они явно отвергаются или не применяются специалистом в данной области.
Краткое описание графических материалов
На фиг. 1 показана кривая роста для несовместимых по HLA опухолей у гуманизированных мышей NSG.
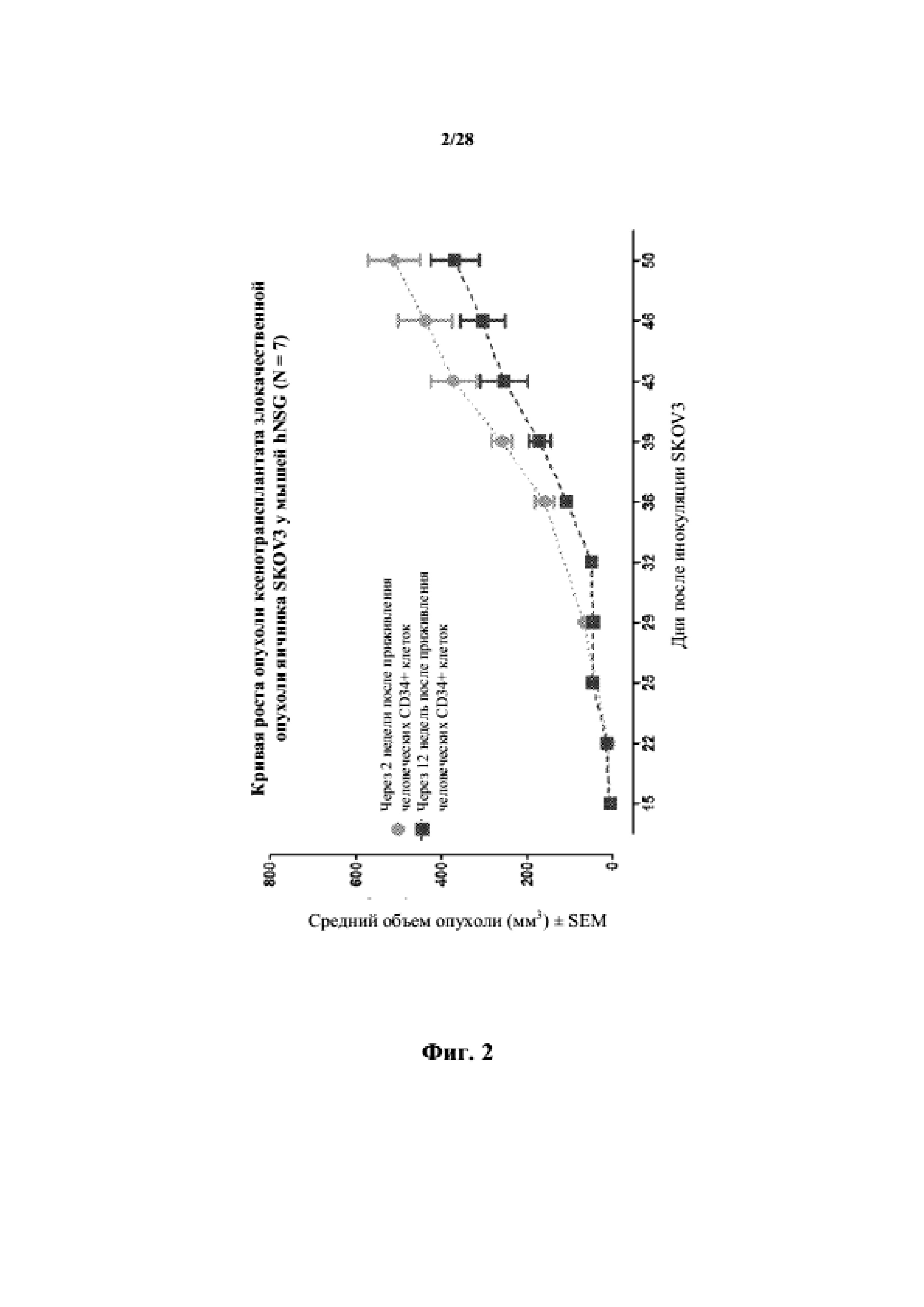
На фиг. 2 показана кривая роста несовместимого по HLA ксенотрансплантата злокачественной опухоли яичника SKOV3 у гуманизированных мышей NSG (n = 7).
На фиг. 3 показаны hCD45+ клетки (%) в периферической крови через 50 суток после инокуляции раковых клеток SKOV3.
На фиг. 4A-4C показаны кривые роста для несовместимых по HLA опухолей (BR0744, LG0977 и SA0209, соответственно) у мышей NSG по сравнению с гуманизированными мышами NSG.
На фиг. 5A-5C показано процентное отношение hCD45+ клеток к суммарной опухолевой (BR0744, LG0977 и SA0209, соответственно) популяции у мышей NSG по сравнению с гуманизированными моделями NSG.
На фиг. 6A-6C показано процентное отношение человеческих лимфоцитов к суммарным инфильтрующимся CD45+ клеткам в трех несовместимых по HLA опухолевых PDX (BR0744, LG0977 и SA0209, соответственно).
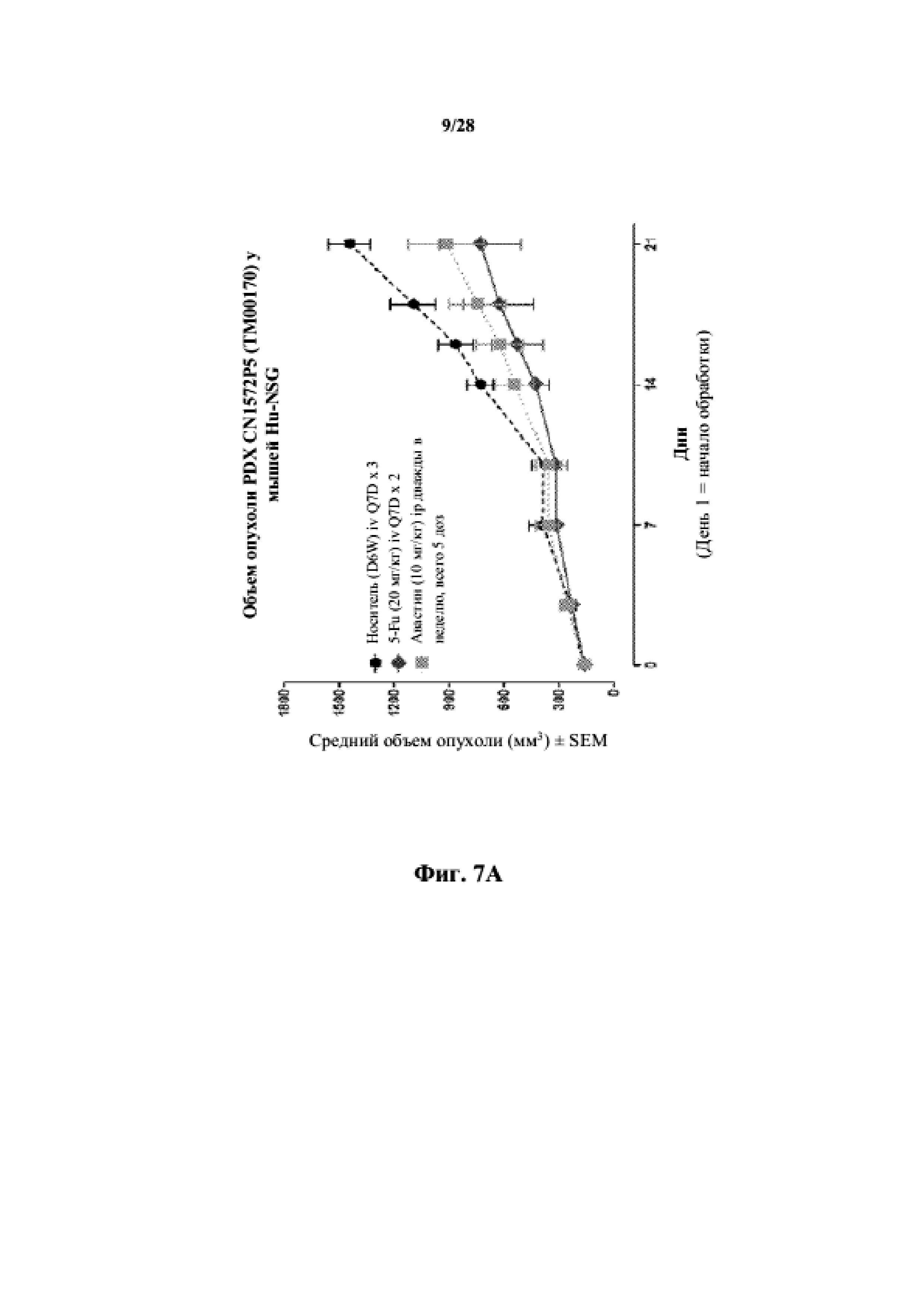
На фиг. 7A показаны кривые объема опухоли PDX злокачественной опухоли толстой кишки CN1572P5 у несовместимой по HLA гуманизированной модели NSG, обработанной 5-FU, авастином и носителем в качестве контроля при указанных режимах дозирования. На фиг. 7B показан средний объем опухоли в день 21 исследования в трех группах.
На фиг. 8A показаны кривые объема опухоли PDX злокачественной опухоли молочной железы MDA-MB-231 у несовместимой по HLA гуманизированной модели NSG, обработанной цисплатином, пембролизумабом (кейтрудой) и носителем в качестве контроля при указанных режимах дозирования. На фиг. 8B показан средний объем опухоли в день исследования 20 у получавших пембролизумаб (кейтруду) и получавших носитель групп. Выполняли эксперимент, подобный описываемому на фиг. 8A, и результат представлен на фиг. 8C.
На фиг. 9A-9D показано, что человеческие T-клетки (как CD3+CD4+, так и CD3+CD8+) и B-клетки (CD19+) присутствуют в периферической крови заявляемой мыши Hu-CD34 NSGTM с несовместимыми по HLA PDX MDA-MB-231.
На фиг. 10A-10C показано, что человеческие T-клетки присутствуют в опухолевой ткани заявляемой мыши Hu-CD34 NSGTM с несовместимыми по HLA PDX MDA-MB-231.
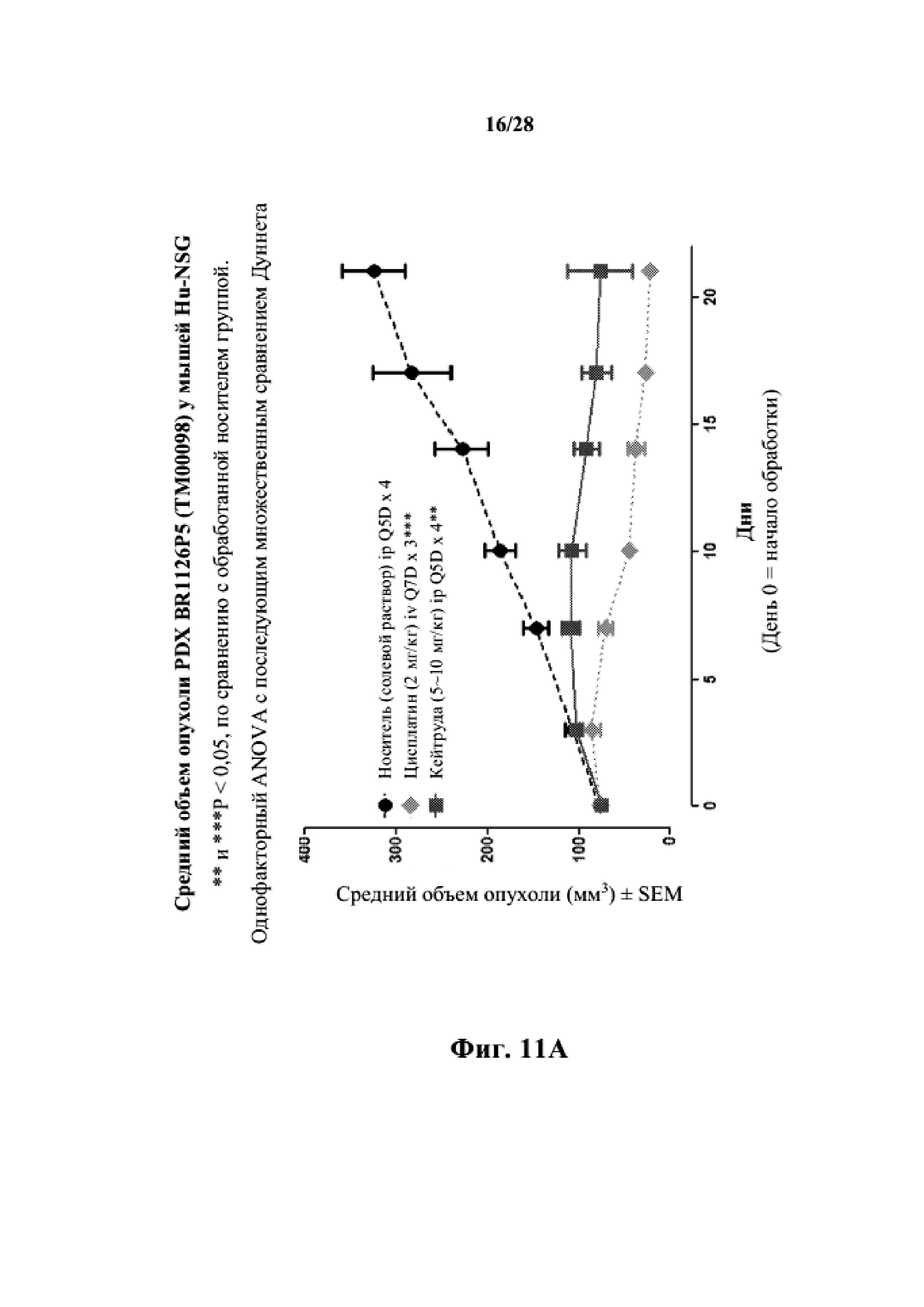
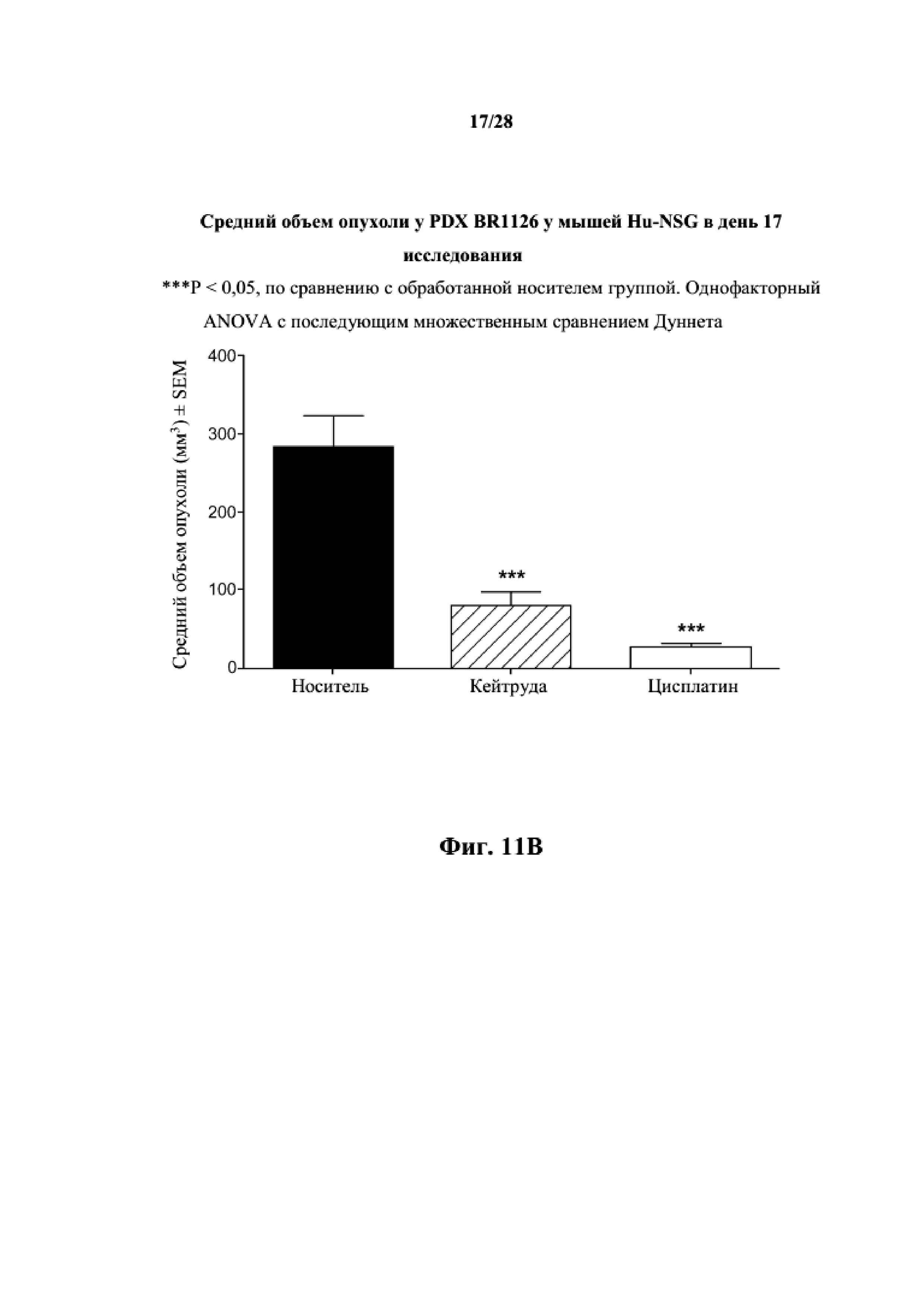
На фиг. 11A показаны кривые объема опухоли PDX злокачественной опухоли молочной железы BR1126 у несовместимой по HLA гуманизированной модели NSG, обработанной цисплатином, пембролизумабом (кейтрудой) и носителем в качестве контроля при указанных режимах дозирования. На фиг. 11B показан средний объем опухоли в день исследования 17 в трех группах. Выполняли эксперимент, подобный описываемому на фиг. 11A, и результат представлен на фиг. 11C.
На фиг. 12A-12D показано, что человеческие T-клетки (как CD3+CD4+, так и CD3+CD8+) и B-клетки (CD19+) присутствуют в периферической крови заявляемых мышей Hu-CD34 NSGTM с несовместимыми по HLA PDX BR1126.
На фиг. 13A-13D показано, что человеческие T- и B-клетки присутствуют в опухолевой ткани заявляемых мышей Hu-CD34 NSGTM с несовместимыми по HLA PDX BR1126. На фиг. 13E-13H показано, что человеческие T- и B-клетки присутствуют в селезенках заявляемых мышей Hu-CD34 NSGTM с несовместимыми по HLA PDX BR1126.
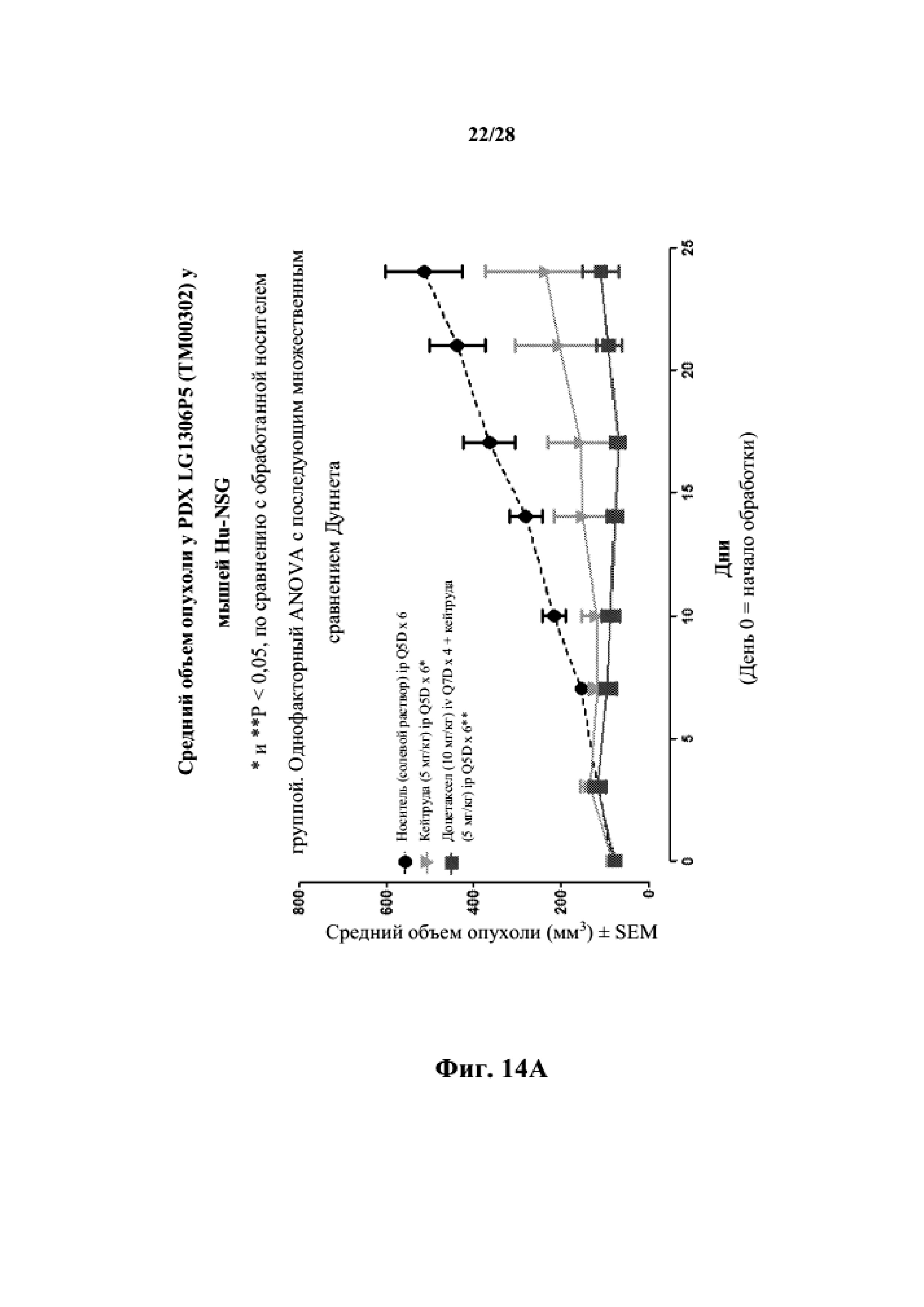
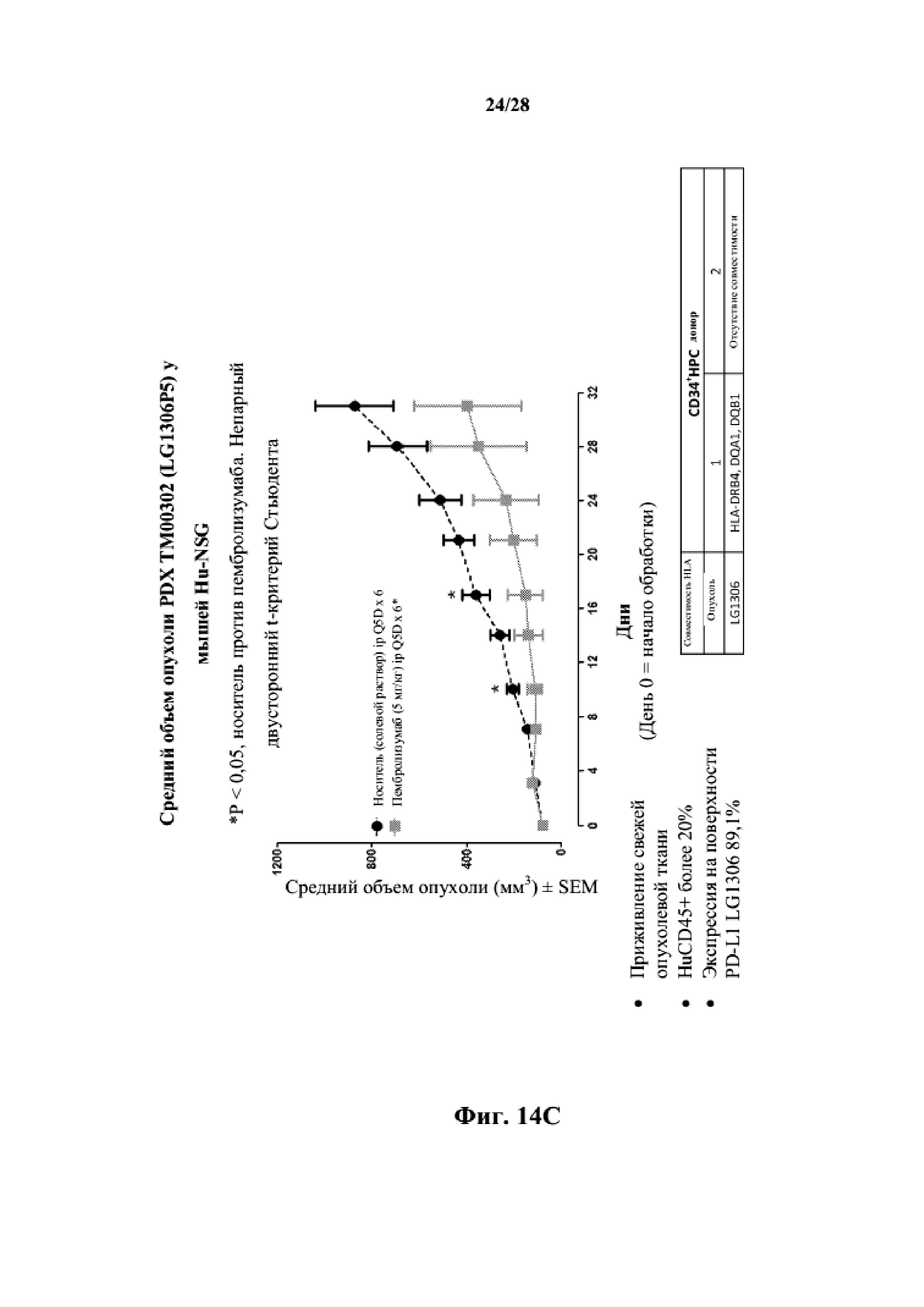
На фиг. 14A показаны кривые объема опухоли PDX злокачественной опухоли легкого LG1306 у несовместимой по HLA гуманизированной модели NSG, обработанной пембролизумабом (кейтрудой) с децетаксолом или без такового и носителем в качестве контроля при указанных режимах дозирования. На фиг. 14B показан средний объем опухоли в день исследования 24 в трех группах. Выполняли эксперимент, подобный описываемому на фиг. 14A, и результат представлен на фиг. 14C.
На фиг. 15A-15D показано, что человеческие T-клетки (как CD3+CD4+, так и CD3+CD8+) и B-клетки (CD19+) присутствуют в периферической крови заявляемых мышей Hu-CD34 NSGTM с несовместимыми по HLA PDX LG1306. На фиг. 15E-15H показано, что человеческие T- и B-клетки присутствуют в селезенках заявляемых мышей Hu-CD34 NSGTM с несовместимыми по HLA PDX LG1306. На фиг. 15I-15K показано, что человеческие T- и B-клетки присутствуют в опухолевой ткани заявляемых мышей Hu-CD34 NSGTM с несовместимыми по HLA PDX LG1306.
На фиг. 16 показано иммунное окрашивание на присутствие инфильтрующихся CD45+CD8+ T-клеток в образцах PDX, обработанных носителем (контролем), только химиотерапией, средством против PD1 (кейтрудой) и против CTLA4 (ипилимумабом). Данные показывают, что терапевтические средства против PD1 и против CTLA4 вызывают заметное присутствие инфильтрующихся T-клеток в опухолевых PDX.
Подробное раскрытие настоящего изобретения
1. Обзор
В традиционном подходе к лечению злокачественных опухолей используют химические средства широкого действия, которые являются токсичными для быстро делящихся клеток, таких как опухолевые/раковые клетки. Такой химиотерапевтический подход может быть успешным, но может быть осложнен широким спектром внецелевых токсичностей и риском индуцирования устойчивости к лекарственному средству. В иммунных системах млекопитающих выработался ряд эффективных, высокоспецифических механизмов устранения целевых клеток, в том числе клеток, которые инфицированы патогенами, и тех, которые становятся раковыми. В ответ в опухолевых клетках выработался свой собственный набор механизмов для уклонения от иммунитета. Следовательно, достижение лучшего понимания взаимодействия между иммунными эффекторными клетками и опухолями открывает новый и перспективный путь стратегий лечения, которые стимулируют долговременную, опосредуемую иммунитетом регрессию опухоли, для клинического применения. Этот класс новых стратегий иммуноонкологического лечения является весьма обнадеживающим, однако, для дальнейших исследований в этой области может быть полезна платформа in vivo тестирования заявляемой гуманизированной модели на основе небольших животных (например, на основе мыши), которая дает человеку более глубокое биологическое понимание взаимодействий иммунных и опухолевых клеток и позволяет проводить доклиническое тестирование новых терапевтических средств, которые характеризуются более высокой вероятностью успеха при переходе к клиническому применению.
Настоящее изобретение, описываемое в настоящем документе, частично основывается на неожиданном открытии того, что для скорости роста полученного от пациента ксенотрансплантата (PDX) у мышей NSG с приживленными человеческими CD34+ клетками не требуется полное совмещение HLA-типа между PDX и прививаемыми человеческими иммунными клетками.
Настоящее изобретение, описываемое в настоящем документе, также частично основывается на неожиданном открытии того, что время приживления линии раковых клеток по сравнению с гуманизацией не оказывает значительного влияния на рост ксенотрансплантата. С другой стороны, время приживления линии раковых клеток также не оказывает значительного эффекта в отношении популяции CD45+ клеток.
Таким образом, один аспект настоящего изобретения относится к гуманизированной иммунодефицитной без ожирения с диабетом (NOD) мыши, при этом мышь (1) является гомозиготной по мутации scid; (2) характеризуется недостаточностью гамма-цепи рецептора IL-2; (3) имеет приживленные CD34+ человеческие кроветворные стволовые клетки (HSC); (4) инокулирована человеческим полученным от пациента ксенотрансплантатом (PDX); при этом HSC и PDX являются несовместимыми по HLA.
Используемый в настоящем документе термин «несовместимый по HLA» относится к неполному совмещению по HLA, в том числе к только частичному совмещению по HLA или к несовмещению по HLA. Согласно некоторым вариантам осуществления наблюдается только частичное совмещение по HLA между HSC и PDX. Согласно некоторым вариантам осуществления отсутствует совмещение по HLA между HSC и PDX.
Согласно некоторым вариантам осуществления мышью является мышь NSG или близкородственный вариант, такой как мышь NSGS, мышь NSG-SGM3 или мышь BLT с приживленными человеческими CD34+ клетками.
Гуманизированная мышь в соответствии с настоящим изобретением может быть использована в широком спектре биологических, медицинских и клинических исследований, в том числе в исследованиях биологии злокачественных опухолей, иммуноонкологии, регенеративной медицины, кроветворения у человека, инфекционных заболеваний, трансплантации, доклинического тестирования эффективности лекарственных средств, а также иммунитета и аутоиммунитета, среди прочих.
Например, заявляемые модели гуманизированных мышей могут быть использованы для изучения иммунного ответа в противораковой терапии, лечении инфекционного заболевания, генной терапии, иммуногенности высокомолекулярных лекарственных средств и т.п.
Заявляемые модели гуманизированных мышей также могут быть использованы в доклинических прогнозирующих исследованиях так, что специфический для больного ксенотрансплантат (такой как PDX из злокачественной опухоли) может быть исследован на заявляемой мышиной модели в присутствии приживленных человеческих кроветворных систем. Эффект, безопасность (например, какой-либо ассоциированный побочный эффект в отношении иммунной системы) и эффективность любых тестируемых соединений или лекарственных средств могут быть исследованы путем введения таких тестируемых соединений или лекарственных средств согласно одному или нескольким режимам дозирования заявляемой мышиной модели. Это особенно эффективно при исследовании иммуноонкологии или иммуномодуляторов или при каком-либо исследовании, предусматривающем взаимодействие между больной тканью (например, при злокачественной опухоли, аутоиммунном заболевании) и иммунной системой.
Заявляемые модели гуманизированных мышей, кроме того, могут быть использованы для исследования какого-либо PDX в присутствии приживленной человеческой кроветворной системы. Это предусматривает проведение исследований гистологии опухоли, «омных» исследований или профилирований (протеомных, геномных, метаболических и т.п.). Согласно некоторым вариантам осуществления информация об изучаемом PDX может быть получена из базы данных Mouse Tumor Biology (MTB), которую разработали в помощь исследователям в таких областях, как выбор экспериментальных моделей, изучение паттернов мутаций в определенных злокачественных опухолях и идентификация генов, которые обычно мутируют в ряде злокачественных опухолей.
Заявляемые модели гуманизированных мышей также могут быть использованы для изучения развития и функции иммунной системы человека, в том числе в разработке гуманизированных мышиных моделей, анализе функции врожденных иммунных клеток, проверке T-клеточного гомеостаза и/или в характеристиках модели мыши BLT (эмбриональная вилочковая железа/эмбриональная печень).
При том, что выше описаны общие аспекты настоящего изобретения, далее в приведенных ниже разделах описываются некоторые аспекты или варианты осуществления настоящего изобретения.
2. Определения
Если не указано иное, научные и технические термины, используемые в настоящем документе, имеют значения, обычно понятные рядовому специалисту в данной области. Такие термины определяются и иллюстративно используются в контексте различных стандартных ссылок, в том числе в J. Sambrook and D. W. Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; 3rd Ed., 2001; F. M. Ausubel, Ed., Short Protocols in Molecular Biology, Current Protocols; 5th Ed., 2002; B. Alberts et al., Molecular Biology of the Cell, 4th Ed., Garland, 2002; D. L. Nelson and M. M. Cox, Lehninger Principles of Biochemistry, 4th Ed., W.H. Freeman & Company, 2004; Herdewijn, P. (Ed.), Oligonucleotide Synthesis: Methods and Applications, Methods in Molecular Biology, Humana Press, 2004; A. Nagy, M. Gertsenstein, K. Vintersten, R. Behringer (Eds.) 2002, Manipulating the Mouse Embryo: A Laboratory Manual, 3rd edition, Cold Spring Harbor Laboratory Press, ISBN-10: 0879695919; и K. Turksen (Ed.), “Embryonic Stem Cells: Methods And Protocols in Methods,” Mol. Biol., 185:499, 2002, Humana Press; Current Protocols in Stem Cell Biology, ISBN: 9780470151808.
Термины в единственном числе не являются ограничивающими и предусматривают множественное число упоминаемых объектов, если явно не указано иное, или если в контексте явно не подразумевает иное.
Термины «экспрессировать», «экспрессия», «экспрессирование» и «экспрессирует» относятся к гену или относятся к транскрипции гена c продуцированием соответствующей mRNA и/или к трансляции mRNA с продуцированием функционального соответствующего кодируемого белка.
Термин «иммунодефицитное отличное от человека животное» относится к отличному от человека животному (например, к мыши), характеризующемуся одним или несколькими из отсутствия функциональных иммунных клеток, таких как T-клетки и B-клетки; дефекта репарации ДНК; дефекта в перестройке генов, кодирующих антиген-специфические рецепторы на лимфоцитах; а также отсутствия иммунных функциональных молекул, таких как IgM, IgG1, IgG2a, IgG2b, IgG3 и IgA.
Термин «иммунодефицитная мышь» относится к мыши, характеризующейся одним или несколькими из отсутствия функциональных иммунных клеток, таких как T-клетки и B-клетки; дефекта репарации ДНК; дефекта в перестройке генов, кодирующих антиген-специфические рецепторы на лимфоцитах; а также отсутствия иммунных функциональных молекул, таких как IgM, IgG1, IgG2a, IgG2b, IgG3 и IgA. Иммунодефицитные мыши могут характеризоваться одной или несколькими недостаточностями гена, вовлеченного в иммунную функцию, такого как Rag1 и Rag2 (Oettinger et al., Science, 248:1517-1523, 1990; и Schatz et al., Cell, 59:1035-1048, 1989). Иммунодефицитные мыши могут иметь любой из этих или других дефектов, которые приводят к патологической иммунной функции у мышей.
Особенно применимыми штаммами иммунодефицитных мышей являются NOD.Cg-PrkdcscidIl2rgtml Wjl/SzJ, обычно называемый мыши NOD scid gamma (NSG), подробно описанный в Shultz et al., J. Immunol., 174:6477-6489, 2005; и NOD.Cg-Rag1tmlMom Il2rgtml Wjl/SzJ, Shultz et al., Clin. Exp. Immunol., 154(2):270-284, 2008, обычно называемый мышами NRG.
Термин «тяжелый комбинированный иммунодефицит (SCID)» относится к состоянию, характеризующемуся отсутствием T-клеток и дефицитом функции B-клеток.
Обычные формы SCID включают в себя связанный с Х-хромосомой SCID, который характеризуется генными мутациями гамма-цепи в гене IL2RG и лимфоцитным фенотипом T(-) B(+) NK(-), а также аутосомальный рецессивный SCID, характеризующийся мутациями гена Jak3 и лимфоцитным фенотипом T(-) B(+) NK(-), мутациями гена ADA и лимфоцитным фенотипом T(-) B(-) NK(-), мутациями альфа-цепи IL-7R и лимфоцитным фенотипом T(-) B(+) NK(+), мутациями CD3 дельта или эпсилон и лимфоцитным фенотипом T(-) B(+) NK(+), мутациями RAG1/RAG2 и лимфоцитным фенотипом T(-) B(-) NK(+), мутациями гена Artemis и лимфоцитным фенотипом T(-) B(-) NK(+), мутациями гена CD45 и лимфоцитным фенотипом T(-) B(+) NK(+).
Генетически модифицированная мышь согласно аспектам настоящего изобретения имеет мутацию тяжелого комбинированного иммунодефицита (Prkdcscid), обычно называемую мутацией scid. Мутация scid хорошо известна и располагается хромосоме 16 мыши, как описывается в Bosma et al., Immunogenetics, 29:54-56, 1989. Гомозиготные по мутации scid мыши характеризуются отсутствием функциональных T-клеток и B-клеток, лимфопенией, гипоглобулинемией и нормальным гематопоэтическим микроокружением. Мутация scid может быть выявлена, например, путем выявления маркеров мутации scid с использованием хорошо известных способов, таких как PCR или проточная цитометрия.
Генетически модифицированная мышь согласно аспектам настоящего изобретения имеет недостаточность гамма-цепи рецептора IL2. Термин «недостаточность гамма-цепи рецептора IL2» относится к уменьшенной гамма-цепи рецептора IL2. Уменьшенная гамма-цепь рецептора IL2 может быть результатом генной делеции или мутации. Уменьшенная гамма-цепь рецептора IL2 может быть выявлена, например, путем выявления делеции или мутации гена гамма-цепи рецептора IL2 и/или путем выявления пониженной экспрессии гамма-цепи рецептора IL2 с использованием хорошо известных способов. Согласно некоторым вариантам осуществления недостаточность гамма-цепи рецептора IL2 представляет собой нуль-мутацию гена гамма-цепи рецептора IL2. Согласно некоторым вариантам осуществления животное с недостаточностью гамма-цепи рецептора IL2 является гомозиготным мутантом по гамма-цепи рецептора IL2.
Согласно аспектам настоящего изобретения представлены генетически модифицированные иммунодефицитные мыши, имеющие мутацию scid или недостаточность гамма-цепи рецептора IL2 в комбинации с мутацией scid. Согласно аспектам настоящего изобретения представлены генетически модифицированные мыши NOD scid gamma.
Термины «NOD scid gamma» и «NSG» используются взаимозаменяемо в настоящем документе в отношении хорошо известного штамма иммунодефицитных мышей NOD.Cg-Prkdcscid NSG, объединяющих несколько иммунных дефицитов от фоновой линии NOD/ShiLtJ, мутацию тяжелого комбинированного иммунодефицита (scid) и полный нокаут гамма-цепи рецептора интерлейкина-2. В результате у мышей NSG отсутствуют зрелые T-, B- и NK-клетки, и они характеризуются дефицитом цитокинового сигнала. Мыши NSG характеризуются отсутствием экспрессии IL2R-γ (gamma c), отсутствием выявляемого сывороточного иммуноглобулина, отсутствием гемолитического комплемента, отсутствием зрелых T-лимфоцитов и отсутствием зрелых естественных клеток-киллеров.
Согласно аспектам настоящего изобретения представлены генетически модифицированные иммунодефицитные отличные от человека животные (например, мыши), имеющие тяжелый комбинированный иммунодефицит или недостаточность гамма-цепи рецептора IL2 в комбинации с тяжелым комбинированным иммунодефицитом.
Создание генетически модифицированного иммунодефицитного отличного от человека животного может быть достигнуто путем ведения нацеливающегося на ген вектора в предварительно имплантированные эмбриональные или стволовые клетки, такие как эмбриональные стволовые (ES) клетки или индуцированные плюрипотентные стволовые (iPS) клетки.
Термин «нацеливающийся на ген вектор» относится к двухнитевой рекомбинантной молекуле ДНК, эффективной для рекомбинации и мутации определенного хромосомного локуса, например, путем вставки в целевой ген или замещения целевого гена.
Термин «дикий тип» относится к встречающимся в природе или немутантным организму, белку или нуклеиновой кислоте.
Необязательно генетически модифицированных иммунодефицитных отличных от человека животных (например, мышей) в соответствии с настоящим изобретением получают путем селекционного скрещивания. Первый родительский штамм отличного от человека животного, которое обладает первым желаемым генотипом, может быть скрещен со вторым родительским штаммом отличного от человека животного, которое обладает вторым желаемым генотипом, с получением потомства, которое представляет собой генетически модифицированных отличных от человека животных с первым и вторым желаемыми генотипами.
Генетически модифицированными иммунодефицитными отличными от человека животными в соответствии с настоящим изобретением предпочтительно являются отличные от человека млекопитающие, в частности, грызуны, такие как мыши, крысы или морские свинки.
Генетически модифицированной иммунодефицитной мышью, имеющей недостаточность гамма-цепи рецептора IL2 в комбинации с мутацией scid, представленной согласно аспектам настоящего изобретения, может быть мышь NSG, мышь NSGS, мышь NSG с приживленными человеческими CD34+ HSC/NSGS или мышь BLT с приживленными человеческими CD34+.
Термин «ксеногенный» используют в настоящем документе в отношении клетки-хозяина или организма-хозяина для указания того, что материал, называемый «ксеногенным», получают из других видов, а не из клетки-хозяина или организма-хозяина.
Используемый в настоящем документе термин «кроветворные стволовые клетки» относится к мультипотентным стволовым клеткам, функция которых дает начало иммунной системе. Кроветворные стволовые клетки от мышей экспрессируют рецептор c-Kit. Рецептор c-Kit хорошо известен в уровне техники, например, описывается в Vandenbark et al., “Cloning and structural analysis of the human c-kit gene,” Oncogene, 7(7): 1259-1266, 1992 ; и Edling & Hallberg, “c-Kit--a hematopoietic cell essential receptor tyrosine kinase,” Int. J. Biochem. Cell Biol., 39(11):1995-1998, 2007. Человеческие кроветворные стволовые клетки экспрессируют CD34. CD34 является хорошо известным белком, например, описываемым в Simmons et al., “Molecular cloning of a cDNA encoding CD34, a sialomucin of human hematopoietic stem cells,” J. Immunol., 148(1):267-271, 1992.
Согласно аспектам настоящего изобретения ксеногенные (например, человеческие) кроветворные стволовые клетки вводят генетически модифицированному иммунодефицитному отличному от человека животному (например, мыши) в соответствии с настоящим изобретением, при этом ксеногенные кроветворные стволовые клетки дифференцируются в ксеногенные иммунные клетки у генетически модифицированного иммунодефицитного отличного от человека животного.
Согласно аспектам настоящего изобретения человеческие кроветворные стволовые клетки вводят генетически модифицированной иммунодефицитной мыши в соответствии с настоящим изобретением, при этом человеческие кроветворные стволовые клетки дифференцируются в человеческие иммунные клетки у генетически модифицированной иммунодефицитной мыши.
Кроветворные стволовые клетки для введения генетически модифицированному иммунодефицитному животному могут быть получены из любой ткани, содержащей HSC, такой как без ограничения пуповинная кровь, костный мозг, GM-CSF-мобилизованная периферическая кровь и эмбриональная печень.
Необязательно кроветворные стволовые клетки для введения генетически модифицированному иммунодефицитному животному могут быть получены как клетки, культивируемые in vitro перед введением для наращивания популяции клеток, полученных из одной или нескольких тканей, содержащих HSC, таких как без ограничения пуповинная кровь, костный мозг, GM-CSF-мобилизованная периферическая кровь и эмбриональная печень.
HSC могут быть введены новорожденным животным путем введения различными путями, такими как без ограничения в сердце (внутрисердечной инъекцией), печень (внутрипеченочной инъекцией) и/или лицевую вену. HSC могут быть введены взрослым животным различными путями, такими как без ограничения введение в хвостовую вену, в полость костного мозга бедренной кости или в селезенку. В качестве дополнительного примера, HSC в виде эмбриональной печени и/или эмбриональной вилочковой железы могут быть приживлены под почечную капсулу (например, в виде 1 мм3 органоидов мыши BLT).
Необязательно HSC вводят кондиционированному животному. Кондиционирование реципиентного животного при подготовке к получению HSC выполняют для истощения или подавления HSC и клеток-предшественников, эндогенных реципиентному животному, перед получением ксеногенных HSC. Кондиционирование реципиентного животного предусматривает введение радиации и/или одного или нескольких химических средств, эффективных в истощении или подавлении HSC и клеток-предшественников, эндогенных реципиентному животному, перед получением ксеногенных HSC. Бусульфан является хорошо известным примером химического средства, эффективного в истощении или подавлении HSC и клеток-предшественников, эндогенных реципиентному животному, перед получением ксеногенных HSC. Кондиционирование радиацией и/или одним или несколькими химическими средствами, эффективными в истощении или подавлении HSC и клеток-предшественников, эндогенных реципиентному животному, перед получением ксеногенных HSC выполняют согласно хорошо известным протоколам получения кондиционированного животного.
Приживление ксеногенных HSC может быть оценено любым из многочисленных способов, таких как без ограничения анализ проточной цитометрии клеток у животных, которым вводят ксеногенные HSC, в одну или несколько временных точек после введения HSC.
Типичные способы выделения ксеногенных HSC, введения ксеногенных HSC в организм-хозяина и способы оценивания их приживления описываются в настоящем документе и в T. Pearson et al., Curr. Protoc. Immunol., 81:15.21.1-15.21.21, 2008; Ito et al., Blood, 100:3175-3182, 2002; Traggiai et al., Science, 304:104-107, 2004; Ishikawa et al., Blood, 106:1565-1573, 2005; Shultz et al., J. Immunol. 174: 6477-6489, 2005; Holyoake et al., Exp Hematol., 27(9):1418-1427, 1999, все из которых включены посредством ссылки.
Введенные HSC выделяют из исходного материала для получения популяции клеток, обогащенной HSC. Выделенные HSC могут быть или могут не быть чистыми.
Согласно некоторым вариантам осуществления HSC очищают путем отбора по клеточному маркеру, такому как CD34.
Согласно некоторым вариантам осуществления введенные HSC человека представляют собой популяцию человеческих клеток, в которой CD34+ клетки составляют приблизительно 1-100% всех клеток, хотя может быть использована популяция человеческих клеток, среди которых CD34+ клетки составляют менее 1% всех клеток. Согласно некоторым вариантам осуществления введенные HSC человека представляют собой клетки пуповинной крови с истощением T-клеток, среди которых CD34+ клетки составляют приблизительно 1-3% всех клеток, клетки пуповинной крови с истощением определенных линий, среди которых CD34+ клетки составляют приблизительно 50% всех клеток, или CD34+ положительно отобранные клети, среди которых CD34+ клетки составляют приблизительно 90% всех клеток.
Количество вводимых HSC не считается ограничивающим в отношении создания ксеногенной иммунной системы у иммунодефицитной мыши. Одна HSC может создать клетки иммунной системы. Таким образом, число водимых HSC обычно находится в диапазоне 1-10 × 106 HSC, если реципиентом является мышь, хотя можно использовать большее количество. Для других видов число клеток может быть отрегулировано при необходимости с использованием исключительно рутинного эксперимента.
В целом, HSC присутствуют в виде субпопуляции CD34+ клеток в более крупной популяции CD34+. Таким образом, популяцию CD34+ клеток, полученных из любой ткани, содержащей HSC, такой как без ограничения пуповинная кровь, костный мозг, GM-CSF-мобилизованная периферическая кровь и эмбриональная печень, вводят для доставки субпопуляции HSC реципиентному животному, подлежащему прививанию. Число CD34+ клеток, полученных из любой ткани, содержащей HSC, такой как без ограничения пуповинная кровь, костный мозг, GM-CSF-мобилизованная периферическая кровь и эмбриональная печень, введенных для доставки субпопуляции HSC реципиентному животному, подлежащему прививанию, не ограничивается и может находиться в диапазоне от 1 клетки до 1 миллиарда клеток, например, от 1 клетки до 500 миллионов клеток, от 1 клетки до 100 миллионов клеток, от 1 клетки до 10 миллионов клеток, от 1 клетки до 5 миллионов клеток, от 1 клетки до 1 миллиона клеток, от 1 клетки до 500000 клеток, от 1 клетки до 100000 клеток, от 1 клетки до 50000 клеток, от 1 клетки до 10000 клеток, от 1 клетки до 1000 клеток, таких CD34+ клеток. Кроме того, число введенных CD34+ клеток находится в диапазоне от 100 клеток до 10 миллионов клеток, от 100 клеток до 5 миллионов клеток, от 100 клеток до 1 миллиона клеток, от 100 клеток до 500000 клеток, от 100 клеток до 100000 клеток, от 100 клеток до 50000 клеток, от 100 клеток до 10000 клеток или от 100 клеток до 1000 клеток. Кроме того, число введенных CD34+ клеток находится в диапазоне от 1000 клеток до 10 миллионов клеток, от 1000 клеток до 5 миллионов клеток, от 1000 клеток до 1 миллиона клеток, от 1000 клеток до 500000 клеток, от 1000 клеток до 100000 клеток, от 1000 клеток до 50000 клеток или от 1000 клеток до 10000 клеток.
Приживление является успешным, если ксеногенные HSC и клетки, дифференцированные из HSC, у реципиентного животного выявляют на тот момент времени, когда большинство любых введенных отличных от HSC клеток выродилось. Критерием успешного приживления человеческих HSC является мультилинейная дифференцировка человеческих иммунных клеток и хоминг в костный мозг, вилочковую железу, селезенку, PBL и т.п. Мыши NSG обеспечивают мультилинейное приживление и хоминг иммунных клеток почти во все соответствующие органы и ткани. Полный диапазон популяций человеческих иммунных клеток, выявляемых у мышей Hu-CD34 NSG, кратко описывается в Ishikawa et al. (Blood, 106(5): 1565-1573, 2005); и Canada et al. (J. Immunol., 188(12): 6145-6155, 2012).
Выявление дифференцированных клеток HSC может быть достигнуто путем выявления ксеногенной ДНК у реципиентного животного или путем выявления интактных ксеногенных HSC и клеток, дифференцированных из HSC, например. Серийный перенос CD34+ клеток вторичному реципиенту и приживление ксеногенной кроветворной системы является дополнительным тестом приживления HSC у первичного реципиента. Приживление может быть выявлено проточной цитометрией как 0,05% или больше ксеногенных CD45+ клеток в крови через 10-12 недель после введения HSC.
Согласно аспектам настоящего изобретения представлены способы, которые предусматривают доставку ксеногенного фактора стволовых клеток (SCF) в ксеногенные кроветворные стволовые клетки у иммунодефицитных животных. SCF может быть доставлен животным кратковременно или хронически. Согласно аспектам настоящего изобретения иммунодефицитные отличные от человека животные могут дополнительно содержать трансген, кодирующий ксеногенный SCF, функционально связанный с промотором. Согласно следующему варианту, если животные экспрессируют ксеногенный SCF, то этих животных не кондиционируют путем введения радиомиметического средства перед введением ксеногенных стволовых клеток.
Способы идентификации модуляторов ответа иммунной системы согласно аспектам настоящего изобретения предусматривают обеспечение отличного от человека генетически модифицированного иммунодефицитного животного; введение ксеногенных кроветворных стволовых клеток отличному от человека генетически модифицированному иммунодефицитному животному, при этом ксеногенные кроветворные стволовые клетки дифференцируются с получением ксеногенных иммунных клеток у отличного от человека генетически модифицированного иммунодефицитного животного; введение стимулятора иммунной системы животному; введение тестируемого соединения животному; оценивание ответа ксеногенных иммунных клеток на стимулятор иммунной системы и сравнение ответа со стандартом с определением эффекта тестируемого соединения в отношении ответа ксеногенных иммунных клеток на стимулятор, при этом эффект тестируемого вещества идентифицирует модулятор ксеногенной иммунной системы у животного.
Тестируемым соединением, используемым в способе в соответствии с настоящим изобретением, может быть любой химический объект, иллюстративно включающий в себя синтетическое или встречающееся в природе соединение или комбинацию синтетического или встречающегося в природе соединения, малую органическую или неорганическую молекулу, белок, пептид, нуклеиновую кислоту, углевод, олигосахарид, липид или комбинацию любых из них.
Образцом, используемым в настоящем документе, может быть образец, полученный из отличного от человека животного, иллюстративно включающий в себя селезенку, костный мозг, кровь, плазму крови и сыворотку крови.
Необязательно анализируют конкретные клеточные популяции иммунной системы, такие как дендритные клетки, плазмоцитоидные дендритные клетки, миелоидные дендритные клетки, тучные клетки, моноциты/макрофаги, естественные клетки-киллеры, нейтрофилы, базофилы и эозинофилы, T-лимфоциты (CD3+CD4+ или CD3+CD8+ T-клетки), B-лимфоциты (например, CD19+ B-клетки).
Настоящее изобретение относится к выделенным клеткам костного мозга генетически модифицированных иммунодефицитных отличных от человека животных, имеющих приживленную человеческую иммунную систему. Настоящее изобретение относится к выделенным клеткам костного мозга генетически модифицированных иммунодефицитных отличных от человека животных, имеющих приживленную человеческую иммунную систему.
Настоящее изобретение относится к выделенным клеткам генетически модифицированных иммунодефицитных отличных от человека животных, имеющих приживленную человеческую иммунную систему. Такие выделенные клетки могут быть культивированы in vitro для применения в различных анализах. Например, такие выделенные клетки применимы в качестве контролей в анализах по оцениванию тестируемого вещества для определения активности тестируемого вещества. Согласно следующему примеру такие выделенные клетки костного мозга применимы для определения активности тестируемого вещества в отношении активности иммунной системы.
Иммуноаналитические способы могут быть использованы для анализа целевого аналита или индикатора ответа иммунных клеток в образце, в том числе без ограничения твердофазный иммуносорбентный анализ (ELISA), твердофазный иммунофильтрационный анализ (ELIFA), проточная цитометрия, иммуноблоттинг, иммунопреципитация, иммуногистохимия, иммуноцитохимия, люминесцентный иммуноанализ (LIA), флуоресцентный иммуноанализ (FIA) и радиоиммуноанализ. Аналитические способы могут быть использованы для получения качественных и/или количественных результатов. Конкретные детали подходящих аналитических способов как для качественного, так и количественного анализа образца описываются в стандартных ссылках, иллюстративно включающих в себя E. Harlow and D. Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1988; F. Breitling and S. Dubel, Recombinant Antibodies, John Wiley & Sons, New York, 1999; H. Zola, Monoclonal Antibodies: Preparation and Use of Monoclonal Antibodies and Engineered Antibody Derivatives, Basics: From Background to Bench, BIOS Scientific Publishers, 2000; B. K. C. Lo, Antibody Engineering: Methods and Protocols, Methods in Molecular Biology, Humana Press, 2003; F. M. Ausubel et al., Eds., Short Protocols in Molecular Biology, Current Protocols, Wiley, 2002; S. Klussman, Ed., The Aptamer Handbook: Functional Oligonucleotides and Their Applications, Wiley, 2006; Ormerod, M. G., Flow Cytometry: A Practical Approach, Oxford University Press, 2000; Givan, A. L., Flow Cytometry: First Principles, Wiley, New York, 2001; Gorczyca, W., Flow Cytometry in Neoplastic Hematology: Morphologic-Immunophenotypic Correlation, Taylor & Francis, 2006; Crowther, J. R., The ELISA Guidebook (Methods in Molecular Biology), Humana Press, 2000; Wild, D., The Immunoassay Handbook, 3rd Edition, Elsevier Science, 2005; и J. Sambrook and D. W. Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 3rd Ed., 2001.
Антитела и способы получения антител хорошо известны в уровне техники. Используемые в настоящем документе термины «антитело» и «антитела» охватывают моноклональные антитела, поликлональные антитела, биспецифические антитела, мультиспецифические антитела, человеческие антитела, гуманизированные антитела, химерные антитела, верблюжьи антитела, однодоменные антитела, одноцепочечные Fv (scFv), одноцепочечные антитела, дисульфид-связанные Fv (sdFv) и антиидиотипические (анти-Id) антитела, а также связывающие антиген фрагменты любых из вышеупомянутых. В частности, антитела включают в себя иммуноглобулиновые молекулы и иммунологически активные фрагменты иммуноглобулиновых молекул, т.е. молекул, которые содержат связывающий антиген сайт. Иммуноглобулиновые молекулы принадлежат любому типу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу.
Используемые в настоящем документе термины «фрагмент антитела» и «связывающий антиген фрагмент» означают фрагмент антитела, который иммуноспецифически связывается с целевым аналитом. Фрагменты антитела могут быть созданы с помощью любой методики, известной специалисту в данной области. Например, фрагменты Fab и F(ab’)2 могут быть получены путем протеолитического расщепления иммуноглобулиновых молекул с использованием ферментов, таких как папаин (для получения фрагментов Fab) или пепсин (для получения фрагментов F(ab’)2). Фрагменты антител также получают методами рекомбинантной ДНК.
Антитела, связывающие антиген фрагменты, способы их создания и способы скрининга созданных антител для по сути специфического связывания с антигеном известны в уровне техники, и такие антитела, связывающие антиген фрагменты и способы описываются в дополнительных подробностях, например, в Antibody Engineering, Kontermann, R. and Dubel, S. (Eds.), Springer, 2001; Harlow, E. and Lane, D., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1988; F. Breitling and S. Dubel, Recombinant Antibodies, John Wiley & Sons, New York, 1999; H. Zola, Monoclonal Antibodies: Preparation and Use of Monoclonal Antibodies and Engineered Antibody Derivatives, Basics: From Background to Bench, BIOS Scientific Publishers, 2000; Ausubel, F. et al., (Eds.), Short Protocols in Molecular Biology, Wiley, 2002; J. D. Pound (Ed.) Immunochemical Protocols, Methods in Molecular Biology, Humana Press, 2nd ed., 1998; B. K. C. Lo (Ed.), Antibody Engineering: Methods and Protocols, Methods in Molecular Biology, Humana Press, 2003; и Kohler, G. and Milstein, C., Nature, 256:495-497 (1975). Антитела против целевых аналитов, таких как toll-подобный рецептор 4, или индикаторы ответа врожденных иммунных клеток, могут быть получены в животных, синтезированы, получены рекомбинантными способами и/или получены коммерчески.
Выявление связывания между целевым аналитом, присутствующим в образце, и партнером связывания достигают любым из ряда способов, известных в уровне техники, иллюстративно включающих в себя выявление выявляемой метки, непосредственно или опосредованно присоединенной к целевому аналиту или партнеру связывания. Термин «выявляемая метка» относится к материалу, способному продуцировать сигнал, указывающий на присутствие метки, выявляемой любым подходящим способом, иллюстративно включающим в себя спектроскопический, оптический, фотохимический, биохимический, ферментативный, электрический и/или иммунохимический. Примеры выявляемых меток иллюстративно включают в себя флуоресцентный фрагмент, хемилюминесцентный фрагмент, биолюминесцентный фрагмент, электронноплотную частицу, магнитную частицу, фермент, субстрат, радиоизотоп и хромофор.
Идентичность конкретных используемых выявляемых метки или меток зависит от используемого процесса выявления. Такие процессы выявления предусматривают, в частности, аналитические форматы, иллюстративно включающие в себя ELISA, вестернблоттинг, иммунопреципитацию, иммуноцитохимию, иммунофлуоресцентный анализ, жидкостную хроматографию, проточную цитометрию, другие процессы выявления, известные в уровне техники, или их комбинации.
Анализ связывания может предусматривать партнера связывания, присоединенного к подложке. Подложка с присоединенным партнером связывания, используемым в анализе связывания, может быть твердой или полутвердой и может представлять собой любой из ряда материалов, таких как стекло, кремний, бумага, синтетический или встречающийся в природе полимер, такой как полистирол, поликарбонат, полипропилен, PVDF, нейлон, целлюлоза, агароза, декстран и полиакриламид или любой другой материал, к которому партнер связывания может быть стабильно присоединен для применения в анализе связывания.
Используемая подложка может включать в себя функциональные группы для связывания с партнерами связывания, такие как без ограничения карбоксильную, аминную, амино, карбоксилатную, галогенную, сложноэфирную, спиртовую, карбамидную, альдегидную, хлорметильную, оксида серы, оксида азота, эпокси и/или тозильную функциональные группы. Присоединение партнеров связывания к подложке достигают любым из ряда способов, иллюстративно включающих в себя адсорбцию и химическое связывание. Согласно одному примеру химические соединения 1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорид, EDC или EDAC могут быть использованы для присоединения партнеров связывания к частицам. Партнеры связывания могут быть связаны непосредственно или опосредованно с материалом подложки, например, путем связывания с покрытием или линкером, расположенными на подложке. Функциональные группы, их модификация и соединение партнера связывания с подложкой известны в уровне техники, например, описываются в Fitch, R. M., Polymer Colloids: A Comprehensive Introduction, Academic Press, 1997.
Такие подложки могут иметь любую из ряда форм и конфигураций, включающих в себя без ограничения микротитрационные планшеты, микротитрационные лунки, иглы, волокна, гранулы, предметные стекла, кремниевые чипы и мембраны, такие как нитроцеллюлозная или PVDF мембрана.
Согласно аспектам настоящего изобретения может быть использован любой из ряда способов спектроскопии для анализа целевого аналита, такого как toll-подобный рецептор 4 или индикатор ответа врожденных иммунных клеток, в том числе без ограничения газовая хроматография, жидкостная хроматография, спектрометрия подвижности ионов, масс-спектрометрия, жидкостная хроматография-масс-спектрометрия (LC-MS или HPLC-MS), спектрометрия подвижности ионов-масс-спектрометрия, тандемная масс-спектрометрия, газовая хроматография-масс-спектрометрия, времяпролетная масс-спектрометрия десорбцией с использованием матрицы (MALDI-TOF), усиленная поверхностью лазерная десорбция/ионизация (SELDI) и спектроскопия ядерного магнитного резонанса, все из которых хорошо известны специалисту в данной области.
Необязательно используют спектрометрический анализ для анализа образца на предмет целевого аналита, такого как toll-подобный рецептор 4 или индикатор ответа врожденных иммунных клеток. Может быть использован анализ масс в анализе согласно аспектам настоящего изобретения. Анализ масс проводят с использованием, например, время-пролетной (TOF) масс-спектрометрии или масс-спектрометрии ионного циклотронного резонанса с преобразованием Фурье. Методики масс-спектрометрии известны в уровне техники, и типичные подробные описания способов для анализа белков и/или пептидов находятся в Li J., et al., Clin Chem., 48(8):1296-1304, 2002; Hortin, G. L., Clinical Chemistry, 52: 1223-1237, 2006; A. L. Burlingame, et al. (Eds.), Mass Spectrometry in Biology and Medicine, Humana Press, 2000; и D. M. Desiderio, Mass Spectrometry of Peptides, CRC Press, 1990.
3. Гуманизированные несущие опухоль мыши NSG
Мыши NSG из Jackson Laboratory (NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, № по каталогу 005557) также широко известны как NOD scid gamma; NSG; NOD-scid IL2Rgammanull и NOD-scid IL2Rgnull. Они объединяют признаки фоновой линии NOD/ShiLtJ (Jackson Laboratory, № по каталогу 001976), мутацию тяжелого комбинированного иммунодефицита (scid) и недостаточность гамма-цепи рецептора IL2. В результате у мышей NSG отсутствуют зрелые T-клетки, B-клетки (и, таким образом, не образуются мышиные антитела) и функциональные NK-клетки, отсутствует система комплемента и имеется дефицит цитокинового сигнала, что ведет к лучшему приживлению человеческих кроветворных стволовых клеток (HSC) и мононуклеарных клеток периферической крови (PBMC), чем у любого другого известного штамма мышей. Мыши NSG также имеют дефективные макрофаги и дендритные клетки. Недавние публикации продемонстрировали исключительную применимость данного штамма в исследованиях трансплантации островковых клеток, кроветворных стволовых клеток и раковых стволовых клеток.
В частности, мыши NSG не экспрессируют ни ген Prkdc, ни связанный с Х-хромосомой ген Il2rg. Мыши NSG жизнеспособны, фертильны, имеют нормальный размер и не демонстрируют каких-либо тяжелых физических или поведенческих патологий. Гистологическое обследование лимфоидных тканей показывает отсутствие лимфоидных клеток и каких-либо кистозных структур в вилочковой железе, отсутствие фолликулов в селезенке и заметно уменьшенной клеточности лимфатических узлов. У мышей NSG имеется дефицит зрелых T- и B-лимфоцитов, сывороточный Ig не выявляется, а цитотоксическая активность натуральных клеток-киллеров (NK) является чрезвычайно низкой. Данные мыши устойчивы к развитию лимфомы, даже после сублетальной обработки облучением. Показали, что эти мутантные мыши легко несут приживление человеческих CD34+ кроветворных стволовых клеток и представляют собой превосходную долгоживущую (медиана выживаемости составляет более 89 недель) модель, подходящую для исследования используемых стратегий ксенотрансплантации.
Мыши NSG несут истинную нуль-мутацию гамма-цепи рецептора интерлейкина-2 в отличии от других штаммов, которые экспрессируют усеченную гамма-цепь рецептора интерлейкина-2 (см. Ohbo et al., Blood, 87:956-967, 1996). Мыши NSG могут быть использованы в некоммерческих исследовательских институтах по договору о передаче материалов (MTA), и компания Jackson Laboratory распространяет мышей NSG по договору с NIH.
Для создания заявляемой гуманизированной NSG мыши (HU-NSGTM) кроветворные стволовые клетки, такие как человеческие CD34+ HSC, вводят мышам NSG Jackson Laboratory с помощью, например, инъекции в хвостовую вену, внутрисердечной инъекции или внутрипеченочной инъекции. HSC могут быть введены мышам NSG возрастом приблизительно 2, 3 или 4 недели. Как правило, могут быть использованы иглы 25 калибра для инъекции в хвостовую вену. Также могут быть использованы иглы меньшего калибра с потенциально повышенным сдвигом клеток в инокулюме.
Альтернативные участки для доставки HSC включают в себя ретроорбитальный венозный синус, собственно полость костного мозга и селезенку. Инъекцию в ретроорбитальный синус легче выполнять, но она является более инвазивной, чем использование хвостовой вены, и требует анестезии мыши-реципиента. Хоминг стволовых клеток в костный мозг зависит от молекул, таких как стромальный фактор 1 и фактор стволовых клеток, которые направляют стволовые клетки из периферической крови в полость костного мозга. Поэтому, доставка стволовых клеток в кровоток (или ортотопически в костный мозг) повышает вероятность того, что клетки установятся в костном мозге нового хозяина.
Необязательно непосредственно перед введением HSC мышей NSG подвергают тотальному облучению или облучению всего тела (TBI) для миелоаблативности, что может быть достигнуто путем помещения мышей NSG в специально разработанные облучатели с дозой гамма-облучения всего тела, разработанной так, чтобы животные становились либо временно, либо хронически иммуносупрессивными.
Для успешного выживания человеческой иммунной системы у мышей NSG может требоваться подавление иммунной системы хозяина каким-либо образом для предупреждения отторжения HVG (хозяин-против-трансплантата). Кроме подавления иммунной системы хозяина облучение также помогает истощить в костном мозге нишу клеток-предшественников у хозяина, что тем самым обеспечивает пространство для приживления донорских стволовых клеток. Для мышей NSG такая подготовка обычно сопровождается гамма-облучением всего тела. Облучатели могут варьировать по размеру в зависимости от их предназначения. Небольшие облучатели (например, облучатель Mark-I от компании JL Shepherd and Associates, San Fernando, CA) имеют размер холодильника и обычно используются для облучения как клеток, так и небольшого количества мышей. Напротив, для облучения сразу нескольких дюжин мышей можно применять один традиционно используемый более крупный (6600-фунтовый) гамма-облучатель (Gammacell-40, MDS Nordion, Ottawa, ON). Животных обычно облучают в течение коротких периодов времени (менее 15 минут). Количество времени, проведенного внутри облучателя, варьирует в зависимости от графиков распада радиоизотопов, необходимого количества облучения и источника ионизирующей энергии (то есть рентгеновские лучи против гамма-лучей, для которых необходим источник цезия или кобальта). При необходимости также могут использоваться более крупные облучатели, такие как линейный ускоритель Clinac 4/80 (Varian Medical Systems, Palo Alto, CA). Как правило, мышей не нужно анестезировать для облучения.
Доза миелоаблативного облучения обычно составляет от 700 до 1300 сГр, согласно некоторым вариантам осуществления может быть использованы более низкие дозы, такие как 1-100 сГр (например, приблизительно 2, 5 или 10 сГр) или 300-700 сГр. Это может быть либо облучение цезием, либо облучение рентгеновскими лучами.
Согласно некоторым вариантам осуществления самкам мышей NSG хирургическим путем имплантируют фрагменты вилочковой железы и печени человека и вводят инъекцией человеческие CD34+ кроветворные стволовые клетки совместимого донора (гуманизированной мыши BLT-NSG). Такие гуманизированные мыши BLT (hu-BLT) имеют наиболее функциональную иммунную систему по сравнению с любой современной моделью гуманизированной мыши и обеспечивают определенные преимущества и улучшенные показатели при некоторых исследованиях, такие как иммунные ответы слизистой оболочки.
Согласно некоторым вариантам осуществления вместо использования мышей NSG для гуманизации могут быть использованы мыши NSGS или NSG-SGM3 (NOD.Cg-Prkdcscid Il2rgtm1Wjl Tg(CMV-IL3,CSF2,KITLG)1Eav/MloySzJ, Jackson Laboratory, № по каталогу 013062, также широко известные как NOD-scid IL2Rgnull-3/GM/SF). Эта многоаллельная линия мышей объединяет иммунодефицитную среду с наличием нескольких трансгенных человеческих цитокинов, способствующих размножению человеческих миелоидных клеток, и представляет собой особенно применимую модель для размещения ксенотрансплантатов. В частности, эти мыши содержат три трансгена: гены интерлейкина-3 (IL-3) человека, гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) человека и стального фактора (SF) человека, каждый из которых управляется последовательностью промотора цитомегаловируса человека/энхансера. Эти мыши поддерживаются на фоновой линии мышей NSG (NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ) и конститутивно продуцируют уровни человеческого IL-3, GM-CSF и SF в сыворотке крови 2-4 нг/мл. Il2rg-/- специфическая фоновая линия NOD.SCID обеспечивает приживление человеческих и мышиных кроветворных клеток, подавляет эритропоэз человеческих клеток, улучшает миелопоэз человеческих клеток и уменьшает B-лимфопоэз человеческих клеток у мышей после трансплантации человеческих клеток костного мозга или эмбриональной печени.
Согласно некоторым вариантам осуществления мыши прививают мононуклеарные клетки периферической крови человека, например, мыши hu-PBMC NSG™ (или гуманизированной PBMC мыши).
Для простоты, согласно некоторым вариантам осуществления различные мышиные штаммы NSG или полученные из NSG можно совместно называть мышью NSG.
Согласно некоторым вариантам осуществления человеческие CD34+ HSC вводят мышам NSG (или мышам NSGS, или мышам BLT-NSG), когда мыши достигают возраста около 3 недель, а зрелые человеческие B-клетки появляются на приблизительно 12 неделе, и зрелые человеческие T-клетки появляются на приблизительно 15 неделе.
Согласно некоторым вариантам осуществления мыши NSG с приживленными человеческими CD34+ (или мыши NSGS, или мыши BLT-NSG) имеют по меньшей мере приблизительно 20%, 25%, 30% или больше человеческих CD45+ клеток в периферической крови через приблизительно 12 недель после приживления HSC.
Для создания заявляемых гуманизированных мышей NSG (или мышей NSGS, или мышей BLT-NSG) с полученным от пациента ксенотрансплантатом (PDX) мышам NSG (или мышам NSGS, или мышам BLT-NSG), репопулированным человеческими CD34+ HSC, вводили инъекцией соответствующее количество полученных от пациента клеток, например, 1-10 × 106 человеческих раковых клеток. Человеческое происхождение раковых клеток может быть подтверждено с помощью окрашивания Ki67. Согласно некоторым вариантам осуществления PDX вводят мышам через приблизительно 2 недели после приживления HSC. Согласно некоторым вариантам осуществления PDX вводят мышам через приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 недель после приживления HSC. Согласно некоторым вариантам осуществления PDX вводят мышам до появления приживленных человеческих иммунных клеток (например, человеческих B- или T-клеток или NK-клеток).
Согласно некоторым вариантам осуществления тип HLA у PDX не совмещается с типом HLA донорских HSC человека.
ПРИМЕРЫ
Любые патенты или публикации, упоминаемые в настоящем описании, включены в настоящий документ посредством ссылки в той же степени, как если бы было указано, что каждая отдельная публикация специально и индивидуально включена посредством ссылки.
Отличные от человека животные (например, мышь), композиции и способы в соответствии с настоящим изобретением, описываемое в настоящем документе, представляют некоторые иллюстративные варианты осуществления, типичные варианты осуществления и не предназначены для ограничений объема настоящего изобретения. Изменения в них и другие применения будут очевидны специалистам в данной области. Такие изменение и другие применения могут быть осуществлены без отступления от объема настоящего изобретения, изложенного в формуле изобретения.
Пример 1. Мыши
Мышей NOD.Cg-PrkdcscidIl2rgtml Wjl/SzJ (NOD-scid IL2rγnull, NSG) получали из колоний, разработанных и поддерживаемых при Jackson Laboratory (Bar Harbor, ME). Всех животных размещали в специальном не содержащем патогенов помещении в микроизоляторных клетках, давали автоклавированный корм и держали на обработанной сульфаметоксазол-триметопримом воде (Goldline Laboratories, Ft. Lauderdale, Fla.) и подкисленной автоклавированной воде каждую вторую неделю.
Пример 2. Приживление мышам человеческих кроветворных стволовых клеток (HSC)
Группы мышей NSG возрастом 24-72 часа (новорожденных) облучали 100 сГр, как описывается в Pearson et al. (Curr. Protoc. Immunol. 81:15.21.1-15.21.21, 2008). Облученным мышам вводили инъекцией истощенную по CD3 T-клеткам человеческую пуповинную кровь (UCB), содержащую 3 × 104 CD34+ кроветворных стволовых клеток (HSC) в объеме 25-50 мкл посредством внутрисердечной инъекции, как описывается в Brehm et al. (Clinic. Immunol. 135(1):84-98, 2010). Через 12 недель с помощью анализов проточной цитометрии крови реципиентов HSC количественно определяли приживление человеческой иммунной системы. Для экспериментальных исследований использовали исключительно мышей с >20% периферических человеческих CD45+ клеток и >5% человеческих CD3+ T-клеток.
Подобным образом, сублетально облученным новорожденным мышам NSG также можно вводить инъекцией истощенную по CD3 T-клеткам человеческую пуповинную кровь (UCB), содержащую 3 × 104 CD34+ кроветворных стволовых клеток (HSC), посредством внутрипеченочной инъекции или посредством инъекции в лицевую вену, как описывается в Brehm et al. (Clinic. Immunol., 135(1):84-98, 2010).
Кроме того, группы мышей NSG возрастом приблизительно 3 недели могут быть подвергнуты облучению всего тела сублетальной дозой приблизительно 200-1300 сГр перед введением инъекцией 0,2-1 × 106 CD34+ HSC через латеральную хвостовую вену с использованием стандартных методик. Например, каждое животное взвешивали перед инъекцией и вводили объем приблизительно 1% от массы тела животного на инъекцию. Перед инъекцией животных грели в течение 5-10 минут (например, в коммерчески доступном нагревающем боксе, или под находящейся сверху лампой для обогрева, или с использованием подушки с циркулирующей теплой водой, расположенной под клеткой) для расширения вен. Затем легко анестезированных животных клали набок на перезаряжаемый теплый поддон или на подушку с циркулирующей теплой водой, чтобы держать их в тепле во время анестезии. Затем вставляли иглу небольшого калибра (28-30) со скошенным верхом в вену в направлении головы животного, пытаясь удержать иглу и шприц параллельно хвосту. Игла должна была плавно продвигаться в вену. После инъекции животных помещали в клетку и наблюдали в течение 5-10 минут, чтобы убедиться, что кровотечение не возобновилось.
Для мышиной модели BLT (костный мозг/печень/вилочковая железа) приблизительно 1 мм3 эмбриональной печени и эмбриональной вилочковой железы имплантировали в виде органоидов мыши-хозяину NSG, которую предварительно подвергали облучению всего тела приблизительно 200 сГр. Затем приблизительно 0,2-1 × 106 CD34+ HSC вводили инъекцией в латеральную хвостовую вену с использованием стандартных методик. Мышиная модель BLT обеспечивает надежное и последовательное развитие ксенотрансплантатной (например, человеческой) иммунной системы, содержащей множество линий кроветворных клеток, демонстрирует устойчивое развитие высокого содержания T-клеток, и T-клетки коммитируются в аутологичные ткани вилочковой железы. Такая мышиная модель, как правило, характеризуется выявляемыми T- и B-клеточными ответами на вирусную инфекцию (например, EBV и HIV).
В любой из подходящих гуманизированных мышиных моделей, таких как гуманизированные мыши NSG, полученный от пациента ксенотрансплантат (PDX) или линию раковых клеток инокулируют в определенные временные точки, например, 2 или 12 недели после инъекции человеческих CD34+ клеток. Обеспечивают рост ксенотрансплантатов, например, в течение приблизительно 7 недель с частым мониторингом массы тела и объема опухоли (например, дважды в неделю).
Периферическая кровь мышей может быть собрана в конце исследования для анализа степени приживления человеческих CD45+ донорских клеток. Предпочтительно человеческие CD45+ донорские клетки должны достигать по меньшей мере приблизительно 20-30% от периферической крови.
Пример 3. Для повторяемости предполагаемых скоростей роста PDX не требуется совмещение по HLA-типу
Гуманизацию мыши NSG выполняли, в основном, как описывается выше в примере 2. Вкратце, группы мышей NSG возрастом приблизительно 3 недели подвергали облучению всего тела (приблизительно 200 сГр) перед введением инъекцией приблизительно 0,2-1 × 106 CD34+ HSC в латеральную хвостовую вену с использованием стандартных методик. Ксенотрансплантаты PDX с использованием трех разных образцов злокачественной опухоли (раковые клетки молочной железы BR0620, раковые клетки легкого LG1208 и раковые клетки мочевого пузыря BL0440) имплантировали подкожно заявляемой модели гуманизированных мышей NSG, т.е. Hu-CD34 мышей NSG, с установленными и функционально созревшими человеческими иммунными клетками, полученными от совместимого по HLA донора человеческих HSC, и контролировали рост приживленного PDX в течение до приблизительно 55 дней после приживления PDX. Все три опухоли демонстрировали устойчивый рост и отсутствие признаков отторжения (фиг. 1).
Результаты демонстрируют, что не требуется совместимость по HLA-типу для повторяемости предполагаемой скорости роста PDX у заявляемой модели гуманизированных мышей NSG.
Пример 4. Временная оценка приживленного PDX по росту опухоли у мышей Hu-CD34 NSGTM
Для оценивания какого-либо временного эффекта в отношении роста опухоли ксенотрансплантата PDX у несовместимой по HLA гуманизированной hCD34+ мыши NSG инокулировали приблизительно 5 × 106 человеческий раковых клеток яичника SKOV3 либо через 2, либо через 12 недель после инъекции несовместимых по HLA человеческих CD34+ клеток мыши NSG согласно процедуре, в основном, как описывается выше в примерах 2 и 3. Обеспечивали рост ксенотрансплантатов дольше чем приблизительно 7 недель с контролированием массы тела и объема опухоли два раза в неделю. Периферическую кровь мышей собирали в конце исследования для анализа степени приживления человеческих CD45+ донорских клеток. Среднее результатов от двух групп из 7 мышей каждая (2 недели против 12 недель) показано на фиг. 2.
Через 2 недели после приживления человеческий иммунитет еще не развивался. Действительно, требуется по меньшей мере 12 недель, чтобы зрелые человеческие T- и B-клетки становились выявляемыми в PBL мышей Hu-CD34 NSG. В исследованиях приживления опухоли, однако, получали 100% опухоль в обеих группах (N = 7 для обеих), а увеличение объема опухоли с течением времени в 2-недельной группе несколько опережало 12-недельную группу (фиг. 2).
Результаты показали, что между двумя группами мышей нет существенной разницы, это указывает на то, что время приживления линии раковых клеток в отличии от гуманизации не оказывает значительного влияния (если таковое имеется) на рост раковых клеток яичника SKOV3.
Мышей тестировали на предмет человеческого кроветворного химеризма через 50 дней после инокуляции раковых клеток, и все показали 25-50% huCD45 + клеток в PBL, что указывало на успешное приживление (фиг. 3). Результаты показали, что время приживления линии раковых клеток не оказывает значительного эффекта (если таковой имеется) на популяцию CD45+ клеток у модели гуманизированных мышей NSG с несовместимым по HLA PDX.
Пример 5. Гуманизация не оказывает значительного влияния на кинетические параметры роста PDX
Важным вопросом, который не рассматривался в этих экспериментах, был вопрос о том, влияет ли присутствие человеческих иммунных клеток на скорости роста опухоли по сравнению со скоростями их роста у нормальных, негуманизированных мышей NSG.
Для определения того, оказывает ли гуманизация мышей NSG какое-либо существенное влияние на кинетические параметры роста несовместимого по HLA PDX, PDX трех свежих образцов опухоли - злокачественной опухоли молочной железы BR0744 (фиг. 4A), злокачественной опухоли легкого LG0977 (фиг. 4B) и саркомы мягких тканей SA0209 (фиг. 4C) - независимо прививали параллельно либо модели мыши NSG, либо модели гуманизированной мыши Hu-CD34 NSG с использованием в основном тех же способов, что описываются выше, измеряли рост PDX и строили кривые роста, соответственно.
У обеих моделей мышей NSG и гуманизированных мышей NSG частота приживания для всех трех опухолей составляла 100%, и опухоли развивались у каждого из привитых хозяев. Только опухоль молочной железы росла с чуть более высокой скоростью у реципиентов NSG, чем у реципиентов Hu-CD34 NSG (фиг. 4A); другие две опухоли росли с одинаковой скоростью у обоих хозяев (фиг. 4B и 4C). Но в целом не было существенной разницы в кривых роста опухоли между моделями NSG и hNSG у опухолей PDX в течение всего 40-70-дневного экспериментального периода после приживления.
Во всех экспериментальных группах hNSG hCD45+ клетки в периферической крови составляли более 20%, подтверждая успешность гуманизации. Также на фиг. 5A-5C показано, что hCD45+ клетки не наблюдали у негуманизированных мышей NSG.
В конце исследования роста опухоли также собирали и анализировали опухоли проточной цитометрией на предмет присутствия TIL. Все три опухоли содержали человеческие CD4+ и CD8+ T-клетки, но выявляли незначительное количество CD19+ B-клеток (см. фиг. 6A-6C). Без углубления в какую-либо конкретную теорию, неспособность TIL замедлять рост опухоли у реципиентов Hu-CD34 NSG свидетельствует о том, что Т-клетки, которые распознают опухоль, могут становиться анергическими.
Вместе эти результаты показывают, что мыши Hu-CD34 NSG поддерживают рост несовместимой по HLA опухоли, и что присутствие человеческих иммунных клеток не оказывает существенного влияния на приживание опухоли или скорости роста.
Пример 6. Мыши Hu-CD34 NSGTM с PDX представляют собой функциональную платформу для оценивания эффективности лекарственного средства
Способность гуманизированных мышей NSG поддерживать рост несовместимых по HLA опухолей человека, как показано выше, стало важным фактом в разработке данной платформы доклинического тестирования.
Для тестирования того, можно ли заявляемых мышей Hu-CD34 NSGTM с несовместимым по HLA PDX использовать для оценки эффективности лекарственного средства против PDX с использованием клинически релевантных стандартных методов лечения (SOC), строили кривые роста опухоли за 21 день для группы отрицательного контроля/получавшей носитель группы и двух групп, получавших лечение с использованием 5-FU и авастина, соответственно, против PDX злокачественной опухоли толстой кишки CN1572P5. В частности, 5-FU вводили i.v. дозой приблизительно 20 мг/кг массы тела Q7d × 2 (каждые 7 дней, всего 2 дозы). Авастин вводили i.p. дозой приблизительно 10 мг/кг массы тела, два раза в неделю, всего 5 доз. Носитель (D5W) вводили i.v. Q7d × 3.
Результаты на фиг. 7A и 7B показывают, что как 5-FU, так и авастин являются эффективными против несовместимого по HLА PDX злокачественной опухоли толстой кишки у заявляемой гуманизированной модели NSG. Это показывает, что заявляемая модель Hu-CD34 NSG с несовместимым по HLA PDX представляет функциональную платформу для оценивания эффективности клинически релевантных стандартных лекарственных средств (SOC).
Пример 7. Кейтруда и цисплатин ингибируют рост модели злокачественной опухоли PD-L1+ MDA-MB-231 у Hu-CD34 NSGTM
Белок запрограммированной смерти клетки 1 (также известный как PD-1 и CD279) является белком, который у людей кодируется геном PDCD1. PD-1 представляет собой иммуноингибиторный рецептор клеточной поверхности, который принадлежит семейству CD28 иммуноглобулинового (Ig) суперсемейства и экспрессируется на T-клетках, предшественниках B-клеток, моноцитах, естественных клетках-киллерах и многих инфильтрующихся в опухоль лимфоцитах (TIL). Он представляет собой важный рецептор иммунной «контрольной точки», который ингибирует T-клеточный ответ и играет ключевую роль в модулировании T-клеточной функции.
PD-1 связывает два лиганда PD-L1 и PD-L2, оба из которых находили в опухолевых клетках, и оба из которых использовались опухолевыми клетками для вовлечения рецептора PD-1 в активированные T-клетки для подавления функции активированных T-клеток, чтобы таким образом избежать иммунного ответа против опухолевых клеток. Следовательно, PD-1 и его лиганды играют важную роль в подавлении иммунной системы путем предотвращения активации T-клеток, что в свою очередь подавляет иммунный ответ против злокачественной опухоли, но также снижает аутоиммунитет и обеспечивает аутотолерантность. Полагают, что ингибиторный эффект PD-1 осуществляется через двойной механизм обеспечения апоптоза (запрограммированной смерти клетки) антиген-специфических T-клеток в лимфатических узлах со снижением при этом апоптоза регуляторных T-клеток (супрессорных T-клеток).
Новый класс лекарственных средств, которые блокируют PD-1, ингибиторов PD-1, активирует иммунную систему для атаки опухолей и, поэтому, применим для лечения злокачественной опухоли. Например, моноклональные антитела против PD-1 могут стимулировать иммунную систему и, таким образом, применимы для лечения злокачественной опухоли. Кроме того, многие опухолевые клетки экспрессируют иммуносупрессивный лиганд PD-1 - PD-L1. Таким образом ингибирование взаимодействия между PD-1 и PD-L1 может усиливать T-клеточные ответы in vitro и опосредовать предклиническую противоопухолевую активность.
Одно такое лекарственное средство на основе антитела против PD-1 ниволумаб (Opdivo - Bristol Myers Squibb) обеспечивает полные или частичные ответы при немелкоклеточной злокачественной опухоли легкого, меланоме и почечноклеточной злокачественной опухоли в клиническом испытании с общей сложностью 296 больными. Ниволумаб также нацеливается на рецепторы PD-1 и был одобрен в Японии в июле 2014 года и одобрен FDA в США в декабре 2014 года для лечения метастатической меланомы.
Другое такое лекарственное средство на основе антитела против PD-1 пембролизумаб (кейтруда, MK-3475, Merck) нацеливается на рецепторы PD-1 и было одобрено FDA в сентябре 2014 года для лечения метастатической меланомы. С марта 2015 года пембролизумаб стал доступным для больных запущенной меланомой в Соединенном Королевстве по схеме раннего доступа к медицинским препаратам (EAMS) в Соединенном Королевстве. Его также используют в клинических испытаниях в США при злокачественной опухоли легкого и при мезотелиоме.
Другие нацеливающиеся на рецепторы PD-1 лекарственные средства в разработке на ранней стадии, включают в себя пидилизумаб (CT-011, Cure Tech), BMS 936559 (Bristol Myers Squibb) и MPDL328OA (Roche).
С другой стороны, цисплатин является первым представителем класса содержащих платину противораковых химиотерапевтических лекарственных средств, которые также включают в себя карбоплатин и оксалиплатин. Такие комплексы платины реагируют in vivo, связывая ДНК и вызывая ее сшивание, что в конечном счете вызывает апоптоз (запрограммированную смерть клетки).
Чтобы определить, будут ли привитые опухолевые PDX отвечать на клинически релевантные иммуноонкологические ингибиторы контрольных точек, или могут ли ингибиторы контрольных точек реактивировать противоопухолевые ответы в резидентных человеческих иммунных клетках, разрабатывали и выполняли серии экспериментов.
Во-первых, для определения эффективности ингибитора контрольных точек пембролизумаба (кейтруда) в заявляемой гуманизированной модели NSG с несовместимым по HLA PDX создавали модель huNSG с PDX согласно способам в соответствии с настоящим изобретением. В частности, гуманизированным мышам NSG (выясняли, что человеческие CD45+ клетки составляли более 25% в периферической крови мышей huNSG, что демонстрировало успешное приживление huCD34) прививали 5 × 106 несовместимых по HLA PD-L1-положительных клеток злокачественной опухоли молочной железы линии MDA-MB-231 на мышь путем s.c. инокуляции с матригелем. Данная клеточная линия экспрессирует очень высокие уровни PD-L1 на поверхности опухолевых клеток, который может связываться с PD-1 на T-клетках и индуцировать анергию, приблизительно 94,3% клеток MDA-MB-231 экспрессировали PD-L1. Затем гуманизированных мышей NSG с привитой опухолью обрабатывали или носителем, или цисплатином, или пембролизумабом (кейтрудой).
Строили кривые роста опухоли за 21 день для группы отрицательного контроля/получавшей носитель группы и двух групп, получавших лечение с использованием цисплатина и пембролизумаба (кейтруды), соответственно, против PDX MDA-MB-231. В частности, цисплатин вводили i.v. дозой приблизительно 2 мг/кг массы тела Q7d × 2 (каждые 7 дней, всего 2 дозы). Пембролизумаб (кейтруду) вводили i.p. дозой приблизительно 5-10 мг/кг массы тела, Q5d × 4 (каждые 5 дней, всего 4 дозы). Носитель (солевой раствор) вводили i.p. Q5d × 4.
Цисплатин представляет собой содержащее платину химиотерапевтическое средство, которое вызывает сшивание ДНК и апоптоз у быстро делящихся клеток. Лечение цисплатином только минимально снижает скорость роста опухолей MDA-MB-231 у гуманизированных мышей. Напротив, кейтруда существенно замедляет рост опухоли в пределах ~2 недель после начала лечения (фиг. 8A и 8B).
По окончании исследования роста периферическую кровь экспериментальных мышей собирали и анализировали на предмет человеческих CD19+ B-клеток и человеческих CD4+ и CD8+ T-клеток. На фиг. 9A-9D показано, что человеческие T-клетки, в том числе и CD3+CD4+, и CD3+CD8+ T-клетки, а также CD19+ B-клетки присутствуют в периферической крови заявляемой мыши Hu-CD34 NSGTM с несовместимыми по HLA PDX MDA-MB-231.
Опухоли также собирали и анализировали на предмет человеческих CD4+ и CD8+ инфильтрующихся T-клеток. На фиг. 10A-10C показано, что человеческие T-клетки (и CD3+CD4+, и CD3+CD8+ T клеток) присутствуют в опухолевой ткани заявляемой мыши Hu-CD34 NSGTM с несовместимыми по HLA PDX MDA-MB-231.
Таким образом, все три получающих лечение группы демонстрировали подобные процентные отношения этих клеток независимо от лечения. Отсутствие дополнительных TIL в опухолях, обработанных кейтрудой, указывает на то, что более медленный рост опухоли обусловлен повторной активацией резидентных TIL, а не дополнительной стимуляцией инфильтрации TIL из PBL или селезенки.
Данные снова демонстрируют, что заявляемая модель Hu-CD34 NSG с несовместимым по HLA PDX представляет собой функциональную платформу для оценивания эффективности лекарственного средства, в том числе иммуномодуляторных лекарственных средств, которая может основываться на функции привитых человеческих иммунных клеток.
Пример 8. Кейтруда и цисплатин ингибируют рост модели злокачественной опухоли молочной железы PD-L1+ TNBC BR1126 у Hu-CD34 NSGTM
В целом, в данном примере наблюдали тот же результат, что и в примере 7, при этом несовместимые по HLA PD-L1-положительные клетки линии злокачественной опухоли молочной MDA-MB-231 заменяли несовместимыми по HLA PD-L1-положительными клетками линии злокачественной опухоли молочной железы BR1126 - клетками линии трижды негативной злокачественной опухоли молочной железы (TNBC). Трижды негативная злокачественная опухоль молочной железы представляет собой агрессивную подгруппу злокачественных опухолей молочной железы с ограниченными вариантами лечения. У больных TNBC отмечали экспрессию PD-L1. Если экспрессию PD-L1 оценивали в TIL, она коррелировала с опухолями более высокой степени и более крупного размера. Экспрессия PD-L1 в опухоли также коррелировала с инфильтрацией регуляторных Т-клеток при TNBC, при этом данные факты указывают на роль экспрессирующих PD-L1 опухолей и экспрессирующих PD-1/PD-L1 TIL в регуляции иммунного ответа при TNBC.
В частности, гуманизированным мышам NSG прививали 5 × 106 несовместимых по HLA PD-L1-положительных клеток линии злокачественной опухоли молочной железы BR1126 на мышь путем s.c. инокуляции. Это может быть выполнено в присутствии матригеля. Приблизительно 56,9% клеток BR1126 экспрессировали PD-L1. Выяснили, что человеческие CD45+ клетки составляли более 25% в периферической крови мышей hNSG.
Строили кривые роста опухоли за 21 день для группы отрицательного контроля/получавшей носитель группы и двух групп, получавших лечение с использованием цисплатина и пембролизумаба (кейтруды), соответственно, против PDX BR1126. В частности, цисплатин вводили i.v. дозой приблизительно 2 мг/кг массы тела Q7d × 3 (каждые 7 дней, всего 3 дозы). Пембролизумаб (кейтруду) вводили i.p. дозой приблизительно 5-10 мг/кг массы тела, Q5d × 4 (каждые 5 дней, всего 4 дозы). Носитель (солевой раствор) вводили i.p. Q5d × 4.
Результаты на фиг. 11A и 11B показывают, что как цисплатин, так и кейтруда существенно снижали рост опухоли по сравнению с носителем в качестве контроля против несовместимого по HLA PD-L1+ PDX злокачественной опухоли молочной железы в заявляемой гуманизированной модели NSG.
На фиг. 12A-12D, кроме того, показано, что человеческие T-клетки, в том числе и CD3+CD4+, и CD3+CD8+ T-клетки, а также CD19+ B-клетки присутствуют в периферической крови заявляемых мышей Hu-CD34 NSGTM с несовместимыми по HLA PDX BR1126.
Опухоли от обрабатываемых кейтрудой мышей собирали в конце исследования и проверяли на предмет инфильтрации лимфоцитов. На фиг. 13A-13D показано, что человеческие T-клетки (и CD3+CD4+, и CD3+CD8+ T-клетки) и CD19+ B-клетки присутствуют в опухолевой ткани заявляемых мышей Hu-CD34 NSGTM с несовместимыми по HLA PDX BR1126. Таким образом, как и в эксперименте с линией раковых клеток в опухоли также инфильтровывались человеческие CD4+ и CD8+ T-клетки, а также человеческие B-клетки, и лечение кейтрудой не снижало инфильтрацию в опухоль по сравнению с обработанными носителем мышами, что опять-таки предполагает, что более медленный рост опухоли обуславливается реактивацией резидентных иммунных эффекторных клеток.
На фиг. 13E-13H, кроме того, показано, что человеческие T-клетки (как CD3+CD4+, так и CD3+CD8+ T-клетки) и CD19+ B-клетки присутствуют в селезенках заявляемых мышей Hu-CD34 NSGTM с несовместимыми по HLA PDX BR1126.
В подобном эксперименте выполняли иммуноокрашивание образцов опухолевого PDX, обрабатываемых только химиотерапией, средством кейтруда на основе антител против PD1 и средством ипилимумаб на основе антител против CTLA4, для выявления присутствия CD45+CD8+ инфильтрующихся T-лимфоцитов. На фиг. 16 показано, что методы лечения с использованием средства кейтруда на основе антител против PD1 и средства ипилимумаб на основе антител против CTLA4 приводят к большому количеству присутствующих инфильтрующихся CD45+CD8+ T-лимфоцитов по сравнению с химиотерапией отдельно.
Это опять-таки демонстрирует, что заявляемая модель Hu-CD34 NSG с несовместимый по HLA PDX представляет собой функциональную платформу для оценивания эффективности лекарственного средства, в том числе иммуномодуляторных лекарственных средств, которая может основываться на функции привитых человеческих иммунных клеток.
Пример 9. Кейтруда +/- доцетаксол ингибируют рост медели злокачественной опухоли PD-L1+ LG1306 в Hu-CD34 NSGTM
Данный эксперимент выполняли для определения того, будет ли комбинаторное лечение опухоли у мышей Hu-CD34 NSG демонстрировать более высокую эффективность, чем терапия в виде какого-либо отдельного средства.
В данном примере получали в основном тот же результат, что и в примерах 7 и 8, при этом несовместимые по HLA PD-L1-положительные клетки линии злокачественной опухоли молочной MDA-MB-231 заменяли несовместимыми по HLA PD-L1-положительными клетками линии злокачественной опухоли легкого LG1306.
В частности, гуманизированным мышам NSG прививали 5 × 106 несовместимых по HLA PD-L1-положительных клеток линии злокачественной опухоли легкого LG1306 на мышь. Приблизительно 89,1% из клеток LG1306 экспрессировали PD-L1. Выяснили, что человеческие CD45+ клетки составляли более 20% в периферической крови мышей hNSG.
Строили кривые роста опухоли за 24 дня для группы отрицательного контроля/получавшей носитель группы и двух групп, получавших лечение с использованием пембролизумаба (кейтруды) с противомитотическим химиотерапевтическим средством декотаксол или без такового, против PDX LG1306. В частности, децетаксол, если предусматривался, вводили i.v. дозой приблизительно 10 мг/кг массы тела Q7d × 4 (каждые 7 дней, всего 4 дозы). Пембролизумаб (кейтруду) вводили i.p. дозой приблизительно 5 мг/кг массы тела, Q5d × 6 (каждые 5 дней, всего 6 дозы). Носитель (солевой раствор) вводили i.p. Q5d × 6.
Опухоли от обрабатываемых кейтрудой отдельно мышей демонстрировали сниженный рост по сравнению с таковыми от обрабатываемых носителем контрольных групп, но эти ответы были высоко вариабельными из-за того, что одна из 10 мышей не отвечала на кейтруду. При объединении кейтруды с доцетакселом рост опухоли значительно подавлялся в пределах 10 дней после обработки, с очень небольшой вариабельностью от мыши к мыши (от опухоли к опухоли). Однако, когда одну мышь, которая не отвечала на кейтруду, исключили из вычислений, не было разницы между группами, получавшими кейтруду и комбинацию. Обе группы демонстрировали значительное снижение роста опухоли, и не наблюдали аддитивные эффекты при объединении кейтруды и доцетаксела.
Таким образом, результаты, представленные на фиг. 14A и 14B, демонстрируют, что пембролизумаб (кейтруда), с децетаксолом или без такового, является эффективным против несовместимого по HLA PD-L1+ PDX злокачественной опухоли молочной железы в заявляемой гуманизированной модели NSG.
Совместно эксперименты, описываемые в настоящем документе, в частности, эксперименты в примерах 6-9, продемонстрировали, что человеческие опухоли, привитые мышам Hu-CD34 NSG, способны отвечать на стандартные химиотерапевтические средства. Тем не менее, еще более значительным является то, что привитые опухоли, как представляется, уклоняются от иммунитета человека так же, как и у больных, от которых они были получены. Более того, обработка ингибитором контрольной точки TIL предположительно высвобождает Т-клетки от анергии и стимулирует их цитотоксичность в отношении опухоли.
Данные показывают мышей hu-CD34 NSG как мощную платформу для сбора новых сведений о взаимодействиях человеческих иммунных клеток и опухолей, а также для тестирования иммуноонкологических и комбинированных терапевтических средств.
В целом, результаты, показанные в приведенных в настоящем документе примерах, демонстрируют приживление и рост опухолевых PDX у заявляемых гуманизированных мышей (например, мышей NSG), ответы привитых мышей на стандартные (SOC) методы лечения и опосредуемую иммунитетом регрессию опухоли после обработки ингибитором контрольной точки. Эти результаты подтверждают применение заявляемых гуманизированных мышей (например, мышей NSG) в качестве нового предклинического звена для иммуноонкологических терапевтических средств.
Все ссылки, в том числе патентная литература, цитируемые в настоящем документе, включены посредством ссылки.
Реферат
Изобретение относится к области биотехнологии, в частности к гуманизированной иммунодефицитной без ожирения с диабетом (NOD) мыши в качестве модели, а также к способу ее создания. Также раскрыто применение вышеуказанной мыши в способе прогнозирования ранжирования эффективности множества противоопухолевых средств для лечения опухоли, способе тестирования комбинированной терапии для лечения опухоли с применением двух или более кандидатных средств, способе определения эффективности режима дозирования для лечения опухоли с использованием средства, а также в способе определения безопасности режима дозирования для лечения опухоли с использованием средства. Изобретение позволяет эффективно изучать специфические для человека инфекции и методы лечения, что, таким образом, обеспечивает клинически значимые in vivo исследования человеческих клеток, тканей и иммунных систем без риска для больных. 6 н. и 13 з.п. ф-лы, 16 ил., 2 табл., 9 пр.

Комментарии