Антитела против il-6, композиции, способы и применение - RU2318829C2
Код документа: RU2318829C2
Чертежи













Описание
Предшествующий уровень техники
Область, к которой относится изобретение
Настоящее изобретение относится к антителам, включая их определенные части или варианты, специфичные по меньшей мере к одному белку интерлейкину-6 (IL-6, также называемому интерфероном β2) или к его фрагментам, а также к кислотам, кодирующим указанные антитела против IL-6, к комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам и к способам их получения и использования, включая терапевтические композиции, их введение и устройства для их введения.
Описание прототипов
Интерлейкин-6 (IL-6) представляет собой провоспалительный цитокин, который продуцируется многими клетками различных типов. Основными источниками IL-6 in vivo являются стимулированные моноциты, фибробласты и эндотелиальные клетки. Другие клетки, такие как макрофаги, Т- и В-лимфоциты, гранулоциты, кератиноциты, тучные клетки, остеобласты, хондроциты, глиальные клетки и клетки гладких мышц также продуцируют IL-6 после стимуляции (Kishimoto T., Blood 74:1-10 (1989) и Kurihara N. et al., J. Immunology 144:4226-4230 (1990)). Некоторые опухолевые клетки также продуцируют IL-6 (Smith P.C. et al., Cytokine and Growth Factor Reviews 12:33-40 (2001)), и недавно было показано, что IL-6 является прогностическим фактором, указывающим на прогрессирование рака предстательной железы (Nakashima J. et al. Clinical Cancer Research 6:2702-2706 (2000)). Продуцирование IL-6 может регулироваться самим IL-6 и зависит от типа клеток, причем IL-6 может стимулировать или ингибировать свой собственный синтез.
IL-6 может связываться с рецептором IL-6, экспрессируемым на активируемых митогеном В-клетках, Т-клетках, периферических моноцитах и некоторых опухолях (Ishimi Y. et al., Immunology 145:3297-3303 (1990)). Рецептор IL-6 имеет по меньшей мере две различные формы и состоит из альфа-цепи, называемой gp80, которая ответственна за связывание с IL-6, и из бета-цепи, называемой gp130, которая необходима для передачи сигнала (Adebanjo O. et al., Cell Biology 142:1347-1356 (1998) и Poli V. et al., EMBO 13:1189-1196 (1994)). Все цитокины семейства, которое включает в себя IL-6, LIF, онкостатин М, IL-11, CNTF и СТ-1, имеют рецепторы, содержащие субъединицу gp130. Кроме того, все члены семейства, к которому принадлежит цитокин IL-6, могут индуцировать экспрессию белков острой фазы в печени (Bellido T. et al., J. Clin. Investigation 97:431-437 (1996)).87908790.
Известны по меньшей мере две главные биологические функции IL-6: опосредование белков острой фазы и действие в качестве фактора дифференцировки и активации (Avvisti G. et al., Baillieres Clinical Hematology 8:815-829 (1995) и Poli V. et al., EMBO 13:1189-1196 (1994)). Известно, что белки острой фазы регулируют иммунные ответы, опосредуют воспалительные процессы и играют определенную роль в ремоделировании ткани. IL-6, в качестве фактора дифференцировки и активации, индуцирует дифференцировку В-клеток и секрецию антитела, индуцирует дифференцировку Т-клеток в цитотоксические Т-клетки, активирует факторы передачи клеточных сигналов и стимулирует гемопоэз (Ishimi Y. et al., J. Immunology 145:3297-3303 (1990)). Очевидно, что IL-6 участвует во многих важных функциях организма и в протекающих в нем процессах. В результате этого физиологические процессы, включая метаболизм в кости, опухолевую трансформацию и иммунные и воспалительные ответы, могут усиливаться, подавляться или предотвращаться путем модификации биологической активности IL-6 in vivo под действием антитела (Adebanjo O. et al., J. Cell Biology 142:1347-1356 (1998)).
Недавно проведенные исследования показали, что Mab против IL-6 может ингибировать in vivo рост опухолей предстательной железы (Smith P.C. & Keller E.T. The Prostate in press & Okatomo M. et al., Cancer Research 57:141-146 (1997) и карциномы почек (Weissglas M. et al., The Journal of Urology 153:554-557 (1995)). Помимо прямого влияния на рост опухоли, блокирование продуцирования IL-6 может быть также чувствительным к химическому воздействию и усиливать цитотоксическое действие (Smith P.C. et al. Cytokine and Growth Factor Reviews 12:33-40 (2001)). В целом, в литературе показано, что блокирование активности IL-6 может ингибировать деградацию кости, рост опухоли и кахексию при раке.
Пассивная иммунотерапия с использованием нечеловеческих поликлональных антител (например, антисыворотки) или моноклональных антитела (Mab) и их фрагментов (например, продуктов их протеолитического расщепления) является потенциальным терапевтическим средством, которое было разработано как средство для лечения различных заболеваний. Однако известно, что антитела, состоящие из фрагментов нечеловеческих антител, вырабатывают иммунный ответ при их введении человеку. Этот иммунный ответ часто не позволяет проводить повторное введение антитела в целях терапии и может приводить к опосредованному иммунным комплексом выведению этих антител из кровотока и тем самым к снижению терапевтического эффекта у пациентов. Примерами состояний, которые могут возникать в результате повторного введения антител, состоящих из фрагментов нечеловеческих антител, являются сывороточная болезнь и анафилаксия.
В попытке решить эти и другие проблемы было разработано несколько способов, включая получение химерных антител и "гуманизированных" антител для снижения иммуногенности антител/их фрагментов. Эти способы позволяют продуцировать антитела, имеющие пониженную иммуногенность. Указанные антитела в основном происходят от человеческих антител, и лишь их гипервариабельные области (определяющие комплементарность области, CDR) и некоторые каркасные остатки, которые влияют на конформацию CDR, не происходят от человеческих антител. Поэтому для иммунотерапии особенно подходящими являются новые человеческие или гуманизированные моноклональные антитела, используемые отдельно или в комбинации с уже существующими молекулами.
В соответствии с этим необходимо получить высокоаффинные, нейтрализующие химерные или человеческие антитела против IL-6 или их фрагментов, которые помогли бы решить многие из указанных проблем, а также необходимо получить улучшенные варианты известных антител или их фрагментов для их использования в целях предупреждения, лечения, ослабления или диагностики состояний, ассоциированных с IL-6.
Мышиные моноклональные антитела против IL-6, продуцируемые гибридомной клеточной линией, являются известными и описаны, например, в патенте США № 5618700. В патенте США № 5856135 описаны реконструированные человеческие антитела против человеческого IL-6, происходящие от мышиного моноклонального антитела SК2, в котором гипервариабельные области (CDR) из вариабельной области мышиного антитела SК2 были перенесены в вариабельную область человеческого антитела и присоединены к константной области человеческого антитела.
Нейтрализующие моноклональные антитела против IL-6 могут быть подразделены на две группы по их способности к распознаванию двух различных эпитопов на молекуле IL-6, называемых Сайтом I и Сайтом II. Сайт I представляет собой конформационный эпитоп, обозначенный gp130 и состоящий из амино-концевых и карбокси-концевых частей молекулы IL-6. Сайт II, обозначенный SIL6R, включает аминокислоты, играющие важную роль в данной активности (Brakenhoff et al., J. Immunol. (1990)(145:561)).
Мышиное моноклональное антитело против IL-6, называемое CLB-8, которое обладает высокой аффинностью и которое связывается с эпитопом gp130, т.е., сайтом I, является известным (Brakenhoff et al., см.выше). Однако, как описано выше, это мышиное антитело является в высокой степени иммуногенным для человека, а поэтому оно имеет ограниченное терапевтическое применение. Поэтому необходимость в получении антител против IL-6, которые обладали бы высокой аффинностью и желательным фармацевтическим профилем, остается актуальной.
Краткое описание изобретения
Настоящее изобретение относится к выделенным химерным гуманизированным и/или CDR-привитым антителам против IL-6, имеющим по меньшей мере одну антигенсвязывающую область, происходящую от высокоаффинного анти-IL-6-антитела CLB-8; а также к композициям анти-IL-6-антител; к кодирующим или комплементарным нуклеиновым кислотам; к векторам; к клеткам-хозяевам; к композициям; к лекарственным препаратам; к устройствам; к трансгенным животным; к трансгенным растениям; и к описанным здесь и воспроизводимым способам их получения и использования в комбинации с уже известным уровнем техники. Антитело согласно изобретению специфически и с высокой степенью аффинности нейтрализует человеческий IL-6.
Настоящее изобретение относится по меньшей мере к одному выделенному химерному гуманизированному или CDR-привитому анти-IL-6-антителу CLB-8 ("антителу cCLB-8"), описанному в настоящей заявке. Антитело cCLB-8 согласно изобретению включает любую белковую или пептидную молекулу, которая содержит по меньшей мере одну гипервариабельную область (CDR) тяжелой или легкой цепи или его лигандсвязывающую часть, происходящие от мышиного моноклонального антитела CLB-8, в комбинации с константной областью тяжелой или легкой цепи, с каркасной областью или с любой ее частью, которые могут быть включены в антитело согласно изобретению. В одном из вариантов настоящее изобретение относится к химерному антителу против IL-6, содержащему две легких и две тяжелых цепи, каждая из которых содержит по меньшей мере часть человеческой константной области и по меньшей мере часть вариабельной области (v), происходящей от мышиного моноклонального антитела cCLB-8, специфичного к человеческому IL-6, где указанное антитело связывается с высокой степенью аффинности с ингибирующим и/или нейтрализующим эпитопом человеческого IL-6, например такое как антитело cCLB-8. Настоящее изобретение также относится к фрагментам или к производному такого антитела, например к одному или нескольким частям цепи антитела, таким как константные, связывающие, дивергирующие или вариабельные области тяжелой цепи, или константные, связывающие или вариабельные области легкой цепи.
В одном из аспектов настоящее изобретение относится к выделенным молекулам нуклеиновой кислоты, содержащим полинуклеотид или комплементарный ему полинуклеотид, или гибридизующийся с ним полинуклеотид, кодирующий вышеупомянутые специфические антитела против IL-6, содержащие по меньшей мере одну конкретную последовательность, домен, часть или вариант. Настоящее изобретение также относится к рекомбинантным векторам, содержащим указанные молекулы нуклеиновой кислоты, кодирующие анти-IL-6-антитело, к клеткам-хозяевам, содержащим такие нуклеиновые кислоты и/или рекомбинантные векторы, а также к способам получения и/или использования указанных антителокодирующих нуклеиновых кислот, векторов и/или клеток-хозяев.
По крайней мере, одно антитело согласно изобретению связывается по меньшей мере с одним конкретным эпитопом, специфичным по меньшей мере к одному белку IL-6 или к его субъединице, фрагменту, части или любой их комбинации. По крайней мере, один эпитоп может содержать по меньшей мере одну антителосвязывающую область, которая включает по меньшей мере одну часть указанного белка, где указанный эпитоп, предпочтительно, состоит по меньшей мере из 1-5 аминокислот по меньшей мере одной его части, такой как, но не ограничивающейся ими, по меньшей мере один функциональный, внеклеточный, растворимый, гидрофильный, внешний или цитоплазматический домен указанного белка или любая его часть.
По крайней мере, одно указанное антитело может содержать по меньшей мере одну специфическую часть по меньшей мере одной гипервариабельной области (CDR)(например, CDR1, CDR2 или CDR3 вариабельной области тяжелой или легкой цепи), происходящей от мышиного моноклонального антитела CLB-8, и/или одной константной или вариабельной каркасной области или любой ее части. По крайней мере, одна аминокислотная последовательность антитела может кроме того, но необязательно, содержать по меньшей мере одну специфическую замену, инсерцию или делецию, описанные в настоящей заявке или известные специалистам.
Предпочтительными антителами согласно изобретению являются химерные, гуманизированные и/или CDR-привитые антитела, которые конкурентно ингибируют in vivo связывание человеческого IL-6 с мышиным анти-IL-6-антителом CLB-8, химерным анти-IL-6-антителом CLB-8 или антителом, обладающим, в основном, аналогичными связывающими свойствами, а также с фрагментами и областями.
Предпочтительными антителами согласно изобретению являются антитела, которые связываются с эпитопами, распознаваемыми CLB-8 и cCLB-8 и включенными в эпитоп gp130 Сайта 1. Описание предпочтительных методов определения специфичности моноклональных антител и аффинности посредством конкурентного ингибирования можно найти в работе Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1988), которая вводится в настоящее изобретение посредством ссылки.
Кроме того, настоящее изобретение относится по меньшей мере к одному анти-IL-6 анти-идиотипическому антителу, связанному по меньшей мере с одним анти-IL-6-антителом cCLB-8 согласно изобретению. Такое анти-идиотипическое антитело включает любую белок- или пептидсодержащую молекулу, которая содержит по меньшей мере часть иммуноглобулиновой молекулы, такой как, но не ограничивающейся ими, по меньшей мере одна гипервариабельная область (CDR) тяжелой или легкой цепи или ее лиганд-связывающая часть, вариабельная область тяжелой цепи или легкой цепи, константная область тяжелой цепи или легкой цепи, каркасная область или любая их часть, которые могут быть введены в анти-идиотипическое антитело против антитела согласно изобретению. Анти-идиотипическое антитело согласно изобретению может присутствовать у любого млекопитающего, либо оно может происходить от любого млекопитающего, такого как, но не ограничивающегося ими, человек, мышь, кролик, грызун, примат и т.п.
В одном из своих аспектов настоящее изобретение относится к выделенным молекулам нуклеиновой кислоты, содержащим полинуклеотид, комплементарный полинуклеотид или гибридизующийся с ним полинуклеотид, кодирующий по меньшей мере одно анти-идиотипическое антитело против IL-6, содержащее по меньшей мере одну специфическую последовательность, ее домен, часть или вариант. Настоящее изобретение также относится к рекомбинантным векторам, содержащим молекулы нуклеиновой кислоты, кодирующие антиидиотипическое антитело против IL-6, к клеткам-хозяевам, содержащим указанные нуклеиновые кислоты, и/или к рекомбинантным векторам, а также к способам получения и/или использования таких нуклеиновых кислот, кодирующих указанное антиидиотипическое антитело, к векторам и/или к клеткам-хозяевам.
Настоящее изобретение также относится по меньшей мере к одному способу экспрессии по меньшей мере одного вышеупомянутого анти-IL-6-антитела или анти-IL-6 антиидиотипического антитела в клетке-хозяине, предусматривающему культивирование описанной здесь клетки-хозяина в условиях, при которых по меньшей мере одно анти-IL-6-антитело экспрессируется в детектируемых и/или выделяемых количествах.
Настоящее изобретение также относится по меньшей мере к одной композиции, содержащей (а) выделенную нуклеиновую кислоту, кодирующую анти-IL-6-антитело cCLB-8 и/или описанное здесь антитело; и (b) подходящий носитель или разбавитель. Носитель или разбавитель может быть, но необязательно, фармацевтически приемлемым как и известные носители или разбавители. Кроме того, указанная композиция может содержать, но необязательно, по меньшей мере одно дополнительное соединение, белок или композицию.
Кроме того, настоящее изобретение относится по меньшей мере к способу получения по меньшей мере одного анти-IL-6-антитела cCLB-8 или к композиции, содержащей это антитело, для его введения в терапевтически эффективном количестве в целях облегчения или лечения по меньшей мере одного ассоциированного с IL-6 состояния в клетке, в органе, у животного или пациента, до и/или после возникновения данного состояния или при уже имеющемся состоянии, известном специалистам и/или описанным в настоящей заявке.
Настоящее изобретение также относится по меньшей мере к одной композиции, устройству и/или к способу доставки терапевтически или профилактически эффективного количества по меньшей мере одного анти-IL-6-антитела cCLB-8 согласно изобретению.
Кроме того, настоящее изобретение относится по меньшей мере к способу получения по меньшей мере одного анти-IL-6-антитела cCLB-8 или к композиции, содержащей это антитело, для диагностики по крайней мере одного ассоциированного с IL-6 состояния в клетке, в органе, у животного или пациента, до и/или после возникновения данного состояния или при уже имеющемся состоянии, известном специалистам и/или описанным в настоящей заявке.
Настоящее изобретение также относится по меньшей мере к одной композиции, устройству и/или способу диагностики с использованием по меньшей мере одного анти-IL-6-антитела согласно изобретению.
В одном из своих аспектов настоящее изобретение относится по меньшей мере к одному выделенному анти-IL-6-антителу cCLB-8 млекопитающего, содержащему по меньшей мере одну вариабельную область, включающую SEQ ID NO:7 или 8.
В другом своем аспекте настоящее изобретение относится по меньшей мере к одному выделенному анти-IL-6-антителу cCLB-8 млекопитающего, содержащему либо (i) все аминокислотные последовательности гипервариабельных областей (CDR) тяжелой цепи SEQ ID NO:1, 2 и 3, или (ii) все аминокислотные последовательности CDR легкой цепи SEQ ID NO:4, 5 и 6.
В другом своем аспекте настоящее изобретение относится по меньшей мере к одному выделенному анти-IL-6-антителу cCLB-8 млекопитающего, содержащему по меньшей мере одну CDR тяжелой или легкой цепи, имеющую аминокислотную последовательность по меньшей мере одной из SEQ ID NO:1, 2, 3, 4, 5 или 6.
В другом своем аспекте настоящее изобретение относится по меньшей мере к одному выделенному анти-IL-6-антителу cCLB-8 млекопитающего, содержащему по меньшей мере одну человеческую CDR, где указанное антитело специфически связывается по меньшей мере с одним эпитопом, включающим по меньшей мере 1-3 аминокислоты человеческого IL-6.
Кроме того, по меньшей мере одно антитело может, но необязательно, связываться с IL-6 с аффинностью (Кd), составляющей по меньшей мере 10-9 М, а предпочтительно по меньшей мере 10-10 М, и/или в значительной степени нейтрализовать по меньшей мере одну активность по меньшей мере одного белка IL-6. В предпочтительном варианте осуществления изобретения указанное антитело связывается с IL-6 с аффинностью (Кd), составляющей по меньшей мере 1×10-11 М, а предпочтительно, 5×10-10 М, и нейтрализует человеческий IL-6. Предпочтительно, чтобы указанное антитело не связывалось с другими членами суперсемейства IL-6 и блокировало передачу транс-сигнала GР130.
Настоящее изобретение также относится к выделенной нуклеиновой кислоте, кодирующей по меньшей мере одно выделенное анти-IL-6-антитело cCLB-8 млекопитающего; к выделенному нуклеиновокислотному вектору, содержащему выделенную нуклеиновую кислоту, и/или к прокариотической или эукариотической клетке-хозяину, содержащей указанную выделенную нуклеиновую кислоту. Указанной клеткой-хозяином может быть, но необязательно, по меньшей мере одна клетка, выбранная из клеток COS-1, COS-7, НЕК293, ВНК21, СНО, BSK-1, Нер G2, 653, SР2/0, 293, HeLa, клеток миеломы или лимфомы или любых дериватизированных, иммортализованных или трансформированных клеток. Настоящее изобретение также относится к способу продуцирования по меньшей мере одного анти-IL-6-антитела cCLB-8, предусматривающему трансляцию антителокодирующей нуклеиновой кислоты в условиях in vitro, in vivo или in situ, так чтобы указанное анти-IL-6-антитело экспрессировалось в детектируемых или выделяемых количествах.
Настоящее изобретение также относится к композиции, содержащей по меньшей мере одно выделенное химерное анти-IL-6-антитело cCLB-8 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. Кроме того, указанная композиция может, но необязательно, содержать эффективное количество по меньшей мере одного соединения или белка, выбранного из группы, состоящей из детектируемой метки или репортера, антагониста TNF, противоревматического средства, миорелаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (НСПВС), аналгетика, анестезирующего средства, седативного средства, местного анестезирующего средства, нейромышечного блокатора, противомикробного средства, средства против псориаза, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего средства, иммуноглобулина, иммунодепрессанта, гормона роста, гормонзаместительного лекарственного средства, радиофармацевтического препарата, антидепрессанта, антипсихотического средства, стимулятора, противоастматического средства, бета-агониста, стероида для ингаляции, эпинефрина или аналога цитотоксического или другого противоракового средства, антиметаболита, такого как метотрексат, антипролиферирующего средства, цитокина или антагониста цитокина.
Настоящее изобретение также относится к антиидиотипическому антителу или к его фрагменту, которые специфически связываются по меньшей мере с одним выделенным анти-IL-6-антителом cCLB-8 согласно изобретению.
Настоящее изобретение также относится к способу диагностики или лечения IL-6-ассоциированного состояния в клетке, в органе или у животного, где указанный способ предусматривает контактирование с указанной клеткой, тканью, органом или животным, либо введение в них композиции, содержащей эффективное количество по меньшей мере одного выделенного анти-IL-6-антитела cCLB-8 согласно изобретению. Кроме того, этот способ может, но необязательно, предусматривать использование эффективного количества 0,001-50 мг на килограмм клеток, ткани, органов или животного. Кроме того, указанный способ может, но необязательно, предусматривать контактирование или введение, осуществляемое по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, внутрикапсулярного, внутрихрящевого, внутриполостного, внутрибрюшного, внутриможжечкового, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, внутрипочечного, внутрисетчаточного, внутрипозвоночного, интрасиновиального, внутригрудного, внутриматочного, внутривезикулярного, болюсного, вагинального, ректального, трансбуккального, подъязычного, интраназального или чрескожного способов введения. Кроме того, этот способ может, но необязательно, предусматривать введение до, во время или после контактирования антитела по меньшей мере с одной композицией, или введения антитела по меньшей мере в одну композицию, содержащую эффективное количество по меньшей мере одного соединения или белка, выбранного из группы, состоящей из детектируемой метки или репортера, антагониста TNF, противоревматического средства, миорелаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (НСПВС), аналгетика, анестезирующего средства, седативного средства, местного анестезирующего средства, нейромышечного блокатора, противомикробного средства, средства против псориаза, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего средства, иммуноглобулина, иммунодепрессанта, гормона роста, гормонзаместительного лекарственного средства, радиофармацевтического препарата, антидепрессанта, антипсихотического средства, стимулятора, противоастматического средства, бета-агониста, стероида для ингаляции, эпинефрина или аналога цитотоксического или другого противоракового средства, антиметаболита, такого как метотрексат, антипролиферирующего средства, цитокина или антагониста цитокина.
Настоящее изобретение также относится к медицинскому устройству, содержащему по меньшей мере одно выделенное анти-IL-6-антитело согласно изобретению, происходящее от млекопитающего, где указанное устройство является подходящим для контактирования или введения по меньшей мере одного анти-IL-6-антитела по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, внутрикапсулярного, внутрихрящевого, внутриполостного, внутрибрюшного, внутриможжечкового, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, внутрипочечного, внутрисетчаточного, внутрипозвоночного, интрасиновиального, внутригрудного, внутриматочного, внутривезикулярного, болюсного, вагинального, ректального, трансбуккального, подъязычного, интраназального или чрескожного введения.
Настоящее изобретение также относится к промышленному изделию, предназначенному для введения человеку в фармацевтических или диагностических целях и содержащему упаковочный материал и контейнер, включающий раствор или лиофилизованную форму по меньшей мере одного выделенного анти-IL-6-антитела согласно изобретению, происходящего от млекопитающего. Такое промышленное изделие может, но необязательно, содержаться в контейнере в качестве компонента устройства или системы для доставки парентеральным, подкожным, внутримышечным, внутривенным, внутрисуставным, внутрибронхиальным, интраабдоминальным, внутрикапсулярным, внутрихрящевым, внутриполостным, внутрибрюшным, внутриможжечковым, интрацеребровентрикулярным, внутрикишечным, интрацервикальным, внутрижелудочным, внутрипеченочным, интрамиокардиальным, внутрикостным, внутритазовым, интраперикардиальным, внутрибрюшинным, интраплевральным, интрапростатическым, внутрилегочным, интраректальным, внутрипочечным, внутрисетчаточным, внутрипозвоночным, интрасиновиальным, внутригрудным, внутриматочным, внутривезикулярным, болюсным, вагинальным, ректальным, трансбуккальным, подъязычным, интраназальным или чрескожным способом введения.
Настоящее изобретение также относится к способу получения по меньшей мере одного выделенного анти-IL-6-антитела согласно изобретению, предусматривающему продуцирование клетки-хозяина, трансгенного животного, трансгенного растения или клетки растения, способных экспрессировать выделяемое количество указанного антитела. Кроме того, настоящее изобретение относится по меньшей мере к одному анти-IL-6-антителу, продуцированному вышеуказанным способом.
Кроме того, настоящее изобретение относится к любому описанному здесь изобретению.
Описание чертежей
Фигура 1: График, иллюстрирующий связывание cCLB-8 с человеческим рекомбинантным IL-6.
Фигура 2: График, иллюстрирующий ингибирование IL-6-опосредованной секреции мышиного IgM из клеток SКW6.4 под действием cCLB-8.
Фигура 3: График, иллюстрирующий ингибирование IL-6-опосредованного продуцирования МСР-1 под действием cCLB-8.
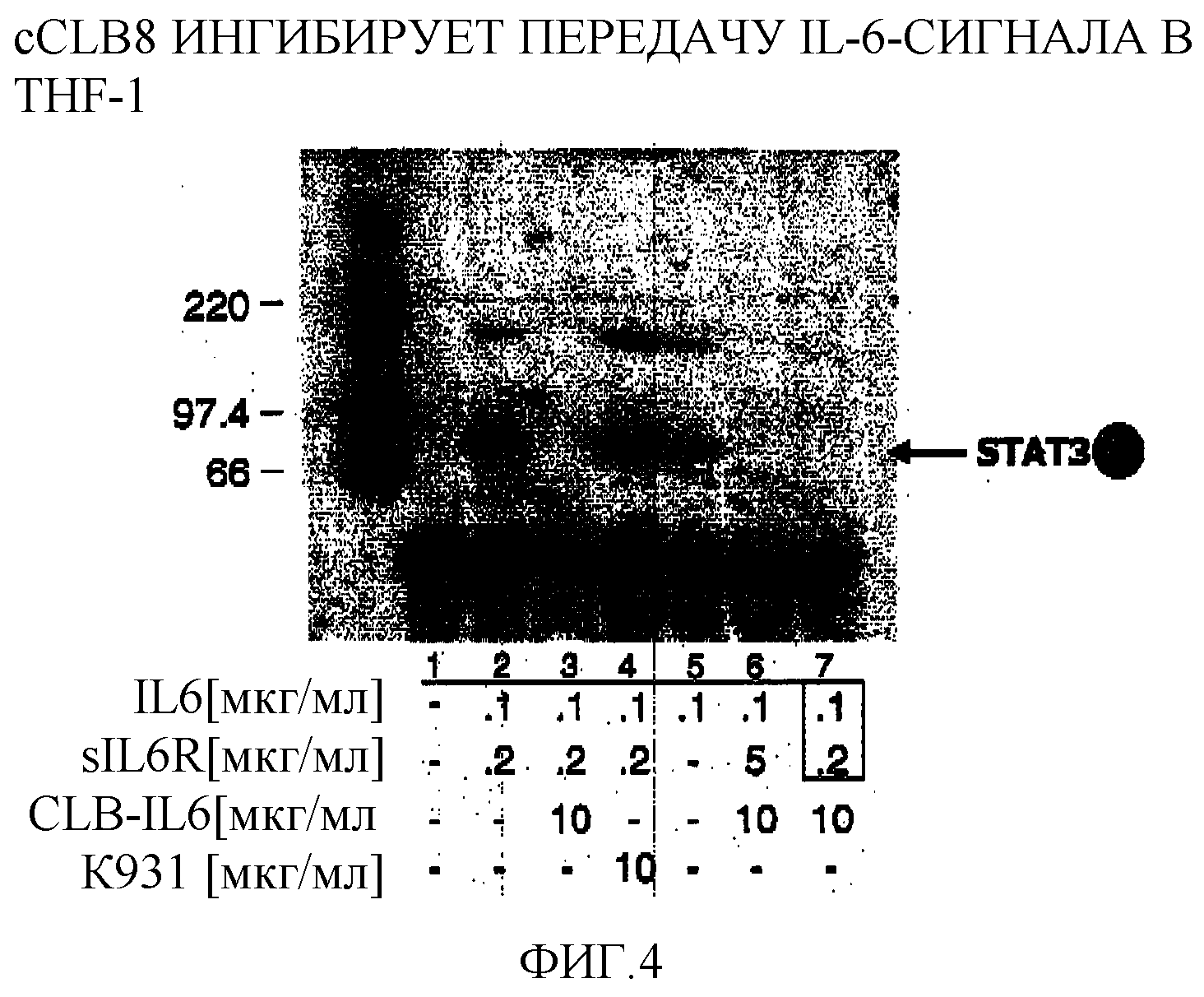
Фигура 4: Фотография Вестерн-блота, иллюстрирующая cCLB-8-ингибирование передачи сигнала IL-6 в человеческих моноцитах лейкоза ТНР-1.
Фигура 5: График, иллюстрирующий cCLB8-ингибирование IL-6-индуцированного продуцирования сывороточного амилоида А из клеток НерG2.
Фигура 6: График, иллюстрирующий способность cCLB-8 нейтрализовать rhIL-6-индуцированную пролиферацию клеток.
Фигура 7: График, иллюстрирующий относительное снижение потери массы тела организмом-хозяином, то есть мышью, несущей человеческую опухоль и обработанной античеловеческим и антимышиным антителами против IL-6.
Фигура 8А-G: График, иллюстрирующий исследуемые профили ингибирования сывороточных уровней для 7 антиидиотипических антител.
Фигура 9: График, иллюстрирующий ингибирование связывания cCLB-8 с человеческим IL-6 под действием антиидиотипических (анти-Id) Mab.
Фигура 10: График, иллюстрирующий ингибирование связывания анти-Id антитела с антителом cCLB-8, предварительно связанным с человеческим IL-6.
Подробное описание изобретения
Настоящее изобретение относится к выделенным рекомбинантным и/или синтетическим, химерным, гуманизированным или CDR-привитым анти-IL-6-антителам, имеющим по меньшей мере одну антигенсвязывающую область, происходящую от антитела CLB-8 и антиидиотипических антител против анти-IL-6-антител, а также к композициям и к кодирующим нуклеиновым кислотам, содержащим по меньшей мере один полинуклеотид, кодирующий такое анти-IL-6-антитело или антиидиотипическое антитело. Настоящее изобретение также включает, но не ограничивается ими, способы получения и использования нуклеиновых кислот, антител и антиидиотипических антител; а также диагностические и терапевтические композиции, способы и устройства.
Используемый здесь термин "антитело CLB-8 против интерлейкина-6", "анти-IL-6-антитело CLB-8", "часть анти-IL-6-антитела CLB-8" или "фрагмент анти-IL-6-антитела CLB-8" и/или "вариант антитела анти-IL-6-антитела CLB-8" и т.п. означает любую белок- или пептидсодержащую молекулу, которая включает по меньшей мере часть молекулы иммуноглобулина, содержащую по меньшей мере одну гипервариабельную область (CDR) тяжелой или легкой цепи или ее лигандсвязывающую часть, происходящую от мышиного моноклонального антитела CLB-8 в комбинации с вариабельной областью тяжелой цепи или легкой цепи, с константной областью тяжелой цепи или легкой цепи, с каркасной областью или любой их частью, которые могут быть включены в антитело согласно изобретению. Такое антитело, кроме того, но необязательно, взаимодействует со специфическим лигандом, таким способом, но не ограничивающимся им, в результате которого указанное антитело модулирует, снижает, увеличивает, подавляет, стимулирует, уменьшает, ослабляет, блокирует, ингибирует, отменяет и/или предотвращает по меньшей мере одну активность или связывание IL-6, либо активность или связывание рецептора IL-6 in vitro, in situ и/или in vivo. В качестве неограничивающего примера могут служить подходящее анти-IL-6-антитело согласно изобретению или его определенная часть, или вариант, которые могут связываться с высокой степенью аффинности с ингибирующим и/или нейтрализующим эпитопом человеческого IL-6. Подходящее анти-IL-6-антитело, его определенная часть или вариант могут также, но необязательно, влиять по меньшей мере на одну активность или функцию IL-6, такие как, но не ограничивающиеся ими, синтез РНК, ДНК или белка, высвобождение IL-6, передача сигнала рецептором IL-6, расщепление мембранного IL-6, активность IL-6, продуцирование и/или синтез IL-6.
Термин "антитело", кроме того, охватывает антитела, фрагменты их расщепления, определенные части и варианты, включая антитела-миметики или антитела, содержащие части антител, которые имитируют структуру и/или функцию антитела или его определенного фрагмента или определенной части, включая одноцепочечные антитела и их фрагменты, каждый из которых содержит по меньшей мере одну CDR, происходящую от моноклонального антитела CLB-8. Функциональными фрагментами являются антигенсвязывающие фрагменты, которые связываются с IL-6 млекопитающего. Так, например, фрагментами антител, способными связываться с IL-6 или с его частями, являются, но не ограничиваются ими, следующие фрагменты: Fab (например, образующийся в результате гидролиза папаином), Fab' (например, образующийся в результате гидролиза пепсином и частичного восстановления) и F(ab')2 (например, образующийся в результате гидролиза пепсином), facb (например, образующийся в результате гидролиза плазмином), pFc' (например, образующийся в результате гидролиза пепсином или плазмином), Fd (например, образующийся в результате гидролиза пепсином, частичного восстановления и реагрегации), Fv или scFv (например, полученные методами молекулярной биологии), которые входят в объем согласно изобретению (см. выше, например, Colligan, Immunology).
Такие фрагменты могут быть продуцированы методом ферментативного расщепления, методом синтеза или рекомбинантными методами, известными специалистам и/или описанными в настоящей заявке. Антитела могут быть также продуцированы в виде различных усеченных форм с использованием генов для антител, в которых один или несколько стоп-кодонов были введены в область, расположенную слева (по ходу транскрипции) от природного сайта терминации. Так, например, для встраивания ДНК-последовательностей, кодирующих СН1-домен и/или шарнирную область тяжелой цепи, был сконструирован комбинированный ген, кодирующий F(ab')2-фрагмент тяжелой цепи. Различные фрагменты антител могут быть связаны друг с другом стандартными химическими методами либо они могут быть получены в виде непрерывной белковой последовательности методами генной инженерии.
В соответствии с настоящим изобретением получают химерные или гуманизированные антитела, в которых CDR происходят от мышиного антитела CLB-8, способного связываться с человеческим IL-6 и по меньшей мере с его частью, а остальная часть антитела происходит от одного или нескольких человеческих антител. Таким образом, человеческая часть антитела может включать каркасную область, СL,СН-домены (например, СН1, СН2, СН3), шарнирную область, области VL, VН, которые являются, в основном, неиммуногенными для человека. Используемые здесь термины "химерные" антитела или "гуманизированные" антитела или "CDR-привитые" антитела означают любую комбинацию вышеописанных мышиных CDR с одним или несколькими белками или пептидами, происходящими от человеческого антитела. Области указанного антитела, происходящие от человеческих антител необязательно должны быть на 100% идентичны человеческим антителам. В предпочтительном варианте осуществления изобретения желательно, чтобы многие аминокислотные остатки человеческих антител были, по возможности, сохранены для снижения иммуногенности, но при этом человеческие остатки могут быть, если это необходимо, модифицированы так, чтобы был сохранен антигенсвязывающий сайт, образованный CDR, и в то же самое время была максимизирована "гуманизация" данного антитела. Такие изменения или модификации, необязательно и предпочтительно, сохраняют или снижают иммуногенность данного антитела у человека или у животных других видов, имеющих антитела, родственные немодифицированным антителам. Следует отметить, что гуманизированное антитело может быть продуцировано животным, не относящимся к человеку, либо прокариотическими или эукариотическими клетками, способными экспрессировать функционально перегруппированные гены человеческого иммуноглобулина (например, тяжелой цепи и/или легкой цепи). Кроме того, если указанное антитело является одноцепочечным антителом, то оно может содержать линкерный пептид, не обнаруживаемый в природных человеческих антителах. Так, например, Fv может содержать линкерный пептид, например, имеющий примерно от 2 до 8 глициновых остатков или других аминокислотных остатков, которые соединяют вариабельную область тяжелой цепи и вариабельную область легкой цепи. Предусматривается, что такие линкерные пептиды имеют человеческое происхождение.
Могут быть также использованы биспецифические, гетероспецифические, гетероконъюгированные или аналогичные им антитела, которые представляют собой моноклональные гуманизированные антитела, специфически связывающиеся по меньшей мере с двумя различными антигенами. В данном случае одной из специфичностей связывания является специфичность связывания по меньшей мере с одним белком IL-6, а другой специфичностью является специфичность связывания с любым другим антигеном. Методы получения биспецифических антител известны специалистам. Традиционный метод рекомбинантного продуцирования биспецифических антител основан на коэкспрессии двух пар "тяжелая цепь-легкая цепь" иммуноглобулина, где указанные две тяжелые цепи обладают различными специфичностями (Milstein & Cuello, Nature 305:537 (1983)). В результате случайной реаранжировки тяжелых и легких цепей иммуноглобулина эти гибридомы (квадромы) продуцируют смесь из 10 возможных различных молекул антитела, из которых только одна имеет правильную биспецифическую структуру. Очистка такой "правильной" молекулы, которую обычно осуществляют путем проведения постадийной аффинной хроматографии, является достаточно трудоемким процессом, и выходы продукта являются низкими. Аналогичные процедуры описаны, например, в WO 93/08829, в патентах США №№ 6210668, 6193967, 6132992, 6106833, 6060285, 6037453, 6010902, 5989530, 5959084, 5959083, 5932448, 5833985, 5821333, 5807706, 5643759, 5601819, 5582996, 5496549, 4676980, в WO 91/00360, WO 92/00373, EP 03089, Traunecker et al., EMBO J. 10:3655 (1991), Suresh et al., Methods in Enzymology 121:210 (1986), каждый из которых вводится в настоящее описание посредством ссылки.
Анти-IL-6-антитела cCLB-8, используемые в способах и композициях согласно изобретению, характеризуются высокой аффинностью связывания с IL-6 и, необязательно, но предпочтительно, низкой токсичностью. В частности, в настоящем изобретении используется антитело, его определенный фрагмент или вариант, в котором отдельные компоненты, такие как вариабельная область, константная область и каркасные области, взятые отдельно или в комбинации друг с другом, необязательно, но предпочтительно, имеют низкую иммуногенность. Антитела, которые могут быть использованы в настоящем изобретении характеризуются, но необязательно, своей способностью оказывать терапевтическое действие на пациентов в течение продолжительного периода времени со значительным ослаблением симптомов заболевания и низкой и/или приемлемой токсичностью. Низкая или приемлемая иммуногенность и/или высокая аффинность, а также другие подходящие свойства могут вносить свой вклад в достигаемые терапевтические эффекты. Термин "низкая иммуногенность" определяется здесь как вырабатывание значимого НАНА-, НАСА или НАМА-ответов примерно у менее, чем 75% или предпочтительно, примерно менее чем 50% пациентов; и/или как продуцирование низких титров у подвергаемых лечению пациентов (примерно менее чем 300, предпочтительно, примерно менее чем 100, как было измерено с помощью ферментного иммуноанализа с двойным антигеном) (Elliott et al., Lancet 344:1125-1127 (1994), эта работа во всей своей полноте вводится в настоящее описание посредством ссылки).
Применение
Выделенные нуклеиновые кислоты согласно изобретению могут быть использованы для продуцирования по меньшей мере одного анти-IL-6-антитела или его специфического варианта, которые могут быть использованы для оценки их эффекта в клетке, ткани, органе или у животного (включая млекопитающих и человека) в целях диагностики, мониторинга, ослабления, лечения, смягчения, предупреждения или уменьшения симптомов по меньшей мере одного состояния, ассоциированного с IL-6 и выбранного из группы, состоящей из, но не ограничивающейся ими, иммунного расстройства или заболевания, сердечно-сосудистого расстройства или заболевания, инфекционного, злокачественного и/или неврологического расстройства или заболевания, аллергического расстройства или заболевания, кожных синдромов или болезней, гемологической реакции или болезни и/или легочного расстройства или заболевания, либо другого известного или специфического состояния, ассоциированного с IL-6.
Такой способ может предусматривать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно анти-IL-6-антитело, в клетку, ткань, орган, животному или пациенту, нуждающемуся в таком ослаблении, лечении, облегчении, предупреждении или снижении симптомов, эффектов или механизмов. Указанное эффективное количество может составлять примерно 0,001-500 мг/кг при введении разовой дозы (например, ударной дозы), многократных доз, или непрерывном введении, либо оно может достигать концентрации в сыворотке в пределах 0,01-5000 мкг/мл при введении разовой дозы или многократных доз, или при непрерывном введении, либо эта концентрация может иметь значения в любом эффективном интервале или любое значение в этом интервале, как было осуществлено и определено известными методами, описанными в настоящей заявке или в литературе.
Ссылки
Все цитируемые здесь публикации или патенты во всей своей полноте вводятся в настоящее описание посредством ссылки, если они отражают состояние предшествующего уровня техники на момент создания согласно изобретению и/или если в них имеется информация, обеспечивающая раскрытие и воспроизводимость согласно изобретению. Эти публикации относятся к любым научным или патентным публикациям или к любой другой информации, доступной в любом формате, включая все регистрируемые, электронные или печатные средства информации. Нижеследующие публикации во всей своей полноте вводятся в настоящее описание посредством ссылки: Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, NY (1987-2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor, NY (1989); Harlow and Lane, antibodies, a Laboratory Manual, Cold Spring Harbor, NY (1989); Colligan, et al., eds., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2001); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY, NY, (1997-2001).
Антитела согласно изобретению
В соответствии с настоящим изобретением, химерным анти-IL-6-антителом CLB-8 является антитело, в котором вариабельная область или CDR происходят от мышиного антитела CLB-8, способного связываться с человеческим IL-6 и ингибировать его функцию, а каркасная и константная области указанного антитела происходят от одного или нескольких человеческих антител. Вариабельная область или CDR, происходящие от мышиного антитела CLB-8, предпочтительно, примерно на 90%-100% идентичны вариабельной области или CDR мышиного антитела CLB-8, хотя в них могут быть внесены любые или все модификации, включая замены, инсерции и делеции, при условии, что указанное химерное антитело будет сохранять способность связываться с тканевым фактором и ингибировать этот фактор. Области химерного, гуманизированного или CDR-привитого антитела, происходящие от человеческих антител, необязательно должны быть на 100% идентичны человеческим антителам. В предпочтительном варианте осуществления изобретения желательно, чтобы многие аминокислотные остатки человеческих антител были по возможности сохранены для снижения иммуногенности, но при этом человеческие остатки, а в частности остатки каркасной области, если это необходимо, могут быть заменены, как описано ниже, в соответствии с настоящим изобретением. Такие модификации, описанные в настоящей заявке, являются необходимыми для сохранения антигенсвязывающего сайта, образованного CDR, и в то же время для максимизации "гуманизации" данного антитела.
Мышиное моноклональное антитело CLB-8 против человеческого IL-6, от которого могут происходить вариабельные области или CDR, известно специалистам (Brakenhoff et al., см.выше) и вводится в настоящее описание посредством ссылки, либо оно может быть получено хорошо известными методами продуцирования моноклональных антител (см., например, Harlow et al., eds., 1988, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratories Press, Cold Spring Harbor, New York). Очищенный человеческий IL-6, против которого могут быть продуцированы моноклональные антитела, также хорошо известен специалистам.
Каждый специалист может определить последовательности вариабельной области и/или CDR с использованием опубликованной научной литературы или баз данных для последовательностей, либо путем клонирования и секвенирования тяжелой и легкой цепей мышиного антитела в соответствии со стандартной методикой. В соответствии с настоящим изобретением, кДНК и аминокислотные последовательности тяжелой цепи (SEQ ID NO:3 и 4, соответственно) мышиного антитела CLB-8 показаны на фигуре 1. кДНК и выведенные аминокислотные последовательности легкой цепи мышиного CLB-8 показаны на фигуре 2.
Каждая из вариабельных областей тяжелой и легкой цепей содержит три CDR, которые объединены так, что они образуют антигенсвязывающий сайт. Эти три CDR окружены четырьмя каркасными областями (FR), которые играют главную роль в сохранении CDR. Последовательности CDR внутри последовательностей вариабельных областей тяжелой и легкой цепей могут быть идентифицированы путем компьютерного сопоставления выровненных первичных последовательностей, как описано Kabat et al. (1987), Sequences of Proteins of Immunological Interest, 4th ed., United States Department of Health and Human Services, U.S. Government Printing Office, Washington, D.C., или путем молекулярного моделирования вариабельных областей, например, с использованием программы ENCAD, описанной Levitt (1983) J.Mol.Biol. 168:595.
В предпочтительном варианте осуществления изобретения, CDR происходят от мышиного моноклонального антитела CLB-8. Предпочтительные CDR тяжелой цепи имеют следующие последовательности:
CDR1 SFAMS (SEQ ID NO:1)
CDR2 EISSGGSYTYYPDTVTG (SEQ ID NO:2)
CDR3 GLWGYYALDY (SEQ ID NO:3)
Предпочтительные CDR легкой цепи имеют следующие последовательности:
CDR1 SASSSVSYMY (SEQ ID NO:4)
CDR2 DTSNLAS (SEQ ID NO:5)
CDR3 QQWSGYPYT (SEQ ID NO:6)
Последовательности CDR мышиного антитела CLB-8 могут быть модифицированы путем введения инсерций, замен и делеций так, чтобы CDR-привитое антитело сохраняло способность связываться с человеческим тканевым фактором и ингибировать этот фактор. Каждый специалист может определить уровень сохранения этой активности путем осуществления функциональных анализов, описанных ниже. Например, CDR могут быть примерно на 50%-100% гомологичны CDR SEQ ID NO:1-6. В предпочтительном варианте осуществления изобретения, CDR могут быть примерно на 80%-100% гомологичны CDR SEQ ID NO:1-6. В более предпочтительном варианте осуществления изобретения, CDR могут быть примерно на 90%-100% гомологичны CDR SEQ ID NO:1-6. В наиболее предпочтительном варианте осуществления изобретения, CDR могут быть примерно на 100% гомологичны CDR SEQ ID NO:1-6.
Альтернативно, вся вариабельная область тяжелой цепи и вся вариабельная область легкой цепи мышиного антитела CLB-8, описанные в примере 2 (SEQ ID NO:7 и 8), могут быть объединены с человеческой константной и каркасной областями с получением химерного антитела cCLB-8 согласно изобретению.
Человеческие гены, которые кодируют константные (С) области химерных антител согласно изобретению, их фрагменты и области, могут быть получены из библиотеки клеток печени человеческого плода известными методами. Гены человеческой С-области могут быть получены из любых человеческих клеток, включая клетки, которые экспрессируют и продуцируют человеческие иммуноглобулины. Человеческая СН-область может происходить от человеческих Н-цепей антитела любого известного класса или изотипа, включая гамма, μ, α, δ, ε и их подтипы, такие как G1, G2, G3 или G4. Поскольку изотип Н-цепи ответственен за различные эффекторные функции антитела, то при выборе СН-области следует учитывать желательные эффекторные функции, такие как фиксация комплемента или активность в отношении антителозависимой клеточной цитотоксичности (ADCC). Предпочтительно, чтобы СН-область происходила от иммуноглобулина гамма-1 (IgG1).
Человеческая СL-область может происходить от человеческой L-цепи изотипа каппа или лямбда, а предпочтительно каппа-цепи.
Гены, кодирующие С-области человеческого иммуноглобулина, получают из человеческих клеток стандартными методами клонирования (Sambrook et al. (Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (1989) и Ausubel et al., eds., Current Protocols in Molecular Biology (1987-1993)). Гены человеческой С-области могут быть легко получены из известных клонов, содержащих гены, представляющие два класса L-цепи, пять классов Н-цепи и их подклассы. Фрагменты химерных антител, такие как F(ab')2 и Fab, могут быть получены путем конструирования гена химерной Н-цепи, который является соответствующим образом усеченным. Так, например, химерный ген, кодирующий часть Н-цепи F(ab')2-фрагмента, должен включать ДНК-последовательности, кодирующие СН1-домен и шарнирную область Н-цепи, за которыми следует кодон терминации трансляции, в результате чего получают усеченную молекулу.
В общих чертах, мышиные, человеческие или мышиные и химерные антитела, их фрагменты и области согласно изобретению получают путем клонирования ДНК-сегментов, кодирующих антигенсвязывающие области Н- и L-цепи TNF-специфического антитела, и последующим присоединением этих ДНК-сегментов к ДНК-сегментам, кодирующим СН- и СL-области, соответственно, в результате чего получают гены, кодирующие мышиные, человеческие или химерные иммуноглобулины.
Таким образом, в предпочтительном варианте осуществления изобретения получают гибридный химерный ген, который содержит первый ДНК-сегмент, кодирующий по меньшей мере антигенсвязывающую область, не происходящую от человека, такую как функционально перегруппированную V-область с соединяющим (J) сегментом, связанным со вторым ДНК-сегментом, кодирующим по меньшей мере часть человеческой С-области.
Последовательности вариабельных областей мышиного антитела CLB-8 могут быть модифицированы путем введения инсерций, замен и делеций так, чтобы химерное антитело сохраняло способность связываться с человеческим IL-6 и ингибировать его. Каждый специалист может определить уровень сохранения этой активности путем осуществления функциональных анализов, описанных ниже. Вариабельные области могут быть примерно на 50%-100% гомологичны вариабельным областям SEQ ID NO:7-8. В предпочтительном варианте осуществления изобретения, вариабельные области могут быть примерно на 80%-100% гомологичны вариабельным областям SEQ ID NO:7-8. В более предпочтительном варианте осуществления изобретения, вариабельные области могут быть примерно на 90%-100% гомологичны вариабельным областям SEQ ID NO:7-8. В наиболее предпочтительном варианте осуществления изобретения, вариабельные области могут быть примерно на 100% гомологичны CDR SEQ ID NO:1-6.
Для удобства в настоящем описании была принята схема нумерации по Кабату. Остатки обозначены строчными буквами или дефисом, если это необходимо для подтверждения соответствия данной последовательности стандартной последовательности, пронумерованной по Кабату.
В соответствии с настоящим изобретением, остатки могут быть сохранены в FR-области, которая является идиосинкразической для родительского антитела, например, CLB-8. Остатки, которые, как было показано, имеют важное значение для гуманизации других антител, могут быть также сохранены. Вышеуказанные рекомендации до некоторой степени необходимы для сохранения антигенсвязывающего сайта, образованного CDR, и одновременно для максимизации гуманизации антитела.
Аминокислотная последовательность репрезентативной вариабельной области тяжелой цепи, происходящей от мышиного моноклонального антитела CLB-8 и человеческого антитела, описана ниже в примере 2.
Аминокислотная последовательность репрезентативной химерной вариабельной области легкой цепи, происходящей от мышиного моноклонального антитела CLB-8 и человеческого антитела, описана ниже в примере 2.
В соответствии с настоящим изобретением было продемонстрировано, что химерное антитело, содержащее вариабельные области мышиного антитела CLB-8, является эффективным в качестве мышиного моноклонального антитела CLB-8 при его связывании с IL-6.
По крайней мере, одно анти-IL-6-антитело согласно изобретению может быть, но необязательно, продуцировано клеточной линией, смешанной клеточной линией, иммортализованной клеткой или клональной популяцией иммортализованных клеток, хорошо известных специалистам. См., например, публикации Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, NY (1987-2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor, NY (1989); Harlow and Lane, antibodies, a Laboratory Manual, Cold Spring Harbor, NY (1989); Colligan, et al., eds., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2001); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY, NY, (1997-2001), каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
В одном способе гибридому продуцируют путем слияния подходящей иммортализованной клеточной линии, например миеломной клеточной линии, такой как, но не ограничивающейся ими, Sр2/0, Sр2/0-АG14, NSO, NS1, NS2, AE-1, L5, >243, P3X63Ag8.653, Sp2 SA3, Sp2 MAI, Sp2 SS1, Sp2 SA5, U937, MLA 144, ACT IV, MOLT4, DA-1, JURKAT, WEHI, K-562, COS, RAJI, NIH 3T3, HL-60, MLA 144, NAMAIWA, NEURO 2A или т.п., или гетеромиелом, их гибридных продуктов, либо любой клетки или происходящей от нее гибридной клетки, либо любой другой подходящей клеточной линии, известной специалистам, см., например, www.atcc.org.www.lifetech.com, и т.п., с антителопродуцирующими клетками, такими как, но не ограничивающимися ими, выделенные или клонированные клетки селезенки, периферической крови, лимфы, миндалин или другие иммунные или В-клетки, либо с любыми другими клетками, экспрессирующими константные, вариабельные, каркасные области или CDR-последовательности тяжелой или легкой цепи, либо эндогенные, либо гетерологичные нуклеиновые кислоты, такие как рекомбинантные или эндогенные, вирусные или бактериальные, нуклеиновые кислоты нуклеиновые кислоты водорослей, прокариотических организмов, амфибий, насекомых, рептилий, рыб, млекопитающих, грызунов, лошадей, овец, коз, приматов и эукариотических организмов, геномные ДНК, кДНК, рДНК, митохондриальные ДНК или РНК, ДНК или РНК хролопластов, чРНК, мРНК, тРНК, одноцепочечные, двухцепочечные, трехцепочечные, гибридидизованные ДНК и т.п. любая их комбинация. См., например, публикации Ausubel, см.выше, и Colligan, Immunology, см.выше, глава 2, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Для экспрессии гетерологичной или эндогенной нуклеиновой кислоты, кодирующей антитело согласно изобретению, его специфический фрагмент или вариант, могут быть также использованы любые другие подходящие клетки-хозяева. Слитые клетки (гибридомы) или рекомбинантные клетки могут быть выделены с использованием селективных условий культивирования или другими подходящими известными методами и клонированы путем лимитирующего разведения или клеточного сортинга, либо другими известными методами. Клетки, продуцирующие антитела с нужной специфичностью, могут быть выбраны с помощью подходящего анализа (например, ELISA).
Могут быть использованы методы генного конструирования или гуманизации нечеловеческих или человеческих антител и эти методы хорошо известны специалистам. В общих чертах, гуманизированное или сконструированное антитело имеет один или несколько аминокислотных остатков, происходящих от источника, не являющегося человеком, например такого, как, но не ограничивающегося ими, мышь, крыса, кролик, примат, не являющийся человеком, или другое млекопитающее. Эти человеческие аминокислотные остатки часто называют "импортируемые" остатками, которые обычно происходят от "импортируемого" вариабельного, константного или другого домена известной человеческой последовательности. Известные последовательности человеческого Ig описаны, например, на интернетовских сайтах www.ncbi.nlm.nih.gov/entrez/query.fcgi; www.atcc.org/phage/hdb.html; www.sciquest.com/; www.abcam.com/; www.antibodyresource.com/onlinecomp.html; www.public.iastate.edu/˜pedro/research_tools.html; www.mgen.uni-heidelberg.de/SD/IT/IT.html; www.whfreeman.com/immunology/CH05/kuby05.htm; www.library.thinkquest.org/12429/Immune/Antibody.html; www.hhmi.org/grants/lectures/1996/vlab/; www.path.cam.ac.uk/˜mrc7/mikeimages.html; www.antibodyresource.com/; mcb.Harvard.edu/BioLinks/Immunology.html.www.immunologylink.com/; pathbox.wustl.edu/-hcenter/index.html; www.biotech.ufl.edu/˜hcl/; www.pebio.com/pa/340913/340913.html; www.nal.usda.gov/awic/pubs/antibody/; www.m.ehime-u.ac.jp/˜yasuhito/Elisa.html; www.biodesign.com/table.asp; www.icnet.uk/axp/facs/davies/links.html; www.biotech.ufl.edu/˜ fccl/protocol.html; www.isac-net.org/sites_geo.html; aximt1.imt.uni-marburg.de/˜rek/AEPStart.html; baserv.uci.kumn.nl/˜jraats/links 1.html; www.recab.uni-hd.de/immuno.bme.nwu.edu/; www.mrc-cpe.cam.ac.uk/imt-doc/public/INTRO.html; www.ibt.unam.mx/vir/V_mice.html; imgt.cnusc.fr:8104/; www.biochem.ucl.ac.uk/˜martin/abs/index.html; antibody.bath.ac.uk/; abgen.cvm.tamu.edu/lab/wwwabgen.html; www.unizh.ch/˜honegger/AHOseminar/Slide01.html; www.cryst.bbk.ac.uk/˜ubcg07s/; www.nimr.mrc.ac.uk/CC/ccaewg/ccaewg.htm; www.path.cam.ac.uk/˜ mrc7/humanisation/TAHHP.html; www.ibt.unam.mx/vir/structure/stat_aim.html; www.biosci.missouri.edu/smithgp/index.html; www.cryst.bioc.cam.ac.uk/˜fmolina/Web-pages/Pept/spottech.html; www.jerini.de/fr_products.htm; www.patents.ibm.com/ibm.html.Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983), каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Такие импортированные последовательности могут быть использованы для снижения иммуногенности или для снижения, усиления или модификации связывания, аффинности, скорости продуцирования, скорости элиминации, авидности, специфичности, времени полужизни или любых других нужных свойств, известных специалистам. Обычно, часть или все нечеловеческие или человеческие CDR-последовательности сохраняют, а нечеловеческие последовательности вариабельной или константной области заменяют человеческими или другими аминокислотами. Антитела могут быть, но необязательно, гуманизированы с сохранением высокой аффинности для данного антигена и других желательных биологических свойств. Для достижения этой цели гуманизированные антитела могут быть, но необязательно, получены путем анализа исходных последовательностей и различных консептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и известны специалистам. Существуют компьютерные программы, которые иллюстрируют и отображают вероятные трехмерные конформационные структуры отобранных иммуноглобулиновых последовательностей-кандидатов. Исследование этих отображений позволяет проанализировать возможную роль данных остатков в функционировании иммуноглобулиновой последовательности-кандидата, то есть проанализировать остатки, которые влияют на способность иммуноглобулина-кандидата связываться с антигеном. Таким образом, FR-остатки могут быть выбраны и объединены с консенсусными и "импортированными" последовательностями так, чтобы данное антитело обладало нужными свойствами, такими как повышенная аффинность по отношению к антигену-мишени. В основном, CDR-остатки непосредственно и в высокой степени влияют на связывание с антигеном. Гуманизация или конструирование антител согласно изобретению могут быть осуществлены любым методом, таким как, но не ограничивающимся ими, методы, описанные в работах Winter (Jones et al., Nature 321:522 (1986); Riechmann et al., Nature 332:323 (1988); Verhoeyen et al., Science 239:1534 (1988)), Sims et al., J. Immunol. 151:2296 (1993); Chothia and Lesk, J. Mol. Biol. 196:901 (1987), Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89:4285 (1992); Presta et al., J. Immunol. 151;2623 (1993), патенты США №№ 5723323, 5976862, 5824514, 5817483, 5814476, 5763192, 5723323, 5766886, 5714352, 6204023, 6180370, 5693762, 5530101, 5585089, 5225539; 4816567, РСТ/: US98/16280, US96/18978, US91/09630, US91/05939, US94/01234, GB89/01334, GB91/01134, GB92/01755; WO90/14443, WO90/14424, WO90/14430, EP 229246, каждая из которых во всей своей полноте вводятся в настоящее описание посредством ссылки.
Антитела согласно изобретению могут быть получены с использованием по меньшей мере одной нуклеиновой кислоты, кодирующей анти-IL-6-антитело, для генерирования трансгенных животных или млекопитающих, таких как козы, коровы, лошади, овцы и т.п., у которых указанные антитела продуцируются в молоке. Такие животные могут быть получены известными методами. См., например, патенты США №№ 5827690, 5849992, 4873316, 5849992, 5994616, 5565362, 5304489 и т.п., каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Антитела согласно изобретению могут быть также продуцированы с использованием по меньшей мере одной нуклеиновой кислоты, кодирующей анти-IL-6-антитело, с получением трансгенных растений и культивированных растительных клеток (например, таких как, но не ограничивающихся ими, табак и кукуруза), которые продуцируют указанные антитела, их специфические части или варианты в клетках растения или в полученных из них культивированных клетках. Неограничивающим примером являются листья трансгенного табака, экспрессирующие рекомбинантные белки, которые были с успехом использованы для получения больших количеств рекомбинантных белков, например, с помощью индуцибельного промотора. См. например, работу Cramer et al., Curr. Top. Microbol. Immunol. 240:95-118 (1999) и цитируемые там работы. Кроме того, трансгенная кукуруза была использована для экспрессии белков млекопитающих на коммерчески доступных уровнях, при этом их биологическая активность была эквивалентна активности белков, продуцируемых в других рекомбинантных системах или выделенных из природных источников. См. например, работу Hood et al., Adv. Exp. Med. Biol. 464:127-147 (1999) и цитируемые там работы. Антитела, включая фрагменты антитела, такие как одноцепочечные антитела (scFv), также были продуцированы в больших количествах из семян трансгенных растений, включая семена табака и клубни растений. См. например, работу Conrad et al., Plant. Mol. Biol. 38:101-109 (1998) и цитируемые там работы. Таким образом, антитела согласно изобретению могут быть также продуцированы с использованием трансгенных растений в соответствии известными методами. См. также, например, работы Fischer et al. Biotechnol. Appl. Biochem. 30:99-108 (Oct.,1999), Ma et al., Trends Biotechnol. 13:522-7 (1995), Ma et al., Plant Physiol. 109:341-6 (1995); Whitelam et al., Biochem. Soc. Trans. 22:940-944 (1994) и цитируемые там работы. Описание экспрессии антител в растениях, в общих чертах, можно также найти в вышеуказанных работах и в других работах, где каждая из указанных работ во всей своей полноте вводится в настоящее описание посредством ссылки.
Антитела согласно изобретению могут связываться с человеческим IL-6 с аффинностями в широком диапазоне (КD). В предпочтительном варианте осуществления изобретения по меньшей мере одно человеческое mAb согласно изобретению может, но необязательно, связываться с человеческим IL-6 с высокой аффинностью. Так, например, человеческое mAb может связываться с человеческим IL-6 с КD, имеющим величину примерно 10-7М или менее, такую как, но не ограничивающаяся ею, величина в пределах 0,1-9,9 (или любой интервал величин или любая величина в указанных пределах) × 10-7, 10-8, 10-9, 10-10, 10-11, 10-12, 10-13, или любой интервал величин или величина в указанных пределах.
Аффинность или авидность антитела по отношению к антигену может быть определена экспериментально любым подходящим методом (см. например, работы Berzofsky et al., "Antibody-Antigen Interactions "In Fundamental Immunology, Paul W.E., Ed., Raven Press: New York, NY (1984); Kuby, Janis Immunology, W.H. Freeman and Company: New York, NY (1992) и описанные там методы). Измеряемая аффинность конкретного взаимодействия "антитело-антиген" может варьироваться в зависимости от различных условий измерения (например, концентрации соли, рН). Таким образом, измерения аффинности и других параметров связывания с антигеном (например, КD, Ка, Кd) предпочтительно осуществляют с использованием стандартизированных растворов антитела и антигена и стандартизированного буфера, такого как описанный здесь буфер.
Молекулы нуклеиновой кислоты
С использованием приведенной здесь информации, такой как нуклеотидные последовательности, кодирующие по меньшей мере 70-100% смежных аминокислот по меньшей мере одной из SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, их определенных фрагментов, вариантов или консенсусных последовательностей, или депонированный вектор, содержащий по меньшей мере одну из указанных последовательностей молекулы нуклеиновой кислоты согласно изобретению, кодирующей по меньшей мере одно антитело против IL-6, могут быть получены методами, описанными в настоящей заявке или известными специалистам.
Молекулы нуклеиновой кислоты согласно изобретению могут быть получены в форме РНК, такой как мРНК, чРНК, тРНК, или в любой другой форме, либо в форме ДНК, включая, но не ограничиваясь ими, кДНК и геномная ДНК, полученные методами клонирования или синтеза или их комбинации. ДНК может представлять собой трехцепочечную, двухцепочечную или одноцепочечную ДНК или любую их комбинацию. Любая часть по меньшей мере одной цепи ДНК или РНК может представлять собой кодирующую цепь, также известную как смысловая цепь, либо она может представлять собой некодирующую цепь, называемую также антисмысловой цепью.
Выделенными молекулами нуклеиновой кислоты согласно изобретению могут быть молекулы нуклеиновой кислоты, содержащие открытую рамку считывания (ОРС), необязательно с одним или несколькими интронами, например, такими как, но не ограничивающимися ими, по меньшей мере одна определенная часть по меньшей мере одной CDR, а именно CDR1, CDR2 и/или CDR3 по меньшей мере одной тяжелой цепи (например, SEQ ID NO:1-3) или легкой цепи (например, SEQ ID NO:4-6); молекулы нуклеиновой кислоты, содержащие кодирующую последовательность для анти-IL-6-антитела или его вариабельную область (например, SEQ ID NO:7,8); и молекулы нуклеиновой кислоты, содержащие нуклеотидную последовательность, которая, по существу, отличаются от описанных выше последовательностей, но которая, из-за вырожденности генетического кода, еще кодирует по меньшей мере одно анти-IL-6-антитело, описанное в настоящей заявке и/или известное специалистам. Само собой разумеется, что генетический код хорошо известен специалистам. Таким образом, каждый специалист может генерировать такие вырожденные варианты нуклеиновой кислоты, которые кодируют специфические анти-IL-6-антитела согласно изобретению, например, см. выше, Ausubel et al., и такие варианты нуклеиновой кислоты входят в объем согласно изобретению. Неограничивающими примерами выделенных молекул нуклеиновой кислоты согласно изобретению являются SEQ ID NO:1-8; молекулы нуклеиновой кислоты, кодирующие, соответственно, CDR1 НС, CDR2 НС, CDR3 НС, CDR1 LC, CDR2 LC, CDR3 LC, вариабельную область НС и вариабельную область LC.
Как указано в настоящем описании, молекулами нуклеиновой кислоты согласно изобретению, которые включают нуклеиновую кислоту, кодирующую анти-IL-6-антитело, могут быть, но не ограничиваются ими, молекулы, кодирующие аминокислотную последовательность фрагмента антитела, саму аминокислотную последовательность, кодирующую последовательность всего антитела или его части; кодирующую последовательность антитела, его фрагмента или части, а также дополнительные последовательности, такие как кодирующая последовательность по меньшей мере одного сигнального лидерного или гибридного пептида, вместе с вышеупомянутыми дополнительными кодирующими последовательностями, или без них, такими как по меньшей мере один интрон, а также вместе с другими некодирующими последовательностями, включая, но не ограничиваясь ими, некодирующие 5'- и 3'-последовательности, такие как транскрибируемые нетранслируемые последовательности, которые играют определенную роль в транскрипции, в мРНК-процессинге, включая сигналы сплайсинга и полиаденилирования (например, связывания с рибосомой и стабильности мРНК), и дополнительная кодирующая последовательность, которая кодирует другие аминокислоты, такие как аминокислоты, обладающие дополнительными функциональными свойствами. Таким образом, последовательность, кодирующая антитело, может быть присоединена к маркерной последовательности, такой как последовательность, кодирующая пептид, облегчающий очистку гибридного антитела, содержащего фрагмент или часть антитела.
Полинуклеотиды, которые селективно гибридизуются с описанным здесь полинуклеотидом
Настоящее изобретение относится к выделенным нуклеиновым кислотам, которые гибридизуются с описанным здесь полинуклеотидом в условиях селективной гибридизации. Так, например, полинуклеотиды такого варианта изобретения могут быть использованы для выделения, детекции и/или количественной оценки нуклеиновых кислот, содержащих такие полинуклеотиды. Так, например, полинуклеотиды согласно изобретению могут быть использованы для идентификации, выделения или амплификации неполных или полноразмерных клонов в депонированной библиотеке. В некоторых вариантах осуществления изобретения указанные полинуклеотиды представляют собой выделенные геномные последовательности или кДНК-последовательности, или другие последовательности, комплементарные кДНК, происходящей от библиотеки нуклеиновых кислот человека или млекопитающего.
Предпочтительно, чтобы кДНК-библиотека содержала по меньшей мере 80% полноразмерных последовательностей, предпочтительно по меньшей мере 85% или 90% полноразмерных последовательностей, а более предпочтительно по меньшей мере 95% полноразмерных последовательностей. Библиотеки кДНК могут быть нормализованы на увеличение представительности редких последовательностей. Обычно, но не исключительно, применяются условия гибридизации низкой или умеренной жесткости с использованием последовательностей, имеющих последовательности с меньшей идентичностью по отношению к комплементарным последовательностям. Для последовательностей с большей идентичностью могут быть, но необязательно, использованы условия гибридизации умеренной и высокой жесткости. Условия низкой жесткости позволяют осуществлять селективную гибридизацию последовательностей, имеющих примерно 70%-ю идентичность, и они могут быть использованы для идентификации ортологичных или паралогичных последовательностей.
Полинуклеотиды согласно изобретению кодируют, но необязательно, по меньшей мере часть антитела, кодируемого описанными здесь полинуклеотидами. Полинуклеотиды согласно изобретению включают последовательности нуклеиновой кислоты, которые могут быть использованы для селективной гибридизации с полинуклеотидом, кодирующим антитело согласно изобретению. См., например, публикации Ausubel, см. выше, и Colligan, Immunology, см. выше, глава 2, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Конструирование нуклеиновых кислот
Выделенные нуклеиновые кислоты согласно изобретению могут быть получены (а) рекомбинантными методами, (b) методами синтеза, (с) методами очистки или комбинированными методами, хорошо известными специалистам.
Обычно нуклеиновые кислоты, помимо полинуклеотида согласно изобретению, могут содержать и другие последовательности. Так, например, для облегчения выделения данного полинуклеотида в нуклеиновую кислоту может быть встроен сайт множественного клонирования, содержащий один или несколько сайтов рестрикции эндонуклеазами. Кроме того, для облегчения выделения транслированного полинуклеотида согласно изобретению в него могут быть встроены транслируемые последовательности. Так, например, удобным средством для очистки белков согласно изобретению может служить гекса-гистидиновая маркерная последовательность. Нуклеиновой кислотой согласно изобретению за исключением кодирующей последовательности, является, но необязательно, вектор, адаптер или линкер для клонирования и/или экспрессии полинуклеотида согласно изобретению.
В такие клонирующие и/или экспрессирующие последовательности могут быть добавлены и другие последовательности для оптимизации их функций при клонировании и/или экспрессии, для облегчения выделения полинуклеотида или для облегчения введения полинуклеотида в клетку. Использование клонирующих векторов, экспрессирующих векторов, адаптеров и линкеров хорошо известно специалистам (Например, Ausubel, см. выше, или Sambrook, см. выше).
Рекомбинантные методы конструирования нуклеиновых кислот
Композиции выделенных нуклеиновых кислот согласно изобретению, таких как РНК, кДНК, геномная ДНК или любая их комбинация, могут быть получены из биологических источников с использованием методов клонирования, известных специалистам. В некоторых вариантах осуществления изобретения для идентификации нужной последовательности в библиотеке кДНК или геномных ДНК используются олигонуклеотидные зонды, которые селективно гибридизуются с полинуклеотидами согласно изобретению в жестких условиях. Выделение РНК и конструирование библиотек кДНК и геномных ДНК хорошо известны специалистам (Например, Ausubel, см. выше, или Sambrook, см. выше).
Методы скрининга и выделения нуклеиновых кислот
Библиотека кДНК или геномных ДНК может быть скринирована с использованием зонда, полученного на основе последовательности полинуклеотида согласно изобретению, например, описанного в настоящей заявке. Зонды могут быть использованы для гибридизации с геномными ДНК- или кДНК-последовательностями в целях выделения гомологичных генов в тех же самых или в различных организмах. Для каждого специалиста очевидно, что в данном анализе может быть использована гибридизация различных степеней жесткости; при этом жесткой может быть либо среда для гибридизации, либо среда для промывки. По мере увеличения жесткости условий для гибридизации должна увеличиваться степень комплементарности между зондом и мишенью для образования дуплекса. Степень жесткости может регулироваться одним или несколькими факторами, такими как температура, ионная сила, рН и присутствие частично денатурирующего раствора, такого как формамид. Так, например, жесткость гибридизации обычно варьируется в зависимости от изменения полярности реакционного раствора, например, при изменении концентрации формамида в пределах от 0% до 50%. Степень комплементарности (идентичность последовательностей), необходимая для детектируемого связывания, будет варьироваться в зависимости от жесткости среды для гибридизации и/или среды для промывки. Оптимальная степень комплементарности равна 100% или составляет в пределах 70-100% или любой интервал или величину в указанных пределах. Однако следует отметить, что небольшие изменения в последовательностях зондов и праймеров могут компенсироваться за счет снижения жесткости среды для гибридизации и/или промывки.
Методы амплификации РНК или ДНК хорошо известны специалистам и могут быть использованы в соответствии с настоящим изобретением без излишнего экспериментирования лишь исходя из описания и рекомендаций, представленных в настоящей заявке.
Известными методами амплификации ДНК или РНК являются, но не ограничиваются ими, полимеразная цепная реакция (ПЦР) и подобные способы амплификации (см., например, патенты США №№ 4683195, 4683202, 4800159, 4965188, Mullis, et al., 4795699 и 4921794 Tabor, et al.; 5142033 Innis; 5122464 Wilson, et al.; 5091310 Innis; 5066584 Gyllensten, et al.; 4889818 Gelfand, et al.; 4994370 Silver, et al.; 4766067 Baswas; 4656134 Ringold) и РНК-опосредованная амплификация, в которой для последовательности-мишени используется антисмысловая РНК в качестве матрицы для синтеза двухцепочечной ДНК (патент США № 5130238, Malek et al., с торговым знаком NASBA), полное содержание которого вводится в настоящее описание посредством ссылки (например, Ausubel, см. выше, или Sambrook, см. выше).
Так, например, метод полимеразной цепной реакции (ПЦР) может быть использован для амплификации полинуклеотидных последовательностей согласно изобретению и родственных генов, происходящих непосредственно из библиотек геномных ДНК или кДНК. ПЦР и другие методы in vitro-амплификации могут быть также использованы, например, для клонирования последовательностей нуклеиновых кислот, кодирующих экспрессируемый белок, для получения нуклеиновых кислот, используемых в качестве зондов для детекции на присутствие нужной мРНК в образцах, для секвенирования нуклеиновых кислот и для других целей. Примеры методов in vitro-амплификации, которые могут быть осуществлены любым специалистом, можно найти у Berger, см. выше, Sambrook, см. выше и Ausubel, см. выше, а также у Mullis et al., патент США № 4683202 (1987) и Innis et al., PCR Protocols A Guide to Methods and Applications, Eds., Academic Press Inc., San Diego, CA (1990). Коммерчески доступные наборы для геномной ПЦР-амплификации известны специалистам. См., например, набор для геномной ПЦР Advantage-GC (Clontech). Кроме того, для увеличения выхода длинноцепочечных ПЦР-продуктов может быть использован ген 32 белка Т4 (Boehringer Mannheim).
Методы синтеза для конструирования нуклеиновых кислот
Выделенные нуклеиновые кислоты согласно изобретению могут быть также получены путем прямого химического синтеза известными методами (например, см. выше, Ausubel et al.). Химический синтез позволяет, в основном, продуцировать одноцепочечный олигонуклеотид, который может быть превращен в двухцепочечную ДНК путем гибридизации с комплементарной последовательностью или путем полимеризации с помощью ДНК-полимеразы с использованием одной цепи в качестве матрицы. Для каждого специалиста очевидно, что хотя химический синтез ДНК может быть ограничен последовательностями длиной примерно в 100 или более оснований, однако могут быть получены и более длинные последовательности путем лигирования коротких последовательностей.
Кластеры для экспрессии рекомбинантных последовательностей
Настоящее изобретение также относится к кластерам для экспрессии рекомбинантных последовательностей, содержащим нуклеиновую кислоту согласно изобретению. Последовательность нуклеиновой кислоты согласно изобретению, например, кДНК или геномная последовательность, кодирующая антитело согласно изобретению, может быть использована в целях конструирования кластера для экспрессии рекомбинантных последовательностей, который может быть введен по меньшей мере в одну нужную клетку-хозяина. Кластер для экспрессии рекомбинантных последовательностей обычно содержит полинуклеотид согласно изобретению, функционально присоединенный к последовательностям регуляции инициации транскрипции, которые регулируют транскрипцию полинуклеотида в нужной клетке-хозяине. Для регуляции экспрессии нуклеиновых кислот согласно изобретению могут быть использованы как гетерологичные, так и негетерологичные (то есть, эндогенные) промоторы.
В некоторых вариантах осуществления изобретения выделенные нуклеиновые кислоты, которые служат в качестве промотора, энхансера и других элементов, могут быть введены в соответствующее положение (выше, ниже или в интрон) негетерологичной формы полинуклеотида согласно изобретению, так чтобы они позитивно или негативно регулировали экспрессию полинуклеотида согласно изобретению. Так, например, эндогенные промоторы могут быть модифицированы in vivo или in vitro посредством мутации, делеции и/или замены.
Векторы и клетки-хозяева
Настоящее изобретение также относится к векторам, включающим выделенные молекулы нуклеиновой кислоты согласно изобретению, к клеткам-хозяевам, генетически сконструированным с использованием таких рекомбинантных векторов, и к продуцированию по меньшей мере одного анти-IL-6-антитела методами рекомбинантных ДНК, хорошо известными специалистам. См., например, публикации Sambrook et al. и Ausubel et al. (см. выше), каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Указанные полинуклеотиды могут быть, но необязательно, присоединены к вектору, содержащему селективный маркер для их амплификации в хозяине. В общих чертах, плазмидный вектор вводят в преципитат, такой как преципитат фосфата кальция, или в комплекс с заряженным липидом. Если вектором является вирус, то он может быть упакован in vitro с использованием соответствующей упаковывающей клеточной линии, а затем он может быть перенесен в клетки-хозяева.
ДНК-вставка должна быть функционально присоединена к соответствующему промотору. Экспрессирующие конструкции, кроме того, содержат сайты инициации и терминации транскрипции, а в транскрибируемой области - сайт связывания с рибосомой для инициации трансляции. Кодирующая часть зрелых транскриптов, экспрессируемых указанными конструкциями, предпочтительно, включает в начале сайт инициации трансляции, а в конце кодон терминации (например, UAA, UGA или UAG), соответствующим образом расположенный на конце транслируемой мРНК, при этом для экспрессии в клетках млекопитающих или в эукариотических клетках предпочтительными являются кодоны UAA и UAG.
Экспрессирующие векторы предпочтительно, но необязательно, включают по меньшей мере один селективный маркер. Такими маркерами являются, но не ограничиваются ими, гены резистентности к метотрексату (МТХ), ген дегидрофолатредуктазы (DHFR, патенты США №№ 4399216, 4634665, 4656134, 4956288, 5149636, 5179017), гены резистентности к ампициллину, неомицину (G418), микофеноловой кислоте или глутамин-синтетазе (GS) (патенты США №№ 5122464, 5770359, 5827739) для культивирования эукариотических клеток и гены резистентности к тетрациклину или ампициллину для культивирования в E.coli и в других бактериях или в прокариотах (все вышеупомянутые патенты вводятся в настоящее описание посредством ссылки). Соответствующие культуральные среды и условия культивирования вышеописанных клеток-хозяев известны специалистам. Подходящие векторы могут быть легко получены специалистом. Введение векторной конструкции в клетку-хозяина может быть осуществлено путем трансфекции фосфатом кальция; трансфекции, опосредованной DEAE-декстраном; трансфекции, опосредованной катионным липидом; электропорации; трансдукции; инфекции или другими известными методами. Такие методы описан в литературе, например, у Sambrook, см. выше, главы 1-4 и 16-18, и Ausubel, см. выше, главы 1, 9, 13, 15, 16.
По крайней мере, одно антитело согласно изобретению может экспрессироваться в модифицированной форме, такой как гибридный белок, и может включать не только сигналы секреции, но также и другие гетерологичные функциональные области. Так, например, для повышения стабильности и персистентности в клетке-хозяине во время очистки или в процессе последующей обработки и хранения к N-концу антитела может быть добавлена область из дополнительных аминокислот, а в частности из заряженных аминокислот. Кроме того, для облегчения очистки к антителу согласно изобретению могут быть добавлены пептидные молекулы. Такие области могут быть удалены перед конечным получением антитела или по меньшей мере одного его фрагмента. Такие методы описаны во многих известных лабораторных руководствах, таких как Sambrook, см. выше, главы 17. 29-17.42 и 18.1-18.74; Ausubel, см. выше, главы 16, 17 и 18.
Каждому специалисту известно множество экспрессирующих систем, подходящих для экспрессии нуклеиновой кислоты, кодирующей белок согласно изобретению.
Альтернативно, нуклеиновые кислоты согласно изобретению могут быть экспрессированы в клетке-хозяине путем модификации (путем манипуляции) в клетке-хозяине, которая содержит эндогенную ДНК, кодирующую антитело согласно изобретению. Эти методы хорошо известны специалистам и описаны, например, в патентах США №№ 5580734, 5641670, 5733746 и 5733671, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Примерами клеточных культур, подходящих для продуцирования антител, из определенных фрагментов или вариантов, являются клетки млекопитающих. Клеточные системы млекопитающих часто имеют форму монослоев клеток, хотя могут быть также использованы и суспензии клеток млекопитающих или биореакторы. Специалистами был разработан ряд подходящих клеточных линий хозяев, способных экспрессировать интактные гликозилированные белки, и такими клеточными линиями являются COS-1 (например, АТСС CRL 1650), COS-7 (например, АТСС CRL 1651), НЕК293, ВНК21 (например, АТСС CRL-10), СНО (например, АТСС CRL 1610) и BSK-1 (например, АТСС CRL-26), клетки COS-7, клетки СНО, клетки hерG2, P3X63Ag8.653, Sр2/0-Аg14, клетки 293, клетки HeLa и т.п., которые могут быть взяты, например, из Американской коллекции типовых культур, Manassas, Va (www.atcc.org.). Предпочтительными клетками-хозяевами являются клетки лимфоидного происхождения, такие как миеломные клетки и клетки лимфомы. Особенно предпочтительными клетками-хозяевами являются клетки P3X63Ag8.653 (АТСС, рег. № CRL 1580) и клетки Sр2/0-Аg14 (АТСС, рег. № CRL 1851). В особенно предпочтительном варианте осуществления изобретения рекомбинантной клеткой является клетка P3X63Ag8.653 или клетка Sр2/0-Аg14.
Экспрессирующие векторы для этих клеток могут включать одну или несколько из нижеследующих последовательностей регуляции экспрессии, таких как, но не ограничивающихся ими, сайт инициации репликации, промотор (например, поздний или ранний промоторы SV40, промотор CMV (патенты США №№ 5168062, 5385839), промотор tk HSV, промотор pgk (фосфоглицерат-киназы), промотор EF-1-альфа (патент США № 5266491) по меньшей мере один промотор человеческого иммуноглобулина, энхансер, и/или сайты инициации процессинга, такие как сайты связывания с рибосомой, сайты сплайсинга РНК, сайты полиаденилирования (например, сайт присоединения poly A большого Т-антигена Ag SV40) и последовательности терминации транскрипции. См., например, Ausubel см. выше, или Sambrook см. выше. Другие клетки, которые могут быть использованы для продуцирования нуклеиновых кислот или белков согласно изобретению, известны специалистам и/или могут быть взяты из каталога Американской коллекции типовых культур клеточных линий и гибридом (www.atcc.org.) или из других известных или коммерчески доступных источников.
При использовании эукариотических клеток-хозяев в вектор обычно вводят последовательности полиаденилирования или терминации транскрипции. Примером последовательности терминации является последовательность полиаденилирования гена бычьего гормона роста. Могут быть также введены последовательности точного сплайсинга транскрипта. Примером последовательности сплайсинга является интрон VP1 вируса SV40 (Sprague et al., J. Virol. 45:773-781 (1983)). Кроме того, в вектор могут быть встроены генные последовательности для регуляции репликации в клетке-хозяине, известные специалистам.
Очистка антитела
Анти-IL-6-антитело может быть выделено и очищено из рекомбинантных клеточных культур хорошо известными методами, включая, но не ограничиваясь ими, очистку с использованием белка А, преципитацию сульфатом аммония или этанолом, экстракцию кислотой, анионообменную или катионообменную хроматографию, хроматографию на фосфоцеллюлозе, гидрофобную хроматографию, аффинную хроматографию, хроматографию на гидроксиапатитах и хроматографию на лектине. Для очистки может быть также использована высокоэффективная жидкостная хроматография ("ВЭЖХ"). См. например, Colligan, Current Protocol in Immunology, or Current Protocol in Protein Science, John Wiley & Sons, NY, NY (1997-2001), например, главы 1, 4, 6, 8, 9, 10, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Антителами согласно изобретению являются природные очищенные продукты, продукты химического синтеза и продукты, полученные рекомбинантными методами из эукариотического хозяина, включая, например, клетки дрожжей, высших растений, насекомых и млекопитающих. В зависимости от хозяина, используемого в методе рекомбинантного продуцирования, антитело согласно изобретению может быть гликозилированным, либо оно может быть негликозилированным, а предпочтительно, гликозилированным. Такие методы описаны во многих известных лабораторных руководствах, таких как Sambrook, см. выше, главы 17.37-17.42; Ausubel, см. выше, главы 10, 12, 13, 16, 18 и 20; Colligan, Protein Science, см. выше, главы 12-14, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Анти-IL-6-антитела
Выделенные антитела согласно изобретению содержат аминокислотные последовательности описанного здесь антитела или любого выделенного или продуцированного антитела, кодируемые любым подходящим полинуклеотидом. Предпочтительно, человеческое антитело или его антигенсвязывающий фрагмент связывается с человеческим IL-6 и тем самым частично или в значительной степени нейтрализует по меньшей мере одну биологическую активность указанного белка. Антитело или его специфическая часть или вариант, которые частично или предпочтительно в значительной степени нейтрализуют по меньшей мере одну биологическую активность по меньшей мере одного белка IL-6 или его фрагмента, могут связываться с указанным белком или фрагментом и тем самым ингибировать активности, опосредуемые связыванием с IL-6 с рецептором IL-6, или другими IL-6-зависимыми или опосредуемыми механизмами. Используемый здесь термин "нейтрализующее антитело" означает антитело, которое может ингибировать IL-6-зависимую активность примерно на 20-120%, а предпочтительно по меньшей мере примерно на 10, 20, 30, 40, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% или более в зависимости от данного анализа. Способность анти-IL-6-антитела ингибировать IL-6-зависимую активность, предпочтительно, оценивают с помощью анализа по меньшей мере на один подходящий белок IL-6 или его рецептор, как описано в настоящей заявке и/или как известно специалистам. Человеческая константная область химерного антитела согласно изобретению может представлять собой область антитела любого класса (IgG, IgA, IgM, IgE, IgD и т.п.) или изотипа и может включать легкую цепь каппа или лямбда. В одном из вариантов осуществления изобретения человеческая константная область содержит тяжелую цепь IgG или ее определенный фрагмент, например, по меньшей мере одного из изотипов IgG1, IgG2, IgG3 или IgG4. В другом варианте осуществления изобретения человеческое антитело против человеческого IL-6 содержит тяжелую цепь IgG1 и легкую К-цепь IgG1.
По крайней мере, одно антитело согласно изобретению связывается по меньшей мере с одним конкретным эпитопом, специфичным по меньшей мере к одному белку IL-6, к его субъединице, фрагменту, части или любой их комбинации. Указанный по меньшей мере один эпитоп может содержать по меньшей мере одну антителосвязывающую область, которая содержит по меньшей мере одну часть этого белка, где указанный эпитоп, предпочтительно, состоит из по меньшей мере одной внеклеточной, растворимой, гидрофильной, внешней или цитоплазматической части указанного белка. Указанный по меньшей мере один конкретный эпитоп может содержать любую комбинацию из по меньшей мере одной аминокислотной последовательности, имеющей по меньшей мере 1-3 аминокислоты или всей конкретной части смежных аминокислот последовательности SEQ ID NO:9.
В основном, человеческое антитело или антигенсвязывающий фрагмент согласно изобретению содержит антигенсвязывающую область, которая включает по меньшей мере одну человеческую гипервариабельную область (CDR1, CDR2 и CDR3) или вариант по меньшей мере одной вариабельной области тяжелой цепи и по меньшей мере одну человеческую гипервариабельную область (CDR4, CDR5 и CDR6) или вариант по меньшей мере одной вариабельной области легкой цепи. В качестве неограничивающего примера может служить антитело или его антигенсвязывающая часть или вариант, которые могут содержать по меньшей мере одну CDR3 тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO:3, и/или CDR3 легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:6. В конкретном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент могут иметь антигенсвязывающую область, содержащую по меньшей мере часть по меньшей мере одной CDR тяжелой цепи (то есть, CDR1, CDR2 и/или CDR3), имеющей аминокислотную последовательность соответствующих CDR1, 2 и/или 3 (например, SEQ ID NO:1, 2 и/или 3). В другом конкретном варианте осуществления изобретения антитело или его антигенсвязывающая часть или вариант могут иметь антигенсвязывающую область, содержащую по меньшей мере часть по меньшей мере одной CDR легкой цепи (то есть, CDR4, CDR5 и/или CDR6), имеющей аминокислотную последовательность соответствующих CDR4, 5 и/или 6 (например, SEQ ID NO:4, 5 и/или 6). В предпочтительном варианте осуществления изобретения три CDR тяжелой цепи и три CDR легкой цепи указанного антитела или антигенсвязывающего фрагмента имеют аминокислотную последовательность соответствующей CDR по меньшей мере одного из mAb cCLB-8 и химерного анти-IL-6 Mab, описанных в настоящей заявке. Такие антитела могут быть получены путем химического соединения вместе различных частей (например, CDR, каркасных участков) антитела стандартными методами, путем продуцирования и экспрессии (то есть, одной или нескольких) молекул нуклеиновой кислоты, кодирующих указанное антитело, с использованием стандартной методики рекомбинантных ДНК или другим подходящим методом.
Анти-IL-6-антитело может содержать по меньшей мере одну вариабельную область тяжелой или легкой цепи, имеющую определенную аминокислотную последовательность. Так, например, в предпочтительном варианте осуществления изобретения анти-IL-6-антитело содержит по меньшей мере одну вариабельную область тяжелой цепи, необязательно имеющую аминокислотную последовательность SEQ ID NO:7, и/или по меньшей мере одну вариабельную область легкой цепи, необязательно имеющую аминокислотную последовательность SEQ ID NO:8. Антитела, которые связываются с человеческим IL-6 и которые содержат определенную вариабельную область тяжелой или легкой цепи, могут быть получены подходящими методами, такими как метод фагового представления (Katsube Y. et al., Int. J. Mol. Med., 1(5):863-868 (1988)), или методами с использованием трансгенных животных, хорошо известными специалистам и/или описанными в настоящей заявке. Так, например, указанное антитело, его определенная часть или вариант могут быть экспрессированы с использованием кодирующей нуклеиновой кислоты или ее части в подходящей клетке-хозяине.
Настоящее изобретение также относится к антителам, к антигенсвязывающим фрагментам, к иммуноглобулиновым цепям и к CDR, содержащим аминокислоты в последовательности, которая, в основном, идентична аминокислотной последовательности, описанной в настоящей заявке. Предпочтительно, чтобы такие антитела или антигенсвязывающие фрагменты и антитела, содержащие указанные цепи или CDR, могли связываться с человеческим IL-6 с высокой степенью аффинности (например, с КD менее или равным примерно 10-9М). Аминокислотными последовательностями, которые, в основном, аналогичны описанным здесь последовательностям, являются последовательности, содержащие консервативные аминокислотные замены, а также делеции и/или инсерции аминокислот. Термин "консервативная аминокислотная замена" означает замену первой аминокислоты на вторую аминокислоту, которая имеет химические и/или физические свойства (например, заряд, структуру, полярность, гидрофобность/гидрофильность), аналогичные свойствам первой аминокислоты. Консервативной заменой является замена одной аминокислоты на другую аминокислоту, проводимая внутри следующих групп аминокислот: лизин (К), аргинин (R) и гистидин (Н); аспартат (D) и глутамат (Е); аспарагин (N), глутамин (Q), серин (S), треонин (Т), тирозин (Y), K, R, H, D и Е; аланин (А), валин (V), лейцин (L), изолейцин (I), пролин (Р), фенилаланин (F), триптофан (W), метионин (М), цистеин (С) и глицин (G); F, W и Y; С, S и Т.
Коды аминокислот
Аминокислоты, которые составляют анти-IL-6-антитела согласно изобретению, часто приводятся в виде аббревиатур. Аминокислоты могут быть представлены однобуквенным кодом, трехбуквенным кодом, их названием или кодоном(ами) из трех нуклеотидов, хорошо известными специалистам (см. Alberts, B. et al., Molecular Biology of The Cell, Third Ed., Garland Publishing, Inc., New York, 1994).
Анти-IL-6-антитело согласно изобретению может включать одну или несколько замен, делеций или добавлений аминокислот, образующихся либо в результате природных мутаций, либо вносимых искусственно путем модификаций, как описано в настоящей заявке.
Само собой разумеется, что некоторые аминокислотные замены могут быть осуществлены любым специалистом в зависимости от многих факторов, включая факторы, описанные выше. Вообще говоря, число аминокислотных замен, инсерций или делеций для любого данного анти-IL-6-антитела, его фрагмента или варианта составляет не более чем 40, 30, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, например 1-30 или любой интервал или любую величину в пределах указанного интервала, как описано в настоящей заявке.
Аминокислоты в анти-IL-6-антителе согласно изобретению, которые играют главную роль в его функционирования, могут быть идентифицированы известными методами, такими как сайт-направленный мутагенез или аланинсканирующий мутагенез (например, Ausubel, см. выше, главы 8, 15; Cunningham & Wells, Science 244:1081-1085 (1989). Проведение последней процедуры позволяет вводить единичные аланиновые мутации в каждом остатке молекулы. Затем полученные мутантные молекулы тестируют на биологическую активность, такую как, но не ограничивающуюся ею, по меньшей мере одна IL-6-нейтрализующая активность. Сайты, которые играют решающую роль в связывании с антителом, могут быть также идентифицированы с помощью структурного анализа, такого как кристаллизация, ядерный магнитный резонанс или фотоаффинное мечение (Smith et al., J. Mol. Biol. 224:899-904 (1992) и de Vos et al., Science 255:306-312 (1992)).
Анти-IL-6-антитела согласно изобретению могут включать, не ограничиваясь ими, по меньшей мере одну часть, последовательность или комбинацию, включающую от 5 и более или все смежные аминокислоты по меньшей мере одной из последовательностей SEQ ID NO:1, 2, 3, 4, 5, 6.
Кроме того, анти-IL-6-антитело может, но необязательно, содержать полипептид, имеющий по меньшей мере одну последовательность, состоящую из 70-100% смежных аминокислот по меньшей мере одной SEQ ID NO:7,8.
В одном варианте осуществления изобретения аминокислотная последовательность иммуноглобулиновой цепи или ее части (например, вариабельной области, CDR) примерно на 70-100% (например, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 или любой интервал или любое число в пределах указанного интервала) идентична аминокислотной последовательности соответствующей цепи по меньшей мере одной из последовательностей SEQ ID NO:7,8. Так, например, аминокислотная последовательность вариабельной области легкой цепи может быть сравнима с последовательностью SEQ ID NO:8, либо аминокислотная последовательность CDR тяжелой цепи может быть сравнима с последовательностью SEQ ID NO:7. Предпочтительно, 70-100%-ную идентичность (то есть, идентичность, составляющую 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% или в любом интервале или любую величину в пределах указанного интервала) аминокислот определяют с использованием подходящего компьютерного алгоритма, известного специалистам.
Примеры последовательностей вариабельных областей тяжелой и легкой цепей приводятся в SEQ ID NO:7,8. Антитела согласно изобретению или их определенные варианты могут содержать любое число смежные аминокислотных остатков антитела согласно изобретению, где указанное число выбрано из группы целых чисел, составляющих 10-100% от числа смежных остатков в анти-IL-6-антителе. Длина этой подпоследовательности смежных аминокислот составляет, но необязательно, по меньшей мере примерно из 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250 или более аминокислот, либо любой интервал или величину в пределах указанного интервала. Кроме того, число таких подпоследовательностей может быть любым целым числом, выбранным из группы, состоящей из 1-20, таким как по меньшей мере 2, 3, 4 или 5.
Для каждого специалиста очевидно, что настоящее изобретение включает по меньшей мере одно биологически активного антитело согласно изобретению. Биологически активные антитела обладают удельной активностью, составляющей по меньшей мере 20%, 30% или 40%, а предпочтительно по меньшей мере 50%, 60% или 70% и наиболее предпочтительно по меньшей мере 80%, 90% или 95-100% от активности природного (несинтезированного), эндогенного, родственного и известного антитела. Методы анализа и количественной оценки ферментативной активности и специфичности к субстрату хорошо известны специалистам.
В другом своем аспекте настоящее изобретение относится к человеческим антителам и к их антигенсвязывающим фрагментам, описанным в настоящей заявке, которые были модифицированы посредством ковалентного связывания с органической молекулой. В результате такой модификации могут быть продуцированы антитела или антигенсвязывающие фрагменты с улучшенными фармакокинетическими свойствами (например, с повышенным временем полужизни в сыворотке in vivo). Органической молекулой может быть прямая или разветвленная гидрофильная полимерная группа, группа жирной кислоты или группа сложного эфира жирной кислоты. В конкретных вариантах осуществления изобретения гидрофильная полимерная группа может иметь молекулярную массу примерно от 800 до 120000 Дальтон, и такой группой может быть полиалкангликоль (например, полиэтиленгликоль (ПЭГ), полипропиленгликоль (ППГ)), углеводный полимер, аминокислотный полимер или поливинилпирролидон, а группа жирной кислоты или группа сложного эфира жирной кислоты может содержать примерно от восьми до сорока атомов углерода.
Модифицированные антитела и антигенсвязывающие фрагменты согласно изобретению могут содержать одну или несколько органических молекул, которые ковалентно связаны, прямо или опосредованно, с данным антителом. Каждая органическая молекула, связанная с антителом или антигенсвязывающим фрагментом согласно изобретению, может независимо представлять собой гидрофильную полимерную группу, группу жирной кислоты или группу сложного эфира жирной кислоты. Используемый здесь термин "жирная кислота" охватывает монокарбоновые кислоты и дикарбоновые кислоты. Используемый здесь термин "гидрофильная полимерная группа" означает органический полимер, который является более растворимым в воде, чем в октане. Так, например, полилизин является более растворимым в воде, чем в октане. Таким образом, в объем согласно изобретению входит антитело, модифицированное путем ковалентного связывания с полилизином. Гидрофильными полимерами, подходящими для модификации антител согласно изобретению, могут быть прямые или разветвленные полимеры, и такими полимерами являются, например, полиалкангликоли (например, ПЭГ, монометокси-полиэтиленгликоль (мПЭГ), ППГ и т.п.), углеводы (например, декстран, целлюлоза, олигосахариды, полисахариды и т.п.), полимеры гидрофильных аминокислот (например, полилизин, полиаргинин, полиаспартат и т.п.), полиалканоксиды (например, полиэтиленоксид, полипропиленоксид и т.п.) и поливинилпирролидон. Предпочтительно, чтобы гидрофильный полимер, который модифицирует антитело согласно изобретению, имел молекулярную массу примерно от 800 до 150000 Дальтон в виде отдельной молекулярной частицы. Так, например, могут быть использованы ПЭГ5000 и ПЭГ20000, где нижний индекс означает среднюю молекулярную массу полимера в Дальтонах. Гидрофильная полимерная группа может быть замещена примерно одной-шестью алькильными группами, группами жирной кислоты или группами эфира жирной кислоты. Гидрофильные полимеры, замещенные группой жирной кислоты или группой сложного эфира жирной кислоты, могут быть получены подходящими методами. Так, например, полимер, содержащий аминогруппу, может быть связан с карбоксилатом жирной кислоты или эфиром жирной кислоты, а активированный карбоксилат (например, активированный N,N-карбонилдиимидазолом) на жирной кислоте или на сложном эфире жирной кислоты может быть связан с гидроксильной группой на полимере.
Жирные кислоты и сложные эфиры жирных кислот, подходящие для модификации антител согласно изобретению, могут быть либо насыщенными, либо они могут содержать одну или несколько ненасыщенных групп. Жирными кислотами, подходящими для модификации антител согласно изобретению, являются, например, н-додеканоат (С12, лаурат), н-тетрадеканоат (С14, миристат), н-октадеканоат (С18, стеарат), н-эйкозаноат (С20, арахидат), н-декозаноат (С22, бегенат), н-триаконтаноат (С30), н-тетраконтаноат (С40), цис-Δ9-октадеканоат (С18, олеат), все цис-Δ5,8,11,14-эйкозаттетраеноаты (С20, арахидонат), октандионовая кислота, тетрадекандионовая кислота, октадекандионовая кислота, декозандионовая кислота и т.п. Подходящими сложными эфирами жирных кислот являются сложные моноэфиры дикарбоновых кислот, содержащие прямую или разветвленную низшую алкильную группу. Низшая алкильная группа может содержать примерно от одного до двенадцати, а предпочтительно примерно от одного до шести, атомов углерода.
Модифицированные человеческие антитела и антигенсвязывающие фрагменты могут быть получены подходящими методами, например, посредством взаимодействия с одним или несколькими модифицирующими агентами. Используемый здесь термин "модифицирующий агент" означает подходящую органическую группу (например, гидрофильный полимер, жирную кислоту, сложный эфир жирной кислоты), содержащую активирующую группу. "Активирующая группа" представляет собой химическую молекулу или функциональную группу, которая, в соответствующих условиях, может реагировать со второй химической группой, образуя тем самым ковалентную связь между модифицирующим агентом и второй химической группой. Так, например, реагирующими с амином активирующими группами являются электрофильные группы, такие как тозилат, мезилат, галоген (хлор, бром, фтор, иод), N-гидроксисукцинимидиловые сложные эфиры (NHS) и т.п. Активирующими группами, которые могут реагировать с тиолом, являются, например, малеимид, иодацетил, акрилоил, пиридилсульфды, 5-тиол-2-нитробензойная кислота-тиол (TNB-тиол) и т.п. Альдегидная функциональная группа может быть присоединена к амино- или гидразинсодержащим молекулам, а азидная группа может реагировать с трехвалентной фосфорной группой с образованием фосфорамидатных или фосфорамидных связей. Подходящие методы введения активирующих групп в молекулы известны специалистам (см, например, Hermanson, G.T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996)). Активирующая группа может быть непосредственно связана с органической группой (например, с гидрофильным полимером, жирной кислотой, сложным эфиром жирной кислоты), или она может быть связана посредством линкерной группы, например, двухвалентной С1-С12-группы, где один или несколько атомов углерода могут быть заменены гетероатомом, таким как кислород, азот или сера. Подходящими линкерными группами являются, например, тетраэтиленгликоль, -(СН2)3-, -NH-(СН2 )6-NH-, -(СН2)2-NH и СН2-О-СН2-СН2-О-СН2-СН2-О-СН-NH-. Модифицирующие агенты, содержащие линкерную группу, могут быть продуцированы, например, посредством реакции взаимодействия моно-Вос-алкилдиамина (например, моно-Вос-этилендиамина, моно-Вос-диаминогексана) с жирной кислотой в присутствии 1-этил-3-(3-диметиаминопропил)карбодиимида (EDC) с образованием амидной связи между свободным амином и карбоксилатом жирной кислоты. Защитная группа Вос может быть удалена из указанного продукта путем обработки трифторуксусной кислотой (TFA) с получением первичного амина, который может быть связан с другим карбоксилатом, как описано в настоящей заявке, либо он может быть подвергнут реакции с малеиновым ангидридом, после чего полученный продукт подвергают реакции циклизации с получением активированного малеимидопроизводного жирной кислоты (см., например, заявку Thompson et al., WO 92/16221, которая во всей своей полноте вводится в настоящее описание посредством ссылки).
Модифицированные антитела согласно изобретению могут быть продуцированы путем реакции человеческого антитела или антигенсвязывающего фрагмента с модифицирующим агентом. Так, например, органические молекулы могут быть связаны с антителом несайт-специфическим способом с использованием реагирующего с амином модифицирующего агента, например NHS-эфира ПЭГ. Модифицированные человеческие антитела или антигенсвязывающие фрагменты могут быть также получены путем восстановления дисульфидных связей (например, внутрицепьевых дисульфидных связей) антитела или антигенсвязывающего фрагмента. Восстановленное антитело или восстановленный антигенсвязывающий фрагмент могут быть затем подвергнуты реакции с модифицирующим агентом, способным реагировать с тиолом, с продуцированием модифицированного антитела согласно изобретению. Модифицированные человеческие антитела и антигенсвязывающие фрагменты, содержащие органическую группу, связанную со специфическими сайтами антитела согласно изобретению, могут быть получены подходящими методами, такими как обратный протеолиз (Fisch et al., Bioconjugate Chem., 3:147-153 (1992); Werlen et al., Bioconjugate Chem., 5:411-417 (1994); Kumaran et al., Protein Sci. 6(10):2233-2241 (1997); Itoh et al., Bioorg. Chem., 24(1):59-68 (1996); Capellas et al., Biotechnol. Bioeng., 56(4):456-463 (1997)), и методами, описанными Hermanson, G.T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996).
Антиидиотипические антитела против композиции анти-IL-6-антител
Помимо моноклональных или химерных анти-IL-6-антител настоящее изобретение также относится к антиидиотипическому (анти-Id) антителу, специфичному к указанным антителам согласно изобретению. Анти-Id антитело представляет собой антитело, которое распознает уникальные детерминанты, обычно ассоциированные с антигенсвязывающей областью другого антитела. Анти-Id-антитело может быть получено путем иммунизации животного такого же вида и генетического типа (например, мышиной линии), как и источник Id-антитела, данным антителом или его CDR-содержащей областью. Иммунизованное животное будет распознавать и отвечать на идиодипические детерминанты иммунизирующего антитела и продуцировать анти-Id-антитело. Анти-Id-антитело может быть также использовано в качестве "иммуногена" для индуцирования иммунного ответа у других животных с продуцированием так называемого анти-анти-Id-антитела.
Композиции анти-IL-6-антител
Настоящее изобретение также относится по меньшей мере к одной композиции анти-IL-6-антител, содержащей по меньшей мере, одно по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть или более анти-IL-6-антител, описанных в настоящей заявке и/или известных специалистам, которые присутствуют в виде не встречающейся в природе композиции, смеси или форме. Такие композиции включают неприродные композиции, содержащие по меньшей мере один или два полноразмерных, делетированных по С- и/или N-концу вариантов, доменов, фрагментов или конкретных вариантов аминокислотной последовательности анти-IL-6-антитела, выбранной из группы, состоящей из 70-100% смежных аминокислот последовательностей SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8 или их определенных фрагментов, доменов или вариантов. Предпочтительные композиции анти-IL-6-антител включают по меньшей мере один или два полноразмерных фрагмента, домена или варианта в виде по меньшей мере одной из CDR- или LBR-содержащих частей последовательности анти-IL-6-антитела, составляющих 70-100% от SEQ ID NO: 1, 2, 3, 4, 5, 6 или их определенных фрагментов, доменов или вариантов. Более предпочтительные композиции включают 40-99% по меньшей мере одной из последовательностей, которая составляет 70-100% от последовательностей SEQ ID NO: 1, 2, 3, 4, 5, 6 или их определенных фрагментов, доменов или вариантов. Указанные проценты композиции даны по массе, объему, концентрации, молярности или моляльности жидких или сухих растворов, смесей, суспензий, эмульсий или коллоидов, известных специалистам или описанных в настоящей заявке.
Композиции анти-IL-6-антител согласно изобретению могут также содержать по меньшей мере одно из любых подходящих и эффективных количеств композиции или фармацевтической композиции, содержащей по меньшей мере одно анти-IL-6-антитело, которое может быть введено в клетку, ткань, орган, животному или пациенту, нуждающимся в модуляции состояния, лечении или терапии и, кроме того, содержащей, но необязательно, введение по меньшей мере один агент, выбранный по меньшей мере из одного антагониста TNF (например, такого как, но не ограничивающихся ими, антитело против TNF или его фрагмент, растворимый рецептор TNF или его фрагмент, их гибридные белки или небольшая молекула антагониста TNF), противоревматического средства (например, метотрексата, ауранофина, ауротиоглюкозы, азатиоприна, этанерцепта, тиомалата золота-натрия, сульфата гидроксихлорохина, лефлуномида, сульфасалцина), миорелаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (НСПВС), аналгетика, анестезирующего средства, седативного средства, местного анестезирующего средства, нейромышечного блокатора, противомикробного средства (например, аминогликозида, противогрибкового средства, антипаразитарного средства, противовирусного средства, карбапенема, цефалоспорина, фторхинолона, макролида, пенициллина, сульфонамида, тетрациклина и других противомикробных средств), средства против псориаза, кортикостероида, анаболического стероида, ассоциированного с диабетом агента, минералов, питательного средства, тиреоидного фактора, витамина, кальцийассоциированного гормона, средства против диареи, средства против кашля, противорвотного средства, противоязвенного средства, слабительного средства, антикоагулянта, эритропоэтина (например, эпоэтина альфа), филграстима (например, G-CSF, Neupogen), сарграмостима (GM-CSF, лейкина), иммунизирующего средства, иммуноглобулина, иммунодепрессанта (например, базиликсимаба, циклоспорина, даклицумаба), гормона роста, гормонзаместительного лекарственного средства, модулятора рецептора эстрогена, мидриатического средства, средства против циклоплегии, алкилирующего агента, антиметаболита, митотического ингибитора, радиофармацевтического препарата, антидепрессанта, средства против маниакального психоза, антипсихотического средства, анксиолитика, гипнотического средства, симпатомиметика, стимулятора, донепецила, такрина, противоастматического средства, бета-агониста, стероида для ингаляции, ингибитора лейкотриена, метилксантина, кромолина, эпинефрина или его аналога, дорназы альфа (пульмозима), цитокина или антагониста цитокина. Неограничивающими примерами таких цитокинов являются любой из IL-1 - IL-23. Подходящие дозы хорошо известны специалистам. См., например, публикации Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange, Stamford, CT (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, CA (2000)), каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Указанными противораковыми или противоинфекционными средствами могут быть также молекулы токсина, которые ассоциированы, связаны, совместно приготовлены или совместно вводятся по меньшей мере с одним антителом согласно изобретению. Такой токсин может, но необязательно, селективного уничтожать патологические клетки или ткани. Патологическими клетками могут быть раковые или другие клетки. Такими токсинами могут быть, но не ограничиваются ими, очищенный или рекомбинантный токсин или его фрагмент, содержащий по меньшей мере один функциональный цитотоксический домен токсина, например, выбранный по меньшей мере из группы, состоящей из рицина, дифтерийного токсина, токсина яда или бактериального токсина. Термин "токсин" также включает эндотоксины и экзотоксины, продуцируемые любыми природными, мутантными или рекомбинантными бактериями или вирусами, которые могут вызывать любое патологическое состояние у человека и у других млекопитающих, включая токсический шок, который может приводить к смерти. Такими токсинами могут быть, но не ограничиваются ими, энтеротоксигенный термочувствительный энтеротоксин E.coli (LT), термостабильный энтеротоксин (ST), цитотоксин Shigella, энтеротоксины Aeromonas, токсин-1, ассоциированный с синдромом токсического шока (TSST-1), стафилококковый энтеротоксин А (SEA), В (SEB) или С (SEC), стрептококковые энтеротоксины и т.п. Такими бактериями являются, но не ограничиваются ими, штаммы бактерий вида энтеротоксигенной E.coli (ЕТЕС), энтерогеморрагической E.coli (например, штаммы серотипа 0157:Н7), вида стафилококков (например, Staphylococcus aureus, Staphylococcus pyogenes), вида Shigella (например, Shigelladysenteriae, Shigella flexneri, Shigella boydii и Shigella sonnei), вида Salmonella (например, Salmonella typhi, Salmonella cholerasuis, Salmonella enteritidis), вида Clostridium (например, Clostridium perfringens, Clostridium dificile, Clostridium botulinum), вида Camphlobacter (например, Camphlobacter jejuni, Camphlobacter fetus), вида Heliobacter (например, Heliobacter pylori), вида Aeromonas (например, Aeromonas sobria, Aeromonas hydrophilia, Aeromonas caviae), Pleisomonas shigelloides, Yersina enterocolitica, вида Vibrios (например, Vibrios cholerae, Vibrios parahemolyticus), вида Klebsiella, Pseudomonas aeruginosa и Streptococcus. См., например, публикации Stein, ed., INTERNAL MEDICINE, 3rd ed., pp.1-13, Little, Brown and Co., Boston, (1990); Evans et al., eds., Bacterial Infections of Humans: Epidemiology and Control, 2d. Ed., pp.239-254, Plenum Medical Book Co., New York (1991); Mandell et al., Principles and Practice of Infectious Diseases, 3d. Ed., Churchill Livingstone, New York (1990); Berkow et al., eds., The Merck Manual, 16th edition, Merck and Co., Rahway, N.J., 1992; Wood et al., FEMS Microbiology Immunology, 76:121-134 (1991); Marrack et al., Science, 248:705-711 (1990), содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Соединения, композиции или комбинации анти-IL-6-антител согласно изобретению могут, кроме того, содержать по меньшей мере одно подходящее вспомогательное средство, такое как, но не ограничивающееся ими, разбавитель, связующий агент, стабилизатор, буферы, соли, липофильные растворители, консервант, адъювант или т.п. Предпочтительными являются фармацевтически приемлемые вспомогательные средства. Неограничивающие примеры и методы получения указанных стерильных растворов хорошо известны специалистам, например, такие как, но не ограничивающиеся ими, примеры и методы, описанные в руководстве Gennaro, Ed., Remington's Pharmaceutical Sciences 18th Edition, Mack Publishing. Co. (Easton, PA) 1990. Фармацевтически приемлемые носители могут быть выбраны из традиционных носителей, которые являются подходящими для данного способа введения и обеспечивают растворимость и/или стабильность композиции анти-IL-6-антитела, его фрагмента или варианта и которые хорошо известны специалистам или описаны в настоящей заявке.
Фармацевтическими наполнителями и добавками, используемыми в композиции согласно изобретению, являются, но не ограничиваются ими, белки, пептиды, аминокислоты, липиды и углеводы (например, сахара, включая моносахариды, ди-, три-, тетра- и олигосахариды; дериватизированные сахара, такие как альдитолы, альдоновые кислоты, этерифицированные сахара и т.п.; и полисахариды или полимеры сахаров), которые могут присутствовать отдельно или в комбинации и составляют 1-99,99% по массе или объему композиции. Примерами белковых наполнителей являются сывороточный альбумин, такой как альбумин человеческой сыворотки (HSA), рекомбинантный человеческий альбумин (rHA), желатин, казеин и т.п. Репрезентативными аминокислотами/компонентами антитела, которые также могут обладать забуферивающей способностью, являются аланин, глицин, аргинин, бетаин, гистидин, глутаминовая кислота, аспарагиновая кислота, цистеин, лизин, лейцин, изолейцин, валин, метионин, фенилаланин, аспартам и т.п. Предпочтительной аминокислотой является глицин.
Углеводными наполнителями, подходящими для использования в настоящем изобретении, являются, например, моносахариды, такие как фруктоза, мальтоза, галактоза, глюкоза, D-манноза, сорбоза и т.п.; дисахариды, такие как лактоза, сахароза, трегалоза, целлобиоза и т.п.; полисахариды, такие как раффиноза, мелезитоза, мальтодекстрины, декстраны, крахмалы и т.п.; и альдитолы, такие как маннит, ксилит, мальтит, лактит, ксилитолсорбит (глюцит), миоинозит и т.п. Предпочтительными углеводными наполнителями, используемыми в настоящем изобретении, являются маннит, трегалоза и раффиноза.
Композиции анти-IL-6-антител могут также включать буфер или рН-корректирующий агент; при этом буфером обычно является соль, полученная из органической кислоты или органического основания. Репрезентативными буферами являются соли органических кислот, такие как соли лимонной кислоты, аскорбиновой кислоты, глюконовой кислоты, угольной кислоты, винной кислоты, янтарной кислоты, уксусной кислоты или фталевой кислоты; трис, гидрохлорид трометанина или фосфатные буферы. Предпочтительными буферами, используемыми в композициях согласно изобретению, являются соли органических кислот, такие как цитрат.
Кроме того, композиции анти-IL-6-антител согласно изобретению могут включать полимерные наполнители/добавки, такие как поливинилпирролидоны, фиколлы (полимерный сахар), декстраны (например, циклодекстрины, такие как 2-гидроксипропил-β-циклодекстрин), полиэтиленгликоли, отдушки, противомикробные агенты, подсластители, антиоксиданты, антистатики, поверхностно-активные вещества (например, полисорбаты, такие как "Твин 20" и "Твин 80"), липиды (например, фосфолипиды, жирные кислоты), стероиды (например, холестерин) и хелатообразующие агенты (например, EDTA).
Эти и другие известные фармацевтические наполнители и/или добавки, подходящие для использования в композициях анти-IL-6-антител согласно изобретению или их частей или вариантов, известны специалистам и, например, перечислены в руководстве "Remington: The Science & Practice of Pharmacy", 19th ed., Williams & Williams (1995) и в руководстве "Physician Desk Reference", 52th ed., Medical Economics, Montvale, NJ (1998), содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки. Предпочтительными носителями или наполнителями являются углеводы (например, сахариды и альдитолы) и буферы (например, цитрат) или полимерные агенты.
Препараты
Как указывалось выше, настоящее изобретение относится к стабильным композициям, которые, предпочтительно, представляют собой фосфатный буфер с физиологическим раствором или с выбранной солью, а также к растворам и композициям, содержащим консервант, а также к консервантсодержащим композициям для многократного использования, подходящим для применения в фармацевтике или ветеринарии, и содержащим по меньшей мере одно анти-IL-6-антитело в фармацевтически приемлемой композиции. Композиции с добавлением консерванта содержат по меньшей мере один известный консервант или консервант, необязательно выбранный из группы, состоящей по меньшей мере из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, нитрита фенилртути, феноксиэтанола, формальдегида, хлорбутанола, хлорида магния (например, гексагидрата), алкилпарабена (метил-, этил-, пропил-, бутилпарабена и т.п.), хлорида бензалкония, хлорида бензэтония, дегидроацетата натрия и тимерозала или их смесей в водном разбавителе. Как известно специалистам, может быть использована любая подходящая концентрация или смесь в количестве от 0,001 до 5% или в любых интервалах, входящих в указанные пределы, или величину в указанных интервалах, такую как, но не ограничивающуюся ими, 0,001, 0,003, 0,005, 0,009, 0,01, 0,02, 0,03, 0,05, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1, 9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,3, 4,5, 4,6, 4,7, 4,8, 4,9 или любой промежуточный интервал или величина в этом интервале. Неограничивающими примерами являются консерванты: 0,11-2% м-крезол (например, 0,2, 0,3, 0,4, 0,5, 0,9, 1,0%), 0,1-3% бензиловый спирт (например, 0,5, 0,9, 1,1, 1,5, 1,9, 2,0, 2,5%), 0,001-0,5% тимерозал (например, 0,005, 0,01%), 0,001-2,0% фенол (например, 0,05, 0,25, 0,28, 0,5, 0,9, 1,0%), 0,0005-1,0% алкилпарабен(ы) (например, 0,00075, 0,0009, 0,001, 0,002, 0,005, 0,0075, 0,009, 0,01, 0, 02, 0,05, 0,075, 0,09, 0,1, 0,2, 0,3, 0,5, 0,75, 0,9, 1,0%) и т.п.
Как указывалось выше, настоящее изобретение относится к промышленному изделию, содержащему упаковочный материал и по меньшей мере один сосуд, содержащий раствор по меньшей мере одного анти-IL-6-антитела с выбранными буферами и/или консервантами, необязательно, в водном разбавителе, где указанный упаковочный материал имеет этикетку, на которой указано, что такой раствор может храниться в течение 1, 2, 3, 4, 5, 6, 9, 12, 18, 20, 24, 30, 36, 40, 48, 54, 60, 66, 72 часов или более. Настоящее изобретение также относится к промышленному изделию, содержащему упаковочный материал, первый сосуд, включающий по меньшей мере одно лиофилизованное анти-IL-6-антитело, и второй сосуд, включающий водный разбавитель для выбранного буфера или консерванта, где указанный упаковочный материал имеет этикетку с инструкцией для пациента по разведению по меньшей мере одного анти-IL-6-антитела в водном разбавителе для получения раствора, который может храниться в течение двадцати четырех часов или более.
По крайней мере, одно анти-IL-6-антитело, используемое в соответствии с настоящим изобретением, может быть получено рекомбинантными способами, включая продуцирование указанного антитела из клеток млекопитающих или из трансгенных препаратов, либо оно может быть выделено из других биологических источников, как описано в настоящей заявке или в литературе.
Дозы по меньшей мере одного анти-IL-6-антитела в продукте согласно изобретению включают количества, полученные после разведения указанного антитела, если оно присутствует в водной/безводной системе, то есть концентрации, составляющие примерно от 1,0 мкг/мл до 1000 мг/мл, хотя могут быть использованы более низкие и более высокие концентрации в зависимости от выбранного носителя для доставки, например состав раствора будет зависеть от методов введения, например посредством чрескожного пластыря или пульмонального, трансмукозального или осмотического введения, или введения с помощью микронасоса.
Кроме того, водный разбавитель, предпочтительно, но необязательно, содержит фармацевтически приемлемый консервант. Предпочтительными консервантами являются консерванты, выбранные из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, алкилпарабена (метил-, этил-, пропил-, бутилпарабена и т.п.), хлорида бензалкония, хлорида бензэтония, дегидроацетата натрия и тимерозала или их смесей. Концентрация консерванта, используемого в указанной композиции, представляет собой концентрацию, достаточную для достижения противомикробного эффекта. Такие концентрации зависят от конкретно выбранного консерванта и могут быть легко определены любым специалистом.
В указанный разбавитель могут быть, предпочтительно, но необязательно, добавлены и другие добавки, например изотонические агенты, буферы, антиоксиданты, усилители действия консервантов. Изотонический агент, такой как глицерин, обычно используется в известных концентрациях. Для улучшения коррекции рН предпочтительно добавить физиологически приемлемый буфер. Указанные композиции могут иметь рН в широком интервале, таком как примерно рН 4-10, предпочтительно примерно рН 5-9, а наиболее предпочтительно примерно рН 6,0-8,0. Предпочтительно, чтобы композиции согласно изобретению имели рН примерно от 6,8 до 7,8. Предпочтительными буферами являются фосфатные буферы, наиболее предпочтительным является фосфат натрия, а в частности забуференный фосфатом физиологический раствор (PBS).
Для снижения агрегации в препараты или композиции могут быть, но необязательно, включены и другие добавки, такие как фармацевтически приемлемые солюбилизаторы, например Твин 20 (сорбитанмонолаурат полиоксиэтилена (20)), Твин 40 (сорбитанмонопальмитат полиоксиэтилена (20)), Твин 80 (сорбитанмоноолеат полиоксиэтилена (20)), Плюроник F68 (блоксополимеры полиоксиэтилена и полиоксипропилена) и ПЭГ (полиэтиленгликоль) или неионогенные поверхностно-активные вещества, такие как полисорбат 20 или 80 или полоксамер 184 или 188, полимеры Плюроник®, другие блоксополимеры и хелатообразующие агенты, такие как EDTA и EGTA. Эти добавки являются особенно подходящими в том случае, если для введения композиции используется насос или пластиковый контейнер. Присутствие фармацевтически приемлемого поверхностно-активного вещества снижает способность указанного белка к агрегации.
Композиции согласно изобретению могут быть получены способом, предусматривающим смешивание по меньшей мере одного анти-IL-6-антитела и консерванта, выбранного из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, алкилпарабена (метил-, этил-, пропил-, бутилпарабена и т.п.), хлорида бензалкония, хлорида бензэтония, дегидроацетата натрия и тимерозала или их смесей, в водном разбавителе. Смешивание по меньшей мере одного анти-IL-6-антитела и консерванта в водном разбавителе осуществляют с использованием стандартных процедур растворения и смешивания. Например, для приготовления подходящей композиции предварительно определенное количество по меньшей мере одного анти-IL-6-антитела в забуференном растворе объединяют с нужным консервантом в забуференном растворе в количествах, достаточных для достижения нужных концентраций белка и консерванта. Каждый специалист может внести изменения в эту процедуру по своему усмотрению. Так, например, такими факторами, которые могут быть оптимизированы для получения данной концентрации и для используемых способов введения, являются порядок добавления компонентов, независимо от используемых дополнительных добавок, температура и рН, при которых получают данную композицию.
Заявленные композиции могут быть введены пациентам в виде очищенных растворов или в виде двойных сосудов, содержащих сосуд по меньшей мере с одним лиофилизованным анти-IL-6-антителом, которое разводят содержимым второго сосуда, включающим воду, консервант и/или наполнители, предпочтительно, фосфатный буфер и/или физиологический раствор и выбранную соль в водном разбавителе. Любой один сосуд с раствором или двойной сосуд, необходимый для разведения, может быть использован многократно и может быть достаточным для проведения одного или множества курсов лечения пациента, и таким образом может быть обеспечен более удобный режим лечения, чем те режимы, которые обычно используются в настоящее время.
Заявленные в настоящем изобретении промышленные изделия могут быть использованы для однократного введения или введения в течение двадцати четырех часов или более. В соответствии с этим, заявленные в настоящем изобретении промышленные изделия имеют значительные преимущества для пациента. Композиции согласно изобретению могут, но необязательно, надежно храниться при температурах примерно от 2 до 40°С и сохранять биологическую активность белка в течение более длительных периодов времени, а поэтому на этикетке упаковки может быть указано, что данный раствор может храниться и/или использоваться в течение 6, 12, 18, 24, 36, 48, 72 или 96 часов или более. При использовании разбавителя с консервантом на такой этикетке может быть указан срок использования, составляющий до 1-12 месяцев, полгода, полтора года и/или два года.
Растворы, содержащие по меньшей мере одно анти-IL-6-антитело согласно изобретению, могут быть получены способом, предусматривающим смешивание по меньшей мере одного антитела в водном разбавителе. Смешивание осуществляют в соответствии со стандартными процедурами растворения и смешивания. Так, например, для получения подходящего разбавителя определенное количество по меньшей мере одного антитела в воде или в буфере объединяют с количеством, достаточным для получения нужных концентраций белка и, необязательно, консерванта или буфера. Каждый специалист может внести изменения в эту процедуру по своему усмотрению. Так, например, такими факторами, которые могут быть оптимизированы для получения данной концентрации и для используемых способов введения, являются порядок добавления компонентов, независимо от используемых дополнительных добавок, температура и рН, при которых получают данную композицию.
Заявленные продукты могут быть введены пациентам в виде очищенных растворов или в виде двойных сосудов, содержащих сосуд по меньшей мере с одним лиофилизованным анти-IL-6-антителом, которое разводят содержимым второго сосуда, включающим водный разбавитель. Любой один или двойной сосуд с раствором, необходимым для разведения, может быть использован многократно и может быть достаточным для проведения одного или множества циклов лечения пациента, и таким образом может быть обеспечен более удобный режим лечения, чем те режимы, которые обычно используются в настоящее время.
Заявленные продукты могут доставляться пациентам через аптеки, клиники или другие аналогичные организации и лечебные учреждения в виде очищенных растворов или в виде двойных сосудов, содержащих сосуд по меньшей мере с одним лиофилизованным анти-IL-6-антителом, которое разводят содержимым второго сосуда, включающим водный разбавитель. В данном случае очищенный раствор может иметь объем до одного литра или более и помещен в большую емкость, из которой один раз или многократно могут быть взяты небольшие порции по меньшей мере одного раствора антитела для их переноса в менее крупные емкости и для поставки в аптеки или клиники с последующей их доставкой потребителям и/или пациентам.
Известными устройствами, содержащими указанные системы в одном сосуде, являются пэн-инжекторы (инжекторы перьевого типа) для доставки растворов, таких как BD Pens, BD Autojector®, Humaject® NovoPen®, BD®Pen, AutoPen®, и OptiPen®, GenotropinPen®, Genotronorm Pen®, Humatro Pen®, RecoPen®, Roferon Pen®, Biojector®, iject®, J-tip Needle-Free Injector®, Intraject®, Medi-Ject®, например, изготовленные или разработанные Becton Dickensen (Franklin Lakes, NJ, www.bectondickenson.com), Disetronic (Burgdorf, Switzerland, www.disetronic.com; Bioject, Portland, Oregon (www.bioject.com); National Medical Products, Weston Medical (Peterborough, UK, www.weston-medical.com), Medi-Ject Corp (Minneapolis, MN, www.mediject.com). Известными устройствами, содержащими указанные системы в двух сосудах, являются системы типа пэн-инжекторов для разведения лиофилизованного лекарственного средства в картридже в целях доставки в виде разведенного раствора, такого как HumatroPen®.
Заявленные продукты согласно изобретению включают упаковочный материал. Помимо информации, требуемой регуляторными органами, упаковочный материал обеспечивает условия, при которых может быть использован данный продукт. Упаковочный материал согласно изобретению включает инструкции для пациента по разведению по меньшей мере одного анти-IL-6-антитела в водном разбавителе для получения раствора и для использования данного раствора в течение периода времени 2-24 часа или более для продукта в водной/безводной системе с двумя сосудами. Для продукта в растворе с одним сосудом, на этикетке должно быть указано, что такой раствор может быть использован в течение периода времени 2-24 часа или более. Заявленные в настоящем изобретении продукты могут быть использованы в качестве фармацевтического продукта для введения человеку.
Композиции согласно изобретению могут быть получены способом, который предусматривает смешивание по меньшей мере одного анти-IL-6-антитела и выбранного буфера, предпочтительно, фосфатного буфера, содержащего физиологический раствор или выбранную соль. Смешивание по меньшей мере одного антитела и буфера в водном разбавителе осуществляют в соответствии со стандартными процедурами растворения и смешивания. Так, например, для получения подходящего препарата определенное количество по меньшей мере одного антитела в воде или в буфере объединяют с количеством нужного забуферивающего агента в воде, достаточным для получения нужных концентраций белка и буфера. Каждый специалист может внести изменения в эту процедуру по своему усмотрению. Так, например, такими факторами, которые могут быть оптимизированы для получения данной концентрации и для используемых способов введения, являются порядок добавления компонентов, независимо от используемых дополнительных добавок, температура и рН, при которых получают данную композицию.
Заявленные стабильные или консервантсодержащие композиции могут быть введены пациентам в виде очищенных растворов или в виде двойных сосудов, содержащих сосуд по меньшей мере с одним лиофилизованным анти-IL-6-антителом, которое подвергается разведению содержимым второго сосуда, включающим консервант или буфер и наполнители в водном разбавителе. Любой один сосуд с раствором или двойной сосуд, необходимый для разведения, может быть многократно использован и может быть достаточным для проведения одного или множества курсов лечения пациента, и таким образом может быть обеспечен более удобный режим лечения, чем те режимы, которые обычно используются настоящее время.
По крайней мере, одно анти-IL-6-антитело в описанных здесь стабильных или консервантсодержащих композициях или растворах может быть введено пациенту в соответствии с настоящим изобретением различными методами доставки, включая подкожные (s.c.) или внутримышечные (i.m.) инъекции, чрескожное, пульмональное или трансмукозальное введение, введение с помощью имплантата, осмотического насоса, картриджа, микронасоса, или другими известными специалистам методами, хорошо описанными в литературе.
Терапевтические применения
Настоящее изобретение также относится к способу облегчения или лечения по меньшей мере одного IL-6-ассоциировнного заболевания в клетке, ткани, органе, у животного или пациента, известного специалистам или описанного в настоящей заявке, с использованием по меньшей мере одного "двойного" антитела против интегрина согласно изобретению.
Настоящее изобретение также относится к способу облегчения или лечения по меньшей мере одного IL-6-ассоциировнного заболевания в клетке, ткани, органе, у животного или пациента, включая, но не ограничиваясь ими, ожирение, иммуноассоциированное заболевание, сердечнососудистое заболевание, инфекционное заболевание, злокачественное заболевание или неврологическое заболевание.
Настоящее изобретение также относится к способу облегчения или лечения по меньшей мере одного иммуноассоциированного заболевания в клетке, ткани, органе, у животного или пациента, включая, но не ограничиваясь ими, ревматоидный артрит, ювенильный ревматоидный артрит, внезапно начавшийся системный ювенильный ревматоидный артрит, псориазный артрит, анкилозирующий спондилит, язву желудка, серонегативные артритопатии, остеоартрит, воспалительное заболевание кишечника, язвенный колит, системную красную волчанку, антифосфолипидный синдром, иридоциклит/увеит/неврит зрительного нерва, идиопатический фиброз легких, системный васкулит/гранулематоз Вегенера, саркоидоз, орхит/ операции по реверсивной вазоэктомии, аллергические/атопические заболевания, астму, аллергический ринит, экзему, аллергический контактный дерматит, аллергический конъюнктивит, аллергический пневмонит, трансплантаты, отторжение трансплантированного органа, реакцию "трансплантат против хозяина", синдром системного воспалительного ответа, септический синдром, сепсис, вызванный грам-положительными бактериями, сепсис, вызванный грам-отрицательными бактериями, сепсис, отрицательный по культуре, грибковый сепсис, нейропеническая лихорадка, уросепсис, менингококцемию, травму/геморрагию, ожоги, облучение ионизирующим излучением, острый панкреатит, респираторный дистресс-синдром взрослых, ревматоидный артрит, алкогольный гепатит, хронические воспалительные патологии, саркоидоз, болезнь Крона, серповидно-клеточная анемия, диабет, нефроз, атопические заболевания, реакцию гиперчувствительности, аллергический ринит, сенная лихорадка, хронический ринит, конъюктивит, эндометриоз, астму, крапивницу, системную анафилаксию, дерматиты, пернициозную анемию, гемолитическую болезнь, тромбоцитопению, отторжение любого трансплантированного органа или ткани, отторжение трансплантированной почки, отторжение трансплантированного сердца, отторжение трансплантированной печени, отторжение трансплантированной поджелудочной железы, отторжение трансплантированного легкого, отторжение трансплантированного костного мозга (ВМТ), отторжение аллотрансплантата кожи, отторжение хрящевого трансплантата, отторжение костного трансплантата, отторжение трансплантата тонкого кишечника, отторжение имплантата тимуса плода, отторжение трансплантата паращитовидной железы, отторжение ксенотрансплантата любого органа или ткани, отторжение аллотрансплантата, анти-рецепторные реакции гиперчувствительности, болезнь Грейвса, болезнь Рейно, инсулинрезистентный диабет типа В, астму, тяжелую миастению, опосредуемую антителом цитотоксичность, реакции гиперчувствительности типа III, системную красную волчанка, синдром POEMS (полинейропатию, органомегалию, эндокринопатию, гаммапатию, ассоциированную с дефицитом моноклональных антител и синдром изменению кожи) полинейропатию, органомегалию, эндокринопатию, гаммапатию, ассоциированную с дефицитом моноклональных антител и синдром изменения кожи, антифосфолипидный синдром, пузырчатку, склеродермию, смешанную соединительнотканную болезнь, идиопатическую болезнь Адиссона, сахарный диабет, хронический активный гепатит, первичный биллиарный цирроз, витилиго, васкулит, пост-MI-кардиотомный синдром, гиперчувствительность типа IV, контактный дерматит, аллергический пневмонит, отторжение аллотрансплантата, гранулемы, вызываемые внутриклеточными микроорганизмами, чувствительность к лекарственным средствам, метаболическую/идиопатическую болезнь, болезнь Вильсона, гемахроматоз, дефицит альфа-1-антитрипсина, диабетическую ретинопатию, тиреоидит Хашимото, остеопороз, нарушение системы гипоталамус-гипофиз-надпочечники, первичный билиарный цирроз, тироидит, энцефаломиелит, кахексию, кистозный фиброз, хроническое заболевание легких у новорожденных, хроническую обструктивную болезнь легких (ХОБЛ), наследственный гемофагоцитарный лимфогистиоцитоз, кожные заболевания, псориаз, алопецию, нефротический синдром, нефрит, гломерулярный нефрит, острую почечную недостаточность, гемодиализ, уремию, токсикоз, преэкламсию, okt3-терапию, анти-сd3-терапию, цитокиновую терапию, химиотерапию, терапию путем облучения (например, включая, но не ограничиваясь ими, астению, анемию, кахексию и т.п.), хроническую интоксикацию салицилатами, апноэ во сне, ожирение, сердечную недостаточность, синуситы, воспалительные заболевания кишечника и т.п. См., например, руководства Merck Manual, 12th-17th Editions, Merck & Company, Rahway, NJ (1972, 1977, 1982, 1987, 1992, 1999), Pharmacotherapy Handbook, Wells et al., eds., Second Edition, Appleton and Lange, Stamford, Conn. (1998, 2000), каждое из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Настоящее изобретение также относится к способу облегчения или лечения по меньшей мере одного инфекционного заболевания в клетке, ткани, органе, у животного или пациента, включая, но не ограничиваясь ими, по меньшей мере одно из острых или хронических бактериальных инфекций, острых или хронических паразитарных инфекций или инфекционных процессов, включая бактериальные, вирусные и грибковые инфекции, ВИЧ-инфекции/ВИЧ-нейропатию, минингит, гепатит (А, В, С или т.п.), септический артрит, перитонит, пневмонию, эпиглоттит, инфекцию, вызываемую E.coli 0157:h7, гемолилический уремический синдром/тромболитическую тромбоцитопеническую пурпуру, малярию, геморрагическую лихорадку Денге, лейшманиоз, лепру, синдром септического шока, стрептококковый миозит, газовую гангрену, заболевание, вызываемое бактерией Mycobacteriumtuberculosis, внутриклеточную инфекцию, вызываемую Mycobacterium avium, пневмонию, вызываемую Pneumocyctis carinii, воспаление тазовых органов, орхит/эпидидимит, болезнь, вызываемую бактерией Legionella, болезнь Лима, грипп А, заболевание, вызываемое вирусом Эпштейна-Барра, витальный гемафагоцитарный синдром, витальный энцефалит/ассептический менингит и т.п.
Настоящее изобретение также относится к способу облегчения или лечения по меньшей мере одного инфекционного заболевания в клетке, ткани, органе, у животного или пациента, включая, но не ограничиваясь ими, по меньшей мере одно из следующих заболеваний: лейкоз, острый лейкоз, острый лимфобластный лейкоз (ОЛЛ), В-клеточный, Т-клеточный или FAB-ОЛЛ, острый миелоидный лейкоз (ОМЛ), хронический миелоцитарный лейкоз (ХМЛ), хронический лимфоцитарный лейкоз (ХЛЛ), лейкемический ретикулоэндотелиоз, миелодисплазия (МД), лимфома, болезнь Ходжкина, злокачественная лимфома, не-ходжскинская лимфома, лимфома Беркитта, множественная миелома, саркома Капоши, карцинома толстой и прямой кишки, карцинома поджелудочной железы, карцинома носоглотки, злокачественный гистоцитоз, паранеопластический синдром/гиперкальцемия при злокачественных опухолях, солидные опухоли, аденокарцинома, саркома, злокачественная меланома, гемангиома, метастазы рака, ассоциированная с раком резорбция кости, ассоциированные с раком боли в кости и т.п. Указанный способ может быть, но необязательно, использован в комбинации с лучевой терапией, с введением антиангиогенного средства, химиотерапевтических средств, ингибитора фарнезилтрансферазы или т.п., осуществляемых до, во время или после введения указанного антитела против IL-6.
В частности, настоящее изобретение относится к способу облегчения или лечения аутоиммунных заболеваний, таких как ревматоидный артрит, системная красная волчанка и аутоиммунный инсулинзависимый диабет; лечения бактериальных инфекций; лечения септического шока, вызванного бактериальными инфекциями; лечения вирусных инфекций; лечения рака, такого как множественная миелома; подавления метастазов рака; снижения кахексии при раке; и лечения воспалительных заболеваний, таких как мезангиальный пролиферирующий гломерулонефрит, путем введения антитела согласно изобретению. Указанный способ может, но необязательно, предусматривать введение эффективного количества по меньшей мере одной композиции или фармацевтической композиции, содержащей по меньшей мере одно анти-IL-6-антитело, в клетку, в ткань, в орган, животному или пациенту, нуждающемуся в таком ослаблении симптомов, лечении или терапии. Показания для лечения с использованием анти-IL-6-терапии описаны в нижеследующих работах, которые вводятся в настоящее описание посредством ссылки: Van Snick, "Interleukin-6: An Overview", Ann. Rev. Immunol., 8:253-278 (1990); Campbell et al., "Essential Role for Interferon-gamma. And Interleukin-6 in Autoimmune Insulin-Dependent Diabetes in NOD/Wehi Mice," J. Clin. Invest., 87:739-742 (1991); Heinrich et al.,:Interleukin-6 Monoclonal Antibody Therapy for a Patient with Plasma Cell Leukemia", Blood, 78(5):1198-1204 (1991); Starnes et al., "Anti-IL-6 Monoclonal Antibodies Protect Against Lethal Escherichia coli Infection and Lethal Tumor Necrosis Factor-alpha. Challenge in Mice", J. Immunol., 145(12):4185-4191 (1990); Strassman et al., "Evidence for the Involvement of Interleukin 6 in Experimental Cancer Cachexia", J. Clin. Invest., 89:1681-1684 (1992).
Любой способ согласно изобретению может предусматривать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно анти-IL-6-антитело, в клетку, в ткань, в орган, животному или пациенту, нуждающемуся в таком ослаблении симптомов, лечении или терапии. Кроме того, такой способ может, но необязательно, предусматривать совместное введение или проведение комбинированной терапии для лечения указанных иммунных заболеваний или злокачественных заболеваний, где введение по меньшей мере одного указанного анти-IL-6-антитела, его определенной части или варианта, кроме того, осуществляют до, во время и/или после введения по меньшей мере одного агента, выбранного из по меньшей мере одного антагониста TNF (например, такого как, но не ограничивающегося ими, антитело против TNF или его фрагмент, растворимый рецептор TNF или его фрагмента, их гибридные белки или небольшая молекула антагониста TNF), анти-IL-18-антитела или его фрагмент, небольшой молекулы антагониста IL-18 или белка, связывающегося с рецептором IL-18, анти-IL-1-антитела (включая IL-1 альфа и IL-1 бета) или его фрагмента, растворимого антагониста рецептора IL-1, противоревматического средства (например, метотрексата, ауранофина, ауротиоглюкозы, азатиоприна, этанерцепта, тиомалата золота-натрия, сульфата гидроксихлорохина, лефлуномида, сульфасалацина, лучевой терапии, антиангиогенного агента, химиотерапевтического средства, талидомида), миорелаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (НСПВС), аналгетика, анестезирующего средства, седативного средства, местного анестезирующего средства, нейромышечного блокатора, противомикробного средства (например, аминогликозида, противогрибкового средства, антипаразитарного средства, противовирусного средства, карбапенема, цефалоспорина, флурохинолона, макролида, пенициллина, сульфонамида, тетрациклина, других противомикробных средств), средства против псориаза, кортикостероида, анаболического стероида, ассоциированного с диабетом агента, минералов, питательного средства, тиреоидного фактора, витамина, кальцийассоциированного гормона, эритропоэтина (например, эпоэтина альфа), филграстима (например, G-CSF, Neupogen), сарграмостима (GM-CSF, лейкина), иммунизирующего средства, иммуноглобулина, иммунодепрессанта (например, базиликсимаба, циклоспорина, даклицумаба), гормона роста, гормонзаместительного лекарственного средства, модулятора рецептора эстрогена, мидриатического средства, средства против циклоплегии, алкилирующего агента, антиметаболита, митотического ингибитора, радиофармацевтического препарата, антидепрессанта, средства против маниакального психоза, антипсихотического средства, анксиолитика, гипнотического средства, симпатомиметика, стимулятора, донепецила, такрина, противоастматического средства, бета-агониста, стероида для ингаляции, ингибитора лейкотриена, метилксантина, кромолина, эпинефрина или его аналога, дорназы альфа (пульмозима), цитокина или антагониста цитокина. Подходящие дозы хорошо известны специалистам. См., например, публикации Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange, Stamford, CT (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, CA (2000), каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Антагонистами TNF, подходящими для композиций, комбинированной терапии, совместного введения и для использования в устройствах или способах согласно изобретению (также включая по меньшей мере одно антитело, его определенную часть и вариант согласно изобретению), являются, но не ограничиваются ими, анти-TNF-антитела, его антигенсвязывающие фрагменты и рецепторные молекулы, которые специфически связываются с TNF; соединения, которые предотвращают и/или ингибируют синтез TNF, секрецию TNF или их действие на клетки-мишени, такие как талидомид, тенидап, ингибиторы фосфодиэстеразы (например, пентоксифиллин и ролипам), агонисты аденозинового рецептора А2b и стимуляторы аденозинового рецептора А2b; соединения, которые предотвращают и/или ингибируют передачу сигнала рецептора TNF, такие как активированные митогеном ингибиторы протеинкиназы (МАР); соединения, которые блокируют и/или ингибируют расщепление мембранного TNF, такие как ингибиторы металлопротеиназы; соединения, которые блокируют и/или ингибируют активность TNF, такие как ингибиторы ангиотензинконвертирующего фермента (АКФ) (например, каптоприл); и которые блокируют и/или ингибируют продуцирование и/или синтез TNF, такие как ингибиторы МАР-киназы.
Используемые здесь термины "антитело против фактора некроза опухоли", "антитело против TNF", "антитело против TNFα" или его фрагмент и т.п. означают антитело, которое снижает, блокирует, ингибирует, отменяет и/или предотвращает активность TNF-α in vitro, in situ и/или, предпочтительно, in vivo. Так, например, подходящее человеческое анти-TNF-антитело согласно изобретению может связываться с TNF-α, и таким антителом являются анти-TNF-антитела, их антигенсвязывающие фрагменты и их определенные мутанты или домены, которые специфически связываются с TNF-α. Подходящее анти-TNF-антитело или его фрагмент могут также снижать, блокировать, отменять, предотвращать, предупреждать и/или ингибировать синтез РНК, ДНК или белка TNF, высвобождение TNF, передачу сигнала рецептора TNF, расщепление мембранного TNF, активность TNF, продуцирование TNF и/или синтез TNF.
Химерное антитело сА2 состоит из антигенсвязывающей вариабельной области высокоаффинного нейтрализующего мышиного антитела IgG1 против человеческого TNF-α, обозначенного А2, и из константных областей человеческого иммуноглобулина IgG1, каппа. Человеческая Fc-область IgG1 усиливает эффекторную функцию аллогенного антитела, увеличивает время его полужизни в сыворотке крови и снижает иммуногенность указанного антитела. Авидность и специфичность к эпитопу химерного антитела сА2 обусловлена вариабельной областью мышиного антитела А2. В конкретном варианте осуществления изобретения предпочтительным источником нуклеиновых кислот, кодирующих вариабельную область мышиного антитела А2, является гибридомная клеточная линия А2.
Химерное антитело А2 (сА2) нейтрализует цитотоксический эффект природного и рекомбинантного человеческого TNF-α дозозависимым способом. Исходя из анализов на связывание химерного антитела сА2 и рекомбинантного человеческого TNF-α была вычислена аффинная константа химерного антитела сА2, которая составляет 1,04×1010М-1. Предпочтительные методы определения специфичности и аффинности моноклонального антитела при конкурентном ингибировании можно найти в публикациях Harlow, et al., antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1988; Colligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc. And Wiley Interscience, New York, (1992-2000); Kozbor et al., Immunol. Today, 4:72-79 (1983); Ausubel et al., eds., Current Protocols in Molecular Biology, Wiley Interscience, New York (1987-2000); и Muller, Meth. Enzymol., 92:589-601 (1983), которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
В конкретном варианте осуществления изобретения мышиное моноклональное антитело А2 продуцируется клеточной линией, обозначенной с134А. Химерное антитело сА2 продуцируется клеточной линией, обозначенной с168А.
Дополнительные примеры моноклональных анти-TNF-антител, которые могут быть использованы в настоящем изобретении, описаны в литературе (см., например, патент США № 5231024; Möller, A et al., Cytokine 2(3):162-169 (1990); заявку США № 07/943852 (поданную 11 сентября 1992); Rathjen et al., Международная публикация № WO 91/02708 (поданная 21 февраля 1991); Rubin et al., патентная публикация ЕРО № 0218868 (опубликованная 22 апреля 1987); Yone et al., патентная публикация ЕРО № 0288088 (26 октября 1988); Liang, et al., Biochem. Biophys. Res. Comm. 137:847-854 (1986); Meager, et al., Hybridoma 6:305-311 (1987); Fendly et al., Hybridoma 6:359-369 (1987); Bringman, et al., Hybridoma 6:489-507 (1987); и Hirai, et al., J. Immunol. Meth. 96:57-62 (1987), каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки).
Молекулы рецептора TNF
Предпочтительными молекулами рецептора TNF, используемыми в настоящем изобретении, являются молекулы, которые связываются с TNFα с высокой аффинностью (см., например, Feldmann et al., международная публикация № WO 92/07076 (опубликованная 30 апреля 1992), Schall et al., Cell 61:361-370 (1990) и Loetscher et al., Cell 61:351-359 (1990), которые во всей своей полноте вводятся в настоящее описание посредством ссылки) и обладают, но необязательно, низкой иммуногенностью. В частности, в настоящем изобретении могут быть использованы поверхностно-клеточные рецепторы TNF 55 кДа (р55 TNF-R) и 75 кДа (р75 TNF-R). В настоящем изобретении также могут быть использованы усеченные формы этих рецепторов, содержащие внеклеточные домены (ECD) указанных рецепторов или их функциональные части (см, например, Corcoran et al., Eur. J. Biochem., 223:831-840 (1994)). Усеченные формы рецепторов TNF, содержащие ECD, были детектированы в моче и в сыворотке в виде белков, ингибирующих связывание 30 кДа- и 40 кДа-TNF-α (Engelmann H. et al., J. Biol. Chem., 265:1531-1536 (1990)). Дополнительными примерами молекул рецепторов TNF, которые могут быть использованы в способах и композициях согласно изобретению, являются мультимерные молекулы рецептора TNF и гибридные молекулы иммунорецептора TNF и их производные, фрагменты или части. Молекулы рецепторов TNF, которые могут быть использованы в настоящем изобретении, характеризуются своей способностью оказывать терапевтическое действие на пациента в течение продолжительных периодов времени с достижением хорошего или очень высокого уровня ослабления симптомов и обладают низкой токсичностью. Достижение таких терапевтических эффектов может быть обусловлено низкой иммуногенностью и/или высокой аффинностью, а также другими, еще не выясненными свойствами.
Мультимерные молекулы рецептора TNF, используемые в настоящем изобретении, содержат весь ECD или функциональную часть ECD двух или более рецепторов TNF, связанных друг с другом одним или несколькими полипептидными линкерами или другими непептидными линкерами, такими как полиэтиленгликоль (ПЭГ). Указанные мультимерные молекулы могут, кроме того, содержать сигнальный пептид секретируемого белка для регуляции экспрессии мультимерной молекулы. Эти мультимерные молекулы и методы их получения были описаны в заявке США № 08/437533 (поданной 9 мая 1995), содержание которой во всей своей полноте вводится в настоящее описание посредством ссылки.
Гибридные молекулы иммунорецептора TNF, используемые в способах и композициях согласно изобретению, содержат по меньшей мере одну часть одной или нескольких молекул иммуноглобулина и всю молекулу или ее функциональную часть одного или нескольких рецепторов TNF. Эти гибридные молекулы иммунорецептора могут быть собраны в виде мономеров, либо гетеро- или гомомультимеров. Гибридные молекулы иммунорецептора могут быть также моновалентными или мультивалентными. Примером такой гибридной молекулы иммунорецептора TNF является гибридный белок "рецептор TNF/IgG". Гибридные молекулы иммунорецептора TNF и методы их продуцирования описаны в литературе (Lesslauer et al., Eur. J. Immunol. 21:2883-2886 (1991); Ashkenazi et al., Proc. Natl. Acad. Sci. USA 88:10535-10539 (1991); Peppel et al., J. Exp. Med. 174:1483-1489 (1991); Kolls et al., Proc. Natl. Acad. Sci. USA 91:215-219 (1994); Butler et al., Cytokine 6(6):616-623 (1994); Baker et al., Eur. J. Immunol. 24:2040-2048 (1994); Beutler et al., патент США № 5447851 и заявка США № 08/442133 (поданная 16 мая 1995), которые во всей своей полноте вводятся в настоящее описание посредством ссылки). Методы получения гибридных молекул иммунорецептора можно найти в патенте США № 5116964; Capon et al., в патенте США № 5225538; и Capon et al., Nature 337:525-531 (1989), которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Функциональный эквивалент, производное, фрагмент или область молекулы рецептора TNF означают часть молекулы рецептора TNF или часть последовательности молекулы рецептора TNF, кодирующую молекулу рецептора TNF, то есть часть молекулы, которая имеет размер и последовательности, достаточные для функционального сходства с молекулами рецептора TNF, и которая может быть использована в настоящем изобретении (которая, например, связывается с TNF с высокой аффинностью и обладает низкой иммуногенностью). Функциональными эквивалентами молекулы рецептора TNF также являются модифицированные молекулы рецептора TNF, которые функционально сходны с молекулами рецептора TNF и которые могут быть использованы в настоящем изобретении (которые, например, связываются с TNF с высокой аффинностью и обладают низкой иммуногенностью). Так, например, функциональный эквивалент молекулы рецептора TNF может содержать "молчащий" кодон или одну или несколько замен, делеций или добавлений аминокислот (например, замену одной кислотной аминокислоты на другую кислотную аминокислоту; или замену одного кодона, кодирующего гидрофобную аминокислоту, на другой кодон, кодирующий ту же самую или другую гидрофобную аминокислоту). См., Ausubel et al., Current Protocols in Molecular Biology, GreenePublisching Associates and Wiley Interscience, New York (1987-2000).
Цитокинами являются любые известные цитокины. См., например, CopewithCytokines.com. Антагонистами цитокинов являются, но не ограничиваются ими, любое антитело, его фрагмент или миметик, любой растворимый рецептор, его фрагмент или миметик, любая небольшая молекула-антагонист или любая их комбинаций.
Терапевтическое лечение
Любой способ согласно изобретению может включать d ct,z способ лечения IL-6-опосредуемого расстройства, предусматривающий введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно анти-IL-6-антитело, в клетку, в ткань, в орган, животному или пациенту, нуждающимся в модуляции, лечении или терапии такого расстройства. Кроме того, такой способ может, но необязательно, предусматривать совместное введение или проведение комбинированной терапии для лечения указанных иммунных заболеваний или злокачественных заболеваний, где введение по меньшей мере одного указанного анти-IL-6-антитела, его определенной части или варианта, кроме того, осуществляют до, во время и/или после введения по меньшей мере одного агента, выбранного по меньшей мере bp одного антагониста TNF (например, такого как, но не ограничивающегося ими, антитело против TNF или его фрагмент, растворимый рецептор TNF или его фрагмент, их гибридные белки или небольшая молекула антагониста TNF), противоревматического средства (например, метотрексата, ауранофина, ауротиоглюкозы, азатиоприна, этанерцепта, тиомалата золота-натрия, сульфата гидроксихлорохина, лефлуномида, сульфасалацина), миорелаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (НСПВС), аналгетика, анестезирующего средства, седативного средства, местного анестезирующего средства, нейромышечного блокатора, противомикробного средства (например, аминогликозида, противогрибкового средства, антипаразитарного средства, противовирусного средства, карбапенема, цефалоспорина, флурохинолона, макролида, пенициллина, сульфонамида, тетрациклина, других противомикробных средств), средства против псориаза, кортикостероида, анаболического стероида, ассоциированного с диабетом агента, минерала, питательного средства, тиреоидного фактора, витамина, кальцийассоциированного гормона, средства против диареи, средства против кашля, противорвотного средства, противоязвенного средства, слабительного средства, антикоагулянта, эритропоэтина (например, эпоэтина альфа), филграстима (например, G-CSF, Neupogen), сарграмостима (GM-CSF, лейкина), иммунизирующего средства, иммуноглобулина, иммунодепрессанта (например, базиликсимаба, циклоспорина, даклицумаба), гормона роста, гормонзаместительного лекарственного средства, модулятора рецептора эстрогена, мидриатического средства, средства против циклоплегии, алкилирующего агента, антиметаболита, митотического ингибитора, радиофармацевтического препарата, антидепрессанта, средства против маниакального психоза, антипсихотического средства, анксиолитика, гипнотического средства, симпатомиметика, стимулятора, донепецила, такрина, противоастматического средства, бета-агониста, стероида для ингаляции, ингибитора лейкотриена, метилксантина, кромолина, эпинефрина или его аналога, дорназы альфа (пульмозима), цитокина или антагониста цитокина.
Обычно лечение патологических состояний осуществляют путем введения эффективного количества или дозы композиции по меньшей мере одного анти-IL-6-антитела, которая в целом или в среднем составляет в пределах по меньшей мере примерно от 0,01 до 500 миллиграммов по меньшей мере одного анти-IL-6-антитела на килограмм массы пациента на одну дозу, а предпочтительно по меньшей мере примерно от 0,01 до 100 миллиграммов антитела/килограмм массы пациента на разовую дозу или дробные дозы, в зависимости от удельной активности антитела, содержащегося в данной композиции. Альтернативно, эффективная сывороточная концентрация может составлять 0,1-5000 мгк/мл на вводимую разовую дозы или вводимые дробные дозы. Подходящие дозы могут быть установлены лечащим врачом и, как известно, зависят от конкретного патологического состояния, удельной активности вводимой композиции и от конкретного пациента, подвергаемого лечению. В некоторых случаях для достижения нужного терапевтического эффекта может оказаться необходимым повторное введение, то есть повторное введение индивидууму конкретно регулируемого или конкретно дозируемого количества, где такое введение индивидууму повторяют до тех пор, пока не будет установлена нужная суточная доза или не будет достигнут нужный эффект.
Предпочтительные дозы, могут, но необязательно, составлять 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 и/или 100-300 мг/кг на одно введение, или любой интервал, величину или фракцию в указанном диапазоне, либо, для достижения нужной концентрации в сыворотке, эти дозы могут составлять 0,1, 0,5, 0,9, 1,0, 1,1, 1,2, 1,5, 1,9, 2,0, 2,5, 2,9, 3,0, 3,5, 3,9, 4,0, 4,5, 4,9, 5,0, 5,5, 5,9, 6,0, 6,5, 6,9, 7,0, 7,5, 7,9, 8,0, 8,5, 8,9, 9,0, 9,5, 9,9, 10, 10,5, 10,9, 11, 11,5, 11,9, 20, 12,5, 12,9, 13,0, 13,5, 13,9, 14,0, 14,5, 4,9, 5,0, 5,5, 5,9, 6,0, 6,5, 6,9, 7,0, 7,5, 7,9, 8,0, 8,5, 8,9, 9,0, 9,5, 9,9, 10, 10,5, 10,9, 11, 11,5, 11,9, 12, 12,5, 12,9, 13,0, 13,5, 13,9, 14, 14,5, 15, 15,5, 15,9, 16, 16,5, 16,9, 17, 17,5, 17,9, 18, 18,5, 18,9, 19, 19,5, 19,9, 20, 20,5, 20,9, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 96, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, и/или 5000 мг/кг на одно введение, или любой интервал, величину или фракцию в указанном диапазоне.
Альтернативно, вводимая доза может варьироваться в зависимости от нужных факторов, таких как факмакодинамические свойства конкретного агента, способ и путь его введения; возраст, состояние здоровья и масса реципиента; природа и тяжесть симптомов, вид сопутствующего лечения, режим лечения и желаемый эффект. Обычно доза активного ингредиента может составлять примерно 0, 1- 100 миллиграммов на килограмм массы тела. В основном, для достижения нужных результатов эффективной является доза, составляющая 0,1-50 миллиграммов, а предпочтительно 0,1-10 миллиграммов на килограмм для введения разовой лекарственной формы или для введения лекарственной формы пролонгированного высвобождения.
Неограничивающим примером является лечение человека или животных, которое может быть осуществлено путем введения однократной дозы или периодического введения дозы по меньшей мере одного антитела согласно изобретению, составляющей 0,1-100 мг/кг, такой как 0, 5, 0,9, 1,0, 1,1, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90 или 100 мг/кг, в день, и вводимой по меньшей мере в один из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 дней, либо альтернативно или дополнительно по меньшей мере в одну из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51 или 52 недель, либо альтернативно или дополнительно по меньшей мере в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 лет или в любой их комбинация с использованием разовых доз, вливания или введения многократных доз.
Лекарственные формы (композиции), подходящие для внутреннего введения, обычно содержат примерно от 0,1 миллиграммов до 500 миллиграммов активного ингредиента в одной разовой форме или в контейнере. В этих фармацевтических композициях активный ингредиент обычно присутствует в количестве примерно 0,5-99,999% по массе всей композиции.
Для парентерального введения указанное антитело может быть приготовлено в виде раствора, суспензии, эмульсии или лиофилизованного порошка, взятого отдельно или в комбинации с фармацевтически приемлемым носителем для парентерального введения. Примерами таких носителей являются вода, физиологический раствор, раствор Рингера, раствор декстрозы и 1-10% альбумин человеческой сыворотки. Могут быть также использованы липосомы и безводные носители, такие как жирные масла. Указанный носитель или лиофилизованный порошок могут содержать добавки, поддерживающие изотоничность (например, хлорид натрия, маннит) и химическую стабильность (например, буферы и консерванты). Указанную композицию стерилизуют известными или подходящими методами.
Подходящие фармацевтические носители описаны в последнем новом издании руководства Remington's Pharmaceutical Sciences, А. Osol, то есть стандартного руководства, используемого специалистами в данной области.
Альтернативное введение
Для введения фармацевтически эффективных количеств по меньшей мере одного анти-IL-6-антитела согласно изобретению могут быть использованы многие известные и разработанные способы введения. Хотя ниже описано пульмональное введение, однако в соответствии с настоящим изобретением аналогичные результаты могут быть достигнуты и с помощью других способов введения.
Анти-IL-6-антитела согласно изобретению могут быть доставлены в носителе в виде раствора, эмульсии, коллоида или суспензии, либо в виде сухого порошка с использованием любых устройств и способов, подходящих для введения путем ингаляции, или других способов, описанных в настоящей заявке или известных специалистам.
Парентеральные композиции и их введение
Композиции для парентерального введения могут содержать стандартные наполнители, такие как стерильная вода или физиологический раствор, полиалкиленгликоли, такие как полиэтиленгликоль, растительные масла, гидрогенизированные нафталины и т.п. Водные или масляные суспензии для инъекций могут быть получены с использованием соответствующего эмульгатора или увлажнителя и суспендирующего агента известными методами. Агентами для инъекций могут быть нетоксичные и не предназначенные для перорального введения разбавители, такие как водный раствор или стерильный раствор для инъекций или суспензия в растворителе. В качестве приемлемого носителя или растворителя могут быть использованы вода, раствор Рингера, изотонический физиологический раствор и т.п.; а в качестве стандартного или суспендирующего растворителя может быть использовано стерильное нелетучее масло. Для этих целей могут быть использованы нелетучее масло и жирная кислота любого вида, включая природные, синтетические или полусинтетические жирные масла или жирные кислоты, а также природные, синтетические или полусинтетические моно-, ди- или триглицериды. Способы парентерального введения известны специалистам, и такими способами являются, но не ограничиваются ими, стандартные способы инъекций, способы с использованием безыгольных устройств, работающих под давлением газа, описанных в патенте США № 5851198, и лазерных перфораторов, как описано в патенте США № 5839446, где указанные патенты во всей своей полноте вводятся в настоящее описание посредством ссылки.
Альтернативная доставка
Настоящее изобретение также относится к доставке по меньшей мере одного анти-IL-6-антитела путем парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, внутрикапсулярного, внутрихрящевого, внутриполостного, внутрибрюшного, внутриможжечкового, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интрапериакрдиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, внутрипочечного, внутрисетчаточного, внутрипозвоночного, интрасиновиального, внутригрудного, внутриматочного, внутривезикулярного, введения в виде болюса, вагинального, ректального, буккального, подъязычного, интраназального или чрескожного введения. Для парентерального (подкожного, внутримышечного или внутривенного) или любого другого введения композиция, содержащая по меньшей мере одно анти-IL-6-антитело, может быть, в частности, получена в форме жидких растворов или суспензий; для вагинального или ректального введения она может быть, в частности, получена в полутвердых формах, таких как, но не ограничивающихся ими, кремы и суппозитории; для трансбуккального или подъязычного введения она может быть получена в таких формах, но не ограничивающихся ими, как таблетки и капсулы; для интраназального введения она может быть получена в таких формах, но не ограничивающихся ими, как порошки, капли в нос или аэрозоли или некоторые другие средства; для чрескожного введения она может быть получена в таких формах, но не ограничивающихся ими, как гель, мазь, лосьон, суспензия или система для доставки типа пластыря с химическими стимуляторами, такими как диметисульфоксид, используемыми для модификации структуры кожи или для увеличения концентрации лекарственного средства в указанном чрескожном пластыре (см. работы Junginger et al., In "Drug Permeation Enhancement"; Hsieh D.S. Eds., pp.59-90 (Marcel Dekker, Inc. New York 1994, которые во всей своей полноте вводятся в настоящее описание посредством ссылки), либо с окислителями, используемыми для облегчения нанесения препаратов, содержащих белки и пептиды, на кожу (WO 98/53847), или наложения электрических полей для создания путей кратковременного транспорта, например при электропорации, либо для увеличения подвижности заряженных лекарственных средств, проходящих через кожу, например при ионофорезе, либо для обработки ультразвуком, например при сонофорезе (патенты США №№ 4309989 и 4767402)(все вышеуказанные публикации и патента во всей своей полноте вводятся в настоящее описание посредством ссылки).
Пульмональное/назальное введение
Для пульмонального введения предпочтительно, чтобы по меньшей мере одна композиция анти-IL-6-антитела была доставлена в виде частиц, имеющих размер, эффективный для их доставки в нижние дыхательные пути легких или синусов. В соответствии с настоящим изобретением по меньшей мере одно анти-IL-6-антитело может быть доставлено с помощью любых ингаляторов или устройств для назального введения, известных специалистам и используемых для введения терапевтического средства путем ингаляции. Такими устройствами, способными накапливать распыляемые композиции в синусовой полости или альвеолах пациента, являются ингаляторы с дозирующими клапанами для доставки, распылители, аэрозольный генератор для сухих порошков, пульверизаторы и т.п. Специалистам также известны и другие устройства, подходящие для регуляции пульмонального или назального введения антител. Во всех указанных устройствах могут быть использованы композиции, подходящие для введения определенных доз антитела, присутствующего в аэрозоле. Такие аэрозоли могут состоять либо из растворов (как водных, так и безводных), либо из твердых частиц. В ингаляторах с дозируемой доставкой, таких как дозирующий ингалятор Ventolin®, обычно используется газ-пропеллент и эти ингаляторы приводятся в действие во время вдыхания (см., например, WO 94/16970, WO 98/35888). Ингаляторы для сухих порошков, такие как TurbuhalerTM (Astra), Rotahaler® (Glaxo), Diskus® (Glaxo), ингалятор SpirosTM (Dura), устройства, имеющиеся в продаже под торговым знаком Inhale Therapeutics, и инсуффлятор Spinhaler® (Fisons) приводятся в действие при вдыхании смешанного порошка (патент США № 4668218 Astra, EP 237507 Astra, WO 97/25086 Glaxo, WO 94/08552 Dura, патент США № 5458135, Inhale, WO 94/06498 Fisons, которые во всей своей полноте вводятся в настоящее описание посредством ссылки). Распылители, такие как AERxTM Aradigm, распылитель Ultravent® (Mallinckrodt) и распылитель Acorn II® (Marquest Medical Products)(патент США 5404871, Aradigm, WO 97/22376, которые во всей своей полноте вводятся в настоящее описание посредством ссылки) образуют аэрозоли из растворов, а ингаляторы с дозируемым клапаном, ингаляторы для сухих порошков и т.п. генерируют аэрозоли с небольшими частицами. Эти конкретные примеры коммерчески доступных ингаляторов приводятся лишь для иллюстрации конкретных устройств, подходящих для осуществления согласно изобретению, и не должны рассматриваться как ограничение объема изобретения. Предпочтительно, чтобы композиция, содержащая по меньшей мере одно анти-IL-6-антитело, была доставлена с помощью ингалятора для сухих порошков или распылителя. Для введения по меньшей мере одного антитела согласно изобретению устройство для ингаляции имеет несколько преимуществ. Например, доставка с использованием устройства для ингаляции является достаточно надежной, воспроизводимой и точной. С использованием устройства для ингаляции можно, но необязательно, осуществлять доставку небольших сухих частиц, например, размером примерно менее чем 10 мкм, а предпочтительно примерно 1-5 мкм, которые легко вдыхаются.
Введение композиции анти-IL-6-антитела в виде спрея
Спрей, включающий белок композиции анти-IL-6-антитела, может быть получен путем подачи суспензии или раствора по меньшей мере одного анти-IL-6-антитела через сопло под давлением. Для достижения нужного выхода и размера частиц необходимо выбрать соответствующие размеры и конфигурацию сопла, давление и скорость подачи жидкости. Электроспрей может быть продуцирован, например, путем наложения электрического поля в сочетании с подачей через капилляр или сопло. Предпочтительно, чтобы частицы белка композиции, содержащей по меньшей мере одно анти-IL-6-антитело и доставляемой с помощью распылителя, имели размер примерно менее чем 10 мкм, предпочтительно в пределах примерно 1-5 мкм, а наиболее предпочтительно примерно 2-3 мкм.
Препараты белковой композиции, содержащей по меньшей мере одно анти-IL-6-антитело, подходящие для использования с помощью распылителя, обычно включают белок композиции антител в водном растворе в концентрации, составляющей примерно 0,1 мг - 100 мг указанного белка на мл раствора или мг/г, или любой интервал или величину в указанном интервале, такую как, но не ограничивающуюся ими, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 34, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90 или 100 мг/мл или мг/г. Данная композиция может включать такие агенты, как наполнитель, буфер, агент, придающий изотоничность, консервант, поверхностно-активное вещество, а предпочтительно цинк. Указанная композиция может также включать наполнитель или средство для стабилизации белка композиции антител, такие как буфер, восстановитель, белок-наполнитель или углевод. Белками-наполнителями, используемыми для получения препаратов, содержащих белки композиции антител, являются альбумин, протамин или т.п. Типичными углеводами, используемыми для получения препаратов, содержащих белки композиции антител, являются сахароза, маннит, лактоза, трегалоза, глюкоза или т.п. Препарат, содержащий белок композиции антител, может также включать поверхностно-активное вещество, которое может снижать или предотвращать поверхностно-индуцированную агрегацию белка композиции антител, вызываемую распылением раствора при образовании аэрозоля. При этом могут быть использованы различные стандартные поверхностно-активные вещества, такие как полиоксиэтилированные эфиры жирных кислот и спирты, а также полиоксиэтилированные эфиры сорбита и жирных кислот. Их количества обычно составляют в пределах от 0,001 и 14% по массе препарата. Для целей согласно изобретению особенно предпочтительными поверхностно-активными веществами являются полоксиэтиленсорбитанмоноолеат, полисорбат 80, полисорбат 20 или т.п. Для получения препаратов белка, такого как анти-IL-6-антитело или его определенные части или варианты, в данный препарат могут быть также включены и другие агенты, известные специалистам.
Введение композиций анти-IL-6-антител с помощью аэрозольного ингалятора
Белок композиции антитела может быть введен с помощью аэрозольного ингалятора, такого как струйный ингалятор или ультразвуковой ингалятор. Обычно в струйном ингаляторе для создания высокоскоростной струи воздуха, поступающей через отверстие, используется источник сжатого воздуха. Поскольку газ распространяется за пределы сопла, то создается область низкого давления, которая направляет раствор белка композиции антител через капиллярную трубку, присоединенную к резервуару с жидкостью. Поток жидкости из капиллярной трубки разделяется на нестабильные струйки и капельки на выходе из трубки, в результате чего образуется аэрозоль. Для получения нужных технологических характеристик данного струйного ингалятора могут быть использованы различные конфигурации, скорости потока и типы перегородок. В ультразвуковом ингаляторе для создания вибрационной механической энергии используется электроэнергия высокой частоты обычно с применением пьезоэлектрического преобразователя. Эта энергия передается препарату, содержащему белок композиции антител, либо непосредственно, либо через связующую жидкость, в результате чего образуется аэрозоль, содержащий белок композиции антител. Предпочтительно, чтобы частицы белка композиции антител, доставляемой с помощью распылителя, имели размер примерно менее чем 10 мкм, предпочтительно в пределах примерно 1-5 мкм, а наиболее предпочтительно примерно 2-3 мкм.
Препараты, содержащие по меньшей мере одно анти-IL-6-антитело, подходящие для использования с применением аэрозольного ингалятора, либо струйного, либо ультразвукового, обычно включают по меньшей мере один белок анти-IL-6-антитела, в концентрации примерно 0,1 мг - 100 мг на мл раствора. Данный препарат может включать такие агенты, как наполнитель, буфер, агент, придающий изотоничность, консервант, поверхностно-активное вещество, а предпочтительно цинк. Указанный препарат может также включать наполнитель или средство для стабилизации по меньшей мере одного белка в композиции анти-IL-6-антител, такие как буфер, восстановитель, белок-наполнитель или углевод. Белками-наполнителями, используемыми для получения препаратов, содержащих белки композиции по меньшей мере одного анти-IL-6-антитела, являются альбумин, протамин или т.п. Типичными углеводами, используемыми для получения по меньшей мере одного анти-IL-6-антитела, являются сахароза, маннит, лактоза, трегалоза, глюкоза или т.п. Препарат, содержащий по меньшей мере одно анти-IL-6-антитело, может также включать поверхностно-активное вещество, которое может снижать или предотвращать поверхностно-индуцированную агрегацию по меньшей мере одного анти-IL-6-антитела, вызываемую распылением раствора при образовании аэрозоля. При этом могут быть использованы различные стандартные поверхностно-активные вещества, такие как полиоксиэтилированные эфиры жирных кислот и спирты, и полиоксиэтилированные эфиры сорбита и жирных кислот. Их количества обычно составляют в пределах от 0,001 и 14% по массе препарата. Для целей согласно изобретению особенно предпочтительными поверхностно-активными веществами являются полоксиэтиленсорбитанмоноолеат, полисорбат 80, полисорбат 20 или т.п. Для получения препаратов, содержащих белок, такой как анти-IL-6-антитело или его определенные части или варианты, в данный препарат белка могут быть также включены и другие агенты, известные специалистам.
Введение композиций анти-IL-6-антител с помощью ингалятора с дозирующим клапаном
В ингаляторе с дозирирующим клапаном (MDI) пропеллент, по меньшей мере одно анти-IL-6-антитело и любые наполнители или другие добавки содержатся в контейнере в виде смеси, включающей сжиженный газ под давлением. Приведение в действие дозирующего клапана высвобождает смеси в виде аэрозоля, содержащего частицы размером, предпочтительно менее чем примерно 10 мкм, более предпочтительно примерно 1-5 мкм, а наиболее предпочтительно примерно 2-3 мкм. Аэрозольные частицы нужного размера могут быть получены с использованием препарата белка композиции антител, приготовленного различными известными методами, включая размол на струйной мельнице, осушку распылением, конденсацию в критической точке и т.п. Предпочтительными ингаляторами с дозирующим клапаном являются ингаляторы, производимые 3М или Glaxo, в которых используется гидрофторуглеродный пропеллент.
Композиции, содержащие по меньшей мере одно анти-IL-6-антитело и используемые в ингаляторе с дозирующим клапаном, обычно включают тонкодисперсный порошок, содержащий по меньшей мере одно анти-IL-6-антитело в виде суспензии в безводной среде, например, суспендированной в пропелленте с помощью поверхностно-активного вещества. Таким пропеллентом может быть любой стандартный материал, используемый для этих целей, такой как хлорфторуглерод, хлорфторуглеводород, фторуглеводород или углеводород, включая трихлорфторметан, дихлордифторметан, дихлортетрафторэтанол и 1,1,1,2-тетрафторэтан, HFA-134a (гидрофторалкан-134а), HFA-227 (гидрофторалкан-227) или т.п. Предпочтительным углеводородом является фторуглеводород. Поверхностно-активное вещество может быть выбрано так, чтобы оно стабилизировало по меньшей мере одно анти-IL-6-антитело, суспендированное в пропелленте, для защиты активного агента от химической деградации и т.п. Подходящими поверхностно-активными веществами являются сорбитантриолеат, лицитин сои, олеиновая кислота или т.п. В некоторых случаях аэрозоли растворов, предпочтительно, приготавливают с использованием растворителей, таких как этанол. Для получения препарата белка в данный препарат белка могут быть также включены и другие агенты, известные специалистам.
Для каждого специалиста очевидно, что способы согласно изобретению могут быть осуществлены путем пульмонального введения композиций, содержащих по меньшей мере одно анти-IL-6-антитело, с использованием других устройств, не описанных в настоящей заявке.
Пероральные композиции и их введение
Препараты для перорального введения основаны на совместном введении адъювантов (например, резорцинов и неионогенных поверхностно-активных веществ, таких как олеиловый эфир полиооксиэтилена и эфир н-гексадецилполиэтилена), используемых для искусственного усиления проницаемости стенок кишечника, а также для совместного введения ингибиторов ферментов (например, ингибиторов трипсина поджелудочной железы, диизопропилфторфосфата (DFF) и тразилола) в целях ингибирования ферментативного расщепления. Активное соединение, являющееся компонентом твердой лекарственной формы для перорального введения, может быть смешано по меньшей мере с одной добавкой, включая сахарозу, лактозу, целлюлозу, маннит, трегалозу, раффинозу, мальтит, декстран, крахмалы, агар, аргинаты, хитины, хитозаны, пектины, трагакантовую камедь, аравийскую камедь, желатин, коллаген, казеин, альбумин, синтетический или полусинтетический полимер и глицерид. Эти лекарственные формы могут также содержать добавки другого типа (типов), например неактивный разбавитель; замасливатель, такой как стеарат магния, парабен; консервант, такой как сорбиновая кислота, аскорбиновая кислота, альфа-токоферол; антиоксидант, такой как цистерин; дезинтергратор; связующий агент; загуститель; забуферивающий агент; подсластитель; отдушку; ароматизатор и т.п.
Таблетки и драже могут быть также изготовлены в виде препаратов с энтеросолюбильным покрытием. Жидкими препаратами для перорального введения являются эмульсии, сиропы, эликсиры, суспензии и растворы, пригодные для использования в медицине. Такие препараты могут содержать неактивные разбавители, обычно используемые специалистами в данной области, например воду. В качестве систем для доставки таких лекарственных средств, как инсулин и гепарин, также используются липосомы (патент США № 4239734). Совсем недавно для доставки фармацевтических средств были использованы микросферы из искусственных полимеров смешанных аминокислот (протеиноидов) (патент США № 4925673). Кроме того, для пероральной доставки биологически активных агентов используются соединения-носители, описанные в патентах США №№ 5879681 и 5871753 и известные специалистам.
Препараты для введения через слизистую оболочку и их применение
Для абсорбции через слизистую оболочку в композициях и методах введения по меньшей мере одного анти-IL-6-антитела используется эмульсия, содержащая множество субмикронных частиц, мукоадгезивную макромолекулу, биологически активный пептид и водную непрерывную фазу, и стимулирующая абсорбцию через слизистую оболочку посредством адгезии эмульсионных частиц на поверхности слизистой оболочки (патент США №№ 5514670). Способами, подходящими для нанесения эмульсий согласно изобретению на поверхность слизистых оболочек, являются роговичное, конъюнктивальное, буккальное, подъязычное, назальное, вагинальное, пульмональное внутрижелудочное, интестинальное и ректальное введение. Композиции для вагинального или ректального введения, например суппозитории, могут содержать наполнители, например полиалкиленгликоли, вазелин, масло-какао и т.п. Композиции для интраназального введения могут быть твердыми и могут содержать в качестве наполнителя, например, лактозу, либо они могут представлять собой водные или масляные растворы капель в нос. Для буккального введения наполнителями являются сахара, стеарат кальция, стеарат магния, предварительно желатинизированный крахмал и т.п. (патент США № 5849695).
Чрескожные композиции и их введение
Для чрескожного введения по меньшей мере одно анти-IL-6-антитело инкапсулируют в системы для доставки, такие как липосома, полимерные наночастицы, микрочастицы, микрокапсулы или микросферы (имеющие общее название "микрочастицы, если это не оговорено особо). Известно несколько подходящих систем, включая микрочастицы, изготовленные из синтетических полимеров, таких как полигидроксикислоты, например полимолочная кислота, полигликолевая кислота и их сополимеры, полиортоэфиры, полиангидриды и полифосфазены, и природных полимеров, таких как коллаген, полиаминокислоты, альбумин и другие белки, альгинат и другие полисахариды и их комбинации (патент США № 5814599).
Пролонгированное введение и композиции
Иногда индивидууму желательно вводить соединения согласно изобретению в течение продолжительных периодов времени, например в течение периода времени от одной недели до одного года в виде разовой дозы. Для этого могут быть использованы различные лекарственные формы для пролонгированного высвобождения, депо-формы или имплантаты. Так, например, лекарственная форма может содержать фармацевтически приемлемую нетоксичную соль соединения, обладающую низкой степенью растворимости в физиологических жидкостях, например (а) кислотно-аддитивную соль с полиосновной кислотой, такой как фосфорная кислота, серная кислота, лимонная кислота, винная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинмоно- или нафталиндисульфоновые кислоты, полигалактуроновая кислота и т.п.; (b) соль, образованную катионом поливалентного металла, такого как цинк, кальций, висмут, барий, магний, алюминий, медь, кобальт, никель, кадмий и т.п.; или органическим катионом, образованным, например, N,N'-дибензил-этилендиамином или этилендиамином; или (с) комбинации (а) и (b), например цинковую соль дубильной кислоты. Кроме того, соединения согласно изобретению или, предпочтительно, относительно нерастворимая соль, такая как вышеуказанные соли, могут быть приготовлены в виде геля, например геля, содержащего моностеарат алюминия с добавлением, например, кунжутного масла для инъекции. Особенно предпочтительными солями являются соли цинка, цинковые соли дубильной кислоты, соли памовой кислоты и т.п. Другие типы депо-препарата замедленного высвобождения, предназначенные для инъекций, могут содержать соединение или соль, диспергированную для инкапсуляции в медленно разлагающемся нетоксичном и неантигенном полимере, таком как полимер полимолочной кислоты/полигликолевой кислоты, например, описанный в патенте США № 3773919. Соединения или, предпочтительно, относительно нерастворимые соли, например соли, описанные выше, могут быть также получены в виде силастических гранул с холестериновым матриксом, которые могут быть, в частности, использованы для введения животным. Другие препараты для замедленного высвобождения, депо-формы или имплантаты, например газовые или жидкие липосомы, описаны в литературе (патент США № 5770222 и "Sustained and Controlled Release Drug Delivery Systems", J.R. Robinson ed., Marcel Dekker, Inc., N.Y., 1978).
Клонирование и экспрессия анти-IL-6-антитела в клетках млекопитающих
Типичный вектор для экспрессии в млекопитающих содержит по меньшей мере один промоторный элемент, который опосредует инициацию транскрипции мРНК, антитело-кодирующую последовательность и сигналы, необходимые для терминации транскрипции и полиаденилирования транскрипта. Дополнительными элементами являются энхансеры, последовательности Козака и интронные последовательности, фланкированные донорными и акцепторными сайтами для РНК-сплайсинга. Высокоэффективная транскрипция может быть достигнута с использованием раннего и позднего промоторов SV40, длинных концевых повторов (LTS), происходящих от ретровирусов, например, RSV, HTLV-I, ВИЧ-1 и раннего промотора цитомегаловируса (CMV). Однако могут быть также использованы и клеточные элементы (например, промотор человеческого актина). Подходящими экспрессирующими векторами, используемыми для осуществления согласно изобретению, являются, например, такие векторы как pIRES1neo, pRetro-Off, pRetro-On, PLXSN или pLNCX (Clontech Labs, Palo Alto, CA), pcDNA3.1 (+/-), pcDNA/Zeb (+/-) или pcDNA3.1/Hygro (+/-) (Invitrogen), PSVL и PMSG (Pharmacia, Uppsala, Sweden), pRSVcat (ATCC 37152), pSV2dhfr (ATCC 37146) и pBC12MI (ATCC 67109). Могут быть использованы клетки-хозяева млекопитающих, такие как человеческие клетки Hela 293, H9 и клетки Jurkat, мышиные клетки NIH3T3 и С127, клетки Cos 1, Cos 7 и CV1, клетки QC1-3 перепелов, мышиные L-клетки и клетки яичника китайского хомячка (СНО).
Альтернативно, ген может экспрессироваться в стабильных клеточных линиях, которые содержат ген, интегрированный в хромосому. Ко-трансфекция селективным маркером, таким как ген dhfr, ген gpt, ген неомицина или гигромицина, позволяет идентифицировать и выделять трансфецированные клетки.
Трансфецированный ген может быть также амплифицирован для экспрессии больших количеств кодируемого антитела. Маркер DHFR (дигидрофолатредуктаза) может быть использован для выявления клеточных линий, несущих несколько сотен или даже несколько тысяч копий нужного гена. Другим подходящим селективным маркером является фермент глутамин-синтаза (GS)(Murphy et al., Biochem, J. 227:277-279 (1991); Bebbington et al., Bio/Technology 10:169-175 (1992)). С использованием этих маркеров клетки млекопитающих культивируют в селективной среде и отбирают на наибольшую резистентность. Эти клеточные линии содержат амплифицированный(е) ген(ы), интегрированный(е) в хромосому. Для продуцирования антител часто используются клетки яичника китайского хомячка (СНО) и клетки NSO.
Экспрессирующие векторы рС1 и рС4 содержат сильный промотор (LTR) вируса саркомы Рауса (Cullen et al., Molec. Cell. Biol. 5:438-447 (1985)) плюс фрагмент CMV-энхансера (Boshart et al., Cell 41:521-530 (1985)). Сайты множественного клонирования, например сайты расщепления рестриктирующими ферментами BamHI, XbaI и Asp718, облегчают клонирование нужного гена. Эти векторы, помимо 3'интрона, содержат сигнал полиаденилирования и стоп-сигнал гена крысиного препроинсулина.
Клонирование и экспрессия в клетках СНО
Для экспрессии анти-IL-6-антитела используется вектор рС4. Плазмида рС4 представляет собой производное плазмиды рSV2-dhfr (АТСС рег.№ 37146). Эта плазмида содержит мышиный ген DHFR, находящийся под контролем раннего промотора SV40. Клетки яичника китайского хомячка или другие клетки, в которых отсутствует дигидрофолатная активность и которые были трансфецированы указанными плазмидами, могут быть отобраны путем культивирования этих клеток на селективной среде (например, на среде альфа--МЕМ, Life Technologies, Gaithersburg, MD) с добавленным химиотерапевтическим средством, метотрексатом. Амплификация генов DHFR в клетках, резистентных к метотрексату (МТХ), была подробно описана в литературе (см., например, F.W. Alt, et al., J. Biol. Chem. 253:1357-1370 (1978); J.L. Hamlin & C.Ma, Biochem. et Biophys. Acta 1097:107-143 (1990) и M.J. Page & M.A. Sydenham, Biotechnology 9:64-68 (1991)). В процессе роста клеток при возрастающих концентрациях МТХ у них развивается резистентность к лекарственному средству посредством сверхпродуцирования нужного фермента, DHFR, что является результатом амплификации гена DHFR. Если второй ген сцеплен с геном DHFR, то он обычно ко-амплифицируется и сверхэкспрессируется. Известно, что такой подход может быть использован для выявления клеточных линий, несущих более чем 1000 копий амплифицированного гена(ов). Затем, после удаления метотрексата, получают клеточные линии, которые содержат амплифицированный ген, интегрированный в одну или несколько хромосом клетки-хозяина.
Плазмида рС4, для экспрессии нужного гена, содержит сильный промотор длинных концевых повторы (LTR) вируса саркомы Рауса (Cullen et al., Molec. Cell. Biol. 5:438-447 (1985)) плюс фрагмент, выделенный из энхансера предраннего гена цитомегаловируса человека (CMV) (Boshart et al., Cell 41:521-530 (1985)). За промотором расположены сайты расщепления рестриктирующими ферментами BamHI, XbaI и Asp718, которые обеспечивают интеграцию генов. За этими сайтами клонирования в данной плазмиде находятся 3'интрон и сайт полиаденилирования гена крысиного препроинсулина. Для экспрессии могут быть также использованы и другие высокоэффективные промоторы, например промотор человеческого бета-актина, ранний или поздний промотор SV40 или длинные концевые повторы, происходящие от других ретровирусов, например ВИЧ и HTLVI. Для экспрессии IL-6 под контролем регуляторных последовательностей в клетках млекопитающих могут быть использованы системы экспрессии генов Tet-off и Tet-on Clontech и аналогичные системы (M.Gossen & H.Bujard, Proc. Natl. Acad. Sci.USA 89:5547-5551 (1992)). Для полиаденилирования мРНК могут быть также использованы и другие сигналы, например сигналы, происходящие от генов человеческого гормона роста или глобина. Стабильные клеточные линии, несущие нужный ген, интегрированный в хромосомы, могут быть также отобраны в результате ко-трансфекции с селективным маркером, таким как gpt, G418 или гигромицин. При этом предпочтительно использовать более чем один селективный маркер, например, прежде всего, например, G418 плюс метотрексат.
Плазмиду рС4 гидролизуют рестриктирующими ферментами, а затем дефосфорилируют стандартными способами с использованием телячьей кишечной фосфатазы. Затем вектор выделяют из 1% агарозного геля.
В соответствии со стадиями известного метода используют ДНК-последовательность, кодирующую полное анти-IL-6-антитело, например, представленную в SEQ ID NO:7 и 8, и соответствующую вариабельным областям НС и LC анти-IL-6-антитела согласно изобретению. В этой конструкции также используется выделенная нуклеиновая кислота, кодирующая подходящую человеческую константную область (то есть, области НС и LC).
Затем выделенную ДНК, кодирующую вариабельную и константную область, и дефосфорилированный вектор лигируют вместе с помощью ДНК-лигазы Т4. После этого клетки E.coli НВ1010 или XL-1 Blue трансформируют и идентифицируют бактерии, которые содержат фрагмент, встроенный в плазмиду рС4, с использованием, например, рестрикционного анализа.
Для трансфекции используют клетки яичника китайского хомячка (СНО), в которых отсутствует ген активной DHFR. 5 мкг экспрессионной плазмиды рС4 ко-трансфецируют 0,5 мкг плазмиды рSV2-neo с использованием липофектина. Плазмида рSV2-neo содержит доминантный селективный маркер, а именно ген neo от Tn5, кодирующий фермент, который сообщает резистентность к группе антибиотиков, включая G418. Эти клетки высевают в среду альфа--МЕМ, в которую было добавлено 1 мкг/мл G418. Через два дня клетки трипсинизируют и высевают в планшеты для клонирования гибридом (Greiner, Germany) в среде альфа--МЕМ, в которую было добавлено 10, 25 или 50 нг/мл метотрексата плюс 1 мкг/мл G418. Примерно через 10-14 дней одиночные клоны трипсинизируют, а затем высевают в 6-луночные чашки Петри или в 10 мл-колбы с различными концентрациями метотрексата (50 нМ, 100 нМ, 200 нМ, 400 нМ, 800 нМ). Затем клоны, выращенные при наибольших концентрациях метотрексата, переносят в новые 6-луночные чашки, содержащие еще большие концентрации метотрексата (1 мМ, 2 мМ, 5 мМ, 10 мМ, 20 мМ). Ту же самую процедуру повторяют до тех пор, пока не будут получены клоны, которые выращены при концентрации 100-200 мМ. Экспрессию нужного генного продукта анализируют, например, с помощью электрофореза в ДСН-ПААГ и Вестерн-блоттинга, либо с помощью обращенно-фазовой ВЭЖХ.
Сокращения
BSA - альбумин бычьей сыворотки
ИФА (EIA) - иммуноферментный анализ
FBS - фетальная бычья сыворотка
H2O2 - пероксид водорода
ПХ (HRP) - пероксидаза хрена
Ig - иммуноглобулин
IL-6 - интерлейкин-6
i.p. - внутрибрюшинно
i.v. - внутривенно
Mab - моноклональное антитело
OD - оптическая плотность
OPD - дигидрохлорид о-фенилендиамина
ПЭГ (PEG) - полиэтиленгликоль
PSA - пенициллин, стрептомицин, амфотерицин
к.т. (RT) - комнатная температура
s.c. - подкожно
об./об. - объем на объем
мас./об. - масса на объем
Пример 1
Продуцирование мышиного Mab CLB-8
Иммунизация
Гибридому, продуцирующую мышиное антитело CLB-IL-6-8, выделяли из гибрида, полученного в лаборатории Dr. Lucien Aarden, Central Laboratory of the Netherlands Red Cross Transfusion Service (CLB) (как сообщалось Brackenhoff et al., J. Immunol. (1990) 145:561-568).
Восьминедельных самок мышей Balb/с, полученных от специально выведенного штамма, не содержащего специфичного для CLB патогена, внутримышечно (i.m.) иммунизировали 10 мкг очищенного рекомбинантного интерлейкина-6 (rIL-6)(CLB), эмульгированного в полном адъюванте Фрейнда. Три последующие i.m.-инъекции, каждая по 10 мкг rIL-6 в неполном адъюванте Фрейнда, проводили с интервалом в 4-8 недель.
Слияние клеток
Через четыре дня после последней бустер-инъекции, i.m., мышей умерщвляли, брали селезенку и тонко измельчали. Моноклеточную суспензию получали в сбалансированном солевом растворе внешней среды Эрла. Затем клетки промывали и подсчитывали. Жизнеспособные клетки селезенки подвергали слиянию с мышиными миеломными клетками (SР2/0-Ag14) в отношении 1:3 в присутствии 42% (мас./об.) полиэтиленгликоля в среде Дульбекко, модифицированной по способу Исков (IMDM). Не секретирующий Ig партнер по слиянию, SР2/0, был взят из банка клеток при CLB. После слияния клетки ресуспендировали в IMDM, в которую было добавлено 5% фетальной бычьей сыворотки, 50 мкМ пенициллина/стрептомицина, 5×10-5 М 2-меркаптоэтанола (2-МЕ) и НАТ (6×10-4 М гипоксантина, 6,5×10-7 М аминоптерина, 6,4×10-5 М тимидина). Пролиферация этих гибридом непосредственно после слияния зависела от IL-6, а поэтому в селективную среду добавляли 100 ед/мл очищенного мышиного IL-6 (Van Smick, Brussels). После этого, слитые клетки распределяли по 96-луночным планшетам при концентрации 1×105 клеток/100 мкл на лунку.
Предварительная характеризация мышиных анти-IL-6 гибридом
Гибриды, секретирующие анти-IL-6-антитело, отбирали с помощью твердофазного иммуноферментного анализа (ELISA) и радиоиммуноанализа (RIA) (Brackenhoff et al. (1990) 145:561-568). Твердофазный ELISA использовали для скрининга моноклональных антител, специфичных для человеческого IL-6. Очищенный rIL-6 (0,5 мкг/мл) наносили на ночь при комнатной температуре на плоскодонные планшеты (Dynatech) в концентрации 100 мкл/лунку в забуференном фосфатом физиологическом растворе (PBS). Планшеты промывали PBS, 0,02 % (об./об.) твина 20 (PBS/твин) и инкубировали в течение 2 часов при комнатной температуре с разведениями 1:2 супернатантов культуры в PBS/твине, в который был добавлен 0,3% желатин (PTG). После промывки планшеты инкубировали с легкой цепью-каппа моноклонального антитела крысиного антимышиного антитела 226, конъюгированного с пероксидазой хрена (Einstein University, NY) в PTG (2 мкг/мл) в течение 1 часа. Планшеты промывали и связанную пероксидазу детектировали с использованием 100 мкл/лунку 3,5,3,5-тетраметиленбензидина/0,003% пероксида водорода в 0,1М ацетате натрия, рН 5,5. Реакцию развития окраски прекращали добавлением 2М Н2SO4 и планшеты считывали при 450 нМ на ридере Titertek, Multiscan. Были выбраны лунки с положительной OD.
Твердофазный RIA также использовали для скрининга анти-IL-6 гибридом. Козьи антитела против мышиных IgG конъюгировали с активированной бромцианом сефарозой CL-4В (Pharmacia). Сефарозу промывали и ресуспендировали в 10 мг/мл в PBS, 0,1% твина 20, 0,1% азида натрия. На сефарозные сферы наносили гибридомные супернатанты в присутствии приблизительно 20000 им/мин125I-rIL-6 (CLB) в течение 6 часов при непрерывном перемешивании. Эти сферы интенсивно промывали в PBS/твине и подсчитывали в гамма-счетчике. Были выбраны лунки с наибольшими удельными активностями.
Были отобраны гибридомы, которые давали положительный результат в обоих аналитических системах, и эти гибридомы дважды субклонировали при лимитирующих разведениях в среде IMDM, в которую было добавлено 2×10-5М 2-МЕ и 5% FBS (полной среде IMDM). Затем отбирали IL-6-независимый субклон CLB-IL6-8 и поддерживали в полной IMDM. Через 4 дня после культивирования на клетках-мишенях Vero76 маточные культуры тестировали на отсутствие микоплазмы с использованием непрямого окрашивания по Hoescht. Определение изотипа супернатанта с использованием набора для установления изотипа мышиного моноклонального антитела с помощью иммуноанализа Innogenetics Line ImmunoAssay (INNO-LIA) показало, что это антитело имеет один мышиный изотип IgG1-каппа. Определение этого изотипа было подтверждено с помощью иммуноферментного анализа ИФА с захватом антитела.
Продуцированную таким образом мышиную гибридому и клеточную линию CLBIL-6/8 называли CLB8. Она была подвергнута химеризации и последующей характеризации, описанной ниже.
Пример 2. Химеризация и секвенирование
Клонирование и экспрессия генов вариабельной области cCLB8
Геномную ДНК выделяли из мышиной гибридомы С143А, которая секретирует мышиное моноклональное антитело, специфичное для человеческого IL-6.
Для легкой цепи ДНК гидролизовали рестриктирующей эндонуклеазой HindIII и подвергали электрофорезу в 0,8% агарозном геле. Часть геля, содержащую ДНК-фрагменты длиной приблизительно 3,4 т.п.н., вырезали и ДНК элюировали. Эти фрагменты лигировали в вектор vector8charon27 и упаковывали в бактериофаговые частицы. Для тяжелой цепи ДНК гидролизовали рестриктирующей эндонуклеазой EcoRI и подвергали электрофорезу в 0,8% агарозном геле. Часть геля, содержащую ДНК-фрагменты длиной приблизительно 3,4 т.п.н., вырезали и ДНК элюировали. Эти фрагменты лигировали в вектор vector8gt10 и упаковывали в бактериофаговые частицы.
Бактериофаговые библиотеки тяжелой и легкой цепей высевали на E.coli и культивировали в течение ночи. Бляшки переносили на нитроцеллюлозные фильтры и зондировали32Р-меченными ДНК-фрагментами, соответствующими мышиным JК-(легкой цепи) или мышиным JН -последовательностям. Позитивные бляшки идентифицировали и очищали. Фаговую ДНК выделяли, а затем HindIII-вставку (легкая цепь) или EcoRI-вставку (тяжелая цепь) выделяли и клонировали в векторы для экспрессии иммуноглобулинов.
Плазмиды, экспрессирующие тяжелую и легкую цепи, использовали для ко-трансфекции клеток SР2/0 и проводили отбор с использованием микофеноловой кислоты. Отдельные клоны, продуцирующие химерное антитело, идентифицировали и субклонировали для подтверждения моноклональности и для генерирования высших продуцентов.
Антитело, выделенное из отдельных клеточных линий, тестировали на способность к нейтрализации в анализе на IL-6-зависимую пролиферацию клеток В9. В настоящей заявке это антитело было названо химерным CLB8 или cCLB8.
Вариабельная область тяжелой цепи cCLB-8
Вариабельная область легкой цепи cCLB8
Пример 3. Измерение связывания cCLB-8 с человеческим IL-6 с помощью твердофазного ИФА
Твердофазный ИФА использовали для оценки способности Mab cCLB-8 связываться с человеческим IL-6. Планшеты покрывали рекомбинантным человеческим IL-6 (RDI) при концентрации 1 мкг/мл в PBS в течение ночи при 4°С. После промывки в 0,15М физиологическом растворе, содержащем 0,02% (об./об.) твина 20, лунки блокировали 1% (мас./об.) BSA в PBS, при концентрации 200 мкл/лунку в течение 1 часа при комнатной температуре. Очищенное антитело инкубировали в двукратных серийных разведениях исходя из начальной концентрации 5 мкг/мл в течение 1 часа при 37°С. Планшет промывали, а затем зондировали 50 мкл/лунку ПХ-меченного козьего антитела против человеческого IgG (Tago), разведенного 1:20000 в 1% BSA-PBS в течение 1 часа при комнатной температуре. Планшет снова промывали и в течение 15 минут добавляли 100 мкл на лунку цитрат-фосфатного субстратного раствора (0,1М лимонной кислоты и 0,2М фосфата натрия, 0,01% H2O2 и 1 мг/мл OPD) при комнатной температуре. Затем добавляли блокирующий раствор (4н серная кислота) при 25 мкл/лунку и проводили количественную оценку поглощения при 490 нм с использованием автоматического планшет-фотометра. На фигуре 1 показано связывание cCLB-8 с IL-6, измеренное как OD 490 нм, и продемонстрировано, что cCLB-8 связывается с рекомбинантным человеческим IL-6 в зависимости от концентрации.
Пример 4. Анализы на нейтрализацию in vitro
Блокирование IL-6 антителом cCLB-8 ингибирует секрецию IgM и МСР-1
Химерное моноклональное антитело cCLB-8 анализировали в двух биоанализах простого формата в целях определения его нейтрализующей биоактивности, направленной на IL-6-индуцированную секрецию человеческого IgGM и хемокина МСР-1. В этих исследованиях использовали две человеческих клеточных линии. Клеточная линия SКW6.4 была первоначально получена из EBV-трасформированной В-клеточной лимфомы Беркитта и секретировала растворимый IgM в ответ на IL-6. Клеточная линия U937 представляет собой монобласты, коммитированные по дифференцировке моноциты, и была первоначально выделена у пациента с диффузной гистоцитарной лимфомой. Клеточная линия U937 секретирует МСР-1 в ответ на IL-6. Была проведена оценка cCLB8-ингибирование этих конкретных биоактивностей, поскольку их мониторинг может быть легко осуществлен в формате ИФА. До проведения анализа клетки выдерживали в бессывороточной среде в течение ночи, а затем культивировали еще один день с IL-6 или с IL-6, предварительно инкубированным с различными концентрациями антитела или данного антитела, используемого в качестве негативного контроля. После 72-часового инкубирования супернатанты собирали и использовали в IgM-специфическом и МСР-1-специфическом ИФА. Результаты, представленные на фиг.2 и 3, продемонстрировали, что cCLB-8 в значительной степени ингибирует IL-6-опосредованную секрецию IgM и МСР-1 in vitro.
В эксперименте, проиллюстрированном на фиг.2, ИФА-планшеты покрывали Fc5μ-фрагментом козьего антитела против человеческого IgM в 10 мМ карбонатного буфера, рН 9,6, в течение ночи при 4°С. Планшеты промывали 0,15 М физиологическим раствором с 0, 02% об./об. твина 20 и блокировали PBS/1% (мас./об.) BSA в течение 1 часа. Супернатант клеточной культуры добавляли в виде двухкратных серийных разведений. После инкубирования и промывки 0,02% твином, 0,15 М физиологическим раствором, планшет зондировали ПХ-меченной μ-цепью козьего антитела против человеческого IgM. Затем добавляли OPD субстрат и после проявления окраски OD считывали при 490 нм. Эти данные показали, что cCLB-8, но не относящееся к этому изотипу антитело сК931, используемое в качестве негативного контроля, ингибирует секрецию μ-цепи IgM.
В эксперименте, проиллюстрированном на фиг.3, ИФА-планшеты покрывали козьим антителом против человеческого МСР-1 в 10 мМ карбонатном буфере, рН 9,6, в течение ночи при 4°С. Планшеты промывали 0, 15 М физиологическим раствором с 0,02% об./об. твина 20 и блокировали PBS/1% (мас./об.) BSA в течение 1 часа. Супернатант клеточной культуры добавляли в виде двухкратных серийных разведений. После инкубирования и промывки 0,02% твином, 0,15 М физиологическим раствором, планшет зондировали биотинилированным антителом против человеческого МСР-1 в соответствии с инструкциями производителей. Планшеты снова промывали и в течение 1 часа добавляли ПХ-меченный стрептавидин. Проявление окраски индуцировали с использованием ТМВ-субстрата. OD считывали при 450 нм. Эти данные показали, что cCLB-8, но не сК931, ингибирует IL-6-опосредованное продуцирование МСР-1.
Нейтрализация IL-6-опосредованного фосфорилирования STАТ3
Рецептор IL-6 состоит из связывающей 80 кД-субъединицы, IL6R -α, и субъединицы передачи сигнала, gp130. IL-6 связывается с субъединицей IL6Rα и инициирует связывание IL6Rα с gp130, с образованием высокоаффинного рецептора и передачи сигнала. IL6Rα также существует в растворимой форме. IL-6 может связываться с растворимым IL6R (sIL6R) и этот комплекс может функционировать на клетках, экспрессирующих gp130. Было также показано, что IL-6 активирует STAT3. Для иллюстрации ингибирования фосфорилирования STAT3 под действием cCLB-8 была использована человеческая клеточная линия острого моноцитарного лейкоза, THP-1. Клетки стимулировали (IL-6 + sIL6R) ± cCLB8 или нерелевантным антителом (К931), используемым в качестве негативного контроля. Клеточные лизаты подвергали иммунопреципитации анти-STAT3 антителом, образцы разделяли с помощью электрофореза на 7,5% ДСН-ПААГ и переносили на мембрану Hybond-Р, а затем подвергали Вестерн-блоттингу с использованием ПХ-конъюгированного антитела против фосфотирозина. Для детекции использовали ЭХЛ (ECLplus).
Данные, представленные на фиг.4, показали, что cCLB8 может ингибировать фосфорилирование STAT3 в том случае, если оно (а) связывается с rIL6 до добавления sIL6R, (b) связывается с sIL6R до добавления rIL6 или (с) если rIL6 связывается с IL-6 до добавления cCLB8 и клеток. Клетки ТНР-1 инкубировали в бессывороточной среде в течение 16 часов, соскабливали со стенок колб и ресуспендировали в 0,5 мл-среде, дорожки 2-6, IL-6 инкубировали с +/- антителом в течение 15 минут, а затем добавляли sIL6R и инкубировали в течение 15 минут. После этого добавляли клетки и инкубирование продолжали еще 15 минут. Дорожка 7, IL-6 инкубировали с sIL6R в течение 15 минут, после чего добавляли CLB-IL-6 и инкубировали 15 минут. Затем добавляли клетки и инкубирование продолжали еще 15 минут. Образцы подвергали иммунопреципитации анти-STAT3 антителом [1 мкг/мл], ресуспендировали в буфере Лэммли для образцов, разделяли с помощью электрофореза на 7,5% ДСН-ПААГ и переносили на мембрану Hybond-Р. Мембраны инкубировали с ПХ-конъюгированным антителом против фосфотирозина.
cCLB-8 ингибирует продуцирование сывороточного амилоида А
IL-1β является сильным индуктором продуцирования сывороточного амилоида А (SAA) из клеток гепатомы человека НерG2 в присутствии человеческого IL-6 (Smith & McDonald, Clin.Exp.Immunol. 90:293-9 (1992)). Поэтому Mab cCLB-8 анализировали на его способность ингибировать IL-1β/IL-6-индуцированное продуцирование SAA из этих клеток. Для этого клетки HepG2 высевали при концентрации 2,25×105 клеток/лунку в течение 24 часов. IL-6 (100 нг/мл, RDI) и IL-6sR (200 нг/мл, S&D) предварительно инкубировали в течение 30 минут и смешивали с IL-1β (1 нг/мл, R&D). Mab cCLB-8 и изотип Mab, используемый в качестве негативного контроля (cSF25), серийно разводили, а затем предварительно инкубировали с вышеуказанной смесью в течение еще 30 минут.
Для получения экспериментальных результатов, представленных на фиг.5, серийные разведения cCLB-8 или cSF25 (нерелевантное Mab соответствующего изотипа) предварительно инкубировали с IL-6sR и IL-1β, а затем культивировали с клетками НерG2 в течение 24 часов. После этого клеточный супернатант анализировали на уровне продуцирования сывороточного амилоида А с помощью ELISA (набора для ELISA-анализа, Human SAA ELISA Kit, Biosource, осуществляемого в соответствии с инструкциями производителей). Величины ошибок означают ср.кв.от. для образцов в дубликатах. Данные на фигуре 5 указывают на то, что cCLB-8 способно ингибировать IL-1β/IL-6-индуцированное продуцирование SAA из клеток НерG2 дозозависимым образом.
Ингибирование IL-6-индуцированной пролиферации клеток под действием Mab cCLB8
Клеточные линии мышиной В-миеломы, 7ТD1, индуцировали для их пролиферации в присутствии IL-6. Для подтверждения способности Mab cCLB-8 нейтрализовать активность IL-6 клетки инкубировали при 37°С в течение 72 часов в IMDM, содержащей 10% FBS и 0,5 нг/мг рекомбинантного человеческого IL-6 (R&D Systems), с серийными разведениями Mab cCLB-8 или Mab 17-1А, используемым в качестве негативного контроля. Пролиферацию клеток оценивали с помощью люминесцентного АТР-анализа (ATPLite, Packard Bioscience), где интенсивность люминесценции прямо пропорциональна числу клеток.
Данные, представленные на фигуре 6, продемонстрировали, что IL-6 сильно стимулирует пролиферацию клеток 7ТD1, а cCLB-8 ингибирует такую пролиферацию клеток дозозависимым образом с концентрацией EC50, равной 7,2 нг/мл. Величины ошибок означают ср.кв.от. для образцов в дубликатах. *означает пролиферацию клеток в отсутствии rIL-6.
Пример 5. Картирование эпитопов
Эпитопы нескольких нейтрализующих анти-IL-6 Mab, включая CLB8, были охарактеризованы с использованием антитела, связывающегося с мутантными белками человеческого IL-6, как описано в работе Brakenhoff J. et al. (1990) J. Immunology 145:561-568. Были получены мутанты с делециями по амино- и карбокси-концам, и панель антител против IL-6 анализировали в экспериментах по конкурентному связыванию антител. Исходя из исследований по конкурентному связыванию нейтрализующие Mab подразделяли на 2 группы (I и II). В этом методе остатки, включенные в эпитоп указанного Mab, характеризовали по их неспособности распознавать соответствующие варианты антигенного белка, имеющего сайт-специфическую замену одной аминокислоты. CLB.IL-6/8 картировали по сайту I на молекуле человеческого IL-6, которая состоит из аминокислот Gln29-Leu34, находящихся в непосредственной близости от карбокси-конца указанной молекулы. Последующие исследования (Kalai M. et al., Eur. J. Biochem. 249, 690-700 (1997)) показали, что антитело CLB.IL-6/8 распознавало аминокислотные остатки, имеющие важное значение для связывания IL-6 с IL-6R (gp80). Эти исследования также показали, что указанный эпитоп охватывает концы областей АВ-петли и D-спирали молекулы IL-6.
Пример 6. Характеризация in vivo
Лечение с использованием мышиных Mab против человеческого IL-6 (cCLB-8) и против мышиного IL-6 замедляет кахексию при раке
Клетки человеческой меланомы (А375S2) инокулировали самкам "голых" (бестимусных) крыс и в тот же самый день начали проводить Mab-терапию. Антитела инъецировали внутрибрюшинно в дозе 10 мг/кг (2 раза в неделю), а в качестве контрольного Mab использовали антитело С57 (против CMV). Комбинацию cCLB-8 (против человеческого IL-6) и МР520F3 (Mab против мышиного IL-6, R&D Systems) использовали для создания комбинированной блокады, ингибирующей потерю массы у животного, несущего человеческую опухоль меланому, по сравнению с контрольными животными, обработанными антителом С57 (фигура 7). Терапия с использованием антитела не оказывала влияния на рост опухоли или на конечную массу опухоли. Этот факт указывает на то, что IL-6 участвует в опухольопосредованной потере массы животного, а блокада IL-6 может замедлять кахексию при раке в этой модели.
Фигура 7. Комбинированная блокада человеческого и мышиного IL-6 (анти-IL-6-антителом cCLB8 и МР520А3) приводит к значительному ингибированию потери массы у животного. Скорректированная потеря массы животного, отложенная на оси Y, равна: (масса животного - масса опухоли в конце исследования) минус масса животного в начале исследования. Каждый столбец гистограммы означает данные, полученные по меньшей мере для 14 животных на группу, а величины ошибок означают стандартное отклонение. Анализ с использованием двустороннего т-критерия показал, что в группе, обработанной анти-IL-6-антителом, наблюдалось значительное ингибирование потери массы тела с р=0,007.
Пример 7. Измерение аффинности
Сенсорный чип СМ-5 (BIAcore 2000)(золотая поверхность на чипе покрыта карбоксиметилированным декстрановым матриксом), HBS (10 мМ HEPES с 0,15 NaCl, 3,4 мМ EDTA и 0,05% поверхностно-активного вещества Р20 при рН 7,4), реагенты, взаимодействующие с амином (N-гидроксисукцинимидом (NHS), N-этил-N'-(3-метиламинопропил)-карбодиимид (EDC) и 1М этаноламин-HCl) были получены от BIAcore и приготовлены в соответствии с инструкциями производителей. Античеловеческий Fc-фрагмент (козье антитело против человеческого IgG, Jackson AffinPure,

Химерное моноклональное антитело IgG, cCLB8 (Lot# PD1F03), в 5 мл 0,15М хлорида натрия, 0,01М фосфата натрия, рН 7,2, производится формой Centocor. Рекомбинантный человеческий IL-6 (Lot# А1197111) закупали у R&D Systems.
Античеловеческий Fc-фрагмент (1,8 мг/мл) разводили до концентрации 50 мкг/мл в буфере NaOAc (10 мМ, рН 4,8) и присоединяли к карбоксиметилированному декстрановому матриксу сенсорного чипа СМ-5 методом химического присоединения к амину, как описано в инструкции производителей BIAcore Systems. С использованием уникального препарата с соответствующими поверхностями, адаптированными для 10000 РЕ, карбоксильные группы на сенсорных поверхностях были сначала активированы NHS/EDC, а затем был добавлен античеловеческий Fc-фрагмент. Остальные активированные группы были блокированы путем инжекции 1М этаноламина. Каждая из проточных кювет была подсоединена отдельно. С использованием этих условий были получены поверхности четырех проточных кювет, содержащих 7554-9571 резонансных единиц (РЕ) античеловеческого Fc. В предварительных экспериментах было установлено, что три инъекции (15 мкл при 30 мкл/мин) 100 мМ H3PO4/0,05% CHAPS должны эффективно элиминировать связывание иммуноглобулина и предотвращать связывание иммобилизованного античеловеческого Fc.
Было проведено два эксперимента на BIAcore 2000 при 25°С и при скорости потока 30 мкл/мин. cCLB8 растворяли в HBS при 5 мкг/мл. Аналит, IL-6, растворяли в HBS при 0,25, 0,125, 0,062, 0,031 и 0,015 мкг/мл. Определенное количество антитела пропускали через ее соответствующую проточную кювету, а затем инъецировали 30 мкл каждого IL-6 при концентрации 30 мкл/мин (фаза ассоциации) и при непрерывном потоке буфера в течение 800 секунд (фаза диссоциации). Поверхность чипа была регенерирована тремя последовательными инъекциями 100 мМ H3PO4/0,05% CHAPS (15 мкл каждая). Инъекции HBS служили в качестве стандарта (контрольная сенсограмма) для вычитания общих показателей преломления для анализа. С использованием 1:1-модели в BIA-анализе 3.0, локальную аппроксимацию проводили как для диссоциации (kd, [s-1], так и для ассоциации (ka, [М-1s-1]) и вычисляли константу диссоциации (KD, [M] (kd/ka).
Анализ осуществляли с использованием BIAevaluation version 3.0. Кинетические константы определяли по данным сенсограммы путем построения экспериментальных кривых по расчетным уравнениям, полученным для моделей механизмов взаимодействия. Исходя из общиего анализа, проводимого на 1:1-модели связывания с использованием локальной аппроксимации РЕmax, были определены ka, kd, KD (Таблица 1).
Пример 8. Антиидиотипические антитела
При разработке эффективных аналитических систем (иммуногистохимии и детекции в сыворотке) для cCLB8 необходимо использовать антиидиотипические антитела. Поэтому мышей Balb/с иммунизировали cCLB8 для генерирования антиидиотипических антител против cCLB8, которые могут быть использованы в качестве фармакокинетических зондов для детекции в сыворотке и в иммуногистохимических анализах.
Иммунизация
Пять 6-7-недельных мышей Balb/с (Charles River Laboratories) иммунизировали в течение 12 недель антителом cCLB8 (Centocor, PD1F03) путем i.p.-инъекции 50 мкг и s.c.-инъекции 25 мкг антитела. Каждой мыши вводили i.p.-инъекции и s.c.-инъекции. Инъекции проводили с интервалами в две недели на протяжении всего периода иммунизации. Материал для i.p.-инъекции эмульгировали с использованием равного объема адъюванта Фрейнда (Sigma). Для первой инъекции i.p. использовали полный адъювант Фрейнда в полном объеме 200 мкл. Последующие i.p.-инъекции вводили с использованием неполного адъюванта Фрейнда. Материал для s.c.-инъекции разводили в PBS и разделяли для введения на две части по 100 мкл/участок. В дни 0, 21, 47 и 77 у мышей брали кровь. Забор крови осуществляли у анестезированных мышей путем пункции в ретроорбитальную область и собирали сыворотку для определения титра cCLB8 в твердофазном ИФА. Через три недели после окончания протокола иммунизации мыши #1 вводили i.v. последнюю бустер-инъекцию 100 мкг cCLB8, разведенного в 125 мкг PBS (2).
Детекция мышиных IgG-антител против cCLB8 в сыворотке мыши
Для скрининга мышиной сыворотки на антитела, специфичные к cCLB8, использовали твердофазный ИФА. Для этого планшеты (Costar, 9018) сенсибилизировали в течение ночи антителом cCLB8 при концентрации 10 мкг/мл в PBS. После промывки в 0,15 М физиологическом растворе, содержащем 0,02% (мас./об.) Твина 20, лунки блокировали 1% (мас./об.) BSA в PBS в течение 1 часа при комнатной температуре. Планшеты замораживали при -20°С для последующего использования. Разведения мышиной сыворотки при концентрации 50 мкл/лунку инкубировали на планшетах, покрытых cCLB8, в течение 30 минут при комнатной температуре. Планшеты промывали, а затем при комнатной температуре в течение 30 минут зондировали 50 микролитрами/лунку ПХ-меченного Fc-фрагмента козьего антитела против мышиного IgG (Sigma), разведенного 1:20000 в PBS/1% BSA. Планшеты снова промывали, а затем инкубировали в течение 15 минут при комнатной температуре с 50 мкл/лунку цитрат-фосфатного субстратного раствора (0,1М лимонная кислота и 0,2М фосфат натрия, 0,01% H2O2 и 1 мг/мл OPD). Развитие субстратиндуцируемой окраски прекращали добавлением 4н серной кислоты при 50 мкл/лунку и определяли OD при 490 нм на автоматическом спектрофотометре для планшетов (3).
Слияние клеток
Через три дня после введения последней инъекции i.v. мышь #1 подвергали эвтаназии путем CO2-асфиксии и селезенку удаляли в условиях асептики, и погружали в 10 мл холодного PBS/PSA (PBS, содержащего PSA, который состоит из 100 Е/мл пенициллина, 100 мкг/мл стрептамицина и 0,25 мкг/мл аминоптерина В). Клетки селезенки выделяли путем пропускания через стерильный сборщик клеток при интенсивной промывке средой RPMI (RPMI, 20% FBS, 1мМ пируват натрия, 4мМ L-глутамин, 1% МЕМ с заменимыми аминокислотами). Затем клетки один раз промывали и подсчитывали на счетчике Coulter.
Слияние жизнеспособных клеток селезенки с мышиными миеломными клетками осуществляли в отношении 5:1 (Centocore's Cell Biology Services, P3х63Ag8.653). Смесь клеток селезенки и миеломных клеток помещали в пробирку емкостью 50 мл и осаждали. Осадок медленно ресуспендировали 2 мл 50% (мас./об.) раствора ПЭГ (5 г ПЭГ с молекулярной массой 3000, 5 мл стерильной dH2O, рН 8,0, 500 мкл ДМСО (Sigma) при 37°С. Слияние клеток осуществляли в течение 2 минут при комнатной температуре. Это слияние прекращали путем медленного добавления 15 мл RPMI (без добавок) при 37°С. Слитые клетки центрифугировали в течение 10 минут при 1000 об/мин, забирали 25 мл-пипеткой и вводили в колбу емкостью 225 см2 (Costar, 431082), содержащую 100 мл среды для слияния клеток (RPMI, 20% FBS, 1 мМ пируват натрия, 4мМ L-глутамин, 1% МЕМ с заменимыми аминокислотами, 25 мкг/мл гентамицина, 100 мкМ гипоксантина, 0,4 мкМ аминоптерина и 16 мкМ тимидина). Клетки оставляли на ночь при 37°С, в колбу добавляли 100 мл среды для слияния клеток при 37°С, и эту колбу вращали для ресуспендирования клеток. Затем клетки высевали при 200 мкл/мл в девять плоскодонных 96-луночных планшетов для культивирования тканей (Costar, 3595). Планшеты для слияния помещали на 7-10 дней в инкубатор с повышенной влажностью при 37°С и 5% СО2. Через 7 дней среду для слияния клеток заменяли (4).
Детекция мышиных IgG против антител cCLB8 в гибридомном супернатанте
Гибридомы, образующиеся в результате слияния cCLB8-иммунизованных мышиных лимфоцитов с мышиными миеломными клетками (Centocor's Cell Biology Services, P3х63Ag8.653), оценивали с помощью ИФА на их способность секретировать антитела против вариабельной области. Для этого планшеты сенсибилизировали cCLB8 при 10 мкг/мл в PBS в течение ночи при 4°С. Эти планшеты промывали и блокировали как описано выше, а затем замораживали вплоть до их использования. Неразведенные гибридомные супернатанты, полученные от 12-дневной культуры слитых клеток, инкубировали на планшетах с cCLB8 в течение 30 минут при комнатной температуре. Были протестированы все 1824 лунки в планшетах для слияния. Эти планшеты промывали, а затем зондировали ПХ-меченным Fc-фрагментом козьего антитела против мышиного IgG, разведенного в отношении 1:20000 в PBS/1% BSA. Планшеты снова промывали, а затем инкубировали с цитрат-фосфатным субстратным раствором, как описано выше. Клетки в позитивных лунках переносили в 24-луночные планшеты и супернатанты тестировали на другие химерные антитела "мышь/человек", такие как С207А (антитело против фактора VII), С128А (антитело против CD4), С116J (антитело против тромбоцитов GPIIb/IIIa), C168J (антитело против TNFα) и С300А/С301А (два различных антитела против опухолевых антигенов предстательной железы). Клетки в негативных лунках клонировали до >80% гомогенности и этим клеткам присваивали коды С. Получали банки клеток для исследования, в каждом по 12 сосудов, и проводили тестирование на микоплазму и стерильность для Mab С433А-С437А (5).
Определение изотипа
Определение изотипа антител осуществляли с использованием набора для определения изотипов мышиных моноклональных антител (Life Technologies) в формате с использованием стерженей. Смесь буфера для разведения, гибридомного супернатанта и конъюгата крысиного антимышиного антитела инкубировали в течение ночи при комнатной температуре при встряхивании в пробирках, содержащих стержни, предварительно покрытые иммобилизованными мышиными антителами различных изотипов. Затем стержни вынимали из пробирок, слегка промывали в dH2O и определяли изотипы (6).
Анализ на сывороточное ингибирование
Оценку ингибирующего действия конкурентных циркулирующих иммуноглобулинов в NHS на способность 7 антиидиотипических антител связываться с cCLB8 проводили с помощью твердофазного ИФА. Эти 7 очищенных антиидиотипических антител инкубировали при двухкратных серийных разведениях, начиная с исходной концентрации 50 мкг/мл в присутствии 0%, 0,5%, 5% и 50% (об./об.) пула нормальной человеческой сыворотки в течение 30 минут при 37°С. Эти смеси переносили в планшеты, сенсибилизированные cCLB8, инкубировали в течение 30 минут при 37°С, а затем промывали. Планшеты зондировали при комнатной температуре в течение 30 минут ПХ-меченным Fc-фрагментом козьего антитела против мышиного IgG, разведенного в отношении 1:20000 в PBS/1% BSA, а затем промывали. Развитие окраски, индуцированное OPD-субстратом, наблюдалось в темноте в течение 15 минут при комнатной температуре. Для прекращения развития окраски в планшеты добавляли 4н серную кислоту. Планшеты оценивали на ингибирование связывания путем измерения OD при 490 нм (7).
Ингибирование связывания cCLB8 с huIL-6 под действием антиидиотипических Mab
Анализ на способность 7 антиидиотипических антител ингибировать связывание cCLB8 с HuIL-6 проводили с помощью твердофазного ИФА для HuIL-6. Планшеты сенсибилизировали HuIL-6 при 1 мкг/мл в PBS в течение ночи при 4°С и блокировали PBS/1% BSA в течение 1 часа при комнатной температуре. cCLB8 в конечной концентрации 2 мкг/мл предварительно инкубировали в течение 30 минут при 37°С двухкратными серийными разведениями 7 антиидиотипических антител при исходной концентрации 50 мкг/мл. Затем смеси для предварительного инкубирования добавляли в планшеты с HuIL-6, инкубировали в течение 30 минут при 37°С и промывали. Планшеты зондировали при 37°С в течение 30 минут ПХ-меченным Fc козьего антитела против человеческого IgG (Accurate), разведенного в отношении 1:25000, а затем промывали. Развитие окраски, индуцированное OPD-субстратом, наблюдалось в темноте в течение 15 минут при комнатной температуре. Для прекращения развития окраски в планшеты добавляли 4н серную кислоту. Планшеты оценивали на ингибирование связывания путем измерения OD при 490 нм (8).
Связывание антиидиотипических моноклональных антител с cCLB8, предварительно связанным с HuIL-6
Оценивали способность 7 антиидиотипических антител связываться с cCLB8, уже связанным с HuIL-6. Планшеты сенсибилизировали HuIL-6 при 1 мкг/мл в PBS в течение ночи при 4°С и блокировали. cCLB8 при 10 мкг/мл в PBS инкубировали на планшетах с HuIL-6 в течение 30 минут при 37°С. Планшеты промывали, добавляли трехкратные серийные разведения антиидиотипических Mab при исходной концентрации 10 мкг/мл и инкубировали при 37°С в течение 30 минут. Планшеты промывали, а затем зондировали при 37°С в течение 30 минут ПХ-меченным Fc козьего антитела против мышиного IgG, разведенного в отношении 1:20000 в PBS/*1% BSA. Планшеты снова промывали, а затем проявляли добавлением OPD-субстрата в течение 30 минут при комнатной температуре. OD измеряли при 490 нм (9).
Генерирование мышиных антиидиотипических моноклональных антител против cCLB8
В результате одного слияния клеток селезенки мышей Balb/с, иммунизованных cCLB8, было идентифицировано 7 cCLB8-специфических антиидиотипических антител с помощью ИФА. Было показано, что 7 антиидиотипических антител не связываются с другими химерными антителами "мышь/человек", такими как С207А, С128А, С168J, С116J, С300А и С301А. Шесть из семи антител имели изотип IgG1k, а одно антитело имело изотип IgG2bk. Результаты слияния клеток систематизированы в таблице 2. Следует отметить, что максимальный титр антитела в сыворотке 1:800 достигался у мышей через 47 дней и оставался постоянным в течение всей процедуры иммунизации.
Таблица 1. Свойства мышиных антиидиотипических моноклональных антител против cCLB8
Анализ на сывороточное ингибирование
Определяли воздействие пула нормальной человеческой сыворотки на способность 7 антиидиотипических антитела связываться с cCLB8. Ингибирование связывания анти-Id Mab с cCLB8 под действием 0% и 0,5% NHS не наблюдалось ни для одного из указанных Mab. Для трех Mab (С433, С435А и С437А) наблюдалось частичное ингибирование связывания под действием 5% NHS. Все антитела, за исключением С434А и С436А, подвергались значительному воздействию NHS при концентрации 50%. На фигуре 8А-G показаны профили ингибирования связывания 7 антиидиотипических антител в сыворотке. Фигура 8А-G: Двойные разведения антиидиотипических Mab при исходной концентрации 50 мг/мл инкубировали в присутствии 0%, 0,5%, 5% и 50% NHS в течение 30 минут при 37°С. Эти смеси переносили в cCLB8-сенсибилизированные планшеты и инкубировали в течение 30 минут при 37°С. Планшеты промывали, а затем зондировали ПХ-меченным Fc козьего антитела против мышиного IgG. (А) С433А, (В) С434А, (С) С435А, (D) С436А, (Е) С437А, (F) С438А и (G) С439А.
Ингибирование связывания cCLB8 с HuIL-6 под действием антиидиотипических Mab
Анализировали способность 7 антиидиотипических антител ингибировать связывание cCLB8 с HuIL-6. Предварительные исследования с помощью ИФА показали, что cCLB8 очень слабо связывается с HuIL-6-сенсибилизированными планшетами (10). Два Mab (С435А и С437А), используемые в 6-25 раз большей концентрации, продемонстрировали фактически полное ингибирование связывания cCLB8 с HuIL-6. С434А оказывало ингибирующее действие на cCLB8 только в 25-кратном избытке. Двумя антителами, показавшими наилучшее ингибирование связывания cCLB8 с HuIL-6, были С436А и С439А. Эти два антитела обладали способностью ингибировать связывание cCLB8 при 3-25-кратном избытке концентрации. С434А и С438А не обнаруживали ингибирующей активности. Этот анализ подтвердил результаты, полученные в предыдущем исследовании (11). Фигура 9: cCLB8 при 2 мкг/мл инкубировали в течение 30 минут при 37°С с двойными разведениями антиидиотипических Mab при исходной концентрации 50 мг/мл. Смеси переносили в HuIL-6-сенсибилизированные планшеты и инкубировали в течение 30 минут при 37°С. Планшеты промывали, а затем зондировали ПХ-меченным Fc козьего антитела против человеческого IgG.
Связывание антиидиотипических моноклональных антител с cCLB8, предварительно связанным с HuIL-6
Оценивали способность 7 антиидиотипических антител связываться с cCLB8, предварительно связанным с HuIL-6. Как и в предварительных исследованиях, только антитела С436А и С438А были способны связываться с антителом cCLB8, предварительно связанным с HuIL-6 (11). На фигуре 3 проиллюстрирована способность 7 антиидиотипических антител связываться с cCLB8, которые были предварительно связаны с HuIL-6.
Фигура 10: cCLB8 при 10 мкг/мл инкубировали на планшетах с HuIL-6 в течение 30 минут при 37°С. Планшеты промывали, а затем инкубировали с тройными разведениями антиидиотипических Mab при исходной концентрации 10 мг/мл в течение 30 минут при 37°С. Планшеты промывали, а затем зондировали ПХ-меченным Fc козьего антитела против мышиного IgG.
Заключение
Семь моноклональных антиидиотипических антител продуцировали в результате слияния мышиных миеломных клеток и клеток селезенки мышей Balb/с, иммунизированных химерным антителом против человеческого IL-6 (cCLB8). Пять антиидиотипических антител (С434А, С435А, С436А, С437А и С439А) были способны блокировать связывание cCLB8 с HuIL-6. Два антитела (С436А и С438А) обладали способностью связываться с cCLB8, которое было предварительно связано с HuIL-6, а связывание двух антител (С434А и С436А) с cCLB8 фактически не блокировалось никакими тестированными концентрациями NHS. Широкие профили связывания этих антиидиотипических антител с cCLB8 позволяют рассматривать эти антитела как возможные кандидаты на их использование в качестве фармакокинетических зондов для детекции в сыворотке и для иммуногистохимических анализов.
Краткие выводы
IL-6, вследствие его плейотропной активности, играет определенную роль в патологии ряда заболеваний. Поэтому может оказаться желательным использовать высокоаффинное нейтрализующее химерное или человеческое антитело против IL-6 для лечения IL-6-ассоциированных заболеваний, таких как рак, кахексия, СКВ (системная красная волчанка), остеопороз и ЗСН (застойная сердечная недостаточность). cCLB8 или любые производные этого mAb, включая химерное или гуманизированное антитело или его фрагменты, могут быть использованы для облегчения боли в костях, для ингибирования роста опухолей, таких как рак предстательной железы и множественная миелома, и лечения других заболеваний, в патогенезе которых участвует IL-6. Это антитело может быть использовано либо в виде отдельного средства, либо в виде комбинации с другими терапевтическими средствами. Кроме того, это Mab может быть использовано в качестве хемосенсибилизатора, и тем самым оно может повышать терапевтическую эффективность цитотоксических агентов.
Очевидно, что настоящее изобретение может быть осуществлено способами, отличающимися от способов, конкретно описанных в настоящем описании и в примерах.
Исходя из приведенного выше описания, в настоящее изобретение могут быть внесены различные модификации и изменения, которые входят в объем прилагаемой формулы изобретения.
Список последовательностей
Список последовательностей-вставок:
SEQ. ID No. 1 CDR 1
SEQ. ID No. 2 CDR 2
SEQ. ID No. 3 CDR 3
SEQ. ID No. 4 CDR 4
SEQ. ID No. 5 CDR 5
SEQ. ID No. 6 CDR 6
SEQ ID NO:7 Вариабельная область тяжелой цепи cCLB8
SEQ ID NO:8 Вариабельная область легкой цепи cCLB8
Вариабельная область тяжелой цепи cCLB8
Вариабельная область легкой цепи cCLB8
Реферат
Изобретение относится к биотехнологии и иммунологии. Предложены варианты химерных анти-IL-6-антител на основе мышиного антитела CLB-8, каждое из которых содержит константную область из одного или нескольких антител человека. Описаны варианты: нуклеиновых кислот, кодирующих анти-IL-6-антитело, векторов, клеток-хозяина. Раскрыт способ получения анти-IL-6-антитела с использованием нуклеиновой кислоты или вектора. Описаны варианты композиций для применения в способе модуляции злокачественного расстройства или расстройства иммунной системы, опосредуемого IL-6. Раскрыто применение анти-IL-6-антитела для лечения иммунологического расстройства или заболевания, опосредуемого IL-6, а также применение анти-IL-6-антитела для модуляции злокачественного расстройства или расстройства иммунной системы, опосредуемого IL-6. Использование вариантов химерного анти-IL-6-антитела, которое сохраняет высокую аффинность мышинного анти-IL-6-антитела при уменьшении иммуногенности, может найти применение в медицине для лечения заболеваний, опосредованных IL-6. 12 н. и 14 з.п. ф-лы, 16 ил., 3 табл.
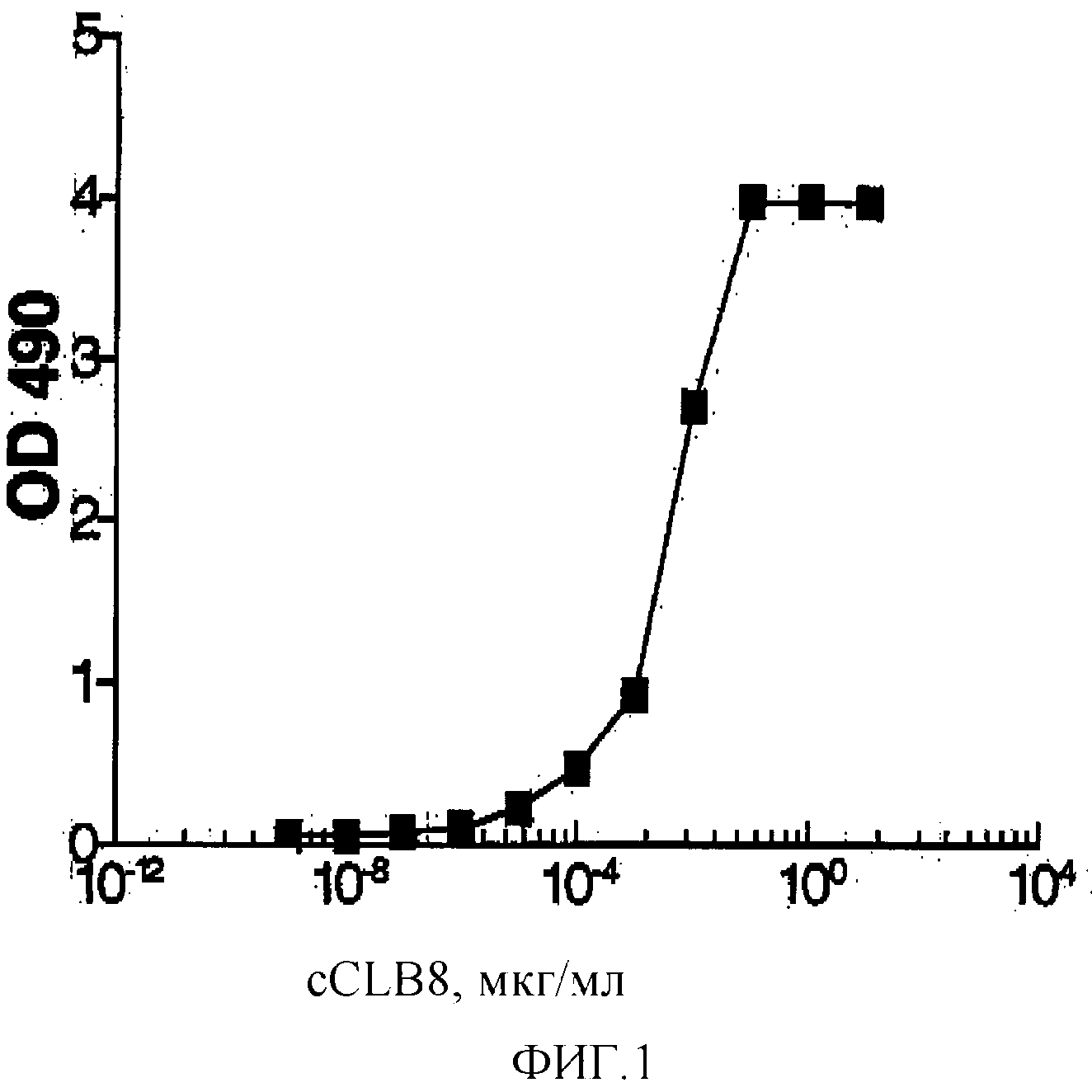
Формула
Документы, цитированные в отчёте о поиске
Фармацевтическая композиция для профилактики или лечения заболеваний, вызываемых образованием il-6

Комментарии