Генетически модифицированные, не принадлежащие к человеческому роду животные и способ их использования - RU2642319C2
Код документа: RU2642319C2
Чертежи



































Описание
Перекрестные ссылки на родственные заявки
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США №61/698,002, поданной 7 сентября 2012, и предварительной заявке на патент США 61/775,171, поданной 8 марта 2013, содержание каждой из которых полностью включено в настоящую заявку посредством ссылки.
Уровень техники
Целью биомедицинских исследований является улучшение понимания физиологии человека и применения этих знаний для предотвращения, лечения или исцеления болезней человека. Вследствие практических и этических барьеров проведения экспериментов на людях, многие исследования осуществляются на небольших животных моделях, например на мышах. Однако мыши не являются людьми, и знания, полученные в результате проведения экспериментов на животных, не всегда применимы к людям. В этом контексте мыши, репопулированные с помощью гемато-лимфоидной системы человека (HHLS) представляют собой удобную модель на мелком животном для исследования гематопоэза человека и иммунной фракции in vivo.
HHLS мышей получают путем пересадки гематопоэтических стволовых клеток и клеток-предшественников (прогениторных клеток) человека (HSPCs) и/или эмбриональных тканей человека мышам-реципиентам, лишенным врожденной и адаптивной ветвей иммунного ответа. Первые модели HHLS мышей были разработаны в конце 1980-х (Mosier et al., 1988, Nature 335:256-259; McCune et al., 1988, Science 241:1632-1639; Kamel-Reid и Dick, 1988, Science 242:1706-1709), и с тех пор были подвергнуты целому ряду усовершенствований (Legrand et al., 2006, Journal of Immunology 176:2053-2058; Shultz et al., 2007, Nature Reviews Immunology 7:118-130). Линии мышей, используемых в настоящее время в качестве реципиентов для приживления человеческого гематопоэтического трансплантата, имеют три общие характеристики. Во-первых, у них отсутствуют В и Т-клетки вследствие Scid мутации в гене, кодирующем PRKDC белок (Mosier et al., 1988, Nature 335:256-259; McCune et al., 1988, Science 241:1632-1639), или вследствие делеции одного из двух генов Rag (Shultz et al., 2000, Journal of immunology 164:2496-2507; Traggiai et al., 2004, Science 304:104-107). Во-вторых, делеция или мутация Il2rg гена, кодирующего общую гамма цепь (γс) рецепторов цитокинов, ликвидирует IL-15 сигнальный путь и приводит к отсутствию NK-клеток (Traggiai et al., 2004, Science 304:104-107; Ito et al. 2002, Blood 100:3175-3182). В-третьих, взаимодействие между SIRPA рецептором, экспрессированным на мышиных макрофагах, и CD47 лигандом на человеческих клетках предоставляет ингибиторный сигнал для мышиных макрофагов и обеспечивает фагоцитарную толерантность к человеческому ксенотрансплантату (Takenaka et al., 2007, Nature Immunology 8:1313-1323; Takizawa & Manz, 2007, Nature Immunology 8:1287-1289). Межвидовое взаимодействие между SIRPA, экспрессированным на мышиных клетках, и человеческим CD47 достигается при использовании генетического окружения NOD, которое содержит естественный полиморфизм в Sirpa гене (Takenaka et al., 2007, Nature Immunology 8:1313-1323; Takizawa & Manz, 2007, Nature Immunology 8:1287-1289; Legrand et al., 2011, Proc Natl Acad Sci USA 108:13224-13229), или путем ВАС-трансгенной экспрессии человеческого гена SIRPA (Strowig et al., 2011, Proc Natl Acad Sci USA 108:13218-13223). Высокие уровни приживления человеческих гематопоэтических клеток после трансплантации человеческих HSPC достигаются при использовании NOD Scid γс-/- (NOG (Ito et al. 2002, Blood 100:3175-3182) или NSG (Ishikawa et al., 2005, Blood 106:1565-1573)) или hSIRPAtg RAG2-/- γс-/- (SRG (Strowig et al., 2011, Proc Natl Acad Sci USA 108:13218-13223)) мышей в качестве реципиентов.
Хотя у этих линий-реципиентов наблюдается мультилинейное развитие человеческих гематопоэтических клеток, конечная дифференцировка, гомеостаз и/или эффекторная функция большинства человеческих типов клеток является недостаточной. Было выдвинуто предположение, что это состояние является следствием уменьшения или отсутствия перекрестной реактивности между цитокинами, секретируемыми мышиными тканями, и человеческими рецепторами, экспрессированными на гематопоэтических клетках (Manz, 2007, Immunity 26:537-541; Willinger et al., 2011, Trends in Immunology 32:321-327). С целью преодоления этого ограничения были разработаны некоторые стратегии доставки человеческих цитокинов в хозяина-мышь. Эти способы включают инъекцию рекомбинантных цитокинов (Lapidot et al., 1992, Science 255:1137-1141; van Lent et al., 2009, J. Immunol 183:7645-7655), лентивирусную доставку кДНК, кодирующей цитокин (O'Connell et al., 2010, PloS One 5(8):e12009), гидродинамическую инъекцию плазмидной ДНК (Chen et al., 2009, Proc Natl Acad Sci USA 106:21783-21788), трансгенную экспрессию кДНК (Nicolini et al., et al., 2004, Leukemia 18(2):341-347; Brehm et al., 2012, Blood 119:2778-2788; Takagi et al., 2012, Blood 119:2768-2777) или «нокин» замену генов, кодирующих цитокины (Rongvaux et al., 2011, Proc Natl Acad Sci USA 108:2378-2383; Willinger et al., 2011, Proc Natl Acad Sci USA 108:2390-2395; Rathinam et al., 2011, Blood 118:3119-3128). Последний метод имеет преимущество, заключающееся в более физиологической экспрессии человеческого гена. Кроме того, если человеческий цитокин является не полностью перекрестаореагирующим на мышином рецепторе, он может вызывать нарушение в популяциях мышиных клеток и обеспечивать дополнительное конкурентное преимущество человеческим клеткам. При использовании стратегии «нокин» замещения гена, гуманизация гена, кодирующего тромбопоэтин (Тро), приводила к лучшему сохранению функциональных человеческих гематопоэтических стволовых клеток и повышенному приживлению в костном мозге (Rongvaux et al., 2011, Proc Natl Acad Sci USA 108:2378-2383); замена генов, кодирующих интерлейкин-3 и GM-CSF (Il3 и Csf2), вызывала потерю мышиных легочных альвеолярных макрофагов (AM) и развитие функциональных человеческих AM (Willinger et al., 2011, Proc Natl Acad Sci USA 108:2390-2395); а замена Csf1 гена, кодирующего M-CSF, давала в результате повышенное количество человеческих моноцитов во многих тканях (Rathinam et al., 2011, Blood 118:3119-3128).
Гемато-лимфоидные системы человека и мыши различаются во многих аспектах (Haley, 2003, Toxicology 188:49-71; Mestas & Hughes, 2004, J Immunol 172:2731-2738). Одно из основных различий между двумя видами заключается в их лейкоцитарной формуле. Кровь человека богата миелоидными клетками, которые представляют 50-75% всех белых клеток крови (лейкоцитов). В отличие от этого в крови мыши преобладают лимфоциты и только 20-30% лейкоцитов являются клетками миелоидного ростка. Это видовое различие, функциональное и эволюционное значение которого не ясно, не воспроизводится у обыкновенных HHLS мышей, таких как NOG/NSG или SRG. Действительно, развитие миелоидных человеческих клеток, в частности, является нарушенным у этих хозяев, при этом миелоидные клетки представляют только 5-10% человеческих лейкоцитов.
Одним применением мышей с функциональными человеческими иммунными системами является создание и тестирование человеческих вакцин. Как показывает время, индукция иммунных ответов in vivo относительно неэффективна (2004, Traggiai et al., Science 304:104-107; 2002, Ito et al., Blood 100:3175-3182; 2005, Ishikawa et al., Blood 106:1565-1573; 2005, Shultz et al., J Immunol 174:6477-6489; 2006, Baenziger et al., Proc Natl Acad Sci USA 103:15951-15956). Некоторые исследования сообщали об успешных патоген-специфических иммунных ответах после инфицирования. И хотя сообщалось, что примерно у 50% мышей вырабатывался вирус-специфический IgM и IgG после заражения вирусом денге (2007, Kuruvilla et al. Virology 369:143-152), другие исследования сообщали о количестве ниже 20% мышей, продуцирующих антиген-специфический IgM и IgG после HIV и EBV инфекции (2006, Baenziger et al., Proc Natl Acad Sci USA 103:15951-15956; 2008, Yajima et al., J Infect Dis 198:673-682). После иммунизации адьювантом и антигеном переключение классов антиген-специфических иммуноглобулинов, как показывает время, также является неэффективным при наличии одной лишь фракции иммунизированных животных, демонстрирующих антиген-специфические IgG ответы (2004, Traggiai et al., Science 304:104-107; 2002, Ito et al., Blood 100:3175-3182; 2005, Ishikawa et al., Blood 106:1565-1573; 2005, Shultz et al., J Immunol 174:6477-6489; 2009, Watanabe et al., Int Immunol 21:843-858; 2010, Becker et al., PLoS ONE 5). Эти исследования включали NSG и BALB/c RAG2-/- γс-/- мышей и различные комбинации адьювант/антиген.
В данной области техники имеется потребность в гуманизированных, не принадлежащих к человеческому роду животных, способных обеспечить и поддерживать приживление человеческих гематопоэтических клеток. Настоящее изобретение направлено на эту неудовлетворенную потребность в данной области техники.
Раскрытие изобретения
В общем, данное изобретение имеет отношение к генетически модифицированным животным, не относящимся к человеческому роду, экспрессирующим, по меньшей мере, что-либо из числа человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SIRPA или человеческого ТРО, а также к способам их использования. Таким образом, в одном варианте осуществления данное изобретение представляет собой генетически модифицированное, не относящееся к человеческому роду животное, содержащее геном, содержащий, по меньшей мере, одну нуклеиновую кислоту, кодирующую, по меньшей мере, что-либо из группы, содержащей человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, при этом, по меньшей мере, одна нуклеиновая кислота является функционально связанной с промотором, при этом у животного экспрессируется, по меньшей мере, один полипептид, выбранный из группы, состоящей из человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SIRPA и человеческого ТРО. В другом варианте осуществления данное изобретение представляет собой генетически модифицированное, не относящееся к человеческому роду животное, содержащее геном, содержащий нуклеиновую кислоту, кодирующую человеческий M-CSF, нуклеиновую кислоту, кодирующую человеческий IL-3, нуклеиновую кислоту, кодирующую человеческий GM-CSF, нуклеиновую кислоту, кодирующую человеческий SIRPA, и нуклеиновую кислоту, кодирующую человеческий ТРО, при этом каждая из нуклеиновых кислот, кодирующая человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, является функционально связанной с промотором, а у животного экспресссируется человеческий M-CSF полипептид, человеческий IL-3 полипептид, человеческий GM-CSF полипептид, человеческий SIRPA полипептид и человеческий ТРО полипептид. В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное является иммунодефицитным. В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует активирующий рекомбинацию ген 2 (Rag-2-/-). В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует гамма цепь IL2 рецептора (гамма цепь-/-). В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует Rag-2 и генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует гамма цепь IL2 рецептора (Rag-2-/- гамма цепь-/-). В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное является грызуном. В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное является мышью. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное также содержит, по меньшей мере, одну человеческую гематопоэтическую клетку. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное также включает, по меньшей мере, одну человеческую раковую клетку. В некоторых вариантах осуществления человеческая раковая клетка является лейкемической клеткой или клеткой меланомы.
В другом варианте осуществления данное изобретение представляет собой способ приживления гематопоэтических стволовых и прогениторных клеток (HSPC) у генетически модифицированного, не относящегося к человеческому роду животного, при этом у животного экспрессируется, по меньшей мере, что-либо из группы, включающей человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, причем данный способ включает стадию введения, по меньшей мере, одной HSPC генетически модифицированному животному, экспрессирующему, по меньшей мере, что-либо из группы, состоящей из человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SIRPA и человеческого ТРО. В некоторых вариантах осуществления HSPC является человеческой HSPC. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное является грызуном. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное является мышью. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное является иммунодефицитным. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует активирующий рекомбинацию ген 2 (Rag-2-/-). В одном варианте осуществления генетически модифицированное, иммунодефицитное, не относящееся к человеческому роду животное не экспрессирует эндогенный IL2 рецептор (гамма цепь-/-). В одном варианте осуществления генетически модифицированное, иммунодефицитное, не относящееся к человеческому роду животное не экспрессирует эндогенный Rag-2 и не экспрессирует эндогенную гамма цепь (Rag-2-/- гамма цепь-/-). В одном варианте осуществления генетически модифицированное животное содержит человеческую раковую клетку. В одном варианте осуществления человеческая раковая клетка является лейкемической клеткой или клеткой меланомы.
В другом варианте осуществления изобретением является генетически модифицированная мышь Rag-2-/- гамма цепь-/-, имеющая геном, содержащий, по меньшей мере, одну нуклеиновую кислоту, кодирующую, по меньшей мере, что-либо из группы, состоящей из человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SIRPA и человеческого ТРО, при этом, по меньшей мере, одна нуклеиновая кислота является функционально связанной, по меньшей мере, с одним промотором, причем мышь экспрессирует, по меньшей мере, один полипептид, выбранный из группы, состоящей из человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SERPA и человеческого ТРО. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное содержит геном, имеющий нуклеиновую кислоту, кодирующую человеческий M-CSF, нуклеиновую кислоту, кодирующую человеческий IL-3, нуклеиновую кислоту, кодирующую человеческий GM-CSF, нуклеиновую кислоту, кодирующую человеческий SIRPA и нуклеиновую кислоту, кодирующую человеческий ТРО, при этом каждая из нуклеиновых кислот, кодирующих человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, является функционально связанной с промотором, и при этом животное экспрессирует человеческий M-CSF полипептид, человеческий IL-3 полипептид, человеческий GM-CSF полипептид, человеческий SIRPA полипептид и человеческий ТРО полипептид. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное является грызуном. В одном варианте осуществления генетически модифицированное не относящееся к человеческому роду животное является мышью. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное содержит человеческую гематопоэтическую клетку. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное содержит человеческую раковую клетку. В некоторых вариантах осуществления человеческая раковая клетка является лейкемической клеткой или клеткой меланомы.
Краткое описание чертежей
Следующее подробное описание предпочтительных вариантов осуществления изобретения будет более понятно после прочтения в сочетании с прилагаемыми чертежами. Для иллюстрации изобретения предпочтительные в настоящее время варианты осуществления представлены в виде чертежей. Однако следует понимать, что изобретение не ограничивается точным порядком и средствами вариантов осуществления, показанных на чертежах.
Фигура 1, включающая Фигуры 1А-1Е, показывает результаты экспериментов, демонстрирующих, что MISTRG мыши поддерживают высокие уровни приживления человеческого гематопоэтического трансплантата. Предварительно обработанным рентгеновскими лучами новорожденным мышам указанных линий было привито 100,000 (FL-)CD34+ человеческих эмбриональных клеток печени с помощью внутрипеченочной инъекции. Уровни приживления человеческого трансплантата (hCD45+ клетки) измеряли в крови через 7-9 недель, а в ВМ через 10-12 недель. (Фигура 1А) Репрезентативное исследование с помощью проточной цитометрии встречаемости мышиных и человеческих CD45+ клеток в крови и ВМ указанных реципиентных мышей. Числа рядом с областями гейтов указывают проценты от числа всех CD45+ клеток. (Фигура 1В) Представлены объединенные данные уровней приживления клеток крови (% hCD45+ клеток), полученные в 19 независимых экспериментах. В каждом эксперименте один образец FL-CD34+ клеток был отделен и введен мышам соответствующих линий. Каждый символ представляет отдельную мышь, красные планки показывают средние значения (n=56-155; ns - незначимое значение; * р<0.05 тест Тьюки (полный статистический анализ показан на Фигуре 6). Серая горизонтальная линия показывает 10% hCD45+ клеток. (Фигура 1С) Уровни приживления в ВМ репрезентативной подгруппы мышей (Фигура 6С) из панели (Фигура 6В) (n=12-16; * р<0.05 тест Тьюки; смотри также Фигуры 6D-6E). (Фигура 1D) Репрезентативное исследование с помощью проточной цитометрии приживления hCD45+ клеток в крови и ВМ через 3 месяца после внутрипеченочной инъекции 200,000 FL-CD34+ клеток необлученным новорожденным мышам MISTRG. (Фигура 1Е) Уровни приживления человеческих CD45+ клеток в крови и ВМ MISTRG мышей с пересадкой, как на Фигуре 1D (n=16). В этом случае показан ВМ всех мышей (включая мышей с hCD45+<10%).
Фигура 2, включающая Фигуры 2A-2K, показывает результаты экспериментов, демонстрирующих, что MISTRG мыши обеспечивают эффективное развитие и сохранение миелоидных клеток в лимфоидной и нелимфоидной тканях. (Фигура 2А) Процентное содержание человеческих миелоидных клеток (hCD33+) среди человеческих гематопоэтических клеток (hCD45+) в крови указанных реципиентных мышей, которым в возрасте новорожденных были пересажены FL-CD34+ клетки посредством внутрипеченочной инъекции после предварительной обработки рентгеновскими лучами. Каждый символ представляет отдельную мышь, красные планки показывают средние значения (n=20-113; статистический анализ показан на Фигуре 7А). (Фигура 2В) Композиция человеческих лейкоцитов на таких же мышах (n=20-113 мышей/группу; n=8 доноров-людей; планки погрешностей показывают стандартную ошибку среднего (ош. ср.). (Фигура 2С) Иммуногистологическое окрашивание человеческих миелоидных клеток (hCD68+) в нелимфоидных тканях указанных мышей-реципиентов. Черные планки показывают 20 мкм, и показанные изображения являются характерными, по меньшей мере, для трех проанализированных мышей на группу. (Фигура 2D и Фигура 2Е) Репрезентативное исследование с помощью проточной цитометрии (Фигура 2D) и частота встречаемости (Фигура 2Е) человеческих подгрупп моноцитов, установленных по экспрессии CD14 и CD16 среди CD45+CD33+ клеток в крови мышей-реципиентов (n=8-12 мышей/группу; планки погрешностей показывают ОШ. СР.). (Фигура 2F и Фигура 2G) Выработка цитокинов человеческими моноцитами, выделенными из ВМ MITRG реципиентов и стимулированными in vitro LPS (Фигура 2F) или R848 (Фигура 2G) (планки погрешностей показывают SD трех повторов; отражающих 3 независимых эксперимента). (Фигура 2Н) In vitro фагоцитоз GFP-экспрессирующих E.coli человеческими клетками, присутствующими в крови MITRG мышей (n=7). (Фигуры 2I, 2J, 2K) Выработка цитокинов in vivo, измеренная методом ELISA в сыворотке или с помощью ОТ-ПЦР в легких мышей, обработанных LPS (Фигура I; 90 мин, n=15-18), или инфицированных Listeria monocytogenes (Фигура 2J; день 2, n=6-15) или гриппом A/PR8 H1N1 (Фигура 2K; день 3, n=3-5). (Фигуры 2А, 2J, 2K) р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA, а затем апостериорного теста Тьюки (* р<0.05); (Фигура 2I) р-значение вычисляли с помощью непарного критерия Стьюдента с логарифмическим (log10) преобразованием значений.
Фигура 3, включающая Фигуры 3A-3I, показывает результаты экспериментов, демонстрирующих, что MISTRG мыши эффективно обеспечивают развитие и функцию человеческих NK клеток. (Фигура 3А) Количественный ОТ-ПЦР анализ экспрессии мРНК человеческих IL-15 и IL-15Rα в печени NSG, MITRG и MISTRG мышей с пересаженными клетками (n=7-8; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 апостериорный тест Тьюки). Экспрессию нормировали по отношению к мыши Hprt. (Фигура 3В) Количественный ОТ-ПЦР анализ экспрессии мРНК человеческих IL-15 и IL-15Rα в популяции человеческих клеток, очищенных из костного мозга MITRG мышей с пересаженными клетками (n=4-5, планки погрешностей указывают ОШ. СР.). Экспрессия, нормированная относительно человеческого HPRT, показана относительно hCD14+hCD16- клеток. (Фигура 3С и Фигура 3D) Репрезентативное исследование с помощью проточной цитометрии (гейтирование по hCD45+mCD45- клеткам, «канал» лимфоцитов; числа рядом с оконтуренными областями показывают проценты клеток) (Фигура 3С) и абсолютное количество или частота (Фигура 3D) человеческих NK клеток (hNKp46+hCD3-) у NSG, MITR и MISTRG мышей с пересаженными клетками (n=8-16; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 апостериорный тест Тьюки). (Фигура 3Е) Абсолютное количество человеческих NK печени (hNKp46+hCD3-) и Т-клеток (hCD3+, показаны как контроль) от мышей MISTRG с пересаженными клетками, или оставленных необработанными или обработанных в течение 3 последовательных дней инкапсулированным в липосомы клодронатом для истощения фагоцитов (n=8; р-значение вычисляли с помощью непарного критерия Стьюдента; ns - незначимое значение). (Фигура 3F) Меченые LCL721.221 (HLA класс I отрицательные) и LCL721.45 (класс I положительные) клетки инъецировали i.v. в соотношении 1:1, и отношения HLA класс I положительных или отрицательных, среди меченых клеток, восстановленных спустя 12 часов в селезенке, использовали для вычисления цитотоксичности специфических NK-клеток (n=8, р-значение вычисляли с помощью непарного критерия Стьюдента). (Фигура 3G) Количественный ОТ-ПЦР анализ экспрессии мРНК человеческого IFNγ в печени NSG и MISTRG мышей через 2 дня после заражения Listeria (n=8-9, р-значение вычисляли с помощью непарного критерия Стьюдента). Экспрессию нормировали по отношению к мыши Hprt. (Фигура 3Н и Фигура 3I) Репрезентативное исследование с помощью проточной цитометрии (Фигура 3Н) и частота (Фигура 3I) IFNγ-экспрессирующих и дегранулированных (CD107a+) человеческих NK-клеток печени из неинфицированных или Listeria-инфицированных NSG и MISTRG мышей (n=4-11; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA). Результаты двух (Фигуры 3А, 3Е-3I), трех (Фигура 3В) или четырех (Фигуры 3С, 3D) экспериментов были объединены.
Фигура 4, включающая Фигуры 4A-4F, показывает результаты экспериментов, демонстрирующих, что человеческие миелоидные клетки в MISTRG проникают в опухоль и поддерживают рост. Клетки меланомы человека Ме290 были имплантированы в бок NSG и MISTRG мышей с пересаженными клетками или без пересадки. Некоторых мышей обработали VEGF-ингибитором Avastin™. Опухоли измеряли и извлекали для проведения исследования через 11 дней. (Фигура 4А) Инфильтрация человеческих гематопоэтических клеток в опухоль, определенная по экспрессии мРНК, кодирующей человеческие гематопоэтические (PTPRC, кодирующий CD45) и миелоидные (ITGAM, кодирующий CD11b) маркеры (n=6-7; р-значение вычисляли с помощью непарного критерия Стьюдента). (Фигура 4В и Фигура 4D) Репрезентативные иммуногистохимические изображения маркеров человеческих миелоидных клеток в опухолях от NSG, MISTRG и пациентов. (Фигура 4С) Количественная оценка плотности CD163+ клеток (n=3 образцов/группу, подсчитывали 3 слайда на образец). (Фигура 4Е и Фигура 4F) Типичные изображения (Фигура 4Е) и объем (Фигура 4F) опухолей в указанных группах мышей (n=7-24 мышей/группу), р-значения вычисляли с помощью критерия Стьюдента (Фигура 4А) или с помощью однофакторного дисперсионного анализа ANOVA (Фигуры 4С, 4Е) с последующим апостериорным тестом Тьюки (* р<0.05).
Фигура 5 показывает цитокины, вовлеченные в HSC функцию и миелоидное развитие. Схематическое изображение развития гематопоэтических стволовых клеток в миелоидные клетки и неполный перечень цитокинов, которые, как известно, регулируют этот процесс. Штриховкой указаны проценты идентичности аминокислот между человеческими и мышиными цитокинами. Процент идентичности аминокислот является самой объективной мерой консервативности белка между видами, однако, он не всегда коррелирует с функциональной межвидовой перекрестной реактивностью in vivo. Черные прямоугольники показывают цитокины, генетически гуманизированные в MISTRG. HSC - гематопоэтические стволовые клетки; МРР - мультипотентные предшественники; СМР - общий миелоидный предшественник; GMP - предшественник гранулоцита/макрофага; МЕР - предшественник мегакариоцита/эритроцита.
Фигура 6, включающая Фигуры 6А-6Е, показывает результаты статистических анализов уровней приживления у реципиентных мышей. (Фигура 6А) Статистический анализ (однофакторный дисперсионный анализ ANOVA с последующим апостериорным тестом Тьюки; ns - незначимое значение) результатов представлен на Фигуре 1А (процент hCD45+ клеток в крови мыши-реципиента). (Фигура 6В) Количество мышей-реципиентов, которые достигают уровня приживления, по меньшей мере, 10% hCD45+ клеток в крови через 7-9 недель после трансплантации. (Фигура 6С) Уровни приживления клеток крови у мышей, использованных на Фигуре 1С для анализа ВМ. (Фигура 6D) Статистический анализ, подобный анализу на Фигуре 6А, данных, представленных на Фигуре 1С (процент hCD45+ клеток в ВМ мыши-реципиента). (Фигура 6Е) Абсолютное количество hCD45+ клеток в ВМ (2 бедренных кости и 2 большеберцовых кости) мышей-реципиентов, показанных на Фигуре 1С. Уменьшенное количество клеток в ВМ MISTRG является следствием меньшего размера мышей в таком возрасте (10-12 недель после трансплантации) и является результатом первых клинических признаков анемии, описанных подробно на Фигуре 10.
Фигура 7, включающая Фигуры 7А-7Н, показывает результаты экспериментов, дающих оценку повышенному развитию человеческих миелоидных клеток у мышей MISTRG. (Фигура 7А) Статистический анализ (однофакторный дисперсионный анализ ANOVA с последующим апостериорным тестом Тьюки; ns - незначимое значение) результатов представлен на Фигуре 2А (процент hCD33+ клеток в крови мыши-реципиента). (Фигура 7В и Фигура 7С) Частота (Фигура 7В) и статистический анализ (Фигура 7С) человеческих миелоидных клеток (hCD33+) в ВМ мыши-реципиента. (Фигура 7D) Репрезентативное исследование с помощью проточной цитометриии человеческой лимфоидной и миелоидной клеточных линий в крови MISTRG. (Фигура 7Е и Фигура 7F) Репрезентативное исследование с помощью проточной цитометриии человеческих моноцитов (CD33hiSSCloCD66-) и гранулоцитов (CD33+SSChiCD66+) в ВМ (Фигура 7Е) и крови (Фигура 7F) мышей MISTRG и человека-донора. (Фигура 7G и Фигура 7Н) Абсолютное количество человеческих миелоидных клеток (hCD33+) в легких (Фигура 7G) и печени (Фигура 7Н) мышей-реципиентов (n=8-12; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA с последующим апостериорным тестом Тьюки, * р<0.05).
Фигура 8, включающая Фигуры 8А и 8В, показывает результаты экспериментов, демонстрирующих повышенное развитие подгрупп человеческих моноцитов у мышей MISTRG. (Фигура 8А) Репрезентативный анализ методом проточной цитометрии подгрупп человеческих моноцитов, установленных по экспрессии CD14 и CD16 среди hCD45+CD33+ клеток в ВМ, селезенке, легком и печени указанной мыши-реципиента. (Фигура 8В) Частота (планки погрешностей представляют ОШ. СР.) среди hCD33+ клеток и абсолютные количества подгрупп моноцитов в легких и печени мышей-реципиентов (n=12 мышей/группу; р-значения вычисляли с помощью однофакторного ANOVA; *, р<0.05 апостериорный тест Тьюки).
Фигура 9, включающая Фигуры 9А и 9В, показывает результаты экспериментов, демонстрирующих, что подгруппы человеческих моноцитов являются сходными у MISTRG и у людей-доноров. Расширенный иммунофенотип указанных подгрупп человеческих моноцитов в крови (Фигура 9А) и ВМ (Фигура 9В) MISTRG реципиентов и человека-донора. Показано окрашивание изотипическими контрольными антителами и специфическими антителами.
Фигура 10, включающая Фигуры 10A-10I, представляет результаты экспериментов, демонстрирующих, что человеческие миелоидные клетки нарушают фагоцитарную толерантность человек-мышь. (Фигура 10А) CFSE-меченые мышиные RBCs были пересажены указанным мышам, а частота меченых клеток была измерена в указанные моменты времени. (Фигура 10 В) MISTRG с пересаженными клетками предварительно обрабатывали или не обрабатывали клодронатом с целью истощения фагоцитов, а затем мышиные RBCs, меченые CFSE, пересаживали и контролировали, как показано на Фигуре 10А (р-значение, эффект клодроната, определенный путем повторного измерения ANOVA в течение дней 1-3). Эти результаты показывают, что пересаженные мышиные RBCs быстро устраняются in vivo фагоцитами, которые присутствуют у MISTRG, но не присутствуют у NSG. (Фигура 10С) Подсчет RBC в крови мышей без пересадки (n=9-15) или через 8-10 недель после пересадки человеческих FL-CD34+ клеток (n=11-37). р-значения показывают сравнение между мышами без пересадки и мышами с пересаженными клетками каждого генотипа (непарный t-критерий Стьюдента). (Фигура 10D) Корреляция между уровнями приживления человеческих клеток (процент hCD45+ клеток в крови) и подсчет RBC (n=13-22). (Фигура 10Е) Анализ с помощью проточной цитометрии мышиных (mTer119+) и человеческих (hCD235a+) эритроидных клеток в крови у мышей MISTRG без пересадки или с пересаженными клетками, показывающий, что почти все эритроидные клетки в крови MISTRG с пересаженными клетками являются клетками мышиного происхождения, а человеческие эритроидные клетки едва обнаружимы. (Фигура 10F) Типичные изображения и вес селезенки мышей указанных линий с пересаженными клетками (n=3-22), показывающие спленомегалию у привитых MISTRG мышей. Селезенки от мышей Balb/c использовали в качестве контроля (р-значение, однофакторный анализ ANOVA; *, р<0.05 по сравнению со всеми другими группами, апостериорный тест Тьюки). (Фигура 10G) Гистологический срез селезенки NSG и MISTRG с пересаженными клетками, окрашенный Н&Е и иллюстрирующий увеличение красной пульпы селезенки у MISTRG мышей со спленомегалией. (Фигура 10Н) Анализ с помощью проточной цитометрии мышиных эритроидных предшественников (mTer119+mCD71+), которые присутствуют почти в 80% клеток в селезенке MISTRG с пересаженными клетками. (Фигура 10I) Мазки крови MISTRG без пересадки и с пересаженными клетками иллюстрируют обогащение ретикулоцитов. Взятые в совокупности, эти результаты дают веские основания предполагать, что анемия у MISTRG происходит в результате отсутствия фагоцитарной толерантности человек-мышь, и массивный экстрамедуллярный мышиный эритропоэз не в состоянии компенсировать уничтожение mRBCs. Представлены результаты, по меньшей мере, 5 мышей, исследованных в каждой группе (Фигуры 10С, 10Е-10I), и 2 независимых экспериментов (Фигуры 10А, 10В).
Фигура 11, включающая Фигуры 11А и 11В, предоставляет результаты экспериментов, показывающих, что MISTRG мыши обеспечивают человеческий IL-15/IL-15Rα. (Фигура 11А) Количественный ОТ-ПЦР анализ экспрессии мРНК человеческих IL-15 и IL-15Rα в легких NSG, MITRG и MISTRG мышей с пересаженными клетками (n=7-8; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 постериорный тест Тьюки). Экспрессия была нормирована относительно мыши Hprt. (Фигура 11В) Исследование методом проточной цитометрии экспрессии IL-15Rα на популяции человеческих клеток (hCD45+mCD45-) из крови MISTRG мышей с пересаженными клетками (n=4). Гистограммы представляют окрашивание изотипическим контролем или IL-15Rα антителом, соответственно. Объединены или представлены результаты двух экспериментов.
Фигура 12, включающая Фигуры 12А и 12В, представляет результаты экспериментов, показывающих усиленный рост человеческих NK-клеток у MISTRG мышей. (Фигура 12А и Фигура 12В) Частота (Фигура 12А) и абсолютное количество (Фигура 12 В) человеческих NK-клеток (hNKp46+hCD3-) у NSG, MITRG и MISTRG мышей с пересаженными клетками (n=8-16; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 апостериорный тест Тьюки). Объединены результаты четырех экспериментов.
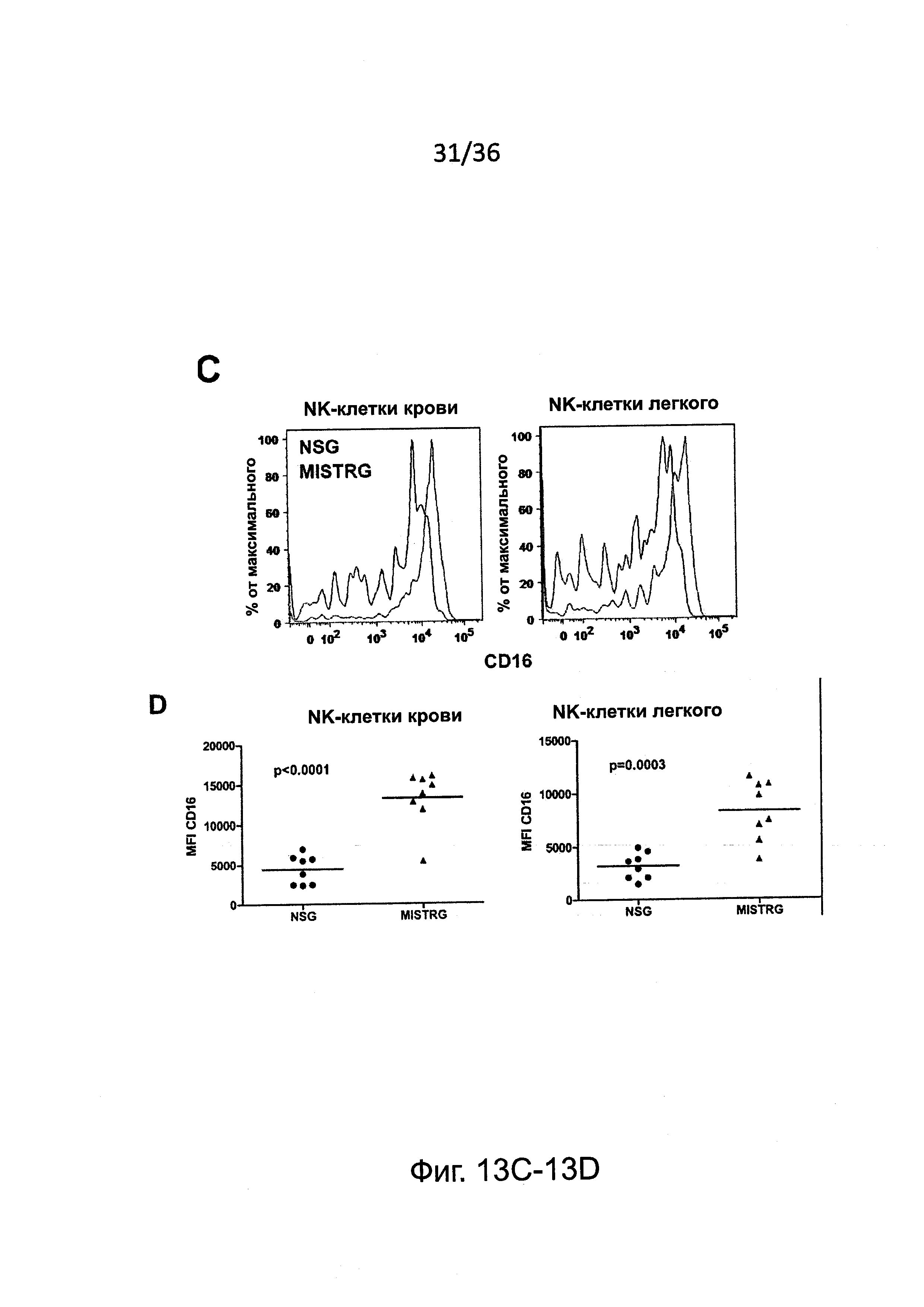
Фигура 13, включающая Фигуры 13A-13F, представляет результаты экспериментов, показывающих, что настоящие зрелые человеческие NK-клетки присутствуют у мышей MISTRG. (Фигура 13А) Исследование методом проточной цитометрии экспрессии CD94 и CD161 на человеческих NK-клетках крови от человека-донора и у MISTRG с пересаженными клетками (n=3). Гистограммы представляют окрашивание изотипическими контрольными Abs или CD94/CD161 Abs. (Фигура 13В) Исследование методом проточной цитометрии экспрессии KIR на человеческих NK-клетках крови от человека-донора или от MISTRG мышей с пересаженными клетками (n=3). Числа указывают частоту KIR+ клеток. (Фигура 13С и Фигура 13D) Поверхностная экспрессия CD16 на человеческих NK-клетках от NSG, MTTRG и MISTRG мышей с пересаженными клетками (n=4-8; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 апостериорный тест Тьюки). (Фигура 13Е и Фигура 13F) Внутриклеточная экспрессия перфорина человеческими NK печени (hNKp46+hCD3-) и Т-клетками (hCD3+) от мышей NSG и MISTRG с пересаженными клетками (n=3; р-значения вычисляли с помощью непарного t-критерия Стьюдента). MFI - средняя интенсивность флуоресценции. Представлены или объединены результаты одного (Фигура 13А и Фигура 13В), двух (Фигура 13Е и Фигура 13F) или четырех (Фигура 13С и Фигура 13D) экспериментов.
Фигура 14 представляет результаты экспериментов, демонстрирующих эффект истощения человеческих моноцитов/макрофагов на гомеостаз человеческих NK клеток у MISTRG мышей. MISTRG мышей с пересаженными клетками оставляли необработанными или обрабатывали в течение 3 последовательных дней инкапсулированным в липосомы клодронатом с целью истощения фагоцитов. Показан проточный цитометрический анализ человеческих моноцитов/макрофагов (верхняя панель, гейтирование по hCD33+ клеткам) и NK-клеток (hNKp46+hCD3-) в печени (n=8). Представлены результаты двух экспериментов. У 1 из 8 мышей истощение клодронатом моноцитов/макрофагов было неэффективным, кроме того, у этих мышей не наблюдалось уменьшение количества NK-клеток.
Фигура 15 показывает результаты экспериментов, демонстрирующих иммуногистохимическое исследование инфильтрации человеческих миелоидных клеток в меланому. Характерное иммуногистохимическое окрашивание человеческих миелоидных клеток в опухоли из NSG, MISTRG или пациентов-людей. Представлены три субъекта на группу и 3 изображения на субъекта.
Фигура 16 показывает сравнение уровней приживления, а также развития и функции иммунных клеток у реципиентных мышей с заменой одного гена у мышей NSG, MISTRG и у людей.
Фигура 17, включающая Фигуры 17A-17D, показывает результаты экспериментов, демонстрирующих, что образцы, выделенные из пациентов с AML, CMML и MDS, могут быть приживлены мышам MISTRG. (Фигура 17А) Характеристики использованных образцов (включая тип болезни и генетическое нарушение, обнаруженное в образцах пациентов), экспериментальный протокол (способ очистки клеток, количество клеток, инъецированных одной мыши, и время после трансплантации, когда мышь исследовали) и результаты приживления (включая количество мышей с обнаружимым приживлением человеческого трансплантата, процент человеческих гематопоэтических CD45+ клеток и миелоидных CD33+ клеток, и генетическое нарушение, обнаруженное в человеческих клетках, выделенных из мышей). (Фигура 17В) Репрезентативное исследование методом проточной цитометрии зернистости (SSC) миелоидных CD33+ клеток, выделенных из мыши с трансплантированными RAEB I пациента или нормальными клетками донора, показывающее недостаточную зернистость в RAEB I образцах. (Фигура 17С) Репрезентативный fish-анализ человеческих клеток, выделенных из мышей с трансплантированным RAEB II образцом, показывающий отсутствие хромосомы 5q. (Фигура 17D) Кариотип человеческих клеток, выделенных из мышей с трансплантированным образцом CMML, который показывает делецию в хромосоме 6.
Подробное описание изобретения
В общем, изобретение имеет отношение к генетически модифицированному, не относящемуся к человеческому роду животному, экспрессирующему, по меньшей мере, что-либо из числа человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SIRPA или человеческого ТРО. Это изобретение имеет отношение к способам получения и использования генетически модифицированных, не относящихся к человеческому роду животных, описанных в данном документе. В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное является мышью. В некоторых вариантах осуществления генетически модифицированному, не относящемуся к человеческому роду животному, описанному в этом документе, пересажены человеческие гематопоэтические клетки. В различных вариантах осуществления генетически модифицированные, не принадлежащие к человеческому роду животные изобретения с пересаженными человеческими гематопоэтическими клетками используются для оценки in vivo роста и дифференцировки гематопоэтических и иммунных клеток, для оценки in vivo человеческого гематопоэза, для in vivo оценки раковых клеток, для in vivo оценки иммунного ответа, для in vivo оценки вакцин и режимов вакцинации, для использования при тестировании эффекта средств, модулирующих рост или выживаемость раковой клетки, для in vivo оценки лечения рака, для производства in vivo и сбора иммунных медиаторов, включая человеческие антитела, и для использования при проверке эффектов средств, модулирующих функцию гематопоэтической или иммунной клетки.
Определения
Если не указано иное, все технические и научные термины, использованные в описании, имеют те же самые значения, которые обычно понятны специалисту в области техники, к которой относится данное изобретение. Определение этих терминов могут быть найдены в разных стандартных ссылках, где они используются в контексте, в том числе в J. Sambrook и D.W. Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; 3rd Ed., 2001; F. M. Ausubel, Ed., Short Protocols in Molecular Biology, Current Protocols; 5th Ed., 2002; B. Alberts et al., Molecular Biology of the Cell, 4th Ed., Garland, 2002; D. L. Nelson и M.M. Cox, Lehninger Principles of Biochemistry, 4th Ed., W.H. Freeman & Company, 2004; и Herdewijn, P. (Ed.), Oligonucleotide Synthesis: Methods и Applications, Methods in Molecular Biology, Humana Press, 2004. Несмотря на то, что при осуществлении или проверке настоящего изобретения могут использоваться любые методы и материалы, сходные или эквивалентные описанным в данном документе, предпочтительные методы и материалы описываются в этом документе.
При использовании в описании каждый из следующих терминов имеет значение, связанное с ним в данном разделе.
Термины, используемые в единственном числе также включают и множественное число. В качестве примера, "элемент" означает один или более чем один элемент.
"Около (примерно)" при использовании в описании и при упоминании измеряемой величины, такой как количество, временной интервал и тому подобное, предназначается для включения изменений в размере ±20% или ±10%, более предпочтительно ±5%, даже более предпочтительно ±1% и еще более предпочтительно ±0.1% от заданного значения, собственно поскольку эти изменения допустимы при осуществлении раскрытых способов.
Термин "аномальный (ненормальный)" при использовании в отношении организмов, тканей, клеток или их компонентов, относится к таким организмам, тканям, клеткам или их компонентам, которые отличаются, по меньшей мере, одной наблюдаемой или обнаружимой характерной чертой (такой как, например, возраст, лечение, время суток и т.д.) от тех организмов, тканей, клеток или их компонентов, которые демонстрируют "нормальную" (ожидаемую) соответствующую характерную черту. Характерные черты, являющиеся нормальными или ожидаемыми для одной клетки или типа ткани, могут быть ненормальными для другой клетки или типа ткани.
Использованный в описании термин "антитело" относится к молекуле иммуноглобулина, способной специфически связываться со специфическим эпитопом на антигене. Антитела могут быть интактными иммуноглобулинами, происходящими из природных источников или из рекомбинантных источников, и могут быть иммунореактивными участками интактных иммуноглобулинов. Антитела в настоящем изобретении могут существовать в различных формах, включая, например, поликлональные антитела, моноклональные антитела, внутриклеточные антитела ("интраантитела"), Fv, Fab и F(ab)2, а также одноцепочечные антитела (scFv), тяжелоцепочечные антитела, такие как антитела верблюдовых и гуманизированные антитела (Harlow et al., 1999, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426).
Термин "рак" при использовании в описании определяется как болезнь, характеризующаяся неконтролируемой пролиферацией и/или ростом аномальных клеток. Раковые клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части организма. В данном документе «рак» включает и солидные опухоли и гематопоэтические злокачественные заболевания. Примеры различных форм рака, подходящих для данного изобретения, включают, но не ограничиваются этим, рак молочной железы, рак предстательной железы, рак яичника, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, почечный рак, рак печени, рак кости, рак мозга, лимфому, лейкемию, рак легкого, миелодиспластические синдромы, миелопролиферативные нарушения и тому подобное.
"Конститутивная" экспрессия - это состояние, при котором генный продукт вырабатывается в живой клетке при большей части или при всех физиологических условиях клетки.
"Кодирующий участок" гена состоит из остатков нуклеотидов кодирующей цепи гена и нуклеотидов некодирующей цепи гена, которые являются гомологичными или комплементарными, соответственно, с кодирующим участком молекулы мРНК, которая образуется в результате транскрипции гена.
"Кодирующий участок" молекулы мРНК также состоит из остатков нуклеотидов молекулы мРНК, которые соответствуют участку антикодона молекулы транспортной РНК во время трансляции молекулы мРНК, или который кодирует стоп-кодон. Кодирующий участок, таким образом, может включать остатки нуклеотидов, содержащих кодоны для аминокислотных остатков, которые не присутствуют в зрелом белке, кодированном молекулой мРНК (например, аминокислотные остатки в белке экспортируют сигнальную последовательность).
"Болезнь" - это состояние здоровья животного, при котором у животного не может поддерживаться гомеостаз и при котором, в том случае, когда болезнь не проходит, здоровье животного продолжает ухудшаться.
В противоположность этому "нарушение" у животного - это состояние здоровья, при котором у животного может поддерживаться гомеостаз, но при котором состояние здоровья животного является менее благополучным, чем оно могло бы быть при отсутствии нарушения. При отсутствии лечения нарушение не вызывает в обязательном порядке дальнейшее ухудшение состояния здоровья животного.
Болезнь или нарушение "подавляется", если тяжесть симптома болезни или нарушения, частота, с которой такой симптом испытывается пациентом, или и то и другое, уменьшается.
"Эффективное количество" или "терапевтически эффективное количество" соединения - это такое количество соединения, которое является достаточным для обеспечения благоприятного действия на субъекта, которому вводится данное соединение. "Эффективное количество" системы доставки (носителя) - это количество, достаточное для эффективного связывания или доставки соединения.
"Кодирование" относится к неотъемлемому свойству специфических последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матрицы для синтеза других полимеров и макромолекул в биологических процессах, имеющих или определенную последовательность нуклеотидов (т.е. рРНК, тРНК и мРНК) или определенную последовательность аминокислот, и возникающим в связи с этим биологическим свойствам. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующая этому гену, приводит к продукции белка в клетке или другой биологической системе. И кодирующая цепь, нуклеотидная последовательность которой является идентичной мРНК последовательности и обычно предоставляется в списках последовательностей, и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, может упоминаться как кодирующая белок или другой продукт этого гена или кДНК.
При использовании в описании "эндогенный" относится к любому материалу, происходящему из или выработанному внутри организма, клетки, ткани или системы.
При использовании в описании термин "экзогенный" относится к любому материалу, введенному снаружи или произведенному вне организма, клетки, ткани или системы.
При использовании в описании термины "экспрессирующая конструкция" и "экспрессионная кассета" относятся к двухцепочечной рекомбинантной молекуле ДНК, содержащей желательную человеческую нуклеиновокислотную кодирующую последовательность и содержащей один или более регуляторных элементов, необходимых или желательных для экспрессии функционально связанной кодирующей последовательности.
Использованный в описании термин "фрагмент", применительно к нуклеиновой кислоте или полипептиду, относится к последовательности большей нуклеиновой кислоты или полипептида. "Фрагмент" нуклеиновой кислоты может составлять, по меньшей мере, примерно 15 нуклеотидов в длину; например, по меньшей мере, примерно от 50 нуклеотидов до 100 нуклеотидов; по меньшей мере, примерно от 100 до 500 нуклеотидов, по меньшей мере, от 500 до 1000 нуклеотидов, по меньшей мере, примерно от 1000 нуклеотидов до 1500 нуклеотидов; или примерно от 1500 нуклеотидов до 2500 нуклеотидов; или около 2500 нуклеотидов (и любое целое значение между значениями). "Фрагмент" полипептида может составлять, по меньшей мере, примерно 15 нуклеотидов в длину; например, по меньшей мере, примерно от 50 аминокислот до 100 аминокислот; по меньшей мере, примерно от 100 до 500 аминокислот, по меньшей мере, примерно от 500 до 1000 аминокислот, по меньшей мере, примерно от 1000 аминокислот до 1500 аминокислот; или примерно от 1500 аминокислот до 2500 аминокислот; или около 2500 аминокислот (и любое целое значение между значениями).
Использованные в описании термины "ген" и "рекомбинантный ген" относятся к молекулам нуклеиновой кислоты, содержащим открытую рамку считывания, кодирующую полипептид. Такие природные аллельные изменения, как правило, приводят к 1-5% изменчивости в нуклеотидной последовательности данного гена. Альтернативные аллели могут быть установлены путем секвенирования интересующего гена у целого ряда различных индивидуумов. Это может быть легко осуществлено при использовании гибридизационных зондов для идентификации одинаковых генетических локусов у целого ряда индивидуумов. Все подобные нуклеотидные вариации и являющиеся результатом этого аминокислотные полиморфизмы или изменения, являющиеся результатом природного аллельного разнообразия и не изменяющие функциональную активность, включаются в объем изобретения.
"Гомологичный" при использовании в описании относится к сходству последовательностей между двумя полимерными молекулами, например между двумя молекулами нуклеиновой кислоты, например двумя молекулами ДНК или двумя молекулами РНК, или между двумя молекулами полипептида. Когда положение в обеих из двух молекул занято одинаковой мономерной субъединицей, например, если положение в каждой из двух молекул ДНК занято аденином, тогда они являются гомологичными в этом положении. Гомология между двумя последовательностями является прямой функцией числа соответствующих или гомологичных положений, например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях являются гомологичными, тогда две последовательности являются на 50% гомологичными, если 90% положений, например, 9 из 10, являются соответствующими или гомологичными, тогда две последовательности имеют 90% гомологию. Например, последовательности ДНК 5'-ATTGCC-3' и 5-TATGGC-3' имеют 50% гомологию.
Термины "человеческие гематопоэтические стволовые клетки и клетки-предшественники (прогениторные клетки)" и "человеческие HSPC" при использовании в описании относятся к человеческим самоподдерживающимся мультипотентным гематопоэтическим стволовым клеткам и гематопоэтическим прогениторным клеткам.
"Индуцибельная" экспрессия - это состояние, при котором продукт гена производится в живой клетке в ответ на наличие сигнала в клетке.
При использовании в описании "учебный (инструктирующий) материал" включает публикацию, запись, диаграмму или любую другую среду выражения, которая может быть использована для сообщения о полезности соединения, композиции, вектора или системы доставки изобретения в наборе, предназначенном для облегчения различных болезней или нарушений, перечисленных в данном документе. Необязательно, или альтернативно, учебный (инструктирующий) материал может описывать один или более способов облегчения болезни или нарушения в клетке или ткани млекопитающего. Инструктирующий материал набора изобретения, например, может являться принадлежностью контейнера, содержащего определенное соединение, композицию, вектор или систему доставки изобретения, или транспортироваться вместе с контейнером, содержащим определенное соединение, композицию, вектор или систему доставки. Альтернативно, инструктирующий материал может доставляться отдельно от контейнера с той целью, что инструктирующий материал и данное соединение будут использоваться получателем совместно.
Термин "функционально связанный" при использовании в описании относится к полинуклеотиду в рамках функциональной зависимости со вторым полинуклеотидом. Описание двух полинуклеотидов как "функционально связанных" означает, что одноцепочечная или двухцепочечная молекула (фрагмент) нуклеиновой кислоты содержит два полинуклеотида, расположенные в молекуле нуклеиновой кислоты таким образом, что, по меньшей мере, один из двух полинуклеотидов способен проявлять физиологическое действие, которым он отличается, в результате наличия другого. Например, промотор, функционально связанный с кодирующим участком гена, способен стимулировать транскрипцию кодирующего участка. Предпочтительно, в том случае, когда нуклеиновая кислота, кодирующая желательный белок, дополнительно содержит промотор/регуляторную последовательность, промотор/регуляторная последовательность располагается на 5' конце последовательности, кодирующей желательный белок, так что он обусловливает экспрессию желательного белка в клетке. Вместе, нуклеиновая кислота, кодирующая желательный белок, и ее промотор/регуляторная последовательность образуют "трансген."
Использованный в описании термин "полинуклеотид" определяется как цепочка нуклеотидов. Кроме того, нуклеиновые кислоты представляют собой полимеры, состоящие из нуклеотидов. Таким образом, термины «нуклеиновые кислоты» и "полинуклеотиды" при использовании в описании являются взаимозаменяемыми. Специалист в данной области обладает общим знанием о том, что нуклеиновые кислоты являются полинуклеотидами, которые могут гидролизоваться в мономерные "нуклеотиды". Мономерные нуклеотиды могут гидролизоваться в нуклеозиды. Использованные в описании полинуклеотиды включают, но не ограничиваются этим, все последовательности нуклеиновых кислот, полученные любыми способами, доступными в данной области техники, включая, без ограничения, рекомбинантные способы, т.е. клонирование последовательностей нуклеиновых кислот из рекомбинантной библиотеки или клеточного генома, используя обычные методы клонирования и ПЦР, и тому подобное, и синтетические способы.
При использовании в описании термины "пептид", "полипептид" и "белок" используются взаимозаменяемым образом и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать, по меньшей мере, две аминокислоты, и нет ограничения максимального количества аминокислот, которое может содержаться в последовательности белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислот, соединенных друг с другом пептидными связями. Использованный в описании термин относится как к коротким цепям, которые обычно называются, например, пептидами, олигопептидами и олигомерами, так и к более длинным цепям, которые в данной области техники обычно называются белками, в их число входит множество типов белков. "Полипептиды" включают, например, биологически активные фрагменты, практически гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, гибридные белки, в числе прочих. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды или их комбинацию. Термин "пептид" в большинстве случаев относится к коротким полипептидам. Термин "белок", как правило, относится к крупным полипептидам.
Термин "потомство" при использовании в описании относится к потомку или потомству и включает дифференцированную или недифференцированную дочернюю клетку, происходящую от родительской клетки. В одном случае, термин потомство относится к дочерней клетке, которая является генетически тождественной родительской клетке. В другом случае, термин потомство относится к дочерней клетке, которая является генетически и фенотипически идентичной родительской. В еще одном случае, термин потомство относится к дочерней клетке, которая дифференцируется из родительской клетки.
Термин "промотор" при использовании в описании относится к ДНК последовательности, функционально связанной с последовательностью нуклеиновой кислоты, которая должна транскрибироваться, такой как последовательность нуклеиновой кислоты, кодирующая желательную молекулу. В большинстве случаев промотор располагается «выше» последовательности нуклеиновой кислоты, которая должна транскрибироваться, и обеспечивает сайт для специфического связывания с РНК полимеразой и другими факторами транскрипции. В конкретных вариантах осуществления промотор, как правило, располагается «выше» последовательности нуклеиновой кислоты, транскрибируемой с целью производства желательной молекулы, и обеспечивает сайт для специфического связывания с РНК-полимеразой и другими факторами транскрипции. Включенный промотор может быть конститутивным промотором или может обеспечивать индуцибельную экспрессию; и может обеспечивать универсальную, ткане-специфическую или специфическую для данного типа клеток экспрессию.
Пределы: на всем протяжении этого раскрытия, различные аспекты изобретения могут быть представлены в формате пределов (диапазона). Следует понимать, что описание в формате пределов используется только для удобства и краткости и не должно рассматриваться как строгое ограничение объема изобретения. Соответственно, описание предела следует рассматривать, как включающее все возможные точно раскрытые подпределы, а также отдельные численные значения внутри этого предела. Например, описание предела, такое как от 1 до 6, следует рассматривать, как включающее точно раскрытые подпределы, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельные числа внутри этого предела, например 1, 2, 2.7, 3, 4, 5, 5.3 и 6. Это применимо вне зависимости от ширины данного предела.
"Рекомбинантный полипептид" - это полипептид, который производится в результате экспрессии рекомбинантного полинуклеотида.
Использованный в описании термин "регуляторный элемент" относится к нуклеотидной последовательности, которая контролирует некоторый аспект экспрессии нуклеиновокислотных последовательностей. Иллюстративные примеры регуляторных элементов включают энхансер, участок внутренней посадки рибосомы (IRES), интрон; точку начала репликации, сигнал полиаденилирования (рА), промотор, энхансер, терминацию транскрипции последовательности и вышерасположенный регуляторный домен, который способствует репликации, транскрипции, посттранскрипционному процессингу нуклеиновокислотной последовательности. Специалисты в данной области техники могут отобрать и использовать эти и другие регуляторные элементы в экспрессирующей конструкции путем обычного экспериментирования. Экспрессирующие конструкции могут быть получены рекомбинантно или искусственно с использованием хорошо известных методов.
Использованный в описании в отношении антитела термин "специфически связывается" означает антитело, которое распознает специфический антиген, но в большинстве случаев не распознает и не связывается с другими молекулами в образце. Например, антитело, которое специфически связывается с антигеном от других видов, также может связываться с антигеном от одного или более видов. Тем не менее, такая межвидовая реакционная способность собственно не меняет классификацию антитела как специфического. В другом примере, антитело, специфически связывающееся с антигеном, также может связываться с разными аллельными формами антигена. Однако подобная перекрестная реактивность собственно не меняет классификацию антитела как специфического.
В некоторых случаях термины "специфическое связывание" или "специфически связывающий" могут использоваться в отношении взаимодействия антитела, белка или пептида со вторыми химическими молекулами, что означает, что взаимодействие зависит от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) на химических молекулах; например, антитело распознает и связывается со специфической белковой структурой, а не с белками вообще. Если антитело является специфическим для эпитопа "А", присутствие молекулы, содержащей эпитоп А (или свободной, немеченой А), в реакции, содержащей меченый "А" и антитело, будет уменьшать количество меченого А, связанного с антителом.
Использованный в описании термин "синтетическое антитело" обозначает антитело, которое получают с использованием технологии рекомбинантных ДНК, такое как, например, антитело, экспрессируемое бактериофагом, как описано здесь. Термин также может означать антитело, полученное путем синтеза молекулы ДНК, кодирующей антитело, при этом ДНК молекула экспрессирует белок антитела или аминокислотную последовательность, определяющую антитело, при этом ДНК или аминокислотную последовательность получают с использованием технологии синтеза ДНК или аминокислотной последовательности, которая доступна и хорошо известна в данной области техники.
Использованный в описании термин "вариант" означает последовательность нуклеиновой кислоты или последовательность пептида, которая отличается по последовательности от исходной последовательности нуклеиновой кислоты или последовательности пептида соответственно, но сохраняет основные биологические свойства исходной молекулы. Изменения в последовательности варианта нуклеиновой кислоты могут не менять аминокислотную последовательность пептида, кодированного исходной нуклеиновой кислотой, или могут приводить к аминокислотным заменам, вставкам, делениям, слияниям и укорочениям. Изменения в последовательности вариантов пептидов в большинстве случаев являются ограниченными или консервативными, так что последовательность исходного пептида и варианта являются близко сходными вообще, а во многих участках идентичными. Вариант и исходный пептид могут отличаться в аминокислотной последовательности одной или более заменами, вставками, делениями в любой комбинации. Вариант нуклеиновой кислоты или пептида может быть природного происхождения, таким как аллельный вариант, или может быть вариантом, который не встречается в природе. Не встречающиеся в природе варианты нуклеиновых кислот и пептидов также могут быть получены с помощью методов мутагенеза или путем прямого синтеза.
Использованный в описании термин "генетически модифицированное" означает животное, зародышевые клетки которого содержат экзогенную человеческую нуклеиновую кислоту или человеческую последовательность нуклеиновой кислоты. В качестве неограничивающих примеров, генетически модифицированное животное может быть трансгенным животным или «нокин» животным, при условии, что животное содержит человеческую последовательность нуклеиновой кислоты.
Использованный в описании термин "нокин" означает генетическую модификацию, которая заменяет генетическую информацию, кодированную в хромосомном локусе у животного, не принадлежащего к человеческому роду, другой последовательностью ДНК.
Описание
Данное изобретение имеет отношение к генетически модифицированному, не принадлежащему к человеческому роду животному, экспрессирующему человеческий М-CSF, человеческий IL-3/GM-CSF, человеческий SIRPA и человеческий ТРО (в данном описании называется MIST). Изобретение также имеет отношение к способам получения и использования генетически модифицированных не принадлежащих к человеческому роду животных, описанных здесь. В некоторых вариантах осуществления генетически модифицированное не принадлежащее к человеческому роду животное является мышью. В некоторых вариантах осуществления генетически модифицированное не принадлежащее к человеческому роду животное является иммунодефицитной мышью. В конкретном варианте осуществления иммунодефицитная мышь представляет собой RAG2-/- γс-/- мышь. В другом конкретном варианте осуществления генетически модифицированное, не принадлежащее к человеческому роду животное изобретения экспрессирует человеческий M-CSF, человеческий IL-3/GM-CSF и человеческий ТРО и не экспрессирует RAG2 или γс (в описании называется MITRG). В другом отдельном варианте осуществления генетически модифицированное, не принадлежащее к человеческому роду животное изобретения экспрессирует человеческий M-CSF, человеческий IL-3/GM-CSF, человеческий SIRPA и человеческий ТРО и не экспрессирует RAG2 или γс (в описании называется MISTRG). В некоторых вариантах осуществления генетически модифицированным не принадлежащим к человеческому роду животным, описанным здесь, пересажены человеческие гематопоэтические клетки.
В различных вариантах осуществления генетически модифицированные, не принадлежащие к человеческому роду животные изобретения с пересаженными человеческими гематопоэтическими клетками используются для оценки in vivo роста и дифференцировки гематопоэтических и иммунных клеток, для оценки in vivo человеческого гематопоэза, для in vivo оценки раковых клеток, для оценки in vivo иммунного ответа, для оценки in vivo вакцин и режимов вакцинации, для использования при тестировании эффекта средств, модулирующих рост раковой клетки или выживаемости, для in vivo оценки лечения рака, для производства in vivo и сбора иммунных медиаторов, включая человеческие антитела, и для использования при проверке действия средств, модулирующих функцию гематопоэтической или иммунной клетки.
Генетически модифицированные, не принадлежащие к человеческому роду животные
Изобретение включает генетически модифицированное, не принадлежащее к человеческому роду животное, экспрессирующее, по меньшей мере, что-либо из числа человеческого M-CSF, человеческого IL-3/GM-CSF, человеческого SIRPA, человеческого ТРО и любой их комбинации. В некоторых вариантах осуществления генетически модифицированное, не принадлежащее к человеческому роду животное, экспрессирующее нуклеиновую кислоту, также экспрессирует соответствующую нечеловеческую нуклеиновую кислоту животного. В других вариантах осуществления генетически модифицированное не принадлежащее к человеческому роду животное, экспрессирующее человеческую нуклеиновую кислоту, не экспрессирует соответствующую нечеловеческую нуклеиновую кислоту животного. В некоторых вариантах осуществления генетически модифицированное животное представляет собой животное, имеющее один или более нокаутированных генов, с целью приведения животного в состояние иммунодефицитного животного, как описано в другом месте этого документа. Для создания генетически модифицированного, не принадлежащего к человеческому роду животного, нуклеиновая кислота, кодирующая человеческий белок, может быть встроена в рекомбинантный вектор экспрессии в форме, подходящей для экспрессии человеческого белка в нечеловеческой клетке-хозяине. В различных вариантах осуществления рекомбинантный вектор экспрессии включает одну или более регуляторных последовательностей, функционально связанных с нуклеиновой кислотой, кодирующей человеческий белок, таким способом, который создает возможность для транскрипции нуклеиновой кислоты в мРНК и трансляции мРНК в человеческий белок. Термин "регуляторная последовательность" принят в данной области техники и включает промоторы, энхансеры и другие элементы, контролирующие экспрессию (например, сигналы полиаденилирования). Такие регуляторные последовательности известны специалистам в данной области техники и описаны в 1990, Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif. Следует понимать, что дизайн вектора экспрессии может зависеть от таких факторов, как выбор клетки-хозяина, предназначенной для трансфицирования, и/или количества человеческого белка, которое должно экспрессироваться.
Генетически модифицированное животное может быть создано, например, путем введения нуклеиновой кислоты, кодирующей человеческий белок (как правило, связанной с соответствующими регуляторными элементами, такими как конститутивный или ткане-специфический энхансер) в ооцит, например, с помощью микроинъекции, и позволение ооциту развиться в «приемном» животном женского рода. Интронные последовательности и сигналы полиаденилирования также могут быть включены в трансген, чтобы увеличить эффективность экспрессии трансгена. Методы получения генетически модифицированных животных, в частности, таких как мыши, становятся обычными в данной области техники и описываются, например, в патентах США №4 736 866 и 4 870 009, 1986, Hogan et al., А Laboratory Manual, Cold Spring Harbor, N.Y., Cold Spring Harbor Laboratory. Генетически модифицированное животное-основатель может быть использовано для разведения дополнительных животных, несущих трансген. Генетически модифицированные животные, несущие трансген, кодирующий человеческий белок изобретения, могут быть дополнительно скрещены с другими генетически модифицированными животными, несущими другие трансгены, или могут быть скрещены с нокаут-животными, например нокаут-животным, которое не экспрессирует один или более из его генов. В различных вариантах осуществления генетически модифицированное животное изобретения является мышью, крысой или кроликом.
В некоторых вариантах осуществления генетически модифицированное животное изобретения экспрессирует одну или более человеческих нуклеиновых кислот, благодаря нечеловеческому нативному промотору животного и нативным регуляторным элементам. В других вариантах осуществления генетически модифицированное животное изобретения экспрессирует человеческую нуклеиновую кислоту за счет нативного человеческого промотора и нативных регуляторных элементов. Специалисту ясно, что генетически модифицированное животное изобретения включает генетически модифицированных животных, экспрессирующих, по меньшей мере, одну человеческую нуклеиновую кислоту за счет какого-либо промотора. Примеры промоторов, пригодных для изобретения, включают, но не ограничиваются этим, DNA pol II промотор, PGK промотор, убиквитиновый промотор, альбуминовый промотор, промотор глобина, промотор овальбумина, ранний промотор SV40, промотор вируса саркомы Рауса (RSV), ретровирусный LTR и лентивирусный LTR. Экспрессирующие системы промотора и энхансера, пригодные в изобретении, также включают индуцибельные и/или ткане-специфические экспрессирующие системы.
В некоторых вариантах осуществления изобретение включает генетически модифицированных иммунодефицитных животных, имеющих геном, содержащий нуклеиновую кислоту, кодирующую человеческий полипептид, функционально связанный с промотором, при этом животное экспрессирует кодированный человеческий полипептид. В различных вариантах осуществления изобретение включает генетически модифицированных, иммунодефицитных, не принадлежащих к человеческому роду животных, имеющих геном, который включает экспрессирующую кассету, содержащую нуклеиновую кислоту, кодирующую, по меньшей мере, один человеческий полипептид, при этом нуклеиновая кислота является функционально связанной с промотором и сигналом полиаденилирования, а также содержит интрон, и при этом данное животное экспрессирует кодированный человеческий полипептид.
В различных вариантах осуществления для введения человеческой нуклеиновокислотной последовательности иммунодефицитному животному с целью получения генетически модифицированного иммунодефицитного животного, экспрессирующего человеческий ген, используются различные методы. Такие методы хорошо известны в данной области техники и включают, но не ограничиваются этим, микроинъекцию в пронуклеус, трансформацию эмбриональными стволовыми клетками, гомологичную рекомбинацию и нокин методы. Методы получения генетически модифицированных животных, которые могут использоваться, включают, но не ограничиваются этим, методы, описанные в Sundberg и Ichiki (2006, Genetically Engineered Mice Handbook, CRC Press), Hofker и van Deursen (2002, Genetically modified Mouse Methods и Protocols, Humana Press), Joyner (2000, Gene Targeting: A Practical Approach, Oxford University Press), Turksen (2002, Embryonic stem cells: Methods и Protocols in Methods Mol Biol., Humana Press), Meyer et al. (2010, Proc. Nat. Acad. Sci. USA 107:15022-15026) и Gibson (2004, A Primer Of Genome Science 2nd ed. Sunderland, Massachusetts: Sinauer), патент США №6 586 251, Rathinam et al. (2011, Blood 118:3119-28), Willinger et al. (2011, Proc Natl Acad Sci USA, 108:2390-2395), Rongvaux et al. (2011, Proc Natl Acad Sci USA, 108:2378-83) и Valenzuela et al. (2003, Nat Biot 21:652-659).
В некоторых вариантах осуществления композиции способы изобретения включают генетически модифицированных иммунодефицитных животных с недостаточным количеством В-клеток и/или Т-клеток и/или недостаточностью их функции отдельно или в комбинации с недостатком количества и/или функции NK-клеток (например, вследствие дефицита гамма цепи рецептора IL2 (т.е., γc-/-)), имеющих геном, содержащий человеческую нуклеиновую кислоту, функционально связанную с промотором, при этом данное животное экспрессирует кодированный человеческий полипептид. Генетически модифицированное животное изобретения может быть получено такими способами, как инъекция ДНК экспрессирующей конструкции в предимплантационный эмбрион, или путем использования стволовых клеток, таких как эмбриональные стволовые (ES) клетки или индуцированные плюрипотентные стволовые (iPS) клетки.
В одном варианте осуществления человеческая нуклеиновая кислота экспрессируется нативными регуляторными элементами человеческого гена. В других вариантах осуществления человеческая нуклеиновая кислота экспрессируется нативными регуляторными элементами не принадлежащего к человеческому роду животного. В других вариантах осуществления человеческая нуклеиновая кислота экспрессируется за счет убиквитинового промотора. Неограничивающие примеры убиквитиновых промоторов, подходящих для использования в экспрессирующей конструкции композиций и способов изобретения, включают промотор 3-фосфоглицераткиназы (PGK-1), промотор бета-актина, ROSA26 промотор, промотор белка теплового шока 70 (Hsp70), промотор EF-1 альфа гена, кодирующего фактор 1 альфа элонгации (EF1), промотор эукариотического фактора инициации 4A (eIF-4A1), промотор хлорамфеникол ацетилтрансферазы (CAT) и промотор CMV (цитомегаловируса).
В других вариантах осуществления человеческая нуклеиновая кислота экспрессируется за счет ткане-специфического промотора. Неограничивающие примеры ткане-специфических промоторов, подходящих для использования в экспрессирующей конструкции композиций и способов изобретения, включают промотор гена, экспрессируемого в гематопоэтической системе, такой как M-CSF промотор, IL-3 промотор, GM-CSF промотор, SIRPA промотор, ТРО промотор, IFN-β промотор, промотор белка синдрома Вискотта-Олдрича (WASP), промотор CD45 (также называемый общий лейкоцитарный антиген), Flt-1 промотор, эндоглин (CD105) промотор и промотор ICAM-2 (молекула внутриклеточной адгезии 2). Эти и другие промоторы, подходящие для использования в композициях и методах изобретения, известны в данной области техники и приведены, например, в Abboud et al. (2003, J. Histochem & Cytochem. 51:941-949), Schorpp et al. (1996, NAR 24:1787-1788), McBurney et al. (1994, Devel. Dynamics, 200:278-293) и Majumder et al. (1996, Blood 87:3203-3211). В различных вариантах осуществления изобретения в дополнение к промотору также содержится один или более дополнительных регуляторных элементов, таких как энхансер или интронная последовательность. Примеры энхансеров, пригодных для композиций и методов изобретения включают, но не ограничиваются этим, ранний энхансер цитомегаловируса (CMV) и энхансер SV40. Примеры интронных последовательностей, пригодных для композиций и методов изобретения, включают, но не ограничиваются этим, интрон бета-глобина или характерный для определенного рода (родовой) интрон. Другие дополнительные регуляторные элементы, пригодные в некоторых вариантах осуществления изобретения, включают, но не ограничиваются этим, последовательность терминации транскрипции и последовательность полиаденилирования (рА) мРНК.
В некоторых вариантах осуществления методы введения конструкции, экспрессирующей человеческую нуклеиновую кислоту, в предимплантационный эмбрион включают линеаризацию экспрессионной конструкции до введения ее в предимплантационный эмбрион. В предпочтительных вариантах осуществления экспрессионная конструкция инжектируется в оплодотворенные ооциты. Оплодотворенные ооциты могут быть собраны у сверх-овулированных самок днем позже после спаривания и введены в экспрессионную конструкцию. Инжектированные ооциты или культивируют в течение ночи или переносят непосредственно в маточные трубы 0.5-дней р.с. псевдобеременных самок. Способы суперовуляции, сбора ооцитов, введения экспрессионной конструкции и переноса эмбриона известны в данной области техники и описаны в Manipulating the Mouse Embryo (2002, A Laboratory Manual, 3rd edition, Cold Spring Harbor Laboratory Press). Потомство может быть оценено на наличие введенной нуклеиновой кислоты с помощью анализа ДНК (например, ПЦР, саузерн блоттинга, секвенирования ДНК и т.д.) или путем анализа белков (например, ELISA, Вестерн блоттинга и т.д.).
В других вариантах осуществления экспрессионная конструкция может быть трансфицирована в стволовые клетки (ES клетки или iPS клетки) с помощью хорошо известных способов, таких как электропорация, осаждение фосфатом кальция и липофекция. Наличие введенной нуклеиновой кислоты в клетках может быть оценено путем анализа ДНК (например, ПНР, Саузерн блоттинга, секвенирования ДНК и т.д.) или путем анализа белков (например, ELISA, Вестерн блоттинга и т.д.). Затем клетки, содержащие введенную экспрессионную конструкцию, могут быть введены с помощью микроинъекции в предимплантационные эмбрионы. Подробное описание известных в данной области техники методов, подходящих для композиций и способов изобретения, смотри в Nagy et al. (2002, Manipulating the Mouse Embryo: A Laboratory Manual, 3rd edition, Cold Spring Harbor Laboratory Press), Nagy et al. (1990, Development 110:815-821), патенте США №7 576 259, патенте США №7 659 442, патенте США №7 294 754 и Kraus et al. (2010, Genesis 48:394-399).
Генетически модифицированные, не принадлежащие к человеческому роду животные изобретения могут быть скрещены с иммунодефицитным животным с целью получения иммунодефицитного животного, экспрессирующего, по меньшей мере, одну человеческую нуклеиновую кислоту. Различные варианты осуществления изобретения обеспечивают генетически модифицированных животных, содержащих человеческую нуклеиновую кислоту практически во всех клетках, а также генетически модифицированных животных, которые содержат человеческую нуклеиновую кислоту в некоторых, но не во всех своих клетках. В геном клеток генетически модифицированных животных может интегрироваться одна или несколько копий, смежных или отдаленных по отношению друг к другу, человеческой нуклеиновой кислоты.
В некоторых вариантах осуществления изобретением является генетически модифицированная мышь, которой пересажена, по меньшей мере, одна человеческая гематопоэтическая клетка. В других вариантах осуществления изобретением является способ приживления человеческих гематопоэтических клеток у генетически модифицированного, не принадлежащего к человеческому роду животного. Пересаженные человеческие гематопоэтические клетки, пригодные для использования в композициях и методах изобретения, включают любую человеческую гематопоэтическую клетку. Неограничивающие примеры человеческих гематопоэтических клеток, подходящих для изобретения, включают, но не ограничиваются этим, HSC, HSPC, инициирующие лейкемию клетки (LIC) и гематопоэтические клетки любой линии дифференцировки на любой стадии дифференцировки, включая терминально дифференцированные гематопоэтические клетки любой линии дифференцировки. Такие гематопоэтические клетки могут быть получены из любой ткани или местоположения донора-человека, включая, но без ограничения, костный мозг, периферическую кровь, печень, эмбриональную печень или пуповинную кровь. Такие гематопоэтические клетки могут быть выделены из любого донора-человека, включая здоровых доноров, а также доноров с заболеваниями, такими как рак, включая лейкемию.
В других вариантах осуществления изобретение является способом приживления человеческих гематопоэтических клеток у генетически модифицированного не принадлежащего к человеческому роду животного. В некоторых вариантах осуществления генетически модифицированное не принадлежащее к человеческому роду животное, которому пересажены человеческие гематопоэтические клетки, является иммунодефицитным животным. Приживление гематопоэтических клеток у генетически модифицированного животного изобретения характеризуется присутствием человеческих гематопоэтических клеток у животного с пересаженными клетками. В конкретных вариантах осуществления приживление гематопоэтических клеток у иммунодефицитного животного характеризуется присутствием дифференцированных человеческих гематопоэтических клеток у животного с пересаженными клетками по сравнению с соответствующими контрольными животными.
В некоторых вариантах осуществления животным изобретения трансплантируются человеческие раковые клетки (например, из солидных опухолей человека и т.д.) в дополнение к человеческим гематопоэтическим клеткам. В различных вариантах осуществления человеческие раковые клетки могут быть клеточной линией рака или клеткой первичного рака человека, полученной от пациента, любого из многих различных типов рака (включая, в качестве неограничивающих примеров, меланому, рак молочной железы, рак легких и т.д.). В некоторых вариантах осуществления человеческие раковые клетки и HSPC получают от одного и того же пациента и трансплантируют одному, не принадлежащему к человеческому роду животному.
Генетически модифицированные, не принадлежащие к человеческому роду животные, предоставленные в различных вариантах осуществления настоящего изобретения, могут иметь разное применение, без ограничения, например в качестве модели роста и дифференцировки гематопоэтических клеток, для оценки in vivo человеческого гематопоэза, для оценки in vivo раковых клеток, для изучения in vivo иммунного ответа, для оценки in vivo вакцин и режимов вакцинации, для использования при тестировании эффекта средств, модулирующих рост или выживаемость раковой клетки, для in vivo оценки лечения рака, для in vivo производства и сбора иммунных медиаторов, таких как антитело, и для использования при проверке действия средств, модулирующих функцию гематопоэтической или иммунной клетки.
Приживление человеческих гематопоэтических клеток у генетически модифицированных и/или иммунодефицитных, не принадлежащих к человеческому роду животных обычно требует кондиционирования гематопоэтических клеток до введения или сублетального облучения животного-реципиента высокочастотным электромагнитным излучением (как правило, используются гамма-лучи или рентгеновское излучение) или обработки радиомиметическим средством, таким как бусульфан или азотистый иприт. Полагают, что кондиционирование уменьшает количество гематопоэтических клеток хозяина, создает соответствующие факторы микроокружения для приживления человеческих гематопоэтических клеток, и/или создания ниш микроокружения для приживления человеческих гематопоэтических клеток. Стандартные способы кондиционирования известны в данной области техники, например описанные в J. Hayakawa et al, 2009, Stem Cells, 27(1):175-182. Способы приживления человеческих гематопоэтических клеток у иммунодефицитных животных предоставляются согласно вариантам осуществления настоящего изобретения, которые включают предоставление человеческих гематопоэтических клеток иммунодефицитным животным в сочетании с облучением или без облучения животных до введения гематопоэтических клеток. Способы приживления человеческих гематопоэтических клеток у иммунодефицитных животных предоставляются согласно вариантам осуществления настоящего изобретения, которые включают предоставление человеческих гематопоэтических клеток генетически модифицированным, не принадлежащим к человеческому роду животным изобретения с введением или без введения радиомиметического средства, такого как бусульфан или азотистый иприт, до введения животным гематопоэтических клеток.
В некоторых вариантах осуществления способы приживления гематопоэтических клеток у генетически модифицированного, не принадлежащего к человеческому роду животного согласно вариантам осуществления настоящего изобретения включают предоставление человеческих гематопоэтических клеток генетически модифицированному животному изобретения, как описано в другом месте данного документа. В некоторых вариантах осуществления генетически модифицированное, не принадлежащее к человеческому роду животное является иммунодефицитным животным, у которого имеется дефицит количества и/или функции нечеловеческих В-клеток, нечеловеческих Т-клеток и/или количества, и/или функции нечеловеческих NK-клеток. В других вариантах осуществления у иммунодефицитного животного имеется тяжелый комбинированный иммунодефицит (SCID). SCID - это состояние, характеризующееся отсутствием Т-клеток и утратой функции В-клеток. Примеры SCID включают: X-связанный SCID, который характеризуется мутациями гена гамма цепи в IL2RG гене, и лимфоцитарный фенотип Т(-) В(+) NK(-); и аутосомный рецессивный SCID, характеризующийся мутациями гена Jak3, и лимфоцитарный фенотип Т(-) В(+) NK(-), мутации гена ADA и лимфоцитарный фенотип Т(-) В(-) NK(-), мутации альфа-цепи IL-7R и лимфоцитарный фенотип Т(-) В(+) NK(+), CD3 дельта или эпсилон мутации и лимфоцитарный фенотип Т(-) В(+) NK(+), мутации RAG1/RAG2 и лимфоцитарный фенотип Т(-) В(-) NK(+), мутации гена Artemis и лимфоцитарный фенотип Т(-) В(-) NK(+), мутации CD45 гена и лимфоцитарный фенотип Т(-) В(+) NK(+). В некоторых вариантах осуществления генетически модифицированное, не принадлежащее к человеческому роду животное изобретения представляет собой RAG1-/-.
В некоторых вариантах осуществления методы приживления гематопоэтических клеток у генетически модифицированного животного согласно вариантам осуществления настоящего изобретения включают снабжение человеческими гематопоэтическими клетками генетически модифицированного, не принадлежащего к человеческому роду животного, имеющего мутацию, вызывающую тяжелый комбинированный иммунодефицит (Prkdcscid), обычно называемую scid-мутация. Scid-мутация хорошо известна и локализуется на мышиной хромосоме 16, как описано в работе Bosma et al. (1989, Immunogenetics 29:54-56). Мыши, гомозиготные по scid-мутации, отличаются отсутствием функциональных Т-клеток и В-клеток, лимфопенией, липоглобулинемией и нормальным гематопоэтическим микроокружением. Scid-мутация может быть обнаружена, например, путем обнаружения маркеров scid-мутации с использованием хорошо изместных методов.
В других вариантах осуществления способы приживления гематопоэтических клеток у генетически модифицированного животного согласно вариантам осуществления настоящего изобретения включают предоставление человеческих гематопоэтических клеток генетически модифицированному, иммунодефицитному, не принадлежащему к человеческому роду животному, у которого имеется дефицит гамма цепи рецептора IL2, или отдельно или в комбинации с мутацией, вызывающей тяжелый комбинированный иммунодефицит (scid-мутацией). Термин "дефицит гамма цепи рецептора IL2" относится к уменьшению наличия гамма-цепи рецептора IL2. Уменьшение наличия гамма цепи рецептора IL2 может быть результатом делеции или мутации гена. Уменьшение наличия гамма цепи рецептора IL2 можно обнаружить, например, путем обнаружения делеции или мутации гена гамма цепи рецептора IL2 и/или обнаружения пониженной экспрессии гамма цепи рецептора IL2 с использованием хорошо известных методов.
В дополнение к природным человеческим нуклеиновокислотным и аминокислотным последовательностям термин включает варианты человеческих нуклеиновокислотных или аминокислотных последовательностей. Использованный в описании термин "вариант" определяет или изолированный природный генетический мутант человека или рекомбинантно полученное изменение, каждое из которых содержит одну или более мутаций по сравнению с соответствующим диким типом. Например, такие мутации могут представлять собой одну или более аминокислотных замен, вставок и/или делеций. Термин "вариант" также включает не принадлежащие к человеческому роду ортологи. В некоторых вариантах осуществления вариант полипептида настоящего изобретения имеет, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность с человеческим полипептидом дикого типа.
Процент идентичности между двумя последовательностями определяется с помощью методов, описанных в данном документе. Мутации могут быть введены с помощью стандартных методов молекулярной биологии, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Специалисту в данной области понятно, что одна или более мутаций аминокислот могут быть введены без изменения функциональных свойств человеческих белков.
В человеческих белках могут быть сделаны консервативные замены аминокислот с целью получения вариантов человеческих белков. Консервативными аминокислотными заменами являются принятые в данной области техники замены одной аминокислоты на другую аминокислоту, имеющую сходные характеристики. Например, каждая аминокислота может быть описана как имеющая одну или более из следующих характеристик: электроположительная, электроотрицательная, алифатическая, ароматическая, полярная, гидрофобная и гидрофильная. Консервативная замена - это замена одной аминокислоты, имеющей точно установленную структурную или функциональную характеристику, другой аминокислотой, имеющей сходную характеристику. Кислые аминокислоты включают аспартат, глутамат; основные аминокислоты включают гистидин, лизин, аргинин; алифатические аминокислоты включают изолейцин, лейцин и валин; ароматические аминокислоты включают фенилаланин, глицин, тирозин и триптофан; полярные аминокислоты включают аспартат, глутамат, гистидин, лизин, аспарагин, глутамин, аргинин, серии, треонин и тирозин; и гидрофобные аминокислоты включают аланин, цистеин, фенилаланин, глицин, изолейцин, лейцин, метионин, пролин, валин и триптофан; и консервативные замены включают замены среди аминокислот в пределах каждой группы. Аминокислоты также могут быть описаны в отношении их относительного размера, как правило, аланин, цистеин, аспартат, глицин, аспарагин, пролин, треонин, серии, валин считаются маленькими по размеру.
Человеческие варианты могут включать синтетические аналоги аминокислот, производные аминокислот и/или нестандартные аминокислоты, для иллюстрации включая, без ограничения, альфа-аминомасляную кислоту, цитруллин, канаванин, цианоаланин, диаминомасляную кислоту, диаминопимелиновую кислоту, дигидрокси-фенилаланин, дьенколовую кислоту, гомоаргинин, гидроксипролин, норлейцин, норвалин, 3-фосфосерин, гомосерин, 5-гидрокситриптофан, 1-метилгистидин, метилгистидин и орнитин.
Человеческие варианты кодируются нуклеиновыми кислотами, имеющими высокую степень идентичности с нуклеиновой кислотой, кодирующей человеческий дикий тип. Комплементарная цепь нуклеиновой кислоты, кодирующей человеческий вариант, специфически гибридизируется с нуклеиновой кислотой, кодирующей человеческий вариант дикого типа в жестких условиях.
Термин "нуклеиновая кислота" относится к молекулам РНК или ДНК, имеющим более чем один нуклеотид в любой форме, включая одноцепочечную, двухцепочечную, олигонуклеотид или полинуклеотид. Термин "нуклеотидная последовательность" имеет отношение к порядку (расположению) нуклеотидов в олигонуклеотиде или полинуклеотиде в форме одноцепочечной нуклеиновой кислоты.
Нуклеиновые кислоты, кодирующие человеческий вариант, могут быть выделены или получены рекомбинантым или синтетическим путем с использованием хорошо известных методов.
Способы выделения человеческих гематопоэтических клеток, введения человеческих гематопоэтических клеток животному-хозяину и оценки их приживления хорошо известны в данной области техники. Гематопоэтические клетки для введения животному-хозяину могут быть получены из любой ткани, содержащей гематопоэтические клетки, такой как, но без ограничения, пуповинная кровь, костный мозг, периферическая кровь, мобилизированная цитокином или химиотерапией периферическая кровь и эмбриональная печень. Гематопоэтические клетки могут быть введены новорожденным или взрослым животным с помощью разных способов введения, таких как, но без ограничения, внутривенное введение, внутрипеченочное, внутрибрюшинное, внутримышечное введение в бедро и/или голень.
Приживление человеческих гематопоэтических клеток у генетически модифицированного животного изобретения может быть оценено с помощью ряда методов, таких как, но без ограничения, проточный цитометрический анализ клеток у животных, которым вводятся человеческие гематопоэтические клетки в один или более моментов времени после введения гематопоэтических клеток.
Типичные способы выделения человеческих гематопоэтических клеток, введения человеческих гематопоэтических клеток животному-хозяину и оценки приживления человеческих гематопоэтических клеток у животного-хозяина описаны в текущем документе и в Pearson et al. (2008, Curr. Protoc. Immunol. 81:1-15), Ito et al. (2002, Blood 100:3175-3182), Traggiai et al. (2004, Science 304:104-107), Ishikawa et al. (2005, Blood 106:1565-1573), Shultz et al. (2005, J. Immunol. 174:6477-6489) и Holyoake et al. (1999, Exp Hematol. 27:1418-27).
В некоторых вариантах осуществления изобретения человеческие гематопоэтические клетки выделяют из природного исходного материала для получения популяции клеток, обогащенных определенной популяцией гематопоэтических клеток (например, HSCs, HSPCs, LICs, CD34+, CD34-, линиеспецифического маркера и т.д.). Выделенные гематопоэтические клетки могут быть или могут не быть чистой популяцией. В одном варианте осуществления гематопоэтические клетки, подходящие для композиций и способов изобретения, лишены клеток, имеющих определенный маркер, такой как CD34. В другом варианте осуществления гематопоэтические клетки, подходящие для композиций и способов изобретения, являются обогащенными в результате селекции по маркеру, такому как CD34. В некоторых вариантах осуществления гематопоэтические клетки, подходящие для использования в композициях и способах изобретения, представляют собой популяцию клеток, в которых CD34+ составляют около 1-100% клеток, тем не менее, в некоторых вариантах осуществления также может использоваться популяция клеток, в которых CD34+ клетки составляют меньше, чем 1% от всех клеток. В некоторых вариантах осуществления гематопоэтические клетки, подходящие для композиций и способов изобретения, представляют собой популяцию клеток, лишенную Т-клеток, в которых CD34+ клетки составляют около 1-3% от всех клеток, популяцию клеток, лишенных направления дифференцировки, в которой CD34+ клетки составляют около 50% от всех клеток, или отобранную как CD34+ положительную популяцию клеток, в которой CD34+ клетки составляют около 90% от всех клеток.
Количество введенных гематопоэтических клеток, необходимых для получения человеческой гематопоэтической и/или иммунной системы у генетически модифицированного, не принадлежащего к человеческому роду животного, экспрессирующего, по меньшей мере, один человеческий ген, не ограничивается. Таким образом, в качестве неограничивающего примера, количество введенных гематопоэтических клеток может находиться в пределах примерно от 1X103 до 1X107, тем не менее, в различных вариантах осуществления также может использоваться больше или меньше клеток. В качестве неограничивающего примера количество введенных HSPCs может находиться в пределах примерно от 3X103 до 1X106 CD34+ клеток, в том случае, когда реципиентом является мышь, тем не менее, в различных вариантах осуществления также может использоваться больше или меньше клеток. В отношении других видов реципиентов количество клеток, которое необходимо ввести, может быть определено только путем обычного проведения экспериментов.
В общем, приживление может считаться успешным в том случае, когда количество (или процент) человеческих гематопоэтических клеток, присутствующих у генетически модифицированного, не принадлежащего к человеческому роду животного выше, чем количество (или процент) человеческих клеток, которые были введены не принадлежащему к человеческому роду животному, в момент времени за пределами срока жизни введенных человеческих гематопоэтических клеток. Обнаружение потомства введенных гематопоэтических клеток можно осуществить, например, путем обнаружения человеческой ДНК у животных-реципиентов или путем обнаружения интактных человеческих гематопоэтических клеток, например, путем обнаружения человеческих маркеров на клеточной поверхности, таких как CD45. Последовательный перенос человеческих гематопоэтических клеток от первого реципиента второму реципиенту и приживление человеческих гематопоэтических клеток у второго реципиента является дополнительным необязательным тестированием приживления у первого реципиента. Приживление может быть установлено с помощью проточной цитометрии как содержание 0.05% или больше человеческих CD45+ клеток в крови, селезенке или костном мозге через 1-4 месяца после введения человеческих гематопоэтических клеток. Для мобилизации стволовых клеток может использоваться цитокин (например, GM-CSF), например, как описано в Watanabe (1997, Bone Marrow Transplantation 19:1175-1181).
Экспериментальные примеры
Далее изобретение подробно описывается с учетом следующих экспериментальных примеров. Эти примеры предоставляются только с иллюстративной целью и не предназначаются для ограничения, если не указано иное. Таким образом, изобретение никоим образом не должно истолковываться как ограниченное следующими примерами, а скорее должно истолковываться как включающее все возможные изменения, которые станут очевидны в результате предоставленной в описании идеи.
Предполагается, что без дополнительного описания специалист в данной области может, используя предшествующее описание и следующие далее иллюстративные примеры, изготовить и использовать соединения настоящего изобретения и осуществлять заявленные способы. Поэтому следующие рабочие примеры конкретно указывают на предпочтительные варианты осуществления настоящего изобретения и не должны рассматриваться, как ограничивающие каким бы то ни было образом оставшуюся часть раскрытия.
Пример 1
Функциональные врожденные иммунные ответы и поддержание солидных опухолей в человеческой гемато-лимфоидной системе мышей
Как здесь было описано, мыши, репопулированные человеческой гемато-лимфоидной системой (HHLS), представляют собой эффективный инструмент для предсказывающего доклинического исследования in vivo. Основным ограничением существующих в настоящее время HHLS мышей является неправильное развитие человеческих клеток, необходимых для врожденного иммунитета. Здесь описывается новая линия мышей, у которой многие гены, кодирующие цитокины, являются генетически гуманизированными. Эти гуманизированные цитокины действуют синергетически для эффективной поддержки человеческого гематопоэза, а также развития и функции человеческих моноцитов/макрофагов и NK-клеток. В опухолевом микроокружении человеческие макрофаги приобретают иммуносупрессорный фенотип и поддерживают рост рака человека. При наличии более полной и функциональной системы человеческого врожденного иммунитета эта новая модель HHLS мышей обладает исключительным потенциалом для оказания содействия исследованиям физиологии и патологии человеческого врожденного иммунитета in vivo.
Моноциты и макрофаги являются основными клеточными компонентами врожденного иммунного ответа (Auffray et al., 2009, Annual review of immunology 27, 669). С одной стороны, эти клетки способны обнаруживать инфекцию и опосредовать прямые антимикробные действия с помощью различных механизмов, таких как фагоцитоз или секреция провоспалительных факторов. С другой стороны, моноциты/макрофаги могут приобретать иммуносупрессорные свойства, важные для урегулирования воспаления и репарации тканей. Кроме того, эти противовоспалительные свойства могут быть кооптированы проникающими в опухоль макрофагами и обеспечивать преимущество выживания развивающимся опухолям за счет использования целого ряда механизмов (Allavena и Mantovani, 2012, Clinical и experimental immunology 167, 195; Qian и Pollard, 2010, Cell 141, 39).
Модели небольших животных, таких как мыши, часто используются для изучения in vivo иммунных ответов млекопитающих. Однако существует принципиальное различие в иммунной функции между видами (Mestas и Hughes, 2004, Journal of Immunology 172, 2731; Rongvaux et al., 2013, Annual review of immunology 31, 635). В частности, между популяциями моноцитов/макрофагов существуют значительные фенотипические и функциональные видоспецифичные различия, поэтому знания, полученные при проведении исследований на мышах, только отчасти применимы к людям (Auffray et al., 2009, Annual review of immunology 27, 669; Rongvaux et al., 2013, Annual review of immunology 31, 635; Chow et al., 2011, Nature reviews Immunology 11, 788). Один перспективный подход к изучению специфичности человеческой гематопоэтической и иммунной функции in vivo заключается в использовании мышей, несущих человеческую гемато-лимфоидную систему (HHLS) (Rongvaux et al., 2013, Annual review of immunology 31, 635; Shultz et al., 2012, Nature reviews Immunology 12, 786). Однако развитие и функция некоторых типов человеческих иммунных клеток, таких как моноциты/макрофаги и NK-клетки, в основном имеет дефекты в имеющихся на данный момент HHLS мышах (Rongvaux et al., 2013, Annual review of immunology 31, 635). Вероятнее всего, эти дефекты являются результатом уменьшенной перекрестной реактивности мышиных цитокинов на соответствующих человеческих рецепторах (Manz, 2007, Immunity 26, 537). Для устранения этого ограничения была разработана стратегия замены мышиных генов, кодирующих цитокины, их человеческим эквивалентом (Willinger et al., 2011, Trends in immunology 32, 321). Этот подход привел к значительным улучшениям в создании и функции отдельных типов человеческих клеток (Фигура 16) (Rathinam et al., 2011, Blood 118, 3119; Willinger et al., 2011, Proceedings of the National Academy of Sciences 108, 2390; Rongvaux et al., 2011, Proceedings of the National Academy of Sciences 108, 2378).
Гематопоэз является строго регулируемым процессом развития, в котором мультипотентные гематопоэтические стволовые клетки видоизменяются в более коммитированные клетки-предшественники, а затем в зрелые клетки крови (Kondo et al., 2003, Annual review of immunology 21, 759; Doulatov et al., 2012, Cell stem cell 10, 120). Для этого процесса необходимы специфические цитокины, способствующие следующим одна за другой стадиям развития (Фигура 5). Возможно, может быть необходимо совместное действие (синергизм) между множеством гуманизированных цитокинов, для того, чтобы полностью воспроизвести человеческий гематопоэз у мыши. По этой причине была получена новая линия мышей, названная MISTRG, в которой гены, кодирующие M-CSF (Rathinam et al., 2011, Blood 118, 3119), IL-3/GM-CSF (Willinger et al., 2011, Proceedings of the National Academy of Sciences 108, 2390) и ТРО (Rongvaux et al., 2011, Proceedings of the National Academy of Sciences 108, 2378) были заменены их человеческими эквивалентами (Willinger et al., 2011, Trends in immunology 32, 321) на основе hSIRPAtg RAG2-/- IL-2Rγ-/- (Traggiai et al., 2004, Science 304, 104; Strowig et al., 2011, Proceedings of the National Academy of Sciences 108,13218).
Новорожденных MISTRG мышей и их однопометных особей MITRG (не имеющих hSIRPA трансген) облучили сублетальной дозой и пересадили им человеческие эмбриональные CD34+ клетки, полученные из печени, в соответствии со стандартным протоколом (Traggiai et al., 2004, Science 304, 104). RAG2-/- IL2-Rγ-/- (RG) мыши, имеющие то же самое генетическое окружение (наследственность), но лишенные всех гуманизированных аллелей, и коммерчески доступные NOD-Scid IL2-Rγ-/- (NSG) мыши служили в качестве контрольных мышей. Уровни приживления (процент hCD45+ клеток; (Фигуры 1А и 1В; и Фигура 6А) были более низкими у RG и более высокими у NSG реципиентов, как сообщалось ранее (Strowig et al., 2011, Proceedings of the National Academy of Sciences 108, 13218; Brehm et al., 2010, Clinical immunology 135, 84). Процент hCD45+ клеток в крови был сходным у MISTRG и у NSG. Кроме того, приживление было значительно увеличено у MITRG по сравнению с RG, указывая на то, что комбинированная гуманизация генов преодолевает необходимость индуцировать фагоцитарную толерантность посредством SIRPα/CD47 перекрестной реактивности (Strowig et al., 2011, Proceedings of the National Academy of Sciences 108, 13218; Takenaka et al., 2007, Nature immunology 8, 1313; Legrand et al., 2011, Proceedings of the National Academy of Sciences 108, 13224), возможно за счет ослабления врожденного ответа. Мыши, содержащие, по меньшей мере, 10% человеческих CD45+ клеток в крови были отобраны для проведения дальнейших экспериментов (Фигура 6В). В костном мозге (ВМ) процент hCD45+ клеток превышал 90% и достигал 99% у большинства из MISTRG реципиентов (Фигуры 1А и 1С; и Фигуры 6С-6Е), при этом высокоэффективное приживление в ВМ было независимо от SIRPα/CD47 взаимодействия. Для проверки способности гуманизированных цитокинов поддерживать человеческий гематопоэз в условиях большей конкуренции, человеческие CD34+ клетки были пересажены необлученным MISTRG. Этот протокол давал в результате человеческие CD45+ клетки в крови и ВМ всех реципиентов (Фигуры 1D и 1Е) и примечательно, что половина мышей продемонстрировала химеризм вплоть до самых высоких уровней, измеренных у реципиентов с пересаженными клетками после предварительного облучения рентгеновскими лучами (сравни Фигура 1Е - Фигуры 1В и 1С). Описанные здесь данные показывают, что генетическое замещение некоторого количества цитокинов у MISTRG создает микроокружение, при котором человеческий гематопоэз может почти полностью заменить мышиный гематопоэз в костном мозге, и избавляет от необходимости облучения, вызывающего патологию.
Затем была оценена способность MISTRG мышей поддерживать человеческий миелопоэз. Человеческие миелоидные клетки (hCD33+) присутствовали в значительно более высоких соотношениях в крови и костном мозге MISTRG по сравнению с RG и NSG (Фигура 2А и Фигуры 7А-7С). Увеличенная доля миелоидных клеток в MISTRG дает в результате состав крови, который напоминает физиологический состав человеческой крови, богатой миелоидными клетками, и радикально отличающийся от состава мышиной крови, богатой лимфоидными клетками (Mestas и Hughes, 2004, Journal of Immunology 172, 2731; Rongvaux et al., 2013, Annual review of immunology 31, 6354) (Фигура 2B и Фигура 7D). Тогда как, в ВМ присутствовали и моноциты (CD33hiSSCloCD66-) и гранулоциты (CD33+SSChiCD66+) (Фигура 7Е), популяции человеческих миелоидных клеток в периферической крови главным образом состояли из моноцитов (Фигура 7F), что указывает на то, что конечная дифференцировка и выход из ВМ или выживание на периферии человеческих гранулоцитов по-прежнему является недостаточным в этом мышином окружении. Важно отметить, что человеческие миелоидные клетки присутствовали в большом количестве в нелимфоидных тканях, таких как легкое, печень и толстый кишечник MISTRG, что показано с помощью иммуногистохимических методов (hCD68+ клетки; (Фигура 2С) или с помощью проточной цитометрии (hCD33+; (Фигуры 7G и 7Н), и в значительной степени превышали количество человеческих миелоидных клеток, обнаруженных у NSG мышей (в ~10 раз).
У людей были фенотипически и функционально описаны три подгруппы моноцитов, исходя из экспрессии CD14 и CD16 маркеров (Auffray et al., 2009, Annual review of immunology 27, 669; Cros et al., 2010, Immunity 33, 375). Все три субпопуляции человеческих моноцитов (CD14+CD16-, CD14+CD16+ и CD14dimCD16+) присутствовали в лимфоидных и нелимфоидных тканях, таких как легкое и печень, MISTRG (Фигуры 2D и 2Е и Фигуры 8А и 8В). В противоположность этому, у NSG, в дополнение к более низкой частоте миелоидных клеток, только CD14+CD16- и в какой-то мере CD14+CD16+ моноциты можно было регулярно обнаружить, в то время как CD14dimCD16+ клетки были представлены только минимально. Расширенный иммунофенотип (CD33, CD11b, CD115, CD62L и CX3CR1) субпопуляций моноцитов, обнаруженных у MISTRG, тщательно сравнили с эквивалентными подгруппами в человеческой периферической крови (Фигура 9). Человеческие CD14+CD16- и CD14+CD16+ моноциты, выделенные из ВМ MITRG, продуцировали высокие уровни воспалительных цитокинов в ответ на TLR4 и TLR7/8 лиганды (LPS и R848, соответственно) (Фигуры 2F и sG). В исследованиях in vitro, проведенных на лейкоцитах MITRG, и CD14+CD16- и CD14+CD16+ клетки обладали высокой способностью к фагоцитозу GFP-экспрессирующих Е. coli, тогда как CD14dimCD16+ моноциты имели ограниченную фагоцитарную активность (Фигура 2Н), опять отражая физиологические свойства соответствующих субпопуляций в человеческой крови (Cros et al., 2010, Immunity 33, 375). При заражении in vivo LPS или инфицировании бактериальными и вирусными человеческими патогенами Listeria monocytogenes и гриппом А, соответственно, MISTRG мыши отвечали активной выработкой человеческих воспалительных цитокинов (TNFα, IL-6 и IFNγ, соответственно), тогда как NSG мыши показали значительно более низкие ответы, ниже примерно на один log (Фигуры 2I-2K). Эти результаты показывают, что подгруппы человеческих моноцитов, которые развиваются у MISTRG, являются функциональными in vitro и in vivo. Однако отрицательной стороной наличия функциональных человеческих фагоцитов у мыши является нарушение фагоцитарной толерантности человек-мышь, к которой мышиные RBCs являются особенно чувствительными (Фигура 10А и 10В). Это разрушение мышиных RBCs приводило к анемии (Фигуры 10С to 10I) и ограничивало продолжительность жизни мышей с пересаженными клетками до 10-12 недель (MISTRG) или 12-16 недель (MITRG).
Миелоидные клетки могут поддерживать развитие и дифференцировку других иммунных клеток посредством выработки цитокинов. Было оценено, был ли миелоидный компартмент MISTRG мышей источником человеческих цитокинов, таких как IL-15. В соответствии с этим, было обнаружено, что экспрессия мРНК человеческих IL-15 и IL-15Rα была повышена более чем в 10 раз у MISTRG по сравнению с NSG (Фигура 3А и Фигура 11А). С целью более точного установления клеточного источника человеческого IL-15/IL-15Rα у MISTRG было измерено относительное количество транскриптов человеческих IL-15 и IL-15Rα в очищенных человеческих клеточных популяциях. Экспрессия мРНК человеческого IL-15Rα была выше в человеческих миелоидных клетках (hCD33+), чем в немиелоидных клетках (hCD33-) (Фигура 3В). В частности, CD14+CD16+ моноциты показали обогащение обоих транскриптов EL-15 и IL-15Rα (Фигура 3В). Экспрессия человеческого белка IL-15Rα на поверхности человеческих миелоидных клеток от MISTRG была подтверждена с помощью проточной цитометрии (Фигура 11В).
На основе этих открытий было оценено, поддерживают ли MISTRG мыши развитие человеческих иммунных клеток, зависящих от IL-15 транс-презентирования, таких как NK-клетки (Ма et al., 2006, Annual review of immunology 24, 657; Soderquest et al., 2011, Blood 117, 4511). Эффективное развитие человеческих NK-клеток на современных мышиных HHLS моделях требует экзогенной фармакологической доставки человеческого IL-15/IL-15Rα (Huntington et al., 2009, Journal of experimental medicine 206, 25; Chen et al., 2009, Proceedings of the National Academy of Sciences 106, 21783; Pek et al., 2011, Immunobiology 216, 218) 23-25), поскольку мышиного IL-15 недостаточно для поддержания человеческих NK-клеток in vivo. Как сообщалось ранее (Huntington et al., 2009, Journal of experimental medicine 206, 25; Chen et al., 2009, Proceedings of the National Academy of Sciences 106, 21783; Pek et al., 2011, Immunobiology 216, 218), очень немного человеческих NK-клеток (hNKp46+hCD3-) наблюдалось у NSG с пересаженными клетками (Фигуры 3С и 3D и Фигуры 12А и 12В). В противоположность этому, человеческие NK-клетки можно было легко обнаружить во многих тканях MISTRG с пересаженными клетками, при этом их количество было увеличено примерно в 10 раз по сравнению с NSG (Фигура 3С и 3D и Фигура 12А и 12В). За исключением костного мозга, MITRG имели меньше человеческих NK-клеток, чем MISTRG, что вероятнее всего было следствием сообщенной ранее потребности в человеческом SIRPα для выживаемости человеческих NK клеток на периферии (Legrand et al., 2011, Proceedings of the National Academy of Sciences 108, 13224). hNKp46+hCD3- клетки у MISTRG мышей представляли собой настоящие NK-клетки, так как они экспрессировали типичные маркеры поверхности NK-клеток CD94, CD161 и рецепторы подавления цитотоксичности (KIRs), точно имитируя человеческие контроли (Фигуры 12А и 12В). В дополнение к его действию на развитие IL-15 также способствует созреванию NK-клеток. Соответственно, было обнаружено, что поверхностная экспрессия маркера созревания CD16 и количества белка перфорина протеазосодержащей вакуоли были более высокими на NK-клетках из MISTRG по сравнению с NSG (Фигура 13С-13F).
Клеточный источник IL-15 транс-презентирования in vivo у людей в настоящее время неизвестен, тем не менее, человеческие миелоидные клетки могут поддержать пролиферацию человеческих NK-клеток in vitro (Huntington et al., 2009, Journal of experimental medicine 206, 25). Для проверки предположения о том, что транс-презентирование человеческого IL-15 человеческими моноцитами/макрофагами лежит в основе улучшенного развития человеческих NK-клеток у MISTRG, мыши были обработаны инкапсулированным в липосомы клодронатом с целью истощения фагоцитов (Фигура 14). Истощение фагоцитов также вызывало значительное уменьшение человеческих NK-клеток (Фигура 3Е), давая основание предполагать, что человеческие моноциты/макрофаги в самом деле являются решающим клеточным типом, который транс-презентирует IL-15 для поддержки гомеостаза человеческих NK-клеток in vivo.
NK-клетки участвуют во врожденной защите против патогенов, уничтожая клетки, которые утратили экспрессию МНС класса I (потеря своего) (Raulet, 2006, Seminars in immunology 18, 145), и вырабатывая ключевой цитокин IFNγ (Vivier et al., 2008, Nature immunology 9, 503). В соответствии с более высокой экспрессией перфорина (Фигуры 13Е и 13F), существенно увеличенная цитотоксическая активность NK-клеток против человеческих клеток, утративших МНС класса I, наблюдалась in vivo у MISTRG по сравнению с NSG (Фигура 3F). NK-клетки являются ранним источником IFNγ после инфекции Listeria. Соответственно, было обнаружено, что экспрессия мРНК человеческого IFNγ в печени более чем в 10 раз выше MISTRG, чем у NSG через два дня после инфекции (Фигура 3G). При степени разделения до одной клетки (одноклеточном разрешении), NK-клетки из MISTRG, инфицированных Listeria, показали выработку человеческого IFNγ без ex vivo повторной стимуляции (Фигура 3Н), с частотой значительно более высокой, чем у NSG (Фигура 3I). NK-клетки у MISTRG также обладали литической активностью (дегрануляция) после инфекции Listeria, как показано путем экспозиции плазматической мембраны CD107a (Фигура 3Н). В целом, MISTRG посредством эффективной выработки человеческих миелоидных клеток поддерживают развитие, дифференцировку и функцию человеческих NK-клеток, тем самым преодолевая основное ограничение современных мышиных HHLS моделей.
Далее, была оценена роль человеческих миелоидных клеток в контексте опухолевого микроокружения. Соответственно, в качестве опухолевой модели использовали линию клеток меланомы человека Ме290 (Valmori et al., 1998, Journal of immunology 160, 1750). Клинические наблюдения показывают, что миелоидные клетки проникают в некоторые солидные опухоли, и высокие плотности инфильтрирующих макрофагов коррелируют с плохим прогнозом для пациентов в большинстве типов рака (Qian и Pollard, 2010, Cell 141, 39; Coussens et al., Science 339, 286; Egeblad et al., 2010, Developmental cell 18, 884; Nelson и Bissell, 2006, Annual review of cell и developmental biology 22, 287; Bingle et al., 2002, T Journal of pathology 196, 254). Соответственно, более высокая инфильтрация человеческих миелоидных клеток была обнаружена в опухолях у MISTRG, чем у NSG, как видно по экспрессии мРНК человеческих PTPRC и ITGAM (кодирующих соответственно CD45 и CD11b) (Фигура 4А). Напоминая человеческие опухоли у пациентов, клетки, экспрессирующие маркеры макрофагов CD163 и CD14, имелись в изобилии в опухолях у MISTRG, однако были почти необнаружимыми в некоторых опухолях у NSG (Фигуры 4В и 4С и Фигура 15). Большинство CD163+ клеток также экспрессировали низкие уровни HLA-DR и высокие уровни CD206 (Фигура 4 В и 4D), иммунофенотип, обычно связанный с "М2-подобными" макрофагами (Нао et al., 2012, Clinical & developmental immunology 2012, 948098; Tang, 2013, Cancer Lett 332, 3).
Подтип M2 макрофагов способствует прогрессированию опухоли при посредстве целого ряда эффекторных механизмов, включая сигналы пролиферации для раковых клеток, антиапоптотические сигналы, проангиогенную активность, предоставление возможности для раковой клетки выходить из первичных опухолей и образование метастазов (Qian и Pollard, 2010, Cell 141, 39; Coussens et al., Science 339, 286; Egeblad et al., 2010, Developmental cell 18, 884). Было установлено, что инфильтрация макрофагов в опухоли может способствовать росту опухоли у MISTRG. Было отмечено, что размер опухолей у MISTRG с пересаженными CD34+, которые сильно инфильтрируются человеческими CD163+ HLA-DRlow CD206+ макрофагами, был значительно больше, чем опухоли у NSG, которые не инфильтрируются человеческими макрофагами и имеют такой же небольшой размер, как наблюдаемый у NSG или MISTRG мышей без пересадки (Фигуры 4Е и 4F). Одним из механизмов, посредством которого макрофаги поддерживают рост опухоли, является выработка цитокинов или ферментов, способствующих васкуляризации и подавлению иммунитета. VEGF является важной многофункциональной молекулой, поддерживающей опухоль (Kandalaft et al., Current topics in microbiology и immunology 344, 129; Motz и Coukos, Immunity 39, 61), и для проверки того, вовлечен ли этот фактор в опухолевый рост у MISTRG, мышей обрабатывали ингибитором человеческого-VEGF авастином™. Эта обработка полностью изменяла фенотип развития опухоли (Фигура 4F), демонстрируя, что миелоидные клетки у MISTRG поддерживают рост меланомы посредством VEGF-зависимого механизма. В общем, эти результаты показывают, что MISTRG мыши повторяют роль человеческих макрофагов в развитии опухоли и восполняют острую потребность в моделях, обеспечивающих возможность исследования взаимодействия между опухолями человека и человеческими макрофагами in vivo, в частности, в начале развития опухоли.
Описанные здесь данные демонстрируют, что обеспечение многих человеческих цитокинов у MISTRG мышей обуславливало синергические действия (Фигура 16) на человеческий гематопоэз и прямую или опосредованную поддержку функции человеческих иммунных клеток. Модель MISTRG HHLS мышей предоставляет исключительную возможность для исследования человеческих врожденных иммунных ответов in vivo.
Далее описываются материалы и методы.
Линии мышей
Было сообщено о получении мышей с нокин заменой генов, кодирующих ТРО, IL-3/GM-CSF и M-CSF, или с ВАС-трансгенной экспрессией человеческого SIRPα на генетической основе RAG2-/-γc-/- Balb/c × 129 (Rathinam et al., 2011, Blood 118, 3119; Willinger et al., 2011, Proceedings of the National Academy of Sciences 108, 2390; Rongvaux et al., 2011, Proceedings of the National Academy of Sciences 108, 2378; Strowig et al., 2011, Proceedings of the National Academy of Sciences 108, 13218). Эти линии были скрещены, чтобы получить MITRG (M-CSFh/hIL-3/GM-CSFh/hTPOh/hRAG2-/-γc-/-) и MISTRG (М-CSFh/hIL-3/GM-CSFh/hhSIRPAtgTPOh/hRAG2-/-γc-/-) мышей. Такие мыши являются жизнеспособными, здоровыми и способными к размножению. Мышей содержали в свободных от специфической патогенной микрофлоры условиях с постоянным добавлением энрофлоксацина в питьевую воду (Baytril, 0.27 мг/мл). NOD Scid γc-/- (NSG) мыши были получены из лаборатории Jackson.
Получение человеческих HSPC и пересадка мышам-реципиентам
Мышам-реципиентам были пересажены человеческие гематопоэтические стволовые и прогениторные клетки, как описано (Rathinam et al., 2011, Blood 118, 3119; Willinger et al., 2011, Proceedings of the National Academy of Sciences 108, 2390; Rongvaux et al., 2011, Proceedings of the National Academy of Sciences 108, 2378; Traggiai et al., 2004, Science 304, 104; Strowig et al., 2011, Proceedings of the National Academy of Sciences 108, 13218). Образцы эмбриональной печени разрезали на небольшие фрагменты, обрабатывали коллагеназой D (Roche, 100 нг/мл) в течение 45 минут при 37°C и готовили клеточную суспензию. Человеческие CD34+ клетки очищали центрифугированием в градиенте плотности (Lymphocyte Separation Medium, MP Biomedicals), а затем проводили положительную иммуномагнитную селекцию с помощью микрогранул анти-человек CD34 (Miltenyi Biotec). Клетки замораживали в FBS, содержащем 10% DMSO, и хранили в жидком азоте.
Для исследования приживления новорожденных детенышей (в течение 2 дней жизни) облучали сублетальной дозой (рентгеновское облучение; RG, 2×180 cGy (сантигрэй) с интервалом 4 час; NSG, 1×100 cGy; MISTRG, 1×150 cGy), затем в печень вводили 100,000 FL-CD34+ клеток в 20 мкл PBS с помощью иглы 22-колибра (Hamilton Company). В определенных экспериментах (Фигуры 1D и 1Е), 200,000-300,000 клетки вводили необлученным MISTRG новорожденным эксципиентам. Кровь у мышей отбирали через 7-9 недель и определяли процент человеческих CD45+ клеток с помощью проточной цитометрии. Мыши, у которых человеческие CD45+ клетки, представляли, по меньшей мере, 5% (RG) или 10% (NSG, MITRG и MISTRG) от всех (мышиных и человеческих совместно) CD45+ популяций, были отобраны для проведения дальнейших экспериментов. Мышей забивали или использовали в экспериментах через 9-12 недель после трансплантации.
Все эксперименты были проведены с согласия комитета Йельского университета Human Investigation Committee и в соответствии с протоколами Йельского комитета по содержанию и использованию лабораторных животных.
Иммунофенотипический анализ человеческих клеточных популяций
Для получения лейкоцитов, гепаринизированную кровь дважды обработали ACK лизирующим буфером для устранения RBCs. Одноклеточную суспензию селезенки и костного мозга (выделенного из бедренной кости и большой берцовой кости) обработали лизирующим буфером ACK. Лейкоциты печени и легкого были выделены путем механической диссоциации и обработки тканей 100 Ед/мл коллагеназой IV и 0.02 мг/мл ДНКазой I (Sigma) в течение 1 часа при 37°C, а затем путем центрифугирования в градиенте плотности.
Для проведения FACS анализов использовали антитела к следующим антигенам.
Мышиные антигены: CD45 (клон 30-F11), CD71 (RI7217), Ter119.
Человеческие антигены: CD1c (BDCA1, клон L161), CD3 (UCHT1), CD11b (ICRF44), CD11c (3.9), CD14 (М5Е2), CD16 (3G8), CD19 (HIB19), CD33 (WM53), CD45 (HI30), CD62L (DREG-56), CD66 (ASL-32), CD94 (DX22), CD107a (Н4А3), CD115 (9-4D2-1Е4), CD123 (6Н6), CD141 (BDCA3, М80), CD161 (HP-3G10), CD235a (HI264), CD303 (BDCA2, 201А), NKp46 (9Е2), IL-15Rα (JM7A4), CX3CR1 (2А9-1), HLA-A,B,C (W6/32), HLA-DR (L243), IFNγ (B27) KIR2DL1/S1 (HP-MA4), KIR2DL2/L3 (DX27), KIR3DL1 (DX9), перфорин (dG9).
Смесь человеческих линий дифференцировки: CD3, CD15, CD19, CD56, NKp46
Все антитела были получены от Biolegend, BD Biosciences или Miltenyi Biotec. Результаты были получены при использовании FACSDiva на проточном питометре LSRII (BD Biosciences) и проанализированы с помощью программного обеспечения FlowJo.
Для проведения гистологических исследований ткани селезенки, легкого, печени и толстого кишечника фиксировали в течение ночи в IHC цинковом фиксаже (BD Biosciences) или 4% параформальдегиде и заливали парафином. Срезы окрашивали гематоксилином и эозином или анти-человек CD68 антителами (клон PGM1), а затем HRP-конъюгированными вторичными антителами и выявляли субстратом пероксидазы 3,3'-диамонобензидином.
Изучение фагоцитоза in vitro
Е. Coli, экспрессирующие GFP, выращивали в LB среде в течение ночи при 37°C до OD600 1.5-1.8, в этот момент времени бактерии разбавляли и выращивали в течение 1-2 часов до значения OD600 приблизительно 1.0. Затем Е. Coli три раза промывали PBS и инкубировали с лейкоцитами от мышей MITRG в течение 4 часов при 37°C в объеме 200 мкл примерно с 2×108 Е. coli на 1×107 лейкоцитов. После инкубации клетки промывали PBS и анализировали с помощью проточной цитометрии.
TLR стимулирование in vitro и инфицирование in vivo
Подгруппы человеческих моноцитов выделяли из ВМ мышей. Коротко, ВМ клетки были выделены из задней конечности и позвоночника шести мышей и объединены. Человеческие CD33+ клетки собирали с помощью магнитного выделения (набор EasySep CD33 selection, StemCell Technologies). Подгруппы CD14+CD16- и CD14+CD16+ были очищены с помощью клеточного сортера FACSAria (BD Biosciences). 100,000 клеток в 200 мкл среды культивировали в течение ночи в присутствии TLR4 лиганда LPS (Е. Coli 0111:В4, Sigma-Aldrich, 100 нг/мл) или TLR7/8 лиганда R848 (Invivogen, 10 мкг/мл).
Для стимулирования in vivo внутрибрюшинно инъецировали 35 мкг LPS (Е. Coli 0111:В4, Sigma-Aldrich) в 100 мкл PBS, а сыворотку собирали через 90 минут.
Мышей инфицировали листерией моноцитогенной (Listeria monocytogenes, штамм 10403S) в количестве 3×103 колониеобразующих единиц (КОЕ) с помощью внутривенной инъекции. Через сорок восемь часов после инфицирования собирали сыворотку и ткани для проведения анализа ELISA и количественной ПЦР, соответственно. Лимфоциты печени от инфицированных и неинфицированных мышей инкубировали при 37°C/5% СО2 в течение 4 часов в среде, содержащей монензин (GolgiStop, BD Biosciences) и античеловек CD107a антитела. Затем клетки окрашивали на поверхностные антигены, пермеабилизацию проводили с использованием набора Cytofix/Cytoperm (BD Biosciences) и окрашивали на внутриклеточный человеческий IFNγ.
Мышей заражали интраназально 2×104 БОЕ вирусом гриппа A/PR8 (H1N1), легкие собирали на 3 день после заражения для проведения qPCR анализов.
Концентрации цитокинов (человеческих TNFα, IL-6 и IL-1β) в сыворотке мышей и в культуральных супернатантах измеряли с помощью наборов ELISA MAX Standard kits (Biolegend), следуя инструкциям производителя.
RBC анализ
Подсчет RBC проводили на приборе Hemavet 950 (Drew Scientific). Мазки крови окрашивали по Райту-Гимзе. Для экспериментов по переносу RBC получали кровь от RG мышей, меченых CFSE (20 мкМ, 15 минут при 37°C), три раза промывали PBS, и 200 мкл меченых RBC вводили с помощью ретро-орбитальной внутривенной инъекции. Через 5 минут брали кровь у мышей для определения первоначальной частоты встречаемости (День 0, 100%) CFSE-положительных клеток среди Ter119+ клеток с помощью проточной цитометрии. Затем брали кровь в указанные моменты времени и подсчитывали содержание CFSE-меченых Ter119+ клеток в виде процента от значений на День 0.
Истощение фагоцитов in vivo
Обеднение фагоцитов осуществляли с помощью внутривенной ретро-орбитальной инъекции 100 мкл липосом, нагруженных клодронатом (Van Rooijen и Sanders, 1994, Journal of immunological methods 174, 83). Липосомы с клодронатом вводили три раза в день, а человеческие NK-клетки в печени мышей исследовали через 24 часа после последней инъекции. Для исследования фагоцитоза RBC липосомы с клодронатом вводили 3 дня и 1 день до переноса CFSE-меченых RBC.
Количественный ОТ-ПЦР
Общую РНК выделяли из тканей или очищенных клеток с помощью реактива TRIzol (Invitrogen) в соответствии с инструкциями производителя и использовали для синтеза кДНК с помощью Superscript First-Strand Synthesis System (Invitrogen). Количественный анализ ОТ-ПЦР проводили на системе 7500 Fast Real-Time PCR, наборы праймеров и зондов были куплены у компании ABI. Значения экспрессии вычисляли, используя метод сравнительного порогового цикла, и нормировали относительно мышиного Hprt или человеческого HPRT, как указано.
Исследование цитотоксичности NK-клеток in vivo
Цитотоксичность человеческих NK клеток in vivo определяли согласно протоколу, сообщенному ранее (Strowig et al., 2010, Blood 116, 4158). LCL721.221 (HLA класс I отрицательные) и LCL721.45 (класс I положительные) клетки смешивали в соотношении 1:1, метили CellTrace Violet (Invitrogen) и вводили внутривенно (1×107 клеток/мышь) NSG или MISTRG мышам с пересадкой. Через 12 часов мышей забивали, готовили одноклеточную суспензию из селезенок и анализировали с помощью проточной цитометрии. Были измерены соотношения положительных и отрицательных HLA класса I среди окрашенных в фиолетовый цвет клеток, а специфический лизис вычисляли как (МНС класс I положительные - МНС класс I отрицательные) × 100 / МНС класс I положительные.
Образование опухолей
Клетки меланомы человека Ме290 (Valmori et al., 1998, Journal of immunology 160, 1750) выращивали до конфлюентности (заселенности) ~90%, а затем клетки (~7 миллион клеток на мышь) подкожно вводили в правый бок мыши под анестезией. В некоторых экспериментах мышей обрабатывали через день, начиная со дня перевивки опухоли, античеловек VEGF антителами Avastin™ (Roche; 100 мкг, внутривенно). Размер опухолей измеряли через 11 дней, а объем вычисляли, используя следующую формулу: Объем = 0.5 * длина 2 * ширина.
Ткани пациентов и мышей были заморожены в Optimum Cutting Temperature (OCT, Sakura Finetek). Криосрезы (7 мкм) были последовательно обработаны Triton-100Х 0.1% в течение 15 минут, гиалуронидазой 0.03% в течение 15 минут, Background Buster (Innovex bioscience) в течение 15 минут, Fc Receptor Block (Innovex bioscience) в течение 15 минут и Background Buster в течение дополнительных 15 минут. Затем срезы окрашивали первичными антителами, разведенными в PBS с добавлением 5% BSA и 0.01% сапонина в течение 1 часа при комнатной температуре, промывали и окрашивали вторичными антителами при комнатной температуре в течение 40 минут. Ядра окрашивали 4',6-диамидино-2-фенилиндолом (1 мкг/мл) в течение 2 минут.
Первичные антитела: человеческие CD14 (1:200, UCHM1, AbD Serotec); человеческие CD163 (1:200, EDHu-1, AbD Serotec); человеческие CD206 (1:100, 15-2, AbD Serotec); человеческие HLA-DR (1:100, LN3, Biolegend). Для совместного окрашивания CD163/CD206, и те и другие антитела метили Alexa Fluor 488 или 568 Antibody Labeling Kit (Molecular Probes) до окрашивания ткани.
Вторичные антитела: козьи анти-крыса Alexa Fluor 568; козьи анти-мышь Alexa Fluor 488; козьи анти-мышь Alexa Fluor 588 или козьи анти-мышь Alexa Fluor 647 (1:700, Molecular Probes).
Визуализацию иммунофлуоресценции осуществляли с помощью инвертированного микроскопа Eclipse Ti (Nikon Instruments Inc.), действующего с помощью программного обеспечения NIS-Element Ar (Nikon Instruments Inc).
Для количественного определения интенсивности инфильтрации CD163+ клеток были отобраны опухоли от 3 разных пациентов с меланомой, 3 NSG и 3 MISTRG. 3 криосреза каждой опухоли были окрашены в отношении человеческого CD163. Из каждого окрашенного среза было получено 3 репрезентативных изображения, составляя в сумме 27 репрезентативных изображений из каждой группы (пациенты, MISTRG и NSG). Для каждого изображения были подсчитаны CD163+ клетки с использованием программного обеспечения NIS-Element Ar (Niko Instruments Inc.). Каждое изображение было проанализировано с использованием "split channels + overlay" изображение и при увеличении одновременно на каждом отдельном канале и на overlay.
Статистический анализ
Статистический анализ проводили с помощью программного обеспечения GraphPad Prism 5, используя однофакторный дисперсионный анализ ANOVA, а затем апостериорный тест Тьюки, двусторонний непарный критерий Стьюдента или повторное измерение ANOVA.
Пример 2
Миелоидные новообразования человека могут быть пересажены MISTRG
Миелоидная лейкемия является формой рака, затрагивающего клетки миелоидного ростка. Миелоидные лейкемии делятся на разные типы, включая острый миелоидный лейкоз (AML), миелопролиферативное заболевание (MPD), хронический миеломоноцитарный лейкоз (CMML) и миелодиспластический синдром (MDS). Риск развития миелоидных лейкемий увеличивается с возрастом, а частота возникновения этих заболеваний, вероятно, увеличивается со старением популяции. Несмотря на то что терапия и поддерживающее лечение являются доступными в клинике, необходимо лучшее понимание этой группы болезней и новые виды лечения.
Один из способов, используемых для исследования лейкемий пациентов, основывается на ксенотрансплантации образцов пациентов иммунодефицитным мышам. Однако доступные в настоящее время мыши-реципиенты не являются оптимальными для этой цели: только часть AML образцов может быть пересажена успешно; и о полноценном приживлении MPD, CMML или MDS (включая RCUD, RAEB I и RAEB II) до сих пор не сообщалось. Таким образом, необходимы оптимизированные линииреципиентных мышей для лучшего приживления миелоидной лейкемии человека.
В данном документе показано, что MISTRG лучше поддерживают приживление человеческих гематопоэтических клеток, приводя почти к полной замене мышиного гематопоэза человеческим гематопоэзом в костном мозге. В данном документе также показано, что образцы, полученные от пациентов с AML, CMML и MDS, могут быть пересажены MISTRG (Фигура 17).
Следовательно, описанные в данном документе, генетически модифицированные, не принадлежащие к человеческому роду животные представляют новую in vivo животную модель миелоидной лейкемии человека, которая будет полезна для (i) исследования клеточного и молекулярного патогенеза данной болезни; (ii) для установления биомаркеров с предказывающим или прогностическим значением; (iii) для установления новых мишеней для терапии и (iv) для проверки методов лечения в доклинических исследованиях, касающихся отдельного пациента.
Раскрытия всех и каждого патента, патентной заявки и публикации, цитированных здесь, полностью включаются в описание путем отсылки. Несмотря на то что это изобретение раскрывается со ссылкой на конкретные варианты осуществления, очевидно, что другие варианты осуществления и изменения данного изобретения могут быть разработаны другими специалистами в данной области без выхода за пределы истинного объема и сущности изобретения. Прилагаемые пункты формулы изобретения предназначаются для включения всех таких вариантов осуществления и эквивалентных изменений.
Реферат
Настоящее изобретение относится к генетической инженерии, в частности к генетически модифицированному иммунодефицитному грызуну, который экспрессирует полипептид M-CSF человека, полипептид IL-3 человека, полипептид GM-CSF человека, полипептид SIRPA человека и полипептид ТРО человека. Указанный грызун модифицирован таким образом, что содержит в своем геноме нуклеиновые кислоты, кодирующие человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, соответственно. При этом каждая из указанных нуклеиновых кислот является функционально связанной с промотором. Настоящее изобретение также раскрывает способ приживления гематопоэтической стволовой и прогениторной клетки (HSPC). Данный способ предусматривает введение HSPC генетически модифицированному иммунодефицитному грызуну согласно изобретению. Настоящее изобретение позволяет получать генетически модифицированных грызунов, демонстрирующих улучшенное приживление солидных опухолей, для использования в качестве моделей человеческой иммунной системы. 2 н. и 17 з.п. ф-лы, 17 ил., 2 пр.

Комментарии