Двойной вектор для подавления вируса иммунодефицита человека - RU2562868C2
Код документа: RU2562868C2
Чертежи


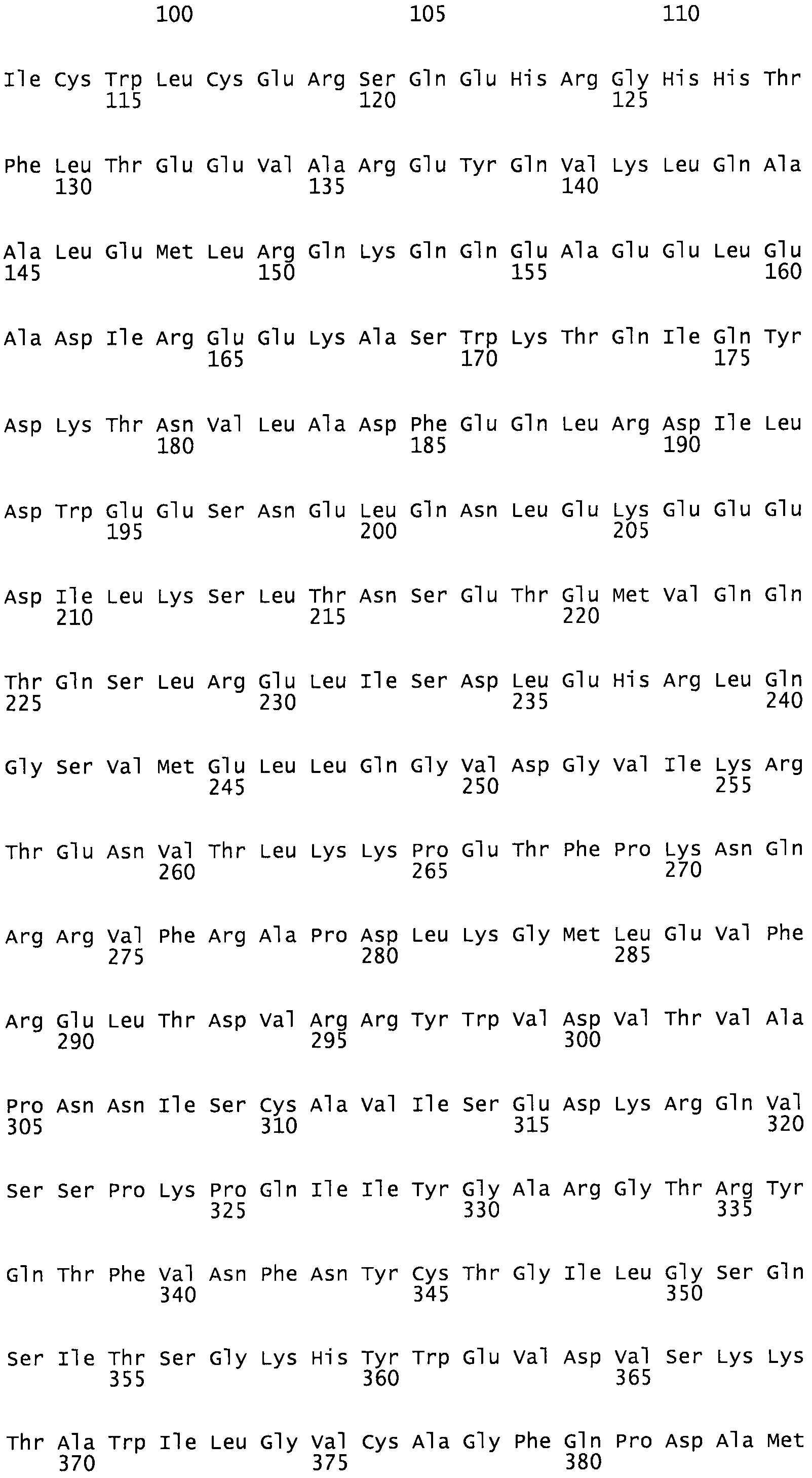


























Описание
Перекрестная ссылка на родственные заявки
Это описание изобретения заявляет преимущество приоритета Предварительной заявки США №61/287,599, поданной 17 декабря 2009 года, и Предварительной заявки США №61/225,687, поданной 15 июля 2009 года, и обе эти заявки полностью включены в это описание изобретения посредством ссылки.
Описание текстового файла, представленного в электронном виде
Содержание текстового файла, представленного в электронном виде, полностью включено в это описание изобретения посредством ссылки: экземпляр порядкового перечня в формате, читаемом компьютером (название файла: CALI_004_01WO_SeqList_ST25.txt, дата регистрации: 26 мая 2010 года, размер файла 9 килобайт).
Область техники
Это изобретение относится, в целом, к области молекулярной биологии и вирусологии. В частности, это изобретение относится к экспрессионным векторам, используемым в лечении и профилактике ВИЧ инфекций.
Уровень техники
Вирус иммунодефицита человека (ВИЧ) является возбудителем синдрома приобретенного иммунодефицита (СПИД) у людей, который приводит к недостаточности иммунной системы и повышает вероятность смертельного исхода инфекций, вызываемых условно-патогенными микроорганизмами. Инфекция ВИЧ представляет мировую проблему здравоохранения, о чем свидетельствует ее определение Всемирной Организацией Здравоохранения как пандемии. Большинство людей, инфицированных ВИЧ, в конце концов, заболевают СПИДом, ежегодно уносящим жизни более одного миллиона человек.
Антиретровирусная терапия, такая как высокоактивная антиретровирусная терапия (ВААРТ), включающая комбинации нуклеозидных аналогов ингибиторов обратной транскриптазы, ингибиторов протеазы и ненуклеозидных ингибиторов обратной транскриптазы, значительно снизила заболеваемость и смертность от ВИЧ/СПИД в тех регионах мира, где она доступна. Однако ВААРТ не излечивает и не устраняет полностью все симптомы ВИЧ/СПИД. ВААРТ связана с некоторыми побочными эффектами, а также, с появлением штаммов ВИЧ, резистентных к ретровирусным ингибиторам. По этим причинам, а также, из-за высокой стоимости ВААРТ и необходимости строго придерживаться режима лечения, такая терапия может быть относительно неэффективной для большого количества пациентов. Таким образом, существует потребность в разработке улучшенных стратегий лечения и профилактики ВИЧ инфекций.
Сущность изобретения
Настоящее изобретение обеспечивает новый терапевтический подход к лечению и/или профилактике ВИЧ инфекций, согласно которому генная терапия нацелена на два различных этапа вирусной инфекции. Например, настоящее изобретение предлагает вектор, кодирующий ингибитор проникновения вируса в клетку хозяина и ингибитор слияния вируса и/или ингибитор репликации вируса. Соответственно, в одном из вариантов осуществления этого изобретения, предлагается экспрессионный вектор, содержащий первую последовательность нуклеиновых кислот, кодирующую ингибитор корецептора ВИЧ, и вторую последовательность нуклеиновых кислот, кодирующую белок, который ингибирует слияние ВИЧ с клеткой-мишенью или репликацию ВИЧ, причем указанная первая последовательность нуклеиновых кислот функционально связана с первым промотором, а указанная вторая последовательность нуклеиновых кислот функционально связана со вторым промотором. Экспрессионным вектором может быть вирусный вектор, такой как ретровирусный или лентивирусный вектор. В некоторых вариантах осуществления этого изобретения, первая и вторая последовательность нуклеиновых кислот транскрибируются с единого промотора. В определенном варианте осуществления этого изобретения участок внутренней посадки рибосомы (УВПР) расположен слева от второй последовательности нуклеиновых кислот.
В определенных вариантах осуществления этого изобретения, экспрессионный вектор также содержит третью последовательность нуклеиновых кислот, кодирующую ингибитор попадания вируса в клетку, слияния вируса или репликации вируса. В некоторых вариантах осуществления этого изобретения, третья последовательность нуклеиновых кислот функционально связана с третьим промотором. В других вариантах осуществления этого изобретения, две из трех последовательностей нуклеиновых кислот транскрибируются с одного промотора (например, первая и вторая последовательность нуклеиновых кислот или вторая и третья последовательность нуклеиновых кислот). В иных вариантах осуществления этого изобретения, все три последовательности нуклеиновых кислот транскрибируются с одного промотора. Одна или несколько УВПР могут располагаться слева от второй и/или третьей последовательности нуклеиновых кислот.
В одном из вариантов осуществления этого изобретения, первая последовательность нуклеиновых кислот экспрессионного вектора кодирует молекулу ингибиторной нуклеиновой кислоты, такой как малая интерферирующая РНК (миРНК) или короткая шпилечная РНК (кшРНК), действующую на корецептор ВИЧ. В некоторых вариантах осуществления этого изобретения, молекула миРНК или кшРНК содержит двухцепочечный участок, последовательность нуклеотидов которого существенно идентична и комплементарна С-С рецептору хемокина 5 (CCR5). В других вариантах осуществления этого изобретения, молекула миРНК или кшРНК содержит двухцепочечный участок, последовательность нуклеотидов которого существенно идентична и комплементарна С-Х-С рецептору хемокина 4 (CXCR4).
В другом варианте осуществления этого изобретения, вторая последовательность нуклеиновых кислот экспрессионного вектора кодирует белок, который ингибирует слияние ВИЧ с клеткой-мишенью. Белком-ингибитором слияния ВИЧ может быть белок С46 или иной подобный белок, ингибирующий слияние ВИЧ с поверхностью клетки, трансгенно экспрессированный и находящийся на поверхности клетки (например, белок Т20 или родственные белки, энфувиртид, СР32М, и сифувиртид).
Еще в одном варианте осуществления этого изобретения, вторая последовательность нуклеиновых кислот экспрессионного вектора кодирует белок, ингибирующий репликацию ВИЧ. Например, в некоторых вариантах осуществления этого изобретения, вторая последовательность нуклеиновых кислот кодирует белок TRIM5α (трехсоставный взаимодействующий мотив 5 альфа) или производный от него белок, или продукт его слияния. В некоторых вариантах осуществления этого изобретения, вторая последовательность нуклеиновых кислот кодирует химерный белок TRIM5α, аминотерминальная область которого происходит от белка TRIM5α человека, а карбокситерминальная область PRYSPRY - от белка TRIM5α макаки-резус. В других вариантах осуществления этого изобретения, вторая последовательность нуклеиновых кислот кодирует белок слияния TPIM5-циклофилин.
В одном из вариантов осуществления этого изобретения, экспрессионный вектор содержит первую, вторую и третью последовательность нуклеиновых кислот, причем первая последовательность нуклеиновых кислот кодирует ингибитор корецептора ВИЧ (например, кшРНК для CCR5 or CXCR4), вторая последовательность нуклеиновых кислот кодирует ингибитор слияния (например, С46), а третья последовательность нуклеиновых кислот кодирует ингибитор репликации ВИЧ (т.е. белок TRIM5α или производный от него, или продукт слияния).
В некоторых вариантах осуществления этого изобретения, ингибитор корецептора ВИЧ и ингибитор слияния ВИЧ с клеткой-мишенью, или ингибитор репликации ВИЧ экспрессированы от разных промоторов на экспрессионном векторе. В одном из вариантов осуществления этого изобретения, ингибитор корецептора ВИЧ (например, CCR5 или CXCR4) экспрессирован от промотора РНК-полимеразы III, а ингибитор слияния и/или репликации ВИЧ - экспрессирован от промотора РНК-полимеразы II. Два различных ингибитора могут быть экспрессированы от системы экспрессии в разных соотношениях.
Настоящее изобретение также предлагает способы создания экспрессионных векторов, описанных в этом документе, а также, фармацевтические композиции, включающие новые экспрессионные векторы. Например, в одном из вариантов осуществления этого изобретения, способ получения вирусного экспрессионного вектора, который, находясь в клетке, может подавлять связывание ВИЧ с клеткой и предотвращать слияние ВИЧ с клеткой или репликацию ВИЧ, заключается в синтезе кДНК гена, экспрессирующего белок, способный предотвращать слияние ВИЧ с клеткой или репликацию ВИЧ; клонировании синтезированной кДНК в участок рестрикции вирусного вектора; и внедрении экспрессионного элемента, способного подавлять экспрессию корецептора ВИЧ, в участок рестрикции вектора.
Настоящее изобретение также предлагает способ лечения и профилактики ВИЧ инфекции у пациентов. В одном из вариантов осуществления этого изобретения, способ заключается в назначении пациенту фармацевтической композиции, содержащей экспрессионный вектор, являющийся предметом этого изобретения. Применение таких композиций может придать пациенту сопротивляемость инфекции R5 и Х4-тропными штаммами ВИЧ. В одном из вариантов осуществления этого изобретения, пациентом является человек. Пациент может быть с отрицательным диагнозом ВИЧ или ВИЧ-положительным. В некоторых вариантах осуществления этого изобретения, пациент может быть никогда ранее не получавшим высокоактивной антриретровирусной терапии (ВААРТ), получающим ВААРТ, или пациентом, которому ВААРТ не помогает или не помогала. В других вариантах осуществления этого изобретения, пациент может иметь резко выраженный СПИД (например, СПИД/лимфому).
В другом варианте осуществления этого изобретения, способ заключается в трансфекции кроветворных клеток (например, HPSC, CD4+ Т-лимфоциты, CD8+ Т-лимфоциты или моноциты/макрофаги) экспрессионным вектором, являющимся предметом этого изобретения, и пересадке таких трансфектированных клеток пациенту, причем такие трансфектированные клетки являются резистентными к ВИЧ инфекции. В одном из вариантов осуществления этого изобретения, кроветворными клетками являются гематопоэтические клетки-предшественники/стволовые клетки (ГПСК), генерирующие гранулоциты, моноциты/макрофаги и лимфоциты, резистентные к ВИЧ инфекции после трансплантации пациенту. В некоторых вариантах осуществления этого изобретения, ГПСК являются аутологичными и CD34- положительными. Трансфектированные ГПСК могут генерировать гранулоциты, моноциты/макрофаги и лимфоциты, резистентные к R5-и Х4-тропическим штаммам ВИЧ. В некоторых вариантах осуществления этого изобретения, трансфектированные ГПСК могут генерировать гранулоциты, моноциты/макрофаги и лимфоциты, резистентные к инфекции штаммами ВИЧ, резистентными к ВААРТ.
В этом описании изобретения, если контекст не требует иного, слово «содержит», «состоит из» или соответствующие вариации означают включение указанного в тексте элемента, целого числа или этапа, или группы элементов, чисел или этапов, но не исключение любого иного элемента, числа или этапа, или группы элементов, чисел или этапов.
Любое обсуждение документов, актов, материалов, приборов, статей и тому подобного, включенное в это описание изобретения, приводится лишь для создания контекста, в котором предлагается это изобретение. Не следует допускать, что любые или все эти вещи входят в состав прототипа или являлись общей известной информацией в области, к которой относится это изобретение, до даты приоритета каждого из пунктов формулы этого изобретения.
Чтобы сделать это изобретение более понятным, предпочтительные варианты его воплощения будут описаны со ссылкой на следующие чертежи и примеры.
Краткое описание чертежей
Фигура 1 - системы лентивирусного вектора. Схематически представлены важные элементы, каждый из которых содержит указанные векторы. Двойной вектор sh5/C46 обведен пунктирной линией.
Фигура 2 - остовные системы. Схематическое изображение важных элементов, составляющих каждый остовный лентивирусный вектор, «р» означает плазмиду. pFG11F получена из pFG12 путем введения сайтов множественного клонирования (СМК или «MCS») в разных местах, включая слева от убихинонового промотора (Ubc).
Фигура 3 - векторы, производные от остова FG12. Схематическое представление образования pFG12-H1-R5-U-EGFP и pFG12-H1-R5.
Фигура 4 - векторы, производные от остова FG11F. Схематическое представление образования pFG11F- U-C46 и pFG1 1F-H1-R5-U-C46.
Фигура 5 - получение лентивируса. Схематическое представление (слева) генома ВИЧ-1 дикого типа и родовых векторов в транзиторной системе совместной трансфекции: 1. Плазмида вектора ВИЧ (испытуемый вектор, например, системы, представленные на фигурах 1-4); 2-4: различные плазмиды-помощники. Схема, обведенная пунктиром (справа), представляет элементы фактической плазмиды-помощника, используемой в получении лентивируса.
Фигура 6 - стабильность экспрессии в клетках CEM.NKR.CCR5. Анализ сортировки флуоресцентно-активированных клеток CEM.NKR.CCR5, трансфектированных указанными системами в культуре клеток на 4 и 8 неделе. В клетках анализировали экспрессию CCR5 (по антителу CD 195), экспрессию С46 (по антителу 2F5) и экспрессию усиленного зеленого флуоресцентного белка (EGFP). Экспрессия зеленого флуоресцентного белка (GFP) наблюдается для систем, содержащих EGFP (контроль GFP и sh5/EGFP; части 1,3); снижение экспрессии CCR5 наблюдается для систем, содержащих sh5 (sh5, sh5/EGFP, и sh5/C46; части 2, 3, 5), и экспрессия С46 наблюдается для систем, содержащих С46 (С46 и sh5/C46; части 4,5). Процент положительных клеток представлен в каждом квадранте проточной цитометрии (Q1-Q4). На 4 и 8 неделе наблюдаются аналогичные результаты.
Фигура 7 - стабильность экспрессии в клетках Molt4/CCR5. Анализ сортировки флуоресцентно-активированных клеток Molt4/CCR5, трансфектированных указанными системами в культуре клеток на 4 и 8 неделе. В клетках анализировали экспрессию CCR5 (по антителу CD 195), экспрессию С46 (по антителу 2F5) и экспрессию усиленного зеленого флуоресцентного белка (EGFP). Экспрессия зеленого флуоресцентного белка (GFP) наблюдается для систем, содержащих EGFP (контроль GFP и sh5/EGFP; части 1,3); снижение экспрессии CCR5 наблюдается для систем, содержащих sh5 (sh5, sh5/EGFP, и sh5/C46; части 2,3,5), и экспрессия С46 наблюдается для систем, содержащих С46 (С46 и sh5/C46; части 4,5). Процент положительных клеток представлен в каждом квадранте проточной цитометрии (Q1-Q4). На 4 и 8 неделе наблюдаются аналогичные результаты.
Фигура 8 - характеристики роста трансфектированных клеток CEM.NKR.CCR5. Столбчатая диаграмма, показывающая количество клеток CEM.NKR.CCR5, трансфектированных указанными лентивирусными системами, через 4-7 дней после высевания в указанных концентрациях; представлены 4 независимых случая высевания, пронумерованные по оси Х1-4. Трансдукция с применением различных систем (sh5(2), sh5/EGFP(3), C46(4), sh5/C46(5)) не повлияла на скорость роста клеток в сравнении с нетрансфектированными клетками (1).
Фигура 9 - методы трансдукции в мононуклеарных клетках периферической крови (МКПК). Мононуклеарные клетки периферической крови были трансфектированы лентивирусной системой sh5/EGFP одним из следующих путей: 1X трансдукция с применением среды, содержащей вирус, 2Х трансдукция с применением среды, содержащей вирус, 1X трансдукция с применением предварительно нагрузки среды, содержащей вирус (предварительная нагрузка × 1), 2Х трансдукция с применением предварительно нагрузки среды, содержащей вирус (предварительная нагрузка × 2), и трансдукция с применением концентрированной среды, содержащей вирус. А. Анализ мононуклеарных клеток периферической крови, трансфектированных лентивирусной системой sh5/EGFP с применением указанных способов. В. Итоговый процент EGFP-положительных клеток при применении каждого из способов трансдукции. Результаты показывают, что трансдукция была осуществлена наиболее эффективно при применении концентрированного вируса, затем (по мере убывания эффективности) следуют предварительная нагрузка 2Х, предварительная нагрузка 1X, и суспензии 2Х и 1X; в каждом случае представлены по 2 повторных эксперимента.
Фигура 10 - трансдукция в мононуклеарных клетках периферической крови (МКПК). Анализ сортировки флуоресцентно-активированных мононуклеарных клеток периферической крови, трансфектированных указанными системами, через 4 дня после трансдукции. Экспрессия зеленого флуоресцентного белка (GFP) наблюдается для систем, содержащих EGFP (части 1, 2); подавление CCR5 наблюдается для систем, содержащих sh5 (части 2 и 4), и экспрессия С46 (измеряемая по антителу 2F5) наблюдается для систем, содержащих С46 (части 3, 4). Срединные значения интенсивности флуоресценции составили, слева направо: 16,2; 8,4; 16,8; 9,4.
Фигура 11 - сравнение экспрессии генов в трансфектированных мононуклеарных клетках периферической крови (МКПК) (на 4 день) и трансфектированных клетках CEM.NKR.CCR5 Т (на 8 неделе). Аналогичный характер экспрессии наблюдается в клетках обоих типов. Экспрессия GFP наблюдается для систем, содержащих EGFP (части 1, 2); экспрессия CCR5 снижается в клетках, трансфектированных системами, содержащими sh5 (части 2 и 4), и экспрессия С46 (измеряемая по антителу 2F5) наблюдается для систем, содержащих С46 (части 3, 4).
Фигура 12 - характеристики роста трансфектированных МКПК человека. Общее количество клеток в лунке (часть А) и процент живых клеток (часть В) были аналогичными для МКПК, трансфектированными каждой из указанных систем, и для не трансфектированных МКПК. Представлены по два повторных засева для каждой группы клеток.
Фигура 13 - стабильность трансгенной экспрессии в МКПК. Анализ сортировки флуоресцентно-активированных МКПК, трансфектированных указанными системами через 4, 7 и 12 дней после трансдукции. В клетках анализировали экспрессию GFP, CCR5 и С46 (по антителу 2F5). Экспрессия GFP представлена в частях 1, 3; экспрессия sh5-частях 2, 3 и 5, и экспрессия С46 - в частях 4 и 5.
Фигура 14 - выделение и трансдукция CD34+. Анализ сортировки флуоресцентно-активированных групп мононуклеарных клеток человека до и после отделения клеток CD34+ с помощью магнитного разделения клеток с применением антитела (верхняя часть). Анализ сортировки флуоресцентно-активированных кроветворных стволовых клеток человека CD34+, трансфектированных указанными системами (нижняя часть). Экспрессия GFP представлена в частях 1, 2; экспрессия С46 - в частях 4 и 5.
Фигура 15 - индукция ВИЧ двойным тройным штаммом SF2 в клетках Molt4/CCR5. Клетки Molt4/CCR5 были либо не трансфектированы, либо трансфектированы лентивирусным вектором sh5/C46 и затем пробно заражены ВИЧ - двойным тропным (CCR5 и CXCR4) вирусом SF2 с различной множественностью заражения - 0,2; 0,02 и 0,002. Уровни белка Р24 оценивали через 13 дней после вирусного заражения в качестве меры ВИЧ инфекции.
Фигура 16 - индукция ВИЧ двойным тропным штаммом SF2 в клетках Molt4/CCR5. Клетки Molt4/CCR5 были либо не трансфектированы, либо трансфектированы лентивирусными системами sh5/C46 или С46 и затем пробно заражены ВИЧ - двойным тропным (CCR5 и CXCR4) вирусом SF2 с различной множественностью заражения - 0,2 и 0,02. Уровни белка Р24 оценивали через 11 дней после вирусного заражения в качестве меры ВИЧ инфекции (верхняя часть). Анализ сортировки флуоресцентно-активированных нетрансфектированных клеток Molt4/CCR5 или клеток Molt4/CCR5, трансфектированных лентивирусными системами С46 или sh5/C46, в день вирусного заражения (нижняя часть). Оценивали экспрессию CCR5 и С46 (измеряемую по антителу 2F5).
Фигура 17 - индукция ВИЧ двойным тропным штаммом SF2 в клетках Molt4/CCR5. Клетки Molt4/CCR5 были либо не трансфектированы, либо трансфектированы лентивирусными системами С46 (ген 2) или sh5/C46 (G2R5) и затем пробно заражены ВИЧ - двойным (CCR5 и CXCR4)-тропным вирусом SF2, Bal (CCR5-тропным) или NL4-3 (CXCR4-тропным) вирусом с множественностью заражения 0,2. Уровни белка Р24 оценивали через 11 дней после вирусного заражения в качестве меры ВИЧ инфекции. Нумерация на гистограммах (1-6) соответствует примененным штаммам ВИЧ (условные обозначения указаны справа на фигуре).
Фигура 18 - индукция ВИЧ CCRS-тропным штаммом Bal в клетках Molt4/CCR5. Клетки Molt4/CCR5 были либо не трансфектированы (Molt4), либо трансфектированы одной из следующих четырех лентивирусных систем: sh5 (R5); С46 (G2); sh5/C46 (R5-G2); или sh5/EGFP (R5-GFP). «Смешанная группа» клеток - это смесь нетрансфектированных клеток и клеток, трансфекрированных sh5, С46, sh5/C46, взятых поровну (например, по 25% клеток каждого типа). Затем клетки были заражены ВИЧ - Bal CCR5-тропным вирусом с множественностью заражения 0,2. Уровни белка Р24 оценивали через 7 и 10 дней (первая и вторая гистограмма, соответственно) после вирусного заражения в качестве меры ВИЧ инфекции.
Фигура 19 - индукция ВИЧ в мононуклеарных клетках периферической крови. А. Схема двойной системы sh1005/C46. В. МКПК были трансфектированы одной из следующих четырех лентивирусных систем: sh5/C46 (LVsh5C46); С46 (LVC46); sh5/GFP (LVsh5-GFP); или GFP контроль (LV-GFP). Анализ сортировки флуоресцентно-активированных трансфектированных МКПК через четыре дня после трансдукции. С.Через шестнадцать дней после трансдукции, клетки, представленные в части В, заражали либо CCR5 (R5)-тропным, либо CXCR4 (Х4)-тропным штаммом ВИЧ, и оценивались уровни белка р24 в культуре супернатантов через четыре дня после вирусного заражения.
Фигура 20 - эффективное снижение уровней CCR5 в the NOD SCID-hu BLT мыши. А. Проточная цитометрия. С помощью анализа сортировки флуоресцентно-активированных клеток в лимфоидных органах мышей с восстановленными органами исследовался процент экспрессии CCR5 в клетках EGFP+ (верхняя часть) и mCherry+ (нижняя часть) в Т-клетках CD4+. Представлены репрезентативные данные для мыши через 20 недель после восстановления органа. Thy/Liv: пересаженный органоид, подобный тимусу человека. LPL: лимфоциты собственной пластинки слизистой оболочки кишечника. В. CCRS-тропное ингибирование HIV-1 ex vivo.. Селезеночные макрофаги, выделенные из мыши с пересаженной селезенкой, были активированы фитогемагглютинином (ФГА) в течение 2 дней и интерлейкином И-2 в течение 5 дней, и были удалены клетки CD8+. Клетки рассортировали до более чем 99% чистоты EGFP+ и mCherry+. Рассортированные клетки EGFP+(черные ромбы) и mCherry+ (не закрашенные квадраты) (4×104) инфицировали R5 ВИЧ-1NFNSXSL9 или Х4 ВИЧ-1 ВИЧ-1NL4-3 при множественности заражения 2,5 одновременно по три экземпляра каждого образца. Клетки отмывали 3 раза после инфицирования. Количество оставшихся исходных частиц ВИЧ-1 в супернатанте культуры определяли через 1 час после инфицирования ВИЧ р24 с помощью твердофазного иммуноферментного анализа. Количество продуцированного ВИЧ в супернатанте культуры определяли на 4, 7 и 12 день после инфицирования во время культивирования. С. Селективное преимущество подавленных CCR5 Т-клеток CD4+ in vivo. Мышей с пересаженными кроветворными клетками-предшественниками/стволовыми клетками (ГПСК) инфицировали R5-тропным ВИЧ-1NFNSXSL9 (доза=200 нг р24) через 9 недель после пересадки ГПСК. Кинетику % популяции EGFP+ CD4+Т-клеток (серый столбик) в периферической крови контролировали в течение 8 недель после введения R5-тропного ВИЧ. Процент популяции mCherry+ CD4+ Т-клеток (белый столбик) контролировали в том же животном. Процент EGFP+ и mCherry+ в мышах, инфицированных ВИЧ, сохранялся через 17 недель после пересадки ГПСК (данные не представлены). Представлены репрезентативные данные. D. Селективная поддержка соотношения CD4/CD8 ratio in vivo.. Кинетику соотношения CD4/CD8 в EGFP+ CD45+ Т-клетках (серый столбик) в периферической крови контролировали в течение 8 недель после введения R5-тропного ВИЧ. Соотношение CD4/CD8 в % mCherry+ CD4+ Т-клеток (белый столбик) контролировали в том же животном. Представлено репрезентативное животное. Соотношение CD4/CD8 в клетках EGFP+ и mCherry+ CD45+ сохранялось на уровне выше 1 у мышей, инфицированных ВИЧ, через 17 недель после пересадки ГПСК (данные не представлены).
Фигура 21 - прогнозированное влияние введения трансфектированных sh5/C46 клеток CD34+ и/или CD4+ ВИЧ-положительному пациенту, не получавшему ранее ВААРТ. Прогнозируемая вирусная нагрузка (А) и количество CD4 (В) у пациентов, получивших одну дозу трансфектированных клеток (звездочки), в сравнении с пациентами, не получавшими лечения (треугольники).
Фигура 22 - прогнозированное влияние введения трансфектированных sh5/C46 клеток CD34+ и/или CD4+ ВИЧ-положительному пациенту, регулярно получающему ВААРТ. Прогнозируемая вирусная нагрузка отложена по оси y. На оси x указано, когда принималась антиретровирусная терапия или когда осуществлялось прерывание терапии для анализа. Показаны прогнозированные вирусные нагрузки для пациентов, получивших одну дозу трансфектированных клеток (звездочки), в сравнении с пациентами, не получавшими лечения (треугольники).
Фигура 23 - прогнозированное влияние введения трансфектированных sh5/C46 клеток CD34+ и/или CD4+ ВИЧ-положительному пациенту, которому не помогает ВААРТ. Прогнозируемая вирусная нагрузка (А) и количество CD4 (В) у пациентов, получивших одну дозу трансфектированных клеток (звездочки), в сравнении с пациентами, не получавшими лечения (треугольники).
Фигура 24 - двойная лентивирусная система с направленным действием shRNA на CCR5 и белок TRIMSa. А. Схематично представлены элементы pFGHF-H1-R5-U-TRIM5α. В. Схематично представлено получение тройного вектора pFGHF-H1-R5-U-C46-B-TRIM5α.
Подробное описание изобретения
Настоящее изобретение основывается, частично, на признании того, что терапевтический подход, нацеленный на не-ВИЧ гены и/или белки (т.е. гены и/или белки клеток-хозяев), снижает вероятность появления новых штаммов ВИЧ, резистентных к ингибиторам. В частности, настоящее изобретение предлагает векторы и способы применения таких векторов для профилактики или лечения ВИЧ инфекции, нацеливаясь или используя клеточные белки, влияющие на разные стадии жизненного цикла ВИЧ. Например, в одном из вариантов осуществления этого изобретения предлагается вектор, способный к экспрессии ингибитора вхождения (связывания) вируса и ингибитора вирусного слияния с клеточной мембраной. В другом варианте осуществления этого изобретения, вектор способен к экспрессии ингибитора вхождения вируса в клетку и ингибитора вирусной репликации. Соответственно, настоящее изобретение предлагает экспрессионный вектор, содержащий первую последовательность нуклеиновых кислот, кодирующую ингибитор корецептора ВИЧ, и вторую последовательность нуклеиновых кислот, кодирующую белок, который ингибирует слияние ВИЧ с клеткой-мишенью или репликацию ВИЧ.
В одном варианте осуществления этого изобретения, все три элемента (например, ингибитор корецептора ВИЧ, белок, подавляющие слияние ВИЧ с клеткой-мишенью, и белок, подавляющий репликацию ВИЧ) объединены в одном векторе. Например, в одном из вариантов осуществления этого изобретения, экспрессионный вектор содержит первую, вторую и третью последовательность нуклеиновых кислот, причем первая последовательность нуклеиновых кислот кодирует ингибитор корецептора ВИЧ (например, кшРНК для CCR5 или CXCR4), вторая последовательность нуклеиновых кислот кодирует ингибитор слияния (например, С46), а третья последовательность нуклеиновых кислот кодирует ингибитор репликации ВИЧ (например, белок TRIM5α или производный белок или результат его слияния). В другом варианте осуществления этого изобретения, экспрессионный вектор содержит первую, вторую и третью последовательность нуклеиновых кислот, причем первая последовательность нуклеиновых кислот кодирует первый ингибитор корецептора ВИЧ (например, кшРНК для CCR5), вторая последовательность нуклеиновых кислот кодирует второй ингибитор корецептора ВИЧ (например, кшРНК для CXCR4), а третья последовательность нуклеиновых кислот кодирует ингибитор вирусного слияния ВИЧ с клеткой-мишенью (например, С46).
Используемый в этом описании термин «экспрессионный вектор» или «вектор» означает смесь веществ, которую можно применить для доставки интересующих нуклеиновых кислот вовнутрь клетки таким образом, чтобы они экспрессировались клеткой. Специалистам в данной области известны многочисленные векторы, включая, среди прочего, линейные полинуклеотиды, полинуклеотиды, связанные с ионными или амфифильными соединениями, плазмиды и вирусные векторы. Примеры вирусных векторов включают, среди прочего, аденовирусные векторы, адено-связанные вирусные векторы, ретровирусные векторы (включая лентивирусные векторы) и тому подобное. В одном из вариантов осуществления этого изобретения, экспрессионным вектором является вирусный вектор. Предпочтительно, вирусный вектор является ретровирусным или лентивирусным вектором.
«Ретровирусы» - это вирусы, обладающие геномом РНК, обратно транскрибированным с помощью ретровирусной обратной транскриптазы до копии кДНК, интегрированной в геном клетки-хозяина. Ретровирусные векторы и способы получения ретровирусных векторов известны специалистам. Вкратце, для создания ретровирусного вектора, нуклеиновую кислоту, кодирующую интересующий ген, встраивают в геном вируса в месте определенных вирусных последовательностей для создания репликационно-дефектного вируса. Для получения вирионов, создают пакующую клеточную линию, содержащую гены gag, pol и env, но без длинных концевых повторов и упаковочных компонентов (Mann et al.. Cell, Vol.33: 153-159, 1983). Когда рекомбинантная плазмида, содержащая кДНК вместе с ретровирусными длинными концевыми повторами и упаковывающими последовательностями, вводится в такую линию клеток, упаковывающая последовательность позволяет транскрипту РНК рекомбинантной плазмиды упаковываться в вирусные частицы, которые затем выделяются в культуральную среду. Затем среду, содержащую рекомбинантные ретровирусы, собирают, иногда концентрируют, и используют для передачи генов (см. пример 1).
«Лентивирус» означает род ретровирусов, способных инфицировать делящиеся и неделящиеся клетки. Несколько примеров лентивирусов включают ВИЧ (вирус иммунодефицита человека, включая ВИЧ типа 1 и ВИЧ типа 2); этиологический фактор синдрома приобретенного иммунодефицита человека (СПИД); меди-висна, вызывающий энцефалит (висна) или пневмонию (меди) у овец; вирус артроэнцефалита козлов, вызывающий иммунодефицит, артрит и энцефалопатию у коз; вирус инфекционной анемии у лошадей, вызывающий аутоиммунную гемолитическую анемию и энцефалопатию у лошадей; вирус иммунодефицита кошек (ВИК), вызывающий иммунологическую недостаточность у кошек; вирус бычьего иммунодефицита, вызывающий лимфаденопатию, лимфоцитоз и, возможно, инфекцию центральной нервной системы крупного рогатого скота; и вирус иммунодефицита обезьян (ВИО), вызывающий иммунодефицит и энцефалопатию у человекообразных приматов.
Используемый в этом описании изобретения термин «гибридный вирус» означает вирус, обладающий компонентами от одного или нескольких других вирусных векторов, включая элементы неретровирусных векторов, например, аденовирусные-ретровирусные гибриды. Используемые в этом описании гибридные векторы, имеющие ретровирусный компонент, должны полагаться относящимися к ретровирусам.
«Псевдотипированный» ретровирус - это ретровирусная частица, имеющая оболочечный белок от вируса, отличающегося от вируса, от которого был получен геном РНК. Оболочечный белок может быть от другого ретровируса или от вируса, не относящегося к ретровирусам. Предпочтительным оболочечным белком является белок G вируса везикулярного стоматита. Однако, для исключения возможности заражения человека, вирусы, в качестве альтернативы, могут быть псевдотипированы экотропным оболочечным белком, ограничивающим заражение определенных видов, таких как мыши или птицы. Например, в одном из вариантов осуществления этого изобретения, используется мутантный экотропный оболочечный белок, такой как экотропный оболочечный белок 4.17 (Powell et al. Nature Biotechnology 18(12): 1279-1282 (2000)).
Термин «провирус» используется для обозначения последовательности двухцепочечной ДНК в хромосомах эукариотов, соответствующей геному РНК ретровируса. Провирус может передаваться от одного поколения клеток следующему поколению, не вызывая лизиса или разрушения клетки-хозяина.
Геном лентивируса, как правило, имеет длинный концевой повтор 5', ген gag, ген pol, ген env, добавочные гены (nef, vif, vpr, vpu) и длинный концевой повтор 3'. Длинный концевой повтор вируса разделен на три участка: U3, R и U5. Участок U3 содержит элементы энхансера и промотора. Участок U5 содержит сигналы полиаденилирования. Участок R (повтор (англ.)) разделяет участки U3 и U5, и транскрибированные последовательности участка R находятся у обоих концов 5' и 3' вирусной РНК. См., например, «РНК вирусы: практический подход» (Alan J. Cann, Ed., Oxford University Press, (2000)); O Narayan and Clements (1989) J. Gen. Virology, Vol.70: 1617-1639; Fields et al. (1990) Fundamental Virology Raven Press.; Miyoshi H, Blamer U, Takahashi M, Gage F H, Verma I M. (1998) J Virol., Vol.72 (10):8150 7, и Патент США №6,013,516.
Лентивирусные векторы известны специалистам, включая несколько векторов, которые используются для инфицирования кроветворных клеток-предшественников/стволовых клеток (ГПСК). Такие векторы описаны, например, в следующих публикациях, включенных в это описание изобретения посредством ссылки: Evans et al.. Hum Gene Ther., Vol.10: 1479-1489, 1999; Case et al., Proc Nati Acad Sci USA, Vol.96: 2988-2993, 1999; Uchida et al., Proc Nati Acad Sci USA, Vol.95:11939-11944, 1998; Miyoshi et al., Science, Vol.283: 682-686, 1999; and Sutton et al., J. Virol., Vol.72: 5781-5788, 1998. В одном из вариантов осуществления этого изобретения, экспрессионным вектором является модифицированный лентивирус, который, таким образом, может инфицировать как делящиеся, так и неделящиеся клетки. Такие лентивирусные векторы имеют в своем составе модифицированный лентивирусный геном, содержащий первую последовательность нуклеиновых кислот, кодирующую ингибитор корецептора ВИЧ, и вторую последовательность нуклеиновых кислот, кодирующую белок, подавляющий слияние ВИЧ с клеткой-мишенью или репликацию ВИЧ. Кроме того, модифицированный лентивирусный геном, предпочтительно, не содержит генов лентивирусных белков, необходимых для репликации вируса, что предотвращает нежелательную репликацию, такую как репликацию в клетках-мишенях. Белки, необходимые для репликации модифицированного генома, обеспечиваются, предпочтительно, в трансположении в пакующей клеточной линии во время получения рекомбинантного ретровируса (или, точнее, лентивируса). В одном из вариантов осуществления этого изобретения, пакующей клеточной линией является линия клеток 293Т. Лентивирусный вектор, предпочтительно, содержит последовательности длинных концевых повторов 5' и 3' лентивируса. В одном из вариантов осуществления этого изобретения, вирусная конструкция содержит последовательности R и U5 длинного концевого повтора 5' лентивируса и инактивированного или самоинактивирующегося длинного концевого повтора 3' лентивируса. Последовательности длинных концевых повторов могут быть последовательностями длинных концевых повторов любого лентивируса, включая любые виды или штаммы. Например, длинным концевым повтором могут быть последовательности длинных концевых повторов ВИЧ, вируса иммунодефицита обезьян (ВИО), вируса иммунодефицита кошек (ВИК) или вируса бычьего иммунодефицита. Предпочтительно, последовательностями длинных концевых повторов являются последовательности длинных концевых повторов ВИЧ.
В некоторых вариантах осуществления этого изобретения, лентивирусный вектор содержит инактивированный или самоинактивирующийся длинный концевой повтор 3', т.е. лентивирусный вектор является самоинактивирующимся. «Самоинактивирующийся длинный концевой повтор 3'» является длинным концевым повтором 3', содержащим мутацию, замену или делецию, предотвращающую возбуждение экспрессии гена, регулирующего последующие звенья сигнальных каскадов, последовательностями длинных концевых повторов. Копия участка U3 длинного концевого повтора 3' выступает в качестве матрицы для создания обоих длинных концевых повторов интегрированного провируса. Таким образом, если длинный концевой повтор 3' с инактивирующей делецией или мутацией интегрируется как длинный концевой повтор 5' провируса, транскрипция с длинного концевого повтора 5' не возможна. Это устраняет конкуренцию между вирусным энхансером/промотором и любым внутренним энхансером/промотором. Самоинактивирующиеся длинные концевые повторы 3' описаны, например, в работах: Zufferey et al., J. Virol., Vol.72: 9873-9880, 1998; Miyoshi et al., J. Virol, Vol.72: 8150-8157, 1998; и Iwakuma et al., Virology, Vol.261: 120-132, 1999. Длинный концевой повтор 3' можно сделать самоинактивирующимся любым способом, известным специалистам. В одном из вариантов осуществления этого изобретения, элемент U3 длинного концевого повтора 3' содержит делецию в последовательности энхансера, предпочтительно, в сайтах ТАТА-бокс, Spl и NF-каппа В. Благодаря самоинактивирующемуся длинному концевому повтору 3', провирус, интегрированный в геном клетки-хозяина, будет содержать инактивированный длинный концевой повтор 5'. Вирусные экспрессионные векторы, являющиеся предметом этого изобретения, предпочтительно, не подавляют получение вектора в клетках-продуцентах. В некоторых вариантах осуществления этого изобретения, вирусный экспрессионный вектор, в значительной степени, не обладает токсичностью по отношению к трансфектированным и содержащим соответствующий ген клеткам.
Экспрессионный вектор, являющийся предметом этого изобретения, содержит первую последовательность нуклеиновых кислот, кодирующую ингибитор корецептора ВИЧ. В одном из вариантов осуществления этого изобретения, корецептором ВИЧ является С-С рецептор хемокина 5 (CCR5). CCR5 является первичным корецептором ВИЧ-1 для макрофаготропных штаммов и незаменимым для ВИЧ инфекции. Популяционные генетические исследования показали, что индивидуумы, гомозиготные по дефектному гену CCR5 (например, CCR5Δ32), защищены от ВИЧ инфекции. Интересно отметить, что гетерозиготные индивидуумы, обнаруживающие 50% снижение количества рецепторов CCR5 на клетках, демонстрируют значительно сниженную скорость развития заболевания. Индивидуумы, гомозиготные по аллели CCR5Δ32, оказываются в пределах нормы, за исключением повышенной восприимчивости к энцефалиту, вызываемому вирусом Западного Нила. Ингибитор CCR5 малых молекул маравирок был утвержден Управлением США по пищевым продуктам и лекарствам для применения в лечении людей. Этот ингибитор эффективен в профилактике ВИЧ-1 инфекции, и, хотя отмечались некоторые нежелательные эффекты, ни один из таких эффектов не был результатом блокирования самого CCR5. Как ожидалось, возникает резистентность к ВИЧ-1, хотя, интересно отметить, что основная форма резистентности оказалась вариантами ВИЧ-1, адаптированными к применению занятой лекарством формы CCR5, а не ХСС рецептора хемокина 4 (CXCR4) или других корецепторов. Таким образом, нокдаун CCR5 (например, с помощью миРНК, кшРНК или антисмысловой) может быть более эффективен, чем блокирование доступа. В другом варианте осуществления этого изобретения, целевым корецептором ВИЧ является CXCR4 - основной корецептор для Т-клеточнотропных штаммов.
В некоторых вариантах осуществления этого изобретения, ингибитором корецептора ВИЧ является ингибиторная нуклеиновая кислота. В этом описании изобретения, ингибиторная нуклеиновая кислота включает, среди прочего, малую интерферирующую РНК (миРНК), короткую шпилечную РНК (кшРНК), аптамер, рибозим и антисмысловой олигонуклеотид. Так, в одном из вариантов осуществления этого изобретения, первая последовательность нуклеиновых кислот кодирует ингибиторную нуклеиновую кислоту, воздействующую на корецептор ВИЧ. «Воздействует» означает способность ингибитора связываться и/или сталкиваться с эндогенным транскриптом, кодирующим корецептор ВИЧ. Например, ингибиторная нуклеиновая кислота может иметь последовательность нуклеотидов, существенно комплементарную нуклеиновой кислоте, кодирующей корецептор ВИЧ, так что ингибиторная нуклеиновая кислота связывается с нуклеиновой кислотой, кодирующей корецептор ВИЧ, блокируя, таким образом, экспрессию или начиная разрушение корецепторной нуклеиновой кислоты. Соответственно, в некоторых вариантах осуществления этого изобретения, ингибитор корецептора ВИЧ может снижать экспрессию корецептора ВИЧ, если экспрессионный вектор, кодирующий указанный ингибитор, экспрессируется в клетке хозяина.
«Малая интерферирующая РНК» или «миРНК» - это двухцепочечная молекула, способная подавлять экспрессию гена такой же гомологии. Участок гена или другой гомологичной последовательности нуклеотидов называется «участком-мишенью». В одном из вариантов осуществления этого изобретения, миРНК может быть «шпилечной» РНК или молекулой РНК со структурой «стебель-петля» (кшРНК), содержащей смысловой участок, участок петель и антисмысловой участок, комплементарный смысловому. В других вариантах осуществления этого изобретения, миРНК содержит две разные молекулы РНК, связанные нековалентной связью в двойную спираль.
В некоторых вариантах осуществления этого изобретения, экспрессионный вектор, являющийся предметом этого изобретения, содержит первую последовательность нуклеиновых кислот, кодирующую антисмысловой олигонуклеотид, последовательность которого в значительной степени комплементарна, по крайней мере, части последовательности нуклеиновых кислот, кодирующей корецептор ВИЧ, такой как CCR5 и/или CXCR4. Используемое в этом описании изобретения выражение «в значительной степени комплементарная» означает последовательность, не менее чем на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% комплементарную последовательности целевого полинуклеотида. В одном из вариантов осуществления этого изобретения, антисмысловой олигонуклеотид имеет последовательность, на 100% комплементарную, по крайней мере, части последовательности нуклеиновых кислот, кодирующей CCR5 или CXCR4. Антисмысловой олигонуклеотид может содержать примерно от 15 до 30 нуклеотидов, в некоторых вариантах осуществления этого изобретения - примерно от 19 до 25 нуклеотидов в цепочке.
В других вариантах осуществления этого изобретения, экспрессионный вектор, являющийся предметом этого изобретения, содержит первую последовательность нуклеиновых кислот, кодирующую миРНК или кшРНК. Предпочтительно, миРНК или кшРНК обладает двухцепочечным участком, содержащим последовательность, в значительной степени идентичную или комплементарную части последовательности нуклеиновых кислот, кодирующей корецептор ВИЧ, т.е. не менее чем на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную и комплементарную части последовательности нуклеиновых кислот, кодирующей CCR5 или CXCR4. В одном из вариантов осуществления этого изобретения, миРНК или кшРНК обладает двухцепочечным участком, содержащим последовательность, на 100% идентичную или комплементарную последовательности корецептора ВИЧ (например, CCR5 и/или CXCR4). Двухцепочечный участок миРНК или кшРНК может содержать примерно от 5 до 60 нуклеотидов, предпочтительно, примерно от 10 до 30 нуклеотидов, еще более предпочтительно, примерно от 15 до 25 нуклеотидов, например, 20 нуклеотидов в последовательности. В некоторых вариантах осуществления этого изобретения, первая последовательность нуклеиновых кислот экспрессионного вектора кодирует кшРНК, обладающую структурой «стебель-петля», причем стебельный или двухцепочечный участок является в значительной степени идентичным и комплементарным последовательности CCR5 или CXCR4. Участок петель кшРНК может содержать примерно от 2 до 15 нуклеотидов в последовательности. В определенном варианте осуществления этого изобретения, первая последовательность нуклеиновых кислот кодирует кшРНК, содержащую последовательность 5'-GAGCAAGCUC AGUUUACACC UUGUCCGACG GUGUAAACUG AGCUUGCUCU U-3'(SEQ ID №:1).
Экспрессионный вектор, являющийся предметом этого изобретения, предпочтительно, содержит вторую последовательность нуклеиновых кислот, кодирующую белок, подавляющий слияние ВИЧ с клеткой-мишенью или репликацию ВИЧ. В некоторых вариантах осуществления этого изобретения, белок, подавляющий слияние ВИЧ с клеткой-мишенью, является белком С46. С46 - это прикрепленный к мембране ингибитор слияния, производный от С-терминального повтора последовательности из семи аминокислот ВИЧ gp41, слившегося с шарнирным участком иммуноглобулина человека и трансмембранным доменом CD34. С46 - это мощный ингибитор слияния ВИЧ, определенным образом аналогичный утвержденному Управлением США по пищевым продуктам и лекарствам растворимому лекарству энфувиртиду (Т20), который действует в точке жизненного цикла ВИЧ, отличной от точки присоединения корецептора CCR5. В одном из вариантов осуществления этого изобретения, безопасность С46 изучалась в клиническом испытании первого этапа, в котором пациенты получали вливания аутогенных Т-клеток, трансфектированных ретровирусным вектором С46. Другой аспект этого испытания заключался в том, что пациенты не имели нежелательных эффектов, связанных с генной терапией, и у пациентов не развивались явные иммунные реакции на С46. В одном из вариантов осуществления этого изобретения, вторая последовательность нуклеиновых кислот кодирует белок С46, содержащий последовательность:

В другом варианте осуществления этого изобретения, вторая последовательность нуклеиновых кислот содержит последовательность:

Другие подходящие белки, подавляющие слияние ВИЧ с клеткой-мишенью, которые могут кодироваться второй последовательностью нуклеиновых кислот в экспрессионных векторах, являющихся предметом этого изобретения, включают Т20 и родственные белки, энфувиртид, СР32М и сифувиртид.
В определенных вариантах осуществления этого изобретения, вторая последовательность нуклеиновых кислот кодирует белок, подавляющий репликацию ВИЧ. В некоторых вариантах осуществления этого изобретения, белком, подавляющим репликацию ВИЧ, является белок 5 альфа, содержащий трехсоставный взаимодействующий мотив (TRIM5α), или его производные или результаты слияния. Например, вторая последовательность нуклеиновых кислот может кодировать белок TRIM5α человека, TRIM5α макака-резус, химерный белок TRIM5α или белок слияния TPIM5-циклофилин человека. В одном из вариантов осуществления этого изобретения, вторая последовательность нуклеиновых кислот кодирует белок TRIM5α человека, содержащий последовательность:

В другом варианте осуществления этого изобретения, вторая последовательность нуклеиновых кислот содержит последовательность:

«Химерный TRIM5α» означает белок TRIM5α, содержащий домены или фрагменты белков TRIM5α от двух и большего количества видов. Например, химерный белок TRIM5α может содержать не менее одного домена от белка TRIM5α человека и не менее одного домена от белка TRIM5α макака-резус. В некоторых вариантах осуществления этого изобретения, химерный белок TRIM5α содержит аминотерминальный домен от белка TRIM5α человека и карбокситерминальный домен PRYSPRY от белка TRIM5α макака-резус.
В другом варианте осуществления этого изобретения, вторая последовательность нуклеиновых кислот кодирует белок слияния, содержащий TRIM5α и циклофилин. Например, в одном из вариантов осуществления этого изобретения, белок слияния TPIM5-циклофилин содержит фрагмент аминокислот от 1 до примерно 309 белка TRIM5α человека, присоединенный путем слияния непосредственно к молекуле полной длины циклофилина А человека. В другом варианте осуществления этого изобретения, белок слияния TRIM5-циклофилин содержит фрагмент аминокислот от 1 до примерно 322 белка TRIM5α человека, присоединенный путем слияния непосредственно к молекуле полной длины циклофилина А человека. Еще в другом варианте осуществления этого изобретения, белок слияния TRIM5-циклофилин содержит фрагмент аминокислот от 1 до примерно 331 белка TRIM5α человека, присоединенный путем слияния непосредственно к молекуле полной длины циклофилина А человека. Другие подходящие белки, ингибирующие репликацию ВИЧ, которые могут кодироваться второй последовательностью нуклеиновых кислот, включают, среди прочего, циклофилин, ЕЗ убиквитин, APOBEC3G и антиген 2 стромальных клеток костного мозга (BST-2).
Последовательности нуклеиновых кислот, являющиеся предметом этого изобретения, включают также последовательности нуклеиновых кислот, кодирующие консервативные варианты или функциональные эквиваленты белков, представленных в этом описании изобретения. Используемый в этом описании изобретения термин «консервативный вариант» означает изменения в аминокислотной последовательности белка, которые не влияют нежелательным образом на биологические функции такого белка. Замещение, внедрение или делеция являются нежелательно влияющими на белок, если измененная аминокислотная последовательность мешает или нарушает биологическую функцию, связанную с таким белком. Например, общий заряд, структуру или гидрофобные/гидрофильные свойства белка можно изменить, не влияя нежелательным образом на биологическую активность такого белка. Соответственно, аминокислотная последовательность может быть изменена, например, чтобы сделать белок более гидрофобным или гидрофильным, без нежелательного влияния на биологическую активность такого белка.
Как правило, варианты консервативного замещения или функциональные эквиваленты белков обладают аминокислотной последовательностью, идентичной описанным аминокислотным последовательностям SEQ ID №2 и 4, не менее чем примерно на 55%, не менее чем примерно на 65%, не менее чем примерно на 75%, не менее чем примерно на 80%, не менее чем примерно на 85%, не менее чем примерно на 90%, не менее чем примерно на 95% или не менее чем примерно на 96%-99%. Идентичность или гомология по отношению к таким последовательностям в этом описании изобретения определяется как процент аминокислотных остатков в оцениваемой последовательности, идентичный известным пептидам, после совмещения последовательностей и введения пробелов, при необходимости, для достижения максимальной процентной гомологии, и не учитывая консервативные замещения как отличительные признаки последовательности. N-терминальные, С-терминальные или внутренние расширения, делеции или вставки в пептидную последовательность не должны считаться влияющими на гомологию.
Таким образом, последовательности нуклеиновых кислот экспрессионных векторов, являющихся предметом этого изобретения, могут кодировать консервативные варианты или функциональные эквиваленты последовательностей белков, описанных в этом документе. Предполагаемые варианты также включают варианты, содержащие заданные мутации, полученные путем, например, гомологической рекомбинации, сайт-направленного или ПЦР-мутагенеза, и соответствующие белки других видов животных, включая, среди прочего, белки кролей, крыс, свиней, крупного рогатого скота, овец, лошадей и приматов (кроме человека).
В некоторых вариантах осуществления этого изобретения, экспрессионные векторы, являющиеся предметом этого изобретения, содержат первую последовательность нуклеиновых кислот, кодирующую ингибитор корецептора ВИЧ, которая функционально связана с первым промотором, и вторую последовательность нуклеиновых кислот, кодирующую белок, ингибирующий слияние ВИЧ с клеткой-мишенью или репликацию ВИЧ, которая функционально связана со вторым промотором. В некоторых вариантах осуществления этого изобретения, в которых экспрессионный вектор содержит три последовательности нуклеиновых кислот, каждая из трех последовательностей нуклеиновых кислот может быть функционально связана с отдельным промотором. Например, в одном из вариантов осуществления этого изобретения, первая последовательность нуклеиновых кислот, кодирующая ингибитор корецептора ВИЧ, функционально связана с первым промотором, вторая последовательность нуклеиновых кислот, кодирующая белок, ингибирующий слияние ВИЧ с клеткой-мишенью, функционально связана со вторым промотором, а третья последовательность нуклеиновых кислот, кодирующая белок, ингибирующий репликацию ВИЧ, функционально связана с третьим промотором. В других вариантах осуществления этого изобретения, две из трех последовательностей нуклеиновых кислот транскрибируются с одного промотора (например, первая и вторая последовательность нуклеиновых кислот или вторая и третья последовательность нуклеиновых кислот). В иных вариантах осуществления этого изобретения, все три последовательности нуклеиновых кислот транскрибируются с одного промотора. Все три промотора могут быть одинаковыми или отличаться друг от друга.
Используемое в этом описании изобретения выражение «функционально связанная» или «под транскрипционным контролем» означает, что промотор находится в правильном положении и правильно ориентирован в отношении последовательности нуклеиновых кислот для того, чтобы контролировать инициацию транскрипции РНК-полимеразой и экспрессию нуклеиновой кислоты. Выбранные промоторы, предпочтительно, не содержат исключений промотора, что предотвращает выключение одним промотором другого (других) промотора (промоторов). Первый, второй и третий промоторы могут быть промоторами РНК-полимеразы I (pol I), полимеразы II (pol II) или полимеразы III (pol III). Промоторы могут быть конститутивными промоторами или индуцируемыми промоторами. Индуцируемые промоторы известны специалистам и могут включать тетрациклиновый промотор, металлотионеиновый НА промотор, промотор теплового шока, элементы стероидного/гормонального (щитовидной железы)/ретиноево-кислотного отклика, поздний аденовирусный промотор, и длинный концевой повтор индуцируемого вируса опухоли молочной железы мыши. В одном из вариантов осуществления этого изобретения, промотор содержит, по крайней мере, часть длинного концевого повтора ВИЧ (например, трансактивируемый регуляторный элемент, TAR) и индуцируется ВИЧ инфекцией. В некоторых вариантах осуществления этого изобретения, первый промотор - это промотор РНК-полимеразы III. Промоторы РНК-полимеразы III, подходящие к применению в экспрессионных векторах, являющихся предметом этого изобретения, включают, среди прочего, промотор U6 человека, мышиный промотор U6 и промотор Р1 человека. В одном из вариантов осуществления этого изобретения, первый промотор - это промотор HI РНК-полимеразы III. В других вариантах осуществления этого изобретения, второй промотор - это промотор РНК-полимеразы II. В одном определенном варианте осуществления этого изобретения, второй промотор - это промотор убиквитин С-полимеразы II. В некоторых вариантах осуществления этого изобретения, второй промотор может быть тканеспецифичным промотором. Например, подходящие тканеспецифичные промоторы включают макрофагоспецифичные промоторы (например, MPG-1 и подобные ему) и Т-клеточные промоторы (например, CD4 и подобные ему). В одном из вариантов осуществления этого изобретения, третий промотор - это промотор РНК-полимеразы II. В другом варианте осуществления этого изобретения, третий промотор - это промотор убиквитин С-полимеразы II. В некоторых вариантах осуществления этого изобретения, третий промотор может быть тканеспецифичным промотором. Первый, второй и третий промоторы могут быть комбинацией любых, описанных в этом документе промоторов. В определенных вариантах осуществления этого изобретения, предпочтительными являются промоторы РНК-полимеразы III, в которых последовательность нуклеиновых кислот кодирует молекулу ингибиторной РНК, такой как миРНК или кшРНК. В других вариантах осуществления этого изобретения, предпочтительными являются промоторы РНК-полимеразы II, в который последовательность нуклеиновых кислот кодирует белок.
В вариантах воплощения этого изобретения, в которых ингибитором корецептора ВИЧ является молекула миРНК, для создания молекулы миРНК могут применяться несколько промоторов. Например, в одном из вариантов осуществления этого изобретения, экспрессионный вектор содержит одну молекулу нуклеиновой кислоты, кодирующую смысловую нить молекулы миРНК, а другая молекула нуклеиновой кислоты кодирует антисмысловую нить молекулы миРНК, так что двухцепочечная миРНК образуется после экспрессии этих двух нуклеиновых кислот.В таких вариантах осуществления этого изобретения, экспрессионный вектор может содержать первый промотор полимеразы III (Pol III), функционально связанный с первой нуклеиновой кислотой, кодирующей смысловую нить, и второй промотор Pol III, функционально связанный со второй нуклеиновой кислотой, кодирующей антисмысловую нить. В другом варианте осуществления этого изобретения, экспрессионный вектор содержит первый промотор РНК-полимеразы III, функционально связанный с первой последовательностью нуклеиновых кислот, кодирующей молекулу миРНК, воздействующую на корецептор ВИЧ, и второй промотор РНК-полимеразы III, функционально связанный с той же первой последовательностью нуклеиновых кислот в противоположном направлении, так что экспрессия первой последовательности нуклеиновых кислот от первого промотора РНК-полимеразы III приводит к синтезу смысловой нити молекулы миРНК, а экспрессия первой последовательности нуклеиновых кислот от второго промотора РНК-полимеразы III приводит к синтезу антисмысловой нити молекулы миРНК. После экспрессии первой последовательности нуклеиновых кислот от двух разных промоторов, смысловая и антисмысловая нити гибридизируются с образованием двухцепочечной миРНК.
В одном из вариантов осуществления этого изобретения, первая последовательность нуклеиновых кислот и вторая последовательность нуклеиновых кислот транскрибируются с одного промотора. Например, первая последовательность нуклеиновых кислот и вторая последовательность нуклеиновых кислот функционально связаны с промотором таким образом, что создается единый транскрипт. В другом варианте осуществления этого изобретения, участок внутренней посадки рибосомы (УВПР) расположен слева от второй последовательности нуклеиновых кислот и справа от первой последовательности нуклеиновых кислот. В других вариантах осуществления этого изобретения, в которых экспрессионный вектор содержит три последовательности нуклеиновых кислот, две из трех последовательностей нуклеиновых кислот транскрибируются с одного промотора (например, первая и вторая последовательности нуклеиновых кислот или вторая и третья последовательности нуклеиновых кислот). В других вариантах осуществления этого изобретения, все три последовательности нуклеиновых кислот транскрибируются с одного промотора. Один или несколько элементов УВПР могут находиться слева от второй и/или третьей последовательности нуклеиновых кислот. Например, в одном из вариантов осуществления этого изобретения, первая, вторая и третья последовательности нуклеиновых кислот могут быть функционально связаны с одним промотором, и первый элемент УВПР может располагаться между первой и второй последовательностью нуклеиновых кислот, а второй элемент УВПР может располагаться между второй и третьей последовательностью нуклеиновых кислот. Элементы УВПР обеспечивают эффективную трансляцию полицистронных мРНК. Любые известные специалистам элементы УВПР могут применяться в экспрессионных конструкциях, являющихся предметом этого изобретения.
В определенных вариантах осуществления этого изобретения, первая и вторая последовательности нуклеиновых кислот экспрессируются в разных соотношения, так что экспрессия ингибитора корецептора ВИЧ может быть выше, чем экспрессия ингибитора репликации или слияния ВИЧ. Например, отношение экспрессии первой последовательности нуклеиновых кислот к экспрессии второй последовательности нуклеиновых кислот может быть изменяться от примерно 2:1 до примерно 10:1, предпочтительно, от примерно 5:1 до примерно 10:1, еще более предпочтительно - от примерно 2:1 до примерно 5:1. В одном из вариантов осуществления этого изобретения, отношение экспрессии первой последовательности нуклеиновых кислот к экспрессии второй последовательности нуклеиновых кислот равно примерно 2:1. В вариантах осуществления этого изобретения, в которых экспрессионный вектор содержит три последовательности нуклеиновых кислот, соотношение экспрессии первой, второй и третьей последовательности нуклеиновых кислот можно изменять так, чтобы экспрессия ингибитора корецептора ВИЧ была выше, чем экспрессия ингибиторов репликации и слияния ВИЧ. Например, в вариантах осуществления этого изобретения, в которых первая последовательности нуклеиновых кислот кодирует ингибитор корецептора ВИЧ (например, CCR5 или CXCR4), вторая последовательность нуклеиновых кислот кодирует ингибитор слияния, а третья последовательность нуклеиновых кислот кодирует ингибитор репликации, соотношение экспрессии первой, второй и третьей последовательностей нуклеиновых кислот может изменяться от примерно 2:1:1 до примерно 10:1:1, от примерно 5:1:1 до примерно 10:1:1 или от примерно 2:1:1 до примерно 5:1:1.
Описанные в этом изобретении экспрессионные векторы можно создавать с помощью любых подходящих генно-инженерных методик, хорошо известных специалистам, включая, среди прочего, стандартную методику полимеразной цепной реакции (ПЦР), олигонуклеотидный синтез, ферментативный гидролиз с помощью рестрикционной эндонуклеазы, лигирование, трансформацию, плазмидную очистку и секвенирование ДНК, описанные, например, в следующих книгах: Sambrook et al. (Молекулярное клонирование-Лабораторное руководство (3rd Ed.), Vol.1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., (2000)), Ausubel et al. (Действующие протоколы в молекулярной биологии, Greene Publishing Associates, Inc. and John Wiley & Sons, Inc.), Coffin et al. (Retroviruses. Cold Spring Harbor Laboratory Press, N.Y. (1997)) и "РНК вирусы: практический подход" (Alan J. Cann, Ed., Oxford University Press, (2000)).
В одном из вариантов осуществления этого изобретения, экспрессионным вектором служит вектор FG12, более предпочтительно - лентивирусный вектор FG11F (см. пример 1). В другом варианте осуществления этого изобретения, вторая последовательность нуклеиновых кислот клонируется в два сайта рестрикции (например, BamHI и EcoRI вектора FG11F). В ином варианте осуществления этого изобретения, первая последовательность нуклеиновых кислот расположена между двумя сайтами рестрикции (например, сайтами Xbal/Xhol вектора FG11F). В определенных вариантах осуществления этого изобретения, вирусный экспрессионный вектор также содержит, по крайней мере, еще одну молекулу нуклеиновой кислоты, способную ингибировать инфекцию ВИЧ, выбранную из кшРНК или миРНК, антисмысловой молекулы, рибозима или аптамера, направленного на вирусную последовательность ВИЧ или последовательность хозяина. В других вариантах осуществления этого изобретения, вирусный экспрессионный вектор также содержит одну или большее количество кодирующих белок последовательностей нуклеиновых кислот, представленных в этом описании изобретения. Например, в одном из вариантов осуществления этого изобретения, вирусный экспрессионный вектор также содержит одну или более последовательностей нуклеиновых кислот, кодирующих белки-ингибиторы вирусное слияние ВИЧ или репликацию ВИЧ.
Новые экспрессионные векторы, являющиеся предметом этого изобретения, придают сопротивляемость инфекции несколькими вариантами ВИЧ, если они экспрессируются в клетках хозяина. В одном из вариантов осуществления этого изобретения, новые экспрессионные векторы, экспрессируемые в клетках хозяина, придают сопротивляемость инфекции R5- и Х4-тропными штаммами ВИЧ. В некоторых вариантах осуществления этого изобретения, новые экспрессионные векторы, экспрессируемые в клетках хозяина, придают сопротивляемость инфекции штаммами ВИЧ, резистентными к ВААРТ или терапии маравироком.
Это изобретение предлагает также способ получения вирусного экспрессионного вектора, который, будучи экспрессирован в клетке хозяина, может подавлять связывание ВИЧ с клеткой и предотвращать слияние ВИЧ с клеткой или репликацию ВИЧ. В одном из вариантов осуществления этого изобретения, такой способ заключается в синтезе кДНК гена, экспрессирующего белок, способный предотвращать слияние ВИЧ с клеткой или репликацию ВИЧ; клонировании синтезированной кДНК в участок рестрикции вирусного вектора; и внедрении экспрессионного элемента, способного подавлять экспрессию корецептора ВИЧ, в участок рестрикции вектора. кДНК может быть от любого гена, экспрессирующего любой описанный в этом документе ингибитор слияния белков или репликации. Например, в одном из вариантов осуществления этого изобретения, кДНК - это кДНК С46. В другом варианте осуществления этого изобретения, кДНК - это кДНК TRIM5α или его слияния с циклофилином. Экспрессионным элементом, способным подавлять экспрессию корецептора ВИЧ, является любая представленная в этом описании изобретения ингибиторная молекула РНК, такая как миРНК, кшРНК или антисмысловая РНК, воздействующая на корецептор. В одном из вариантов осуществления этого изобретения, экспрессионным элементом является кшРНК, воздействующая на CCR5. В одном из вариантов осуществления этого изобретения, кшРНК, воздействующая на CCR5, имеет последовательность SEQ ID №1.
Вирусный вектор может быть ретровирусным вектором. В определенных вариантах осуществления этого изобретения, вирусный вектор является лентивирусным вектором, таким как лентивирусный вектор FG11F. В некоторых вариантах осуществления этого изобретения, кДНК гена, кодирующего ингибитор слияния или репликации, клонирована в сайты рестрикции BamHI и EcoRI вектора FG11F. В других вариантах осуществления этого изобретения, экспрессионный элемент, способный подавлять экспрессии корецептора ВИЧ, вставлен между сайтами рестрикции Xbal/Xhol вектора FG11F. Другие лентивирусные векторы и сайты рестрикции, подходящие для применения в описанном способе, известны специалистам в данной области.
Настоящее изобретение также предлагает клетку хозяина, содержащую новые экспрессионные векторы, являющиеся предметом этого изобретения. «Клетка хозяина» и «клетка-мишень» означает клетку, которая подлежит трансформации с применением способов и экспрессионных векторов, являющихся предметом этого изобретения. В некоторых вариантах осуществления этого изобретения, клетки хозяина являются клетками млекопитающих, в которых может быть экспрессирован экспрессионный вектор. Подходящими клетками млекопитающего хозяина являются, не ограничиваясь этим, клетки человека, мыши, клетки приматов, кроме человека (например, клетки макака-резус), клетки-предшественники или стволовые клетки человека, клетки 293, клетки HeLa, 28 клетки D17, клетки Мадин-Дарби почек собак (MDCK), клетки почек новорожденного хомяка (ВНК) и клетки Cf2Th (вилочковой железы собаки). В некоторых вариантах осуществления этого изобретения, клетка хозяина, содержащая экспрессионный вектор, являющийся предметом этого изобретения, представляет собой кроветворную клетку, такую как гематопоэтическую клетку-предшественника/стволовую клетку (например, CD34-позитивную гематопоэтическую клетку-предшественника/стволовую клетку (ГПСК), моноцит, макрофаг, мононуклеарную клетку периферической крови, Т-лимфоцит CD4+, Т-лимфоцит CD8+ или дендритную клетку. В некоторых вариантах осуществления этого изобретения, клеткой хозяина является гематопоэтическая клетка CCR5+. В других вариантах осуществления этого изобретения, клетка хозяина может быть клеткой хозяина от пациента или соответствующая пациенту. В определенных вариантах осуществления этого изобретения, клетка хозяина, трансфектированная экспрессионными векторами, являющимися предметом этого изобретения, обладает сопротивляемостью к инфекции Х4 или R5 -тройными штаммами ВИЧ, включая штаммы, резистентные к ВААРТ.
Методы доставки экспрессионных векторов и нуклеиновых кислот к клеткам известны специалистам и включают, например, вирусную инфекцию, соосаждение кальция фосфатом, электропорацию, микроинъекцию, применение диэтиламиноэтилдекстрана, липофекцию, трансфекцию с помощью реактивов для полиаминной трансфекции, обработку клеток ультразвуком, бомбардировку генов высокоскоростными микрочастицами и трансфекцию с участием рецепторов.
Настоящее изобретение также предлагает фармацевтическую композицию, содержащую новые экспрессионные векторы по этому изобретению. В одном из вариантов осуществления этого изобретения, фармацевтическая композиция содержит эффективное количество, по крайней мере одного из экспрессионных векторов, представленных в этом описании изобретения, и фармацевтически приемлемый носитель. Например, в определенных вариантах осуществления этого изобретения, фармацевтическая композиция содержит эффективное количество экспрессионного вектора и фармацевтически приемлемый носитель, причем такой экспрессионный вектор содержит первую последовательность нуклеиновых кислот, кодирующую ингибитор корецептора ВИЧ, и вторую последовательность нуклеиновых кислот, кодирующую белок, который подавляет слияние ВИЧ с клеткой-мишенью или репликацию ВИЧ, как описано в этом документе.
Выражения «фармацевтически приемлемый» и «фармакологически приемлемый» означают молекулярные субстанции и композиции, не вызывающие нежелательных, аллергических или других нецелевых реакций при назначении животным или человеку. Используемый в этом описании изобретения термин «фармацевтически приемлемый носитель» включает растворители, буферы, растворы, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие всасывание, и тому подобные средства, приемлемые для применения в создании фармацевтических препаратов, таких как фармацевтические препараты, пригодные для лечения людей. Применение таких сред и средств для фармацевтически активных веществ хорошо известно специалистам. За исключением случаев, когда какая-либо традиционная среда или средство несовместимо с экспрессионными векторами, являющимися предметом этого изобретения, традиционные среды и средства могут применяться в терапевтических композициях. Фармацевтические композиции, являющиеся предметом этого изобретения, могут предназначаться для введения различными путями, включая, среди прочего, оральное, назальное, буккальное введение, и подкожную, внутримышечную, внутрибрюшинную или внутривенную инъекцию. В некоторых вариантах осуществления этого изобретения, фармацевтическая композиция может быть приготовлена в виде ректальных суппозиториев. В композиции можно также вводить дополнительные активные ингредиенты, если они не инактивируют векторы или полинуклеотиды, входящие в состав композиций.
Фармацевтические композиции, являющиеся предметом этого изобретения, могут включать классические фармацевтические препараты. В качестве иллюстрации: растворы активных соединений в виде свободных оснований или фармакологически приемлемых солей могут быть приготовлены смешиванием в воде с подходящим поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии можно также приготовить в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. В обычных условиях хранения и применения такие препараты, как правило, содержат консервант для предотвращения роста микроорганизмов.
Фармацевтические формы, пригодные для инъекций, включают, например, стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий непосредственно перед введением. В общем случае, такие препараты являются стерильными и достаточно жидкими для обеспечения возможности введения путем инъекции. Препараты должны быть устойчивыми в условиях изготовления и хранения, и должны быть защищены от загрязнения микроорганизмами, такими как бактерии и грибы. Подходящие растворители или дисперсионные среды могут содержать, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), подходящие их смеси и растительные масла. Надлежащую текучесть можно поддерживать, например, используя покрытия, такие как лецитин, поддержанием необходимого размера частиц в случае дисперсий и применением поверхностно-активных веществ. Действие микроорганизмов можно предотвратить, используя различные антибактериальные и противогрибковые средства, например, парабены, хлорбутанол, фенол, сорбиновую кислоту, тимеросал и т.п. Во многих случаях предпочтительно применять изотонические средства, например, сахара и натрия хлорид. Продолжительного всасывания инъекционных композиций можно добиться применением в таких композициях средств, замедляющих всасывание, например, алюминия моностеарата или желатина.
Стерильные инъекционные растворы можно приготовить введением активных соединений в подходящем количестве в растворитель вместе с любыми другими желаемыми ингредиентами (например, перечисленными выше) с последующей стерилизацией фильтрованием. Как правило, дисперсии готовят введением различных стерилизованных активных ингредиентов в стерильный растворитель, содержащий основную дисперсионную среду и иные желаемые ингредиенты, например, перечисленные выше. В случае стерильных порошков для приготовления инъекционных растворов, предпочтительные способы приготовления включают сушку под вакуумом или лиофилизацию, позволяющую получить порошок активных ингредиентов и любых дополнительных желаемых ингредиентов из предварительно стерилизованного фильтрованием раствора таких ингредиентов.
Композиции, являющиеся предметом этого изобретения, как правило, можно приготовить в нейтральной форме или в форме соли. Фармацевтически приемлемые соли включают, например, соли, полученные посредством добавления кислоты (образованные со свободными аминогруппами белка), соли неорганических кислот (например, соляной или фосфорной кислоты) или органических кислот (например, уксусной, оксалиновой, винной, миндальной кислоты и т.п.). Соли, образованные свободными карбоксильными группами белка, также можно получать с неорганическими основаниями (например, натрием, калием, аммонием, кальцием или гидроксидами трехвалентного железа) или с органическими основаниями (например, изопропиламином, триметиламином, гистидином, прокаином и т.п.).
Настоящее изобретение также предлагает способ лечения и профилактики ВИЧ инфекции у пациентов, требующих такого лечения. Используемые в этом описании изобретения слова «пациент» и «индивидуум» могут включать любое позвоночное, включая, среди прочего, человека и млекопитающих. Однако, предпочтительно, пациентом или индивидуумом является млекопитающее, такое как человек или примат, кроме человека, или млекопитающее, такое как домашнее млекопитающее, например, собака, кот, лошадь и т.п. или сельскохозяйственное млекопитающее, такое как корова, овца, свинья и т.п. Если пациентом является млекопитающее, отличное от человека, это изобретение предлагает способ лечения или профилактики инфекции, родственной ВИЧ (например, инфекции вирусом иммунодефицита обезьян, вирусом иммунодефицита кошек или вирусом иммунодефицита крупного рогатого скота). В предпочтительном варианте осуществления этого изобретения, пациентом является человек.
В одном из вариантов осуществления этого изобретения, способ заключается в назначении пациенту фармацевтической композиции, содержащей экспрессионный вектор, являющийся предметом этого изобретения. Например, в некоторых вариантах осуществления этого изобретения, способ заключается во введении пациенту фармацевтической композиции, содержащей экспрессионный вектор, причем такой экспрессионный вектор содержит первую последовательность нуклеиновых кислот, кодирующую кшРНК, воздействующую на CCR5 (или CXCR4), и вторую последовательность нуклеиновых кислот, кодирующую белок С46, и, в некоторых случаях, такая первая последовательность нуклеиновых кислот функционально связана с первым промотором, а вторая последовательность нуклеиновых кислот функционально связана со вторым промотором так, как описано выше. В других вариантах осуществления этого изобретения, способ заключается во введении пациенту фармацевтической композиции, содержащей экспрессионный вектор, причем такой экспрессионный вектор содержит первую последовательность нуклеиновых кислот, кодирующую кшРНК, воздействующую на CCR5 (или CXCR4), и вторую последовательность нуклеиновых кислот, кодирующую белок TRIM5α или производный белок или белок слияния такого белка, и, в некоторых случаях, такая первая последовательность нуклеиновых кислот функционально связана с первым промотором, а вторая последовательность нуклеиновых кислот функционально связана со вторым промотором так, как описано выше. Еще в других вариантах осуществления этого изобретения, способ заключается во введении пациенту фармацевтической композиции, содержащей экспрессионный вектор, причем такой экспрессионный вектор содержит первую последовательность нуклеиновых кислот, кодирующую ингибитор корецептора ВИЧ (например, кшРНК для CCR5 или CXCR4), и вторую последовательность нуклеиновых кислот, кодирующую ингибитор слияния (например, С46), и третью последовательность нуклеиновых кислот, кодирующую ингибитор репликации ВИЧ (например, белок TRIM5α или производный белок или белок слияния такого белка), и, в некоторых случаях, такая первая, вторая и третья последовательность нуклеиновых кислот функционально связана, соответственно, с первым, вторым и третьим промотором так, как описано выше. В другом варианте осуществления этого изобретения, способ заключается во введении пациенту фармацевтической композиции, содержащей экспрессионный вектор, причем такой экспрессионный вектор содержит первую последовательность нуклеиновых кислот, кодирующую первый ингибитор корецептора ВИЧ (например, кшРНК для CCR5), вторую последовательность нуклеиновых кислот, кодирующую второй ингибитор корецептора ВИЧ (например, кшРНК для CXCR4), и третью последовательность нуклеиновых кислот, кодирующую ингибитор слияния ВИЧ с клеткой-мишенью или репликацию ВИЧ, и, в некоторых случаях, такая первая, вторая и третья последовательность нуклеиновых кислот функционально связана, соответственно, с первым, вторым и третьим промотором так, как описано выше.
В некоторых вариантах осуществления этого изобретения, пациент, которому вводится фармацевтическая композиция, является пациентом из группы риска инфицирования R5- и Х4-тропными штаммами ВИЧ, включая штаммы, резистентные к ВААРТ, и такой риск снижается после введения композиции. В некоторых вариантах осуществления этого изобретения, пациент может быть с отрицательным диагнозом ВИЧ. В других вариантах осуществления этого изобретения, пациент (например, человек) может быть ВИЧ-положительным или никогда ранее не получавшим высокоактивной антриретровирусной терапии (ВААРТ), включающей комбинации нуклеозидных аналогов ингибиторов обратной транскриптазы, ингибиторов протеазы и ненуклеозидных ингибиторов обратной транскриптазы. В некоторых вариантах осуществления этого изобретения, пациент проходит курс ВААРТ. В других вариантах осуществления этого изобретения, пациенту ВААРТ не помогает или не помогала (т.е. ВААРТ оказалась неэффективной в снижении вирусной нагрузки за счет резистентности). Так, в определенных вариантах осуществления этого изобретения, экспрессионный вектор вводят непосредственно пациенту либо профилактически, если у пациента нет диагноза ВИЧ, или для лечения ВИЧ инфицированного пациента.
Экспрессионные векторы, входящие в состав композиций, можно модифицировать так, чтобы они были специфически локализованными у определенных типов клеток, таких как иммунные клетки. В качестве примера: экспрессионный вектор может смешиваться с растворителем, направленно действующим на гены с применением рецепторов, причем такой растворитель, действующий на гены, содержит лиганд, специфичный к рецепторам клеток, и средство, связывающее ДНК. В качестве альтернативы, лиганд, специфичный к рецепторам клеток, может быть присоединен к липосоме, содержащей экспрессионный вектор. Лиганд, специфичный к рецепторам клеток, можно выбрать в зависимости от интересующего типа клеток. Например, в некоторых вариантах осуществления этого изобретения, экспрессионный вектор может быть локализован на клетках CD34+ с помощью лиганда, связывающегося с поверхностным маркером клеток CD34. Специалисты могут выбрать подходящие лиганды, действующие на определенные типы клеток, такие как иммунные клетки (например, моноциты/макрофаги, мононуклеарные клетки периферической крови, Т-лимфоциты CD4+ и Т-лимфоциты CD8+ или дендритные клетки). В определенных вариантах осуществления этого изобретения, в которых экспрессионный вектор является вирусным вектором, вирусный вектор может быть упакован в вирусные частицы, обладающие особенным тропизмом к определенным типам клеток. Например, в одном из вариантов осуществления этого изобретения, вирусный вектор упакован в ретровирусные частицы ВИЧ, что позволяет рекомбинантному ретровирусу инфицировать Т-клетки CD4+ и макрофаги.
Фармацевтические композиции в соответствии с этим описанием изобретения можно вводить пациенту любым обычным способом, если целевая ткань оказывается доступной при применении такого способа. Такими способами может быть оральное, назальное введение или введение за щеку. В качестве альтернативы, вводить композицию можно с помощью внутрикожной, подкожной, внутримышечной, внутрибрюшинной или внутривенной инъекции. В одном из вариантов осуществления этого изобретения, фармацевтическую композицию можно вводить ректально (например, с помощью суппозитория). После приготовления, растворы, предпочтительно, вводятся способом, совместимым с формой дозировки, и в терапевтически эффективных количествах. Препараты могут вводиться в разнообразных формах дозировки, таких как инъекционные растворы, капсулы, выделяющие лекарство, и т.п. Для парентерального введения в водном растворе, например, к такому раствору, как правило, добавляют подходящий буферный раствор, и жидкий разбавитель вначале делают изотоническим, например, с помощью достаточного количества соли или глюкозы. Такие водные растворы могут применяться, например, для внутривенного, внутримышечного, подкожного или внутрибрюшинного введения. Предпочтительно, используются стерильные водные среды, известные специалистам, в частности, в свете этого описания изобретения. В качестве иллюстрации: разовую дозу можно растворить в 1 мл изотонического раствора NaCl и либо добавить к 1000 мл жидкости для подкожного введения, либо ввести в предлагаемое место инфузии (см., например, "Remington's Pharmaceutical Sciences" 15-ое издание, стр.1035-1038 и 1570-1580). Дозы могут несколько изменяться в зависимости от стадии ВИЧ инфекции у пациента, проходящего лечение. Лицо, ответственное за назначение композиции, в любом случае, определит подходящую дозу для конкретного пациента. Кроме того, при введении препаратов человеку, препараты должны отвечать стандартам стерильности, пирогенности, общей безопасности и чистоты, введенным Отделом биологических стандартов Управления США по пищевым продуктам и лекарствам (FDA).
В другом варианте осуществления этого изобретения, настоящее изобретение предлагает способ лечения или профилактики ВИЧ введением пациенту резистентных к ВИЧ кроветворных клеток, полученных путем трансфекции клеток экспрессионным вектором, являющимся предметом этого изобретения. Например, в одном из вариантов осуществления этого изобретения, способ заключается в трансфекции гематопоэтических клеток ex vivo экспрессионным вектором, представленным в этом описании изобретения, и вливании трансфектированных клеток пациенту. Пациенту можно назначить одно или несколько вливаний трансфектированных клеток. В некоторых вариантах осуществления этого изобретения, пациент получает много вливаний трансфектированных клеток с определенной периодичностью, такой как раз в неделю, раз в две недели, раз в месяц, раз в квартал или раз в год. В одном из вариантов осуществления этого изобретения, пациент получает вливание трансфектированных клеток раз в две недели. Кроветворные клетки, подходящие для применения в этом способе, включают, среди прочего, гематопоэтические клетки-предшественники/стволовые клетки (ГПСК), моноциты, макрофаги, мононуклеарные клетки периферической крови, Т-лимфоциты CD4+, Т-лимфоциты CD8+ и дендритные клетки. В одном из вариантов осуществления этого изобретения, гематопоэтическими клетками, используемыми в предлагаемом способе, служат Т-лимфоциты CD4+, Т-лимфоциты CD8+ или моноциты/макрофаги. В предпочтительном варианте осуществления этого изобретения, гематопоэтическими клетками, используемыми в предлагаемом способе, являются ГПСК. Используемые в этом изобретении трансфектированные гематопоэтические клетки включают как сами по себе трансфектированные клетки, так и клетки, производные от трансфектированных клеток (например, клетки, полученные из трансфектированных ГПСК).
Так, в одном определенном варианте осуществления этого изобретения, предлагается способ лечения или профилактики ВИЧ инфекции путем восстановления иммунной системы пациента с помощью резистентных к ВИЧ клеток, полученных из трансфектированных ГПСК. Например, в одном варианте осуществления этого изобретения, способ включает трансфекцию ГПСК экспрессионным вектором, описанным в этом документе, и пересадку указанных трансфектированных ГПСК пациенту, причем такие пересаженные клетки создают гранулоциты, моноциты/макрофаги и лимфоциты, резистентные к инфекции ВИЧ. Гранулоциты, моноциты/макрофаги и лимфоциты проявляют сопротивляемость по отношению к инфекции R5 и Х4-тропными штаммами ВИЧ. В некоторых вариантах осуществления этого изобретения, гранулоциты, моноциты/макрофаги и лимфоциты проявляют сопротивляемость по отношению к инфекции штаммами ВИЧ, резистентными к ВААРТ. Пациент может не иметь диагноза ВИЧ или быть ВИЧ инфицированным. В одном из вариантов осуществления этого изобретения, пациент (человек) ранее не получал высокоактивную антиретровирусную терапию (ВААРТ). В другом варианте осуществления этого изобретения, пациент проходит курс ВААРТ. Еще в другом варианте осуществления этого изобретения, пациенту не помогает или не помогала ВААРТ.
Кроветворные клетки (например, ГПСК, Т-лимфоциты CD4+, Т-лимфоциты CD8+ и/или моноциты/макрофаги), которые должны быть трансфектированы экспрессионным вектором, являющимся предметом этого изобретения, могут быть аллогенными или аутологичными. «Аллогенные клетки» - это клетки, полученные от разных индивидуумов одного и того же вида. Используемое в этом описании изобретения выражение «аутологичные клетки» означает клетки, выделенные из пациента, которые затем повторно пересаживаются или вводятся тому же пациенту. Так аутологичная пересадка означает, что донор и реципиент - это один и тот же пациент. В определенных вариантах осуществления этого изобретения, гематопоэтическими клетками являются аутологичные ГПСК. ГПСК являются, предпочтительно, CD34-положительными, и их можно выделить из костного мозга или периферической крови пациента. Способы такого выделение и очистки клеток известны специалистам (см., например. Патенты США №№4,965,204; 4,714,680; 5,061,620; 5,643,7414 5,677,136; 5,716,827; 5,750,397 и 5,759,793). Например, один способ выделения таких CD34-положительных стволовых клеток включает центрифугирование образцов периферической крови для отделения мононуклеарных клеток и гранулоцитов, с последующей сортировкой флуоресцентно-активированных клеток для отбора клеток CD34+. В одном из вариантов осуществления этого изобретения, клетки обогащаются клетками CD34+ с помощью методики магнитного разделения, такой как обеспечивается компанией Miltenyi Biotec и была ранее описана (Kogler et al. (1998) Bone Marrow Transplant., Vol.21: 233-241; Pasino et al. (2000) Br. J. Haematol., Vol.108: 793-800). CD34-положительные клетки можно мобилизовать из костного мозга в кровь до отбора образцов, сделав пациенту инъекцию одного или нескольких цитокинов, о которых известно, что они мобилизуют кроветворные стволовые клетки, таких как фактор, стимулирующий колониеобразование гранулоцитов, фактор, стимулирующий гранулоциты/макрофаги, и фактор стволовых клеток.
Выделенные CD34-положительные ГПСК (и/или другие кроветворные клетки, упомянутые в этом описании изобретения), предпочтительно, трансфектируют экспрессионным вектором, являющимся предметом этого изобретения. Например, в одном из вариантов осуществления этого изобретения, экспрессионный вектор содержит первую последовательность нуклеиновых кислот, кодирующую ингибитор корецептора ВИЧ, и вторую последовательность нуклеиновых кислот, кодирующую белок, который подавляет слияние ВИЧ с клеткой-мишенью или репликацию ВИЧ, причем, в некоторых случаях, указанная первая последовательность нуклеиновых кислот функционально связана с первым промотором, а указанная вторая последовательность нуклеиновых кислот функционально связана со вторым промотором. В другом варианте осуществления этого изобретения, экспрессионный вектор содержит первую последовательность нуклеиновых кислот, кодирующую ингибитор корецептора ВИЧ, вторую последовательность нуклеиновых кислот, кодирующую ингибитор слияния, и третью последовательность нуклеиновых кислот, кодирующую ингибитор репликации ВИЧ, причем, в некоторых случаях, указанные первая, вторая и третья последовательности нуклеиновых кислот функционально связаны с соответствующим первым, вторым и третьим промотором. В другом варианте осуществления этого изобретения, экспрессионный вектор содержит первую последовательность нуклеиновых кислот, кодирующую первый ингибитор корецептора ВИЧ, вторую последовательность нуклеиновых кислот, кодирующую второй ингибитор корецептора ВИЧ, и третью последовательность нуклеиновых кислот, кодирующую ингибитор вирусного слияния ВИЧ с клеткой-мишенью, или ингибитор репликации ВИЧ, причем, в некоторых случаях, указанные первая, вторая и третья последовательности нуклеиновых кислот функционально связаны с соответствующим первым, вторым и третьим промотором.
В одном из вариантов осуществления этого изобретения, первая последовательность нуклеиновых кислот (или вторая последовательность нуклеиновых кислот в вариантах осуществления этого изобретения, в которых экспрессионный вектор содержит три последовательности нуклеиновых кислот) кодирует миРНК или кшРНК, обладающую двухцепочечным участком, причем двухцепочечный участок содержит последовательность, существенным образом идентичную и комплементарную последовательности CCR5. В другом варианте осуществления этого изобретения, первая последовательность нуклеиновых кислот кодирует кшРНК, воздействующую на CCR5, которая обладает последовательностью SEQ ID №1. В другом варианте осуществления этого изобретения, первая последовательность нуклеиновых кислот кодирует миРНК или кшРНК, обладающую двухцепочечным участком, причем двухцепочечный участок содержит последовательность, существенным образом идентичную и комплементарную последовательности CXCR4. В определенных вариантах осуществления этого изобретения, трансфектированные гематопоэтические клетки (например, ГПСК, Т-лимфоциты CD4+, Т-лимфоциты CD8+ и/или моноциты/макрофаги) или клетки, полученные из них, выделяют сниженные уровни белка - корецептора ВИЧ (например, CCR5 или CXCR4) в сравнении с нетрансфектированными гематопоэтическими клетками. Например, трансфектированные гематопоэтические клетки или клетки, полученные из них, могут экспрессировать на 30%, 40%, 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, или 95% меньше белка-корецептора ВИЧ в сравнении с нетрансфектированными гематопоэтическими клетками. В других вариантах осуществления этого изобретения, гематопоэтические клетки трансфектируют экспрессионным вектором, являющимся предметом этого изобретения, в котором вторая последовательность нуклеиновых кислот (или третья последовательность нуклеиновых кислот в вариантах осуществления этого изобретения, в которых экспрессионный вектор содержит три последовательности нуклеиновых кислот) кодирует белок TRIM5α или производный от него белок или белок его слияния, такой как TRIM5α человека, TRIM5α макака-резус, химерный TRIM5α или белок слияния TPIM5-циклофилин (человека). Еще в других вариантах осуществления этого изобретения, гематопоэтические клетки трансфектируют экспрессионным вектором, являющимся предметом этого изобретения, в котором вторая последовательность нуклеиновых кислот (или третья последовательность нуклеиновых кислот в вариантах осуществления этого изобретения, в которых экспрессионный вектор содержит три последовательности нуклеиновых кислот) кодирует белок С46. В таких вариантах осуществления этого изобретения, трансфектированные гематопоэтические клетки или клетки, полученные из них, экспрессируют повышенные уровни белка (например, С46 или TRIM5α, или его производный белок или продукт слияния) в сравнении с нетрансфектированными гематопоэтическими клетками, т.е. экспрессируют уровни кодируемого белка на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150% или более чем на 200% выше в сравнении с нетрансфектированными гематопоэтическими клетками.
После трансфекции гематопоэтических клеток (например, ГПСК, Т-лимфоцитов CD4+, Т-лимфоцитов CD8+ и/или моноцитов/макрофагов) экспрессионным вектором, являющимся предметом этого изобретения, трансфектированные клетки повторно вводятся или пересаживаются обратно тому же пациенту. Трансфектированные клетки можно вводить пациенту парентерально или повторно вводить любым путем, известным специалистам. В одном из вариантов осуществления этого изобретения, трансфектированные гематопоэтические клетки вводятся пациенту внутривенно. Предпочтительно, пациенту вводится эффективная доза трансфектированных гематопоэтических клеток. «Эффективная доза» - это количество, достаточное для получения полезного или желаемого клинического результата, которое может зависеть от типа примененных гематопоэтических клеток. В одном из вариантов осуществления этого изобретения, гематопоэтической клеткой является ГПСК, а эффективной дозой - количество клеток, достаточное, по крайней мере, для частичного восстановления иммунной системы ВИЧ-резистентными клетками. Указанную дозу можно вводить в один или несколько приемов, и такая доза может составлять примерно от 0,5×106 ГПСК на кг веса пациента примерно до 1×109 ГПСК на кг веса пациента. В другом варианте осуществления этого изобретения, гематопоэтической клеткой является Т-лимфоцит CD4+, Т-лимфоцит CD8+ и/или моноцит/макрофаг, а эффективная доза может быть примерно от 1×109 клеток для одного пациента до 1×1011 клеток для одного пациента. Однако точное определение эффективной дозы может основываться на факторах, индивидуальных для каждого пациента, включая размер, возраст пациента, тяжесть ВИЧ инфекции (например, вирусный титр) и время, прошедшее после заражения вирусом. Специалист, а именно, врач сможет определить количество трансфектированных гематопоэтических клеток, которое могло бы составить эффективную дозу, без излишнего экспериментирования.
Не ограничиваясь определенной теорией, Заявители полагают, что успешная терапия заболевания, обусловленного ВИЧ, стволовыми клетками включает выбор клеток для трансфекции и пересадки. В одном из аспектов этого изобретения, подробные кинетические исследования на ВИЧ-инфицированных пациентах показали, что ВИЧ-1 убивает, а организм пополняет примерно по 109-1010 CD4+ Т-клеток ежедневно. Это соответствует обороту примерно 0,5%-5% популяции CD4+ Т-клеток каждый день, что приводит к расчетному обороту всей популяции CD4+ Т-клеток примерно каждые 2 недели. Поэтому, даже у здоровых ВИЧ-инфицированных пациентов, не получающих лечения, стабильное количество CD4+ Т-клеток маскирует массовую продолжающуюся гибель и пополнение Т-клеток. Т-клетки замещаются из двух источников - размножение существующих периферических Т-клеток и получение новых, ранее не подвергавшихся воздействию Т-клеток, получаемых из вилочковой железы примерно так же, как и получение новых Т-клеток после пересадки ГПСК. Это изобретение предлагает способ восстановления иммунной системы ГПСК с модификацией генов, которые обеспечивают непрерывный источник защищенных Т-клеток и моноцитов/макрофагов. Такие клетки, скорее всего, следует выделять в виду массивного истощения Т-клеток в условиях ВИЧ инфекции.
Концепция применения селективного давления, включающего гибель и регенерацию Т-клеток, для отбора генно-трансфектированных клеток, основывается на прочном фундаменте знаний о гематопоэтической и лимфоидной дифференциации. Эта концепция также была успешно испытана в клинических исследованиях генной терапии в лечении тяжелой комбинированной иммунной недостаточности (ТКИН), связанной с X-хромосомой и ТКИН, связанной с дефицитом аденозиндезаминазы, при которой Т-клетки, содержащие ген, полученные от пересаженных ГПСК, отбираются аналогичным образом, приводя к восстановлению популяции генетически модифицированными Т-клетками.
Недавно проведенное исследование историй болезни подтвердило, что восстановление иммунной системы клетками, защищенными от ВИЧ-1 инфекции, может привести к отбору защищенных клеток, существенному подавлению репликации ВИЧ-1 и благоприятному клиническому течению заболевания. ВИЧ-1-инфицированного пациента, одновременно страдающего острым миелоцитарным лейкозом, лечили пересадкой аллогенных ГПСК, специально отобранных у CCR5Δ32-гомозиготной донора. Следует отметить, что клетки CCR5Δ32-гомозиготной донора полностью заместили клетки реципиента всего за 60 дней, и у пациента не обнаруживался ВИЧ-1 в течение более 200 дней на фоне отсутствия антиретровирусной терапии.
Более подробно это изобретение будет далее проиллюстрировано упоминанием конкретных вариантов его воплощения, описанных в следующих примерах. Приведенные примеры являются чисто иллюстративными, и никоим образом не ограничивают объем этого изобретения.
Примеры
Пример 1. Построение двойного вектора, содержащего кшРНК против CCR5 и ингибитор слияния С46 (двойной вектор sh5/C46), и контрольных векторов с одной лечебной вставкой или без лечебных вставок
А. Конструкции векторных плазмид
Разнообразные конструкции были спроектированы и созданы в ДНК в форме плазмид. Эти конструкции представлены в таблице 1 и на фигурах 1-4. Все эти конструкции приводят к образованию лентивирусных векторов после трансфекции в пакующие клеточные линии (см. раздел В ниже).
Указанные векторы были получены методами генной инженерии следующим образом.
Плазмида остовного лентивирусного вектора pFG12, содержащая усиленный зеленый флуоресцентный белок (EGFP), управляемый убиквитиновым промотором (pFG12-U-EGFP) (обозначен как «pFG12» на фигуре 2), был получен из предыдущего лентивирусного вектора FUGW (Lois et al. (2002) Science, Vol.295: 868-872), как описано в (Qin et al. (2003) Proc. Natl. Acad. Sci., Vol.100: 183-188). Для обеспечения дальнейшей вставки в остовный вектор, был получен плазмидный остов pFGHF введением сайтов множественного клонирования в FG12, что позволило получить pFGHF-U-EGFP (обозначенный как «pG11F» на фигуре 2).
Смешанная библиотека коротких шпилечных РНК (кшРНК), направленных против корецептора химокинов 5 человека (huCCR5) под контролем промотора HI в лентивирусном векторе, была создана путем ферментативного получения библиотек РНК-интерференции из кДНК. Очищенные фрагменты ДНК расщепляли с помощью BpmI, обеспечивали тупые концы с помощью фрагмента Кленова, расщепляли с помощью BamHI и лигировали плазмидной ДНК pBShH1-5, содержащей промотор РНК-полимеразы III человека HI и сигнал терминации 4Т. Смесь для лигирования вводили в культуру Е. coli и оставляли в чашке на ночь. Затем собирали колонии и готовили плазмидную ДНК. Экспрессионные элементы кшРНК, состоящие из промотора H1, последовательности кшРНК и сигнала терминации 4Ts, удаляли из плазмидных ДНК pBShH1-5 путем расщепления с помощью XbaI и XholI и вставляли в сайты XbaI/XholI вектора pFG12-U-EGFP для получения контролируемой промотором HI кшРНК, воздействующей на CCR5. Лучшая из таких конструкций, sh1005, была выбрана для дальнейших экспериментов. Плазмидная конструкция, содержащая sh1005 и контролируемый убиквитиновым промотором усиленный зеленый флуоресцентный белок (EGFP), получила название pFG12-H1-R5-U-EGFP (фигура 3; An et al. (2007) Proc. Natl. Acad. Sci., Vol.104 (32): 13110-13115). Кассета U-EGFP была удалена из pFG12-H1-R5-U-EGFP с помощью рестриктаз с получением pFG12-Hl-R5 (фигура 3).
Ген EGFP был удален из pFGHF-U-EGFP (pFGHF на фигуре 4) и замещен геном С46 с получением pFGHF-U-C46 (фигура 4). Кассета H1-R5 была удалена из pFG12-H1-R5-U-EGFP путем расщепления с помощью NdeI/XhoI и вставлена в pFGHF-U-C46, которая также была расщеплена с помощью NdeI/XhoI, чтобы получить pFGHF-H1-R5-U-C46 (фигура 4).
В. Получение лентивирусного вектора
Весь запас лентивирусных векторов, псевдотипированных белком G вируса везикулярного стоматита (VSV или ВВС) был получен временной кальций-фосфатной трансфекцией Т-клеток НЕК-293. Т-клетки НЕК-293 культивировали стандартным образом в среде Игла, модифицированной по способу Дульбекко (DMEM) (получения GIBCO Invitrogen) и переносили в среду Дульбекко, модифицированную по способу Исков (IMDM) для трансфекции. Все культуры содержали 10% эмбриональной телячьей сыворотки (HyClone), 100 единиц пенициллина и 100 мкг/мл стрептомицина. Клетки совместно трансфектировали подходящими количествами векторной плазмиды, упаковывающими конструкциями pRSV-Rev и pMDLg/pRRE лентивируса ВИЧ-1 и экспрессионной плазмидой pCMV-VSV-G белка G вируса везикулярного стоматита (таблица 2). Вирусы собирали из супернатантов культур на 2 и 3 день после трансфекции и концентрировали. Концентрированный вирусный материал титровали на Т-клетках НЕК-293, исходя из экспрессии зеленого флуоресцентного белка. Титры кшРНК-экспрессионных конструкций усиленного зеленого флуоресцентного белка были лишь немного снижены в сравнении с родительским вектором усиленного зеленого флуоресцентного белка. Плазмиды, примененные для получения, схематично представлены на фигуре 5.
Способ 1: Получение лентивируса кальций-хлоридной трансфекцией с применением реактивов, не входящих в набор
1. НЕК 293Т-клетки высеваются в количестве 1,5×107 клеток на флакон Т 175 в среде DMEM+10% эмбриональной телячьей сыворотки с антибиотиками в день перед трансфекцией.
2. В день трансфекции среду меняют на 25 мл IMDM+10% эмбриональной телячьей сыворотки с антибиотиками и хлорохином (100 мкл 10 мМ раствора).
3. Готовят мастер-микс ДНК
a. pMDLg/pRRE: 10 мкг
b. pRSV-Rev: 2,5 мкг
с. pCMV-VSV-G: 3,2 мкг
d. вектор (например, одна из конструкций, представленных на фигурах 1-4): 10 мкг
е. Воду добавляют до общего объема 980 мкл
4. Добавляют 133 мкл 2М CaCl2, перемешивают и инкубируют на льду в течение 10 минут.
5. По каплям добавляют 1110 мкл 2×HBS (1 г Hepes (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота), 1,6 г NaCl, 0,72 мл 0,25 М Na2HPO4, 1 мл 1М KCl), встряхивая пробирку в руке.
6. Инкубируют на льду в течение 20 минут.
7. Флакон Т 175 с клетками переворачивают, смесь ДНК добавляют в среду, флакон перемешивают 2-3 раза и флакон переворачивают в исходное положение.
8. Культуру инкубируют 6-8 часов.
9. Среду удаляют и заменяют свежей средой (42 мл) IMDM+10% эмбриональной телячьей сыворотки с антибиотиками.
10. Через 48 часов после трансдукции среду собирают и отфильтровывают сквозь фильтр с размером пор 0,22 или 0,45 мкм, и заменяют свежей средой (42 мл) IMDM+10% эмбриональной телячьей сыворотки с антибиотиками.
11. Через 72 часа после трансдукции среду собирают и отфильтровывают сквозь фильтр с размером пор 0,22 или 0,45 мкм.
12. Оба сбора объединяют.
13. Среду, содержащую вирус, концентрируют ультрацентрифугированием в пробирках SW28 или SW32.
а. 33-38 мл среды, содержащей вирус, поместили в пробирки с градиентом сахарозы.
b. Пробирки центрифугируют при 20000 об./мин, 4°С в течение 90 минут.
с. Удаляют супернатант и к осадку добавляют 250-500 мкл физиологического раствора с фосфатным буфером или HBS.
d. Оставляют среду, содержащую вирус, на ночь при 4°С.
е. Среду, содержащую вирус, перемешивают, отбирая и выливая порции пипеткой, делят на порции и хранят при -70°С.
Способ 2: Получение лентивируса кальций-хлоридной трансфекцией с применением набора реактивов Clontech CalPhos
1. НЕК 293Т-клетки высеваются в количестве 2,1×107 клеток на флакон Т225 в 30 мл среды IMDM+10% эмбриональной телячьей сыворотки в день перед трансфекцией.
2. В день трансфекции готовят мастер-микс ДНК в пробирках емкостью 15 мл:
a. pMDLg/pRRE 13 мкг
b. pRSV-Rev 3,25 мкг
c. pCMV-VSV-G 4,16 мкг
d. вектор (например, одна из конструкций, представленных на фигурах 1-4) 13 мкг
е. Воду добавляют до общего объема 1500 мкл
3. Добавляют 186 мкл 2М CaCl2 и перемешивают.
4. По каплям добавляют 1500 мкл 2×HBS, вращая пробирку в руке.
5. Инкубируют на льду в течение 20 минут.
6. В пробирку емкостью 50 мл добавляют 30 мл среды IMDM+2% эмбриональной телячьей сыворотки.
7. К среде IMDM в пробирке емкостью 50 мл добавляют раствор ДНК.
8. Среду отсасывают от клеток, собранных в предыдущий день.
9. Раствор ДНК/IMDM осторожно выливают во флакон так, чтобы не нарушить монослой клеток.
10. Флакон осторожно качают из стороны в сторону, чтобы покрыть клетки смесью.
11. Культуру инкубируют в течение 4 часов.
12. Среду удаляют, клетки промывают физиологическим раствором с фосфатным буфером и добавляют свежую среду IMDM с 2% эмбриональной телячьей сыворотки (30 мл).
13. Через 24 часа после трансдукции среду собирают и заменяют свежей средой (30 мл) IMDM+2% эмбриональной телячьей сыворотки.
14. Собранную среду, содержащую вирус, фильтруют сквозь фильтр с размером пор 0,22 мкм и оставляют на ночь при 4°С.
15. Через 48 часов после трансдукции среду собирают и фильтруют сквозь фильтр с размером пор 0,22 мкм.
16. Оба сбора среды, содержащей вирус, объединяют и делят на порции для хранения при -70°С.
17. При необходимости, среду, содержащую вирус, концентрируют с помощью колонок Vivaspin 20 (Sartorius):
а. Готовят колонку Vivaspin 20 MWCO 100 000, добавляя 10 мл 70% этанола.
b. Центрифугируют при 1000 g в течение 10 минут.
с. Удаляют оставшийся этанол и добавляют 15 мл физиологического раствора с фосфатным буфером или HBS.
d. Центрифугируют при 1000 g в течение 10 минут.
е. Оставшийся физиологический раствор с фосфатным буфером удаляют и добавляют 18 мл среды, содержащей вирус.
f. Центрифугируют при 1000 g в течение 30 минут или до тех пор, пока среда, содержащая вирус, не пройдет сквозь колонку.
Средой, содержащей вирус, полученной одним из указанных способов (разбавленной или концентрированной), трансфектировали клетки-мишени (линии Т-клеток, мононуклеарные клетки периферической крови (МКПК), гематопоэтические клетки-предшественники/стволовые клетки (ГПСК) CD34+), и трансфектированные клетки анализировали методом проточной цитометрии на экспрессию усиленного зеленого флуоресцентного белка (EGFP), экспрессию CCR5 (путем окрашивания антител CD 195) и экспрессию С46 (путем окрашивания антител 2F5).
Пример 2. Трансфекция линий Т-клеток-мишеней (человека) двойным вектором sh5/C46.
Различные лентивирусные векторы, описанные в примере 1, применялись для инфицирования клеток CEM.NKR.CCR5 и Molt4/CCR5 (Программа реактивов для СПИД Национального Института Здоровья (NIH AIDS Reagent Program)). Получали суспензию 2×105 клеток в 1 мл неконцентрированной среды, содержащей вирус с 10% эмбриональной телячьей сыворотки и 8 мкг/мл полибрена. Культуры инкубировали при 37°С в течение 1,5 часа и затем добавляли еще 1 мл питательной среды (RPMI-раствор + 10% эмбриональной телячьей сыворотки). Клетки анализировали методом сортировки флуоресцентно-активированных клеток (FACS-анализ) через 4 дня после трансфекции для определения экспрессии С46 (путем окрашивания антитела 2F5), нокдауна CCR5 (путем окрашивания антитела CD 195) и экспрессии зеленого флуоресцентного белка. Клетки хранили в непрерывной культуре в течение периода до 8 недель, пересевая дважды в неделю.
Одновременная экспрессия кшРНК (определяемая по нокдауну CCR5) и С46 в трансфектированных клетках CEM.NKR.CCR5 и Molt4/CCR5 представлена на фигуре 6 и фигуре 7, соответственно. Экспрессия зеленого флуоресцентного белка (GFP) наблюдалась в конструкциях, содержащих усиленный зеленый флуоресцентный белок (EGFP) (панели 1, 3 - слева направо); снижение экспрессии CCR5 (например, подавление CCR5, демонстрирующее экспрессию кшРНК) наблюдалось для конструкций, содержащих sh5 (панели 2, 3, 5 - слева направо), и экспрессия С46 (измеряемая по антителу 2F5) наблюдалась для конструкций, содержащих С46 (панели 4, 5 - слева направо). Процент положительных клеток представлен в каждом квадранте проточной цитометрии (Q1-Q4) для каждой группы клеток, трансфектированных указанными лентивирусными векторами, на 4 и 8 неделе культивирования. Аналогичные уровни экспрессии наблюдались на 4 и 8 неделе. Значения средней интенсивности флуоресценции для фигуры 6 представлены в таблице 3 ниже, а значения средней интенсивности флуоресценции для фигуры 7 - в таблице 4.
Для определения того, вызвали ли трансгены какие-либо отличия в параметрах роста клеток, клетки CEM.NKR.CCR5, каждая из которых демонстрировала 100% экспрессию трансгенной конструкции, высевали в количестве 2×104 клеток/мл, культивировали 4 дня и подсчитывали. Затем клетки высевали из этой популяции четыре (отдельных) раза в течение 3-недельного периода в концентрации 1 или 2×105/мл и подсчитывали через 4-7 дней после высевания. В клетках, трансфектированных различными конструкциями, не наблюдались отличия в скорости роста (фигура 8).
Результаты этих экспериментов показывают, что как CCR5, связанный с кшРНК, так и белок С46 могут быть экспрессированы в достаточном количестве с одного и того же вектора в линиях Т-клеток человека, и экспрессия CCR5 кшРНК и С46 не влияет на скорость роста клеток.
Пример 3. Трансфекция мононуклеарных клеток периферической крови человека (МКПК) двойным вектором Sh5/C46.
Различные лентивирусные векторы, описанные в примере 1, применялись для инфицирования мононуклеарных клеток периферической крови человека (МКПК), полученных у Службы переливания крови Красного креста Австралии. МКПК выделяли из лейкоцитарных пленок с помощью среды фиколл-пак ПЛЮС (Ficoll-Paque PLUS (GE Healthcare)) с последующим отделением CD8 с помощью микрогранул CD8+(Miltenyi Biotec) и магнитного блока VarioMACS. МКПК после элиминации CD8+культивировали 48 часов в среде RPMI 1640, содержащей 20% эмбриональной телячьей сыворотки и 5 мкг/мл фитогемагглютинина (ФГА) (Sigma) в начальной концентрации 2×106 клеток/мл. После 2 дней стимуляции ФГА, суспензию клеток собирали, центрифугировали при 200g в течение 5 минут, повторно суспендировали в количестве 2×106 клеток/мл в среде RPMI + 20% эмбриональной телячьей сыворотки + 10 Ед./мд рекомбинантного интерлейкина-2 человека (rhIL-2; Roche) в течение 4 часов перед трансдукцией.
Для выбора предпочтительного способа трансдукции, МКПК были трансфектированы лентивирусной конструкцией sh5/EGFP в разных условиях: 1X трансдукция с применением среды, содержащей вирус; 2Х трансдукция с применением среды, содержащей вирус; 1X трансдукция с применением предварительной нагрузки средой, содержащей вирус (предварительная нагрузка 1); и 2Х трансдукция с применением предварительной нагрузки средой, содержащей вирус (предварительная нагрузка 2), и с применением примерно 20-кратно концентрированной среды, содержащей вирус (см. пример 1, часть В). Как показано на фигуре 9, трансдукция была осуществлена наиболее эффективно при применении концентрированного вируса. Разовая трансдукция с предварительной нагрузкой средой, содержащей вирус (предварительная нагрузка 1), была выбрана как предпочтительный способ трансдукции для дальнейших экспериментов. Значения средней интенсивности флуоресценции для фигуры 9 представлены в таблице 5 ниже.
МКПК либо оставляли нетрансфектированными, либо трансфектировали (IX с предварительной нагрузкой) одной из лентивирусных конструкций sh5/GFP, C46, sh5/C46, GFP-контроль или sh5 в соответствии со следующей процедурой. Помещали 1 мл МКПК на планшеты с 24 лунками (5 мкг/см2), покрытые ретронектином, которые предварительно (за 6 часов) нагружали 250 мкл неконцентрированной среды, содержащей вирус, и оставляли культивироваться на ночь. На следующий день клетки переносили в 6-луночные планшеты в 3 мл среды RPMI + 20% эмбриональной телячьей сыворотки + 10 Ед./мд рекомбинантного интерлейкина-2 человека (rhIL-2). Клетки анализировали на экспрессию EGFP, CCR5 и С46 через 4 дня после трансдукции. Результаты представлены на фигурах 10-13.
Как показано на фигуре 10, экспрессия EGFP, CCR5 и С46 в МКПК на 4 день после трансдукции была такой, как и ожидалась для различных конструкций. Экспрессия усиленного зеленого флуоресцентного белка (EGFP) наблюдалась для систем, содержащих EGFP (GFP-контроль и sh5/GFP, панели 1, 2); снижение экспрессии CCR5 (демонстрирующее экспрессию CCR5 кшРНК) наблюдалось для конструкций, содержащих sh5 (sh5/EGFP и sh5/C46, панели 2 и 4), и экспрессия С46 (измеряемая по антителу 2F5) наблюдалась для конструкций, содержащих С46 (С46 и sh5/C46; панели 3, 4). Срединные значения интенсивности флуоресценции составили, слева направо на фигуре 10: 16,2; 8,4; 16,8; 9,4.
На фигуре 11 представлено сравнение экспрессии генов в трансфектированных МКПК (на 4 день) и Т-клетках линии CEM.NKR.CCR5 (на 8 неделе). Экспрессия EGFP наблюдалась для систем, содержащих EGFP (GFP-контроль и sh5/GFP, панели 1, 2); подавление экспрессии CCR5 наблюдалось в клетках, трансфектированных конструкциями, содержащими sh5 (sh5/EGFP и sh5/C46, панели 2 и 4), и экспрессия С46 (измеряемая по антителу 2F5) наблюдалась в клетках, трансфектированных конструкциями, содержащими С46 (С46 и sh5/C46; панели 3, 4). Хотя достаточные уровни экспрессии наблюдались в клетках обоих типов после трансдукции лентивирусных конструкций, более высокая экспрессии наблюдалась в Т-клетках в сравнении с МКПК. Значения средней интенсивности флуоресценции для фигуры 11 представлены в таблице 6 ниже.
Кроме того, сравнивались скорости роста генно-трансфектированных (sh5, sh5/EGFP, С46, sh5/C46) и нетрансфектированных МКПК в 1, 4, 8 и 12 день после трансдукции. Применялись по два одинаковых засева каждой группы клеток. Общее количество клеток в лунке и процент живых клеток были примерно одинаковыми для всех трансфектированных МКПК в сравнении друг с другом и с нетрансфектированными клетками (фигура 12).
Испытывали также устойчивость трансгенной экспрессии в МКПК. На фигуре 13 представлена экспрессия EGFP, CCR5 и С46 (по антителу 2F5) в клетках, трансфектированных указанными конструкциями, через 4, 7 и 12 дней после трансдукции. Жизнеспособность клеток на 12 день была неопределенной, и поэтому, сравнивали только 4 и 7 день. Как видно на фигуре 13, наблюдалась экспрессия различных трансгенов в оба указанных момента времени с очевидным снижением со временем, что, вероятно, связано со снижением роста и жизнеспособности с течением времени (см. фигуру 12). Значения средней интенсивности флуоресценции для фигуры 13 представлены в таблице 7 ниже.
Эти результаты показывают, что как CCR5, связанный с кшРНК, так и белок С46 могут быть экспрессированы в достаточном количестве с одного и того же вектора в мононуклеарных клетках периферической крови человека.
Пример 4. Трансфекция гематопоэтических клеток-предшественников/стволовых клеток человека (ГПСК) двойным вектором Sh5/C46.
Лентивирусный вектор (ЛВ) Sh5/C46 применялся для трансфекции гематопоэтических клеток-предшественников/стволовых клеток человека (ГПСК), полученных из массы мононуклеарных клеток донорской периферической крови. Донорам вводили колониестимулирующий фактор гранулоцитов (Г-КСФ) для мобилизации ГПСК и мононуклеарных клеток периферической крови. После инъекции Г-КСФ, клетки собирали с помощью афереза, и массу мононуклеарных клеток, содержащую мобилизованные ГПСК, замораживали. Образец мононуклеарных клеток, примененный в этом примере, получили из такого запаса замороженных клеток. Мешок для сбора стволовых клеток емкостью 50 мл, содержавший во время замораживания 3.7×107 CD34+ГПСК, размораживали. При размораживании обнаружилось, что мешок содержал of 33,6×108 живых клеток (73% жизнеспособность) и конечное количество клеток CD34+ГПСК, выделенных методом разделения популяций клеток с помощью магнитно-активированных антител (торговая марка - MACS), составило -3,3×107, т.е. -1% от общего количества мононуклеарных клеток с 98% положительным отделением клеток CD34 (см. анализ до и после разделения на верхней панели фигуры 14).
Такие клетки затем применялись в следующем экспериментальном протоколе:
1. 6×106 клеток предварительно стимулировали в течение 24 часов ex vivo в средах, не содержащих сыворотки, и содержащих фактор стволовых клеток (ФСК), тромбопоэтин (ТПО) и лиганд Flt3 (Flt3L) (каждый - в концентрации 50 нг/мл).
2. Порции по 4×105 клеток переносили на 12-луночный планшет, предварительно нагруженный в течение 6 часов средой, содержащей вирус.Клетки трансфектировали в течение ночи (GFP-контролем, sh5, sh5/EGFP, C46 или sh5/C46) или оставляли нетрансфектированными, и затем переносили в свежие среды на 72 часа.
3. Проведенная через 72 часа после трансдукции сортировка флуоресцентно-активированных клеток показала 25-30%-ную трансфекцию зеленым флуоресцентным белком (GFP) (фигура 14, нижняя панель). В этом примере C46 невозможно было определить окрашиванием антитела 2F5, очевидно, из-за недостаточной чувствительности проточной цитометрии для определения таких клеток. Оставшиеся клетки поместили в метилцеллюлозную среду CAMEO-4 (Hemogenix) и повторно разместили на планшете по 100 клеток в лунке. Подсчет колоний не обнаружил достоверных отличий между культурами на 11 день (таблица 8).
Пример 5. Линии Т-клеток, трансфектированные sh5/C46, подавляют репликацию ВИЧ
Линии Т-клеток (Molt4/CCR5), трансфектированные двойной лентивирусной конструкцией sh5/C46 (см. описание вектора в примере 1), пробно заражали различными штаммами ВИЧ: HIVeal (CCR5-тропным), HIVSF2 (СХСК4-тропным) и HIVsp2 (CCR- и CXCR4-тропным). Для приготовления образцов пробного заражения, 1×106трансфектированных клеток Molt4/CCR5 помещали в пробирки емкостью 15 мл и центрифугировали. Супернатант отставляли. Среду, содержащую ВИЧ, добавляли до достижения окончательной концентрации в каждой пробирке при множественности заражения 0,2-0,002. Затем в каждую пробирку добавляли полибрен до концентрации 8 мкг/мл, и каждую пробирку осторожно встряхивали. Клетки с вирусом инкубировали 2 часа при 37°С с осторожным встряхиванием через каждые 30 минут. После 2 часов инкубации, клетки промывали средой (RPMI+10% эмбриональной телячьей сыворотки) и повторно суспендировали в 3-4 мл среды во флаконах Т25. Образцы клеток отбирали, и клетки подпитывали через каждые 3-4 дня до 11 дня. Отделяли по две порции по 150 мкл супернатанта, и хранили при 4°С. Уровни белка Р24 (мера ВИЧ инфекции) анализировали в соответствии с протоколом изготовителя, как правило, используя разведение 1/105-/106 для обеспечения попадания значений на калибровочную кривую.
Фигура 15 показывает уровни белка р24 от нетрансфектированных клеток и клеток, трансфектированных двойной лентивирусной конструкцией sh5/C46 через 13 дней после пробного заражения штамма SF2 ВИЧ двойной тропности (CCR5- и CXCR40 тропный штамм). Результаты показывают, что клетки, трансфектированные конструкцией sh5/C46, обнаруживают примерно второй порядок подавления при всех трех значениях множественности заражения (0,2; 0,02 и 0,002) в каждом из 2 независимых наборов образцов в сравнении с нетрансфектированными клетками. Фигура 16 показывает уровни белка р24 от нетрансфектированных клеток и клеток, трансфектированных либо sh5/C46, либо лентивирусной конструкцией С46, через 11 дней после пробного заражения штаммом ВИЧ SF2 двойной тропности. Данные показывает примерно второй порядок подавления конструкцией sh5/C46 в каждом из 2 независимых наборов образцов и третий порядок подавления конструкцией С46 (очевидно, из-за большей экспрессии С46 в этой конструкции) при обоих испытанных значениях множественности заражения. Нижняя панель на фигуре 16 показывает экспрессию, определенную методом проточной цитометрии. Средние значения интенсивности флуоресценции представлены в таблице 9 ниже.
В отдельном эксперименте, клетки Molt4/CCR5 либо оставляли нетрансфектированными, либо трансфектировали лентивирусными конструкциями С46 (Ген 2) или sh5/C46 (G2R5) и затем пробно заражали вирусом HIV-SF2 (CCR5- и CXCR4-тропным), Bal (ССР5-тропным) или NL4-3 (СХСР4-тропным) при множественности заражения 0,2. Уровни белка р24 определяли через 11 дней после пробного заражения вирусом как меру ВИЧ инфекции. Как показано на фигуре 17, клетки, экспрессирующие обе лентивирусные конструкции, эффективно снижали уровень инфекции всеми тремя штаммами ВИЧ. Фигура 18 представляет уровни белка р24 от нетрансфектированных клеток (Molt4) или клеток, трансфектированных одной из четырех лентивирусных конструкций [(1) sh5 (R5); (2) С46 (G2); (3) sh5/C46 (R5-G2); (4) sh5/EGFP (R5-GFP)], через 7 и 10 дней после пробного заражения CCR5-тропным штаммом Bal ВИЧ при множественности заражения 0,2. «Смешанная» группа представляла собой смесь равных количеств (т.е. по 25% каждого вида) нетрансфектированных клеток и клеток, трансфектированных sh5, С46 или sh5/C46. Результаты показывают, что клетки, экспрессирующие кшРНК в ответ на CCR5 и ген С46 от одной лентивирусой конструкции (двойной конструкции), обеспечивают повышенную защиту от инфекции CCR5-тропным штаммом ВИЧ как через 7, так и через 10 дней после пробного заражения вирусом.
Результаты этой серии экспериментов показывают, что Т-клетки, трансфектированные двойной лентивирусной конструкцией sh5/C46, обеспечивают защиту от инфицирования штаммами CCR5, CXCR4, CCR5 (двойной тропности) и CXCR4 ВИЧ.
Пример 6. Мононуклеарные клетки периферической крови, трансфектированные двойным вектором sh5/C46, подавляют репликацию ВИЧ
Мононуклеарные клетки периферической крови (МКПК), стимулированные фитогемагглютинином (ФГА)/интерлейкином-2 (ИЛ2), трансфектировали лентивирусными векторами так, как описано в примере 3. Схематически, двойная конструкция, экспрессирующая кшРНК в ответ на CCR5 и белок С46 (ЛВ: LVsh5C46), представлена на фигуре 19А. Через четыре дня после трансдукции, клетки окрашивали подходящим моноклональным антителом (например, антителом CD195 или 2F5) и анализировали экспрессию CCR5, С46 и зеленого флуоресцентного белка (GFP) методом проточной цитометрии (фигура 19В). МКПК, трансфектированные лентивирусом, пробно заражали R5- или Х4-тропными штаммами ВИЧ через 16 дней после лентивирусной трансдукции. Супернатанты над культурами собирали через четыре дня после заражения ВИЧ и количественно определяли белок р24 методом твердофазного иммуноферментного анализа (ELISA) (фигура 19С).
Как показано на фигуре 19С, МКПК, трансфектированные лентивирусным вектором sh5/C46, обнаруживают снижение ВИЧ инфекции обоими штаммами (R5-тропным и Х4-тропным), оцениваемой по уровням белка р24. МКПК, трансфектированные конструкцией sh5/GFP, проявляют сопротивляемость инфекции R5-тропным, но не Х4-тропным штаммом ВИЧ. Эти результаты показывают, что двойной вектор sh5/C46 может защитить от ВИЧ инфекции, вызванной как R5-тропным, так и Х4-тропным штаммом.
Пример 7. Вектор sh5 подавляет экспрессию CCR5 в лимфоидных органах и влияет на предпочтительную выживаемость трансфектированных Т-лимфоцитов CD4+ex vivo
Трансфектированные лентифирусом sh5 гематопоэтические клетки-предшественники/стволовые клетки (ГПСК) CD34+, загущенные белковой смесью Matrigel в комбинации с участком вилочковой железы, были имплантированы под почечную капсулу гуманизированной (по костному мозгу/печени/тимусу) мышиной модели (мышиная модель BLT) (см. Melkus et al. (2006) Nat Med, Vol.12: 1316-1322; Shimizu et al. (2010) Blood, Vol.115: 1534-1544). Гуманизированные мыши NOD/SCID-hu BLT (т.е. не страдающие ожирением мыши с диабетом (NOD) и тяжелой комбинированной иммунной недостаточностью (SCID), которым под почечную капсулу пересадили эмбриональную печень (L) и вилочковую железу (Т) человека, а спустя три недели облучили и ввели (инъекцию) суспензии клеток CD34+от того же образца эмбриональной печени человека, которые высеялись в костный мозг (В) мышей) позволяют изучать дифференциацию трансфектированных ГПСК человека в органоидах, подобных тимусу человека (тимус/печень), и миграцию дифференцированных Т-лимфоцитов человека в системные лимфоидные органы, включая связанную с кишечником лимфоидную ткань - основное место репликации ВИЧ.
Для изучения sh1005 (кшРНК, воздействующей на CCR5) в этой гуманизированной мышиной модели, трансфектированные вектором клетки CD34+, полученные из печени, и клетки CD34+, загущенные белковой смесью Matrigel в комбинации с участком вилочковой железы, были пересажены под почечную капсулу для создания трансфектированной вектором тимусо/печеночной ткани. Три недели спустя, трансфектированные вектором аутологичные клетки CD34+ГПСК (1×106 клеток) вводили в хвостовую вену мыши, получившей сублетальную дозу излучения. Для оценки влияния снижения экспрессии CCR5 в животном, совместно пересадили смесь равных количеств (5×105) клеток CD34+ГПСК, трансфектированных вектором sh1005 (EGFP+) и контрольным вектором, не содержащим кшРНК (mCherry+). Такая схема эксперимента позволяет узнать, отличаются ли клетки, трансфектированные вектором sh1005, от клеток, трансфектированных вектором, не содержащим кшРНК, по уровню стабильности и специфичности снижения экспрессии CCR5; оба вектора присутствовали в одном и том же животном для учета различий между мышами. Ни EGFP, ни mCherry, каждый сам по себе, не влияли на кинетику восстановления популяции или экспрессию CCR5 (данные не представлены).
Приживление человеческих клеток изучалось через 11 недель после инъекции CD34+. Человеческие лимфоидные клетки CD45+ обнаруживались в популяции лимфоцитов, дающих сигнал выше порогового уровня, в периферической крови мыши после пересадки клеток методом проточной цитометрии (среднее значение - 44%, стандартное отклонение ±28, n=19). Экспрессию EGFP и mCherry обнаружили в популяции человеческих клеток CD45+ в мышах после трансплантации (среднее значение для EGFP 22%, стандартное отклонение ±19, среднее значение для mCherry 22%, стандартное отклонение 13; n=16). Нокдаун CCR5 в человеческих Т-лимфоцитах CD4+ и CD45+ в различных лимфоидных тканях животных с пересаженными клетками изучался на 14-20 неделе после пересадки CD34+ГПСК (фигура 20А). Экспрессия CCR5 эффективно снижалась в EGFP+Т-лимфоцитах CD4+and CD45+ человека во всех проанализированных тканях. Следует отметить, что подавление CCR5 было эффективным, даже в лимфоцитах собственной пластинки (слизистой кишечника), выделенных из кишечника, которые обычно эскпрессируют большие количества CCR5. Экспрессия CCR5 не снижалась в клетках mCherry+ человеческие CD4+/CD45+ Т-лимфоциты того же животного. Эти результаты показывают, что экспрессия CCR5-кшРНК не влияет на дифференциацию и миграцию Т-лимфоцитов человека и эффективно подавляет экспрессию CCR5 в системных лимфоидных органах in vivo.
Для исследования чувствительности к ВИЧ клеток с подавлением экспрессии CCR5, EGFP+ и mCherry+ спленоциты выделяли из животных методом сортировки клеток. Отсортированные клетки (по три образца) инфицировали либо R5-тропным HIV-1NFNSXSL9, либо Х4-тропным HIV-1NL4-3 при множественности заражения 2,5. В культуре супернатанта над EGFP+ спленоцитами не наблюдалось увеличение получения капсидного белка р24 ВИЧ gag в течение 12-дневного культивирования (фигура 20 В). В отличие от этого, mCherry+ спленоциты были восприимчивы к R5-тропному HIV-1NFNSXSL9, и производили приблизительно в 4 раза более высокие уровни булка р24 в супернантах над культурами на 7 и 12 день (Р=0,003), указывая на то, что подавление CCR5 эффективно подавляет инфекцию, вызванную R5-тропным ВИЧ-1. В отличие от инфекции R5-тропным ВИЧ-1, инфекция Х4-тропным HIV-1NL4-3 приводит к получению сравнимых количеств белка р24 в обоих супернатантах культур EGFP+ и mCherry+ спленоцитов, подтверждая специфичность подавления (Р=0,23). Эти результаты показывают, что подавление CCR5 вектором sh1005 было достаточным для защиты ex vivo стимулированных клеток от пробного заражения R5-тропным, но не Х4-тропным штаммом ВИЧ-1.
Для исследования чувствительности к ВИЧ in vivo и селективной защиты и выживаемости CD4+Т-клеток с подавлением экспрессии CCR5, R5-тропный ВИЧ-1 NFNSXSL9 вводили внутривенно (р24=200 нг) мышам с пересаженными клетками на 9 неделе после трансплантации ГПСК. ВИЧ инфекция у мышей подтверждалась наличием белка р24 в супернатанте культуры клеток периферической крови с активированными ФГА/ИЛ2 человеческими МКПК на 8 неделе после инъекции ВИЧ. Изучалась кинетика CD4+ Т-клеток, экспрессирующих EGFP и mCherry, в периферической крови (фигура 20С). Процент EGFP+ популяции в CD4+ Т-клетках в периферической крови увеличился от 20% до 40% к 8 неделе после инъекции ВИЧ животным. В отличие от этого, mCherry+ популяция в CD4+ Т-клетках снизилась у животных с 40% до 3%. Отношение CD4/CD8 в EGFP+ лимфоцитах сохранилось на уровне выше 1 к 8 неделе после пробного заражения ВИЧ в периферической крови (фигура 20D). В отличие от этого, отношение CD4/CD8 в mCherry+ CD45+ клетках изменилось до 0,1. Эти результаты показывают устойчивое подавление CCR5 вектором sh1005, которое оказывается достаточным для предпочтительного увеличения количества CD4+ Т-клеток после пробного заражения R5-тропным штаммом ВИЧ in vivo.
Пример 8. Испытание двойного вектора sh5/C46 на гуманизированной мышиной модели.
Двойной лентивирусный вектор sh5/C46 испытывался на гуманизированной BLT-мышиной модели так же, как описано в примере 7 для вектора sh5 (Shimizu et al. (2010) Blood, Vol.115: 1534-1544). Для изучения двойного вектора sh5/C46 в этой гуманизированной мышиной модели, трансфектированные вектором CD34+ клетки, полученные из эмбриональной печени, и CD34-клетки, загущенные белковой смесью Matrigel в комбинации с участком вилочковой железы, были пересажены под почечную капсулу для создания трансфектированной вектором тимусо/печеночной ткани. Три недели спустя, трансфектированные вектором аутологичные клетки CD34+ГПСК (1×106клеток) вводили в хвостовую вену мыши, получившей сублетальную дозу излучения. Для оценки влияния снижения CCR5 и экспрессии С46 в животном, совместно пересадили смесь равных количеств (5×105) клеток CD34+ГПСК, трансфектированных вектором sh5/C46 (EGFP+) и контрольным вектором, не содержащим кшРНК и С46 (mCherry+). Другие контрольные векторы, такие как моновектор sh5, содержащий другой флуоресцентный белок (например, желтый флуоресцентный белок, YFP), и моновектор С46, содержащий еще другой флуоресцентный белок (например, голубой флуоресцентный белок, CFP), также применялись для трансфекции CD34+ГПСК и присутствовали в смеси для трансплантации. Такая схема эксперимента позволяет узнать, отличаются ли клетки, трансфектированные различными конструкциями, по уровню стабильности и специфичности снижения CCR5 и экспрессии С46; все векторы присутствовали в одном и том же животном для учета различий между мышами.
Трансфектированные контрольным вектором (mCherry+) и активным вектором sh5/C46 (EGFP+) клетки сравнивали во времени с применением проточной цитометрии и ПЦР в масштабе реального времени. Сравнивали клетки, трансфектированные двойным вектором sh5/C46, и клетки, трансфектированные одним из моновекторов (sh5 или С46). Чувствительность к ВИЧ инфекции определяли, вводя штаммы R5, Х4, или штамм ВИЧ двойной тропности внутривенно животным после трансплантации ГПСК. Оценивали процент CD4+ Т-клеток и отношение CD4/CD8 Т-клеток в каждой трансфектированной вектором популяции клеток для выяснения влияния нокдауна CCR5 и экспрессии С46 на выживаемость CD4+ Т-клеток.
Пример 9. Применение двойных конструкций для пациентов (людей) с ВИЧ
Двойную лентивирусную конструкцию, включая двойной вектор sh5/C46, двойной вектор sh5/TRIM5α или двойной вектор sh5/TRIM5α-циклофилин, вводят в аутологичные клетки человека и затем предоставляют пациенту. Двойная лентивирусная конструкция вводится в один или несколько из следующих типов клеток: CD34+ГПСК клетки, CD4+ Т-клетки, CD8+ Т-клетки, моноциты/макрофаги, выделенные из тканей пациента, которому они затем повторно пересаживаются (например, аутологичные клетки). В качестве альтернативы, используются клетки другого человека (аллогенные клетки). В качестве альтернативы, используется тройной вектор, описанный в этом описании изобретения.
Анализируя тропизм ВИЧ следует отметить, что многие пациенты имеют вирус R5, меньшая часть - вирус Х4, и промежуточное количество - смешанную популяцию вирусов. Двойная конструкция, описанная в этом документе, может воздействовать как на вирус R5, так и на вирус Х4, и может быть полезной для пациентов со смешанной популяцией клеток, а также, может предотвращать развитие резистентности у пациентов с популяцией одного вируса. Такие конструкции могут быть полезны для пациентов с вирусом, резистентным к ВААРТ.
Клетки для трансфекции получают от пациента, вводя один или несколько цитокинов, которые мобилизуют ГПСК и другие клетки, и соответствующие популяции клеток отделяют для лентивирусной трансфекции. Трансфектированные клетки вводят внутривенно тому же пациенту или другому пациенту для лечения или профилактики ВИЧ инфекции. Одна или несколько доз или вливаний трансфектированных клеток используются так, как описано в этом документе.
Схема клинического испытания основывается на учете клинического состояния пациента, предыдущего лечения и/или резистентности к лечению. В испытание включены различные группы пациентов. Например, одна группа пациентов еще не получала высокоактивной антиретровирусной терапии (ВААРТ). Как правило, такие пациенты являются довольно здоровыми (несмотря на их фоновую ВИЧ инфекцию), и критерии отбора для получения терапии гематопоэтическими клетками, трансфектированными двойным лентивирусом, могут включать пациентов с относительно быстрым снижением уровня CD4 в анамнезе, высокой вирусной нагрузкой и/или ранними симптомами. На фигуре 21 представлена ожидаемая реакция на лечение в такой группе пациентов. Клетки, Трансфектированные двойным лентивирусом, вводятся пациенту в момент времени 0. Фигуры 21А и 21В представляют прогноз вирусной нагрузки и количества CD4 у пациентов, получивших одно вливание трансфектированных клеток (звездочки), в сравнении с пациентами, не получавшими клетки, Трансфектированные двойным лентивирусом (треугольники). Ожидается, что у пациентов, не получавших лечения, сохранится высокая вирусная нагрузка и будет продолжаться снижение количества CD4 со временем. Напротив, ожидается, что пациенты, получавшие лечение клетками, трансфектированными двойным лентивирусом, обнаружат снижение вирусной нагрузки со временем и увеличение количества CD4 (после возможного небольшого начального снижения из-за афереза). Таким образом, такое лечение может отложить потребность в ВААРТ и/или снизить необходимость продолжения уже начатой ВААРТ.
Второй подгруппой пациентов являются ВИЧ-положительные пациенты, состояние которых хорошо контролируется ВААРТ. На фигуре 22 представлена ожидаемая реакция на одно вливание клеток, трансфектированных двойным лентивирусом, в такой группе пациентов. Представлена прогнозируемая вирусная нагрузка для пациента, получившего одну дозу трансфектированных клеток (звездочка), в сравнении с нелеченным пациентом (треугольник). Клетки, трансфектированные двойным лентивирусом, вводятся пациенту в момент времени 0. ВААРТ прерывают в два разные момента времени, например, в течение 24-28 недель и 40-48 недель, причем пациент не получает ВААРТ, если вирусная нагрузка остается ниже заданного предельного безопасного уровня (например, 100К копий/мл). Прерывание ВААРТ необходимо для того, чтобы обеспечить период, в течение которого можно обеспечить индуцированное ВИЧ предпочтительное выживание клеток, защищенных двойной лентивирусной конструкцией, и связанное с этим снижение вирусной нагрузки. Первичным анализируемым параметром является вирусная нагрузка на 48 неделе, однако можно также измерять площадь под кривой вирусной нагрузки на 40-48 неделе и 40-100 неделе. Прогнозируемая вирусная нагрузки в долгосрочной перспективе снижается для обеих групп пациентов, как получавших, так и не получавших терапию трансфектированными двойным лентивирусным вектором клетками (хотя такое снижение происходит медленнее в группа пациентов, не получавших вливания клеток, трансфектированных двойным лентивирусом), так как пациенты возвращаются к ВААРТ (при необходимости). Такое лечение может снизить потребность в ВААРТ и связанные с ней осложнения.
Третья группа состояла из пациентов, которым ВААРТ не помогала из-за резистентности к лекарствам, входящим в состав ВААРТ, несоблюдения пациентами режима лечения или по иным причинам. На фигуре 23 представлена вирусная нагрузка (фигура 23А) и прогнозируемое количество CD4 (фигура 23В), ожидаемые для каждого такого пациента. После вливания трансфектированных двойным лентивирусом клеток в день 0, ожидается, что вирусная нагрузка снизится, а количество CD4 увеличится (звездочка) в сравнении с данными для нелеченного пациента, для которого вирусная нагрузка ожидается на том же или большем уровне, а количество CD4 ожидается снижающимся во времени (треугольник).
Целевыми анализируемыми параметрами для всех групп пациентов служат вирусная нагрузка, количество CD4, время до возобновления/начала ВААРТ, процент трансфектированных клеток и TRECs (устойчивый побочный продукт ДНК, образующийся при реаранжировке гена Т-рецептора в процессе развития Т-клеток в тимусе) и снижение потребности в ВААРТ.
Пример 10. Создание двойного вектора, содержащего кшРНК против CCR5 и TRIM5α (двойной вектор sh5/TRIM5α)
Двойной лентивирусный вектор, содержащий кшРНК, воздействующую на CCR5 под контролем промотора HI, и нуклеиновую кислоту, кодирующую белок TRIM5α под контролем убиквитинового промотора, создается с применением остовных векторов, описанных в примере 1. Например, кассета U-EGFP удаляется из pFG12-H1-R5-U-EGFP, плазмидной конструкции, содержащей sh1005 и управляемый убиквитиновым промотором усиленный зеленый флуоресцентный белок (EGFP) (см. фигуру 3), с помощью рестриктаз для получения pFG12-H1-R5.
Ген EGFP удаляется из pFG11F-U-EGFP (pFG11F на фигуре 4) и заменяется геном TRIM5α (SEQ ID NO:5) для получения pFGHF-U-TRIM5α. Кассета H1-R5 удаляется из pFG12-H1-R5-U-EGFP путем расщепления с помощью NdeI/XhoI и также вставляется в pFGHF-U-TRIM5α. который также подвергается расщеплению с помощью NdeI/XhoI, с получением pFGHF-H1-R5-U-TRIM5α (фигура 24А). Эта конструкция используется для создания лентивируса так, как описано в разделе В примера 1.
Пример 11. Создание тройного вектора, содержащего кшРНК против CCR5, С46 и TRIM5α (тройной вектор sh5/C46/TRIM5α)
Тройной вектор получают из двойного вектора pFGHF-H1-R5-U-C46 клонированием β-актинового промотра TRIM5α в сайт множественного клонирования так, как представлено на фигуре 24В.
Все публикации, патенты и патентные заявки, обсуждаемые и цитируемые в этом описании изобретения, полностью включены в него посредством ссылки. Само собой разумеется, что описанное изобретение не ограничивается определенной описанной методологией, протоколами и материалами, так как они могут меняться. Также, само собой разумеется, что примененная в этом описании изобретения терминология используется для описания определенных вариантов воплощения этого изобретения и не предполагает ограничение объема этого изобретения; объем этого изобретения ограничивается только представленной формулой изобретения.
Специалисты знают или могут найти, используя лишь стандартную экспериментальную технику, много эквивалентов конкретным вариантам воплощения этого изобретения. Такие эквиваленты также предполагаются входящими в объем приведенной ниже формулы изобретения.
Реферат
Изобретение относится к области биотехнологии, генной инженерии и вирусологии. Описан экспрессионный вектор для предотвращения или подавления вхождения, слияния или репликации ВИЧ в клетках млекопитающих. Рекомбинантный ретровирусный вектор кодирует ингибитор корецептора ВИЧ, такой как CCR5 или CXCR4, и белок, ингибирующий слияние ВИЧ с клеткой-мишенью или репликацию ВИЧ. Описаны также фармацевтические композиции, содержащие такие конструкции, и способы их применения для профилактики или лечения ВИЧ инфекции у пациентов. Предложенная группа изобретений может быть использована в медицине. 9 н. и 48 з.п. ф-лы, 24 ил., 9 табл., 11 пр.
Формула
синтез кДНК гена, экспрессирующего белок, способный предотвращать слияние ВИЧ с клеткой или репликацию ВИЧ;
клонирование синтезированной кДНК в рестрикционный сайт у вирусного вектора; и
введение молекулы нуклеиновой кислоты, способной подавлять экспрессию корецептора ВИЧ, в рестрикционный сайт у вектора.

Комментарии