Генетическая модификация крыс - RU2690352C2
Код документа: RU2690352C2
Чертежи




















Описание
ОБЛАСТЬ ТЕХНИКИ
Плюрипотентные, тотипотентные и эмбриональные стволовые (ЭС) клетки, не относящиеся к человеку, в частности крысиные плюрипотентные, тотипотентные и/или крысиные ЭС клетки и способы их получения. Предлагаются способы получения плюрипотентных, тотипотентных и ЭС клеток крыс. Предлагаются способы нацеливания плюрипотентных, тотипотентных и ЭС клеток крыс. Предлагаются способы достижения трансмиссии через зародышевую линию генетической модификации в клетку крысы. Предлагаются среды для получения, выращивания и поддержания плюрипотентных, тотипотентных и ЭС клеток крыс.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДСТАВЛЕННЫЙ В ВИДЕ ТЕКСТОВОГО ФАЙЛА ЧЕРЕЗ EFS-WEB
Официальная копия перечня последовательностей представлена одновременно со спецификацией в виде текстового файла через EFS-Web в соответствии с Американским стандартным кодом для обмена информацией (ASCII), с названием файла 441914seqlist.txt, датой создания 20 февраля 2014 г. и размером 2 килобайта. Перечень последовательностей, поданный с помощью EFS-Web, является частью спецификации и включен в данное описание в полном объеме посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Крыса является важной моделью для многих видов применения, включая, но не ограничиваясь этим, применение в разработке лекарственных средств. Практическая значимость крыс была несколько уменьшена из-за сложностей в получении генетически модифицированных крыс, в частности, в разработке способов генетической модификации крыс и создании пригодных для применения крысиных клеток, которые могут быть использованы в протоколах генетических модификаций, включая, но не ограничиваясь этим, протоколы, которые приводят к трансмиссии через зародышевую линию генетической модификации в геном крыс.
В данной области техники существует необходимость в крысиных клетках (например, эмбриональных стволовых клетках), которые могут быть генетически модифицированы таким образом, что генетическую модификацию можно передавать через зародышевую линию. В данной области техники существует необходимость в улучшении частоты трансмиссии через зародышевую линию генетических модификаций у крыс.
В данной области техники существует необходимость в донорских крысиных плюрипотентных, тотипотентных и ЭС клетках от разных линий крыс, способных производить потомство F0, или полностью полученных из донорских клеток крыс F0. В данной области техники существует необходимость в донорских крысиных плюрипотентных, тотипотентных и ЭС клетках, способных производить крыс, имеющих генетическую модификацию зародышевой линии.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предлагаются композиции и способы получения крысиных плюрипотентных и/или тотипотентных клеток, в том числе крысиных эмбриональных стволовых (ЭС) клеток. Предлагаются композиции и способы повышения эффективности или частоты трансмиссии через зародышевую линию генетических модификаций у крыс. В различных аспектах способы и композиции включают in vitro культуру, которая содержит питающий клеточный слой и популяцию крысиных ЭС клеток или линию крысиных ЭС клеток, причем условия культивирования in vitro позволяют поддерживать плюрипотентность крысиной ЭС клетки. Дополнительно предлагаются различные способы создания крысиных ЭС клеточных линий. Также предлагается способ отбора генетически модифицированных крысиных ЭС клеток наряду с различными способами создания трансгенных крыс из генетически модифицированных крысиных ЭС клеток, представленными в настоящем документе. Дополнительно предлагаются различные наборы и изделия.
Неограничивающие варианты реализации настоящего изобретения следующие:
1. Выделенная крысиная ЭС клетка из линии, выбранной из ACI или DA, где выделенная крысиная ЭС клетка способна передавать свой геном через зародышевую линию.
2. Выделенная крысиная ЭС клетка в соответствии с вариантом реализации настоящего изобретения 1, отличающаяся тем, что указанная клетка получена от крысы линии ACI.
3. Выделенная крысиная ЭС клетка в соответствии с вариантом реализации настоящего изобретения 1 или 2, отличающаяся тем, что указанная клетка получена от крысы линии Dark Agouti (DA).2.
4. Выделенная крысиная ЭС клетка в соответствии с вариантом реализации настоящего изобретения 1, 2 или 3, отличающаяся тем, что указанная клетка является эуплоидной и способна передавать целевую генетическую модификацию через зародышевую линию.
5. Выделенная крысиная ЭС клетка в соответствии с вариантом реализации настоящего изобретения 4, отличающаяся тем, что крысиная ЭС клетка имеет эффективность трансмиссии через зародышевую линию целевой генетической модификации по меньшей мере 3%.
6. Выделенная крысиная ЭС клетка в соответствии с вариантом реализации настоящего изобретения 4, отличающаяся тем, что крысиная ЭС клетка имеет эффективность трансмиссии через зародышевую линию целевой генетической модификации по меньшей мере 60%.
7. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-6, отличающаяся тем, что крысиная ЭС клетка демонстрирует целевую эффективность гомологичной рекомбинации по меньшей мере 2%.
8. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-8, отличающаяся тем, что крысиная ЭС клетка способна к передаче целевой генетической модификации потомству после очередного цикла электропорации.
9. Выделенные крысиные ЭС клетки в соответствии с любым из вариантов реализации настоящего изобретения 1-8, отличающиеся тем, что крысиная ЭС клетка содержит одну или более, две или более или три или более целевых генетических модификаций.
10. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 4-9, отличающаяся тем, что целевая генетическая модификация представляет собой инсерцию, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
11. Выделенная крысиная ЭС клетка в соответствии с вариантом реализации настоящего изобретения 9, отличающаяся тем, что целевая генетическая модификация представляет собой по меньшей мере одну инсерцию гетерологичного полинуклеотида в геном клетки.
12. Выделенная крысиная ЭС клетка в соответствии с вариантом реализации настоящего изобретения 11, отличающаяся тем, что гетерологичный полинуклеотид содержит селективный маркер.
13. Выделенная крысиная ЭС клетка в соответствии с вариантом реализации настоящего изобретения 12, отличающаяся тем, что (a) селективный маркер содержит неослабленный ген селективного маркера, функционально связанный с промотором; или (b) крысиная ЭС клетка содержит по меньшей мере 2 копии полинуклеотида, кодирующего селективный маркер.
14. Выделенная крысиная ЭС клетка в соответствии с вариантом реализации настоящего изобретения 12, отличающаяся тем, что селективный маркер имеет повышенную активность по сравнению с селективным маркером дикого типа.
15. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-14, отличающаяся тем, что крысиная ЭС клетка образует сфероподобную колонию при посеве на питающий клеточный слой в культуре, содержащей полипептид LIF, ингибитор GSK3 и ингибитор MEK.
16. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-15, отличающаяся тем, что крысиная ЭС клетка, при культивации in vitro, свободно прикрепляются к питающему клеточному слою.
17. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-16, отличающаяся тем, что для поддержания плюрипотентности указанной клетки нет необходимости в паракринной сигнализации LIF.
18. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-17, отличающаяся тем, что указанная клетка представляет собой мужскую (XY) крысиную ЭС клетку.
19. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-19, отличающаяся тем, что указанная клетка представляет собой женскую (XX) крысиную ЭС клетку.
20. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-19, отличающаяся тем, что крысиную ЭС клетку можно пересевать до по меньшей мере 11 раз в среде, содержащей ингибитор GSK3 и ингибитор MEK, без снижения ее целевой эффективности или эффективности трансмиссии через зародышевую линию целевой генетической модификации.
21. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-20, отличающаяся тем, что крысиные ЭС клетки экспрессируют по меньшей мере один маркер плюрипотентности, выбранный из Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, LIF-рецептора, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинации.
22. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-21, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более маркеров плюрипотентности, выбранных из с-Мус, Ecat1, Rexo1 или их комбинации.
23. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-22, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более мезодермальных маркеров, выбранных из Brachyury, Bmpr2 или их комбинации.
24. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-23, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более эндодермальных маркеров, выбранных из Gata6, Sox17, Sox7 или их комбинации.
25. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-24, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более нейронных маркеров, выбранных из Nestin, Рах6 или их комбинации.
26. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-25, отличающаяся тем, что указанная клетка экспрессирует маркер плюрипотентности, включающий Oct-4, Sox2, щелочную фосфатазу или их комбинацию.
27. Выделенная крысиная ЭС клетка в соответствии с любым из вариантов реализации настоящего изобретения 1-26, отличающаяся тем, что крысиная ЭС клетка характеризуется экспрессией одного или более крысиных ЭСК-специфических генов, выбранных из одного или более: белка, связанного с адгезионными контактами (Ajap1), клаудина 5 (Cldn5), фактора 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимой протеинкиназы IV (Camk4), эфрина-А1 (Efna1), ЕРН рецептора А4 (Epha4), белка бета 5 межклеточных щелевых контактов (Gjb5), белка 1, подобного белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкина 36 бета (Il1f8), рецептора альфа интерлейкина 28 (Il28ra), фактора 1 детерминации асимметрии (Lefty1), альфа-рецептора фактора ингибирования лейкемии (Lifr), рецептора 2 лизофосфатидной кислоты (Lpar2), нейронального рецептора пентраксина (Ntm), протеинтирозинфосфатазы нерецепторного типа 18 (Ptpn18), гомеобокса 2 каудального типа (Cdx2), повторных доменов 1 фибронектина III и анкирина (Fank1), гена forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), гена, родственного hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), гена forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), гена, родственного hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактора 1, связывающего лимфоидный энхансер (Lef1), гена 3, подобного Sal (дрозофила) (Sall3), гомеобокса 1 SATB (Satb1), miR-632 или их комбинации.
28. Выделенная популяция крысиных ЭС клеток, отличающаяся тем, что по меньшей мере 70% крысиных ЭС клеток являются эуплоидными и образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro.
29. Выделенная популяция крысиных ЭС клеток в соответствии с вариантом реализации настоящего изобретения 28, отличающаяся тем, что крысиные ЭС клетки получены от крысы линии ACI.
30. Выделенная популяция крысиных ЭС клеток в соответствии с вариантом реализации настоящего изобретения 28, отличающаяся тем, что крысиные ЭС клетки получены от крысы линии Dark Agouti (DA).
31. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-30, отличающаяся тем, что крысиные ЭС клетки способны передавать свой геном через зародышевую линию.
32. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-31, отличающаяся тем, что крысиные ЭС клетки имеют эффективность трансмиссии через зародышевую линию целевой генетической модификации по меньшей мере 3%.
33. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-31, отличающаяся тем, что крысиные ЭС клетки имеют эффективность трансмиссии через зародышевую линию целевой генетической модификации по меньшей мере 60%.
34. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-31, отличающаяся тем, что крысиные ЭС клетки демонстрируют целевую эффективность гомологичной рекомбинации по меньшей мере 2%.
35. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-34, отличающаяся тем, что крысиные ЭС клетки способны передавать целевую генетическую модификацию потомству после очередного цикла электропорации.
36. Выделенная популяция в соответствии с любым из вариантов реализации настоящего изобретения 28-35, отличающаяся тем, что крысиные ЭС клетки содержат одну или более, две или более или три или более целевых генетических модификаций и могут передавать целевую генетическую модификацию через зародышевую линию.
37. Выделенная популяция крысиных ЭС клеток в соответствии с вариантом реализации настоящего изобретения 36, отличающаяся тем, что целевая генетическая модификация находится в локусе Rosa26 крысы.
38. Выделенная популяция крысиных ЭС клеток в соответствии с вариантом реализации настоящего изобретения 36, отличающаяся тем, что целевая генетическая модификация представляет собой инсерцию, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
39. Выделенная популяция крысиных ЭС клеток в соответствии с вариантом реализации настоящего изобретения 36, отличающаяся тем, что целевая генетическая модификация содержит по меньшей мере одну инсерцию гетерологичного полинуклеотида в геном клетки.
40. Выделенная популяция крысиных ЭС клеток в соответствии с вариантом реализации настоящего изобретения 39, отличающаяся тем, что гетерологичный полинуклеотид содержит селективный маркер.
41. Выделенная популяция крысиных ЭС клеток в соответствии с вариантом реализации настоящего изобретения 40, отличающаяся тем, что
(a) селективный маркер содержит неослабленный ген селективного маркера, функционально связанный с промотором; или
(b) крысиная ЭС клетка содержит по меньшей мере 2 копии полинуклеотида, кодирующего селективный маркер.
42. Выделенная популяция крысиных ЭС клеток в соответствии с вариантом реализации настоящего изобретения 40, отличающаяся тем, что селективный маркер имеет повышенную активность по сравнению с селективным маркером дикого типа.
43. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-42, отличающаяся тем, что указанные клетки образуют сфероподобную колонию при посеве на питающий клеточный слой в культуре, содержащей полипептид LIF, ингибитор GSK3 и ингибитор MEK.
44. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-43, отличающаяся тем, что указанные клетки при культивации in vitro свободно прикрепляются к питающему клеточному слою.
45. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-44, отличающаяся тем, что указанные клетки для поддержания плюрипотентности не требуют паракринной сигнализации LIF.
46. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-44, отличающаяся тем, что крысиные ЭС клетки представляют собой мужские (XY) крысиные ЭС клетки.
47. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-44, отличающаяся тем, что крысиные ЭС клетки представляют собой женские (XX) крысиные ЭС клетки.
48. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-47, отличающаяся тем, что крысиные ЭС клетки можно пересевать до по меньшей мере 11 раз в среде, содержащей ингибитор GSK3 и ингибитор MEK, без снижения ее целевой эффективности или эффективности трансмиссии через зародышевую линию целевой генетической модификации.
49. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-48, отличающаяся тем, что крысиные ЭС клетки экспрессируют по меньшей мере один маркер плюрипотентности, выбранный из Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, LIF-рецептора, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинации.
50. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-49, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более маркеров плюрипотентности, выбранных из с-Мус, Ecat1, Rexo1 или их комбинации.
51. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-50, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более мезодермальных маркеров, выбранных из Brachyury, Bmpr2 или их комбинации.
52. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-51, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более эндодермальных маркеров, выбранных из Gata6, Sox17, Sox7 или их комбинации.
53. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-52, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более нейронных маркеров, выбранных из Nestin, Рах6 или их комбинации.
54. Выделенная популяция крысиных ЭС клеток в соответствии с любым вариантом реализации настоящего изобретения 28-53, отличающаяся тем, что крысиные ЭС клетки экспрессируют маркер плюрипотентности, включающий Oct-4, Sox2, щелочную фосфатазу или их комбинацию.
55. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-54, отличающаяся тем, что крысиные ЭС клетки характеризуются экспрессией одного или более крысиных ЭСК-специфических генов, выбранных из одного или более: белка, связанного с адгезионными контактами (Ajap1), клаудина 5 (Cldn5), фактора 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимой протеинкиназы IV (Camk4), эфрина-А1 (Efna1), ЕРН рецептора А4 (Epha4), белка бета 5 межклеточных щелевых контактов (Gjb5), белка 1, подобного белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкина 36 бета (Il1f8), рецептора альфа интерлейкина 28 (Il28ra), фактора 1 детерминации асимметрии (Lefty1), альфа-рецептора фактора ингибирования лейкемии (Lifr), рецептора 2 лизофосфатидной кислоты (Lpar2), нейронального рецептора пентраксина (Ntm), протеинтирозинфосфатазы нерецепторного типа 18 (Ptpn18), гомеобокса 2 каудального типа (Cdx2), повторных доменов 1 фибронектина III и анкирина (Fank1), гена forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), гена, родственного hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), гена forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), гена, родственного hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактора 1, связывающего лимфоидный энхансер (Lef1), гена 3, подобного Sal (дрозофила) (Sall3), гомеобокса 1 SATB (Satb1), miR-632 или их комбинации.
56. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-55, отличающаяся тем, что популяция содержит по меньшей мере 104 клеток.
57. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-56, отличающаяся тем, что крысиные ЭС клетки имеют одну или более характеристик, включающих:
a. по меньшей мере 90% крысиных ЭС клеток являются эуплоидными;
b. по меньшей мере 70% крысиных ЭС клеток экспрессируют по меньшей мере один маркер плюрипотентности; причем по меньшей мере один маркер плюрипотентности представляет собой Oct-4, Sox2, щелочную фосфатазу или их комбинацию;
c. клетка из популяции крысиных ЭС клеток при объединении с крысиным эмбрионом-хозяином передает геном линии крысиных ЭС клеток потомству;
d. крысиные ЭС клетки при культивации in vitro свободно прикрепляются к питающему клеточному слою;
e. крысиные ЭС клетки образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro; (f) крысиные ЭС клетки сохраняют плюрипотентность при культивации in vitro в средах, содержащих ингибитор GSK3, ингибитор МЕК, LIF и питающий клеточный слой, который не является генетически модифицированным для экспрессии LIF;
f. крысиная ЭС клетка демонстрирует целевую эффективность гомологичной рекомбинации по меньшей мере 2%;
g. крысиные ЭС клетки сохраняют плюрипотентность in vitro без потребности в паракринной сигнализации LIF;
h. по меньшей мере 70% крысиных ЭС клеток являются эуплоидными и образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro;
i. крысиные ЭС клетки экспрессируют по меньшей мере один маркер плюрипотентности, выбранный из Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, LIF-рецептора, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинации;
j. крысиные ЭС клетки не экспрессируют один или более маркеров дифференциации, выбранных из с-Мус, Ecat1, Rexo1;
k. крысиные ЭС клетки не экспрессируют один или более мезодермальных маркеров, выбранных из Brachyury, Bmpr2 или их комбинации;
l. крысиные ЭС клетки не экспрессируют один или более эндодермальных маркеров, выбранных из Gata6, Sox17, Sox7 или их комбинации; и/или
m. крысиные ЭС клетки не экспрессируют один или более нейронных маркеров, выбранных из Nestin, Рах6 или их комбинации.
58. Выделенная популяция крысиных ЭС клеток в соответствии с любым из вариантов реализации настоящего изобретения 28-57, отличающаяся тем, что (a) крысиные ЭС клетки получены из бластоцисты крысы; (b) крысиная ЭС клетка получена из эмбриона крысы на стадии морулы; и/или (c) линия крысиных ЭС клеток получена от крысы с суперовуляцией.
59. Культура in vitro, содержащая питающий клеточный слой, популяцию крысиных эмбриональных стволовых (ЭС) клеток и среду, содержащую фактор ингибирования лейкемии (LIF), ингибитор GSK3, и ингибитор MEK, причем по меньшей мере 70% крысиных ЭС клеток являются эуплоидными и крысиная ЭС клетка образует сфероподобную колонию.
60. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 59 или 60, отличающаяся тем, что крысиная ЭС клетка свободно прикрепляется к питающему клеточному слою.
61. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 59, 60 или 61, отличающаяся тем, что крысиные ЭС клетки способны передавать свой геном через зародышевую линию.
62. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 59, 60 или 61, отличающаяся тем, что крысиные ЭС клетки получены от крысы линии ACI.
63. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 59, 60 или 61, отличающаяся тем, что крысиные ЭС клетки получены от крысы линии Dark Agouti (DA).2.
64. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-63, отличающаяся тем, что крысиные ЭС клетки способны передавать целевую генетическую модификацию через зародышевую линию.
65. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 64, отличающаяся тем, что крысиные ЭС клетки имеют эффективность трансмиссии через зародышевую линию целевой генетической модификации по меньшей мере 3%.
66. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 64, отличающаяся тем, что крысиные ЭС клетки имеют эффективность трансмиссии через зародышевую линию целевой генетической модификации по меньшей мере 60%.
67. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-66, отличающаяся тем, что крысиные ЭС клетки демонстрируют целевую эффективность гомологичной рекомбинации по меньшей мере 2%.
68. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-67, отличающаяся тем, что крысиная ЭС клетка способна к передаче целевой генетической модификации потомству после очередного цикла электропорации.
69. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-68, отличающаяся тем, что крысиная ЭС клетка содержит одну или более, две или более или три или более целевых генетических модификаций.
70. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 69, отличающаяся тем, что целевая генетическая модификация представляет собой инсерцию, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
71. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 69, отличающаяся тем, что целевая генетическая модификация содержит по меньшей мере одну инсерцию гетерологичного полинуклеотида в геном клетки.
72. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 71, отличающаяся тем, что гетерологичный полинуклеотид содержит селективный маркер.
73. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 72, отличающаяся тем, что (a) селективный маркер содержит неослабленный ген селективного маркера, функционально связанный с промотором; или (b) крысиная ЭС клетка содержит по меньшей мере 2 копии полинуклеотида, кодирующего селективный маркер.
74. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 72, отличающаяся тем, что селективный маркер имеет повышенную активность по сравнению с селективным маркером дикого типа.
75. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-74, отличающаяся тем, что для поддержания плюрипотентности указанной клетки нет необходимости в паракринной сигнализации LIF.
76. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-75, отличающаяся тем, что указанная клетка представляет собой мужскую (XY) крысиную ЭС клетку.
77. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-75, отличающаяся тем, что указанная клетка представляет собой женскую (XX) крысиную ЭС клетку.
78. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-77, отличающаяся тем, что крысиную ЭС клетку можно пересевать до по меньшей мере 11 раз в среде, содержащей ингибитор GSK3 и ингибитор MEK без снижения ее целевой эффективности или эффективности трансмиссии через зародышевую линию целевой генетической модификации.
79. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-78, отличающаяся тем, что крысиные ЭС клетки экспрессируют по меньшей мере один маркер плюрипотентности, выбранный из Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, LIF-рецептора, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинации.
80. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-79, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более маркеров плюрипотентности, выбранных из с-Мус, Ecat1, Rexo1 или их комбинации.
81. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-80, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более мезодермальных маркеров, выбранных из Brachyury, Bmpr2 или их комбинации.
82. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-81, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более эндодермальных маркеров, выбранных из Gata6, Sox17, Sox7 или их комбинации;
83. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-82, отличающаяся тем, что крысиные ЭС клетки не экспрессируют один или более нейронных маркеров, выбранных из Nestin, Рах6 или их комбинации.
84. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-83, отличающаяся тем, что указанная клетка экспрессирует маркер плюрипотентности, включающий Oct-4, Sox2, щелочную фосфатазу или их комбинацию.
85. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-84, отличающаяся тем, что крысиные ЭС клетки характеризуются экспрессией одного или более крысиных ЭСК-специфических генов, выбранных из одного или более: белка, связанного с адгезионными контактами (Ajap1), клаудина 5 (Cldn5), фактора 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимой протеинкиназы IV (Camk4), эфрина-А1 (Efna1), ЕРН рецептора А4 (Epha4), белка бета 5 межклеточных щелевых контактов (Gjb5), белка 1, подобного белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкина 36 бета(Il1f8), рецептора альфа интерлейкина 28 (Il28ra), фактора 1 детерминации асимметрии (Lefty1), альфа-рецептора фактора ингибирования лейкемии (Lifr), рецептора 2 лизофосфатидной кислоты (Lpar2), нейронального рецептора пентраксина (Ntm), протеинтирозинфосфатазы нерецепторного типа 18 (Ptpn18), гомеобокса 2 каудального типа (Cdx2), повторных доменов 1 фибронектина III и анкирина (Fank1), гена forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), гена, родственного hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), гена forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), гена, родственного hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактора 1, связывающего лимфоидный энхансер (Lef1), гена 3, подобного Sal (дрозофила) (Sall3), гомеобокса 1 SATB (Satb1), miR-632 или их комбинации.
86. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-84, отличающаяся тем, что концентрация LIF составляет от 50 Ед/мл до 150 Ед/мл.
87. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-85, отличающаяся тем, что концентрация LIF составляет 100 Ед/мл.
88. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-87, отличающаяся тем, что LIF получен от мыши или имеет по меньшей мере 92% идентичности последовательности с SEQ ID NO: 1.
89. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-88, отличающаяся тем, что крысиная ЭС клетка способна поддерживать плюрипотентность без потребности в паракринной сигнализации LIF.
90. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-89, отличающаяся тем, что питающий клеточный слой не модифицирован генетически для экспрессии LIF.
91. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-90, отличающаяся тем, что питающий клеточный слой содержит монослой митотически инактивированных мышиных эмбриональных фибробластов (МЭФ).
92. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-91, отличающаяся тем, что ингибитор MEK представляет собой PD0325901.
93. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-92, отличающаяся тем, что ингибитор GSK-3 представляет собой CHIR99021.
94. Культура in vitro в соответствии с любым из вариантов реализации настоящего изобретения 59-93, отличающаяся тем, что популяция крысиных ЭС клеток получена из эмбриона крысы на стадии бластоцисты или эмбриона крысы на стадии морулы.
95. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 94, отличающаяся тем, что эмбрион крысы на стадии бластоцисты или на стадии морулы дополнительно содержит разрастание аморфной недифференцированной массы крысиных ЭС клеток.
96. Культура in vitro в соответствии с вариантом реализации настоящего изобретения 94, отличающаяся тем, что популяция крысиных ЭС клеток содержит изолированное разрастание аморфной недифференцированной массы крысиных ЭС клеток.
97. Способ создания линии крысиных эмбриональных стволовых (ЭС) клеток, включающий: (a) культивирование in vitro первого питающего клеточного слоя и эмбриона крысы на стадии морулы или бластоцисты, где у эмбриона крысы на стадии морулы или бластоцисты была удалена блестящая оболочка яйцеклетки, и где условия культивирования сохраняют плюрипотентность крысиной ЭС клетки и содержат среду с мышиным фактором ингибирования лейкемии (LIF) или последовательностью, имеющей по меньшей мере 91% идентичности последовательности с SEQ ID NO: 1 и имеющей активность LIF, и с ингибитором GSK3, и ингибитором MEK; и, (b) перенос разрастания аморфной недифференцированной массы крысиных ЭС клеток в лунку для культивирования in vitro, содержащую второй питающий клеточный слой, и культивирование разрастания в условиях, включающих среду с мышиным LIF или активным вариантом мышиного LIF, поддерживая тем самым плюрипотентность крысиных ЭС клеток и создавая линию крысиных ЭС клеток.
98. Способ в соответствии с вариантом реализации настоящего изобретения 97, отличающийся тем, что линию крысиных ЭС клеток пересевают по меньшей мере 5 раз.
99. Способ в соответствии с вариантом реализации настоящего изобретения 97 или 98, отличающийся тем, что линию крысиных ЭС клеток пересевают по меньшей мере 10 раз.
100. Способ в соответствии с вариантом реализации настоящего изобретения 97, 98 или 99, отличающийся тем, что среда содержит от около 50 Ед/мл до около 150 Ед/мл мышиного LIF.
101. Способ в соответствии с любым из вариантов реализации настоящего изобретения 97-100, отличающийся тем, что среда содержит около 100 Ед/мл мышиного LIF.
102. Способ в соответствии с любым из вариантов реализации настоящего изобретения 97-101, отличающийся тем, что питающий клеточный слой не модифицирован генетически для экспрессии LIF.
103. Способ в соответствии с любым из вариантов реализации настоящего изобретения 97-102, отличающийся тем, что питающий клеточный слой содержит монослой митотически инактивированных мышиных эмбриональных фибробластов (МЭФ).
104. Способ в соответствии с любым из вариантов реализации настоящего изобретения 97-103, отличающийся тем, что ингибитор МЕК представляет собой PD0325901.
105. Способ в соответствии с любым из вариантов реализации настоящего изобретения 97-104,отличающийся тем, что ингибитор GSK-3 представляет собой CHIR99021.
106. Способ в соответствии с любым вариантом реализации настоящего изобретения 97-105, отличающийся тем, что (а) линия крысиных ЭС клеток получена от крыс линии ACI или получена от крыс линии Dark Agouti (DA); (b) линия крысиных ЭС клеток получена от эмбриона крысы на стадии морулы или на стадии бластоцисты; и/или, (c) линия крысиных ЭС клеток получена от эмбриона на стадии морулы или на стадии бластоцисты от крысы с суперовуляцией.
107. Способ в соответствии с любым из вариантов реализации настоящего изобретения 97-106, отличающийся тем, что среда дополнительно содержит по меньшей мере один из: ингибитора рецептора FGF, ингибитора ROCK или ингибитора ALK.
108. Способ в соответствии с вариантом реализации настоящего изобретения 107, отличающийся тем, что ингибитор рецептора FGF представляет собой PD184352, ингибитор ROCK представляет собой Y-27632 или ингибитор ALK представляет собой А-83-01.
109. Способ в соответствии с любым из вариантов реализации настоящего изобретения 97-108, отличающийся тем, что по меньшей мере одна крысиная ЭС клетка имеет эффективность трансмиссии через зародышевую линию целевой генетической модификации по меньшей мере 3%.
110. Способ в соответствии с любым из вариантов реализации настоящего изобретения 97-109, отличающийся тем, что эффективность трансмиссии через зародышевую линию целевой генетической модификации составляет по меньшей мере 60%.
111. Способ отбора крысиных эмбриональных стволовых (ЭС) клеток, имеющих стабильно включенный в геном гетерологичный полинуклеотид, включающий: (a) предоставление in vitro популяции крысиных ЭС клеток; (b) введение по меньшей мере в одну крысиную ЭС клетку гетерологичного полинуклеотида, содержащего селективный маркер, функционально связанный с промотором, активным в крысиной ЭС клетке; и (c) культивирование in vitro популяции крысиных ЭС клеток попеременно в первой и второй культуральной среде, причем первая культуральная среда содержит эффективное количество селективного агента в течение первого периода времени, а вторая культуральная среда не содержит селективного агента, причем условия культивирования in vitro являются достаточными для сохранения плюрипотентности; тем самым обеспечивая отбор крысиных ЭС клеток, имеющих стабильно включенный в их геном гетерологичный полинуклеотид.
112. Способ в соответствии с вариантом реализации настоящего изобретения 111, отличающийся тем, что чередование первой и второй культуральной среды проводят каждые 24 часа.
113. Способ в соответствии с вариантом реализации настоящего изобретения 111 или 112, отличающийся тем, что селективный маркер придает устойчивость к антибиотику.
114. Способ в соответствии с любым из вариантов реализации настоящего изобретения 111-113, отличающийся тем, что антибиотик представляет собой G418.
115. Способ в соответствии с любым из вариантов реализации настоящего изобретения 111-114, отличающийся тем, что селективный маркер представляет собой неомицинфосфотрансферазу (neor), гигромицин-В фосфотрансферазу (hygr), пуромицин-N-ацетилтрансферазу (puror), бластицидин-S дезаминазу (bsrr), ксантин/гуанин фосфорибозилтрансферазу (gpt) и тимидинкиназу вируса простого герпеса (HSV-k) или их комбинацию.
116. Способ в соответствии с любым из вариантов реализации настоящего изобретения 111-115, отличающийся тем, что (a) селективный маркер имеет повышенную активность по сравнению с селективным маркером дикого типа; и/или (b) множество копий селективного маркера стабильно введены в геном крысиной ЭС клетки.
117. Способ в соответствии с вариантом реализации настоящего изобретения 116, отличающийся тем, что селективный маркер представляет собой не ослабленный селективный маркер.
118. Способ генетической модификации выделенной крысиной эмбриональной стволовой (ЭС) клетки, включающий введение в геном выделенной крысиной ЭС клетки в соответствии с любым из вариантов реализации настоящего изобретения 1-58 гетерологичного полинуклеотида для получения генетически модифицированной крысиной ЭС клетки.
119. Способ получения генетически модифицированной крысы, включающий:
(a) введение в геном выделенной крысиной эмбриональной стволовой (ЭС) клетки в соответствии с любым из вариантов реализации настоящего изобретения 1-58 гетерологичного полинуклеотида для получения крысиной ЭС клетки с генетической модификацией;
(b) введение по меньшей мере одной из крысиных ЭС клеток, имеющих целевую генетическую модификацию, в крысиный эмбрион-хозяин для получения эмбриона F0;
(c) имплантацию эмбриона F0 суррогатной матери;
(d) созревание эмбриона F0 в организме суррогатной матери до соответствующего срока; и (e) идентификацию крысы F0, имеющей целевую генетическую модификацию.
120. Способ в соответствии с вариантом реализации настоящего изобретения 119, дополнительно включающий скрещивание самцов крыс F0 с самками крыс дикого типа с получением потомства F1, являющегося гетерозиготным по целевой генетической модификации.
121. Способ в соответствии с вариантом реализации настоящего изобретения 120, дополнительно включающий скрещивание самцов крыс F0 с самками крыс дикого типа с получением потомства F1, являющегося гетерозиготным по целевой генетической модификации.
122. Способ в соответствии с вариантом реализации настоящего изобретения 119, дополнительно включающий скрещивание самцов крыс потомства F1 с самками крыс потомства F1 с получением потомства F2, являющегося гомозиготным по генетической модификации.
123. Способ в соответствии с любым из вариантов реализации настоящего изобретения 119-122, отличающийся тем, что по меньшей мере 3% крыс F0, имеющих генетическую модификацию, передают эту генетическую модификацию потомству F1.
124. Способ в соответствии с любым из вариантов реализации настоящего изобретения 119-123, отличающийся тем, что по меньшей мере 10% крыс F0, имеющих генетическую модификацию, передают эту генетическую модификацию потомству F1.
125. Способ в соответствии с любым из вариантов реализации настоящего изобретения 119-124, отличающийся тем, что по меньшей мере 60% крыс F0, имеющих генетическую модификацию, передают эту генетическую модификацию потомству F1.
126. Способ в соответствии с любым из вариантов реализации настоящего изобретения 119-125, отличающийся тем, что генетически модифицированная крысиная ЭС клетка получена из той же линии крыс, что и крысиный эмбрион-хозяин.
127. Способ в соответствии с любым из вариантов реализации настоящего изобретения 119-127, отличающийся тем, что генетически модифицированная крысиная ЭС клетка получена из линии крыс, отличной от той, к которой принадлежит крысиный эмбрион-хозяин.
128. Выделенная популяция крысиных ЭС клеток по любому из предшествующих пунктов, культивирование in vitro по любому из предшествующих пунктов или способ по любому из предшествующих пунктов, отличающиеся тем, что крысиные ЭС клетки в популяции содержат следующее:
(a) по меньшей мере 90% крысиных ЭС клеток являются эуплоидными;
(b) по меньшей мере 70% крысиных ЭС клеток экспрессируют по меньшей мере один маркер плюрипотентности; причем по меньшей мере один маркер плюрипотентности представляет собой Oct-4, Sox2, щелочную фосфатазу или их комбинацию;
(c) клетка из популяции крысиных ЭС клеток при объединении с крысиным эмбрионом-хозяином передает геном линии крысиных ЭС клеток потомству;
(d) крысиные ЭС клетки при культивации in vitro свободно прикрепляются к питающему клеточному слою;
(e) крысиные ЭС клетки образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro;
(f) крысиные ЭС клетки сохраняют плюрипотентность при культивации in vitro в средах, содержащих ингибитор GSK3, ингибитор МЕК, LIF и питающий клеточный слой, который не является генетически модифицированным для экспрессии LIF;
(g) крысиная ЭС клетка демонстрирует целевую эффективность гомологичной рекомбинации по меньшей мере 2%;
(h) крысиные ЭС клетки сохраняют плюрипотентность in vitro без потребности в паракринной сигнализации LIF;
(i) по меньшей мере 70% крысиных ЭС клеток являются эуплоидными и образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro;
(j) крысиные ЭС клетки экспрессируют по меньшей мере один маркер плюрипотентности, выбранный из Dnmt3L, Eras, Err-бета, Fbxo15, Fgf4, Gdf3, Klf4, Lef1, LIF-рецептора, Lin28, Nanog, Oct4, Sox15, Sox2, Utf1 или их комбинации;
(k) крысиные ЭС клетки не экспрессируют один или более маркеров дифференциации, выбранных из с-Мус, Ecat1, Rexo1.
(l) крысиные ЭС клетки не экспрессируют один или более мезодермальных маркеров, выбранных из Brachyury, Bmpr2 или их комбинации;
(m) крысиные ЭС клетки не экспрессируют один или более эндодермальных маркеров, выбранных из Gata6, Sox17, Sox7 или их комбинации; и/или
(n) крысиные ЭС клетки не экспрессируют один или более нейронных маркеров, выбранных из Nestin, Рах6 или их комбинации.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Файл настоящего патента или заявки содержит по меньшей мере один цветной рисунок. Копии публикации этого патента или патентной заявки с цветным рисунком (рисунками) будут предоставлены Управлением по запросу и после оплаты необходимой пошлины.
На ФИГ. 1 изображены кЭСК, растущие в виде компактных сферических колоний, которые обычно не прикреплены и плавают в чашке для культивирования.
На ФИГ. 2A-D изображены различные маркеры плюрипотентности, экспрессируемые кЭСК: на А изображен Oct-4 (зеленый); на В изображен Sox-2 (красный); на С изображен DAPI (голубой); на D изображено наложение маркеров плюрипотентности, экспрессируемых кЭСК.
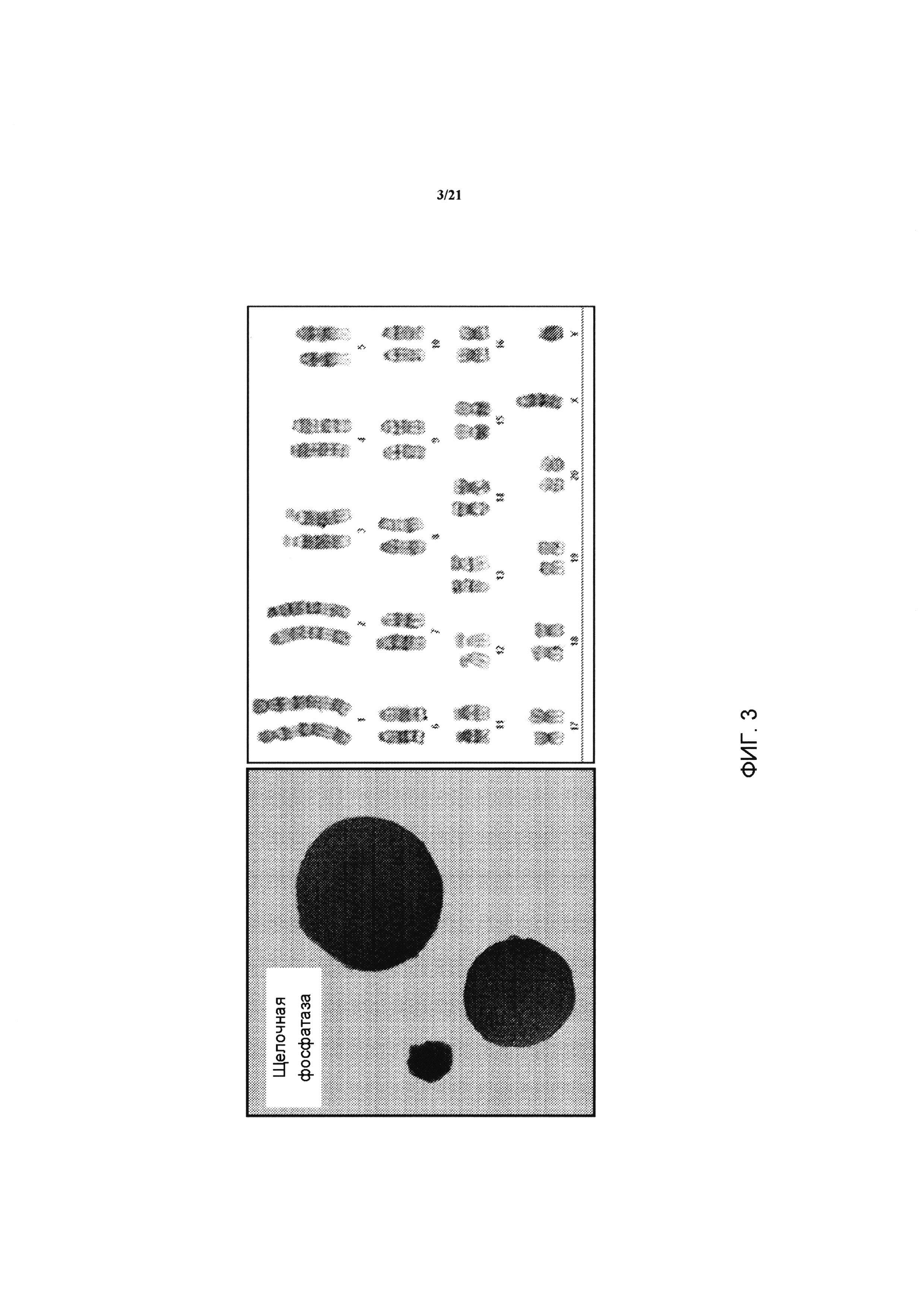
На ФИГ. 3 показано, что кЭСК экспрессируют слабые уровни щелочной фосфатазы (маркер плюрипотентности) (слева) и кариотип для линии DA.2B представляет собой 42X,Y (справа). Кариотипирование выполняли потому что кЭСК часто становятся тетраплоидными; таким образом, был проведен предварительный скрининг линий путем подсчета препаратов метафазных хромосом, и линии в основном с нормальными количествами были затем кариотипированы по соответствующей форме.
На ФИГ. 4 показан вид вблизи кЭСК, представленных на ФИГ. 1.
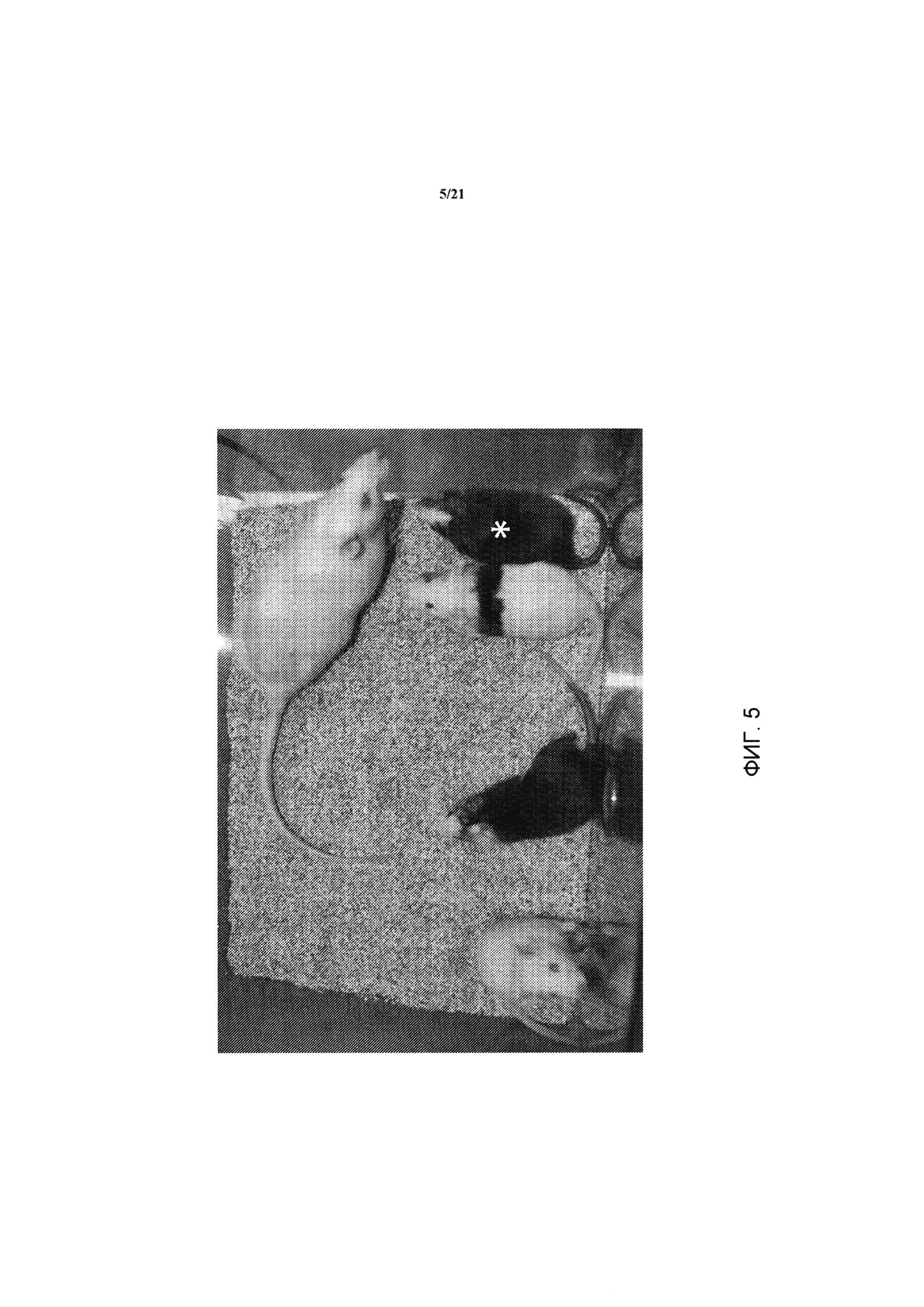
На ФИГ. 5 изображено получение химер путем инъекций бластоцисты и передачи генома кЭСК через зародышевую линию; химеры, произведенные посредством инъекций бластоцисты с использованием родительских ACI.G1 кЭСК; у высокого процента химер, как правило, морды альбиносов.
На ФИГ. 6 изображены детеныши агути F1 из помета с альбиносами, произведенными от химеры ACI/SD, помеченной звездочкой (*) на ФИГ. 5.
На ФИГ. 7 на панели А изображено нацеливание на крысиный локус Rosa 26, который находится между генами Setd5 и Thumpd3 как и у мыши, на том же расстоянии. На панели А показана структура мышиного локуса Rosa 26. Транскрипты mRosa26 состоят из 2 или 3 экзонов. На панели В показана структура локуса rRosa26; крысиный локус содержит второй экзон 1 (Ex1b) в дополнение к гомологичному экзону мышиного экзона 1 (Ex1a); у крыс не был выявлен третий экзон. На панели С показан целевой аллель rRosa26; группы гомологий по 5 тысяч оснований каждая клонировали с помощью ПЦР с использованием геномной ДНК от кЭСК DA; целевой аллель содержит кассету SA-lacZ-hUB-neo замещающую делецию 117 п.о. в интроне rRosa26.
На ФИГ. 8А изображен контрольный мозг 14-недельных крыс дикого типа, которых лечили X-gal. В контрольном мозге продемонстрирован низкий уровень фонового окрашивания в отношении LacZ (вид сзади).
На ФИГ. 8В изображена экспрессия LacZ в мозге гетерозиготных крыс rRosa26 (в возрасте 14 недель). Репортер lacZ экспрессировался повсеместно в мозге гетерозиготной крысы rRosa26.
На ФИГ. 8С изображены контрольное сердце и тимус (вставка) 14-недельной крысы дикого типа, которую лечили X-gal. В контрольном сердце и тимусе продемонстрирован низкий уровень фонового окрашивания в отношении LacZ.
На ФИГ. 8D изображена экспрессия LacZ в сердце и тимусе (вставка) гетерозиготной крысы rRosa26 в возрасте 14 недель. Репортер lacZ экспрессировался повсеместно в сердце и тимусе гетерозиготной крысы rROSA26.
На ФИГ. 8Е изображено контрольное легкое 14-недельной крысы дикого типа, которую лечили X-gal. В контрольном легком продемонстрирован низкий уровень фонового окрашивания в отношении LacZ.
На ФИГ. 8F изображена экспрессия LacZ в легком гетерозиготной крысы rRosa26 в возрасте 14 недель. Репортер lacZ экспрессировался повсеместно в легком гетерозиготной крысы rRosa26.
На ФИГ. 8G и Н изображена экспрессия LacZ у эмбриона е12.5. В отличие от контрольного эмбриона дикого типа (Н), который демонстрирует низкий уровень фонового окрашивания LacZ, гетерозиготный эмбрион rRosa26 демонстрирует повсеместную экспрессию репортера LacZ по всему эмбриону.
На ФИГ. 8I и J изображена экспрессия LacZ у эмбриона е14.5. В отличие от контрольного эмбриона дикого типа (J), который демонстрирует низкий уровень фонового окрашивания LacZ, гетерозиготный эмбрион rRosa26 крысы демонстрирует повсеместную экспрессию репортера LacZ по всему эмбриону.
На Фиг. 9А-В представлена фотография, демонстрирующая анализ числа хромосом в линии ЭС клеток крыс ACI.G1.
На Фиг. 10А-В представлена фотография, демонстрирующая анализ числа хромосом в линии ЭС клеток крыс DA.2B.
На Фиг. 11А-В представлена фотография, демонстрирующая анализ числа хромосом в линии крысиных ЭС клеток DA.C2.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Ниже более подробно описаны настоящие способы и композиции со ссылкой на прилагаемые рисунки, на которых показаны некоторые, но не все, варианты реализации способов и композиций данного изобретения. Действительно, эти способы и композиции могут быть реализованы во многих различных формах и не должны быть истолкованы как ограниченные вариантами реализации настоящего изобретения, изложенными в данном документе; скорее эти варианты реализации настоящего изобретения представлены таким образом, что это описание будет удовлетворять соответсвующим требованиям законодательства. Одинаковые номера относятся к одинаковым элементам по всему описанию.
Многие модификации и другие варианты реализации способов и композиций, изложенные в настоящем документе, будут очевидны специалистам в той области техники, к которой эти способы и композиции относятся, с преимуществом идей изобретения, представленных в изложенном выше описании и сопутствующих рисунках. Таким образом, следует понимать, что способы и композиции не должны быть ограничены конкретными раскрытыми вариантами реализации настоящего изобретения и что модификации и другие варианты реализации настоящего изобретения включены в объем прилагаемой формулы изобретения. Хотя в данном документе используются конкретные термины, они используются только в общем и описательном смысле, а не для целей ограничения.
I. Общие сведения
Крысы уже давно являются предпочтительными организмами моделей грызунов в нескольких областях биомедицинских исследований, таких как сердечно-сосудистые заболевания, обмен веществ, токсикология, нейробиология и поведение. Были разработаны сотни крысиных линий; некоторые являются отличными моделями сложных заболеваний человека, таких как гипертония, диабет и рак. Однако понимание генетики этих моделей было сильно затруднено из-за сложности модификации генома крыс контролируемым образом. Благодаря использованию сайт-специфических эндонуклеаз можно получать мутации в гене, представляющем интерес, но этот способ остается неточным и дорогостоящим. Нацеливание и передача зародышевой линии крысиных ЭС клеток остается сложной задачей.
В данном документе описано выделение крысиных ЭС клеток (кЭСК) от двух инбредных крысиных линий. Были получены кЭСК от линий DA и ACI. Эти клетки экспрессируют маркеры плюрипотентности и демонстрируют нормальный кариотип 42X,Y. Высокий процент химер был получен посредством микроинъекции в эмбрионы SD-хозяев на стадии бластоцисты, и передача генома кЭСК была продемонстрирована через зародышевую линию для обеих линий. Используя плазмидные нацеливающие векторы, авторы настоящего изобретения разработали целевые мутации в крысином эквиваленте локуса ROSA26 и добились трансмиссии через зародышевую линию целевого аллеля в обеих линиях. Эти гетерозиготные животные экспрессируют lacZ во всех тканях на всех исследованных стадиях.
В различных аспектах ЭС клетки получали от линии ACI, чтобы получить благоприятное количество мужского потомства от ACI-доноров ЭС клеток. В одном варианте реализации изобретения мужское потомство составляет приблизительно 50%.
В различных аспектах ЭС клетки были получены из линии DA, чтобы получить преимущественно потомство женского пола.
II. Крысиные эмбриональные стволовые (ЭС) клетки
В настоящем документе предлагаются различные композиции и способы, включающие эмбриональные стволовые (ЭС) клетки крысы. Стволовые клетки являются популяцией клеток, которые обладают бесконечной способностью к самообновлению и являются плюрипотентными. «Эмбриональная стволовая клетка», или «ЭС клетка», представляет собой стволовую клетку, полученную из эмбриона или плода. Различные крысиные ЭС клетки, представленные в настоящем документе, могут иметь одно или более из следующих свойств:
(a) обладают компетентностью зародышевой линии, что означает, что при имплантации крысиной ЭС клетки в крысиный эмбрион-хозяин, геном линии крысиных ЭС клеток передается потомству;
(b) обладают компетентностью зародышевой линии после по меньшей мере одной целевой генетической модификации, что означает, что при имплантации крысиной ЭС клетки с целевой генетической модификацией в крысиный эмбрион-хозяин целевая генетическая модификация в геноме линии крысиных ЭС клеток передается потомству;
(c) обладают плюрипотентностью in vitro;
(d) обладают тотипотентностью in vitro;
(e) при культивации in vitro свободно прикрепляются к питающему клеточному слою;
(f) при культивации in vitro образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro;
(g) сохраняют плюрипотентность при культивации in vitro в условиях, включающих питающий клеточный слой, который не является генетически модифицированным для экспрессии фактора ингибирования лейкемии (LIF), причем культуральная среда содержит достаточную концентрацию LIF;
(h) сохраняют плюрипотентность при культивации in vitro в условиях, включающих питающий клеточный слой, причем культуральная среда содержит мышиный LIF или его активный вариант или фрагмент;
(i) имеют молекулярную сигнатуру, которая характеризуется следующим:
i) экспрессией одного или более генов, специфических для крысиных ЭС клеток, включая белок, связанный с адгезионными контактами (Ajap1), клаудин 5 (Cldn5), фактор 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН рецептор А4 (Epha4), белок бета 5 межклеточных щелевых контактов (Gjb5), белок 1, подобный белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), фактор 1 детерминации асимметрии (Lefty1), альфа-рецептор фактора ингибирования лейкемии (Lifr), рецептор 2 лизофосфатидной кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpn18), гомеобокс 2 каудального типа (Cdx2), повторные домены 1 фибронектина III и анкирина (Fank1), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактор 1, связывающий лимфоидный энхансер (Lef1), ген 3, подобный Sal (дрозофила) (Sall3), гомеобокс 1 SATB (Satb1), miR-632 или их комбинацию;
ii) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более генов, специфических для крысиных ЭС клеток, включая белок, связанный с адгезионными контактами (Ajap1), клаудин 5 (Cldn5), фактор 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН рецептор А4 (Epha4), белок бета 5 межклеточных щелевых контактов (Gjb5), белок 1, подобный белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), фактор 1 детерминации асимметрии (Lefty1), альфа-рецептор фактора ингибирования лейкемии (Lifr), рецептор 2 лизофосфатидной кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpn18), гомеобокс 2 каудального типа (Cdx2), повторные домены 1 фибронектина III и анкирина (Fank1), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактор 1, связывающий лимфоидный энхансер (Lef1), ген 3, подобный Sal (дрозофила) (Sall3), гомеобокс 1 SATB (Satb1), miR-632 или их комбинацию;
iii) по меньшей мере 20-кратным повышением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 14, по сравнению с ЭС клеткой мышей линии F1H4;
iv) по меньшей мере 20-кратным повышением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 14, по сравнению с ЭС клеткой мышей линии F1H4;
v) экспрессией одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13;
vi) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13;
vii) по меньшей мере 20-кратным повышением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13, по сравнению с ЭС клеткой мышей линии F1H4;
viii) по меньшей мере 20-кратным повышением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13, по сравнению с ЭС клеткой мышей линии F1H4;
ix) по меньшей мере 20-кратным снижением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 12, по сравнению с ЭС клеткой мышей линии F1H4; и/или
x) по меньшей мере 20-кратным снижением экспрессии по меньшей мере 2, 3,4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 12, по сравнению с ЭС клеткой мышей линии F1H4;
xi) любой комбинацией экспрессии генов, специфических для крысиных ЭС клеток согласно разделам (i)-(x);
xii) уровнем относительной экспрессии маркеров плюрипотентности, как показано в Таблице 15, для по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 перечисленных маркеров плюрипотентности. См. уровни относительной экспресии в колонке ранжирования плюрипотентности Таблицы 15;
xiii) уровнем относительной экспрессии мезодермальных маркеров, как показано в Таблице 15, для по меньшей мере 2, 3 или 4 перечисленных мезодермальных маркеров. См. уровни относительной экспрессии в колонке мезодермального ранжирования Таблицы 15;
xiv) уровнем относительной экспрессии эндодермальных маркеров, как показано в Таблице 15, для по меньшей мере 2, 3, 4, 5 или 6 перечисленных эндодермальных маркеров. См. уровни относительной экспрессии в колонке эндодермального ранжирования Таблицы 15;
xv) уровнем относительной экспрессии нейронных маркеров, как показано в Таблице 15, для по меньшей мере 2 и 3 перечисленных нейронных маркеров. См. уровни относительной экспрессии в колонке нейронного ранжирования Таблицы 15;
xvi) уровнем относительной экспрессии трофэктодермальных маркеров, как показано в Таблице 15, для перечисленных трофэктодермальных маркеров. См. уровни относительной экспрессии в колонке трофэктодермального ранжирования Таблицы 15;
xvii) любым уровнем относительной экспрессии одного или более (2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30) маркеров плюрипотентности, мезодермальных маркеров, эндодермальных маркеров, нейронных маркеров и/или трофэктодермальных маркеров, приведенных в Таблице 15;
xviii) уровнем относительной экспрессии каждого из маркеров, приведенных в Таблице 15;
xix) любой комбинацией сигнатур, приведенных в пунктах xii-xiix; и/или
xx) любой комбинацией сигнатур, приведенных в пунктах i-xiix;
(j) обладают способностью продуцировать крысу F0;
(k) способны к субкультивированию и поддержанию недифференцированного состояния;
(l) имеют то же количество хромосом, что и клетка нормальной крысы;
(m) сохраняют плюрипотентность in vitro без потребности в паракринной сигнализации LIF; и/или
(n) обладают способностью самообновления, что означает, что они делятся бесконечно, сохраняя плюрипотентность.
Одна или более характеристик, приведенных в пунктах (a)-(n), может присутствовать в выделенной крысиной ЭС клетке, популяции крысиных ЭС клеток или линии крысиных ЭС клеток, представленных в данном документе, причем эти крысиные ЭС клетки не подвергались целевой генетической модификации. В других вариантах реализации изобретения одна или более характеристик, приведенных в пунктах (a)-(n) может присутствовать в выделенной крысиной ЭС клетке, популяции крысиных ЭС клеток или линии крысиных ЭС клеток, представленных в данном документе, имеющих одну или более целевых генетических модификаций. Целевая генетическая модификация содержит изменение в геноме крысиной ЭС клетки и включает, например, инсерцию, делецию, нокаут, нокин, мутацию или их комбинацию. В других случаях целевая генетическая модификация содержит по меньшей мере одну инсерцию гетерологичного полинуклеотида в геном крысиной ЭС клетки. Дополнительное описание таких целевых генетических модификаций представлено в других разделах данного документа.
В специфических вариантах реализации изобретения различные крысиные ЭС клетки и клеточные линии, представленные в данном документе, являются компетентными в отношении зародышевой линии, что означает, что когда крысиную ЭС клетку имплантируют в крысиный эмбрион-хозяин, геном крысиной ЭС клетки передается потомству. Такая трансмиссия потомству (т.е. популяции F1) может произойти в случае, если крысиная ЭС клетка не подвергалась целевой генетической модификации. Кроме того, крысиная ЭС клетка, имеющая целевую генетическую модификацию, также является компетентной в отношении зародышевой линии, что означает, что когда крысиную ЭС клетку, имеющую целевую генетическую модификацию, имплантируют в крысиный эмбрион-хозяин, целевая генетическая модификация крысиной ЭС клетки передается потомству (т.е. популяции F1). Таким образом, в различных аспектах крысиные ЭС клетки и способы, описанные в данном документе, используются для получения высокой частоты или высокой эффективности передачи зародышевой линии генома крысиной клетки как от крысиных ЭС клеток, которые не подвергались целевой генетической модификации, так и от крысиных ЭС клеток, которые подвергались целевой генетической модификации. В различных вариантах реализации изобретения частота передачи зародышевой линии составляет больше чем 1:600, больше чем 1:500, больше чем 1:400, больше чем 1:300, больше чем 1:200 и больше чем 1:100. В различных вариантах реализации изобретения частота передачи зародышевой линии составляет больше чем 1%, больше чем 2%, больше чем 3%, больше чем 4%, больше чем 5%, больше чем 6%, больше чем 7%, больше чем 8%, больше чем 9%, больше чем 10%, до около 16%, больше чем 25%, больше чем 50%, больше чем 60%, больше чем 65%, больше чем 70%, больше чем 75% или больше. В различных вариантах реализации изобретения частота передачи зародышевой линии находится в диапазоне от 9% до 16%. В различных аспектах процент потомства, полученного из донорских кЭСК, в поколении F1 составляет 1% или больше, 2% или больше, 3% или больше, 10% или больше, 20% или больше, 30% или больше, 40% или больше, 50% или больше, 60% или больше, от 3% до около 10% или больше; от 3% или больше до около 63%, от около 10% до около 30%, от около 10% до около 50%, от около 30% до около 70%, от около 30% до около 60%, от около 20% до около 40%, от около 20% до 65% или от около 40% до 70%. Таким образом, крысиная ЭС клетка, представленная в настоящем документе, которая не подвергалась целевой генетической модификации, или, в альтернативном варианте, крысиная ЭС клетка, имеющая целевую генетическую модификацию, обладает способностью передавать их геном популяции F1.
Крысиная ЭС клетка, которая не подвергалась целевой генетической модификации, или крысиная ЭС клетка, имеющая целевую генетическую модификацию, может быть плюрипотентной и/или тотипотентной. Термин «плюрипотентная» или «плюрипотентность» относится к стволовой клетке, которая обладает потенциалом в любом из трех зародышевых слоев: энтодерме, мезодерме или эктодерме. Потентность клетки - это общий термин, который описывает способность дифференцироваться в другие типы клеток. См., например, публикацию Hans et al. (2007). «The Potential of Stem Cells: An Inventory». Human biotechnology as Social Challenge. Ashgate Publishing, Ltd. p. 28, включенную в данный документ посредством ссылки. Термин «тотипотентность» или «тотипотентный» представляет способность одной клетки делиться и производить все дифференцированные клетки в организме. См., например, публикацию Western Р (2009). Int. J. Dev. Biol. 53 (2-3): 393-409, включенную в данный документ посредством ссылки. В специфических вариантах реализации изобретения различные ЭС клетки, описанные в данном документе, могут быть плюрипотентными и/или тотипотентными.
Для определения того, является ли крысиная ЭС клетка плюрипотентной, можно использовать разные способы. Например, можно проводить анализ ЭС клетки на экспрессию различных маркеров плюрипотентности, включая, но не ограничиваясь этим, Oct-4, Sox2, щелочную фосфатазу или их комбинацию. См., например, публикации Okamoto, K. et al., Cell, 60: 461-472 (1990), Scholer, H.R. et al., EMBOJ. 9: 2185-2195 (1990)) и Nanog (Mitsui, K. et al., Cell, 113: 631-642 (2003), Chambers, I. et al., Cell, 113: 643-655 (2003) относительно различных анализов на наличие таких маркеров или их уровней. См., также Фигуры 2 и 3, представленные в данном документе. Другие маркеры плюрипотентности включают, например, присутствие по меньшей мере 1, 2, 3, 4 или 5 маркеров плюрипотентности, которые включают Nanog, Klf4, Dppa2, Fgf4, Rex1, Eras, Err-бета и/или Sall3. Другие маркеры плюрипотентности включают, например, отсутствие по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 маркеров плюрипотентности, которые включают T/Brachyury, Flk1, Nodal, Bmp4, Bmp2, Gata6, Sox17, Hhex1, Sox7 и/или Рах6.
В специфических вариантах реализации изобретения экспрессию и/или уровень экспрессии этих маркеров можно определить с использованием ОТ-ПЦР. Для определения уровня и/или наличия щелочной фосфатазы доступны различные наборы, в том числе, например, набор для окрашивания ткани ALP tissue staining kit (Sigma) и набор Vector Red Alkaline Phosphatase Substrate Kit I (Funakoshi) и тому подобное. Дополнительные анализы включают гибридизацию in situ, иммуногистохимический анализ, анализ иммунофлюоресценции. В специфических вариантах реализации изобретения крысиная ЭС клетка характеризуется экспрессией по меньшей мере одного маркера плюрипотентности, включая, например, экспрессию Oct-4, Sox2, щелочной фосфатазы или их комбинации и предпочтительно всех трех этих маркеров.
Различные крысиные ЭС клетки, представленные в настоящем документе (т.е. крысиные ЭС клетки, которые не подвергались целевой генетической модификации и/или крысиные ЭС клетки, имеющие целевую генетическую модификацию), способны сохранять плюрипотентность и/или тотипотентность при поддержании в условиях культивирования in vitro. Различные крысиные ЭС клетки, представленные в настоящем документе, в некоторых вариантах реализации изобретения могут быть субкультивированными, все еще сохраняя недифференцированное состояние. Различные способы культивации крысиных ЭС клеток описаны более подробно в других разделах данного документа.
Крысиные эмбриональные стволовые клетки, представленные в данном документе, были выделены из эмбриона крысы с использованием различных способов выделения, очистки и роста культуры, которые подробно описаны в других разделах данного документа. Используемый в данном документе термин «клетка» относится к отдельным клеткам, клеточным линиям или культурам, полученным из таких клеток. «Выделенная» ЭС клетка крысы или крысиного эмбриона была извлечена из ее природной среды. Термин «выделенный» может означать отсутствие 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99% составляющих, с которыми компонент находится в своем естественном состоянии. В данном документе определение «линия крысиных ЭС клеток» означает популяцию выделенных крысиных клеток, которые развивали из одной крысиной ЭС клетки, и, следовательно, популяция клеток в пределах данной клеточной линии имеет единую генетическую структуру, отличную от мутаций или кариотипических изменений, происходящих в процессе культивирования или во время целевых генетических модификаций. Например, как указано в других разделах данного документа, описанные крысиные ЭС клетки характеризуются высоким уровнем эуплоидии. Тем не менее, в некоторых клеточных линиях уровень эуплоидии составляет меньше 100% из-за кариотипических изменений при культивировании линии из одной клетки. Более того, данная популяция крысиных ЭС клеток может содержать по меньшей мере 10 в 3 степени, 10 в 4 степени, 10×104, 10×105, 10×106, 10×107, 10×108, 10×109 или 10×1010 клеток или больше. Некоторые клеточные популяции имеют достаточное количество клеток, что позволяет провести отбор желательной модифицированной клетки, но не слишком большое количество, чтобы уменьшить возможность мутаций или кариотипических изменений, развивающихся в клеточной линии. Например, некоторые популяции клеток имеют от 10 в 3 степени до 10 в 6 степени клеток.
Как описано в других разделах данного документа, для целевой генетической модификации линии крысиных ЭС клеток предлагаются различные способы. При осуществлении таких способов по меньшей мере одна клетка в линии крысиных ЭС клеток содержит целевую генетическую модификацию. С помощью различных способов культивирования и/или отбора получают линии крысиных ЭС клеток, имеющие одну или больше желательных целевых генетических модификаций.
В специфических вариантах реализации изобретения крысиная ЭС клетка, популяция крысиных ЭС клеток или линия крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) являются эуплоидными и, таким образом, имеют число хромосом, кратное гаплоидному числу. В дополнительном варианте реализации изобретения крысиная ЭС клетка, популяция крысиных ЭС клеток или линия крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) являются диплоидными и, таким образом, имеют два гаплоидных набора гомологичных хромосом. При упоминании популяции крысиных ЭС клеток или популяции клеток из данной популяции крысиных ЭС клеток или линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию), по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% клеток в данной популяции являются или эуплоидными и/или диплоидными. В других случаях при упоминании популяции крысиных ЭС клеток или популяции клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% клеток в данной популяции являются эуплоидными и/или диплоидными.
В дополнительных вариантах реализации изобретения крысиная ЭС клетка, популяция крысиных ЭС клеток или линия крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеют 42 хромосомы. При упоминании популяции крысиных ЭС клеток или популяции клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% клеток в данной популяции имеют 42 хромосомы. В других случаях, при упоминании популяции крысиных ЭС клеток или популяции клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию), по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% клеток в данной популяции имеют 42 хромосомы.
В дополнительных вариантах реализации изобретения крысиная ЭС клетка, популяция крысиных ЭС клеток или линия крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию), представленные в данном документе, образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro. «Сфероподобная» морфология относится к форме колоний крысиных ЭС клеток в культуре, а не к форме отдельных ЭС клеток. Колонии крысиных ЭС клеток являются сфероподобными. Колонии, свободно прикрепленные к питающим клеткам, являются круглыми (имеют морфологию, подобную кругу). Свободно плавающие колонии являются сфероподобными. Колонии крысиных ЭС клеток являются сфероподобными и очень компактными, что означает, что очень трудно увидеть границы между клетками. Край колонии яркий и четкий. Отдельные ядра трудно различить, потому что клетки очень малы (так что ядро занимает большую часть объема клетки). Мышиные ЭС клетки образуют вытянутые колонии и прочно прикрепляются к питающим клеткам. Морфология мЭСК может изменяться в зависимости от линии; например, колонии В6 более круглые и более куполообразные, чем колонии F1H4, но все еще более удлиненные по сравнению с кЭСК. Колонии ЭС клеток человека более плоские и более распространенные по сравнению с колониями мЭСК. Непосредственно колонии крысиных ЭС не являются плоскими и не похожи на колонии ЭС клеток человека.
В дополнительных вариантах реализации изобретения крысиная ЭС клетка, популяция крысиных ЭС клеток или линия крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеют круглую морфологию. Морфологическая шкала для круга приводится ниже, где оценка 10 представляет идеальный круг, а оценка 1 представляет эллипс.
Морфологическая шкала круга:
10 = Круг со структурой, имеющей продольную ось и вертикальную ось, которые проходят через центр структуры и имеют одинаковую длину.
9 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна ось составляет 0,9999-0,9357 длины другой оси.
8 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна ось составляет 0,9357-0,875 длины другой оси.
7 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна ось составляет от 0,875 до около 0,8125 длины другой оси.
6 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна ось составляет 0,8125-0,750 длины другой оси.
5 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна ось составляет 0,750-0,6875 длины другой оси.
4 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна ось составляет 0,6875-0,625 длины другой оси.
3 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна ось составляет 0,625-0,5625 длины другой оси.
2 = Структура, имеющая продольную ось и вертикальную ось, которые проходят через центр круга, причем одна ось составляет 0,5625-0,523 длины другой оси.
1 = Эллипс, который определяется как имеющий продольную ось и вертикальную ось, которые проходят через центр структуры, причем одна ось составляет 0,523-0,500 длины другой оси.
В одном неограничивающем варианте реализации изобретения популяция крысиных ЭС клеток или популяция клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеют по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% клеток в данной популяции с оценкой по шкале морфологии круга 10, 9 или 8. В других вариантах реализации изобретения популяция крысиных ЭС клеток или популяция клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеют по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% клеток в данной популяции с оценкой по шкале морфологии круга 10, 9 или 8.
В другом неограничивающем варианте реализации изобретения популяция крысиных ЭС клеток или популяция клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеют по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% клеток в данной популяции с оценкой по шкале морфологии круга 7, 6, 5, 4 или 3. В других неограничивающих вариантах реализации изобретения популяция крысиных ЭС клеток или популяция клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеют по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% клеток в данной популяции с оценкой по шкале морфологии круга 7, 6, 5, 4 или 3.
В дополнительных вариантах реализации изобретения, когда крысиные ЭС клетки (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) высевают на питающий клеточный слой in vitro, образуются сфероподобные колонии. Морфологическая шкала для сферы приводится ниже, где оценка 10 представляет идеальную сферу, а оценка 1 представляет трехмерную эллиптическую структуру.
Морфологическая шкала сфероподобной структуры:
10 = Сфера представляет собой структуру, имеющую ось X, ось Y и ось Z, каждая из которых проходит через центр структуры, и которые имеют одинаковую длину.
9 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из указанных осей составляет от 0,9999 до 0,9357 длины по меньшей мере одной из других осей.
8 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из указанных осей составляет от 0,9357 до 0,875 длины по меньшей мере одной или двух других осей.
7 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из указанных осей составляет от 0,875 до 0,8125 длины по меньшей мере одной или двух других осей.
6 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из указанных осей составляет от 0,8125 до 0,750 длины по меньшей мере одной или двух других осей.
5 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из указанных осей составляет от 0,750 до 0,6875 длины по меньшей мере одной или двух других осей.
4 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из указанных осей составляет от 0,6875 до 0,625 длины по меньшей мере одной или двух других осей.
3 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из указанных осей составляет от 0,625 до 0,5625 длины по меньшей мере одной или двух других осей.
2 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из указанных осей составляет от 0,5625 до 0,523 длины по меньшей мере одной или двух других осей.
1 = Структура, имеющая ось X, ось Y и ось Z, которые проходят через центр структуры, причем одна из указанных осей составляет от 0,523 до 0,500 длины по меньшей мере одной или двух других осей.
В одном неограничивающем варианте реализации изобретения популяция крысиных ЭС клеток или популяция клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеет по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% колоний, образованных при посеве клеток на питающий клеточный слой in vitro, с оценкой по шкале сфероподобной морфологии 10, 9 или 8. В других вариантах реализации изобретения популяция крысиных ЭС клеток или популяция клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеет по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% колоний, образованных при посеве клеток на питающий клеточный слой in vitro с оценкой по шкале сфероподобной морфологии 10, 9 или 8.
В другом неограничивающем варианте реализации изобретения популяция крысиных ЭС клеток или популяция клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеет по меньшей мере около 50%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% колоний, образованных при посеве клеток на питающий клеточный слой in vitro, с оценкой по шкале сфероподобной морфологии 7, 6, 5, 4 или 3. В других вариантах реализации изобретения популяция крысиных ЭС клеток или популяция клеток из данной линии крысиных ЭС клеток (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию) имеет по меньшей мере от около 50% до 95%, от около 60% до 90%, от около 60% до 95%, от около 60% до 85%, от около 60% до 80%, от около 70% до 80%, от около 70% до 85%, от около 70% до около 90%, от около 70% до около 95%, от около 70% до около 100%, от около 80% до около 100%, от около 80% до около 95%, от около 80% до около 90%, от около 90% до около 100%, от около 90% до около 99%, от около 90% до около 98%, от около 90% до около 97%, от около 90% до около 95% колоний, образованных при посеве клеток на питающий клеточный слой in vitro, с оценкой по шкале сфероподобной морфологии 7, 6, 5, 4 или 3.
Данная крысиная ЭС клетка, популяция крысиных ЭС клеток или линия крысиных ЭС клеток, представленная в настоящем документе, может быть мужской (XY) крысиной ЭС клеткой, мужской (XY) популяцией крысиных ЭС клеток или мужской (XY) линией крысиных ЭС клеток. В других вариантах реализации изобретения популяция крысиных ЭС клеток или линия крысиных ЭС клеток, представленная в данном документе, может быть женской (XX) крысиной ЭС клеткой, женской (XX) популяцией крысиных ЭС клеток или женской (XX) линией крысиных ЭС клеток. Любая такая крысиная ЭС клетка, популяция крысиных ЭС клеток или линия крысиных ЭС клеток может быть эуплоидной и/или диплоидной, как описано выше.
Различные крысиные ЭС клетки, представленные в данном документе, могут происходить от любой линии крыс, включая, но не ограничиваясь этим, линию крыс ACI, линию крыс Dark Agouti (DA), линию крыс Wistar rat, линию крыс LEA, линию крыс Sprague Dawley (SD) или линию крыс Fischer, такую как Fisher F344 или Fisher F6. Различные крысиные ЭС клетки также можно получать из линии, полученной из смеси двух или больше линий, перечисленных выше. В одном варианте реализации изобретения крысиная ЭС клетка получена из линии, выбранной из линии DA и линии ACI. В специфическом варианте реализации изобретения крысиная ЭС клетка получена из линии ACI. Линия крыс ACI характеризуется наличием черного агути с белым животом и лапами и гаплотипом RT1aν1. Такие линии являются коммерчески доступными из различных источников, включая Harlan Laboratories. В других вариантах реализации изобретения разные крысиные ЭС клетки получены из линии крыс Dark Agouti (DA), которая характеризуется наличием покрова агути и гаплотипом RT1aν1. Такие крысы являются коммерчески доступными из различных источников, включая Charles River и Harlan Laboratories. В дополнительном варианте реализации изобретения разные крысиные ЭС клетки, представленные в данном документе, получены из инбредных линий крыс.
В специфических вариантах реализации изобретения линия крысиных ЭС клеток получена от крысы ACI и содержит крысиную ЭС клетку ACI.G1, описанную в данном документе. В другом варианте реализации изобретения линия крысиных ЭС клеток получена от крысы DA и содержит крысиную ЭС клеточную линию DA.2B или крысиную ЭС клеточную линию DA.2C, описанную в настоящем документе.
Данная крысиная ЭС клетка, представленная в настоящем документе, может быть получена из эмбриона крысы на любой стадии развития эмбриона крысы. Типичные стадии развития эмбриона крысы представлены ниже в Таблице 1. Эмбрионы крыс, которые используют для получения крысиных ЭС клеток, могут представлять собой эмбрион на стадии морулы, эмбрион на стадии бластоцисты или эмбрион крысы на стадии развития между эмбрионом на стадии морулы и эмбрионом на стадии бластоцисты. Таким образом, в специфических вариантах реализации изобретения используемый эмбрион крысы находится между стадиями 5 и 7 по Вичи. В других вариантах реализации изобретения используемый эмбрион крысы находится на стадии 5, 6 или 7 по Вичи.
В одном варианте реализации изобретения крысиная ЭС клетка получена из бластоцисты крысы. В других вариантах реализации изобретения крысиная ЭС клетка получена из бластоцисты крысы с суперовуляцией. В других вариантах реализации изобретения крысиные ЭС клетки получают из эмбриона на стадии 8 клеток, который затем культивируют in vitro до его развития в эмбрион на стадии морулы, эмбрион на стадии бластоцисты или эмбрион на стадии развития между стадиями 5 и 7 по Вичи либо в эмбрион на стадии 5, 6 или 7 по Вичи. После чего в этот момент время эмбрионы высевали. Эмбрионы на стадии морулы представляют собой компактный шар клеток без внутренней полости. Эмбрионы на стадии бластоцисты имеют видимую внутреннюю полость (бластоцель) и содержат внутреннюю клеточную массу (ВКМ). ВКМ клетки из ЭС клетки.


Дополнительно представлены различные крысиные ЭС клетки (которые не подвергались целевой генетической модификации и/или имеют целевую генетическую модификацию), которые характеризуются следующим.
Крысиная ЭС клетка характеризуются:
i) экспрессией одного или более генов, специфических для крысиных ЭС клеток, включая белок, связанный с адгезионными контактами (Ajap1), клаудин 5 (Cldn5), фактор 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН рецептор А4 (Epha4), белок бета 5 межклеточных щелевых контактов (Gjb5), белок 1, подобный белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), фактор 1 детерминации асимметрии (Lefty1), альфа-рецептор фактора ингибирования лейкемии (Lifr), рецептор 2 лизофосфатидной кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpn18), гомеобокс 2 каудального типа (Cdx2), повторные домены 1 фибронектина III и анкирина (Fank1), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактор 1, связывающий лимфоидный энхансер (Lef1), ген 3, подобный Sal (дрозофила) (Sall3), гомеобокс 1 SATB (Satb1), miR-632 или их комбинацию;
ii) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более генов, специфических для крысиных ЭС клеток, включая белок, связанный с адгезионными контактами (Ajap1), клаудин 5 (Cldn5), фактор 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН рецептор А4 (Epha4), белок бета 5 межклеточных щелевых контактов (Gjb5), белок 1, подобный белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), фактор 1 детерминации асимметрии (Lefty1), альфа-рецептор фактора ингибирования лейкемии (Lifr), рецептор 2 лизофосфатидной кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpn18), гомеобокс 2 каудального типа (Cdx2), повторные домены 1 фибронектина III и анкирина (Fank1), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактор 1, связывающий лимфоидный энхансер (Lef1), ген 3, подобный Sal (дрозофила) (Sall3), гомеобокс 1 SATB (Satb1), miR-632 или их комбинацию;
iii) по меньшей мере 20-кратным повышением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 14, по сравнению с ЭС клеткой мышей линии F1H4;
iv) по меньшей мере 20-кратным повышением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 14, по сравнению с ЭС клеткой мышей линии F1H4;
v) экспрессией одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13;
vi) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13;
vii) по меньшей мере 20-кратным повышением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13, по сравнению с ЭС клеткой мышей линии F1H4;
viii) по меньшей мере 20-кратным повышением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13, по сравнению с ЭС клеткой мышей линии F1H4;
ix) по меньшей мере 20-кратным снижением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 12, по сравнению с ЭС клеткой мышей линии F1H4; и/или
x) по меньшей мере 20-кратным снижением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 12, по сравнению с ЭС клеткой мышей линии F1H4;
xi) любой комбинацией экспрессии генов, специфических для крысиных ЭС клеток согласно пунктам (i)-(x);
xii) уровнем относительной экспрессии маркеров плюрипотентности, как показано в Таблице 15, для по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 перечисленных маркеров плюрипотентности. См. уровни относительной экспрессии в колонке ранжирования плюрипотентности Таблицы 15;
xiii) уровнем относительной экспрессии мезодермальных маркеров, как показано в Таблице 15, для по меньшей мере 2, 3 или 4 перечисленных мезодермальных маркеров. См. уровни относительной экспрессии в колонке мезодермального ранжирования Таблицы 15;
xiv) уровнем относительной экспрессии эндодермальных маркеров, как показано в Таблице 15, для по меньшей мере 2, 3, 4, 5 или 6 перечисленных эндодермальных маркеров. См. уровни относительной экспрессии в колонке эндодермального ранжирования Таблицы 15;
xv) уровнем относительной экспрессии нейронных маркеров, как показано в Таблице 15, для по меньшей мере 2 и 3 перечисленных нейронных маркеров. См. уровни относительной экспрессии в колонке нейронного ранжирования Таблицы 15;
xvi) уровнем относительной экспрессии трофэктодермальных маркеров, как показано в таблице 15, для перечисленных трофэктодермальных маркеров. См. уровни относительной экспрессии в колонке трофэктодермального ранжирования Таблицы 15;
xvii) любым уровнем относительной экспрессии одного или более (2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30) маркеров плюрипотентности, мезодермальных маркеров, эндодермальных маркеров, нейронных маркеров и/или трофэктодермальных маркеров, приведенных в Таблице 15;
xviii) уровнем относительной экспрессии каждого из маркеров, приведенных в таблице 15;
xix) любой комбинацией сигнатур, приведенных в пунктах xii-xiix; и/или
xx) любой комбинацией сигнатур, приведенных в пунктах i-xiix.
В одном варианте реализации изобретения при трансплантации в эмбрион крысы на стадии преморулы крысиная ЭС клетка (которая не подвергалась целевой генетической модификации и/или имеет целевую генетическую модификацию) может вносить вклад по меньшей мере 90% клеток в поколение F0, вносить вклад по меньшей мере 95% клеток в поколение F0, вносить вклад по меньшей мере 96% клеток в поколение F0, вносить вклад по меньшей мере 97% клеток в поколение F0, вносить вклад по меньшей мере 98% клеток в поколение F0 или вносить вклад по меньшей мере 99% клеток в поколение F0.
III. Деривация и культивирование эмбриональных стволовых (ЭС) клеток
Предложены различные способы получения крысиных ЭС клеток, описанных в данном документе. В специфических вариантах реализации изобретения такие способы включают (a) предоставление культуры in vitro, содержащей питающий клеточный слой и популяцию выделенных крысиных эмбриональных стволовых (ЭС) клеток; (b) культивирование in vitro в условиях, достаточных для поддержания плюрипотентности и/или тотипотентности выделенной крысиной ЭС клетки. Такие способы, таким образом, позволяют культивировать популяцию крысиных ЭС клеток и/или линию крысиных ЭС клеток.
В одном варианте реализации изобретения предложен способ культивирования линии крысиных эмбриональных стволовых клеток. Такие способы включают культивирование in vitro питающего клеточного слоя и линии крысиных ЭС клеток, причем условия культивирования сохраняют плюрипотентность крысиных ЭС клеток и содержат среду с мышиным фактором ингибирования лейкемии (LIF) либо его активным вариантом или фрагментом. Различные способы дополнительно включают пересев и культивирование in vitro клеток линии крысиных ЭС клеток, причем каждое последующее культивирование in vitro включает культивирование крысиных ЭС клеток на питающем клеточном слое в условиях, которые сохраняют плюрипотентность крысиных ЭС клеток и содержат среду с мышиным LIF либо его активным вариантом или фрагментом.
i. Условия культивирования
Культуральная среда, используемая в различных способах и композициях, будет поддерживать крысиные ЭС клетки. Термины «поддержание» и «поддерживать» относятся к стабильному сохранению по меньшей мере одной или больше характеристик или фенотипов крысиных ЭС клеток, описанных в данном документе. Такие фенотипы могут включать поддержание плюрипотентности и/или тотипотентности, морфологии клеток, профилей экспрессии генов и других функциональных характеристик крысиных стволовых клеток, описанных в данном документе. Термин «поддерживать» может также включать культивирование стволовых клеток или увеличение количества культивируемых стволовых клеток. Этот термин также предусматривает условия культивирования, обеспечивающие сохранение плюрипотентности стволовых клеток, в то время как стволовые клетки могут продолжать или не продолжать делиться и увеличиваться в количестве.
Термин «питающая клетка» или «питающий клеточный слой» относится к культуре клеток, которая растет in vitro и секретирует по меньшей мере один фактор в культуральную среду, используемую для поддержания роста другой клетки, представляющей интерес, в культуре. Питающие клетки используются в настоящем изобретении с целью поддержания плюрипотентности крысиных ЭС клеток и, в специфических вариантах реализации изобретения, одной или больше других характеристик или фенотипов, описанных в данном документе. Можно использовать различные питающие клетки, включая, например, мышиные эмбриональные фибробласты, в том числе мышиные эмбриональные фибробласты, полученные между 12-м и 16-м днями беременности. В специфических вариантах реализации изобретения питающий клеточный слой содержит монослой митотически инактивированных мышиных эмбриональных фибробластов (МЭФ).
Культуры in vitro крысиных ЭС клеток дополнительно содержат эффективное количество фактора ингибирования лейкемии (LIF) либо его активного варианта или фрагмента. Фактор ингибирования лейкемии (LIF) принадлежит к семейству рецепторов IL-6. LIF связывается с гетеродимерным мембранным рецептором, состоящим из LIF-специфических субъединиц, gp190 или LIFR, и субъединицы gp130, которые являются общими с другими членами семейства IL-6. LIF ингибирует дифференциацию эмбриональных стволовых клеток у мышей и вносит вклад в самообновление стволовых клеток. LIF человека и мыши разделяют 79% гомологии последовательности и демонстрируют межвидовую активность. LIF крысы (rtLIF) представляет собой белок массой 22,1 кДа, содержащий 202 аминокислотных остатка, который демонстрирует 91% идентичности аминокислотной последовательности LIF мыши (Takahama et al. 1998). Существуют шесть возможных аспарагин-связанных сайтов гликозилирования (N-гликозилирование), которые являются консервативными среди LIF полипептидов от различных видов и дополнительного сайта Asn150, специфического для LIF крыс. Третичная структура LIF мыши и ее функции более подробно описаны в публикациях Aikawa et al. (1998) Biosci. Biotechnol. Biochem. 62 1318-1325 и Senturk et al. (2005) Immunology of Pregnancy, editor Gil Mor., патенте США №5750654 и публикации D Р Gearing (1987) EMBO Journal 1987-12-20, которые включены в данный документ в полном объеме посредством ссылки. Частичная последовательность LIF мыши зарегистрирована на веб-сайте SwissProt под номером доступа Р09056.
Активность LIF мыши оценивают по его способности индуцировать дифференциацию клеток миелолейкоза M1. Специфическая активность составляет 1×106 единиц/мл (номер по каталогу 03-0011 от Stemgent) и 1×107 единиц/мл (номер по каталогу 03-0011-100 от Stemgent), где 50 единиц определяется как количество мышиного LIF, необходимого для индукции дифференциации у 50% колоний M1 в 1 мл среды. См. также публикации Williams, R.L. et al. (1988) Nature 336: 684-687.; Metcalf, D. et al. (1988) Leukemia 2: 216-221; Niwa, H. et al. (2009) Nature 460: 118-122; Xu, J. et al. (2010) Cell Biol Int. 34: 791-797; Fukunaga, N. et al. (2010) Cell Reprogram. 12: 369-376; и Metcalf D. (2003) Stem Cells 21: 5-14, к которые включены в данный документ в полном объеме посредством ссылки. «Эффективное количество LIF» означает концентрацию LIF, которая позволяет культуре крысиных ЭС клеток in vitro оставаться в недифференцированном плюрипотентном состоянии. Различные маркеры, которые могут быть использованы для анализа клеток, остающихся в плюрипотентном состоянии, описаны в других разделах данного документа.
Полипептид LIF, используемый в различных способах и композициях, представленных в данном документе, может быть получен от любого организма, включая млекопитающее, грызуна, человека, крысу или мышь. В одном варианте реализации изобретения полипептид LIF получен от мыши. В дополнительных вариантах реализации изобретения мышиный полипептид LIF имеет аминокислотную последовательность, приведенную под номером доступа SwissProt: Р09056, которая включена в данный документ в полном объеме посредством ссылки, а также приведена в SEQ ID NO: 1.
В других вариантах реализации изобретения можно использовать активный вариант или фрагмент мышиного полипептида LIF, приведенного в SEQ ID NO: 1 или под номером доступа SwissProt: Р09056. Такие активные варианты и фрагменты (включая активные варианты, имеющие по меньшей мере 75%, 80%, 85% 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности с SEQ ID NO: 1) более подробно описаны в других разделах данного документа.
Полипептид LIF, или его активный вариант, или фрагмент может быть предоставлен в культуру in vitro различными способами. В одном варианте реализации изобретения эффективное количество полипептида LIF, или его активного варианта, или фрагмента добавляют в культуральную среду. В других вариантах реализации изобретения питающие клетки генетически модифицируют для сверхэкспрессии полипептида LIF либо его активного варианта или фрагмента. Такие питающие клетки включают питающие клетки, полученные из фибробластов мышей линии DIA-M, подвергшихся гамма-облучению или обработке митомицином-С, которые экспрессируют связанный с матриксом LIF. Способ создания и использования таких генетически модифицированных питающих клеток можно найти, например, в публикациях Buehr et al. (2003) Biol Reprod 68:222-229, Rathjen et al. (1990) Cell 62 1105-1115 и Buehr et al. (2008) Cell 135:1287-1298, которые включены в данный документ посредством ссылки. Гетерологичный LIF, экспрессируемый в питающих клетках, может быть из того же организма, что и питающие клетки, или из организма, отличного от того, из которого получена питающая клетка. Кроме того, гетерологичный LIF, экспрессируемый в питающих клетках, может быть из того же или из другого организма, что и ЭС клетки, которые поддерживает питающий слой.
В других вариантах реализации изобретения питающие клетки, используемые в различных способах, описанных в настоящем документе, не являются генетически модифицированными для экспрессии гетерологичного полипептида LIF либо его активного варианта или фрагмента. Таким образом, в конкретных вариантах реализации изобретения монослой митотически инактивированных мышиных эмбриональных фибробластов, используемый в способах настоящего изобретения, не был генетически модифицирован для экспрессии гетерологичного полипептида LIF.
В других вариантах реализации изобретения полипептид LIF либо его активный вариант или фрагмент добавляют в культуральную среду. Если LIF добавляют в культуральную среду, указанный LIF может быть получен от любого организма, включая млекопитающее, грызуна, человека, крысу или мышь. В одном варианте реализации изобретения LIF, находящийся в культуральной среде, получен от мыши. В дополнительных вариантах реализации изобретения мышиный полипептид LIF имеет аминокислотную последовательность, приведенную в SEQ ID NO: 1. В других вариантах реализации изобретения может быть использован активный вариант или фрагмент мышиного полипептида LIF, приведенный в SEQ ID NO: 1. Такие активные варианты и фрагменты (включая активные варианты, имеющие по меньшей мере 75%, 80%, 85% 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности с SEQ ID NO: 1) более подробно описаны в других разделах настоящего документа.
В специфических вариантах реализации изобретения крысиные ЭС клетки и линии крысиных ЭС клеток, представленные в данном документе, сохраняют плюрипотентность in vitro без потребности в паракринной сигнализации LIF.
В специфических вариантах реализации изобретения LIF, или его активный вариант или фрагмент присутствует в культуральной среде в любой концентрации, которая сохраняет крысиные ЭС клетки. Полипептид LIF, или его активный вариант, или фрагмент присутствует в культуральной среде в концентрации от около 25 Ед/мл до около 50 Ед/мл, от около 50 Ед/мл до около 100 Ед/мл, от около 100 Ед/мл до около 125 Ед/мл, от около 125 Ед/мл до около 150 Ед/мл, от около 150 Ед/мл до около 175 Ед/мл, от около 175 Ед/мл до около 200 Ед/мл, от около 200 Ед/мл до около 225 Ед/мл, от около 225 Ед/мл до около 250 Ед/мл, от около 250 Ед/мл до около 300 Ед/мл, от около 300 Ед/мл до около 325 Ед/мл, от около 325 Ед/мл до около 350 Ед/мл, от около 350 Ед/мл до около 400 Ед/мл, от около 400 Ед/мл до около 425 Ед/мл, от около 425 Ед/мл до около 450 Ед/мл, от около 450 Ед/мл до около 475 Ед/мл, от около 475 Ед/мл до около 500 Ед/мл, от около 75 Ед/мл до около 500 Ед/мл или больше. В других вариантах реализации изобретения полипептид LIF, или его активный вариант, или фрагмент присутствует в культуральной среде в концентрации от около 25 Ед/мл до около 50 Ед/мл, от около 25 Ед/мл до около 100 Ед/мл, от около 75 Ед/мл до около 125 Ед/мл, от около 50 Ед/мл до около 150 Ед/мл, от около 90 Ед/мл до около 125 Ед/мл, от около 90 Ед/мл до около 110 Ед/мл, от около 80 Ед/мл до около 150 Ед/мл, от около 80 Ед/мл до около 125 Ед/мл. В специфическом варианте реализации изобретения полипептид LIF, или его активный вариант, или фрагмент присутствует в культуральной среде в концентрации около 100 Ед/мл.
Если используется мышиный LIF, мышиный полипептид LIF, или его активный вариант, или фрагмент присутствует в культуральной среде в любой концентрации, которая сохраняет крысиные ЭС клетки. Мышиный полипептид LIF, или его активный вариант, или фрагмент присутствует в концентрации от около 25 Ед/мл до около 50 Ед/мл, от около 50 Ед/мл до около 100 Ед/мл, от около 100 Ед/мл до около 125 Ед/мл, от около 125 Ед/мл до около 150 Ед/мл, от около 150 Ед/мл до около 175 Ед/мл, от около 175 Ед/мл до около 200 Ед/мл, от около 200 Ед/мл до около 225 Ед/мл, от около 225 Ед/мл до около 250 Ед/мл, от около 250 Ед/мл до около 300 Ед/мл, от около 300 Ед/мл до около 325 Ед/мл, от около 325 Ед/мл до около 350 Ед/мл, от около 350 Ед/мл до около 400 Ед/мл, от около 400 Ед/мл до около 425 Ед/мл, от около 425 Ед/мл до около 450 Ед/мл, от около 450 Ед/мл до около 475 Ед/мл, от около 475 Ед/мл до около 500 Ед/мл, от около 75 Ед/мл до около 500 Ед/мл или больше. В других вариантах реализации изобретения мышиный полипептид LIF, или его активный вариант, или фрагмент присутствует в концентрации от около 25 Ед/мл до около 50 Ед/мл, от около 25 Ед/мл до около 100 Ед/мл, от около 75 Ед/мл до около 125 Ед/мл, от около 50 Ед/мл до около 150 Ед/мл, от около 90 Ед/мл до около 125 Ед/мл, от около 90 Ед/мл до около 110 Ед/мл, от около 80 Ед/мл до около 150 Ед/мл, от около 80 Ед/мл до около 125 Ед/мл. В специфическом варианте реализации изобретения мышиный полипептид LIF, или его активный вариант, или фрагмент присутствует в культуральной среде в концентрации около 100 Ед/мл.
Используемая культуральная среда поддерживает крысиные ЭС клетки. Таким образом, в специфических вариантах реализации изобретения культуральная среда, используемая в различных способах и композициях, будет поддерживать плюрипотентность всех или большинства (т.е. более 50%) крысиных ЭС клеток в клеточной линии в течение периода, равного по меньшей мере 5, 10 или 15 пересевам. В одном варианте реализации изобретения культуральная среда содержит одно или больше соединений, помогающих в поддержании плюрипотентности. В одном варианте реализации изобретения культуральная среда содержит ингибитор пути MEK и ингибитор гликогенсинтазы-киназы-3 (GSK-3). Среда может дополнительно содержать дополнительные компоненты с целью поддержания ЭС клеток, включая, например, ингибиторы рецептора FGF, ингибиторы ROCK и/или ингибиторы ALK (рецептор TGFb). Неограничивающий пример ингибиторов рецептора FGF включает PD184352. Неограничивающий пример ингибитора ROCK включает Y-27632, а неограничивающий пример ингибитора ALK (рецептор TGFb) включает А-83-01. В специфических вариантах реализации изобретения при оттаивании криоконсервированных кЭСК или при пересеве кЭСК после диссоциации трипсином используется среда 2i (Таблица 2) с 10 мкМ ROCKi.
В других вариантах реализации изобретения среда содержит комбинацию ингибиторов, состоящую из ингибитора пути MEK и ингибитора гликогенсинтазы-киназы-3 (GSK-3).
В одном неограничивающем варианте реализации изобретения культуральная среда содержит ингибитор GSK-3, представляющий собой CHIR99021, и/или содержит ингибитор MEK, представляющий собой PD0325901. В других вариантах реализации изобретения среда содержит комбинацию ингибиторов, состоящую из CHIR99021 и PD0325901. Любое из этих соединений может быть получено, например, от компании Stemgent. В специфических вариантах реализации изобретения CHIR99021 присутствует в культуральной среде в концентрации от около 0,5 мкМ до около 3 мкМ, от около 0,5 мкМ до около 3,5 мкМ, от около 0,5 мкМ до около 4 мкМ, от около 0,5 мкМ до около 1 мкМ, от около 1 мкМ до около 1,5 мкМ, от около 1,5 мкМ до около 2 мкМ, от около 2 мкМ до около 2,5 мкМ, от около 2,5 до около 3 мкМ, от 3 мкМ до около 3,5 мкМ. В дополнительных вариантах реализации изобретения CHIR99021 присутствует в культуральной среде в концентрации около 3 мкМ. В других вариантах реализации изобретения PD0325901 присутствует в культуральной среде в концентрации от около 0,4 мкМ до около 1 мкМ, от около 0,4 мкМ до около 1,5 мкМ, от около 0,4 мкМ до около 2 мкМ, от около 0,4 мкМ до около 0,8 мкМ, от 0,8 мкМ до около 1,2 мкМ, от около 1,2 до около 1,5 мкМ. В дополнительных вариантах реализации изобретения PD0325901 присутствует в культуральной среде в концентрации около 1 мкМ. В специфических вариантах реализации изобретения CHIR99021 присутствует в культуральной среде в концентрации около 3 мкМ, a PD0325901 присутствует в концентрации около 1 мкМ.
В одном неограничивающем варианте реализации изобретения культуральная среда, используемая в различных способах и композициях, описанных в данном документе, представлена в Таблице 2. В контексте данной заявки среда, описанная в Таблице 2, называется средой 2i.

Дополнительные среды, которые могут быть использованы, включают описанные в публикациях Li et al. (2008) Cell 135:1299-1310, Yamamoto et al. (2012) Transgenic Rats 21:743-755, Ueda et al. (2008) PLoS ONE 3(6):e2800, Meek et al. (2010) PLoS ONE 4(12):e14225; Tong et al. (2010) Nature 467:211-213; публикации патента США 2012/0142092, Buehr et al. (2008) Cell 135:1287-1298, Li et al. (135) Cell 1299-1310, которые включены в данный документ в полном объеме посредством ссылки. При использовании таких сред концентрация и источник LIF могут быть изменены, как описано в данном документе. В специфических вариантах реализации изобретения различные культуральные среды используют в комбинации с мышиным LIF либо его активным вариантом или фрагментом, и в дополнительных вариантах реализации изобретения различные культуральные среды содержат мышиный LIF либо его активный вариант или фрагмент в концентрации от около 50 Ед/мл до около 100 Ед/мл, от около 50 Ед/мл до около 150 Ед/мл или около 100 Ед/мл.
Температуру культур крысиных ЭС клеток, как для производства ЭС клеточной линии, так и для культивирования и поддержания линии ЭС, обычно поддерживают на уровне от около 35°С до около 37,5°С. В специфическом варианте реализации изобретения температура составляет 37,0°С. Культивирование обычно осуществляют с использованием 7,5% СО2.
ii. Создание линии крысиных ЭС клеток
Предлагаются способы создания крысиных эмбриональных стволовых (ЭС) клеток. Такие способы включают (a) культивирование in vitro первого питающего клеточного слоя и эмбриона на стадии морулы, эмбриона на стадии бластоцисты или эмбриона крысы на стадии развития между эмбрионом на стадии морулы и эмбрионом на стадии бластоцисты, где у эмбриона крысы была удалена блестящая оболочка яйцеклетки и где условия культивирования сохраняют плюрипотентность крысиной ЭС клетки и содержат среду с мышиным фактором ингибирования лейкемии (LIF) либо его активным вариантом или фрагментом; и (b) перенос разрастания аморфной недифференцированной массы крысиных ЭС клеток в лунку для культивирования in vitro, содержащую второй питающий клеточный слой, и культивирование разрастания в условиях, которые сохраняют плюрипотентность крысиных ЭС клеток, и содержат среды с мышиным LIF либо его активным вариантом или фрагментом, тем самым создавая линию крысиных ЭС клеток. Различные способы дополнительно включают пересев и культивирование in vitro клеток линии крысиных ЭС клеток, причем каждое последующее культивирование in vitro включает культивирование крысиных ЭС клеток на питающем клеточном слое в условиях, которые сохраняют плюрипотентность крысиных ЭС клеток и содержат среду с мышиным LIF либо его активным вариантом или фрагментом. Также предлагаются линии крысиных ЭС клеток, полученных такими способами.
Неограничивающие примеры способов создания линии крысиных ЭС клеток, имеющей различные характеристики, которые рассматриваются в данном документе, представлены в Примере 3. Вкратце, эмбрион крысы (т.е. эмбрион на стадии морулы, эмбрион на стадии бластоцисты или эмбрион крысы на стадии развития между эмбрионом на стадии морулы и эмбрионом на стадии бластоцисты) вымывают из маток самок крыс. В специфических вариантах реализации изобретения получают бластоцисту или 8-клеточный эмбрион. Блестящую оболочку яйцеклетки удаляют и эмбрионы крыс культивируют на питающих клетках (как описано в других разделах данного документа), которые в специфических вариантах реализации изобретения содержат монослой митотически инактивированных мышиных эмбриональных фибробластов (МЭФ). Клетки эмбриона на стадии морулы, эмбриона на стадии бластоцисты или эмбриона крысы на стадии развития между эмбрионом на стадии морулы и эмбрионом на стадии бластоцисты культивируют in vitro в условиях, которые сохраняют крысиные ЭС клетки и, таким образом, являются достаточными для сохранения плюрипотентности и/или тотипотентности ЭС клеток. На этой стадии можно использовать различные среды, в том числе любую из различных сред, рассмотренных выше, которые содержат в средах LIF, в том числе мышиный LIF либо его активный вариант или фрагмент.
Культуры наблюдают на наличие разрастания (аморфная недифференцированная масса клеток). После того как разрастание достигает соответствующего размера, данное разрастание переносят на новый питающий планшет и культивируют. Для получения множества колоний перенос сопровождается ферментативной диссоциацией с использованием трипсина. Этот перенос обычно называют «пересев 1». Скорость, с которой растет каждая линия, различна. Среды меняют по мере необходимости, чтобы поддерживать плюрипотентность или тотипотентность крысиных ЭС клеток. Культуры наблюдают на наличие колоний, имеющих морфологию эмбриональных стволовых клеток. Такая морфология включает одну или больше следующих характеристик: (a) круглые, циркулярные бугорки, возвышающиеся над монослоем питающих клеток; (b) клетки, плотно упакованные вместе, так что клеточные границы трудно увидеть; (c) более маленький размер клеток; (d) небольшое количество цитоплазмы и увеличенное ядро, (e) образуют сфероподобные колонии при посеве на питающие клетки in vitro. После того, как появляются такие колонии, культивирование может продолжаться до достижения примерно 50% слияния. Колонии затем переносят на новый питающий планшет. Для увеличения числа колоний перенос сопровождается ферментативной диссоциацией с использованием трипсина. Этот процесс называют «пересев 2». Клетки продолжают культивировать с питающими клетками до достижения около 50% слияния, после чего эти клетки могут подвергаться дополнительным пересевам для поддержания клеточных линий или эти линии могут быть заморожены. См. также публикации Tong et al. (2010) Nature 467(9):211-215; Li et al. (2008) Cell 135:1299-1310 и Buehr et al. (2008) Cell 135:1287-1298, которые включены в данный документ посредством ссылки. Таким образом, в специфических вариантах реализации изобретения возможна субкультивация и поддержание недифференцированного состояния различных крысиных ЭС клеток, линий клеток и популяций клеток, описанных в данном документе.
В одном неограничивающем варианте реализации изобретения деривация крысиных ЭС клеток происходит следующим образом. В день 0 самок крыс умерщвляют и отсекают маточные трубы и рога матки и помещают в чашку с культурой ткани, содержащую теплую среду N2B27. Средой промывают рога матки и маточные трубы, чтобы извлечь бластоцисты в среду. Бластоцисты собирают и переносят на чашку для культивирования эмбриона, содержащую KSOM + 2i (1 мк MPD0325901, 3 мк М CHIR99021). KSOM можно приобрести в компании Millipore, номер по каталогу MR-106-D. Среда 2i, упоминавшаяся в данном документе, содержит набор сред, приведенный в Таблице 2. Клетки культивируют в течение ночи при 37°С и 7,5% CO2.
В других неограничивающих вариантах реализации изобретения крысиные ЭС клетки получают от 8-клеточных эмбрионов или замороженных 8-клеточных эмбрионов. Эмбрионы культивируют в среде М2 в течение 10 минут при комнатной температуре, а потом переносят на среду KSOM + 2i и культивируют в течение ночи.
В неограничивающем примере деривация крысиных ЭС клеток происходит следующим образом: на День 1 - перенос эмбрионов с наличием полости в среду 2i (Таблица 2) и культивирование в течение ночи. Культивирование эмбрионов без сформированной полости продолжают в среде KSOM + 2i. На день 2 все оставшиеся эмбрионы переносят в среду 2i, независимо от того, произошло ли образование в них полости. Культивирование продолжают в течение ночи в среде 2i. На день 3 эмбрионы инкубируют с кислотой Тироде для удаления блестящей оболочки яйцеклетки и промывают 3 раза в среде 2i для удаления кислоты Тироде. Каждый эмбрион депонируют в отдельной лунке питающего планшета, в котором каждая лунка содержит монослой митотически инактивированных мышиных эмбриональных фибробластов (МЭФ). Клетки культивируют в течение ночи в среде 2i. На день 4 и 5 посеянные клетки эмбрионов наблюдают на наличие разрастания, аморфной недифференцированной массы клеток. Разрастания готовы для переноса, когда их размер увеличивается в два раза по сравнению с размером высеянного эмбриона. Каждый день истощенную среду удаляют и заменяют свежей средой 2i. Разрастания переносят в новые питающие лунки, и снова удаляют истощенную среду, и питающие лунки промывают фосфатно-солевым буферным раствором, ФСБ. Удаляют ФСБ, добавляют трипсин и инкубируют около 10 минут. Реакцию с трипсином останавливают добавлением 30 мкл среды 2i и 10% фетальной бычьей сыворотки (ФБС). Клетки осторожно диссоциируют и все содержимое переносят в лунку питающего планшета. Этот процесс называют «Пересев 1» 1 (Р1). Клетки культивируют в течение ночи в среде 2i. С дня 5-8, в зависимости от того, как быстро растет каждая линия, среду 2i меняют каждый день и культуры наблюдают на наличие колоний, имеющих морфологию ЭСК. Такая морфология ЭСК подробно описана в других разделах данного документа. Культивирование продолжается до тех пор, пока колонии не разрастутся до около 50% слияния. Затем колонии обрабатывают трипсином и пересевают, как и раньше, в питающие лунки. Этот процесс называют «пересев 2». Питание и наблюдение за каждой линией продолжается до тех пор, пока не произойдет около 50% слияния. Клетки, как обычно, обрабатывают трипсином. Реакцию с трипсином останавливают добавлением среды 2i + 10% ФБС. Клетки осаждают центрифугированием, и клетки помещают в 400 мкл среды для замораживания (70% 2i, 20% ФБС, 10% ДМСО). После этого клетки можно заморозить. Этот процесс называют «пересев 3».
iii. Поддержание и пересев линии крысиных ЭС клеток
Дополнительно предложены способы поддержания или культивирования клеточной линии эмбриональных стволовых клеток крысы. Этот способ включает культивирование in vitro питающего клеточного слоя и линии крысиных ЭС клеток, причем условия культивирования сохраняют плюрипотентность крысиных эмбриональных стволовых (ЭС) клеток и содержат среду с мышиным фактором ингибирования лейкемии (LIF) либо его активным вариантом или фрагментом. В таких способах используют культуральную среду и питающий клеточный слой, как описано выше. В одном варианте реализации изобретения линию крысиных ЭС клеток можно пересевать по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 40, 50 или больше раз. В вариантах реализации изобретения крысиные ЭС клетки можно пересевать до по меньшей мере 11 раз в среде, содержащей ингибитор GSK3 и ингибитор МЕК, без снижения ее целевой эффективности или эффективности трансмиссии через зародышевую линию целевой генетической модификации.
Линии крысиных ЭС клеток питают и наблюдают. В специфических вариантах реализации изобретения пересев осуществляют при слиянии культуры, составляющем около 30%, 40%, 50% или 60%. В других вариантах реализации изобретения пересев осуществляют при слиянии культуры на 50%. В зависимости от того, как быстро растет каждая линия, пересев можно осуществлять каждые 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 55, 60, 65, 70, 75, 80, 90, 95 или 100 часов. В других вариантах реализации изобретения время между пересевами находится в диапазоне от 24 часов до 96 часов, от около 30 до 50 часов, от около 25 до 75 часов, от около 50 до 96 часов, от около 25 до 75 часов, от около 35 до 85 часов или от около 40 до 70 часов. В одном варианте реализации изобретения время удвоения крысиной ЭС клетки, линии клеток или популяции клеток, описанной в настоящем документе, находится в диапазоне от около 24 часов до около 36 часов. В одном варианте реализации изобретения время удвоения крысиной ЭС клетки составляет 25 часов.
Различные линии крысиных ЭС клеток при получении и поддержании, описанном в данном документе, могут иметь одно или более следующих свойств:
(a) обладают компетентностью зародышевой линии, что означает, что при имплантации крысиной ЭС клетки в крысиный эмбрион-хозяин геном линии крысиных ЭС клеток передается потомству;
(b) обладают компетентностью зародышевой линии после целевой генетической модификации, что означает, что при имплантации крысиной ЭС клетки в крысиный эмбрион-хозяин целевая генетическая модификация в геноме линии крысиных ЭС клеток передается потомству;
(c) обладают плюрипотентностью in vitro;
(d) обладают тотипотентностью in vitro;
(e) при культивации in vitro свободно прикрепляются к питающему клеточному слою;
(f) при культивации in vitro образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro;
(g) сохраняют плюрипотентность при культивации in vitro в условиях, включающих питающий клеточный слой, который не является генетически модифицированным для экспрессии фактора ингибирования лейкемии (LIF), причем культуральная среда содержит достаточную концентрацию LIF;
(h) сохраняют плюрипотентность при культивации in vitro в условиях, включающих питающий клеточный слой, причем культуральная среда содержит мышиный LIF либо его активный вариант или фрагмент;
(i) имеют молекулярную сигнатуру, которая характеризуется следующим:
i) экспрессией одного или более генов, специфических для крысиных ЭС клеток, включая белок, связанный с адгезионными контактами (Ajap1), клаудин 5 (Cldn5), фактор 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН рецептор А4 (Epha4), белок бета 5 межклеточных щелевых контактов (Gjb5), белок 1, подобный белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), фактор 1 детерминации асимметрии (Lefty1), альфа-рецептор фактора ингибирования лейкемии (Lifr), рецептор 2 лизофосфатидной кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpn18), гомеобокс 2 каудального типа (Cdx2), повторные домены 1 фибронектина III и анкирина (Fank1), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактор 1, связывающий лимфоидный энхансер (Lef1), ген 3, подобный Sal (дрозофила) (Sall3), гомеобокс 1 SATB (Satb1), miR-632 или их комбинацию;
ii) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более генов, специфических для крысиных ЭС клеток, включая белок, связанный с адгезионными контактами (Ajap1), клаудин 5 (Cldn5), фактор 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН рецептор А4 (Epha4), белок бета 5 межклеточных щелевых контактов (Gjb5), белок 1, подобный белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), фактор 1 детерминации асимметрии (Lefty1), альфа-рецептор фактора ингибирования лейкемии (Lifr), рецептор 2 лизофосфатидной кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpn18), гомеобокс 2 каудального типа (Cdx2), повторные домены 1 фибронектина III и анкирина (Fank1), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактор 1, связывающий лимфоидный энхансер (Lef1), ген 3, подобный Sal (дрозофила) (Sall3), гомеобокс 1 SATB (Satb1), miR-632 или их комбинацию;
iii) по меньшей мере 20-кратным повышением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 14, по сравнению с ЭС клеткой мышей линии F1H4;
iv) по меньшей мере 20-кратным повышением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 14, по сравнению с ЭС клеткой мышей линии F1H4;
v) экспрессией одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13;
vi) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13;
vii) по меньшей мере 20-кратным повышением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13, по сравнению с ЭС клеткой мышей линии F1H4;
viii) по меньшей мере 20-кратным повышением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13, по сравнению с ЭС клеткой мышей линии F1H4;
ix) по меньшей мере 20-кратным снижением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 12, по сравнению с ЭС клеткой мышей линии F1H4; и/или
x) по меньшей мере 20-кратным снижением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 12, по сравнению с ЭС клеткой мышей линии F1H4;
xi) любой комбинацией экспрессии генов, специфических для крысиных ЭС клеток согласно разделам (i)-(x);
xii) уровнем относительной экспрессии маркеров плюрипотентности, как показано в Таблице 15, для по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 перечисленных маркеров плюрипотентности. См. уровни относительной экспрессии в колонке ранжирования плюрипотентности Таблицы 15;
xiii) уровнем относительной экспрессии мезодермальных маркеров, как показано в Таблице 15, для по меньшей мере 2, 3 или 4 перечисленных мезодермальных маркеров. См. уровни относительной экспрессии в колонке мезодермального ранжирования Таблицы 15;
xiv) уровнем относительной экспрессии эндодермальных маркеров, как показано в Таблице 15, для по меньшей мере 2, 3, 4, 5 или 6 перечисленных эндодермальных маркеров. См. уровни относительной экспрессии в колонке эндодермального ранжирования таблицы 15;
xv) уровнем относительной экспрессии нейронных маркеров, как показано в Таблице 15, для по меньшей мере 2 и 3 перечисленных нейронных маркеров. См. уровни относительной экспрессии в колонке нейронного ранжирования Таблицы 15;
xvi) уровнем относительной экспрессии трофэктодермальных маркеров, как показано в Таблице 15, для перечисленных трофэктодермальных маркеров. См. уровни относительной экспрессии в колонке трофэктодермального ранжирования Таблицы 15;
xvii) любым уровнем относительной экспрессии одного или более (2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30) маркеров плюрипотентности, мезодермальных маркеров, эндодермальных маркеров, нейронных маркеров и/или трофэктодермальных маркеров, приведенных в Таблице 15;
xviii) уровнем относительной экспрессии каждого из маркеров, приведенных в Таблице 15;
xix) любой комбинацией сигнатур, приведенных в разделах xii-xiix; и/или
xx) любой комбинацией сигнатур, приведенных в разделах i-xiix;
(j) обладают способностью продуцировать крысу F0;
(k) способны к субкультивированию и поддержанию недифференцированного состояния;
(l) имеют то же количество хромосом, что и клетка нормальной крысы; и/или
(m) сохраняют плюрипотентность in vitro без потребности в паракринной сигнализации LIF;
(n) обладают способностью самообновления, что означает, что они делятся бесконечно, сохраняя плюрипотентность.
Такие свойства данной линии крысиных ЭС клеток могут присутствовать в любом из пересевов, в том числе в пересевах 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 40, 50 или позже.
Таким образом, в одном неограничивающем варианте реализации изобретения предлагается культура in vitro, содержащая питающий клеточный слой и популяцию крысиных ЭС клеток, причем условия культивирования in vitro сохраняют плюрипотентность крысиных ЭС клеток и содержат среду с мышиным фактором ингибирования лейкемии (LIF) либо его активным вариантом или фрагментом. В специфических вариантах реализации изобретения в крысиных ЭС клетках, культивируемых в таких условиях, плюрипотентность сохраняется по меньшей мере у 50% популяции клеток на протяжении по меньшей мере 10 пересевов, плюрипотентность сохраняется по меньшей мере у 60% популяции клеток на протяжении по меньшей мере 10 пересевов, плюрипотентность сохраняется по меньшей мере у 70% популяции клеток на протяжении по меньшей мере 10 пересевов, плюрипотентность сохраняется по меньшей мере у 75% популяции клеток на протяжении по меньшей мере 10 пересевов, плюрипотентность сохраняется по меньшей мере у 80% популяции клеток на протяжении по меньшей мере 10 пересевов, плюрипотентность сохраняется по меньшей мере у 85% популяции клеток на протяжении по меньшей мере 10 пересевов, плюрипотентность сохраняется по меньшей мере у 90% популяции клеток на протяжении по меньшей мере 10 пересевов или плюрипотентность сохраняется по меньшей мере у 95% популяции клеток на протяжении по меньшей мере 10 пересевов.
Дополнительно в настоящем документе предлагаются культуры in vitro, содержащие различные крысиные ЭС клетки, популяции клеток и линии клеток, описанные в данном документе, а также наборы для культивирования этих различных ЭС клеток. Например, как описано выше, в специфических вариантах реализации изобретения различные крысиные ЭС клетки, представленные в данном документе, имеют одну или больше следующих характеристик: (1) при культивации in vitro свободно прикрепляются к питающему клеточному слою; (2) при культивации in vitro они образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro; (3) они поддерживают плюрипотентность при культивации in vitro в условиях, включающих питающий клеточный слой, который не является генетически модифицированным для экспрессии фактора ингибирования лейкемии (LIF), причем культуральная среда содержит достаточную концентрацию LIF; и/или (4) они способны к субкультивированию и поддержанию недифференцированного состояния. Более того, популяции крысиных ЭС клеток в любой их этих in vitro культур могут содержать, например, популяцию клеток, в которой по меньшей мере 70%, 75%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% клеток в популяции являются эуплоидными, диплоидными и/или имеют 42 хромосомы.
Один способ культивирования крысиных эмбриональных стволовых клеток in vitro включает (a) предоставление культуры in vitro, содержащей питающий клеточный слой, в популяцию выделенных крысиных эмбриональных стволовых (ЭС) клеток; и (b) культивирование in vitro в условиях, достаточных для поддержания плюрипотентности и/или тотипотентности выделенной крысиной эмбриональной стволовой (ЭС) клетки, причем крысиные ЭС клетки образуют колонии, свободно прикрепляющиеся к питающему клеточному слою. «Свободное прикрепление» или «прикрепляются свободно» означает, что если чашку с культурой оставить в покое на какое-то время (минимум 8 часов), некоторые колонии будут прикрепляться к питающему слою таким образом, что они могут сохранять прикрепление при осторожном перемещении чашки для культивирования. В более мелких лунках (в которых среда перемещается меньше) свободное прикрепление происходит чаще. В любом случае, эти колонии могут быть смещены либо путем a) создания завихрения в чаше для культивирования, либо посредством осторожного отбора пипеткой среды по всей поверхности питающего слоя. Морфология этих свободно прикрепленных колоний по-прежнему остается сферической. В таких случаях крысиные ЭС клетки образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro. Такие сфероподобные колонии показаны, например, на Фигуре 1.
IV. Наборы и культуры in vitro
Крысиные ЭС клетки и линии крысиных ЭС клеток, предложенных в настоящем документе, могут содержаться в наборе или в изделии. В специфических вариантах реализации изобретения набор или изделие содержит любую из линий или популяций крысиных ЭС клеток, описанных в данном документе. Набор может дополнительно содержать любую культуральную среду, поддерживающую крысиную ЭС клетку, включая среду, поддерживающую плюрипотентность крысиных ЭС клеток. Такая среда может представлять собой культуральную среду, содержащую мышиный LIF либо его активный вариант или фрагмент, как более подробно описано в других разделах данного документа. Среда в наборе может дополнительно содержать ингибитор MEK и ингибитор GSK-3, или, в альтернативном варианте, среда в наборе может дополнительно содержать комбинацию ингибиторов, состоящую из ингибитора MEK и ингибитора GSK-3. В специфических вариантах реализации изобретения среда в наборе содержит ингибитор MEK, представляющий собой PD0325901, и/или ингибитор GSK-3, представляющий собой CHIR99021. Любая из различных сред, описанных в данном документе, может содержаться в наборе.
Дополнительно предложены набор или изделие, содержащее любую из линий или популяций крысиных ЭС клеток, описанных в данном документе, любую из различных сред, описанных в данном документе, и популяцию питающих клеток. В одном варианте реализации изобретения питающие клетки в наборе или изделии не являются генетически модифицированными для экспрессии LIF и/или питающие клетки содержат митотически инактивированные мышиные эмбриональные фибробласты (МЭФ). Любые питающие клетки, описанные в данном документе, могут использоваться в наборе или в изделии.
IV. Генетическая модификация крысиных эмбриональных стволовых (ЭС) клеток
Различные крысиные ЭС клетки и клеточные линии, описанные в данном документе, могут быть модифицированы и могут содержать по меньшей мере одну целевую генетическую модификацию. Таким образом, предлагаются различные способы генетической модификации выделенных крысиных эмбриональных стволовых (ЭС) клеток, описанных в данном документе. Способ включает введение в геном выделенной крысиной ЭС клетки, описанной в данном документе, целевой генетической модификации для получения генетически модифицированной крысиной ЭС клетки. Целевая генетическая модификация может представлять собой любую модификацию в геноме крысиной ЭС, включая, например, инсерцию, делецию, нокаут, нокин, мутацию или их комбинацию. В одном варианте реализации изобретения целевая генетическая модификация представляет собой инсерцию гетерологичного полинуклеотида в геном крысиной ЭС клетки. В данном документе термин «гетерологичный» со ссылкой на последовательность означает последовательность, которая происходит из чужеродных видов, или, если она происходит из того же вида, является существенно модифицированной по сравнению с нативной формой в композиции и/или геномном локусе посредством преднамеренного вмешательства человека.
В одном аспекте предлагается выделенная крысиная ЭС клетка или линия крысиных ЭС клеток, которая способна поддерживать плюрипотентность после одной или большего количества генетических модификаций in vitro и которая способна передавать генетически модифицированный геном зародышевой линии поколению F1. Таким образом, крысиная ЭС клетка сохраняет свою плюрипотентность, чтобы развиться во множество типов клеток после одной или больше серийных генетических модификаций in vitro (например, двух, трех, четырех, пяти, шести или больше серийных генетических модификаций). В других вариантах реализации изобретения выполняют множество целевых генетических модификаций в данной крысиной ЭС клетке, включая, например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 14, 15 или больше. Таким образом, в геном также можно интегрировать множество гетерологичных полинуклеотидов, включая, например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 14, 15 или больше.
В одном варианте реализации изобретения после любой из от одной до 15 серийных генетических модификаций генетически модифицированные крысиные ЭС клетки при воздействии среды для дифференциации способны дифференцироваться во множество типов клеток. В одном варианте реализации изобретения после любой из от одной до 15 серийных генетических модификаций генетически модифицированные крысиные ЭС клетки способны сохраняться в культуре в недифференцированном состоянии. В одном варианте реализации изобретения генетически модифицированные и культивированные крысиные ЭС клетки в недифференцированном состоянии, при использовании в качестве донорских клеток в крысином эмбрионе-хозяине, заселяют эмбрион и образуют бластоцисту, содержащую от одной до пятнадцати генетических модификаций. В одном варианте реализации изобретения при имплантации бластоцисты суррогатной матери в условиях, подходящих для развития беременности, она развивается в потомство F0 крыс, которое содержит от одной до 15 генетических модификаций.
Можно использовать различные способы создания целевых генетических модификаций в геноме крысиной ЭС клетки. Например, в одном случае для целевой генетической модификации используется система, которая будет создавать целевую генетическую модификацию посредством события гомологичной рекомбинации. В других случаях крысиные ЭС клетки могут быть модифицированы с использованием нуклеазных агентов, которые создают разрыв одиночной или двойной цепи в целевом участке генома. Одно- или двухцепочечный разрыв затем восстанавливается по пути негомологичного соединения концов (NHEJ). Такие системы находят применение, например, в создании целевой потери функциональных генетических модификаций. См., например, публикацию Tesson et al. (2011) Nature Biotechnology 29:695-696, включенную в данный документ посредством ссылки. Такие агенты включают эффекторные нуклеазы, подобные активаторам транскрипции (TALEN) (WO 2010/079430; Morbitzer et al. (2010) PNAS 10.1073/pnas.1013133107; Scholze & Boch (2010) Virulence 1:428-432; Christian et al. Genetics (2010) 186:757-761; Li et al. (2010) Nuc. Acids Res. (2010) doi:10.1093/nar/gkq704; и Miller et al. (2011) Nature Biotechnology 29:143-148; заявки на патент №№2011/0239315 A1, 2011/0269234 A1, 2011/0145940 A1, 2003/0232410 A1, 2005/0208489 A1, 2005/0026157 A1, 2005/0064474 A1, 2006/0188987 A1 и 2006/0063231 A1 (включены в данный документ посредством ссылки); нуклеазу белкового домена «цинковые пальцы» (ZFN) (US 20060246567; US 20080182332; US 20020081614; US 20030021776; WO/2002/057308 A2; US 20130123484; US 20100291048; и WO/2011/017293 А2, которые включены в данный документ посредством ссылки); мегануклеазу (см., Epinat et al., (2003) Nucleic Acids Res 31:2952-62; Chevalier et al., (2002) Mol Cell 10:895-905; Gimble et al., (2003) Mol Biol 334:993-1008; Seligman et al., (2002) Nucleic Acids Res 30:3870-9; Sussman et al., (2004) J Mol Biol 342:31-41; Rosen et al., (2006) Nucleic Acids Res 34:4791-800; Chames et al., (2005) Nucleic Acids Res 33:e178; Smith et al., (2006) Nucleic Acids Res 34:e149; Gruen et al., (2002) Nucleic Acids Res 30:e29; Chen and Zhao, (2005) Nucleic Acids Res 33:e154; WO 2005105989; WO 2003078619; WO 2006097854; WO 2006097853; WO 2006097784; и WO 2004031346); и систему CAS/CRISPER (Mali P et al. (2013) Science 2013 Feb 15; 339(6121):823-6; Jinek M et al. Science 2012 Aug 17; 337(6096):816-21; Hwang WY et al. Nat Biotechnol 2013 Mar; 31(3):227-9; Jiang W et al. Nat Biotechnol 2013 Mar; 31(3):233-9; и Cong L et al. Science 2013 Feb 15; 339(6121):819-23, которые включены в данный документ посредствос ссылки).
В других вариантах реализации настоящего изобретения целевую геномную модификацию можно выполнить с использованием нацеленного вектора гомологичной рекомбинации. В таких случаях нацеленный вектор содержит вставку полинуклеотида и дополнительно содержит расположенные выше и ниже группы гомологий, которые фланкируют вставку полинуклеотида. Группы гомологий, которые фланкируют вставку полинуклеотида, соответствуют областям генома в целевом геномном локусе. Для удобства, соответствующие геномные области в пределах целевого геномного локуса называют в данном описании «сайтами-мишенями». Таким образом, в одном примере, нацеленный вектор может содержать первую вставку полинуклеотида, которую фланкируют первая и вторая группы гомологий, соответствующие первому и второму сайтам-мишеням, расположенным в целевом геномном локусе. Нацеленный вектор, таким образом, помогает в интеграции вставки полинуклеотида в целевой геномный локус посредством события гомологичной рекомбинации, которое происходит между группами гомологий и соответствующими сайтами-мишенями в геноме клетки.
В данном документе термины группа гомологий и сайт-мишень «соответствуют» друг другу или являются «соответствующими», когда две области разделяют достаточный уровень идентичности последовательности друг с другом, чтобы действовать в качестве субстратов для реакции гомологичной рекомбинации. Термин «гомологии» означает ДНК-последовательности, которые являются идентичными или разделяют идентичность последовательности с соответствующей последовательностью. Идентичность последовательности между данным сайтом-мишенью и соответствующей группой гомологий, имеющихся на нацеленном векторе, может представлять собой любую степень идентичности последовательностей, которая позволяет произойти гомологичной рекомбинации. Например, величина идентичности последовательности, разделяемой группой гомологий нацеленного вектора (или его фрагмента) и сайтом-мишенью (или его фрагментом), может составлять по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,9% или 100% идентичности последовательности, таким образом, что последовательности подвергаются гомологичной рекомбинации. Более того, соответствующая область гомологии между группой гомологий и соответствующим сайтом-мишенью может быть любой длины, достаточной для содействия гомологичной рекомбинации в отщепленном сайте распознавания.
В специфических вариантах реализации изобретения выделенная крысиная ЭС клетка, линия клеток или популяция клеток демонстрируют эффективность гомологичной рекомбинации, составляющую по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75% или по меньшей мере 80%. В одном варианте реализации изобретения эффективность гомологичной рекомбинации при использовании крысиной ЭС клетки составляет больше 4%.
В специфических вариантах реализации изобретения при создании целевой генетической модификации в крысиной ЭС клетке используют селективный маркер. Полинуклеотид, кодирующий селективный маркер, может присутствовать в нацеленном векторе, предназначенном для введения целевой генетической модификации в геном, либо он может быть на отдельной плазмиде или векторе. Полинуклеотид, кодирующий селективный маркер, может содержаться в кассете экспрессии. Различные компоненты такой кассеты экспрессии более подробно описаны в других разделах данного документа.
Различные селективные маркеры могут быть использованы в способах и композициях, описанных в настоящем документе. Такие селективные маркеры могут, например, придавать устойчивость к антибиотику, такому как G418, гигромицину, бластоцидину, пуромицину или неомицину. Такие селективные маркеры включают неомицинфосфотрансферазу (neor), гигромицин-В фосфотрансферазу (hygr), пуромицин N-ацетилтрансферазу и бластицидин S дезаминазу (bsrr). В других вариантах реализации изобретения селективный маркер функционально связан с индуцибельным промотором и экспрессия селективного маркера токсична для клетки. Неограничивающие примеры таких селективных маркеров включают ксантин/гуанин фосфорибозилтрансферазу (gpt), гагипоксантин-гуанин фосфорибозилтрансферазу (HGPRT) или тимидинкиназу вируса простого герпеса (HSV-TK). См., например, публикации Santerre et al. (1984) Gene 30:147-56; Joyner (1999) The Practical Approach Series, 293; Santerre et al. (1984) Gene 30:147-56; Bernard et al. (1985) Exp Cell Res 158:237-43; Giordano and McAllister (1990) Gene, 88:285-8; Izumi et al. (1991) Exp Cell Res 197:229-33), которые включены в данный документ в полном объеме посредством ссылки. В специфических вариантах реализации изобретения селективный маркер neoR представляет собой ген неомицинфосфотрансферазы (neo), описанный в публикации Beck et al. (1982) Gene, 19:327-36, которая включена в данный документ посредством ссылки. Селективный маркер neoR представляет собой тот, что использовался в патентах США №7205148 или 6596541, которые включены в данный документ посредством ссылки.
В специфических вариантах реализации изобретения используемый селективный маркер представляет собой неослабленный селективный маркер. «Неослабленный селективный маркер» представляет собой селективный маркер, который сохраняет активность нативного полипептида, или селективный маркер имеет повышенную активность по сравнению с нативной формой полипептида. Повышенная активность селективного маркера может представлять собой любое статистически значимое повышение активности, включая, например, повышение по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70% 80% или выше. Таким образом, экспрессия неослабленного селективного маркера в клетке-хозяине обеспечит более высокий процент клеток-хозяев, выживающих в присутствии более высокой концентрации селективного агента, чем при использовании ослабленного селективного маркера. Неослабленные селективные маркеры включают, например, неомициновый неослабленный селективный маркер. См., например, публикацию Beck et al. (1982) Gene, 19:327-36 либо патент США №7205148 или 6596541, которые включены в данный документ посредством ссылки.
В других случаях повышенная активность селективного маркера по сравнению с ослабленным селективным маркером и/или селективным маркером дикого типа (нативным) может быть результатом увеличения количества копий какого-либо из неослабленного, ослабленного или интактного селективного маркера в геноме крысиной ЭС клетки. Таким образом, данная крысиная ЭС клетка может содержать в своем геноме по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше копий данного селективного маркера (т.е. неослабленного селективного маркера, ослабленного селективного маркера или нативного (дикого типа) селективного маркера).
Различные используемые селективные маркеры кодируются полинуклеотидом, функционально связанным с промотором, активным в крысиной ЭС клетке. В специфических вариантах реализации изобретения повышенная активность селективного маркера может быть результатом увеличения экспрессии селективного маркера. Таким образом, для повышения уровней экспрессии данного селективного маркера может быть использован промотор. Промоторы, представляющие интерес, включают, но не ограничиваются ими, промотор CMV, промотор PGK и промотор CAG. В одном варианте реализации изобретения для экспрессии селективного маркера используют промотор убиквитина (hUb) человека. См. публикацию Valenzuela et al. (2003) Nature Biotechnology 21:652-659, включенную в данный документ в полном объеме посредством ссылки.
В одном варианте реализации изобретения крысиная ЭС клетка сохраняет свою плюрипотентность для развития во множество типов клеток после одного цикла электропорации с экзогенной нуклеиновой кислотой. В другом варианте реализации изобретения крысиная ЭС клетка сохраняет свою плюрипотентность для развития во множество типов клеток после второго цикла электропорации с экзогенной нуклеиновой кислотой, после третьего цикла электропорации с экзогенной нуклеиновой кислотой, после четвертого цикла электропорации с экзогенной нуклеиновой кислотой, после пятого цикла электропорации с экзогенной нуклеиновой кислотой, после шестого цикла электропорации с экзогенной нуклеиновой кислотой, после седьмого цикла электропорации с экзогенной нуклеиновой кислотой, после восьмого цикла электропорации с экзогенной нуклеиновой кислотой, после девятого цикла электропорации с экзогенной нуклеиновой кислотой, после десятого цикла электропорации с экзогенной нуклеиновой кислотой, после одиннадцатого цикла электропорации с экзогенной нуклеиновой кислотой, после двенадцатого цикла электропорации с экзогенной нуклеиновой кислотой, после тринадцатого цикла электропорации с экзогенной нуклеиновой кислотой, после четырнадцатого цикла электропорации с экзогенной нуклеиновой кислотой и/или после пятнадцатого цикла электропорации с экзогенной нуклеиновой кислотой. В других вариантах реализации изобретения крысиная ЭС клетка способна к передаче целевой генетической модификации потомству после очередного цикла электропорации (т.е. по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше раундов электропорации).
i. Введение последовательностей в крысиную эмбриональную стволовую клетку
Способы, представленные в настоящем документе, включают введение в клетку одной или больше полинуклеотидных или полипептидных конструкций, содержащих различные композиции, необходимые для выполнения целевой геномной модификации. «Введение» означает предоставление в клетку последовательности (полипептидной или полинуклеотидной) таким образом, что последовательность получает доступ к внутренней части клетки. Способы, представленные в данном документе, не зависят от конкретного способа введения любого компонента системы целевой геномной интеграции в клетку, а только от того, получил ли полинуклеотид доступ к внутренней части по меньшей мере одной клетки. Способы введения полинуклеотидов в различные типы клеток известны в данной области и включают, но не ограничиваются ими, способы стабильной трансфекции, способы временной трансфекции и вирус-опосредованные способы. Такие способы включают, но не ограничивается ими, электропорацию, внутрицитоплазматическую инъекцию, инфицирование вирусом (включая аденовирусные, лентивирусные и ретровирусные векторы), трансфекцию, опосредованную липидами трансфекцию и/или Nucleofaction™. См., например, публикацию Stadtfeld et al. (2009) Nature Methods 6(5):329-330; Yusa et al. (2009) Nat. Methods 6:363-369; Woltjen et al. (2009) Nature 458, 766-770. Такие способы включают, но не ограничиваются ими, прямую доставку ДНК, например путем ex vivo трансфекции (Wilson et al., Science, 244:1344-1346, 1989, Nabel and Baltimore, Nature 326:711-713, 1987), необязательно с Fugene6 (Roche) или липофектамином (Invitrogen), посредством инъекции (патенты США №№5994624, 5981274, 5945100, 5780448, 5736524, 5702932, 5656610, 5589466 и 5580859, включены в данный документ посредством ссылки), включая микроинъекцию (Harland and Weintraub, J. Cell Biol., 101:1094-1099, 1985; патент США No. 5789215, включенные в настоящий документ путем ссылки); посредством электропорации (патент США №5384253, включенный в данный документ посредством ссылки; Tur-Kaspa et al., Mol. Cell Biol., 6:716-718, 1986; Potter et al., Proc. Nat'l Acad. Sci. USA, 81:7161-7165, 1984); посредством преципитации фосфатом кальция (Graham and Van Der Eb, Virology, 52:456-467, 1973; Chen and Okayama, Mol. Cell Biol., 7(8):2745-2752, 1987; Rippe et al., Mol. Cell Biol., 10:689-695, 1990); с использованием DEAE-декстрана, a потом полиэтиленгликоля (Gopal, Mol. Cell Biol., 5:1188-1190, 1985); посредством прямой ультразвуковой загрузки (Fechheimer et al., Proc. Nat'l Acad. Sci. USA, 84:8463-8467, 1987); посредством трансфекции, опосредованной липосомами (Nicolau and Sene, Biochim. Biophys. Acta, 721:185-190, 1982; Fraley et al., Proc. Nat'l Acad. Sci. USA, 76:3348-3352, 1979; Nicolau et al., Methods Enzymol., 149:157-176, 1987; Wong et al., Gene, 10:87-94, 1980; Kaneda et al., Science, 243:375-378, 1989; Kato et al., Biol. Chem., 266:3361-3364, 1991) и с помощью трансфекции, опосредованной рецепторами (Wu and Wu, Biochemistry, 27:887-892, 1988; Wu and Wu, J. Biol. Chem., 262:4429-4432, 1987); и при помощи комбинации таких способов, которые включены в данный документ посредством ссылки.
В некоторых вариантах реализации изобретения клетки, используемые в способах и композициях, содержат конструкцию ДНК, стабильно включенную в их геном. Термин «стабильно включенная» или «стабильно введенная» означает введение полинуклеотида в клетку таким образом, что нуклеотидная последовательность интегрируется в геном клетки и может быть унаследована потомством клетки. Для стабильного включения конструкций ДНК или различных компонентов, используемых для создания целевой геномной модификации, может быть использован любой протокол.
Протоколы трансфекции, а также протоколы для введения полипептидных или полинуклеотидных последовательностей в клетки могут изменяться. Неограничивающие способы трансфекции включают химические способы трансфекции, которые включают использование липосом; наночастиц; фосфата кальция (Graham et al. (1973). Virology 52 (2): 456-67, Bacchetti et al. (1977) Proc Natl Acad Sci USA 74 (4): 1590-4 и Kriegler, M (1991). Transfer and Expression: A Laboratory Manual. New York: W.H. Freeman and Company, pp. 96-97); дендримеров; или катионных полимеров, таких как DEAE-декстран или полиэтиленамин. Нехимические способы включают электропорацию; сонопорацию и оптическую трансфекцию. Трансфекция частицами включает использование генной пушки, магнитную трансфекцию (Bertram, J. (2006) Current Pharmaceutical Biotechnology 7, 277-28). Для трансфекции также можно использовать вирусные способы.
Неограничивающий пример способа введения гетерологичного полинуклеотида в крысиную ЭС клетку описан ниже. Крысиные ЭС клетки, описанные в данном документе, пересевают в течение от около 24 до около 48 часов до электропорации. Примерно за 24 часа до электропорации среду меняют на RVG2i + ROCKi (10 мкМ Y-27632). Крысиные ЭС клетки обрабатывают трипсином и крысиные ЭС клетки изолируют. Крысиные ЭС клетки суспендируют до достижения конечной концентрации клеток от около 2×10^6 до около 10×10^6 клеток на 75 мкл. Около 75λ крысиных ЭС клеток добавляют к около 50λ ДНК, содержащей гетерологичный полинуклеотид, и добавляют около 125λ буфера ЕР. В одном неограничивающем варианте реализации изобретения электропорацию осуществляют со следующими параметрами: 400 В; 400 В; Ω; 100 мкФ. Затем клетки культивируют в RVG2i и 10 мкМ ROCKi, и их можно переносить на питающие клетки.
ii. Отбор крысиных эмбриональных стволовых клеток, имеющих целевую геномную модификацию
Предлагаются различные способы отбора и поддержания крысиных ЭС клеток, имеющих стабильно включенную в их геном целевую генетическую модификацию. В одном неограничивающем примере при введении гетерологичного полинуклеотида в крысиную ЭС клетку способ может включать (a) предоставление in vitro популяции крысиных ЭС клеток; (b) введение по меньшей мере в одну крысиную ЭС клетку гетерологичного полинуклеотида, содержащего селективный маркер, функционально связанный с промотором, активным в крысиной ЭС клетке; и (c) культивирование in vitro популяции крысиных ЭС клеток попеременно в первой и второй культуральной среде, причем первая культуральная среда содержит эффективное количество селективного агента в течение первого периода времени, а вторая культуральная среда не содержит селективного агента, причем условия культивирования in vitro сохраняют плюрипотентность или тотипотентность; и тем самым обеспечивают отбор крысиных ЭС клеток, имеющих стабильно включенный в их геном гетерологичный полинуклеотид. В различных способах, посредством которых в данной популяции можно произвести отбор крысиной ЭС клетки, имеющей целевую генетическую модификацию, можно использовать систему культивирования in vitro, которая позволяет крысиным ЭС клеткам сохранять плюрипотентность. Таким образом, можно использовать любые культуральные среды in vitro и питающие клетки, описанные в данном документе.
В специфических вариантах реализации изобретения чередование первой и второй культуральной среды проводят каждые 5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40 часов или больше. В специфическом варианте реализации изобретения чередование первой и второй культуральной среды проводят каждые 24 часа.
Можно использовать любой подходящий селективный маркер, и соответствующий селективный агент будет присутствовать в культуральной среде в эффективной концентрации. Такие селективные маркеры включают любой из нативного, ослабленного или неослабленного селективных маркеров, описанных в данном документе. В одном варианте реализации изобретения используемый селективный маркер придает устойчивость к антибиотику, включая, например, G418. Неограничивающие примеры селективных маркеров включают неомицинфосфотрансферазу II (nptII) или гигромицин фосфотрансферазу (hpt).
Концентрация селективного агента является такой, которая позволяет произвести отбор крысиной ЭС клетки, имеющей селективный маркер, при сохранении плюрипотентности крысиных ЭС клеток, присутствующих в культуре. При использовании, например, G418 концентрация G418 в среде для отбора может находиться в диапазоне от около 50 мкг/мл до около 125 мкг/мл, от около 60 мкг/мл до около 125 мкг/мл, от около 70 мкг/мл до около 125 мкг/мл, от около 80 мкг/мл до около 125 мкг/мл, от около 90 мкг/мл до около 125 мкг/мл, от около 100 мкг/мл до около 125 мкг/мл, от около 110 мкг/мл до около 125 мкг/мл, от около 80 мкг/мл до около 100 мкг/мл, от около 65 мкг/мл до около 85 мкг/мл, от около 70 мкг/мл до около 80 мкг/мл. В одном варианте реализации изобретения концентрация G418 в культуре составляет 75 мкг/мл.
Среда, используемая в отборе, позволяет сохранять плюрипотентность крысиных эмбриональных стволовых клеток. Такие среды описаны подробно в других разделах настоящего документа.
Протокол отбора может быть инициирован в любое время после введения полинуклеотида, кодирующего селективный маркер, в геном крысиной ЭС клетки. В специфических вариантах реализации изобретения протокол отбора начинается через 10, 15, 20, 24, 30, 35, 40, 50, 60 или больше часов после введения селективного маркера в крысиную ЭС клетку. В одном варианте реализации изобретения протокол отбора начинается около через 2 дня после введения полинуклеотида, кодирующего селективный маркер.
Неограничивающий пример протокола отбора с использованием G418 является следующим. На день 2 (2-й день после введения полинуклеотида, кодирующего селективный маркер) популяция крысиных ЭС клеток представляет собой клетки, инкубированные в среде 2i с добавлением G418 в концентрации 75 мкг/мл. На день 3 популяция крысиных ЭС клеток представляет собой клетки, инкубированные в среде 2i без G418. На день 4 популяцию крысиных ЭС клеток инкубируют в среде 2i с добавлением G418 в концентрации 75 мкг/мл. На день 5 популяция крысиных ЭС клеток представляет собой клетки, инкубированные в среде 2i без G418. На день 6 популяцию крысиных ЭС клеток инкубируют в среде 2i с добавлением G418 в концентрации 75 мкг/мл. На день 7 популяцию крысиных ЭС клеток инкубируют в среде 2i без G418. На день 8 популяцию крысиных ЭС клеток инкубируют в среде 2i без добавления G418 в концентрации 75 мкг/мл. На день 9 популяция крысиных ЭС клеток представляет собой клетки, инкубированные в среде 2i без G418. На день 10 популяция крысиных ЭС клеток представляет собой клетки, инкубированные в среде 2i с добавлением G418 в концентрации 75 мкг/мл. На день 11 популяция крысиных ЭС клеток представляет собой клетки, инкубированные в среде 2i без G418. На день 12 выбирают колонии для роста и скрининга.
После отбора крысиных ЭС клеток, имеющих селективный маркер, можно увеличивать количество колоний. В специфических вариантах реализации изобретения период роста для увеличения их количества может составлять 1, 2, 3, 4, 5 или больше дней в условиях культивирования, которые поддерживают плюрипотентность клеток. В одном неограничивающем варианте реализации настоящего изобретения отобранные колонии растут в течение 3 дней. В дополнительном варианте реализации изобретения используемая среда представляет собой среду 2i. Каждый клон можно пересевать и выращивать дальше.
Крысиные ЭС клетки и линии клеток, имеющие одну или больше целевых генетических модификаций, могут иметь одно или более из следующих свойств:
(a) обладают компетентностью зародышевой линии после целевой генетической модификации, что означает, что при имплантации крысиной ЭС клетки в крысиный эмбрион-хозяин целевая генетическая модификация в геноме линии крысиных ЭС клеток передается потомству;
(b) обладают плюрипотентностью in vitro;
(c) обладают тотипотентностью in vitro;
(d) при культивации in vitro свободно прикрепляются к питающему клеточному слою;
(e) при культивации in vitro образуют сфероподобные колонии при посеве на питающий клеточный слой in vitro;
(f) сохраняют плюрипотентность при культивации in vitro в условиях, включающих питающий клеточный слой, который не является генетически модифицированным для экспрессии фактора ингибирования лейкемии (LIF), причем культуральная среда содержит достаточную концентрацию LIF;
(g) сохраняют плюрипотентность при культивации in vitro в условиях, включающих питающий клеточный слой, причем культуральная среда содержит мышиный LIF или его активный фрагмент;
(h) имеют молекулярную сигнатуру, которая характеризуется следующим:
i) экспрессией одного или более генов, специфических для крысиных ЭС клеток, включая белок, связанный с адгезионными контактами (Ajap1), клаудин 5 (Cldn5), фактор 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН рецептор А4 (Epha4), белок бета 5 межклеточных щелевых контактов (Gjb5), белок 1, подобный белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), фактор 1 детерминации асимметрии (Lefty1), альфа-рецептор фактора ингибирования лейкемии (Lifr), рецептор 2 лизофосфатидной кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpn18), гомеобокс 2 каудального типа (Cdx2), повторные домены 1 фибронектина III и анкирина (Fank1), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактор 1, связывающий лимфоидный энхансер (Lef1), ген 3, подобный Sal (дрозофила) (Sall3), гомеобокс 1 SATB (Satb1), miR-632 или их комбинацию;
ii) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более генов, специфических для крысиных ЭС клеток, включая белок, связанный с адгезионными контактами (Ajap1), клаудин 5 (Cldn5), фактор 9 гуанин-нуклеотидного обмена Cdc42 (Arhgef9), кальций/калмодулин-зависимую протеинкиназу IV (Camk4), эфрин-А1 (Efna1), ЕРН рецептор А4 (Epha4), белок бета 5 межклеточных щелевых контактов (Gjb5), белок 1, подобный белку, связывающему инсулиноподобный фактор роста (Igfbpl1), интерлейкин 36 бета (Il1f8), рецептор альфа интерлейкина 28 (Il28ra), фактор 1 детерминации асимметрии (Lefty1), альфа-рецептор фактора ингибирования лейкемии (Lifr), рецептор 2 лизофосфатидной кислоты (Lpar2), нейрональный рецептор пентраксина (Ntm), протеинтирозинфосфатазу нерецепторного типа 18 (Ptpn18), гомеобокс 2 каудального типа (Cdx2), повторные домены 1 фибронектина III и анкирина (Fank1), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), ген forkhead box E1 (тироидный фактор транскрипции 2) (Foxe1), ген, родственный hairy/enhancer-of-split с мотивом 2 YRPW (Hey2), фактор 1, связывающий лимфоидный энхансер (Lef1), ген 3, подобный Sal (дрозофила) (Sall3), гомеобокс 1 SATB (Satb1), miR-632 или их комбинацию;
iii) по меньшей мере 20-кратным повышением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 14, по сравнению с ЭС клеткой мышей линии F1H4;
iv) по меньшей мере 20-кратным повышением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 14, по сравнению с ЭС клеткой мышей линии F1H4;
v) экспрессией одного или более генов, специфических для крысиных ЭС клеток, как указано в таблице 13;
vi) экспрессией по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13;
vii) по меньшей мере 20-кратным повышением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13, по сравнению с ЭС клеткой мышей линии F1H4;
viii) по меньшей мере 20-кратным повышением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 13, по сравнению с ЭС клеткой мышей линии F1H4;
ix) по меньшей мере 20-кратным снижением экспрессии одного или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 12, по сравнению с ЭС клеткой мышей линии F1H4; и/или
x) по меньшей мере 20-кратным снижением экспрессии по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более генов, специфических для крысиных ЭС клеток, как указано в Таблице 12, по сравнению с ЭС клеткой мышей линии F1H4;
xi) любой комбинацией экспрессии генов, специфических для крысиных ЭС клеток согласно разделам (i)-(x);
xii) уровнем относительной экспрессии маркеров плюрипотентности, как показано в таблице 15, для по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 перечисленных маркеров плюрипотентности. См. уровни относительной экспресии в колонке ранжирования плюрипотентности Таблицы 15;
xiii) уровнем относительной экспрессии мезодермальных маркеров, как показано в Таблице 15, для по меньшей мере 2, 3 или 4 перечисленных мезодермальных маркеров. См. уровни относительной экспресии в колонке мезодермального ранжирования Таблицы 15;
xiv) уровнем относительной экспрессии эндодермальных маркеров, как показано в Таблице 15, для по меньшей мере 2, 3, 4, 5 или 6 перечисленных эндодермальных маркеров. См. уровни относительной экспрессии в колонке эндодермального ранжирования Таблицы 15;
xv) уровнем относительной экспрессии нейронных маркеров, как показано в Таблице 15, для по меньшей мере 2 и 3 перечисленных нейронных маркеров. См. уровни относительной экспрессии в колонке нейронного ранжирования Таблицы 15;
xvi) уровнем относительной экспрессии трофэктодермальных маркеров, как показано в Таблице 15, для перечисленных трофэктодермальных маркеров. См. уровни относительной экспрессии в колонке трофэктодермального ранжирования Таблицы 15;
xvii) любым уровнем относительной экспрессии одного или более (2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30) маркеров плюрипотентности, мезодермальных маркеров, эндодермальных маркеров, нейронных маркеров и/или трофэктодермальных маркеров, приведенных в Таблице 15;
xviii) уровнем относительной экспрессии каждого из маркеров, приведенных в Таблице 15;
xix) любой комбинацией сигнатур, приведенных в разделах xii-xiix; и/или
xx) любой комбинацией сигнатур, приведенных в разделах i-xiix.
(i) обладают способностью продуцировать крысу F0;
(j) способны к субкультивированию и поддержанию недифференцированного состояния;
(k) имеют то же количество хромосом, что и клетка нормальной крысы;
(l) сохраняют плюрипотентность in vitro без потребности в паракринной сигнализации LIF; и/или
(m) обладают способностью самообновления, что означает, что они делятся бесконечно, сохраняя плюрипотентность.
iii. Кассеты экспрессии
Термины «полинуклеотид», «полинуклеотидная последовательность», «последовательность нуклеиновой кислоты» и «фрагмент нуклеиновой кислоты» используются в данном документе взаимозаменяемо. Эти термины охватывают нуклеотидные последовательности и т.п. Полинуклеотид может быть полимером РНК или ДНК, который является одно- или двухцепочечным и необязательно содержит синтетические, неприродные или измененные нуклеотидные основания. Полинуклеотид в форме полимера ДНК может состоять из одного или больше сегментов кДНК, геномной ДНК, синтетической ДНК или их смесей. Полинуклеотиды могут содержать дезоксирибонуклеотиды и рибонуклеотиды, включая как молекулы, встречающиеся в природе, так и синтетические аналоги и их любую комбинацию. Полинуклеотиды, представленные в данном документе, также охватывают все формы последовательностей, включая, но не ограничиваясь этим, одноцепочечные формы, двухцепочечные формы, шпильки, структуры типа «стебель-петля» и т.п.
Дополнительно представлены рекомбинантные полинуклеотиды. Термины «рекомбинантный полинуклеотид» и «конструкция рекомбинантной ДНК» используются в данном документе взаимозаменяемо. Рекомбинантная конструкция содержит искусственную или гетерологичную комбинацию последовательностей нуклеиновых кислот, например регуляторных и кодирующих последовательностей, которые вместе в природе не встречаются. В других вариантах реализации изобретения рекомбинантная конструкция может содержать регуляторные последовательности и кодирующие последовательности, которые происходят из различных источников, или регуляторные последовательности и кодирующие последовательности, которые происходят из одного и того же источника, но расположены способом, отличным от встречающегося в природе. Такая конструкция может быть использована сама по себе или может быть использована в сочетании с вектором. Если используется вектор, то выбор вектора зависит от способа, который будет использоваться для трансформации клеток-хозяев, как хорошо известно специалисту в данной области. Например, может использоваться плазмидный вектор. В настоящем документе предложены генетические элементы, необходимые для успешной трансформации, селекции и размножения клеток-хозяев, содержащих любой из выделенных фрагментов нуклеиновой кислоты. Скрининг можно провести, среди прочего, саузерн-анализом ДНК, нозерн-анализом экспрессии мРНК, анализом иммуноблоттинга экспрессии белка или фенотипическим анализом.
В специфических вариантах реализации изобретения один или больше компонентов, описанных в данном документе, могут быть предоставлены в кассете экспрессии для экспрессии в крысиной клетке. Кассета может включать 5' и 3' регуляторные последовательности, функционально связанные с полинуклеотидом, представленным в данном документе. «Функционально связанный» означает функциональную связь между двумя или больше элементами. Например, функциональная связь между полинуклеотидом, представляющим интерес, и регуляторной последовательностью (т.е. промотором) является функциональным звеном, которое позволяет экспрессию полинуклеотида, представляющего интерес. Функционально связанные элементы могут быть непрерывными или не непрерывными. При использовании для обозначения соединения двух кодирующих белок областей «функционально связанный» означает, что кодирующие области находятся в одной рамке считывания. В другом случае последовательность нуклеиновой кислоты, кодирующая белок, может быть, функционально связана с регуляторными последовательностями (например, последовательностью промотера, энхансера, сайленсера и т.п.) таким образом, чтобы сохранить надлежащее регулирование транскрипции. Кассета может дополнительно содержать по меньшей мере один дополнительный полинуклеотид, представляющий интерес, для совместного введения в крысиную ЭС клетку. В альтернативном варианте дополнительный полинуклеотид, представляющий интерес, может быть представлен на множестве кассет экспрессии. Такая кассета экспрессии представлена со множеством сайтов рестрикции и/или сайтов рекомбинации для инсерции рекомбинантного полинуклеотида, который должен находиться под транскрипционным контролем регуляторных областей. Кассета экспрессии может дополнительно содержать селективные маркерные гены.
Кассета экспрессии может включать в 5'-3' направлении транскрипции, область инициации транскрипции и трансляции (т.е. промотор), рекомбинантный полинуклеотид, представленный в данном документе, и область терминации транскрипции и трансляции (т.е. область терминации), функциональный в клетке млекопитающего или клетке-хозяине, представляющей интерес. Регуляторные области (т.е. промоторы, области, регулирующие транскрипцию и области терминации трансляции) и/или полинуклеотид, представленный в настоящем документе, могут быть нативными/аналогичными клетке-хозяину или друг другу. В альтернативном варианте регуляторные области и/или полинуклеотид, представленный в данном документе, могут быть гетерологичными клетке-хозяину или друг другу. Например, промотор, функционально связанный с гетерологичным полинуклеотидом, происходит от видов, отличных от видов, из которых был получен полинуклеотид, или, если он происходит из тех же/аналогичных видов, один или оба по сути изменены по сравнению с их первоначальной формой и/или геномным локусом, или промотор не является природным промотором для функционально связанного полинуклеотида. В альтернативном варианте регуляторные области и/или рекомбинантный полинуклеотид, представленные в данном документе, могут быть полностью синтетическими.
Область терминации может быть нативной с областью инициации транскрипции, может быть нативной с функционально связанным рекомбинантным полинуклеотидом, может быть нативной с клеткой-хозяином или может быть получена из другого источника (например, чужеродного или гетерологичного) промотора, рекомбинантного полинуклеотида, клетки-хозяина или любой их комбинации.
При подготовке кассеты экспрессии различными фрагментами ДНК можно манипулировать таким образом, чтобы предоставить последовательности ДНК в правильной ориентации. С этой целью могут быть использованы адаптеры или линкеры, чтобы присоединить фрагменты ДНК, или могут быть использованы другие манипуляции для обеспечения подходящих сайтов рестрикции, удаление избыточной ДНК, удаление сайтов рестрикции и т.п. С этой целью может быть использован in vitro мутагенез, восстановление праймеров, рестрикция, отжиг, перезамещения, например переходы и трансверсии.
В кассетах экспрессии, представленных в данном документе, может использоваться ряд промоторов. Промоторы могут быть выбраны на основе желаемого результата. Следует понимать, что различные виды применения могут быть улучшены за счет использования в кассетах экспрессии различных промоторов для модулирования выбора времени, расположения и/или уровня экспрессии полинуклеотида, представляющего интерес. Такие конструкции экспрессии также могут содержать, при желании, регулирующую область промотора (например, одну придающую индуцибельность, конститутивную, регулируемую условиями окружающей среды или развития, либо клеточно- или тканеспецифическую/селективную экспрессию), начало сайта инициации транскрипции, сайт связывания рибосом, сигнал обработки РНК, сайт терминации транскрипции и/или сигнал полиаденилирования.
iv. Создание крысиных эмбрионов F0 и потомства F1 с целевой генетической модификацией
Для создания генетически модифицированных крыс можно использовать различные композиции и способы, предложенные в настоящем документе. Такие способы обычно включают (a) введение в геном выделенной крысиной ЭС клетки, описанной в данном документе, целевой генетической модификации для получения генетически модифицированной крысиной ЭС клетки, имеющей генетическую модификацию; (b) имплантацию по меньшей мере одной из генетически модифицированных крысиных ЭС клеток, имеющих генетическую модификацию, в крысиный эмбрион-хозяин для создания эмбриона F0; (c) имплантацию эмбриона F0 суррогатной матери; (d) созревание эмбриона F0 в организме суррогатной матери до соответствующего срока; и (e) идентификацию крыс F0, имеющих генетическую модификацию.
Генетически модифицированные крысиные ЭС клетки, имеющие генетическую модификацию, могут быть имплантированы в крысиный эмбрион-хозяин из той же крысиной линии или из другой крысиной линии. Например, генетически модифицированная крысиная ЭС клетка линии DA может быть имплантирована в крысиный эмбрион-хозяин линии DA или может быть имплантирована в эмбрион-хозяин линии SD, эмбрион-хозяин линии ACI или другой гетерологичный крысиный эмбрион-хозяин. Подобным образом, генетически модифицированная крысиная ЭС клетка линии ACI может быть введена в крысиный эмбрион-хозяин линии ACI или может быть введена в крысиный эмбрион-хозяин линии SD, эмбрион-хозяин линии DA или другой гетерологичный крысиный эмбрион-хозяин. Точно так же, суррогатная мать может быть из той же линии крыс, что и генетически модифицированная крысиная клетка и/или крысиный эмбрион-хозяин, или суррогатная мать может быть из другой линии крыс, а не из той, что генетически модифицированная крысиная клетка и/или крысиный эмбрион-хозяин. В одном неограничивающем варианте реализации изобретения генетически модифицированная крысиная клетка происходит от линии DA, эмбрион-хозяин происходит от эмбриона-хозяина линии SD, и суррогатная мать происходит от линии DA. В другом неограничивающем варианте реализации изобретения генетически модифицированная крысиная клетка происходит от линии ACI, эмбрион-хозяин происходит от линии SD, и суррогатная мать происходит от линии DA.
В дополнительных вариантах реализации изобретения химерных крыс (F0) можно разводить для получения потомства F1, которое является гетерозиготным по целевой генетической модификации. Кроме того, самцов крыс потомства F1 можно скрещивать с самками крыс потомства F1 с получением потомства F2, являющегося гомозиготным по генетической модификации.
Способы и композиции, предложенные в данном документе, обеспечивают получение по меньшей мере 1%, 3%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или больше крыс F0 F0, имеющих генетическую модификацию для передачи генетической модификации потомству F1.
В некоторых вариантах реализации изобретения крысиные ЭС клетки, имеющие целевую генетическую модификацию, вводят в эмбрион стадии преморулы из соответствующего организма, например, мышиный эмбрион на стадии 8 клеток. См., например, патенты US 7576259, US 7659442, US 7294754 и US 2008-0078000 A1, которые включены в данный документ в полном объеме посредством ссылки. В других вариантах реализации изобретения For, донорские крысиные ЭС клетки, могут быть имплантированы в эмбрион-хозяин на стадии 4 клеток, на стадии 8 клеток.
Крысиные эмбрионы, содержащие генетически модифицированные крысиные ЭС клетки, инкубируют до стадии бластоцисты, а затем имплантируют суррогатной матери для получения потомства F0. Крысы, несущие генетически модифицированный геномный локус, могут быть идентифицированы с помощью анализа модификации аллеля (МОА), как описано в данном документе. Полученное в результате из генетически модифицированных крысиных ЭС клеток потомство F0 скрещивают с крысой дикого типа с получением потомства поколения F1. После генотипирования с использованием специфических праймеров и/или зондов, F1 крыс, гетерозиготных по генетически модифицированному геномному локусу, скрещивают друг с другом, чтобы получить крысу, гомозиготную по генетически модифицированному геномному локусу.
Дополнительно представлен эмбрион крысы F0, содержащий внутреннюю клеточную массу, содержащую по меньшей мере одну гетерологичную стволовую клетку, включающую любую из крысиных ЭС клеток, представленных в данном документе. В других вариантах реализации изобретения представлено потомство крысиного эмбриона F0, в котором по меньшей мере 50%, 60%, 70% или больше потомства F0 получено от генетически модифицированной крысиной ЭС клетки, как описано в настоящем документе.
В одном аспекте предложен способ получения крысиной ЭС клетки, включая получение крысиной клетки из эмбриона крысы на стадии морулы, эмбриона крысы на стадии бластоцисты или эмбриона крысы на стадии развития между эмбрионом на стадии морулы и эмбрионом на стадии бластоцисты, и культивирование крысиной клетки из крысиного эмбриона в условиях, достаточных для сохранения плюрипотентности и/или тотипотентности. В одном варианте реализации изобретения условия, достаточные для сохранения плюрипотентности и/или тотипотентности, включают среду 2i.
В одном аспекте предложен способ получения генетически модифицированной крысы, включающий стадию модификации генома крысиной ЭС клетки последовательностью нуклеиновой кислоты, представляющей интерес, с образованием модифицированной крысиной ЭС клетки, и использование модифицированной крысиной ЭС клетки в качестве донорской крысиной ЭС клетки, объединение донорской крысиной ЭС клетки с крысиным эмбрионом-хозяином, культивирование донорской ЭС клетки и крысиного эмбриона-хозяина и использование культивированного эмбриона-хозяина с получением генетически модифицированной крысы.
В одном аспекте предложен способ получения генетически модифицированного потомства крыс F1, включающий стадию модификации генома крысиной ЭС клетки последовательностью нуклеиновой кислоты, представляющей интерес, с образованием модифицированной крысиной ЭС клетки, и использование модифицированной крысиной ЭС клетки в качестве донорской крысиной ЭС клетки, объединение донорской крысиной ЭС клетки с крысиным эмбрионом-хозяином, культивирование донорской ЭС клетки и крысиного эмбриона-хозяина и использование культивированного эмбриона-хозяина с получением генетически модифицированной крысы, причем около 3%, около 10% или больше, или около 63% или больше получено из генетически модифицированной донорской крысиной ЭС клетки.
В одном варианте реализации изобретения культивированный эмбрион-хозяин имплантируют суррогатной матери-крысе, и происходит развитие плода из культурального эмбриона-хозяина в организме суррогатной матери.
В одном аспекте предложен способ передачи с высокой частотой генетической модификации из крысиной плюрипотентной клетки крысиному потомству, включающий генетическую модификацию плюрипотентной крысиной клетки последовательностью нуклеиновой кислоты, представляющей интерес, в бактериальной искусственной хромосоме с образованием генетически модифицированной крысиной плюрипотентной клетки, и использование генетически модифицированной крысиной плюрипотентной клетки с крысиным эмбрионом-хозяином в организме суррогатной матери для создания потомства, содержащего генетическую модификацию, и, необязательно, разведение потомства.
В одном аспекте предложен способ получения крысиной ЭС клетки, причем этот способ включает культивирование замороженного эмбриона на стадии 8 клеток до стадии бластоцисты и получение из культивированной бластоцисты крысиной клетки, культивирование крысиной клетки в условиях, достаточных для сохранения плюрипотентности и/или тотипотентности.
V. Варианты, фрагменты и идентичность последовательностей
Активные варианты и фрагменты описанного полипептида LIF, в частности мышиного полипептида LIF, представлены в данном документе. Термин «варианты» относятся к по существу сходным последовательностям. Используемый в данном документе термин «вариант полипептида» означает полипептид, полученный из нативного белка путем делеции (так называемого усечения) одной или больше аминокислот в N-концевом и/или С-концевом участке нативного белка; делеции и/или добавления одной или больше аминокислот в одном или больше внутренних сайтов в нативном белке, или замены одной или больше аминокислот в одном или больше сайтах нативного белка. Варианты полипептидов продолжают обладать желаемой биологической активностью нативного полипептида, то есть они ингибируют дифференциацию крысиных и/или мышиных эмбриональных стволовых клеток и вносят вклад в самообновление стволовых клеток. Вариант полипептида, описанный в данном документе (т.е. SEQ ID NO: 1 или с номером доступа SwissProt Р09056), как правило, будет иметь по меньшей мере около 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или больше идентичности последовательности с эталонной последовательностью.
Термин «фрагмент» относится к части аминокислоты, содержащей специфическое количество смежных аминокислот. В конкретных вариантах реализации изобретения фрагмент полипептида, описанного в данном документе, может сохранять биологическую активность полноразмерного полипептида и, следовательно, ингибировать дифференциацию крысиных и/или мышиных эмбриональных стволовых клеток и вносить вклад в самообновление стволовых клеток. Фрагменты полипептида, описанные в настоящем документе (т.е. SEQ ID NO: 1 или номер доступа SwissProt No. Р09056), могут содержать по меньшей мере 10, 15, 25, 30, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 смежных аминокислот, или вплоть до общего числа аминокислот, присутствующих в полноразмерном белке.
Используемый в данном документе термин «идентичность последовательностей» или «идентичность» в контексте двух полинуклеотидов или полипептидных последовательностей ссылается на остатки в двух последовательностях, которые являются одинаковыми при выравнивании для максимального соответствия в определенном окне сравнения. При использовании процента идентичности последовательностей со ссылкой на белки следует понимать, что положения неидентичных остатков часто отличаются консервативными аминокислотными заменами, при которых аминокислотные остатки замещены другими аминокислотными остатками со сходными химическими свойствами (например, зарядом или гидрофобностью) и, следовательно, не изменяют функциональные свойства молекулы. В тех случаях, когда последовательности отличаются консервативными заменами, процент идентичности последовательностей может быть скорректирован в сторону повышения для коррекции консервативной природы замены. О последовательностях, которые различаются такими консервативными заменами, говорят, что они имеют «сходство последовательностей» или «сходство». Способы осуществления этой корректировки хорошо известны специалистам в данной области. Обычно они включают в себя учет консервативной замены как частичного, а не полного несоответствия, увеличивая, таким образом, процент идентичности последовательностей. Следовательно, например, если идентичная аминокислота имеет коэффициент 1, а неконсервативное замещение имеет коэффициент нуль, консервативное замещение имеет коэффициент между нулем и 1. Подсчет консервативных замещений проводится, например, в соответствии с алгоритмом программы PC/GENE (Intelligenetics, Mountain View, California).
В данном документе термин «процент идентичности последовательностей» означает величину, определенную путем сравнения двух оптимально выровненных последовательностей через окно сравнения, причем часть полинуклеотидной последовательности в окне сравнения может содержать добавления или делеции (например, гэпы) в сравнении с эталонной последовательностью (которая не содержит добавления или делеции) для оптимального выравнивания двух последовательностей. Процент рассчитывают путем определения количества положений, в которых идентичные основания нуклеиновых кислот или аминокислотные остатки присутствуют в обеих последовательностях, для получения числа совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнивания и умножения результата на 100 для получения процента идентичности последовательностей.
Если не указано иное, значения идентичности/схожести последовательностей, представленных в данном документе, относятся к значению, полученному с использованием программного обеспечения GAP версии 10 с использованием следующих параметров: % идентичности и % сходства для нуклеотидной последовательности с применением значений веса ГЭП 50 и веса длины 3, и матрицы подсчета nwsgapdna.cmp; % идентичности или % сходства для аминокислотной последовательности с применением значений веса ГЭП 8 и веса длины 2 и матрицы подсчета BLOSUM62 или эквивалентной программы. Под «эквивалентной программой» подразумевают любую программу сравнения последовательностей, которая для любых двух рассматриваемых последовательностей производит выравнивание, имеющее идентичные совпадения нуклеотидных или аминокислотных остатков и идентичный процент идентичности последовательностей по сравнению с соответствующим выравниванием, произведенным посредством программы GAP версии 10.
Приведенные ниже примеры предназначены для иллюстрации, а не для ограничения объема изобретения.
ПРИМЕРЫ
Пример 1: Деривация крысиных ЭС клеток.
Характеристика кЭСК. Как показано на ФИГ. 1, кЭСК растут в виде компактных сферических колоний, которые обычно не прикреплены и плавают в чашке для культивирования (крупный план на ФИГ. 4). В, С, F, G: кЭСК экспрессируют маркеры плюрипотентности, включая Oct-4 (ФИГ. 2А) и Sox2 (ФИГ. 2В) и экспрессируют высокие уровни щелочной фосфатазы (ФИГ. 3, левая панель). Кариотип для линии DA.2B представляет собой 42X,Y (ФИГ. 3, правая панель). кЭСК часто становятся тетраплоидными; таким образом, проводят предварительный скрининг линий путем подсчета препаратов метафазных хромосом; линии в основном с нормальным количеством затем формально кариотипируют.
Бластоцисты ACI собирают от коммерчески приобретенных самок с суперовуляцией; культивируют бласты DA от коммерчески приобретенных замороженных 8-клеточных эмбрионов. Блестящую оболочку яйцеклетки удаляют с использованием кислоты Тироде, и бласты высевают на митотически инактивированные МЭФ. Разрастания собирают и выращивают с использованием стандартных способов. Все бласты высевают, культивируют и выращивают с использованием среды 2i (публикация Li et al. (2008) Germline competent embryonic stem cells derived from rat blastocysts, Cell 135:1299-1310; включена в данный документ посредством ссылки).

Пример 2: Получение крыс
Химерных крыс получали посредством инъекции бластоцисты и трансмиссии генома кЭСК через зародышевую линию. Химеры, полученные с помощью микроинъекции бластоцисты с использованием родительской кЭСК ACI.G1, показаны на ФИГ. 5. Детеныши агути F1 из помета с альбиносами, произведенными от химеры ACI/SD, помеченной звездочкой (*) на ФИГ. 5, показаны на ФИГ. 6.
Трансмиссия через зародышевую линию родительской кЭСК. Три линии эуплоидной кЭСК оценивали на плюрипотентность путем микроинъекции в бластоцист альбиносов SD. Химеры были идентифицированы по окрасу покрова агути, указывающему на вклад кЭСК. В каждой линии большинство химер передало геном кЭСК потомству F1 (Таблица 4).

Пример 3: нацеливание кЭСК: Локус Rosa 26 крыс.
Локус rRosa26 находится между генами Setd5 и Thumpd3, как и у мыши, на том же расстоянии. Локус rRosa 26 (ФИГ. 7, панель В) отличается от локуса mRosa 26 (ФИГ. 7, панель А). Транскрипты mRosa26 состоят из 2 или 3 экзонов. Крысиный локус содержит 2-й экзон 1 (Ex1b) в дополнение к гомологичному экзону мышиного экзона 1 (Ex1a). У крыс не был выявлен 3-й экзон. Нацеливание на аллель rRosa26 показано на ФИГ. 7 (панель С), где группы гомологий по 5 тысяч оснований каждая клонировали с помощью ПЦР с использованием геномной ДНК от кЭСК DA. Целевой аллель содержит кассету SA-lacZ-hUB-neo, замещающую делецию 117 п.о. в интроне rRosa26.
Определяли целевую эффективность локуса rRosa 26 (Таблица 5). Линеаризованный вектор вводили с помощью электропорации в кЭСК линии DA или ACI, и трансфицированные колонии культивировали в среде 2i с добавлением G418, с использованием стандартных способов. Отдельные колонии собирали и подвергали скринингу с использованием анализа утраты аллеля (Loss of Allele, LOA) (публикация Valenzuela, D. et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21:652-660, включена в данный документ посредством ссылки).

Получение химеры и трансмиссия через зародышевую линию и с использованием целевой Rosa26 кЭСК. Вновь подтвержденные целевые клоны rRosa26 вводили путем микроинъекции в бластоцисты SD, которые затем переносили самкам-реципиентам DS с ложной беременностью, с использованием стандартных способов. Химеры были идентифицированы по окрасу покрова; самцов химер F0 скрещивали с самками SD. Зародышевую линию (агути) F1 детенышей генотипировали на наличие целевого аллеля Rosa26; девять из 22 детенышей агути генотипировали как гетерозиготных по локусу Rosa26 (Таблица 6).

Пример 3: Деривация крысиных эмбриональных стволовых клеток.
Протокол суперовуляции для крыс
День 0: вводят инъекцию сыворотки беременной кобылы: ИП, 20 Ед (0,4 мл).
День 1: действий не проводят
День 2: (через 46 часов): вводят инъекцию hCG, ИП, 50 Ед (1 мл).
- проводят спаривания самок по одной.
День 3: проверяют наличие копулятивных пробок. У самок имеются копулятивные пробки. Это день 0,5.
День 6 (е3.5): Подвергают эвтаназии самок и вымывают эмбрионы.
Протокол деривации ЭС клеток (суперовуляция)
День 0:
1) Подвергают эвтаназии самок крыс с использованием СО2.
2) Протирают вентральную часть живота 70% этанола; с помощью ножниц вскрывают брюшную стенку с экспонированием внутренних органов.
3) Отсекают маточные трубы и рога матки и помещают их в чашку с культурой ткани, содержащую теплую среду N2B27. Отмывают кровь максимально, насколько это возможно, и переносят в новую чашку с N2B27.
4) Используя шприц на 1 мл и тупую иглу калибра 27G, промывают средой рога матки и маточные трубы, чтобы извлечь бластоцисты в среду.
5) Бластоцисты собирают ротовой пипеткой и переносят на чашку для культивирования эмбриона, содержащую KSOM + 2i (1 мкМ PD0325901, 3 мкМ CHIR99021). KSOM представляет собой культуральную среду, производимую компанией Millipore. Номер по каталогу MR-106-D.
6) Культивирование проводят в течение ночи при температуре 37°С; 7,5% CO2.
Протокол деривации ЭС клеток (замороженные эмбрионы)
День 0:
1) Оттаивают замороженные 8-клеточные эмбрионы (приобретенные из коммерческих источников) в среде М2. Культивирование проводят в течение 10 минут при комнатной температуре.
2) Переносят в KSOM + 2i и культивируют в течение ночи.
Протокол деривации ЭС клеток (аналогичен для обоих)
День 1:
1) Переносят эмбрионы с наличием полости в среду 2i и культивируют в течение ночи.
2) Культивирование эмбрионов без сформированной полости продолжают в среде KSOM + 2i.
День 2:
1) Все оставшиеся эмбрионы переносят в среду 2i (независимо от того, произошло ли образование в них полости).
2) Культивирование проводят в течение ночи; продолжают культивирование ранних эмбрионов в среде 2i.
День 3:
1) Перенесенные эмбрионы обрабатывают 30-60 секунд кислотой Тироде для удаления блестящей оболочки яйцеклетки.
2) Эмбрионы промывают 3 раза в среде 2i для удаления кислоты Тироде.
3) Каждый эмбрион депонируют в отдельной лунке 96-луночного питающего планшета (лунка содержит монослой митотически инактивированных мышиных эмбриональных фибробластов (МЭФ).
4) Культивирование проводят в течение ночи в среде 2i.
День 4-5:
1) Высеянные эмбрионы наблюдают на наличие разрастания (аморфная недифференцированная масса клеток). Разрастания готовы для переноса, когда их размер увеличивается в два раза по сравнению с размером высеянного эмбриона.
2) Каждый день истощенную среду удаляют микропипеткой и заменяют свежей средой 2i.
3) Переносят разрастания в новые питающие лунки:
a. Удаляют истощенную среду, и лунки аккуратно промывают ФСБ.
b. Удаляют ФСБ и добавляют 30 мкл 0,05% трипсина; инкубируют в течение 10 минут.
c. Реакцию с трипсином останавливают добавлением 30 мкл среды 2i и 10% ФБС.
d. Клетки осторожно диссоциируют микропипеткой, и все содержимое лунки переносят в новую лунку в 24-луночный питающий планшет. Это называют «пересев 1» (Р1).
e. Культивирование проводят в течение ночи в среде 2i.
День 5-8: (выбор времени зависит от того, как быстро растет каждая линия)
1) Среду меняют каждый день (среда 2i) и наблюдают на наличие колоний, имеющих морфологию ЭСК.
2) После того, как появляются такие колонии, культивирование продолжают до достижения ~50% слияния.
3) Колонии подвергают воздействию трипсина и пересевают как раньше; высевают на питающие планшеты, 1 лунка на линию, в 6-луночную чашку. Это называют «пересев 2» (Р2).
Продолжение:
1) Питание и наблюдение за каждой линией продолжают до тех пор, пока не произойдет около 50% слияния.
2) Клетки, как обычно, обрабатывают трипсином.
3) Реакцию с трипсином останавливают добавлением среды 2i и 10% ФБС; клетки осаждают центрифугированием (5 минут, 1200 оборотов в минуту в настольной центрифуге Beckman-Coulter).
4) Аспирируют супернатант, и осторожно ресуспендируют клетки в 400 мкл среды для замораживания (70% 2i, 20% ФБС, 10% ДМСО).
5) Клетки распределяют в 2 флакона и замораживают при температуре -80°. Это называют «пересев 3» (Р3).
6) Для длительного хранения флаконы переносят на хранение в жидкий N2.
Среду 2i готовят так, как показано ниже в Таблице 7.

Поставщики гормонов
PMSG: Sigma #G-4877 (1000 ME). Ресуспендируют в ФСБ до конечной [] 50 МЕ/мл. Хранят при температуре -20° в аликвотах по 1 мл.
HCG: Sigma #CG-5 (5000 ME). Ресуспендируют в ФСБ до конечной [] 50 МЕ/мл. Хранят при температуре -20° в аликвотах по 1 мл.
Пример 4: Кариотипирование линий крысиных эмбриональных стволовых клеток.
Линию крысиных ЭС клеток, полученную в настоящем изобретении, кариотипировали, результаты приведены в Таблицах 8-11.





Пример 5: Электропорации вектора в эмбриональную стволовую клетку крысы
1. Пересевают крысиные ЭС клетки за 24-48 часов до электропорации.
2. Производят замену среды на RVG2i + ROCKi (10 мкМ Y-27632) за 24 часа до электропорации.
3. Производят замену среды за 30 минут до обработки трипсином.
4. Делят на аликвоты ДНК для электропорации.
5. Дают возможность ДНК нагреться до КТ в течение >10 мин.
6. Нагревают ДНК в течение 5 минут при 62°С. Помещают ДНК на лед.
7. Проводят обработку клеток трипсином:
a. Собирают плавающие колонии. Промывают планшет, чтобы собрать максимально возможное количество плавающих колоний.
b. Осаждают колонии: 3 минуты при 750 оборотах в минуту.
c. Промывают осадок 1×5-10 мл ФСБ и снова центрифугируют/осаждают.
d. Аспирируют супернатант; добавляют 500Я, трипсина, 0,05%+1% куриной сыворотки.
i. Не объединяйте более чем 1 10 см планшет с колониями на пробирку. Если в нижней части пробирки во время обработки трипсином упаковано слишком много колоний, они будут слипаться в комки и большинство клеток будет потеряно.
e. 4 минуты при 37°. Пипетируют колонии несколько раз, чтобы свести к минимуму образование комков.
f. Повторяют стадии 1-2 X: 4 минуты при 37°.
g. Реакцию с трипсином останавливают добавлением 500λ RVG2i + 10% ФБС.
8. Осаждают клетки: 5 минут при 1200 оборотах в минуту.
9. Ресуспендируют клетки в 10 мл ФСБ. Подсчитывают две аликвоты по 20λ, чтобы определить общее число клеток.
10. Осаждают клетки (5 мин./1200 оборотов в минуту); рассчитывают общее число клеток и общий объем ресуспендирования, чтобы достичь правильной концентрации клеток (целевое кол-во/75 мкл буфера ЕР).
11. Ресуспендируют в минимальном объеме буфера ЕР; измеряют общий объем и корректируют до целевого объема с помощью буфера ЕР. Буфер для электропорации приобретают у Millipore. Номер по каталогу ES-003-D. См., публикацию Valenzuela et al. (2003) Nature Biotechnology 21:652-659, которая включена в данный документ посредством ссылки.
12. Добавляют 75λ клеток к 50λ ДНК; переносят раствор 125λ клеток/ДНК в одну лунку 48-луночной кюветы ВТХ.
a. Наполняют пустые лунки в том же столбце 125λ буфера ЕР.
13. Кювету подвергают воздействию одного импульса в электропораторе ВТХ:
a. Параметры: 400 В; Ω; 100 мкФ (параметры могут изменяться)
14. Помещают кювету на лед на 15 минут для восстановления.
15. Отбирают клетки в 5 мл RVG2i + 10 мкМ ROCKi.
16. Добавляют к 15 см планшету с 20 мл RVG2i + 10 мкМ ROCKi. Планшет содержит 2х neoR МЭФ (или другие МЭФ в зависимости от проекта). Селективный маркер neoR представляет собой ген неомицинфосфотрансферазы (neo), публикация Beck et al. (1982) Gene, 19:327-36 или патент США №7205148 или 6596541, которые включены в данный документ посредством ссылки.
17. Инкубируют при 37°. Отбор начинают спустя 48 часов.
Используемый ингибитор ROCK представлял собой Y-27632.
Пример 6: Отбор целевой генетической модификации в крысиной эмбриональной стволовой клетке
1. Пересевают клетки за 24-48 часов до электропорации.
2. Производят замену среды на RVG2i + ROCKi (10 мкМ Y-27632) за 24 часа до электропорации.
3. Производят замену среды за 30 минут до обработки трипсином.
4. Делят на аликвоты ДНК для электропорации.
5. Дают возможность ДНК нагреться до КТ в течение >10 мин.
6. Нагревают ДНК в течение 5 минут при 62°С. Помещают ДНК на лед.
7. Проводят обработку клеток трипсином:
h. Собирают плавающие колонии. Промывают планшет, чтобы собрать максимально возможное количество плавающих колоний.
i. Осаждают колонии: 3 минуты при 750 оборотах в минуту.
j. Промывают осадок 1×5-10 мл ФСБ и снова центрифугируют/осаждают.
k. Аспирируют супернатант; добавляют 500λ трипсина, 0,05%+1% куриной сыворотки.
i. Не объединяйте более чем 1 10 см планшет с колониями на пробирку. Если в нижней части пробирки во время обработки трипсином упаковано слишком много колоний, они будут слипаться в комки и большинство клеток будет потеряно.
l. 4 минуты при 37°. Пипетируют колонии несколько раз, чтобы свести к минимуму образование комков.
m. Повторяют 1-2 раза: 4 минуты при 37°.
n. Реакцию с трипсином останавливают добавлением 500λ RVG2i + 10% ФБС.
8. Осаждают клетки: 5 минут при 1200 оборотах в минуту.
9. Ресуспендируют клетки в 10 мл ФСБ. Подсчитывают две аликвоты по 20λ, чтобы определить общее число клеток.
10. Осаждают клетки (5 мин./1200 оборотов в минуту); рассчитывают общее число клеток и общий объем ресуспендирования, чтобы достичь правильной концентрации клеток (целевое кол-во/75 мкл буфера ЕР).
11. Ресуспендируют в минимальном объеме буфера ЕР; измеряют общий объем и корректируют до целевого объема с помощью буфера ЕР.
12. Добавляют 75λ клеток к 50λ ДНК; переносят раствор 125λ клеток/ДНК в одну лунку 48-луночной кюветы ВТХ.
а. Наполняют пустые лунки в том же столбце 125λ буфера ЕР.
13. Кювету подвергают воздействию одного импульса в электропораторе ВТХ:
а. Параметры: 400 В; 400 В; Ω; 100 мкФ (параметры могут изменяться)
14. Помещают кювету на лед на 15 минут для восстановления.
15. Отбирают клетки в 5 мл RVG2i + 10 мкМ ROCKi.
16. Добавляют к 15 см планшету с 20 мл RVG21 + 10 мкМ ROCKi. Планшет содержит 2х neoR МЭФ (или другие МЭФ в зависимости от проекта).
17. Инкубируют при 37°. Отбор начинают спустя 48 часов.
18. Протокол отбора с использованием G418 является следующим:
a. День 2 (2-й день после ЕР): инкубируют клетки в среде 2i с добавлением G418, 75 мкг/мл.
b. День 3: инкубируют клетки в среде 2i без G418
c. День 4: инкубируют клетки в среде 2i с добавлением G418, 75 мкг/мл.
d. День 5: инкубируют клетки в среде 2i без G418
e. День 6: инкубируют клетки в среде 2i с добавлением G418, 75 мкг/мл.
f. День 7: инкубируют клетки в среде 2i без G418
g. День 8: инкубируют клетки в среде 2i с добавлением G418, 75 мкг/мл.
h. День 9: инкубируют клетки в среде 2i без G418
i. День 10: инкубируют клетки в среде 2i с добавлением G418, 75 мкг/мл.
j. День 11: инкубируют клетки в среде 2i без G418
k. День 12: выбирают колонии для роста и скрининга. Каждую колонию диссоциируют в 0,05% трипсине + 1% куриной сыворотке в течение 10 минут, после чего высевают в 1 лунку 96-луночного питающего планшета.
19. Выращивают колонии в течение 3 дней в среде 2i.
20. Пересевают клоны 1:1 в новые 96-луночные питающие планшеты.
21. Выращивают клоны в течение 3 дней в среде 2i.
22. Для каждого клона диссоциируют колонии в трипсине. Замораживают 2/3 каждого клона и хранят при температуре -80°; высевают оставшуюся 1/3 на ламининовые планшеты (96-луночные планшеты, покрытые 10 мкг/мл ламинина).
23. После слияния на ламининовых планшетах, переносят в лабораторию для скрининга для генотипирования клонов.
Пример 7: Молекулярная сигнатура крысиных эмбриональных стволовых клеток
Перечисленные в Таблице 13 гены экспрессировались на 20-кратно более высоких уровнях в крысиных ЭС клетках по сравнению с соответствующими генами в мышиных ЭС клетках. Перечисленные в Таблице 12 гены экспрессировались на 20-кратно более низких уровнях в крысиных ЭС клетках по сравнению с соответствующими генами в мышиных ЭС клетках.
Данные микроматрицы в Таблицах 12 и 13 получали следующим образом. Крысиные ЭС клетки (ACI.G2 и DA.2B) и мышиные ЭС клетки (F1H4) культивировали в среде 2i в течение трех пересевов до слияния. Клетки F1H4 культивировали на планшетах, покрытых желатином, при отсутствии питающего слоя. Мышиные ЭС клетки F1H4 получали из 129S6/SvEvTac и C57BL/6NTac гетерозиготных эмбрионов (см., например, патент США №7294754 и публикации Poueymirou, W.T., Auerbach, W., Frendewey, D., Hickey, J.F., Escaravage, J.M., Esau, L., Dore, A.T., Stevens, S., Adams, N.C., Dominguez, M.G., Gale, N.W., Yancopoulos, G.D., DeChiara, T.M., Valenzuela, D.M. (2007), включенные в данный документ в полном объеме посредством ссылки).
Следующий протокол использовали для приготовления образцов:
Материалы включали: реагент тризол; буфер для лизиса РНК (Zymo Kit); и пробирки Эппендорф объемом 1,5 мл.
На этикетках пробирок Эппендорф объемом 1,5 мл указывали идентификатор образца. Клетки, выращенные на планшете, промывали 37С ФСБ. Удаляли ФСБ и добавляли 300 мкл тризола. Для разрушения клеток в тризоле использовали шпатель. Лизированные клетки собирали в тризол в пробирки Эппендорф объемом 1,5 мл. Клетки, выращенные в суспензии, промывали 37С ФСБ. Клетки собирали в пробирки объемом 1,5 мл, клетки центрифугировали, удаляли ФСБ и добавляли 300 мкл тризола. Клетки пипетировали вверх и вниз для разрушения клеток. Образцы сортировали для FACS с 101-105 клеток, объем концентрировали до менее чем 100 мкл. Добавляли 4 объема буфера для лизиса РНК и смешивали при помощи пипетирования. Например, к 80 мкл образца добавляли 320 мкл буфера для лизиса РНК. Образцы хранили при температуре -20°С.
РНК-секвенирование использовали для измерения уровня экспрессии мышиных и крысиных генов. Результаты секвенирования картировали относительно эталонного генома мыши и крысы при помощи программного обеспечения Tophat и RPKM (фрагменты на тысячу оснований экзона на миллион картированных остатков) и рассчитывали для мышиных и крысиных генов. Гены гомологии были выбраны на основе символа гена, а затем для сравнения уровня экспрессии гена между мышью и крысой использовали t-тест.
miR-632 находится в 10 наиболее экспрессируемых в ЭСК крысы, но они не экспрессировались в ЭС клетках мыши. Поэтому нет сравнительных данных для этих генов. На основании уровней экспрессии по сравнению с другими генами и их известной функции в эмбриональном развитии, экспрессию miR-632 использовали в качестве маркера для крысиных ЭС клеток.




















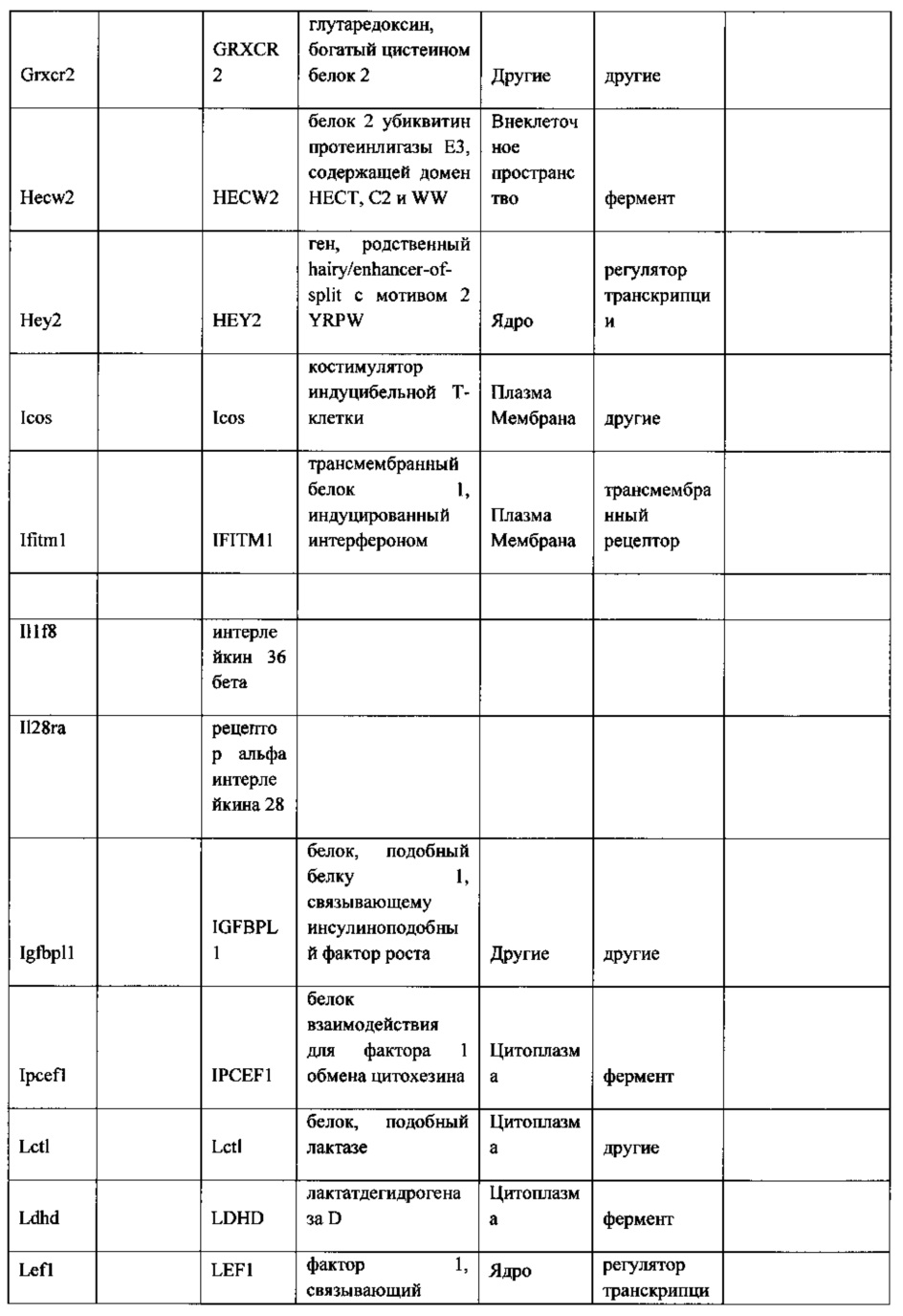






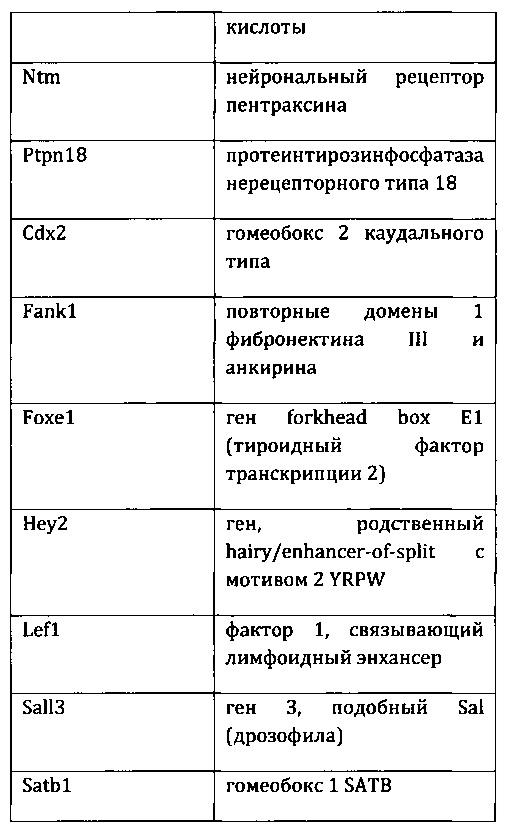
Также была разработана дополнительная молекулярная сигнатура с использованием маркеров/генов плюрипотентности крысиных ЭС клеток. В Таблице 15 представлен список генов и ранги их экспрессии из профилирования данных РНК. мРНК выделяли из крысиных ЭС клеток и уровень экспрессии различных маркеров плюрипотентности сравнивали друг с другом. Перечисленные «гены плюрипотентности» представляют собой гены, используемые другими группами (в основном у мыши, но также у крысы) в качестве маркеров ЭС клеток. Мезодермальный, энтодермальный и нейронный гены определяются аналогичным образом. Определение «ранг» относится к экспрессии в эксперименте, проведенном авторами изобретения: чем выше ранг (1 является самым высоким), тем выше экспрессия. Например, ранг Oct4's равный 13 означает, что из всех генов, которые анализировали, экспрессия этого гена была выше всех, кроме 12 генов. Фоновым в этом эксперименте был любой уровень экспрессии ниже 30; 6107 генов имели уровни экспрессии 30 или выше.


Все публикации и патентные заявки, упомянутые в настоящем описании, указывают на уровень специалистов в области техники, к которой относится данное изобретение. Все публикации и патентные заявки включены в настоящее описание посредством ссылки в той же степени, как если бы каждая отдельная публикация или патентная заявка была конкретно и индивидуально указана как включенная посредством ссылки. Если иное не очевидно из контекста, любой вариант реализации изобретения, аспект, стадия или особенность настоящего изобретения могут быть использованы в сочетании с любыми другими. Ссылка на диапазон включает любые целые числа в пределах диапазона, любой поддиапазон в пределах диапазона. Ссылка на множество диапазонов включает в себя композицию таких диапазонов.
Реферат
Изобретение относится к области биотехнологии, а именно к созданию линии крысиных эмбриональных стволовых клеток, получению генетически модифицированной крысы и композиции для культивирования и поддержания плюрипотентности крысиных эмбриональных стволовых клеток. Способ включает культивирование, которое сохраняет плюрипотентность, in vitro первого слоя фидерных клеток, которые не являются модифицированными для экспрессии фактора ингибирования лейкемии (LIF), и эмбриона крысы на стадии морулы или бластоцисты, у которого была удалена блестящая оболочка яйцеклетки в среде, содержащей от около 50 Ед/мл до около 150 Ед/мл LIF, и комбинацию ингибиторов, состоящую из ингибитора МЕК и ингибитора GSK3. Затем осуществляют перенос разрастания аморфной недифференцированной массы крысиных эмбриональных стволовых клеток в лунку для культивирования in vitro, содержащую второй слой фидерных клеток, которые не являются модифицированными для экспрессии LIF. Затем осуществляют культивирование разрастания в условиях, включающих среду, содержащую от около 50 Ед/мл до около 150 Ед/мл LIF, и комбинацию ингибиторов, состоящую из ингибитора МЕК и ингибитора GSK3, поддерживая тем самым плюрипотентность крысиных ЭС клеток, и модификацию крысиной ЭС клетки с тем, чтобы она содержала целевую генетическую модификацию, причем крысиные ЭС клетки способны передавать целевую генетическую модификацию через зародышевую линию, не экспрессируют с-Мус, имеют нормальный кариотип и образуют сфероподобные свободно плавающие колонии в культуре. Далее возможно получение клона крысиной ЭС клетки с получением генетически модифицированной крысы. Изобретение позволяет осуществить направленную генетическую модификацию в крысиных эмбриональных стволовых клетках, которая может передаваться по геному. 3 н. и 44 з.п. ф-лы, 21 ил., 15 табл., 7 пр.

Комментарии