Силильные производные [1]бензотиено[3,2-в][1]бензотиофена, способ их получения и электронные устройства на их основе - RU2687051C2
Код документа: RU2687051C2
Чертежи
Описание
Изобретение относится к новым кремнийорганическим монофункциональным дизамещенным производным бензотиенобитиофена, также к способу получения таких соединений, полупроводниковых слоев и электронных устройств, на основе этих соединений и их применение.
Органическая электроника в наши дни стала одной из самых быстро развивающихся областях науки и техники, основанной на полупроводниковых свойствах π-π-сопряженных олигомеров и полимеров. Применение органических полупроводников в качестве тонких активных слоев позволяет изготавливать гибкие прозрачные электронные устройства большой площади. Одним из основных элементов многих из них являются органические полевые транзисторы (ОПТ). Было установлено, что перенос заряда в ОПТ происходит преимущественно в нескольких нанометрах толщины слоя органического полупроводника вблизи границы раздела полупроводник-изолятор.
Примером реализации соединения с общей формулой (I) является то, что представлено в п. 1.
Примером реализации способа изготовления соединения общей формулы (I) является то, что представлено в п. 8.
Примером реализации полупроводникового слоя является то, что представлено в п. 9.
Примером реализации электронного устройства является то, что представлено в п. 14.
Примером реализации способа изготовления электронного устройства является представленный в п. 18.
Пример варианта реализации использования соединения общей формулы (I) характеризует то, что представлено в п. 21.
Сопровождающие чертежи, которые включены для обеспечения дальнейшего понимания изобретения и составляют часть данной спецификации, иллюстрируют варианты реализации изобретения и вместе с описанием помогают объяснить принципы изобретения. На рисунках:
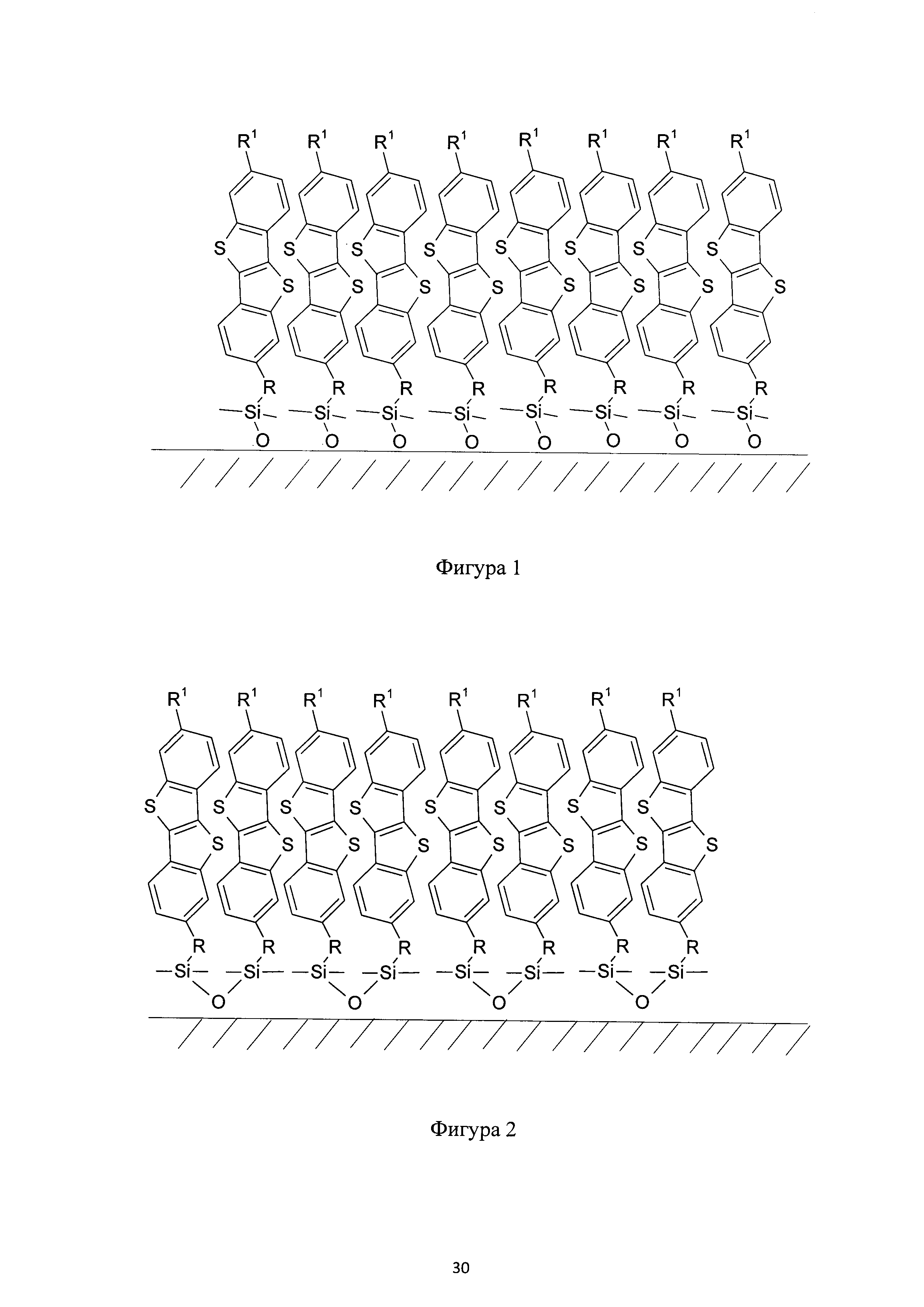
Фиг. 1 - схематическое изображение монослоя, сформированного соединением (Ia);
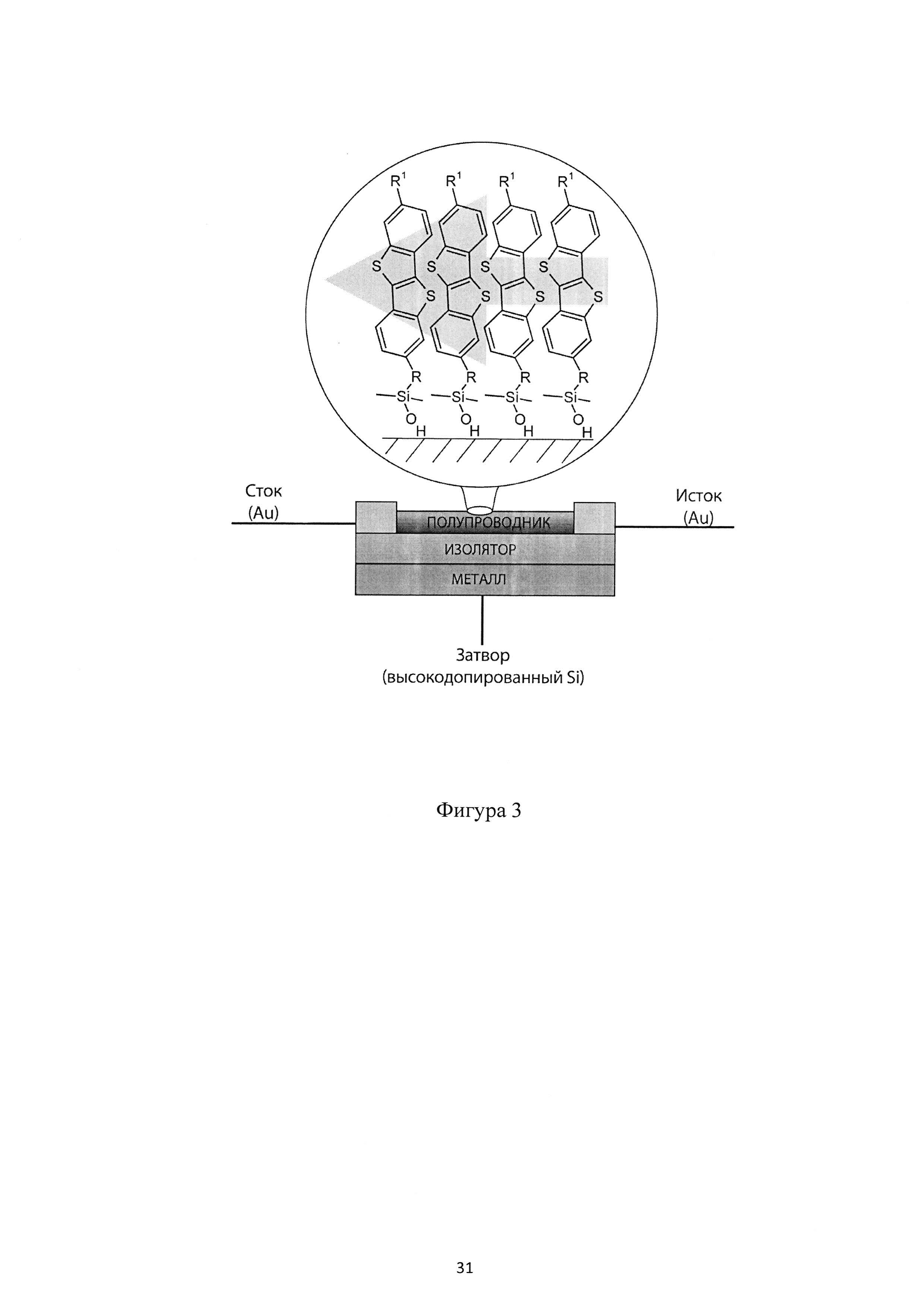
Фиг. 2 - схематическое изображение монослоя, сформированного соединением (Ib);
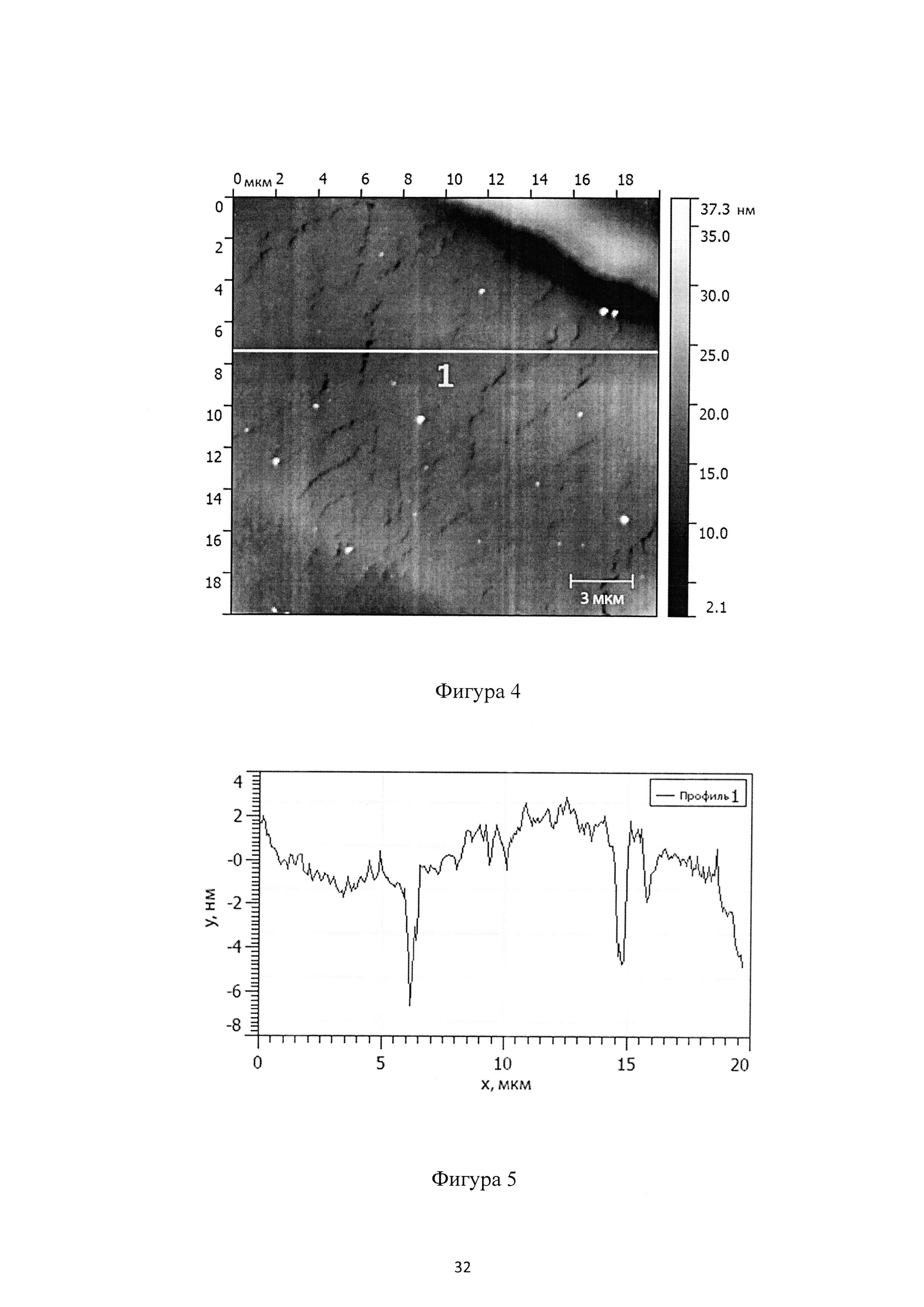
Фиг. 3 - схематическое изображение монослойного полевого транзистора;
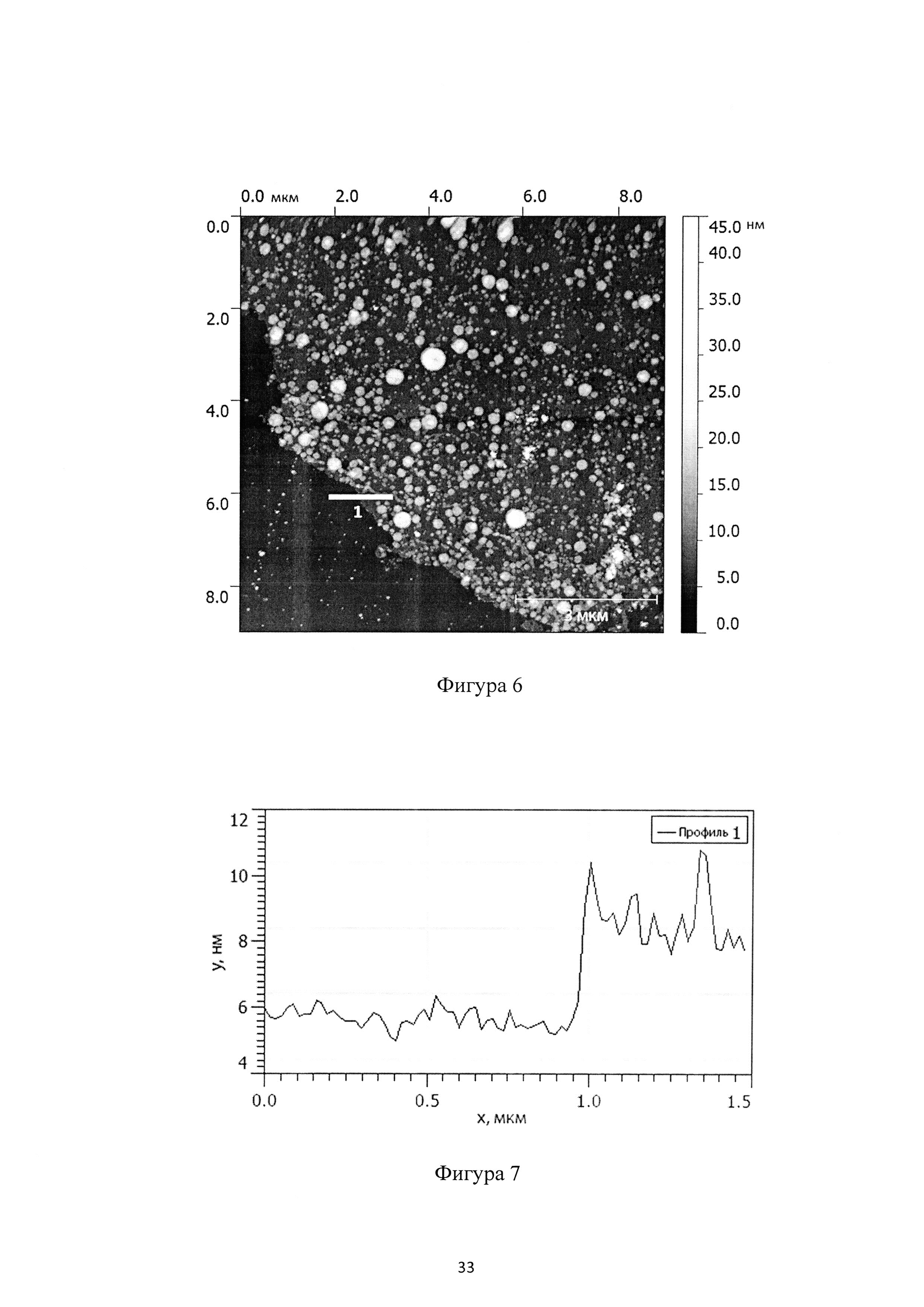
Фиг. 4 - АСМ изображение пленки монослоя соединения (Ia-1);
Фиг. 5 - профиль пленки монослоя соединения (Ia-1);
Фиг. 6 - АСМ изображение пленки монослоя соединения (Ib-1);
Фиг. 7 - профиль пленки монослоя соединения (Ib-1);
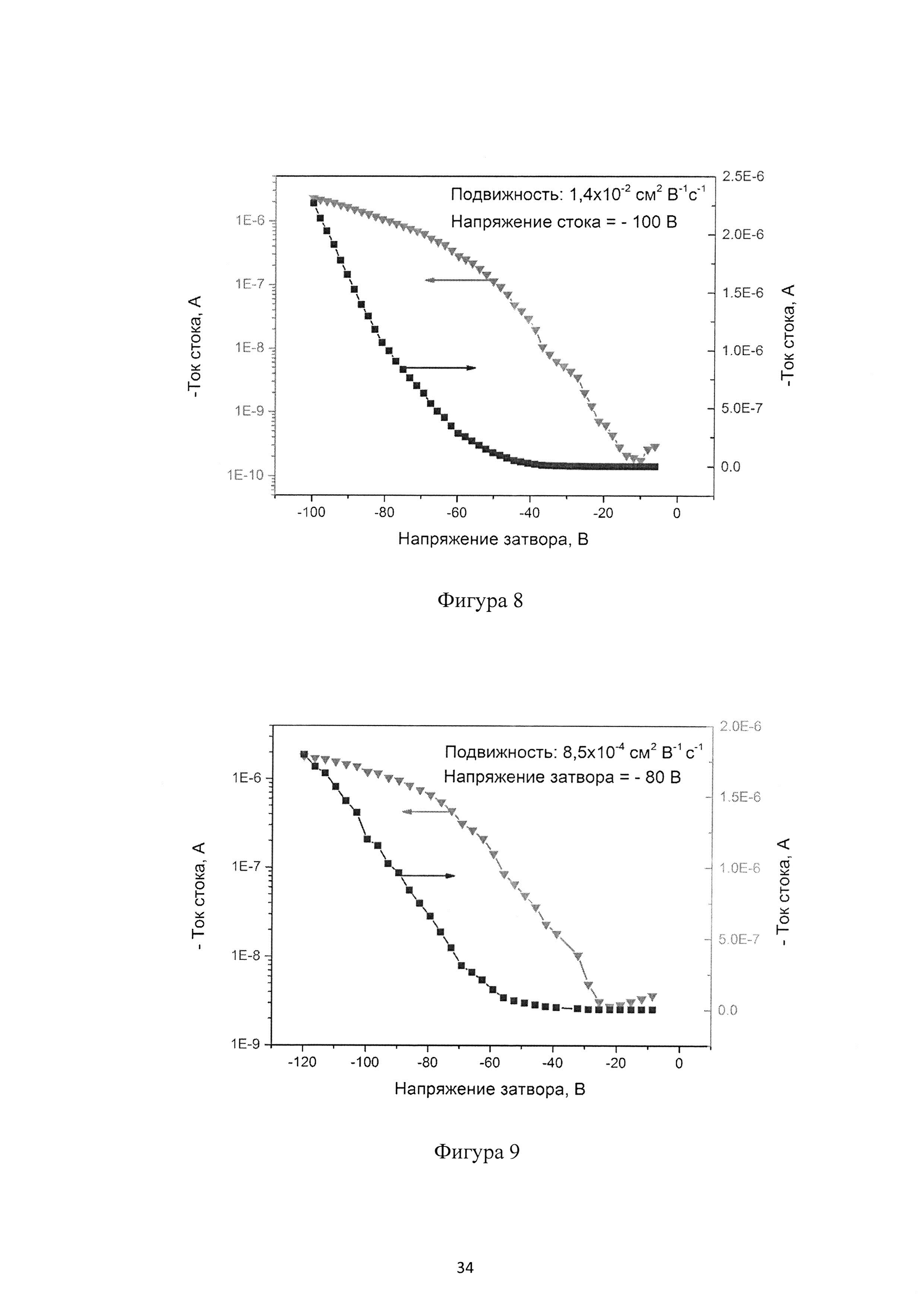
Фиг. 8 - передаточные характеристики ОПТ на основе монослоя соединения (Ia-1);
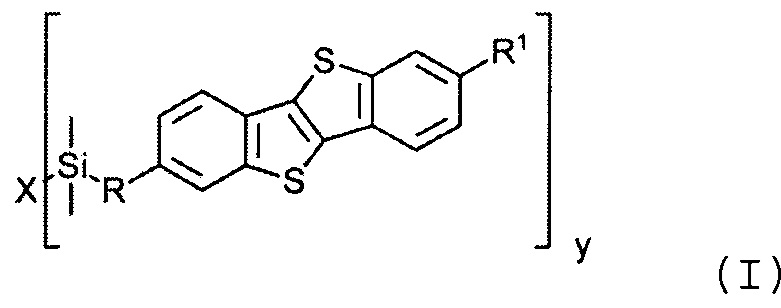
Фиг. 9 - передаточные характеристики ОПТ на основе монослоя соединения (Ib-1);
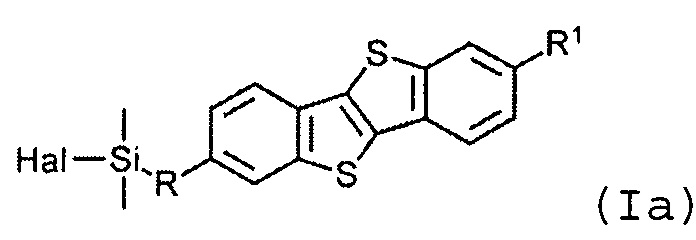
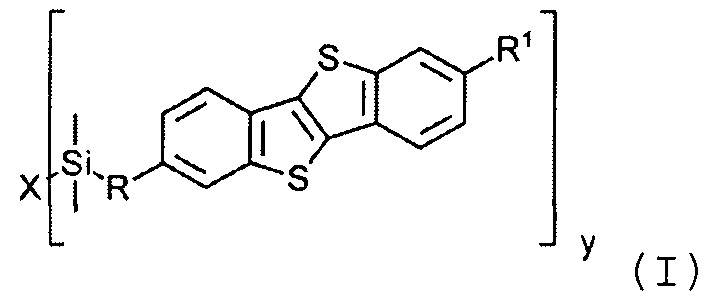
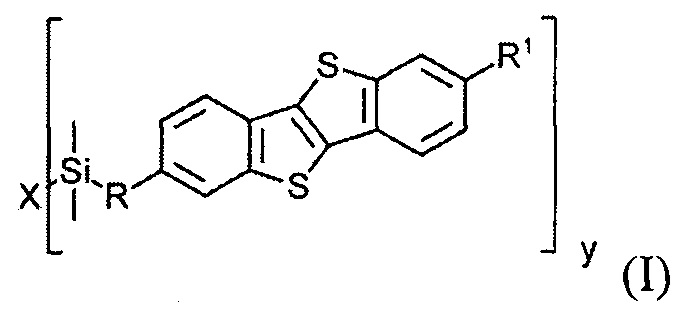
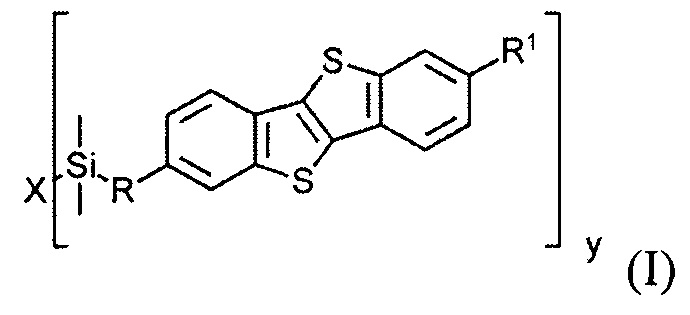
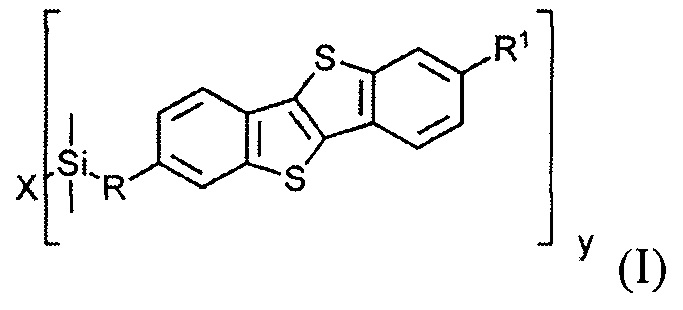
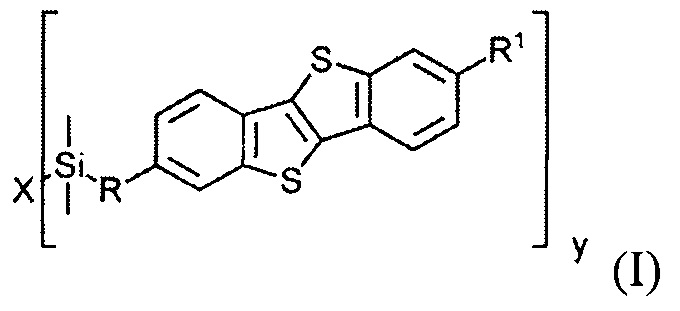
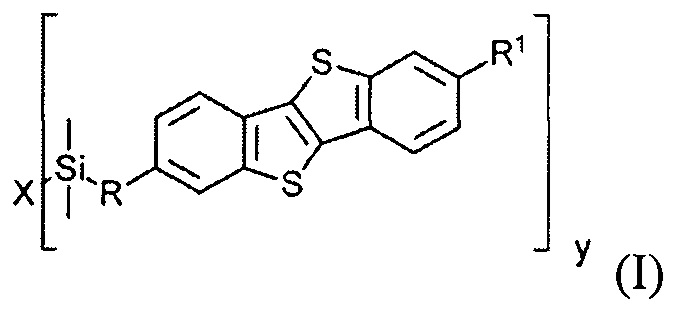
В соответствии с примером реализации предлагается новое соединение общей формулы (I):
где
R1 означает С2-С13 алкил,
R означает С3-С18алкенил,
X означает О или Hal, и
Y равно 1 или 2, при условии, когда у равно 1, X означает Hal, и когда у равно 2, X означает О.
Соединения общей формулы (I) являются кремнийорганическими монофункциональными ди-замещенными производными [1]бензотиено[3,2-В] [1]-бензотиофена (ВТВТ). Заместитель R1 может быть линейными или разветвленными С2-С13 алкильными группами. Заместитель R может быть линейными или разветвленными С3-C18 алкенильными группами. Алкенильные и алкильные группы могут быть как замещенными, так и не имеющие заместителей. Символ X означает атом кислорода или галогена - Cl, Br или I.
В одном варианте реализации соединение имеет формулу (I) и R является линейным С3-С12 алкенилом.
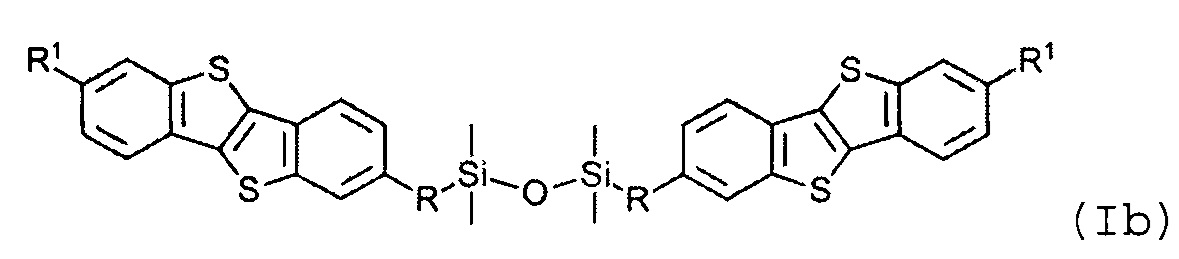
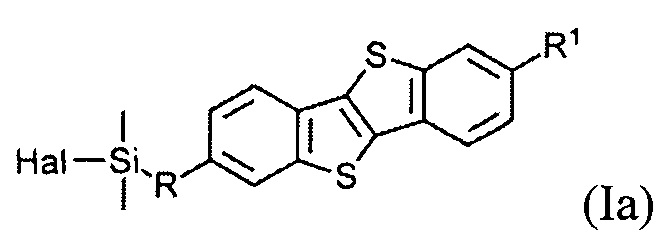
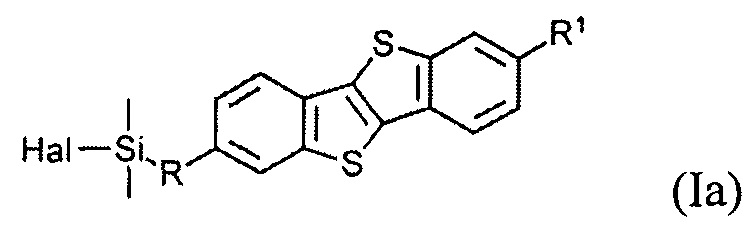
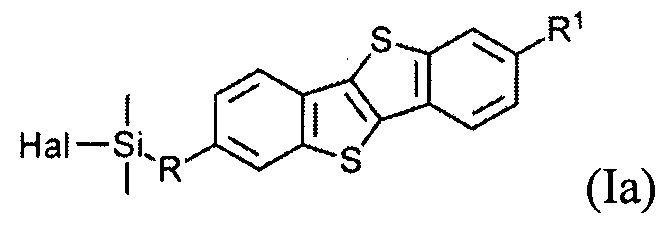
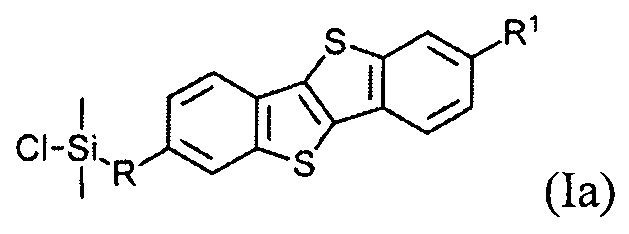
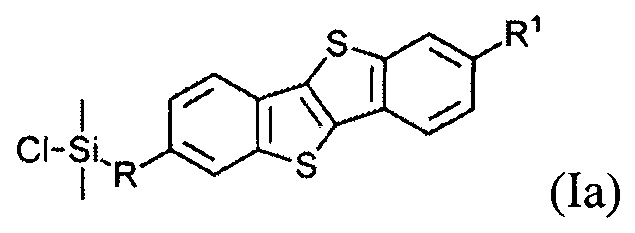
В одном варианте реализации соединение, когда у=1 и X - галоген (Hal), соединение имеет следующую формулу (Ia):
где
R1 означает С2-С13 алкил, и
R означает С3-С18 алкенил.
В одном варианте реализации соединение имеет формулу (Ia) и R означает С3-С12 алкенил.
В одном варианте реализации соединение имеет формулу (Ia) и X означает Cl.
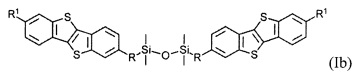
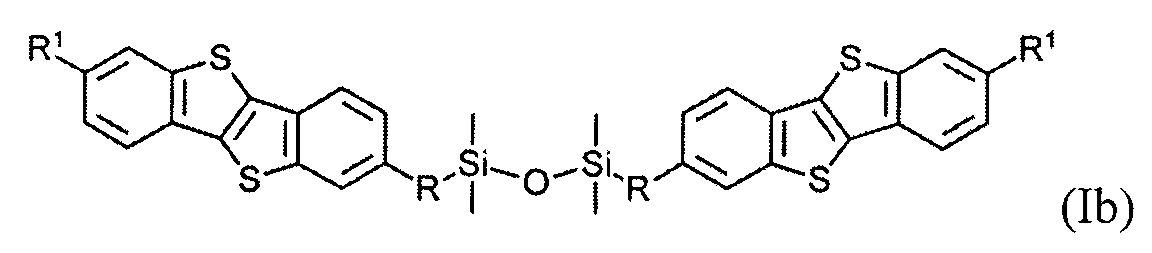
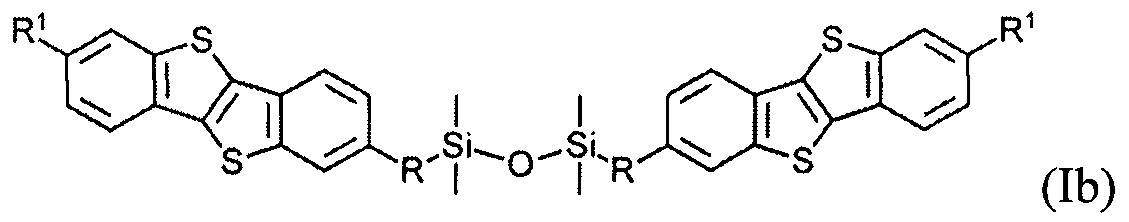
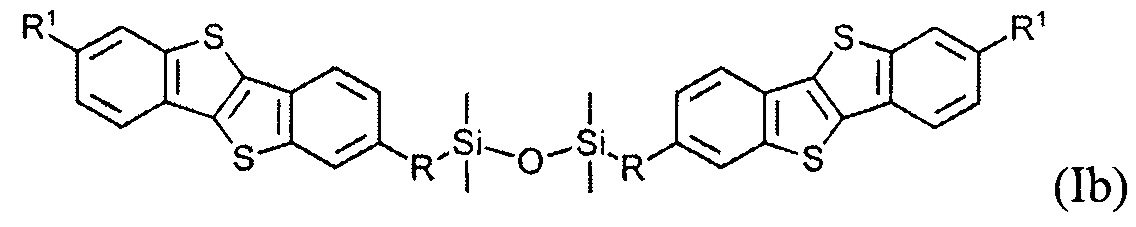
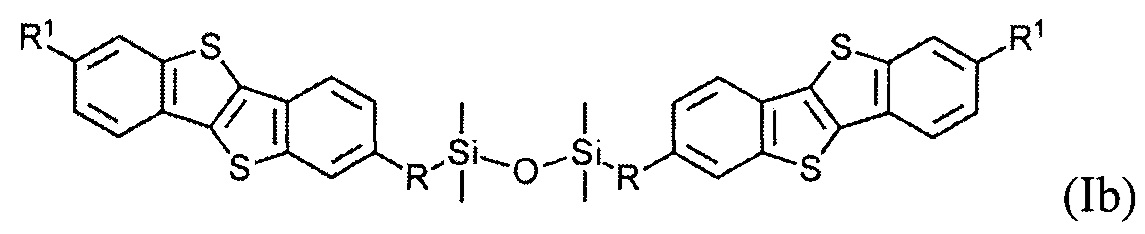
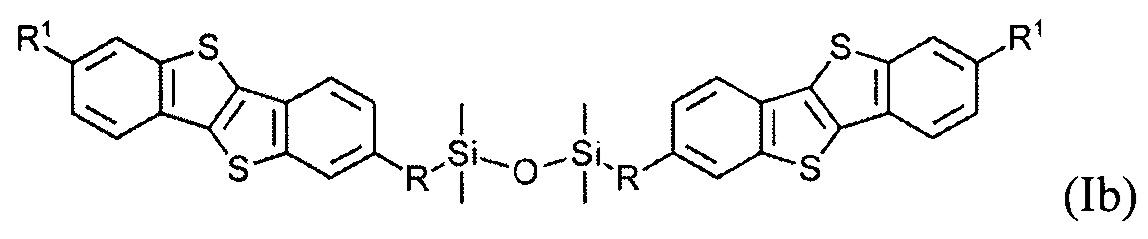
В одном варианте реализации соединение, когда у равно 2 и X означает кислород, соединение имеет следующую формулу (Ib):
где
R1 означает С2-С13 алкил, и
R означает С3-C18 алкенил.
В одном варианте реализации соединение имеет формулу (Ib) и R означает С3-С12 алкенил.
В одном варианте реализации соединение имеет формулу (Ia), где R1 означает С6 алкил, R означает С10 алкенил и X означает Cl.
В одном варианте реализации соединение имеет формулу (Ib), где R1 означает С6 алкил и R означает С11 алкенил.
Соединения (I) могут образовывать слои на поверхности субстрата. Функциональные группы соединения имеют сродство к соответствующему субстрату. Это помогает прикрепить соединение к нему. Функциональные группы в соединении (Ia) - это галогенсилильные (X=Hal). Функциональными группами в соединении (Ib) являются дисилоксановые (X=О).
Алкильные группы R1 соединений (I) улучшают растворимость в обычных органических растворителях, таких как толуол, бензол, ТГФ, хлороформ, хлорбензол и других, а также в их смесях.
Соединение (I), имеющее дисилоксановую функциональную группу является химически стабильным. Имеет хорошую окислительную и термическую стабильность. Это соединение (I) является стабильным в окружающей атмосфере до 300°C.
В соответствии с примером реализации предложен новый метод для изготовления дизамещенных соединений формулы (I). Способ изготовления соединения общей формулы (I)
где
R1 означает С0-С13 алкил,
R означает С3-С18-алкенил,
X означает О или галоген, и
y равно 1 или 2,
при условии когда у равно 1, X означает галоген и когда у равно 2, X означает О
включает в себя:
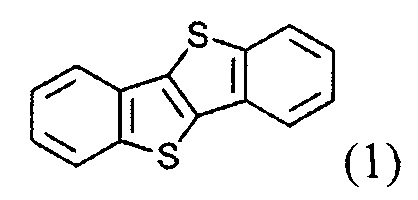
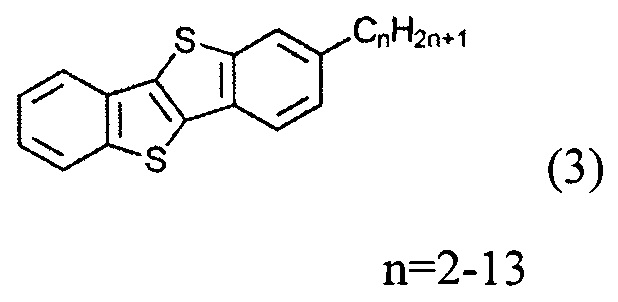
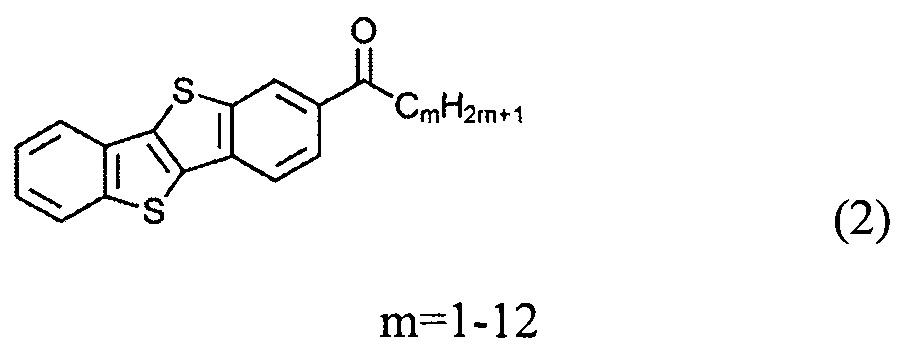
а) получение 2-алкил-[1]бензотиено[3,2-b][1]бензотиофена (3)
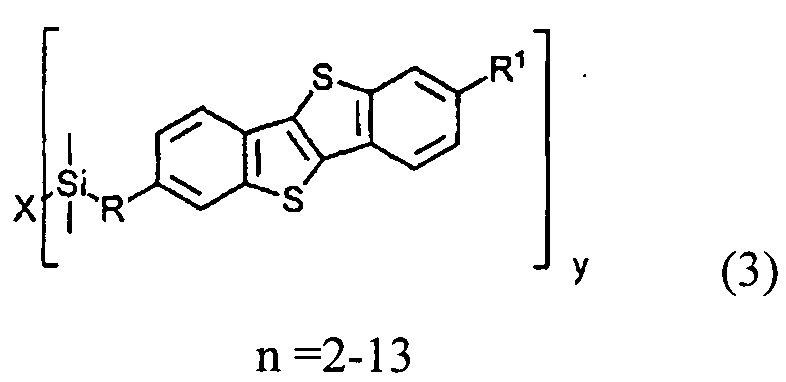
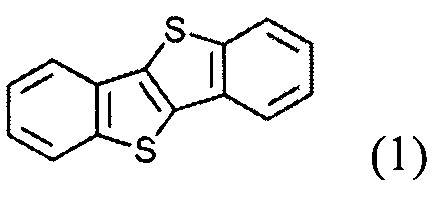
ацилированием [1]бензотиено[3,2-b][1]бензотиофена (1)
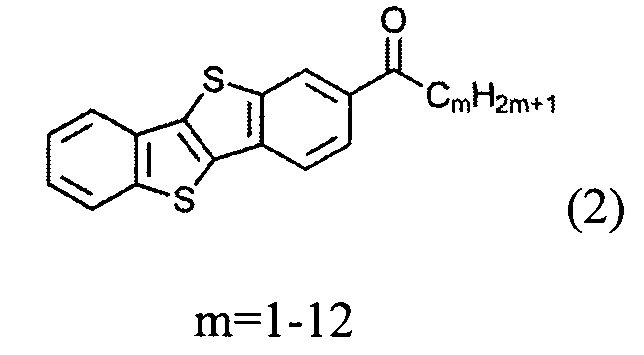
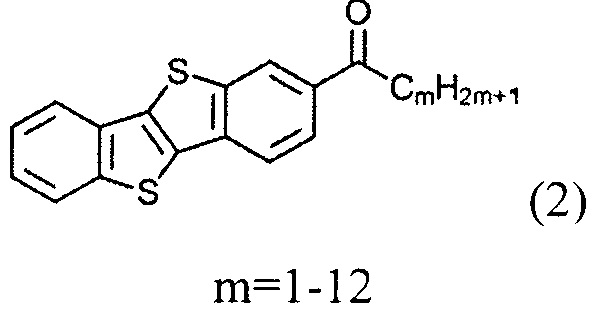
и восстановленим полученного [1]бензотиено[3,2-b][1]бензотио-2-ил-алканона (2)
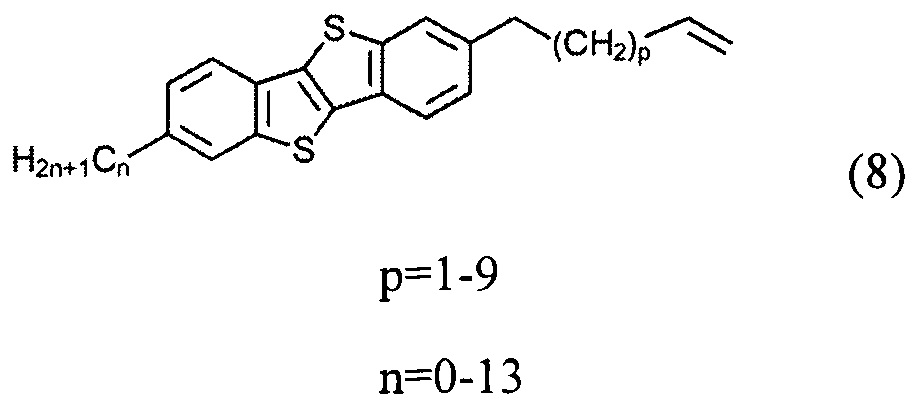
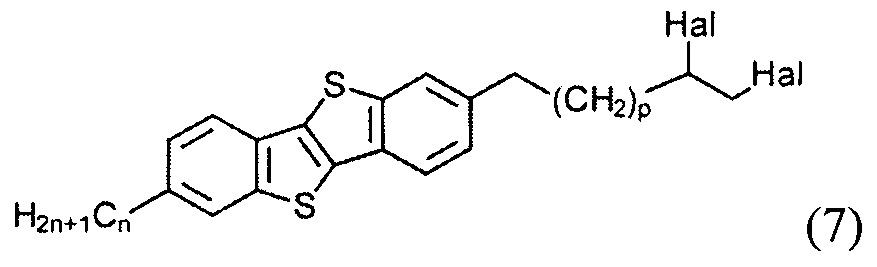
б) получение 2-алкил-7-алкен-1-ил[1]бензотиено[3,2-b][1]бензотиофена (8)
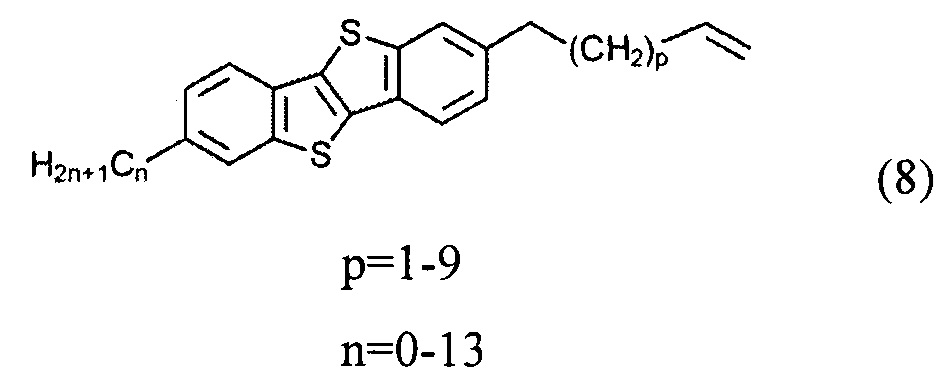
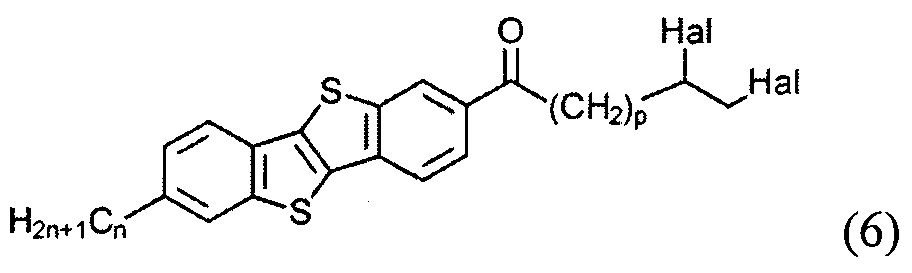
ацилированием 2-алкил-[1]бензотиено[3,2-b][1]бензотиофена (3) или [1]бензотиено[3,2-b][1]бензотиофена (1) с дигалогеналканоил хлоридом (5)
Cl(СО)(СН2)pCH(Hal)СН2(Hal)
и восстановлением полученного соединения (6)
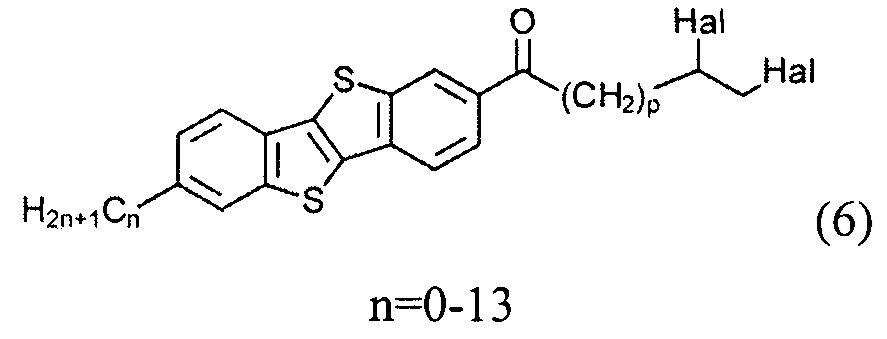
с образованием соединения (7)
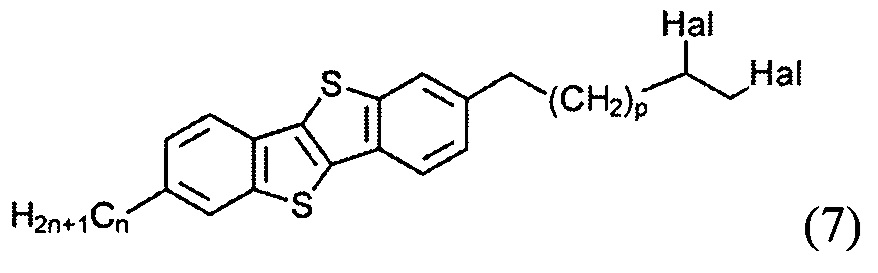
и последующего удаления атомов галогенов из соединения (7) с образованием двойной связи и соединения (8), и
в) получением соединения формулы (I), где у равно 1 и X означает галоген, т.е. соединение формулы (Ia)
гидросилилированием 2-алкил-7-алкен-1-ил[1]бензотиено[3,2-b] [1] бензотиофена (8) с диметилгалогенсиланом формулы H(CH3)2Si-Hal, или
г) получение соединения формулы (I), где y равно 2 и X означает О, т.е. соединение формулы (Ib)
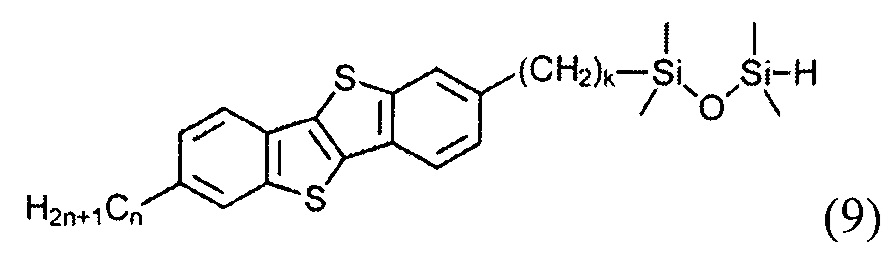
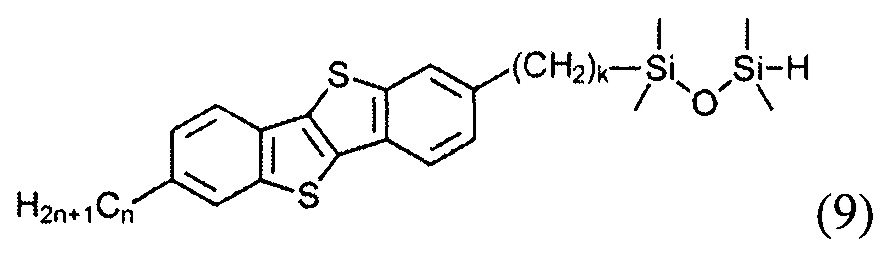
Гидросилилированием 2-алкил-7-алкен-1-ил[1]бензотиено[3,2-b] [1] бензотиофена (8) с тетраметилдисилоксаном с образованием соединения (9)
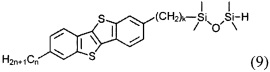
и последующим взаимодействием соединения (9) с соединением (8) в условиях реакции гидросилилирования.
В одном варианте реализации заявленный способ включает получение дизамещенного соединения общей формулы (I), в котором R1 означает С2-С13 алкил, R означает С3-C18 алкенил, X означает О или галоген и у равно 1 или 2, при условии когда у равно 1, X означает галоген и когда у равно 2, X означает О.
Метод изготовления дизамещенного соединения формулы (Ia) включает шаги с а) по в). Способ изготовления соединения формулы (Ia)
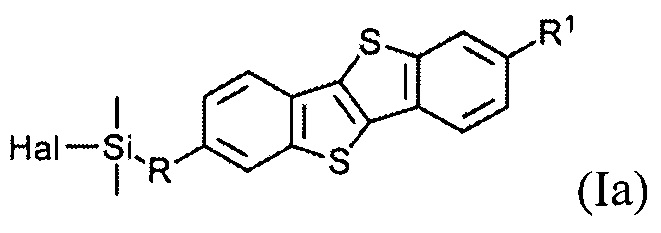
где
R1 означает С0-С13 алкил,
R означает С3-C18 алкенил,
Hal означает галоген,
включает в себя:
а) получение 2-алкил-[1]бензотиено[3,2-b][1]бензотиофена (3)
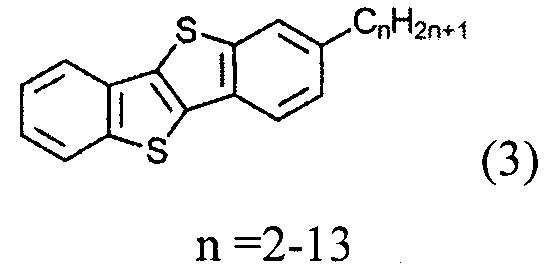
ацилированием [1]бензотиено[3,2-b][1]бензотиофена (1)
и восстановлением полученного [1]бензотиено[3,2-b][1]бензотио-2-ил-алкан-1-она (2)
б) получение 2-алкил-7-алкен-1-ил[1]бензотиено[3,2-b][1]бензотиофена (8)
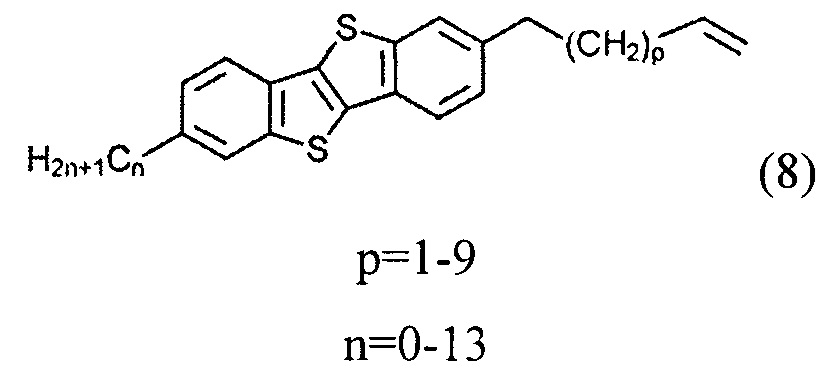
ацилированием 2-алкил-[1]бензотиено[3,2-b][1]бензотиофена (3) или [1]бензотиено[3,2-b][1]бензотиофена (1) с дигалогеналканоил хлоридом (5)
Cl(СО)(СН2)pCH(Hal)СН2(Hal)
и восстановлением полученного соединения (6)
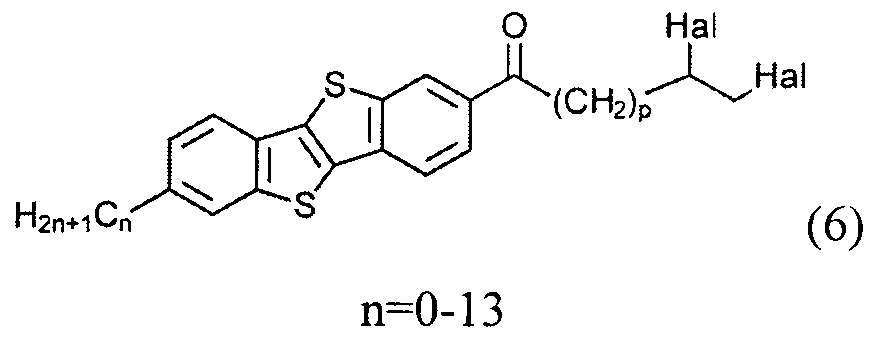
с образованием соединения (7)
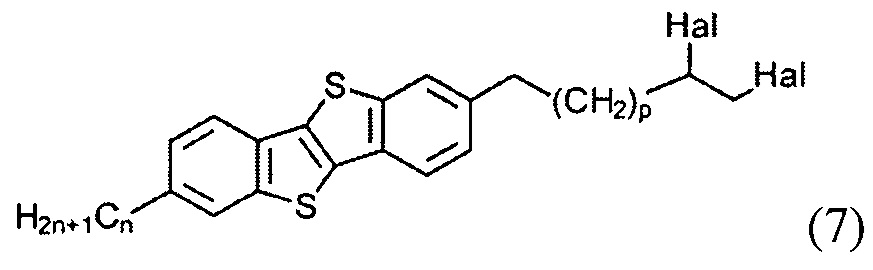
и последующего удаления атомов галогена из соединения (7) и образования двойной связи и соединения (8), и
в) получения соединения формулы (Ia)
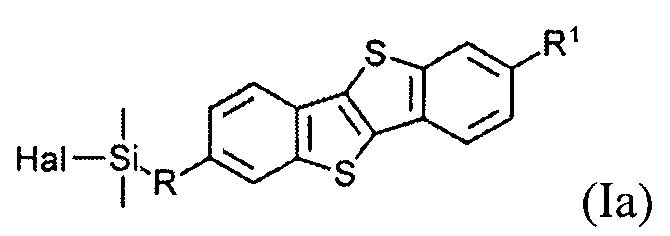
гидросилилированием 2-алкил-7-алкен-1-ил[1]бензотиено[3,2-b] [1] бензотиофена (8) с диметилгалогенсиланом формулы H(CH3)2Si-Hal.
В одном варианте реализации способ включает получение соединения формулы (Ia), где R1 означает С2-С13 алкил, R означает С3-C18 алкенил и Hal означает галоген.
Метод изготовления дизамещенного соединения формулы (Ib) включает в себя этапы а), б) и г). Способ изготовления соединения формулы (Ia)
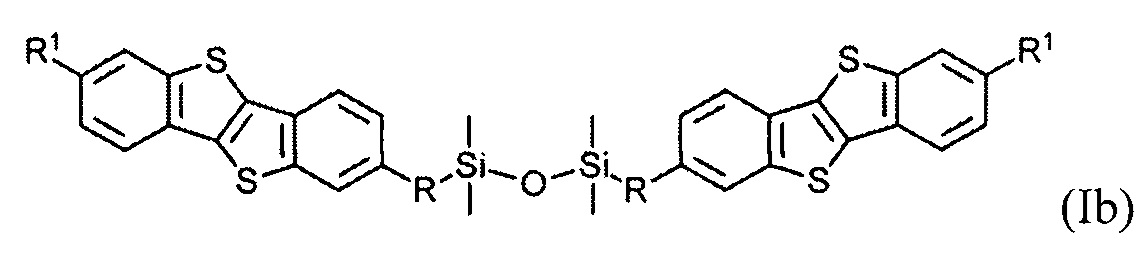
где
R1 означает С0-С13 алкил,
R означает С3-С18 алкенил,
включает в себя:
а) получение 2-алкил-[1]бензотиено[3,2-b][1]бензотиофена (3)
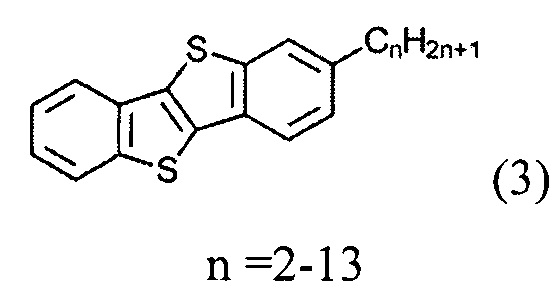
ацилированием [1]бензотиено[3,2-b][1]бензотиофена (1)
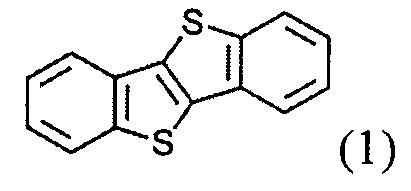
и восстановлением полученного [1]бензотиено[3,2-b][1]бензотио-2-ил-алкан-1-она (2)
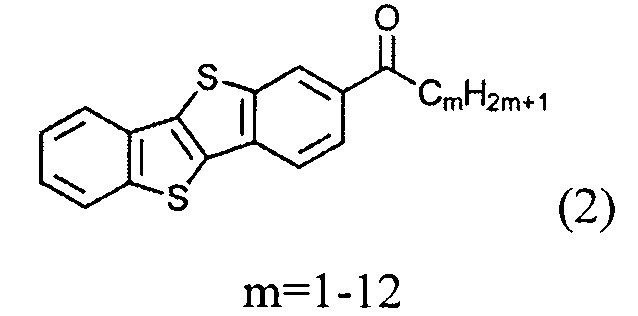
б) получение 2-алкил-7-алкен-1-ил[1]бензотиено[3,2-b][1]бензотиофена (8)
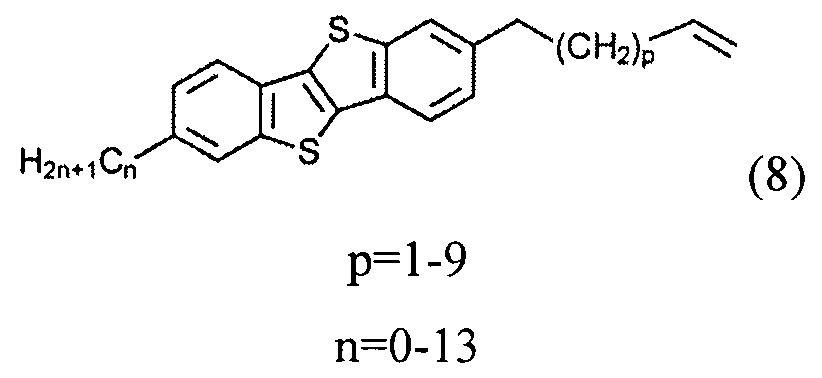
ацилированием 2-алкил-[1]бензотиено[3,2-b][1]бензотиофена (3) или [1]бензотиено[3,2-b][1]бензотиофена (1) с дигалогеналканоил хлоридом (5)
Cl(СО)(СН2)pCH(Hal)СН2(Hal)
и восстановлением полученного соединения (6)
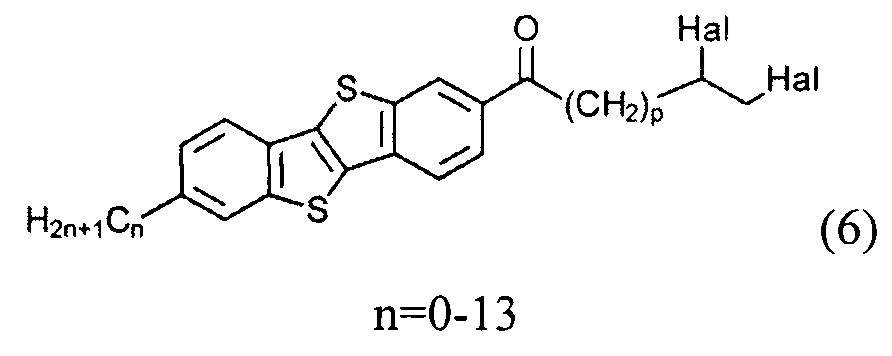
с образованием соединения (7)
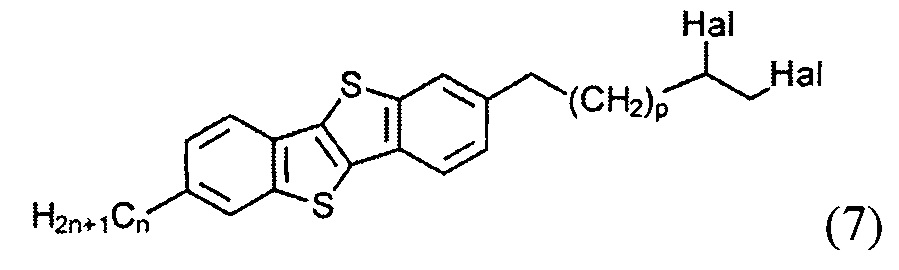
и последующего удаления атомов галогена из соединения (7) и образования двойной связи и соединения (8), и
г) получения соединения формулы (Ib)
гидросилилированием 2-алкил-7-алкен-1-ил[1]бензотиено[3,2-b] [1] бензотиофена (8) с тетраметилдисилоксаном с образованием соединения (9)
и последующего взаимодействия соединения (9) и соединения (8) в условиях реакции гидросилилирования.
В одном варианте реализации способ включает приготовление соединения формулы (Ib), где R1 означает С2-С13 алкил и R означает С3-C18 алкенил.
Ацилирование шага а) может быть осуществлено по реакции Фриделя-Крафтса. Ацилирование может быть осуществлено с использованием различных алканоил хлоридов под каталитическим действием кислот Льюиса, таких как безводный алюминия(III) хлорида.
Восстановление кетона формулы (2) может осуществляться металл-гидридными реагентами в соответствующем растворителе. В одном варианте восстановление осуществляется боргидридом натрия и безводного алюминия (III) хлорида в ТГФ.
Ацилирование шага б) может быть осуществлено с помощью дигалогеналканоил хлорида (5) Cl(СО)(СН2)pCH(Hal)CH2(Hal), р равно 1-9. Соединение (5) получают из соответствующего алканоил хлорида формулы (4) Cl(СО)(СН2)pCH=СН2, имеющего терминальную двойную связь. Двойная связь соединения (4) защищена галогенирования с атомом галогена. Защищенное соединение (5) может быть введено во взаимодействие с соединением (1) или его алкильных производных (3) в условиях реакции Фриделя-Крафтса для формирования несимметричного соединения (6) с защищенной терминальной двойной связью. Соединение (6), где n равно 2-13 образуется, когда соединение (5) реагирует с соединением (3). Реакция соединения (5) с соединением (1) приводит к образованию соединения (6), где n равно 0. Использование соединения (5) не влияет на течение и региоселективность в реакции ацилирования и приводит к образованию кетона (6).
В одном варианте ацилирование на стадии б) осуществляют дибромированным алканоил хлоридном (5) Cl(СО)(СН2)pCH(Br)СН2(Br), где p равно 1-9, в присутствии кислоты Льюиса.
Восстановление на шаге б) может быть осуществлено в тех же условиях, что и восстановление кетона (2) на шаге а) для получения соединения (7). В одном варианте восстановление осуществляется борогидридом натрия и безводным алюминия(III) хлоридом в ТГФ.
Соединение (8) с двойной связью на конце может быть получено дегалогенированием соединения (7), т.е. снятием защиты двойной связи. В одном варианте соединение (7) может быть подвергнуто взаимодействию с порошком Zn в уксусной кислоте при нагревании с образованием соединения (8) с алкил-алкенил конецевой связи. Снятие защиты двойной связи может быть выполнено с отличным выходом.
На шаге б) применение соединения (1) в реакции с соединением (5) образует соединения (6), (7) и (8), где n равно 0, и применение соединения (1) в реакции с соединением (5) образует соединения (6), (7) и (8) где n равно 2-13.
Соединение (Ia) с хлорсилилиными функциональными группами могут быть получены гидросилилированием соединения (8) с диметилхлорсиланом.
Гидросилилирование соединения (8) может привести к несимметричному соединению (9) с гидридсилильной функциональной группой, если гидросилилирование осуществляется с избытком тетраметилдисилоксана (ТМДС). Соединение (Ib) с дисилоксановыми функциональными группами могут быть получены при дальнейшем взаимодействии соединения (9) в условиях реакции гидросилилирования с соединением (8).
В одном варианте соединение (Ib) получается гидросилилированием соединения (8) с половинным молярным объемом ТМДС.
В контексте данного метода, соединением общей формулы (I) может быть любое соединение, описанное в данной спецификации.
Соединения (I) могут образовывать слои или монослоя на поверхности подложки. Функциональные группы соединений (I) имеют сродство к соответствующему субстрату. Соответствующий субстрат может иметь гидроксилсодержащую, гидрофильную или гидрофобную поверхности.
Самоорганизующиеся монослои (SAM) из органических молекул являются молекулярными агрегатами самопроизвольно образованными на поверхности путем адсорбции или самоорганизации на границе раздела фаз вода-воздух в ванне Ленгмюра с последующим перенесением путем SAM на субстрат, т.е. по методу Ленгмюра-Блоджетт и Ленгмюра-Шаффера.
Монофункциональные соединения (Ia) с хлорсилильными функциональными группами могут образовывать монослои на любой гидроксилсодержащей поверхности. Такие монослои могут быть получены по классической самосборке из раствора или методом переноса Ленгмюра-Блоджетт самоорганизованного Ленгмюровского слоя с поверхности раздела фаз воздух-вода.
Монофункциональные соединения (Ib) с функциональной дисилоксановой группой могут образовывать монослой на любой гидрофильной поверхности. Такие монослои могут быть произведены методом переноса самоорганизованного монослоя с поверхности воздуха-вода по Ленгмюра-Блоджетт и Ленгмюра-Шефера, благодаря слабым Ван-дер-Ваальсовым взаимодействиям между полярными дисилоксановыми группами соединения (Ib) и водной поверхности.
Слои соединения общей формулы (I) могут иметь подвижность носителей заряда до 1 см2/Вс. Носителями зарядов являются, например, положительнно заряженные дырки.
Соединение (I) может быть использовано в качестве полупроводникового слоя. В одном варианте полупроводниковый слой содержит соединение общей формулы (I)
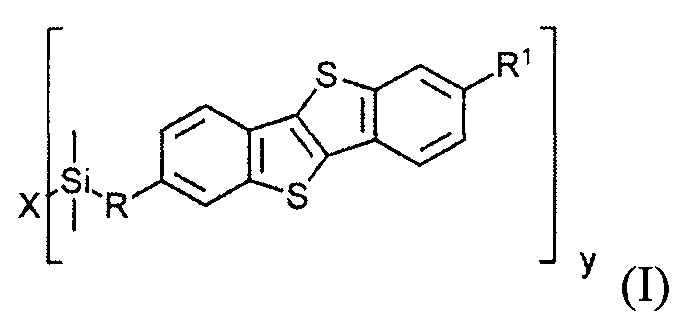
где
R1 означает С2-С13 алкил,
R означает С3-C18 алкенил,
X означает О или галоген,
y равно 1 или 2,
при условии когда y равно 1, X означает галоген и когда у равно 2, X означает О.
В одном варианте полупроводниковый слой включает в себя мономолекулярный слой соединения общей формулы (I).
В одном варианте полупроводниковый слой состоит из самоорганизующегося монослоя (SAM) соединения общей формулы (I).
В одном варианте полупроводниковый слой включает в себя мономолекулярный слой, образованный из соединения формулы (Ia)
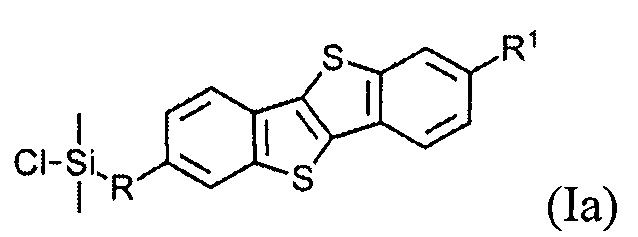
где R и R1 определены выше.
В одном варианте полупроводниковый слой состоит из мономолекулярного слоя соединения формулы (Ib)
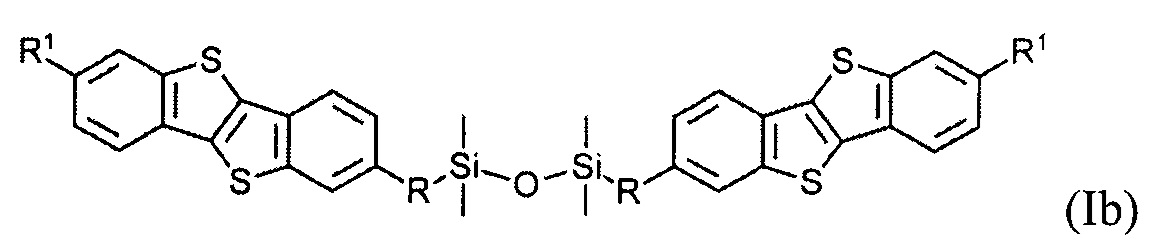
где R и R1 определены выше.
В контексте полупроводникового слоя, соединением общей формулы (I) может быть любое соединение, описанное в данной спецификации.
В одном примере реализации электронное устройство включает в себя полупроводниковый слой, как определено выше.
Электронным устройством может быть полевой транзистор, или датчик. Полупроводниковый слой может быть слоем в органическом светоизлучающем диоде.
В одном варианте электронное устройство является полевым транзистором.
В одном варианте полевой транзистор представляет собой органический полевой транзистор, содержащий подложку, в качестве электрода, слой изолятора, нанесенный на подложку, полупроводниковый слой, который наносится на слой диэлектрика и включает соединение общей формулы (I), и электродами (затвором и истоком) в полупроводниковом слое.
В одном варианте устройство включает в себя полупроводниковый слой, содержащий мономолекулярный слой, образованный из соединения формулы (Ia)
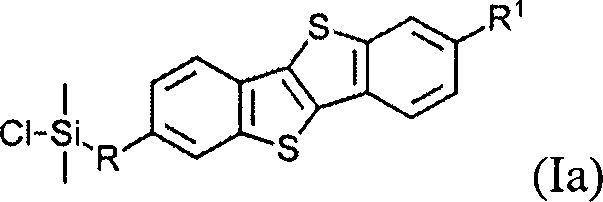
где R и R1 определены выше, и устройство является монослойным органическим полевым транзистором.
В одном варианте устройство включает в себя полупроводниковый слой, содержащий мономолекулярный слой соединения формулы (Ib)
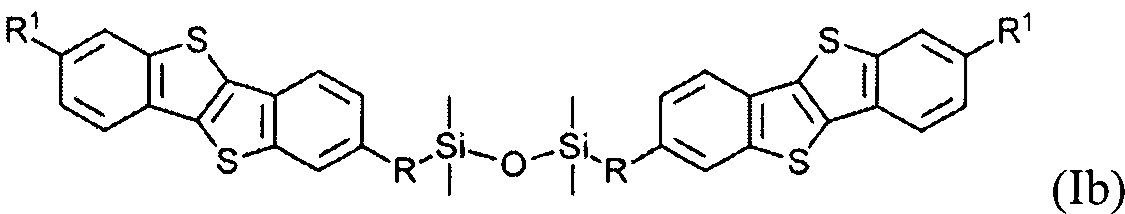
где R и R1 определены выше, устройство является монослойным органическим полевым транзистором.
В контексте электронного устройства, соединением общей формулы (I) может быть любое соединение, описанное в данной спецификации.
В соответствии с примером реализации обеспечивается способ изготовления электронного устройства, который включает в себя:
i) предоставление подложки;
ii) получение на подложке слоя, содержащего соединение общей формулы (I)
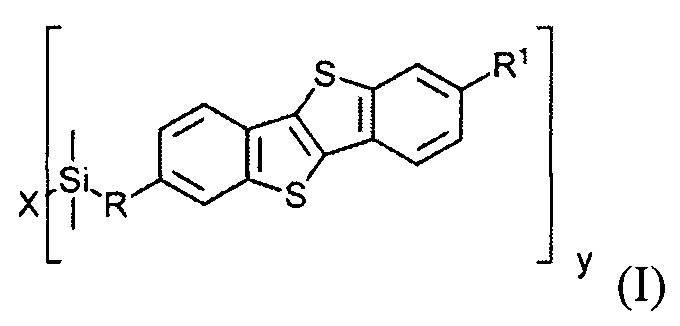
где
R1 означает С2-С13 алкил,
R означает С3-C18 алкенил,
X означает О или галоген,
у равно 1 или 2,
при условии когда у равно 1, X означает галоген и когда у равно 2, X означает О.
В одном варианте, где слой содержит соединение формулы (Ia), слой производится путем самосборки из раствора или методом переноса Ленгмюра-Блоджетт самоорганизующегося монослоя с границы раздела фаз вода-воздух.
В одном варианте, отличающимся тем, что слой включает соединение формулы (Ib), слой изготавливается методом переноса Ленгмюра-Блоджетт или Ленгмюра-Шефера самоорганизующегося монослоя с поверхности раздела фаз воздух-вода. В некоторых вариантах, это обеспечивает химически стабильное соединение (Ib). Химически стабильное соединение (Ib) удобно при использовании в расворных методах производства органической электроники.
В одном варианте, где слой включает в себя соединение формулы (Ib) слой изготавливается методом Ленгмюра-Блоджетт.
В одном варианте полученное электронное устройство представляет собой монослойный органический полевой транзистор.
В некоторых вариантах выполнения методы самосборки обеспечивают быстрые и легкие способы обработки при производстве электронного устройства и/или полупроводникового слоя, содержащего соединение формулы (I). Кроме того, в некоторых вариантах реализации способ изготовления электронного устройства, использующего эти методики самосборки, не требуют каких-либо особых условий подготовки.
Эти методы имеют промышленные модификации в виде рулонной технологии.
В некоторых вариантах полученный монослой ОПТ показывает термическую и окислительную стабильность и хорошую подвижность носителей заряда.
В соответствии с примером реализации обеспечивается применение соединения общей формулы (I)
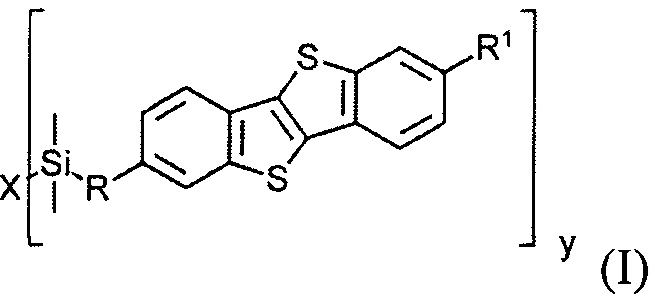
где
R1 означает С2-С13 алкил,
R означает С3-C18 алкенил,
X означает О или галоген,
у равно 1 или 2,
при условии когда у равно 1, X означает галоген и когда у равно 2, X означает О
в полупроводниковом слое в электронный компоненте.
Варианты реализации описанного выше изобретения могут быть использованы в любой комбинации друг с другом. Несколько вариантов могут быть объединены вместе, чтобы сформировать дальнейшая реализация изобретения. Метод, композиция или использование, к которым относится данное изобретение, может содержать, по меньшей мере, один из вариантов реализации изобретения, описанных выше.
Теперь будет приведена информация о вариантах реализации настоящего изобретения, примеры которых проиллюстрированы в сопроводительных чертежах. Описание ниже раскрывает некоторые варианты реализации изобретения в таком виде, что специалист в данной области техники имеет возможность использовать изобретение, основанное на данном описании. Не все этапы реализации описаны подробно, поскольку многие действия, основанные на этой спецификации, будут очевидны для специалиста в данной области техники.
На Фиг. 1 показан монослой, образованный соединением (Ia), имеющим хлорсилановые функциональные группы. Соединение (Ia) может образовывать монослой на любой гидроксилсодержащей поверхности, как показано на Фиг. 1. Такие монослои могут быть произведены либо по классической самосборке из раствора или методом переноса Ленгмюра-Блоджетт самоорганизующегося монослоя с поверхности раздела фаз вода-воздух.
На Фиг. 2 показан монослой, образованный соединением (Ib) с дисилоксановыми функциональными группами. Соединение (Ib) может образовывать монослой на любой гидрофильной поверхности, как показано на Фиг. 2. Соединение (Ib) является химически стабильным. Это упрощает изготовление монослоя и переработку растворными методами органической электроники. Такие монослои могут быть изготовлены методом переноса Ленгмюра-Блоджетт самоорганизующегося монослоя с поверхности раздела фаз воздух-вода. Формирование SAM происходит благодаря водородным связям между полярными дисилоксановыми группами соединения (Ib) и молекулами воды. Методу Ленгмюра-Блоджетт - быстрый и легкий, технологичен в производстве электронных устройств и полупроводниковых слоев. Этот способ использования соединения формулы (Ib) не требует каких-то особых условий подготовки.
Монослои также могут быть изготовлены методом переноса Ленгмюра-Шефера самоорганизующегося монослоя с поверхности раздела фаз воздух-вода.
На Фиг. 3 показана структура полевого транзистора на основе монослоя соединения (Ia). Сильно легированный кремний с термически выращенным оксидом был использован для затворного электрода (МЕТАЛЛ) и затворного диэлектрика (ИЗОЛЯТОР), соответственно. Золотые электроды истока и стока были нанесены на верхнюю часть диэлектрика затвора с помощью теневой маски. Монослой соединения (Ia) между золотыми электродами формирует полупроводниковый слой транзистора (ПОЛУПРОВОДНИК), позволяя протекать току от истока к стоку. Варьируя напряжение на затворе, ток между стоком и истоком может быть изменен на несколько порядков.
Соединение (Ib) также может быть использовано для формирования монослоя в ОПТ.
Материал для подложки в качестве электрода может быть изготовлен из сильно допированных пластин кремния, алюминия или фольги другого металла. Материал для слоя изолятора, нанесенного на подложку, может быть диоксидом кремния, полимера, например, полистирола, ПММА и поли(п-ксилилена) или оксида алюминия. Полупроводниковый слой, который наносится на слой диэлектрика, включает соединение общей формулы (I).
Другой подходящий материал субстрата - диэлектрики, например, стекло или полимеры, такие как ПЭТ, ПЭН, полиэфирсульфоны, полиимиды. Затвор, а также электроды истока и стока могут быть изготовлены как напылением металлов с помощью масок, так и с помощью литографии или печатных металлов с использованием проводящих чернил. Также можно печатать органические проводники, такие как PEDOT, PANI и углеродные нанотрубки и использовать их в качестве электродов.
Изготовленные монослойные ОПТ термически и окислительно стабильны и имеют хорошую подвижность носителей заряда.
ПРИМЕР 1 - Синтез соединений IVa-1 и IVb-1.
Схема реакции:
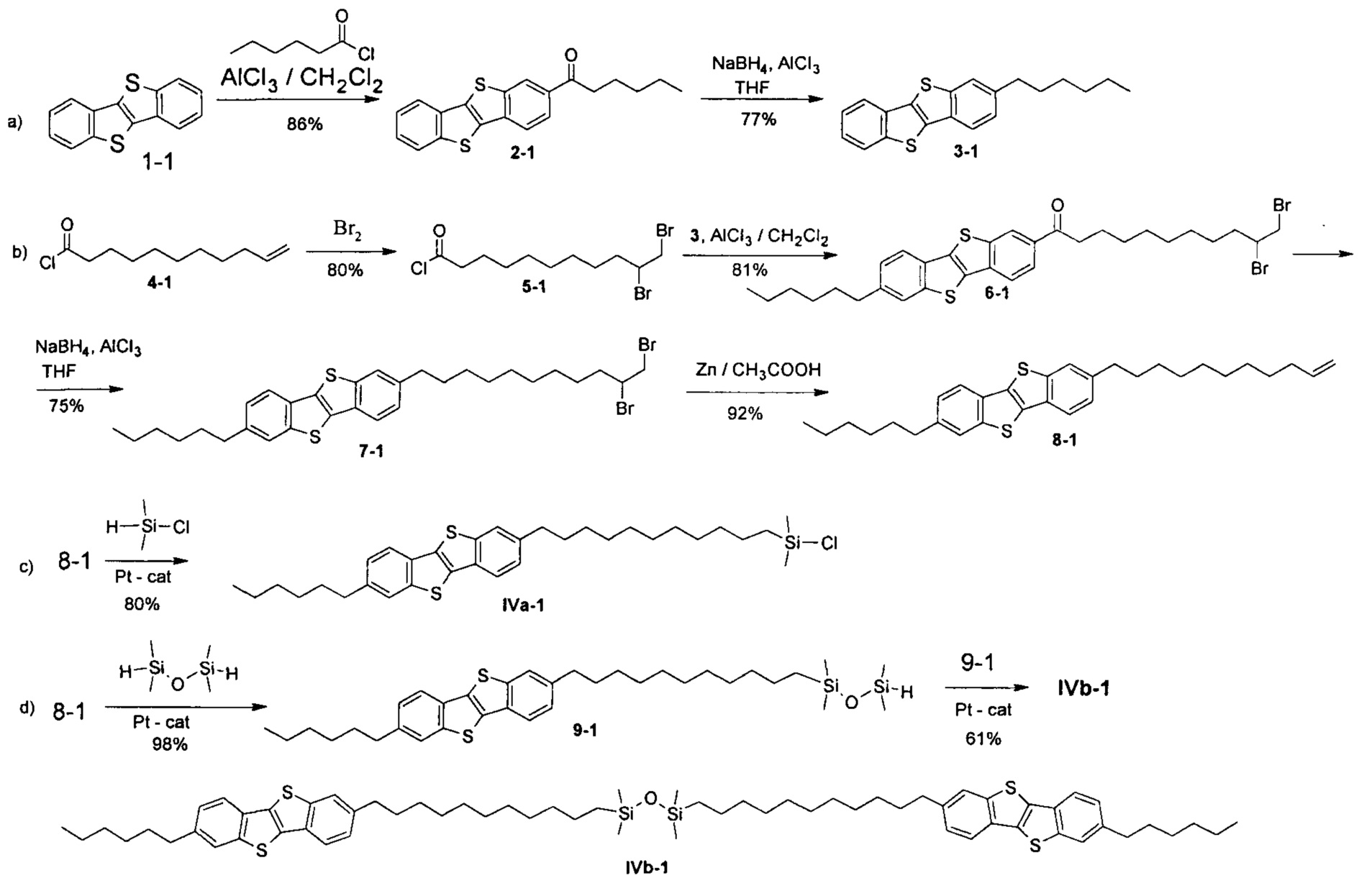
Материалы
Хлористый алюминий, н-генксаноил хлорид, натрия борогидрид, бром, порошок цинка, 1,1,3,3-тетраметилдисилоксан, диметилхлорсилан были получены от Sigma-Aldrich Со. и использованы без дополнительной очистки. ТГФ сушили над CaH2 и перегоняли над LiAlH4. Дихлорметан сушили перегонкой над Р2О5. Толуол и гексан были перегнаны перед использованием. Растворители упаривали в вакууме под давлением до 1 торр при 40°C. Все реакции проводили в инертной атмосфере. [1]Бензотиено[3,2-b][1]бензотиофен (ВТВТ) готовили по методике, описанной ранее [Kosata. В., Kozmic V., Svoboda J., Novotna V., Vanek P., Glogarova M. Liquid Crystals, 2003, V. 30, 603-610].
Использованные аналитические методы
ГПХ анализ проводился с помощью LC10AVP хроматографа фирмы Shimadzu (Япония), оснащенным рефрактометром RID-10AVP и диодной матрицей CPD-M10AVP в качестве детекторов и колонкой Phenomenex (США) размером 7.8×300 мм2, наполненной сорбентом Phenogel с размером пор
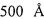
Для колоночной хроматографии был использован силикагель 60 ("Мерк").
1Н ЯМР спектры были записаны на спектрометре ""Bruker WP-250 SY", работающем на частоте 250.13 МГц и с использованием ДМСО-d6 сигнала (2.45 ppm) в качестве внутреннего стандарта.13С и29Si ЯМР-спектры записывали с помощью спектрометра "Bruker Avance II 300" на 75 МГц и 60 МГц, соответственно. В случае1Н ЯМР-спектроскопии, соединений для анализа были взяты 1% растворы соединений в CDCl3. В случае13С и29Si ЯМР спектроскопии соединений для анализа были взяты 5% растворы в CDCl3. Затем спектры были обработаны на компьютере с использованием программного обеспечения ACD Labs.
Элементный анализ на С, Н элементы проводился с использованием CNH автоматического анализатора СЕ1106 (Италия). Экспериментальная ошибка 0.30-0.50%. Анализ элемента Br проводился методом визуального титрования, используя Hg(NO3)2 и дифенилкарбазона в качестве индикатора. Горение было сделано в колбе Sheninger через щелочной раствор перекиси водорода в качестве абсорбента. Экспериментальная ошибка 0.30-0.50%. Метод спектрофотометрии был использован для анализа Si.
[1]бензотиено[3,2-b][1]бензотиен-2-ил)-гексан-1-он (2-1)
Раствор [1]бензотиено[3,2-В][1]бензотиофен 1-1 (ВТВТ, 1,0 г, 4.2 ммоль) в сухом дихлорметане (160 мл) охладили до -5°С и хлорид алюминия (1,0 г, 7,5 ммоль) добавили одной порцией. Смесь перемешивали в течение 1 ч при указанной температуре. После этого, н-гексаноил хлорид (1,0 г, 7,5 ммоль) добавляли по каплям. После перемешивания в течение 1 ч при -5°C реакционную смесь вылили в 200 мл воды и 300 мл дихлорметана. Органический слой промыли водой и осушили над сульфатом натрия. Растворитель упаривали в вакууме и продукт очищали с помощью колоночной хроматографии на силикагеле (элюент-толуол), получили чистое вещество 2-1(1.214 г, 86%).
1Н ЯМР (250 МГц, CDCl3) δ 8.55 (дд, J=1.5, 0.6 Гц, 1H), 8.06 (дд, J=8.5, 1.5 Гц, 1H), 7.94 (м, 3Н), 7.48 (м, 2Н), 3.07 (т, J=7.3 Гц, 2Н), 1.81 (м, 2Н), 1.42 (м, 4Н), 0.94 (т, J=7.0 Гц, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 199.47, 142.78, 142.20, 136.88, 136.18, 133.60, 132.93, 132.72, 125.78, 125.08, 124.64, 124.45, 124.10, 122.01, 121.30, 38.73, 31.58, 24.19, 22.55, 13.96.
Элементный анализ рассчитано для C20H18OS2: С, 70.97; Н, 5.36; S, 18.95. Найдено: С, 71.08; Н, 5.60; S, 18.63.
2-Гексил-[1]бензотиено[3,2-b] [1]бензотиофен (3-1)
В перемешиваемый раствор соединения 2-1 (0.60 г, 1,8 ммоль) в сухом ТГФ (30 мл) боргидрид натрия (0,34 г, 8.9 ммоль) и хлорид алюминия (0,59 г, 4,4 ммоль) добавляли последовательно. После окончания экзотермической реакции, смесь перемешивали при нагревании с обратным холодильником в течение 4 ч. Затем 10 мл воды добавляли по каплям. Затем реакционную смесь добавляли к 100 мл воды и 150 мл дихлорметана. Органический слой промыли водой и сушили над сульфатом натрия. Растворитель упаривали в вакууме и продукт очищали путем колоночной хроматографии на силикагеле (элюент-толуол), для выделения чистого вещества 3-1 (0,44 г, 77%).
1Н ЯМР (250 МГц, CDCl3) δ 7.90 (дд, J=14.1, 7.5 Гц, 2Н), 7.80 (д, J=8.2 Гц, 1Н), 7.73 (с, 1Н), 7.44 (м, 2Н), 7.30 (дд, J=8.1, 1.3 Гц, 1Н), 2.78 (т, J=7.5 Гц, 2Н), 1.72 (м, 2Н), 1.36 (м, 6Н), 0.92 (т, J=6.9 Гц, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 199.57, 142.07, 140.07, 133.88, 133.26, 132.57, 131.01, 125.88, 124.78, 124.68, 123.97, 123.33, 121.38, 121.23, 36.12, 31.72, 31.64, 28.97, 22.60, 14.09.
Элементный анализ рассчитано для C20H20S2: С, 74.03; Н, 6.21; S, 19.76. Найдено: С, 74.18; Н, 6.44; S, 19.88.
10,11-Дибромоундеканоил хлорид (5-1)
Br2 (16.00 г, 98.7 ммоль) медленно добавляют к раствору 10-ундеценоил хлорида 4-1 (20.00 г, 98.7 ммоль) в сухом дихлорметане (50 мл) при 0°C. Смесь перемешивали в течение 1 ч при 0°C и после этого в течение дополнительного 1 ч при комнатной температуре. После упаривания растворителя продукт очищали вакуумной перегонкой (1 мбар 170°C), получили чистое вещество 5-1 (28.62 г, 80%) в виде бесцветной жидкости.
1Н ЯМР (250 МГц, CDCl3) δ 4.17 (м, 1Н), 3.86 (дд, J=10.1, 4.3 Гц, 1Н), 3.63 (т, J=10.1 Гц, 1Н), 2.90 (т, J=7.3 Гц, 2Н), 2.15 (м, 1Н), 1.29-1.88 (перекрывающиеся пики, 13Н).
13С ЯМР (75 МГц, CDCl3) δ 173.76, 52.99, 47.04, 36.27, 35.93, 29.00, 28.88, 28.60, 28.31, 26.62, 24.98.
Элементный анализ рассчитано для C11H19Br2ClO: С, 36.44; Н, 5.28; Br, 44.08, Cl, 9.78. Найдено: С, 36.70; Н, 5.43; Br, 44.00; Cl, 9.68.
10,11-дибромо-1-(7-гексил[1]бензотиено[3,2-b][1]бензотиен-2-ил)ундекан-1-он (6-1)
Раствор соединения 3-1 (1,0 г, 3.1 ммоль) в сухом дихлорметане (60 мл) охлаждают до -10°C и хлорид алюминия (1,23 г, 9.2 ммоль) добавляют одной порцией. Смесь перемешивают в течение 1 ч при указанной температуре. После этого реакционную смесь охлаждают до -70°C и соединение 5-1 (5,0 г, 13.9 ммоль) прикапывают. После перемешивания в течение 2 ч при 70°C реакционную смесь выливают в 200 мл воды и 300 мл дихлорметана. Органический слой промывают водой и сушат над сульфатом натрия. Растворитель упаривали в вакууме и продукт очищали с помощью колоночной хроматографии на силикагеле (элюент-толуол), для получения чистого вещества 6-1 (1,62 г, 81%).
1Н ЯМР (250 МГц, CDCl3) δ 8.53 (д, J=0.9 Гц, 1Н), 8.05 (дд, J=8.4, 1.5 Гц, 1H), 7.88 (д, J=8.4 Гц, 1Н), 7.83 (д, J=8.1 Гц, 1Н), 7.74 (с, 1Н), 7.31 (дд, J=8.2, J=1.3 Гц, 1H), 4.18 (м, 1Н), 3.86 (дд, J=10.3, 4.5 Гц, 1Н), 3.64 (т, J=10.0 Гц, 1H), 3.06 (т, J=7.5 Гц, 2Н), 2.78 (т, J=7.5 Гц, 2Н), 2.14 (м, 1Н), 1.52-1.87 (перекрывающиеся пики, 7Н), 1.26-1.51 (перекрывающиеся пики, 14Н), 0.91 (т, J=7.0 Гц, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 199.48, 143.16, 142.03, 141.37, 136.97, 136.44, 133.34, 132.14, 130.67, 126.17, 124.65, 124.49, 123.41, 121.71, 121.13, 53.11, 38.72, 36.35, 36.16, 36.00, 31.70, 31.57, 29.33, 29.31, 29.21, 28.96, 28.73, 26.71, 24.47, 22.59, 14.08.
Элементный анализ рассчитано для C31H38Br2OS2: С, 57.23; Н, 5.89; Br, 24.56; S, 9.86. Найдено: С, 56.92; Н, 5.65; Br, 24.76; S, 9.64.
2-(10,11-дибромоундецил)-7-гексил [1] бензотиено [3,2-b] [1] бензотиофен (7-1)
В перемешиваемый раствор соединения 6-1 (0,3 г, 0,5 ммоль) в сухом ТГФ (40 мл), боргидрид натрия (0,09 г, 2,3 ммоль) и хлорид алюминия (0,16 г, 1,2 ммоль) добавляли последовательно. После окончания экзотермической реакция, смесь перемешивали при нагревании с обратным холодильником в течение 4 ч. Затем 10 мл воды добавляли по каплям. Затем реакционную смесь вылили в 100 мл воды и 150 мл дихлорметана. Органический слой промывают водой и сушат над сульфатом натрия. Растворитель упаривали в вакууме и продукт очищали с помощью колоночной хроматографии на силикагеле (элюент-толуол), для получения чистого вещества 7-1 (0.22 г, 75%).
1Н ЯМР (250 МГц, CDCl3) δ 7.78 (д, J=8.1 Гц, 2Н,), 7.72 (с, 2Н), 7.28 (дд, J=8.2, h=1.3 Гц, 2Н), 4.17 (м, 1H), 3.86 (дд, J=10.3, 4.4 Гц, 1Н), 3.63 (т, J=10.0 Гц, 1Н), 2.77 (т, J=7.5 Гц, 4H), 2.14 (м, 1Н), 1.52-1.87 (перекрывающиеся пики, 7Н), 1.26-1.51 (перекрывающиеся пики, 16Н), 0.91 (т, J=7.0 Гц, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 142.41, 140.06, 139.97, 132.55, 132.53, 131.21, 131.19, 125.81, 123.31, 121.05, 53.13, 36.35, 36.11, 36.09, 36.04, 31.73, 31.64, 31.62, 29.41, 29.40, 29.32, 29.22, 28.98, 28.77, 26.73, 22.60, 14.08.
Элементный анализ рассчитано для C31H40Br2S2: С, 58.49; Н, 6.33; Br, 25.10; S, 10.07. Найдено: С, 58.30; Н, 6.31; Br, 25.32; S, 9.98.
2-гексил-7-ундец-10-ен-1-ил[1]бензотиено[3,2-b][1]бензотиофен (8-1)
Смесь соединения 7-1 (0.93 г, 1,5 ммоль) и порошока цинка (0,48 г, 7.3 ммоль) добавляли к ледяной уксусной кислоте (20 мл). Реакционную смесь нагревали с помощью микроволнового облучения (50 МВт) в течение 1-2 мин без перемешивания. Затем реакционную смесь охладили до комнатной температуры. Вода (100 мл) и дихлорметан (100 мл) добавили к реакционной смеси и органический слой отделили. Органический слой промыли водой и осушили над сульфатом натрия. После выпаривание растворителя получили чистое соединение 8-1 (0,68 г, 98%).
1Н ЯМР (250 МГц, CDCl3) δ 7.77 (д, J=8.2 Гц, 2Н,), 7.71 (с, 2Н), 7.28 (дд, J=8.2, 1.3 Гц, 2Н), 5.82 (м, 1Н), 4.97 (м, 2Н), 2.77 (т, J=7.5 Гц, 4Н), 2.05 (дд, J=14.2, 6.8 Гц, 2Н,), 1.72 (м, 4Н), 1.25-1.47 (перекрывающиеся пики, 18Н), 0.91 (т, J=7.0 Гц, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 142.44, 140.06, 140.04, 139.22 132.57, 131.23, 131.19, 125.82, 123.31, 121.05, 114.09, 36.12, 33.80, 31.74, 31.65, 29.52, 29.50, 29.48, 29.30, 29.13, 28.99, 28.94, 22.60, 14.07.
Элементный анализ рассчитано для C31H40S2: С, 78.09; Н, 8.46; S, 13.45. Найдено: С, 78.21; Н, 8.52; S, 13.42.
1-[11-(7-гексил[1]бензотиено[3,2-b][1]бензотиен-2-ил)ундецил]-1,1,3,3-тетраметилдисилоксан (9-1)
Соединение 8-1 (0,33 г, 0,7 ммоль) растворяли в смеси толуола (10 мл) и 1,1,3,3-тетраметилдисилоксана (5 мл) под аргоном, после чего добавили 25 мкл катализатора Карстеда. Реакция была завершена через 3 ч перемешивания при температуре 50-60°C. испарение растворителя дает чистое соединение 9-1 (0,42 г, 98%).
1Н ЯМР (250 МГц, CDCl3) δ 7.77 (д, J=8.2 Гц, 2Н,), 7.72 (с, 2Н), 7.28 (дд, J=8.2, 1.3 Гц, 2Н), 4.71 (м, 1Н), 2.77 (т, J=7.5 Гц, 4Н), 1.72 (м, 4Н), 1.25-1.47 (перекрывающиеся пики, 22Н), 0.92 (т, J=7.0 Гц, 3Н), 0.55 (т, J=7.5 Гц, 2Н), 0.18 (д, J=2.75 Гц, 6Н), 0.08 (с, 6Н).
13С ЯМР (75 МГц, CDCl3) δ 142.42, 140.05, 132.55, 131.21, 125.81, 123.31, 121.05, 36.13, 33.39, 31.74, 31.70, 31.65, 29.62, 29.60, 29.54, 29.37, 29.33, 28.99, 23.91, 22.61, 18.15, 14.08, 0.91, 0.05.29Si ЯМР (60 МГц, CDCl3) δ -10.00, -6.93.
Элементный анализ рассчитано для C35H54S2Si2: С, 68.79; Н, 8.91; S, 10.49; Si, 9.19. Найдено: С, 68.72; Н, 9.07; S, 10.44; Si, 9.10.
Хлоро[10-(7-гексил[1]бензотиено[3,2-b] [1]бензотиен-2-ил)децил] диметилсилан (Ia-1).
Соединение 8-1 (0,1 г, 0,2 ммоль) и диметилхлорсилан (ДМХС, 0,4 г, 4.2 ммоль) растворяют в толуоле (5 мл) под аргоном, после чего добавляют 10 мкл катализатора Карстеда. Реакция была завершена через 9 ч перемешивания при температуре 40-50°C. упаривание растворителя дает целевое соединение Ia-1 80% чистоты (0,11 г, 93%).
1Н ЯМР (250 МГц, CDCl3) δ 7.77 (д, J=8.2 Гц, 2Н,), 7.72 (с, 2Н), 7.28 (дд, J=8.2, 1.3 Гц, 2Н), 2.77(т, J=7.5 Гц, 4Н), 1.71 (м, 4Н), 1.21-1.47 (перекрывающиеся пики, 22Н), 0.91 (т, J=7.0 Гц, 3Н), 0.88 (м, 2Н), 0.41 (с, 6Н).
Морфология монослоя соединения (Ia-1) изучена с помощью атомно-силовой микроскопии (АСМ), как показано на Фиг. 4. Толщина пленки составляет 4 нм, как видно из профиля (Фиг. 5), что соответствует высоте одной молекулы соединения (Ia-1).
Передаточные характеристики монослоя ОПТ на основе соединения (Ia-1) показаны на Фиг. 8. Устройство демонстрирует модуляцию тока в 4 порядка между "открытой" и "закрытой" фазами. Измеренная подвижность носителей заряда составляет 1.4×10-2 см2/Вс.
1,3-бис[11-(7-гексил[1]бензотиено[3,2-b][1]бензотиен-2-ил)ундецил]-1,1,3,3-тетраметилдисилоксан (Ib-1).
Соединение 8-1 (0,27 г, 0,6 ммоль) и соединение 9-1 (0,35 г, 0,6 ммоль) растворяют в безводном толуоле (15 мл) под аргоном, и затем добавляют 25 мкл катализатора Карстеда. Реакция была завершена после того, как раствор перемешивали при 55°С в течение 5 ч. Выход реакции по данным ГПХ-анализа составил 75%. Сырой продукт очищали путем колоночной хроматографии на силикагеле (элюент - смесь толуол: гексан 1:10), чтобы выделить чистое вещество Ib-1 (0.38 г, 61%).
1H ЯМР (250 МГц, CDCl3) δ 7.76 (д, J=8.2 Гц, 4Н,), 7.70 (с, 4Н), 7.28 (дд, J=8.2, 1.3 Гц, 4Н), 2.76 (т, J=7.5 Гц, 8Н), 1.71 (м, 8Н), 1.22-1.47 (перекрывающиеся пики, 44Н), 0.92 (т, J=7.0 Гц, 6Н), 0.52 (т, J=7.5 Гц, 4Н), 0.05 (с, 12Н).
13С ЯМР (75 МГц, CDCl3) δ 142.37, 140.02, 132.50, 131.15, 125.78, 123.28, 121.03, 36.11, 33.45, 31.73, 31.68, 29.72, 29.62, 29.55, 29.42, 29.35, 28.99, 23.29, 22.61, 18.41, 14.11, 0.40.
29Si ЯМР (60 МГц, CDCl3) δ 7.33.
Элементный анализ рассчитано для C66H94OS4Si2: С, 72.87; Н, 8.71; S, 11.79; Si, 5.16. Найдено: С, 72.94; Н, 8.81; S, 11.59; Si, 5.26.
Сканирование АСМ монослоя соединения (Ib-1) показано на Фиг. 6. Толщина пленки составляет 4 нм (Фиг. 7), что соответствует высоте одной молекулы соединения (Ib-1).
Передаточные характеристики монослоя ОПТ на основе соединения (Ib-1) показана на Фиг. 9. Измеренное соотношение включения-выключения устройства 103, иллюстрирующее успешную работу устройства. Подвижность дырок составляет 8.5×10-4 см2/Вс. Соединение (Ib-1) является химически стабильным, что приводит к удобству переработки растворными методами в органической электронике.
Несмотря на то, что различные аспекты настоящего изобретения изложены в независимых формулировках, другие аспекты настоящего изобретения включают в себя другие комбинации особенностей из описанных реализаций настоящего изобретения и/или зависимые формулировки с особенностями из независимых формулировок, а не только исключительно сочетания в явном виде изложенные в формулировках изобретения.
Следует также отметить, что, хотя выше описан пример реализации изобретения, эти описания не следует рассматривать в смысле ограничения. Наоборот, существует несколько вариантов и модификаций, которые могут быть сделаны без отхода от объема настоящего изобретения, как определено в прилагаемой формуле изобретения.
Реферат
Изобретение относится к новым кремнийорганическим монофункциональным дизамещенным производным бензотиенобитиофена, способу их получения и их применению в электронике. Предложено соединение общей формулы (I), где Rозначает С-Салкил, R означает С-Салкенил, X означает О или галоген, а у равен 1 или 2 при условии, что когда у равен 1, X означает галоген, а в случае, когда у равен 2, X означает О. Изобретение относится также к способу получения соединения (I), полупроводникового слоя и электронного устройства, содержащего соединение (I), и применению соединения (I). Технический результат: предложенное соединение позволяет получать полупроводниковый слой на различных подложках, пригодный для получения гибких, термически устойчивых и стабильных при окислении электронных устройств большой площади. 20 з.п. ф-лы, 9 ил., 1 пр.
Формула

Комментарии