Эпитопы поверхностного антигена рецептора эпидермального фактора роста и их применение - RU2650770C2
Код документа: RU2650770C2
Чертежи















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к эпитопам рецептора эпидермального фактора роста (в настоящем описании обозначен как “EGFR”) и их применению. Эпитопы, предоставленные в соответствии с одним из вариантов осуществления настоящего изобретения, приведенным в качестве примера, являются высококонсервативными и расположены в домене, тесно связанном с присоединением эпидермального фактора роста (в настоящем описании обозначен как “EGF”). Следовательно, композиции вакцины, содержащие эпитопы, антитела против данных эпитопов, или композиции, содержащие антитела, могут эффективно блокировать передачу сигналов, вызванную связыванием EGFR и EGF, и, таким образом, могут иметь важное значение и могут использоваться для лечения различных заболеваний, таких как злокачественные новообразования. Дополнительно, антитела, связывающиеся с эпитопами, могут эффективно ингибировать связывание различных лигандов EGFR, таких как, но не ограничиваясь ими, EGF, а также трансформирующий фактор роста-α (TGF-α), амфирегулин (AR), бетацеллюлин (ВТС), эпирегулин (EPR) и гепарин-связывающий EGF-подобный фактор роста (HB-EGF) с EGFR, и, таким образом, могут быть использованы для лечения различных заболеваний, вызываемых активацией EGFR.
Также настоящее изобретение относится к способу получения антитела, специфичного в отношении эпитопов.
Предшествующий уровень техники
Преимущества иммунотерапевтических способов лечения злокачественных новообразований состоят в увеличении специфичности в отношении мишеневых заболеваний у пациентов по сравнению с хирургическим вмешательством, лучевой терапией и химиотерапией, в результате чего усиливаются противоопухолевые эффекты и снижаются побочные эффекты. Опухолеспецифические моноклональные антитела используются в качестве терапевтического средства, которое является эффективным для лечения опухолей благодаря нацеливанию на определенные белки, которые специфически сверхэкспрессируются в различных типах злокачественных новообразований, вызывая противоопухолевые эффекты.
Рецептор эпидермального фактора роста (EGFR) представляет собой мембранный белок типа I, имеющий молекулярную массу, равную 170 кДа, и известно, что он сверхэкспрессируется в различных типах опухолей. EGFR исследовались в течение длительного периода времени, и в настоящее время были успешно проведены кристаллографические исследования клеточного домена (Garrett TP et al., Cell, 2002, 110: 763-773) и внутриклеточного домена киназы (Stamos J et al., J Biol. Chem., 2002, 277: 46265-46272). Эти исследования дали ключевую информацию о поведении рецепторов и их лигандов. EGFR представляет собой молекулу, связанную с поверхностью клетки, которая активируется посредством связывания с ней EGF-лигандов и трансформирующего фактора роста-α (TGF-α). После связывания лигандов, рецепторы димеризуются и фосфорилируют внутриклеточный домен тирозинкиназы. В результате активируются последующие реакции сигнального каскада, индуцируя рост и пролиферацию нормальных клеток и усиливая рост опухолевых клеток. В частности, поскольку функции опухолевых клеток зависят в основном от EGFR, то понятно, что рецептор является общей мишенью для лечения из-за высокой вероятности ингибирования регуляторных функций EGFR.
Свехэкспрессию EGFR, например, отмечают при некоторых типах злокачественных новообразований, таких как рак легких, рак молочной железы, рак ободочной кишки, рак желудка, рак мозга, рак шеи и головы, рак яичника и рак простаты. Если связывание EGF и EGFR ингибируется с помощью антител против EGFR, то можно ингибировать рост злокачественных клеток и злокачественное новообразование излечиваться, что уже было экспериментально доказано на моноклональном антителе против EGFR.
В то же время, хотя были сделаны попытки выяснить положения соответствующих доменов EGFR, связывающихся с EGF (S. Yokoyama et al., Cell, 2002, 110: 775-787), следует провести дополнительное исследование, ингибирует ли антитело, если такой домен используется в качестве эпитопа, активацию пути передачи сигналов EGFR за счет EGF.
В последние годы, для лечения метастатического колоректального рака в клинической области используется цетуксимаб (антитело С225, название продукта: эрбитукс; ImClone, США), который представляет собой химерное антитело, получаемое посредством связывания вариабельной области антитела мыши и константной области антитела IgG1 человека (имеющей приблизительно 30% мышиной аминокислотной последовательности), и который, таким образом, ингибирует рост опухолевых клеток и фосфорилирование EGFR посредством EGF in vitro, и подавляет образование опухолей человека у “голых” мышей. Также было обнаружено, что антитело обладает синергизмом с некоторым химиотерапевтическим средством для уничтожения опухолей человека на ксенотрансплантатной мышиной модели. Однако проблема использования цетуксимаба состоит в том, что он вызывает иммунный ответ у пациентов (приблизительно 10%), и может использоваться только в виде сочетанной терапии с химиотерапевтическим средством, так как он не проявляет удовлетворительного терапевтического эффекта при его самостоятельном использовании в терапии.
Панитумумаб (название продукта: вектибикс; Amgen Inc. США), который является еще одним антителом, используемым для лечения метастатического колоректального рака, представляет собой полностью антитело человека, которое ингибирует рост опухолевых клеток и фосфорилирование EGFR посредством EGF in vitro, и подавляет образование опухолей человека у “голых” мышей. Также было обнаружено, что антитело обладает синергизмом с некоторым химиотерапевтическим средством для уничтожения опухолей человека на ксенотрансплантатной мышиной модели. Панитумумаб отличается от цетуксимаба тем, что является полностью антителом человека, обладает антигенсвязывающей способностью, в 10 раз превышающей аналогичную способность цетуксимаба, снижает вероятность индукции иммунного ответа, вызываемого цетуксимабом как антитело IgG2-типа, и проявляет только ингибирующий эффект на передачу сигналов при связывании EGFR и EGF вследствие ограничений IgG2, несмотря на то, что активность связывания увеличена для снижения побочных эффектов и улучшения эффективности. Следовательно, сообщалось, что панитумумаб обладает общими клиническими эффектами, аналогично цетуксимабу, поскольку он не обладает активностью антитело-зависимой клеточной цитотоксичности (ADCC) наряду с ингибирующим эффектом на передачу сигналов, и активность ADCC у цетуксимаба известна из уровня техники.
Матузумаб (mAb425), который был разработан совместно Merck Serono и Takeda Pharmaceuticals, до настоящего времени также не обладает удовлетворительным терапевтическим эффектом при одиночной терапии.
Прежде всего, все общепринятые терапевтические средства на основе антител, нацеленных на EGFR, не имеют разрешения на назначение для лечения K-ras мутантного колоректального рака. Данные, приведенные в 2009 г., подтвердили, что процентная доля пациентов, у которых два антитела демонстрируют терапевтический эффект, количественно составляет приблизительно 21%, и антитела не проявляют терапевтического эффекта у остальных 79% пациентов. Группа из 43% пациентов, у которых антитела не проявляют терапевтического эффекта, т.е. приблизительно 30% от общего числа пациентов, имеет K-ras мутант, который принадлежит к этой группе K-ras мутантного колоректального рака. Общепринятые терапевтические средства на основе антител, цетуксимаба и панитумумаба, показывают терапевтический эффект только приблизительно у 1,5% с K-ras мутантом.
Следовательно, все сильнее становится необходимость в новых анти-EGFR антителах, имеющих дифференциацию и эффективное действие, которые могут решить проблемы и ограничения общепринятых антител против EGFR благодаря более эффективному ингибированию связывания EGFR и EGF.
Сущность изобретения
Следовательно, объектом настоящего изобретения является аминокислотная последовательность RGDSFTH (SEQ ID NO: 2) или эпитоп EGFR, включающий указанную последовательность, и, в частности, эпитоп, имеющий аминокислотную последовательность RGDSFTHTP (SEQ ID NO: 3).
Еще одним объектом настоящего изобретения является способ получения эпитопа, композиция для противоопухолевых вакцин или противоопухолевой вакцины, содержащая данный эпитоп, способ получения антитела, которое способно специфически связываться с эпитопом, применение эпитопа и композиция или терапевтическое средство для профилактики и/или лечения злокачественных новообразований, содержащие антитело, полученное с помощью указанного способа.
Еще одним дополнительным объектом настоящего изобретения является эпитоп или полинуклеотидная последовательность, кодирующая данный эпитоп, и композиция и набор для диагностики злокачественных новообразований, содержащие указанную полинуклеотидную последовательность.
Краткое описание фигур
На фиг. 1 представлена диаграмма, показывающая характеристики связывания EGFR и антитела GC1118 в виде 3D-изображения.
На фиг. 2 представлена диаграмма, показывающая характеристики связывания EGFR и EGF в виде 3D-изображения.
На фиг. 3 представлена диаграмма, показывающая характеристики связывания антитела GC1118 и EGFR, с которым связан EGF, если антитело GC1118 перекрывает EGFR.
На фиг. 4 представлена диаграмма, показывающая характеристики связывания EGFR и цетуксимаба и матузумаба в виде 3D-изображения.
На фиг. 5 представлена диаграмма, показывающая методику синтеза вариантного гена EGFR и методику трансформации дрожжевых клеток.
На фиг. 6 представлена диаграмма, показывающая, что соответствующие варианты EGFR синтезируются надлежащим образом посредством идентификации аминокислотной последовательности, определенной по последовательности оснований ДНК.
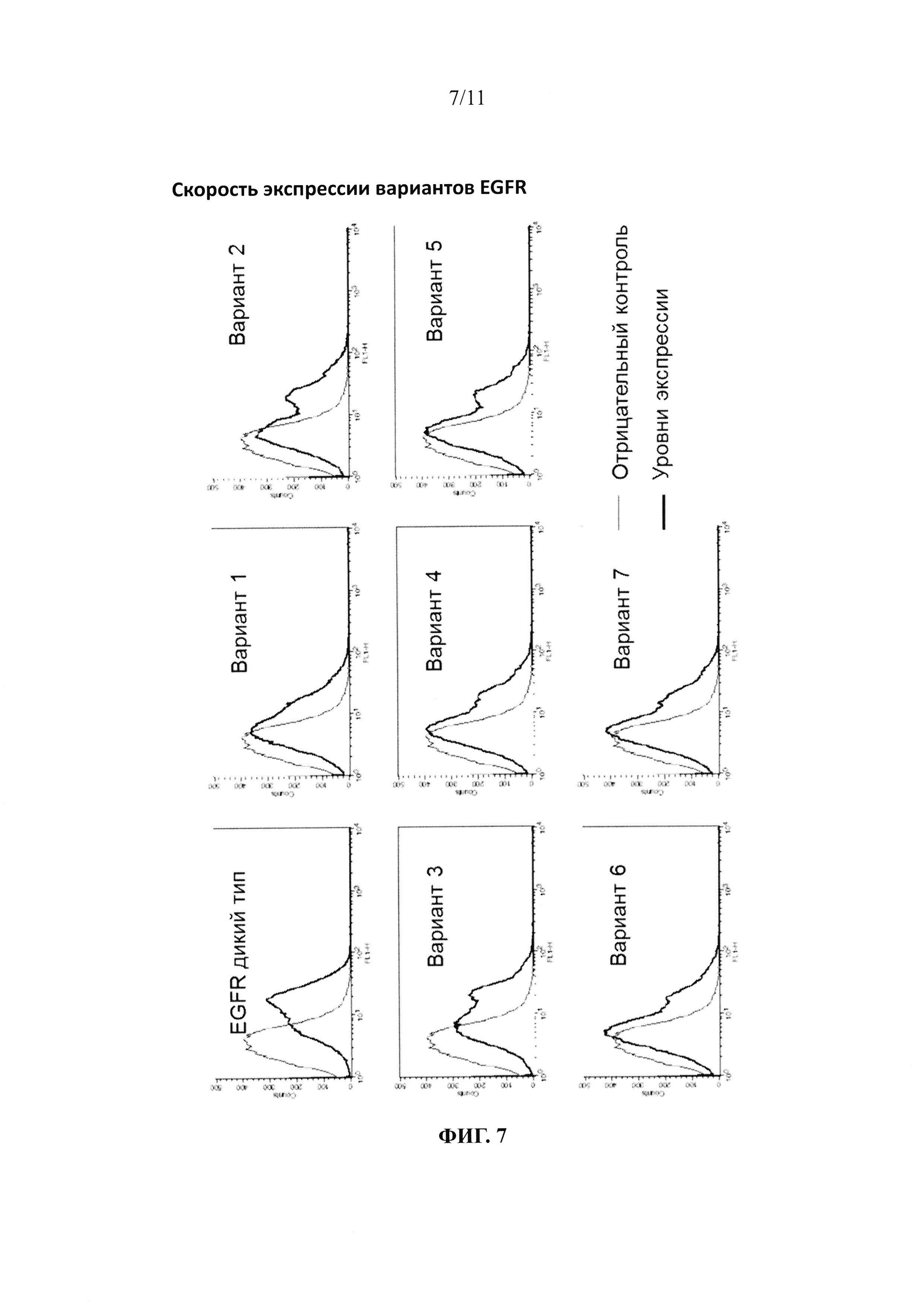
На фиг. 7 представлена диаграмма, показывающая скорость экспрессии соответствующих вариантов EGFR.
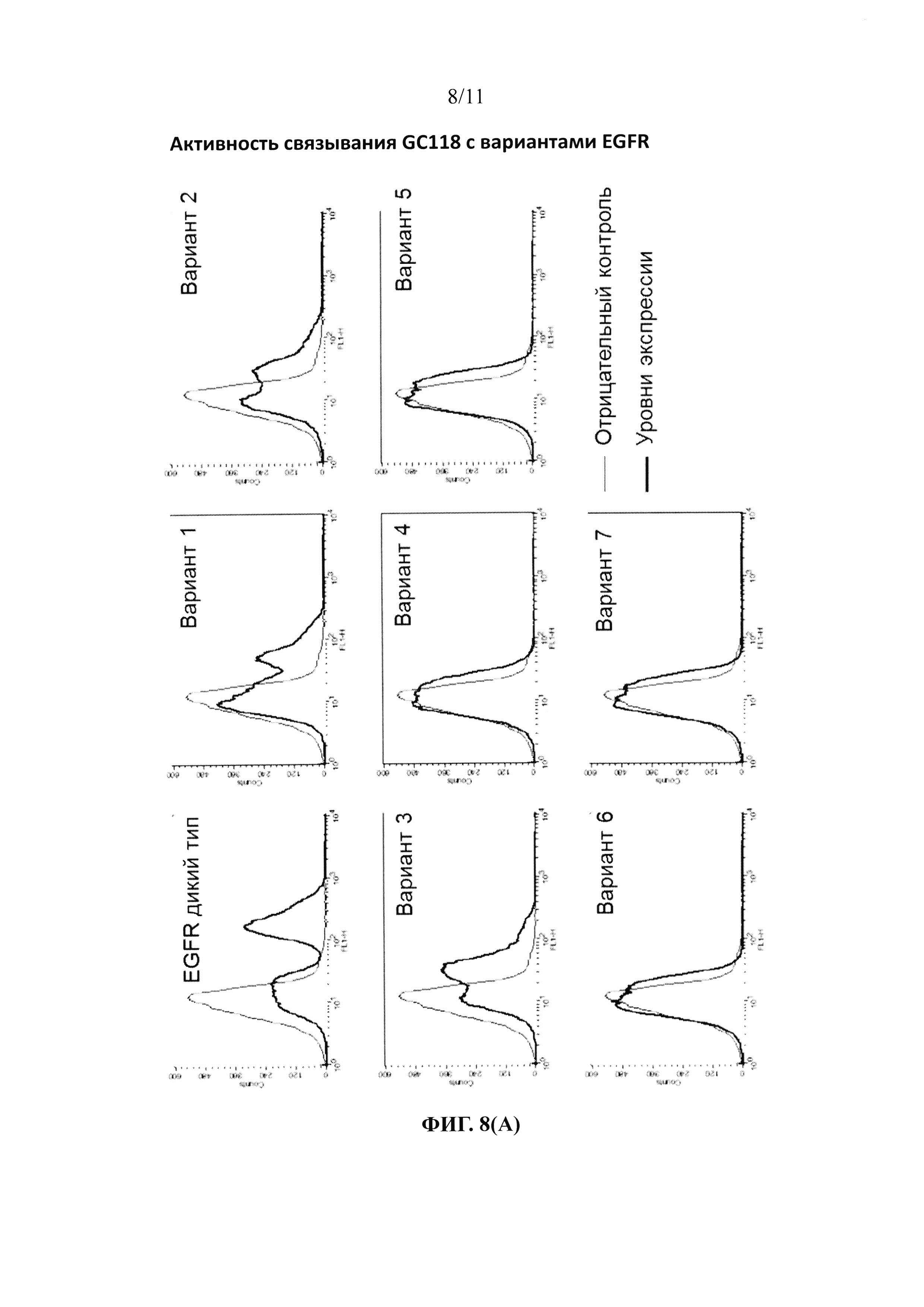
На фиг. 8 представлена диаграмма, показывающая способность к связыванию антител против соответствующих мутантов EGFR: (А) GC118 и (В) цетуксимаб (контроль).
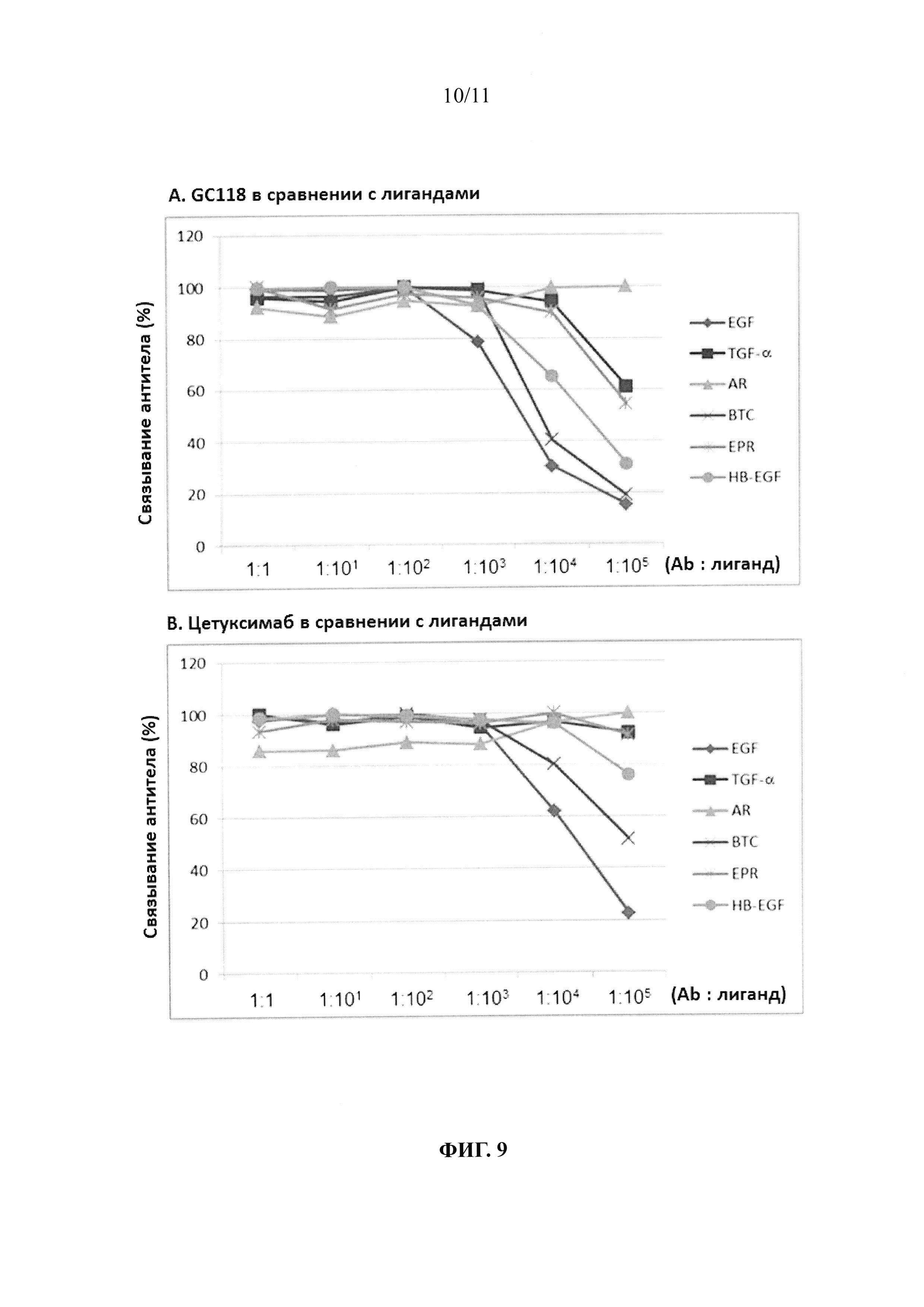
На фиг. 9 представлена диаграмма, показывающая способность к конкурентному связыванию лигандов EGFR с GC118: (А) GC118 и (В) цетуксимаб (контроль).
На фиг. 10 представлена диаграмма, показывающая влияние ингибирующих активностей GC118 на индукцию клеточной пролиферации.
Подробное описание изобретения
Далее в описании настоящее изобретение будет описано подробно.
Авторы настоящего изобретения обнаружили, что аминокислотная последовательность SEQ ID NO: 2 или содержащая ее аминокислотная последовательность, в частности, аминокислотная последовательность RGDSFTHTP (SEQ ID NO: 3), по существу проявляет активность в отношении связывания с EGF среди аминокислотных последовательностей EGFR, и было обнаружено, что антитела с аминокислотной последовательностью в качестве эпитопа, очень эффективно ингибируют связывание EGFR и EGF и, таким образом, проявляют превосходные эффекты в отношении лечения злокачественных новообразований посредством блокирования передачи сигналов в результате связывания. Следовательно, настоящее изобретение было выполнено на основании этих фактов.
Аминокислотная последовательность RGDSFTH, показанная как SEQ ID NO: 2, соответствует аминокислотным остаткам 353-359 аминокислотной последовательности внеклеточного домена EGFR, показанной как SEQ ID NO: 1, и аминокислотная последовательность RGDSFTHTP, показанная как SEQ ID NO: 3, соответствует аминокислотным остаткам 353-361 внеклеточного домена EGFR, показанного как SEQ ID NO: 1.
Аминокислотные остатки, присутствующие в аминокислотной последовательности по настоящему изобретению, представлены посредством либо трех-, либо однобуквенных сокращений, известных из уровня техники. Кроме того, в настоящем изобретении термин “xA” относится к А аминокислотех последовательности EGFR, показанной как SEQ ID NO: 1, и термин “xAz” означает, что А аминокислота х заменена на z. Например, термин “R353” относится к аргинину (Arg), который является 353 аминокислотным остатком аминокислотной последовательности, показанной как SEQ ID NO: 1, и термин “R353G” означает, что аргинин (Arg), который является 353 аминокислотным остатком аминокислотной последовательности, показанной как SEQ ID NO: 1, заменен на глицин (Gly).
Эпитоп, имеющий аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, может использоваться в комбинации с носителем для поддержания его собственной 3D-структуры или обеспечения эффективности при использовании в качестве композиции, такой как противоопухолевая вакцина. Носитель, в соответствии с одним из вариантов осуществления настоящего изобретения, приведенного в качестве примера, является биосовместимым, и все типы носителей могут быть использованы в данном случае, поскольку с ними может быть достигнут желаемый эффект. В данном случае, носитель может быть выбран из группы, состоящей из пептида, сывороточного альбумина, иммуноглобулина, гемоцианина и полисахарида, но не ограничиваясь ими.
Эпитоп, имеющий аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, может использоваться как таковой или использоваться в виде комплекса в комбинации с носителем. В этом случае, эпитоп или комплекс могут быть использованы в композиции противоопухолевой вакцины. В настоящем описании композиция вакцины может дополнительно содержать фармацевтически приемлемый адъювант или эксципиент. Может использоваться любой тип адъюванта, поскольку они предназначены для увеличения образования антитела при инъекционном введении в организм, благодаря чему достигаются цели настоящего изобретения. В частности, адъювант может представлять собой по меньшей мере один адъювант, выбранный из группы, состоящей из соли алюминия (Al(OH)3 или AlPO4), сквалена, сорбитана, полисорбата 80, СрG, липосомы, холестерина, монофосфориллипида А (MPL) и глюкопиранозиллипида А (GLA), но, не ограничиваясь ими.
Полинуклеотид, кодирующий эпитоп, имеющий аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3 по настоящему изобретению, может использоваться в форме генетической противоопухолевой вакцины как таковой. В этом случае, полинуклеотид может использоваться сам по себе, без использования системы доставки, или он может быть доставлен в организм в составе вирусной или невирусной системы доставки. Может использоваться любой тип вирусной или невирусной системы доставки, поскольку известно, что они доступны в данной области. Конкретно, вирусная система доставки включает аденовирус, адено-ассоциированный вирус, лентивирус, ретровирус и т.п., и невирусный вектор, который может использоваться в настоящем изобретении, включает по меньшей мере один вектор, выбранный из группы, состоящей из катионного полимера, неионного полимера, липосомы, липида, фосфолипида, гидрофильного полимера, гидрофобного полимера и их комплекса, но, не ограничиваясь ими.
Настоящее изобретение относится к рекомбинантному вектору, содержащему полинуклеотид, кодирующий эпитоп, имеющий аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, к клетке-хозяину, содержащей рекомбинантный вектор, и к способу получения эпитопа, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность из SEQ ID NO: 3, используя рекомбинантный вектор или клетку-хозяина по настоящему изобретению.
В настоящем изобретении термин “рекомбинантный вектор” относится к вектору экспрессии, способному к экспрессии мишеневого белка в соответствующей клетке-хозяине, которая представляет собой генную конструкцию, содержащую незаменимый регуляторный элемент, функционально связанный для экспрессии генной вставки. В настоящем изобретении термин “функционально связанный” означает, что последовательность нуклеиновой кислоты, кодирующая желаемый белок, функционально связана с экспрессионной контрольной последовательностью нуклеиновой кислоты для выполнения общих функций. Функциональное связывание с рекомбинантным вектором может осуществляться с использованием технологий генетической рекомбинации, широко известных в данной области, и сайт-специфическое расщепление ДНК и лигирование могут легко проводиться с использованием ферментов, широко известных в данной области.
Подходящий вектор экспрессии, который может использоваться в настоящем изобретении, может содержать сигнальные последовательности для мембранного нацеливания или секреции в дополнение к элементам контроля экспрессии, такие как промотор, кодон инициации, стоп-кодон, сигнал полиаденилирования и энхансер. Кодон инициации и стоп-кодон, как правило, считаются частью нуклеотидной последовательности, кодирующей иммуногенный мишеневый белок, и, таким образом, должны по существу использоваться у индивида, если генную конструкцию вводят индивиду, и встраивают в рамку вместе с кодирующей последовательностью. Промотор в общем случае может быть конститутивным или индуцируемым. В прокариотических клетках присутствуют промоторы Lac, Tac, T3 и T7, но не ограничиваясь ими. Существуют промотор β-актина и промоторы, выделенные из гемоглобина человека, мышечного креатина человека и металлотионеина человека, а также промоторы, выделенные из обезьяньего вируса 40 (SV40), мышиного вируса опухоли молочных желез (MMTV), вируса иммунодефицита человека (ВИЧ) (например, промотор длинного терминального повтора (LTR) из ВИЧ), вируса Молони, цитомегаловируса (СМV), вируса Эпстейна-Барра (EBV) и вируса саркомы Рауса (RSV), присутствующих в эукариотических клетках, но, не ограничиваясь ими.
Вектор экспрессии может содержать маркер селекции для отбора клетки-хозяина, содержащей вектор. Маркер селекции используют для селекции клеток, трансформированных вектором. В данном случае, маркеры, придающие селектируемый фенотип, например толерантность к лекарственным средствам, ауксотрофность, толерантность к цитотоксическим средствам или экспрессию поверхностных белков, могут использоваться в качестве маркера селекции. Поскольку только клетки, экспрессирующие маркер селекции, выживают в окружении, обработанном средством для селекции, можно проводить селекцию трансформированных клеток. Также, если вектор представляет собой реплицируемый вектор экспрессии, то вектор может включать точку начала репликации, которая является определенной последовательностью нуклеиновой кислоты, от которой инициируется репликация. Различные типы векторов, таких как плазмида, вирус и космида, могут быть использованы в качестве рекомбинантных векторов экспрессии. Может использоваться любой тип рекомбинантного вектора, без конкретного ограничения, поскольку они могут функционировать для экспрессии желательного гена в различных клетках-хозяевах, таких как прокариотические клетки и эукариотические клетки, и продуцировать желаемый белок. Однако вектор, который содержит промотор сильной активности и может продуцировать в больших количествах чужеродный белок, имеющий форму, сходную белком дикого типа, в то же время сохраняя сильную интенсивность экспрессии, может предпочтительно использоваться в качестве рекомбинантного вектора.
В частности, различные комбинации хозяев/векторов экспрессии могут использоваться для экспрессии эпитопа в соответствии с одним из вариантов осуществления настоящего изобретения, приведенного в качестве примера, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3. Вектор экспрессии, подходящий для хозяев-эукариотов, может содержать регуляторную последовательность для экспрессии, включающую, но без ограничения, последовательность, выделенную из SV40, вируса бычьей папилломы, аденовируса, адено-ассоциированного вируса, цитомегаловируса, лентивируса и ретровируса. Вектор экспрессии, который может использоваться в бактериальном хозяине, включает бактериальные плазмиды, полученные из Escherichia coli, такие как pET, pRSET, pBluescript, pGEX2T, вектор pUC, col E1, pCR1, pBR322, pMB9 и их производные; плазмиды, имеющие широкий диапазон хозяев, такие как RP4; фаговые ДНК, включающие различные производные фага лямбда, такие как λgt10, λgt11 и NM989; и другие ДНК фагов, такие как М13 и нитевидные одноцепочечные фаговые ДНК. Вектором, используемым для клеток насекомых, является pVL941.
Рекомбинантный вектор вводят в клетки-хозяева для образования трансформантов. Подходящие клетки-хозяева могут включать прокариоты, такие как E. coli, Bacillus subtilis, Pseudomonas sp., Proteus mirabilis или Staphylcoccus sp., грибки, такие как Aspergillus sp., дрожжевые клетки, такие как Pichia pastoris, Saccharomyces cerevisae, Shizosaccharomyces sp. и Neurospora crassa; и другие низшие эукариоты, и клетки высших эукариотов, такие как клетки насекомых. Дополнительно, клетки-хозяева могут предпочтительно быть выделены из растений и млекопитающих, такие как клетки почки обезьяны (COS7), клетки NSO, SP2/0, клетки яичника китайского хомяка (СНО), W138, клетки почки молодого хомяка (ВНК), MDCK, линия клеток миеломы, клетки HuT 78, клетки HEK293, но без ограничения. Особенно предпочтительными являются клетки СНО.
В настоящем изобретении термин “трансформация” в клетки-хозяева охватывает любой метод введения последовательности нуклеиновой кислоты в организм, клетку, ткань или орган, и трансформация может осуществляться стандартными методиками, подходящими для клетки-хозяина, как известно в данной области. Такие методы включают, но без ограничения, электропорацию, слияние протопластов, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), встряхивание с использованием волокон карбида кремния, Agrobacteria-опосредованную трансформацию, метод ПЭГ, метод с декстрансульфатом, липофектаминовый метод и трансформацию, опосредованную сушкой/подавлением. Эпитоп, в соответствии с одним из вариантов осуществления настоящего изобретения, приведенного в качестве примера, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, может быть подвергнут крупномасштабному получению путем культивирования трансформантов, экспрессирующих рекомбинантный вектор в питательной среде. Среда и условия культивирования могут быть надлежащим образом выбраны в зависимости от клетки-хозяина. Условия, такие как температура, рН среды и время культивирования могут соответственно регулироваться для обеспечения эффективного роста клеток и получения белка в больших количествах. Как описано выше, эпитоп, имеющий аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, может быть выделен рекомбинантно из среды или клеточного лизата, и может быть выделен и очищен с использованием общепринятых методов биохимического разделения (Sambrook et al., Molecular Cloning: A laboratory Manual, 2nd Ed., Col Spring Harbr Laboratory Press (1989); Deuscher, M., Guide to Protein Purificaton Methods Enzymology, Vol. 182. Academic Press. Inc., San Diego, CA (1990)). Методики биохимического разделения, которые могут быть использованы в данном случае, могут включать, но без ограничения, электрофорез, центрифугирование, гель-фильтрацию, осаждение, диализ, хроматографию (ионообменную хроматографию, аффинную хроматографию, иммуноабсорбентную хроматографию или эксклюзионную по размерам хроматографию), изоэлектрическое фокусирование и различные их модифицированные и комбинированные методы.
Настоящее изобретение относится к способу экспрессии эпитопа, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, на поверхности микроорганизмов или вирусов. В способе по настоящему изобретению может использоваться рекомбинантный вектор, отличающийся тем, что содержит последовательность, кодирующую индуцируемый промотор или сигнальный белок, и различные микроорганизмы или вирусы. Особенно подходящие микроорганизмы или вирусы включают, но без ограничения, рекомбинантную E. coli, рекомбинантные дрожжи и рекомбинантные бактериофаги. Технологии дисплея, широко известные в данной области, могут быть использованы для экспрессии эпитопа, имеющего аминокислотную последовательность SEQ ID NO: 2 или SEQ ID NO: 3 на поверхности микроорганизма или вируса. В частности, может быть использован, но, не ограничиваясь только им, способ связывания полинуклеотидной последовательности, кодирующей эпитоп, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, с последовательностью, кодирующей промотор или сигнальный белок для индукции экспрессии эпитопа на поверхности микробиальных или вирусных клеток, или способ делеции части гена, кодирующего белок, изначально экспрессируемый на поверхности микробиальных или вирусных клеток, и вставки полинуклеотидной последовательности, кодирующей эпитоп, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, в ген, подвергнутый частичной делеции. Эпитоп, экспрессированный на поверхностях микрорганизмов или вирусов, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, может быть выделен и очищен как таковой, и может быть использован с целью конкретного применения в соответствии с одним из вариантов осуществления настоящего изобретения, приведенного в качестве примера, и может быть использован для пэннинга антитела, специфически связывающегося с эпитопом, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, если он экспрессирован на поверхности микрорганизмов или вирусов для получения антитела.
Настоящее изобретение также относится к эпитопу, имеющему аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, антителу, специфически связывающегося с эпитопом, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, к применению комплекса, включающего эпитоп или полинуклеотид, кодирующий данный эпитоп, или к способу получения фрагмента такого антитела. Такое антитело может представлять собой поликлональное антитело или моноклональное антитело, и фрагмент антитела входит в объем настоящего изобретения, поскольку он сохраняет характеристики для связывания с эпитопом, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3. В частности, антитело или его фрагмент в соответствии с одним из вариантов осуществления настоящего изобретения, приведенного в качестве примера, включает, но без ограничения, антитела с одиночной цепью, диатела, триатела, тетратела, Fab-фрагменты, F(ab')2-фрагменты, Fd, scFv, доменные антитела, биспецифические антитела, минитела, scAb, IgD-антитела, IgE-антитела, IgM-антитела, IgG1-антитела, IgG2-антитела, IgG3-антитела, IgG4-антитела, производные константных областей антител и искусственные антитела на основе белковых матриц, поскольку они обладают активностью связывания с эпитопом, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3. Также антитела, имеющие мутации в их вариабельных областях, входят в объем настоящего изобретения, поскольку они сохраняют их характеристики в соответствии с одним из вариантов осуществления настоящего изобретения, приведенном в качестве примера. В качестве примера, мутации могут включать консервативные замены аминокислот в вариабельных областях. Консервативная замена относится к замене исходной аминокислотной последовательности на другой аминокислотный остаток, имеющий аналогичную характеристику. Например, остатки лизина, аргинина и гистидина являются сходными с точки зрения наличия у них основной боковой цепи. Также, остатки аспарагиновой кислоты и глутаминовой кислоты являются сходными с точки зрения наличия у них кислотной боковой цепи. Также, остатки глицина, аспарагина, глутамина, серина, треонина, тирозина, цистеина и триптофана являются сходными с точки зрения наличия у них незаряженной, полярной боковой цепи, а остатки аланина, валина, лейцина, треонина, изолейцина, пролина, фенилаланина и метионина являются сходными с точки зрения наличия у них неполярной боковой цепи. Дополнительно, остатки тирозина, фенилаланина, триптофана и гистидина являются сходными с точки зрения наличия у них ароматической боковой цепи. Следовательно, для специалистов в области будет очевидным, что аминокислотные замены среди группы аминокислот, имеющих сходные характеристики, как описано выше, не будут вызывать какого-либо изменения в характеристиках. В результате, способ получения антитела, имеющего мутации посредством консервативных замен в его вариабельной области входят в объем настоящего изобретения, поскольку антитело сохраняет свои характеристики.
Антитело, связывающееся с эпитопом по настоящему изобретению, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, может быть получено способами, широко известными в области, к которой относится настоящее изобретение. Конкретно, антитело может быть получено путем инокуляции животному эпитопа, имеющего аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, комплекса, включающего данный эпитоп, или полинуклеотида, кодирующего данный эпитоп, и продуцирования и пэннинга антитела, специфически связывающегося с эпитопом, имеющим аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, из инокулированного животного.
В этом случае, животное, предпочтительно, представляет собой животное, трансформированное с целью продукции антитела, имеющего такую же последовательность, как последовательность человека, в частности, трансформированную крысу. В данном случае, может быть получено полностью антитело человека, имеющее пониженную иммуногенность, с использованием трансформированной крысы в соответствии со способами, как описано в патентах США 5569825; 5633425 и 7501552. Если животное не трансформировано для продукции антитела, имеющего такую же последовательность, как последовательность человека, может быть дополнительно осуществлена стадия гуманизации или деиммунизации антитела, полученного из животного, таким образом, что антитело становится подходящим для лечебного использования в организме, как описано в способах патентов США 5225539; 5859205; 6632927; 5693762; 6054297 и 6407213; и WO 1998/52976. Конкретно, стадия гуманизации или деиммунизации может включать стадию CDR-прививки для прививания последовательности CDR антитела, продуцируемого от животного в каркас (FR) антитела человека, и стадию блуждающей-CDR замены, вставки или делеции по меньшей мере, одной аминокислотной последовательности, для дополнительного повышения аффинности или уменьшения иммуногенности.
Если непроцессированный EGFR, отличный от эпитопа, имеющего аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, комплекса, включающего данный эпитоп, или полинуклеотида, кодирующего данный эпитоп, используют в качестве иммуногена, можно также применять способ пэннинга антитела, включающий первоначальный пэннинг антител, способных к связыванию с EGFR, и пэннинг антитела, специфически распознающего эпитоп, имеющий аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, среди антител, первоначально подвергнутых пэннингу. В данном случае, можно также применять способ пэннинга антитела, включающий индуцирование мутаций в ключевом участке связывания эпитопа, имеющего аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, и пэннинг антител, которые потеряли или уменьшили активность связывания с EGFR вследствие мутаций в ключевом сайте связывания эпитопа, имеющего аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, среди антител, первоначально подвергнутых пэннингу, связывающихся с EGFR.
Также, антитело человека, связывающееся с эпитопом SEQ ID NO: 2 или SEQ ID NO: 3, может быть получено и подвергнуто пэннингу, с использованием технологии дисплея, широко известной в области, к которой относится настоящее изобретение. Эта технология дисплея предпочтительно представляет собой по меньшей мере одну технологию, выбранную из группы, состоящей из технологий фагового дисплея, дисплея дрожжей, дисплея бактерий и дисплея рибосом, но, не ограничиваясь ими. Получение и дисплей библиотеки может быть легко осуществлен, как описано в патентах США 5733743; 7063943; 6172197; 6348315 и 6589741. В частности, библиотеку, используемую в дисплее, предпочтительно создают, чтобы иметь последовательность антитела, полученную от человека. В частности, способ отличается тем, что включает пэннинг только антител, специфически связывающихся с эпитопом, имеющим аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, с использованием эпитопа, имеющего аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, или комплекса, включающего данный эпитоп.
Наконец, настоящее изобретение относится к эпитопу, имеющему аминокислотной последовательностью SEQ ID NO: 2, аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 3, к комплексу, включающему данный эпитоп, или к композиции для противоопухолевых вакцин, содержащей полинуклеотид, кодирующий данный эпитоп.
Настоящее изобретение будет описано более подробно посредством примеров вариантов осуществления, приведенных ниже. Однако следует отметить, что подробное описание и конкретные примеры, указывающие на предпочтительные варианты осуществления изобретения, являются только иллюстративными, так как различные изменения и модификации в пределах объема изобретения будут понятны специалистам в данной области из этого подробного описания.
Пример 1: Идентификация структуры связывания EGFR и Fab GC1118
Для идентификации структуры связывания EGFR с антиген-связывающим фрагментом (Fab) GC1118 (см. KR 10-2011-0034914 A), разработанной группой исследователей настоящего изобретения, получали данные рентгеновской дифракции кристаллической структуры композита EGFR/GC1118 Fab с использованием лучевой линии BL26B2 (Spring-8 Institution, Япония), которые индексировали и масштабировали, используя программное обеспечение HKL2000 (HKL Research Inc., США), и затем получали раннюю карту электронной плотности композита EGFR/GC1118, применяя метод молекулярной замены (MR). Для использования метода MR, были необходимы данные по 3D-структуре белка, имеющего структуру, аналогичную структуре композита EGFR/мишеневое антитело. В этом случае, структуру композита EGFR/цетуксимаб (PDB ID: IYY9) использовали в качестве структуры для композита EGFR/GC1118. Информацию по ранней фазе композита EGFR/GC1118 получали, используя программу Morlep (http://www.ysbl.york.ac.uk/-alexei/morlep.html), и задание построения модели осуществляли, используя кристаллографический объект-ориентированный набор инструментов (COOT: http://www.biop.ox.ac.uk/coot/), на основании полученной информации о ранней фазе. Затем задание по уточнению выполняли с использованием программного обеспечения Refmac5 (http://www.ccp4.ac.uk/html/refmac5.html) и программного обеспечения на базе Питон для иерархического окружения для интегрированной рентгеновской кристаллографии (PHENIX: http://www.phenix-online.org/.
В результате, было показано, что эпитоп EGFR GC1118 был расположен в 3 домене EGFR, и, в частности, эпитоп представлял собой область короткой петли в 3 домене, которая состоит из 9 аминокислотных остатков от 353 до 361 аминокислотных остатков аминокислотной последовательности (см. SEQ ID NO: 1 и фиг. 1). Эта область петли выступает наружу, и она окружена CDR антитела. В частности, аминокислотные остатки, играющие ключевую роль в связывании между GC1118 и EGFR, представляют собой F357 и H359 EGFR. Два аминокислотных остатка окружены аминокислотными остатками области CDR антитела GC1118 и функционируют с образованием гидрофобных связей и водородных связей с аминокислотными остатками области CDR, для плотного поддержания связывания между EGFR и GC1118. R353 также способствует дополнительному связыванию с антителом через ионные связи с вариабельной областью (VH) тяжелой цепи антитела GC1118 (см. фиг. 1).
В то же время, область, с которой связывается EGF, расположена между 1 и 3 доменами EGFR. В этом случае, EGF сначала связывается с 1 доменом EGFR (см. фиг. 2) для индукции структурного изменения домена EGFR, и затем связывается с 3 доменом EGFR (см. фиг. 3). В этом случае, важным аминокислотным остатком EGFR, участвующим в связывании с EGF, является D3555 3 домена(Ferguson et al., Molecular Cell, 2003, 11:507-517). В этом случае, аминокислотный остаток присутствует в петле, содержащей R353, F357 и H359, которые являются эпитопами GC1118. То есть, поскольку эпитопы EGFR, с которыми связывается GC1118, присутствуют в той же самой области, что и область, с которой связывается EGF, причем связывание антитела с эпитопами GC1118 может напрямую ингибировать связывание EGF с 3 доменом EGFR. Это дополнительно подтверждается при сравнении со структурой EGFR, связанной с EGF. Соответственно, если структура EGFR, активированная через связывание с EGF, перекрывает структуру GC1118, можно видеть, что область VH GC1118 и EGF перекрываются друг с другом (см. фиг. 3).
При сравнении со связыванием используемого в настоящее время цетуксимаба с EGFR, цетуксимаб имеет эпитопы, расположенные в 3 домене EGFR, но участки связывания цетуксимаба были широко разбросаны на поверхности 3 домена. Следовательно, некоторые из эпитопов имели опосредованное влияние на связывание EGF (см. фиг. 4А). Матузумаб, который является еще одним антителом, также имело эпитопы, расположенные в 3 домене EGFR, но эпитопы матузумаба присутствовали в положениях, отличающихся от положений эпитопов в соответствии с одним из вариантов осуществления настоящего изобретения, приведенным в качестве примера, и расположены в области, отличной от области, с которой был связан EGF, так что эпитопы матузумаба не обладали способностью напрямую затруднять связывание EGF (см. фиг. 4В).
Пример 2: Верификация эпитопов EGFR GC1118 с использованием способа экспрессии поверхности дрожжевых клеток
Для верификации эпитопов (аминокислотных остатков R353, F357 и H359) EGFR против GC1118, обнаруженных посредством структурной модели, соответствующие аминокислотные остатки замещали глицином, не обладающим реакционной способностью связывания, чтобы продуцировать варианты, и затем экспрессировали их на поверхностях дрожжевых клеток. Затем связывание GC1118 с вариантами EGFR, в которых эпитопы были экспрессированы на поверхностях дрожжевых клеток, подтверждали при использовании проточной цитометрии (BD FACS Calibur™, США). В результате, было подтверждено, что активность связывания с GC1118 снижалась у всех вариантов EGFR.
2.1 Конструирование вариантов EGFR
Варианты EGFR конструировали посредством замены одного или более из R353, F357 и H359 аминокислотной последовательности EGFR (см. SEQ ID NO: 1) на глицин, с использованием метода перекрывающей ПЦР, в котором генную последовательность, кодирующую внеклеточный домен EGFR человека, использовали в качестве матрицу. Результаты приведены в следующей таблице 1.
2.1.1 Реакция ПЦР для синтеза вариантов EGFR
Два генных фрагмента (приблизительно 1150 п.о. и 720 п.о.), обычно включающие каждый из вариантов EGFR, синтезировали путем осуществления реакции ПЦР с использованием набора AccuPower™ TLA PCR PreMix (Bioneer, Корея), включающего генную последовательность EGFR человека в качестве матрицы, и набора праймеров (см. таблицу 2), сконструированных для индуцирования мутации гена EGFR. Два синтезированных генных фрагмента подвергали электрофорезу в 1% агарозном геле, и ДНК каждого из генных фрагментов очищали, используя набор Qiagen (Qiagen 28706, Германия). Последовательно, осуществляли перекрывающую реакцию ПЦР, используя ДНК набора из двух очищенных генных фрагментов в качестве одной матрицы и праймеры, имеющие аминокислотные последовательности, как показано в SEQ ID NO: 4-19 (см. таблицу 2), синтезируя, таким образом, конечные варианты генов EGFR (см. фиг. 5). Синтезированные гены расщепляли, используя ферменты рестрикции NheI/MluI (New England Biolabs, США). Термин “прямой” после названий праймеров, как приведено в таблице 2, представляет прямой праймер, и термин “обратный” представляет обратный праймер.
2.1.2 Лигирование и трансформация вариантов EGFR
Вектор экспрессии дрожжевой поверхности pCTCON (Boder, E.T. et al., Nat Biotechnol. 1997, 15(6): 553-7) расщепляли с использованием ферментов рестрикции NheI/MluI, подвергали электрофорезу в 1% агарозном геле и очищали, используя набор Qiagen. ДНК вариантов EGFR, полученных в примере 2.1.1, смешивали с pCTCON, и к ним добавляли ДНК-лигазу Т4 (New England Biolabs, США), и проводили реакцию при 25°С в течение 2 часов. Лигирующую смесь трансформировали с помощью XL1-голубых клеток E. coli (Stratagene, США) посредством электропорации с использованием Gene Pulser (Bio-Rad Laboratories, Inc., США) и инкубировали в течение часа в целом в 2 мл среды. Затем трансформированные клетки распределяли в планшет с LB-агаром, дополненным карбенициллином (Sigma, США). Далее клетки инкубировали в течение ночи при 37°С.
2.1.3 Секвенирование оснований вариантов EGFR
Колонии на планшете, культивированные в примере 2.1.2, инкубировали в течение ночи в 2 мл LB-среды, дополненной 50 мкг/мл карбенициллина, и рекомбинантную плазмиду затем отделяли, используя плазмидный мининабор Qiagen (Qiagen 27106, Германия) для определения последовательностей оснований ДНК вариантов EGFR, введенных в плазмиду. Праймеры, имеющие последовательности, как показано в SEQ ID NO: 20-22, использовали в качестве секвенирующих праймеров, используемых для секвенирования оснований (см. таблицу 3), и секвенирование оснований осуществляли и анализировали в Genotech Corporation (Тэджон, Республика Корея) в соответствии с известным методом. Последовательность оснований EGFR человека использовали в качестве контроля. После того, как были определены последовательности оснований ДНК вариантов EGFR, определенные последовательности оснований ДНК транслировали в аминокислотные последовательности с использованием веб-программы (www.expasy.org: DNA to Protein translate tool), которая транслирует последовательность оснований в аминокислотную последовательность. Результаты трансляции показаны на фиг. 6. Затем подтверждали, что все из вариантных генов EGFR, приведенных в таблице 1, были корректно введены в векторы pCTCON.
2.2. Анализ экспрессии вариантов EGFR на поверхностях дрожжевых клеток и связывания с антителом
2.2.1 Методика экспрессирования вариантов EGFR на поверхностях дрожжевых клеток
Штамм дрожжей EBY100 (S. cerevisiae) трансформировали с помощью pCTCON-EGFR, верифицированного в примере 2.1, с использованием Gene Pulser от Bio-Rad Laboratories, Inc. (фиг. 1). Трансформированные колонии инкубировали при 30°С в течение 20 часов в среде для селекции, жидкой среде SD-CAA (20 г/л глюкозы, 6,7 г/л дрожжевого азотного основания без аминокислот, 5,4 г/л Na2HPO4, 8,6 г/л NaH2PO4H2O и 5 г/л казаминокислот). Затем экспрессию варианта EGFR на поверхностях дрожжевых клеток индуцировали инкубацией трансформированных колоний при 30°С в течение 20 часов в среде для селекции, жидкой среде SD-CAA (20 г/л галактозы, 6,7 г/л дрожжевого азотного основания без аминокислот, 5,4 г/л Na2HPO4, 8,6 г/л NaH2PO4H2O и 5 г/л казаминокислот).
2.2.2 Определение экспрессии вариантов EGFR на поверхностях дрожжевых клеток
Экспрессию вариантов EGFR на поверхностях дрожжевых клеток подтверждали с использованием BD FACS Calibur™ (Becto Dickinson). Дрожжевые клетки, экспрессированные при плотности, равной приблизительно 1×107 клеток/мл, подвергали взаимодействию с анти-с-myc 9E10 mAb (разведение 1:1000) в 0,1 мл забуференного фосфатом физраствора (PBSB, включающем 1 мг/мл BSA; pH 7,4) (при 25°С в течение 30 минут), и промывали PBSB. Дрожжевые клетки вторично подвергали взаимодействию с козьими антителами против мышиных IgG, конъюгированными с R-фикоэритрином (разведение 1:25) на льду в течение 15 минут, промывали PBSB и затем анализировали с использованием BD FACS Calibur™. Из результатов анализа видно, что варианты EGFR хорошо экспрессировались на поверхностях дрожжевых клеток (см. фиг. 7).
2.2.3 Анализ связывания между вариантами EGFR и GC1118 с использованием проточной цитометрии
Связывание между GC1118 и вариантами EGFR, экспрессированными на поверхностях дрожжевых клеток, подтверждали с использованием BD FACS Calibur™ (Becto Dickinson). В качестве контрольного антитела использовали цетуксимаб. Дрожжевые клетки, экспрессированные при плотности, равной приблизительно 1×107 клеток/мл, подвергали взаимодействию с 1 мкг каждого из антител в 0,1 мл PBSB (включающем 1 мг/мл BSA; pH 7,4) (при 25°С в течение 30 минут) и промывали PBSB. Дрожжевые клетки вторично подвергали взаимодействию с антителами против IgG человека, конъюгированными с FITC (разведение 1:50) на льду в течение 15 минут, промывали PBSB, и затем измеряли среднюю интенсивность флуоресценции с использованием BD FACS Calibur™. Результаты измерений приведены в таблице 4 и показаны на фиг. 8. Как видно из таблицы 4, было доказано, что связывание GC1118 ингибировалось у вариантов EGFR, в которых эпитопы (R353, F357 и H359, в соответствии с одним из вариантов осуществления настоящего изобретения, приведенным в качестве примера, посредством структурного анализа) были замещены глицином, и, таким образом, замененные аминокислотные остатки представляли собой эпитопы GC1118.
Пример 3: Анализ конкурентного связывания GC118 и лигандов с EGFR
Для определения, имеют ли GC118 и шесть лигандов, приведенных в таблице 5, идентичные или сходные участки связывания для EGFR, осуществляли тест на конкурентное связывание. В качестве контрольного антитела использовали цетуксимаб. Сначала, предварительную концентрацию антитела (1,5 нМ) и различные концентрации лиганда подвергали взаимодействию на планшете, покрытом 2 мкг/мл EGFR. В этом случае, лиганд присутствовал в концентрации таким образом, что молярное отношение антитела и лиганда количественно составляло 1:1, 1:10, 1:102, 1:103,1:104 и 1:105. Полученной в результате смеси давали взаимодействовать при комнатной температуре в течение 30 минут, и затем ее промывали пять раз PBST (включающим 0,05% Твин 20; рН 7,4). Затем смесь вторично подвергали взаимодействию с антителами против IgG человека (Fc-специфичными), конъюгированными с пероксидазой (Sigma A0170, США), при комнатной температуре в течение 30 минут, и затем ее промывали пять раз PBST. Последовательно, к каждой лунке добавляли 100 мкл раствора 3,3',5,5'-тетраметилбензидина (TMB) субстрата пероксидазы для микропланшетов (KPL 50-76-03 США), и затем измеряли значения ОП (оптической плотности) при 405 нм. Было отмечено, что два реагирующих компонента (антитело и лиганд) конкурировали друг с другом, если способность к связыванию GC1118 с EGFR снижалась при возрастающей концентрации лиганда, указывая на то, что два реагирующих компонента имели идентичные эпитопы с EGFR, или имели очень близкое совпадение. Конкуренция между антителом и лигандами показана на фиг. 9 и приведена в таблице 6. В результате можно видеть, что GC1118 имеет превосходящую способность к ингибированию связывания EGF, TGF-α, BTC, EPR и HB-EGF по сравнению с цетуксимабом.
Пример 4: Ингибирующий эффект на пролиферацию клеток, индуцируемую лигандами EGFR
Для сравнения ингибирующего эффекта GC1118 настоящего изобретения и цетуксимаба на пролиферацию раковых клеток, индуцируемую лигандами EGFR, клеточную линию колоректального рака, LS174T (ATCC, CL-188), распределяли в 96-луночном микропланшете (Nunc) таким образом, чтобы количество клеток количественно составляло 3000 клеток/лунка. Через один день, культуральную среду удаляли, и культуральные среды, не включающие бычьего сывороточного альбумина, обрабатывали GC1118 и контрольным антителом, цетуксимаб, при концентрациях, равных 0,1, 1 и 10 мкг/мл. В то же самое время, если проводили обработку антителами, культуральную среду обрабатывали лигандами EGFR по типу при концентрациях (EGF: 50 нг/мл, TGF-α: 100 нг/мл, амфирегулин: 100 нг/мл, эпирегулин: 300 нг/мл, HB-EGF: 50 нг/мл и β-целлюлин: 100 нг/мл), и затем инкубировали при 37°С в течение 3 часов в CO2-инкубаторе. Для измерения уровня пролиферации раковых клеток через 3 дня, к раковым клеткам, инкубированным в 96-луночном планшете, добавляли 40 мкл раствора MTS (CellTiter 96 Aqueous One solution Reagent, Promega), реакцию осуществляли при 37°С в течение 3 часов в CO2-инкубаторе, и затем измеряли значения ОП при 490 нм.
В результате, можно видеть, что GC1118 намного более эффективно ингибировало пролиферацию раковых клеток, индуцированную лигандами EGF, TGF-α, HB-EGF и BTC, по сравнению с цетуксимабом, что указывает на соответствие этих результатов результатам примера 3.
Исходя из полученных результатов, было продемонстрировано, что антитела, имеющие эпитопы, в соответствии с одним из вариантов осуществления настоящего изобретения, приведенного в качестве примера, показали превосходящий ингибирующий эффект на пролиферацию клеток, поскольку антитела имели различные эпитопы с цетуксимабом и, таким образом, обладали способностью ингибировать связывание лиганда (см. фиг. 10). В частности, антитела, связывающиеся с эпитопами, в соответствии с одним из вариантов осуществления настоящего изобретения, приведенного в качестве примера, способны к применению для лечения различных заболеваний, таких как рак, развивающийся при активации EGFR благодаря связыванию не только с EGF, но также других лигандов EGFR, поскольку антитела эффективно ингибируют связывание различных лигандов EGFR, таких как, но, не ограничиваясь ими, EGF, а также TGF-α, AR, BTC, EPR и HB-EGF с EGFR.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Эпитопы EGFR, предоставленные в соответствии с одним из вариантов осуществления настоящего изобретения, приведенном в качестве примера, являются высококонсервативными и расположены в домене, тесно связанном со связыванием с EGF. Следовательно, композиции, содержащие антитела против эпитопов, или композиции вакцин, содержащих эпитопы, могут эффективно блокировать передачу сигналов, вызванную связыванием EGF и EGFR, и, таким образом, могут иметь важное значение при использовании для лечения различных заболеваний, таких как злокачественные новообразования.
Реферат
Настоящее изобретение относится к области биотехнологии, конкретно к эпитопам рецептора эпидермального фактора роста (EGFR), и может быть использовано в медицине для лечения злокачественного новообразования, связанного с активацией EGFR. Получены эпитопы EGFR с аминокислотной последовательностью RGDSFTH (SEQ ID NO:2) или RGDSFTHTP (SEQ ID NO: 3). Полученные эпитопы являются высококонсервативными и расположены в домене, тесно связанном с EGF. Изобретение позволяет эффективно блокировать передачу сигналов, вызванную связыванием EGF и EGFR. 7 н. и 16 з.п. ф-лы, 11 ил., 6 табл., 4 пр.

Комментарии