Липосомы, содержащие олигопептидные фрагменты основного белка миелина, фармацевтический состав и способ лечения рассеянного склероза - RU2639497C2
Код документа: RU2639497C2
Чертежи
















Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США № 13/444788, поданной 11 апреля 2012 года, под названием "ЛИПОСОМЫ, СОДЕРЖАЩИЕ ОЛИГОПЕПТИДНЫЕ ФРАГМЕНТЫ ОСНОВНОГО БЕЛКА МИЕЛИНА, ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ И СПОСОБ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА", содержание которой полностью включено в настоящую заявку посредством ссылки для всевозможных целей.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Рассеянный склероз (РС) - нейродегенеративное заболевание, при котором повреждаются жировые миелиновые оболочки вокруг аксонов головного мозга и спинного мозга, что приводит к демиелинизации и образованию рубцов. Повреждение, причиненное центральной нервной системе (ЦНС), приводит к неврологическим симптомам широкого спектра. Во всем мире приблизительно один миллион людей страдают от данного аутоиммунного заболевания, имеющего загадочную этиологию и мало изученный патогенез. B- и Т-клетки, химически активные в отношении составляющих миелиновой оболочки, опосредуют демиелинизацию в головном и спинном мозге и, как представляется, отвечают за большую часть прогрессирования заболевания.
Перечень потенциальных аутоантигенов, для которых B- и Т-клетки являются химически активными в отношении пациентов с РС, постепенно растет и включает в себя несколько олигодендроцитарно-ассоциированных белков, в частности, основной белок миелина (ОБМ) и миелиновый олигодендроцитарный гликопротеин (МОГ). Инфильтрация центральной нервной системы этими макрофагами и лимфоцитами посредством гематоэнцефалического барьера (ГЭБ) приводит к образованию воспалительных очагов демиелинизации в головном и спинном мозге.
В то время как Т-клетки несут ответственность за большую часть эффекта демиелинизации, хотя и В-клетки играют в этом существенную роль. Это связано с тем, что В-клетки функционируют в качестве антиген-представляющих клеток и цитокинов продуцирующих клеток, в дополнение к их всеми признанной роли в образовании антител (Хикада и Зуали, журнал "Природа иммунологии" (Hikada and Zouali, Nat Immunol) 2010; 11:1065-8). Дополнительным подтверждением причастности В-клеток к демиелинизации является обнаружение каталитических антител к ОБМ у пациентов с рассеянным склерозом. Эти каталитические антитела способны не только связывать их антиген, но также расщеплять его (Пономаренко Н.А. и др., Труды Национальной академии наук, США 2006; 103:281-6). Факты показывают, что существует сильная экологическая составляющая для прогрессирования РС, в котором аутоантитела, обладающие перекрестной реактивностью к нейронным и вирусным антигенам, способствуют этиологии и патогенезу РС (Габибоа А.Г. и др., журн. Федерация американских обществ экспериментальной биологии 2011; 25:4211-21).
Было предложено множество методов лечения РС, в том числе: (i) введение глатиромерацетата (GA); (ii) введение "измененных пептидных лигандов" (APL), которые взаимодействуют с рецепторами Т-клеток (TCR); (iii) введение IFNβ; (iv) введение анти-CD20, анти-CD25 и анти-CD52 моноклональных антител; (v) различные пероральные терапии; (vi) вакцинация инактивированных Т-клеток или гипервариабельных участков TCR; (vii) толеризация иммунной системы путем введения аутоантигенов или DNA-вакцинация; и (viii) нацеленная деплеция B-клеток.
Однако, несмотря на многообещающие клинические, иммунологические и биохимические данные, ни один из существующих методов лечения не способен вылечить или предотвратить прогрессирование РС. Таким образом, в данной области существует большая потребность в эффективных терапевтических подходах к лечению РС.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение удовлетворяет потребность в области медицины по эффективным составам и способам лечения рассеянного склероза (РС), путем предоставления терапевтической композиции иммунодоминантных пептидов ОБМ, связанных с вектором для введения нуждающемуся в этом субъекту. В конкретном воплощении композиция включает в себя иммунодоминантные пептиды ОБМ, инкапсулированные в маннозилированные липосомы. Как видно из данного документа, введение этих композиций улучшает непрерывный экспериментальный аутоиммунный энцефаломиелит в ЭАЭ-индуцированной модели крыс с РС.
Настоящее изобретение основано, отчасти, на обнаружении того факта, что определенные пептиды ОБМ являются основными эпитопами В-клеток у пациентов, страдающих рассеянным склерозом. Было обнаружено, что введение липосомальных рецептур этих пептидов, а не свободных пептидов, моделям грызунов с РС привело к статистически значимому снижению паралича. Не вдаваясь в теорию, мы можем смело заявить, что липосомная рецептура данных пептидов приводит к улучшению доставки пептидов в иммунные клетки (например, В-клетки и/или антигенпрезентирующие клетки) и/или улучшает потребление этих пептидов в иммунных клетках (например, В-клетки и/или антигенпрезентирующие клетки).
Таким образом, настоящее изобретение, кроме всего прочего, предоставляет нам композиции (составы) и способы лечения рассеянного склероза. Композиции содержат один или несколько идентифицированных пептидов ОБМ, связанных с вектором (например, a маннозилированные липосомы).
В одном аспекте данное изобретение обеспечивает композицию для лечения рассеянного склероза. Данная композиция содержит в себе первый пептид основного белка миелина (ОБМ), связанный с первым вектором; первый пептид ОБМ состоит из следующей аминокислотной последовательности: (R1)a-P1-(R2)b, где P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R1 и R2, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; а каждая переменная a и b, независимо друг от друга, равна нулю или единице.
В одном из воплощений составов, приведенных выше, а и b оба равны нулю. В другом из воплощений составов, приведенных выше, а равно единице, а b равно нулю. В другом из воплощений составов, приведенных выше, а равно нулю, а b равно единице. В другом из воплощений составов, приведенных выше, а и b оба равны единице.
В одном из воплощений составов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:1. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 90%-идентичностью с SEQ ID NO:1. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 95%-идентичностью с SEQ ID NO:1. В другом из воплощений составов, приведенных выше, Р1 - это аминокислотная последовательность SEQ ID NO:1.
В одном из воплощений составов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:2. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 90%-идентичностью с SEQ ID NO:2. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере, 95%-идентичностью с SEQ ID NO:2. В другом из воплощений составов, приведенных выше, Р1 - это аминокислотная последовательность SEQ ID NO:2.
В одном из воплощений составов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:3. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 90%-идентичностью с SEQ ID NO:3. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 95%-идентичностью с SEQ ID NO:3. В другом из воплощений составов, приведенных выше, Р1 - это аминокислотная последовательность SEQ ID NO:3.
В одном из воплощений составов, приведенных выше, состав дополнительно содержит второй пептид ОБМ, связанный со вторым вектором, второй пептид ОБМ состоит из следующей аминокислотной последовательности: (R3)c-P2-(R4)d, где P2 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R3 и R4, независимо друг от друга, является аминокислотными последовательностями состоящими из 1-10 аминокислот; а каждая переменная c и d, независимо друг от друга, равна нулю или единице, и где P1 и P2 представляют собой различные аминокислотные последовательности.
В одном из воплощений составов, приведенных выше, первый и второй векторы являются одним вектором.
В одном из воплощений составов, приведенных выше, состав дополнительно содержит третий пептид ОБМ, связанный с третьим вектором, третий пептид ОБМ состоит из следующей аминокислотной последовательности: (R5)e-P3-(R6)f, где P3 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R5 и R6, независимо друг от друга, является аминокислотными последовательностями состоящими из 1-10 аминокислот; а каждая переменная e и f, независимо друг от друга, равна нулю или единице, и где P1, P2, и P3 - различные аминокислотные последовательности.
В одном из воплощений составов, приведенных выше, первый, второй и третий векторы являются одним вектором.
В одном из воплощений составов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:1; P2 - аминокислотная последовательность SEQ ID NO:2; а P3 - аминокислотная последовательность SEQ ID NO:3.
В одном из воплощений составов, приведенных выше, пептид ОБМ ковалентно связан с вектором. В другом из воплощений составов, приведенных выше, пептид ОБМ нековалентно связан с вектором.
В одном из воплощений составов, приведенных выше, вектор содержит наночастицы. В особом воплощении составов, приведенных выше, наночастицы представляют собой липосомы.
В одном из воплощений составов, приведенных выше, вектор содержит целевой фрагмент. В особом воплощении составов, приведенных выше, вектор представляет собой целевой фрагмент.
В одном из воплощений составов, приведенных выше, целевой фрагмент повышает: (a) доставку пептида ОБМ к иммунной клетке; или (б) поступление пептида ОБМ в иммунную клетку; по сравнению с пептидом ОБМ, связанного с вектором при отсутствии целевой части.
В одном из воплощений составов, приведенных выше, целевой фрагмент содержит остаток маннозы. В другом из воплощений составов, приведенных выше, целевой фрагмент содержит антитело, которое особым образом связывается с иммунной клеткой. В другом из воплощений составов, приведенных выше, целевой фрагмент содержит аптамер, который особым образом связывается с иммунной клеткой. В одном из воплощений составов, приведенных выше, целевой фрагмент содержит пептид, который особым образом связывается с иммунной клеткой. В одном из воплощений составов, приведенных выше, иммунная клетка представляет собой В-клетку. В другом из воплощений составов, приведенных выше, иммунная клетка представляет собой антигенпрезентирующую клетку (АПК).
В одном аспекте данное изобретение обеспечивает композицию для лечения рассеянного склероза. Данная композиция содержит в себе первый пептид основного белка миелина (ОБМ), связанный с первым вектором; первый пептид ОБМ состоит из следующей аминокислотной последовательности: (R1)a-P1-(R2)b, где P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NOS:1-3; каждый R1 и R2, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; а каждая переменная a и b, независимо друг от друга, равна нулю или единице, где вектор представляет собой липосому, содержащую маннозилированные липиды.
В одном из воплощений составов, приведенных выше, P1 - это аминокислотная последовательность SEQ ID NO:1.
В одном из воплощений составов, приведенных выше, состав дополнительно содержит: второй пептид ОБМ, связанный со вторым вектором, второй пептид ОБМ состоит из следующей аминокислотной последовательности: (R3)c-P2-(R4)d; и третий пептид ОБМ, связанный с третьим вектором, третий пептид ОБМ состоит из следующей аминокислотной последовательности: (R5)e-P3-(R6)f, где P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью SEQ ID NO:1; P2 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью SEQ ID NO:2; P3 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью SEQ ID NO:3; каждый R1, R2, R3, R4, R5 и R6, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; а каждая переменная a, b, c, d, e и f, независимо друг от друга, равна нулю или единице.
В одном из воплощении составов, приведенных выше, пептид(ы) ОБМ нековалентно связан(ы) с липосомами. В другом из воплощений составов, приведенных выше, пептид(ы) ОБМ инкапсулирован(ы) липосомами.
В одном из воплощений составов, приведенных выше, средний диаметр липосомы составляет 100-200 нм.
В одном из воплощений составов, приведенных выше, маннозилированным липидом является тетраманнозил-3-L-лизин-диолеоил глицерола. В другом из воплощений составов, приведенных выше, маннозилированным липидом является manDOG.
В одном аспекте настоящее изобретение предлагает способ лечения рассеянного склероза у пациента, нуждающегося в лечении: способ, включающий в себя введение указанному пациенту состава, состоящего из первого пептида основного белка миелина (ОБМ), связанного с первым вектором; первый пептид ОБМ состоит из следующей аминокислотной последовательности: (R1)a-P1-(R2)b, где P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R1 и R2, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; а каждая переменная a и b, независимо друг от друга, равна нулю или единице.
В одном варианте осуществления способов, приведенных выше, а и b оба равны нулю. В другом варианте осуществления способов, приведенных выше, а равно единице, а b равно нулю. В другом варианте осуществления способов, приведенных выше, а равно нулю, а b равно единице. В другом варианте осуществления способов, приведенных выше, а и b оба равны единице.
В одном варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:1. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 90%-идентичностью с SEQ ID NO:1. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 95%-идентичностью с SEQ ID NO:1. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:1.
В одном варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:2. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 90%-идентичностью с SEQ ID NO:2. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 95%-идентичностью с SEQ ID NO:2. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:2.
В одном варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:3. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 90%-идентичностью с SEQ ID NO:3. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 95%-идентичностью с SEQ ID NO:3. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:3.
В одном варианте осуществления способов, приведенных выше, состав дополнительно содержит второй пептид ОБМ, связанный со вторым вектором, второй пептид ОБМ состоит из следующей аминокислотной последовательности: (R3)c-P2-(R4)d, где P2 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R3 и R4, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; каждая переменная c и d, независимо друг от друга, равна нулю или единице, и где P1 и P2 представляют собой различные аминокислотные последовательности.
В одном варианте осуществления способов, приведенных выше, первый и второй векторы являются одним вектором.
В одном варианте осуществления способов, приведенных выше, состав дополнительно содержит третий пептид ОБМ, связанный с третьим вектором, третий пептид ОБМ состоит из следующей аминокислотной последовательности: (R5)e-P3-(R6)f, где P3 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R5 и R6, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; каждая переменная e и f, независимо друг от друга, равна нулю или единице, и где P1, P2 и P3 представляют собой различные аминокислотные последовательности.
В одном варианте осуществления способов, приведенных выше, первый, второй и третий векторы являются одним вектором.
В одном варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:1; P2 - аминокислотная последовательность SEQ ID NO:2; а P3 - аминокислотная последовательность SEQ ID NO:3.
В одном варианте осуществления способов, приведенных выше, пептид ОБМ ковалентно связан с вектором. В другом варианте осуществления способов, приведенных выше, пептид ОБМ нековалентно связан с вектором.
В одном варианте осуществления способов, приведенных выше, вектор содержит наночастицы. В конкретном воплощении наночастица представляет собой липосому.
В одном варианте осуществления способов, приведенных выше, вектор содержит целевой фрагмент.
В одном варианте осуществления способов, приведенных выше, целевой фрагмент повышает: (a) доставку пептида ОБМ к иммунной клетке; или (б) поступление пептида ОБМ в иммунную клетку; по сравнению с пептидом ОБМ, связанным с вектором при отсутствии целевой части.
В одном варианте осуществления способов, приведенных выше, вектор представляет собой целевой фрагмент. В другом варианте осуществления способов, приведенных выше, целевой фрагмент содержит остаток маннозы. В другом варианте осуществления способов, приведенных выше, целевой фрагмент содержит антитело, которое особым образом связывается с иммунной клеткой. В другом варианте осуществления способов, приведенных выше, целевой фрагмент содержит аптамер, который особым образом связывается с иммунной клеткой. В другом варианте осуществления способов, приведенных выше, целевой фрагмент содержит пептид, который особым образом связывается с иммунной клеткой. В одном варианте осуществления способов, приведенных выше, иммунная клетка представляет собой В-клетку. В другом варианте осуществления способов, приведенных выше, иммунная клетка представляет собой антигенпрезентирующую клетку (АПК).
В одном варианте осуществления способов, приведенных выше, состав содержит пептид ОБМ, имеющий аминокислотную последовательность SEQ ID NO:1, пептид ОБМ связан с вектором, содержащим целевой фрагмент, где вектор, содержащий целевой фрагмент, представляет собой липосому, содержащую маннозилированный липид.
В одном варианте осуществления способов, приведенных выше, состав содержит: (i) первый пептид ОБМ, имеющий аминокислотную последовательность SEQ ID NO:1; (ii) второй пептид ОБМ, имеющий аминокислотную последовательность SEQ ID NO:2; и (iii) третий пептид ОБМ, имеющий аминокислотную последовательность SEQ ID NO:3.
В одном варианте осуществления способов, приведенных выше, пептид(ы) ОБМ нековалентно связан(ы) с липосомой.
В одном варианте осуществления способов, приведенных выше, пептид(ы) ОБМ инкапсулирован(ы) липосомами.
В одном варианте осуществления способов, приведенных выше, средний диаметр липосомы составляет 100-200 нм.
В одном варианте осуществления способов, приведенных выше, маннозилированным липидом является тетраманнозил-3-L-лизин-диолеоил глицерола. В другом варианте осуществления способов, приведенных выше, маннозилированным липидом является manDOG.
В одном варианте осуществления способов, приведенных выше, состав вводят пациенту, по меньшей мере, один раз в неделю. В другом варианте осуществления способов, приведенных выше, состав вводят пациенту, по меньшей мере, два раза в неделю. В другом варианте осуществления способов, приведенных выше, состав вводят пациенту ежедневно.
В одном варианте осуществления способов, приведенных выше, состав вводится пациенту путем местного применения, энтеросолюбильного введения или парентерального введения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1. Крысы линии DA с индуцированным ЭАЭ (экспериментальный аллергический энцефаломиелит) являются наиболее соответствующими моделями грызунов с РС с точки зрения анти-ОБМ аутоантител, связывающих паттерн. (A) Сыворотка аутоантител от пациентов с РС и моделей грызунов, вырабатывающих экспериментальный аутоиммунный энцефаломиелит (крысы линии DA и SJL, а также мыши линии C57BL/6), воспроизводимым образом связывает ОБМ при методе ELISA (энзим-связанный иммуносорбентный метод исследования). В качестве отрицательного контроля была использована сыворотка мышей линии BALB/c. (B) Построение эпитопного банка ОБМ. Типичное окрашивание Кумасси и гибридизация с использованием вестерн-блоттинга для anti-с-myc и анти-ОБМ мАт с эпитопным банком ОБМ. Anti-с-myc Ab связывает все члены эпитопного банка ОБМ благодаря наличию целевого эпитопа во всех слитых белках (схема сверху), тем самым, предполагая воздействие и доступность всех пептидов ОБМ, расположенный непосредственно выше по потоку к эпитопу с-myc. Моноклональные анти-ОБМ Ab (клон F4A3, эпитоп ОБМ RHGFLPRHR (SEQ ID NO:20)) вступает в реакцию с ОБМ и его пептидами ОБМ2 и ОБМ3, как и было предсказано. (C) Сыворотка аутоантител, связывающих паттерн с эпитопным банком ОБМ согласно методу ELISA. По нашим данным крысы линии DA, вырабатывающие ЭАЭ, являются наиболее подходящей моделью грызунов с РС. Последовательность ОБМ с пептидами, представленными в его эпитопном банке, показаны снизу (SEQ ID NO:17). Каждый десятый аминокислотный остаток отмечен жирным шрифтом. Квадратные скобки представляют собой иммунодоминантные пептиды ОБМ-1/-2/-3, отобранные для достижения эффективности скрининга лечения.
Фиг.2. Характеристика специфичности и аффинности поликлональных антител от крыс линии DA, иммунизированных ОБМ (63-81). (A) Верхняя панель показывает нам, что три фрагмента ОБМ распознаются по сыворотке аутоантитела от крыс линии DA с искусственным ЭАЭ. Иммунодоминантные пептиды были определены согласно методу ELISA из аutoАb, связывающегося с эпитопным банком, а дальнейший теоретический расчет основан на предположении их перекрывающихся последовательностей. Кроме того, для проверки анализа связывания, эпитопный банк ОБМ был гибридизован с anti-с-myc и анти-ОБМ F4A3 мкАт (нижняя панель). (B) Количественные характеристики распознавания определенных эпитопов с помощью аутоантитела, измеряемого методом ППР (поверхностный плазмонный резонанс). Вы можете также увидеть соответствующие пептиды и эффективные константы диссоциации. Точные эпитопы выделены жирным шрифтом, н/о = не определено.
Фиг.3. Схематическое изображение метода липосомации, используемого для инкапсуляции иммунодоминантных пептидов ОБМ в маннозилированные SUV липосомы. (Сверху слева) Смесь липидов (Egg PC с 1% маннозилированного DOG) в хлороформе. (Сверху посередине) Образование нерегулярных липидных слоев при испарении органического растворителя. (Сверху справа) Первая регидратация приводит к образованию многослойных MLV липосом. Средний диаметр частиц составляет 1-5 мкм. (Снизу слева) Лиофилизация SUV липосом, полученных из MLV липосом путем гомогенизации под высоким давлением, и смеси пептидов избыточным сахаром. (Снизу посередине) Пептиды расположены между обрушившимися SUV липосомами. (Снизу справа) Инкапсулирование пептидов в течение второй регидратации в SUV липосомы размером около 60-80 нм и 1,0% остатков маннозы на поверхность. Воспроизведения были выполнены компанией "Visual Science Company".
Фиг.4. Включенные в липосомы иммунодоминантные пептиды ОБМ улучшают показатели экспериментального аутоиммунного энцефаломиелита у крыс линии DA. Все рассматриваемые группы (А-G) были изучены по среднему индексу заболевания, показателю глиоза/демиелинизации. Необработанная контрольная (получающая носитель) группа показана жирной темной линией (А) и повторяется на каждом графике для сравнения. Для лечения ЭАЭ у крыс линии DA использовались три иммунодоминантных фрагмента ОБМ, инкапсулированные в маннозилированные SUV липосомы: Во время первой атаки (B) ОБМ (46-62) оказался наиболее эффективным при снижении максимального индекса заболевания, ОБМ (124-139) (C) и ОБМ (147-170) (D) предотвратили развитие периода ремиссии. Введение смеси ОБМ (46-62), ОБМ (124-139) и ОБМ (147-170) иммунодоминантных пептидов ОБМ, включенных в липосомы, значительно улучшило показатели затянувшийся ЭАЭ (E), копаксон (copaxone) (F) и свободный пептид ОБМ (46-62) (G) использовались в качестве положительного и отрицательного контроля, соответственно. Для каждой группы представлен средний индекс заболевания. Статистически существенная разница показана жирным курсивом. Характерный профиль отдельно выбранной крысы показан тонкой линией. Характерный показатель гематоксилина и окрашивания эозином показаны на панели справа.
Фиг.5. Включенные в липосомы иммунодоминантные пептиды ОБМ снижают содержание сывороточного анти-ОБМ титра аутоантител и подавляет Th1 профиль цитокина ЦНС. (A) Концентрация сывороточного анти-ОБМ аутоантитела у крыс линии DA c ЭАЭ, получавших ОБМ1 SUV, ОБМ1/2/3 SUV и копаксон, в сравнении с необработанными и неиммунизированными крысами. Типичное окрашивание luxol fast blue (B), иммуноокрашивание для Th1 цитокинов IFNγ (B) и IL2 (C), и иммуноокрашивание BDNF (нейротрофический фактор головного мозга) (D) в срезах мозга крыс линии DA, получивших ОБМ1 SUV (внизу справа), ОБМ1/2/3 SUV (внизу слева) и копаксон (сверху справа), в сравнении c необработанными крысами (сверху слева).
Фиг.6. Средний балл паралича для ЭАЭ-индуцированных моделей крыс с РС. В течение всего срока периодов исследования мы ежедневно присваивали показатель паралич каждой крысе: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения (всего 35 дней). 54 ЭАЭ-индуцированных крыс линии DA были поровну разделены на 9 групп. Группы I-VII лечили лекарственными средствами 1-7, VIII группу лечили копаксоном (положительная контрольная группа), IX группе вводили инъекции воды (отрицательная контрольная группа). Мы ежедневно записывали показатели паралича, и они отображаются в виде средних значений для групп I-V (A) и групп VI-IX (B). Статистически значимое снижение показателя паралича, в сравнении контрольных групп, наблюдалось у группы IV (лечение 4 лекарственным средством) на 3 и 4 день после лечения (n=6, *p<0,05). Стандартное отклонение измеряется планками погрешностей.
Фиг.7. Средний вес туловища (г) ЭАЭ-индуцированных моделей крыс с РС. Мы записывали вес всех животных на протяжении всех периодов исследования: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения (всего 35 дней). 54 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 9 групп. Статистически значимых различий между весом тел крыс, получавших препараты с пептидом ОБМ, и контрольными группами не выявлено. Стандартное отклонение измеряется планками погрешностей.
Фиг.8. Окрашивание гематоксилином и эозином (H & E) спинного мозга от ЭАЭ-индуцированной модели крысы с РС. Изображения при 10× и 40× увеличении спинного мозга, выделенного из ЭАЭ-индуцированных крыс линии DA, получавших: (A) (крыса 35; группа II), (крыса 53; группа IV), (крыса 69; группа IX); (B) (крыса 71; группа VIII), (крыса 77; группа III), (крыса 79; группа V); (C) (крыса 81; группа I), (крыса 95; группа VII), (крыса 2003; группа VI).
Фиг.9. Экспериментальный план. Экспериментальная модель, включая пептидные идентичности, содержание липосомное и дозировка для всех экспериментальных лекарственных средств, испытанная в примерах 12, 13 и 14. ОБМ1 (SEQ ID NO:1); ОБМ1FL (SEQ ID NO:9); ОБМ1FR (SEQ ID NO:10); ОБМ2 (SEQ ID NO:2); ОБМ3 (SEQ ID NO:3).
Фиг.10. Средний показатель паралича для ЭАЭ-индуцированных моделей крыс с РС. В течение всего срока периодов исследования мы ежедневно присваивали показатель паралич каждой крысе: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения (всего 36 дней). 54 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 10 групп. Группы I-VIII лечили лекарственными средствами ОБМ F 1-8, IX группу лечили Копаксоном (положительная контрольная группа), X группе вводили инъекции воды (отрицательная контрольная группа). Статистически значимое снижение показателя паралича, в сравнении контрольных групп, наблюдалось у групп III и IV (лечение осуществлялось 200 мг дозой) на 2 и 3 день после лечения (n=5, *p<0,05). Стандартное отклонение измеряется планками погрешностей.
Фиг.11. Средний вес туловища (г) ЭАЭ-индуцированных моделей крыс с РС. Мы записывали вес всех животных на протяжении всех периодов исследования: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения (всего 36 дней). 54 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 10 групп. Статистически значимых различий между весом тел крыс, получавших препараты с пептидом ОБМ, и контрольными группами не выявлено. Стандартное отклонение измеряется планками погрешностей.
Фиг.12. Средний показатель паралича для ЭАЭ-индуцированных моделей крыс с РС. В течение всего срока периодов исследования мы ежедневно присваивали показатель паралич каждой крысе: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения. 42 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 7 групп. Группы II-V лечили лекарственными средствами ОБМ F I-IV, группы VI и VII лечили копаксоном (150 мкг и 450 мкг, соответственно; положительная контрольная группа), а I группе вводили инъекции воды (отрицательная контрольная группа). Статистически значимое снижение показателя паралича, в сравнении с отрицательным контролем, наблюдалось для: группа II (лечение осуществлялось липосомной рецептурой ОБМ1; соотношение пептида к липиду 1:330) на 1-4 день после лечения (n=6, *p<0,005); группа III (лечение осуществлялось липосомной рецептурой ОБМ1/2/3; соотношение пептида к липиду 1:330) в 1 день после лечения (n=6, *p<0,05); и группа V (лечение осуществлялось липосомной рецептурой ОБМ1/2/3; соотношение пептида к липиду 1:110) на 1-3 день после лечения (n=6, *p<0,05). Стандартное отклонение измеряется планками погрешностей.
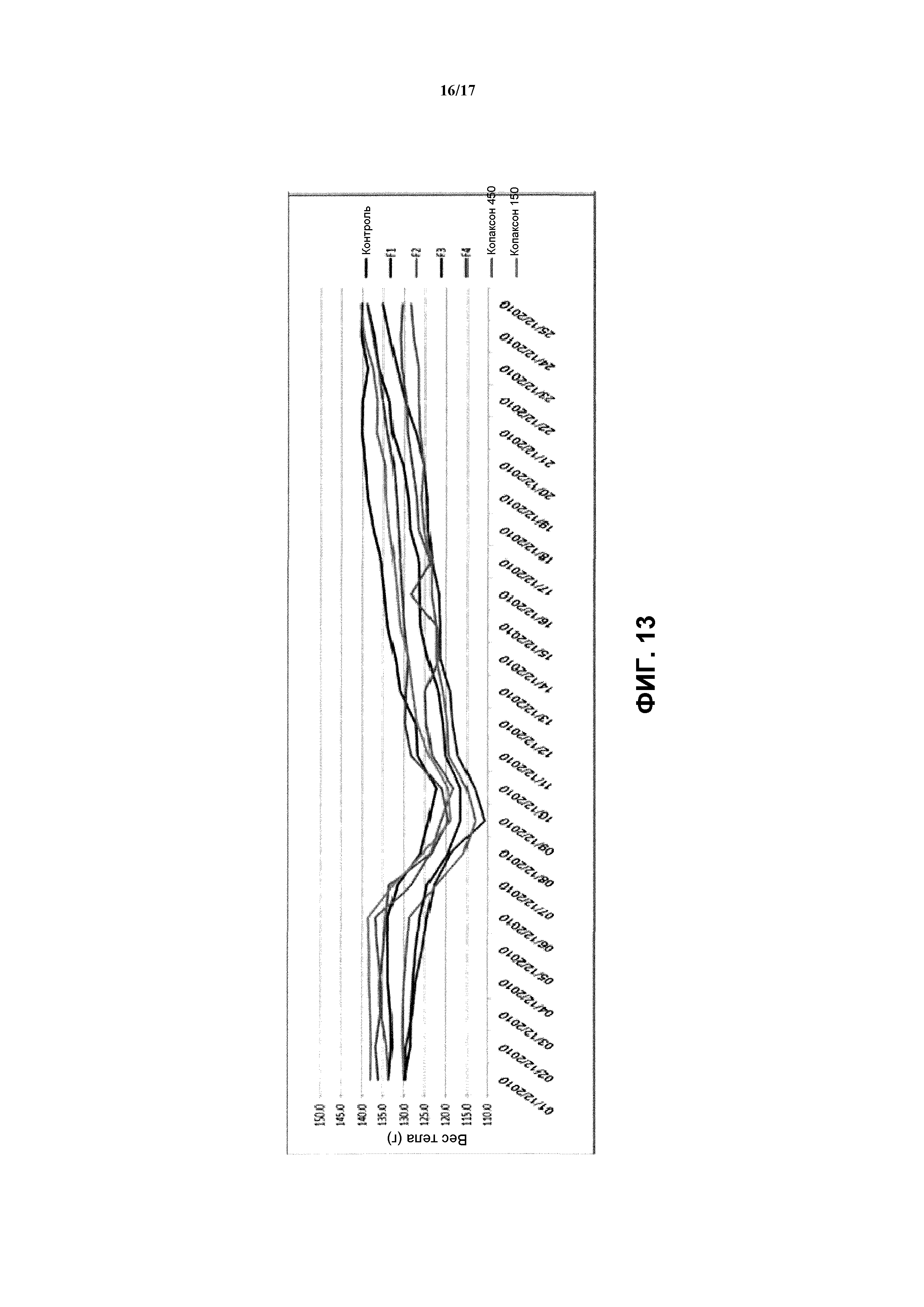
Фиг.13. Средний вес туловища (г) ЭАЭ-индуцированных моделей крыс с РС. Мы записывали вес всех животных на протяжении всех периодов исследования: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения. 42 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 7 групп. Статистически значимых различий между весом тел крыс, получавших препараты с пептидом ОБМ, и контрольными группами не выявлено. Стандартное отклонение измеряется планками погрешностей.
Фиг.14. Выравнивание последовательности 7 сплайсированных изоформ ОБМ Идент. номера компании "UniProt": P02686 (SEQ ID NO:13); P02686-2 (SEQ ID NO:14); P02686-3 (SEQ ID NO:15); P02686-4 (SEQ ID NO:16); P02686-5 (SEQ ID NO:17); P02686-6 (SEQ ID NO:18); и P02686-7 (SEQ ID NO:19).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Введение
Рассеянный склероз (РС) - нейродегенеративное заболевание тяжелой степени, имеющее аутоиммунный фон. Хотя уже известно несколько методов лечения по управлению рассеянным склерозом, лекарства от этой болезни не существует. Кроме того, существующие в настоящее время терапии имеют ограниченную эффективность и могут привести к нежелательным побочным эффектам. Соответственно, разработка новых подходов к лечению РС имеет большое значение. В данном документе мы приводим доклад о композициях и использовании В-клеточных эпитопов основного белка миелина (ОБМ), инкапсулированного в небольшие однослойные (SUV) маннозилированные липосомы, в качестве эффективного лекарственного средства для экспериментального лечения аутоиммунного энцефаломиелита (ЭАЭ) у крыс линии DA, и принятую в данной области модель РС у людей.
Одновременно, настоящее изобретение предлагает терапевтические композиции антигенных пептидов ОБМ, связанных с вектором, пригодные для лечения рассеянного склероза. В конкретном воплощении терапевтические композиции содержат один, два или три антигенных пептида ОБМ, связанных с вектором (например, липосомы), необязательно содержащих целевую часть (например, маннозилированный липид). При введении пациенту с рассеянным склерозом, терапевтические композиции улучшают когнитивные способности и облегчают симптомы паралича. Таким образом, настоящее изобретение также предлагает способы лечения, управления и профилактики рассеянного склероза у нуждающегося в этом субъекта.
Используя эпитопный банк основного белка миелина, мы смогли проанализировать вяжущий шаблон сывороточных аутоантител (autoAb) ремиттирующих пациентов с РС и сравнить с анти-ОБМ autoAb от швейцарских мышей Джеймса Ламберта (SJL), мышей линии C57 black 6 (C57BL/6) и крыс линии Dark Agouti (DA) с ЭАЭ. На основе спектрального анализа autoAb по отношению к ОБМ фрагментам было обнаружено, что крысы линии DA с ЭАЭ являются наиболее соответствующими моделями грызунов с РС. Для лечения ЭАЭ у крыс линии DA использовались три иммунодоминантных фрагмента ОБМ, инкапсулированного в маннозилированные SUV липосомы. ОБМ (46-62) оказался наиболее эффективным в снижении максимального индекса заболевания во время первой атаки, в то время как ОБМ (124-139) и ОБМ (147-170) предотвратили развитие стадии обострения заболевания. Введение смеси иммунодоминантных пептидов ОБМ, значительно включенных в липосомы, улучшает затянувшийся ЭАЭ. благодаря понижающей регуляции цитокинов Th1 и вызыванию выработки BDNF (нейротрофический фактор головного мозга) в ЦНС. Синергетические эффекты ОБМ пептидов снижают общие показатели течения заболевания при умеренной первой атаке и дают быстрый результат при обострении, предлагая новейшее лечебное воздействие для лечения РС.
II. Определения
В данном контексте понятие "вектор" относится к молекулярной структуре, способной связываться с грузом (например, терапевтические или диагностические малые молекулы, пептиды, нуклеиновые кислоты и белковые биопрепараты). В одном воплощении вектор представляет собой молекулярную структуру, которая "таит" или "пасет" терапевтический груз (например, пептид ОБМ), введенный нуждающемуся субъекту. Вектор может, но вовсе не обязательно: улучшить терапевтический эффект, придаваемый грузом; улучшить или осуществить целевую доставку груза к местоположению в условиях in vivo или клеточному типу; улучшить усвоение груза во всех клетках или отдельных клетках в условиях in vitro или in vivo; увеличить период полураспада груза в условиях in vivo; защитить груз от нежелательных взаимодействий в условиях in vivo; или уменьшить скорость выведения груза из кровотока и/или тела субъекта. В одном воплощении вектор содержит наночастицу, которая, согласно нижеследующему, способна инкапсулировать, встраивать и привязывать груз. В некоторых случаях вектор, например, наполнитель в виде наночастиц, может дополнительно содержать целевую часть. В другом воплощении вектор представляет собой целевой фрагмент, который непосредственно связан (ковалентно или нековалентно) с грузом. Безграничные примеры векторов включают в себя: наночастицы, такие как липосомы, мицеллы, мицеллы блок-сополимера, полимерсомы, ниосомы, нанопузырьки с липидным покрытием и дендримеры; твердые носители, такие как металлические частицы и частицы кремнезема; сахарные компоненты, такие как манноза, маннозы производные, аналоговые маннозы или углевод, содержащие один или несколько маннозных остатков, производные маннозы или аналог маннозы; пептиды, такие как лиганд-клеточный рецептор; полипептиды, такие как антитела или их функциональный фрагмент; и нуклеиновые кислоты, такие как аптамер или Spiegelmer®.
В данном контексте понятие "целевой фрагмент" относится к средству, которое улучшает эффективность терапевтического или диагностического груза при связи с грузом, по сравнению с эффективностью лишь только одного груза. В одном воплощении целевой фрагмент улучшает доставку соответствующего груза к местоположению или клеточному типу в условиях in vivo; и/или улучшает усвоение груза в клетке или местоположении в условии in vivo. Целевой фрагмент может быть связан с грузом, как ковалентно, так и нековалентно (например, пептид ОБМ), включая, но не ограничиваясь ими, посредством ковалентной связи, ионной связи, электростатического взаимодействия, гидрофобного взаимодействия или физического улавливания. В определенных воплощениях связь может быть опосредована посредством линкера или другой векторной структуры. Примеры целевых фрагментов включают в себя, не ограничиваясь лишь ими: сахарный фрагмент (например, манноза или углевод, содержащий один или несколько маннозных остатков), пептид (например, лиганд-клеточный рецептор), полипептид (например, антитело или его функциональный фрагмент) и нуклеиновая кислота (например, аптамер или Spiegelmer®).
В данном контексте понятие "вектор, содержащий целевой фрагмент" относится к молекулярной структуре, которая улучшает доставку груза к клетке и/или улучшает усвоение груза клеткой. В одном воплощении вектор, содержащий целевой фрагмент, ковалентно или нековалентно связанный с наполнителем наночастицы, способной доставлять груз (например, пептид ОБМ или другое терапевтическое средство). Совсем необязательно, что вектор, содержащий целевой фрагмент, включает в себя наполнитель в виде наночастиц, способный укрывать груз. В другом воплощении вектор, содержащий целевой фрагмент, состоит из целевого фрагмента, который напрямую связан, ковалентно или нековалентно, с грузом (например, пептид ОБМ или другое терапевтическое средство). В конкретном воплощении вектор, содержащий целевой фрагмент, представляет собой целевой фрагмент.
В данном контексте понятие "наночастица" относится к вектору, средний диаметр которого приблизительно равен 1-1000 нм, который связан с грузом, например, пептид (например, пептид ОБМ), нуклеиновая кислота, терапевтический фрагмент или диагностический фрагмент. Наночастицы могут быть полыми (например, имеет наружную оболочку и полую сердцевину), твердыми или многослойными. Груз (например, пептид ОБМ) может быть привязан к, встроенный в или инкапсулирован наночастицей. В данной области известно множество наночастиц (см., например, Elizondo и др., Prog Mol Biol Transl Sci. 2011; 104:1-52, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей) и включают в себя, без ограничения, липосому, мицеллу, мицеллу блок-сополимера (взято из Kataoka и др., Adv Drug Deliv Rev. 2001 Mar 23; 47(1):113-31, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей), полимерсомы (взято из Christian и др., Eur J Pharm Biopharm. 2009 Mar; 71(3):463-74, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей), ниосому (взято из Kazi и др., J Adv Pharm Technol Res. 2010 Oct; 1(4):374-80, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей), покрытый липидом нанопузырек (Unger и др., Adv Drug Deliv Rev. 2004 May 7; 56(9):1291-314, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей), дендример, металлическую частицу (например, частица оксида железа или частица золота) и частицу кремнезема.
В одном воплощении средний диаметр наночастицы составляет приблизительно 1-1000 нм. В другом воплощении средний диаметр наночастицы составляет приблизительно 20-500 нм. В другом воплощении средний диаметр наночастицы составляет приблизительно 50-400 нм. В другом воплощении средний диаметр наночастицы составляет приблизительно 75-300 нм. В еще одном воплощении средний диаметр наночастицы составляет приблизительно 100-200 нм. В некоторых воплощениях липосомы могут включать в себя катионные липиды, анионные липиды, цвиттерионные липиды, нейтральные липиды или их комбинации.
В данном контексте понятие “липосома” относится к любой структуре, заключенной при помощи липидного бислоя (т.е. ламелла). Понятие липосома включает в себя: липосомы мультиламеллярных везикул (MLV) размером приблизительно 0,1-5 мкм, липосомы небольших моноламеллярных везикул (SUV) размером приблизительно 0,02-0,05 мкм и липосомы больших однослойных везикул размером приблизительно 0,06 мкм и больше. В данном контексте понятие “мультиламеллярный” относится к липидной структуре, содержащей более двух липидных слоев. Соответственно, понятие “моноламеллярный” относится к липидной структуре, содержащей два липидных слоя, т.е. один липидный бислой. Как правило, при присутствии в водной среде, гидрофильная часть (например, полярные головные группы липида) большинства липидов, содержащих липидный бислой, будут расположены на поверхности структуры (т.е. наружной или внутренней лицевой стороне бислоя, а гидрофобные участки (например, насыщенные или ненасыщенные углеводородные группы) большинства липидов, содержащих липидный бислой, будут располагаться на внутренней стороне бислоя.
В данном контексте понятие "мицелла" относится к любой структуре, заключенной в липидном монослое. Как правило, при присутствии в водной среде, гидрофильная часть (например, полярные головные группы липида) большинства липидов, содержащих мицеллу, будет располагаться на поверхности структуры, а гидрофобные участки (например, насыщенные или ненасыщенные углеводородные группы) большинства липидов, содержащих мицеллу, будут располагаться на внутренней стороне структуры. В определенных воплощениях липосома может быть инкапсулирована в мицеллу большего размера. Аналогичным образом, в определенных воплощениях мицелла может быть инкапсулирована в липосому большего размера.
В данном контексте понятие "маннозилированная липосома" относится к липосоме, содержащей один или более остатков маннозы, производной маннозы или аналога маннозы, связанной с внешней частью липидного бислоя. В одном воплощении маннозилированная липосома включает в себя липид, конъюгированный с одним или несколькими остатками, производными или аналогами маннозы. В конкретном воплощении остаток, производная или аналог маннозы будут конъюгированы с полярной головной группой или другой липидной структурой, как правило, расположенной на внешней стороне липидного бислоя, присутствующего в водной среде (например, внешней и/или внутренней поверхности липосомы). В предпочтительном варианте, по меньшей мере, процентная доля маннозных остатков, производных или аналогов, конъюгированных с маннозилированной липосомой, будет подвергаться воздействию внешней среды липосома и, таким образом, будет доступна для взаимодействия, например, с иммунными клетками. В одном воплощении маннозилированная липосома включает в себя моно-маннозилированный липид. В конкретном воплощении моно-маннозилированный липид представляет собой ManDOG липид (см., Ponpipom, M.M. и др., J. Med. Chem. 1981, 24, 1388; и Espuelas и др., Bioorg Med Chem Lett. 2003 Aug 4; 13(15):2557-60, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Структура липида ManDOG представлена на фиг.3. В другом воплощении маннозилированная липосома включает в себя липид тетраманнозил-3-L-лизин-диолеоил глицерола (Espuelas и др., выше). Безграничные примеры производных и аналогов маннозы включают: 1-Deoxymannojirimycin гидрохлорид, метил-α-D-маннопиранозид, 2-дезокси-D-глюкозу (2-DG), 2-дезокси-2-фтор-маннозу (2-FM) и 2-дезокси-2-хлор-маннозу (2-CM), каждый из которых может быть конъюгирован с липидом.
В определенных воплощениях, по меньшей мере, 0,01% липидов, содержащих маннозилированную липосому, будет конъюгирован с одним остатком маннозы, как минимум. В другом воплощении, по меньшей мере, 0,1% липидов, содержащих маннозилированную липосому, будет конъюгирован с одним остатком маннозы, как минимум. В другом воплощении, по меньшей мере, 1% липидов, содержащих маннозилированную липосому, будет конъюгирован с одним остатком маннозы, как минимум. В еще других воплощениях, по меньшей мере, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% липидов, содержащих маннозилированную липосому, будет конъюгировано с одним остатком маннозы, как минимум.
В данном контексте понятие "липид" относится к гидрофобным или амфифильным молекулам, способным образовывать однослойные или двухслойные структуры в водной среде, например, мицелла или липосома. Липиды включают в себя, без ограничения, жиры, воск, стерины, жирорастворимые витамины, моноглицериды, диглицериды, триглицериды и фосфолипиды. Липиды, используемые для образования наночастиц, таких как липосомы и мицеллы, можно дополнительно модифицировать или конъюгировать с целевым фрагментом. Безграничные примеры целевых фрагментов, которые могут быть конъюгированы с липидами, включают: сахарные фрагменты (например, манноза или углевод, содержащий один или несколько остатков маннозы), пептиды (например, лиганд-клеточный рецептор), полипептиды (например, антитело или его функциональный фрагмент) и нуклеиновые кислоты (например, аптамер или Spiegelmer®).
В данном контексте понятие "холестерол" относится к встречающемуся в природе стероидному спирту (стерол), имеющему четыре конденсированных кольца, а также к его сложным эфирам с длинноцепочечными жирными кислотами и их аналоги, которые сохраняют способность модулировать текучесть мембран. Холестерол и сложные эфиры холестерина являются компонентами липопротеинов плазмы и наружной клеточной мембраны клеток животных, обладающих способностью модулировать текучесть мембран. Аналоги холестерола, которые сохраняют способность модулировать текучесть мембран, хорошо известны в данной области (см., например, Gimpl, G., и др. (1997) Biochemistry 36:10959-10974) и включают в себя, например, 5-холестен, 5-прегнен-3β-ол-20-он, 4-холестен-3-он и 5-холестен-3-он. Холестерин и аналоги холестерола являются общими компонентами липосомальными, которые могут придать дополнительную текучесть в липидном монослое или бислое, образуя мицеллу или липосому.
В данном контексте понятия "связанный" и "конъюгированный" являются взаимозаменяемыми и относятся к ковалентной или нековалентной связи между двумя фрагментами, например, между терапевтическим средством и вектором или целевым фрагментом. Связи, образующиеся между двумя фрагментами, но не обязательно ковалентными в природе, помогают поддерживать связь между фрагментами. Безграничные примеры связей, которые могут быть использованы для связывания двух фрагментов, например, пептида ОБМ и целевого фрагмента, включают в себя: ковалентные взаимодействия (такие как, ковалентные химической связи, образующиеся непосредственно между первым фрагментом и вторым фрагментом или через линкерную молекулу); ионные взаимодействия (например, ионная связь, образующаяся непосредственно между первым фрагментом и вторым фрагментом или через линкерную молекулу); электростатические взаимодействия (например, притяжение двух противоположных зарядов); гидрофобные взаимодействия; взаимодействия, скрепленные с помощью сил Ван-дер-Ваальса; и взаимодействия, скрепленные посредством физического улавливания (например, инкапсуляции или заделка грузовой молекулы в пределах наночастицы). В одном воплощении грузовая молекула (например, пептид ОБМ), инкапсулированная в пределах вектора (например, липосома), связана с целевым фрагментом (например, остаток маннозы), который привязан к внешней части вектора.
В данном контексте понятие "заложенный в пределах" относится к позиционированию грузовой молекулы по отношению к вектору, в котором грузовая молекула расположена в пределах матрицы векторной структуры. Например, когда мы говорим, что пептидный груз заложен в пределах липосомного или мицеллярного вектора, это означает, что пептид, или его часть, расположен в липидном бислое (липосома) или монослое (мицелла). Грузовые молекулы, заложенные в пределах вектора, могут быть ковалентно или нековалентно связаны с векторной матрицей (например, в полимерную оболочку) или субкомпонентой векторной матрицы (например, липид присутствует в липидном бислое липосомы), например, посредством ковалентной связи, ионной связи, электростатического взаимодействия, гидрофобного взаимодействия или физического улавливания.
В данном контексте понятие "инкапсулированный в" относится к позиционированию грузовой молекулы по отношению к вектору, в котором грузовая молекула заключена или содержится во внутренней части векторной структуры. Например, когда мы говорим, что пептидный груз инкапсулирован в липосомальном векторе, это означает, что пептид расположен с внутренней стороны по отношению к липидному бислою липосомы, тем самым он защищен от воздействия окружающей среды, считаемой внешней по отношению к липосоме. Грузовые молекулы, инкапсулированные в вектор, могут быть ковалентно или нековалентно связаны с вектором (например, в полимерную оболочку) или субкомпонентой векторной матрицы (например, липид присутствует в липидном бислое липосомы), например, посредством ковалентной связи, ионной связи, электростатического взаимодействия, гидрофобного взаимодействия или физического улавливания.
В определенных воплощениях внутренняя часть липосомального или мицеллярного вектора будет содержать водную среду. Соответственно, гидрофильный груз, такой как пептид или нуклеиновая кислота, может быть частично или полностью сольватирован в пределах внутренней части вектора. В других воплощениях внутренняя часть липосомального или мицеллярного вектора может содержать безводную среду, например, он может состоять из полярного растворителя. Соответственно, гидрофобный груз, такой как неполярная малая молекула, может быть частично или полностью сольватирован в пределах внутренней части вектора.
В данном контексте понятие "привязанный к" относится к позиционированию грузовой молекулы по отношению к вектору, в котором грузовая молекула связана с векторной структурой в одной или нескольких точках. Привязывание грузовой молекулы может осуществляться, как ковалентно (например, посредством химической связи), так и нековалентно (например, посредством гибридизации нуклеиновой кислоты). Грузовые молекулы могут быть привязаны к внешней или внутренней поверхности вектора (например, к полимерной оболочке) или субкомпоненте векторной матрицы (например, липид присутствует в липидном бислое липосомы). Грузовая молекула, привязанная к векторной структуре в точке прикрепления, в противном случае может свободно перемещаться по пространству (например, иначе сольватироваться окружающей средой, внешней или внутренней по отношению к вектору). Грузовые молекулы, привязанные к вектору, могут быть связаны с вектором ковалентно или нековалентно (например, к полимерной оболочке) или субкомпонентой векторной матрицы (например, липид присутствует в липидном бислое липосомы), например, посредством ковалентной связи, ионной связи, электростатического взаимодействия, гидрофобного взаимодействия или физического улавливания.
В данном контексте понятия "аптамер", "SPIEGELMER®" и "лиганд нуклеиновой кислоты" являются взаимозаменяемыми и относятся к не встречающемуся в природе олигонуклеотиду (как правило, 15-250 нуклеотидов в длину), который особым образом связывается с конкретной целью. Аптамеры представляют собой нуклеиновые кислоты, содержащие определенную вторичную структуру, придающую специфичность целевой молекуле (например, маркер или рецептор клеточной поверхности). Аптамеры дополнительно могут содержать специфическую тройную и, возможно, четвертичную структуру, которая дополнительно вносит свой вклад в образование крепкой связи между нуклеиновой кислотой и целевой молекулой. При присутствии в надлежащей трехмерной структуре аптамер особым образом связывается с конкретной целью. Аптамеры охватывают последовательности натуральных нуклеиновых кислот (например, dA, dT, dC, dG, rA, rU, rC и rG), а также синтетические нуклеиновые кислоты (например, dU, dI, rT, rI) и модифицированные нуклеиновые кислоты. SPIEGELMER® - аптамеры, образованные с помощью L-нуклеиновых кислот, в отличие от встречающихся в природе D-нуклеиновых кислот. Аптамеры и SPIEGELMER® могут включать в себя смесь L- и D-нуклеиновых кислот.
В данном контексте понятие «антитело» относится к полипептиду, который является иммунологически реактивным с конкретным антигеном. Понятие "иммуноглобулин", используемый здесь, охватывает интактные молекулы различных изотипов, а также фрагменты с антигенсвязывающей способностью, например, Fab', F(ab')2, Fab, Fv и rIgG. См., например, Pierce Catalog and Handbook, 1994-1995 (Pierce Chemical Co., Rockford, Ill.); Kuby, J., Immunology, 3rd Ed., W.H. Freeman & Co., New York (1998), содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей. Понятие также включает рекомбинантные одноцепочечные Fv фрагменты (scFv). Понятие дополнительно охватывает бивалентные или биспецифичные молекулы, диатела, триатела и тетратела. Двухвалентные и биспецифичные молекулы описаны в, например, Kostelny и др. (1992) J. Immunol. 148:1547; Pack and Pluckthun (1992) Biochemistry 31:1579; Hollinger и др., 1993, Proc Natl Acad Sci U S A. 1993 Jul 15; 90(14):6444-8; Gruber и др., (1994) J. Immunol. 5368; Zhu и др., (1997) Protein Sci 6:781; Hu и др., (1996) Cancer Res. 56:3055, содержание которых включено в данное описание посредством ссылки во всей своей полноте для любых целей. Понятие антитело также охватывает, например, человеческие антитела, гуманизированные антитела и химерные антитела.
"Химерное антитело" представляет собой молекулу иммуноглобулина, в которой (a) константная область или ее часть переделана, заменена или обменена таким образом, что антигенсвязывающий участок (вариабельный участок) связан с константной областью другого или измененного класса, эффекторной функцией и/или видами или совершенно другой молекулой, придающей новые свойства химерному антителу, например, фермент, токсин, гормон, фактор роста, лекарство и т.п.; или (б) вариабельный участок или его часть переделан, заменен или обменен с вариабельным участком, имеющим другую или переделанную антигенную специфичность.
"Гуманизированное антитело" представляет собой молекулу иммуноглобулина, которая содержит минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Гуманизированные антитела включают в себя иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области (CDR) реципиента заменены остатками из CDR от не относящихся к человеку видов (донорское антитело), таких как мышь, крыса или кролик, обладающих желаемой специфичностью, аффинностью и функциональной активностью. В некоторых случаях каркасные остатки Fv иммуноглобулина человека заменены соответствующими не принадлежащими человеку остатками. Гуманизированные антитела могут также содержать остатки, которые не обнаруживаются ни в антителе-реципиенте, ни в импортируемых CDR или каркасных последовательностях. Как правило, гуманизированное антитело будет содержать по существу все из одного, а обычно двух вариабельных доменов, в которых все или все по существу области CDR соответствуют такому нечеловеческому иммуноглобулину, а все или по существу все каркасные (FR) области являются той самой консенсусной последовательностью человеческого иммуноглобулина. В оптимальном варианте гуманизированное антитело также будет содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), типичной для человеческого иммуноглобулина (Jones и др., Nature 321:522-525 (1986); Riechmann и др., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992), содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Гуманизация может быть выполнена по методу Винтера и его соавторов (Jones и др., Nature 321:522-525 (1986); Riechmann и др., Nature 332:323-327 (1988); и Verhoeyen др., Science 239:1534-1536 (1988), содержание которых включено в данное описание посредством ссылки во всей своей полноте для любых целей), путем замены CDR грызунов или последовательностей CDR для соответствующих последовательностей антитела человека. Соответственно, такие гуманизированные антитела являются химерными антителами (U.S. патент № 4816567, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей), где, как минимум, интактный человеческий вариабельный домен был заменен соответствующей последовательностью из нечеловеческих видов.
В данном контексте понятие "особым образом связывается" относится к молекуле (например, целевому фрагменту), которая связывается с конкретной целью (например, маркер или рецептор клеточной поверхности), которая, по меньшей мере, обладает в 2 раза большей аффинностью по сравнению с нецелевой молекулой. В некоторых воплощениях молекула особым образом связывается с нецелевой молекулой, которая обладает, по меньшей мере в 3, 4, 5, 6, 7, 8, 9, 10, 25, 50, 100, 500, 1000, 5000, 10000 раз или большей аффинностью по сравнению с нецелевой молекулой.
В данном контексте понятие "иммунные клетки" относится к клеткам, которые имеют гемопоэтическое происхождение и которые играют роль в деле иммунного ответа. К иммунным клеткам относятся лимфоциты, такие как В-клетки и Т-клетки; естественные клетки-киллеры; миелоидные клетки, такие как моноциты, макрофаги, эозинофилы, тучные клетки, базофилы и гранулоциты.
В данном контексте понятие «В-клетка» относится к лимфоциту, полученному в костном мозге большинства млекопитающих, функционирующему в гуморальной иммунной системе. В течение различных этапов развития В-клетки упоминаются как: исходные (или пре-пре) B-клетки; начальные про (или пре-пре)-B-клетки; поздние про (или пре-пре)-B-клетки; большие пре-B-клетки; маленькие пре-B-клетки; незрелые В-клетки; и зрелые В-клетки, каждая из которых охватывается термином В-клетки. Фенотипические маркеры клеточной поверхности, которые можно использовать для дифференциации В-клеток из других лимфоцитов (например, T-клетки): молекулы MHC класса II, CD19 и CD21. Понятие "В-клетка" охватывает В-клетки плазмы, В-клетки памяти, клетки B-1, клетки В-2, В-клетки маргинальной зоны и фолликулярные В-клетки.
В данном контексте понятия "антигенпрезентирующая клетка" и "АПК" являются взаимозаменяемыми и относятся к выделенным антигенпрезентирующим клеткам (например, В-лимфоциты, моноциты, дендритные клетки, клетки Лангерганса), а также другим антигенпрезентирующих клеткам (например, кератиноциты, эндотелиальные клетки, астроциты, фибробласты и олигодендроциты).
В данном контексте понятия "маркер клеточной поверхности", "рецептор клеточной поверхности" и "молекула клеточной поверхности" относятся к антигенной структуре, присутствующей на поверхности клетки. Антигеном клеточной поверхности может быть, но не ограничивается лишь ими: клетка-специфический антиген, иммунная клетка-специфический антиген, В-клетка-специфический антиген, антигенпрезентирующая клетка-специфический антиген, лимфоцит-специфический антиген, антиген, связанный с рассеянным склерозом, рецептор (например, рецептор фактора роста), поверхностный эпитоп, антиген, который распознается конкретной иммунологической эффекторной клеткой, такой как Т-клетка, и антиген, который распознается неспецифической иммунологической эффекторной клеткой, такой как макрофагальная клетка или естественная клетка-киллер. Примеры "антигенов клеточной поверхности" включают в себя, но не ограничиваются ими, фенотипические маркеры: естественных киллеров (например, CD16 и CD56); Т-хелперов (например, TCRαβ, CD3 и CD4); Т-супрессоров (например, TCRαβ, CD3 и CD8); Т-клеток γδ (например, TCRγδ и CD3); и B-клеток (MHC класса II, CD 19 и CD21). Молекулы клеточной поверхности могут также включать в себя углеводы, белки, липопротеины, гликопротеины или любые другие молекулы, присутствующие на поверхности интересующей вас клетки.
В данном контексте понятия "основной белок миелина" и "ОБМ" являются взаимозаменяемыми и относятся к белку, кодируемому геном основного миелинового белка человека (ОБМ; Идент. номер гена согласно NCBI: 4155). В состоянии in vivo множественные изоформы протеина ОБМ возникают из альтернативного сплайсинга (см., Harauz и др., Biochemistry, (2009) Sep 1; 48(34):8094-104, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей), каждая из которых охватывается понятием "основной белок миелина”. Выравнивание семи представительных последовательностей ОБМ представлено на фиг.14. В данном контексте нумерация аминокислот пептидов ОБМ указывает на аминокислотную последовательность преобладающей изоформы ОБМ, обнаруженной у зрелого миелина (сплайсинг изоформы 5; Идент. номер согласно UniProt: P02686-5), 18,5 кДа протеин, состоящий из 171 аминокислоты (SEQ ID NO:17).
В данном контексте понятия "рассеянный склероз" и "РС" являются взаимозаменяемыми и относятся к воспалительному заболеванию, при котором жирные миелиновые оболочки вокруг аксонов головного и спинного мозга повреждены и/или истощены, приводя к демиелинизации и рубцеванию, а также широкому спектру признаков и симптомов (см. Compston and Coles, Lancet. 2008 Oct 25; 372(9648):1502-17, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Ряд подтипов классификации РС, включая: рецидивирующе-ремиттирующий (РРРС), вторично-прогрессирующий (ВПРС), первично-прогрессирующий (ППРС) и прогрессивно-рецидивирующий (ПРРС), каждый из которых охватывается термином рассеянный склероз.
В данном контексте понятие "пациент" или "субъект" являются взаимозаменяемыми и относятся к индивидууму, нуждающемуся или обращающемуся за лечением. Например, субъект диагностирован с или подвержен риску развития рассеянного склероза (РС) или его подтипа. Понятие "пациент с рассеянным склерозом" может относиться к человеку, которому был поставлен диагноз РС и который получает лечение в связи с РС, ранее проходил лечение РС или никогда не проходил лечения РС, человек, который подвержен риску рецидива РС, или человек, подверженный риску возникновения РС (например, человек, генетически предрасположенный к РС).
В данном контексте понятия "терапия", "лечение" рассеянного склероза являются взаимозаменяемыми и относятся к любому паллиативному лечению или уменьшению интенсивности нежелательного физиологического или психологического состояния, возникшего вследствие РС. Например, снижение степени тяжести или периодичности: гипестезии; парестезии; мышечной слабости; клонуса; мышечных спазмов; паралича; атаксии; дизартрии; дисфагии; нистагмы; неврита зрительного нерва (например, фосфены или диплопия); усталости; острой или хронической боли; сложности с мочеиспусканием и работой кишечника; когнитивных нарушений; депрессии; симптома Ухтоффа; и признака Лермитта. В одном воплощении Расширенная шкала статуса инвалидности (РСШИ) может использоваться для измерения прогрессирования и степени тяжести заболевания у пациентов с РС (см. Kurtzke JF, Neurology 1983; 33:1444-52, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Соответственно, в одном воплощении понятие "терапия" относится к улучшению РСШИ пациента.
В данном контексте понятия "профилактика" и "профилактическое лечение" рассеянного склероза являются взаимозаменяемыми и относятся к терапевтическим лечениям, которые уменьшают риск, тяжесть или появление клинических симптомов РС. Профилактика может быть как частичной, так и полной. Частичная профилактика может повлечь за собой отсроченное появление или задержку прогрессирования болезненного состояния или симптома у пациента, подверженного риску развития РС или рецидива РС. Хотя никакого строгого причинного генетического компонента РС выявлено не было, были выявлены несколько генетических факторов, скоррелированных с повышенным риском развития рассеянного склероза, включая, без ограничений, ОНП, описанного в статье Hafler DA и др. (N Engl J Med. 2007 Aug 30; 357(9):851-62, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей), таких как rs3135388 (A аллель; ген HLA-DRA), rs12722489 (C аллель; ген IL2RA), rs2104286 (T аллель; ген IL2RA), rs6897932 (C аллель; ген IL7R), rs6498169 (G аллель; KIAA0350), rs6604026 (C аллель; RPL5), rs10984447 (A аллель; ген DBC1), rs12044852 (C аллель; ген CD58), rs7577363 (A аллель; ген ALK), rs7536563 (A аллель; ген FAM69A), rs11164838 (C аллель; ген FAM69A), rs10975200 (G аллель; ген ANKRD15), rs10735781 (G аллель; ген EVI5), rs6680578 (T аллель; ген EVI5), rs4763655 (A аллель; ген KLRB1), rs12487066 (T аллель; ген CBLB), and rs1321172 (C аллель; ген PDE4B).
В данном контексте понятия "доза" и "дозировка" являются взаимозаменяемыми и относятся к количеству активного ингредиента, вводимого в одной точке времени. В контексте настоящего изобретения доза может относиться к количеству пептида ОБМ, вводимого субъекту. Дозировка может также относиться к количеству векторного препарата пептида ОБМ, вводимого субъекту, например, липосомальный препарат одного или комбинации пептидов ОБМ. Дозировка, вводимая пациенту, будет варьироваться в зависимости от ряда факторов, включая частоту введения; степень тяжести состояния (например, рассеянный склероз); подтипа состояния (например, рецидивирующе-ремиттирующий РС, вторично-прогрессирующий РС, первично-прогрессирующий РС и прогрессивный рецидивирующий РС); стадии состояния (например, первый приступ, рецидив и ремиссия); габариты и толерантность субъекта; используемый способ введения; риск развития побочных эффектов; риск неблагоприятных лекарственных взаимодействий; и реакцию на предыдущие лечения, каждый из которых может быть легко определен квалифицированным врачом. Понятие "лекарственная форма" относится к конкретной форме фармацевтического препарата, например, жидкий состав для подкожного введения или гель-препарат для контролируемого высвобождения через депо.
В данном контексте понятия "терапевтически эффективная доза" и "терапевтически эффективное количество" являются взаимозаменяемыми и относятся к дозе, которая производит эффекты, для которых она вводится. Точная доза будет зависеть от цели лечения и будет устанавливаться специалистом в данной области, с использованием известных методик (см., например, Augsburger & Hoag, Pharmaceutical Dosage Forms (vols. 1-3, 3rd Ed. 2008); Lloyd, The Art, Science and Technology of Pharmaceutical Compounding (3rd Ed., 2008); Pickar, Dosage Calculations (8th Ed., 2007); и Remington: The Science and Practice of Pharmacy, 21st Ed., 2005, Gennaro, Ed., Lippincott, Williams & Wilkins).
В данном контексте понятие "фармацевтическая композиция" относится к рецептуре, подходящей для введения субъекту, содержащей терапевтическое средство и, необязательно, один или несколько из указанных ниже: вектор; целевой фрагмент; буферный агент; соль; консервант (например, антиоксидант или антимикробный препарат); осмотический препарат; объемообразующий препарат; и любой другой наполнитель или носитель, пригодный для доставки терапевтического средства посредством определенного способа введения.
В данном контексте понятие "контроль" относится к образцу, уровню или фенотипическому результату, который служит в качестве эталона для сравнения с результатом теста, например, терапевтическая польза, достигнутая за счет конкретного лечения. Понятие контроль охватывает как положительные контроли (например, значения или результаты, ожидаемые для данной терапии), так и отрицательные контроли (например, значения или результат, которых следовало ожидать при отсутствии лечения).
Положительный контроль может относиться к результату, достигнутому путем введения терапевтического средства, которое наверняка обеспечит благоприятное воздействие на болезненное состояние или симптом. Например, результат, достигнутый за счет введения препарата копаксон (Copaxone) субъекту с диагнозом РС или животной модели с РС, может быть использован в качестве положительного контроля для экспериментальной терапии РС. В этом плане, экспериментальная терапия, которая приводит к подобным или лучшим результатам, по сравнению с достигнутым результатом при введении препарата Copaxone, будет рассматриваться в качестве хорошего кандидата для лечения РС.
Отрицательный контроль может относиться к результату, достигнутому при отсутствии лечения болезненного состояния или симптома. Например, введение воды или пустого вектора субъекту с диагнозом РС, или животной модели с РС, можно использовать в качестве отрицательного контроля для экспериментальной терапии РС. В этом плане, экспериментальная терапия, которая приводит к аналогичному результату, достигнутому при помощи отрицательного контроля, не будет рассматриваться в качестве хорошего кандидата для лечения РС. Тогда как экспериментальная терапия, которая приводит к лучшим результатам, по сравнению с результатом, достигнутым при отрицательном контроле, будет рассматриваться в качестве хорошего кандидата для лечения РС.
В данном контексте понятия "молекула нуклеиновой кислоты", "олигонуклеотид" и "полинуклеотид" являются взаимозаменяемыми и относятся к дезоксирибонуклеотиду или рибонуклеотидному полимеру в одноцепочечной или двухцепочечной форме и, если конкретно не указано иное, охватывают полинуклеотиды, содержащие известные аналоги природных нуклеотидов, которые могут функционировать таким же образом, как и природные нуклеотиды. Следует иметь в виду, когда молекула нуклеиновой кислоты представлена последовательностью ДНК, что также включает в себя молекулы РНК, имеющие соответствующую последовательность РНК, в которой “U” (уридин) заменяет “T” (тимидин).
В данном контексте понятия "протеин", "пептид" и "полипептид" используются взаимозаменяемо и относятся к полимеру из четырех или более аминокислотных остатков. Понятия применяются к аминокислотным полимерам, в которых один или более аминокислотных остатков представляют собой искусственный химический аналог соответствующей природной аминокислоты, а также природных аминокислотных полимеров. Понятие "рекомбинантный пептид" относится к пептиду, который получают путем экспрессии нуклеотидной последовательности, кодирующей аминокислотную последовательность пептида из рекомбинантной молекулы ДНК.
В данном контексте понятие "синтетический пептид" относится к пептиду, который получают химическими способами, например, методом жидкофазного или твердофазного синтеза пептида. К синтетическим пептидам относятся полимеры аминокислот, в которых один или более аминокислотных остатков являются искусственным химическим аналогом соответствующей природной аминокислоты, а также природных полимеров аминокислот.
В данном контексте понятие "аминокислота" относится к природным и неприродным аминокислотам, включая аминокислотные аналоги и аминокислотные миметики, которые функционируют подобно встречающимся в природе аминокислотам. Встречающиеся в природе аминокислоты включают в себя те аминокислоты, которые кодируются генетическим кодом, а также те аминокислоты, которые впоследствии модифицированы, например, гидроксипролин, γ-карбоксиглутамат, O-фосфосерин, 5-гидрокситриптофан, лантионин. Встречающиеся в природе аминокислоты могут включать в себя, например, D- и L-аминокислоты. Аминокислоты, используемые в данном документе, могут также включать в себя неприродные аминокислоты. Понятие "аминокислотные аналоги" относится к соединениям, которые имеют такую же основную химическую структуру, что и у встречающейся в природе аминокислоты, т.е. любой атом углерода, который связан с водородом, карбоксильной группой, аминогруппой и R группой, например, гомосерин, норлейцин, метионинсульфоксид или метионин метил сульфоний. Такие аналоги имеют модифицированные R группы (например, норлейцин) или модифицированные пептидные остовы, но при этом они сохраняют ту же самую основную химическую структуру, что и у встречающейся в природе аминокислоте. Аминокислотные миметики относятся к химическим соединениям, которые имеют структуру, отличающуюся от общей химической структуры аминокислоты, но которая функционирует подобно природной аминокислоте. Аминокислоты могут обозначаться в данном документе в виде широко известных трехбуквенных символов, либо с помощью однобуквенных символик, рекомендованных Комиссией по биохимической номенклатуре ИЮПАК Международного биохимического союза (IUPAC-IUB).
Что касается аминокислотных последовательностей, рядовой специалист в данной области поймет, что это отдельные замены, делеции или добавки к нуклеиновой кислоте или пептидной последовательности, которая изменяет, добавляет или удаляет единичную аминокислоту или небольшой процент аминокислот в кодируемой последовательности, представляют собой "консервативно модифицированный вариант", где результаты внесения изменения в замещения аминокислоты с химически подобных аминокислот. Таблицы консервативных замен, предоставляющие функционально подобные аминокислоты, хорошо известны в данной области науки. Такие консервативно модифицированные варианты являются лишь дополнительными и не исключают полиморфные варианты, межвидовые гомологи и аллелей изобретения.
Каждая из следующих восьми групп содержит аминокислоты, которые являются консервативными заменами друг для друга: 1) аланин (A), глицин (G); 2) аспарагиновая кислота (D), глутаминовая кислота (E); 3) аспарагин (N), глутамин (Q); 4) аргинин (R), лизин (K); 5) изолейцин (I), лейцин (L), метионин (M), валин (V); 6) фенилаланин (F), тирозин (Y), триптофан (W); 7) серин (S), треонин (T); и 8) цистеин (C), метионин (M). См., например, Creighton, Proteins (1984).
В данном контексте понятия "идентичен" и "идентичность", используемые в отношении двух или более полинуклеотидных последовательностей или двух или более полипептидных последовательностей, относятся к остаткам в последовательностях, которые являются одинаковыми при выравнивании для достижения максимального соответствия. Когда процент идентичности последовательностей используется в качестве ссылки на пептид, следует понимать, что одна или несколько остаточных позиций, которые иначе не могут быть идентичны, могут отличаться от консервативной аминокислотной замены, в которой первый аминокислотный остаток замещен другим аминокислотным остатком, имеющим сходные химические свойства, такие как аналогичный заряд или гидрофобный или гидрофильный характер, и, следовательно, существенно не меняет функциональные свойства пептида. Когда пептидные последовательности различаются по консервативным заменам, процент идентичности последовательности может быть скорректирован вверх для исправления консервативного характера замены. Подобная корректировка может быть сделана с использованием хорошо известных методов, например, определяя консервативную замену в качестве частичного, а не полного несоответствия, тем самым увеличивая процент идентичности последовательности. Так, например, если идентичные аминокислоты получают 1 балл, а неконсервативная замена получает ноль баллов, консервативной замене присваивается балл от нуля до 1. Подсчет баллов консервативных замен можно рассчитать с помощью любого хорошо известного алгоритма (см., например, Meyers and Miller, Comp. Appl. Biol. Sci. 4:11-17, 1988; Smith and Waterman, Adv. Appl. Math. 2:482, 1981; Needleman and Wunsch, J. Mol. Biol. 48:443, 1970; Pearson and Lipman, Proc. Natl. Акад. наук., США 85:2444 (1988); Хиггинс и Шарп, Ген 73:237-244, 1988; Хиггинс и Шарп, CABIOS 5:151-153; 1989; Корпет и соавт., Ядер. остатки кислот. 16:10881-10890, 1988; Хуанг и соавт., Комп. Приклад. биол. наук. 8:155-165, 1992; Пирсон и соавт., Мет. Мол. Биол., 24:307-331, 1994). Выверка также может быть выполнена путем простого визуального осмотра и ручного выравнивания последовательностей.
Следует иметь в виду, что отдельные замены, деления или добавления, которые изменяют, добавляют или убирают одну аминокислоту или небольшой процент аминокислот (например, менее 15%, менее 10% или менее 5%) в пептидной последовательности, могут рассматриваться в качестве консервативно модифицированных вариаций, предоставляющих альтернативные результаты при замещении аминокислоты химически подобной аминокислотой.
Консервативные аминокислотные замены, обеспечивающие функционально аналогичные аминокислоты, хорошо известны в данной области. В зависимости от функциональности конкретной аминокислоты, например, каталитически важной, структурно важной, стерически важной, различные группирования аминокислоты могут быть рассмотрены в качестве консервативных замен друг для друга. В таблице 1 представлены группирования аминокислот, рассматриваемых в качестве консервативных замен на основе заряда и полярности аминокислоты, гидрофобность аминокислоты, поверхностное обножение/структурная природа аминокислоты и склонность вторичной структуры аминокислоты.
Две или более аминокислотных последовательностей или две или более нуклеотидных последовательностей считаются "идентичными по существу", если аминокислотные последовательности или нуклеотидные последовательности разделяют идентичность последовательности, по меньшей мере, на 60% друг с другом или с эталонной последовательностью в течение заданного окна сравнения. Таким образом, идентичные по существу последовательности включают в себя те, которые имеют, например, по меньшей мере, 60% идентичность последовательности, по меньшей мере, 65% идентичность последовательности, по меньшей мере, 70% идентичность последовательности, по меньшей мере, 75% гомологию последовательности, по меньшей мере, 80% гомологию последовательности, по меньшей мере, 85% идентичность последовательности, по меньшей мере, 90% идентичность последовательности, по меньшей мере, 95% идентичность последовательности или, по меньшей мере, 99% идентичность последовательности. В определенных воплощениях идентичные по существу последовательности будет иметь, по меньшей мере, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности. В одном воплощении последовательности разделяют 60%-95% идентичность последовательности. В другом воплощении последовательности разделяют 65%-90% идентичность последовательности. В другом воплощении последовательности разделяют 70%-85% идентичность последовательности. В еще других воплощениях последовательности разделяют 65%-95% идентичность последовательности, 70%-95% идентичность последовательности, 75%-95% идентичность последовательности, 80%-95% идентичность последовательности, 85%-95% идентичность последовательности или 90%-95% идентичность последовательности.
В определенных воплощениях два полипептида будут рассмотрены идентичными по существу, если они разделяют идентичные или почти идентичные сердцевинные пептидные последовательности, которые являются эффективными для обеспечения терапевтической пользы. Например, если первая сердцевинная пептидная последовательность обеспечивает терапевтическую пользу вне зависимости от наличия дополнительных аминокислот, расположенных выше по потоку (т.е. N-терминальные по отношению к сердцевинной последовательности) или ниже по потоку (т.е. С-терминальные по отношению к сердцевинной последовательности), полипептид, содержащий вторую сердцевинную пептидную последовательность, которая разделяет, по меньшей мере, 80% идентичность с первой сердцевинной пептидной последовательностью, может рассматриваться по существу идентичным. Данное утверждение считается справедливым даже тогда, когда полипептидная последовательность целиком не разделяет, по меньшей мере, 80% идентичность с эталонной последовательностью. Например, два терапевтических полипептида, имеющих следующие аминокислотные последовательности: (R1)a-P1-(R2)b и (R3)c-P2-(R4)d, могут рассматриваться идентичными по существу, если (i) P1 и P2 идентичны, по меньшей мере, на 80%, а (ii) P1 и P2 являются достаточными для обеспечения терапевтической пользы субъекту, нуждающемуся в этом, независимо от аминокислотных последовательностей R1, R2, R3 и R4.
В определенных воплощениях, идентичные по существу сердцевинные пептидные последовательности будут разделять, по меньшей мере, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности. В конкретном воплощении сердцевинные пептидные последовательности разделят, по меньшей мере, 85% идентичность последовательности (т.е. 85%-100% идентичность). В другом воплощении сердцевинные пептидные последовательности разделят, по меньшей мере, 90% идентичность последовательности (т.е. 90%-100% идентичность). В другом воплощении сердцевинные пептидные последовательности разделят, по меньшей мере, 95% идентичность последовательности (т.е. 95%-100% идентичность). В еще других воплощениях сердцевинные пептидные последовательности разделят 100% идентичность последовательности, независимо от общей идентичности последовательности двух сравниваемых полипептидов. В одном воплощении сердцевинные пептидные последовательности разделяют 60%-95% идентичность последовательности. В другом воплощении сердцевинные пептидные последовательности разделяют 65%-90% идентичность последовательности. В другом воплощении сердцевинные пептидные последовательности разделяют 70%-85% идентичность последовательности. В еще других воплощениях сердцевинные пептидные последовательности разделяют 65%-95% идентичность последовательности, 70%-95% идентичность последовательности, 75%-95% идентичность последовательности, 80%-95% идентичность последовательности, 85%-95% идентичность последовательности или 90%-95% идентичность последовательности.
В данном контексте термин "окно сравнения" относится к смежному участку аминокислот или нуклеотидов, по которому последовательность из двух полипептидов или полинуклеотидов сравнивается на идентичность или подобие последовательности. Применительно к терапевтическим пептидам, окно сравнения может состоять приблизительно из 5-50 аминокислот в длину. В одном воплощении окно сравнения может состоять приблизительно из 5-25 аминокислот в длину. В еще одном воплощении окно сравнения может состоять приблизительно из 10-20 аминокислот в длину. В зависимости от факторов, таких как длина сравниваемых полипептидов, окно сравнения может состоять, например, из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более аминокислот в длину. В частном воплощении, окном сравнения является вся длина эталонной аминокислотной последовательности.
Выравнивание последовательностей может осуществляться, например, с помощью алгоритма локальной гомологии Смита и Ватермана (Smith and Waterman) (1981) Adv. Appl. Math. 2: 482, по алгоритму выравнивания по гомологии Нидлемана и Вунша (Needleman and Wunsch) (1970) J. Mol. Biol. 48: 443, путем поиска для метода подобия Пирсона и Липмана (Pearson and Lipman) (1988) Proc. Нац. Акад. Наук. (США) 85: 2444, путем компьютеризированных внедрений этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA, представленные в Wisconsin Genetics Software Package Release 7.0, Genetics Computer Group, 575 Science Dr., Madison, Wis.), или путем проверки и наилучшего выравнивания (т.е. приводит к самому высокому проценту гомологии в окне сравнения), сгенерированного различными выбранными способами. BLAST-алгоритм прекрасно подходит для определения процента идентичности последовательности и сходства последовательности (Altschul и др., J Mol. 215:403-410, (1990), раскрытие которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Некоторые ПО, включающие BLAST-алгоритм, находятся в публичном доступе на сайте "Национального центра биотехнологической информации" (NCBI). Данные программы включают в себя следующие ПО: blastp, blastn, blastx, tblastn, tblastx и PSI-blast.
III. Пептиды ОБМ
А. Введение
Согласно одному из аспектов, настоящее изобретение предлагает нам пептиды основного белка миелина (ОБМ), пригодные для лечения или предотвращения рецидива рассеянного склероза (РС). Как показано на фиг.1C, две иммунодоминантные области ОБМ были определены у модели ЭАЭ-индуцированных крыс линии DA с РС, которая соотносится с иммунологическим ответом на ОБМ у пациентов с диагнозом рецидивирующе-ремиттирующий рассеянный склероз (РРРС): ОБМ (43-64) или ОБМ (115-170). Было обнаружено, что поликлональные IgG аутоантитела в этих областях были сгенерированы у модели ЭАЭ-индуцированных крыс линии DA (фиг.2), предполагая, что эти области содержат B-клеточные эпитопы, важные для изучения патологии РС. Таким образом, пептиды, частично или полностью содержащие эти области, могут быть пригодны для лечения или профилактики РС. В конкретном воплощении пептид ОБМ содержит В-клеточный эпитоп.
В одном аспекте настоящего изобретения пептиды, содержащие аминокислотные последовательности, идентичные или по существу идентичные для выявленных иммунодоминантных областей ОБМ, предназначены для лечения РС. В конкретном воплощении пептиды ОБМ, содержащие, по меньшей мере, 6 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12), предназначены для лечения РС. Как правило, пептид ОБМ будет состоять из 6-100 аминокислот в длину. В одном воплощении этот пептид ОБМ будет состоять из 6-50 аминокислот в длину. В другом воплощении этот пептид ОБМ будет состоять из 6-25 аминокислот в длину. В других вариантах воплощения пептид ОБМ будет состоять примерно из 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 или более аминокислот. В конкретном воплощении пептид ОБМ состоит из 6-40 аминокислот в длину.
В одном воплощении пептид ОБМ содержит, по крайней мере, 10 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В другом воплощении пептид ОБМ содержит, по крайней мере, 15 последовательных аминокислот ОБМ(43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В других воплощениях пептид ОБМ содержит, по крайней мере, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или 22 последовательных аминокислоты ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В еще одних воплощениях пептид ОБМ содержит, по крайней мере, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40 или более последовательных аминокислот ОБМ (115-170) (SEQ ID NO:12). В одном воплощении пептид ОБМ связан с вектором, который может как включать, так и не включать в себя целевую часть. В конкретном воплощении вектор является липосомой. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В еще одном аспекте пептид ОБМ содержит 6-25 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В другом воплощении пептид ОБМ содержит 10-20 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В другом воплощении пептид ОБМ содержит 6-40, 6-35, 6-30 или 6-20 последовательных аминокислот ОБМ (115-170) (SEQ ID NO:12). В еще одних воплощениях пептид ОБМ содержит 6-20, 6-18, 6-16, 6-14, 6-12, 6-10 или 6-8 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В одном воплощении пептиды ОБМ связаны с вектором. В конкретном воплощении вектор является липосомой. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В конкретном воплощении пептид ОБМ заключает в себе следующую последовательность: GGDRGAPKRGSGKDSHH (ОБМ (46-62); SEQ ID NO:1). В одном воплощении пептиды ОБМ (46-62) связаны с вектором. В конкретном воплощении вектор является липосомой. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В другом конкретном воплощении пептиды ОБМ заключают в себе следующую последовательность: GFGYGGRASDYKSAHK (ОБМ (124-139); SEQ ID NO:2). В одном воплощении пептиды ОБМ (124-139) связаны с вектором. В конкретном воплощении вектор является липосомой. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В другом конкретном воплощении пептиды ОБМ заключают в себе следующую последовательность: QGTLSKIFKLGGRDSRSGSPMARR (ОБМ (147-170); SEQ ID NO:3). В одном воплощении пептиды ОБМ (147-170) связаны с вектором. В конкретном воплощении вектор является липосомой. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В. Аминокислотные замены
Пептиды МВР, представленные здесь, могут дополнительно содержать одну или более аминокислотных замен по отношению к последовательности ОБМ дикого типа (SEQ ID NO:17). В одном воплощении аминокислотная замена представляет собой консервативную аминокислотную замену. Например, аминокислоты, имеющие аналогичные гидрофобности (например, Leu и Ile), могут быть легко заменены друг другом. В таблице 1 представлены группирования аминокислот, рассматриваемых в качестве консервативных замен на основе заряда и полярности аминокислоты, гидрофобности аминокислоты, поверхностного обнажения/структурной природы аминокислоты и склонность вторичной структуры аминокислоты. В другом воплощении аминокислотная замена не является консервативной аминокислотной заменой.
В одном воплощении пептид ОБМ включает в себя аминокислотную последовательность, имеющую, по меньшей мере, 80%-идентичность последовательности по отношению к пептидной последовательности, по меньшей мере, 6 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, имеющую, по меньшей мере, 85%-идентичность последовательности по отношению к пептидной последовательности, по меньшей мере, 6 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, имеющую, по меньшей мере, 90%-идентичность последовательности по отношению к пептидной последовательности, по меньшей мере, 6 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, имеющую, по меньшей мере, 95%-идентичность последовательности по отношению к пептидной последовательности, по меньшей мере, 6 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). В еще одном воплощении пептид ОБМ включает в себя аминокислотную последовательность, имеющую, по меньшей мере, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-идентичность последовательности по отношению к пептидной последовательности, по меньшей мере, 6 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12).
В конкретном воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 80%-идентичность последовательности с SEQ ID NO:1. В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 85%-идентичность последовательности с SEQ ID NO:1. В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 90%-идентичность последовательности с SEQ ID NO:1. В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 95%-идентичность последовательности с SEQ ID NO:1. В еще одном воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-идентичность последовательности с SEQ ID NO:1.
В конкретном воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 80%-идентичность последовательности с SEQ ID NO:2. В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 85%-идентичность последовательности с SEQ ID NO:2. В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 90%-идентичность последовательности с SEQ ID NO:2. В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 95%-идентичность последовательности с SEQ ID NO:2. В еще одном воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-идентичность последовательности с SEQ ID NO:2.
В конкретном воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 80%-идентичность последовательности с SEQ ID NO:3. В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 85%-идентичность последовательности с SEQ ID NO:3. В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 90%-идентичность последовательности с SEQ ID NO:3. В другом воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 95%-идентичность последовательности с SEQ ID NO:3. В еще одном воплощении пептид ОБМ включает в себя аминокислотную последовательность, которая имеет, по меньшей мере, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-идентичность последовательности с SEQ ID NO:3.
С. Фланкирующие области пептида
Антигенпрезентирующие клетки (АПК), такие как В-клеточные лимфоциты, дендритные клетки и макрофаги, стимулируют иммунное реагирование путем интернализации, обработки и представления обработанного чужеродного тела (например, в ответ на патогенную инфекцию) или собственных (например, при аутоиммунном заболевании) антигенов с тем, чтобы стимулировать различные типы Т-клеток. Не опираясь на какую-либо теорию, поскольку АРК способны путем интернализации и обработки больших антигенов в меньшие антигенные пептиды, признанных Т-клеточным механизмом, пептид ОБМ, описанный здесь как содержащий, по меньшей мере, 6 последовательных аминокислот ОБМ (43-64) или ОБМ (115-170), может иметь дополнительные аминокислоты на N- и или С-конце, т.е. фланкирующие остатки.
Фланкирующие остатки ОБМ могут включать природные фланкирующие области, присутствующие в диком типе белка ОБМ (например, аминокислотный N-конец к 43 и 115 остаткам ОБМ и/или аминокислотный С-конец к 64 и 170 остаткам ОБМ), или, в качестве альтернативы, могут содержать экзогенную или случайную последовательность. В одном воплощении N- и/или С-конечные фланкирующие остатки могут придавать благотворное свойство пептиду ОБМ. Например, фланкирующие аминокислотные остатки могут стабилизировать пептид; направлять пептид к определенному внутриклеточному или внеклеточному местоположению; улучшать нагружающие свойства вектора пептида; или улучшать или непосредственно обрабатывать, или представлять антиген в иммунной клетке (например, B-клетке или АПК).
В одном воплощении пептид ОБМ дополнительно содержит от 1 до 50 дополнительных аминокислот на N- и/или C-конце пептида. В другом воплощении пептид ОБМ дополнительно содержит от 1 до 25 дополнительных аминокислот на N- и/или C-конце пептида. В другом воплощении пептид ОБМ дополнительно содержит от 1 до 10 дополнительных аминокислот на N- и/или C-конце пептида. В еще одних воплощениях пептид ОБМ дополнительно содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более дополнительных аминокислот на N- и/или C-конце пептида.
В конкретном воплощении пептид ОБМ, содержащий последовательность GGDRGAPKRGSGKDSHH (ОБМ (46-62); SEQ ID NO:1), дополнительно содержит от 1 до 50 дополнительных аминокислот на N- и/или C-конце пептида. В другом воплощении пептид ОБМ (46-62) дополнительно содержит от 1 до 25 дополнительных аминокислот на N- и/или C-конце пептида. В другом воплощении пептид ОБМ (46-62) дополнительно содержит от 1 до 10 дополнительных аминокислот на N- и/или C-конце пептида. В еще одних воплощениях пептид ОБМ (46-62) дополнительно содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более дополнительных аминокислот на N- и/или C-конце пептида.
В конкретном воплощении пептид ОБМ, содержащий последовательность GFGYGGRASDYKSAHK (ОБМ (124-139); SEQ ID NO:2), дополнительно содержит от 1 до 50 дополнительных аминокислот на N- и/или C-конце пептида. В другом воплощении пептид ОБМ (124-139) дополнительно содержит от 1 до 25 дополнительных аминокислот на N- и/или C-конце пептида. В другом воплощении пептид ОБМ (124-139) дополнительно содержит от 1 до 10 дополнительных аминокислот на N- и/или C-конце пептида. В еще одних воплощениях пептид ОБМ (124-139) дополнительно содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более дополнительных аминокислот на N- и/или C-конце пептида.
В конкретном воплощении пептид ОБМ, содержащий последовательность QGTLSKIFKLGGRDSRSGSPMARR (ОБМ (147-170); SEQ ID NO:3), дополнительно содержит от 1 до 50 дополнительных аминокислот на N- и/или C-конце пептида. В другом воплощении пептид ОБМ (147-170) дополнительно содержит от 1 до 25 дополнительных аминокислот на N- и/или C-конце пептида. В другом воплощении пептид ОБМ (147-170) дополнительно содержит от 1 до 10 дополнительных аминокислот на N- и/или C-конце пептида. В еще одних воплощениях пептид ОБМ (147-170) дополнительно содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более дополнительных аминокислот на N- и/или C-конце пептида.
Согласно данному документу пептид ОБМ может быть описан с точки зрения сердцевинной пептидной последовательности (Px), возможной N-концевой фланкирующей последовательности (Rn) и возможной C-концевой фланкирующей последовательности (Rc). В определенных воплощениях общее количество аминокислот на Px, Rn и Rc участках пептида ОБМ составляет менее 250. В другом воплощении общее количество аминокислот составляет менее 100. В другом воплощении общее количество аминокислот составляет менее 50. В еще одних воплощениях общее количество аминокислот составляет менее 250, 240, 230, 220, 210, 200, 190, 180, 170, 160, 150, 145, 140, 135, 130, 125, 120, 115, 110, 105, 100, 99, 98, 97, 96, 95, 94, 93, 92, 91, 90, 89, 88, 87, 86, 85, 84, 83, 82, 81, 80, 79, 78, 77, 76, 75, 74, 73, 72, 71, 70, 69, 68, 67, 66, 65, 64, 63, 62, 61, 60, 59, 58, 57, 56, 55, 54, 53, 52, 51, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8 или 7. В одном воплощении общее количество аминокислот составляет 6-250 единиц. В другом воплощении общее количество аминокислот составляет 6-100 единиц. В другом воплощении общее количество аминокислот составляет 6-50 единиц. В еще одних воплощениях общее количество аминокислот составляет 10-250, 10-100, 10-50, 15-250, 15-200, 15-175, 15-150, 15-125, 15-100, 15-90, 15-80, 15-75, 15-70, 15-65, 15-60, 15-55, 15-50, 15-45, 15-40, 15-35, 15-30, 15-25 или 15-20 единиц.
В одном воплощении сердцевинная пептидная последовательность (Px) имеет аминокислотную последовательность, идентичную или идентичную по существу, по меньшей мере, 6 последовательным аминокислотам ОБМ (43-64) или ОБМ (115-170), и предпочтительно, по меньшей мере, 6 последовательным аминокислотам ОБМ (46-62), ОБМ (124-139) или ОБМ (147-170). В конкретных воплощениях Px имеет аминокислотную последовательность, которая, по меньшей мере, на 60%, 65, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична одной из последовательностей SEQ ID NO:1-3.
В одном воплощении Rn и Rc по отдельности имеют от 1 до 250 аминокислот. В частном воплощении комбинация Rn и Rc имеет от 1 до 250 аминокислот. В одном воплощении пептид ОБМ имеет и N-концевую фланкирующую область (Rn), и C-концевую фланкирующую область (Rc). В другом воплощении пептид ОБМ имеет и N-концевую фланкирующую область (Rn), но не имеет C-концевую фланкирующую область (Rc). В другом воплощении пептид ОБМ имеет и C-концевую фланкирующую область (Rc), но не имеет N-концевую фланкирующую область (Rn).
D. Синтез пептидов
Пептид ОБМ, раскрытый здесь, может быть синтезирован любым подходящим способом, например, путем твердофазного синтеза, в том числе путем твердофазного синтеза пептидов. Обычные твердофазные методы синтеза пептидов могут начинаться с ангидридов N-альфа-защищенной аминокислоты, подготовленных в кристаллической форме или непосредственно в растворе, и используются для последовательного присоединения аминокислоты на N-конец. При каждом прибавлении остатка наращиваемый пептид (на твердой подложке) обрабатывают кислотой для удаления N-альфа-защитной группы, промывают несколько раз, чтобы удалить остаточную кислоту, и способствуют доступности пептидного конца к реакционной среде. Пептид затем подвергают реакции с активированным N-защищенным аминокислотой симметричным ангидридом, а твердый носитель промывают. На каждом этапе добавления остатка, реакция присоединения аминокислоты может быть повторена в общей сложности в виде двух или трех отдельных реакций присоединения, чтобы увеличить процент наращиваемых пептидных молекул, которые вступают в реакцию. Как правило, используется 1 или 2 цикла реакции в течение первых двенадцати добавлений остатка, и 2 или 3 цикла реакции для остальных остатков.
По завершении цепей наращиваемого пептида, защищенный твердый пептид обрабатывают сильной кислотой, такой как жидкая фтористоводородная кислота или трифторуксусная кислота, чтобы разблокировать и освободить пептиды от подложки. Для приготовления амидированного пептида выбирается смола-носитель, используемая в синтезе, для подачи С-концевой амида, после расщепления пептида от смолы. После удаления сильной кислотой, пептид может быть извлечен и помещен в раствор 1 М уксусной кислоты, а затем лиофилизирован. Пептид может быть выделен путем первоначального разделения методом гель-фильтрации, что позволит удалить пептидные димеры и полимеры с более высокой молекулярной массой, а также удалить нежелательные соли. Частично очищенный пептид может быть дополнительно очищен методом препаративной ЖХВД хроматографии, и чистота и идентичность пептида подтверждается анализом состава аминокислоты, масс-спектрометрией и методом аналитического ЖХВР (например, в двух различных системах растворителей).
Аналогичным образом, пептиды ОБМ, раскрытые здесь, могут быть получены методом экспрессии в подходящей клетке-хозяине, с последующей очисткой от клеточной культуры. В данной области науки известно большое множество систем для осуществления экспрессии пептидов. Примеры подходящих штаммов-хозяев включают в себя, но не ограничиваются ими: грибковые или дрожжевые виды, такие как Aspergillus, Trichoderma, Saccharomyces, Pichia, Candida и Hansenula; виды бактерий, такие как Salmonella, Bacillus, Acinetobacter, Rhodococcus, Streptomyces, Escherichia, Pseudomonas, Methylomonas, Methylobacter, Alcaligenes, Synechocystis, Anabaena, Thiobacillus, Methanobacterium, Klebsiella, Burkholderia, Sphingomonas, Brevibacterium, Corynebacterium, Mycobacterium, Arthrobacter, Nocardia, Actinomyces и Comamonas; клетки млекопитающих, такие как линии клеток человека, линии клеток хомяков и грызунов; а также линии клеток насекомых, такие как экспрессионные системы на основе бакуловируса.
IV. Векторы пептидов ОБМ
А. Введение
Пептиды ОБМ по настоящему изобретению связаны с вектором для их введения нуждающемуся субъекту исследования. Выбор соответствующего вектора будет основан на многих факторах, таких как особенности используемого пути введения; дозировка поставляемого пептида; частота приемки дозы; эффективность предыдущих процедур; тяжесть заболевания или симптома, подлежащего лечению; и текущая стадия заболевания у субъекта.
Грузовой пептид ОБМ может быть связан с вектором, как ковалентным, так и нековалентным образом. Например, пептид ОБМ может быть связаны с вектором посредством ковалентной связи, ионной связи, электростатических взаимодействий, гидрофобного взаимодействия, силы Ван-дер-Ваальса, встроенной в, привязанной к или физически захваченной вектором.
В одном воплощении вектор, связанный с пептидом ОБМ, представляет собой наночастицу. Безграничные примеры наночастиц включают в себя липосомы, мицеллы, блок-сополимерные мицеллы; полимерсомы; ниосомы; нанопузырьки с липидным покрытием; дендримеры; металлические частицы (например, частицы оксида железа или частицы золота); и частицы кремнезема. Пептидный груз может быть инкапсулирован в пределах, встроен в, производится на поверхности или привязан к вектору наночастиц.
Использование наночастиц для доставки терапевтического средства обеспечивает ряд преимуществ по сравнению с введением одного только терапевтического средства. Например, наночастицы могут использоваться для защиты лабильных терапевтических средств, таких как природные пептидыов или полинуклеотиды, от внутриклеточного и/или внеклеточного инсульта. Наночастицы могут также воздействовать на уменьшение или устранение токсических воздействий, вызванных терапевтическим средством. Таким образом, более высокие дозы потенциально вредного или токсичного терапевтического средства могут быть доставлены через состав с наночастицами.
Для увеличения полужизни в сыворотке липосомы наночастицы можно связать с водорастворимыми или высокомолекулярными неиммуногенными полимерами (например, см. U.S. патенты №№ 5013556, 5676971 и 6132763, содержание которых включено в данное описание посредством ссылки во всей своей полноте для любых целей). Безграничные примеры наночастиц подходящих водорастворимых полимеров включают в себя: поли (алкиленгликоли), такие как полиэтиленгликоль (ПЭГ), поли(пропиленгликоль) (ППГ), сополимеры этиленгликоля и пропиленгликоля и подобные им, поли(оксиэтилированный полиол), поли(олефиновый спирт), поли(винилпирролидон), поли(гидроксиалкилметакриламид), поли(гидроксиалкилметакрилат), поли(сахариды), поли(α-гидрокси кислота), поли(виниловый спирт), полифосфазен, полиоксазолин, поли(N-акрилоилморфолин), поли(алкиленоксид) полимеров, поли(малеиновая кислота), поли(DL-аланин), полисахариды, такие как полисиаловая кислота или карбоксиметилцеллюлоза, декстран, крахмал или производные крахмала, такие как гидроксиэтилкрахмал (ГЭК), гиалуроновая кислота и хитин, поли(мет)акрилаты и комбинации любых из вышеперечисленных.
В отдельных воплощениях вектор пептида ОБМ связан с целевым фрагментом. В других воплощениях вектор, связанный с пептидом ОБМ, представляет собой целевой фрагмент. В конкретном воплощении целевой фрагмент (i) увеличивает доставку пептида ОБМ к клетке (например, иммунной клетке), по сравнению с пептидом ОБМ, не связанным с целевым фрагментом; и/или (ii) увеличивает потребление пептида ОБМ в клетке (например, иммунной клетке), по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В конкретном воплощении целевой фрагмент особым образом связывается с классом или типом клеток, например, с иммунными клетками, содержащими определенный антиген клеточной поверхности.
В. Липосомы
В конкретном воплощении вектор пептида ОБМ представляет собой липосому. Применение липосом для доставки терапевтических средств хорошо известно в данной области (для ознакомления см. Chrai, R. Murari, and I. Ahmad. Liposomes (a review). Part two: Drug delivery systems. BioPharm. 15(1):40,42-43,49 (2002), содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Примеры липосомальных композиций включают в себя американские патенты за №№ 4983397, 6476068, 5834012, 5756069, 6387397, 5534241, 4789633, 4925661, 6153596, 6057299, 5648478, 6723338 и 6627218; заявки на патент в США номера публикаций 2003/0224037, 2004/0022842, 2001/0033860, 2003/0072794, 2003/0082228, 2003/0212031, 2003/0203865, 2004/0142025 и 2004/0071768; международные публикации патента: WO 00/74646, WO 96/13250 и WO 98/33481; Papahadjopolulos D. и др. (Proc Natl Acad Sci U.S.A. (1991) 88: 11460-11464), Allen and Martin (Semin Oncol (2004) 31: 5-15 (suppl 13)), и Weissig и сооавт. (Pharm. Res. (1998) 15: 1552-1556), содержание которых включены в данное описание посредством ссылки во всей своей полноте для любых целей.
В некоторых воплощениях липосома включает фосфолипид, например, фосфатидилхолин. Фосфолипид может быть природными, полусинтетическим или синтетическим. В некоторых воплощениях фосфолипид представляет собой не встречающейся в природе фосфатидилхолин. В некоторых воплощениях фосфолипид - катионный. В других воплощениях фосфолипид - анионный. В еще других воплощениях фосфолипид нейтрален. Иллюстративные фосфолипиды включают в себя, но не ограничиваются ими, фосфатидилхолины (ФК), фосфатидную кислоту, фосфатидилсерин и фосфатидилглицерин.
В некоторых воплощениях фосфолипид представляет собой фосфатидилхолин. Безграничные примеры фосфатидилхолина включают в себя: 2,3-дипальмитоил-Sn-глицеро-L-фосфатидилхолин; дистеароил фосфатидилхолина (ДСФХ); димиристоилфосфатидилхолин (ДМФХ); дипальмитоилфосфатидилхолин (ДПФХ); пальмитоил олеоил фосфатидилхолин (ПОФХ); яичный фосфатидилхолин (ЯФХ); и гидрогенизированный соевый фосфатидилхолин (ГСФХ).
В некоторых воплощениях липосома содержит катионный липид. В данном контексте понятие "катионные липиды" относится к молекулам, состоящим, по меньшей мере, из одной и, наиболее типично, двух цепей жирных кислот и положительно заряженной полярной головной группы. Обычные катионные липиды имеют либо додециловые (C12), либо гексадециловые (цетил, C16) цепи жирных кислот, хотя понятие "катионный липид" также предназначен для охвата липидов с цепями жирных кислот иных длин. Безграничные примеры катионных липидов, включают в себя: DOTAP (1,2-диацил-3-триметиламмоний пропан), DOPE (диолеоил фосфатидилэтаноламина), DOTMA ([2,3-бис(олеоил)пропил]триметиламмониум хлорид), DOGS (диоктадецил амидо-глицил-спермин), DODAB (диоктадецил диаммоний бромид), DODAC (диоктадецил диаммоний хлорид), DOSPA (2,3- диолеоилокси-N-[сперминкарбоксаминометил]-N-N-диметил-1-пропанаминий), DC-Chol (3β[N-(n′,N′-диметиламиноэтан)-карбамоил]холестерол, диолеоил), DOIC (1-[2-(олеолокси)-этил]-2-олеоил-3-(2-гидроксиэтил)имидазолиний хлорид), DOPC (диолеоил фосфатидилхолина) и DMRIE (димиристоилпропил диметил гидроксиэтил аммония бромид).
В определенных воплощениях липосомы будут дополнительно содержать холестерол, холестериновый аналог и/или производное холестерола, который придает дополнительную текучесть липидному бислою липосомы. Безграничные примеры аналогов и производных холестерола, которые могут использоваться в представленных здесь липосомах, включают в себя: 5-холестен, 5-прегнен-3β-ол-20-он, 4-холестен-3-она и 5-холестен-3-он. В определенных воплощениях концентрация холестерола в липосоме будет составлять примерно 0,01-25 моль%. В определенных воплощениях концентрация холестерола в липосоме будет составлять примерно 0,01-10 моль%. В еще одних воплощениях концентрация холестерола в липосоме составляет примерно 0,01 моль%, 0,02 моль%, 0,03 моль%, 0,04 моль%, 0,05 моль%, 0,06 моль%, 0,07 моль%, 0,08 моль%, 0,09 моль%, 0,1 моль%, 0,2 моль%, 0,3 моль%, 0,4 моль%, 0,5 моль%, 0,6 моль%, 0,7 моль%, 0,8 моль%, 0,9 моль%, 1 моль%, 2 моль%, 3 моль%, 4 моль%, 5 моль%, 6 моль%, 7 моль%, 8 моль%, 9 моль%, 10 моль%, 11 моль%, 12 моль%, 13 моль%, 14 моль%, 15 моль%, 16 моль%, 17 моль%, 18 моль%, 19 моль%, 20 моль%, 21 моль%, 22 моль%, 23 моль%, 24 моль%, 25 моль% или выше.
В частном воплощении липосома включает в себя липид, связанный с целевым фрагментом. Безграничные примеры целевых фрагментов, которые могут быть связаны с липидом, используемым для образования липосомы, включают в себя: сахарные фрагменты (например, манноза или углевод, содержащий один или более маннозных остатков, аналоги или его производные); пептиды (например, лиганд-клеточный рецептор), полипептиды (например, антитело или его функциональный фрагмент); и нуклеиновые кислоты (например, аптамер или Spiegelmer®).
В одном воплощении липид, связанный с целевым фрагментом, входит в конечную концентрацию в размере не менее 0,01% от общего содержания липидов в липосоме. В другом воплощении концентрация липида, связанного с целевым фрагментом в липосоме, по меньшей мере, составляет 0,1% от общего содержания липидов. В другом воплощении концентрация липида, связанного с целевым фрагментом в липосоме, по меньшей мере, составляет 1% от общего содержания липидов. В другом воплощении концентрация липида, связанного с целевым фрагментом, по меньшей мере, составляет 5% или, по крайней мере, 10% от общего содержания липидов в липосоме. В еще одних воплощениях концентрация липида, связанного с целевым фрагментом, составляет примерно 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% от общего содержания липидов в липосоме.
В конкретном воплощении липосома содержит липид, связанный с одним или более маннозных остатков (например, маннозилированная липосома). Безграничные примеры маннозилированных липидов включают в себя: ManDOG липид (Espuelas и др., Bioorg Med Chem Lett. 2003 Aug 4; 13(15):2557-60, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей); липид тетраманнозил-3-L-лизин-диолеоил глицерола (Espuelas и др., выше); и маннозилированные фосфатидилинозитолы (Barratt и др. (1986) Biochim. Biophy. Acta, 862:153-164, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей).
В определенных воплощениях средний размер диаметра липосом, описанных в данном документе, составляют примерно 50-500 нм. Например, средний диаметр липосомы может составлять примерно 50-400 нм, 50-300 нм, 50-250 нм, 50-225 нм, 50-200 нм, 50-175 нм, 75-500 нм, 75-400 нм, 75-300 нм, 75-250 нм, 75-225 нм, 75-200 нм, 100-500 нм, 100-400 нм, 100-300 нм, 100-250 нм, 100-225 нм, 100-200 нм. В частном воплощении средний диаметр липосомы будет составлять примерно 100-200 нм.
Липосомы могут быть произведены с помощью ряда хорошо известных методов в данной области науки, включая метод экструзии, испарение с обращенной фазой, обработку ультразвуком, метод стимуляции и самосборка в водном растворе (см., Torchilin VP, Weissig V (2003) Liposomes: a practical approach. Practical approach series, Vol 264, 2nd edition, Oxford University, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Кроме того, хорошо известно, что способы получения липосом также можно использовать для изготовления композиций, инкапсулированных в липосомы грузов.
Безграничные примеры способов получения липосомальных композиций описаны в международных патентных публикациях: WO 1999/65465 и WO 2010/052326; патенты США №№ 7381421, 7604803, 8075896, 7790696, 7384923, 7008791 и публикации заявки на патент США №№ 2009/0068254 и 2008/0317838 (содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Примерная схема образования липосомальной композиции пептида(ов) состоит из пяти шагов: шаг 1) - формирование сухих нерегулярных липидных слоев путем выпаривания органического растворителя (липидов в хлороформе); шаг 2) - регидратация сухих нерегулярных липидных слоев, ведущая к образованию многослойных липосомов MLV; шаг 3) - генерация SUV липосом из MLV липосом посредством гомогенизации под высоким давлением; шаг 4) - дегидратация путем лиофильной сушки смеси SUV липосом со смесью пептида вместе с избыточным сахаром; и шаг 5) - регидратация обезвоженной смеси SUV липосом со смесью пептида(ов) вместе с избыточным сахаром в SUV липосомах размером примерно 100-200 нм.
V. Целевые фрагменты
А. Введение
Для повышения их терапевтического эффекта, композиции пептида ОБМ, описанные в данном документе, могут быть связаны с целевым фрагментом. Целевой фрагмент может быть ковалентно или нековалентно связан с пептидом ОБМ, например, посредством ковалентной связи, ионной связи электростатического взаимодействия, гидрофобного взаимодействия или физического улавливания. В определенных воплощениях связь может быть опосредована через линкерную или векторную структуру. Примеры нацеленных фрагментов включают в себя, но не ограничиваются лишь ими: сахарные фрагменты (например, манноза или углевод, содержащий один или более остатков маннозы, аналоги, или его производные), пептид (например, лиганд-клеточный рецептор), полипептид (например, антитело или его функциональный фрагмент) и нуклеиновая кислота (например, аптамер или Spiegelmer®).
При связи целевой фрагмент улучшает эффективность пептида ОБМ, по сравнению с эффективностью одного только груза. В одном воплощении целевой фрагмент улучшает доставку ассоциированного пептида ОБМ к местоположению в состоянии in vivo или клеточному типу; и/или улучшает поглощение пептида ОБМ в клетке или местоположении в состоянии in vivo. В частном воплощении целевой фрагмент улучшает доставку ассоциированного пептида ОБМ к иммунной клетке (например, B-клетке или АПК); и/или улучшает поглощение пептида ОБМ в иммунной клетке (например, B-клетке или АПК).
Когда целевой фрагмент ковалентно или нековалентно связан с одним или более пептидом ОБМ, он может: (i) повышать доставку пептида ОБМ к клетке (например, иммунной клетке), как минимум на 10%, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом; и/или (ii) увеличивать поступление пептида ОБМ в клетку (например, иммунную клетку), как минимум на 10%, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В конкретном воплощении иммунная клетка представляет собой В-клетку или антигенпрезентирующую клетку (АПК). В одном воплощении целевой фрагмент (i) улучшает доставку; и/или (ii) улучшает поступление пептида ОБМ в клетку, как минимум на 25%, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В другом воплощении целевой фрагмент (i) улучшает доставку; и/или (ii) улучшает поступление пептида ОБМ в клетку, как минимум на 50%, 75% или 100%, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В еще одном воплощении целевой фрагмент (i) улучшает доставку; и/или (ii) улучшает поступление пептида ОБМ в клетку, как минимум в 2-раза, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В других воплощениях целевой фрагмент (i) улучшает доставку; и/или (ii) улучшает поступление пептида ОБМ в клетку, как минимум в 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 75, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900 или 1000 раз, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом.
В. Сахарные остатки
В одном воплощении целевой фрагмент содержит углеводный фрагмент (например, остаток сахара). В определенных воплощениях сахарный фрагмент может быть моносахаридом, дисахаридом или полисахаридом. Сахарный фрагмент может быть природного происхождения, аналогом встречающегося в природе сахара или производным встречающегося в природе сахара. Безграничные примеры сахарных фрагментов, которые могут быть использованы в качестве целевых фрагментов, включают в себя следующие: манноза, глюкоза, фруктоза, галактоза, ксилоза, рибоза, галактозамин, глюкозамин, сиаловая кислота, N-ацетилглюкозамин, сахароза, лактулоза, лактоза, мальтоза, целлобиоза, трегалоза, койибиоза, нигероза, изомальтоза, β, β-трегалоза, α,β-трегалоза, софороза, ламинарибиоза, гентиобиоза, тураноза, мальтулоза, палатиноза, генцибиулоза, маннобиоза, мелибиозы, мелибиулоза, рутиноза, рутинулоза, ксилобиоза, их аналоги или производные.
Безграничные примеры производных и аналогов маннозы включают: 1-Deoxymannojirimycin гидрохлорид, метил-α-D-маннопиранозид, 2-дезокси-D-глюкоза (2-DG), 2-дезокси-2-фтор-манноза (2-FM) и 2-дезокси-2-хлор-манноза (2-CM), каждый из которых может быть конъюгирован с липидом.
С. Антитела
Согласно контексту, в другом воплощении целевой фрагмент содержит антитело или функциональный фрагмент. В одном воплощении антитело особым образом связывается с антигеном клеточной поверхности. В конкретном воплощении антитело специфически связывается с антигеном клеточной поверхности, присутствующим на иммунной клетке. В более конкретном воплощении антитело связывается с антигеном клеточной поверхности, присутствующим на B-клетке или антигенпрезентирующей клетке (АПК). В частном воплощении антитело особым образом связывается с рецептором маннозы, присутствующим на поверхности клетки.
Безграничные примеры антигенов клеточной поверхности, которые могут служить мишенью антитела, связанного с пептидом ОБМ или вектором, включают в себя: фенотипические маркеры для: естественных киллеров (например, CD16 и CD56); Т-хелперов (например, TCRαβ, CD3 и CD4); Т-супрессоров (например, TCRαβ, CD3 и CD8); Т-клеток γδ (например, TCRγδ и CD3); и B-клеток (MHC класса II, CD19 и CD21). Молекулы клеточной поверхности могут также включать в себя углеводы, белки, липопротеины, гликопротеины или любые другие молекулы, присутствующие на поверхности интересующей вас клетки.
D. Аптамеры
В другом воплощении целевой фрагмент содержит аптамер. В одном воплощении аптамер особым образом связывается с антигеном клеточной поверхности. В конкретном воплощении аптамер специфически связывается с антигеном клеточной поверхности, присутствующим на иммунной клетке. В более конкретном воплощении аптамер связывается с антигеном клеточной поверхности, присутствующим на B-клетке или антигенпрезентирующей клетке (АПК). В частном воплощении аптамер особым образом связывается с рецептором маннозы, присутствующим на поверхности клетки.
Безграничные примеры антигенов клеточной поверхности, которые могут служить мишенью аптамера, связанного с пептидом ОБМ или вектором, включают в себя: фенотипические маркеры для: естественных киллеров (например, CD16 и CD56); Т-хелперов (например, TCRαβ, CD3 и CD4); Т-супрессоров (например, TCRαβ, CD3 и CD8); Т-клеток γδ (например, TCRγδ и CD3); и B-клеток (MHC класса II, CD19 и CD21). Молекулы клеточной поверхности могут также включать в себя углеводы, белки, липопротеины, гликопротеины или любые другие молекулы, присутствующие на поверхности интересующей вас клетки.
VI. Терапевтические композиции
А. Введение
В одном аспекте данное изобретение предлагает терапевтическую композицию для лечения рассеянного склероза (РС), содержащую пептид основной белок миелина (ОБМ), связанный с вектором, как это определено далее. В одном воплощении пептид ОБМ содержит, по меньшей мере, 6 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12). Как правило, пептид ОБМ будет состоять из 6-100 аминокислот в длину. В одном воплощении этот пептид ОБМ будет состоять из 6-50 аминокислот в длину. В другом воплощении этот пептид ОБМ будет состоять из 6-25 аминокислот в длину. В других вариантах воплощения пептид ОБМ будет состоять примерно из 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 или более аминокислот. В одном воплощении вектор представляет собой липосомы. В более конкретном воплощении вектор включает в себя целевую часть и является маннозилированной липосомой.
В. Векторные композиции
В одном воплощении композиция содержит по меньшей мере два пептида ОБМ, каждый из которых связан с вектором. В одном воплощении оба пептида ОБМ связаны с одним вектором (например, инкапсулированный в пределах одной липосомы). В другом воплощении каждый пептид ОБМ связан с отдельным вектором (например, инкапсулированный в пределах отдельных липосом), а соответствующие ОБМ-векторные комплексы смешивают перед введением препарата.
В одном воплощении композиция включает в себя первый пептид ОБМ, содержащий, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:1 и связанный с первым вектором, и второй пептид ОБМ, содержащий, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:2 и связанный со вторым вектором. В конкретном воплощении первый пептид ОБМ включает аминокислотную последовательность SEQ ID NO:1, а второй пептид ОБМ включает аминокислотную последовательность SEQ ID NO:2. В более конкретном воплощении первый пептид ОБМ включает аминокислотную последовательность SEQ ID NO:1, а второй пептид ОБМ включает аминокислотную последовательность SEQ ID NO:2.
В одном воплощении композиция включает в себя первый пептид ОБМ, содержащий, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:1 и связанный с первым вектором, и второй пептид ОБМ, содержащий, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:3 и связанный со вторым вектором. В конкретном воплощении первый пептид ОБМ включает аминокислотную последовательность SEQ ID NO:1, а второй пептид ОБМ включает аминокислотную последовательность SEQ ID NO:3. В более конкретном воплощении первый пептид ОБМ включает аминокислотную последовательность SEQ ID NO:1, а второй пептид ОБМ включает аминокислотную последовательность SEQ ID NO:3.
В одном воплощении композиция включает в себя первый пептид ОБМ, содержащий, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:2 и связанный с первым вектором, и второй пептид ОБМ, содержащий, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:3 и связанный со вторым вектором. В конкретном воплощении первый пептид ОБМ включает аминокислотную последовательность SEQ ID NO:2, а второй пептид ОБМ включает аминокислотную последовательность SEQ ID NO:3. В более конкретном воплощении первый пептид ОБМ включает аминокислотную последовательность SEQ ID NO:2, а второй пептид ОБМ включает аминокислотную последовательность SEQ ID NO:3.
В одном воплощении композиция содержит, по меньшей мере, три пептида ОБМ, каждый из которых связан с вектором. В одном воплощении три пептида ОБМ связаны с одним вектором (например, инкапсулированный в пределах одной липосомы). В другом воплощении каждый пептид ОБМ связан с отдельным вектором (например, инкапсулированный в пределах отдельных липосом), а соответствующие ОБМ-векторные комплексы смешивают перед введением препарата.
В третьем воплощении композиция включает в себя первый пептид ОБМ, содержащий, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:1 и связанный с первым вектором, второй пептид ОБМ, содержащий, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:2 и связанный со вторым вектором, и третий пептид ОБМ, содержащий, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:3 и связанный с третьим вектором. В конкретном воплощении первый пептид ОБМ включает аминокислотную последовательность SEQ ID NO:1, второй пептид ОБМ включает аминокислотную последовательность SEQ ID NO:2, и третий пептид ОБМ включает аминокислотную последовательность SEQ ID NO:3. В более конкретном воплощении первый пептид ОБМ состоит из аминокислотной последовательности SEQ ID NO:1, второй пептид ОБМ состоит из аминокислотной последовательности SEQ ID NO:2, и третий пептид ОБМ состоит из аминокислотной последовательности SEQ ID NO:3.
В одном аспекте настоящее изобретение предлагает композицию для лечения рассеянного склероза, композицию, содержащую пептид ОБМ, и, как определено здесь, этот пептид связан с вектором, содержащим целевой фрагмент. В конкретном воплощении вектор, содержащий целевой фрагмент, увеличивает: (i) доставку пептида к иммунной клетке; или (ii) поступление пептида в иммунной клетке, по сравнению с пептидом, связанным с вектором в отсутствие целевого фрагмента. В конкретном воплощении вектор содержит липосому. В другом конкретном воплощении целевой фрагмент содержит маннозилированный липид.
В определенных воплощениях описанных здесь композиций, вектор ковалентно или нековалентно связан с целевым фрагментом. В одном воплощении целевой фрагмент (i) увеличивает доставку пептид ОБМ к клетке (например, иммунной клетке), по сравнению с пептидом ОБМ, не связанным с целевым фрагментом; и/или (ii) увеличивает поступление пептида ОБМ в клетку (например, иммунную клетку), по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В конкретном воплощении клетка представляет собой иммунную клетку. В более конкретном воплощении иммунная клетка представляет собой В-клетку или антигенпрезентирующую клетку (АПК).
С. Липосомальные векторные композиции
В конкретных вариантах осуществления настоящего изобретения, терапевтические композиции, описанные в данном документе, включают в себя липосомальные векторы. Соответственно, настоящее изобретение предлагает композицию для лечения РС, содержащую инкапсулированные в липосомы пептиды ОБМ. В конкретном воплощении липосома связана с целевым фрагментом. В более конкретном воплощении целевой фрагмент представляет собой маннозилированный липид, присутствующий в липосомном бислое.
В конкретном воплощении липосома связана с целевым фрагментом маннозы, т.е. представляет собой маннозилированную липосому. В определенных воплощениях, по меньшей мере, 0,01% липидов, содержащих маннозилированную липосому, будет конъюгирован с одним остатком маннозы, как минимум. В другом воплощении, по меньшей мере, 0,1% липидов, содержащих маннозилированную липосому, будет конъюгирован с одним остатком маннозы, как минимум. В другом воплощении, по меньшей мере, 1% липидов, содержащих маннозилированную липосому, будет конъюгирован с одним остатком маннозы, как минимум. В еще других воплощениях, по меньшей мере, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% липидов, содержащих маннозилированную липосому, будет конъюгирован с одним остатком маннозы, как минимум.
Липосомные композиции могут быть изготовлены согласно хорошо известным в данной области методами. Липосомные препараты могут содержать один или более компонентов, перечисленных далее: буферное вещество (например, ацетатный буфер, фосфатный буфер, цитратный буфер, боратный буфер или тартратный буфер); сахар (например, трегалоза, мальтоза, сахароза, лактоза, маннозы, глюкоза или фруктоза); сахарный спирт (например, сорбит, мальтитол, лактитол, маннитол или глицерол), спирт (например, этанол или трет-бутанол); соль (например, хлорид натрия, хлорид калия, цитрат натрия, фосфат натрия или фосфат калия); антиоксидант (например, глутатион).
D. Целевой фрагмент
В определенных воплощениях целевой фрагмент представляет собой сахарный фрагмент (например, манноза или углевод, содержащий один или несколько остатков маннозы); пептид (например, лиганд-клеточный рецептор), полипептиды (например, антитело или его функциональный фрагмент); или нуклеиновую кислоту (например, аптамер или Spiegelmer®). В конкретном воплощении целевой фрагмент представляет собой остаток маннозы.
В одном воплощении целевой фрагмент: (i) повышает доставку пептида ОБМ к клетке (например, иммунной клетке), как минимум на 10%, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом; и/или (ii) увеличивает поступление пептида ОБМ в клетку (например, иммунную клетку), как минимум на 10%, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В конкретном воплощении иммунная клетка представляет собой В-клетку или антигенпрезентирующую клетку (АПК). В одном воплощении целевой фрагмент (i) улучшает доставку; и/или (ii) улучшает поступление пептида ОБМ в клетку, как минимум на 25%, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В другом воплощении целевой фрагмент (i) улучшает доставку; и/или (ii) улучшает поступление пептида ОБМ в клетку, как минимум на 50%, 75% или 100%, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В еще одном воплощении целевой фрагмент (i) улучшает доставку; и/или (ii) улучшает поступление пептида ОБМ в клетку, как минимум в 2 раза, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом. В других воплощениях целевой фрагмент (i) улучшает доставку; и/или (ii) улучшает поступление пептида ОБМ в клетку, как минимум в 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 75, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900 или 1000 раз, по сравнению с пептидом ОБМ, не связанным с целевым фрагментом.
В одном аспекте настоящее изобретение относится к композиции для лечения РС, содержащей пептид ОБМ, как определено здесь, ковалентно связанный с целевым фрагментом (например, в случае, где вектор представляет собой целевой фрагмент). В определенных воплощениях целевой фрагмент ковалентно связан непосредственно с пептидом ОБМ. Целевой фрагмент может быть связан, например, на N- или С-конце протеина ОБМ, на первичной аминогруппе лизина, глутамина или боковой цепи аспарагина, на гидроксильной группе серина или боковой цепи треонина или на свободном тиоле боковой цепи цистеина. В определенных воплощениях целевой фрагмент, связанный непосредственно с пептидом ОБМ, представляет собой сахарный фрагмент (например, остаток маннозы или углевод, содержащий один или более остатков маннозы, его аналог или его производное), пептид (например, лиганд-клеточный рецептор), полипептид (например, антитело или его функциональный фрагмент) или нуклеиновую кислоту (например, аптамер или Spiegelmer®). В конкретном воплощении целевой фрагмент представляет собой остаток маннозы.
Е. Комплексная терапия
В настоящее время лекарства от рассеянного склероза не существует. Однако ряд терапевтических методик были утверждены для лечения симптомов, связанных с РС. К таким видам терапии относятся: финголимод, модулятор рецептора сфингозин-1-фосфата, который изолирует лимфоциты в лимфатических узлах, предотвращая их от участия в аутоиммунной реакции; интерферон β-1a и β-1b, который, вероятно, служит для уменьшения скорости возникновения рецедивов РС, а также для замедления прогрессирования нетрудоспособности у больных РС благодаря своим противовоспалительным свойствам; глатиромерацетат (копаксон), неинтерферонный, нестероидный иммуномодулятор, которые представляет собой случайный полимер из четырех доминирующих аминокислот, обнаруженных в ОБМ, глютамин (Glu), лизин (Lys), аланин (Ala) и тирозин (Tyr); митоксантрон, ингибитор топоизомеразы типа II, используемый для лечения вторично-прогрессирующего РС; и натализумаб, гуманизированное моноклональное антитело против клеточной молекулы адгезии α4-интегрина.
Кроме того, использование следующих методов лечения может обеспечить некоторую терапевтическую пользу для пациентов с диагнозом или риском развития РС: (i) Введение глатирамера ацетата (GA), утвержденного для лечения возвратно-ремиттирующего РС (ВРРС). GA представляет собой синтетический статистический сополимер Glu, Lys, Ala и Tyr, который порождает популяцию Th2 регуляторных Т-клеток со способностью пересечения ГЭБ и производит противовоспалительные цитокины IL-4, IL-6, IL-10, и нейротрофический фактор роста из тканей мозга (Aharoni R. и др., Proc Natl Acad Sci U S A 2003; 100:14157-62). (ii) Введение так называемых "измененных пептидных лигандов" (APL), взаимодействующих с рецепторами Т-клеток (TCR). APL несут модифицированные (Luca ME и др., J Neuroimmunol 2005; 160:178-87), мутированные (Katsara M. и др., J Med Chem 2009; 52:214-8) или ограниченные (Warren KG и др., Eur J Neurol 2006; 13:887-95) TCR-связывающие фрагменты и способны частично активировать Т-клетки, замещая фенотип Th1 на Th2, а также, в некоторых случаях, вызывают анергию Т-клеток. Пептид ОБМ (82-98), AФА полученное из энцефалитогенного фрагмента ОБМ, показывает перспективное ингибирование прогрессирования РС у пациентов с гаплотипом HLA-DR2-DR4. Однако фармацевтическая композиция на основе данного пептида провалила испытание на III фазе клинического испытания (Fontoura and Garren, Results Probl Cell Differ 2010; 51:259-85). Двойная мутация пептида ОБМ (83-99) вызывает отклики IL-4 и является антагонистом откликов IFN-гамма (Katsara M. и др., J Neuroimmunol 2008; 200:77-89); (iii) введение IFNβ; (iv) моноклональных АТ, таких как ритуксимаб (анти-CD20), нацеленных на В-клетки (Hauser SL и др., N Engl J Med 2008; 358:676-88), даклизумаб (анти-CD25, альфа-субъединицы рецептора IL-2), истощающие активированные Т-клетки (Rose JW и др., Ann Neurol 2004; 56:864-7) и алемтузумаб (анти-CD52, гликопротеин с неизвестной функцией, представленный на всех зрелых лимфоцитах и моноцитах) (Coles A. и др., Clin Neurol Neurosurg 2004; 106:270-4); (v) пероральные терапии, такие как применение FTY720 в фосфорилированной форме (ингибитор SP1-ассоциированных рецепторов, сопряженных с G-белком), терифлуномид (ингибитор пролиферации Т-клеток), BG-12 (индуктор Th2-цитокинов), лахинимод (ингибитор Т-клеток и макрофагальный трафик в ЦНС, Th2/Th3 сдвиг триггера), кладрибин (субстрат для дезоксицитидинкиназы, вступающий в конфликт с репарацией ДНК и гибелью лимфоцитов) (см. Fontoura and Garren, Results Probl Cell Differ 2010; 51:259-85); (vi) инъекция инактивированной T-клетки или вакцинация TCR гипервариабельных областей для стимулирования TCR-специфических противорегулированных CD8+ клеток; (vii) толеризация иммунной системы: индукция "носовой" или "оральной толерантности" аутоантигеном, или ДНК-вакцинация плазмидом BHT-3009, который кодирует всю молекулу ОБМ и вызывает значительную толеризацию обеих Т-клеток и аутоантител в достижении нескольких миелиновых антигенов. (viii) Недавно была предложена новая терапия, предполагающая уменьшение количества конкретных B-клеток (Stepanov AV и др., PLoS One; 6:e20991).
В одном из аспектов настоящее изобретение предусматривает комбинированную терапию для пациентов с диагнозом или подверженных риску возникновения рассеянного склероза. В одном воплощении терапия включает совместное введение композиции пептида ОБМ, описанного здесь, и ранее идентифицированного терапевтического средства, например, финголимод, интерферон β-1a, интерферон β-1b, глатиромерацетат, митоксантрон, ингибитор топоизомеразы II типа, используемый для лечения вторично- прогрессирующего РС, и антитело анти-α4-интегрина.
В одном воплощении совместное введение включает в себя одновременное или последовательное введение антигенного пептида ОБМ, связанного с векторами вторым терапевтическим средством. В другом воплощении совместное введение включает в себя введение первого препарата либо пептидной композицией ОБМ при полном терапевтическом цикле или альтернативную терапию, с последующим введением полного терапевтического режима с другим методом лечения. В данном воплощении введение двух лекарственных средств не пересекаются, скорее, эти методы лечения циклически противоположны друг другу.
VII. Лечение рассеянного склероза
А. Введение
В одном аспекте настоящее изобретение представляет способы лечения рассеянного склероза (РС) у субъекта, нуждающегося в этом, путем введения субъекту В-клеточного эпитопа пептида ОБМ, связанного с вектором, как описано в данном документе. В конкретном воплощении метод включает в себя введение нуждающемуся в этом субъекту инкапсулированного в липосомы пептида ОБМ, содержащего последовательность, которая по существу совпадает с одной из последовательностей SEQ ID NO:1-3.
В одном воплощении метод включает в себя введение терапевтического пептида основного белка миелина (ОБМ), включающего в себя, по меньшей мере, 6 последовательных аминокислот ОБМ (43-64) (SEQ ID NO:11) или ОБМ (115-170) (SEQ ID NO:12), связанного с вектором (например, липосомой). Как правило, пептид ОБМ будет состоять из 6-100 аминокислот в длину. В одном воплощении этот пептид ОБМ будет состоять из 6-50 аминокислот в длину. В другом воплощении этот пептид ОБМ будет состоять из 6-25 аминокислот в длину. В других вариантах воплощения пептид ОБМ будет состоять примерно из 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 или более аминокислот. В одном воплощении вектор представляет собой липосомы. В более конкретном воплощении вектор представляет собой маннозилированную липосому.
В конкретном воплощении способ предусматривает введение пептида ОБМ, который содержит, по крайней мере, 6 последовательных аминокислот следующей последовательности: GGDRGAPKRGSGKDSHH (ОБМ (46-62); SEQ ID NO:1), связанной с вектором, нуждающемуся в этом субъекту. В конкретном воплощении пептид ОБМ содержит аминокислотную последовательность SEQ ID NO:1. В более конкретном воплощении пептид ОБМ содержит аминокислотную последовательность SEQ ID NO:1. В одном воплощении вектор представляет собой липосому. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В другом конкретном воплощении способ предусматривает введение пептида ОБМ, который содержит, по крайней мере, 6 последовательных аминокислот следующей последовательности: GFGYGGRASDYKSAHK (ОБМ (124-139); SEQ ID NO:2), связанной с вектором, нуждающемуся в этом субъекту. В конкретном воплощении пептид ОБМ содержит аминокислотную последовательность SEQ ID NO:2. В более конкретном воплощении пептид ОБМ содержит аминокислотную последовательность SEQ ID NO:2. В одном воплощении вектор представляет собой липосому. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В другом конкретном воплощении способ предусматривает введение ОБМ, который содержит, по крайней мере, 6 последовательных аминокислот следующей последовательности: QGTLSKIFKLGGRDSRSGSPMARR (MBP(147-170); SEQ ID NO:3), связанной с вектором, нуждающемуся в этом субъекту. В конкретном воплощении пептид ОБМ содержит аминокислотную последовательность SEQ ID NO:3. В более конкретном воплощении пептид ОБМ содержит аминокислотную последовательность SEQ ID NO:3. В одном воплощении вектор представляет собой липосому. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В другом конкретном воплощении метод включает в себя введение, по меньшей мере, двух пептидов ОБМ, каждый соответствующий пептид ОБМ содержит, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3, пептиды ОБМ связаны с вектором. В более конкретном воплощении каждый пептид ОБМ включает в себя аминокислотную последовательность, взятую из SEQ ID NO:1-3. В более конкретном воплощении каждый пептид ОБМ содержит аминокислотную последовательность, взятую из SEQ ID NO:1-3. В одном воплощении вектор представляет собой липосому. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В еще одном конкретном воплощении метод включает введение трех пептидов ОБМ, каждый соответствующий пептид ОБМ содержит, по меньшей мере, 6 последовательных аминокислот SEQ ID NO:1, SEQ ID NO:2, или SEQ ID NO:3, пептиды ОБМ связаны с вектором. В более конкретном воплощении каждый пептид ОБМ включает в себя аминокислотную последовательность, взятую из SEQ ID NO:1-3. В более конкретном воплощении каждый пептид ОБМ содержит аминокислотную последовательность, взятую из SEQ ID NO:1-3. В одном воплощении вектор представляет собой липосому. В более конкретном воплощении липосома представляет собой маннозилированную липосому.
В отдельных воплощениях субъекту был поставлен диагноз - рассеянный склероз. В одном воплощении субъекту исследования был поставлен диагноз - рецидивирующе-ремиттирующий рассеянный склероз (РРРС). В другом воплощении субъекту исследования был поставлен диагноз - вторично-прогрессирующий рассеянный склероз (ВПРС). В другом воплощении субъекту исследования был поставлен диагноз - первично-прогрессирующий рассеянный склероз (ППРС). В другом воплощении субъекту исследования был поставлен диагноз - прогрессирующий рецидивирующий рассеянный склероз (ПРРС).
В одном воплощении лечение включает в себя введение состава пептида ОБМ во время или сразу же после острого симптоматического приступа. В одном воплощении острый симптоматический приступ представляет собой начало приступа. В другом воплощении острый симптоматический приступ представляет собой рецидив приступа. В определенных воплощениях субъекту могут быть одновременно введены внутривенные кортикостероиды (например, метилпреднизолон) во время острого симптоматического приступа. В отдельных воплощениях субъекту был поставлен диагноз первичного прогрессирующего, вторичного прогрессирующего или рецидивирующе-ремиттирующего РС. В одном воплощении лечение уменьшит тяжесть острого приступа или улучшит один или несколько физических или психологических симптомов у субъекта.
В другом воплощении лечение включает в себя введение состава пептида ОБМ в период ремиссии РС у субъекта. В определенных воплощениях субъекту был поставлен диагноз вторичного прогрессирующего или рецидивирующе-ремиттирующего РС. В одном воплощении лечение предотвратит наступление острого приступа, отсрочит наступление острого приступа, уменьшит тяжесть последующего острого приступа или улучшит одно или несколько физических или психологических симптомов у субъекта.
В другом воплощении лечение включает в себя введение состава пептида ОБМ в период прогрессирующего снижения у субъекта. В определенных воплощениях субъекту был поставлен диагноз вторичного прогрессирующего, первичного прогрессирующего или прогрессирующего рецидивирующего РС. В одном воплощении лечение предотвратит наступление острого приступа, отсрочит наступление острого приступа, уменьшит тяжесть последующего острого приступа, снизит прогрессирование заболевания, остановит прогрессирование заболевания или улучшит одно или несколько физических или психологических симптомов у субъекта.
В еще одном воплощении лечение включает в себя введение состава пептида ОБМ субъекту, которому поставлен диагноз - повышенный риск развития РС. В определенных воплощениях субъект будет иметь один или более факторов риска РС, включая, но не ограничиваясь лишь ими: семейный анамнез РС, наличие заболевания, повышающая регуляция или понижающая регуляция биомаркера заболевания (например, интерлейкин-6, оксид азота и синтаза оксида азота, остеопонтин, фетуин-А и анти-ОБМ аутоантитела) и генетический маркер РС. В определенных воплощениях профилактическое введение состава пептида ОБМ субъекту, нуждающемуся в этом, предотвратит начало заболевания, отсрочит наступление заболевания, предотвратит первоначальный острый приступ, отсрочит наступление первоначального острого приступа, уменьшит степень тяжести заболевания или уменьшит степень тяжести первоначального острого приступа.
В определенных воплощениях субъект ранее проходил лечение от РС. В других воплощениях субъект ранее не проходил лечение от РС.
В. Введение препарата
Композиции с пептидом ОБМ, согласно настоящему изобретению, могут быть введены в соответствии с каким-либо известным способом введения, например, местное, энтеросолюбильное, парентеральное, внутривенное, подкожное, внутримышечное, внутрибрюшинное, ингаляция, эпидуральное, катетеризация (например, внутривенное, назальное, пероральное или с помощью внутричерепной иглы для инъекции), введение непосредственно в центральную нервную систему, или любой другой аналогичный способ введения. Способ введения, выбираемый для конкретного терапевтического лечения, будет зависеть, например, от фармацевтической композиции, дозы поставляемого терапевтического средства, статуса состояния заболевания, подлежащего лечению; результатов, представленных клиническими испытаниями, таких как эффективность данного конкретного препарата и профиль безопасности для конкретного препарата, а также ожидаемое согласие пациента. В конкретном воплощении пептид ОБМ вводят подкожно.
В определенных воплощениях пептид ОБМ вводят таким образом, чтобы композиция подавалась или накапливалась в центральной нервной системе. В одном воплощении композиция вводится непосредственно в центральную нервную систему (ЦНС), например, с помощью эпидурального спинномозгового, интраназального введения (см. Liu X., Expert Opin Drug Deliv. 2011 Dec; 8(12):1681-90 и Wen MM., Discov Med. 2011 Jun; 11(61):497-503, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей) или внедрение системы доставки лекарственного средства (см., Tresco and Winslow, Crit Rev Biomed Eng. 2011; 39(1):29-44, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей).
Поскольку прямое введение терапевтических средств в ЦНС порождает много трудностей, в том числе риск потенциальных летальных инфекций, состав можно также вводить снаружи в направлении к (ЦНС). Терапевтики, поставляемые данным образом, должны пройти через гематоэнцефалический барьер (ГЭБ), чтобы войти в ЦНС. Был предложен ряд стратегий для повышения прохождения терапевтических средств через ГЭБ (см. Hossain S и др. Curr Drug Deliv. 2010 Dec; 7(5):389-97, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Например, использование векторных систем, отображающих рецепторные лиганды BBB, пептидов или антител, специфичных для BBB на их поверхности (для обзора см. Costantino L., Future Med Chem. 2010 Nov; 2(11):1681-701 и Craparo др., CNS Neurosci Ther. 2011 Dec; 17(6):670-7, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей), или химерный пептид, содержащий пептид ОБМ, слитый с транспортным вектором ГЭБ, такой как эндогенный пептид, модифицированный белок или пептидомиметическое моноклональное антитело (MAb), который претерпевает RMT через ГЭБ на эндогенных эндотелиальных рецепторных системах (см. Pardridge, W.M., Mol. Interv., 2003, 3(2), 90-105, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей).
В одном воплощении лечение включает в себя периодическое введение препарата, например, один раз в месяц, два раза в месяц, один раз в неделю, два раза в неделю, три раза в неделю, через день, каждый день или два раза в день, в течение определенного периода времени. В зависимости от терапевтического режима заболевания и состояния пациента, цикл лечения может длиться, как минимум один месяц или, по крайней мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев. Там, где это уместно, цикл лечения может длиться, по крайней мере, один год или, по крайней мере, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более лет. Квалифицированный врач может наблюдать пациента и регулировать по мере необходимости ход лечения, например, чтобы улучшить эффективность или снизить количество побочных эффектов.
Доза, вводимая пациенту, будет варьироваться в зависимости от ряда факторов, включая следующее: частота введения препарата; тяжесть состояния (например, рассеянный склероз); подтип состояния (например, рецидивирующе-ремиттирующий РС, вторичный прогрессирующий РС, первично-прогрессирующий РС и прогрессивный рецидивирующий РС); стадии состояния (например, первоначальная атака, рецидив и ремиссия); габариты и толерантность субъекта; способ используемого введения; риск возникновения побочных эффектов; риск неблагоприятных лекарственных взаимодействий; и реакция на предыдущее лечение, каждый из которых может быть легко определен квалифицированным врачом.
Как обсуждалось выше, многие факторы будут способствовать определению соответствующей дозировки, включая, частоту введения препарата. В одном воплощении композиция пептидов ОБМ, предоставленная в данном документе, может вводиться в дозировке примерно 0,01-1000 мг/кг. В других воплощениях доза может составлять примерно 0,05-500 мг/кг. В другом воплощении доза может составлять примерно 0,1-250 мг/кг. В другом воплощении доза может составлять примерно 0,25-100 мг/кг. В другом воплощении доза может составлять примерно 0,5-50 мг/кг. В еще одном воплощении доза может составлять примерно 1-25 мг/кг. В еще других воплощениях доза может составлять примерно 0,1-10 мг/кг, 5-25 мг/кг, 20-50 мг/кг, 50-100 мг/кг, 100-250 мг/кг или 200-500 мг/кг. В одном воплощении доза вводится ежедневно. В другом воплощении доза вводится через день, на каждый третий день, каждый четвертый день, каждый пятый день, каждый шестой день или каждый седьмой день. В одном воплощении доза вводится один раз в неделю. В другом воплощении доза вводится один раз в две недели. В других воплощениях доза вводится раз в три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать и двенадцать недель.
VIII. Примеры
Пример 1 - Подготовка липосом, содержащих пептиды ОБМ, путем обработки ультразвуком
45 г смеси фосфолипида, содержащей 1 мас. часть маннозилированного липида DOG (ManDOG) и 99 мас. частей 2,3-дипальмитоил-Sn-глицеро-l-фосфатидилхолина, растворяют в 450 мл хлороформа и помещают в колбу вакуумного испарителя емкостью 1 л. Хлороформ выпаривают под вакуумом для образования липидной пленки на стенках колбы. После окончания выпаривания колба заполняется газообразным азотом и в нее медленно добавляют 800 мл воды для инъекции (ВДИ). Затем колбу помещают в ультразвуковую баню на 30 минут для разъединения предварительно сформированных липидов. После обработки ультразвуком липиды заново формируются в водную эмульсию липосом.
0,75 г смеси пептидов ОБМ, содержащих GGDRGAPKRGSGKDSHH (SEQ ID NO:1; ОБМ1), GFGYGGRASDYKSAHK (SEQ ID NO:2; ОБМ2) и QGTLSKIFKLGGRDSRSGSPMARR (SEQ ID NO:3; ОБМ3), и избыток лактозы (соотношение лактозы к липиду 3:1) в равных количествах затем растворяют в 40 мл воды для инъекций. Эмульсию липосом добавляют к раствору пептида МВР, и смесь перемешивают в течение 30 минут, в результате чего мы получаем эмульсию липосом размером от 100 нм до 200 нм и некапсулированные пептиды ОБМ. Полученную эмульсию моноламеллярных липосом затем лиофилизируют.
Следующим шагом стала регидратации в контролируемых условиях с последующим промыванием полученных SUV липосом с помощью центрифугирования для удаления материалов, не входящих в состав. Промытые гранулы ресуспендировали в ФСБ до получения требуемого объема дозы. Включения пептида оцениваются на основании обращенно-фазовой ВЭЖХ с использованием линейного градиента ацетонитрила, нанесенного на колонку C18. Средний z-диаметр и дзета-потенциал липосом измерялись на устройстве Zetasizer Brookhaven ZetaPlus при 25°С путем разбавления 20 мкл дисперсии до требуемого объема, используя ФСБ или соответствующее средство. Контрольные липосомы, которые не содержат пептиды (наполнитель), и липосомы, лишенные маннозилированного липида, были получены идентичным образом, за исключением добавления пептидов ОБМ и ManDOG, соответственно.
Пример 2 - Подготовка липосом, содержащих пептиды ОБМ, посредством дезинтеграции
45 г смеси фосфолипида, содержащей 1 мас. часть маннозилированного липида DOG (ManDOG) и 99 мас. частей 2,3-дипальмитоил-Sn-глицеро-l-фосфатидилхолина, растворяют в 450 мл хлороформа и помещают в колбу вакуумного испарителя емкостью 1 л. Хлороформ выпаривают под вакуумом для образования липидной пленки на стенках колбы. После окончания выпаривания колба заполняется газообразным азотом и в нее медленно добавляют 800 мл воды для инъекции. Полученная смесь переносится в проточный приемник дезинтегратора, а давление объема хода дезинтегратора устанавливают на уровне 150 МПа. 100 мл смеси добавляют в проточный дезинтегратор, находящийся под нагрузкой, а полученную в результате эмульсию липосом собирают из приемника дезинтегратора.
0,75 г смеси пептидов ОБМ, содержащих GGDRGAPKRGSGKDSHH (SEQ ID NO:1; ОБМ1), GFGYGGRASDYKSAHK (SEQ ID NO:2; ОБМ2) и QGTLSKIFKLGGRDSRSGSPMARR (SEQ ID NO:3; ОБМ3), и избыток лактозы (соотношение лактозы к липиду 3:1) в равных количествах затем растворяют в 40 мл воды для инъекций. Эмульсию липосом добавляют к раствору пептида МВР, и смесь перемешивают в течение 30 минут, в результате чего мы получаем эмульсию липосом, размером от 100 нм до 200 нм и некапсулированные пептиды ОБМ. Полученную эмульсию моноламеллярных липосом затем лиофилизируют.
Следующим шагом стала регидратации в контролируемых условиях с последующим промыванием полученных SUV липосом с помощью центрифугирования для удаления материалов, не входящих в состав. Промытые гранулы ресуспендировали в ФСБ до получения требуемого объема дозы. Включения пептида оцениваются на основании обращенно-фазовой ВЭЖХ с использованием линейного градиента ацетонитрила, нанесенного на колонку C18. Средний z-диаметр и дзета-потенциал липосом измерялись на устройстве Zetasizer Brookhaven ZetaPlus при 25°С путем разбавления 20 мкл дисперсии до требуемого объема, используя ФСБ или соответствующее средство. Контрольные липосомы, которые не содержат пептиды (наполнитель), и липосомы, лишенные маннозилированного липида, были получены идентичным образом, за исключением добавления пептидов ОБМ и ManDOG, соответственно.
Пример 3 - Водная композиция липосом, содержащих пептиды ОБМ
К 1000 мг лиофилизированных липосом пептида ОБМ, приготовленных, как это описано в примере 1, в стерильных условиях добавляют 100 мл солевого раствора фосфата (ФСР) и встряхивают. В качестве антиокислителя добавляют бета-каротин в композицию до конечной концентрации 0,01%. Композицию липосомы затем распределяют в гидролитические стеклотары I класса в стерильных условиях и в атмосфере азота. После этого контейнеры были запечатаны резиновыми пробками и снабжены алюминиевыми колпачками.
Пример 4 - Лиофилизированная композиция липосом, содержащих пептиды ОБМ
К 1000 мг лиофилизированных липосом пептида ОБМ, приготовленных, как это описано в примере 1, в стерильных условиях добавляют 2 мг твердого альфа-токоферола и встряхивают. 100 мг полученной смеси были разлиты в гидролитические стеклотары I класса в стерильных условиях и в атмосфере азота. После этого контейнеры были запечатаны резиновыми пробками и снабжены алюминиевыми колпачками. Перед использованием просушенные липосомальные смеси ОБМ восстанавливали 1-2 мл воды для инъекций на каждый контейнер и встряхивали в течение 1-2 минут до образования гомогенной эмульсии липосомы.
Пример 5 - Лечение ЭАЭ у крыс линии DA инкапсулированными в липосомы пептидами ОБМ
Для индукции экспериментального аллергического энцефаломиелита (ЭАЭ) крысам линии DA, массой 220-250 г (возраст 12-14 месяцев), подкожно в переднюю лапку вводили 10 мкг энцефалогенного фрагмента пептида основного белка миелина (ARTTHYGSLPQKSQRSQ) (SEQ ID NO:4; "Anaspeс", США) эмульсифицированного в полном адъюванте Фрейнда ("Difco", США), в концентрации 10% (мас./об.). Крысы взвешивались каждый день и оценивались на наличие неврологических симптомов ЭАЭ. Профиль симптома ЭАЭ каждого курса оценивали в соответствии со следующей шкалой: (0) - отсутствие симптомов ЭАЭ; (1) - снижение тонуса хвоста; (2) - снижение рефлекса выпрямления; (3) - парезы; (4) - полный паралич; и (5) - агония или смерть. Промежуточные по тяжести симптомы ЭАЭ оценивались, соответственно, путем уменьшения или увеличения значения на 0,5 единиц. На шестой день после индукции ЭАЭ животные случайным образом распределялись в различные группы (по 12 животных в каждой).
Животным соответствующей группы с 6 по 11 дни (включительно) после индукции вводили подкожно: либо являемые липосомы, приготовленные, как это описано в примере 2 (эмульгированные в фосфатном солевом растворе, рН 7,4), либо препарат позитивного контроля - глатиромерацетат (ГА; Копаксон, "Teva Pharmaceutical Industries Ltd", Израиль), прототип пептида: DENPVVIIFFKNIVTPRT (SEQ ID NO:5) или плацебо - забуференный фосфатный солевой раствор (pH 7,4). Пептид, глатиромерацетат, и липосомальные препараты были приготовлены непосредственно перед введением с использованием буферного фосфатного солевого раствора (pH 7,4). Каждому животному ежедневно вводили 0,1 мл каждого состава в концентрации 150 мкг. Результаты эксперимента представлены в таблице 2:
Как видно из таблицы 2, введение пептида ОБМ липосомальной композиции предоставляют значительно больший терапевтический эффект, снижая интенсивность и скорость прогрессирования ЭАЭ у крыс линии DA, по сравнению с введением любого из прототипа пептида или композиции глатиромерацетата (если сравнить средние баллы ЭАЭ на 20-й день).
Пример 6 - Лечение испытуемых женщин с диагнозом рассеянный склероз инкапсулированными в липосомы пептидами ОБМ
Больная СДА, 30 лет. Диагноз: рассеянный склероз, (церебро-спинальная форма, с прогрессирующим течением). Терапия кортикостероидными препаратами, интерфероном бета и глатирамера ацетатом не привела к успеху. Неврологический дефицит и когнитивные расстройства нарастали. Уровень сыворотки антител к ОБМ составил 107 Ед/мл. Индекс стимуляции (ИС) Т-лимфоцитов у больной составил 6,5.
Пациенту с его согласия начали введение липосомальной композиции трипептида ОБМ, приготовленной, как это описано в примере 3, в дозе 200 мг раз в две недели в течение 6 месяцев подкожно. За время лечения наблюдалась частичная регрессия неврологического дефицита в 1,5 единиц (шкала EDSS) Уровень аутоантител IgG к анти-ОБМ уменьшился до неопределяемых величин. Через 6 месяцев ИС Т-лимфоцитов составил 2.
Данные результаты свидетельствуют о том, что РС поддается эффективному лечению у людей при введении липосомальной композиции пептида ОБМ, представленного в данном документе.
Пример 7 - Лечение испытуемых мужчин с диагнозом рассеянный склероз инкапсулированными в липосомы пептидами ОБМ
Больной МКЕ, 36 лет, с диагнозом рассеянный склероз, церебро-спинальная форма, ремитирующее течение, стадия обострения процесса. Неоднократно лечился кортикостероидными препаратами. Длительность заболевания 3 года. Неврологический статус: горизонтальный нистагм при взгляде вправо, сухожильные рефлексы живые, на ногах S Осмотр окулиста: побледнение височных половин дисков зрительных нервов. При исследовании МНПК пациента у него была выявлена активность Т-лимфоцитов в отношении ОБМ с индексом стимуляции (ИС) 7,45. Уровень аутоантител IgG составил 75 Ед/мл. С согласия пациента ему были проведены внутривенные инъекции прототипа композиции пептида 1 раз в 2 недели по 500 мг. Через каждые 7 дней после каждой инъекции у пациента отбирались пробы периферической (венозной) крови на предмет изменений активности Т-лимфоцитов в отношении ОБМ и уровня аутоантител. На протяжении 7 недель клиническая картина умеренно ухудшалась. Уровень IgG составил к 4 неделе 112 Ед/мл, а ИС Т-лимфоцитов увеличился вдвое. После этого, в связи с неэффективностью предыдущей терапии, пациенту с его согласия назначено лечение липосомальной композицией трипептида ОБМ, описанной выше. Пациенту вводили 100 мг композиции раз в две недели в течение двенадцати недель (всего 6 инъекций). На 3-й неделе после начала терапии с помощью липосомальной композиции трипептида ОБМ наступили признаки ремиссии. Уровень IgG составил к 8 неделе 25 Ед/мл, а ИС Т-лимфоцитов уменьшился втрое по отношению к ИС, измеренному перед началом лечения. Нормализовались мочеиспускание и походка. В позе Ромберга устойчив. Пяточно-коленную пробу выполняет четко. Оценка по шкале EDSS 5 баллов. Данные результаты свидетельствуют о том, что РС поддается эффективному лечению у людей при введении липосомальной композиции пептида ОБМ, представленного в данном документе. Пример 8 - Определение подходящей модели грызунов для исследования рассеянного склероза ЭАЭ можно индуцировать многим видам с помощью иммунизации миелиновых антигенов, которые выступают в качестве модели для рассеянного склероза (РС). Эти модели РС, хотя используются во многих исследованиях, не являются полностью подходящими для заболевания РС. Например, ряд исследований, показывающих эффективность предлагаемой РС терапии на модели животных ЭАЭ-индуцированных, не сумели перевести на положительный эффект, и даже вызвать обострение, при лечении больного человека РС (Hohlfeld and Wekerle, Proc Natl Acad Sci U S A 2004; 101:14599-606). Таким образом, тщательное изучение моделей ЭАЭ-индуцированных грызунов было проведено с целью идентификации системы большего соответствия спектра аутоантител к ОБМ (autoAb), присутствующих у пациентов с РС. Эпитопный банк ОБМ, представляющий фрагменты этого нейроантигена, сливающегося с носителем белка тиоредоксина носителем, был подготовлен заранее (Belogurov AA и соавторы, J Immunol 2008; 180:1258-67, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Сообщалось, что характер autoAb привязки к эпитопному банку ОБМ может рассматриваться в качестве молекулярной сигнатуры, или снимка патогенного ответа В-клеток на РС. Чтобы определить наиболее релевантную модель грызунов для испытания препарата от РС, ЭАЭ был индуцирован трем видам грызунов: мыши линии SJL и C57BL/6, а также крысы линии DA (фиг.1B). Эпитопный банк ОБМ был протестирован посредством гибридизации с анти-МВР и анти-с-Myc мАт (фиг.1А) для определения анти-ОБМ аутоантител, связывающего паттерн ЭАЭ-индуцированных моделей грызунов. Данный связывающий паттерн был затем подвергнут сравнению с анти-ОБМ аутоантителу, связывающего паттерн, определенный для 12 пациентов с РС. Все исследования на животных были проведены на животных объектах Медицинского центра Асаф Арофэ (г. Зерифин, Израиль) с использованием стандартных утвержденных практик по уходу за животными. Индукция ЭАЭ выполнялась на 8-9 неделях жизни крыс самок линии Dark Agouti (DA). Для вызывания ЭАЭ крысам в основание хвоста подкожно вводили 200 мкл инокулята, содержащего 50 мкг пептида ОБМ (63-81) (ANASPEC), в физиологическом растворе смешивали (1:1) с CFA, (IFA, Sigma) и 1 мг Mt (штамм H37 RA; лаборатории Difcо, Детройт, штат Мичиган). В исследование были включены животные с развивающимися симптомами РС. Крыс лечили различными композициями липосом (таблица 3), копаксоном или плацебо (наполнитель) в аналогичных условиях в течение 6 дней. Все препараты вводили путем подкожной инъекции один раз в день. Животных наблюдали вплоть до 28-го дня после индукции ЭАЭ. Оценка клинических признаков осуществлялась ежедневно на протяжении всех периодов исследования. Распределение баллов было следующим: 0 – норма, 1 - вялость хвостовой части, 2 - слабость или парезы задних конечностей, 3 - паралич задних конечностей, волочение задних конечностей, 4 - полный паралич, неспособность двигаться, 5 - смерть. СПФ самки мышей линии SJL, возраст 6-8 недель, были иммунизированы согласно установленному протоколу (Coligan JE, Current protocols in immunology. [New York]: Wiley, 1996, p. Suppl. 19, Unit 5.1 & Suppl. 21, Unit 2.8) 50 мкг бычьего ОБМ в состоянии полного адъюванта Фрейнда, содержащего 2 мг/мл M. tuberculosis. СПФ самки мышей линии C57BL/6, в возрасте 6-8 недель, были иммунизированы согласно установленному протоколу (Oliver AR и соавторы, J Immunol 2003; 171:462-8) с рекомбинантным внеклеточным доменом MOG, введенной в объеме 100 мкг каждой мыши при состоянии полного адъюванта Фрейнда, содержащего 0,5 мг/мл M. tuberculosis. В период с 14 и 28 день после второй иммунизации мыши с выраженными клиническими симптомами были подвергнуты эвтаназии и их сыворотки были отобраны для анализа. 10 мл проб крови, взятых у 12 пациентов с возвратно-ремиттирующим РС, были получены из Московского центра изучения множественного склероза в городской больнице № 11. Возраст пациентов с РС: от 23 лет до 61 года (средний возраст 32,2 года). Их показатели по расширенной шкале инвалидности (EDSS) варьировались от 0 до 4 (в среднем 2,0). EDSS оценивается по шкале от 0 до 10, где высокие деления указывают большую инвалидность. Ни один из пациентов не проходил лечение кортикостероидами, по крайней мере за месяц до отбора проб крови (Kurtzke JF, Neurology 1983; 33:1444-52). Все пациенты подписали заявление о согласии согласно нормативным правовым актам Министерства здравоохранения Российской Федерации, утвержденным Комитетом по этике городской больницы № 11. Для определения анти-ОБМ аутоантитела, связывающего паттерны в сыворотке, отобранной у ЭАЭ-индуцированных моделей грызунов и больных с РС человека, эксперименты ELISA проводились нижеописанным образом. Пластины микротитратора (MaxiSorp-Nunc) покрывались 50 мкл 10 мкг/мл раствора ОБМ или рекомбинантными пептидами ОБМ в 100 мМ карбонатном/бикарбонатном буфере с pH 9,0, в нечетных лунках столбиков. Пластины герметизировали при помощи герметика ELISA ("Costar") и инкубировали при температуре 4°С в течение ночи, а затем промыты (300 мкл/лунку) три раза в забуференном фосфатом физиологическом растворе (PBS), содержащем 0,15% Твин-20. Затем все лунки блокировали при помощи 250 мкл 2% бычьего сывороточного альбумина (БС) ("Sigma") в карбонатном/бикарбонатном буфере с рН 9,0 и инкубировали в течение 1 часа при температуре 37°С. Пластины промывали ЗФР, содержащим 0,15% Твин-20. Сывороточные антитела разводили в ФСБ, содержащем 0,15% Твин-20 и 0,5% БСА при конечном разведении соотношение составляло 1:1000-1:50000. 50 мкл разведенного образца добавляли в каждую лунку пластины. В качестве контроля использовали крысиное анти-ОБМ моноклональное антитело (ab7349, Abcam). Пластины инкубировали в течение 1 ч при температуре 37°С, промывали три раза ФСБ с 0,15% твина-20. В каждую лунку буфера добавляли 50 мкл козьего анти-целостный анти-крысиный IgG, конъюгированный с пероксидазой хрена (A9037. "Sigma"), разведенного в пропорции 1:4000, и инкубировали в течение 1 ч при температуре 37°С. После пяти промывок в ФСБ, содержащем 0,15% Твин-20, в каждую лунку добавляли 50 мкл тетра-метил-бензидина и хранили в темном месте на протяжении 5-15 мин. Реакцию прекращали с помощью 50 мкл/лунку 10%-ой фосфорной кислоты. Значения OD450 были измерены с использованием планшет-ридера Varioscan ("Thermo", США). Согласно реакции autoAb: одна иммунодоминантная область, ОБМ (124-147) была выявлена у мышей линии C57BL/6; две у мышей линии SJL, ОБМ (24-44) и ОБМ (72-139); и две у крыс линии DA; ОБМ (40-60) и ОБМ(107-170). Два последних коррелируются с человеческим паттерном РС, в том числе два фрагмента ОБМ (43-64) и ОБМ (115-170), свидетельствуя о том, что иммунологический ответ, увиденный у крыс линии DA, индуцированных ЭАЭ, существенно соответствует в качестве модели для человеческого РС. Для дальнейшего анализа были отобраны три пептида: ОБМ (46-62) (“ОБП1”); ОБП (124-139) (“ОБП2”); и ОБП (147-170) (“ОБП3”), которые были наиболее иммунодоминантными и у людей, больных РС, и крыс линии DA. Важно отметить, что миелиновые-специфические CD4+ Т-клетки с высокой авидностью, описанные Белековой и соавт. (Bielekova B и соавторы, J Immunol 2004; 172:3893-904, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей), обладают реактивностью по отношению к пептидам ОБМ 111-129 и 146-170, которые перекрываются фрагментами ОБМ, определенными в настоящем исследовании, демонстрируя перекрестную реактивность между этими Т- и В-клеточными эпитопами. Пример 9 - ЭАЭ крысы линии DA, иммунизированные MBP63-81, выделяющего анти-ОВР аутоантитела, распознающие энцефалитогенные и С-концевые пептиды ОБМ Ранее способность индуцирования ЭАЭ у крыс линии DA наблюдалась лишь у GPBP (62-84") и, в меньшей степени, у GPBP (68-88) (Miyakoshi А. и соавт. J Immunol 2003; 170:. 6371-8). Однако, учитывая, что энцефалитогенный пептид ОБМ (81-104) играет важную роль при оценке РС (Aharoni R. и соавт,. J Neuroimmunol 1998; 91:135-46), протокол иммунизации, который приводит к воспроизводимо высокому уровню аутоантител по отношению к С-концевому фрагменту, и энцефалитогенные области ОБМ стали предметом желаний. Для обеспечения распространения эпитопа, который является отличительной чертой РС, входящего в патогенез ЭАЭ модели грызунов, гомогенат спинного мозга был исключен из гомогената, используемого в настоящем исследовании. Кратко говоря, крысы линии DA были иммунизированы пептидом ОБМ (63-81") с тем, чтобы достичь желаемых патологий ЭАЭ. Анализ сывороточных антител, взятый у крыс линии DA после иммунизации, выявил повышенную реакцию аутоантител к трем фрагментам ОБМ: MDHARHGFLPRH (SEQ ID NO:6); QDENPVVHFFKNIV (SEQ ID NO:7) и IFKLGGRDSRSGSPMARR (SEQ ID NO:8). Специфичность поликлональных IgG аутоантител от ОБМ определяли в соответствии с привязкой к эпитопному банку ОБМ, а дальнейший теоретический расчет основан на предположении о наличии перекрытия пептидов (фиг.2A). Не было выявлено никакой существенной активности сывороточного autoAb у ЭАЭ-индуцированных крыс линии DA крыс в отношении ОБМ (63-81). Поскольку пептид ОБМ (63-81) был использован в качестве антигена, это предлагает участие распространения эпитопа во время развития ЭАЭ у крыс линии DA. Это наблюдение также основывается согласно ранее полученными данным о том, что ОБМ (62-75), один из основных энцефалитогенных пептидов у крыс линии DA, не является иммунодоминантным, как это было определено Sercarz и соавт. (Sercarz EE и соавторы, Annu Rev Immunol 1993; 11:729-66, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Для количественной оценки распознавания аутоантителом выявленных эпитопов ОБМ и подтверждения их последовательности в состоянии in vitro, аффинность поликлональных сывороточных антител от ОБМ, выделенных из иммунизированных крыс линии DA для получения биотинилированных пептидов ОБМ, была определена с помощью поверхностного плазмонного резонанса (фиг.2B). Эффективная константа диссоциации полноразмерного белка ОБМ (1,5×10-8) была определена в наномоль в качестве константы диссоциации для энцефалитогенных ОБМ (9,6×10-9) и C-конечных (8,4×10-9) фрагментов, тем самым осуществляя проверку их идентичности, как основных эпитопов В-клеток. Привязки к пептиду с последовательностью MDHARHGFLPRH (SEQ ID NO:6) не было обнаружено, и, таким образом, он был исключен из дальнейшей оценки в данном исследовании в качестве биомаркеров для определения прогрессии ЭАЭ. Все резонансные измерения поверхностного плазмона проводились на аппарате Biacore Т-200 ("GE Healthcare", США). Биотинилированные пептиды ОБМ (50 мкг/мл) (перечисленные на фиг.2) и ОБМ иммобилизовали на чипах СА и СМ-5, соответственно. Все процедуры были выполнены согласно рекомендациям завода-изготовителя. Скорость потока HBS-EP буфера выставлена на отметке 10 мкл/мин для всех измерений. Антитела (50 мкг/мл) были протестированы на обоих чипах на протяжении стандартного времени ассоциативной/диссоциативной реакции, равного 300/300 сек. Константы диссоциации были рассчитаны с использованием пробного ПО версии 1.0 на аппарате BIACORE T-200. Пример 10 - Введение ОБМ-производных вклеточных эпитопов, инкапсулированных в маннозилированную SUV липосому, значительно улучшает ЭАЭ в крысиной модели РС Лечение ЭАЭ у крыс Льюиса уже выполнялось ранее с помощью инкапсулированных миелиновых аутоантигенов, отличных от тех, которые предусмотрены в настоящем документе (см. St Louis J. и соавт., J Neuroimmunol 1997; 73:90-100; и Avrilionis and Boggs, J Neuroimmunol 1991; 35:201-10, содержание которых включено в данное описание посредством ссылки во всей своей полноте для любых целей). В то же время группа Nagelkerken показала, что введение маннозилированного АФА M-PLP139-151 стимулирует пептид-специфическую устойчивость к ЭАЭ у мышей линии SJL (Luca ME и сооавт., J Neuroimmunol 2005; 160:178-87, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Вновь выявленные антигены В-клетки пептидов ОБМ, пептиды инкапсулированы в малые липосомы однослойных везикул (SUV), несущих остатки маннозы на своей поверхности. Главная польза такого подхода заключается в том, что иммунодоминантные немодифицированные пептиды находятся в исходной форме внутри липосомы, в то время как доставка в антигенпредставляющие клетки (АПК) усиливается за счет поверхности, подвергшейся воздействию маннозы. АПК имеют высокий уровень маннозных рецепторов на своей поверхности, укрепляя тем самым эндоцитоз маннозилированных частиц липосомы в цитозоле (Keler T. и соавт., Expert Opin Biol Ther 2004; 4:1953-62, содержание которой включено в данное описание посредством ссылки во всей своей полноте для любых целей). С другой стороны, введение катионных липосом, лишенных маннозы, может значительно увеличить ответную реакцию антитела, как это описано у Дуровой и ее соавторов, в отношении "вакцины против ВИЧ" (Durova OM и соавт., Mol Immunol 2009; 47:87-95, раскрытие информации которой включено в данное описание посредством ссылки во всей своей полноте и для любых целей), и не должно применяться для индукции состояния аутотолерантности. Липосомы собирались из смеси яичного фосфатидилхолина (ФХ) и одного молярного процента маннозилированной липосомы DOG (ManDOG) (Durova OM, supra). Молекулы SUV липосом собирали так, как это показано на фиг.3: (i) формирование нетипичных липидных слоев в процессе испарения органического растворителя, с последующей регидратацией, которая приводит к образованию многослойных липосомов многослойной везикулы (MLV); (ii) гомогенизация под высоким давлением, в результате которой образуется полая липосома SUV; (iii) сублимационная сушка SUV липосом с пептидами - на этой стадии пептиды расположены между сжатыми SUV липосомами; и (iv) инкапсуляция пептидов во время повторной регидратации в SUV липосомах, средний диаметр которых составляет примерно 60-100 нм, содержащих 1,0% остатков маннозы на своей поверхности. В данном исследовании использовались четыре композиции: каждый пептид ОБМ В-клеточного эпитопа (ОБМ1, ОБМ2 и ОБМ3) по отдельности и в смеси из всех трех пептидов в пропорции 1:1:1(по массе). Небольшие однослойные везикулы (SUV) получали из яичного фосфатидилхолина (ФХ) и маннозилированной липосомы DOG (Espuelas S. и сооавт., Synthesis of an amphiphilic tetraantennary mannosyl conjugate and incorporation into liposome carriers, 2003 Bioorg Med Chem Lett., Aug 4; 13(15):2557-60, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей) (молярная концентрация 1:100) посредством гомогенизации под высоким давлением (Durova OM, supra). Говоря короче, липидная смесь (100 мг/мл) была высушена в CHCl3 в вакууме, далее заново суспендирована в Milli-Q воде до получения конечной концентрации липида, равной 50 мг/мл, с последующей гомогенизацией под высоким давлением (20000 фунт/кв. дюйм). Причиненные в результате SUV липиды были смешаны с пептидами (соотношение липидов и пептидов 330:1) вместе с избытком сахара (соотношение лактозы и липида 3:1) с последующей лиофильной сушкой. После регидратации при контролируемых условиях, полученные в результате SUV липосомы промывали путем центрифугирования для удаления материалов, не входящих в состав включенных материалов. Промытые гранулы ресуспендировали в ФСБ до получения требуемого объема дозы. Включения пептида оцениваются на основании обращенно-фазовой ВЭЖХ с использованием линейного градиента ацетонитрила, нанесенного на колонку C18. Средний z-диаметр и дзета-потенциал липосом измерялись на устройстве Zetasizer Brookhaven ZetaPlus при 25°С путем разбавления 20 мкл дисперсии до требуемого объема, используя ФСБ или соответствующее средство. Для проверки терапевтического потенциала четырех композиций, крысам линии DA, представленным с индуцированной ЭАЭ, подкожно вводили одну из четырех маннозилированных липосомальных композиций, копаскон (положительный контроль), свободный (некапсулированный) пептид ОБМ1 (отрицательный контроль) и полые маннозилированные липосомы (контроль носителем; таблица 3).
(нм)
(мВ)
(%)
Лечение каждой крысы начинали при проявлении первого клинического признака ЭАЭ. Как видно из таблицы 4, лечение при помощи препаратов липосомного пептида ОБМ1 и ОБМ1/2/3 значительно сократило максимальный и общий индекс заболевания у ЭАЭ-индуцированных крыс линии DA. Кроме того, была снижена смертность во всех группах, получивших липосомальные пептиды ОБМ (ОБМ2 SUV - 1/11; все ОБМ SUV - 1/54), по сравнению с группой, получавшей "пустой" проводник липосомы (3/17). Одна смерть произошла также в группе, получавшей свободный ОБМ1 (1/15).
Средний индекс заболевания и скорость глиоза / демиелинизации были определены для каждой группы, проходящей лечение, как это показано на фиг.4. Как можно видеть, лечение с помощью липосомальных составов ОБМ1 обеспечило наибольшее снижение при максимальном индексе заболевания во время первоначального приступа (панель 4А). Лечение липосомальными составами ОБМ2 и ОБМ3 ограничило прогрессирование болезни в период ремиссии (панели 4C и 4D). Введение липосомальной композиции смеси всех трех пептидов ОБМ существенно мелиорируемого ЭАЭ затяжного характера, снижающий общий профиль заболевания (панель 4E).
Лечение свободным пептидом ОБМ1 не представил каких-либо полезных эффектов (панель 4G), в то время как лечение копаксоном привело к мелиоративной скорости возникновения ЭАЭ аналогично лечению препаратом ОБМ1/2/3 SUV (панель 4F). Однако, пациеты, прошедшие лечение копаксоном, не полностью оправились от ЭАЭ после первой атаки, также как и крысы, получавшие липосомальный препарат ОБМ1/2/3 SUV. Эти данные соответствуют репрезентативному окрашиванию гематоксилином и эозином и рассчитанному индексу глиоза/демиелинизации (фиг.4, правые панели). Кроме того, ОБМ1 и ОБМ1/2/3 SUV значительно снизили средний максимальный индекс заболевания и срединные индексы кумулятивных заболеваний, предполагая их высокий терапевтический потенциал (таблица 4).
Пример 11 - Липосомальные пептиды ОБМ блокируют развитие ЭАЭ путем понижающей регуляции Th1 цитокинов и вызывают выработку нейротрофического фактора головного мозга в ЦНС
Для исследования иммунологического статуса ЭАЭ -индуцированных крыс линии DA после лечения липосомно-инкапсулированными пептидами ОБМ, сыворотка, выделенная из крыс, прошедших лечение, согласно примеру 10 была проанализирована на наличие анти-ОБМ антител и было произведено окрашивание цитокинов ЦНС (фиг.5). Значительное снижение анти-ОБМ концентрации autoAb наблюдалось в сыворотке крыс, получавших липосомно-инкапсулированные пептиды ОБМ, по сравнению с сывороткой крыс, прошедших лечение методом отрицательного контроля наполнителем (фиг.5A). Уровни аутоантител, специфичные для основных идентифицированных эпитопов ОБМ В-клеток, а также аутоантител, реакционноспособных в отношении полноразмерного ОБМ. Примечательно, что эпитопы ОБМ (81-103) отсутствовали во всех липосомальных препаратах, хотя концентрация аутоантител, распознающих этот эпитоп, была снижена до той же степени, что и у аутоантител, распознающих полноразмерный протеин ОБМ. Таким образом, можно сделать вывод, что наблюдаемый эффект не может быть объяснен примитивной нейтрализацией патогенных антител в кровотоке.
Композиции пептидов ОБМ, описанные в данном документе, могут частично действовать через механизм с участием аутореактивных Т-клеток, за счет перекрытия В- и Т-клеточных эпитопов (Belogurov A. и др., Bioessays 2009; 31:1161-71, содержание которого включено в данное описание посредством ссылки во всей своей полноте для любых целей). Для исследования такой возможности, окрашивание для Th1 цитокинов проводилось на образцах, отобранных у ЭАЭ-индуцированных крыс линии DA, прошедших лечение согласно примеру 10 (фиг.5B). Было обнаружено, что уровни IL-2 и IFNγ были значительно снижены у крыс, прошедших лечение липосомальными препаратами с пептидом ОБМ (таблица 5), предполагая специальные функции препарата, такого как противовоспалительные препараты. Пониженная демиелинизация наблюдалась также у ЭАЭ-индуцированных крыс линии DA, прошедших лечение липосомальными композициями пептида ОБМ. Это наблюдение соотносится с повышенной выработкой нейротрофического фактора головного мозга (фиг.5B), предполагая, что липосомно- захваченные пептиды ОБМ функционируют посредством механизма, который аналогичен копаксону, который, как известно, повышает экспрессию нейротрофического фактора головного мозга (Aharoni R и др., Proc Natl Acad Sci USA 2003; 100:14157-62).
Анализ гистологии и окрашивание цитокинами проводили следующим образом. Мы собрали спинной мозг животных, залили их парафином, расчленили на ломтики и окрасили с помощью Н & Е и Luxol fast blue (LFB). Гистологические параметры: сорт глиоза (балловая оценка от 0 до 3; 0 означает отсутствие глиоза, 1 - легкий глиоз (до 5-10 клеток), 2 - умеренный глиоз (между 10-50 клеток в фокусе) и 3 - тяжелый глиоз (более 50 клеток в фокусе). Степень индекса демиелинизации оценивается от 0 до 3; 0 соответствует отсутствию демиелинизации, 1 - легкой демиелинизации, 2 - умеренной демиелинизации и 3 - тяжелой степени демиелинизации. Окрашивание цитокинов IL-2, IFNγ и BDNF проводили согласно протоколу, предоставленному разработчиком.
Настоящие исследования выявили две иммунодоминантные области ОБМ у ЭАЭ-индуцированных крыс линии DA, которые также были выявлены у пациентов с РС. При введении пептидов, заключенных в маннолизированные липосомы, которые соответствуют этим иммунодоминантным областям, значительно снижает ЭАЭ у крыс линии DA, уменьшая первый приступ и увеличивая восстановление от обострения. Было установлено, что эти композиции понижают регуляцию Th1 цитокинов, индуцируют экспрессию нейротрофического фактора головного мозга и ингибируют выработку анти-ОБМ антитела (таблица 5). Не будучи связанными с какой-либо теорией, один из возможных механизмов действия для этого терапевтического эффекта заключается в том, что остатки маннозы присутствуют на поверхности липосом, нагруженных пептидами ОБМ, увеличивает потребление инкапсулированных в липосомы пептидов ОБМ в клетках АПК, которое в свою очередь приводит к увеличению индукции толерантности по отношению к основному белку миелина и последующей мелиорации заболевания. Наблюдаемый положительный эффект инкапсулированных в липосомы фрагментов ОБМ лучше всего отслеживается на стадии прогрессирования заболевания с ЭАЭ у крыс линии DA, в сочетании с иммунологическими сходствами между ЭАЭ-индуцированными крысами линии DA и человеческимих пациентами с РС, предполагая новое лечебное воздействие для лечения РС.
Пример 12 - Терапевтическая эффективность инкапсулированных в липосомы пептидов ОБМ у моделей крыс с РС (DA-ЭАЭ-28-01)
Для оценки использования пептидов ОБМ В-клеточного эпитопа при лечении РС, проводилось исследование на ЭАЭ-индуцированных крысах линии DA. Цели данного исследования: 1) подтвердить терапевтическую эффективность пептида ОБМ1; 2) определить, обеспечивает ли SUV инкапсуляция дополнительную терапевтическую пользу; 3) определить, обеспечивает ли MSL на основе SUV препарата дополнительную терапевтическую пользу; 4) определить, обеспечивает ли добавление фланкирующих областей пептида ОБМ1 дополнительную пользу смеси в SUV; 5) определить, обеспечивает ли добавление фланкирующих областей пептида ОБМ1 дополнительную пользу смеси для MSL на основе SUV; 6) сравнить активность пептида ОБМ1/ОБМ1FL/ОБМ1FR для препарата SUV MSL при использовании обостренной модели ЭАЭ у самок крыс линии Dark Agouti (DA).
Каждый из семи оцениваемых липосомальных препаратов был предоставлен в виде лиофилизированного порошка и хранился при температуре 4°C. Регидратация каждой суточной дозы группы выполялась водой для инъекций в соответствии с таблицей 6. Препараты с пептидом ОБМ повторно суспендировали в воде для инъекций (лекарство медицинское), а копаксон (Teva LTD) разводили физиологическим раствором до достижения концентрации 150 мкг/мл. Каждому испытуемому животному вводили тестовый препарат в течение 6 дней подряд путем подкожной инъекции.
В качестве подопытных использовались самки крыс линии Dark Agouti (DA) 9 недельного возраста (Harlan Laboratories, Inc.), весом 125-145 грамм. Состояние здоровья животных, используемых в данном исследовании, было проверено по прибытию. Только здоровые животные прошли акклиматизацию к лабораторным условиям и использовались при исследовании. Животных держали на протеиновой диете, разработанной для грызунов (Teklad), в неограниченном количестве и предоставляли им свободный доступ к питьевой воде. Животных содержали в управляемой среде при температуре 20-24°С с относительной влажностью 30-70%, 12 ч при дневном свете/12 ч в темноте. Животные были случайным образом распределены на соответствующие тестовые группы. Данное исследование было проведено после рассмотрения Комитетом по этике поведения руководством по содержанию и использованию лабораторных животных в медицинском центре "Асаф Арофэ", Беэр-Яаков, комиссия по этике №: 68/2009.
Для вызывания ЭАЭ крысам в основание хвоста подкожно вводили 200 мкл инокулята, содержащего 50 мкг пептида ОБМ (63-81) (ANASPEC), в физиологическом растворе смешивали (1:1) с CFA, (IFA, Sigma) и 1 мг Mt (штамм H37 RA; лаборатории Difcо, Детройт, штат Мичиган).
Крысы подвергались оценке ежедневно, первый раз через 24 часа после иммунизации. На 8-й день после иммунизации более чем у 50% крыс развились признаки паралича. Животные с симптомами РС были разделены на 9 групп для начала курса лечения. До начала курса лечения у двух крыс из каждой группы брали кровь. На 9 и 10 день после иммунизации у 55 из 60 крыс развились признаки паралича.
Через 7-10 дней после вызывания развития ЭАЭ, 54 животных разделяли на 9 групп (6 крыс в каждой), и до начала лечения мы брали кровь у 2 крыс из каждой группы. Каждая группа крыс подвергалась лечению один раз в день при помощи лекарственного препарата согласно таблице 7 на протяжении 6 дней подряд. Препараты вводились посредством подкожной инъекции в нижнюю область брюшной части. Кровь у всех крыс отбирали через 24 ч после последнего введения препарата. Животных держали под наблюдением 28 дней после введения ЭАЭ. Клинические показатели присваивались ежедневно в течение периода исследования. Животных умерщвляли через 28 дней после введения ЭАЭ, плазма крови и сыворотка были забраны из сердец крыс. Животных подвергали перфузии 4% PFA, головной и спинной мозг собирали и держали в 4%-ном формалине.

Животные наблюдались в индивидуальном порядке, и клинические признаки регистрировались один раз в сутки на протяжении всех периодов исследования. Наблюдения включали изменения в меховом покрове, глазах, частоте дыхания, вокализации, параличе, активности и характере поведения. Подсчет баллов признаков паралича, связанных с РС для каждого животного осуществляли ежедневно согласно критериям, указанным в таблице 8. Вес каждого животного измерялся ежедневно на протяжении всех периодов исследования. Все животные с индексом паралича более 1 получали 2 мл воды и 2 мл повторно увлажненного белка гранулированного корма (Teklad) ежедневно, путем проведения зондового кормления.
Взятие крови на протяжении жизненного цикла: Кровь отбирали из орбитального синуса живых крыс. Кровь отбирали в пробирки 2 типов: ЭДТА пробирка и 2-мл пробирка Эппендорфа. Отделенная плазма и сыворотка каждого животного были дополнительно оценены на концентрации цитокина IL-2, IL-4, IL-10, IL-17, ФНО-альфы, IFN-гаммы (гаммы-интерферона) и TGF-бета с помощью метода ELISA. Взятие крови во время фазы завершения: Сразу же после умерщвления мы брали кровь из сердец крыс в пробирки 2 типов: ЭДТА пробирка и 2 мл пробирка Эппендорфа. Сыворотка и плазма были отделены и сохранены при -20°C.
После умерщвления с помощью 0,5 л 4% ПФА осуществлялись перфузии. Непосредственно после взятия крови сосудистую систему промывали 20 мл физиологического раствора, а 0,5 л ПФА подвергали перфузии с использованием 180-200 мм рт.ст. через правую камеру сердца. Головной и спинной мозг каждого животного собирали и фиксировали в 4% формальдегиде. Ткани иссекали, заливали парафином, толщина среза составляла примерно 5 мкм, и окрашивали гематоксилином и эозином (H&E) и методом окрашивания Шифф-иодной кислотой (PAS окрашивание).
Результаты
Как показано в таблице 9, смертность произошла в группах, получавших свободный ОБМ1 (группа 1; 1/6), (группа 2; 1/6) и группа 3; 2/6), копаксон (группа VIII; 2/6) и воду д/и (группа IX; 2/6). И наоборот, ни одна крыса не умерла в группах, получавших (группы IV-VII, соответственно).
Статистически значимое снижение индекса паралича, по сравнению с другими группами, наблюдалось у крыс, получавших препараты, содержащие протеины В-клеточного эпитопа ОБМ1/ОБМ1FL/ОБМP1FR в маннозилированных липосомах (группа IV), на 3 и 4 день после начала лечения (фиг.6A; (x)).
Увеличение массы тела всех животных было установлено в пределах диапазона значений, обычно ожидаемых во время периода акклиматизации. Снижение массы тела наблюдалось во время пика заболевания у животных всех групп. Увеличение массы тела произошло после пикового периода заболевания во всех группах. Никаких статистически значимых различий по любым из измерений массы тела не было обнаружено между группами, проходящими лечение, и контрольными группами (фиг.7).
Никаких статистически значимых различий до и после лечения, а также между группами, прошедшими лечение тестируемыми препаратами, на уровнях IL-2, IL-4, IL-10, IL-17, TNF-альфа, IFN-гамма и TGF-бета обнаружено не было. Сравнение различий по уровням цитокинов между группами, прошедшими лечение препаратами, содержащими пептид ОБМ, и контрольными группами не имело статистически значимых показателей.
Чтобы оценить миелинизацию у ЭАЭ-индуцированных крыс, прошедших лечение препаратами I-IX, гистология была выполнена вслепую одним патологоанатомом, т.е. он не знал, какие животные прошли курс лечения и каким веществом. Результаты сравнили с гистологией животного, не прошедшего курс лечения.
Если говорить кратко, то все препараты окрашивались контрастными веществами НЕ, периодической кислотой Шиффа (PAS) и Luxol Fast Blue (LFB). Чтобы охарактеризовать природу очагов поражения, нами были отобраны гистологические параметры. Глиоз оценивался по шкале от 0 до 3, согласно следующей шкале: 0 = глиоз отсутствует, 1 = легкий глиоз (5-10 клеток), 2 = умеренный глиоз (10-50 клеток в фокусе) и 3 = тяжелая степень глиоза (более 50 клеток в фокусе). Демиелинизация оценивалась по шкале от 0 до 3, согласно следующей шкале: 0 = демиелинизация отсутствует, 1 = легкая демиелинизация, 2 = умеренная демиелинизация и 3 = тяжелая степень демиелинизации. Дополнительные очаги поражения также были отмечены, при их наличии.
Гистопатологический анализ спинного мозга у 2 случайно выбранных животных из каждой группы показал появление глиоза у всех проанализированных крыс. Тем не менее, значительное улучшение в миелинизации был замечен у обоих животных из группы IV (ОБМ1/ОБМ1FL/ОБМ1FR, инкапсулированный в маннозилированные липосомы) и у одной из крыс из группы V (ОБМ1/ОБМ1FL/ОБМ1FR, инкапсулированный в немодифицированные липосомы), по сравнению с животными из других групп. Иллюстративные паттерны окрашивания H & E показаны на фиг.8A-C.
Это исследование демонстрирует нам, что введение пептидов В-клеточного эпитопа ОБМ1, ОБМ1FL и ОБМ1FR, одновременно инкапсулированного в маннозилированную липосому, приводит к статистически значимому снижению паралича у моделей грызунов с РС. Данное исследование рассматривает эффективность различных пептидных последовательностей: ОБМ1, ОБМ1FL и ОБМ1FR в липосомальной (1% молярный маннозилированный липидный состав при соотношении пептида к липиду, равному 1:330) рецептуре. Липосомальная рецептура всех трех пептидов обладает существенно эффективной реакцией (группа 4), по сравнению с отдельными пептидами (группы 2, 3, 6 и 7) и отрицательным контролем (группа 9). Для сравнения, три пептида, сгруппированные в липосомальной композиции, не содержащей 1% молярного маннозного липида (группа 5 в сравнении с группой 4), не показывают существенной эффективности, что указывает на повышенную реакцию за счет включения маннозилированного липида. Был сопоставлен общий индекс заболевания для пептида ОБМ1 (Группа 1) или инкапсулированного пептида (Группа 2); однако гистологическое исследование для глиоза и миелинизации спинного мозга, отобранных у 2 случайно выбранных крыс из каждой группы, демонстрирует низкий показатель демиелинизации, что указывает на улучшение патологического результата для липосомальной композиции пептида ОБМ1 (Группа 2). Самый лучший (т.е. самый низкий) показатель демиелинизации был получен при введении липосомальных композиций всех трех пептидов ОБМ (Группа 4), который также привел к значительному улучшению общего индекса заболевания.
Пример 13 - Терапевтическая эффективность инкапсулированных в липосомы пептидов ОБМ у модели крыс с РС (DA-ЭАЭ-28-02)
Для дальнейшей оценки используют пептиды ОБМ В-клеточного эпитопа при лечении РС, исследование проводилось на ЭАЭ-индуцированных крысах линии DA. Mаннозилированные липосомальные композиции различных комбинаций пептидов ОБМ - ОБМ1, ОБМ1FL, ОБМ1FR, ОБМ2 и ОБМ3, были испытаны на терапевтический потенциал на ЭАЭ-индуцированной модели крыс линии DA с РС, описанной выше.
Каждый из восьми оцениваемых липосомальных препаратов был предоставлен в виде лиофилизированного порошка и хранился при температуре 4°C. Регидратация каждой суточной дозы группы выполнялась водой для инъекций в соответствии с таблицей 10. Препараты с пептидом ОБМ повторно суспендировали в воде для инъекций ("Cure Medical"), а копаксон ("Teva LTD") разводили физиологическим раствором до достижения концентрации 450 мкг/мл. Каждому испытуемому животному вводили тестовый препарат в течение 6 дней подряд путем подкожной инъекции.
В качестве подопытных использовались самки крыс линии Dark Agouti (DA) 8-9-недельного возраста (Harlan Laboratories, Inc.), весом 110-145 г. Состояние здоровья животных, используемых в данном исследовании, было проверено по прибытию. Только здоровые животные прошли акклиматизацию к лабораторным условиям и использовались при исследовании. Животным предоставляли еду в неограниченном количестве и свободный доступ к питьевой воде. Животных содержали в управляемой среде при температуре 20-24°С с относительной влажностью 30-70%, 12 ч при дневном свете/12 ч в темноте. Животные были случайным образом распределены на соответствующие тестовые группы. Данное исследование было проведено после рассмотрения Комитетом по этике поведения руководством по содержанию и использованию лабораторных животных в медицинском центре "Асаф Арофэ", Беэр-Яаков, комиссия по этике №: 830_b2451_6.
Для вызывания ЭАЭ, крысам в основание хвоста подкожно вводили 200 мкл инокулята, содержащего 50 мкг пептида ОБМ (63-81) (ANASPEC), в физиологическом растворе смешивали (1:1) с CFA, (IFA, Sigma) и 1 мг Mt (штамм H37 RA; лаборатории Difcо, Детройт, штат Мичиган).
Крысы подвергались оценке ежедневно, первый раз через 24 часа после иммунизации. На 9-й день после иммунизации более чем у 50% крыс развились признаки паралича. Животные с симптомами РС были разделены на 10 групп для начала курса лечения. До начала курса лечения у двух крыс из каждой группы брали кровь. На 9 и 11 день после иммунизации у 54 из 60 крыс развились признаки паралича.
Через 9-11 дней после вызывания развития ЭАЭ, 54 животных разделяли на 10 групп (по 5-6 крыс в каждой), и до начала лечения мы брали кровь у 2 крыс из каждой группы. Каждая группа крыс подвергалась лечению один раз в день при помощи лекарственного препарата согласно таблице 11 на протяжении 6 дней подряд. Животных держали под наблюдением 28 дней после введения ЭАЭ. Клинические показатели присваивались ежедневно в течение периода исследования. Животных умерщвляли через 28 дней после введения ЭАЭ, используя изофлуран. Сразу же после умерщвления из крысиных сердец отбиралась кровь. Сыворотка и плазма были отделены и хранились при -20°С. Животных подвергались перфузии 4% PFA, головной и спинной мозг собирали и держали в 4%-ом формалине.
Животные наблюдались в индивидуальном порядке, и клинические признаки регистрировались один раз в сутки на протяжении всех периодов исследования. Наблюдения включали изменения в меховом покрове, глазах, частоте дыхания, вокализации, параличе, активности и характере поведения. Подсчет баллов признаков паралича, связанных с РС, для каждого животного осуществляли ежедневно согласно критериям, указанным в таблице 8. Вес каждого животного измерялся ежедневно на протяжении всех периодов исследования. Все животные с индексом паралича более 1 получали 2 мл воды и 2 мл повторно увлажненного белка гранулированного корма (Teklad) ежедневно, путем проведения зондового кормления.
Результаты
Как показано в таблице 12, 1 крыса из каждой группы, получавших свободный, инкапсулированный в липосомы, ОБМ2 (группа V; 1/6), Копаксон (группа IX; 1/5) и воду д/и (группа X; 1/5) умерла.
Статистически значимое снижение индекса паралича по сравнению с контролем водой (Группа X) наблюдалось у крыс, прошедших лечение высокой дозой инкапсулированного в липосомы пептида ОБМ1 (Группа IV), на 2 и 3 дни после начала лечения (фиг.10 (Δ)).
Увеличение массы тела всех животных было установлено в пределах диапазона значений, обычно ожидаемых во время периода акклиматизации. Снижение массы тела наблюдалось во время пика заболевания у животных всех групп. Увеличение массы тела произошло после пикового периода заболевания во всех группах. Никаких статистически значимых различий между группами, которым вводили инкапсулированные в липосомы пептиды ОБМ, и контрольными группами обнаружено не было (фиг.11).
За исключением группы 2, в этом исследовании была протестирована одна липосомная композиция (1% молярная манноза липидного состава и соотношение пептида и липида 1:330) и была исследована терапевтическая эффективность различных B-клеточных эпитопов пептидов ОБМ, а также их комбинации. Следует отметить, что статистически значимое снижение индекса паралича наблюдалось у крыс, прошедших лечение 200 мкг (номинальная доза) инкапсулированного в липосомы ОБМ (46-62) (Группа 4), по сравнению с отрицательным контролем. Кроме того, не статистически значимое различие (тенденция) по индексу паралича наблюдалось у крыс, прошедших лечение 200 мг инкапсулированного в липосомы ОБМ (46-62) (Группа 4), по сравнению с крысами, прошедшими лечение копаксоном (Группа 9), на 4 и 5 день после лечения.
Профиль степени тяжести заболевания, наблюдаемый в данном исследовании, имел различные первичные и рецидивные стадии. При сравнении результатов у крыс, прошедших лечение одной и той же дозой (50 мкг/сут) инкапсулированных в липосомы одиночных пептидов ОБМ, было обнаружено, что введение ОБМ (46-62) (Группа III) обеспечило наибольшую терапевтическую пользу на первичной стадии заболевания, в то время как введение инкапсулированного в липосомы ОБМ (124-139) (Группа V) или ОБМ (147-170) (Группа VI) обеспечило терапевтическую пользу во время рецидивной стадии заболевания. Такой перекос не наблюдался в качестве абсолютного и может быть сведен на нет дозой пептида, поскольку введение высокой дозы инкапсулированного в липосомы ОБМ (46-62) (Группа 4) является наиболее эффективным на обеих стадиях. Терапевтическую пользу липосомальных композиций, содержащих множественные пептиды ОБМ, трудно объяснить, возможно, из-за низкой дозы каждого соответствующего пептида. Что касается использования одного и того же пептида, сформулированного в пропорциях с другим пептидом и липидом (сравнение Группы I и II), то мы не наблюдали никакой разницы в общем показателе степени тяжести заболевания.
Пример 14 - Терапевтическая эффективность инкапсулированных в липосомы пептидов ОБМ у модели крыс с РС (DA-ЭАЭ-28-05)
Для дальнейшей оценки используют пептиды ОБМ В-клеточного эпитопа при лечении РС, исследование проводилось на ЭАЭ-индуцированных крысах линии DA. Цели исследования включали: 1) дальнейшее подтверждение того, что липосомальные композиции ОБМ1 и ОБМ1/2/3 обеспечивают терапевтическую пользу для крысиной модели с РС; и 2) исследование терапевтического эффекта различных дозировок и соотношений пептидов и липидов для липосомальных композиций ОБМ.
Каждый из четырех оцениваемых липосомальных препаратов был предоставлен в виде лиофилизированного порошка и хранился при температуре 4°C. Регидратация препарата выполнялась водой для инъекций в соответствии с таблицей 13. Копаксон ("Teva LTD") разводили физиологическим раствором до достижения концентрации 720 мкг/мл. Каждому испытуемому животному вводили тестовый препарат в течение 6 дней подряд путем подкожной инъекции.
В качестве подопытных использовались самки крыс линии Dark Agouti (DA) 8-9-недельного возраста (Harlan Laboratories, Inc.), весом 110-145 г. Состояние здоровья животных, используемых в данном исследовании, было проверено по прибытию. Только здоровые животные прошли акклиматизацию к лабораторным условиям и использовались при исследовании. Животным предоставляли еду в неограниченном количестве и свободный доступ к питьевой воде. Животных содержали в управляемой среде при температуре 20-24°С с относительной влажностью 30-70%, 12 ч при дневном свете/12 ч в темноте. Животные были случайным образом распределены на соответствующие тестовые группы. Данное исследование было проведено после рассмотрения Комитетом по этике поведения руководством по содержанию и использованию лабораторных животных в медицинском центре "Наука в действии Лтд." (Science in action LTD, г. Рехотов. Комиссия по этике №: IL-10-11-109.
Для вызывания ЭАЭ крысам в основание хвоста подкожно вводили 200 мкл инокулята, содержащего 50 мкг пептида ОБМ (63-81) (ANASPEC), в физиологическом растворе смешивали (1:1) с CFA, (IFA, Sigma) и 1 мг Mt (штамм H37 RA; лаборатории Difcо, Детройт, штат Мичиган).
Крысы подвергались оценке ежедневно, первый раз через 24 часа после иммунизации. у 42 из 50 крыс развились признаки паралича на 6-10 день после иммунизации. Животные, у которых проявились симптомы РС, были разделены на 7 групп (по 6 крыс в каждой) для начала курса лечения. Каждая группа крыс подвергались лечению один раз в день при помощи лекарственного препарата согласно таблице 14 на протяжении 6 дней подряд. Препараты вводились посредством подкожной инъекции в нижнюю область брюшной части. Кровь у всех крыс отбирали через 24 ч после последнего введения препарата. Животных держали под наблюдением 28 дней после введения ЭАЭ. Клинические показатели присваивались ежедневно в течение периода исследования. Животных умерщвляли через 28 дней после введения ЭАЭ, плазма крови и сыворотка были забраны из сердец крыс. Животных подвергали перфузии 4% PFA, головной и спинной мозг собирали и держали в 4%-ном формалине.
Животные наблюдались в индивидуальном порядке, и клинические признаки регистрировались один раз в сутки на протяжении всех периодов исследования. Наблюдения включали изменения в меховом покрове, глазах, частоте дыхания, вокализации, параличе, активности и характере поведения. Подсчет баллов признаков паралича, связанных с РС, для каждого животного осуществляли ежедневно согласно критериям, указанным в таблице 8. Вес каждого животного измерялся ежедневно на протяжении всех периодов исследования.
Результаты
В данном исследовании ни одна крыса не умерла по истечении 28 дней после индукции ЭАЭ.
Статистически значимое снижение индекса паралича по сравнению с контролем водой (Группа 1), наблюдалось у крыс, прошедших лечение: комбинированный пептид ОБМ1 в пропорции 1:330 (пептид:липид; Группа 2), и комбинированный пептид ОБМ1/2/3 в пропорции 1:330 (пептид:липид; Группа 3) и 1:110 (пептид:липид; Группа 5, на 1-4 день после начала лечения (фиг.12). Наблюдалось не статистически значимое различие (тенденция) в индексе паралича крыс, прошедших лечение копаксоном (Группы 6 и 7), по сравнению с контролем водой (Группа 1).
Увеличение массы тела всех животных было установлено в пределах диапазона значений, обычно ожидаемых во время периода акклиматизации. Снижение массы тела наблюдалось во время пика заболевания у животных всех групп. Увеличение массы тела произошло после пикового периода заболевания во всех группах. Никаких статистически значимых различий между группами, которым вводили инкапсулированные в липосомы пептиды ОБМ, и контрольными группами обнаружено не было (фиг.13).
Данное исследование показывает, что лечение с помощью липосомно-образованных В-клеточных эпитопных пептидов ОБМ1 и солипосомно-образованных В-клеточных эпитопных пептидов ОБМ1/2/3 оказывает статистически значимый терапевтический эффект на крысиную модель РС. При более высоком соотношении пептида и липида, появляется сопоставимый препарат с ОБМ1/2/3, что обеспечит более высокие терапевтические показатели, чем у одного пептида ОБМ1. И наоборот, при низком соотношении пептида к липиду одинарные композиции ОБМ1, по-видимому, предоставляют более высокие терапевтические показатели, чем совместные композиции ОБМ1/2/3. В обоих случаях, однако, липосомно- образованные пептиды ОБМ1 обеспечили большую терапевтическую пользу, чем копаксон, терапевтически одобренный для лечения возвратно-ремиттирующего рассеянного склероза.
Следует понимать, что примеры и воплощения, описанные в данном документе, предназначены только для иллюстративных целей и что в их свете будут предложены различные модификации или изменения специалистам в данной области, и которые будут включены в пределах сущности и сфере компетенции данного применения и масштабов прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, цитируемые здесь, представлены в качестве ссылок во всей своей полноте и для любых целей.
Реферат
Изобретение относится к области биотехнологии, конкретно к получению липосом с пептидом основного белка миелина (ОБМ), и может быть использовано в медицине для лечения рассеянного склероза. Получают композицию, содержащую пептид ОБМ с SEQ ID NO: 11 или SEQ ID NO: 12, связанный с первым вектором, где вектор содержит липосому, имеющую поверхность, подверженную воздействию целевой части, которая содержит остаток маннозы или производное маннозы. Изобретение обеспечивает большую терапевтическую пользу, чем копаксон, терапевтически одобренный для лечения возвратно-ремиттирующего рассеянного склероза. 4 н. и 14 з.п. ф-лы, 14 ил., 14 табл., 14 пр.

Комментарии