Терапия и диагностика на основе белков тау-опосредуемой патологии при болезни альцгеймера - RU2645259C2
Код документа: RU2645259C2
Чертежи





































































































































































































































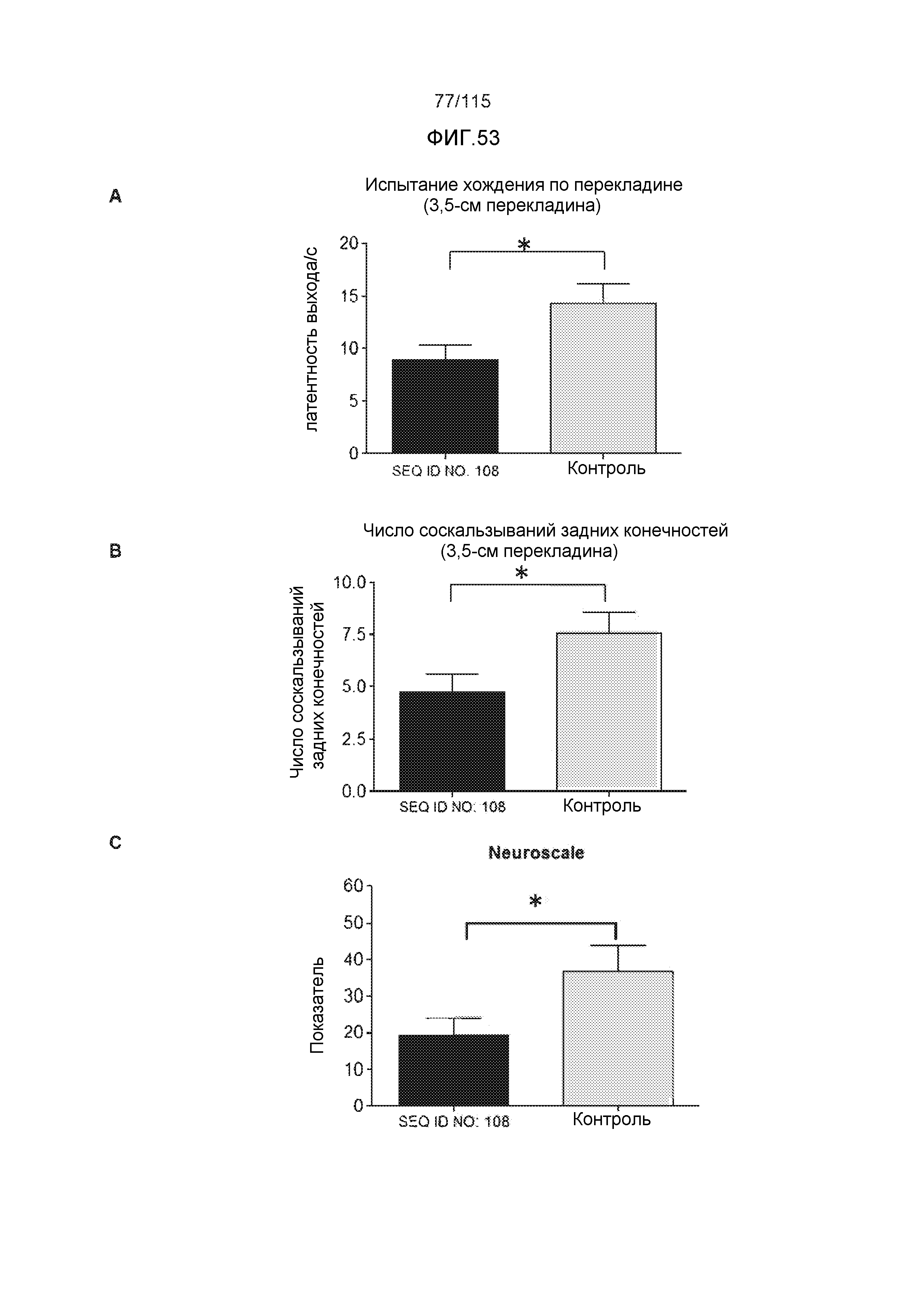
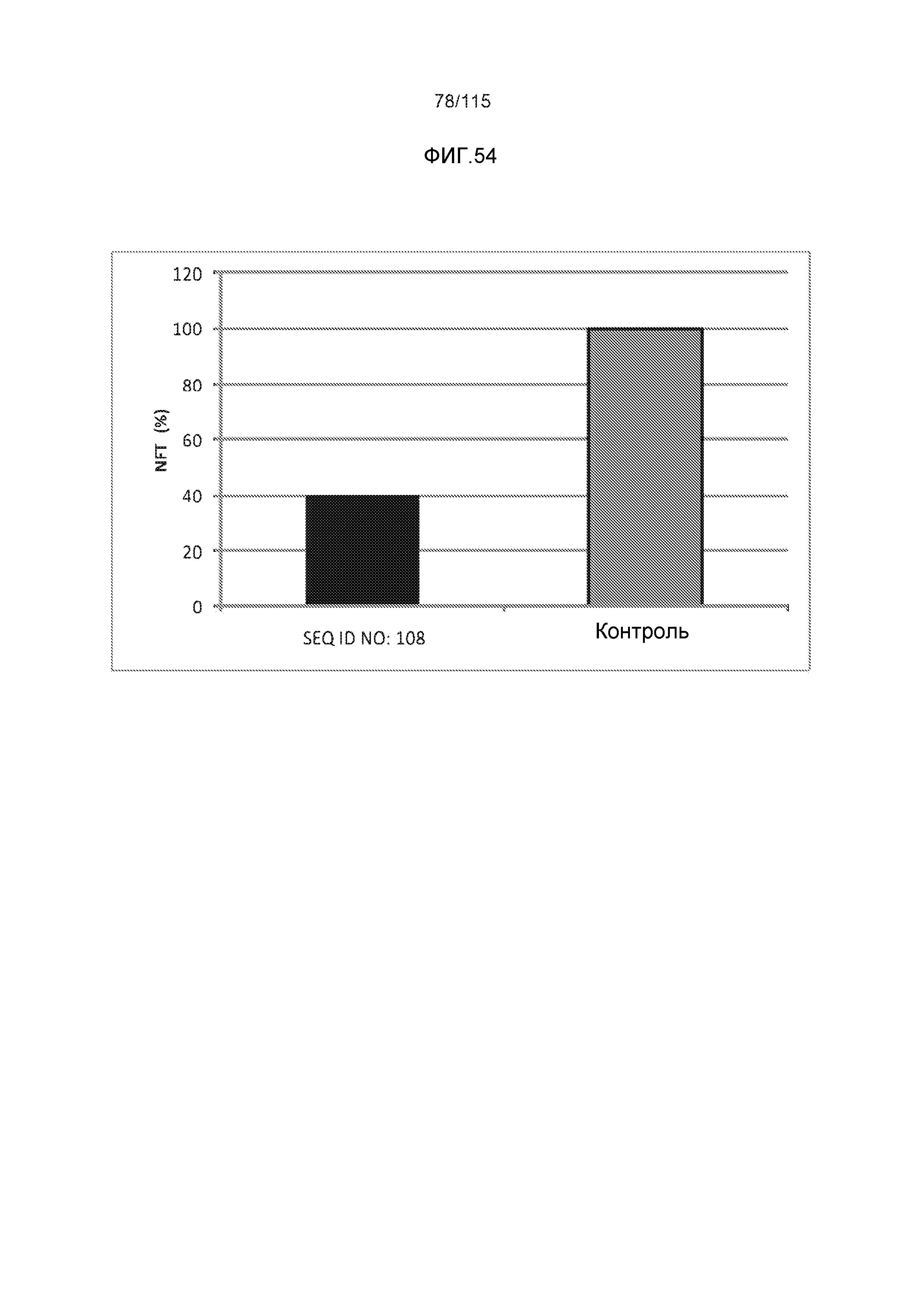


































Описание
Для настоящей заявки испрашивается приоритет по предварительным заявкам США 61/536339, поданной 19 сентября 2011 года, и 61/653115, поданной 30 мая 2012 года, содержание обеих из которых включено в настоящее описание в качестве ссылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит список последовательностей, предоставленный в формате ASCII через EFS-Web и, таким образом, включенный в качестве ссылки в полном объеме. Указанная копия ASCII, созданная 13 сентября 2012 года, названа SEQUENCE_LISTING.txt и имеет размер 155400 байт.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам и средствам на основе белков (например, антитела, пептиды) для препятствования продукции и выведения определенных форм тау-белка, которые вовлечены в стимуляцию и/или развитие патологических агрегатов тау-тау при болезни Альцгеймера, а также к способам получения антител против белка тау, которые пригодны для диагностики и лечения болезни Альцгеймера. Кроме того, изобретение относится к способам и средствам для диагностики болезни Альцгеймера, включая способы определения стадии и оценки хода лечения.
УРОВЕНЬ ТЕХНИКИ
Болезнь Альцгеймера (AD) представляет собой прогрессирующее нейродегенеративное расстройство, которое разрушает высшие структуры головного мозга, такие как структуры, вовлеченные в память и познание. Заболевание приводит к дефициту когнитивной функции и отклонениям в памяти, способности к обучению, речи и к способности выполнять намеренные и целенаправленные движения. AD также сопровождается сопутствующим поведенческим, эмоциональным, межличностным и социальным истощением. Эти когнитивные и поведенческие расстройства усложняют жизнь (Burns et al., 2002). Пациенты с AD на поздней стадии часто не способны говорить, понимать речь и осуществлять основной уход за собой, что в конечном итоге требует постоянного ухода и наблюдения, и они часто зависят от членов семей и домов инвалидов. AD является основной причиной сенильной деменции и, согласно прогнозам, его распространенность будет увеличиваться по мере роста доли пожилых людей в популяции. Согласно прогнозам, общее количество людей с AD увеличится по меньшей мере в три раза всего лишь между 2000 и 2050 годами, что делает AD общемировой проблемой здравоохранения (Sloane et al., 2002). Клиническое управление течением AD остается по большей части поддерживающим. Иными словами, пациентам проводят лечение, нацеленное на предупреждение, контроль или смягчение осложнений и побочных эффектов AD, и на повышение их комфорта и качества жизни. Все еще существует неудовлетворенная потребность в способах лечения, которые прямо нацелены на прогрессирование заболевания и имеют модифицирующие заболевание эффекты.
AD гистологически характеризуется наличием экстранейрональных бляшек и внутриклеточных и внеклеточных нейрофибриллярных узелков в головном мозге. Бляшки в основном состоят из β-амилоида (Aβ), в то время как узелки содержат патологические формы белка тау, такие как патологические конформеры белка тау и их агрегаты. Взаимосвязь между бляшками и узелками и процессом заболевания остается неясной, хотя исследования наводят на мысль о связи между патогенезом, обуславливаемым амилоидом и белком тау (Hardy et al., 1998; Oddo et al., 2004; Rapoport et al., 2002; Roberson, et al., 2007; Shipton et al., 2011). Предположение о центральной роли для Aβ в патологии AD первоначально было сделано в гипотезе, называемой "Aβ-каскадом", согласно которой после отложения Aβ следует фосфорилирование белка тау и образование узелков, а затем нейрональная гибель (Hardy and Allsop, 1991; Hardy and Selkoe, 2002; для обзора см. Walsh and Selkoe, 2004; также см. Seabrook et al., 2007). Таким образом, первоначальные терапевтические подходы для AD были сфокусированы, главным образом, на нацеливании на Aβ. Однако имеется документально подтвержденное отсутствие корреляции между степенью Aβ-патологии головного мозга у пациентов AD и клиническим прогрессированием заболевания (Braak and Braak, 1991). Кроме того, у бессимптомных индивидуумов при вскрытии выявляют обширное, часто диффузное, отложение амилоида (Braak and Braak, 1991), и уже при AD ранней стадии, утрата нейронов и отложение амилоида встречаются в различных областях головного мозга (Carter and Lippa, 2001). Таким образом, нацеливание только на Aβ не может быть достаточным для изменения процесса заболевания у каких-либо или всех пациентов. Тем не менее, наиболее передовыми нацеленными на заболевание способами терапии, которые проходят клинические испытания у пациентов с AD, остаются способы терапии, нацеленные на продукцию и выведение Aβ. Эти способы терапии включают пассивную иммунотерапию, например, бапинейзумаб, соланейзумаб и понезумаб, а также низкомолекулярный ингибитор гамма-секретазы семагацестат (для обзора см. Citron et al., 2010).
Общепризнанная роль белка тау в патологии AD была продемонстрирована в многочисленных исследованиях. Например, Braak продемонстрировал, что наибольшую корреляцию с нейродегенерацией при AD имеет присутствие узелков белка тау, а не амилоидных бляшек (Braak and Braak, 1991). В другом исследовании было выявлено, что нейротоксичность Aβ в культивируемых нейронах зависит от белка тау (Rapoport et al., 2002). В недавних исследованиях, снижение уровня эндогенного белка тау препятствовало расстройству поведения у трансгенных мышей, которые экспрессировали белок-предшественник амилоида человека, без изменения у них высоких уровней Aβ (Roberson et al., 2007). Снижение уровня белка тау также защищало как трансгенных, так и нетрансгенных, мышей от эксайтотоксичности. Там же. Santacruz et al. продемонстрировали, что снижение количества белка тау восстанавливало функцию памяти в модели таупатии (Santacruz et al., 2005).
Таким образом, терапия, нацеленная на снижение уровня тау, может представлять собой эффективную стратегию лечения AD и других связанных с белком тау болезненных состояний.
Белок тау принадлежит семейству белков с внутренней неупорядоченностью, характеризующихся отсутствием жесткой трехмерной структуры в их физиологической окружающей среде (Zilka et al., 2008). Однако укорочение и гиперфосфорилирование белка тау может вызывать патологические трансформации из состояния внутренней неупорядоченности во множественные растворимые и нерастворимые небеспорядочные структуры, включая парные спиральные филаменты (PHF) и другие агрегаты (Wischik et al., 1988a; Wischik et al., 1988b; Novak et al., 1993; Skrabana et al., 2006; Zilka et al., 2008; Kovacech et al., 2010). Эти структурные изменения приводят к токсическому увеличению функции, к утрате физиологической функции нативного белка или к обоим из них (Zilka et al., 2008; Kovacech et al., 2010).
Физиологическая функция белка тау состоит в опосредовании сборки мономеров тубулина в микротрубочки, которые составляют сеть нейрональных микротрубочек (Buee et al., 2000). Белок тау связывается с микротрубочками через повторяющиеся области, расположенные в C-концевой части белка. Там же. Эти повторяющиеся домены (R1-R4) не идентичны друг другу, но содержат 31-32 высоко консервативные аминокислоты (Taniguchi et al., 2005b). В головном мозге человека существует шесть уникальных изоформ белка тау, которые отличаются друг от друга присутствием или отсутствием определенных аминокислот в N-концевой части белка тау, в комбинации либо с тремя (R1, R3 и R4), либо с четырьмя (R1-R4) повторяющимися доменами, на C-конце белка. Также см. фиг.1, на которой показано шесть изоформ человека (2N4R, 1N4R, 2N3R, 0N4R, 1N3R и 0N3R). Было предположено, что наиболее эффективной частью белка тау, индуцирующей полимеризацию микротрубочек, является область 274-KVQIINKK-281 (SEQ ID NO: 113), перекрывающая R1-R2. Там же. Кроме того, на патологические и физиологические функции белка тау, по-видимому, влияет конкретная структурная конформация и внутренняя неупорядоченная структура, принимаемые полноразмерными изоформами белка и их фрагментами. Например, Kontsekova et al. описали конформационную область (охватывающую остатки 297-IKHVPGGGSVQIVYKPVDLSKVTSKCGSL-325 (SEQ ID NO: 114)) в определенных укороченных молекулах белка тау, которая имела значительную взаимосвязь с функцией этих укороченных молекул белка тау в отношении сборки микротрубочек (WO 2004/007547).
Полагают, что в дополнение к их физиологической роли повторы белка тау участвуют в образовании патологических агрегатов белка тау и других структур. Таким образом, существует потребность в нацеленных на белок тау терапевтических и диагностических подходах, которые способны различать физиологическую и патологическую опосредуемую повторами активность. Например, устойчивая к проназе центральная часть патологических парных спиральных филаментов (PHF) состоит из связывающих микротрубочки областей изоформ белка тау с 3 и 4 повторами (Jakes et al., 1991; Wischik, et al. 1988a; Wischik, et al. 1988b). Кроме того, Novak et al. продемонстрировали, что устойчивая к протеазам центральная часть PHF, которая имеет длину 93-95 аминокислот, ограничена тремя тандемными повторами (Novak et al., 1993). Von Bergen et al. определили минимальный пептид тау/мотив взаимодействия (306-VQIVYK-311; SEQ ID NO: 1 15), а также второй участок на белке тау (275-VQIINK-280) (SEQ ID NO: 116), которые образуют бета-слои и описаны как потенциально ответственные за инициацию образования PHF - патологического агрегата белка тау (Von Bergen et al., 2000; EP 1214598; WO 2001/18546). См. фиг.2 для функциональной карты белка тау. Следовательно, современные стратегии нацелены на создание лекарственных средств против агрегации, которые не нарушают внутриклеточную роль белка тау в стабилизации микротрубочек.
Более того, хотя в физиологических обстоятельствах белок тау рассматривается как внутриклеточный цитоплазматический белок, внутриклеточный белок тау может высвобождаться во внеклеточное пространство и участвовать в нейродегенерации (Gomez-Ramos et al., 2006). Действительно, утрата нейронов связана с топографическим распределением нейрофибриллярных узелков (образованных белком тау) в головном мозге при AD (West et al., 1994; Gomez-lsla et al., 1996, 1997). Кроме того, уровни общего белка тау и фосфорилированного белка тау увеличены в цереброспинальной жидкости (CSF) пациентов с AD (Hampel et al., 2010), и внеклеточный белок тау описывают как "узелки-призраки" в головном мозге (Frost and Diamond, 2009), что указывает на то, что внутриклеточный белок тау высвобождается во внеклеточное пространство. Кроме того, внутриклеточные агрегаты белка тау могут проникать в клетки и стимулировать фибриллизацию внутриклеточного белка тау, далее формируя мономер для образования патологических агрегатов белка тау (Frost et al., 2009). Такие исследования показали, что внеклеточный нерастворимый белок тау может действовать как распространяющийся агент, распределяя патологию, связанную с белком тау, по всему головному мозгу подобно прионам (Frost et al., 2009; Frost and Diamond, 2009). Выведение внеклеточных узелков белка тау может снизить обусловленную белком тау внеклеточную и внутриклеточную патологию. См., например, Asuni et al., 2007. Таким образом, существует потребность в способах лечения, способных снижать внутриклеточный уровень белка тау, путем препятствования его образованию, путем стимуляции его выведения, или обоими из этих способов, а также в способах лечения, которые снижают внутриклеточный уровень обуславливающего заболевание белка тау.
В целом, белок тау, по-видимому, играет патологическую роль в клинических проявлениях AD, разработка лекарственных средств, которые действуют против белка тау, протекает медленно, частично вследствие значения белка тау для физиологической динамики микротрубочек и вследствие его комплексной биологии (Dickey and Petrucelli, 2006). Однако, улучшенное понимание молекулярных механизмов, лежащих в основе патологических трансформаций белка тау, открыло возможность специфического нацеливания на патологические модификации белка тау для терапевтических целей. В результате появился ряд терапевтических подходов, которые прямо или непрямо нацелены на каскад белка тау (для обзорных статей, см., например, Dickey and Petrucelli, 2006; Schneider and Mandelkow, 2008; Zilka et al., 2008), включая соединения, которые предотвращают или обращают вспять агрегацию белка тау (Wischik et al., 1996; Necula et al. 2005; Pickhardt et al., 2005; Taniguchi et al., 2005a; Larbig et al., 2007), низкомолекулярные лекарственные средства, которые ингибируют киназы белка тау или активируют фосфатазы белка тау (Iqbal and Grundke-Iqbal, 2004; Noble et al., 2005; Iqbal and Grundke-Iqbal, 2007), стабилизирующие микротрубочки лекарственные средства (Zhang et al., 2005), лекарственные средства, которые способствуют протеолитической деградации неправильно свернутых белков тау (Dickey et al., 2005, Dickey et al. 2006; Dickey and Petrucelli, 2006), и иммунодепрессивные лекарственные средства (Zilka et al., 2008), а также иммунотерапевтические стратегии, включающие активную и пассивную иммунизацию (Schneider and Mandelkow et al., 2008; Zilka et al., 2008: Tabira, T. Immunization Therapy for Alzheimer Disease: A Comprehensive Review of Active Immunization Strategies. Tohoku J. Exp. Med., 220: 95-106 (2010)).
В более общем смысле, новые моноклональные антитела (mAb) входят в фазу клинических испытаний с частотой более 40 в год с 2007 года. В конце 2010 года по меньшей мере 25 mAb и пять слитых белков Fc находились на фазе 2/3 или фазе 3 клинических испытаний в США (Reichert, 2011). Эта тенденция демонстрирует, что пассивная иммунотерапия является расширяющимся подходом при лечении нарушений у человека, включая AD. См., например, Citron et al., 2010. В действительности, хотя проблемой способов лечения AD является преодоление гематоэнцефалического барьера (ГЭБ), возрастающее количество доклинических и клинических испытаний сообщают, что опосредуемые антителами способы терапии могут выводить агрегаты AD из головного мозга, и предлагают множество механизмов действия, таких как (i) захват антител в головной мозг через измененную проницаемость ГЭБ при AD, или просачивание через ГЭБ; (ii) антитела, действующие как "периферические стоки" для растворимых образующих бляшки типов амилоида; (iii) проникновение секретирующих антитела клеток из периферии в головной мозг, доставляющих антитела локально; и (iv) транспорт IgG в пределах и через клетки. См., например, Citron et al., 2010, и Asuni et al., 2007, для обзора. Таким образом, терапевтические антитела, нацеленные на связанные с заболеванием формы белка тау, представляют собой перспективный подход для лечения и/или диагностики AD и других таупатий (WO 2004/007547, US2008/0050383).
Один из подходов иммунотерапии для нацеливания на патологию белка тау основан на принципе, что антитела против белка тау могут препятствовать агрегации белка тау, выводить агрегаты белка тау, или на обоих из них. Хотя в исследованиях описаны антитела, которые связываются с последовательностями белка тау, и некоторые из этих антител, согласно сообщениям, препятствуют агрегации и выведению белка тау (Asuni et al., 2007), в настоящее время все еще нет моноклонального антитела против белка тау, проходящего доклинические или клинические испытания при AD. Действительно, было предсказано, что mAb имеет три участка связывания в домене, связывающем микротрубочки белка тау мыши (а именно, в R3, R4 и, возможно, R1), однако оно не блокировало связывание микротрубочек. (Dingus et al., 1991). Dingus не описали роли этого антитела в агрегации белка тау, и, таким образом, нет причин полагать, что антитело Dingus блокирует агрегацию белка тау. Согласно другим сообщениям, были получены mAb, которые различают изоформы белка тау, но вновь отсутствует предположение о том, что они имеют эффект на агрегацию белка тау (DeSilva et al., 2003; Ueno et al., 2007). Taniguchi et al. продемонстрировали, что определенные mAb против белка тау, направленные против R1 или R2, ингибировали агрегацию белка тау в PHF in vitro, одновременно стимулируя индуцируемую белком тау сборку тубулина (Taniguchi et al., 2005b). Антитела RTA-1 и RTA-2 Taniguchi связывались специфически с R1 и R2, соответственно. Ни одно из антител не связывало более одного повтора белка тау и ни одно из антител, согласно сообщениям, не было исследовано в отношении эффектов in vivo как на агрегацию белка тау, так и на выведение. Несмотря на существование по меньшей мере трех антител против амилоида в клинических испытаниях терапии AD на основе пассивной иммунизации (т.е. терапия, в которой антитела вводят пациенту), в настоящее время не доступно отчетов о клинических испытаниях пассивной иммунотерапии AD на основе белка тау.
В нескольких исследованиях AD на трансгенных по APP мышах было выявлено, что подход активной иммунизации (т.е. подход, в котором организм пациента сам индуцирует иммунитет против мишени) является эффективным в отношении выведения отложений Aβ и обращения вспять нейропатологических очагов повреждения (см., например, Schenk et al., 1999; Janus et al., 2000; Morgan et al., 2000; Sigurdsson et al., 2001). Недавно, в моделях патологии, связанной с узелками белка тау, на мышах активная иммунотерапия фосфорилированным эпитопом белка тау (тау 379-408 [P-Ser 396, 404]) снижала уровень агрегированного белка тау в головном мозге и замедляла прогрессирование поведенческого фенотипа (Asuni et al., 2007; Boutajangout et al. 2010; US2008/0050383; US/2010/00316564). Животные, которым проводили введение, продуцировали антитела против белка тау, которые выявлялись в головном мозге и локализовались совместно с антителами, которые распознавали патологический белок тау (Asuni et al., 2007). Этот иммунотерапевтический подход был существенно более эффективным на ранних стадиях функциональных нарушений у животных (5 месяцев), чем на более поздних стадиях (8 месяцев), что указывает на то, что выведение патологического белка тау на ранней стадии может иметь терапевтическую пользу (Asuni et al., 2007; Zilka et al., 2008). Действительно, существует информация, что не весь белок тау является поддающимся или, возможно, даже подходящим для разрушения или выведения. Некоторые предположили, что разрушение агрегатов белка тау может увеличивать уровень токсических промежуточных соединений, в то время как другие предположили, что поддающиеся выявлению агрегаты белка тау не обязательно являются токсичными и даже могут играть защитную роль (Lee et al., 2005). Таким образом, хотя иммунотерапевтические подходы для нацеливания на белок тау имеют доклинические перспективы, все еще существует потребность в терапевтических средствах, которые специфически нацелены на ранние аберрантные формы белка тау, устранение которых обеспечивает увеличенную длительную пользу. Тем не менее, также все еще существует потребность в идентификации тех видов белка тау, которые являются пригодными мишенями для иммунотерапии.
В связи с этим, другим фактором, учитываемым при разработке mAb против белка тау, является идентификация и охарактеризация различных структурных форм белка тау (физиологическая, форма раннего заболевания, форма позднего заболевания) и стадий патологии белка тау, на которые осуществляют нацеливание. Oddo et al. выявили, что, хотя иммунотерапия Aβ выводила бляшки Aβ и устраняла раннюю патологию белка тау в модели AD на трансгенных мышах, зрелые агрегаты белка тау оставались неизмененными (Oddo et al., 2004). Аналогично, генетическое (не иммунотерапевтическое) снижение экспрессии белка тау в модели таупатии P301L tau улучшало память, даже несмотря на то, что нейрофибриллярные узелки продолжали накапливаться (Santacruz et al., 2005).
Несмотря на ее распространенность, AD остается наибольшей неудовлетворенной медицинской потребностью в нейрологии (Citron, 2010). Наиболее распространенным медицинским подходом является предоставление симптоматической терапии, которая не является эффективной даже после лечения в течение нескольких лет. Необходимо, чтобы новые терапевтические подходы и стратегии для AD вышли за пределы лечения симптомов, предотвращая снижение когнитивных способностей и противодействую фундаментальным патологическим процессам заболевания. В частности, существует потребность в разработке молекул, которые либо отдельно, либо в комбинации с другими нацеленными на AD лекарственными средствами, препятствуют по меньшей мере некоторым из наиболее ранних стадий заболевания. Такие молекулы могут обеспечить новые преимущественные возможности для ранней диагностики (которая сама по себе может улучшить исходы лечения), профилактики и лечения AD.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном варианте осуществления изобретение относится к выделенному антителу, где антитело связывается с одним или несколькими эпитопами белка тау и способно к двум или более из следующих:
a) проявлять более высокую аффинность в отношении патологического белка тау по сравнению с физиологическим белком тау;
b) ингибировать агрегацию тау-тау; и
c) опосредовать захват и деградацию патологического белка тау микроглией;
и где каждый эпитоп белка тау содержит стимулирующую агрегацию область белка тау.
В одном варианте осуществления это выделенное антитело является таким, что каждый из одного или нескольких эпитопов независимо выбран из эпитопов в:
i. положении 267-273 или остатках KHQPGGG (SEQ ID NO: 98) относительно тау441;
ii. положении 298-304 или остатках KHVPGGG (SEQ ID NO: 99) относительно тау441;
iii. положении 329-335 или остатках HHKPGGG (SEQ ID NO: 100) относительно тау441;
iv. положении 361-367 или остатках THVPGGG (SEQ ID NO: 101) относительно тау441.
В определенных вариантах осуществления выделенное антитело, обладающее свойствами, описанными в вариантах осуществления предыдущих абзацев, способно связываться с одной или несколькими формами патологического белка тау, выбранными из разупорядоченного белка тау, небеспорядочного белка тау, нерастворимого в саркозиле белка тау, нейрофибриллярных узелков, нейропильных нитей и нейритических бляшек, в биоптате головного мозга пациента-человека с болезнью Альцгеймера, в образце головного мозга в модели болезни Альцгеймера на животных, или в обоих из этих случаев. В определенных вариантах осуществления выделенное антитело является таким, что по меньшей мере один из эпитопов, которые оно распознает, является конформационным эпитопом.
В одном варианте осуществления изобретение относится к выделенному антителу, где антитело связывается с одним или несколькими эпитопами белка тау и способно к двум или более из следующих:
a) проявлять более высокую аффинность в отношении патологического белка тау по сравнению с физиологическим белком тау;
b) ингибировать агрегацию тау-тау; и
c) опосредовать захват и деградацию патологического белка тау микроглией;
и где каждый эпитоп белка тау содержит стимулирующую агрегацию область белка тау.
В одном варианте осуществления это выделенное антитело является таким, что каждый из одного или нескольких эпитопов независимо выбран из эпитопов в:
i. положении 268-273 или остатках HQPGGG (SEQ ID NO: 223) относительно тау441;
ii. положении 299-304 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441;
iii. положении 330-335 или остатках HKPGGG (SEQ ID NO: 224) относительно тау441;
iv. положении 362-367 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441.
В одном варианте осуществления это выделенное антитело является таким, что каждый из одного или нескольких эпитопов, с которыми оно связывается, независимо выбран из эпитопов в:
i. положении 268-273 или остатках HQPGGG (SEQ ID NO: 223) относительно тау441;
ii. положении 299-304 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441;
iii. положении 330-335 или остатках HKPGGG (SEQ ID NO: 224) относительно тау441;
iv. положении 362-367 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441;
и антитело содержит:
a) вариабельную область легкой цепи антитела, содержащую:
i. QSLLNSRTRKNY (SEQ ID NO: 117) или SEQ ID NO: 247 для CDR1;
ii. WAS (SEQ ID NO: 118) или SEQ ID NO: 253 для CDR2; и
iii. KQSFYLRT (SEQ ID NO: 119) или любую из SEQ ID NO: 255, 257, 258, 259 и 260 для CDR3; и
b) вариабельную область тяжелой цепи антитела, содержащую:
iv. GYIFTDYVIS (SEQ ID NO: 120), SEQ ID NO: 261 или SEQ ID NO: 262 для CDR1;
v. IFPRSGST (SEQ ID NO: 121), SEQ ID NO: 264 или SEQ ID NO: 265 для CDR2; и
vi. ARDYYGTSFAMDY (SEQ ID NO: 122), SEQ ID NO: 266, SEQ ID NO: 267 или SEQ ID NO: 269 для CDR3.
Также изобретение относится к выделенному антителу, которое связывает один или несколько эпитопов на белке тау конформационно-специфическим образом, где:
a) каждый из одного или нескольких эпитопов независимо выбран из эпитопов в:
i. положении 267-273 или остатках KHQPGGG (SEQ ID NO: 98) относительно тау441;
ii. положении 298-304 или остатках KHVPGGG (SEQ ID NO: 99) относительно тау441;
iii. положении 329-335 или остатках HHKPGGG (SEQ ID NO: 100) относительно тау441; и
iv. положении 361-367 или остатках THVPGGG (SEQ ID NO: 101), относительно тау441;
b) ноль, один, два или три из эпитопов представляет собой/представляют собой линейный эпитоп(ы); и
c) один, два, три или четыре из эпитопов представляет собой/представляют собой конформационный эпитоп(ы).
Изобретение также относится к выделенному антителу, которое связывает один или несколько эпитопов на белке тау конформационно-специфическим образом, где:
a) каждый из одного или нескольких эпитопов независимо выбран из эпитопов в:
i. положении 268-273 или остатках HQPGGG (SEQ ID NO: 223), относительно тау441;
ii. положении 299-304 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441;
iii. положении 330-335 или остатках HKPGGG (SEQ ID NO: 224) относительно тау441;
iv. положении 362-367 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441;
b) ноль, один, два или три из эпитопов представляет собой/представляют собой линейный эпитоп(ы); и
c) один, два, три или четыре из эпитопов представляет собой/представляют собой конформационный эпитоп(ы).
В одном варианте осуществления это антитело представляет собой DC8E8, где DC8E8 представляет собой антитело, продуцируемое гибридомой, депонированной как запатентованный депозит American Type Culture Collection no. PTA-11994.
В определенных вариантах осуществления выделенное антитело связывается с одним или несколькими из тех же эпитопов на белке тау, с которыми связывается DC8E8. В одном варианте осуществления выделенное антитело конкурирует с моноклональным антителом DC8E8 за связывание с белком тау.
Изобретение также относится к выделенному антителу, содержащему в его связывающем эпитоп домене одну или несколько последовательностей определяющих комплементарность областей (CDR), выбранных из:
i. QSLLNSRTRKNY (SEQ ID NO: 117);
ii. WAS (SEQ ID NO: 118);
iii. KQSFYLRT (SEQ ID NO: 119);
iv. GYIFTDYVIS (SEQ ID NO: 120);
v. IFPRSGST (SEQ ID NO: 121); и
vi. ARDYYGTSFAMDY (SEQ ID NO: 122).
Изобретение также относится к тому, что любые из антител, описанных в любом из вариантов осуществления, описанных в предшествующих абзацах, могут быть такими, что выделенное антитело содержит:
a) вариабельную область легкой цепи антитела, содержащую:
i. QSLLNSRTRKNY (SEQ ID NO: 117) для CDR1;
ii. WAS (SEQ ID NO: 118) для CDR2; и
iii. KQSFYLRT (SEQ ID NO: 119) для CDR3; и
b) вариабельную область тяжелой цепи антитела, содержащую:
iv. GYIFTDYVIS (SEQ ID NO: 120) для CDR1;
v. IFPRSGST (SEQ ID NO: 121) для CDR2; и
vi. ARDYYGTSFAMDY (SEQ ID NO: 122) для CDR3.
Изобретение также относится к тому, что любые из антител, описанных в предшествующих вариантах осуществления, могут быть такими, что выделенное антитело содержит:
a) одну или несколько последовательностей CDR легкой цепи из моноклонального антитела DC8E8, или одну или несколько последовательностей, имеющих по меньшей мере 80%, 90% или 95% идентичность после оптимального выравнивания с одной из этих CDR легкой цепи; и
b) одну или несколько последовательностей CDR тяжелой цепи из моноклонального антитела DC8E8, или одну или несколько последовательностей, имеющих по меньшей мере 80%, 90% или 95% идентичность после оптимального выравнивания с одной из этих CDR тяжелой цепи; и где:
i. CDR легкой цепи содержат последовательность, выбранную из QSLLNSRTRKNY (SEQ ID NO: 117), WAS (SEQ ID NO: 118) и KQSFYLRT (SEQ ID NO: 119); и
ii. CDR тяжелой цепи содержат последовательность, выбранную из GYIFTDYVIS (SEQ ID NO: 120), IFPRSGST (SEQ ID NO: 121) и ARDYYGTSFAMDY (SEQ ID NO: 122).
Изобретение также относится к тому, что любые из антител, описанных для предшествующих вариантов осуществления, могут состоять из или содержать Fab, Fab', F(ab')2, Fabc, Fv-фрагмент, любой другой антигенсвязывающий фрагмент; или антигенсвязывающую часть антитела; имеющие один или несколько из следующих иммунологических характеристик связывания:
1. Антитело связывает один или несколько эпитопов белка тау конформационно-специфическим образом, где: a) каждый из одного или нескольких эпитопов белка тау независимо выбран из эпитопов в:
i. положении 267-273 или остатках KHQPGGG (SEQ ID NO: 98) относительно тау441;
ii. положении 298-304 или остатках KHVPGGG (SEQ ID NO: 99) относительно тау441;
iii. положении 329-335 или остатках HHKPGGG (SEQ ID NO: 100) относительно тау441; и
iv. положении 361-367 или остатках THVPGGG (SEQ ID NO: 101) относительно тау441;
b) ноль, один, два или три из эпитопов представляют собой линейный эпитоп;
c) один, два, три или четыре из эпитопов представляют собой конформационный эпитоп;
2. Антитело связывает два или более эпитопов белка тау и способно проявлять более высокую аффинность связывания с патологическим белком тау относительно физиологического белка тау, где два эпитопа тау выбраны из эпитопов в:
v. положении 267-273 или остатках KHQPGGG (SEQ ID NO: 98) относительно тау441;
vi. положении 298-304 или остатках KHVPGGG (SEQ ID NO: 99) относительно тау441;
vii. положении 329-335 или остатках HHKPGGG (SEQ ID NO: 100) относительно тау441; и
viii. положении 361-367 или остатках THVPGGG (SEQ ID NO: 101) относительно тау441.
Изобретение также относится к тому, что любые из антител, описанных для предшествующих вариантов осуществления, могут состоять из или содержать Fab, Fab', F(ab')2, Fabc, Fv-фрагмент, любой другой антигенсвязывающий фрагмент; или антигенсвязывающую часть антитела; имеющие один или несколько из следующих иммунологических характеристик связывания:
1. Антитело связывает один или несколько эпитопов белка тау конформационно-специфическим образом, где:
a) каждый из одного или нескольких эпитопов белка тау независимо выбран из эпитопов в:
i. положении 268-273 или остатках HQPGGG (SEQ ID NO: 223) относительно тау441;
ii. положении 299-304 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441;
iii. положении 330-335 или остатках HKPGGG (SEQ ID NO: 224) относительно тау441;
iv. положении 362-367 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441;
b) ноль, один, два или три из эпитопов представляют собой линейный эпитоп;
c) один, два, три или четыре из эпитопов представляют собой конформационный эпитоп;
2. Антитело связывает два или более эпитопов белка тау и способно проявлять более высокую аффинность в отношении патологического белка тау, чем в отношении физиологического белка тау, где два эпитопа белка тау выбраны из эпитопов в:
i. положении 268-273 или остатках HQPGGG (SEQ ID NO: 223) относительно тау441;
ii. положении 299-304 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441;
iii. положении 330-335 или остатках HKPGGG (SEQ ID NO: 224) относительно тау441;
iv. положении 362-367 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441.
Изобретение также относится к любому выделенному антителу, которое конкурентно связывает белок тау относительно антител, описанных для предшествующих вариантов осуществления. В одном варианте осуществления выделенное антитело конкурентно связывается с белком тау при исследовании против выделенного DC8E8 в отношении связывания с белком тау.
В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую SEQ ID NO: 141. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую SEQ ID NO: 138. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую SEQ ID NO: 141, и легкую цепь, содержащую SEQ ID NO:138.
Изобретение относится к тому, что антитела, предусматриваемые изобретением, могут быть выбраны из:
a) моноклонального антитела;
b) поликлонального антитела;
c) рекомбинантного антитела;
d) химерного антитела;
e) гуманизированного антитела;
f) антитела человека; и
g) антигенсвязывающего фрагмента или антигенсвязывающей части любого из (a)-(f).
Любые из выделенных антител, предусматриваемых изобретением, могут быть индуцированы у млекопитающего. В определенных вариантах осуществления выделенное антитело продуцируется рекомбинантным животным или рекомбинантной клеткой-хозяином.
Изобретение относится к тому, что любое из выделенных антител против белка тау, предусматриваемых в рамках настоящего изобретения, может быть таким, что они являются меченными поддающимся выявлению образом одним или несколькими агентами для мечения. В определенных вариантах осуществления по меньшей мере один агент для мечения выбран из фермента, радиоизотопа, флуорофора, маркера ядерно-магнитного резонанса и тяжелого металла.
В некоторых вариантах осуществления антитело содержит по меньшей мере одно лекарственное средство (комбинируемое средство), присоединенное к молекуле антитела.
Изобретение также относится к выделенным нуклеиновым кислотам, кодирующим по меньшей мере одну CDR, или по меньшей мере связывающий домен или вариабельную область цепи иммуноглобулина любых из антител против белка тау, описанных в предшествующих вариантах осуществления. Также предусматриваются выделенные векторы, содержащие любую из этих нуклеиновых кислот. В некоторых вариантах осуществления изобретение относится к выделенной клетке-хозяину, содержащей одну или несколько из этих выделенных нуклеиновых кислот и векторов.
В определенных вариантах осуществления изобретение относится к выделенной клеточной линии, экспрессирующей любые из антител против белка тау, описанных в предшествующих вариантах осуществления. В одном варианте осуществления выделенная клеточная линия представляет собой гибридому. В одном варианте осуществления выделенная клеточная линия представляет собой гибридому, которая продуцирует моноклональное антитело DC8E8, и эта клеточная линия была депонирована в American Type Culture Collection, Manassas, VA, USA, 13 июля 2011 года, с обозначением запатентованного депозита ATCC PTA-11994.
Изобретение относится к применению любого из антител против белка тау, нуклеиновых кислот и клеток, предусматриваемых в рамках настоящего изобретения, в качестве лекарственного средства или для изготовления лекарственного средства для диагностики, профилактики или лечения болезни Альцгеймера или родственной таупатии.
В некоторых вариантах осуществления антитела содержатся в фармацевтической композиции, кроме того, содержащей фармацевтически приемлемый носитель и/или разбавитель. В одном варианте осуществления фармацевтическая композиция содержит комбинацию антител и фармацевтически приемлемого носителя и/или разбавителя, где комбинация включает по меньшей мере два различных антитела, и где каждое из антител независимо выбрано из антител, описанных для предшествующих вариантов осуществления. В одном варианте осуществления по меньшей мере одно из антител представляет собой DC8E8, или человеческую версию DC8E8, или гуманизированную версию DC8E8.
В некоторых вариантах осуществления антитела содержатся в композиции, кроме того, содержащей разбавитель и/или носитель. Композиция может представлять собой фармацевтическую композицию, диагностическую композицию или любую другую композицию. В некоторых вариантах осуществления композиция, кроме того, может содержать по меньшей мере одно соединение или средство, выбранное из поддающейся выявлению метки, гемоцианина лимфы улитки, столбнячного токсоида или токсоида, происходящего из других патогенных бактерий, сывороточных альбуминов, бычьего сывороточного альбумина, молекулы иммуноглобулина или ее фрагмента, тиреоглобулина, овоглобулина, универсального T-клеточного эпитопа, цитокина, хемокина, интерлейкина 1-альфа (IL-1α), IL-1β, IL-2, IL-10, интерферона-гамма (IFN-γ), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), макрофагального воспалительного белка 1 альфа (MIP1α), MIP1β и RANTES (белок, регулируемый при активации, экспрессируемый и секретируемый нормальными T-клетками).
Изобретение также относится к изделию (например, набору) для фармацевтического или диагностического применения, содержащему упаковочный материал и контейнер, содержащий раствор лиофилизированной формы любого одного или нескольких из антител против белка тау, описанных в настоящем описании. В определенных вариантах осуществления контейнер представляет собой компонент устройства или системы для доставки антитела индивидууму.
В некоторых вариантах осуществления изобретение относится к медицинскому устройству, содержащему антитело против белка тау, описанное в настоящем описании (см. выше), где устройство пригодно для контактирования или введения антитела по меньшей мере одним путем, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, внутрикапсулярного, внутрихрящевого, внутриполосного, осуществляемого внутрь брюшной полости, внутримозжечкового, интрацеребровентрикулярного, интратекального, внутритолстокишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, внутриперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, внутриректального, внутрипочечного, интраретинального, внутрипозвоночного, интрасиновиального, внутригрудного, внутриматочного, внутрипузырного, внутриочагового, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и трансдермального.
В одном варианте осуществления изобретение относится к способу лечения или профилактики болезни Альцгеймера или родственной таупатии у индивидуума, причем способ включает введение указанному индивидууму эффективного количества по меньшей мере одного из антител против белка тау, описанных в настоящем описании. В некоторых вариантах осуществления способ способен уменьшать двигательные нарушения, улучшать двигательную функцию, уменьшать когнитивные нарушения, улучшать когнитивную функцию или осуществлять их комбинацию.
В определенных вариантах осуществления изобретение относится к способу смягчения по меньшей мере одного из симптомов, ассоциированных с болезнью Альцгеймера или родственной таупатии у индивидуума, причем способ включает введение указанному индивидууму эффективного количества по меньшей мере одного из антител против белка тау, описанных в настоящем описании.
В другом варианте осуществления изобретение относится к способу диагностики или скрининга индивидуума на наличие болезни Альцгеймера или родственной таупатии у индивидуума или определения риска развития у индивидуума болезни Альцгеймера или родственной таупатии, причем способ включает:
a) контактирование индивидуума или клетки, ткани, органа, жидкости или любого другого образца от индивидуума с эффективным количеством по меньшей мере одного антитела против белка тау, описанного в настоящем описании; и
b) определение присутствия комплекса, содержащего патологический белок тау и антитело, где присутствие комплекса является диагностическим критерием болезни Альцгеймера или родственной таупатии, обусловленной присутствием патологического белка тау.
В родственном варианте осуществления изобретение относится к способу мониторинга у индивидуума наличия, прогрессирования, регрессии или стабилизации болезни Альцгеймера или родственной таупатии у индивидуума, или определения стадии болезни Альцгеймера или родственной таупатии у индивидуума, причем способ включает:
a) контактирование индивидуума, или клетки, ткани, органа, жидкости или любого другого образца от индивидуума с эффективным количеством по меньшей мере одного из антител против белка тау, описанных в настоящем описании; и
b) определение присутствия и/или характеристик комплекса, содержащего патологический белок и антитело, где присутствие комплекса является диагностическим критерием болезни Альцгеймера или родственной таупатии, обусловленной присутствием патологического белка тау.
В некоторых вариантах осуществления антитело вводят внутривенно, внутримышечно, подкожно, внутрибрюшинно, интраназально, интрацеребровентрикулярно, интратекально или в виде аэрозоля.
В некоторых вариантах осуществления способов лечения или профилактики прогрессирования болезни Альцгеймера или родственной таупатии у индивидуума, и способов смягчения по меньшей мере одного из симптомов, ассоциированных с болезнью Альцгеймера или родственной таупатией у индивидуума, эффективное количество каждого антитела составляет по меньшей мере 1 мг/кг массы тела индивидуума на дозу. В некоторых вариантах осуществления эффективное количество каждого антитела составляет по меньшей мере 10 мг/кг массы тела индивидуума на дозу. В некоторых вариантах осуществления по меньшей мере одно из антител вводят во множестве дозировок в течение периода по меньшей мере шести месяцев. В некоторых вариантах осуществления антитело вводят периферически индивидууму-человеку для достижения его благоприятных эффектов. В некоторых вариантах осуществления антитело, при введении периферически индивидууму-человеку, связывается с растворимым белком тау, нерастворимым в саркозиле белком или с обоими из них. В некоторых вариантах осуществления антитело, при введении периферически индивидууму-человеку, связывается с белком тау, где белок тау находится в одной или нескольких патологических формах из разупорядоченного белка тау, небеспорядочного белка тау, нерастворимого в саркозиле белка тау, нейрофибриллярных узелков, нейропильных нитей и нейритических бляшек в биоптате головного мозга пациента-человека с болезнью Альцгеймера, в образце головного мозга в модели болезни Альцгеймера на животных. В некоторых вариантах осуществления антитело, при введении периферически индивидууму-человеку, достигает одного или нескольких опосредуемых эффекторной функцией благоприятных эффектов у индивидуума. В некоторых вариантах осуществления антитело доставляют на периферию путем инъекции/имплантации экспрессирующей антитело клетки в головной мозг индивидуума. В некоторых вариантах осуществления экспрессирующая антитело клетка представляет собой клетку гибридомы. В некоторых вариантах осуществления клетка гибридомы представляет собой гибридому, экспрессирующую DC8E8.
В определенных родственных вариантах осуществления изобретение относится к выделенному пептиду, где:
a) выделенный пептид представляет собой фрагмент белка тау, который имеет длину по меньшей мере 6 аминокислотных остатков, по меньшей мере 7 аминокислотных остатков, по меньшей мере 9 аминокислотных остатков, по меньшей мере 10 аминокислотных остатков, по меньшей мере 12 аминокислотных остатков или 30 аминокислотных остатков; и
b) выделенный пептид содержит терапевтический эпитоп белка тау.
В некоторых родственных вариантах осуществления терапевтический эпитоп включает терапевтический эпитоп, выбранный из эпитопов в:
i. положении 267-273 или остатках KHQPGGG (SEQ ID NO: 98) относительно тау441;
ii. положении 298-304 или остатках KHVPGGG (SEQ ID NO: 99) относительно тау441;
iii. положении 329-335 или остатках HHKPGGG (SEQ ID NO: 100) относительно тау441;
iv. положении 361-367 или остатках THVPGGG (SEQ ID NO: 101) относительно тау441.
В определенных родственных вариантах осуществления изобретение относится к выделенному пептиду, где:
a) выделенный пептид представляет собой фрагмент белка тау, который имеет длину по меньшей мере 6 аминокислотных остатков, по меньшей мере 7 аминокислотных остатков, по меньшей мере 9 аминокислотных остатков, по меньшей мере 10 аминокислотных остатков, по меньшей мере 12 аминокислотных остатков или 30 аминокислотных остатков; и
b) выделенный пептид содержит терапевтический эпитоп белка тау.
В некоторых родственных вариантах осуществления терапевтический эпитоп включает терапевтический эпитоп, выбранный из эпитопов в:
i. положении 268-273 или остатках HQPGGG (SEQ ID NO: 223) относительно тау441;
ii. положении 299-304 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441;
iii. положении 330-335 или остатках HKPGGG (SEQ ID NO: 224) относительно тау441;
iv. положении 362-367 или остатках HVPGGG (SEQ ID NO: 154) относительно тау441.
В некоторых родственных вариантах осуществления терапевтический эпитоп выбран из:
i. положения 268-273 или остатков HQPGGG (SEQ ID NO: 223), относительно тау441;
ii. положения 299-304 или остатков HVPGGG (SEQ ID NO: 154) относительно тау441;
iii. положения 330-335 или остатков HKPGGG (SEQ ID NO: 224) относительно тау441;
iv. положения 362-367 или остатков HVPGGG (SEQ ID NO: 154) относительно тау441.
В других вариантах осуществления выделенный пептид представляет собой последовательность, выбранную из SEQ ID NO: 1-4, SEQ ID NO: 9-101 и SEQ ID NO: 108-112, NIKAVPGGGS (SEQ ID NO: 200), NIKHVPGGGS (SEQ ID NO: 201), IKHVPGGGS (SEQ ID NO: 202), KHVPGGGSV (SEQ ID NO: 203), HVPGGGSVQ (SEQ ID NO: 204), VPGGGSVQ (SEQ ID NO: 205), GWSIHSPGGGSC (SEQ ID NO: 250), SVFQHLPGGGSC (SEQ ID NO: 251), ANIKHVPGGGS (SEQ ID NO: 144), DAIKHVPGGGS (SEQ ID NO: 146), DNAKHVPGGGS (SEQ ID NO: 149), DNIAHVPGGGS (SEQ ID NO: 151), DNIKAVPGGGS (SEQ ID NO: 159), DNIKHAPGGGS (SEQ ID NO: 161) и DNIKHVPGGGS (SEQ ID NO: 171).
В других вариантах осуществления выделенный пептид представляет собой последовательность, выбранную из SEQ ID NO: 270 (TENLKHQPGGGK); SEQ ID NO: 271 (KHQPGGG), SEQ ID NO: 272 (HQPGGG); SEQ ID NO: 275 (ENLKHQPGGGKVQIINKKLDLSNVQSKCGSKDNIKHVPGGGS), SEQ ID NO: 276 (KHVPGGG), SEQ ID NO: 277 (HVPGGG), SEQ ID NO: 280 (DNIKHVPGGGSVQIVYKPV), SEQ ID NO: 281 (HHKPGGG), SEQ ID NO: 282 (HKPGGG) и SEQ ID NO: 283 (THVPGGG).
В других вариантах осуществления выделенный пептид представляет собой последовательность, выбранную из SEQ ID NO: 270 (TENLKHQPGGGK); SEQ ID NO: 271 (KHQPGGG), SEQ ID NO: 272 (HQPGGG); SEQ ID NO: 275 (ENLKHQPGGGKVQIINKKLDLSNVQSKCGSKDNIKHVPGGGS), SEQ ID NO: 276 (KHVPGGG), SEQ ID NO: 277 (HVPGGG), SEQ ID NO: 280 (DNIKHVPGGGSVQIVYKPV), SEQ ID NO: 281 (HHKPGGG), SEQ ID NO: 282 (HKPGGG) и SEQ ID NO: 283 (THVPGGG); и терапевтический эпитоп выбран из:
i. положения 268-273 или остатков HQPGGG (SEQ ID NO: 223) относительно тау441;
ii. положения 299-304 или остатков HVPGGG (SEQ ID NO: 154) относительно тау441;
iii. положения 330-335 или остатков HKPGGG (SEQ ID NO: 224) относительно тау441;
iv. положения 362-367 или остатков HVPGGG (SEQ ID NO: 154) относительно тау441.
В других вариантах осуществления выделенный пептид представляет собой последовательность, выбранную из SEQ ID NO: 272 (HQPGGG) и SEQ ID NO: 277 (HVPGGG).
В определенных вариантах осуществления выделенный пептид является активным по меньшей мере в одном анализе, выбранном из анализов, которые определяют для пептида:
a) способность конкурировать с белком тау за связывание с моноклональным антителом DC8E8;
b) способность снижать уровень нерастворимого в саркозиле белка тау in vivo;
c) способность стимулировать выведение белка тау из головного мозга in vivo;
d) способность снижать уровень по меньшей мере одного биохимического маркера AD in vivo;
e) способность снижать нагрузку нейрофибриллярными узелками (NFT), in vivo;
f) способность улучшать по меньшей мере один нейроповеденческий параметр in vivo;
g) способность благоприятным образом модифицировать течение AD у индивидуума;
h) способность снижать уровень белка тау в головном мозге, в цереброспинальной жидкости или в обоих из них; и/или
i) способность служить в качестве иммуногена для получения антитела, способного конкурировать с моноклональным DC8E8 за связывание с белком тау.
Изобретение также относится к соединениям, содержащим любой из выделенных пептидов, описанных в настоящем описании, и часть. В определенных вариантах осуществления часть является N-концевой, C-концевой или связанной с внутренней аминокислотой пептида, и где часть выбрана из одного или нескольких из остатка цистеина, фосфогруппы, гемоцианина лимфы улитки, столбнячного токсоида или токсоида, происходящего из других патогенных бактерий, сывороточных альбуминов, бычьего сывороточного альбумина, молекулы иммуноглобулина или ее фрагмента, тиреоглобулина, овоглобулина, универсального T-клеточного эпитопа, цитокина, хемокина, интерлейкина 1-альфа (IL-1α), IL-1β, IL-2, IL-10, интерферона-гамма (IFN-γ), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), макрофагального воспалительного белка 1 альфа (MIP1α), MIP1β и RANTES (белок, регулируемый при активации, экспрессируемый и секретируемый нормальными T-клетками).
Также предусматриваются фармацевтические композиции, содержащие один или несколько из выделенных пептидов и/или соединений, предусматриваемых изобретением, и фармацевтически приемлемый носитель, и/или разбавитель, и/или адъювант. В некоторых вариантах осуществления фармацевтическая композиция адаптирована так, что она обеспечивает дозировку пептида или соединения от 1 нг до 10 мг. В определенных вариантах осуществления фармацевтическая композиция адаптирована так, что она обеспечивает дозировку пептида или соединения, превышающую 10 микрограмм.
Изобретение также относится к изделию (например, набору) для фармацевтического или диагностического применения, содержащему упаковочный материал и контейнер, содержащий раствор лиофилизированной формы пептида и/или соединения, предусматриваемого изобретением. В некоторых вариантах осуществления контейнер представляет собой компонент устройства или системы для доставки пептида или соединения индивидууму.
Также предусматриваются медицинские устройства, содержащие пептид, соединение, и/или композицию пептида/соединения, предусматриваемые изобретением, где устройство пригодно для контактирования или введения антитела по меньшей мере одним путем, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, внутрикапсулярного, внутрихрящевого, внутриполосного, осуществляемого внутрь брюшной полости, внутримозжечкового, интрацеребровентрикулярного, интратекального, внутритолстокишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, внутриперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, внутриректального, внутрипочечного, интраретинального, внутрипозвоночного, интрасиновиального, внутригрудного, внутриматочного, внутрипузырного, внутриочагового, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и трансдермального.
В родственных вариантах осуществления изобретение относится к способу лечения или профилактики прогрессирования болезни Альцгеймера или родственных таупатий у индивидуума, причем способ включает введение указанному индивидууму эффективного количества по меньшей мере одного пептида и/или по меньшей мере одного соединения, предусматриваемого изобретением. В некоторых вариантах осуществления способ способен уменьшать двигательные нарушения, улучшать двигательную функцию, уменьшать когнитивные нарушения, улучшать когнитивную функцию или осуществлять их комбинацию.
В родственных вариантах осуществления изобретение относится к способу смягчения по меньшей мере одного из симптомов, ассоциированных с болезнью Альцгеймера или родственными таупатиями у индивидуума, причем способ включает введение указанному индивидууму эффективного количества по меньшей мере одного пептида и/или по меньшей мере одного соединения, предусматриваемого изобретением.
В некоторых из этих способов лечения, профилактики или смягчения по меньшей мере одного из симптомов, ассоциированных со способом смягчения по меньшей мере одного из симптомов, ассоциированных с болезнью Альцгеймера или родственной таупатии, у индивидуума, способ включает введение пациенту-человеку пептида и/или соединения, предусматриваемого изобретением, и/или адъюванта, который усиливает иммунный ответ, причем способ обеспечивает иммунный ответ, включающий антитела против патологического белка тау, тем самым, осуществляя лечение, профилактику прогрессирования или смягчение по меньшей мере одного из симптомов, ассоциированных с AD, у пациента-человека.
Изобретение также относится к способу продуцирования антитела, которое способно конкурировать с DC8E8 за связывание с белком тау, причем способ включает иммунизацию индивидуума по меньшей мере одним пептидом и/или по меньшей мере одним соединением, предусматриваемым изобретением. В некоторых вариантах осуществления по меньшей мере один пептид выбран из любого из SEQ ID NO: 1-4, SEQ ID NO: 9-101 и SEQ ID NO: 108-112, NIKHVPGGGS (SEQ ID NO: 201), IKHVPGGGS (SEQ ID NO: 202), KHVPGGGSV (SEQ ID NO: 203), HVPGGGSVQ (SEQ ID NO: 204), VPGGGSVQ (SEQ ID NO: 205), GWSIHSPGGGSC (SEQ ID NO: 250), SVFQHLPGGGSC (SEQ ID NO: 251), ANIKHVPGGGS (SEQ ID NO: 144), DAIKHVPGGGS (SEQ ID NO: 146), DNAKHVPGGGS (SEQ ID NO: 149), DNIAHVPGGGS (SEQ ID NO: 151), DNIKAVPGGGS (SEQ ID NO: 159), DNIKHAPGGGS (SEQ ID NO: 161) и DNIKHVPGGGS (SEQ ID NO: 171). В одном варианте осуществления пептид выбран из SEQ ID NO: 1-4. В другом варианте осуществления пептид представляет собой SEQ ID NO: 108. В одном варианте осуществления пептид представляет собой GWSIHSPGGGSC (SEQ ID NO: 250). В определенных вариантах осуществления пептид представляет собой SVFQHLPGGGSC (SEQ ID NO: 251). В определенных вариантах осуществления пептид выбран из SEQ ID NO: 270 (TENLKHQPGGGK); SEQ ID NO: 271 (KHQPGGG), SEQ ID NO: 272 (HQPGGG); SEQ ID NO: 275 (ENLKHQPGGGKVQIINKKLDLSNVQSKCGSKDNIKHVPGGGS), SEQ ID NO: 276 (KHVPGGG), SEQ ID NO: 277 (HVPGGG), SEQ ID NO: 280 (DNIKHVPGGGSVQIVYKPV), SEQ ID NO: 281 (HHKPGGG), SEQ ID NO: 282 (HKPGGG) и SEQ ID NO: 283 (THVPGGG). В других вариантах осуществления пептид выбран из SEQ ID NO: 272 (HQPGGG) и SEQ ID NO: 277 (HVPGGG).
Также предусматривается способ выделения DC8E8 или выделения антитела, которое способно конкурировать с DC8E8 за связывание с белком тау, причем способ включает контактирование DC8E8 или антитела с пептидом и/или с соединением, предусматриваемым изобретением.
В родственных вариантах осуществления изобретение относится к способу диагностики или скрининга индивидуума в отношении наличия болезни Альцгеймера или родственных таупатий у индивидуума, или в отношении определения риска развития у индивидуума болезни Альцгеймера или родственных таупатий, причем способ включает:
a) контактирование индивидуума, или клетки, ткани, органа, жидкости или любого другого образца от индивидуума, с эффективным количеством по меньшей мере одного антитела, предусматриваемого изобретением; и
b) определение присутствия комплекса, содержащего патологический белок тау и антитело, где присутствие комплекса является диагностическим критерием болезни Альцгеймера или родственных таупатий, ассоциированных с присутствием патологического белка тау.
В определенных вариантах осуществления изобретение относится к способу мониторинга наличия, прогрессирования, регрессии или стабилизации у индивидуума болезни Альцгеймера или родственных таупатий, или определения стадии болезни Альцгеймера или родственных таупатий у индивидуума, причем способ включает:
a) контактирование (например, введение) индивидуума, или клетки, ткани, органа, жидкости или любого другого образца индивидуума с эффективным количеством по меньшей мере одного антитела, предусматриваемого по меньшей мере одним вариантом осуществления изобретения; и
b) определение наличия и/или характеристик комплекса, содержащего патологический белок тау и антитело, где присутствие комплекса является диагностическим критерием болезни Альцгеймера или родственных таупатий, ассоциированных с присутствием патологического белка тау.
В некоторых вариантах осуществления способа мониторинга наличия, прогрессирования, регрессии или стабилизации у индивидуума болезни Альцгеймера или родственных таупатий, или определения стадии болезни Альцгеймера или родственных таупатий у индивидуума, антитело, пептид и/или соединение вводят внутривенно, внутримышечно, подкожно, внутрибрюшинно, интраназально, интрацеребровентрикулярно, интратекально или в виде аэрозоля. В некоторых вариантах осуществления эффективное количество каждого пептида и/или соединения составляет по меньшей мере 1 мкг на дозу, по меньшей мере 10 мкг на дозу, по меньшей мере 100 мкг на дозу. В некоторых вариантах осуществления эффективное количество каждого пептида и/или соединения составляет по меньшей мере 10 мкг на дозу в присутствии адъюванта, и по меньшей мере 100 мкг на дозу в отсутствие адъюванта. В некоторых вариантах осуществления по меньшей мере один пептид или соединение вводят во множестве дозировок в течение периода по меньшей мере шести месяцев.
В соответствии с родственным вариантом осуществления изобретение относится к способу лечения или профилактики прогрессирования болезни Альцгеймера или родственных таупатий у индивидуума, причем способ включает введение указанному индивидууму эффективного количества по меньшей мере одного антитела, и/или по меньшей мере одного пептида, и/или по меньшей мере одного соединения, предусматриваемого изобретением, в комбинации по меньшей мере с одним комбинируемым средством, выбранным из ингибиторов ацетилхолинэстеразы, антагонистов рецептора N-метил-D-аспартата (NMDA), хелаторов переходных металлов, факторов роста, гормонов, нестероидных противовоспалительных лекарственных средств (NSAID), антиоксидантов, средств, снижающих уровень липидов, селективных ингибиторов фосфодиэстеразы, ингибиторов агрегации белка тау, ингибиторов протеинкиназ, ингибиторов белков теплового шока, пассивной и активной иммунизации против амилоида, ингибиторов агрегации амилоида и ингибиторов секретаз. В некоторых вариантах осуществления способ способен уменьшать двигательные нарушения, улучшать двигательную функцию, уменьшать когнитивное нарушение, улучшать когнитивную функцию или осуществлять их комбинацию.
В родственных вариантах осуществления изобретение относится к способу смягчения по меньшей мере одного из симптомов, ассоциированных с болезнью Альцгеймера или родственными таупатиями у индивидуума, причем способ включает введение указанному индивидууму эффективного количества по меньшей мере одного антитела, по меньшей мере одного пептида и/или по меньшей мере одного соединения, предусматриваемого изобретением, в комбинации по меньшей мере с одним комбинируемым средством, выбранным из ингибиторов ацетилхолинэстеразы, антагонистов рецептора NMDA, хелаторов переходных металлов, факторов роста, гормонов, нестероидных противовоспалительных лекарственных средств (NSAID), антиоксидантов, средств, снижающих уровень липидов, селективных ингибиторов фосфодиэстеразы, ингибиторов агрегации белка тау, ингибиторов протеинкиназ, ингибиторов белков теплового шока, реагентов для пассивной и активной иммунизации против амилоида, ингибиторов агрегации амилоида и ингибиторов секретазы.
В некоторых вариантах осуществления способов лечения, профилактики или смягчения по меньшей мере одного из симптомов, ассоциированных с болезнью Альцгеймера или родственными таупатиями у индивидуума, способ включает введение пациенту-человеку эффективного количества по меньшей мере одного антитела, по меньшей мере одного пептида и/или по меньшей мере одного соединения, предусматриваемых изобретением, и/или адъюванта, который усиливает иммунный ответ; в комбинации по меньшей мере с одним комбинируемым средством, выбранным из ингибиторов ацетилхолинэстеразы, антагонистов рецептора NMDA, хелаторов переходных металлов, факторов роста, гормонов, нестероидных противовоспалительных лекарственных средств (NSAID), антиоксидантов, средств, снижающих уровень липидов, селективных ингибиторов фосфодиэстеразы, ингибиторов агрегации белка тау, ингибиторов протеинкиназ, ингибиторов белков теплового шока, пассивной и активной иммунизации против амилоида, ингибиторов агрегации амилоида и ингибиторов секретазы; где способ обеспечивает иммунный ответ, включающий антитела против патологического белка тау, тем самым, осуществляя лечение, профилактику прогрессирования или смягчение по меньшей мере одного из симптомов, ассоциированных с AD, у пациента-человека.
В некоторых вариантах осуществления способов лечения, профилактики или смягчения по меньшей мере одного из симптомов, ассоциированных с болезнью Альцгеймера, или родственных таупатий у индивидуума, комбинируемое средство вводят до, одновременно или после введения антитела, пептида и/или соединения, предусматриваемого изобретением.
В родственных вариантах осуществления изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и/или разбавитель; и
a) антитело, предусматриваемое изобретением; и/или
b) пептид, предусматриваемый изобретением; и/или
c) соединение, предусматриваемое изобретением;
в комбинации по меньшей мере с одним комбинируемым средством, выбранным из ингибиторов ацетилхолинэстеразы, антагонистов рецептора NMDA, хелаторов переходных металлов, факторов роста, гормонов, нестероидных противовоспалительных лекарственных средств (NSAID), антиоксидантов, средств, снижающих уровень липидов, селективных ингибиторов фосфодиэстеразы, ингибиторов агрегации белка тау, ингибиторов протеинкиназ, ингибиторов белков теплового шока, реагентов для пассивной и активной иммунизации против амилоида, ингибиторов агрегации амилоида и ингибиторов секретазы. В некоторых вариантах осуществления антитело представляет собой DC8E8. В определенных вариантах осуществления антитело содержит по меньшей мере одну CDR из DC8E8. В некоторых вариантах осуществления антитело содержит по меньшей мере одну вариабельную цепь (легкую или тяжелую) из DC8E8. В определенных вариантах осуществления можно использовать гуманизированную или человеческую версию DC8E8. В некоторых вариантах осуществления по меньшей мере один пептид выбран из любой из SEQ ID NO: 1-4, SEQ ID NO: 9-101 и SEQ ID NO: 108-112, NIKHVPGGGS (SEQ ID NO: 201), IKHVPGGGS (SEQ ID NO: 202), KHVPGGGSV (SEQ ID NO: 203), HVPGGGSVQ (SEQ ID NO: 204), VPGGGSVQ (SEQ ID NO: 205), GWSIHSPGGGSC (SEQ ID NO: 250), SVFQHLPGGGSC (SEQ ID NO: 251), ANIKHVPGGGS (SEQ ID NO: 144), DAIKHVPGGGS (SEQ ID NO: 146), DNAKHVPGGGS (SEQ ID NO: 149), DNIAHVPGGGS (SEQ ID NO: 151), DNIKAVPGGGS (SEQ ID NO: 159), DNIKHAPGGGS (SEQ ID NO: 161) и DNIKHVPGGGS (SEQ ID NO: 171). В одном варианте осуществления пептид выбран из SEQ ID NO: 1-4. В другом варианте осуществления пептид представляет собой SEQ ID NO. 108. В одном варианте осуществления пептид представляет собой GWSIHSPGGGSC (SEQ ID NO: 250). В определенных вариантах осуществления пептид представляет собой SVFQHLPGGGSC (SEQ ID NO: 251). В определенных вариантах осуществления пептид выбран из SEQ ID NO: 270 (TENLKHQPGGGK); SEQ ID NO: 271 (KHQPGGG), SEQ ID NO: 272 (HQPGGG); SEQ ID NO: 275 (ENLKHQPGGGKVQIINKKLDLSNVQSKCGSKDNIKHVPGGGS), SEQ ID NO: 276 (KHVPGGG), SEQ ID NO: 277 (HVPGGG), SEQ ID NO: 280 (DNIKHVPGGGSVQIVYKPV), SEQ ID NO: 281 (HHKPGGG), SEQ ID NO: 282 (HKPGGG) и SEQ ID NO: 283 (THVPGGG). В других вариантах осуществления пептид выбран из SEQ ID NO: 272 (HQPGGG) и SEQ ID NO: 277 (HVPGGG).
Дополнительные задачи и преимущества вариантов осуществления указаны частично в описании, которое приведено ниже, и частично будут очевидны из описания, или они могут быть установлены при осуществлении на практике вариантов осуществления. Задачи и преимущества вариантов осуществления будут реализовываться и достигаться с помощью элементов и комбинаций, в частности, указанных в прилагаемой формуле изобретения.
Следует понимать, что как представленное выше общее описание, так и представленное ниже подробное описание, являются только иллюстративными и пояснительными, и не ограничивают заявленные варианты осуществления.
Прилагаемые чертежи, которые включены и составляют часть настоящего описания, иллюстрируют несколько вариантов осуществления и вместе с описанием служат для пояснения принципов вариантов осуществления. Публикации, рассмотренные в настоящем описании, предоставлены только для их раскрытия до даты подачи настоящей заявки. Они включены в качестве ссылок в полном объеме для любых целей. Ничто в настоящем описании не следует истолковывать, как допущение того, что настоящее изобретение не дает право на противопоставление факта создания изобретения с более ранним приоритетом. Кроме того, предоставленные даты публикации могут отличаться от фактических дат публикации, и они требуют независимого подтверждения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1: Схематическое представление шести изоформ белка тау человека.
Фиг.2: Схематическое представление функциональной карты белка тау человека (2N4R). На фиг.2 "VQIINK" и "VQIVYK" представлены как SEQ ID NO: 116 и 115, соответственно.
Фиг.3: Нуклеотидные и аминокислотные последовательности вариабельных областей DC8E8 и их выравнивание с наиболее сходными последовательностями мыши эмбрионального типа. На фиг.3 представлены нуклеотидная последовательность (SEQ ID NO: 165) (A) и аминокислотная последовательность (SEQ ID NO: 141 (для вариабельной области легкой цепи) и 117-119 (для каждой из ее CDR, согласно IMGT), соответственно, по порядку); (B) последовательности вариабельной области легкой цепи (VL) DC8E8 (выравнивание раскрывает SEQ ID NO: 166 и 168, соответственно, по порядку); и (C) выравнивание V-гена вариабельной области легкой цепи DC8E8 с наиболее сходной последовательность мыши эмбрионального типа IGKV8-21*01 (выравнивание раскрывает SEQ ID NO: 166 и 167, соответственно, по порядку) с последующим выравниванием J-гена VL DC8E8 (SEQ ID NO:168) с наиболее сходным J-геном мыши, IGKJ1*01 (SEQ ID NO: 169). На фиг. представлена нуклеотидная (SEQ ID NO: 170) (в D) и аминокислотная последовательность вариабельной области тяжелой цепи DC8E8 и ее трех CRD (SEQ ID NO: 171 и 120-122, соответственно, по порядку). На (F) представлены следующие выравнивания для DC8E8: во-первых, V-ген вариабельной области тяжелой цепи (VH) DC8E8 (SEQ ID NO 172) с наиболее сходной последовательностью мыши эмбрионального типа IGHV1-81*01 (SEQ ID NO 172); во-вторых, D-ген вариабельной области тяжелой цепи (VH) DC8E8 (SEQ ID NO 174) с наиболее сходной последовательностью мыши эмбрионального типа IGHD2-14*01 (SEQ ID NO 175); и, наконец, J-ген вариабельной области тяжелой цепи (VH) DC8E8 (SEQ ID NO 176) с наиболее сходной последовательностью мыши эмбрионального типа IGHJ4*01 (SEQ ID NO 177). Также представлены последовательность константной области легкой цепи каппа DC8E8 (SEQ ID NO: 178) (G) и последовательность константной области тяжелой цепи (SEQ ID NO: 179) (H). Определяющие комплементарность области (CDR) подчеркнуты в последовательности белка (B) и (E), и они идентифицированы в соответствии с системой нумерации IMGT.
Фиг.4: Выравнивание последовательности вариабельной области легкой цепи (VL) DC8E8 (SEQ ID NO: 166 (V-ген) и 168 (J-ген), соответственно, с наиболее сходным геном VL человека эмбрионального типа (SEQ ID NO: 180-181, соответственно, по порядку).
Фиг.5: Выравнивание последовательности вариабельной области тяжелой цепи (VH) DC8E8 (SEQ ID NO: 172, 174 и 176, для генов V, D и J, соответственно) с наиболее сходным геном VH человека эмбрионального типа (SEQ ID NO: 182-183 и 185, соответственно, по порядку).
Фиг.6: Картирование эпитопа DC8E8 с помощью делеционных мутантов белка тау с использованием ELISA. (A) Схематическое представление белков тау, использованных для картирования эпитопа DC8E8, и (B) их аминокислотная последовательность (SEQ ID NO: 186-197, 102, 104 и 198-199, соответственно, по порядку). (C) Данные ELISA. DC8E8 распознает следующие белки тау: Δ358-441, Δ421-441, Δ134-168, Δ1-220, Δ1-126, 2N4R, 2N3R, Δ(1-296; 392-441)и Δ(1-150; 392-441)/4R. DC8E8 не распознает следующие белки тау: Δ222-427, Δ306-400, Δ228-441, Δ300-312, Δ257-400, Δ137-441, Δ283-441.
Фиг.7: (A) и (B) Схематическое представление синтетических пептидов (SEQ ID NO: 206, 207, 208, 2, 210, 211, 212, 3, 214, 215, 4, 217, 26, 219, 36, 221, 222, 109 и 88, соответственно, по порядку) для картирования эпитопа, и их последовательность, соответственно. (C) Картирование эпитопа DC8E8 с помощью синтетического пептида способом ELISA. (D) Схематическое представление эпитопов, которые DC8E8 способно связывать в белке тау. DC8E8 способно связываться с любой из четырех отдельных связывающих областей, каждая из которых представляет собой отдельный эпитоп, называемый эпитопами с 1 по 4. Каждый из этих четырех эпитопов расположен отдельно в 1-ом (эпитоп #1), 2-ом (эпитоп #2), 3-ем (эпитоп #3) и 4-ом (эпитоп #4) повторяющихся доменах белка тау. Как показано, каждый из четырех эпитопов DC8E8, соответственно, охватывается одной из следующих аминокислотных последовательностей: 267-KHQPGGG-273 (SEQ ID NO: 98) (в 1-ом повторяющемся домене белка тау), 298-KHVPGGG-304 (SEQ ID NO: 99) (во 2-ом повторяющемся домене белка тау), 329-HHKPGGG-335 (SEQ ID NO: 100) (в 3-ем повторяющемся домене белка тау) и 361-THVPGGG-367 (SEQ ID NO: 101) (в 4-ом повторяющемся домене белка тау), соответственно.
Фиг.8: (A) Выравнивание аминокислотной последовательности белка тау человека (SEQ ID NO: 225) с последовательностью белка тау из другого вида (SEQ ID NO: 226-245, соответственно, по порядку). Для выравнивания использовали полноразмерный белок тау человека; представлены только аминокислоты 265-368 белка тау человека после выравнивания. Области, содержащие четыре отдельных эпитопа DC8E8 на белке тау человека, и выровненные последовательности заключены в рамку и показаны полужирным шрифтом. (B) Конкурентный ELISA, демонстрирующий способность шести пептидов белка тау (SEQ ID NO: 201-205 и 200, соответственно, по порядку) конкурировать с тауΔ(1-150; 392-441)/4R (SEQ ID NO: 199) за связывание с антителом DC8E8, способным распознавать по меньшей мере один из эпитопов белка тау, вовлеченных в агрегацию тау-тау, (C) Конкурентный ELISA, демонстрирующий способность семи тау-пептидов (SEQ ID NO: 144, 146, 149, 151, 159, 161 и 171) конкурировать с тауΔ(1-150; 392-441)/4R за связывание с антителом DC8E8, способным распознавать по меньшей мере один из эпитопов белка тау, вовлеченных в агрегацию тау-тау.
Фиг.9: (A). Поверхностный плазмонный резонанс (SPR) для охарактеризации связывания DC8E8 с тауΔ(1-150; 392-441)/4R и 2N4R. (B). Поверхностный плазмонный резонанс (SPR) для охарактеризации связывания DC8E8 с тауΔ(1-150; 392-441)/3R и 2N3R.
Фиг.10: (A). Константы ассоциации и диссоциации для связывания DC8E8 с тауΔ(1-150; 392-441)/4R и с тау 2N4R, при определении с помощью SPR. (B). Константы ассоциации и диссоциации для связывания DC8E8 с тауΔ(1-150; 392-441)/3R и с тау 2N3R, при определении с помощью SPR. Концентрации, использованные в измерениях, указаны на графиках, пунктирные линии были интерполированы компьютерной программой BIA evaluation software 4.1 (Biacore AB) из измеренных данных для вычисления кинетических параметров.
Фиг.11: Моноклональное антитело DC8E8 способно различать доклиническую AD, клинически начинающуюся AD и полностью развернутую AD конечной стадии. DC8E8 проявляет окрашивание ранних стадий (мономеры, димеры белка тау) патологического белка тау при доклинической AD у человека - стадия I Браака. (A). Антитело распознает стадию олигомеров патологического белка тау (стрелки) и стадию полимеров патологического белка тау (узелков) (концы стрелок) (B). При полностью развернутой болезни Альцгеймера (конечная стадия - стадия VI Браака), DC8E8 распознает в основном полимеры патологического белка тау в формах нейрофибриллярных узелков (концы стрелок), нейритических бляшек (внутри окружности) и нейритических нитей (внутри пятиугольника) (C). Масштабная метка: 100 мкм. Моноклональное антитело DC8E8 распознает все стадии развития образования узелков при болезни Альцгеймера (D). DC8E8 распознает ранние стадии развития образования узелков - мономерную, димерную и раннюю олигомерную стадию (D1), и позднюю олигомерную доузелковую стадию (D2), а также поздние стадии развития полимеров патологического белка тау - внутриклеточные (D3) и внеклеточные нейрофибриллярные узелки (D4). Конец стрелки указывает на небольшие олигомерные агрегаты белка тау внутри пирамидальных гиппокампальных нейронов (D1). Масштабная метка: 10 мкм.
Фиг.12: (A) Моноклональное антитело DC8E8 распознает нейрофибриллярную дегенерацию у трансгенных крыс SHR72. DC8E8 распознает стадию олигомерного белка тау (стрелки) и стадию узелков (концы стрелок) при нейродегенерации белка тау. Более того, антитело взаимодействует с неправильно свернутым белком тау, который располагается в аксональных волокнах (внутри прямоугольника). (B) В головном мозге совпадающих по возрасту контрольных крыс антитело не демонстрирует интранейронального окрашивания. Масштабная метка: 20 мкм. DC8E8 также распознает все стадии развития образования узелков в головном мозге трансгенных крыс (SHR72), как и при болезни Альцгеймера у человека. DC8E8 распознает ранние стадии развития образования узелков - мономерную, димерную и раннюю олигомерную стадию (C) и позднюю олигомерную доузелковую стадию (D), а также поздние стадии развития полимеров патологического белка тау - внутриклеточные (E) и внеклеточные нейрофибриллярные узелки (отсутствующее ядро) (F). Конец стрелки в (C) указывает на небольшие олигомерные агрегаты белка тау внутри нейронов (A). Масштабная метка: 10 мкм.
Фиг.13: (A) Окрашивание с помощью DC8E8 нейрофибриллярных узелков в коре трансгенных крыс SHR24, которые экспрессируют тауΔ(1-150; 392-441)/3R. (B) DC8E8 распознавало нейрофибриллярные узелки в стволе головного мозга трансгенных крыс SHR72, которые экспрессируют тауΔ(1-150; 392-441)/4R. Срезы тканей контрастно окрашивали метиловым зеленым. Стрелки - нейрофибриллярные узелки. Масштабная метка: 50 мкм.
Фиг.14: Моноклональное антитело DC8E8 распознает как растворимый (A), так и нерастворимый белок тау (B) в образцах головного мозга, выделенных из трансгенных крыс в модели SHR24 (изокортекс) и от пациентов с болезнью Альцгеймера (ткань аллокортекса, включающая гиппокамп, энторинальную и темпоральную кору). Конец стрелки - укороченный белок тау человека, стрелка - эндогенный белок тау крысы. Для растворимых фракций белка тау наносили 15 мкг белка на дорожку. Для нерастворимых фракций белка тау осадок растворяли в 1 × буфере для нанесения образцов с додецилсульфатом натрия (SDS) в 1/50 объема 1S, наносили тот же объем, как и случае растворимых фракций. Моноклональное антитело DC8E8 распознает как растворимые, так и нерастворимые белки тау в образцах головного мозга, выделенных от пациентов с болезнью Альцгеймера (ткань аллокортекса, включающая гиппокамп, энторинальную и темпоральную кору) (C) и из трансгенных крыс в модели SHR72 (ствол головного мозга) (D). Стрелка - физиологические белки тау человека (A) и эндогенный белок тау крысы (B), конец стрелки - укороченный тау человека (тауΔ(1-150; 392-441)/4R), экспрессируемый в качестве трансгена в нейронах крыс SHR72 (D). Для растворимых фракций белка тау наносили 15 мкг общего белка на дорожку. Для нерастворимых фракций белка тау осадок растворяли в 1 × буфере для нанесения образцов с додецилсульфатом натрия (SDS) в 1/50 объема 1S, наносили тот же объем, как и случае растворимых фракций.
Фиг.15: DC8E8 ингибирует патологическое взаимодействие тау-тау в флуоресцентном анализе фибриллизации белка тау. С помощью гепарина осуществляли индукцию конформационных изменений и фибриллизации тауΔ(1-150; 392-441)/4R (фиг.15A) или тауΔ(1-296;392-441)/4R (фиг.15B) при измерении по флоуресценции тиофлавина T; mAb DC8E8, Rab50 и DC11 исследовали в отношении их способности предупреждать патологическое изменение конформации.
Фиг.16: Анализ ингибиторного потенциала DC8E8 в отношении предотвращения образования димеров, тримеров и олигомеров белка тау для укороченного белка тау тауΔ(1-296;392-441)/4R с помощью иммуноблоттинга с использованием конъюгированного с HRP mAb DC25.
Фиг.17: Захват и деградация тауΔ(1-150; 392-441)/4R клетками микроглии BV2. ТауΔ(1-150; 392-441)/4R добавляли к клеткам BV2 мыши либо отдельно (1 мкМ), либо в комплексе с моноклональным антителом DC8E8 (1 мкМ тауΔ(1-150; 392-441)/4R + 1 мкМ DC8E8). После инкубации в течение различных периодов времени (2, 4, 6 и 12 часов), клетки BV2 промывали кислотой, экстрагировали клеточные белки и анализировали уровни интернализованного белка тау вестерн-блоттингом с общим антителом против тау DC25. ТауΔ(1-150; 392-441)/4R метили иммунной меткой в клеточных лизатах (внутриклеточный белок тау) (A) и в среде для культивирования клеток (внеклеточный белок тау) (B). Антитело DC8E8 визуализировали с помощью конъюгированного с HRP антитела против антител мыши. На дорожку наносили 20 г белка.
Фиг.18: Стабильность (срок хранения) DC8E8 при 37°C, при исследовании с помощью ELISA. Антитело распознавало тауΔ(1-150; 392-441)/4R после хранения в течение нескольких месяцев (1, 2, 3 и 4 месяца). Планки соответствуют серийным разведениям антитела, как указано. Измерения проводили в трех экземплярах.
Фиг.19: DC8E8 распознает и нацелено на неправильно свернутый (обуславливающий заболевание) белок тау в тканях головного мозга при болезни Альцгеймера у человека. (A) Анализ с использованием вестерн-блоттинга с общим антителом против белков тау DC25:
4) Биохимическая экстракция патологического белка тау из тканей головного мозга при болезни Альцгеймера человека (Greenberg and Davies, 1989);
5) Имитирующее антитело (Rab50) не распознает белок тау;
6) DC8E8 распознает и нацелено на неправильно свернутый (обуславливающий заболевание) белок тау в тканях головного мозга при болезни Альцгеймера человека; и
(B) Окрашивание понсо S: 2),3) Контроль количества антитела (Rab50 и DC8E8), использованного в эксперименте.
Фиг.20: DC8E8 распознает и нацелено на неправильно свернутый (связанный с заболеванием) белок тау в тканях головного мозга в модели AD на крысах SHR72. (A) Анализ с использованием вестсерн-блоттинга с общим антителом против белка тау DC25:
1) Биохимическая экстракция патологического белка тау из тканей головного мозга при болезни Альцгеймера человека (Greenberg and Davies, 1989);
2) Имитирующее антитело (Rab50) не распознает белок тау;
3) DC8E8 распознает и нацелено на неправильно свернутый (обуславливающий заболевание) белок тау в тканях головного мозга при болезни Альцгеймера человека; и
(B) Окрашивание понсо S: 2),3) Контроль количества антитела (Rab50 и DC8E8), использованного в эксперименте.
Фиг.21: In vivo, DC8E8 нацелено на патологические формы белка тау в головном мозге трансгенных крыс (SHR72) и транспортирует патологический белок тау из головного мозга в периферическую кровь. (A) Концентрация антитела DC8E8 в сыворотке животных, которым вводили DC8E8, достигала 466, 200 и 273 пг/мл, соответственно. Наблюдали (B) транспорт in vivo комплексов DC8E8-тау из головного мозга в периферическую кровь. Патологический белок тау достигал средней концентрации 350 пг/мл сыворотки. Активный транспорт белка тау посредством DC8E8 устраняет патологические белки тау из головного мозга. С другой стороны, не было выявлено белков тау в сыворотке животных, которым вводили имитирующее антитело (Rab50), которое распознает вирус бешенства (Macikova et al., 1992). Концентрацию белка тау в сыворотке животных, которым проводили введение, определяли с помощью Innotest hTAU ELISA (Innogenetics, Belgium). На графике представлены средние значения со стандартными ошибками среднего значения (SEM). Каждая из 8 планок для крыс A-C указывает на отличающееся последовательное разведение сыворотки (от разведения в 100 раз до разведения в 12800 раз, слева направо).
Фиг.22: Моноклональное антитело DC8E8 устраняет патологический белок тау из головного мозга трансгенных крыс (SHR72). (A) Внутримозговое применение DC8E8 (левая панель) устраняет (стрелки) патологический белок тау из нейронов по сравнению с животными, которым проводили имитирующее введение (правая панель). (B) Количественное определение патологического белка тау в нейронах животных с имитирующим введением и введением DC8E8 продемонстрировало значительное уменьшение количества патологического белка тау у животных, которым вводили DC8E8 (p<0,0001).
Фиг.23: Рекомбинантный фрагмент scFv (scDC8E8v) моноклонального антитела DC8E8, экспрессируемого в бактериях, распознает патологический небеспорядочный тауΔ(1-150; 392-441)/4R. (A) Окрашивание кумасси бриллиантовым голубым неочищенных лизатов контрольных бактерий BL21 и бактерий, содержащих экспрессирующую плазмиду scDC8E8v, разделенных с помощью 10% SDS-PAGE: дорожка 1, неочищенный лизат контрольных бактерий BL21; дорожка 2, неочищенный лизат бактерий BL21, экспрессирующих scDC8E8v; и дорожка M, маркер молекулярной массы белка (Page Ruller Prestained Protein Ladder #SM0672, Fermentas). (B) Окрашенная понсо S нитроцеллюлозная мембрана, содержащая белки тау: дорожка 1, тауΔ(1-150; 392-441)/4R, 500 нг; дорожка 2, тауΔ(1-150; 392-441)/4R, 250 нг; дорожка 3, тауΔ(1-150; 392-441)/4R, 125 нг; дорожка 4 тауΔ228-441, 50 нг; и дорожка M, маркер молекулярной массы белка. (C) Вестерн-блот/нитроцеллюлозная мембрана, содержащие белки тау, нанесенные согласно B), исследованные с помощью лизата бактерий, экспрессирующих scDC8E8v. (D) Вестерн-блот/нитроцеллюлозная мембрана, содержащие белки тау, нанесенные согласно B), исследованные с помощью отрицательного контрольного бактериального лизата.
Фиг.24: Рекомбинантный фрагмент scFv моноклонального антитела DC8E8 (scDC8E8v) проявляет свойства связывания белка тау, сходные с антителом DC8E8 - селективно распознает тауΔ(1-150; 392-441)/4R. (A) Кинетическое определение аффинности с помощью SPR для связывания scDC8E8v с тауΔ(1-150; 392-441)/4R при AD. (B) Кинетическое определение аффинности с помощью SPR для связывания scDC8E8v с тау 2N4R. (C) Константы скоростей (kON и kOFF) и равновесная константа ассоциации для связывания scDC8E8v.
Фиг.25: Идентификация остатков в активном центре scDC8E8v, которые влияют на распознавание scDC8E8v/DC8E8 небеспорядочного белка тау. (A) Окрашивание кумасси бриллиантовым голубым полиакриламидных гелей после разделения белков из неочищенного лизата бактерий BL21, содержащих экспрессирующую плазмиду scDC8E8v (wt) и ее мутантные формы. Каждая пронумерованная дорожка соответствует соответствующему номеру клона (например, дорожка 2 соответствует 2-VL-R33A). Экспрессируемые одноцепочечные белки указаны звездочками. Контрольные бактериальные культуры не экспрессируют одноцепочечные белки. (B) Окрашенная понсо S нитроцеллюлозная мембрана, содержащая белки тау: дорожка 1, тауΔ(1-150; 392-441)/4R, 500 нг; дорожка 2, тауΔ(1-150; 392-441)/4R, 250 нг; дорожка 3, тауΔ(1-150; 392-441)/4R, 125 нг. (C) Вестерн-блоттинг на нитроцеллюлозных мембранах, содержащих белки тау, нанесенные согласно B), которые исследовали с помощью лизатов бактерий, экспрессирующих либо scDC8E8v (гель wt), либо одну из мутантных форм (блоты с 1-VL-N31A по 22-VH-G102A).
Фиг.26: (A) Схематическое представление тау 2N4R (SEQ ID NO: 102) с четырьмя эпитопами DC8E8, показанными с помощью заштрихованных рамок в увеличенной области между остатками 261 и 373 (SEQ ID NO: 246): SEQ ID NO: 98-101, соответственно. (1) Схематическое представление перекрывания происходящих из белка тау пептидных иммуногенов, содержащих по меньшей мере одну из четырех областей белка тау, распознаваемых антителом DC8E8, для применения в качестве активных вакцин или для очистки антител DC8E8 и т.п.; (2) общая возможность для других модифицированных или сконструированных пептидов и соединений, с необязательными частями. (B) Обобщение анализа с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга трансгенных крыс (SHR72, экспрессирующие тауΔ(1-150; 392-441)/4R), которым вводили пептиды SEQ ID NO: 1-8 и 108. Анализ с помощью иммуноблотинга проводили с различными mAb для определения снижения количества нерастворимого белка тау по следующим имеющим значение при AD эпитопам: mAb DC25 (тау 347-353), mAb DC217 (тау pThr217), mAb DC209 (тау pThr 231), mAb AT8 (тау pSer202/pThr205) и mAb AT270 (тау pThr181). (C) Денситометрический анализ с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга крыс, которым вводили 251-PDLKNVKSKIGSTENLKHQPGGGKVQIINK-280 (SEQ ID NO: 1) в комбинации с адъювантом, и из контрольных крыс, которым вводили только адъювант. Средние величины представлены со стандартной ошибкой среднего значения.
Фиг.27: Нейроповеденческая оценка трансгенных крыс (SHR72) в модели AD, которым вводили тау 251-PDLKNVKSKIGSTENLKHQPGGGKVQIINK-280 (SEQ ID NO:1). Через десять суток после 5-ой дозы иммуногена трансгенных крыс использовали для поведенческого исследования. На диаграммах представлено среднее значение ± SEM. Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни. (A) Испытание хождения по перекладине (перекладина 3,5 см). (B) Число соскальзываний задних конечностей (перекладина 3,5 см). (C) NeuroScale.
Фиг.28: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 1 обеспечила 49% снижение нагрузки нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.29: Количественный анализ с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга трансгенных крыс (SHR72), которым вводили тау 256-VKSKIGSTENLKHQPGGGKVQIINKKLDLS-285 (SEQ ID NO: 2) с адъювантом, или контрольных крыс, которым вводили только адъювант. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.30: Нейроповеденческая оценка трансгенных крыс (SHR72), которым вводили 256-VKSKIGSTENLKHQPGGGKVQIINKKLDLS-285 (SEQ ID NO:2). Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни. (A) Испытание хождения по перекладине (перекладина 3,5 см). (B) Число соскальзываний задних конечностей (перекладина 3,5 см). (C) NeuroScale.
Фиг.31: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 2 обеспечила 60% снижение нагрузки нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.32: Количественный анализ с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга трансгенных крыс (SHR72), которым вводили 256-VKSKIGSTENLKHQPGGGKVQIINKKLDLS-285 с фосфорилированным Ser262 (SEQ ID NO: 2) с адъювантом, или контрольных крыс, которым вводили только адъювант. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.33: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO:2/фосфо обеспечивала 77% снижение нагрузки нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.34: Количественный анализ с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга трансгенных крыс (SHR72), которым вводили тау 259-KIGSTENLKHQPGGGKVQIINKKLDLSNVQ-288 (SEQ ID NO:3) с адъювантом, или контрольных крыс, которым вводили только адъювант. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.35: Нейроповеденческая оценка трансгенных крыс (SHR72), которым вводили тау 259-KIGSTENLKHQPGGGKVQIINKKLDLSNVQ-288 (SEQ ID NO: 3). Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни. (A) Испытание хождения по перекладине (перекладина 3,5 см). (B) Число соскальзываний задних конечностей (перекладина 3,5 см). (C) NeuroScale.
Фиг.36: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 3 обеспечила 58% снижение нагрузки нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.37: Количественный анализ с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга трансгенных крыс (SHR72), которым вводили тау 275-VQIINKKLDLSNVQSKCGSKDNIKHVPGGG-304 (SEQ ID NO: 4), или контрольных крыс, которым вводили только адъювант. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.38. Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 4 продемонстрировала умеренное улучшение нейроповеденческих параметров. (A) Испытание хождения по перекладине (перекладина 3,5 см). (B) Число соскальзываний задних конечностей (перекладина 3,5 см). (C) NeuroScale. Данные представлены в качестве средних значений со стандартной ошибкой среднего значения.
Фиг.39: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 4 обеспечила 66% снижение нагрузки нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.40: Анализ с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга трансгенных крыс (SHR72), иммунизированных 201-GSPGTPGSRSRTPSLPTPPTREPKKVAVVR-230/содержащих фосфорилированный треонин в положении 217 (SEQ ID NO: 5) с адъювантом, или контрольных крыс, которым вводили только адъювант. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.41: Нейроповеденческая оценка трансгенных крыс (SHR72), которым вводили тау 201-GSPGTPGSRSRTPSLPTPPTREPKKVAVVR-230/содержащий фосфорилированный треонин в положении 217 (SEQ ID NO: 5). Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни. (A) Испытание хождения по перекладине (перекладина 3,5 см). (B) Число соскальзываний задних конечностей (перекладина 3,5 см). (C) NeuroScale.
Фиг.42: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 5 не продемонстрировала эффекта на нагрузку нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.43: Анализ с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга трансгенных крыс (SHR72), иммунизированных тау 379-RENAKAKTDHGAEIVYKSPWSGDTSPRHL-408, содержащим фосфорилированные остатки серина в положениях 396 и 404 (SEQ ID NO: 6) и адъювантом, или контрольных крыс, которым вводили только адъювант. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.44: Нейроповеденческая оценка трансгенных крыс (SHR72), которым вводили белок тау SEQ ID NO: 6, фосфорилированный по Ser396/Ser404. Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни. (A) Испытание хождения по перекладине (перекладина 3,5 см). (B) Число соскальзываний задних конечностей (перекладина 3,5 см). (C) NeuroScale.
Фиг.45: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 6 продемонстрировала отсутствие снижения нагрузки нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.46: Анализ с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга крыс (SHR72), иммунизированных тау 181-TPPSSGEPPKSGDRSGYSSPGSPGTPGSRS-210, содержащим фосфорилированный остаток серина в положении 202 и остаток треонина в положении 205 (SEQ ID NO: 7) с адъювантом, или контрольных крыс, которым вводили только адъювант. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.47: Нейроповеденческая оценка крыс SHR72, которым вводили тау 181-TPPSSGEPPKSGDRSGYSSPGSPGTPGSRS-210, содержащий фосфорилированный остаток серина в положении 202 и остаток треонина в положении 205 (SEQ ID NO: 7). Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни. (A) Испытание хождения по перекладине (перекладина 3,5 см). (B) Число соскальзываний задних конечностей (перекладина 3,5 см). (C) NeuroScale.
Фиг.48: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 7 продемонстрировала отсутствие эффекта на нагрузку нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.49: Анализ с помощью иммуноблоттинга нерастворимых белков тау, полученных из ствола головного мозга крыс (SHR72), иммунизированных тау 300-VPGGGSVQIVYKPVDLSK-317 (SEQ ID NO: 8) с адъювантом, или контрольных крыс, которым вводили только адъювант. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.50: Нейроповеденческая оценка трансгенных крыс с AD (SHR72), которым вводили тау 300-VPGGGSVQIVYKPVDLSK-317 (SEQ ID NO: 8). Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни. (A) Испытание хождения по перекладине (перекладина 3,5 см). (B) Число соскальзываний задних конечностей (перекладина 3,5 см). (C) NeuroScale.
Фиг.51: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 8 продемонстрировала отсутствие снижения нагрузки нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.52: Вакцинация трансгенных крыс SHR72 тау-пептидом (SEQ ID NO: 108) статистически значимо снижала уровень нерастворимого патологического белка тау (p<0,001). Патологический нерастворимый белок тау экскретировался из головного мозга трансгенных крыс SHR72, иммунизированных тау-пептидом и анализированных с помощью иммуноблоттинга. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.53: Вакцинация трансгенных крыс SHR72 тау-пептидом (SEQ ID NO: 108) статистически значимо улучшала нейроповеденческие параметры (p<0,05). (A) Испытание хождения по перекладине (перекладина 3,5 см). (B) Число соскальзываний задних конечностей (перекладина 3,5 см). (C) NeuroScale. Данные представлены в качестве средних значений со стандартной ошибкой среднего значения.
Фиг.54: Вакцинация трансгенных крыс SHR72 тау-пептидом (SEQ ID NO: 108) обеспечила 60% снижение нагрузки нейрофибриллярными узелками (NFT). Для оценки NFT в тканях головного мозга трансгенных крыс SHR72 использовали антитело AT8.
Фиг.55: ELISA антисыворотки, полученной иммунизацией трансгенных крыс (SHR72) тау-пептидом 275-VQIINKKLDLSNVQSKCGSKDNIKHVPGGG-304 (SEQ ID NO: 4), демонстрирует различие связывания антисывороток с патологическим тауΔ(1-150; 392-441)/4R человека и физиологическим белком тау человека 2N4R.
Фиг.56: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 108 индуцировала образование антител, предпочтительно связывающихся с патологическим белком тау. Геометрические средние титры антител, измеренные с помощью ELISA, демонстрируют, что антитела, индуцированные вакцинацией тау-пептидом SEQ ID NO: 108, обладали наиболее высокой активностью связывания с иммуногеном (пептид SEQ ID NO: 108) и с патологическим тауΔ(1-150; 392-441)/4R. Физиологический белок тау (тау 2N4R), который использовали в качестве контроля, распознавался слабее.
Фиг.57: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 108 предпочтительно индуцировала образование изотипов IgG-антител, специфичных к патологическому белку тау. Представлен профиль изотипов антител, индуцированных тау-пептидом SEQ ID NO: 108. Сыворотки отдельных крыс разбавляли 1:800 и активность связывания с патологическим белком тауΔ(1-150; 392-441)/4R анализировали с помощью ELISA.
Фиг.58: Определение с помощью SPR аффинности антисывороток, полученных иммунизацией крыс SHR72 тау-пептидом 275-VQIINKKLDLSNVQSKCGSKDNIKHVPGGG-304 (SEQ ID NO: 4) в отношении связывания с тауΔ(1-150; 392-441)/4R человека и тау 2N4R человека.
Фиг.59: Иммуногистохимическое окрашивание головного мозга пациента-человека с AD антителами крысы, полученными иммунизацией трансгенных крыс (SHR72) тау 275-VQIINKKLDLSNVQSKCGSKDNIKHVPGGG-304 (SEQ ID NO: 4). (A) Антисыворотки распознавали нейрофибриллярные очаги в головном мозге при болезни Альцгеймера, в гиппокампе. (B) Более высокое увеличение продемонстрировало нейрофибриллярные узелки. Масштабные метки: 100 мкм (A), 10 мкм (B).
Фиг.60: Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 108 индуцировала антитела, распознающие патологические белки тау в срезах тканей головного мозга человека при болезни Альцгеймера. Репрезентативное иммунное окрашивание сыворотки крысы № 3 (A), 5 (B), 6 (C), 7 (D) и 8 (E) демонстрирует, что все исследованные антитела сыворотки крысы распознавали нейрофибриллярные узелки в слое пре-α энторинальной коры пациента с болезнью Альцгеймера. Объединенные сыворотки крыс, иммунизированных только адъювантом, использовали в качестве отрицательного контроля (F). Использовали серийные срезы тканей головного мозга из энторинальной коры. Масштабная метка: 50 мкм.
Фиг.61: Вакцинация трансгенных крыс SHR72 пептидом SEQ ID NO: 108 индуцировала специфические антитела, распознающие патологические белки белок в головном мозге человека при болезни Альцгеймера, а также в головном мозге трансгенных крыс SHR72. Патологический белок тау экстрагировали из тканей головного мозга человека и крысы и анализировали с помощью иммуноблоттинга с объединенными сыворотками от иммунизированных пептидом SEQ ID NO: 108 трансгенных крыс SHR72. Сывороточные антитела распознавали мономерный (дорожка № 1, 2 и № 3) и олигомерный (дорожка №2 и №3) патологический белок тау, включая характерный для AD патологический белок тау A68.
Фиг.62: Иммунизация мышей тау-пептидом SEQ ID NO: 109 индуцировала антитела со статистически значимо более высокой активностью связывания с патологическим белком тауΔ(1-150; 392-441)/4R, чем с физиологическим белком тау 2N4R (p=0,0115). На графике представлена статистическая оценка результатов ELISA для отдельных сывороток, разбавленных 1:800. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.63: Иммунизация мышей тау-пептидом SEQ ID NO: 110 индуцировала антитела, обладающие статистически значимо более высокой активностью связывания с патологическим белком тауΔ(1-150; 392-441)/4R, чем с физиологическим белком тау 2N4R (p=0,0029). На графике представлена статистическая оценка результатов ELISA для отдельных сывороток, разбавленных 1:800. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.64: Иммунизация мышей тау-пептидом SEQ ID NO: 111 индуцировала антитела, обладающие статистически значимо более высокой активностью связывания с патологическим белком тауΔ(1-150; 392-441)/4R, чем с физиологическим белком тау 2N4R (p=0,0007). На графике представлена статистическая оценка результатов ELISA для отдельных сывороток, разбавленных 1:800. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.65: Иммунизация мышей тау-пептидом SEQ ID NO: 112 индуцировала антитела, обладающие статистически значимо более высокой активностью связывания с патологическим тауΔ(1-150; 392-441)/4R, чем с физиологическим белком тау 2N4R (p<0,001). На графике представлена статистическая оценка результатов ELISA для отдельных сывороток, разбавленных 1:800. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.66: Сконструированные терапевтические эпитопы GWSIHSPGGGSC (SEQ ID NO: 250) и SVFQHLPGGGSC (SEQ ID NO: 251) конкурировали с патологическим тауΔ(1-150; 392-441)4R за связывание с антителом DC8E8.
Фиг.67: Сконструированные терапевтические эпитопы GWSIHSPGGGSC (SEQ ID NO: 250) и SVFQHLPGGGSC (SEQ ID NO: 251) индуцировали продукцию антител, которые статистически значимо различали патологический тауΔ(1-150; 392-441)4R и физиологический белок тау 2N4R, при анализе с помощью ELISA. Сыворотки (в разведении 1:3200) мышей, иммунизированных одним из пептидов 250 и 251, исследовали в отношении антител, специфичных к белкам тау: патологический тауΔ(1-150; 392-441)4R и физиологический белок тау 2N4R, с помощью ELISA.
Фиг.68: Иммунизация сконструированными терапевтическими эпитопами GWSIHSPGGGSC (SEQ ID NO: 250) и SVFQHLPGGGSC (SEQ ID NO: 251) индуцировала наиболее устойчивую продукцию антител изотипа IgG1.
Фиг.69: Измерения с помощью количественного SPR (поверхностный плазмонный резонанс) демонстрируют, что антитела, индуцированные сконструированным терапевтическим эпитопом 1 (GWSIHSPGGGSC, SEQ ID NO: 250) (фиг.69A) и сконструированным терапевтическим эпитопом 2 (SVFQHLPGGGSC, SEQ ID NO: 251) (фиг.69B) статистически значимо (p<0,001 и p<0,01, соответственно) различали патологический тауΔ(1-150; 392-441)/4R и физиологический белок тау 2N4R.
Фиг.70: Иммуногистохимическое окрашивание тканей головного мозга человека с заболеванием AD сыворотками против сконструированного терапевтического эпитопа 1 (GWSIHSPGGGSC, SEQ ID NO: 250) и сконструированного терапевтического эпитопа 2 (SVFQHLPGGGSC, SEQ ID NO: 251). (A) Антисыворотки против сконструированного терапевтического эпитопа 1 распознавали нейрофибриллярную патологию в головном мозге пациента с AD. (C) Высокое увеличение нейрофибриллярного узелка и нейропильных нитей (стрелки). (B) Антисыворотки против сконструированного терапевтического эпитопа 2 распознавали нейрофибриллярную патологию в головном мозге пациента с AD. (D) Высокое увеличение окрашенного нейрофибриллярного узелка и нейропильных нитей (стрелки). Антисыворотки против сконструированного терапевтического эпитопа 1 и сконструированного терапевтического эпитопа 2 не распознавали нормальный белок тау в контрольном головном мозге человека (E, F). Масштабная метка: 50 мкм (A, B, E, F), 20 мкм (C, D). (G) Сыворотка, полученная против сконструированного терапевтического эпитопа 2 (SVFQHLPGGGSC, SEQ ID NO: 251) распознает нейрофибриллярные очаги у трансгенных крыс SHR72. (H) В головном мозге совпадающих по возрасту контрольных крыс антитело не демонстрирует интранейронального окрашивания. Сыворотка распознает олигомерную доузелковую стадию (I), а также внутриклеточную (J). Масштабная метка: 20 мкм (A, B), 10 мкм (C, D).
Фиг.71: Антитела, индуцированные сконструированным терапевтическим эпитопом 1 (GWSIHSPGGGSC, SEQ ID NO: 250) и сконструированным терапевтическим эпитопом 2 (SVFQHLPGGGSC, SEQ ID NO: 251) распознавали растворимый и нерастворимый в саркозиле патологический белок тау, выделенный из тканей головного мозга человека при болезни Альцгеймера.
Фиг.72: Антитела, индуцированные сконструированным терапевтическим эпитопом 1 (GWSIHSPGGGSC, SEQ ID NO: 250) и сконструированным терапевтическим эпитопом 2 (SVFQHLPGGGSC, SEQ ID NO: 251) распознавали растворимый (дорожка 1, 3, 5) и нерастворимый (дорожка 2, 4, 6) патологический белок тау, выделенный из головного мозга в модели болезни Альцгеймера на крысах (SHR72).
Фиг.73: Иммунотерапия сконструированным терапевтическим эпитопом 2 (SVFQHLPGGGSC, SEQ ID NO: 251) продемонстрировала значительное улучшение нейроповеденческих параметров (NeuroScale) у крыс SHR72, которым проводили введение. (A) Испытание хождения по перекладине. (B) Число соскальзываний задних конечностей (p<0,05). (C) NeuroScale. Крысы, которым вводили сконструированный терапевтический эпитоп 2 (SEQ ID NO: 251), продемонстрировали: a) снижение латентности выхода на 27% в испытании хождения по перекладине, b) снижение количества соскальзываний задних конечностей на 44% (p<0,05), и c) снижение показателя NeuroScale на 26% по сравнению с трансгенным контрольными крысами, которым вводили только адъювант. Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни.
Фиг.74: Иммунотерапия сконструированным терапевтическим эпитопом 2 (SVFQHLPGGGSC, SEQ ID NO: 251) продемонстрировала статистически значимое снижение уровня патологического белка тау в головном мозге иммунизированных трансгенных крыс SHR72 с болезнью Альцгеймера. Иммунотерапия статистически значимо (p<0,05) снижала количество патологического нерастворимого белка тау у иммунизированных животных по сравнению с контрольными трансгенными крысами, которым вводили только адъювант. Снижение патологического нерастворимого тау наблюдали для всех проанализированных эпитопов белка тау (P<0,05).
Фиг.75: (A) Схематическое представление синтетических пептидов, использованных для дальнейшей оценки минимального эпитопа DC8E8 (терапевтический центральный элемент) и определения иммуногенного потенциала и (B) их аминокислотные последовательности.
Фиг.76: Определение минимального эпитопа DC8E8 (терапевтический центральный элемент) с использованием синтетических пептидов с помощью конкурентного ELISA. Десять тау-пептидов (SEQ ID NO: 270, 271, 272, 275, 276, 277, 280, 281, 282 и 283), которые содержат по меньшей мере 6 аминокислот последовательности распознавания DC8E8, способны конкурировать с патологическим тауΔ(1-150; 392-441)/4R за связывание с антителом DC8E8. Тау-пептиды, содержащие только 5 аминокислот последовательности распознавания DC8E8 (SEQ ID NO: 273, 274, 278 и 279) не конкурируют с тауΔ(1-150; 392-441)/4R (SEQ ID NO: 199) за связывание с антителом DC8E8.
Фиг.77: Индукция специфичных к белку тау антител после иммунизации мышей C57BL тау-пептидами. (A) 12-мерные, 7-мерные и 6-мерные пептиды (SEQ ID NO: 270, 271 и 272, соответственно) являются иммуногенными. Антитела, индуцированные иммунизацией, проявляют статистически значимо более высокую активность связывания с патологическим тауΔ(1-150; 392-441)/4R, чем с физиологическим белком тау 2N4R (p<0,0079; p<0,0052; p<0,0079, соответственно). 5-мерные пептиды SEQ ID NO: 273 и 274 не являются иммуногенными. (B) 42-мерные, 19-мерные, 7-мерные и 6-мерные пептиды (SEQ ID NO: 275, 280, 276 и 277, соответственно) являются иммуногенными. Антитела, индуцированные этими пептидами, статистически значимо (p<0,0079, p<0,0159, p<0,0079 и p<0,0379, соответственно) различали патологический тауΔ(1-150; 392-441)/4R и физиологический белок тау 2N4R. 5-мерные пептиды SEQ ID NO: 278 и 279 не являются иммуногенными. (C) 7-мерные пептиды (SEQ ID NO: 281 и 283) являются иммуногенными. Антисыворотки против этих пептидов статистически значимо (p<0,0379 и p<0,0286, соответственно) различали патологический тауΔ(1-150; 392-441)/4R и физиологический белок тау 2N4R. Уровни антител к патологическому белку тау и физиологическому белку тау, индуцированных 6-мерным пептидом SEQ ID NO: 282, были очень низкими. На графиках представлена статистическая оценка результатов ELISA для отдельных сывороток, разбавленных 1:800. Средние значения представлены со стандартной ошибкой среднего значения.
Фиг.78: Геометрические средние титры антител специфичных к белку тау антител после иммунизации мышей C57BL тау-пептидами. Вакцинация мышей C57BL тау-пептидом SEQ ID NO: 270, 271, 272, 275, 276, 277, 280, 281 и 283 индуцировала образование специфичных к белку тау антител. Геометрические средние титры антител, измеренные с помощью ELISA, демонстрируют, что антитела, индуцированные вакцинацией тау-пептидом SEQ ID NO: 270, 271, 272, 275, 276, 277, 280, 281 и 283, проявляли более высокую активность связывания с патологическим тауΔ(1-150; 392-441)/4R, чем с физиологическим белком тау (тау 2N4R). После иммунизации мышей тау-пептидами SEQ ID NO: 273, 274, 278, 279 и 282 были выявлены более низкие титры специфичных к белку тау антител.
Фиг.79A и 79B: Представлен профиль изотипов антител, индуцированных тау-пептидами. Иммунизация мышей C57/BL тау-пептидами, содержащими минимальный эпитоп DC8E8, предпочтительно индуцировала образование антител изотипов IgG1 и IgG2b, специфичных к патологическому белку тау. Объединенные сыворотки отдельных мышей разбавляли 1:800 и активность связывания с патологическим белком тауΔ(1-150; 392-441)/4R анализировали с помощью ELISA.
Фиг.80: Количественная оценка связывающей способности антител, которые индуцировали у мышей C75BL, иммунизированных тау-пептидами, с тауΔ(1-150; 392-441)/4R и 2N4R. Измерение с помощью поверхностного плазмонного резонанса (SPR) продемонстрировало, что антитела против тау-пептидов SEQ ID NO: 270, 271, 272, 275, 276, 277, 280, 281 и 283 статистически значимо (** ... p<0,001 и * ... p<0,01) различали патологический тауΔ(1-150; 392-441)/4R и физиологический белок тау 2N4R. KA - равновесная константа ассоциации для связывания.
Фиг.81: Антитела, индуцированные у мышей, иммунизированных тау-пептидами, распознают патологические формы белка тау при вестерн-блоттинге. Вакцинация мышей C57BL тау-пептидами SEQ ID NO: 270, 271, 272, 275, 276, 277, 280, 281 и 283 индуцировала специфические антитела, которые распознают патологические белки тау, выделенные из ткани головного мозга человека с болезнью Альцгеймера, а также из ствола головного мозга трансгенных крыс SHR72. Антисыворотки после иммунизации мышей пептидами SEQ ID NO: 273, 274, 278, 279 и 282 не распознавали патологические формы белка тау.
Фиг.82A-C: Нейрофибриллярные узелки, распознаваемые индуцированными тау-пептидом антителами, в тканях головного мозга человека при AD. Вакцинация мышей C57BL тау-пептидами SEQ ID NO: 270, 271, 272, 275, 276, 277, 280, 281 и 283 индуцировала антитела, распознающие нейрофибриллярные очаги в гиппокампе головного мозга при болезни Альцгеймера. Сыворотки от мышей, иммунизированных только адъювантом, использовали в качестве отрицательного контроля. Использовали срезы ткани головного мозга из гиппокампа CA1. Масштабная метка: 100 мкм.
Фиг.83: Обобщение данных иммуногистохимического окрашивания (и соответствующей относительной интенсивности) тканей головного мозга от пациента-человека с AD с помощью сывороточных антител, полученных иммунизацией мышей C57BL тау-пептидами SEQ ID NO: 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282 и 283.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин "антитело" относится к иммуноглобулину, полученному способами генетической инженерии, природному, или полностью или частично синтетически или рекомбинантно продуцированному. Все его производные, части и фрагменты, которые сохраняют антигенсвязывающие свойства и по меньшей мере одно из обуславливаемых белком тау характерных свойств согласно изобретению, включены в этот термин. Также термин охватывает любой белок, обладающий связывающим доменом, который является гомологичным или по большей части гомологичным связывающему домену иммуноглобулина. Эти белки могут происходить из природных источников, или они могут быть частично или полностью синтетически или рекомбинантно продуцированными. Антитело может быть моноклональным или поликлональным. Антитело может быть представителем любого класса иммуноглобулинов, включая любой из классов иммуноглобулинов человека: IgG, IgM, IgA, IgD и IgE. Производные класса IgG являются предпочтительными в некоторых вариантах осуществления настоящего изобретения.
Термины "выделенное антитело" и "выделенный пептид" относятся к белку или пептиду, продуцируемым с кДНК, рекомбинантной РНК или любого другого синтетического источника, или некоторой их комбинации; а также к белкам и пептидам, которые по их происхождению, или источнику получения, либо (1) не ассоциированы с белками, встречающимися в природе, либо (2) свободны от других белков из того же источника, например, свободны от белков мыши, либо (3) экспрессируется клеткой отличающегося вида, либо (4) не встречаются в природе.
Антитела согласно изобретению включают, кроме того, такие антитела, которые имеют "консервативные модификации последовательности" - модификации нуклеотидной и аминокислотной последовательности, которые не влияют или не изменяют упомянутые выше характеристика антитела по изобретению. Модификации можно вносить стандартными способами, известными в данной области, такими как сайт-направленный мутагенез и ПЦР-опосредуемый мутагенез. Консервативные аминокислотные замены включают замены, в которых аминокислотный остаток заменен аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, предсказанный несущественный аминокислотный остаток в антителе против белка тау может быть заменен другим аминокислотным остатком из того же семейства боковых цепей.
"Фрагменты антител" и "части антител" включают часть полноразмерного антитела, как правило, по меньшей мере его антигенсвязывающую часть/домен или вариабельную область. Примеры фрагментов антител включают диантитела, одноцепочечные молекулы антител, иммунотоксины и полиспецифические антитела, образованные из фрагментов антител. Кроме того, фрагменты антител включают одноцепочечные полипептиды, обладающие характеристиками связывания VH-цепи с патологическим белком тау, а именно, способные собираться вместе с VL-цепью, или связывания VL-цепи с патологическим белком тау, а именно, способные собираться вместе с VH-цепью, формируя функциональный антигенсвязывающий карман и, тем самым, обеспечивая свойство связывания с патологическим белком тау. Термины также включают фрагменты, которые сами по себе не способны обеспечивать эффекторные функции (например, ADCC/CDC), но обеспечивают эту функцию после комбинирования с соответствующим константным доменом(ами) антитела.
Термин "химерное антитело" относится к моноклональному антителу, содержащему вариабельную область, т.е. связывающую область, из одного источника или вида, и по меньшей мере часть константной области, происходящую из отличающегося источника или вида, обычно получаемому способами рекомбинантных ДНК. Особенно предпочтительными являются химерные антитела, содержащие вариабельную область мыши и константную область человека. Такие химерные антитела мыши/человека являются продуктом экспрессируемых генов иммуноглобулинов, содержащих сегменты ДНК, кодирующие вариабельные области иммуноглобулинов мыши, и сегменты ДНК, кодирующие константные области иммуноглобулинов человека. Другие формы "химерных антител", охватываемые настоящим изобретением, представляют собой формы, в которых класс или подкласс модифицирован или изменен относительно исходного антитела. Такие "химерные" антитела также называют "антителами с переключенным классом". Способы получения химерных антител вовлекают общепринятые способы рекомбинантных ДНК и способы трансфекции генов, в настоящее время известные в данной области. См., например, Morrison, S.L., et al., Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; патенты США № 5202238 и 5204244.
Термин "гуманизированное антитело" относится к антителам, в которых каркасные области (FR) и/или определяющие комплементарность области (CDR) модифицированы так, чтобы они содержали CDR иммуноглобулина отличающейся специфичности по сравнению с исходным иммуноглобулином. В одном варианте осуществления CDR мыши трансплантируют в каркасную область антитела человека с получением "гуманизированного антитела". См., например, Riechmann, L, et al., Nature 332 (1988) 323-327; и Neuberger, M. S., et al., Nature 314 (1985) 268-270. Особенно предпочтительные CDR соответствуют CDR, соответствующим последовательностям, распознающим антигены и эпитопы, описанные в настоящем описании как "терапевтические эпитопы" на белке тау.
Термин "антитело человека", как используют в рамках изобретения, включает антитела, имеющие вариабельные и константные области, происходящие из последовательностей иммуноглобулинов человека эмбрионального типа. Константные области антитела могут представлять собой, например, константные области IgG1-типа человека. Такие области могут быть аллотипическими и описаны, например, Johnson, G. и Wu, T.T., Nucleic Acids Res. 28 (2000) 214-218, и в базах данных, упоминаемых в указанном документе, и предпочтительно они пригодны для некоторых вариантов осуществления, при условии что сохраняются свойства индукции ADCC и, например, CDC согласно изобретению.
Термин "рекомбинантное антитело человека", как используют в рамках изобретения, включает все антитела человека, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, такие как антитела, выделенные из клетки-хозяина, такой как клетка NSO или CHO, или из животного (например, мышь, такая как XENOMOUSE - генетически модифицированная мышь, которая продуцирует антитела, имеющие аминокислотные последовательности антител человека, например, аминокислотные последовательности каркасной области человека (FR) и константной области человека), которые являются трансгенными по генам иммуноглобулинов человека, или антитела, экспрессируемые с использованием рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяина. Такие рекомбинантные антитела человека имеют вариабельные и константные области, происходящие из последовательностей иммуноглобулинов человека эмбрионального типа в переупорядоченной форме. Рекомбинантные антитела человека согласно изобретению подвергают соматической гипермутации in vivo. Таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя и происходят из и являются родственными последовательностям VH и VL человека эмбрионального типа, не могут существовать в природе в репертуаре антител человека эмбрионального типа in vivo.
Термин "эффекторные функции" включает, но не ограничивается ими, связывание C1q; комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточно-опосредуемую цитотоксичность (ADCC); фагоцитоз; и подавление рецепторов клеточной поверхности (например, B-клеточный рецептор; BCR).
Термин "эпитоп" используют в настоящем описании для обозначения участков связывания, распознаваемых связывающим белком или антителом. Эпитопы могут представлять собой любую молекулу или их группу, включая, но не ограничиваясь ими, аминокислоты, боковые цепи аминокислот, сахара и липиды, и могут иметь конкретную трехмерную структуру или конформацию. Таким образом, эпитоп может содержать любую часть молекулы пептида/белка тау, которая включает первичную, вторичную, третичную или четвертичную структуру, как эти термины общеизвестны в данной области. "Линейный эпитоп" составлен из последовательности последовательно расположенных аминокислотных остатков. Линейный эпитоп представляет собой эпитоп, который присутствует на физиологическом белке тау (например, присутствует на тау 2N/4R). "Конформационный эпитоп" представляет собой эпитоп, с которым связывается антитело или связывающий белок конформационный-специфическим образом. В случае эпитопов на основе белка, связывание может зависеть от содержащей эпитоп вторичной, третичной или четвертичной структуры белка. Иными словами, антитело связывается специфическим для структуры образом, специфическим для третичной структуры образом или специфическим для четвертичной структуры образом. Конформационный эпитоп представляет собой эпитоп, который присутствует в патологическом белке тау (например, присутствует в тауΔ(1-150; 392-441)/4R)).
Термин "терапевтический эпитоп" относится к областям в белке тау, которые указаны в настоящем описании, и которые, как было выявлено, стимулируют агрегацию тау-тау, когда они находятся в определенных конформациях (распознаваемых антителом DC8E8). Антитела (и другие связывающие белки), которые связываются с одной или несколькими из этих областей, ингибируют ранние и поздние стадии агрегации белка тау, включая преобразование мономера белка тау в димер, и преобразование в более высокие формы агрегатов; т.е. антитела ингибируют преобразование физиологического белка тау в патологический белок тау. Эти области в белке тау могут быть вовлечены в стимуляцию фибриллизации белка тау в парные спиральные филаменты (PHF), путем стимуляции образования бета-слоев в соседних областях белка тау. Терапевтические эпитопы содержатся в 267-KHQPGGG-273 (в 1-ом повторяющемся домене белка тау), 298-KHVPGGG-304 (во 2-ом повторяющемся домене белка тау), 329-HHKPGGG-335 (в 3-ем повторяющемся домене белка тау) и 361-THVPGGG-367 (в 4-ом повторяющемся домене белка тау). В некоторых вариантах осуществления каждый из терапевтических эпитопов содержится в 268-HQPGGG-273 (в 1-ом повторяющемся домене белка тау), 299-HVPGGG-304 (во 2-ом повторяющемся домене белка тау), 330-HKPGGG-335 (в 3-ем повторяющемся домене белка тау) и 362-HVPGGG-367, соответственно.
Термин "проявление более высокой аффинности в отношении патологического белка тау, чем в отношении физиологического белка тау" относится к более высокой степени взаимодействия между антителом и по меньшей мере одной формой патологического белка тау, чем между антителом и по меньшей мере одной формой физиологического белка тау. Взаимодействие можно измерять, например, с помощью ELISA или поверхностного плазмонного резонанса (SPR), как описано в разделе "ПРИМЕРЫ" ниже.
Термины "специфически связывается", "связывается специфически" и "специфичный к" являются взаимозаменяемыми и означают, что антитело или его антигенсвязывающий фрагмент (или другой связывающий белок) образуют комплекс с антигеном или эпитопом, который является относительно стабильным в физиологических условиях. Специфическое связывание может характеризоваться константой диссоциации приблизительно 1×10-6 M или меньше, например, менее чем приблизительно 100 нМ, и, например, менее 10 нМ. Способы определения того, связываются ли специфически две молекулы, известны в данной области и включают, например, равновесный диализ, поверхностный плазмонный резонанс и т.п. Как правило, антитело или его антигенсвязывающий фрагмент, предусматриваемые изобретением, представляет собой молекулу, которая связывает антиген или эпитоп с такой константой диссоциации, составляющей по меньшей мере приблизительно 1×10-6 M или менее, но не связывает другие молекулы с такой константой диссоциации.
"Предпочтительно связывается" относится к связыванию с более высокой аффинностью с патологическим белком тау, чем с физиологическим белком тау, например, связывание с более высокой аффинностью с тауΔ(1 150; 392-441)/4R, чем с 2N4R.
"Универсальный T-клеточный эпитоп" представляет собой последовательность, выбранную из гемагглютинина вируса гриппа: HA307-319 (PKYVKQNTLKLAT) (SEQ ID NO: 123); PADRE (AKXVAAWTLKAAA) (SEQ ID NO: 124); малярийного CS: эпитоп T3 (EKKIAKMEKASSVFNV) (SEQ ID NO: 125); поверхностного антигена вируса гепатита B: HBsA919_28 (FFLLTRILTI) (SEQ ID NO: 126); белка теплового шока 65: hsp65153_171 (DQSIGDLIAEAMDKVGNEG) (SEQ ID NO: 127); бациллы Кальметта-Герена (QVHFQPLPPAWKL) (SEQ ID NO: 128); столбнячного токсоида: TI830-844 (QYIKANSKFIGITEL) (SEQ ID NO: 129); столбнячного токсоида: TI947-967 (FNNFTVSFWLRVPKVSASHLE) (SEQ ID NO: 130); и T1 gp120 ВИЧ (KQIINMWQEVGKAMYA) (SEQ ID NO: 131).
Термин "внутренне неупорядоченный белок тау" относится к нормальной/физиологической форме белка тау, которая лишена какой-либо определенной 3D-структуры. Она существует в здоровом головном мозге (Kovacech et al., 2010).
"Небеспорядочный белок тау" относится к формам белка тау, которые конформационно отличаются от нормального/физиологического внутренне неупорядоченного белка тау, и не имеют жесткой/определенной 3D-структуры. Небеспорядочный укороченный белок тау способен индуцировать нейрофибриллярную дегенерацию in vivo. Он не существует в здоровом головном мозге (Kovacech et al., 2010). "Разупорядоченный белок тау" относится к структурированной патологической форме белка тау, собранной в полимеры PHF, которые образуют NFT. Разупорядоченный не существует в здоровом головном мозге (Kovacech et al., 2010).
"SHR24" относится к линии трансгенных крыс, которые экспрессируют белок тау типа IIB (151-391/R3). У трансгенных крыс развивается прогрессирующая зависимая от возраста нейрофибриллярная дегенерация в кортикальных областях головного мозга. Нейрофибриллярные узелки (NFT) у крыс SHR24 удовлетворяют нескольким ключевым гистологическим критериям, используемым для идентификации нейрофибриллярной дегенерации при болезни Альцгеймера у человека, включая аргирофилию, двулучепреломление конго красного и реактивность в отношении тиофлавина S. Эти критерии можно использовать для анализа нейрофибриллярной дегенерации у индивидуумов, которым осуществляют введение любого из вариантов осуществления изобретения. Нейрофибриллярные узелки также были идентифицированы с помощью антител, используемых для выявления патологического белка тау в головном мозге человека, в том числе DC11, распознающего аномальную конформацию тау, и антител, которые специфичны к гиперфосфорилированным формам белка тау. Более того, нейрофибриллярная дегенерация характеризуется обширным образованием нерастворимых в саркозиле комплексов белка тау, состоящих из эндогенных и укороченных типов белка тау крысы (Filipcik et al., 2010).
"SHR72" относится к трансгенным крысам, которые экспрессируют укороченный тауΔ(1-150; 392-441)/4R человека согласно международной патентной заявке PCT WO 2004/007547, в нескольких областях головного мозга и в спинном мозге. Получение этой линии крыс описано Zilka et al., 2006, и патология белка тау описана в Koson et al., 2008.
"Тип белка тау IA" относится к белку тау с двойным укорочением на N- и C-концах, который имеет укорочение по меньшей мере на первые 236 N-концевых аминокислот и по меньшей мере на последние 45 C-концевых аминокислот содержащего 4 повтора тау43. Молекулы выявляются в ткани головного мозга при болезни Альцгеймера, в то время как молекулы не выявляются в нормальной здоровой ткани головного мозга (WO2004/007547 A2).
"Тип белка тау IB" относится к белку тау с двойным укорочением на N- и C-концах, который имеет укорочение по меньшей мере на первые 236 N-концевых аминокислот и по меньшей мере на последние 45 C-концевых аминокислот содержащего 3 повтора тау44. Молекулы выявляются в ткани головного мозга при болезни Альцгеймера, в то время как молекулы не выявляются в нормальной здоровой ткани головного мозга (WO2004/007547 A2).
"Тип белка тау IIA" относится к белку тау с двойным укорочением на N- и C-концах, который имеет укорочение по меньшей мере на первые 68 N-концевых аминокислот и по меньшей мере на последние 40 C-концевых аминокислот содержащего 4 повтора тау43. Молекулы выявляются в ткани головного мозга при болезни Альцгеймера, в то время как молекулы не выявляются в нормальной здоровой ткани головного мозга (WO2004/007547 A2).
"Тип белка тау IIB" относится к белку тау с двойным укорочением на N- и C-концах, который имеет укорочение по меньшей мере на первые 68 N-концевых аминокислот и по меньшей мере на последние 20 C-концевых аминокислот содержащего 3 повтора тау44. Молекулы выявляются в ткани головного мозга при болезни Альцгеймера, в то время как молекулы не выявляются в нормальной здоровой ткани головного мозга (WO2004/007547 A2).
Как используют в рамках изобретения, термины "лечение", "осуществление лечения" и т.п., относятся к достижению желаемого фармакологического и/или психологического эффекта. Эффект может быть профилактическим с точки зрения полного или частичного предупреждения заболевания или его симптома и/или он может быть терапевтическим с точки зрения частичного или полного излечения от заболевания и/или неблагоприятного явления, свойственного заболеванию. "Лечение", как используют в рамках изобретения, также охватывает любое лечение AD или родственных таупатий у млекопитающего, в частности, у человека, и включает: (a) профилактику возникновения заболевания у индивидуума, который может быть предрасположенным к заболеванию или имеет риск приобретения заболевания, но у которого еще не диагностировано его наличие; (b) ингибирование заболевания, т.е. остановка его развития; и (c) смягчение заболевания, т.е. обеспечение регрессии заболевания. Предпочтительные варианты осуществления "лечения" дополнительно рассмотрены ниже. В некоторых вариантах осуществления "лечение" относится к введению лекарственного средства пациенту, предположительно страдающему или уже страдающему AD или другой таупатией. Также оно может относиться к снижению, устранению или по меньшей мере частичной остановке, а также достижению любого благоприятного эффекта, в отношении одного или нескольких симптомов заболевания и/или симптомов, ассоциированных с заболеванием, и/или их осложнений.
"Профилактика" относится к введению пациенту, предрасположенному к конкретному заболеванию, или имеющему иной его риск. Любой в общей популяции имеет риск AD. Некоторые индивидуумы имеют увеличенный генетический риск AD. Профилактика может устранять или снижать риск или отсрочивать возникновение заболевания. Отсрочку возникновения или прогрессирования заболевания можно измерять на основе стандартного времени прогрессирования заболевания в сходных популяциях или у сходных индивидуумов.
"Таупатия" относится к заболеванию, обусловленному образованием патологического белка тау.
"Физиологический белок тау" относится к любой из 6 изоформ нормального белка тау человека, а именно:
2N4R (SEQ ID NO: 102)
1N4R (SEQ ID NO: 103)
2N3R (SEQ ID NO: 104)
0N4R (SEQ ID NO: 105)
1N3R (SEQ ID NO: 106)
0N3R (SEQ ID NO: 107)
Исключением из этого определения являются те изоформы, которые имеют любой из типов фосфорилирования, ассоциированных с болезнью Альцгеймера и другими таупатиями.
"Патологический белок тау" включает патологические конформеры и структуры белка тау и охватывает все из следующих: тип белка тау IA, IB, IIA и IIB, разупорядоченный, небеспорядочный белок тау (мономер, димер, тример, олигомер), небеспорядочный растворимый белок тау, нерастворимый в саркозиле белок тау, внеклеточные депозиты белка тау, агрегаты белка тау, парные спиральные филаменты, нейрофибриллярная патология, включая нейрофибриллярные очаги, узелки, нити, фибриллы, аксональные сфероиды, высоко фосфорилированные формы укороченного белка тау и полноразмерного белка, или любая другая форма белка тау, ассоциированная с AD или другой таупатией.
"Связанный" относится к присоединению части к пептиду, антителу или соединению. Часть может быть связана, или может образовывать комплекс, или может быть ковалентно или нековалентно присоединена. Часть может быть химически сшита или экспрессирована или синтезирована в качестве слитой молекулы с пептидом или антителом.
"Часть" относится к любому соединению, органическому соединению, пептиду, белку, нуклеиновой кислоте, носителю, адъюванту, которые могут быть присоединены к пептиду, антителу или связывающему белку, но которые не являются самим заявленным пептидом, антителом или связывающим белком.
"Иммуногенный" относится к чему-либо, что может индуцировать иммунный ответ. Иммунный ответ может быть антитело-опосредуемым или клеточно-опосредуемым, или опосредуемым и тем, и другим.
"Адъювант" относится к веществу, которое способно увеличивать, усиливать или модулировать иммунный ответ на сопровождающий его пептид.
"Другая терапия" относится к дополнительным способам терапии, которые могут проводиться у рассматриваемых пациентов.
"Выведение" относится к снижению уровней или обнаружения патологического белка тау и/или патологической структуры белка тау. Выведение не должно представлять собой полное исчезновение патологического белка тау, т.е. оно может представлять собой частичное исчезновение.
Термин "стимуляция" охватывает индукцию, усиление или увеличение.
"Ткань головного мозга" относится к любой нейрональной ткани, например, из головного мозга, ствола головного мозга и спинного мозга.
Термины "специфическое связывание" и "высокая аффинность", соответственно, относятся к антителу, связывающемуся с заданным антигеном, т.е. эпитопом белка тау, определенным выше. Как правило, антитело связывается с константой диссоциации (KD) 10-6 M или менее, и связывается с заданным антигеном с KD, которая по меньшей мере в два раза меньше, чем его KD для связывания с неспецифическим антигеном (например, BSA, казеин, или любой другой стандартный полипептид), отличным от заданного антигена. Выражения "антитело, распознающее антиген" и "антитело, специфичное в отношении антигена" используют в настоящем описании взаимозаменяемо с термином "антитело, которое специфически связывается с антигеном". Как используют в рамках изобретения "высокоспецифическое" связывание означает, что относительная KD антитела в отношении небеспорядочного белка тау по меньшей мере в 4 раза меньше, чем KD для связывания антитела с другими лигандами или с нормальным полноразмерным белком тау.
Термин "прокариотический" включает все бактерии, которые могут быть трансформированы или трансфицированы молекулой ДНК или РНК для экспрессии антитела по изобретению или одной или нескольких соответствующих цепей иммуноглобулинов. Прокариотические хозяева могут включать грамотрицательные, а также грамположительные бактерии, такие как, например, E. coli, S. typhimurium, Serratia marcescens и Bacillus subtilis. Термин "эукариотический" включает клетки дрожжей, высших растений, насекомых и, например, млекопитающих, например, клетки HEK 293, NSO и CHO.
Термин "химическое производное" описывает молекулу, которая содержит дополнительные химические части, которые обычно не являются частью основной молекулы. Такие части могут повышать растворимость, время полужизни, всасывание и т.д. основной молекулы. Альтернативно части могут ослаблять нежелательные побочные эффекты основной молекулы или снижать токсичность основной молекулы.
Термины "нуклеиновая кислота", "нуклеотидная последовательность", "последовательность нуклеиновой кислоты", "полинуклеотид", "олигонуклеотид", "полинуклеотидная последовательность" и "нуклеотидная последовательность" используют в настоящем описании взаимозаменяемо, и они относятся к точной последовательности нуклеотидов, модифицированной или не модифицированной, определяющей фрагмент или область нуклеиновой кислоты, содержащей неприродные нуклеотиды или не содержащей их, и являющейся либо двухцепочечной ДНК, либо одноцепочечной ДНК, либо продуктами транскрипции указанных ДНК.
Термины "выделенный полинуклеотид" или "выделенная нуклеиновая кислота", как используют в рамках изобретения, означают полинуклеотид геномного происхождения, из кДНК, или синтетического происхождения или некоторую их комбинацию, который по происхождению либо (1) не ассоциирован со всем или частью полинуклеотида, в котором "выделенный полинуклеотид" встречается в природе, либо (2) функционально связан с полинуклеотидом, с которым он не связан с природе, либо (3) не встречается в природе в качестве части более крупной последовательности.
Антитела для диагностики, пассивной иммунизации, доставки лекарственных средств и терапии AD
В настоящем описании описаны новые выделенные антитела, специфичные к одному или нескольким эпитопам белка тау, которыми обладают патологические формы белка тау. Эти эпитопы расположены в областях белка тау, которым впервые приписывается роль в патологической агрегации белка тау, а именно, в: 267-KHQPGGG-273 (SEQ ID NO: 98) (т.е. эпитоп #1 расположен в 267-KHQPGGG-273, который находится в 1-ом повторяющемся домене белка тау), 298-KHVPGGG-304 (SEQ ID NO: 99) (эпитоп #2, во 2-ом повторяющемся домене белка тау), 329-HHKPGGG-335 (SEQ ID NO: 100) (эпитоп #3, в 3-ем повторяющемся домене белка тау) и 361-THVPGGG-367 (SEQ ID NO: 101) (эпитоп #4, в 4-ом повторяющемся домене белка тау). Эти антитела способны распознавать разупорядоченный и небеспорядочный тау в головном мозге человека при AD, а также в моделях AD и родственных таупатий на трансгенных крысах, экспрессирующих небеспорядочный укороченный тауΔ(1-150; 392-441)/3R или тауΔ(1-150; 392-441)/4R человека. Выделенные антитела также способны препятствовать одному или нескольким из множества опосредуемых белком тау видов активности, участвующих в патологии AD, включая: (i) переход либо из разупорядоченного, либо из физиологического, белка тау в небеспорядочный белок тау; (ii) образование мономеров, димеров, тримеров "патологического белка тау" и других мультимеров; (iii) образование нерастворимых агрегатов белка тау; и (iv) стимуляцию выведения внеклеточного белка тау.
Описанное изобретение основано, частично, на открытии, что антитела, которые специфично связываются с одной из четырех ранее неидентифицированных функциональных областей белка тау, выбранных из 267-KHQPGGG-273 (SEQ ID NO: 98) (в 1-ом повторяющемся домене белка тау), 298-KHVPGGG-304 (SEQ ID NO: 99) (во 2-ом повторяющемся домене белка тау), 329-HHKPGGG-335 (SEQ ID NO: 100) (в 3-ем повторяющемся домене белка тау) и 361-THVPGGG-367 (SEQ ID NO: 101) (в 4-ом повторяющемся домене белка тау) способны ингибировать образование патологических агрегатов белка тау, и обнаруживать различные патологические формы белка тау, некоторые из которых наиболее рано образуются при заболевании (например, патологические мономеры). Гибридомы, полученные против небеспорядочного белка тау II человека (151-391/4R), который также обозначают в настоящей заявке как тауΔ(1-150; 392-441)/4R, подвергали скринингу в отношении продукции моноклональных антител, специфичных к PHF человека, как с помощью иммуногистохимии (IHC), так и с помощью ферментных иммуноанализов (ELISA). Полученный набор включал моноклональное антитело (mAb) мыши DC8E8, которое представляет собой антитело подкласса IgG1. Картирование эпитопов DC8E8 показало, что оно связывается с четырьмя ранее неидентифицированными эпитопами на белке тау человека. Более того, дельнейший функциональный анализ DC8E8 показал, что каждый эпитоп представляет собой отличающуюся функциональную область в белке тау. Эти области, которые в настоящем описании могут быть описаны как новые мишени для диагностики и терапии AD, и, таким образом, обозначаются как "терапевтические эпитопы", содержатся в 267-KHQPGGG-273 (SEQ ID NO: 98) (в 1-ом повторяющемся домене белка тау), 298-KHVPGGG-304 (SEQ ID NO: 99) (во 2-ом повторяющемся домене белка тау), 329-HHKPGGG-335 (SEQ ID NO: 100) (в 3-ем повторяющемся домене белка тау) и 361-THVPGGG-367 (SEQ ID NO: 101) (в 4-ом повторяющемся домене белка тау). В некоторых вариантах осуществления один или несколько из терапевтических эпитопов содержится в 268-HQPGGG-273 (SEQ ID NO: 223) (в 1-ом повторяющемся домене белка тау), 299-HVPGGG-304 (SEQ ID NO: 154) (во 2-ом повторяющемся домене белка тау), 330-HKPGGG-335 (SEQ ID NO: 224) (в 3-ем повторяющемся домене белка тау) и 362-HVPGGG-367 (SEQ ID NO: 154) (в 4-ом повторяющемся домене белка тау). В некоторых вариантах осуществления по меньшей мере один из терапевтических эпитопов содержится в 299-HVPGGG-304 (SEQ ID NO: 154) (во 2-ом повторяющемся домене белка тау). В некоторых вариантах осуществления один или несколько из терапевтических эпитопов представляет собой 299-HVPGGG-304 (SEQ ID NO: 154).
Действительно, DC8E8 способно различать патологические и нормальные белки тау, что указывает на то, что по меньшей мере один из этих четырех эпитопов является конформационным. Иными словами, DC8E8 выявило, что по меньшей мере одна из областей, охватываемых каждым из четырех терапевтических эпитопов, демонстрирует конформацию в патологическом белке тау, которая отличается от формы(форм), которую он принимает во внутренне неупорядоченном белке тау (нормальный белок тау). DC8E8 способно определять или выявлять это изменение, поскольку оно связывается с патологическим белком тау с более высокой аффинностью, чем с физиологическим белком тау. Более того, связывание DC8E8 с белком тау способно ингибировать взаимодействия тау-тау, приводящие к образованию патологических агрегатов белка тау, при измерении по способности DC8E8 ингибировать образование нерастворимых агрегатов белка тау in vitro. Например, связывание DC8E8 с нормальным белком тау способно препятствовать одному или нескольким из изменений конформации/формы, рассмотренных выше, для областей, охватывающих терапевтические эпитопы.
Кроме того, связывание DC8E8 с нормальным белком тау в одной или нескольких из этих областей или терапевтическими эпитопами препятствует некоторым другим конформационным изменениям где-либо в молекуле, которые необходимы для образования патологического белка тау. Без связи с каким-либо конкретным механизмом, предусматривается, что один или несколько из этих эпитопов/областей в белке тау, которые распознаются DC8E8, функционируют в тау как стимуляторы агрегации тау-тау. Например, структура/форма/конформация одного или нескольких из этих эпитопов влияет на структуру соседних областей, так что фиксация его формы в молекуле белка тау путем связывания с ней DC8E8 препятствует способности или тенденции соседней области (например, 274-281) к образованию бета-слоев, где образование бета-слоя необходимо для агрегации тау-тау. Таким образом, предусматривается, что связывание DC8E8 с одной из этих четырех областей в нормальном белке тау способно препятствовать одному из наиболее ранних патологических изменений в белке тау, идентифицированных на сегодняшний день: изменение, которое необходимо для стимуляции, или которое само стимулирует или обеспечивает образование бета-слоев в белке тау. Более того, также предусматривается, что связывание DC8E8 с одной из этих четырех областей в небеспорядочном/патологическом белке тау, т.е. после того, как одна или несколько из четырех областей изменилась на патологическую конформацию, все еще способно ингибировать патологическую агрегацию тау-тау, по меньшей мере поскольку оно все еще ингибирует образование бета-слоя, блокирует физическое взаимодействие тау-тау или осуществляет оба из них.
Таким образом, с использованием DC8E8 в качестве инструмента для идентификации новых мишеней или функциональных областей в белке тау, четырем конкретным участкам связывания DC8E8 на белке тау была приписана роль в болезни Альцгеймера. Это было осуществлено путем понимания, что один или несколько этих участков белка тау вовлечены в образование мономеров и мультимеров патологического белка тау, по меньшей мере поскольку связывание DC8E8 с одним или несколькими из них способно ингибировать эти процессы. Более того, антитела (например, DC8E8), которые связываются с одним или несколькими из этих терапевтических эпитопов, способны стимулировать выведение патологического белка тау из внеклеточной среды, по меньшей мере поскольку они способны опосредовать захват и деградацию патологического белка тау микроглией in vitro; снижение внеклеточного и внутриклеточного белка тау в головном мозге in vivo; или осуществлять оба из них. Иными словами, эти антитела обладают способностью помогать снижать повреждение, которое такие патологические формы белка тау вызывают в головном мозге.
Таким образом, в настоящем описании описаны антитела, которые специфически связываются с одним или несколькими терапевтическими эпитопами на белке тау, где каждый из терапевтических эпитопов по отдельности расположен в аминокислотных остатках 267-KHQPGGG-273 (SEQ ID NO: 98) (эпитоп #1, в 1-ом повторяющемся домене белка тау), 298-KHVPGGG-304 (SEQ ID NO: 99) (эпитоп #2, во 2-ом повторяющемся домене белка тау), 329-HHKPGGG-335 (SEQ ID NO: 100) (эпитоп #3, в 3-ем повторяющемся домене белка тау) и 361-THVPGGG-367 (SEQ ID NO: 101) (эпитоп #4, в 4-ом повторяющемся домене белка тау). В некоторых вариантах осуществления терапевтические эпитопы #1-4 содержатся в 268-HQPGGG-273 (SEQ ID NO: 223) (в 1-ом повторяющемся домене белка тау), 299-HVPGGG-304 (SEQ ID NO: 154) (во 2-ом повторяющемся домене белка тау), 330-HKPGGG-335 (SEQ ID NO: 224) (в 3-ем повторяющемся домене белка тау) и 362-HVPGGG-367 (SEQ ID NO: 154) (в 4-ом повторяющемся домене белка тау). Антитела могут быть моноклональными или поликлональными. Также включены антигенсвязывающие части антител, фрагменты антитела, варианты антител, сконструированные способами инженерии белки и полимерные каркасы. Они включают любой белок или содержащую пептид молекулу, которые содержат по меньшей мере часть молекулы иммуноглобулина, такую как, но не ограничиваясь ими, по меньшей мере одну определяющую комплементарность область (CDR) тяжелой или легкой цепи или ее связывающую лиганд часть, вариабельную область тяжелой цепи или легкой цепи, константную область тяжелой цепи или легкой цепи, каркасную область или любую их часть.
В качестве неограничивающего примера подходящее антитело, часть антитела, фрагмент, или вариант, предусматриваемые настоящим изобретением, могут связываться по меньшей мере с одним из описанных терапевтических эпитопов. Термин "антитело" также включает фрагменты расщепления антител, конкретные части антител и их варианты, включая миметики антител или части антител, которые имитируют структуру и/или функцию антитела или его указанного фрагмента или части, включая одноцепочечные антитела и их фрагменты. Функциональные фрагменты включают антигенсвязывающие фрагменты, которые связываются с одним или несколькими терапевтическими эпитопами. Например, фрагменты антител, способные связываться с терапевтическим эпитопом, включают, но не ограничиваются ими, фрагменты Fab (например, путем расщепления папаином), Fab' (например, путем расщепления пепсином и частичного восстановления) и F(ab')2 (например, путем расщепления пепсином), facb (например, путем расщепления плазмином), pFc' (например, путем расщепления пепсином или плазмином), Fd (например, путем расщепления пепсином, частичного восстановления и повторной агрегации), Fv или scFv (например, способами молекулярной биологии), и предусматриваются настоящим изобретением. См. также, William E. Paul (ed.) Fundamental Immunology, 6th Edition, Lippincott Williams & Wilkins, NY, N.Y. (2008), включенную в настоящее описание в полном объеме. Определенные фрагменты можно получать путем ферментативного расщепления, способами синтеза или рекомбинантными способами, как общеизвестно в данной области, или как описано в настоящем описании. Антитела также можно получать в различных укороченных формах с использованием генов антител, в которых один или несколько стоп-кодонов внесены выше природного стоп-участка. Например, может быть сконструирован комбинированный ген, кодирующий часть F(ab')2 тяжелой цепи, так, чтобы он включал последовательности ДНК, кодирующие домен CH1 и/или шарнирную область тяжелой цепи. Различные части антител можно связывать друг с другом химически общепринятыми способами или можно получать в качестве непрерывного белка с использованием общепринятых способов генетической инженерии.
Известно, что основной структурный элемент антитела содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну "легкую" (приблизительно 25 кДа) и одну "тяжелую" цепь (приблизительно 50-70 кДа). N-концевая часть каждой цепи включает вариабельную область из приблизительно 100-110 или более аминокислот, главным образом, ответственных за распознавание антигена. C-концевая часть каждой цепи определяет константную область, главным образом, ответственную за эффекторную функцию. Легкие цепи человека классифицируют как легкие цепи каппа и лямбда. Тяжелые цепи классифицируют как мю, дельта, гамма, альфа или эпсилон, и определяют изотип антитела как IgM, IgD, IgA и IgE, соответственно. В легких и тяжелых цепях вариабельные и константные области связаны областью "J" приблизительно из 12 или более аминокислот с тяжелой цепью, также включающей область "D" приблизительно из 10 или более аминокислот. См. главным образом, Fundamental Immunology Ch. 7 (Paul, W., ed., 2nd ed. Raven Press, N.Y. (1989)) (включенную в качестве ссылки в полном объеме для любых целей). Вариабельные области каждой пары легкая/тяжелая цепь формируют участок связывания антитела. Таким образом, неизмененное антитело имеет два участка связывания. За исключением бифункциональных или биспецифических антител, два участка связывания являются одинаковыми. Все цепи проявляют одинаковую общую структуру из относительно консервативных каркасных областей (FR), соединенных тремя гипервариабельными областями, также называемыми определяющими комплементарность областями или CDR. CDR из двух цепей каждой пары совмещаются каркасными областями, обеспечивающими связывание с конкретным эпитопом. От N-конца к C-концу, как легкие, так и тяжелые, цепи содержат домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Отнесение аминокислот к каждому из доменов проводят в соответствие с определениями IMGT. Также специалисту в данной области известны альтернативные определения. См., например, Kabat, Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987 and 1991)), или Chothia & Lesk J. Mol. Biol. 196:901-917 (1987); Chothia et al. Nature 342:878-883 (1989).
В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, имеющую по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичность аминокислотной последовательности с любой из SEQ ID NO: 141, 143, 152 и 153. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, которая отличается от любой из SEQ ID NO: 141, 143, 152 и 153 только на одну, две, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислот. Специалисты в данной области могут определить, какие аминокислоты в вариабельной области легкой цепи могут быть изменены. Например, путем сравнения аминокислотных последовательностей вариабельных областей легкой цепи антител с одинаковой специфичностью, специалисты в данной области могут определить, какие аминокислоты могут быть изменены без изменения специфичности. См. раздел "Примеры" для сравнения аминокислотных последовательностей CDR иллюстративной легкой цепи антитела DC8E8. Более того, определение того, изменена ли специфичность, можно проводить с использованием анализа связывания антигена. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в любой из SEQ ID NO: 141, 143, 152 и 153.
В некоторых вариантах осуществления рассматриваемое антитело содержит тяжелую цепь, содержащую аминокислотную последовательность, имеющую по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 98%, или по меньшей мере приблизительно 99% идентичность аминокислотной последовательности с любой из SEQ ID NO: 138, 140, 147 и 148. В некоторых вариантах осуществления рассматриваемое антитело содержит тяжелую цепь, содержащую аминокислотную последовательность, которая отличается от любой из SEQ ID NO: 138, 140, 147 и 148 только на одну, две, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислот. Специалисты в данной области могут определить, какие аминокислоты в вариабельной области тяжелой цепи могут быть изменены. Например, путем сравнения аминокислотных последовательностей вариабельных областей тяжелой цепи антител с одинаковой специфичностью, специалисты в данной области могут определить, какие аминокислоты могут быть изменены без изменения специфичности. См., например, фиг.3E и 25B для сравнения аминокислотных последовательностей CDR иллюстративной тяжелой цепи антитела DC8E8. Более того, определение того, изменяется ли специфичность, можно проводить с использованием анализа связывания антигена. В некоторых вариантах осуществления рассматриваемое антитело содержит тяжелую цепь, содержащую аминокислотную последовательность, как указано в любой из SEQ ID NO: 138, 140, 147 и 148.
В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 141, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 138. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 141, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 140. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 141, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 147. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 141, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 148. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 143, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 138. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 143, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 140. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 143, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 147. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 143, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 148. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 152, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 138. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 152, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 140. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 152, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 147. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 152, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 148. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 153, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 138. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 153, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 140. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 153, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 147. В некоторых вариантах осуществления рассматриваемое антитело содержит легкую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 153, и тяжелую цепь, содержащую аминокислотную последовательность, как указано в SEQ ID NO: 148.
В некоторых вариантах осуществления рассматриваемое антитело содержит вариабельную область легкой цепи, содержащую по меньшей мере одну, по меньшей мере две или три CDR, выбранных из SEQ ID NO: 117-119. В некоторых вариантах осуществления рассматриваемое антитело содержит вариабельную область тяжелой цепи, содержащую по меньшей мере одну, по меньшей мере две или три CDR, выбранных из SEQ ID NO: 120-122. Также предусматриваются варианты осуществления, в которых любая из этих трех CDR изменена, как описано в примере 14. В некоторых вариантах осуществления по меньшей мере одна из измененных CDR в легкой цепи выбрана из SEQ ID NO: 247 для CDR1, SEQ ID NO: 253 для CDR2, и любой из SEQ ID NO: 255, 257, 258, 259 и 260 для CDR3. В некоторых вариантах осуществления по меньшей мере одна из измененных CDR в тяжелой цепи выбрана из SEQ ID NO: 261 или SEQ ID NO: 262 для CDR1, SEQ ID NO: 264 или SEQ ID NO: 265 для CDR2, и SEQ ID NO: 266, SEQ ID NO: 267 или SEQ ID NO: 269 для CDR3.
Биспецифическое или бифункциональное антитело представляет собой искусственное гибридное антитело, имеющее две различных пары тяжелая/легкая цепь и два различных участка связывания. Биспецифические антитела можно получать различными способами, включая слияние гибридом или связывание Fab'-фрагментов. См., например, Songsivilai & Lachmann Clin. Exp. Immunol. 79: 315-321 (1990), Kostelny et al. J. Immunol. 148:1547-1553 (1992). Получение биспецифических антител может быть относительно трудоемким процессом по сравнению с получением общепринятых антител и выход и степень чистоты для биспецифических антител обычно являются более низкими. Биспецифические антитела не существуют в форме фрагментов, имеющих один участок связывания (например, Fab, Fab' и Fv).
Изобретение не относится к антителам в природной форме, т.е. они не взяты из их природного окружения, а выделены и получены путем очистки из природных источников или получены способами генетической рекомбинации или химического синтеза, и таким образом они могут содержать неприродные аминокислоты. Таким образом, как используют в рамках изобретения, двадцать общепринятых аминокислот и их сокращенные обозначения соответствуют общепринятому использованию. См. Immunology-A Synthesis (2nd Edition, E. S. Golub and D. R. Gren, Eds., Sinauer Associates, Sunderland, Mass. (1991)), которая включена в настоящее описание в качестве ссылки. Стереоизомеры (например, D-аминокислоты, Nle, Nva, Cha, Orn, Hle, Chg, Hch или Har) двадцати общепринятых аминокислот, неприродные аминокислоты, такие как альфа,альфа-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие нетрадиционные аминокислоты также могут быть подходящими компонентами для полипептидов по настоящему изобретению. Примеры нетрадиционных аминокислот включают (т.е. не ограничиваются ими): 4-гидроксипролин, гамма-карбоксиглутамат, эпсилон-N,N,N-триметиллизин, эпсилон-N-ацетиллизин, O-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, сигма-N-метиларгинин и другие сходные аминокислоты и иминокислоты (например, 4-гидроксипролин). В обозначении полипептидов, используемом в настоящем описании, направление влево представляет собой направление к N-концу, и направление вправо представляет собой направление к С-концу, в соответствии со стандартным использованием и условным обозначением.
Аналогично, настоящее изобретение не относится к нуклеотидным последовательностям в их природном хромосомном окружении, т.е. в природном состоянии. Последовательности по настоящему изобретению являются выделенными и очищенными, т.е. их образцы являются полученными, прямо или непрямо, например, путем копирования, причем их окружающая среда по меньшей мере частично модифицирована. Также предусматриваются выделенные нуклеиновые кислоты, полученные с помощью рекомбинантной генетики, с помощью, например, клеток-хозяев, или полученные химическим синтезом.
В отношении настоящего описания, "процентная идентичность" между двумя последовательностями нуклеиновых кислот или аминокислот означает процент идентичных нуклеотидов или аминокислотных остатков между двумя последовательностями, подлежащими сравнению, полученными после оптимального выравнивания, этот процент является исключительно статистическим и отличия между двумя последовательностями распределены случайным образом вдоль их длины. Сравнение двух последовательностей нуклеиновых кислот или аминокислотных последовательности традиционно проводят путем сравнения последовательностей после их оптимального выравнивания, причем указанное сравнение возможно проводить по сегменту или с использованием "окна выравнивания". Оптимальное выравнивание последовательностей для сравнения можно проводить, в дополнение к сравнению вручную, с помощью алгоритма локальной гомологии Smith and Waterman (1981) [Ad. App. Math. 2:482], с помощью алгоритма локальной гомологии Neddleman and Wunsch (1970) [J. Mol. Biol. 48:443], с помощью способа поиска сходства Pearson and Lipman (1988) [Proc. Natl. Acad. Sci. USA 85:2444] или с помощью компьютерного программного обеспечения с использованием этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI, или с помощью программного обеспечения для сравнения BLAST NR или BLAST P).
Процентную идентичность между двумя последовательностями нуклеиновых кислот или аминокислотными последовательностями определяют путем сравнения двух оптимально выровненных последовательностей, где последовательность нуклеиновой кислоты или аминокислотная последовательность, подлежащая сравнению, может иметь вставки или делеции по сравнению с эталонной последовательностью для оптимального выравнивания между двумя последовательностями. Процентную идентичность вычисляют путем определения количества положений, в которых нуклеотид или аминокислотный остаток идентичен между двумя последовательностями, например, между двумя полными последовательностями, деления количества идентичных положений на общее количество положений в окне выравнивания и умножения результата на 100 с получением процентной идентичности между двумя последовательностями.
Например, можно использовать программу BLAST, "BLAST 2 sequence" (Tatusova et al., "Blast 2 sequence - a new tool for comparing protein and nucleotide sequences", FEMS Microbiol., 1999, Lett. 174:247-250), доступную на сайте http://www.ncbi.nlm.nih.gov/gorf/bl2.html, с параметрами по умолчанию (в частности, для параметров "штраф за внесение пропуска": 5, и "штраф за продолжение пропуска": 2; выбранная матрица представляет собой, например, матрицу "BLOSUM 62", предлагаемую программой); процентную идентичность между двумя последовательностями для сравнения вычисляют прямо с помощью программы.
Для аминокислотной последовательности, проявляющей по меньшей мере 80%, например, 85%, 90%, 95% и 98% идентичность с эталонной аминокислотной последовательностью, предпочтительные примеры включают последовательности, содержащие эталонную последовательность, определенные модификации, в частности, делецию, вставку или замену по меньшей мере одной аминокислоты, укорочение или удлинение. В случае замены одной или нескольких последовательно расположенных или не последовательно расположенных аминокислот, предпочтительными являются замены, в которых замещенные аминокислоты заменены "эквивалентными" аминокислотами. В настоящем описании, выражение "эквивалентные аминокислоты" указывает на любые аминокислоты, вероятно заменяющие одну из структурных аминокислот, однако без модификации биологической активности соответствующих антител и конкретных примеров, определенных ниже.
Эквивалентные аминокислоты можно определять либо по их структурной гомологии с аминокислотами, которые они заменяют, либо на основе результатов сравнительных исследований биологической активности между различными антителами, которые, вероятно, будут получены. В качестве неограничивающего примера, в таблице ниже обобщенно представлены возможные замены, которые, вероятно, будут осуществлены без значительной модификации биологической активности соответствующего модифицированного антитела; обратные замены, естественно, являются возможными в тех же условиях.

Изобретение относится к антителу, продуцируемому клеточной линией гибридомы мыши, депонированной в American Type Culture Collection (ATCC, 10801 University Blvd, Manassas, VA, USA) 13 июля 2011 года, с обозначением запатентованного депозита ATCC PTA-11994 (оформленного 29 июля 2011 года), как описано в примерах 1-2. Другие подходящие антитела могут продуцироваться клеточной линией, смешанной клеточной линией, иммортализованной клеткой или клональной популяцией иммортализованных клеток, как известно в данной области. См., например, Ausubel et al. (Ed.), Current Protocols in Molecular Biology (John Wiley & Sons, Inc., New York, N.Y. (1987-2001)); Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Edition (Cold Spring Harbor, N.Y. (1989)) и Sambrook et al., Molecular Cloning-A Laboratory Manual (3rd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 2000 (в совокупности, "Sambrook"); Harlow and Lane, Antibodies, A Laboratory Manual (Cold Spring Harbor, N.Y. (1989)); Colligan, et al. (Eds.), Current Protocols in Immunology (John Wiley & Sons, Inc., N.Y. (1994-2001)); Colligan et al., Current Protocols in Protein Science (John Wiley & Sons, NY, N.Y. (1997-2001)), каждая из которых полностью включена в настоящее описание в качестве ссылки.
В одном подходе для получения антител, предусматриваемых изобретением, получают гибридому путем слияния подходящей иммортализованной клеточной линии (например, миеломной клеточной линии) с любой из различных продуцирующих антитело клеток. Подходящие иммортализованные клеточные линии включают, но не ограничиваются ими, Sp2/0, Sp2/0-AG14, P3/NS1/Ag4-1, NSO, P3X63Ag8.653, MCP-11, S-194, гетеромиеломы, их продукты слияния или любую клетку или слитую клетку, происходящую из них, или любую другую подходящую клеточную линию, известную в данной области и/или коммерчески доступную для этой цели (например, ATCC). Подходящие продуцирующие антитело клетки включают, но не ограничиваются ими, выделенные или клонированные клетки селезенки, периферической крови, лимфы, миндалевидной железы или другие иммунные клетки или клетки, содержащие B-клетки, или любые другие клетки, экспрессирующие константные, или вариабельные, или каркасные последовательности, или последовательности CDR тяжелой или легкой цепи, либо в качестве эндогенной, либо в качестве гетерологичной нуклеиновой кислоты, в качестве рекомбинантной или эндогенной, вирусной, бактериальной, происходящей из водорослей, прокариотической, происходящей из земноводных, насекомых, пресмыкающихся, рыб, млекопитающих, животных семейства грызунов, животных семейства лошадиных, животных семейства овец, коз, овец, приматов эукариотической, геномной ДНК, кДНК, рДНК, митохондриальной ДНК или РНК, хлоропластной ДНК или РНК, гяРНК, мРНК, тРНК, являющихся одноцепочечными, двухцепочечными или трехцепочечными, гибридизованными, и т.п. или любой их комбинации. См., например, Ausubel, выше, и Colligan, Immunology, выше, Chapter 2, полностью включенные в настоящее описание в качестве ссылок.
Другие подходы для продукции антител согласно различным вариантам осуществления, описанным выше, включают, но не ограничиваются ими, способы, которые осуществляют отбор рекомбинантных антител из библиотек пептидов или белков, включая библиотеки, коммерчески доступные от Cambridge antibody Technologies, Cambridgeshire, UK; MorphoSys, Martinsreid/Planegg, Del.; Biovation, Aberdeen, Scotland, UK; Biolnvent, Lund, Sweden; Dyax Corp., Enzon, Affymax/Biosite; Xoma, Berkeley, Calif.; Ixsys; Applied Molecular Evolution; и т.п.; способы, которые основаны на иммунизации трансгенных животных, которые способны продуцировать выбираемые наборы антител человека (как правило, эти мыши содержат по меньшей мере один трансген, содержащий ДНК из по меньшей мере одного локуса иммуноглобулинов человека, который функционально реаранжирован, или который может претерпевать функциональную реаранжировку; эндогенные локусы иммуноглобулинов у таких мышей могут быть разрушены или удалены для устранения способности животного продуцировать антитела, кодируемые эндогенными генами); способы селекции, включая рибосомный дисплей, технологии продуцирования антител единичными клетками (например, способ селекции антител лимфоцитов ("SLAM")) и B-клеточную селекцию; субтрактивную иммунизацию с использованием обработки циклофосфамидом; а также любые другие способы, общеизвестные в данной области, включая, но не ограничиваясь ими, способы, описанные в опубликованной заявке США № 2005/0142609, которая полностью включена в качестве ссылки).
В некоторых вариантах осуществления антитела представляют собой оптимизированные полноразмерные антитела, химерные или гуманизированные, которые можно получать любым или комбинацией известных способов, как указано и проиллюстрировано, например, в главах 3, 4 и 5 "Business Insights, Preclinical Development of Monoclonal Antibodies and Related Biologicals-Emerging technologies and new therapeutic candidates, James Shirvill, 2010", полное содержание которой включено в качестве ссылки, таких как: пересадка CDR, такая как технология SLAM UBC, технология SMART PDL, супергуманизация Arana Therapeutics pic, корректировка каркасных областей, способы получения составных антител человека, платформа ATLAb BioAtla LLC, технология Humaneering, управляемые мутационной линией (MLG) стратегии, стратегии деиммунизации, стратегии Humanation, инженерия антител человека (например, технология HE XOMA), FcX, система LEX Biolex Therapeutics Inc (Pittsboro, NC, США), подходы Potelligent (например, BioWa), технология Complegent, BestMAb, ImmunoBody, EB66, Synageva Expression Platforms, Xencor Inc. XmAb, антитела с модифицированными сахарами (например, Seattle Genetics Inc (Bothell, WA, США)), антитела "Wox" (с окисленным триптофаном) (например, InNexus Biotechnology Inc (Vancouver, BC, Канада)); и т.п. В некоторых вариантах осуществления антитела представляют собой полностью человеческие моноклональные антитела, и их можно получать с помощью одной или комбинации технологических платформ, как указано и проиллюстрировано, например, в главе 4 "Business Insights, Preclinical Development of Monoclonal Antibodies and Related Biologicals-Emerging technologies and new therapeutic candidates, James Shirvill, 2010", и включая, но не ограничиваясь ими: фаговый дисплей (например, PDL, Dyax Corp; Cambridge, MA, США); скрининг антител на основе молекул (MBAS) (например, Affitech A/S, описанный, например, в EP0547201 и US 6730483); платформы клеточной селекции антител (CBAS); комбинаторные библиотеки антител человека (HuCAL; например, MorphoSys AG); платформы MAbstract (например, Crucell NV), включая платформы с клеточной линией PER.C6; платформы Adimab; XenoMouse; платформы UltiMAb; платформы SEBVI; платформы Veloclmmune, платформы Open Monoclonal Technology, платформы Xenerex; платформы Cloning the Human Response (например, IQ Therapeutics) и "Instant Immunity Antibodies"; платформы Viventia (например, Fusogenics, UnLock, ImmunoMine); платформы "Natural Human Antibodies" (например, OncoMab, Patrys, Acceptys); MablgX (например, Kenta Biotech); платформы Reverse Translational Medicine (например, Neuimmune Therapeutics); I-STAR (например, Theraclone Sciences); CellSpot (например, Trellis Bioscience); iBioLaunch (например, iBio Inc.); и т.п.
В некоторых вариантах осуществления антитела модифицированы путем связывания их с не являющимися антителами агентами, с использованием одной или нескольких технологических платформ и способов, как описано в главе 5 "Business Insights, Preclinical Development of Monoclonal Antibodies and Related Biologicals-Emerging technologies and new therapeutic candidates, James Shirvill, 2010", включая: конъюгат антитело-лекарственное средство (например, ADC, Seattle Genetics); направленную нагрузку антител (TAP; Immunogen Inc); Probody (например, CytomX Therapeutics); маскирование антител (например, BioTransformations); направленную фотодинамическую терапию (например, PhotoBiotics; AlbudAb (например, GSK); hyFc (например, Genexine); лигандные ловушуки (например, BioLogix); CovX-Body (например, CovX); динамическое сшивание (например, InNexus Biotechnology); технологию LEC (например, Pivotal Biosciences, Morphotek); и т.п.
В некоторых вариантах осуществления антитело или кодирующие его кДНК можно дополнительно модифицировать. Таким образом, в следующем варианте осуществления изобретение относится к способам получения антител согласно различным вариантам осуществления, где способы включают любую стадию(ии) получения химерного антитела, гуманизированного антитела или аналога любого из них. В некоторых вариантах осуществления получение химерных антител является таким, как описано в международной заявке WO89/09622. Способы получения гуманизированных антител описаны, например, в патенте США № 6548640 или патенте Канады № 1340879 (пересадка CDR).
Кроме того, можно дополнительно модифицировать антитело или кодирующие его кДНК. Таким образом, в следующем варианте осуществления изобретение относится к способам, включающим любую стадию(и) получения одноцепочечного антитела, Fab-фрагмента, биспецифического антитела, слитого антитела, меченого антитела или аналога любого из них. Как рассмотрено выше, антитело по изобретению может существовать в различных формах, помимо полных антител; включая, например, Fv, Fab и F(ab)2, а также в виде единичных цепей. См. например международную заявку WO88/09344. Более того, специалисту в данной области хорошо известны диантитела и связывающие молекулы с V-подобным доменом; см., например, патент США № 7166697.
В некоторых вариантах осуществления антитела (например, DC8E8) модифицированы и служат в качестве основы для получения связывающих молекул с одним или несколькими свойствами связывания антигена, описанными для антитела DC8E8. Эти связывающие белки можно получать одним или несколькими способами, приведенными и проиллюстрированными, например, в главе 6 "Business Insights, Preclinical Development of Monoclonal Antibodies and Related Biologicals-Emerging technologies and new therapeutic candidates, James Shirvill, 2010", включая: Fab, TetraMAB (например, Galileo Oncologics); scFv; Immuna (например, ESBA Tech AG); [scFv]2, включая связывающие молекулы, которые связывают любые два из четырех терапевтических эпитопов DC8E8; BiTE (Affitech, Micromet AG); Avibody (например, Avipep Pty); TandAb (например, Affimed Therapeutics); Flexibody (например, Affirmed); V-NAR (например, AdAlta); Nanobody (Ablynx NV); доменные антитела (например, Diversys Ltd. GSK, патент США № 6248516 и EP0368684); гетерополимер (например, Elusys Therapeutics Inc.); Unibody (например, GenMab A S); антитела с заменой доменов (например, Calmune Corporation, Science. 2003 Jun 27;300(5628):2065-71); иммунопрепараты на основе модульного белка с малым размером молекул (SMIP) и молекулы SCORPION (например, Trubion Pharmaceuticals); иммуноглобулин с двойным вариабельным доменом DVD-Ig (Abbott Laboratories); и т.п.
Антитела по настоящему изобретению или их соответствующая цепь(и) иммуноглобулина может быть дополнительно модифицирована с использованием общепринятых способов, известных в данной области, например, с использованием делеции(ий), инсерции(ий), замены(замен), вставки(вставок) и/или рекомбинации(ий) и/или любой другой модификации(ий) аминокислот, известной в данной области, либо отдельно, либо в комбинации. См., например, раздел "Примеры", предоставленный ниже. Способы внесения таких модификаций в последовательность ДНК, лежащую в основе аминокислотой последовательности цепи иммуноглобулина, известны специалисту в данной области. См., например, Sambrook (выше) и Ausubel (выше).
Модификации антитела по изобретению включают химическое и/или ферментативное преобразование одной или нескольких составляющих его аминокислот, включая модификации боковой цепи, модификации основной цепи, и N- и C-концевые модификации, включающие ацетилирование, гидроксилирование, метилирование, амидирование и присоединение или удаление углеводных или липидных частей, кофакторов, и т.п. Аналогично, настоящее изобретение охватывает получение химерных белков, которые содержат описанное антитело или его некоторый фрагмент на N-конце, слитые с гетерологичной молекулой, такой как иммуностимулирующий лиганд на С-конце. См., например, международную заявку WO00/30680 для соответствующих технических деталей, включенную в настоящее описание в качестве ссылки в полном объеме.
В одном варианте осуществления изобретение относится к способу получения антитела или его связывающего фрагмента, или их цепи(ей) иммуноглобулина, причем способ включает:
(a) культивирование клетки, как описано выше; и
(b) выделение указанного антитела или связывающего фрагмента, или их цепи(ей) иммуноглобулина из культуры.
В некоторых вариантах осуществления выделение включает контактирование содержащего антитело образца с одним из пептидов, предусматриваемых изобретением, с которыми связывается антитело.
Трансформированных хозяев можно выращивать в ферментерах и культивировать в соответствии со способами, известными в данной области, для достижения оптимального роста клеток. После экспрессии целые антитела, их димеры, отдельные легкие и тяжелые цепи или другие формы иммуноглобулинов по настоящему изобретению, можно очищать в соответствии со стандартными в данной области методиками, включая преципитацию с сульфатом аммония, аффинные колонки, колоночную хроматографию, гель-электрофорез и т.п.; см., Scopes, "Protein Purification", Springer Verlag, N.Y. (1982). Затем антитело или его соответствующую цепь(и) иммуноглобулина можно выделять из среды для роста, клеточных лизатов или клеточных мембранных фракций. Выделение и очистку, например, рекомбинантно экспрессированных антител или цепей иммуноглобулинов, предусматриваемых изобретением, можно проводить любыми общепринятыми способами, например, такими как препаративное хроматографическое разделение и иммунологическое разделение, подобные тем, что вовлекают использование моноклональных или поликлональных антител, направленных против константной области антитела по изобретению.
Для фармакологических применений предпочтительными являются по существу чистые иммуноглобулины с гомогенностью по меньшей мере приблизительно 90-95%, и наиболее предпочтительной является гомогенность 98-99% или более. После очистки, частично или до желаемой гомогенности, антитела можно использовать терапевтически (в том числе экстракорпорально) или в разработке или выполнении методик анализа.
Изобретение также относится к антителам, связанным с другими частями для таких целей, как нацеливание лекарственного средства и применение для визуализации. Такое присоединение можно проводить химически после экспрессии антитела к участку присоединения, или связанный продукт можно встраивать способами инженерии в антитело по изобретению на уровне ДНК. Затем ДНК экспрессируются в подходящей системе хозяина, и экспрессированные белки при необходимости собирают и ренатурируют.
Настоящее изобретение также вовлекает способ получения клеток, способных экспрессировать антитело по изобретению или его соответствующую цепь(и) иммуноглобулина, включающий модификацию способами генной инженерии клеток полинуклеотидом или вектором по изобретению. Клетки, получаемые способом по изобретению, можно использовать, например, для исследования взаимодействия антитела по изобретению с его антигеном.
Изобретение также относится к продуцирующим антитела клеточным линиям и рекомбинантным клеткам, в качестве источника антител, предусматриваемых настоящим изобретением. Настоящее изобретение, кроме того, относится к диагностическим анализам и наборам, которые содержат антитела, предусматриваемые изобретением, или эквивалентную связывающую молекулу, и к терапевтическим способам на их основе.
Изобретение также относится к способам получения антител, которые способны конкурировать с DC8E8 и также способны ингибировать патологические взаимодействия тау-тау. Эти антитела можно подвергать скринингу по их способности в достаточной степени конкурировать с DC8E8 за связывание с белком тау и связывание с одним, двумя, тремя или всеми четырьмя из "терапевтических эпитопов", описанных в настоящем описании.
Настоящее изобретение также относится к полинуклеотидам, кодирующим одно или несколько средств на основе антител, предусматриваемых изобретением. В определенных случаях нуклеотид, например, кодирует по меньшей мере связывающий домен или вариабельную область цепи иммуноглобулина антител, описанных выше. Как правило, указанная вариабельная область, кодируемая полинуклеотидом, содержит по меньшей мере одну определяющую комплементарность область (CDR) VH и/или VL вариабельной области указанного антитела. Специалисту в данной области известно, что каждый вариабельный домен (VH тяжелой цепи и VL легкой цепи) антитела содержит три гипервариабельных области, иногда называемых определяющими комплементарность областями или "CDR", фланкированными четырьмя относительно консервативными каркасными областями или "FR", и относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. В соответствии с системой нумерации Kabat, гипервариабельные области или CDR субтипа IgG человека в антителе содержат аминокислотные остатки из остатков 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи, как описано Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed Public Health Service, National Institutes of Health, Bethesda, Md. (1991), и/или остатки из гипервариабельной петли, т.е. остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи, и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи, как описано Chothia et al., J. Mol. Biol. 196 (1987), 901-917. В уникальной системе нумерации IMGT консервативные аминокислоты всегда имеют одно и то же положение, например, цистеин 23 (1-ый CYS), триптофан 41 (косервативный TRP), гидрофобная аминокислота 89, цистеин 104 (2-ой CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). См., например, Lefranc M.-P., Immunology Today 18, 509 (1997); Lefranc M.-P., The Immunologist, 7, 132-136 (1999); Lefranc, M.-P., Pommie, C, Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L, Thouvenin-Contet, V. и Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003). Уникальная нумерация IMGT обеспечивает стандартизованное определение границ каркасных областей (FR1-IMGT: положения 1-26, FR2-IMGT: 39-55, FR3-IMGT: 66-104 и FR4-IMGT: 118-128), и определяющих комплементарность областей: CDR1-IMGT: 27-38, CDR2-IMGT: 56-65 и CDR3-IMGT: 105-117. Уникальную нумерацию IMGT используют в 2D-графических представлениях, обозначаемых как IMGT Colliers de Perles. См., например, Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002); Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007). Также ее используют для представления 3D-структур. См., например, IMGT/3Dstructure-DB Kaas, Q., Ruiz, M. и Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004). Каркасные остатки или остатки FR представляют собой остатки вариабельного домена, отличные от гипервариабельных областей и ограничивающие их.
Таким образом, изобретение также относится к выделенной нуклеиновой кислоте, отличающейся тем, что она выбрана из следующих нуклеиновых кислот (включая любой вырожденный генетический код):
a) нуклеиновая кислота, ДНК или РНК, кодирующая антитело по изобретению;
b) нуклеиновая кислота, комплементарная нуклеиновой кислоте, как определено в a);
c) нуклеиновая кислота по меньшей мере из 18 нуклеотидов, способная гибридизоваться в условиях высокой жесткости по меньшей мере с одной из CDR, выбранных из SEQ ID NO: 117-122 и SEQ ID NO: 247, 253, 255, 257-259, 122, 261, 262, 264, 265-267 и 269; и
d) нуклеиновая кислота по меньшей мере из 18 нуклеотидов, способная гибридизоваться в условиях высокой жесткости по меньшей мере с последовательностью нуклеиновой кислоты легкой цепи SEQ ID 165 и/или последовательностью нуклеиновой кислоты тяжелой цепи SEQ ID No: 170, или последовательностью по меньшей мере с 80%, например 85%, 90%, 95% и 98% идентичностью после оптимального выравнивания с последовательностями SEQ ID No: 165 и/или SEQ ID 170, например, по меньшей мере с одной из CDR из них в соответствии с нумерацией IMGT.
Нуклеотидные последовательности, обладающие процентной идентичностью по меньшей мере 80%, например 85%, 90%, 95% и 98%, после оптимального выравнивания с предпочтительной последовательностью, означают нуклеотидные последовательности, обладающие, относительно эталонной нуклеотидной последовательности, определенными модификациями, такими как, в частности, делеция, укорочение, удлинение, химерное слияние и/или замена, предпочтительно точечные. В некоторых вариантах осуществления они представляют собой последовательности, которые кодируют те же аминокислотные последовательности, что и эталонная последовательность, это связано с вырожденностью генетического кода, или комплементарные им последовательности, которые, вероятно, будут специфически гибридизоваться с эталонными последовательностями, например в условиях высокой жесткости, в частности, в условиях, описанных ниже.
Гибридизация в условиях высокой жесткости означает, что условия, касающиеся температуры и ионной силы, выбирают так, чтобы обеспечить сохранение гибридизации между двумя комплементарными фрагментами ДНК. Исключительно в иллюстративных целях, условиях высокой жесткости стадии гибирдизации для определения полинуклеотидных фрагментов, описанных выше, преимущественно являются следующими.
Гибридизацию ДНК-ДНК или ДНК-РНК осуществляют на двух стадиях: (1) прегибридизация при 42°C в течение трех часов в фосфатном буфере (20 мМ, pH 7,5), содержащем 5X SSC (1 X SSC соответствует раствору 0,15 M NaCl + 0,015 M цитрат натрия), 50% формамид, 7% додецилсульфат натрия (SDS), 10X раствор Денхардта, 5% сульфат декстрана и 1% ДНК спермы лосося; (2) первичная гибридизация в течение 20 часов при температуре, зависящей от длины зонда (т.е.: 42°C для зонда длиной >100 нуклеотидов), затем два промывания в течение 20 минут при 20°C в 2X SSC + 2% SDS, одно промывание в течение 20 минут при 20°C в 0,1 X SSC + 0,1% SDS. Последнее промывание проводят в 0,1 X SSC + 0,1% SDS в течение 30 минут при 60°C для зонда длиной >100 нуклеотидов. Условия гибридизации высокой жесткости, описанные выше для полинуклеотида определенного размера, могут быть адаптированы специалистом в данной области для более длинных или более коротких олигонуклеотидов, в соответствии с методиками, описанными в Sambrook, et al. (Molecular cloning: a laboratory manual, Cold Spring Harbor Laboratory; 3rd edition, 2001).
Аффинность или авидность антитела к антигену можно определять экспериментально с использованием любого подходящего способа; см., например, Pope ME, Soste MV, Eyford BA, Anderson NL, Pearson TW. (2009) J Immunol Methods. 341 (1-2):86-96, и способы, описанные в указанном источнике. Измеренная аффинность конкретного взаимодействия антитело-антиген может варьировать при измерении в различных условиях, например, концентрации соли, pH. Таким образом, измерение аффинности и других параметров связывания антигена, например, KD, IC50, проводят, например, в стандартизованных растворах антитела и антигена, и в стандартизованном буфере.
Изобретение также относится к тому, что вариабельный домен антитела, имеющего описанный выше вариабельный домен, можно использовать для конструирования других полипептидов или антител с желаемой специфичностью и биологической функцией. Таким образом, настоящее изобретение также охватывает полипептиды и антитела, содержащие по меньшей мере одну CDR описанного выше вариабельного домена и которые преимущественно имеют по существу такие же или сходные свойства связывания, как и антитело, описанное в прилагаемых примерах. Специалисту в данной области будет понятно, что с использованием вариабельных доменов или CDR, описанных в настоящем описании, антитела можно конструировать в соответствии со способами, известными в данной области, например, как описано в заявках на патент Европы EP 0 451 216 A1 и EP 0 549 581 A1. Более того, специалисту в данной области известно, что аффинность связывания можно повышать путем внесения аминокислотных замен в CDR или в гипервариабельные петли (Chothia and Lesk, J. Mol. Biol. 196 (1987), 901-917), которые частично перекрываются с CDR, как определено Kabat. Таким образом, настоящее изобретение также относится к антителам, где одна или несколько из упомянутых CDR содержат одну или несколько, например, не более двух, аминокислотных замен. В некоторых вариантах осуществления антитело по изобретению содержит в одной или обеих из его цепей иммуноглобулина две или три CDR вариабельных областей, как указано на фиг.3B и 3E. В некоторых вариантах осуществления антитело по изобретению содержит в одной или нескольких его цепях иммуноглобулина две или все три CDR, как указано на фиг.25B.
Полинуклеотиды или нуклеиновые кислоты, кодирующие описанные выше антитела, могут представлять собой, например, ДНК, кДНК, РНК или синтетически продуцированные ДНК или РНК или рекомбинантно продуцированную химерную молекулу нуклеиновой кислоты, содержащую любой из этих полинуклеотидов, либо отдельно, либо в комбинации. В некоторых вариантах осуществления полинуклеотид является частью вектора. Такие векторы могут содержать дополнительные гены, такие как маркерные гены, которые позволяют селекцию указанного вектора в подходящей клетке-хозяине и в подходящих условиях.
В некоторых вариантах осуществления полинуклеотид функционально связан с одной или несколькими последовательностями контроля экспрессии, обеспечивающими экспрессию в прокариотических или эукариотических клетках. Экспрессия указанного полинуклеотида включает транскрипцию полинуклеотида в транслируемую мРНК. Регуляторные элементы, обеспечивающие экспрессию в эукариотических клетках, например, клетках млекопитающих, известны специалистам в данной области. Они обычно содержат регуляторные последовательности, обеспечивающие инициацию транскрипции и необязательно сигналы поли-A, обеспечивающие терминацию транскрипции и стабилизацию транскрипта. Дополнительные регуляторные элементы могут включать энхансеры транскрипции, а также трансляции, и/или естественным образом ассоциированные или гетерологичные промоторные области.
В этом отношении, специалисту в данной области будет понятно, что полинуклеотиды, кодирующие по меньшей мере вариабельный домен легкой и/или тяжелой цепи, могут кодировать вариабельные домены обеих цепей иммуноглобулинов или только одной. Аналогично, указанные полинуклеотиды могут находиться под контролем того же промотора или их экспрессия может контролироваться отдельно. Возможные регуляторные элементы, обеспечивающие экспрессию в прокариотических клетках-хозяевах, включают, например, промоторы PL, lac, trp или tac в E. coli, и примерами регуляторных элементов, обеспечивающих экспрессию в эукариотических клетках-хозяевах, являются промоторы AOX1 или GAL1 в дрожжах или промоторы CMV, SV40, RSV, энхансер CMV, энхансер SV40 или интрон глобина в клетках млекопитающих и других животных.
Помимо элементов, которые ответственны за инициацию транскрипции, такие регуляторные элементы также могут содержать сигналы терминации транскрипции, такие как участок поли-A SV40 или участок поли-A tk, ниже полинуклеотида. Более того, в зависимости от используемой экспрессирущей системы, к кодирующей последовательности полинуклеотидов можно присоединять лидерные последовательности, способные направлять полипептид в клеточный компартмент или секретировать его в среду. Лидерную последовательность(и) присоединяют в соответствующей фазе с последовательностями трансляции, инициации и терминации, и необязательно, лидерная последовательность способна направлять секрецию транслируемого белка или его части в периплазматическое пространство или во внеклеточную среду. В некоторых вариантах осуществления гетерологичная последовательность может кодировать слитый белок, включающий C- или N-концевой идентификационный пептид, обеспечивающий желаемые характеристики, например, стабилизацию или облегчение очистки экспрессируемого рекомбинантного продукта. В этом контексте, подходящие экспрессирующие векторы известны в данной области, и включают, но не ограничиваются ими, экспрессирующий кДНК-вектор Okayama-Berg pcDV1 (Pharmacia), pCDM8, pRc/CMV, pcDNAI, pcDNA3 (Invitrogen) и pSPORT1 (GIBCO BRL).
В некоторых вариантах осуществления последовательности контроля экспрессии могут представлять собой эукариотические промоторные системы в векторах, способных трансформировать или трансфицировать эукариотические клетки-хозяева, однако также можно использовать последовательности контроля для прокариотических хозяев. После введения вектора в соответствующего хозяина, хозяина поддерживают в условиях, пригодных для экспрессии на высоком уровне нуклеотидных последовательностей, и, если желательно, после этого может следовать сбор и очистка легких цепей, тяжелых цепей, димеров легкая/тяжелая цепь иммуноглобулинов или целых антител, связывающих фрагментов или других форм иммуноглобулинов. См., например, Beychok, Cells of Immunoglobulin Synthesis, Academic Press, N.Y. (1979).
Более того, изобретение относится к векторам, в частности, плазмидам, космидам, вирусам и бактериофагам, обычно используемым в генетической инженерии, которые содержат полинуклеотид, кодирующий вариабельный домен цепи иммуноглобулина в антителе по изобретению; необязательно в комбинации с полинуклеотидом по изобретению, который кодирует вариабельный домен другой цепи иммуноглобулина в антителе по изобретению. В некоторых вариантах осуществления указанный вектор представляет собой экспрессирующий вектор и/или вектор для переноса генов или вектор для нацеливания. Экспрессирующие векторы, происходящие из вирусов, таких как ретровирусы, вирус осповакцины, аденоассоциированный вирус, вирус герпеса или вирус папилломы крупного рогатого скота, можно использовать для доставки полинуклеотидов или вектора по изобретению в заданную клеточную популяцию. Для конструирования рекомбинантных вирусных векторов можно использовать любые способы, которые известны специалистам в данной области. См., например, способы, описанные в Sambrook (выше) и Ausubel (выше). Альтернативно полинуклеотиды и векторы, предусматриваемые изобретением, можно заключать в липосомы для доставки в клетки-мишени. Векторы, содержащие полинуклеотиды, предусматриваемые изобретением (например, последовательности, кодирующие вариабельный домен(ы) тяжелой и/или легкой цепи цепей иммуноглобулина и последовательности контроля экспрессии) можно переносить в клетку-хозяина известными способами, которые варьируют, в зависимости от типа клетки-хозяина. Например, для прокариотических клеток обычно используют трансфекцию с хлоридом кальция, в то время для других клеток-хозяев можно использовать обработку фосфатом кальция или электропорацию.
Более того, настоящее изобретение относится к клеткам-хозяевам, трансформированным полинуклеотидом или вектором, предусматриваемым изобретением. Клетка-хозяин может представлять собой прокариотическую или эукариотическую клетку. Полинуклеотид или вектор, который присутствует в клетке-хозяине, может либо встраиваться в геном клетки-хозяина, либо он может поддерживаться внехромосомно. Клетка-хозяин может представлять собой любую прокариотическую или эукариотическую клетку, такую как клетка бактерий, насекомых, грибов, растений, животных или человека. Предпочтительными клетками грибов являются, например, клетки рода Saccharomyces, в частности клетки вида S. cerevisiae. В зависимости от хозяина, используемого в методике рекомбинантного продуцирования, антитела или цепи иммуноглобулинов, кодируемые полинуклеотидом по настоящему изобретению, могут быть гликозилированными или могут быть негликозилированными. Определенные антитела, предусматриваемые изобретением, или соответствующие цепи иммуноглобулинов, также могут включать первоначальный аминокислотный остаток метионина. Полинуклеотид по изобретению можно использовать для трансформации или трансфекции хозяина с использованием любого из способов, общеизвестных средним специалистам в данной области. Более того, способы получения слитых функционально связанных генов и экспрессии их, например, в клетках млекопитающих и бактерий, хорошо известны в данной области. См., например, Sambrook. Генетические конструкции и способы, описанные в указанном источнике, можно использовать для экспрессии антител, предусматриваемых изобретением, или их соответствующих цепей иммуноглобулинов, в эукариотических или прокариотических хозяевах. Как правило, используют экспрессирующие векторы, содержащие промоторные последовательности, которые способствуют эффективной транскрипции встроенного полинуклеотида, применительно к данному хозяину. Экспрессирующий вектор, как правило, содержит ориджин репликации, промотор и терминатор, а также конкретные гены, которые способны обеспечивать фенотипическую селекцию трансформированных клеток. Подходящие клетки-источники для последовательностей ДНК и клетки-хозяева для экспрессии и секреции иммуноглобулинов, могут быть получены из ряда источников, таких как American Type Culture Collection ("Catalogue of Cell Lines and Hybridomas", Fifth edition (1985) Manassas, VA, U.S.A., и другая доступная версия, включенная в настоящее описание в качестве ссылки). Более того, для крупномасштабной продукции антитела по изобретению можно использовать трансгенных животных, например, млекопитающих, содержащих клетки по изобретению.
Кроме того, настоящее изобретение охватывает небольшие пептиды, включающие пептиды, содержащие связывающую молекулу, как описано выше, например, содержащую область CDR3 вариабельной области любого из упомянутых антител, в частности, CDR3 тяжелой цепи, поскольку для определенных антител часто наблюдают, что CDR3 тяжелой цепи (HCDR3) представляет собой область, имеющую более высокую степень вариабельности и является преобладающим участником взаимодействия антиген-антитело. Такие пептиды можно синтезировать или продуцировать рекомбинантными способами для получения связывающей молекулы, пригодной согласно изобретению. Такие способы известны средним специалистам в данной области. Пептиды можно синтезировать, например, с использованием автоматизированных устройств для синтеза пептидов, которые являются коммерчески доступными. Пептиды также можно продуцировать рекомбинантными способами путем включения ДНК, экспрессирующей пептид, в экспрессирующий вектор и трансформации клеток экспрессирующим вектором для продуцирования пептида.
Описанные выше слитые белки, кроме того, могут содержать отщепляемый линкер или участок расщепления протеазами, которые могут называться спейсерными частями. Эти спейсерные части, в свою очередь, могут быть либо нерастворимыми, либо растворимыми (Diener et al., Science 231 (1986), 148) и могут быть выбраны для обеспечения освобождения лекарственного средства от антитела в заданной области. Примерами лекарственных средств, которые могут быть присоединены к антителам по настоящему изобретению для иммунотерапии, являются лекарственные средства, радиоизотопы, лектины и токсины. Лекарственные средства, которые могут быть конъюгированы с антителами и антигенами по настоящему изобретению, включают соединения, которые обычно называют лекарственными средствами, такие как митомицин C, даунорубицин и винбластин. При использовании конъюгированных с радиоизотопной меткой антител или антигенов по изобретению, например, для иммунотерапии, определенные изотопы могут быть более предпочтительными, чем другие, в зависимости от таких факторов, как распределение в лейкоцитах, а также стабильность и испускание изотопа. В зависимости от аутоиммунного ответа, некоторые эмиттеры являются предпочтительными относительно других. Как правило, для иммунотерапии предпочтительными являются радиоизотопы, излучающие альфа- и бета-частицы. В определенных предпочтительных случаях радиоизотопы представляют собой короткодействующие высокоэнергетические альфа-излучатели, такие как212Bi. Примерами радиоизотопов, которые могут быть связаны с антителами или антигенами по изобретению для терапевтических целей, являются125I,131I,90Y,67Cu,212Bi,212At,211Pb,47Sc,109Pd и188Re. В определенных случаях радиоактивная метка представляет собой64Cu. Другие лекарственные средства, которые могут быть присоединены к антителу или антигену по изобретению, а также терапевтические протоколы ex vivo и in vivo, известны или могут быть установлены специалистами в данной области. При любых обстоятельствах специалист в данной области может использовать полинуклеотид по изобретению, кодирующий (и являющийся источником) любое из описанных выше антител, антигенов, или соответствующий вектор вместо самого белкового материала.
Изобретение также относится к применению связывающей молекулы или антитела, предусматриваемых в настоящем описании, для получения композиции для применения in vivo для подавления образования или снижения иным образом уровней небеспорядочного и/или разупорядоченного белка тау у индивидуума; или для экстрокорпоральной экстракции патологических соединений тау или их предшественников из жидкостей организма. Эти способы можно использовать для улучшения когнитивной способности или замедления или обращения вспять снижения когнитивных способностей, ассоциированного с заболеванием. Антитело или связывающие молекулы, предусматриваемые изобретением или их химические производные можно вводить прямо в кровь или CSF и извлекать на последующей стадии путем аффинного улавливания из крови или CSF, тем самым, извлекая разупорядоченный и небеспорядочный белок тау вместе с упомянутой выше связывающей молекулой. Таким образом, настоящее изобретение также относится к способу лечения или профилактики возникновения или прогрессирования болезни Альцгеймера или родственных таупатий у индивидуума, включающему извлечение крови или CSF из организма индивидуума, обработку крови и CSF и возвращение индивидууму крови и CSF, соответственно, полученных таким образом.
Молекулы и частицы с антителом, пептидом или связывающей молекулой/белком по изобретению также обладают диагностической применимостью. Изобретение относится к антителам, которые распознают и различают различные формы белка тау, которые присутствуют на различных стадиях болезни Альцгеймера. Эти антитела способны обнаруживать белок тау (и его различные конформационные изменения), как in vitro, так и in vivo. Антитела могут различать физиологический и патологический белок тау в различных анализах, включая биохимический анализ, иммунопреципитацию, ELISA, вестерн-блоттинг и иммуногистохимический анализ (например, свежего, фиксированного, замороженного, заключенного в парафин образца), а также визуализацию in vivo с использованием, например, радиоактивно меченного DC8E8 (включая фрагменты DC8E8, такие как одноцепочечное DC8E8), которое отличает физиологический от патологического белка тау (см. примеры). Также они способны осуществлять это как в твердых, так и жидких образцах и биоптатах (например, кровь, плазма, CSF, гомогенаты) животного (например, грызуны, человек). Некоторые из этих анализов для обнаружения описаны в разделе "Примеры". Другие общепринятые способы обнаружения белков известны специалистам в данной области, и, таким образом, их можно стандартным образом адаптировать для антител, пептидов и связывающих белок тау молекул, предусматриваемых изобретением. Антитела по настоящему изобретению могут быть меченными (например, флуоресцентная, радиоактивная, ферментная, ядерно-магнитная метка, тяжелый металл) и могут быть использованы для обнаружения конкретных мишеней in vivo или in vitro, включая подобные иммунохимическим анализы in vitro (см., например, примеры, описанные ниже). Также, in vivo, их можно использовать аналогичным образом для способов визуализации ядерной медицины для обнаружения тканей, клеток или другого материала, имеющего небеспорядочный белок тау и его отложения. Нацеливание на внутриклеточный и внеклеточный небеспорядочный белок тау и нейрофибриллярные очаги с помощью диагностических визуализирующих зондов, выявляемых с помощью MRI или PET, могут обеспечить биологический маркер для более точного досмертного диагноза AD, а также средства для мониторинга эффективности терапии, нацеленной на белок тау. Таким образом, изобретение относится к применению антител, описанных в настоящем описании, для получения композиции, и в способах, для обнаружения белка тау и/или нацеливания диагностического средства на патологический белок тау и нейрофибриллярные очаги в головном мозге для диагностики AD. Эти композиции и способы можно использовать в качестве части протокола лечения AD и родственных таупатий.
Изобретение относится к антителам, пригодным для применения в иммуноанализах, в которых они могут быть использованы в жидкой фазе или могут быть связаны с твердофазным носителем. Примерами иммуноанализов, в которых можно использовать антитела по изобретению, являются конкурентные и неконкурентные иммуноанализы либо в прямом, либо в непрямом формате. Примерами таких иммуноанализов являются радиоиммунный анализ (RIA), сэндвич-анализ (иммунометрический анализ), проточная цитометрия и анализ с использованием вестерн-блоттинга. Антитела по изобретению могут быть связаны с одним из множества различных носителей и могут быть использованы для выделения клеток, специфически связывающихся с ними. Примеры известных носителей включают стекло, полистирол, поливинилхлорид, полипропилен, полиэтилен, поликарбонат, декстран, нейлон, амилозы, природные и модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. Для целей изобретения носитель может быть либо растворимым, либо нерастворимым. Существует множество различных меток и способов мечения, известных средним специалистам в данной области.
Примеры типов меток, которые можно использовать в рамках настоящего изобретения, включают ферменты, радиоизотопы и радионуклиды, коллоидные металлы, флуоресцентные соединения, хемилюминесцентные соединения, биотинильные группы, заданные полипептидные эпитопы, распознаваемые вторичным репортером (например, последовательности пары лейциновой молнии, участки связывания для вторичных антител, связывающие металлы домены, эпитопные метки), и хеми/электрохеми/биолюминесцентные соединения. Ферменты включают пероксидазу (например, HRP), люциферазу, щелочную фосфатазу, α-D-галактозидазу, глюкозооксидазу, глюкозоамилазу, карбоангидразу, ацетилхолинэстеразу, лизоцим, малатдегидрогеназу или глюкоза-6-фосфатдегидрогеназу. Альтернативно метка представляет собой биотин, дигоксигенин или 5-бромдезоксиуридин. Также с антителами и тау-связывающими белками, предусматриваемые изобретением, можно комбинировать флуоресцентные метки, включая родамин, люминофоры на основе комплексов лантанидов, флуоресцеин и его производные, флуорохромы, родамин и его производные, зеленый флуоресцентный белок (GFP), красный флуоресцентный белок (RFP) и другие, дансил, умбеллиферон. В таких конъюгатах антитела/связывающие белки по изобретению можно получать способами, известными специалисту в данной области. Затем их можно связывать с ферментами или флуоресцентными метками прямо; через спейсерную группу или через линкерную группу, такую как полиальдегид, глутаральдегид, этилендиаминтетрауксусная кислота (EDTA) или диэтилентриаминпентауксусная кислота (DPTA); или в присутствии других связывающих агентов, таких как связывающие агенты, общеизвестные в данной области. Конъюгаты, содержащие флуоресцеиновые метки, можно получать, например, путем реакции с изотиоцианатом. В определенных случаях метка или маркер также могут быть терапевтическими.
Другие конъюгаты могут включать хемилюминесцентные метки, такие как люминол и диоксетан, биолюминесцентные метки, такие как люцифераза и люциферин, или радиоактивные метки, такие как йод123, йод125, йод126, йод133,131, бром77, технеций99ь, индий111, индий113m, галлий67, галлий68, рутений95, рутений97, рутений103, рутений105, ртуть107, ртуть203, рений99m, рений101, рений105, скандий47, теллур121m, теллур122m, теллур125m, тулий165, тулий167, тулий168, фтор18, иттрий199 и йод131. Можно использовать существующие способы, известные специалисту в данной области, для мечения антител радиоизотопами, либо прямо, либо через хелатирующий агент, такой как EDTA или DTPA, упомянутый выше, в качестве диагностических радиоизотопов. См., например, мечение [I125]Na способом с хлорамином-T [Hunter W.M. и Greenwood F.C. (1962) Nature 194:495]; мечение технецием, как описано Crockford et al. (патент США 4424200); и связывание через DTPA, как описано Hnatowich (патент США 4479930).
Изобретение также относится к антителам и другим тау-связывающим молекулам, которые также можно использовать в способе диагностики нарушения у индивидуума, путем получения образца жидкости организма от индивидуума, который может представлять собой образец крови, образец лимфы или образец любой другой жидкости организма, и контактирование образца жидкости организма с антителом по настоящему изобретению в условиях, обеспечивающих образование комплексов антитело-антиген. Затем определяют присутствие и/или количество таких комплексов способами, известными в данной области, причем уровень, значительно превышающий уровень, образующийся в контрольном образце, указывает на присутствие заболевания у исследуемого индивидуума. Таким образом, настоящее изобретение относится к иммуноанализу in vitro, включающему антитело по изобретению.
Более того, настоящее изобретение относится к способам визуализации in vivo с использованием любой из связывающих белок тау молекул по настоящему изобретению. Например, способ медицинской визуализации позитронная эмиссионная томография (PET), который дает на выходе трехмерное изображение частей организма, основан на выявлении излучения вследствие эмиссии позитронов. Как правило, биомолекула является радиоактивно меченной, например, она включает радиоактивный изотопный индикатор. При введении меченой биомолекулы индивидууму, как правило, путем инъекции в кровоток, радиоактивно меченая биомолекула концентрируется в представляющих интерес тканях. Затем индивидуума помещают в визуализирущий сканер, который обнаруживает эмиссию позитронов. В одном варианте осуществления меченую, например, меченную64Cu, связывающую молекулу, такую как антитело, вводят индивидууму и проводят обнаружение связывающей молекулы и, таким образом, небеспорядочного или разупорядоченного белка тау, путем помещения индивидуума в визуализирующий сканер и обнаружения эмиссии позитронов, что, тем самым, указывает на наличие неврологического нарушения в случае обнаружения эмиссии. Настоящее изобретение, таким образом, охватывает способ визуализации PET, включающий стадию введения меченной64Cu или эквивалентно меченной связывающей молекулы по настоящему изобретению индивидууму.
Настоящее изобретение также относится к изделию, такому как фармацевтические и диагностические упаковки или наборы, содержащие один или несколько контейнеров, заполненных одним или несколькими из описанных выше ингредиентов, т.е. связывающую молекулу, антитело или их связывающий фрагмент, полинуклеотид, вектор или клетку, предусматриваемые изобретением. К такому контейнеру(ам) может прилагаться уведомление в форме, предписываемой правительственным учреждением, регулирующим изготовление, применение или продажу фармацевтических или биологических продуктов, в котором отражено одобрение учреждением изготовления, применения или продажи для введения человеку. Дополнительно или альтернативно, набор содержит реагенты и/или инструкции по применению соответствующих диагностических анализов. Композиция или набор по настоящему изобретению пригодны для диагностики, профилактики и лечения болезни Альцгеймера и родственных таупатий.
Биологическая активность связывающих молекул, например, антител, предусматриваемых изобретением, указывает на то, что они обладают достаточной аффинностью, чтобы стать кандидатами для локализации лекарственного средства/доставки лекарственного средства в клетки или ткани. Нацеливание на отложения небеспорядочного белка тау и связывание с ними может быть полезным для доставки терапевтически или диагностически активных средств и генной терапии/доставки генов. Таким образом, изобретение относится к применению антител, описанных в настоящем описании, для получения композиции и в способах для обнаружения и/или нацеливания терапевтического или диагностического средства на патологический белок тау и нейрофибриллярные очаги в головном мозге. Эти композиции и способы можно использовать в качестве части протокола лечения AD и родственных таупатий.
Таким образом, настоящее изобретение относится к композициям, содержащим одно или несколько из упомянутых выше соединений, включая связывающие молекулы, антитела, связывающие фрагменты; их химические производные; полинуклеотиды, векторы и клетки. Определенные композиции, кроме того, могут содержать один или несколько фармацевтически приемлемых носителей и один или несколько фармацевтически приемлемых разбавителей. Определенные химические производные содержат химические части, которые обычно не являются частью основной молекулы или клетки (например, антитела, связывающей молекулы, полинуклеотидов, векторов и клеток), но связаны с ним общепринятыми способами. Такие части могут функционировать, например, улучшая растворимость, время полужизни, визуализацию, возможность обнаружения и/или всасывание, основной молекулы или клетки. Альтернативно части могут снижать нежелательные побочные эффекты основной молекулы или снижать токсичность основной молекулы.
Изобретение также относится к фармацевтическим композициям, содержащим комбинации антител, предусматриваемых изобретением, с дополнительными средствами, такими как интерлейкины или интерфероны, в зависимости от предполагаемого применения фармацевтической композиции. Например, для применения при лечении болезни Альцгеймера дополнительное средство может быть выбрано из группы, состоящей из низкомолекулярных органических молекул, антител против белка тау, антител против бета-амилоида и их комбинаций. Другие средства включают, но не ограничиваются ими, ингибиторы ацетилхолинэстеразы, антагонисты рецепторов NMDA, хелаторы переходных металлов, факторы роста, гормоны, нестероидные противовоспалительные лекарственные средства (NSAID), антиоксиданты, средства, снижающие уровень липидов, селективные ингибиторы фосфодиэстеразы, ингибиторы агрегации белка тау, ингибиторы протеинкиназ, ингибиторы белков теплового шока, реагенты для пассивной и активной иммунизации против амилоида, ингибиторы агрегации амилоида и ингибиторы секретазы. Таким образом, в одном варианте осуществления настоящее изобретение относится к применению связывающей молекулы, антитела или связывающего фрагмента по настоящему изобретению или связывающей молекулы, имеющей по существу такую же специфичность связывания, как и любой из них, полинуклеотида, вектора или клетки по настоящему изобретению для получения фармацевтической или диагностической композиции для лечения или профилактики прогрессирования болезни Альцгеймера или родственных таупатий; для смягчения симптомов, ассоциированных с болезнью Альцгеймера или родственными таупатиями; для диагностики или скрининга индивидуума в отношении наличия болезни Альцгеймера или родственных таупатий и для определения риска развития у индивидуума болезни Альцгеймера или родственных таупатий.
Пептиды для диагностики, активной иммунизации и терапии AD
Настоящее изобретение основано частично на открытии, что определенные фрагменты белка тау являются активными в отношении индукции иммунного ответа на патологический белок тау при инъецировании в моделях AD на крысах, и можно ожидать, что они будут активными подобным образом у человека. Было выявлено, что эти иммуногенные фрагменты белка тау, которые содержат одну или несколько из областей белка тау, идентифицированных, как описано выше с помощью DC8E8, в качестве ускорителей или по меньшей мере участников развития и прогрессирования AD, способны (i) ускорять выведение внеклеточных отложений белка тау в головном мозге при AD (модели на крысах); (ii) индуцировать продукцию защитных антител против AD в модели на животных; и/или (iii) замедлять прогрессирование AD у реципиентных индивидуумов, при измерении с помощью одного или нескольких биохимических и неврологических анализов, в модели на животных. Они также могут прямо физически препятствовать способности белка тау осуществлять патологические взаимодействия тау-тау вдоль этих областей.
Изобретение относится к иммуногенам или иммуногенным пептидам, происходящим из вновь идентифицированных областей белка тау, которые являются важными для образования центральной части PHF и стимулируют сборку PHF in vitro. Стратегическое нацеливание на эти области ("терапевтические эпитопы") может обеспечить успешное лечение AD и родственных таупатий. Иммуногены можно подвергать скринингу в отношении терапевтической эффективности в модели на животных, такой как модели на трансгенных крысах, описанные ниже.
В одном варианте осуществления настоящего изобретения тау-пептиды, например, охватывают одну из следующих аминокислотных последовательностей, в каждой из которой по отдельности содержится каждый из четырех терапевтических эпитопов: a) SEQ ID NO: 98, тау 267-KHQPGGG-273, b) SEQ ID NO: 99, тау 298-KHVPGGG-304, c) SEQ ID NO: 100, тау 329-HHKPGGG-335, и d) SEQ ID NO: 101, тау 361-THVPGGG-367 (нумерация согласно наиболее длинной изоформе белка тау человека 2N4R длиной 441 остатка, см. SEQ ID NO: 102). В другом варианте осуществления тау-пептиды содержат по меньшей мере один терапевтический эпитоп, где терапевтический эпитоп выбран из тау 268-HQPGGG-273 SEQ ID NO: 223, тау 299-HVPGGG-304 SEQ ID NO: 154, тау 330-HKPGGG-335 SEQ ID NO: 224 и тау 362-HVPGGG-367 SEQ ID NO: 154.
Изобретение относится к иммуногенам длиной 30 аминокислот, таким как любая из SEQ ID NO, представленных в таблице 1. Каждый из иммуногенов, включенных в таблицу 1, представляет собой обособленный фрагмент белка тау, который содержит один из терапевтических эпитопов, расположенных в SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100 и SEQ ID NO: 101.






В некоторых вариантах осуществления иммуногенный пептид выбран из SEQ ID NO: 1, тау 251-PDLKNVKSKIGSTENLKHQPGGGKVQIINK-280; SEQ ID NO: 2, тау 256-VKSKIGSTENLKHQPGGGKVQIINKKLDLS-285; SEQ ID NO: 3, тау 259-KIGSTENLKHQPGGGKVQIINKKLDLSNVQ-288; и SEQ ID NO: 4, тау 275-VQIINKKLDLSNVQSKCGSKDNIKHVPGGG-304.
Изобретение также относится к более коротким и более длинным иммуногенным пептидам для применения в рамках настоящего изобретения, которые содержат одну или несколько из аминокислотных последовательностей SEQ ID NO: 98 267-KHQPGGG-273, или аминокислот SEQ ID NO: 99 298-KHVPGGG-304, или аминокислот SEQ ID NO: 100 329-HHKPGGG-335, или аминокислот SEQ ID NO: 101 361-THVPGGG-367, которые могут происходить из любой из шести изоформ белка тау человека. В одном варианте осуществления иммуногенный пептид содержит по меньшей мере один терапевтический эпитоп, где терапевтический эпитоп выбран из тау 268-HQPGGG-273 SEQ ID NO: 223, тау 299-HVPGGG-304 SEQ ID NO: 154, тау 330-HKPGGG-335 SEQ ID NO: 224 и тау 362-HVPGGG-367 SEQ ID NO: 154. В одном варианте осуществления иммуногенный пептид содержит последовательность, выбранную из SEQ ID NO: 109, тау 314-DLSKVTSKCGSLGNIHHKPGGGQVEVKSE-342; SEQ ID NO: 110, тау 352-SKIGSLDNITHVPGGGNKKIETHKLTFREN-380; SEQ ID NO: 111, тау 325-LGNIHHKPGGGQ-336; SEQ ID NO: 112, тау 357-LDNITHVPGGGN-368; SEQ ID NO: 108, тау 294-305 KDNIKHVPGGGS. В некоторых вариантах осуществления по меньшей мере один иммуногенный пептид выбран из любой из SEQ ID NO: 1-4, SEQ ID NO: 9-101 и SEQ ID NO: 108-112, NIKAVPGGGS (SEQ ID NO: 200), NIKHVPGGGS (SEQ ID NO: 201), IKHVPGGGS (SEQ ID NO: 202), KHVPGGGSV (SEQ ID NO: 203), HVPGGGSVQ (SEQ ID NO: 204), VPGGGSVQ (SEQ ID NO: 205), GWSIHSPGGGSC (SEQ ID NO: 250) и SVFQHLPGGGSC (SEQ ID NO: 251), ANIKHVPGGGS (SEQ ID NO: 144), DAIKHVPGGGS (SEQ ID NO: 146), DNAKHVPGGGS (SEQ ID NO: 149), DNIAHVPGGGS (SEQ ID NO: 151), DNIKAVPGGGS (SEQ ID NO: 159), DNIKHAPGGGS (SEQ ID NO: 161) и DNIKHVPGGGS (SEQ ID NO: 171).
Аминокислотные последовательности, соответствующие изоформам белка тау человека, приведены в SEQ ID NO: 102-107
SEQ ID NO: 102 (2N4R):
MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKSTP TAEDVTAPLV DEGAPGKQAA AQPHTEIPEG TTAEEAGIGD TPSLEDEAAG HVTQARMVSK SKDGTGSDDK KAKGADGKTK IATPRGAAPP GQKGQANATR IPAKTPPAPK TPPSSGEPPK SGDRSGYSSP GSPGTPGSRS RTPSLPTPPT REPKKVAWR TPPKSPSSAK SRLQTAPVPM PDLKNVKSKI GSTENLKHQP GGGKVQIINK KLDLSNVQSK CGSKDNIKHV PGGGSVQIVY KPVDLSKVTS KCGSLGNIHH KPGGGQVEVK SEKLDFKDRV QSKIGSLDNI THVPGGGNKK IETHKLTFRE NAKAKTDHGA EIVYKSPVVS GDTSPRHLSN VSSTGSIDMV DSPQLATLAD EVSASLAKQG L
SEQ ID NO: 103 (1N4R):
MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKSTP TAEAEEAGIG DTPSLEDEAA GHVTQARMVS KSKDGTGSDD KKAKGADGKT KIATPRGAAP PGQKGQANAT RIPAKTPPAP KTPPSSGEPP KSGDRSGYSS PGSPGTPGSR SRTPSLPTPP TREPKKVAVV RTPPKSPSSA KSRLQTAPVP MPDLKNVKSK IGSTENLKHQ PGGGKVQIIN KKLDLSNVQS KCGSKDNIKH VPGGGSVQIV YKPVDLSKVT SKCGSLGNIH HKPGGGQVEV KSEKLDFKDR VQSKIGSLDN ITHVPGGGNK KIETHKLTFR ENAKAKTDHG AEIVYKSPW SGDTSPRHLS NVSSTGSIDM VDSPQLATLA DEVSASLAKQ GL
SEQ ID NO: 104 (2N3R):
MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKSTP TAEDVTAPLV DEGAPGKQAA AQPHTEIPEG TTAEEAGIGD TPSLEDEAAG HVTQARMVSK SKDGTGSDDK KAKGADGKTK IATPRGAAPP GQKGQANATR IPAKTPPAPK TPPSSGEPPK SGDRSGYSSP GSPGTPGSRS RTPSLPTPPT REPKKVAWR TPPKSPSSAK SRLQTAPVPM PDLKNVKSKI GSTENLKHQP GGGKVQIVYK PVDLSKVTSK CGSLGNIHHK PGGGQVEVKS EKLDFKDRVQ SKIGSLDNIT HVPGGGNKKI ETHKLTFREN AKAKTDHGAE IVYKSPWSG DTSPRHLSNV SSTGSIDMVD SPQLATLADE VSASLAKQGL
SEQ ID NO: 105 (0N4R):
MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKAEEAGI GDTPSLEDEA AGHVTQARMV SKSKDGTGSD DKKAKGADGK TKIATPRGAA PPGQKGQANA TRIPAKTPPA PKTPPSSGEP PKSGDRSGYS SPGSPGTPGS RSRTPSLPTP PTREPKKVAV VRTPPKSPSS AKSRLQTAPV PMPDLKNVKS KIGSTENLKH QPGGGKVQII NKKLDLSNVQ SKCGSKDNIK HVPGGGSVQI VYKPVDLSKV TSKCGSLGNI HHKPGGGQVE VKSEKLDFKD RVQSKIGSLD NITHVPGGGN KKIETHKLTF RENAKAKTDH GAEIVYKSPV VSGDTSPRHL SNVSSTGSID MVDSPQLATL ADEVSASLAK QGL
SEQ ID NO: 106 (1N3R):
MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKSTP TAEAEEAGIG DTPSLEDEAA GHVTQARMVS KSKDGTGSDD KKAKGADGKT KIATPRGAAP PGQKGQANAT RIPAKTPPAP KTPPSSGEPP KSGDRSGYSS PGSPGTPGSR SRTPSLPTPP TREPKKVAVV RTPPKSPSSA KSRLQTAPVP MPDLKNVKSK IGSTENLKHQ PGGGKVQIVY KPVDLSKVTS KCGSLGNIHH KPGGGQVEVK SEKLDFKDRV QSKIGSLDNI THVPGGGNKK IETHKLTFRE NAKAKTDHGA EIVYKSPVVS GDTSPRHLSN VSSTGSIDMV DSPQLATLAD EVSASLAKQG L
SEQ ID NO: 107 (0N3R):
MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKAEEAGI GDTPSLEDEA AGHVTQARMV SKSKDGTGSD DKKAKGADGK TKIATPRGAA PPGQKGQANA TRIPAKTPPA PKTPPSSGEP PKSGDRSGYS SPGSPGTPGS RSRTPSLPTP PTREPKKVAV VRTPPKSPSS AKSRLQTAPV PMPDLKNVKS KIGSTENLKH QPGGGKVQIV YKPVDLSKVT SKCGSLGNIH HKPGGGQVEV KSEKLDFKDR VQSKIGSLDN ITHVPGGGNK KIETHKLTFR ENAKAKTDHG AEIVYKSPW SGDTSPRHLS NVSSTGSIDM VDSPQLATLA DEVSASLAKQ GL
Применение вакцин на основе пептидов для индукции иммунного ответа при заболеваниях, против которых еще не доступны общепринятые вакцины, является перспективным (Brown, 1994; BenYedidia, et al., 1997). Однако во многих случаях небольшие пептиды являются плохими иммуногенами, поскольку они действуют в качестве гаптенов, которые лишены необходимых эпитопов Th-клеток и/или которые захватываются антигенпредставляющими клетками (APC) с низкой эффективностью. В одном варианте осуществления настоящего изобретения иммуногенные эпитопы могут быть более длинными полипептидами, которые включают защитный эпитоп тау-пептида, или аналог вместе с другими аминокислотами.
Некоторые из средств, описанных в настоящем описании для индукции иммунного ответа, содержат подходящий эпитоп для индукции иммунного ответа против патологического белка тау и отложений тау, но являются слишком малыми, чтобы быть иммуногенными. В этом случае, пептидный иммуноген может быть связан с подходящим носителем, помогающим индуцировать иммунный ответ. В определенных вариантах осуществления подходящие носители включают сывороточные альбумины, гемоцианин лимфы улитки, молекулы иммуноглобулинов, тиреоглобулин, овальбумин, столбнячный токсоид, или токсоид из других патогенных бактерий, такой как дифтерийный, E. coli, холерный или H. pylori, или ослабленное производное токсина. Другие носители для стимуляции или усиления иммунного ответа включают цитокины, такие как IL-1, пептиды IL-1α и β, IL-2, γINF, IL-10, GM-CSF и хемокины, такие как MIP1α и β и RANTES. Иммуногенные агенты также могут быть связаны с пептидами, которые усиливают транспорт через ткани, как описано в O'Mahony, WO 97/17613 и WO 97/17614.
Иммуногенные агенты могут быть связаны с носителем путем химического сшивания. Способы связывания иммуногена с носителем включают образование дисульфидных связей с использованием N-сукцинимидил-3-(2-пиридилтио)пропионата (SPDP) и сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (SMCC) (если пептид лишен сульфгидрильной группы, это может быть обеспечено присоединением остатка цистеина). Эти реагенты создают дисульфидную связь между ними самими и остатками цистеина в пептиде на одном белке и амидную связь через эпсилон-аминогруппу на лизине или другую свободную аминогруппу в других аминокислотах. Множество таких образующих дисульфид/амид агентов описано в Immun. Rev. 62, 185 (1982). Другие бифункциональные связывающие агенты образуют тиоэфирную, а не дисульфидную связь. Многие из этих тиоэфир-образующих агентов являются коммерчески доступными и включают реакционноспособные сложные эфиры 6-малеимидокапроевой кислоты, 2-бромуксусной кислоты и 2-йодуксусной кислоты, 4-(N-малеимидометил)циклогексан-1-карбоновой кислоты. Карбоксильные группы могут быть активированы путем комбинирования их с сукцинимидом или 1-гидроксил-2-нитро-4-сульфоновой кислотой, соль натрия.
Иммуногенные пептиды также могут экспрессироваться в качестве слитых белков с носителями. Иммуногенный пептид может быть связан с носителем на N-конце, С-конце или в участке где-либо в пептиде (внутренне). В некоторых вариантах осуществления в слитом белке может присутствовать множество повторов иммуногенного пептида.
Например, также предусматриваются иммуногены, которые включают слитые белки, содержащие тау-пептид, содержащий защитный B-клеточный эпитоп, связанный со случайным неприродным общим по DR эпитопом Th-клеток, который индуцирует B-клеточный ответ против защитного эпитопа. В следующей альтернативе изобретение относится к иммуногенам, которые могут быть сконструированы в качестве полимеров (Jackson et al., 1997), множественных систем антигенных пептидов (MAP) (Tarn and Recent, 1996), иммуностимулирующих комплексов (ISCOM) (Barr, I. G. and Mitchell, 1996) и, возможно, других разветвленных амфотерных полипептидов (Wilkinson et al., 1998), или химерных пептидов, получаемых путем колинеаризации эпитопов (Marussig et al., 1997).
В определенных вариантах осуществления терапевтические пептиды можно использовать отдельно или в комбинации, связанными или не связанными с фармацевтически приемлемым носителем, включая KLH, столбнячный токсоид, связывающий альбумин белок, бычий сывороточный альбумин, дендример (MAP; Biol. Chem. 358: 581), а также адъювантными веществами или их комбинациями, описанными, например, в O'Hagan et al. (2003) (в частности, эндогенные иммуностимулирующие соединения и системы распределения, описанные в настоящем описании) и в Wilson-Welderer et al. (2009) (в частности, с теми из них, которые представлены в таблице 2 и 3 указанного документа) или их смесями.
В определенных вариантах осуществления иммуногенный агент по настоящему изобретению может быть связан или присоединен к подходящему носителю химическим сшиванием для усиления иммунного ответа против патологического белка тау, в том числе отложений белка тау. В определенных вариантах осуществления связанный или присоединенный фармацевтически приемлемый носитель представляет собой гемоцианин лимфы улитки (KLH), столбнячный токсоид, бычий сывороточный альбумин (BSA), молекулу иммуноглобулина (Ig), тиреоглобулин или овоглобулин. Другие носители для стимуляции иммунного ответа включают цитокины (такие как IL-1, IL-2, IL-10, IFNγ, GM-CSF) и хемокины (такие как MIP1α и β).
Пептиды или аналоги белка тау можно синтезировать с помощью твердофазного синтеза пептидов или рекомбинантной экспрессии, или их можно получать из природных источников. Автоматические устройства для синтеза пептидов являются коммерчески доступными от многочисленных поставщиков, таких как Applied Biosystems, EZBiolab или Antagene. Рекомбинантные экспрессирующие системы включают бактерии, такие как E. coli, дрожжи, клетки насекомых или клетки млекопитающих. Методики для манипулирования ДНК и получения конструкций ДНК для рекомбинантной экспрессии описаны Sambrook et al. (1989), способы получения рекомбинантных белков подробно описаны в Current Protocols in Protein Science (глава 5 "Production of Recombinant Proteins", UNITS 5.1-5.24, DOI: 10.1002/0471 140864, также доступна на onlinelibrary.wiley.com/book/10.1002/0471 140864/toc).
Иммуногенные агенты по настоящему изобретению могут экспрессироваться вирусом или бактерией в качестве вектора или носителя. Нуклеиновую кислоту, кодирующую иммуногенный пептид, встраивают в геном или эписому вируса или бактерии. В итоге, иммуногенные пептиды могут экспрессироваться в качестве секретируемого белка или в качестве слитого белка с белком наружной поверхности вируса, или они могут экспонироваться в качестве трансмембранного белка бактерий. Вирусы или бактерии, используемые в таких способах, обычно являются непатогенными или ослабленными. Подходящие вирусы включают аденовирус, HSV, вирус венесуэльского энцефалита лошадей и другие альфа-вирусы, вирус везикулярного стоматита и другие рабдовирусы, вирусы осповакцины и оспы птиц. Подходящие бактерии включают Salmonella и Shigella. Альтернативно является пригодным слияние иммуногенного пептида с HBsAg HBV.
Следующий аспект настоящего изобретения относится к лекарственному средству или иммуногену, которые также могут быть аналогами различных пептидов, описанных в различных вариантах осуществления (например, SEQ ID NO: 1-4; 9-97), или их фрагментами.
Настоящее изобретение также основано на открытии новых пептидов, обозначаемых в настоящей заявке как сконструированные терапевтические эпитопы. Несмотря на наличие первичной последовательности, которая отличается от первичной последовательности белка тау и фрагментов белка тау, настоящее изобретение относится к сконструированным терапевтическим эпитопам, которые способны иметь форму (например, внутренне неупорядоченная структура, третичная структура, конформация), которая имитирует этот один или несколько из "терапевтических эпитопов" белка тау, описанных выше. Путем имитации одной или нескольких из этих областей, эти сконструированные терапевтические эпитопы могут быть пригодны для получения антител против них, таких как антитела, которые конкурируют с DC8E8. Эти пептиды способны конкурировать с белком тау или фрагментами белка тау за связывание с антителом DC8E8, описанным выше.
Также включены иммуногенные сконструированные терапевтические эпитопы, способные индуцировать иммунный ответ на патологический белок тау при инъецировании в моделях AD на крысах и которые, как можно ожидать, будут осуществлять то же самое у человека. Кроме того, также описаны антитела/антисыворотки мыши, продуцируемые в ответ на иммунизацию одним или несколькими сконструированными терапевтическими эпитопами, и способные (i) распознавать один или несколько эпитопов, которые представляют собой или имитируют эпитопы DC8E8; (ii) различать патологический белок тау и нормальный белок тау; и/или (iii) распознавать нейрофибриллярные очаги в головном мозге человека при AD и/или в моделях AD на трансгенных крысах.
Изобретение также относится к композициям для предупреждения, лечения и/или диагностики болезни Альцгеймера, где композиция содержит (i) средство для лечения болезни Альцгеймера у индивидуума путем ингибирования агрегации тау-тау; и (2) фармацевтически приемлемый носитель и/или разбавитель. Изобретение также относится к композициям для предупреждения, лечения и/или диагностики болезни Альцгеймера, где композиция содержит (i) средство для лечения болезни Альцгеймера у индивидуума путем связывания с одним или несколькими "терапевтическим эпитопами" в патологическом белке тау; и (2) фармацевтически приемлемый носитель и/или разбавители. Изобретение также относится к композициям для предупреждения, лечения и/или диагностики болезни Альцгеймера, где композиция содержит (i) средство для снижения агрегации тау-тау путем связывания с одним или несколькими "терапевтическими эпитопами" в патологическом белке тау; и (2) фармацевтически приемлемый носитель и/или разбавители.
Составы
Средства по изобретению можно вводить в качестве фармацевтических составов, содержащих лекарственное средство (например, антитело или пептид, как описано выше), и один или несколько других фармацевтически приемлемых компонентов. См. Remington's Pharmaceutical Science (15th ed., Mack Publishing Company, Easton, Pa., 1980). Эти составы включают, например, порошки, пасты, мази, желе, воски, масла, липиды, содержащие липиды (катионные или анионные) везикулы (такие как LIPOFECTIN), конъюгаты ДНК, безводные абсорбционные пасты, эмульсии типа "масло-в-воде" и "вода-в-масле", эмульсии карбовакс (полиэтиленгликоли с различными молекулярными массами), полутвердые гели и полутвердые смеси, содержащие карбовакс. Любая из указанных выше смесей может быть пригодна для способов лечения и терапии в соответствии с настоящим изобретением при условии, что активный ингредиент в составе не инактивируется составом и состав является физиологически совместимым и переносимым при данном пути введения. См. также Baldrick P. "Pharmaceutical excipient development: the need for preclinical guidance". Regul. Toxicol. Pharmacol. 32(2):210-8 (2000), Wang W. "Lyophilization and development of solid protein pharmaceuticals". Int. J. Pharm. 203(1-2): 1-60 (2000), Charman W N "Lipids, lipophilic drugs, and oral drug delivery-some emerging concepts". J. Pharm Sci. 89(8):967-78 (2000), Powell et al. "Compendium of excipients for parenteral formulations". PDA J Pharm Sci Technol. 52:238-31 1 (1998) и цитаты в них, для дополнительной информации, касающейся составов, эксципиентов и носителей, известных фармацевтическим химикам.
Широкое множество фармацевтически приемлемых эксципиентов известно в данной области и не нуждается в детальном обсуждении в настоящем описании. Фармацевтически приемлемые эксципиенты исчерпывающе описаны в различных публикациях, включающих, например, A. Gennaro (2000) "Remington: The Science and Practice of Pharmacy", 20th edition, Lippincott, Williams, & Wilkins; Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H. C. Ansel et al., eds., 7.sup.th ed., Lippincott, Williams, & Wilkins; и Handbook of Pharmaceutical Excipients (2000) A. H. Kibbe et al., eds., 3 ed. Amer. Pharmaceutical Assoc.
Выбранный состав зависит от предполагаемого пути введения и терапевтического применения. Составы также могут включать фармацевтически приемлемые нетоксичные носители или разбавители, которые определяют как носители, широко используемые для составления фармацевтических композиций для введения животному или человеку. Разбавитель выбирают так, чтобы он не влиял на биологическую активность комбинации. Примерами таких разбавителей являются дистиллированная вода, физиологический фосфатно-солевой буфер, растворы Рингера, раствор декстрозы и раствор Хенкса. Фармацевтическая композиция или состав также могут включать другие носители, адъюванты или нетоксичные, нетерапевтические, неиммуногенные стабилизаторы и т.п. Однако, некоторые реагенты, пригодные для введения животным, такие как полный адъювант Фрейнда, как правило, не включают в композиции для применения у человека.
Примеры подходящих фармацевтических носителей известны в данной области и включают фосфатно-солевые буферы, воду, эмульсии, такие как эмульсии масло/вода, различные типы смачивающих веществ, стерильные растворы и т.д. Композиции, содержащие такие носители, можно составлять известными общепринятыми способами. Более подробно носители описаны ниже.
Адъюванты
Терапевтические средства, иммуногены, по изобретению можно вводить в комбинации с адъювантами, т.е. веществами, которые сами по себе не вызывают адаптивный иммунный ответ, но усиливают или модулируют ответ на сопутствующий антиген. В комбинации с терапевтическими пептидами и антителами по настоящему изобретению можно использовать различные адъюванты, для индукции иммунного ответа. Предпочтительный адъювант(ы) усиливает естественный ответ на иммуноген, не вызывая конформационные изменения иммуногена, которые повлияли бы на качественную форму ответа.
В определенных вариантах осуществления адъювант представляет собой соль алюминия (квасцы), такую как гидроксид алюминия, фосфат алюминия и сульфат алюминия (Hunter, 2002). Такие адъюванты можно использовать с другими конкретными иммуностимулирующими средствами, такими как 3 де-O-ацилированный монофосфориллипид A (MPL) или 3-DMP, полимерные или мономерные аминокислоты, такие как полиглутаминовая кислота или полилизин, или без них. Такие адъюванты можно использовать с другими конкретными иммуностимулирующими средствами, такими как мурамилпептиды (например, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (MTP-PE), N-ацетилглюкозаминил-N-ацетилмурамил-L-Al-D-изо-glu-L-Ala-дипальмитоксипропиламид (DTP-DPP) theramideTM), или другие компоненты клеточной стенки бактерий, или без них. Другие адъюванты представляют собой эмульсии типа "масло-в-воде" и включают (a) MF59 (WO 90/14837, Van Nest et al., которая включена в настоящее описание в качестве ссылки в полном объеме), содержащий 5% сквален, 0,5% Tween 80 и 0,5% Span 85 (необязательно содержащий различные количества MTP-PE), составленный в виде субмикронных частиц с использованием микрофлуидизатора, такого как микрофлуидизатор Model 110Y (Microfluidics, Newton Mass.), (b) SAF, содержащий 10% сквален, 0,4% Tween 80, 5% pluronic-блокированный полимер L121, и thr-MDP, либо микрофлуидизированный в субмикронную эмульсию, либо перемешанный встряхиванием для получения эмульсии с более крупным размером частиц, и (c) адъювантную систему Ribi.TM. (RAS), (Ribi InunoChem, Hamilton, Mont.), содержащую 2% сквален, 0,2% Tween 80, и один или несколько компонентов клеточной стенки бактерий из группы, состоящей из монофосфориллипида A (MPL), димиколата трегалозы (TDM) и скелета клеточной стенки (CWS), например MPL+CWS (Detox.TM.). В некоторых вариантах осуществления адъювант представляет собой сапонин, такой как StimulonTM (QS21, Aquila, Worcester, Mass.) или частицы, сформированные из него, такие как ISCOM (иммуностимулирующие комплексы) и ISCOMATRIX. Другие адъюванты включают полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA), цитокины, такие как интерлейкины (IL-1, IL-2 и IL-12), макрофагальный колониестимулирующий фактор (M-CSF) и фактор некроза опухоли (TNF).
Альтернативно тау-пептиды и их иммуногенные аналоги можно связывать с адъювантом. Например, липопептидную версию тау-пептида "A" можно получать путем присоединения пальмитиновой кислоты или других липидов непосредственно к N-концу "A", как описано для вакцинации антигеном гепатита B (Livingston, J. Immunol. 159, 1383-1392 (1997)). Однако такое присоединение по существу не должно изменять конформацию тау-пептида "A" настолько, чтобы повлиять на природу иммунного ответа на него.
Адъювант можно вводить с иммуногеном в качестве единой композиции, или его можно вводить до, одновременно или после введения иммуногена. Иммуноген и адъювант могут быть упакованы и предоставлены в одной и той же емкости или они могут быть упакованы в отдельные емкости и их смешивают перед применением. Иммуноген и адъювант, как правило, упакованы с ярлыком, на котором указано предполагаемое терапевтическое применение. Если иммуноген и адъювант упакованы по отдельности, упаковка, как правило, включает инструкции по смешению перед применением. Выбор адъюванта и/или носителя зависит от стабильности иммуногенного состава, содержащего адъювант, пути введения, схемы дозирования, эффективности адъюванта для вида, подвергаемого вакцинации, и, у человека, фармацевтически приемлемый адъювант представляет собой адъювант, который одобрен или может быть одобрен для введения у человека соответствующими контролирующими органами. Например, полный адъювант Фрейнда не пригоден для введения у человека. Однако, для введения у человека пригодны квасцы, MPL или неполный адъювант Фрейнда (Chang et al., Advanced Drug Delivery Reviews 32:173-186 (1998), которая включена в настоящее описание в качестве ссылки в полном объеме) отдельно или необязательно в комбинации с любыми из квасцов, QS21 и MPL и все их комбинации.
Фармацевтические композиции также могут включать крупные медленно метаболизируемые макромолекулы, такие как белки, полисахариды, такие как хитозан, полимолочные кислоты, полигликолевые кислоты и сополимеры (например, функционализированная латексом сефароза, агароза, целлюлоза, и т.п.), полимерные аминокислоты, сополимеры аминокислот и агрегаты липидов (например, масляные капли или липосомы). Кроме того, эти носители могут выполнять функцию иммуностимулирующих средств (т.е. адъювантов).
Комбинации
Изобретение относится к композициям и способам для лечения, которые сочетают в себе антитела и пептиды, описанные в настоящем описании, с другими способами лечения AD и родственных таупатий. Например, в настоящее время связанные с тау терапевтические стратегии, главным образом, сфокусированы на лекарственных средствах, которые ингибируют киназы белка тау или активируют фосфатазы (Iqbal and Grundke-lqbal, 2004, 2005, 2007; Noble et al. 2005), лекарственных средствах, которые стабилизируют микротрубочки (Zhang et al. 2005), лекарственных средствах, которые способствуют протеолитичесвкой деградации неправильно свернутого белка тау (Dickey et al. 2005; Dickey and Petrucelli, 2006; Dickey et al. 2006), соединениях, которые препятствуют или обращают вспять агрегацию белка тау (Wischik et al. 1996; Pickhardt et al. 2005; Taniguchi et al. 2005; Necula et al. 2005; Larbig et al. 2007) или опосредуемом вакциной выведении агрегированного белка тау (Asuni et al. 2007). Таким образом, изобретение относится к тому, что множественное нацеливание (например, нацеливание как на белок тау, так и на бета-амилоид) может существенно увеличить эффективность лечения.
В случае болезни Альцгеймера и родственных таупатий, при которых патологический растворимый белок тау и нерастворимый белок тау (отложения тау) появляются в головном мозге, средство по изобретению также можно вводить вместе с другими средствами, которые увеличивают прохождение средств по изобретению через гематоэнцефалический барьер.
Способы введения
Средства для индукции иммунного ответа (пассивного или активного), для снижения уровня белка тау или для любых из способов предупреждения, лечения или диагностики (in vivo), описанных в настоящем описании, можно вводить парентеральным, местным, внутрикожным, внутривенным, пероральным, подкожным, внутрибрюшинным, интраназальным или внутримышечным путем для профилактического и/или терапевтического лечения. Типичным путем введения является подкожный путь, хотя другие пути могут быть равноэффективными. Другим типичным путем является внутримышечная инъекция. Этот тип инъекции, наиболее часто, выполняют в мышцы предплечья или бедра. Внутривенные инъекции, так же как и внутрибрюшинные инъекции, внутриартериальные, внутричерепные или внутрикожные инъекции, также являются эффективными в отношении индукции иммунного ответа. В некоторых способах средства инъецируют прямо в конкретную ткань, где скопились отложения.
Аэрозольные составы, такие как составы назального спрея, включают очищенные водные или другие растворы активного вещества с консервантами и изотоническими средствами. Такие составы, например, доведены до pH и изотонического состояния, совместимых со слизистыми оболочками носа. Составы для ректального или вагинального введения могут быть предоставлены в качестве суппозитория с подходящим носителем.
Для парентерального введения терапевтические пептиды по настоящему изобретению можно вводить в качестве инъецируемых дозировок раствора или суспензии вещества в физиологически приемлемом разбавителе с фармацевтическим носителем, который может представлять собой стерильную жидкость, такую как вода, масло, солевой раствор, глицерин или этанол. Кроме того, в композициях могут присутствовать вспомогательные вещества, такие как смачивающие вещества или эмульгаторы, поверхностно-активные вещества, pH-буферные вещества и т.п. Другие компоненты фармацевтических композиций представляют собой компоненты нефтяного, животного, растительного или синтетического происхождения. Все из арахисового масла, соевого масла и минерального масла являются примерами пригодных материалов. Как правило, гликоли, такие как пропиленгликоль или полиэтиленгликоль, являются предпочтительными жидкими носителями, в частности, для инъецируемых растворов. Средства по изобретению также можно вводить в форме депо-инъекции или имплантируемого препарата, который может быть составлен таким образом, чтобы обеспечить замедленное высвобождение активного ингредиента. Иллюстративная композиция содержит моноклональное антитело в количестве 5 мг/мл, составленное в водном буфере, состоящим из 50 мМ L-гистидина, 150 мМ NaCl, доведенном до pH 6,0 с помощью HCl.
Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевой раствор и буферные среды. Парентеральные носители включают раствор хлорида натрия, раствор декстрозы Рингера, раствор декстрозы и хлорида натрия, лактированный раствор Рингера или жирные масла. Внутривенные носители включают средства, восполняющие жидкость и питательные вещества, средства, восполняющие электролиты (такие как средства на основе раствора декстрозы Рингера), и т.п. Также могут присутствовать консерванты и другие добавки, например, такие как противомикробные средства, антиоксиданты, хелатирующие агенты и инертные газы и т.п.
Как правило, композиции получают в качестве инъецируемых препаратов, либо в качестве жидких растворов, либо в качестве суспензий; также можно получать твердые формы, пригодные для растворения или суспендирования в жидких носителях перед инъекцией. Препарат также может быть эмульгирован или инкапсулирован в липосомы или микрочастицы, такие как на основе полилактида, полигликолида или сополимера для усиления адъювантного эффекта, как рассмотрено выше (см. Langer, Science 249, 1527 (1990) и Hanes, Advanced Drug Delivery Reviews 28, 97-119 (1997). Средства по настоящему изобретению можно вводить в форме депо-инъекции и имплантируемого препарата, которые могут быть составлены так, чтобы обеспечить непрерывное или импульсное высвобождение активного ингредиента.
Дополнительные составы, пригодные для других путей введения, включают пероральные, интраназальные и легочные составы, суппозитории и составы для чрескожного применения.
Для суппозиториев связующие вещества и носители включают, например, полиалкиленгликоли или триглицериды; такие суппозитории могут быть образованы из смесей, содержащих активный ингредиент в диапазоне от 0,5% до 10%, например 1%-2%. Пероральные составы включают эксципиенты, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза и карбонат магния фармацевтической категории. Эти композиции имеют форму растворов, суспензий, таблеток, пилюль, капсул, составов с замедленным высвобождением или порошков и содержат 10%-95% активного ингредиента, например 25%-70%.
Местное применение может обеспечить чрескожную или внутрикожную доставку. Местному введению может способствовать совместное введение средства с холерным токсином или его детоксифицировавнными производными или субъединицами, или другими сходными бактериальными токсинами (См. Glenn et al., Nature 391, 851 (1998)). Совместного введения можно достигать с использованием компонентов в качестве смеси или в качестве связанных молекул, полученных путем химического сшивания или экспрессии в качестве слитого белка.
Альтернативно чрескожную доставку можно обеспечивать с использованием трансдермальнного пластыря или с использованием трансферосом (Paul et al., Eur. J. Immunol. 25, 3521-24 (1995); Cevc et al., Biochem. Biophys. Acta 1368, 201-15 (1998)). Подкожное введение рассматриваемого антитела, пептида или соединения осуществляют с использованием стандартных способов и устройств, например, иглы и шприца, системы подкожной доставки через отверстие для инъекции, и т.п. Внутримышечное введение осуществляют с помощью стандартных средств, например, иглы и шприца, системы для непрерывной доставки и т.д. В некоторых вариантах осуществления рассматриваемое антитело, пептид и/или соединение доставляют с помощью системы для непрерывной доставки. Термин "система для непрерывной доставки" используют в настоящем описании взаимозаменяемо с термином "система для контролируемой доставки", и он охватывает медицинские устройства (например, насосы) для непрерывной (например, контролируемой) доставки в комбинации с катетерами, устройствами для инъекций и т.п., широкое множество которых известно в данной области. Также для применения в рамках настоящего изобретения могут быть пригодны механические или электромеханические инфузионные насосы. Примеры таких устройств включают устройства, описанные, например, в патентах США № 4692147; 4360019; 4487603; 4360019; 4725852; 5820589; 5643207; 6198966; и т.п. Как правило, способы доставки лекарственных средств по настоящему изобретению можно выполнять с использованием любых из множества заправляемых насосных систем. Насосы обеспечивают постоянное контролируемое высвобождение с течением времени.
Средства также можно вводить с помощью стандартной в настоящее время методики просверливания небольшого отверстия в черепе для введения лекарственного средства. В предпочтительном аспекте связывающая молекула, особенно антитело или лекарственное средство на основе антитела по настоящему изобретению может проходить через гематоэнцефалический барьер, что позволяет осуществлять внутривенное или пероральное введение.
В фармацевтических дозированных формах средства (антитела, пептиды, соединения, предусматриваемые изобретением) можно вводить в форме их фармацевтически приемлемых солей, или их также можно использовать отдельно или в соответствующей ассоциации, а также в комбинации, с другими фармацевтически активными соединениями. Способы и эксципиенты, описанные в настоящем описании, являются только иллюстративными и никоим образом не ограничивающими. Рассматриваемое антитело, пептид или соединение можно составлять в виде препаратов для инъекции путем растворения, суспендирования или эмульгации их в водном или неводном растворителе, таком как растительные или другие сходные масла, синтетические алифатические кислые глицериды, сложные эфиры высших алифатических кислот или пропиленгликоля; и, если желательно, с общепринятыми добавками, такими как солюбилизаторы, изотонические средства, суспендирующие вещества, эмульгаторы, стабилизаторы и консерванты. Единичные дозированные формы для инъекции или внутривенного введения могут содержать активное вещество в композиции в качестве раствора в стерильной воде, нормальном солевом растворе или другом фармацевтически приемлемом носителе. Термин "единичная дозированная форма" или "доза", как используют в рамках изобретения, относится к физически дискретным единицам, пригодным в качестве единичных дозировок для человека и животных, причем каждая единица содержит заданное количество рассматриваемого антитела, вычисленное в количестве, достаточном для обеспечения желаемого эффекта, в ассоциации с фармацевтически приемлемым разбавителем, носителем или наполнителем. Характеристики единичных дозированных форм по настоящему изобретению зависят от конкретного используемого соединения и от эффекта, которого намереваются достигнуть, и фармакодинамики, ассоциированной с каждым соединением у хозяина.
Иммунные ответы против патологических белков тау и отложений тау также могут быть индуцированы путем введения нуклеиновых кислот, кодирующих терапевтические тау-пептиды. Такие нуклеиновые кислоты могут представлять собой ДНК или РНК. Сегмент нуклеиновой кислоты, кодирующий иммуноген, связан с регуляторными элементами, такими как промотор и энхансер, которые обеспечивают экспрессию такого сегмента ДНК в предполагаемых клетках-мишенях пациента. Обычно промоторные и энхансерные элементы из генов иммуноглобулинов (легкой или тяжелой цепи) или главный предранний промотор и энхансер CMV пригодны для направления экспрессии в клетках крови, которые являются желаемой мишенью для индукции иммунного ответа. Связанные регуляторные элементы и кодирующие последовательности часто клонируют в вектор.
Доступен ряд систем вирусных векторов, включая ретровирусные системы (см., например, Lawrie et al., Cur. Opin. Genet. Develop. 3:102-109 (1993), которая включена в настоящее описание в качестве ссылки в полном объеме); аденовирусные векторы (Bett et al., J. Virol. 67:5911 (1993), которая включена в настоящее описание в качестве ссылки в полном объеме); векторы на основе аденоассоциированного вируса (Zhou et al., J. Exp. Med. 179:1867 (1994), которая включена в настоящее описание в качестве ссылки в полном объеме), вирусные векторы из семейства покс-вирусов, включая вирус осповакцины и вирусы оспы птиц, вирусные векторы из рода альфа-вирусов, такие как векторы, происходящие из вируса Синдбис и вирус леса Семлики (Dubensky et al., J. Virol 70:508-519 (1996), которая включена в настоящее описание в качестве ссылки в полном объеме), вирус венесуэльского энцефалита лошадей (см. патент США № 5643576, Johnston et al., который включен в настоящее описание в качестве ссылки в полном объеме) и рабдовирусы, такие как вирус везикулярного стоматита (см. WO 96/34625, Rose, которая включена в настоящее описание в качестве ссылки в полном объеме) и вирусы папилломы (Ohe, et al., Human Gene Therapy 6:325-333 (1995); WO 94/12629, Woo et al.; и Xiao & Brandsma, Nucleic Acids. Res. 24:2630-2622 (1996), которые включены в настоящее описание в качестве ссылок в полном объеме).
ДНК, кодирующая иммуноген, или вектор, содержащий ее, могут быть заключены в липосомы. Подходящие липиды и родственные аналоги описаны в патентах США № 5208036, 5264618, 5279833 и 5283185. Векторы и ДНК, кодирующие иммуноген, также могут быть адсорбированы или связаны с носителями в форме частиц, примеры которых включают полиметилметакрилатные полимеры и полилактиды и сополимеры лактидов и гликолидов, см., например, McGee et al., J. Micro Encap. (1996).
Векторы для генной терапии или оголенную ДНК можно доставлять in vivo путем введения конкретному пациенту, как правило, путем системного введения (например, внутривенная, внутрибрюшинная, назальная, желудочная, внутрикожная, внутримышечная, подкожная или внутричерепная инфузия) или местного применения (см., например, патент США № 5399346). ДНК также можно вводить с использованием генной пушки (см. патент США № 6436709). В настоящей заявке ДНК, кодирующую иммуноген, преципитируют на поверхность микроскопических металлических гранул. Микроснаряды ускоряют с помощью ударной волны или расширяющегося газообразного гелия, и они проникают в ткани на глубину нескольких клеточных слоев (рассмотрено в Haynes et al., 1996). Например, являются пригодными устройство для доставки генов AccelTM, изготавливаемое Agacetus, Inc. (Middleton, WI) или генная пушка Helios, изготавливаемая Bio-Rad Laboratories, Inc. (Hercules, CA). Для терапевтических целей ДНК также можно доставлять путем электропорации (например, как описано в Trollet et al., 2008 и ссылкам в указанном источнике). Альтернативно оголенная ДНК может проходить через кожу в кровоток просто при точечном нанесении ДНК на кожу вместе с химическим или механическим раздражением (см. WO 95/05853) или путем татуирования (например, как описано van den Berg et al., 2009).
В другом варианте осуществления, ДНК или векторы, кодирующие иммуногены, можно доставлять в клетки ex vivo, такие как клетки, эксплантированные из конкретного пациента (например, лимфоциты, полученный путем аспирации материал костного мозга, биоптат ткани) или гемопоэтические стволовые клетки от универсального донора, с последующей реимплантацией клеток пациенту, например, после подтверждения экспрессии иммуногена, и обычно после селекции клеток, которые включили вектор.
Другим перспективным, хотя и более рискованным, подходом для лечения человека является трансфекция дендритных клеток (DC, путем прямой доставки ДНК или с использованием вирусных стратегий) для продукции самого антигена (Xing et al., 2005), таким образом, обеспечивая непрерывное предоставление неизмененного антигена, представляемого через MHC I.
Индивидуумы, подлежащие лечению
Индивидуумы, подлежащие лечению, включают индивидуумов, имеющих риск болезни Альцгеймера или родственных таупатий, но не имеющих симптомов, а также пациентов, уже имеющих симптомы. В случае болезни Альцгеймера, практически каждый имеет риск болезни Альцгеймера, если он или она живет достаточно долго. Таким образом, способы лечения или терапии по настоящему изобретению можно проводить даже профилактически у общей популяции без какой-либо оценки риска у конкретного пациента. Вакцины, описанные в настоящем патенте, могут быть особенно пригодными для индивидуумов, которые обладают известным генетическим риском болезни Альцгеймера. Такие индивидуумы включают индивидуумов, имеющих родственников, страдающих этим заболеванием, и индивидуумов, у которых риск определяется присутствием генетических или биохимических маркеров. Генетические маркеры риска семейной болезни Альцгеймера с ранним началом включают мутации в гене APP, генах пресенилина PS1 и PS2, и маркеры болезни Альцгеймера с поздним началом включают мутации в гене ApoE4 (недавно рассмотрено Bertram and Tanzi, 2008). Дополнительные факторы риска включают AD в семейном анамнезе, гиперхолестеринемию или атеросклероз.
Индивидуумов, в текущий момент страдающих болезнью Альцгеймера, можно распознать по характерной деменции, а также по наличию факторов риска, описанных выше. Кроме того, доступен ряд диагностических тестов для идентификации индивидуумов, которые имеют AD. Они включают количественное определение уровней общего белка тау, фосфо-тау и амилоида β(1-42) в CSF. Повышенные уровни белка тау и/или фосфо-тау и сниженные уровни амилоида β(1-42) указывают на наличие AD. Индивидуумы, страдающие болезнью Альцгеймера, также может быть диагностированы по MMSE, ADRDA или другим критериям.
У бессимптомных пациентов лечение может быть начато в любом возрасте (например, 10, 20, 30). Однако, может не быть необходимым начало лечения до тех пор, пока пациент не достигнет 40, 50, 60 или 70. Лечение может вовлекать множество дозировок в течение некоторого периода времени. Мониторинг лечения можно проводить путем оценки ответов антитела или активированных T-клеток или B-клеток на лекарственное средство (например, тау-пептид) с течением времени. Если ответ снижается, показана вспомогательная дозировка. В случае потенциальных пациентов с синдромом Дауна, которые имеют более высокий риск AD или родственных таупатий, лечение можно начинать внутриутробно, путем введения лекарственного средства матери, или вскоре после рождения.
В некоторых вариантах осуществления DC8E8 (или его химерное, гуманизированное, человеческое или другое производное/часть/фрагмент) представляет собой антитело или пассивную вакцину, предназначенную для применения у пожилых пациентов с болезнью Альцгеймера (AD) со стареющей иммунной системой, которые демонстрируют значительное снижение уровней костимулирующей молекулы CD28 на T-клетках. Снижение уровня костимулирующей молекулы CD28 указывает на ослабление иммунного ответа (Saurwein-Teissl et al., 2002). Клоны CD8+CD28- T-клеток, которые часто являются CD45RA+ (иммунофенотип: CD8+CD28- CD45RA+) продуцируют большое количество провоспалительного цитокина IFN-γ и незначительные количества IL-5. Эти клоны накапливаются в процессе нормального старения и индуцируют дисбаланс продукции Th1- и Th2-цитокинов. Таким образом, накапливающиеся клоны CD8+ CD28- CD45RA+ T-клеток вместе с уменьшающейся численностью популяции наивных B-клеток (Siegrist and Aspinall, 2009) являются основными участниками снижения иммунных функций, которое поражает приблизительно одну треть популяции пожилых людей (Weng et al., 2009, Saurwein-Teissl et al., 2002).
Таким образом, пассивная иммунотерапия (например, посредством DC8E8 (или его химерного, гуманизированного, человеческого или другого производного/части/фрагмента) обеспечивает средство для того, чтобы обойти ослабление иммунной системы большой популяции пациентов с AD и осуществить нацеливание на патологические белки тау, вызывающие нейрофибриллярную дегенерацию.
В некоторых вариантах осуществления один из терапевтических эпитопов белка тау (или пептид, содержащий один из терапевтических эпитопов белка тау, описанных в настоящем описании) используют в качестве активной вакцины, предназначенной для применения у пожилых иммунокомпетентных пациентов с болезнью Альцгеймера. Иммунофенотип иммунокомпетентных пациентов представляет собой CD8+ CD28+ CD45RA+. Таким образом, уровни костимулирующей молекулы CD28 на CD8+ T-клетках можно определять и использовать в качестве селективного маркера у пациентов для активной вакцинации.
Более того, перед лечением CSF и кровь, взятые от пациентов, можно исследовать на антитела против Borrelia, Treponema, Chlamydia, Herpesvirus и других патогенов головного мозга для исключения индивидуумов с хроническими инфекциями и воспалительными нарушениями ЦНС, которые могут имитировать или усиливать симптомы AD (Balin et al., 2008; Itzhaki and Wozniak, 2008; Miklossy, 2008; Andreasen, 2010). Инфекции ЦНС часто нарушают функцию гематоэнцефалического барьера (BBB), особенно инфекции Chlamydia эндотелиальных клеток головного мозга, которые могут приводить к увеличенному притоку моноцитов в паренхиму головного мозга и, таким образом, могут влиять на местный иммунный ответ (Balin et al., 2008). Было показано, что пожилые индивидуумы с более высокими уровнями IgG к цитомегаловирусу (CMV) имели более высокие скорости снижения когнитивных способностей (Itzhaki and Wozniak, 2008). Таким образом, для предотвращения неблагоприятных эффектов после иммунизации одним из средств, предусматриваемых изобретением (например, неконтролируемая иммунная реакция на нормальный белок тау), пациентов с болезнью Альцгеймера с инфекциями ЦНС или пациентов с положительными результатами исследования на антитела против упомянутых выше патогенов можно лечить более селективной вакциной.
Перед лечением CSF и кровь, взятые от пациентов, можно исследовать на антитела против Borrelia, Treponema, Chlamydia, Herpesvirus и других патогенов головного мозга с хроническими инфекционными и воспалительными нарушениями ЦНС, которые могут имитировать или усиливать симптомы AD (Balin et al., 2008; Itzhaki and Wozniak, 2008; Miklossy, 2008; Andreasen, 2010). Для предотвращения возможных неблагоприятных эффектов, обеспечиваемых различными хроническими инфекциями, эту группу пациентов можно лечить более селективным антителом или вакциной, содержащими терапевтический эпитоп. В некоторых случаях активная вакцина представляет собой сконструированный эпитоп (например, см. примеры), индуцирующий продукцию строго селективных антител, нацеленных на терапевтический эпитоп на патологических белках тау. В некоторых вариантах осуществления вакцина не содержит никакую аминокислотную последовательность, являющуюся общей с нормальным/физиологическим белком тау.
Режимы лечения
В профилактических применениях фармацевтические композиции или лекарственные средства вводят пациенту, предрасположенному или имеющему иной риск конкретного заболевания, в количестве, достаточном для устранения или снижения риска или замедления возникновения заболевания. В терапевтических применениях композиции или лекарственные средства вводят пациенту, предположительно страдающему или уже страдающему таким заболеванием в количестве, достаточном для излечения или по меньшей мере частичной остановки симптомов заболевания и его осложнений. Количество, достаточное для осуществления этого, определяется как терапевтически или фармацевтически эффективная доза. Как в профилактическом, так и в терапевтическом режимах средства обычно вводят несколькими дозировками до тех пор, пока не достигают достаточного иммунного ответа. Как правило, осуществляют мониторинг иммунного ответа и вводят повторные дозировки, если иммунный ответ начинает ослабевать.
Эффективные дозы композиций по настоящему изобретению для лечения описанных выше состояний варьируют, в зависимости от множества факторов, включая путь введения, заданную область, физиологическое состояние пациента, то, является ли пациент человеком или животным, другие вводимые лекарственные средства, и то, является ли лечение профилактическим или терапевтическим. Обычно пациентом является человек. Дозировки лечения необходимо титровать для оптимизации безопасности и эффективности. Таким образом, лечение антителом или белком, связывающим белок тау, как правило, будет вовлекать множество дозировок в течение некоторого периода времени. Для пассивной иммунизации антителом дозировки находятся в диапазоне приблизительно от 0,0001 до 100 мг/кг, и более часто от 0,01 до 5 мг/кг массы тела хозяина. В некоторых применениях антитело или белок, связывающий белок тау, можно вводить в дозировке по меньшей мере 0,1 мг/кг массы тела, в дозировке по меньшей мере 0,5 мг/кг массы тела, 1 мг/кг массы тела, или в любой комбинации дозировок от 0,1 до 10 мг/кг массы тела. В некоторых способах антитело или белок, связывающий белок тау, можно вводить множеством дозировок (равных или различных) в течение периода по меньшей мере 1 месяц, по меньшей мере 3 месяца или по меньшей мере 6 месяцев. Общее количество дозировок в течение любого периода лечения может составлять, например, от 4 до 6, хотя можно использовать другие количества, в зависимости от факторов, рассмотренных выше. Мониторинг лечения можно проводить любыми способами, описанными ниже.
Количество иммуногена зависит от того, вводят ли также адъювант, причем в отсутствие адъюванта требуются более высокие дозировки. Количество иммуногена для введения иногда варьирует в диапазоне 1 мкг - 500 мкг на пациента и более часто в диапазоне 5-500 мкг на инъекцию для введения человеку. Иногда используют более высокую дозу, составляющую 1-2 мг на инъекцию. Как правило, для каждой инъекции человеку используют приблизительно 10, 20, 50 или 100 мкг. Время инъекций может значительно варьировать от одного раза в сутки до одного раза в год и до одного раза в десять лет. В любой данный день, когда вводят дозировку, дозировка превышает 1 мкг/пациент и обычно превышает 10 мкг/пациент, если также вводят адъювант, и превышает 10 мкг/пациент и обычно превышает 100 мкг/пациент в отсутствие адъюванта. Типичный режим состоит из иммунизации с последующими вспомогательными инъекциями с интервалами 6 недель. Другой режим состоит из иммунизации с последующими вспомогательными инъекциями через 1, 2 и 12 месяцев. Другой режим вовлекает инъекцию каждые два месяца на протяжении всей жизни. Альтернативно вспомогательные инъекции могут быть нерегулярными, в зависимости от результатов мониторинга иммунного ответа. В некоторых вариантах осуществления активную вакцину можно составлять с подходящим носителем, предпочтительно KLH, и гидроксидом алюминия в качестве адъюванта. Предпочтительно, 100 мкг пептид/доза/пациент (но также 1 мкг, 10 мкг, 100 мкг и 1 мг будут вводить в доклинической фазе и 10 мкг, 100 мкг, 200 мкг в фазе I испытаний токсичности) будут вводить один раз в 4 недели, всего 5 доз.
Дозы для нуклеиновых кислот, кодирующих иммуногены, находятся в диапазоне приблизительно от 10 нг до 1 г, от 100 нг до 100 мг, от 1 мкг до 10 мг, или 30-300 мкг ДНК на пациента. Дозы для инфекционных вирусных векторов находятся в диапазоне 10-109 или более вирионов на дозу. Мониторинг лечения можно проводить путем анализа ответа антител или ответов активированных T-клеток или B-клеток на лекарственное средство с течением времени. Если ответ ослабевает, может быть назначена вспомогательная доза.
В конечном итоге, режим дозирования будет определяться лечащим врачом и клиническими факторами. Как известно в области медицины, дозировки для любого пациента зависят от множества факторов, включая размер пациента, площадь поверхности тела, возраст, конкретное соединение, подлежащее введению, пол, время и путь введения, общее состояние здоровья и другие лекарственные средства, вводимые одновременно. Типичная доза может находиться, например, в диапазоне от 0,001 до 1000 мг; однако предусматриваются дозы ниже или выше этого иллюстративного диапазона, особенно учитывая упомянутые выше факторы. Как правило, режим в качестве регулярного введения фармацевтической композиции должен находиться в диапазоне от 1 мг до 10 мг единиц в сутки. Если режим представляет собой непрерывную инфузию, он также должен находиться в диапазоне от 1 мг до 10 мг на килограмм массы тела в минуту, соответственно. Мониторинг прогрессирования можно осуществлять путем периодической оценки.
Кроме того, может быть желательным совместное введение или последовательное введение других средств. В некоторых вариантах осуществления терапевтически эффективная доза или количество относятся к количеству активного ингредиента, достаточному для смягчения симптомов или состояния. Терапевтическую эффективность и токсичность таких соединений можно определять с помощью стандартных фармацевтических методик в культурах клеток или у экспериментальных животных, например, ED50 (доза, терапевтически эффективная у 50% популяции) и LD50 (доза, летальная для 50% популяции). Соотношение доз между терапевтическими и токсическими эффектами представляет собой терапевтический индекс, и его можно выражать как соотношение LD50/ED50. В некоторых вариантах осуществления лекарственное средство в композиции присутствует в количестве, достаточном для восстановления нормального поведения и/или когнитивных свойств в случае болезни Альцгеймера и родственных таупатий.
Изобретение относится к различным показателям, на которые можно полагаться при оценке эффективности лечения с помощью средств, предусматриваемых изобретением. Примеры включают, но не ограничиваются ими, сниженные уровни одной или нескольких патологических форм белка тау (например, в головном мозге), увеличенное выведение патологического белка тау из головного мозга и/или CSF; показатели улучшения когнитивной деятельности, такие как когнитивные функции (исследуемые, например, с помощью клинической оценки деменции - CDR, шкалы оценки болезни Альцгеймера - подшкала когнитивных способностей - исследование умственного состояния ADAS-Cog Mini - MMSE); исследования улучшения двигательной функции (например, испытание силы сжатия, испытание Timed Up & Go (TUG), ручной TUG, испытание разговаривания во время ходьбы, унифицированная шкала оценки болезни Паркинсона - UPDRS); исследования улучшения характеристик основных видов активности повседневной жизни (ADL) (например, гигиена, одевание, регуляция функции мочевого пузыря или кишечника, прием пищи, приготовление пищи, телефонные разговоры, осуществление прогулок, финансовые операции и корреспонденция; исследования по оценке инвалидизации при деменции); и снижение тяжести/степени нарушения силы сжатия при AD, двигательной активности и апраксии (которые имеют прямые корреляции с моделями на животных и анализами, описанными ниже в примерах), снижение памяти, афазию, агнозию, дезориентацию во времени и пространстве и депрессию.
Для оценки эффективности лечения уровни и распределение белка тау (в головном мозге и в жидкостях организма) можно оценивать любым из способов, описанных в настоящем описании и/или любыми другими способами, доступными для выявления белка тау. Например, уровни белка тау можно измерять in vivo (позитронная эмиссионная томография) с использованием нового визуализирующего радиоактивного индикатора 18F-THK523, который селективно связывает белок тау и с патологией тау in vitro, ex vivo (срезы тканей) и in vivo (трансгенные мыши) (Fodero-Tavoletti et al., 2011, Brain). Белок тау можно идентифицировать в цереброспинальной жидкости и в крови, а также с использованием наборов ELISA, распознающих либо общий белок тау, либо фосфо-тау.
Действительно, нейроповеденческое нарушение у трансгенных крыс имеет параллели с двигательным нарушением у пациентов с болезнью Альцгеймера, что имеет последствия для клинических испытаний и протоколов лечения с любым из лекарственных средств, предусматриваемых в рамках настоящего изобретения (включая, но не ограничиваясь ими, средства для активной вакцинации. У человека, болезнь Альцгеймера клинически характеризуется прогрессирующим ухудшением памяти и снижением когнитивных способностей, изменениями поведения и психологическими симптомами (расстройства настроения, эмоций, аппетита, цикла сна и пробуждения, спутанность сознания, тревожное возбуждение и депрессия) и нарушением двигательной функции (апраксия, миоклонус, нарушение походки, сниженная сила мышц, экстрапирамидальные признаки, такие как брадикинезия, ригидность и тремор в состоянии покоя) (Goldman et al., 1999; Boyle et al., 2009). Во многих исследованиях было описано, что часто при болезни Альцгеймера (AD) наблюдают двигательные признаки и они становятся более выраженными по мере прогрессирования заболевания (Goldman et al., 1999; Wilson et al., 2003; Louis et al., 2004; Pettersson et al., 2005; Scarmeas et al., 2004; Scarmeas et al., 2005; Waite et al., 2005; Alfaro-Acha et al., 2006; Wang et al., 2006; Buchman et al., 2007a; Boyle et al., 2009). Примечательно, что двигательные признаки могут предшествовать снижению когнитивных способностей и прогнозировать снижение когнитивных способностей и функциональное ухудшение, помещение в лечебное учреждение и смертность при болезни Альцгеймера (Morris et al., 1989; Soininen et al., 1992; Kraemer et al., 1994; Chui et al., 1994; Scarmeas et al., 2004; Scarmeas et al., 2005). Было показано, что снижение мышечной силы предшествует развитию снижения когнитивных способностей (Buchman et al., 2007b; Boyle et al., 2009).
Развитие двигательных признаков при AD ассоциировано с нейрональной дегенерацией и потерей нейронов в стволе головного мозга (Zarow et al. 2003; Burns et al. 2005; Grudzien et al. 2007; Simic et al., 2009; Wai et al., 2009; Braak and DelTredici, 2011). Более того, в нескольких исследованиях было предположено, что нейрофибриллярная дегенерация возникает в стволе головного мозга и предшествует кортикальной нейродегенерации (Hertz, 1989; Simic et al., 2009; Braak and DelTredici, 2011).
Эти данные указывают на то, что двигательное нарушение является ключевым признаком в патогенезе AD. Более того, функциональное нарушение некоторых двигательных доменов может предшествовать деменции и прогнозировать снижение когнитивных способностей. Активная иммунотерапия пептидами (включая терапевтические эпитопы), описанными в настоящем описании, может привести к улучшению при двигательном нарушении у трансгенных крыс, экспрессирующих патологический белок тау человека. Таким образом, прямое нацеливание на патологию ствола головного мозга с помощью активной иммунотерапии может предотвращать, замедлять или отсрочивать двигательное нарушение, а также снижение когнитивных способностей, у пациентов-людей с AD. Таким образом, исследование двигательных функций может быть включено в набор исследований, которые можно использовать для оценки клинической эффективности средств (например, средства для выведения белка тау, активные и пассивные вакцины), описанных в настоящем описании.
Также специалисту в данной области известно о точно установленных корреляциях между уровнями и распределением патологического белка тау (например, NFT в коре/гиппокампе) и прогрессированием заболевания. Плотность патологического белка тау (патология NFT) коррелирует с когнитивным дефицитом и тяжестью болезни Альцгеймера (Braak and Braak, 1991; Bierer et al., 1995; Berg et al., 1998; Duyckaerts et al., 1998; Giannakopoulos et al., 1998, 2003). Патологический белок тау (например, NFT, нейропильные нити) в энторинальное коре и гиппокампе обратно взаимосвязаны с лонгитудинальными изменениями памяти (Reitz et al., 2009). Аналогично, в стволе головного мозга патологический белок тау (NFT) встречается в дорзальном ядре шва на очень ранней стадии; другие ядра шва поражаются позднее. Эти очаги повреждения объясняют серотонинергический дефицит, встречающийся при AD (Duykaerts et al., 2009). Экстрапирамидальные симптомы коррелируют с патологией белка тау в черной субстанции (Liu et al., 1997). Таким образом, лекарственное средство, которое может влиять на один или несколько из этих профилей распределения при AD, вероятно, будет иметь благоприятный эффект при AD.
ПРИМЕРЫ
ПРИМЕР 1: ПОЛУЧЕНИЕ РЕКОМБИНАНТНЫХ БЕЛКОВ ТАУ ЧЕЛОВЕКА
Полноразмерный белок тау человека (2N4R, 2N3R) и делеционные мутанты белка тау: рекомбинантные белки тау (фиг.1 и 6) получали из клона τ40 (Goedert,1989), который субклонировали в экспрессирующую плазмиду pET-17b (Novagen) и экспрессировали в бактериях. Каждый делеционный мутант белка тау проверяли секвенированием ДНК. Все делеционные мутанты белка тау и тау-пептиды пронумерованы в соответствии с наиболее длинной изоформой белка тау человека 2N4R, длина которой составляет 441 аминокислот и которая, таким образом, также обозначается как тау441 (D'Souza, 2005). Делеционные мутанты и пептиды белка тау, происходящие из изоформы 2N3R, обозначены с помощью "3R" для указания на то, что второй связывающий микротрубочки повтор (аминокислоты 275-305 2N4R) отсутствует. Получение белков тау вовлекало следующие стадии: a) экспрессия белка тау в бактериях; b) очистка белка тау ионообменной хроматографией; c) очистка белка тау гель-фильтрацией; d) концентрирование и хранение выделенного белка тау; и e) иммуноаффинная очистка (это является исключением, принятым только для тауΔ(1-150; 392-441)/4R, который использовали в эксперименте по захвату микроглией, см. пример 10, фиг.17).
a) Бактериальная экспрессия полноразмерного белка тау человека (либо 2N4R, либо 2N3R) и рекомбинантных делеционных мутантов белка тау: экспрессирующие плазмиды для белка тау человека (выше) трансформировали в Escherichia coli (E. coli), продуцирующий штамм BL21 (DE3). Бактериальные клетки, содержавшие соответствующую экспрессирующую плазмиду, культивировали и индуцировали, как описано в "Molecular Cloning: A Laboratory Manual", Sambrook and Russell (2001). Единичную колонию бактерий BL21 (DE3), трансформированных плазмидой pET-17b, запускающей экспрессию белка тау и его фрагмента, выращивали при 37°C в 500 мл бульонной среды Лурия с 100 г/мл ампициллина при 300 об./мин. и индуцировали добавлением изопропил-β-D-1-тиогалактопиранозида (IPTG) до конечной концентрации 0,4 мМ. После дальнейшей инкубации при 37°C в течение 3 часов бактерии собирали центрифугированием при 3000 × g в течение 15 мин при 4°C.
b) Очистку с помощью катионообменной хроматографии основных и нейтральных белков тау (полноразмерные изоформы белка тау, тауΔ358-441, тауΔ306-400, тауΔ421-441, тауΔ300-312, тауΔ134-168, тауΔ1-220, тауΔ1-126, тауΔ(1-150; 392-441)/4R, тауΔ(1-150; 392-441)/3R и тауΔ(1-296; 392-441)/4R) проводили, по существу как описано ранее (Krajciova et al., 2008). После экспрессии бактериальный осадок ресуспендировали в 10 мл лизирующего буфера (50 мМ 1,4-пиперазиндиэтансульфоновая кислота (PIPES) pH 6,9, 50 мМ хлорид натрия (NaCl), 1 мМ этилендиаминтетрауксусная кислота (EDTA), 5 мМ дитиотреитол (DTT), 0,1 мМ фенилметилсульфонилфторид (PMSF), 5% (об./об.) глицерин), быстро замораживали в жидком азоте, и хранили при -80°C до использования для очистки белков тау. Для очистки белка тау замороженные суспензии бактерий быстро размораживали и помещали на лед. Клеточные стенки бактерий разрушали обработкой ультразвуком на льду с использованием Sonopuls HD 2200, наконечник TT-13 (Bandelin, Германия), установленного на 50% рабочий цикл, выходную мощность 50 Вт, 6 раз по 30 с паузами 30 с. Лизаты очищали центрифугированием (21000 × g в течение 15 мин при 4°C) и супернатанты фильтровали через 0,45-мкм мембранный фильтр. Крупномасштабную очистку рекомбинантных белков тау проводили при 6°C с использованием рабочей станции ÄKTA-FPLC (Amersham Biosciences, Швеция). Фильтрованные лизаты наносили при скорости потока 3 мл/мин на 5-мл колонку HiTrap SP HP (GE Healthcare, Uppsala, Швеция), уравновешенную лизирующим буфером, и промывали тщательно 60 мл лизирующего буфера до тех пор, пока исходный уровень при 280 нм не становился стабильным. Связавшиеся белки тау элюировали градиентом (0-30% в 15 мл) буфера B (лизирующий буфер, дополненный 1 M NaCl). Отдельные 1-мл фракции собирали и анализировали с помощью электрофореза на полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE). Для удаления нуклеиновых кислот, которые очищаются вместе с положительно заряженными белками тау, фракции, содержавшие белок тау, объединяли и очищали с помощью второй стадии катионообменной хроматографии с использованием 5-мл колонки HiTrap SP HP (GE Healthcare, Uppsala, Швеция) с менее резким градиентом буфера B (0-30% в 45 мл).
c) Очистку с помощью анионообменной хроматографии кислотных белков тау (тауΔ222-427, тауΔ228-441, тауΔ257-400, тауΔ137-441, тауΔ283-441) проводили, как описано ранее (Csokova et. al. 2004). После экспрессии бактериальный осадок ресуспендировали в 10 мл гистидинового лизирующего буфера (20 мМ гистидин, pH 6,0, 50 мМ NaCl, 1 мМ EDTA, 5 мМ DTT, 0,1 мМ PMSF и 5% (об./об.) глицерин). Клеточные стенки бактерий разрушали обработкой ультразвуком на льду с использованием Sonopuls HD 2200, наконечник TT-13 (Bandelin, Германия), установленного на 50% рабочий цикл, выходную мощность 50 Вт, 6 раз по 30 с паузами 30 с. Лизаты очищали центрифугированием (21000 × g в течение 15 мин при 4°C). Бактериальные лизаты осаждали 1% сульфатом стрептомицина (Medexport, Россия), инкубировали на льду в течение 5 мин, очищали с помощью центрифугирования (21000 × g в течение 15 мин при 4°C) и фильтровали через 0,45-мкм мембранный фильтр. Фильтрованные преципитированные стрептомицином лизаты наносили со скоростью потока 3 мл/мин на 5-мл колонку HiTrap QSepharose HP (Amersham Biosciences, Швеция) и тщательно промывали 30-50 мл гистидинового лизирующего буфера до тех пор, пока исходный уровень при A280 не становился стабильным. Белки тау элюировали с помощью двухшагового солевого градиента (0,05-0,5 M NaCl в 40 мл, а затем 0,5-1 M NaCl в 20 мл) в гистидиновом лизирующем буфере.
d) На конечной стадии очистки путем гель-фильтрации (одинаковая для всех белков тау), объединенные фракции белка тау, полученные ионообменной хроматографией, инжектировали в колонку для гель-фильтрации (колонка HiLoad 26/60 Superdex 200 prep grade column, GE Healthcare) при 3 мл/мин либо в PIPES, либо в гистидиновом лизирующем буфере для основных/нейтральных или кислотных белков тау, соответственно, дополненном 100 мМ NaCl. Элюированные белки тау объединяли.
e) Для концентрирования белка тау после очистки гель-фильтрацией, объединенные фракции разбавляли 1,5 объема 2,5% глицерина и вновь наносили на колонку HiTrap SP HP (основные и нейтральные белки тау) или на колонку HiTrap Q HP (кислотные белки тау). Затем концентрированный рекомбинантный белок элюировали с колонки с пошаговым градиентом 1 M NaCl. Наконец, буфер заменяли на фосфатно-солевой буфер (PBS, 8,09 мМ дифосфат натрия (Na2HPO4), 1,47 мМ дигидрофосфат калия (KH2PO4), 136,89 мМ NaCl, 2,7 мМ хлорид калия (KCI)), насыщенный аргоном, с использованием 5-мл колонки для обессоливания HiTrap Desalting column (GE Healthcare). Количественное определение белка в очищенных образцах проводили с использованием наборов для количественного определения с помощью бицинхониновой кислоты (BCA) (Pierce, США), с бычьим сывороточным альбумином (BSA) в качестве стандарта. Белки тау разделяли на рабочие аликвоты, быстро замораживали в жидком азоте и хранили при -70°C.
f) Для удаления возможных бактериальных примесей из рекомбинантного тауΔ(1-150; 392-441)/4R, использованного для измерений захвата белка тау микроглией (пример 10, фиг.17), рекомбинантный белок тау очищали модифицированным способом следующим образом. После первой стадии катионообменной хроматографии, фракции, содержащие белок тау, объединяли и добавляли 1/20 объема ледяного 5% полиэтиленимина при перемешивании. Перемешивание продолжали в течение дополнительных 30 мин на льду. Образец центрифугировали при 20000 × g в течение 15 мин при 4°C. Супернатант собирали и инжектировали в колонку HiLoad 26/60 Superdex 200 prep grade column (GE Healthcare) при 3 мл/мин в лизирующем буфере PIPES, дополненном 100 мМ NaCl, но лишенном DTT или любого другого восстановителя. После гель-фильтрации фракции с белком тау объединяли и наносили на иммуноаффинную колонку (при скорости потока 0,5 мл/мин), содержавшую антитело DC25 (эпитоп 347-353 2N4R тау, Axon Neuroscience, Vienna, Австрия), иммобилизованное на CNBr-активированной сефарозе. Колонку предварительно уравновешивали в 20 мМ Tris-HCl, pH 7,4, 150 мМ NaCl, 0,1% Tween 20 (TBS-Tween). После связывания колонку промывали 5 объемами колонки TBS-Tween и связавшиеся белки тау элюировали 0,1 M глицином, pH 2,7. Собранные фракции нейтрализовывали добавлением 1/30 объема 1 M Tris-HCl pH 8,8 и объединяли. Наконец, буфер заменяли на PBS (насыщенный аргоном), с использованием колонки для обессоливания HiTrap Desalting column, 5 мл (GE Healthcare). Количественное определение белка в очищенных образцах проводили с использованием наборов для количественного определения с помощью бицинхониновой кислоты (BCA) (Pierce, США) с BSA в качестве стандарта. Белки разделяли на рабочие аликвоты, быстро замораживали в жидком азоте и хранили при -70°C.
Очищенное антитело DC25 (Axon Neuroscience, Vienna, Австрия), использованное для аффинной колонки с DC25 (выше), приготавливали следующим образом. Бессывороточный культуральный супернатант гибридомы DC25 доводили до pH 7,5 добавлением 0,2 объема PBS, предварительно очищали центрифугированием при 20000 × g в течение 10 минут при 4°C, и супернатант фильтровали через 0,2-мкм фильтр. Предварительно очищенный культуральный супернатант гибридомы DC25 наносили на предварительно уравновешенную PBS колонку HiTrap Protein G HP (5 мл, GE Healthcare) при 1 мл/мин. После завершения нанесения колонку промывали 4 объемами колонки PBS, и связавшееся антитело элюировали 100 мМ глицином, pH 2,7. Элюированные фракции нейтрализовывали 1 M Tris-HCl, pH 9, объединяли, и буфер заменяли на PBS с использованием колонки для обессоливания HiTrap Desalting column (5 мл, GE Healthcare). Очищенное антитело DC25 хранили небольшими аликвотами при -70°C.
ПРИМЕР 2: ПОЛУЧЕНИЕ ГИБРИДОМНЫХ КЛЕТОЧНЫХ ЛИНИЙ, ПРОДУЦИРУЮЩИХ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ БЕЛКА ТАУΔ(1-150:392-441)/4R ЧЕЛОВЕКА, СКРИНИНГ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ С ПОМОЩЬЮ ELISA, И ПЕРВОНАЧАЛЬНАЯ ОХАРАКТЕРИЗАЦИЯ МОНОКЛОНАЛЬНОГО АНТИТЕЛА DC8E8
Мышей Balb/c в возрасте шести недель подвергали первичной иммунизации подкожно посредством 50 мкг рекомбинантного тауΔ(1-150; 392-441)/4R (полученного, как описано в примере 1) в полном адъюванте Фрейнда (SIGMA) и проводили вспомогательные иммунизации пять раз с интервалами пять недель посредством 50 мкг того же антигена в неполном адъюванте Фрейнда. За трое суток до слияния мышам внутривенно инъецировали 50 мкг того же антигена в PBS. Клетки селезенки от иммунизированных мышей подвергали слиянию с клетками миеломы NS/0 в соответствии со способом Kontsekova et al. (1988). Спленоциты (108) смешивали с 2 × 107 клеток миеломы NS/0 (соотношение 5:1) и подвергали слиянию в течение 1 минуты в 1 мл 50% полиэтиленгликоля (PEG) 1550 (Serva) в бессывороточной модифицированной способом Дульбекко среде Игла (DMEM), дополненной 10% диметилсульфоксидом. Слитые клетки ресуспендировали в DMEM, содержавшей 20% сыворотку лошади, L-глутамин (2 мМ), гипоксантин (0,1 мМ), аминоптерин (0,04 мМ), тимидин (0,016 мМ) и гентамицин (40 Е/мл), при плотности 2,5 × 105 клеток селезенки на лунку 96-луночных планшетов. Клетки инкубировали в течение 10 суток при 37°C и вырастающие гибридомы подвергали скринингу в отношении продукции моноклональных антител, специфичных к тауΔ(1-150; 392-441)/4R, с использованием твердофазного иммуноферментного анализа (ELISA).
ELISA использовали для выявления в супернатантах культур гибридом моноклональных антител, направленных против тауΔ(1-150; 392-441)/4R (небеспорядочная форма белка тау). Микропланшеты для титрования покрывали в течение ночи тауΔ(1-150; 392-441)/4R (5 г/мл, 50 мкл/лунка) при 37°C в PBS. После блокирования 1% обезжиренным сухим молоком для снижения неспецифического связывания, планшеты промывали PBS-0,05% Tween 20 и инкубировали с 50 мкл/лунка супернатанта культуры гибридомы в течение 1 ч при 37°C. Связавшиеся моноклональные антитела выявляли с помощью антитела овцы против иммуноглобулинов мыши (Ig), конъюгированного с пероксидазой хрена (HRP, DAKO). Реакцию осуществляли с помощью раствора ортофенилендиамина в качестве субстрата пероксидазы и останавливали 50 мкл 2 M H2SO4. Поглощение при 492 нм измеряли с использованием устройства для считывания Multiscan MCC/340 ELISA reader (Labsystems). Данные считывания с величиной поглощения, по меньшей мере в два раза превышающей отрицательные контроли (PBS), считали положительными. Положительные культуры гибридом далее исследовали с помощью иммуногистохимии (в соответствии со способом Zilka et al., 2003) и субклонировали в мягком агаре в соответствии с методикой, описанной в Kontsekova et al. (1991).
Моноклональное антитело DC8E8 (продуцированное гибридомной клеточной линии, депонированной в American Type Culture Collection 13 июля 2011 года с обозначением запатентованного депозита ATCC PTA-11994) было идентифицировано среди положительных культур гибридом, полученных и отобранных таким образом. DC8E8 далее охарактеризовывали, как описано ниже. Изотип антитела определили как IgG1 мыши с помощью ELISA с использованием набора для изотипирования Ig мыши (ISO-2, SIGMA).
ПРИМЕР 3: СЕКВЕНИРОВАНИЕ ВАРИАБЕЛЬНЫХ ОБЛАСТЕЙ DC8E8 И ЕГО ГУМАНИЗАЦИЯ ПУТЕМ ПЕРЕСАДКИ CDR
a) Определение нуклеотидных и аминокислотных последовательности вариабельных областей легкой и тяжелой цепей DC8E8 (фиг.3). Нуклеотидную последовательность вариабельных областей DC8E8 (фиг.3A и 3D) определяли ДНК-секвенированием с использованием кДНК, синтезированной с использованием тотальной РНК, экстрагированной из гибридомной клеточной линии мыши PTA-11994 (ATCC), которая экспрессирует моноклональное антитело DC8E8. Тотальную РНК экстрагировали с использованием реагента TRIZOL® (Invitrogen, США). Синтез кДНК первой цепи проводили с использованием набора для обратной транскрипции кДНК "High capacity cDNA reverse transcription" kit в соответствии с протоколом изготовителя (Applied Biosystems, США). Состав реагентов для 2× основной смеси для обратной транскрипции был следующим (количества на реакционную смесь объемом 20 мкл): 2 мкл 10× буфера RT; 0,8 мкл 25× смеси dNTP (100 мМ); 2 мкл 10× случайных праймеров RT (50 мкМ); 1 мкл обратной транскриптазы MultiScribeTM (50 Е/мкл); 4,2 мкл не содержащей нуклеаз H2O. Для обратной транскрипции 10 мкл 2× основной смеси для обратной транскрипции смешивали с образцом РНК (2 мкг 10 мкл) и кДНК синтезировали в следующих условиях: 10 мин при 25°C, 120 мин при 37°C, 5 мин при 85°C, и конечное охлаждение до 4°C. Амплификацию генов, кодирующих вариабельные области легкой и тяжелой цепей, проводили с помощью полимеразной цепной реакции (ПЦР) с использованием высокоточной ДНК-полимеразы Phusion® (Finnzymes, Финляндия). Прямые праймеры (8E8L-смысловой 5'-ACATTGTGATGTCACAGTCTCCATCCTCC-3' (SEQ ID NO: 132) и 8E8H-смысловой 5'-CTCCTCCAATTGCAGCAGTCTGG-3'(SEQ ID NO: 133)) конструировали в соответствии с белковой последовательностью N-концов легкой (DIVMSQSPSS) (SEQ ID NO: 134) и тяжелой (QVQLQQSGPE) (SEQ ID NO: 135) цепей DC8E8. N-концевые последовательности белка определяли с использованием расщепления Эдмана (легкая цепь) и MALDI с распадом внутри источника (тяжелая цепь). С использованием этой информации в Genebank были идентифицированы наиболее сходные белки с легкими и тяжелыми цепями вместе с их соответствующими нуклеотидными последовательностями. Затем идентифицировали наиболее вероятные нуклеотидные последовательности V-генов мыши (легкая и тяжелая цепь) в базе данных IMGT/LIGM-DB (www.imgt.org). Эти гены использовали для конструирования прямых праймеров (коррекцию проводили с использованием N-концевых белковых последовательностей DC8E8). Обратные праймеры для легкой и тяжелой цепей (каппа-антисмысловой 5'-GGAATTCGTTGAAGCTCTTGACAATGGGTG-3' (SEQ ID NO: 136) и G1-антисмысловой 5'-GGAATTCACATATGCAAGGCTTACAACCAC-3 (SEQ ID NO: 137)) происходили из константных областей цепей каппа и IgG1, соответственно.
Продукты ПЦР секвенировали и полученные последовательности ДНК вариабельных областей легкой и тяжелой цепей DC8E8 представлены на фиг.3A и 3D, соответственно. Выравнивание DC8E8 с наиболее сходной легкой цепью IGKV8-21*01 и тяжелой цепью IGHV1-81*01 мыши эмбрионального типа представлено на фиг.3C и 3F, соответственно. Определяющие комплементарность области (CDR) подчеркнуты в белковых последовательностях легкой и тяжелой цепей DC8E8 (фиг.3B и 3E, соответственно). CDR и каркасные области (FR) были идентифицированы в соответствии с системой нумерации ImMunoGeneTics (IMGT) (см., например, Lefranc MP. The IMGT unique numbering for immunoglobulins, T-cell receptors, and Ig-like domains. The Immunologist 7, 132-136, 1999 (1999)).
b) Гуманизация DC8E8. Для идентификации подходящего иммуноглобулина человека, являющегося кандидатом для получения гуманизированного DC8E8 посредством пересадки определяющих комплементарность областей (CDR) DC8E8, ген человека эмбрионального типа с наиболее высокой идентичностью последовательности с DC8E8 определяли с использованием попарного выравнивания ClustalX2 нуклеотидной последовательности DC8E8 против выбранного набора генов иммуноглобулинов человека, извлеченных из простого файла IMGT/LIGM-DB выпуска 201112-6 (www.imgt.org). IgKv4-1*01 был идентифицирован как наиболее сходный ген человека эмбрионального типа для легкой цепи DC8E8 (фиг.4), и IgHV1-69*10 был идентифицирован как наиболее сходный ген эмбрионального типа для тяжелой цепи DC8E8 (фиг.5). Был разработан следующий подход (способ 1 и способ 2) и его можно использовать для получения одной или нескольких гуманизированных версий антитела DC8E8. После экспрессии в соответствующей системе для экспрессии антител (например, экспрессирующие векторы млекопитающих, используемые для экспрессии антител in vitro (например, клетки HEK293) или in vivo (трансгенные животные)), полученные гуманизированные рекомбинантные антитела можно исследовать в отношении активности (например, биохимическая и терапевтическая активность) в соответствии с любыми способами, используемыми для охарактеризации активности DC8E8.
Способ 1: Пересадка CDR и мутации в каркасной области (FR), если необходимы (CDR выделены полужирным шрифтом и подчеркнуты, мутации FR выделены полужирным шрифтом):
Вариабельная область тяжелой цепи (SEQ ID NO: 138-140, соответственно, по порядку):

Вариабельная область легкой цепи (SEQ ID NO: 141-143, соответственно, по порядку):

Способ 2: Были найдены иммуноглобулины эмбрионального типа мыши (фиг.3) и человека (фиг.4 и 5) с наиболее высокой идентичностью последовательности с DC8E8 и выровнены с белковой последовательностью DC8E8. Области CDR были идентифицированы согласно системе нумерации IMGT. Наиболее возможные контактирующие с антигеном остатки в активном центре DC8E8 были идентифицированы, исходя из работы MacCallum et al., J. Mol. Biol.1996.
Различные аминокислоты-кандидаты для мутации в гуманизированной версии DC8E8 были идентифицированы с помощью следующих совокупных критериев:
i. их присутствие в CDR и возможность контакта с антигеном;
ii. их присутствие в зоне Vernier;
iii. независимо от того, мутированы ли они в последовательности мыши эмбрионального типа.
С помощью указанных выше критериев было идентифицировано два уровня кандидатов для мутаций:
Остатки X-типа (выделенные полужирным шрифтом):
- Остатки, отличающиеся между DC8E8 и наиболее сходной последовательностью мыши эмбрионального типа, несходные аминокислоты;
- Остатки в CDR и контактирующие с антигеном. CDR представлены строчными буквами полужирным шрифтом и курсивом в последовательности DC8E8, представленной ниже.
Остатки Y-типа (выделенные полужирным шрифтом, подчеркнутые):
- Остатки, идентичные между DC8E8 и наиболее сходной последовательностью мыши эмбрионального типа, но отличающиеся в наиболее сходной последовательности человека эмбрионального типа и расположенные в зоне Vernier (несходная аминокислота);
- Остатки, отличающиеся между DC8E8 и наиболее сходной последовательностью мыши эмбрионального типа (сходная/консервативная аминокислота).
Две гуманизированных последовательности для каждой цепи были идентифицированы с мутациями, для которых было предсказано, что они влияют на активность DC8E8:
SEQ ID NO: 147, 152: Только остатки X-типа являются мутантными;
SEQ ID NO: 148, 153: Остатки как X, так и Y-типа являются мутантными.
Вариабельная область тяжелой цепи (SEQ ID NO: 138, 145, 139, соответственно, по порядку):

Вариабельная область легкой цепи (SEQ ID NO: 141-143, соответственно, по порядку):

ПРИМЕР 4: КАРТИРОВАНИЕ ЭПИТОПА DC8E8 С ИСПОЛЬЗОВАНИЕМ РЕКОМБИНАНТНЫХ ДЕЛЕЦИОННЫХ МУТАНТНОВ БЕЛКА ТАУ И ПРОИСХОДЯЩИХ ИЗ БЕЛКА ТАУ ПЕПТИДОВ
Делеционные мутанты белка тау 2N4R человека, а также происходящие из белка тау пептиды (Antagene, Inc. (Sunnyvale, CA) и EZBiolab (США)) использовали для картирования эпитопов DC8E8 с использованием ELISA (фиг.6, 7 и 8). Рекомбинантные изоформы белка тау человека (2N4R; 2N3R) и делеционные мутанты белка тау (фиг.6A, 6B) получали, как описано в примере 1. Пептиды (фиг.7A, 7B) были синтезированы в EZBiolabs (США) с чистотой более 85%.
Микропланшеты для титрования покрывали в течение ночи при 37°C либо рекомбинантными белками тау, либо тау-пептидами (5 мкг/мл в PBS, 50 мкл/лунка). После блокирования 1% обезжиренным молоком для уменьшения неспецифического связывания планшеты промывали PBS-0,05% Tween 20 и инкубировали с 50 мкл/лунка супернатанта культуры гибридомы DC8E8 в течение 1 ч при 37°C. Связавшееся моноклональное антитело выявляли с помощью антитела овцы против Ig мыши, конъюгированного с HRP (DAKO). Реакцию осуществляли с раствором ортофенилендиамина в качестве субстрата пероксидазы и останавливали 50 мкл 2 M H2SO4. Поглощение измеряли при 492 нм с использованием устройства для считывания Multiscan MCC/340 ELISA (Labsystems). Данные считывания с величиной поглощения, по меньшей мере в два раза превышающей величину для отрицательных контролей (PBS), считали положительными.
DC8E8 распознавало следующие белки тау человека: Δ358-441, Δ421-441, Δ134-168, Δ1-220, Δ1-126, Δ(1-296;392-441)/4R и Δ(1-150; 392-441)/4R, но не распознавало белки тау с делециями Δ222-427, Δ306-400, Δ228-441, Δ300-312, Δ257-400, Δ137-441 и Δ283-441 (фиг.6B, 6C). DC8E8 распознавало физиологические изоформы белка тау 2N4R и 2N3R в меньшей степени, чем оно распознавало a патологический/небеспорядочный тауΔ(1-296;392-441)/4R, тауΔ(1-150; 392-441)/4R и делеционные мутанты (Δ358-441, Δ421-441, Δ134-168, Δ1-220, Δ1-126) белка тау 2N4R (фиг.6C). Более детальное картирование эпитопов с использованием тау-пептидов выявило, что DC8E8 не распознает тау-пептиды 240-270, 270-300 и 301-330 (фиг.7A, 7B, 7C). Взятые вместе, эти данные указывают на то, что DC8E8 имеет четыре участка связывания или эпитопа на белке тау человека, каждый из которых расположен в области связывающегося с микротрубочками повторяющегося домена белка тау, и каждый из этих эпитопов расположен отдельно в одной из следующих последовательностей белка тау: 267-KHQPGGG-273 (SEQ ID NO: 98) (1-ый повторяющийся домен белка тау, 298-KHVPGGG-304 (SEQ ID NO: 99) (2-ой повторяющийся домен белка тау), 329-HHKPGGG-335 (SEQ ID NO: 100) (3-ий повторяющийся домен белка тау) и 361-THVPGGG-367 (SEQ ID NO: 101) (4-ый повторяющийся домен белка тау) (фиг.7D). Более того, поскольку DC8E8 связывается с укороченными формами белка тау лучше, чем с полноразмерным белком тау с 3 повторами и 4 повторами, эти результаты также указывают на то, что DC8E8 связывается лучше со связанными с заболеванием формами белка тау, чем с физиологическим белком тау (тау39 (2N3R) и тау40 (2N4R)). Также, поскольку полагают, что белок тау изменяет конформацию от физиологического белка тау (внутренне неупорядоченного) на связанный с заболеванием белок (небеспорядочный и разупорядоченный, Kovacech et al., 2010), эти результаты указывают на то, что один или несколько участков связывания для DC8E8 (эпитопы DC8E8) имеют отличающуюся конформацию в физиологическом белке тау, относительно связанного с заболеванием белка тау, и что DC8E8 способен выявлять это конформационное изменение.
Поскольку эти повторяющиеся домены белка тау являются консервативными среди видов (фиг.8A), DC8E8, вероятно, будет реагировать против белков тау из таких разнообразных видов, как крыса, мышь, корова, шимпанзе, лягушка и другие. Выравнивание белков тау различных видов животных проводили с использованием программного обеспечения ClustalW2 (доступное, например, на www.ebi.ac.uk/Tools/msa/clustalw2/). Белок тау человека представлен наиболее длинной изоформой тау, экспрессируемой в нейронах головного мозга человека (2N4R, 441 аминокислота). Белки тау других видов выбраны из общедоступных баз данных. Последовательности, в которых расположен каждый из четырех эпитопов, распознаваемых антителом DC8E8, заключены в рамку.
Дополнительные точковые мутации и делеции вносили в определенные происходящие из белка тау пептиды (8-меры, 9-меры и 10-меры) для дальнейшего определения эпитопов DC8E8, при оценке по способности каждого пептида конкурировать с тауΔ(1-150; 392-441/4R) за связывание с DC8E8. Пептиды были синтезированы в EZBiolabs (США) с чистотой более 85%. Конкурентный ELISA проводили в соответствии со следующим стандартным протоколом. Планшеты для ELISA (планшет с высоким связыванием IWAKI, #3801-096, Bertoni GmbH, Австрия) покрывали в течение ночи при 4°C посредством 100 мкл/лунка рекомбинантного очищенного тауΔ(1-150; 392-441/4R) в PBS в концентрации 5 мкг/мл. Планшеты с высоким связыванием IWAKI промывали 4 раза PBS/Tween 20 (0,05% об./об.), и блокировали PBS/Tween 20 в течение 2 ч при 25°C. Каждый из пептидов отдельно растворяли в PBS в конечной концентрации 5 мМ. Проводили серийные разведения (2-кратные) пептидов в PBS/Tween 20 в полипропиленовых планшетах с коническим дном лунок (Greiner, #651201) (диапазон концентраций 80 мкМ, 40 мкМ, 20 мкМ, 10 мкМ, 5 мкМ и 2,5 мкМ). Добавляли 100 мкл каждого разведения на лунку. Очищенное моноклональное антитело DC8E8 (очистку проводили, как описано ниже в примере 5) разбавляли до концентрации 2 мкг/мл в PBS/Tween 20 и 100 мкл этого разбавленного антитела смешивали с каждым серийным разведением пептидов в смесях объемом 200 мкл с 100 нг антитела/100 мкл, содержащих каждый соответствующий исследуемый пептид в концентрации 40 мкМ, 20 мкМ, 10 мкМ, 5 мкМ, 2,5 мкМ и 1,25 мкМ. Смеси антитело/пептид инкубировали в течение 1 ч при 25°C на вращающейся платформе, установленной на 250 об./мин. Сто микролитров (100 мкл) смесей антитело/пептид переносили из полипропиленовых планшетов в покрытые тауΔ(1-150; 392-441/4R) и блокированные PBS/Tween 20 планшеты IWAKI с высоким связыванием и инкубировали в течение 1 ч при 25°C на вращающейся платформе, установленной на 250 об./мин. Планшеты промывали 4× посредством PBS/Tween 20. Образцы (в планшетах) инкубировали в течение 1 ч при 25°C на вращающейся платформе (установленной на 250 об./мин.) с 100 мкл поликлонального антитела козы против иммуноглобулинов мыши/ HRP (Dako, #P0447), разбавленного 1:4000 в PBS/Tween 20. Планшеты промывали 4× посредством PBS/Tween. Затем образцы/планшеты инкубировали с 100 мкл раствора 1,5 мг/2 мл o-PDA (o-фенилендиамин, SIGMA, P1526) в 0,1 M Na-ацетате pH 6,0 (Roth, #6779), дополненного в 1,5 мкл/2 мл 30% H2O2 (SIGMA, H-0904), в течение 10 минут при 25°C в темноте. Реакцию останавливали добавлением 100 мкл 2 M H2SO4 (Merck, 1.00731.1000). За протеканием реакции наблюдали посредством считывания поглощения образцов/планшетов при 490 нм (например, с использованием устройства Victor Multilabel Counter (Wallac).
На фиг.8B представлены результаты конкурентного ELISA, проведенного для следующих шести пептидов: NIKAVPGGGS (SEQ ID NO: 200), NIKHVPGGGS (SEQ ID NO: 201), IKHVPGGGS (SEQ ID NO: 202), KHVPGGGSV (SEQ ID NO: 203), HVPGGGSVQ (SEQ ID NO: 204) и VPGGGSVQ (SEQ ID NO: 205). Пептиды KHVPGGGSV (SEQ ID NO: 203) и HVPGGGSVQ (SEQ ID NO: 204), охватывающие терапевтический эпитоп #2 белка тау, конкурировали по меньшей мере с одним из исходных терапевтических эпитопов, присутствующих на тауΔ(1-150; 392-441/4R). Удаление неподчеркнутого остатка гистидина из эпитопа SEQ ID NO: 204 привело к утрате активности конкурирования (см. пептид VPGGGSVQ, SEQ ID NO: 205). Точковая мутация, заменяющая гистидин на аланин (в соответствующем положении белка тау 299, в "эпитопе #2") привела к утрате активности конкурирования (пептид NIKAVPGGGS, SEQ ID NO: 200). Пептиды, содержавшие 2 или 3 аминокислоты перед "гистидином 299" (в направлении N-конца) также конкурировали с исходным эпитопом (пептиды IKHVPGGGS (SEQ ID NO: 202) и NIKHVPGGGS (SEQ ID NO: 201), соответственно). Эти результаты указывают на то, что минимальный эпитоп DC8E8, находящийся во втором тау-повторе (эпитоп #2) находится в 6-мерной последовательности, а именно HVPGGG (SEQ ID NO: 154).
Упомянутые выше эксперименты по картированию указали на присутствие аминокислотной последовательности PGGG в одном или нескольких эпитопах антитела DC8E8. Более того, эта аминокислотная последовательность присутствует во всех четырех эпитопах на белке тау, связываемых DC8E8 (см. SEQ ID NO: 98, 99, 100, 101). Для определения остатков в N-концевой области эпитопов DC8E8, проводили эксперименты по сканированию аланином на тау-пептиде 295-DNIKHVPGGGS-305, который содержит эпитоп DC8E8 (в 298-KHVPGGG-304, SEQ ID NO: 99), который находится во 2-ом повторяющемся домене белка тау.
Связывающую способность мутантных пептидов с DC8E8 оценивали по способности каждого пептида конкурировать с тауΔ(1-150; 392-441/4R) за связывание с DC8E8. Семь пептидов было синтезировано EZBiolabs (США) с чистотой более 85%: ANIKHVPGGGS (SEQ ID NO: 144), DAIKHVPGGGS (SEQ ID NO: 146), DNAKHVPGGGS (SEQ ID NO: 149), DNIAHVPGGGS (SEQ ID NO: 151), DNIKAVPGGGS (SEQ ID NO: 159), DNIKHAPGGGS (SEQ ID NO: 161) и пептид с исходной последовательностью DNIKHVPGGGS (SEQ ID NO: 171). Конкурентный ELISA проводили в соответствии со следующим стандартным протоколом. Планшет с высоким связыванием IWAKI, #3801-096, Bertoni GmbH, Австрия) покрывали в течение ночи при 4°C посредством 100 мкл/лунка рекомбинантного очищенного тауΔ(1-150; 392-441/4R) в PBS в концентрации 5 мкг/мл. Проводили серийные разведения (2-кратные) пептидов в PBS/Tween 20 в полипропиленовых планшетах с коническим дном лунок (Greiner, #651201) (диапазон концентраций 320 мкМ, 160 мкМ, 80 мкМ, 40 мкМ, 20 мкМ, 10 мкМ, 5 мкМ и 2,5 мкМ). Добавляли 100 мкл каждого разведения на лунку. Очищенное моноклональное антитело DC8E8 (очистку проводили, как описано ниже в примере 5) разбавляли до концентрации 2 мкг/мл в PBS/Tween 20 и 100 мкл этого разбавленного антитела смешивали с каждым серийным разведением пептидов в смесях объемом 200 мкл с 100 нг антитела/100 мкл, содержащих каждый соответствующий исследуемый пептид в концентрации 160 мкМ, 80 мкМ, 40 мкМ, 20 мкМ, 10 мкМ, 5 мкМ, 2,5 мкМ и 1,25 мкМ. Смеси антитело/пептид инкубировали в течение 1 ч при 25°C на вращающейся платформе, установленной на 250 об./мин. Сто микролитров (100 мкл) смесей антитело/пептид переносили из полипропиленовых планшетов в покрытые тауΔ(1-150; 392-441/4R) и блокированные PBS/Tween 20 планшеты IWAKI с высоким связыванием и инкубировали в течение 1 ч при 25°C на вращающейся платформе, установленной на 250 об./мин. Планшеты промывали 4× посредством PBS/Tween 20. Образцы (в планшетах) инкубировали в течение 1 ч при 25°C на вращающейся платформе (установленной на 250 об./мин.) с 100 мкл поликлонального антитела козы против иммуноглобулинов мыши/ HRP (Dako, #P0447), разбавленного 1:4000 в PBS/Tween 20. Планшеты промывали 4× посредством PBS/Tween. Затем образцы/планшеты инкубировали с 100 мкл раствора 1,5 мг/2 мл o-PDA (o-фенилендиамин, SIGMA, P1526) в 0,1 M Na-ацетате pH 6,0 (Roth, #6779), дополненного в 1,5 мкл/2 мл 30% H2O2 (SIGMA, H-0904), в течение 10 минут при 25°C в темноте. Реакцию останавливали добавлением 100 мкл 2 M H2SO4 (Merck, 1.00731.1000). За протеканием реакции наблюдали посредством считывания поглощения образцов/планшетов при 490 нм (например, с использованием устройства Victor Multilabel Counter (Wallac).
На фиг.8C представлены результаты конкурентного ELISA, проведенного для следующих семи пептидов: ANIKHVPGGGS (SEQ ID NO: 144), DAIKHVPGGGS (SEQ ID NO: 146), DNAKHVPGGGS (SEQ ID NO: 149), DNIAHVPGGGS (SEQ ID NO: 151), DNIKAVPGGGS (SEQ ID NO: 159), DNIKHAPGGGS (SEQ ID NO: 161) и DNIKHVPGGGS (SEQ ID NO: 171). Точковая мутация, заменяющая гистидин на аланин (в соответствующем положении белка тау 299, в "эпитопе #2") приводила к полной потере активности конкурирования с тауΔ(1-150; 392-441/4R) за связывание с DC8E8 (пептид DNIKAVPGGGS, SEQ ID NO: 159). Мутации, которые изменяли аминокислоты D, N, I, K и V на аланин, не устраняли активность конкурирования соответствующих мутантных пептидов (пептиды ANIKHVPGGGS (SEQ ID NO: 144), DAIKHVPGGGS (SEQ ID NO: 146), DNAKHVPGGGS (SEQ ID NO: 149), DNIAHVPGGGS (SEQ ID NO: 151), DNIKHAPGGGS (SEQ ID NO: 161). Эти результаты указывают на то, что минимальный эпитоп DC8E8, находящиеся во втором повторе белка тау (эпитоп #2) расположен в 6-мерной последовательности, а именно HVPGGG (SEQ ID NO: 154), и что DC8E8 связывается с HXPGGG (SEQ ID NO: 164).
ПРИМЕР 5: DC8E8 РАСПОЗНАЕТ НЕБЕСПОРЯДОЧНЫЙ ТАУΔ(1-150; 151-391)/4R ПРИ ОЦЕНКЕ ПОВЕРХНОСТНЫМ ПЛАЗМОННЫМ РЕЗОНАНСОМ
Поверхностный плазмонный резонанс (SPR) можно использовать для выявления связывания белка и для определения термодинамических параметров белковых комплексов (например, комплексы антитело-антиген) путем прямого мониторинга события связывания в реальном времени. Эту технологию обычно используют для охарактеризации как диагностических, так и терапевтических антител (см., например, Karlsson and Larsson, Affinity Measurement Using Surface Plasmon Resonance, Methods in Molecular Biology, Vol. 248: Antibody Engineering: Methods and Protocols. Edited by: B. K. C. Lo (c) Humana Press Inc., Totowa, NJ (2008)).
Для экспериментов SPR, моноклональное антитело DC8E8 (mAb) очищали из бессывороточного супернатанта гибридомы на аффинной колонке с белком G, следующим образом. Супернатант гибридомы доводили до pH 7,5, раствор предварительно очищали центрифугированием, фильтровали через 0,45-мкм мембранный фильтр, и наносили на 5-мл колонку с белком G-сефарозой. mAb DC8E8 элюировали с колонки с помощью 0,1 M глицина-HCl, pH 2,7. Элюированные фракции сразу нейтрализовывали 1 M Tris-HCl, pH 9,0. объединенные фракции подвергали диализу против PBS, концентрировали ультрафильтрацией и хранили при -70°C. Концентрацию антитела определяли путем измерения поглощения при 280 нм с использованием формулы c(мг/мл)=A280нм/1,43.
Для анализов с использованием SPR использовали устройство BIACORE3000 с сенсорным чипом CM5 (Biacore AB, Uppsala). Реагенты для связывания аминов (EDC, NHS, этаноламин pH 8,5), детергент P20 и 10 мМ ацетат натрия pH 5,0 были получены от Biacore AB. Эти эксперименты проводили при 25°C в PBS, pH 7,4, с 0,005% P20 (PBS-P) в качестве подвижного буфера. Как правило, 5000 ЕО (единиц ответа) поликлонального антитела против антител мыши (No. Z 0420; DakoCytomation, Glostrup, Дания) связывали при pH 5,0 через первичные амины одновременно в двух проточных ячейках, одну из которых использовали для эталонного измерения.
В каждом цикле анализа очищенный DC8E8 иммобилизовывали в аналитической проточной ячейке для достижения уровня иммобилизации 230-250 ЕО. Для определения KA, а также для определения кинетических констант скорости (kON и kOFF), двукратные серийные разведения либо белка тау (против которого исследовали аффинность DC8E8), либо PBS-P в качестве контроля, инжектировали со скоростью потока 50 мкл/мин на сенсорный чип. Кинетические данные о связывании подвергали двойному сравнению с эталоном в соответствии с Myszka, 1999, и аппроксимировали с помощью программного обеспечения для оценки BIA evaluation software 4.1 (Biacore AB) к двухфазной модели реакции. Кинетические константы скорости подвергали глобальной аппроксимации, максимальные ответы аппроксимировали локально, и совокупный ответ был установлен на ноль.
Для количественного определения аффинности DC8E8 в отношении каждого из исследуемых белков тау, определяли равновесные константы ассоциации (KA) для связывания DC8E8 с изоформой белка тау с четырьмя повторами 2N4R, изоформой белка тау с тремя повторами 2N3R, а также с небеспорядочным тауΔ(1-150; 392-441)/4R и небеспорядочным тауΔ(1-150; 392-441)/3R. Все белки тау, использованные для SPR, получали в соответствии с примером 1. Аффинность DC8E8 была наиболее высокой для тауΔ(1-150; 392-441)/4R с четырьмя повторами, за которым следовала полноразмерная изоформа белка тау с четырьмя повторами 2N4R, а затем тауΔ(1-150; 392-441)/3R с тремя повторами, и, наконец, полноразмерная изоформа белка тау с тремя повторами 2N3R (фиг.9A, B). Эти результаты подтвердили: (1) специфичность DC8E8 в отношении небеспорядочной формы белка тау, и (2) селективность DC8E8 в отношении небеспорядочного белка тау (т.е. связанный с заболеванием или патологический белок тау) относительно полноразмерного белка тау (т.е. нормальный или физиологический белок тау).
Мониторинг в реальном времени событий связывания с использованием SPR позволил измерение кинетической скорости ассоциации (kON) и диссоциации (kOFF) между DC8E8 и несколькими белками тау. Кинетика связывания DC8E8 продемонстрировала измененную конформацию для небеспорядочного тауΔ(1-150; 392-441)/4R и тауΔ(1-150; 392-441)/3R по сравнению с физиологическим 2N4R тау, на что указывает более легкодоступный эпитоп(ы) DC8E8 в небеспорядочных белках тау. Это отражается более быстрым связыванием и более высокой kON для небеспорядочных белков тау по сравнению с их полноразмерными аналогами. Более того, присутствие дополнительного участка связывания для DC8E8 на типах белка тау с четырьмя повторами привело к в 10 раз более медленной диссоциации типов белка тау 4R из комплекса с DC8E8 и соответствующей в 10 раз более низкой kOFF (фиг.10A, B; пунктирные линии интерполированы из измеренных данных путем вычислений кинетических параметров с использованием компьютерной программы BIAEvaluation v4.1).
ПРИМЕР 6: DC8E8 РАСПОЗНАЕТ ВСЕ СТАДИИ РАЗВИТИЯ НЕЙРОФИБРИЛЛЯРНОЙ ДЕГЕНЕРАЦИИ В ГОЛОВНОМ МОЗГЕ ЧЕЛОВЕКА С БОЛЕЗНЬЮ АЛЬЦГЕЙМЕРА
Ткань головного мозга человека (на парафиновых блоках) получали из Netherlands Brain Bank. Блоки нарезали на микротоме. Заключенные в парафин срезы (8 мкм) гиппокампа-энторинальной коры из головного мозга при болезни Альцгеймера (стадия Браака VI) и контроля без деменции (стадия Браака I и III) обрабатывали холодной (+4°C) 99% муравьиной кислотой в течение 1 мин при комнатной температуре (25°C). Срезы тканей инкубировали в блокирующем растворе (5% BSA, 0,3% Triton X-100 в 50 нМ Tris-HCl), а затем в течение ночи с очищенным первичным антителом DC8E8 (7,8 мг/мл; полученным, как описано в примере 5), которое было разбавлено 1:2000 в блокирующем растворе. Затем срезы инкубировали с биотинилированным вторичным антителом (Vectastain Elite ABC Kit, Vector Laboratories) при комнатной температуре в течение одного часа, а затем подвергали реакции с комплексом авидин-биотин-пероксидаза в течение 60 минут (Vectastain Elite ABC Kit, Vector Laboratories), в обоих случаях при комнатной температуре (25°C). Иммунную реакцию визуализировали с помощью набора субстрата пероксидазы (Vector VIP, Vector laboratories, Ca, США) и контрастно окрашивали метиловым зеленым (Vector Laboratories). Срезы исследовали с помощью микроскопа Olympus BX71.
Моноклональное антитело DC8E8 различало доклиническую AD, клинически начинающуюся AD и полностью развернутую конечную стадию AD. Иммуногистохимическое исследование показало, что DC8E8 обнаруживало ранние стадии (мономер, димеры тау) патологического белка тау при доклинической AD у человека - на стадии Браака I. (фиг.11A). Головной мозг содержит только ограниченное количество нейрофибриллярных узелков (NFT) в энторинальной коре и не содержит NFT в гиппокампе (стадия Браака I). В головном мозге с клинически начинающейся AD, где немного NFT было выявлено в гиппокампе (стадия Браака III), mAb DC8E8 распознавало как стадию олигомеров патологического белка тау (стрелки), так и стадию полимеров патологического белка тау (узелки) (фиг.11B). В головном мозге при полностью развернутой болезни Альцгеймера, где присутствует обширная нейрофибриллярная дегенерация, DC8E8 распознает, главным образом, полимеры патологического белка тау в форме нейрофибриллярных узелки, нейритических бляшек и нейритических нитей (фиг.11C). Таким образом, mAb DC8E8 распознает все стадии развития нейрофибриллярных очагов в ткани головного мозга человека с болезнью Альцгеймера, включая мономерную, димерную, раннюю олигомерную стадию (фиг.11 D1) и позднюю олигомерную доузелковую стадию (фиг.11 D2), а также поздние стадии развития полимеров патологического белка тау - внутриклеточные (фиг.11 D3) и внеклеточные нейрофибриллярные узелки (фиг.11 D4). Таким образом, эта реактивность mAb DC8E8 является пригодной как для диагностических, так и для терапевтических применений этого антитела.
ПРИМЕР 7: DC8E8 РАСПОЗНАЕТ ВСЕ СТАДИИ РАЗВИТИЯ НЕЙРОФИБРИЛЛЯРНОЙ ДЕГЕНЕРАЦИИ В ГОЛОВНОМ МОЗГЕ ТРАНСГЕННЫХ КРЫС SHR72, НАБЛЮДАЕМЫЕ ПРИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА У ЧЕЛОВЕКА
Линия трансгенных крыс SHR24: эта линия экспрессирует тауΔ(1-150; 392-441)/3R - белок, описанный в международной патентной заявке PCT WO 2004/007547. Получение и охарактеризация этой трансгенной линии описаны в Filipcik et al., 2010. У этих трансгенных крыс развивается прогрессирующая и зависящая от возраста нейрофибриллярная дегенерация в кортикальных областях головного мозга. Нейрофибриллярные узелки (NFT) удовлетворяли нескольким ключевым гистологическим критериям, используемым для идентификации нейрофибриллярной дегенерации при болезни Альцгеймера у человека, включая аргирофилию, двулучепреломление конго красного и реактивность в отношении тиофлавина S. Нейрофибриллярные узелки также идентифицировали с помощью антител, используемых для выявления патологического белка тау в головном мозге человека, включая DC11, которое распознает связанную с заболеванием конформацию белка тау (Vechterova et al. 2003; Kovacech et al., 2010), и антитела, которые являются специфичными к гиперфосфорилированным формам белка тау. Более того, нейрофибриллярная дегенерация характеризовалась обширным образованием нерастворимых в саркозиле комплексов белка тау, состоящих из эндогенных типов белка тау крысы и трансгенных укороченных типов белка тау (Filipcik et al., 2010). Наиболее выраженным гистопатологическим признаком этих крыс является обширная нейрофибриллярная патология - нейрофибриллярные узелки в коре. Средняя продолжительность жизни трансгенных крыс составляет 222,5 суток (SD=43,56) и наибольший период выживания достигает 475 суток (Filipcik et al., 2010).
Линия трансгенных крыс SHR72: эти трансгенные крысы экспрессируют укороченный тауΔ(1-150; 392-441)/4R человека в соответствии с международной патентной заявкой PCT WO 2004/007547 в нескольких областях головного мозга и в спинном мозге. Получение этой линии крыс описано Zilka et al., 2006, и патология белка тау была описана Koson et al., 2008. Наиболее выраженным гистопатологическим признаком этих крыс является обширная нейрофибриллярная патология, например, нейрофибриллярные узелки. Появление NFT удовлетворяло нескольким гистологическим критериям, используемым для идентификации нейрофибриллярной дегенерации при болезни Альцгеймера у человека, включая аргирофилию, двулучепреломление конго красного и реактивность в отношении тиофлавина S. NFT также идентифицировали с помощью антител, используемых для выявления патологического белка тау в головном мозге человека, включая DC11, распознающее аномальную конформацию белка тау (см. патент США № 7446180), и антител, которые являются специфичными к гиперфосфорилированным формам белка тау. Более того, нейрофибриллярная дегенерация характеризовалась обширным образованием нерастворимых в саркозиле комплексов белка тау, состоящих из эндогенных типов белка тау крысы и трансгенных укороченных типов белка тау. В гетерозиготной линии этой модели наиболее обширную нейрофибриллярную патологию наблюдали в стволе головного мозга и в спинном мозге (Zilka et al., 2006). Уровни экспрессии трансгена, нагрузка NFT, и продолжительность жизни крыс были определены ранее. Средняя продолжительность жизни для трансгенных крыс (линия SHR72) составляла 222,5 суток (SD=24,48) (Koson et al., 2008).
У линий трансгенных крыс SHR24 (экспрессирует тауΔ(1-150; 392-441)/3R) и SHR72 (экспрессирует тауΔ(1-150; 392-441)/4R) развивается обширная нейрофибриллярная дегенерация в головном мозге и спинном мозге. Линия трансгенных крыс SHR24 проявляет тяжелую нейродегенерацию в изокортексе, стволе головного мозга и спинном мозге, в то время как у трансгенных крыс SHR72 NFT развиваются в основном в стволе головного мозга и в спинном мозге, но не в коре. Прогрессирование сенсорно-двигательного и неврологического ухудшения является сходным в обеих трансгенных линиях; однако трансгенные крысы SHR72 обладают более короткой продолжительностью жизни.
В исследованиях на трансгенных крысах, описанных в настоящей заявке, использовали гемизиготных трансгенных крыс (SHR24 и SHR72). Всех крыс содержали в стандартных лабораторных условиях со свободным доступом к воде и корму и их содержали при суточных условиях освещения (циклы 12 часов на свету/в темноте с началом освещения в 7:00). Были предприняты попытки минимизировать используемое количество крыс и ограничить их неудобство, боль и страдание.
Иммуногистохимия ткани головного мозга с DC8E8: трансгенных крыс (в возрасте 7 месяцев) подвергали транскардиальной перфузии PBS в течение 1 мин под глубоким наркозом, а затем проводили перфузию 100 мл 4% параформальдегида (pH 7,4). После перфузии голову отсоединяли и головной мозг быстро извлекали. Головной мозг разрезали продольно на два полушария равного размера с использованием одноразовых лезвий скальпеля. Ткани головного мозга подвергали пост-фиксации в 4% параформальдегиде, заключали в парафин и нарезали на срезы на микротоме. Иммуногистохимическое и гистопатологическое исследование проводили на 8-мкм заключенных в парафин срезах тканей. Срезы ткани предварительно обрабатывали в течение 20 мин обнаруживающим антиген раствором (Vector laboratories, CA, США) и в течение 1 мин холодной (+4°C) 90% муравьиной кислотой (Applichem, Германия), при комнатной температуре (25°C). После блокирования срезы инкубировали в течение ночи с очищенным моноклональным антителом DC8E8 (7,8 мг/мл), разбавленным 1:2000 в блокирующем растворе (5% бычий сывороточный альбумин, 0,3% Triton X 100 в 50 нМ Tris-HCl). После промывания срезы инкубировали с биотинилированным вторичным антителом (Vectastain Elite ABC Kit, Vector laboratories) при комнатной температуре в течение одного часа, а затем подвергали реакции с раствором комплекса авидин-биотин-пероксидаза в течение 60 минут (Vectastain Elite ABC Kit, Vector laboratories), при комнатной температуре (25°C). Иммунную реакцию визуализировали с помощью набора субстрата для пероксидазы (Vector VIP, Vector laboratories, Ca, США), и срезы контрастно окрашивали метиловым зеленым (Vector laboratories). Срезы исследовали с помощью микроскопа Olympus BX71.
В головном мозге трансгенных крыс (SHR72), mAb DC8E8 распознавало олигомеры патологического белка тау на стадии заболевания (стрелки) и полимеры патологического белка тау на стадии заболевания (узелки) (фиг.12A). Более того, DC8E8 реагировало с неправильно свернутым белком тау, который расположен в аксональных волокнах. В совпадающем по возрасту контрольном головном мозге крысы антитело не окрашивало тела нейронов или аксональные отростки (фиг.12B).
Как и в случае головного мозга человека с болезнью Альцгеймера (см. выше), mAb DC8E8 распознавало все стадии развития нейрофибриллярных очагов в головном мозге трансгенных крыс SHR72, включая мономерную, димерную и раннюю олигомерную стадию (фиг.12C) и позднюю олигомерную доузелковую стадию белка тау (фиг.12D), а также поздние стадии развития полимеров патологического белка тау - внутриклеточные (фиг.12E) и внеклеточные нейрофибриллярные узелки (фиг.12F).
DC8E8 также распознавало нейрофибриллярные узелки в головном мозге трансгенных крыс, экспрессирующих тауΔ(1-150; 392-441)/3R) (SHR24, фиг.13A; SHR72, фиг.13B).
ПРИМЕР 8: DC8E8 РАСПОЗНАЕТ КАК РАСТВОРИМЫЙ НЕБЕСПОРЯДОЧНЫЙ ТИП БЕЛКА ТАУ, ТАК И НЕРАСТВОРИМЫЕ ТИПЫ БЕЛКА ТАУ ПРИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА У ЧЕЛОВЕКА И В ГОЛОВНОМ МОЗГЕ КРЫС С ТРАНСГЕННЫМ БЕЛКОМ ТАУ
Растворимый белок тау и нерастворимые комплексы белка тау выделяли из головного мозга человека с AD или из головного мозга крыс с трансгенным связанным с заболеванием белком тау (линии SHR24 и SHR72, описанные в примере 7), с использованием способа с саркозилом (Greenberg and Davies, 1990). Для экстракции белка замороженные ткани головного мозга человека с AD (аллокортекс, образцы стадий Браака V и VI, полученные из Netherlands Brain Bank) и ткани трансгенных крыс SHR24 (изокортекс, возраст 10, 12 и 14 месяцев) и трансгенных крыс SHR72 (ствол головного мозга, возраст 7,5 месяцев) гомогенизировали в 10 объемах холодного буфера для экстракции (10 мМ Tris pH 7,4, 0,8 M NaCl, 1 мМ EGTA и 10% сахароза). Гомогенаты центрифугировали в течение 20 мин при 20000 × g и 50 мкл супернатанта использовали для анализа растворимого белка тау.
Для получения нерастворимого в саркозиле белка тау в оставшиеся супернатанты добавляли N-лауроилсаркозин (SIGMA) до конечной концентрации 1% и инкубировали в течение 1 ч при комнатной температуре, при встряхивании. После центрифугирования при 100000 × g в течение 1 ч, полученные супернатанты удаляли, и осадок содержал фракцию нерастворимого в саркозиле белка тау.
Фракции растворимого белка тау и нерастворимого в саркозиле белка тау анализировали с использованием иммуноблоттинга. Фракции растворимого белка тау разбавляли равным объемом 2× буфера для нанесения образца с SDS (с β-меркаптоэтанолом) (Laemmli, 1970) и наносили 15 мкг белков на дорожку. Для фракций нерастворимого в саркозиле белка тау осадок растворяли в 1× буфере для нанесения образца с SDS в 1/50 объема растворимой фракции, используемой для получения фракции нерастворимого белка тау. Затем равные объемы растворимого белка тау и нерастворимого в саркозиле белка тау использовали для анализа с использованием иммуноблоттинга, что соответствовало 15 мкг общего белка в растворимой фракции (см. Filipcik et al., 2010). Образцы нагревали при 95°C в течение 5 мин, наносили на полиакриламидные гели с 5-20% градиентном SDS, и подвергали электрофорезу в буферной системе Tris-глицин-SDS в течение 40 минут при 25 мА. Белки переносили на мембрану из поливинилиденфторида (PVDF) (1 ч при 150 мА в 10 мМ CAPS, pH 12). После переноса мембраны блокировали в 5% обезжиренном сухом молоке в фосфатно-солевом буфере (PBS; 136,89 мМ NaCl, 2,7 мМ KCl, 8,09 мМ Na2HPO4, 1,47 мМ KH2PO4) в течение 1 ч при комнатной температуре, а затем инкубировали в течение 1 ч с супернатантом культуры гибридомы DC8E8, разбавленным 1:1 с помощью TBST-молоко (20 мМ Tris-HCl, pH 7,4, 150 мМ NaCl, 0,1% Tween 20, 5% обезжиренное сухое молоко), а затем проводили три промывания большими объемами PBS. Мембраны инкубировали (1 ч при комнатной температуре) с конъюгированным с HRP антителом козы против Ig мыши (DAKO, Дания), разбавленным 1:4000 с помощью PBS, в качестве вторичного антитела. После этой инкубации следовало промывание (три раза) 0,2% Igepal CA-630 (SIGMA) в PBS. Блоты проявляли с помощью хемилюминесцентного субстрата SuperSignal West Pico Chemiluminescent Substrate (Pierce, США), и сигналы белка выявляли с использованием визуализирующей системы LAS3000 (FUJI Photo Film Co., Япония). Интенсивность хемилюминесцентного сигнала количественно определяли с использованием программного обеспечения AIDA (Advanced Image Data Analyzer, Raytest, Straubenhardt, Германия).
DC8E8 распознавало как растворимый тауΔ(1-150; 392-441)/3R человека, так и физиологические изоформы белка тау крысы у трансгенных крыс SHR24 (фиг.14A). Более того, DC8E8 распознавало тауΔ(1-150; 392-441)/3R и патологические белки тау крысы в нерастворимых в саркозиле фракциях белка тау из головного мозга крыс SHR24 (фиг.14B). Важно, что DC8E8 строго распознавало белки тау человека во фракции нерастворимого в саркозиле белка тау в головном мозге человека с AD (стадии Браака V и VI, фиг.14B и 14C). DC8E8 распознавало как растворимый тауΔ(1-150; 392-441)/4R человека, так и полноразмерные (физиологические) изоформы белка тау крысы у трансгенных крыс SHR72 (фиг.14D). Существенно, что DC8E8 специфически распознавало патологический белок тауΔ(1-150; 392-441)/4R и патологические формы белка тау крысы во фракциях нерастворимого в саркозиле белка тау из головного мозга крыс SHR72 (фиг.14D).
ПРИМЕР 9: DC8E8 ИНГИБИРУЕТ ПАТОЛОГИЧЕСКИЕ ВЗАИМОДЕЙСТВИЯ ТАУ-ТАУ
Анализ фибриллизации белка тау. Анализ фибриллизации белка тау in vitro использовали для определения того, обладает ли DC8E8 ингибиторным эффектом на патологические взаимодействия тау-тау. Анализ основан на свойстве, присущем белкам тау, а именно, на их способности претерпевать конформационное изменение при взаимодействии с полианионами, такими как сульфатированный гликозаминогликан гепарин. Эта измененая конформация на одной молекуле белка тау далее приводит к ее патологическим взаимодействиям с другой молекулой белка тау, стабилизации комплекса тау-тау через образование поперечных структур β-слоев в связывающих микротрубочки областях взаимодействующих молекул белка тау, и, наконец, формированию парных спиралных филаментов (PHF), аналогичных структурам при болезни Альцгеймера (Skrabana et al., 2006). Образование структур, богатых бета-слоями, можно выявлять с помощью флуоресцентных красителей, таких как тиофлавин T.
Анализ для измерения эффекта DC8E8 на патологические взаимодействия тау-тау проводили в PBS (фильтрованный через 0,2-мкм фильтр), содержавшем: 20 мкМ (конечная концентрация) любой из исследуемых рекомбинантных белков тау (тауΔ(1-150; 392-441)/4R или тауΔ(1-296; 392-441)/4R), очищенных, как описано в примере 1; 5 мкМ гепарин (натриевая соль гепарина из слизистой оболочки кишечника свиньи, ≥150 МЕ/мг, в расчете на сухую массу, от SIGMA); и 12,5 мкМ (конечная концентрация) тиофлавин T. Каждую реакционную смесь (конечный объем 80 мкл) инкубировали в течение 20 ч при 37°C в закрытых черных твердых планшетах из полистирола (384 лунок, Greiner BioOne). Флуоресценцию тиофлавина T измеряли с использованием устройства для считывания флуоресценции (Fluoroskan Ascent FL (Labsystems)), с длиной волны возбуждения 450 нм, испусканием при 510 нм, и временем измерения 200 мс. Для определения ингибиторной активности mAb DC8E8 на патологические взаимодействия тау-тау, очищенный DC8E8 (пример 5) добавляли в реакционную смесь при конечной концентрации 20, перед инкубацией при 37°C. В качестве контролей использовали два антитела: DC51 (распознающее белок оболочки вируса бешенства; Macikova et al., 1992) и DC11 (распознающее определенные укороченные конформационно измененные формы белка тау, патент США № 7446180).
Количество конформационно измененного и фибрилизированного белка тау измеряли по флуоресценции тиофлавина T в отсутствие ("контроль") и в присутствии ("DC8E8") DC8E8 (фиг.15A и 15B). MAb DC8E8, добавленное в конечной концентрации 20 мкМ, препятствовало патологическому конформационному изменению и фибриллизации обоих небеспорядочных белков тау, снижая количество фибриллизированных форм патологического белка тау до менее чем 5% и 16% для тауΔ(1-150; 392-441)/4R и тауΔ(1-296;392-441)/4R, соответственно. Эта ингибиторная активность DC8E8 была статистически значимой при анализе с помощью непараметрического t-критерия ("DC8E8", p<0,001 и p<0,01 на фиг.15A и 15B, соответственно). Постороннее антитело Rab50 (Macikova et al., 1992), которое не связывается с белком тау, не препятствовало конформационному изменению белка тау, что приводило к неизмененной флуоресценции тиофлавина T ("Rab50"). Антитело DC11, которое распознает определенные патологически измененные конформации белка тау (Vechterova et al., 2003 и патент США № 7446180), далее стимулировало образование фибрилизированного белка тау; этот эффект может отражать стабилизацию патологической конформации белка тау, требуемой для аномального взаимодействия тау-тау и образования фибрилл посредством DC11.
DC8E8 также ингибировало образование димеров, тримеров и олигомеров белка тау небеспорядочным тауΔ(1-296;392-441/4R) (фиг.16). Рекомбинантный тауΔ(1-296;392-441)/4R инкубировали в течение 1, 4 и 20 ч либо в присутствии, либо в отсутствие DC8E8, как описано выше, для анализа фибриллизации. В указанные моменты времени реакцию останавливали добавлением буфера для нанесения образца с SDS. Для анализа белка 10 мкл каждой реакционной смеси для фибриллизации наносили на полиакриламидные гели с 5-20% градиентном SDS, и подвергали электрофорезу в буферной системе Tris-глицин-SDS в течение 40 минут при 25 мА. После переноса белка на мембраны из PVDF (1 ч при 150 мА в 10 мМ CAPS, pH 12), мембраны блокировали в 5% обезжиренном сухом молоке в PBS в течение 1 ч при комнатной температуре, а затем инкубировали в течение 1 ч с конъюгированным с HRP DC25 (Skrabana et al. (2006)), разбавленное 1:1000 в PBS, а затем проводили три промывания большими объемами PBS. Блоты проявляли с помощью хемилюминесцентного субстрата SuperSignal West Pico Chemiluminescent Substrate (Pierce, США), и хемилюминесцентные сигналы выявляли с использованием визуализирующей системы LAS3000 (FUJI Photo Film Co., Япония). Интенсивность хемилюминесцентного сигнала количественно определяли с использованием программного обеспечения AIDA (Advanced Image Data Analyzer, Raytest, Straubenhardt, Германия).
Эти результаты показали, что один или несколько из четырех участков связывания, которые распознает/связывает DC8E8 на белке тау человека, вовлечены в конформационные изменения мономера белка тау, фибриллизацию белка тау и в образование агрегатов белка тау (димеры, тримеры и другие олигомеры). Иными словами, одна или несколько из четырех областей белка тау, охватываемых остатками 267-KHQPGGG-273 (SEQ ID NO: 98) (1-ый повторяющийся домен белка тау), 298-KHVPGGG-304 (SEQ ID NO: 99) (2-ой повторяющийся домен белка тау), 329-HHKPGGG-335 (SEQ ID NO: 100) (3-ий повторяющийся домен белка тау) и 361-THVPGGG-367 (SEQ ID NO: 101) (4-ый повторяющийся домен белка) стимулируют и/или вовлечены в фибриллизацию белка тау и образование агрегатов белка тау (димеры, тримеры и другие олигомеры).
ПРИМЕР 10: DC8E8 ОПОСРЕДУЕТ ЗАХВАТ И ДЕГРАДАЦИЮ НЕБЕСПОРЯДОЧНОГО БЕЛКА ТАУ
Клетки микроглии мыши BV2 обрабатывали в 6-луночных планшетах в течение различных периодов времени либо 1 мкМ рекомбинантным тауΔ(1-150; 392-441)/4R отдельно, либо смесью/комплексом тауΔ(1-150; 392-441)/4R и DC8E8. Среду собирали и клетки промывали PBS, а затем в течение 1 мин мягким кислым промывочным раствором (0,5 M NaCl, 0,2 M уксусная кислота, pH 3). Затем промытые клетки лизировали в буфере TTL (20 мМ Tris pH 7,4, 150 мМ NaCl, 1 мМ EDTA, 1 мМ DTT, 0,5% Triton X-100, 50 мМ NaF, 1 мМ Na3VO4, Roche - полный ингибитор протеаз) и быстро замораживали в жидком азоте. Полученные клеточные экстракты анализировали на 12% геле SDS-PAGE и вестерн-блоте, как описано ранее (Koson et al., 2008). В кратком изложении, белки переносили на нитроцеллюлозные мембраны (Millipore, Billerica, MA, США) и окрашивали понсо S для подтверждения единообразного переноса белка, а затем мембраны исследовали с помощью супернатанта культуры гибридомы DC25, распознающего остатки белка тау 347-353 и называемого общим антителом против белков тау (Axon Neuroscience, Vienna, Австрия). Вестерн-блоттинг с антителом против GADPH (1:1000, Abeam) использовали в качестве контроля для нанесения белка. После инкубации с первичным антителом DC25 следовали промывания и инкубация с поликлональным вторичным антителом козы против IgG мыши, конъюгированным с HRP (1:3000; Dako, Glostrup, Дания). Блоты проявляли с помощью хемилюминесценного субстрата SuperSignal West Pico Chemiluminescent Substrate (Pierce, США), и хемилюминесцентные сигналы выявляли с использованием визуализирующей системы LAS3000 (FUJI Photo Film Co., Япония).
ТауΔ(1-150; 392-441)/4R добавляли к культурам клеток BV2 мыши в концентрации 1 мкМ либо отдельно, либо с 1 мкМ mAb DC8E8, как описано в предыдущем абзаце. После инкубации в течение 2, 4, 6 и 12 часов клеточные белки экстрагировали и уровни интернализованного белка тау анализировали вестерн-блоттингом. Общее антитело против белков DC25 показало присутствие небеспорядочного белка тау внутри клеток микроглии. Профиль вестерн-блоттинга показал, что деградация небеспорядочного белка тау была более быстрой в присутствии DC8E8 (фиг.17A).
Само антитело DC8E8 также было выявлено внутри клеток BV2. Фиг.17A. Более того, DC8E8 снижало нагрузку растворимого небеспорядочного белка тау в клеточной среде, что может отражать активацию внеклеточного протеолитического аппарата (фиг.17B).
ПРИМЕР 11: DC8E8 ЯВЛЯЕТСЯ СТАБИЛЬНЫМ ПРИ 37°C
DC8E8 (очищенное, как описано в примере 5), разбавляли до концентрации 2 мг/мл в PBS и аликвоты (100 мкл) инкубировали при 37°C. Через различные интервалы в 1 месяц аликвоты замораживали при -20°C. Аликвоту DC8E8 (2 мг/мл), которую продолжали хранить при -20°C в течение эксперимента, использовали в качестве "контроля". Через 4 месяца (когда все образцы были собраны) проводили анализ активности DC8E8 (связывание с рекомбинантным тауΔ(1-150; 392-441)/4R в качестве твердой фазы), и, таким образом, стабильности при хранении при 37°C, с помощью ELISA, как описано в примере 2. Каждую аликвоту DC8E8 разбавляли в 2000 раз (т.е. 2000× или 1:2000), 4000×, 8000×, 16000×, 32000×, 64000×, 128000×, 256000× и 512000×. DC8E8 было активным (при измерении по его способности связывать тауΔ(1-150; 392-441)/4R) и, таким образом, стабильным даже после инкубации в течение 4 месяцев при 37°C, по сравнению с "контролем" (фиг.18).
ПРИМЕР 12: DC8E8 СПОСОБНО СВЯЗЫВАТЬ И ИММУНОПРЕЦИПИТИРОВАТЬ КАК РАСТВОРИМЫЙ, ТАК И НЕРАСТВОРИМЫЙ БЕЛОК ТАУ ИЗ ГОЛОВНОГО МОЗГА ЧЕЛОВЕКА С AD И ИЗ ГОЛОВНОГО МОЗГА КРЫС SHR72, В ЕСТЕСТВЕННЫХ УСЛОВИЯХ, ПОДОБНЫХ УСЛОВИЯМ EX VIVO
Нерастворимые в саркозиле неправильно свернутые белки тау биохимически выделяли либо из головного мозга человека с AD, либо из головного мозга крыс с трансгенным белком тау (линия SHR72, описанная в примере 7) с использованием способа с саркозилом (Greenberg and Davies, 1990). Для экстракции белка нефиксированный замороженный головной мозг человека с AD (трансэнторинальная кора, стадия Браака V, полученная из Netherlands Brain Bank, Нидерланды) и ткани трансгенной крысы SHR72 (изокортекс, животные в возрасте 7,5 месяцев) гомогенизировали в 10 объемах ледяного буфера для экстракции [10 мМ Tris pH 7,4, 0,8 M NaCl, 1 мМ EGTA, и 10% сахароза (дополненный 50 мМ NaF, 1 мМ Na3VO4, и коктейлем ингибиторов протеаз Complete® без EDTA (от Roche)]. Гомогенаты центрифугировали в течение 20 мин при 20000 × g для удаления мембранного материала. Для получения фракций нерастворимого в саркозиле белка тау в супернатанты добавляли N-лауроилсаркозин (SIGMA) до конечной концентрации 1% и инкубировали в течение 1 ч при комнатной температуре, при встряхивании. После центрифугирования при 100000 × g в течение 1 ч, полученные супернатанты удаляли и осадок промывали один раз 3 мл фосфатно-солевого буфера (PBS, 8,09 мМ Na2HPO4, 1,47 мМ KH2PO4, 136,89 мМ NaCl, 2,7 мМ (KCl)). Затем осадок, который соответствует белковой фракции головного мозга, обогащенной олигомерными и полимерными неправильно свернутыми типами белка тау (т.е. связанные с заболеванием белки тау), ресуспендировали в 1 мл PBS (дополненном 50 мМ NaF, 1 мМ Na3VO4 и коктейлем ингибиторов протеаз Complete® без EDTA (Roche)) путем обработки ультразвуком в течение 2 минут на льду с использованием Bandelin Sonopuls HD2200/UW2200, оборудованного зондом MS72, с 20% рабочим циклом с мощностью, установленной на 20% (Bandelin Electronic, Германия).
Полученные суспензии (как из головного мозга человека с AD, так и из головного мозга в модели AD на крысах), обогащенные связанными с заболеванием белками тау, разделяли на две 500-мкл части и в каждую часть добавляли 25 мкг одного из двух очищенных антител: либо DC8E8, либо контрольного антитела Rab50 (распознающее белок оболочки вируса бешенства; Macikova et al., 1992). Суспензии инкубировали с антителами с вращением вдоль вертикальной оси при 6°C в течение 2 часов. Для выделения образовавшихся комплексов антитело-связанный с заболеванием белок тау, в каждую реакционную суспензию добавляли 50 мкл 50% суспензии гранул Protein G Mag Sepharose beads (GE Healthcare), уравновешенных в PBS, которые далее инкубировали при 6°C в течение 1 часа. Гранулы со связавшимися с ними комплексами антитело-белок тау собирали и промывали три раза PBS (дополненный 50 мМ NaF, 1 мМ Na3VO4, 0,02% IGEPAL CA-630 (SIGMA) и коктейлем ингибиторов протеаз Complete® без EDTA (Roche)). Связавшиеся комплексы антитела элюировали с гранул путем трех отдельных инкубаций в течение 5 мин в 100 мкл 200 мМ муравьиной кислоты, pH 2,7. Элюаты объемом 100 мкл объединяли, лиофилизировали, белки растворяли в буфере для нанесения образца SDS-PAGE (Laemmli, 1970), разделяли на 12% гелях SDS-PAGE, переносили на нитроцеллюлозные мембраны, и белки тау выявляли путем инкубации с общим антителом против белков тау DC25 (эпитоп 347-353 2N4R тау, Axon Neuroscience, Vienna, Австрия), конъюгированным с HRP (Kementec, Дания), как описано выше. После инкубации (1 ч при комнатной температуре) следовало промывание (три раза) 0,2% Igepal CA-630 (SIGMA) в PBS. Блоты проявляли с помощью хемилюминесцентной субстратной системы SuperSignal West Pico Chemiluminescent Substrate system (Pierce, США) и сигналы выявляли с использованием визуализирующей системы aLAS3000 (FUJI Photo Film Co., Япония).
DC8E8 распознает, нацеливается и связывает все формы связанных с заболеванием белков тау: олигомерные и полимерные неправильно свернутые типы белка тау в головном мозге пациента с болезнью Альцгеймера (фиг.19A). На дорожке 1 на фиг.19A представлены биохимически экстрагированные типы патологического белка тау из головного мозга человека с AD. На дорожке 3 представлены типы тау, распознаваемые, связываемые DC8E8 и выделяемые путем иммунопреципитации с DC8E8. Профиль связанных/иммунопреципитированных посредством DC8E8 связанных с заболеванием типов белка тау представлял собой профиль биохимически экстрагированных белков тау. Эти результаты демонстрируют эффективное распознавание DC8E8 ex vivo патологических типов белка тау в головном мозге человека, т.е. в экстрактах, где белки находятся в подобной in vivo немодифицированной форме, демонстрируя, что DC8E8 обладает полезными терапевтическими свойствами, являясь способным нацеливаться на связанные с заболеванием типы белка тау in vivo. Контрольное антитело Rab50 ("имитирующее антитело", дорожка 2) не распознает никакой из белков тау, присутствующих в экстракте головного мозга, что подтверждает, что связывание DC8E8 с белками тау является специфическим.
На фиг.19B представлено количество имитирующего антитела (Rab50) и DC8E8 (дорожки 2 и 3, соответственно), использованного для иммунопреципитации белков тау. Положения тяжелой и легкой цепей DC8E8 также обозначены на дорожке 3 фиг.19A. Присутствие более высокого количества цепей антитела искажает профиль связанного с заболеванием белка тау.
DC8E8 также распознает и нацеливается на все формы неправильно свернутого (связанного с заболеванием) белка тау в головном мозге крыс SHR72 в модели болезни Альцгеймера. На фиг.20A на дорожке 1 представлены биохимически экстрагированные связанные с заболеванием типы белка тау из головного мозга трансгенных крыс. Инкубация антитела DC8E8 с экстрактом головного мозга трансгенных крыс обеспечила иммунную очистку связанных с заболеванием типов белка тау, присутствующих в головном мозге (фиг.20A, дорожка 3). Очищенные с помощью DC8E8 типы белка тау продемонстрировали профиль, идентичный профилю биохимически выделенных белков тау (фиг.20A, дорожка 1), что подтверждает, что DC8E8 распознает и связывает все патологические типы белка тау, присутствующие в головном мозге трансгенной крысы. Небольшое искажение профиля связывания белков тау вызвано присутствием тяжелой и легкой цепей антитела DC8E8 (обозначены на фиг.20A, дорожка 3). Имитирующее антитело Rab50 (фиг.20A, дорожка 2) не связывало никакие из белков тау.
На фиг.20B представлено количество имитирующего антитела (Rab50) и DC8E8 (дорожки 2 и 3, соответственно), используемого для иммунной очистки белков тау из экстракта головного мозга крыс в трансгенной модели болезни Альцгеймера. Положения тяжелой и легкой цепей DC8E8 также обозначены на дорожке 3 фиг.20A. Присутствие более высокого количества цепей антитела немного исказило профиль связанного с заболеванием белка тау.
ПРИМЕР 13: МОНОКЛОНАЛЬНОЕ АНТИТЕЛО DC8E8 УСТРАНЯЕТ ПАТОЛОГИЧЕСКИЙ БЕЛОК ТАУ ИЗ ГОЛОВНОГО МОЗГА ТРАНСГЕННЫХ КРЫС SHR72
Гибридомные клетки, продуцирующие либо DC8E8, либо Rab50 (отрицательное контрольное антитело, распознающее вирус бешенства) культивировали в DMEM, содержавшей 10% NHS и 1% глутамин. Клетки подсчитывали в камере для подсчета Burker. Суспензии клеток, содержавшие 500000 клеток на миллилитр, центрифугировали при 100×g в течение 5 мин и осадок ресуспендировали в 1 мл PBS. Суспензии клеток вновь осаждали при 100×g в течение 5 мин, и осадок ресуспендировали в 5 мкл PBS.
Для этих экспериментов использовали трансгенных крыс SHR72 (в возрасте 6 месяцев) (3 крысы на группу). По меньшей мере за один час до хирургической операции крысам подкожно вводили иммунодепрессивное лекарственное средство - сандиммун (15 мг/кг). Трансгенных крыс подвергали анестезии смесью тилетамин-золазепам (100 мг/мл)/ксилазин (20 мг/мл) в соотношении 3:5, инъецируемой внутрибрюшинно. Дозирование анестетиков было следующим: золетил (30 мг/кг) и ксиларием (10 мг/кг). Головы подвергнутых анестезии крыс фиксировали в стереотаксическом аппарате (David Kopf Instruments, Tujunga, CA, США) путем помещения фиксирующих рычагов в ушные каналы каждого животного. В голове каждого животного просверливали отверстие с использованием хирургической дрели в соответствии с выбранными стереотаксическими координатами (латеральные 5 мм; передне-задние 4 мм; дорсовентральные -5 мм относительно брегмы). Суспензии клеток гибридом, продуцирующих либо DC8E8 (105 клеток), либо Rab50 (105 клеток), билатерально инъецировали в бахромку гиппокампа головного мозга крыс. Вскоре после операции внутримышечно вводили кетонал (5мг/кг). Сандиммун (15 мг/кг) вводили подкожно в течение 8 суток после операции. Энроксил (20 мг/кг/24 ч) вводили с питьевой водой в течение 10 суток.
Через две недели после хирургической операции крыс подвергали анестезии смесью золетила (30 мг/кг) и ксилариема (10 мг/кг). Через 2-5 минут крыс помещали на препаровальный столик, и их брюшную полость вскрывали. Перед перфузией проводили взятие крови для анализа уровней белка тау и антитела в сыворотке крови. Иглу для перфузии помещали в левый желудочек сердца, и крыс подвергали перфузии PBS в течение 2 минут с использованием перистальтического насоса (тип pp1-05, Zalimp, скорость - 10×, степень 7-22 мл/1 мин перфузионной жидкости). Каждую крысу декапитировали, ее череп открывали с помощью Paean, и головной мозг (с частью спинного мозга) осторожно извлекали. Головной мозг разрезали продольно на две части; правую сторону фиксировали в 4% PFA (4°C) в течение ночи. Левую сторону разрезали и ствол головного мозга и кортикальные области быстро замораживали в жидком азоте.
Количество антитела DC8E8 в сыворотке подвергнутых введению животных определяли с помощью ELISA, как описано ниже в примере 19, с использованием тауΔ(1-150; 392-441)4R в качестве твердой фазы. Сыворотку каждого животного (A, B, C) подвергали серийному разведению от 100× до 12800× (фиг.21A). Концентрацию антитела DC8E8 в сыворотке определяли с использованием очищенного DC8E8 в качестве стандарта. DC8E8 достигало концентраций 466, 200 и 273 нг/мл у животных, которым проводили введение (A, B, C, для группы введения DC8E8, соответственно).
Также определяли концентрацию белка в сыворотках каждого подвергнутого введению животного. Это осуществляли с использованием набора Innotest hTAU ELISA kit (Innogenetics, Бельгия), в соответствии с протоколом изготовителя. Введение DC8E8 обеспечивало транспорт комплексов антитело-белок тау в кровь, где белок тау достигал средней концентрации 350 пг/мл. Этот эффект DC8E8 помогает устранить патологические белки тау из головного мозга. С другой стороны, не было выявлено белков тау в сыворотке животных, которым вводили имитирующее антитело (Rab50), которое распознает белок оболочки вируса бешенства (Macikova et al., 1992). На графике показаны средние значения со стандартными ошибками среднего значения (SEM) (фиг.21B).
Фиксированные ткани головного мозга погружали в парафин и нарезали на микротоме. Иммуногистохимическое исследование проводили на 8-мкм заключенных в парафин срезах. Срезы тканей обрабатывали в течение 20 минут кипящим обнаруживающим антиген раствором (Vector laboratories, Burlingame, CA, США) и в течение 1 минуты 85% муравьиной кислотой (Applichem, Darmstadt, Германия). После блокирования срезы тканей инкубировали с mAb DC8E8 в течение ночи, а затем проводили промывания и инкубацию (в течение 1 часа при комнатной температуре) с биотинилированным вторичным антителом (Vectastain Elite ABC Kit, Vector laboratories). После промывания срезы подвергали реакции с комплексом авидин-биотин-пероксидаза (Vectastain Elite ABC Kit, Vector laboratories) в течение 60 минут при комнатной температуре. Иммунную реакцию визуализировали с помощью набора субстрата для пероксидазы VIP (Vector VIP, Vector laboratories, Burlingame, CA, США). Для количественного определения внутринейронального сигнала DC8E8 использовали верхний оливарный комплекс. Общий сигнал количественно определяли в индивидуальных двигательных нейронах, по меньшей мере в 15 нейронах на срез. Анализ изображения проводили с использованием программного обеспечения AIDA (Advanced Image Data Analyzer, Raytest, Straubenhardt, Германия). Подсчет проводили на срезах всех подвергнутых введению животных, а затем статистически оценивали с использованием непараметрического критерия Манна-Уитни.
Определение (фиг.22B) количества патологического белка тау в верхнем оливарном комплексе срезов животных с имитирующим введением (фиг.22A, правая панель) и животных, которым вводили DC8E8 (фиг.22A, левая панель) продемонстрировало снижение количества патологического белка тау в исследованных областях головного мозга у всех трех животных, которым вводили DC8E8, по сравнению с животными с имитирующим введением (p<0,0001) (фиг.22A и 22B).
ПРИМЕР 14: КАРТИРОВАНИЕ ОСТАТКОВ В АКТИВНОМ ЦЕНТРЕ DC8E8, КОТОРЫЕ ВЛИЯЮТ НА РАСПОЗНАВАНИЕ DC8E8 ТЕРАПЕВТИЧЕСКИХ ЭПИТОПОВ БЕЛКА ТАУ
a) Клонирование одноцепочечного антитела DC8E8 и мутагенез активного центра антитела. Чтобы упростить картирование аминокислотных остатков mAb DC8E8, необходимых для распознавания белков тау, получали функциональную одноцепочечную версию (scDC8E8v) полноразмерного DC8E8 mAb. Это осуществляли с использованием кДНК легкой и тяжелой цепей DC8E8, полученных, как описано в примере 3.
Вариабельные области DC8E8 далее амплифицировали с помощью ПЦР с использованием праймеров для клонирования, имеющих участки для ферментов рестрикции NcoI (прямой праймер: 5'- ATATTACCATGGACATTGTGATGTCACAG-3' (SEQ ID NO: 155)) и XhoI (обратный праймер: 5'-ATATTATTCTCGAGGGAGACGGTGACTGAGGT-3' (SEQ ID NO: 156)) и олигонуклеотидные линкерные последовательности (VH-LINK-F: 5'-GGCGGCGGCGGCTCCGGTGGTGGTGGTTCCATGCAGGTCCAATTGCAGCAG-3' (SEQ ID NO: 157); VL-LINK-R: 5'-GGAGCCGCCGCCGCCAGAACCACCACCACCAGAACCACCACCACCCCGTTTG ATGTCCAGCTTGGTGCC-3' (SEQ ID NO: 158)), которые использовали для связывания вариабельных областей тяжелой и легкой цепей (линкерную последовательность конструировали в соответствии с Krebber et al., 1997). После расщепления выделенных продуктов ПЦР (с использованием ферментов NcoI и XhoI) и очистки с помощью агарозного гель-электрофореза фрагменты клонировали в расщепленную посредством NcoI и XhoI плазмиду pET22b с использованием ДНК-лигазы T4 (Fermentas, Германия). Бактериальный штамм DH5α использовали для амплификации полученной плазмиды и правильное расположение вставки в выбранных клонах подтверждали с помощью анализа с ферментами рестрикции. Правильность последовательности полученной одноцепочечной конструкции DC8E8 (scDC8E8v) подтверждали секвенированием ДНК с использованием анализатора 3130 Genetic Analyzer (Applied Biosystems, США).
b) Идентификация с помощью сканирующего аланином мутагенеза остатков в активном центре DC8E8, которые влияют на распознавание DC8E8 патологического белка тау. Для идентификации остатков, которые влияют на связывание DC8E8 с белком тау, проводили сканирующий Ala мутагенез выбранных участков (выделенных полужирных шрифтом и подчеркнутых, см. ниже) scDC8E8v. Аминокислоты, выбранные для замены на Ala, были идентифицированы, исходя из работы MacCallum et al. (J. Mol. Biol. 1996). Мутагенез scDC8E8v проводили способом удлинения с перекрыванием с использованием мутантных олигонуклеотидов в ПЦР по стандартным методикам, описанным в "Molecular Cloning: A Laboratory manual", Sambrook and Russell (2001).
Мутантные отдельные цепи приведены ниже относительно каждой исходной последовательности DC8E8. Мутантные остатки выделены полужирным шрифтом и подчеркнуты. Названия мутантных отдельных цепей состоят из номера конструкции, сокращенного обозначения тяжелой или легкой цепи (VH или VL), однобуквенного кода исходной аминокислоты в DC8E8, за которым следует его положение в последовательности легкой и тяжелой цепей SEQ ID NO: 141 и 138, соответственно, а затем A для каждого заменяющего аланин. Например, мутантный 1-VL-N31A соответствует одноцепочечному мутанту номер 1, где в вариабельную область легкой цепи внесена мутация в положении 31 (относительно DC8E8), путем замены аспарагина 31 (N31) аланином (A)):
Вариабельная область легкой цепи DC8E8 (CDR подчеркнуты):

Мутации в CDR1 [SEQ ID NO: 117] (мутантные остатки выделены полужирным шрифтом и подчеркнуты): QSLLNSRTRKNY (SEQ ID NO: 117) (исходная последовательность CDR1 DC8E8)
1 - VL-N31A [SEQ ID NO: 247]
2 - VL-R33A [SEQ ID NO: 248]
3 - VL-Y38A [SEQ ID NO: 249]
Мутация в каркасной области FR2, предшествующей CDR2: LAWYQQKPGQSPKLLIY (SEQ ID NO: 160) (исходная последовательность каркасной области FR2 DC8E8)
4 - VL-Y55A [SEQ ID NO: 252]
Мутация в CDR2 [SEQ ID NO: 118]: WAS (SEQ ID NO: 118) (исходная последовательность CDR2 DC8E8)
5 - VL-W56A [SEQ ID NO: 253]
Мутации в CDR3 [SEQ ID NO: 119]: KQSFYLRT (SEQ ID NO: 119) (исходная последовательность CDR3 DC8E8)
6 - VL-K95A [SEQ ID NO: 254]
7 - VL-Q96A [SEQ ID NO: 255]
8 - VL-S97A [SEQ ID NO: 256]
9 - VL-F98A [SEQ ID NO: 257]
10 - VL-Y99A [SEQ ID NO: 258]
11 - VL-L100A [SEQ ID NO: 259]
12 - VL-R101A [SEQ ID NO: 260]
Вариабельная область тяжелой цепи DC8E8 (CDR подчеркнуты):

Мутации в CDR1 [SEQ ID NO: 120] (мутантные остатки выделены полужирным шрифтом и подчеркнуты): GYIFTDYVIS (SEQ ID NO: 120) (исходная последовательность CDR1 DC8E8)
14 - VH-Y32A [SEQ ID NO: 261]
15 - VH-V33A [SEQ ID NO: 262]
Мутация в каркасной области FR2, предшествующей CDR2: WVKQRTGQGLEWIGE (SEQ ID NO: 162) (исходная последовательность каркасной области FR2 DC8E8)
16 - VH-E50A [SEQ ID NO: 263]
Мутации CDR2 [SEQ ID NO: 121]: IFPRSGST (SEQ ID NO: 121) (исходная последовательность CDR2 DC8E8)
17 - VH-F52A [SEQ ID NO: 264]
18 - VH-S57A [SEQ ID NO: 265]
Мутации в CDR3 [SEQ ID NO: 122]: ARDYYGTSFAMDY (SEQ ID NO: 122) (исходная последовательность CDR3 DC8E8)
19 - VH-D99A [SEQ ID NO: 266]
20 - VH-Y100A [SEQ ID NO: 267]
21 - VH-Y101A [SEQ ID NO: 268]
22 - VH-G102A [SEQ ID NO: 269]
Аналитическая и препаративная экспрессия рекомбинантных вариантов антитела DC8E8: конструкции ДНК pET22b-scDC8E8v антитела дикого типа и его мутантов (все из которых являются His-меченными) трансформировали в клетки E. coli продуцирующего штамма BL21 (DE3). Для полученных клонов сначала подтверждали продукцию рекомбинантного scDC8E8v. Индивидуальные колонии, полученные после трансформации, инокулировали в 2 мл среды LB, дополненной 100 мкг/мл ампициллина и выращивали при 37°C в течение 5 часов при постоянном встряхивании (Sambrook and Russell 2001). 100-мкл аликвоту каждой культуры отбирали, смешивали с 2/3 объема 100% глицерина и хранили замороженной при -80°C до последующего применения. Экспрессию рекомбинантного белка индуцировали добавлением изопропил-β-D-1-тиогалактопиранозида (IPTG) до конечной концентрации 1 мМ и инкубацию продолжали в течение дополнительных 3 часов. Клетки собирали центрифугированием в настольной центрифуге при 4°C в течение 1 мин при 10000×g, супернатант удаляли, клеточный осадок ресуспендировали в 1× буфере для образца с SDS (Laemmli, 1970) и кипятили в течение 5 минут. Образцы центрифугировали в течение 5 минут при 10000×g и супернатанты (бактериальные лизаты) анализировали с помощью SDS-полиакриламидного гель-электрофореза (SDS-PAGE). Разделенные белки визуализировали путем окрашивания кумасси бриллиантовым синим R250 (SIGMA).
Для препаративной экспрессии каждого антитела scDC8E8v (нативного и мутантного), бактериальные клетки, содержащие соответствующие экспрессирующие плазмиды, культивировали и индуцировали, как описано в "Molecular Cloning: A Laboratory manual", Sambrook and Russell (2001). Трансформированные клетки выращивали при 37°C в 100-500 мл среды LB с 100 мкг/мл ампициллина при 230 об./мин. Когда поглощение в культуре при 600 нм достигало 0,8-1,0, добавляли IPTG до конечной концентрации 1 мМ для индукции экспрессии scDC8E8v. После дальнейшей инкубации при 37°C в течение 3 часов, клетки собирали центрифугированием при 3000 g в течение 15 мин при 4°C. Клеточный осадок ресуспендировали в 10 мл лизирующего буфера (50 мМ PIPES pH 6,9, 50 мМ NaCl, 0,1 мМ PMSF) и обрабатывали ультразвуком на льду 6 раз в течение 30 с и с паузами 30 с, используя наконечник TT-13 (рабочий цикл 50%, выходная мощность 50 Вт, Sonopuls HD 2200, Bandelin, Германия). Лизат очищали центрифугированием (21000 × g в течение 15 мин при 4°C). Лизаты фильтровали через 0,45-мкм мембранный фильтр и хранили при -80°C до применения. Для исследования успешной индукции и уровня экспрессии 1 мл индуцированной культуры собирали, клетки собирали центрифугированием, как описано выше, ресуспендировали в 100 мкл 1 × буфера для образца SDS, кипятили в течение 5 минут при 95°C, а затем анализировали с помощью SDS-PAGE (фиг.23A). Цитоплазматический лизат использовали для связывания/выявления белков тау (анализом с использованием вестерн-блоттинга) и для определения с использованием SPR аффинности рекомбинантных антител в отношении белка тау, оба из которых являются показателями активности нативных и мутантных антител scDC8E8v.
ПРИМЕР 15: РЕКОМБИНАНТНЫЙ ФРАГМЕНТ SCFV МОНОКЛОНАЛЬНОГО АНТИТЕЛА DC8E8 (SCDC8E8V) РАСПОЗНАЕТ ПАТОЛОГИЧЕСКИЙ БЕЛОК ТАУ (ТАУΔ(1-150; 392-441)/4R)
Для определения связывающих свойств scDC8E8v с патологическим формами белка тау, белковый лизат из бактерий, экспрессирующих scDC8E8v, разбавляли в 16 раз в буфере TBS-T (20 мМ Tris pH 7,4, 150 мМ NaCl, 0,1% Tween 20) и использовали для нанесения на нитроцеллюлозную мембрану, содержащую 500, 250 и 125 нг рекомбинантного укороченного белка тау (тауΔ(1-150; 392-441)/4R) и рекомбинантного укороченного на C-конце белка тау (тауΔ228-441) (окрашивание белков понсо S, фиг.23B). Связавшееся scDC8E8v выявляли с помощью иммуноблоттинга с антителом против 6xhis-меткой (SEQ ID NO: 163) (No. A00174; GenScript, Piscataway, NJ, США) и визуализировали с помощью конъюгированным с HRP антителом против антител кролика (DAKO Cytomation, Дания) (фиг.23C). Блоты проявляли с помощью хемилюминесцентного субстрата SuperSignal West Pico Chemiluminescent Substrate (Pierce, США), выявляемого с использованием визуализирующей системы LAS3000 (FUJI Photo Film Co., Япония).
Анализ с использованием вестерн-блоттинга продемонстрировал, что рекомбинантное одноцепочечное антитело (scDC8E8v) выявляет укороченный белок тау [тауΔ(1-150; 392-441)/4R]. Связывание является специфическим, поскольку scDC8E8v не распознает контрольный укороченный белок тау тауΔ228-441, который не содержит ни один из четырех терапевтических эпитопов, распознаваемых неизмененным DC8E8 (фиг.23C, дорожка 4). Исследование нитроцеллюлозной мембраны, содержащей белки тау (нанесенные, как показано на фиг.23B) с помощью лизата контрольных бактерий, не экспрессирующих scDC8E8v, не обеспечило никакого сигнала (фиг.23D).
ПРИМЕР 16: РЕКОМБИНАНТНЫЙ ФРАГМЕНТ SCFV МОНОКЛОНАЛЬНОГО АНТИТЕЛА DC8E8 (SCDC8E8V) ПРОЯВЛЯЕТ СВОЙСТВА СВЯЗЫВАНИЯ БЕЛКА ТАУ, СХОДНЫЕ С АНТИТЕЛОМ DC8E8 - СЕЛЕКТИВНО РАСПОЗНАЕТ ПАТОЛОГИЧЕСКИЙ БЕЛОК ТАУ (ТАУΔ(1-150; 392-441)/4R) И В ЗНАЧИТЕЛЬНОЙ СТЕПЕНИ ОТЛИЧАЕТ ЕГО ОТ ФИЗИОЛОГИЧЕСКОГО НАТИВНОГО БЕЛКА ТАУ (TAU2N4R)
Для количественного определения свойств связывания белка тау у рекомбинантного одноцепочечного антитела scDC8E8v, проводили кинетическое определение аффинности с использованием SPR (Biacore 3000, Biacore, Швеция) для измерения связывания scDC8E8v с патологическим укороченным белком тау (тауΔ(1-150; 392-441)/4R) (фиг.24A) и с нормальной изоформой белка тау человека с четырьмя повторами 2N4R (фиг.24B). Для этого 11000 ОЕ поликлонального антитела кролика против His-метки (No. A00174; GenScript, Piscataway, NJ, США) иммобилизовывали на сенсорном чипе CM5. Все эксперименты проводили при 25°C в PBS pH 7,4 с 0,005% P20 (PBS-P) в качестве подвижного буфера. Рекомбинантное His-меченное scDC8E8v иммобилизовывали в аналитической проточной ячейке для достижения уровня иммобилизации 60 ОЕ, и известные концентрации каждого белка тау или контрольного образца PBS-P инжектировали со скоростью потока 100 мкл/мин над сенсорным чипом. Кинетические данные связывания подвергали двойному сравнению с эталоном и аппроксимировали с помощью программного обеспечения для оценки BIA evaluation software 4.1 (Biacore AB) к модели взаимодействия 1:1. Кинетические константы скорости подвергали глобальной аппроксимации, максимальные ответы аппроксимировали локально, и совокупный ответ был установлен на ноль.
Кинетические измерения показали более высокую константу скорости ассоциации и более низкую константу скорости диссоциации scDC8E8v в отношении патологического связанного с AD тауΔ(1-150; 392-441)/4R, чем в отношении нормального тау 2N4R (фиг.24C). Следовательно, аффинность scDC8E8v в отношении укороченного связанного с AD белка тау является более высокой (более высокая величина равновесной константы ассоциации KA), чем в отношении полноразмерной изоформы белка тау 2N4R. Эти измерения подтвердили, что одноцепочечная версия антитела DC8E8 (scDC8E8v) демонстрирует предпочтение связывания в отношении конформационно измененных патологических белков тау, подобно исходному полноразмерному антителу DC8E8. Таким образом, рекомбинантное scDC8E8v пригодно для идентификации аминокислотных остатков в активном центре антитела DC8E8, ответственных за его свойства связывания.
ПРИМЕР 17: ИДЕНТИФИКАЦИЯ ОСТАТКОВ В АКТИВНОМ ЦЕНТРЕ SCDC8E8V, КОТОРЫЕ ВЛИЯЮТ НА РАСПОЗНАВАНИЕ SCDC8E8V/DC8E8 ЭПИТОПОВ ПАТОЛОГИЧЕСКОГО БЕЛКА ТАУ
Несколько аминокислоных остатков, которые влияют на взаимодействие DC8E8-антиген, были определены путем сканирующего аланином мутагенеза остатков активного центра scDC8E8v. Потенциальные контактирующие с антигеном остатки в легкой и тяжелой цепях идентифицировали, исходя из работы MacCallum et al. (J. Mol. Biol., 1996) и подвергали мутации на аланин, как описано в примере 14. Затем мутантные версии scDC8E8v экспрессировали в штамме BL21 E. coli (фиг.25A, одноцепечечные белки указаны звездочками). Свойства связывания мутантного scDC8E8v анализировали вестерн-блоттингом (фиг.25B-C). На фиг.25B представлено окрашивание понсо S нитроцеллюлозных мембран, содержащих различные количества укороченного белка тауΔ(1-150; 392-441)/4R. Идентичные мембраны использовали для выявления укороченного белка тау различными мутантными одноцепочечными антителами (фиг.25C).
Исходя из этих результатов, аминокислотные остатки в вариабельной области DC8E8 были подразделены на три основных категории следующим образом:
Категория 1: Остатки, приведенные в этой категории (полужирным шрифтом) вносили наибольший вклад в связывание scDC8E8v с патологическим укороченным связанным с AD белком тау (тауΔ(1-150; 392-441)/4R). Мутация любого из этих остатков на аланин в наибольшей степени препятствовала распознаванию DC8E8 эпитопов на белке тау.
Остатки категории 1 в легкой цепи DC8E8:
Аспарагин в положении 31 в CDRL1 [SEQ ID NO: 117]
Тирозин в положении 38 в CDRL1 [SEQ ID NO: 117]
Серин в положении 97 в CDRL3 [SEQ ID NO: 119]
Остатки категории 1 в тяжелой цепи DC8E8:
Глутаминовая кислота в положении 50 в FRH2, предшествующей CDRH2 [SEQ ID NO: 121]
Тирозин в положении 101 в CDRH3 [SEQ ID NO: 122]
Категория 2: Остатки, приведенные в этой категории, вносят вклад в связывание scDC8E8v с патологическим белком тау (тауΔ(1-150; 392-441)/4R). Мутация любого из этих остатков на аланин снижает реактивность scDC8E8v в отношении укороченного связанного с AD белка тау (тауΔ(1-150; 392-441)/4R), но препятствует ей в меньшей степени, чем мутации остатков категории 1:
Остатки категории 2 в легкой цепи DC8E8:
Тирозин в положении 55 в каркасной области FRL2, предшествующей CDRL2 [SEQ ID NO: 118]
Лизин в положении 95 в CDRL3 [SEQ ID NO: 119]
Остатки категории 2 в тяжелой цепи DC8E8:
Серин в положении 57 в CDRH2 [SEQ ID NO: 121]
Тирозин в положении 100 в CDRH3 [SEQ ID NO: 122]
Глицин в положении 102 в CDRH3 [SEQ ID NO: 122]
Категория 3: Остатки, приведенные в этой последней категории, вносят наименьший вклад в связывание scDC8E8v с патологическим связанным с AD белком тау (тауΔ(1-150; 392-441)/4R). Мутация этих остатков на аланин не изменяет реактивности scDC8E8v в отношении укороченного белка тау (тауΔ(1-150; 392-441)/4R):
Остатки категории 3 в легкой цепи:
Аргинин в положении 33 в CDRL1 [SEQ ID NO: 117]
Триптофан в положении 56 в CDRL2 [SEQ ID NO: 118]
Глутамин в положении 96 в CDRL3 [SEQ ID NO: 119]
Фенилаланин в положении 98 в CDRL3 [SEQ ID NO: 119]
Тирозин в положении 99 в CDRL3 [SEQ ID NO: 119]
Лейцин в положении 100 в CDRL3 [SEQ ID NO: 119]
Аргинин в положении 101 в CDRL3 [SEQ ID NO: 119]
Остатки категории 3 в тяжелой цепи:
Тирозин в положении 32 в CDRH1 [SEQ ID NO: 120]
Валин в положении 33 в CDRH1 [SEQ ID NO: 121]
Фенилаланин в положении 52 в CDRH2 [SEQ ID NO: 121]
Аспарагиновая кислота в положении 99 в CDRH3 [SEQ ID NO: 122]
ПРИМЕР 18: АКТИВНАЯ ВАКЦИНАЦИЯ ТЕРАПЕВТИЧЕСКИМИ ЭПИТОПАМИ БЕЛКА ТАУ: ПОЛУЧЕНИЕ ИММУНОГЕНОВ ДЛЯ ВАКЦИН НА ОСНОВЕ ОДНОГО ИЗ СВЯЗЫВАЮЩИХ ЭПИТОПОВ DC8E8 НА БЕЛКЕ И ВВЕДЕНИЕ ВАКЦИНЫ
a. Пептиды: Пептидные иммуногены, состоящие из синтетических фрагментов белка тау человека 2N4R, были синтезированы в Antagene, Inc. (Sunnyvale, CA) и EZBiolab, США, с чистотой более 95%. Каждую пептидную последовательность конструировали так, чтобы она охватывала по меньшей мере одну из последовательностей, предположительно вовлеченных в и/или стимулирующих фибриллизацию/агрегацию белка тау (новые "терапевтические эпитопы"-мишени), и эти эпитопы были идентифицированы, как описано выше и с помощью анализов, описанных в примерах 1-11, в качестве участков связывания для DC8E8. См. фиг.26A. Эти четыре последовательности также называют в настоящем описании "терапевтическими эпитопами" (см. ниже). Эти эпитопы соответствуют мотивам взаимодействия тау-тау (эпитопы агрегации), которые важны для фибриллизации белка тау/сборки PHF. Таким образом, нацеливание на эти стратегические терапевтические эпитопы может приводить к успешному лечению AD и родственных таупатий. Более того, использование такой специфической направленной против белка тау терапии может оказаться безопаснее, чем широко нацеленные способы терапии, основанные на случайным образом выбранных эпитопах на белках тау, поскольку полагают, что нацеливание на некоторые эпитопы белка вызывают аутоиммунный ответ и потенциально усиливают заболевание (Furlan et al., 2003; Gruden et al., 2004).
Таким образом, для дальнейшего определения терапевтического потенциала иммунотерапии на основе белков тау, было сконструировано несколько наборов тау-пептидов для применения в качестве иммуногенов. Все из остатков относятся к остаткам полноразмерного белка тау 2N4R, который имеет 441 аминокислотный остаток. Первый набор иммуногенов состоял из тау 251-PDLKNVKSKIGSTENLKHQPGGGKVQIINK-280, SEQ ID NO: 1; тау 256-VKSKIGSTENLKHQPGGGKVQIINKKLDLS-285, SEQ ID NO: 2; тау 259-KIGSTENLKHQPGGGKVQIINKKLDLSNVQ-288, SEQ ID NO: 3; тау 275-VQIINKKLDLSNVQSKCGSKDNIKHVPGGG-304, SEQ ID NO: 4; тау 201-GSPGTPGSRSRTPSLPTPPTREPKKVAWR-230, SEQ ID NO: 5; тау 379-RENAKAKTDHGAEIVYKSPWSGDTSPRHL-408, SEQ ID NO: 6; тау 181-TPPSSGEPPKSGDRSGYSSPGSPGTPGSRS-210, SEQ ID NO: 7; тау 300-VPGGGSVQIVYKPVDLSK-317, SEQ ID NO: 8; и тау 294-KDNIKHVPGGGS-305, SEQ ID NO: 108. Некоторые из этих последовательностей содержат фосфорилированные эпитопы, ранее встречавшиеся при патологии белка тау при AD. Таким образом, тау-пептид SEQ ID NO: 5 содержит фосфорилированный треонин в положении 217, тау-пептид SEQ ID NO: 6 содержит фосфорилированные остатки серина в положениях 396 и 404, и тау-пептид SEQ ID NO: 7 содержит фосфорилированный серин в положении 202 и треонин в положении 205. Тау-пептид SEQ ID NO: 2 синтезировали в нефосфорилированной и фосфорилированной форме. Фосфорилированная форма содержит фосфорилированный остаток серина в положении 262.
В этом наборе одна подгруппа иммуногенов (тау-пептиды SEQ ID NO: 1-4 и 108) охватывает один из терапевтических эпитопов, соответствующих либо SEQ ID NO: 98 (тау 267-KHQPGGG-273), либо SEQ ID NO: 99 (тау 298-KHVPGGG-304). Другая подгруппа тау-пептидов (SEQ ID NO: 5-7) охватывает фосфорилированные участки, встречающиеся при болезни Альцгеймера и других таупатиях. Тау-пептид SEQ ID NO: 8 не содержит каких-либо из упомянутых эпитопов и его использовали в качестве контроля (фиг.26).
Второй набор пептидов состоял из SEQ ID NO: 9-97, которые отражают перекрывающиеся последовательности, охватывающие остатки 244-390 белка тау человека 2N4R. Каждый из этих пептидов содержит одну из последовательностей терапевтических эпитопов в отличающемся окружении, основанном на белке тау. Иными словами, в каждой подгруппе каждый из эпитопов с #1 по #4 окружен отличающимися остатками белка тау на обоих из его N- и C-концов. (фиг.26).
b. Конъюгация для применения в качестве вакцины: Тау-пептиды SEQ ID NO: 2, 4, 7 и 108 конъюгировали с гемоцианином лимфы улитки (KLH) через цистеиновый линкер.
Для этого тау-пептиды SEQ ID NO: 2, 4, 7 и 108 синтезировали в качестве связанных с цистеином пептидов с дополнительным расположенным на N-конце остатком цистеина с целью достижения ориентированного присоединения пептида на поверхности белка KLH. Пептиды связывали с носителем KLH через бифункциональный сшивающий линкер N-[γ-малеимидобутирилокси]сукцинимидный сложный эфир (GMBS). Для получения реакционной смеси для конъюгации, 20 мг KLH (Calbiochem) растворяли в буфере для конъюгации (PBS с 0,9 M NaCl, 10 мМ EDTA) до концентрации 10 мг/мл путем осторожного перемешивания в течение 10 минут. Для получения активированного малеинимидом KLH, 2 мг активного бифункционального сшивающего линкера GMBS растворяли в 50 мкл безводного диметилформамида и смешивали с 2 мл раствора KLH в течение 1 часа при комнатной температуре. Затем не вступивший в реакцию GMBS удаляли на 5-мл колонке для обессоливания HiTrap Desalting column (GE Healthcare), уравновешенной буфером для конъюгации. Конъюгацию проводили при соотношении пептида к активированному малеинимидом KLH 1:1 (масс./масс., 20 мг пептида) в течение 2 ч при комнатной температуре (25°C). Полученные конъюгаты подвергали диализу против 100-кратного избытка PBS с четырьмя заменами буфера для диализа, чтобы удалить неконъюгированный пептид. После диализа конъюгаты центрифугировали при 21000×g в течение 15 мин при 2°C. Завершенность конъюгации подтверждали по отсутствию свободного пептида в буфере для диализа, определяемому с использованием LC-MS/MS. Конъюгаты разделяли на аликвоты и хранили при -20°C до применения.
c. Получение вакцины: для получения иммунизирующих доз с адъювантом алюминий/квасцы AdjuPhos (Brenntag Biosector, Дания), 200 мкг каждого соответствующего конъюгата тау-пептида (растворенного в 150 мкл PBS) эмульгировали в соотношении 1:1 (об./об.) с адъювантом AdjuPhos в конечном объеме дозы 300 мкл. Каждую суспензию/эмульсию инкубировали при вращении при 4°C в течение ночи, чтобы позволить пептиду адсорбироваться на частицы фосфата алюминия.
Для получения иммунизирующих доз с полным адъювантом Фрейнда 200 мкг каждого соответствующего конъюгата тау-пептида (растворенного в 150 мкл PBS) эмульгировали в соотношении 1:1 (об./об.) с полным адъювантом Фрейнда в конечном объеме дозы 300 мкл. Для вспомогательных доз иммуноген получали аналогичным образом, но эмульгировали в неполном адъюванте Фрейнда.
d. Введение вакцины: Полученные дозы вакцин инъецировали крысам с трансгенным белком тау, имеющим трансген укороченного белка тау человека (линия SHR72, описанная выше в примере 7, экспрессирующая тауΔ(1-150; 392-441)/4R (Zilka et al., 2006). Крысам проводили первую подкожную инъекцию 200 мкг иммуногена в конечном объеме 300 мкл в возрасте 2 месяца, а затем проводили вторую инъекцию через три недели, а затем по схеме раз в месяц. Контрольным крысам вводили адъювант, смешанный 1:1 с PBS. Оценка эффективности иммунотерапии описана в примере 19.
Выделение и очистка эмбрионального белка тау крыс для применения в качестве внутреннего стандарта в количественном анализе нерастворимого белка тау у крыс, которым вводили вакцину: Очистку эмбрионального белка тау крыс проводили, по существу как описано в Ivanovova et al., 2008, с использованием 1% перхлорной кислоты. Ткань головного мозга, полученную от детенышей крыс в возрасте 1-7 суток, гомогенизировали в ледяной 1% перхлорной кислоте (1,5 г ткани на 5 мл перхлорной кислоты, PCA) и оставляли стоять на льду в течение 20 мин. Гомогенат центрифугировали при 15000×g в течение 20 мин, и прозрачный супернатант концентрировали и одновременно заменяли буфер на промывочный буфер (20 мМ Tris, pH 7,4, 150 мМ NaCl, 0,1% Tween 20) с использованием устройства Amicon Ultra Centrifugal Filter device (Millipore). Фильтрованные экстракты головного мозга PCA, содержавшие приблизительно 10 мг тотальных белков, наносили при скорости потока 0,2 мл/мин на колонку Poly-Prep C10/10 (GE Healthcare), заполненную сефарозой, содержащей иммобилизованное общее mAb против белков тау DC25 (см. выше). Не связавшиеся белки смывали 10-15 мл промывочным буфером до тех пор, пока поглощение элюируемых фракций (при 280 нм) не становилось стабильным. Эмбриональный белок тау, связавшийся с mAb DC25, элюировали с помощью 0,1 M глицина, pH 2,6. Элюированные 0,5-мл фракции сразу нейтрализовывали 50 мкл 1 M Tris-HCl, pH 9, и анализировали с помощью SDS-PAGE. Фракции, содержавшие эмбриональный белок тау, концентрировали с использованием устройства Amicon Ultra Centrifugal Filter device (Millipore) при одновременной замене буфера на PBS. Эмбриональный белок тау, очищенный аффинной хроматографией, преципитировали в соответствии с Chen et al., (2005), путем добавления четырех объемов ледяного ацетона, содержавшего 10% трихлоруксусную кислоту. Смесь инкубировали при -20°C в течение 2 часов и центрифугировали при 15000×g в течение 20 мин при 2°C. Супернатант удаляли и осадок ресуспендировали в 1 мл ледяного ацетона, оставляли стоять на льду в течение 20 мин и вновь центрифугировали, как описано выше. Полученный осадок сушили при комнатной температуре и растворяли в объеме PBS, равном объему до преципитации.
ПРИМЕР 19: ОБЩИЕ СПОСОБЫ ОЦЕНКИ ВАКЦИН НА ОСНОВЕ ТАУ-ПЕПТИДОВ В МОДЕЛЯХ БОЛЕЗНИ АЛЬЦГЕЙМЕРА НА ТРАНСГЕННЫХ КРЫСАХ
Активные вакцины оценивали с помощью следующих подходов: (a) биохимически, путем оценки эффекта их введения на уровни фосфорилированных форм нерастворимого белка тау с использованием иммуноблоттинга образцов головного мозга крысы со специфичными к фосфорилированию моноклональными антителами AT270, DC209, DC217 и AT8, и общего количества нерастворимого белка тау с использованием общего моноклонального антитела против белков тау DC25; (b) нейроповеденческий подход, с использованием оценки NeuroScale; (c) иммуногистохимически, включая количественное определение NFT; и (d) путем анализа индуцированного антительного ответа. Пассивные вакцины также можно оценивать доклинически с помощью одного или нескольких из этих подходов, среди прочих.
(a). Биохимический анализ: фракции нерастворимых белков тау получали с использованием способа с саркозилом (Greenberg and Davies, 1990) из ствола головного мозга трансгенных крыс (SHR72), иммунизированных исследуемыми пептидами, а также крыс SHR72 с имитирующим введением (которым инъецировали только адъювант (контроль)), как описано в примере 8. Образцы нерастворимого в саркозиле белка тау анализировали иммуноблоттингом с использованием различных моноклональных антител, как описано ниже. Результаты этого анализа иммуногенных пептидов SEQ ID NO: 1-8 и 108 обобщенно представлены на фиг.26B. Было показано, что уровни нерастворимого белка тау коррелируют с прогрессированием патологии белка тау у трансгенных крыс SHR72. Koson et al., 2008.
Анализ с использованием иммуноблоттинга: Образцы фракций нерастворимого в саркозиле белка тау растворяли в 1× буфере для нанесения образца с додецилсульфатом натрия (SDS) (Laemmli, 1970) в 1/50 объема растворимой фракции (см. Filipcik et al., 2010) и нагревали при 95°C в течение 5 мин. 6 мкл каждого образца наносили на полиакриламидные гели с 5-20% градиентом SDS и подвергали электрофорезу в буферной системе Tris-глицин-SDS в течение 40 минут при 25 мА. Белки переносили на PVDF-мембраны (1 ч при 150 мА в 10 мМ CAPS, pH 12). После переноса мембраны блокировали в 5% обезжиренном молоке в PBS в течение 1 ч при комнатной температуре, а затем инкубировали в течение 1 ч с первичными (тау-специфическими) моноклональными антителами (см. ниже для более подробного описания каждого антитела), а затем проводили три промывания большим объемом PBS. После промывания использовали конъюгированное с HRP антитело козы против Ig мыши (DAKO, Дания), разбавленное 1:4000 PBS в качестве вторичного антитела. После инкубации (1 ч при комнатной температуре) следовало промывание (три раза) 0,2% Igepal в PBS. Блоты проявляли с помощью хеминлюминесцентного субстрата SuperSignal West Pico Chemiluminescent Substrate (Pierce, США) и сигнал выявляли с использованием визуализирующей системы LAS3000 (FUJI Photo Film Co., Япония). Интенсивность сигнала количественно определяли с использованием программного обеспечения AIDA (Advanced Image Data Analyzer, Raytest, Straubenhardt, Германия). В качестве внутреннего стандарта для количественного анализа использовали эмбриональный белок тау (0,6 мкг/дорожка).
Моноклональные антитела AT8 и AT270 приобретали от Innogenetics (Бельгия) и оба из них использовали для анализа с использованием иммуноблоттинга. AT8 также использовали для иммуногистохимии. AT8 распознает фосфорилированный серин 202 и треонин 205, расположенные в богатом пролином домене белка тау, который вносит основной вклад в аффинность связывания белка тау с микротрубочками. AT270 распознает фосфорилированный треонин 181, расположенный также в богатом пролином домене. Оба антитела связывают растворимый и нерастворимый белок тау. Специфичные к фосфорилированию моноклональные антитела DC209 (распознает pT231), DC217 (распознает pT217), использованные в этом исследовании, были получены от Axon Neuroscience, GmbH (Vienna, Австрия). Общее антитело против белков тау DC25 (Axon Neuroscience, GmbH) распознает эпитоп в четвертом связывающем микротрубочке повторе на C-конце белка тау (347-353) во всех формах растворимого и нерастворимого белка тау. Антитело DC25 распознает белки тау, независимо от их уровня фосфорилирования.
(b). Нейроповеденческая оценка: Нейроповеденческие ответы у крыс оценивали через 10 суток после последней дозы вакцины с использованием NeuroScale, которая представляет собой набор поведенческих исследований, первоначально разработанных для трансгенных крыс, экспрессирующих укороченный белок тау человека (Korenova et al., 2009). NeuroScale состоит из сенсорно-двигательных (испытание хождения по перекладине), нервно-мышечных (испытание мышечной тяги с захватом), и неврологических заданий (ориентировка в пространстве, выпрямление, поза, ушные раковины, вздрагивание, и рефлекс убегания в виде растяжения задних конечностей), дополненных основными наблюдательными оценками.
Общее наблюдение вовлекало оценку позы и функции конечностей; неврологическая оценка включала основные рефлекторные ответы, все из которых классифицировали по 1-балльной шкале (нормальный ответ 0; замедленный или неполный ответ 1 балл). Оценку рефлекса убегания в виде растяжения задних конечностей оценивали по 3-балльной шкале (нормальный ответ 0-1; дефицит 2-3 балла).
Для испытания хождения по перекладине использовали три типа сегментов для прохождения (3×3 см, 4×2 см, и округлая перекладина диаметром 3,5 см). Максимальное количество баллов составляло 10 (5 баллов для задержки + 5 баллов для соскальзываний задних конечностей на одном типе перекладины). Чем ниже показатель, полученный в испытании хождения по перекладине, тем лучше способность к сенсорно-двигательной координации у исследуемого животного. Сумма баллов, которую возможно было достигнуть, составляла 30.
Для испытания мышечной тяги с захватом крысе позволяли схватить передними конечностями горизонтальную стальную проволоку (диаметром 3 мм), подвешенную на 76 см выше поверхности с мягкой обивкой. Измеряли период до падения с проволоки. Максимальное присваемое количество баллов составляло 5, что отражает тяжелое нарушение нервномышечной функциональности и мышечную слабость. Чем больше период до падения, тем ниже показатель, полученный в этом задании, отражающий мышечную силу передних конечностей и подвижность исследуемого животного.
Показатель NeuroScale вычисляли из показателей, полученных в индивидуальных исследованиях. Максимальный возможный общий показатель составлял 49 баллов при суммировании вклада наблюдательской оценки, неврологического исследования, трех серий испытания хождения по перекладине и испытания мышечной тяги с захватом. Чем тяжелее нейроповеденческое нарушение, тем выше показатель NeuroScale.
(c). Иммуногистохимия: Для сбора образцов головного мозга крыс подвергали транскардиальной перфузии PBS в течение 2 минут под глубоким наркозом. После перфузии головной мозг крыс извлекали и разрезали продольно на два равных по размеру полушария. Ствол головного мозга и мозжечок правого полушария извлекали для биохимических анализов. Левое полушарии фиксировали 4% параформальдегидом в течение ночи при 4°C, а затем проводили обработку 25% сахарозой в течение 48 часов для обеспечения криопротекции. Затем материал замораживали в холодном 2-метилбутане (-42°C) в течение 30 c и нарезали на срезы на криомикротоме. Продольные срезы (40 мкм) нарезали в криостате при -18°C. Для иммуногистохимических исследований использовали свободноплавающие срезы.
Иммуногистохимическое окрашивание проводили на замороженных срезах головного мозга крыс, которым проводили введение, и контрольных крыс. Koson et al., 2008, показали, что количество NFT в головном мозге трансгенных крыс SHR72 коррелирует с временем смерти животных (т.е. чем больше NFT, тем раньше смерть животного). Для анализа нейрофибриллярных изменений в головном мозге крыс получали продольные срезы головного мозга. Свободноплавающие срезы тканей обрабатывали холодной (+4°C) 80% муравьиной кислотой в течение 30 c при комнатной температуре (25°C). Срезы головного мозга инкубировали в течение 20 минут при комнатной температуре в PBS, содержавшем 0,3% Triton X-100 и 1% H2O2, а затем проводили инкубацию в течение 30 минут в блокирующем растворе (PBS, содержащий 0,3% Triton X-100, 1% сыворотка лошади), а затем проводили инкубацию в течение ночи при 4°C либо с очищенным антителом AT8 (0,2 г/мл в блокирующем буфере), либо с супернатантом культуры гибридомы DC217 (1:100 в блокирующем буфере). Оба антитела продемонстрировали сходный профиль иммунного окрашивания в стволе головного мозга трансгенных крыс. После промывания срезы подвергали иммунному окрашиванию с использованием стандартного способа с авидином-биотином-пероксидазой (ABC Elite, Vector laboratories, Burlingame, CA). Продукт реакции визуализировали с использованием системы авидин-биотин и Vector VIP в качестве хромогена (Vector laboratories). Затем срезы исследовали с помощью микроскопа Olympus BX 51.
(d). Антительный ответ: Перед началом исследования (т.е. перед первой инъекцией) и через две недели после последней инъекции у трансгенных крыс проводили взятие крови. Антительный ответ на введенный иммуноген/вакцину определяли с помощью ELISA с использованием серийно разведенных образцов плазмы. Пептидными иммуногенами, рекомбинантным белком тауΔ(1-150; 392-441)/4R и рекомбинантной полноразмерной изоформой белка тау 2N4R, по отдельности покрывали 96-луночнцые планшеты (IWAKI, Япония) в концентрации 10 мкг/мл в PBS в течение ночи при 37°C. После блокирования 1% обезжиренным сухим молоком в PBS планшеты промывали PBS-0,05% Tween 20 и инкубировали с 50 мкл/лунка серийных разведений плазмы (1:200-1:128000 в блокирующем буфере) в течение 1 ч при 37°C. После инкубации и промывания конъюгированное с пероксидазой вторичное антитело (антитело кролика против Ig крысы, DAKO, Дания) разбавляли 1:1000 и наносили в лунки (50 мкл/лунка) в течение 1 ч при 37°C. Реакцию проявляли с помощью o-фенилендиамина в растворе субстрата пероксидазы (0,1 M фосфатный буфер) и останавливали 50 мкл 2M H2SO4. Поглощение при 492 нм измеряли с использованием устройства для считывания Multiscan MCC/340 ELISA (Labsystems). Данные поглощения, по меньшей мере в два раза превышающие величину отрицательных контролей, считали положительными.
Измерения аффинности проводили с использованием SPR, как описано выше в примере 5. В кратком изложении, эксперименты проводили при 25°C в фосфатно-солевом буфере, pH 7,4, с 0,005% P20 (PBS-P) в качестве подвижного буфера. 3000 ЕО (единиц ответа) поликлонального антитела против антител мыши (No. Z 0420; DakoCytomation, Glostrup, Дания) связывали в концентрации 5 мкг/мл (полученной путем разведения в 40 раз исходного раствора 200 мкг/мл 0,5× PBS в 10 мМ натрий-ацетатном буфере, pH 4,5) через первичные амины, одновременно с двумя проточными ячейками, одну из которых использовали при измерении в качестве эталона. В каждом цикле анализа разбавленную в 1000 раз сыворотку иммобилизовывали в аналитической проточной ячейке для достижения уровня иммобилизации ~850 ЕО, который приближался к насыщению. Для определений KA, а также для определения кинетических констант скорости, 100 нМ растворы иммуногенных тау-пептидов или белков тау инжектировали со скоростью потока 100 мкл/мин на сенсорный чип. Инжекцию PBS-P использовали для вычитания фонового сигнала в методике двойного сравнения с эталоном (Myszka, J Mol Rec, 1999). Кинетические данные аппроксимировали с помощью программного обеспечения для оценки BIA evaluation software 4.1 (Biacore AB) к модели реакции 1:1. Кинетические константы скорости подвергали глобальной аппроксимации, максимальные ответы аппроксимировали локально, и совокупный ответ был установлен на ноль.
ПРИМЕР 20: ВАКЦИНЫ НА ОСНОВЕ ТАУ-ПЕПТИДОВ, СОДЕРЖАЩИЕ ПО МЕНЬШЕЙ МЕРЕ ОДНУ ИЗ ЧЕТЫРЕХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ТЕРАПЕВТИЧЕСКИХ ЭПИТОПОВ, ИМЕЮТ БЛАГОПРИЯТНЫЕ ЭФФЕКТЫ У ТРАНСГЕННЫХ КРЫС, КОТОРЫЕ ЯВЛЯЮТСЯ МОДЕЛЬЮ БОЛЕЗНИ АЛЬЦГЕЙМЕРА У ЧЕЛОВЕКА
a. SEQ ID NO: 1, тау 251-PDLKNVKSKIGSTENLKHQPGGGKVQIINK-280. Трансгенных крыс (SHR72) иммунизировали тау-пептидом SEQ ID NO: 1, составленным с адъювантом Adju-phos.
Преобразование белка тау из растворимых в нерастворимые в саркозиле патологические формы считают важной стадией развития связанной с белком тау патологии и, по-видимому, оно зависит от нескольких факторов, таких как концентрация белка тау, укорочение белка тау и степень фосфорилирования белка тау (Alonso et al., 2001; Koson et al., 2008; Kovacech and Novak, 2010). Результаты количественного анализа с использованием иммуноблоттинга нерастворимого белка тау в нерастворимых в саркозиле фракциях головного мозга, полученных от группы крыс, иммунизированных тау-пептидом SEQ ID NO: 1, и от контрольной группы, представлены на фиг.26C. Вакцинация уменьшала количество нерастворимого белка тау у крыс, иммунизированных тау251-280 (SEQ ID NO: 1) по сравнению с контрольными крысами, которым вводили только адъювант (фиг.26C). Это снижение наблюдали как для общих уровней нерастворимоого белка тау (при оценке с помощью общего антитела против белков тау DC25, распознающего остатки 347-353), а также для всех других исследованных имеющих значение при AD эпитопов белка тау (заместительные маркеры AD), представленных на фиг.26B и 26C и известных тем, что они присутствуют в нерастворимых в саркозиле фракциях. Действительно, иммунизация тау-пептидом SEQ ID NO: 1 индуцировала статистически значимое (p<0,001) снижение уровня нерастворимого белка тау, которое наблюдали на уровне общего нерастворимого белка тау (71%) с использованием общего моноклонального антитела против белков тау DC25 (фиг.26 B,C). Анализ с помощью DC217 (pThr217), AT270 (pThr181), показал тенденцию в направлении снижения уровней фосфорилирования Thr217 (42%) и pThr181 (58%) нерастворимого белка тау у иммунизированных крыс по сравнению с контрольными крысами. Более слабый эффект введения (11%) наблюдали для фосфоэпитопа pThr231 нерастворимого белка тау (фиг.26B). Эти результаты указывают на то, что вакцина активировала механизм, ответственный за ингибирование агрегации белка тау, и/или механизм, вовлеченный в снижение уровней белков тау, подверженных взаимодействию тау-тау.
Для крыс, которым вводили иммуноген в виде тау-пептида SEQ ID NO: 1, было продемонстрировано статистически значимое снижение латентности выхода в испытании хождения по перекладине (*p=0,045) по сравнению с контрольными крысами (фиг.27A). Аналогично, число соскальзываний задних конечностей было снижено в вакцинированной группе по сравнению с контролями; однако это отличие было статистически малозначимым (p=0,059, фиг.27B). Показатель NeuroScale (описанный в примере 19, выше) вычисляли из величин, полученных в испытаниях хождения по перекладине, испытаниях мышечной тяги с захватом и неврологической оценке (основные рефлексы, рефлекс убегания в виде растяжения задних конечностей). Иммунизация улучшала показатель NeuroScale у крыс, которым вводили пептид SEQ ID NO: 1, по сравнению с контрольной группой, однако это улучшение не было статистически значимым (p=0,065, фиг.27C). Общий показатель NeuroScale подтвердил нейроповеденческое улучшение у крыс, которым проводили введение, по сравнению с крысами без введения. Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни.
Нейроповеденческие параметры коррелировали с уровнями нерастворимого белка тау в стволе головного мозга. Крысы, которым проводили введение, с низкими уровнями нерастворимого белка тау, продемонстрировали более низкую латентность выхода и соскальзывание задних конечностей по сравнению с контролями. Эти данные указывают на то, что снижение уровня высоконерастворимого неправильно свернутого белка тау приводит к функциональному улучшению у иммунизированных крыс, что может иметь терапевтическую ценность. Иммунотерапия тау-пептидом SEQ ID NO: 1 привела к улучшению нейроповеденческих параметров у крыс, которым проводили введение. Этот эффект сопровождался снижением уровней нерастворимого белка тау в головном мозге иммунизированных крыс. Эти данные указывают на то, что снижение уровней нерастворимых белков тау имеет терапевтическую пользу.
Эффективность иммунотерапии тау-пептидом SEQ ID NO: 1 далее исследовали на иммуногистохимическом уровне (фиг.28). Нейрофибриллярные узелки (NFT) анализировали с использованием антител против белка тау AT8, DC217, которые распознают фосфорилированные эпитопы на патологическом белке тау, в стволе головного мозга трансгенных крыс SHR72, которым проводили введение и контрольных трансгенных крыс SHR72 с имитирующим введением, которым вводили только адъювант/PBS. Количество NFT определяли с использованием полуколичественного способа. Было назначено три количественных уровня: 1) нет или мало нейрофибриллярных узелков (вплоть до 3 в стволе головного мозга); 2) умеренный (много NFT, в основном, в ретикулярной формации ствола головного мозга); и 3) тяжелый (много NFT во всех областях ствола головного мозга). "Обширный" означает стадию от умеренной до тяжелой нейрофибриллярной нейродегенерации. Иммуногистохимический анализ показал 50% снижение нагрузки нейрофибриллярными узелками в группе трансгенных животных, которым вводили вакцину.
Снижение уровней нерастворимого белка тау, измеренных биохимически, коррелировало с результатами иммуногистохимического анализа. Данные об иммунизации SEQ ID NO: 1 демонстрируют лечебную способность этого пептида, содержащего эпитоп № 1 DC8E8.
b. SEQ ID NO: 2, тау 256-VKSKIGSTENLKHQPGGGKVQIINKKLDLS-285. Трансгенных крыс (SHR72) иммунизировали тау-пептидом SEQ ID NO: 2, конъюгированным с носителем KLH (как описано выше).
Анализ с использованием иммуноблоттинга показал, что вакцина снижала количество нерастворимого белка тау у иммунизированных крыс по сравнению с контрольными крысами, которым вводили только адъювант. На фиг.29 показано снижение всех подвергнутых мониторингу эпитопов, присутствующих в нерастворимом/агрегированном белке тау. Количественный анализ иммунореактивности общего антитела против белков тау DC25 продемонстрировал 41% снижение уровня нерастворимого белка тау (статистически значимое, p<0,001) у иммунизированных крыс по сравнению с контрольными крысами, которым вводили только адъювант (фиг.26B). Аналогично, иммунореактивность других антител, распознающих фосфорилированные специфичные к AD эпитопы на нерастворимом белке тау была снижена (фиг.26B и фиг.29). Кроме того, введение не оказывало влияния на уровень другого фосфоэпитопа белка тау, который был сформирован двумя фосфоостатками Ser202/Thr205 и который, как известно, является маркером патологии AD. Вакцина индуцировала 80% снижение уровня этого эпитопа у иммунизированных трансгенных крыс по сравнению с крысами, которым не проводили введение. Аналогично, уровни фосфорилированных эпитопов белка тау Thr217, Thr231 и Thr181, были снижены на 72% (p<0,001), 64% и 74% (p<0,01), соответственно. Эти результаты указывают на то, что вакцина индуцировала механизм, ответственный за ингибирование агрегации белка тау и/или механизм, снижающий уровни типов белка тау, подверженных патологическому взаимодействию тау-тау.
Крыс подвергали поведенческим анализам, и на фиг.30 представлены результаты, полученные в испытании хождения по перекладине (фиг.30A), испытании соскальзывания задних конечностей (фиг.30B) и в анализе NeuroScale (фиг.30C, *p,0,05). Наблюдали положительную тенденцию в отношении латентности выхода при хождении по перекладине (p=0,096) в группе крыс, которым вводили тау-пептид SEQ ID NO: 2. Иммунизация снижала число соскальзываний задних конечностей в испытании хождения по перекладине; однако отличие не было статистически значимым (p=0,25) по сравнению с контрольной группой. Испытания двигательных нарушений вместе с испытанием мышечной тяги с захватом и неврологическим исследованием были обобщены в показатель NeuroScale. На фиг.30 представлено статистически значимое улучшение показателя NeuroScale у крыс, которым вводили тау-пептид SEQ ID NO: 2, по сравнению с контрольной группой (*p=0,036). Как правило, иммунизация тау-пептидом SEQ ID NO: 2 улучшала общую двигательную активность. Улучшение на нейроповеденческом уровне коррелировало со снижением количества нерастворимого белка тау (матричный белок тау при AD) у иммунизированных животных по сравнению с контролями. Эти данные указывают на то, что снижение уровней нерастворимого белка тау может иметь терапевтическую пользу.
Эффективность иммунотерапии тау-пептидом SEQ ID NO: 2 далее исследовали на иммуногистохимическом уровне (фиг.31). Для этой цели использовали два различных антитела против белка тау (AT8, DC217), которые распознают как фосфорилированный растворимый, так и нерастворимый белок тау. Нейрофибриллярная патология у этих крыс (SHR72) локализуется в основном в стволе мозга и в спинном мозге и частично в мозжечке (данные не представлены). Количество NFT определяли с использованием полуколичественного способа. Было назначено три количественных уровня: 1) нет или мало нейрофибриллярных узелков (вплоть до 3 в стволе головного мозга); 2) умеренный (много NFT, в основном, в ретикулярной формации ствола головного мозга); и 3) тяжелый (много NFT во всех областях ствола головного мозга). "Обширный" означает стадию от умеренной до тяжелой нейрофибриллярной нейродегенерации. Иммунотерапия пептидом SEQ ID NO: 2 снижала количество трансгенных крыс с обширными NFT в стволе головного мозга практически на 60% (фиг.31).
Эти результаты демонстрируют, что вакцинация тау-пептидом SEQ ID NO: 2 демонстрирует несколько желательных результатов для вакцины: 1) снижение уровня нерастворимого белка тау в головном мозге иммунизированных трансгенных крыс на биохимическом уровне; 2) смягчение сенсорно-двигательных дефицитов у иммунизированных трансгенных крыс на поведенческом уровне; и 3) уменьшение количеств нейрофибриллярных очагов на иммуногистохимическом уровне.
SEQ ID NO: 2, тау 256-VKSKIGSTENLKHQPGGGKVQIINKKLDLS-285 с фосфорилированным Ser262. SEQ ID NO: 2, содержащий фосфорилированный серин в положении 262, конъюгировали с KLH.
Иммуноблоттинг фракций нерастворимого в саркозиле белка тау в головном мозге крысы с помощью антитела DC25 показал, что вакцина статистически значимо снижала общее количество нерастворимого белка тау на 46% (p<0,01) у иммунизированных животных по сравнению с контрольными трансгенными крысами, которым вводили адъювант отдельно (фиг.32 и фиг.26B, измерения на основе DC25 (данные "347-353")). Аналогично, количественное определение сигналов DC209 (pThr231), DC217 (pThr217), AT8 (pSer202, pThr205) и AT270 (pT181) продемонстрировало более низкие уровни нерастворимого фосфорилированного белка тау в иммунизированной группе животных по сравнению с контролями (фиг.26B). Однако снижение уровней фосфорилированного нерастворимого белка тау в положениях pThr217 (p<0,001; 73%), pThr231 (84%), pSer202/pThr205 (82%) и pThr181 (p<0,01; 82%) было более выраженным, чем снижение, наблюдаемое для общего нерастворимого белка тау. Эти изменения уровней фосфоэпитопов, вовлеченных в каскад неправильного сворачивания белка тау при AD, являются полезным индикатором эффекта лечения. Снижение имеющих значение при AD эпитопов белка тау демонстрирует, что вакцина активировала механизм, ответственный за ингибирование агрегации белка тау и/или механизм, снижающий уровни белка тау, подверженного патологическим взаимодействиям с эндогенным белком тау.
Иммуногистохимический профиль (фиг.33) демонстрирует, что иммунотерапия фосфопептидом SEQ ID NO: 2 привела к снижению количества трансгенных крыс с обширными NFT в стволе головного мозга. В иммунизированной группе наблюдали 78% снижение количества трансгенных крыс с обширными NFT, по сравнению с контрольной неимунизированной группой. Иммунизация останавливала развитие патологии белка тау в головном мозге иммунизированных животных. Сходный эффект был получен на биохимическом уровне, со снижением уровней нерастворимого белка тау на основе проанализированных имеющих значение при AD эпитопов (фиг.26B и 32).
Эти результаты демонстрируют, что вакцинация тау-фосфопептидом SEQ ID NO: 2/pSer262 вызывала: 1) снижение уровня нерастворимого белка тау в головном мозге иммунизированных трансгенных крыс на биохимическом уровне; и 2) положительный эффект введения на ряд нейрофибриллярных очагов на иммуногистохимическом уровне.
d. SEQ ID NO: 3, тау 259-KIGSTENLKHQPGGGKVQIINKKLDLSNVQ-288. Трансгенных крыс (линия SHR72) иммунизировали тау-пептидом SEQ ID NO: 3, составленным с адъювантом на основе квасцов (AdjuPhos).
На фиг.34 показано, что иммунотерапия снижает уровень нерастворимого белка тау у иммунизированных крыс по сравнению с контрольными крысами, которым вводили адъювант. Снижение уровня нерастворимого белка тау было выявлено для всех проанализированных эпитопов белка тау (т.е. для антитела 347-353/DC25, антитела pT217/DC217, антитела pT231/DC209, антитела pS202/pT205/AT8 и антитела pT181/AT270). Уровень общего нерастворимого белка тау был снижен на 40%, как было выявлено с помощью иммунологического анализа с помощью общего антитела против белков тау DC25. Аналогично, вакцина индуцировала 30% снижение уровня белка тау, фосфорилированного по pT217, как показано на фиг.26B и фиг.34. Введение имело больший эффект на уровни нерастворимых форм белка тау, фосфорилированных в положениях Thr231 (63%), Thr181 (74%) и Ser202/Thr205 (61%) у иммунизированных крыс по сравнению с неиммунизированными крысами (фиг.26B и фиг.34). Эти данные демонстрируют, что снижение уровня нерастворимого белка тау может приводить к дополнительным изменениям уровней белков тау, приводящих к патологии, и, таким образом, может иметь терапевтическое значение. Снижение имеющих значение при AD эпитопов белка тау демонстрирует, что вакцина активировала механизм, ответственный за ингибирование агрегации белка тау, и/или механизм, снижающий уровни белка тау, подверженного патологическим взаимодействиям с эндогенным белком тау.
На фиг.35A-C представлены результаты, полученные путем нейроповеденческой оценки. В группе крыс, которым вводили пептид SEQ ID NO: 3, наблюдали положительную латентность выхода при хождении по перекладине; однако без статистически значимого отличия между крысами, которым вводили пептид, и крысами, которым не проводили введения/вводили контроль (фиг.35A; p=0,21). Аналогично, введение приводило к снижению числа соскальзываний задних конечностей в группе иммунизированных крыс по сравнению с крысами без введения, однако этот эффект не был статистически значимым (фиг.35B, p=0,15). Общий показатель NeuroScale подтвердил нейроповеденческое улучшение у крыс, которым вводили тау-пептид SEQ ID NO: 3, по сравнению с крысами без введения (p=0,11 в обоих случаях). Однако отличие в показателях NeuroScale не было статистически значимым (p=0,19). Иммунотерапия тау-пептидом SEQ ID NO: 3 приводила к лучшей сенсорно-двигательной координации крыс, которым проводили введение, по сравнению с контрольными крысами, в испытании хождения по перекладине, а также в испытании соскальзываний задних конечностей; эти результаты были подтверждены показателем NeuroScale.
Более того, иммуногистохимический профиль показал, что иммунотерапия фосфопептидом SEQ ID NO: 3 привела к 58% снижению NFT в стволе головного мозга животных, которым вводили вакцину (фиг.36). Эти результаты демонстрируют, что иммунизация SEQ ID NO: 3, который содержит эпитоп № 1 DC8E8, значительно снижала уровень патологического полимерного белка тау, собирающегося в NFT. Более того, этот положительный эффект введения также был показан на биохимическом уровне, который отражает статистически значимое снижение уровня нерастворимого патологического белка тау.
e. SEQ ID NO: 4, тау 275-VQIINKKLDLSNVQSKCGSKDNIKHVPGGG-304. Пептид SEQ ID NO: 4 конъюгировали с KLH и использовали для иммунизации адъювантом на основе квасцов (AdjuPhos).
На фиг.37 и фиг.26B показано, что иммунотерапия посредством SEQ ID NO: 4 приводит к снижению количества нерастворимого белка тау у иммунизированных крыс по сравнению с контрольными крысами, которым вводили адъювант отдельно. Данные показывают, что снижение уровня нерастворимого белка тау было выявлено для всех проанализирвоанных эпитопов белка тау. Общие уровни нерастворимого белка тау были снижены на 63%, как было выявлено по иммунореактивности с помощью общего антитела против белков тау DC25. Аналогично, вакцина индуцировала снижение уровня белка тау, фосфорилированного в положениях pThr217 (92%), Thr231 (95%), Thr181 (87%) и Ser202/Thr205 (95%), как показано на фиг.26B. Ранее было показано, что уровень нерастворимого белка тау коррелирует с прогрессированием патологии белка тау (Zilka et al., 2006). Настоящие результаты показывают, что иммунотерапия, направленная на терапевтический эпитоп белка тау, содержащийся в SEQ ID NO: 99, может снижать уровни нерастворимого белка тау и замедлять прогрессирование патологии белка тау.
Комплексную двигательную недостаточность определяли с помощью стандартных двигательных испытаний в комбинации с неврологической оценкой в составном показателе - NeuroScale. В возрасте 6,5 месяцев трансгенных крыс SHR72, которым вводили тау-пептид SEQ ID NO: 4, подвергали поведенческим испытаниям с целью определения эффекта этой иммунотерапии. Крысы, которым вводили иммуноген в виде тау-пептида SEQ ID NO: 4, продемонстрировали снижение латентности спасение в испытании хождения по перекладине, по сравнению с трансгенными крысами, которым вводили только адъювант (контроли) (фиг.38A). Аналогично, в вакцинированной группе наблюдали положительные результаты для числа соскальзываний задних конечностей по сравнению с трансгенными крысами с контрольным введением (фиг.38B). Общий показатель NeuroScale вычисляли, исходя из данных, полученных в испытаниях хождения по перекладине, испытаниях мышечной тяги с захватом и при неврологической оценке (основные рефлексы, рефлекс убегания в виде растяжения задних конечностей). Иммунизация улучшила показатель NeuroScale у крыс, которым вводили пептид SEQ ID NO: 4, по сравнению с контрольной группой введения (фиг.38C). Общий показатель NeuroScale подтвердил нейроповеденческое улучшение у трансгенных крыс, которым проводили введение, по сравнению с трансгенными крысами, которым не проводили введения.
Эффективность иммунотерапии тау-пептидом SEQ ID NO: 4 далее исследовали на иммуногистохимическом уровне (фиг.39). Нейрофибриллярные узелки (NFT) анализировали с использованием антител против белка тау AT8 и DC217, которые распознают фосфорилированные эпитопы на патологическом белке тау, в стволе головного мозга крыс SHR72, которым вводили вакцину и которым вводили адъювант (контроль). Ткань головного мозга животных, которым вводили только адъювант, содержала положительные по AT8 и DC217 NFT во всех областях ствола головного мозга и, главным образом, в ретикулярной формации ствола головного мозга. Иммуногистохимический анализ показал 66% снижение нейрофибриллярной патологии у трансгенных крыс SHR72, которым вводили вакцину (фиг.39).
Изменения уровней нерастворимого белка тау в стволе головного мозга трансгенной линии крыс SHR72 являются чувствительным показателем эффекта лечения. Как уровни нерастворимого общего белка тау, так уровни фосфорилированного белка тау (патологические мономеры, димеры, олигомеры и полимеры), эффективно снижались в стволе головного мозга при введении тау-пептида SEQ ID NO: 4 (63-95% снижение; фиг.26B). Снижение уровней нерастворимого белка тау, измеренных биохимически, коррелировало с результатами, полученными в иммуногистохимическом анализе. Этот анализ показал более чем 60% снижение нейрофибриллярной патологии в стволе головного мозга трансгенных крыс, которым вводили вакцину (фиг.38). Данные иммунизации посредством SEQ ID NO: 4 демонстрируют лечебную способность этого пептида, содержащего эпитоп №2 DC8E8.
f. SEQ ID NO: 5, тау 201-GSPGTPGSRSRTPSLPTPPTREPKKVAVVR-230, содержащий фосфорилированный треонин в положении 217. Тау-пептид SEQ ID NO: 5, фосфорилированный в положении треонина 217, вводили трансгенным крысам SHR72 с использованием адъюванта на основе квасцов (AdjuPhos).
Анализ с использованием иммуноблоттинга показал, что иммунизация фосфопептидом SEQ ID NO: 5 не влияет на количество общего нерастворимого белка тау (выявленного с помощью антитела DC25) по сравнению с контрольными Tg-крысами, которыми вводили адъювант отдельно (фиг.40 и фиг.26B). Однако анализ с помощью антител DC209 и AT270 показал приблизительно 30% снижение уровней белка фосфо-тау pThr231 и pThr181 во фракции нерастворимого белка тау (фиг.26B). С другой стороны, введение индуцировало умеренное увеличение уровня нерастворимого белка тау, фосфорилированного в положении треонина 217 (11% увеличение), и белка тау, содержащего фосфорилированные участки Ser202/Thr205 (31% увеличение) по сравнению с контрольными трансгенными крысами. Эти данные указывают на неоднозначный или нейтральный эффект вакцины при иммунизации фосфопептидом SEQ ID NO: 5 на оцениваемые имеющие значение при AD маркеры, причем этот пептид не охватывает никакой агрегации эпитопов #1-#4 белка тау, идентифицированных выше (примеры 1-11), в качестве терапевтических эпитопов.
Нейроповеденческий анализ крыс, которым вводили фосфорилированный тау-пептид SEQ ID NO: 5, продемонстрировал, что происходило значимое улучшение нейроповеденческих функций в группе, в которой проводили введение, в испытании хождения по перекладине (фиг.41A, p=0,19) или в числе соскальзываний задних конечностей по сравнению с контрольной группой (фиг.41B). Общий показатель NeuroScale (фиг.41C) не подтвердил нейроповеденческого улучшения у крыс, которым проводили введение, по сравнению с крысами с имитирующей иммунизацией (p=0,28).
Иммунотерапия тау-фосфопептидом SEQ ID NO: 5 не снижала количество трансгенных крыс (SHR72) с обширными NFT в стволе головного мозга по сравнению с контрольными крысами посредством иммуногистохимии (фиг.42).
Эти результаты демонстрируют, что вакцинация тау-пептидом SEQ ID NO: 5 pT217, который лишен всех из терапевтических эпитопов (SEQ NO: 98-101), не приводит к статистически значимому улучшению нейроповеденческой функции, а только к 11% снижению количества нейрофибриллярных очагов приблизительно на иммуногистохимическом уровне. Не было выявлено эффекта на биохимический уровень в отношении снижения нерастворимого белка тау при оценке с помощью антитела DC25.
g. SEQ ID NO: 6, тау 379-RENAKAKTDHGAEIVYKSPVVSGDTSPRHL-408, содержащий фосфорилированные остатки серина в положении 396 и 404. Тау-пептид, фосфорилированный в положении 396 и 404, вводили SHR72 с использованием адъюванта на основе квасцов (AdjuPhos). SEQ ID NO: 6/pS396/pS404 лишен каких-либо терапевтических эпитопов, соответствующих SEQ NO: 98-101, но содержит фосфо-эпитоп, избыточно присутствующий в белках тау в головном мозге при AD (Greenberg et al. 1992; Otvos et al. 1994).
В противоположность снижению количества нерастворимого в саркозиле белка тау, наблюдаемого для пептидов SEQ ID NO: 1-4, иммунизация фосфорилированным пептидом SEQ ID NO: 6 привела к увеличению количества нерастворимого белка тау у иммунизированных крыс по сравнению с контрольными крысами, которым вводили только адъювант. Анализ с использованием иммуноблоттинга показал тенденцию в направлении общего увеличения уровней нерастворимого белка фосфо-тау (фиг.43 и фиг.26B). Иммунизация привела к увеличению общих уровней белка тау во фракции нерастворимого белка тау, как выявлено с помощью общего mAb против белков тау DC25. Увеличение также наблюдали для эпитопов белка тау pT217 (33% увеличение), Thr231 (44% увеличение) и Thr181 (7% увеличение). Однако имеющий значение при AD эпитоп pS202/pT205 был исключением (фиг.26B). Уровень белка тау, содержащего этот фосфо-эпитоп, был снижен на 19% по сравнению с контрольными крысами. Увеличенные уровни имеющего значение для множества заболеваний патологического нерастворимого белка тау указывают на нежелательный отрицательный эффект этой вакцины у крыс.
Оценивали нейроповеденческий ответ у крыс, которым вводили тау-пептид SEQ ID NO: 6/pS396/pS404, и контролей (фиг.44A, B и C). Иммунотерапия продемонстрировала отсутствие статистически значимых отличий между крысами, которым проводили введение, и контрольными крысами в латентности выхода при хождении по перекладине (p=0,82) или в числе соскальзываний задних конечностей (p=0,75). Эти результаты были подтверждены с помощью показателя NeuroScale (p=0,96), для которого не было выявлено статистически значимых отличий в общих нейроповеденческих характеристиках между иммунизированными и контрольными крысами. Таким образом, введение пептида SEQ ID NO: 6/pS396/pS404 не имело статистически значимого влияния на латентность выхода в испытании хождения по перекладине или в числе соскальзываний задних конечностей, или в общей двигательной активности исследуемых крыс.
На фиг.45 показан процент трансгенных крыс с обширной патологией белка тау, оцениваемой путем иммуногистохимии с AT8. Иммунотерапия тау-пептидом SEQ ID NO: 6/pS396/pS404 увеличивала нагрузку узелками на 9% относительно контрольной группы. Таким образом, отрицательный эффект SEQ ID NO: 6/pS396/pS404 на иммуногистохимическом уровне был подтвержден на биохимическом и нейроповеденческом уровнях.
Эти результаты показывают, что вакцинация тау-фосфопептидом SEQ ID NO: 6/pS396/pS404, который лишен какого-либо из терапевтических эпитопов белка тау, представленных в SEQ ID NO: 98-101, демонстрирует: 1) отсутствие терапевтического эффекта на нерастворимый белок тау в головном мозге иммунизированных крыс; 2) отсутствие эффекта на поведенческом уровне; и 3) отсутствие снижения, а вместо этого 9% увеличение нагрузки узелками. Таким образом, этот фосфо-эпитоп, который был описан как специфический для AD (Greenberg et al. 1992; Otvos et al., 1994), не индуцировал терапевтического эффекта.
h. SEQ ID NO: 7, тау 181-TPPSSGEPPKSGDRSGYSSPGSPGTPGSRS-210, содержащий фосфорилированный остаток серина в положении 202 и фосфорилированный остаток треонина в положении 205. Полученный тау-пептид SEQ ID NO: 7/ pS202/pT205 лишен какого-либо из терапевтических эпитопов, присутствующих в SEQ ID NO: 98-101. Фосфопептид конъюгировали с KLH и вводили трансгенным крысам (линия SHR72) в адъюванте Фрейнда.
Количественный анализ иммунореактивности белка тау в стволе головного мозга с помощью иммуноблоттинга не продемонстрировал никакого терапевтического эффекта (фиг.46). Уровни общего белка тау (эпитоп DC25, 6% увеличение) и белков тау, фосфорилированных по имеющим значение для заболевания эпитопам белка тау pT217 (3% увеличение), Thr231 (11% увеличение) и Thr181 (7% увеличение) были немного увеличены у иммунизированных крыс по сравнению с контролями (фиг.46 и 26B). Иммунизация индуцировала более высокое увеличение уровня нерастворимого белка тау, фосфорилированного в положении Ser202/Thr205 (41% увеличение).
Иммунотерапия фосфорилированным пептидом SEQ ID NO: 7 не влияла значительно на сенсорно-двигательную функцию крыс (фиг.47). Иммунизированные крысы продемонстрировали заметное улучшение нейроповеденческих параметров по сравнению с контролями. Однако группы статистически не отличались, поскольку не было выявлено статистически значимых отличий между крысами, которым проводили введение, и контролями в латентности выхода при хождении по перекладине (p=0,47, фиг.47A), а также в количестве соскальзываний задних конечностей (p=0,54, фиг.47B) и показателе NeuroScale (p=0,3, фиг.47C).
Пептид SEQ ID NO: 7 содержит фосфорилированный эпитоп белка тау, который не содержит никакой из эпитопов DC8E8. Исследование ствола головного мозга крыс SHR72, которым проводили введение, показало, что иммунотерапия тау-пептидом SEQ ID NO: 7 не была способна снизить нагрузку нейрофибриллярными узелками (фиг.48). Ткань головного мозга от вакцинированных и контрольных животных содержала практически идентичные количества положительных по AT8 и DC217 NFT во всех областях ствола головного мозга, а именно, в ретикулярной формации. Вакцина, содержащая SEQ ID NO: 7, лишенный эпитопов DC8E8, не продемонстрировала никакого благоприятного эффекта на животных, которым проводили введение.
Эти результаты демонстрируют, что вакцинация тау-фосфопептидом SEQ ID NO: 7/pS202/pT205 вызывает: 1) отсутствие изменения уровней нерастворимого белка тау в головном мозге иммунизированных крыс на биохимическом уровне; и 2) отсутствие эффекта на поведенческом уровне. Этот фосфопептид обеспечивает дополнительные доказательства того, что фосфорилированные участки, соответствующие pS202/pThr205, не являются достаточными для индукции иммунной реакции, устраняющей патологические белки тау и/или положительно влияющей на нейроповеденческий статус крыс. Напротив, терапевтические эпитопы белка тау (SEQ ID NO: 98-101) достигают этого эффекта.
i. SEQ ID NO: 8, тау-300-VPGGGSVQIVYKPVDLSK-317.
Иммунотерапию более коротким тау-пептидом, который использовали в качестве контроля, поскольку он не содержит ни полного 6-мера белка тау, в котором может находиться один из четырех "терапевтических эпитопов" белка тау, ни фосфорилированного эпитопа, проводили для определения ее способности влиять на уровни патологического нерастворимого белка тау и нейрофибриллярных отложений в головном мозге. Уровень общего нерастворимого белка тау, выявленный с помощью общего mAb против белков тау DC25, был значительно увеличен (82%) у иммунизированных крыс по сравнению с контролями, которым вводили только адъювант (фиг.49 и фиг.26B). Аналогично, иммунотерапия индуцировала увеличение уровней нерастворимого белка тау, фосфорилированного в положении T231 (60%), и сходное увеличение уровней нерастворимого белка тау, фосфорилированного в положении T181 (10%). Количественный анализ с различным набором антител: DC217 (pT217) и AT8 (pS202/pT205) не выявил никакого эффекта на эти эпитопы в нерастворимом белке (фиг.26B).
Животных подвергали поведенческому анализу (фиг.50A, B, C). Крысы, которым вводили пептид SEQ ID NO: 8, продемонстрировали отсутствие статистически значимых отличий в латентности выхода в испытании хождения по перекладине (p=0,6) по сравнению с контролями. Отличие в числе соскальзываний задних конечностей также не было статистически значимым (p=0,49) по сравнению с контролями. Аналогично, не было статистически значимых отличий в показателе NeuroScale (p=0,9). Таким образом, введение пептида SEQ ID NO: 8 не оказывало статистически значимого влияния на двигательную активность крыс.
Эти результаты демонстрируют, что вакцинация тау-пептидом SEQ ID NO: 8, который лишен всех терапевтических эпитопов (в SEQ ID NO: 98-101), вызывала: 1) отсутствие изменения уровня нерастворимого белка тау в головном мозге иммунизированных крыс на биохимическом уровне; и 2) отсутствие эффекта на нейроповеденческом уровне.
Эффект пептидной вакцины на нагрузку NFT в стволе головного мозга животных, которым проводили введение и которым вводили имитирующий контроль (вводили только адъювант) оценивали с помощью иммуногистохимии. Результаты показали, что иммунотерапия тау-пептидом SEQ ID NO: 8 не снижала количество нейрофибриллярных узелков (фиг.51). У животных, которым проводили введение и которым вводили имитирующий контроль, развивалось практически идентичное количество нейродегенеративных изменений во всех областях ствола головного мозга, главным образом, в ретикулярной формации ствола головного мозга, выявляемых окрашиванием AT8 и DC217.
Вакцинация SEQ ID NO: 8, которое не охватывает никакой полный терапевтический эпитоп (SEQ ID NO: 98-101), не продемонстрировала никакого благоприятного эффекта у животных, которым проводили введение. Таким образом, результаты иммунизации пептидами SEQ ID NO: 5-8 демонстирруют, что присутствие по меньшей мере одного полного терапевтического эпитопа (расположенного в SEQ ID NO: 98-101) необходимо для желаемого положительного эффекта вакцины - снижения патологии белка тау и улучшения по меньшей мере одного нейроповеденческого параметра.
j. SEQ ID NO: 108, тау 294-KDNIKHVPGGGS-305. Крыс SHR72 иммунизировали тау-пептидом SEQ ID NO: 108, конъюгированным с носителем KLH, составленным с адъювантом на основе квасцов, и вводили в дозе 100 мкг на животное.
Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 108 статистически значимо снижала уровень нерастворимого патологического белка тау (p<0,001). Поскольку патология болезни Альцгеймера у SHR72 вызвана патологическими нерастворимыми формами белка тау (соответствующие мономерам, димерам, олигомерам и полимерам патологического белка тау), анализировали влияние введения 12-мерной пассивной вакцины SEQ ID NO: 108 на уровни нерастворимого белка тау. Ствол головного мозга трансгенных животных, иммунизированных соответствующим иммуногеном, и контрольной группы, иммунизированной только адъювантом, использовали для экстракции нерастворимого в саркозиле патологического белка тау (как описано выше). Результаты количественного анализа с использованием иммуноблоттинга для группы трансгенных крыс, иммунизированных тау-пептидом SEQ ID NO: 108, и контрольной группы представлены на фиг.52 и 26B. Вакцинация статистически значимо снижала уровень патологического нерастворимого белка тау у иммунизированных животных по сравнению с контрольными трансгенными крысами, которым вводили только адъювант (фиг.52). Это снижение наблюдали для всех проанализированных имеющих отношение к AD эпитопов белка тау. Иммунизация тау-пептидом SEQ ID NO: 108 индуцировала значительное снижение нерастворимого патологического белка тау (p<0,001; 70%), выявляемое путем измерения с помощью общего моноклонального антитела против белков тау DC25 (фиг.52). Более того, анализ с помощью фосфо-зависимых mAb DC217 (pThr217) и AT8 (pSer202/pThr205) показал значимое снижение уровней патологических типов белка тау, фосфорилированных по Thr217 (p<0,001; 96%) и по Ser202/pThr205 (p<0,05; 98%) в нерастворимом белке тау у иммунизированных крыс по сравнению с контролями (фиг.52). Статистически значимое снижение также наблюдали в отношении уровней нерастворимого патологического белка тау, содержащего pThr231 (p<0,05; 97%) и pThr181 (p<0,05; 94%). Эти результаты показывают, что индуцируемый вакциной иммунный ответ приводит к статистически значимому снижению уровней ранних форм патологического белка тау (представленных мономерами, димерами, олигомерами) и поздних форм патологических полимеров белка тау (представленных PHF).
Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 108 статистически значимо улучшала нейроповеденческие параметры (p<0,05). Двигательную недостаточность измеряли с помощью набора стандартных двигательных испытаний в комбинации с неврологическим исследованием в составном показателе - NeuroScale. В возрасте 6,5 месяцев трансгенных крыс SHR72, которым вводили тау-пептид SEQ ID NO: 108, подвергали поведенческим испытаниям с целью определения эффекта иммунотерапии. Крысы, которым вводили иммуноген в виде тау-пептида SEQ ID NO: 108, продемонстрировали значимо сниженную латентность выхода в испытании хождения по перекладине (*p=0,04) по сравнению с трансгенными крысами, которым вводили только адъювант (контроли) (фиг.53). Аналогично, наблюдали положительную тенденцию в числе соскальзываний задних конечностей в вакцинированной группе по сравнению с трансгенными крысами с контрольным введением, это отличие было значимым (*p=0,045, фиг.53). Общий показатель NeuroScale вычисляли из данных, полученных в испытании хождения по перекладине, испытаниях мышечной тяги с захватом и неврологических исследованиях (основные рефлексы, рефлекс убегания в виде растяжения задних конечностей). Иммунизация значимо улучшала показатель NeuroScale у крыс, которым вводили пептид SEQ ID NO: 108, по сравнению с контрольной группой введения (*p=0,047) (фиг.53C). Общий показатель NeuroScale подтвердил нейроповеденческое улучшение у трансгенных крыс, которым проводили введение, по сравнению с трансгенными крысами, которым не проводили введения. Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни.
Нейроповеденческие параметры коррелировали с уровнями нерастворимого патологического белка тау в стволе головного мозга трансгенных животных, которым проводили введение. Животные, которым вводили вакцинный пептид SEQ ID NO: 108, обладали низкими уровнями нерастворимого патологического белка тау, которые были ассоциированы с более низкой латентностью выхода и более низким числом соскальзываний задних конечностей по сравнению с животными с контрольным введением. Эти данные показывают, что снижение уровней нерастворимого патологического белка тау приводит к статистически значимому улучшению нейроповеденческого дефицита в группе трансгенных животных, иммунизированных вакциной на основе 12-мерного пептида (SEQ ID NO: 108), демонстрируя ее терапевтическую ценность.
Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 108 привела к 60% снижению нагрузки нейрофибриллярными узелками (NFT). Иммуногистохимический анализ нейрофибриллярной патологии белка тау (нейрофибриллярные узелки, NFT) в стволе головного мозга продемонстрировал снижение NFT, достигаемое у крыс SHR72, которым вводили вакцину (фиг.54). Количество иммунизированных трансгенных крыс с обширными NFT в стволе головного мозга по сравнению с животными, которым вводили адъювант, было снижено более чем на 60%. Иммунизация снижала патологию белка тау (полимеры патологического белка тау, PHF) в головном мозге трансгенных животных, иммунизированных вакциной на основе пептида SEQ ID NO: 108.
Результаты демонстрируют, что иммунотерапия тау-пептидом SEQ ID NO: 108 эффективно уменьшала патологию белка тау у крыс SHR72. Вакцинация привела к статистически значимому снижению уровней нерастворимого патологического белка тау в головном мозге иммунизированных животных, а также к снижению нагрузки нейрофибриллярными узелками (PHF). Уменьшение количества патологических белков тау приводило к статистически значимому улучшению нейроповеденческих параметров трансгенных крыс, которым проводили введение. Таким образом, введение тау-пептида SEQ ID NO: 108 обладает способностью лечить AD.
ПРИМЕР 21: ИММУНОТЕРАПИЯ ТЕРАПЕВТИЧЕСКИМИ ПЕПТИДАМИ ПРОТИВ AD ЯВЛЯЕТСЯ ИММУНОГЕННОЙ И ИНДУЦИРУЕТ ПРОДУКЦИЮ СПЕЦИФИЧНЫХ К СВЯЗАННОМУ С ЗАБОЛЕВАНИЕМ БЕЛКУ ТАУ АНТИТЕЛ У ТРАНСГЕННЫХ КРЫС
a. После пяти доз вакцины на основе тау-пептида проводили анализ иммуногенности пептида у крыс, которым проводили введение. Для определения титра антител использовали сыворотку иммунизированных крыс. Сыворотку крыс, иммунизированных только адъювантом, использовали в качестве контроля. Титры специфических антител против белка тау определяли с помощью ELISA, как описано в примере 19. Серийные разведения каждой сыворотки исследовали против связанного с AD тауΔ(1-150; 392-441)/4R и рекомбинантного полноразмерного белка тау 2N4R, которыми были предварительно покрыты лунки микропланшетов для титрования. Анализируемые иммуногены индуцировали продукцию специфических антител против белка тау.
Например, специфические антитела против белка тау получали после иммунизации 275-VQIINKKLDLSNVQSKCGSKDNIKHVPGGG-304 (SEQ ID NO: 4). Антитела, индуцированные тау-пептидом SEQ ID NO: 4, проявляли приблизительно в 3 раза более высокую активность связывания с небеспорядочным тауΔ(1-150; 392-441)/4R, чем с белком тау 2N4R (фиг.55; разведение 1:3200). Эти результаты далее указывают на то, что эта вакцина индуцировала антитела, которые обладают терапевтическим потенциалом и распознают и устраняют/нейтрализуют патологические белки тау при болезни Альцгеймера.
Также, вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 108 индуцировала образование антител, предпочтительно связывающихся с патологическим белком тау, относительно физиологического белка тау. После пяти доз вакцины проводили анализ иммуногенности у каждой из вакцинированных крыс. У животных отбирали кровь через две недели после последней вспомогательной дозы, и собранные сыворотки использовали для определения геометрического среднего титра антител (GMT). Титры специфических антител против белка тау определяли с помощью ELISA, как описано в примере 19. Серийные разведения (от 1:100 до 1:51200) каждой сыворотки исследовали против патологического белка тауΔ(1-150; 392-441)/4R и физиологического белка тау 2N4R, использованных в качестве твердой фазы. Титры определяли в качестве обратной величины разведения сыворотки, которая дает половину максимальной оптической плотности (поглощение). Для вычисления геометрических средних титров антител, результатом титров, меньшим 100, приписывали величину 10. Как показано на фиг.56, титр антител патологического белка тауΔ(1-150; 392-441)/4R (GMT 12800) был в три раза выше, чем титр полноразмерного белка тау 2N4R (GMT 4200). Титры антител также измеряли против неконъюгированного пептида SEQ ID NO: 108 с использованием той же технологии, которая описана в примере 19. На фиг.56 показано, что наиболее высокие титры антител индуцировались против тау-пептида SEQ ID NO: 108 (GMT 20800). У трансгенных крыс, иммунизированных только адъювантом, не было выявлено антительных ответов (GMT 10; данные не представлены). Вакцинация пептидом SEQ ID NO: 108, содержащим эпитоп DC8E8 № 2 (в SEQ ID NO: 99), индуцировала антитела, предпочтительно распознающие патологический белок тау, таким образом, различающие патологический тауΔ(1-150; 392-441/4R) и физиологический белок тау 2N4R. Более того, результат показал, что SEQ ID NO: 108 является иммуногенным и, таким образом, обладает терапевтическим потенциалом в отношении устранения патологических белков тау при болезни Альцгеймера.
Более того, вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 108 предпочтительно индуцировала образование изотипов IgG-антител, специфичных к патологическому белку тау. Для определения конкретных изотипов антител, продуцируемых в ответ на пептид SEQ ID NO: 108, сыворотки крыс иммунизированной и контрольной групп подвергали серийному разведению от 1:100 до 1:12800, и исследовали в двух экземплярах с помощью ELISA (как описано в примере 19) против патологического белка тауΔ(1-150; 392-441)/4R. Для выявления изотипов IgG1, IgG2a, IgG2b, IgG2c и IgM крысы, специфичные к подклассам антител крысы, конъюгированные с HRP вторичные антитела разбавляли 1:5000 в PBS (Pierce, антитело против IgG1 - PA1-84708, антитело против IgG2a - PA1-84709, антитело против IgG2b - PA1-84710, антитело против IgG2c - PA1-84711 и антитело против IgM - PA1-84712). На фиг.57 представлены результаты для репрезентативного разведения 1:800. Данные демонстрируют, что пептид SEQ ID NO: 108, конъюгированный с KLH, индуцировал широкий спектр изотипов антител против белка тау. Вакцина индуцирует высокие уровни изотипов антител (IgG1, IgG2a, IgG2b и IgG2c), которые считаются высокоаффинными антителами. Напротив, изотипический профиль продемонстрировал очень низкие уровни IgM-антител. Считается, что они обладают низкой аффинностью к антигену. Наличие высоких титров IgG-антитела с предпочтительной аффинностью в отношении патологического белка тау показало, что иммунный ответ, индуцируемый вакциной, направлен против типов патологического белка тау. Контрольные сыворотки, полученные от крыс с имитирующей иммунизацией (которым вводили только адъювант), были отрицательными.
Эти данные далее использовали для определения поляризации (фенотип Th1/Th2) иммунного ответа. Уровни изотипов IgG1 и IgG2a, индуцированных иммунизацией, непрямо указывают на вклад Th1-цитокинов относительно Th2-цитокинов в иммунный ответ. Как правило, продукция IgG1-антител индуцируется Th2-цитокинами и продукция IgG2a-антител индуцируется Th1-цитокинами. Таким образом, соотношение изотипов IgG1 и IgG2a вычисляли путем деления величин OD для IgG1 на величины OD для IgG2a. Эти данные указывают на то (соотношение=0,625), что иммунный ответ немного сдвинут в сторону Th1-фенотипа.
b. Мониторинг в реальном времени событий связывания с использованием поверхностного плазмонного резонанса позволил измерение кинетической скорости ассоциации (kON) и диссоциации (kOFF) антител из объединенных сывороток крыс, иммунизированных тау-пептидом 275-VQIINKKLDLSNVQSKCGSKDNIKHVPGGG-304 (SEQ ID NO: 4). Анализ показал отличие между распознаванием тауΔ(1-150; 392-441)/4R и физиологической изоформы белка тау 2N4R (фиг.58). Антитела, индуцируемые иммунизацией, проявляли предпочтительную аффинность в отношении тауΔ(1-150; 392-441)/4R, связывая этот белок тау с в три раза более высокой аффинностью в случае укороченного связанного с AD белка тау по сравнению с их аффинностью в отношении соответствующей полноразмерной изоформы 2N4R. Было определено, что это отличие в связывании является, частично, следствием приблизительно в пять раз более высокой скорости kON для тауΔ(1-150; 392-441)/4R (данные не представлены).
c. Для дальнейшего определения специфичности антител, индуцируемых у крыс, иммунизированных терапевтическими тау-пептидами, антисыворотку можно использовать для иммуногистохимического окрашивания замороженных срезов гиппокампа из головного мозга человека с AD. Например, с помощью этого анализа оценивали антитела, индуцированные после иммунизации SEQ ID NO: 4. Гиппокамп из головного мозга человека с AD фиксировали 4% параформальдегидом при 4°C в течение 2 суток, а затем обрабатывали 25% сахарозой в течение 72 часов для обеспечения криопротекции. Затем материал замораживали в холодном 2-метилбутане (-42°C) в течение 30 секунд и нарезали на срезы на криомикротоме. Коронарные срезы (40-мкм) нарезали в криостате при -18°C. Для иммуногистохимических исследований использовали свободноплавающие срезы. Свободноплавующие срезы ткани обрабатывали холодной (+4°C) 99% муравьиной кислотой в течение 1 мин при комнатной температуре (25°C). Срезы головного мозга инкубировали в течение 20 минут при комнатной температуре в 0,01 M PBS, pH 7,4, содержавшем 0,3% Triton X-100 и 1% H2O2, а затем проводили инкубацию в течение 30 минут в блокирующем растворе (0,01 M PBS, содержащий 0,3% Triton X-100, 1% сыворотка лошади), а затем проводили инкубацию в течение ночи с сыворотками от трансгенных крыс, иммунизированных вакциной, содержащей пептид SEQ ID NO: 4 (разбавленный 1:1000) при 4°C. После промывания срезы подвергали иммунному окрашиванию с использованием стандартного способа с авидином-биотином-пероксидазой (ABC Elite, Vector laboratories, Burlingame, CA). Продукт реакции визуализировали с использованием системы авидин-биотин и Vector VIP в качестве хромогена (Vector laboratories). Затем срезы исследовали с помощью микроскопа Olympus BX 51. Иммуногистохимическое окрашивание показало, что антитела, индуцированные путем иммунизации пептидом SEQ ID NO: 4, специфически распознавали патологические структуры белка тау, т.е. нейрофибриллярные очаги в гиппокампе головного мозга при болезни Альцгеймера (фиг.59A, B). Сыворотки от контрольных крыс, которым вводили только адъювант, использовали в качестве отрицательного контроля, и они не распознавали никакой нейрональной патологии (данные не представлены).
Вакцинация трансгенных крыс SHR72 тау-пептидом SEQ ID NO: 108 индуцировала антитела, распознающие патологические белки тау в срезах тканей головного мозга человека с болезнью Альцгеймера. Для дальнейшего определения специфичности антител, индуцируемых у крыс, иммунизированных терапевтическим тау-пептидом SEQ ID NO: 108, их сыворотку использовали для иммуногистохимического окрашивания энторинальной коры с использованием замороженных срезов головного мозга человека с AD (стадия Браака VI). Свободноплавающие срезы тканей инкубировали с сыворотками (разбавленными 1:1000) от иммунизированных трансгенных крыс при 4°C. Индивидуальные сыворотки от животных, вакцинированных SEQ ID NO: 108, использовали по отдельности, в то время как сыворотки от животных, вакцинированных только адъювантом, объединяли. После иммунного окрашивания с использованием стандартного способа с авидином-биотином-пероксидазой (ABC Elite, Vector laboratories, Burlingame, CA) срезы исследовали с помощью микроскопа Olympus BX 51. Иммуногистохимическое окрашивание показало, что антитела, индуцированные иммунизацией пептидом SEQ ID NO: 108, специфически распознавали патологические структуры белка тау, т.е. нейрофибриллярные очаги в энторинальной коре головного мозга при болезни Альцгеймера. На фиг.60 (A-E) представлено репрезентативное иммунное окрашивание сывороткой крысы, взятой от пяти вакцинированных трансгенных крыс SHR72. Сыворотки животных, вакцинированных SEQ ID NO: 108, устраняли нейрофибриллярную патологию очень интенсивно, подтверждая, что антитела эффективно нацеливались на патологические белки тау. Сыворотки контрольных крыс, которым вводили только адъювант, использовали в качестве отрицательных контролей. Они не распознавали никакой нейрофибриллярной патологии (фиг.60F).
Антитела, индуцированные вакциной SEQ ID NO: 108, распознают патологические белки тау, экстрагированные из головного мозга SHR72 и из головного мозга человека с AD. Специфичность сывороток от крыс, иммунизированных тау-пептидом SEQ ID NO: 108, далее исследовали в отношении патологических форм растворимого и нерастворимого патологического белка тау с использованием способа иммуноблоттинга (как описано в примере 19). Ствол головного мозга крыс SHR72 на поздней стадии патологии использовали для экстракции растворимых и нерастворимых патологических белков тау. Височную кору головного мозга человека с AD (стадия Браака VI; полученная от Netherlands Brain Bank, Нидерланды) использовали для экстракции патологического белка тау человека с AD. Растворимые и нерастворимые патологические белки тау получали с использованием того же способа, который описан в примере 8. Для растворимых фракций белка тау 15 мкг тотальных белков наносили на дорожку. Для нерастворимых фракций белка тау осадок растворяли в 1× буфере для нанесения образца с додецилсульфатом натрия (SDS) (Laemmli, 1970) в 1/50 объема растворимой фракции, использованной для получения нерастворимой фракции белка тау, и равный объем наносили на SDS-PAGE. Объединенные сыворотки иммунизированных животных разбавляли 1:1000 в PBS и использовали в качестве первичного антитела. После инкубации с первичным антителом следовало поликлональное антитело кролика против иммуноглобулинов крысы, конъюгированное с пероксидазой хрена (1:3000; Dako, Glostrup, Дания). Сигнал вестерн-блоттинга оцифровывали с помощью визуализирующей системы LAS3000 CCD (Fujifilm, Япония). Результаты этого анализа с использованием иммуноблоттинга представлены на фиг.61.
Результаты (фиг.61) показывают, что антитела, индуцированные против пептида, содержащего эпитоп 2 (SEQ ID NO: 99) DC8E8, распознают патологические белки тау, экстрагированные из SHR72 и из тканей головного мозга при AD. Индуцированные антитела распознавали мономерные формы патологического белка тау (дорожка № 1, 2 и № 3), а также олигомерные формы патологического белка тау (дорожка № 2 и № 3), включая триплет белка тау A68, характерный для AD. Эти данные оказывают ключевое влияние на иммунотерапию с использованием этой модели болезни Альцгеймера на крысах. Высокоаффинные антитела, индуцированные вакциной, нацелены на все формы патологических белков тау. Они нацелены на мономерные формы патологических белков тау и, таким образом, препятствуют патологическому взаимодействию тау-тау (олигомеризация), ведущему к снижению уровней нерастворимых белков тау у вакцинированной крысы и, следовательно, к улучшению нейроповеденческих параметров. Индуцированные антитела также связывают олигомерные формы патологического белка тау и нацеливают их на деградацию, например микроглией, как описано в примере 10 для mAb DC8E8.
ПРИМЕР 22: ИММУНОТЕРАПИЯ ТЕРАПЕВТИЧЕСКИМИ ПЕПТИДАМИ ПРОТИВ AD ИНДУЦИРУЕТ ПРОДУКЦИЮ АНТИТЕЛ, СПЕЦИФИЧНЫХ К СВЯЗАННОМУ С ЗАБОЛЕВАНИЕМ БЕЛКУ ТАУ, У МЫШЕЙ
Пептиды SEQ ID NO: 109, SEQ ID NO: 110 (SEQ ID NO: 88 соответствует SEQ ID NO: 110 с дополнительным N-концевым Cys для конъюгации), SEQ ID NO: 111 и SEQ ID NO: 112, содержащие один из терапевтических эпитопов либо в SEQ ID NO: 100, либо в 101, индуцировали продукцию антител у иммунизированных мышей. Полученные антитела демонстрируют статистически значимо более высокую активность связывания с патологическим белком тауΔ(1-150; 392-441)/4R, чем с физиологическим белком тау 2N4R.
SEQ ID NO: 109, тау 314-DLSKVTSKCGSLGNIHHKPGGGQVEVKSE-342
SEQ ID NO: 110, тау 352-SKIGSLDNITHVPGGGNKKIETHKLTFREN-381
SEQ ID NO: 111, тау 325-LGNIHHKPGGGQ-336
SEQ ID NO: 112, тау 357-LDNITHVPGGGN-368
SEQ ID NO: 100, тау 329-HHKPGGG-335
SEQ ID NO: 101, тау 361-THVPGGG-367
Действительно, с целью дальнейшего определения иммуногенного потенциала пептидов, содержащих один или несколько терапевтических эпитопов DC8E8 (например, в 7-мере: SEQ ID NO: 100 и SEQ ID NO: 101), конструировали пептиды длиной двенадцать и тридцать аминокислот (SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111 и SEQ ID NO: 112), содержащие один из терапевтических эпитопов DC8E8. Тау-пептиды SEQ ID NO: 109 (30 аминокислот) и SEQ ID NO: 111 (12 аминокислот) содержат терапевтических эпитоп, находящийся в SEQ ID NO: 100. Тау-пептиды SEQ ID NO: 110 (30 аминокислот) и SEQ ID NO: 112 (12 аминокислот) содержат терапевтический эпитоп, находящийся в SEQ ID NO: 101. Пептиды конъюгировали с KLH через их N-концевой остаток Cys, как описано в примерах 18-19. Получали вакцины для иммунизаций с конъюгатами пептид-KLH, содержащие 100 мкг конъюгированного пептида в 100 мкл PBS и эмульгированные 1:1 (об./об.) с адъювантом Фрейнда в конечном объеме дозы 200 мкл. Использовали пять мышей Balb/c на группу введения. Первую иммунизацию проводили с использованием конъюгата пептида в PBS, составленного с полным адъювантом Фрейнда. Две последующие иммунизации с интервалами две недели проводили с использованием конъюгата пептида в PBS, составленного с неполным адъювантом Фрейнда. В качестве контроля использовали вакцину, содержащую только адъювант. Сыворотки получали через 10 суток после последней иммунизации и антительный ответ измеряли с помощью ELISA, как описано в примере 19. Сыворотки индивидуальных мышей подвергали серийному разведению от 1:100 до 1:12800 и исследовали в двух экземплярах. Для определения специфичности сывороток патологический белок тауΔ(1-150; 392-441/4R) и физиологический белок тау 2N4R использовали в качестве твердой фазы. На фиг.62-65 представлено обобщение результатов для сывороток в разведении 1:800. Результаты ELISA статистически оценивали с использованием непараметрического критерия Манна-Уитни.
Все исследуемые пептиды индуцировали специфичные к белку тау антитела у иммунизированных мышей. Антитела, индуцированные путем вакцинаций тау-пептидами SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111 и SEQ ID NO: 112, обладали статистически значимо более высокой активностью связывания с патологическим белком тауΔ(1-150; 392-441)/4R, чем с физиологическим белком тау 2N4R (фиг.62-65). Более того, укорочение пептидов от 30 аминокислот (SEQ ID NO: 109, SEQ ID NO: 110) до 12 аминокислот (SEQ ID NO: 111 и SEQ ID NO: 112) приводило к значительно более высокой продукции специфических антител, которые предпочтительно распознавали патологический белок тау (SEQ ID NO: 109, p=0,0115; SEQ ID NO: 110, p=0,0029; SEQ ID NO: 111, p=0,0007; SEQ ID NO: 112, p<0,001). Взятые вместе, эти результаты показали, что пептиды SEQ ID NO: 109 и SEQ ID NO: 111 (содержащие терапевтический эпитоп в SEQ ID NO: 100) и пептиды SEQ ID NO: 110 и SEQ ID NO: 112 (содержащие терапевтический эпитоп в SEQ ID NO: 101) являются иммуногенными и обладают терапевтической активностью, нацеленной на патологические белки тау, присутствующие в головном мозге пациентов, страдающих болезнью Альцгеймера.
ПРИМЕР 23: ИДЕНТИФИКАЦИЯ СКОНСТРУИРОВАННЫХ ПЕПТИДОВ (СКОНСТРУИРОВАННЫЕ ТЕРАПЕВТИЧЕСКИЕ ЭПИТОПЫ), СПОСОБНЫХ КОНКУРИРОВАТЬ С ПАТОЛОГИЧЕСКИМ БЕЛКОМ ТАУ ЗА СВЯЗЫВАНИЕ ПО МЕНЬШЕЙ МЕРЕ С ОДНИМ ЭПИТОПОМ DC8E8
Конструировали два дополнительных пептида (11-меры) на основе консервативных аминокислотных остатков между эпитопом #1 (в KHQPGGG, SEQ ID NO: 98), #2 (в KHVPGGG, SEQ ID NO: 99), #3 (в HHKPGGG, SEQ ID NO: 100) и #4 (в THVPGGG, SEQ ID NO: 101). В их конструкции пять остатков, обеспечивающих связывание DC8E8 с этими эпитопами, оставляли фиксированными: гистидин, пролин и три остатка глицина в последовательности HxPGGG (SEQ ID NO: 164). Пептиды были синтезированы в EZBiolabs (США) с чистотой более 85%. Два сконструированных терапевтических эпитопа представляют собой GWSIHSPGGGSC (SEQ ID NO: 250) и SVFQHLPGGGSC (SEQ ID NO: 251).
Эти пептиды анализировали в отношении их способности конкурировать с патологическим белком тау с использованием конкурентного ELISA. Планшеты для ELISA (планшет с высоким связыванием IWAKI, #3801-096, Bertoni GmbH, Австрия) покрывали 100 мкл/лунка рекомбинантного очищенного тауΔ(1-150; 392-441)4R в концентрации 5 г/мл в PBS в течение ночи при 4°C. Покрытые планшеты для ELISA промывали 4 раза PBS/Tween 20 (фосфатно-солевой буфер, дополненный 0,05% об./об. Tween 20), и блокировали PBS/Tween 20 в течение 2 ч при 25°C. Каждый из пептидов по отдельности растворяли в PBS в конечной концентрации 5 мМ. Получали серийные 2-кратные разведения пептидов в PBS/Tween 20 в полипропиленовых планшетах (Greiner, #651201) (диапазон концентрации 80 мкМ, 40 мкМ, 20 мкМ, 10 мкМ, 5 мкМ и 2,5 мкМ). 100 мкл каждого разведения пептида смешивали со 100 мкл очищенного моноклонального антитела DC8E8 в концентрации 2 мкг/мл (очистку проводили, как описано в примере 5). Следовательно, полученные 200 мкл смеси содержали 1 мкг/мл антитела DC8E8 и 40 мкМ, 20 мкМ, 10 мкМ, 5 мкМ, 2,5 мкМ и 1,25 мкМ пептиды. В качестве положительного контроля включали тауΔ(1-150; 392-441)4R. Смеси антитело/пептид инкубировали в течение 1 ч при 25°C на вращающейся платформе, установленной на 250 об./мин. Затем сто микролитров смесей антитело/пептид переносили в подготовленные планшеты для ELISA и инкубировали в течение 1 ч при 25°C на вращающейся платформе, установленной на 250 об./мин. Планшеты промывали 4× посредством PBS/Tween 20. Затем планшеты для ELISA инкубировали со 100 мкл поликлонального антитела козы против иммуноглобулинов мыши/ HRP (Dako, #P0447), разбавленного 1:4000 в PBS/Tween 20 и инкубировали в течение 1 ч при 25°C на вращающейся платформе, установленной на 250 об./мин. Планшеты для ELISA промывали 4× посредством PBS/Tween20. Затем планшеты для ELISA инкубировали с 100 мкл раствора 1,5 мг/2 мл o-PDA (o-фенилендиамин, SIGMA, P1526) в 0,1 M Na-ацетате pH 6,0 (Roth, #6779), дополненного в 1,5 мкл/2 мл 30% H2O2 (SIGMA, H-0904), в течение 10 минут при 25°C в темноте. Реакцию останавливали добавлением 100 мкл 2 M H2SO4 (Merck, 1.00731.1000). Формирующийся сигнал измеряли путем считывания при 490 нм (например, с использованием Victor Multilabel Counter (Wallac).
Два сконструированных пептида, а именно, GWSIHSPGGGSC (SEQ ID NO: 250) и SVFQHLPGGGSC (SEQ ID NO: 251), были оба способны конкурировать с тауΔ(1-150; 392-44)4R за связывание с DC8E8 (фиг.66). Пептид GWSIHSPGGGSC (SEQ ID NO: 250), названный сконструированным терапевтическим эпитопом 1, продемонстрировал наиболее сходную аффинность в отношении DC8E8 по сравнению с тауΔ(1-150; 392-441)4R. Аффинность пептида SVFQHLPGGGSC (SEQ ID NO: 251), названного сконструированным терапевтическим эпитопом 2, в отношении DC8E8 была более чем на один порядок величины выше, чем аффинность связанного с заболеванием белка тау (тауΔ(1-150; 392-441)4R в отношении этого антитела.
ПРИМЕР 24: ИССЛЕДОВАНИЕ IN VIVO СКОНСТРУИРОВАННЫХ ТЕРАПЕВТИЧЕСКИХ ЭПИТОПОВ 1 И 2 ДЛЯ ИММУНОГЕНЕТИКИ И СПЕЦИФИЧНОСТЬ ИММУННОГО ОТВЕТА.
Сконструированный терапевтический эпитоп 1 (GWSIHSPGGGSC, SEQ ID NO: 250) и сконструированный терапевтический эпитоп 2 (SVFQHLPGGGSC, SEQ ID NO: 251) конъюгировали с KLH через их C-концевой остаток Cys (как описано в примере 18) и использовали для иммунизации мышей Balb/c. Для каждого сконструированного терапевтического эпитопа использовали трех мышей. Иммунизацию проводили следующим образом. Получали вакцины для иммунизации с конъюгатами сконструированный терапевтический эпитоп-KLH, содержащие 100 мкг конъюгированного пептида в 100 мкл PBS, и эмульгировали 1:1 (об./об.) с адъювантом Фрейнда в конечном объеме дозы 200 мкл. Первую иммунизацию проводили с использованием конъюгата сконструированный терапевтический эпитоп-KLH в PBS, составленном с полным адъювантом Фрейнда. Четыре последующих иммунизации проводили с интервалами четыре недели с использованием конъюгатов сконструированный терапевтический эпитоп-KLH в PBS, составленных с неполным адъювантом Фрейнда. Для контрольной иммунизации использовали PBS вместо конъюгатов сконструированного терапевтического эпитопа. Сыворотки получали через 14 суток после последней иммунизации.
1. Антитела различают патологический белок тау. Для определения специфичности сыворотки использовали два белка тау: рекомбинантный патологический белок тауΔ(1-150; 392-441)4R и физиологический белок тау 2N4R. Сыворотку от каждой мыши подвергали серийному разведению от 1:100 до 1:12800 и исследовали в трех экземплярах. Титры антител определяли с использованием поликлонального антитела козы против иммуноглобулинов мыши/ HRP (Dako, #P0447), разбавленного 1:4000. На фиг.67 представлены репрезентативные результаты для разведения 1:3200.
Оба сконструированных терапевтических эпитопа индуцировали высокий иммунный ответ у иммунизированных мышей. Более того, оба исследованных сконструированных терапевтических эпитопа индуцировали антитела, которые распознают патологический белок тауΔ(1-150; 392-441)4R с более высокой аффинностью по сравнению с физиологическим белком тау 2N4R (фиг.67). Это отличие является статистически значимым для сывороток всех иммунизированных животных. Взятые вместе, и в комбинации с результатами, полученными для активности, наблюдаемой для DC8E8, эти результаты показывают, что оба сконструированных терапевтических эпитопа 1 и 2 являются иммуногенными и индуцируют антительный ответ с терапевтическим потенциалом нацеливания на патологические белки тау в головном мозге пациентов с болезнью Альцгеймера.
2. Изотип антитела: Для определения конкретных изотипов антител, продуцируемых в ответ на эти сконструированные терапевтические эпитопы 1 и 2, сыворотки от мышей из одной и той же группы объединяли, подвергали серийному разведению от 1:100 до 1:12800, и исследовали в трех экземплярах с помощью ELISA для определения изотипов антител. Для выявления изотипов IgM, IgG1, IgG2a, IgG2b и IgG3 мыши использовали вторичные антитела, специфичные к подклассам антител мыши, конъюгированные с HRP (антитела, приобретенные от Lifespan Biosciences, антитело против IgG1 - #LS-C59107, антитело против IgG2a - #LS-C59112, антитело против IgG2b - #LS-C59117, антитело против IgG3 - #LS-C59125 и антитело против IgM - #LS-C55875). Антисыворотки, полученные от контрольных мышей, были отрицательными. На фиг.68 представлены репрезентативные результаты для разведения 1:800. Данные, полученные для объединенных сывороток, продемонстрировали, что иммунизация обоими исследуемыми сконструированными терапевтическими эпитопами индуцировала широкий спектр изотипов антител против белка тау и что профиль изотипов был в высокой степени сходным во всех исследованиях. Оба сконструированных терапевтических эпитопа индуцировали в основном IgG1-антитела по сравнению с ответами IgG2a, IgG2b и IgG3 (фиг.68).
3. Сконструированные терапевтические эпитопы индуцируют антительный ответ, который на статистически высокозначимом уровне различает патологический и физиологический белок тау. Анализ аффинности антител, индуцированных против сконструированных терапевтических эпитопов, проводили с использованием поверхностного плазмонного резонанса на BIACORE3000 с использованием сенсорного чипа CM5 (Biacore AB, Uppsala), как описано в примерах 5 и 19. В каждом цикле анализа антисыворотку мыши против либо GWSIHSPGGGSC (SEQ ID NO: 250), сконструированный терапевтический эпитоп 1 (разбавленный в 100 раз), либо SVFQHLPGGGSC (SEQ ID NO: 251), сконструированный терапевтический эпитоп 2 (разбавленный в 100 раз), (объединенные антисыворотки от 3 мышей), иммобилизовывали в аналитической проточной ячейке до достижения уровня иммобилизации ~950 ОЕ, который приближался к насыщению. В качестве эталона в эталонной проточной ячейке иммобилизовывали постороннее антитело Rab50 (Macikova et al., 1992), которое не связывает белок тау. Для определения KA, а также для определения кинетических констант скорости kON и kOFF, 100 нМ растворы либо патологического белка тауΔ(1-150; 392-441)4R, либо физиологического белка тау 2N4R, инжектировали со скоростью потока 100 мкл/мин на сенсорный чип.
Антитела, индуцированные вакцинацией сконструированными терапевтическими эпитопами 1 и 2 различали патологический белок тауΔ(1-150; 392-441)4R и физиологический белок тау 2N4R (фиг.69A и 69B). Аффинность антител, присутствующих в антисыворотке против сконструированного терапевтического эпитопа 1 (GWSIHSPGGGSC, SEQ ID NO: 250), измеренная с использованием поверхностного плазмонного резонанса, была практически в 50 раз более высокой в отношении патологического белка тау, по сравнению с физиологическим белком тау, что является статистически высокозначимым (p<0,001). Аффинность антител, присутствующих в антисыворотке против сконструированного терапевтического эпитопа 2 (SVFQHLPGGGSC (SEQ ID NO: 251), измеренная с использованием поверхностного плазмонного резонанса, была практически в 15 раз более высокой в отношении патологического белка тау, по сравнению с физиологическим белком тау, что является статистически высокозначимым (p<0,01).
4. Сконструированные терапевтические эпитопы индуцируют антительный ответ, распознающий патологические типы белка тау в головном мозге человека с AD. Для определения специфичности антител, индуцированных у мышей, иммунизированных сконструированными терапевтическими эпитопами, проводили иммуногистохимическое окрашивание замороженных срезов головного мозга человека с AD.
Образцы ткани головного мозга человека с AD (энторинальная кора, стадия AD Браака VI, предоставленная Netherlands Brain Bank) фиксировали 4% параформальдегидом в PBS в течение 2 суток при 4°C, а затем подвергали криопротекции (25% сахароза), замораживали в холодном 2-метилбутане (-42°C) и нарезали на срезы на криотоме. Свободноплавающие срезы тканей (40 мкм) обрабатывали холодной (4°C) 99% муравьиной кислотой в течение 1 мин при комнатной температуре (25°C). Срезы подвергали иммунному окрашиванию с использованием стандартного способа с авидином-биотином-пероксидазой (ABC Elite, Vector laboratories, Burlingame, CA). Антисыворотки против сконструированного терапевтического эпитопа 1 (SEQ ID: 250) и сконструированного терапевтического эпитопа 2 (SEQ ID NO: 251), каждая из которых была объединенной от 3 иммунизированных мышей, разбавляли 1:2000 в блокирующем растворе (5% бычий сывороточный альбумин, 0,3% Triton X-100 в PBS). Затем срезы исследовали с помощью микроскопа Olympus BX 51.
Иммуногистохимическое окрашивание показало, что иммунные сыворотки мыши, полученные против обоих сконструированных терапевтических эпитопов GWSIHSPGGGSC (SEQ ID NO: 250) и SVFQHLPGGGSC (SEQ ID NO: 251) специфически распознавали патологические структуры белка тау, т.е. нейрофибриллярные узелки и нейропильные нити, в энторинальной коре головного мозга при болезни Альцгеймера (фиг.70A-D). Антисыворотки против сконструированного терапевтического эпитопа 1 и сконструированного терапевтического эпитопа 2 не распознавали нормальный белок тау в контрольном головном мозге человека (фиг.70E, F).
5. Сконструированный терапевтический эпитоп 2 (SVFQHLPGGGSC, SEQ ID NO: 251) индуцирует антительный ответ, распознающий патологические типы белка тау в головном мозге трансгенных крыс в модели болезни Альцгеймера. Для определения специфичности антител, индуцированных у мышей, иммунизированных сконструированными терапевтическими эпитопами, проводили иммуногистохимическое окрашивание на заключенных в парафин срезах головного мозга трансгенных крыс SHR72.
Трансгенных крыс лини SHR72 (в возрасте 7 месяцев) подвергали транскардиальной перфузии PBS в течение 1 мин под глубоким наркозом, а затем проводили перфузию 100 мл 4% параформальдегида (pH 7,4). После перфузии голову отсоединяли и головной мозг быстро извлекали. Головной мозг разрезали продольно на два полушария равного размера с использованием одноразовых лезвий скальпеля. Ткани головного мозга подвергали пост-фиксации в 4% параформальдегиде, заключали в парафин и нарезали на срезы на микротоме. Иммуногистохимическое и гистопатологическое исследование проводили на 8-мкм заключенных в парафин срезах тканей. Срезы ткани предварительно обрабатывали в течение 20 мин обнаруживающим антиген раствором (Vector laboratories, CA, США) и в течение 1 мин холодной (+4°C) 90% муравьиной кислотой (Applichem, Германия), при комнатной температуре (25°C). После блокирования срезы инкубировали в течение ночи с сывороткой, полученной против сконструированного терапевтического эпитопа 2 (SVFQHLPGGGSC, SEQ ID NO: 251), разбавленной 1:1000 в блокирующем растворе (5% бычий сывороточный альбумин, 0,3% Triton X 100 в 50 нМ Tris-HCl). После промывания срезы инкубировали с биотинилированным вторичным антителом (Vectastain Elite ABC Kit, Vector laboratories) при комнатной температуре в течение одного часа, а затем подвергали реакции с раствором комплекса авидин-биотин-пероксидаза в течение 60 минут (Vectastain Elite ABC Kit, Vector laboratories), при комнатной температуре (25°C). Иммунную реакцию визуализировали с помощью набора субстрата для пероксидазы (Vector VIP, Vector laboratories, Ca, США). Срезы исследовали с помощью микроскопа Olympus BX71.
В головном мозге трансгенной крысы (SHR72) сыворотка, полученная против сконструированного терапевтического эпитопа 2 (SVFQHLPGGGSC, SEQ ID NO: 251), распознавала нейрофибриллярные узелки (фиг.70G). В головном мозге совпадающих по возрасту контрольных крыс антитело не окрашивало нейрональные клетки (фиг.70H).
Сыворотка, полученная против сконструированного терапевтического эпитопа 2 (SVFQHLPGGGSC, SEQ ID NO: 251), распознавала белок тау на олигомерной доузелковой стадии (фиг.70I), а также внутриклеточные нейрофибриллярные узелки (фиг.70J).
6. Антитела, индуцированные сконструированными терапевтическими эпитопами 1 и 2, распознают растворимый и нерастворимый патологический белок тау в головном мозге человека с AD: растворимый и нерастворимый в саркозиле патологический белок тау выделяли из височной коры человека с болезнью Альцгеймера (полученной от Netherlands Brain Bank) и анализировали с использованием иммуноблоттинга, как описано в примере 8.
Мембраны, содержащие растворимые и нерастворимые фракции патологического белка тау, инкубировали либо с супернатантом гибридомы DC8E8, разбавленным 1:1 5% обезжиренным сухим молоком в PBST, либо с объединенными антисыворотками мыши, полученными против сконструированного терапевтического эпитопа 1 (SEQ ID NO: 250, GWSIHSPGGGSC), либо с объединенными антисыворотками мыши, полученными против сконструированного терапевтического эпитопа 2 (SVFQHLPGGGSC, SEQ ID NO: 251), при этом обе объединенные антисыворотки разбавляли 1:100 в 5% обезжиренном сухом молоке в PBST. Мембраны промывали, а затем инкубировали с конъюгированным с пероксидазой антителом козы против IgG мыши (DAKO, Дания), разбавленным 1:4000. Блотты проявляли с помощью хеминлюминесцентного субстрата SuperSignal West Pico Chemiluminescent Substrate (Pierce, США), выявляемого с использованием визуализирующей системы LAS3000 (FUJI Photo Film Co., Япония). Интенсивность сигнала количественно определяли с использованием программного обеспечения AIDA (Advanced Image Data Analyzer, Raytest, Straubenhardt, Германия).
Результаты этого анализа с использованием иммуноблоттинга представлены на фиг.71. Эти результаты демонстрируют, что антитела, индуцированные против обоих сконструированных терапевтических эпитопов 1 (т.е. GWSIHSPGGGSC) (SEQ ID NO: 250) и 2 (т.е. SVFQHLPGGGSC) (SEQ ID NO: 251) распознают те же патологические белки тау, что и DC8E8. Все из антисывороток против GWSIHSPGGGSC (SEQ ID NO: 250), антисывороток против SVFQHLPGGGSC (SEQ ID NO: 251) и антитела DC8E8 специфически распознавали патологические белки тау, присутствующие в растворимых и нерастворимых в саркозиле фракциях белка тау, выделенных из тканей головного мозга при AD (фиг.71).
7. Антитела, индуцированные сконструированными терапевтическими эпитопами 1 и 2, распознают растворимый и нерастворимый патологический белок тау в головном мозге с трансгенным белком тау крыс. Растворимый и нерастворимый в саркозиле патологический белок тау выделяли из головного мозга крыс с трансгенным белком тау (линия SHR72, описанная в примере 7), как описано в примере 8.
Результаты анализа с использованием иммуноблоттинга (описанного в примере 8) представлены на фиг.72. Эти результаты показывают, что антитела, индуцированные сконструированными терапевтическими эпитопами 1 (т.е. GWSIHSPGGGSC) (SEQ ID NO: 250) и 2 (т.е. SVFQHLPGGGSC) (SEQ ID NO: 251) распознают те же патологические белки тау, что и DC8E8 (фиг.72). Нацеливание на мономерный и олигомерный патологический белок тау препятствует образованию агрегатов патологического белка тау, что приводит к снижению патологии белка тау, обеспечивая терапевтический эффект и лечение AD у человека.
ПРИМЕР 25: ЭФФЕКТИВНОСТЬ IN VIVO СКОНСТРУИРОВАННЫХ ТЕРАПЕВТИЧЕСКИХ ЭПИТОПОВ У ТРАНСГЕННЫХ КРЫС В МОДЕЛИ AD
Иммунотерапия сконструированными терапевтическими эпитопами продемонстрировала улучшение нейроповеденческих параметров у крыс, которым проводили введение. Сконструированный терапевтический эпитоп 2 (SEQ ID NO: 251) был выбран для иммунотерапии у трансгенных крыс SHR 72. Крыс подкожно иммунизировали дозами вакцины, содержавшей сконструированный терапевтический эпитоп 2 (SEQ ID NO: 251), конъюгированный с KLH, в комбинации с адъювантом Adju-phos. Вакцины получали, как описано в примере 18. Одна доза содержала 100 мкг конъюгированного сконструированного терапевтического эпитопа 2. Комплексную двигательную недостаточность определяли с помощью стандартных двигательных испытаний в комбинации с неврологической оценкой в составном показателе - NeuroScale. В возрасте 6,5 месяцев трансгенных крыс SHR72, которым вводили вакцину, содержащую сконструированный терапевтический эпитоп 2 (SEQ ID NO: 251), подвергали поведенческим испытаниям с целью определения эффекта этой иммунотерапии.
Крысы, которым вводили сконструированный терапевтический эпитоп 2 (SEQ ID NO: 251), продемонстрировали снижение латентности выхода на 27% в испытании хождения по перекладине относительно контрольных крыс, которым вводили только адъювант (фиг.73A). Количество соскльзиваний задних конечностей было статистически значимо снижено (p<0,05) на 44% в вакцинированной группе по сравнению с трансгенными контролями (фиг.73B). Показатель NeuroScale вычисляли, исходя из величин, полученных в испытаниях хождения по перекладине, испытаниях мышечной тяги с захватом и при неврологической оценке (основные рефлексы, рефлекс убегания в виде растяжения задних конечностей). Иммунизация значительно улучшала показатель NeuroScale у крыс, которым вводили пептид SEQ ID NO: 251, на 26%, по сравнению с контрольной группой (фиг.73C). Общий показатель NeuroScale подтвердил нейроповеденческое улучшение у трансгенных крыс, которым проводили введение, по сравнению с трансгенными крысами, которым не проводили введения. Все статистические данные получали с использованием непараметрического U-критерия Манна-Уитни.
Иммунотерапия сконструированным терапевтическим эпитопом 2 продемонстрировала статистически значимое снижение (p<0,05) уровня патологического белка тау в головном мозге трансгенных крыс с болезнью Альцгеймера, которым проводили введение. Для подтверждения эффекта иммунизации сконструированным терапевтическим эпитопом 2 (SEQ ID NO: 251) на уровни нерастворимого патологического белка тау, авторы настоящего изобретения использовали анализ с использованием иммуноблоттинга образцов головного мозга крысы. Ткань головного мозга (ствола головного мозга) трансгенных животных, иммунизированных сконструированным терапевтическим эпитопом 2 (SEQ ID NO: 251), и контрольной группы трансгенных животных, иммунизированных только адъювантом, использовали для получения фракции нерастворимого в саркозиле белка тау, как описано в примере 8. Анализ с использованием иммуноблоттинга проводили, как описано в примере 19. Статистический анализ проводили с использованием T-критерия. В исследовании использовали зависимые от фосфорилирования моноклональные антитела AT8, DC209, DC217 и общее моноклональное антитело против белка DC25.
Результаты количественного анализа с использованием иммуноблоттинга уровней нерастворимого белка тау в группе трансгенных крыс, иммунизированных сконструированным терапевтическим эпитопом 2 (SEQ ID NO: 251), и в контрольной группе представлены на фиг.74. Иммунотерапия статистически значимо снижала количество нерастворимого белка тау у иммунизированных животных по сравнению с контрольными трансгенными крысами, которым вводили только адъювант. Снижение уровня нерастворимого белка тау наблюдали для всех проанализированных эпитопов белка тау. Снижение уровней эпитопа 347-353 и эпитопов белка фосфо-тау было статистически значимым (P<0,05). Наблюдаемое снижение было следующим: для эпитопа тау 347-353 на 46% (P<0,05), для эпитопа тау pT217 на 57% (P<0,05), для эпитопа тау p231 на 55% (P<0,05), для эпитопа тау pS202/pT205 на 47% (P<0,05).
Эти результаты показывают, что вакцина индуцировала антитела, специфичные к патологическому белку тау, которые привели к снижению уровня патологического белка тау. Снижение уровней патологического белка тау в головном мозге в модели болезни Альцгеймера у крыс, которым проводили введение, коррелировало с нейроповеденческими параметрами. Животные, которым проводили введение, с низкими уровнями нерастворимого белка тау, продемонстрировали более короткую латентность выхода и статистически значимо сниженное количество соскальзываний задних конечностей (p<0,05), по сравнению с контрольными животными. Эти данные показывают, что иммунизация сконструированным терапевтическим эпитопом приводит к снижению уровня нерастворимого патологического белка тау и к нейроповеденческому улучшению у животных, которым проводили введение, что подчеркивает терапевтический потенциал вакцин для лечения болезни Альцгеймера и родственных таупатий у человека.
ПРИМЕР 26: ДАЛЬНЕЙШАЯ ОХАРАКТЕРИЗАЦИЯ МИНИМАЛЬНЫХ ЭПИТОПОВ DC8E8 (ДЛЯ ТЕРАПЕВТИЧЕСКИХ ЦЕНТРАЛЬНЫХ ЭЛЕМЕНТОВ)
Для дальнейшей охарактеризации минимальных эпитопов DC8E8 конструировали панель тау-пептидов различной длины (42-мер, 19-мер, 12-меры, 7-меры, 6-меры и 5-меры), происходящих из областей связывающих микротрубочки повторов (MTBR1, MTBR2, MTBR3, MTBR4) белка тау человека 2N4R (фиг.75A, B). Пептиды были синтезированы в EZBiolabs (США) с чистотой более 95%. Все пептиды анализировали в отношении их способности конкурировать с патологическим белком тауΔ(1-150; 392-441)/4R за связывание с DC8E8 с помощью конкурентного ELISA. Планшеты для ELISA (Sarstedt, #821581001) покрывали 50 мкл/лунка рекомбинантного очищенного тауΔ(1-150; 392-441)/4R) в PBS в концентрации 5 мкг/мл в течение ночи при 37°C. Покрытые планшеты промывали 5 раз PBS/Tween 20 (0,05% об./об.) и блокировали PBS/Tween 20 (0,05% об./об.) в течение 1 ч при 25°C. Каждый из пептидов отдельно растворяли в PBS в конечной концентрации 1 мМ. Получали серийные разведения (2,5×) пептидов в PBS/Tween 20 в полипропиленовых микропланшетах для титрования с коническим дном лунок (Greiner, #651201) в диапазоне концентраций 200 мкМ; 80 мкМ; 32 мкМ; 12,8 мкМ; 5,12 мкМ; 2,048 мкМ; 0,8192 мкМ; 0,32768 мкМ). Моноклональное антитело для проверки DC8E8 разбавляли до концентрации 0,6 мкг мл в PBS и 60 мкл этого разбавленного антитела добавляли в каждую лунку с серийными разведениями пептидов с получением 120 мкл/лунка смеси. Смеси антитело/пептид инкубировали в течение 1 ч при 25°C на вращающейся платформе, установленной на 230 об./мин. 50 мкл/лунка смесей антитело/пептид переносили из полипропиленовых планшетов в покрытые тауΔ(1-150; 392-441)/4R и блокированные PBS/Tween 20 планшеты для ELISA (в двух экземплярах) и инкубировали в течение 1 ч при 25°C. Планшеты промывали 5× раз PBS/Tween 20 и инкубировали с 50 мкл/лунка поликлонального антитела козы против иммуноглобулинов мыши/HRP (Dako, #P0447), разбавленного 1:1000 в PBS/Tween 20, в течение 1 ч при 25°C. После промывания планшеты инкубировали с 50 мкл/лунка 1 мг/2 мл o-PDA (o-фенилендиамин, Sigma, P1526) в 0,1 M Na-ацетате, pH=6,0 (Roth, #6779), дополненном 1,5 мкл/2 мл 30% H2O2 (Sigma, H-0904) в течение 20 минут при 25°C в темноте. Реакцию останавливали добавлением 50 мкл/лунка 2M H2SO4 (Merck, 1.00731.1000), а затем проводили считывание планшетов при 492 нм (например, Powerwave HT, Bio-Tek).
На фиг.76 представлены результаты конкурентного ELISA, проводимого со следующими пептидами: TENLKHQPGGGK (SEQ ID NO: 270), KHQPGGG (SEQ ID NO: 271), HQPGGG (SEQ ID NO: 272), HQPGG (SEQ ID NO: 273), QPGGG (SEQ ID NO: 274), ENLKHQPGGGKVQIINKKLDLSNVQSKCGSKDNIKHVPGGGS (SEQ ID NO: 275), KHVPGGG (SEQ ID NO: 276), HVPGGG (SEQ ID NO: 277), HVPGG (SEQ ID NO: 278), VPGGG (SEQ ID NO: 279), DNIKHVPGGGSVQIVYKPV (SEQ ID NO: 280), HHKPGGG (SEQ ID NO: 281), HKPGGG (SEQ ID NO: 282) и THVPGGG (SEQ ID NO: 283). Все анализируемые пептиды, которые охватывали терапевтические эпитопы белка тау, конкурировали с патологическим белком тауΔ(1-150; 392-441/4R). Как показано на фиг.76, даже 6-мерные пептиды (SEQ ID NO: 272, SEQ ID NO: 277 и SEQ ID NO: 282) были способны конкурировать с белком тауΔ(1-150; 392-441)/4R за связывание с DC8E8. Однако удаление либо гистидина (5-мерные пептиды SEQ ID NO: 274, 279) либо последнего глицина (5-мерные пептиды SEQ ID NO: 273, 278) привело к утрате активности конкурирования с тауΔ(1-150; 392-441/4R) за связывание с DC8E8 (5-мерные пептиды происходили из SEQ ID NO: 272 и SEQ ID NO: 277, удаленные аминокислоты His и Gly подчеркнуты, см. выше). Эти результаты указывают на то, что 5-мерные пептиды не образовывали терапевтическую 3D-структуру, которая распознается DC8E8 на патологическом белке тау. С другой стороны, пептиды, содержащие шесть аминокислотных остатков, образуют терапевтическую 3D-структуру, ответственную за биологическую активность, измеренную с помощью конкурентного ELISA, и формируют минимальные эпитопы (терапевтические центральные элементы) DC8E8. В этой конструкции пять аминокислотных остатков важны для распознавания DC8E8, которые являются консервативными (гистидин, пролин и три остатка глицина в последовательности HxPGGG).
Заключение: Данные указывают на то, что минимальный эпитоп DC8E8 на белке тау человека состоит из 6 аминокислот, которые содержат остатки HQPGGG (расположенные в MTBR1), HVPGGG (в MTBR2), HKPGGG (в MTBR3) и HVPGGG (в MTBR4). Таким образом, участок связывания DC8E8 (=эпитоп) присутствует четыре раза в белке тау 2N4R и три раза в белке тау 2N3R. Это указывает на то, что необходимыми аминокислотами в 6-мерной последовательности являются гистидин и все три остатка глицина.
ПРИМЕР 27: ОПРЕДЕЛЕНИЕ ИММУНОГЕНЕТИКИ ПЕПТИДОВ, СОДЕРЖАЩИХ МИНИМАЛЬНЫЕ ЭПИТОПЫ DC8E8
a) Пептиды, содержащие минимальные эпитопы DC8E8, являются иммуногенными: С целью определения иммуногенного потенциала индивидуальных тау-пептидов, пептиды конъюгировали с KLH через их N-концевой остаток Cys.
Для этого тау-пептиды синтезировали в качестве цистеинированных пептидов с дополнительным расположенным на N-конце остатком цистеина с целью достижения ориентированного присоединения пептида на поверхности белка KLH. Пептиды связывали с носителем KLH через бифункциональный сшивающий линкер N-[γ-малеимидобутирилокси]сукцинимидный сложный эфир (GMBS). Для получения реакционной смеси для конъюгации, 20 мг KLH (Calbiochem) растворяли в буфере для конъюгации (PBS с 0,9 M NaCl, 10 мМ EDTA) до концентрации 10 мг/мл путем осторожного перемешивания в течение 10 минут. Для получения активированного малеинимидом KLH, 2 мг активного бифункционального сшивающего линкера GMBS растворяли в 50 мкл безводного диметилформамида и смешивали с 2 мл раствора KLH в течение 1 часа при комнатной температуре. Затем не вступивший в реакцию GMBS удаляли на 5-мл колонке для обессоливания HiTrap Desalting column (GE Healthcare), уравновешенной буфером для конъюгации. Конъюгацию проводили при соотношении пептида к активированному малеинимидом KLH 1:1 (масс./масс., 20 мг пептида) в течение 2 ч при комнатной температуре (25°C). Полученные конъюгаты подвергали диализу против 100-кратного избытка PBS с четырьмя заменами буфера для диализа, чтобы удалить неконъюгированный пептид. После диализа конъюгаты центрифугировали при 21000 × g в течение 15 мин при 2°C. Конъюгаты разделяли на аликвоты и хранили при -20°C до применения.
Получали вакцины для иммунизация с конъюгатами пептид-KLH, содержащие 100 мкг конъюгированного пептида, в 100 мкл PBS и эмульгировали 1:1 (об./об.) с адъювантом Фрейнда в конечном объеме дозы 200 мкл. Использовали пять мышей C57/BL на группу введения. Первую иммунизацию проводили с использованием конъюгата пептида в PBS, составленного с адъювантом Фрейнда. Две последующие иммунизации с интервалами одна неделя проводили с использованием конъюгата пептида в PBS, составленного с неполным адъювантом Фрейнда. У животных отбирали кровь через одну неделю после последней вспомогательной дозы, и собранные сыворотки использовали для определения титра антител. Титры специфических антител против белка тау определяли с помощью ELISA, как описано в примере 19. Серийные разведения (от 1:100 до 1:102400) каждой сыворотки исследовали против патологического белка тауΔ(1-150; 392-441)/4R и физиологического белка тау 2N4R, используемого в качестве твердой фазы. На фиг.77A-C представлено обобщение результатов для сывороток в разведении 1:800. Результаты ELISA статистически оценивали с использованием непараметрического критерия Манна-Уитни. Титры определяли как обратная величина разведения сыворотки, дающего половину максимальной OD, и они обобщенно представлены на фиг.78.
Иммунизация мышей тау-пептидами TENLKHQPGGGK (SEQ ID NO: 270), KHQPGGG (SEQ ID NO: 271), ENLKHQPGGGKVQIINKKLDLSNVQSKCGSKDNIKHVPGGGS (SEQ ID NO: 275), KHVPGGG (SEQ ID NO: 276), HVPGGG (SEQ ID NO: 277), DNIKHVPGGGSVQIVYKPV (SEQ ID NO: 280), HHKPGGG (SEQ ID NO: 281) и THVPGGG (SEQ ID NO: 283) индуцировала высокие уровни специфичных к белку тау антител у иммунизированных мышей. Более того, индуцированные антитела проявляли более высокую аффинность в отношении патологического белка тауΔ(1-150; 392-441)/4R, чем в отношении физиологического белка тау 2N4R (фиг.. 77A-C). Это отличие было статистически значимым для сывороток всех иммунизированных животных (SEQ ID NO: 270, p<0,0079; SEQ ID NO: 271, p<0,0052; SEQ ID NO: 275,p<0,0079; SEQ ID NO: 276, p<0,0079; SEQ ID NO: 277,p<0,0379; SEQ ID NO: 280, p<0,0159; SEQ ID NO: 281,p<0,0379, и SEQ ID NO: 283, p<0,0286). В основном, геометрические средние титры антител к патологическому белку тауΔ(1-150; 392-441)/4R были в от трех до пяти раз более высокими, чем к физиологическому белку тау 2N4R (фиг.78). Как показано на фиг.78, наиболее высокие титры антитела к патологическому белку тау индуцировались тау-пептидом SEQ ID NO: 275 (GMT 51200), SEQ ID NO: 280 (GMT 51200), SEQ ID NO: 270 (GMT 22286) и SEQ ID NO: 276 (GMT 22286). 5-мерные пептиды (SEQ ID NO: 273, 274, 278, 279), которые, по-видимому, лишены терапевтической 3D-структуры, не были способны индуцировать специфичные к белку тау антитела у иммунизированных животных. Взятые вместе, эти результаты показали, что пептиды (SEQ ID NO: 270, 271, 272, 275, 276, 277, 280, 281 и 283), содержащие минимальные терапевтические эпитопы (терапевтические центральные элементы) являются иммуногенными и индуцируют антитела с терапевтическим потенциалом нацеливания на патологические белки тау в головном мозге пациентов с болезнью Альцгеймера. Упомянутые выше эксперименты по картированию эпитопов продемонстрировали, что пептид SEQ ID NO: 282 формирует терапевтическую 3D-структуру (например, по меньшей мере частично имитирует минимальный эпитоп DC8E8), тем не менее, он не индуцировал специфический антительный ответ у иммунизированных мышей (GMT для патологического белка тау составил 174, фиг.78).
b) Изотипический профиль: Вакцинация мышей C57/BL тау-пептидами SEQ ID NO: 270, 271, 275, 276, 277, 280, 281 и 283 предпочтительно индуцировала образование изотипов антител IgG1 и IgG2b, специфичных к патологическому белку тау. Для определения специфических изотипов антител, продуцируемых в ответ на пептиды, сыворотки мышей объединяли и разбавляли от 1:100 до 1:12800, и исследовали в двух экземплярах с помощью ELISA (как описано в примере 19) против патологического белка тауΔ(1-150; 392-441)/4R. Для выявления изотипов IgG1, IgG2b, IgG2c, IgG3 и IgM мыши, специфичные к подклассам антител мыши, конъюгированные с HRP вторичные антитела разбавляли 1:5000 в PBS (антитела, приобретенные от Lifespan Biosciences). На фиг.79 представлены результаты для репрезентативного разведения 1:800. Данные указывают на то, что пептиды, конъюгированные с KLH, индуцировали широкий спектр изотипов антител против белка тау. Как правило, вакцинация пептидами индуцировала наиболее высокие уровни изотипов антител (IgG1, IgG2b), которые считаются высокоаффинными антителами. Присутствие высоких титров антител IgG1 и IgG2b с предпочтительной аффинностью к патологическому белку тау показало, что иммунный ответ, индуцированный вакциной, направлен против патологических типов белка тау. Контрольные сыворотки, полученные от мышей с имитирующей иммунизацией (которым вводили только адъювант) были отрицательными (данные не представлены).
c) Пептиды, обладающие терапевтическими эпитопами, индуцируют антитела, различающие патологический и физиологический белок тау: Мониторинг в реальном времени событий связывания с использованием поверхностного плазмонного резонанса позволил измерение кинетической скорости ассоциации (kON) и диссоциации (kOFF) антител из объединенных сывороток мышей C57/BL, иммунизированных отдельными тау-пептидами TENLKHQPGGGK (SEQ ID NO: 270), KHQPGGG (SEQ ID NO: 271), HQPGGG (SEQ ID NO: 272), HQPGG (SEQ ID NO: 273), QPGGG (SEQ ID NO: 274), ENLKHQPGGGKVQIINKKLDLSNVQSKCGSKDNIKHVPGGGS (SEQ ID NO: 275), KHVPGGG (SEQ ID NO: 276), HVPGGG (SEQ ID NO: 277), HVPGG (SEQ ID NO: 278), VPGGG (SEQ ID NO: 279), DNIKHVPGGGSVQIVYKPV (SEQ ID NO: 280), HHKPGGG (SEQ ID NO: 281), HKPGGG (SEQ ID NO: 282) и THVPGGG (SEQ ID NO: 283). Анализ проводили с использованием поверхностного плазмонного резонанса на BIACORE3000 с использованием сенсорного чипа CM5 (Biacore AB, Uppsala), как описано в примерах 5 и 19. Анализ показал, что антитела, индуцированные иммунизацией пептидами, были способны различать распознавание тауΔ(1-150; 392-441)/4R и физиологической изоформы белка тау 2N4R (фиг.80). Антитела, индуцированные иммунизацией пептидами SEQ ID NO: 270, 271, 272, 275, 276, 277, 280, 281 и 283, содержащими минимальные терапевтические эпитопы, проявляли предпочтительную аффинность в отношении тауΔ(1-150; 392-441)/4R, по сравнению с их аффинностью в отношении соответствующего физиологического белка тау 2N4R. Это отличие было статистически значимым для сывороток, полученных для пептидов: SEQ ID NO: 270 (p=0,0392), SEQ ID NO: 271 (p=0,0363), SEQ ID NO: 272 (p=0,0022), SEQ ID NO: 276 (p=0,0013), SEQ ID NO: 277 (p=0,0023), SEQ ID NO: 280 (p=0,0104), SEQ ID NO: 281 (p=0,0123) и SEQ ID NO: 283 (p=0,0011). Полученные результаты соответствуют предшествующим экспериментам по иммуногенности, обобщенно представленным на фиг.77A-C и фиг.78.
d) Индуцируемые пептидами антитела распознают патологические формы белка тау в вестерн-блоттинге: Антитела, индуцируемые иммунизацией мышей C57/BL отдельными тау-пептидами, исследовали в отношении патологических форм белка тау с использованием способа иммуноблоттинга (как описано в примере 19). Ствол головного мозга крыс SHR72 на поздней стадии нейрофибриллярной патологии использовали для экстракции нерастворимых патологических белков тау. Для экстракции патологического белка тау при AD у человека использовали височную кору головного мозга человека с AD (стадия Браака VI; полученная от Netherlands Brain Bank, Нидерланды). Экстрагированные белки тау получали в соответствии со способом с саркозилом (Greenberg and Davies 1990). Объединенные сыворотки иммунизированных животных разбавляли 1:1000 в PBS и использовали в качестве первичного антитела. После инкубации с первичным антителом следовало поликлональное антитело кролика против иммуноглобулинов крысы, конъюгированное с пероксидазой хрена (1:3000; Dako, Glostrup, Дания). Затем антитела, конъюгированные с пероксидазой хрена, визуализировали с помощью хемилюминесценции с использованием хемилюминесцентного субстрата SuperSignal West Pico Chemiluminescence Substrate (Thermo Scientific, Belgium). Сигнал оцифровывали с помощью визуализирующей системы LAS3000 CCD (Fujifilm, Япония). Обобщенные результаты представлены на фиг.81. Антитела, индуцированные вакцинацией пептидами, вероятно формирующими терапевтическую 3D-структуру эпитопа(ов) DC8E8 (SEQ ID NO: 270, 271, 272, 275, 276, 277, 280, 281 и 283) распознавали все патологические формы белка тау, экстрагированные из SHR72 и из тканей головного мозга при AD, включая тау-триплет A68, характерный для AD. Тем не менее, пептид SEQ ID NO: 282, который, по-видимому, формирует терапевтическую 3D-структуру (конкурирует с тауΔ(1-150; 392-441)/4R за связывание с DC8E8), не индуцировал специфический антительный ответ у этих иммунизированных мышей, таким образом, реактивность была отрицательной. Аналогично, 5-мерные пептиды, которые не были способны индуцировать специфичный к белку тау антительный ответ, были отрицательными в этом анализе.
e) Индуцируемые пептидами антитела распознают патологические белки тау в срезах головного мозга человека при болезни Альцгеймера: Специфичные к белку тау антитела, индуцированные вакцинацией мышей C57/BL отдельными пептидами, исследовали на ткани головного мозга человека (парафиновые блоки), полученной от Netherlands brain bank. Блоки нарезали на микротоме. Заключенные в парафин срезы (8 мкм) гиппокампа-сектора CA1 из головного мозга при болезни Альцгеймера (стадия Браака V) обрабатывали холодной (+4°C) 99% муравьиной кислотой в течение 1 мин при комнатной температуре (25°C). Срезы тканей инкубировали в блокирующем растворе (5% BSA, 0,3% Triton X-100 в 50 нМ Tris-HCl), а затем в течение ночи с сывороткой, разбавленной 1:1000 в блокирующем растворе. Затем срезы инкубировали с биотинилированным вторичным антителом (Vectastain Elite ABC Kit, Vector Laboratories) при комнатной температуре в течение одного часа, а затем подвергали реакции с комплексом авидин-биотин-пероксидаза в течение 60 минут (Vectastain Elite ABC Kit, Vector Laboratories), в обоих случаях при 25°C. Иммунную реакцию визуализировали с помощью набора субстрата пероксидазы (Vector VIP, Vector laboratories, Ca, США) и контрастно окрашивали метиловым зеленым (Vector Laboratories). Срезы исследовали с помощью микроскопа Olympus BX71. Иммуногистохимическое окрашивание (фиг.82A-C, фиг.83) указывает на то, что антитела, индуцированные иммунизацией пептидом SEQ ID NO: 270, 271, 275, 276, 280, 281 и 283, специфично распознавали патологические структуры белка тау, т.е. нейрофибриллярные узелки, в гиппокампе ткани головного мозга при болезни Альцгеймера. Сыворотки животных, вакцинированных упомянутыми выше пептидами, интенсивно устраняли нейрофибриллярную патологию, подтверждая, что антитела нацеливались на патологические белки тау. Антитела, индуцированные вакцинацией пептидами SEQ ID NO: 272 и 277, демонстрируют более слабую интенсивность окрашивания патологических структур белка тау в тканях головного мозга. Пептиды, которые индуцировали более низкие уровни специфичного к белку тау антительного ответа, или не индуцировали специфичный к белку тау антительный ответ (SEQ ID NO: 273, 274, 278, 279 и 282), были отрицательными в этом анализе. Сыворотки от мышей, которым вводили только адъювант, использовали в качестве отрицательных контролей. Они не распознавали нейрофибриллярную патологию (фиг.82C).
Все ссылки, цитированные в настоящем описании, включая патенты, патентные заявки, статьи, справочники и т.п., и ссылки, цитированные в них, если они еще не включены, включены в настоящее описание в качестве ссылок в полном объеме. Кроме того, следующие ссылки, которые цитированы в предшествующих абзацах в более сокращенной форме, также включены в настоящее описание в качестве ссылок в полном объеме, включая ссылки, цитированные в таких ссылках.


















Реферат
Изобретение относится к области биохимии, а именно к уникальным терапевтическим и диагностическим антителам, а также к их фрагментам, частям, производным и вариантам, которые связывают области белка тау, которые участвуют в инициации и развитии патологических взаимодействий тау-тау, а также к способам их получения. Также изобретение относится к способам применения этих антител для диагностики, профилактики и лечения болезни Альцгеймера и родственных таупатий. Кроме того, изобретение относится к способу профилактического и терапевтического лечения болезни Альцгеймера и других нейродегенеративных таупатий. Этот способ охватывает инъекцию антител и/или пептидных вакцин, которые индуцируют иммунный ответ, направленный на патологические белки тау и депозиты белка тау в головном мозге пациентов. Данные вакцины содержат тау-пептид, имеющий один или несколько из терапевтических эпитопов, предусматриваемых в рамках изобретения. Изобретение обеспечивает эффективную профилактику и лечение болезни Альцгеймера. 13 н. и 21 з.п. ф-лы, 83 ил., 1 табл., 27 пр.

Комментарии