Иммунизация вектором на основе вируса бешенства, экспрессирующим чужеродный белковый антиген - RU2660566C2
Код документа: RU2660566C2
Чертежи





Описание
Информация о правительственной дотации
Изобретение, описанное в настоящем описании, было осуществлено при правительственной поддержке по гранту № R21AI068837-01A2, выданному National Institutes of Health. Правительство имеет определенные права на настоящее изобретение.
Перекрестная ссылка на родственную заявку
Испрашивается приоритет по дате подачи временной патентной заявки США №61/708197, поданной 1 октября 2012 года. Полное содержание упомянутой выше заявки включено в качестве ссылки.
Список последовательностей
Настоящая заявка включает список последовательностей, который предоставлен в формате ASCII через EFS-Web, и он включен в настоящее описание в качестве ссылки в полном объеме. Указанная копия ASCII, созданная 17 июня 2013 года, названа 37075_0280_00_WO_SeqListing_ST25, и имеет размер 3396 байт.
Область изобретения
Изобретение относится к области биотехнологии и иммунологии, в частности, к применению рекомбинантных вакцин на основе вируса бешенства, экспрессирующих чужеродные антигены, для иммунизации против этих чужеродных антигенов.
Уровень техники, к которому относится изобретение
Вирус бешенства (RV) представляет собой вирус с несегментированной отрицательной цепью РНК семейства Rhabdoviridae и рода лиссавирусов. Геном RV имеет размер приблизительно 12 т.п.н. и кодирует пять моноцистронных РНК, кодирующих нуклеокапсидный белок (N), фосфопротеин (P), матриксный белок (M), трансмембранный гликопротеин (G) и вирусную полимеразу (L). Белок N RV заключает в капсид вирусную РНК с формированием рибонуклеопротеина (RNP), который является матрицей для транскрипции и репликации РНК вирусным полимеразным комплексом, состоящим из белков P и L. M RV связывает RNP с цитоплазамтическим доменом (CD) G RV в образовавшейся в клетке-хозяине вирусной мембране. G RV опосредует инфицирование клетки-хозяина. Главным признаком вируса бешенства является нейроинвазивность, которая относится к уникальной способности проникать в центральную нервную систему (ЦНС) из периферических областей.
Вирус бешенства представляет собой перспективный вакцинный вектор, способный эффективно индуцировать гуморальные и клеточные иммунные ответы на чужеродные антигены. Рекомбинантные живые вирусные векторы, экспрессирующие чужеродные антигены, эффективно индуцируют мощные клеточные и гуморальные иммунные ответы против экспрессируемых антигенов. Вследствие низкой распространенности серотипов в человеческой популяции, RV является превосходным кандидатом для вирусного вектора. Способы конструирования вирусов являются устоявшимися, в настоящее время включают вплоть до двух чужеродных генов общим размером 6,5 т.п.н., и чужеродные последовательности стабильно поддерживаются. RV растет до высоких титров в клеточных линиях, одобренных для производства вакцин человека, и его получение является экономичным. См., Smith et al., 2006, Virology, 353(2): 344-356. Например, компетентный по репликации RV, содержащий гетерологичные последовательности нуклеиновых кислот, кодирующие gp160 ВИЧ-1, описан в WO 01/55330. Иммунизация RV, кодирующим бактериальные, вирусные антигены или антигены злокачественной опухоли, слитые по меньшей мере с частью белка N или белка G RV, описаны в публикации патента США 2008/0311147. Экспрессия Env или Gag ВИЧ-1 приводит к мощным иммунным ответам, направленным против ВИЧ-1 (Schnell et al,. 2000, Proc. Natl. Acad. Sci USA 97(7): 3544-3549).
Доступность технологии обратной генетики позволила модифицировать вирусные элементы RV, которые обеспечивают патогенность и иммуногенность, и сделала осуществимой систематическую разработку более безопасного и более эффективного модифицированного живого вектора на основе бешенства. Например, патогенность фиксированных штаммов RV (т.е. ERA, SAD) для иммунокомпетентных мышей может быть полностью устранена путем внесения единичных аминокислотных замен в их белке G (Faber et al., 2005, J Virol 79: 14141-14148). RV, содержащие G SADB19 с мутацией Arg333→Glu333 являются непатогенными для взрослых мышей после внутричерепной/внутримозговой инокуляции; мутация Asn194→Ser194 в том же гене препятствует реверсии в патогенный фенотип (Faber et al., 2005, J Virol 79:14141-14148; Dietzschold et al., 2004, Vaccine 23: 518-524; US Pat. 7695724). Ген G, содержащий обе мутации, был обозначен как "GAS". С использованием гена GAS были сконструированы варианты RV с единичным и двойным GAS, SPBNGAS и SPBNGAS-GAS, соответственно (Faber et al., 2005, J Virol 79: 14141-14148; Li et al., 2008, Vaccine 26: 419-426). Внесение второго гена G значительно повышает эффективность вакцин посредством повышения его иммуногенности вследствие более высокой экспрессии G (Faber et al., 2002, J Virol 76: 3374-3381). Повышенная экспрессия G ассоциирована с мощной активацией генов, связанных с каскадом передачи сигнала NFκB, включая IFN-α/β и IFN-γ (Li et al., 2008, Vaccine 26:419-426) и увеличенной клеточной смертью (Faber et al., 2002, J Virol 76:3374-3381). Более того, присутствие двух генов G также существенно снижает вероятность реверсии к патогенности, поскольку непатогенный фенотип, определяемый GAS, доминирует над патогенным G, который может появиться во время роста вируса in vivo или in vitro (Faber et al., 2007, J Virol 81:7041-7047).
Следующим усовершенствованием безопасности рекомбинантного RV является высоко аттенуированный вариант RV с тройным G, SPBAANGAS-GAS-GAS (Faber et al., 2009, Proc. Natl. Acad. Sci USA 206(27):11300-11305). Вариант SPBAANGAS-GAS-GAS является полностью непатогенным после внутричерепного инфицирования мышей, которые либо имеют иммунодефицит, связанный со стадией развития (например, мыши в возрасте 5 суток), либо имеют врожденные дефициты иммунной функции.
Рекомбинантный RV, которые экспрессируют чужеродные антигены, происходящие из различных болезнетворных агентов, могут служить подходящими вакцинными векторами. Однако проблема, которая часто появляется при использовании рекомбинантных вирусов в вакцинологии, состоит в том, что они сконструированы так, что иммунная система подвергается воздействию антигенов вирусного вектора и чужеродного агента одновременно, и иммунный ответ против вирусного вектора доминирует над ответом на чужеродный антиген.
Для повышения эффективности вакцин широко используют адъюванты. Безопасность и переносимость являются ключевыми нормативными вопросами, противостоящими применению адъювантов. Область разработки адъювантов рассмотрена Petrovsky et al., "New-Age Vaccine Adjuvants: Friend or Foe?" BioPharm International, August 2, 2007, http
Как описано Petrovsky et al., польза включения любого адъюванта в вакцины должна быть сбалансирована относительно любой увеличенной реактогенности или риска неблагоприятных реакций. В большинстве случаев увеличенная эффективность адъюванта ассоциирована с увеличенной реактогенностью и токсичностью. Например, хотя полный адъювант Фрейнда (CFA) является "золотым стандартом" с точки зрения адъювантной эффективности, его чрезвычайная реактогенность и токсичность препятствуют его применению в вакцинах для человека.
Как описано Petrovsky et al., основной нерешенной проблемой в разработке адъювантов является то, как достигнуть мощного адъювантного эффекта, избегая реактогенности или токсичности. Большинство новых адъювантов для человека, включая MF59,4, ISCOMS,5, QS21,6, AS02,7 и AS048 обладают существенно более высокой локальной реактогенностью и системной токсичностью, чем квасцы. Даже квасцы, хотя и являются одобренными FDA, имеют существенные неблагоприятные эффекты, включая боль в области инъекции, воспаление и лимфаденопатию, и менее часто некроз в области инъекции, гранулемы или стерильный абсцесс. Хотя многие вызываемые адъювантами реакции на вакцины не являются опасными для жизни и устраняются с течением времени, они остаются одним из наиболее важных барьеров для лучшего принятия обществом стандартной профилактической вакцинации. В частности, это касается педиатрической вакцинации, где длительное недомогание ребенка вследствие увеличенной реактогенности может прямо приводить к сопротивлению вакцинации со стороны родителей и общества.
Использование эмульсий типа "масло-в-воде" ограничивается их реактогенностью и потенциалом в отношении неблагоприятных реакций. Частицы эмульсий типа "масло-в-воде" являются раздражающими и вызывают локальное воспаление, индуцируя хемотактический сигнал, который вызывает локальную инвазию макрофагов. Вследствие частых неблагоприятных реакций, основным применением у человека эмульсий типа "масло-в-воде" являются терапевтические вакцины против злокачественной опухоли и ВИЧ. Petrovsky et al., выше. Другие адъюванты, предложенные для применения у человека, характеризуются проблемами безопасности и/или рисками реактогенности в различной степени: монофосфориллипид A (значительная реактогенность); неметилированный динуклеотид CpG (в основном, реактогенность, токсичность, включая реакции области инъекции, гриппоподобные симптомы и головная боль), QS21, содержащий тритерпеноидные гликозиды (сапонины), происходящие из коры южноамериканского мыльного дерева (сильная боль в области инъекции, гранулемы и тяжелый гемолиз); ISCOM, которые представляют собой иммуностимулирующие комплексы, содержащие сапонин, стерин, и необязательно фосфолипид (проблемы токсичности и безопасности). Petrovsky et al., выше. Только недавно нанокристаллические частицы инулина Advax продемонстрировали перспективу свободы от побочных эффектов, адъювант является природным происходящим из растений полисахаридом, состоящим из цепи молекул фруктозы, оканчивающейся одной молекулой глюкозы.
Существует потребность в рекомбинантных композициях на основе RV и способах иммунизации, которые обеспечивают мощный иммунный ответ на чужеродные антигены, экспрессируемые рекомбинантными RV, без использования адъювантов.
Сущность изобретения
Способ индукции иммунного ответа у индивидуума включает стадии: (a) получения аттенуированного рекомбинантного вируса бешенства, кодирующего по меньшей мере один чужеродный белковый антиген, функционально связанный с последовательностями контроля, которые контролируют экспрессию указанного чужеродного антигена в подходящей реципиентной клетке; (b) введения указанного вируса бешенства в реципиентную клетку указанного индивидуума в условиях, которые позволяют экспрессию указанного одного или нескольких чужеродных белковых антигенов, тем самым индуцируя иммунный ответ на указанный чужеродный белковый антиген; и (c) усиления указанного иммунного ответа на указанный чужеродный белковый антиген путем введения указанному индивидууму указанного чужеродного белкового антигена, содержащегося в усиливающей композиции, которая свободна от адъюванта.
Чужеродный белковый антиген может содержать, например, прионный белковый антиген, ассоциированный со злокачественной опухолью антиген, вирусный антиген, бактериальный антиген или антиген простейших.
Вирус бешенства аттенуируют, т.е. преобразуют в непатогенный, например, путем внесения одной или нескольких мутаций в ген гликопротеина (G) бешенства, которые обеспечивают аттенуацию. Например, аттенуированный рекомбинантный вирус бешенства может содержать мутантный ген G, который кодирует гликопротеин вируса бешенства, где аминокислота 333 представляет собой глутаминовую кислоту. Мутантный ген G, кроме того, может кодировать гликопротеин вируса бешенства, где аминокислота 194 отлична от лизина, например, аминокислота 194 представляет собой серин. В некоторых вариантах осуществления аттенуированный рекомбинантный вирус бешенства содержит два или более генов G. По меньшей мере один и предпочтительно все из генов G содержат ослабляющую патогенность мутацию.
В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая по меньшей мере один чужеродный белковый антиген, расположена между двумя генами G в геноме указанного аттенуированного рекомбинантного вируса бешенства. В других вариантах осуществления нуклеотидная последовательность, кодирующая по меньшей мере один чужеродный белковый антиген, расположена между генами M и L в геноме аттенуированного рекомбинантного вируса бешенства.
В некоторых вариантах осуществления иммунизация аттенуированным рекомбинантным вирусом бешенства, кодирующим по меньшей мере один чужеродный белок, происходит без адъюванта.
Изобретение также относится к набору для осуществления на практике упомянутого выше режима иммунизации. Набор может содержать: (a) первую композицию, содержащую аттенуированный рекомбинантный вирус бешенства, кодирующий по меньшей мере один чужеродный белковый антиген, функционально связанный с последовательностями контроля, которые контролируют экспрессию указанного чужеродного антигена в подходящей реципиентной клетке; и (b) вторую композицию, содержащую по меньшей мере один чужеродный белковый антиген, где указанная вторая композиция является свободной от адъюванта. В некоторых вариантах осуществления первая композиция набора также свободна от адъюванта.
Описание чертежей
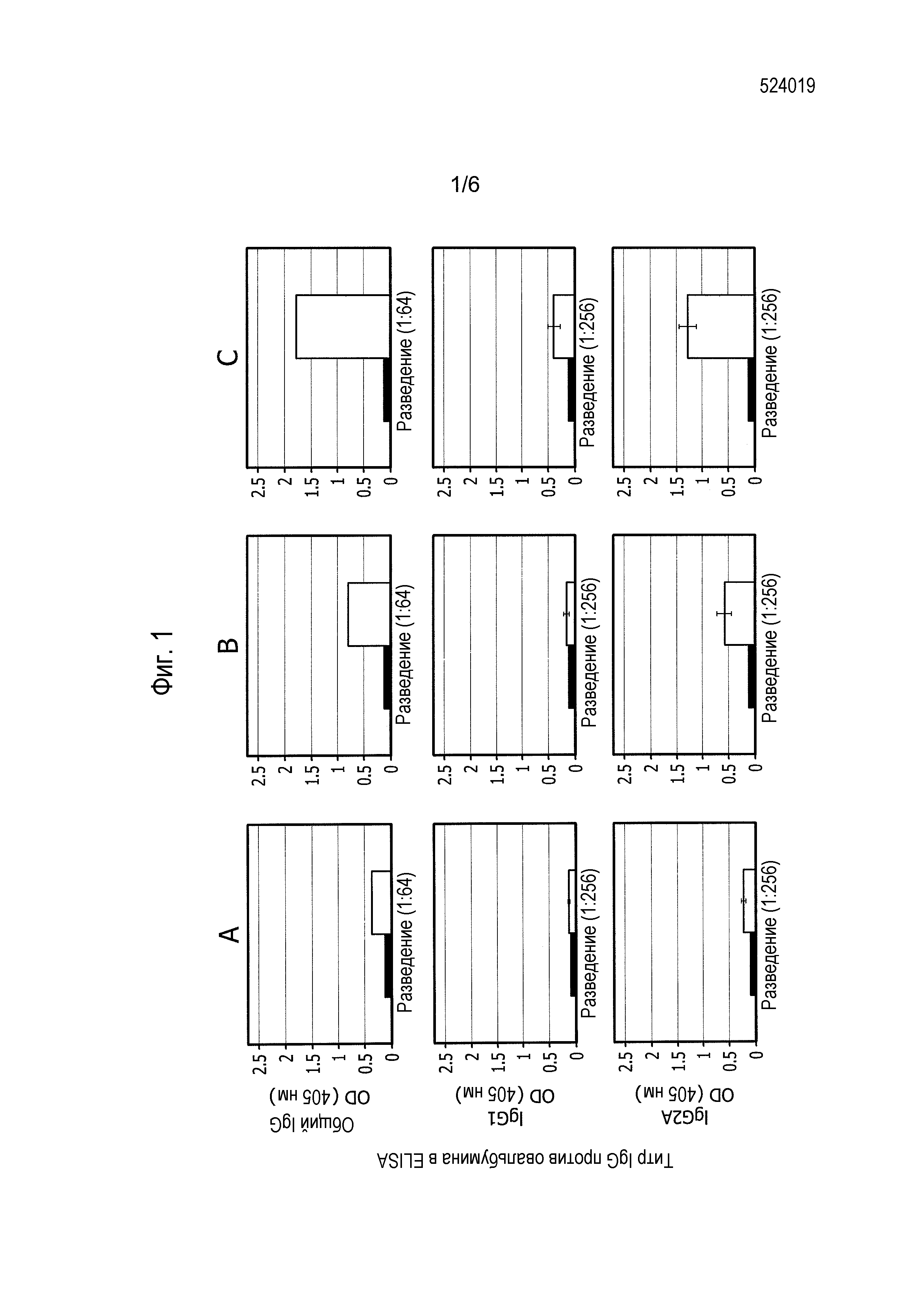
На фиг. 1 представлена серия графиков, демонстрирующих титры антител против овальбумина для общего иммуноглобулина (общий IgG), IgG1 и IgG2A у мышей, иммунизированных SPBAANGAS-OVA-GAS или SPBAAGAS-GAS (столбец A), с последующей усиливающей иммунизацией SPBAANGAS-OVA-GAS (столбец B) и третьей иммунизацией растворимым OVA (столбец C). В каждой рамке левый столбик соответствует мышам, первоначально иммунизированным SPBAAGAS-GAS, в то время как правый столбик соответствует мышам, первоначально иммунизированным SPBAAGAS-OVA-GAS.
На фиг. 2 представлены графики продуцирования нейтрализующих антител против вируса Нипах (NiV) (панель A), и антител, связывающих гликопротеин NiV (NiV-G) (панель B). Мышей иммунизировали различными концентрациями (103-106 FFU) варианта RV SPBAANGAS-NG-GAS, а затем у них проводили взятие крови через 21 сутки после первичной иммунизации и через 10 суток после усиливающей иммунизации. Нейтрализующие титры NiV определяли с использованием объединенной сыворотки. Результаты представлены на фиг. 2, панель A (нейтрализующие антитела против NiV) и панель B (антитела, связывающие NiV-G). В каждой паре столбиков левый столбик соответствует титру антител после первичной иммунизации; правый столбик соответствует титру антител после усиливающей иммунизации. Титры антител, связывающих NiV-G, представлены в качестве средних значений ± стандартная ошибка.
На фиг. 3 представлены графики продуцирования нейтрализующих антител против NiV (панель A), и антител, связывающих NiV-G (панель B). Мышей иммунизировали 105 FFU варианта RV SPBNGAS-GAS. Затем через 29 суток в одной группе проводили усиливающую иммунизацию 105 FFU SPBAANGAS-NG-GAS (столбики, обозначенные SPBNGAS-GAS/SPAANGAS-NG-GAS), в то время как другую группу иммунизировали 105 FFU SPBN (столбики, обозначенные SPBNGAS-GAS/SPBNGAS-GAS). Взятие крови у мышей проводили через 21 сутки после первичной иммунизации (1 взятие крови: левые столбики в каждом из двух наборов столбиков на панелях) и через 10 суток после усиливающей иммунизации (2 взятие крови: правые столбики в каждом из двух наборов столбиков на панелях). Нейтрализующие титры NiV определяли с использованием объединенной сыворотки. Результаты представлены на фиг. 3A (NiV нейтрализующие антитела) и на фиг. 3B (антитела, связывающие NiV-G). Титры антител, связывающих NiV-G, представлены в качестве средних значений ± стандартная ошибка.
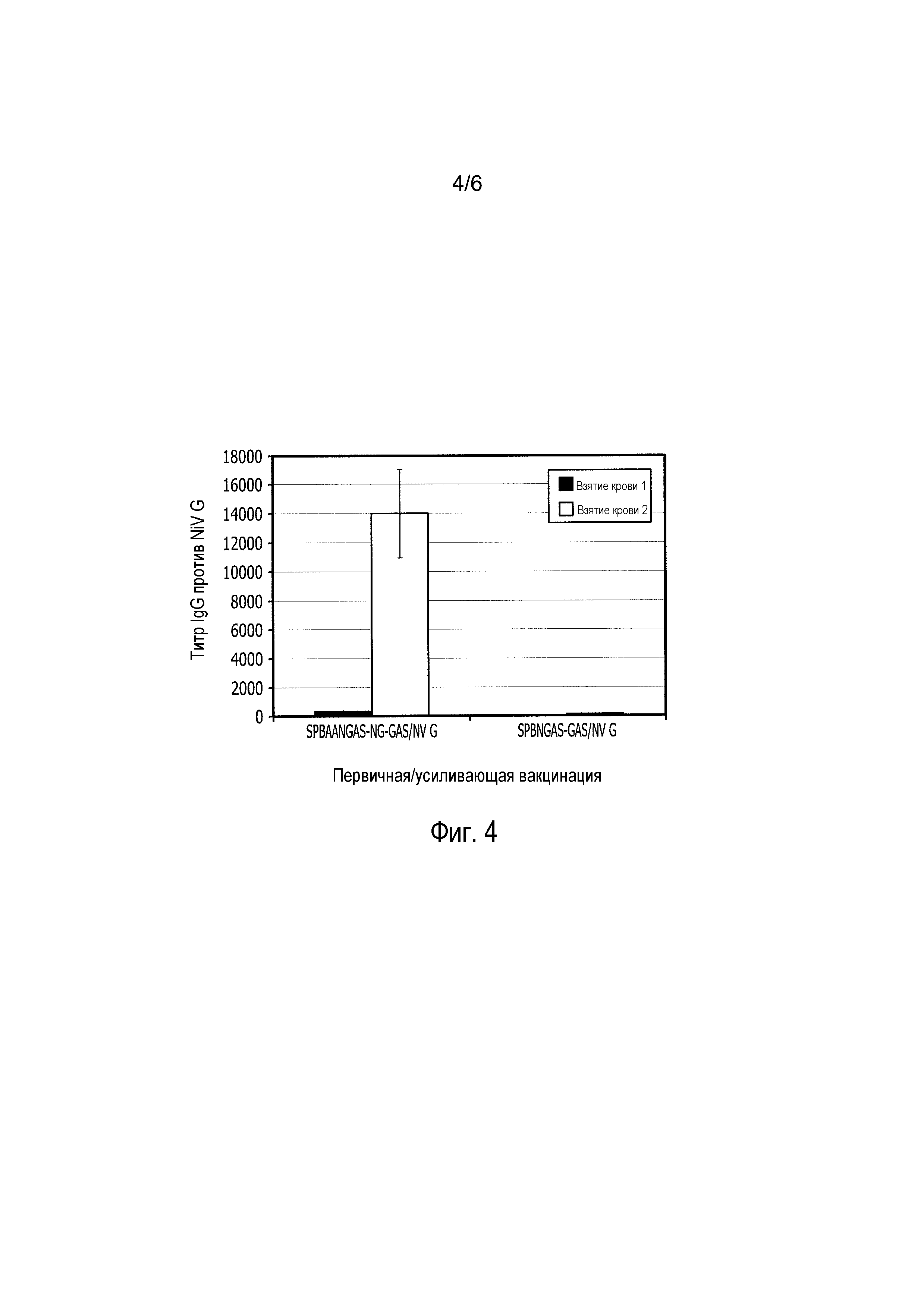
На фиг. 4 представлен график продуцирования антител против NiV-G. Сначала две группы мышей иммунизировали 105 FFU SPBAANGAS-NG-GAS или 105 FFU варианта RV SPBNGAS-GAS. Через двадцать три дня обеим группам мышей проводили усиливающую иммунизацию рекомбинантно экспрессируемым растворимым не содержащим адъюванта NiV-G. У мышей проводили взятие крови через 19 суток после первичной иммунизации (левые столбики в каждой паре столбиков на фиг. 4) и через 10 суток после усиливающей иммунизации (правые столбики в каждой паре столбиков) и количественно определяли антитела, связывающие NiV-G. Титры антител, связывающих NiV-G, представлены в качестве средних значений ± стандартная ошибка.
Фиг. 5 включает иммунизацию и расписание взятия образцов крови A, и на серии графиков B-D представлена продукция антител против NiV-G. Мышей иммунизировали на нулевые сутки и 29 сутки 105 FFU SPBAANGAS-NG-GAS. Через сто девяносто пять суток после второй иммунизации мышам проводили усиливающую иммунизацию рекомбинантно экспрессируемым растворимым NiV-G. У мышей проводили взятие крови в моменты времени взятия крови, показанные в расписании, обозначенном A. Количественно определяли нейтрализующие антитела против NiV (панель B), все специфические антитела против NiV-G (панель C), и специфичные к NG изотипы IgM, IgG 1, IgG 2A и IgG 2B (панель D). Нейтрализующие титры NiV определяли с использованием объединенной сыворотки. Титры антител, связывающих NiV-G, представлены в качестве средних значений ± стандартная ошибка.
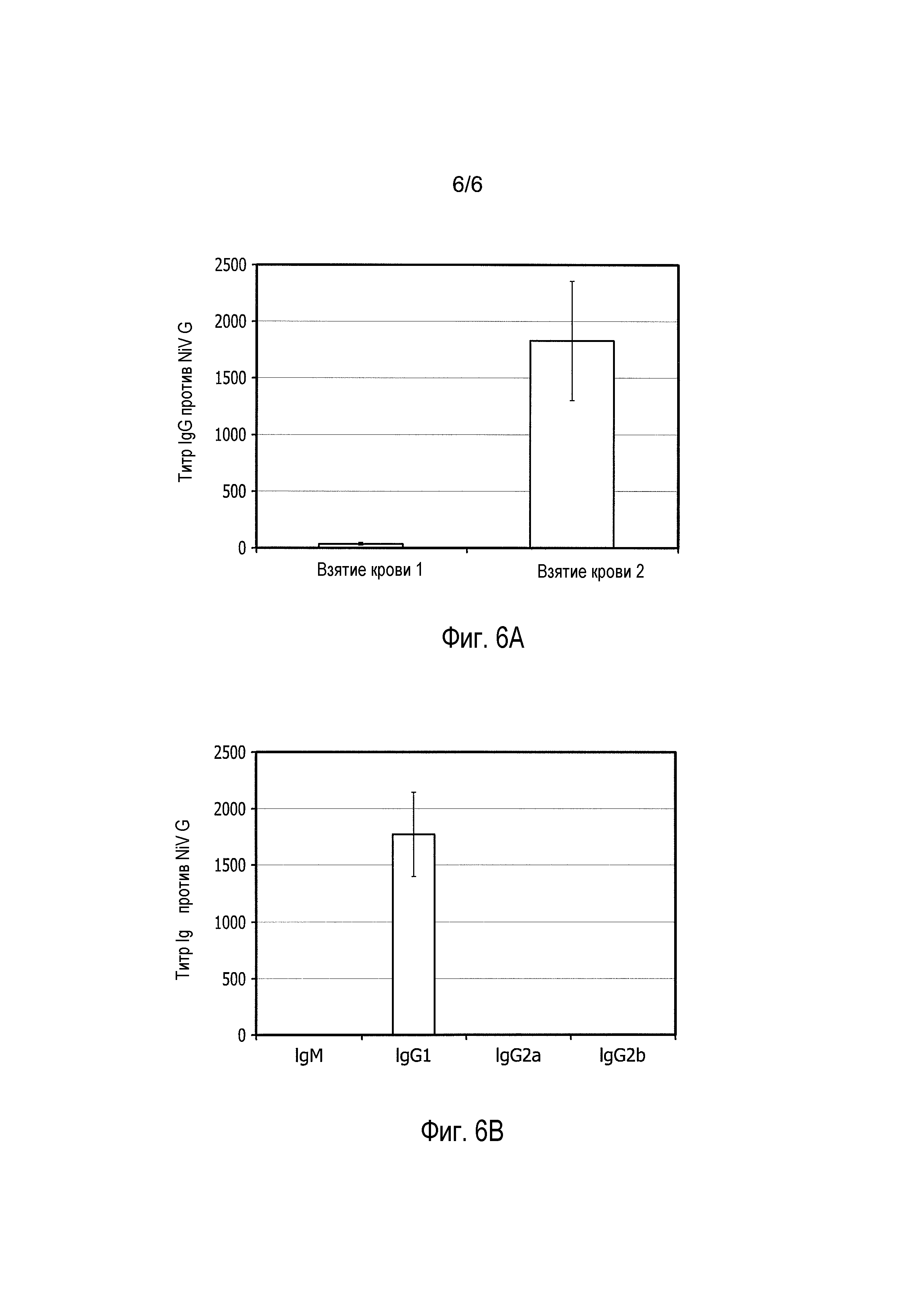
На фиг. 6A и 6B представлена продукция антител против NiV-G. Мышей иммунизировали NiV-G и через 3 недели им проводили усиливающую иммунизацию NiV-G. У мышей проводили взятие крови через 10 суток после первичной иммунизации и через 10 суток после усиливающей иммунизации. Проводили измерение общих антител, связывающих NiV-G, для двух взятий крови (фиг. 6A). Специфичные к NiV-G изотипы IgM, IgG 1, IgG 2A и IgG 2B, продуцированные после усиливающей иммунизации, измеряли с использованием ELISA (фиг. 6B). Титры антител, связывающих NiV-G, представлены в качестве средних значений ± стандартная ошибка.
Определения
Определения, используемые в настоящей заявке, предназначены для иллюстративных целей и не ограничивают объем изобретения.
Форма единственного числа используется в настоящем описании для обозначения одного или более одного (например, по меньшей мере одного) грамматического объекта. В качестве примера, "элемент" означает один элемент или более одного элемента.
Термин "приблизительно" понятен специалисту в данной области, и он варьирует в некоторой степени в зависимости от контекста, в котором его используют. Как используют в рамках изобретения, "приблизительно" охватывает варьирование ±20% или ±10%, более предпочтительно ±5%, еще более предпочтительно ±1%, и еще более предпочтительно ±0,1%.
Термин "антитело", как используют в рамках изобретения, относится к молекуле иммуноглобулина, которая способна специфически связываться с определенным эпитопом на антигене. Антитела могут представлять собой интактные иммуноглобулины, происходящие из природных источников или из рекомбинантных источников, и они могут представлять собой иммунореактивные части интактных иммуноглобулинов. Антитела, как правило, представляют собой тетрамеры молекул иммуноглобулинов. Антитела, которые можно использовать при применении на практике настоящего изобретения, могут существовать в различных формах, включая, например, поликлональные антитела, моноклональные антитела, Fv, Fab и F(ab)2, а также одноцепочечные антитела и гуманизированные антитела (Harlow et al., 1999, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York; Harlow et al., 1989, Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85: 5879-5883; Bird et al., 1988, Science 242: 423-426).
Термин "адъювант" относится к соединению или смеси, которые усиливают иммунный ответ на антиген. Адъювант может служить в качестве депо в ткани, которое медленно высвобождает антиген, а также в качестве активатора лимфоидной системы, который неспецифически усиливает иммунный ответ (Hood et al., Immunology, Second Ed., 1984, Benjamin/Cummings: Menlo Park, Calif., p. 384). Адъюванты включают, но не ограничиваются ими, полный адъювант Фрейнда, неполный адъювант Фрейнда, сапонин, минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, полиолы плюроник, полианионы, пептиды, масляные или углеводородные эмульсии, гемоцианины лимфы улитки, динитрофенол и потенциальные пригодные для человека адъюванты, такие как BCG (бацилла Кальметта-Герена) и Corynebacterium parvum. Термин "не содержащий адъюванта" относится к любому препарату, который не содержит адъюванта, как описано выше.
Как используют в рамках изобретения, каждая "аминокислота" представлена с помощью ее полного названия, трехбуквенного кода, соответствующего ему, или соответствующего ему однобуквенного кода, как указано в следующей таблице:
Выражение "аминокислота", как используют в рамках изобретения, включает как природные, так и синтетические аминокислоты, и как D-, так и L-аминокислоты.
Термин "животное" имеет его обычно значение и включает человека.
"Аттенуированный", как используют в рамках изобретения в контексте живого вируса, такого как вирус бешенства, означает, что способность вируса инфицировать клетку или индивидуума и/или способность вызывать заболевание снижена (например, устранена). Аттенуация может быть результатом либо генетического механизма, вовлекающего преждевременную терминацию транскрипции с генома RV, либо она может быть иммунологической в качестве процесса, при котором патогенный RV утрачивает свою вирулентность.
"Кодирующий" относится к свойству, присущему конкретным последовательностям нуклеотидов в полинуклеотиде, таким как ген, кДНК или мРНК, служить в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, имеющих определенную последовательность нуклеотидов (т.е., рРНК, тРНК и мРНК) или определенную последовательность аминокислот и биологический свойства, являющихся результатом этого. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, приводит к образованию белка в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно предоставляется в списках последовательностей, так и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, может быть указана в качестве кодирующей белок или другой продукт этого гена или кДНК.
"Экспрессия гена" или "экспрессия", как используют в рамках изобретения, относится к процессу, посредством которого информация с гена преобразуется в функциональный продукт гена, такой как РНК или белок. Таким образом, "уровень экспрессии" продукта маркерного гена в представляющем интерес образце относится к уровню РНК, в частности, к уровню мРНК, или к уровню кодируемого белка, и он не ограничивается любым из них.
Как используют в рамках изобретения, "экспрессирующий вектор" представляет собой генетический элемент, который функционирует в качестве автономного элемента репликации ДНК под его собственной последовательностью контроля, с которым может быть связан или в который может быть встроен другой сегмент ДНК, так чтобы осуществлялась репликация связанного или встроенного сегмента. Экспрессирующие векторы включают плазмиды, фаги или космиды. Как правило, экспрессирующие векторы содержат промоторные последовательности, которые способствуют эффективной транскрипции и трансляции связанного или встроенного сегмента ДНК в конкретной клетке-хозяине. Экспрессирующий вектор также обычно содержит ориджин репликации и терминатор(ы) транскрипции, а также конкретные гены, которые способны обеспечивать фенотипическую селекцию в трансфицированных клетках-хозяевах.
Под "чужеродным белковым антигеном" или антигеном, экспрессируемым рекомбинантным вирусом бешенства, подразумевают антиген белка, который не является нативным для вируса бешенства, экспрессирующего антиген. В определенных вариантах осуществления, когда чужеродный антиген представляет собой антиген вируса, вирус отличается от вируса бешенства.
Как используют в рамках изобретения, термин "ген" относится к элементу или комбинации элементов, которые способны экспрессироваться в клетке либо отдельно, либо в комбинации с другими элементами. Как правило, ген содержит (от 5' к 3'-концу): (1) промоторную область, которая включает 5' нетранслируемую лидерную последовательность, способную функционировать в любой клетке, такой как прокариотическая клетка, вирус или эукариотическая клетка (включая трансгенных животных); (2) последовательность структурного гена или полинуклеотидную последовательность, которая кодирует желаемый белок; и (3) 3'-нетранслируемую область, которая, как правило, вызывает терминацию транскрипции и полиаденилирование 3'-области последовательности РНК. Каждый из этих элементов функционально связан путем последовательного присоединения к соседнему элементу.
Как используют в рамках изобретения, "продукты генов" включают любой продукт, который продуцируется в процессе транскрипции, обратной транскрипции, полимеризации, трансляции, посттрансляционного процессинга и/или экспрессии гена. Продукты генов включают, но не ограничиваются ими, белки, полипептиды, пептиды, пептидные фрагменты или полинуклеотидные молекулы.
Как используют в рамках изобретения, "ген белка G RV" или "ген белка G" или "ген G" означает последовательности нуклеиновой кислоты, которые, когда они присутствуют в геноме RV, являются достаточными для кодирования гликопротеина RV в инфицированной клетке. Таким образом, ген белка G включает кодирующую последовательность, которая фланкируется на 3'-конце короткой последовательностью начала транскрипции и на 5'-конце короткой последовательностью остановки транскрипции/полиаденилирования. Ген G может включать межгенную область из 1-59 нетранслируемых нуклеотидов, которая расположена между 5'-последовательность остановки/полиаденилирования и 3'-последовательностью начала транскрипции следующего гена вируса. См., например, pgs. 134-136 Conzelman K-K (1998), Ann. Rev. Genet. 32: 123-62.
"Гомологичный", как используют в рамках изобретения, относится к субъединичному сходству последовательностей между двумя полимерными молекулами, например, между двумя молекулами нуклеиновой кислоты, такими как две молекулы ДНК или две молекулы РНК, или между двумя полипептидными молекулами. Когда положение субъединиц в обеих молекулах занимает одна и та же мономерная субъединица; например, если положение в каждой из двух молекулах ДНК занимает аденин, тогда они являются гомологичными по этому положению. Гомология между двумя последовательностями прямо зависит от количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях являются гомологичными, две последовательности являются на 50% гомологичными; если 90% положений (например, 9 из 10), совпадают или гомологичны, две последовательности являются на 90% гомологичными. В качестве примера, последовательности ДНК 3'ATTGCC5' и 5'TATGGC3' являются на 50% гомологичными.
Как используют в рамках изобретения, "гомологию" используют синонимично с "идентичностью".
Термин "иммунизация" относится к процессу индукции частичной или полной защиты от заболевания. Альтернативно термин относится к процессу индукции или усиления ответа иммунной системы на антиген.
"Иммунный ответ" на антиген или вакцинную композицию представляет собой развитие у индивидуума гуморального и/или клеточно-опосредуемого иммунного ответа на молекулы, присутствующие в представляющей интерес антигенной или вакцинной композиции. Для целей настоящего изобретения "гуморальный иммунный ответ" представляет собой опосредуемый антителами иммунный ответ, и он вовлекает образование антител с аффинностью в отношении антигена/вакцины по изобретению, в то время как "клеточно-опосредуемый иммунный ответ" представляет собой ответ, опосредуемый T-лимфоцитами и/или другими лейкоцитами. "Клеточно-опосредуемый иммунный ответ" индуцируется презентацией антигенных эпитопов, связанных с молекулами класса I или класса II главного комплекса гистосовместимости (MHC).
"Выделенный" означает измененный или извлеченный из природного состояния действиями человека. Например, нуклеиновая кислота или пептид, присутствующие в природе в живом организме, не являются "выделенными", однако те же нуклеиновая кислота или пептид, частично или полностью отделенные от сосуществующих с ними материалов в их природном состоянии, являются "выделенными". Выделенная нуклеиновая кислота или белок могут существовать в по существу очищенной форме или они могут существовать в ненативной среде, например, такой как клетка-хозяин.
"Мутация", как используют в рамках изобретения, относится к изменению последовательности нуклеиновой кислоты или полипептида относительно эталонной последовательности (которая предпочтительно представляет собой встречающуюся в природе нормальную последовательность или последовательность "дикого типа"), и включает транслокации, делеции, инсерции и замены/точковые мутации. "Мутант", как используют в рамках изобретения, относится либо к нуклеиновой кислоте, либо к белку, содержащим мутацию.
"Нуклеиновая кислота" относится к полинуклеотиду и включает полирибонуклеотиды и полидезоксирибонуклеотиды.
Кодирующая последовательность является "функционально связанной" с последовательностью контроля, такой как последовательность контроля транскрипции и трансляции в клетке, когда РНК-полимераза транскрибирует кодирующую последовательность в мРНК, которая затем подвергается транс-сплайсингу РНК и транслируется в белок, кодируемый кодирующей последовательностью.
Как используют в рамках изобретения, термины "пептид", "полипептид" и "белок" используют взаимозаменяемо, и они относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должны содержать по меньшей мере две аминокислоты, и отсутствует ограничение максимального количества аминокислот, которое может составлять последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащие две или более аминокислот, связанных друг с другом пептидными связями. Как используют в рамках изобретения, термин относится как к коротким цепям, которые обычно в данной области называют, например, пептидами, олигопептидами и олигомерами, и к более длинным цепям, которые обычно называют в данной области белками, для которых существует множество типов. "Полипептиды" включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки, среди прочих. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды или их комбинацию.
Как используют в рамках изобретения, "полинуклеотид" включает кДНК, РНК, гибрид ДНК/РНК, антисмысловую РНК, рибозим, геномную ДНК, синтетические формы и смешанные полимеры, как смысловые, так и антисмысловые цепи, и он может быть химически или биохимически модифицирован так, чтобы он содержал неприродные или дериватизированные, синтетические или полусинтетические нуклеотидные основания. Также в объем изобретения входят изменения гена дикого типа или синтетического гена, включающие, но не ограничивающиеся ими, делецию, инсерцию, замену одного или нескольких нуклеотидов, или слияние с другими полинуклеотидными последовательностями при условии, что такие изменения первичной последовательности гена не изменят способности экспрессируемого пептида индуцировать пассивный иммунитет.
"Фармацевтически приемлемый" означает физиологически переносимый для применения либо у человека, либо в ветеринарии.
Как используют в рамках изобретения, "фармацевтические композиции" включают составы для применения у человека и в ветеринарии.
Как используют в рамках изобретения, "промотор" относится к области последовательности ДНК, активной при инициации и регуляции экспрессии структурного гена. Эта последовательность ДНК, обычно выше кодирующей последовательности структурного гена, контролирует экспрессию кодирующей области путем обеспечения распознавания РНК-полимеразой и/или другими элементами, требуемыми для начала транскрипции в правильном участке.
Как используют в рамках изобретения, термин "индивидуум" относится к любому позвоночному животному, включая, но не ограничиваясь ими, человека и других приматов, грызунов (например, мыши, крысы и морские свинки), зайцеобразных (например, кролики), бычьих (например, крупный рогатый скот), овечьих (например, овца), козьих (например, козы), свиных (например, свинья), лошадиных (например, лошади), собачьих (например, собаки), кошачьих (например, кошки), домашних птиц (например, куры, индейки, утки, гуси, другие куриноподобные птицы и т.д.), а также неприрученных или диких животных, включая, но не ограничиваясь ими, таких животных как копытное животное (например, олень), медведь, рыбы, зайцеобразные, грызуны, птицы и т.д.
Как используют в рамках изобретения, "трансфицированная" клетка представляет собой клетку, в которую введена экзогенная или гетерологичная последовательность нуклеиновой кислоты. Последовательность нуклеиновой кислоты, которая была введена, может быть встроена в геном трансфицированной клетки или может поддерживаться эписомально. Стабильно трансфицированная клетка представляет собой клетку, в которой введенная ДНК встроилась в хромосому так, что она наследуется дочерними клетками посредством репликации хромосомы.
Термин "вакцина", как используют в рамках изобретения, определяют как материал, используемый для индукции иммунного ответа после введения материала позвоночному, как правило, млекопитающему. В предпочтительных вариантах осуществления вакцина может представлять собой иммуногенную композицию, обеспечивающую или способствующую предупреждению заболевания. В других вариантах осуществления вакцина представляет собой композицию, которая может обеспечивать или способствовать излечению заболевания. В других вариантах осуществления вакцинная композиция может обеспечивать или способствовать смягчению заболевания. Другие варианты осуществления вакцинной иммуногенной композиции можно использовать в качестве терапевтических и/или профилактических средств.
"Вектор", как используют в рамках изобретения, относится к репликону, такому как плазмида, фаг или космида, с которым может быть связан другой сегмент ДНК для осуществления репликации связанного сегмента.
Термин "вирус", как используют в рамках изобретения, определяют как частицу, состоящую из нуклеиновой кислоты (РНК или ДНК), заключенной в белковую оболочку, с наружной липидной оболочкой или без нее, которая способна реплицироваться в клетке-хозяине.
Как предусматривается настоящим изобретением в отношении описанных композиций и способов, в одном аспекте варианты осуществления изобретения включают компоненты и/или стадии, описанные в настоящем описании. В другом аспекте варианты осуществления изобретения по существу состоят из компонентов и/или стадий, описанных в настоящем описании. В другом аспекте варианты осуществления изобретения состоят из компонентов и/или стадий, описанных в настоящем описании.
Подробное описание изобретения
Проблемой, которая часто возникает при использовании рекомбинантных вирусов в вакцинологии для вакцинации против чужеродных антигенов, включая рекомбинантные RV, экспрессирующие чужеродные антигены, является то, что иммунный ответ против вирусного вектора доминирует над ответом на чужеродный антиген. Для усиления иммунного ответа на чужеродный антиген предусматривается режим первичной/усиливающей иммунизации. В режиме используются живые аттенуированные, предпочтительно непатогенные, рекомбинантные RV, экспрессирующие один или несколько чужеродных белковых антигенов. В одном варианте осуществления чужеродный белковый антиген не экспрессируется в структуре рекомбинантного RV, а экспрессируется только в клетках, инфицированных вирусом. Режим включает первичную иммунизацию вакциной на основе высоко аттенуированного рекомбинантного вируса бешенства, например, SPBAANGAS-GAS, который экспрессирует конкретный белковый антиген, чужеродный для вируса бешенства, и усиливающую иммунизацию соответствующим чужеродным белковым антигеном в свободной форме, например, в растворимой форме. Режим может включать множество иммунизаций экспрессисрующим чужеродный белковый антиген RV, и/или множество усиливающих иммунизаций чужеродным белковым антигеном. Состав усиливающей композиции не содержит адъюванта.
Первичная иммунизация рекомбинантным RV, экспрессирующим чужеродный белковый антиген отдельно, индуцирует длительную память T-клеток в отношении чужеродного белкового антигена. Однако антительный ответ на чужеродный антиген является слабым после первичной иммунизации рекомбинантной вакциной на основе RV и только немного увеличивается при повторном введении той же рекомбинантной вакцины RV. Напротив, усиливающая иммунизация соответствующим свободным чужеродным белковым антигеном приводит к отчетливому увеличению продукции антител, специфичных к чужеродному белковому антигену, неожиданно в отсутствие адъюванта в составе для усиливающей иммунизации. Величина и качество иммунного ответа, который индуцируется с использованием первичной иммунизации рекомбинантным RV с последующим усилением не содержащим от адъюванта чужеродным белковым антигеном, является лучшей, чем в случае первичной/усиливающей иммунизации только одной формой антигена или других стратегий первичной-усиливающей иммунизации (например ДНК, а затем белок).
Примечательно, против чужеродного белка продуцируются преимущественно антитела IgG 2A/C и IgG 2B после первичной/усиливающей иммунизации рекомбинантной вакциной RV и растворимым антигеном, что указывает на TH1-ответ. Важно, что этот режим не индуцирует патологические воспалительные механизмы. С другой стороны, первичная/усиливающая иммунизация с использованием только растворимых белков приводит к продуцированию относительно низких количеств специфичных к антигену антител, которые практически исключительно представляют собой изотип IgG 1, что указывают на ответ TH2. TH1-ответ T-клеток обычно считают преимущественным при защите против определенных патогенов и неопластических клеток относительно TH2-ответа. Это особенно справедливо для инфекций/злокачественных опухолей в тканях, для терапии которых требуется инфильтрация иммунных клеток. Таким образом, режим первичной/усиливающей иммунизации с использованием рекомбинантной вакцины RV вместе с соответствующим растворимым чужеродным белком индуцирует иммунный ответ и иммунологическую память, подходящие для оптимальной защиты против множества инфекционных агентов.
Живой аттенуированный рекомбинантный RV доставляет синтезированный de novo чужеродный белковый антиген для безопасного примирования иммунного ответа на белок с соответствующими характеристиками, например, ответа TH1 в отсутствие воспаления. Усиливающая иммунизация соответствующим растворимым чужеродным белком стимулирует примированные B- и T-клетки в вакцинированном хозяине, вызывая мощный антительный TH1-ответ на белок. В то время как белки пригодны в качестве антигенов, поскольку их точное химическое определение позволяет определить точные эпитопы, против которых будет индуцироваться иммунный ответ, растворимые белки сами по себе могут быть слабоиммуногенными, требующими совместного введения с мощными адъювантами, например, адъювантом Фрейнда. Неожиданно, мощного ответа достигают с использованием усиливающего состава, который не включает адъюванта.
Первичная иммунизация рекомбинантной вакциной RV, экспрессирующей чужеродный белок в заданных инфицированных клетках, с последующей усиливающей иммунизацией соответствующим растворимым чужеродным белком, даже в отсутствие адъюванта в усиливающем составе, индуцирует иммунный ответ и иммунологическую память, пригодную для оптимальной защиты от множества инфекционных агентов. В случае иммунизации против патогена, индуцированный иммунный ответ может включать "защитный" иммунный ответ, который служит для защиты индивидуума от инфекции. Обеспечиваемая защита может не быть абсолютной, т.е. инфекция не должна предупреждаться или устраняться полностью, если существует статистически значимое улучшение по сравнению с контрольной популяцией млекопитающих. Защита может ограничиваться уменьшением тяжести или быстроты появления симптомов инфекции.
Неожиданно, изобретение относится к индукции иммунитета против антигенов, которые являются слабоиммуногенными, как в случае вирусов, которые опосредуют определенные острые и хронические вирусные инфекции, а также антигенов, которые экспрессируются различными злокачественными клетками. Таким образом, изобретение удовлетворяет потребность в вакцинах, которые являются эффективными для предупреждения или излечения появляющихся инфекционных заболеваний и злокачественных опухолей. Важно, что патологические воспалительные механизмы не индуцируются режимом иммунизации/усиления по настоящему изобретению.
Пригодным RV для применения настоящего изобретения на практике является аттенуированный RV. Варианты осуществления RV для применения в рамках настоящего изобретения включают рекомбинантные непатогенные живые вирусы бешенства, которые модифицированы для предупреждения или устранения мутации или реверсии в патогенную форму. В некоторых вариантах осуществления непатогенный рекомбинантный RV содержит модифицированный или измененный ген G. В определенных вариантах осуществления ослабления достигают с помощью одной или нескольких мутаций в гене G RV, который кодирует гликопротеин. Аминокислота(ы) в белке G живого вируса бешенства, которые обеспечивают патогенную форму вируса, можно определять, и ген G, или более конкретно кодон(ы) для одной или нескольких аминокислот в гене G, можно модифицировать путем замены одного или нескольких нуклеотидов. Модифицированный ген G обеспечивает непатогенный живой вирус бешенства, который устраняет или противодействует последующему возникновению мутации, приводящей к замене аминокислот в экспрессируемом гликопротеине.
Способы модификации последовательностей G-белка для обеспечения аттенуации вирусов известны и обобщенно представлены в патенте США 7223584. Например, патогенность конкретного вируса бешенства связана с детерминантой G-белка, которая взаимодействует с предполагаемыми рецепторами клеточной поверхности (Coulon et al. (1982), J. Gen. Virol. 61: 97; Coulon et al. (1983), J. Gen. Virol. 64: 693-696; и Dietzschold et al. (1983), Proc. Natl. Acad. Sci USA. Изменение этой детерминанты белка G может ослабить патогенность RV. В частности, замена аргинина в положении 333 белка G глутамином или глицином приводит к замедлению захвата вируса и полной утрате патогенности определенных штаммов RV (например, ERA, CVS-11). См. Dietzschold et al. (1983), выше, и Dietzschold et al. (1985), J. Virol. 56: 12-18.
Делеции или другие изменения в цитоплазматическом домене белка G, так чтобы цитоплазматическая хвостовая часть белка G более не связывалась с комплексом RNP-M, также ослабляют патогенность штамма RV. Например, замена цитоплазматического домена конкретного белка G цитоплазматическим доменом из другого штамма RV делает RV непатогенным при в/м введении. См. Morimoto et al. (2000), J. Neuro Virol. 6: 373-381.
Например, рекомбинантный RV SPBNGA сконструирован так, чтобы он содержал ген G штамма SAD B19, в котором Arg333 заменен на Glu333. Содержащий Glu333 белок G, обозначаемый как "GA", делает вирус непатогенным. Arg333 можно заменять другими аминокислотами, которые делают его непатогенным, например, аспарагиновую кислоту можно использовать для замены Arg333 с получением белка G с Asp333.
Вирус бешенства может быть далее ослаблен путем изменения гена G так, чтобы обеспечить по меньшей мере один нуклеотид, кодирующий аминокислоту 194, который препятствует мутации, как описано в патенте США 7695724. По меньшей мере один нуклеотид из нуклеотидов 637-639, кодирующих аминокислоту в положении 194 гликопротеина, изменяют сайт-направленным мутагенезом с AAT, например, на TCC. Эта мутация, которая заменяет аспарагин в положении 194 белка серином, минимизирует возможность замены Asn→Lys в положении аминокислоты 194 белка G. Можно использовать другие вырожденные кодоны для серина в гене G в положении 637-639, и кодоны других аминокислот, которые минимизируют возможность замены Asn→Lys в положении аминокислоты 194 белка GA, могут быть встроены в положении 637-639 в гене G. Для белка GA, имеющего, например, аминокислоту, подобную серину, кодируемую в положении аминокислоты 194, подвергнутый мутагенезу белок GA может быть обозначен как "GAS" и рекомбинантные вирусы, экспрессирующие ген GAS, называют "SPBNGAS". Рекомбинантный вирус, содержащий два или три экспрессирующихся гена GAS, называют "SPBNGAS-GAS" и "SPBNGAS-GAS-GAS", соответственно.
Нуклеотидная последовательность гена GAS представлена в патенте США 7695724 в качестве SEQ ID NO: 5.
В определенных вариантах осуществления рекомбинантный RV может содержать два или более генов G, и, в частности, два или более генов G, содержащих аттенуирующие модификации, описанные выше. Получение рекомбинантного RV, содержащего множество генов G, описано в патенте США 7223584 (SPBNGA-GA), патенте США 7695724 (SPBNGAS-GAS) и в публикации патента США US-2011-0064764 (SPBNGAS-GAS-GAS).
Аттенуации RV также можно достигать путем комбинирования мутаций в двух различных частях вирусного генома, например, в генах фосфопротеина (P) и G. См. публикацию патента США 2002-0164356, в которой описаны RV, содержащие мутацию в области гена P, охватывающей остатки 139-170, и одновременно замену Arg333 в гене G.
Кроме того, аттенуированный RV модифицируют для экспрессии чужеродного белкового антигена. Белковый антиген может кодировать целый белок или любой его иммуногенный фрагмент, который способен индуцировать иммунный ответ у иммунизированного хозяина. Таким образом, под "чужеродным белковым антигеном", как используют в рамках изобретения, подразумевают либо целый белок, либо любой его фрагмент, способный индуцировать иммунный ответ у иммунизированного хозяина. Нуклеотидную последовательность, кодирующую чужеродный белковый антиген, можно встраивать в участок, который не является необходимым для инфекции или репликации вируса, где встраивание не препятствует значительно инфекции или репликации RV. Предпочтительные положения для встраивания гена, экспрессирущего чужеродный белковый антиген, включают положения между множеством копий гена G в RV, содержащем множество генов G, или между генами M и L вируса бешенства.
В соответствии с одним вариантом осуществления кДНК плазмидного вектора SPBAANGAS-GAS содержит один участок клонирования, который расположен между двумя генами GAS. Этот участок используют для встраивания кДНК выбранного белка с использованием стандартной технологии клонирования.
Стандартную технологию рекомбинантных ДНК можно использовать для изменения генома RV для достижения аттенуации и для встраивания генов, кодирующих чужеродные белковые антигены, в геном RV. Например, рекомбинантные геномы RV можно конструировать, сначала получая (путем клонирования, рестрикционного расщепления и выделения, или иным путем) одну или несколько модифицированных последовательностей генов белка G для встраивания в геном RV для обеспечения аттенуации и одну или несколько последовательностей генов, кодирующих один или несколько чужеродных белковых антигенов. Можно использовать сайт-направленный мутагенез, рестрикцию и повторное легирование с гетерологичными последовательностями. Расщепление соответствующими ферментами рестрикции позволяет встраивание дополнительных нуклеотидных последовательностей. Надлежащее встраивание дополнительных нуклеотидных последовательностей можно подтверждать с использованием способов, таких как анализ с ферментами рестрикции и/или секвенирование ДНК.
Живые инфекционные вирусные частицы, способные экспрессировать чужеродные белковые антигены при инфицировании реципиентной клетки для применения в качестве вакцин в соответствии с изобретением, можно выделять или "спасать" путем трансфекции подходящих клеток-хозяев экспрессирующим вектором, содержащим рекомбинантный геном RV, в который встроен ген(ы), кодирующий чужеродный белковый антиген. Встраивание рекомбинантного генома в экспрессирующий вектор для последующей трансфекции в клетки-хозяева для получения вакцины находится в пределах квалификации специалиста в данной области.
Экспрессирующий вектор, содержащий модифицированный геном RV, должен содержать промотор, такой как промотор T7, который является активным в клетке-хозяине. Например, в качестве клетки-хозяина можно использовать клетки BSR, стабильно трансфицированные геном полимеразы T7, как описано в Buchholz et al. (1999), J. Virol. 73: 251-259l. Эти клетки конститутивно экспрессируют полимеразу T7, которая может активировать транскрипцию с промотора T7, содержащегося в экспрессирующем векторе. После подходящего периода времени после трансфекции (например, трое суток), инфекционную рекомбинантную вакцину RV можно выделять из культуральной среды трансфицированных клеток-хозяев. Инфекционность выделенной живой вакцины можно подтверждать путем воздействия на клетки BSR культуральной среды трансфицированных клеток-хозяев, или выделенной живой вакцины. Спасенную живую вакцину можно визуализировать в этих клетках BSR путем окрашивания клеточной культуры меченными FITC антителами против белков RV.
Режим первичной/усиливающей иммунизации по настоящему изобретению можно использовать для иммунизации либо до, либо после воздействия, а также для терапевтической иммунизации против инфицирования патогенами. Режим также можно использовать в качестве профилактической иммунизации против злокачественной опухоли или для лечения злокачественной опухоли.
Индивидуум может включать позвоночное, предпочтительно млекопитающее, наиболее предпочтительно человека. Индивидуумы для иммунизации в соответствии с настоящим изобретением включают, например, человека и других приматов, грызунов (например, мыши, крысы и морские свинки), зайцеобразных (например, кролики), бычьих (например, крупный рогатый скот), овечьих (например, овца), козьих (например, козы), свиных (например, свинья), лошадиных (например, лошади), собачьих (например, собаки), кошачьих (например, кошки), домашних птиц (например, куры, индейки, утки, гуси, другие куриноподобные птицы и т.д.).
Чужеродный белковый антиген, экспрессируемый рекомбинантным RV и предоставляемый при последующей усиливающей иммунизации, представляет собой антиген, который является мишенью для иммунного ответа, который приведет к лечению или предупреждению заболевания, вызванного болезнетворными агентами. Чужеродный белковый антиген может включать антиген любого белка, против которого пытаются достигнуть иммунитета или против которого могут индуцироваться антитела.
Болезнетворный агент или болезненное состояние имеют ассоциированный с ними антиген, который запускает иммунное распознавание и конечное устранение или контроль болезнетворного агента или болезненного состояния у хозяина, путем инициации гуморального и/или клеточного иммунного ответа против ассоциированного болезнетворного агента. Болезнетворные агенты включают, но не ограничиваются ими, злокачественную опухоль и патогенные микроорганизмы.
Злокачественные опухоли, которые можно лечить с использованием рекомбинантного вируса бешенства и способа усиливающей иммунизации по настоящему изобретению, включают, но не ограничиваются ими, первичную или метастатическую меланому, злокачественные опухоли головного мозга, тимому, лимфому, саркому, рак легкого, рак печени, неходжкинскую лимфому, ходжкинскую лимфому, лейкозы, рак тела матки и аденокарциномы, такие как рак молочной железы, рак предстательной железы, рак яичника, рак поджелудочной железы и т.п. Ген, кодирующий антиген, ассоциированный со злокачественной опухолью, включают в рекомбинантный геном вируса RV. Антиген, ассоциированный со злокачественной опухолью, может экспрессироваться на поверхности злокачественной клетки или он может представлять собой внутренний антиген. Предпочтительными антигенами являются молекулы клеточной поверхности.
Ассоциированные со злокачественной опухолью антигены, которые могут целиком или частично включать чужеродный белковый антиген, экспрессируемый RV в соответствии с настоящим изобретением, включают, например, тирозинкиназу 2, ассоциированные с меланомой антигены (MAGE, например, MAGE-1 и MAGE-3), MART-1 (меланома); сурвивин, AIM-2, MAGE-1, TRP-2, gp100, HER-2 и IL13Rα2 (глиобластома); ассоциированный с предстательной железой антиген (PSA) (рак предстательной железы), альфафетопротеин (AFP); карциноэмбриональный антиген (CEA); CA-125 (рак яичника); MUC-1; MCU-2; эпителиальный опухолевый антиген (ETA); ассоциированный с раком молочной железы белок 3 (BCA3); c-erb/B2 (рак молочной железы); ассоциированные с карциномой молочной железы MAR-связывающие белки p90 и p70; тирозиназу; аномальные продукты ras и аномальные продукты p53 (рак поджелудочной железы); и ассоциированный с раком мочевого пузыря белок (BLCAP).
В одном варианте осуществления антиген, ассоциированный со злокачественной опухолью, представляет собой опухолеассоциированный антиген (TAA) или его часть. Ассоциированные со злокачественной опухолью антигены, содержащие TAA, можно идентифицировать, выделять и клонировать способами, известными в данной области, такими как способы, описанные в патенте США №4514506.
В другом варианте осуществления комбинация первичной/усиливающей иммунизации предназначена для вакцинации против болезнетворного агента, где агент представляет собой патогенный микроорганизм. Патогенные микроорганизмы могут включать прион, вирус, бактерию, простейшее или дрожжи. Таким образом, антиген содержит прионный антиген, вирусный антиген, бактериальный антиген, антиген простейших или антиген дрожжей.
Болезнетворные вирусные агенты включают, например, следующие вирусы, где предоставленные антигены являются иллюстративными, но не ограничивающими: ВИЧ (антигены GP-120, p17, GP-160); цитомегаловирус; вирус гриппа (антиген NP, HA); вирус Хендра; вирус простого герпеса (антиген HSVdD); вирус папилломы человека; вирус энцефалита лошадей; вирус гепатита (поверхностный антиген Hep B); нейротропные вирусы; вирус японского энцефалита и т.п. Вирус также может включать вновь появляющийся или повторно появляющийся вирус, такой как вирус Денге, вирус лихорадки западного Нила, вирус Эбола, вирус Нипах или вирус лихорадки долины Рифт. Вирусный антиген может включать, например, поверхностные белки вируса или другие белковые антигены вируса.
В одном варианте осуществления, чужеродный белковый антиген представляет собой антиген вируса Нипах (NiV). NiV представляет собой зоонозный вирус, принадлежащий семейству Paramyxovirus рода Henipaviruses. Биологические свойства NiV, включая широкий видовой тропизм, высокую скорость распространения, высокую смертность у человека, и значительное экономическое влияние на животноводческую промышленность, сделали его значительной общественной и ветеринарной проблемой здоровья. Хотя иммунные ответы, необходимые для защиты от инфекции NiV, не были полностью определены, нейтрализующие антитела, которые индуцируются гликопротеином вируса Нипах (NiV-G), являются основными эффекторами против этой вирусной инфекции. Таким образом, в одном варианте осуществления чужеродный белковый антиген представляет собой NiV-G или его фрагмент.
Патогенные дрожжи включают, например, Aspergillus, инвазивные Candida и т.п.
Белковые антигены прионов включают белки, такие как прионный белок BSE и прионный белок почесухи.
Патогенные бактерии включают, но не ограничиваются ими, Mycobacteria, Legioniella и т.п.
Следующие известные этиологические агенты, ответственные за заболевания, из которых могут происходить подходящие антигены, включают, но не ограничиваются ими, хламидии, дифтерию, коклюш, столбняк, туберкулез, ассоциированные с нетуберкулезными микобактериями заболевания, бактериальные и грибковые пневмонии, бабезиоз, холеру, тиф, чуму, шигеллез, сальмонеллез, болезнь легионеров, болезнь Лайма, малярию, анкилостому, онхоцеркоз, шистозоматоз, трипанозомоз, лейшманиаз, гиардиоз, амебиаз, филяриоз, боррелиоз и трихинеллез. Чужеродный белковый антиген для применения изобретения на практике представляет собой антиген, ассоциированный с заболеванием, более конкретно антиген патогена, вызывающего заболевание.
Рекомбинантные RV, экспрессирующие чужеродный белковый антиген, можно использовать для индукции иммунного ответа против опухолевых клеток и патогенов, которые экспрессируют белок. Прямую доставку фармацевтических композиций in vivo, как правило, осуществляют путем инъекции с использованием общепринятого шприца. В этом отношении композиции можно инъецировать подкожно, эпидермально, внутрикожно, интратекально, интраорбитально, в слизистую оболочку (например, назально, ректально и вагинально), внутрибрюшинно, внутривенно, перорально или внутримышечно. Другие способы введения включают пероральное и легочное введение, суппозитории и трансдермальные аппликации.
После первоначальной иммунизации рекомбинантным RV, экспрессирующим чужеродный белковый антиген ("первоначальная иммунизация") могут следовать дополнительные иммунизации рекомбинантным RV, экспрессирующим чужеродный белковый антиген. В зависимости от предполагаемого пути введения, рекомбинантный RV может быть включен в различные фармацевтические композиции. Композиции могут включать фармацевтически приемлемый носитель и, необязательно, они могут включать другие медицинские агенты, фармацевтические средства, носители, адъюванты, разбавители и эксципиенты. "Фармацевтически приемлемый" означает материал, который не является биологически или иным образом нежелательным, т.е. материал можно вводить индивидууму вместе с рекомбинантной композицией RV без возникновения каких-либо нежелательных биологических эффектов или взаимодействия вредоносным образом с какими-либо другими компонентами фармацевтической композиции, в которой он содержится. Примеры физиологически приемлемых носителей включают солевые растворы, такие как нормальный солевой раствор, раствор Рингера, PBS (фосфатно-солевой буфер), и, как правило, смеси различных солей, включая калиевые и фосфатные соли с добавками или без добавок сахаров, таких как глюкоза. Пригодные эксципиенты представляют собой, например, воду, солевой раствор декстрозу, глицерин и этанол. В композицию можно добавлять нетоксичные вспомогательные вещества, такие как смачивающие вещества, буферы или эмульгаторы. В одном варианте осуществления адъюванты не используют для иммунизаций рекомбинантным RV, экспрессирующим чужеродный белковый антиген.
Парентеральное введение, если его используют, обычно характеризуется инъекцией. Стерильные инъецируемые препараты можно получать в общепринятых формах, либо в качестве жидких растворов, либо в качестве суспензий, в качестве твердых форм, пригодных для растворения или суспендирования в жидкости перед инъекцией, или в качестве эмульсий.
В соответствии с изобретением, иммунологически эффективное количество рекомбинантного RV, экспрессирующего чужеродный белковый антиген, вводят индивидууму, нуждающемуся в защите от или лечении злокачественной опухоли или индуцируемого патогеном заболевания для индукции защитного иммунный ответ на чужеродный белковый антиген. Эффективное иммунизирующее количество, вводимое индивидууму, представляет собой количество, в котором достигается достаточный иммунологический ответ на антиген для обеспечения эффективного с медицинской точки зрения иммунного ответа на злокачественную опухоль или патоген, при усилении усиливающими иммунизациями свободного от адъювантов чужеродного белкового антигена. Для каждого реципиента общее количество вакцины, подлежащее введению, можно устанавливать из протоколов для иммунизации другими вакцинами. Точное количество рекомбинантного RV, экспрессирующего чужеродный белковый антиген, варьирует от индивидуума к индивидууму, в зависимости от вида, возраста, массы тела и общего состояния индивидуума, конкретного штамма RV и кодируемого чужеродного белкового антигена, пути введения и т.п. Иммунологически эффективную дозировку или эффективное иммунизирующее количество, которым инокулируют животное и которое индуцирует удовлетворительный иммунный ответ, можно без труда определять и его можно без труда титровать путем общепринятого тестирования, например, такого как стандартные исследования с титрованием дозы. Как правило, дозировка приближается к дозировке, которая является типичной для введения других вакцин. В определенных вариантах осуществления одна доза рекомбинантного RV, экспрессирующего чужеродный белковый антиген, вводимый индивидууму, составляет от приблизительно 104 до приблизительно 106 инфекционных единиц тканевой культуры (TCIU), более предпочтительно от приблизительно 105 до приблизительно 106 TCIU. Также осуществляют многократное дозирование.
После первичной иммунизации индивидууму инокулируют по меньшей мере один раз усиливающую композицию, содержащую чужеродный белковый антиген. Усиливающая композиция содержит чужеродный белковый антиген в фармацевтически приемлемом носителе. В усиливающей композиции можно использовать любой носитель, подходящий для парентерального введения чужеродного белкового антигена. Усиливающая композиция может содержать носители, указанные выше для составления рекомбинантного RV. Однако усиливающая композиция является свободной от адъювантов. Несмотря на отсутствие адъюванта, усиливающая иммунизация приводит к значительному увеличению продукции антител, специфичных к чужеродному белку.
В предпочтительных вариантах осуществления усиливающая композиция может содержать фосфатно-солевой буфер, водный раствор хлорида натрия, например, 0,9% раствор хлорида натрия. В одном варианте осуществления усиливающая композиция диспергирована или растворена в носителе, обеспечивающем усиливающую композицию. В одном варианте осуществления белковый антиген является растворимым в воде, и он растворен в свободном от адъювантов носителе на водной основе, таком как солевой раствор или фосфатно-солевой буфер. Усиливающая композиция может содержать дополнительные ингредиенты, такие как стабилизаторы или другие добавки в состав при условии, что они не содержат адъюванта.
Усиливающую иммунизацию можно проводить после инициации иммунного ответа на чужеродный белковый антиген рекомбинантным RV. Как правило, следует позволить пройти по меньшей мере приблизительно 5 суткам, более предпочтительно по меньшей мере приблизительно 10 суткам после первичной иммунизации рекомбинантным RV перед усиливающей иммунизацией. В некоторых вариантах осуществления усиливающую иммунизацию проводят в пределах от 1 до 300 суток, от 5 до 250, от 10 до 200, от 15 до 150, от 20 до 100, или от 30 до 60 суток после первичной иммунизации рекомбинантным RV, экспрессирующим чужеродный белок. В конкретных вариантах осуществления усиливающую иммунизацию проводят через 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 52, 53, 54, 55, 56, 57, 58, 59 или 60 суток после первичной иммунизации.
Можно проводить множество усиливающих иммунизаций для усиления иммунного ответа хозяина на чужеродный белковый антиген. Например, можно проводить 2, 3, 4, 5 или 6 усиливающих иммунизаций с интервалами. Интервалы между усиливающими иммунизациями могут быть единообразными, например, усиливающие иммунизации разделены интервалами, составляющими 5, 10, 20, 25 или 30 суток, или усиливающие иммунизации могут быть запланированы с нерегулярными временными интервалами. Мониторинг развития иммунного ответа индивидуума можно осуществлять общепринятыми способами анализа. Например, мониторинг появления антител к чужеродному белковому антигену в крови или сыворотке индивидуума, которому проводили инокуляцию, можно проводить с помощью стандартных способов анализа антител, включая, но не ограничиваясь ими, радиоиммунный анализ, ELISA (твердофазный иммуноферментный анализ), "сэндвич"-иммуноанализы, иммунорадиометрические анализы, реакции преципитина с диффузией в геле, анализы иммунодиффузии, иммуноанализы in situ (с использованием, например, коллоидного золота, ферментных или радиоизотопных меток), вестерн-блоттинга, реакций преципитации, анализов агглютинации (например, анализы агглютинации в геле, анализы гемагглютинации и т.д.), анализов фиксации комплемента, иммунофлуоресцентных анализов, анализов с белком A и анализов на основе иммуноэлектрофореза. Схему усиливающей иммунизации можно пересматривать в соответствии с развитием индивидуального ответа у индивидуума.
Режим лечения по настоящему изобретению не ограничивается однократной иммунизацией рекомбинантным RV. После первичной иммунизации рекомбинантным RV, экспрессирующим чужеродный белковый антиген, можно проводить усиливающие иммунизации, содержащие такой же или отличающийся рекомбинантный RV, экспрессирующий чужеродный белковый антиген. Усиливающие иммунизации RV, экспрессирующим чужеродный белковый антиген, и свободным чужеродным белком при необходимости можно чередовать для увеличения или усиления иммунного ответа индивидуума.
В одном варианте осуществления предусматривается набор, содержащий два вакцинных препарата, пригодных для парентерального введения. Набор содержит первую композицию, содержащую рекомбинантный RV, экспрессирующий по меньшей мере один представляющий интерес чужеродный белковый антиген, для иммунизации индивидуума. Кроме того, набор содержит вторую композицию для усиления иммунного ответа индивидуума на чужеродный белковый антиген. Первая композиция необязательно может содержать адъювант. Предпочтительно, она не содержит адъюванта. Вторая композиция не содержит адъюванта. Соответствующие композиции могут находиться в жидкой или в твердой (лиофилизированной) форме.
Наборы по настоящему изобретению необязательно могут содержать различные контейнеры (например, флакон, ампула, пробирка, колба или бутылка) для каждой индивидуальной композиции. Набор может содержать дополнительные реагенты, такие как буферы, разбавители и т.п., для составления индивидуальных компонентов. Каждый компонент, как правило, является пригодным в качестве распределенного в его соответствующий контейнер или предоставленного в концентрированной форме.
Могут быть включены инструкции по применению набора в соответствии со способами иммунизации, описанными выше. Материал инструкций может содержать публикацию, запись, диаграмму или любой другой носитель, который можно использовать для сообщения о полезности способа по изобретению в наборе для оценки качества ооцитов. Вкладыш в упаковку может содержать текст, находящийся на любом физическом носителе, например, на бумаге, картоне, пленке, или он может содержаться на электронном носителе, таком как дискета, чип, карта памяти или другая электронная форма хранения. Инструкционный материал набора по изобретению может, например, быть прикреплен к контейнеру, который содержит другие компоненты набора, или он может транспортироваться вместе с контейнером, который содержит набор. Альтернативно инструкции могут транспортироваться отдельно от контейнера с тем, чтобы инструкции и содержимое набора могли быть использованы совместно реципиентом.
В определенных вариантах осуществления изобретения режим первичной/усиливающей иммунизации представляет собой иммунизацию против NiV, и чужеродный белок, экспрессируемый рекомбинантным RV и предоставленный в растворимой форме в усиливающей композиции, содержит NiV-G или его иммуногенный фрагмент. Как описано в разделе "Примеры" ниже, иммунизация рекомбинантным RV SPBAANGAS-NG-GAS, высоко аттенуированной живой рекомбинантной вакциной на основе вируса бешенства, экспрессирующей NiV-G, обеспечивала продукцию антител, которые распознают NiV-G и способны нейтрализовать NiV. Однако титры антител были низкими. Усиливающая иммунизация тем же препаратом приводила к мощному анамнестическому антительному ответу и количеству нейтрализующего вирус антитела, которое коррелировало с титрами антител, связывающих NiV-G, в зависимости от концентрации вакцины, использованной для первичной иммунизации. У мышей, которым проводили первичную и вторичную иммунизацию рекомбинантным RV SPBNGAS-GAS, не развивались никакие нейтрализующие NIV или связывающие NIV-G антитела, однако мыши, которым проводили первичную иммунизацию SPBNGAS-GAS, а затем усиливающую иммунизацию SPBAANGAS-NG-GAS, продемонстрировали анамнестический специфичный к NiV-G антительный ответ.
Более того, развитие анамнестического ответа против NiV-G опосредовалось не только вектором RV. Мышей сначала иммунизировали SPBAANGAS-NG-GAS или SPBNGAS-GAS, а затем им проводили усиливающую иммунизацию растворимым свободным от адъюванта NiV-G. Только у мышей, которым проводили первичную иммунизацию SPBAANGAS-NG-GAS, развивался мощный анамнестический антительный ответ против NIV-G, что указывает на то, что иммунизация SPBAANGAS-NG-GAS индуцирует иммунологическую память, которая в основном является специфичной к NiV-G.
Требованием для любой вакцины является ее способность индуцировать длительный иммунитет. Мыши, иммунизированные два раза SPBAANGAS-NG-GAS, проявляли титры Ig против NiV-G, определенные через 176 суток после второй иммунизации, сходные с титрами, определенными через 10 суток после второй иммунизации. Титры антитела против NiV резко возрастали после третьей иммунизации растворимым свободным от адъюванта NiV-G через 195 суток после второй иммунизации SPBAANGAS-NG-GAS.
Иммунный ответ, достигаемый путем первичной иммунизации рекомбинантным RV, экспрессирующим чужеродный белковый антиген, с последующей усиливающей иммунизацией соответствующим растворимым чужеродным белковым антигеном в свободном от адъюванта препарате, является более мощным, чем иммунный ответ, достигаемый посредством первичной и усиливающей иммунизаций только растворимым чужеродным белком. Когда мышам проводили первичную и усиливающую инокуляции растворимым NiV-G с интервалами, составляющими три недели, после первичной иммунизации не продуцировалось значительных количеств специфичных к NiV-G антител. Усиливающая иммунизация NiV-G приводила к продуцированию только низких титров антител против NG. Более того, продуцировался только изотип IgG 1 и не продуцировался изотип IgG 2 после первичной /усиливающей иммунизации растворимым NiV-G отдельно.
Иммунизация двумя последовательными дозами SPBAANGAS-NG-GAS индуцировала мощный длительный ответ против NiV-G. Однако ответ значительно возрастал после дополнительной иммунизации не содержащим адъюванта растворимым NiV-G. Первичная иммунизация SPBAANGAS-NG-GAS с последующей усиливающей иммунизацией не содержащим адъюванта растворимым NiV-G, растворимым NG, также индуцировала высокие титры специфичных к NG антител. Усиливающая иммунизация не содержащим адъюванта растворимым NiV-G, которую проводили после первичной и вторичной иммунизаций SPBAANGAS-NG-GAS, индуцировала в основном изотипы IgG 2A и IgG 2B, что указывает на то, что SPBAANGAS-NG-GAS стимулирует доминирующий Th1-ответ против NiV-G.
Применение изобретения на практике иллюстрируется следующими неограничивающими примерами. Изобретение не следует истолковывать как ограниченное только композициями и способами, описанными в настоящем описании, однако его следует истолковывать как также включающее другие композиции и способы. Специалисту в данной области будет известно, что доступны другие композиции и способы для выполнения способов, описанных в настоящем описании.
ПРИМЕРЫ
Пример получения 1: Рекомбинантные векторы на основе вируса бешенства SPBNGAS и SPBNGAS-GAS
Получение рекомбинантных векторов RV SPBNGAS и SPBNGAS-GAS описано в патенте США 7695724. Рекомбинантная вакцина RV SPBNGAS основана на прототипном рекомбинантном вирусе SPBN, который происходит из клона кДНК SAD B19 (Schnell et al., 1994, EMBO J 13:4195-4203).
Для уменьшения патогенности вакцинного вектора RV SPBN, ген G SPBN заменяли сходным геном G, кодирующим одну аминокислотную замену Arg3333→Glu333 с получением вектора SPBN-GA. Мутантный ген G, кодирующий замену Arg3333→Glu333, обозначают как "GA". Для этого подхода ген G RV амплифицировали способом ПЦР с использованием полимеразы Vent (New England Biolabs, Beverly, Mass.) с SN10-333 (Morimoto et al., Vaccine 19:3543-3551, 2001) и клонировали в SPBN. Полученная плазмида была обозначена как pSPBN-GA. Для конструирования рекомбинантного RV, экспрессирующего два идентичных G RV, ген G амплифицировали способом ПЦР с использованием полимеразы Vent с SN10-333 в качестве матрицы и праймеров SN-10 BsiWI (смысловой;CGATGTATACGTACGAAGATGTTCCTCAGCTCTCCTG [участок BsiWI подчеркнут, инициирующий кодон выделен полужирным шрифтом] (SEQ ID NO:1)), и SN-10 NheI (антисмысловой; CTTATCAGCTAGCTAGCTAGTTACAGTCTGTCTCACCCCCA [участок NheI подчеркнут, стоп-кодон выделен полужирным шрифтом] (SEQ ID NO:2). Продукт ПЦР расщепляли BsiWI и NheI (New England Biolabs) и лигировали с pSPBNGA, который предварительно был расщеплен BsiWI и NheI. Полученная плазмида была обозначена pSPBNGAGA.
Для стабилизации непатогенного фенотипа и предотвращения реверсии SPBN-GA в патогенный фенотип посредством мутации Asn194→Lys194 в GA, Asn194 заменяли на Ser194; реверсия патогенного фенотипа потребовала бы трех замен оснований вместо одной. Далее подвергнутый мутагенезу таким образом ген GA (ATT TCC) обозначили как "GAS". Ген GAS встраивали в вектор RV SPBNGA с получением вектора SPBNGA-S. Вектор pSPBNGAS-GAS, содержащий две копии гена GAS, получали путем встраивания дополнительной копии гена гликопротеина из pSPBNGA-S, как описано выше для конструирования pSPBNGAGA.
Правильные нуклеотидные последовательности встроенных генов подтверждали ПЦР с обратной транскрипцией и секвенированием ДНК следующим образом. Для анализа нуклеотидной последовательности клетки BSR, выращенные во флаконах для культивирования тканей T25, инфицировали спасенными вирусами и инкубировали в течение 3 суток при 34°C. Затем клетки промывали фосфатно-солевым буфером (PBS) и экстрагировали РНК с использованием набора RNeasy mini-kit (QIAGEN, Valencia, CA) в соответствии с протоколом изготовителя. Для синтеза кДНК G RV с геномной РНК RV использовали Superscript One-Step RT-PCR (Invitrogen, Carlsbad, CA) и праймеры SADB19 -120seq(+) (AACATGTTATGGTGCCAT TAAACCGCT) (SEQ ID NO:3) и SADB19 +50seq(−) (GGG TGT TAG TTT TTT TCA TGG ACT TGG) (SEQ ID NO:4). Для синтеза кДНК G RV со второго гена G SPBNGA-GA использовали праймеры SBsi2seq(+) (TAA TTA ACG TCC TTT CAA CGA TCC) (SEQ ID NO:5) и SNhe2seq(−) (GAG CAT CTT GAA GTA AGT AGT CTC AGG T) (SEQ ID NO:6). Амплифицированные способом ПЦР продукты подвергали нуклеотидному секвенированию и получали полные нуклеотидные последовательности гена(ов) G и анализировали в отношении присутствия мутаций.
Пример получения 2: Рекомбинантный вектор на основе вируса бешенства SPBAANGAS-GAS
Для облегчения встраивания генов чужеродных антигенов в вектор SPBNGAS вносили участки рестрикции AsiSI и AscI. Фрагмент pSPBNGAS, содержавший межгенные и регуляторные последовательности между PacI и BsiWI, амплифицировали с использованием полимеразы Deep Vent (New England Biolabs, Inc., Beverly, MA) и праймеров InterG BA(+) (5'-CGA TGT ATA CGT ACG TTT TTG CGA TCG CCG TCC TTT CAA CGA TCC AAG TC-3'[участок BsiWI подчеркнут; участок AsiSI выделен полужирным шрифтом] (SEQ ID NO: 7)) и InterG AN(-) (5'-CTT AGC GCT AGC AAA AAG GCG CGC CGG AGG GGT GTT AGT TTT TTT CAT G-3'[участок NheI подчеркнут; участок AscI выделен полужирным шрифтом] (SEQ ID NO: 8)). Продукт ПЦР расщепляли BsiWI и NheI и лигировали в вакцинный вектор RV pSPBNGAS, предварительно расщепленный BsiWI и NheI, с получением вектора, обозначенного как pSPBAANGAS. Вторую копию гена GAS встраивали в pSPBAANGAS между AscI и NheI аналогичным образом с использованием праймеров, которые содержат участки AscI и NheI: SADB19 AscI(+) (5'-CGA ATT TAT TGG CGC GCC AAG ATG GTT CCT CAG GCT CTC CTG-3' [участок AscI подчеркнут; инициирующий кодон выделен полужирным шрифтом] (SEQ ID NO: 9)) и SADB19 NheI(-) (5'-CTT ATC AGC TAG CTA GCT AGT TAC AGT CTG GTC TCA CCC CCA-3' [участок NheI подчеркнут; стоп-кодон выделен полужирным шрифтом] (SEQ ID NO: 10)) с получением pSPBAANGAS-GAS. Присутствие встроенных фрагментов подтверждали рестрикционным анализом и секвенированием.
Пример получения 3: Рекомбинантный вектор на основе вируса бешенства SPBAANGAS-NG-GAS
Ген G NiV клонировали в или pSPBAANGAS-GAS следующим образом с получением варианта с двойным GAS pSPBAANGAS-NG-GAS. Ген G NiV амплифицировали с использованием полимеразы Deep Vent (New England Biolabs, Inc., Beverly, MA) и специфических для гена G праймеров NGB(+) (5'-CCG GAA TTC CGT ACG AAG ATG CCG GCA GAA AAC AAG AAA GTT AGA TTC GA -3'[участок BsiWI подчеркнут; инициирующий кодон выделен полужирным шрифтом] (SEQ ID NO: 11)) и NGA2(-) (5'- TGC TCT AGA GCG ATC GCC GTT TAT GTA CAT TGC TCT GGT ATC TTA ACC -3' [участок AsiSI подчеркнут; стоп-кодон выделен полужирным шрифтом] (SEQ ID NO: 12)). Участки распознавания BsiWI и AsiSI вносили с 5'- и 3'-стороны гена NiV G (подчеркнут). Продукт ПЦР расщепляли BsiWI и AsiSI и лигировали в вакцинный вектор RV pSPBAANGAS-GAS, предварительно расщепленный BsiWI и AsiSI. Присутствие вставок и фланкирующих последовательностей подтверждали секвенированием.
Пример получения 4: Рекомбинантный вектор на основе вируса бешенства SPBAANGAS-OV-GAS
Ген OV клонировали в pSPBAANGAS-GAS в соответствии с методологией, сходной с методологией, описанной для pSPBAANGAS-NG-GAS с получением двойного варианта GAS pSPBAANGAS-OV-GAS. В кратком изложении, кДНК OVA синтезировали (GenScript), амплифицировали в Escherichia coli, а затем клонировали в pSPBAANGAS-GAS с получением pSPBAANGAS-OVA-GAS. Присутствие вставки OVA и фланкирующих последовательностей подтверждали секвенированием.
Пример получения 5: Спасение SPBNGAS, SPBNGAS-GAS, SPBNGAS-OVA-GAS и SPBNGAS-NG-GAS из клонов кДНК и оценка экспрессии NG и OVA
Для спасения рекомбинантных вирусов клетки BSR трансфицировали с помощью набора для трансфекции с фосфатом кальция (Stratagene, La Jolla, Calif.) с 5,0 мкг pSPBNGAS, pSPBNGAS-GA, pSPBAANGAS-NG-GAS или pSPBAANGAS-OVA-GAS и 5,0 мкг pTIT-N, 2,5 мкг pTIT-P, 2,5 мкг pTIT-L и 2,0 мкг pTIT-G. После инкубации в течение 3 суток супернатанты переносили на клетки BSR и инкубацию продолжали в течение 3 суток при 37°C. Клетки исследовали в отношении присутствия спасенного вируса путем иммунного окрашивания меченным флуоресцеинизотиоцианатом (FITC) антителом против белка N RV (Centocor, Malvern, Pa.).
Для анализа экспрессии NG клетки BSR инфицировали SPBAANGAS-NG-GAS. Для обнаружения экспрессии NG клетки инкубировали в течение 24 ч, затем фиксировали 4% параформальдегидом, инкубировали со специфичным к G NiV моноклональным антителом, а затем с конъгированным с FITC антителом против антител кролика, и экспрессию NG на поверхности определяли проточной цитометрией. Для анализа экспрессии OVA клетки BSR инфицировали SPBAANGAS-OVA-GAS, инкубировали в течение 48 ч, а затем лизировали буфером для лизиса. Присутствие OVA в лизате определяли с помощью вестерн-блоттинга с использованием антитела кролика против OVA.
Пример 6: Первичная/усиливающая иммунизация SPBAANGAS-OVA-GAS и растворимым OVA
Мышей иммунизировали внутримышечно (в/м) SPBAANGAS-OVA-GAS или сходным вектором, лишенным гена, кодирующего овальбумин (SPBAAGAS-GAS) с последующей в/м усиливающей иммунизацией SPBAANGAS-OVA-GAS и третьей иммунизацией растворимым не содержащим адъювантов овальбумином (OVA) следующим образом.
Самок мышей Swiss Webster в возрасте от восьми до 10 недель сначала иммунизировали внутримышечно 100 мкл фосфатно-солевого буфера (PBS), содержавшего 105 FFU SPBAAGAS-OVA-GAS или SPBAAGAS-GAS. Через двадцать восемь суток всем мышам проводили усиливающую иммунизацию 100 мкл PBS, содержавшего 105 FFU SPBAAGAS-OVA-GAS. Через двадцать пять суток после усиливающей иммунизации мышей подвергали в/м гипериммунизации посредством 100 мкл PBS, содержавшего 100 мкг растворимого овальбумина. У мышей проводили взятие крови через 24 суток после первичной иммунизации, через 11 суток после усиливающей иммунизации и через 10 суток после третьей иммунизации. Взятие образцов крови проводили после каждой иммунизации, и их анализировали в отношении присутствия антител против овальбумина.
Титры антител против овальбумина измеряли способом ELISA для общего иммуноглобулина (общий IgG), IgG1 и IgG2A (фиг. 1). В каждой рамке на фиг. 1 левый столбик соответствует мышам, первоначально иммунизированным SPBAAGAS-GAS, в то время как правый столбик соответствует мышам, первоначально иммунизированным SPBAAGAS-OVA-GAS. Первичная вакцинация каждым вектором (фиг. 1, столбик A) индуцировала слабый ответ антител против овальбумина, который только немного возрастал после усиливающей иммунизации (фиг. 1, колонка B). Гипериммунизация путем введения растворимого овальбумина привела к значительному увеличению продукции антител против овальбумина (фиг. 1, столбик C). Примечательно, что после различных иммунизаций продуцировались в основном антитела IgG 2A и не продуцировалось значительных количеств антител IgG 1 против OVA, что указывает на преобладающий ответ TH1.
Сравнительный пример 7: Первичная/усиливающая иммунизация SPBAANGAS-NG-GAS
Мышей внутримышечно (в/м) иммунизировали SPBAANGAS-NG-GAS, а затем проводили в/м усиливающую иммунизацию SPBAANGAS-NG-GAS следующим образом.
Группы из десяти самок мышей Swiss Webster в возрасте 6-8 иммунизировали в/м 100 мкл PBS, содержавшего различные концентрации (от 103 до 106 FFU) SPBAANGAS-NG-GAS и через 29 суток проводили в/м усиливающую иммунизацию 100 мкл PBS, содержавшего 106 FFU SPBAANGAS-NG-GAS. У мышей проводили взятие крови через 21 сутки после первичной иммунизации и через 10 суток после усиливающей иммунизации. Нейтрализующие антитела против NiV и антитела, связывающие NiV-G, количественно определяли с использованием ELISA или теста микронейтрализации, соответственно. Титры нейтрализации NiV определяли с использованием объединенной сыворотки. Результаты представлены на фиг. 2 (панель A: нейтрализующие антитела проти NiV; панель B: антитела, связывающие NiV-G). В каждой паре столбиков правый столбик соответствует титру антител после первичной иммунизации; правый столбик соответствует титру антител после усиливающей иммунизации. Титры антител, связывающих NiV-G, представлены в качестве средних значений ± стандартная ошибка.
Результаты первичной иммунизации демонстрируют, что у иммунизированных мышей продуцировались антитела, которые распознавали NiV-G и были способны нейтрализовать NiV, хотя титры антител были низкими. Первичная иммунизация SPBAANGAS-NG-GAS также запускала иммунологическую память против NiV-G, поскольку усиливающая иммунизация 105 FFU той же вакцины приводила к мощному анамнестическому антительному ответу. Количество нейтрализующего вирус антитела, которое коррелировало с титрами антител, связывающих NiV-G, зависело от концентрации вакцины, использованной для первичной иммунизации.
Сравнительный пример 8: Первичная иммунизация SPBAANGAS, с последующей усиливающей иммунизацией SPBAANGAS-NG-GAS
Две группы из 10 самок мышей Swiss Webster в возрасте 6-8 недель сначала иммунизировали в/м посредством 100 мкл PBS, содержавшего 105 FFU варианта RV SPBNGAS-GAS. Через 29 суток после первичной иммунизации в одной группе мышей проводили усиливающую иммунизацию 100 мкл PBS, содержавшего 105 FFU SPBAANGAS-NG-GAS, в то время как другую группу вновь иммунизировали 100 мкл PBS, содержавшего 105 FFU SPBNGAS-GAS. У мышей проводили взятие крови через 21 сутки после первичной иммунизации и через 10 суток после усиливающей иммунизации, и количественно определяли нейтрализующие антитела против NiV и антитела, связывающие NiV-G, с использованием ELISA или теста микронейтрализации, соответственно. Титры нейтрализации NiV определяли с использованием объединенной сыворотки. Результаты представлены на фиг. 3: панель A, нейтрализующие антитела против NiV; панель B, антитела, связывающие NiV-G. Титры антител, связывающих NiV-G, представлены в качестве средних величин ± стандартная ошибка.
Результаты показывают, что в то время как у мышей, которым проводили первичную и вторичную иммунизацию 105 FFU SPBNGAS-GAS (столбики, обозначенные SPBNGAS-GAS/SPBNGAS-GAS на фиг. 3) не развивались никакие нейтрализующие антитела против NIV или антитела, связывающие NIV-G, мыши, первично иммунизированные 105 FFU SPBNGAS-GAS, а затем подвергнутые усиливающей иммунизацией 105 FFU SPBAANGAS-NG-GAS (столбики, обозначенные SPBNGAS-GAS/SPAANGAS-NG-GAS на фиг. 3) продемонстрировали анамнестический специфичный к NiV-G антительный ответ.
Пример 9: первичная иммунизация SPBAANGAS-NG-GAS, с последующей усиливающей иммунизацией растворимым гликопротеином вируса Нипах
Две группы из 10 самок мышей Swiss Webster в возрасте 6-8 недель сначала иммунизировали в/м посредством 100 мкл PBS, содержавшего 105 FFU SPBAANGAS-NG-GAS или 105 FFU варианта RV SPBNGAS-GAS. Через 23 дня в обеих группах проводили в/м усиливающую иммунизацию 100 мкл PBS, содержавшего 12 мкг рекомбинантно экспрессируемого растворимого не содержащего адъювантов гликопротеина вируса Нипах (NiV-G). У мышей проводили взятие крови через 19 суток после первичной иммунизации (левые столбики в каждой паре столбиков на фиг. 4) и через 10 суток после усиливающей иммунизации (правые столбики в каждой паре столбиков). Антитела, связывающие NiV-G, измеряли с использованием ELISA. Титры антител, связывающих NiV-G, представлены в качестве средних величин ± стандартная ошибка на фиг. 4. Только у мышей, которым проводили первичную иммунизацию SPBAANGAS-NG-GAS (SPBAANGAS-NG-GAS/NG на фиг. 4) развивался мощный анамнестический ответ антител против NiV-G, что указывает на то, что иммунизация SPBAANGAS-NG-GAS индуцирует иммунологическую память, которая по большей части является специфичной к NiV-G.
Пример 10: Первичная иммунизация SPBAANGAS-NG-GAS с последующей усиливающей иммунизацией растворимым гликопротеином вируса Нипах - продолжительность эффекта
Группу из десяти самок мышей Swiss Webster в возрасте 6-8 недель иммунизировали в/м два раза, на нулевые сутки и на сутки 29, посредством 100 мкл PBS, содержавшего 105 FFU SPBAANGAS-NG-GAS. Через сто девяносто пять суток после второй иммунизации мышам проводили в/м усиливающую иммунизацию 100 мкл PBS, содержавшего 12 мкг рекомбинантно экспрессируемый NiV-G. У мышей проводили взятие крови через 21 сутки после первичной иммунизации (взятие крови 1), через 10 и 176 суток после второй иммунизации (взятие крови 2 и взятие крови 3), и через 10 суток после третьей иммунизации (взятие крови 4). См. расписание A на фиг. 5. Нейтрализующие антитела против NiV (панель B на фиг. 5), общие специфические антитела против NiV-G (панель C), и специфичные к NG изотипы IgM, IgG 1, IgG 2A и IgG 2B (панель D) количественно определяли с использованием ELISA. Титры нейтрализации NiV определяли с использованием объединенной сыворотки. Титры антител, связывающих NiV-G, представлены в качестве средних величин ± стандартная ошибка.
Как показано на фиг. 5, титры Ig против NiV-G, определенные через 176 суток (взятие крови 3) после второй иммунизации, были сходными с титрами, определенными через 10 суток (взятие крови 2) после второй иммунизации. Более того, титры антител против NiV резко возрастали (взятие крови 4) после третей иммунизации растворимым NiV-G через 195 суток после второй иммунизации SPBAANGAS-NG-GAS.
Сравнительный пример 11: первичная иммунизация и усиливающая иммунизация растворимым гликопротеином вируса Нипах
Группы из десяти самок мышей Swiss Webster в возрасте 6-8 недель иммунизировали в/м 100 мкл PBS, содержавшего 12 мкг NiV-G и через 3 недели проводили в/м усиливающую иммунизацию 100 мкл PBS, содержавшего 12 мкг NiV-G. У мышей проводили взятие крови через 10 суток после первичной иммунизации и через 10 суток после усиливающей иммунизации. Общие связывающие NiV-G измеряли с использованием ELISA. Результаты представлены на фиг. 6A для двух взятий крови. Также, специфичные к NiV-G изотипы IgM, IgG 1, IgG 2A, и IgG 2B, продуцированные после усиливающей иммунизации, количественно определяли с использованием ELISA. Результаты представлены на фиг. 6B. Титры антител, связывающих NiV-G, представлены в качестве средних величин ± стандартная ошибка.
В то время как после первичной иммунизации не продуцировалось значительных количеств антител, специфичных к NiV-G, усиливающая иммунизация NiV-G приводила к продуцированию относительно низких титров антител против NiV-G (фиг. 6A). Примечательно, что после первичной/усиливающей иммунизации посредством NiV-G отдельно продуцировался только изотип IgG 1 и не продуцировался изотип 2, что указывает на ответ TH2 (фиг. 6B).
Описание каждого патента, патентной заявки и публикации, цитированных в настоящем описании, включено в настоящее описание в качестве ссылки в полном объеме.
Специалисту в данной области будет хорошо понятно, что настоящее изобретение хорошо адаптировано для осуществления задач и достижения упомянутых результатов и преимуществ, а также его неотъемлемых результатов и преимуществ. В то время как изобретение описано применительно к конкретным вариантам осуществления, очевидно, что другие варианты осуществления и варианты настоящего изобретения могут быть установлены другими специалистами в данной области без отклонения от сущности и объема, используемых при применении настоящего изобретения на практике. Прилагаемую формулу изобретения следует истолковывать как включающую все такие варианты осуществления и эквивалентные варианты.
Реферат
Предложенное изобретение относится к области биотехнологии. Предложен способ индукции иммунного ответа у индивидуума на чужеродный белковый антиген. Предложенный способ включает стадии получения аттенуированного рекомбинантного вируса бешенства, кодирующего чужеродный белковый антиген, функционально связанный с последовательностями контроля, инфекции реципиентной клетки указанным вирусом бешенства в условиях, которые позволяют экспрессию чужеродного белкового антигена реципиентной клеткой, и усиления иммунного ответа на указанный чужеродный белковый антиген путем введения указанного чужеродного белкового антигена, содержащегося в усиливающей композиции, которая не содержит адъюванта. При этом чужеродный белковый антиген расположен между двумя генами G в геноме указанного аттенуированного рекомбинантного вируса бешенства и не экспрессируется в структуре рекомбинантного вируса. Предложенный способ обеспечивает у индивидуума достижение мощного иммунного ответа на чужеродные белковые антигены без использования адъювантов и может быть использован в медицине. 10 з.п. ф-лы, 6 ил., 1 табл., 11 пр.
Формула
Документы, цитированные в отчёте о поиске
Векторы на основе рекомбинантных вирусов отряда mononegavirales
Патенты аналоги
Векторы на основе рекомбинантных вирусов отряда mononegavirales

Комментарии