Композиция для иммунизации (варианты), способ ее получения и применение для лечения аллергических эозинофильных заболеваний - RU2319503C2
Код документа: RU2319503C2
Чертежи












Описание
ПРЕДПОСЫЛКА ИЗОБРЕТЕНИЯ
Область изобретения
Данное изобретение относится к областям молекулярной биологии, вирусологии, иммунологии и медицины. Изобретение относится к композиции, содержащей упорядоченную и повторяющуюся матрицу антигенов или антигенных детерминантов и, в частности, матрицу, содержащую белок или пептид IL-5, IL-13 или эотаксина. Более конкретно изобретение относится к композиции, содержащей вирусоподобную частицу и по меньшей мере один связанный с ней белок или пептид IL-5, IL-13 и/или эутаксина. Изобретение также относится к способу получения конъюгатов и, соответственно, упорядоченных и повторяющихся матриц. Композиции согласно изобретению применимы для получения вакцин для лечения аллергических заболеваний с эозинофильным компонентом и в качестве фармацевтической вакцины для профилактики или лечения аллергических заболеваний с эозинофильным компонентом и для эффективной индукции иммунных ответов, в частности гуморальных ответов. Кроме того, композиции согласно изобретению особенно применимы для эффективной индукции специфичных для аутоантигенов иммунных ответов в указанном контексте.
Связанная область
Ряд аллергических заболеваний, включая астму, носовой ринит, носовые полипы, эозинофильные синдромы и атопический дерматит, имеют заметные воспалительные компоненты, характеризующиеся резко выраженной инфильтрацией эозинофилов.
Наиболее важная с медицинской точки зрения группа указанных заболеваний, атопическая астма, считается хроническим воспалительным заболеванием дыхательных путей, которое клинически характеризуется эпизодической обструкцией потока воздуха, воспалением дыхательных путей и повышенной бронхиальной реактивностью на неспецифичные аллергены. Степень обструкции дыхательных путей и гиперреактивность часто коррелирует с уровнем воспаления дыхательных путей. Указанные клинические признаки являются показателем тяжести астмы (Kay, A. B., J. Allergy Clin. Immunol., 1991, 87: 893; De Monchy, J. G. et al., Am. Rev. Respir. Dis., 1985, 131: 373; Beasley, R. et al., Am. Rev. Respir. Dis., 1989, 139: 806; Azzawi, M. et al., Am. Rev. Respir. Dis., 1990, 142: 1407; Ohashi, Y. et al., Am. Rev. Respir. Dis., 1992, 145: 1469; Nakajima, H. et al., Am. Rev. Respir. Dis., 1992, 146: 374; Broide, D. H. et al., Allergy Clin. Immunol., 1991, 88: 637; Warlaw, A. J. et al., Am. Rev. Respir. Dis., 1988, 137: 62). Инфильтрация клеток коррелирует с прогрессированием заболевания и свидетельствует о воспалении дыхательных путей, которое является основным фактором, который вносит вклад в патогенез и патобиологию. Воспалительный инфильтрат при астме является комплексным; однако в настоящее время широко известно, что Th-лимфоциты CD4+с Th2-профилем экспрессии цитокинов (клетки Th2) играют центральную роль в клиническом проявлении и патогенезе данного заболевания (Robinson, D. S. et al., J. Allergy Clin. Immunol., 1993, 92: 397; Walker, C. et al., J. Allergy Clin. Immunol., 1991, 88: 935). Клетки Th2 регулируют прогрессирование заболевания и гиперчувствительность дыхательных путей (AHR), управляя аллергическим воспалением посредством высвобождения ряда цитокинов, таких как IL-4, -5, -9, -10, -13 (Robinson, D. S. et al., N. Eng. J. Med., 1992, 326: 298; Robinson, D. S. et al., J. Allergy Clin. Immunol., 1993, 92: 313; Walker, C. et al., Am. Rev. Respir. Dis., 1992, 146: 109; Drazen, J. M. et al., J. Exp. Med., 1996, 183: 1). Подобно Th2-клеткам уровни эозинофилов и их продуктов воспаления в легком коррелируют с тяжестью заболевания, и накопление указанных лейкоцитов в дыхательных путях является главным признаком бронхиальной дисфункции во время поздней фазы астматического ответа (Bousquet, J. et al., N. Eng. J. Med., 1990, 323: 1033). Хотя клетки Th2 управляют многими аспектами аллергического ответа, считается, что их роль в регуляции эозинофилии посредством секреции IL-5 является главным провоспалительным направлением при астме.
Интерлейкин-5 (IL-5) является провоспалительным цитокином, экспрессируемым у астматиков на высоком уровне. Кроме того, IL-5 является цитокином, главным образом вовлеченным в патогенез атопических заболеваний. Он специфично контролирует продукцию, активацию и локализацию эозинофилов, основную причину повреждения тканей при атопических заболеваниях. Кроме того, IL-5 является индуцируемым цитокином, производимым T-клетками, с заметной специфичностью в отношении линии эозинофилов. Контроль за IL-5 осуществляется на уровне транскрипции, и регуляция гена представляет собой многообещающую мишень для терапии зависимых от эозинофилов аллергических заболеваний, таких как астма, экзема и ринит.
Существует большое количество доказательств, что эозинофилы являются ключевым компонентом аллергического ответа при астме. IL-5 однозначно вовлечен в продукцию эозинофилов и вместе с множеством других цитокинов, таких как IL-13, хемокинов, таких как эотаксин, и других факторов контролирует их активацию, локализацию и жизнеспособность. Таким образом, IL-5 стал важной лекарственной мишенью для новых противоастматических средств (Foster, P. S. et al., Pharmacol. Ther., 2002, 94 (3): 253; Foster, P. S. et al., Trends Mol. Med., 2002, 8 (4): 162).
Имеет место 71% гомология между белками человека и мыши (справочник по цитокинам). IL-5 не проявляет значительной гомологии аминокислотной последовательности с другими цитокинами, за исключением коротких участков в белках: интерлейкине-3 мыши, мышином GM-CSF и интерфероне-γ мыши. Рассчитанная молекулярная масса последовательностей белка и человека, и мыши составляет 13,1 кД. Биологически активный IL-5 является связанным дисульфидными связями гомодимером, который ковалентно связан с помощью высококонсервативных остатков цистеина (44-86' и 86-44'), которые ориентируют мономеры в конфигурации «голова к хвосту» (Takahashi T. et al. Mol. Immunol. 27: 911-920, 1990). Хотя мономерный IL-5 дикого типа неактивен, функциональный мономер IL-5 был сконструирован с помощью инсерционного мутагенеза (Dickason R.R., et al., J. Mol. Med 74: 535-46 1996). Анализ кристаллической структуры IL-5 человека выявил новую конфигурацию, состоящую из двух доменов, при этом каждый домен требует участия двух цепей, укладка которых в высокой степени сходна с укладкой цитокина, обнаруженной в GM-CSF, интерлейкине-3 и интрелейкине-4 (Milburn M.V. et al., Nature 363: 172-176). C-концевая область IL-5, по-видимому, необходима для связывания с рецептором IL-5 и для биологической активности (Proudfoot et al., J. Protein Chem. 15 (5): 491-9, 1996). Считается, что связывание IL-5 с его рецептором происходит в областях, перекрывающих спирали A и D, при этом спираль A главным образом вовлечена в связывание α-субъединицы рецептора (Graber P. et al. J. Biol. Chem. 270: 15762-15769, 1995). Нативный IL-5 человека имеет 2 потенциальных сайта гликозилирования, а IL-5 мыши - три. IL-5 человека как N-гликозилирован, так и O-гликозилирован по Thr 3. Рекомбинантный IL-5, экспрессированный в эукариотических системах, имеет широкие пределы молекулярных масс 45-60 кД вследствие дифференциального гликозилирования. Дегликозилированный IL-5 и IL-5, экспрессированный в прокариотических клетках, полностью сохраняет биологическую активность (Tominaga A. et al., J. Immunol 144: 1345-1352, 1990).
Пути обнаружения лекарственных средств обычно основаны на скринингах ингибиторов продукции IL-5, антагонистов лигандов, контроле экспрессии рецептора и активации рецептора. В частности, ингибирование действия IL-5 может обеспечить путь лечения астмы и других заболеваний, связанных с эозинофилами. Иммунотерапия представляет собой другой и очень привлекательный способ контроля уровней IL-5 и патологических состояний, связанных с эозинофилией, таких как астма.
В настоящее время самым распространенным способом лечения для предотвращения симптомов астмы является применение кортикостероидов путем ингаляции. Обычно применение указанных средств довольно безопасно и дешево. Однако они функционируют, индуцируя общее иммуносупрессирующее действие, и имеют место неблагоприятные побочные эффекты, связанные с их длительным применением, включая высокое кровяное давление, остеопороз и развитие катаракт. Кортикостероиды необходимо принимать каждый день и поэтому соблюдение этого требования пациентом является другой проблемой для успешного применения указанных лекарственных средств. Кроме того, существуют пациенты, не восприимчивые к применению кортикостероидов, которым требуется применение альтернативной терапии. Избирательная направленность на мишень - эозинофилы, с использованием иммунотерапевтических средств, направленных против IL-5, может преодолеть неблагоприятные эффекты использования общих иммуносупрессорных средств плейотропного действия.
В будущем возможное лечение таких заболеваний, как астма, может включать пассивную иммунизацию и, таким образом, применение моноклональных антител, специфичных в отношении IL-5. Ведутся клинические испытания гуманизированных моноклональных антител против IL-5, нацеленные на уменьшение эозинофилии у пациентов, больных астмой. В частности, сообщалось о клинических испытаниях с использованием SCH55700 (эслизумаб, Schering Plough), которое является гуманизированным моноклональным антителом с активностью против IL-5 из различных видов [Egan, R. W. et al., Arneimittel-Forschung, 1999, 49: 779], и SB240563 (меполизумаб, Glaxo Smith Kline), которое является гуманизированным антителом со специфичностью в отношении интерлейкина-5 человека и приматов [Hart, T. K. et al., Am. J. Respir. Crit. Care Med., 1998, 157: A744; Zia-Amirhosseini, P. et al., J. Pharmacol. Exp. Ther., 1999, 291: 1060]. Оба моноклональных антитела показали приемлемые профили безопасности в фазе 1 испытаний и привели к снижению количества эозинофилов, но не наблюдалось уменьшения гиперреактивности дыхательных путей. Полагают, что вредное воздействие, которое оказывают эозинофилы на дыхательные пути больных астмой, является хроническим явлением, в которое вовлечено ремоделирование ткани. Нуждаются в оценке и разрабатываются исследования, предназначенные для того, чтобы тестировать эффективность анти-IL-5-терапии в данном контексте.
Однако лечение с помощью мАт влечет за собой несколько недостатков. Моноклональные антитела являются дорогими терапевтическими средствами, которые необходимо принимать в течение месяца или двух месяцев. Важной проблемой является проблема несоблюдения предписаний пациентами, которая возникает из-за многократных визитов к врачу для введения инъекционного лекарственного средства. Кроме того, отклонения в аллотипах между пациентом и терапевтическим антителом может привести к тому, что терапия моноклональным антителом в конечном итоге станет неэффективной. Высокая доза мАт и возможность образования иммунных комплексов также могут снижать эффективность пассивной иммунизации. Методика активной вакцинации ограничивает указанные трудности.
Другой способ, обеспечивающий терапевтические средства против хронической астмы и других патологических состояний, при которых проявляется эозинофилия, или других состояний, связанных с IL-5, описан в WO 97/45448. В данной заявке предложено применение «модифицированных и вариантных форм молекул IL5, способных антагонизировать активность IL5» для улучшения, ослабления или уменьшения другим образом отклоняющихся от нормы эффектов, вызванных нативными и мутантными формами IL5. Сообщается, что антагонизирующее действие является результатом вариантных форм IL5, связывающихся с низкоаффинной цепью IL5R, но не с высокоаффинными рецепторами. Действуя таким образом, варианты конкурируют с IL5 за связывание с его рецепторами, не влияя на физиологические действия IL5.
Эотаксин является хемокином, специфичным в отношении рецептора хемокинов 3, присутствующего на эозинофилах, базофилах и клетках Th2. Однако эотаксин обладает высокой специфичностью в отношении эозинофилов (Zimmerman et al., J. Immunol. 165: 5839-46 (2000)). Миграция эозинофилов снижается на 70% у мышей, «нокаутированных» по эотаксину-1, у которых, однако, еще может развиваться эозинофилия (Rothenberg et al., J. Exp. Med. 185: 785-90 (1997)). IL-5, по-видимому, ответственен за миграцию эозинофилов из костного мозга в кровь, а эотаксин - за локальную миграцию в ткани (Humbles et al., J. Exp. Med. 186: 601-12 (1997). Таким образом, использование в качестве мишени эотаксина в дополнение к IL-5 может усилить иммунотерапию, направленную на снижение эозинофилии.
Геном человека содержит 3 гена эотаксина, эотаксины 1-3, которые имеют 30% гомологию. В настоящее время известно 2 гена у мышей: эотаксин 1 и эотаксин 2 (Zimmerman et al., J. Immunol. 165: 5839-46 (2000)). Они имеют 38% гомологии. Мышиный эотаксин 2 на 59% гомологичен эотаксину 2 человека. Эотаксин 1 у мышей, по-видимому, экспрессируется повсеместно в желудочно-кишечном тракте, тогда как эотаксин-2, по-видимому, преимущественно экспрессируется в тощей кишке (Zimmerman et al., J. Immunol. 165: 5839-46 (2000)). Эотаксин-1 присутствует в бронхоальвеолярной жидкости (Teixeira et al., J. Clin. Invest. 100: 1657-66 (1997)). Последовательность эотаксина-1 человека показана в SEQ ID No.: 242 (а/к 1-23 соответствуют сигнальному пептиду), последовательность эотаксина-2 человека показана в SEQ ID No.: 243 (а/к 1-26 соответствуют сигнальному пептиду), последовательность эотаксина-3 человека показана в SEQ ID No.: 244 (а/к 1-23 соответствуют сигнальному пептиду), последовательность эотаксина-1 мыши показана в SEQ ID No.: 245 (а/к 1-23 соответствуют сигнальному пептиду) и последовательность эотаксина-2 мыши показана в SEQ ID No.: 246 (а/к 1-23 соответствуют сигнальному пептиду).
Мономер эотаксина имеет массу 8,3 кД и находится в равновесии с димерным эотаксином в широких пределах условий. Определенная Kd равна 1,3 мМ при 37°C, однако мономер является преобладающей формой (Crump et al., J. Biol. Chem. 273: 22471-9 (1998). Структура эотаксина выяснена с помощью ЯМР-спектроскопии. Сайт связывания с его рецептором CCR3 находится на N-конце и область, предшествующая первому цистеину, является наиболее важной (Crump et al., J. Biol. Chem. 273: 22471-9, 1998). Пептиды, полученные из рецепторов хемокинов, связанных с эотаксином, подтвердили это наблюдение. Эотаксин имеет четыре цистеина, образующих два дисульфидных мостика, и его можно синтезировать химическим способом (Clark-Lewis et al., Biochemistry 30: 3128-3135, 1991). Эотаксин 1 по-разному O-гликозилируется по Thr71 (Noso, N. et al., Eur. J. Biochem. 253: 114-122). Также описана экспрессия эотаксина 1 в цитозоле E. coli (Crump et al.,J. Biol. Chem. 273: 22471-9 (1998)). В случае эотаксина-2 сообщалось об экспрессии в E. coli в виде телец включения с последующим рефолдингом (Mayer et al., Biochemistry 39: 8382-95 (2000)) и об экспрессии в клетках насекомых (Forssmann et al., J. Exp. Med. 185: 2171-6 (1997)).
Интерлейкин 13 (IL-13) секретируется в виде биологически активного мономерного цитокина Th2. Зрелая форма IL-13 содержит 112 аминокислот у человека и 111 аминокислот у мышей. Рассчитанная молекулярная масса белка составляет примерно 12,4 кД. IL-13 может быть N-гликозилирован (Fitzgerald K. A. et al., The Cytokines Fact Book 2nd edition Academic Press). IL-13 продуцируется клетками Th2, тучными клетками, базофилами и клетками - природными киллерами (Brombacher F, 2000 Bioessays Jul; 22 (7): 646-56). Функциональный рецептор IL-13 является гетеродимером, состоящим из α-цепи рецептора интерлейкина 4 (α-цепь IL-4R) и одного из двух связывающих белков рецептора α IL-13 (Brombacher F, 2000 Bioassays Jul; 22 (7): 646-56).
IL-13 играет важную роль в патологии астмы. Показано, что IL-13 вовлечен в главные симптомы данного заболевания. Он оказывает непосредственное влияние на индуцированную аллергеном гиперчувствительность дыхательных путей (AHR) и выработку слизи и вовлечен в эозинофилию (Kuperman D. A. 2002, Nature Medicine, в печати). Избирательная нейтрализация IL-13 у мышей в значительной степени ослабляла фенотип астмы. Кроме того, введение IL-13 придавало подобный астме фенотип несенсибилизированным дефицитным по T-клеткам мышам или обычным мышам, соответственно (Grünig G. et al., 1998, Science, 282 (5397): 2261-3; Wills-Karp, M. et al., 1998 Science, 282 (5397): 2258-61). У мышей с целенаправленной делецией IL-13 не могла развиваться индуцированная аллергеном AHR, и наблюдалось заметное снижение выработки слизи (Walter, D. M. et al., 2001, J. Immunol. 167(8): 4668-75). Так как IL-13 также влияет на эозинофилию в модели астмы у мышей (Grünig G. et al., 1998, Science, 282 (5397): 2261-3), возможно, что IL-13 вовлечен во многие другие аллергические заболевания, связанные с эозинофилией, и нейтрализация его активности может служить многообещающим способом лечения пациентов.
Кроме того, повышающая регуляция IL-13 и рецептора IL-13 обнаружена во многих типах опухолей (например, во всех исследованных до настоящего времени линиях клеток лимфомы Ходжкина). Таким образом, иммунизация против IL-13 может обеспечить способ лечения пациентов с опухолями, сверхэкспрессирующими IL-13.
Одним из способов повышения эффективности вакцинации является увеличение степени повторяемости применяемого антигена. В отличие от изолированных белков, вирусы индуцируют немедленные и эффективные иммунные ответы в отсутствие каких-либо адъювантов как с помощью T-клеток, так и без нее (Bachmann and Zinkernagel, Ann. Rev. Immunol. 15: 235-270 (1991)). Хотя вирусы часто состоят из небольшого количества белков, они способны запускать намного более сильные иммунные ответы, чем их изолированные компоненты. В случае ответов B-клеток известно, что одним ключевым фактором для иммуногенности вирусов является повторяемость и порядок поверхностных эпитопов. У многих вирусов обнаружена квазикристаллическая поверхность, на которой экспонирована регулярная матрица эпитопов, которая эффективно перекрестно связывает специфичные для эпитопов иммуноглобулины на B-клетках (Bachmann and Zinkernagel, Immunol. Today 17: 553-558 (1996)). Указанное перекрестное связывание поверхностных иммуноглобулинов на B-клетках является мощным сигналом активации, который непосредственно индуцирует прохождение клеточного цикла и продукцию IgM-антител. Кроме того, такие стимулированные B-клетки способны активировать хелперные T-клетки, которые, в свою очередь, индуцируют переключение с продукции IgM на продукцию IgG-антител в B-клетках и образование долгоживущих B-клеток памяти - цель любой вакцинации (Bachmann and Zinkernagel, Ann. Rev. Immunol. 15:235-270 (1997)). Вирусная структура связана даже с образованием анти-антител, происходящим при аутоиммунном заболевании и являющимся частью естественного ответа на патогены (смотри Fehr, T., et al., J Exp. Med. 185: 1785-1792 (1997)). Таким образом, антитела, презентированные на высокоорганизованной вирусной поверхности, способны индуцировать мощные ответы в виде анти-антител.
Однако, как указано, обычно иммунная система не может продуцировать антитела против структур собственного организма. В случае растворимых антигенов, присутствующих в низкой концентрации, это является следствием толерантности на уровне Th-клеток. При таких условиях связывание аутоантигена с носителем, который может обеспечивать T-помощь, может нарушить толерантность. Для растворимых белков, присутствующих в высоких концентрациях, или мембранных белков в низкой концентрации толерантными могут быть B- и Th-клетки. Однако B-клеточная толерантность может быть обратимой (анергия) и может быть нарушена введением антигена в высокоорганизованной форме, связанного с чужеродным носителем (Bachmann and Zinkernagel, Ann. Rev. Immunol. 15: 235-270 (1997)).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы обнаружили, что белок или пептид IL-5, IL-13 или эотаксина, которые связаны с центральной частицей, имеющей структуру с присущей ей повторяющейся организацией, и таким образом, в частности, с вирусоподобными частицами (VLP) и субъединицами VLP, соответственно, приводящими к образованию высокоупорядоченных и повторяющихся конъюгатов, представляют собой эффективные иммуногены для индукции антител, специфичных в отношении IL-5, IL-13 или эотаксина. Кроме того, указанные аутореактивные антитела ингибируют эозинофилию в мышиной модели астмы. Таким образом, данное изобретение относится к терапевтическому способу лечения аллергического эозинофильного заболевания, который основан на упорядоченной и повторяющейся матрице белок или пептид IL-5, IL-13 или эотаксина-центральная частица, и, в частности, к конъюгату или матрице VLP-белок или пептид IL-5, IL-13 или эотаксина, соответственно. Указанное терапевтическое средство способно индуцировать высокие титры антител против IL-5, IL-13 или эотаксина у вакцинированного животного и ингибировать эозинофилию в мышиной модели астмы.
Таким образом, данное изобретение относится к композиции, содержащей (a) центральную частицу по меньшей мере с одним первым сайтом связывания, и (b) по меньшей мере один антиген или антигенную детерминанту по меньшей мере с одним вторым сайтом связывания, где указанный антиген или антигенная детерминанта является белком или пептидом IL-5, IL-13 или эотаксина и где указанный второй сайт связывания выбран из группы, состоящей из (i) сайта связывания неприродного происхождения с указанным антигеном или антигенной детерминантой, и (ii) сайта связывания природного происхождения с указанным антигеном или антигенной детерминантой, где указанный второй сайт связывания способен к ассоциации с указанным первым сайтом связывания и где указанный антиген или антигенная детерминанта и указанная центральная частица взаимодействуют посредством указанной ассоциации, образуя упорядоченную и повторяющуюся антигенную матрицу. Предпочтительными вариантами центральных частиц, подходящих для применения в данном изобретении, являются вирус, вирусоподобная частица, бактериофаг, бактериальная фимбрия или жгутик или любая другая центральная частица, имеющая присущую ей повторяющуюся структуру, способную образовывать упорядоченную и повторяющуюся антигенную матрицу согласно данному изобретению.
Более конкретно, изобретение относится к композиции, содержащей упорядоченную и повторяющуюся матрицу антигенов или антигенных детерминант, и, таким образом, в частности, конъюгаты белка или пептида IL-5, IL-13 или эотаксина-VLP. Более конкретно, изобретение относится к композиции, содержащей вирусоподобную частицу и по меньшей мере один связанный с ней белок или пептид IL-5, IL-13 или эотаксина. Изобретение также относится к способу получения конъюгатов и упорядоченных и повторяющихся матриц, соответственно. Композиции согласно изобретению применимы для получения вакцин для лечения аллергических заболеваний с эозинофильным компонентом и в качестве фармацевтических вакцин для профилактики или лечения аллергических заболеваний с эозинофильным компонентом и для эффективной индукции иммунных ответов, в частности гуморальных ответов. Кроме того, композиции согласно изобретению особенно применимы для эффективной индукции специфичных для аутоантигенов иммунных ответов в указанном контексте.
В данном изобретении белок или пептид IL-5, IL-13 или эотаксина обычно связан с центральной частицей и, соответственно, с VLP ориентированным образом, образуя упорядоченную и повторяющуюся матрицу антигенов белка или пептида IL-5, IL-13 или эотаксина. Кроме того, высокоповторяющаяся и организованная структура центральных частиц и, соответственно, VLP опосредует экспонирование белка или пептида IL-5, IL-13 или эотаксина высокоупорядоченным и повторяющимся образом, приводя к образованию высокоорганизованной и повторяющейся антигенной матрицы. Кроме того, связывание белка или пептида IL-5, IL-13 или эотаксина с центральной частицей и, соответственно, с VLP обеспечивает эпитопы хелперных T-клеток, так как центральная частица и VLP являются чужеродными по отношению к хозяину, иммунизируемому матрицей центральная частица-белок или пептид IL-5, IL-13 или эотаксина и, соответственно, матрицей VLP-белок или пептид IL-5, IL-13 или эотаксина. Указанные матрицы отличаются от конъюгатов предшествующего уровня техники своей высокоорганизованной структурой, размерами и повторяемостью антигена на поверхности матрицы.
В одном аспекте изобретения белок или пептид IL-5, IL-13 или эотаксина экспрессируют в подходящем хозяине экспрессии, совместимом с правильной укладкой белка IL-5, IL-13 или эотаксина или пептида IL-5, IL-13 или эотаксина, или синтезируют, тогда как центральную частицу и, соответственно, VLP экспрессируют и очищают из экспрессирующего хозяина, подходящего для укладки и сборки центральной частицы и, соответственно, VLP. Белок или пептид IL-5, IL-13 или эотаксина можно синтезировать химическим способом. Затем собирают матрицу белка или пептида IL-5, IL-13 или эотаксина посредством связывания белка или пептида IL-5, IL-13 или эотаксина с центральной частицей и, соответственно, с VLP.
В другом аспекте данное изобретение относится к композиции, содержащей (a) вирусоподобную частицу и (b) по меньшей мере один антиген или антигенную детерминанту, где указанный антиген или указанная антигенная детерминанта является белком или пептидом IL-5, IL-13 или эотаксина и относится к фармацевтической композиции, содержащей (a) композицию по п.1 или п. 22 и (b) приемлемый фармацевтический носитель.
В еще одном аспекте данное изобретение относится к композиции вакцины, содержащей композицию, включающую в себя (a) центральную частицу по меньшей мере с одним первым сайтом связывания и (b) по меньшей мере один антиген или антигенную детерминанту по меньшей мере с одним вторым сайтом связывания, где указанный антиген или антигенная детерминанта является белком или пептидом IL-5, IL-13 или эотаксина и где указанный второй сайт связывания выбран из группы, состоящей из (i) сайта связывания неприродного происхождения с указанным антигеном или антигенной детерминантой и (ii) сайта связывания природного происхождения с указанным антигеном или антигенной детерминантой, где указанный второй сайт связывания способен к ассоциации с указанным первым сайтом связывания и где указанный антиген или антигенная детерминанта и указанная центральная частица взаимодействуют посредством указанной ассоциации, образуя упорядоченную и повторяющуюся антигенную матрицу.
В следующем аспекте данное изобретение относится к композиции вакцины, содержащей композицию, где указанная композиция содержит (a) вирусоподобную частицу и (b) по меньшей мере один антиген или антигенную детерминанту, где указанный антиген или указанная антигенная детерминанта является белком или пептидом IL-5, IL-13 или эотаксина и где указанный по меньшей мере один антиген или антигенная детерминанта связаны с указанной вирусоподобной частицей.
В еще одном аспекте данное изобретение относится к способу получения композиции по п.1, включающему в себя (a) получение вирусоподобной частицы и (b) получение по меньшей мере одного антигена или белка или пептида IL-5, IL-13 или эотаксина; (c) объединение указанной вирусоподобной частицы и указанного по меньшей мере одного антигена или антигенной детерминанты так, чтобы указанный по меньшей мере один антиген или антигенная детерминанта были связаны с указанной вирусоподобной частицей.
В еще одном аспекте данное изобретение относится к способу получения композиции по п.22, включающему в себя (a) получение центральной частицы по меньшей мере с одним первым сайтом связывания; (b) получение по меньшей мере одного антигена или антигенной детерминанты по меньшей мере с одним вторым сайтом связывания, где указанный антиген или антигенная детерминанта является белком или пептидом IL-5, IL-13 или эотаксина и где указанный второй сайт связывания выбран из группы, состоящей из (i) сайта связывания неприродного происхождения с указанным антигеном или антигенной детерминантой и (ii) сайта связывания природного происхождения с указанным антигеном или антигенной детерминантой, и где указанный второй сайт связывания способен к ассоциации с указанным первым сайтом связывания; и (c) объединение указанной центральной частицы и указанного по меньшей мере одного антигена или антигенной детерминанты, где указанный антиген или антигенная детерминанта и указанная центральная частица взаимодействуют посредством указанной ассоциации, образуя упорядоченную и повторяющуюся антигенную матрицу.
В другом аспекте данное изобретение относится к способу иммунизации, включающему в себя введение композиции по п.1 или п.22 или по п.74 животному или человеку.
В следующем аспекте данное изобретение относится к применению композиции по п.1 или п.22 или п.74 для производства лекарственного средства для лечения аллергических заболеваний с эозинофильным компонентом.
В еще одном аспекте данное изобретение относится к применению композиции по п.1 или п.22 или п.74 для приготовления лекарственного средства для терапевтического или профилактического лечения аллергических заболеваний с эозинофильным компонентом, предпочтительно астмы. Кроме того, в еще одном аспекте данное изобретение относится к применению композиции по п.1 или п.22 или п.74 либо отдельно, либо в комбинации с другими агентами, для производства композиции, вакцины, лекарственного средства или медицинского препарата для терапии или профилактики аллергических заболеваний с эозинофильным компонентом, в частности астмы.
Таким образом, изобретение, в частности, относится к композициям вакцин, которые подходят для профилактики и/или ослабления аллергических заболеваний с эозинофильным компонентом или связанных с ними состояний. Изобретение, кроме того, относится к способам иммунизации и вакцинации, соответственно, для профилактики и/или ослабления аллергических заболеваний с эозинофильным компонентом и связанных с ними состояний у животных, в частности у коров, овец и крупного рогатого скота, а также у человека. Композиции согласно изобретению можно использовать профилактически или терапевтически.
В конкретных вариантах изобретение относится к способам профилактики и/или ослабления аллергических заболеваний с эозинофильным компонентом или связанных с ними состояний, которые вызваны или обострены продуктами «собственных» генов, т.е. в используемом в данном описании смысле «аутоантигенами». В родственных вариантах изобретение относится к способам индуцирования иммунологических ответов у животных и человека, соответственно, которые приводят к продукции антител, которые предотвращают и/или ослабляют аллергические заболевания с эозинофильным компонентом или связанные с ними состояния, которые вызваны или обострены продуктами «собственных» генов.
Как будет понятно специалисту в данной области, когда композиции согласно изобретению вводят животному или человеку, они могут быть в композиции, которая содержит соли, буферные вещества, адъюванты или другие вещества, которые требуются для повышения эффективности композиции. Примеры веществ, подходящих для применения при получении фармацевтических композиций, приведены во многих источниках, включая Remington's Pharmaceutical Sciences (Osol, A, ed., Mack Publishing Co. (1990)).
Говорят, что композиции согласно изобретению являются «фармакологически приемлемыми», если может быть допустимо их введение человеку-реципиенту. Кроме того, композиции согласно изобретению будут вводиться в «терапевтически эффективном количестве» (т.е. в количестве, которое дает требуемый физиологический эффект).
Композиции согласно изобретению можно вводить различными способами, известными в данной области, но обычно они будут вводиться путем инъекции, инфузии, ингаляции, перорального введения или другими подходящими физическими способами. Альтернативно композиции можно вводить внутримышечно, внутривенно или подкожно. Компоненты композиций для введения включают стерильные водные (например, физиологический раствор соли) или неводные растворы и суспензии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Можно использовать носители или окклюзионные повязки, чтобы увеличить проницаемость кожи и усилить абсорбцию антигена.
Другие варианты данного изобретения будут очевидны для специалиста в свете того, что известно в данной области, в свете следующих чертежей, описания изобретения и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1. Экспрессия His-C-IL5 мыши. Экстракты из нерастворимой клеточной фракции, полученной после культивирования pMODC6-IL5/BL21-DE3 либо в присутствии, либо без IPTG, получали, как описано выше. Эквивалентные количества экстрактов наносили на 16% SDS-полиакриламидный гель, подвергали электрофорезу и красили Кумасси голубым. Дорожка M, маркер массы (NEB, предварительно окрашенный маркер широкого диапазона), дорожка 1, экстракт из неиндуцированной культуры; дорожка 2, экстракт из культуры, индуцированной в течение 4 час IPTG.
Фиг.2. SDS-ПААГ-анализ очистки His-C-IL-5 с использованием Ni-NTA. Образцы с различных стадий очистки наносили на 16% SDS-ПААГ и разгоняли при восстанавливающих условиях. Белки красили Кумасси голубым. M, маркер; 1: растворенные тельца включения; 2: проходящий поток (несвязанный материал); 3: промывка 1, pH 6,5; 4: промывка 2, pH 6,5; 5: промывка 3, pH 5,9; 6-8: элюат, pH 4,5; 9: чистый рекомбинантный IL-5 мыши.
Фиг.3. SDS-ПААГ, показывающий очистку рекомбинантного мышиного His-C-IL5. Аликвоты по 5 мкг очищенного мышиного His-C-IL5 разделяли в 16% SDS-полиакриламидном геле либо в присутствии (дорожка 2 слева), либо в отсутствие (3-я дорожка слева) дитиотрейтола. Гель красили на белки Кумасси голубым R-250. Дорожка M содержит маркер массы (NEB, предварительно окрашенный маркер широкого диапазона).
Фиг.4. Влияние His-C-IL-5 на пролиферацию клеток BCL1. Клетки BCL1 инкубировали с3H-тимидином в присутствии следующих добавок: мышиный IL-5 (30 нг/мл), His-C-IL5, (30 нг/мл); Qβ (200 нг/мл); Qβ, химически перекрестно связанный с неродственным цитокином (200 нг/мл) или Qβ-His-C-IL5 (105 нг/мл). Неразбавленные исходные концентрации указаны в круглых скобках, и из указанных исходных концентраций готовили пятикратные серийные разведения. Включение3H-тимидина определяли с помощью счета в сцинтилляционной жидкости.
Фиг.5. Анализ реакции связывания с помощью SDS-ПААГ, окрашенного Кумасси голубым. Дорожка M: предварительно окрашенный маркер молекулярной массы; дорожка 1, очищенный His-C-IL-5; дорожка 2, Qβ после дериватизации химическим перекрестно сшивающим агентом SMPH. Дорожка 3, реакционная смесь для связывания; дорожка 4, реакционная смесь для связывания после диализа. Идентификация различных молекулярных образцов в реакционной смеси для связывания приведена на фигуре справа.
Фиг.6. Анализ реакции связывания с помощью Вестерн-блоттинга. Дорожка M: маркер молекулярной массы; дорожка 1, очищенный His-C-IL-5; дорожка 2, Qβ после дериватизации химическим перекрестно сшивающим агентом SMPH. Дорожка 3, реакционная смесь для связывания. Первое антитело для выявления His-C-IL5 представляло собой анти-His-антитело крысы, которое затем инкубировали с антикрысиным антителом, конъюгированным с HRP. Qβ выявляли окрашиванием с использованием кроличьей поликлональной антисыворотки против Qβ, затем конъюгированного с HRP антикроличьего антитела. Идентичные блоты красили, как указано.
Фиг.7. Четырехкратный ELISA. A. Схематичное представление ELISA с ловушкой. Различные компоненты анализа представляют собой 1, антитело козы против IgG кролика; 2, кроличью анти-Qβ поликлональную антисыворотку; 3, либо Qβ-His-C-IL5, Qβ, либо PBS; 4, моноклональное Ат против IL5, TRFK 4 или 5; 5, антитело против IgG мыши-HRP. B. Результаты четверного ELISA. В ELISA определяли способность нейтрализующих моноклональных антител взаимодействовать с His-C-IL5, ковалентно связанным с упорядоченной антигенной матрицей.
Фиг.8. ELISA сыворотки против IL-5. Планшеты для ELISA покрывали His-C-IL5 и инкубировали либо с сывороткой, собранной до иммунизации, либо с сывороткой, собранной на 21 день от мышей, вакцинированных Qβ-His-C-IL5 (4 мыши) или Qβ, смешанным с His-C-IL-5 (5 мышей). Исходное разведение сыворотки составляло 1:50, и осуществляли пятикратные разведения. Связывание специфичных для IL-5 антител регистрировали с использованием антител против IgG мыши, конъюгированных с HRP, и хромогенного субстрата.
Фиг.9. Индукция экспрессии рекомбинантного GST-EK-IL13-C1-His в BL21. Окраска 16% SDS-ПААГ Кумасси голубым. Нагрузка соответствует 0,1 OD600 указанных бактериальных лизатов. Экспрессию IL-13-слитого белка индуцировали 0,75 мМ IPTG и образцы анализировали через 4 час в SDS-ПААГ. Примечание: имеет место значительная экспрессия IL-13-слитого белка в бактериях, которые были трансформированы соответствующей плазмидой (pMod-GST-EK-IL13-C1-His) и индуцированы IPTG (см. стрелку).
Фиг.10. Очистка GST-EK-IL13-Cl-His при денатурации. Окраска двух 16% SDS-ПААГ Кумасси голубым. Нагрузка соответствует 5 мкл указанной фракции. IL-13-слитый белок получали из телец включения, растворяли в денатурирующем буфере на основе гуанидин-HCl и наносили на Ni2+-агарозную колонку, уравновешенную таким же буфером. Связанные белки элюировали в две стадии при разных pH. На фигуре показан анализ осажденных ТХУ аликвот указанных фракций (№5-№30), элюированных вторым буфером при pH 4,5. Примечание: благодаря C-концевой His-метке IL-13-слитый белок эффективно связывался с Ni2+ -агарозной колонкой и элюировался при понижении pH.
Фиг.11. Анализ растворимого IL-13-слитого белка после рефолдинга. GST-EK-IL13-C1-His-слитый белок подвергали рефолдингу, как описано в разделе 18D. После окончания реакции рефолдинга аликвоту раствора белка анализировали в SDS-ПААГ с последующим окрашиванием Кумасси (A) или с использованием Вестерн-блота (B). Указанные первые антитела приобретали в R&D Systems (α-IL13, AF-413-NA), Qiagen (α-PentaHis, 34660) и Amersham Biosciences (α-GST, 24-4577), соответственно. Антитела использовали в концентрациях согласно инструкциям производителей.
Фиг.12. Экспрессия эотаксина-C1 мыши. Надосадки из клеточных лизатов клеток BL21/DE3, трансформированных pmEo-C1, через 9 часов после индукции 1 мМ IPTG разгоняли в 16% ПААГ-геле, переносили в результате блоттинга на нитроцеллюлозную мембрану и подвергали взаимодействию с антителом козы против эотаксина мыши (R&D system). Дорожка 1: предварительно окрашенный белковый маркер (New England Biolabs). Дорожка 2: надосадок клеточных лизатов клеток BL21/DE3, трансформированных pmEo-C1, через 9 часов после индукции 1 мМ IPTG. Дорожка 3: предварительно окрашенный белковый маркер (New England Biolabs). Дорожка 4: Вестерн-блот тех же лизатов, что и на дорожке 2, исследованных с использованием антитела против эотаксина мыши.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не оговорено особо, все технические и научные термины, используемые в данном описании, имеют такие же значения, которые обычно понимает специалист в данной области, к которой относится данное изобретение. Хотя на практике или при проверке данного изобретения можно использовать любые способы и вещества, сходные или эквивалентные способам и веществам, описанным в данной заявке, предпочтительные способы и вещества описаны ниже.
1. Определения.
Аллергические заболевания с эозинофильным компонентом. Термин аллергические заболевания с эозинофильным компонентом в используемом в данном описании смысле относится к патологическим состояниям или статусу, при котором имеет место увеличение количества эозинофилов в циркулирующей крови или тканях и жидкостях организма. Заболевания, при которых повышено количество эозинофилов и при которых эозинофилы оказывают прямое или косвенное влияние на состояние болезни, включают в себя астму, сенную лихорадку, носовой ринит, носовые полипы, идиопатические эозинофильные синдромы, атопический дерматит, заболевания кожи и кожные сыпи, заболевания легких, такие как синдром Леффлера, хроническая эозинофильная пневмония, синдром Чарга-Стросса и гиперэозинофильные синдромы неизвестной природы. Специалисты в данной области могут идентифицировать аллергические заболевания с эозинофильным компонентом.
Аминокислотный линкер: «аминокислотный линкер», также называемый в данном описании «линкером» в используемом смысле либо связывает антиген или антигенную детерминанту со вторым сайтом связывания, либо более предпочтительно уже содержит или включает в себя второй сайт связывания, обычно - но не обязательно - в виде аминокислотного остатка, предпочтительно в виде остатка цистеина. Однако термин «аминокислотный линкер» в используемом в данном описании смысле не предназначен для обозначения того, что такой аминокислотный линкер состоит исключительно из аминокислотных остатков, хотя аминокислотный линкер, состоящий из аминокислотных остатков, является предпочтительным в данном изобретении вариантом. Остатки аминокислот аминокислотного линкера предпочтительно состоят из аминокислот природного происхождения или неприродных аминокислот, известных в данной области, всех L или всех D или их смесей. Однако аминокислотный линкер, содержащий молекулу с сульфгидрильной группой или остаток цистеина, также входит в данное изобретение. Такая молекула предпочтительно содержит остаток C1-C6-алкила, циклоалкила (C5,C6), арила или гетероарила. Однако кроме аминокислотного линкера в объем данного изобретения также следует включить линкер, предпочтительно содержащий остаток C1-C6-алкила, циклоалкила (C5,C6), арила или гетероарила и не имеющий никакой аминокислоты(лот). Связь между антигеном или антигенной детерминантой или необязательно вторым сайтом связывания и аминокислотным линкером предпочтительно осуществляется с помощью по меньшей мере одной ковалентной связи, более предпочтительно с помощью по меньшей мере одной пептидной связи.
Животное. В используемом в данном описании смысле подразумевается, что термин «животное» включает в себя, например, человека, овец, лосей, оленей, оленей-мулов, норок, млекопитающих, обезьян, лошадей, крупный рогатый скот, свиней, коз, собак, кошек, крыс, мышей, птиц, кур, рептилий, рыб, насекомых и паукообразных.
Антитело. В используемом в данном описании смысле термин «антитело» относится к молекулам, которые способны связывать эпитоп или антигенную детерминанту. Подразумевается, что термин включает в себя целые антитела и их антигенсвязывающие фрагменты, включая одноцепочечные антитела. Наиболее предпочтительно антитела являются антигенсвязывающими фрагментами антител человека и включают, но не ограничены указанным, Fab, Fab' и F(ab')2, Fd, одноцепочечные Fv (scFv), одноцепочечные антитела, связанные дисульфидными связями Fv (sdFv) и фрагменты, содержащие либо VL-, либо VH-домен. Источником антител может быть любое животное, включая птиц и млекопитающих. Предпочтительно антитела получены от человека, мыши, кролика, козы, морской свинки, верблюда, лошади или цыпленка. В используемом в данном описании смысле «человеческие» антитела включают в себя антитела, имеющие аминокислотную последовательность иммуноглобулина человека, и включают антитела, выделенные из библиотек иммуноглобулинов человека или из животных, трансгенных по одному или нескольким иммуноглобулинам человека, и которые не экспрессируют эндогенных иммуноглобулинов, как описано, например, в патенте США No. 5939598 Kucherlapati et al.
Антиген. В используемом в данном описании смысле «антиген» относится к молекуле, способной подвергаться связыванию антителом или рецептором T-клеток (TCR), если она презентирована молекулами MHC. Термин «антиген» в используемом в данном описании смысле также охватывает T-клеточные эпитопы. Кроме того, антиген может узнаваться иммунной системой и/или способен индуцировать гуморальный иммунный ответ и/или клеточный иммунный ответ, приводящий к активации B- и/или T-лимфоцитов. Однако это может требовать, по меньшей мере в некоторых случаях, чтобы антиген содержал Th-клеточный эпитоп или был с ним связан и был введен в адъюванте. Антиген может иметь один или несколько эпитопов (B- и T-эпитопов). Подразумевается, что указанная выше специфичная реакция указывает на то, что антиген будет предпочтительно реагировать, обычно высоко избирательным образом, с соответствующим ему антителом или TCR и не будет реагировать со множеством других антител или TCR, которые могут быть вызваны другими антигенами. В используемом в данном описании смысле антигены также могут представлять собой смеси нескольких отдельных антигенов.
Антигенная детерминанта. В используемом в данном описании смысле подразумевается, что термин «антигенная детерминанта» относится к такой части антигена, которая специфично распознается либо B-, либо T-лимфоцитами. B-лимфоциты, отвечающие на антигенные детерминанты, продуцируют антитела, тогда как T-лимфоциты отвечают на антигенные детерминанты пролиферацией и установлением эффекторных функций, необходимых для опосредования клеточного и/или гуморального иммунитета.
Ассоциация. В используемом в данном описании смысле термин «ассоциация» в применении к первому и второму сайтам связывания относится к связыванию первого и второго сайтов связывания, которое предпочтительно осуществляется посредством по меньшей мере одной непептидной связи. Природа ассоциации может быть ковалентной, ионной, гидрофобной, полярной или любой их комбинацией, предпочтительно природа ассоциации является ковалентной.
Сайт связывания, первый. В используемом в данном описании смысле фраза «первый сайт связывания» относится к элементу неприродного или природного происхождения, с которым может вступать в ассоциацию второй сайт связывания, расположенный на антигене или антигенной детерминанте. Первый сайт связывания может быть белком, полипептидом, аминокислотой, пептидом, сахаром, полинуклеотидом, природным или синтетическим полимером, вторичным метаболитом или соединением (биотин, флуоресцеин, ретинол, дигоксигенин, ионы металлов, фенилметилсульфонилфторид) или их комбинацией или их химически реакционноспособной группой. Первый сайт связывания обычно и предпочтительно расположен на поверхности центральной частицы, такой как предпочтительно вирусоподобная частица. Многочисленные первые сайты связывания обычно присутствуют на поверхности центральной частицы и, соответственно, вирусоподобной частицы в повторяющейся конфигурации.
Сайт связывания, второй. В используемом в данном описании смысле фраза «второй сайт связывания» относится к элементу, находящемуся в ассоциации с антигеном или антигенной детерминантой, с которым может вступать в ассоциацию первый сайт связывания, расположенный на поверхности центральной частицы и, соответственно, вирусоподобной частицы. Второй сайт связывания антигена или антигенной детерминанты может быть белком, полипептидом, пептидом, сахаром, полинуклеотидом, природным или синтетическим полимером, вторичным метаболитом или соединением (биотин, флуоресцеин, ретинол, дигоксигенин, ионы металлов, фенилметилсульфонилфторид) или их комбинацией или их химически реакционноспособной группой. На антигене или антигенной детерминанте присутствует по меньшей мере один второй сайт связывания. Термин «антиген или антигенная детерминанта по меньшей мере с одним вторым сайтом связывания» таким образом относится к антигену или антигенной конструкции, содержащей по меньшей мере антиген или антигенную детерминанту и второй сайт связывания. Однако, в частности, в случае второго сайта связывания, который имеет неприродное происхождение, т.е. не естественным образом возник в антигене или антигенной детерминанте, указанные антиген или антигенные конструкции содержат «аминокислотный линкер».
Связь. В используемом в данном описании смысле термин «связь» относится к связыванию или присоединению, которое может быть ковалентным, например, посредством химического связывания, или нековалентным, например, ионные взаимодействия, гидрофобные взаимодействия, водородные связи и т.д. Ковалентные связи, например, могут быть сложноэфирными, эфирными, фосфоэфирными, амидными, пептидными, имидными связями, связями углерод-сера, связями углерод-фосфор и тому подобными. Термин «связанный» является более широким и включает в себя такие термины как «соединенный», «слитый» и «прикрепленный».
Покрывающий белок(ки). В используемом в данном описании смысле термин «покрывающий белок(ки)» относится к белку(кам) бактериофага или РНК-фага, которые могут быть включены в сборку капсида бактериофага или РНК-фага. Однако по отношению к специфичному генному продукту гена покрывающего белка РНК-фага используют термин «CP». Например, специфичный генный продукт гена покрывающего белка РНК-фага Qβ называют «CP Qβ », тогда как «покрывающие белки» бактериофага Qβ содержат «CP Qβ», а также белок A1. Капсид бактериофага Qβ главным образом состоит из CP Qβ с небольшим содержанием белка A1. Подобным образом покрывающий белок VLP Qβ главным образом содержит CP Qβ с небольшим содержанием белка A1.
Центральная частица. В используемом в данном описании смысле термин «центральная частица» относится к жесткой структуре с присущей ей повторяющейся организацией. Центральная частица в используемом в данном описании смысле может быть продуктом процесса синтеза или продуктом биологического процесса.
Связанный. Термин «связанный» в используемом в данном описании смысле относится к связыванию посредством ковалентных связей или сильных нековалентных взаимодействий, обычно и предпочтительно к связыванию посредством ковалентных связей. В данном изобретении можно использовать любой способ, обычно используемый специалистами в данной области для связывания биологически активных веществ.
Эффективное количество. В используемом в данном описании смысле термин «эффективное количество» относится к количеству, необходимому или достаточному, чтобы осуществить требуемое биологическое действие. Эффективным количеством композиции может быть количество, которого достаточно для достижения данного выбранного результата, и определение такого количества может быть обычной практикой для специалиста в данной области. Например, эффективным количеством для лечения недостаточности иммунной системы может быть количество, необходимое для того, чтобы вызвать активацию иммунной системы, приводящую к развитию специфичного для антигена иммунного ответа при воздействии антигена. Термин также является синонимом «достаточного количества».
Эффективное количество для любого конкретного применения может варьировать, в зависимости от таких факторов как заболевание или состояние, подвергаемое лечению, конкретная вводимая композиция, масса субъекта и/или тяжесть заболевания или состояния. Специалист в данной области может эмпирически определить эффективное количество конкретной композиции согласно данному изобретению без необходимости в чрезмерном экспериментировании.
Белок эотаксина. Термин «белок эотаксина» в используемом в данном описании смысле относится к белку, кодируемому геном эотаксина. Различные варианты белка эотаксина могут быть обусловлены точечными нуклеотидными мутациями и полиморфизмом, соответственно, а также инсерциями, делециями и/или заменами одного или нескольких нуклеотидов, и они должны быть особым образом включены в объем данного изобретения. Кроме того, вариабельность может быть вызвана посттрансляционными модификациями, а именно, дифференциально гликозилированные формы эотаксина, а также протеолитически расщепленные формы эотаксина. Термин «белок эотаксина» в используемом в данном описании смысле также должен включать в себя варианты белка эотаксина, включая, но не ограничиваясь указанными выше предпочтительными примерами.
Пептид эотаксина. В используемом в данном описании смысле термин «пептид эотаксина» в широком смысле определяют как любой пептид, который представляет собой часть белка эотаксина и содержит по меньшей мере два, предпочтительно по меньшей мере три, более предпочтительно по меньшей мере четыре, более предпочтительно по меньшей мере пять, более предпочтительно по меньшей мере шесть следующих друг за другом аминокислот исходного белка эотаксина, который представляет собой часть белка эотаксина, наиболее предпочтительно представляет собой упакованную часть эотаксина, содержащую B-клеточный эпитоп, и еще более предпочтительно - часть эотаксина, содержащую нейтрализуемый эпитоп.
Термин «пептид эотаксина», кроме того, предпочтительно должен охватывать любую часть указанного пептида эотаксина, где указанная часть предпочтительно может быть получена путем делеции одной или нескольких аминокислот на N- и/или C-конце белка эотаксина. Пептид эотаксина может быть получен рекомбинантной экспрессией в эукариотических или прокариотических системах экспрессии в виде отдельного пептида эотаксина или в виде слияния с другими аминокислотами или белками, например, чтобы облегчить укладку, экспрессию или растворимость пептида эотаксина или облегчить очистку пептида эотаксина. Чтобы сделать возможным связывание пептидов эотаксина и белков субъединиц VLP или капсидов, к пептиду эотаксина может быть предпочтительно добавлен по меньшей мере один второй сайт связывания. Альтернативно пептиды эотаксина можно синтезировать с использованием способов, известных в данной области. Термин пептид эотаксина в используемом в данном описании смысле также предпочтительно должен включать в себя пептид, который имитирует трехмерную структуру поверхности эотаксина. Такой пептид эотаксина не обязательно получен из непрерывной аминокислотной последовательности эотаксина, а может быть образован несмежными аминокислотными остатками из эотаксина. Такие пептиды даже могут содержать аминокислоты, которые не присутствуют в соответствующем белке эотаксина.
Эпитоп. В используемом в данном описании смысле «эпитоп» относится к непрерывным или прерывающимся частям полипептида, обладающим антигенной или иммуногенной активностью у животного, предпочтительно млекопитающего и наиболее предпочтительно - человека. Эпитоп распознается антителом или T-клеткой посредством его T-клеточного рецептора в контексте молекулы MHC. «Иммуногенный эпитоп» в используемом в данном описании смысле определяют как часть полипептида, которая вызывает гуморальный ответ или индуцирует T-клеточный ответ у животного, который определяется любым способом, известным в данной области (см., например, Geysen et al., Proc. Natl. Acad. Sci. USA 81: 3998-4002 (1983)). Термин «антигенный эпитоп» в используемом в данном описании смысле определяют как часть белка, посредством которой антитело может иммуноспецифично связывать свой антиген, что определяют любым способом, хорошо известным в данной области. Иммуноспецифичное связывание исключает неспецифичное связывание, но не обязательно исключает перекрестную реакционную способность по отношению к другим антигенам. Антигенные эпитопы не обязательно должны быть иммуногенными. Антигенные эпитопы также могут быть T-клеточными эпитопами, и в этом случае они могут иммуноспецифично связываться T-клеточным рецептором в контексте молекулы MHC.
Эпитоп может содержать 3 аминокислоты в пространственной конформации, которая уникальна для эпитопа. Как правило, эпитоп состоит по меньшей мере примерно из 5 таких аминокислот, а чаще состоит по меньшей мере примерно из 8-10 таких аминокислот. Если эпитоп является органической молекулой, он может быть небольшим, таким как нитрофенил.
Слияние. В используемом в данном описании смысле термин «слияние» относится к комбинации аминокислотных последовательностей разного происхождения в одной полипептидной цепи посредством комбинирования в рамке считывания кодирующих их нуклеотидных последовательностей. Термин «слияние» особо включает в себя внутренние слияния, т.е. инсерцию последовательностей разного происхождения в полипептидную цепь, кроме слияния с одним из ее концов.
Иммунный ответ. В используемом в данном описании смысле термин «иммунный ответ» относится к гуморальному иммунному ответу и/или клеточному иммунному ответу, приводящему к активации или пролиферации B- и/или T-лимфоцитов и/или антигенпрезентирующих клеток. Однако в некоторых случаях иммунные ответы могут быть низкой интенсивности, и они становятся регистрируемыми только при использовании по меньшей мере одного вещества согласно изобретению. «Иммуногенный» относится к агенту, используемому для стимуляции иммунной системы живого организма для того, чтобы усилить и направить к иммуногенному агенту одну или несколько функций иммунной системы. «Иммуногенный полипептид» является полипептидом, который вызывает клеточный и/или гуморальный иммунный ответ либо отдельно, либо в связанном с носителем виде в присутствии или в отсутствие адъюванта. Предпочтительно может быть активирована антигенпрезентирующая клетка.
Вещество, которое «усиливает» иммунный ответ, относится к веществу в том случае, когда наблюдается иммунный ответ, который становится больше или усиливается или каким-либо образом отклоняется при добавлении вещества, по сравнению с таким же иммунным ответом, измеренным без добавления вещества. Например, может быть измерена литическая активность цитотоксических T-клеток, например, с использованием анализа высвобождения51Cr в образцах, полученных с применением и без применения вещества в ходе иммунизации. Говорят, что количество вещества, при котором литическая активность CTL усилена по сравнению с литической активностью CTL без вещества, является количеством, достаточным для усиления иммунного ответа животного на антиген. В предпочтительном варианте иммунный ответ усилен по меньшей мере примерно в 2 раза, более предпочтительно примерно в 3 раза или больше. Также может быть изменено количество или тип секретируемых цитокинов. Альтернативно может быть изменено количество индуцируемых антител или их подклассов.
Иммунизация. В используемом в данном описании смысле термины «иммунизировать» или «иммунизация» или связанные термины относятся к приданию способности вырабатывать достаточно сильный иммунный ответ (включая гуморальный и/или клеточный иммунитет, такой как эффекторные CTL) против антигена или эпитопа, являющегося мишенью. Указанные термины не требуют, чтобы был сформирован полный иммунитет, а скорее, чтобы был получен иммунный ответ, который значительно выше исходного уровня. Например, млекопитающее может считаться иммунизированным против антигена-мишени, если после применения способов согласно изобретению возникает клеточный и/или гуморальный иммунный ответ на антиген-мишень.
Природное происхождение. В используемом в данном описании смысле термин «природное происхождение» означает, что целое или часть целого не синтезируют, а оно существует или продуцируется в природе.
Неприродный. В используемом в данном описании смысле термин, в общем, означает полученный не из природы, более конкретно термин означает полученный искусственно человеком.
Неприродное происхождение. В используемом в данном описании смысле термин «неприродное происхождение» в общем означает «синтезирован или получен не из природы»; более конкретно, этот термин означает «получен искусственно человеком».
Упорядоченная и повторяющаяся матрица антигенов или антигенных детерминант. В используемом в данном описании смысле термин «упорядоченная и повторяющаяся матрица антигенов или антигенных детерминант» в общем относится к повторяющемуся образцу антигенов или антигенных детерминант, обычно и предпочтительно характеризующемуся однородным пространственным расположением антигенов или антигенных детерминант по отношению к центральной частице и, соответственно, вирусоподобной частице. В одном варианте изобретения повторяющийся образец может иметь геометрический рисунок. Типичными и предпочтительными примерами подходящих упорядоченных и повторяющихся матриц антигенов или антигенных детерминант являются матрицы, которые имеют строго повторяющиеся паракристаллические порядки расположения антигенов или антигенных детерминант, предпочтительно с расстояниями от 1 до 30 нанометров, предпочтительно от 5 до 15 нанометров.
Фимбрии. В используемом в данном описании термин «фимбрии» (в единственном числе «фимбрия») относится к внеклеточным структурам бактериальных клеток, состоящим из белковых мономеров (например, мономеров пилина), которые организованы в упорядоченные и повторяющиеся структуры. Кроме того, фимбрии являются структурами, которые вовлечены в такие процессы как связывание бактериальных клеток с поверхностными рецепторами клетки-хозяина, межклеточные генетические обмены и распознавание клетками друг друга. Примеры фимбрий включают в себя фимбрии типа 1, P-фимбрии, фимбрии F1C, S-фимбрии и фимбрии 987P. Дополнительные примеры фимбрий указаны ниже.
Структуры, подобные фимбриям. В используемом в данном описании смысле фраза «структура, подобная фимбриям» относится к структурам, имеющим характеристики, сходные с характеристиками фимбрий, и состоящим из белковых мономеров. Одним примером «структуры, подобной фимбриям» является структура, образованная бактериальной клеткой, которая экспрессирует модифицированные белки пилина, которые не образуют упорядоченные и повторяющиеся матрицы, которые идентичны матрицам природных фимбрий.
Полипептид. В используемом в данном описании смысле термин «полипептид» относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также называемыми пептидными связями). Термин указывает на молекулярную цепь аминокислот и не относится к конкретной длине продукта. Таким образом, пептиды, дипептиды, трипептиды, олигопептиды и белки включены в определение полипептида. Подразумевается, что данный термин также относится к модификациям полипептида после экспрессии, например гликозилированиям, ацетилированиям, фосфорилированиям и тому подобному. Рекомбинантный или производный полипептид не обязательно транслируют с определенной последовательности нуклеиновой кислоты. Его также можно создать любым способом, включая химический синтез.
Белок IL-5. Термин «белок IL-5» в используемом в данном описании смысле относится к белку, кодируемому геном IL-5. Различные варианты белка IL-5 могут быть обусловлены точечными мутациями нуклеотидов и полиморфизмом, соответственно, а также инсерциями, делециями и/или заменами одного или нескольких нуклеотидов, и должны быть непосредственно включены в объем данного изобретения. Дополнительная вариабельность может быть обусловлена посттрансляционными модификациями, а именно дифференциально гликозилированными формами IL-5, а также протеолитически расщепленными формами IL-5. Термин «белок IL-5» в используемом в данном описании смысле также должен охватывать варианты белка IL-5, включая, но не ограничиваясь этим, указанные выше предпочтительные примеры.
Пептид IL-5. В используемом в данном описании смысле термин «пептид IL-5» в широком смысле определяют как любой пептид, который представляет собой часть белка IL-5 и содержит по меньшей мере два, предпочтительно по меньшей мере три, более предпочтительно по меньшей мере четыре, более предпочтительно по меньшей мере пять, более предпочтительно по меньшей мере шесть следующих друг за другом аминокислот исходного белка IL-5, который представляет собой часть белка IL-5, наиболее предпочтительно представляет собой упакованную часть IL-5, содержащую B-клеточный эпитоп, и еще более предпочтительно - часть IL-5, содержащую нейтрализуемый эпитоп.
Термин «пептид IL-5», кроме того, предпочтительно должен охватывать любую часть указанного пептида IL-5, где указанная часть предпочтительно может быть получена путем делеции одной или нескольких аминокислот на N- и/или C-конце белка IL-5. Пептид IL-5 может быть получен путем рекомбинантной экспрессии в эукариотических или прокариотических системах экспрессии в виде отдельного пептида IL-5 или в виде слияния с другими аминокислотами или белками, например, чтобы облегчить укладку, экспрессию или растворимость пептида IL-5 или облегчить очистку пептида IL-5. Чтобы сделать возможным связывание пептидов IL-5 и белков субъединиц VLP или капсидов, к пептиду IL-5 может быть предпочтительно добавлен по меньшей мере один второй сайт связывания. Альтернативно пептиды IL-5 можно синтезировать с использованием способов, известных в данной области. Термин пептид IL-5 в используемом в данном описании смысле также предпочтительно должен включать в себя пептид, который имитирует трехмерную структуру поверхности IL-5. Такой пептид IL-5 не обязательно получен из непрерывной аминокислотной последовательности IL-5, а может быть образован несмежными аминокислотными остатками из IL-5. Такие пептиды даже могут содержать аминокислоты, которые не присутствуют в соответствующем белке IL-5.
Белок IL-13. Термин «белок IL-13» в используемом в данном описании смысле относится к белку, кодируемому геном IL-13. Различные варианты белка IL-13 могут быть обусловлены точечными мутациями нуклеотидов и полиморфизмом, соответственно, а также инсерциями, делециями и/или заменами одного или нескольких нуклеотидов, и должны быть непосредственно включены в объем данного изобретения. Дополнительная вариабельность может быть обусловлена посттрансляционными модификациями, а именно дифференциально гликозилированными формы IL-13, а также протеолитически расщепленными формами IL-13. Термин «белок IL-13» в используемом в данном описании смысле также должен охватывать варианты белка IL-13, включая, но не ограничиваясь этим, указанные выше предпочтительные примеры.
Пептид IL-13 В используемом в данном описании смысле термин «пептид IL-13» в широком смысле определяют как любой пептид, который представляет собой часть белка IL-13 и содержит по меньшей мере два, предпочтительно по меньшей мере три, более предпочтительно по меньшей мере четыре, более предпочтительно по меньшей мере пять, более предпочтительно по меньшей мере шесть следующих друг за другом аминокислот исходного белка IL-13, который представляет собой часть белка IL-13, наиболее предпочтительно представляет собой упакованную часть IL-13, содержащую B-клеточный эпитоп, и еще более предпочтительно - часть IL-13, содержащую нейтрализуемый эпитоп.
Термин «пептид IL-13», кроме того, предпочтительно должен охватывать любую часть указанного пептида IL-13, где указанная часть предпочтительно может быть получена путем делеции одной или нескольких аминокислот на N- и/или C-конце белка IL-13. Пептид IL-13 может быть получен путем рекомбинантной экспрессии в эукариотических или прокариотических системах экспрессии в виде отдельного пептида IL-13 или в виде слияния с другими аминокислотами или белками, например, чтобы облегчить укладку, экспрессию или растворимость пептида IL-13 или облегчить очистку пептида IL-13. Чтобы сделать возможным связывание пептидов IL-13 и белков субъединиц VLP или капсидов, к пептиду IL-13 может быть предпочтительно добавлен по меньшей мере один второй сайт связывания. Альтернативно пептиды IL-5 можно синтезировать с использованием способов, известных в данной области. Термин пептид IL-13 в используемом в данном описании смысле также предпочтительно должен включать в себя пептид, который имитирует трехмерную структуру поверхности IL-13. Такой пептид IL-13 не обязательно получен из непрерывной аминокислотной последовательности IL-13, а может быть образован несмежными аминокислотными остатками из IL-13. Такие пептиды даже могут содержать аминокислоты, которые не присутствуют в соответствующем белке IL-13.
Остаток. В используемом в данном описании смысле подразумевается, что термин «остаток» означает специфичную аминокислоту в полипептидной основной или боковой цепи.
Аутоантиген (собственный антиген). В используемом в данном описании смысле термин «аутоантиген» относится к белкам, кодируемым ДНК хозяина, и продукты, образованные белками или РНК, кодируемыми ДНК хозяина, определяют как собственные. Кроме того, белки, которые являются результатом комбинации двух или нескольких собственных молекул или которые представляют собой часть собственной молекулы, и белки, которые обладают высокой гомологией с двумя собственными молекулами, которые определены выше (>95%, предпочтительно >97%, более предпочтительно >99%), также могут считаться собственными.
Лечение. В используемом в данном описании смысле термины «лечение», «лечить», «подвергнутый лечению» или «процесс лечения» относится к профилактике и/или терапии. Например, в случае использования по отношению к инфекционному заболеванию термин относится к профилактическому лечению, которое повышает устойчивость субъекта к инфекции патогеном или, другими словами, уменьшает вероятность того, что субъект станет инфицированным патогеном или будет проявлять симптомы болезни, которые можно отнести к инфекции, а также к лечению после того, как субъект стал инфицированным, чтобы бороться с инфекцией, например, чтобы уменьшить или уничтожить инфекцию или не допустить того, чтобы субъекту стало хуже. В случае использования по отношению к аллергическим заболеваниям с эозинофильным компонентом термин «лечение» относится к профилактическому или терапевтическому лечению, которое, наряду с прочим и предпочтительно, ингибирует или снижает аллергические воспалительные компоненты, связанные с аллергическими эозинофильными заболеваниями.
Вакцина. В используемом в данном описании смысле термин «вакцина» относится к препарату, который содержит композицию согласно данному изобретению и который находится в форме, которую можно вводить животному. Обычно вакцина содержит среду в виде обычного физиологического раствора или забуференного водного раствора, в которой суспендирована или растворена композиция согласно данному изобретению. В указанной форме композицию согласно данному изобретению легко можно использовать для того, чтобы предотвратить, улучшить или другим образом воздействовать на состояние. При введении в хозяина вакцина способна возбуждать иммунный ответ, включая, но не ограничиваясь указанным, продукцию антител и/или цитокинов и/или активацию цитотоксических T-клеток, антигенпрезентирующих клеток, хелперных T-клеток, дендритных клеток и/или другие клеточные ответы.
Необязательно вакцина согласно данному изобретению дополнительно содержит адъювант, который может присутствовать либо в небольшой, либо в большой пропорции относительно соединения согласно данному изобретению. Термин «адъювант» в используемом в данном описании смысле относится к неспецифичным стимуляторам иммунного ответа или веществам, которые делают возможным создание депо в организме хозяина, которые при комбинировании с вакциной согласно данному изобретению обеспечивают еще более усиленный иммунный ответ. Можно использовать множество адъювантов. Примеры включают полный и неполный адъювант Фрейнда, гидроксид алюминия и модифицированный мурамилдипептид.
Вирусоподобная частица (VLP). В используемом в данном описании смысле термин «вирусоподобная частица» относится к структуре, подобной вирусной частице. Кроме того, вирусоподобная частица согласно изобретению является нерепликативной и неинфекционной, так как не содержит всего или части вирусного генома, в частности репликативных и инфекционных компонентов вирусного генома. Вирусоподобная частица согласно изобретению может содержать нуклеиновую кислоту, отличную от ее генома. Типичным и предпочтительным вариантом вирусоподобной частицы согласно данному изобретению является капсид вируса, такой как вирусный капсид соответствующего вируса, бактериофага или РНК-фага. Термины «вирусный капсид» или «капсид», которые используются в данном описании взаимозаменяемо, относятся к макромолекулярной конструкции, состоящей из белковых субъединиц вируса. Обычно и предпочтительно белковые субъединицы вируса собираются в вирусный капсид и, соответственно «капсид», имеющий структуру с присущей ей повторяющейся организацией, где указанная структура обычно является сферической или трубчатой. Например, капсиды РНК-фагов или HBcAg имеют сферическую форму с икосаэдрической симметрией. Термин «капсидоподобная структура» в используемом в данном описании смысле относится к собранной из макромолекул конструкции, состоящей из белковых субъединиц вируса, имеющей аналогичную капсиду морфологию в определенном выше смысле, но имеющей отклонения от типичной симметричной сборки при сохранении достаточной степени порядка и повторяемости.
Вирусоподобная частица бактериофага. В используемом в данном описании смысле термин «вирусоподобная частица бактериофага» относится к вирусоподобной частице, аналогичной по структуре бактериофагу, но являющейся нерепликативной и неинфекционной, и не содержащей по меньшей мере гена или генов, кодирующих аппарат репликации бактериофага, и обычно также не содержащей гена или генов, кодирующих белок или белки, отвечающие за прикрепление вируса или проникновение вируса в хозяина. Однако данное определение также должно охватывать вирусоподобные частицы бактериофагов, в которых вышеуказанный ген или гены еще присутствуют, но неактивны и, следовательно, также приводят к нереплицирующимся и неинфекционным вирусоподобным частицам бактериофагов.
VLP покрывающего белка РНК-фага. Капсидную структуру, образованную в результате самосборки 180 субъединиц покрывающего белка РНК-фага и необязательно содержащую РНК хозяина, называют «VLP покрывающего белка РНК-фага». Конкретным примером является VLP покрывающего белка Qβ. В данном конкретном случае VLP покрывающего белка Qβ может быть собрана либо исключительно из субъединиц CP Qβ (образованных при экспрессии гена CP Qβ, содержащего, например, стоп-кодон TAA, препятствующий любой экспрессии более длинного белка A1 посредством супрессии, см. Kozlovska, T.M. et al., Intervirology 39: 9-15 (1996)), либо дополнительно содержит субъединицы белка A1 в собранной конструкции капсида.
Вирусная частица. Термин «вирусная частица» в используемом в данном описании смысле относится к морфологической форме вируса. У некоторых типов вирусов она содержит геном, окруженный белковым капсидом; другие имеют дополнительные структуры (например, оболочки, хвосты и т.д.).
Один или форма единственного числа. При использовании в данном описании терминов «один» или форм единственного числа, подразумевают «по меньшей мере» один или «один или несколько», если не оговорено особо.
Как будет понятно специалистам в данной области, некоторые варианты изобретения касаются применения методик на основе рекомбинантной нуклеиновой кислоты, таких как клонирование, полимеразная цепная реакция, очистка ДНК и РНК, экспрессия рекомбинантных белков в прокариотических и эукариотических клетках и т.д. Такие методики хорошо известны специалистам в данной области, и их легко можно найти в опубликованных руководствах по лабораторным способам (например, Sambrook, J. et al., eds., Molecular Cloning, A Laboratory Manual, 2nd. edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989); Ausubel, F. et al., eds., Current Protocols in Molecular Biology, John H. Wiley and Sons, Inc. (1997)). Фундаментальные лабораторные методики для работы с линиями клеток культур тканей (Celis, J., ed., Cell Biology, Academic Press, 2nd edition, (1998)) и методики на основе антител (Harlow, E. and Lane, D., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. (1988); Deutscher, M.P., «Guide to Protein Purification», Meth. Enzymol. 128, Academic Press San Diego (1990); Scopes, R.K., Protein Purification Principles and Practice, 3rd ed., Springer-Verlag, New York (1994)) также в достаточной мере описаны в литературе, все указанные публикации включены в данное описание в виде ссылки.
2. Композиции и способы усиления иммунного ответа
Заявленное изобретение относится к композициям и способам усиления иммунного ответа против белка или пептида IL-5, IL-13 или эотаксина у животного. Композиции согласно изобретению содержат или - альтернативно - состоят из (a) центральной частицы по меньшей мере с одним первым сайтом связывания и (b) по меньшей мере одного антигена или антигенной детерминанты по меньшей мере с одним вторым сайтом связывания, где указанный антиген или антигенная детерминанта является белком или пептидом IL-5, IL-13 или эотаксина и где указанный второй сайт связывания выбран из группы, состоящей из (i) сайта связывания неприродного происхождения с указанным антигеном или антигенной детерминантой, и (ii) сайта связывания природного происхождения с указанным антигеном или антигенной детерминантой, где указанный второй сайт связывания способен вступать в ассоциацию с указанным первым сайтом связывания и где указанный антиген или антигенная детерминанта и указанная центральная частица взаимодействуют благодаря указанной ассоциации, образуя упорядоченную и повторяющуюся антигенную матрицу. Более конкретно композиции согласно изобретению содержат или - альтернативно - состоят из вирусоподобной частицы и по меньшей мере одного антигена или антигенной детерминанты, где антиген или антигенная детерминанта является белком или пептидом IL-5, IL-13 или эотаксина и где по меньшей мере один антиген или антигенная детерминанта связаны с вирусоподобной частицей, так что образуется упорядоченная и повторяющаяся антиген-VLP-матрица. Кроме того, изобретение дает возможность специалисту-практику легко конструировать такую композицию, наряду с прочим, для лечения и/или профилактического предотвращения аллергических заболеваний с эозинофильным компонентом.
В одном варианте центральная частица содержит вирус, фимбрию бактерии, структуру, образованную из бактериального пилина, бактериофаг, вирусоподобную частицу, частицу вирусного капсида или их рекомбинантную форму. Любой вирус, известный в данной области, имеющий упорядоченную и повторяющуюся структуру покрывающего и/или корового белка, может быть выбран в качестве центральной частицы согласно изобретению; примеры подходящих вирусов включают в себя вирус Синдбис и другие альфавирусы, рабдовирусы (например, вирус везикулярного стоматита), пикорнавирусы (например, риновирус человека, вирус Аиши), тогавирусы (например, вирус краснухи), ортомиксовирусы (например, вирус Тогото, вирус Баткен, вирус чумы птиц), вирусы полиомы (например, полиомавирус BK, полиомавирус JC, вирус полиомы птиц BFDV), парвовирусы, ротавирусы, вирус Норуолк, вирус ящура, ретровирус, вирус гепатита B, вирус табачной мозаики, вирус овечьих кошар и вирус папилломы человека, и предпочтительно РНК-фаг, бактериофаг Qβ, бактериофаг R17, бактериофаг M11, бактериофаг MX1, бактериофаг NL95, бактериофаг fr, бактериофаг GA, бактериофаг SP, бактериофаг MS2, бактериофаг f2, бактериофаг PP7 (например, см. таблицу 1 в Bachmann, M.F. and Zinkernagel, R.M., Immunol. Today 17: 553-558 (1996)).
В следующем варианте в изобретении используют генетическую инженерию вируса, чтобы создать слияние между упорядоченным и повторяющимся белком вирусной оболочки и первым сайтом связывания, содержащим гетерологичный белок, пептид, антигенную детерминанту или предпочтительно реакционноспособный аминокислотный остаток. Другие генетические манипуляции, известные специалистам в данной области, могут быть включены в конструирование композиций согласно изобретению; например, может требоваться ограничение способности рекомбинантного вируса к репликации посредством генетической мутации. Кроме того, вирус, используемый для данного изобретения, является некомпетентным по репликации вследствие химической или физической инактивации или, как указано, вследствие отсутствия компетентного по репликации генома. Вирусный белок, выбранный для слияния с первым сайтом связывания, должен иметь организованную и повторяющуюся структуру. Такая организованная и повторяющаяся структура включает в себя паракристаллические организации с расстояниями 5-30 нм, предпочтительно 5-15 нм на поверхности вируса. Результатом создания слитого белка данного типа будут множественные, упорядоченные и повторяющиеся первые сайты связывания на поверхности вируса при отражении нормальной организации нативного вирусного белка. Как будет понятно специалистам в данной области, первый сайт связывания может быть частью или может быть любым подходящим белком, полипептидом, сахаром, полинуклеотидом, пептидом (аминокислотой), природным или синтетическим полимером, вторичным метаболитом или их комбинацией, которые могут служить для специфичного связывания антигена или антигенной детерминанты, приводящего к образованию упорядоченной и повторяющейся матрицы антигена или антигенной детерминанты.
В другом варианте изобретения центральная частица является рекомбинантным альфавирусом и более конкретно рекомбинантным вирусом Синдбис. Альфавирусы являются вирусами с позитивной нитью РНК, которые реплицируют свою геномную РНК полностью в цитоплазме инфицированной клетки и без промежуточных ДНК-продуктов (Strauss, J. and Strauss, E., Microbiol. Rev. 58:491-562 (1994)). Большое внимание было обращено на несколько представителей семейства альфавирусов, Синдбис (Xiong, C. et al., Science 243: 1188-1191 (1989); Schlesinger, S., Trends Biotechnol. 11: 18-22 (1993)), вирус леса Семлики (SFV) (Liljeström, P. and Garoff, H., Bio/Technology 9: 1356-1361 (1991)) и другие (Davis, N.L. et al., Virology 171: 189-204 (1989)) в качестве основанных на вирусах экспрессирующих векторов для множества различных белков (Lundstrom, K., Curr. Opin. Biotechnol. 8: 578-582 (1997); Liljeström, P., Curr. Opin. Biotechnol. 5: 495-500 (1994)) и в качестве кандидатов для разработки вакцин. Недавно выпущен ряд патентов, направленных на применение альфавирусов для экспрессии гетерологичных белков и разработки вакцин (см. патенты США No. 5766602, 5792462, 5739026, 5789245 и 5814482). Конструирование альфавирусных центральных частиц согласно изобретению можно осуществить способами, широко известными в области технологии рекомбинантной ДНК, которые описаны в вышеуказанных статьях, которые включены в данное описание в виде ссылки.
Множество различных рекомбинантных клеток-хозяев можно использовать для получения основанной на вирусе центральной частицы для связывания антигена или антигенной детерминанты. Например, известно, что альфавирусы имеют широкий круг хозяев; вирус Синдбис инфицирует культивируемые клетки млекопитающих, рептилий и амфибий, а также некоторые клетки насекомых (Clark, H., J. Natl. Cancer Inst. 51:645 (1973); Leake, C., J. Gen. Virol. 35:335 (1977); Stollar, V. in The Togaviruses, R.W. Schlesinger, Ed., Academic Press, (1980), pp.583-621). Таким образом, в практике данного изобретения можно использовать множество рекомбинантных клеток-хозяев. Клетки BHK, COS, Vero, HeLa и CHO особенно подходят для продукции гетерологичных белков, так как они имеют возможность гликозилировать гетерологичные белки сходным с клетками человека образом (Watson, E. et al., Glycobiology 4: 227, (1994)) и могут быть отобраны в ходе селекции (Zang, M. et al., Bio/Technology 13:389 (1995)) или сконструированы генетическим способом (Renner W. et al., Biotech. Bioeng. 4: 476 (1995); Lee K. et al. Biotech. Bioeng. 50:336 (1996)), так, чтобы они росли в среде, не содержащей сыворотки, а также в суспензии.
Введение полинуклеотидных векторов в клетки-хозяева можно осуществить способами, описанными в стандартных лабораторных руководствах (см., например, Sambrook, J. et al., eds., Molecular Cloning, A Laboratory Manual, 2nd edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989), Chapter 9; Ausubel, F. et al., eds., Current Protocols in Molecular Biology, John H. Wiley and Sons, Inc. (1997), Chapter 16), включая такие способы как электропорация, опосредованная DEAE-декстраном трансфекция, трансфекция, микроинъекция, опосредованная катионными липидами трансфекция, трансдукция, введение с помощью царапин, баллистическое введение и инфекция. Способы введения экзогенных последовательностей ДНК в клетки-хозяева обсуждается в Felgner, P. et al., патент США No. 5580859.
Упакованные последовательности РНК также можно использовать для инфекции клеток-хозяев. Указанные упакованные последовательности РНК можно ввести в клетки-хозяева путем добавления их в культуральную среду. Например, получение неинфекционных альфавирусных частиц описано в ряде источников, включая «Sindbis Expression System», Version C (Invitrogen, номер в каталоге K750-1).
Когда в качестве рекомбинантных клеток-хозяев для получения основанных на вирусах центральных частиц используют клетки млекопитающих, указанные клетки обычно выращивают в культуре ткани. Способы выращивания клеток в культуре хорошо известны в данной области (см., например, Celis, J., ed., Cell Biology, Academic Press, 2nd edition (1998); Sambrook, J. et al., eds., Molecular Cloning, A Laboratory Manual, 2nd edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989); Ausubel, F. et al., eds., Current Protocols in Molecular Biology, John H. Wiley and Sons, Inc. (1997); Freshney, R., Culture of Animal Cells, Alan R. Liss, Inc. (1983)).
Следующие примеры РНК-вирусов, подходящих для применения в качестве центральных частиц в данном изобретении, включают в себя, не ограничиваясь указанным, следующие вирусы: представителей семейства Reoviridae, включая род Orthoreovirus (множественные серотипы ретровирусов млекопитающих и птиц), род Orbivirus (вирус синего языка, вирус Эугенанги, вирус Кемерово, вирус африканской болезни лошадей и вирус колорадской клещевой лихорадки), и род Rotavirus (ротавирус человека, вирус диареи телят Небраски, ротавирус мышей, ротавирус обезьян, бычий или овечий ротавирус, ротавирус птиц); семейство Picomaviridae, включая род Enterovirus (полиовирус, вирус Коксаки A и B, кишечные цитопатические «сиротские» вирусы человека (ECHO), вирусы гепатита A, C, D, E и G, энтеровирусы обезьян, вирусы энцефаломиелита мышей (ME), Poliovirus muris, бычьи энтеровирусы, энтеровирусы свиней, род Cardiovirus (вирус энцефаломиокардита (EMC), вирус Менго), род Rhinovirus (риновирусы человека, включая, по меньшей мере, 113 подтипов; другие риновирусы), род Apthovirus (вирус ящура (FVDV)); семейство Calciviridae, включая вирус везикулярной экзантемы свиней, вирус морских львов Сан-Мигель, кошачий пикорнавирус и вирус Норуолк; семейство Togaviridae, включая род Alphavirus (вирус восточного энцефалита лошадей, вирус леса Семлики, вирус Синдбис, вирус Чикунгунья, вирус О'Ньонг-Ньонг, вирус реки Росс, вирус венесуэльского энцефалита лошадей, вирус западного энцефалита лошадей), род Flavirius (вирус москитной желтой лихорадки, вирус Денге, вирус японского энцефалита, вирус энцефалита Сан-Луи, вирус энцефалита долины Мюррей, вирус Западного Нила, вирус Кунжин, вирус центральноевропейского клещевого энцефалита, вирус дальневосточного клещевого энцефалита, вирус леса Киасанур, вирус Louping III, вирус Повассан, вирус Омской геморрагической лихорадки), род Rubivirus (вирус краснухи), род Pestivirus (вирус болезни слизистых оболочек, вирус холеры свиней, вирус пограничной болезни); семейство Bunyaviridae, включая род Bunyvirus (вирус Буньямвера и родственные вирусы, группа вирусов Калифорнийского энцефалита), род Phlebovirus (вирус сицилийской москитной лихорадки, вирус лихорадки долины Рифт), род Nairovirus (вирус геморрагической лихорадки Крым-Конго, вирус болезни овец Найроби) и род Uukuvirus (вирус Уукуниеми и родственные вирусы); семейство Orthomyxoviridae, включая род вируса гриппа (вирус гриппа типа A, множество серотипов у человека); вирус гриппа свиней и вирусы гриппа птиц и лошадей; вирус гриппа типа B (множество серотипов у человека) и вирус гриппа типа C (возможно отдельный род); семейство Paramyxoviridae, включая род Paramyxovirus (вирус парагриппа типа 1, вирус Сендай, вирус гемадсорбции, вирусы парагриппа типов 2-5, вирус ньюкаслской болезни, вирус свинки), род Morbillivirus (вирус кори, вирус подострого склерозирующего панэнцефалита, вирус чумки, вирус чумы рогатого скота), род Pneumovirus (респираторно-синцитиальный вирус (RSV), бычий респираторно-синцитиальный вирус и вирус пневмонии мышей); вирус леса, семейство Rhabdoviridae, включая род Vesiculovirus (VSV), (вирус Чандипура, вирус Фландерс-Харт Парк), род Lyssavirus (вирус бешенства), рабдовирусы рыб и филовирусы (вирус Марбург и вирус Эбола); семейство Arenaviridae, включая вирус лимфоцитарного хориоменингита (LCM), вирус комплекса Такарибе и вирус Ласса; семейство Coronoaviridae, включая вирус инфекционного бронхита (IBV), вирус гепатитов мышей, кишечный коронавирус человека и вирус инфекционного кошачьего перитонита (кошачий коронавирус).
Иллюстративные ДНК-вирусы, которые можно использовать в качестве центральных частиц, включают в себя, не ограничиваясь указанным, семейство Poxviridae, включая род Orthopoxvirus (вирус натуральной оспы, вирус белой оспы, вирус оспы обезьян, вирус оспы коров, вирус оспы буйволов, вирус оспы кроликов, вирус эктромелии), род Leporipoxvirus (миксома, фиброма), род Avipoxvirus (вирус оспы домашних птиц и вирус оспы других птиц), род Capripoxvirus (оспа овец, оспа коз), род Suipoxvirus (оспа свиней), род Parapoxvirus (вирус инфекционного пустулезного дерматита, вирус псевдооспы коров («узелков доярок»), вирус папулезного стоматита крупного рогатого скота); семейство Iridoviridae (вирус африканской лихорадки свиней, вирусы лягушки 2 и 3, вирус лимфоцистоза рыб); семейство Herpesviridae, включая альфа-герпесвирусы (вирусы простого герпеса типа 1 и 2, вирус Варицелла-Зостер, вирус аборта лошадей, вирус герпеса лошадей типа 2 и 3, вирус псевдобешенства, вирус инфекционного бычьего кератоконъюктивита, вирус инфекционного ринотрахеита крупного рогатого скота, вирус кошачьего ринотрахеита, вирус инфекционного ларинготрахеита), бета-герпесвирусы (цитомегаловирус человека и цитомегаловирусы свиней, обезьян и грызунов); гамма-герпесвирусы (вирус Эпштейн-Барра (EBV), вирус болезни Марека, Herpes saimiri (герпес беличьих обезьян), Herpesvirus ateles (вирус герпеса паукообразных обезьян), Herpesvirus sylvilagus (вирус герпеса лесных кроликов), вирус герпеса морских свинок, вирус опухоли Людке); и семейство Adenoviridae, включая род Mastadenovirus (подгруппы A, B, C, D и E человека и не относящиеся к подгруппам; аденовирусы обезьян (по меньшей мере, 23 серотипа), инфекционный гепатит собак и аденовирусы крупного рогатого скота, свиней, овец, лягушек и многих других видов, род Aviadenovirus (аденовирусы птиц); и некультивируемые аденовирусы; семейство Papoviridae, включая род Papillomavirus (вирусы папилломы человека, вирусы папилломы крупного рогатого скота, вирусы папилломы кроликов Шоупа и различные патогенные вирусы папилломы других видов), род Polyomavirus (полиомавирус, вакуолизирующий вирус обезьян (SV-40), вакуолизирующий вирус кроликов (RKV), K-вирус, BK-вирус, JC-вирус и другие вирусы полиомы приматов, такие как лимфотропный вирус папилломы); семейство Parvoviridae, включая род аденоассоциированных вирусов, род Parvovirus (вирус кошачьей панлейкопении, парвовирус крупного рогатого скота, парвовирус собак, вирус алеутской болезни норок и т.д.). Наконец, ДНК-вирусы могут включать в себя такие вирусы как агенты хронической инфекционной невропатии (вирус CHINA).
В других вариантах бактериальный пилин, субфрагмент бактериального пилина или слитый белок, который содержит либо бактериальный пилин, либо его субфрагмент, используют для приготовления композиций и, соответственно, вакцинных композиций согласно изобретению. Примеры белков пилина включают в себя пилины, продуцируемые Escherichia coli, Haemophilus influenzae, Neisseria meningitidis, Neisseria gonorrhoeae, Caulobacter crescentus, Pseudomonas stutzeri и Pseudomonas aeruginosa. Аминокислотные последовательности белков пилина, подходящие для применения в случае данного изобретения, включают в себя последовательности, указанные в записях GenBank AJ000636 (SEQ ID NO:1), AJ132364 (SEQ ID NO:2), AF229646 (SEQ ID NO:3), AF051814 (SEQ ID NO:4), AF051815 (SEQ ID NO:5) и X00981 (SEQ ID NO:6), полное описание которых включено в данную заявку в виде ссылки.
Белки бактериального пилина обычно процессируются с удалением N-концевых лидерных последовательностей перед экспортом белков в бактериальную периплазму. Кроме того, как будет понятно специалисту в данной области, белки бактериального пилина, используемые для получения композиций и, соответственно, композиций вакцин согласно изобретению, как правило, не будут иметь лидерной последовательности, присутствующей в естественных условиях.
Одним конкретным примером белка пилина, подходящего для применения в данном изобретении, является P-пилин E. coli (запись в GenBank AF237482 (SEQ ID NO:7)). Примером пилина E. coli типа 1, подходящего для применения в изобретении, является пилин, имеющий аминокислотную последовательность, указанную в GenBank, запись P04128 (SEQ ID NO:8), которая кодируется нуклеиновой кислотой, имеющей нуклеотидную последовательность, указанную в GenBank, запись M27603 (SEQ ID NO:9). Полное описание указанных данных GenBank включено в данную заявку в виде ссылки. И снова в большинстве случаев зрелая форма указанного выше белка может быть использована для приготовления композиции и, следовательно, композиции вакцины согласно изобретению.
Бактериальные пилины или субфрагменты пилинов, подходящие для применения в практике данного изобретения, как правило, будут способны вступать в ассоциацию с образованием упорядоченных и повторяющихся антигенных матриц.
Способы получения фимбрий и подобных фимбриям структур in vitro хорошо известны в данной области. Например, Bullitt et al., Proc. Natl. Acad. Sci. USA 93: 12890-12895 (1996) описали реконструирование in vitro субъединиц P-фимбрий E. coli. Кроме того, Eshdat et al., J. Bacteriol. 148: 308-314 (1981) описали способы, подходящие для диссоциации фимбрий типа-1 E. coli и реконструирование фимбрий. Коротко, указанные способы заключаются в следующем: фимбрии подвергают диссоциации путем инкубации при 37°C в насыщенном гидрохлориде гуанидина. Затем белки пилина очищают хроматографией, после которой димеры пилина образуют при диализе против 5 мМ гидрохлорида трис(гидроксиметил)аминометана (pH 8,0). Eshdat et al. также обнаружили, что димеры пилина снова подвергаются сборке, образуя фимбрии, при диализе против 5 мМ трис(гидроксиметил)аминометана (pH 8,0), содержащего 5 мМ MgCl2.
Кроме того, используя, например, обычные способы генетической инженерии и модификации белка, белки пилина можно модифицировать так, чтобы они содержали первый сайт связывания, с которым связывают антиген или антигенную детерминанту посредством второго сайта связывания. Альтернативно антигены или антигенные детерминанты можно непосредственно связывать с помощью второго сайта связывания с аминокислотными остатками, которые присутствуют в указанных белках в природе. Затем указанные модифицированные белки пилина можно использовать в композициях вакцин согласно изобретению.
Бактериальные белки пилина, используемые для получения композиций и, соответственно, композиций вакцин согласно изобретению, можно модифицировать способом, подобным способу, приведенному в данном описании для HBcAg. Например, остатки цистеина и лизина могут быть либо делетированы, либо заменены другими аминокислотными остатками, и к полученным белкам может быть добавлен первый сайт связывания. Кроме того, белки пилина могут быть либо экспрессированы в модифицированной форме, либо химически модифицированы после экспрессии. Подобным образом можно собрать интактные фимбрии из бактерий и затем модифицировать химическим способом.
В другом варианте фимбрии или подобные фимбриям структуры собирают из бактерий (например, E. coli) и используют для образования композиций и композиций вакцин согласно изобретению. Одним примером фимбрий, подходящих для получения композиций и вакцинных композиций, является фимбрия типа-1 E. coli, которая образуется из мономеров пилина, имеющих аминокислотную последовательность, указанную в SEQ ID NO:8.
В данной области известен ряд способов сбора бактериальных фимбрий. Например, Bullitt and Makowski (Biophys. J. 74: 623-632 (1998)), описали способ очистки фимбрий в случае сбора P-фимбрий E. coli. Согласно данному способу фимбрии срезают с E. coli, имеющих гиперколичество фимбрий и содержащих P-фимбрия-плазмиду, и очищают, используя циклы растворения и осаждения с MgCl2 (1,0 М).
После сбора фимбрии или подобные фимбриям структуры можно модифицировать множеством способов. Например, к фимбриям можно добавить первый сайт связывания, с которым могут быть связаны антигены или антигенные детерминанты посредством второго сайта связывания. Другими словами, бактериальные фимбрии или подобные фимбриям структуры можно собирать и модифицировать, получая в результате упорядоченные и повторяющиеся антигенные матрицы.
Антигены или антигенные детерминанты могут быть связаны с остатками цистеина или остатками лизина природного происхождения, присутствующими в фимбиях или подобных фимбриям структурах. В таких случаях высокая упорядоченность и повторяемость аминокислотного остатка природного происхождения могут регулировать связывание антигенов или антигенных детерминант с фимбриями или подобными фимбриям структурами. Например, фимбрии или подобные фимбриям структуры могут быть связаны со вторыми сайтами связывания антигенов или антигенных детерминант с использованием гетеробифункционального перекрестно сшивающего агента.
Когда для получения композиций и вакцинных композиций согласно изобретению используют структуры, которые синтезируются организмами в природе (например, фимбрии), часто преимущество будет давать генетическое конструирование указанных организмов так, чтобы они продуцировали структуры, обладающие требуемыми характеристиками. Например, когда используют фимбрии типа-1 E. coli, E. coli, из которых собирают указанные фимбрии, можно модифицировать, так, чтобы они продуцировали структуры с конкретными характеристиками. Примеры возможных модификаций белков пилина включают в себя инсерцию одного или нескольких остатков лизина, делецию или замену одного или нескольких естественно присущих остатков лизина и делецию или замену одного или нескольких естественно присущих остатков цистеина (например, остатков цистеина в положениях 44 и 84 в SEQ ID NO:8).
Кроме того, могут быть осуществлены дополнительные модификации в генах пилина, которые приводят к продуктам экспрессии, содержащим другой первый сайт связывания, отличный от остатка лизина (например, домен FOS или JUN). Конечно, подходящий первый сайт связывания, в общем, будет ограничен сайтами, которые не препятствуют образованию из белков пилина фимбрий или подобных фимбриям структур, подходящих для применения в композициях вакцин согласно изобретению.
Гены пилина, которые в природе имеются в бактериальных клетках, могут быть модифицированы in vivo (например, посредством гомологичной рекомбинации) или в указанные клетки могут быть встроены гены пилина с конкретными характеристиками. Например, гены пилина могут быть введены в бактериальные клетки в виде компонента либо реплицирующегося клонирующего вектора, либо вектора, который встраивается в бактериальную хромосому. Встроенные гены пилина также могут быть связаны с последовательностями, контролирующими регуляцию экспрессии (например, lac-оператором).
В большинстве случаев фимбрии или подобные фимбриям структуры, используемые в композициях и, соответственно, в композициях вакцин согласно изобретению, будут построены из субъединицы пилина одного типа. Как правило, будут использоваться фимбрии или подобные фимбриям структуры, состоящие из идентичных субъединиц, так как предполагается, что они образуют структуры, которые представляют собой высокоупорядоченные и повторяющиеся антигенные матрицы.
Однако композиции согласно изобретению также включают в себя композиции и вакцины, содержащие фимбрии и подобные фимбриям структуры, образованные из гетерогенных субъединиц пилина. Субъединицы пилина, которые образуют указанные фимбрии или подобные фимбриям структуры, могут быть экспрессированы с генов, присутствующих в бактериальных клетках в природе, или могут быть введены в клетки. Когда оба гена и присутствующий в природе ген пилина, и введенный ген экспрессируются в клетке, которая образует фимбрии или подобные фимбриям структуры, результатом, как правило, будут структуры, образованные из смеси указанных белков пилина. Кроме того, когда в бактериальной клетке экспрессируются два или более генов пилина, относительная экспрессия каждого гена пилина обычно будет фактором, который определяет соотношение различных субъединиц пилина в фимбриях или подобных фимбриям структурах.
В том случае, когда требуются фимбрии или подобные фимбриям структуры, имеющие конкретный состав из смешанных субъединиц пилина, экспрессию по меньшей мере одного из генов пилина можно регулировать гетерологичным индуцируемым промотором. Такие промоторы, а также другие генетические элементы, можно использовать для того, чтобы регулировать относительные количества различных субъединиц пилина, продуцируемых в бактериальной клетке, и, следовательно, состав фимбрий или подобных фимбриям структур.
Кроме того, антиген или антигенная детерминанта может быть связана с бактериальными фимбриями или подобными фимбриям структурами связью, которая не является пептидной связью, бактериальные клетки, которые продуцируют фимбрии или подобные фимбриям структуры, используемые в композициях согласно изобретению, можно генетически сконструировать так, чтобы создавать белки пилина, которые слиты с антигеном или антигенной детерминантой. Такие слитые белки, которые образуют фимбрии или подобные фимбриям структуры, подходят для применения в композициях вакцин согласно изобретению.
Вирусоподобные частицы в контексте данной заявки относятся к структурам, аналогичным вирусной частице, но которые являются непатогенными. В общем, вирусоподобные частицы не содержат вирусного генома и, следовательно, являются неинфекционными. Также вирусоподобные частицы могут продуцироваться в больших количествах в результате гетерологичной экспрессии и могут быть легко очищены.
В предпочтительном варианте вирусоподобной частицей является рекомбинантная вирусоподобная частица. Специалист в данной области может получить VLP, используя методику рекомбинантной ДНК и вирусные кодирующие последовательности, которые легко- и общедоступны. Например, кодирующую последовательность белка оболочки или кора вируса можно сконструировать для экспрессии в бакуловирусном экспрессирующем векторе, используя коммерчески доступный бакуловирусный вектор, под регуляторным контролем вирусного промотора с соответствующими модификациями последовательности, чтобы обеспечить функциональную связь кодирующей последовательности с регуляторной последовательностью. Кодирующую последовательность белка оболочки или кора вируса также можно сконструировать для экспрессии, например, в бактериальном экспрессирующем векторе.
Примеры VLP включают в себя, не ограничиваясь указанным, белки капсида вируса гепатита B (Ulrich et al., Virus Res. 50: 141-182 (1998)), вируса кори (Warnes et al., Gene 160: 173-178 (1995)), вируса Синдбис, ротавируса (патент США 5071651 и патент США 5374426), вируса ящура (Twomey et al., Vaccine 13: 1603-1610, (1995)), вируса Норуолк (Jiang, X. et al., Science 250: 1580-1583 (1990); Matsui, S.M. et al., J. Clin. Invest. 87: 1456-1461 (1991)), ретровирусный белок GAG (WO 96/30523), белок p1 ретротранспозона Ty, поверхностный белок вируса гепатита B (WO 92/11291), вируса папилломы человека (WO 98/15631), РНК-фагов, Ty, fr-фага, GA-фага и Qβ-фага.
Как легко будет понятно специалистам в данной области, VLP согласно изобретению не ограничена какой-либо конкретной формой. Частицу можно синтезировать химическим способом или посредством биологического процесса, который может быть природным или неприродным. В качестве примера такой тип варианта включает в себя вирусоподобную частицу или ее рекомбинантную форму.
В более конкретном варианте VLP может содержать или, альтернативно, по существу состоять или, альтернативно, состоять из рекомбинантных полипептидов или их фрагментов, выбранных из рекомбинантных полипептидов ротавируса, рекомбинантных полипептидов вируса Норуолк, рекомбинантных полипептидов альфавируса, рекомбинантных полипептидов вируса болезни «нога и рот», рекомбинантных полипептидов вируса кори, рекомбинантных полипептидов вируса Синдбис, рекомбинантных полипептидов вируса полиомы, рекомбинантных полипептидов ретровируса, рекомбинантных полипептидов вируса гепатита B (например, HBcAg), рекомбинантных полипептидов вируса табачной мозаики, рекомбинантных полипептидов вируса овечьих кошар, рекомбинантных полипептидов вируса папилломы человека, рекомбинантных полипептидов бактериофагов, рекомбинантных полипептидов РНК-фагов, рекомбинантных полипептидов Ty, рекомбинантных полипептидов fr-фага, рекомбинантных полипептидов GA-фага и рекомбинантных полипептидов Qβ-фага. Вирусоподобная частица, кроме того, может содержать или, альтернативно, по существу состоять, или альтернативно, состоять из одного или нескольких фрагментов таких полипептидов, а также вариантов таких полипептидов. Варианты полипептидов могут иметь, например, по меньшей мере, 80%, 85%, 90%, 95%, 97% или 99% идентичности на аминокислотном уровне со своими аналогами дикого типа.
В предпочтительном варианте вирусоподобная частица содержит, по существу состоит или, альтернативно, состоит из рекомбинантных белков или их фрагментов РНК-фага. Предпочтительно РНК-фаг выбран из группы, состоящей из a) бактериофага Qβ; b) бактериофага R17; c) бактериофага fr; d) бактериофага GA; e) бактериофага SP; f) бактериофага MS2; g) бактериофага M11; h) бактериофага MX1; i) бактериофага NL95; k) бактериофага f2 и l) бактериофага PP7.
В другом предпочтительном варианте данного изобретения вирусоподобная частица содержит или, альтернативно, по существу состоит или, альтернативно, состоит из рекомбинантных белков или их фрагментов, РНК-бактериофага Qβ или РНК-бактериофага fr.
В другом предпочтительном варианте данного изобретения рекомбинантные белки содержат или, альтернативно, по существу состоят или, альтернативно, состоят из покрывающих белков РНК-фага.
Покрывающие белки РНК-фага, образующие капсиды или VLP, или фрагменты покрывающих белков бактериофага, совместимые с самосборкой в капсид или VLP, таким образом, являются следующими предпочтительными вариантами данного изобретения. Покрывающие белки бактериофага Qβ, например, могут быть рекомбинантно экспрессированы в E. coli. Кроме того, при такой экспрессии указанные белки спонтанно образуют капсиды. Кроме того, указанные капсиды образуют структуру с присущей ей повторяющейся организацией.
Конкретные предпочтительные примеры покрывающих белков бактериофага, которые можно использовать для получения композиций согласно изобретению, включают в себя покрывающие белки таких РНК-бактериофагов как бактериофаг Qβ (SEQ ID NO:10; база данных PIR, инвентарный No. VCBPQβ, относящаяся к CP Qβ и SEQ ID NO:11; инвентарный No. AAA16663, относящаяся к белку A1 Qβ), бактериофаг R17 (SEQ ID NO:12; PIR, инвентарный No. VCBPR7), бактериофаг fr (SEQ ID NO:13; PIR, инвентарный No. VCBPFR), бактериофаг GA (SEQ ID NO:14; GenBank, инвентарный No. NP-040754), бактериофаг SP (SEQ ID NO:15; GenBank, инвентарный No. CAA30374, относящаяся к CP SP, и SEQ ID NO:16; инвентарный No. NP-695026, относящаяся к белку A1 SP), бактериофаг MS2 (SEQ ID NO:17; PIR, инвентарный No. VCBPM2), бактериофаг M11 (SEQ ID NO:18; GenBank, инвентарный No. AAC06250), бактериофаг MX1 (SEQ ID NO:19; GenBank, инвентарный No. AAC14699), бактериофаг NL95 (SEQ ID NO:20; GenBank, инвентарный No. AAC14704), бактериофаг f2 (SEQ ID NO:21; GenBank, инвентарный No. P03611), бактериофаг PP7 (SEQ ID NO:22). Кроме того, белок A1 бактериофага Qβ или C-концевые укороченные формы, в которых отсутствуют до 100, 150 или 180 аминокислот из его C-конца, могут быть включены в сборку капсида из покрывающих белков Qβ. Как правило, процентное содержание белка A1 Qβ относительно CP Qβ в собранной конструкции капсида будет ограничено, чтобы обеспечить образование капсида.
Также обнаружено, что покрывающий белок Qβ подвергается самосборке в капсиды при экспрессии в E. coli (Kozlovska TM. et al., GENE 137: 133-137 (1993)). Полученные капсиды или вирусоподобные частицы имели икосаэдрическую структуру капсида, подобную структуре фага, с диаметром 25 нм и квазисимметрию T=3. Кроме того, определена кристаллическая структура фага Qβ. Капсид содержит 180 копий покрывающего белка, которые связаны в ковалентные пентамеры и гексамеры дисульфидными мостиками (Golmohammadi, R. et al., Structure 4: 543-5554 (1996)), обеспечивая поразительную стабильность капсида из покрывающего белка Qβ. Однако капсиды или VLP, полученные из рекомбинантного покрывающего белка Qβ, могут содержать субъединицы, не связанные дисульфидными связями с другими субъединицами в капсиде, или не полностью связанные. Таким образом, при загрузке рекомбинантного капсида Qβ на невосстанавливающий SDS-ПААГ видны полосы, соответствующие мономерному покрывающему белку Qβ, а также полосы, соответствующие гексамеру или пентамеру покрывающего белка Qβ. Не полностью связанные дисульфидными связями субъединицы могут быть видны в виде полосы димера, тримера или даже тетрамера в невосстанавливающем SDS-ПААГ. Белок капсида Qβ также проявляет необычную резистентность к органическим растворителям и денатурирующим агентам. Неожиданно авторы обнаружили, что такие высокие концентрации ДМСО и ацетонитрила, как 30%, и такие высокие концентрации гуанидиния, как 1 М, не влияют на стабильность капсида. Высокая стабильность капсида из покрывающего белка Qβ является признаком, дающим преимущество, в частности, для его применения при иммунизации и вакцинации млекопитающих и человека согласно данному изобретению.
При экспрессии в E. coli N-концевой метионин покрывающего белка Qβ обычно удаляется, как обнаружили авторы в результате N-концевого секвенирования по Эдману, как описано в Stoll, E. et al. J. Biol. Chem. 252: 990-993 (1977). VLP, состоящая из покрывающих белков Qβ, где не удален N-концевой метионин, или VLP, содержащие смесь покрывающих белков Qβ, где N-концевой метионин либо отщеплен, либо присутствует, также входят в объем данного изобретения.
Кроме того, также показано, что покрывающие белки РНК-фага подвергаются самосборке при экспрессии в бактериальном хозяине (Kastelein, R.A. et al., Gene 23: 245-254 (1983), Kozlovskaya, T.M. et al., Dokl. Akad. Nauk SSSR 287: 452-455 (1986), Adhin, M.R. et al., Virology 170: 238-242 (1989), Ni, C.Z., et al., Protein Sci. 5: 2485-2493 (1996), Priano, C. et al., J. Mol. Biol. 249: 283-297 (1995)). Капсид фага Qβ, кроме покрывающего белка, содержит так называемый полностью считываемый белок A1 и белок созревания A2. A1 образуется в результате супрессии в стоп-кодоне UGA и имеет длину 329 а/к. Капсид рекомбинантного покрывающего белка фага Qβ, используемый в данном изобретении, лишен белка лизиса A2 и содержит РНК из хозяина. Покрывающий белок РНК-фагов является РНК-связывающим белком и взаимодействует со стволовой петлей сайта связывания рибосомы гена репликазы, действуя в качестве репрессора трансляции в ходе жизненного цикла вируса. Последовательность и структурные элементы взаимодействия известны (Witherell, G.W. and Uhlenbeck, O.C. Biochemistry 28: 71-76 (1989); Lim F. et al., J. Biol. Chem. 271: 31839-31845 (1996)). Известно, что стволовая петля и РНК в общем вовлечены в сборку вируса (Golmohammadi, R. et al., Structure 4: 543-5554 (1996)).
В следующем предпочтительном варианте данного изобретения вирусоподобная частица содержит или, альтернативно, по существу состоит или, альтернативно, состоит из рекомбинантных белков или их фрагментов РНК-фага, где рекомбинантные белки содержат, по существу состоят или, альтернативно, состоят из мутантных покрывающих белков РНК-фага, предпочтительно мутантных покрывающих белков РНК-фагов, указанных выше. В другом предпочтительном варианте мутантные покрывающие белки РНК-фага модифицированы путем удаления по меньшей мере одного остатка лизина путем замены или добавлением по меньшей мере одного остатка лизина путем замены; альтернативно мутантные покрывающие белки РНК-фага модифицированы делецией по меньшей мере одного остатка лизина или добавлением по меньшей мере одного остатка лизина посредством инсерции.
В другом предпочтительном варианте вирусоподобная частица содержит или, альтернативно, по существу состоит или, альтернативно, состоит из рекомбинантных белков или их фрагментов РНК-бактериофага Qβ, где рекомбинантные белки содержат или, альтернативно, по существу состоят или, альтернативно, состоят из покрывающих белков, имеющих аминокислотную последовательность SEQ ID NO:10, или смеси покрывающих белков, имеющих аминокислотные последовательности SEQ ID NO:10 и SEQ ID NO:11, или мутантов SEQ ID NO:11, и где N-концевой метионин предпочтительно отщеплен.
В следующем предпочтительном варианте данного изобретения вирусоподобная частица содержит, по существу состоит или, альтернативно, состоит из рекомбинантных белков Qβ или их фрагментов, где рекомбинантные белки содержат или альтернативно, по существу состоят или, альтернативно, состоят из мутантных покрывающих белков Qβ. В другом предпочтительном варианте указанные мутантные покрывающие белки модифицированы путем удаления по меньшей мере одного остатка лизина посредством замены или добавлением по меньшей мере одного остатка лизина посредством замены. Альтернативно указанные мутантные покрывающие белки модифицированы путем делеции по меньшей мере одного остатка лизина или добавления по меньшей мере одного остатка лизина посредством инсерции.
На поверхности капсида из покрывающего белка Qβ экспонированы четыре остатка лизина. Мутанты Qβ, для получения которых экспонированные остатки лизина заменяют аргининами, также могут быть использованы для данного изобретения. Таким образом, в практике изобретения могут быть использованы следующие мутанты покрывающего белка Qβ и мутантные VLP Qβ: «Qβ-240» (Lys13-Arg; SEQ ID NO:23), «Qβ-243» (Asn 10-Lys; SEQ ID NO:24), «Qβ-250» (Lys 2-Arg, Lys13-Arg; SEQ ID NO:25), «Qβ-251» (SEQ ID NO:26) и «Qβ-259» (Lys 2-Arg, Lys16-Arg; SEQ ID NO:27). Таким образом, в следующем предпочтительном варианте данного изобретения вирусоподобная частица содержит, по существу состоит или, альтернативно, состоит из рекомбинантных белков мутантных покрывающих белков Qβ, которые содержат белки, имеющие аминокислотную последовательность, выбранную из следующей группы: a) аминокислотной последовательности SEQ ID NO:23; b) аминокислотной последовательности SEQ ID NO:24; c) аминокислотной последовательности SEQ ID NO:25; d) аминокислотной последовательности SEQ ID NO:26 и e) аминокислотной последовательности SEQ ID NO:27. Конструирование, экспрессия и очистка указанных выше покрывающих белков Qβ, VLP и капсидов из мутантных покрывающих белков Qβ, соответственно, описаны в находящейся на рассмотрении заявке на выдачу патента США No. 10/050902, поданной настоящим правопреемником 18 января 2002. В частности, ссылка относится к примеру 18 указанной выше заявки.
В следующем предпочтительном варианте данного изобретения вирусоподобная частица содержит или, альтернативно, по существу состоит или, альтернативно, состоит из рекомбинантных белков Qβ или их фрагментов, где рекомбинантные белки содержат, по существу состоят или, альтернативно, состоят из смеси любого одного из вышеупомянутых мутантов Qβ и соответствующего белка A1.
В следующем предпочтительном варианте данного изобретения вирусоподобная частица содержит или, альтернативно, по существу состоит или, альтернативно, состоит из рекомбинантных белков или их фрагментов РНК-фага AP205.
Геном AP205 состоит из белка созревания, покрывающего белка, репликазы и двух открытых рамок считывания, не присутствующих в родственных фагах; гена лизиса и открытой рамки считывания, играющей роль в трансляции гена созревания (Klovins, J. et al., J. Gen. Virol. 83: 1523-33 (2002)). Покрывающий белок AP205 можно экспрессировать с плазмиды pAP283-58 (SEQ ID NO:79), которая является производной pQb10 (Kozlovska, T. M. et al., Gene 137: 133-37 (1993)) и которая содержит сайт связывания рибосомы AP205. Альтернативно покрывающий белок AP205 может быть клонирован в pQb185 ниже сайта связывания рибосомы, присутствующего в векторе. Оба способа приводят к экспрессии белка и образованию капсидов, как описано в одновременно находящейся на рассмотрении предварительной заявке на выдачу патента США, имеющей название «Молекулярные антигенные матрицы» и поданной настоящим правопреемником 16 июля 2002, которая включена в виде ссылки в полном объеме. Векторы pQb10 и pQb185 являются векторами, полученными из вектора pGEM, и экспрессия клонированных генов в указанных векторах контролируется промотором trp (Kozlovska, T. M. et al., Gene 137: 133-37 (1993)). Плазмида pAP283-58 (SEQ ID NO:79) содержит предполагаемый сайт связывания рибосомы AP205 в следующей последовательности, которая расположена ниже сайта XbaI и непосредственно выше стартового кодона ATG покрывающего белка AP205: tctagaATTTTCTGCGCACCCATCCCGGGTGGCGCCCAAAGTGAGGAAAATCACatg. Вектор pQb185 содержит последовательность Шайне-Далгарно ниже сайта XbaI и выше стартового кодона (tctagaTTAACCCAACGCGTAGGAGTCAGGCCatg, последовательность Шайне-Далгарно подчеркнута).
В следующем предпочтительном варианте данного изобретения вирусоподобная частица содержит или, альтернативно, по существу состоит или, альтернативно, состоит из рекомбинантных покрывающих белков или их фрагментов РНК-фага AP205.
Таким образом, указанный предпочтительный вариант данного изобретения включает в себя покрывающие белки AP205, которые образуют капсиды. Такие белки экспрессируют рекомбинантно или получают из природных источников. Покрывающие белки AP205, продуцированные в бактериях, спонтанно образуют капсиды, что подтверждается электронной микроскопией (ЭМ) и иммунодиффузией. Структурные особенности капсида, образованного покрывающим белком AP205 (SEQ ID NO:80), и особенности капсида, образованного покрывающим белком РНК-фага AP205, почти не отличаются при наблюдении в ЭМ. VLP AP205 являются высокоиммуногенными и могут быть связаны с антигенами и/или антигенными детерминантами с образованием конструкций вакцин, экспонирующих антигены и/или антигенные детерминанты, ориентированные повторяющимся образом. Против экспонированных таким образом антигенов вырабатываются высокие титры антител, что свидетельствует о том, что связанные антигены и/или антигенные детерминанты доступны для взаимодействия с молекулами антител и являются иммуногенными.
В следующем предпочтительном варианте данного изобретения вирусоподобная частица содержит или, альтернативно, по существу состоит, или, альтернативно, состоит из рекомбинантных мутантных покрывающих белков или их фрагментов РНК-фага AP205.
Компетентные в отношении сборки мутантные формы VLP AP205, включая покрывающий белок AP205 с заменой пролина в положении аминокислоты 5 на треонин (SEQ ID NO:81), также можно использовать в практике изобретения, и они составляют следующий предпочтительный вариант изобретения. Указанные VLP, VLP AP205, полученные из природных источников, или вирусные частицы AP205 могут быть связаны с антигенами с образованием упорядоченных повторяющихся матриц антигенов согласно данному изобретению.
Мутантный покрывающий белок P5-T AP205 может быть экспрессирован из плазмиды pAP281-32 (SEQ ID No. 82), которая получена непосредственно из pQb185 и которая содержит ген мутантного покрывающего белка AP205 вместо гена покрывающего белка Qβ. Векторы для экспрессии покрывающего белка AP205 трансфицировали в E. coli для экспрессии покрывающего белка AP205.
Способы экспрессии покрывающего белка и, соответственно, мутантного покрывающего белка, приводящей к самосборке в VLP, описаны в совместно рассматриваемой предварительной заявке на выдачу патента США, имеющей название «Молекулярные антигенные матрицы» и поданной настоящим правопреемником 16 июля 2002, которая включена в виде ссылки в полном объеме. Подходящие штаммы E. coli включают в себя, не ограничиваясь указанным, E. coli K802, JM 109, RR1. Подходящие векторы и штаммы и их комбинации можно идентифицировать в результате тестирования экспрессии покрывающего белка и, соответственно, мутантного покрывающего белка с помощью SDS-ПААГ и тестирования образования и сборки капсида сначала с помощью необязательной очистки капсидов гель-фильтрацией и затем их тестированием в анализе иммунодиффузии (тест Оухтерлони) или с помощью электронной микроскопии (Kozlovska, T. M. et al., Gene 137:133-37 (1993)).
Покрывающие белки AP205, экспрессированные с векторов pAP283-58 и pAP281-32, могут быть лишены начальной аминокислоты метионина вследствие процессинга в цитоплазме E. coli. Расщепленные, нерасщепленные формы VLP AP205 или их смеси являются следующими предпочтительными вариантами изобретения.
В следующем предпочтительном варианте данного изобретения вирусоподобная частица содержит или, альтернативно, по существу состоит или, альтернативно, состоит из смеси рекомбинантных покрывающих белков или их фрагментов РНК-фага AP205 и рекомбинантных мутантных покрывающих белков или их фрагментов РНК-фага AP205.
В следующем предпочтительном варианте данного изобретения вирусоподобная частица содержит или, альтернативно, по существу состоит или, альтернативно, состоит из фрагментов рекомбинантных покрывающих белков или рекомбинантных мутантных покрывающих белков РНК-фага AP205.
Фрагменты рекомбинантного покрывающего белка AP205, способные собираться в VLP, и, соответственно, капсид, также применимы в практике изобретения. Указанные фрагменты можно образовать путем делеции либо внутри, либо на концах покрывающего белка и мутантного покрывающего белка, соответственно. Инсерции в последовательность покрывающего белка и мутантного покрывающего белка или слияния антигенных последовательностей с последовательностью покрывающего белка и мутантного покрывающего белка, которые совместимы со сборкой в VLP, являются следующими вариантами изобретения, которые приводят к химерным покрывающим белкам AP205 и частицам, соответственно. Последствия инсерций, делеций и слияний с последовательностью покрывающего белка и то, совместимо ли это со сборкой в VLP, можно определить с помощью электронной микроскопии.
Частицы, образованные покрывающим белком, фрагментами покрывающего белка или химерными покрывающими белками AP205, описанными выше, можно выделить в чистой форме в результате комбинирования стадий фракционирования путем осаждения и стадий очистки гель-фильтрацией с использованием колонок, например, с сефарозой CL-4B, сефарозой CL-2B, сефарозой CL-6B и их комбинаций, как описано в совместно рассматриваемой предварительной заявке на выдачу патента США, имеющей название «Молекулярные антигенные матрицы» и поданной настоящим правопреемником 16 июля 2002, которая включена в виде ссылки в полном объеме. Другие способы выделения вирусоподобных частиц известны в данной области и могут быть использованы для выделения вирусоподобных частиц (VLP) бактериофага AP205. Например, применение ультрацентрифугирования для выделения VLP дрожжевого ретротранспозона Ty описано в патенте США No. 4918166, который включен в данное описание в виде ссылки в полном объеме.
Определена кристаллическая структура нескольких РНК-бактериофагов (Golmohammadi, R. et al., Structure 4: 543-554 (1996)). Используя указанную информацию, можно идентифицировать экспонированные на поверхности остатки и, таким образом, покрывающие белки РНК-фага можно модифицировать так, чтобы один или несколько реакционноспособных аминокислотных остатков можно было встроить с помощью инсерции или замены. В итоге, указанные модифицированные формы покрывающих белков бактериофага также можно использовать для данного изобретения. Таким образом, варианты белков, которые образуют капсиды или капсидоподобные структуры (например, покрывающие белки бактериофага Qβ, бактериофага R17, бактериофага fr, бактериофага GA, бактериофага SP и бактериофага MS2) также можно использовать для получения композиций согласно данному изобретению.
Хотя последовательность вариантов белков, обсуждаемых выше, будет отличаться от их аналогов дикого типа, указанные варианты белков, как правило, будут сохранять способность образовывать капсиды или капсидоподобные структуры. Таким образом, изобретение, кроме того, включает в себя композиции и, соответственно, композиции вакцин, которые, кроме того, содержат варианты белков, которые образуют капсиды или капсидоподобные структуры, а также способы получения таких композиций и, соответственно, композиций вакцин, отдельные субъединицы белка, используемые для получения таких композиций, и молекулы нуклеиновых кислот, которые кодируют указанные субъединицы белка. Таким образом, в объем изобретения включены вариантные формы белков дикого типа, которые образуют капсиды или капсидоподобные структуры и сохраняют способность вступать в ассоциацию и образовать капсиды или капсидоподобные структуры.
В результате изобретение, кроме того, включает в себя композиции и, соответственно, композиции вакцин, содержащие белки, которые содержат или, альтернативно, по существу состоят или, альтернативно, состоят из аминокислотных последовательностей, которые по меньшей мере на 80%, 85%, 90%, 95%, 97% или 99% идентичны белкам дикого типа, которые образуют упорядоченные матрицы и, соответственно, матрицы, имеющие присущую им повторяющуюся структуру.
Кроме того, в объем изобретения включены молекулы нуклеиновых кислот, которые кодируют белки, используемые для получения композиций согласно данному изобретению.
В других вариантах изобретение, кроме того, относится к композициям, содержащим белки, которые содержат или, альтернативно, по существу состоят или, альтернативно, состоят из аминокислотных последовательностей, которые по меньшей мере на 80%, 85%, 90%, 95%, 97% или 99% идентичны любой из аминокислотных последовательностей, показанных в SEQ ID NO:10-27.
Белки, подходящие для применения в данном изобретении, также включают в себя укороченные на C-конце мутанты белков, которые образуют капсиды или капсидоподобные структуры или VLP. Конкретные примеры таких укороченных мутантов включают в себя белки, имеющие аминокислотную последовательность, показанную в любой из SEQ ID NO:10-27, где 1, 2, 5, 7, 9, 10, 12, 14, 15 или 17 аминокислот были удалены из C-конца. Как правило, указанные укороченные на C-конце мутанты будут сохранять способность образовывать капсиды или капсидоподобные структуры.
Следующие белки, подходящие для применения в данном изобретении, также включают в себя укороченные на N-конце мутанты белков, которые образуют капсиды или капсидоподобные структуры. Конкретные примеры таких укороченных мутантов включают белки, имеющие аминокислотную последовательность, показанную в любой из SEQ ID NO:10-27, где 1, 2, 5, 7, 9, 10, 12, 14, 15 или 17 аминокислот были удалены из N-конца. Как правило, указанные укороченные на N-конце мутанты будут сохранять способность образовывать капсиды или капсидоподобные структуры.
Дополнительные белки, подходящие для применения в данном изобретении, включают в себя укороченные на N- и C-конце мутанты, которые образуют капсиды или капсидоподобные структуры. Подходящие укороченные мутанты содержат белки, имеющие аминокислотную последовательность, показанную в любой SEQ ID NO:10-27, где 1, 2, 5, 7, 9, 10, 12, 14, 15 или 17 аминокислот были удалены из N-конца и 1, 2, 5, 7, 9, 10, 12, 14, 15 или 17 аминокислот были удалены с C-конца. Как правило, указанные укороченные на N-конце и на C-конце мутанты будут сохранять способность образовывать капсиды или капсидоподобные структуры.
Изобретение, кроме того, относится к композициям, содержащим белки, которые содержат или, альтернативно, по существу состоят или, альтернативно, состоят из аминокислотных последовательностей, которые по меньшей мере на 80%, 85%, 90%, 95%, 97% или 99% идентичны описанным выше укороченным мутантам.
Таким образом, изобретение относится к композициям и композициям вакцин, полученным из белков, которые образуют капсиды или VLP, способам получения указанных композиций из отдельных белковых субъединиц и VLP или капсидов, способам получения указанных отдельных белковых субъединиц, молекулам нуклеиновой кислоты, которые кодируют указанные субъединицы, и способам вакцинации и/или способам, вызывающим иммунологические ответы у индивидов, с использованием указанных композиций согласно данному изобретению.
Как указано ранее, изобретение включает в себя вирусоподобные частицы или их рекомбинантные формы. В одном предпочтительном варианте частицы, используемые в композициях согласно изобретению, состоят из корового белка гепатита B (HBcAg) или фрагмента HBcAg. В следующем варианте частицы, используемые в композициях согласно изобретению, состоят из корового белка гепатита B (HBcAg) или фрагмента белка HBcAg, который был модифицирован для того, чтобы либо удалить, либо уменьшить количество свободных остатков цистеина. Zhou et al. (J. Virol. 66: 5393-5398 (1992)) показали, что HBcAg, которые были модифицированы для того, чтобы удалить имеющиеся в природных условиях остатки цистеина, сохраняют способность вступать в ассоциацию и образовывать капсиды. Таким образом, VLP, подходящие для применения в композициях согласно изобретению, включают в себя VLP, содержащие модифицированные HBcAg или их фрагменты, в которых один или несколько имеющихся в природных условиях остатков цистеина были либо делетированы, либо заменены другим аминокислотным остатком (например, остатком серина).
HBcAg является белком, образуемым в результате процессинга белка-предшественника корового антигена гепатита B. Идентифицирован ряд изотипов HBcAg, и их аминокислотные последовательности легко доступны специалистам в данной области. В большинстве случаев композиции и, соответственно, композиции вакцин согласно изобретению могут быть получены с использованием процессированной формы HBcAg (т.е. HBcAg, из которого была удалена N-концевая лидерная последовательность белка-предшественника корового антигена гепатита B).
Кроме того, в том случае, когда HBcAg будут получать в условиях, при которых процессинг не происходит, HBcAg, как правило, будет экспрессироваться в «процессированной» форме. Например, когда для получения HBcAg согласно изобретению будет использоваться система экспрессии E. coli, направляющая экспрессию белка в цитоплазму, указанные белки, как правило, будут экспрессироваться так, чтобы в них отсутствовала N-концевая лидерная последовательность белка-предшественника корового антигена гепатита B.
Получение вирусоподобных частиц гепатита B, которые можно использовать для данного изобретения, описано, например, в WO 00/32227 и в указанной заявке, в частности, в примерах с 17 по 19 и с 21 по 24, а также в WO 01/85208 и в ней, в частности, в примерах с 17 по 19, с 21 по 24, с 31 по 41, и в находящейся на рассмотрении заявке на выдачу патента США No. 10/050902, поданной настоящим правопреемником 18 января 2002. В случае последней заявки это, в частности, относится к примерам 23, 24, 31 и 51. Все три документа включены в данное описание в виде ссылки в полном объеме.
Данное изобретение также включает в себя варианты HBcAg, которые были модифицированы, чтобы делетировать или заменить один или несколько дополнительных остатков цистеина. В данной области известно, что свободные остатки цистеина могут быть вовлечены в ряд побочных химических реакций. Указанные побочные реакции включают в себя дисульфидные обмены, реакцию с химическими веществами или метаболитами, которые, например, инъецированы или образованы при комбинированной терапии с другими веществами, или прямое окисление и реакцию с нуклеотидами при воздействии УФ-света. Таким образом, могут быть образованы токсичные аддукты, особенно учитывая тот факт, что HBcAg имеют устойчивую тенденцию к связыванию нуклеиновых кислот. Таким образом, токсичные аддукты могут быть представлены множеством видов, каждый из которых отдельно может присутствовать в низкой концентрации, но вместе они достигают токсичных уровней.
С точки зрения указанного выше одним из преимуществ применения в композициях вакцин HBcAg, которые были модифицированы, чтобы удалить имеющиеся в природных условиях остатки цистеина, является то, что количество сайтов, с которыми могут связываться токсичные элементы в том случае, когда связаны антигены или антигенные детерминанты, может быть уменьшено или они могут быть вообще удалены.
Идентифицирован ряд вариантов HBcAg природного происхождения, подходящих для применения в практике данного изобретения. Yuan et al. (J. Virol. 73: 10122-10128 (1999)), например, описывают варианты, в которых остаток изолейцина в положении, соответствующем положению 97 в SEQ ID NO:28, заменен либо остатком лейцина, либо остатком фенилаланина. Аминокислотные последовательности ряда вариантов HBcAg, а также нескольких вариантов предшественника корового антигена гепатита B описаны в GenBank, записи AAF121240 (SEQ ID NO:29), AF121239 (SEQ ID NO:30), X85297 (SEQ ID NO:31), X02496 (SEQ ID NO:32), X85305 (SEQ ID NO:33), X85303 (SEQ ID NO:34), AF 151735 (SEQ ID NO:35), X85259 (SEQ ID NO:36), X85286 (SEQ ID NO:37), X85260 (SEQ ID NO:38), X85317 (SEQ ID NO:39), X85298 (SEQ ID NO:40), AF043593 (SEQ ID NO:41), M20706 (SEQ ID NO:42), X85295 (SEQ ID NO:43), X80925 (SEQ ID NO:44), X85284 (SEQ ID NO:45), X85275 (SEQ ID NO:46), X72702 (SEQ ID NO:47), X85291 (SEQ ID NO:48), X65258 (SEQ ID NO:49), X85302 (SEQ ID NO:50), M32138 (SEQ ID NO:51), X85293 (SEQ ID NO:52), X85315 (SEQ ID NO:53), U95551 (SEQ ID NO:54), X85256 (SEQ ID NO:55), X85316 (SEQ ID NO:56), X85296 (SEQ ID NO:57), AB033559 (SEQ ID NO:58), X59795 (SEQ ID NO:59), X85299 (SEQ ID NO:60), X85307 (SEQ ID NO:61), X65257 (SEQ ID NO:62), X85311 (SEQ ID NO:63), X85301 (SEQ ID NO:64), X85314 (SEQ ID NO:65), X85287 (SEQ ID NO:66), X85272 (SEQ ID NO:67), X85319 (SEQ ID NO:68), AB010289 (SEQ ID NO:69), X85285 (SEQ ID NO:70), AB010289 (SEQ ID NO:71), AF121242 (SEQ ID NO:72), M90520 (SEQ ID NO:73), P03153 (SEQ ID NO:74), AF 110999 (SEQ ID NO:75) и M95589 (SEQ ID NO:76), описания каждой из которых включены в данную заявку в виде ссылки. Указанные варианты HBcAg отличаются по аминокислотной последовательности в ряде положений, включая аминокислотные остатки, которые соответствуют аминокислотным остаткам, расположенным в положениях 12, 13, 21, 22, 24, 29, 32, 33, 35, 38, 40, 42, 44, 45, 49, 51, 57, 58, 59, 64, 66, 67, 69, 74, 77, 80, 81, 87, 92, 93, 97, 98, 100, 103, 105, 106, 109, 113, 116, 121, 126, 130, 133, 135, 141, 147, 149, 157, 176, 178, 182 и 183 в SEQ ID NO:77. Следующие варианты HBcAg, подходящие для применения в композициях согласно изобретению, которые могут быть дополнительно модифицированы согласно изложенному в данном описании, описаны в WO 00/198333, WO 00/177158 и WO 00/214478.
Как указано выше, как правило, в композициях и, соответственно, композициях вакцин согласно изобретению будут использованы процессированные HBcAg (т.е. те, в которых отсутствуют лидерные последовательности). Данное изобретение включает в себя композиции вакцин, а также способы применения таких композиций, в которых используются описанные выше варианты HBcAg.
Имеет ли аминокислотная последовательность полипептида аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, 97% или 99% идентична одной из указанных выше аминокислотных последовательностей дикого типа или ее части, можно определить стандартным способом с использованием известных компьютерных программ, таких как программа Bestfit. При использовании Bestfit или любой другой программы выравнивания последовательностей, с тем, чтобы определить, идентична ли конкретная последовательность, например, на 95% эталонной аминокислотной последовательности, параметры устанавливают так, чтобы процент идентичности рассчитывался по всей полной длине эталонной аминокислотной последовательности и чтобы были разрешены пробелы в гомологии до 5% от общего количества аминокислотных остатков в эталонной последовательности.
Варианты и предшественники HBcAg, имеющие аминокислотные последовательности, указанные в SEQ ID NO:29-72 и 73-77, относительно сходны друг с другом. Таким образом, ссылка на аминокислотный остаток варианта HBcAg, расположенный в положении, которое соответствует конкретному положению в SEQ ID NO:77, относится к аминокислотному остатку, который присутствует в данном положении в аминокислотной последовательности, показанной в SEQ ID NO:77. Гомология между указанными вариантами HBcAg среди вирусов гепатита B, которые инфицируют млекопитающих, в большинстве случаев достаточно высока, так что специалист в данной области не будет иметь больших трудностей при просмотре обеих последовательностей, аминокислотной последовательности, показанной в SEQ ID NO:77, и аминокислотной последовательности конкретного варианта HBcAg, и при идентификации «соответствующих» аминокислотных остатков. Кроме того, аминокислотная последовательность HBcAg, показанная в SEQ ID NO:73, в которой представлена аминокислотная последовательность HBcAg, полученного из вируса, который инфицирует лесных сурков, имеет достаточно высокую гомологию с HBcAg, имеющим аминокислотную последовательность, показанную в SEQ ID NO:77, так что легко увидеть, что инсерция из трех аминокислотных остатков присутствует в SEQ ID NO:64 между остатками аминокислот 155 и 156 SEQ ID NO:77.
Изобретение также включает в себя композиции вакцин, которые содержат варианты HBcAg вирусов гепатита B, которые инфицируют птиц, а также композиции вакцин, которые содержат фрагменты указанных вариантов HBcAg. В случае указанных вариантов HBcAg один, два, три или более остатков цистеина, присутствующих в указанных полипептидах в природных условиях, могут быть либо заменены другим аминокислотным остатком, либо делетированы перед их включением в композиции вакцин согласно изобретению.
Как обсуждается выше, удаление свободных остатков цистеина уменьшает количество сайтов, в которых токсичные компоненты могут связываться с HBcAg, а также удаляет сайты, в которых может происходить перекрестное связывание остатков лизина и цистеина одной и той же или соседних молекул HBcAg. Таким образом, в другом варианте данного изобретения один или несколько остатков цистеина белка капсида вируса гепатита B либо делетированы, либо заменены другим аминокислотным остатком.
В других вариантах композиции и, соответственно, композиции вакцин согласно изобретению будут содержать HBcAg, из которых была удалена C-кнцевая область (например, аминокислотные остатки 145-185 или 150-185 SEQ ID NO:77). Таким образом, дополнительные модифицированные HBcAg, подходящие для применения в практике данного изобретения, включают в себя укороченные на C-конце мутанты. Подходящие укороченные мутанты включают HBcAg, в которых 1, 5, 10, 15, 20, 25, 30, 34, 35 аминокислот были удалены из C-конца.
HBcAg, подходящие для применения в практике данного изобретения, также включают укороченные на N-конце мутанты. Подходящие укороченные мутанты включают модифицированные HBcAg, в которых 1, 2, 5, 7, 9, 10, 12, 14, 15 или 17 аминокислот были удалены из N-конца.
Следующие HBcAg, подходящие для применения в практике данного изобретения, включают укороченные на N- и C-концах мутанты. Подходящие укороченные мутанты включают HBcAg, в которых 1, 2, 5, 7, 9, 10, 12, 14, 15 и 17 аминокислот были удалены из N-конца и 1, 5, 10, 15, 20, 25, 30, 34, 35 аминокислот были удалены из C-конца.
Изобретение, кроме того, включает в себя композиции и, соответственно, композиции вакцин, содержащие полипептиды HBcAg, содержащие или, альтернативно, по существу состоящие или, альтернативно, состоящие из аминокислотных последовательностей, которые по меньшей мере на 80%, 85%, 90%, 95%, 97% или 99% идентичны описанным выше укороченным мутантам.
В некоторых вариантах согласно изобретению в полипептид HBcAg вводят остаток лизина, чтобы опосредовать связывание белка или пептида IL-5, IL-13 или эотаксина с VLP HBcAg. В предпочтительных вариантах композиции согласно изобретению получают с использованием HBcAg, содержащего или, альтернативно, состоящего из аминокислот 1-144 или 1-149, 1-185 SEQ ID NO:77, который модифицирован так, чтобы аминокислоты, соответствующие положениям 79 и 80, были заменены пептидом, имеющим аминокислотную последовательность Gly-Gly-Lys-Gly-Gly (SEQ ID NO:78). В следующих предпочтительных вариантах остатки цистеина в положениях 48 и 107 SEQ ID NO:77 мутированы в серин. Изобретение, кроме того, включает в себя композиции, содержащие соответствующие полипептиды, имеющие аминокислотные последовательности, показанные в любой из SEQ ID NO:29-74, которые также имеют указанные выше изменения аминокислот. Кроме того, в объем изобретения включены дополнительные варианты HBcAg, которые способны ассоциировать с образованием капсида или VLP и имеют указанные выше изменения аминокислот. Таким образом, изобретение, кроме того, включает в себя композиции и, соответственно, композиции вакцин, содержащие полипептиды HBcAg, которые содержат или, альтернативно, состоят из аминокислотных последовательностей, которые по меньшей мере на 80%, 85%, 90%, 95%, 97% или 99% идентичны любой из аминокислотных последовательностей дикого типа, и формы указанных белков, которые были процессированы в подходящих для этого случаях, чтобы удалить N-концевую лидерную последовательность, и модифицированы указанными выше изменениями.
Композиции или композиции вакцин согласно изобретению могут содержать смеси различных HBcAg. Таким образом, указанные композиции вакцин могут состоять из HBcAg, которые отличаются по аминокислотной последовательности. Например, могут быть получены композиции вакцин, содержащие HBcAg «дикого типа» и модифицированный HBcAg, в котором один или несколько аминокислотных остатков были изменены (например, делетированы, встроены или заменены). Кроме того, предпочтительными композициями вакцин согласно изобретению являются композиции, которые представляют собой высокоупорядоченную и повторяющуюся антигенную матрицу, в которой антигеном является белок или пептид IL-5, IL-13 или эотаксина.
В следующем предпочтительном варианте данного изобретения по меньшей мере один белок или пептид IL-5, IL-13 или эотаксина связан с указанной центральной частицей и, соответственно, вирусоподобной частицей по меньшей мере одной ковалентной связью. Предпочтительно по меньшей мере один белок или пептид IL-5, IL-13 или эотаксина связан с центральной частицей и, соответственно, с вирусоподобной частицей по меньшей мере одной ковалентной связью, при этом указанная ковалентная связь является непептидной связью, что приводит к образованию упорядоченной и повторяющейся матрицы центральная частица-белок или пептид IL-5, IL-13 или эотаксина и, соответственно, матрицы или конъюгата белок или пептид IL-5, IL-13 или эотаксина с VLP. Данная матрица или, соответственно, конъюгат белок или пептид IL-5, IL-13 или эотаксина с VLP обычно и предпочтительно имеет повторяющуюся и упорядоченную структуру, так как по меньшей мере один, но обычно несколько белков или пептидов IL-5, IL-13 или эотаксина связаны с VLP ориентированным образом. Предпочтительно более 10, 20, 40, 80, 120 белков или пептидов IL-5, IL-13 или эотаксина связаны с VLP или субъединицей VLP. Образование повторяющейся и упорядоченной матрицы или, соответственно, конъюгата белка или пептида IL-5, IL-13 или эотаксина обеспечивается ориентированным и направленным, а также определенным связыванием и, соответственно, присоединением по меньшей мере одного белка или пептида IL-5, IL-13 или эотаксина к VLP, как будет понятно из нижеследующего. Кроме того, обычная присущая, высоко повторяющаяся и организованная структура VLP преимущественно вносит вклад в экспонирование белка или пептида IL-5, IL-13 или эотаксина высокоупорядоченным и повторяющимся образом, приводя к образованию высоко организованной и повторяющейся матрицы и, соответственно, конъюгата белка или пептида IL-5, IL-13 или эотаксина.
Таким образом, предпочтительные конъюгаты и, соответственно, матрицы согласно изобретению отличаются от конъюгатов предшествующего уровня техники своей высокоорганизованной структурой, размерами и повторяемостью антигена на поверхности матрицы. Предпочтительный вариант данного изобретения, кроме того, позволяет осуществлять экспрессию как частицы, так и антигена в экспрессирующем хозяине, обеспечивая правильную упаковку антигена, т.е. по меньшей мере одного белка или пептида IL-5, IL-13 или эотаксина, и правильную упаковку и сборку VLP.
В данном изобретении заявлены способы связывания белка или пептида IL-5, IL-13 или эотаксина с центральными частицами и, соответственно, с VLP. Как указано в одном аспекте данного изобретения белок или пептид IL-5, IL-13 или эотаксина связан с центральной частицей и, соответственно, с VLP с помощью химического перекрестного связывания обычно и предпочтительно с использованием гетеробифункционального перекрестно сшивающего агента. В данной области известно несколько гетеробифункциональных перекрестно сшивающих агентов. В предпочтительных вариантах гетеробифункциональный перекрестно сшивающий агент содержит функциональную группу, которая может взаимодействовать с предпочтительными первыми сайтами связывания, т.е. с аминогруппой боковой цепи остатков лизина центральной частицы и VLP или по меньшей мере одной субъединицы VLP, соответственно, и дополнительную функциональную группу, которая может взаимодействовать с предпочтительным вторым сайтом связывания, т.е. остатком цистеина, имеющимся в природных условиях, который сделан доступным для реакции посредством восстановления или сконструированным на белке или пептиде IL-5, IL-13 или эотаксина и необязательно также сделанным доступным для реакции посредством восстановления. Первая стадия способа, обычно называемая дериватизацией, представляет собой взаимодействие центральной частицы или VLP с перекрестно сшивающим агентом. Продуктом данной реакции является активированная центральная частица или активированная VLP, также называемая активированным носителем. На второй стадии непрореагировавший перекрестно сшивающий агент удаляют, используя обычные способы, такие как гель-фильтрация или диализ. На третьей стадии осуществляют взаимодействие белка или пептида IL-5, IL-13 или эотаксина с активированным носителем, и данную стадию обычно называют стадией связывания. Непрореагировавший белок или пептид IL-5, IL-13 или эотаксина необязательно можно удалить на четвертой стадии, например, диализом. В данной области известно несколько гетеробифункциональных перекрестно сшивающих агентов. Указанные агенты включают предпочтительные перекрестно сшивающие агенты SMPH (Pierce), сульфо-MBS, сульфо-EMCS, сульфо-GMBS, сульфо-SIAB, сульфо-SMPB, сульфо-SMCC, SVSB, SIA и другие перекрестно сшивающие агенты, доступные, например, из Pierce Chemical Company (Rockford, IL, USA), и имеющие одну функциональную группу, реакционноспособную по отношению к аминогруппам, и одну функциональную группу, реакционноспособную по отношению к остаткам цистеина. Все указанные выше перекрестно сшивающие агенты приводят к образованию тиоэфирной связи. Другой класс перекрестно сшивающих агентов, подходящих для практики изобретения, характеризуется введением дисульфидной связи между белком или пептидом IL-5, IL-13 или эотаксина и центральной частицей или VLP при связывании. Предпочтительные перекрестно сшивающие агенты, относящиеся к данному классу, включают в себя, например, SPDP и сульфо-LC-SPDP (Pierce). На степень дериватизации центральной частицы и, соответственно, VLP перекрестно сшивающим агентом можно влиять различными экспериментальными условиями, такими как концентрация каждого из партнеров реакции, избыток одного реагента по сравнению с другим, pH, температура и ионная сила. Степень связывания, т.е. количество белка или пептида IL-5, IL-13 или эотаксина на субъединицу центральной частицы и, соответственно VLP, можно корректировать различными экспериментальными условиями, описанными выше, чтобы обеспечить соответствие требованиям вакцины. Растворимость белка или пептида IL-5, IL-13 или эотаксина может накладывать ограничение на количество белка или пептида IL-5, IL-13 или эотаксина, которое можно связать с каждой субъединицей, и в таких случаях, где полученная вакцина может быть нерастворимой, полезным может быть уменьшение количества белка или пептида IL-5, IL-13 или эотаксина на субъединицу.
Особенно предпочтительным способом связывания белка или пептида IL-5, IL-13 или эотаксина с центральной частицей и, соответственно, с VLP является связывание остатка лизина на поверхности центральной частицы и, соответственно, VLP с остатком цистеина на белке или пептиде IL-5, IL-13 или эотаксина. Таким образом, в предпочтительном варианте данного изобретения первым сайтом связывания является остаток лизина, а вторым сайтом связывания является остаток цистеина. В некоторых вариантах может требоваться конструирование аминокислотного линкера, содержащего остаток цистеина, в качестве второго сайта связывания или в качестве его части, к белку или пептиду IL-5, IL-13 или эотаксина для связывания с центральной частицей и, соответственно, с VLP. Альтернативно цистеин может быть введен в белок или пептид IL-5, IL-13 или эотаксина либо посредством инсерции, либо мутации. Альтернативно остаток цистеина или тиоловую группу можно ввести с помощью химического связывания.
Выбор аминокислотного линкера будет зависеть от природы антигена и, соответственно, аутоантигена, т.е. от природы белка или пептида IL-5, IL-13 или эотаксина, от его биохимических свойств, таких как pI, распределение заряда и гликозилирование. В общем, предпочтительны гибкие аминокислотные линкеры. Предпочтительные варианты аминокислотного линкера выбраны из группы, состоящей из (a) CGG; (b) N-концевого линкера гамма 1; (c) N-концевого линкера гамма 3; (d) шарнирных участков Ig; (e) N-концевых глициновых линкеров; (f) (G)kC(G)n при n=0-12 и k=0-5; (g) N-концевых глицин-сериновых линкеров; (h) (G)kC(G)m(S)l(GGGGS)n при n=0-3, k=0-5, m=0-10, l=0-2; (i) GGC; (k) GGC-NH2; (l) C-концевого линкера гамма 1; (m) C-концевого линкера гамма 3; (n) C-концевых глициновых линкеров; (o) (G)nC(G)k при n=0-12 и k=0-5; (p) C-концевых глицин-сериновых линкеров; (q) (G)m(S)l(GGGGS)n(G)o C(G)k при n=0-3, k=0-5, m=0-10, l=0-2 и o=0-8.
Следующими предпочтительными примерами аминокислотных линкеров являются шарнирный участок иммуноглобулинов, глицин-сериновые линкеры (GGGGS)n и глициновые линкеры (G)n, все из которых, кроме того, содержат остаток цистеина в качестве второго сайта связывания и необязательно дополнительные остатки глицина. Обычно предпочтительными примерами указанных аминокислотных линкеров являются N-концевой гамма 1: CGDKTHTSPP; C-концевой гамма 1: DKTHTSPPCG; N-концевой гамма 3: CGGPKPSTPPGSSGGAP; C-концевой гамма 3: PKPSTPPGSSGGAPGGCG; N-концевой глициновый линкер: GCGGGG; C-концевой глициновый линкер: GGGGCG; C-концевой глицин-лизиновый линкер: GGKKGC; N-концевой глицин-лизиновый линкер: CGKKGG.
В следующем предпочтительном варианте данного изобретения и, в частности, в том случае, если антигеном является пептид IL-5, IL-13 или эотаксина, предпочтительными в качестве аминокислотных линкеров являются линкеры GGCG, GGC или GGC-NH2 («NH2» означает амидирование) на C-конце пептида или CGG на его N-конце. В общем, остатки глицина будут встроены между основной массой аминокислот и цистеином, используемым в качестве второго сайта связывания, чтобы избежать возможных стерических помех со стороны аминокислоты основной массы в реакции связывания.
Остаток цистеина, присутствующий на белке или пептиде IL-5, IL-13 или эотаксина, должен быть в своем восстановленном состоянии, чтобы реагировать с гетеробифункциональным перекрестно сшивающим агентом на активированной VLP, то есть должен быть доступным свободный цистеин или остаток цистеина со свободной сульфгидрильной группой. В том случае, когда остаток цистеина для функционирования в качестве сайта связывания находится в окисленной форме, например, если он образует дисульфидный мостик, требуется восстановление указанного дисульфидного мостика, например, с помощью DTT, TCEP или β-меркаптоэтанола.
Связывание белка или пептида IL-5, IL-13 или эотаксина с центральной частицей или, соответственно, с VLP с использованием гетеробифункционального перекрестно сшивающего агента согласно описанным выше предпочтительным способам позволяет осуществлять связывание белка или пептида IL-5, IL-13 или эотаксина с центральной частицей и, соответственно, с VLP ориентированным образом. Другие способы связывания белка или пептида IL-5, IL-13 или эотаксина с центральной частицей и, соответственно, с VLP включают в себя способы, при которых белок или пептид IL-5, IL-13 или эотаксина перекрестно сшивают с центральной частицей и, соответственно, с VLP, используя карбодиимид, EDC и NHS. Белок или пептид IL-5, IL-13 или эотаксина также сначала может быть тиолирован в ходе реакции, например, с SATA, SATP или иминотиоланом. Затем белок или пептид IL-5, IL-13 или эотаксина при необходимости после снятия защиты можно связывать с центральной частицей и, соответственно, VLP следующим образом. После отделения избытка реагента для тиолирования осуществляют взаимодействие белка или пептида IL-5, IL-13 или эотаксина с центральной частицей и, соответственно, с VLP, предварительно активированной гетеробифункциональным перекрестно сшивающим агентом, содержащим реакционноспособный по отношению к цистеину остаток и, следовательно, экспонирующим по меньшей мере одну или несколько функциональных групп, реагирующих с остатками цистеина, с которыми может реагировать тиолированный белок или пептид IL-5, IL-13 или эотаксина, такой, как описано выше. Необязательно в реакционную смесь могут быть включены небольшие количества восстанавливающего агента. В следующих способах белок или пептид IL-5, IL-13 или эотаксина связывают с центральной частицей и, соответственно, с VLP, используя гомобифункциональный перекрестно сшивающий агент, такой как глутаральдегид, DSG, BM[PEO]4, BS3 (Pierce Chemical Company, Rockford, IL, USA) или другие известные гомобифункциональные перекрестно сшивающие агенты с функциональными группами, реагирующими с аминогруппами или карбоксильными группами центральной частицы и, соответственно VLP.
В следующем варианте белок или пептид IL-5, IL-13 или эотаксина связывают с центральной частицей и, соответственно, с VLP посредством модификации углеводных остатков, присутствующих на гликозилированном белке или пептиде IL-5, IL-13 или эотаксина, и последующего взаимодействия с центральной частицей и, соответственно, с VLP. В одном варианте осуществляют реакцию гликозилированного белка или пептида IL-5, IL-13 или эотаксина с периодатом натрия в условиях реакции мягкого окисления углеводного остатка, получая активированный белок или пептид IL-5, IL-13 или эотаксина с одной или несколькими функциональными альдегидными группами. Активированный таким образом белок или пептид IL-5, IL-13 или эотаксина отделяют от избытка периодата натрия и затем подвергают взаимодействию с центральной частицей и, соответственно, с VLP, при котором остатки лизина центральной частицы и, соответственно, VLP или по меньшей мере одной субъединицы VLP взаимодействуют с ранее образованной альдегидной функциональной группой на белке или пептиде IL-5, IL-13 или эотаксина, например, как описано Hermanson, G.T. в Bioconjugate Techniques, Academic Press Inc., San Diego, CA, USA. Самополимеризацию активированного белка или пептида IL-5, IL-13 или эотаксина можно контролировать, корректируя pH, как описано в вышеуказанной публикации. Образованное основание Шиффа предпочтительно далее восстанавливают цианоборогидридом натрия, который затем удаляют гель-фильтрацией или диализом. Альтернативно можно осуществлять взаимодействие центральной частицы и, соответственно, VLP с EDC по карбоксильным группам центральной частицы и, соответственно, VLP или по меньшей мере одной субъединицы VLP и дигидразидом, таким как дигидразид адипиновой кислоты, получая остаток гидразида, доступный для взаимодействия с одной или несколькими альдегидными функциональными группами, присутствующими на активированном белке или пептиде IL-5, IL-13 или эотаксина. Образованный таким образом гидразон затем можно восстанавливать цианоборогидридом натрия. Альтернативно активированный белок или пептид IL-5, IL-13 или эотаксина с одной или несколькими альдегидными функциональными группами подвергают реакции с цистеамином, получая в результате введение группы цистеина в белок или пептид IL-5, IL-13 или эотаксина. Дополнительные способы перекрестного сшивания и перекрестно сшивающие агенты, подходящие для связывания белка или пептида IL-5, IL-13 или эотаксина с центральной частицей и, соответственно, с VLP, а также руководство по осуществлению реакций связывания и применению химических перекрестно сшивающих агентов и способам химического перекрестного сшивания можно найти в Hermanson, G.T. in Bioconjugate Techniques, Academic Press Inc., San Diego, CA, USA.
Другие способы связывания VLP с белком или пептидом IL-5, IL-13 или эотаксина включают способы, при которых центральную частицу и, соответственно, VLP биотинилируют и белок или пептид IL-5, IL-13 или эотаксина экспрессируют в виде белка, слитого со стрептавидином, или способы, при которых биотинилируют как белок или пептид IL-5, IL-13 или эотаксина, так и центральную частицу и, соответственно, VLP, например, как описано в WO 00/23955. В данном случае белок или пептид IL-5, IL-13 или эотаксина сначала можно связать со стрептавидином или авидином, корректируя отношение белка или пептида IL-5, IL-13 или эотаксина к стрептавидину так, чтобы свободные сайты связывания еще были доступными для связывания центральной частицы и, соответственно, VLP, которую добавляют на следующей стадии. Альтернативно все компоненты можно смешать в реакции «в одном сосуде». Другие пары лиганд-рецептор, где имеется растворимая форма рецептора и лиганда и которые способны к перекрестному сшиванию с центральной частицей и, соответственно, с VLP или белком или пептидом IL-5, IL-13 или эотаксина, можно использовать в качестве связывающих агентов для связывания белка или пептида IL-5, IL-13 или эотаксина с центральной частицей и, соответственно, с VLP. Альтернативно либо лиганд, либо рецептор могут быть слиты с белком или пептидом IL-5, IL-13 или эотаксина и таким образом опосредовать связывание с центральной частицей и, соответственно, с VLP, химически связанной или слитой либо с рецептором, либо с лигандом, соответственно. Слияние также можно осуществлять посредством инсерции или замены.
Как уже говорилось, в предпочтительном варианте данного изобретения VLP является VLP РНК-фага и в более предпочтительном варианте VLP является VLP покрывающего белка РНК-фага Qβ.
Одна или несколько молекул антигена, т.е. белка или пептида IL-5, IL-13 или эотаксина, могут быть связаны с одной субъединицей капсида или VLP покрывающих белков РНК-фага, предпочтительно через экспонированные остатки лизина VLP РНК-фагов, если это стерически допустимо. Таким образом, особым признаком VLP покрывающих белков РНК-фагов и, в частности, VLP покрывающего белка Qβ является возможность связывать несколько антигенов на субъединицу. Это обеспечивает возможность образования плотной антигенной матрицы.
В предпочтительном варианте изобретения связывание и, соответственно присоединение, по меньшей мере, белка или пептида IL-5, IL-13 или эотаксина с центральной частицей и, соответственно, вирусоподобной частицей осуществляют посредством взаимодействия и, соответственно, ассоциации между по меньшей мере одним первым сайтом связывания вирусоподобной частицы и по меньшей мере одним вторым сайтом связывания антигена или антигенной детерминанты.
VLP или капсиды из покрывающего белка Qβ экспонируют определенное количество остатков лизина на своей поверхности с определенной топологией, при этом три остатка лизина направлены внутрь капсида и взаимодействуют с РНК, а четыре других остатка лизина экспонированы на наружную сторону капсида. Указанные определенные свойства предпочтительны для связывания антигенов с наружной стороной частицы, а не с внутренней стороны частицы, где остатки лизина взаимодействуют с РНК. VLP из других покрывающих белков РНК-фагов также имеют определенное количество остатков лизина на своей поверхности и определенную топологию указанных остатков лизина.
В следующих предпочтительных вариантах данного изобретения первый сайт связывания является остатком лизина и/или второй сайт связывания содержит сульфгидрильную группу или остаток цистеина. В очень предпочтительном варианте данного изобретения первый сайт связывания является остатком лизина, а второй сайт связывания является остатком цистеина.
В очень предпочтительных вариантах изобретения белок или пептид IL-5, IL-13 или эотаксина связан через остаток цистеина, либо природно присутствующий на белке или пептиде IL-5, IL-13 или эотаксина, либо сконструированный, с остатками лизина VLP покрывающего белка РНК-фага и, в частности, VLP покрывающего белка Qβ.
Другим преимуществом VLP, полученных из РНК-фагов, является высокий выход их экспрессии в бактериях, который позволяет получать большие количества материала при допустимой стоимости.
Как указано, конъюгаты и матрицы, соответственно, согласно изобретению отличаются от конъюгатов предшествующего уровня техники своей высокоорганизованной структурой, размерами и повторяемостью антигена на поверхности матрицы. Кроме того, применение VLP в качестве носителей позволяет образовывать прочные антигенные матрицы и конъюгаты, соответственно, с изменяемой плотностью антигенов. В частности, применение VLP РНК-фагов и, таким образом, в частности, применение VLP покрывающего белка РНК-фага Qβ позволяет достигать очень высокой плотности эпитопа. Получение композиций VLP покрывающих белков РНК-фагов с высокой плотностью эпитопов можно осуществлять с использованием инструкций, приведенных в данной заявке.
На антигене или антигенной детерминанте может присутствовать либо природный, либо неприродный второй сайт связывания, который определен в данном описании. В случае отсутствия подходящего второго сайта связывания природного происхождения на антигене или антигенной детерминанте необходимо сконструировать неприродный второй сайт связывания на антигене.
Как описано выше, четыре остатка лизина экспонированы на поверхности VLP покрывающего белка Qβ. Обычно такие остатки дериватизируют в ходе реакции с перекрестно сшивающей молекулой. В том случае, когда не все экспонированные остатки лизина могут быть связаны с антигеном, остатки лизина, которые прореагировали с перекрестно сшивающим агентом, остаются с перекрестно сшивающей молекулой, связанной с ε-аминогруппой после стадии дериватизации. Это приводит к исчезновению одного или нескольких положительных зарядов, которое может быть нежелательным для растворимости и стабильности VLP. Заменяя некоторые остатки лизина аргининами, как в заявленных мутантах покрывающего белка Qβ, описанных ниже, авторы предотвратили чрезмерное исчезновение положительных зарядов, так как остатки аргинина не взаимодействуют с перекрестно сшивающим агентом. Кроме того, замена остатков лизина аргининами может приводить к более определенной антигенной матрице, так как меньше сайтов доступно для реакции с антигеном.
Таким образом, экспонированные остатки лизина заменяли аргининами в следующих мутантах покрывающего белка Qβ и мутантных VLP Qβ, описанных в данной заявке: Qβ-240 (Lys13-Arg; SEQ ID NO:23), Qβ-250 (Lys 2-Arg, Lys13-Arg; SEQ ID NO:25) и Qβ-259 (Lys 2-Arg, Lys16-Arg; SEQ ID NO:27). Конструкции клонировали, белки экспрессировали, VLP очищали и использовали для связывания с пептидными и белковыми антигенами. Также конструировали Qβ-251 (SEQ ID NO:26), и руководство по поводу того, как экспрессировать, очищать и связывать VLP покрывающего белка Qβ-251 можно найти на протяжении данной заявки.
В следующем варианте авторы предложили мутантный покрывающий белок Qβ с одним дополнительным остатком лизина, подходящий для получения матрицы антигенов с еще более высокой плотностью. Данный мутантный покрывающий белок Qβ, Qβ-243 (Asn 10-Lys; SEQ ID NO:24) клонировали, белок экспрессировали и капсид или VLP выделяли и очищали, показав, что введение дополнительного остатка лизина совместимо с самосборкой субъединиц в капсид или VLP. Таким образом, матрицы и, соответственно, конъюгаты белка или пептида IL-5, IL-13 или эотаксина можно получить с использованием VLP мутантов покрывающего белка Qβ. Особенно предпочтительным способом связывания антигенов с VLP и, в частности, с VLP покрывающих белков РНК-фага является связывание остатка лизина, присутствующего на поверхности VLP покрывающих белков РНК-фага, с остатком цистеина, природно присутствующим или сконструированным на антигене, т.е. белке или пептиде IL-5, IL-13 или эотаксина. Для того чтобы остаток цистеина был эффективным в качестве второго сайта связывания, сульфгидрильная группа должна быть доступной для связывания. Таким образом, остаток цистеина должен быть в своем восстановленном состоянии, то есть должен быть доступным свободный цистеин или остаток цистеина со свободной сульфгидрильной группой. В том случае, когда остаток цистеина для функционирования в качестве второго сайта связывания находится в окисленной форме, например, если он образует дисульфидный мостик, требуется восстановление указанного дисульфидного мостика, например, с помощью DTT, TCEP или β-меркаптоэтанола. Концентрация восстановителя и молярный избыток восстановителя по сравнению с антигеном должен уточняться для каждого антигена. При необходимости тестируют пределы титрования, начиная с таких низких концентраций восстановителя, как 10 мкМ или ниже, до 10-20 мМ или выше и оценивают связывание антигена с носителем. Несмотря на то, что низкие концентрации восстановителя совместимы с реакцией связывания, как описано в находящейся на рассмотрении заявке на выдачу патента США No. 10/050902, поданной настоящим правопреемником 18 января 2002, более высокие концентрации ингибируют реакцию связывания, как будет понятно специалисту в данной области, и в этом случае восстановитель необходимо удалить диализом или гель-фильтрацией. Преимущественно pH буфера для диализа или уравновешивающего буфера ниже 7, предпочтительно 6. Совместимость буфера с низким значением pH с активностью и стабильностью антигена необходимо проверять.
Плотность эпитопа на VLP покрывающих белков РНК-фага можно модулировать, выбирая перекрестно сшивающий агент и другие условия реакции. Например, перекрестно сшивающие агенты сульфо-GMBS и SMPH обычно обеспечивают достижение высокой плотности эпитопа. На дериватизацию положительно влияет высокая концентрация реагирующих веществ, и манипулирование условиями реакции можно использовать для того, чтобы контролировать количество антигенов, связанных с VLP покрывающих белков РНК-фага и, в частности, с VLP покрывающего белка Qβ.
Перед конструированием неприродного второго сайта связывания необходимо выбрать положение, в котором он должен быть слит, встроен или, в общем, сконструирован. Выбор положения второго сайта связывания в качестве примера может быть основан на кристаллической структуре антигена. Такая кристаллическая структура антигена может давать информацию о доступности C- или N-концов молекулы (определенной, например, исходя из их доступности для растворителя) или об экспонировании по отношению к растворителю остатков, подходящих для использования в качестве вторых сайтов связывания, таких как остатки цистеина. Экспонированные дисульфидные мостики, как в случае Fab-фрагментов, также могут быть источником второго сайта связывания, так как их, как правило, можно превратить в отдельные остатки цистеина посредством умеренного восстановления. Будут выбраны умеренные условия восстановления, не влияющие на иммуногенность белка или пептида IL-5, IL-13 или эотаксина. В общем, в том случае, когда целью иммунизации аутоантигеном является ингибирование взаимодействия данного аутоантигена с его природными лигандами, второй сайт связывания будет добавлен таким образом, чтобы он давал возможность образовывать антитела против сайта взаимодействия с природными лигандами. Таким образом, положение второго сайта связывания будет выбрано так, чтобы избежать стерических помех со стороны второго сайта связывания или любого содержащего его аминокислотного линкера. В следующих вариантах требуется гуморальный ответ, направленный на сайт, отличный от сайта взаимодействия аутоантигена с его природным лигандом. В таких вариантах второй сайт связывания может быть выбран так, чтобы он предотвращал образование антител против сайта взаимодействия аутоантигена с его природными лигандами.
Другие критерии для выбора положения второго сайта связывания включают состояние олигомеризации антигена, сайт олигомеризации, присутствие кофактора и наличие экспериментального доказательства обнаружения сайтов в структуре антигена и последовательности, в которой модификация антигена совместима с функцией аутоантигена или с образованием антител, распознающих аутоантиген.
В наиболее предпочтительных вариантах белок или пептид IL-5, IL-13 или эотаксина содержит единственный второй сайт связывания или единственный реакционноспособный сайт связывания, способный к ассоциации с первыми сайтами связывания на центральной частице и VLP или субъединицах VLP, соответственно. Это обеспечивает определенное и равномерное связывание и, соответственно, ассоциацию, по меньшей мере, одного, но обычно нескольких, предпочтительно более 10, 20, 40, 80, 120, антигенов с центральной частицей и VLP, соответственно. Таким образом, обеспечение одного второго сайта связывания или одного реакционноспособного сайта связывания на антигене обеспечивает один тип равномерного связывания и ассоциации, соответственно, приводящий к очень высокоупорядоченной и повторяющейся матрице. Например, если связывание и ассоциацию, соответственно, осуществляют посредством взаимодействия лизина (в качестве первого сайта связывания) и цистеина (в качестве второго сайта связывания), то, согласно данному предпочтительному варианту изобретения, гарантировано, что только один остаток цистеина на антиген, независимо от того, присутствует ли на антигене данный остаток цистеина природного или неприродного происхождения, способен связываться и ассоциировать, соответственно, с VLP и первым сайтом связывания центральной частицы, соответственно.
В некоторых вариантах конструирование второго сайта связывания на антигене требует слияния аминокислотного линкера, содержащего аминокислоту, подходящую в качестве второго сайта связывания согласно описаниям данного изобретения. Таким образом, в предпочтительном варианте данного изобретения аминокислотный линкер связан с антигеном или антигенной детерминантой посредством по меньшей мере одной ковалентной связи. Предпочтительно аминокислотный линкер содержит или, альтернативно, состоит из второго сайта связывания. В следующем предпочтительном варианте аминокислотный линкер содержит сульфгидрильную группу или остаток цистеина. В другом предпочтительном варианте аминокислотным линкером является цистеин. Некоторые критерии выбора аминокислотного линкера, а также дополнительные предпочтительные варианты аминокислотного линкера согласно изобретению уже указаны выше.
В следующем предпочтительном варианте изобретения по меньшей мере один антиген или антигенная детерминанта, т.е. белок или пептид IL-5, IL-13 или эотаксина, слит с центральной частицей и вирусоподобной частицей, соответственно. Как указано выше, VLP обычно состоит по меньшей мере из одной субъединицы, собирающейся в VLP. Таким образом, снова в следующем предпочтительном варианте изобретения антиген или антигенная детерминанта, предпочтительно по меньшей мере один белок или пептид IL-5, IL-13 или эотаксина слит по меньшей мере с одной субъединицей вирусоподобной частицы или белка, который может быть включен в VLP, с образованием химерного слияния VLP-субъединица-белок или пептид IL-5, IL-13 или эотаксина.
Слияние белка или пептида IL-5, IL-13 или эотаксина можно осуществить путем инсерции в последовательность субъединицы VLP или путем слияния либо с N-, либо с C-концом VLP-субъединицы или белка, который может быть включен в VLP. В дальнейшем при упоминании слитых белков пептида с субъединицей VLP подразумевают слияние либо с концами последовательности субъединицы, либо внутреннюю инсерцию пептида в последовательность субъединицы.
Слияние также можно осуществить путем инсерции последовательностей белка или пептида IL-5, IL-13 или эотаксина в вариант субъединицы VLP, где часть последовательности субъединицы была делетирована, полученные продукты далее называют укороченными мутантами. Укороченные мутанты могут иметь N- или C-концевые или внутренние делеции части последовательности субъединицы VLP. Например, конкретный HBcAg VLP, например, с делецией аминокислотных остатков с 79 по 81, является укороченным мутантом с внутренней делецией. Слияние белка или пептида IL-5, IL-13 или эотаксина либо с N-, либо с C-концом укороченных мутантов VLP-субъединиц также приводит к образованию вариантов согласно данному изобретению. Подобным образом, слияние эпитопа с последовательностью субъединицы VLP также можно осуществить путем замены, при которой, например, для конкретного HBcAg VLP аминокислоты 79-81 заменяют чужеродным эпитопом. Таким образом, слияние, которое упоминается в дальнейшем, можно осуществить путем инсерции последовательности белка или пептида IL-5, IL-13 или эотаксина в последовательность субъединицы VLP путем замены части последовательности субъединицы VLP последовательностью белка или пептида IL-5, IL-13 или эотаксина или посредством комбинирования делеции, замены или инсерции.
Химерные конструкции белок или пептид IL-5, IL-13 или эотаксина-субъединица, как правило, будут способны к самосборке в VLP. VLP, экспонирующие эпитопы, слитые с их субъединицами, также называют в данном описании химерными VLP. Как указано, вирусоподобная частица содержит или, альтернативно, состоит по меньшей мере из одной субъединицы VLP. В следующем варианте изобретения вирусоподобная частица содержит или, альтернативно, состоит из смеси химерных субъединиц VLP и нехимерных субъединиц VLP, т.е. субъединиц VLP, не имеющих слитого с ними антигена, образуя в результате так называемые мозаичные частицы. Это может иметь преимущества для обеспечения образования и сборки в VLP. В указанных вариантах доля химерных VLP-субъединиц может составлять 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95% или больше.
Могут быть добавлены фланкирующие аминокислотные остатки к любому концу последовательности пептида или эпитопа, который необходимо слить с любым из концов последовательности субъединицы VLP, или для внутренней инсерции такой пептидной последовательности в последовательность субъединицы VLP. Остатки глицина и серина являются особенно предпочтительными аминокислотами для использования во фланкирующих последовательностях, добавляемых к белку или пептиду IL-5, IL-13 или эотаксина, который необходимо слить. Остатки глицина придают дополнительную гибкость, которая может снижать возможное дестабилизирующее действие слияния чужеродной последовательности в последовательность субъединицы VLP.
В конкретном варианте изобретения VLP является VLP корового антигена гепатита B. Описаны слитые белки либо с N-концом HBcAg (Neyrinck, S. et al., Nature Med. 5: 1157-1163 (1999)), либо инсерции в так называемую основную иммунодоминантную область (MIR) (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001)), WO 01/98333), и указанные слияния являются предпочтительными вариантами изобретения. Также описаны варианты HBcAg природного происхождения с делециями в MIR (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001), публикация специально включена в виде ссылки в полном объеме), и слияния с N- или C-концом, а также инсерции в положение MIR, соответствующее сайту делеции по сравнению с HBcAg дикого типа, являются следующими вариантами изобретения. Также описаны слияния с C-концом (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001)). Специалист в данной области легко найдет руководство по поводу того, как конструировать слитые белки, используя классические способы молекулярной биологии (Sambrook, J. et al., eds., Molecular Cloning, A Laboratory Manual, 2nd. edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989), Ho et al., Gene 77:51 (1989)). Описаны векторы и плазмиды, кодирующие HBcAg и слитые белки HBcAg и применимые для экспрессии HBcAg и слитых белков HBcAg (Pumpens, P. and Grens, E. Intervirology 44: 98-114 (2001), Neyrinck, S. et al., Nature Med. 5: 1157-1163 (1999)), которые можно использовать в практике изобретения. Авторы также описали в виде примера (пример 6) инсерцию эпитопа в MIR HBcAg с получением в результате химерного подвергаемого самосборке HBcAg. Важным фактором для оптимизации эффективности самосборки и экспонирования эпитопа, встраиваемого в MIR HBcAg, является выбор места инсерции, а также количество аминокислот, которые необходимо делетировать из последовательности HBcAg в MIR (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001); EP 421635; патент США 6231864) при инсерции, или другими словами, какие аминокислоты из HBcAg необходимо заменить новым эпитопом. Например, описана замена аминокислот HBcAg 76-80, 79-81, 79-80, 75-85 или 80-81 чужеродными эпитопами (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001); EP 0421635; патент США 6231864). HBcAg содержит длинный аргининовый хвост (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001)), который не имеет существенного значения для сборки капсида и способен к связыванию нуклеиновых кислот (Pumpens, P. and Grens, E., Intervirology 44: 98-114 (2001)). HBcAg, либо содержащие аргининовый хвост, либо не имеющие такового, являются вариантами изобретения.
В следующем предпочтительном варианте изобретения VLP является VLP РНК-фага. Основные покрывающие белки РНК-фагов спонтанно собираются в VLP при экспрессии в бактериях и, в частности, в E. coli. Конкретные примеры покрывающих белков бактериофагов, которые можно использовать для получения композиций согласно изобретению, включают в себя покрывающие белки таких РНК-бактериофагов как бактериофаг Qβ (SEQ ID NO:10; база данных PIR, инвентарный No. VCBPQβ, относящаяся к CP Qβ, и SEQ ID NO:11; инвентарный No. AAA16663, относящаяся к белку A1 Qβ) и бактериофаг fr (SEQ ID NO:4; PIR, инвентарный No. VCBPFR).
В более предпочтительном варианте по меньшей мере один белок или пептид IL-5, IL-13 или эотаксина сливают с покрывающим белком Qβ. Описаны конструкции слитых белков, в которых эпитопы были слиты с C-концом укороченной формы белка A1 Qβ или встроены в белок A1 (Kozlovska, T. M. et al., Intervirology, 39: 9-15 (1996)). Белок A1 образуется при супрессии в стоп-кодоне UGA и имеет длину 329 а/к или 328 а/к, если принять во внимание отщепление N-концевого метионина. Отщепление N-концевого метионина перед аланином (вторая аминокислота, кодируемая геном CP Qβ) обычно имеет место в E. coli, и так обстоит дело для N-концов покрывающих белков CP Qβ. Часть гена A1 с 3'-стороны от амбер-кодона UGA кодирует удлинение CP, которое имеет длину 195 аминокислот. Инсерция по меньшей мере одного белка или пептида IL-5, IL-13 или эотаксина между положениями 72 и 73 удлинения CP приводит к образованию следующих вариантов согласно изобретению (Kozlovska, T. M. et al., Intervirology 39: 9-15 (1996)). Слияние белка или пептида IL-5, IL-13 или эотаксина с C-концом укороченного на C-конце белка A1 Qβ приводит к образованию следующих предпочтительных вариантов согласно изобретению. Например, Kozlovska et al. (Intervirology, 39: 9-15 (1996)) описали слияния белка A1 Qβ, в которых эпитоп слит с C-концом удлинения CP Qβ, укороченным в положении 19.
Как описано Kozlovska et al. (Intervirology, 39: 9-15 (1996)), сборка частиц, экспонирующих слитые эпитопы, обычно требует присутствия как слияния белок A1-белок или пептид IL-5, IL-13 или эотаксина, так и CP дикого типа, чтобы образовать мозаичную частицу. Однако варианты, содержащие вирусоподобные частицы, и, таким образом, в частности, VLP покрывающего белка РНК-фага Qβ, которые состоят исключительно из субъединиц VLP, имеющих по меньшей мере один слитый с ними белок или пептид IL-5, IL-13 или эотаксина, также входят в объем данного изобретения.
Получение мозаичных частиц можно осуществить рядом способов. Kozlovska et al., Intervirolog., 39: 9-15 (1996) описывают два способа, которые оба можно использовать в практике изобретения. В первом способе эффективное экспонирование слитого эпитопа на VLP опосредовано экспрессией плазмиды, кодирующей слияние белка A1 Qβ, имеющего стоп-кодон UGA между CP и удлинением CP, в штамме E. coli, несущем плазмиду, кодирующую клонированную тРНК-супрессор UGA, который приводит к трансляции кодона UGA в Trp (плазмида pISM3001 (Smiley B.K. et al., Gene 134: 33-40 (1993))). В другом способе стоп-кодон гена CP модифицируют в UAA и проводят котрансфекцию со второй плазмидой, экспрессирующей слияние белка A1 с белком или пептидом IL-5, IL-13 или эотаксина. Вторая плазмида кодирует резистентность к различным антибиотикам, и начало репликации совместимо с первой плазмидой (Kozlovska, T. M. et al., Intervirology 39: 9-15 (1996)). В третьем способе CP и слияние белка A1 с белком или пептидом IL-5, IL-13 или эотаксина кодируются бицистронным образом при оперативном связывании с таким промотором, как промотор Trp, как описано на фиг.1 в Kozlovska et al., Intervirology, 39: 9-15 (1996).
В следующем варианте белок или пептид IL-5, IL-13 или эотаксина встраивают между аминокислотами 2 и 3 (нумерация CP после расщепления, то есть в том случае, когда N-концевой метионин отщеплен) CP fr, таким образом получая белковое слияние белок или пептид IL-5, IL-13 или эотаксина-CP fr. Описаны векторы и экспрессирующие системы для конструирования и экспрессии слитых белков CP fr, самособирающихся в VLP и применимых в практике изобретения (Pushko P. et al., Prot. Eng. 6:883-891 (1993)). В конкретном варианте последовательность белка или пептида IL-5, IL-13 или эотаксина встраивают в делеционный вариант CP fr после аминокислоты 2, когда остатки 3 и 4 CP fr удалены (Pushko P. et al., Prot. Eng. 6:883-891 (1993)).
Слияние эпитопов с N-концевой выступающей β-шпилькой покрывающего белка РНК-фага MS-2 и последующая презентация слитого эпитопа на образованной при самосборке VLP РНК-фага MS-2 также описаны (WO 92/13081), и слияние белка или пептида IL-5, IL-13 или эотаксина путем инсерции или замены в покрывающем белке РНК-фага MS-2 также попадает в объем изобретения.
В другом варианте изобретения белок или пептид IL-5, IL-13 или эотаксина сливают с белком капсида вируса папилломы. В более конкретном варианте белок или пептид IL-5, IL-13 или эотаксина сливают с основным белком капсида L1 вируса папилломы крупного рогатого скота типа 1 (BPV-1). Описаны векторы и экспрессирующие системы для конструирования и экспрессии слитых белков BPV-1 в системах бакуловирус/клетки насекомых (Chackerian, B. et al., Proc. Natl. Acad. Sci. USA 96: 2373-2378 (1999), WO 00/23955). Замена аминокислот 130-136 L1 BPV-1 белком или пептидом IL-5, IL-13 или эотаксина приводит к слитому белку L1 BPV-1-белок или пептид IL-5, IL-13 или эотаксина, который является предпочтительным вариантом изобретения. Описано клонирование в бакуловирусном векторе и экспрессия в инфицированных бакуловирусом клетках Sf9, которые могут быть использованы в практике изобретения (Chackerian, B. et al., Proc. Natl. Acad. Sci. USA 96: 2373-2378 (1999), WO 00/23955). Очистку собранных частиц, экспонирующих слитый белок или пептид IL-5, IL-13 или эотаксина, можно осуществить рядом способов, таких, например, как гель-фильтрация или ультрацентрифугирование в градиенте сахарозы (Chackerian, B. et al., Proc. Natl. Acad. Sci. USA 96: 2373-2378 (1999), WO 00/23955).
В следующем варианте изобретения белок или пептид IL-5, IL-13 или эотаксина сливают с белком Ty, способным включаться в VLP Ty. В более конкретном варианте белок или пептид IL-5, IL-13 или эотаксина сливают с p1 или белком капсида, кодируемым геном TYA gene (Roth, J.F., Yeast 16: 785-795 (2000)). Дрожжевые ретротранспозоны Ty1, 2, 3 и 4 выделены из Saccharomyces cerevisiae, тогда как ретротранспозон Tf1 выделен из Schizosaccharomyces pombae (Boeke, J.D. and Sandmeyer, S.B., «Yeast Transposable elements» in The molecular and Cellular Biology of the Yeast Saccharomyces: Genome dynamics, Protein Synthesis, and Energetics., p. 193, Cold Spring Harbor Laboratory Press (1991)). Ретротранспозоны Ty1 и 2 родственны классу copia элементов растений и животных, тогда как Ty3 относится к семейству ретротранспозонов gypsy, которые родственны ретровирусам растений и животных. В ретротранспозоне Ty1 белок p1, также называемый Gag или капсидным белком, имеет длину 440 аминокислот. P1 расщепляется во время созревания VLP в положении 408, давая белок p2, важный компонент VLP.
Описаны слитые с p1 белки и векторы для экспрессии указанных слитых белков в дрожжах (Adams, S.E. et al., Nature 329: 68-70 (1987)). Таким образом, например, белок или пептид IL-5, IL-13 или эотаксина может быть слит с p1 путем инсерции последовательности, кодирующей белок или пептид IL-5, IL-13 или эотаксина, в сайт BamH1 плазмиды pMA5620 (Adams, S.E. et al., Nature 329: 68-70 (1987)). Клонирование последовательностей, кодирующих чужеродные эпитопы, в векторе pMA5620 приводит к экспрессии слитых белков, содержащих аминокислоты 1-381 p1 Ty1-15, слитые C-терминально с N-концом чужеродного эпитопа. Подобным образом подразумевается, что N-концевое слияние белка или пептида IL-5, IL-13 или эотаксина или внутренняя инсерция в последовательность p1 или замена части последовательности p1 также входит в объем изобретения. В частности, инсерция белка или пептида IL-5, IL-13 или эотаксина в последовательность Ty между аминокислотами 30-31, 67-68, 113-114 и 132-133 p1-белка Ty (EP0677111) дает предпочтительные варианты согласно изобретению.
Следующими VLP, подходящими для слияния белка или пептида IL-5, IL-13 или эотаксина, являются, например, частицы, подобные ретровирусам (WO 9630523), Gag HIV2 (Kang, Y.C. et al, Biol. Chem. 380: 353-364 (1999)), вирус мозаики вигны (Taylor, K.M. et al., Biol. Chem. 380: 387-392 (1999)), VLP парвовируса VP2 (Rueda, P. et al., Virology 263: 89-99 (1999)), HBsAg (патент США 4722840, EP0020416B1).
Примерами химерных VLP, подходящими для практики изобретения, также являются VLP, описанные в Intervirology 39: 1 (1996). Следующими примерами VLP, предполагаемыми для применения в изобретении, являются HPV-1, HPV-6, HPV-11, HPV-16, HPV-18, HPV-33, HPV-45, CRPV, COPV, GAG HIV, вирус табачной мозаики. Также получены вирусоподобные частицы SV-40, вируса полиомы, аденовируса, вируса простого герпеса, ротавируса и вируса Норуолк, и химерные VLP на основе указанных VLP также входят в объем данного изобретения.
В следующем предпочтительном варианте данного изобретения антигеном или антигенной детерминантой является белок или пептид IL-5, IL-13 или эотаксина.
В следующем предпочтительном варианте изобретения антигеном или антигенной детерминантой является вариант белка или пептида IL-5, IL-13 или эотаксина, например, в частности, содержащий аминокислотные замены или инсерции пептидов или полиморфизмы. Как уже указано, композиции и, соответственно, композиции вакцин, содержащие варианты белка или пептида IL-5, IL-13 или эотаксина, включены в объем данного изобретения.
Белок или пептид IL-5, IL-13 или эотаксина можно получить путем экспрессии кДНК IL-5, IL-13 или эотаксина в прокариотических или эукариотических системах экспрессии. Различные их примеры описаны в литературе и могут быть использованы, возможно после модификаций, чтобы экспрессировать любой белок или пептид IL-5, IL-13 или эотаксина любого требуемого вида. Описание того, как получить белок или пептид IL-5, также дано в WO 900/65058 и в приведенных в указанной работе ссылках.
В следующем предпочтительном варианте изобретения антигеном или антигенной детерминантой является пептид IL-5, IL-13 или эотаксина. Такие пептиды IL-5, IL-13 или эотаксина или их фрагменты можно получить с использованием стандартных методов молекулярной биологии, при которых нуклеотидную последовательность, кодирующую представляющий интерес фрагмент, амплифицируют с помощью ПЦР и клонируют в виде слияния с полипептидной меткой, такой как GST-метка, MBP-метка, гистидиновая метка, Flag-метка, myc-метка или константная область антитела (Fc-область). При введении сайта расщепления протеазой между фрагментом IL-5, IL-13 или эотаксина и меткой пептид IL-5, IL-13 или эотаксина можно отделить от метки после очистки, расщепляя соответствующей протеазой. В другом способе белок или пептид IL-5, IL-13 или эотаксина можно синтезировать in vitro, используя стандартные реакции пептидного синтеза, известные специалисту в данной области. В следующем способе пептиды IL-5, IL-13 или эотаксина можно получить путем расщепления протеазой или химического расщепления полноразмерного белка IL-5, IL-13 или эотаксина, оба способа хорошо известны специалистам в данной области.
В еще одном предпочтительном варианте данного изобретения антиген или антигенная детерминанта, кроме того, содержит по меньшей мере один второй сайт связывания, выбранный из группы, состоящей из (i) сайта связывания неприродного происхождения с указанным антигеном или антигенной детерминантой и (ii) сайта связывания природного происхождения с указанным антигеном или антигенной детерминантой. Руководство по поводу того, как модифицировать белок или пептид IL-5, IL-13 или эотаксина для связывания с вирусоподобной частицей дано на протяжении данной заявки. Предпочтительные вторые сайты связывания содержат остаток цистеина для связывания с дериватизованной VLP, и примеры приведены в описании выше и в примерах 12 и 13.
Авторы провели анализ модели 3-мерной структуры IL-5, чтобы определить доступность выбранного второго сайта связывания (NH2-конца) для обеспечения связывания с первым сайтом связывания на VLP согласно данному изобретению. N-Конец является предпочтительным для связывания второго сайта связывания, содержащего аминокислотный линкер с дополнительным остатком цистеина. Однако аминокислотный линкер, содержащий остаток цистеина в качестве второго сайта связывания и слитый с C-концом конструкции IL-5, приводит к образованию следующего предпочтительного варианта согласно изобретению. Конструкция IL-5 человека с N-концевым аминокислотным линкером, содержащим слитый с остатком цистеина L, является очень предпочтительным вариантом изобретения.
Сходные способы специалист в данной области может использовать для моделирования доступности сайтов связывания на IL-13 и эотаксине, чтобы оптимизировать связывание первого сайта связывания VLP.
Описаны конструкции мышиного белка или пептида IL-5, IL-13 или эотаксина, но также могут быть созданы конструкции фрагментов белка или пептида IL-5, IL-13 или эотаксина человека. Следующие предпочтительные конструкции содержат полный белок IL-5, IL-13 или эотаксина человека, пептид IL-5, IL-13 или эотаксина человека. Иммунизация против белка или пептида IL-5, IL-13 или эотаксина с использованием композиций согласно изобретению, предпочтительно содержащих белок или пептид IL-5, IL-13 или эотаксина, связанный с VLP, может обеспечить способ лечения или профилактики аллергических заболеваний с эозинофильным компонентом.
В следующем предпочтительном варианте данного изобретения белок или пептид IL-5, IL-13 или эотаксина содержит, по меньшей мере, один антигенный сайт белка IL-5, IL-13 или эотаксина. Специалисту в данной области известно, как идентифицировать соответствующие пептиды и аминокислотные последовательности, соответственно.
В следующий предпочтительный вариант данного изобретения включены прерывистые или непрерывные пептиды IL-5, IL-13 или эотаксина, такие как пептиды, определяемые нейтрализующими моноклональными антителами (Dickason, R. R. et al J. Immunol. 156 (3): 1030-7 1996).
В следующий предпочтительный вариант данного изобретения включены прерывистые или непрерывные пептиды IL-5, IL-13 или эотаксина, предположительно вовлеченные во взаимодействие с рецептором и являющиеся ключевыми для взаимодействия с рецептором, такие как пептиды из COO-конца IL-5.
Следующие пептиды IL-5, IL-13 или эотаксина, подходящие для применения в данном изобретении, можно определить экспериментально по свойственной им особенности индуцировать T-клеточный или гуморальный ответ. В основном это осуществляется иммунизацией экспериментального животного отдельно выбранными пептидами в иммунологически подходящей композиции и измерением T-клеточного и B-клеточного, т.е. гуморального ответа, с использованием способов, известных специалисту в данной области. В том случае, когда антиген является белком или пептидом, указанная область может быть образована непрерывной аминокислотной последовательностью. Альтернативно эпитоп антитела может быть образован прерывистой аминокислотной последовательностью, в которой после трехмерной укладки белка, полипептида или пептида аминокислоты располагаются таким образом, что они пространственно становятся ближе друг к другу и образуют эпитоп. Представляющие интерес непрерывные пептидные фрагменты можно идентифицировать с помощью экспериментов по иммунизации, которые описаны выше.
Следующие предпочтительные пептиды IL-5, IL-13 или эотаксина, подходящие для применения в данном изобретении, можно идентифицировать с использованием существующих или будущих моноклональных или поликлональных антител, способы для осуществления этого известны специалистам в данной области.
Следующие пептиды IL-5, IL-13 или эотаксина, подходящие для применения в данном изобретении, можно идентифицировать посредством скрининга пептидных библиотек в фаговом дисплее с помощью антител, специфичных по отношению к белку или пептиду IL-5, IL-13 или эотаксина, способом, хорошо известным специалисту в данной области.
В следующем предпочтительном варианте изобретения антигеном или антигенной детерминантой является изолированный белок IL-5, IL-13 или эотаксина любого животного, а также любые антигенные пептиды IL-5, IL-13 или эотаксина любого животного. Специалистам в данной области известно, как получить пептиды из указанных выделенных белков или пептидов IL-5, IL-13 или эотаксина.
В другом предпочтительном варианте изобретения антигенной детерминантой является интерлейкин-13 (IL-13). IL-13 является цитокином, который секретируется активированными T-лимфоцитами и, главным образом, влияет на моноциты, макрофаги и B-клетки. Аминокислотная последовательность предшественника IL-13 человека показана в SEQ ID NO:230, а аминокислотная последовательность процессированного IL-13 человека показана в SEQ ID NO:231. Первые 20 аминокислот белка-предшественника соответствуют сигнальному пептиду и отсутствуют в процессированном белке. Описана мышиная последовательность, и процессированная аминокислотная последовательность показана в SEQ ID NO:232 (Brown K. D. et al., J. Immunol. 142: 679-687 (1989)). В зависимости от хозяина экспрессии конструкция IL-13 будет содержать последовательность белка-предшественника, например, для экспрессии и секреции в эукариотических хозяевах, или состоять из зрелого белка, например, для цитоплазматической экспрессии в E. coli. Для экспрессии в периплазме E. coli сигнальный пептид IL-13 заменяют бактериальным сигнальным пептидом.
IL-13 является цитокином, производимым T-хелперами 2 (подобно IL-4, IL-5), для которого недавно показано участие в аллергических ответах дыхательных путей (астма). Повышающая регуляция IL-13 и рецептора IL-13 обнаружена во многих типах опухолей (например, лимфома Ходжкина). Интерлейкин 13 секретируется и стимулирует рост клеток Ходжкина и Рида-Штернберга (Kapp U et al., J. Exp. Med. 189: 1939-46 (1999)). Таким образом, иммунизация против IL-13 дает способ лечения, наряду с прочим, состояний, описанных выше, таких как астма или лимфома Ходжкина.
Предпочтительно композиция содержит аминокислотный линкер, содержащий свободный остаток цистеина и слитый с N- или C-концом последовательности зрелого IL-13, для того, чтобы ввести в белок второй сайт связывания. В следующих предпочтительных вариантах аминокислотный линкер, содержащий свободный цистеин, добавляют к N-концу зрелой формы IL-13, так как он свободно доступен согласно ЯМР-структуре IL-13 (Eisenmesser, E. Z. et al., J. Mol. Biol. 310: 231 (2001)). В следующих также предпочтительных вариантах аминокислотный линкер, содержащий свободный цистеин, сливают с N-концом последовательности, соответствующей последовательности процессированного белка, или встраивают в N-конец последовательности зрелой формы белка, C-терминально по отношению к сигнальному пептиду. В следующих предпочтительных вариантах аминокислотный линкер, содержащий свободный остаток цистеина, добавляют к C-концу белка.
IL-13 можно экспрессировать в E. coli (Eisenmesser E. Z. et al., Protein Expr. Purif 20: 186-95 (2000)) или в клетках NS-0 (эукариотическая линия клеток) (Cannon-Carlson S. et al., Protein Expr. Purif. 12: 239-48 (1998)). В примере 8 показано клонирование и экспрессия конструкций и очистка мышиного IL-13, слитого с аминокислотным линкером, содержащим остаток цистеина, в бактериях. В примере также описано получение и тестирование вакцины эотаксин-VLP. Конструкции IL-13 можно создать согласно инструкциям примера 8 и собирая белки C-IL-13-F человека (SEQ ID NO:330) и C-IL-13-S человека (SEQ ID NO:331) после экспрессии слитых белков и расщепления фактором Xa и энтерокиназой, соответственно. Образованные таким образом белки можно связать с VLP и фимбриями, получая предпочтительные варианты согласно изобретению.
В еще одном варианте изобретения антигенной детерминантой является интерлейкин-5 (IL-5). IL-5 является специфичным цитокином для линии образования эозинофилов и играет важную роль в заболеваниях, связанных с повышенным количеством эозинофилов, таких как астма. Последовательность предшественника и процессированного IL-5 человека приведена в SEQ ID NO:233 и в SEQ ID NO:234, соответственно, и процессированная аминокислотная последовательность мыши показана в SEQ ID NO:235.
Биологическая функция IL-5 показана в нескольких исследованиях (Coffman R. L. et al., Science 245: 308-10 (1989); Kopf et al., Immunity 4: 15-24 (1996)), в которых обращается внимание на полезное влияние ингибирования функции IL-5 при заболеваниях, опосредованных эозинофилами. Ингибирование действия IL-5 обеспечивает путь лечения астмы и других заболеваний, связанных с эозинофилами.
IL-5 образует димер, ковалентно связанный дисульфидным мостиком. Сообщалось об одноцепочечной (sc) конструкции, в которой два мономера IL-5 связаны пептидным линкером.
В предпочтительных вариантах изобретения пептидный линкер, содержащий свободный цистеин, добавляют в N-концу последовательности процессированной формы IL-5. Также предусмотрено предпочтительное добавление линкера, содержащего свободный цистеин, к N-концу последовательности процессированной формы scIL-5. В следующих предпочтительных вариантах аминокислотный линкер, содержащий свободный цистеин, сливают с N-концом последовательности, соответствующей последовательности процессированного белка, или встраивают в N-конец последовательности зрелой формы белка, C-терминально по отношению к сигнальному пептиду.
В следующих предпочтительных вариантах линкер, содержащий свободный цистеин, сливают с C-концом последовательности IL-5 или с C-концом последовательности scIL-5.
Описан ряд систем экспрессии для IL-5, и их можно использовать для получения композиций согласно изобретению. Бактериальная система экспрессии с использованием E. coli описана Proudfoot et al. (Biochem J. 270: 357-61 (1990)). В том случае, когда IL-5 экспрессируется в цитоплазме E. coli, конструкция IL-5 не имеет сигнального пептида. Клетки насекомых также можно использовать для получения конструкций IL-5 для создания композиций согласно изобретению (Pierrot C. et al., Biochem. Biophys. Res. Commun. 253: 756-60 (1998)). Подобным образом также можно использовать бакуловирусные системы экспрессии (клетки sf9; Ingley E. et al., Eur. J. Biochem. 196: 623-9 (1991), и Brown P. M. et al., Protein Expr. Purif. 6: 63-71 (1995)). Наконец, сообщалось о системах экспрессии млекопитающих (клетки CHO), и их можно использовать для получения композиций согласно изобретению (Kodama S et al., J. Biochem. (Tokyo) 110: 693-701 (1991)).
Бакуловирусные системы экспрессии (Mitchell et al., Biochem. Soc. Trans. 21: 332S (1993); Kunimoto DY et al. Cytokine 3: 224-30 (1991)) и системы экспрессии в клетках млекопитающих с использованием клеток CHO (Kodama S. et al., Glycobiology 2: 419-27 (1992)) также описаны для мышиного IL-5.
В примерах 7 и 10 описана экспрессия, очистка, связывание с VLP, иммунизация и тестирование в мышиной модели экспериментальной астмы конструкции IL-5 мыши, в которой последовательность IL-5 мыши слита своим N-концом с аминокислотными линкерами, содержащими остаток цистеина для связывания с VLP и фимбриями. Конструкции человека можно создать согласно инструкциям примеров 7 и 10 и собрать белки C-IL-5-E человека (SEQ ID NO:335), C-IL-5-F человека (SEQ ID NO:336) и C-IL-5-S человека (SEQ ID NO:337), подходящие для связывания с VLP и фимбриями и приводящие к получению предпочтительных вариантов изобретения.
В другом конкретном варианте антигенной детерминантой является эотаксин. Эотаксин представляет собой хемокин, специфичный для рецептора хемокина 3, присутствующего на эозинофилах, базофилах и клетках Th2. Однако, по-видимому, эотаксин высоко специфичен по отношению к эозинофилам (Zimmerman et al., J. Immunol. 165: 5839-46 (2000)). Миграция эозинофилов снижается на 70% у мышей, нокаутированных по эотаксину-1, у которых, однако, еще развивается эозинофилия (Rothenberg et al., J. Exp. Med. 185: 785-90 (1997)). По-видимому, IL-5 ответственен за миграцию эозинофилов из костного мозга в кровь, а эотаксин - за локальную миграцию в ткани (Humbles et al., J. Exp. Med. 186: 601-12 (1997).
Таким образом, в предпочтительном варианте композиция согласно изобретению содержит аминокислотный линкер, содержащий остаток цистеина в качестве второго сайта связывания и предпочтительно слитый с C-концом последовательности эотаксина. В других предпочтительных вариантах аминокислотный линкер, содержащий свободный цистеин, сливают с N-концом последовательности, соответствующей последовательности процессированного белка, или встраивают в N-конец последовательности зрелой формы белка C-терминально по отношению к сигнальному пептиду. Гены, кодирующие указанные конкретные конструкции, клонируют в подходящем экспрессирующем векторе.
В примере 9 и 11 описано клонирование и экспрессия конструкции эотаксина мыши, в которой последовательность эотаксина слита своим C-концом с аминокислотными линкерами, содержащими остаток цистеина для связывания с VLP или фимбриями. Конструкции человека можно создать согласно инструкциям примера 9 и собрать белки, подходящие для связывания с VLP и фимбриями и приводящие к созданию предпочтительных вариантов согласно изобретению. Эотаксин можно синтезировать химическим способом (Clark-Lewis et al., Biochemistry 30: 3128-3135 (1991)). Также описана экспрессия эотаксина-1 в цитоплазме E. coli (Crump et al., J. Biol. Chem. 273: 22471-9 (1998)). Описана экспрессия эотаксина-2 в E. coli в виде телец включения с последующим рефолдингом (Mayer et al., Biochemistry 39: 8382-95 (2000)) и экспрессия в клетках насекомых (Forssmann et al., J. Exp. Med. 185: 2171-6 (1997)), и это, кроме того, можно использовать для получения конкретных вариантов изобретения.
Специалисту в областях, имеющих отношение к данной проблеме, будет понятно, что легко предположить другие подходящие модификации и адаптации способов и применений, описанных в данной заявке, и их можно осуществить, не выходя за пределы объема изобретения и его любого варианта. Теперь, после подробного описания данного изобретения, то же самое будет более четко понятным при обращении к следующим примерам, которые, таким образом, включены только в целях иллюстрации и не предназначены для ограничения изобретения.
ПРИМЕРЫ
ПРИМЕР 1
Конструирование и экспрессия мутантных покрывающих белков Qβ и очистка VLP или капсидов из мутантных покрывающих белков Qβ
Конструирование плазмиды и клонирование мутантных покрывающих белков
Конструирование pQβ-240:
Плазмиду pQβ10 (Kozlovska, T.M., et al., Gene 137: 133-137) использовали в качестве исходной плазмиды для конструирования pQβ-240. Мутацию Lys13→Arg создавали обратной ПЦР. Обратные праймеры конструировали в обратных направлениях «хвост к хвосту»:

и

Продукты первой ПЦР использовали в качестве матриц для второй реакции ПЦР, в которой использовали верхний праймер

и нижний праймер

Продукт второй ПЦР расщепляли XbaI и Mph1103I и клонировали в экспрессирующем векторе pQβ10, который расщепляли такими же ферментами рестрикции. Реакции ПЦР осуществляли с использованием реагентов из набора для ПЦР и согласно протоколу производителя (MBI Fermentas, Vilnius, Lithuania).
Секвенирование с использованием способа прямого включения метки подтвердило требуемые мутации. Клетки E. coli, несущие pQβ-240, поддерживали эффективный синтез белка 14 кД, мигрирующего в SDS-ПААГ совместно с контрольным покрывающим белком Qβ, выделенным из частиц фага Qβ.
Полученная в результате аминокислотная последовательность: (SEQ ID NO:23)

Конструирование pQβ-243:
Плазмиду pQβ10 использовали в качестве исходной плазмиды для конструирования pQβ-243. Мутацию Asn10→Lys создавали обратной ПЦР. Обратные праймеры конструировали в обратных направлениях «хвост к хвосту»:

и

Продукты первой ПЦР использовали в качестве матриц для второй реакции ПЦР, в которой использовали верхний праймер

и нижний праймер

Продукт второй ПЦР расщепляли XbaI и Mph1103I и клонировали в экспрессирующем векторе pQβ10, который расщепляли такими же ферментами рестрикции. Реакции ПЦР осуществляли с использованием реагентов из набора для ПЦР и согласно протоколу производителя (MBI Fermentas, Vilnius, Lithuania).
Секвенирование с использованием способа прямого включения метки подтвердило требуемые мутации. Клетки E. coli, несущие pQβ-243, поддерживали эффективный синтез белка 14 кД, мигрирующего в SDS-ПААГ совместно с контрольным покрывающим белком Qβ, выделенным из частиц фага Qβ.
Получена в результате аминокислотная последовательность: (SEQ ID NO:24)

Конструирование pQβ-250:
Плазмиду pQβ-240 использовали в качестве исходной плазмиды для конструирования pQβ-250. Мутацию Lys2→Arg создавали сайт-специфичным мутагенезом. Верхний праймер

и нижний праймер

использовали для синтеза мутантного ПЦР-фрагмента, который вводили в экспрессирующий вектор pQβ-185 в уникальные сайты рестрикции NcoI и HindIII. Реакции ПЦР осуществляли с использованием реагентов из набора для ПЦР и согласно протоколу производителя (MBI Fermentas, Vilnius, Lithuania).
Секвенирование с использованием способа прямого включения метки подтвердило требуемые мутации. Клетки E. coli, несущие pQβ-250, поддерживали эффективный синтез белка 14 кД, мигрирующего в ПААГ совместно с контрольным покрывающим белком Qβ, выделенным из частиц фага Qβ.
Получена в результате аминокислотная последовательность: (SEQ ID NO:25)
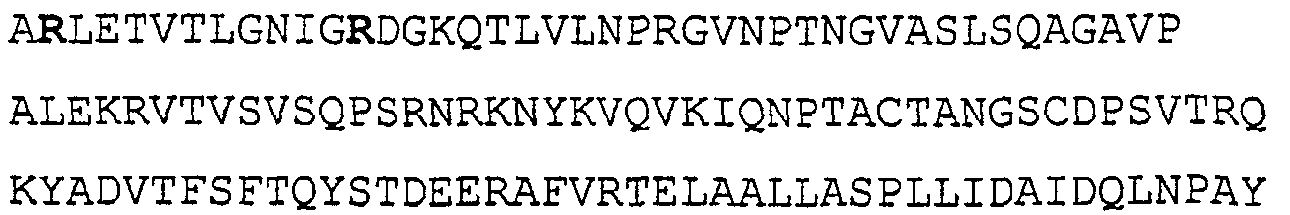
Конструирование pQβ-251:
Плазмиду pQβ10 использовали в качестве исходной плазмиды для конструирования pQβ-251. Мутацию Lys16→Arg создавали обратной ПЦР. Обратные праймеры конструировали в обратных направлениях «хвост к хвосту»:

и
Продукты первой ПЦР использовали в качестве матриц для второй реакции ПЦР, в которой использовали верхний праймер

и нижний праймер

Продукт второй ПЦР расщепляли XbaI и Mph1103I и клонировали в экспрессирующем векторе pQβ10, который расщепляли такими же ферментами рестрикции. Реакции ПЦР осуществляли с использованием реагентов из набора для ПЦР и согласно протоколу производителя (MBI Fermentas, Vilnius, Lithuania).
Секвенирование с использованием способа прямого включения метки подтвердило требуемые мутации. Клетки E. coli, несущие pQβ-251, поддерживали эффективный синтез белка 14 кД, мигрирующего в SDS-ПААГ совместно с контрольным покрывающим белком Qβ, выделенным из частиц фага Qβ. Полученная в результате аминокислотная последовательность, кодируемая данной конструкцией, показана в SEQ ID NO:26.
Конструирование pQβ-259:
Плазмиду pQβ-251 использовали в качестве исходной плазмиды для конструирования pQβ -259. Мутацию Lys2→Arg создавали сайт-специфичным мутагенезом. Верхний праймер

и нижний праймер

использовали для синтеза мутантного ПЦР-фрагмента, который вводили в экспрессирующий вектор pQβ-185 в уникальные сайты рестрикции NcoI и HindIII. Реакции ПЦР осуществляли с использованием реагентов из набора для ПЦР и согласно протоколу производителя (MBI Fermentas, Vilnius, Lithuania).
Секвенирование с использованием способа прямого включения метки подтвердило требуемые мутации. Клетки E. coli, несущие pQβ-259, поддерживали эффективный синтез белка 14 кД, мигрирующего в SDS-ПААГ совместно с контрольным покрывающим белком Qβ, выделенным из частиц фага Qβ.
Получена в результате аминокислотная последовательность: (SEQ ID NO:27)

Общие способы экспрессии и очистки Qβ и мутантов Qβ
Экспрессия
E. coli JM109 трансформировали плазмидами, экспрессирующими покрывающий белок Qβ . В 5 мл жидкой среды LB, содержащей 20 мкг/мл ампициллина, инокулировали клоны, трансформированные плазмидами, экспрессирующими покрывающий белок Qβ. Инокулированную культуру инкубировали при 37°C в течение 16-24 час без встряхивания. Затем полученный инокулят разводили 1:100 в 100-300 мл свежей среды LB, содержащей 20 мкг/мл ампициллина, и инкубировали при 37°C в течение ночи без встряхивания. Полученный в результате второй инокулят разводили 1:50 в среде M9, содержащей 1% казаминовых кислот и 0,2% глюкозы, в колбах и инкубировали при 37°C в течение ночи при встряхивании.
Очистка
Растворы и буферы для способа очистки
1. Лизирующий буфер LB
50 мМ трис-HCl, pH 8,0, с 5 мМ EDTA; 0,1% тритоном Х100 и свежеприготовленным PMSF в концентрации 5 микрограмм на 1 мл, без лизоцима и ДНКазы.
2. SAS
Насыщенный раствор сульфата аммония в воде.
3. Буфер NET
20 мМ трис-HCl, pH 7,8, с 5 мМ EDTA и 150 мМ NaCl.
4. ПЭГ
40% (мас./об.) полиэтиленгликоль 6000 в NET.
Разрушение и лизис
Замороженные клетки ресуспендировали в LB из расчета 2 мл/г клеток. Смесь обрабатывали ультразвуком при 22 кГц пять раз по 15 секунд с интервалами 1 мин, чтобы охладить раствор на льду. Затем лизат центрифугировали при 14000 об/мин в течение 1 час, используя ротор Janecki K 60. Все описанные ниже стадии центрифугирования осуществляли с использованием такого же ротора, если не оговорено особо. Надосадок хранили при 4°C, тогда как обломки клеток дважды промывали в LB. После центрифугирования надосадки и промывные фракции объединяли.
Фракционирование
К описанному выше объединенному лизату по каплям при перемешивании добавляли насыщенный раствор сульфата аммония. Объем SAS доводили до одной пятой общего объема, чтобы получить 20% насыщения. Раствор оставляли стоять в течение ночи и центрифугировали на следующий день при 14000 об/мин в течение 20 мин. Осадок промывали небольшим количеством 20% сульфата аммония и снова центрифугировали. Полученные надосадки объединяли и по каплям добавляли SAS, чтобы получить 40% насыщения. Раствор оставляли стоять в течение ночи, а на следующий день центрифугировали при 14000 об/мин в течение 20 мин. Полученный осадок растворяли в буфере NET.
Хроматография
Капсид или белок VLP, перерастворенный в буфере NET, наносили на колонку с сефарозой CL-4B. В ходе хроматографии элюировали три пика. Первый пик главным образом содержал мембраны и фрагменты мембран, и его не собирали. Капсиды находились во втором пике, тогда как третий пик содержал другие белки E. coli.
Фракции пика объединяли, и концентрацию NaCl доводили до конечной концентрации 0,65 М. По каплям при перемешивании добавляли объем раствора ПЭГ, соответствующий половине объединенной фракции пика. Раствор оставляли стоять в течение ночи без перемешивания. Белок капсида осаждали центрифугированием при 14000 об/мин в течение 20 мин. Затем его растворяли в минимальном объеме NET и снова нагружали на колонку с сефарозой CL-4B. Фракции пика объединяли и осаждали сульфатом аммония при 60% насыщении (мас./об.). После центрифугирования и перерастворения в буфере NET белок капсида нагружали на колонку с сефарозой CL-6B для повторной хроматографии.
Диализ и сушка
Фракции пиков, полученные, как описано выше, объединяли и подвергали диализу против большого объема стерильной воды и лиофилизовали для хранения.
Экспрессия и очистка Qβ-240
Клетки (E. coli JM 109, трансформированные плазмидой pQβ-240) ресуспендировали в LB, обрабатывали ультразвуком пять раз по 15 секунд (рубашка, содержащая воду со льдом) и центрифугировали при 13000 об/мин в течение одного часа. Надосадок хранили при 4°C вплоть до дальнейшей обработки, тогда как обломки клеток 2 раза промывали, 9 мл LB и, наконец 9 мл 0,7 М мочевины в LB. Все надосадки объединяли и нагружали на колонку с сефарозой CL-4B. Объединенные фракции пика осаждали сульфатом аммония и центрифугировали. Затем перерастворенный белок снова очищали на колонке с сефарозой 2B и, наконец, на колонке с сефарозой 6B. Наконец пик капсида диализовали против большого объема воды и лиофилизировали, как описано выше. Сборку покрывающего белка в капсид подтверждали электронной микроскопией.
Экспрессия и очистка Qβ-243
Клетки (E. coli RR1) ресуспендировали в LB и обрабатывали, как описано в общем способе. Белок очищали двумя последовательными стадиями гель-фильтрации на колонке с сефарозой CL-4B и, наконец, на колонке с сефарозой CL-2B. Фракции пика объединяли и лиофилизировали, как описано выше. Сборку покрывающего белка в капсид подтверждали электронной микроскопией.
Экспрессия и очистка Qβ-250
Клетки (E. coli JM 109, трансформированные pOβ-250) ресуспендировали в LB и обрабатывали, как описано выше. Белок очищали гель-фильтрацией на колонке с сефарозой CL-4B и, наконец, на колонке с сефарозой CL-2B и лиофилизировали, как описано выше. Сборку покрывающего белка в капсид подтверждали электронной микроскопией.
Экспрессия и очистка Qβ -259
Клетки (E. coli JM 109, трансформированные pQβ-259) ресуспендировали в LB и обрабатывали ультразвуком. Обломки клеток один раз промывали 10 мл LB и второй раз 10 мл 0,7 М мочевины в LB. Белок очищали двумя стадиями хроматографии на основе гель-фильтрации на колонке с сефарозой CL-4B. Белок подвергали диализу и лиофилизировали, как описано выше. Сборку покрывающего белка в капсид подтверждали электронной микроскопией.
ПРИМЕР 2
Инсерция пептида, содержащего остаток лизина, в c/e1-эпитоп HBcAg (1-149)
Эпитоп c/e1 (остатки с 72 по 88) HBcAg расположен в верхушечной области на поверхности капсида вируса гепатита B (HBcAg). Часть данной области (пролин 79 и аланин 80) генетическим способом заменяли пептидом Gly-Gly-Lys-Gly-Gly (конструкция HBcAg-Lys). Введенный остаток лизина содержит реакционноспособную аминогруппу в своей боковой цепи, которую можно использовать для межмолекулярного химического перекрестного сшивания частиц HBcAg с любым антигеном, содержащим свободную группу цистеина.
ДНК, кодирующую HBcAg-Lys, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:78, создавали с помощью ПЦР: два фрагмента, кодирующие фрагменты HBcAg (аминокислотные остатки с 1 по 78 и с 81 по 149) амплифицировали отдельно в ПЦР. Праймеры, используемые для указанных ПЦР, также вводили последовательность ДНК, кодирующую пептид Gly-Gly-Lys-Gly-Gly. Фрагмент HBcAg (с 1 по 78) амплифицировали с pEco63, используя праймеры EcoRIHBcAg(s) и Lys-HBcAg(as). Фрагмент HBcAg (с 81 по 149) амплифицировали с pEco63, используя праймеры Lys-HBcAg(s) и HBcAg(1-149)Hind(as). Праймеры Lys-HBcAg(as) и Lys-HBcAg(s) вводили комплементарные последовательности ДНК на концах двух продуктов ПЦР, обеспечивая слияние двух продуктов ПЦР в последующей сборке на основе ПЦР. Сблокированные фрагменты амплифицировали в ПЦР, используя праймеры EcoRIHBcAg(s) и HbcAg(1-149)Hind(as).
Для ПЦР использовали 100 пмоль каждого олигонуклеотида и 50 нг ДНК-матриц в 50 мл реакционных смесей, содержащих 2 единицы полимеразы Pwo, 0,1 мМ dNTP и 2 мМ MgSO4. В обеих реакциях температурные циклы осуществляли следующим образом: 94°C в течение 2 минут; 30 циклов 94°C (1 минута), 50°C (1 минута), 72°C (2 минуты).
Последовательности праймеров:

Для слияния двух ПЦР-фрагментов с помощью ПЦР использовали 100 пмоль праймеров EcoRIHBcAg(s) и HBcAg(1-149)Hind(as) со 100 нг двух очищенных ПЦР-фрагментов в 50 мл реакционной смеси, содержащей 2 единицы полимеразы Pwo, 0,1 мМ dNTP и 2 мМ MgSO4. Условия циклов ПЦР представляли собой: 94°C в течение 2 минут; 30 циклов 94°C (1 минута), 50°C (1 минута), 72°C (2 минуты). Продукт, полученный при ПЦР-сборке, анализировали электрофорезом в агарозном геле, очищали и расщепляли в течение 19 часов в соответствующем буфере с ферментами рестрикции EcoRI и HindIII. Полученный при расщеплении фрагмент ДНК лигировали в EcoRI/HindIII-расщепленный вектор pKK, чтобы получить экспрессирующий вектор pKK-HBcAg-Lys. Инсерцию ПЦР-продукта в вектор анализировали с помощью рестрикционного анализа ферментами EcoRI/HindIII и секвенирования ДНК вставки.
ПРИМЕР 3
Экспрессия и очистка HBcAg-Lys
Штаммы E. coli K802 или JM109 трансформировали вектором pKK-HBcAg-Lys. 1 мл ночной культуры бактерий использовали для того, чтобы инокулировать 100 мл среды LB, содержащей 100 мкг/мл ампициллина. Указанную культуру выращивали в течение 4 часов при 37°C до достижения OD при 600 нм, примерно равной 0,8. Индукцию синтеза HBcAg-Lys осуществляли добавлением IPTG до конечной концентрации 1 мМ. После индукции бактерии дополнительно встряхивали при 37°C в течение 4 часов. Бактерии собирали центрифугированием при 5000 x g в течение 15 минут. Осадок замораживали при -80°C. Осадок размораживали и ресуспендировали в буфере для лизиса бактерий (10 мМ Na2HPO4, pH 7,0; 30 мМ NaCl; 0,25% твин-20; 10 мМ EDTA) с добавлением 200 мкг/мл лизоцима и 10 мкг бензоназы (Merck). Клетки инкубировали в течение 30 минут при комнатной температуре и разрушали обработкой ультразвуком. Клетки E. coli, несущие экспрессирующую плазмиду pKK-HBcAg-Lys или контрольную плазмиду, использовали для индукции экспрессии HBcAg-Lys с помощью IPTG. Перед добавлением IPTG из культуры бактерий, несущих плазмиду pKK-HBcAg-Lys, и из культуры бактерий, несущих контрольную плазмиду, брали образец. Через четыре часа после добавления IPTG снова брали образцы из культуры, содержащей pKK-HBcAg-Lys, и из контрольной культуры. Экспрессию белка контролировали с использованием SDS-ПААГ с последующим окрашиванием Кумасси.
Затем лизат центрифугировали в течение 30 минут при 12000 x g, чтобы удалить нерастворимые обломки клеток. Надосадок и осадок анализировали методом Вестерн-блоттинга, используя моноклональное антитело против HBcAg (YVS1841, приобретенное из Accurate Chemical and Scientific Corp., Westbury, NY, USA), показав, что значительное количество белка HBcAg-Lys является растворимым. Коротко, лизаты клеток E. coli, экспрессирующих HBcAg-Lys, и лизаты контрольных клеток центрифугировали при 14000 x g в течение 30 минут. Надосадок (растворимая фракция) и осадок (нерастворимая фракция) разделяли и разбавляли в SDS-буфере для образцов до равных объемов. Образцы анализировали в SDS-ПААГ с последующим Вестерн-блоттингом с моноклональным антителом YVS 1841.
Осветленные лизаты клеток использовали для центрифугирования в ступенчатом градиенте, используя ступенчатый градиент сахарозы, состоящий из 4 мл 65% раствора сахарозы, на который наслаивали 3 мл 15% раствора сахарозы, а затем 4 мл бактериального лизата. Образец центрифугировали в течение 3 час при 100000 x g при 4°C. После центрифугирования собирали фракции объемом 1 мл с верха градиента и анализировали в SDS-ПААГ с последующим окрашиванием Кумасси. Белок HBcAg-Lys выявляли при окрашивании Кумасси.
Обогащенная фракция белка HBcAg-Lys была расположена на границе между 15 и 65% сахарозой, что свидетельствует о том, что белок образовал частицу капсида. Большинство бактериальных белков оставалось в не содержащем сахарозу верхнем слое градиента, таким образом, центрифугирование частиц HBcAg-Lys в ступенчатом градиенте приводило как к обогащению, так и к частичной очистке частиц.
Экспрессию и очистку HBcAg-Lys в крупном масштабе осуществляли следующим образом. Ночную культуру получали, высевая единичную колонию в 100 мл LB, 100 мкг/мл ампициллина и выращивая культуру в течение ночи при 37° C. На следующий день 25 мл предварительной культуры разбавляли в 800 мл среды LB с ампициллином и культуру выращивали до оптической плотности OD600, равной 0,6-0,8. Затем культуру индуцировали 1 мМ IPTG и оставляли расти еще в течение 4 часов. Клетки собирали и лизировали по существу так, как описано выше.
Затем HBcAg-Lys очищали, сначала осаждая белок сульфатом аммония (30% насыщения) из осветленного лизата клеток, затем нанося перерастворенный осадок на колонку для гель-фильтрации (Sephacryl S-400, Pharmacia). Объединенные фракции снова осаждали сульфатом аммония, осадок перерастворяли и наносили второй раз на такую же колонку для гель-фильтрации. Наконец фракции объединяли и концентрировали, и концентрацию оценивали с использованием теста Бредфорда (BioRad).
ПРИМЕР 4
Конструирование HBcAg, лишенного свободных остатков цистеина и содержащего встроенный остаток лизина
Коровый антиген гепатита (HBcAg), называемый в данном описании HBcAg-lys-2cys-Mut, лишенный остатков цистеина в положениях, соответствующих 48 и 107 в SEQ ID NO:77, и содержащий встроенный остаток лизина, конструировали, используя следующие способы.
Две мутации вводили сначала посредством отдельной амплификации трех фрагментов гена HBcAg-Lys, полученных, как описано выше в примере 2, со следующими комбинациями праймеров для ПЦР. Использовали способы ПЦР и обычные способы клонирования для получения гена HBcAg-lys-2cys-Mut.
Коротко, для получения фрагмента 1 использовали следующие праймеры.
Праймер 1: EcoRIHBcAg(s)

Праймер 2: 48as

Для получения фрагмента 2 использовали следующие праймеры.
Праймер 3: 48s

Праймер 4: 107as
Для получения фрагмента 3 использовали следующие праймеры.
Праймер 5: HBcAg149hind-as
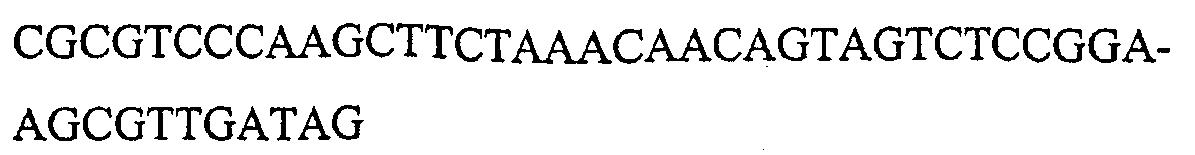
Праймер 6: 107s

Затем фрагменты 1 и 2 объединяли с использованием праймеров ПЦР EcoRIHBcAg(s) и 107as, получая фрагмент 4. Затем фрагмент 4 и фрагмент 3 объединяли с использованием праймеров EcoRIHBcAg(s) и HBcAg149hind-as, получая полноразмерный ген. Затем полноразмерный ген расщепляли ферментами EcoRI(GAATTC) и HindIII(AAGCTT) и клонировали в векторе pKK (Pharmacia), разрезанными в таких же сайтах рестрикции. Экспрессию и очистку HBcAg-lys-2cys-Mut осуществляли, как указано в примере 3.
ПРИМЕР 5
Конструирование HBcAg1-185-Lys
Коровый антиген гепатита (HBcAg) 1-185 модифицировали, как описано в примере 2. Часть области эпитопа c/e1 (остатки с 72 по 88) (пролин 79 и аланин 80) генетическим способом заменяли пептидом Gly-Gly-Lys-Gly-Gly (конструкция HBcAg1-185-Lys). Введенный остаток лизина содержит реакционноспособную аминогруппу в своей боковой цепи, которую можно использовать для межмолекулярного химического перекрестного сшивания частиц HBcAg с любым антигеном, содержащим свободную группу цистеина. Для получения гена HBcAg1-185-Lys использовали способы ПЦР и обычные способы клонирования.
Последовательность Gly-Gly-Lys-Gly-Gly встраивали путем амплификации двух отдельных фрагментов гена HBcAg из pEco63, как описано выше в примере 2, и затем посредством слияния двух фрагментов с помощью ПЦР, чтобы собрать полноразмерный ген. Использовали следующие комбинации ПЦР-праймеров:
фрагмент 1:
праймер 1: EcoRIHBcAg(s) (см. пример 2)
праймер 2: Lys-HBcAg(as) (см. пример 2)
фрагмент 2:
праймер 3: Lys-HBcAg(s) (см. пример 2)
праймер 4: HBcAgwtHindIIII
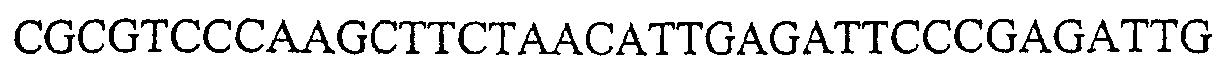
Сборка:
праймер 1: EcoRIHBcAg(s) (см. пример 2)
праймер 2: HBcAgwtHindIIII
Затем собранный полноразмерный ген расщепляли ферментами EcoRI(GAATTC) и HindIII(AAGCTT) и клонировали в векторе pKK (Pharmacia), разрезанном в таких же сайтах рестрикции.
ПРИМЕР 6
Слияние пептидного эпитопа в MIR-области HbcAg
Остатки 79 и 80 HBcAg1-185 заменяли эпитопом CεH3 последовательности VNLTWSRASG. Последовательность CεH3 происходит из последовательности третьего константного домена тяжелой цепи IgE человека. Эпитоп встраивали в последовательность HBcAg1-185, используя способ ПЦР-сборки. На первой стадии ПЦР ген HBcAg1-185, происходящий из ATCC-клона pEco63 и амплифицированный с праймерами HBcAg-wt EcoRI fwd и HBcAg-wt Hind III rev, использовали в качестве матрицы в двух отдельных реакциях, чтобы амплифицировать два фрагмента, содержащих элементы последовательности, кодирующие последовательность CεH3. Затем указанные два фрагмента подвергали сборке на второй стадии ПЦР в реакции ПЦР-сборки.
Комбинации праймеров на первой стадии ПЦР: CεH3fwd с HBcAg-wt Hind III rev и HBcAg-wt EcoRI fwd с CεH3rev. В реакции ПЦР-сборки два фрагмента, выделенных на первой стадии ПЦР, сначала подвергали сборке в течение 3 циклов ПЦР без внешних праймеров, которые добавляли к реакционной смеси позже для следующих 25 циклов. Внешние праймеры: HBcAg-wt EcoRI fwd и HBcAg-wt Hind III rev.
Продукт ПЦР клонировали в pKK223.3, используя сайты EcoRI и HindIII, для экспрессии в E. coli (см. пример 2). Химерную VLP экспрессировали в E. coli и очищали, как описано в примере 2. В объеме элюирования, в котором HBcAg1-185-CεH3 элюировался при гель-фильтрации, показана сборка слитых белков в химерную VLP.
Последовательности праймеров:

ПРИМЕР 7
Клонирование, экспрессия и очистка IL-5 с N-концевым аминокислотным линкером, содержащим остаток цистеина. Связывание с VLP, иммунизация и демонстрация эффективности в экспериментальной модели аллергической астмы с эозинофильным компонентом
A. Клонирование мышиного His-C-IL-5 и экспрессия в виде телец включения в E. coli
IL-5 амплифицировали из ATCC-клона (pmIL5-4G; номер в ATCC: 37562) в ПЦР, используя два следующих праймера: Spelinker3-F1 (SEQ ID NO:340) и Il5StopXho-R (SEQ ID NO:342). Продукт данной ПЦР использовали в качестве матрицы для второй ПЦР с праймерами SpeNlinker3-F2 (SEQ ID NO:341) и Il5StopXho-R. Вставку вырезали SpeI и NotI. Полученную вставку лигировали в вектор, производный от pET (вектор pMODEC3-8), предварительно расщепленный NheI и NotI, и им трансформировали клетки E. coli TG1. Конструкция, полученная клонированием IL5 в pMODEC3-8, содержит, начиная с ее N-конца, гексагистидиновую метку (чтобы облегчить очистку), сайт расщепления энтерокиназой, аминокислотный линкер, полученный из гамма 3 (фланкированный с N-конца аминокислотами ALV и с C-конца аминокислотами AS), содержащий остаток цистеина, и ДНК, кодирующую зрелую форму белка IL-5. Правильность способа клонирования подтверждали секвенированием ДНК.
Описанную выше конструкцию, содержащую IL-5, назвали pMODC6-IL5.2 (также называемую pMODC6-IL5) и ею трансформировали E. coli, штамм BL21-DE3. Рекомбинантный белок, экспрессированный в E. Coli, назван His-C-IL5.
Клональные клетки BL21-DE3, несущие pMODC6-IL5, выращивали в течение ночи в 5 мл LB, содержащей 1 мг/л ампициллина. Аликвоту данной культуры объемом 2,0 мл разбавляли в 100 мл подходящего бульона (TB), содержащего 1 мг/л ампициллина. Культуру выращивали до оптической плотности OD600, равной 0,7-1,0, и экспрессию индуцировали в течение 4 часов добавлением 0,1 мл 1,0 М маточного раствора изопропил-β-D-тиогалактопиранозида (IPTG). Рекомбинантный His-C-IL5 экспрессировался в нерастворимой форме и находился во фракции телец включения индуцированных клеток. Экспрессию His-C-IL5 подтверждали следующим образом. Через 4 часа после индукции брали образец культуры объемом 10 мл и центрифугировали в течение 10 мин при 4000 x g. Осадок ресуспендировали в 0,5 мл лизирующего буфера, состоящего из 50 мМ трис-HCl, 2 мМ EDTA, 0,1% тритона X-100 (pH 8,0). К суспензии добавляли 20 мкл лизоцима (40 мг/мл) и через 30 мин при 4°C обрабатывали ультразвуком в течение 2 мин. Добавляли аликвоту бензоназы объемом 1,0 мл и аликвоту 50 мМ MgCl2 объемом 100 мкл и инкубировали в течение 30 мин при комнатной температуре. После центрифугирования в течение 15 мин при 13000 x g надосадок отбрасывали, а осадок нагревали в течение 5 мин при 98°C в 100 мкл буфера для нанесения с SDS. Затем аликвоты по 10 мкл анализировали в SDS-ПААГ в восстанавливающих условиях. SDS-ПААГ-анализ выявил полосу белка 17 кД, соответствующего по массе IL-5. В качестве контроля клетки BL21-DE2, содержащие pMODC6-IL5, выращивали в отсутствие IPTG и готовили экстракты из нерастворимой клеточной фракции, как описано выше.
B. Очистка и рефолдинг мышиного His-C-IL5
Осуществляли крупномасштабную экспрессию IL-5 из клона pMODC6-IL5 в клетках BL21-DE3 для того, чтобы получить достаточные количества чистого IL-5 для получения вакцины. Выращивали ночные культуры и разводили в объеме, равном либо 100 мл, либо 1 л, среды TB, содержащей 1,0 мг/л ампициллина. Таким образом, получали всего 3 литра культуры и выращивали при 37°C до достижения OD600, равной 0,7, и в это время добавляли IPTG, получая конечную концентрацию 1,0 мМ. После 4 час инкубации клетки собирали путем центрифугирования в течение 30 мин при 10 000 x g. После сбора осадок ресуспендировали в PBS (5,0 мл/г массы во влажном состоянии) и центрифугировали в течение 15 минут при 10000 x g. Промытый осадок хранили при -20°С вплоть до использования.
Бактериальный осадок суспендировали в PBS (2,0 мл/г массы влажных клеток), используя гомогенизатор Даунса. К суспензии добавляли лизоцим (0,8 мг/мл) и инкубировали в течение 30 минут при комнатной температуре. Суспензию 3 раза обрабатывали ультразвуком в течение 1 минуты на льду, затем добавляли бензоназу и MgCl2 (конечная концентрация 10 мМ) и инкубировали в течение 30 минут при комнатной температуре. Добавляли тритон X-100 до конечной концентрации 1% (мас./об.), смесь осторожно перемешивали при комнатной температуре в течение 30 минут. Раствор центрифугировали в течение 20 минут при 20000 x g (пробирки SS34) и надосадок отбрасывали. Осадок, содержащий тельца включения, суспендировали (5,0 мл/г массы во влажном состоянии) в буфере для промывки (PBS, содержащий 2 М мочевину и 1% (мас./об.) тритона X-100), используя гомогенизатор Даунса и встряхивая в течение 5 минут. Раствор центрифугировали в течение 20 минут при 20000 x g, и надосадок отбрасывали. Осадок промывали и центрифугировали, как описано выше, еще 2 раза. Конечную промывку телец включения осуществляли в буфере для промывки в отсутствие тритона X-100.
His-C-IL-5, присутствующий в тельцах включения в осадке, растворяли (5,0 мл/г массы клеток во влажном состоянии) в денатурирующем буфере (100 мМ NaH2PO4, 10 мМ трис-HCl, 6,0 М гуанидин-гидрохлорид, pH 8,0) и осторожно перемешивали в течение 1 часа при 25°C. Суспензию центрифугировали в течение 20 мин при 20000 x g и надосадок смешивали с Ni-NTA-смолой (QIAgen, уравновешенной буфером для растворения). После 3 часов осторожного встряхивания при 4°C взвесь вливали в стеклянную колонку (C10/10) и смолу промывали 100 мл 100 мМ NaH2PO4 , 10 мМ триса, 6,0 М гуанидин-гидрохлорида (pH 6,3). Осуществляли дополнительную стадию промывки 15 мл 100 мМ NaH2PO4, 10 мМ триса, 6,0 М гуанидин-гидрохлорида (pH 5,9). Мышиный His-C-IL5 элюировали со смолы нанесением 20 мл 100 мМ NaH2PO4, 10 мМ триса, 6,0 М гуанидин-гидрохлорида (pH 4,5). Очистку анализировали в SDS-ПААГ.
Фракции со стадии элюирования, содержащие His-C-IL-5, объединяли и диализовали против буфера, содержащего 8,0 М мочевину, 100 мМ NaH2PO4, 10 мМ трис-HCl (pH 8,0), при 4°C, используя мембрану с пределом отсечения 10 кД. После диализа концентрацию белка определяли спектрофотометрически, используя следующую формулу: белок (мг/мл)=(1,55 x A280нм) - (0,76 x A260нм ). Концентрацию белка доводили разбавлением в буфере для диализа до 0,2 мг/мл. Затем раствор диализовали с использованием мембраны с отсечением 3,5 кД в течение 24 часов при 4°C против буфера для рефолдинга 1, содержащего 2,0 М мочевину, 50 мМ NaH2PO4, 5 мМ восстановленный глутатион, 0,5 мМ окисленный глутатион, 0,5 М аргинин, 10% (об./об.) глицерин (pH 8,5), и еще в течение 24 час против другого буфера для рефолдинга 2, содержащего 50 мМ NaH2PO4, 5 мМ восстановленный глутатион, 0,5 мМ окисленный глутатион, 0,5 М аргинин, 10% (об./об.) глицерин (pH 8,5). В конце белок диализовали в течение 24 час при 4°C против PBS pH 8,0, затем центрифугировали при 10000 x g в течение 30 мин. Содержание белка в надосадке определяли анализом по Бредфорду.
Для дополнительной очистки His-C-IL5 осуществляли анионный обмен с использованием смолы Hitrap Q (Amersham Pharmacia, Uppsala Sweden). His-C-IL5 концентрировали до 1 мг/мл, используя центрифужные фильтры (Ultrafree-15 Millipore, предел отсечения 10 кД), и диализовали в течение 14 час против 50 мМ фосфатного буфера, pH 8,4. Раствор наносили на колонку Hitrap Q и промывали 50 мМ фосфатным буфером с pH 8,4. His-C-IL-5 элюировали с колонки, применяя градиент NaCl от 0 до 1 М. His-C-IL5 элюировался с колонки при 100 мМ NaCl. Анализ очистки проводили в SDS-ПААГ и концентрацию измеряли анализом по Бредфорду. Четвертичную структуру белка оценивали при электрофорезе в SDS-ПААГ, осуществляемом в невосстанавливающих условиях.
C. Получение вакцины: связывание His-C-IL5 с Qβ
Исследовали ряд условий для оптимизации эффективности реакции связывания. Условия включали добавление восстанавливающего агента (TCEP) к His-C-IL5 и варьирование молярных отношений мономера Qβ и His-C-IL5 в реакции связывания, условия суммированы в таблице. Вакцину для исследования эффективности получали следующим образом. Очищенный His-C-IL-5 (40 мкМ) восстанавливали в течение 1 час с помощью эквимолярного количества TCEP в PBS, pH 8,0. Восстановленный IL-5 (80 мкМ) инкубировали в течение 4 часов при 22°C с 40 мкМ Qβ, дериватизованным SMPH, в общем объеме 700 мкл. Реакционную смесь диализовали в течение 12 часов против PBS, pH 8,0, используя мембрану для диализа с отсечением 300 кД. Реакцию связывания анализировали в SDS-ПААГ и Вестерн-блоте с использованием анти-His- и анти-Qβ-антител. Концентрацию белка измеряли по Бредфорду. Эффективность связывания [т.е. моль Qβ -IL5/моль мономера Qβ (суммарного)] оценивали в денситометрическом анализе окрашенного Кумасси голубым SDS-ПААГ.
D. ELISA для оценки вакцины
Связывание мышиного His-C-IL5 с Qβ оценивали с использованием «четверного» ELISA, который показан на фиг.7. 96-луночный планшет для ELISA в течение ночи покрывали 100 мкл 1 мг/л антитела козы против IgG кролика на лунку. Планшет четыре раза промывали PBS-твин 0,1% (об./об.) (PBST), затем блокировали в течение 2 час при 37°C 2% (мас./об.) бычьим сывороточным альбумином (БСА) в PBST. После промывки в PBST добавляли поликлональную анти-Qβ-сыворотку кролика (разведение 1:5000) и инкубировали в течение 1 часа. Планшет дважды промывали PBST и добавляли либо варьирующие количества Qβ-His-C-IL5, либо контроль (фиг.5) и инкубировали в течение 1 часа при 25° C. В анализе использовали два разных третьих антитела; антитело крыс против мышиного IL5 (TRFK4) или антитело крыс против мышиного IL5 (TRFK5), которые оба являются нейтрализующими моноклональными антителами. Все антитела использовали в концентрациях 1 мкг/мл. Регистрирующие антитела конъюгированы с пероксидазой хрена (HRP) и специфичны в отношении конкретного Fc-фрагмента третьего антитела. Связывание в «сэндвич»-анализе измеряли с помощью хемилюминесценции (ECL) при 450 нм.
F. Анализ активности IL-5
Способность линии B-клеточной лимфомы BCL1 пролиферировать в ответ на мышиный IL-5 использовали для проверки биоактивности подвергнутого рефолдингу рекомбинантного His-C-IL-5 (Harriman G. R. (1991) Current Protocols in Immunology 6.5.1-6.5.5 John Wiley and Sons Inc). Также оценивали пролиферативную активность His-C-IL5, ковалентно связанного с Qβ. В качестве контроля использовали рекомбинантный мышиный IL-5 (R&D systems, Minneapolis USA). Различные формы рекомбинантного IL-5 инкубировали в 96-луночных планшетах с плоским дном с 2 x 104 клеток BCL1 на лунку и инкубировали в течение 24 час при 37°C, 5% CO2. В каждую лунку добавляли 1 мккюри3H-тимидина (Hartmann Analytic, Switzerland), и планшеты инкубировали еще в течение 6 час при 37°C, 5% CO2. Клетки собирали, промывали и определяли включение тимидина подсчетом β-излучения в жидкостно-сцинтилляционном счетчике.
G. Протокол иммунизации
Чтобы получить аутореактивные антитела к мышиному IL-5, четырем мышам BalbC в 0 день и 14 день подкожно инъецировали 25 мкг вакцины Qβ-His-C-IL5 в 200 мкл PBS. В качестве негативного контроля служили пять мышей, которых иммунизировали в 0 день и 14 день смесью образцов 6,4 мкг Qβ и 16 мкг IL5, т.е. не связанных ковалентно (Qβ + His-C-IL-5), в PBS. У мышей брали кровь перед иммунизацией и на 21 день согласно протоколу иммунизации. Сыворотки анализировали в ELISA.
H. Анализ сывороток
ELISA. Планшеты для ELISA Maxisorp (Nunc) покрывали 50 мкл очищенного His-C-IL-5 (3 мкг/мл) в течение 14 час при 4°C. Планшеты 3 раза промывали PBS и блокировали 2% БСА в PBS в течение 2 час при 37°C, затем дважды промывали PBS. Пятикратные разведения сыворотки добавляли в 2% БСА, 0,1% FCS в PBS и инкубировали при комнатной температуре в течение 1 часа. Затем планшеты 3 раза промывали PBS и инкубировали с антителом против IgG мыши, конъюгированным с HRP (разведение 1:1000) при комнатной температуре в течение 1 час. Планшеты снова 3 раза промывали в PBS и добавляли 100 мкл/лунку проявляющего раствора (0,066 М Na2 HPO4; 0,035 М лимонная кислота; 0,032% H2O2; 0,4% дигидрохлорид 1,2-фенилендиамина). Через 2 минуты протекания реакции при комнатной температуре ELISA останавливали с помощью 50 мкл на лунку 5% H2SO4. Поглощение измеряли при 450 нм на спектрофотометре Spectramax (Molecular Devices).
Окрашивание Вестерн-блота сывороткой мышей, иммунизированных Qβ-IL5.
His-C-IL5, Qβ и контроли разделяли в SDS-ПААГ и подвергали электроблоттингу на нитроцеллюлозную мембрану. Мембрану блокировали в течение 1 час 5% (мас./об.) порошковым молоком в PBS, затем инкубировали с 20 мкл сыворотки, полученной на 21 день от вакцинированных мышей, в 10 мл 1% (мас./об.) порошкового молока в PBS. Мембрану промывали PBS в течение 15 минут и затем инкубировали в течение 1 час с 10 мл 1% (мас./об.) порошкового молока в PBS, содержащем антитело против IgG мыши, конъюгированное с пероксидазой хрена (HRP), в разведении 1:1000. Мембрану промывали в течение 15 минут в PBS и проявляли ECL (Amersham Pharmacia, Sweden) и экспонировали с фотопленкой.
I. Модель эозинофилии
Экспериментальную модель астмы с аллергическим воспалением дыхательных путей использовали для оценки влияния вакцинации на эозинофилию. Мышей Balb/c (4 на группу) иммунизировали любым Qβ-His-C-IL-5, как описано выше. На 23 день согласно программе вакцинации мышам внутрибрюшинно инъецировали 50 мкг овальбумина (OVA) в адъюванте на основе алюминия (Alu-Gel-S). Инъекции проводили также и третьей группе из 4 мышей, которых не иммунизировали. Через 10 дней (т.е. на 33 день) мыши получали 100 мкг OVA в PBS, который вводили интраназально каждый день в течение 4 дней. Через 24 часа после последней антигенной стимуляции мышей забивали и легкие промывали в PBS. Клетки, находящиеся в бронхоальвеолярном лаваже (BAL), красили по Май-Грюнвальду-Гимзе и подсчитывали (Trifilieff A. et al. Clin. Exp. Allergy. 2001 Jun; 31 (6): 934-42).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспрессия. Экспрессию конструкции pMODC6-IL5 в клетках BL21-DE2 анализировали в SDS-ПААГ (фиг.1). На окрашенном Кумасси голубым геле показана IPTG-индуцированная экспрессия белка 17 кД, соответствующего по массе IL-5. В качестве контроля клетки BL21-DE2, содержащие pMODC6-IL5, выращивали в отсутствие IPTG, и экстракты получали из нерастворимой клеточной фракции, как описано выше. Как и ожидалось, в данных условиях не было индукции белка 17 кД. His-C-IL5 находился в нерастворимой фракции телец включения.
Экстракция, очистка и рефолдинг. Нерастворимый His-C-IL5 экстрагировали из промытых детергентом телец включения с использованием 6 М гидрохлорида гуанидина. Растворенный белок очищали металло-хелатной аффинной хроматографией и анализировали в SDS-ПААГ (фиг.2). Обнаружено, что данным способом достигали высокого обогащения фракции рекомбинантного His-C-IL5. Денатурированный белок подвергали процедуре рефолдинга в мочевине, как описано выше, и затем очищали путем анионообменной хроматографии. Указанные стадии давали растворимый высокоочищенный His-C-IL5, судя по SDS-ПААГ (фиг.5, дорожка 1) с извлечением 23% и выходом 6,9 мг.
Так как биологически активный нативный IL-5 является связанным дисульфидной связью гомодимером, то оценивали способность очищенного рекомбинантного His-C-IL5 образовывать димеры с помощью SDS-ПААГ-электрофореза, выполняемого в невосстанавливающих условиях (фиг.3). Судя по молекулярной массе, составляющей 37 кД, His-C-IL5 имел димерную природу, что свидетельствует о сохранении нативной четвертичной структуры.
Биологическую активность рекомбинантного His-C-IL5 оценивали путем определения его способности стимулировать пролиферацию линии B-клеток мышей (фиг.4). Показано, что клетки BCL1, культивируемые в присутствии His-C-IL5, имеют повышенные скорости пролиферации по сравнению с культивированием только в среде или с другими белками. Кроме того, усиленная пролиферация была сходна с пролиферацией, наблюдаемой в случае коммерчески полученного мышиного IL-5. Способность His-C-IL5 стимулировать пролиферацию B-клеток, вероятно, за счет взаимодействия с родственным ему рецептором и принимать димерную структуру свидетельствует о том, что рекомбинантный белок принимает нативную конформацию.
Получение вакцины и аналитика. Ковалентное химическое связывание His-C-IL5 с вирусоподобной частицей Qβ оценивали с помощью SDS-ПААГ и Вестерн-блот-анализа. Окрашенные Кумасси голубым гели в случае реакции связывания показали появление полос с молекулярными массами, соответствующими массам, рассчитанным для His-C-IL5, ковалентно связанного с Qβ (фиг.5). Кроме того, Вестерн-анализы показали совместную локализацию указанных полос при окрашивании либо анти-His-, либо анти-Qβ-антителами (фиг.6). Эффективность связывания [т.е. моль Qβ-IL5/моль мономера Qβ (суммарный)], оцениваемая денситометрическим анализом окрашенного Кумасси голубым SDS-ПААГ, составляла 40,6%.
Способность His-C-IL-5, ковалентно перекрестно связанного с Qβ, стимулировать пролиферацию B-клеток оценивали, как описано ранее. На фиг.5 показано, что Qβ-His-C-IL5 способен вызывать усиленную пролиферацию по сравнению с Qβ, связанным с неродственным цитокином.
Затем анализировали конформацию His-C-IL5, связанного с Qβ, используя четырехкратный ELISA (фиг.7A). На фиг.7B показано, что His-C-IL5 распознается нейтрализующими моноклональными антителами к IL-5 - TRFK 4 и TRFK 5. Когда реакцию проводили с Qβ, а не с Qβ-His-C-IL-5, сигнал не регистрировался. Моноклональное антитело TRFK4 распознает нейтрализуемый эпитоп в IL-5. Способность IL-5-специфичных моноклональных антител распознавать ковалентно связанный His-C-IL-5 свидетельствует о том, что нейтрализуемые эпитопы сохраняются в препарате вакцины.
Анализ сыворотки. Сыворотки, собранные перед иммунизацией и на 21 день от мышей, вакцинированных Qβ-His-C-IL5, собирали и анализировали в ELISA (фиг.8). Результат показывает, что иммунологическая толерантность к аутоантигену IL-5 была преодолена в отсутствие адъюванта и без исключения у 4/4 вакцинированных мышей. Рассчитали, что половина максимальных титров была в пределах от 1:2000 до 1:6000. В контрольной группе, которая получала Qβ, смешанный с His-C-IL5, не регистрировали существенных титров анти-IL-5-антител. Однако 3 из 5 мышей продуцировали низкий титр антител <1:50. Затем иммунные сыворотки от мышей, вакцинированных Qβ-His-C-IL5, тестировали, используя Вестерн-блот-анализ. Во всех случаях иммунные сыворотки специфично распознавали мышиный IL-5.
Эффективность вакцины в модели экспериментальной астмы у животных. Влияние вакцинации Qβ-His-C-IL-5 на эозинофилию оценивали в мышиной модели аллергического воспаления дыхательных путей, которая имитирует ключевые патологические события при астме. В данном эксперименте тестировали способность анти-IL5-антител, образованных при вакцинации Qβ -His-C-IL-5, подавлять действие эндогенного IL-5 in vivo. В контрольном эксперименте мышей вакцинировали PBS перед сенсибилизацией и антигенной стимуляцией OVA. В данном случае подсчитывали большое количество эозинофилов в BAL. Среднее количество эозинофилов/200 просчитанных клеток составляло 96±14 S.D. В отличие от этого среднее значение эозинофилов в BAL у четырех мышей, вакцинированных Qβ-His-C-IL-5, составляло 27,5±11 S.D./200 просчитанных клеток. Указанное снижение составляет 71,4% и является доказательством того, что аутоантитела, образуемые при иммунизации His-C-IL-5, представленным в виде высокоупорядоченной иммунной матрицы, распознают эндогенную молекулу-мишень и таким образом подавляют эозинофилию в экспериментальной модели астмы.
ПРИМЕР 8
Молекулярное клонирование, экспрессия, рефолдинг и очистка мышиного mIL-13 с C-концевым аминокислотным линкером, содержащим остаток цистеина для связывания с VLP и фимбриями. Связывание мышиного интерлейкина-13 с VPL и фимбриями
A. Клонирование IL-13 для прокариотической экспрессии
ДНК для клонирования IL-13 выделяли с помощью ОТ-ПЦР из активированных in vitro спленоцитов, которые получали следующим образом: T-клетки CD4+ выделяли из клеток селезенки мыши и инкубировали 3 дня в IMDM (+5% FCS + 10 нг/мл IL4) в 6-луночных планшетах, предварительно покрытых анти-CD3- и анти-CD28-антителами. РНК из указанных клеток использовали для того, чтобы амплифицировать кДНК, кодирующую IL13, в одностадийной ОТ-ПЦР (набор для одностадийной ПЦР Qiagen). Праймер XhoIL13-R использовали для обратной транскрипции РНК, праймеры NheIL13-F (SEQ ID NO:338) и XhoIL13-R (SEQ ID NO:339) использовали для ПЦР-амплификации кДНК IL13. Амплифицированную кДНК IL13 лигировали в вектор pMOD, используя сайты рестрикции NheI/XhoI (получая вектор pMODB1-IL13). Идентичность полученной в результате последовательности кДНК определяли нуклеотидным секвенированием.
Используя такие же праймеры NheIL13-F (SEQ ID NO:338) и XhoIL13-R (SEQ ID NO:339), амплифицировали кДНК IL-13 из плазмиды pModB1-IL13 и лигировали в вектор pMODGST-EK-C1, получая в результате плазмиду pModGST-EK-IL13-C1. Последовательность кДНК указанной плазмиды определяли путем секвенирования нуклеотидов. кДНК, содержащую кодирующую последовательность для глутатион-S-трансферазы, слитую с сайтом расщепления энтерокиназой, за которым следует последовательность IL-13 с C-концевым линкером 1, амплифицировали в ПЦР с праймером GST-BamHIss и C1-BsmBI/XhoI, используя в качестве матрицы плазмиду pModGST-EK-IL13-C1. Указанную кДНК расщепляли ферментами рестрикции BamHI и BsmBI и лигировали в вектор pModB-N1, используя сайт рестрикции BamHI/XhoI. Полученная в результате плазмида pMod-GST-EK-IL13-C1-His кодирует слитый белок, состоящий из глутатион-S-трансферазы, сайта расщепления энтерокиназой, IL-13, линкера, содержащего цистеин, и полигистидиновой метки (GST-EK-IL13-C1-His). Идентичность кДНК, кодирующей данный слитый белок, подтверждали нуклеотидным секвенированием.
Последовательность олигонуклеотидов

B. Экспрессия IL-13 в E. coli
Плазмидой pMod-GST-EK-IL13-C1-His трансформировали штамм бактерии-хозяина BL 21 (DE3). Через 90 минут восстановления в среде LB, содержащей 2% глюкозы (предварительная культура), в 250 мл MOPS-забуференной среды SB, содержащей 0,2% глюкозы и 100 мкг/л ампициллина, инокулировали 250 мкл предварительной культуры и инкубировали на качалке при 37°C в течение ночи. На следующее утро посеянную культуру разбавляли 750 мл предварительно нагретой MOPS-забуференной среды SB, содержащей 100 мкг/л ампициллина, и инкубировали на качалке при 125 об/мин при 37°C еще в течение 90 мин вплоть до достижения OD600, равной 4,5. 1000 мл культуры разбавляли 500 мл MOPS-забуференной среды SB, содержащей 100 мкг/л ампициллина, и переносили в инкубатор на 24°C, где ее инкубировали на качалке в течение 30 мин до достижения OD600, равной 3,75. Экспрессию слитого белка GST-EK-IL13-C1-His индуцировали добавлением 0,75 мМ IPTG. Через 4 час бактерии собирали центрифугированием и разрушали обработкой ультразвуком.
C. Очистка IL-13 из телец включения в денатурирующих условиях
После лизиса тельца включения осаждали при низкоскоростном центрифугировании (10000 g, 60 мин, при 4°C). Надосадок собирали и снова центрифугировали при тех же условиях. Осадки хранили в виде неочищенной фракции телец включения. Тельца включения 4 раза промывали следующим буфером для промывки: 50 мМ трис-HCl, pH 7,6, 250 мМ NaCl, 5 мМ MgCl2, 2 М мочевина, 2% тритон X-100 и 10 ед. бензоназы/мл. Тельца включения собирали центрифугированием и ресуспендировали в денатурирующем буфере, содержащем 100 мМ NaH2PO4, 10 мМ трис-HCl и 6 М гуанидин-HCl, pH 8,0. Тельца включения обрабатывали ультразвуком в присутствии 10 ед. бензоназы/мл и инкубировали в течение 2 час на вращающейся подставке при комнатной температуре. После центрифугирования надосадок сохраняли, а осадки снова ресуспендировали в денатурирующем буфере и обрабатывали, как описано выше. Надосадки объединяли и наносили на Ni2+-агарозную колонку, уравновешенную денатурирующим буфером. Связанный белок элюировали в две стадии денатурирующим буфером с pH 6,3 и pH 4,5. Аликвоты фракций анализировали окрашиванием амидным черным и после осаждения ТХУ в SDS-ПААГ (фиг.10).
D. Рефолдинг GST-EK-IL13-C1-His
К элюированному белку добавляли β-меркаптоэтанол до конечной концентрации 10 мМ и диализовали в течение ночи против 2 литров буфера, содержащего 8,0 М мочевину, 100 мМ NaH2PO4, 10 мМ трис-HCl, 10 мМ β-меркаптоэтанол (pH 8,0), при 4°C, используя мембрану с пределом отсечения 10 кД. После диализа определяли концентрацию белка и белок разбавляли буфером для диализа до концентрации 0,2 мг/мл. Раствор диализовали в течение 24 час при 4°C против буфера для рефолдинга 1, содержащего 2,0 М мочевину, 50 мМ NaH2PO4, 5 мМ восстановленный глутатион, 0,5 мМ окисленный глутатион, 0,5 М аргинин, 10% (об./об.) глицерин (pH 8,5). На следующий день буфер для рефолдинга 1 заменяли на буфер для рефолдинга 2, содержащий 50 мМ NaH2PO4, 2,5 мМ восстановленный глутатион, 0,25 мМ окисленный глутатион, 0,25 М аргинин, 10% (об./об.) глицерин (pH 8,5) и диализовали при 4°C еще в течение 24 час. Наконец раствор диализовали при 4°C против буфера для рефолдинга 3, содержащего 20 мМ этаноламин, 150 мМ NaCl и 10% (об./об.) глицерин (pH 9,0). Буфер для рефолдинга 3 один раз заменяли через 2 час и диализ продолжали в течение следующих 14 час. Диализат центрифугировали при 4°C и 20000 g в течение 15 мин. Надосадок сохраняли и белок концентрировали центрифугированием в «центрифужных устройствах с фильтром biomax» с отсечением по молекулярной массе 5 кД (Millipore) до конечной концентрации белка 2 мг/мл. Белок анализировали, используя SDS-ПААГ и Вестерн-блот с моноспецифичными антителами против GST, мышиного IL-13 и His-метки, соответственно.
E. Расщепление слитого белка GST-EK-IL13-C1-His энтерокиназой
Слитый белок GST-EK-IL13-C1-His инкубировали с 1x буфером для энтерокиназы (50 мМ трис-HCl, pH 8,0, 10 мМ CaCl2 и 1% твин-20) и 1 ед. энтерокиназы (Invitrogene) на 12,5 мкг слитого белка в течение 24 час при 4°C.
F. Очистка IL13-C1-His
После обработки энтерокиназой отщепленный GST отделяли, комбинируя ионообменную хроматографию, гель-фильтрацию и аффинную хроматографию. Белок IL-13-C1-His концентрировали до конечной концентрации белка 2 мг/мл.
G. Подготовка белка IL-13-C1-His для реакции связывания
Для того чтобы определить оптимальные условия связывания, белок IL-13-C1-His обрабатывали в умеренных условиях восстановления различными концентрациями (от 0 до 500 мкМ) восстанавливающего реагента (DTT или TCEP). Восстановленный белок IL-13-C1-His тестировали в отношении эффективного связывания с дериватизованными VLP и фимбриями.
H. Связывание IL-13-C1-His с капсидами Qβ
Раствор 120 мкМ Qβ-капсида в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 30 минут подвергали взаимодействию с 25-кратным молярным избытком гетеробифункционального перекрестно сшивающего агента, подобного SMPH (Pierce), разбавленного из маточного раствора в ДМСО, при 25°C на качающемся встряхивателе. Затем реакционный раствор дважды диализовали в течение 2 часов против 1 л 20 мМ Hepes, 150 мМ NaCl, pH 7,2, при 4°C. Затем диализованную реакционную смесь дериватизованного Qβ смешивали с белком IL-13-C1-His. В реакции связывания белок IL-13-C1-His присутствовал в двукратном молярном избытке по сравнению с дериватизованным капсидом Qβ. Реакция связывания продолжалась в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ и, кроме того, на Вестерн-блоте.
Связывание IL-13-C1-His с белком капсида fr
Раствор 120 мкМ fr-капсида в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 30 минут подвергали взаимодействию с 25-кратным молярным избытком SMPH (Pierce), разбавленного из маточного раствора в ДМСО, при 25°C на качающемся встряхивателе. Затем реакционный раствор дважды диализовали в течение 2 часов против 1 л 20 мМ Hepes, 150 мМ NaCl, pH 7,2, при 4°C. Затем диализованную реакционную смесь белка капсида fr подвергали взаимодействию с подготовленным белком IL-13-C1-His. В реакции связывания белок IL-13-C1-His присутствовал в двукратном молярном избытке по сравнению с дериватизованным капсидом fr. Реакция связывания продолжалась в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ и, кроме того, на Вестерн-блоте.
Связывание IL-13-C1-His с HBcAg-Lys-2cys-Mut
Раствор 120 мкМ капсида HBcAg-Lys-2cys-Mut в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 30 минут подвергали взаимодействию с 25-кратным молярным избытком SMPH (Pierce), разбавленного из маточного раствора в ДМСО, при 25°C на качающемся встряхивателе. Затем реакционный раствор дважды диализовали в течение 2 часов против 1 л 20 мМ Hepes, 150 мМ NaCl, pH 7,2, при 4°C. Затем диализованную реакционную смесь HBcAg-Lys-2cys-Mut подвергали взаимодействию с подготовленным белком IL-13-C1-His. В реакции связывания белок IL-13-C1-His присутствовал в двукратном молярном избытке по сравнению с дериватизованным капсидом HBcAg-Lys-2cys-Mut. Реакция связывания продолжалась в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ и, кроме того, на Вестерн-блоте.
Связывание белка IL-13-C1-His с фимбриями
Раствор 125 мкМ фимбрий типа-1 E. coli в 20 мМ Hepes, pH 7,4, в течение 60 минут подвергали взаимодействию с 50-кратным молярным избытком перекрестно сшивающего агента SMPH, разбавленного из маточного раствора в ДМСО, при КТ на качающемся встряхивателе. Реакционную смесь обессоливали на колонке PD-10 (Amersham-Pharmacia Biotech). Содержащие белок фракции, элюируемые с колонки, объединяли и обессоленный дериватизованный белок фимбрий подвергали взаимодействию с подготовленным белком IL-13-C1-His. В реакции связывания белок IL-13-C1-His присутствовал в двукратном молярном избытке по сравнению с дериватизованными фимбриями типа-1 E. coli. Реакция связывания продолжалась в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ и, кроме того, на Вестерн-блоте.
Иммунизация мышей IL-13-C1-His, связанным с белком капсида Qβ
Самок мышей Balb/c вакцинировали IL-13-C1-His, связанным с VLP, без добавления адъювантов. 25 мкг общего белка в каждом образце разводили в PBS до 200 мкл и инъецировали подкожно (100 мкл с двух сторон брюшка) в 0 день и 14 день. У мышей брали кровь из ретроорбитальной области на 31 день и их сыворотку анализировали с использованием IL-13-специфичного ELISA.
ПРИМЕР 9
Клонирование, экспрессия, очистка и связывание эотаксина с cys-содержащей аминокислотной последовательностью линкера
Мышиный эотаксин рекомбинантно экспрессировали с аминокислотным линкером C1, слитым с его C-концом. Указанный линкер содержал один остаток цистеина для связывания с VLP.
Конструирование pmEo-C1 и pmHisEo-C1
MCS pET22b(+) (Novagen, Inc.) меняли на GTTTAACTTTAAGAAGGAGATATACATATGGATCCGGCTAGCGCTCGAGGGTTTAAACGGCGGCCGCATGCACC заменой исходной последовательности от сайта NdeI до сайта XhoI отжигаемыми олигонуклеотидами primerMCS-1F и primerMCS-1R (отжигание в 15 мМ трис-HCl-буфере, pH 8). Полученную в результате плазмиду назвали pMod00, и она имела сайты рестрикции NdeI, BamHI, NheI, XhoI, PmeI и NotI в своем MCS. Отжигаемую пару олигонуклеотидов Bamhis6-EK-Nhe-F и Bamhis6-EKNhe-R и отжигаемую пару олиго1F-C-глицин-линкер и олиго1R-C-глицин-линкер вместе лигировали в расщепленную BamHI-NotI плазмиду pMod00, чтобы получить pModEC1, которая имела N-концевую гексагистидиновую метку, сайт расщепления энтерокиназой и C-концевой аминокислотный глициновый линкер, содержащий один остаток цистеина. Эотаксин мыши амплифицировали из ATCC-клона (номер в ATCC 3148394) в ПЦР, используя следующие праймеры: mEotaxin-F, Nhe-mEotaxin-F и mEotaxin-Xho-R. mEotaxin-F имел внутренний сайт NdeI, Nhe-mEotaxin-F имел внутренний сайт NheI и mEotaxin-Xho-R имел внутренний сайт XhoI. Продукт ПЦР с парой праймеров mEotaxin-F и mEotaxin-Xho-R расщепляли NdeI и XhoI и лигировали в pModEC1, расщепленную такими же ферментами. Полученную плазмиду назвали pmEo-C1, и она кодирует слитый белок, состоящий из эотаксина и линкера, содержащего цистеин, на своем C-конце. Продукт ПЦР с парой праймеров Nhe-mEotaxin-F и mEotaxin-Xho-R расщепляли NheI и XhoI и лигировали в pModEC1, расщепленную такими же ферментами. Полученную в результате плазмиду назвали pHismEo-C1, и она кодирует слитый белок, состоящий из N-концевой His-метки, за которой следует сайт расщепления энтерокиназой, эотаксин и цистеиновый линкер.
Для реакции ПЦР использовали 15 пмоль каждого олигонуклеотида и 1 нг ДНК-матрицы в 50 мкл реакционной смеси (2 единицы полимеразы PFX, 0,3 мМ dNTP и 2 мМ MgSO4). Температурные циклы представляли собой следующее: 94°C в течение 2 минут; затем 30 циклов 94°C (30 секунд), 60°C (30 секунд), 68°C (30 секунд) и затем 68°С в течение 2 минут. Все другие стадии осуществляли согласно стандартным протоколам молекулярной биологии.
Последовательности олигонуклеотидов:

Экспрессия pmEo-C1
Компетентные клетки E. coli BL21 (DE3) трансформировали плазмидой pmEo-C1. Отдельные колонии из чашек с агаром, содержащим ампициллин (Amp), размножали в жидкой культуре (SB со 150 мМ MOPS, pH 7,0, 100 мкг/мл Amp, 0,5% глюкозы) и инкубировали при 30°C в течение ночи и встряхивании 220 об/мин. Затем в 1 л SB (150 мМ MOPS; pH 7,0; 100 мкг/мл Amp) высевали ночную культуру в разведении 1:50 об./об. и выращивали при 30°C и встряхивании 150 об/мин до OD600=1,7. Экспрессию индуцировали 1 мМ IPTG. Клетки собирали через 9 часов индукции центрифугированием при 6000 об/мин в течение 5 минут. Осадок клеток суспендировали в лизирующем буфере (10 мМ Na2HPO4, 30 мМ NaCl, 10 мМ EDTA и 0,25% твин-20) с 0,8 мг/мл лизоцима, обрабатывали ультразвуком и обрабатывали бензоназой. После центрифугирования с использованием RCF 48000 в течение 20 минут надосадок разделяли в 16% ПААГ-геле и экспрессию эотаксина подтверждали с использованием антитела против мышиного эотаксина (R&D system) на Вестерн-блоте (фиг.12). Результаты ясно свидетельствуют об экспрессии эотаксина-C1, который разгоняется при ожидаемой молекулярной массе 8,8 кД.
Последовательности белка мышиного эотаксин-C1 и мышиного His-эотаксин-C1 транслировали с последовательностей кДНК.
Мышиный эотаксин-C1:

Мышиный His-эотаксин-C1:
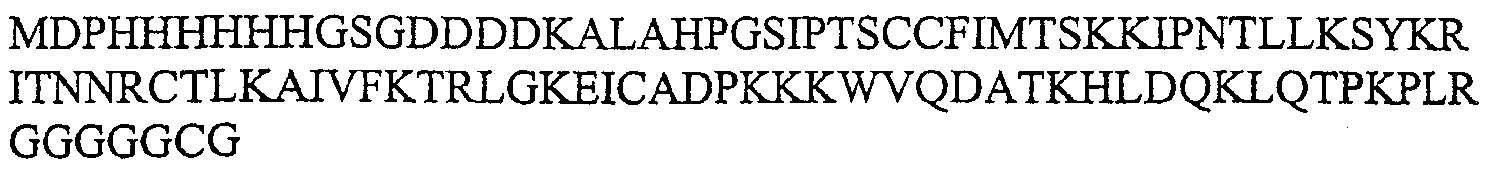
Связывание мышиного эотаксин-C1 с белком капсида Qβ
Раствор объемом 1,48 мл капсидного белка Qβ в концентрации 6 мг/мл в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 60 минут при 25°C подвергали взаимодействию с 14,8 мкл SMPH (Pierce) (из 100 мМ маточного раствора, растворенного в ДМСО). Затем реакционный раствор дважды диализовали в течение 3 часов против 2 л 20 мМ Hepes, 150 мМ NaCl, pH 7,0 при 4°C. 1,3 мл раствора мышиного белка эотаксин-C1 в концентрации 3,6 мг/мл в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 1 часа при 25°C подвергали взаимодействию с 9,6 мкл TCEP (Pierce) (из 36 мМ маточного раствора, растворенного в H2O). Затем 130 мкл дериватизованного и подвергнутого диализу Qβ подвергали взаимодействию с 129 мкл восстановленного эотаксин-C1 в 241 мкл 20 мМ Hepes, 150 мМ NaCl, pH 7,0, в течение ночи при 25°C. Вестерн-блот-анализ с использованием антитела против Qβ и антитела против эотаксина показал ковалентное связывание эотаксина с Qβ.
B. Иммунизация мышей эотаксином-C1 мыши, связанным с белком капсида Qβ
Самок мышей Balb/c вакцинировали мышиным эотаксином-C1, связанным с белком капсида Qβ, без добавления адъювантов. 25 мкг общего белка из каждого образца разводили в PBS до 200 мкл и инъецировали подкожно (100 мкл с двух сторон брюшка) в 0 день и 14 день. У мышей брали кровь из ретроорбитальной области на 31 день, и их сыворотку анализировали с использованием специфичного в отношении к эотаксину ELISA.
C. ELISA
Планшеты для ELISA покрывали мышиным эотаксином-C1 в концентрации 5 мкг/мл. Планшеты блокировали и затем инкубировали с серийными разведениями сыворотки мышей. Связанные антитела выявляли с помощью меченного ферментом антитела против IgG мыши. В качестве контроля также тестировали полученные до иммунизации сыворотки тех же самых мышей.
ПРИМЕР 10
Клонирование и экспрессия интерлейкина 5 (IL-5) с N-концевым аминокислотным линкером, содержащим остаток цистеина для связывания с VLP и фимбриями
A. Клонирование IL-5 для экспрессии в виде телец включения в E. coli
IL-5 амплифицировали из ATCC-клона (pmIL5-4G; номер ATCC: 37562) в ПЦР с использованием следующих двух праймеров: Spelinker3-F1 (SEQ ID NO:340) и Il5StopXho-R (SEQ ID NO:342). Продукт данной ПЦР использовали в качестве матрицы для второй ПЦР с праймерами SpeNlinker3-F2 (SEQ ID NO:341) и Il5StopXho-R. Вставку вылепляли SpeI и NotI. Вставку лигировали в вектор, производный вектора pET (вектор pMODEC3-8), предварительно расщепленный NheI и NotI (не дефосфорилирован), и трансформировали клетки E. coli TG1. Конструкция IL5, созданная клонированием в векторе pMODEC3-8, содержит на своем N-конце гексагистидиновую метку, за которой следует сайт энтерокиназы, N-концевой аминокислотный линкер гамма 3, содержащий остаток цистеина, фланкированный с C-конца последовательностью AS, а с N-конца - последовательностью ALV, и зрелая форма гена IL-5. Белок, высвобождаемый при расщеплении энтерокиназой, назван «мышиный C-IL-5-E» (SEQ ID NO:332). Плазмидной ДНК полученного в результате клона pMODC6-IL5.2 (также называемого pMODC6-IL5), последовательность которого подтверждена ДНК-секвенированием, трансформировали E. coli, штамм BL21.
Клон pMODC6-IL5/BL21 выращивали в течение ночи в 5 мл LB, содержащей 1 мг/л ампициллина. 2 мл данной культуры разбавляли в 100 мл подходящего бульона (TB), содержащего 1 мг/л ампициллина. Культуру индуцировали добавлением 0,1 мл 1,0 М раствора изопропил-β-D-тиогалактопиранозида (IPTG), когда культура достигала оптической плотности OD600=0,7. Каждые 2 час брали образцы объемом 10 мл. Образцы центрифугировали в течение 10 мин при 4000 x g. Осадок ресуспендировали в 0,5 мл лизирующего буфера, содержащего 50 мМ трис-HCl, 2 мМ EDTA, 0,1% тритон X-100 (pH 8). После добавления 20 мкл лизоцима (40 мг/мл) и после инкубации пробирки в течение 30 мин при 4°C клетки обрабатывали ультразвуком в течение 2 мин. Добавляли 100 мкл 50 мМ раствора MgCl2 и 1 мл бензоназы. Затем клетки инкубировали 30 мин при комнатной температуре и центрифугировали 15 мин при 13000 x g.
Надосадок отбрасывали, а осадок кипятили в течение 5 мин при 98°C в 100 мкл буфера для нанесения с SDS. 10 мкл образцов в буфере для нанесения анализировали в SDS-ПААГ в восстанавливающих условиях. На геле ясно видна экспрессия конструкции IL-5. Образцы наносили на гель следующим образом: дорожка M: маркер (NEB, предварительно окрашенный маркер для широкого диапазона). Дорожка 1: клеточный экстракт 1 мл культуры перед индукцией. Дорожка 2: клеточный экстракт 1 мл культуры через 4 час после индукции.
B. Клонирование IL-5 для экспрессии в клетках млекопитающих (HEK-293T)
a) IL-5, слитый своим N-концом с аминокислотным линкером, содержащим остаток цистеина, и слитый своим C-концом с фрагментом Fc
Матрицу, описанную в (A) (ATCC-клон 37562), использовали для клонирования следующей конструкции. Плазмиду pMODB1-IL5 (производную pET) расщепляли BamHI/XhoI, получая небольшой фрагмент, кодирующий IL5, слитый с N-концевым аминокислотным линкером, содержащим цистеин. Полученный фрагмент лигировали в вектор pCEP-SP-XA-Fc*(Δho), который был предварительно расщеплен BamHI и XhoI. Продукт лигирования путем электропорации вводили в штамм TG1 E. Coli и плазмидную ДНК полученного в результате клона pCEP-SP-IL5-Fc.2, последовательность которого подтверждали секвенированием ДНК, использовали для трансфекции клеток HEK-293T. Полученная в результате конструкция IL-5, кодируемая данной плазмидой, имела аминокислотную последовательность ADPGCGGGGGLA, слитую с N-концом последовательности зрелого IL-5. Указанная последовательность содержит последовательность аминокислотного линкера GCGGGGG, содержащего цистеин, и фланкированного аминокислотами, вводимыми во время процедуры клонирования. Белок IL-5, высвобождаемый при расщеплении слитого белка фактором-Xa, в дальнейшем называется «мышиный C-IL-5-F» (SEQ ID NO:333).
После трансфекции и селекции на пиромицине надосадок культуры анализировали на Вестерн-блоте, используя анти-His-антитело (мыши) и антитело против IgG мыши, конъюгированное с пероксидазой хрена. Антитело против IgG мыши, конъюгированное с пероксидазой хрена, также выявляло Fc-слитые белки. Очистку белка осуществляли аффинной хроматографией на белок-A-смоле. Результаты ясно свидетельствуют об экспрессии конструкции IL-5.
На Вестерн-блот наносили следующие образцы: дорожка 1: надосадок культуры HEK, экспрессирующей IL5-Fc (20 мкл). SDS-ПААГ-электрофорез проводили в восстанавливающих условиях. Дорожка 2: надосадок культуры HEK, экспрессирующей IL13-Fc (20 мкл). SDS-ПААГ-электрофорез проводили в невосстанавливающих условиях. Дорожка 3: надосадок культуры HEK, экспрессирующей IL5-Fc (20 мкл). SDS-ПААГ-электрофорез проводили в невосстанавливающих условиях.
B. IL-5, клонированный с GST (глутатион-S-трансфераза) и аминокислотным линкером, содержащим остаток цистеина, слитым с его N-концом
IL-5 (ATCC 37562) амплифицировали с праймерами Nhe-link1-IL13-F и IL5StopXho-R. После расщепления NheI и XhoI вставку лигировали в pCEP-SP-GST-EK, которую предварительно расщепляли NheI и XhoI. Полученную в результате плазмиду pCEP-SP-GST-IL5 секвенировали и использовали для трансфекции клеток HEK-293T. Полученная в результате конструкция IL-5, кодируемая данной плазмидой, имела аминокислотную последовательность LACGGGGG, слитую с N-концом последовательности зрелого IL-5. Указанная последовательность содержит последовательность аминокислотного линкера ACGGGGG, содержащего остаток цистеина и фланкированного дополнительными аминокислотами, введенными во время процедуры клонирования. Белок, высвобождаемый при расщеплении энтерокиназой, в дальнейшем называется «мышиный C-IL-5-S» (SEQ ID NO:334). Очистку полученного в результате белка осуществляли аффинной хроматографией на аффинной смоле с глутатионом.
C. Связывание мышиного C-IL-5-F или мышиного C-IL-5-S с белком капсида Qβ
Раствор 120 мкМ капсидного белка Qβ в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 30 минут при 25°C подвергали взаимодействию с 25-кратным молярным избытком SMPH (Pierce), разведенным из маточного раствора в ДМСО, на качающемся встряхивателе. Затем реакционный раствор дважды диализовали в течение 2 часов против 1 л 20 мМ Hepes, 150 мМ NaCl, pH 7,2, при 4°C. Затем после диализа реакционную смесь Qβ подвергали взаимодействию с раствором мышиного C-IL-5-F или мышиного C-IL-5-S (конечные концентрации: 60 мкМ белок капсида Qβ, 60 мкМ мышиный C-IL-5-F или мышиный C-IL-5-S) в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ.
D. Связывание мышиного C-IL-5-F или мышиного C-IL-5-S с белком капсида fr
Раствор 120 мкМ капсидного белка fr в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 30 минут при 25°C подвергали взаимодействию с 25-кратным молярным избытком SMPH (Pierce), разведенным из маточного раствора в ДМСО, на качающемся встряхивателе. Затем реакционный раствор дважды диализовали в течение 2 часов против 1 л 20 мМ Hepes, 150 мМ NaCl, pH 7,2, при 4°C. Затем после диализа реакционную смесь fr подвергали взаимодействию с раствором мышиного C-IL-5-F или мышиного C-IL-5-S (конечные концентрации: 60 мкМ белок капсида fr, 60 мкМ мышиный C-IL-5-F или мышиный C-IL-5-S) в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ.
E. Связывание мышиного C-IL-5-F или мышиного C-IL-5-S в растворе с HBcAg-Lys-2cys-Mut
Раствор 120 мкМ капсида HBcAg-Lys-2cys-Mut в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 30 минут при 25°C подвергали взаимодействию с 25-кратным молярным избытком SMPH (Pierce), разведенным из маточного раствора в ДМСО, на качающемся встряхивателе. Затем реакционный раствор дважды диализовали в течение 2 часов против 1 л 20 мМ Hepes, 150 мМ NaCl, pH 7,2, при 4°C. Затем после диализа реакционную смесь HBcAg-Lys-2cys-Mut подвергали взаимодействию с раствором мышиного C-IL-5-F или мышиного C-IL-5-S (конечные концентрации: 60 мкМ HBcAg-Lys-2cys-Mut, 60 мкМ мышиный C-IL-5-F или мышиный C-IL-5-S) в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ.
F. Связывание мышиного C-IL-5-F или мышиного C-IL-5-S в растворе с фимбриями
Раствор 125 мкМ фимбрий типа-1 E. coli в 20 мМ Hepes, pH 7,4, в течение 60 минут подвергали взаимодействию с 50-кратным молярным избытком перекрестно сшивающего агента SMPH, разбавленного из маточного раствора в ДМСО, при КТ на качающемся встряхивателе. Реакционную смесь обессоливали на колонке PD-10 (Amersham-Pharmacia Biotech). Содержащие белок фракции, элюируемые с колонки, объединяли и обессоленный дериватизованный белок фимбрий подвергали взаимодействию с раствором мышиного C-IL-5-F или мышиного C-IL-5-S (конечные концентрации: 60 мкМ фимбрии, 60 мкМ мышиный C-IL-5-F или мышиный C-IL-5-S) в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ.
ПРИМЕР 11
Клонирование, экспрессия и очистка IL-13 для связывания с VLP и фимбриями
A. Клонирование и экспрессия интерлейкина 13 (IL-13) с N-концевым аминокислотным линкером, содержащим остаток цистеина для связывания с VLP и фимбриями
a) Клонирование мышиного IL-13 (HEK-293T) для экспрессии в клетках млекопитающих в виде Fc-слитого белка
ДНК для клонирования IL-13 выделяли с помощью ОТ-ПЦР из активированных in vitro спленоцитов, которые получали следующим образом: T-клетки CD4+ выделяли из клеток селезенки мыши и инкубировали 3 дня в IMDM (+5% FCS+10 нг/мл IL4) в 6-луночных планшетах, предварительно покрытых анти-CD3- и анти-CD28-антителами. РНК из указанных клеток использовали для того, чтобы амплифицировать IL-13, в одностадийной ОТ-ПЦР (набор для одностадийной ПЦР Qiagen). Праймер XhoIL13-R использовали для обратной транскрипции РНК, праймеры NheIL13-F (SEQ ID NO:338) и XhoIL13-R (SEQ ID NO:339) использовали для ПЦР-амплификации кДНК IL13. Амплифицированную кДНК IL13 лигировали в вектор pMOD, используя сайты рестрикции NheI/XhoI (получая вектор pMODB1-IL13). pMODB1-IL13 расщепляли BamHI/XhoI и фрагмент, содержащий IL13, лигировали в вектор pCEP-SP-XA-Fc* (Δho), аналог pCEP-SP-XA-Fc*, где сайт XhoI на конце последовательности Fc был удален, который предварительно был расщеплен BamHI/XhoI. Плазмиду, полученную в результате указанного лигирования (pCEP-SP-IL13-Fc), секвенировали и использовали для трансфекции клеток HEK-293T. Полученная в результате конструкция IL-13, кодируемая данной плазмидой, имела аминокислотную последовательность ADPGCGGGGGLA, слитую с N-концом последовательности зрелого IL-13. Указанная последовательность содержит последовательность аминокислотного линкера GCGGGGG, фланкированную дополнительными аминокислотами, введенными во время процедуры клонирования. IL13-Fc можно очистить с использованием белок-A-смолы из надосадка клеток, трансфицированных pCEP-SP-IL13-Fc. Результат экспрессии приведен в примере 10 в отношении описания образцов. Зрелый IL-13, слитый своим N-концом с вышеуказанной аминокислотной последовательностью, высвобождается при расщеплении слитого белка фактором-Xa, с получением белка, называемого в дальнейшем «мышиным C-IL-13-F» и имеющим последовательность SEQ ID NO:328. Результат ясно свидетельствует об экспрессии конструкции IL-13.
b) Клонирование мышиного IL-13 (HEK-293T) для экспрессии в клетках млекопитающих с GST (глутатион-S-трансфераза), слитой с его N-концом
кДНК, используемую для клонирования IL-13 с N-концевой GST, получали из кДНК активированных TH2 T-клеток, как описано выше в (a). IL-13 амплифицировали из указанной кДНК, используя праймеры Nhelink1IL13-F и IL13StopXhoNot-R. Продукт ПЦР расщепляли NheI и XhoI и лигировали в вектор pCEP-SP-GST-EK, предварительно расщепленный NheI/XhoI. Плазмиду, которую можно было выделить в результате лигирования (pCEP-SP-GST-IL13), использовали для трансфекции клеток HEK-293T. Полученная в результате конструкция IL-13, кодируемая данной плазмидой, имела аминокислотную последовательность LACGGGGG, слитую с N-концом последовательности зрелого IL-13. Указанная последовательность содержит последовательность аминокислотного линкера ACGGGGG, фланкированную дополнительными аминокислотами, вводимыми во время процедуры клонирования. Надосадок культуры клеток, трансфицированных pCEP-SP-GST-IL13, содержал слитый белок GST-IL-13, который можно очистить аффинной хроматографией на глутатионе согласно стандартным протоколам. Зрелый IL-13, слитый своим N-концом с вышеуказанной аминокислотной последовательностью, высвобождается при расщеплении слитого белка энтерокиназой с получением белка, в дальнейшем называемого «мышиный C-IL-13-S» и имеющего последовательность SEQ ID NO:329.
B. Связывание мышиного C-IL-13-F, мышиного C-IL-13-S с белком капсида Qβ
Раствор 120 мкМ капсида Qβ в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 30 минут при 25°C подвергали взаимодействию с 25-кратным молярным избытком SMPH (Pierce), разведенным из маточного раствора в ДМСО, на качающемся встряхивателе. Затем реакционный раствор дважды диализовали в течение 2 часов против 1 л 20 мМ Hepes, 150 мМ NaCl, pH 7,2, при 4°C. После диализа реакционную смесь Qβ подвергали взаимодействию с раствором мышиного C-IL-13-F или мышиного C-IL-13-S (конечные концентрации: 60 мкМ белок капсида Qβ, 60 мкМ мышиный C-IL-13-F или мышиный C-IL-13-S) в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ.
C. Связывание мышиного C-IL-13-F или мышиного C-IL-13-S с белком капсида fr
Раствор 120 мкМ капсидного белка fr в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 30 минут при 25°C подвергали взаимодействию с 25-кратным молярным избытком SMPH (Pierce), разведенным из маточного раствора в ДМСО, на качающемся встряхивателе. Затем реакционный раствор дважды диализовали в течение 2 часов против 1 л 20 мМ Hepes, 150 мМ NaCl, pH 7,2, при 4°C. После диализа реакционную смесь fr подвергали взаимодействию с раствором мышиного C-IL-13-F или мышиного C-IL-13-S (конечные концентрации: 60 мкМ белок капсида fr, 60 мкМ мышиный C-IL-13-F или мышиный C-IL-13-S) в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ.
D. Связывание мышиного C-IL-13-F или мышиного C-IL-13-S в растворе с HBcAg-Lys-2cys-Mut
Раствор 120 мкМ капсида HBcAg-Lys-2cys-Mut в 20 мМ Hepes, 150 мМ NaCl, pH 7,2, в течение 30 минут при 25°C подвергали взаимодействию с 25-кратным молярным избытком SMPH (Pierce), разведенным из маточного раствора в ДМСО, на качающемся встряхивателе. Затем реакционный раствор дважды диализовали в течение 2 часов против 1 л 20 мМ Hepes, 150 мМ NaCl, pH 7, 2, при 4°C. После диализа реакционную смесь HBcAg-Lys-2cys-Mut подвергали взаимодействию с раствором мышиного C-IL-13-F или мышиного C-IL-13-S (конечные концентрации: 60 мкМ HBcAg-Lys-2cys-Mut, 60 мкМ мышиный C-IL-13-F или мышиный C-IL-13-S) в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ.
E. Связывание мышиного C-IL-13-F или мышиного C-IL-13-S в растворе с фимбриями
Раствор 125 мкМ фимбрий типа-1 E. coli в 20 мМ Hepes, pH 7,4, в течение 60 минут подвергали взаимодействию с 50-кратным молярным избытком перекрестно сшивающего агента SMPH, разбавленного из маточного раствора в ДМСО, при КТ на качающемся встряхивателе. Реакционную смесь обессоливали на колонке PD-10 (Amersham-Pharmacia Biotech). Содержащие белок фракции, элюируемые с колонки, объединяли и обессоленный дериватизованный белок фимбрий подвергали взаимодействию с раствором мышиного C-IL-13-F или мышиного C-IL-13-S (конечные концентрации: 60 мкМ фимбрии, 60 мкМ мышиный C-IL-13-F или мышиный C-IL-13-S) в течение четырех часов при 25°C на качающемся встряхивателе. Продукты связывания анализировали в SDS-ПААГ.
Теперь на основании полного описания данного изобретения с некоторыми подробностями с использованием иллюстраций и примеров в целях четкого понимания для специалиста в данной области будет очевидно, что то же самое можно осуществить путем модификации или изменения изобретения в широких и эквивалентных пределах условий, композиций и других параметров, не затрагивая объема изобретения или какого-либо конкретного его варианта, и что предполагается, что такие модификации или изменения входят в объем прилагаемой формулы изобретения.
Все публикации, патенты и заявки на выдачу патентов, упоминаемые в данном описании, являются показателем уровня специалиста в данной области, к которой данное изобретение относится, и включены в виде ссылки в такой же степени, как в случае, когда отдельно указано, что каждая отдельная публикация, патент или заявка на выдачу патента включена в виде ссылки.
Реферат
Изобретение относится к областям молекулярной биологии, вирусологии, иммунологии и медицины. Композиция содержит вирусоподобную частицу и по меньшей мере один связанный с ней белок или пептид IL-5, IL-13 или человеческого эотоксина. Также раскрыты способ ее получения и применения, фармацевтическая композиция и композиции вакцины, содержащие такую композицию. Композиции применимы для получения вакцин для лечения аллергических заболеваний с эозинофильным компонентом. Кроме того, композиции особенно применимы для эффективной индукции специфичных для аутоантигенов иммунных ответов. Изобретение может быть использовано в медицине. 9 н. и 31 з.п. ф-лы, 12 ил., 1 табл.

Комментарии