Модифицированные вирусоподобные частицы вируса мозаики огурца - RU2706970C2
Код документа: RU2706970C2
Чертежи





















































Описание
Согласно настоящему изобретению предложены вирусоподобные частицы (ВПЧ) поражающего растения вируса мозаики огурца (Cucumber Mosaic Virus, ВМО) и в частности, модифицированные ВПЧ ВМО, содержащие эпитопы Th-клеток, в частности универсальные эпитопы Th-клеток. Помимо этого, указанные модифицированные ВПЧ предпочтительно могут быть использованы в качестве платформы для создания вакцин, для индукции иммунных ответов, в частности гуморальных ответов, на антигены, связанные с указанными модифицированными ВПЧ. Наличие эпитопов Th-клеток, в частности универсальных эпитопов Th-клеток, привело к дополнительному усилению индуцированного иммунного ответа.
ОБЛАСТЬ ТЕХНИКИ
В течение последних трех десятилетий технология, включающая применение вирусоподобных частиц (ВПЧ), интенсивно развивалась и стала общепринятой, особенно в области разработки вакцин (Zeltins A, Mol Biotechnol (2013) 53: 92-107). Все возрастающий интерес к указанным ВПЧ был преимущественно обусловлен успешной разработкой и внедрением поверхностного антигена вируса гепатита В (ВГВ) и белка капсида L1 вируса папилломы человека (ВПЧ) в качестве коммерческих вакцин против гепатита В и вызванного ВПЧ рака шейки матки, соответственно. Более того, вирусоподобные частицы были описаны как иммунологические носители, которые способны индуцировать сильный иммунный ответ на конъюгированные антигены (Jennings GT and Bachmann MF, Annu Rev Pharmacol Toxicol (2009) 49: 303-26, Jennings GT and Bachmann MF, Biol Chem (2008) 389: 521-536, WO 2002/056905, WO 2003/024481). Данное свойство привело к разработке нескольких вакцин-кандидатов на основе ВПЧ, которые были включены в различные этапы клинических исследований с целью разработки вакцин на основе ВПЧ для медицинских и ветеринарных целей в ближайшем будущем (Liu F, et al., Research in Veterinary Science (2012) 93: 553-559; Roldao A., et al., Expert Review of Vaccines (2010) 9: 1149-1176).
Разработанные до настоящего времени ВПЧ были получены на основе вирусов микроорганизмов, растений, насекомых или млекопитающих. Помимо упомянутых выше систем ВПЧ, ВПЧ, полученные из вирусов растений, недавно привлекли внимание, главным образом благодаря тому, что растения являются экономичной и быстрой альтернативной платформой для получения вакцин на основе ВПЧ ввиду их способности обеспечивать особые посттрансляционные модификации, экономической эффективности, скорости и масштабируемости производства (Chen Q and Lai Н, Human Vaccines & Immunotherapeutics (2013) 9: 26-49; Zeltins A, Mol Biotechnol (2013) 53: 92-107).
Вирус мозаики огурца (ВМО (CMV), семейство Bromoviridae, род Cucumovirus) представляет собой линейный изодиаметрический вирус растений с плюс-цепью РНК, имеющий чрезвычайно широкий спектр хозяев. Геном указанного вируса состоит из трех одноцепочечных РНК (РНК1, РНК2 и РНК3), при этом ген оболочки белка (CP) присутствует в геномной РНК3 (приблизительно 2200 п.о.) и в субгеномной РНК4 (приблизительно п.о.). Капсид содержит 180 копий одной молекулы белка массой приблизительно 26 кДа. Существует множество различных штаммов ВМО, которые связанны с различными симптомами, присутствующими у растения-хозяина, например, штамм ВМО-В, штамм ВМО-С, штаммы BMO-D, штаммы BMO-L, штамм BMO-S, штамм ВМО-Т, штамм BMO-WL, штаммы BMO-V, штамм BMO-Fny, штамм ВМО-Ix, штамм BMO-Q, штамм BMO-R или т.п. (

Недавно были сконструированы химерные формы ВМО для функционирования в качестве системы презентации и для экспрессии на их наружной поверхности эпитопов, полученных из вируса гепатита С (ВГС). В частности, была сконструирована псевдорекомбинантная форма ВМО, BMO-D/S, для переноса геномной РНК3 из штамма BMO-S и РНК1 и РНК2 из штамма BMO-D. Указанная система способна вызывать развитие симптомов вирусной инфекции, таких как легкая мозаика и посветление жилок, в растениях табака Xanthi после инокуляции. Ген CP затем был модифицирован в разных положениях, чтобы кодировать эпитоп вируса гепатита С (ВГС). Выбранный пептид представлял собой так называемый мимеотоп R9, синтетический пептид, полученный из многих последовательностей гипервариабельной области 1 (HVR1) белка оболочки Е2 ВГС. Образцы сыворотки крови от пациентов с хроническим гепатитом С проявляли значительную иммунореактивность в отношении необработанных экстрактов растений, инфицированных одной из выбранных модифицированных псевдорекомбинантных химерных форм ВМО. В этой связи было высказано предположение, что указанные системы могут быть подходящими носителями, позволяющими разрабатывать перспективные стратегии пероральной иммунизации. Последнее будет соответствовать концепции, в основе которой лежит использование растений как возможных биореакторов так называемых нутрицевтиков, поскольку указанные системы активно реплицируются в растениях и, следовательно, могут быть использованы в качестве съедобных вакцин, поскольку сельдерей, салат-латук, огурец, помидор, морковь, перец и бананы являются хозяевами ВМО (Natilla A, et al., Arch Virol (2004) 149: 137-154; Piazzolla G, et al., J Clin Immunol (2005) 25: 142-152; Nuzzaci M, et al., Arch Virol (2007) 152: 915-928; Nuzzaci M, et al., Journal of Virological Methods (2009) 155: 118-121; Nuzzaci M, et al., Journal of Virological Methods (2010) 165: 211-215; Piazzolla G, et al., J Clin Immunol (2012) 32: 866-876).
Мимеотопы R9 были встроены в различные положения в пределах гена CP в РНК3 BMO-S (AF063610, www.dpvweb.net). Для встраивания одного отдельного мимеотопа R9 в указанный ген CP нуклеотидная последовательность мимеотопа R9 была встроена в положения 253, 475, 529 указанного гена CP, в то время как для встраивания двух мимеотопов R9 нуклеотидная последовательность мимеотопа R9 была встроена в положения 392 и 529. Конечные продукты представляли собой химерные частицы ВМО, несущие на своей внешней поверхности 180 или 360 копий мимеотопа R9 для каждой вирусной частицы. (Natilla A, et al., Arch Virol (2004) 149: 137-154; Piazzolla G, et al., J Clin Immunol (2005) 25: 142-152; Nuzzaci M, et al., Arch Virol (2007) 152: 915-928; Nuzzaci M, et al., Journal of Virological Methods (2009) 155: 118-121; Nuzzaci M, et al., Journal of Virological Methods (2010) 165: 211-215; Piazzolla G, et al., J Clin Immunol (2012) 32: 866-876).
Было указано, что выбор положений для вставки мимеотопа R9 в РНК3 BMO-S основывался на учете ряда существенных факторов: i) необходимости защиты N-концевой области белка оболочки ВМО (содержащей большое количество основных аминокислот, известной как внутренний R-домен, который участвует во взаимодействиях белок-РНК, стабилизирующих ВМО (Wikoff WR, et al., Virology (1997) 232: 91-97)), характеризующейся присутствием необычной N-концевой спирали, которая имеет дополнительную стабилизирующую функцию в капсиде (Smith TJ, et al., J Virol (2000) 74: 7578-7686)); ii) поверхностного расположения чужеродного эпитопа для повышения вероятности его потенциальной иммуногенности; iii) доступности путей мутагенеза, обеспечивающих получение модифицированных клонов. Исходя из этих соображений, основные усилия были сосредоточены на последовательности аминокислот с 70 по 192 положение и соответствующих областях нуклеотидной последовательности, как указано выше. Полученные таким способом химерные ВМО сохраняли способность к системному распространению в растении-хозяине, что является обязательной целью при создании потенциального растительного вируса-носителя для экспрессии чужеродного гена в растениях. Результаты исследований методами ИФА и иммунной электронной микроскопии (ИЭМ) показали, что мимеотоп R9 был экспонирован, как планировалось, в правильном положении (Natilla A, et al., Arch Virol (2004) 149: 137-154).
Помимо этого, недавно была описана система экспрессии на основе вируса мозаики огурца для производства вакцин, специфичных в отношении цирковируса свиней (PCV) (Gellert A, et al., PLoS ONE (2012) 7(12): e52688). В частности, эпитопы белка капсида цирковируса свиней 2 типа (PCV2) были встроены в белок оболочки штамма R растительного вируса мозаики огурца (ВМО) после аминокислоты в положении 131. Рекомбинантные клоны исследовали для оценки их инфекционности и стабильности на различных видах Nicotiana, и выделяли стабильные частицы рекомбинантного вируса. Были проведены исследования способности частиц связываться с антителами свиньи, индуцированными PCV, и указанные частицы использовали для индукции специфичных антител у мышей и свиней. Полученные результаты показали, что эпитопы PCV, экспрессированные на поверхности ВМО, были распознаны антителами свиньи, и что указанные эпитопы также могли индуцировать PCV-специфичный гуморальный ответ. Эксперименты с иммунизацией с использованием PCV2, проведенные у иммунизированных свиней, выявили частичную защиту от инфекции.
Эпитопы белка капсида PCV2 встраивали в белок оболочки вируса мозаики огурца (ВМО) в трех стабильных точках введения эпитопа ВМО, зарегистрированных в настоящее время (Nuzzaci М, et al., Arch Virol (2007) 152: 915-928; Vitti A, et al., J Virol Methods (2010) 169: 332-340). Эпитопы, встроенные в этих точках, не блокировали размножение ВМО и распространение в растениях на большое расстояние. Два из указанных эпитопов экспрессируются на внешней поверхности вирионов, и третий эпитоп обращен внутрь вириона. Существует электростатическое ограничение для экспрессии эпитопов, обращенных внутрь вириона, в связи с тем, что возможна экспрессия только эпитопов с положительным зарядом, которые не препятствуют связыванию РНК с внутренней поверхностью капсида ВМО. В частности, первая точка вставки находится в положении 83-84 аминокислотной последовательности и в конце петли βВβС белка CP ВМО. Встроенные эпитопы экспрессируются на поверхности вирионов ВМО. Вторая точка вставки находится в положении 131-132 аминокислотной последовательности и в середине петли βE-αEF белка CP ВМО. Встроенные эпитопы также экспрессируются на поверхности вирионов ВМО. Третья точка вставки находится в положении 176-177 аминокислотной последовательности и в середине петли βG-βH. В последнем случае вставленные эпитопы экспрессируются на внутренней поверхности вирионов ВМО.
Также было описано создание химерных вирусоподобных частиц (ВПЧ) на основе ВМО и предложено их использование в качестве вакцины для животных (Natilla, A, et al., Arch Virol (2006) 151: 1373-1386; Natilla, A, et al., Protein Expression and Purification (2008) 59: 117-121). Однако экспрессия белков капсида (CP) ВМО с помощью широко используемой стандартной системы экспрессии в Е. coli привела к получению лишь нерастворимых телец включения или очень низкому количеству растворимых белков (Xu Y, et al., Chem Commun (2008) 49-51). С другой стороны, белок оболочки (CP) штамма BMO-Fny, экспрессируемый с помощью вируса X картофеля (PVX), образовывал ВПЧ, которые служили в качестве носителей для поверхностной экспрессии различных нейтрализующих эпитопов вируса болезни Ньюкасла (NDV), экономически важного патогена домашней птицы. С этой целью эпитопы из белка слияния (F), белка гемагглютинин-нейраминидаза (NH) и тандемного пептида F-NH, генетически гибридизовали во внутреннюю петлю βH-βI (мотив 5) CP BMO-Fny (соответствующую аминокислотам с 194 по 199 положение) и экспрессировали с помощью векторов PVX в растениях Nicotiana benthamiana. Полученные химерные ВПЧ ВМО морфологически неотличимы от частиц ВМО дикого типа. Помимо этого, у цыплят, иммунизированных очищенными ВПЧ NH-BMO, развивались антигенспецифичные гуморальные ответы, однако иммунизированные указанным способом цыплята не были защищены от экспериментальной иммунизации с использованием NDV (Natilla, A, et al., Arch Virol (2006) 151: 1373-1386; Natilla, A, et al., Protein Expression and Purification (2008) 59: 117-121; Chen Q and Lai H, Human Vaccines & Immunotherapeutics (2013) 9: 26-49).
Как было указано выше, экспрессия белков капсида (CP) ВМО в Е. coli привела к получению лишь нерастворимых телец включения или очень низкому количеству растворимых белков (Xu Y, et al., Chem Commun (2008) 49-51). С другой стороны, в работе Xu et al описана сборка в условиях in vitro генетически рекомбинантных белков CP ВМО в биологические нанотрубки, индуцированная двухцепочечной ДНК различной длины (Xu Y, et al., Chem Commun (2008) 49-51). С этой целью, однако, Xu et al должны были получить чистые растворимые белки CP ВМО. Указанные белки были получены с помощью рекомбинации после экспрессии белков CP в Е. coli. Способ рекомбинации включает разделение и очистку телец включения, образованных после экспрессии полноразмерного гена CP, содержащего 218 аминокислотных остатков (ID АВ008777, www.dpvweb.net), с последующим растворением телец включения с помощью денатурации и, наконец, путем повторного сворачивания денатурированного белка.
Несмотря на прогресс в разработке вакцин на основе ВПЧ все еще существует потребность в дополнительных различных системах ВПЧ. В частности, вакцины индуцируют вариабельные гуморальные ответы у иммунизированных субъектов и индивидуумов, и гуморальные ответы часто охватывают диапазон, превышающий 100-кратное отклонение. Помимо этого, некоторые вакцины, такие как вакцина против гепатита В, не вызывают надлежащего клинического ответа у некоторого количества субъектов. Известно, что нечувствительность связана с определенными молекулами ГКГС класса II, и, как полагают, неспособность индуцировать надлежащие ответы, опосредованные T-хелперами (Th), обуславливает ненадлежащие гуморальные ответы, наблюдаемые у указанных индивидуумов (Goncalves L, et al., Virology (2004) 326: 20-28). Кроме того, престарелые и пожилые пациенты способны к созданию слабого гуморального ответа в целом, и, как полагают, слабый ответ, опосредованный T-клетками, является причиной неэффективности гуморального ответа. Следовательно, вакцины, индуцирующие надлежащие ответы Th-клеток практически у всех субъектов и индивидуумов, являются важной целью в области разработки вакцин.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Неожиданно было установлено, что белки оболочки вируса мозаики огурца (ВМО) могут быть модифицированы для включения эпитопов лимфоцитов T-хелперов (Th) и предпочтительно для включения универсальных эпитопов Th-клеток. Последний факт является особенно удивительным, поскольку известно, что указанные сильные эпитопы Th-клеток вызывают агрегацию и, следовательно, как ожидается, будут препятствовать самосборке после экспрессии, приводящей к образованию ВПЧ. Помимо этого, согласно настоящему изобретению предложены не только модифицированные ВПЧ ВМО, содержащие эпитопы Th-клеток, предпочтительно универсальные эпитопы Th-клеток, и модифицированные ВПЧ ВМО согласно настоящему изобретению, а также ВПЧ ВМО дикого типа, которые были получены путем экспрессии в Е. coli, что также является неожиданным фактом, поскольку предыдущие попытки получить ВПЧ ВМО в Е. coli привели к образованию агрегатов, но не ВПЧ. Помимо этого, ВПЧ согласно настоящему изобретению служат в качестве платформы-носителя, в частности платформы для вакцин, причем антигены, иммунные ответы в отношении которых являются желательными, связаны с ВПЧ согласно настоящему изобретению. Встроенные эпитопы Th-клеток, включенные в модифицированные ВПЧ ВМО согласно настоящему изобретению, дополнительно увеличивали иммуногенность ВПЧ и приводили к увеличению общих иммунных ответов, индуцированных композициями согласно настоящему изобретению, в частности усиливали гуморальные ответы.
Следовательно, согласно первому аспекту в настоящем изобретении предложена модифицированная вирусоподобная частица (ВПЧ) вируса мозаики огурца (ВМО), причем указанная модифицированная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного модифицированного полипептида ВПЧ, причем указанный модифицированный полипептид ВМО содержит или предпочтительно состоит из: (а) полипептида ВМО, и (b) эпитопа клеток T-хелперов; при этом указанный полипептид ВМО содержит или предпочтительно состоит из: (i) аминокислотной последовательности белка оболочки ВМО; или (ii) аминокислотной последовательности, содержащей мутацию, причем указанная аминокислотная последовательность, которую мутируют, представляет собой аминокислотную последовательность белка оболочки ВМО, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и указанного белка оболочки ВМО составляет по меньшей мере 90%, предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 98% и еще более предпочтительно по меньшей мере 99%.
Согласно другому аспекту в настоящем изобретении предложена модифицированная вирусоподобная частица (ВПЧ) вируса мозаики огурца (ВМО), причем указанная модифицированная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного модифицированного полипептида ВМО, при этом указанный модифицированный полипептид ВМО содержит или предпочтительно состоит из: (а) полипептида ВМО, и (b) эпитопа клеток T-хелперов; причем указанный полипептид ВМО содержит или предпочтительно состоит из: (i) аминокислотной последовательности белка оболочки ВМО; или (ii) мутированной аминокислотной последовательности, при этом аминокислотная последовательность, которую мутируют (вносят одну или более мутаций), представляет собой аминокислотную последовательность белка оболочки ВМО, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и указанного белка оболочки ВМО составляет по меньшей мере 90%, предпочтительно по меньшей мере 95%, также еще более предпочтительно по меньшей мере 98% и также еще более предпочтительно по меньшей мере 99%; при этом указанный эпитоп клеток T-хелперов (i) гибридизован с N-концом указанного полипептида ВМО; (ii) гибридизован с C-концом указанного полипептида ВМО; (iii) замещает участок последовательных аминокислотных остатков указанного полипептида ВМО, причем идентичность последовательностей указанного замещенного участка последовательных аминокислот указанного полипептида ВМО и эпитопа клеток T-хелперов составляет по меньшей мере 15%, предпочтительно по меньшей мере 20%; или (iv) замещает N-концевую область указанного полипептида ВМО и при этом указанная замещенная N-концевая область указанного полипептида ВМО состоит из 5-15 последовательных аминокислот.
Согласно другому аспекту в настоящем изобретении предложена вирусоподобная частица (ВПЧ) вируса мозаики огурца (ВМО), причем указанная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного полипептида ВМО, содержащего или предпочтительно состоящего из: (i) аминокислотной последовательности белка оболочки ВМО; или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой аминокислотную последовательность белка оболочки ВМО, и идентичность последовательностей указанной мутированной аминокислотной последовательности, и указанного белка оболочки ВМО составляет по меньшей мере 90%, предпочтительно по меньшей мере 95%, также еще более предпочтительно по меньшей мере 98% и также еще более предпочтительно по меньшей мере 99%; и при этом указанную ВПЧ ВМО получают путем экспрессии указанного полипептида ВМО в Е. coli., и при этом предпочтительно указанную экспрессию осуществляют при температурах от 10°C до 25°C, предпочтительно при температуре 20°C.
Согласно другому аспекту в настоящем изобретении предложена композиция, содержащая модифицированную вирусоподобную частицу. Помимо этого, указанные модифицированные ВПЧ служат, предпочтительно, платформой для вакцин, для индукции иммунных ответов, в частности гуморальных ответов, на антигены, связанные с указанными модифицированными ВПЧ. Присутствие эпитопов Th-клеток, в частности универсальных эпитопов Th-клеток, привело к дополнительному увеличению индуцированного иммунного ответа.
Другие аспекты и предпочтительные варианты реализации настоящего изобретения более подробно описаны в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 Карта плазмиды pET-BMOwt. Относительные положения всех соответствующих генов и сайтов ферментов рестрикции обозначены.
Фиг. 2 Исследование экспрессии с помощью электрофореза в ДСН-ПААГ и очистка белка BMOwt в градиенте сахарозы. М - маркеры размера белка; S - растворимые белки после ультразвуковой обработки; Р - нерастворимые белки после ультразвуковой обработки; Ps - растворимые белки в осадке сульфата аммония (образец для ультрацентрифугирования в градиенте сахарозы); Рр - нерастворимые белки в осадке сульфата аммония; 1, 2, 3, 4, 5, 6 - фракции градиента сахарозы из нижней части градиентной пробирки объемом 35 мл.
Фиг. 3А Динамическое светорассеяние очищенных ВПЧ BMOwt. Размер частиц определяли с использованием Zetasizer Nano ZS (Malvern Instruments Ltd., Великобритания).
Фиг. 3В. Исследование методом электронной микроскопии очищенных ВПЧ BMOwt. Для морфологического исследования ВПЧ использовали электронный микроскоп JEM-1230 (Jeol Ltd., Токио, Япония).
Фиг. 4 Исследование методом масс-спектрометрии очищенных ВПЧ, полученных из ВМО. Исследование методом матрично-активированной лазерной десорбции/ионизации (MALDI)-TOF МС проводили на Autoflex MS (Bruker Daltonik, Германия). Для определения молекулярной массы белков (ММ) использовали калибровочный стандарт II (22,3-66,5 кДа, Bruker Daltonik).
Фиг. 4А ВМО дикого типа ("wt"); теоретическая ММ=24069; установленная ММ=24058.
Фиг. 4В BMO-Npadr; теоретическая ММ=24161 (без первого Met); установленная ММ=24160.
Фиг. 4С BMO-Ntt830; теоретическая ММ=24483 (без первого Met); установленная ММ=24477.
Фиг. 5А Динамическое светорассеяние очищенных ВПЧ BMO-Ntt830. Размер частиц определяли с использованием Zetasizer Nano ZS (Malvern Instruments Ltd., Великобритания).
Фиг. 5В Исследование методом электронной микроскопии очищенных ВПЧ ВМО-Ntt830. Для морфологического анализа ВПЧ использовали электронный микроскоп JEM-1230 (Jeol Ltd., Токио, Япония).
Фиг. 6А Динамическое светорассеяние очищенных ВПЧ BMO-Npadr. Размер частиц определяли с использованием Zetasizer Nano ZS (Malvern Instruments Ltd., Соединенное Королевство).
Фиг. 6B Исследование методом электронной микроскопии очищенных ВПЧ BMO-Npadr. Для морфологического исследования ВПЧ использовали электронный микроскоп JEM-1230 (Jeol Ltd., Токио, Япония).
Фиг. 7А Гуморальный ответ измеряли после иммунизации ВПЧ ВМО дикого типа. Группы мышей иммунизировали 10 мкг, 1 мкг или 0,1 мкг ВПЧ BMO-wt на 0 и 7 день. Титр общего специфичного IgG измеряли на 0 (до иммунизации), 7, 14 и 28 день. Группа включала 4 мышей.
Фиг. 7В Гуморальный ответ измеряли после иммунизации ВПЧ BMO-Npadr. Группы мышей иммунизировали 10 мкг, 1 мкг или 0,1 мкг ВПЧ BMO-Npadr на 0 и 7 день. Титр общего специфичного IgG измеряли на 0 (до иммунизации), 7, 14 и 28 день. Группа включала 4 мышей.
Фиг. 7С Гуморальный ответ измеряли после иммунизации ВПЧ BMO-Ntt830. Группы мышей иммунизировали 10 мкг, 1 мкг или 0,1 мкг ВПЧ BMO-Ntt830 на 0 и 7 день. Титр общего специфичного IgG измеряли на 0 (до иммунизации), 7, 14 и 28 день. Группа включала 4 мышей.
Фиг. 8А Гуморальный ответ на аллерген Fel d1 детектировали у мышей. Основной аллерген кошки Fel d1 был связан с ВМО Npadr. Мышей иммунизировали 5 мкг Fel d1-ВПЧ на 0 и 7 день. Специфичные антитела к Fel d1 измеряли в указанные моменты времени. Группа включала 5 мышей.
Фиг. 8В Гуморальный ответ на аллерген Fel d1 детектировали у мышей. Основной аллерген кошки Fel d1 был связан с ВМО Ntt830. Мышей иммунизировали 5 мкг Fel d1-ВПЧ на 0 и 7 день. Специфичные антитела к Fel d1 измеряли в указанные моменты времени. Группа включала 5 мышей.
Фиг. 9 Представлены результаты оценки гуморального ответа на пептид, полученный из α-синуклеина. Мышей иммунизировали на 0 и 14 день с использованием 20 мкг пептида, полученного из α-синуклеина, связанного с ВМО Ntt830. Титр антител, специфичных в отношении пептида, измеряли в указанные моменты времени. Группа включала 4 мышей.
Фиг. 10 Гуморальный ответ на собственный белок ИЛ-17 детектировали у мышей. Цитокин ИЛ-17 соединяли с ВМО Ntt830. Мышей иммунизировали 20 мкг ИЛ-17-ВМО Ntt830 на 0 и 14 день. ИЛ-17-специфичные антитела измеряли в указанные моменты времени. Группа включала 3 мышей.
Фиг. 11А Результаты оценки экспрессии методом электрофореза в ДСН-ПААГ и очистки белка F12H6GGC из клеток штамма Е. coli С2566, используя набор PrepEase (USB). М - маркеры размера белка; S - растворимая белковая фракция; Р - разрушенные клетки; F - проточная фракция колонки Ni-IDA (несвязанные белки); W1, W2 - промывочные фракции (2×2 мл 1 × буфер LEW), W3, W4 - промывочные фракции (2×2 мл 1 × LEW + 10 мМ имидазола); E1, Е2 - элюированные фракции (2×1,5 мл Е-буфера + 250 мМ имидазола).
Фиг. 11В Исследование методом масс-спектрометрии очищенного F12H6GGC. Вычисленная средняя масса F12H6GGC соответствует 20089,8 Да. Наблюдаемая масса 20105,3 соответствует F12H6GGC, при этом один атом серы метионина окислен до сульфоксидной группы.
Фиг. 11С Результаты оценки очистки F12GGC методом электрофореза в ДСН-ПААГ с окрашиванием Кумасси синим. (A) AmS - растворенный осадок после обработки 50% (NH4)2SO4. Различные фракции из колонки с DEAE и последующей очистки с помощью MonoQ: FT - проточная фракция, А4-А7 - фракции, элюированные при увеличении градиента NaCl. (В) Окончательная очистка на колонке с бутил-HP (HIC).
Фиг. 12 Результаты исследования с помощью набора для ИФА в формате «сэндвич», поставляемого Indoor Biotechnologies, с использованием моноклональных антител (МАТ) к природному Fel d1. МАТ одинаково эффективно распознают F12H6GGC и природный Fel d1.
Фиг. 13А Оценка активации базофилов (ВАТ) для природного Fel d1.
Фиг. 13В Оценка активации базофилов (ВАТ) для F12H6GGC. F12H6GGC и природный Fel d1 индуцируют аналогичные уровни активации базофилов в крови у пациентов с аллергией на антигены кошки, что подтверждается повышением уровня CD63 на CCR3+ базофилах.
Фиг. 14 Гуморальный ответ у мышей, которые получали 10 мкг ВПЧ Fel d1-ВМО (Fel d1-BMO-Ntt830-VLP или Fel d1-BMO-Npadr-VLP) или ВПЧ ВМО (BMO-Ntt830-VLP или BMO-Npadr-VLP), просто смешанных с гибридным белком Fel d1, F12H6GGC, на 0 день и на 14 день. Сыворотку крови собирали на 0, 14 и 21 день и исследовали методом ИФА для оценки IgG к природному Fel d1. N=3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют те же значения, которые обычно понятны специалисту в данной области техники, к которой относится настоящее изобретение.
Вирусоподобная частица (ВПЧ). В настоящей заявке термин «вирусоподобная частица (ВПЧ)» относится к нереплицирующейся или неинфекционной, предпочтительно нереплицирующейся и неинфекционной вирусной частице, или относится к нереплицирующейся или неинфекционной, предпочтительно нереплицирующейся и неинфекционной структуре, напоминающей вирусную частицу, предпочтительно капсид вируса. В настоящей заявке термин «нереплицирующийся» относится к отсутствию способности к репликации генома, содержащегося в ВПЧ. В настоящей заявке термин «неинфекционный» относится к отсутствию способности проникновения в клетку-хозяина. Вирусоподобная частица в соответствии с настоящим изобретением является нереплицирующейся и неинфекционной, поскольку у нее отсутствует весь или часть вирусного генома или функции генома. Вирусоподобная частица в соответствии с настоящим изобретением может содержать нуклеиновую кислоту, отличную от ее генома. Рекомбинантно полученные вирусоподобные частицы обычно содержат РНК, полученную из клеток-хозяев. Типичным и предпочтительным вариантом вирусоподобной частицы в соответствии с настоящим изобретением является вирусный капсид, состоящий из полипептидов согласно настоящему изобретению. Вирусоподобная частица обычно является макромолекулярным комплексом, состоящим из белка оболочки вируса, который обычно содержит 60, 120, 180, 240, 300, 360 или более 360 субъединиц белка на вирусоподобную частицу. Типично и предпочтительно взаимодействия указанных субъединиц приводят к образованию вирусного капсида или вирус-капсидоподобной структуры с присущей ей повторяющейся организацией. Одной из особенностей вирусоподобной частицы является высокоупорядоченное и повторяющееся расположение ее субъединиц.
Вирусоподобная частица ВМО: термины «вирусоподобная частица ВМО» или ВПЧ ВМО относятся к вирусоподобной частице, содержащей или предпочтительно состоящей по существу, или предпочтительно состоящей из по меньшей мере одного полипептида ВМО. Предпочтительно вирусоподобная частица ВМО содержит указанный полипептид ВМО в качестве основного и еще более предпочтительно в качестве единственного белкового компонента структуры капсида. Типично и предпочтительно вирусоподобные частицы ВМО напоминают структуру капсида ВМО. Вирусоподобные частицы ВМО являются нереплицирующимися и/или неинфекционными, и не содержат по меньшей мере гена или генов, кодирующих молекулярный аппарат репликации ВМО, и, как правило, также не содержат гена или генов, кодирующих белок или белки, ответственные за присоединение вируса к клетке хозяина или проникновение в нее. Данное определение включает также вирусоподобные частицы, в которых вышеупомянутый ген или гены все еще присутствуют, но неактивны. Предпочтительные способы устранения способности вирусоподобной частицы ВМО к репликации и/или заражению включают физическую или химическую инактивацию, такую как ультрафиолетовое облучение, обработка формальдегидом. Предпочтительно ВПЧ ВМО лишены гена или генов, кодирующих механизмы репликации ВМО, а также лишены гена или генов, кодирующих белок или белки, ответственные за прикрепление вируса к клетке хозяина или проникновение в нее. Также более предпочтительно нереплицирующиеся и/или неинфекционные вирусоподобные частицы получают с помощью технологии рекомбинантных генов. Вирусоподобные частицы ВМО согласно настоящему изобретению, полученные с помощью рекомбинантных способов, типично и предпочтительно не содержат вирусного генома. Вирусоподобные частицы, содержащие более одного вида полипептидов, часто называемые мозаичными ВПЧ, также включены в объем настоящего изобретения. Следовательно, в одном варианте реализации настоящего изобретения вирусоподобная частица в соответствии с настоящим изобретением содержит по меньшей мере два разных вида полипептидов, причем по меньшей мере один из указанных видов полипептидов представляет собой полипептид ВМО. Предпочтительно ВПЧ ВМО представляет собой макромолекулярный комплекс, состоящий из белка оболочки ВМО, который обычно содержит 180 субъединиц белка оболочки на одну ВПЧ. В настоящей заявке, типично и предпочтительно, ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного полипептида ВМО, содержащего или предпочтительно состоящего из (i) аминокислотной последовательности белка оболочки ВМО; или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой аминокислотную последовательность белка оболочки ВМО, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и аминокислотной последовательности, которую мутируют, составляет по меньшей мере 90%, предпочтительно по меньшей мере 95%, также еще более предпочтительно по меньшей мере 98% и также еще более предпочтительно по меньшей мере 99%.
Полипептид: в настоящей заявке термин «полипептид» относится к полимеру, состоящему из мономеров аминокислот, которые линейно связаны пептидными связями (также известными как амидные связи). Термин полипептид относится к последовательной цепи аминокислот и не относится к определенной длине продукта. Следовательно, пептиды и белки включены в определение полипептида.
Полипептид вируса мозаики огурца (ВМО): в настоящей заявке термин «полипептид вируса мозаики огурца (ВМО)» относится к полипептиду, содержащему или, предпочтительно, состоящему из: (i) аминокислотной последовательности белка оболочки вируса мозаики огурца (ВМО), или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой аминокислотную последовательность белка оболочки ВМО, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и аминокислотной последовательности, которую мутируют, то есть указанного белка оболочки ВМО, составляет по меньшей мере 90%, предпочтительно по меньшей мере 95%, также еще более предпочтительно по меньшей мере 98% и также еще более предпочтительно по меньшей мере 99%. Типично и предпочтительно полипептид ВМО способен образовывать вирусоподобную частицу ВМО после экспрессии путем самосборки.
Белок оболочки (CP) вируса мозаики огурца (ВМО): в настоящей заявке термин «белок оболочки (CP) вируса мозаики огурца (ВМО)» относится к белку оболочки вируса мозаики огурца, который встречается в природе. Вследствие чрезвычайно широкого спектра хозяев вируса мозаики огурца известно множество различных штаммов и изолятов ВМО, и были определены последовательности белков оболочки указанных штаммов и изолятов, и, следовательно, они также известны специалисту в данной области техники. Последовательности указанных белков оболочки (CP) ВМО описаны в известных базах данных, таких как Genbank, www.dpvweb.net или www.ncbi.nlm.nih.gov/protein, и могут быть получены из них. Примеры описанных CP ВМО включают AD92034.1, CDO33961.2, AHZ89404.1, CDO33963.1, ACN60036.1, САС18660.1, САС18661.1, САС18658.1, САС18657.1, САС18659.1, AFS64321.1, AFS64320.1, ABG76792.1, CAI68015.1, AAQ22992.1, АЕМ36051.1, АЕМ36048.1, ADA77134.1, AIS22690.1, AGT15706.1, AFR44555.1, AHY22574.1, АСМ89097.1, ААВ07137.1, AAD17927.1, ААМ81371.1, ААМ81365.1, ААМ81374.1, ААМ81372.1, ААМ81368.1, АВС18318.1, ААХ70966.1, AAU14864.1, AHJ11230.1, AHJ11229.1, AHJ11228.1, О40980.1, САВ43510.1, Q66143.1, САА77065.1, САВ77390.1, САС18666.1, NP_040777.1, Р16489.1, AGV39216.1, AGW51600.1, AGN56074.1, AGN56050.1, AGG16159.1, AGG16145.1, AGG16143.1, AFZ99011.1, 1407131А, САА71834.1, САА07411.1, САС18665.1, Q66135.1, 1F15_A, O40983.1, Q00259.1, AER25350.1, AER25348.1, ADN84922.1, ABU95611.1, BAF93916.1, BAF93914.1, AAY46239.1, AAY46233.1, AAY46235.1, AAY46231.1, AAY46230.1, AAY46237.1, BAF45130.1, АВМ46611.1, АВС00925.1, AAY42625.1, САН25533.1, САН25541.1, САН25539.1, AAV63980.1, AAQ89596.1, AAQ89571.1, AAQ89570.1, AAQ83697.1, AAQ83689.1, AAK52423.1, CCN27449.1, CEF39516.1, САЕ51926.1, САС13146.1, ВАМ15840.1, AEK33396.1, ABY21417.1, АВМ89156.1, CAI84629.1, AGA20617.1, AAO17725.1, CAD42338.1, ABO18585.1, CDF77337.1, CAG25710.1, CAG25430.1, САЕ30336.1, BAF45378.1, AAD17925.1, AGV39211.1, ВАА07858.1, Q66141.1, O40981.1, АСВ87210.1, CAI77626.1, САН25521.1, ABG89138.1, AGT15712.1, AGT15703.1, AII01134.1, AIC76579.1, AIC76576.1, AIC76574.1, AIC76573.1, AIB09173.1, AIB09172.1, ADF81043.1, ACQ99349.1, ACQ99348.1, CBF03403.1, CBF03405.1, САХ45872.1, САХ45871.1, АСН48048.1, AAG01451.1, ААА46409.1, AAD45249.1, AAG25053.1, ААА46410.1, ААА46411.1, ААА46412.1, АВВ89052.1, AAY19285.1, AAW21981.1, AAW21983.1, ААА74483.1, AHL30195.1, ВАА95601.1, Q00261.1, САВ89799.1, AGZ63887.1, BAN67666.1, AFZ62498.1, AFZ62495.1, AFZ62494.1, AGN56098.1, AGN56028.1, AGG16155.1, AGG16151.1, ACS83814.1, ACS83810.1, ACS83800.1, ACS83791.1, ССМ80413.1, ССМ80411.1, ССМ80409.1, AFX68432.1, AFX68428.1, CAI39235.1, CAJ20021.1, САЕ51924.1, AAS57946.1, Q66154.1, Q00260.1, САА61802.1, Р21368.1, ВАВ11693.1, AFV99523.1, AFV99515.1, AER25351.1, AFM56037.1, AFJ92022.1, AFH88687.1, AFC40207.1, BAL63166.1, AFA53169.1, AFA53167.1, BAL61194.1, AEU12505.1, AER35119.1, AEK86513.1, AEK69525.1, AEK69524.1, AEK33395.1, AEK33393.1, AEG79911.1, ADZ54767.1, ADZ54111.1, ADX86746.1, ADN84923.1, ACR14828.1, ACR14827.1, ABU62578.1, ACA13281.1, ABZ80826.1, ABY47903.1, ABY21424.1, ABY21420.1, ABY21419.1, ABY21418.1, ABY21413.1, ABX38992.1, ABV55389.1, ABV49618.1, ABO18588.1, ABO18589.1, ABN72590.1, ABN72591.1, ABN12319.1, ABN12316.1, BAF44939.1, ABM46612.1, CAJ15158.1, ABC00922.1, ABC00921.1, ABC00928.1, ABC00923.1, ABI94145.1, ABI94151.1, ABI94129.1, ABI94150.1, BAF33384.1, ABI93181.1, ABE68905.1, ABC00927.1, AAS48545.1, AAR89470.1, AAR23529.1, AAQ82698.1, AAM95241.1, AAM97677.1, AAK52977.1, AAW71967.1, ABJ55780.1, CAH17693.1, CAH17700.1, CAH17692.1, Q66140.1, ABM63376.1, AGT15704.1, CAB41491.1, AAR89478.1, CCJ09634.1, AEK69527.1, ACS83801.1, AIC76582.1, AHJ58884.1, AHJ11231.1, AGJ94707.1, ACS83798.1, ACS83793.1, ABK81652.1, AAS57945.1, AAN04483.1, ADO66659.1, AAN17777.1, ADG26754.1, AFV99520.1, ABD73006.1, ACE07024.1, ABD64220.1, ABD72575.1, ABP87978.1, ABN13961.1, AAY85627.1, AGG16139.1, ACS83811.1, CAH17699.1, CAH17694.1, AFV69240.1, ACB56602.1, ADJ10637.1, ABM46614.1, AAY45749.1, AAA74484.1, CAH17697.1, ADA63484.1, ADA63482.1, ADA63480.1, Q83251.1, AIC76584.1, AIC76583.1, AAK27169.1, ABC00924.1, ACD62520.1, ABO18591.1, AAO62575.1, AAL48223.1, AIA99525.1, CAH17698.1, AAZ38725.1, AAF09246.2, CAH17701.1, ACB58305.1, AGG16158.1, CAH17695.1, AHJ58883.1, AEZ03836.1, BAB63959.1, ACD62519.1, BAF93912.1, AAZ78354.1, ACN38326.1, AFV99522.1, ADZ54109.1, CAA46151.1, AGV39213.1. Дополнительные примеры белков оболочки ВМО представлены в SEQ ID NO: 1-3.
Следует отметить, что указанные штаммы и изоляты имеют очень сходные последовательности белков оболочки в различных доменах белка, включая N-конец белка оболочки. В частности, 98,1% всех полностью секвенированных изолятов ВМО имеют более чем 85% идентичность последовательностей в области, содержащей первые 28 аминокислот последовательности белка оболочки, и еще 79,5% всех полностью секвенированных изолятов ВМО имеют более чем 90% идентичность последовательностей в области, содержащей первые 28 аминокислот последовательности белка оболочки.
Типично и предпочтительно белок оболочки ВМО, используемый в соответствии с настоящим изобретением, способен образовывать вирусоподобную частицу ВМО при экспрессии с помощью самосборки. Предпочтительно белок оболочки ВМО, используемый в соответствии с настоящим изобретением, способен образовывать вирусоподобную частицу ВМО при экспрессии с помощью самосборки в Е. coli.
SEQ ID NO: 1 соответствует аминокислотной последовательности CP, выделенной и клонированной из ВМО-инфицированных листьев лилии, собранных в частном саду в Риге, Латвия. Следовательно, предпочтительно в настоящей заявке термин «белок оболочки вируса мозаики огурца (ВМО)» относится к аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1.
В другом наиболее предпочтительном варианте реализации указанный белок оболочки ВМО представляет собой аминокислотную последовательность белка оболочки ВМО, причем указанная аминокислотная последовательность содержит последовательность SEQ ID NO: 21, которая представляет собой последовательные аминокислоты 2-27 из последовательности SEQ ID NO: 1, или аминокислотную последовательность белка оболочки ВМО, содержащую область аминокислотной последовательности, причем указанная область аминокислотной последовательности по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 21. Указанный вариант является особенно предпочтительным, поскольку эпитоп Th-клеток предпочтительно замещает N-концевую область полипептида ВМО согласно настоящему изобретению. Высокая идентичность последовательности на N-конце CP ВМО и последовательности, предпочтительно используемой в примерах, обеспечивает надлежащую сборку при экспрессии CP, наряду с замещением указанной N-концевой области эпитопом Th-клеток, который, как правило, вызывает агрегацию.
Согласно другому наиболее предпочтительному варианту реализации указанный белок оболочки ВМО представляет собой (а) аминокислотную последовательность белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотную последовательность, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1; и при этом указанная аминокислотная последовательность, определенная в (а) или (b), содержит последовательность SEQ ID NO: 21, которая представляет собой последовательные аминокислоты 2-27 последовательности SEQ ID NO: 1; или при этом указанная аминокислотная последовательность, определенная в (а) или (b), содержит область аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 21.
Модифицированная вирусоподобная частица (ВПЧ) вируса мозаики огурца (ВМО): в настоящей заявке термин «модифицированная вирусоподобная частица (ВПЧ) вируса мозаики огурца (ВМО)» относится к ВПЧ ВМО, которая является модифицированной, так, что она содержит или предпочтительно по существу состоит, или предпочтительно состоит из по меньшей мере одного модифицированного полипептида ВМО, причем указанный модифицированный полипептид ВМО содержит или предпочтительно состоит из полипептида ВМО и эпитопа клеток T-хелперов. Типично и предпочтительно указанный эпитоп клеток T-хелперов (i) гибридизован с N-концом указанного полипептида ВМО, (ii) гибридизован с C-концом указанного полипептида ВМО, (iii) замещает область последовательных аминокислот указанного полипептида ВМО, причем идентичность последовательностей указанной замещенной области последовательных аминокислот указанного полипептида ВМО и эпитопа клеток T-хелперов составляет по меньшей мере 15%, предпочтительно по меньшей мере 20%, или (iv) замещает N-концевую область указанного полипептида ВМО, и при этом указанная замещенная N-концевая область указанного полипептида ВМО состоит из 5-15 последовательных аминокислот. Предпочтительно указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная замещенная N-концевая область указанного полипептида ВМО содержит 5-15 последовательных аминокислот, предпочтительно от 9 до 14 последовательных аминокислот, более предпочтительно от 11 до 13 последовательных аминокислот и наиболее предпочтительно 11, 12 или 13 последовательных аминокислот. Предпочтительно указанная модифицированная ВПЧ ВМО согласно настоящему изобретению представляет собой рекомбинантную модифицированную ВПЧ ВМО.
Модифицированный полипептид ВМО: в настоящей заявке термин «модифицированный полипептид ВМО» относится к полипептиду ВМО, модифицированному так, как определено в настоящем документе, причем указанный модифицированный полипептид ВМО содержит или предпочтительно состоит из полипептида ВМО и эпитопа клеток T-хелперов. Как правило, модифицированный полипептид ВМО способен образовывать вирусоподобную частицу ВМО при экспрессии с помощью самосборки. Предпочтительно модифицированный полипептид ВМО представляет собой рекомбинантный модифицированный полипептид ВМО и способен образовывать вирусоподобную частицу ВМО при экспрессии с помощью самосборки в Е. coli.
N-концевая область полипептида ВМО: в настоящей заявке термин «N-концевая область полипептида ВМО» относится к N-концу указанного полипептида ВМО и в частности к N-концу белка оболочки ВМО, или к области N-конца указанного полипептида ВМО или указанного белка оболочки ВМО, но начиная со второй аминокислоты N-конца указанного полипептида ВМО или указанного белка оболочки ВМО, если указанный полипептид ВМО или указанный белок оболочки содержит N-концевой остаток метионина. Предпочтительно, в случае если указанный полипептид ВМО или указанный белок оболочки содержит N-концевой остаток метионина, то, с практической точки зрения, старт-кодон, кодирующий метионин, как правило, будет удален и добавлен к N-концу эпитопа Th-клеток. Также предпочтительно одна, две или три дополнительные аминокислоты, предпочтительно одна аминокислота, могут быть необязательно вставлены между указанным метионином и эпитопом Th-клеток для целей клонирования. В настоящей заявке термин «N-концевая область мутированной аминокислотной последовательности полипептида ВМО или белка оболочки ВМО» относится к N-концу указанной мутированной аминокислотной последовательности указанного полипептида ВМО или указанного белка оболочки ВМО или к области N-конца указанной мутированной аминокислотной последовательности указанного полипептида ВМО или указанного белка оболочки ВМО, но начиная со второй аминокислоты N-конца указанной мутированной аминокислотной последовательности указанного полипептида ВМО или указанного белка оболочки ВМО, если указанная мутированная аминокислотная последовательность содержит N-концевой остаток метионина. Предпочтительно, в случае если указанный полипептид ВМО или указанный белок оболочки содержит N-концевой остаток метионина, то, с практической точки зрения, старт-кодон, кодирующий метионин, как правило, будет удален и добавлен к N-концу эпитопа Th-клеток. Также предпочтительно одна, две или три дополнительные аминокислоты, предпочтительно одна аминокислота, могут быть необязательно вставлены между указанным метионином и эпитопом Th-клеток для целей клонирования.
Рекомбинантный полипептид: применительно к настоящему изобретению термин «рекомбинантный полипептид» относится к полипептиду, который получают с помощью способа, который включает по меньшей мере одну стадию технологии рекомбинантных ДНК. Типично и предпочтительно рекомбинантный полипептид получают в прокариотической системе экспрессии. Специалист в данной области техники поймет, что рекомбинантные полипептиды, которые экспрессируются в прокариотической системе экспрессии, такой как Е. coli, могут содержать N-концевой остаток метионина. N-концевой остаток метионина, как правило, отщепляется от рекомбинантного полипептида в хозяине экспрессии при созревании рекомбинантного полипептида. Однако отщепление N-концевого метионина может быть неполным. Следовательно, препарат рекомбинантного полипептида может включать смесь в остальном идентичных полипептидов, содержащих и не содержащих N-концевой остаток метионина. Типично и предпочтительно препарат рекомбинантного полипептида содержит менее 10%, более предпочтительно менее 5% и еще более предпочтительно менее 1% рекомбинантного полипептида с N-концевым остатком метионина.
Рекомбинантный полипептид ВМО: термин «рекомбинантный полипептид ВМО» относится к полипептиду ВМО, определенному выше, который получают с помощью способа, который включает по меньшей мере одну стадию технологии рекомбинантных ДНК. Типично и предпочтительно препарат рекомбинантного полипептида ВМО содержит менее 10%, более предпочтительно менее 5% и еще более предпочтительно менее 1% рекомбинантного полипептида ВМО с N-концевым остатком метионина. Следовательно, рекомбинантная вирусоподобная частица согласно настоящему изобретению может содержать в остальном идентичные рекомбинантные полипептиды, содержащие или не содержащие N-концевой остаток метионина.
Рекомбинантная вирусоподобная частица: применительно к настоящему изобретению термин «рекомбинантная вирусоподобная частица» относится к вирусоподобной частице (ВПЧ), которую получают с помощью способа, который включает по меньшей мере одну стадию технологии рекомбинантных ДНК. Типично и предпочтительно рекомбинантная вирусоподобная частица содержит по меньшей мере один рекомбинантный полипептид, предпочтительно рекомбинантный полипептид ВМО или модифицированный рекомбинантный полипептид ВМО. Наиболее предпочтительно рекомбинантная вирусоподобная частица содержит или состоит из рекомбинантных полипептидов ВМО или рекомбинантных модифицированных полипептидов ВМО. Как следствие, если, применительно к настоящему изобретению, определение рекомбинантных ВПЧ согласно настоящему изобретению осуществляют со ссылкой на конкретные аминокислотные последовательности, содержащие N-концевой остаток метионина, то объем указанных рекомбинантных ВПЧ согласно настоящему изобретению включает ВПЧ, образованные указанными конкретными аминокислотными последовательностями без указанного N-концевого остатка метионина, а также, несмотря на присутствие в небольшом количестве, как указано в настоящем описании, ВПЧ, образованные указанными конкретными аминокислотными последовательностями с указанным N-концевым остатком метионина. Помимо этого, в объем настоящего изобретения, если определение рекомбинантных ВПЧ согласно настоящему изобретению осуществляют со ссылкой на конкретные аминокислотные последовательности, содержащие N-концевой остаток метионина, включены ВПЧ, содержащие обе аминокислотные последовательности, содержащие указанный N-концевой остаток метионина, и аминокислотные последовательности, лишенные N-концевого остатка метионина.
Мутированная аминокислотная последовательность: термин «мутированная аминокислотная последовательность» относится к аминокислотной последовательности, которая получена путем введения определенного набора мутаций в исходную аминокислотную последовательность, которую мутируют. Применительно к настоящему изобретению указанная аминокислотная последовательность, которую мутируют, типично и предпочтительно представляет собой аминокислотную последовательность белка оболочки ВМО. Следовательно, мутированная аминокислотная последовательность отличается от аминокислотной последовательности белка оболочки ВМО по остатку по меньшей мере одной аминокислоты, причем указанная мутированная аминокислотная последовательность и аминокислотная последовательность, которую мутируют, идентичны по меньшей мере на 90%. Типично и предпочтительно указанная мутированная аминокислотная последовательность и указанная аминокислотная последовательность, которую мутируют, идентичны по меньшей мере на 91%, 92%, 93% 94%, 95%, 96%, 97%, 98% или 99%. Предпочтительно указанная мутированная аминокислотная последовательность и указанная последовательность, которую мутируют, различаются не более чем по 11, 10, 9, 8, 7, 6, 4, 3, 2 или 1 аминокислотному остатку, причем более предпочтительно указанные различия выбраны из вставки, удаления и замены аминокислоты. Предпочтительно мутированная аминокислотная последовательность отличается от аминокислотной последовательности белка оболочки ВМО по меньшей мере одной аминокислотой, причем предпочтительно указанное различие представляет собой замену аминокислоты.
Положение, соответствующее остаткам: положение на аминокислотной последовательности, которое соответствует данным остаткам другой аминокислотной последовательности, может быть выявлено путем сопоставления последовательностей типично и предпочтительно с помощью алгоритма BLASTP, наиболее предпочтительно с использованием стандартных параметров. Типичные и предпочтительные стандартные параметры включают: рассчитанный порог: 10; длина сегмента: 3; максимальное соответствие в диапазоне запросов: 0; матрица: BLOSUM62; штраф за делецию: существующая делеция 11, удлинение 1; композиционные корректировки: условная композиционная корректировка оценочной матрицы.
Идентичность последовательностей: идентичность последовательностей двух заданных аминокислотных последовательностей определяется на основании выравнивания обеих последовательностей. Алгоритмы для определения идентичности последовательностей доступны специалисту в данной области техники. Предпочтительно идентичность последовательностей двух аминокислотных последовательностей определяют с использованием общедоступных программ для оценки гомологии, таких как компьютерные программы «BLAST» (http://blast.ncbi.nlm.nih.gov/Blast.cgi) или «ClustalW» (http://www.genome.jp/tools/clustalw), и предпочтительно с помощью программы «BLAST», представленной на главной странице NCBI по веб-адресу http://blast.ncbi.nlm.nih.gov/Blast.cgi, используя настройки по умолчанию, предусмотренные в ней. Типичные и предпочтительные стандартные параметры: рассчитанный порог: 10; длина сегмента: 3; максимальное соответствие в диапазоне запросов: 0; матрица: BLOSUM62; штраф за делецию: существующая делеция 11, удлинение 1; композиционные корректировки: условная композиционная корректировка оценочной матрицы.
Замена аминокислоты: термин замена аминокислоты относится к замене заданного остатка аминокислоты в аминокислотной последовательности любым другим остатком аминокислоты, имеющим другую химическую структуру, предпочтительно остатком другой протеиногенной аминокислоты. Следовательно, в отличие от вставки или удаления аминокислоты, замена аминокислоты не изменяет общее количество аминокислот в указанной аминокислотной последовательности. Наиболее предпочтительной применительно к настоящему изобретению является замена остатка аминокислоты указанной аминокислотной последовательности, которую мутируют, остатком лизина или остатком цистеина.
Эпитоп: термин эпитоп относится к непрерывным или прерывистым участкам антигена, предпочтительно полипептида, причем указанные участки могут быть специфично связаны с антителом или T-клеточным рецептором, применительно к молекуле ГКГС. В отношении антител специфичное связывание исключает неспецифичное связывание, но не обязательно исключает перекрестную реактивность. Эпитоп, как правило, содержит 5-20 аминокислот в пространственной конформации, которая является уникальной для антигенного сайта.
Эпитоп клеток T-хелперов (Th): в настоящей заявке термин «эпитоп клеток (Th) T-хелперов» относится к эпитопу, который может быть распознан Th-клетками.
Универсальный эпитоп Th-клеток: в настоящей заявке термин «универсальный эпитоп Th-клеток» относится к эпитопу Th-клеток, который способен связываться по меньшей мере с одной, предпочтительно более чем одной молекулой ГКГС класса II. Самый простой способ определения, является ли последовательность пептида универсальным эпитопом Th-клеток, заключается в оценке способности пептида связываться с молекулами ГКГС класса II. Указанное связывание может быть измерено по способности пептида конкурировать за связывание с молекулой ГКГС класса II с известным пептидом эпитопа Th-клеток. Типичный набор молекул HLA-DR описан, например, в работе Alexander J, et al., Immunity (1994) 1: 751-761. Величины аффинности эпитопов Th-клеток в отношении молекул ГКГС класса II должны составлять по меньшей мере 10-5 М. В качестве альтернативы более трудный, но и более актуальный способ определения «универсальности» эпитопа Th-клеток включает демонстрацию того факта, что у большей части людей (>30%) развивается измеримая реакция T-клеток после иммунизации и повторной стимуляции через один месяц белком, содержащим эпитоп Th-клеток, изготовленный в неполном адъюванте Фрейнда. Типичный набор молекул ГКГС класса II, которые присутствуют у различных индивидуумов, описан в Panina-Bordignon Р, et al., Eur J Immunol (1989) 19: 2237-2242. Как следствие этого, в настоящей заявке термин «универсальный эпитоп Th-клеток» предпочтительно относится к эпитопу Th-клеток, который индуцирует измеримый ответ T-клеток после иммунизации и повторной стимуляции (через один месяц с использованием белка, содержащего эпитоп Th-клеток, изготовленного в неполном адъюванте Фрейнда), более чем у 30% индивидуумов в выбранной группе, как описано в работе Panina-Bordignon Р, et al., Eur J Immunol (1989) 19: 2237-2242. Помимо этого также предпочтительно в настоящей заявке термин «универсальный эпитоп Th-клеток» предпочтительно относится к эпитопу Th-клеток, который способен связываться по меньшей мере с одним, предпочтительно по меньшей мере с двумя и еще более предпочтительно по меньшей мере с тремя аллелями DR, выбранными из DR1, DR2w2b, DR3, DR4w4, DR4w14, DR5, DR7, DR52a, DRw53, DR2w2a; и предпочтительно выбранными из DR1, DR2w2b, DR4w4, DR4w14, DR5, DR7, DRw53, DR2w2a, с аффинностью, величина которой составляет по меньшей мере 500 нМ (описано в работе Alexander J, et al., Immunity (1994) 1: 751-761 и ссылках, приведенных в настоящем описании); предпочтительный способ количественного исследования связывания для оценки аффинности представляет собой тот, который описан Sette A, et al., J Immunol (1989) 142: 35-40. Также еще более предпочтительно в настоящей заявке термин «универсальный эпитоп Th-клеток» относится к эпитопу Th-клеток, который способен связываться по меньшей мере с одним, предпочтительно по меньшей мере с двумя и еще более предпочтительно по меньшей мере с тремя аллелями DR, выбранными из DR1, DR2w2b, DR4w4, DR4w14, DR5, DR7, DRw53, DR2w2a, с величиной аффинности, которая составляет по меньшей мере 500 нМ (описано в работе Alexander J, et al., Immunity (1994) 1: 751-761 и ссылках, приведенных в настоящем описании); предпочтительный способ количественного исследования связывания для оценки аффинности представляет собой тот, который описан Sette A, et al., J Immunol (1989) 142: 35-40.
Универсальные эпитопы Th-клеток описаны и известны специалисту в данной области техники, например, см. Alexander J, et al., Immunity (1994) 1: 751-761, Panina-Bordignon P, et al., Eur J Immunol (1989) 19: 2237-2242, Calvo-Calle JM, et al., J Immunol (1997) 159: 1362-1373 и Valmori D, et al., J Immunol (1992) 149: 717-721.
Согласно предпочтительному варианту реализации настоящего изобретения эпитоп Th-клеток выбран из НА 307-319 (SEQ ID NO: 26), HBVnc 50-69 (SEQ ID NO: 27), TT 830-843 (SEQ ID NO: 4), CS 378-398 (SEQ ID NO: 28), MT 17-31 (SEQ ID NO: 29), TT 947-967 (SEQ ID NO: 30) и PADRE (SEQ ID NO: 5). Согласно другому предпочтительному варианту реализации настоящего изобретения универсальный эпитоп Th-клеток выбран из НА 307-319 (SEQ ID NO: 26), HBVnc 50-69 (SEQ ID NO: 27), TT 830-843 (SEQ ID NO: 4), CS 378-398 (SEQ ID NO: 28), MT 17-31 (SEQ ID NO: 29), TT 947-967 (SEQ ID NO: 30) и PADRE (SEQ ID NO: 5). Согласно наиболее предпочтительному варианту реализации настоящего изобретения эпитоп Th-клеток представляет собой ТТ 830-843 (SEQ ID NO: 4) или PADRE (SEQ ID NO: 5). Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения универсальный эпитоп Th-клеток представляет собой ТТ 830-843 (SEQ ID NO: 4) или PADRE (SEQ ID NO: 5). Следовательно, в наиболее предпочтительном варианте реализации настоящего изобретения указанный эпитоп Th-клеток представляет собой ТТ 830-843 (SEQ ID NO: 4). Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный эпитоп Th-клеток представляет собой PADRE (SEQ ID NO: 5). Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный универсальный эпитоп Th-клеток представляет собой ТТ 830-843 (SEQ ID NO: 4). Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный универсальный эпитоп Th-клеток представляет собой PADRE (SEQ ID NO: 5). Эпитопы, содержащие последовательность SEQ ID NO: 4 и SEQ ID NO: 5, известны, и их применение было описано (Alexander J, et al., Immunity (1994) 1: 751-761; Panina-Bordignon P, et al., Eur J Immunol (1989) 19: 2237-2242; Valmori D, et al., J Immunol (1992) 149: 717-721; Lanzavecchia A, et al. Eur J Immunol (1983) 13: 733-738; Jemon K, et al., PLoS ONE (2013) 8(6): e66866; Jagu S, et al., PLoS ONE (2012) 8(1): e55538).
Эффективность связывания: эффективность связывания вирусоподобной частицы со специфичным антигеном определяют с помощью исследования продуктов реакций связывания методом электрофореза в ДСН-ПААГ. Интенсивность полос, окрашенных Кумасси синим, соответствующих компонентам реакции связывания, определяют с помощью денситометрии и используют для расчета эффективности связывания. Эффективность связывания определяется как отношение полипептида ВПЧ, связанного с указанным антигеном, к общему количеству полипептида ВПЧ.
Адьювант: в настоящей заявке термин «адъювант» относится к неспецифичным стимуляторам иммунного ответа или веществам, которые обеспечивают создание депо у хозяина, которые в комбинации с вакциной и фармацевтической композицией, соответственно, согласно настоящему изобретению могут обеспечить еще более усиленный иммунный ответ. Предпочтительные адъюванты включают полный и неполный адъювант Фрейнда, адъювант, содержащий алюминий, предпочтительно гидроксид алюминия, и модифицированный мурамилдипептид. Помимо этого, предпочтительные адъюванты представляют собой минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки, динитрофенол и адъюванты человека, такие как BCG (бациллы Кальметта-Герена) и Corynebacterium parvum. Подходящие адъюванты также хорошо известны в данной области техники. Другие адъюванты, которые могут быть введены с композициями согласно настоящему изобретению, включают, но не ограничиваются ими, иммуномодулятор на основе монофосфориллипида, AdjuVax 100а, QS-21, QS-18, CRL1005, соли алюминия (квасцы), MF-59, ОМ-174, ОМ-197, ОМ-294 и виросомальную адъювантную технологию. Адъюванты также могут содержать смеси перечисленных веществ. Вирусоподобные частицы в целом были описаны в качестве адъюванта. Однако применительно к настоящей заявке термин «адъювант» относится к адъюванту, не являющемуся вирусоподобной частицей согласно настоящему изобретению. Термин «адъювант» скорее относится к дополнительному, отличающемуся компоненту композиций согласно настоящему изобретению, вакцин или фармацевтических композиций.
Антиген: в настоящей заявке термин «антиген» относится к молекуле, способной связываться с антителом или T-клеточным рецептором (TCR), если он представлен молекулами ГКГС. В настоящей заявке термин «антиген» относится также к T-клеточным эпитопам. Антиген дополнительно может быть распознан иммунной системой и/или может быть способен индуцировать гуморальный иммунный ответ и/или клеточный иммунный ответ, ведущий к активации В- и/или T-лимфоцитов. Для индукции указных типов ответов, по меньшей мере в некоторых случаях, антиген должен содержать или должен быть связан с эпитопом Th-клеток и введен в комбинации с адъювантом. Антиген может содержать один или несколько эпитопов (В- и T-эпитопы). Специфичная реакция, упомянутая выше, предназначена для указания того, что антиген будет предпочтительно реагировать, как правило, с высокой избирательностью с соответствующим ему антителом или TCR, а не с множеством других антител или TCR, которые могут быть индуцированы другими антигенами. В настоящей заявке антигены также могут представлять собой смесь нескольких отдельных антигенов. Полипептид согласно настоящему изобретению, который образует вирусоподобные частицы согласно настоящему изобретению, может содержать антиген. В частности, полипептид согласно настоящему изобретению может представлять собой гибридный продукт, содержащий антиген. Однако термин антиген не включает мутированную указанную аминокислотную последовательность, которая входит в состав указанного полипептида. Типично и предпочтительно в настоящей заявке термин «антиген» не включает вирусоподобную частицу в соответствии с настоящим изобретением. Типично и предпочтительно термин «антиген» скорее относится к дополнительному компоненту композиций, вакцин и фармацевтических композиций согласно настоящему изобретению, имеющему антигенные свойства, причем указанный антиген может быть ассоциирован, связан, смешан или присоединен к вирусоподобной частице любым способом, описанным в настоящем документе.
Связанный: в настоящей заявке термины «связанный» или «связывание» относятся ко всем возможным путям, предпочтительно химическим взаимодействиям, с помощью которых соединяют две молекулы. Химические взаимодействия включают ковалентные и нековалентные взаимодействия. Типичные примеры нековалентных взаимодействий включают ионные взаимодействия, гидрофобные взаимодействия или водородные связи, в то время как ковалентные взаимодействия основаны, например, на ковалентных связях, таких как сложноэфирная связь, простая эфирная связь, фосфоэфирная связь, связи углерод-фосфор, связи углерод-сера, например, тиоэфир, или имидные связи.
Сайт присоединения, первый: в настоящей заявке выражение «первый сайт присоединения» относится к элементу, который встречается в природе с вирусоподобной частицей или который искусственно добавлен к вирусоподобной частице, и к которому может быть присоединен второй сайт присоединения. Первый сайт присоединения предпочтительно представляет собой белок, полипептид, аминокислоту, пептид, сахар, полинуклеотид, природный или синтетический полимер, вторичный метаболит или соединение (биотин, флуоресцеин, ретинол, дигоксигенин, ионы металлов, фенилметилсульфонилфторид) или химически реакционноспособную группу, такую как аминогруппа, карбоксильная группа, сульфгидрильная группа, гидроксильная группа, гуанидинильная группа, гистидинильная группа или их комбинацию. Предпочтительный вариант химически реакционноспособной группы, которая представляет собой первый сайт присоединения, представляет собой аминогруппу аминокислотного остатка, предпочтительно остатка лизина. Первый сайт присоединения, как правило, расположен на поверхности, предпочтительно на внешней поверхности ВПЧ. Множество первых сайтов присоединения присутствуют на поверхности, предпочтительно на внешней поверхности ВПЧ, как правило, в повторяющейся конфигурации. Согласно предпочтительному варианту реализации настоящего изобретения первый сайт присоединения связан с ВПЧ по меньшей мере одной ковалентной связью, предпочтительно по меньшей мере одной пептидной связью. Согласно другому предпочтительному варианту реализации настоящего изобретения первый сайт присоединения обнаруживается с ВПЧ в природных условиях. Согласно другому предпочтительному варианту реализации настоящего изобретения первый сайт присоединения искусственно добавлен к ВПЧ. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный первый сайт присоединения представляет собой аминогруппу остатка лизина аминокислотной последовательности указанного полипептида ВПЧ.
Сайт присоединения, второй: в настоящей заявке выражение «второй сайт присоединения» относится к элементу, который в природных условиях присоединен к антигену или который искусственно добавлен к антигену и к которому может быть прикреплен первый сайт присоединения. Второй сайт присоединения антигена предпочтительно представляет собой белок, полипептид, пептид, аминокислоту, сахар, полинуклеотид, природный или синтетический полимер, вторичный метаболит или соединение (биотин, флуоресцеин, ретинол, дигоксигенин, ионы металлов, фенилметилсульфонилфторид), или химически реакционноспособную группу, такую как аминогруппа, карбоксильная группа, сульфгидрильная группа, гидроксильная группа, гуанидинильная группа, гистидинильная группа или их комбинацию. Предпочтительный вариант химически реакционноспособной группы, которая является вторым сайтом присоединения, представляет собой сульфгидрильную группу, предпочтительно сульфгидрильную группу аминокислоты цистеина, наиболее предпочтительно сульфгидрильную группу остатка цистеина. Термин «антиген с по меньшей мере одним вторым сайтом присоединения» относится, таким образом, к конструкции, содержащей антиген и по меньшей мере один второй сайт присоединения. Однако, в частности, для второго сайта присоединения, который в природных условиях не встречается с антигеном, указанная конструкция типично и предпочтительно дополнительно содержит «линкер». Согласно другому предпочтительному варианту реализации настоящего изобретения второй сайт присоединения связывается с антигеном по меньшей мере одной ковалентной связью, предпочтительно по меньшей мере одной пептидной связью. Согласно другому варианту реализации настоящего изобретения второй сайт присоединения в природных условиях обнаруживается в антигене. Согласно другому предпочтительному варианту реализации настоящего изобретения второй сайт присоединения искусственно добавлен к антигену посредством линкера, причем указанный линкер содержит или, в качестве альтернативы, состоит из цистеина. Предпочтительно линкер гибридизован с антигеном пептидной связью.
Связанный: в настоящей заявке термины «связанный» или «связь» относятся ко всем возможным путям, предпочтительно химическим взаимодействиям, с помощью которых соединены по меньшей мере один первый сайт присоединения и по меньшей мере один второй сайт присоединения. Химические взаимодействия включают ковалентные и нековалентные взаимодействия. Типичные примеры нековалентных взаимодействий включают ионные взаимодействия, гидрофобные взаимодействия или водородные связи, в то время как ковалентные взаимодействия основаны, в качестве примера, на ковалентных связях, таких как сложноэфирная связь, простая эфирная связь, фосфоэфирная связь, связи углерод-фосфор, связи углерод-сера, например, тиоэфир, или имидные связи. Согласно некоторым предпочтительным вариантам реализации настоящего изобретения первый сайт присоединения и второй сайт присоединения связаны посредством по меньшей мере одной ковалентной связи, предпочтительно посредством по меньшей мере одной непептидной связи и еще более предпочтительно посредством исключительно непептидной связи(ей). В настоящей заявке термин «связанный», однако, не должен относиться только к непосредственной связи по меньшей мере с одним первым сайтом присоединения и по меньшей мере с одним вторым сайтом присоединения, а также включает, в другом предпочтительном варианте, непрямую связь по меньшей мере одного первого сайта присоединения и по меньшей мере одного второго сайта присоединения посредством промежуточной молекулы(молекул), и тем самым, типично и предпочтительно, с использованием по меньшей мере одного, предпочтительно одного, гетеробифункционального сшивающего линкера. Согласно другим предпочтительным вариантам реализации настоящего изобретения первый сайт присоединения и второй сайт присоединения связаны посредством по меньшей мере одной ковалентной связи, предпочтительно посредством по меньшей мере одной пептидной связи и наиболее предпочтительно посредством исключительно пептидной связи(ей).
Линкер: в настоящей заявке термин «линкер» связывает второй сайт присоединения с антигеном или уже содержит, по существу состоит или состоит из второго сайта присоединения. Предпочтительно в настоящей заявке «линкер» уже содержит второй сайт присоединения, типично и предпочтительно, но необязательно, в виде одного аминокислотного остатка, предпочтительно в виде остатка цистеина. Предпочтительными линкерами являются аминокислотные линкеры, т.е. линкеры, содержащие по меньшей мере один остаток аминокислоты. Термин аминокислотный линкер не означает, что такой линкер состоит исключительно из остатков аминокислот. Однако линкер, состоящий исключительно из остатков аминокислот, представляет собой предпочтительный вариант реализации настоящего изобретения. Аминокислотные остатки линкера являются, предпочтительно, состоят из природных аминокислот или неприродных аминокислот, известных в данной области техники, только L-аминокислот или только D-аминокислот или их смесей. Другие предпочтительные варианты реализации линкера в соответствии с настоящим изобретением представляют собой молекулы, содержащие сульфгидрильную группу или остаток цистеина, и указанные молекулы, следовательно, также включены в объем настоящего изобретения. Другие линкеры, пригодные для настоящего изобретения, представляют собой молекулы, содержащие С1-С6 алкил-, циклоалкил, такой как фрагмент циклопентила или циклогексила, циклоалкенила, арила или гетероарила. Помимо этого, линкеры, содержащие предпочтительно фрагмент С1-С6 алкила, циклоалкила (С5, С6), арила или гетероарила и дополнительную аминокислоту(ы), также могут быть использованы в качестве линкеров в соответствии с настоящим изобретением, и должны быть включены в объем настоящего изобретения. Линкер связан с антигеном предпочтительно посредством по меньшей мере одной ковалентной связи, более предпочтительно посредством по меньшей мере одной пептидной связи.
Упорядоченный и повторяющийся антигенный массив: в настоящей заявке термин «упорядоченный и повторяющийся антигенный массив» относится к повторяющейся структуре антигена, которая типично и предпочтительно характеризуется высокой степенью однородности в пространственном расположении антигенов по отношению к ВПЧ. Согласно одному варианту реализации настоящего изобретения повторяющаяся структура может представлять собой геометрическую структуру. Некоторые варианты реализации настоящего изобретения, такие как антигены, соединенные с ВПЧ согласно настоящему изобретению, являются типичными и предпочтительными примерами подходящих упорядоченных и повторяющихся антигенных массивов, которые, помимо всего прочего, обладают строго повторяющимися паракристаллическими порядками антигенов, предпочтительно с интервалом от 1 до 30 нм, предпочтительно от 2 до 15 нм, еще более предпочтительно от 2 до 10 нм, также еще более предпочтительно от 2 до 8 нм и еще более предпочтительно от 1,6 до 7 нм.
Белок Fel d1: в настоящей заявке термин «белок Fel d1» относится к белку, содержащему или, в качестве альтернативы, состоящему из цепи 1 Fel d1 и цепи 2 Fel d1. Предпочтительно цепь 1 Fel d1 и цепь 2 Fel d1 связаны ковалентно. Согласно одному предпочтительному варианту реализации настоящего изобретения цепь 1 Fel din цепь 2 Fel d1 связаны посредством по меньшей мере одной дисульфидной связи. Согласно другому предпочтительному варианту реализации настоящего изобретения цепь 1 и цепь 2 гибридизованы непосредственно или через спейсер, и в этом случае указанный белок Fel d1 дополнительно содержит или, в качестве альтернативы, состоит из спейсера. Предпочтительно белок Fel d1, определенный в настоящем документе, в общей сложности содержит не более 300, еще более предпочтительно не более 200 аминокислот. Типично и предпочтительно белок Fel d1, в соответствии с настоящим изобретением, способен индуцировать в условиях in vivo выработку антител, специфично связывающихся с природным Fel d1 или рекомбинантным Fel d1, полученным в соответствии с примером 8 настоящего изобретения.
Цепь 1 Fel d1: в настоящей заявке термин «цепь 1 Fel d1» относится к полипептиду, содержащему или, в качестве альтернативы, состоящему из аминокислотной последовательности SEQ ID NO: 37, или гомологичной ей последовательности. В настоящей заявке термин «последовательность гомологичная последовательности SEQ ID NO: 37» относится к полипептиду, последовательность которого идентична последовательности SEQ ID NO: 37, более чем на 80%, более предпочтительно более чем на 90%, еще более предпочтительно более чем на 95%. В настоящей заявке термин «цепь 1 Fel d1» также относится к полипептиду, содержащему по меньшей мере одну посттрансляционную модификацию, включая, но не ограничиваясь ими, по меньшей мере одно гликозилирование цепи 1 Fel d1, как определено в настоящем документе. Предпочтительно цепь 1 Fel d1, определенная в настоящем документе, в общей сложности содержит не более 130, еще более предпочтительно не более 100 аминокислот.
Цепь 2 Fel d1: в настоящей заявке термин «цепь 2 Fel d1» относится к полипептиду, содержащему или, в качестве альтернативы, состоящему из аминокислотной последовательности SEQ ID NO: 38, SEQ ID NO: 39 или SEQ ID NO: 40, или гомологичной им последовательности. В настоящей заявке термин «последовательность, гомологичная последовательности SEQ ID NO: 38, SEQ ID NO: 39 или SEQ ID NO: 40» относится к полипептиду, последовательность которого идентична последовательности SEQ ID NO: 38, SEQ ID NO: 39 или SEQ ID NO: 40, более чем на 80%, предпочтительно более чем на 90% и еще более предпочтительно более чем на 95%. В настоящей заявке термин «цепь 2 Fel d1» также относится к полипептиду, содержащему по меньшей мере одну посттрансляционную модификацию, включая, но не ограничиваясь ими, по меньшей мере одно гликозилирование цепи 2 Fel d1, определенное в настоящем документе, предпочтительно цепь 2 Fel d1, определенная в настоящем документе, содержит в общей сложности не более 150, еще более предпочтительно не более 130, еще более предпочтительно не более 100 аминокислот.
Иммуностимулирующее вещество: в настоящей заявке термин «иммуностимулирующее вещество» относится к веществу, способному индуцировать и/или усиливать иммунный ответ. В настоящей заявке иммуностимулирующие вещества включают, но не ограничиваются ими, вещества, активирующие Toll-подобный рецептор, и вещества, индуцирующие секрецию цитокинов. Вещества, активирующие Toll-подобный рецептор, включают, но не ограничиваются ими, иммуностимулирующие нуклеиновые кислоты, пептидогликаны, липополисахариды, липотейхоевые кислоты, соединения имидазохинолина, флагеллины, липопротеины и иммуностимулирующие органические вещества, такие как таксол.
Иммуностимулирующая нуклеиновая кислота: в настоящей заявке термин иммуностимулирующая нуклеиновая кислота относится к нуклеиновой кислоте, способной индуцировать и/или усиливать иммунный ответ. Иммуностимулирующие нуклеиновые кислоты включают рибонуклеиновые кислоты и, в частности, дезоксирибонуклеиновые кислоты, причем рибонуклеиновые кислоты и дезоксирибонуклеиновые кислоты могут быть двухцепочечными или одноцепочечными. Предпочтительная ИС-НК представляет собой дезоксирибонуклеиновую кислоту, причем наиболее предпочтительно указанная дезоксирибонуклеиновая кислота является одноцепочечной. Предпочтительно иммуностимулирующие нуклеиновые кислоты содержат по меньшей мере один CpG-мотив, содержащий неметилированный С. Наиболее предпочтительные иммуностимулирующие нуклеиновые кислоты содержат по меньшей мере один CpG-мотив, причем указанный по меньшей мере один CpG-мотив содержит или предпочтительно состоит из по меньшей мере одного, предпочтительно одного динуклеотида CG, в котором С неметилирован. Предпочтительно, но не обязательно, указанный CG-динуклеотид является частью палиндромной последовательности. Термин иммуностимулирующая нуклеиновая кислота также относится к нуклеиновым кислотам, которые содержат модифицированные основания, предпочтительно 4-бромцитозин. Особенно предпочтительными применительно к настоящему изобретению являются ИС-НК, которые способны стимулировать выработку ИФН-альфа в дендритных клетках. Иммуностимулирующие нуклеиновые кислоты, пригодные для целей настоящего изобретения, описаны, например, в WO 2007/068747 A1.
Олигонуклеотид: в настоящей заявке термин «олигонуклеотид» относится к последовательности нуклеиновой кислоты, содержащей 2 или более нуклеотидов, предпочтительно от приблизительно 6 до приблизительно 200 нуклеотидов, более предпочтительно от 20 до приблизительно 100 нуклеотидов, наиболее предпочтительно от 20 до 40 нуклеотидов. Наиболее предпочтительно олигонуклеотиды содержат приблизительно 30 нуклеотидов, более предпочтительно олигонуклеотиды содержат ровно 30 нуклеотидов, наиболее предпочтительно олигонуклеотиды содержат ровно 30 нуклеотидов. Олигонуклеотиды представляют собой полирибонуклеотиды или полидезоксирибонуклеотиды и предпочтительно выбраны из (а) немодифицированной РНК или ДНК, и (b) модифицированной РНК или ДНК. Модификация может включать основную цепь или аналоги нуклеотидов. Олигонуклеотиды предпочтительно выбраны из группы, состоящей из (а) одно- и двухцепочечной ДНК, (b) ДНК, которая представляет собой смесь одно- и двухцепочечных областей, (с) одно- и двухцепочечной РНК, (d) РНК, которая представляет собой смесь одно- и двухцепочечных областей, и (е) гибридных молекул, содержащих ДНК и РНК, которые являются одноцепочечными или, более предпочтительно, двухцепочечными или представляют собой смесь одно- и двухцепочечных областей. Предпочтительные нуклеотидные модификации/аналоги выбраны из группы, состоящей из (а) пептидной нуклеиновой кислоты, (b) инозина, (с) тритилированных оснований, (d) фосфотиоатов, (е) алкилфосфотиоатов, (f) 5-нитроиндолдезоксирибофуранозила, (g) 5-метилдезоксицитозина, и (h) 5,6-дигидро-5,6-дигидроксидезокситимидина. Нуклеотиды, содержащие фосфотиоат, защищены от разрушения в клетке или организме и, следовательно, представляют собой предпочтительные нуклеотидные модификации. Немодифицированные олигонуклеотиды, состоящие исключительно из нуклеотидов, связанных фосфодиэфирными связями, как правило, более активны, чем модифицированные нуклеотиды и, следовательно, как правило, являются предпочтительными применительно к настоящему изобретению. Наиболее предпочтительными являются олигонуклеотиды, состоящие исключительно из дезоксинуклеотидов, связанных фосфодиэфирными связями, причем более предпочтительные указанные олигонуклеотиды являются одноцепочечными. Помимо этого, предпочтительными являются олигонуклеотиды, способные стимулировать выработку ИФН-альфа в клетках, предпочтительно в дендритных клетках. Наиболее предпочтительные олигонуклеотиды, способные стимулировать выработку ИФН-альфа в клетках, выбраны из CpG А-типа и CpG C-типа. Помимо этого, предпочтительными являются молекулы РНК не содержащие кэпа.
CpG-мотив: в настоящей заявке термин «CpG-мотив» относится к структуре нуклеотидов, которая содержит неметилированный центральный CpG, т.е. неметилированный динуклеотид CpG, в котором С неметилирован, фланкированный по меньшей мере одним основанием, предпочтительно одним или двумя нуклеотидами, фланкирующими (на 3'- и 5-конце) центральный CpG. Типично и предпочтительно в настоящей заявке CpG-мотив содержит или, в качестве альтернативы, состоит из неметилированного динуклеотида CpG и двух нуклеотидов на его 3'- и 5'-концах. Не желая быть связанными соответствием какой-либо теории, авторы настоящего изобретения полагают, что основания, фланкирующие CpG, обеспечивают существенную долю активности олигонуклеотида CpG.
Неметилированный CpG-содержащий олигонуклеотид: в настоящей заявке термин «неметилированный CpG-содержащий олигонуклеотид» или «CpG» относится к олигонуклеотиду, предпочтительно к олигодезоксинуклеотиду, содержащему по меньшей мере один CpG-мотив. Следовательно, CpG содержит по меньшей мере один неметилированный цитозин-гуаниновый динуклеотид. Предпочтительные CpG стимулируют/активируют, например, оказывают митогенное влияние, или индуцируют или повышают экспрессию цитокинов клетками, полученными из костного мозга позвоночных. Например, CpG можно применять для активации В-клеток, NK-клеток и антигенпредставляющих клеток, таких как дендритные клетки, моноциты и макрофаги. Предпочтительно CpG относится к олигодезоксинуклеотиду, предпочтительно к одноцепочечному олигодезоксинуклеотиду, содержащему неметилированный цитозин с последующим гуанозином, расположенным в направлении 3'-конца, причем указанный неметилированный цитозин и указанный гуанозин связаны фосфатной связью, при этом предпочтительно указанная фосфатная связь представляет собой фосфодиэфирную связь или фосфотиоатную связь, и при этом также предпочтительно указанная фосфатная связь представляет собой фосфодиэфирную связь. CpG могут содержать нуклеотидные аналоги, такие как аналоги, содержащие сложные фосфотиоэфирные связи, и могут быть двухцепочечными или одноцепочечными. В целом, двухцепочечные молекулы являются более стабильными в живом организме, в то время как одноцепочечные молекулы увеличивали иммунную активность. Предпочтительно в настоящей заявке CpG представляет собой олигонуклеотид, который содержит по меньшей мере приблизительно десять нуклеотидов в длину и содержит по меньшей мере один CpG-мотив, при этом более предпочтительно указанный CpG содержит от 10 до 60, более предпочтительно от 15 до 50, еще более предпочтительно от 20 до 40, еще более предпочтительно приблизительно 30 и наиболее предпочтительно ровно 30 нуклеотидов в длину. CpG может состоять из метилированных и/или неметилированных нуклеотидов, причем указанный по меньшей мере один CpG-мотив содержит по меньшей мере один CG-динуклеотид, в котором С неметилирован. CpG может также содержать участки метилированных и неметилированных последовательностей, при этом указанный по меньшей мере один CpG-мотив содержит по меньшей мере один CG-динуклеотид, в котором С неметилирован. Наиболее предпочтительно CpG, относится к одноцепочечному олигодезоксинуклеотиду, содержащему неметилированный цитозин с последующим гуанозином, расположенным в направлении 3'-конца, причем указанный неметилированный цитозин и указанный гуанозин связаны фосфодиэфирной связью, CpG могут содержать нуклеотидные аналоги, такие как аналоги, содержащие сложные фосфотиоэфирные связи, и могут быть двухцепочечными или одноцепочечными. Как правило, фосфодиэфирные CpG относятся к CpG А-типа, как указано ниже, в то время как стабилизированные сложной фосфотиоэфирной связью CpG относятся к CpG В-типа. Предпочтительные олигонуклеотиды CpG применительно к настоящему изобретению относятся к CpG А-типа.
CpG А-типа: в настоящей заявке термин «CpG А-типа» или «CpG D-типа» относится к олигодезоксинуклеотиду (ODN), содержащему по меньшей мере один CpG-мотив. CpG А-типа предпочтительно стимулируют активацию T-клеток и созревание дендритных клеток и способны стимулировать выработку ИФН-альфа. В CpG А-типа нуклеотиды по меньшей мере одного мотива CpG связаны по меньшей мере одной фосфодиэфирной связью. CpG А-типа содержат по меньшей мере один CpG-мотив с фосфодиэфирной связью, который может быть фланкирован на 5'-конце и/или предпочтительно на 3'-конце нуклеотидами, присоединенными фосфотиоатными связями. Предпочтительно CpG-мотив и, следовательно, предпочтительно динуклеотид CG и его ближайшие фланкирующие области, содержащие по меньшей мере один, предпочтительно два нуклеотида, состоят из нуклеотидов, соединенных фосфодиэфирными связями. Предпочтительный CpG А-типа состоит исключительно из нуклеотидов, соединенных фосфодиэфирными связями (РО). Типично и предпочтительно мотив поли-G содержит или, в качестве альтернативы, состоит из по меньшей мере одного, предпочтительно по меньшей мере трех, по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 G (гуанозинов), наиболее предпочтительно по меньшей мере 10 гуанозинов. Предпочтительно CpG А-типа согласно настоящему изобретению содержит или, в качестве альтернативы, состоит из палиндромной последовательности.
Вирусоподобные частицы (ВПЧ): в настоящей заявке термин вирусоподобные частицы относится к нереплицирующейся или неинфекционной, предпочтительно нереплицирующейся и неинфекционной вирусной частице, или относится к нереплицирующейся или неинфекционной, предпочтительно нереплицирующейся и неинфекционной структуре, напоминающей вирусную частицу, предпочтительно капсид вируса. В настоящей заявке термин «нереплицирующийся» относится к отсутствию способности реплицировать геном, содержащийся в ВПЧ. В настоящей заявке термин «неинфекционный» относится к отсутствию способности проникать в клетку-хозяина. Вирусоподобная частица в соответствии с настоящим изобретением является нереплицирующейся и неинфекционной, поскольку она лишена всего или части вирусного генома или функции генома. Вирусоподобная частица в соответствии с настоящим изобретением может содержать нуклеиновую кислоту, отличную от ее генома. Рекомбинантно полученные вирусоподобные частицы обычно содержат РНК, полученную из клетки-хозяина. Типичный и предпочтительный вариант вирусоподобной частицы в соответствии с настоящим изобретением представляет собой вирусный капсид, состоящий из полипептидов согласно настоящему изобретению. Вирусоподобная частица представляет собой макромолекулярный комплекс, состоящий из белка оболочки вируса, который обычно содержит 60, 120, 180, 240, 300, 360 или более 360 белковых субъединиц на одну вирусоподобную частицу. Типично и предпочтительно взаимодействия указанных субъединиц приводят к образованию вирусного капсида или структуры, сходной с вирусным капсидом, с присущей ей повторяющейся организацией. Одной из особенностей вирусоподобной частицы является высокоупорядоченное и повторяющееся расположение ее субъединиц. Вирусоподобные частицы, содержащие более одного вида полипептидов, которые часто упоминаются как мозаичные ВПЧ, также включены в объем настоящего изобретения. Следовательно, в одном варианте реализации настоящего изобретения вирусоподобная частица в соответствии с настоящим изобретением содержит по меньшей мере два различных вида полипептидов, причем по меньшей мере один из указанных видов полипептидов представляет собой полипептид ВПЧ, содержащий универсальный эпитоп Th-клеток.
Упакованный: в настоящей заявке термин «упакованный» относится к состоянию полианионной макромолекулы или иммуностимулирующих веществ по отношению к ВПЧ. В настоящей заявке термин «упакованный» включает связывание, которое может быть ковалентным, например, путем химического связывания, или нековалентным, например, посредством ионных взаимодействий, гидрофобных взаимодействий, водородных связей и т.д. Термин также включает встраивание или частичное встраивание полианионной макромолекулы. Следовательно, полианионная макромолекула или иммуностимулирующие вещества могут быть заключены в ВПЧ без фактического связывания, в частности, ковалентного связывания. В предпочтительных вариантах реализации настоящего изобретения по меньшей мере одна полианионная макромолекула или иммуностимулирующие вещества упакованы внутри ВПЧ, наиболее предпочтительно с помощью нековалентного взаимодействия. В том случае, если указанные иммуностимулирующие вещества представляют собой нуклеиновую кислоту, предпочтительно ДНК, термин «упакованный» подразумевает, что указанная нуклеиновая кислота не является доступной для гидролиза под действием нуклеаз, предпочтительно не доступна для гидролиза ДНКазой (например, ДНКазой I или бензоназой), при этом предпочтительно указанную доступность количественно исследуют так, как описано в примерах 11-17 WO 2003/024481 A2.
В настоящем изобретении предложены вирусоподобные частицы растительного вируса мозаики огурца (ВМО) и в частности модифицированные ВПЧ ВМО, содержащие эпитопы Th-клеток, в частности универсальные эпитопы Th-клеток.
Следовательно, согласно первому аспекту в настоящем изобретении предложена модифицированная вирусоподобная частица (ВПЧ) вируса мозаики огурца (ВМО), причем указанная модифицированная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного модифицированного полипептида ВМО, при этом указанный модифицированный полипептид ВМО содержит или предпочтительно состоит из: (а) полипептида ВМО, и (b) эпитопа клеток T-хелперов; и при этом указанный полипептид содержит ВМО или предпочтительно состоит из: (i) аминокислотной последовательности белка оболочки ВМО; или (ii) мутированной аминокислотной последовательности, причем указанная аминокислотная последовательность, которую мутируют, представляет собой аминокислотную последовательность белка оболочки ВМО, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и указанного белка оболочки ВМО составляет по меньшей мере 90%, предпочтительно по меньшей мере 95%, также еще более предпочтительно по меньшей мере 98% и также еще более предпочтительно по меньшей мере 99%.
Согласно предпочтительному варианту реализации указанный полипептид ВМО содержит, предпочтительно состоит из аминокислотной последовательности белка оболочки ВМО. Согласно другому варианту реализации настоящего изобретения указанный полипептид ВМО содержит, предпочтительно состоит из мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой аминокислотную последовательность белка оболочки ВМО, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и указанного белка оболочки ВМО составляет по меньшей мере 90%, предпочтительно по меньшей мере 95%, также еще более предпочтительно по меньшей мере 98% и также еще более предпочтительно по меньшей мере 99%; причем предпочтительно указанная мутированная аминокислотная последовательность и аминокислотная последовательность, которую мутируют, различаются по меньшей мере одним и не более чем 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 остатками аминокислот, и при этом также предпочтительно указанные различия выбраны из (i) вставки, (ii) удаления, (iii) замены аминокислоты, и (iv) любой комбинации (i)-(iii). Мутации могут быть введены в аминокислотную последовательность, подлежащую мутированию, для модификации определенных особенностей вирусоподобных частиц, таких как стабильность и/или эффективность связывания. Введение остатков цистеина может усилить стабильность цистеиновых мостиков, которые образуются между субъединицами, и введение остатков лизина в поверхность ВПЧ может повысить эффективность связывания.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (i) (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1; или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой указанную аминокислотную последовательность, определенную в (i) настоящего пункта, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и указанной аминокислотной последовательности, которую мутируют, составляет по меньшей мере 95%, предпочтительно по меньшей мере 98% и еще более предпочтительно по меньшей мере 99%.
Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (i) (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит последовательность SEQ ID NO: 21, или (b) аминокислотной последовательности белка оболочки ВМО, содержащей область аминокислотной последовательности, причем указанная область аминокислотной последовательности идентична по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% последовательности SEQ ID NO: 21; или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой указанную аминокислотную последовательность, определенную в (i) данного пункта, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и аминокислотной последовательности, которую мутируют, составляет по меньшей мере 95%, предпочтительно по меньшей мере 98% и еще более предпочтительно по меньшей мере 99%.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит последовательность SEQ ID NO: 21, или (b) аминокислотной последовательности белка оболочки ВМО, содержащей область аминокислотной последовательности, причем указанная область аминокислотной последовательности идентична по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% последовательности SEQ ID NO: 21.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (i) (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1; и при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит последовательность SEQ ID NO: 21; или при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит область аминокислотной последовательности, причем указанная область аминокислотной последовательности идентична по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% последовательности SEQ ID NO: 21; или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой указанную аминокислотную последовательность, определенную в (i) данного пункта, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и аминокислотной последовательности, которую мутируют, составляет по меньшей мере 98%, предпочтительно по меньшей мере 99%.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 1; и при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит последовательность SEQ ID NO: 21; или при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит область аминокислотной последовательности, причем указанная область аминокислотной последовательности идентична по меньшей мере на 90% последовательности SEQ ID NO: 21.
Типично и предпочтительно указанный эпитоп клеток T-хелперов (i) гибридизован с N-концом указанного полипептида ВМО, (ii) гибридизован с C-концом указанного полипептида ВМО, (iii) замещает область последовательных аминокислот указанного полипептида ВМО, причем идентичность последовательностей указанной замещенной области последовательных аминокислот в указанном полипептиде ВМО и эпитопа клеток T-хелперов составляет по меньшей мере 15%, предпочтительно по меньшей мере 20%, или (iv) замещает N-концевую область указанного полипептида ВМО, и при этом указанная замещенная N-концевая область указанного полипептида ВМО содержит от 5 до 15 последовательных аминокислот.
Согласно предпочтительному варианту реализации настоящего изобретения указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, причем предпочтительно количество аминокислот указанной замещенной N-концевой области равно или меньше, чем количество аминокислот, из которых состоит указанный эпитоп клеток T-хелперов. Другими словами, указанная N-концевая область указанного полипептида ВМО состоит из первого ряда аминокислот и эпитоп Th-клеток состоит из второго ряда аминокислот, и согласно предпочтительному варианту реализации настоящего изобретения указанный первый ряд аминокислот равен или меньше, чем второй ряд аминокислот.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанная замещенная N-концевая область указанного полипептида ВМО содержит от 5 до 15 последовательных аминокислот, предпочтительно от 9 до 14 последовательных аминокислот, более предпочтительно от 11 до 13 последовательных аминокислот. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанная N-концевая область указанного полипептида ВМО соответствует аминокислотам 2-12 последовательности SEQ ID NO: 1.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (i) (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1; или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой указанную аминокислотную последовательность, определенную в (i) данного пункта, и идентичность последовательностей указанной мутированной аминокислотной последовательности и аминокислотной последовательности, которую мутируют, составляет по меньшей мере 95%, предпочтительно по меньшей мере 98%, и более предпочтительно по меньшей мере 99%, и при этом указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, причем предпочтительно количество аминокислот указанной замещенной N-концевой области равно или меньше, чем количество аминокислот, из которых состоит указанный эпитоп клеток T-хелперов.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (i) (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1; или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой указанную аминокислотную последовательность, определенную в (i) данного пункта, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и аминокислотной последовательности, которую мутируют, составляет по меньшей мере 95%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99%, при этом указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная замещенная N-концевая область указанного полипептида ВМО содержит от 5 до 15 последовательных аминокислот, предпочтительно от 9 до 14 последовательных аминокислот, более предпочтительно от 11 до 13 последовательных аминокислот.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (i) (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1; или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой указанную аминокислотную последовательность, определенную в (i) данного пункта, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и аминокислотной последовательности, которую мутируют, составляет по меньшей мере 95%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99%, причем указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная N-концевая область указанного полипептида ВМО соответствует аминокислотам 2-12 последовательности SEQ ID NO: 1.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1, и при этом указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, причем предпочтительно количество аминокислот в указанной замещенной N-концевой области равно или меньше, чем количество аминокислот, из которых состоит указанный эпитоп клеток T-хелперов.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1, причем эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная замещенная N-концевая область указанного полипептида ВМО содержит от 5 до 15 последовательных аминокислот, предпочтительно от 9 до 14 последовательных аминокислот, более предпочтительно от 11 до 13 последовательных аминокислот.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% идентична последовательности SEQ ID NO: 1, причем указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная N-концевая область указанного полипептида ВМО соответствует аминокислотам 2-12 последовательности SEQ ID NO: 1.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит последовательность SEQ ID NO: 21, или (b) аминокислотной последовательности белка оболочки ВМО, содержащей область аминокислотной последовательности, причем указанная область аминокислотной последовательности идентична по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, еще более предпочтительно по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% последовательности SEQ ID NO: 21, и при этом указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, при этом предпочтительно количество аминокислот в указанной замещенной N-концевой области равно или меньше, чем количество аминокислот, из которых состоит указанный эпитоп клеток T-хелперов.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит последовательность SEQ ID NO: 21, или (b) аминокислотной последовательности белка оболочки ВМО, содержащей область аминокислотной последовательности, причем указанная область аминокислотной последовательности идентична по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также еще более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% последовательности SEQ ID NO: 21, причем указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная замещенная N-концевая область указанного полипептида ВМО содержит от 5 до 15 последовательных аминокислот, предпочтительно от 9 до 14 последовательных аминокислот, более предпочтительно от 11 до 13 последовательных аминокислот.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит последовательность SEQ ID NO: 21, или (b) аминокислотной последовательности белка оболочки ВМО, содержащей область аминокислотной последовательности, причем указанная область аминокислотной последовательности идентична по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, также еще более предпочтительно по меньшей мере на 90%, также более предпочтительно по меньшей мере на 95%, также еще более предпочтительно по меньшей мере на 98% и также еще более предпочтительно по меньшей мере на 99% последовательности SEQ ID NO: 21, причем указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная N-концевая область указанного полипептида ВМО соответствует аминокислотам 2-12 последовательности SEQ ID NO: 1.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере 90% идентична последовательности SEQ ID NO: 1; и при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит последовательность SEQ ID NO: 21; или при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит область аминокислотной последовательности, причем указанная область аминокислотной последовательности идентична по меньшей мере на 90% последовательности SEQ ID NO: 21, и при этом указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, причем предпочтительно количество аминокислот в указанной замещенной N-концевой области равно или меньше, чем количество аминокислот, из которых состоит указанный эпитоп клеток T-хелперов.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 1; и при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит последовательность SEQ ID NO: 21; или при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит область аминокислотной последовательности, при этом указанная область аминокислотной последовательности идентична по меньшей мере на 90% последовательности SEQ ID NO: 21, причем указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная замещенная N-концевая область указанного полипептида ВМО содержит от 5 до 15 последовательных аминокислот, предпочтительно от 9 до 14 последовательных аминокислот, более предпочтительно от 11 до 13 последовательных аминокислот.
Следовательно, согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из: (а) аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или (b) аминокислотной последовательности, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 1; и при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит последовательность SEQ ID NO: 21; или при этом указанная аминокислотная последовательность, определенная в (а) или (b) данного пункта, содержит область аминокислотной последовательности, причем указанная область аминокислотной последовательности идентична по меньшей мере на 90% последовательности SEQ ID NO: 21, причем указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная N-концевая область указанного полипептида ВМО соответствует аминокислотам 2-12 последовательности SEQ ID NO: 1.
Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный эпитоп клеток T-хелперов представляет собой универсальный эпитоп клеток T-хелперов, причем предпочтительно указанный эпитоп клеток T-хелперов состоит не более чем из 20 аминокислот.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный эпитоп клеток T-хелперов представляет собой последовательность PADRE. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный эпитоп клеток T-хелперов содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 5.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный эпитоп клеток T-хелперов получен из вакцины человека. Предпочтительно указанный эпитоп клеток T-хелперов получен из столбнячного токсина (токсина столбняка). Также предпочтительно указанный эпитоп клеток T-хелперов содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 4.
Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный полипептид ВМО содержит или предпочтительно состоит из аминокислотной последовательности белка оболочки ВМО, причем указанная аминокислотная последовательность содержит или предпочтительно состоит из последовательности SEQ ID NO: 1, или аминокислотная последовательность идентична по меньшей мере на 95% последовательности SEQ ID NO: 1; и при этом указанная аминокислотная последовательность содержит последовательность SEQ ID NO: 21, и при этом указанный эпитоп клеток T-хелперов замещает N-концевую область указанного полипептида ВМО, и при этом указанная замещенная N-концевая область указанного полипептида ВМО содержит от 11 до 13 последовательных аминокислот, предпочтительно 11 последовательных аминокислот, и при этом также предпочтительно указанная N-концевая область указанного полипептида ВМО соответствует аминокислотам 2-12 последовательности SEQ ID NO: 1.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный модифицированный полипептид ВМО содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 6. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный модифицированный полипептид ВМО содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 7.
ВПЧ согласно настоящему изобретению могут быть экспрессированы в прокариотических или эукариотических системах экспрессии. Предпочтительные системы включают Е. coli, дрожжи, клетки насекомых, а также линии клеток млекопитающих. В наиболее предпочтительном варианте модифицированную ВПЧ ВМО или указанную ВПЧ ВМО получают путем экспрессии указанного модифицированного полипептида ВМО или указанного полипептида ВМО в Е. coli., и при этом предпочтительно указанную экспрессию осуществляют при температурах от 10°C до 25°C, предпочтительно при температуре 20°C. Как было указано выше, рекомбинантно полученные полипептиды могут содержать N-концевой остаток метионина. Согласно одному варианту реализации настоящего изобретения указанный полипептид ВМО или модифицированный полипептид ВМО, следовательно, содержит N-концевой остаток метионина. Однако, типично и предпочтительно, указанный N-концевой остаток метионина отщепляется от указанного полипептида ВМО или указанного модифицированного полипептида ВМО.
Следовательно, согласно другому аспекту в настоящем изобретении предложена вирусоподобная частица (ВПЧ) вируса мозаики огурца (ВМО), причем указанная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного полипептида ВМО, содержащего или предпочтительно состоящего из: (i) аминокислотной последовательности белка оболочки ВМО; или (ii) мутированной аминокислотной последовательности, причем аминокислотная последовательность, которую мутируют, представляет собой аминокислотную последовательность белка оболочки ВМО, и при этом идентичность последовательностей указанной мутированной аминокислотной последовательности и указанного белка оболочки ВМО составляет по меньшей мере 90%, предпочтительно по меньшей мере 95%, также еще более предпочтительно по меньшей мере 98% и также еще более предпочтительно по меньшей мере 99%; и при этом указанную ВПЧ ВМО получают путем экспрессии указанного полипептида ВМО в Е. coli, и при этом предпочтительно указанную экспрессию осуществляют при температурах от 10°C до 25°C, предпочтительно при температуре 20°C.
В область настоящего изобретения включены композиции, в которых указанные ВПЧ согласно настоящему изобретению содержат любую из технических характеристик, описанных в настоящем документе, по отдельности или в любой возможной комбинации.
Согласно другому аспекту в настоящем изобретении предложена композиция, содержащая модифицированную вирусоподобную частицу. Помимо этого, указанные модифицированные ВПЧ применяют в качестве, предпочтительно, платформы для вакцин, для индукции иммунных реакций, в частности гуморальных ответов на антигены, связанные с указанными модифицированными ВПЧ. Присутствие эпитопов клеток T-хелперов, в частности, универсальных эпитопов клеток T-хелперов, привело к дополнительному увеличению индуцированного иммунного ответа.
Следовательно, согласно другому предпочтительному варианту реализации настоящего изобретения указанная композиция содержит: (а) по меньшей мере одну модифицированную вирусоподобную частицу согласно настоящему изобретению, причем указанная модифицированная вирусоподобная частица содержит по меньшей мере один первый сайт присоединения; и (b) по меньшей мере один антиген, причем указанный антиген содержит по меньшей мере один второй сайт присоединения; при этом (а) и (b) связаны посредством указанного по меньшей мере одного первого сайта присоединения и по меньшей мере одного второго сайта присоединения. Способы связывания указанной модифицированной вирусоподобной частицы и указанного антигена посредством указанного первого и указанного второго сайтов присоединения описаны, например, в WO 2002/056905 A2 и WO 2004/084940 A1.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный первый сайт присоединения связывается с указанным вторым сайтом присоединения посредством по меньшей мере одной ковалентной связи. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный первый сайт присоединения и указанный второй сайт присоединения соединены посредством по меньшей мере одной ковалентной пептидной связи. Согласно другому предпочтительному варианту реализации настоящего изобретения указанная ковалентная связь представляет собой непептидную связь. Следовательно, согласно другому предпочтительному варианту реализации настоящего изобретения указанный первый сайт присоединения и указанный второй сайт присоединения соединены посредством по меньшей мере одной ковалентной непептидной связи. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный первый сайт присоединения представляет собой аминогруппу, предпочтительно аминогруппу лизина.
Соединение между модифицированными вирусоподобными частицами и антигенами посредством дисульфидных связей является лабильным, в частности, с молекулами, содержащими сульфгидрильный фрагмент, и, кроме того, менее стабильно в сыворотке крови, чем, например, соединение с помощью тиоэфирной связи (Martin FJ. and Papahadjopoulos D. (1982) J. Biol. Chem. 257: 286-288). Следовательно, согласно другому предпочтительному варианту реализации настоящего изобретения ассоциация или связь модифицированной ВПЧ и по меньшей мере одного антигена не содержит дисульфидной связи. Также предпочтительно, следовательно, по меньшей мере один второй сайт присоединения содержит, или предпочтительно представляет собой, сульфгидрильную группу. Помимо этого, ассоциация или связь модифицированной ВПЧ и по меньшей мере одного антигена, предпочтительно, не содержит связи сера-сера. Также предпочтительно, следовательно, по меньшей мере один второй сайт присоединения содержит, или предпочтительно представляет собой, сульфгидрильную группу. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения по меньшей мере один первый сайт присоединения не содержит сульфгидрильную группу или не представляет собой сульфгидрильную группу. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения по меньшей мере один первый сайт присоединения не содержит сульфгидрильную группу цистеина или не представляет собой сульфгидрильную группу цистеина. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный второй сайт присоединения представляет собой сульфгидрильную группу, предпочтительно сульфгидрильную группу цистеина.
Согласно наиболее предпочтительному варианту реализации настоящего изобретения по меньшей мере один первый сайт присоединения представляет собой аминогруппу, предпочтительно представляет собой аминогруппу остатка лизина и по меньшей мере один второй сайт присоединения представляет собой сульфгидрильную группу, предпочтительно сульфгидрильную группу остатка цистеина или сульфгидрильную группу, которая была химически присоединена к антигену. Согласно другому предпочтительному варианту реализации настоящего изобретения только один из указанного второго сайта присоединения связывается с указанным первым сайтом присоединения посредством по меньшей мере одной непептидной ковалентной связи с образованием одного и единообразного типа связывания указанного антигена с указанной модифицированной вирусоподобной частицей, причем указанный один второй сайт присоединения, который связывается с указанным первым сайтом присоединения, представляет собой сульфгидрильную группу, и при этом указанный антиген и указанная модифицированная вирусоподобная частица взаимодействуют посредством указанной ассоциации, образуя упорядоченный и повторяющийся антигенный массив.
Согласно одному предпочтительному варианту реализации настоящего изобретения антиген связан с модифицированной ВПЧ путем химического сшивания, типично и предпочтительно с использованием гетеробифункционального сшивающего линкера. Согласно предпочтительным вариантам реализации настоящего изобретения гетеробифункциональный сшивающий линкер содержит функциональную группу, которая может взаимодействовать с предпочтительными первыми сайтами присоединения, предпочтительно с аминогруппой, более предпочтительно с аминогруппами остатка(ов) лизина модифицированной ВПЧ, и дополнительную функциональную группу, которая может взаимодействовать с предпочтительным вторым сайтом связывания, т.е. сульфгидрильной группой, предпочтительно остатком(ми) цистеина, присущими или искусственно добавленными к антигену, и также необязательно была сделана реакционноспособной путем восстановления. Несколько гетеробифункциональных сшивающих линкеров известны в данной области техники. Подходящие линкеры включают предпочтительные сшивающие линкеры SMPH (Pierce), сульфо-MBS, сульфо-EMCS, сульфо-GMBS, сульфо-SIAB, сульфо-SMPB, сульфо-SMCC, сульфо-KMUS SVSB, SIA, и другие сшивающие линкеры, доступные, например, от Pierce Chemical Company и содержащие одну функциональную группу, способную вступать в реакции с аминогруппами, и одну функциональную группу, способную вступать в реакции с сульфгидрильными группами. Все указанные выше сшивающие линкеры приводят к образованию амидной связи после реакции с аминогруппой и тиоэфирной связи после реакции с сульфгидрильными группами. Другой класс сшивающих линкеров, пригодных для реализации настоящего изобретения, характеризуется введением дисульфидной связи между антигеном и модифицированной ВПЧ при связывании. Предпочтительные сшивающие линкеры, принадлежащие к этому классу, включают, например, SPDP и сульфо-LC-SPDP (Pierce).
Соединение антигена с модифицированной ВПЧ с использованием гетеробифункционального сшивающего линкера в соответствии с предпочтительными способами, описанными выше, обеспечивает связывание антигена с модифицированной ВПЧ с получением определенной ориентации в пространстве. Другие способы связывания антигена с модифицированной ВПЧ включают способы, в которых антиген сшивают с модифицированной ВПЧ с использованием карбодиимида EDC и NHS. Антиген также может быть сначала тиолирован посредством реакции, например, с SATA, SATP или иминотиоланом. Антиген, после удаления защитной группы, если это необходимо, затем может быть присоединен к модифицированной ВПЧ описанным ниже способом. После отделения избытка реагента тиолирования, антиген вступает в реакцию с модифицированной ВПЧ, предварительно активированной с использованием гетеробифункционального сшивающего линкера, содержащего фрагмент, способный реагировать с цистеином, и, следовательно, имеющей по меньшей мере одну или несколько функциональных групп, способных вступать в реакцию с остатками цистеина, с которыми может реагировать тиолированный антиген, например, как описано выше. В реакционную смесь необязательно включены низкие количества восстанавливающего агента. В других способах антиген присоединен к модифицированной ВПЧ с использованием гомобифункционального сшивающего линкера, такого как глутаровый альдегид, DSG, ВМ[РЕО]4, BS3, (Pierce), или других известных гомобифункциональных сшивающих линкеров, содержащих функциональные группы, способные вступать в реакцию с аминогруппами или карбоксильными группами модифицированной ВПЧ.
Согласно наиболее предпочтительным вариантам реализации настоящего изобретения антиген связан посредством остатка цистеина, добавленного к N-концу или C-концу, или природного остатка цистеина, содержащегося в антигене, с остатками лизина модифицированной вирусоподобной частицы. Согласно предпочтительному варианту реализации композиция согласно настоящему изобретению дополнительно содержит линкер, причем указанный линкер связывает указанный антиген с указанным вторым сайтом присоединения, и при этом предпочтительно указанный линкер содержит или, в качестве альтернативы, состоит из указанного второго сайта присоединения.
Прикрепление второго сайта присоединения на антиген осуществляют путем связывания линкера, предпочтительно содержащего по меньшей мере одну аминокислоту, пригодную для использования в качестве второго сайта присоединения в соответствии с сущностью настоящего изобретения. Следовательно, согласно предпочтительному варианту реализации настоящего изобретения линкер связан с антигеном посредством по меньшей мере одной ковалентной связи, предпочтительно по меньшей мере одной, предпочтительно одной пептидной связи. Предпочтительно линкер содержит или, в качестве альтернативы, состоит из второго сайта присоединения. Согласно другому предпочтительному варианту реализации настоящего изобретения линкер содержит сульфгидрильную группу, предпочтительно остаток цистеина. Согласно другому предпочтительному варианту реализации настоящего изобретения аминокислотный линкер представляет собой остаток цистеина.
Выбор линкера будет зависеть от характера антигена, от его биохимических свойств, таких как изоэлектрическая точка (pI), распределение заряда и гликозилирование. В целом гибкие аминокислотные линкеры являются предпочтительными. Согласно другому предпочтительному варианту реализации настоящего изобретения линкер состоит из аминокислот, причем более предпочтительно линкер состоит по меньшей мере из одной и не более чем 25, предпочтительно не более чем 20, более предпочтительно не более чем 15 аминокислот. Согласно другому предпочтительному варианту реализации настоящего изобретения аминокислотный линкер содержит от 1 до 10 аминокислот. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный линкер содержит или, в качестве альтернативы, состоит из указанного второго сайта присоединения.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный линкер представляет собой аминокислотный линкер, и при этом предпочтительно указанный аминокислотный линкер выбран из группы, состоящей из: (а) CGG; (b) N-концевого гамма 1-линкера; (с) N-концевого гамма 3-линкера; (d) участка петли Ig; (е) N-концевых глициновых линкеров; (f) (G)kC(G)n с n=0-12 и k=0-5; (g) N-концевых глицин-сериновых линкеров; (h) (G)kC(G)m(S)l(GGGGS)n с n=0-3, k=0-5, m=0-10, 1=0-2; (i) GGC; (j) GGC-NH2; (k) C-концевого гамма 1-линкера; (1) C-концевого гамма 3-линкера; (m) C-концевых глициновых линкеров; (n) (G)nC(G)k с n=0-12 и k=0-5; (о) C-концевых глицин-сериновых линкеров; и (р) (G)m(S)l(GGGGS)n(G)oC(G)k с n=0-3, k=0-5, m=0-10, 1=0-2 и о=0-8. В целом остатки глицина будут встроены между объемными аминокислотами и цистеином, используемым в качестве второго сайта присоединения, чтобы избежать возможного пространственного затруднения из-за объемной аминокислоты в реакции связывания.
Согласно другому предпочтительному варианту реализации настоящего изобретения линкер добавлен к N-концу антигена. Согласно другому предпочтительному варианту реализации настоящего изобретения линкер добавлен к C-концу антигена.
В других вариантах реализации настоящего изобретения композиция содержит или, в качестве альтернативы, по существу состоит из вирусоподобной частицы, связанной с антигеном с помощью химических взаимодействий, причем по меньшей мере одно из указанных взаимодействий не является ковалентной связью. Соединение модифицированной ВПЧ с антигеном можно осуществлять путем биотинилирования модифицированной ВПЧ и экспрессии антигена в виде гибридного белка со стрептавидином. В других вариантах реализации настоящего изобретения сульфгидрильные группы, используемые для химического связывания с лизинами, прикреплены к модифицированной ВПЧ или антигену с помощью химической модификации.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанная композиция дополнительно содержит по меньшей мере одно иммуностимулирующее вещество. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанное иммуностимулирующее вещество упаковано в модифицированные ВПЧ согласно настоящему изобретению. Согласно другому предпочтительному варианту реализации настоящего изобретения иммуностимулирующее вещество смешано с модифицированными ВПЧ согласно настоящему изобретению. Иммуностимулирующие вещества, пригодные для настоящего изобретения, как правило, известны в данной области техники и описаны, в частности, в WO 2003/024481 A2.
Согласно другому варианту реализации настоящего изобретения указанное иммуностимулирующее вещество состоит из ДНК или РНК неэукариотического происхождения. Согласно другому предпочтительному варианту реализации настоящего изобретения указанное иммуностимулирующее вещество выбрано из группы, состоящей из: (а) иммуностимулирующей нуклеиновой кислоты; (b) пептидогликана; (с) липополисахарида; (d) липотейхоевой кислоты; (е) соединения имидазохинолина; (f) флагеллина; (g) липопротеина; и (h) любых смесей по меньшей мере одного вещества, указанного в (a)-(g). Согласно другому предпочтительному варианту реализации настоящего изобретения указанное иммуностимулирующее вещество представляет собой иммуностимулирующую нуклеиновую кислоту, причем указанная иммуностимулирующая нуклеиновая кислота выбрана из группы, состоящей из: (а) рибонуклеиновых кислот; (b) дезоксирибонуклеиновых кислот; (с) химерных нуклеиновых кислот; и (g) любой смеси (а), (b) и/или (с). Согласно другому предпочтительному варианту реализации настоящего изобретения указанная иммуностимулирующая нуклеиновая кислота представляет собой рибонуклеиновую кислоту, и при этом указанная рибонуклеиновая кислота представляет собой РНК бактериального происхождения. Согласно другому предпочтительному варианту реализации настоящего изобретения указанная иммуностимулирующая нуклеиновая кислота представляет собой поли-LC или ее производное. Согласно другому предпочтительному варианту реализации настоящего изобретения указанная иммуностимулирующая нуклеиновая кислота представляет собой дезоксирибонуклеиновую кислоту, причем указанная дезоксирибонуклеиновая кислота представляет собой неметилированный CpG-содержащий олигонуклеотид.
Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанное иммуностимулирующее вещество представляет собой неметилированный CpG-содержащий олигонуклеотид. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный неметилированный CpG-содержащий олигонуклеотид представляет собой CpG А-типа. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный CpG А-типа содержит последовательность

Согласно другому предпочтительному варианту реализации настоящего изобретения указанное иммуностимулирующее вещество представляет собой неметилированный CpG-содержащий олигонуклеотид, и при этом предпочтительно указанный неметилированный CpG-содержащий олигонуклеотид содержит палиндромную последовательность, и также предпочтительно CpG-мотив указанного неметилированного CpG-содержащего олигонуклеотида является частью палиндромной последовательности, и при этом также предпочтительно указанная палиндромная последовательность представляет собой
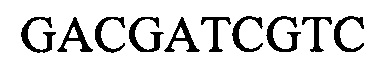
Согласно другому предпочтительному варианту реализации настоящего изобретения указанная иммуностимулирующая нуклеиновая кислота представляет собой неметилированный CpG-содержащий олигонуклеотид, содержащий последовательность

Антигены, пригодные для целей настоящего изобретения, описаны, например, в WO 2002/056905 A2, WO 2004/007538 A2, WO 2006/037787 A2, WO 2004/084940 A1 и WO 2006/032674 A1. Согласно одному варианту реализации настоящего изобретения указанный антиген получен из источника, выбранного из группы, состоящей из: (а) вирусов; (b) бактерий; (с) паразитов; (d) опухолей; (е) аутологичных молекул; (f) молекул непептидных гаптенов; (g) аллергенов; (h) гормонов; (i) цитокинов; (k) хемокинов; (l) биологически активных пептидов. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой опухолевый антиген, собственный антиген, полипептидный патоген, аллерген или гаптен. Согласно другому наиболее предпочтительному варианту реализации указанный антиген представляет собой пептид, связанный с геном кальцитонина (CGRP).
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой опухолевый антиген, причем предпочтительно указанный опухолевый антиген выбран из группы, состоящей из: (а) полипептида клеток рака молочной железы; (b) полипептида клеток рака почек; (с) полипептида клеток рака простаты; (g) полипептида клеток рака кожи; (е) полипептида клеток рака мозга; и (f) полипептида клеток лейкемии.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой опухолевый антиген, выбранный из группы, состоящей из: (а) Her2; (b) ганглиозида GD2; (с) EGF-R; (d) эмбрионального опухолевого антигена (СЕА); (е) CD52; (f) CD21; (g) gp100 меланомы человека; (h) melanA/MART-1 меланомы человека; (i) аналога melanA/MART-1 меланомы человека; (j) тирозиназы; (k) NA17-A nt; (1) MAGE3; (m) белка р53; и (n) антигенных фрагментов любого из опухолевых антигенов от (а) до (m).
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой полипептид, выбранный из группы, состоящей из: (a) IgE; (b) ИЛ-6; (с) лиганда рецептора активатора ядерного фактора каппа В (RANKL); (d) фактора роста эндотелия сосудов (VEGF); (е) рецептора фактора роста эндотелия сосудов (VEGF-R); фактора роста гепатоцитов (HGF); (f) интерлейкина-1α; (g) интерлейкина-1β; (h) интерлейкина-5; (i) интерлейкина-8; (j) интерлейкина-13; (k) интерлейкина-15; (1) интерлейкина-17 (ИЛ-17); (m) ИЛ-23; (n) грелина; (о) ангиотензина; (р) хемокина (C-С мотив) (CCL21); (d) хемокина (C-Х мотив) (CXCL 12); (r) фактора, полученного из стромальных клеток 1 (SDF-I); (s) макрофагального колониестимулирующего фактора (М-КСФ); (t) белка хемотаксиса моноцитов 1 (МСР-1); (u) эндоглина; (v) резистина; (w) гонадотропин-высвобождающего гормона (GnRH); (х) соматолиберина (GHRH); (у) лютеинизирующего гормона рилизинг гормона (ЛГРГ); (g) тиреотропин-рилизинг-гормона (TRH); (аа) фактора ингибирования миграции макрофагов (MIF); (bb) глюкозо-инсулинотропного пептида (GIP); (сс) эотаксина; (dd) брадикинина; (ее) Дез-Арг брадикинина; (ff) хемоаттрактанта В-лимфоцитов (BLC); (gg) макрофагального колониестимулирующего фактора M-CSF; (hh) фактор некроза опухоли-α (ФНО-α); (ii) амилоидного бета-пептида (Aβ1-42); (jj) амилоидного бета-пептида (Aβ1-6); (kk) IgE человека; (ll) внеклеточного домена CCR5; (mm) внеклеточного домена CXCR4; (nn) гастрина; (оо) СЕТР; (с) С5α; (рр) рецептора эпидермального фактора роста (EGF-R); (rr) CGRP; (ss) α-синуклеина; (tt) пептида, связанного с геном кальцитонина (CGRP); (uu) амилина или (w) фрагмента любого одного из указанных полипептидов от (а) до (uu); и (хх) антигенного мутированного варианта или фрагмента любого из полипептидов от (а) до (uu).
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой аутоантиген, причем указанный аутоантиген представляет собой полипептид, выбранный из группы, состоящей из: (a) IgE; (b) ИЛ-6; (с) лиганда рецептора активатора ядерного фактора каппа В (RANKL); (d) фактора роста эндотелия сосудов (VEGF); (е) рецептора фактора роста эндотелия сосудов (VEGF-R); фактора роста гепатоцитов (HGF); (f) интерлейкина-1α; (g) интерлейкина-1β; (h) интерлейкина-5; (i) интерлейкина-8; (j) интерлейкина-13; (k) интерлейкина-15; (1) интерлейкина-17 (ИЛ-17); (m) ИЛ-23; (n) грелина; (о) ангиотензина; (р) хемокина (C-С мотив) (CCL21); (q) хемокина (C-Х мотив) (CXCL 12); (r) фактора, полученного из стромальных клеток 1 (SDF-I); (s) макрофагального колониестимулирующего фактора (М-КСФ); (t) белка хемотаксиса моноцитов 1 (МСР-1); (u) эндоглина; (v) резистина; (w) гонадотропин-высвобождающего гормона (GnRH); (х) соматолиберина (GHRH); (у) лютеинизирующего гормона рилизинг гормона (ЛГРГ); (g) тиреотропин-рилизинг-гормона (TRH); (аа) фактора ингибирования миграции макрофагов (MIF); (bb) глюкозо-инсулинотропного пептида (GIP); (сс) эотаксина; (dd) брадикинина; (ее) Дез-Арг брадикинина; (ff) хемоаттрактанта В-лимфоцитов (BLC); (gg) макрофагального колониестимулирующего фактора M-CSF; (hh) фактора некроза опухоли-α (ФНО-α); (ii) амилоидного бета-пептида (Аβ1-42); (jj) амилоидного бета-пептида (Аβ1-6); (kk) IgE человека; (ll) внеклеточного домена CCR5; (mm) внеклеточного домена CXCR4; (nn) гастрина; (оо) СЕТР; (с) С5α; (рр) рецептора эпидермального фактора роста (EGF-R); (rr) CGRP; (ss) α-синуклеина; (tt) пептида, связанного с геном кальцитонина (CGRP); (uu) амилина или (vv) фрагмента любого одного из указанных полипептидов от (а) до (uu); и (хх) антигенного мутированного варианта или фрагмента любого из полипептидов от (а) до (uu).
Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой интерлейкин-17 (ИЛ-17). Интерлейкин-17 представляет собой цитокин T-клеточного происхождения, который индуцирует высвобождение провоспалительных медиаторов в широком диапазоне типов клеток. Аберрантные ответы Th17 и избыточная экспрессия ИЛ-17 были вовлечены в патофизиологию ряда аутоиммунных расстройств, включая ревматоидный артрит и рассеянный склероз. Молекулы, блокирующие ИЛ-17, такие как ИЛ-17-специфические моноклональные антитела, оказались эффективными в облегчении заболевания в животных моделях. Помимо этого, недавно была предложена активная иммунизация, направленная на ИЛ-17, с использованием вирусоподобных частиц, конъюгированных с рекомбинантным ИЛ-17 (

Следовательно, согласно другому наиболее предпочтительному варианту реализации указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 42. Помимо этого предложенные в настоящем изобретении композиции, содержащие модифицированные ВПЧ, используют в способе лечения воспалительного заболевания, предпочтительно хронического воспалительного заболевания у животного или человека. Предпочтительно указанное воспалительное заболевание выбрано из PA, PC, псориаза, астмы, болезни Крона, колита, ХОБЛ, сахарного диабета, нейродермита (аллергического дерматита), также предпочтительно указанное воспалительное заболевание представляет собой PC. Помимо этого, предпочтительно указанный антиген указанной композиции согласно настоящему изобретению содержит или предпочтительно состоит из последовательности SEQ ID NO: 42.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-5. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 41. Помимо этого предложенные в настоящем изобретении композиции, содержащие модифицированные ВПЧ, используют в способе лечения воспалительного заболевания, предпочтительно хронического воспалительного заболевания у животного или человека. Предпочтительно указанное воспалительное заболевание выбрано из PA, PC, псориаза, астмы, болезни Крона, колита, ХОБЛ, сахарного диабета, нейродермита (аллергического дерматита). Помимо этого, предпочтительно указанный антиген указанной композиции согласно настоящему изобретению содержит или предпочтительно состоит из последовательности SEQ ID NO: 41.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-5 собаки. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 61, или аминокислотной последовательности, которая по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательности SEQ ID NO: 61. Предпочтительно указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 61. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген указанной композиции согласно настоящему изобретению содержит или предпочтительно состоит из последовательности SEQ ID NO: 61. Помимо этого предпочтительно композиция согласно настоящему изобретению содержит (i) модифицированную вирусоподобную частицу (ВПЧ) вируса мозаики огурца (ВМО), содержащую по меньшей мере один первый сайт присоединения, причем указанная модифицированная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного модифицированного полипептида ВМО, причем указанный модифицированный полипептид ВМО содержит или предпочтительно состоит из (а) полипептида ВМО, и (b) эпитопа клеток T-хелперов; и при этом указанный модифицированный полипептид ВМО содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7; (b) по меньшей мере одного антигена, содержащего по меньшей мере один второй сайт присоединения, и при этом указанный антиген представляет собой ИЛ-5 собаки; и при этом указанная ВПЧ ВМО и указанный ИЛ-5 собаки связаны посредством указанного по меньшей мере одного первого и по меньшей мере одного второго сайта присоединения, и при этом указанный ИЛ-5 собаки содержит или предпочтительно состоит из последовательности SEQ ID NO: 61, или аминокислотной последовательности, которая по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательности SEQ ID NO: 61, и также предпочтительно ИЛ-5 собаки содержит или предпочтительно состоит из последовательности SEQ ID NO: 61.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-4. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 45.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-4 собаки. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 62, или аминокислотной последовательности, которая по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательности SEQ ID NO: 62. Предпочтительно указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 62. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген указанной композиции согласно настоящему изобретению содержит или предпочтительно состоит из последовательности SEQ ID NO: 62. Помимо этого предпочтительно композиция согласно настоящему изобретению содержит (i) модифицированную вирусоподобную частицу (ВПЧ) вируса мозаики огурца (ВМО), содержащую по меньшей мере один первый сайт присоединения, причем указанная модифицированная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного модифицированного полипептида ВМО, причем указанный модифицированный полипептид содержит ВМО или предпочтительно состоит из: (а) полипептида ВМО, и (b) эпитопа клеток T-хелперов; и при этом указанный модифицированный полипептид ВМО содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7; (b) по меньшей мере одного антигена, содержащего по меньшей мере один второй сайт присоединения, и при этом указанный антиген представляет собой ИЛ-4 собаки; и при этом указанная ВПЧ ВМО и указанный ИЛ-4 собаки связаны посредством указанного по меньшей мере одного первого сайта присоединения и по меньшей мере одного второго сайта присоединения, и при этом указанный ИЛ-4 собаки содержит или предпочтительно состоит из последовательности SEQ ID NO: 62, или аминокислотной последовательности, которая по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательности SEQ ID NO: 62, и также предпочтительно ИЛ-4 собаки содержит или предпочтительно состоит из последовательности SEQ ID NO: 62.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-13. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 46.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-13 собаки. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 63, или аминокислотной последовательности, которая по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательности SEQ ID NO: 63. Предпочтительно указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 63. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген указанной композиции согласно настоящему изобретению содержит или предпочтительно состоит из последовательности SEQ ID NO: 63. Помимо этого предпочтительно композиция согласно настоящему изобретению содержит (i) модифицированную вирусоподобную частицу (ВПЧ) вируса мозаики огурца (ВМО), содержащую по меньшей мере один первый сайт присоединения, причем указанная модифицированная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного модифицированного полипептида ВМО, причем указанный модифицированный полипептид содержит ВМО или предпочтительно состоит из: (а) полипептида ВМО, и (b) эпитопа клеток T-хелперов; и при этом указанный модифицированный полипептид ВМО содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7; (b) по меньшей мере одного антигена, содержащего по меньшей мере один второй сайт присоединения, и при этом указанный антиген представляет собой ИЛ-13 собаки; и при этом указанная ВПЧ ВМО и указанный ИЛ-13 собаки связаны посредством указанного по меньшей мере одного первого сайта присоединения и по меньшей мере одного второго сайта присоединения, и при этом указанный ИЛ-13 собаки содержит или предпочтительно состоит из последовательности SEQ ID NO: 63, или аминокислотной последовательности, которая по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательности SEQ ID NO: 63, и также предпочтительно ИЛ-13 собаки содержит или предпочтительно состоит из последовательности SEQ ID NO: 63.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ФНО-α. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-1α.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-1β. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 60.
Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой пептид, полученный из Аβ-1-42. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой IgE, или пептид, или домен, содержащийся в IgE.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-31 человека, кошки или собаки. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 43 или SEQ ID NO: 44. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ИЛ-31 собаки. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 43, или аминокислотной последовательности, которая по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательности SEQ ID NO: 43. Предпочтительно указанный антиген содержит или предпочтительно состоит из последовательности SEQ ID NO: 43. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген указанной композиции согласно настоящему изобретению содержит или предпочтительно состоит из последовательности SEQ ID NO: 43. Помимо этого предпочтительно композиция согласно настоящему изобретению содержит (i) модифицированную вирусоподобную частицу (ВПЧ) вируса мозаики огурца (ВМО), содержащую по меньшей мере один первый сайт присоединения, причем указанная модифицированная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного модифицированного полипептида ВМО, причем указанный модифицированный полипептид содержит ВМО или предпочтительно состоит из: (а) полипептида ВМО, и (b) эпитопа клеток T-хелперов; и при этом указанный модифицированный полипептид ВМО содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7; (ii) по меньшей мере один антиген, содержащий по меньшей мере один второй сайт присоединения, и при этом указанный антиген представляет собой ИЛ-31 собаки; и при этом указанная ВПЧ ВМО и указанный ИЛ-31 собаки связаны посредством указанного по меньшей мере одного первого и по меньшей мере одного второго сайта присоединения, и при этом указанный ИЛ-31 собаки содержит или предпочтительно состоит из последовательности SEQ ID NO: 43, или аминокислотной последовательности, которая по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична последовательности SEQ ID NO: 43, и также предпочтительно ИЛ-31 собаки содержит или предпочтительно состоит из последовательности SEQ ID NO: 43.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой α-синуклеин или пептид, полученный из α-синуклеина, и при этом предпочтительно указанный пептид содержит от 6 до 14 аминокислот, и при этом более предпочтительно указанный антиген представляет собой пептид, полученный из α-синуклеина, выбранный из любой из последовательностей SEQ D NO: 32, SEQ ID NO: 33 и SEQ ID NO: 34. Другие предпочтительные пептиды, полученные из α-синуклеина, описаны в заявке WO 2011/020133, которая включена в настоящую заявку посредством ссылки.
Альфа-синуклеин (α-Syn), небольшой белок с множеством физиологических и патологических функций, является одним из основных белков, обнаруженных в тельцах Леви, которые являются патологическим признаком заболеваний, связанных с тельцами Леви, включая болезнь Паркинсона (PD). Недавно α-Syn был обнаружен в жидкостях организма, включая кровь и спинномозговую жидкость, и, вероятно, он вырабатывается периферическими тканями и клетками центральной нервной системы. Обмен альфа-синуклеина между мозгом и периферическими тканями может иметь важные патофизиологические и терапевтические последствия (Gardai SJ et al., PLoS ONE (2013) 8(8): e71634). Получено подавляющее количество доказательств причастности альфа-синуклеина (α-Syn) к патогенезу болезни Паркинсона (PD). Однако отсутствует четкое согласованное мнение относительно способа, с помощью которого α-Syn приводит к патологии при PD и других синуклеинопатиях.
Альфа-синуклеин является одним из основных компонентов телец Леви (LB), и имеются убедительные доказательства того, что сверхэкспрессия α-Syn приводит к агрегации. Данные генетических исследований у человека показали, что миссенс-мутации и умножения в гене α-Syn вызывают семейную PD. В случае умножения в гене повышенные уровни белка α-Syn, как предполагают, приводят к доминирующему усилению функции, что приводит к патологии. Несмотря на то, что повышенные уровни α-Syn могут привести к агрегации и токсичности, исследования, проведенные в течение последних нескольких лет, также выявили, что повышенные уровни α-Syn могут помешать созданию, локализации и/или поддержанию пула везикул (Gardai SJ et al., PLoS ONE (2013) 8(8): e71634, а также ссылки, приведенные в указанной работе).
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой амилин. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ангиотензин I или пептид, полученный из ангиотензина I. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ангиотензин II или пептид, полученный из ангиотензина II. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой ГнРГ. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой эотаксин.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой полипептид паразита, причем предпочтительно указанный патоген выбран из группы, состоящей из: (a) Toxoplasma spp.; (b) Plasmodium falciparum; (с) Plasmodium vivax; (d) Plasmodium ovale; (e) Plasmodium malariae; (f) Leishmania; (g) Schistosoma; и (h) Nematodes. Предпочтительно указанный антиген получен из Plasmodium falciparum или Plasmodium vivax.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой бактериальный полипептид, причем предпочтительно указанная бактерия выбрана из группы, состоящей из: (a) Chlamydia; (b) Streptococccus; (с) Pneumococcus; (d) Staphylococcus; (e) Salmonella; (f) Mycobacteria; (g) Clostridia; (h) Vibrio; (i) Yersinia; (k) Meningococcus; (l) Borelia.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой вирусный антиген, причем предпочтительно указанный вирусный антиген представляет собой полипептид, выбранный из группы, состоящей из: (а) ВИЧ и других ретровирусов; (b) вируса гриппа, предпочтительно внеклеточного домена М2 или НА или глобулярного домена НА вируса гриппа А; (с) полипептида вируса гепатита В, предпочтительно preSl; (d) вируса гепатита С; (е) ВПЧ, предпочтительно HPV16E7; (f) РСВ, (g) атипичной пневмонии и других коронавирусов, (h) Денге и других флавивирусов, таких как вирус Западного Нила и энтеровирус везикулярного стоматита, (i) чикунгунья и других альфавирусов; (k) ЦМВ и других герпесвирусов; (l) ротавируса. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой производное РСВ.
Согласно предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой внеклеточный домен белка М2 вируса гриппа А, или его антигенный фрагмент. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит или предпочтительно состоит из внеклеточного домена белка М2 вируса гриппа А, причем предпочтительно указанный внеклеточный домен белка М2 вируса гриппа А представляет собой последовательность SEQ ID NO: 24. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой глобулярный домен вируса гриппа.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой аллерген, причем предпочтительно указанный аллерген получен из группы, состоящей из: (а) экстракта пыльцы; (b) экстракта пыли; (с) экстракта пылевых клещей; (d) экстракта грибков; (е) эпидермального экстракта млекопитающих; (f) экстракта перьев; (g) экстракта насекомых; (h) экстракта пищевых продуктов; (i) экстракта волос; (j) экстракта слюны; и (k) экстракта сыворотки. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой аллерген, причем указанный аллерген выбран из группы, состоящей из: (а) деревьев; (b) злаковых трав; (с) домашней пыли; (d) клещей домашней пыли; (е) Aspergillus; (f) волос животных; (g) перьев животных; (h) пчелиного яда; (i) продуктов животного происхождения; (j) растительных продуктов; (k) перхоти животных; (l) аллергенов арахиса.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой рекомбинантный аллерген, причем указанный аллерген выбран из группы, состоящей из: (а) фосфолипазы А2 пчелиного яда; (b) Amb a1 пыльцы амброзии; (с) Bet v I пыльцы березы; (d) 5 DoI m V яда пятнистой осы; (е) Der р 1 клещей домашней пыли; (е) Der f 2 клещей домашней пыли; (g) Der р 2 клещей домашней пыли; (h) Lep d клещей домашней пыли; (i) грибкового аллергена Alt 1; (j) грибкового аллергена Asp f 1; (k) грибкового аллергена Asp f 16; (l) аллергена арахиса (m) аллергена кошки Fel d1; (n) аллергенов собаки Can f1, Can f2; (о) аллергенов арахиса; или (р) аллергена японского кедра Cry J2. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой аллергены собаки Can f1, Can f2.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой аллерген арахиса. Предпочтительно указанный антиген представляет собой аллерген арахиса, содержащий аминокислотную последовательность, выбранную из последовательности SEQ ID NO: 57, SEQ ID NO: 64 или SEQ ID NO: 65.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой аллерген, полученный из Cry J 2 японского кедра. Предпочтительно указанный антиген получен из Cry J 2 японского кедра и содержит аминокислотную последовательность SEQ ID NO: 55.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой аллерген, полученный из Amb а 1 пыльцы амброзии. Предпочтительно указанный антиген получен из Amb а 1 пыльцы амброзии и содержит аминокислотную последовательность SEQ ID NO: 54.
Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой аллерген кошки Fel d1. Домашняя кошка (Felis domesticus) является важным источником внутренних аллергенов (Lau, S., et al. (2000) Lancet 356, 1392-1397). Действительно, кошки встречаются приблизительно в 25% домашних хозяйств в западных странах, и аллергия на кошек встречается у значительной части населения. Тяжесть симптомов варьируется от относительно легкого ринита и конъюнктивита до потенциально опасных для жизни астматических обострений. Несмотря на то, что пациенты иногда сенсибилизированы к нескольким различным молекулам в перхоти и шкуре кошки, главный аллерген представляет собой Fel d1. Важность этого аллергена была подчеркнута в многочисленных исследованиях. Действительно, более 80% пациентов с аллергией на кошек имеют антитела IgE к указанному мощному аллергену (van Ree, R., et al. (1999) J. Allergy Clin Immunol 104, 1223-1230).
Fel d1 представляет собой кислый гликопротеин массой 35-39 кД, содержащий 10-20% N-связанных углеводов, и обнаруживается в шкуре, слюне и слезных железах кошек. Fel d1 образован двумя нековалентно связанными гетеродимерами. Каждый гетеродимер состоит из одного пептида, содержащего 70 остатков (известного как «цепь 1»), и одного пептида, содержащего 78, 85, 90 или 92 остатка (известного как «цепь 2»), которые кодируются отдельными генами (см. Duffort, О.A., et al. (1991) Mol Immunol 28, 301-309; Morgenstern, J.P., et al; (1991) Proc Natl Acad Sci USA 88, 9690-9694 и Griffith, I.J., et al. (1992) Gene 113, 263-268).
Было описано несколько рекомбинантных конструкций Fel d1 (Vailes LD, et al., J Allergy Clin Immunol (2002) 110: 757-762;

Следовательно, согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой rFel d1. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой белок Fel d1, причем указанный белок Fel d1 представляет собой гибридный белок, содержащий цепь 1 Fel d1 и цепь 2 Fel d1, причем C-конец указанной цепи 2 Fel d1 гибридизован с N-концом указанной цепи 1 Fel d1 непосредственно через одну пептидную связь или посредством спейсера, при этом указанный спейсер состоит из аминокислотной последовательности, содержащей 1-20 аминокислотных остатков, при этом предпочтительно указанный спейсер состоит из аминокислотной последовательности, содержащей 10-20 аминокислотных остатков. Весьма предпочтительно указанный спейсер состоит из аминокислотной последовательности, содержащей 15 остатков аминокислот, и еще более предпочтительно указанный спейсер содержит аминокислотную последовательность SEQ ID NO: 47. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой белок Fel d1, причем указанный белок Fel d1 представляет собой гибридный белок, содержащий цепь 1 Fel d1 и цепь 2 Fel d1, при этом C-конец указанной цепи 1 Fel d1 гибридизован с N-концом указанной цепи 2 Fel d1 непосредственно через одну пептидную связь или посредством спейсера, при этом указанный спейсер состоит из аминокислотной последовательности, содержащей 1-20 аминокислотных остатков, при этом предпочтительно указанный спейсер состоит из аминокислотной последовательности, содержащей 10-20 аминокислотных остатков. Предпочтительно указанная цепь 1 Fel d1 содержит последовательность SEQ ID NO: 37 или гомологичную последовательность, причем указанная гомологичная последовательность идентична последовательности SEQ ID NO: 37, более чем на 90%, или еще более предпочтительно более чем на 95%. Помимо этого, предпочтительно указанная цепь 2 Fel d1 содержит последовательность SEQ ID NO: 38, SEQ ID NO: 39 или SEQ ID NO: 40, или гомологичную последовательность, при этом указанная гомологичная последовательность идентична последовательности SEQ ID NO: 38, SEQ ID NO: 39 или SEQ ID NO: 40, более чем на 90% и еще более предпочтительно более чем на 95%.
Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит, предпочтительно состоит из последовательности SEQ ID NO: 17. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит, предпочтительно состоит из последовательности SEQ ID NO: 18. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген содержит, предпочтительно состоит из последовательности SEQ ID NO: 52. Согласно наиболее предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой белок Fel d1, содержащий аминокислотную последовательность, выбранную из: (a) SEQ ID NO: 17; (b) SEQ ID NO: 18; (с) SEQ ID NO: 50; (d) SEQ ID NO: 56; (e) SEQ ID NO: 59; или SEQ ID NO: 52.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный белок Fel d1 содержит аминокислотную последовательность, выбранную из: (a) SEQ ID NO: 50; (b) SEQ ID NO: 56 (с) SEQ ID NO: 59; или (d) SEQ ID NO: 52. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный белок Fel d1 содержит аминокислотную последовательность, выбранную из: (a) SEQ ID NO: 50; (b) SEQ ID NO: 56 или (с) SEQ ID NO: 59.
Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный белок Fel d1 содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 52. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный белок Fel d1 содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 59. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный белок Fel d1 содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 50. Согласно другому наиболее предпочтительному варианту реализации настоящего изобретения указанный белок Fel d1 содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 56.
Согласно наиболее предпочтительному варианту реализации настоящего изобретения композиция согласно настоящему изобретению содержит: (i) модифицированную вирусоподобную частицу (ВПЧ) вируса мозаики огурца (ВМО), содержащую по меньшей мере один первый сайт присоединения, причем указанная модифицированная ВПЧ ВМО содержит, по существу состоит или, в качестве альтернативы, состоит из по меньшей мере одного модифицированного полипептида ВМО, причем указанный модифицированный полипептид ВМО содержит или предпочтительно состоит из (а) полипептида ВМО, и (b) эпитопа клеток T-хелперов; и при этом указанный модифицированный полипептид ВМО содержит, предпочтительно состоит из аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7; (b) по меньшей мере одного антигена, содержащего по меньшей мере один второй сайт присоединения, и при этом указанный антиген представляет собой белок Fel d1; и при этом указанная ВПЧ ВМО и указанный белок Fel d1 связаны посредством указанного по меньшей мере одного первого и по меньшей мере одного второго сайта присоединения, и при этом указанный белок Fel d1 содержит аминокислотную последовательность, выбранную из: (a) SEQ ID NO: 50; (b) SEQ ID NO: 56; (c) SEQ ID NO: 59; или (d) SEQ ID NO: 52, и при этом предпочтительно указанный белок Fel d1 содержит аминокислотную последовательность, выбранную из: (a) SEQ ID NO: 50; (b) SEQ ID NO: 56 или (с) SEQ ID NO: 59.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой яд животного. Согласно предпочтительному варианту реализации настоящего изобретения антиген представляет собой инактивированный змеиный яд. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный антиген представляет собой гаптен. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный гаптен представляет собой лекарственный препарат, причем указанный лекарственный препарат предпочтительно выбран из группы, состоящей из: (а) кодеина; (b) фентанила; (с) героина; (d) морфина; (е) амфетамина; (f) кокаина; (g) метилендиоксиметамфетамина; (h) метамфетамина; (i) метилфенидата; (j) никотина; (k) ЛСД; (1) мескалина; (m) псилоцибина; (n) тетрагидроканнабинола; и (о) никотина.
Согласно другому предпочтительному варианту реализации настоящего изобретения указанный гаптен представляет собой гормон, причем предпочтительно указанный гормон выбран из группы, состоящей из: (а) прогестерона; (b) эстрогена; (с) тестостерона; (d) фолликулостимулирующего гормона; (е) меланинстимулирующего гормона; (f) адреналина; и (g) норадреналина. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный гаптен представляет собой токсин, причем предпочтительно указанный токсин выбран из группы, состоящей из: (а) афлатоксина; (b) сигуатоксина; (с) тетродотоксина; и (d) антибиотиков. Согласно другому предпочтительному варианту реализации настоящего изобретения указанный гаптен представляет собой углевод, полученный из патогена.
Согласно другому аспекту в настоящем изобретении предложена вакцина, содержащая или, в качестве альтернативы, состоящая из модифицированной вирусоподобной частицы согласно настоящему изобретению или композиции согласно настоящему изобретению. В область настоящего изобретения включены вакцины, в которых указанные модифицированные ВПЧ и/или указанная композиция содержит любую из технических особенностей, раскрытых в настоящем документе, по отдельности или в любой возможной комбинации. Согласно одному варианту реализации настоящего изобретения вакцина дополнительно содержит адъювант. Согласно другому варианту реализации вакцина не содержит адъювант. Согласно предпочтительному варианту реализации настоящего изобретения указанная вакцина содержит эффективное количество композиции согласно настоящему изобретению. «Эффективное количество» относится к количеству, которое должно быть введено субъекту для достижения детектируемого физиологического действия.
Согласно другому аспекту в настоящем изобретении предложена фармацевтическая композиция, содержащая: (а) модифицированную ВПЧ согласно настоящему изобретению, композицию согласно настоящему изобретению или вакцину согласно настоящему изобретению; и (b) фармацевтически приемлемый носитель, разбавитель и/или вспомогательное вещество. Указанный разбавитель включает стерильные водные (например, физиологический раствор) или неводные растворы и суспензии. Примеры неводных растворителей включают пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Носители или окклюзионные повязки могут быть использованы для повышения проницаемости кожи и усиления всасывания антигена. Фармацевтические композиции согласно настоящему изобретению могут быть обеспечены в форме, которая содержат соли, буферы, адъюванты или другие вещества, которые являются желательными для повышения эффективности конъюгата. Примеры материалов, пригодных для использования в приготовлении фармацевтических композиций, приведены в многочисленных источниках, включая Remington's Pharmaceutical Sciences (Osol, A, ed., Mack Publishing Co., (1990)). Согласно одному варианту реализации настоящего изобретения указанная фармацевтическая композиция содержит эффективное количество вакцины согласно настоящему изобретению. «Эффективное количество» относится к количеству, которое необходимо ввести субъекту для достижения детектируемого физиологического эффекта.
Согласно другому аспекту настоящего изобретения предложен способ иммунизации, включающий введение модифицированной ВПЧ согласно настоящему изобретению, композиции согласно настоящему изобретению, вакцины согласно настоящему изобретению или фармацевтической композиции согласно настоящему изобретению животному или человеку. В предпочтительном варианте указанный способ включает введение композиции согласно настоящему изобретению, вакцины согласно настоящему изобретению или фармацевтической композиции согласно настоящему изобретению животному или человеку.
Согласно другому аспекту настоящего изобретения предложен способ лечения или предотвращения заболевания, расстройства или физиологического состояния у животного, причем указанный способ включает введение модифицированной ВПЧ согласно настоящему изобретению, композиции согласно настоящему изобретению, вакцины согласно настоящему изобретению или фармацевтической композиции согласно настоящему изобретению указанному животному, причем указанное животное предпочтительно может представлять собой человека. Согласно другому предпочтительному варианту реализации настоящего изобретения указанную модифицированную ВПЧ, указанную композицию, указанную вакцину или указанную фармацевтическую композицию вводят указанному животному подкожно, внутривенно, внутрикожно, интраназально, перорально, интранодально или трансдермально.
ПРИМЕРЫ
ПРИМЕР 1
Выделение и клонирование белка оболочки (CP) вируса мозаики огурца (ВМО)
Общую РНК из листьев лилии, инфицированной ВМО, собранных в частном саду в Риге, Латвия, выделяли с использованием реагента TRI (Sigma, Сент-Луис, США) в соответствии с рекомендациями производителя. Для синтеза кДНК использовали набор OneStep RT-PCR (Qiagen, Венло, Нидерланды). Для амплификации гена CP ВМО последовательности праймеров выбирали после анализа последовательностей ВМО в GenBank: CMcpF


ПРИМЕР 2
Экспрессия CP, имеющего последовательность SEQ ID NO: 1, в Е. coli с получением ВПЧ ВМО
Для получения ВПЧ ВМО клетки штамма Е. coli С2566 (New England Biolabs, Ипсвич, США) трансформировали плазмидой pET-BMOwt, содержащей ген CP ВМО. После отбора клонов с самым высоким уровнем экспрессии белка-мишени культуры Е. coli выращивали в среде 2×TY, содержащей канамицин (25 мг/л), на ротационном шейкере (200 об./мин; Infors, Боттминген, Швейцария) при 30°C до достижения оптической плотности при 600 нм (OD600) 0,8-1,0. Затем клетки индуцировали 0,2 мМ IPTG, и среду дополняли 5 мМ MgCl2. Инкубацию продолжали на ротационном шейкере при 20°C в течение 18 ч. Полученную биомассу собирали с помощью низкоскоростного центрифугирования и замораживали при -20°C. После оттаивания на льду клетки суспендировали в буфере, содержащем 50 мМ цитрата натрия, 5 мМ бората натрия, 5 мМ EDTA, 5 мМ меркаптоэтанола (рН=9,0, буфер А) и разрушали путем ультразвуковой обработки. Нерастворимые белки и остатки клеток удаляли центрифугированием (13000 об./мин, 30 мин при 5°C). Растворимый белок CP ВМО в очищенном лизате осаждали с использованием насыщенного сульфата аммония (1:1, об./об.) в течение ночи при +4°C. Осажденные белки солюбилизировали в том же буфере А (без меркаптоэтанола) в течение 4 ч при +4°C. Нерастворимые белки удаляли с помощью низкоскоростного центрифугирования (13000 об./мин, 15 мин при 4°C). Раствор белка, содержащий растворимый CP ВМО, отделяли от клеточных белков с помощью ультрацентрифугирования (ротор SW28, Beckman, Пало-Альто, США, при 25000 об./мин, 6 ч, 5°C) в градиенте сахарозы (20-60% сахарозы в буфере А без меркаптоэтанола, с добавлением 0,5% тритона Х-100). Градиент разделяли на шесть фракций, начиная с нижней части градиента, и фракции исследовали методом электрофореза в ДСН-ПААГ (фиг. 2). Фракции №2 и №3, содержащие рекомбинантный CP ВМО, объединяли и подвергали диализу против 200 объемов буфера (5 мМ бората натрия, 2 мМ ЭДТА, рН=9,0) для удаления сахарозы и тритона Х-100. После диализа раствор CP ВМО стерилизовали путем фильтрации через фильтр с размером пор 0,2 мкм. Далее CP ВМО концентрировали путем ультрацентрифугирования с использованием ротора Туре70 (Beckman, Пало-Альто, США) через «подушку» 20% сахарозы в стерильных условиях (50000 об./мин, 4 ч, +5°C). Концентрацию очищенного BMOwt оценивали с использованием флуориметра QuBit в соответствии с рекомендациями производителя (Invitrogen, Юджин, США). Концентрированные растворы ВПЧ (приблизительно 3 мг/мл) хранили при +4°C в буфере, содержащем 5 мМ бората натрия, 2 мМ ЭДТА (рН=9,0). Все этапы экспрессии и очистки ВПЧ контролировали с помощью электрофореза в ДСН-ПААГ с использованием 12,5% гелей.
Как показано на фиг. 2, белок оболочки ВМО может быть успешно экспрессирован в клетках Е. coli, и значительная часть может быть получена в растворимой фракции. Помимо этого, указанные белки обнаруживали непосредственно в экстрактах клеток Е. coli в виде изометрических ВПЧ, согласно результатам исследования с использованием градиента сахарозы (фиг. 3А), динамического рассеяния света и электронной микроскопии (фиг. 3В).
ПРИМЕР 3
Клонирование модифицированного белка оболочки ВМО, содержащего эпитоп столбнячного анатоксина (BMO-Ntt830)
Для того чтобы заместить природные аминокислоты на N-конце CP ВМО, имеющего последовательность SEQ ID NO: 1, последовательностями чужеродных эпитопов, плазмиду pET-BMOwt использовали в качестве матрицы для ПЦР-амплификации и мутагенеза. Сайт рестрикции Sail, содержащийся в последовательности гена BMOwt (фиг. 1), использовали для клонирования соответствующих продуктов ПЦР.
Чтобы ввести последовательность, кодирующую эпитоп столбнячного анатоксина, в ген BMOwt, потребовались два этапа ПЦР-мутагенеза. Для первого этапа амплификации использовали следующие праймеры для ПЦР: рЕТ-220
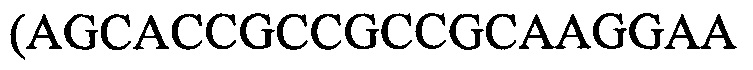
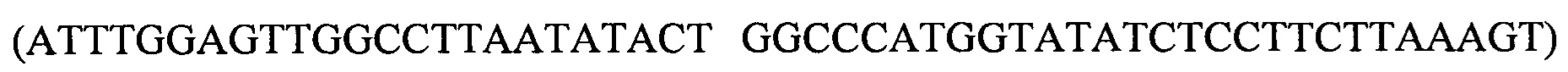

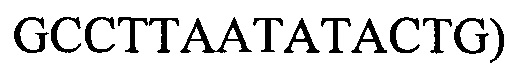
ПРИМЕР 4
Экспрессия BMO-Ntt830 в Е. coli с получением модифицированных ВПЧ ВМО
Способы экспрессии и очистки BMO-Ntt830 по существу были аналогичны тем, которые применяли для получения BMOwt, и описаны в примере 2. Чтобы продемонстрировать наличие эпитопа столбняка в ВПЧ ВМО использовали масс-спектрометрический анализ очищенных BMO-Ntt830 ВПЧ. Как показано на фиг. 4С, основной полученный пик соответствует теоретической молекулярной массе белка, если первый метионин удален в процессе синтеза белка в клетках Е. coli. Результаты исследования методами динамического рассеяния света и электронной микроскопии подтверждают изометрическую морфологию частиц, аналогичную таковой для ВПЧ BMOwt (фиг. 5).
ПРИМЕР 5
Клонирование модифицированного белка оболочки ВМО, содержащего эпитоп PADRE (BMO-Npadr)
Для того чтобы ввести последовательность, кодирующую эпитоп PADRE, в ген BMOwt, ПЦР-мутагенез проводили с использованием плазмиды pET-BMOwt в качестве матрицы для амплификации и субклонирования (см. также пример 3). Для амплификации использовали следующие праймеры: рЕТ-220 (SEQ ID NO: 11) и BMO-padrSal-R

ПРИМЕР 6
Экспрессия BMO-Npadr в Е. coli с получением модифицированных ВПЧ ВМО Способы экспрессии и очистки BMO-Npadr были аналогичны таковым для BMOwt и описаны в примере 2. Чтобы продемонстрировать присутствие эпитопа PADRE в ВПЧ ВМО использовали масс-спектрометрический анализ очищенных ВПЧ BMO-Npadr. Как показано на фиг. 4В, основной полученный пик соответствует теоретической молекулярной массе белка, если первый метионин удален в процессе синтеза белка в клетках Е. coli. Результаты исследований методами динамического рассеяния света и электронной микроскопии подтвердили изометрическую морфологию частиц, которая незначительно отличается от таковой для ВПЧ BMOwt и BMO-Nt830 (фиг. 6).
ПРИМЕР 7
Иммунизация мышей с использованием BMOwt, BMO-Ntt830 и BMO-Npadr
Группы из четырех самок мышей линии Balb/c иммунизировали с использованием ВПЧ BMOwt, BMO-Npadr и ВПЧ BMO-Ntt830. ВПЧ изготавливали в 150 мМ фосфатно-солевом буфере (ФСБ), рН=7,4, и 150 мкл вводили внутривенно на 0 и день 7 день. ВПЧ BMOwt, BMO-Npadr и ВПЧ BMO-Ntt830 вводили в трех дозах: 10, 1 или 0,1 мкг. У мышей брали кровь на 0 день (до иммунизации), 7 день, 14 день и 25 день, и образцы сыворотки крови исследовали с помощью ИФА, специфичного в отношении ВПЧ BMOwt, ВПЧ BMO-Npadr и ВПЧ BMO-Ntt830. Все иммунные сыворотки исследовали для определения соответствующих ВПЧ, используемых для иммунизации.
ИФА
Гуморальный ответ в образцах сыворотки мышей исследовали в указанное время. Для определения титров антител, специфичных в отношении ВПЧ BMOwt, BMO-Npadr и ВПЧ BMO-Ntt830, планшеты для ИФА (Nunc Immuno MaxiSorp, Рочестер, Нью-Йорк, США) покрывали с использованием 100 мкл соответствующих ВПЧ (1 мкг/мл) в течение ночи при 4°C в покрывающем буфере (буфер на основе 0,1 М гидрокарбоната натрия, рН=9,6). Для того чтобы избежать неспецифичного связывания планшеты для ИФА блокировали 200 мкл 2% БСА в ФСБТ и инкубировали в течение 2 часов при комнатной температуре. Образцы сыворотки разводили в 2% БСА/ФСБТ. Предварительно разбавленные образцы сыворотки переносили на планшеты с покрытием и дополнительно последовательно разводили, чтобы получить титры антител на основании расчета OD50. После 2 часов инкубации при комнатной температуре планшеты для ИФА промывали 5 раз с использованием 200 мкл ФСБТ. Связывание антител сыворотки крови определяли с помощью конъюгированного с пероксидазой хрена козьего антитела к IgG мыши (Jackson Immunoresearch). Детектирующее антитело разводили в соотношении 1:1000 в 2% БСА/ФСБТ и переносили 100 мкл на пробу. Планшеты инкубировали в течение 1 часа при комнатной температуре. Планшеты для ИФА промывали, как описано выше. Раствор субстрата готовили до промывки. Для получения указанного раствора 1 таблетку (10 мг) OPD (1,2-фенилендиамина дигидрохлорида) и 9 мкл 30% Н2О2 растворяли в 25 мл буфера на основе лимонной кислоты (0,066 М Na2HPO4, 0,035 М лимонной кислоты, рН=5,0). 100 мкл раствора субстрата пипеткой наносили на планшеты и инкубировали точно в течение 7 минут при комнатной температуре. Для остановки реакции на планшеты пипеткой наносили 50 мкл стоп-раствора (5% H2SO4 в Н2О). Величины оптической плотности для цветной реакции 1,2-фенилендиамина дигидрохлорида регистрировали при длине волны 450 нм. На фиг. 7 представлены антитела, специфичные в отношении BMOwt (фиг. 7А), BMO-Npadr (фиг. 7В) и BMO-Ntt880 (фиг. 7С), в зависимости от дозы.
ПРИМЕР 8
Связывание конструкций рекомбинантных Fel d1 с ВПЧ BMO-Npadr и ВПЧ BMO-Ntt830 и индукция иммунного ответа
Ковалентные гибриды rFel d1 (SEQ ID NO: 17) получали, как описано ранее (Schmitz N, et al., J Exp Med (2009) 206: 1941-1955). В общих чертах, комплементарную ДНК, кодирующую ковалентный димер цепи 2 и цепи 1, в которой C-конец цепи 2 Fel d1 гибридизован с N-концом цепи 1 Fel d1 посредством линкера, содержащего 15 аминокислот (GGGGS)3, получали с помощью ПЦР-амплификации с использованием набора перекрывающихся ДНК-праймеров (конструкция называется «конструкция rFel-2-G3-l»). Указанную комплементарную ДНК клонировали в рамке считывания в модифицированный вариант рЕТ-42а(+) (EMD), что привело к добавлению кодирующей последовательности для

Аналогичным образом, другой ковалентный гибрид rFel d1 (SEQ ID NO: 18) получали, как описано ранее (WO 2006/097530), соответствующий гибридному белку rFel d1, содержащему цепь 1 Fel d1 и цепь 2 Fel d1, причем C-конец цепи 1 Fel d1 гибридизован с N-концом цепи 2 Fel d1 посредством линкера, содержащего 15 аминокислот (GGGGS)3 («конструкция rFel-1-G3-2»).
Вирусоподобные частицы ВПЧ BMO-Npadr и ВПЧ BMO-Ntt830 в объеме 2,5 мл с конечной концентрацией 2 мг/мл (71 мкМ) вступали в реакцию с 27 мкл 50 мМ гетеробифункционального химического сшивающего линкера, сукцинимидил-6-(b-малеимидпропионамид)гексаноата (SMPH), в течение 1 часа при комнатной температуре (RT). Линкер содержит сложный эфир NHS, который реагирует с лизином на поверхности ВПЧ. Количество SMPH относится к 7,5-кратному молярного избытку относительно одного мономера ВПЧ, т.е. одного полипептида ВМО. Не вступивший в реакцию сшивающий линкер удаляли путем диализа против 150 мМ ФСБ, рН=7,4. Для получения композиций rFel d1-BMO-Npadr и rFel d1-BMO-Ntt830 раствор белка rFel d1 с концентрацией 2,7 мг/мл, что соответствует 150 мкМ в объеме 200 мкл, смешивали с 5-кратным молярным избытком восстанавливающего агента, трис-2-карбоксиэтилфосфина (ТСЕР), и инкубировали в течение 5 мин при комнатной температуре. Молярный избыток относился к количеству белка Fel d1. ТСЕР восстанавливает дисульфидные мостики между двумя остатками цистеина двух белковых молекул, чтобы сделать их доступными для реакции связывания к дериватизированными ВПЧ. Предварительно обработанный белок Fel d1 подвергали взаимодействию в молярном соотношении 1:1 с ВПЧ BMO-Npadr и ВПЧ BMO-Ntt830, дериватизированными с использованием 7,5-кратного избытка SMPH, в течение 3 часов при комнатной температуре при встряхивании. Восстановленные остатки цистеина белка вступали в реакцию с малеимидом сшивающего агента SMPH, связанного с ВПЧ. После ковалентного связывания несвязанный rFel d1 удаляли с помощью гель-фильтрации в 150 мМ ФСБ, рН=7,4. Композиции исследовали методом электрофореза в ДСН-ПААГ и иммуноблоттинга, чтобы обнаружить и подтвердить полосы после связывания. Для этой цели образцы ВПЧ BMO-Npadr и BMO-Ntt830, дериватизированных с использованием SMPH, композиции rFel d1-BMO-Npadr и rFel d1-BMO-Ntt830 и белок Fel d1 наносили на параллельные дорожки на геле. Связывание определяли методом иммуноблоттинга с использованием антител к пентагистидиновой последовательности, связывающихся с His-меткой белка Fel d1. Видимые полосы свидетельствовали о наличии белка Fel d1, а также SMPH-дериватизированных ВПЧ BMO-Npadr, ВПЧ BMO-Ntt830 и композиций rFel d1-BMO-Npadr и rFel d1-BMO-Ntt830, все из которых были легко различимы по их размеру. Помимо этого, гель после электрофореза в ДСН-ПААГ окрашивали Кумасси синим, полученные результаты позволили обнаружить и подтвердить связывание.
Иммунизация мышей с использованием rFel d1, связанного с BMO-Npadr и BMO-Ntt830
Группы из пяти самок мышей линии Balb/c иммунизировали с использованием ВПЧ BMO-Npadr и ВПЧ BMO-Ntt830, связанных посредством SMPH с rFel d1. По 5 мкг rFel d1-BMO-Npadr и rFel d1-BMO-Ntt830, соответственно, разбавляли в 150 мМ ФСБ, рН=7,4, до конечного объема 150 мкл и вводили внутривенно на 0 день и 7 день. У мышей брали кровь на 0 день (до иммунизации), 7 день, 14 день и 25 день, и образцы сыворотки исследовали с помощью ИФА, специфичного в отношении Fel d1.
ИФА
Гуморальный ответ в образцах сыворотки крови мышей исследовали в указанное время. Антитела, специфичные в отношении Fel d1, исследовали с помощью покрытых планшетов для ИФА с концентрацией 1 мкг/мл в объеме 100 мкл в ФСБ (рН=7,2) при 4°C в течение ночи. Планшеты для ИФА промывали 5 раз с использованием 200 мкл ФСБ, содержащего 0,05% твин-20 (рН=7,2, ФСБТ). Чтобы избежать неспецифичного связывания планшеты для ИФА блокировали 200 мкл 2% БСА в ФСБТ и инкубировали в течение 2 часов при комнатной температуре. Образцы сыворотки разводили в 2% БСА/ФСБТ. Предварительно разбавленные образцы сыворотки переносили на покрытые планшеты и дополнительно последовательно разводили, чтобы получить титры антител на основании расчета OD50. После 2 часов инкубации при комнатной температуре планшеты для ИФА промывали 5 раз с использованием 200 мкл ФСБТ. Связывание антител сыворотки крови определяли с помощью конъюгированного с пероксидазой хрена козьего антитела к IgG мыши (Jackson Immunoresearch). Детектирующее антитело разводили в соотношении 1:1000 в 2% БСА/ФСБТ и переносили 100 мкл на пробу. Планшеты инкубировали в течение 1 часа при комнатной температуре. Планшеты для ИФА промывали, как описано выше. Раствор субстрата готовили до промывки. Для получения указанного раствора 1 таблетку (10 мг) OPD (1,2-фенилендиамина дигидрохлорида) и 9 мкл 30% Н2О2 растворяли в 25 мл буфера на основе лимонной кислоты (0,066 М Na2HPO4, 0,035 М лимонной кислоты, рН=5,0). 100 мкл раствора субстрата пипеткой наносили на планшеты и инкубировали точно в течение 7 минут при комнатной температуре. Для остановки реакции на планшеты пипеткой наносили 50 мкл стоп-раствора (5% H2SO4 в Н2О). Величины оптической плотности для цветной реакции 1,2-фенилендиамина дигидрохлорида регистрировали при длине волны 450 нм. На фиг. 8 показано, что антитела, специфичные в отношении Fel d1, были индуцированы у мышей при использовании композиций согласно настоящему изобретению, rFel d1-BMO-Npadr (фиг. 8А) и rFel d1-BMO-Ntt830 (фиг. 8В).
ПРИМЕР 9
Связывание пептида α-синуклеина с BMO-Ntt830 и индукция иммунного ответа
Связывание пептида α-синуклеина, содержащего последовательность SEQ ID NO: 22, с ВПЧ, образованными из BMO-Ntt830 (SEQ ID NO: 6), проводили следующим образом. 1 мл раствора 1 мг/мл BMO-Ntt830 в 20 мМ HEPES, 50 мМ NaCl, рН=7,3 подвергали реакции с 79,3 мкл раствора SMPH (10 мМ в ДМСО) в течение 60 мин при комнатной температуре. Помимо этого, 1 мл раствора 1 мг/мл BMO-Ntt830 в 20 мМ HEPES, 50 мМ NaCl, рН=7,3 подвергали реакции с 79,3 мкл раствора сульфо-KMUS (10 мМ в 20 мМ HEPES, рН=7,4) в течение 60 мин при комнатной температуре. Реакции подвергали трехкратному диализу при 4°C против 2 л 20 мМ HEPES, 50 мМ NaCl, рН=7,3 в течение 2 ч, 14 ч и 2 ч в диализной кассете Slide-A-Lyzer с НОММ 10 кДа. По 800 мкл дериватизированных и диализованных растворов BMO-Ntt830 смешивали с 21,5 мкл пептида α-синуклеина (22,32 мг/мл) и инкубировали для химического сшивания в течение 3 ч при комнатной температуре при 500 об./мин на термосмесителе со встряхиванием Eppendorf. Реакционные смеси после реакции связывания очищали путем центрифугирования при 20000 g в течение 10 мин при 4°C. Дериватизированный белок оболочки BMO-Ntt830 и продукты реакции связывания исследовали методом электрофореза в ДСН-ПААГ в восстанавливающих условиях на 4-12% бис-трис гелях NuPAGE®. Затем проводили денситометрический анализ гелей, окрашенных Кумасси синим. Были видны несколько полос, свидетельствующих о повышенной молекулярной массе по отношению к мономеру белка оболочки BMO-Ntt830, что ясно указывало на успешное связывание пептида α-синуклеина с BMO-Ntt830 (NuPAGE®, окрашенный Кумасси синим, не показан). Плотность связывания была выше 1,0, и эффективность связывания составила приблизительно 60%. Чтобы подтвердить целостность ВПЧ ВМО-Ntt830 после дериватизации и связывания, дериватизированные BMO-Ntt830 и связанные продукты исследовали методом электрофореза в 1% агарозном геле в 1×ТАЕ с последующим окрашиванием Кумасси синим и бромистым этидием. Полосы белков и нуклеиновых кислот дериватизированных и связанных ВПЧ BMO-Ntt830, соответственно, совместно мигрируют и имеют характер миграции, который аналогичен таковому для немодифицированных и несвязанных BMO-Ntt830. Совместная миграция для белка оболочки и нуклеиновых кислот ясно показала, что ВПЧ BMO-Ntt830 оставались неповрежденными, и что нуклеиновая кислота не высвобождалась из ВПЧ BMO-Ntt830.
Иммунизация мышей с использованием пептида, полученного из α-синуклеина, связанного с белком оболочки BMO-Ntt830
Группы из четырех самок мышей С57В/6 иммунизировали с использованием ВПЧ BMO-Ntt830, связанных посредством SMPH с пептидом α-синуклеина (SEQ ID NO: 22). 250 мкг общего белка разводили в 150 мМ ФСБ, рН=7,4 до конечного объема 150 мкл, и вводили внутривенно на 0 день и 14 день. У мышей брали кровь на 0 день (до иммунизации), 7 день, 14 день, 21 день, 28 день и 34 день, и образцы сыворотки крови исследовали с помощью ИФА, специфичного в отношении α-синуклеина.
ИФА
Пептиды α-синуклеина связывали с бычьей РНКазой А с использованием химического сшивающего линкера сульфо-SPDP. Планшеты для ИФА покрывали препаратами РНКазы, связанной с пептидом α-синуклеина, в концентрации 5 мкг/мл. Планшеты блокировали и затем инкубировали с последовательно разведенной сывороткой крови мыши. Связанные антитела детектировали с использованием ферментативно меченого антитела к IgG мыши. В качестве контроля исследовали образцы сыворотки крови от тех же самых мышей до иммунизации. Как показано на фиг. 9, все мыши имели очевидный и сильный ответ IgG на пептид, полученный из α-синуклеина.
ПРИМЕР 10
Связывание пептида ИЛ-17А с BMO-Ntt830 и индукция иммунного ответа
Белок мыши ИЛ-17А (SEQ ID NO: 20) связывали с белком оболочки BMO-Ntt830 (SEQ ID NO: 6). Белок мИЛ-17А ковалентно конъюгировали с BMO-Ntt830 с помощью двухэтапного способа. Сначала ВПЧ BMO-Ntt830 (2 мг/мл в 50 мМ NaH2PO4, 10% глицерина, рН=7,4) подвергали взаимодействию с эквимолярным количеством гетеробифункционального химического сшивающего линкера, сукцинимидил-6-(b-малеимидпропионамид)гексаноата (SMPH) при комнатной температуре в течение 60 мин. Не вступивший в реакцию сшивающий линкер удаляли с помощью гель-фильтрации на колонке для обессоливания PD-10, используя один и тот же буфер (50 мМ NaH2PO4, 10% глицерина, рН=7,4). Перед этапом конъюгации очищенный белок мИЛ-17А инкубировали в течение 5 мин при комнатной температуре с 10-кратным избытком три-2-карбоксиэтилфосфина гидрохлорида (ТСЕР-HCl), чтобы восстановить любые остатки цистеина в линкере. Затем белок мИЛ-17А ковалентно связывали с дериватизированными ВПЧ путем взаимодействия эквимолярных количеств белка мИЛ-17А и ВПЧ в течение 3 ч при комнатной температуре. Вакцину исследовали методами электрофореза в ДСН-ПААГ с последующим окрашиванием Кумасси синим и иммуноблоттинга с использованием антител к His-метке. Интенсивности полос, окрашенных Кумасси синим, соответствующих различным компонентам реакции связывания, определяли с помощью денситометрии и использовали для расчета эффективности связывания. Мономерный, дериватизированный BMO-Ntt830 мигрировал в виде дискретной полосы массой 28 кДа, в то время как конъюгат BMO-Ntt830-mIL-17 мигрировал в виде полосы массой 45 кДа (28 кДа мономер BMO-Ntt830 + 17 кДа белок мИЛ-17). Исследование методом электрофореза в ДСН-ПААГ и окрашивание Кумасси синим позволило выявить несколько полос с повышенной молекулярной массой по сравнению с белком оболочки BMO-Ntt830, что указывает на успешное связывание белка ИЛ-17 с ВПЧ BMO-Ntt830. Эффективность связывания определяли как молярное соотношение мономеров BMO-Ntt830, связанных с мИЛ-17А (45 кДа), к общему количеству мономеров BMO-Ntt830 (сумма полос 28 и 45 кДа). Было установлено, что эффективность связывания составляет по меньшей мере 15,3%, что соответствует одной молекуле мИЛ-17А на 6,5 молекул BMO-Ntt830. Эффективность связывания, вычисленная таким образом, является минимальной оценкой степени связывания, поскольку она не учитывает мономеры BMO-Ntt830, связанные с более чем одной молекулой мИЛ-17. Следовательно, белки, представляющие интерес, такие как ИЛ-17А, могут быть эффективно связаны с ВПЧ BMO-Ntt830.
Иммунизация мышей с использованием белка ИЛ-17А мыши, связанного с ВПЧ BMO-Ntt830
Группу из 3 самок мышей Balb/c иммунизировали с использованием белка оболочки BMO-Ntt830, связанного с белком мыши ИЛ-17А. Двадцать мкг общего белка разводили в ФСБ, рН=7,4 до конечного объема 150 мкл, и вводили внутривенно на 0 день и 14 день. У мышей брали кровь на 0 день (до иммунизации), 7 день, 14 день, 21 день и 34 день, и образцы сыворотки крови исследовали с помощью ИФА, специфичного в отношении ИЛ-17А мыши.
ИФА
Планшеты для ИФА покрывали ИЛ-17А мыши в концентрации 1 мкг/мл. Указанные планшеты блокировали и инкубировали с последовательно разведенной сывороткой мыши, взятой на 0, 4, 14, 21 и 34 день. Связанные антитела детектировали с использованием ферментативно меченого антитела к IgG мыши. Титры антител сыворотки крови мышей рассчитывали как среднее значение для тех разведений, которые позволили получить половину максимальной оптической плотности при длине волны 450 нм. Мыши, иммунизированные ВПЧ BMO-Ntt830, связанными с ИЛ-17А, имели сильный иммунный ответ на белок ИЛ-17 (фиг. 10).
Детектирование нейтрализующих антител
Образцы сыворотки крови мышей, иммунизированных ИЛ-17 мыши, связанным с BMO-Ntt830, как описано выше, затем испытывали для определения их способности ингибировать связывание белка ИЛ-17А мыши с рецептором ИЛ-17. Планшеты для ИФА покрывали, соответственно, белком А рецептора ИЛ-17 мыши в концентрации 1 мкг/мл. Последовательные разведения сыворотки крови мышей, полученные на 35 день, предварительно инкубировали с 10 нг/мл биотинилированного ИЛ-17А мыши в течение одного часа и затем добавляли к планшетам, покрытым рецептором ИЛ-17. Связывание ИЛ-17 с рецептором, покрывающим планшеты, детектировали с использованием пероксидазы хрена, конъюгированной со стрептавидином. Титры нейтрализующих антител рассчитывали как среднее значение тех разведений сыворотки крови, которые обеспечили достижение половины максимальной оптической плотности при длине волны 450 нм.
Эффективность BMO-Ntt830-mIL17A в облегчении экспериментального аутоиммунного энцефалита в модели рассеянного склероза на мышах
Самок мышей SJL иммунизировали, как описано выше, и вводили подкожно 100 мкг пептида PLP, смешанного с полным адъювантом Фрейнда, через одну неделю после последней иммунизации. В тот же день всем мышам вводили внутрибрюшинно 400 нг коклюшного токсина. Мышей ежедневно обследовали для оценки развития неврологических симптомов по следующей схеме: 0, отсутствие клинического заболевания; 0,5, обмякший конец хвоста; 1, хвост полностью обмякший; 1,5, обмякший хвост и слабость задних конечностей (неустойчивая походка и плохое сцепление задних конечностей); 2, односторонний частичный паралич задних конечностей; 2,5, двусторонний частичный паралич задних конечностей; 3, полный двусторонний паралич задних конечностей; 3,5, полный двусторонний паралич задних конечностей и односторонний паралич передних конечностей; 4, полный паралич задних и передних конечностей. Средние клинические показатели оценивали у мышей, которых иммунизировали BMO-Ntt830-mIL17A или BMO-Ntt830, как описано выше. Мыши, иммунизированные BMO-Ntt830-mIL17A, имели значительно сниженные клинические симптомы в течение периода с 53 по 61 день, по сравнению с мышами, иммунизированными BMO-Ntt830. Полученные результаты свидетельствует о том, что антитела к ИЛ-17, которые вырабатываются при иммунизации с использованием ВМО-Ntt830-mIL17A, способны улучшить клинические симптомы в модели рассеянного склероза на мышах.
ПРИМЕР 11
Связывание ИЛ-5 мыши с BMO-Ntt830 и индукция иммунного ответа
ИЛ-5 экспрессировали и очищали, как описано (Zou Y, et al., Vaccine 28 (2010) 3192-3200). Связывание мИЛ-5 (SEQ ID NO: 23) с ВПЧ BMO-Ntt830, содержащими модифицированный CP, содержащий последовательность SEQ ID NO: 6, проводили следующим образом. Для связывания с ИЛ-5 ВПЧ BMO-Ntt830 сначала дериватизировали с использованием 30-кратного избытка гетеробифункционального химического сшивающего линкера, сукцинимидил-6-(b-малеимидпропионамид)этилгексаноата (SMPH). Несвязанный SMPH удаляли путем диализа против ФСБ. рИЛ-5 восстанавливали в течение 1 ч с эквимолярным количеством три-2-карбоксиэтилфосфина гидрохлорида (ТСЕР) в ФСБ (рН=8,0). Восстановленный рИЛ-5 (80 мкМ) инкубировали в течение 4 ч при 22°C с 40 мкМ BMO-Ntt830, дериватизированных с использованием SMPH. Реакционную смесь подвергали диализу против ФСБ рН=8,0 в течение 12 ч.
Иммунизация мышей пептидами, полученными из ИЛ-5, связанными с ВПЧ модифицированного белка оболочки BMO-Ntt830
Группы из четырех самок мышей линии Balb/c иммунизировали ВПЧ BMO-Ntt830, связанными посредством SMPH с ИЛ-5 (SEQ ID NO: 23). 50 мкг общего белка разводили в 20 мМ HEPES, 50 мМ NaCl, рН=7,3 до конечного объема 200 мкл и вводили подкожно (по 100 мкл на двух вентральных боках) на 0 день и 14 день. У мышей брали кровь на 0 день (до иммунизации), 14 день и 21 день, и образцы сыворотки крови исследовали с использованием ИФА, специфичного в отношении ИЛ-5 и BMO-Ntt830.
ИФА
Планшеты для ИФА покрывали ИЛ-5 в концентрации 10 мкг/мл или ВПЧ ВМО-Ntt830 в концентрации 2 мкг/мл. Указанные планшеты блокировали и инкубировали с последовательно разведенной сывороткой мыши. Связанные антитела детектировали с помощью ферментативно меченного антитела к IgG мыши. В качестве контроля исследовали образцы сыворотки крови тех же самых мышей, взятые до иммунизации, (данные не представлены). Все мыши имели очевидный и сильный ответ IgG на пептиды, а также BMO-Ntt830.
Овальбуминовая модель аллергического воспаления дыхательных путей
Для того чтобы индуцировать аллергическое воспаление дыхательных путей самкам мышей Balb/c (5 животных на группу) вводили (внутрибрюшинно) 10 мкг овальбумина (OVA) (класс V, Sigma-Aldrich), смешанного с 2 мг квасцов (гелевый адъювант на основе гидроокиси алюминия, Brenntag Biosector, Дания). Через 10 дней мышей повторно ежедневно стимулировали путем интраназального введения 100 мкг OVA в течение 4 дней. Через 24 часа после последней стимуляции BAL и легкие подвергали гистологическому исследованию. Мышей, которым вводили внутрибрюшинно OVA и квасцы, но не стимулировали путем интраназального введения OVA, использовали в качестве отрицательного контроля для индукции заболевания в данных экспериментах.
Используя указанную модель, мышей дважды иммунизировали (d-0, d-14) с использованием 100 мкг ВПЧ BMO-Ntt830 или ВПЧ ВМО-Ntt830, связанных с ИЛ-5. На 21 день мышей сенсибилизировали с использованием OVA, и на 31 день стимулировали путем интраназального введения OVA. Мыши, иммунизированные ИЛ-5, имели значительно сниженное количество эозинофилов в бронхоальвеолярной жидкости.
ПРИМЕР 12
Связывание пептида М2 с вирусоподобными частицами BMO-Ntt830
2 мл раствора 1 мг/мл ВПЧ BMO-Ntt830, содержащих модифицированный CP, содержащий последовательность SEQ ID NO: 6, в ФСБ/10% глицерина, рН=7,2, подвергали реакции в течение 60 мин при комнатной температуре с 42,6 мкл раствора SMPH (150 мМ в ДМСО). Реакционный раствор подвергали диализу при 4°C против двух 2 л 20 мМ HEPES/10% глицерина рН=7,2 в течение 12 и 4 часов. 0,6 мл дериватизированного и диализованного раствора BMO-Ntt830 смешивали с 21,45 мкл раствора пептида М2 вируса гриппа (SEQ ID NO: 24) в 10 мМ ДМСО и инкубировали в течение 4 ч при комнатной температуре для химического связывания с получением ВМО-Ntt830-М2-конъюгированной вакцины. Несвязанный пептид удаляли путем диализа против 20 мМ HEPES/10% глицерина рН=7,2 в течение 12 ч и 4 ч. Связанный продукт исследовали на 12% бис-трис-полиакриламидном геле в восстанавливающих условиях. Наблюдали несколько полос с повышенной молекулярной массой по отношению к мономеру капсида BMO-Ntt830, что ясно свидетельствует об успешном связывании пептида М2 вируса гриппа и белка капсида BMO-Ntt830.
Иммунизация мышей пептидом М2, связанным с капсидами BMO-Ntt830 (BMO-Ntt830-M2)
Четырех самок мышей линии Balb/C на группу иммунизировали с использованием 40 мкг вакцины BMO-Ntt830-M2, изготовленной в 200 мкл ФСБ, которую вводили подкожно на 0 день и 20 день. У мышей брали кровь на 34 день, и образцы сыворотки крови исследовали с использованием ИФА, специфичного в отношении М2 и ВМО-Ntt830.
Детектирование антител к М2 с помощью ИФА
Планшеты для ИФА покрывали пептидом М2 (SEQ ID NO: 24) в концентрации 10 мкг/мл или вирусоподобными частицами BMO-Ntt830 в концентрации 10 мкг/мл. Указанные планшеты блокировали и инкубировали с последовательно разведенной сывороткой мыши. Связанные антитела детектировали с использованием ферментативно меченых антител к IgG мыши. Титры антител в образцах сыворотки крови мышей определяли как обратные значения разведений, которые позволяют достичь 50% величины OD, измеренной при насыщении (OD50). Средние титры антител к М2 и титры к BMO-Ntt830 на 34 день у мышей составили >1:10000. Полученные данные указывают на то, что связывание пептида М2 с капсидом BMO-Ntt830 значительно усиливало иммуногенность пептида М2, поскольку по отдельности пептид М2 не является иммуногенным.
Эффективность иммунизации BMO-Ntt830-M2 исследовали в модели инфекции вируса гриппа на мышах. Мышей заражали летальной дозой 4×LD50 адаптированного вируса гриппа мыши A/PR/8/34. Вирус разводили в ФСБ и вводили (2×50 мкл) через нос под слабой анестезией изофлураном. Мышей, которые потеряли более 30% массы тела или температура тела которых была равна или ниже 30°C, подвергали эвтаназии. Выживаемость мышей в обеих группах была следующей: все мыши, иммунизированные BMO-Ntt830-M2, выжили, в то время как все мыши, иммунизированные только ВМО-Ntt830, умерли. Полученный результат свидетельствует о том, что иммунизация мышей пептидом М2, связанным с BMO-Ntt830, индуцирует выработку М2-специфичных антител, которые защищают мышей от летальной инфекции вирусом гриппа A/PR/8/34.
ПРИМЕР 13
Связывание пептида Аβ1-6 с вирусоподобными частицами BMO-Ntt830
2 мл раствора 1 мг/мл ВПЧ BMO-Ntt830, содержащих модифицированный CP, содержащий последовательность SEQ ID NO: 6, в ФСБ/10% глицерина, рН=7,2, подвергали реакции в течение 60 мин при комнатной температуре с 42,6 мкл раствора SMPH (150 мМ в ДМСО). Реакционный раствор подвергали диализу при 4°C против двух 2 л 20 мМ HEPES/10% глицерина, рН=7,2 в течение 12 ч и 4 ч. 0,6 мл дериватизированного и диализованного раствора BMO-Ntt830 смешивали с 21,45 мкл раствора Аβ1-6 (SEQ ID NO: 25) в 10 мМ ДМСО и инкубировали в течение 4 ч при комнатной температуре для химического связывания с получением BMO-Ntt830-Aβ1-6 конъюгированной вакцины. Несвязанный пептид удаляли путем диализа против 20 мМ HEPES/10% глицерина рН=7,2 в течение 12 ч и 4 ч. Связанный продукт исследовали на 12% бис-трис-полиакриламидном геле в восстанавливающих условиях. Наблюдали несколько полос с повышенной молекулярной массой по отношению к мономеру капсида BMO-Ntt830, что ясно указывало на успешное связывание пептида Аβ1-6 с BMO-Ntt830.
Иммунизация мышей пептидом Аβ1-6, связанным с капсидами BMO-Ntt830 (BMO-Ntt830-Aβ1-6)
Четырех самок мышей линии Balb/c в каждой группе иммунизировали с использованием 40 мкг вакцины BMO-tt830-Aβ1-6, изготовленной в 200 мкл ФСБ, которую вводили подкожно на 0 день и 20 день. У мышей брали кровь на 34 день, и образцы сыворотки крови исследовали с помощью ИФА, специфичного в отношении Аβ1-6 и ВМО-Ntt830.
Детектирование антител к Аβ1-6 с помощью ИФА
Планшеты для ИФА покрывали Аβ1-6, связанным с РНКазой в концентрации 10 мкг/мл или вирусоподобными частицами BMO-Ntt830 в концентрации 2 мкг/мл. Указанные планшеты блокировали и инкубировали с последовательно разведенной сывороткой мыши. Связанные антитела детектировали с использованием ферментативно меченого антитела к IgG мыши. Титры антител в образцах сыворотки крови мышей определяли как обратные значения разведений, которые позволили получить 50% величину OD, измеренной при насыщении (OD50). Средние титры антител к Аβ1-6 и титры антител к BMO-Ntt830 на 34 день у мышей составили >1:10000. Полученные данные указывают на то, что связывание пептида Аβ1-6 с капсидами BMO-Ntt830 сильно усиливает иммуногенность пептида Аβ1-6, поскольку по отдельности пептид Аβ1-6 не является иммуногенным. Срезы мозга пациентов с болезнью Альцгеймера человека окрашивали сывороткой крови мышей и бляшки стали отчетливо видны.
ПРИМЕР 14
Клонирование гибридных белков Fel d1
Гибридный белок Fel d1 (названный F12H6GGC), состоящий из цепи 1 Fel d1, гибридизованной с N-концом цепи 2 Fel d1 с помощью последовательности из 15 аминокислот (GGGGS)3 (SEQ ID NO: 47), и содержащий последовательность


После синтеза ген вырезали из вспомогательной плазмиды и субклонировали в рамке считывания в сайты рестрикции NdeI/XhoI плазмиды рЕТ42а(+) (Novagen, США) с получением вектора экспрессии pET42-F12H6GGC.
Гибридные белки Fel d1, без гексагистидиновой последовательности (названные F12GGC), получали с помощью ПЦР-мутагенеза с использованием плазмиды рЕТ42-F12H6GGC в качестве матрицы. Олигонуклеотидные праймеры, используемые в ПЦР для получения указанных гибридных белков, включали:
Для F12GGC, прямой праймер представлял собой Fel_BglF (SEQ ID NO: 51) и обратный праймер представлял собой Feld-dHR (SEQ ID NO: 53).
Все продукты ПЦР разрезали с помощью ферментов рестрикции BglII/XhoI и повторно субклонировали в вектор pET42-F126HGGC в аналогичные сайты рестрикции. После выделения плазмидной ДНК введенные изменения подтверждали с использованием циклического набора для секвенирования BigDye и генетического анализатора ABI Prism 3100 (Applied Biosystems, Карлсбад, США). Полученный вектор экспрессии был назван pET42-F12GGC. Указанный вектор, соответственно, кодирует гибридный белок Fel d1, F12GGC (SEQ ID NO: 56).

Гексагистидиновая последовательность позволяет проводить очистку с помощью металл-хелатной аффинной хроматографии, и C-концевая последовательность, содержащая GGC или GGCG (SEQ ID NO: 58), обеспечивает связывание гибридных белков Fel d1 с BMO-Ntt830 и BMO-Npadr.
ПРИМЕР 15
Экспрессия и очистка гибридных белков Fel d1 Экспрессия гибридных белков Fel d1 в Е. coli. Клетки штамма Е. coli, С2566 трансформировали векторами экспрессии Fel d1, pET42-F12H6GGC и pET42-F12GGC (New England Biolabs, Ипсвич, США). Клоны, экспрессирующие высокие уровни белка-мишени, отбирали и использовали в дальнейших экспериментах. Экспрессию различных рекомбинантных гибридных белков Fel d1 осуществляли следующим образом. Культуры клеток Е. coli, несущих плазмиды экспрессии, выращивали в среде 2×TY, содержащей канамицин (25 мг/л), на ротационном шейкере (200 об./мин; Infors, Боттминген, Швейцария) при 30°C до OD600 0,8-1,0. Экспрессию генов гибридного белка Fel d1 затем индуцировали добавлением 0,2 мМ IPTG. Среду дополняли 5 мМ MgCl2. Инкубацию продолжали в ротационном шейкере при 20°C в течение 18 ч. Полученную биомассу собирали с помощью низкоскоростного центрифугирования и замораживали при -20°C до очистки.
Очистка гексагистидинмеченых гибридных белков Fel d1. Для очистки гибридных белков F12H6GGC использовали набор USB PrepEase (Affymetrix, High Wycombe, Великобритания) в соответствии с инструкциями изготовителя. После оттаивания на льду клетки Е. coli из 100 мл культуры (приблизительно 0,75 г) суспендировали в 1 × буфере LEW, содержащем 5 мМ DTT, и затем разрушали ультразвуком. Нерастворимые белки и остатки клеток удаляли центрифугированием (13000 об./мин, 30 мин при 5°C). Очищенный лизат наносили на колонку с Ni-IDA, дважды промывали аналогичным буфером (без ДТТ) и элюировали 2×1,5 мл имидазола, содержащего 1 × буфер Е. Фракции, содержащие Fel d1, определяли с помощью электрофореза в ДСН-ПААГ (фиг. 11А) и дважды подвергали диализу против 200 объемов буфера (20 мМ фосфата натрия, 2 мМ ЭДТА, рН=7,0). После диализа концентрацию белка оценивали с помощью флуориметра QuBit в соответствии с инструкциями производителя (Invitrogen, Юджин, США) или с помощью УФ-спектрофотометрии при длине волны 280 нм. Идентичность очищенных белков подтверждали с помощью масс-спектрометрии (фиг. 11В), а также с помощью Вестерн-блоттинга с использованием антител к His-метке (Novagen, каталожный номер 71840-3; данные не представлены).
Очистка гибридных белков Fel d1 без гексагистидиновой метки. Для очистки гибридных белков F12GGC использовали анионообменную хроматографию и хроматографию гидрофобных взаимодействий. Три грамма IPTG-индуцированных клеток Е. coli разрушали ультразвуком в 20 мл буфера для лизиса LB (20 мМ Трис/HCl, рН=8,0, 50 мМ NaCl, 5 мМ DTT). После обработки ультразвуком раствор центрифугировали в течение 15 мин при 15000 g, и собирали супернатант. Сульфат аммония добавляли при постоянном перемешивании до достижения 30% насыщения и затем инкубировали в течение 5 мин при комнатной температуре. После центрифугирования твердый сульфат аммония добавляли к восстановленной надосадочной жидкости до достижения 50% насыщения. После центрифугирования осадок белков собирали и растворяли в 2 мл LB и избыток соли удаляли с использованием колонки для обессоливания 5 мл HiTrap™ (GE Healthcare Life Sciences), уравновешенной LB. Элюат обессоленного белка загружали на 1 мл колонку с носителем DEAE HiTrap™Capto™, уравновешенную LB. Связанный F12GGC элюировали возрастающим градиентом NaCl. Фракции, содержащие гибридные белки Fel d1, собирали и объединяли. Полученный раствор разбавляли 4 объемами 20 мМ Трис/HCl, рН=8,0, 5 мМ DTT и наносили на колонку MonoQ 5/50 GL в LB и элюировали возрастающим градиентом NaCl. Фракции, содержащие гибридные белки Fel d1, собирали и объединяли. К раствору добавляли 5 М NaCl до концентрации 2,5 М и ДТТ добавляли, чтобы поддерживать концентрацию 5 мМ. Раствор, содержащий Fel d1, затем загружали в 1 мл колонку HiTrap™ Butyl HP в 2,5 М NaCl, 5 мМ DTT и элюировали равномерно уменьшающейся концентрацией NaCl. Фракции, содержащие гибридные белки Fel d1, собирали и объединяли. Все этапы очистки контролировали с помощью гелей для электрофореза в ДСН-ПААГ, окрашенных Кумасси синим (фиг. 11С). Идентичность очищенных белков подтверждали методом Вестерн-блоттинга с использованием поликлональных антител, полученных против рекомбинантного Fel d1 (данные не представлены).
ПРИМЕР 16
Подлинность рекомбинантного гибридного белка(ов) Fel d1
Гибридные белки Fel d1 аналогичным образом распознаются Fel d1-специфичными моноклональными антителами. Связывание гибридного белка Fel d1, F12H6GGC, и природного Fel d1 (nFel d1) с Fel d1-специфичными моноклональными антителами (MAT) сравнивали с использованием набора для сэндвич-ИФА, специфичного в отношении Fel d1 (6F9/3E4) от Indoor biotechnologies (Кардифф, Великобритания). С этой целью планшеты для ИФА Nunc покрывали МАТ к Fel d1, 6F9 (при 1 мкг/мл), при 4°C в течение ночи. Планшеты промывали в ФСБ, содержащем 0,05% твин-20 (ФСБТ), и блокировали с использованием Superblock (Invitrogen) в течение 2 ч при комнатной температуре (RT). Природные Fel d1, а также F12H6GGC (1 мкг/мл), последовательно разводили в соотношении 1:3 и инкубировали в течение 2 ч при комнатной температуре. Планшеты промывали ФСБТ и вносили биотинилированное МАТ к Fel d1, 3Е4 (1 мкг/мл), и инкубировали в течение 1 ч при комнатной температуре. Для детектирования применяли стрептавидин, конъюгированный с пероксидазой хрена (ПХ). С этой целью планшеты промывали в ФСБТ и затем в планшеты вносили стрептавидин-пероксидазу (Sigma, разведение 1:1000) и инкубировали в течение 30 мин при комнатной температуре. Детектирование проводили с помощью раствора субстрата OPD и 5% H2SO4 в качестве стоп-раствора. Оптическую плотность измеряли с помощью ИФА-ридера (BioRad) при 450 нм.
Природные Fel d1 и F12H6GGC имели сходные титры согласно результатам ИФА, которые свидетельствуют о том, что указанные белки аналогичным образом распознавались МАТ к Fel d1, тем самым подтверждая подлинность рекомбинантного Fel d1, F12H6GGC (фиг. 12).
Рекомбинантные гибридные белки Fel d1 активируют базофилы в цельной крови пациентов с аллергией на кошек. Кровь пациентов с аллергией на кошек содержит базофилы, несущие Fel d1-специфичные антитела IgE на своей поверхности, которые при воздействии аллергена связывают FcεRI и вызывают дегрануляцию. Чтобы проверить способность рекомбинантного Fel d1 вызвать дегрануляцию, собирали образцы цельной крови пациентов с аллергией на Fel d1, и использовали в комбинации с рекомбинантным гибридным белком Fel d1, F12H6GGC, в наборе для активации базофилов Basophil Activation Test от
Было установлено, что рекомбинантные гибридные белки Fel d1 легко инициируют дегрануляцию базофилов у пациентов с аллергией на кошек. Помимо этого, по сравнению с природным белком Fel d1, были достигнуты аналогичные уровни дегрануляции, что свидетельствует об идентичности рекомбинантно полученных гибридных белков Fel d1. (фиг. 13А / фиг. 13В).
ПРИМЕР 17
Связывание гибридных белков Fel d1 с BMO-Ntt830 и ВПЧ ВМО
Гибридный белок Fel d1, F12H6GGC, ковалентно связывали с ВПЧ BMO-Ntt830 и BMO-Npadr с использованием гетеробифункционального химического сшивающего линкера, сукцинимидил-6-(β-малеимидпропионамид)гексаноата (SMPH), как описано ниже.
Буферный раствор, в котором хранили вирусоподобные частицы BMO-Ntt830 и BMO-Npadr, содержащий 5 мМ Na-бората, 2 мМ ЭДТА, рН=9,0, замещали буфером, содержащим 20 мМ Na-фосфата, 30% сахарозы и 2 мМ EDTA, с помощью колонок PD10 (GE Healthcare). Раствор BMO-Npadr или ВПЧ BMO-Ntt830 вступал в реакцию с 7,5-кратным молярным избытком гетеробифункционального сшивающего линкера SMPH в течение 60 мин при комнатной температуре. Не вступивший в реакцию SMPH удаляли из колонок PD10 с использованием буфера, содержащего 20 мМ Na-фосфата, 30% сахарозы и 2 мМ ЭДТА.
Гибридный белок Fel d1, F12H6GGC, обрабатывали 10-кратным молярным избытком ТСЕР (Thermo Fisher). Дериватизированные ВПЧ BMO-Ntt830 и BMO-Npadr, подвергали взаимодействию с 1- или 2-кратным молярным избытком рекомбинантного гибридного белка Fel d1, F12H6GGC, в течение 3 ч при 23°C. Эффективность реакции связывания исследовали методом электрофореза в ДСН-ПААГ в восстанавливающих условиях (4-12% бис-трис гель NuPAGE®) с окрашиванием полос Кумасси синим. Белковые полосы с массами приблизительно 44,5 кДа и 69 кДа наблюдали после химической реакции конъюгации (данные не представлены). Указанные полосы соответствуют белку оболочки ВМО (24,5 кДа), ковалентно связанному с гибридным белком Fel d1, F12H6GGC (20 кДа), и двум молекулам белка оболочки ВМО (49 кДа), ковалентно связанным с одним гибридным белком Fel d1, F12H6GGC, соответственно, что указывает на образование ВПЧ Fel d1-ВМО.
ПРИМЕР 18
Иммунный ответ на ВПЧ Fel d1-BMO у мышей
Группы из трех самок мышей линии Balb/c иммунизировали с использованием ВПЧ Fel d1-BMO-Ntt830, полученных, как описано в примере 10, или ВПЧ BMO-Ntt830, непосредственно смешанных с гибридным белком Fel d1, F12H6GGC. Обе композиции содержат одинаковое количество гибридного белка Fel d1. По 10 мкг каждой композиции готовили в 150 мМ ФСБ, рН=7,4 и вводили в объеме 150 мкл внутривенно на 0 день и 14 день. У мышей брали кровь на 0 день (до иммунизации), 14 день и 21 день, и образцы сыворотки крови исследовали с помощью ИФА для определения специфичных антител IgG к природному Fel d1.
Планшеты для ИФА Nunc покрывали природным Fel d1 (Indoor Biotechnologies) в ФСБ с конечной концентрацией 1 мкг/мл в течение ночи при 4°C. Планшеты блокировали с использованием Superblock (Invitrogen). Последовательное разведение сывороток проводили с целью детектирования OD50. OD50 описывает обратное значение разбавления, которое позволяет достичь половины максимального значения OD. Антитело IgG, специфичное в отношении Fel d1, детектировали с помощью антитела к IgG мыши, непосредственно меченого пероксидазой хрена (ПХ) (Jackson). Превращение о-фенилендиамина дигидрохлорида (OPD) под действием ПХ измеряли как возникновение окрашивания при 450 нм, реакцию останавливали добавлением 5% серной кислоты (H2SO4) после 7 минут инкубации.
Fel d1-специфичные антитела IgG детектировали у мышей (на 14-й день) уже после однократной иммунизации. Ответ стимулировали с помощью второй инъекции. ВПЧ Fel d1-ВМО значительно увеличили индукцию Fel d1-специфичных антител IgG по сравнению со смешанными композициями, которые вызывали усиление иммунного ответа в результате химической конъюгации гибридных белков Fel d1 с ВПЧ (фиг. 14).
ПРИМЕР 19
Взаимодействие ИЛ-1β человека с BMO-Ntt830 и ВПЧ ВМО
Зрелый белок ИЛ-1β человека (SEQ ID NO: 60) ковалентно связывали с ВПЧ ВМО-Ntt830 и BMO-Npadr с использованием гетеробифункционального химического сшивающего линкера, сукцинимидил-6-(β-малеимидпропионамид)гексаноата (SMPH), как описано ниже.
Буферный раствор, в котором хранили вирусоподобные частицы BMO-Ntt830 и BMO-Npadr, содержащий 5 мМ Na-бората, 2 мМ ЭДТА, рН=9,0, замещали буфером, содержащим 20 мМ Na-фосфата, 30% сахарозы и 2 мМ EDTA, с помощью колонок PD10 (GE Healthcare). Раствор BMO-Npadr или ВПЧ BMO-Ntt830 вступал в реакцию с 7,5-кратным молярным избытком гетеробифункционального сшивающего линкера SMPH в течение 60 мин при комнатной температуре. Не вступивший в реакцию SMPH удаляли из колонок PD10 с использованием буфера, содержащего 20 мМ Na-фосфата, 30% сахарозы и 2 мМ ЭДТА.
Белок ИЛ-1β человека, обрабатывали 5-кратным молярным избытком ТСЕР (Thermo Fisher). Дериватизированные ВПЧ BMO-Ntt830 и BMO-Npadr, подвергали взаимодействию с 1- или 2-кратным молярным избытком белка ИЛ-1β человека в течение 3 ч при 23°C. Эффективность реакции связывания исследовали методом электрофореза в ДСН-ПААГ в восстанавливающих условиях (4-12% бис-трис гель NuPAGE®) с окрашиванием полос Кумасси синим. Белковые полосы с массами приблизительно 41,5 кДа и 66 кДа наблюдали после химической реакции конъюгации (данные не представлены). Указанные полосы соответствуют белку оболочки ВМО (24,5 кДа), ковалентно связанному с белком ИЛ-1β (17 кДа), и двум молекулам белка оболочки ВМО (49 кДа), ковалентно связанным с одним белком ИЛ-1β человека, соответственно, что указывает на образование ВПЧ ИЛ-1β-ВМО.
ПРИМЕР 20
Связывание ИЛ-5 собаки с BMO-Ntt830 и индукция иммунного ответа
ИЛ-5 собаки (сИЛ-5) (SEQ ID NO: 61) модифицировали для включения свободного остатка Cys и экспрессировали аналогично тому, как описано для ИЛ-5 мыши в Zou Y, et al., Vaccine 28 (2010) 3192-3200. Связывание указанного модифицированного с ИЛ-5 с ВПЧ BMO-Ntt830 осуществляли следующим образом. Для связывания с сИЛ-5 ВПЧ BMO-Ntt830 сначала дериватизировали с использованием 30-кратного избытка гетеробифункционального химического сшивающего линкера, сукцинимидил-6-(β-малеимидпропионамид)этилгексаноата (SMPH). Несвязанный SMPH удаляли путем диализа против ФСБ. сИЛ-5 восстанавливали в течение 1 ч с эквимолярным количеством три-2-карбоксиэтилфосфина гидрохлорида (ТСЕР) в ФСБ (рН=8,0). Восстановленный сИЛ-5 (80 мкМ) инкубировали в течение 4 ч при 22°C с 40 мкМ SMPH-дериватизированных BMO-Ntt830. Реакционную смесь подвергали диализу против ФСБ, рН=8,0 в течение 12 ч.
Иммунизация собак с использованием сИЛ-5, связанного с ВПЧ BMO-Ntt830
Группы из четырех самок беспородных собак иммунизировали с использованием ВПЧ BMO-Ntt830, связанных посредством SMPH с сИЛ-5, как описано выше. 50 мкг композиции разбавляли в 20 мМ HEPES, 50 мМ NaCl, рН=7,3 до конечного объема 500 мкл и подкожно вводили на 0 день и 14 день. У собак брали кровь на 0 день (до иммунизации), 14 день и 21 день, и образцы сыворотки крови исследовали с помощью ИФА, специфичного в отношении сИЛ-5 и BMO-Ntt830.
ИФА
Планшеты для ИФА покрывали сИЛ-5 в концентрации 10 мкг/мл или ВПЧ ВМО-Ntt830 в концентрации 2 мкг/мл. Планшеты блокировали и затем инкубировали с последовательно разведенной сывороткой мыши. Связанные антитела детектировали с помощью ферментативно меченого антитела к IgG собаки. В качестве контроля исследовали образцы сыворотки крови, взятые у тех же самых собак до иммунизации (данные не представлены). У всех собак развился очевидный и сильный ответ IgG к сИЛ-5, а также BMO-Ntt830.
ПРИМЕР 21
Связывание ИЛ-4 собаки с BMO-Ntt830 и индукция иммунного ответа
ИЛ-4 собаки (сИЛ-4) (SEQ ID NO: 62) модифицировали для включения свободного остатка Cys и экспрессировали аналогично тому, как описано для ИЛ-5 мыши в Zou Y, et al., Vaccine 28 (2010) 3192-3200. Связывание указанного модифицированного сИЛ-4 с ВПЧ BMO-Ntt830 осуществляли следующим образом. Для связывания с сИЛ-4 ВПЧ BMO-Ntt830 сначала дериватизировали с использованием 30-кратного избытка гетеробифункционального химического сшивающего линкера, сукцинимидил-6-(β-малеимидпропионамид)этилгексаноата (SMPH). Несвязанный SMPH удаляли путем диализа против ФСБ. сИЛ-4 восстанавливали в течение 1 ч с эквимолярным количеством три-2-карбоксиэтилфосфина гидрохлорида (ТСЕР) в ФСБ (рН=8,0). Восстановленный сИЛ-4 (80 мкМ) инкубировали в течение 4 ч при 22°C с 40 мкМ SMPH-дериватизированных BMO-Ntt830. Реакционную смесь подвергали диализу против ФСБ, рН=8,0 в течение 12 ч.
Иммунизация собак с использованием сИЛ-4, связанного с ВПЧ BMO-Ntt830
Группы из четырех самок беспородных собак иммунизировали с использованием ВПЧ BMO-Ntt830, связанных посредством SMPH с сИЛ-4, как описано выше. 50 мкг композиции разбавляли в 20 мМ HEPES, 50 мМ NaCl, рН=7,3 до конечного объема 500 мкл и подкожно вводили на 0 день и 14 день. У собак брали кровь на 0 день (до иммунизации), 14 день и 21 день, и образцы сыворотки крови исследовали с помощью ИФА, специфичного в отношении сИЛ-4 и BMO-Ntt830.
ИФА
Планшеты для ИФА покрывали сИЛ-4 в концентрации 10 мкг/мл или ВПЧ ВМО-Ntt830 в концентрации 2 мкг/мл. Планшеты блокировали и затем инкубировали с последовательно разведенной сывороткой мыши. Связанные антитела детектировали с помощью ферментативно меченого антитела к IgG собаки. В качестве контроля исследовали образцы сыворотки крови, взятые у тех же самых собак до иммунизации (данные не представлены). У всех собак развился очевидный и сильный ответ IgG к сИЛ-4, а также BMO-Ntt830.
ПРИМЕР 22
Связывание ИЛ-13 собаки с BMO-Ntt830 и индукция иммунного ответа
ИЛ-13 собаки (сИЛ-13) (SEQ ID NO: 63) модифицировали для включения свободного остатка Cys и экспрессировали аналогично тому, как описано для ИЛ-5 мыши в Zou Y, et al., Vaccine 28 (2010) 3192-3200. Связывание указанного модифицированного сИЛ-13 с ВПЧ BMO-Ntt830 осуществляли следующим образом. Для связывания с сИЛ-13 ВПЧ BMO-Ntt830 сначала дериватизировали с использованием 30-кратного избытка гетеробифункционального химического сшивающего линкера, сукцинимидил-6-(β-малеимидпропионамид)этилгексаноата (SMPH). Несвязанный SMPH удаляли путем диализа против ФСБ. сИЛ-13 восстанавливали в течение 1 ч с эквимолярным количеством три-2-карбоксиэтилфосфина гидрохлорида (ТСЕР) в ФСБ (рН=8,0). Восстановленный сИЛ-13 (80 мкМ) инкубировали в течение 4 ч при 22°C с 40 мкМ SMPH-дериватизированных BMO-Ntt830. Реакционную смесь подвергали диализу против ФСБ, рН=8,0 в течение 12 ч.
Иммунизация собак с использованием сИЛ-13, связанного с ВПЧ BMO-Ntt830
Группы из четырех самок беспородных собак иммунизировали с использованием ВПЧ BMO-Ntt830, связанных посредством SMPH с сИЛ-13, как описано выше. 50 мкг композиции разбавляли в 20 мМ HEPES, 50 мМ NaCl, рН=7,3 до конечного объема 500 мкл и подкожно вводили на 0 день и 113 день. У собак брали кровь на 0 день (до иммунизации), 14 день и 21 день, и образцы сыворотки крови исследовали с помощью ИФА, специфичного в отношении сИЛ-13 и BMO-Ntt830.
ИФА
Планшеты для ИФА покрывали сИЛ-13 в концентрации 10 мкг/мл или ВПЧ ВМО-Ntt830 в концентрации 2 мкг/мл. Планшеты блокировали и затем инкубировали с последовательно разведенной сывороткой мыши. Связанные антитела детектировали с помощью ферментативно меченого антитела к IgG собаки. В качестве контроля исследовали образцы сыворотки крови, взятые у тех же самых собак до иммунизации (данные не представлены). У всех собак развился очевидный и сильный ответ IgG к сИЛ-13, а также BMO-Ntt830.
ПРИМЕР 23
Связывание ИЛ-31 человека с BMO-Ntt830 и индукция иммунного ответа
ИЛ-31 человека (чИЛ-31) (SEQ ID NO: 43) модифицировали для включения свободного остатка Cys и экспрессировали аналогично тому, как описано для ИЛ-5 мыши в Zou Y, et al., Vaccine 28 (2010) 3192-3200. Связывание указанного модифицированного чИЛ-31 с ВПЧ BMO-Ntt830 осуществляли следующим образом. Для связывания с чИЛ-31 ВПЧ BMO-Ntt830 сначала дериватизировали с использованием 30-кратного избытка гетеробифункционального химического сшивающего линкера, сукцинимидил-6-(β-малеимидпропионамид)этилгексаноата (SMPH). Несвязанный SMPH удаляли путем диализа против ФСБ. чИЛ-31 восстанавливали в течение 1 ч с эквимолярным количеством три-2-карбоксиэтилфосфина гидрохлорида (ТСЕР) в ФСБ (рН=8,0). Восстановленный чИЛ-31 (80 мкМ) инкубировали в течение 4 ч при 22°C с 40 мкМ SMPH-дериватизированных BMO-Ntt830. Реакционную смесь подвергали диализу против ФСБ, рН=8,0 в течение 12 ч.
Иммунизация мышей с использованием чИЛ-31, связанного с ВПЧ BMO-Ntt830
Группы из четырех мышей Balb/c иммунизировали с использованием ВПЧ ВМО-Ntt830, связанных посредством SMPH с чИЛ-31, как описано выше. 50 мкг композиции разбавляли в 20 мМ HEPES, 50 мМ NaCl, рН=7,3 до конечного объема 500 мкл и подкожно вводили на 0 день и 113 день. У собак брали кровь на 0 день (до иммунизации), 14 день и 21 день, и образцы сыворотки крови исследовали с помощью ИФА, специфичного в отношении чИЛ-31 и BMO-Ntt830.
ИФА
Планшеты для ИФА покрывали чИЛ-31 в концентрации 10 мкг/мл или ВПЧ ВМО-Ntt830 в концентрации 2 мкг/мл. Планшеты блокировали и затем инкубировали с последовательно разведенной сывороткой мыши. Связанные антитела детектировали с помощью ферментативно меченого антитела к IgG мыши. В качестве контроля исследовали образцы сыворотки крови, взятые у тех же самых мышей до иммунизации (данные не представлены). У всех мышей развился очевидный и сильный ответ IgG к чИЛ-31, а также BMO-Ntt830.
Реферат
Изобретение относится к области биотехнологии и молекулярной генетики. Предложена вирусоподобная частица (ВПЧ) вируса мозаики огурца (ВМО), содержащая эпитоп клетки Т-хелпера, а также соответствующие композиция, применение и способ иммунизации. Изобретение может быть использовано в медицине благодаря усиленной индукции иммунного ответа. 6 н. и 64 з.п. ф-лы, 14 ил., 23 пр.

Комментарии