Иммунорегуляторная вакцина - RU2650709C2
Код документа: RU2650709C2
Чертежи



























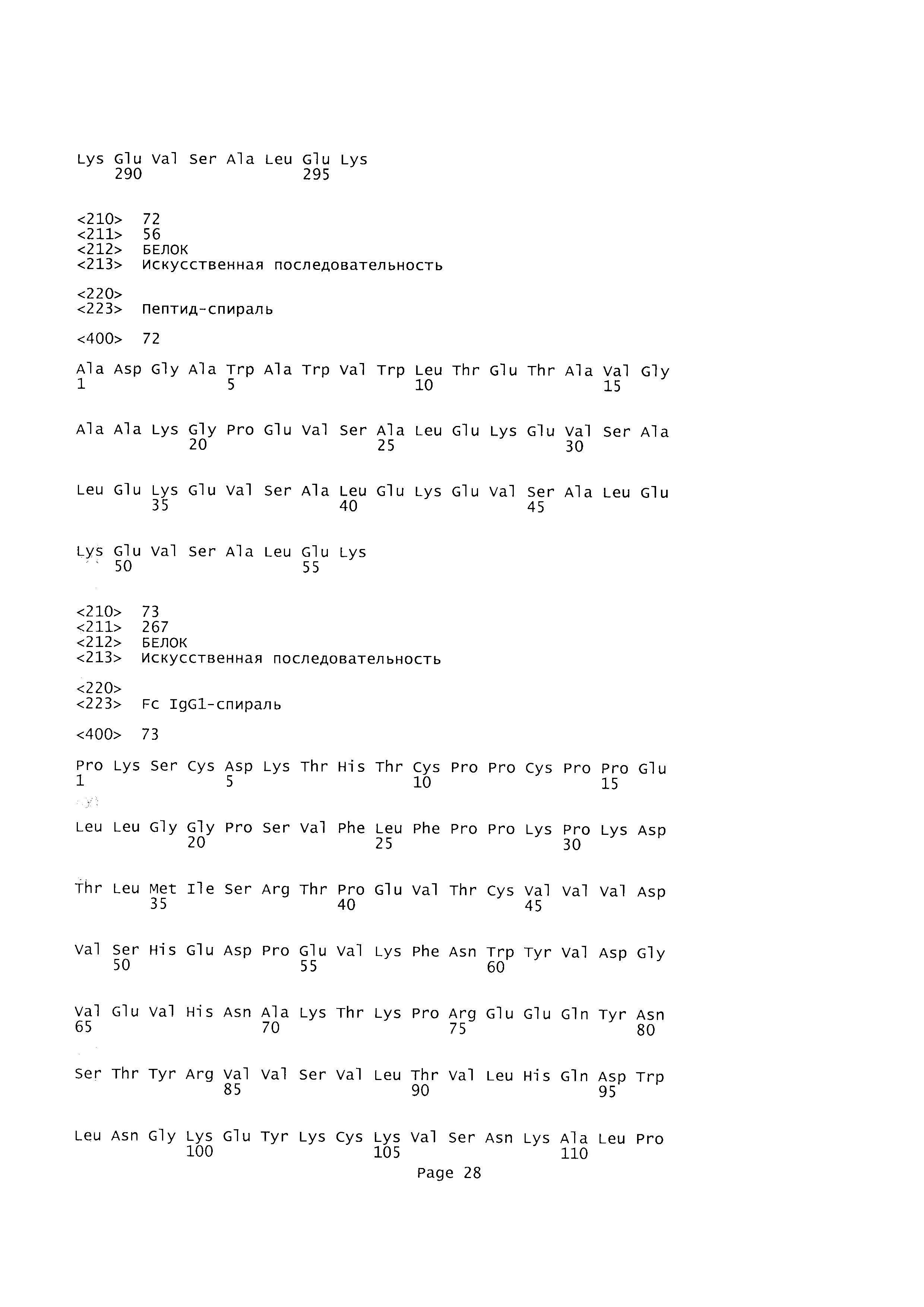






























Описание
Настоящее изобретение относится к иммунорегуляторной вакцине, содержащей иммуноген и соединенный с ним направленный адъювант, благодаря чему указанная вакцина модулирует иммунный ответ на иммуноген. Настоящее изобретение дополнительно относится к вакцине, содержащей иммуногенную композицию, содержащую
направленный адъювант, содержащий по меньшей мере направленную против CD32 молекулу, соединенную с лигандом TLR9, и
иммуноген, который связан с указанным направленным адъювантом;
для применения при лечении субъекта с целью вызвать транзиторный иммунный ответ IgG, направленный на указанный иммуноген.
УРОВЕНЬ ТЕХНИКИ
При иммунологических заболеваниях, включающих аллергию, рак и аутоиммунные заболевания, ключевую роль играет регулирование иммунного равновесия, опосредуемое Th1/Th2/Th17/Treg клетками, и его применение для разработки новых вариантов иммунотерапии.
Для Th1 клеток (клеток Т-хелперов 1-го типа) характерно продуцирование провоспалительных цитокинов, таких как IFN-гамма, IL-2 и TNF-бета. Th1 клетки участвуют в клеточном иммунитете. Цитокины, продуцируемые Th1 клетками, стимулируют фагоцитоз и разрушение микробных патогенов. Было описано, что некоторые хронические воспалительные заболевания представляют собой заболевания с преобладающим влиянием Th1, например, рассеянный склероз, диабет и ревматоидный артрит.
Th2 клетки (клетки Т-хелперы 2-го типа) характеризуются продукцированием IL-4, IL-5, IL-9, IL-10 и IL-13. Полагают, что Th2 клетки играют роль в аллергических реакциях. Цитокины, подобные IL-4, как правило, стимулируют продуцирование антител. IL-5 стимулирует реакции эозинофилов, также являющиеся частью иммунного ответа. Атопию и аллергию считают состояниями с преобладающим влиянием Th2.
Нарушение равновесия между Th1/Th2 или Th17/Treg типами иммунитета становится причиной различных иммунопатологий.
Аллергию считают реакцией гиперчувствительности на белки в окружающей среде. Аллергены представляют собой антигены, на которые страдающие атопией пациенты отвечают образованием IgE антител, что впоследствии приводит к аллергическим реакциям. Антигены в комплексах или гибридных белках могут представлять собой аллергены окружающей среды (например, аллергены клеща домашней пыли, пыльцу березы, пыльцу трав, антигены кошек, антигены тараканов) или пищевые аллергены (например, коровье молоко, арахис, креветку, сою), или комбинацию обоих типов аллергенов. Молекулы IgE важны благодаря их роли в активации эффекторных клеток (тучных клеток, базофилов и эозинофилов). Исследователи сходятся во мнениях, что IgE также играет важную роль в индукционной фазе аллергических заболеваний за счет повышения способности захватывать антиген у В-клеток и дендритных клеток (ДК), как посредством низкоаффинных (CD23), так и посредством высокоаффинных (FcεRI) рецепторов. Негативным функциям IgE-антител могут противодействовать аллерген-специфические IgG-антитела, например, так как они перенаправляют иммунный ответ от В-клеток к моноцитам и ДК и способны подавлять опосредованную рецептором IgE активацию эффекторных клеток посредством перекрестной сшивки FcεRI с FcγRIIb (CD32b) на данных клетках. Кроме того, они конкурируют с молекулами IgE за сайты связывания аллергена. Аллергии, следовательно, можно лечить, излечивать и предупреждать путем индукции аллерген-специфичных молекул IgG, в особенности IgG1.
Период полувыведения молекул IgG из сыворотки составляет приблизительно 3 недели, по сравнению с приблизительно 3 днями для молекул IgE. Взаимодействие между (наивными) В-клетками и Th2 клетками индуцирует молекулы IgE, что вызывает экспрессию IL-4 и IL-13, вместе с экспрессией CD40L, что необходимо для переключения класса антител на IgE в В-клетках памяти и плазматических клетках. Наоборот, Th1 клетки, которые продуцируют IFN-гамма и IL-2, вызывают переключение класса антител на IgG. Таким образом, индукция клеточных ответов на аллергены с задействованием Th1 клеток вместо Th2 клеток полезна для профилактики, лечения и выздоровления при аллергических заболеваниях.
На сегодняшний день используют несколько форм активной вакцинации с применением аллергенов. Наиболее распространена так называемая "иммунотерапия", которая основана на частых иммунизациях относительно высокими концентрациями аллергенов. Данная методика обладает лишь средней степенью эффективности при незначительном числе аллергических заболеваний, таких как аллергия на пчелиный яд, и в некоторых случаях ринита и конъюнктивита, и недавно в некоторых публикациях показали ее эффективность при легких формах астмы и атопического дерматита. Совсем недавно с несколько лучшими результатами стали применять интенсивную иммунотерапию, при которой возрастающие количества аллергена вводили путем инъекции в довольно короткий промежуток времени. Обычно для введения аллергенов применяют подкожную инъекцию, но недавно данный путь введения сравнили с пероральным применением или даже местным применением, и полученные результаты, как правило, были положительными, но не всегда согласующимися. Иной методикой иммунотерапии является методика, описанная у Saint-Remy (ЕР 0178085 и ЕР 0287361), согласно которой применяют аутологичные IgG-антитела, которые in vitro объединены в комплекс с соответствующими аллергенами. Данная методика позволяет применять гораздо меньшие количества аллергена с меньшими побочными эффектами.
Механизм, лежащий в основе данных методик лечения, неясен. При классической терапии, по-видимому, благоприятного результата добиваются, если терапия вызывает повышение количества специфических IgG-антител, хотя не каждый раз достоверное повышение количества специфических IgG коррелирует с успешной иммунотерапией. Возможным аргументом в пользу того, почему это происходит, является относительно низкая аффинность IgG-антител к CD32 на В-клетках, моноцитах и тучных клетках. В подходе Saint-Remy производят отбор специфических lgG-антител у пациента, которые впоследствии смешивают с соответствующими аллергенами in vitro. Таким образом, в рамках указанной методики, аллерген не может свободно реагировать с клетками или другими изотипами антител на клетках, такими как IgE на тучных клетках. Дополнительно утверждается, что индуцируется образование антиидиотипических антител против специфических молекул IgG, при этом указанные антиидиотипические антитела будут предотвращать развитие аллергии в будущем.
В WO 97/07218 раскрыты гибридные белки, представляющие собой объединение аллергена и направленной против CD32 молекулы. В данной публикации устранили проблемы, связанные с выделением специфических молекул IgG и низкой аффинностью таких IgG-антител к CD32, а также уменьшили факторы риска классической иммунотерапии, в которой применяют полные "связывающие IgE" аллергены. Тем не менее, заявленная индукция Th-опосредованных анамнестических реакций исключительно благодаря нацеливанию вакцины, содержащей направленную против CD32 молекулу, на дендритные клетки не подтверждена доказательствами.
В WO 2007098934 A1 раскрыты молекулы, способные связываться с TLR9 и с CD32, содержащие по меньшей мере один эпитоп по меньшей мере одного антигена, и получение и применение таких молекул в качестве лекарственного средства, особенно для лечения аллергических реакций.
Иммунорегуляция может иметь эффект не только в случае аллергических заболеваний, но также при целом ряде других заболеваний.
Целью профилактической или терапевтической противоинфекционной иммунотерапии является усиление иммунного ответа на инфекционные агенты, такие как микробные патогены.
При иммунотерапиях опухоли целью является также применение специфических к опухолевым антигенам клеток Т-хелперов 1-го типа (Th1), дополнительно к цитотоксическим Т-лимфоцитам (CTL).
Рак, известный в медицине как злокачественное новообразование, представляет собой широкую группу различных заболеваний, вызванных неконтролируемым ростом клеток. При раке клетки неконтролируемо делятся и растут, образуя злокачественные опухоли, и проникают в близлежащие части организма. Рак также может распространяться в более удаленные части организма через лимфатическую систему или кровоток. Не все опухоли являются раковыми. Доброкачественные опухоли не растут неконтролируемо, не проникают в соседние ткани и не распространяются по всему организму. Существует более 200 различных известных видов рака, которые поражают людей.
Сложно определить, что именно вызывает рак. Известно множество факторов, повышающих риск возникновения рака, включая употребление табака, некоторые инфекции, радиацию, отсутствие физической активности, ожирение и вещества, загрязняющие окружающую среду. Такие факторы могут непосредственно повреждать гены или совместно с существующими внутри клеток генетическими нарушениями вызывать заболевание. Приблизительно от пяти до десяти процентов раков полностью наследуемые.
Рак можно диагностировать множеством способов, в том числе основываясь на присутствии некоторых признаков и симптомов, скрининговых тестах или медицинской визуализации. После обнаружения потенциального рака проводят его диагностику с помощью исследования под микроскопом образца ткани. Рак обычно лечат химиотерапией, радиационной терапией и хирургическим вмешательством. Шансы выжить при раковом заболевании сильно варьируют в зависимости от типа и местонахождения рака и стадии заболевания на момент начала лечения. Несмотря на то, что рак может поражать людей всех возрастов и некоторые типы рака чаще встречаются у детей, риск развития рака, как правило, повышается с возрастом. В 2007 г. приблизительно 13% всех человеческих смертей по всему миру (7,9 миллионов) были вызваны раком. И этот показатель растет по мере того, как все больше людей доживают до пожилого возраста, и происходит изменение образа жизни людей в развивающемся мире.
Поскольку иммунная система реагирует на факторы окружающей среды, с которыми она встречается, на основе распознавания своего и чужого, многие виды опухолевых клеток, которые возникают в результате появления рака, в большей или меньшей степени игнорируются собственной иммунной системой пациента, поскольку опухолевые клетки по существу являются собственными клетками пациента, которые растут, делятся и распространяются без надлежащего регуляторного контроля.
Иммунная толерантность или иммунологическая толерантность представляет собой процесс, в результате которого иммунная система не атакует антиген. При естественной толерантности или аутотолерантности в организме не индуцируется иммунный ответ на собственные антигены (аутоантигены). Выделены три формы указанного процесса: центральная толерантность, периферическая толерантность и приобретенная толерантность.
Центральная толерантность1:
Центральная толерантность возникает в процессе развития лимфоцитов и действует в тимусе и костном мозге. Там Т- и В-лимфоциты, которые распознают собственные антигены, удаляются до того, как указанные клетки разовьются в полностью иммунокомпетентные клетки, что предотвращает аутоиммунитет. Данный процесс наиболее активно происходит в эмбриональном периоде, но продолжается на протяжении всей жизни по мере образования незрелых лимфоцитов.
Периферическая толерантность2:
Периферическая толерантность представляет собой иммунологическую толерантность, которая развивается после того, как Т- и В-клетки созревают и выходят на периферию. Т-клетки, которые покидают тимус, относительно безопасны, хотя и не полностью. На некоторых из них будут присутствовать рецепторы (TCR), которые могут отвечать на собственные антигены, присутствующие в таких высоких концентрациях, что они могут связываться со "слабыми" рецепторами, с которыми Т-клетка не встречалась в тимусе (такими как тканеспецифические молекулы, подобные таковым в островках Лангерганса, головном мозге или спинном мозге). Такие аутореактивные Т-клетки, которые избегают негативной селекции в тимусе, могут вызвать повреждение клетки, если их не удалить или эффективно не инактивировать в периферической ткани. Известно, что существует несколько механизмов обратной связи для подавления таких потенциально аутореактивных Т-клеток. Они включают следующие механизмы: анергия, вызванная активацией гибель клеток, периферическая супрессия.
Приобретенная или индуцированная толерантность3:
Под приобретенной или индуцированной толерантностью понимают адаптацию иммунной системы к внешним антигенам, отличительным признаком которой служит специфическая нечувствительность лимфоидных тканей к данному антигену, который при других обстоятельствах вполне вероятно вызвал бы клеточный или гуморальный иммунитет. Одним из наиболее важных естественных видов приобретенной толерантности является иммунная толерантность при беременности, когда необходима толерантность материнской иммунной системы к зародышу и плаценте.
Иммунотерапия, нацеленная на опухолевые специфические антигены.
Иммунотерапия рака представляет собой использование иммунной системы для отторжения рака. Основной предпосылкой является стимуляция иммунной системы пациента для атаки злокачественных опухолевых клеток, которые вызвали данное заболевание. Это можно осуществить либо посредством активной иммунизации пациента (например, путем введения клеточной вакцины от рака, такой как Провендж, Dendreon, Сиэтл, Вашингтон, США)4, при которой собственная иммунная система пациента обучается распознавать опухолевые клетки как мишени для уничтожения, или посредством введения терапевтических антител как лекарственных средств, при этом иммунная система пациента привлекается к уничтожению опухолевых клеток с помощью терапевтических антител. Другим подходом к активации иммунной системы пациента против опухоли является применение так называемых опухолевых специфических антигенов (Tumor Associated Antigens; ТАА), которые представляют собой собственные белки, которые в некотором количестве экспрессируются здоровыми нормальными клетками, но сверхэкспрессируются опухолевыми клетками, или они включают гормоны/факторы роста клеток, в ответ на которые опухолевые клетки пролиферируют5. Данные ТАА включают в состав лекарственной формы и представляют организму в качестве иммуногена таким образом, что иммунная система выработает ответ, несмотря на тот факт, что данные белки являются собственными. Очевидно, что данный подход будет полезен лишь для ТАА, против которых данный пациент развил периферическую или приобретенную толерантность. Если Т- и В-клетки, распознающие ТАА, были удалены из иммунологического репертуара, активная иммунотерапия рака не представляется возможной.
Гастрин.
Примером аутоантигена (гормона/фактора роста), который можно применять в качестве мишени для лечения таких видов рака желудочно-кишечного тракта, как рак поджелудочной железы, является малый гастрин (G17)6-9. Кроме того, нейтрализация G17 также может оказаться полезной при любом связанном с гастрином болезненном состоянии, включая язвы желудка, гастроэзофагеальную рефлюксную болезнь (ГЭРБ)10, поскольку pH желудка регулируется гастрином, и терминальную стадию почечной недостаточности (ТСПН)11, поскольку концентрации гастрина в кровотоке у пациентов с ТСПН выше, чем в норме.
В US 5023077 раскрыты иммуногенные композиции и способы лечения и предупреждения язвенной болезни желудка и двенадцатиперстной кишки, данные иммуногенные композиции составлены на основе пептидов гастрина, которые соединены с иммуногенным носителем, таким как дифтерийный анатоксин, столбнячный анатоксин, гемоцианин лимфы улитки или бычий сывороточный альбумин.
Гастрин выполняет несколько важных функций в желудочно-кишечном тракте, две наиболее важные из которых представляют собой стимуляцию секреции кислоты и стимуляцию роста клеток в желудочно-кишечном тракте. Данный гормон существует, по меньшей мере, в двух молекулярных формах: в форме гептадекагастрина, так называемого малого гастрина ("G17"), и в форме тетратриаконтагастрина ("G34"), - названных в соответствии с количеством аминокислотных остатков ("АА") в каждой молекуле, при этом G17 состоит из 17 аминоконцевых ("N-концевых") остатков G34.
В US 5609870 раскрыт способ получения иммуногена против G17, который вызывает образование антител у млекопитающего против собственного G17, которые не реагируют с G34. Указанный способ включает конъюгацию пептида, который состоит из последовательности, соответствующей фрагменту N-концевой последовательности аминокислот G17 до аминокислотного остатка номер 12 по С-концу со спейсерным пептидом, который конъюгирован с иммуногенным носителем, таким как дифтерийный анатоксин, столбнячный анатоксин, гемоцианин лимфы улитки и бычий сывороточный альбумин.
Иммунное равновесие.
Иммунное равновесие, которое регулируется Th1/Th2/Th17/Treg клетками, играет важную роль в разработке иммунологических способов лечения.
При аутоиммунных заболеваниях, т.е. при состояниях, при которых иммунная система атакует собственную ткань, существует потребность в регуляции нарушенного равновесия Th1/Th2/Th17/Treg.
Роль TLR9.
Toll-подобные рецепторы (TLR) представляют собой класс белков, которые играют ключевую роль в системе врожденного иммунитета. Они представляют собой некаталитические рецепторы, один раз пронизывающие мембрану, обычно экспрессируемые на поверхности клетки и в эндоцитозном компартменте «сторожевых» клеток, таких как макрофаги и дендритные клетки. TLR распознают патоген-ассоциированные молекулярные паттерны (ПАМП), структурно консервативные молекулы микробов, и запускают передачу сигналов, которые вызывают продукцию цитокинов, необходимых для врожденного иммунитета и, впоследствии, приобретенного иммунитета.
Различные TLR проявляют различные рисунки экспрессии. Данный ген преимущественно экспрессируется в богатых иммунными клетками тканях, например, в селезенке, лимфатическом узле, костном мозге и лейкоцитах периферической крови.
У людей и мышей в совокупности было обнаружено тринадцать TLR (названных просто TLR1-TLR13), и эквивалентные формы многих из них были обнаружены у других видов млекопитающих. Тем не менее, не каждый рецептор TLR, обнаруженный у мышей, также обнаруживают у людей, или наоборот. Кроме того, не для каждого рецептора TLR известен лиганд и функция, например, TLR10 представляет собой «сиротский» рецептор с неизвестной функцией.
Активацию рецепторов TLR применяют для лечения различных заболеваний, например, было показано, что активация TLR9 фармацевтическими композициями полезна для лечения аллергии и онкологии. Исследования у мышей и человека свидетельствуют о том, что природные лиганды TLR9 представляют собой неметилированные последовательности CpG в молекулах ДНК. Сайты CpG относительно редко встречаются (~1%) в геномах позвоночных по сравнению с геномами бактерий или вирусной ДНК. TLR9 экспрессируется множеством клеток иммунной системы, таких как дендритные клетки, В-лимфоциты, моноциты и натуральные клетки-киллеры (NK). Тем не менее, у здоровых людей экспрессия TLR9 ограничена плазмацитоидными дендритными клетками (пДК) и В-клетками. Его экспрессия происходит в эндосомальных компартментах внутри клетки и его функция состоит в том, чтобы предупредить иммунную систему о вирусных и бактериальных инфекциях путем связывания с ДНК, богатой мотивами CpG. Тем не менее, при патологических состояниях экспрессию TLR9 наблюдали также на поверхности клеток12-14.
Было описано множество различных синтетических молекул агонистов TLR9. Агонистические лиганды (активирующие TLR9) классифицировали на три группы.
Первая группа состоит из CpG класса А, в частности, из олигодезоксинуклеотидов (ОДН) CpG-A (D)15, также известных как ОДН "D''-типа. Такие агонисты TLR9 вызывают сильную индукцию IFN-альфа и минимальное созревание дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 1". Пример представляет собой ОДН221616: GGGGGACGATCGTCGGGGGG (SEQ ID NO: 48).
Вторая группа состоит из CpG класса В, в частности, из олигодезоксинуклеотидов (ОДН) CpG-B (K)17, также известных как ОДН "K"-типа. Такие агонисты TLR9 вызывают слабую индукцию IFN-альфа и созревание дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 2". Пример представляет собой ОДН200618;19: TCGTCGTTTTGTCGTTTTGTCGTT (SEQ ID NO: 49).
Третья группа состоит из CpG класса С, также известных как олигодезоксинуклеотиды (ОДН) CpG-C20. Такие агонисты TLR9 индуцируют IFN-альфа и созревание незрелых дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 3". Пример представляет собой ОДНМ36221: TCGTCGTCGTTCGAACGACGTTGAT (SEQ ID NO: 69).
Все описанные на сегодняшний день лиганды TLR9 имеют в основе нуклеотиды. Хотя антитела, специфичные к TLR9, были описаны и применялись, чтобы продемонстрировать присутствие и местонахождение рецептора, данные молекулы не были описаны в качестве лигандов TLR9, не было сообщений о какой-либо их активирующей или ингибирующей TLR9 активности.
Роль CD32.
CD32 экспрессируется на высоком уровне моноцитами/дендритными клетками и В-клетками и, следовательно, такие молекулы разрабатывают таким образом, чтобы они направляли иммунный ответ на данные важные иммунные клетки с целью предотвратить презентацию антигена В-клетками, при этом способствуя презентации антигена, главным образом, дендритными клетками (ДК), что при достаточной стимуляции приводит к индукции ТМ-ответов на антиген. Существует по меньшей мере два типа ДК: миелоидные дендритные клетки (мДК) и плазмацитоидные дендритные клетки (пДК), описание этих двух типов привело к формированию новой концепции ДК1 и ДК2 клеток. В данной концепции клетки ДК1 способствуют индукции развития Th1 клеток после антиген-специфической стимуляции, а клетки ДК2 поддерживают развитие Th2 клеток. ДК моноцитарного происхождения (или мДК), как правило, считают типом ДК1, тогда как пДК считают типом ДК2. Оба типа ДК экспрессируют CD32a и будут вызывать антиген-специфический ответ Т-клеток; тем не менее, нет гарантии, что в результате разовьется ответ Th1. В действительности, у страдающих аллергией доноров Th2-ответы более вероятны. Важно отметить, что пДК экспрессируют рецептор TLR9, который связывает CpG-ОДН (олигодезоксинуклеотиды (ОДН), содержащие неметилированные мотивы CpG). Активация данного рецептора в пДК приводит к очень высокой продукции IFN-альфа и IL-12, которые вызывают индукцию Th1 и, таким образом, превращают потенциальные клетки ДК2 в ДК1.
Таким образом, такие молекулы могут совмещать способность активаций рецептора TLR9 у пДК со специфической стимуляцией и индукцией антиген-специфических Th1 клеток.
При иммунотерапиях опухоли конкретной целью является применение специфических к опухолевым антигенам Т-хелперов 1-го типа (Th1) дополнительно к цитотоксическим Т-лимфоцитам (CTL).
Суперспирали.
Суперспирали состоят из структурных мотивов в белках, в которых 2-7 альфа-спиралей скручены вместе, как нити в веревке; наиболее распространенными типами являются димеры и тримеры. Суперскрученные спирали применяют для стабилизации Fv-фрагментов антител, что приводит к получению гетеродимерных суперспиральных доменов22.
Стабильность и свернутая структура сложных белковых молекул является решающей при разработке иммуногенов. Таким образом, цель настоящего изобретения состоит в получении вакцины с улучшенной стабильностью и структурой, для регуляции иммунного ответа на определенные иммуногены.
Дополнительно существует потребность в улучшенных способах иммунотерапии, нацеленной на гастрин и зависимые от гастрина болезненные состояния. Таким образом, цель настоящего изобретения состоит в получении вакцины с улучшенной иммуногенностью, стабильностью и структурой, для регуляции иммунного ответа на определенные эпитопы гастрина.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Указанная цель достигается заявленным объектом изобретения.
Согласно настоящему изобретению предложена иммунорегуляторная вакцина, содержащая
- направленный адъювант, содержащий по меньшей мере направленную против CD32 молекулу, соединенную с лигандом TLR9 и первой пептидной альфа-спиралью, и
- иммуноген, который имеет по меньшей мере один эпитоп и вторую пептидную альфа-спираль, скрученную с указанной первой альфа-спиралью.
В частности, указанный эпитоп представляет собой Т-клеточный и/или В-клеточный эпитоп.
Согласно конкретному аспекту настоящего изобретения каждая из указанных первой и второй альфа-спиралей содержит повторы аминокислотного мотива из 3-5 аминокислот, специфично связывающиеся друг с другом с Kd, меньшей чем 10-6 М, предпочтительно с Kd, меньшей чем 10-7 М, более предпочтительно, меньшей чем 10-8 М или 10-9 М.
Согласно дополнительному конкретному аспекту настоящего изобретения указанная направленная против CD32 молекула выбрана из группы, состоящей из антитела к CD32, фрагмента антитела и пептида, предпочтительно нацеленного на CD32a. Указанный фрагмент антитела, в частности, может представлять собой, например, фрагмент Fab, Fv, scFv, dAb, F(ab)2 или Fcab, или любую другую возможную связывающую единицу при условии, что она специфично связывается с рецептором и интернализуется после связывания.
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9 представляет собой агонист TLR9, выбранный из группы, состоящей из CpG класса А, в частности, из олигодезоксинуклеотидов (ОДН) CpG-A (D)23, также известных как ОДН "D"-типа. Такие агонисты TLR9 вызывают сильную индукцию IFN-альфа и минимальное созревание дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 1".
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9 представляет собой агонист TLR9, выбранный из группы, состоящей из CpG класса В, в частности, из олигодезоксинуклеотидов (ОДН) CpG-B (K)24, также известных как ОДН "K"-типа. Такие агонисты TLR9 вызывают слабую индукцию IFN-альфа и созревание дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 2".
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9, в частности, представляет собой агонист TLR9, выбранный из группы, состоящей из CpG класса С, также известных как олигодезоксинуклеотиды (ОДН) CpG-C25;26. Такие агонисты TLR9 индуцируют IFN-альфа и созревание незрелых дендритных клеток, и в данной заявке их называют лигандами TLR9 "группы 3".
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9, в частности, представляет собой иммуностимулирующий пептид, имитирующий любой из олигодезоксинуклеотидов CpG класса А, В или С, т.е. пептид, специфично связывающийся с TLR9, с активирующей, агонистической функцией.
Согласно другому аспекту настоящего изобретения указанный лиганд TLR9 представляет собой антагонист TLR9, выбранный из группы, состоящей из ингибиторных олигодезоксинуклеотидов (ОДН)27;28 (иногда называемых ингибиторными CPG), например, из тех, которые содержат ингибиторный мотив, состоящий из CCx(не-C)(не-C)xxGGG (х - любое основание)29. Доказали, что определенные ингибиторные ОДН не индуцируют IFN-альфа и не индуцируют созревание дендритных клеток, также блокируя активацию посредством агониста TLR9.
Такого агониста или антагониста TLR9 можно определить с помощью подходящего анализа, основанного на клеточной системе, в котором измеряют стабильную экспрессию любого из IFN-альфа или по меньшей мере одного из маркеров CD80, CD83 и CD86, которые отражают созревание незрелых дендритных клеток (ДК). Для этой цели плазмацитоидные дендритные клетки (пДК) выделяют из крови здорового донора, как описано у Tel и др.30, и впоследствии инкубируют с подходящими концентрациями лиганда TLR9. Через 24 ч измеряют количество IFN-альфа в супернатанте, применяя стандартные протоколы твердофазного иммуноферментного анализа (ELISA). Для определения статуса созревания клеток, пДК окрашивают доступными для приобретения специфичными антителами до и после инкубации с лигандом TLR9, чтобы выявить экспрессию CD80, CD83 или CD86, применяя стандартные процедуры сортировки клеток с возбуждением флуоресценции (FACS).
Индукцию IFN-альфа можно определить по уровню экспрессии IFN-альфа и соответствующему его увеличению по сравнению с эталонным уровнем. Такое увеличение по сравнению с нестимулированными клетками можно сравнить с уровнями, индуцированными установленными эталонами для каждого типа CpG, который определяют по группе 1, 2 или 3 лигандов TLR9, и обычно оно составляет от 30% до 300% от соответствующего эталонного уровня, предпочтительно, по меньшей мере 100%, более предпочтительно по меньшей мере 120%, по меньшей мере 150%, по меньшей мере 200% или по меньшей мере 250%.
Созревание незрелых дендритных клеток можно определить по уровню экспрессии любого из маркеров CD80, CD83 и CD86. Соответствующее увеличение по сравнению с нестимулированными клетками можно сравнить с уровнями, индуцированными установленными эталонами для каждого типа CpG, который определяют по группе 1, 2 или 3 лиганда TLR9, и обычно оно составляет от 30% до 300% от соответствующего эталонного уровня, предпочтительно по меньшей мере 100%, более предпочтительно по меньшей мере 120%, по меньшей мере 150%, по меньшей мере 200% или по меньшей мере 250%.
В частности, агонист TLR9 из группы 1 и 3 будет приводить к повышенной экспрессии IFN-альфа и агонист TRL9 из группы 2 и 3 будет приводить к повышенной экспрессии любого из факторов созревания ДК CD80, CD83 и CD86. Антагонист TLR9 будет приводить к пониженной экспрессии IFN-альфа и к пониженной экспрессии любого из факторов созревания ДК CD80, CD83 и CD86, даже в присутствии агониста TLR9 из любой группы 1-3.
Согласно конкретному варианту реализации настоящего изобретения указанный иммуноген получен из любого из следующего:
- опухолевого специфичного антигена, для применения при иммунотерапии раковых заболеваний, или
- патогена, для применения при иммунотерапии инфекционных заболеваний, или
- аллергена, для применения при иммунотерапии аллергических заболеваний.
Такая вакцина обычно представляет собой иммуностимулирующую вакцину, например, стимулирующую гуморальный и Т-клеточный (Th1) иммунный ответ.
В данном варианте реализации иммуностимулирующей вакцины, в частности, используется лиганд TLR9, который представляет собой агонист TLR9. В данном случае указанная вакцина преимущественно индуцирует Th1-ответы против иммуногена.
В частности, указанная молекула, направленная против CD32, нацелена на CD32a, предпочтительно с высокой аффинностью с Kd≤10-6 М, более предпочтительно, меньшей чем 10-7 М или меньшей чем 10-8 М.
В частности, указанная молекула, направленная против CD32, специфично или избирательно связывает CD32a, т.е. не связывает CD32b или связывает CD32b с низкой аффинностью с Kd>10-6 М, предпочтительно выше, чем 10-5 М, более предпочтительно выше, чем 10-4 М. Различие в аффинности связывания с CD32a и CD32b предпочтительно составляет по меньшей мере 10 раз, более предпочтительно по меньшей мере 20 раз или по меньшей мере 30 раз, или различие значений Kd еще выше.
Особенно предпочтительна высокая аффинность или высокая разница в аффинности связывания CD32a вместо CD32b у молекулы, направленной против CD32, обычно применяемой в иммуностимулирующей вакцине, дополнительно использующей агонист TLR9. Дополнительно предпочтительным является применение в такой вакцине иммуногена, выбранного из целого ряда онкологических мишеней или патогенных мишеней, когда Thl-ответ и специфические IgG-антитела необходимы для эффективной борьбы с заболеваниями.
Согласно альтернативному варианту реализации указанная молекула, направленная против CD32, нацелена на оба маркера CD32a и CD32b, с высокой аффинностью с Kd≤10-6 М, предпочтительно с более высокой аффинностью, чем 10-7 М, более предпочтительно с более высокой аффинностью, чем 10-8 М. Особенно предпочтительную высокую аффинность связывания обоих CD32a и CD32b молекулой, направленной против CD32, обычно используют в вакцине, дополнительно содержащей агонист TLR9. Дополнительно предпочтительным является применение в такой вакцине иммуногена, выбранного из целого ряда аллергических мишеней, когда осуществляют переключение Th2-ответа на Th1-ответ.Обычно, предпочтительно отсутствие выработки антител против самой вакцины. Кроме того, предпочтительна определенная вакцина, которая связывается с CD32b приблизительно с такой же аффинностью, как и с CD32a.
Аффинность связывания молекулы, направленной против CD32, специфично нацеленной на любой из CD32a или CD32b, или сразу на оба CD32a и CD32b, можно определить с помощью подходящего анализа, такого как обычный ELISA, применяя доступные для приобретения меченые гистидиновой (HIS) меткой рекомбинантные формы CD32a и CD32b, которыми покрывают планшеты с Ni-NTA для ELISA, например, планшеты Ni-NTA HisSorb (Qiagen, Австрия). Молекулы, направленные против CD32, можно биотинилировать и после этого обнаружить, применяя стрептавидин-HRP (стрептавидин, конъюгированный с пероксидазой хрена) или стрептавидин-АР (стрептавидин, конъюгированный со щелочной фосфатазой) и подходящие субстраты. В качестве альтернативы указанные молекулы можно исследовать с помощью FACS анализа, применяя клетки U937 (например, номер в Американской коллекции типовых культур (АТСС): CRL 1593), экспрессирующие CD32a, но не CD32b, и трансформированные вирусом Эпштейна-Барр (EBV) В-клетки, например, CFB4:2, как описано у van Reijsen и др.31, экспрессирующие CD32b, но не CD32a.
Согласно дополнительному варианту реализации настоящего изобретения, указанный иммуноген получают из любого из следующего:
- аллергена, для применения при иммунотерапии аллергических заболеваний, или
- аутоантигена человека, для применения при иммунотерапии аутоиммунных заболеваний.
Такая вакцина для применения при аутоиммунном заболевании обычно представляет собой вакцину, вызывающую иммунотолерантность, например, вызывающую Т-клеточную толерантность к иммуногену регуляторных Т-клеток и снижающую гуморальный иммунный ответ.
В данном варианте реализации, относящемся к иммунотолерантности, в частности, применяют лиганд TLR9, который представляет собой агонист TLR9 из группы 1 или представляет собой антагонист TLR9. В данном случае указанная вакцина будет преимущественно снижать ответы Th1/2/17 клеток на иммуноген, но активировать клетки Treg.
Такая вакцина для применения при аллергии может представлять собой либо:
- вакцину, вызывающую иммунотолерантность, например, индуцирующую Т-клеточную толерантность к иммуногену регуляторных Т-клеток и снижающую гуморальный иммунный ответ, задействуя лиганд TLR9, который представляет собой агонист TLR9 из группы 1 или представляет собой антагонист TLR9. В данном случае указанная вакцина будет преимущественно снижать ответы Th1/2/17 клеток на иммуноген, но активировать клетки Treg;
либо
- иммуностимулирующую вакцину, индуцирующую Th1-ответы на иммуноген, при этом предотвращающую гуморальный иммунный ответ на вакцину, задействуя лиганд TLR9, который представляет собой агонист TLR9 из группы 3.
Согласно данному варианту реализации вакцины, вызывающей иммунотолерантность, указанная молекула, направленная против CD32, специфично нацелена на любой из CD32a или CD32b, или сразу на оба CD32a и CD32b с высокой аффинностью с Kd≤10-6 М, предпочтительно с более высокой аффинностью с Kd≤10-7 М, более предпочтительно с Kd≤10-8 М. Предпочтительно, чтобы молекула, направленная против CD32, была специфично нацелена на оба CD32a и CD32b.
Также для иммуностимулирующей вакцины для применения при аллергии указанная молекула, направленная против CD32, специфично нацелена на CD32a и CD32b с высокой аффинностью с Kd≤10-6 М, предпочтительно с более высокой аффинностью, например, с Kd≤10-7 М, более предпочтительно с Kd≤10-8 М. Предпочтительно, чтобы молекула, направленная против CD32, была специфично нацелена на оба CD32a и CD32b.
В частности, согласно настоящему изобретению предложена вакцина для применения для иммунотерапии аллергических заболеваний, в которой указанный иммуноген получен из аллергена и в которой указанная молекула, направленная против CD32, нацелена на CD32a и CD32b.
Конкретные варианты реализации настоящего изобретения можно представить в следующей таблице, в которой описан выбор молекулы, направленной против CD32, в соответствии с ее специфичностью и аффинностью связывания с CD32a и/или CD32b, типом лиганда TLR9 и типом иммуногена.
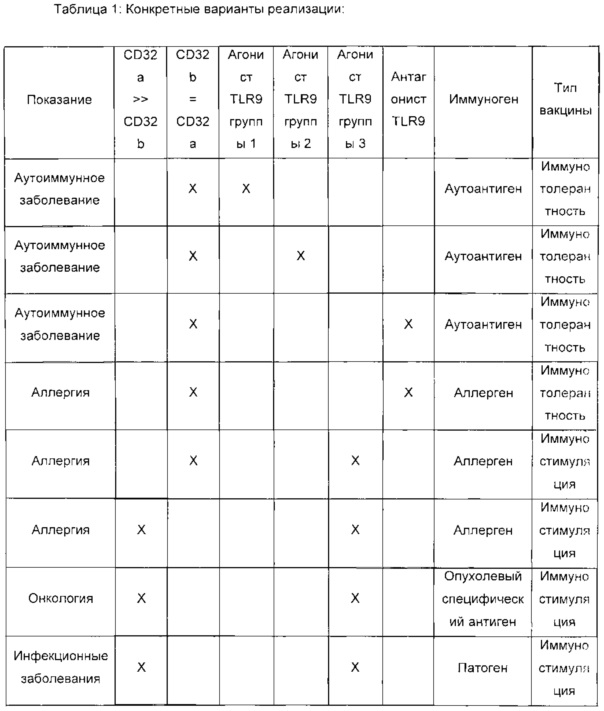
Колонки 2 и 3 относятся к селективности и/или аффинности связывания молекулы, направленной против CD32, с любым из CD32a и CD32b:
CD32a >> CD32b означает селективное связывание с CD32a (различие в аффинностях связывания/Kd по меньшей мере в 10 раз);
CD32b = CD32a означает связывание с обоими CD32a и CD32b приблизительно в одинаковой степени (различие в аффинностях связывания/Kd менее чем в 10 раз).
Особенно для противоаллергической вакцины, т.е. вакцины, вызывающей иммунотолерантность, для лечения аллергических болезненных состояний, или для вакцины против аутоиммунного заболевания, т.е. вакцины, вызывающей иммунотолерантность для лечения аутоиммунных болезненных состояний, указанная молекула, направленная против CD32, специфично нацелена на оба CD32a и CD32b с приблизительно одинаковой высокой аффинностью, например, различие в аффинностях связывания (в значениях Kd) с каждой из мишеней CD32a и CD32b меньше, чем в 20 раз, предпочтительно, меньше, чем в 10 раз.
Согласно настоящему изобретению дополнительно предложена иммуногенная композиция, содержащая
a. направленный адъювант, содержащий по меньшей мере молекулу, направленную против CD32, соединенную с лигандом TLR9 и первой пептидной альфа-спиралью; и
b. пептидный иммуноген гастрин-17, соединенный со второй пептидной альфа-спиралью, скрученной с первой альфа-спиралью, при этом указанный пептидный иммуноген представляет собой любой из следующих иммуногенов:
(i) гастрин-17 человека, включающий последовательность аминокислот SEQ ID NO: 78, или ее фрагмент, включающий последовательность аминокислот SEQ ID NO: 79, или по меньшей мере 4 N-концевые аминокислоты последовательности SEQ ID NO: 79;
(ii) аналог (i), предпочтительно полученный из макака-резуса или мыши; и/или
(iii) функционально активный вариант любого из (i) или (ii), с одной, двумя, тремя или четырьмя точечными мутациями в последовательности аминокислот SEQ ID NO: 79.
В частности, указанный пептидный иммуноген представляет собой линейный пептид, включающий или состоящий из
(i) последовательности аминокислот в SEQ ID NO: 80, предпочтительно SEQ ID NO: 81;
(ii) последовательности аминокислот SEQ ID NO: 82, предпочтительно SEQ ID NO: 83;
(iii) последовательности аминокислот SEQ ID NO: 84, предпочтительно SEQ ID NO: 85; или
(iii) последовательности аминокислот SEQ ID NO: 79 или 86.
Предпочтительно, чтобы иммуногенная композиция согласно настоящему изобретению содержала по меньшей мере два пептидных иммуногена, соединенных со второй пептидной альфа-спиралью, предпочтительно 2, 3 или 4 пептидных иммуногена.
Если со второй альфа-спиралью связан более чем один пептидный иммуноген, указанные пептидные иммуногены могут быть конъюгированы с альфа-спиралью, например, последовательно, т.е. пептидные иммуногены могут быть соединены в ряд, например, С-конец первого пептидного иммуногена может быть соединен с N-концом второго пептидного иммуногена, при этом указанные первый и второй пептидные иммуногены идентичны или отличаются друг от друга.
В качестве альтернативы или дополнения, в иммуногенную композицию согласно настоящему изобретению можно включить дополнительные пептидные иммуногены путем перекрестной сшивки, например, два или более пептидных иммуногена, которые либо идентичны, либо отличаются друг от друга, соединяют с одной и той же альфа-спиралью путем химической реакции, такой как химическая перекрестная сшивка, позволяющей образование межмолекулярных поперечных связей, например, с помощью гомобифункциональных реагентов, таких как диметиладипимидат (DMA), диметилсуберимидат (DMS) или глутаральдегид. Например, такую перекрестную сшивку можно осуществить, применяя перекрестную сшивку с помощью глутаральдегида свободных боковых групп лизина альфа-спирали или спейсера/линкера, соответственно. Таким образом, два или более пептидных иммуногенов, применяемых в соответствии с настоящим изобретением, оказываются соединенными с альфа-спиралью параллельно или бок о бок.
Согласно дополнительному конкретному аспекту настоящего изобретения указанная иммуногенная композиция содержит одну или более линкерйых последовательностей, предпочтительно состоящих из остатков глицина, и/или серина, и/или лизина, предпочтительно последовательность аминокислот, представленную SEQ ID NO: 89 или 90. Линкерные последовательности могут быть линейными или разветвленными, например, чтобы позволить связывание или перекрестную сшивку двух или более пептидных или полипептидных молекул.
Согласно дополнительному конкретному аспекту настоящего изобретения указанная иммуногенная композиция содержит или состоит из последовательности аминокислот, представленной SEQ ID NO: 87 или SEQ ID NO: 88.
Согласно настоящему изобретению, дополнительно предложена вакцина, содержащая иммуногенную композицию согласно настоящему изобретению и фармацевтически приемлемый носитель. Такая вакцина, как правило, представляет собой иммуностимулирующую вакцину, например, стимулирующую гуморальный и Т-клеточный (Th1) иммунный ответ.
Согласно предпочтительному варианту реализации гуморальный и Т-клеточный (Th1) иммунный ответ является транзиторным, например, с определенным максимальным титром IgG, индуцированным вакцинацией, который обычно достигается в течение периода от 2 до 8 недель после вакцинации, после чего титр снижается на по меньшей мере 30%, предпочтительно по меньшей мере 40%, или по меньшей мере 50%, или по меньшей мере 60%, или по меньшей мере 70%, или по меньшей мере 80%, или по меньшей мере 90% или до 100% в течение 6 месяцев после вакцинации, предпочтительно в течение 5 месяцев, или в течение 4 месяцев, или в течение 3 месяцев, или в течение 2 месяцев после вакцинации. Такой сниженный титр можно снова повысить путем вторичной (бустерной) инъекции. При серии вакцинаций, возможно, определяют транзиторный иммунный ответ после последней инъекции иммуногенной композиции или вакцины. Индукция транзиторного иммунного ответа обеспечивает преимущество контролируемого лечения, например, с возможностью прервать или остановить лечение при необходимости.
В соответствии с настоящим изобретением предпочтительно предложена вакцина, содержащая иммуногенную композицию, содержащую
- направленный адъювант, содержащий по меньшей мере направленную против CD32 молекулу соединенную с лигандом TLR9, и
- иммуноген, который связан с направленным адъювантом, предпочтительно путем присоединения или аффинного связывания: например, соединения с помощью технологий рекомбинантной ДНК или химической конъюгации,
для применения для лечения субъекта, с целью вызвать направленный против иммуногена иммунный ответ IgG, который является транзиторным, предпочтительно с определенным максимальным титром IgG, вызванным вакцинацией, который обычно достигается в течение периода от 2 до 8 недель после вакцинации, после чего титр снижается на по меньшей мере 30%, предпочтительно по меньшей мере 40%, или по меньшей мере 50%, или по меньшей мере 60%, или по меньшей мере 70%, или по меньшей мере 80%, или по меньшей мере 90% или до 100% в течение 6 месяцев после вакцинации, например, после последней вакцинации из серии вакцинаций.
Такую вакцину предпочтительно применяют с иммуногеном, который представляет собой или включает антиген или эпитоп собственного антигена, например, выбранный из группы, состоящей из опухолевого специфического антигена (ТАА), предпочтительно рецептора на поверхности опухолевой клетки или растворимого антигена, продуцируемого опухолевой клеткой, такого как Her2/neu, гастрин, интерферон-альфа (INF-альфа), эпидермальный фактор роста (EGF), рецептор EGF (EGF-R), молекула адгезии эпителиальных клеток (ЕрСАМ), альфафетопротеин (АФП), карциноэмбриональный антиген (СЕА), MUC-1 или LewisY, прегормоны и гормоны, такие как любой из пищеварительных гормонов, включая секретин или инсулин, гормоны щитовидной железы или половые гормоны.
При лечении человека собственный антиген должен быть исключительно человеческого происхождения.
Под транзиторным иммунным ответом Th1, вызванным данным типом вакцины, понимают не необратимый аутоиммунный ответ, а обратимый, о котором свидетельствует определенный уровень циркулирующего IgG, например, после того, как IgG был индуцирован, происходит снижение уровня циркулирующего IgG на менее чем 50%, предпочтительно, менее чем 60%, предпочтительно, менее чем 70%, предпочтительно, менее чем 80%, или менее чем 90%, даже до 100%. После индукции IgG, как правило, следует снижение уровня IgG в течение определенного периода времени, например, в течение 1 года, или в течение 6 месяцев, или в течение 3 месяцев после последней иммунизации.
В этом отношении, согласно настоящему изобретению дополнительно предложен способ лечения субъекта, нуждающегося во временном снижении уровня собственных антигенов, путем введения субъекту эффективного количества вакцины, например, в одной или более дозах, при этом по меньшей мере последняя доза обеспечивает транзиторное действие.
Согласно настоящему изобретению дополнительно предложен набор для получения иммуногенной композиции согласно настоящему изобретению, включающий следующие компоненты:
a. направленный адъювант, содержащий по меньшей мере молекулу, направленную против CD32, соединенную с лигандом TLR9 и первой пептидной альфа-спиралью; и
b. пептидный иммуноген гастрин-17, соединенный со второй пептидной альфа-спиралью, сочетающейся с первой альфа-спиралью, при этом указанный пептидный иммуноген представляет собой любой из следующих иммуногенов:
(i) гастрин-17 человека, включающий последовательность аминокислот, представленную в SEQ ID NO: 78, или ее фрагмент, включающий последовательность аминокислот, представленную в SEQ ID NO: 79, или по меньшей мере 4 N-концевые аминокислоты последовательности SEQ ID NO: 79;
(ii) аналог (i), предпочтительно полученный из макака-резуса или мыши; и/или
(iii) функционально активный вариант любого из (i) или (ii), с одной, двумя, тремя или четырьмя точечными мутациями в последовательности аминокислот, представленной в SEQ ID NO: 79.
Указанный набор, в частности, можно применять, чтобы упростить получение вакцины путем применения готового компонента направленного адъюванта для комбинирования с иммуногеном, который можно предусмотреть в соответствии с потребностью группы субъектов или отдельного субъекта.
Согласно настоящему изобретению дополнительно предложена иммуногенная композиция для применения для лечения субъекта, страдающего от гастринзависимых заболеваний или болезненных состояний. Такое заболевание или болезненное состояние, главным образом, вызвано или связано с эндогенной или чрезмерной продукцией гастрина у субъекта. Гастринзависимые заболевания или болезненные состояния, в частности, включают гастринзависимые опухоли или гастринзависимый рак, такой как рак поджелудочной железы или виды рака желудочно-кишечного тракта, язву желудка, гастроэзофагеальную рефлюксную болезнь (ГЭРБ), конечную стадию почечной недостаточности (ТСПН) или ожирение.
Таким образом, в соответствии с настоящим изобретением, в частности, предложен способ лечения субъекта, страдающего от гастринзависимых заболеваний, таких как гастринзависимые опухоли или гастринзависимый рак, такой как рак поджелудочной железы или виды рака желудочно-кишечного тракта, язва желудка, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), конечная стадия почечной недостаточности (ТСПН) или ожирение, путем введения субъекту эффективного количества иммуногенной композиции или вакцины согласно настоящему изобретению, либо профилактически, например, чтобы предотвратить появление заболевания или болезненного состояния или прогрессирование заболевания, либо терапевтически, например, чтобы уменьшить выраженность заболевания или болезненного состояния.
В частности, указанную композицию вводят субъекту в эффективном количестве, используя стратегию прайм-буст.
В частности, эффективное количество находится в диапазоне от 0,0001 до 2 мг на введение, предпочтительно от 0,001 до 2 мг на дозу.
Согласно конкретному варианту реализации настоящего изобретения субъекта дополнительно лечат с помощью химиотерапии, например, в ходе лечения гастринзависимого рака.
В частности, иммуногенная композиция согласно настоящему изобретению запускает защитный иммунный ответ у субъекта, предпочтительно с титром в сыворотке IgG против гастрина-17 человека, равным по меньшей мере 1/1000, предпочтительно по меньшей мере 1/104, предпочтительно по меньшей мере 1/105, предпочтительно по меньшей мере 1/106 или ниже, до такой степени, пока его можно обнаружить при большем разведении.
ФИГУРЫ
На Фигуре 1 показано высокоаффинное взаимодействие суперспирали, применяемой в соответствии с настоящим изобретением (пример 4).
Иммуногеном со спиралью-К покрывали чип BIACore, а "боеголовка" со спиралью-Е находилась в проточном буфере. Каждая спираль содержала альфа-спираль с 5-кратным гептадным повтором.
- Полученные результаты подтвердили чрезвычайно высокую аффинность двух указанных спиралей по отношению друг к другу (что было видно по низкой скорости диссоциации)32.
- Связывание спирали иммуногена со спиралью «боеголовки» было специфичным, и его можно было блокировать предварительной инкубацией с иммуногеном.
На Фигуре 2 показана вызванная иммуногеном 3 реактивность Т-клеток (пример 6).
Мононуклеарные клетки периферической крови (РВМС) из сенсибилизированных Der р1 макак-резусов (Масаса mulatta) культивировали в трех повторностях с Der р1 или иммуногеном 3. Пролиферацию анализировали по включению [3H]-тимидина. Результаты представлены как число импульсов в минуту. Дополнительно анализировали уровни IL-10 и GM-CSF в супернатантах, каждый указан в виде пг/мл.
- Не наблюдалось значимого различия между ответами на Der р1 или иммуноген 3 ни по пролиферации, ни по продукции цитокинов, что указывает на то, что Т-клеточные эпитопы в иммуногене 3, которые выбрали на основании экспрессии HLA II класса человека, в равной степени хорошо представлены в молекулах II класса макака-резуса и индуцируют одинаково сильные Т-клеточные ответы.
На Фигуре 3 показана опосредованная «боеголовкой» улучшенная презентация антигена (пример 7).
Пролиферация в течение 24 ч (анализировали по включению [3H]-тимидина) Т-клеток макака-резуса (Масаса mulatta) после предварительной инкубации в течение 30 минут на льду, соответственно, с «боеголовкой» и Der р1 или «боеголовкой» и иммуногеном 3. После каждой предварительной инкубации клетки промывали (НПО = ниже предела обнаружения).
- Только когда иммуноген мог взаимодействовать с «боеголовкой» посредством своей спирали (иммуноген 3), можно было наблюдать дозозависимую пролиферацию Т-клеток. Der р1 не вызывал ответ после предварительной инкубации с «боеголовкой». В качестве положительного контроля Der р1 оказался реактивным после инкубации в течение ночи (без промывки).
- Опосредованное «боеголовкой» поглощение антигена оказалось более эффективным, чем поглощение посредством пиноцитоза.
На Фигуре 4 показан аутоиммунный ответ, вызванный аутоантигеном, соединенным с CpG (пример 8)
РВМС макак-резусов (Масаса mulatta) и нормальные РВМС человека культивировали в течение 24 ч с CpG, или с биотинилированным CpG (CpG-биот), или с анти-CD32-биот + CpG. Супернатанты собирали и анализировали количество в них IL-4 и IFN-гамма (каждое количество представлено в пг/мл)
- В случае, когда CpG был соединен с биотином (CpG-биот), вызывался сильный ответ IL-4 (в РВМС макака-резуса и человека) по сравнению с CpG без биотина. РВМС человека также проявили сильный ответ IFN-гамма против CpG-биот.Когда биотин и CpG не были соединены (анти-CD32-биот + CpG), не наблюдали усиления ответа по сравнению с CpG в РВМС макака-резуса и человека.
На Фигуре 5 показана вызванная иммуногеном 5 реактивность Т-клеток (пример 10).
РВМС здоровых людей-доноров культивировали в течение 24 ч в трех повторностях с Der р1 или иммуногеном 5. Супернатанты собирали и анализировали в них уровни IL-10 и GM-CSF (каждый представлен в пг/мл; НПО = ниже предела обнаружения).
- Т-клетки человека в равной степени хорошо отвечают как на иммуноген 5, так и на Der р1, что измерили по индукции IL-10 и IFN-гамма.
На Фигуре 6 показана индукция аутоиммунного ответа «боеголовкой» SG100. Иммунизация с «боеголовкой» индуцировала сильный lgG1 и lgG2a ответ на ScFV-1-спираль, а также на MAT IV.3 на 28 день. Положительный ответ наблюдали независимо от присутствия квасцов. Иммунизация только ScFV-1-спиралью индуцировала ответ IgG1 против ScFV-1-спирали и только в присутствии квасцов; ответ IgG2a не был индуцирован.
Фигура 7 (пример 12.8).
Обнаружили сильные ответы IgG на «боеголовку» и иммуноген SG100, но не обнаружили антител против Der р1, Der р2, Der р5 или Der р7, что указывает на то, что животные ранее не встречались с исследуемыми аллергенами клеща домашней пыли (КДП), и что SG100 не содержит В-клеточных эпитопов, которые перекрестно реагируют с исследуемыми аллергенами КДП.
Фигура 8 (пример 12.8).
У животных выявили сильную пролиферацию при стимуляции in vitro «боеголовкой», immo5, Der р1, Der р2, Der р7, но не Der р5. Der р5 не является частью immo5.
Фигура 9 (пример 12.8).
Животные продуцировали IFN-гамма, но не IL-4, после стимуляции «боеголовкой», immo5, Der р1, Der р2, Der р7, но не Der р5. Der р5 не является частью immo5. На фигуре 10 показана индукция антитела (IgG) у яванских макак. Кривая зависимости от времени индукции IgG против G17 после трех инъекций вакцины (TYG100_2RM) в день 0 (д0), д14 и д28.
- Наблюдали достоверную индукцию IgG против ScFV-спирали1 и G17RM и G17H. Не наблюдали ответа на контрольный пептид со сходной молекулярной массой или при иммунизации животных G17RM_2 в отсутствие «боеголовки». Все титры специфических IgG снижались через 4 недели после последней иммунизации, что указывает на необходимость вторичных инъекций для поддержания уровней IgG. Кроме того, присутствие природного G17RM не поддерживает ответ, и поскольку снижение титров IgG против G17RM достоверно выше, чем снижение титров IgG против ScFV-спирали1, то можно сделать вывод, что вызванный иммунный ответ обратим.
На Фигуре 11 показана потеря массы после иммунизации против гастрина.
- У четырех из 6 животных наблюдали существенную зависимую от времени потерю массы тела после иммунизации TYG100_2RM. Ухаживающий за животными персонал наблюдал, что данные животные потеряли аппетит во время дневных перекусов, без потери интереса к нормальной ежедневной пище. Такое никогда не наблюдалось при применении других вакцин, следовательно, вакцину против гастрина согласно настоящему изобретению можно применять для контроля ожирения.
На Фигуре 12 показана информация о следующих последовательностях:
SEQ ID NO: 78: малый гастрин человека, G17;
SEQ ID NO: 79: пептид гастрина человека, первые (N-концевые) 12 аа (аминокислот) малого гастрина, G12;
SEQ ID NO: 80: N-концевой эпитоп малого гастрина, первые (N-концевые) 4 аа, включая конкретные функционально активные варианты с точечными мутациями;
SEQ ID NO: 81: N-концевой эпитоп малого гастрина, первые (N-концевые) 4 аа, включая более конкретные функционально активные варианты с точечными мутациями;
SEQ ID NO: 82: N-концевой эпитоп малого гастрина, первые (N-концевые) 12 аа, включая конкретные функционально активные варианты с точечными мутациями;
SEQ ID NO: 83: N-концевой эпитоп малого гастрина, первые (N-концевые) 12 аа, включая более конкретные функционально активные варианты с точечными мутациями;
SEQ ID NO: 84: N-концевой эпитоп малого гастрина, первые (N-концевые) 13 аа, включая конкретные функционально активные варианты с точечными мутациями;
SEQ ID NO: 85: N-концевой эпитоп малого гастрина, первые (N-концевые) 13 аа, включая более конкретные функционально активные варианты с точечными мутациями;
SEQ ID NO: 86: пептид гастрина человека, первые (N-концевые) 13 аа (аминокислот) малого гастрина, G13;
SEQ ID NO: 87: Иммуногенный компонент TYG100_1H: часть иммуногенной композиции согласно настоящему изобретению, содержащая один пептид гастрина человека с последовательностью SEQ ID NO: 86, линкерную последовательность и альфа-спираль пептида (TYG10CMH). Данную часть можно соединить с подходящим направленным адъювантом путем соединения в суперспираль.
- жирным шрифтом обозначен иммуноген пептида, курсивом обозначен линкер, спираль подчеркнута.
SEQ ID NO: 88: Иммуногенный компонент TYG100_2H: часть иммуногенной композиции согласно настоящему изобретению, содержащая два пептида гастрина человека с последовательностью SEQ ID NO: 86, разветвленную линкерную последовательность и альфа-спираль пептида (TYG100_2H). Данную часть можно соединить с подходящим направленным адъювантом путем соединения в суперспираль.
- жирным шрифтом обозначен пептидный иммуноген, курсивом обозначен линкер, спираль подчеркнута.
SEQ ID NO: 89: линейная линкерная последовательность;
SEQ ID NO: 90: разветвленная линкерная последовательность.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Конкретные термины, используемые повсюду в настоящем описании, имеют следующие значения.
Термин "адъювант" в данной заявке обозначает объединенный или вводимый совместно компонент вакцины, который:
- усиливает иммунный ответ на определенный иммуноген, например, на антиген или гаптен. Вызванный иммунный ответ обычно сильнее, чем иммунный ответ, вызываемый эквивалентным количеством иммуногенной композиции, которую вводят без адъюванта,
и/или
- указанный адъювант, который применяют, чтобы вызвать иммунный ответ конкретного типа или класса на иммуноген, например, иммунный ответ Th1 или Treg типа, в данной заявке называют "направленным адъювантом". "Эффективное количество" адъюванта согласно настоящему изобретению, в частности, представляет собой такое количество, которое усиливает иммунологический ответ на иммуноген таким образом, что для генерации эффективного иммунного ответа предполагаемого класса, необходимы, например, меньшие дозы или меньшее количество доз иммуногенной композиции..
Направленный адъювант согласно настоящему изобретению опосредует не только эффективный иммунный ответ, но также регуляцию иммунного ответа желаемым образом. Направляя иммуноген к подходящим иммунным клеткам для его интернализации и дальнейшего процессинга, направленный адъювант вызывает иммунный ответ Th1 вместо иммунного ответа Th2, в частности, при применении лиганда TLR9, который представляет собой агонист TLR9 из группы 3. Если в указанной композиции вакцины применяют антагонист TLR9, соответствующий иммунный ответ снижается в любом случае. Если агонист TLR9 из группы 1 комбинируют с молекулой, направленной против CD32, которая связывает CD32b, обычно ожидают индукцию Treg клеток.
"Эффективное количество" адъюванта согласно настоящему изобретению, в частности, представляет собой такое количество, которое усиливает иммунологический ответ на иммуноген таким образом, что для генерации эффективного иммунного ответа предполагаемого класса, необходимы, например, меньшие дозы или меньшее количество доз иммуногенной композиции.
Направленный адъювант согласно настоящему изобретению опосредует не только эффективный иммунный ответ, но также регуляцию иммунного ответа желаемым образом. Направляя иммуноген к подходящим иммунным клеткам для его интернализации и дальнейшего процессинга, направленный адъювант вызывает иммунный ответ Th1 вместо иммунного ответа Th2, в частности, при применении лиганда TLR9, который представляет собой агонист TLR9 из группы 3. Если агонист TLR9 из группы 1 комбинируют с молекулой, направленной против CD32, которая связывает CD32b, обычно ожидают индукцию Treg клеток.
"Эффективное количество" иммуногенной композиции, например, применяемой в вакцине согласно настоящему изобретению, относится к количеству, достаточному для того, чтобы принести значительную пользу субъекту, которого лечат, при введении в рамках режима дозирования вакцины. Для средних специалистов в данной области должно быть очевидно, что в некоторых вариантах реализации можно считать, что конкретная композиция содержит профилактически или терапевтически эффективное количество, если она содержит количество, подходящее для лекарственной формы, содержащей разовую дозу, которую вводят в рамках определенного режима дозирования, даже несмотря на то, что такого количества может быть недостаточно для достижения значительной пользы при введении в виде однократной разовой дозы. Для средних специалистов в данной области дополнительно должно быть очевидно, что эффективное количество иммуногенной композиции может отличаться для различных субъектов, получающих указанную композицию, например, в зависимости от таких факторов, как желательный биологический результат, природа указанной композиции, конкретный путь введения, состояние здоровья, размер и/или возраст субъекта, которого лечат, и т.д. В некоторых вариантах реализации эффективное количество представляет собой такое количество, которое коррелирует с благоприятным результатом при введении в рамках определенного режима дозирования, например, при однократном введении или при серии введений, например, при "бустерной" схеме введения.
Термин "пептидная альфа-спираль" в данной заявке означает спиральный структурный мотив на основе последовательности пептида, содержащей множество повторов, также называемых спиральными повторами. Такая альфа-спираль способна связываться с другим партнером, также называемым соответствующей альфа-спиралью того же типа, с получением димера, тримера или другого олигомера, также называемого суперспиралью.
Суперспираль представляет собой структурный мотив в полипептидах или пептидах, в котором от двух до семи альфа-спиралей скручены друг с другом, как нити в канате. В некоторых вариантах реализации суперспираль указанной вакцины представляет собой суперспираль из двух скрученных друг с другом альфа-спиралей. Такие альфа-спиральные участки вероятно будут образовывать суперспиральные структуры, и могут участвовать в олигомеризации спиральных повторов, что можНВ измерить в подходящем анализе взаимодействия с образованием суперспирали.
В частности, димер альфа-спиралей можно получить путем осуществления контакта двух мономеров таким образом, что в результате взаимодействия двух альфа-спиралей с образованием суперскрученного домена образуется димер. В некоторых вариантах реализации спирали включают пептид с последовательностью аминокислот, представленной в SEQ ID NO: 1 или 2 (спираль и противоположно скрученная спираль), которая содержит х повторов.


В качестве альтернативы можно применять любую из последовательностей, описанных у Chao и др.33 или Litowsky и др.34, или их функциональных эквивалентов, которые образуют связь определенного суперспирального типа:

Для целей настоящего изобретения предпочтительный тип суперспирали представляет собой димер, либо гетеродимер (гетероспираль) двух различных, но сочетающихся с друг другом спиралей, которые отличаются по меньшей мере на одну. аминокислоту в последовательности спирального повтора, либо гомодимер двух идентичных соответствующих друг другу спиралей, т.е. содержащих совпадающие последовательности спирального повтора ("спирали").
Предпочтительное количество спиральных повторов составляет 3-5, предпочтительна любая из комбинаций количества повторов: 3+3, 3+4, 3+5, 4+4, 4+5, 5+5, 4+3, 5+3 или 5+4.
В качестве альтернативы гептадным повторам (повторам последовательности аминокислот, состоящей из 7 аминокислот, 7-мерам) можно применять 6-меры, 8-меры или 9-меры.
В случае гомодимерной суперспирали обычное количество спиральных повторов, в частности, составляет не более 5, чтобы избежать нежелательных несоответствий структуры. В случае гетеродимерной суперспирали обычно желательно использовать последовательность пептида такой длины, чтобы указанная последовательность содержала, по меньшей мере, 3 спирали. Таким образом, обычно добиваются связывания компонентов вакцины друг с другом, т.е. направленного адъюванта и иммуногенных компонентов, с предпочтительно высокой аффинностью с Kd меньшей, чем 10-7 М, более предпочтительно меньшей, чем 10-8 М или 10-9 М. Тем не менее, несмотря на то, что большее количество повторов повышает аффинность, в результате частота гомодимеризации может увеличиться.
Компоненты иммуногенной композиции согласно настоящему изобретению также могут включать пептидный спейсер для присоединения молекулы, направленной против CD32, и/или лиганда TLR9, и возможно также эпитопа (например, из пептидного иммуногена) со спиральными повторами, соответственно. Например, пептидный спейсер может быть на любом или на обоих концах суперспирали. Каждый из пептидных спейсеров может быть присоединен к одной альфа-спирали суперскрученного домена суперспирали.
Пептидный спейсер может представлять собой, например, пептид из по меньшей мере 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот или более, либо линейный, либо разветвленный, например, чтобы образовать две, три, четыре или более ветвей. Количество аминокислот в пептидном спейсере может составлять, в некоторых вариантах реализации, 20 аминокислот или больше или меньше на количество аминокислот, равное или меньшее 10, в зависимости от конкретных последовательностей и длины спирали.
Термин «направленная против CD32 молекула», ", в данной заявке должен означать лиганд, специфично связывающийся с целевым клеточным CD32, либо с CD32a, либо с CD32b, либо с обоими CD32a и CD32b. Указанная молекула может иметь любую связывающую структуру, например, полученную из белков, полипептидов или пептидов, включая антитела и фрагменты антител или комбинированные молекулы со связывающими частями. Связывающая часть молекул или молекулярного комплекса согласно настоящему изобретению может состоять из белков, таких как антитела или фрагменты антител, такие как Fab, Fv, димер VH/VL, scFv, доменное антитело (dAb), F(ab)2, миниантитело, небольшие мутированные домены иммуноглобулина, Fcab, МАТ2, или другие связывающие биологические молекулы, такие как растворимый рецептор Т-клеток, дарпины и т.д. Антитела и фрагменты и производные антител можно получить и подвергнуть селекции в зависимости от связывания с CD32 согласно известным способам, таким как гибридомная технология, клонирование В-клеток, фаговый дисплей, дрожжевой дисплей, рибосомный дисплей или дисплей библиотек антител на поверхности клеток, скрининг вариантов антител с использованием матриц («чипов»). Примерами молекул, направленных против CD32, являются scFv, полученные на основе моноклонального антитела к CD32 АТ-1035, IV.336, 2Е637 или любого другого моноклонального антитела к CD32.
Специфическое связывание можно определить с помощью подходящего способа анализа связывания, такого как обычные иммуноанализы.
Существует множество известных в данной области способов обнаружения связывания путем иммуноанализа. Можно применять различные иммуноанализы, известные в данной области, включая конкурентные и неконкурентные системы анализа с применением таких методик, как радиоиммунологические анализы, ELISA (твердофазный иммуноферментный анализ), иммунорадиометрические анализы, реакции диффузной преципитации в геле, иммунодиффузионные анализы, вестерн-блоттинг, BIAcore и т.д.
Термин "перекрестно реагирующий" по отношению к антигенам или антителам в данной заявке относится к эпитопам, общим у антигенов различного происхождения, например, человека, макака-резуса или мыши. Обнаружили, что N-концевой эпитоп, включающий или состоящий из первых 4 аа G17, является перекрестно реагирующим в пептидах различного происхождения, указанный эпитоп запускает иммунный ответ и продукцию IgG-антител, которые перекрестно реагируют с указанными эпитопами.
Иммуногенная композиция согласно настоящему изобретению, в частности, полезна для лечения гастринзависимых заболеваний или болезненных состояний, которые связаны с избытком гастрина, например, гастринзависимых опухолей или гастринзависимого рака, таких как рак поджелудочной железы, язва желудка, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), конечная стадия почечной недостаточности (ТСПН) или ожирение.
Термин "гастринзависимая опухоль" или "гастринзависимый рак" в данной заявке следует относить к опухолям или к связанным с ними заболеваниям или болезненным состояниям, например, к гастринзависимой колоректальной аденокарциноме и другим гастринзависимым ракам, таким как рак желудка, печени, поджелудочной железы и мелкоклеточная карцинома легких. Указанный термин, в частности, используют в данной заявке по отношению к лечению опухоли для предотвращения прогрессирования опухолевого заболевания, для положительного ответа опухоли на лечение или для уменьшения размеров опухоли. Данный термин также применяют по отношению к минимальным остаточным явлениям болезни, которые будут успешно лечить, например, путем нацеливания на циркулирующие опухолевые клетки, чтобы уменьшить их количество ниже некоторого порога, например, ниже предела обнаружения.
Язвенная болезнь желудка может быть вызвана повышенной секрецией желудочной кислоты и нарушением сложных механизмов защиты желудка, которые обычно защищают слизистую оболочку желудка от повреждения кислотой. Хотя этиологии двух указанных состояний различны, для обоих полезно уменьшение секреции желудочной кислоты. Желудочная кислота продуцируется специализированной клеткой желудка - обкладочной клеткой. Можно стимулировать ацетилхолином, гистамином и гастрином секрецию кислоты обкладочными клетками, путем связывания каждого из данных соединений со специфическими рецепторами на поверхности указанных клеток. Из данных соединений наиболее эффективным стимулятором секреции кислоты является пептидный гормон гастрин. Иммунотерапия, направленная против гастрина, описанная в данной заявке, снизит выраженность болезненных состояний, связанных с язвой желудка.
Термин "пептид гастрина-17", или "пептид G17", или "G17" в данной заявке следует относить к малому гастрину G17, который состоит из N-концевых 17 аминокислот гастрина. Пептид G17 может быть человеческого происхождения или может происходить из другого млекопитающего, включая макака-резуса или мышь, то есть иметь последовательность, полученную из человека или другого млекопитающего, или может представлять собой искусственную конструкцию, содержащую искусственнее последовательности, например, полученные путем изменения типа и/или последовательности аминокислотных остатков в нативной (встречающейся в природе) последовательности G17. Указанный термин, в частности, включает варианты G17 человека с последовательностью аминокислот, представленной в SEQ ID NO: 78, или ее фрагментами, но которые отличаются от последовательности пептида тем, что они получены из гомологичной последовательности отличного вида. Такие варианты называют встречающимися в природе вариантами или аналогами. Термин "аналоги" также относится к химерным конструкциям, происходящим из двух или более источников, при этом, по меньшей мере одна часть встречается в природе, например, которая составляет основную часть (по меньшей мере 50%) пептидного иммуногена, и другая часть, отличная от нее, либо встречается в природе, либо синтетическая (искусственная).
Термин, в частности, должен включать фрагменты или функционально активные варианты G17, например, варианты, содержащие одну или более точечных мутаций, или другие пептиды или полипептиды, содержащие дополнительные последовательности аминокислот, помимо G17, например, к N-концу и/или С-концу которых присоединены дополнительные один или более аминокислотных остатков или последовательностей. К С-концу, например, предпочтительно присоединены повторы последовательности G17, либо идентичные, либо нет, или дополнительные последовательности аминокислот гастрина.
Указанный термин, в частности, должен включать пептиды с одним или более модифицированными аминокислотными остатками. Обычные модификации включают фосфорилирование, метилирование, ацетилирование, амидирование, образование пирролидонкарбоновой кислоты, изомеризацию, гидроксилирование, сульфатирование, связывание флавина, окисление цистеина и нитрозилирование. Пример модификации, описанной в данной заявке, представляет собой модификацию N-концевой глутаминовой кислоты G17, т.е. пиро-Glu в положении 1, которая также известна как "пирролидонкарбоновая кислота (Glu)", или пGlu, или пЕ.
В данной заявке термин "функционально активные варианты" по отношению к пептидному иммуногену согласно настоящему изобретению обозначает последовательность, полученную в результате модификации данной последовательности (исходной последовательности), например, путем вставки, делеции или замены одной или более аминокислот, например, с помощью методик рекомбинации или получения химическим методом производных одного или более аминокислотных остатков в последовательности аминокислот, или нуклеотидов внутри кодирующей последовательности нуклеотидов, или на любом или обоих дистальных концах указанной последовательности, при этом данная модификация не влияет (в частности, не ухудшает) на активность данной последовательности. В случае пептидного иммуногена; вызывающего некоторый иммунный ответ на целевой гастрин, функционально активный вариант пептидного иммуногена все еще будет содержать антигенную детерминанту или эпитоп, хотя это может быть изменено, например, с целью повысить иммуногенность. В частности, функционально активные варианты пептидного иммуногена G17, или его фрагмента, такого как фрагмент G12 или G13, эффективно вызывают выработку IgG-антител против гастрина у получающего лечение субъекта, и данные антитела перекрестно реагируют с эндогенным гастрином субъекта.
Функционально активные варианты можно получить, например, путем изменения последовательности исходного пептида, например, пептида G17 человека, макака-резуса или мыши, или его фрагмента, например, пептида G12 или G13, путем введения одной или более модификаций, которые по существу не изменяют перекрестно реагирующие эпитопы, с получением молекулы с по существу такой же иммуногенностью. Термин "по существу такая же иммуногенность" в данной заявке относится к степени иммунного ответа или к количеству IgG-антител против гастрина, индуцированных у субъекта, которого лечат иммуногенной композицией, указанное количество составляет предпочтительно по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или даже по меньшей мере 100%, или по меньшей мере 110%, или по меньшей мере 120%, или по меньшей мере 130%, или по меньшей мере 140%, или по меньшей мере 150%, или по меньшей мере 160%, или по меньшей мере 170%, или по меньшей мере 180%, или по меньшей мере 190%, например, до 200% от количества, определенного для исходного пептида.
В предпочтительном варианте реализации функционально активный вариант исходного пептида:
a) получен из указанного пептида путем по меньшей мере одной замены, вставки (добавления) и/или делеции аминокислоты, например, содержит одну или более точечных мутаций, при этом последовательность функционально активного варианта до некоторой степени идентична последовательности исходной молекулы, например, последовательность идентична по меньшей мере на 50%, предпочтительно по меньшей мере на 60%, более предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 80%, еще более предпочтительно по меньшей мере на 90%; и/или
b) состоит из пептида и дополнительной по меньшей мере одной аминокислоты, гетерологичной по отношению к данному пептиду.
Функционально активные варианты можно получить путем внесения изменений в последовательность пептида, например, с помощью одной или более точечных мутаций, при этом указанные изменения в последовательности по существу сохраняют функцию неизмененной последовательности пептида, при применении согласно настоящему изобретению. Такие изменения в последовательности или точечные мутации могут включать, но не ограничены перечисленными, (консервативные) замены, добавления; делеции, мутации и вставки, например, изменения 1, 2, 3 или 4 аминокислот, или добавления или вставки от одной до нескольких аминокислот, например, 1, 2, 3 или 4 аминокислот, или получение химическим методом производных от одной до нескольких аминокислот, например, 1, 2, 3 или 4 аминокислот, или комбинацию перечисленных изменений, предпочтительно путем введения точечных мутаций, которые не контактируют. Замены в аминокислотных остатках могут представлять собой консервативные замены, например, замену одной гидрофобной аминокислоты на альтернативную гидрофобную аминокислоту.
Консервативные замены представляют собой такие замены, которые происходят в пределах семейства аминокислот, содержащих похожие боковые цепи и обладающих сходными химическими свойствами. Примерами таких семейств являются семейства аминокислот с основными боковыми цепями, с кислыми боковыми цепями, с неполярными алифатическими боковыми цепями, с неполярными ароматическими боковыми цепями, с незаряженными полярными боковыми цепями, с малыми боковыми цепями, с большими боковыми цепями и т.д.
Предпочтительные точечные мутации относятся к замене аминокислот с одинаковой полярностью и/или зарядом. В этом отношении, аминокислоты относятся к двадцати встречающимся в природе аминокислотам, кодируемым шестьюдесятью четырьмя триплетными кодонами. Данные 20 аминокислот можно разделить на аминокислоты с нейтральными зарядами, положительными зарядами и отрицательными зарядами.
"Нейтральные" аминокислоты представлены ниже с указанием соответствующего трехбуквенного и однобуквенного кода и полярности:
Алании: (Ala, А) неполярная, нейтральная;
Аспарагин: (Asn, N) полярная, нейтральная;
Цистеин: (Cys, С) неполярная, нейтральная;
Глутамин: (Gln, Q) полярная, нейтральная;
Глицин: (Gly, G) неполярная, нейтральная;
Изолейцин: (Ile, I) неполярная, нейтральная;
Лейцин: (Leu, L) неполярная, нейтральная;
Метионин: (Met, М) неполярная, нейтральная;
Фенилаланин: (Phe, F) неполярная, нейтральная;
Пролин: (Pro, Р) неполярная, нейтральная;
Серин: (Ser, S) полярная, нейтральная;
Треонин: (Thr, Т) полярная, нейтральная;
Триптофан: (Trp, W) неполярная, нейтральная;
Тирозин: (Tyr, Y) полярная, нейтральная;
Валин: (Val, V) неполярная, нейтральная; и
Гистидин: (His, Н) полярная, слабо положительная (положительная 10%, нейтральная 90%).
"Положительно" заряженные аминокислоты представляют собой:
Аргинин: (Arg, R) полярная, положительная; и
Лизин: (Lys, K) полярная, положительная.
"Отрицательно" заряженные аминокислоты представляют собой:
Аспарагиновую кислоту: (Asp, D) полярная, отрицательная; и
Глутаминовую кислоту: (Glu, Е) полярная, отрицательная.
"Процент (%) идентичности последовательностей аминокислот" по отношению к последовательностям пептидов, описанным в данной заявке, определяют как процент аминокислотных остатков в анализируемой последовательности, которые идентичны аминокислотным остаткам в определенной последовательности пептида после выравнивания указанной последовательности и введения разрывов (гэпов) при необходимости для достижения максимального процента идентичности последовательностей, без учета вклада любых консервативных замен в идентичность последовательностей. Специалисты в данной области могут определить подходящие параметры для построения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
Функционально активные варианты можно получить с помощью любых из известных способов мутагенеза, включая точечные мутации в желательных положениях, например, полученные с помощью методик рандомизации. В некоторых случаях положения выбирают произвольно, например, либо с любой из возможных аминокислот, либо для рандомизации последовательности пептида выбирают предпочтительные аминокислоты. В этом отношении, термин "мутагенез" относится к любой известной в данной области методике изменения полинуклеотидной или полипептидной последовательности.
Термин "иммуноген" в данной заявке должен означать один или более антигенов, запускающих иммунный ответ у субъекта. Термин "антиген" в данной заявке, в частности, должен относиться к любой антигенной детерминанте, которая потенциально может распознаваться сайтом связывания антитела или способна связываться с бороздкой пептида молекул HLA I класса или II класса, и, следовательно, может стимулировать определенные Т-клетки. Целевой антиген распознается либо как целая целевая молекула, либо как фрагмент такой молекулы, особенно подструктуры, например, как полипептидные или углеводные структуры мишеней, как правило называемые "эпитопами" (например, В-клеточными эпитопами, Т-клеточными эпитопами), которые иммунологически значимы, т.е. также могут распознаваться природными или моноклональными антителами. В данной заявке применение Т-клеточных эпитопов является предпочтительным, например, для получения вакцин для применения при аллергии.
Термин "пептидный иммуноген" в данной заявке обозначает антиген или иммуноген с пептидной структурой, в частности, иммуноген, который включает или состоит из пептида с определенной последовательностью аминокислот, который предусмотрен либо в виде линейного пептида, либо в виде разветвленного пептида, содержащего встречающиеся в природе аминокислотные остатки или модифицированные остатки, например, в виде производного, полученного путем модификации или путем получения производных химическим методом, например, путем фосфорилирования, метилирования, ацетилирования, амидирования, образования пирролидонкарбоновой кислоты, изомеризации, гидроксилирования, сульфатирования, связывания флавина, окисления цистеина и нитрозилирования.
Указанный пептидный иммуноген, в частности, разработан таким образом, чтобы запускать иммунный ответ у субъекта, и, в частности, содержит одну или более антигенных детерминант, которые возможно могут распознаваться сайтом связывания антитела или способны связываться с бороздкой пептида молекул HLA I класса или II класса или других антигенпрезентирующих молекул, таких как CD1, и, следовательно, могут стимулировать специфические Т-клетки. Целевой антиген распознается либо как целая целевая молекула, либо как фрагмент такой молекулы, особенно как подструктуры, например, как полипептидные или углеводные структуры мишеней, как правило называемые "эпитопами", например, В-клеточными эпитопами, Т-клеточными эпитопами, которые иммунологически значимы, т.е. также могут быть распознаны природными или моноклональными антителами. В данной заявке применение В-клеточных эпитопов является предпочтительным для получения, например, вакцин для применения при онкологических заболеваниях.
В данной заявке термин "эпитоп" согласно настоящему изобретению, в частности, относится к молекулярной структуре, которая может полностью представлять собой партнера по специфическому связыванию или быть его частью с сайтом связывания модульного антитела согласно настоящему изобретению. Термин эпитоп также может относиться к гаптенам. Химически эпитоп может состоять из любого углевода, пептида, жирной кислоты, органического, биохимического или неорганического вещества или его производных, и любой комбинации перечисленных веществ. Если эпитоп представляет собой полипептид, он будет, как правило, содержать по меньшей мере 3 аминокислоты, предпочтительно по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 аминокислот. Не существует критического верхнего предела длины пептида, который может включать едва ли не всю длину полипептидной последовательности белка. Эпитопы могут быть либо линейными, либо конформационными. Линейный эпитоп состоит из одного фрагмента первичной последовательности полипептидной или углеводной цепи. Линейные эпитопы могут быть непрерывными или перекрывающимися. Конформационные эпитопы состоят из аминокислот или углеводов, сближенных в результате фолдинга полипептида с образованием третичной структуры, и указанные аминокислоты не обязательно расположены рядом друг с другом в линейной последовательности. В частности, эпитопы представляют собой по меньшей мере часть диагностически значимых молекул, т.е. отсутствие или присутствие эпитопа в образце качественно или количественно коррелирует либо с заболеванием, либо с состоянием здоровья пациента, либо со статусом процесса производства, либо с экологическим и пищевым статусом. Эпитопы также могут представлять собой по меньшей мере часть терапевтически значимых молекул, т.е. молекул, на которые можно нацелить специфично связывающий домен, что приводит к изменению течения заболевания.
Согласно настоящему изобретению можно применять один или более эпитопов одного и того же антигена или различных антигенов, которые могут включать антигены из всех собственных антигенов, патогенов, аллергенов или аутоантигенов, для которых желательно осуществить регуляцию иммунного ответа, например, против которых желательно вызвать у хозяина достоверный ответ Th1-типа или ответ Treg (в зависимости от типа вакцины).
При раковом заболевании желателен иммунный ответ на собственный антиген. Термин "собственный антиген" в данной заявке означает любой антиген, в частности, полипептид или пептид, продуцированный нормальным здоровым субъектом, при этом указанная молекула сама по себе не вызывает иммунный ответ. Данные собственные антигены могут продуцироваться на аномальных или высоких уровнях при некоторых болезненных состояниях, включая раковое заболевание, их также называют опухолевые специфические антигены (ТАА). В данной заявке гастрин человека или G17 человека понимают как собственный антиген у людей и, в частности, как ТАА у субъектов, страдающих от гастринзависимой опухоли. Собственные антигены, которые связаны с аутоиммунным заболеванием, описанным в данной заявке, называют аутоантигенами.
Должно быть очевидно, что собственные антигены могут существовать в природе, или их можно получить рекомбинантным или синтетическим путем. Также должно быть очевидно, что собственные антигены не обязательно должны быть идентичны продуцируемому в природе антигену, но, скорее, могут содержать вариации, и их последовательности могут быть в некоторой степени идентичны, сходны или гомологичны.
Выбор собственного антигена для применения при терапии рака зависит от типа й стадии ракового заболевания и, в частности, от паттерна экспрессии у раковой клетки, такой как клетка, полученная из опухоли или метастазов. Конкретные примеры выбранных опухолевых специфических антигенов, которые возможно применяют в вакцине согласно настоящему изобретению, представляют собой молекулу адгезии эпителиальных клеток (ЕрСАМ), LeY антиген, альфафетопротеин (АФП) и карциноэмбриональный антиген (СЕА), HER2/Neu, MUC-1 и т.д.
Выбор аутоантигена для применения для терапии аутоиммунных заболеваний зависит от типа аутоиммунного заболевания. Конкретные примеры выбранных антигенов, ассоциированных с аутоиммунным заболеванием, которые возможно применяют в вакцине согласно настоящему изобретению, представляют собой C1q, ADAMTS13, десмоглеин 3, кератин, ганглиозиды (например, GM1, GD1a, GQ1b), коллаген IV типа, IgM, кардиолипин, аннексии А5 и т.д.
В некоторых вариантах реализации иммуноген включает один или более определенных аллергенов. "Аллерген" представляет собой антиген, который может вызывать состояние гиперчувствительности или который может провоцировать реакцию гиперчувствительности немедленного типа у субъекта, который уже сенсибилизирован аллергеном. Аллергены обычно представляют собой белки или химические вещества, связанные с белками, которые обладают способностью вызывать аллергию. Тем не менее, аллергены также могут включать органические или неорганические материалы, полученные из множества синтетических или природных источников, такие как растительные материалы, металлы, ингредиенты косметики, или детергенты, латексы, или тому подобные материалы.
Выбор аллергена для применения в противоаллергической терапии зависит от типа и тяжести аллергии. Конкретные примеры выбранных ассоциированных с аллергией антигенов, которые возможно применяют в вакцине согласно настоящему изобретению, представляют собой любой аллерген, обычно применяемый в качестве иммуногена, в частности, аллергены клещей домашней пыли (например, Der р1, Der р2, Der р3-Der p23, Der f1, Der f2, Derf3 - Der f23), аллергены кошачьей перхоти, пыльца травы или деревьев, аллергены тараканов и т.д.
Выбор антигена, специфично вызывающего иммунный ответ на патоген, для применения для профилактики или терапии инфекционных заболеваний зависит от типа патогена, например, от того, является ли инфекционный агент микробным или вирусным. Конкретные примеры выбранных полученных из патогена антигенов, которые возможно применяют в вакцине согласно настоящему изобретению, представляют собой антигены гепатита В, гепатита С, холеры, ВИЧ, коклюша, гриппа, брюшного тифа и т.д.
Пептидный иммуноген или иммуногенная композиция, применяемая в вакцине согласно настоящему изобретению, обычно входит в состав вакцины в эффективном количестве, которое в данной заявке, в частности, понимают как "иммунологически эффективное количество". Под "иммунологически эффективным количеством" подразумевают, что введение такого количества субъекту, либо в однократной дозе, либо в виде одной дозы из серии доз, эффективно с учетом терапевтических или профилактических целей. Данное количество будет изменяться в зависимости от состояния здоровья и физического состояния субъекта, которого лечат, от возраста, способности иммунной системы субъекта синтезировать антитела, желательной степени иммунного ответа, лекарственной формы вакцины и других условий.
Согласно настоящему изобретению также предложен способ лечения субъекта или индукции иммунного ответа у субъекта, включающий этап введения иммунологически эффективного количества пептидного иммуногена, иммуногенной композиции или вакцины согласно настоящему изобретению.
Эффективное количество или дозировка может находиться в диапазоне от 0,0001 до 2 мг, например, от 0,001 до 2 мг иммуногенной композиции, которую вводят нуждающемуся в этом субъекту, например, взрослому человеку. Эффективная дозировка иммуногенной композиции способна вызвать иммунный ответ у пациента с эффективными уровнями титров антител, чтобы связать и нейтрализовать эндогенный зрелый G17 и предшественник G17, например, в течение 1-3 месяцев после иммунизации. Эффективность указанной терапии можно оценить по титрам антител к гастрину в образцах крови, взятых у субъекта.
Термин "лиганд TLR9" в данной заявке понимают следующим образом.
Toll-подобный рецептор 9 (TLR9) распознает бактериальную ДНК с неметилированными CpG и инициирует каскад передачи сигналов, приводящий к продукции провоспалительных цитокинов. Существует множество структур или последовательностей, которые, как было показано, выступают в качестве лиганда TLR9, т.е. связываются с данным рецептором и, таким образом, либо активируют TLR9 (стимулируют, активируют; агонист TLR9), либо дезактивируют TLR9 (ингибируют; антагонист TLR9). Например, микробная ДНК или синтетическая ДНК, например, синтетические CpG-ОДН, могут стимулировать TLR9 с вариациями в количестве и местонахождении димеров CpG, а также в точных последовательностях оснований, фланкирующих димеры CpG. Синтетические CpG-ОДН отличаются от микробной ДНК тем, что их каркасы частично или полностью соединены фосфотиоатными связями вместо обычных фосфодиэфирных связей, и что они могут не содержать или могут содержать поли-G хвост на 3'-конце, 5'-конце или на обоих концах.
В данной заявке термин "агонист" по отношению к лиганду TLR9, в частности, должен относиться к связыванию и активации TLR9 в клеточном анализе.
Лиганд TLR9, который состоит из последовательности нуклеотидов, обычно соединен с направленным адъювантом, компонентом описанной иммуногенной композиции, путем химического связывания, например, с применением доступного для приобретения набора от Solulink. Пептидный лиганд TLR9 можно присоединить, применяя стандартную пептидную химию, или можно интегрировать, применяя технологию рекомбинантных ДНК.
Примеры лигандов TLR9 представляют собой ОДН 221638 (группа 1), ОДН 2006/ОДН 200739 (группа 2) и CpG-M36240 (группа 3).
Дополнительные примеры лигандов TLR9 могут представлять собой пептиды, которые имитируют действие CpG-агониста TLR9, например, обнаруженные с помощью библиотеки пептидов или полученные из нее, которые выбирают из библиотеки по аффинности связывания с TLR9 и доказанной агонистической активности; или белковые лиганды, включая специфические антитела.
Конкретные лиганды TLR9 представляют собой иммуностимулирующие пептиды, например, которые имитируют любой из классов CpG, такие как пептиды, выбранные из подходящей пептидной библиотеки. Примеры иммуностимулирующих пептидов выбраны из группы, состоящей из ESWDKFLSHYLP (SEQ ID NO: 50), TDWSWFY (SEQ ID NO: 51), YPVYWPW (SEQ ID NO: 52), EWWFYWP (SEQ ID NO: 53), WFPIEWW (SEQ ID NO: 54), DQVDIGY (SEQ ID NO: 55), THQVYIS (SEQ ID NO: 56), WFPIEWWFYWP (SEQ ID NO: 57), DSWQAFLTKFVL (SEQ ID NO: 58), HDIQWFWQHWNS (SEQ ID NO: 59), WSWWDHTFNYML (SEQ ID NO: 60), TTQQTWNVRYPY (SEQ ID NO: 61), DHTMPWTRNAKN (SEQ ID NO: 62), SWDPYWPFPWFS (SEQ ID NO: 63), AIYYVPSPMFTV (SEQ ID NO: 64), ETTLLKMWLAQM (SEQ ID NO: 65), YPWLDVAWSLY (SEQ ID NO: 66), VPGWHYLATLRA (SEQ ID NO: 67) и FDPLGSRDIKGS (SEQ ID NO: 68), и функционально активных вариантов указанных пептидов, которые представляют собой их фрагменты, мутанты или гибриды.
В частности, функционально активный вариант стимулирует пДК, вызывая тем самым повышение уровней IL-6 и TNF-альфа по сравнению с отрицательным контролем.
В частности, функционально активный вариант:
а) гомологичен по меньшей мере на 60% любому из пептидов с последовательностью SEQ ID NO: 50-68;
b) представляет собой мутантную форму любого из пептидов с последовательностью SEQ ID NO: 50-68, который можно получить путем модификации исходной последовательности аминокислот путем вставки, делеции или замены одной или более аминокислот в указанной последовательности или в любом или обоих дистальных концах последовательности; или
c) представляет собой фрагмент любого из пептидов с последовательностью SEQ ID NO: 50-68, содержащий по меньшей мере 5 аминокислот.
Конкретные иммуностимулирующие пептиды содержат мотив, выбранный из группы, состоящей из EWWFYWP (SEQ ID NO: 53), EWW (SEQ ID NO: 125), WFY (SEQ ID NO: 126), YWP (SEQ ID NO: 127) и QVxI, где x представляет собой любую аминокислоту (SEQ ID NO: 128).
Функцию лиганда, или агониста, или антагониста TLR9 можно определить с помощью подходящего способа анализа, например, следующим способом: пДК выделяют из крови здорового донора, как описано у Tel и др.41, а затем инкубируют с подходящими концентрациями лиганда TLR9. Через 24 ч измеряют концентрацию IFN-альфа в супернатанте, применяя стандартные протоколы ELISA. Для определения статуса созревания клеток пДК окрашивают, доступными для приобретения специфичными антителами до и после инкубации с лигандом TLR9, чтобы визуализировать экспрессию CD80, CD83 или CD86, применяя стандартные процедуры FACS.
Количество реактивных Т-клеток, которые активируются при воздействии вакцины согласно настоящему изобретению, можно определить с помощью множества способов, включая анализ ELISPOT, анализ FACS, анализ высвобождения цитокинов или анализ пролиферации Т-клеток.
В данной заявке, термин "специфичность" или "специфическое связывание" относится к реакции связывания, которая позволяет определить родственный интересующий лиганд в гетерогенной популяции молекул. Таким образом, при обозначенных условиях (например, условиях иммуноанализа) один или более антигенов специфично связываются соответствующим сайтом(ами) связывания связывающей молекулы, которая не связывается в существенных количествах с другими молекулами, присутствующими в образце. Специфическое связывание означает, что связывание селективно в отношении идентичности мишени, высокой, средней или низкой аффинности или авидности связывания, в зависимости от предпочтения. Селективное связывание обычно достигается, если константа связывания или динамика связывания различаются по меньшей мере в 10 раз, предпочтительно, различие составляет по меньшей мере в 100 раз, и более предпочтительно, по меньшей мере в 1000 раз. Должно быть очевидно, что указанный термин также должен относиться к перекрестно реагирующим или мультиспецифическим связывающим молекулам, которые специфически распознают один или более различных антигенов.
Термин "лечение" в данной заявке всегда должен относиться к лечению субъектов с профилактическими (т.е. для предотвращения инфекции и/или заболевания) или терапевтическими (т.е. для лечения заболеваний, независимо от их патогенеза) целями. Лечение субъекта, как правило, будет терапевтическим в случаях аллергических, аутоиммунных или раковых болезненных состояний, или профилактическим при лечении инфекционных болезненных состояний. Лечение субъекта, как правило, будет терапевтическим в случаях раковых болезненных состояний, включая гастринзависимые опухоли или гастринзависимый рак. Тем не менее, в случае пациентов, страдающих от первичного заболевания, которые находятся в группе риска прогрессирования заболевания или риска развития вторичного болезненного состояния или побочной реакции, например, например, зависимых от эндогенной продукции гастрина или влияния гастрина, лечение может быть профилактическим.
Также в случае пациентов с аллергией, находящихся в группе риска развития указанного заболевания, например, пациентов, имеющих семейный анамнез аллергии, лечение может быть профилактическим.
Такое лечение можно осуществлять с помощью вакцины согласно настоящему изобретению в качестве единственного профилактического или терапевтического агента или же в комбинации с любыми подходящими средствами, например, включая химиотерапию или применение антацидов.
Термин "комбинация", используемый в этом отношении, например, по отношению к комбинации соединений или способов лечения, в частности, относится к сопутствующему, одновременному, параллельному или последовательному лечению субъекта.
Следующие конкретные аллергические заболевания лечат согласно настоящему изобретению: аллергический риноконъюнктивит (сенную лихорадку), аллергическую астму, аллергическую экзему, такую как атопическая экзема или атопический дерматит.
Для терапии аллергии конкретные дополнительные терапевтические меры включают применение кортикостероидов (ингалируемых) в комбинации с бронхолитическими средствами (при аллергической астме), содержащих стероиды кремов (при атопической экземе) и при более легких формах аллергии (например, при сенной лихорадке) антигистаминов и специфической иммунотерапии.
Аллергия, при которой поляризованные Th2-ответы, обильная секреция IL-4/IL-13 и ответ IgE-антител недопустимы и опасны, является лишь примером неправильного иммунного ответа. Для других примеров характерны Th1-опосредованные состояния, связанные с системными аутоиммунными заболеваниями.
Лечение аутоиммунных заболеваний вакциной согласно настоящему изобретению, в частности, может относиться, наряду с другими примерами, к лечению диабета, синдрома Гийена-Барре, системной красной волчанки, рассеянного склероза или тромбоцитопении.
Профилактика или терапия инфекционных заболеваний с применением вакцины согласно настоящему изобретению, в частности, относится к профилактике или терапии таких патологических состояний, как микробные инфекции, т.е. состояния, вызванные бактериальными, вирусными, грибковыми патогенами, патогенами простейших или гельминтов. Для целей настоящего изобретения термин "патоген" применяют в широком смысле, и он относится к определенному агенту, вызывающему заболевание или состояние, и включает любой агент, который вызывает иммунный ответ. Патогены включают вирусы, бактерии, грибы, простейшие, паразиты и тому подобные патогены. Обычно, иммуноген получают из одного или более пептидных, полипептидных, белковых или углеводных антигенов, продуцируемых патогеном. Способы определения подходящих антигенов, получения и создания таких молекул хорошо известны в данной области.
Лечение инфекционных заболеваний, вызванных патогенами, в частности, относится, например, к лечению гепатита В, гепатита С, холеры, ВИЧ, коклюша, гриппа или брюшного тифа.
Иммунотерапевтические способы лечения опухоли, описанные в данной заявке, в частности, относятся к способам и вакцинам согласно настоящему изобретению для лечения рака шейки матки, рака груди, колоректального рака, рака предстательной железы, рака легких и меланомы.
При терапии рака дополнительные способы лечения включают, например, хирургическое иссечение, лучевую терапию, химиотерапию, гормональную терапию, противоопухолевые вакцины, методы лечения на основе антител, тотальное облучение организма, трансплантацию костного мозга, трансплантацию стволовых клеток периферической крови и введение химиотерапевтических агентов.
Для лечения иммуногенную композицию или вакцину согласно настоящему изобретению можно вводить за один раз или разделить на отдельные компоненты и/или множество меньших доз для введения через некоторые промежутки времени. Вакцину обычно вводят при концентрации от 0,1 до 500 мкг/мл, например, любым из перечисленных путей: подкожно, внутрикожно, внутримышечно, внутривенно, перорально, путем ингаляции или интраназально, совместно с дополнительным адъювантом, таким как квасцы, или без него. Должно быть очевидно, что точная дозировка и продолжительность лечения зависит от заболевания, от которого лечат, и их можно определить опытным путем, применяя известные протоколы тестирования, или путем экстраполяции результатов исследования in vivo или in vitro.
Иммуногенную композицию или вакцину согласно настоящему изобретению можно вводить с помощью любых подходящих средств и соответствующих лекарственных форм, включая, но не ограничиваясь перечисленными, например, парентеральную (включая подкожную, внутримышечную, внутривенную и внутрикожную) инъекцию или местную инъекцию в пораженный участок, такой как суставы, или внутрь опухоли или вблизи от опухоли. В предпочтительном варианте реализации указанная вакцина предусмотрена в лекарственной форме для внутримышечной, подкожной или внутрикожной инъекции.
Согласно настоящему изобретению также предложено устройство доставки, например, шприц, предварительно наполненный вакциной согласно настоящему изобретению.
Обычно после примирования субъекта первой инъекцией вакцины согласно настоящему изобретению, можно осуществить одну или более вторичную инъекцию через некоторый период времени тем же или другими путями введения. Если применяют несколько инъекций, то последующие инъекции можно осуществить, например, в пределах от 1 до 52 недель с момента предыдущей инъекции или даже большего времени.
Указанная вакцина, как правило, может содержать разбавители, такие как вода, солевой раствор, глицерин, этанол и т.д. Кроме того, в качестве вспомогательных веществ могут присутствовать такие вспомогательные вещества, как смачивающие или эмульгирующие агенты, буферные агенты для поддержания рН и тому подобные вещества. Обычно, вакцину согласно настоящему изобретению получают в лекарственной форме для инъекций, либо в виде жидких растворов или суспензий, либо в твердых формах, подходящих для растворения или суспендирования в жидких средах перед введением. Указанные композиции также можно эмульгировать или заключить в липосомы.
Введение вакцины согласно настоящему изобретению можно подходящим образом дополнительно объединить с любым из агонистов или антагонистов TLR9 и/или дополнительным адъювантом, чтобы усилить иммунорегуляторный эффект или иммунный ответ. Усиление иммунного ответа может включать усиление одного или более из следующих ответов: иммунного ответа Th1, иммунного ответа Th2, иммунного ответа Th17 или иммунного ответа Treg.
Усиление иммунного ответа Th1 может включать повышение концентрации одного или более из цитокинов, связанных с иммунным ответом Th1 (таких как IFN-гамма), и увеличение количества активированных макрофагов.
Усиление иммунного ответа Th1 может включать повышение концентрации одного или более из антигенспецифических IgG-антител, особенно IgG1 антител.
Например, иммуногенная композиция или вакцина согласно настоящему изобретению может быть объединена (например, химически или рекомбинантно присоединена, связана путем аффинного связывания или смешана с отдельными компонентами) с одним или более адъювантами и/или фармацевтически приемлемыми вспомогательными веществами. Вакцина согласно настоящему изобретению может содержать одно или более фармацевтически приемлемых вспомогательных веществ или носителей, таких как вода, солевой раствор, глицерин, этанол и т.д. Кроме того, в таких носителях могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, буферные агенты для поддержания pH и тому подобные вещества. Адъюванты, в частности, можно применять для повышения эффективности вакцины. Адъюванты можно добавить непосредственно в композиции вакцин или можно вводить отдельно, либо одновременно, либо сразу после введения вакцины.
Подходящие адъюванты включают цитокины и аналогичные соединения, которые помогают координировать иммунный ответ на иммуноген. В данной заявке термин "цитокин" применяют как родовое название для разнообразной группы растворимых белков и пептидов, которые действуют как гуморальные регуляторы при нано- и пикомолярных концентрациях и которые, либо при нормальных, либо при патологических состояниях модулируют функциональные активности отдельных клеток и тканей. Данные белки также опосредуют непосредственные взаимодействия между клетками и регулируют процессы, происходящие во внеклеточной среде.
Примеры цитокинов включают IL-1, IL-4, TNF-альфа, IFN-альфа, INF-гамма, GM-CSF, G-CSF.
Олигонуклеотиды CpG также можно применять в качестве адъюванта в совокупности с презентацией соответствующих эпитопов. Другие адъюванты включают квасцы, (не)полный адъювант Фрейнда, B. pertussis или его токсин, IC31, и т.д.
Компоненты иммуногенной композиции, т.е. компонент направленного адъюванта, например, молекулу, направленную против CD32, соединенную с лигандом TLR9 и первой пептидной альфа-спиралью, и иммуногенный компонент, например, включающий пептидный иммуноген, соединенный со второй пептидной альфа-спиралью, которая подходит к первой спирали, а также иммуногенную композицию или вакцину, или любую из ее связывающих молекул или лигандов и иммуноген со спиральными повторами или без них можно получить с помощью различных способов, известных в данной области, например, путем очистки или выделения из культуры клеток, с помощью рекомбинантного способа или путем химического синтеза.
Согласно конкретному варианту реализации иммуногенную композицию, и/или компонент направленного адъюванта, и/или ее иммуногенный компонент получают в виде рекомбинантного полипептида, например, с помощью технологии рекомбинантных ДНК. В данной заявке термин "рекомбинантный" относится к молекуле или конструкции, которая не встречается в природе в клетке-хозяине. В некоторых вариантах реализации рекомбинантные молекулы нуклеиновой кислоты содержат две или более встречающихся в природе последовательностей, которые соединены таким способом, который не встречается в природе. Рекомбинантный белок относится к белку, который кодируется и/или экспрессируется с рекомбинантной нуклеиновой кислоты. В некоторых вариантах реализации "рекомбинантные клетки" экспрессируют гены, которые не обнаруживают в идентичной форме внутри нативной формы (т.е., не рекомбинантной) данной клетки, и/или экспрессируют нативные гены, экспрессия которых аномально высока, аномально низка и/или вообще отсутствует благодаря преднамеренному вмешательству человека. Рекомбинантные клетки содержат по меньшей мере один рекомбинантный полинуклеотид или полипептид. "Рекомбинация", "рекомбинирование" и получение "рекомбинантной" нуклеиновой кислоты, как правило, включает соединение по меньшей мере двух фрагментов нуклеиновых кислот. В некоторых вариантах реализации рекомбинантные белки и рекомбинантные нуклеиновые кислоты остаются функциональными, т.е. сохраняют свою активность или проявляют повышенную активность в клетке-хозяине.
Таким образом, настоящее изобретение дополнительно относится к получению иммуногенной композиции или ее компонентов, и к рекомбинантным средствам для такого получения, включая нуклеиновую кислоту, кодирующую последовательность аминокислот, кассету экспрессии, вектор или плазмиду, содержащую нуклеиновую кислоту, кодирующую последовательность аминокислот, которую нужно экспрессировать, и клетку-хозяин, содержащую любые такие средства. Подходящие стандартные технологии рекомбинантных ДНК известны в данной области и описаны, среди прочего, у Sambrook и др., "Molecular Cloning: A Laboratory Manual" (1989), 2ое издание (Cold Spring Harbor Laboratory press).
Термин "сенсибилизирущая вакцина" в данной заявке понимают следующим образом. Субъекта можно подвергнуть специфической сенсибилизации к компонентам вакцины, не включающим иммуноген, чтобы вызвать специфический гуморальный иммунный ответ. Согласно настоящему изобретению субъекта, например, сенсибилизируют введением сенсибилизирущей вакцины согласно настоящему изобретению, которая содержит направленный адъювант и пептидную альфа-спираль, предпочтительно суперспираль или двойную спираль, чтобы стабилизировать молекулу. Таким образом, иммуноген, применяемый в иммунорегуляторной вакцине согласно настоящему изобретению, в частности, не применяется в такой сенсибилизирущей вакцине. После введения такой сенсибилизирущей вакцины субъекту у указанного субъекта может развиться иммунный ответ на эпитопы сенсибилизирущей вакцины. Дополнительное введение тому же субъекту иммунорегуляторной вакцины согласно настоящему изобретению затем вызовет специфический иммунный ответ на иммуноген, который необходим для лечения или предупреждения заболевания. Благодаря сенсибилизации потенциально опасная существующая иммунологическая память к компонентам иммуногена, например, в случае пациентов с аллергией, не вызовет нежелательные иммунные реакции против тех компонентов вакцины, с которыми указанный пациент не встречался до иммунизации.
В данной заявке следует понимать, что термин "субъект" включает человека или млекопитающих, включая сельскохозяйственных животных, домашних животных и лабораторных животных, в частности, людей, которые представляют собой либо пациентов, страдающих от конкретного болезненного состояния, либо здоровых субъектов.
Согласно настоящему изобретению дополнительно предложен набор компонентов для получения иммуногенной композиции согласно настоящему изобретению, например, фармацевтический набор, содержащий один или более контейнеров, наполненных указанными компонентами. Указанные наборы можно применять в описанных выше способах. В некотором варианте реализации набор дополнительно содержит инструкции по применению компонентов иммуногенной композиции или готовой иммуногенной композиции или вакцины согласно настоящему изобретению.
Компоненты вакцины, т.е. компонент направленного адъюванта и иммуногенный компонент, а также вакцину или любую из ее связывающих молекул или лигандов, и иммуноген со спиральными повторами или без них можно получить с помощью различных способов, известных в данной области, например, путем очистки или выделения из культуры клеток, с помощью рекомбинантного способа или путем химического синтеза.
Следовательно, согласно настоящему изобретению предложена уникальная вакцина и соответствующие применения.
Согласно конкретному примеру вакцина согласно настоящему изобретению содержит рекомбинантный полипептид с последовательностью

На N-конце подчеркнута: последовательность ScFv, специфично связывающего CD32a;
Курсив: линкер; можно применять любой альтернативный линкер, широко применяемый в композициях scFv.
Жирный шрифт: метка StrepTag II для очистки, можно применять любую альтернативную метку, например, метку flag или гистидиновую (HIS) метку.
На С-конце подчеркнута двойной чертой: альфа-спираль с гептадным повтором (рерЕ) для получения суперспирали с противоположной альфа-спиралью с гептадным повтором в иммуногене (pepK).
В данном примере (SEQ ID NO: 19) используется 5 повторов; большее количество повторов может вызывать самоагрегацию, а меньшее количество повторов может снижать аффинность. Предпочтительное минимальное функциональное количество повторов, используемых для спиралей, составляет 3, и предпочтительное максимальное функциональное количество составляет 542-44, но возможно большее количество повторов в зависимости от используемого типа альфа-спирали. Ограничивающим будет то количество повторов, которое начнет вызывать гомодимеризацию. Таким образом, гомодимеризация специально исключена.
Сходные полипептиды могут содержать сигнальную (лидерную) последовательность, последовательность аминокислот специфической молекулы, направленной против CD32, которая, например, представляет собой рекомбинантный scFv, линкер, метку для очистки и последовательность пептидной альфа-спирали рерЕ. Данную конструкцию с лигандом TLR9 или без него также называют "боеголовкой", которую затем можно применять для конструирования вакцины путем комбинирования с иммуногеном, соединенным с противоположной альфа-спиралью pepK.
Согласно другому конкретному примеру молекула, направленная против CD32, представляет собой пептид, направленный против CD32, с последовательностью SEQ ID NO: 20: ADGAWAWVWLTETAVGAA45, применяемый в качестве альтернативы ScFv.
Согласно дополнительному примеру получают иммуноген, содержащий аллерген, содержащий спираль, такой как Т-клеточные эпитопы Der Р1 и Der Р2. Пептидная альфа-спираль подходящим образом соединена с иммуногеном посредством линкера, чтобы обеспечить гибкость.
Согласно дополнительному примеру получают стабильную суперспираль между «боеголовки» scFv и указанным иммуногеном.
Согласно другому примеру получают иммуноген, содержащий спираль, который содержит приблизительно 29 различных Т-клеточных эпитопов аллергена.
В дополнительном примере можно показать, что указанная «боеголовка» опосредовала повышенную презентацию антигена. Т-клетки были эффективно стимулированы, когда иммуноген со спиралью (спиралью pepK) взаимодействовал с «боеголовкой», содержащей противоположную спираль (спираль рерЕ).
В дополнительном примере доказали, что агонист TLR9 - CpG - опосредовал активацию аутоиммунных реактивных Т-клеток.
В еще одном примере описано лечение аллергии с применением «боеголовки», в которой применяют либо scFv, направленный против CD32, либо пептид, направленный против CD32, соединенный посредством суперспирали с аллерген-специфическим иммуногеном.
Согласно дополнительному примеру получают стабильную суперспираль между «боеголовкой» scFv и указанным иммуногеном.
Доказали, что РВМС можно эффективно стимулировать таким иммуногеном или вакциной.
В дополнительном примере можно показать, что такая «боеголовка» опосредует улучшенную презентацию антигена. Т-клетки эффективно стимулировались, когда иммуноген со спиралью (спиралью pepK) взаимодействовал с «боеголовкой», содержащей противоположную спираль (спираль рерЕ).
В дополнительных примерах описано лечение рака поджелудочной железы у мыши и у макака-резуса в качестве моделей с применение «боеголовки», в которой применяется либо scFv, направленный против CD32, либо пептид, направленный против CD32, соединенный посредством суперспирали с пептидным иммуногеном G13. Описано снижение аппетита и контроль аппетита в модели у макака-резуса.
Следовательно, согласно настоящему изобретению предложена уникальная иммуногенная композиция и вакцина и соответствующие применения.
Более полному пониманию предшествующего описания будут способствовать следующие примеры. Такие примеры, тем не менее, представляют собой лишь типичные способы осуществления одного или более вариантов реализации настоящего изобретения, и их не следует воспринимать, как ограничивающие объем настоящего изобретения.
ПРИМЕРЫ
Пример 1. Спираль, содержащая «боеголовку» ScFV.

АК 1-19: сигнальная (лидерная) последовательность (для секреции продукта).
АК 20-271: последовательность ScFV (домен VH подчеркнут, домен VL подчеркнут двойной чертой), порядок доменов VH и VL можно поменять местами).
АК 140-154: линкер можно заменить на любой линкер, применяемый для получения ScFV.
АК 272-279: StrepTag II для выделения можно заменить на любой тип метки, например, на метку flag или на гистидиновую метку.
АК 280-281: короткий линкер (может быть длиннее).
АК 282-316: альфа-спираль с гептадным повтором (рерЕ) для получения суперспирали с противоположной альфа-спиралью с гептадным повтором в иммуногене (pepK). В данном примере используют 5 повторов, большее количестве повторов может вызвать самоагрегацию, а меньшее количество повторов может снизить аффинность, тем не менее, 4 повтора все еще функциональны. Минимальное функциональное количество повторов для применяемых спиралей составляет 3 и 546-48.
Агонист TRL9, такой как CpG, можно соединить с «боеголовкой» путем химического связывания, например, применяя набор для присоединения олигонуклеотида к антителу от Solulink. Пептидный агонист TRL9 можно присоединить, применяя стандартную пептидную химию.
Пример 2. Суперспираль, содержащая пептидную «боеголовку».

Аминокислоты 1-19: последовательность пептида, направленного против CD32a, опубликованная Berntzen и др.45
Аминокислоты 20-24 и аминоксилоты 32-33: Линкеры можно заменить на любой линкер, также на более длинные линкеры, чтобы обеспечить гибкость между двумя соединенными последовательностями.
Аминокислоты 24-31: StrepTag II для очистки можно заменить на любой тип метки, например, на метку flag или на гистидиновую метку.
Аминокислоты 34-68: альфа-спираль с гептадным повтором (рерЕ) для получения суперспирали с противоположной альфа-спиралью с гептадным повтором в иммуногене (pepK). В данном примере используют 5 повторов, большее количество повторов может вызвать самоагрегацию, а меньшее количество повторов может снизить аффинность, тем не менее, 4 повтора все еще функциональны. Минимальное функциональное количество повторов для применяемых спиралей составляет 3 и 549-51.
Агонист TRL9, такой как CpG, можно соединить с «боеголовкой» путем химического связывания, например, применяя набор для присоединения олигонуклеотида к антителу от Solulink. Пептидный агонист TRL9 можно присоединить, применяя стандартную пептидную химию.
Пример 3. Спираль, содержащая иммуноген 3 (Т-клеточные эпитопы Der Р1 и Der Р2, выбранные на основании экспрессии HLA II класса человека).

АК 1-6: гистидиновую метку для очистки можно заменить на любой тип метки, например, на метку flag или StrepTag II. Метка также может располагаться между линкером и альфа-спиралью, см. пример 4. Предпочтительно, чтобы она располагалась не на С-конце, поскольку это может препятствовать функционированию суперспирали.
АК 208-219: линкер между пептидами аллергена и линкером (указанный линкер можно заменить на любой другой линкер, чтобы обеспечить гибкость между двумя соединенными последовательностями). Подчеркнутый цистеин может быть удален из последовательности.
АК 220-254: альфа-спираль с гептадным повтором (pepK) для получения суперспирали с противоположной альфа-спиралью с гептадным повтором в «боеголовке» (рерЕ). В данном примере используют 5 повторов, большее количество повторов может вызвать самоагрегацию, а меньшее количество повторов может снизить аффинность, тем не менее, 4 повтора все еще функциональны. Минимальное функциональное количество повторов для применяемых спиралей составляет 3 и 552-54.
АК 6-54: Т-клеточные эпитопы из Der р1 (АК 181-220 нативного белка):
YYRYVAREQSCRRPNAQRFGISNYCQIYPPNANKIREALAQTHSAIAV
(SEQ ID NO: 24)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
АК 55-88: Т-клеточные эпитопы из Der р1 (95-128):
DLRQMRTVTPIRMQGGCGSCWAFSGVAATESAYL
(SEQ ID NO: 25)
Жирным и курсивным шрифтом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
АК 89-108: Т-клеточные эпитопы из Der р2 (АК 85-104 нативного белка):
QQYDIKYTWNVPKIAPKSEN
(SEQ ID NO: 26)
Жирным и курсивным шрифтом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
АК 109-134: Т-клеточные эпитопы из Der р2 (АК 105-130 нативного белка):
VVVTVKVMGDDGVLACAIATHAKIRD
(SEQ ID NO: 27)
Жирным и курсивным шрифтом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
АК 135-183: Т-клеточные эпитопы из Der р1 (АК 228-276 нативного белка):
DAFRHYDGRTIIQRDNGYQPNYHAVHIVGYSNAQGVDYWIVRNSWDTNW
(SEQ ID NO: 28)
Жирным и курсивным шрифтом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
АК 184-208: Т-клеточные эпитопы из DerP2 (АК 11-45 нативного белка):
HEIKKVLVPGCHGSEPCIIHRGKPF
(SEQ ID NO: 29)
Жирным и курсивным шрифтом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
Пример 4. Образование стабильной суперспирали между «боеголовкой» ScFV и иммуногеном 3.
Иммуноген 3 иммобилизовали в проточных ячейках 1, 2, 3 чипа СМ5 BIACore, применяя стандартные процедуры, с получением ~700 единиц ответа, впоследствии «боеголовку» (10 мкг/мл в ФБР) вводили в проточную ячейку 1 и измеряли увеличение массы в динамике (скорость ассоциации), через ~160 секунд буфер заменяли на ФБР. Скорость диссоциации свидетельствовала о стабильности связывания «боеголовки» с иммуногеном, иммобилизованным в ячейке, в которую вводили только ФБР. Если «боеголовку» предварительно инкубировали со спиралью pepK и впоследствии вводили в проточную ячейку 2, то не наблюдали связывания «боеголовки» с чипом. Аналогично, когда чип предварительно инкубировали с pep Е (проточная ячейка 3) перед введением «боеголовки», не наблюдали связывания «боеголовки» с иммуногеном (см. фигуру 1).
Пример 5. Спираль, содержащая иммуноген 5-12 (~29 Т-клеточных эпитопов Der р1, Der р2, Der р3, Der р4, Der р7, Der р9, Der р10, Der р11, Der р14, Der р15, выбранных на основании экспрессии HLA II класса человека).


АК 1369-274: гистидиновую метку для очистки можно заменить на любой тип метки, например, на метку flag или StrepTag II. Метка также может располагаться между линкером и альфа-спиралью, см. пример 4. Предпочтительно, чтобы она располагалась не на С-конце, поскольку это может препятствовать функционированию суперспиралей.
АК 365-368 и 375-381: линкеры между пептидами аллергена, гистидиновой меткой и pepK. Данные линкеры можно заменить на любой другой линкер, чтобы обеспечить гибкость между двумя соединенными последовательностями. Подчеркнутый цистеин (Cys379) предпочтительно удален из последовательности.
АК 382-416: альфа-спираль с гептадным повтором (pepK) для получения суперспирали с противоположной альфа-спиралью с гептадным повтором в «боеголовке» (рерЕ). В данном примере используют 5 повторов, большее количество повторов может вызвать самоагрегацию, а меньшее количество повторов может снизить аффинность, тем не менее, 4 повтора все еще функциональны. Минимальное функциональное количество повторов для применяемых спиралей составляет 3 и 555-57.
«Боеголовку» (на основе ScFV спираль-1 IV.3 + ОДНМ362) смешивали с иммуногеном 5-12 в соотношении, которое обеспечивало связывание от 10% до 100% боеголовок с иммуногеном путем образования суперспиральной структуры, предпочтительно, при этом не оставалось свободного иммуногена или оставалось менее чем 50% свободного иммуногена, и включали в состав лекарственной формы, абсорбированной на квасцах.
В качестве примера, дополнительно описанного ниже, согласно предпочтительному варианту реализации настоящего изобретения предложена вакцина, отличающаяся тем, что иммунорегуляторная вакцина согласно настоящему изобретению содержит:
- направленный адъювант, который состоит из молекулы, направленной против CD32, соединенной с первой альфа-спиралью, включающей или состоящей из последовательности SEQ ID NO: 70, который соединен с лигандом TLR9 с последовательностью SEQ ID NO: 69, например, в соотношении 1:1-18 (молекул на молекулы); и
- иммуноген, который включает или состоит из иммуногена с последовательностью SEQ ID NO: 30, соединенный со второй альфа-спиралью, предпочтительно с последовательностью SEQ ID NO: 75, или ее функционально активным вариантом, предпочтительно вариантом, в котором Cys379 удален, или в котором порядок полученных из аллергена пептидов изменен,
при этом направленный адъювант и иммуноген связаны друг с другом посредством суперспиральной структуры, образованной первой и второй альфа-спиралями.
Т-клеточные эпитопы (существует 15 полученных из аллергена пептидов в immo5-12: 1-2-3-4-5-6-7-8-9-10-11-12-13-14-15). Порядок пептидов, полученных из аллергенов КДП, оптимизировали для лучшей растворимости, но также возможен любой другой порядок.
1) АК: 1-14 Der р2 (АК 116-129 нативного белка)
GVLACAIATHAKIR (SEQ ID NO: 31)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
I) АК: 15-51 Der р11 (АК 697-733 нативного белка)
EQERLVKLETVKKSLEQEVRTLHVRIEEVEANALAGG (SEQ ID NO: 32)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
3) АК: 52-72 Der р1 (АК 95-115 нативного белка)
DLRQMRTVTPIRMQGGCGSCW
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
4) АК: 73-92 Der р10 (АК 219-238 нативного белка)
EAHEQQIRIMTTKLKEAEAR (SEQ ID NO: 34)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
5) АК: 93-106 Der р2: (АК 85-98 нативного белка)
QQYDIKYTWNVPKI (SEQ ID NO: 35)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
6) АК: 107-132 Der р1 (АК 251-276 нативного белка)
AVNIVGYSNAQGVDYWIVRNSWDTNW (SEQ ID NO: 104)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
7) АК: 133-150 Der р4 (АК 2-19 нативного белка):
YHNPHFIGNRSVITHLME (SEQ ID NO: 105)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
8) АК: 151-181 Der р7 (АК 66-96 нативного белка):
DLKGELDMRNIQVRGLKQMKRVGDANVKSED (SEQ ID NO: 36)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
9) АК: 182-203 Der р1 (АК 228-252 нативного белка)
DAFRHYDGRTIIQRDNGYQPNY (SEQ ID NO: 37)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
10) АК: 204-235 Der р9 (АК 54-85 нативного белка):
LDEYWILTAAHCVDGQT VSKLIRSKVL GEKIS (SEQ ID NO: 38)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
11) АК: 236-260 Der р1 (АК 181-205 нативного белка)
YYRYVAREQSCRRPNAQRFGISNYC (SEQ ID NO: 39)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
12) АК: 261-271 Der р2 (АК 105-115 нативного белка)
VVVTVKVMGDD (SEQ ID NO: 40)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
13) АК: 272-294 Der р15 (АК 251-273 нативного белка)
ELHTYFNVNYTMHYYLNNGATRD (SEQ ID NO: 41)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
14) АК: 295-327 Der р3 (АК 58-90 нативного белка)
ILDEYWILTAAHCVAGQTASKLSIRYNSLKHSL (SEQ ID NO: 42)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
15) АК: 328-364 Der р14 (АК 1061-1097 нативного белка)
FKYRPFKVNELNLEGEFGRELQHKFRLMRNSQMEVEE (SEQ ID NO 43)
Жирным шрифтом и курсивом выделены предсказанные Т-клеточные эпитопы, презентируемые классом HLA.
Пример 6. Стимуляция РВМС обезьян иммуногеном 3.
РВМС (100000/лунку) из сенсибилизированных Der р1 макак-резусов (Масаса mulatta) культивировали в трех повторностях со средой, 3 мкг/мл Der р1 или 3 и 5 мкг/мл иммуногена 3 при 37°С/5% CO2 в присутствии 20 ед./мл IL-2. Пролиферацию анализировали по включению [3H]-тимидина (0,5 мкКи/лунку) в течение последних 18 часов 2-дневного культивирования. Клетки собирали для подсчета бета-сцинтилляций (Topcount NXT, Packard, Рамси, Миннесота, США). Результаты представлены в виде числа импульсов в минуту. Дополнительно для параллельных культур анализировали в двух повторностях уровни IL-10 и GM-CSF в супернатантах, применяя доступный для приобретения набор для ELISA (U-Cytech, Утрехт, Нидерланды), в соответствии с инструкциями производителя. См. фигуру 2.
Не наблюдали достоверного различия между ответом на Der р1 или на иммуноген 3 ни в пролиферации, ни в продукции цитокинов, что указывает на то, что Т-клеточные эпитопы в иммуногене 3, которые выбрали на основании экспрессии HLA II класса человека, в равной степени хорошо презентированы молекулами II класса макака-резуса.
Пример 7. Опосредованная «боеголовкой» улучшенная презентация антигена.
РВМС (100000/лунку) из сенсибилизированных Der р1 макак-резусов (Масаса mulatta) предварительно инкубировали (30 мин на льду) с 1 мкг/мл «боеголовки» ScFV и трижды промывали ФБР или предварительно инкубировали только с ФБР и трижды промывали. Впоследствии данные клетки инкубировали (30 мин на льду) с различными концентрациями иммуногена 3 или Der р1 при концентрации 3 мкг/мл и трижды промывали ФБР, после чего клетки культивировали при 37°С/5% CO2 в присутствии 20 ед./мл IL-2 в течение 48 часов. В качестве положительного контроля РВМС (без предварительной инкубации с «боеголовкой») инкубировали с 3 мкг/мл Der Р1 без промывки и культивировали при 37°С/5% CO2 в присутствии 20 ед./мл IL-2. Пролиферацию анализировали по включению [3H]-тимидина (0,5 мкКи/лунку) в течение последних 18 часов 2-дневного культивирования. Клетки собирали для подсчета бета-сцинтилляций (Topcount NXT, Packard, Рамси, Миннесота, США). Результаты представлены в виде числа импульсов в минуту. См. фигуру 3.
Для того, чтобы стимулировать Т-клетки, антиген должен быть интернализован и процессирован антигенпрезентирующими клетками. Этого можно добиться путем культивирования Т-клеток и АРС в присутствии антигена или путем нацеливания антигена на рецептор клеточной поверхности, способный интернализоваться и перемещаться в лизосомы58-62. В соответствии с литературными данными, стимуляция РВМС предварительно инкубированным иммуногеном в отсутствие «боеголовки» не приводила к пролиферации (результаты не представлены). Также предварительная инкубация с Der р1 в присутствии «боеголовки» не приводила к пролиферации. Тем не менее, когда РВМС предварительно инкубировали с 1 мкг/мл «боеголовки» ScFV, промывали и впоследствии инкубировали с различными концентрациями иммуногена 3 и снова промывали, наблюдали дозозависимую стимуляцию, которая была даже выше, чем в положительном контроле, когда РВМС культивировали 48 ч в присутствии 3 мкг/мл Der р1 без промывки. Таким образом, стимуляцию наблюдали только тогда, когда иммуноген (содержащий спираль pepK) получал возможность взаимодействовать с «боеголовкой» (содержащей спираль рерЕ) таким образом, чтобы образовалась стабильная суперспираль. «Боеголовка» в комбинации с Der Р1 не приводила к стимуляции, поскольку в Der Р1 отсутствует спираль, и Der Р1 не связывается с РВМС.
Пример 8. Опосредованная CpG активация аутоиммунных реактивных Т-клеток.
РВМС (100000/лунку) макак-резусов (Масаса mulatta) или нормальных людей-доноров инкубировали в трех повторностях с 50 мкМ CpG или CpG-биот. Параллельно РВМС предварительно инкубировали (30 мин на льду) с 1 мкг/мл биотинилированной ScFV «боеголовки» scFv, промывали 3 раза и впоследствии инкубировали с 50 мкМ CpG. Анализировали уровни IL-4 и IFN-гамма в супернатантах в двух повторностях, применяя доступный для приобретения набор для ELISA в соответствии с инструкциями производителя. См. фигуру 4.
CpG не вызывал специфический Т-клеточный ответ в клетках обезьян или человека (левые столбики), он также не усиливал и не индуцировал Т-клеточный ответ на биотинилированный белок, который вводили совместно (правые столбики). Только когда CpG и биотин были физически соединены (зеленые столбики), вызывался специфический ответ на биотин. Поскольку биотин (также называемый витамином b7, витамином Н или витамином В8) представляет собой собственную молекулу, иммунный ответ не должен вызываться. Тем не менее, когда биотин презентирован активированными TLR9 АРС, Т-клеточная толерантность преодолевается, что указывает на то, что физическое присоединение агониста TLR9 к собственному белку приведет к иммунному ответу, который, в том случае, когда собственный белок представляет собой опухолевый специфический антиген (ТАА), можно применять для лечения рака. "Физически соединенный" означает либо непосредственно соединенный с ТАА, либо опосредованно соединенный с применением «боеголовки» и ТАА, соединенного со спиралью (или содержащего спираль), которая взаимодействует со спиралью «боеголовки». Последний из упомянутых вариантов предпочтителен. Также можно применять любую другую форму комплекса между агонистом TRL9 и ТАА при условии, что гарантировано поглощение агониста TLR9 и ТАА одной и той же АРС.
Пример 9. Лечение рака.
В отличие от лечения аллергии, «боеголовка», которую применяют для лечения рака, должна преимущественно связываться с CD32a, а не с CD32b. «Боеголовка» из Примеров 1 и 2 предпочтительна для применения при лечении рака.
Пример 10. Стимуляция РВМС человека иммуногеном 5-12.
РВМС (100000/лунку) от сенсибилизированных Der р1 нормальных доноров культивировали в трех повторностях со средой, 3 мкг/мл Der р1 или 5, 1 или 0,5 мкг/мл иммуногена 5-12 (Immo5-12) при 37°С/5% CO2 в течение 24 ч. Анализировали уровни IL-10 и IFN-гамма в супернатантах в двух повторностях, применяя доступные для приобретения наборы для ELISA (eBioscience), в соответствии с инструкциями производителя. См. фигуру 5.
Пример 11. Лечение аутоиммунных заболеваний.
Вакцину, содержащую «боеголовку», которая распознает CD32a и CD32b, суперспираль и антагонист или агонист TLR9, который вызывает ингибиторную передачу сигналов TLR9 (см. ссылки), объединяли с аутоантигеном. Такая вакцина не будет вызывать образование новых антител против какой-либо части вакцины, включая аутоантиген, и, следовательно, она безопасна для применения у таких пациентов. Применение ингибиторных CpG (ингибиторных ОДН) в данной вакцине вызовет ответ Treg клеток против вакцины, содержащей аутоантиген. То же самое произойдет, если применять агонист CpG из группы 1 или 2. Агонист TLR9 из группы 3 не является предпочтительным, так как он приведет к индукции более сильного аутоиммунного ответа, см. фигуру 4.
Пример 12. Примеры связывающих молекул.
12.1. Связывающая CD32 область, которую в данной заявке также называют молекулой, направленной против CD32, или молекулой, связывающей CD32.
Молекулы, связывающие СР32а:
Антитело, специфично связывающееся с CD32a: MAT IV.3 (Stuart и др. (1987) J. Ехр. Med. 166: 1668)
ScFV, полученный из MAT IV.3 (VH-линкер-VL): (SEQ ID NO: 44)

Подчеркнут: домен VH.
Жирный шрифт: домен HL.
Обычный шрифт: гибкий линкер (может быть любой линкер).
Пептид, направленный против CD32: Berntzen и др. (J. Biol. Chem. (2009) 284: 1126-1135):
(SEQ ID NO: 45)
ADGAWAWVWLTETAVGAAK
Молекулы, связывающие группу CD32a+b:
Антитело, специфично связывающееся с CD32a и CD32b: МАТ АТ-10 (AbD Serotec) ScFV, полученный из МАТ АТ-10 (VH-линкер-VL): (SEQ ID NO: 46)


Подчеркнут: домен VH.
Жирный шрифт: домен HL.
Обычный шрифт: гибкий линкер (может быть любой линкер).
Фрагмент Fc IgG1 (домен СН2-СН3): (SEQ ID NO: 47)

Между () расположен шарнирный участок, его можно исключить.
Подчеркнут: СН2 домен.
Жирный шрифт: СН3 домен.
12.2. Область или молекула, связывающая TLR9, которую в данной заявке также называют связывающим TLR9 веществом или лигандом TLR9.
CpG класса А.
Группа CpG-A:
ОДН2216: (SEQ ID NO: 48).
GGGGGACGATCGTCGGGGGG
CpG класса В.
Группа CpG-B:
Природные лиганды:
ОДН2006: (SEQ ID NO: 49).
TCGTCGTTTTGTCGTTTTGTCGTT
Пептидные лиганды (иммуностимулирующие пептиды):

Такие иммуностимулирующие пептиды можно предпочтительно применять в качестве миметика CpG. Аналогичным образом можно применять их функционально активные варианты, которые представляют собой фрагменты, мутанты или гибриды, включая комбинации перечисленных вариантов.
Функционально активные варианты, в частности, отличаются тем, что они стимулируют пДК, таким образом, вызывая повышение уровня IL-6, и/или TNF-альфа, и/или IFN-альфа, по сравнению с отрицательным контролем.
Функционально активные варианты иммуностимулирующих связывающих TLR9 пептидов, в частности:
a) по меньшей мере на 60% гомологичны или идентичны по последовательности любому из пептидов с последовательностью SEQ ID NO: 73-91, предпочтительно по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90% гомологичны или идентичны;
b) представляют собой мутантов любого из пептидов с последовательностью SEQ ID NO: 50-68, которые можно получить путем модификации исходной последовательности аминокислот путем вставки, делеции или замены одной или более аминокислот в указанной последовательности или в любом или обоих дистальных концах последовательности, предпочтительно, путем введения менее чем 5, 4, 3, 2 или 1 точечной мутации; или
с) представляют собой фрагменты любого из пептидов с последовательностью SEQ ID NO: 50-68, содержащие по меньшей мере 50% исходной последовательности; или по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, или по меньшей мере 90% исходной последовательности; или по меньшей мере 5 аминокислот, предпочтительно по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10 или по меньшей мере 11 аминокислот исходной последовательности.
CpG класса С.
Группа CpG-C.
ОДНМ362: (SEQ ID NO: 69).
TCGTCGTCGTTCGAACGACGTTGAT
12.3. Примеры связывающих CD32 продуктов со спиралями.

Подчеркнут: домен VH.
Жирный шрифт: домен HL.
Обычный шрифт: гибкий линкер (может быть любой линкер).
Курсивный шрифт: спираль рерЕ плюс С-концевая последовательность StrepTag II и "GP", линкером может быть любой гибкий линкер (StrepTag II можно удалить или заменить на гистидиновую метку или любую другую метку).


Подчеркнут: домен VH.
Жирный шрифт: домен HL.
Обычный шрифт: гибкий линкер (может быть любой линкер).
Курсивный шрифт: спираль рерЕ плюс С-концевая последовательность StrepTag II и "GP", линкером может быть любой гибкий линкер (StrepTag II можно удалить или заменить на гистидиновую метку или любую другую метку).
Пептид-спираль: (SEQ ID NO: 72)
ADGAWAWVWLTETAVGAAKGPEVSALEKEVSALEKEVSALEKEVSALEKEVSALEK
Курсивный шрифт: спираль рерЕ плюс "GP", линкером может быть любой гибкий линкер.

Между () расположен шарнирный участок, его можно исключить.
Подчеркнут: домен СН2.
Жирный шрифт: домен СН3.
Курсивный шрифт: спираль рерЕ плюс "GP", линкером может быть любой гибкий линкер.
12.4. Примеры продуктов, связывающих TLR9, с SH-группой для химического перекрестной сшивки с молекулой, связывающей CD32.
Группа CpG-A:
OДH2216_SH: (SEQ ID NO: 48).
GGGGGACGATCGTCGGGGGG-SH
Жирным шрифтом обозначен гибкий линкер с SH-группой для химической перекрестной сшивки с ScFV-спиралью (может представлять собой любой линкер и химически реакционноспособную группу, например, NH2, подходящую для химической перекрестной сшивки).
Группа CpG-B:
Природные лиганды:
ОДН2006_SH: (SEQ ID NO: 49).
TCGTCGTTTTGTCGTTTTGTCGTT-SH
Пептидные лиганды_SH:

Жирным шрифтом обозначен гибкий линкер с SH-группой для химической перекрестной сшивки с ScFV-спиралью (может представлять собой любой линкер и химически реакционноспособную группу, например, NH2, подходящую для химической перекрестной сшивки).
Группа CpG-C.
ОДНМ362_SH: (SEQ ID NO: 69).
TCGTCGTCGTTCGAACGACGTTGAT-SH
Жирным шрифтом обозначен гибкий линкер с SH-группой для химической перекрестной сшивки с ScFV-спиралью (может представлять собой любой линкер и химически реакционноспособную группу, например, NH2, подходящую для химической перекрестной сшивки).
12.5. Примеры «боеголовки», т.е. структуры, содержащей молекулу, связывающую CD32, и молекулу, связывающую TLR9.
Любой представитель из группы молекул, связывающих CD32, химически соединен с помощью любого способа с любым представителем из группы молекул, связывающих TLR9, при этом предпочтительно молекулы, связывающие TLR9, соединены С доступными лизинами (K) в молекулах, связывающих CD32, в качестве примера. Также смеси различных молекул, связывающих TLR9, можно соединить, например, с природными или пептидными молекулами, связывающими CpG-B.

Лизины в спиральной структуре (курсив) являются предпочтительными
или
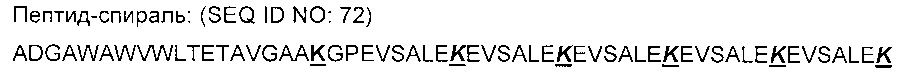
Лизины в спиральной структуре (курсив) являются предпочтительными.
12.6. Пример иммуногена, также называемого в данной заявке антигеном.
Иммуноген 3, содержащий спираль (Т-клеточные эпитопы Der Р1 и Der Р2, которые выбрали на основании экспрессии HLA II класса человека).

Подчеркнута: гистидиновая метка (ее можно удалить).
Жирный шрифт: линкер (может быть любой линкер).
Курсивный шрифт: спираль pepK для взаимодействия с «боеголовкой».
Иммуноген 5-12, содержащий спираль (~29 Т-клеточных эпитопов Der р1, Der р2, Der р3, Der р4, Der р7, Der р9, Der р10, Der р11, Der р14, Der р15, которые выбрали на основании экспрессии HLA II класса человека).

Подчеркнута: гистидиновая метка (ее можно удалить).
Жирный шрифт: линкер (может быть любой линкер).
Курсивный шрифт: спираль pepK для взаимодействия с «боеголовкой».
12.7. Пример вакцины SG100 против аллергии на клеща домашней пыли (КДП).
Типичный молекулярный комплекс получают путем химического присоединения, слияния и/или аффинного связывания, в частности, путем образования суперспиральной структуры.
Боеголовку (на основе ScFV-спираль-1 IV.3 + ОДНМ362) смешивали с иммуногеном 5-12 в соотношении, которое обеспечивало образование комплекса 90% «боеголовки» с иммуногеном, при этом не оставалось свободного иммуногена (молярное соотношение ~1:1,5), и включали в состав лекарственной формы, абсорбированной на квасцах.
12.8. Эффективность SG100 у макак-резусов.
Способы:
5 здоровых макак-резусов, ранее не контактировавших с клещами домашней пыли (КДП), иммунизировали 3× SG100 (100 мкг/иньекцию, абсорбирована на квасцах), в день 0 (д0), д14 и д28. Образцы крови отбирали в д0 и д49 для анализа активации Т-клеток и продукции антител.
Гуморальный иммунный ответ:
С помощью стандартного ELISA анализировали присутствие в образцах сыворотки IgG-антител против «боеголовки», immo 5-12 (Immo5), Der р1, Der р2, Der р5 и Der р7. Антигенами покрывали планшеты Maxisorb (1 мкг/мл в ФБР) в течение ночи при 4°С, дважды промывали, блокировали с помощью 1% БСА в ФБР, дважды промывали, инкубировали с сыворотками при разведении 1:1000 в течение 1 ч при 4°С, дважды промывали, а затем детектировали путем окрашивания антителом к IgG человека-РО (перекрестно реагирующим с IgG макака-резуса).
Клеточный иммунный ответ:
Пролиферация: РВМС (105/лунку) культивировали в течение 4 дней (37°С/5% CO2/влажность 99%) в 8 повторностях со средой, «боеголовкой» (2 мкг/мл), иммуногеном (2 мкг/мл), Der р1 (2 мкг/мл), Der р2 (2 мкг/мл), Der р5 (2 мкг/мл) и Der р7 (2 мкг/мл). В качестве положительного контроля применяли Con А (конканавалин А, Sigma). Пролиферацию измеряли по включению [3Н]-тимидина (0,5 мкКи/лунку) в течение последних 18 часов 4-дневного культивирования. Клетки собирали для подсчета бета-сцинтилляций (Topcount NXT, Packard, Рамси, Миннесота, США). Чистое число импульсов в минуту рассчитывали путем вычитания числа импульсов в минуту, полученного для контроля (среды), из такового, вызванного различными антигенами.
Продукция цитокинов:
Через 24 ч из каждой экспериментальной лунки после 8-кратной стимуляции пролиферации отбирали по 50 мкл супернатанта и объединяли. Исследовали присутствие в объединенных супернатантах IFN-гамма и IL-4, применяя доступные для приобретения наборы для ELISA от U-Cytech (Утрехт, Нидерланды).
Результаты:
Гуморальный ответ:
Измерили сильные ответы IgG на «боеголовку» и иммуноген вакцины SG100, но антител против Der р1, Der р2, Der р5 или Der р7 (фигура 7) не обнаружили, что указывает на то, что животные ранее не встречались с исследуемыми аллергенами КДП, и что SG100 не содержит В-клеточных эпитопов, которые перекрестно реагируют с исследуемыми аллергенами КДП.
Ответ Т-клеток:
На фигуре 8 можно увидеть, что у животных выявили сильную пролиферацию при стимуляции in vitro «боеголовкой», immo5, Der р1, Der р2, Der р7, но не Der р5. Также в супернатантах из культур in vitro с «боеголовкой», immo5, Der р1, Der р2, Der р7, но не с Der р5, выявили присутствие IFN-гамма, но не IL-4 (фигура 9). Продукцию IL-4 наблюдали после стимуляции Con А (результаты не представлены).
Заключение:
Иммунизация SG100 вызывала вторичный иммунный ответ Th1 типа на вакцину, о чем свидетельствовало присутствие IgG-антител, а также индукцию Т-клеток, которые продуцируют IFN-гамма, но не IL-4, при стимуляции «боеголовкой» или Immo5. Как и ожидалось, IgG (= В-клеточная память) против Der р1, Der р2, Der р5 или Der р7 не продуцировались, поскольку вакцина не содержала В-клеточные эпитопы из данных аллергенов. Тем не менее, вызывалась память Th1-типа против Т-клеточных эпитопов аллергенов клеща домашней пыли, которые присутствовали в Der р1, Der р2, Der р7 данной вакцины. Не вызывалась память Th1-типа против Der р5, который не входил в состав вакцины.
Полученные результаты подтверждают концепцию SG100.
12.9. Пример вакцины с «боеголовкой» для применения в онкологии.
ScFV-спираль-1 (IV.3): (SEQ ID NO: 70)

Подчеркнут: домен VH.
Жирный шрифт: домен HL.
Обычный шрифт: гибкий линкер (может быть любой линкер).
Курсивный шрифт: спираль рерЕ плюс С-концевая последовательность StrepTag II и "GP", линкером может быть любой гибкий линкер (StrepTag II можно удалить или заменить на гистидиновую метку или любую другую метку).
Боеголовка с ОДНМ362:

ОДНМ362_SH (SEQ ID NO: 69)
TCGTCGTCGTTCGAACGACGTTGAT-SH
ОДН-М362 можно соединить с любым из доступных лизинов в ScFV-спирали 1.
Боеголовка (SG100):
ScFV-спираль-1 химическим способом присоединяли к ОДН-M362-SH. Полученный препарат представлял собой смесь из ScFV-спиралей-1, соединенных с 1-18 молекулами ОДН-М362, предпочтительно представлял собой смесь из ScFV-спиралей-1, соединенных с 1-6 молекулами ОДН-М362. Все данные смеси можно назвать «боеголовкой» или ScFV-спиралью-1-М362.
Предпосылки:
Онкологические мишени для активной иммунотерапии фактически по определению представляют собой аутоантигены, экспрессия которых повышена в опухолевых клетках. Данные антигены называют опухолевыми специфическими антигенами (ТАА), и иммунная система не способна отвечать на данные антигены, так как они распознаются как собственные. Лекарственная форма вакцины, которая дает возможность иммунной системе вырабатывать специфический гуморальный и/или клеточный иммунный ответ на аутоантиген, потенциально подходит для применения в качестве противоопухолевой вакцины.
Боеголовка вакцины SG100 запускает аутоиммунный ответ:
24 мышей (6/группу) иммунизировали подкожно (п/к) 2× ScFV-спиралью-1 (35 мкг в 150 мкл) или «боеголовкой» (ScFV-спираль-1-M362), либо в составе лекарственной формы, абсорбированной на квасцах, либо разбавленной ФБР. Иммунизации осуществляли в д0 и д14, сыворотки отбирали в д0 (перед иммунизацией) и д28 и анализировали присутствие в них IgG1 и IgG2a против ScFV-спирали-1 (обозначена как ScFV) и МАТ IV.3 с помощью стандартного ELISA. См. фигуру 6.
На фигуре 6 можно видеть, что иммунизация «боеголовкой» вызывала сильный IgG1 и IgG2a ответ на ScFV-спираль-1, а также на MAT IV.3 в день 28. Положительный ответ наблюдали независимо от присутствия квасцов. Иммунизация только ScFV-спиралью-1 вызывала IgG1 ответ против ScFV-спирали-1 и лишь в присутствии квасцов, но не вызывала ответ IgG2a. Полученные результаты согласуются с концепцией, что CpG (М362) вызывает ответ Th1 типа (IgG2a), а квасцы вызывают ответ Th2 типа (IgG1). Ответ на ScFV-спираль-1 свидетельствует о том, что данный белок является иммуногенным у мыши, действительно, как StrepTag II (последовательность аминокислот "SAWSHPQFEK" (SEQ ID NO: 76)), так и рерЕ (последовательность аминокислот "EVSALEKEVSALEKEVSALEKEVSALEKEVSALEK" SEQ ID NO: 77) были мишенью IgG ответов (результаты не представлены). Тем не менее, ScFV-спираль-1 также содержит "собственные последовательности мыши", так как ScFV содержит домены VH и VL MAT IV.3 мыши. Следовательно, иммунный ответ на IV.3 свидетельствует о присутствии аутоиммунных антител. В действительности, лишь «боеголовка» с квасцами или без них могла вызывать данный тип иммунного ответа. Следовательно, присутствие М362 на ScFV-спирали-1 способно преодолеть толерантность по отношению к аутоантигенам - доменам VH и VL исходного антитела При объединении аутоантигена, например, ТАА, посредством высокоаффинного взаимодействия с рерЕ «боеголовки», такая «боеголовка» сможет вызвать необходимый аутоиммунный ответ на ТАА. Комплекс «боеголовки» (ScFV-спираль-1-М362) с ТАА образует эффективную вакцину для лечения рака с повышенной экспрессией ТАА в вакцине. Такую вакцину можно включить в состав лекарственной формы вместе с любыми адъювантами, например, абсорбировать на квасцах.
Пример 13. Применение данной технологической платформы в онкологии, иммуноген G17.
Боеголовка на основе ScFV-спирали1 (IV.3) + ОДНМ362 и иммуноген G17 из макака-резуса и яванского макака (G17RM). Далее пЕ понимают как пироGlu.
Последовательность иммуногена человека малого гастрина (G17H, первые 13 аминокислот, SEQ ID NO: 86):
pEGPWLEEEE EAYG
Последовательность иммуногена макака-резуса и яванского макака малого гастрина (G17RM, первые 13 аминокислот, SEQ ID NO: 99):
pEGPWMEEEE AAYG
Последовательность иммуногена мыши малого гастрина (G17M, первые 13 аминоксилот, SEQ ID NO: 100):
pERPRMEEEE EAYG
Отличия от G17RM выделены жирным шрифтом.
Конечный продукт иммуноген G17RM-спираль-1 и G17H-спираль-1:
G17RM_спираль-1, SEQ ID NO: 101:

G17H_спираль-1, SEQ ID NO: 102:

Жирный шрифт: линкер (может быть любой линкер).
Курсивный шрифт: спираль pepK для взаимодействия с «боеголовкой».
Готовый к использованию (конечный продукт) TYG100-1RM и TYG100-1H.
Боеголовку, описанную выше (на основе ScFV-спирали1 IV.3), смешивали с G17RM_спиралью-1 или G17H_спиралью-1 в соотношении, которое обеспечивало образование комплекса 100% «боеголовки» с G17RM_спиралью-1 или G17H_спиралью-1, при этом свободный иммуноген G17 отсутствовал (молярное соотношение ~1:1), и включали в состав лекарственной формы, абсорбированной на квасцах. Таким образом получали TYG100_1RM и TYG100_1H.
Пример 14. TYG100 1RM для лечения гастринзависимого рака, например, рака поджелудочной железы.
6 мышей Balb/c в день 0, день 14 и день 35 трижды иммунизировали TYG100_1RM или G17_1RM (без «боеголовки»), содержащими G17 макака-резуса (58,4 мкг/иньекцию в 0,5 мл). Через две недели после последней иммунизации брали пробы сыворотки и анализировали присутствие в них IgG-антител против G17RM, G17H и G17M (= G17 из мыши).

В таблице 2 показано, что все мыши отвечали выработкой IgG на 2 указанных компонента вакцины (боеголовку и G17RM). Важно отметить, что все мыши продуцировали IgG, которые перекрестно реагировали с G17 человека и, в меньшей степени, с G17 мыши (G17M). Последний факт удивителен, потому что первые 13 аминокислот G17 мыши (pERPRMEEEEEAYG, SEQ ID NO: 86) отличаются в трех положениях аминокислот от G17RM (различия выделены жирным шрифтом и подчеркнуты), и G17M является аутоантигеном для мыши. Следовательно, антитела, распознающие G17M, представляют собой аутоантитела, что указывает на то, что TYG100_1RM смог преодолеть природную толерантность по отношению к аутоантигену G17M. Ответ на G17 отсутствовал, когда осуществляли иммунизацию G17-пептидом без «боеголовки».
Способность вакцины вызывать аутоиммунный ответ является необходимым условием для создания противораковой вакцины, при этом все опухолевые специфические антигены (ТАА) представляют собой аутоантигены, экспрессия которых повышена, например, которые сверхэкспрессируются в опухолевых клетках. Следовательно, вакцину, состоящую из «боеголовки» TYG100_1RM, объединенной с G17 человека в качестве иммуногена, можно применять в качестве вакцины для лечения гастринзависимых опухолей, таких как рак поджелудочной железы.
Пример 15. Примеры продуктов, содержащих димер пептидного иммуногена.
Конечный продукт иммуноген G17RM-спираль-2 и G17H-спираль-2:
Димер G17RM (первые 13 аминокислот малого гастрина) синтезировали химическим способом, применяя специальный гибкий линкер, соединяющий 2 пептида в одну спираль pepK.
G17RM-спираль-2: (SEQ ID NO: 103: часть иммуногенной композиции согласно настоящему изобретению, содержащая два пептида гастрина макака-резуса с последовательностью SEQ ID NO: 99, разветвленную линкерную последовательность и альфа-спираль пептида (TYG100_2RM). Данную часть можно соединить с подходящим направленным адъювантом посредством образования суперспирали.

Жирным шрифтом выделен специальный гибкий линкер (может быть любой линкер, который позволяет соединить три пептида).
Курсивным шрифтом выделена спираль pepK для взаимодействия с «боеголовкой».
С17Н-спираль-2: (SEQ ID NO: 88: Часть иммуногенной композиции согласно настоящему изобретению, содержащая два пептида гастрина человека с последовательностью SEQ ID NO: 86, разветвленную линкерную последовательность и альфа-спираль пептида (TYG100_2H). Данную часть можно соединить с подходящим направленным адъювантом соединением путем суперспирали.

Жирным шрифтом выделен специальный гибкий линкер (может быть любой линкер, который позволяет соединить три пептида).
Курсивным шрифтом выделена спираль pepK для взаимодействия с «боеголовкой».
Конечный продукт TYG100-2RM и TYG100-2H
«Боеголовку», описанную выше (на основе ScFV-спирали1; IV.3), смешивали с G17RM_спиралью-2 или С17Н_спиралью-2 в соотношении, которое обеспечивало образование комплекса 100% «боеголовки» с иммуногеном G17RM_спираль-2 или G17H_спираль-2, при этом свободный иммуноген G17 отсутствовал (молярное соотношение ~1:1), и включали в состав лекарственной формы, абсорбированной на квасцах Таким образом получали TYG100_2RM и TYG100_2H.
Пример 16. TYG100 2RM для лечения гастринзависимого рака, например, рака поджелудочной железы.
6 мышей Balb/c в день 0, день 14 и день 35 трижды иммунизировали TYG100_2RM, содержащим первые 13 аминокислот G17 макака-резуса (66,8 мкг/иньекцию в 0,5 мл). Через две недели после последней иммунизации отбирали сыворотки и анализировали присутствие в них IgG-антител против G17RM, G17H и G17M (= G17 из мыши).

В таблице 3 показано, что все мыши отвечали выработкой IgG на 2 указанных компонента вакцины (боеголовку и G17RM). Важно отметить, что все мыши продуцировали IgG, которые перекрестно реагировали с G17 человека и, в меньшей степени, с G17 мыши (G17M). Последний факт удивителен, потому что первые 13 аминокислот G17 мыши (pERPRMEEEEEAYG, SEQ ID NO: 86) отличаются по трем положениям аминокислот от G17RM (различия выделены жирным шрифтом и подчеркнуты), и G17M является аутоантигеном для мыши. Следовательно, антитела, распознающие G17M, представляют собой аутоантитела, что указывает на то, что TYG100_2RM смог преодолеть природную толерантность по отношению к аутоантигену G17M. Ответ на G17 отсутствовал, когда осуществляли иммунизацию G17-пептидом без «боеголовки».
Способность вакцины вызывать аутоиммунный ответ является необходимым условием для создания противораковой вакцины, при этом все опухолевые специфические антигены (ТАА) представляют собой аутоантигены, экспрессия которых повышена в опухолевых клетках. Следовательно, вакцину, состоящую из «боеголовки» TYG100_2RM, объединенной с G17 человека в качестве иммуногена, можно применять в качестве вакцины для лечения гастринзависимых опухолей, таких как рак поджелудочной железы. Ответы на все 3 типа G17, вызванные TYG100_2RM, были сильнее, чем таковые, вызванные TYG100_1RM (таблица 2), что указывает на то, что для получения вакцины предпочтителен данный димер.
Пример 17. TYG100 2RM для лечения гастринзависимого рака, например, рака поджелудочной железы.
6 яванских макак иммунизировали TYG100_2RM и 6 иммунизировали G17RM_спиралью-2 в день 0 (д0), д14 и д28. В д0, д14, д28, д42 и д56 анализировали присутствие в сыворотках IgG-антител против аутологичного малого гастрина (G17RM), малого гастрина из людей (G17H), постороннего контрольного пептида с молекулярной массой, сходной с таковой у гастрина (контрольного пептида) или против «боеголовки» (ScFV-спираль-1), применяя мультиплексную систему ELISA от Meso Scale Discovery (MSD), согласно инструкциям MSD.
На фигуре 10 можно видеть, что все 6 животных проявили сильный зависимый от времени ответ IgG на «боеголовку» (ScFV-спираль-1), а также на G17RM и G17H, при этом ответ на контрольный пептид не наблюдался. Ответ на G17RM после трех иммунизаций составлял 75% ответа на ScFV-спираль-1. Это было примечательно, поскольку G17RM представляет собой 100% аутологичный белок с молекулярной массой лишь ~1,2 кДа, тогда как ScFV-спираль-1 представляет собой 100% аллогенный белок с молекулярной массой >30 кДа. Антитела против G17RM сильно перекрестно реагировали с G17H. Не наблюдали ответа против G17RM, когда пептид G17RM_спираль-2 применяли без «боеголовки». Титр IgG между днями 42 и 56 снижался сильнее для G17RM, чем для ScFV, что указывает на то, что часть IgG-антител нейтрализовалась эндогенным G17. Важно отметить, что присутствие эндогенного G17 не поддерживало ответ на G17RM.
Результаты на фигуре 10 показывают, что вакцина способна вызывать истинный ответ с участием аутоантител, который был обратим. Это необходимое условие для создания противораковой вакцины, поскольку опухолевые специфические антигены (ТАА) представляют собой аутоантигены, экспрессия которых в опухолевых клетках повышена, например, которые сверхэкспрессируются в опухолевых клетках, но также присутствуют с низким уровнем экспрессии в нормальных здоровых клетках. Следовательно, такую вакцину, как TYG100_2RM или TYG100_2H, можно применять для лечения гастринзависимых опухолей, таких как рак поджелудочной железы. После того, как рак будет полностью вылечен, лечение можно остановить, и индуцированные антитела против G17 будут выведены из циркуляции. Для поддержания устойчивого аутоиммунного ответа (в процессе лечения), его необходимо стимулировать повторными инъекциями вакцины. Данный тип вакцины не вызывает необратимого аутоиммунного заболевания.
Пример 18. TYG100 2RM для лечения ожирения.
Отслеживали аппетит животных из примера 14 и измеряли их массу тела в д0, д14, д28, д42 и д56. После двух инъекций TYG100_2RM 4 из 6 животных утратили интерес к ежедневным закускам (печенью), тогда как потребление основной пищи оставалось нормальным. Это сопровождалось значимой потерей массы тела (фигура 11), при этом не было зарегистрировано нежелательных побочных действий. До настоящего времени подобного результата никогда не наблюдали при вакцинации другими вакцинами, которые были основаны на взаимодействии «боеголовки» и суперспирали, такими как вакцины, нацеленные на иммуногены, отличные от иммуногенов гастрина (результаты не представлены).
Полученные результаты свидетельствуют о том, что TYG100_2RM уменьшает желание перекусить (между приемами пищи), при этом не влияя на потребление основной пищи, необходимой для здоровой жизни. Данные животные были активны и довольны, как обычно. Следовательно, TYG100_2RM можно применять для лечения ожирения.
Библиографический указатель
1. Mathis, D. and C. Benoist. 2004. Back to central tolerance. Immunity 20: 509-516.
2. Miller, J.F.A.P. and G. Morahan. 1992. Peripheral T cell tolerance. Annu. Rev. Immunol. 10: 51-69.
3. Tafuri.A., J. Alferink, P. Möller, G.J. Hammerling, and B. Arnold. 1995. T cell awareness of paternal alloantigens during pregnancy. Science 270: 630-633.
4. Cheever, M.A. and C.S. Higano. 2011. PROVENGE (Sipuleucel-T) in prostate cancer: the first FDA-approved therapeutic cancer vaccine. Clin. Cancer Res. 17: 3520-3526.
5. Linley, A.J., M. Ahmad, and R.C. Rees. 2011. Tumour-associated antigens: considerations for their use in tumour immunotherapy. Int. J. Hematol. 93: 263-273.
6. Brett, B.T., S.C. Smith, C.V. Bouvier, D. Michaeli, D. Hochhauser, B.R. Davidson, T.R. Kurzawinski, A.F. Watkinson, S.N. Van, R.E. Pounder, and M.E. Caplin. 2002. Phase II study of anti-gastrin-17 antibodies, raised to G17DT, in advanced pancreatic cancer. J Clin Oncol 20: 4225-4231.
7. Rengifo-Cam, W. and P. Singh. 2004. Role of progastrins and gastrins and their receptors in GI and pancreatic cancers: targets for treatment. Curr. Pharm. Des 10: 2345-2358.
8. Watson, S.A., D. Michaeli, T.M. Morris, P. Clarke, A. Varro, N. Griffin, A. Smith, T. Justin, and J.D. Hardcastle. 1999. Antibodies raised by gastrimmune inhibit the spontaneous metastasis of a human colorectal tumour, AP5LV. Eur J Cancer 35: 1286-1291.
9. Watson, S.A., T.M. Morris, D.F. McWilliams, J. Harris, S. Evans, A. Smith, and P.A. Clarke. 2002. Potential role of endocrine gastrin in the colonic adenoma carcinoma sequence. Br. J Cancer 87: 567-573.
10. Morton, M., G.C. Prendergast, and T.D. Barrett. 2011. Targeting gastrin for the treatment of gastric acid related disorders and pancreatic cancer. Trends in pharmacological sciences 32: 201-205.
11. Ciccotosto, G.D., J.K. Dawborn, K.J. Hardy, and A. Shulkes. 1996. Gastrin processing and secretion in patients with end-stage renal failure. J Clin Endocrinol. Metab 81: 3231-3238.
12. Eaton-Bassiri, A., S.B. Dillon, M. Cunningham, M.A. Rycyzyn, J. Mills, R.T. Sarisky, and M.L. Mbow. 2004. Toll-like receptor 9 can be expressed at the cell surface of distinct populations of tonsils and human peripheral blood mononuclear cells. Infect. Immun. 72: 7202-7211.
13. Saikh, K.U., T.L. Kissner, A. Sultana, G. Ruthel, and R.G. Ulrich. 2004. Human monocytes infected with Yersinia pestis express cell surface TLR9 and differentiate into dendritic cells. J. Immunol. 173: 7426-7434.
14. Tanaka, J., K. Sugimoto, K. Shiraki, M. Tameda, S. Kusagawa, K. Nojiri, T. Beppu, K. Yoneda, N. Yamamoto, K. Uchida, T. Kojima, and Y. Takei. 2010. Functional cell surface expression of toll-like receptor 9 promotes cell proliferation and survival in human hepatocellular carcinomas. Int. J Oncol. 37: 805-814.
15. Hartmann, G., J. Battiany, H. Poeck, M. Wagner, M. Kerkmann, N. Lubenow, S. Rothenfusser, and S. Endres. 2003. Rational design of new CpG oligonucleotides that combine В cell activation with high IFN-a induction in plasmacytoid dendritic cells. Eur. J. Immunol. 33: 1633-1641.
16. Tversky, J.R., A.P. Bieneman, K.L. Chichester, R.G. Hamilton, and J.T. Schroeder. 2010. Subcutaneous allergen immunotherapy restores human dendritic cell innate immune function. Clin. Exp. Allergy. 40: 94-102.
17. Hartmann, G., J. Battiany, H. Poeck, M. Wagner, M. Kerkmann, N. Lubenow, S. Rothenfusser, and S. Endres. 2003. Rational design of new CpG oligonucleotides that combine В cell activation with high IFN-a induction in plasmacytoid dendritic cells. Eur. J. Immunol. 33: 1633-1641.
18. Abel, K., Y. Wang, L. Fritts, E. Sanchez, E. Chung, P. Fitzgerald-Bocarsly, A.M. Krieg, and C.J. Miller. 2005. Deoxycytidyl-deoxyguanosine oligonucleotide classes A, B, and С induce distinct cytokine gene expression patterns in rhesus monkey peripheral blood mononuclear cells and distinct alpha interferon responses in TLR9-expressing rhesus monkey plasmacytoid dendritic cells. Clin Diagn. Lab Immunol 12: 606-621.
19. Puig, M., K.W. Tosh, L.M. Schramm, L.T. Grajkowska, K.D. Kirschman, C. Tami, J. Beren, R.L. Rabin, and D. Verthelyi. 2012. TLR9 and TLR7 agonists mediate distinct type I IFN responses in humans and nonhuman primates in vitro and in vivo. J Leukoc. Biol. 91: 147-158.
20. Hartmann, G., J. Battiany, H. Poeck, M. Wagner, M. Kerkmann, N. Lubenow, S. Rothenfusser, and S. Endres. 2003. Rational design of new CpG oligonucleotides that combine В cell activation with high IFN-a induction in plasmacytoid dendritic cells. Eur. J. Immunol. 33: 1633-1641.
21. Hartmann, G., J. Battiany, H. Poeck, M. Wagner, M. Kerkmann, N. Lubenow, S. Rothenfusser, and S. Endres. 2003. Rational design of new CpG oligonucleotides that combine В cell activation with high IFN-a induction in plasmacytoid dendritic cells. Eur. J. Immunol. 33: 1633-1641.
22. Arndt, K.M., K.M. Muller, and A. Pluckthun. 2001. Helix-stabilized Fv (hsFv) antibody fragments: substituting the constant domains of a Fab fragment for a heterodimeric coiled-coil domain. J Mol. Biol. 312: 221-228.
23. Puig, M., K.W. Tosh, L.M. Schramm, L.T. Grajkowska, K.D. Kirschman, C. Tami, J. Beren, R.L. Rabin, and D. Verthelyi. 2012. TLR9 and TLR7 agonists mediate distinct type I IFN responses in humans and nonhuman primates in vitro and in vivo. J Leukoc. Biol. 91: 147-158.
24. Puig, M., K.W. Tosh, L.M. Schramm, L.T. Grajkowska, K.D. Kirschman, C. Tami, J. Beren, R.L. Rabin, and D. Verthelyi. 2012. TLR9 and TLR7 agonists mediate distinct type I IFN responses in humans and nonhuman primates in vitro and in vivo. J Leukoc. Biol. 91: 147-158.
25. Puig, M., K.W. Tosh, L.M. Schramm, L.T. Grajkowska, K.D. Kirschman, C. Tami, J. Beren, R.L. Rabin, and D. Verthelyi. 2012. TLR9 and TLR7 agonists mediate distinct type I IFN responses in humans and nonhuman primates in vitro and in vivo. J Leukoc. Biol. 91: 147-158.
26. Abel, K., Y. Wang, L. Fritts, E. Sanchez, E. Chung, P. Fitzgerald-Bocarsly, A.M. Krieg, and C.J. Miller. 2005. Deoxycytidyl-deoxyguanosine oligonucleotide classes A, B, and С induce distinct cytokine gene expression patterns in rhesus monkey peripheral blood mononuclear cells and distinct alpha interferon responses in TLR9-expressing rhesus monkey plasmacytoid dendritic cells. Clin Diagn. Lab Immunol 12: 606-621.
27. Lund, J., A. Sato, S. Akira, R. Medzhitov, and A. Iwasaki. 2003. Toll-like receptor 9-mediated recognition of herpes simplex virus-2 by plasmacytoid dendritic cells. J. Exp.Med. 198: 513-520.
28. Plitas, G., B.M. Burt, H.M. Nguyen, Z.M. Bamboat, and R.P. Dematteo. 2008. Toll-like receptor 9 inhibition reduces mortality in polymicrobial sepsis. J. Exp. Med. 205: 1277-1283.
29. Ashman, R.F., J.A. Goeken, E. Latz, and P. Lenert. 2011. Optimal oligonucleotide sequences for TLR9 inhibitory activity in human cells: lack of correlation with TLR9 binding. Int. Immunol. 23: 203-214.
30. Tel, J., N. Beenhakker, G. Koopman, B. Hart, G.C. Mudde, and V. de, I. 2012. Targeted delivery of CpG ODN to CD32 on human and monkey plasmacytoid dendritic cells augments IFNalpha secretion. Immunobiology. 217: 1017-1024.
31. Van Reijsen, F.C, C.A.F.M. Bruijnzeel-Koomen, F.S. Kalthoff, E. Maggi, S. Romagnani, J.K.T. Westland, and G.C. Mudde. 1992. Skin-derived aeroallergen-specific T-cell clones of Th2 phenotype in patients with atopic dermatitis. J. Allergy Clin. Immunol. 90: 184-193.
32. Litowski, J.R. and R.S. Hodges. 2002. Designing heterodimeric two-stranded alpha-helical coiled-coils. Effects of hydrophobicity and alpha-helical propensity on protein folding, stability, and specificity. J. Biol. Chem. 277: 37272-37279.
33. Chao, H., D.L. Bautista, J. Litowski, R.T. Irvin, and R.S. Hodges. 1998. Use of a heterodimeric coiled-coil system for biosensor application and affinity purification. J. Chromatogr. В Biomed. Sci. Appl. 715: 307-329.
34. Litowski, J.R. and R.S. Hodges. 2002. Designing heterodimeric two-stranded alpha-helical coiled-coils. Effects of hydrophobicity and alpha-helical propensity on protein folding, stability, and specificity. J. Biol. Chem. 277: 37272-37279.
35. Greenman, J., A.L. Tutt, A.J. George, K.A. Pulford, G.T. Stevenson, and M.J. Glennie. 1991. Characterization of a new monoclonal anti-Fc gamma RII antibody, AT10, and its incorporation into a bispecific F(ab')2 derivative for recruitment of cytotoxic effectors. Mol. Immunol 28: 1243-1254.
36. Looney, R.J., G.N. Abraham, and C.L. Anderson. 1986. Human monocytes and U937 cells bear two distinct Fc receptors for IgG. J Immunol. 136: 1641-1647.
37. Macintyre, E.A., P.J. Roberts, R. bdul-Gaffar, K. O'Flynn, G.R. Pilkington, F. Farace, J. Morgan, and D.C. Linch. 1988. Mechanism of human monocyte activation via the 40-kDa Fc receptor for IgG. J Immunol. 141: 4333-4343.
38. Krug, A, S. Rothenfusser, V. Hornung, B. Jahrsdorfer, S. Blackwell, Z.K. Ballas, S. Endres, A.M. Krieg, and G. Hartmann. 2001. Identification of CpG oligonucleotide sequences with high induction of IFN-alpha/beta in plasmacytoid dendritic cells. Eur J Immunol. 31: 2154-2163.
39. Krieg, A.M., A.K. Yi, S. Matson, T.J. Waldschmidt, G.A. Bishop, R. Teasdale, G.A. Koretzky, and D.M. Klinman. 1995. CpG motifs in bacterial DNA trigger direct B-cell activation. Nature. 374: 546-549.
40. Hartmann, G., J. Battiany, H. Poeck, M. Wagner, M. Kerkmann, N. Lubenow, S. Rothenfusser, and S. Endres. 2003. Rational design of new CpG oligonucleotides that combine В cell activation with high IFN-alpha induction in plasmacytoid dendritic cells. Eur J Immunol. 33: 1633-1641.
41. Tel, J., N. Beenhakker, G. Koopman, B. Hart, G.C. Mudde, and V. de, I. 2012. Targeted delivery of CpG ODN to CD32 on human and monkey plasmacytoid dendritic cells augments IFNalpha secretion. Immunobiology. 217: 1017-1024.
42. Chao, H., D.L. Bautista, J. Litowski, R.T. Irvin, and R.S. Hodges. 1998. Use of a heterodimeric coiled-coil system for biosensor application and affinity purification. J. Chromatogr. В Biomed. Sci. Appl. 715: 307-329.
43. Litowski, J.R. and R.S. Hodges. 2001. Designing heterodimeric two-stranded alpha-helical coiled-coils: the effect of chain length on protein folding, stability and specificity. J. Pept. Res. 58: 477-492.
44. Litowski, J.R. and R.S. Hodges. 2002. Designing heterodimeric two-stranded alpha-helical coiled-coils. Effects of hydrophobicity and alpha-helical propensity on protein folding, stability, and specificity. J. Biol. Chem. 277: 37272-37279.
45. Berntzen, G., J.T. Andersen, K. Ustgard, T.E. Michaelsen, S.A. Mousavi, J.D. Qian, P.E. Kristiansen, V. Lauvrak, and I. Sandlie. 2009. Identification of a high affinity Fcgamma RIIA binding peptide that distinguishes Fcgamma RIIA from Fcgamma RIIB and exploits Fcgamma RIIA mediated phagocytosis and degradation. J. Biol. Chem. 284: 1126-1135.
46. Chao, H., D.L. Bautista, J. Litowski, R.T. Irvin, and R.S. Hodges. 1998. Use of a heterodimeric coiled-coil system for biosensor application and affinity purification. J. Chromatogr. В Biomed. Sci. Appl. 715: 307-329.
47. Litowski, J.R. and R.S. Hodges. 2001. Designing heterodimeric two-stranded alpha-helical coiled-coils: the effect of chain length on protein folding, stability and specificity. J. Pept. Res. 58: 477-492.
48. Litowski, J.R. and R.S. Hodges. 2002. Designing heterodimeric two-stranded alpha-helical coiled-coils. Effects of hydrophobicity and alpha-helical propensity on protein folding, stability, and specificity. J. Biol. Chem. 277: 37272-37279.
49. Chao, H., D.L. Bautista, J. Litowski, R.T. Irvin, and R.S. Hodges. 1998. Use of a heterodimeric coiled-coil system for biosensor application and affinity purification. J. Chromatogr. В Biomed. Sci. Appl. 715: 307-329.
50. Litowski, J.R. and R.S. Hodges. 2001. Designing heterodimeric two-stranded alpha-helical coiled-coils: the effect of chain length on protein folding, stability and specificity. J. Pept. Res. 58: 477-492.
51. Litowski, J.R. and R.S. Hodges. 2002. Designing heterodimeric two-stranded alpha-helical coiled-coils. Effects of hydrophobicity and alpha-helical propensity on protein folding, stability, and specificity. J. Biol. Chem. 277: 37272-37279.
52. Chao, H., D.L. Bautista, J. Litowski, R.T. Irvin, and R.S. Hodges. 1998. Use of a heterodimeric coiled-coil system for biosensor application and affinity purification. J. Chromatogr. В Biomed. Sci. Appl. 715: 307-329.
53. Litowski, J.R. and R.S. Hodges. 2001. Designing heterodimeric two-stranded alpha-helical coiled-coils: the effect of chain length on protein folding, stability and specificity. J. Pept. Res. 58: 477-492.
54. Litowski, J.R. and R.S. Hodges. 2002. Designing heterodimeric two-stranded alpha-helical coiled-coils. Effects of hydrophobicity and alpha-helical propensity on protein folding, stability, and specificity. J. Biol. Chem. 277: 37272-37279.
55. Chao, H., D.L. Bautista, J. Litowski, R.T. Irvin, and R.S. Hodges. 1998. Use of a heterodimeric coiled-coil system for biosensor application and affinity purification. J. Chromatogr. В Biomed. Sci. Appl. 715: 307-329.
56. Litowski, J.R. and R.S. Hodges. 2001. Designing heterodimeric two-stranded alpha-helical coiled-coils: the effect of chain length on protein folding, stability and specificity. J. Pept. Res. 58: 477-492.
57. Litowski, J.R. and R.S. Hodges. 2002. Designing heterodimeric two-stranded alpha-helical coiled-coils. Effects of hydrophobicity and alpha-helical propensity on protein folding, stability, and specificity. J. Biol. Chem. 277: 37272-37279.
58. Sallusto, F. and A. Lanzavecchia. 1994. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor a. J. Exp. Med. 179: 1109-1118.
59. Mudde, G.C, F.C. Van Reijsen, G.J. Boland, G.C. De Gast, P.L.B. Bruijnzeel, and C.A.F.M. Bruijnzeel-Koomen. 1990. Allergen presentation by epidermal Langerhans' ceils from patients with atopic dermatitis is mediated by IgE. Immunology 69: 335-341.
60. Santamaria, L.F., R. Bheekha, F.C. Van Reijsen, M.T. Perez Soler, M. Suter, C.A.F.M. Bruijnzeel-Koomen, and G.C. Mudde. 1993. Antigen focusing by specific monomeric immunoglobulin E bound to CD23 on Epstein-Barr virus-transformed В cells. Hum. Immunol. 37: 23-30.
61. Mudde, G.C, I.G. Reischl, N. Corvaїa, A. Hren, and E.-M. Pöllabauer. 1996. Antigen presentation in allergic sensitization. Immunol. Cell Biol. 74: 167-173.
62. Maurer, D., C. Ebner, B. Reininger, E. Fiebiger, D. Kraft, J.-P. Kinet, and G. Stingl. 1995. The high affinity IgE receptor (FceRI) mediates IgE-dependent allergen presentation. J. Immunol. 154: 6285-6290.
Реферат
Изобретение относится к биотехнологии. Описана иммунорегуляторная вакцина, содержащая первую часть, содержащую по меньшей мере направленную против CD32 молекулу, соединенную с лигандом TLR9 и первой пептидной альфа-спиралью, и вторую часть с по меньшей мере одним эпитопом и второй пептидной альфа-спиралью, скрученной с первой альфа-спиралью, в результате чего образуется суперспираль, при этом указанные первая и вторая части связаны между собой посредством образования указанной суперспирали, причем указанные первая и вторая альфа-спирали представляют собой две различные спирали и при этом указанная суперспираль представляет собой гетероспираль, образованную указанными двумя различными спиралями. Также описан способ иммунотерапии для лечения аллергических заболеваний у пациента, включающий введение указанному пациенту эффективного количества вакцины, при этом в указанной вакцине указанная направленная против CD32 молекула направлена против CD32a и CD32b. Кроме того, описан набор для получения вакцины. Представлен способ лечения субъекта, с целью вызвать направленный против иммуногена транзиторный иммунный ответ IgG, предпочтительно с определенным максимальным титром IgG, индуцированным после вакцинации, с последующим снижением титра на по меньшей мере 30%, предпочтительно на по меньшей мере 40%, или на по меньшей мере 50%, или на по меньшей мере 60%, или на по меньшей мере 70%, или на по меньшей мере 80%, или на по меньшей мере 90% или до 100% в течение 6 месяцев после вакцинации, включающий введение указанному субъекту эффективного количества вакцины, содержащей иммуногенную композицию, содержащую первую часть, содержащую по меньшей мере направленную против CD32 молекулу, соединенную с лигандом TLR9, и иммуноген, который связан с указанной первой частью предпочтительно путем присоединения или аффинного связывания. 4 н. и 15 з.п. ф-лы, 12 ил., 3 табл., 18 пр.

Комментарии