Вакцинация с помощью рекомбинантных дрожжей с формированием защитного гуморального иммунного ответа против определенных антигенов - RU2630620C2
Код документа: RU2630620C2
Чертежи























Описание
Область техники
Изобретение относится к рекомбинантным дрожжам для формирования гуморального иммунного ответа против определенных антигенов, к получению этих дрожжей и к их применению для защитной вакцинации против патогенных микроорганизмов и злокачественных клеток, которые содержат эти антигены.
Предшествующий уровень техники
Вакцины применяют для предотвращения болезни (профилактические вакцины) или для лечения уже возникших болезней (иммунотерапевтические вакцины). Профилактические программы вакцинации в течение последних примерно 100 лет внесли большой вклад в снижение инфекционных болезней. Иммунотерапевтические вакцины разрабатывают и применяют в течение всего примерно 20 лет, например против стойких инфекций вирусами, бактериями или паразитами или против канцерогенных болезней. Целью вакцинации является формирование клеточного (то есть, по существу, опосредованного Т-клетками и NK-клетками) и/или гуморального (то есть, по существу, опосредованного В-клетками/антителами) иммунного ответа и иммунологической памяти против антигенных компонентов патогенных микроорганизмов или злокачественных (опухолегенных) клеток.
Классические вакцины содержат целые возбудители болезней в аттенуированной (инактивированной) или убитой форме, включая их генетический материал - нуклеиновые кислоты в форме ДНК или РНК. Для производства этих классических вакцин обычно необходимы особые меры предосторожности, и/или использование экспериментальных животных, и/или использование культур клеток; кроме того, часто их трудно хранить и транспортировать или необходимо хранить и транспортировать в охлажденном или замороженном состоянии. Кроме того, они таят в себе опасность того, что вещества, используемые при производстве (например, из экспериментального животного или из культуры клеток), вызовут побочные эффекты в вакцинированном животном, или что произойдет нежелательная реактивация возбудителя. Проблемы существуют и с диагностикой: так, например, в случае вакцинации сельскохозяйственных животных вакцинированные животные могут не отличаться от естественно инфицированных животных, так что может не сработать система раннего оповещения, которая основана на выявлении новых инфекций. Поэтому разработаны так называемые «субъединичные» вакцины, которые содержат только части возбудителя. Предпосылкой для этого является знание «основных антигенов» соответствующих возбудителей болезней. Основные антигены, в основном, являются компонентами поверхности возбудителя, которые могут распознаваться иммунной системой, например белки оболочки вируса или капсида вируса. Они могут и в отсутствие целой вирусной частицы вызывать в организме-хозяине гуморальный и/или клеточный иммунный ответ и иммунологическую память против вируса. Так как при «субклеточной вакцинации» также отсутствуют типичные компоненты возбудителя, то посредством дифференциальной диагностики можно отличить вакцинированных индивидуумов от естественно инфицированных; поэтому говорят также о «субъединичной маркерной вакцине». Недостатками многих субъединичных вакцин часто являются дорогостоящее производство и недостаточная иммуногенность: если самих возбудителей болезней можно эффективно культивировать (с вышеуказанными ограничениями), то их основные антигены необходимо получать дорогостоящими и часто неэффективными способами генной инженерии и очищать трудоемкими способами. Соответственно, полученные таким образом субъединичные вакцины являются чувствительными, их также часто необходимо хранить и транспортировать в охлажденном виде, и они имеют ограниченную сохраняемость. По этим причинам большая часть массовых вакцин по-прежнему базируется на классическом принципе с использованием целых возбудителей болезней. Например, большая часть вакцин против широко распространенной болезни домашней птицы - инфекционного бурсита (IBD; от англ. infectious bursal disease) - основана в настоящее время на аттенуированных (ослабленных) или инактивированных вирусах инфекционного бурсита кур (IBDV; от англ. infectious bursal disease virus), вызывающих IBD.
Проблему, связанную с более слабой иммуногенностью субъединичных вакцин, пытаются компенсировать за счет дополнительного применения адъювантов. Адъюванты - это вещества, которые эмпирически признаны иммуностимулирующими. Они неспецифическим и часто малопонятным образом усиливают иммунный ответ. В настоящее время лишь немногие адъюванты разрешены для применения у людей. Единственными вспомогательными средствами, которые разрешены, например, в США для применения у людей, являются соли алюминия, гидроксид алюминия и фосфат алюминия. Однако композиции, содержащие соли алюминия, создают дополнительные трудности при хранении соответствующих вакцин. Кроме того, эти адъюванты обеспечивают достаточную эффективность не со всеми антигенами.
Генно-инженерное производство чужеродных белков, к которым относится большинство субъединичных вакцин, можно осуществлять в различных клетках-хозяевах. Кроме кишечной бактерии Escherichia coli, используют клетки млекопитающих, которые могут размножаться в клеточных культурах, растительные клетки и различные грибы. Микробиологические системы, такие как бактерии и грибы, можно особенно экономично культивировать в большом масштабе. Дрожжевые клетки родов Saccharomyces, Pichia и Kluyveromyces уже в течение нескольких десятилетий рутинно используют для экспрессии чужеродных белков. По сравнению с бактериями, дрожжевые клетки имеют преимущество в том, что они являются эукариотическими, то есть во многих аспектах они сходны с животными клетками, а эукариотические белки, то есть белки, которые образуются и/или должны быть функциональными в животных клетках, могут быть экономично получены в дрожжах в нативной или близкой к нативной форме (Bathurst, 1994; Gellissen & Hollenberg, 1997). Дрожжи вначале использовали только для получения чужеродных белков, и белки, выделенные из дрожжевых клеток, очищали и использовали в качестве субъединичной вакцины. Только недавно стали пытаться вводить в качестве вакцины сами дрожжи или клеточные фракции дрожжей.
Примерно в течение 5 лет пытаются использовать для вакцинации Saccharomyces cerevisiae («хлебопекарные дрожжи»; S. cerevisiae); так, удалось показать, что за счет подкожно введенных антиген-экспрессирующих клеток S. cerevisiae активируются дендритные клетки, и можно вызвать антиген-специфические Т-клеточные иммунные ответы, в частности, специфические цитотоксические Т-клеточные ответы против определенных антигенов. Этот клеточный иммунный ответ проявил себя как защитный против введения определенных опухолевых клеток, то есть у вакцинированных животных после вакцинации возникло меньше опухолей, чем у контрольных животных. Этот способ в настоящее время также испытывают в иммунотерапевтических применениях при опухолевых заболеваниях (Stubbs et al., 2001; Lu et al., 2004).
Специалисту в данной области техники известны следующие публикации из предшествующего уровня техники, в которых описана вакцинация на основе дрожжей: ряд патентов США, например публикации 20090304741, 5830463 и 10738646, и 20070166323, в которых описано применение S. cerevisiae, содержащих по меньшей мере один рекомбинантный антиген, в иммунотерапии. Показано, что эти дрожжи эффективно стимулируют иммунный ответ, в частности клеточно-опосредованный иммунный ответ.
В публикации WO/2006/044923 описаны дрожжи (S. cerevisiae), которые рекомбинантно экспрессируют различные белки вируса гепатита С (HCV; от англ. Hepatitis С virus), и которые могут вызывать иммунную реакцию, прежде всего Т-клеточный ответ, против этих белков HCV и должны использоваться в качестве вакцины против хронического гепатита С.
В публикации WO/2007/092792 описано возможное применение рекомбинантных S. cerevisiae против инфекций вирусом гриппа, при котором используют комбинации различных штаммов дрожжей, введение которых приводит к активации Т-клеток, а также клеточного иммунного ответа.
Публикация WO/2011/032119 относится к способу повышения эффективности иммунотерапии на основе дрожжей у пациентов. Способ включает средство на основе дрожжей, которое модулирует продукцию или выживаемость клеток CD4+ ТН17.
Ни в одном из доступных патентов по достоверным сведениям не использовали дрожжи для индукции защитного гуморального иммунного ответа против инфекционных болезней или опухолей (тема данной заявки). Кроме того, не использовали ни дрожжи Saccharomyces cerevisiae или Pichia pastoris, ни Kluyveromyces lactis (тема данной заявки).
Как и S. cerevisiae, «молочные дрожжи» Kluyveromyces lactis (К. Lactis) имеют статус GRAS (от англ. generally regarded as safe; «признанный безвредным»), то есть они пригодны для применения у животного или человека (van Ooyen et al., 2006). Хотя морфологически они очень похожи на хлебопекарные дрожжи S. cerevisiae, направления развития обоих родов в течение более чем 100 миллионов лет расходились от общего предка в различных направлениях. Поэтому К. lactis по многим свойствам принципиально отличается от S. cerevisiae. Некоторые из этих различий имеют большое значение для применимости в биотехнологических прикладных задачах. Эволюция S. cerevisiae принесла с собой специализацию обмена веществ по типу спиртового брожения и поэтому - утрату многих генов предка. Однако спиртовое брожение нетипично для большинства дрожжей. Оно осуществляется в S. cerevisiae при высоких концентрациях глюкозы даже в том случае, когда имеется кислород, и митохондриальное дыхание по существу обеспечивает гораздо более эффективное получение энергии из обмена Сахаров: функция митохондрий, «силовых станций» клетки, в значительной степени подавлено «репрессией глюкозой». К. lactis существенно отличается от S. cerevisiae регуляцией функции митохондрий (Chen and Clark-Walker, 1995; Clark-Walker, 2007). В отличие от S. cerevisiae, К. lactis относится к так называемым «крэбтри-отрицательным» дрожжам. Такие дрожжи в жестких аэробных условиях, как правило, не образуют этанол, а полностью разлагают глюкозу до С02 с образованием АТФ за счет митохондриальной активности. Это физиологическое свойство имеет фундаментальное значение, так как оно приводит к заметному повышению выхода биомассы при ферментации в крупном масштабе, следствием чего является заметное снижение затрат при использовании этих дрожжей в качестве продуцентов рекомбинантных белков. Кроме того, исследования, проведенные на К. lactis, показали, что мутации в опосредованном гексокиназой сигнальном пути глюкозы могут улучшать экспрессию гетерологичных генов (Donnini et al., 2004). Сниженная репрессия глюкозой, особенно респираторных генов, является признаком «крэбтри-отрицательных» дрожжей и может быть связана с эмпирически наблюдавшейся лучшей экспрессией чужеродных генов в таких дрожжах.
Кроме того, К. lactis и S. cerevisiae обнаруживают значительные различия в составе глюканов клеточной стенки (Backhaus et al., 2011); эти различия предположительно основаны на различных гликозилтрансферазах в аппарате Гольджи, которые участвуют в созревании гликопротеинов: так, гликопротеины в S. cerevisiae содержат большое количество маннозофосфатов, а гликопротеины в К. lactis прежде всего содержат N-ацетилглюкозамины (Raschke and Ballou, 1972). Можно предположить, что эти различия между S. cerevisiae и К. lactis при гликозилировании и секреции белков, а также при биосинтезе клеточной стенки оказывают значительное влияние на внутриклеточную локализацию, фолдинг и стабильность, а значит - на иммуногенность гетерологично экспрессированных чужеродных белков (Uccelletti et al., 2004).
В публикации WO/2010/054649 описано получение рекомбинантной системы К. lactis. В приведенных в ней примерах осуществления изобретения рекомбинантные штаммы, производные от штамма VAK367-D4, использовали для мукозальной или оральной вакцинации против различных антигенов. Однако недостатком оральной/мукозальной вакцинации является то, что для достижения защитной иммунизации вакцины необходимо использовать в больших количествах.
Краткое описание графических материалов
Фиг. 1 схематически изображает получение вакцинного штамма VAK887, который содержит чужеродный ген VP2 вируса инфекционного бурсита кур (IBDV), посредством гомологичной рекомбинации в исходном штамме VAK367-D4. Посредством трансформации плазмиды Klp3-MCS (последовательность SEQ Ю No.: 10), которая содержит ген VP2 штамма D78 IBDV, чужеродный ген VP2 посредством гомологичной рекомбинации был включен в хромосомный локус LAC4, который был разрушен посредством вставки гена URA3. При рекомбинации в геноме хозяина ген URA3 был заменен на ген VP2 и снова был получен ген LAC4; рекомбинантные штаммы дрожжей можно было получить посредством селекции на лактозной среде без урацила. В дальнейшем экспрессия LAC4 (В-галактозидазы) регулируется через промотор KIGAL80, а экспрессия гена VP2 - через промотор LAC4.
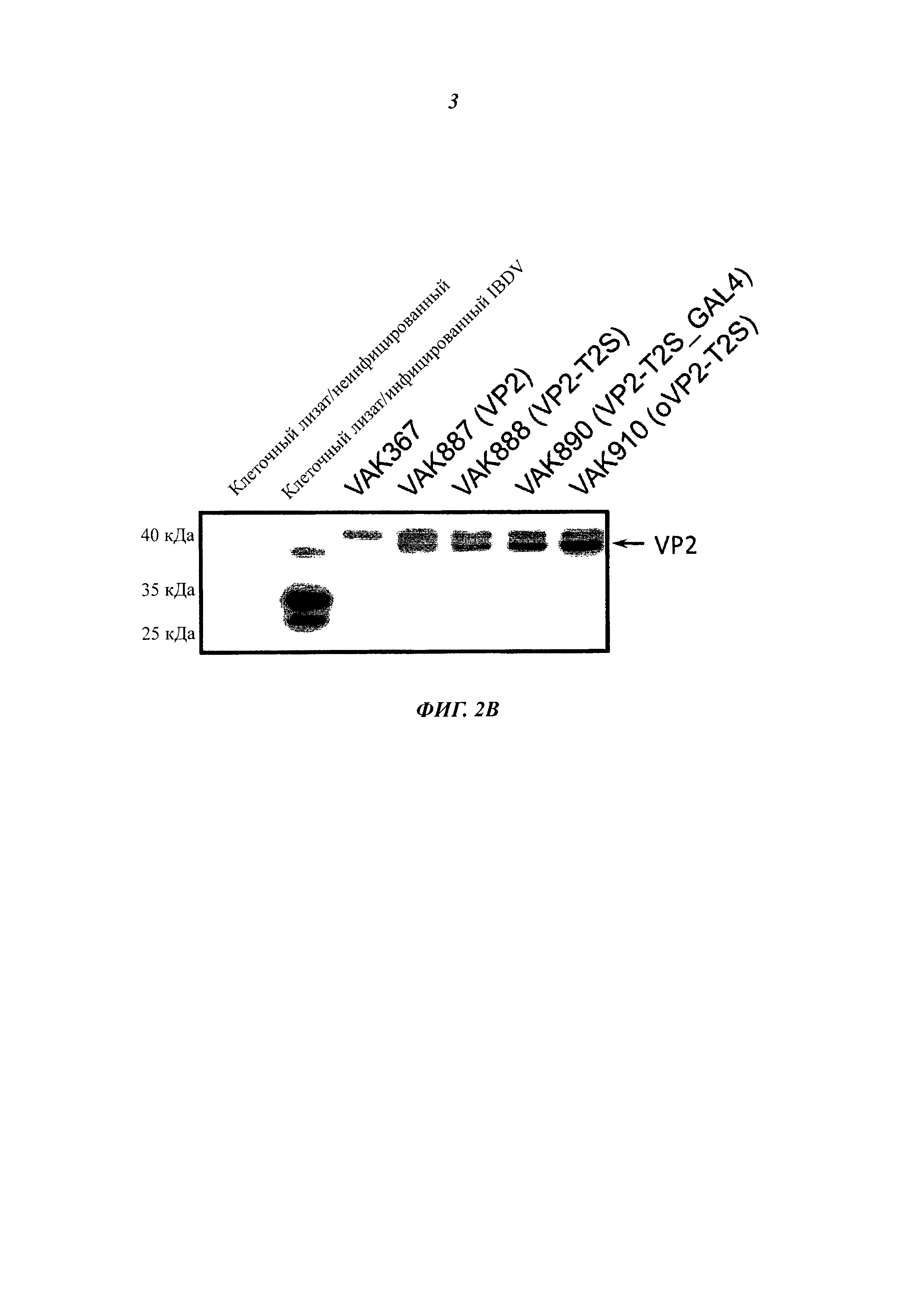
Фиг. 2А демонстрирует экспрессию гена VP2 IBDV штаммом VAK887 по сравнению с исходным штаммом (VAK367) и по сравнению с инфицированными IBDV клетками куриц посредством вестерн-анализа с VP2-специфическими антителом. Фиг. 2В демонстрирует анализ экспрессии рекомбинантного гена VP2 IBDV или мутированного гена VP2-T2S в различных экспрессирующих VP2 вариантах К. lactis. Исходный вариант VP2 (VAK887) К. lactis экспрессировал лишь умеренные количества вирусного белка. Экспрессию белка VP2 удалось повысить в штамме VP2-T2S (VAK888) К. lactis, в котором треонин в положении 2 последовательности аминокислот белка VP2 был заменен на серии. Дальнейшего повышения удалось достичь посредством повышения дозы гена KIGAL4 (VP2-T2S_GAL4=VAK890) или за счет использования оптимизированного к кодону дрожжей синтетического гена VP2 (oVP2-T2S=VAK910).
Фиг. 3 демонстрирует, что тепловая инактивация дрожжей согласно настоящему изобретению при 90°С в течение 2 часов не приводит к потере рекомбинантного белка VP2-T2S (Фиг. 3А). Способом SDS PAGE (электрофорез белков в полиакриламидном геле в присутствии додецилсульфата натрия) были выделены одинаковые количества белка из неактивированных дрожжей, инактивированных дрожжей и дрожжей из кормовой гранулы и испытаны в сравнении с клеточными лизатами из клеток домашней птицы, инфицированных или не инфицированных IBDV, посредством вестерн-блоттинга с антителами к VP2. Фиг. 3 также показывает, что количество VP2-T2S в варианте VAK890 составляет примерно 0,7 фг гетерологичного белка на одну дрожжевую клетку (Фиг. 3В). В этом случае определенные количества очищенного VP2-T2S в сравнении с VP2 из определенного числа клеток извлеченного из ферментера К. lactis (штамм VAK890) окрасили в вестерн-блоте и определили результат денситометрически.
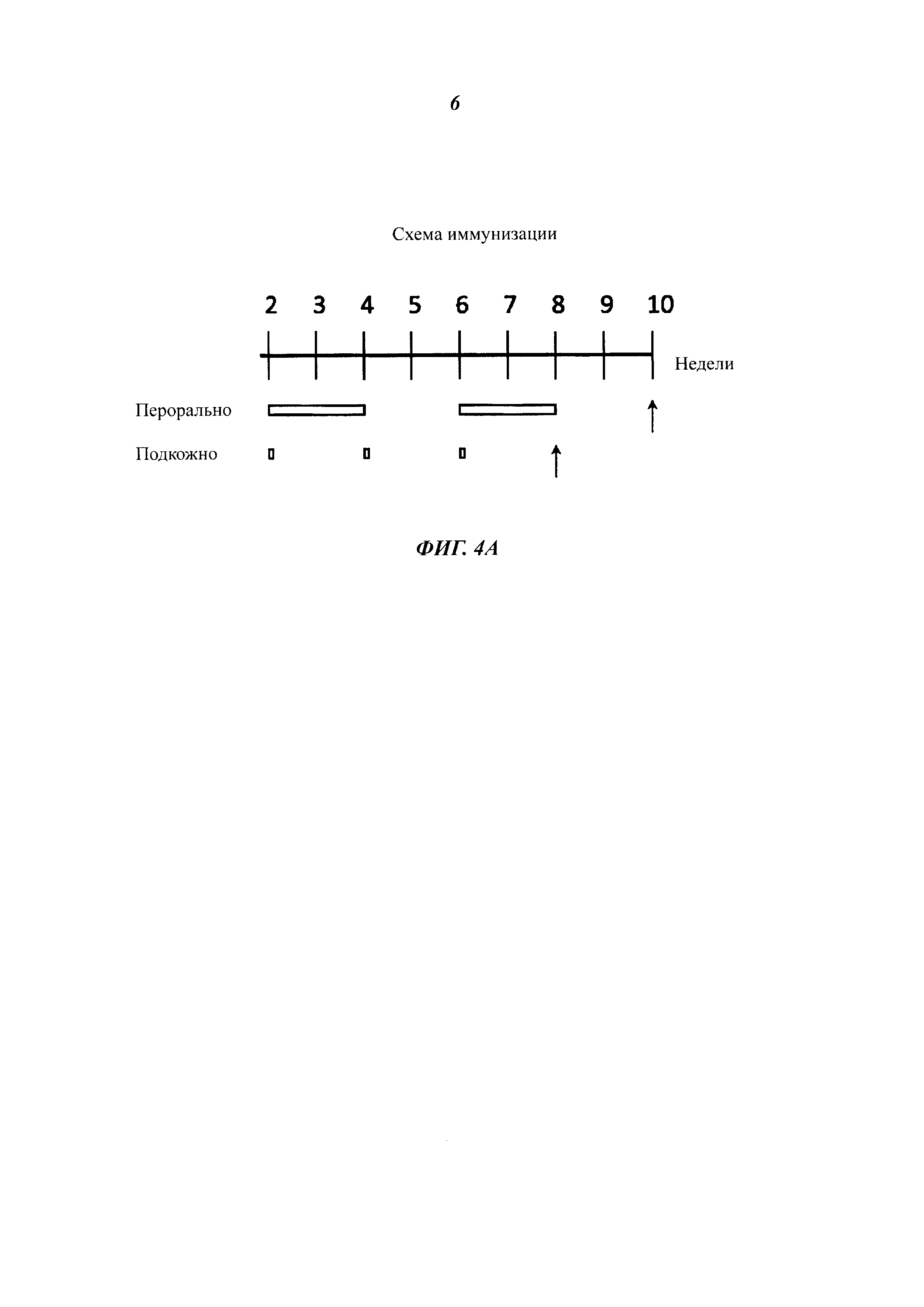
Фиг. 4 разъясняет вакцинацию мышей подкожно введенными, инактивированными теплом целыми дрожжевыми клетками варианта VAK890 К. lactis по сравнению с оральной вакцинацией целыми дрожжевыми клетками варианта VAK890 К. lactis. Фиг. 4А демонстрирует схему иммунизации: иммунизацию проводят подкожно три раза с двухнедельными паузами; для сравнения вакцину давали орально два раза в течение двух недель. Через две недели (стрелка) после последнего введения дрожжей пробы сыворотки обработанных мышей исследовали на наличие антител к VP2 посредством IBDV-специфического анализа ELISA (иммуноферментный твердофазный анализ) (Фиг. 4 В) и нейтрализационного анализа IBDV (Фиг. 4С). Фиг. 4D обобщает, что мыши, которые получали экспрессирующий VP2 К. lactis (штамм Kl VP2-T2S_GAL4 (VAK890)), имели более высокие титры антител/нейтрализующих антител, чем мыши, которые получали К. lactis дикого типа (штамм VAK367). Кроме того, было показано, что мыши, получавшие К. lactis (штамм VAK890) подкожно, имели заметно более высокий титр антител/нейтрализующих антител, чем мыши, получавшие К. lactis (штамм VAK890) орально. Мыши, которые были иммунизированы К. lactis (штамм 890) орально, разумеется, имели также более высокий титр антител/нейтрализующих антител, чем мыши, получавшие К. lactis дикого типа (штамм VAK367).
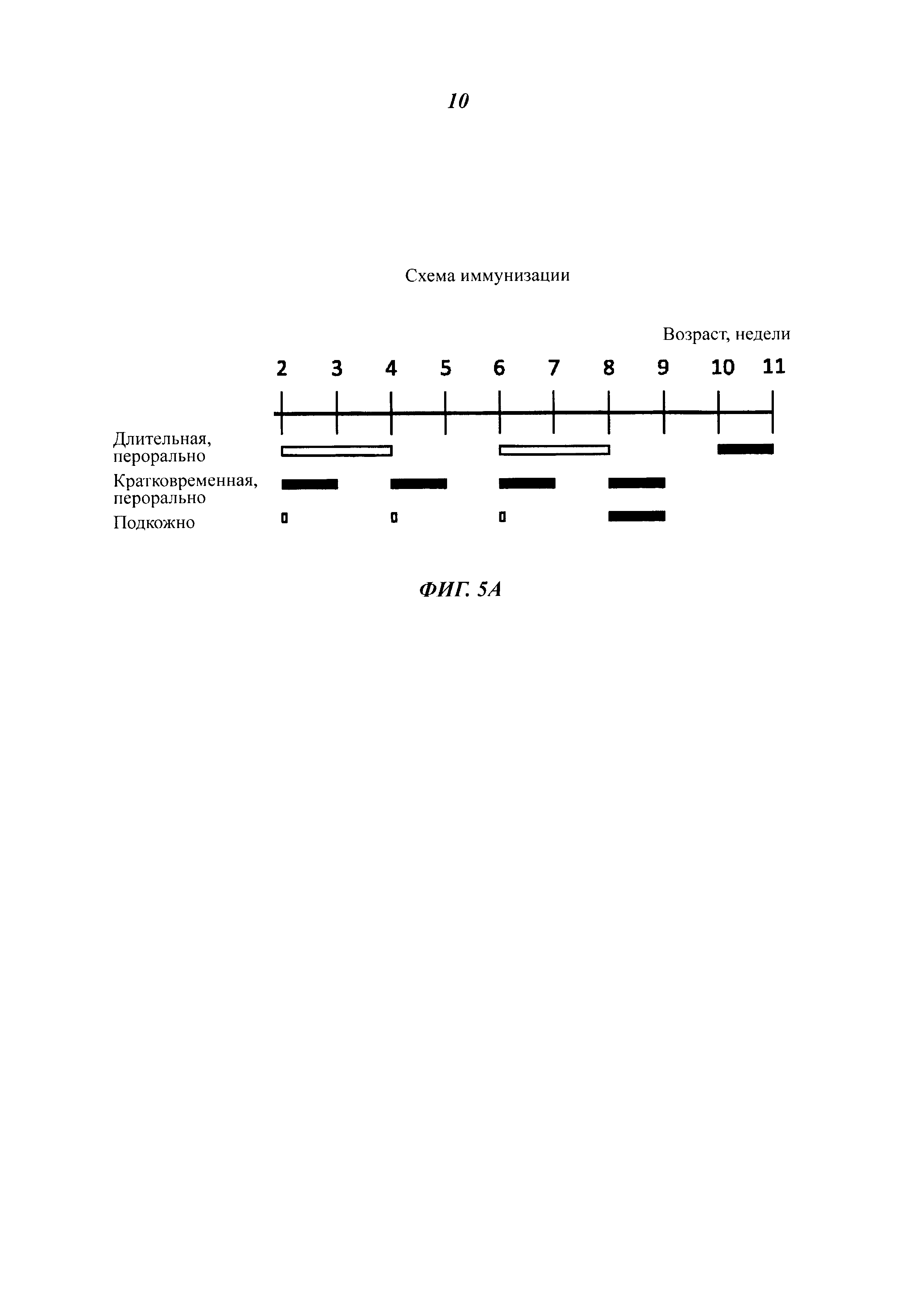
Фиг. 5 демонстрирует оральную и подкожную вакцинацию куриц инактивированными теплом целыми дрожжевыми клетками К. lactis варианта VP2-T2S_GAL4 (VAK890). Для оральной вакцинации использовали либо короткую схему 1/1/1/1/1 (1 неделя орально, 1 неделя паузы, 1 неделя орально и т.д.) или более длительную схему 2/2/2 (Фиг. 5А). После 1-недельной или 2-недельной паузы после вакцинации всех вакцинированных животных инфицировали IBDV (штамм Edgar) в концентрации, равной 100 EID50 (от англ. Egg Infective Dose; 50%-я инфицирующая доза для куриного эмбриона) на животное (вирусная нагрузка: черные полосы). После оральной вакцинации, в частности после использования более длительной схемы лечения, у некоторых животных удалось обнаружить повышенные титры нейтрализующих вирус антител. Напротив, подкожная вакцинация рекомбинантным К. lactis вызвала высокий титр нейтрализующих вирус антител у всех обработанных животных (Фиг. 5В. И 5С; IBDV-специфический анализ ELISA, нейтрализационный анализ IBDV). Ни одно из животных, получавших рекомбинантные дрожжи К. lactis, не погибло после заражения IBDV, независимо от того, какая схема лечения была использована. В противоположность этому, в контрольной группе показатель смертности составил от 10 до 35% (Фиг. 5С). Анализ поражений в фабрициевой сумке обработанных животных показал, что у примерно 10% животных, обработанных орально, после использования удлиненной схемы лечения не было признаков вирусной инфекции после инокуляции IBDV: при этом использовали так называемую «шкалу поражений» - оценки 1, 2 означают неповрежденные или почти неповрежденные фабрициевы сумки; оценки 3, 4 означают поврежденные и сильно поврежденные фабрициевы сумки. В противоположность этому все животные, которым рекомбинантный К. lactis штамма VAK890 вводили подкожно, продемонстрировали полную защиту от болезни прививкой против IBDV (Фиг. 5С).
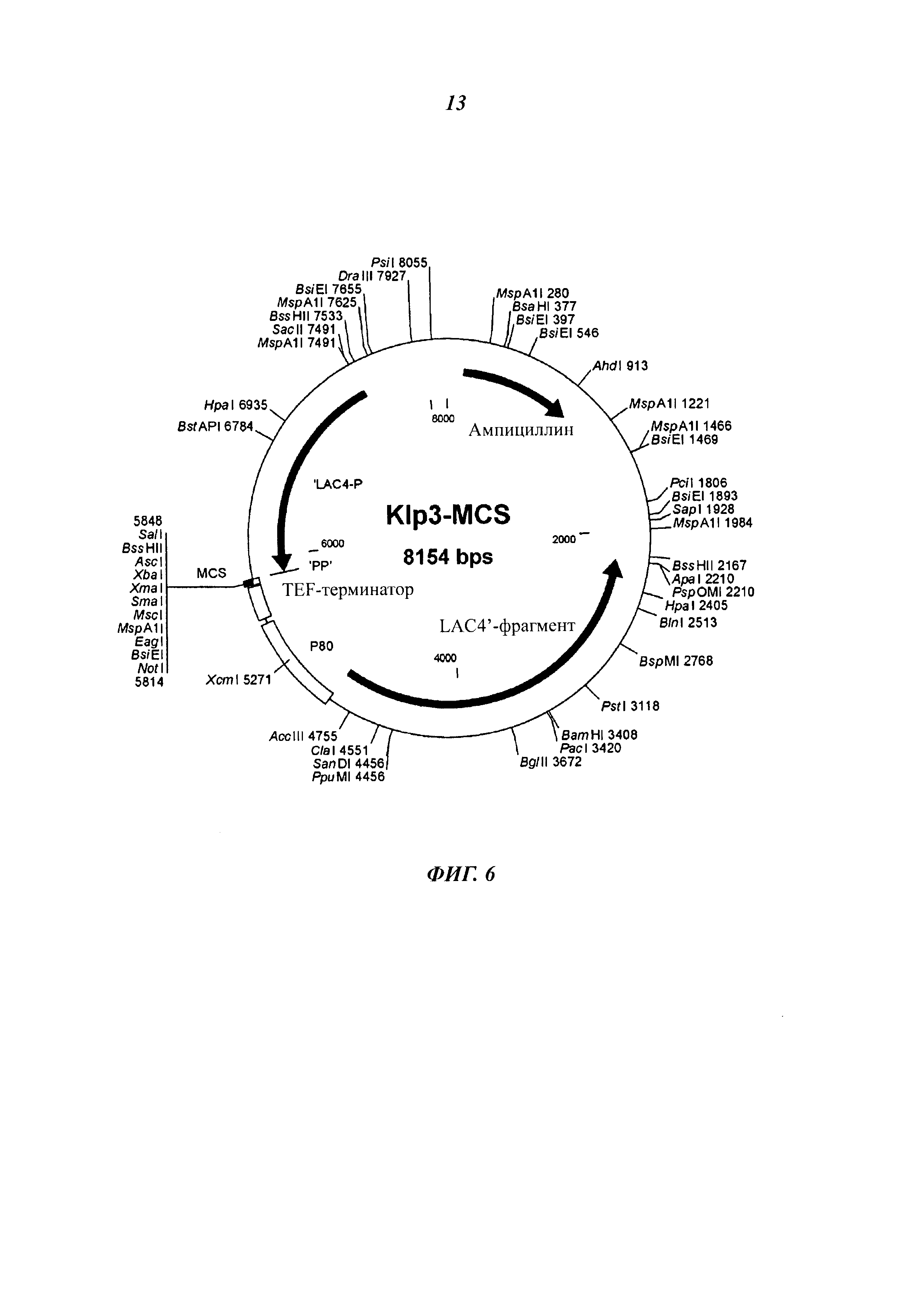
Фиг. 6 схематически изображает строение вектора Klp3-MCS (последовательность SEQ ID No.: 10).
Раскрытие изобретения
Возможность применения рекомбинантных дрожжей для подкожной вакцинации известна специалисту из предшествующего уровня техники: Stubbs et al. (2001) Nat. Med. 7: 625-629; Stubbs and Wilson (2002) Curr. Opin. Mol. Ther. 4: 35-40; Wansley et al. (2008) Clin. Cancer Res. 14: 4316-4325; US 5,830,463, WO/2006/044923; WO/2007/092792 и WO/2011/032119. Однако в примерах осуществления из этих публикаций работали исключительно с дрожжами Saccharomyces cerevisiae. «Дрожжи» - это собирательное понятие для одноклеточно растущих эукариотических микроорганизмов с отчасти очень различными свойствами вследствие дивергентной эволюции в течение сотен миллионов лет (примерно 100 миллионов лет для S. cerevisiae и К. lactis). Поэтому при использовании S. cerevisiae и К. lactis для целей вакцинации у высших эукариот, таких как животное или человек, следует исходить из того, что иммунный ответ, вызванный S. cerevisiae, значительно отличается от иммунного ответа, вызванного К. lactis. Это относится как к иммунному ответу против экспрессированных в дрожжах чужеродных антигенов, так и к иммунному ответу против собственных антигенов дрожжей. При подкожных иммунизациях целыми клетками S. cerevisiae была получена индукция Т-клеток, то есть клеточный иммунный ответ. Защитный гуморальный иммунный ответ против антигена, полученный с использованием рекомбинантного S. cerevisiae простым способом (то есть посредством прямого использования штамма, экспрессирующего единственный антиген), до сих пор не был подтвержден в предшествующем уровне техники.
Исходя из вышеизложенных предпосылок, была поставлена задача обеспечить способ, которым можно получить защитный гуморальный иммунный ответ против определенных антигенов. Следующая задача состояла в том, чтобы получить субъединичную маркерную вакцину, которая одновременно обладала бы сильными адъювантными свойствами и поэтому была бы сильно иммуногенной.
Эти задачи были решены за счет получения экспрессионной системы на основе дрожжей, которая позволяет целенаправленную интеграцию чужеродных генов в геном дрожжей. С помощью этой системы можно быстро (то есть в течение нескольких недель) получать рекомбинантные дрожжи, которые экспрессируют чужеродные гены. Дрожжи можно экономично размножать в ферментере в больших количествах (например, в килограммовом (кг) диапазоне). Посредством регулируемой экспрессии и ферментации способом культивирования с подпиткой в этой дрожжевой системе можно также экспрессировать цитотоксические антигены. После экспрессии чужеродного гена дрожжи инактивируют теплом, после чего их можно хранить и транспортировать в форме порошка без охлаждения. Порошкообразные дрожжи можно непосредственно, то есть без дальнейшего фракционирования, использовать либо в форме эмульсии, либо в форме гранул (см. примеры осуществления настоящего изобретения) в качестве субъединичной маркерной вакцины. Антигенная композиция и необходимый для эффективной, т.е. защитной, иммунизации адъювантный эффект обусловлены двумя факторами: (i) возможностью целенаправленной генно-инженерной модификации экспрессируемых чужеродных белков, (и) экспрессией чужеродных белков в дрожжах и непосредственным использованием дрожжей в пероральной или подкожной форме; сами дрожжи оказывают сильный адъювантный эффект. Предпочтительным является подкожное введение. Был получен рекомбинантный штамм дрожжей; он экспрессирует специфический вирусный антиген и в способе согласно настоящему изобретению может быть использован для подкожной вакцинации. Была достигнута полная профилактическая защита против инфекции соответствующим вирусом. При этом были использованы очень малые количества дрожжей (например, в миллиграммовом (мг) диапазоне при подкожном применении у домашней птицы). Для обеспечения этой защиты было необходимо лишь 2-3-кратное применение.
Способ согласно настоящему изобретению пригоден для применения как в области медицины человека, так и в области ветеринарной медицины. Предпочтительным является применение способа согласно настоящему изобретению в области ветеринарной медицины.
Способ согласно настоящему изобретению осуществляют с использованием дрожжей. Подходящими дрожжами являются, например, дрожжи родов Saccharomyces sp., Pichia sp.и Kluyveromyces sp.В предпочтительном варианте осуществления настоящего изобретения способ согласно настоящему изобретению осуществляют с использованием дрожжей рода Saccvharomyces sp.и Kluyveromyces sp. Особо предпочтительным при этом является использование Saccharomyces cerevisiae и Kluyveromyces lactis (К. lactis).
В наиболее предпочтительном варианте осуществления настоящего изобретения способ согласно настоящему изобретению осуществляют с использованием дрожжей Kluyveromyces lactis.
Дрожжи К. lactis относятся к так называемым дрожжам «пищевого качества», которые имеют статус GRAS (от англ. generally regarded as safe; «признанный безвредным»). Как и хлебопекарные дрожжи, которые проверены в течение нескольких тысяч лет и доказали свою пригодность в качестве пищевой добавки, часто встречающиеся в молочных продуктах дрожжи К. lactis являются безопасными при использовании в пищевой промышленности.
Кроме известной из предшествующего уровня техники возможности ферментации, дрожжи К. lactis обладают многочисленными преимуществами перед S. cerevisiae в отношении экспрессии гетерологичных генов. К. lactis относится к так называемым «петит-негативным» дрожжам, что означает, что потеря митохондриальной ДНК является летальной (из-за нарушения митохондриального мембранного потенциала (Chen et al., 1995; Clark-Walker, 2007)). Функция митохондрий тесно связана с Са2+-зависимой передачей сигнала, продукцией активных соединений кислорода, ответом клеток на стресс, гликозилированием белков и целостностью клеточной стенки. За счет этого функция митохондрий оказывает решающее влияние на продукцию рекомбинантных гликопротеинов и состав клеточной стенки.
У дрожжей и млекопитающих первые этапы N-гликозилирования белков, которые происходят в эндоплазматическом ретикулуме, одинаковы. Однако этапы, осуществляемые в аппарате Гольджи, различаются. Гликозилтрансферазы, находящиеся в аппарате Гольджи, различны у различных видов дрожжей. Из-за этого возникают различия в составе гликопротеинов клеточной стенки. В К. lactis гликопротеины содержат терминальные N-ацетилглюкозамины, в отличие от маннозофосфата у S. cerevisiae (Raschke und Ballou, 1972). При вакцинациях это может оказать значительное влияние на стимуляцию иммунной системы соответствующими видами дрожжей.
Повышенная секреция рекомбинантных белков в мутантах К. lactis с измененной а-1,6-маннозилтрансферазой (KIOCH1) демонстрирует связь между гликозилированием/секрецией белков и биосинтезом клеточной стенки (Uccelletti et al., 2004). Кроме того, изменения в гликозилировании белков влияют на внутриклеточную локализацию рекомбинантных белков, которые задерживаются на пути к секреции из-за неправильного фолдинга.
К. lactis - это один из немногих видов дрожжей, которые могут использовать лактозу как источник углерода и энергии. Лактоза - это дешевый сахар, который получают в больших количествах как компонент молочной сыворотки (например, как побочный продукт на молочных фермах). К. lactis при использовании лактозы может достигать таких же темпов роста, как и при использовании глюкозы. Регуляцию генов, участвующих в обмене лактозы, интенсивно исследовали. Сильный промотор β-галактозидазы (LAC4) может быть использован для регуляции экспрессии гетерологичных генов и продукции рекомбинантных белков (van Ooven et al., 2006; Breunig et al., 2000). Из-за сниженной репрессии глюкозой гетерологичная экспрессия генов в культурах К. lactis, которые культивировались в среде, содержащей глюкозу, может легко и эффективно быть индуцирована добавлением лактозы.
Согласно настоящему изобретению генно-инженерным способом был получен штамм К. lactis, предпочтительно VAK367-D4 и варианты этого штамма, который позволяет целенаправленную интеграцию чужеродных генов в локус LAC4 генома дрожжей (Фиг. 1). Эта интеграция требует лишь одного этапа с использованием соответствующим образом сконструированной плазмиды; селекция рекомбинантных штаммов возможна без использования генов резистентности к антибиотикам, а экспрессию чужеродных генов в рекомбинантных штаммах можно индуцировать через промотор LAC4 посредством добавления в среду лактозы. Клетки К. lactis с интегрированными чужеродными генами можно в течение нескольких недель получить этим способом и охарактеризовать. Оба аспекта этой системы имеют большое значение: во-первых, возможно воспроизводимое выращивание дрожжевых клеток, которые содержат заранее определенные количества чужеродных белков (Фиг. 2, 3). Во-вторых, при использовании для вакцинации против пластичных (легко изменяемых) антигенов (таких как, например, гемагглютинин - антиген вируса гриппа) за короткое время могут быть получены новые штаммы дрожжей, например - при возникновении новых, потенциально пандемичных штаммов вируса гриппа. При этом высока вероятность того, что полученные новые рекомбинантные штаммы К. lactis обладают сходными свойствами с уже испытанными штаммами (например, в отношении характеристик их роста в ферментере). За счет дополнительной интеграции генов трансактиватора KIGal4 в геном дрожжей можно дополнительно значительно повысить уровень экспрессии чужеродного гена (Kuger et al., 1990).
В следующем варианте осуществления настоящего изобретения способ согласно настоящему изобретению осуществлен с использованием особого штамма К. lactis - VAK367-D4 - и его потомков. Была получена серия (VAK) рекомбинантных вариантов, основанных на штамме VAK367-D4 К. lactis. В основном, эти варианты индуцируемо экспрессировали значительные количества чужеродного белка, или доменов этого чужеродного белка, или доменов этого чужеродного белка, слитых с доменами белков другого биологического вида. Использованные при этом домены белков другого биологического вида служат для целенаправленной стимуляции иммунного ответа (адъювантность) или целенаправленной компартментализации экспрессированных чужеродных белков в дрожжевой клетке. Кроме адъювантных эффектов, компартментализация экспрессированных чужеродных белков важна для оптимизации экспрессии или для формирования состава продуктов экспрессии.
В следующем варианте осуществления настоящего изобретения способ согласно настоящему изобретению осуществлен с использованием VAK367-D4 и его потомков в качестве субъединичной вакцины. Применение рекомбинантных К. lactis, которые экспрессируют лишь определенные белковые антигены (чужеродные белки), в качестве вакцины позволяет в ходе дифференциальной диагностики отличить вакцинированных индивидуумов от естественно инфицированных. Один из этих рекомбинантных штаммов К. lactis (см. примеры осуществления изобретения) был успешно использован для пероральной и подкожной вакцинации. При подкожном применении была получена полная защита индивидуумов, подвергшихся вакцинации.
В качестве «чужеродных белков» в контексте настоящего изобретения следует понимать любые пептиды, полипептиды и белки, которые пригодны для того, чтобы вызвать защитный иммунный ответ, предпочтительно защитный гуморальный иммунный ответ, у людей или у животного против патогенных микроорганизмов или пораженных раком клеток. Чужеродные белки могут происходить из любых возбудителей болезней или опухолей, у которых охарактеризованы антигены, способные самостоятельно индуцировать защитный иммунный ответ, предпочтительно защитный гуморальный иммунный ответ.
В предпочтительном варианте осуществления настоящего изобретения чужеродные белки происходят из возбудителей болезней (вирусов, бактерий, паразитов), у которых охарактеризованы антигены, способные самостоятельно индуцировать защитный иммунный ответ, предпочтительно защитный гуморальный иммунный ответ.
Это, например:
Чужеродные белки, происходящие от паразитов
Necator americanus; Ancylostoma duodenale: белок ASP, гемоглобин-разрушающие протеазы
Leishmanial gp63, 46 кДа антиген промастиготы, LACK
Plasmodium: белок CSP, CSA-1, CSA-3, ЕХР1, SSP2, STARP, SALSA, MSP1, MSP2, MSP3, АМА-1, GLURP, Pfs 25, Pfs 28, Pvs 25, Pvs 28, Pfs 48/45, Pfs 230
Schistosoma: TP1, Sm23, ShGSTs 26 и 28, парамиозин, паразитарный миозин, Sm 14
Чужеродные белки, происходящие от бактерий
Mycobacterium tuberculosis: Ag85A, Hsp65, R8307, 19 кДа, 45 кДа, 10.4
Helicobacter pylori: VacA, LagA, NAP, hsp, уреаза, каталаза
Streptococcus группы A: M, SCPA пептидаза, эндотоксины SPEA и SPEC, фибронектин-связывающий белок
Streptococcus pneumoniae: PspA, Psa A, BHV 3, BHV 4
Salmonella typhimurium: Vi антиген
Shigella: LPS
Vibrio cholerae: CTB
Escherichia coli: ETEC: LT, LT-ST, CTB
Yersinia pestis: F1, V
Чужеродные белки, происходящие из опухолевых клеток/опухолевых штаммов (опухолеассоциированные антигены, NFF)
СЕА
5Т4
MUC1
MART1
HER-2
Особо предпочтительны чужеродные белки, происходящие из вирусов
Caliciviridae (норовирусы, вирус гепатита Е (HEV; от англ.: hepatitis Е virus)): NV 60 кДа; HEV ORF2
Reoviridae (ротавирусы): VP7, VP4
Retroviridae (ВИЧ): Gag, Pol, Nef, Env, gp160, gp120, gp140, gp41
Flaviviridae (род Flavivirus: WNV, Dengue, YF, TBE, JEV): preM-Env, NS3, NS4, NS5
Flaviviridae (род Pestivirus BVDV, CSFV, BDV. Род Hepacivirus HCV (вирус гепатита С)): E1, E2, ERNA (Pesti), С, NS3, NS4, NS5
Hepadnaviridae (HBV (вирус гепатита В)): HBS антиген
Paramyxoviridae (Paramyxovirinae: PIV-1, PIV-2, Mumps, Sendai, PIV-2, PIV-4, Morbilli): M, HN, N, A
Paramyxoviridae (Pneumovirinae: RSV): F, G, SH, M
Rhabdoviridae (бешенство): G
Herpesviridae (EBV, HSV2): gp350/220 (EBV), gB2, gD2 ((HSV)
Coronaviridae (SARS): CoV, N, M, S
Orthomyxoviridae (грипп А, В): HA, NA, M1, M2, NP
Papillomaviridae: L2, E6, E7
В наиболее предпочтительном варианте осуществления настоящего изобретения чужеродные белки происходят от представителей семейства Birnaviridae, например от IBD-вируса, и способны индуцировать защитный иммунный ответ, предпочтительно защитный гуморальный ответ.
В предпочтительном варианте осуществления настоящего изобретения получен вариант VP2 (VAK887) штамма К. lactis VAK367-D4, который в качестве чужеродного белка экспрессирует капсид-формирующий антиген VP2 вируса инфекционного бурсита (IBDV, штамм D78) (последовательности SEQ ID No.: 1 и 2). Особо предпочтителен вариант VP2-T2S (VAK888) К. lactis VAK367-D4, в котором белок VP2 был мутирован в аминокислотной позиции 2 (замена треонина на серии; Jagadish et al. (1991)), и который содержит последовательность нуклеотидов или аминокислот согласно последовательностям SEQ ID No.: 3 и 4.
В особо предпочтительном варианте осуществления настоящего изобретения был получен оптимизированный вариант К. lactis VAK367-D4 -VP2T2S_GAL4, в котором белок VP2 был мутирован в аминокислотной позиции 2 (последовательности SEQ ID No.: 3 и 4), и который дополнительно содержал по меньшей мере два гена KIGAL4 (VAK890). Особо предпочтителен вариант К. lactis VAK367-D4 - OVP2-T2S, в котором мутированный VP2-aHTnreH был закодирован кодон-оптимизированной последовательностью нуклеотидов дрожжей SEQ ID No.: 5, или в котором рекомбинантно экспрессирован мутированный антиген VP2 с последовательностью аминокислот согласно последовательности SEQ ID No.: 6. Оптимизированный вариант К. lactis oVP2-T2S_GAL4 (VAK911) обладает следующими преимуществами:
- За счет мутации чужеродный белок был дополнительно стабилизирован.
- За счет гиперэкспрессии трансактиватора и/или за счет оптимизации кодона последовательности удалось добиться заметного повышения экспрессии VP2 (Фиг. 2).
- Интеграция дополнительного гена KIGAL4 также коррелировала с более высокой скоростью размножения этого варианта К. lactis.
- Этот вариант К. lactis обнаруживает особенно высокую воспроизводимость при ферментации при высокой плотности клеток и особенно большое количество экспрессированного белка VP2 (Фиг. 3).
Полученный согласно настоящему изобретению вариант К. lactis VP2-T2S_GAL4, который в качестве чужеродного белка рекомбинантно экспрессирует мутированный VP2-антиген IBDV и содержит дополнительные копии трансактиваторного гена KIGAL4 (VAK890), 29 ноября 2011 г. был депонирован в Немецкой коллекции микроорганизмов и культур клеток (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, DSMZ, Inhoffenstrasse 7B, 38124 Braunschweig, Deutschland) согласно Будапештскому договору под номером DSM 25405.
Полученный согласно настоящему изобретению вариант К. lactis OVP2-T2S, который в качестве чужеродного белка рекомбинантно экспрессирует мутированный и кодон-оптимизированный VP2-amweH IBDV (VAK910), 29 ноября 2011 г. был депонирован в Немецкой коллекции микроорганизмов и культур клеток (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, DSMZ, Inhoffenstrasse 7B, 38124 Braunschweig, Deutschland) согласно Будапештскому договору под номером DSM 25406.
Полученный согласно настоящему изобретению вариант К. lactis OVP2-T2S, который в качестве чужеродного белка рекомбинантно экспрессирует мутированный и кодон-оптимизированный VP2-aHTnreH IBDV и содержит дополнительные копии трансактиваторного гена KIGAL4 (VAK911), 29 ноября 2011 г. был депонирован в Немецкой коллекции микроорганизмов и культур клеток (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, DSMZ, Inhoffenstrasse 7B, 38124 Braunschweig, Deutschland) согласно Будапештскому договору под номером DSM 25407.
Следующий вариант осуществления настоящего изобретения относится к применению рекомбинантных дрожжей согласно настоящему изобретению в способе получения защитной иммунизации, в частности защитной гуморальной иммунизации.
Этот способ включает следующие стадии:
a) культивирование и размножение рекомбинантных дрожжей согласно настоящему изобретению,
b) сбор и инактивацию дрожжей,
c) введение рекомбинантных дрожжей согласно установленной схеме иммунизации,
d) определение титра образовавшихся антител и/или
e) подтверждение иммунизации.
Культивирование и размножение рекомбинантных дрожжей согласно настоящему изобретению можно осуществить любым доступным стандартным способом. Особо предпочтительны при этом способы, которые при малых затратах обеспечивают высокие выходы клеток. Сюда относятся способы ферментации, в частности ферментации при высокой плотности клеток. Особо предпочтительным является проведение ферментации с использованием протокола ферментации с подпиткой.
В предпочтительном варианте осуществления настоящего изобретения защитная гуморальная иммунизация обеспечивается за счет того, что рекомбинантные дрожжи вводят перорально/мукозально или подкожно. В особо предпочтительном варианте осуществления настоящего изобретения рекомбинантные дрожжи вводят подкожно. Особо предпочтительным в способе согласно настоящему изобретению является применение К. lactis, в частности генно-инженерно-модифицированных вариантов VAK367-D4 и производного от них варианта VAK890 и его вариантов для подкожного введения.
Рекомбинантные дрожжевые клетки в способе согласно настоящему изобретению следует использовать в инактивированном/убитом состоянии. Для этого дрожжи после культивирования и экспрессии чужеродных генов высушивают и затем инактивируют. Инактивацию можно выполнять любым доступным стандартным способом. Особенно подходящим для применения в способе согласно настоящему изобретению является тепловая инактивация (например, тепловая инактивация в течение 2 часов при 90°С).
Для пероральной/мукозальной вакцинации можно, например, использовать короткую 1/1/1/1 схему иммунизации (введение в течение 1 недели, пауза в течение 1 недели, введение в течение 1 недели и т.д.) или более длительную схему 2/2/2 (введение в течение 2 недель, пауза в течение 2 недель, введение в течение 2 недель). Для подкожной вакцинации можно использовать, например, двукратное или трехкратное применение с интервалом, равным двум неделям (Фиг. 4 и 5).
Для подтверждения успешной иммунизации используют любые стандартные способы. В одном из вариантов осуществления настоящего изобретения для подтверждения иммунизации исследуют титр нейтрализующих вирус антител. Для этого можно выполнить, например, специфические ELISA-анализы или нейтрализационные анализы. В нейтрализационном анализе определенное число IBD-вирусов разбавляют определенным количеством сыворотки иммунизированного животного или контрольного животного. Затем исследуют ингибирование инфекции (нейтрализации) обработанными таким образом вирусами в культуре клеток. Была ли иммунизация успешной, можно также определить в эксперименте с «нагрузкой», например в эксперименте с «вирусной нагрузкой». Для этого обработанным животным вводят дозу патогенного микроорганизма или вируса, которая обычно у неиммунизированных животных приводит к болезни. Если после такой нагрузки не происходит заболевания животного, то получено доказательство успешной иммунизации (Фиг. 5). Наконец, доказательство иммунизации можно также получить с помощью иммуногистохимии. При этом после нагрузки исследуют органы-мишени патогенного микроорганизма на признаки инфекции или повреждения (Фиг. 5).
Согласно настоящему изобретению было показано, что рекомбинантные варианты К. lactis, которые были получены, соответственно, из VAK367-D4, удалось успешно использовать для вакцинации посредством подкожного введения. Полученный в примерах осуществления настоящего изобретения вариант штамма VAK890 экспрессирует VP2-антиген вируса инфекционного бурсита (IBDV; штамм D78). В случае VP2 IBDV речь идет о вирусном капсид-формирующем белке. Относительно VP2 известно, что сформированного гуморального иммунного ответа против этого антигена достаточно для того, чтобы превентивно защитить инфицированный организм от последующей инфекционной болезни, вызванной соответствующим вирусом (IBDV). С одной стороны, формирование эффективного гуморального иммунного ответа можно было показать посредством количественного определения вируснейтрализующих антител. С другой стороны, было проведено подтверждение защитного иммунного ответа посредством «эксперимента с вирусной нагрузкой» и иммуногистохимии после вирусной нагрузки. Согласно настоящему изобретению удалось подтвердить, что такой рекомбинантный К. lactis, или рекомбинантный К. lactis, происходящий от штамма VAK367-D4, при подкожном применении является эффективно действующим, т.е. является 90-100% защитной вакциной (90-100% соответствует «золотому стандарту» при вакцинации) (Фиг. 4 и 5). Таким образом было подтверждено, что рекомбинантный К. lactis, или рекомбинантный К. lactis, происходящий от штамма VAK367-D4, является «субъединичной» маркерной вакциной против возбудителей инфекций, например вирусов. Это значит, что в качестве антигена был использован отдельный иммуногенный белковый компонент вируса. Применение в качестве «субъединичной» маркерной вакцины означает, что ее применение позволяет отличить вакцинированные организмы от невакцинированных инфицированных организмов. Это возможно, например, при применении способа дифференциальной диагностики, который выявляет как антитела против антигена, использованного для вакцинации, так и антитела против другого антигена возбудителя инфекции. За счет иммунизации рекомбинантным штаммом VAK890 (DSM 25405) К. lactis, происходящим от штамма VAK367-D4, удалось получить высокий титр антител против соответствующего вирусного антигена. Для этих антител удалось показать, что они являются нейтрализующими вирус. Уже из этого свойства и измеренного высокого титра можно эмпирически сделать вывод, что этот гуморальный ответ достаточен для того, чтобы защитить организм от последующей инфекции соответствующим вирусом. Окончательное доказательство удалось получить для IBDV. Высокий титр полученных вируснейтрализующих антител в модельном эксперименте на курицах коррелировал с полной защитой вакцинированных животных от последующей вирусной инфекции (Фиг. 5).
Применение К. lactis, в частности генно-инженерно-модифицированного варианта VAK367-D4 и его производных, например К. lactis VP2-T2S_GAL4 (VAK890), имеет следующие значительные преимущества перед стандартными способами:
1. При применении для экспрессии чужеродных генов К. lactis имеет значительные принципиальные преимущества перед S. cerevisiae, которые обусловлены в течение миллионов лет дивергировавшей относительно S. cerevisiae физиологией К. lactis.
2. Экспрессия чужеродного гена осуществляется не с помощью плазмидных векторов, а за счет целенаправленной и стабильной интеграции чужеродного гена в определенный локус генома К. lactis. Это обеспечивает высокую воспроизводимость экспрессии белка в неселективных условиях. Этот аспект важен для воспроизводимого получения вакцины посредством культивации штамма дрожжей в ферментере. Принцип штамма VAK367-D4 и его производных уже описан для пероральной вакцинации (WO 20101054649 А2). В настоящем изобретении показано, что штамм VAK367-D4 и его производные, в частности штаммы К. lactis VP2-T2S_GAL4 (VAK890) и oVP2-T2S_GAL4 (VAK911), при подкожной вакцинации с использованием значительно меньших количеств дрожжей приводит к эффективной защите при вирусных инфекциях.
3. Экспрессия гена является индуцируемой и может быть дополнительно повышена посредством повышения концентрации активатора транскрипции Gal4 и/или за счет оптимизации кодона последовательности нуклеотидов чужеродного гена для приспособления ее к дрожжам-хозяевам. Использование протокола ферментации с подпиткой также обеспечивает эффективную продукцию цитотоксических антигенов.
4. Интеграция чужеродного гена в VAK367-D4 и его производные является «одношаговой процедурой». Это значит, что примерно за 3 недели можно получить и охарактеризовать новые рекомбинантные штаммы; это особенно важно для быстрой разработки эффективных вакцин против модифицированных вариантов вируса.
5. За счет подкожного введения рекомбинантных дрожжей типа К. lactis, в частности рекомбинантных дрожжей штамма VAK367-D4 и его производных, удалось получить защитный иммунный ответ как у мышей, так и у куриц. Процедура очень проста: определенное количество инактивированных (убитых теплом) дрожжевых клеток в 2-3-разовом способе вводят под кожу вакцинируемому индивидууму. Через две недели после последнего введения сыворотку вакцинируемого индивидуума исследуют на наличие и функциональность антигенспецифических антител. Посредством анализов с нейтрализацией вирусов удалось доказать, что этот иммунный ответ преимущественно, если не исключительно, основан на выработке нейтрализующих антител (защитный гуморальный иммунный ответ). Этим иммунный ответ, вызываемый К. lactis при подкожном введении, отличается от иммунного ответа, индуцируемого S. cerevisiae, который прежде всего вызывает Т-клеточный ответ. Поэтому возможности подкожного применения К. lactis являются принципиально иными, нежели возможности подкожного применения S. cerevisiae: если К. lactis в качестве субъединичной вакцины может быть использован с антигенами, которые могут вызывать защитный гуморальный иммунный ответ (например, с вирусными антигенами, такими как VP2 антиген вируса инфекционного бурсита, IBDV, или гемагглютининовый антиген НА вируса гриппа), то S. cerevisiae может быть использован с антигенами, которые могут вызывать клеточный иммунный ответ (например, NS3 белок вируса гепатита С или опухолевые антигены, например Her-2). Эти различия в форме вызванного иммунного ответа предположительно можно объяснить значительно различающимися свойствами клеток S. cerevisiae и К. lactis, которые описаны выше.
В целом, настоящее изобретение существенно дополняет предшествующий уровень техники и обеспечивает многочисленные варианты осуществления, превосходящие предшествующий уровень техники:
- Авторам изобретения удалось получить субъединичные маркерные вакцины, благодаря которым можно отличить вакцинированных индивидуумов от естественно инфицированных.
- Кроме того, можно получить маркерные вакцины, которые одновременно обладают сильными адъювантными свойствами и поэтому являются сильно иммуногенными.
- Субъединичные маркерные вакцины согласно настоящему изобретению могут быть использованы многократно.
- Субъединичные маркерные вакцины согласно настоящему изобретению вызывают системный защитный иммунный ответ и иммунологическую память у вакцинированного индивидуума.
- Благодаря настоящему изобретению можно также получить вакцину против цитотоксических антигенов.
- Способ согласно настоящему изобретению обеспечивает максимально быстрое получение новых вариантов вакцин.
- В частности, способы вакцинации являются очень дешевыми.
- Для получения вакцины согласно настоящему изобретению не нужны экспериментальные животные или использование клеток животных или человека в форме культуры.
- Вакцины согласно настоящему изобретению не чувствительны к температуре, их можно транспортировать и хранить без охлаждения.
- В способе согласно настоящему изобретению не используют живые рекомбинантные клетки или организмы.
- Благодаря использованию способа согласно настоящему изобретению можно ограничить количества используемой вакцины и число применений, необходимое для достижения защитной иммунизации, минимальным уровнем.
Описание примеров осуществления изобретения
1. Получение штамма VAC367-D4 (metA ura3-5 lac4::ScilRA3) К. lactis
Исходный штамм VAC367 для гетерологичной экспрессии чужеродных белков обладает следующими свойствами: он обеспечивает культивирование до высокой плотности клеток без обнаружимого высвобождения при этом внутриклеточных белков. В связи с этим этот штамм отличается от многих близкородственных штаммов К. lactis. Штамм VAK367 был получен посредством двух циклов мутагенеза из штамма CBS 2359 (Центральное бюро плесневых культур http://www.fungalbiodiversitycentre.com) и является ауксотрофным по аминокислоте метионину и нуклеотидному основанию урацилу. Из штамма VAK367 генно-инженерными способами был получен штамм VAK367-D4 (18.11.2009 депонирован в Немецкую коллекцию микроорганизмов и культур клеток (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSMZ)) в Брауншвейге под инвентарным номером DSM 23097), в котором с помощью плазмиды pD4-2 последовательность с +358 по +1181 гена LAC4 была заменена геном ScURA3. Штамм VAK367-D4 позволяет интеграцию чужеродных генов в локус LAC4 без дополнительного маркера, так как его можно селектировать по росту в лактозной среде. При этом при использовании подходящего интегрирующего вектора, например Klp3-MCS (Фиг. 6) посредством гомологичной рекомбинации дизруптивная кассета заменяется так, что после потери ScURA3 маркера реконструируется интактный ген LAC4 (Фиг. 1).
2. Получение интегрирующего вектора, который обеспечивает индуцируемую экспрессию чужеродных генов
Вектор: Klp3-MCS (последовательность SEQ ID. No.: 10)
В случае вектора Klp3-MCS (последовательность SEQ ID. No.: 10) (Фиг. 6) речь идет о векторе Е. coli, основанном на YRp7, который в дрожжах не может реплицироваться автономно, так как последовательность ARS1 делетирована. Klp3-MCS (последовательность SEQ ID. No.: 10) содержит промотор LAC4 К. lactis и последовательности, которые обеспечивают интеграцию в локусе LAC4 за счет гомологичной рекомбинации.
Между промотором LAC4 и точкой начала транскрипции встраивают отрезок ДНК, который содержит терминатор TEF1 и промотор KIGAL80. За счет этого рамка считывания LAC4 после реконструкции посредством гомологичной рекомбинации может экспрессироваться под контролем промотора KIGAL80. Промотор KIGAL80 через фактор транскрипции KIGAL4 может сорегулироваться промотором LAC4 (Zenke et al. 1993). Эта конструкция обеспечивает возможность проследить индукцию экспрессии чужеродного гена посредством измерения кодируемой LAC4 В-галактозидазы. Klp3-MCS (последовательность SEQ ID. No.: 10) позволяет инсерцию чужеродного гена между промотором LAC4 и терминатором TEF1 за счет уникальных точек рестрикции в сайте множественного клонирования (MSC; от англ. multiple cloning site) (Фиг. 6). Для интеграции полученную плазмиду разрезают с использованием соответствующих рестрицирующих ферментов, так что кассета экспрессии отделяется от векторных последовательностей Е. coli. После трансформации в VAC367-D4 К. lactis кассета экспрессии интегрируется в хромосому; полученные штаммы не содержат бактериальных последовательностей.
3. Вариант К. lactis, который экспрессирует \/Р2-антиген вируса инфекционного бурсита (вариант D78 IBDV)
Получение рекомбинантного штамма дрожжей
кДНК, которая кодирует VP2-aHTnreH IBDV D78, была амплифицирована из плазмиды pD78A (Icard et al., 2008) с помощью следующих олигонуклеотидов:
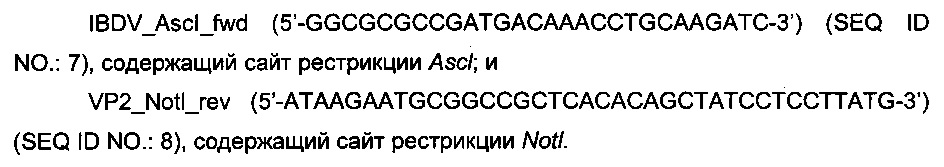
Для получения VP2-T2S была использована следующая пара олигонуклеотидов:

Амплифицированные таким образом фрагменты ДНК после проверки и подтверждения нуклеотидных последовательностей через сайты рестрикции AscI и Notl клонировали в вектор Klp3-MCS (SEQ ID No.: 10) (Фиг. 6). После этого выполняли интеграцию в геном (Фиг. 1). В частности, интегрирующую плазмиду обрабатывали рестрицирующим ферментом EcoRI и трансформировали полученные фрагменты в компетентные клетки VAK367-D4. Трансформированные клетки наносили на среду YEPD (от англ.: Yeast Extract Peptone Dextrose, среда, содержащая дрожжевой экстракт, пептон и декстрозу) и инкубировали в течение ночи при 30°С. Для обнаружения позитивных колоний трансформационный планшет дублировали на среде SM, которая содержит лактозу в качестве источника углерода, и инкубировали в течение 2 дней при 30°С. Идентифицированные этим способом позитивные клоны исследовали дальше.
Интеграция в геном дополнительных копий гена KIGAL4 была осуществлена стандартным способом (Kuger et al. (1990)). Оптимизация кодонов соответствовала алгоритму, разработанному для Saccharomyces cerevisiae (mr.gene.com, Raab et al., 2010). Кодон-оптимизированные фрагменты ДНК были получены прямым синтезом. В процессе синтеза сайты рестрикции 5' AscI и 3' Notl были уже встроены (mr.gene.com, Регенсбург, Германия). Затем было произведено клонирование в вектор Klp3-MCS (SEQ ID NO.: 10).
Вестерн-блот-анализ
Клеточные осадки ресуспендировали в буфере В60 (50 мМ HEPES-KOH рН 7,3; 60 мМ ацетата калия; 5 мМ ацетата магния; 0,1% Triton Х100; 10% глицерина; 1 мМ фторида натрия; 20 мМ глицерофосфата; 10 мМ MgCl2; 1 мМ дитиотреитола (DTT; от англ. dithiothreitol); полный ингибитор протеаз (Roche)) и разрушали клетки посредством интенсивного перемешивания со стеклянными шариками. Экстракт центрифугировали (14000 об/мин, 20 мин при 4°С) и определяли концентрацию белка. 40 мкг белкового экстракта разделяли способом SDS-PAGE в 12%-ном геле. После этого белки переносили на мембрану. Вестерн-блоттинг выполняли с использованием традиционных способов с использованием α-IBDV антисыворотки кролика (1:15000; Granzow et al., 1997) и конъюгированных с пероксидазой хрена антител козы против а-глобулинов кролика (1:3000, Santa Cruz Biotechnology, Inc.).
Нозерн-блот-анализ
Для полной экстракции РНК 5 мл культуры дрожжей охлаждали на льду. Лизис клеток осуществляли в буфере Prot К (100 мл Tris/HCI, рН 7,9, 150 мМ NaCl, 25 мМ ЭДТА, 1% SDS) в присутствии 50 мг протеиназы К (Fermentas) при сильном встряхивании со стеклянными шариками. Пробы инкубировали в течение 1 часа при 35°С, РНК экстрагировали, осаждали этанолом и ресуспендировали в воде, обработанной диэтилпирокарбонатом (DEPC; от англ.: diethylpyrocarbonate). Нозерн-анализ проводили так, как описано в публикации Engler-Blum et al., 1993, но с некоторыми отклонениями. 5 мкг общей РНК разделяли в 1%-ном формальдегид-агарозном геле и переносили на нейлоновую мембрану (Amersham HybondTM-N+, GE Healthcare). Мембрану инкубировали при 68°С с меченым диоксигенином (DIG; от англ. dioxygenin) РНК-зондом, который был получен посредством транскрипции in vitro ПЦР-фрагментов в присутствии DIG-NTP (Roche) (NTP; от англ. nucleotidtriphosphate; нуклеотидтрифосфат). Блот обрабатывали блокирующим раствором и инкубировали конъюгированным с щелочной фосфатазой антителом против DIG (Roche). Определение активности щелочной фосфатазы осуществляли стандартными способами.
Количественное определение гетерологично экспрессированного VP2
Был использован модифицированный протокол из публикации Saugar et al., 2005. 2000 Единиц оптической плотности (ODE; от нем. optische Dichte-Einheit) культуры дрожжей, трансформированных эписомальной VP2-плазмидой (pADH1-P_VP2-T2S), культивировали в течение ночи на селективной среде (0,67% YNB (основа азотного агара для дрожжей), 2% глюкозы и следующие добавки: 11 мг/л Ade; 14 мг/л Туг; по 38 мг/л His, Trp, Arg, Met; 48 мг/л Phe; по 58 мг/л Leu, Не, Lys, Val, Thr). После сбора и промывки дистиллированной водой клетки разрушали стеклянными шариками в лизирующем буфере (10 мМ Tris (рН 8,0), 150 мМ NaCI, 20 мМ CaCl2, 1 мМ ЭДТА, полный ингибитор протеазы (Roche), рН 8,0). Полученный белковый экстракт центрифугировали (10000g в течение 1 часа при 4°С) и растворимую фракцию наслаивали на 20 масс./об.% сахарозную подушку в сахарозном буфере (10 мМ Tris, рН 8,0, 150 мМ NaCl, 20 мМ CaCl2; содержит полный ингибитор протеазы (Roche)). После центрифугирования при 170000 g в течение 3 часов при 4°С осадок растворяли в 200 мкл сахарозного буфера и еще 17 часов центрифугировали при 114000 g в градиенте сахарозы от 20% до 53% в сахарозном буфере. Градиент собирали в виде фракций по 700 мкл и анализировали способами SDS-PAGE и вестерн-блоттинга. Олигомерные белковые комплексы гетерологично экспрессированного VP2 таким способом можно было концентрировать и очистить. Белок удалось обнаружить, а количество белка определить посредством SDS-PAGE и окрашивания по Кумасси в сравнении со стандартным белком (не показано на рисунке). Очищенный таким образом VP2 затем был использован в качестве стандарта в сравнительном вестерн-блоттинге с антителами против VP2. Было произведено сравнение количеств VP2 из определенного числа дрожжевых клеток из различных ферментаций (Фиг. 3).
Ферментация и тепловая инактивация дрожжей
Все экспериментальные ферментации были проведены в системе параллельных биореакторов DasGip (DasGip AG, Юлих, Германия) с четырьмя полностью оборудованными ферментерами объемом по 2 л. Ферментации в промышленном масштабе были проведены компанией Organobalance GmbH (Берлин, Германия) или в собственной лаборатории в биореакторе Biostat ED (В. Braun Biotech, Мельсунген, Германия) с рабочим объемом, равным 10 л. Все производственные процессы были осуществлены с использованием способа с подпиткой. Была использована комплексная культуральная среда, содержавшая 2% экстракта дрожжей и 1% пептона, а также 20%-ный питательный раствор лактозы. Температура дрожжевой культуры поддерживалась равной 30°С, а pO2 поддерживали на уровне 30%-ного насыщения. Значение рН во время ферментации поддерживали равным 5,0 посредством добавления 2М NaOH или 2М H3PO4.
Для экспериментов in vivo на мышах и курицах дрожжи лиофилизировали и после этого инактивировали теплом в течение 2 часов при 90°С. После использования этого способа жизнеспособными были менее 10 клеток на грамм массы сухих клеток.
4. Подкожное введение мышам
Для подкожного введения варианта К. lactis, который экспрессирует VP2-антиген вируса инфекционного бурсита (вариант D78 IBDV) (VAK890), мышам высушенные и измельченные до порошкообразного состояния дрожжи для первого применения смешивали с полным адъювантом Фрейнда (CFA; от англ. Freund's Complete Adjuvant); в других применениях дрожжи смешивали с неполным адъювантом Фрейнда (IFA; от англ.: Incomplete Freund's Adjuvant) (100 мкг дрожжевого материала на 200 мкл CFA или IFA). 200 мкл эмульсий (с содержащимися в них 100 мкг дрожжей) инъецировали каждому индивидууму во время одной иммунизации. При этом количество VP2, введенное одной мыши во время подкожной иммунизации, составляло примерно 18 нг (Фиг. 3). После начальной инъекции (День 0) два раза с двухнедельными интервалами производили повторные иммунизации (в День 14 и День 28; Фиг. 4). Еще через две недели животных умерщвляли под наркозом для получения сыворотки крови.
5. Подкожное введение курицам
Для подкожного введения курицам 5 мг высушенного и измельченного до порошкообразного состоянии варианта К. factis, который экспрессирует VP2-антиген вируса инфекционного бурсита (вариант D78 IBDV) (VAK890), растворяли в 750 мкл фосфатного буферного раствора (PBS; от англ.: phosphate buffer saline) и 500 мкл стерильной дистиллированной воды и получали эмульсию с добавлением 1,25 мл IFA. 500 мкл этой эмульсии (с содержащимся в них 1 мг дрожжей) инъецировали в Дни 0, 14 и 28 (Фиг. 5). При этом количество VP2, введенное одной курице во время одной подкожной иммунизации, составляло примерно 180 нг (Фиг. 3, 4).
6. Вирусная «нагрузка»
После вакцинации (Фиг. 5) вакцинированных куриц в День 42 перорально инфицировали 100 EID50 штамма «Edgar» IBDV и через шесть дней определяли коэффициент смертности. После умерщвления животных под наркозом получали сыворотки и удаляли фабрициевы сумки животных. Их вначале в течение 24 часов фиксировали в 10%-ном нейтральном забуференном растворе формалина, после чего заливали в парафин.
7. Твердофазный иммуноферментный анализ (ELISA)
Титры IBDV-специфических антител в сыворотках вакцинированных животных определяли посредством коммерческого ELISA-теста с использованием набора IDEXX FlockChek® IBD ELISA (IDEXX Laboratories, Inc.). В случае сывороток от вакцинированных мышей использовали вторичное антитело другого производителя (Sigma Aldrich).
8. Нейтрализационный анализ
Нейтрализационный анализ для определения концентрации нейтрализующих вирус антител был выполнен в соответствии с протоколом из публикации Schroder et al., 2000.
9. Иммуногистохимия
Из фабрициевых сумок, залитых в парафин, были изготовлены срезы органов толщиной 4 мкм. После удаления парафина их окрашивали гематоксилином и эозином с использованием стандартных процедур. Образцы исследовали под микроскопом и определяли «оценку повреждений» по шкале от 1 до 4 (1 = от нормального состояния до 10%-ной фолликулярной атрофии; 2=10-30%-ная фолликулярная атрофия; 3=30-70%-ная фолликулярная атрофия; 4=более чем 70%-ная атрофия).
Результаты
Получение и оптимизация штамма К. lactis, экспрессирующего VP2 IBDV
Были получены различные варианты К. lactis с встроенным геном VP2 IBDV. Для экспериментов с вакцинацией был использован оптимизированный вариант, у которого белок VP2 был мутирован в аминокислотной позиции 2 (замена треонина на серии; Jagadish et al. (1991)) и содержал дополнительную тандемную интеграцию по меньшей мере двух генов KIGAL4 (вариант VP2-T2S_GAL4; штамм VAK890). За счет мутации чужеродный белок был дополнительно стабилизирован; за счет гиперэкспрессии трансактиватора удалось добиться заметного повышения экспрессии VP2 (Фиг. 2). Интеграция дополнительных генов KIGAL4 коррелировала с более высокой скоростью роста этого варианта К. lactis. Условия роста для соответствующего штамма К. lactis, экспрессирующего VP2, были оптимизированы, так что можно было ферментировать дрожжи с высокими плотностями и с воспроизводимым количеством экспрессируемого VP2. После получения дрожжи лиофилизировали и инактивировали при 90°С в течение 2 часов. Было получено доказательство инактивации: в каждом грамме инактивированного дрожжевого материала сохранилось менее 10 живых дрожжевых клеток. Было определено количество VP2 в одной дрожжевой клетке: в штамме VAK890 оно было равно примерно 0,7 фг гетерологичного белка VP2 в одной дрожжевой клетке.
Подкожное введение мышам и курицам
Иммунизации были произведены так, как описано выше; через две недели после последнего введения сыворотки вакцинированных животных были исследованы на наличие нейтрализующих антител. Для этого был использован IBDV-специфический ELISA-анализ и проведен анализ с нейтрализацией IBDV (Фиг. 4 и 5). С вакцинированными курицами также был проведен эксперимент с «вирусной нагрузкой». Для этого животным вводили дозу вируса, равную 100 EID50 на животное, сильно вирулентного штамма «Edgar» IBDV - концентрация, которая у невакцинированной домашней птицы вызывает значительный бурсит с коэффициентом смертности, равным примерно 10-35% (Фиг. 5D). В завершение эксперимента с «вирусной нагрузкой» фабрициевы сумки вакцинированных животных исследовали с использованием иммуногистохимии на наличие признаков инфекции и повреждений в фабрициевой сумке и характеризовали так называемой «оценкой поражений» (Фиг. 5).
Как эксперименты на мышах, так и эксперименты на курицах показали, что за счет подкожного введения штамма VAK890 К. lactis практически у всех обработанных животных удалось получить высокий титр вирус-нейтрализующих антител (Фиг. 4В, 4С; Фиг. 5В, 5С). Также удалось показать, что практически все вакцинированные курицы были защищены против вирусной нагрузки и практически не имели признаков вирусной инфекции в фабрициевых сумках (Фиг. 5). Таким образом, все животные, подкожно инокулированные штаммом VAK890 К. lactis, продемонстрировали значительный гуморальный иммунный ответ против VP2. Этот иммунный ответ можно было наблюдать уже после однократной иммунизации, из чего можно сделать вывод, что двух инъекций, которые к тому же можно произвести с использованием неполного адъюванта Фрейнда (иммунизация и одна поддерживающая инъекция), уже достаточно для обеспечения защиты. Кроме того, все курицы, инокулированные штаммом VAK890 К. lactis, были защищены против последующей вирусной инфекции (Фиг. 5).

Перечень ссылок
Backhaus, К. et al. Milk and sugar: Regulation of cell wall synthesis in the milk yeast Kluyveromyces lactis. European Journal of Cell Biology 90, 745-750 (2011).
Bathurst, I.C. Protein Expression in Yeast as an Approach to Production of Recombinant Malaria Antigens. The American Journal of Tropical Medicine and Hygiene 50, 20-26 (1994).
Botstein D, Falco, S.C., Stewart, S.E., Brennan, M., Scherer, S., Stinchcomb, D.T., Struhl, K. & Davis, R.W. Sterile host yeast (SHY): a eukaryotic system of biological containment for recombinant DNA experiments. Gene 8, 17-24 (1979).
Breunig et al. Regulation of primary carbon metabolism in Kluyveromyces lactis. Enzyme Microbial Technology 26, 771-780 (2000).
Chen, X.J. & Clark-Walker, G.D. Specific mutations in alpha- and gamma-subunits of F1-ATPase affect mitochondrial genome integrity in the petite-negative yeast Kluyveromyces lactis. EMBO Journal 14, 3277-3286 (1995).
Clark-Walker, G.D. The F1-ATPase inhibitor Inh1 (IF1) affects suppression of mtDNA loss-lethality in Kluyveromyces lactis. FEMS Yeast Research 7, 665-674 (2007).
Donnini, C. et al. Improved Production of Heterologous Proteins by a Glucose Repression-Defective Mutant of Kluyveromyces lactis. Applied and Environmental Microbiology 70, 2632-2638 (2004).
Engler-Blum, G., Meier, M., Frank, J. & Muller, G.A. Reduction of background problems in nonradioactive northern and southern blot analyses enables higher sensitivity than 32P-based hybridizations. Analytical Biochemistry 210, 235-244 (1993).
Gellissen G. & Hollenberg CP. Application of yeasts in gene expression studies: a comparison of Saccharomyces cerevisiae, Hansenula polymorpha and Kluyveromyces lactis - a review. Gene 190, 87-97 (1997).
Granzow, H. et al. A second form of infectious bursal disease virus-associated tubule contains VP4. Journal of Virology 71, 8879-8885 (1997).
Jagadish, M.N., Laughton, D.L., Azad, A.A. & Macreadie, I.G. Stable synthesis of viral protein 2 of infectious bursal disease virus in Saccharomyces cerevisiae. Gene 108,275-279(1991).
Icard, A.H., Seilers, H.S., & Mundt, E. Detection of infectious bursal disease virus isolates with unknown antigenic properties by reverse genetics. Avian Disease 52, 590-598. (2008)
Kuger, P., Godecke, A. & Breunig, K.D. A mutation in the Zn-finger of the GAL4 homolog LAC9 results in glucose repression of its target genes. Nucleic Acids Research 18, 745-751 (1990).
Lu, Y. et al. Mutation-Selective Tumor Remission with Ras-Targeted, Whole Yeast-Based Immunotherapy. Cancer Research 64, 5084 - 5088 (2004).
Raab, D., Graf, M., Notka, F., Schodl, T. & Wagner, R. The GeneOptimizer Algorithm: using a sliding window approach to cope with the vast sequence space in multiparameter DNA sequence optimization. Systems and Synthetic Biology A, 215-225 (2010).
Raschke, W.C. & Ballou, C.E. Characterization of a yeast mannan containing N-acetyl-D-glucosamine as an immunochemical determinant. Biochemistry 11, 3807-3816 (1972).
Saugar, I. et al. Structural polymorphism of the major capsid protein of a double-stranded RNA virus: An Amphipathic [alpha] Helix as a Molecular Switch. Structure 13, 1007-1017(2005).
Schroder, A., van Loon, A.A.W.M., Goovaerts, D. & Mundt, E. Chimeras in noncoding regions between serotypes I and II of segment A of infectious bursal disease virus are viable and show pathogenic phenotype in chickens. Journal of General Virology 81, 533-540 (2000).
Stubbs, A.C. et al. Whole recombinant yeast vaccine activates dendritic cells and elicits protective cell-mediated immunity. Nature Medicine 7, 625-629 (2001).
Stubbs, A.C. & Wilson, C.C. Recombinant yeast as a vaccine vector for the induction of cytotoxic T-lymphocyte responses. Current Opinion of Molecular Therapy 4, 35-40 (2002)
Uccelletti, D., Farina, F., Mancini, P. & Palleschi, C. KIPMR1 inactivation and calcium addition enhance secretion of non-hyperglycosylated heterologous proteins in Kluyveromyces lactis. Journal of Biotechnology 109, 93-101 (2004).
Van Ooyen, A.J., Dekker, P., Huang, M., Olsthoorn, M.M., Jacobs, D.I., Colussi, P.A. & Taron, C.H.. Heterologous protein production in the yeast Kluyveromyces lactis. FEMS Yeast Research 6, 381-392 (2006).
Wansley E.K. et al. Vaccination with a recombinant Saccharomyces cerevisiae expressing a tumor antigen breaks immune tolerance and elicits therapeutic antitumor responses. Clinical Cancer Research 14, 4316-4325 (2008).
Zenke, FT., Zachariae, W., Lunkes, A., & Breunig, K.D. Gal80 proteins of Kluyveromyces lactis and Saccharomyces cerevisiae are highly conserved but contribute differently to glucose repression of the galactose regulon. Molecular and Cellular Biology 13, 7566-7576(1993)
Реферат
Группа изобретений относится к области биотехнологии. Представлены рекомбинантные дрожжи штамма Kluyveromyces lactis DSM 25405, Kluyveromyces lactis DSM 25406 или Kluyveromyces lactis DSM 25407, несущие в качестве чужеродного гена ген для VP2-антигена вируса инфекционного бурсита (IBDV), интегрированный в геном дрожжей и обеспечивающий экспрессию VP2-антигена IBDV в качестве чужеродного белка. Представлен способ подкожной вакцинации с помощью целых дрожжевых клеток указанных рекомбинантных дрожжей. Группа изобретений позволяет сделать способ подкожной вакцинации более экономичным, а также обеспечивает эффективную защиту при вирусных инфекциях в результате подкожной вакцинации с использованием значительно меньших количеств дрожжей. 3 н. и 14 з.п. ф-лы, 13 ил., 1 табл., 9 пр.
Формула
Документы, цитированные в отчёте о поиске
Мутант вируса инфекционной бурсальной болезни (ibdv), экспрессирующий вирус-нейтрализующие эпитопы, специфичные для классического и вариантного штаммов ibdv

Комментарии