Композиции и способы лечения грибковых и бактериальных патогенов - RU2717306C2
Код документа: RU2717306C2
Чертежи








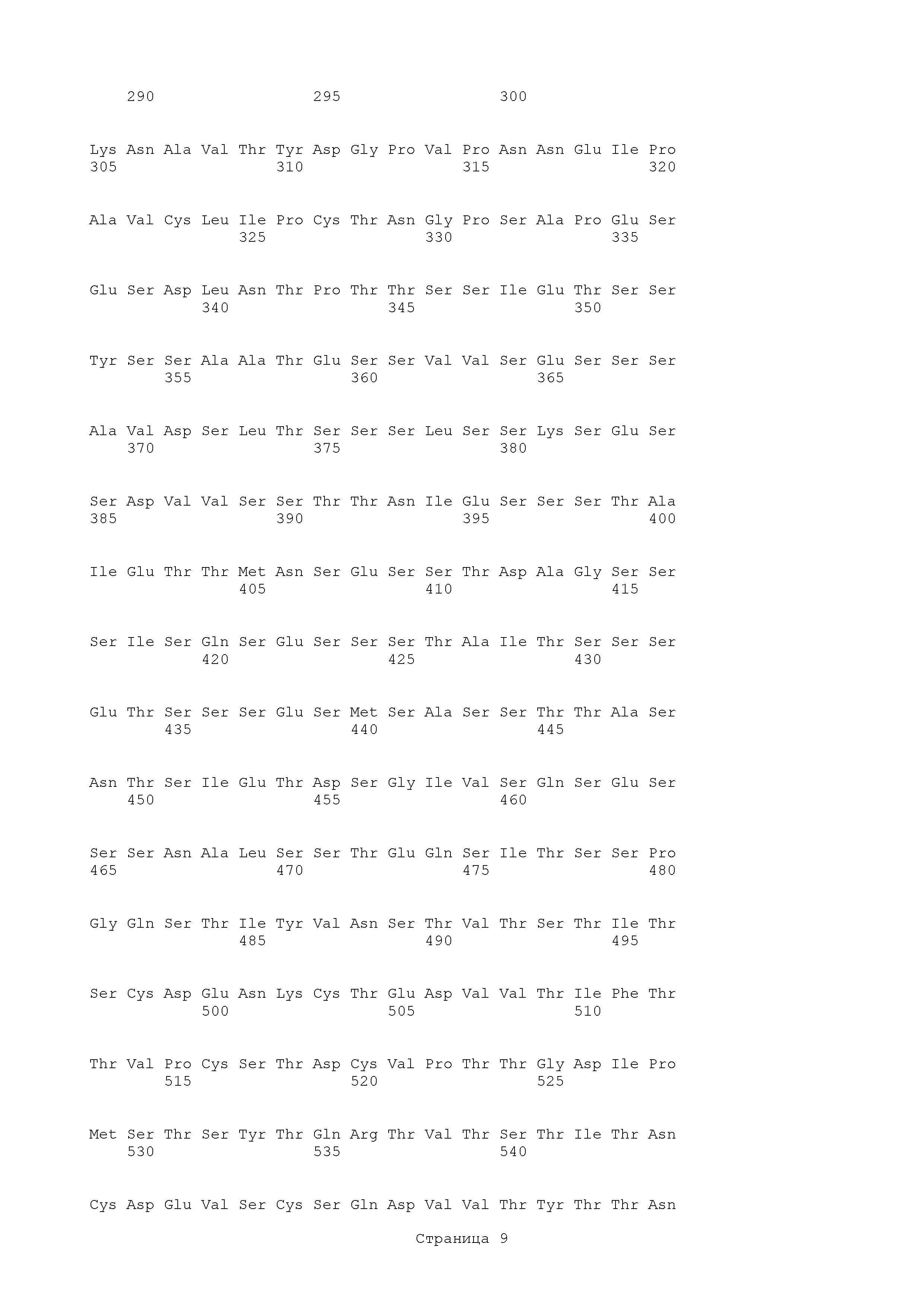
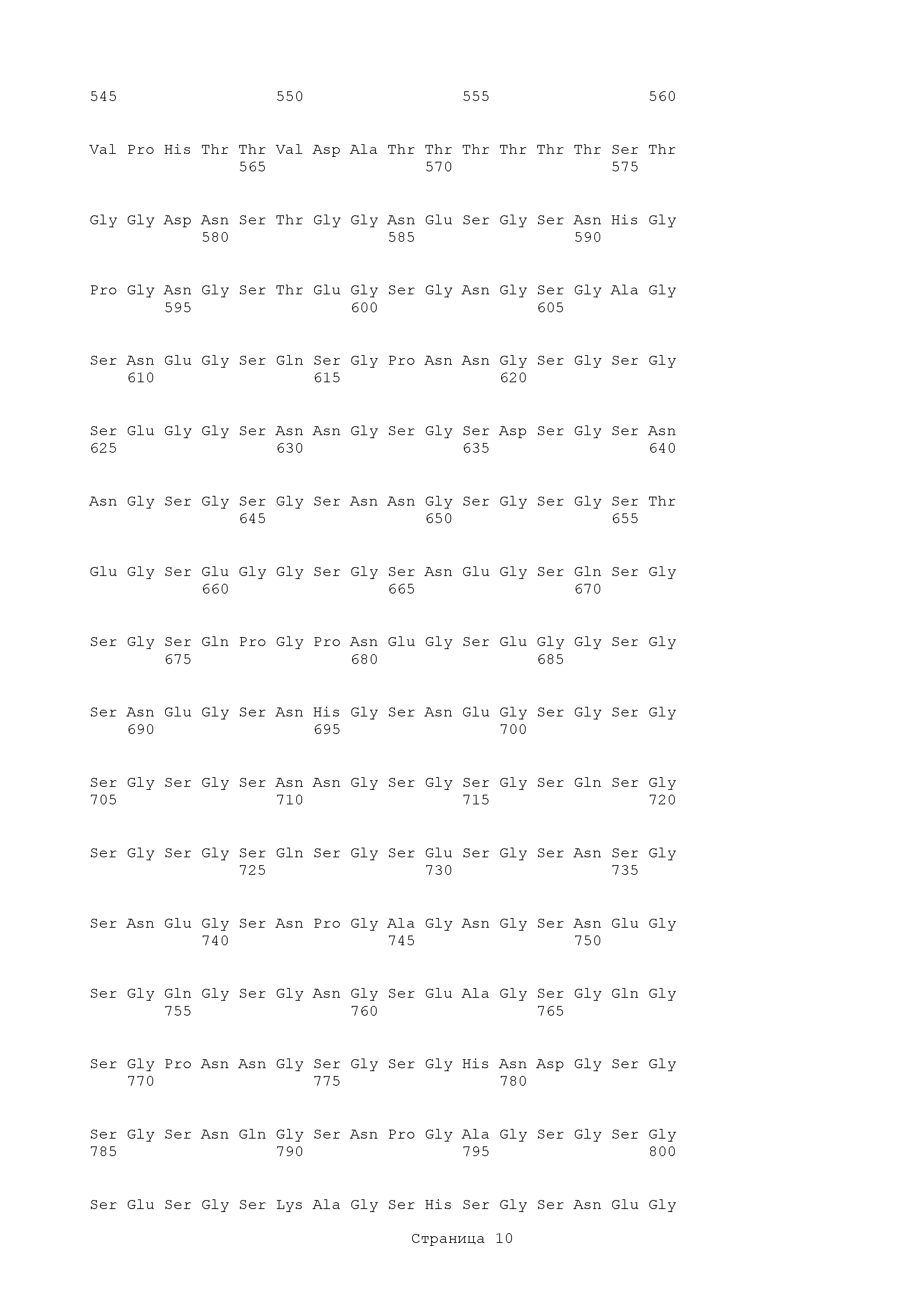




































































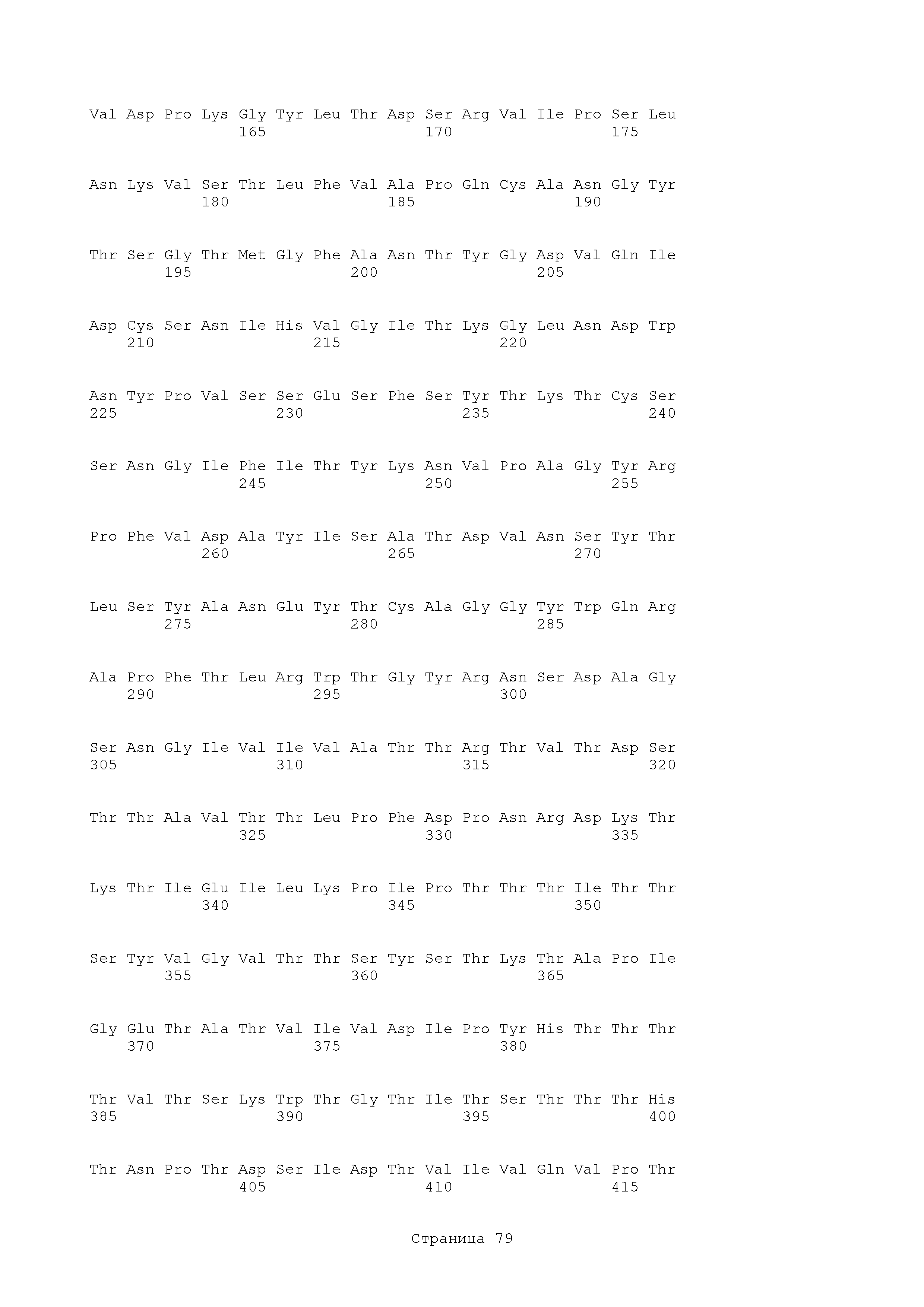
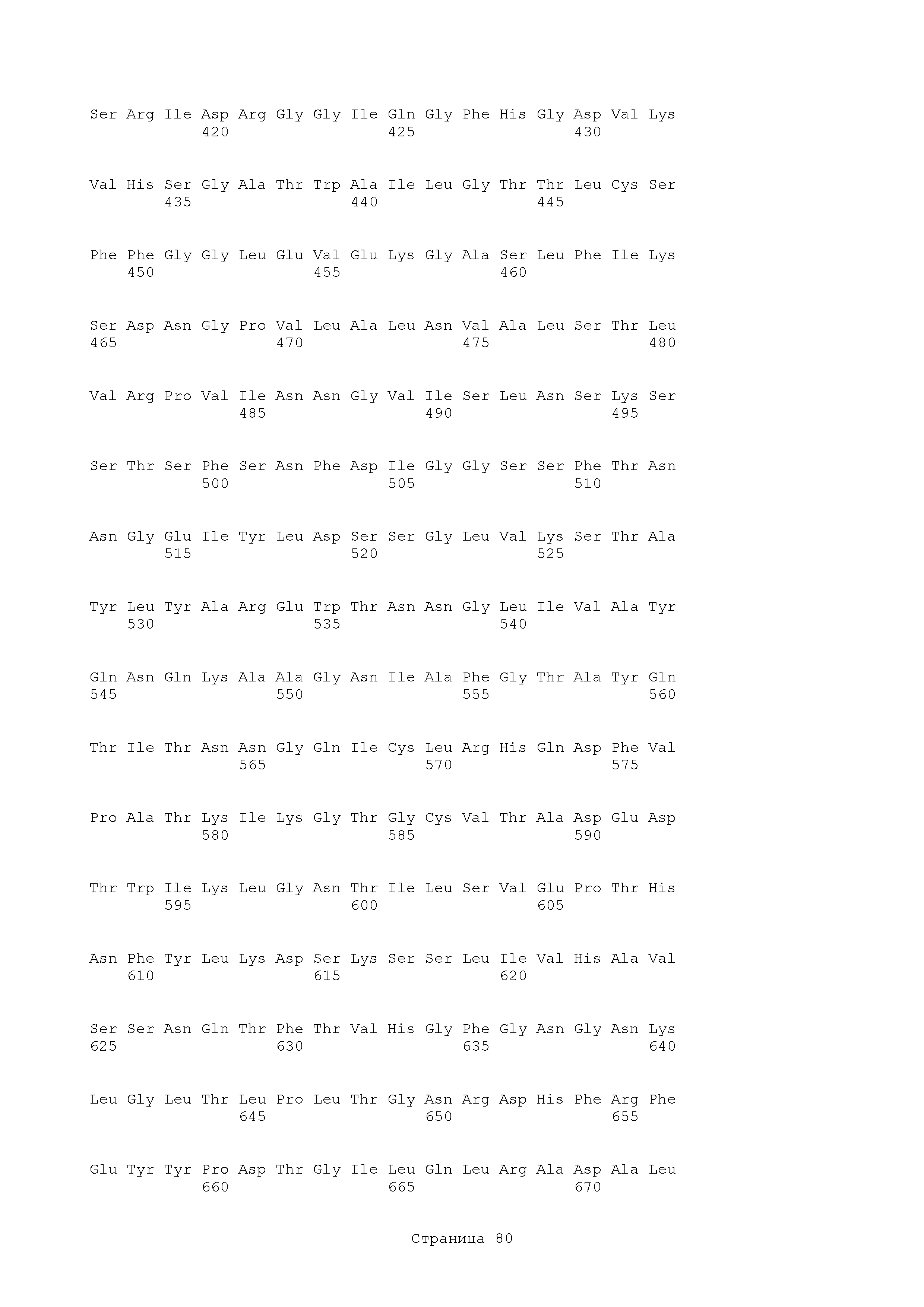




Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в основном относится к композициям и способам обнаружения, лечения и предупреждения инфекционных заболеваний у субъекта.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Грибок Candida, третья наиболее распространенная причина инфекций кровяного русла, ассоциированных с медицинским уходом, вызывает приблизительно 60000 случаев гематологически диссеминированного кандидоза в год в Соединенных Штатах, в результате чего расходы на здравоохранение составляют миллиарды долларов. Несмотря на современную противогрибковую терапию, смертность остается недопустимо высокой. Из-за растущей частоты возникновения опасного для жизни кандидоза и большого количества неудач в лечении требуются более эффективные профилактические и терапевтические стратегии.
Летальные инфекции, вызванные устойчивыми к антибиотикам патогенными бактериями, таким как инфекции в результате Candida, становятся все более частыми. Кроме того, риск заражения этими летальными инфекциями очень высокий для многих пациентов из групп риска в отделениях интенсивной терапии (ОИТ) из года в год, а также для солдат, дислоцированных в пограничных районах боевых действий. Виды Acinetobacter являются частым источником инфекции для госпитализированных пациентов и солдат, в частности, виды Acinetobacter baumannii. Acinetobacter представляет собой род грамотрицательных бактерий, принадлежащих к Gammaproteobacteria. Виды Acinetobacter способствуют минерализации ароматических соединений в почве. К сожалению, в настоящее время не существует технологии, которая предотвращает инфекции, вызванные Acinetobacter, за исключением стандартного мытья рук и других практик инфекционного контроля в больничных условиях.
Другие бактерии, Staphylococcus aureus являются главной причиной инфекций кожи и кожной структуры, включая целлюлит и фурункулез, и является одним из наиболее распространенных причин бактериемии. Штаммы S. aureus, которые представляют метициллин-устойчивый (MRSA) фенотип, являются доминирующими причинами внутрибольничных и внебольничных инфекций, включая инвазивные заболевания в иммунокомпетентных организмах-хозяевах, при подавлении иммунитета (например, нейтропения, трансплантаты паренхиматозных органов или костного мозга) и унаследованных иммунных дисфункциях, проявляющихся повторяющейся кожной инфекцией (например, синдром Джоба, хронический гранулематоз). Значительное влияние MRSA на здоровье населения вызывает особую озабоченность в свете высоких показателей смертности, связанных с вызванным S. aureus инвазивным заболеванием даже при соответствующей антибактериальной терапии (например, 15-40% при бактериемии и эндокардите). Возрастающая частота угрожающих жизни инфекций и снижение чувствительности к антибиотикам требуют разработки эффективной вакцины, целью которой является S. aureus.
Соответственно, существует необходимость создания соединений и способов, которые снижают риск инфекционных заболеваний, связанных с грибковыми и бактериальными инфекциями, и обеспечивают эффективные методы лечения. Настоящее изобретение удовлетворяет такую необходимость и, кроме того, обеспечивает соответствующие преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Ниже приводится описание фрагментов белков клеточной поверхности Candida Als3 и Hyr1 и их комбинаций, полезных при иммунизации субъекта против грибковых или бактериальных инфекций или того и другого.
Аминокислотная последовательность нативного полипептида С. albicans SC5314 Als3 имеет вид:
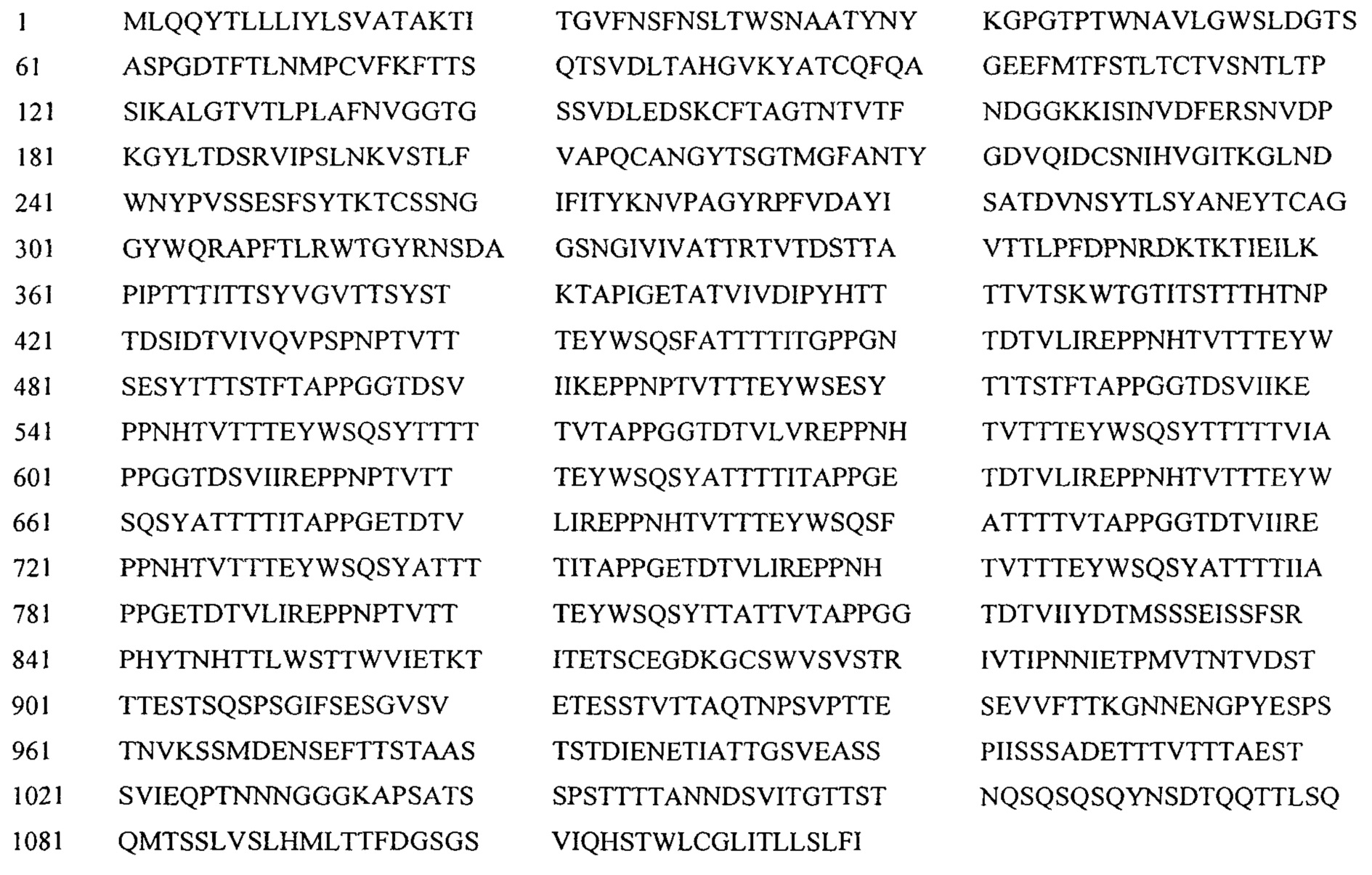
Выбранные фрагменты Als следующие.
Als3 (18-324)
В одном аспекте в изобретении представлен и Als3 (фрагмент аминокислоты 18-324). В частности, в данном изобретении представлен выделенный полипептид, факультативно слитый с партнером гетерологичного слияния, в котором аминокислотная последовательность полипептида состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность относительно

Als3 (Ser/Thr-богатая последовательность)
В другом аспекте в настоящем изобретении представлен выделенный полипептид, факультативно слитый с партнером гетерологичного слияния, в котором аминокислотная последовательность полипептида состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность относительно

Hyr1
В другом аспекте в настоящем изобретении представлены фрагменты Hyr1. Аминокислотная последовательность нативного полипептида С. albicans SC5314 Hyr1 имеет вид:

Выбранные фрагменты Hyr1 следующие.
Hyr1 (гидрофобная последовательность)
В частности, в настоящем изобретении представлен выделенный полипептид, факультативно слитый с партнером гетерологичного слияния, в котором аминокислотная последовательность полипептида состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность относительно
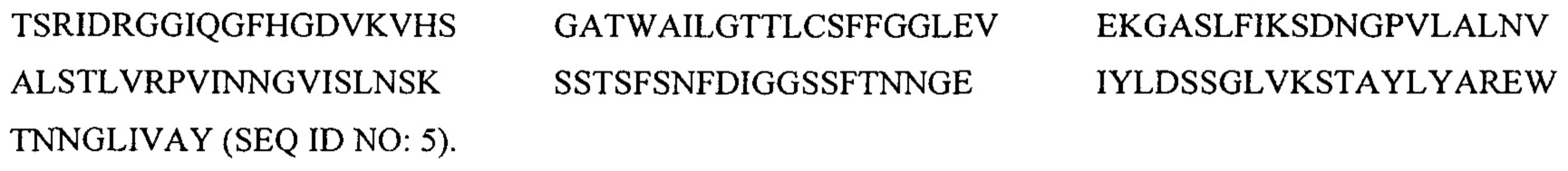
Hyr1 (154-350)
В другом аспекте в настоящем изобретении представлен выделенный полипептид, факультативно слитый с партнером гетерологичного слияния, в котором аминокислотная последовательность полипептида состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность относительно

Hyr1 (201-350)
В другом аспекте в настоящем изобретении представлен выделенный полипептид, факультативно слитый с партнером гетерологичного слияния, в котором аминокислотная последовательность полипептида состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность относительно
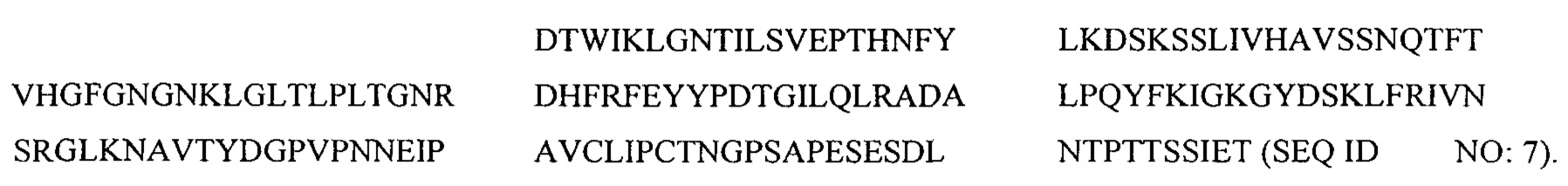
Hyr1 (25-469)
В другом аспекте в настоящем изобретении представлен выделенный полипептид, факультативно слитый с партнером гетерологичного слияния, в котором аминокислотная последовательность полипептида состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность относительно

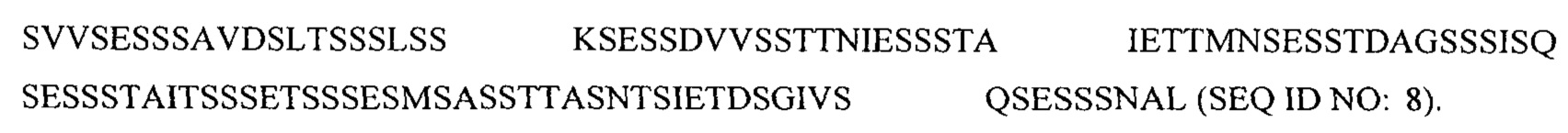
Hyr1 (201-469)
В другом аспекте в настоящем изобретении представлен выделенный полипептид, факультативно слитый с партнером гетерологичного слияния, в котором аминокислотная последовательность полипептида состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность относительно

Hyr1 (Ser/Thr-богатая последовательность)
В другом аспекте в настоящем изобретении представлен выделенный полипептид, факультативно слитый с партнером гетерологичного слияния, в котором аминокислотная последовательность полипептида состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность относительно

Hyr1 (154-469)
В другом аспекте в настоящем изобретении представлен выделенный полипептид, факультативно слитый с партнером гетерологичного слияния, в котором аминокислотная последовательность полипептида состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность относительно

Любой из вышеописанных полипептидных фрагментов может продуцироваться рекомбинантно в E. coli или S. cerevesiae. Кроме того, в изобретении представлены Als3/Hyr1 слитые полипептиды и системы рекомбинантной экспрессии, продуцирующие их.
E. coli-экспрессированные слитые полипептиды Als3/Hyr1
В другом аспекте в настоящем изобретении представлены фрагменты комбинаций полипептидов Als3 и Hyr1, экспрессированные в Е. coli. В частности, эти фрагменты и линкеры, соединяющие такие фрагменты, имеют вид:

Примеры слитых полипептидов следующие:
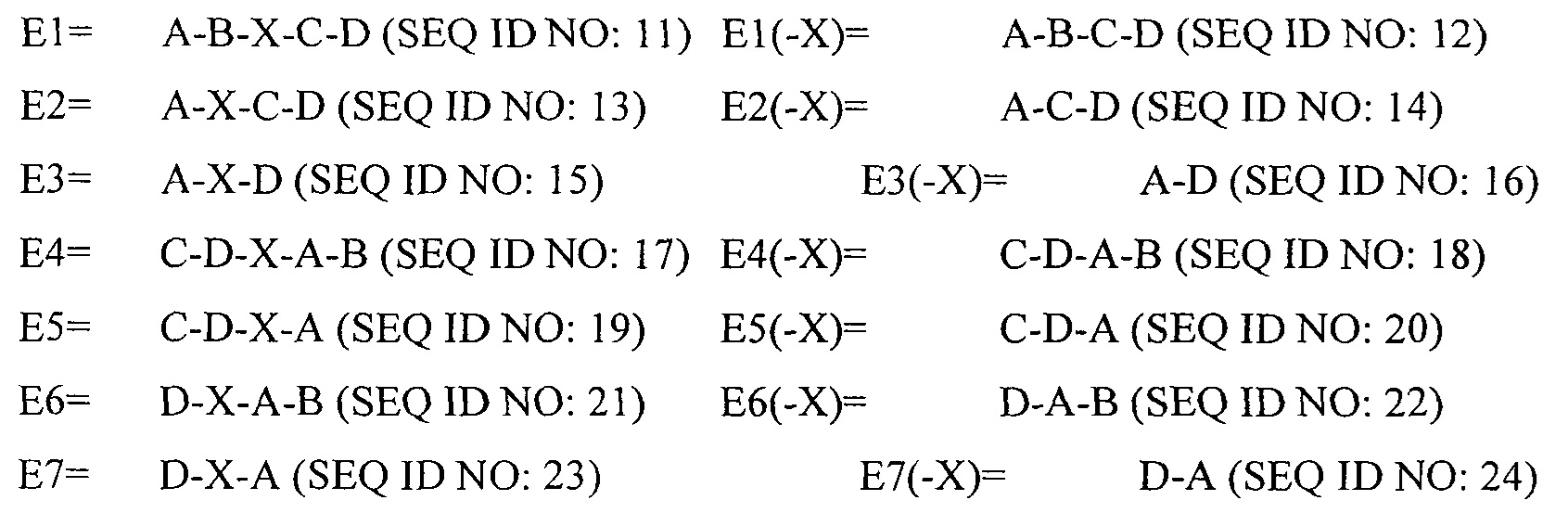
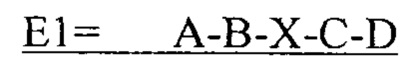
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
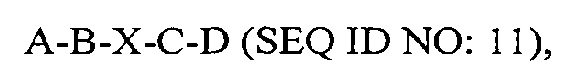
где А представляет собой SEQ ID NO: 2;
где В представляет собой SEQ ID NO: 3;
где X отсутствует или представляет собой линкерный пептид;
где С представляет собой SEQ ID NO: 5; и
где D представляет собой SEQ ID NO: 6.
В некоторых вариантах осуществления выделенный полипептид по существу идентичен А-B-C-D (SEQ IDNO: 12). В других вариантах осуществления полипептид представляет собой А-В-C-D (SEQIDNO: 12).

В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
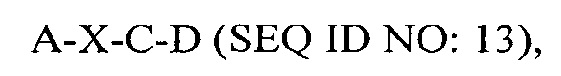
где А представляет собой SEQ ID NO: 2;
где X отсутствует или представляет собой линкерный пептид;
где С представляет собой SEQ ID NO: 5; и
где D представляет собой SEQ ID NO; 6.
В некоторых вариантах осуществления полипептид по существу идентичен A-C-D (SEQ ID NO: 14). В других вариантах осуществления полипептид представляет собой A-C-D (SEQ ID NO: 14).

В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
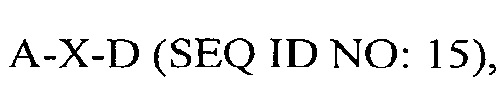
где А представляет собой SEQ ID NO: 2;
где X отсутствует или представляет собой линкерный пептид; и
где D представляет собой SEQ ID NO: 6.
В некоторых вариантах осуществления полипептид по существу идентичен A-D (SEQ ID NO: 16). В других вариантах осуществления полипептид представляет собой A-D (SEQ IDNO: 16).
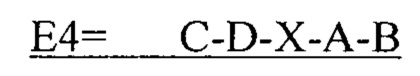
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
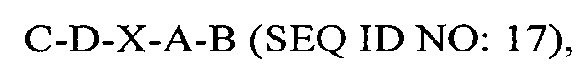
где С представляет собой SEQ ID NO: 5;
где D представляет собой SEQ ID NO: 6;
где X отсутствует или представляет собой линкерный пептид;
где А представляет собой SEQ ID NO: 2; и
где В представляет собой SEQ ID NO: 3.
В некоторых вариантах осуществления полипептид по существу идентичен C-D-A-B (SEQ ID NO: 18). В других вариантах осуществления полипептид представляет собой C-D-A-B (SEQ ID NO: 18).
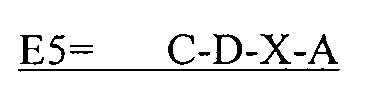
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
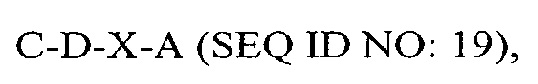
где С представляет собой SEQ ID NO: 5;
где D представляет собой SEQ ID NO: 6;
где X отсутствует или представляет собой линкерный пептид; и
где А представляет собой SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид по существу идентичен C-D-A (SEQ ID NO: 20). В других вариантах осуществления полипептид представляет собой C-D-A (SEQ ID NO: 20).
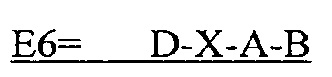
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
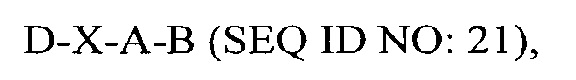
где D представляет собой SEQ ID NO: 6;
где X отсутствует или представляет собой линкерный пептид;
где А представляет собой SEQ ID NO: 2; и
где В представляет собой SEQ ID NO: 3.
В некоторых вариантах осуществления полипептид по существу идентичен D-A-B (SEQ ID NO: 22). В других вариантах осуществления полипептид представляет собой D-A-B (SEQ ID NO: 22).
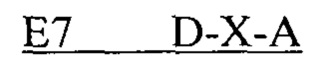
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
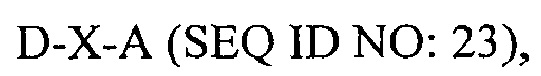
где D представляет собой SEQ ID NO: 6;
где X отсутствует или представляет собой линкерный пептид; и
где А представляет собой SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид по существу идентичен D-A (SEQ ID NO: 24). В других вариантах осуществления полипептид представляет собой D-A (SEQ ID NO: 24).
S. cerevisiae-экспрессированные слитые полипептиды Als3/Hyr1
В другом аспекте настоящее изобретение относится к фрагментам комбинаций полипептидов Als3 и Hyr1, экспрессированных в S. cerevisiae. В частности, эти фрагменты и линкеры, соединяющие такие фрагменты, имеют вид:


В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
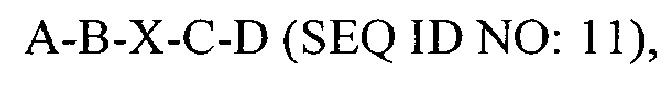
где А представляет собой SEQ ID NO: 2;
где В представляет собой SEQ ID NO: 3;
где X отсутствует или представляет собой линкерный пептид;
где С представляет собой SEQ IDNO: 5; и
где D представляет собой SEQ ID NO: 6.
В некоторых вариантах осуществления полипептид по существу идентичен A-B-C-D (SEQ IDNO: 12). В других вариантах осуществления полипептид представляет собой A-B-C-D (SEQ ID NO: 12).
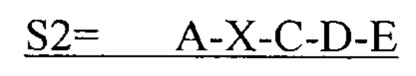
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
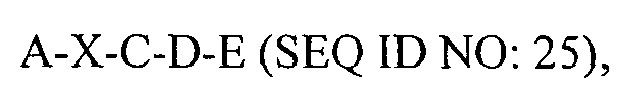
где А представляет собой SEQ ID NO: 2;
где X отсутствует или представляет собой линкерный пептид;
где С представляет собой SEQ ID NO: 5;
где D представляет собой SEQ ID NO: 6; и
где Е представляет собой SEQ ID NO: 10.
В некоторых вариантах осуществления полипептид по существу идентичен A-C-D-E (SEQ ID NO: 26). В других вариантах осуществления полипептид представляет собой A-C-D-E (SEQ ID NO: 26).
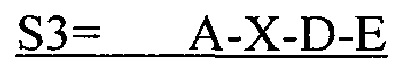
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
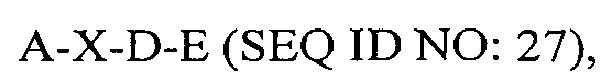
где А представляет собой SEQ ID NO: 2;
где X отсутствует или представляет собой линкерный пептид;
где D представляет собой SEQ ID NO: 6; и
где Е представляет собой SEQ ID NO: 10.
В некоторых вариантах осуществления полипептид по существу идентичен A-D-E (SEQ ID NO: 28). В других вариантах осуществления полипептид представляет собой A-D-E (SEQ ID NO: 28).
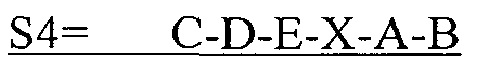
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
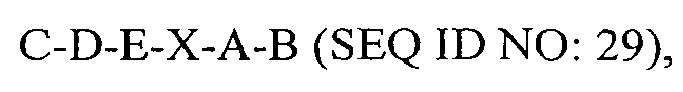
где С представляет собой SEQ ID NO: 5;
где D представляет собой SEQ ID NO: 6;
где Е представляет собой SEQ ID NO: 10;
где X отсутствует или представляет собой линкерный пептид;
где А представляет собой SEQ ID NO: 2; и
где В представляет собой SEQ ID NO: 3.
В некоторых вариантах осуществления полипептид по существу идентичен C-D-E-A-B (SEQ ID NO: 30). В других вариантах осуществления полипептид представляет собой C-D-E-A-B (SEQ ID NO: 30).
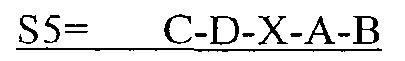
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
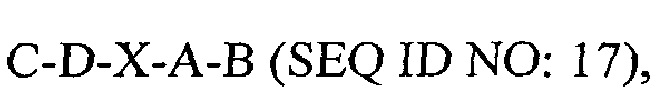
где С представляет собой SEQ ID NO: 5;
где D представляет собой SEQ ID NO: 6;
где X отсутствует или представляет собой линкерный пептид;
где А представляет собой SEQ ID NO: 2; и
где В представляет собой SEQ ID NO: 3.
В некоторых вариантах осуществления полипептид по существу идентичен C-D-A-B (SEQ ID NO: 18). В других вариантах осуществления полипептид представляет собой C-D-A-B (SEQ ID NO: 18).
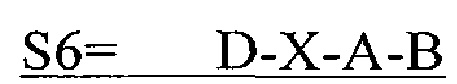
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности

где D представляет собой SEQ ID NO: 6;
где X отсутствует или представляет собой линкерный пептид;
где А представляет собой SEQ ID NO: 2; и
где В представляет собой SEQ ID NO: 3.
В некоторых вариантах осуществления полипептид по существу идентичен D-A-B (SEQ ID NO: 22). В других вариантах осуществления полипептид представляет собой D-A-B (SEQ ID NO: 22).

В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
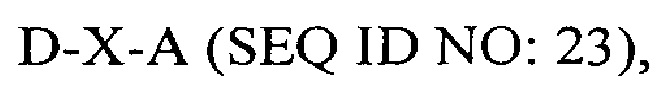
где D представляет собой SEQ ID NO: 6;
где X отсутствует или представляет собой линкерный пептид; и
где А представляет собой SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид по существу идентичен D-A (SEQ ID NO: 24). В других вариантах осуществления полипептид представляет собой D-A (SEQ ID NO: 24).
В других аспектах в настоящем изобретении представлена выделенная молекула нуклеиновой кислоты, которая кодирует любой из полипептидов или слитых полипептидов, описанных здесь.
В другом аспекте в настоящем изобретении представлена выделенная молекула нуклеиновой кислоты, включающая последовательность нуклеиновой кислоты, которая по существу идентична любой выделенной молекуле нуклеиновой кислоты, которая кодирует любой из полипептидов или слитых полипептидов, описанных здесь.
Кроме того, в изобретении представлен вектор, включающий любую из молекул нуклеиновой кислоты, кодирующих полипептиды или слитые полипептиды, описанные здесь. В изобретении также представлены векторы, содержащие нуклеиновые кислоты в соответствии с изобретением. Подходящие экспрессирующие векторы хорошо известны в данной области и включают векторы, способные экспрессировать нуклеиновую кислоту, функционально связанную с регуляторной последовательностью или элементом, как например, область промотора или область энхансера, которая способна регулировать экспрессию нуклеиновой кислоты. Соответствующие векторы экспрессии включают векторы, воспроизводимые в эукариотических клетках и/или прокариотических клетках, и векторы, которые остаются эписомальными или интегрируются в геном клетки-хозяина.
В изобретении также представлен способ экспрессии полипептида, как описан здесь, путем культивирования клеток, содержащих нуклеиновую кислоту, которая кодирует полипептид, в условиях, пригодных для экспрессии полипептида. Таким образом, предлагается способ рекомбинантного продуцирования полипептида в соответствии с настоящим изобретением путем экспрессии последовательностей нуклеиновых кислот, кодирующих полипептид в подходящих клетках-хозяевах. Системы экспрессии рекомбинантных ДНК, которые пригодны для продуцирования полипептидов, описаны здесь и хорошо известны в данной области. Например, описанные выше нуклеотидные последовательности могут инкорпорироваться в векторы для дальнейшей обработки. Векторы могут содержать плазмиду рекомбинантной ДНК или РНК или вирус, содержащий дискретные элементы, которые используются для введения гетерологичной ДНК в клетки либо для ее экспрессии, либо для ее репликации.
Аналогично, в настоящем изобретении представлена клетка, включающая любую из молекул нуклеиновой кислоты, кодирующих полипептиды или слитые полипептиды, описанные здесь.
В другом аспекте в настоящем изобретении представлен способ получения рекомбинантного полипептида, способ включает следующие этапы: (а) получение клетки, трансформированной молекулой нуклеиновой кислоты, кодирующей полипептид или слитый полипептид, описанный здесь, позиционированный для экспрессии в клетке; (b) культивирование трансформированной клетки в условиях для экспрессии молекулы нуклеиновой кислоты, причем культивирование приводит к экспрессии рекомбинантного полипептида; и (с) выделение рекомбинантного полипептида. В некоторых вариантах осуществления клетка представляет собой бактерию (например, E. coli). В других вариантах осуществления клетка представляет собой дрожжевую клетку (например, Saccharomyces cerevisae). В другом аспекте в настоящем изобретении представлен рекомбинантный полипептид, полученный в соответствии с вышеуказанным способом.
В другом аспекте в настоящем изобретении представлено по существу чистое антитело, которое специфически распознает и связывается с любым из полипептидов, описанных здесь.
В еще одном аспекте в настоящем изобретении представлена антигенная композиция, включающая вышеупомянутые полипептиды и фармацевтически приемлемый носитель, разбавитель и/или наполнитель. В некоторых вариантах осуществления композиция, кроме того, включает адъювант.
В другом аспекте в настоящем изобретении представлен способ индукции иммунного ответа у млекопитающего против антигена, включающий введение любого из вышеупомянутых полипептидов или вышеупомянутой антигенной композиции млекопитающему (например, человеку), в котором полипептид или композиция индуцирует иммунный ответ против антигена у млекопитающего. Как правило, млекопитающему вводят разовую дозу полипептида или композиции. В некоторых вариантах осуществления млекопитающему вводят несколько доз полипептида или композиции. В некоторых вариантах осуществления вводят несколько доз по меньшей мере с интервалом один день (например, несколько доз вводят, по меньшей мере с интервалом две недели). В других вариантах осуществления композиция вводится дважды.
В другом аспекте в настоящем изобретении представлена вакцина, включающая иммуногенное количество любого из вышеуказанных полипептидов и фармацевтически приемлемый наполнитель. В некоторых вариантах осуществления вакцина включает смесь различных полипептидов из любых вышеуказанных полипептидов. В некоторых вариантах осуществления вакцина, кроме того, включает адъювант (Алгидрогель). Вакцина в соответствии с изобретением пригодна для вакцинации млекопитающего (например, человека) против кандидоза, бактериальной инфекции, например, вызванной Staphylococcus или Acinetobacter. Как правило, вакцину следует вводить внутримышечно, подкожно или внутрикожно. Вакцину также можно вводить внутримышечно. Вакцинация может, кроме того, включать введение бустер-дозы. Кандидоз может принимать различные формы, такие как диссеминированный кандидоз (например, гематогенно диссеминированный кандидоз) или мукозальный кандидоз. Кандидоз вызывают, например, Candida albicans, Candida glabrata, Candida krusei, Candida parapsilosis или Candida tropicalis. В некоторых вариантах осуществления вакцинация выполняется против Acinetobacter или Staphylococcus.
В других аспектах в настоящем изобретении представлен способ получения химерной вакцины, включающий следующие этапы: (а) получение фага, дрожжей или вируса; (b) введение в фаг, дрожжи или вирус молекулы нуклеиновой кислоты, которая кодирует любой из вышеупомянутых полипептидов; (с) обеспечение экспрессии полипептида в фаге, дрожжах или вирусе; (d) выделение фага, дрожжей или вируса, полученного на этапе (с), включающего экспрессированный полипептид; и (е) добавление фармацевтически приемлемого наполнителя к выделенному фагу, дрожжам или вирусу, полученным на этапе (d). В некоторых вариантах осуществления полипептид отображается на поверхности фага, дрожжей или вируса после этапа (с).
В других аспектах в настоящем изобретении представлено выделенное моноклональное антитело, которое связывается с любым из вышеупомянутых полипептидов или слитых полипептидов. Как правило, антитело человеческое или гуманизированное. Антитело может быть также химерным. Антитело может быть также получено рекомбинантными способами. Диагностическая композиция, включающая эти антитела, находится в объеме изобретения.
Другой аспект настоящего изобретения относится к фармацевтической композиции, включающей любое из вышеупомянутых антител отдельно или в комбинации, и фармацевтически приемлемый наполнитель. В некоторых вариантах осуществления фармацевтическая композиция включает смесь антител с рядом различных специфичностей.
В еще одном аспекте в настоящем изобретении представлена фармацевтическая композиция, включающая поликлональные антитела, которые связываются с любым из полипептидов или слитых полипептидов, описанных здесь, или которые связываются со смесью различных полипептидов из таких описанных полипептидов. В некоторых вариантах осуществления фармацевтическая композиция предназначена для применения в пассивной иммунизации млекопитающего (например, млекопитающего) против кандидоза или бактериальной инфекции. Как правило, фармацевтическую композицию вводят внутримышечно, подкожно или внутрикожно. В некоторых вариантах осуществления фармацевтическую композицию вводят внутримышечно. В некоторых вариантах осуществления кандидоз представляет собой диссеминированный кандидоз, например, гематогенно диссеминированный кандидоз. В других вариантах осуществления кандидоз представляет собой мукозальный кандидоз. В некоторых вариантах осуществления кандидоз вызывают Candida albicans, Candida glabrata, Candida krusei, Candida parapsilosis или Candida tropicalis. В некоторых вариантах осуществления пассивная иммунизация выполняется против Acinetobacter или Staphylococcus.
В другом аспекте в настоящем изобретении представлен способ пассивной иммунизации млекопитающего (например, человека) против кандидоза или бактериальной инфекции, как например, вызванные Staphyloccocus или Acinetobacter, включающий введение млекопитающему эффективного количества любой из фармацевтических композиций, описанных здесь, тем самым выполняется пассивная иммунизация млекопитающего против кандидоза. В некоторых вариантах осуществления фармацевтическую композицию вводят внутримышечно, подкожно или внутрикожно. В других вариантах осуществления фармацевтическую композицию вводят внутримышечно. В некоторых вариантах осуществления кандидоз представляет собой кандидоз, например, гематогенно диссеминированный кандидоз. В некоторых вариантах осуществления кандидоз представляет собой мукозальный кандидоз. В некоторых вариантах осуществления кандидоз вызывают Candida albicans, Candida glabrata, Candida krusei, Candida parapsilosis или Candida tropicalis.
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
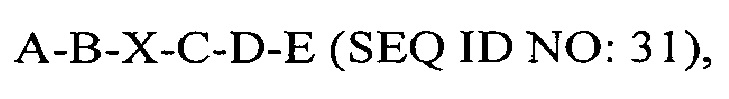
где А отсутствует или представляет собой SEQ ID NO: 2;
где В отсутствует или представляет собой SEQ ID NO: 3;
где X отсутствует или представляет собой линкерный пептид;
где С отсутствует или представляет собой SEQ ID NO: 5;
где D отсутствует или представляет собой SEQ ID NO: 6; и
где Е отсутствует или представляет собой SEQ ID NO: 10,
при условии, что в полипептиде присутствуют два или более из А, В, С, D и Е.
В некоторых вариантах осуществления полипептид представляет собой A-B-C-D-E (SEQ ID NO: 32); A-B-X-C-D (SEQ ID NO: 11); A-B-C-D (SEQ ID NO: 12); A-X-C-D-E (SEQ ID NO: 25);A-C-D-E (SEQ ID NO: 26); A-X-C-D (SEQ ID NO: 13); A-C-D (SEQ ID NO: 14); A-X-D-E (SEQ ID NO: 27); A-D-E (SEQ ID NO: 28); A-X-D (SEQ ID NO: 15); или A-D (SEQ ID NO: 16).
В другом аспекте в настоящем изобретении представлен выделенный полипептид, включающий последовательность, имеющую существенную идентичность относительно аминокислотной последовательности
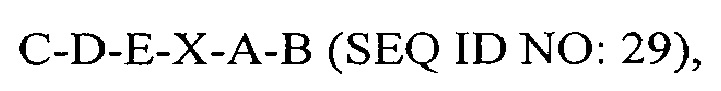
где С отсутствует или представляет собой SEQ ID NO: 5;
где D отсутствует или представляет собой SEQ ID NO: 6;
где Е отсутствует или представляет собой SEQ ID NO: 10;
где X отсутствует или представляет собой линкерный пептид;
где А отсутствует или представляет собой SEQ ID NO: 2;
где В отсутствует или представляет собой SEQ ID NO: 3, при условии, что в полипептиде присутствуют два или более из С, D, Е, А и В.
В некоторых вариантах осуществления полипептид представляет собой C-D-E-A-B (SEQ IDNO: 30); C-D-X-A-B (SEQ ID NO: 17); C-D-A-B (SEQ ID NO: 18); D-X-A-B (SEQ ID NO: 21); D-A-B (SEQ ID NO: 22): D-X-A (SEQ ID NO: 23); или D-A (SEQ ID NO: 24).
В других аспектах в настоящем изобретении представлены композиции и способы, как описаны здесь, которые основаны, по меньшей мере частично, на предположении, что иммунный ответ, как например, антитела и другие механизмы, нацелен на полипептид Candida HYR1 и обеспечивает защиту от Acinetobacter инфекции, например, Acinetobacter baumannii. Подходы активной или пассивной иммунизации с использованием фрагмента полипептида HYR1 или белков слияния полипептида Als3/Hyr1, описанных здесь, пригодны для защиты от инфекций, вызванных грамотрицательными палочковидными бактериями, включающими, но не ограничивающиеся этим, Acinetobacter baumannii. Некоторые применения композиций и способовописанных здесь, включают пассивную вакцинацию подверженных большому риску пациентов с помощью дозы анти-HYR1 или анти-ALs/Hyr1 антитела, чтобы не допустить инфекцию Acinetobacter baumannii. Кроме того, пациентов с активной инфекцией Acinetobacter baumannii можно лечить антителами отдельно или в сочетании с другими антибактериальными агентами. Альтернативно, пациентов, которые подвергаются риску развития таких инфекций, как например, военный персонал, можно активно вакцинировать с помощью полипептидов Hyr1 или Als3/Hyr1 или специфических полипептидов Acinetobacter baumannii, описанных здесь для предупреждения таких инфекций.
В дополнение к вакцинации субъектов, чувствительных к инфекциям Acinetobacter или Candida или и к той, и другой, вакцинные композиции в соответствии с настоящим изобретением также могут использоваться для лечения, иммунотерапевтическим методом, субъектов, страдающих различными грамотрицательными бактериальными инфекциями. Соответственно, вакцины, содержащие одну или несколько композиций из полипептидов и/или антител, описанных здесь, в комбинации с адъювантами, могут действовать в целях профилактического или терапевтического лечения инфекций, вызванных грамотрицательными бактериями. В одном варианте осуществления вакцины в соответствии с настоящим изобретением будут индуцировать собственную иммунную систему организма для поиска и ингибирования грамотрицательных бактерий или Candida, или и тех, и других.
Вакцины в соответствии с изобретением относятся к композиции, которую можно вводить субъекту в целях его защиты от инфекционного заболевания. Вакцины защищают от заболеваний за счет индукции или усиления иммунного ответа у животного против инфекционного заболевания. Примеры инфекционных заболеваний, поддающихся лечению вакцинами в соответствии с изобретением, включают тяжелую пневмонию, инфекции мочевыводящих путей, инфекции кровяного русла и инфекции других частей тела. Защитой, опосредованной вакциной, может быть гуморальный и/или клеточно-опосредованный иммунитет, индуцированный в организме-хозяине, когда субъект подвергается заражению, например, или иммуногенный участок полипептида или белка, описанного здесь.
Соответственно, в некоторых вариантах осуществления в изобретении представлен способ лечения или профилактики инфекций, вызванных грамотрицательными бактериями, у субъекта, нуждающегося в этом, путем введения терапевтически эффективного количества фармацевтической композиции, как описано здесь, или вакцинной композиции, как описано здесь. Например, в изобретении представлены способы лечения или профилактики инфекций, вызванных одной или несколькими грамотрицательными бактериями, которые включают бактерии рода Acinetobacter, как например, A. baumannii, A. iwoffii, A. haemolyticus, A. calcoaceticus, A. johnsonii, A. radioresistens и A. junii, бактерии рода Haemophilus, как например, Н. aegyptius, H. aphrophilus, Н. avium, Н. ducreyi, Н. felis, Н. haemolyticus, Н. influenza, Н. parainfluenzae, Н. paracuniculus, Н. parahaemolyticus, Н. pittmaniae и Н. somnus, бактерии рода Bordetella, как например, В. ansorpii, В avium, В. bronchiseptica, В. hinzii, В. holmesii, В. parapertussis, В. pertussis, В. petrii и В. trematum, бактерии рода Salmonella, как например, S. typhimurium, S. bongori, S. enterica subsp. enterica, S. enterica subsp. salamae, S. arizonae, S. enterica subsp. diarizonae, S. enterica subsp. houtenae и S. enterica subsp. indica, бактерии рода Yersina, как например, Yersina pseudotuber, Y. aldovae, Y. aleksiciae, Y. bercovieri, Y. enterocolitica, Y. frederiksenii, Y. intermedia, Y. kristensenii, Y. mollaretii, Y. pestis, Y. pseudotuberculosis, Y. rohdei и Y. ruckeri, бактерии рода Escherichia, как например, Е. albertii, Е. blattae, Е. coli, Е. fergusonii, Е. hermannii и Е. vulneris, бактерии рода Pedobacter, как например, P. heparinus, P. roseus sp. nov. и P. aquatilis sp. nov, бактерии рода Pseudomonas, как например, P. aeruginosa, P. alcaligenes, P. mendocina, P. fluorescens, P. monteilii, P. oryzihabitans, P. luteola, P. putida, P. cepacia, P. stutzeri, P. maltophilia, P. putrefaciens, P. mallei and P. pseudomallei, бактерии рода Klebsiella, как например, K. pneumoniae, K. planticola K. oxytoca и K. rhinoscleromatis. В других вариантах осуществления может выполняться лечение или профилактика видов Candida, как описано здесь.
Под «адъювантом» подразумевается одно или несколько веществ, которые вызывают стимуляцию иммунной системы. В данном контексте адъювант используется для повышения иммунного ответа на один или несколько вакцинных антигенов или антител. Адъювант можно вводить субъекту до введения вакцины или антитела, совместно с введением вакцины или антитела или после введения вакцины или антитела. Примеры химических соединений, используемых в качестве адъювантов, включают, но не ограничиваются ими, соединения алюминия (например, квасцы, алгидрогель), масла, блок-сополимеры, иммуностимулирующие комплексы, витамины и минералы (например, витамин Е, витамин А, селен и витамин В12), Quil A (сапонины), компоненты стенки бактериальной и грибковой клетки (например, липополисахариды, липопротеины и гликопротеины), гормоны, цитокины и костимуляторные факторы.
Под «антителом» подразумеваются полные антитела, иммуноглобулины или любой антигенсвязывающий фрагмент или его одиночные цепи. Антитела, как используются здесь, могут быть от млекопитающих (например, человека или мыши), гуманизированными, химерными, рекомбинантными, полученные синтетическим путем или естественно выделенные, и могут быть, например, моноклональными или поликлональными. У большинства млекопитающих, включая человека, полные антитела имеют, по меньшей мере, две тяжелые (Н) цепи и две легкие (L) цепи, соединенные дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно здесь VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3 и шарнирной области между CH1 и CH2. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно здесь vl) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, cl. Области vh и vl могут дополнительно подразделяться на участки гипервариабельности, называемые участками, определяющими комплементарность (CDR), перемежающиеся с участками, которые являются более консервативными, называемыми каркасными участками (FR). Каждая область vh и vl состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки), и первого компонента (Clq) классической системы комплемента.
Антитела в соответствии с настоящим изобретением включают все известные формы антител и другие белковые матриксы со свойствами антител. Например, антитело может быть антителом человека, гуманизированным антителом, биспецифическим антителом, химерным антителом или белковым матриксом со свойствами антител, как например, фибронектиновые или анкириновые повторы. Антитело может представлять собой Fab, Fab'2, scFv, SMIP, диатело, нанотело, аптамеры, или доменное антитело. Антитело может иметь любой из следующих изотипов: IgG (e.g., IgG1, IgG2, IgG3 и IgG4), IgM, IgA (например, IgA1, IgA2 и IgAsec), IgD или IgE.
Термин «фрагмент антитела», как используется здесь, относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Антиген-связывающую функцию антитела могут выполнять фрагменты антитела полной длины, которые включают, но не ограничиваются ими: (i) Fab-фрагмент, одновалентный фрагмент, состоящий из vl, vh, cl и CH1 доменов; (ii) F(ab')2 - фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из vh и Сн1 доменов; (iv) Fv-фрагмент, состоящий из vl и vh доменов одного плеча антитела, (v) dAb, включающий vh и vl домены; (vi) dAb-фрагмент (Ward et al.. Nature 341: 544-546 (1989)), который состоит из vh домена; (vii) dAb, который состоит из vh или vl домена; (viii) выделенный участок, определяющий комплементарность (CDR); и (ix) сочетание двух или более выделенных CDR, которые могут быть факультативно соединены синтетическим линкером. Кроме того, хотя два домена фрагмента Fv, vl и vh, кодируются отдельными генами, они могут соединяться с использованием рекомбинантных способов синтетическим линкером, который позволяет им быть в одной белковой цепи, в которой пара областей vl и vh образует моновалентные молекулы (известные как одиноцепочечные Fv (scFv), см. например. Bird et al., Science 242: 423-426 (1988) и Huston et al., Proc. Natl. Acad. Sci. USA 85: 5879-5883 (1988)). Эти фрагменты антител получают с помощью обычных методов, известных специалистам в данной области, и фрагменты скринируются на пригодность так же, как и интактные антитела. Фрагменты антител могут быть получены с помощью методов рекомбинантной ДНК или путем ферментативного или химического расщепления интактных иммуноглобулинов.
Под «антигеном» подразумевается молекула, с которой антитело может селективно связываться. Целевой антиген может представлять собой белок (например, антигенный пептид), карбогидрат, нуклеиновую кислоту, липид, гаптен или другое природное или синтетическое соединение. Целевой антиген может быть полипептидом или пептидом-имитатором. Антиген можно также вводить животному для генерации иммунного ответа у животного.
Под «носителем» в контексте конъюгата подразумевается фрагмент или частица, например, KLH, CRM 197, столбнячный анатоксин, фаг, дрожжи, вирус, виросома или рекомбинантная вирусоподобная частица, которые подходят для связывания с полипептидом или для его отображения, как описано здесь.
Под «химерным антителом» подразумевается иммуноглобулин или антитело, чьи вариабельные области вытекают из первого вида, и чьи константные области вытекают из второго вида. Химерные антитела могут быть построены, например, с помощью генной инженерии из сегментов иммуноглобулинового гена, принадлежащих к разным видам (например, от мыши и человека).
Под «химерной вакциной» подразумевается вакцина, которая включает по меньшей мере два различных антигена, например, соединенных ковалентно. Примером химерной вакцины является композиция, которая включает полипептид, отображенный, например, на поверхности частицы, как например фаг, вирус, дрожжи, виросома или рекомбинантная вирусоподобная частица.
Под «конъюгатом» подразумевается соединение, которое включает полипептид в соответствии с настоящим изобретением, связанный с другим фрагментом или частицей, например, KLH, CRM 197, столбнячный анатоксин, фаг, дрожжи, вирус, виросома или рекомбинантная вирусоподобная частица.
Под «консервативным замещением» в аминокислотной последовательности подразумевается замена аминокислоты на другую в рамках семейства аминокислот, которые родственны по химической природе своих боковых цепей.
Генетически кодируемые аминокислоты можно разделить на четыре семейства: кислотные (аспартат, глутамат); основные (лизин, аргинин, гистидин); неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан); и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серии, треонин, тирозин). Фенилаланин, триптофан и тирозин иногда группируют как ароматические аминокислоты. Аналогичным образом, аминокислоты также можно разделить на следующие группы: кислотные (аспартат, глутамат); основные (лизин, аргинин, гистидин); алифатические (глицин, аланин, валин, лейцин, изолейцин, серин, треонин), причем серин и треонин факультативно группируются отдельно, как алифатический гидроксил; ароматические (фенилаланин, тирозин, триптофан); амидные (аспарагин, глутамин); и серосодержащие (цистеин, метионин).
Любое изменение аминокислотной последовательности, приводящее к функциональному варианту, может быть определено путем оценки способности вариантного полипептида функционировать таким же образом, как и полипептид дикого типа, с использованием стандартных методов, как например, описанные в данном документе.
Под «диагностической композицией» подразумевается композиция, содержащая полипептид, конъюгат, вакцину или антитело в соответствии с изобретением, разработанная для применения в сочетании с диагностическим методом.
Под «эффективным количеством» в контексте пассивной иммунизации с использованием фармацевтической композиции, например, содержащей антитело, подразумевается количество фармацевтической композиции, необходимое для пассивной иммунизации клинически подходящим образом. Эффективное количество фармацевтической композиции, применяемой для осуществления на практике методов пассивной иммунизации, описанных здесь, варьируется в зависимости от способа введения, возраста, массы тела и общего состояния здоровья субъекта. В конечном счете, решение о назначении соответствующего количества и схемы дозировки принимают врачи, назначающие лечение.
Под «фланкирующей аминокислотой» подразумевается аминокислота в полипептидной последовательности, которая непосредственно примыкает к N- или С-концу конкретной определенной последовательности. Желательно, чтобы фланкирующая аминокислота присутствовала HaN- и/или С-конце аминокислотной последовательности SEQ IDNO: 1 или 2 или ее фрагмента; и более предпочтительно, чтобы 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 фланкирующих аминокислот присутствовали на N- и/или С-конце аминокислотной последовательности SEQ ID NO: 1 или 2 или ее фрагмента.
Под «белком слияния» подразумевается белок, который включает полипептид в соответствии с изобретением, например, фрагмент или вариант пептида, а также партнер слияния.
Под «партнером слияния» подразумевается гетерологичная последовательность, которая может сливаться с полипептидом или пептидом в соответствии с изобретением, например, один или несколько пептидов 3-11 или их вариантов. В данном документе описаны примеры партнеров слияния, которые включают маркеры обнаружения, стабилизирующие домены, последовательности, которые помогают продуцированию или очистке белка, или домены, которые повышают антигенность полипептида.
Под «иммуногенным» подразумевается любое вещество, которое способно индуцировать иммунный ответ у субъекта.
Под «иммуногенным количеством» в контексте вакцины подразумевается количество вакцины, необходимое для индукции иммунного ответа у субъекта клинически подходящим образом. Иммуногенное количество вакцины, применяемой для осуществления на практике методов вакцинации, описанных здесь, варьируется в зависимости от способа введения, возраста, массы тела и общего состояния здоровья субъекта. В конечном счете, решение о назначении соответствующего количества и схемы дозировки принимают врачи, назначающие лечение.
Под «выделенный» или «очищенный» подразумевается выделенный из других природных сопутствующих компонентов. Как правило, соединение (например, нуклеиновая кислота, полипептид, антитело или малая молекула), по существу, является выделенным, когда оно составляет по меньшей мере 60% по весу, не содержит белков и/или природных органических молекул, с которыми она естественно связана. Это определение также распространяется, например, на молекулу полипептида или нуклеиновой кислоты, выделенной из ее фланкирующих последовательностей (например, в отношении аминокислотной последовательности, выделенная относится к последовательности, которая не содержит фланкирующих аминокислот, с которыми последовательность естественно связана в полипептиде). В некоторых случаях, соединение является выделенным по меньшей мере на 75%, более предпочтительно по меньшей мере на 90%, и наиболее предпочтительно по меньшей мере на 99% по весу. Выделенное соединение, например, полипептид, можно получить с помощью стандартных методов, например, путем экстракции из естественного источника (например, очистка от клеток, инфицированных бактериями Candida);
путем экспрессии рекомбинантной нуклеиновой кислоты, кодирующей Als3 или CNA фрагмент или вариант, или их белок слияния; или путем химического синтеза полипептида. Чистоту можно измерять любым подходящим способом, например, с помощью колоночной хроматографии, электрофореза в полиакриламидном геле или ВЭЖХ-анализа.
Под термином «связанный с» или «конъюгированный с» в контексте конъюгата подразумевается ковалентное или нековалентное взаимодействие между полипептидом и партнером-носителем или партнером слияния. Нековалентные взаимодействия включают, но не ограничиваются ими, водородное связывание, ионные взаимодействия между заряженными группами, электростатическое связывание, ван-дер-ваальсовские взаимодействия, гидрофобные взаимодействия между неполярными группами, липофобные взаимодействия и притяжения, зависимые от logP.
Под «линкером», как используется здесь, подразумевается аминокислотная последовательность одной или нескольких аминокислот в длину, например, которая не расщепляется, например, путем авторасщепления, ферментативного или химического расщепления. Линкер может включать неполярные, полярные и/или заряженные аминокислоты. В некоторых вариантах осуществления линкеры включают или состоят из гибких частей, например, областей без существенной фиксированной вторичной или третичной структуры. Примерами гибких линкеров являются глицин-богатые линкеры, например, содержащие по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или даже 100% остатков глицина. Линкеры могут также содержать, например, остатки серина. В некоторых случаях аминокислотная последовательность линкеров состоит только из остатков глицина и серина. Линкер может представлять собой, например, от 1 до 100 аминокислот в длину, например, 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 аминокислот в длину.
Под «моноклональным антителом» подразумевается антитело, полученное из популяции по существу гомогенных антител, т.е. индивидуальных антител, составляющих популяцию, являются идентичными за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Кроме того, в отличие от препаратов с обычными (поликлональными) антителами, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Моноклональные антитела можно получить с помощью любой методики, признанной в данной области, и с помощью описанных здесь методик, как, например, метод гибридом, описанный в Kohler et al., Nature 256: 495 (1975), метод с трансгенными животными (например, Lonberg et al., Nature 368(6474): 856-859 (1994)), метод с рекомбинантной ДНК (например, патент США 4816567) или с помощью фага, дрожжей или синтетических библиотек матриксных антител с использованием методик, описанных, например, в Clackson et al.. Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol. 222: 581-597 (1991).
Под «молекулой нуклеиновой кислоты» подразумевается молекула, например, РНК или ДНК, имеющая последовательность двух или более ковалентно связанных, природных или модифицированных нуклеотидов. Молекула нуклеиновой кислоты может быть, например, одно- или двухцепочечной и может включать модифицированные или немодифицированные нуклеотиды или их смеси или комбинации. Различные соли, смешанные соли и формы свободной кислоты также включены.
Под «пациентом» или «субъектом» подразумевается млекопитающее, включающее, но не ограничивающееся этим, человека или других млекопитающих, как, например, корова, лошадь, собаки, овцы или кошки.
Термины «пептид», «полипептид» и «белок» используются взаимозаменяемо и относятся к любой цепи двух или нескольких природных или неприродных аминокислот, независимо от посттрансляционной модификации (например, гликозилирование или фосфорилирование), составляющие весь или часть природного или неприродного полипептида или пептида, как описано здесь. Такие полипептиды обычно являются непрерывным и неразветвленным пептидом. Пептид представляет собой короткий полимер мономеров аминокислоты. «Белки» включают в себя один или несколько полипептидов, расположенных биологически функциональным образом. Аминокислоты, содержащие полипептиды в соответствии с изобретением, могут быть связаны пептидными связями или другими связями, например, связями сложного эфира или простого эфира. Аминокислоты, содержащие полипептиды в соответствии с изобретением, могут включать не генетически закодированные аминокислоты, природные или химически синтезированные.
Полипептид в соответствии с изобретением может также охватывать одно или несколько консервативных замещений. Консервативные замещения кодированных аминокислот включают, например, аминокислоты, принадлежащие к следующим группам: (1) неполярные аминокислоты (Gly, Ala, Val, Leu и Ilе); (2) полярные нейтральные аминокислоты (Cys, Met, Ser, Thr, Asn и Gln); (3) полярные кислые аминокислоты (Asp и Glu); (4) полярные основные аминокислоты (Lys, Arg и His); и (5) ароматические аминокислоты (Phe, Trp, Tyr и His). Другие незначительные модификации также включены в полипептиды в соответствии с настоящим изобретением при условии, что полипептид сохраняет некоторые или все свои функции, как описано здесь.
Полипептиды в соответствии с изобретением могут также включать производные, аналоги и функциональные миметики, при условии, что такой полипептид сохраняет некоторые или все свои функции, как описано здесь. Например, производные могут включать химические модификации полипептида, как например, алкилирование, ацилирование, карбамилирование, иодирование, или любую модификацию, которая порождает полипептид. Такие дериватизированные молекулы включают, например, молекулы, в которых свободные аминогруппы дериватизированы с образованием амингидрохлоридов, р-толуол сульфонильных групп, карбобензокси групп, t-бутилоксикарбонильных групп, хлорацетильных групп или формильных групп. Свободные карбоксильные группы могут быть дериватизированы с образованием солей, метиловых и этиловых эфиров или других типов сложных эфиров или гидразидов. Свободные гидроксильные группы могут быть дериватизированы с образованием O-ацильных или O-алкильных производных. Имидазольный азот гистидина может быть дериватизирован с образованием N-им-бензилгистидина. Также в качестве производных или аналогов выступают пептиды, которые содержат одно или несколько природных аминокислотных производных двадцати стандартных аминокислот, например, 4-гидроксипролин, 5-гидроксилизин, 3-метилгистидин, гомосерин, орнитин или карбоксиглутамат, и могут включать аминокислоты, не связанные пептидными связями. Полипептиды по настоящему изобретению также включают любой полипептид, имеющий одну или несколько вставок и/или делеций остатков, по отношению к последовательности полипептида, последовательность которого представлена в настоящем документе, при условии, что поддерживается иммуногенная активность, как описано здесь.
Полипептиды в соответствии с изобретением могут быть выделены с помощью различных способов, хорошо известных в данной области, например, рекомбинантных экспрессионных систем, осаждения, гель-фильтрации, ионного обмена, хроматографии с обращенной фазой и аффинной хроматографии, и тому подобное. Другие хорошо известные способы описаны в Deutscher et al., Guide to Protein Purification: Methods in Enzymology Vol. 182, (Academic Press, (1990)). В качестве альтернативы, выделенные полипептиды в соответствии с настоящим изобретением могут быть получены с помощью хорошо известных рекомбинантных способов (см, Ausubel et al., "Immunology," Short Protocols in Molecular Biology, John Wiley & Sons, Inc. Chapter 11. Page 11.1-11.29 (1999); Sam brook and Russell, "Molecular Cloning: A Laboratory Manual," Cold Spring Harbor Laboratory (2001)). Способы и условия для биохимической очистки полипептида в соответствии с изобретением может выбирать специалист в данной области и выполнять мониторинг очистки, например, с помощью иммунологического анализа или функционального анализа.
Примером средства для получения полипептида в соответствии с изобретением является экспрессия нуклеиновых кислот, кодирующих полипептид в соответствии с изобретением, в подходящей клетке-хозяине, например, бактериальной клетке, дрожжевой клетке, клетке амфибий, как например, ооцит, или клетке млекопитающего, при использовании способов, хорошо известных в данной области, и для извлечения экспрессированного полипептида, снова с использованием хорошо известных методов очистки, как описано здесь. Полипептиды в соответствии с изобретением могут быть выделены непосредственно из клеток, которые были трансформированы векторами экспрессии, как описано здесь. Полипептиды в соответствии с изобретением могут быть также получены путем химического синтеза. Методы химического синтеза полипептидов хорошо известны в данной области и коммерчески доступны.
Рекомбинантно экспрессированные полипептиды в соответствии с изобретением так же могут быть экспрессированы в качестве белков слияния соответствующими партнерами слияния. Соответствующий партнер слияния может быть аминокислотной последовательностью, которая обычно не соединяется с аминокислотной последовательностью, как например, гетерологичная последовательность, которая выполняет конкретную функцию или придает дополнительную характеристику полипептидам в соответствии с изобретением. Неограничивающие примеры подходящих гетерологичных последовательностей включают детектируемый маркер, стабилизирующий домен, белок-носитель для создания антител, линкерную последовательность и последовательность, которая способствует очистке полипептида. Последовательности, которые могут способствовать очистке полипептидов в соответствии с изобретением, включают аффинные метки, такие как глутатион S-трансфераза (GST) или поли His. Таким образом, в некоторых аспектах в изобретении представлен белок слияния, имеющий полипептид, как описано здесь, слитый с гетерологичной последовательностью, белок-носитель, аффинную метку или линкерную последовательность или другие полипептиды, как описано здесь.
Как используется здесь, природная аминокислота является природной α-аминокислотой, имеющей L-конфигурацию, как например, аминокислоты, которые обычно встречаются в природных полипептидах. Искусственная аминокислота относится к аминокислоте, обычно не встречающейся в полипептидах, например, эпимер природной α-аминокислоты, имеющей L-конфигурацию, а именно к аминокислоте, имеющей неприродную D-конфигурацию; или их (D,L)-изомерную смесь; или гомолог такой аминокислоты, например, β-аминокислоты, α,α-дизамещенной аминокислоты или α-аминокислоты, в которой боковая цепь аминокислоты укорочена на одну или две метиленовые группы или удлинена вплоть до 10 атомов углерода, как например, α-амино алкановая кислота, имеющая от 5 до включительно 10 атомов углерода в линейной цепи, незамещенную или замещенную ароматическую (α-арил или α-арил низший алкил), например, замещенный фенилаланин или фенилглицин.
Термины «фармацевтически приемлемый носитель» и «фармацевтически приемлемый наполнитель» используются взаимозаменяемо и означают носитель или наполнитель, который физиологически приемлем для лечения пациента, сохраняя при этом лечебные свойства соединения, с которым он вводится. Одним из примеров вещества фармацевтически приемлемого носителя является физиологический раствор. Другие физиологически приемлемые носители и их составы известны специалистам в данной области и описаны, например, в Remington's Pharmaceutical Sciences, (20-е издание), под ред. А. Геннаро, 2000 г., Lippincott, Williams & Wilkins, Филадельфия, штат Пенсильвания.
Под «фармацевтической композицией» подразумевается композиция, содержащая полипептид, конъюгат, вакцину или антитело в соответствии с изобретением, которые приготовлены с фармацевтически приемлемым наполнителем и производятся или продаются при одобрении государственного регулирующего органа в рамках терапевтической схемы для лечения или профилактики заболевания или события у млекопитающего. Фармацевтические композиции могут быть приготовлены, например, для внутривенного введения (например, в виде стерильного раствора, не содержащего частиц эмболы, и в системе растворителей, пригодной для внутривенного применения), для перорального введения (например, таблетки, капсулы, капли, желатиновые капсулы или сироп) или в виде любого другого препарата, описанного здесь, например, стандартной лекарственной форме.
Под термином «специфически связывается» подразумевается преимущественная ассоциация фрагмента связывания (например, антитело, фрагмент антитела, рецептор, лиганд или часть малой молекулы агента, как описано здесь) с молекулой-мишенью (например, полипептидом или конъюгатом, включающим его) или с клеткой или тканью, несущей молекулу-мишень (например, антиген клеточной поверхности, как например рецептор или лиганд), но не с нецелевыми молекулами, клетками, тканями, в которых молекула-мишень не содержится. Общепризнано, что в определенной степени неспецифическое взаимодействие может происходить между связующим фрагментом и нецелевой молекулой (присутствующей отдельно или в сочетании с клеткой или тканью). Однако специфическое связывание может быть определено как опосредованное через специфическое узнавание молекулы-мишени. Специфическое связывание приводит к более сильной ассоциации между связывающим фрагментом (например, антитело) и молекулой-мишенью (например, полипептид или конъюгат, включающий ее), чем между связывающим фрагментом и, например, нецелевыми молекулами или другими композициями, не содержащими молекулу-мишень. Специфическое связывание обычно приводит к более чем 2-кратному, предпочтительно более чем 5-кратному, более предпочтительно, более чем к 10-кратному и наиболее предпочтительно, более чем 100-кратному увеличению количества связанного связывающего фрагмента (в единицу времени), например, с клетками или тканями, несущими молекулу-мишень или маркер, по сравнению с клетками или тканями, не содержащими такую молекулу-мишень или маркер. Связывающие фрагменты связываются с молекулой-мишенью или маркером с константой диссоциации, например, меньше 10-6М, меньше 10-7М, 10-8М, 10-9М, 10-10M 10-11М, или 10-12М или даже меньше 10-13M, 10-14M или 10-15М. Для специфического связывания с белком в таких условиях требуется связывающий фрагмент, который выбирается по его специфичности в отношении такого конкретного белка. Для выбора связывающих фрагментов (например, антитела), способных специфически связываться с конкретной молекулой-мишенью, подходят различные форматы анализов. Например, для выбора моноклональных антител, специфически иммунореактивных в отношении белка, обычно используются твердофазные иммунологические анализы ELISA. Описание форматов иммуноанализа и условий, которые могут использоваться для определения специфической иммунологической реактивности, приводится в Harlow & Lane, Antibodies, A Laboratory Manual, Cold Spring Harbor Publications, New York (1988).
Под «по существу идентична» подразумевается аминокислотная последовательность или нуклеинокислотная последовательность, которая обладает по меньшей мере 50% идентичностью относительно эталонной последовательности. Такая последовательность обычно идентична по меньшей мере, например, на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% на аминокислотном уровне или нуклеинокислотном уровне относительно эталонной последовательности. В общем, для полипептидов длина сравниваемых последовательностей может составлять по меньшей мере пять аминокислот, например, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 250, 300 или более аминокислот, вплоть до полной длины полипептида. Для нуклеиновых кислот длина сравниваемых последовательностей, как правило, может составлять по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 250, 300, 400, 500, 600, 700, 800, 900 или более нуклеотидов, вплоть до полной длины молекулы нуклеиновой кислоты. Подразумевается, что для целей определения идентичности последовательности при сравнении последовательности ДНК с последовательностью РНК тимин нуклеотид эквивалентен урацил нуклеотиду.
Как используется здесь, когда последовательность полипептида или нуклеиновой кислоты именуется как имеющая «по меньшей мере Х% идентичность» относительно эталонной последовательности, это означает, что по меньшей мере Х процентов аминокислот или нуклеотидов в полипептиде или нуклеиновой кислоте идентичны таковым эталонной последовательности, когда последовательности оптимально выровнены. Оптимальное выравнивание последовательностей может определяться различными способами, которые известны специалистам в данной области, например, алгоритм выравнивания Смита-Ватермана (Smith et al., J. Mol. Biol. 147: 195-7, 1981) и BLAST (Средство поиска основного локального выравнивания - Basic Local Alignment Search Tool; Altschul et al., J. Mol. Biol. 215: 403-10, 1990).
Эти и другие алгоритмы выравнивания доступны при использовании общедоступного компьтерного программного обеспечения, как например, «Best Fit - наилучшее приближение» (Smith and Waterman, Advances in Applied Mathematics, 482-489, 1981), как встроенное в GeneMatcher PlusTM (Schwarz and Dayhof, Atlas of Protein Sequence and Structure, Dayhoff, M.O., Ed pp 353-358, 1979), BLAST, BLAST-2, BLAST-P, BLAST-N, BLAST-X, WU-BLAST-2, ALIGN, ALIGN-2, CLUSTAL или Megalign (DNASTAR). Кроме того, специалисты в данной области техники могут определить соответствующие параметры для измерения выравнивания, включающие любые алгоритмы, необходимые для достижения оптимального выравнивания по длине сравниваемых последовательностей.
Термины «вызванная Staphylococcus aureus инфекция кожи и мягких тканей», «Staphylococcus aureus SSTI», «вызванная Staphylococcus aureus инфекция кожи/структуры кожи» и «Staphylococcus aureus SSSI» используются здесь как взаимозаменяемые и относятся к инфекции кожи или мягких тканей (например, целлюлит, абсцесс мягких тканей, дермальный некроз, миозит или другие инфекции), вызванные бактериями S. aureus, проникшими в организм в месте, где кожа повреждена в результате пореза, царапины, укуса или других ран. В некоторых случаях S. aureus SSSI является результатом живущего на теле бактерий S. aureus и могут возникать спонтанно при отсутствии видимого места повреждения или раны на коже. Такие инфекции могут поражать слои кожи или более глубокие ткани, такие как мышцы и соединительная ткань (переплетающийся каркас ткани, который формирует связки, сухожилия и другие поддерживающие структуры тела). Абсцессы кожи также могут возникать на участках кожи, где организм борется с инфекцией S. aureus. Наиболее важные штаммы S. aureus, ответственные за инфекции кожи или мягких тканей, представляют собой устойчивый к антибиотикам Staphylococcus, известный как метициллин-устойчивый Staphylococcus aureus (MRSA); ванкомицин-устойчивые и даптомицин-устойчивые штаммы бактерий S. aureus также могут вызывать SSSI. Штамм MRSA устойчив к обычным антибиотикам. Staphylococcus aureus SSSI также могут быть вызваны метициллин-чувствительным Staphylococcus aureus (MSSA).
Млекопитающих, которые подвергаются риску развития вызванной S. aureus инфекции кожи или мягких тканей, можно лечить в профилактическом режиме. В качестве альтернативы млекопитающих можно лечить при наличии симптомов вызванной S. aureus инфекции кожи или мягких тканей. Вакцинация, как описано здесь, уменьшает тяжесть, задерживает или предотвращает развитие симптомов. Млекопитающие подвергаются повышенному риску инфекции, если они помещены в больницу или живут в учреждении закрытого типа, подвергаются лечению антибиотиками или имеют ослабленный иммунитет, включая детей, имеющих ВИЧ/СПИД или другие заболевания, которые опасны для иммунной функции, лица, имеющие частый контакт с системой медико-санитарной помощи, имеющие хронические заболевания, как например, диабет, рак, ВИЧ/СПИД, лица очень молодого или очень пожилого возраста, часто использующие антибиотики, имеющие открытую рану, дерматит или поражение кожи, с плохим питанием или плохой гигиеной. Среди других млекопитающих, находящихся в группе риска, это лица, живущие в жилищных условиях скученности, военнослужащие, особенно развернутых войск, спортсмены и заключенные. К другим млекопитающим из группы риска развития вызванной S. aureus инфекции кожи или мягких тканей относятся лица, которые ранее подвергались таким инфекциям, или лица, у которых запланирована хирургическая или инвазивная медицинская процедура или подвергавшиеся такой процедуре.
Под «молекулой-мишенью» или «клеткой-мишенью» подразумевается молекула (например, полипептид, эпитоп, антиген, рецептор или лиганд) или клетка, с которой связывающий фрагмент (например, антитело) может специфически связываться. В некоторых случаях молекулы-мишени обнаруживают снаружи клетки-мишени (например, белок клеточной поверхности или секретируемый белок), но молекулы-мишени могут альтернативно или также присутствовать внутри клетки-мишени.
Под «лечением» подразумевается консервативное лечение пациента с целью вылечить, улучшить, стабилизировать, уменьшить вероятность или предотвратить заболевание, патологическое состояние, расстройство или событие путем введения фармацевтической композиции. Этот термин включает в себя активное лечение, то есть лечение, направленное именно на улучшение, или сопутствующее излечению, заболевания, патологического состояния, расстройства или события, а также включает этиотропную терапию, то есть лечение, направленное на устранение причины сопутствующего заболевания, патологического состояния, расстройства или события. Кроме того, этот термин включает паллиативное лечение, то есть лечение, направленное на смягчение симптомов, а не на излечение заболевания, патологического состояния, расстройства или события; симптоматическое лечение, то есть лечение, направленное на конституциональные симптомы ассоциированного заболевания, патологического состояния, расстройства или события; профилактическое лечение, то есть лечение, направленное на минимизацию или частичное или полное подавление развития соответствующего заболевания, патологического состояния, расстройства или события, например, у пациента, который еще не болен, но который подвержен или иным образом связан с риском конкретного заболевания, патологического состояния, расстройства или события; и поддерживающее лечение, то есть лечение, применяемое в дополнение к другой специфической терапии, направленной на улучшение сопутствующего заболевания, патологического состояния, расстройства или события.
Под «вакциной», как используется здесь, подразумевается композиция, которая вызывает иммунный ответ у субъекта, которому ее вводят.
Под «вакцинировать», как используется здесь, подразумевается лечение пациента путем введения вакцины, например, для предупреждения или улучшения заболевания, патологического состояния, расстройства или события.
Под «вариантом» в контексте полипептида или его части, как описано здесь, или молекулы нуклеиновой кислоты, кодирующий его, подразумевается включение замещений или изменений в аминокислотной последовательности или нуклеинокислотной последовательности, например, с получением в результате, по существу, идентичной последовательности. Полипептид, имеющий вариантную последовательность, может сохранять по меньшей мере одну биологическую активность исходного полипептида, например, иммуногенную активность. Термин «вариант» включает, например, аминокислотные инсерционные производные, такие как амино и/или карбоксилконцевые слияния, а также вставки внутри последовательности одной или нескольких аминокислот. Инсерционные аминокислотные варианты представляют собой такие варианты, в которых один или несколько аминокислотных остатков вводятся в заранее определенное место в белке. Случайная вставка также возможна при подходящем скрининге полученного продукта. Делеционные варианты характеризуются удалением одной или нескольких аминокислот из последовательности. Варианты заместительной аминокислоты - это варианты, в которых по меньшей мере один остаток вставляется на его место. Когда дериватизация белка происходит путем замещения аминокислоты, аминокислоты обычно заменяются путем консервативных замещений, например, другими аминокислотами, имеющими аналогичные физико-химические свойства, как например, гидрофобность, гидрофильность, электроотрицательность, громоздкие боковые цепи и тому подобное.
С точки зрения настоящего изобретения варианты также включают одно или несколько замещений, делеций и/или добавлений любого(ых) компонента(ов), природно или искусственно связанного(ых) с частью природного белка, из которого может быть получен полипептид, например, углеводы, липиды и/или другие белковоподобные фрагменты. Все эти молекулы охватывает термин «вариант».
Под «вариантной последовательностью» подразумевается аминокислотная или нуклеинокислотная последовательность варианта, как определено здесь.
Другие признаки и преимущества настоящего изобретения будут очевидны из следующего подробного описания и патентной формулы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Идентификация Als3 и Hyr1 полипептидных фрагментов и Als3/Hyr1 полипептидов слияния и других композиций, описанных здесь, обеспечивает, например, эффективное лечение и вакцинацию против кандидоза или бактериальных инфекций, например, вызванные любыми из описанных здесь.
В изобретении представлены полипептиды, например, полученные из Als3 или Hyr1 или Als3/Hyr1 слитых полипептидов, конъюгаты, вакцины, антитела, композиции, способы вакцинации с использованием указанного, и способы их получения, как описано более подробно ниже.
Полипептиды
В изобретении представлены полипептиды, полученные из Als3 или Hyr1. Аминокислотная последовательность rAls3 белка имеет вид:

Аминокислотная последовательность rHyr1 белка имеет вид:


В изобретении представлены полипептиды, имеющие существенную идентичность относительно любого из полипептидов, описанных здесь, включая следующие.


В некоторых случаях модификация полипептида, как описано здесь, не существенно уменьшает биологическую активность, например, иммуногенную активность, полипептида. Модифицированный полипептид может иметь или может оптимизировать характеристику полипептида, как например, in vivo устойчивость, биодоступность, токсичность, иммунологическую активность, иммунологическую идентичность или свойства конъюгации.
Модификации включают модификации в результате естественных процессов, как например, посттрансляционная обработка, или методов химической модификации, известных в данной области. Модификации могут происходить в любом участке полипептида, включая полипептидный остов, аминокислотные боковые цепи и амино- или карбокси-конец. Аналогичный тип модификации может присутствовать в такой же или в разной степени в нескольких участках в данном полипептиде, и полипептид может содержать более одного типа модификации.
Вариантный или иным образом модифицированный полипептид может также включать одну или несколько аминокислотных инсерций, делеций или замещений, либо консервативных, либо неконсервативных (например, D-аминокислоты, дезаминокислоты) в последовательности полипептида. Например, добавление одного или нескольких цистеиновых остатков к амино- или карбокси-концу любого из полипептидов в соответствии с настоящим изобретением может облегчить конъюгацию этих полипептидов. Примеры полипептидов, имеющих цистеин N- или С-конца.
Аминокислотные замещения могут быть консервативными (т.е. в котором остаток заменен другим того же общего типа или группы) или неконсервативными (т.е. в котором остаток заменен аминокислотой другого типа). Кроме того, неприродные аминокислоты могут быть замещены на природную аминокислоту (т.е. замещение неприродной консервативной аминокислоты или замещение неприродной неконсервативной аминокислоты).
Полипептиды, полученные синтетическим образом, например, с использованием способов, известных в данной области, могут включать замещения аминокислот, неприродно-кодируемых ДНК (например, неприродные или искусственная аминокислота). Примеры неприродных аминокислот включают D-аминокислоты, аминокислоту, имеющую ацетиламинометильную группу, присоединенную к атому серы цистеина, пегилированную аминокислоту, омега аминокислоты с формулой NH2(CH2)nCOOH, где n=2-6, нейтральные неполярные аминокислоты, такие как саркозин, трет-бутиловый аланин, трет-бутиловый глицин, N-метил-изолейцин и норлейцин. Фенилглицин может быть замещен на Trp, Tyr или Phe; цитруллин и метионин сульфоксид являются нейтральными неполярными, цистеиновая кислота кислая, а орнитин является основным. Пролин может быть замещен гидроксипролином и может сохранять свойства, сообщающие конформацию.
Варианты могут быть получены путем замещающего мутагенеза и могут сохранять или даже увеличивать биологическую активность, например, иммуногенную активность, исходного полипептида.
Полипептиды, описанные здесь, могут быть получены, например, путем химического синтеза с использованием коммерчески доступного автоматизированного пептидного синтезатора. Синтезированный белок или полипептид может осаждаться и дополнительно очищаться, например, путем высокоэффективной жидкостной хроматографии (ВЭЖХ). Альтернативно, белки и Полипептиды могут быть получены с помощью рекомбинантных способов, например, хорошо известных в данной области техники.
Конъюгаты
Полипептиды в соответствии с изобретением могут быть конъюгированы с другим фрагментом или другой частицей.
Фрагменты белка
В некоторых случаях может быть полезно конъюгировать полипептид с белком, который является иммуногенным в видах, подлежащих иммунизации, например, гемоцианин лимфы улитки (KLH), CRM197, столбнячный анатоксин, дифтерийный анатоксин, сывороточный альбумин, бычий тироглобулин, ингибитор соевого трипсина или поликатион (поли-L-лизин или поли-L-аргинин), например, с использованием бифункционального или дериватизирующего агента, известного в данной области, например, малеимидобензоил сульфосукцинимид сложный эфир (конъюгация через остатки цистеина), N-гидроксисукцинимид (через остатки лизина), глутаральдегид или янтарный ангидрид.
В некоторых случаях конъюгат может представлять собой рекомбинантный белок слияния, например, для облегчения экспрессии и очистки полипептида.
Частицы для конъюгации или отображения полипептидов
В некоторых случаях полипептиды конъюгируются или отображаются на частицу, например, фаг, дрожжи, вирус, виросома или рекомбинантная вирусоподобная частица.
Например, один или несколько полипептидов могут быть конъюгированы с фагом, дрожжами или вирусной частицей, например, на поверхности частицы. В одном варианте осуществления молекула нуклеиновой кислоты, кодирующая полипептид, вставляется в фаг, дрожжи или вирусную частицу, в результате чего происходит экспрессия полипептида в фаге, дрожжах или вирусной частице, например, на поверхности частицы. Популяцию фага, дрожжей или вируса, содержащую полипептид, можно затем выделить и приготовить, например, в виде вакцины, с добавлением фармацевтически приемлемого наполнителя.
В некоторых вариантах осуществления полипептиды, описанные здесь, конъюгируются с виросомой или вирусоподобной частицей (VLP). Виросомы и VLP обычно содержат один или несколько белков из вируса, факультативно в сочетании или в составе с фосфолипидом. Они, как правило, не патогенные, нереплицируемые и в общем не содержат никакого нативного вирусного генома. Вирусные белки могут быть получены или выделены рекомбинантно из целых вирусов. Вирусные белки, пригодные для использования в виросомах или VLP, включают белки, полученные из вируса гриппа (например, НА или NA), вируса гепатита В (как например, коровые или капсидные белки), вируса гепатита Е, вируса кори, вируса Синдбиса, ротавируса, вирус афтозной лихорадки, ретровируса, вируса Норуолка, вируса папилломы человека, ВИЧ, РНК-фагов, Qβ-фага (как, например, белки оболочки), GA-фага, fr-фага, АР205 фага и Ту (как например, ретротранспозон Ту белок р 1). Виросомы рассматриваются, кроме того, например, в работе Gluck et al. (2002), Vaccine 20: B10-B16, которая включена по ссылке во всей своей полноте.
Вирусоподобные частицы также рассматриваются, например, в Niikura et al. (2002), Virology 293: 273-280; Lenz et al. (2001), J' Immunol 166: 5346-5355; Pinto et al. (2003), J Infect Dis 188: 327-338; Gerber et al. (2001), Viral 75: 4752-4760; WO 03/024480; и WO 03/024481, каждая из которых включена по ссылке во всей своей полноте.
Антитела
В изобретении представлены моноклональные и поликлональные антитела, которые связываются с полипептидами или конъюгатами, описанными здесь.
Моноклинальные антитела
Моноклональные антитела могут быть получены, например, с помощью метода гибридом, впервые описанного авторами Kohler et al., Nature 256: 495, 1975, или могут быть получены методами рекомбинантных ДНК (см, например, патент США 4816567). В методе гибридом мышь или другое подходящее животное-хозяин, как например, хомяка или обезьяну макаки, иммунизируют, например, с использованием полипептида или конъюгата, описанного здесь, вызывая появление лимфоцитов, которые продуцируют или способны продуцировать антитела, которые специфически связываются с полипептидом или конъюгатом, используемым для иммунизации. В качестве альтернативы, лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с клетками миеломы с использованием подходящего агента для слияния, как например, полиэтиленгликоль, с образованием клетки гибридомы (Coding, Monoclonal Antibodies: Principles and Practice, pp. 59-103, Academic Press, 1986).
Клетки гибридомы, полученные таким образом, высевают и выращивают в подходящей культуральной среде, которая может содержать одно или несколько веществ, которые сдерживают рост или выживание неслитых исходных клеток миеломы. Например, если исходные миеломные клетки не содержат ферментную гипоксантин-гуанин-фосфорибозилтрансферазу (HGPRT или HPRT), культуральная среда для гибридом, как правило, будет включать гипоксантин, аминоптерин и тимидин (среда HAT), вещества которой предотвращают рост HGPRT-дефицитных клеток.
Примером клеток миеломы служат клетки, которые эффективно сливаются, поддерживают стабильное продуцирование высокого уровня антител выбранными продуцирующими антитело клетками и чувствительны к среде, как например, среда HAT. Среди них отдельные клеточные линии миеломы, которые можно рассматривать для использования, представляют собой мышиные линии миеломы, как например, полученные из опухолей мыши МОРС-21 и МРС-11, доступных из Центра распределения клеток Института Солка [Salk Institute Cell Distribution Center], Сан-Диего, штат Калифорния, США, и SP-2 или X63-Ag8-653 клеток, доступных из Американской коллекции типовых культур [American Type Culture Collection], Манассас, штат Вирджиния, США. Клеточные линии миеломы человека и гетеромиеломы мыши-человека также были описаны для получения человеческих моноклональных антител (Kozbor, J. Immunol. 133: 3001, 1984; Brodeur et al.. Monoclonal Antibody Production Techniques and Applications, pp. 51-63, Marcel Dekker, Inc., New York, 1987).
Культуральную среду, в которой выращиваются клетки гибридомы, анализируют на продуцирование моноклональных антител, направленных против антигена. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, можно определить с помощью иммунопреципитации или анализа связывания in vitro, как например, радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
После идентификации гибридомных клеток, которые продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны могут быть субклонированы путем ограничения процедур разведения и выращены с помощью стандартных методов (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103, Academic Press, 1986). Подходящие культуральные среды для этой цели включают, например, D-MEM или RPMI-1640 среду. Кроме того, клетки гибридомы могут быть выращены in vivo как асцитные опухоли у животных.
Моноклональные антитела, секретированные субклонами, соответствующим образом выделяются из культуральной среды, асцитной жидкости или сыворотки обычными способами очистки иммуноглобулинов, как например, белок А-сефарозная, гидроксилапатитовая хроматография, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, легко выделяется и секвенируется с помощью обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Клетки гибридомы служат в качестве источника такой ДНК. После выделения ДНК можно поместить в экспрессирующие векторы, которые затем трансфицируются в клетки-хозяева, как например, клетки E. coli, клетки обезьяны COS, клетки яичника китайского хомячка (СНО) или клетки миеломы, которые иным образом не продуцируют белок иммуноглобулина, с получением синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Рекомбинантное продуцировние антител будет более подробно описано ниже.
В следующем варианте осуществления антитела или фрагменты антител могут быть выделены из библиотек фаговых антител, созданных с помощью методов, описанных, например, в McCafferty et al., Nature 348: 552-554, 1990.
Авторами Clackson et al., Nature 352: 624-628, 1991 and Marks et al., J. Mol. Biol. 222: 581-597, 1991, описано выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В последующих публикациях описано продуцирование антител человека (диапазон нМ) с высокой аффинностью путем перестановки цепей (Marks et al., Bio/Technology 10: 779-783, 1992), а также комбинаторная инфекция и in vivo рекомбинация как стратегия для конструирования очень больших фаговых библиотек (Waterhouse et al., Nucl. Acids. Res. 21: 2265-2266, 1993). Таким образом, эти методы являются приемлемыми альтернативами традиционным методам моноклональных антител гибридом для выделения моноклональных антител.
ДНК также может быть модифицирована, например, путем замещения кодирующей последовательности константными доменами человеческой тяжелой и легкой цепи вместо гомологичных мышиных последовательностей (Патент США №4816567; Morrison et al., Proc. Natl. Acad. Sci. U.S.A. 81: 6851, 1984) или путем ковалентного присоединения к кодирующей иммуноглобулин последовательности всей или части кодирующей последовательности для неиммуноглобулинового полипептида.
Как правило, такие неиммуноглобулиновые полипептиды заменяют константными доменами антитела, или их заменяют вариабельными доменами одного антигенсвязывающего сайта антитела для создания химерного двухвалентного антитела, включающего один антигенсвязывающий сайт, обладающий специфичностью в отношении антигена, и другой антигенсвязывающий сайт, обладающий специфичностью в отношении другого антигена.
Поликлональные антитела
Поликлональные антитела, как правило, выращивают у животных путем многократных инъекций, например, подкожными или внутрибрюшинными инъекциями, соответствующего антигена и адъюванта. В некоторых случаях это может подходить для конъюгации полипептида с белком, который является иммуногенным в видах, подлежащих иммунизации, например, гемоцианин лимфы улитки (KLH), CRM197, столбнячный анатоксин, дифтерийный анатоксин, сывороточный альбумин, бычий тироглобулин, ингибитор трипсина сои или поликатион (поли-L-лизин или поли-L-аргинин), например, с использованием бифункционального или дериватизирующего агента, известного в данной области, например, малеимидобензоил сульфосукцинимид сложный эфир (конъюгация через остатки цистеина), N-гидроксисукцинимид (через остатки лизина), глутаральдегид или янтарный ангидрид.
Вакцины и содержащие антиатела фармацевтические композиции
Композиции для вакцин и содержащих антитела фармацевтических композиций (собирательно «композиции»), как описано здесь, можно получить, используя стандартные химические методы и методики составления фармацевтических составов, которые легкодоступны в данной области для специалистов средней квалификации. Например, полипептиды, конъюгаты или антитела, как здесь описано, можно объединять с одним или несколькими фармацевтически приемлемыми наполнителями или связующими веществами. Вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, рН-буферные вещества и т.п., могут присутствовать в наполнителе или связующем. Эти наполнители, связующие и вспомогательные вещества, как правило, являются фармацевтическими агентами, которые не индуцируют иммунный ответ у субъекта, получающего композицию, и которые могут вводиться без неспецифической токсичности. Фармацевтически приемлемые наполнители включают, но не ограничиваются ими, жидкости, как например, вода, физиологический раствор, полиэтиленгликоль, гиалуроновая кислота, глицерин и этанол. Фармацевтически приемлемые соли также могут быть включены, например, соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и тому подобное; и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и тому подобное. Подробное описание фармацевтически приемлемых наполнителей, связующих и вспомогательных веществ приводится в Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991).
Такие композиции можно получать, расфасовывать или продавать в форме, пригодной для введения болюса или для непрерывного введения. Инъецируемые композиции можно получать, расфасовывать или продавать в единичной дозированной форме, например, в ампулах или в многодозовых контейнерах, содержащих консервант. Композиции могут включать, но не ограничиваются ими, суспензии, растворы, эмульсии в масляных или водных связующих веществах, пасты и имплантируемые, с замедленным высвобождением или биоразлагаемые составы. Такие композиции могут, кроме того, содержать один или несколько дополнительных ингредиентов, включающие, но не ограничивающиеся этим, суспендирующие, стабилизирующие или диспергирующие агенты. В одном варианте композиция для парентерального введения активный ингредиент содержится в сухой (например, в виде порошка или гранул) форме, которая восстанавливается с помощью подходящего носителя (например, стерильная апирогенная вода) перед парентеральным введением восстановленной композиции. Композиции можно получать, расфасовывать или продавать в форме стерильной инъецируемой водной или масляной суспензии или раствора. Такую суспензию или раствор можно составить по известным в данной области методикам, и она может содержать, в дополнение к активному ингредиенту, дополнительные ингредиенты, такие как диспергаторы, смачивающие агенты или суспендирующие агенты, описанные здесь. Такие стерильные инъецируемые составы можно получать с использованием нетоксичного парентерально приемлемого разбавителя или растворителя, такого как вода или 1,3-бутандиол, например. Другие приемлемые разбавители и растворители включают, но не ограничиваются ими, раствор Рингера, изотонический раствор хлорида натрия и нелетучие масла, такие как синтетические моно- или диглицериды.
Другие парентерально вводимые пригодные композиции включают композиции, которые содержат активный ингредиент в микрокристаллической форме, в липосомном препарате, или в качестве компонента биоразлагаемых полимерных систем. Композиции для замедленного высвобождения или имплантации могут содержать фармацевтически приемлемые полимерные или гидрофобные материалы, такие как эмульсии, ионообменную смолу, умеренно растворимый полимер или умеренно растворимую соль.
Альтернативно, полипептиды, конъюгаты и антитела, описанные здесь, могут быть инкапсулированы, адсорбированы или связаны с носителей в виде частиц. Подходящие носители в виде частиц включают носители, полученные из полимеров полиметилметакрилата, а также как микрочастицы PLG, полученные из поли(лактидов) и поли(лактид-со-гликолидов). Смотри, например, Jeffery et al. (1993) Pharm. Res. 10: 362-368. Другие системы в виде частиц и полимеры также могут использоваться, например, полимеры, такие как полилизин, полиаргинин, полиорнитин, спермин, спермидин, а также конъюгаты этих молекул.
Составленные композиции будут включать некоторое количество одного или нескольких полипептидов или конъюгатов, описанных здесь, достаточное для создания иммунологического ответа. Иммуногенное количество может легко определить специалист в данной области. Такое количество попадает в относительно широкий диапазон, который может быть определен с помощью рутинных испытаний. Композиции могут содержать от примерно 0,1% до примерно 99,9% полипептидов, конъюгатов или антител, и они могут вводиться непосредственно субъекту или, в качестве альтернативы, доставляться ex vivo, в клетки, полученные от субъекта, используя способы, известные специалистам в данной области.
Композиции могут включать смесь различных полипептидов, конъюгатов или антител, как описано здесь. Например, вакцины могут включать, например, 2, 3, 4, 5, 6, 7, 8 или более различных полипептидов или конъюгатов, как описано здесь, например, содержащих или состоящих из аминокислотных последовательностей, представленных здесь, или их вариантную последовательность, имеющую до трех замещений, делеций или дополнений к аминокислотной последовательности любой из аминокислотных последовательностей, представленных здесь. В одном варианте осуществления вакцина включает восемь различных полипептидов, причем аминокислотная последовательность восьми полипептидов состоит из последовательности аминокислотных последовательностей, представленных здесь. В другом варианте осуществления содержащие антитела фармацевтические композиции могут включать смесь моноклональных или поликлональных антител, например, обладающих различными специфичностями к полипептидам или конъюгатам, как описано здесь.
Вещества, которые стимулируют иммунный ответ, например, адъюванты, могут быть включены в композиции, например, в вакцины. Примеры химических соединений, используемых в качестве адъювантов, включают, но не ограничиваются ими, соединения алюминия (например, квасцы, алгидрогель), масла, блок-сополимеры, иммуностимулирующие комплексы, витамины и минералы (например, витамин Е, витамин А, селен и витамин В12), Quil А (сапонины), бактериальные и грибковые компоненты клеточной стенки (например, липополисахариды, липопротеины и гликопротеины), гормоны, цитокины и костимуляторные факторы.
Способы лечения
В изобретении представлены способы вакцинации млекопитающих против кандидоза, включающие введение животному вакцины, как описано здесь, таким образом, обеспечивая вакцинацию млекопитающего против кандидоза. Кроме того, в изобретении предлагаются способы пассивной иммунизации млекопитающих против кандидоза, включая введение млекопитающему эффективного количества фармацевтической композиции, как описано здесь, таким образом, выполняя пассивную иммунизацию млекопитающего против кандидоза. Кандидоз может включать, например, диссеминированный кандидоз, например, гематогенно-диссеминированный кандидоз, или мукозальный кандидоз. В некоторых случаях, кандидоз вызывается, например, бактериями Candida albicans, Candida glabrata, Candida krusei, Candida parapsilosis или Candida tropicalis. Другие виды Candida включают Candida lusitaniae и Candida stellatoidea.
Кроме того, могут использоваться композиции и способы, описанные здесь, например, для вакцинации человека с риском развития системной инфекции S. aureus или инфекции кожи или мягких тканей против S. aureus. Во-первых, человек с риском развития инфекции, вызванной S. aureus или S. aureus SSSI, идентифицируется. Во-вторых, человеку вводят иммуногенное количество вакцины, содержащей описанный здесь полипептид, в фармацевтически приемлемом носителе с адъювантом или без адъюванта. Например, человеку вводят от одной до трех доз полипептида, описанного здесь, с содержанием от 3 и 1000 мг полипептида на дозу, причем введение нескольких доз происходит с интервалом от двух недель до шести месяцев.
Ожидается, что после введения вакцины у человека снижается риск развития инфекции, вызванной S. aureus или S. aureus SSSI, на период продолжительностью от одного месяца до нескольких лет или более.
Таким же образом, человека, который идентифицирован как имеющий инфекцию, вызванную S. aureus или S. aureus SSSI, можно лечить путем введения иммуногенного количества фармацевтической композиции, содержащей пептид 1 в фармацевтически приемлемом носителе с адъювантом или без адъюванта. Например, человеку вводят от одной до трех доз полипептида, представленного здесь, с содержанием от 3 и 1000 мг полипептида на дозу, причем введение нескольких доз происходит с интервалом от двух недель до шести месяцев.
Опять же, ожидается, что после введения фармацевтической композиции тяжесть инфекции, вызванной S. aureus SSSI, у человека уменьшается.
Композиции и способы, описанные здесь, могут использоваться, например, для вакцинации видов крупного рогатого скота с риском развития системной инфекции, вызванной S. aureus, или даже инфекции кожи или мягких тканей, вызванной S. aureus, против Staphylococcus aureus. В частности, виды крупного рогатого скота могут подвергаться риску развития мастита, вызванного S. aureus. Во-первых, виды крупного рогатого скота, подверженные риску развития S. aureus SSSI, например, мастита крупного рогатого скота, идентифицируются. Например, любой из производящих молоко представителей крупного рогатого скота может считаться подверженным риску развития мастита, вызванного S. aureus. Во-вторых, видам крупного рогатого скота вводят иммуногенное количество вакцины, содержащей один или несколько полипептидов, представленных здесь, в фармацевтически приемлемой среде с адъювантом или без адъюванта. Например, видам крупного рогатого скота вводят от одной до трех доз полипептида, представленного здесь, с содержанием от 3 и 1000 μг полипептида на дозу, причем введение нескольких доз происходит с интервалом от двух недель до шести месяцев.
Ожидается, что после введения вакцины, у видов крупного рогатого скота снижается риск развития S. aureus SSSI, например, мастита крупного рогатого скота.
Аналогично, виды крупного рогатого скота, идентифицированные как имеющие S. aureus SSSI, например, маститы крупного рогатого скота, можно лечить введением иммуногенного количества фармацевтической композиции, содержащей один или несколько полипептидов, описанных здесь, в фармацевтически приемлемом носителе с адъювантом или без адъюванта. Например, видам крупного рогатого скота вводят от одной до трех доз полипептида с содержанием от 3 до 1000 μг полипептида на дозу, причем введение несколько доз происходит с интервалом от двух недель до шести месяцев.
Ожидается, что после введения фармацевтической композиции тяжесть S. aureus SSSI, например, мастита крупного рогатого скота, уменьшается.
Вакцины и содержащие антитела фармацевтические композиции (собирательно «композиции»), как описано здесь, можно вводить с профилактической или терапевтической целью отдельно или в сочетании с другими известными композициями, которые индуцируют защитные ответы против патогенов (например, вирусные, бактериальные, грибковые или паразитарные патогены), опухолей или рака, аллергенов, аутоиммунных расстройств или отторжения трансплантата. Например, композиции можно вводить одновременно, раздельно или последовательно, например, с другой вакциной для иммунизации, такие как вакцина, например, от гриппа, малярии, туберкулеза, оспы, кори, краснухи, эпидемического паротита, или любые другие вакцины, известные в данной области.
Композиции, как описано здесь, могут вводиться в организм млекопитающего (например, человека или другого млекопитающего, описанного здесь) с использованием множества известных путей и методов. Например, композиция может быть в виде инъекционного раствора, суспензии или эмульсии, и может вводиться с помощью внутримышечной, подкожной, внутрикожной, внутриполостной, парентеральной, эпидермальной, внутриартериальной, внутрибрюшинной или внутривенной инъекции с помощью обычной иглы и шприца или с использованием системы впрыска струи жидкости. Композиции можно также вводить местно в кожную или слизистую ткань, например, интраназально, внутритрахеально, внутрикишечно, ректально или вагинально, или в виде мелкораспыленного спрея, пригодного для респираторного или пульмонального введения. Другие способы введения включают пероральное введение, суппозитории и активные или пассивные методы чрескожной доставки.
Описанные здесь композиции могут вводиться в организм млекопитающего (например, человека или другого млекопитающего, описанного здесь) в количестве, которое совместимо с лекарственной формой и которое будет профилактически и/или терапевтически эффективным. Соответствующее эффективное количество попадает в относительно широкий диапазон, но специалист в данной области может его легко определить путем рутинных испытаний. Для определения необходимых количеств можно использовать «Physicians Desk Reference» [«Настольный справочник врача»] и «Goodman and Gilman's The Pharmacological Basis of Therapeutics» [«Фармакологические основы терапии»].
Профилактика или терапия может осуществляться путем одного прямого введения в один момент времени или путем многократного введения, по выбору в различные моменты времени. Введение также может обеспечиваться в одно или несколько мест. Специалисты в данной области могут регулировать дозировку и концентрацию в соответствии с конкретным маршрутом доставки. В одном варианте осуществления одна доза вводится за один раз. В альтернативном варианте осуществления количество доз вводят субъекту за один раз, но, например, в разные места. В еще одном варианте осуществления многократные дозы вводят за несколько приемов. Такие многократные дозы можно вводить отдельными порциями, то есть несколькими введениями в разные места за один раз, или их можно вводить по отдельности, однократным введением в каждый из нескольких приемов (по выбору, в несколько мест). Может использоваться любая комбинация таких схем введения.
В одном варианте осуществления различные композиции в соответствии с изобретением могут вводиться в разные места или в разные приемы как часть той же схемы лечения.
Различные введения могут быть выполнены за один приме, в тот же день, с интервалом один, два, три, четыре, пять или шесть дней или одна, две, три, четыре или более недель. В некоторых случаях введения выполняют с интервалом 1-5 недель, например, 2-4 недели, например, 2 недели, 3 недели или 4 недели. График и сроки таких многократных введений могут отрабатываться в отношении конкретной вакцины или фармацевтической композиции специалистом в данной области путем рутинных испытаний.
Дозировка
Адекватная доза вакцин или содержащих антитела фармацевтических композиций, описанных здесь, может изменяться в зависимости от таких факторов как способ получения, способ введения, возраст, масса тела и пол пациента, тяжесть симптомов, время введения, путь введения, скорость выведения и чувствительность. Дозу введения, эффективную для лечения, может легко определить и диагностировать врач обычной квалификации в данной области.
Композиции могут быть приготовлены в виде препаратов в единичной дозе или в многократной дозе специалистами в данной области с использованием фармацевтически приемлемого носителя и/или наполнителя в соответствии со способом, известным в данной области.
Векторы
В изобретении также представлены векторы, содержащие нуклеиновые кислоты, кодирующие полипептиды, описанные в данном документе. Подходящие векторы экспрессии хорошо известны в данной области и включают векторы, способные экспрессировать нуклеиновую кислоту, функционально связанную с регуляторной последовательностью или таким элементом, как промоторная область или энхансерная область, которая способна регулировать экспрессию нуклеиновой кислоты. Соответствующие векторы экспрессии включают векторы, реплицируемые в эукариотических клетках и/или прокариотических клетках, и векторы, которые остаются эписомными или встраиваются в геном клетки-хозяина.
Термины «вектор», «клонирующий вектор» и «экспрессирующий вектор» означают носитель, с помощью которого нуклеиновая кислота может быть введена в клетку-хозяин. Вектор может использоваться для распространения или укрывания нуклеиновой кислоты или для полипептидной экспрессии кодируемой последовательности. В данной области известно большое число векторов, включающих, например, плазмиды, фаги и вирусы. Описание примеров векторов можно найти, например, в Sambrook et al., "Molecular Cloning: A Laboratory Manual," 3rd Edition. Cold Spring Harbor Laboratories, Cold Spring Harbor, N.Y., 2001; и Ausubel et al., "Current Protocols in Molecular Biology," John Wiley and Sons, Baltimore, MD (1999).
Промоторы или энхансеры, в зависимости от характера регуляции, могут быть конститутивными или регулируемыми. Регуляторные последовательности или регуляторные элементы функционально связаны с нуклеиновой кислотой в соответствии с изобретением таким образом, что физическая и функциональная зависимость между нуклеиновой кислотой и регуляторной последовательностью обеспечивает транскрипцию нуклеиновой кислоты.
Векторы, пригодные для экспрессии в эукариотических клетках, могут включать, например, регуляторные элементы, включающие ранний промотор SV40, промотор цитомегаловируса (CMV), стероид-индуцируемый промотор вируса опухоли молочной железы мыши (MMTV), промотор вируса мышиного лейкоза Молони (MMLV) и тому подобное. Векторы в соответствии с изобретением могут быть использованы для субклонирования и амплификации молекулы нуклеиновой кислоты и для рекомбинантной экспрессии полипептида, как описано здесь. Вектор в соответствии с изобретением может включать, например, вирусные векторы, такие как бактериофаг, бакуловирус или ретровирус; космиды или плазмиды; и, в частности, для клонирования больших молекул нуклеиновой кислоты, векторы бактериальных искусственных хромосом (ВАС) и векторы искусственных дрожжевых хромосом (YAC). Такие векторы коммерчески доступны и об их применении хорошо известно в данной области. Специалисту в данной области будет известен или он может легко определить соответствующий промотор для экспрессии в конкретной клетке-хозяине.
Кроме того, в изобретении представлены рекомбинантные клетки, содержащие нуклеиновые кислоты в соответствии с изобретением. Рекомбинантные клетки генерируются путем введения в клетку-хозяин вектора, содержащего молекулу нуклеиновой кислоты. Рекомбинантные клетки подвергаются трансдукции, трансфекции или иным генетическим модификациям. Примеры клеток-хозяев, которые могут быть использованы для экспрессии рекомбинантных молекул, включают первичные клетки млекопитающих; установленные клеточные линии млекопитающих, такие как COS, CHO, HeLa, NIH3T3, HEK 293 и РС12 клетки; клетки амфибий, такие как зародыши и ооциты Xenopus; и другие клетки позвоночных. Примеры клеток-хозяев также включают клетки насекомых, такие как Drosophila, дрожжевые клетки, такие как Saccharomyces cerevisiae, Saccharomyces pombe или Pichia pastoris, и прокариотические клетки, такие как Escherichia coli.
В вариантах осуществления настоящего изобретения также представлены специфические полипептиды Als3 или Hyr1 или полипептиды Als3/Hyr1, которые могут выступать в качестве антигенов для генерации иммунного ответа на Candida, грамотрицательные бактерии, включающие бактерии рода Acinetobacter, например, Acinetobacter baumannii, а также стафилококковая бактерия.
В некоторых аспектах настоящего изобретения полипептиды в соответствии с изобретением включают по существу одну и ту же аминокислотную последовательность, представленную в любой из аминокислотных последовательностей, описанных здесь. Например, аминокислотная последовательность может иметь по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичность последовательности относительно любой из SEQ ID NOS: 1-33. В других аспектах такие полипептиды являются иммуногенными и способны вызывать продуцирование анти-Als3 антитела, анти-HYR1 антитела и Als3/Hyr1 антитела или иммуногенный ответ у субъекта.
Как описано здесь, полипептиды в соответствии с изобретением могут охватывать по существу сходные аминокислотные последовательности, имеющие по меньшей мере примерно 65% идентичность по отношению к эталонной аминокислотной последовательности, и сохранять сравнимую функциональную и биологическую активность, характерную для эталонной аминокислотной последовательности. В одном аспекте, полипептиды, имеющие по существу одну и ту же аминокислотную последовательность, будут иметь по меньшей мере 50% или 60% идентичность, по меньшей мере 65% идентичность, по меньшей мере 70% идентичность, по меньшей мере 75% идентичность, по меньшей мере 80% идентичность, по меньшей мере 85% идентичность, по меньшей мере 90% идентичность, по меньшей мере 95% идентичность, по меньшей мере 98% идентичность или по меньшей мере 99% идентичность. Следует признать, однако, что полипептиды, или кодирующие нуклеиновые кислоты, содержащие более низкие, чем описанные, уровни идентичности последовательности, возникающие как сплайс-варианты, или которые модифицированы консервативными аминокислотными замещениями или путем замещения вырожденных кодонов, также входят в объем настоящего изобретения.
ОЦЕНКА
Следующие примеры предназначены для иллюстрации настоящего изобретения. Они ни коим образом не рассчитаны на ограничение изобретения.
Способы и материалы для оценки лечения кандидоза
Штаммы Candida и условия роста
С. albicans 15663, С. glabrata 31028, С. parapsilosis 22019 и С. tropicalis 4243 являются клиническими изолятами кровяного русла, получены из медицинского центра Харбор UCLA. С. krusei 91-1159 был любезно предоставлен Michael Rinaldi, Сан-Антонио, штат Техас. Штаммы С. albicans CAAH-31 и ТНЕ31 - это штаммы, которые описаны в литературе. Все протестированные штаммы были выращены по стандартной методике в YPD (2% бакто-пептон, 1% дрожжевой экстракт, 2% декстроза). Плотность клеток определяли путем подсчета в гемоцитометре.
Рекомбинантные полипептиды и кроличьи поликлоналъные антитела
Рекомбинантные полипептиды генерируются в соответствии со стандартными методами. Для генерации антител пептиды могут быть очищены и конъюгированы с гемоцианином лимфы улитки (KLH) перед выращиванием кроличьей антисыворотки отдельно с использованием стандартного протокола иммунизации. При исследованиях пассивной иммунизации весь IgG из смешанной сыворотки подвергается аффинной очистке с помощью Pierce белок А плюс агароза (Thermo Scientific, Рокфорд, Иллинойс) перед введением.
Протокол иммунизации и исследования на животных
Все активные вакцинации проводятся в соответствии со стандартными методиками. Вкратце, молодых (10-12 недель) Balb/C мышей вакцинируют подкожно 30 μг полипептида, смешанного с квасцами (2% алгидрогель; Brenntag Biosector, Фредериксзунд, Дания) в качестве адъюванта в забуференном фосфатом физиологическом растворе (PBS) в день 0, повторно такой же дозой в день 21, а затем инфицировали через хвостовую вену в день 35. Контрольные мыши были вакцинированы только квасцами.
Чтобы проверить эффективность вакцины на мышах с ослабленным иммунитетом, мышей вакцинируют, как описано выше, перед индуцированием нейтропении путем внутрибрюшинной инъекции 200 мг/кг циклофосфамида в день -2 с последующей еще одной дозой 100 мг/кг в день + 7 относительно инфекции. Этот режим заканчивается приблизительно через 10 дней лейкопенией с уменьшением числа нейтрофилов, лимфоцитов и моноцитов в соответствии со стандартными методами. Как для иммунокомпетентных мышей, так и для мышей с нейтропенической инфекцией различия в выживаемости между вакцинированными и адъювант-вакцинированными мышами сравнивают с помощью логрангового критерия.
Для пассивной иммунизации иммунный IgG вводят внутрибрюшинно ранее не получавшим лечение мышам за 2 ч до инфицирования внутривенно, используя С. albicans. Контрольным мышам дают согласующийся с изотипом IgG (Innovative Research, США). Дозы IgG повторяют через 3 дня после инфекции, и выживаемость мышей контролировали дважды в день.
Количественное культивирование почек от вакцинированных или контрольных мышей, подлежащих инфицированию различными видами Candida, выполняется в соответствии со стандартными методами. Вкратце, мышей инфицировали через хвостовую вену. Почки собирают на 3-й день после инфекции, гомогенизируют, серийно разводят в 0,85% солевом растворе, и количественно культивируют на YPD, который содержит 50 мг/мл хлорамфеникола. Колонии подсчитывают после инкубации планшетов при 37°С в течение от 24 до 48 ч, и результаты выражают в виде log КОЕ на грамм инфицированного органа.
При эксперименте на грибковое бремя почки удаляют в асептических условиях у двух мышей в группе для гистопатологического исследования. Почки погружают в цинко-формалиновый фиксатор, где они находятся до начала выполнения экспертизы. Фиксированные органы обезвоживают в растворах набора спиртов повышающейся концентрации, заливают парафином и разрезают на срезы толщиной 6 мм. Полученные срезы окрашивают метенамин-серебром по Гомори и исследуют с помощью световой микроскопии (Davis et al. (2000) Infect Immun 68: 5953-5959).
Фермент-связанное иммуносорбентное исследование (ELISA)
Для проверки способности полипептида индуцировать иммунный ответ титры антител образцов сыворотки собирают от вакцинированных и контрольных мышей, определяют с помощью ELISA на 96-луночных планшетах, как описано ранее (Ibrahim et al. (2005) Infect Immun 73: 999-1005). Лунки покрывают пептидом при расчете 100 μл на лунку (например, один или несколько пептидов 2-11) при 5 μг/мл в PBS. Мышиные сыворотки инкубируют в течение 1 ч при комнатной температуре с последующим блокирующим этапом с использованием Трис-солевого буфером (TBS; 0.01 М Tris HCl [рН 7.4], 0.15 М NaCl), содержащим 3% бычий сывороточный альбумин. Затем лунки промывают три раза с помощью TBS, содержащим 0,05% Tween 20, а затем еще трижды раствором TBS. Козье антимышиное вторичное антитело, конъюгированное с пероксидазой хрена (Sigma) добавляют при конечном разведении 1:5000 и планшет инкубируют дополнительно в течение 1 ч при комнатной температуре. Лунки затем промывают с помощью TBS и инкубируют с субстратом, содержащим 0,1 М цитратного буфера (рН 5,0), 50 мг о-фенилендиамина (Sigma) и 10 μл 30% H2O2. Цвет проявляется в течение 30 мин, после чего реакцию завершают добавлением 10% H2SO4, и оптическую плотность (OD) при 490 нм определяют по счетчику титрационного микропланшета. Отрицательные контрольные лунки получали только разбавитель, и фоновое поглощение вычитается из тестовых лунок для получения окончательных показателей OD. Титр ELISA принимается за обратную величину последнего разведения сыворотки, который дал положительное показание OD (т.е. больше, чем среднее OD отрицательных контрольных образцов плюс 2 стандартных отклонения).
Анализ блокировки F(ab')2
Для изучения механизма защиты, опосредованной антителами анти-полипептидов (например, описаных здесь) в фагоцит-опосредованном уничтожении С. albicans, используются клетки HL-60, которые были дифференцированы в нейтрофилоподобный фенотип (Luo et al., (2010) J Infect Dis 201: 1718-1728). Анализ уничтожения проводится в присутствии анти-пептидного IgG или F(ab')2 фрагментов, как описано ранее (Luo (2010) J Infect Dis 201: 1718-1728). Вкратце, клетки HL-60 индуцируются 2,5 μм ретиноевой кислоты и 1,3% DMSO в течение трех дней при 37°С при 5% СО2. Иммунные анти-Als3 или анти-Hyr1 или анти-Als3/Hyr1 полипептидные сыворотки, при желании, объединяют и общий IgG выделяют с помощью белок А агарозы (Thermo Scientific). Сыворотка, собранная от тех же кроликов перед иммунизацией полипептидами, используется в качестве контрольной сыворотки. F(ab')2 фрагменты от иммунного или контрольного IgG очищают с помощью комплекта препаратов Pierce F(ab')2 в соответствии с инструкцией изготовителя. Для указания, что >95% Fc фрагмента переваривается, используют анализ SDS-PAGE. Далее, С. Albicans клетки, избыточно экспрессирующие или подавляющие Als3, инкубируют с 50 μг/мл вакцинированных или контрольных F(ab')2 фрагментов на льду в течение 45 мин. С. Albicans, культивированные совместно с F(ab')2 фрагментами, инкубируют с HL-60-полученными нейтрофилами в течение 1 ч при 37°С при 5% CO2 перед разрушением ультразвуком и количественным культивированием на YPD планшетах. Уничтожение в процентах рассчитывается путем деления числа КОЕ после сокультивирования с HL-60-полученными нейтрофилами на число КОЕ от С. albicans, инкубированных со средами без нейтрофилоподобных клеток.
Статистический анализ
Для определения различий времени выживаемости мышей используется непараметрический логранговый критерий. Анализ уничтожения нейтрофилов, титры антител и грибковое бремя в тканях сравнивают с помощью теста Манна-Уитни U для непарных сравнений. Корреляции вычисляются с помощью критерия суммы рангов Спирмена. Значения Р<0,05 считаются существенными.
Ожидаемые результаты
Пептиды, которые существенно повысили выживаемость и снизили грибковое бремя у иммунокомпетентных мышей, которые были заражены внутривенно С. albicans, считаются полезными в данном изобретении. Аналогично, полипептиды, которые статистически защищают мышей с ослабленным иммунитетом от кандидоза, полезны в данном изобретении. Мыши, защищенные от грибковой инфекции после получения очищенного IgG, нацеленного на полипептид, описанный в данном документе, в определенной дозировке, не только считаются показателем полезности стратегий пассивной иммунизации для лечения кандидоза, но и полезности полипептидного антигена, используемого для возбуждения иммунного ответа. Полипептидные вакцины, которые существенно снижают грибковое бремя в ткани у BALB/c мышей, зараженных несколькими видами Candida, не являющимися albicans, также считаются полезными в данном изобретении.
Способы и материалы для оценки лечения инфекции, вызванной Acinteobacter
Рекомбинантные полипептиды, описанные здесь, получают в соответствии со стандартными методами, например, с помощью системы экспрессии Е. coli. Рекомбинантный полипептид затем используется для активной вакцинации мышей. Мыши, например, иммунизируют только гидроксидом алюминия или рекомбинантным полипептидом, смешанным с гидроксидом алюминия (n=9) в день 0 и повторно в день 21. Вакцинированных мышей далее инфицируют бактериями A. baumannii в день 35. Полипептидные вакцины, обеспечивающие статистически значимую выживаемость по сравнению с контрольными мышами, считаются полезными в данном изобретении. Кроме того, проверяется измерение бактериального груза в ткани мышей, вакцинированных и инфицированных аналогично. Бактериальный груз, измеряемый по числу колониеобразующих единиц на грамм ткани, показывающий, что пробы ткани, выделенные из почек, легких и селезенки, имеют более низкий бактериальный груз по сравнению с контрольными образцами тканей, также принимается в качестве показателя полезных полипептидных вакцин.
В другом демонстрационном примере полная пассивная иммунизация против инфекции, вызванной Acinetobacter baumannii, также может быть проанализирована у диабетических мышей. Очищенный IgG от восьми различных поликлональных антител вводится диабетическим мышам за 2 часа до инфицирования. Коммерчески доступный неродственный кроличий IgG вводится контрольным мышам с диабетом. Затем мышей инфицировали смертельной дозой Acinetobacter baumannii путем инъекции в хвостовую вену. Мыши, идентифицированные с более значительным сроком выживаемости после получения разовой дозы соответствующего IgG, чем у мышей, получивших контрольный IgG (например, - 80% выживаемости при анти-полипептидном IgG против 0% в контрольной группе, р<0,0001 по логранговому критерию), считаются доказательством эффективности полипептидного антигена.
Способы и материалы для оценки лечения стафилококковой инфекции
Вкратце, для определения, защищает ли полипептид, описанный здесь, от S. aureus, женские особи BALB/c мышей вакцинируют полным адъювантом Фрейнда в соответствии со стандартными методами по схеме в день 0, после чего вводится бустер-доза в неполном адъюванте Фрейнда через 3 недели. Через две недели после вакцинации мышей инфицируют через хвостовую вену летальной дозой S. aureus штамма 67-0, который устойчив к метициллину и, как известно, вирулентный на животных моделях. Полипептиды, опосредующие улучшенную долгосрочную выживаемость у этих инфицированных мышей, считаются полезными в данном изобретении.
Полипептиды также можно тестировать на следующей мышиной модели инфекции кожи или мягких тканей. Полипептидная вакцинация оценивается в диапазоне доз по схеме алгидрогелевого адъюванта. Дозы по 3, 10, 30, 100 или 300 μг (1М) изучаются параллельно. После первичной вакцинации (день 0) выполняется идентичная повторная вакцинация в день исследования 21. Мыши инфицируются S. aureus через 14 дней после бустер-дозы (день исследования 35). Для этих исследований модифицируется модель с подкожным абсцессом / абсцессом мягких тканей согласно описанию в Ding et al. (J. Bacteriol. 2008 190: 7123-9) и/или Voyich et al. (.J Infect. Dis. 2006 194: 1761-1770). В день исследования 35 мышей анестезировали, обрили бока и стерилизовали, ввели 2×107 КОЕ инокулум (без шариков или матрицы) в подкожный отдел путем инъекции (100 μл). В каждом исследовании использовали минимум 20 мышей в контрольной группе или в группе в режиме вакцинации. Площадь/объем абсцесса затем замеряли на каждом боку мыши в течение периода исследования вплоть до 14 дней после заражения. Для этого мышей анестезировали и длина (1) и ширина (w) места повреждения оценивали с целью количественного определения площади абсцесса или дермального некроза (см2). Объем абсцесса (см3) рассчитывается по формуле для сферического эллипсоида: [v=(π/6)×1×w2]. Для количественного анализа культуры в заранее выбранные периоды после инфицирования мышей гуманно умерщвляют и обрабатывают для количественного культивирования абсцессов. Каждый бок асептически рассекают, абсцесс удаляют и препарируют для культивирования. Абсцессы отдельно гомогенизируют и последовательно разводят в стерильном растворе PBS для количественного культивирования на планшетах с агаром овечьей крови. Культуры инкубируют (37°С) в течение 24 часов, и полученные колонии нумеруют. Для статистического анализа различия в экспериментальных результатах сравниваются на основании оценок мощности, указывающих, что 16-20 мышей в группе дают>85% мощности с детектированием 1 log различия в КОЕ на грамм ткани, или 2 мм площади абсцесса (а=0,05; тест Манна-Уитни U. Р значения определяются в соответствии со стандартными методами.
Ожидаемые результаты
Полипептидные вакцины, которые значительно снижают площадь, объем абсцесса или КОЕ плотности у мышиной модели по результатам анализа MRSA кожи или мягких тканей, считаются полезными в данном изобретении. Такие результаты считаются показателем того, что тестируемая полипептидная вакцина полезна в качестве средства предотвращения или уменьшения MRSA инфекции кожи или абсцессов или того и другого у млекопитающих.
Дополнительная оценка с использованием человеческих РМВС [мононуклеарные клетки периферической крови]
Полезные полипептидные антигены, описанные здесь, также определяют с помощью стандартных человеческих клеток РМВС. Клетки РМВС получают от лиц, вакцинированных с помощью Als3 или Hyr1 в различные моменты времени после вакцинации. Собранные РМВС хранят при -80°С и оттаивают перед использованием.
Для анализа используют планшеты ELISpot, покрытые антителами к специфическим человеческим цитокинам или хемокинам, например, IFN-γ, IL-17A, IL-4 или GRO. Образцы РВМС затем активируют в культуре в течение 48 ч и распределяют в 96-луночные планшеты ELISpot по ~ 200000 клеток на лунку. Специфические полипептиды и/или комбинации полипептидов помещают в лунки в трех экземплярах и инкубируют в течение 48-96 ч, а затем супернатанты из каждой лунки удаляют для анализа. ELISpot планшеты разработаны для выявления формирующих пятна единиц на лунку, отражающих число клеток в лунке, которые продуцируют представляющее интерес соединение. Пептиды или комбинация пептидов, показывающие увеличение продуцирования цитокинов или хемокинов по отношению к нестимулированным РМВС, считаются полезными в данном изобретении.
Другие варианты осуществления
Все публикации, патенты и патентные заявки, упомянутые в вышеприведенном описании, включены в данный документ по ссылке. Различные модификации и вариации описанных способов по настоящему изобретению будут очевидны специалистам в данной области без отступления от объема и сущности настоящего изобретения. Несмотря на то что изобретение описано в отношении конкретных вариантов осуществления, следует понимать, что заявленное изобретение не должно быть ненадлежащим образом ограничено такими конкретными вариантами осуществления. Несомненно, предполагается, что различные модификации описанных средств осуществления изобретения, которые очевидны специалистам в данной области техники, находятся в пределах объема настоящего изобретения.
Другие варианты осуществления приведены в патентной формуле.
Реферат
Данное изобретение относится к биотехнологии. Предложен выделенный полипептид, представляющий собой фрагмент белка Hyr1, для вакцинирования млекопитающего. Указанный полипептид обладает иммуногенными свойствами не только в отношении дрожжей, но и в отношении грамотрицательных бактерий. Кроме того, представлены: молекула нуклеиновой кислоты, кодирующая упомянутый полипептид, вектор экспрессии, клетка, способ получения полипептида, антигенная композиция и способ ее получения, а также способ индуцирования иммунного ответа. 9 н. и 14 з.п. ф-лы.

Комментарии