Иммуногенная композиция для модуляции иммунной системы и ее применение, способ лечения и предотвращения заболеваний, способ индукции регенерации клеток и способ восстановления иммунного ответа - RU2678317C2
Код документа: RU2678317C2
Чертежи






Описание
Настоящее изобретение относится к иммуногенным композициям для модуляции иммунной системы, содержащим терапевтически эффективное количество двух или более иммуноактивных антигенных агентов, представляющих собой патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP; от англ. "danger-associated molecular pattern"), и один или более физиологически приемлемых носителей, наполнителей, разбавителей или растворителей.
Предпочтительно композиции по настоящему изобретению содержат иммуноактивные антигенные агенты, представляющие собой патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP), выбранные из группы, состоящей из следующих агентов: (А) антигенных агентов с молекулярными паттернами, ассоциированными с бактериями; (В) антигенных агентов с молекулярными паттернами, ассоциированными с вирусами; (С) антигенных агентов с молекулярными паттернами, ассоциированными с грибами и дрожжами; (D) антигенных агентов с молекулярными паттернами, ассоциированными с простейшими; (Е) антигенных агентов с молекулярными паттернами, ассоциированными с многоклеточными паразитами/или (F) антигенных агентов с молекулярными паттернами, ассоциированными с прионами.
Другим аспектом настоящего изобретения является применение иммуногенных композиций при получении лекарственных средств для предотвращения и/или лечения инфекционных заболеваний, аутоиммунных заболеваний, аллергических заболеваний, воспаления, артрита, воспалительных заболеваний, отторжения трансплантата, заболеваний, вызванных сосудистыми расстройствами, заболеваний, вызванных геморрагическими или ишемическими сердечно-сосудистыми осложнениями, ишемии, инфаркта и кровотечения, приводящего к деструкции тканей, сердечного, почечного, респираторного или печеночного заболевания, рака, опухолей, а также злокачественных и доброкачественных повреждений.
Иммуногенные композиции по изобретению также непосредственно применяют при предотвращении и/или лечении инфекционных заболеваний, инфекционных заболеваний, аутоиммунных заболеваний, аллергических заболеваний, воспаления, артрита, воспалительных заболеваний, отторжения трансплантата, заболеваний, вызванных сосудистыми расстройствами, заболеваний, вызванных геморрагическими или ишемическими сердечнососудистыми осложнениями, ишемии, инфаркта и кровотечения, приводящего к деструкции тканей, сердечного, почечного, респираторного или печеночного заболевания, рака, опухолей, а также злокачественных и доброкачественных повреждений.
Настоящее изобретение дополнительно относится к способам индукции клеточной регенерации, тканевой регенерации, регенерации органов и регенерации систем органов, таких как система кровообращения, нервная система и эндокринная система.
Наконец, настоящее изобретение относится к способам восстановления иммунного ответа у животных, в частности, у людей.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Об открытии антибиотиков и других лекарственных средств
С тех пор, как во второй половине 20-го века были впервые открыты антибиотики, ведутся широкомасштабные разработки новых антибиотиков, полусинтетических антибиотиков и новых химиотерапевтических средств, обладающих антибактериальной активностью, против большинства внутриклеточных и внеклеточных бактерий. Эти разработки изменили историю медицины, давая возможность добиться широкого спектра лечения подавляющего большинства бактериальных инфекционных заболеваний, которое поддерживает человечество.
Таким образом, открытие антибиотиков было ключевой точкой, переломным моментом, поскольку инфекцию можно было направленно лечить определенным путем, при четком взаимоотношении причины и эффекта, а также измеримо при ее установлении. Данное открытие значительно расширило способность к фармакотерапии, оказав огромное положительное влияние на здоровье и продолжительность жизни людей. Открытие антибиотиков в развитии лечения заболеваний глубоко повлияло на исследования и научную мысль исследователей в связи с успехом, достигнутым данной экспериментальной моделью (Reeves G, Todd I. Lecture notes on immunology. 2nd ed: Blackwell Scientific Publications, 1991; Neto VA, Nicodemo AC, Lopes HV.




За антибиотиками последовала разработка и применение противогрибковых, антипаразитарных и антивирусных лекарственных средств. Были также разработаны противоопухолевые, цитостатические и цитостатические лекарственные средства против злокачественных опухолей, противовоспалительные, противоаллергические и иммуносупрессивные лекарственные средства (антилимфоцитарные, нейтрализующие иммунную систему антилейкоцитарные средства) гормональной и негормональной природы, имеющие широкий ряд применений, как, например, среди прочего, для лечения инфекционных заболеваний, воспалительных заболеваний любой этиологии, аутоиммунных заболеваний, генетических заболеваний, сосудистых заболеваний, аллергических заболеваний, травм, опухолевых заболеваний, гормональных заболеваний, дегенеративных заболеваний.
Таким образом, новые лекарственные средства создали огромные возможности для медицинского вмешательства, обладающего многочисленными полезными эффектами, приводящего к определенному и частичному излечению, к продлению жизни при неизлечимых заболеваниях, однако, привели к значительной заболеваемости вследствие побочных эффектов, обусловленным недостатком специфичности этих лекарственных средств к патофизиологии заболеваний, подлежащих лечению.
О врожденном иммунитете
Врожденный иммунитет, в дополнение к предотвращению проникновения микроорганизмов и предотвращению их развития, обладает другой недавно открытой жизненно важной функцией: распознавания между "своим" и "не своим" и способностью к распознаванию паттерна, связанного с сигналом и командой к началу или ингибированию целостного иммунного ответа против инвазионного микроорганизма, либо к остановке, репарации или ингибированию состояния деструкции или самоагрессии для организма, например, среди прочего, при травме, аутоиммунных заболеваниях и аллергических заболеваниях. Эту двойную способность ранее ошибочно приписывали исключительно адаптивному иммунитету. Врожденный иммунитет, посредством его собственных рецепторов, распознает инвазионные патогенные микроорганизмы, аутологичные или даже аллогенные опухолевые клетки, либо аллогенные или гетерологичные трансплантаты как "не свои", идентифицируя их как не принадлежащие к организму. С этого момента он запускает сигнал тревоги и объединенный врожденный и адаптивный иммунитет, чтобы устранить их или подавить ответ, вредный для организма человека или животного (Goldsby RA, Kindt TJ, Osborne В. Imunologia de Kuby. 6 ed: Artmed; 2008, 704 p; Janeway C, Travers P, Walport M, Slhlomchik MJ. Immunobiology five. 5 ed: Garland Pub.; 2001. 732 p.; Voltarelli JC. Imunologia clinica ha pratica medica: atheneu editora; 2009; Janeway CA, Jr., Medzhitov R. Innate immune recognition. Annual review of immunology. 2002; 20:197-216. Epub 2002/02/28; Matzinger P. The danger model: a renewed sense of self. Science. 2002; 296 (5566):301-5. Epub 2002/04/16; Steinman RM, Banchereau J. Taking dendritic cells into medicine. Nature. 2007; 449 (7161): 419-26. Epub 2007/09/28; Beutler BA. TLRs and innate immunity. Blood. 2009; 113 (7): 1399-407. Epub 2008/09/02; Moresco EM, LaVine D, Beutler B. Toll-like receptors. Current biology: CB. 2011; 21 (13): R488-93. Epub 2011/07/12).
(Паттерн по умолчанию/стандартный паттерн?) распознавания "не своего", инвазивного микроорганизма, опухолевой клетки или измененной или трансплантированной клетки осуществляется сигнальными клетками, представленными среди прочего эпителиальными клетками, слизистыми клетками и стромальными клетками, такими как среди прочего перициты, дендритные клетки, макрофаги и фибробласты. Эти клетки, стратегически распределенные по всему организму, имеют ПРР (паттернраспознающие рецепторы) и DRR (рецепторы, распознающие опасность; от англ. "Danger Recognition Receptors"), которые представляют собой рецепторы, соответственно способные распознавать а) стандартные молекулы идентификации, характеристические для широкого ряда микроорганизмов, и b) некоторые химические и физические паттерны инертных веществ и изменений вследствие метаболического стресса, например, высвобождения свободных радикалов и химических изменений в тканях, вызванных среди прочего ионизирующим излучением или химическими веществами.
ПРР не отличают один определенный индивидуальный микроорганизм, но отличают присутствие микроорганизмов, отличающихся от микроорганизмов организма человека. Каждый реципиент ПРР может связываться с несколькими различными патогенами, распознаваемыми как ПАМП (патоген-ассоциированные молекулярные паттерны) углеводов, липидов, пептидов и нуклеиновых кислот из бактерий, вирусов, грибов или паразитов, не находищихся в организме человека или животного.
DRR различают наличие тканевого повреждения, опасную ситуацию, вызванную неживыми или инертными агентами. DRR идентифицируют DAMP (молекулярные паттерны, ассоциированные с опасностью), ассоциированные с тканевым повреждением за счет токсичных веществ, облучения или травмы, которое вызывает следующие процессы: метаболический стресс, высвобождение свободных радикалов и химические изменения в ткани, распознаваемые этими рецепторами. (Janeway С, Travers Р, Alport М, Slhlomchik MJ. Immunobiology five. 5th ed: Garland Pub.; 2001. 732 p.; Matzinger P. The danger model: a renewed sense of self. Science. 2002; 296 (5566): 301-5. Epub 2002/04/16; Beutler BA. TLRs and innate immunity. Blood. 2009; 113 (7): 1399-407. Epub 2008/09/02; Moresco EM, LaVine D, Beutler B. Toll-like receptors. Current biology: CB. 2011; 21 (13): R488-93. Epub 2011/07/12).
Таким образом, сигнальные клетки посредством своих рецепторов PRR и DRR играют роль в разрушении того, что принадлежит ("своего"), и того, что не принадлежит (не "своего") к организму, и запускают воспалительный и иммунный ответ посредством распознавания ПАМП инвазионных патогенов и DAMP, вызванных опухолевыми клетками и токсичными веществами или модификациями вследствие травмы, приводящими к ситуации реальной опасности для организма человека и животного.
Эти активированные сигнальные клетки немедленно дают тревожные сигналы, запускающие врожденный иммунный ответ посредством сигнальной системы трансляции NF-kB (ядерного фактора-kB; от англ. «Nuclear Factor-kB»), приводящий к секреции провоспалительных цитокинов и сигнальной системы трансляции IRF, которая продуцирует альфа- и бета-интерфероны типа I. Данные цитокины, совместно действуя на клетки и сосуды, вызывают локальный воспалительный процесс, чтобы первоначально подавить инвазионный, аутологичный (опухолевая клетка), гетерологичный (микроорганизмы, прионы, графты и трансплантаты) или аллогенный (графты и трансплантаты) агент или репарировать опасные ситуации. Это подавление осуществляется посредством антител, предсуществующих, опсонизирующих белков активной фазы, и посредством лейкоцитов и макрофагов, которые поглощают и начинают разрушать внеклеточные и внутриклеточные микроорганизмы соответственно или устранять другие этиологические агенты любого рода.
При подагре, при силикозе, химической агрессии, при гранулемах инородных тел, при травме воспалительный процесс формируется, чтобы по возможности устранить провоцирующий фактор, а затем индуцировать заживление и регенерацию ткани. Если провоцирующий фактор не устраняется, воспаление закрепляется и вызывает неизлечимое и неконтролируемое хроническое воспалительное заболевание, стабильное или прогрессирующее, угрожающее жизни или здоровью пациента.
Взаимодействие и интеграция врожденного иммунитета и адаптивного иммунитета
Одновременно в сайте инвазии, агрессии и воспаления сигнальные клетки врожденного иммунитета, играющие роль АПК (антигенпрезентирующих клеток), такие как дендритные клетки и макрофаги, фагоцитируют и пиноцитируют, среди прочих агрессоров, микроорганизмы, либо опухолевые клетки, либо трансплантированные клетки, и обрабатывают их антигены. Эти АПК, стимулированные антигенами, мигрируют в регионарные лимфатические узлы и активируют их. Клетки АПК в реактивных лимфатических узлах, активированные и зрелые, презентируют антигены лимфоцитам, секретируют цитокины и, таким образом, индуцируют, координируют, поляризуют, амплифицируют и поддерживают адаптивный иммунный ответ, специфичный к инвазионным микроорганизмам, либо к опухолевым клеткам, либо к трансплантированным клеткам, либо к другому провоцирующему фактору, давая возможность бороться с этими факторами и устранять их, где это возможно, и впоследствии лечить инфекцию или воспаление, а также осуществлять репарацию, регенерацию или заживление раны.
Таким образом, данные иммунные механизмы борются с заболеванием посредством их врожденных и адаптивных ответов интегрированным и синергетическим путем, осуществляемым сигнальными клетками, сигнальными клетками, имеющими функцию АПК, и клеточными и молекулярными эффекторами врожденного иммунитета в сочетании с клеточными и молекулярными эффекторами адаптивного иммунитета, представляющими собой соответственно лимфоциты, цитокины и антитела.
Таким образом, взаимодействие двух иммунитетов, врожденного и адаптивного, в ситуации инфекции или иммунного ответа против агрессора любого рода способствует борьбе с заболеванием интегрированным и синергетическим путем. Их интеграция первоначально происходит посредством действия клеток врожденного иммунитета, обладающих функцией АПК, таких как дендритные клетки и макрофаги, но, в основном, посредством активности дендритных клеток, поскольку они представляют собой клетки, способные к инициации адаптивного иммунного ответа против первичного инфекционного или паразитического агента, эффективно защищая организм.
Как отмечено, макрофаги также функционируют в качестве АПК, но являются более специализированными и вовлечены в фагоцитоз и устранение микроорганизмов как часть эффекторной петли. В лимфоциты, когда они созревают, также представляют собой клетки АПК, и их самое хорошо известное действие состоит в презентировании антигеном Т лимфоцитам в рамках кооперирования обоих лимфоцитов с образованием антител против Т-зависимого антигена и вторичного ответа антител. Макрофаги, подобно другим миелоидным клеткам, также вовлечены в подавление иммунного ответа при раке и при неизлечимых хронических инфекциях. В этих случаях их действие является неблагоприятным для защиты организма, поскольку оно подавляет иммунный ответ и благоприятствует опухоли. Злокачественное опухолевое заболевание характеризуется тем, что вызывает первоначальное неактивное воспаление, являющееся незначительным, и в конце оно становится крайне провоспалительным и симптоматическим посредством ТН17 профиля воспалительной ткани, что обычно приводит к длительному страданию пациента.
Если костимуляторные молекулы не экспрессируются на клеточной поверхности АПК, в результате отсутствия тревожного сигнала, характеризующегося отсутствием активации ПРР за счет ПАМП и DAMP, возникает только первый сигнал, подаваемый Т-клеточным рецептором, ТКР. После того, как ТКР связывается с антигеном, в отсутствие второго сигнала Т лимфоцит становится толерантным к специфичному презентированному антигену, и иммунный ответ прекращается.
С другой стороны, молекула CD 40L активированных Т лимфоцитов, если она связывается с молекулой CD40 на клетках АПК, значительно повышает экспрессию молекул CD80 и CD86, усиливая текущий ответ, который, таким образом, происходит только тогда, когда адаптивный Т-ответ уже задействован в защиту организма. Третий сигнал, подаваемый цитокинами, такими как интерлейкин-1 (ИЛ-1), подается АПК только после связывания костимуляторных молекул и испускания второго сигнала. ИЛ-1, секретируемый АПК, действует на лимфоцитарные клетки и приводит к полной экспрессии рецептора к ИЛ-2 и продуцированию цитокинов девственными Т-лимфоцитами или Т-лимфоцитами памяти, задействованными в ответе, инициирующем клональную экспрессию.
Таким образом, активация врожденного иммунитета патогенами является ключевым фактором высвобождения вторых и третьих сигналов и возникновения потенциально эффективного иммунитета посредством полной активации Т-лимфоцитов, задействованных в ответе. Без появления второго и третьего сигнала ответ прерывается, и создается толерантность, специфичная к презентированному антигену.
В то же время, когда нейтрофилы, моноциты и макрофаги инициируют борьбу с бактериями и с другими инфекционными агентами посредством связывания ПАМП с ППР на антигенпрезентирующих клетках (АПК), они активируют дендритные клетки и макрофаги, как локальные, так и вновь прибывшие. Эти клетки фагоцитируют и пиноцитируют бактерии и бактериальные антигены, обрабатывая их и начиная процесс созревания. Теперь активированные и созревшие дендритные клетки мигрируют в регионарные лимфатические узлы, где они презентируют антигены и инициируют иммунный ответ против инвазионного агента.
Зрелые, стимулированные антигеном АПК, в частности, дендритные клетки в лимфатических узлах, кооперируются с Т и В лимфоцитами и инициируют адаптивный ответ. Дендритные клетки являются наиболее эффективными клетками для презентации антигенов, и только АПК способны активировать действенные CD4 Т-лимфоциты и начать новый иммунный ответ.
После периода, составляющего приблизительно семь суток, в лимфатическом узле кооперирование между девственными CD4 лимфоцитами, которые становятся Т лимфоцитами CD4 Th2, с В лимфоцитами и антигенпрезентирующими дендритными клетками инициирует дифференциацию специфичных сенсибилизированных В лимфоцитов. Эти В клетки, теперь активированные, распознают бактериальные антигены за счет поверхностных иммуноглобулинов после контакта с этими антигенами, пролиферируют, созревают и дифференцируются в плазматические клетки, которые теперь секретируют специфичные антитела против данной бактерии. Инфекции всех типов, бактериальные, вирусные, грибковые и паразитарные, могут в целом в острой фазе приобретать изменения либо до полного излечения с регенерацией и заживлением, либо до излечения с осложнениями. Они могут также претерпевать изменения до полностью хронического заболевания, контролируемого или неконтролируемого, до хронического заболевания с заживлением, с осложнениями или без осложнений, или до смерти.
Поляризация иммунного ответа
Иммунные профили, известные и индуцированные дендритными клетками за счет прямого и непрямого контакта с различными цитокинами, а также генерируемые Т CD4+ клетками, принадлежат к следующим четырем типам:
a) клеточный Th1 профиль, образующий клеточный иммунитет, опосредованный клетками;
b) гуморальный Th2 профиль, создающий гуморальный иммунитет, опосредованный антителами;
c) тканевой или воспалительный Th17 профиль, создающий воспалительный тканевой иммунитет, также опосредованный клетками и цитокинами, который индуцирует воспаление, важное для устранения некоторых патогенов, и
d) Treg/Tr1 профиль, подавляющий иммунный ответ и контроль посредством ингибирования трех других описанных выше профилей, обеспечивающий восстановление равновесного состояния организма.
e) профили, еще не полностью установленные, такие как Tfh (фолликулярные хелперы) профиль гуморального ответа, Th9 профиль для некоторых паразитов или другие профили, которые могут быть открыты.
Таким образом, различные профили обеспечивают защиту организма и устранение инвазионных гетерологичных (инфекционных) возбудителей и аутологичных (опухолевых) колонизирующих агентов. Последний профиль обеспечивает терминацию иммунного ответа, равновесие, регенерацию, безопасное восстановление нормального состояния, и он предотвращает самоповреждение и аллергию и, следовательно, жизненно важен для здоровья и предохранения людей и животных в равной степени с другими профилями.
Явление поляризации иммунного ответа определяют как преобладание определенного иммунологического профиля, например, Th1 или Th2, за счет других профилей, которые становятся второстепенными или нулевыми. Это явление происходит в соответствии с типом атаки, которой подвергается организм. То есть, в соответствии с типом инфекции, патологии, а также стадией инфекции или стадией патологии преобладают различные типы иммунного ответа, который может представлять собой клеточный, гуморальный, тканевой или иммунорегуляторный ответ, тогда как другие типы иммунного ответа ингибированы, что приводит в результате к явлению поляризации.
По определению, профиль при поляризации является преобладающим, но другие не преобладающие профили также необходимы и экспрессируются комплементарно, что способствует устранению заболевания. Например, туберкулез представляет собой появление Th17 клеток в легком, что дает возможность осаждения Th1 клеток, что может привести к излечению этой инфекции в легочной паренхиме (Stockinger, В. and Veldhoen, М. Differentiation and function of Th17 T cells. Current Opinion in Immunology, 19 (3), pp. 281-286. 2007). При вирусных инфекциях клетки CTL профиля Th1 разрушают клетки, инфицированные вирусами, чтобы устранить вирус. Тем не менее, антитела необходимы, чтобы предотвратить инфекцию вирусом других здоровых клеток и, следовательно, предотвратить распространение инфекции. Координированное согласование двух профилей необходимо для излечения некоторых вирусных инфекций. Для излечения определенных кишечных инфекций внеклеточными грамотрицательными бациллами на последней стадии требуется, помимо Th2 профиля, образование дополнительного Th17 профиля, способного к созданию сильного воспаления, необходимого для устранения данного типа бактерий.
В заключение, вследствие того факта, что дендритные клетки являются единственными «профессиональными» АПК, способными инициировать первичный адаптивный иммунный ответ, и наиболее эффективны при запуске вторичного специфичного иммунного ответа при любом профиле, следовательно, именно они получают команду к взаимодействию и интеграции врожденного иммунитета с адаптивным иммунитетом, вызывая эффективный иммунный ответ, способный к излечению заболевания. Дендритные клетки при кооперировании с другими АПК и сигнальными клетками при контакте с различными агрессорами при различных функциональных состояниях в сайтах воспаления, в лимфатических узлах, в селезенке, в слизистых оболочках способны направлять, координировать, поляризовать и амплифицировать адаптивный иммунный ответ, первичный и вторичный, например, специфичный к пептидам инвазионных патогенов, который в данном случае наиболее пригоден для устранения текущей инфекции.
Следовательно, дендритные клетки и другие АПК являются ключевыми клетками врожденного иммунного ответа, поскольку они определяют природу аутологичного и гетерологичного возбудителя, то есть тип патогенна или колонизирующих клеток, и с помощью сигнальных клеток измеряют и определяют размер гетерологичной или аутологичной агрессии, ее степень, интенсивность и агрессивность, кроме того, посылают команду на адаптивный иммунитет с профилем и интенсивностью, необходимой для устранения патогена.
После дифференцировки может произойти трансдифференцировка, индуцированная микроокружением и/или типом антигена или его презентирования, при котором профиль Th1 или Th2 может быть изменен на воспалительный профиль, либо на иммуносупрессивный профиль или наоборот. Эта крайняя пластичность иммунной системы при дифференцировке или трансдифференцировке в любом направлении указывает на стратегическое окно для манипуляциями с иммунной системой в процессе инфекции, когда направление, выбранное поляризацией, не является лучшим для лечения процесса инфекции или новообразования.
В качестве иллюстративного примера рассмотрим то, что случается при тяжелой инфекции или токсицемии, когда массивное воспаление, вызванное большие числом микроорганизмов, которые затрагивают сигнальные клетки во всем организме, индуцирует также Th17 профиль, который, в свою очередь, еще больше усиливает воспаление и, следовательно, становится разрушительным, вероятнее приводя к деструкции ткани, чем индуцируя ее заживление. В этих случаях Th17 профиль за счет деструкции ткани и усиления воспаления, в основном, ответственен за появление клинических осложнений, таких как тяжелый ОРДСВ (острый респираторный дистресс-синдром взрослых), легочный шок, почечная недостаточность или шок, которые подвергают риску выздоровление.
Трансдифференцировка поляризации для Th1 или Th2 профилей при ингибировании массивного воспаления является логическим и стратегическим путем для разработанной или подготовленной иммунотерапии, чтобы постараться разрешить данную ситуацию критического или чрезвычайного типа во время тяжелой инфекции или сепсиса, который имеет значительную смертность и заболеваемость, и при котором антибиотики или другие антибактериальные средства при современных схемах, таких как однократный режим, обладают разочаровывающими противоинфекционными результатами. Такой же пример применим к тяжелой внутриклеточной бактериальной, грибковой, вирусной и паразитарной инфекции при обширной деструкции ткани и массивном воспалении, обычно с плохим прогнозом.
Применение адъювантов для стимуляции иммунного ответа
Организмы человека и животного обычно не продуцируют антитела против растворимых белков, поэтому, чтобы получить желаемый иммунный ответ, необходимо применение так называемых неспецифических или неродственных адъювантов. Эти адъюванты, применяемые с момента возникновения иммунологии при иммунизациях и в вакцинных применениях, готовили и готовят из частей микроорганизмов, минеральных масел и других веществ, активирующих врожденный иммунитет, а затем приводящих к тревоге и контролю, необходимому для развития желаемого иммунного ответа на интересующий белок или вакцину (Goldsby RA, Kindt TJ, Osborne BA. Imunologia de Kuby. 6 ed: Artmed; 2008. 704 p); (Janeway C, Travers P, Alport M, Slhlomchik MJ. Immunobiology five. 5 ed: Garland Pub.; 2001. 732 p.); (Voltarelli Jc. Imunologia Clinica Na Pratica Medica: Atheneu Editora; 2009); (Janeway CA, Jr., Medzhitov R. Innate immune recognition. Annual review of immunology. 2002; 20:197-216. Epub 2002/02/28); (Matzinger P. The danger model: a renewed sense of self. Science. 2002; 296 (5566): 301-5. Epub 2002/04/16.): (Steinman RM, Banchereau J. Taking dendritic cells into medicine. Nature. 2007; 449 (7161): 19-26. Epub 2007/09/28.); (Beutler BA. TLRs and innate immunity. Blood. 2009; 113 (7): 1399-407. Epub 2008/09/02.); (Moresco EM, LaVine D, Beutler B. Toll-like receptors. Current biology: CB. 2011; 21 (13): R488-93. Epub 2011/07/12).
Следует отметить, что применение адъювантов для иммунизации, несмотря на то, что оно является одним из старейших и до сих пор существующих признаков, широко применяемых и необходимых для вакцинаций и для исследований в области иммунологии, рассматривали только как полезный неспецифический эффект. В течение более чем столетия не рассматривали их роль во врожденном иммунитете при различении того, что является "своим" и "не своим", и их способность, уникальную и фундаментальную для выживания людей и животных как вида, подавать тревожный сигнал и команду начать, не начать или ингибировать следующие виды иммунного ответа: интегрированный, защитный или заживляющий, врожденный и адаптивный (Goldsby Ra, Kindt Tj, Osborne Ba. Imunologia De Kuby. 6 ed: Artmed; 2008. 704 p); (Janeway C, Travers P, Walport M, Slhlomchik MJ. Immunobiology five. 5 ed: Garland Pub.; 2001. 732 p.); (Voltarelli JC. Imunologia Clinica Na Pratica Medica: Atheneu Editora; 2009); (Janeway CA, Jr., Medzhitov R. Innate immune recognition. Annual review of immunology. 2002; 20:197-216. Epub 2002/02/28.); (Matzinger P. The danger model: a renewed sense of self. Science. 2002; 296 (5566): 301-5. Epub 2002/04/16.): (Steinman RM, Banchereau J. Taking dendritic cells into medicine. Nature. 2007; 449 (7161): 419-26. Epub 2007/09/28.); (Beutler BA. TLRs and innate immunity. Blood. 2009; 113 (7): 1399-407. Epub 2008/09/02.); (Moresco EM, La Vine D, Beutler B. Toll-like receptors. Current biology: CB. 2011; 21 (13): R488-93. Epub 2011/07/12).
Современные противоинфекционные и противораковые терапии
Большое число медицинских материалов, рабочих часов, лекарств и больничных коек можно использовать лучше при терапии, при которой оценивают, располагают в порядке очередности и оптимизируют косвенные показатели, оказывающие влияние на смещение биологического равновесия в пользу пациента, и модулируют его иммунную систему, уменьшая неэффективность и давая возможность для большего числа выписки пациентов за меньшее время. Предшествующему уровню техники еще предстоит обеспечить осуществление надлежащей реполяризации иммунной системы в реальном времени, или времени на изменение или обратное развитие ее ответа на текущее заболевание или расстройство, по возможности улучшить качество жизни или увеличить продолжительность жизни, либо способствовать процессу борьбы пациента с текущим заболеванием или расстройством.
Бактериальная, грибковая, вирусная, паразитарная или опухолевая резистентность к антибиотикам, противогрибковым, антипаразитарным и противоопухолевым лекарственным средствам, применяемым в клинической практике, по-видимому, представляет собой основное препятствие к лечению бактериальных, грибковых, вирусных, паразитарных и опухолевых заболеваний, и считается серьезной проблемой для здоровья человека в глобальном масштабе. Данную проблему преодолевают путем использования целесообразного и рационального применения антибиотиков, антибактериальных и противораковых лекарственных средств, а также с помощью поступления новых, более эффективных лекарственных средств. Тем не менее, рано или поздно резистентность всегда неизбежно устанавливается, и решение этой проблемы еще предстоит найти. Поскольку антибиотики, противогрибковые, противовирусные, антипаразитарные и противоопухолевые средства рассматривают как единственную действующие и эффективные противоинфекционные, антипаразитарные и противоопухолевые методы лечения, перспектива будущих методов лечения вызывает беспокойство и неизвестна в связи с явлением резистентности микроорганизмов и опухолей.
Антибиотики, противогрибковые, противовирусные, антипаразитарные и противоопухолевые средства можно применять на любой стадии инфекции: бактериальной, грибковой, вирусной, паразитарной, и опухолевых состояний. Тем не менее, антибиотики, антибактериальные и противоопухолевые средства неспособны лечить наиболее прогрессирующие, первазивные и тяжелые бактериальные, грибковые, вирусные, паразитарные и раковые состояния, которые в целом обладают очень высокой частотой смертности и заболеваемости.
Кроме того, открытие новых лекарственных средств направлено на лекарственные средства, способные к устранению возбудителя и лечению инфекции, инвазии и новообразований, на основе концепции единого лекарственного средства, способного к лечению инфекционного, паразитарного и опухолевого заболевания.
Лечение опухолей в настоящее время
Цитокины, такие как интерлейкин 2 и альфа и бета интерфероны типа I, применяют для лечения иммуногенных опухолей, таких как меланома и гипернефрома. Функцию цитокинов в качестве факторов роста колоний костного мозга с хорошими результатами применяют для борьбы с анемией, лейкопенией, цитопениями элементов периферической крови, вызванными заболеванием или лечением. Интерфероны типа I широко применяют с хорошими результатами для борьбы с вирусным гепатитом В и С и с менее значимыми результатами для лечения рассеянного склероза. Трансплантацию аллогенного и аутологичного костного мозга применяют для лечения рака. Пассивные иммунотерапии дендритными клетками CTL CD8, лейкоцитами, аутологичными или аллогенными, с цитокином или без цитокина применяют для лечения некоторых опухолей, и результаты этого лечения все же не очень значимы или полностью значимы, но ограничены некоторыми исключительными патологиями, такими как опухоли, индуцированные вирусом, которые растут у трансплантированных пациентов с подавленным иммунитетом. В этих случаях пассивная иммунотерапия специфичными клетками Т CTL CD8 и CD4 против вируса EBV обычно успешна и лечит эти исключительные опухоли, которые растут только у пациентов с подавленным иммунитетом. Тем не менее, примечательно, что при данных методах, а также при других подобных, но менее эффективных методах не разработаны агенты или группы агентов, способные к эффективной иммуномодуляции иммунной системы, чтобы она начала реагировать против какого-либо инвазионного патогена (инфекции) или аутологичной колонизации (опухолей), присутствующих в организме индивидуума, подлежащего лечению, или агенты, которые могут разрешить состояния дизавтономии в первичной или вторичной генетической иммунной системе, приводящие к состоянию самоповреждения иммунной системой, которая должна защищать организм от агрессии.
Примеры включают успешное лечение рака, при котором применяют иммуномодуляторный агент, содержащий молекулярные паттерны, распознаваемые ПРР, применении бациллы Кальметта и Гирена (БЦЖ) в качестве одного из редких отработанных методов, одобренных и доказанных, при которых применяют иммуномодуляцию как средство лечения. Brake с соавторами описали применение иммунотерапии БЦЖ у пациентов с поверхностным раком мочевого пузыря, находящихся в стадии TI (Brake М, Loertzer Н, Horsch R, Keller Н (2000). "Long-term results of intravesical bacillus
Следуя этому пути, Burger с соавторами продемонстрировали рандомизированное сравнительное испытание, при котором у пациентов с неинвазионным раком мочевого пузыря мышечного слоя применяли БЦЖ или клеточную терапию аутологичными макрофагами (BEXIDEM®) (Burguer М, Thiounn N, Denzinger S, Kondas J, Benoit G, et. al (2010). "The application of adjuvant autologous antravesical macrophage cell therapy vs BCG in non-muscle invasive bladder cancer: a multicenter, randomized trial. Journal of Translation Medicine, 8:54. doi: 10.1186/1479-5876-8-54). По сравнению с БЦЖ встречаемость побочных эффектов была значительно ниже при лечении BEXIDEM (26% и 14% соответственно). Тем не менее, частота рецидива опухоли у пациентов, которых лечили BEXIDEM, была значительно выше, чем у пациентов, которые получали БЦЖ в качестве вспомогательной терапии.
Donald с соавторами описали применении БЦЖ как формы иммунотерапии у пациентов с меланомой (Donald L. Morton, M.D., Frederick R. Eilber, M.D., E. Carmack Holmes, M.D., John S. Hunt, M.D., et. al (1974). "BCG Immunotherapy of Malignant Melanoma: Summary of a Seven-year Experience". Ann. Surg., p: 635-641). Пациенты, отобранные для исследования, страдали рецидивирующей меланомой, известным остаточным заболеванием или высоким риском развития рецидива. Сначала применяли прямые инъекции в злокачественные узлы меланомы, используя 0,1-0,5 см3 БЦЖ в каждом внутрикожном и подкожном повреждении. Пациентов, находящихся на стадии II, лечили только иммунотерапией БЦЖ или БЦЖ и аллогенными клетками меланомы. БЦЖ вводили отдельно или в качестве адъюванта, смешанного с опухолевыми клетками, пациентам на стадии III заболевания. Пациентов с внутрикожными метастазами, которых лечили внутриопухолевыми инъекциями БЦЖ, представляли собой пациентов, лучше реагирующих на лечение, и, по-видимому, с ответом на иммунотерапию БЦЖ согласуется три следующих фактора: локализация метастазов, количеств присутствующей опухоли и иммунокомпетентность пациента. Противоопухолевая активность БЦЖ была низкой у пациентов с обширным заболеванием или висцеральными метастазами. Результаты показали, что был обнаружен 31% пациентов с внутрикожными метастазами, не имеющими рецидива заболевания в течение периода, составляющего вплоть до 6 лет после начала иммунотерапии.
Иммунотерапия, описанная Grant с соавторами, состоит в применении ВЕС2 (идиотипического антитела, имитирующего ганглиозид GD3, присутствующий на поверхности большинства опухолей мелкоклеточного рака легкого) в комбинации с БЦЖ (Grant SC, Kris MG, Houghton AN, Chapman PB (1999). "Long Survival of Patients with Small Cell Lung Cancer after Adjuvant Treatment with the Anti-Idiotypic Antibody BEC2 Plus Bacillus Calmette-Gue". Clinicai Cancer Research, Vol. 5, 1319-1323).
Применяемая доза у пациентов с раком легкого составляла 2,5 мг в течение периода, превышающего 10 недель. Пациенты, которых лечили иммунотерапией, имели значительное повышение выживаемости и выживаемости в отсутствие рецидивов заболевания по сравнению с подобной группой пациентов.
Popiela с соавторами оценивали применение иммунотерапии БЦЖ и химиотерапии ФАМ (5-фторурацил, адриамицин, митомицин С) у пациентов с раком желудочно-кишечного тракта (ЖКТ) стадии III или IV, которые ранее проходили лечебную гастроэктомию этого рака (Popiela Т, Kulig J, Czupryna A, Sczepanik AM, Zembala M (2004). "Efficiency of adjuvant immunochemotherapy following curative resection in patientes with locally advanced gastric cancer". Gastric cancer, 7: 240-245). Пациентов случайным образом делили на 3 группы: БЦЖ=ФАМ, ФАМ и контроль (только операция). Вводили дозу иммунотерапии БЦЖ, составляющую 2-4 жизнеспособных единицы на дозу. В группе иммунотерапии в целом наблюдали 10-летнюю выживаемость, составляющую 47,1%. Powles с соавторами описано исследование, в котором пациентов с острым миелоидным лейкозом лечили БЦЖ и мертвыми аллогенными опухолевыми клетками. Дозу БЦЖ оценивали как составляющую приблизительно 106 организмов (RL Powles, PJ Selby, DR Jones, JA Russel, HG Prentice, et. al (1977). "Maintenance of remission in acute myelogenous leukemia by a mixture of B.C.G. and irradiated leukemia cells". The Lancet, 1107-1110). Улучшение наблюдали у пациентов, в которых показана ремиссия в течение периода, что привело к выводу, что иммунотерапия комбинацией опухолевых клеток лейкоза и БЦЖ может быть эффективна для продления ремиссии. Vuvan с соавторами также описали применение иммунотерапии БЦЖ у пациентов с острым нелимфоцитарным лейкозом (Н. Vuvan, D. Fiere, М. Doillon, С. Martin, В. Coiffier, et. al (1978). "BCG Therapy in Acute Non Lymphoid Leukaemias". Scand J Haematol 21, 40-46). Было проведено рандомизированное исследование, при котором пациентов делили на 2 группы: одну лечили только химиотерапией, и вторую лечили химиотерапией и БЦЖ, причем, БЦЖ вводили во время перерыва циклов химиотерапии в дозах, составляющих 6×108 жизнеспособных единиц. Результаты показали, что пациенты, получающие иммунотерапию, имеют более высокую выживаемость по сравнению с группой, получающей только химиотерапию. Кроме того, наблюдали, что БЦЖ, по-видимому, более эффективна у пациентов старше 40 лет.
Наконец, Hsueh с соавторами применяли терапевтическую вакцину, состоящую из клеток меланомы, называемую канваксином (Hsueh ED, Essner R, Foshag LJ, Ollila DW, Gammon G, et al (2002). "Prolonged Survival After Complete Resection of Disseminated Melanoma and Active Immunotherapy with a Therapeutic

Тем не менее, в упомянутых выше исследованиях, в которых применяли БЦЖ, хотя в них применяют иммуностимулирующий агент отдельно от этиологического фактора заболевания или расстройства, чтобы вызвать желаемые эффекты у пациента, в комбинации или не в комбинации с другими лечебными процедурами и терапиями, как предложено в настоящем изобретении, не использовано преимущество, состоящее в применении множественных антигенных компонентов, связанных с отдельными патогенными молекулярными паттернами, в частности, комбинации, представляющей собой внутриклеточные и внеклеточные бактерии, вирусы, паразиты, грибы и дрожжи. Упомянутые выше группы исследователей и исследователи применяли только БЦЖ, выполняющий простую функцию адъюванта, не учитывая основу настоящего изобретения, нацеленного на активацию клеток памяти или девственных клеток, которые могут быть инактивированы в различных тканях организма посредством широкого ряда патоген-ассоциированных молекулярных паттернов, которые могут обеспечить наибольшее возможное число клеток памяти и эффекторных клеток. Если данная комбинация отдельных антигенных неспецифических агентов, способных стимулировать врожденный и специфичный иммунитет, как описано, не презентирована, многие популяции иммунных клеток памяти, согласно приведенным аргументам, перестают стимулироваться, что не приводит к повторной контекстуализации, восстановлению и перепрограммированию иммунного ответа столь же эффективно, как при ее презентации.
На уровне техники никогда не была раскрыта важность протоколов иммунизации и локальных и дистальных применений иммуностимулирующих агентов, и не было раскрыто, насколько необходимо множество применений в различных частях организма для программированного и прицельного пути, вызывающего достижение молекулярными паттернами, представляющими собой ПАМП и DAMP, тканей, удерживающих АПК, имеющих адекватное количество и качество, чтобы вызвать оптимальный ответ и поляризацию.
Tanaka с соавторами (Tanaka N., Gouchi A. Ohara Т., Mannami Т., Konaga Е., Fuchimoto S., Okamura S., Sato K., Orita K (1994). "Intratumoral injection of a streptococcal preparation, OK-432, before sugery for gastric







Aftergut с соавторами (Kent Aftergut, MD, Mary Curry, MD, Jack Cohen, DO (2005). "


Engelhardt с соавторами (Engelhardt R, Mackensen A, Galanos С (1991). "Phase I Trial of Intravenously Administered Endotoxin (Salmonella abortus equi) in


Как можно наблюдать на примерах предшествующего уровня техники, описанных Aftergut (Kent Aftergut, MD, Mary Curry, MD, Jack Cohen, DO (2005). "Candida Antigen in the Treatment of Basal Cell Carcinoma". Dermatol Surg, 31: 16-18), Miles (Miles D, Towlson KE, Graham R, Reddish M, Longenecker BM, et al (1996). "A randomised phase II study of sialyl-Tn and Detox-B adjuvant with or without cyclophosphamide pretreatment of the active specific immunotherapy of breast





William В. Coley был первооткрывателем в исследовании, связанном с применением иммунотерапии у пациентов с раком (Edward F. McCarthy, MD. "The Toxins of Willian B. Coley and the treatment of bone and soft-tissue sarcomas". The Iowa Orthopaedic Journal, v. 26, p: 154-157). В исследованиях, проведенных Coley, описано успешное применение Streptococcus вместе с Serratia marcescens (Coley Toxin) при лечении саркомы мягкой ткани, а также отмечено, что такая иммунотерапия была не настолько эффективна при лечении других раков, таких как меланомы и саркомы. Поскольку эти исследования были проведены более столетия назад, и современная медицина относительно пренебрегла ими (поскольку весьма сосредоточена на получении единого лекарственного средства для заболеваний), их основные концепции и возможности не изучены и не прояснены. Coley в его композиции применял только два бактериальных компонента и не исследовали способ применения и все возможные модуляции иммунной системы, как описано в данном изобретении. Hayashi et al смогли дополнительно продвинуть понимание важности иммунной системы, а также объединили два антигенных компонента, но эти концепции еще не исследованы в полном объеме. В данной работе Hayashi et al оценивали эффект значимости лимфатических узлов при лечении пациентов с раком яичника цитоскелетом Mycobacterium bovis, ассоциированным с бациллой Кальметта и Гирена (BCG-CWS) ((Hayashi A, Nishida Y, Yoshii S, Kim SY, Uda H, Hamasaki T (2009). "Immunotherapy of ovarian cancer with cell wall skeleton of Mycobacterium bovis Bacillus

Согласно существующим знаниям в данной области техники, существуют две жизненно важных роли иммунной системы для борьбы с заболеваниями, но немногие технологии способны эффективно стимулировать и модулировать эту систему для лучшей борьбы с заболеванием, когда оно уже установлено.
Кроме того, примечательно, что лечение инфекций и новообразований, в противоположность тому, что проповедуется и принято в наши дни, всегда поддерживается иммунной системой. Антибиотики, антибактериальные и противораковые лекарственные средства действуют, прежде всего, как важный стимулятор и часто незаменимы для лечения инфекций. Иными словами, антибиотики сами по себе не достигают излечения заболевания, но способствуют процессу лечения, осуществляемому иммунной системой, и стимулируют его. Антибиотики действуют в этом отношении как агенты, смещающие биологическое равновесие в пользу инфицированного организма, чтобы ингибировать, устранить или разрушить часть бактерий "in vivo" посредством их специфического действия, что дает возможность более быстрого и эффективного действия иммунной системы. Тем не менее, не существует работы in vivo, показывающей устранение микроорганизмов под действием антибактериальных средств.
При данном новом научном предположении необходимо разработать иммуномодулирующие агенты, иммуногенные композиции и способы лечения, способные к выбору агентов, дающих возможность для индукции врожденного иммунного ответа в реальном времени, который будет повторно контекстуализировать, перепрограммировать и восстанавливать иммунную систему для нового специфичного адаптивного ответа, эффективного для заболевания, подлежащего лечению, посредством правильного презентирования патогенных антигенов АПК, которые посредством клеток памяти и девственных клеток иммунной системы будут эффективно бороться с инфекционными заболеваниями и другими заболеваниями, присутствующими у данного пациента. Таким образом, без необходимости в получении и введении специфичного антигена для установленного заболевания, используя соответствующие механизмы иммунной системы после ее повторной контекстуализации, перепрограммирования, восстановления, возможно индуцированного иммуномодуляторными агентами, причем, иммунные ответы, достигающие скорости и эффективности, эквивалентным скорости и эффективности иммунных ответов, запускаемых повторными инвазиями того же патогена, который был ранее запомнен иммунной системой.
Таким образом, новые иммуномодуляторные агенты, иммуногенные композиции и способы лечения должны сдвинуть равновесие биологической и антибактериальной химиотерапии при всех злокачественных опухолях, инфекциях и инвазиях. Данный новый терапевтический подход, который объединил бы современное применение иммунотерапии с современными антибиотиками, и при инфекционных процессах любого рода и при паразитарных инфекциях повысил шансы лечения, может резко снизить заболеваемость и смертность от этих заболеваний по сравнению с терапиями, в которых учитывается функция только антибактериальных агентов и химиотерапии.
ЦЕЛИ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения состоит в разработке иммуногенных композиций для модуляции иммунной системы, содержащих терапевтически эффективное количество двух или более иммуноактивных антигенных агентов, представляющих собой патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP), один или более физиологически приемлемых носителей, наполнителей, разбавителей или растворителей.
В частности, цель настоящего изобретения состоит в разработке иммуногенных композиций для модуляции иммунной системы, содержащих антигенные агенты, обладающие иммуноактивными патоген-ассоциированными молекулярными паттернами (ПАМП) и/или молекулярными паттернами, ассоциированными с опасностью (DAMP), выбранные из группы, состоящей из следующих агентов: (А) антигенных агентов с молекулярными паттернами, ассоциированными с бактериями; (В) антигенных агентов с молекулярными паттернами, ассоциированными с вирусами; (С) антигенных агентов с молекулярными паттернами, ассоциированными с грибами и дрожжами; (D) антигенных агентов с молекулярными паттернами, ассоциированными с простейшими; (Е) антигенных агентов с молекулярными паттернами, ассоциированными с многоклеточными паразитами/или (F) антигенных агентов с молекулярными паттернами, ассоциированными с прионами.
Другая цель изобретения состоит в разработке применения этих иммунологических композиций для получения лекарственных средств предотвращения и/или лечения инфекционных заболеваний, аутоиммунных заболеваний, аллергических заболеваний, воспаления, артрита, воспалительных заболеваний, отторжения трансплантата, заболеваний, вызванных сосудистыми расстройствами, заболеваний, вызванных геморрагическими или ишемическими сердечно-сосудистыми осложнениями, ишемии, инфаркта и кровотечения, приводящего к деструкции тканей, сердечного, почечного, респираторного или печеночного заболевания, рака, опухолей, а также злокачественных и доброкачественных повреждений.
Настоящее изобретение также направлено на разработку способов предотвращения или лечения инфекционных заболеваний, аутоиммунных заболеваний, аллергических заболеваний, воспаления, артрита, воспалительных заболеваний, отторжения трансплантата, заболеваний, вызванных сосудистыми расстройствами, заболеваний, вызванных геморрагическими или ишемическими сердечно-сосудистыми осложнениями, ишемии, инфаркта и кровотечения, приводящего к деструкции тканей, сердечного, почечного, респираторного или печеночного заболевания, рака, опухолей, а также злокачественных и доброкачественных повреждений у животных, более конкретно у людей.
Настоящее изобретение также направлено на разработку способов индукции клеточной репарации, тканевой регенерации, регенерации органов и регенерации систем органов, таких как система кровообращения, нервная система и эндокринная система.
Наконец, настоящее изобретение направлено на разработку способов восстановления иммунного ответа у животных, в частности, у людей.
ОПРЕДЕЛЕНИЯ
В контексте данной заявки на патент несколько раз использованы сокращения, и их определения в соответствии с их использованием в данной заявке суммированы ниже:
- БЦЖ относится к аттенуированной Mycobacterium bovis, бацилле Кальметта и Гирена;
- DAMP относится к молекулярным паттернам, ассоциированным с опасностью;
- DECA относится к композиции, раскрытой в Примере 1 настоящей заявки на патент;
GM-CSF относится к гранулоцитарно-макрофагальному колониестимулирующему фактору (от англ. "Granulocyte macrophage colony-stimulating factor");
- ИЛ12 относится к интерлейкину-12;
- ИЛ15 относится к интерлейкину-15;
- ИЛ-2 относится к интерлейкину-2;
- ИЛ-21 относится к интерлейкину-21;
- ИЛ4 относится к интерлейкину-4;
- ИЛ5 относится к интерлейкину-5;
- ИЛ7 относится к интерлейкину-7;
- ПАМП относится к патоген-ассоциированным молекулярным паттернам.
- БОЕ: бляшкообразующие единицы.
- PPD относится к производному очищенного белка (от англ. "purified protein derivative") М. tuberculosis;
- PPD относится к фракции очищенного белкового экстракта культуры бациллы Коха (от англ. "Purified Protein Derivative"). PPD является основным антигеном Mycobacterium tuberculosis;
- TDCI50 представляет собой единицу для количественного определения вирусных частиц, и представляет собой инфекционную дозу в 50% клеток в тканевой культуре;
- Туберкулин Коха относится к инактивированному лизату Mycobacterium bovis;
- Единицы Lf или "единицы флокуляции Limes" представляют собой международную единицу для количественного определения антигена в токсоидных вакцинах, принятых Всемирной Организацией Здравоохранения;
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Приведенные ниже графические материалы составляют часть данной работы и включены для иллюстрации определенных аспектов данного изобретения. Объект настоящего изобретения может быть лучше понят со ссылкой на один или более этих графических материалов в сочетании с подробным описанием предпочтительной формы осуществления, представленной в данной работе.
- На фиг. 1 показано действие обработки DECA, DECA + ИЛ-2 на рост опухоли in vivo. Клетки меланомы мыши (B16F10) инокулировали на сутки ноль (1×106, 100 мкг/животное) подкожно (s.c.) на спину самцов мышей С57В16. Объем опухоли (А) (в мм3) измеряли каждые трое суток с помощью штангенциркуля с цифровой индикацией. Вычисленный процент (В) увеличения объема каждой опухоли получали на 7е сутки. Результаты выражали в виде среднего ± стандартная ошибка среднего (SEM; от англ. "Standard Error of Mean"). *p менее 0,05 представляет статистически значимое различие по сравнению с контрольной группой (односторонний критерий ANOVA, апостериорный: критерий Даннетта). n=9-10 животных.
- На фиг. 2 показано действие обработки DECA, DECA + ИЛ-2 на выживаемость животных, инокулированных клетками меланомы мыши. Клетки меланомы мыши (B16F10) инокулировали на сутки ноль (1×106, 100 мкг/животное) подкожно (s.c.) на спину самцов мышей С57В16. График представляет собой кривую смертности, и процент представляет собой процент животных, оставшихся живыми на 30е сутки после инокуляции опухоли, n=9-10 животных. *p, 0,05 (p=0,0361), Статистический анализ: Логарифмический ранговый критерий - Хи-квадрат.
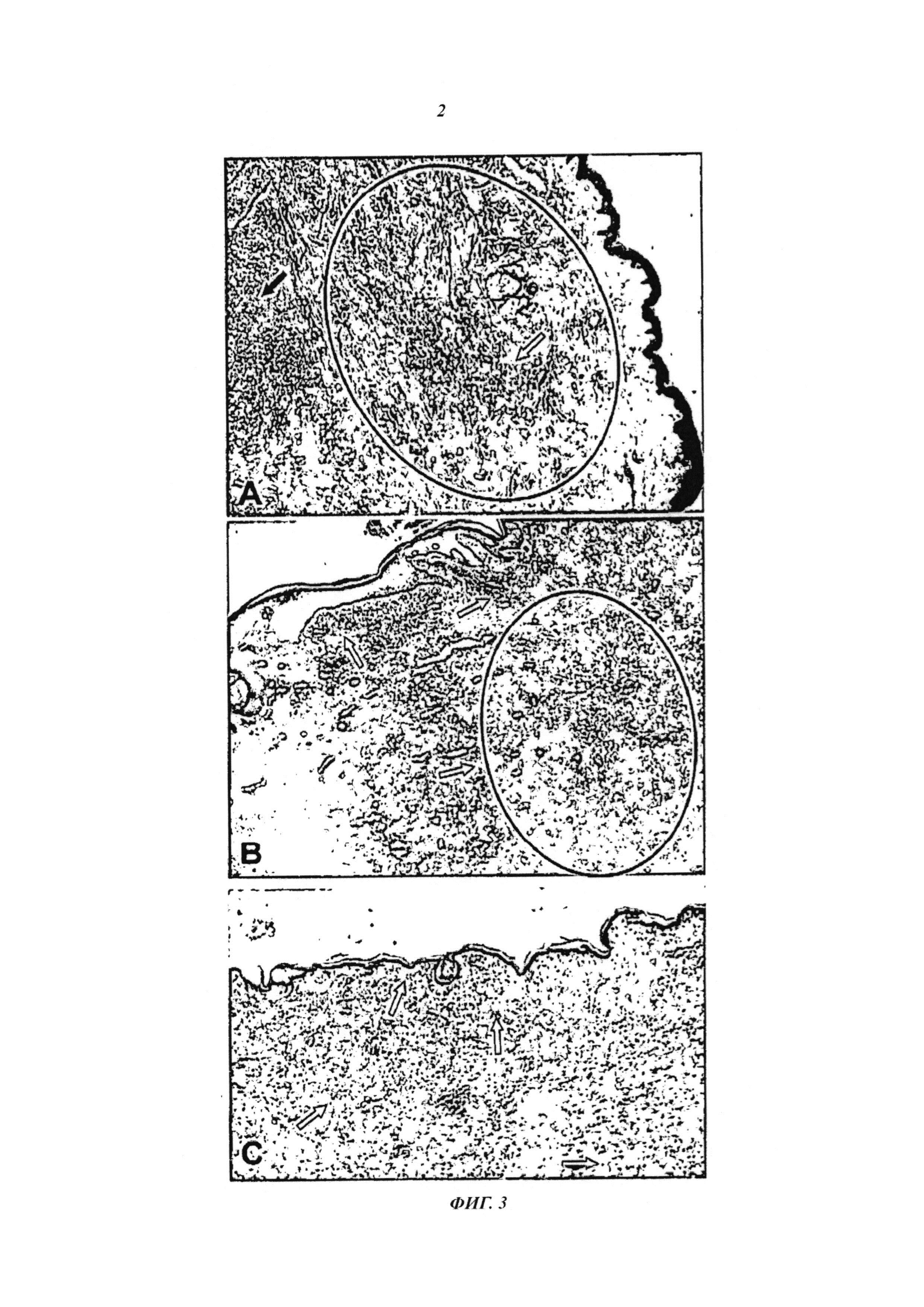
- На фиг. 3 показаны патологоанатомические исследования волонтера "MBS". А. Исследование лечения, предшествующего иммунотерапии, черной стрелкой указана область опухоли, а белой стрелкой - отсутствие воспалительного инфильтрата. Область, выделенная черным цветом, иллюстрирует ингибирование иммунной системы опухолью, обнаруженное на основании отсутствия воспалительного инфильтрата. В. Исследование после иммунологической терапии, где можно наблюдать полное устранение опухоли, белыми стрелками указан плотный воспалительный инфильтрат, и область, заключенная в черный цвет, показывает примеры областей фиброза и репарационных изменений, в которые проникают воспалительные инфильтраты. С. Реконтекстуализация иммунной системы применением по настоящему изобретению, остановленная положительной реакцией на S-100 в бесчисленных интраэпидермальных дендритных клетках (указаны стрелками) и в окружении кожного воспалительного инфильтрата, распространяющегося в глубокую дерму, при отсутствии меланоцитов или остаточной меланомы.
- На фиг. 4 показаны патологоанатомические исследования волонтера "РРС". А. Исследование лечения, предшествующего иммунотерапии, показывающее область агрессивной метастатической меланомы с несколькими пигментированными клетками и едва заметный и слабый воспалительный периферический инфильтрат, указанный стрелкой, подтверждающий ингибирование иммунной системы опухолью. В. Исследование после иммунотерапии, иллюстрирующее исчезновение опухоли и вытеснение ее интенсивным и плотным воспалительным инфильтратом. С. Реконтекстуализация иммунной системы лечением по настоящему изобретению, остановленная положительной реакцией на S-100 в бесчисленных интраэпидермальных дендритных клетках (указаны стрелками) и в окружении кожного воспалительного инфильтрата, распространяющегося в глубокую дерму, при отсутствии остаточной меланомы.
- На фиг. 5 показаны ядерно-магнитно-резонансные исследования (А1, А2 и A3 после лечения, предшествующего иммунологическому, 30/07/2008) и сканирование с помощью компьютерной томографии (КТ-сканирование) (В1, В2, В3 после лечения 13/05/2009, С1 и С3 после лечения 30/08/2011 и С2 после лечения 13/04/2010) пациента R-М. А1. Канцероматоз, показывающий уплотнение жира (стрелка). А2. Кластер лимфатических узлов чревного ствола (стрелка; наибольшее измерение 3,7 см). A3. Кластер лимфатических узлов печеночно-желудочной связки, измерение 4 см (стрелка). В1. Исчезновение канцероматоза, показано исчезновение уплотнения жира (стрелка). В2. Сокращение самого крупного узла (от 3,7 см до 1,4 см) в кластере лимфатических узлов чревного ствола (стрелка). В3. Исчезновение кластера лимфатических узлов печеночно-желудочной связки (стрелка). С1. Исчезновение концероматоз (стрелка). С2. Сокращение самого крупного лимфатического узла (от 1,4 см до 1,1 см) в кластере лимфатических узлов чревного ствола (стрелка). С3. Подтверждение исчезновения кластера лимфатических узлов печеночно-желудочной связки (стрелка). Эти данные показывают полную ремиссию злокачественного канцероматоза брюшины и диссеминации лимфатических узлов рака желудка при комбинации иммунотерапии по настоящему изобретению в сочетании с паллиативной радио- и химиотерапией.
- На фиг. 6 показаны исследования КТ-сканирований грудной клетки и брюшной полости волонтера A-D. А. Исследование лечения, предшествующего иммунотерапии, проведенное 09/10/2006, идентифицирующее опухоли в областях, указанных кружками. В. Исследование после иммунотерапии 11/12/2006, свидетельствующее об отсутствии этих опухолей в проанализированных областях.
- На фиг. 7 показаны тесты сывороточных уровней простатического специфического антигена (ПСА) у пациента О-S. Первая точка относится к остаточному значению маркера, указывающего на присутствие остаточных опухолевых клеток после инкурабельного заболевания, которые при иммунологическом лечении становятся необнаружимыми (нанесены на график как ноль) за 4 недели. Эти данные в значительной степени позволяют предположить, что иммунотерапевтическое лечение, при условии, что оно представляло собой терапию единым лекарственным средством, принятое в ожидании начала лучевой терапии, было эффективным при полной ремиссии опухоли и местно-регионарному устранению опухоли, поскольку современное состояние уровня техники не дает возможности отличать полное устранение массы опухоли при минимальном остаточном заболевании.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Описание иммуногенных композиций
Настоящее изобретение относится к иммуногенным композициям для модуляции иммунной системы, содержащим терапевтически эффективное количество двух или более антигенных иммуноактивных агентов, презентирующих патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP), и один или более физиологически приемлемых носителей, наполнителей, разбавителей или растворителей.
Предпочтительно композиции по настоящему изобретению содержат иммуноактивные антигенные агенты, презентирующие патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP), выбранные из группы, состоящей из следующих агентов: (А) антигенных агентов с молекулярными паттернами, ассоциированными с бактериями; (В) антигенных агентов с молекулярными паттернами, ассоциированными с вирусами; (С) антигенных агентов с молекулярными паттернами, ассоциированными с грибами и дрожжами; (D) антигенных агентов с молекулярными паттернами, ассоциированными с простейшими; (Е) антигенных агентов с молекулярными паттернами, ассоциированными с многоклеточными паразитами/или (F) антигенных агентов с молекулярными паттернами, ассоциированными с прионами.
Еще более предпочтительно композиции по данному изобретению включают патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP), выбранные из по меньшей мере трех категорий (А), (В), (С), (D), (Е) и (F), описанных выше.
Еще более предпочтительно композиции по данному изобретению включают патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP), выбранные из по меньшей мере четырех категорий (А), (В), (С), (D), (Е) и (F), описанных выше.
Антигенные агенты по настоящему изобретению, которые могут быть выбраны из эпитопов, генетических материалов, липидов, полисахаридов и/или иммуноактивных белков по настоящему изобретению, могут быть получены путем очистки из изолированных фрагментов материала, существующего в природе, или фракций, выделенных из растения, животного или микробиологических экстрактов, либо их можно продуцировать путем генетической рекомбинации, и предпочтительно они имеют происхождение из штаммов вирусов, грибов, паразитов или бактерий, а также прионов.
Таким образом, антигенные агенты по настоящему изобретению с молекулярными паттернами, ассоциированными с бактериями, по настоящему изобретению могут быть выбраны, но не ограничены ими, из антигенных агентов с молекулярными паттернами, ассоциированными с бактериями следующих родов: Staphylococcus, Streptococcus, Enterococcus, Corynebacterium, Bacillus, Listeria, Clostridium, Mycobacterium, Actinomyces, Nocardia, Escherichia, Proteus, Klebsiella, Serratia, Enterobacter, Salmonella, Shigella, Pseudomonas, Burkholderia, Stenotrophomonas, Acinetobacter, Vibrio, Campylobacter, Helicobacter, Bacteroides, Neisseria, Moraxella, Haemophilus, Bordetella, Brucella, Francisella, Pasteurella, Yersinia, Legionella, Gardnerella, Treponema, Leptospira, Borrelia, Mycoplasma, Rickettsial и Chlamydia.
Антигенные агенты с молекулярными паттернами, ассоциированными с вирусом, по настоящему изобретению могут быть выбраны, но не ограничены ими, из антигенных агентов с молекулярными паттернами, ассоциированными со следующими семействами вирусов: Adenoviridae, Arenaviridae, Bunyaviridae, Coronaviridae, Filoviridae, Flaviviridae, Hepadnaviridae, Deltavirus, Caliciviridae, Herpesviridae, Orthomyxoviridae, Papovaviridae, Paramyxoviridae, Parvoviridae, Picornaviridae, Poxyviridae, Reoviridae, Retroviridae, Rhabdoviridae и Togaviridae.
Антигенные агенты с молекулярными паттернами, ассоциированными с грибами и дрожжами, по настоящему изобретению могут быть выбраны, но не ограничены ими, из антигенных агентов с молекулярными паттернами, ассоциированными с грибами и дрожжами следующих родов: Sporothrix, Aspergillus, Blastomyces, Candida, Coccidioides, Cryptococcus, Histoplasma и Pneumocystis.
Антигенные агенты с молекулярными паттернами, ассоциированными с простейшими, по настоящему изобретению могут быть выбраны, но не ограничены ими, из антигенных агентов с молекулярными паттернами, ассоциированными с простейшими следующих родов: Cryptosporidium, Ciclospora, Entamoeba, Naegleria, Giardia, Leishmania, Plasmodium, Toxoplasma, Trichomonas, Trypanosoma, Microsporidia и Isospora.
Антигенные агенты с молекулярными паттернами, ассоциированными с многоклеточными паразитами, по настоящему изобретению могут быть выбраны, но не ограничены ими, из антигенных агентов с молекулярными паттернами, ассоциированными со следующими многоклеточными паразитами: трематодами, цестодами и нематодами.
Антигенные агенты по настоящему изобретению включают молекулы белка, полисахарида, липида и/или композитные синтетические молекулы, имитирующие молекулы белка, полисахарида и/или липида.
Более конкретно агенты по изобретению включают антигенные молекулы иммуноактивного белка, обладающего ферментативной активностью, например, киназ, фосфатаз, стрептокиназ, стрептодорназ и дезоксирибонуклеаз (например, дорназ).
Иммуногенные композиции для модуляции иммунной системы по настоящему изобретению содержат от 0,001 до 500 микрограммов на мл каждого иммуногенного агента.
Такие иммуногенные агенты могут быть инкапсулированы в капсулах, микрочастицах, наночастицах, таблетках с покрытием, липосомах.
В частности, иммуногенные композиции для модуляции иммунной системы по настоящему изобретению содержат от 4 до 20 антигенных агентов, выбранных из группы, состоящей из антигенов, имеющих происхождение от следующих агентов: дорназы, леведурина, оидиомицина, PPD, прионов, стрептокиназы, стрептококкового токсоида, дифтерийного токсоида, столбнячного токсоида, туберкулина Коха, инактивированного лизата Ascaris lumbricoides, Aspergillus spp., Aspergillus flavus, Aspergillus fumigatus, Aspergillus terreus, Candida spp., Candida albicans, Candida glabrata, Candida parapsilosis, Chlamydia spp., Chlamydia pneumoniae, Chlamydia psittaci, Chlamydia trachomatis, Cryptosporidium spp., Dermatophytes, Entamoeba hystolitica, Enterobius vermicularis, Enterococcus faecalis, Epidermophyton floccosum, Escherichia coli, Giardia lamblia, Haemophilus influenzae, Microsporum cannis, Mycobacterium spp., Mycobacterium bovis, Mycobacterium leprae, Mycobacterium tuberculosis, Neisseria gonorrhoeae, вируса папилломы человека, полиовируса, Proteus spp., Proteus mirabilis, Proteus penerii, Proteus vulgaris, Salmonella spp., Salmonella bongori, Salmonella enterica, Serratia spp., Serratia liquefaciens, Serratia marcencens, Shigella spp., Shigella flexneri, Shigella sonnei, Staphylococcus spp., Staphylococcus aureus, Staphylococcus epidermidis, Strongyloides stercoralis, Streptococcus spp., Streptococcus bovis, Streptococcus viridans, Streptococcus equinus, Streptococcus pneumoniae, Streptococcus pyogenes, Toxoplasma gondii, Trichomonas vaginalis, трихофитина, Trichophyton spp., Trichophyton rubrum, Trichophyton tonsurans, Trichophyton mentagrophytes, вируса желтой лихорадки, вируса гепатита В, вируса краснухи, вируса ветряной оспы, вируса оспы, вируса эпидемического паротита, вируса кори, вируса герпеса и вируса осповакцины или синтетических аналогов, презентирующих патоген-ассоциированные молекулярные паттерны (ПАМП) и/или молекулярные паттерны, ассоциированные с опасностью (DAMP), ассоциированные с этими антигенными агентами.
Предпочтительная иммуногенная композиция по изобретению содержит инактивированный лизат Mycobacterium bovis, производное очищенного белка М. tuberculosis, инактивированный лизат Staphylococcus aureus, инактивированный лизат Staphylococcus epidermidis, инактивированный лизат Steptococcus pyogenes, инактивированный лизат Streptococcus pneumonia, инактивированный лизат Enterococcus faecalis, стрептокиназу/дорназу, инактивированный лизат Candida albicans, инактивированный лизат Candida glabrata, инактивированный лизат Epidermophyton floccosum, инактивированный лизат Microsporum cannis, инактивированный лизат Trichophyton mentagrophytes группы interdigitale, инактивированный лизат энтеропатогенной Escherichia coli, инактивированный лизат Salmonella bongori, инактивированный лизат Salmonella enterica и инактивированный лизат Salmonella subterranea.
Предпочтительная иммуногенная композиция по изобретению содержит от 0,001 до 1 нг/мл инактивированного лизата Mycobacterium bovis, от 0,001 до 1 нг/мл производного очищенного белка М. Tuberculosis, от 0,1 до 100 мкг/мл инактивированного лизата Staphylococcus aureus, от 0,1 до 100 мкг/мл инактивированного лизата Staphylococcus epidermidis; от 0,1 до 100 мкг/мл инактивированного лизата Steptococcus pyogenes; от 0,1 до 100 мкг/мл инактивированного лизата Streptococcus pneumonia; от 0,1 до 100 мкг/мл инактивированного лизата Enterococcus faecalis, от 0,01 до 10 мкг/мл стрептокиназы, от 0,01 до 10 мкг/мл дорназы; от 0,1 до 100 мкг/мл инактивированного лизата Candida albicans; от 0,1 до 100 мкг/мл инактивированного лизата Candida glabrata, от 0,1 до 100 мкг/мл инактивированного лизата Epidermophyton floccosum; от 0,1 до 100 мкг/мл инактивированного лизата Microsporum cannis, от 0,1 до 100 мкг/мл инактивированного лизата Trichophyton mentagrophytes группы interdigitale; от 0,1 до 100 мкг/мл инактивированного лизата энтеропатогенной Escherichia coli; от 0,1 до 100 мкг/мл инактивированного лизата Salmonella bongori, от 0,1 до 100 мкг/мл инактивированного лизата Salmonella enterica и от 0,1 до 100 мкг/мл инактивированного лизата Salmonella subterranea.
Дополнительно, чтобы повысить, снизить или поляризовать иммунный ответ в зависимости от цели иммунотерапии, антигенная композиция по настоящему изобретению может содержать цитокины и/или хемокины, такие как GM-CSF, ИЛ4, ИЛ5, ИЛ7, ИЛ12, ИЛ15, ИЛ-21, интерферон, и наиболее предпочтительно ИЛ-2.
Композиции по настоящему изобретению могут дополнительно содержать наполнители, такие как бактерицидные средства, бактериостатики, антиоксиданты, консерванты, буферы, стабилизаторы, регуляторы рН, регуляторы осмолярности, пеногасители и сурфактанты, и агенты, инактивирующие остаточный антиген или фракционирующие агенты, компоненты ростовой среды и растворители, обычно применяемые при продуцировании вакцин и иммунотерапевтических агентов.
Композиции по настоящему изобретению могут представлять собой твердое вещество, жидкость или гель. Как используют в данной работе, применение термина "фармацевтически приемлемый носитель" означает нетоксичный твердый, инертный, полужидкий, жидкий наполнитель, разбавитель, вспомогательный препарат любого типа или просто стерильный водный раствор, например, физиологический раствор. Некоторыми примерами материалов, которые могут служить в качестве фармацевтически приемлемых носителей, являются сахара, такие как лактоза, глюкоза и сахароза, крахмалы, такие как кукурузный крахмал и картофельный крахмал, целлюлоза и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетат целлюлозы, циклодекстрин; масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло, гликоли, такие как пропиленгликоль, полиолы, такие как глицерин, сорбит, маннит, и полиэтиленовые эфиры, такие как этиллаурат, этилолеат, агар, буферные агенты, такие как гидроксид алюминия и гидроксид магния, альгиновая кислота, апирогенная вода, изотонический физиологический раствор, раствор Рингера, буферные растворы этилового спирта и фосфата, а также другие нетоксичные совместимые вещества, применяемые в фармацевтических препаратах.
Для иммунотерапевтических композиций и вакцин, описанных в данной работе, для животных и людей доступен ряд путей введения. Конкретный выбранный режим зависит от выбранных антигенных агентов, от дозировки, необходимой для терапевтической эффективности, и от пациента, которому вводят композицию. Способы по настоящему изобретению можно, как правило, осуществлять на практике, используя любой биологически приемлемый режим введения, то есть любые средства, создающие эффективные уровни иммунного ответа, не вызывая клинически вредных реакций. Такие режимы введения включают внутрикожное, пероральное, ректальное, подъязычное, местное, назальное, чрескожное или парентеральное введение. Термин "парентеральный" включает подкожный, внутривенный, эпидуральный, ирригацию, внутримышечный, насосы растормаживания или инфузию. В частности, в данном изобретении для введения композиций, заявленных в данной работе, предпочтительно следующее введение: пероральное, внутрикожное, парентеральное, подкожное, внутривенное, внутримышечное, а также введение через слизистую оболочку носа и/или пероральное введение.
Для парентерального введения активные ингредиенты можно также растворять в фармацевтическом носителе и вводить в виде раствора, эмульсии, включая микро- и наноэмульсии, или суспензии. Примерами подходящих носителей являются следующие вещества: вода, физиологический раствор, растворы декстрозы, растворы фруктозы или масла животного, растительного или синтетического происхождения. Другие растворители могут также содержать другие ингредиенты, например, консерванты, суспендирующие агенты, солюбилизирующие агенты, буферы и тому подобное.
Свойства иммуногенных композиций по настоящему изобретению
Иммуногенные композиции по настоящему изобретению обладают неожиданным действием на иммунный ответ.Как видно в приведенных ниже Примерах, иммуногенные композиции по настоящему изобретению проявляют неожиданный технический эффект, вызывая иммунный ответ, в который вовлечены следующие события: реконтекстуализация, восстановление и перепрограммирование иммунного ответа в реальном времени.
Более конкретно иммунотерапевтические композиции по настоящему изобретению способны провоцировать реконтекстуализацию способности иммунной системы к оперативному действию путем изменения соотношения сил против агрессоров в ее пользу, давая иммунной системе конкурентное преимущество, чего не происходит спонтанно при развитии заболевания. Данная реконтекстуализация определяет последующее восстановление и перепрограммирование установившегося иммунного ответа, либо установившегося в начальной стадии развития, либо установившегося неправильно, ошибочно атакуя дизавтономным путем организм человека или животного, его поляризацию до соответствующего первичного или вторичного, активного или ингибиторного, более эффективного иммунного ответа.
Данный эффект осуществляется посредством стимуляции, активации и объединенного действия определенных компонентов иммунной системы, таких как сигнальные клетки, антигенпрезентирующие сигнальные клетки и лимфоциты памяти. В частности, композиции по данному изобретению правильно активируют сигнальные клетки, дендритные клетки и другие АПК, создавая такую степень и интенсивность активации CD4 Т и степень и интенсивность активации иммунного профиля, чтобы бороться с инфекцией, инвазией или опухолевым заболеванием.
Соответственно, иммуномодуляторные антигенные композиции по настоящему изобретению, когда они находятся в больших или значительных количествах, запускают адаптивный иммунный ответ, обладающий специфичной активностью, желательной для борьбы с бактериальными, вирусными или паразитарными инфекциями, при борьбе с новообразованиями, раком и опухолями.
Кроме того, лечение иммуногенными композициями по настоящему изобретению способно стимулировать регенеративную способность иммунной системы, обеспечивая последующее действие по устранению инфекционного заболевания и других заболеваний: восстановление клеток и тканей, восстановление функции органа, ослабленной в результате травмы, и повреждения, вызывающего утрату части организма.
Таким образом, иммуногенные композиции по настоящему изобретению способны мобилизовать иммунную систему и приводить к повышенной регенеративной способности организма посредством мобилизации стволовых клеток или активации наборов генов, дающих возможность регенерации клеток и тканей, и могут даже реконструировать органы и их функции, а также могут восстанавливать системы органов, такие как среди прочего сосудистая система, нервная система и эндокринная система.
Как видно в приведенных ниже Примерах, иммуногенные композиции по настоящему изобретению проявляют неожиданный технический эффект реконтекстуализации, восстановления и перепрограммирования иммунного ответа в реальном времени и, следовательно, значимые вероятности излечения по сравнению с лекарственными средствами и методологиями уровня техники.
В первой форме осуществления изобретения определенную концентрацию иммуномодуляторного агента(агентов) применяют для приготовления иммунотерапевтической фармацевтической композиции, способной индуцировать врожденный иммунный ответ, запускающий каскад иммунных событий, включающих активацию лимфоцитов памяти от агента(ов), инокулированного путем вмешательства человека, и одновременную активацию антигенов, присутствующих в собственном организме пациентов, что приводят в результате к реконтекстуализации, восстановлению и перепрограммированию текущего иммунного ответа на конкретное установившееся заболевание (или еще находящееся в фазе установления), эффективно вызывая адаптивный ответ, специфичный для данного заболевания, что дает возможность бороться с патогеном. Как таковое, введение композиции, содержащей агенты по настоящему изобретению, реполяризует или улучшает поляризацию иммунной системы в присутствии заболевания, когда ранее установившаяся поляризация неадекватна, под действием этиологического фактора или колонизатора. Активности агентов по настоящему изобретению влияют на форму, время, точность и поляризацию иммунного ответа, предпочтительно приводя к специфичному врожденному и/или адаптивному ответу, более эффективному для борьбы с заболеванием, что приводит к лучшей реакции самого организма.
Настоящее изобретение обеспечивает путь для борьбы с данными типами гетерологичных (инфекции и инвазии) и аутологичных (новообразований) атак посредством применения раскрытых антигенных комбинаций. Настоящее изобретение также обеспечивает возможность присоединения традиционных терапий к агентам по данному изобретению, способствующего процессу устранения этиологических гетерологичных инвазионных агентов и колонизации аутологичных клеток посредством реального терапевтического потенциала антибактериальных, противораковых и других лекарственных средств, избирательных для патогенов и других инфекционных агентов. Эта возможность предоставляется за счет принципа смещения биологического равновесия в пользу пациента в сочетании с правильной поляризацией иммунного ответа, как описано в данной работе.
Когда иммуностимуляция следует за ситуацией иммунного ответа, после терминации механизма заболевания или агрессии продолжающаяся активация иммунной системы антигенами или иммуномодуляторными агентами по настоящему изобретению посредством активации стволовых клеток приводит к регенерации тканей, органов и систем за счет механизмов, еще не полностью понятных, но связанных с механизмами заживления или восстановления целостности, наблюдаемыми в различных медицинских ситуациях.
Композиции по настоящему изобретению дают возможность рекрутмента максимального числа девственных клеток и клеток памяти индивидуума, производя более значительные эффекты, чем повышение антител, как раскрыто на предшествующем уровне техники. Применение множественных антигенных агентов с достаточно определенными ПАМП и DAMP для имитации различных типов атак, от которых страдает организм, и к которым организм уже имеет иммунологическую память в результате воздействий окружающей среды или программ вакцинации, дает возможность для более широкого рекрутмента клеток памяти и девственных клеток, обеспечивающих реконтекстуализацию иммунного ответа в реальном времени, и, следовательно, эффективно и радикально изменяющих тип иммунного ответа и прогрессирования заболевания или расстройства, поражающего индивидуума, положительным, и в некоторых случаях таким неожиданным путем по сравнению с предшествующим уровнем техники. Кроме того, в настоящем изобретении, в отличие от предшествующего уровня техники, применяют большее количество бактериальных компонентов, среди которых представлены как внутриклеточные, так и внеклеточные бактерии в композиции, помимо компонентов вирусов, паразитов, грибов и дрожжей. Hayashi с соавторами не исследованы более разнообразные композиции для получения потенциально большего эффекта. Способ применения антигенных агентов также отличался, поскольку настоящим изобретением охвачены большие площади организма и тканей, имеющих АПК, и предпочтительно рассмотрено воздействие на положения, близкие к сайтам инфекции, и другие дистальные применения в сайтах заболевания (как в случае расстройств или заболеваний, проявляющихся в конкретных положениях организма). Композиции по настоящему изобретению при применении в соответствии со способом применения по настоящему изобретению в одной или обычно в различных стратегиях областей организма, дренируемых лимфоидными бассейнами, либо в первичных и/или вторичных лимфоидных органах, либо даже внутри повреждения воспринимаются ППР (патоген-ассоциированными паттернраспознающими рецепторами) сигнальных клеток организма.
При первой группе агрессивных состояний или реальной опасности, где иммунная система сразу перегружается, парализуется или преодолевается бактериями, грибами, вирусами, прионами, паразитами или другими микро- или макроорганизмами, одно- или многоклеточными (гетерологичная агрессия), либо доброкачественным или злокачественным новообразованием (аутологичная агрессия), модификацию ее подготовки производят в состоянии активации и мобилизации клеточного и молекулярного аппарата врожденного и адаптивного иммунитета, которые в интегрированном состоянии способны обеспечить обратное развитие ситуации конкурентного преимущества, в которой находится иммунная система и организм.
При второй группе агрессивных состояний, где реальная опасность исходит от самой иммунной системы, то есть когда она атакует организм человека или животного при аутоиммунном или аллергическом заболевании происходит реконтекстуализация иммунной системы, поскольку препарат должен обладать способностью ингибировать данное разрушительное действие. Настоящее изобретение индуцирует подавление состояния активации иммунной системы и демобилизацию эффекторных петель памяти, поддерживающих самоагрессию. Этот эффект достигается за счет мобилизации клеточного и молекулярного аппарата врожденного и адаптивного иммунитета, ответственного за подавление и регуляцию иммунного ответа, и возвращения к равновесию, известному как гомеостаз или норма.
При третьей группе состояний, где иммунная система имеет дело с последствиями тканевых, органных или системных атак в результате множественных причин, гетерологичных или аутологичных, или даже травматических, иммунная система осуществляет действия по репарации повреждения, вызванного этими атаками. В этом случае подготовка или мобилизация иммунной системы происходит посредством мобилизации стволовых клеток из самой иммунной системы или из других клеточных систем, аутологичных, аллогенных или гетерологичных, либо даже посредством активации наборов генов, присутствующих в собственных клетках пациента.
Таким образом, в настоящем изобретении применяют иммуномодуляторные агенты в количествах, концентрациях и определенных положениях, чтобы реконтекстуализировать иммунную систему, активировать или перенаправить механизмы тканевой репарации и регенерации, которые осуществляются во время заживления и регенерации ткани, органа или системы, приводящего к "восстановлению целостности" или восстановления с образованием рубца. Эта репарация обычно запускается по окончании процесса иммунного ответа, после излечения травмы, инфекции, опухолевого заболевания или аутоиммунной или аллергической реакции.
Применение иммуногенных композиций по настоящему изобретению
С учетом свойств иммуногенных композиций по настоящему изобретению они составляют другой аспект настоящего изобретения, представляющий собой применение иммуногенных композиций при получении лекарственных средств для предотвращения и/или лечения инфекционных заболеваний, аутоиммунных заболеваний, аллергических заболеваний, воспаления, артрита, воспалительных заболеваний, отторжения трансплантата, заболеваний, вызванных сосудистыми расстройствами, заболеваний, вызванных геморрагическими или ишемическими сердечно-сосудистыми осложнениями, ишемии, инфаркта и кровотечения, приводящего к деструкции тканей, сердечного, почечного, респираторного или печеночного заболевания, рака, опухолей, а также злокачественных и доброкачественных повреждений.
Иммуногенные композиции по настоящему изобретению также непосредственно применяют при предотвращении и/или лечении инфекционных заболеваний, аутоиммунных заболеваний, аллергических заболеваний, воспаления, артрита, воспалительных заболеваний, отторжения трансплантата, заболеваний, вызванных сосудистыми расстройствами, заболеваний, вызванных геморрагическими или ишемическими сердечно-сосудистыми осложнениями, ишемии, инфаркта и кровотечения, приводящего к деструкции тканей, сердечного, почечного, респираторного или печеночного заболевания, рака, опухолей, а также злокачественных и доброкачественных повреждений.
Эти инфекционные заболевания могут иметь вирусное, бактериальное, грибковое или паразитарное происхождение.
Заболевания вирусного происхождения, которые предотвращают и/или лечат иммуногенными композициями по настоящему изобретению, могут быть вызваны следующими вирусами, но не ограниченными ими: ВИЧ, вирусом гепатита, вирусом герпеса, рабдовирусом, вирусом краснухи, вирусом натуральной оспы, поксвирусом, парамиксовирусом и вирусом кори.
Заболевания бактериального происхождения, которые предотвращают и/или лечат иммуногенными композициями по настоящему изобретению, могут быть вызваны следующими бактериями, но не ограниченными ими: Pneumococcus, Staphylococcus, Bacillus, Streptococcus, Meningococcus, Gonococcus, Escherichia, Klebsiella, Proteus, Pseudomonas, Salmonella, Shigella, Haemophilus, Yersinia, Listeria, Corynebacterium, Vibrio, Clostridia, Chlamydia, Mycobacterium, Treponema и Helicobacter.
Грибковые заболевания, которые предотвращают и/или лечат иммуногенными композициями по настоящему изобретению, могут быть вызваны следующими грибами, но не ограниченными ими: Candida, Aspergillus, Cryptococcus neoformans и/или грибами, вызывающими поверхностный и глубокий микоз. Заболевания, вызванные паразитами, вызваны следующими паразитами: Trypanosoma, Schistosoma, Leishmania, амебой и гельминтами.
Иммуногенные композиции по настоящему изобретению также применяют при предотвращении и/или лечении среди прочего следующих заболеваний: эритематоза и локализованной волчанки, ревматоидного артрита, узлового полиартериита, полимиозита и прогрессирующего дерматомиозита, прогрессирующего системного склероза, диффузной склеродермы, гломерулонефрита, тяжелой миастении, синдрома Шегрена, зоба Хасимото, болезни Грейвса, адреналита, гипопаратиреоза, пернициозной анемии, диабета, рассеянного склероза, демиелинизирующих заболеваний, увеита, обыкновенной пузырчатки, пемфигоидного цирроза, неспецифического язвенного колита, миокардита, регионарного энтерита, респираторного дистресс-синдрома взрослых и местных проявлений реакции на лекарства, атопического дерматита, детской экземы, контактного дерматита, псориаза, красного плоского лишая, аллергических энтеропатий, бронхиальной астмы, отторжения трансплантата, постстрептококковых заболеваний, таких как сердечные, почечные и суставные ревматические лихорадочные проявления и другие родственные проявления, множественных и разнообразных форм рака, таких как карциномы, аденокарциномы, меланомы, саркомы, злокачественные астроцитомы, гепатомы, гипернефрома, лимфомы и меланомы.
Иммунотерапевтические композиции по настоящему изобретению также полезны при лечении следующих заболеваний: рака, аутологичной колонизации доброкачественными и злокачественными опухолевыми клетками при всех формах рака, известных как карциномы, аденомы, аденокарцинома, гепатома, астроцитомы и другие новообразования центральной и периферической нервной системы, меланомы, саркомы, лимфомы и лейкозы, а также все злокачественные опухоли.
Иммунотерапевтические композиции по данному изобретению могут быть также полезны для лечения заболеваний, возникающих при дизавтономии иммунной системы (как уже упомянуто), таких как среди прочего следующие заболевания: системная красная волчанка; ревматоидный артрит; узловой полиартериит, полимиозит, дерматомиозит и прогрессирующий системный склероз (диффузная склеродерма); гломерулонефрит, тяжелая миастения, синдром Шегрена, зоб Хасимото (гипотиреоз), болезнь Грейвса (гипертиреоз); адреналит; гипопаратиреоз, пернициозная анемия, диабет, рассеянный склероз и заболевания, косвенно связанные или связанные с деминерализацией; увеит; обыкновенная пузырчатка, пемфигоидный цирроз; неспецифический язвенный колит; миокардит; регионарный энтерит, гепатит и цирроз; респираторный дистресс-синдром взрослых, местные и системные проявления реакции на лекарства, такие как фармакодермия, дерматит.
Кроме того, в области дизавтономных заболеваний иммунной системы в настоящем изобретении также предложены иммунотерапевтические методы лечения следующих заболеваний: острых артериальных и венозных сосудистых расстройств, таких заболеваний, как инфаркт миокарда, тромбоэмболические явления в легких, головном мозге и пищеварительной системе или в любой другой области организма, где удар или ишемия приводит к геморрагии, результатом которой является некроз или атрофия этих сегментов, таких как, но не ограниченных ими, скелетно-мышечная система в целом, центральная и периферическая нервная система в целом, которая приводит к закупорке кровоснабжения, и приводит в результате к сердечным приступам и повреждениям головного мозга. Таким образом, иммунотерапия по настоящему изобретению обеспечивает усиление противовоспалительного и иммунного ответа, что может привести к блокаде воспалительных процессов, важных для установления заболеваний, таких как метаболический синдром, ожирение, диабет типа 2, атеросклероз, алкогольное ожирение печени, неалкогольное ожирение печени, гипертензия, почечная недостаточность, посттромботический синдром, посттромбофлебит и любое другое заболевание, являющееся следствием воспалительного действия иммунной системы.
В случае аллергических, аутоиммунных и воспалительных заболеваний иммунотерапия по настоящему изобретению может быть полезна, но не ограничена ими, при следующих заболеваниях: воспалении, обусловленном или вызванном аллергическими реакциями кожи, атопической экземе у детей; контактном дерматите при астме, бронхиальной астме, бронхиолите и аллергическом бронхите, аллергическом рините, аллергическом энтерите; аллергической энтеропатии; воспалительных псевдоопухолевых процессах происхождения, неизвестного в настоящее время; псориазе (псевдовоспалительной опухоли); красном плоском лишае, постстрептококковых заболеваниях; отторжении трансплантата сердца, печени, легкого, почки, островков Лангерганса и других; гиперчувствительности или деструктивных иммунных ответах против инфекционных агентов, постстрептококковом заболевании, например, сердца, почек, при миокардите, перикардите и ревматической лихорадке, а также эквивалентных другим этиологическим агентам, не ограниченных этими формами проявлений. В случае аутоиммунных и аллергических заболеваний, которые могут включать, но не ограничены ими, упомянутые выше заболевания, концентрации и дозировки предпочтительно являются значительно более низкими, действующими на неполную активацию иммунных клеток, клеток памяти или других клеток.
Иммуногенные композиции по изобретению также применяют для индукции клеточной регенерации, тканевой регенерации, регенерации органов и регенерации систем органов, таких как система кровообращения, нервная система и эндокринная система.
Таким образом, одна форма осуществления изобретения представляет собой способ индукции клеточной репарации, тканевой регенерации, регенерации органов и регенерации систем органов, таких как система кровообращения, нервная система и эндокринная система, у животного, включающий введение животному эффективного количества одной или более иммуногенных композиций по настоящему изобретению.
Другая форма осуществления настоящего изобретения представляет собой способ восстановления иммунного ответа у животного, включающий следующие стадии:
a) введение животному системно и/или локально терапевтически эффективного количества одной или более иммуногенных композиций, как определено в любом из пунктов формулы изобретения с 1 по 21;
b) обеспечение контакта одной или более иммуногенных композиций, применяемых на стадии "а", с дендритными клетками и другими АПК животного;
c) необязательно введение простетических агентов, таких как витамины, в сайт или область, где нужно лечить заболевание, с целью усиления метаболизма и, следовательно, иммунной системы животного, и
d) необязательно введение лекарственных средств или других специфических терапий.
В одной форме осуществление изобретения композиции по настоящему изобретению вводят однократно в одну область организма или в различные сайты с целью перенаправления иммунной системы на самую высокую возможную эффективность. Применение иммуногенных композиций по настоящему изобретению для модуляции иммунной системы, включающее воздействие на часть системы или на всю систему для распознавания антигенов в иммунной системе, например, на дендритные клетки, макрофаги и лимфатические узлы из различных частей организма, зависит от цели, поставленной заболеванием, с которым предстоит бороться, и его осуществляют преимущественно посредством инъекций или применения пушек, либо систем доставки, либо контролируемой инфузии, либо стимуляции клеток антигенами in vitro. Агент можно применять только в одном положении в организме или в нескольких десятках положений в нескольких следующих формах: подкожной, внутримышечной, внутривенной, пероральной, ингаляционного аэрозоля, кожной (кожные пластыри) в органах, висцеральной системе или конкретных тканях, либо в различных полостях организма, число которых может варьировать от одного до сотни (100) применений за количество сеансов, составляющее от одного до пятидесяти (50) сеансов.
Антигенные композиции по данному изобретению можно также комбинировать с другими лекарственными средствами, которые могут ослаблять размножение, рост или любую другую форму усиления возбудителя заболевания, что вызывает сдвиг равновесия в пользу биологической иммунной защиты хозяина, животного или человека, или, кроме того, при одновременном лечении.
Антигенные композиции по данному изобретению можно также комбинировать с другими методами, такими как, но не ограниченными ими, следующие методы: антибиотики, химиотерапия, радиотерапия, терапия антителами и антисыворотками, применение гормонов или других агентов, модулирующих физиологию (цитокинов, хемокинов, нейрогормонов, пептидов), лечение противовирусными агентами, применение лекарственных трав, витаминные добавки, добавки других кофакторов или простетических агентов, трансплантация клеток или тканей, методы терапевтической или профилактической вакцинации (с клетками или без клеток, и не ограничиваясь типом носителя вакцины), генотерапия, операция или гомеопатия, в зависимости от заболевания или расстройства, с которым нужно бороться, связанного с неправильной или неэффективной иммунной активностью.
В частности, с целью повышения, снижения или поляризации иммунного ответа как цели иммунотерапии антигенные композиции по данному изобретению можно применять в сочетании с терапией цитокинами и/или хемокинами, такими как GM-CSF, ИЛ4, ИЛ5, ИЛ7, ИЛ12, ИЛ15, ИЛ-21, интерферон гамма, и наиболее предпочтительно ИЛ-2.
Реконтекстуализация, восстановление и перепрограммирование иммунного ответа
Реконтекстуализация иммунной системы, как объяснено в тексте данной заявки на патент, достигается посредством стимуляции иммунной системы антигенами различных патогенов, не связанных с патологией, подлежащей лечению, к которым человек или животное предпочтительно уже имеет иммунологическую память.
Эти разнообразные и множественные антигены в количестве более пяти, имеющие множественные ПАМП и DAMP, индуцируют сигнальные клетки и АПК, особенно дендритные клетки, причем, интенсивная активация дает возможность мобилизации этих CD4 лимфоцитов памяти, специфичных к этим антигенам, в сайте применения.
Эти стимулы должны обладать способностью вызывать интенсивный, сильный и эффективный вторичный специфический иммунный ответ на эти антигены в сайте применения, в регионарных лимфатических узлах, в лимфатических узлах, находящихся на расстоянии, и системную мобилизацию иммунной системы, в результате которой она может параллельно вызывать эффективный ответ, способный к устранению прогрессирующей специфической патологии.
Врожденный и адаптивный иммунный ответ, целенаправленно вызванный композицией по настоящему изобретению, должен в полной мере охватывать область организма, пораженную состоянием, подлежащим лечению, и даже по возможности превышать ее, чтобы обладать способностью активировать сигнальные клетки и АПК в необходимом количестве и при необходимой интенсивности, чтобы правильно бороться с агрессией, вызванной патогенным заболеванием, подлежащим лечению, а также активировать и запускать лучший специфический адаптивный ответ, впоследствии эффективно и правильно поляризованный, с целью излечения состояния, подлежащего лечению.
Таким образом, врожденный и адаптивный ответ, индуцированный по настоящему изобретению, географически охватывает состояние, подлежащее лечению, и в результате его интенсивной и широкой активации корректирует неэффективную активацию, направленно ограниченную действием патогена, который преодолевает защиту организма, путем предотвращения конкуренции, правильной мобилизации и развития эффективного адаптивного ответа в соответствии с его самым высоким генетическим и биологическим потенциалом. Идеальная активация должна также вызвать обратное развитие подавления иммунитета, толерантность и избегать механизмов, установленных патогенами, поскольку известно и доказано, что неродственный сильный и интенсивный иммунный ответ, полностью перекрывающий ответ, который нужно корректировать, посредством активированных клеток и цитокинов иммунной системы, эффективно скорректирует эти ситуации недостаточности.
Эффекторные клетки и клетки памяти специфичных антигенов по настоящему изобретению, активируемые и генерируемые в сайте применения антигенов, посредством кровотока поступят в уже активированные лимфатические узлы, дренирующие область, пораженную заболеванием, и обеспечат надежное и эффективное присутствие в этом сайте всех существующих дендритных клеток. Это, таким образом, приведет к активации всего лимфатического узла, вызывающей его рост при повышенном промывании, увеличение его размера, и делающей его реактивным лимфатическим узлом, способным к провокации иммунного ответа против слабых антигенов, которые сами по себе неспособны вызывать иммунный ответ. Данный адъювантный эффект эффекторных Т лимфоцитов/Т лимфоцитов памяти, хорошо известный и продемонстрированный экспериментально и клинически, противостоит действию возбудителя-мишени, то есть блокированию активации лимфатического узла, требующейся для развития иммунного ответа, который необходим для борьбы с обсуждаемым заболеванием.
- Таким образом, исключительно для целей настоящего изобретения и под действием эффективной антигенной композиции по настоящему изобретению может случиться, что сигнальные клетки, а также дендритные клетки и макрофаги иммунной системы будут одними и теми же для неродственных антигенов и для патологических антигенов, но в результате этого действия они претерпевают интенсивнкю и правильную активацию. Дендритные клетки, сильно активированные множественными антигенами, имеют медленный метаболизм и идеально презентируют все доминантные и субдоминантные эпитопы возбудителя посредством известного "хелперного" эффекта, мобилизующего все возможные и доступные Т лимфоциты, способные к специфичному распознаванию антигенов аутологичного или гетерологичного патогена, который нужно лечить и реагировать против него.
- Таким образом, области воспалительного процесса и лимфатические бассейны являются в точности одними и теми же. Воспаленная область, посредством противовоспалительного действия клеток памяти неродственной специфичности, мобилизованных антигенной композицией по настоящему изобретению, заблокирует инфламмасомы и проявит противовоспалительное действие, которое скорректирует патологическое воспаление, ответственное за заболеваемость данным заболеванием, которое было вызвано его возбудителем. Что касается эффекта памяти, важно отметить, что данное известное действие Т клеток памяти, в основном, ответственно за тот факт, что второй контакт с любым патологическим агентом после уже установившегося иммунитета является бессимптомным и не вызывает заболевания.
- Таким образом, лимфатические бассейны являются в точности одними и теми же, только теперь они интенсивно активированы и подают необходимый сигнал тревоги, вызванный композициями по настоящему изобретению, в результате чего вызывают любой иммунный ответ даже на слабый антиген, аналогичный ответу, происходящему посредством дендритных клеток, родственных композициям по данному изобретению, на аутологичный или гетерологичный возбудитель, с которым нужно бороться. Лимфокины и врожденные клетки, которые подают команду для эффективного вторичного ответа, являются одними и теми же, и Т лимфоциты, специфичные к возбудителю, с которым нужно бороться, будут "транспортироваться" данным идеальным микроокружением, посредством чего поддерживать эффективный иммунный ответ.
- Таким образом, дендритные клетки, активированные композициями по настоящему изобретению, могут захватывать антигены возбудителя, с которым нужно бороться, в сайте патологии и в соответствующих лимфатических бассейнах и находиться в контакте с патоген-специфичными Т CD4 лимфоцитами в правильно и идеально обеспеченной иммунной системе. Роль дендритных клеток, активированных и созревших за счет Т CD4 клеток, специфичных к возбудителю, осуществляется в микроокружении, способствующем осуществлению иммунного ответа, обладающего всем генетическим и биологическим потенциалом иммунной системы организма-хозяина.
Эти дендритные клетки в сайте патологии и в лимфатических узлах правильно "калибруют" тяжесть, степень, интенсивность и тип агрессии, активируют, индуцируют, координируют, поляризуют, направляют и поддерживают новый эффективный адаптивный иммунный ответ, эффекторная петля которого при кооперации клеток и эффекторных молекул интенсивного и правильно активированного врожденного иммунитета может обладать способностью к устранению возбудителя, с которым нужно бороться. Таким образом, ответ перепрограммируется и перенаправляется, как отмечено выше, вызывая обращение биологического равновесия в пользу хозяина, которое вплоть до этого момента находилось под действием провоцирующего аутологичного или гетерологичного агента.
Это действие может происходить с помощью или без помощи сместителей биологического равновесия, таких как антибиотики и противораковые лекарственные средства, способных блокировать, ослаблять или нейтрализовать эффекты и потенциал возбудителя, давая шанс иммунной системе излечить патологию, которая является целью лечения. Запущенная каким-либо возбудителем, иммунная система прекратит реагировать только тогда, когда возбудитель устранен, или организм умирает, поэтому изобретение поможет избежать последнего варианта или улучшит состояние пациента, если он имеет хроническое заболевание, которое невозможно вылечить.
Таким образом, действие композиций по настоящему изобретению целенаправленно и стратегически охватывает всю область, находящуюся под действием агента, с которым нужно бороться, реконтекстуализирует иммунную систему посредством активации ПАМП и DAMP в сигнальных клетках и родственных АПК и посредством вторичного адаптивного иммунного ответа неродственной специфичности. Это целенаправленно индуцированный иммунный ответ эффективно активирует весь лимфатический бассейн и бассейн органов, пораженных возбудителем. В реконтекстуализированной области и в опухоли, а также в контексте более сильного иммунного ответа, за счет более сильной, более интенсивной и более обширной вторичной противовоспалительной природы целевой иммунный ответ, как описано выше, перепрограммируется и эффективно восстанавливается, в результате чего пределы его объема дают больший шанс для хозяина, теперь имеющего шанс для обращения биологического равновесия в его пользу.
Адекватность протокола для патофизиологического состояния, подлежащего лечению:
а) Основа иммунотерапии против новообразований
Основным характеристическим признаком злокачественных новообразований является преобладание микроокружения, как определено в исследовании по настоящему изобретению, отличие которого от традиционного определения на современном уровне техники состоит в том, что окружение создается под действием опухолевых клеток клетками организма, посредством которых такое действие заставляет их функционировать в его пользу. Микроокружение, определенное в данной работе, представляет собой пространство вокруг отдельной опухолевой клетки или группы опухолевых клеток, которые посредством поверхностных молекул и/или других молекул, секретируемых ими, полностью подавляют данное окружение за счет их преимущества.
В данном подавляемом пространстве соединительная ткань начинает подпитывать и поддерживать эти клетки посредством своих структурных элементов и посредством новых кровеносных сосудов, предназначенных для снабжения опухолевых клеток и их поддерживающей ткани. Посредством поверхностных молекул, а также веществ и ферментов, секретируемых опухолевыми клетками в данном окружении, эти клетки разрушают ткань, из которой они имеют происхождение, и здоровую ткань, инвазируемую ими, которая колонизируется и вытесняется. Поверхностные и секретируемые молекулы полностью блокируют иммунную систему, инактивируя и иммобилизуя сигнальные клетки, АПК и лимфоциты, индуцируя неспецифическое и специфическое подавление иммунитета и инактивируя местно-регионарные и отдаленные лимфатические узлы. Посредством подавления микроокружения опухолевые клетки за счет поверхностных молекул и ферментов поступают в кровеносные и лимфатические сосуды и колонизируют положения, отдаленные от локальной первичной опухоли, и вызывают отдаленные лимфатические и гематогенные метастазы.
Таким образом, локальное подавление микроокружения вокруг отдельной клетки заставляет опухолевую клетку посредством ее неразборчивой пролиферации первоначально патологически подавлять пространство вокруг нее, ткань, от которой она имеет происхождение, примыкающие области, орган и, наконец, посредством метастазов организм в целом. Подобным образом, следующие события: иммунное игнорирование, подавление иммунитета и индуцированная специфическая и неспецифическая толерантность, происходят сначала in situ, а затем местно, местно-регионарно, в органах, и, наконец, полностью подавляют системную иммунную систему организма-хозяина.
Таким образом, подавление микроокружения представляет собой стратегический, критический и детерминирующий эффект, создаваемый геномным потенциалом опухолевой клетки, который ведет одну опухолевую клетку к подавлению in situ, местного, регионарного, органного и системного пространства и колонизации организма-хозяина, приводящей его к смерти.
Кратко, иммунотерапия должна обязательно нарушать установившееся подавление микроокружения и макроокружения опухоли и охватывать все иммунологические бассейны, подавляемые новообразованием. Лечение посредством иммунотерапии должно также охватывать лимфатические бассейны на расстоянии от опухоли, индуцируя реконтекстуализацию, восстановление и перепрограммирование иммунной системы от наружного до внутреннего пространства пораженной области при сильной инерции, способной вызвать полное обратное развитие доминирования опухоли вместе с местно-регионарным лечением (внутри опухоли и на периферии патологического очага).
Иммунопрофилактику следует проводить каждые 4 или 5 суток, поскольку этот период является физиологическим периодом генерирования клеток-супрессоров, контролирующих иммунный ответ. Последовательные волны повторной антигенной стимуляции в промежутках неопределенно долго наращивают иммунный ответ, закрепляя антигенные стимулы, когда они появляются при инфекции до ее хронической фазы и создания иммунной дисфункции. Неспособность к генерации клеток-супрессоров и реконтекстуализация предотвращает подавление клеток-супрессоров опухолью и их защиту в противоположность микроокружению.
Действие опухолевой клетки в области микроокружения и их группы в макроокружении осуществляется 24 часа в сутки и на протяжении всего периода, в течение которого существует данное состояние. Поэтому иммунотерапию в указанном выше объеме, частоте и величине следует применять непрерывно до тех пор, пока еще существуют опухолевые клетки. Интересно упомянуть, что традиционная иммунотерапия, вызывающая прерывистые стимулы, подобно протоколм иммунизации инертными антигенами (растворимыми или нерастворимыми) или аттенуированными агентами, не находит применения в патофизиологическом контексте, индуцированном опухолями.
Любой специфичный иммунный ответ можно амплифицировать и эффективно усилить путем добавления цитокинов и/или хемокинов, предпочтительно экзогенного ИЛ-2 при уровне стимуляции рецептора, который продуцирует пролиферацию иммунных клеток, распознающих антиген, и, следовательно, полностью экспрессирует на своей поверхности рецептор интерлейкина 2. Таким образом, амплифицируется только ответ на антигены, индуцированный композициями по изобретению и индуцированный возбудителем (аутологичным или гетерологичным). При противоопухолевой иммунотерапии, при которой существуют только слабые антигены, эта терапия должна быть дополнена ИЛ-2, чтобы получить эффективный и надежный иммунный ответ.
Основы иммунотерапии против септицемии, сепсиса и "септического шока"
Септицемию определяют как крайне серьезную инфекцию, при которой одна или более бактерий или микроорганизмов из точки их поступления поступает в кровообращение и начинает циркулировать в большом количестве, устанавливаясь в отдаленных точках, колонизируя ткани, органы, и в большинстве тяжелых случаев могут успешно достигать большей части поверхности тела. Как правило, когда груз микроорганизмов слишком велик, большое число бактерий с их токсическими и метаболическими продуктами, посредством бесчисленного числа ПАМП и DAMP, контактируют со всем также бесчисленными ПРР и RDP большей части поверхности тела, создавая при этом обширный, интенсивный и сильный генерализованный воспалительный процесс с массовым высвобождением цитокинов в результате трансляции всех этих признаков.
Неблагоприятное развитие септицемии приводит к сепсису посредством массового высвобождения следующих провоспалительных цитокинов: факторов некроза опухоли TNF (tumor necrosis factors), ИЛ1, ИЛ18, ИЛ6 и других, вызывая воспалительный коллапс с изменением гемодинамических характеристик, таких как гипотензия, частый пульс, кульминацией которых может быть септический шок, обычно необратимый. Септицемия, сепсис и серьезные инфекции имеют высокую заболеваемость и смертность. При этих тяжелых инфекциях иммунной системы, в свою очередь, при ее нарушенной оперативности в результате слабости и блокады, индуцированной бактериями, начинает действовать таким образом, что устраняет бактерии любой ценой посредством воспалительного тканевого профиля Th17, диспропорционально увеличивая воспаление и, следовательно, повреждая организм.
При данном воспалительном тканевом профиле эффекторные петли врожденного иммунитета, контролируемого TCD4 лимфоцитами, вызывает тканевое повреждение и иногда массовую деструкцию, нарушающую органы и ткани и обостряет инфекции, приводя, например, к дыхательной недостаточности, легочному шоку и РДСВ (респираторный дистресс-синдром взрослых), также приводя к почечной недостаточности и множественной недостаточности органов.
Следовательно, при септицемии, при сепсисе и при септическом шоке существует два параметра, которые следует стратегически учитывать и следует направлять на них иммунотерапию, поэтому она является успешной. Эти два параметра представляют собой воспаление, вызванное массовым распространением бесчисленных бактерий во всем организме, и его связь с ПРР и DPP, и поляризацию Th17 профиля, вызванную функциональной недостаточностью Th1 и Th2 профилей. Эти параметры являются краеугольным камнем серьезности, тяжести, заболеваемости и смертности этих заболеваний.
С учетом этих двух параметров для эффективности иммунотерапии при этих инфекциях ее следует применять таким образом, чтобы охватывать всю поверхность тела, включая наибольшее число лимфатических бассейнов, чтобы географически перекрывать действие патогена или патогенов. Ее также следует применять на поврежденных областях и на периферических областях повреждения, чтобы вместе они могли вызвать широко распространенную реконтекстуализацию, которая при ее действии может восстановить целостность Т петли и продуцировать распространенный, обширный и интенсивный противовоспалительный эффект за счет эффекторных Т клеток/Т клеток памяти, образующихся внутри сайтов применения. Параллельно посредством реконтекстуализации и перепрограммирования, описанных выше, она должна изменить поляризацию Т CD4 ответа воспалительного тканевого профиля Th17 на гуморальный профиль Th2 и клеточный профиль Th1, дополнительно снижая генерализованное воспаление.
Амплификация петли посредством ИЛ-2 должна быть очень низкой, достаточной только для специфичной амплификации реполяризации иммунного ответа воспалительного профиля на иммунный профиль.
Таким образом, реконтекстуализация и перепрограммирование, достигаемые иммунотерапией при применении композиций по настоящему изобретению, путем восстановления иммунных клеток посредством противовоспалительного действия Т лимфоцитов памяти неродственной специфичности, путем реполяризации тканевого воспалительного профиля Th17 на элективные и эффективные профили иммунитела Th1 и Th2 изменяет направление иммунного ответа. Этот иммунный ответ, восстановленный в реальном времени в течение инфекционного процесса, в сочетании со сместителем биологического равновесия в случае применения различных антибактериальных агентов имеет шанс для обращения биологического равновесия в конце кривой, где он является весьма благоприятным для микроорганизма, в благоприятную сторону для хозяина, и теперь имеет шанс разрешения болезни.
Адекватность протокола "статусу" иммунной системы при патологии и пациенту, подлежащему лечению
В случае рака и септицемии за счет их собственных патофизиологических механизмов существует брешь в целостности и функциональности Т петли при неадекватной поляризации для подавления профиля TREG при раке и воспалительного тканевого профиля Th17 при септицемии вследствие почти полного отсутствия оперативности иммунной системы, подавленной заболеванием. В этих случаях, как упомянуто в примерах, приведенных в данной работе, реконтекстуализация должна достигать всего организма, чтобы полностью вызвать обратное развитие следующих событий, индуцированных патологией: подавления иммунитета, толерантности и иммунного игнорирования, а также полностью восстановить оперативную и функциональную способность иммунной системы, чтобы получить перепрограммированный и восстановленный эффективный иммунный ответ.
Обоснование терапевтического протокола
Терапевтический протокол по настоящему изобретению, предназначенный для применения в случаях рака и спетицемии, должен выполнять следующие действия:
- Применяться в большей части стратегических лимфатических областей организма или инфекции. В случаях, описанных в данной работе, действие произведено более чем на 10 лимфатических бассейнов. Он должен применяться внутри опухоли и на инфицированных и периферических областях.
- Иммунотерапевтический препарат должен содержать по меньшей мере 5 антигенов, которые должны содержать ПАМП и DAMP, чтобы обладать способностью к реконтекстуализации иммунной системой.
- Область применения должна покрывать, охватывать и перекрывать всю протяженность областей, подавляемых опухолью и инфекцией.
- Антигенные стимулы должны повторяться каждые 4 или 5 суток во избежание генерирования клеток-супрессоров, способных прерывать новый желаемый иммунный ответ или подавлять достигнутую реполяризацию.
- Лечение необходимо поддерживать таким образом до устранения последней опухолевой клетки, либо до окончания инфекции, либо до заживления раны, органа или системы.
- На практике от 1 до 3 мл данной иммунотерапии необходимо применять на 10 или более лимфатических бассейнов. Данное изобретение следует сочетано применять в областях, поврежденных раком или инфекцией, находящихся внутри и снаружи повреждения или опухоли.
В итоге, иммунотерапия "системно" распределяется в нескольких (по меньшей мере в десяти) лимфатических бассейнах, на периферии и внутри опухоли или повреждения, причем, ее объем способен нарушить и дестабилизировать подавление опухолью ее микро- и макроокружения или покрыть область, значительно пораженную инфекцией и воспалением, а также восстановить микроокружение, являющееся благоприятным для иммунного ответа организма. Иммунотерапию следует применять каждые 4-5 суток при применении низких доз экзогенного интерлейкина-2 непрерывно на протяжении всего периода течения заболевания. В случае септицемии, сепсиса и септического шока, как отмечено выше, эта доза должна быть как можно более низкой.
ПРИМЕРЫ
Чтобы дать возможность лучше понять изобретение и четко продемонстрировать достигнутый технический прогресс, ниже в качестве примеров представлены результаты различных тестов, проведенных в отношении данного изобретения.
В Примере 1 раскрыто несколько предпочтительных иммуногенных композиций по настоящему изобретению. В Примерах 2-8 показаны свойства, применение и терапевтические способы с применением иммуногенных композиций по настоящему изобретению. В Примерах 2-8 была использована иммуногенная композиция, раскрытая в Примере 1, Композиция 1, в настоящей работе названная как DECA.
Данные Примеры приведены только в иллюстративных целях и никоим образом не должны рассматриваться как ограничивающие объем и уровень изобретения.
Пример 1: Иммуногенные композиции
В целях достижения реконтекстуализации, восстановления и перепрограммирования иммунного ответа в реальном времени, согласно изобретательским концепциям, раскрытым в настоящем изобретении, специалист в данной области техники может разхработать различные и отличающиеся друг от друга композиции или препараты лекарственных средств, находящиеся в пределах объема изобретения.
Как описано, для соответствия таких композиций техническим требованиям новаторских или неопубликованных результатов при борьбе с рядом заболеваний и расстройств, они должны иметь высокое разнообразие антигенов от патогенов, чтобы получить максимальный синергетический эффект при связывании ПАМП и DAMP с их рецепторами, что позволяет достичь высокой степени активации врожденного иммунитета в сигнальных клетках (обладающих или не обладающих функцией АПК), в результате чего дает возможность реконтекстуализации, восстановления и перепрограммирования иммунного ответа в реальном времени.
В таких композициях предпочтительно следует применять антигенные агенты, к которым большинство людей в связи с предшествующим контактом должно иметь клоны памяти в их иммунной системе, способные к индукции широкого противовоспалительного действия параллельно реконтекстуализации. Для этого антигенные агенты предпочтительно должны быть выбраны таким образом, чтобы обладать следующими свойствами:




В соответствии с данными концепциями разработано несколько композиций с применением антигенных агентов в их уже доступных, безопасных и одобренных формах для применения в программах вакцинации людей или тестах аллергических реакций и тестах оценки иммунитета.
Таким образом, авторы изобретения представляют несколько приведенных ниже примеров композиций, находящихся в пределах объема настоящего изобретения, однако, не ограничиваясь ими, поскольку настоящее изобретение и его концепции дают возможность для разработки иммуногенных композиций, содержащих очень большое число комбинаций антигенных агентов.
Композиция 1:

Композиция 2:


Композиция 3:

Композиция 4:


Композиция 5:

Композиция 6:

Композиция 7:

Композиция 8:


Композиция 9:
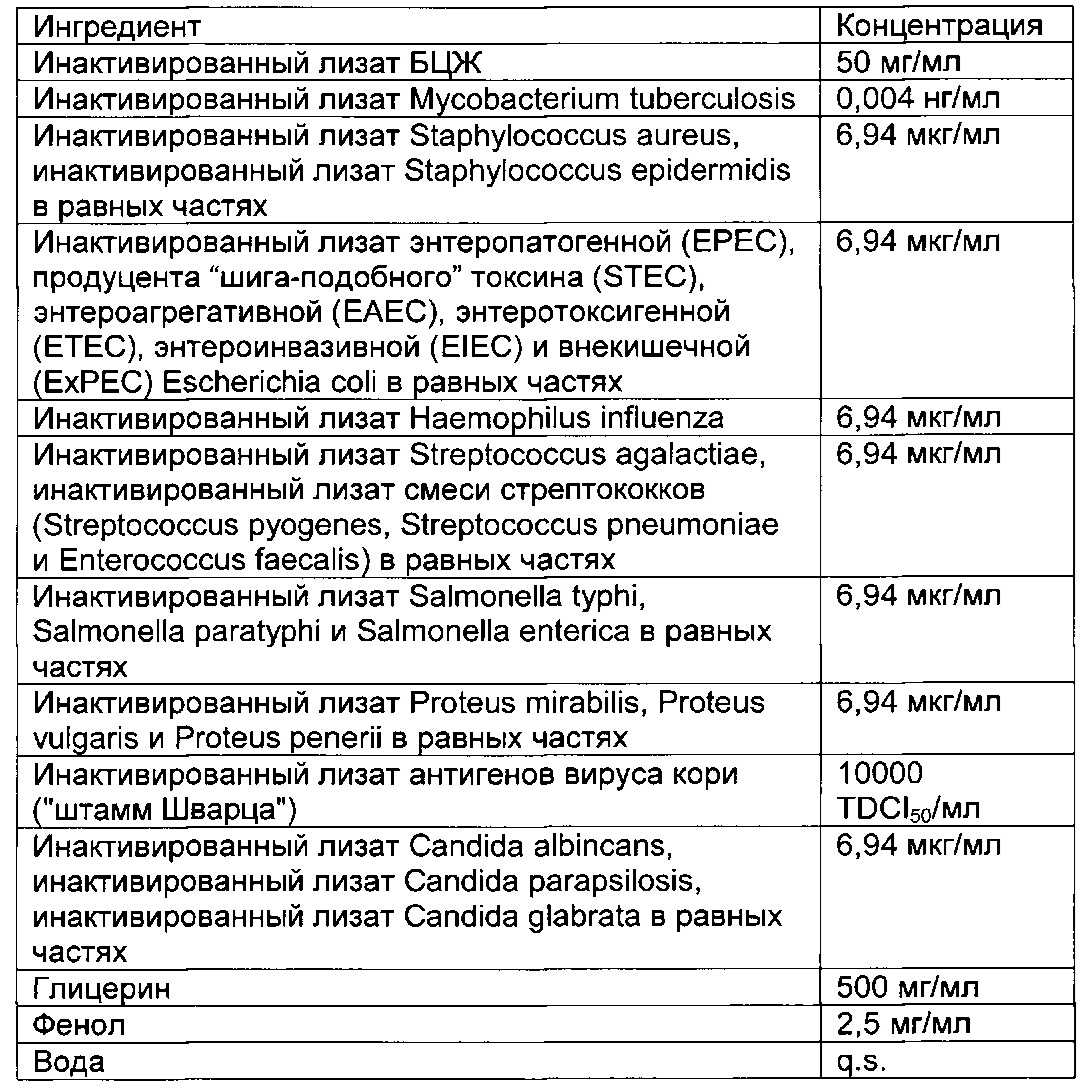
Композиция 10:
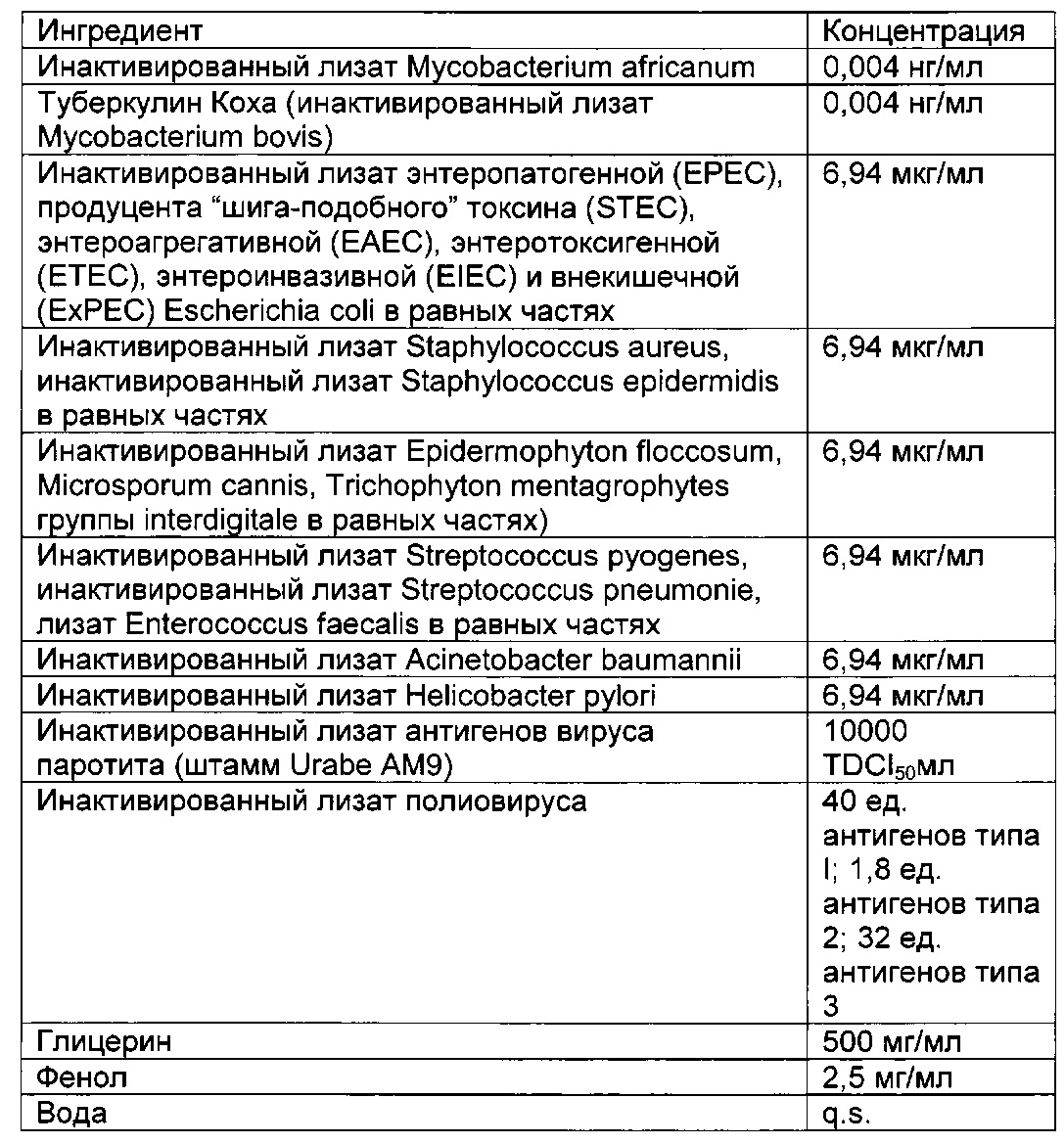
Композиция 11:


Композиция 12:

Композиция 13:


Композиция 14:

Композиция 15:


Композиция 16:

Композиция 17:

Композиция 18:


Композиция 19:


Композиция 20:


Композиция 21:


Композиция 22:
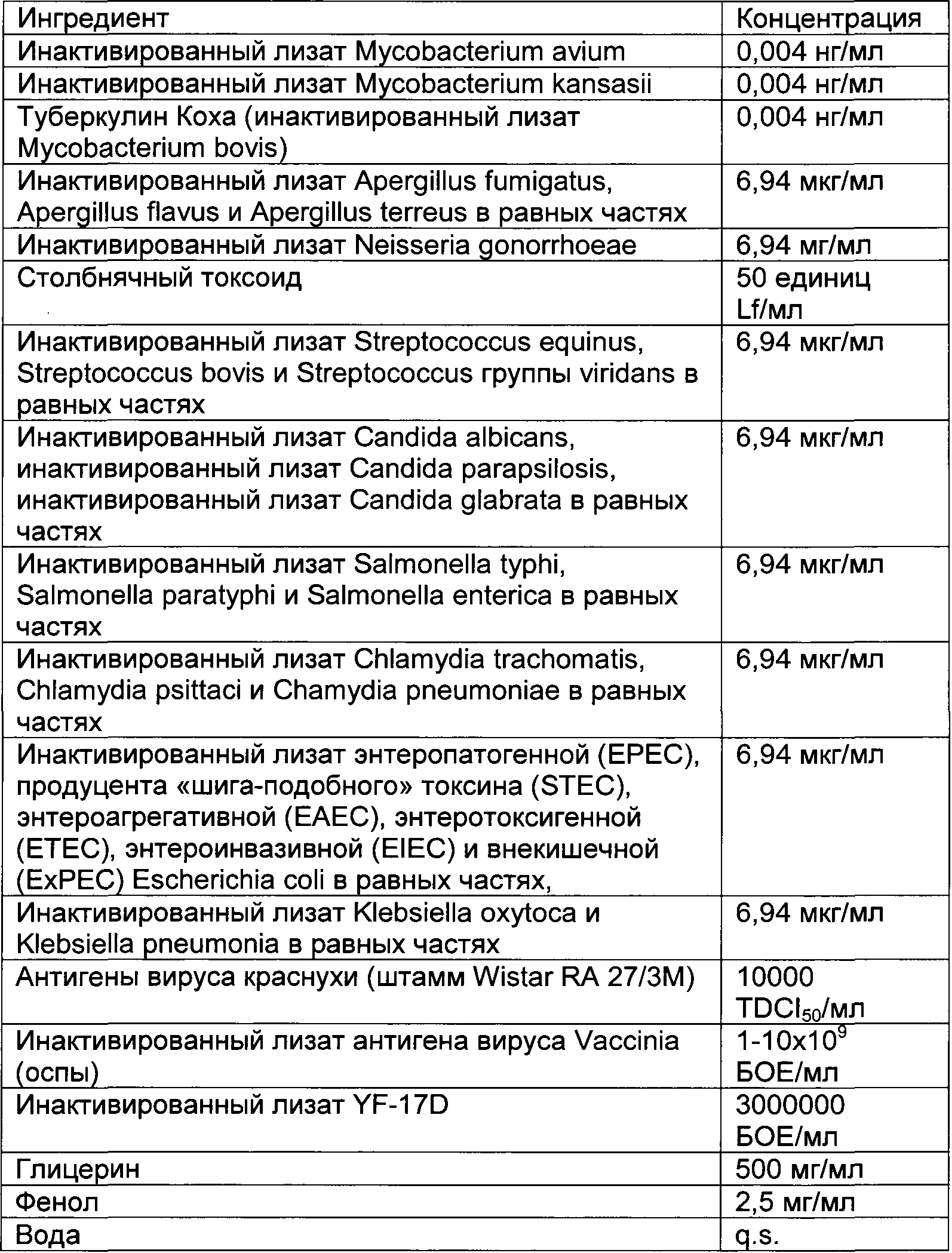
Композиция 23:


Композиция 24:


Композиция 25:


Композиция 26:
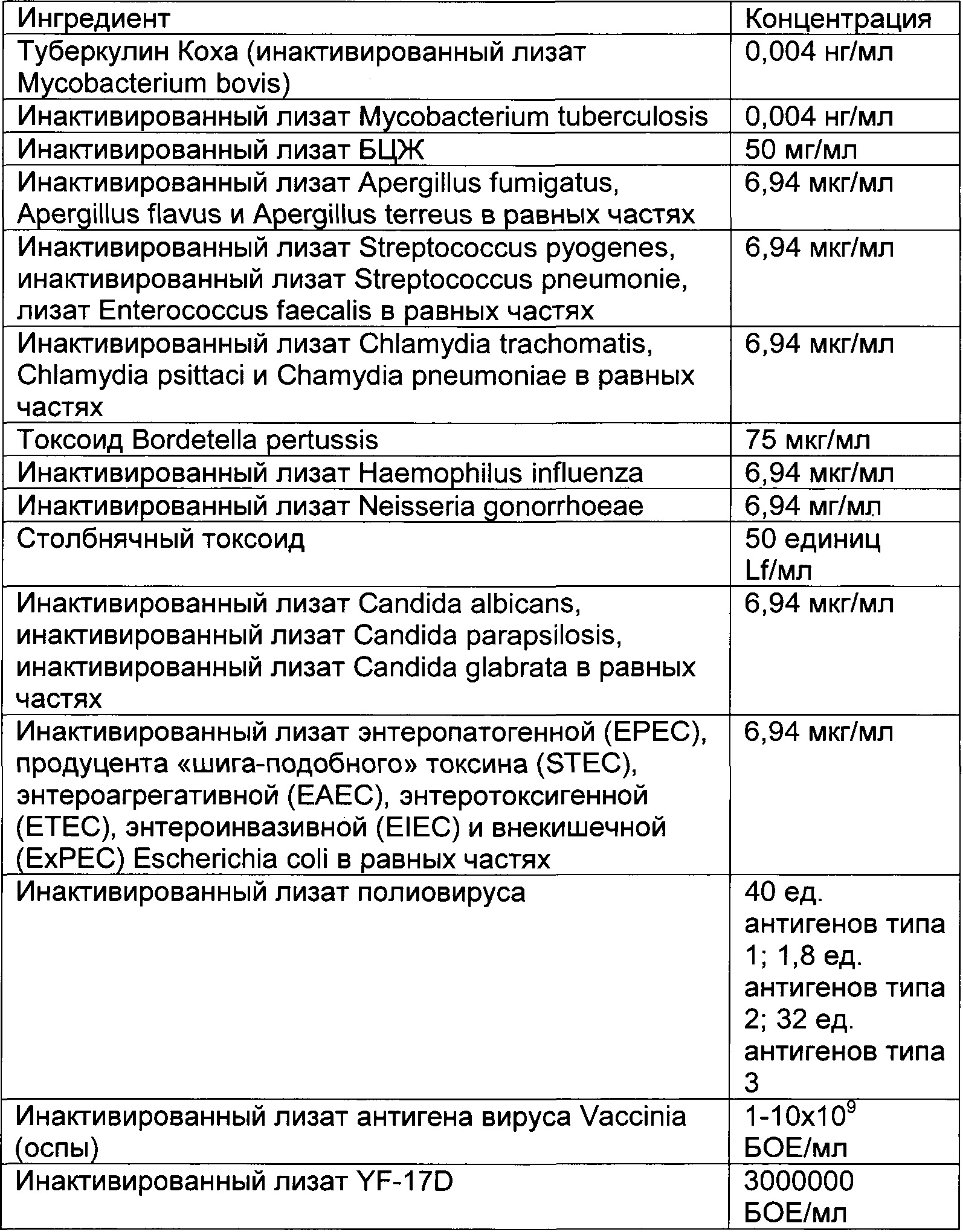
Композиция 27:

Композиция 28:

Композиция 29:

Композиция 30:

Композиция 31:

Композиция 32:
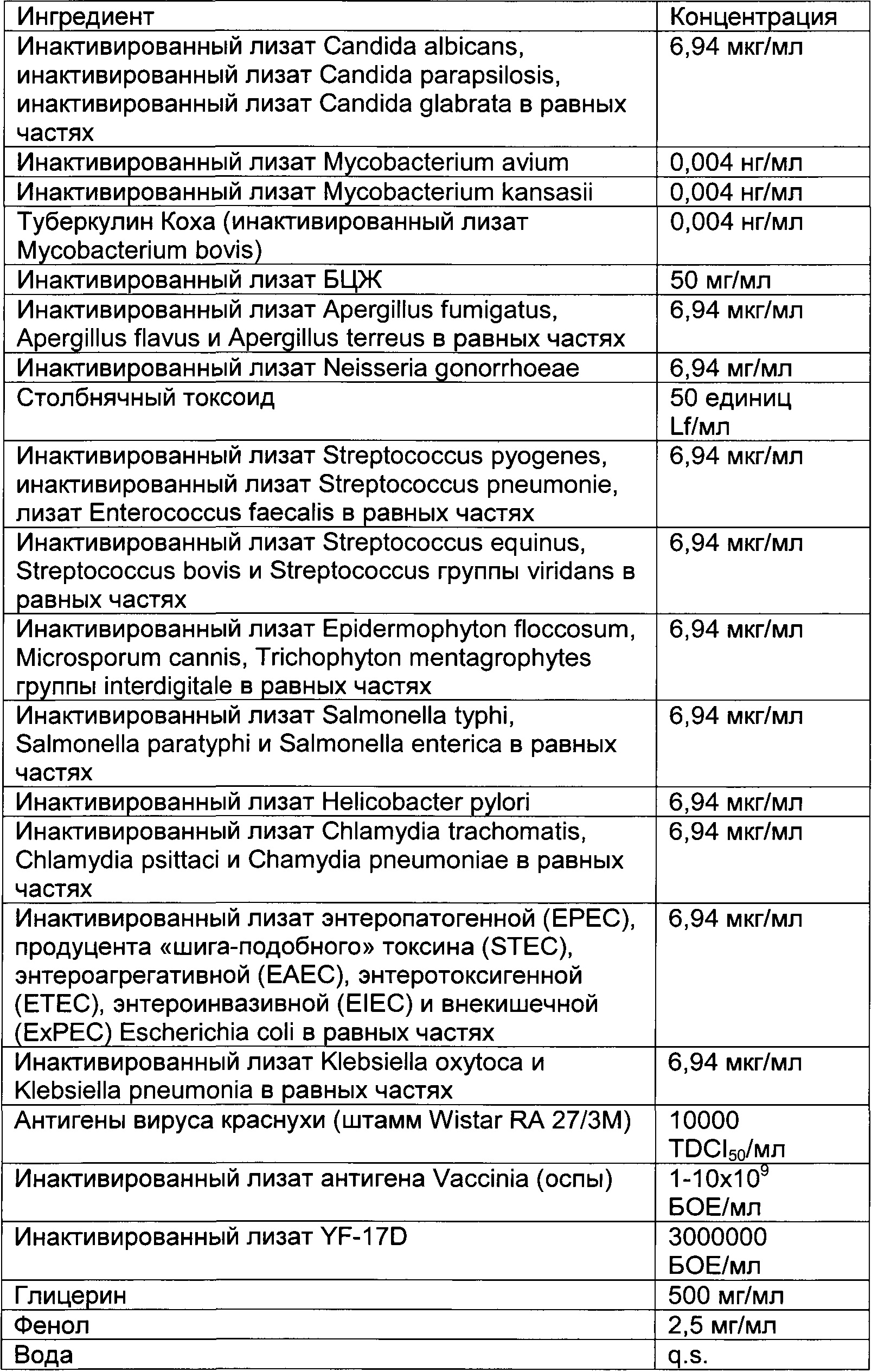
Композиция 33:

Композиция 34:


Композиция 35:


Композиция 36:


Когда имеются сопутствующие паразитарные заболевания, либо паразитарные заболевания, с которыми нужно бороться, композиции предпочтительно содержат антигенные агенты паразитарного происхождения. В данном случае, согласно концепции, раскрытой в настоящем изобретении, композиции должны содержать антигенные агенты, имеющие происхождение от наиболее распространенных паразитов, к которым индивидуумы имеют больше клеток памяти, в соответствии с географическим распределением и местным и региональным развитием человека (развитые или неразвитые страны). Такие параметры являются определяющими для встречаемости этих паразитов, и существования соответствующих клеток памяти в иммунной системе населения данного региона.
Композиция 37: сочетание композиции 2 со следующими ингредиентами:

Композиция 38: сочетание композиции 3 со следующими ингредиентами:

Композиция 39: сочетание композиции 4 со следующими ингредиентами:

Композиция 40: сочетание композиции 5 со следующими ингредиентами:

Композиция 41: сочетание композиции 6 со следующими ингредиентами:

Композиция 42: сочетание композиции 7 со следующими ингредиентами:

Композиция 43: сочетание композиции 8 со следующими ингредиентами:

Композиция 44: сочетание композиции 9 со следующими ингредиентами:

Композиция 45: сочетание композиции 10 со следующими ингредиентами:

Композиция 46: сочетание композиции 11 со следующими ингредиентами:

Композиция 47: сочетание композиции 12 со следующими ингредиентами:

Композиция 48: сочетание композиции 13 со следующими ингредиентами:

Композиция 49: сочетание композиции 14 со следующими ингредиентами:

Композиция 50: сочетание композиции 15 со следующими ингредиентами:


Композиция 51: сочетание композиции 16 со следующими ингредиентами:

Композиция 52: сочетание композиции 17 со следующими ингредиентами:

Композиция 53: сочетание композиции 18 со следующими ингредиентами:

Композиция 54: сочетание композиции 19 со следующими ингредиентами:

Композиция 55: сочетание композиции 20 со следующими ингредиентами:

Композиция 56: сочетание композиции 21 со следующими ингредиентами:


Композиция 57: сочетание композиции 22 со следующими ингредиентами:

Композиция 58: сочетание композиции 23 со следующими ингредиентами:

Композиция 59: сочетание композиции 24 со следующими ингредиентами:

Композиция 60: сочетание композиции 25 со следующими ингредиентами:

Композиция 61: сочетание композиции 26 со следующими ингредиентами:

Композиция 62: сочетание композиции 27 со следующими ингредиентами:

Композиция 63: сочетание композиции 28 со следующими ингредиентами:

Композиция 64: сочетание композиции 29 со следующими ингредиентами:

Композиция 65: сочетание композиции 30 со следующими ингредиентами:

Композиция 66: сочетание композиции 31 со следующими ингредиентами:


Композиция 67: сочетание композиции 32 со следующими ингредиентами:

Композиция 68: сочетание композиции 33 со следующими ингредиентами:

Композиция 69: сочетание композиции 33 со следующими ингредиентами:

Композиция 70: сочетание композиции 35 со следующими ингредиентами:

Композиция 71: Association of Композиция 36 with:


Пример 2:
Экспериментальная модель лечения меланомы на мышах с применением антигенной композиции DECA Животные
Использовали свободных от специфичных патогенов (SPF; от англ. "Specific Pathogen free") самцов мышей C57BL6 (25-35 г, 8-12 недель). Животных держали в окружающей среде с контролируемой температурой и влажностью (22±2°С и 60-80% соответственно) при 12-часовом световом цикле, при свободном доступе к воде и корму вплоть до момента эксперимента.
Индукция меланомы мышей
Клетки меланомы линии клеток B16-F10 инокулировали на сутки ноль (1×106 клеток в 100 мкл культуральной среды на животное) подкожно (s.c.) в спину самцов мышей C57BL/6 (Lee, Y.S., et al. Suppression of tumor growth by a new glycosaminoglycan isolated from the African giant snail Achatina fulica. European Journal of Pharmacology, 465: 191-198, 2003). Животных (n=8 на группу, таблица 3) Обрабатывали, начиная с суток 7 (и после этого каждые 4 суток), наполнителем (контроль), композицией DECA или DECA+ИЛ-2, как показано на схеме, представленной в таблице 1. Группы DECA+ИЛ-2 также получала ежесуточные инъекции ИЛ-2 (20000 международных единиц (ME), дважды в сутки, подкожно). Объемы опухоли оценивали с помощью штангенциркуля с цифровой индикацией и определяли (мм3) согласно следующей формуле: объем опухоли (мм3)=ширина × длина × 0,5 (Lee, Y.S., et al. Suppression of tumor growth by a new glycosaminoglycan isolated from the African giant snail Achatina fulica. European Journal of Pharmacology, 465: 191-198, 2003). Объем солидной опухолевой массы оценивали каждые 3 суток в течение 28-суточного периода после инъекции опухолевых клеток. Выживаемость животных оценивали в течение периода, составляющего 30 суток после инъекции опухолевых клеток.
Таблица 1. Схема обработки
Начало на сутки 7, и впоследствии каждые 4 суток
Контрольная ГРУППА (наполнитель)
1й системный физиологический раствор - 24 внутрикожных инъекции физиологического раствора (NaCl, 0,9% стерильно) в предопределенные точки в дорзальных и вентральных областях
2й внутриопухолевый физиологический раствор - две инъекции (одна инъекция 0,02 мл в центр повреждения и одна инъекция 0,02 мл в основание повреждения)
3й физиологический раствор на периферии повреждения (6 точек применения - с целью обведения опухоли)
ГРУППА DECA
1я системная композиция DECA - 24 внутрикожных инъекции раствора DECA (стерильно) в предопределенные точки в дорзальных и вентральных областях
2я внутриопухолевая композиция DECA - две инъекции (одна инъекция 0,02 мл в центр повреждения и одна инъекция 0,02 мл в основание повреждения)
3я композиция DECA на периферии повреждения (6 точек применения) ГРУППА DECA+ИЛ-2
1я системная композиция DECA - 24 внутрикожных инъекции раствора DECA (стерильно) в предопределенные точки в дорзальных и вентральных областях
2я внутриопухолевая композиция DECA - две инъекции (одна инъекция 0,02 мл в центр повреждения и одна инъекция 0,02 мл в основание повреждения)
3я композиция DECA на периферии повреждения (6 точек применения - с целью обведения опухоли)
4й внутриопухолевый ИЛ-2 20000 ME (инъекция 0,02 мл в центр опухоли)
51 ИЛ-2 на периферии повреждения 20000 ME (одна точка применения дозы в область, окруженную точками применения DECA)
6й интраперитонеальный ИЛ-2 20000 ME
OBS.: Ежесуточно, начиная с суток 7: 20000 ME ИЛ-2 внутрь повреждения (2 раза в сутки)
Результаты
Результаты показали, что через 28 суток после инокуляции опухолевых клеток объем опухоли достигал своего пика, составляющего 6728,65±2027,01 мм3 (среднее±SEM), причем, выживаемость животных составляла 33,3% (3 из 9 животных, участвовавших в исследовании, оставались живыми в течение 30 суток после инокуляции клеток B16F10) (фиг. 1). Несмотря на отсутствие статистически значимого различия, в группе животных, которая получала обработку DECA, на 28е сутки после запуска модели был представлен более низкий объем опухолевой массы по сравнению с контрольной группой (3524,87±871,01 мм3), и выживаемость составляла 50% (5 из 10 животных, участвовавших в исследовании). Важно упомянуть, что, хотя данное значение не является значимым, на 28е сутки ингибирование опухоли составляло 47,6% в отношении объема опухоли (по сравнению с контрольной группой), а отсутствие значимости может являться результатом стандартной ошибки среднего, проявляемой контрольной группой. Для группы DECA+ИЛ-2 результаты показали, что данное сочетание способно значимо уменьшить объем опухоли, начиная с суток 13 (57% ингибирования) вплоть до суток 28, когда наблюдали приблизительно 67% ингибирования (2198,36±450,39 мм3), причем, выживаемость составляла 80% (8 из 10 животных, участвовавших в исследовании). Кроме того, животные проявляли хорошую переносимость повторной обработки ИЛ-2. В клинической практике ИЛ-2 вводят в высокой дозе (600000-720000 МЕ/кг), и наблюдаемые токсические симптомы сравнимы с индукцией контролируемого состояния септического шока (низкое кровяное давление, низкая системная сопротивляемость сосудов, печеночная и почечная токсичность, кроме того, отек легких) (Rosenberg SA, Yang YC, Topalian SL, et al. Treatment of 283 consecutive patients with metastatic melanoma or renal cell cancer using high-dose bolus interleukin-2. JAMA, 271: 907-913, 1994). Анализ, представленный на фиг. 1В, подтверждает данные фиг. 1А, показывающие, что уменьшение объема связано со снижением скорости роста опухоли (для группы DECA+ИЛ-2).
В целом результаты показали, что обработка комбинацией DECA+ИЛ-2, кроме снижения скорости роста/объема опухоли (фиг. 1) повышала выживаемость животных по сравнению с контрольной группой (наполнитель) (фиг. 2), что позволяет предположить, что данная комбинация полезна при лечении меланомы.
Пример 3: Лечение метастатической злокачественной меланомы при четвертом рецидиве
Данные пациента
Пациент MBS, 46 лет, женщина.
Диагноз
Метастатическая злокачественная меланома при четвертом рецидиве, уровень по Кларку III и показатель Бреслоу 1,32 мм2, диагностированная 16/05/2006.
Предшествующее традиционное лечение
а. Первая онкологическая операция
Операция была проведена 01/06/2006 с целью расширения края в сайте опухоли с биопсией сигнального лимфатического узла, который оказался отрицательным по злокачественности. Дополнительное иммуногистохимическое патологическое исследование лимфоузла показало присутствие микрометастазов, самый большой из которых имел размер 0,17 мм, что апостериорно подтвердило диагноз метастатической и иммуногенной злокачественной меланомы на основании присутствия антигена Melan A.
b. Вторая онкологическая операция
20/02/2008 было проведено удаление двух поверхностных узлов, подозреваемых на рецидив, в левом бедре, и патологическое исследование выявило диагноз метастатической злокачественной меланомы. Затем было проведено расширение хирургического края с биопсией всех повреждений, прооперированных 09/04/2008.
с. Третья онкологическая операция
Восемь месяцев спустя (15/10/2008) в коже левого бедра появился второй рецидив, который показал метастатическую злокачественную меланому, причем, повреждение совпадало с хирургическим краем. Снова было проведено расширение хирургического края, и 27/11/2008 патологическое исследование не выявило остатков опухоли в хирургическом крае.
d. Четвертая онкологическая операция
13/05/2010 новое повреждение было диагностировано в ягодичной области, и было удалено хирургическим путем 19/05/2010 без теста на замораживание. Новый образец показал метастатическую меланому с нарушенными хирургическими краями, что указывало на третий рецидив заболевания.
е. Результаты четвертой онкологической операции с предварительным введением композиции DECA
23/06/2010 было проведено исследование с помощью позитронно-эмиссионной томографии (ПЭТ)/компьютерной томографии (KT), которое показало наличие опухолевого повреждения, что доказало четвертый рецидив опухоли. Короткое время, за которое из остаточного повреждения образовался четвертый рецидив, показывает агрессивную природу метастатических клеток.
Иммунологическая оценка предварительного введения композиции DECA
Иммунологическая оценка, отчасти состоящая в тестах крови in vitro (клинический анализ крови, фенотипирование лимфоцитов, доза иммуноглобулинов, радиоаллергосорбентный (PACT) тест (на аллергическую реакцию), электрофорез белков острой фазы и тестирование аутоиммунности) и in vivo (тест на первичную и вторичную аллергическую реакцию замедленного типа).
Тесты на аллергическую реакцию замедленного типа проводили с вторичной "батареей" из девяти следующих антигенов, вводимых в количестве 0,1 см3: туберкулин Коха 1:100000; 2) PPD 20 МЕ/мл; 3) стафилококковый токсин 1:100; 4) стрептококковый токсин 1:100; 5) стрептокиназа/дорназа 40/10 ед./мл; 6) оиодиомицин 1:100; 7) трихофитин 1:100; 8) Escherichia coli 1:100; 9) Salmonella spp.1:100.
Тесты на первичную аллергическую реакцию замедленного типа проводили, используя кожную сенсибилизацию пластырями с динитрохлорбензолом (ДНХБ) 0,5% и 2%.
Результат иммунологической оценки, выраженный в изменении белков острой фазы, состоящий в повышении СОЭ, С-реактивного белка (CRP; от англ. С-reactive protein), альфа-1-кислого гликопротеина, показывает системный воспалительный ответ в результате опухолевого роста после операции согласно анализам крови, проведенным 12/06/2010.
Оценка первичной аллергической реакции показала, что эта реакция прекращена. Было показано снижение вторичной системной аллергической реакции замедленного типа, составляющее +/++ при норме +++++ для внутриклеточных антигенов и норму ++/++++ для других антигенов, на расстоянии от опухоли. В областях рецидивов все антигены показали значительно сниженный ответ 0/+ для внутриклеточных антигенов и +/+++ при норме +++++ для других антигенов. В периферической области опухоли реакция оказалась практически прекращена, составляя 0/0 для внутриклеточных антигенов и 0/+ для других антигенов.
Эти результаты вторичной аллергической реакции замедленного типа также показали значительное подавление иммунитета.
Лечение композицией DECA
Начато 26/06/2010 и закончено 04/08/2010 при периоде ожидания в течение выдачи договора медицинского страхования на операцию. Лечение иммунотерапией было проведено при свободном и информированном согласии пациента. Иммунотерапию DECA проводили, как описано ниже:
- Введение 1,8 см3 антигенной композиции, разделенное на 2 введения по 0,9 мл, вблизи 10 основных лимфатических бассейнов.
- Предельное расстояние между введениями составляет 3-4 см, чтобы облегчить оценку изменения лечения с интервалом, составляющим 4±1 суток.
- Введение девяти дополнительных серий по 1,8 см3 на периферии, состоящих из двух введений по 0,9 см3 на серию, обходя рубцы от первой операции, второго и третьего рецидива, а также область четвертого и пятого рецидива, также через интервал, составляющий 4±1 суток.
- На основании оценки второго введения сочетанное применение внутриопухолевого введения проводили в объеме, эквивалентном десяти композициям по 1,8 мл.
- Введение рекомбинантного интерлейкина-2 человека в низких дозах, составляющих уровень насыщения рецептора, при концентрации, составляющей от 1 до 2 млн. единиц на квадратный метр поверхности тела, на расстоянии 5 см от повреждения. Пациенту вводили 1 млн. единиц ежесуточно, подкожно. На сутки введения антигена после введения давали две дополнительные дозы, составляющие 1 млн. единиц, одну внутрь области на периферии повреждения, и другую во внутриопухолевую область. В этих случаях данные введения суммарно составляли 3 млн. единиц, что все же находилось в пределах рекомендуемой низкой дозы на поверхность тела.
Таким образом, вплоть до срока операции было проведено 11 сеансов системной иммунотерапии и иммунотерапии на периферии повреждения, с 24/06/2010 по 02/08/2010, а также 5 одновременных внутриопухолевых введений с интервалом, составляющим 4±1 суток, или через сутки после системного введения и введения на периферии повреждения.
Интересно упомянуть, что ультразвуковые исследования Доплера (19/07/2010 и 04/08/2010) позволяют предположить преобразование опухоли в область воспаления при отсутствии ангиогенеза.
Оценка лечения с помощью иммунотерапии DECA
После пятой операции 05/08/2010 исследование замороженного среза показало отсутствие опухоли в обработанной области, в которой проводили только консервативное удаление воспалительного повреждения.
Результат лечения с помощью иммунотерапии DECA
Послеоперационное патологическое исследование 05/08/2010 показало наличие гранулем в виде частокола с центральным некрозом, кожу с плотным хроническим воспалительным инфильтратом, включающим инородное тело гигантоклеточную гранулему, описанную выше, отсутствие остаточного новообразования и хирургические края, свободные от рака.
Иммуногистохимическое исследование выявило полное отсутствие опухолевых клеток в хирургически удаленной ткани, предварительно обработанной DECA, в соответствии с пределами доступных диагностических методов (фиг. 3).
После первых двух применений описанного выше протокола пациент выздоровел от наблюдаемого подавления иммунитета, о чем свидетельствовала нормализация и гиперактивация всех точек применения иммунотерапии, как у нормального пациента. Эти результаты показывают восстановление Т-петли и всего профиля клеточного иммунитета Th1 пациента, который был подавлен опухолью. Одновременно иммунотерапия создала воспалительный процесс, в который была вовлечена вся опухоль, полностью некротизировала ее и устранила ее, как показано с помощью ультразвуковых исследований и подтверждено гистологическим исследованием.
С 07/08/2010 по 30/11/2011 пациента лечили таким же системным путем и путем введения на периферии повреждения дважды в неделю, а также дозой рекомбинантного интерлейкина-2 человека, составляющей 600000 единиц ежесуточно, то есть ниже уровня насыщения рецептора. С этого времени пациент получает еженедельное введение антигенов и ежесуточное введение интерлейкина-2. Таким образом, данный пациент не имеет опухоли в течение 18 месяцев.
Заключение по случаю
Оцениваемые данные и клинические результаты пациента уже в значительной степени позволяют предположить, что иммунотерапия иммуногенными композициями по настоящему изобретению ответственна за устранение опухоли.
Пример 4: Лечение злокачественной меланомы
Данные пациента
Пациент РРС, 62 года, мужчина.
Диагноз
Злокачественная меланома, уровень по Кларку II и показатель Бреслоу 1,2 мм2, диагностированная 02/02/2011.
Предшествующие терапии
В данном случае предшествующее лечение не было проведено, поскольку иммунотерапия DECA была проведена перед операцией первичной раковой опухоли после прохождения срока свободного и информированного согласия.
Иммунологическая оценка перед введением DECA
Поскольку на предварительную иммунологическую оценку не было времени в связи с необходимостью провести операцию в кратчайшие возможные сроки, данную оценку проводили путем оценки антигенов, применяемых во время лечения DECA.
Лечение DECA перед онкологической операцией
В предоперационном периоде (с 10/02/2011 по 17/02/2011) лечение пациента было начато на следующей основе:
- Введение параллельно 10 основным лимфатическим бассейнам 1,8 см3 композиции 1 или DECA, разделенное на 2 введения по 0,9 см3
- Предельное расстояние между введениями составляет 3-4 см, чтобы облегчить оценку изменения лечения с интервалом, составляющим 4±1 суток.
- Введение 2 дополнительных серий по 1,8 см3 DECA, разделенное на 2 введения по 0,9 см3 для каждой композиции, обходя опухоль меланому на первые сутки лечения.
- Внутриопухолевое введение пяти композиций DECA по 1,8 см3 каждой, причем, конечный объем составлял 9,0 см3
- Введение низких доз рекомбинантного ИЛ-2 человека на уровне насыщения рецептора при концентрации, составляющей от 1 до 2 млн. единиц на м2 поверхности тела на расстоянии 5 см от повреждения. Пациенту вводили 1 млн. единиц ежесуточно, подкожно.
Таким образом, к сроку операции была проведена следующая иммунотерапия: 2 сеанса системной иммунотерапии, 1 сеанс иммунотерапии на периферии повреждения и 1 сеанс внутриопухолевой иммунотерапии, причем, два последних сеанса были проведены на первые сутки лечения. С данным лечением сочетали ежесуточное введение рекомбинантного интерлейкина-2 человека в описанной выше дозе и описанным выше способом.
Результат лечения иммунотерапией DECA перед онкологической операцией
За данный 8-суточный период терапии пациент хорошо реагировал на иммунологическую терапию при полной регрессии злокачественной меланомы. Преобразование повреждения в опухоли частично прогрессировало при интенсивном локальном воспалительном процессе, который некротизировал и исчезал, уступая воспалительному процессу, описанному при хирургической патологии. Необходимо упомянуть, что в данный период у пациента проявлялись следующие явления: эпизоды сильной и слабой лихорадки и интенсивная воспалительная ипсилатеральная паховая аденопатия.
Традиционное лечение хирургическим удалением рака
Была предложена полная эксцизия первичной опухоли с широким хирургическим краем безопасности с внутриоперационным исследованием сигнального лимфатического узла.
Традиционная онкологическая операция первичной опухоли 18/02/2011 пациент был прооперирован, и проведена полная эксцизия опухоли с широким хирургическим краем безопасности, и исследование двух сателлитных лимфоузлов выявило отрицательную злокачественность. В связи с этим дренаж узлов не проводили.
Результаты традиционной онкологической операции первичной опухоли
Патологическое исследование подтвердило состояние полной регрессии опухоли:
- На коже: воспалительные изменения с областью изъязвления, покрытой фибрино-лейкоцитарным кэпом, представляющим собой избыточную грануляционную ткань в основании со смешанным воспалительным инфильтратом. Эта инфильтрация проникает и распространяется через эпителий по краям этой язвы, также с многоядерными гигантскими клетками типа инородного тела. Беловатый куполообразный участок, описанный на микроскопии, соответствует себоррейному кератозу папилломатозного типа с акантозом, гиперкератозом и папилломатозом эпидермиса. Вся кожа была подвергнута гистологическому исследованию, и остаточное меланоцитарное новообразование не было обнаружено.
- В сигнальном лимфатическом узле I: обширный фиброз прикорневого участка и подкапсулярный и синусный гистиоцитоз, причем, с помощью морфологического исследования метастатические отложения не идентифицированы;
- В сигнальном лимфатическом узле II: гистологическая картина, сходная с картиной, описанной для узла I, при морфологическом исследовании не выявлены метастатические отложения.
К настоящему времени иммуногистохимические исследование сигнальных лимфатических узлов I и II не показало микрометастазов меланомы.
Иммуногистохимическое исследование первичной опухоли выявило полное отсутствие опухолевых клеток в ткани, удаленной при операции, предварительно обработанной композицией DECA, в соответствии с ограничениями доступных диагностических методов (фиг. 4).
Результаты лечения первичной опухоли композицией DECA до онкологической операции
Эти данные, полученные посредством операции в пределах контекста и ограничений доступных диагностических методов, показали неожиданные результаты, поскольку первичная опухоль после лечения посредством иммунотерапии DECA не была обнаружена.
Лечение DECA после онкологической операции
При данном результате полной регрессии опухоли иммунотерапия была продолжена на следующей основе:
- Введение параллельно 10 основным лимфатическим бассейнам 1,8 см3 композиции 1 или DECA, разделенное на 2 введения по 0,9 см3.
- Предельное расстояние между введениями составляет 3-4 см, чтобы облегчить оценку изменения лечения с интервалом, составляющим 4±1 суток.
- Введение 2 дополнительных композиций по 1,8 см3 каждой на периферии повреждения, при двух введениях по 0,9 см3 на композицию, обходя широкий операционный рубец, без промежутка между ними, также с интервалом 4±1 суток.
- Ежесуточное введение рекомбинантного интерлейкина 2 человека в низких дозах, на уровне насыщения рецептора при концентрации, составляющей от 1 до 2 млн. единиц на м2 поверхности тела на расстоянии 5 см от операционного рубца. Пациенту вводили 1 млн. единиц на м2 поверхности тела на введение.
Результаты лечения DECA после онкологической операции Операционное поле удаления двух сателлитных лимфатических узлов в паховой области изменялось с образованием скопления жидкости, подтвержденного 16/03/2011 с помощью ультрасонографии, показавшей: простое кистозное образование, имеющее размер 6,0 × 5,2 × 3,1 см, с размытием примыкающих плоскостей жировой ткани, и с помощью цветового Доплера не наблюдали аномальной васкуляризации или изменений сосудов опухолевого типа.
Это описанное выше скопление развивалось при локальном воспалительном процессе, и на ультрасонографии 28/03/2011 обнаружено уменьшение его размера и увеличение воспалительной аденопатии. С помощью цветового Доплера в данном образовании не было обнаружено аномальной васкуляризации. По поводу исследования, проведенного 16/03/2011, отмечено: 1) заметное уменьшение образования, которое ранее имело кистозную картину, что позволяет предположить значительную реабсорбцию и организацию, свидетельствующую в пользу воспалительной/реактивной гипотезы (послеоперационное скопление); это также наблюдали в левых паховых лимфатических узлах; 2) увеличенный размер лимфатических узлов, сохраняющих васкуляризированный корень и реактивные явления, расположенный медиально и проксимально к упомянутому выше образованию, имеющему размер 1,6 × 0,8 см и 2,4 × 1,7 см.
Иммунотерапия была продолжена до 31/07/2011, и объективное обследование выявило полную регрессию повреждений и переход интенсивной регионарной реакции лимфоаденопатии в остаточную регионарную реакцию лимфоаденопатии.
5 и 8 июля 2011 повторное обследование позитронно-эмиссионной томографией (ПЭТ)/компьютерной томографией (KT) и исследование цветовым "Доплером" мягких тканей и ультразвуковое исследование левой ноги и левой паховой области, соответственно, подтвердило воспалительную природу и полную регрессию повреждений, причем, осталась лишь остаточная реакция воспалительной аденопатии. Также отмечена регрессия диффузного повышения метаболической активности в костном мозге осевого и аппендикулярного скелета, показывающая действие DECA на стимуляцию костного мозга при восстановлении иммунного ответа, что демонстрирует способность данной композиции к стимуляции и регенерации тканей.
Обсуждение результатов лечения DECA до и после традиционной онкологической операции
Речь идет о злокачественной меланоме, размер которой составлял приблизительно 1 см, из которой после операции брали однократную биопсию. Эта опухоль была мишенью иммунотерапевтического лечения батареей из 9 антигенов в сочетании со сниженными дозами рекомбинантного интерлейкина-2 человека, как раскрыто выше. Данное лечение вызвало интенсивную воспалительную реакцию, в которую было вовлечено все повреждение, приводящую к некрозу и изъязвлению всей области опухоли, причем, данная реакция исчезла в течение 8 суток лечения.
После этого периода пациенту была сделана операция, и патологическое исследование подтвердило замещение опухолевой ткани изъязвлением при полном отсутствии опухолевых клеток, окруженным интенсивным воспалением, имеющим характеристики гранулемы, обусловленной инородным телом (фиг. 4В).
Патологическое исследование двух сигнальных лимфатических узлов доказало реактивную лимфоидную гиперплазию с интенсивным подкапсулярным синусным гистиоцитозом и обширным фиброзом прикорневой области, причем, метастатические отложения не были идентифицированы. Иммуногистохимическое исследование подтвердило это наблюдение, подтверждая отсутствие микрометастазов в этих лимфатических узлах.
Область, из которой были удалены сателлитные лимфатические узлы, изменялась с образованием скопления жидкости, находящегося внутри воспалительного процесса, при повышенном реакционном воспалительным местно-регионарным лимфаденитом, показывающим хороший иммунный ответ. При продолжении лечения интенсивный воспалительный процесс, окружающий данное скопление жидкости, вызвал его регрессию и абсорбцию, сопровождающуюся неопухолевой воспалительной реакцией сателлитных лимфатических узлов.
Исследования с помощью ультрасонографии Доплера и ПЭТ-КТ продемонстрировали предполагаемую неопухолевую воспалительную картину, доказывая отсутствие опухолевой массы. Данные исследования показывают, что интенсивная регионарная воспалительная реакция и повышенная активность костного мозга свидетельствуют о сильном и эффективном противоопухолевом иммунном ответе.
Заключение по случаю
Оцениваемые данные и клинический результат к настоящему времени надежно позволяют предположить, что иммунотерапия с применением композиций по настоящему изобретению в качестве единственной терапии, применяемой перед операцией первичной раковой опухоли, ответственна за наблюдаемое устранение опухоли в течение 8 суток.
Пример 5:
Лечение распространенной микротубулярной аденокарциномы желудка с перитонеальным канцероматозом и интраабдоминальным метастазированием лимфатических узлов
Данные пациента
Пациент R - М, 72 года, мужчина
Диагноз
Распространенная микротубулярная аденокарцинома желудка с перитонеальным канцероматозом и интраабдоминальным метастазированием лимфатических узлов.
Проведенные исследования
а. Традиционная эндоскопия верхних отделов желудочно-кишечного тракта и патологическое исследование
Эндоскопия верхних отделов желудочно-кишечного тракта 12/06/2008 показала распространенное и стенозирующее новообразование антрального отдела желудка, подтвержденное патологическим исследованием 13/06/2008 при биопсии.
b. Традиционная визуализация
20/06/2008 была проведена дооперационная томография брюшной полости и тазовых органов для проверки стадии рака желудка с заключением о том, что рак представляет собой распространенную аденокарциному желудка с перитонеальным канцероматозом на основании диссеминирующей непрерывности и расширенных лимфатических узлов во множественных областях, причем, размер самого большого из них составлял 4 см (фиг. 5, А1-А3).
с. Послеоперационная иммунологическая оценка
Первая консультация была проведена 23/07/2008 после операции, и были проведены традиционные исследования и иммунологическая оценка 24/07/2008.
Традиционные исследования показали слабую микроцитарную анемию (гемоглобин (Hb) = 11,7 г/дл (норма (NV; от англ. Normal value) = 13-18 г/дл, гематокрит (НТ) = 37,1% (NV = 40-54%) и микроцитоз, нормоцитоз, макроцитоз (VCM) = 70 U3 (NV = 80-97 U3) и гипертромбоцитоз (755000 (NV = 150000-450000/мм3)), лимфоцитоз (9100/мм3 (NV = 4000-11000/мм3), гипергликемию (155 мг/дл (NV = вплоть до 99 мг/дл), повышенное СОЭ 110 мм/ч, повышенное содержание мочевой кислоты (7,3 мг/дл (NV = вплоть до 7,0 мг/дл), повышенный С-реактивный белок (CRP) (0,6 мг/дл; NV составляет вплоть до 0,5 мг/дл), высокий альфа-1-кислый гликопротеин (141 мг/дл (NV = вплоть до 140 мг/дл) и повышенную амилазу, составляющую 170 ед/л (NV = 25-125 ед./л).
После операции была проведена иммунологическая оценка с помощью описанных ниже исследований in vitro (анализов крови) и in vivo (первичная и вторичная аллергическая реакция).
Исследования in vitro состояли в следующем; уровни Т-зависимого иммуноглобулина, которые оказались близкими к максимальным нормальным значениям (Ig А 324 (NV = 82-453), Ig G 1476 (NV = 751-1560), IgM 200 (NV = 46-304) и Ig E 61,89 (NV = 100)), PACT отрицательный для всех исследований, бета-2-микроглобулин 2496 (NV = вплоть до 2030), нормальное иммунофенотипирование CD3+Т лимфоцитов при нормальном количестве CD4+ клеток (43,3% (845/ мм3) NV = 27-57% (560-2700/мм3)), сниженный уровень CD8+ при абсолютных и относительных значениях (242/мм3 NV = 14-34% (330-1400/мм3) и высоком отношении CD4+/CD8+ (3,49 NV = 0,98-3,24).
Исследования in vivo:
- первичная аллергическая реакция замедленного типа: тестирование с помощью кожного пластыря, содержащего 0,5% и 2% ДНХБ.
- вторичная аллергическая реакция замедленного типа.
Результаты показали следующее:
- доказано, что первичная реакция прекращена.
- показано, что системная вторичная аллергическая реакция замедленного типа снижена до 0/+ при норме +++++ для внутриклеточных антигенов и снижена до +/++ для других антигенов на расстоянии от опухоли. В области около рубца для всех антигенов показана прекращенная реакция 0/+ для внутриклеточных антигенов и 0/+ при норме +++++ для других антигенов.
Данные исследования in vivo и in vitro показали значительное подавление иммунитета для первичного и вторичного, местного и системного клеточного иммунитета Th1 профиля, который ответственен за противоопухолевый иммунитет и устранение опухолевых клеток, и механизм ускользания опухоли от иммунного надзора, осуществляемого Th2, причем, ответ антител преобладал над клеточным ответом. Первичное подавление иммунитета с утратой целостности Т петли при отсутствии возможности создания нового Т ответа в сочетании с разрушением профиля клеточного иммунитета Th1, ответственного за противоопухолевый иммунитет, а также преобладание реакции ускользания антител над клеточным ответом свидетельствует о нарушенной иммунной системе, подавленной опухолью, при отсутствии ее собственных шансов сдерживания заболевания.
d. Диагностическое заключение
Стенозирующая распространенная микротубулярная аденокарцинома желудка с перитонеальным канцероматозом в результате непрерывного метастазирования и обширное метастазирование лимфатических узлов во множественных лимфатических бассейнах, самый большой из которых имеет размер, составляющий 4 см.
Лечение
е. Традиционная операция
Лечение (11/07/2008) представляло собой частичную гастрэктомию с паллиативной реконструкцией В2 с частичной лимфаденэктомией.
Патология частичной и паллиативной гастрэктомии и лимфаденэктомии 11/07/2008 показала обширное остаточное распространенное новообразование.
f. Традиционная химиотерапия и радиотерапия
Поскольку заболевание представляло собой распространенный рак желудка с перитонеальным канцероматозом и интраабдоминальным метастазированием лимфатических узлов без возможности излечения путем операции и химиотерапии, была предложена радиотерапия в сочетании с инкурабельной химиотерапией 5-фторурацилом и таксотером циклами, составляющими 21 сутки, для контроля опухолевой массы, а также, чтобы улучшить как качество жизни, так и шансы пациента на выживание. Данная химиотерапия была проведена с 14/08/2008 по 26/12/2008. 25 сеансов радиотерапии были начаты 10/10/2008 и окончены 13/11/2008.
g. Лечение DECA
По вышеуказанным причинам, для улучшения состояния пациента и для возможных благоприятных результатов данной фармакологической комбинации была предложена комбинация иммунотерапии с паллиативной химиотерапией.
Иммунотерапия была проведена за одну неделю (два введения DECA) до начала химиотерапии и продолжена на второй и третьей неделе после первой недели и при каждом 21-суточном цикле химиотерапии. Таким образом, химиотерапия не была прервана, в то время как иммунотерапию проводили в течение периода, составляющего 2 недели, с интервалом в 1 неделю.
Протокол DECA выполняли, как описано ниже:
- Введение 1,8 см3 композиции DECA за два введения по 0,9 см3 в 10 из основных лимфатических бассейнов.
- Предельное расстояние между введениями составляет 3-4 см, чтобы облегчить оценку изменения лечения с интервалом, составляющим 4±1 суток.
- С момента применения 4го введения все ответы нормализовались и стали гиперергическими.
- Введение рекомбинантного интерлейкина-2 в низких дозах на уровне насыщения рецептора при концентрации, составляющей от 1 до 2 млн. единиц на м2 поверхности тела пациента по 600000 единиц ежесуточно, вводимых вблизи операционного рубца.
h. Результаты лечения
i. Традиционное лечение
Одно традиционное лечение (операция) было проведено паллиативным путем, чтобы разрешить закупорку желудка пациента.
ii. Лечение DECA в сочетании с химиотерапией
Тесты на первичную аллергическую реакцию замедленного типа пациента нормализовались за один месяц, а вторичная аллергическая реакция замедленного типа нормализовалась за две недели, что свидетельствует о восстановлении Т петли клеточного ответа. За две недели признаки и симптомы системного воспаления и инфекции исчезли.
Пациента повторно обследовали через шесть месяцев после лечения DECA и сочетанной химиотерапии (начатой, соответственно, 06/08/2008 и 14/08/2008). После шести месяцев (09/02/2009) иммунологического лечения и сочетанной химиотерапии результаты были следующими:
- значительное уменьшение большей части абдоминальной лимфоаденомегалии;
- значительное уменьшение признаков канцероматоза.
- полная ремиссия подавления иммунитета с позитивизацией после 4 недель лечения показателей вторичной аллергической реакции замедленного типа, показывающих положительную реакцию 3+/4+ при 5+ для 9 ранее переносимых антигенов. Первичная аллергическая реакция замедленного типа, ранее прекращенная, стала положительной также после 1 месяца лечения.
После 9 месяцев (13/05/2009) описанного выше лечения результаты были следующими:
- уменьшение лимфаденомегалии чревного ствола с 2,0-1,6 см до 1,4 см при отсутствии дополнительной лимфаденомегалии (фиг. 5, В2-В3).
- ослабление фиброзно-рубцовой картины, показывающее исчезновение признаков канцероматоза (фиг. 5, В1).
- неизмененный левый плевральный экссудат.
После 1 года и 2 месяцев (03/10/2009) вышеописанного лечения результаты были следующими:
- Значительное уменьшение левого плеврального экссудата;
- уменьшение лимфаденомегалии чревного ствола с 1,4 см до 1,3 см при отсутствии дополнительной лимфаденомегалии.
- Ослабление фиброзных Рубцовых изменений операционной полости.
После 1 года и 8 месяцев (13/04/2010) вышеописанного лечения результаты были следующими:
- рассасывание левого плеврального экссудата.
- неизмененная лимфаденомегалия чревного ствола (фиг. 5, С2).
После 1 года и 11 месяцев (31/07/2010) вышеописанного лечения результаты были следующими:
- уменьшение лимфаденомегалии чревного ствола с 1,3 см до 1,1 см при отсутствии дополнительной лимфаденомегалии.
- полное исчезновение печеночных узелков.
После двух лет и четырех месяцев (18/02/2011) вышеописанного лечения результаты были следующими:
- неизмененная грудная клетка.
- сохранение размера лимфатических узлов чревного ствола, составляющего 1,1 см.
Заключение по случаю
Сочетание радио-, химио- и иммунотерапии, проведенной с августа по декабрь 2008, привело к полной ремиссии подавления иммунитета и значительному уменьшению обоих симптомов: канцероматоза и лимфаденомегалии в верхней части брюшной полости. Печеночные узелки и увеличенные лимфатические узлы чревного ствола остались, размер самого большого из них составлял 1,6 см.
С момента данного обследования, начиная с февраля 2012, была назначена исключительно иммунотерапия. В результате этого лечения можно наблюдать следующие результаты: полную ремиссию подозрительных печеночных узелков, исчезновение признаков канцероматоза и значительное уменьшение лимфатических узлов с 2,0-1,6 см до 1,1 см.
Эти данные надежно позволяют предположить, что иммунотерапия была эффективна как дополнение к радиотерапии и химиотерапии, а при отдельном ее применении она была эффективна для индукции и поддержания ремиссии опухоли после 3 лет и 6 месяцев лечения (фиг. 5, С1, С3).
Пример 6
Лечение множественной воспалительной псевдоопухоли, обусловленной вирусом герпеса человека типа VIII
Данные пациента
Пациент A-D, 40 лет, женщина.
Диагноз
Множественная воспалительная псевдоопухоль, обусловленная вирусом герпеса человека типа VIII.
История болезни
а. История болезни
На консультации 04/06/2006 представлена история повышенной температуры тела по вечерам (от 37,5 до 37,8°С), головной боли, утомляемости и одышки при легкой нагрузке. При клиническом обследовании пациента обнаружено следующее: фебрилитет, адинамия, некоторое изнурение при редких хрипах в обоих легких и значительной гепатоспленомегалии.
b. Проведенные исследования
Традиционное тестирование крови
Лабораторные анализы 05/10/2006 показали картину инфекции/воспаления: СОЭ = 41 мм (NV не более 10 мм), CRP = 3,83 мг/дл (N не более 0,50 мг/дл), альфа-1-кислый гликопротеин = 1,66 мг/дл (N = 50-120 мг/дл), гипокальцемию Са2+ = 7,4 мг/дл (N = 8,6-10,3 мг/дл), слабую тромбоцитопению, поскольку счет тромбоцитов составлял 143000/мм3 (NV = 150000-450000 мм3), протеинурию 0,66 г. 05/10/2006 серологическое обследование было отрицательным по следующим возбудителям: токсоплазмоз, лихорадка Денге, бруцеллез, вирус иммунодефицита человека (ВИЧ), вирусы гепатита А, В и С; Paracoccus spp., Histoplasma spp.Прямая полимеразная цепная реакция (ПЦР) была отрицательной по следующим антигенам: Cryptococcus spp.и Histoplasma spp.Серологическое исследование показало прежнюю инфекцию цитомегаловируса, вируса Эпштейна-Барр (ЭБВ) (мононуклеоз) и краснухи. При этом анализ на IgM против вируса герпеса был положительным. Данное состояние, обусловленное вирусом герпеса типа VIII при перекрестной реактивности между данным типом и типом I и II, позволяет предположить инфекцию вирусом человека серотипа VIII.
Традиционная визуализация
Компьютерная томография грудной клетки 09/10/2006 выявила следующее: множественные двухсторонние легочные узелки, размер которых составлял вплоть до 3,0 см, зону опухолевой картины неправильной формы, размер которой составлял 5,0 см, в левой верхушке, правильную воздушную бронхограмму и вздутие в правой средней доле (RML; от англ. "right middle lobe"), примыкающее к плевре (фиг. 6А). Томография брюшной полости подтвердила значимое наличие в настоящий момент гепатоспленомегалии с множественными узлами вокруг корня брыжейки, печеночных узелков и селезеночных узелков. Была также выявлена картина верхнечелюстного синусита и отека и гипертрофии носовых ходов.
Традиционное патологическое исследование
Патологическое исследование доказало комплекс, показывающий воспалительный процесс с множеством гистиоцитов. Исследование было направлено пульмонологу. Анализ гистиопатологического диагноза подтвердил редкое заболевание, представляющее собой воспалительную псевдоопухоль.
Иммунологическая оценка
Иммунологическая оценка была проведена 05/10/2006 с помощью следующих тестов in vitro (анализы крови) и in vivo (первичная и вторичная аллергическая реакция).
Тесты in vitro показали следующую клиническую ситуацию: нормальную дозу иммуноглобулинов (IgG, IgA, IgE), суммарный комплемент и С3 и С4 в соответствии с нормальными стандартами, иммунофенотипирование общих CD3+ Т лимфоцитов, сниженных по абсолютному показателю (715/мм3 - нормальный минимум = 1035/мм3), что свидетельствует о Т-лимфопении при нормальном показателе CD4+ (54% (551/мм3) NV = 35-62% (535-2580/мм3)), сниженные CD8+ клетки по абсолютным показателям (163/мм3 NV = 17-43% (255-1720/мм3) и высокое отношение CD4+/CD8+ (3,4 NV = 0,9-2,6).
Эти результаты показали нормальный гуморальный иммунитет и нормальную систему комплемента, тем не менее, с отсутствием реактивности, то есть не вовлеченную в иммунологический ответ на текущую инфекцию. Иммунофенотипирование показало текущую Т-лимфопению и Т-ответ за счет высокого отношения CD4+/CD8+ (хелперные клетки преобладают над супрессорными/цитотоксическими клетками). Инфекционный агент вызвал поляризацию в сторону ответа клеточного типа Th1.
Исследования in vivo:
- первичная аллергическая реакция замедленного типа: тестирование с помощью кожного пластыря, содержащего 0,5% и 2% ДНХБ.
- вторичная аллергическая реакция замедленного типа.
Результаты показали следующее:
- показано, что первичная реакция прекращена.
- показано, что системная вторичная аллергическая реакция замедленного типа снижена.
Заключение иммунологической оценки: исследование in vivo и in vitro показало, что инфекционный агент вызвал поляризацию в направлении Т-клеточного ответа Th1 типа. Неэффективность данного ответа показывает лимфопения и разрыв Т-петли на основании прекращения первичной аллергической реакции замедленного типа, что указывает на неспособность к осуществлению нового первичного ответа, и вторичной аллергической реакции замедленного типа, свидетельствующей о сниженной клеточной памяти и нарушенной эффекторной петле.
Диагностическое заключение
Множественная воспалительная псевдоопухоль (ассоциированная с вирусом герпеса человека типа VIII и обусловленная им) в сочетании с подавлением Т-иммунитета.
Лечение
Традиционное лечение
Хирургическое вмешательство составляет эффективную форму лечения, и этиология обусловлена вирусом герпеса типа VIII, что объясняет перекрестную реактивность с положительным IgM на вирус герпеса I и II. Описаны случаи рецидива хирургической резекции. В научной литературе отсутствуют аналоги данного случая, при котором имеются множественные легочные узелки, абдоминальные узелки (при корне брыжейки) и гепатоспленомегалия с воспалительной системной гипокальциемией. Поэтому операция не может быть радикальной. Можно сделать вывод, что наблюдаемое сильное подавление Т-иммунитета могло внести вклад в необычную и множественную форму этого редкого заболевания.
Лечение DECA
Вследствие наблюдаемого подавления иммунитета и невозможности хирургического лечения (в связи с множественными очагами) при свободном и информированном согласии было решено лечить это подавление иммунитета композицией DECA в течение периода, составляющего приблизительно два месяца, после которого пациент подлежал повторной оценке. Протокол состоял в следующем:
- Введение трех композиций DECA по 1,8 см3, разделенное на два введения по 0,9 см3 на композицию, в брюшную полость и два введения по 1,8 см3 DECA, разделенных на два введения композиции по 0,9 см3, соответственно, в каждую верхнюю правую и левую конечность, по 0,9 см3 в плечо и 0,9 см3 в предплечье с двух сторон, около 10 основных лимфатических бассейнов.
- Предельное расстояние между введениями составляет 3-4 см, чтобы облегчить оценку изменения лечения с интервалом, составляющим 7±2 суток.
- Введение рекомбинантного интерлейкина-2 человека в низких дозах на уровне насыщения рецептора при концентрации, составляющей от 1 до 2 млн. единиц на м2 поверхности тела пациента по 600000 единиц ежесуточно, при введении в брюшную полость.
I. Результаты лечения
I. Традиционное лечение
В данном случае терапевтические альтернативы отсутствовали, поскольку операция была бы неэффективной против множественных манифестаций заболевания.
II. Лечение DECA
У пациента нормализовались результаты теста на первичную аллергическую реакцию замедленного типа в течение месяца, а на вторичную аллергическую реакцию замедленного типа за две недели, что демонстрирует восстановление Т-петли клеточного ответа. За две недели признаки и симптомы системного воспаления и инфекции исчезли.
После двух месяцев лечения пациент подлежал повторной оценке. On объективном обследовании у пациента отсутствовали признаки инфекции или воспаления; наблюдали регрессию гепатоспленомегалии. Компьютерная томография грудной клетки и брюшной полости, проведенная 11/12/2006, показала следующее:
- Легкие: разреженные затемнения по типу матового стекла в правых верхушечных швах (операционные осложнения), исчезновение множественных разреженных солитарных бессимптомных округлых теней в обоих легких (полная ремиссия воспалительного и инфекционного процесса в легких) и полная регрессия лимфатического узла в области корня правого легкого (фиг. 6В).
- В брюшной полости: полная ремиссия гепатоспленомегалии и значительное уменьшение брыжеечных лимфатических узлов.
Заключение по случаю
После периода лечения (с 15/10/2006 по 11/12/2006) DECA получены следующие результаты: полная ремиссия гепатоспленомегалии, множественных легочных и абдоминальных узелков и нормализация брыжеечного лимфатического узла, а также клинических признаков системного воспаления и инфекции при обследованиях 11/12/2006. Также наблюдали полную ремиссию с позитивизацией подавления иммунитета после 2 недель лечения, причем, регистрация аллергической реакции замедленного типа показала положительную реакцию, составляющую 3+/4+ при 5+. Ранее прекращенная первичная аллергическая реакция замедленного типа стала положительной после 1 месяца лечения. Эти результаты свидетельствуют о полной ремиссии следующих показателей: клинических, лабораторных и показателей визуализации воспалительной псевдоопухоли, а также картины подавления иммунитета, представленной у пациента, в результате применения предложенного лечения. Признаки или рецидив заболевания отсутствуют у пациента в течение 5 лет и 3 месяцев.
Пример 7
Лечение ацинозной аденокарциномы. степень 7 (4+3) по шкале Глисона.
Аденокарцинома локализована на простате, стадия Т2а.
Данные пациента
Пациент O-S, 69 лет, мужчина.
Первичный диагноз
Ацинозная аденокарцинома простаты, степень 7 (4+3) по шкале Глисона, на стадии Т2а.
Идентификация и резюме истории болезни
Простат-специфический антиген (ПСА) повышен на 20, при этом на биопсии выявлена ацинозная аденокарцинома, Gleason grade 7 (4+3) степень 7 (4+3) по шкале Глисона, на стадии Т2а степень 7 (4+3) по шкале Глисона, на стадии Т2а. Необходимо отметить, что пациент имел сопутствующий аллергический ринит.
Традиционное предложенное и проведенное лечение
Тотальная простатэктомия в качестве формы радикальной операции для локализованного заболевания (ограниченного простатой). Операция была проведена без осложнений 18/02/2010.
Результаты проведенного традиционного лечения и окончательный диагноз
Окончательный диагноз в результате патологического исследования описывает распространенное заболевание с местно-регионарной аденокарциномой простаты, степень 9 (4+5) по шкале Глисона, на стадии TNM pT3bN0 2002, поражающее 22% объема железы (объем опухоли составляет 11,2 см3), локализованное в обеих долях железы. Новообразование инфильтрировало в семенной пузырек и перипростатическую жировую ткань, но подвздошные лимфатические узлы и шейка мочевого пузыря были свободны от новообразований.
Окончательное заключение: оперативное лечение было неэффективным, поскольку опухолевая масса сохранилась в перипростатической области, что подвергало риску шансы на предполагаемое излечение. Было предложено лечение посредством радиотерапии в течение двух месяцев и наблюдение онколога каждые 6 месяцев в течение 5 лет.
Иммунологическая оценка до лечения DECA
Первая консультация была проведена 09/03/2010, и пациенту была предложена иммунологическая оценка и возможность иммунотерапии, чтобы сдерживать заболевание до радиотерапии, которая должна проводиться в течение двух месяцев.
Оценка в онкологической лаборатории была проведена 10/03/2010 и показала значение ПСА, составляющее 0,15, совместимое с остаточной опухолью в связи с состоянием неэффективной простатэктомии (фиг. 7).
Первая иммунологическая оценка по показателям крови на 10/03/2010 показала следующее:
- Совместимый Th1 клеточный профиль с хорошим противоопухолевым ответом посредством презентирования антител на нижней границе нормы:
IgG 977 мг/дл (NV = 600-1500);
IgA 233 мг/дл (NV = 50-400 мг/дл);
IgM 112 мг/дл (NV = 50-300 мг/дл);
альбумин 3,67 г/дл (3,50-4,85 г/дл)
Гамма-глобулин 0,97 г/дл (NV = от 0,74 до 1,75 г/дл).
- фенотипически нормальная Т-петля при следующих показателях:
CD4+ 846/мм3;
CD8+ 504/мм3;
Отношение CD4+/CD8+ 1,7
- оценка умеренной аллергической реакции:
IgE 204 мг/дл (NV = менее 100 мг/дл);
Специфичный IgE на пыль 1,5 мг/дл (класс 2, умеренная);
- оценка положительной аутоиммунности для следующих маркеров:
Ядерный антиядерный фактор, АЯФ не менее 1/640;
Ядрышковый АЯФ не менее 1/640.
Тесты in vivo (первичная и вторичная аллергическая реакция замедленного типа) не проводили в связи с коротким периодом времени, остававшимся на иммунотерапию, перед радиотерапией.
Заключение на основе исследований in vitro:
1. Гуморальный иммунитет, система комплемента и Т-петля представлены как фенотипически нормальные без видимого иммунодефицита;
2. Th1 клеточный профиль дает возможность хорошего ответа на иммунотерапию;
3. Функциональные тесты не проводили, поскольку не были проведены тесты in vivo.
Предложенное лечение DECA Лечение DECA состояло в следующем:
- Введение 1,8 см3 композиции DECA за два введения по 0,9 см3 в 10 из основных лимфатических бассейнов.
- Предельное расстояние между введениями составляет 3-4 см, чтобы облегчить оценку изменения лечения с интервалом, составляющим 4±1 суток.
- Введение 6 композиций DECA по 1,8 см3 каждая, разделенных на два введения внутрь повреждения по 0,9 см3 каждое вокруг следующих областей: суммарно четыре композиции в области верхнего и нижнего правого и левого пахового отдела, а также одну композицию в надлобковую область и другую композицию в нижнюю (подпупочную) часть живота.
- Введение рекомбинантного интерлейкина-2 человека в низких дозах на уровне насыщения рецептора при концентрации, составляющей от 1 до 2 млн. единиц на м2 поверхности тела пациента, локализованное в области дополнительных введений DECA. Таким образом, на сутки введения антигенов, а затем ежесуточное подкожное введение миллиона единиц в перечисленные выше области.
Таким образом, вплоть до срока радиотерапии при свободном и информированном согласии пациента было выбрано иммунотерапевтическое лечение, начатое 11/03/2010, при этом первая частичная повторная оценка была назначена на 03/04/2010.
Первый частичный результат предложенного лечения DECA
После 4 недель лечения антиген ПСА стал необнаружимым (фиг. 7), что указывает на полную ремиссию, индуцированную иммунотерапией, которая, по-видимому, способна устранить или значительно уменьшить опухолевую массу. На современном уровне техники невозможно дифференцировать полное радикальное удаление опухолевой массы и минимальное остаточное заболевание, что свидетельствует о том, что предложенное лечение DECA показало неожиданный эффект.
В данной ситуации (03/04/2010) можно было проверить следующие показатели:
IgG 1070 мг/дл (NV = 600-1500);
IgA 248 мг/дл (NV = 50-400 мг/дл);
IgM 129 мг/дл (NV = 50-300 мг/дл).
Вся система комплемента без существенных изменений (от 280 на 10/03/2010 до 281 на 03/04/2010).
Это сохранение системы комплемента можно было также обнаружить по следующим показателям:
С3 (от 117 до 115) и С4 (от 76 до 71);
альбумин 3,21 г/дл (3,50 до 4,85 г/дл);
гамма-глобулин 1,00 г/дл (NV = 0,74-1,75 г/дл).
CD4+ 1,075/мм3;
CD8+ 537 мм3;
Отношение CD4+/CD8+ 2,0.
IgE 165 мг/дл (NV = менее 100 мг/дл);
Ядерный АЯФ не менее 1/320;
Ядрышковый АЯФ не менее 1/320.
Тесты in vivo (вторичная аллергическая реакция замедленного типа) показали следующее:
- при первом введении:
Антигены, вводимые на расстоянии от области опухоли, имели показатели +/++ для всех антигенов;
В области DECA вблизи остаточной области опухоли реакция была снижена и имела показатели +/++ при +++++, оцениваемые как подавление иммунитета опухолью.
- при втором введении:
Антигены, вводимые на расстоянии от области опухоли, стали гиперергическими и имели показатели +++/++++ для всех антигенов;
Область DECA вблизи остаточной области опухоли нормализовалась, начав проявлять показатели ++/+++ при норме +++++, что подтвердило реверсию подавления иммунитета, вызванного остаточной опухолевой массой.
- при третьем введении (в начале второй недели лечения):
Антигены, вводимые на расстоянии от области опухоли, стали гиперергическими и имели показатели ++++/+++++ для всех антигенов;
Область DECA вблизи остаточной области опухоли достигала такого же уровня активности (для ++++/+++++), оцениваемые как полная реверсия подавления иммунитета, вызванного остаточной опухолевой массой.
Эти гиперергические реакции продолжались до момента повторной оценки четвертой недели (03/04/2010).
Заключение по первому частичному результату предложенного лечения DECA
Первоначально у пациента сохранялся системный иммунитет, имеющий клеточный профиль Th1. Этот клеточный профиль Th1 был нарушен в областях, близких к опухоли, имея нереактивную Т-петлю, что оценивали как местно-регионарное подавление иммунитета опухолью.
Иммунотерапия привела к гиперергической вторичной аллергической реакции замедленного типа во всех областях на расстоянии от опухоли после второго введения DECA и к реверсии местно-регионарного подавления иммунитета, приводящей к такой же гиперергической реакции, как и в других областях.
Анализы крови были подкреплены функциональным анализом Т-петли, показывающим увеличение абсолютного и относительного числа CD4+/хелперных клеток и повышение отношения CD4+/CD8+ что оценивали как мобилизацию CD4+ клеток на системном уровне, восстанавливающую клеточный иммунитет пациента. Анализы крови также показали специфичное действие композиции DECA исключительно на клеточный иммунитет, поскольку антитела и система комплемента остались неизменными в первой фазе лечения.
Параллельно авторы изобретения наблюдали другие полезные эффекты в отношении аллергии и аутоиммунной реакции, перечисленные ниже:
- Снижение антител класса IgE, сопровождающееся полной ремиссией сопутствующего аллергического ринита, проявляющегося у пациента, что позволяет предположить противоаллергическое действие предложенного лечения DECA.
- Значительное снижение АЯФ-показателя, составляющее от 1/640 до 1/320, показывающее вероятную регрессию склонности к аутоиммунной реакции.
Конечный результат предложенного лечения DECA перед радиотерапией 27/04/2010 была проведена вторая частичная повторная оценка, когда у пациента были представлены болезненные гиперергические реакции (все показатели +++++). С учетом результата, представляющего собой необнаружимый антиген ПСА, он оставался таким же вплоть до февраля 2012.
Следует особо подчеркнуть, что в результате иммунологического лечения, начатого 11/03/2010, продолжавшегося до 10/06/2010 (за сутки до радиотерапии), суммарно в течение 90 суток полная ремиссия опухоли была достигнута после 4 недель, а реверсия подавления иммунитета за 2 недели.
Результаты лечения DECA
В связи с полной ремиссией пациента с аденокарциномой простаты степени 9 (4+5) по Глисону и хирургическим стадированием pT3bN0, с послеоперационной остаточной опухолевой массой за 4 недели можно сделать вывод, что результаты являются неожиданными по сравнению с уровнем техники, где такие случаи указаны как трудные для реверсии.
Можно дополнительно предположить, что в этот первый месяц лечения иммунотерапия DECA показала потенциальную противоаллергическую способность (снижение IgE в сочетании с полной ремиссией аллергического ринита) и ее способность к регрессии склонности к аутоиммунной реакции (о чем свидетельствует снижение наполовину титра антител против ядерных элементов).
Заключение по случаю
Эти данные позволяют надежно предположить, что иммунотерапевтическое лечение композицией DECA, при условии, что оно было единственным фармакологическим лечением, предпринятым при ожидании начала радиотерапии, было эффективным при полной ремиссии остаточной местно-регионарной опухоли (за 4 недели) в результате простатэктомии, подтвержденной изменением уровней ПСА до необнаружимых, что, таким образом, подтверждает радикальное устранение опухолевой массы, поскольку современный уровень техники не дает возможности дифференцировать радикальное удаление опухолевой массы и минимальное остаточное заболевание.
Кроме того, авторы изобретения наблюдали полную ремиссию аллергического ринита и улучшенные уровни АЯФ (вероятно, склонности к усилению аутоиммунной реакции).
Пример 8
Лечение септицемии
Данные пациента
Пациент J-P, 58 лет, мужчина.
Основной диагноз
Септицемия.
Вторичные диагнозы
Политравма:
- Сложные инфицированные раны со значительной потерей ткани, составляющей приблизительно 40 см.
- Обширный некроз инфицированной ткани с показаниями к ампутации левой нижней конечности.
- Открытый перелом степени инфекции IIIB с остеомиелитом левого бедра с латеральным распространением.
- Открытые инфицированные резано-ушибленные раны без возможности наложения шва на левом плече, тыльной поверхности левой голени и латеральной области правой лодыжки.
Идентификация и резюме истории болезни
12 января 2011 пациент, ставший жертвой обвала, поступил в отделение интенсивной терапии больницы Octavian Constantine Hospital das Clinicas of Teresopolis с открытым переломом левого бедра степени IIIB с обнажением латеральной резаной и медиальной резано-ушибленной раны, имеющей протяженность в глубину, составляющую 40 см, которая сообщалась с обнаженной стороной. Разрывы, ушибы на левом плече, задней поверхности левой ступни и латеральной области правой лодыжки. Развитие картины сепсиса в течение 24 часов с микробиологической идентификацией Pseudomonas aeruginosa.
Традиционное предложенное и проведенное лечение
В отделении оказания экстренной помощи проведено следующее лечение: внешняя фиксация бедра, введение клиндамицина, ванкомицина и цефепима в сочетании с ежесуточной хирургической обработкой.
Результаты проведенного традиционного лечения
Первоначально наблюдали улучшение картины сепсиса, после чего развилась инфекция левой нижней конечности с обширными областями некроза мышц с высоким риском ампутации. Через 15 суток после поступления сепсис ухудшился эпизодами фебрилитета до 39°С, выраженной анемией (пациент получал переливания крови), и антибактериальные лекарственные средства были заменены тазоцимом. Пациент был перевезен с помощью воздушной скорой помощи в Сан-Паулу под медицинским наблюдением.
Выполнение традиционного лечения показало рецидив сепсиса и повышенный некроз левой голени с показаниями к ампутации.
Предложенное лечение DECA в сочетании с традиционным хирургическим лечением
Пациент поступил в отделение интенсивной терапии Hospital Alemao Oswaldo Cruz для хирургической обработки ран и применения лечения DECA, осуществляемого в следующей форме:
- Введение 1,8 см3 композиции DECA, разделенное на 2 введения по 0,9 см3 на композицию вблизи 10 основных лимфатических бассейнов.
- Предельное расстояние между введениями составляет 3-4 см, чтобы облегчить оценку изменения лечения с интервалом, составляющим 4±1 суток.
Эти введения выполняли совместно с хирургической обработкой (в среднем 1-2 раза в неделю).
- Введение 36 дополнительных композиций на периферии повреждений по 1,8 см3 каждой DECA за два введения по 0,9 см3 на серию, обходя следующие открытые повреждения без возможности наложения шва: левую паховую область, латеральную сторону левого бедра, переднюю сторону левого бедра и медиальную часть левого бедра, тыльную область стопы и левую латеральную лодыжку правой голени.
- Введение рекомбинантного интерлейкина-2 человека в низких дозах на уровне насыщения рецептора при концентрации, составляющей от 1 до 2 млн. единиц на м2 поверхности тела пациента, локализованное в области дополнительных введений DECA. Пациенту инъецировали подкожно 3 млн. единиц ежесуточно в левое бедро или паховую область.
- В обнаженные области вводили 15 композиций DECA по 1,8 см3 каждой для инфильтрации обнаженных необработанных областей.
- Данную обширную иммунотерапию всегда применяли на сутки операции очистки и хирургической обработки под общим наркозом.
Таким образом, первая фаза иммунотерапии, начатая 29/01/2011 и оконченная 19/03/2011, суммарно составляющая девять введений DECA за периоды, находящиеся в интервале от одного до двух раз в неделю, при выполнении плановой очистки и хирургической обработки в операционной (вследствие тяжести боли и риска инфекции обширного обнажения внутренних тканей в необработанных областях).
Результаты лечения DECA в сочетании с хирургической обработкой и антибиотикотерапией
Первоначальная оценка повреждений пациента в операционной 29/01/2011 показала, что все раны кровоточат с множеством сгустков, и имеются обширные области некроза и гноя с неприятным запахом. После хирургической очистки ткань продолжала заживать плохо и имела внешний вид цвета вина без каких-либо признаков здоровой грануляционной ткани. Как описано выше, к этим областям применяли иммунотерапию DECA. Интересно отметить, что в данном случае ставили культуры внутренней секреции и фрагментов ткани.
После 24 часов хирургического лечения в сочетании с иммунотерапией DECA проводили первую оценку, которая показала следующее: повреждения красного цвета, имеющие внешний вид здоровой грануляционной ткани с немногими некротическими областями, с редкой секрецией без неприятного запаха и отсутствие активного кровотечения. Повреждения очищали, и применяли иммунотерапию DECA, как отмечено выше. В данном случае антибиотикотерапия была изменена на тазоцим, меронем, кубицин и рифампицин на основании результатов культур.
01/02/2011 результат культур из поврежденной области, периферической крови и центрального катетера показал следующее:
- в ране левого бедра выделение полирезистентной Pseudomonas aeruginosa, полирезистентной Acinetobacter baunnamii, чувствительной только к полимиксину В, и полирезистентной Proteus mirabiles.
- в периферической крови и в центральном катетере выделение полирезистентной Acinetobacter baunnamii, чувствительной только к полимиксину В.
Заключение: Данные результаты показали, что плохой прогноз повреждений левой голени привел к новому эпизоду сепсиса Acinetobacter baunnamii, и в связи с ее полирезистентностью и чувствительностью только к полимиксину В ответ на лечение внутривенным введением тазоцима отсутствовал. С другой стороны, это надежно подтверждает полезный эффект композиции DECA в сочетании с хирургическим лечением при местной и системной защите против инфекции, поскольку улучшение в системной инфекции и повреждениях наблюдали до того, как введение полимиксина В могло бы нейтрализовать данный этиологический агент.
На эти сутки меронем изменили на 20000 МЕ/кг полимиксина В два раза в сутки без изменения других лекарственных средств.
03/02/2011 было обнаружено, что сочетание антибиотикотерапии, хирургической обработки и иммунотерапии DECA вызвало ремиссию картины сепсиса, которая впоследствии дала возможность перевести пациента из отделения интенсивной терапии в палату.
06/02/2011, с учетом токсичности введения полимиксина В и других антибактериальных средств, у пациента была представлена картина острой почечной недостаточности с олигурией. Как следствие, на период между 06/02/2011 и 15/02/2011 (12 суток) введение этих антибиотиков было приостановлено при введении линезолида (Зивокс) для защиты от внутрибольничного заражения стафилококком. 15/02/2011 у пациента была подтверждена полная ремиссия почечной недостаточности. В данный 12-суточный период при комбинированной терапии, включающей только хирургическую обработку, антибиотикопрофилактику и иммунотерапию DECA, пациент показал отличный общий прогресс в отношении инфекций и повреждений, что позволило после данного периода снять внешний фиксатор, проводить хирургическую очистку и ввести внутренний стержень для фиксации перелома при операции, проведенной 17/02/2011. Таким образом, в этот период, совместно с ортопедической операцией, наблюдали значительное сокращение открытых областей без кожи с обширной регенерацией ткани и отсутствие новых инфекций.
Пациент был выписан 15/03/2011 при полном излечении инфекции всех сложных повреждений и ран, включая остеомиелит. Пациент был выписан без назначения антибиотикотерапии.
Заключение по случаю
Наличие тяжелой и широко распространенной инфекции и сложной раны, инфицированной полирезистентной Acinetobacter baunnamii, чувствительной только к полимиксину В, которая была контролируемой в отсутствие специфической антибиотикотерапии при обширном прогрессе излечения от сепсиса во всех обнаженных повреждениях, а также от остеомиелита, позволяет надежно предположить решающую роль иммунотерапии DECA в сочетании с хирургической обработкой и антибиотиками для излечения клинической картины за относительно короткое время.
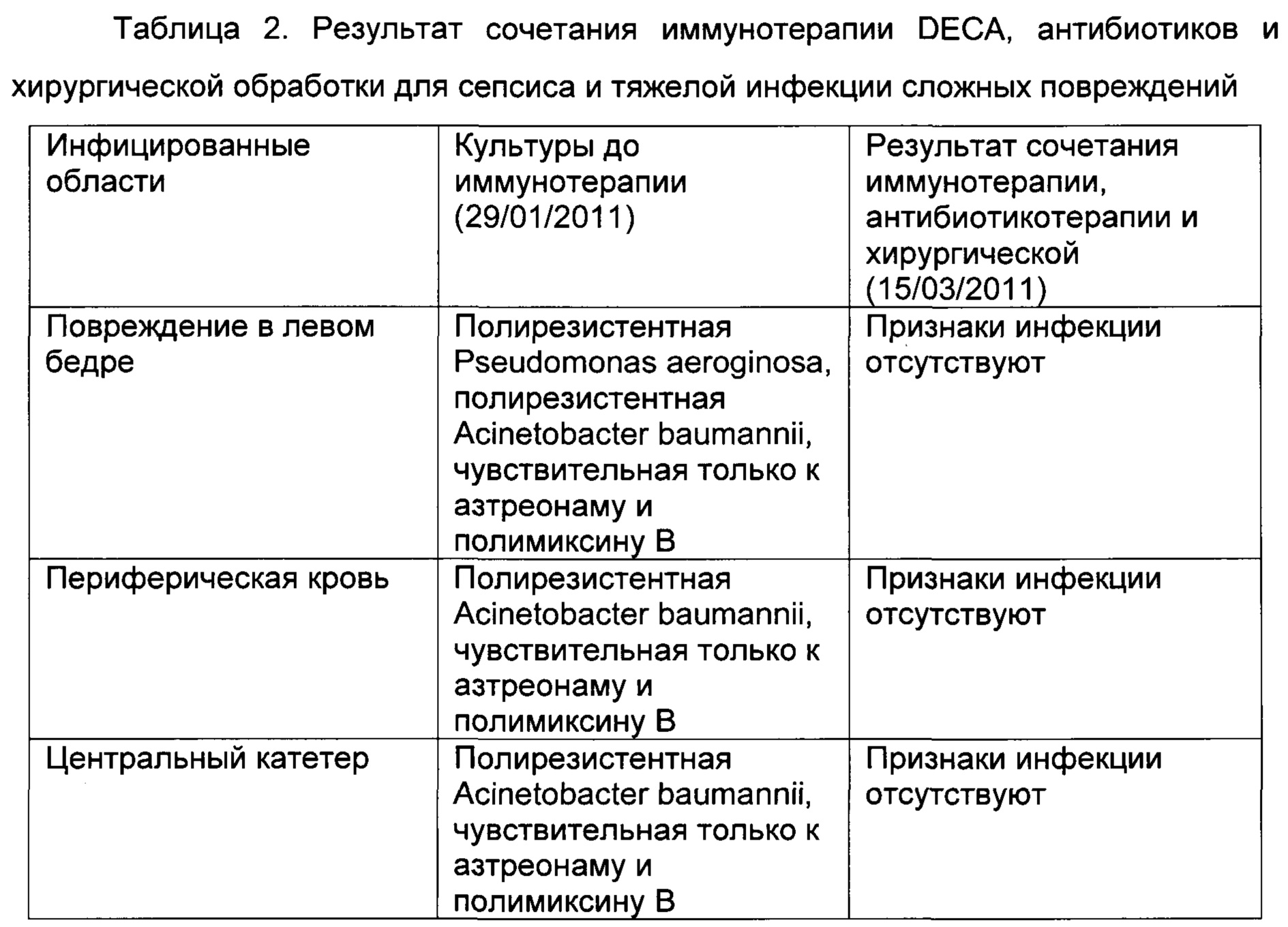
Кратко, клинические случаи, представленные в данной работе, показывают, что расстройства и заболевания, которые считают обладающими большой сложностью и неясным или очень плохим прогнозом при анализе с помощью знаний предшествующего уровня техники, лечат дифференциально, более прогрессивно и более эффективно посредством применения композиций по настоящему изобретению.
Реферат
Группа изобретений относится к медицине и может быть использована для модуляции иммунной системы. Для этого вводят иммуногенную композицию, содержащую туберкулин Коха, очищенный белковый продукт (PPD) бациллы Коха, инактивированный лизат стафилококков, инактивированный лизат стрептококков, стрептокиназу и дорназу из бета-гемолитического стрептококка, инактивированный лизат Candida, инактивированный лизат дерматофитов, инактивированный лизат энтеропатогенной Escherichia coli, инактивированный лизат сальмонеллы. Также предложены применение иммуногенной композиции, способ предотвращения или лечения заболеваний, способ индукции регенерации систем органов и способ восстановления иммунного ответа. Группа изобретений обеспечивает предотвращение и лечение заболеваний путем модуляции иммунной системы у человека. 5 н. и 26 з.п. ф-лы, 2 табл., 7 ил., 8 пр.

Комментарии