Иммуногенные противовоспалительные композиции - RU2722357C2
Код документа: RU2722357C2
Чертежи











































Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В различных аспектах изобретение относится к иммунологической терапии для лечения состояния, характеризуемого воспалением. В альтернативных вариантах изобретение относится к способам получения антигенных композиций для лечения воспалительных состояний.
УРОВЕНЬ ТЕХНИКИ
Более чем у одного из трех людей в развитых странах диагностируют злокачественную опухоль. Более одного из четырех людей умирают от злокачественной опухоли. Терапия злокачественной опухоли главным образом основана на таком лечении, как хирургическая операция, химиотерапия и излучение. Однако такие способы, хотя и являются полезными в случае некоторых типов и стадий злокачественной опухоли, как было показано, обладают ограниченной эффективностью в случае многих распространенных типов и стадий злокачественных опухолей. Например, хирургическое лечение опухоли требует полного удаления злокачественных тканей для предотвращения рецидива. Подобным образом, лучевая терапия требует полного разрушение злокачественных клеток. Такого результата трудно достичь, так как теоретически одна злокачественная клетка может пролиферировать настолько, чтобы вызывать рецидив злокачественной опухоли. Также и хирургическое лечение и лучевая терапия направлены на локализованные области злокачественной опухоли и относительно неэффективны, когда злокачественная опухоль метастазирует. Часто хирургическую операцию или излучение используют в сочетании с системными способами, такими как химиотерапия. Однако химиотерапия связана с проблемой неизбирательности и сопутствующей проблемой вредных побочных эффектов, а также возможностью развития резистентности злокачественных клеток к лекарственным средствам.
Присущие химиотерапии недостатки привели к другим попыткам привлечь различные аспекты иммунной системы для лечения злокачественных опухолей. Часть такой работы относится к иммунизации основанными на микроорганизмах вакцинами. Хотя такой подход имеет относительно длительную историю, как более подробно обсуждается ниже, указанная область является очень запутанной смесью иногда любопытных успехов и множества неудач, что вместе не привело к разработке целостного терапевтического подхода, пригодного для широкого внедрения в клинику.
В альтернативные подходы к лечению злокачественных опухолей были включены способы терапии, которые заключаются в усилении функции иммунной системы, такие как терапия цитокинами (например, рекомбинантным интерлейкином 2 и гамма-интерфероном в случае рака почек), терапия, основанная на дендритных клетках, терапия аутологичной противоопухолевой вакциной, терапия генетически измененной вакциной, основанная на лимфоцитах терапия и терапия микробными вакцинами, при этом считается, что последняя вовлекает систему хозяина неспецифическим образом. Микробные вакцины были применены для вакцинации субъектов против патогенов, которые ассоциированы со злокачественной опухолью, такими как вирус папилломы человека. Иммуностимулирующие микробные вакцины, мишенью которые не являются организмы, вызывающие злокачественные опухоли, т.е. неспецифичные иммуностимулирующие вакцины, такие как пирогенные вакцины, имеют длительную клиническую историю, которая включает сообщения об успехах и неудачах в лечении различных злокачественных опухолей. Например, сообщалось, что вакцина Коли (сочетание Streptococcus pyogenes и Serratia marcescens) полезная для лечения сарком и лимфом (смотри, например, Nauts НС, Fowler GAA, Bogato FH. А review of the influence of bacterial infection and of bacterial products [Coley's toxins] on malignant tumors in man. Acta Med. Scand. 1953; 145 [Suppl. 276]: 5-103). Клинические испытания по имеющимся данным показали положительный результат лечения вакциной Коли в случае лимфомы и меланомы (смотри, например, Kempin S, Cirrincone С, Myers J et al: Combined modality therapy of advanced nodular lymphomas: the role of nonspecific immunotherapy [MBV] as an important determinant of response and survival. Proc Am Soc Clin Oncol 1983;24:56; Kolmel KF, Vehmeyer K. Treatment of advanced malignant melanoma by a pyrogenic bacterial lysate: a pilot study. Onkologie 1991; 14:411-17).
Было высказано предположение, что эффективность некоторых неспецифичных бактериальных противораковых вакцин обусловлена конкретными бактериальными компонентами или продуктами, такими как бактериальная ДНК или эндотоксин (ЛПС), или является следствием того, что они индуцируют экспрессию конкретных факторов, таких как фактор некроза опухолей (TNF) или интерлейкин-12. Соответственно таким способам лечения приписывали широкий круг физиологических механизмов в диапазоне от генерализованных эффектов повышения температуры до антиангиогенных механизмов. В соответствии с такими различными принципами тестировали широкое множество микробных вакцин в качестве общих иммуностимуляторов для лечения злокачественной опухоли. Хотя было показано, что большинство давало отрицательные результаты, несколько вакцин, как было показано, давали представляющие интерес положительные результаты в некоторых контекстах, которые обсуждаются ниже.
Сообщалось, что внутрикожное обработка вакциной БЦЖ (Mycobacterium bovis) эффективна для лечения рака желудка (смотри, например, Ochiai Τ, Sato J, Hayashi R, et ai: Postoperative adjuvant immunotherapy of gastric cancer with BCG-cell wall endoskeleton. Three- to six-year follow-up of a randomized clinical trial. Cancer Immunol Immunother 1983; 14: 167-171) и рака ободочной кишки (Smith RE, Colangelo L, Wieand HS, Begovic M, Wolmark N. Randomized trial of adjuvant therapy in colon carcinoma: 10-Year results of NSABP protocol C-01. J. NCI 2004; 96[15]: 1128-32; Uyl-de Groot CA, Vermorken JB, Hanna MG, Verboon P, Groot MT, Bonsel GJ, Meijer CJ, Pinedo HM. Immunotherapy with autologous tumor cell-BCG vaccine in patients with colon cancer: a prospective study of medical and economic benefits Vaccine 2005; 23[17-18]: 2379-87).
Было обнаружено, что терапия вакциной на основе Mycobacterium w в сочетании с химиотерапией и облучением значимо улучшает качество жизни и ответ на лечение у пациентов с раком легкого (смотри, например, Sur Ρ, Dastidar A. Role of Mycobactehum w as adjuvant treatment of lung cancer [non-small cell lung cancer]. J Indian Med Assoc 2003 Feb; 101[2]:118-120). Подобным образом обнаружено, что терапия вакциной на основе Mycobacterium vaccae улучшает качество жизни (смотри, например, O'Brien Μ, Anderson H, Kaukel Ε, et al. SRL172 [killed Mycobacterium vaccae] in addition to standard chemotherapy improves quality of life without affecting survival, in patients with advanced non-small-cell lung cancer: phase III results. Ann Oncol 2004 Jun; 15[6]; 906-14) и контролирует симптомы (Harper-Wynne С, Sumpter К, Ryan С, et al. Addition of SRL 172 to standard chemotherapy in small cell lung cancer [SCLC] improves symptom control. Lung Cancer 2005 Feb; 47[2]: 289-90) y пациентов с раком легких.
Вакцину на основе Corynebacterium parvum связывали с проявлением тенденции к повышенной выживаемости в случае лечения меланомы (смотри, например, Balch СМ, Smalley RV, Bartolucci ΑA, et al. A randomized prospective trial of adjuvant С parvum immunotherapy in 260 patients with clinically localized melanoma [stage I]. Cancer 1982 Mar 15; 49[6]: 1079-84).
Обнаружено, что внутрикожная обработка вакциной на основе Streptococcus pyogenes является эффективной при лечении рака желудка (смотри, например, Hanaue H, Kim DY, Machimura Τ, et al. Hemolytic streptococcus preparation OK-432; beneficial adjuvant therapy in recurrent gastric carcinoma. Tokai J Exp Clin Med 1987 Nov; 12 [4]: 209-14).
Обнаружено, что вакцина на основе Nocardia rubra является эффективной при лечении рака легких (смотри, например, Yasumoto К, Yamamura Y. Randomized clinical trial of nonspecific immunotherapy with cell-wall skeleton of Nocardia rubra. Biomed Pharmacother 1984; 38[1]: 48-54; Ogura T. Immunotherapy of respectable lung cancer using Nocardia rubra cell wall skeleton. Gan To Kagaku Ryoho 1983 Feb; 10 [2 Pt 2]: 366-72) и связана с тенденцией к повышенной выживаемости в случае лечения острого миелогенного лейкоза (Ohno R, Nakamura H, Kodera Y, et al. Randomized controlled study of chemoimmunotherapy of acute myelogenous leukemia [AML] in adults with Nocardia rubra cell-wall skeleton and irradiated allogeneic AML cells. Cancer 1986 Apr 15; 57[8]: 1483-8).
Обнаружено, что лечение вакциной на основе Lactobacillus casei в сочетании с облучением является более эффективным з случае лечения рака шейки матки, чем облучение отдельно (смотри, например, Okawa Τ, Kita M, Arai Τ, et al. Phase II randomized clinical trial of LC9018 concurrently used with radiation in the treatment of carcinoma of the uterine cervix. Its effect on tumor reduction and histology. Cancer 1989 Nov 1; 64[9j: 1769-76).
Обнаружено, что лечение вакциной на основе Pseudomonas aeruginosa повышает эффективность химиотерапии при лечении лимфомы и рака легких (смотри, например, Li Ζ, Нао D, Zhang Η, Ren L, et al. A clinical study on PA_MSHA vaccine used for adjuvant therapy of lymphoma and lung cancer. Hua Xi Yi Ke Da Xue Xue Bao 2000 Sep; 31 [3]: 334-7).
Обнаружено, что вакцинация в детском возрасте вакциной на основе натуральной оспы (т.е. вакциной на основе вируса вакцинии) ассоциирована с пониженным риском развития меланомы в пожилом возрасте (смотри, например, Pfahlberg A, Kolmel KF, Grange JM. et al. Inverse association between melanoma and previous vaccinations against tuberculosis and smallpox: results of the FEBIM study. J Invest Dermatol 2002 [119]: 570-575), a также пониженной смертностью таких пациентов, у которых развилась меланома (смотри, например, Kolmel KF, Grange JM, Krone В, et al. Prior immunization of patients with malignant melanoma with vaccinia or BCG is associated with better-survival. European Organization for Research and Treatment of Cancer cohort study on 542 patients. EurJ Cancer 41 [2005]: 118-125).
Обнаружено, что лечение вакциной на основе вируса бешенства приводило к временной ремиссии у 8 из 30 пациентов с меланомой (смотри, например, Higgins G, Pack G. Virus therapy in the treatment of tumors. Bull Hosp Joint Dis 1951; 12:379-382; Pack G. Note on the experimental use of rabies vaccine for melanomatosis. Arch Dermatol 1950; 62:694-695).
Несмотря на усиленные попытки вовлечь иммунную систему в борьбу со злокачественными опухолями с использованием неспецифичных иммуностимулирующих микробных вакцин, подавляющее большинство таких попыток были неудачными, и имеется мало клинических или исследовательских данных о больших успехах в повышении выживаемости в популяциях пациентов со злокачественными опухолями. Хотя было ясно, что подходы с использованием иммуностимулирующих микробных вакцин являются многообещающими, также было понятно, что для данной области характерны значительные проблемы (смотри, например, Ralf Kleef, Mary Ann Richardson, Nancy Russell, Cristina Ramirez. "Endotoxin and Exotoxin Induced Tumor Regression with Special Reference to Coley Toxins: A Survey of the Literature and Possible Immunological Mechanisms." Report to the National Cancer Institute Office of Alternative and Complementary Medicine August 1997; DL Mager. "Bacteria and Cancer: Cause, Coincidence or Cure? A Review."Journal of Translational Medicine 28 March 2006 4 [14]:doi:10.1186/1479-5876-4-14).
Воспалительное заболевание кишечника (IBD) является названием, которое часто дают группе воспалительных состояний ободочной кишки и тонкого кишечника, в общем характеризуемых сходными симптомами и неопределенной этиологией. Основные подтипы IBD известны клинически как болезнь Крона и язвенный колит.Кроме болезни Крона и язвенного колита IBD также может включать состояния, известные как любое из следующих состояний: коллагенозный колит, лимфоцитарный колит, ишемический колигг, колит в отключенной кишке, синдром Бехчета или недифференцированный колит.Различие между такими состояниями главным образом связано с положением и природой воспалительных изменений в желудочно-кишечном тракте (ЖКТ). Болезнь Крона, например, обычно известна как болезнь, потенциально поражающая любую часть желудочно-кишечного тракта, от ротовой полости до ануса, при этом для большинства случаев характерно рецидивирующее и ремиттирующее гранулематозное воспаление пищеварительного тракта в терминальном отделе подвздошной кишки и ободочной кишке. Напротив, в общем считают, что язвенный колит ограничен ободочной кишкой и прямой кишкой. Различные области желудочно-кишечного тракта, в которых могут проявляться симптомы таких воспалительных состояний, включают: кишечник, включая: тонкий кишечник (который имеет три части: двенадцатиперстную кишку, тощую кишку и подвздошную кишку); толстый кишечник (который имеет три части: слепую кишку, ободочную кишку, которая включает восходящую ободочную кишку, поперечную ободочную кишку, нисходящую ободочную кишку и сигмовидный изгиб; и прямую кишку); и анус.
Представление о воспалительных заболеваниях кишечника развивается, но еще остается неполным во многих отношениях (смотри, например, Baumgart DC, Carding SR (2007) "Inflammatory bowel disease: cause and immunobiology" The Lancet 369 (9573): 1627-40; Baumgart DC, Sandborn WJ (2007) "Inflammatory bowel disease: clinical aspects and established and evolving therapies" The Lancet 369 (9573): 1641-57; Xavier RJ, Podolsky DK (2007) "Unravelling the pathogenesis of inflammatory bowel disease" Nature 448 (7152): 427-34; J.H. Cho (2008) "The genetics and immunopathogenesis of inflammatory bowel disease" Nature Reviews Immunology 8, 458-466).
Противовоспалительные лекарственные средства и иммунодепрессанты можно применять для лечения IBD, такие как сульфасалазин (азулфидин™), месаламин (асакол™, роваса™), кортикостероиды (например, преднизон), азатиоприн (имуран™), меркаптопурин (пуринетол™), инфликсимаб (ремикад™), адалимумаб (хумира™), цертолизумаб пегол (цимзиа™), метотрексат (ревматрекс™), циклоспорин (генграф™, неорал™, сандиммун™) или натализумаб (тисабри™).
Были предложены альтернативные способы лечения IBD, включая применение различных биологических средств, или способы лечения, которые предположительно регулируют природную кишечную флору, иногда называемые лечением пробиотиками (US 2007/0258953; US 2008/0003207; WO 2007/076534; WO 2007/136719; WO 2010/099824). Например, сообщалось, что IBD можно лечить, используя умышленное заражение паразитическими червями, например, принимая живые яйца гельминта Trichuris suis (Summers et al. (2003) "Trichuris suis seems to be safe and possibly effective in the treatment of inflammatory bowel disease". Am. J. Gastroenterol. 98 (9): 2034-41; Buning et al., (2008) "Helminths as governors of inflammatory bowel disease" Gut 57:1182-1183; Weinstock and Elliott (2009) "Helminths and the IBD hygiene hypothesis" Inflamm Bowel Dis. 2009 Jan; 15(1): 128-33).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте изобретение относится к способу получения противовоспалительной композиции для лечения состояния, характеризуемого воспалением в конкретном органе или ткани. Способ включает в себя отбор, по меньшей мере, одного патогена; который является патогенным в конкретном органе или ткани; получение антигенной композиции, содержащей антигенные детерминанты, которые вместе являются специфичными для патогена; и получение антигенной композиции для введения в качестве противовоспалительной композиции, способной вызывать противовоспалительный ответ в конкретном органе или ткани, при этом состояние, характеризуемое воспалением, не является злокачественной опухолью.
Способ может дополнительно включать в себя диагностическую стадию идентификации конкретного органа или ткани, в которых воспаление является симптоматичным, перед получением антигенной композиции. Необязательно, опухолевое или пролиферативное состояние может иметь место в конкретном органе или ткани.
Необязательно антигенная композиция может быть получена для подкожной инъекции или внутрикожной инъекции. Необязательно антигенная композиция может быть получена для инъекции, чтобы получить локализованную кожную иммунную реакцию в месте введения. Необязательно предлагается способ, подробно описанной в настоящей публикации, при этом, когда конкретной тканью или органом является X, патоген выбран из группы, состоящей из Y. Более конкретно, считают, что следующие сочетания входят в объей данного способа:











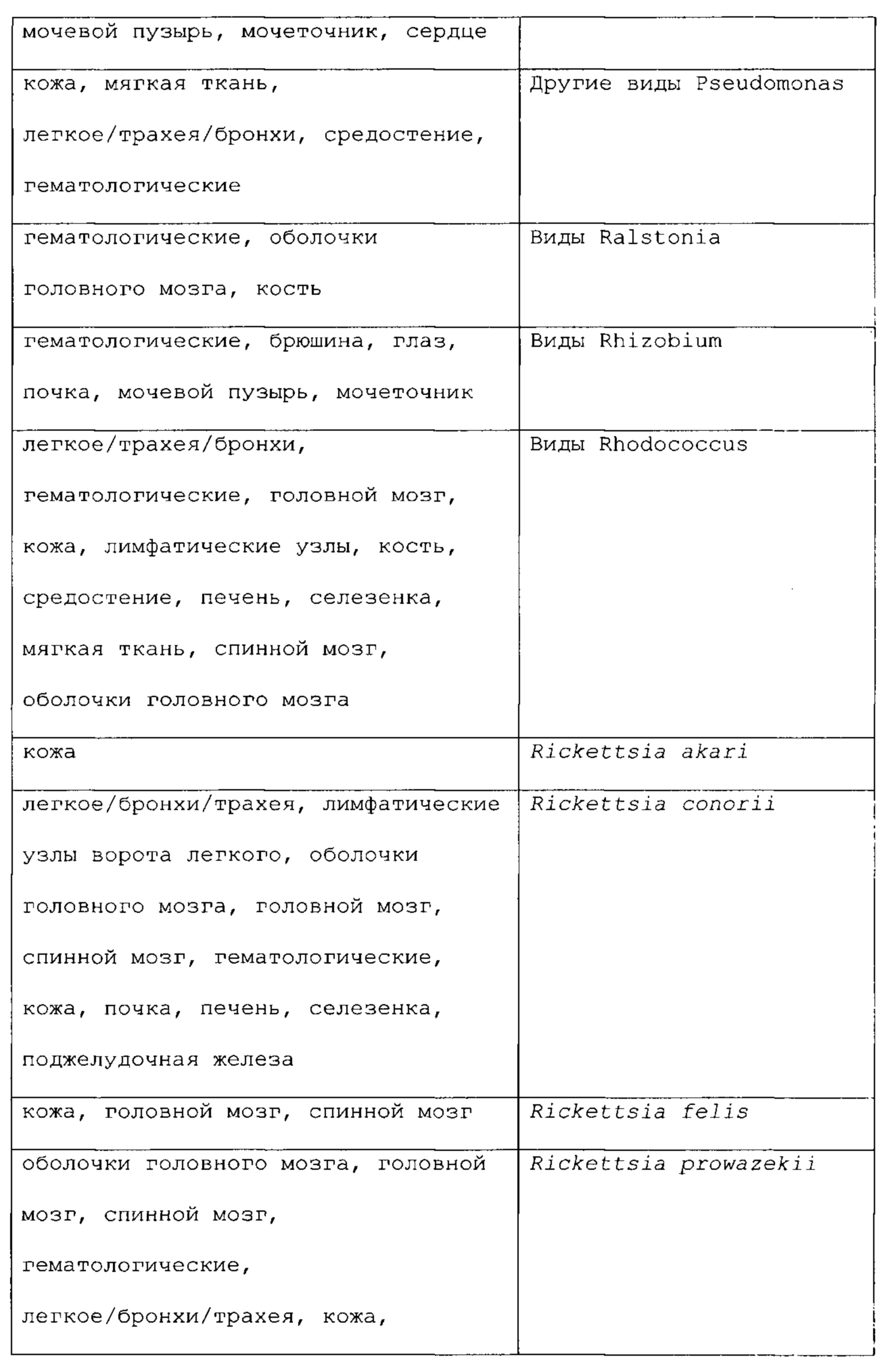




Кроме того, предлагается способ, подробно описанный в настоящей публикации, при этом когда конкретной тканью или органом является X, патоген выбран из группы, состоящей из Y. Более конкретно, считается, что следующие сочетания входят в объем настоящего способа:













Необязательно антигенная композиция может быть получена для многократного подкожного или внутрикожного введения. Необязательно антигенная композиция может быть получена для введения путем, который не является энтеральным. Необязательно патоген, подробно описанный в настоящей публикации, представляет собой бактерию, вирус, простейшее, гриб или гельминт.Кроме того, способ может включать в себя умерщвление патогена для получения антигенной композиции в виде композиции целых мертвых патогенов. Кроме того, патоген может быть представителем вида, который относится к эндогенной флоре конкретного органа или ткани. Кроме того, патоген может быть экзогенным видом.
В другом аспекте предлагается способ лечения индивидуума в связи с состоянием, характеризуемым воспалением в конкретном органе или ткани. Способ включает в себя введение индивидууму противовоспалительной композиции, содержащей антигенные детерминанты. Антигенные детерминанты выбирают и получают так, чтобы вместе они были специфичными, по меньшей мере, для одного патогена, который является патогенным в конкретном органе или ткани. Необязательно противовоспалительная композиция может быть введена в место введения в виде последовательно вводимых доз с интервалом между дозами от одного часа до одного месяца, на протяжении периода дозирования, составляющего, по меньшей мере, две недели.
В другом аспекте раскрыто применение противовоспалительной композиции для лечения индивидуума в связи с состоянием, характеризуемым воспалением в конкретном органе или ткани. Противовоспалительная композиция содержит антигенные детерминанты, выбранные или полученные так, чтобы вместе они были специфичными, по меньшей мере, для одного микробного патогена, который является патогенным в конкретном органе или ткани.
В другом аспекте раскрыто применение противовоспалительной композиции для получения лекарственного средства для лечения индивидуума в связи с состоянием, характеризуемым воспалением в конкретном органе или ткани. Противовоспалительная композиция содержит антигенные детерминанты, выбранные или полученные так, что вместе они являются специфичными, по меньшей мере, для одного микробного патогена, который является патогенным в конкретном органе или ткани.
Необязательно применения, раскрытые в настоящем описании, включают применения, при которых индивидуум имеет злокачественную опухоль, расположенную в органе или ткани. Кроме того и необязательно, противовоспалительная композиция может быть введена в место введения в виде последовательно вводимых доз с интервалом между дозами от одного часа до одного месяца. на протяжении периода дозирования, составляющего, по меньшей мере, две недели.
В одном аспекте предлагается способ сравнения иммунных ответов. Способ включает в себя введение животному, имеющему орган или ткань, лекарственного средства, содержащего антигенную композицию, имеющую антигенные детерминанты, выбранные или полученные так, чтобы вместе антигенные детерминанты были специфичными, по меньшей мере, для одного микробного патогена, который является патогенным в органе или ткани, выделение количественно измеряемого иммунного образца из органа или ткани, измерение характеристики иммунного ответа в органе или ткани ь количественно измеряемом иммунном образце после Еведения лекарственного средства, и сравнение характеристики иммунного ответа в количественно измеряемом иммунном образце с соответствующей характеристикой иммунного ответа в эталонном иммунном образце, полученном из соответствующего органа или ткани.
Необязательно эталонный иммунный образец может быть получен из соответствующего органа или ткани животного перед стадией введения лекарственного средства.
Необязательно эталонный иммунный образец может быть получен из соответствующего органа или ткани второго животного. Необязательно животное может иметь злокачественную опухоль, расположенную в органе или ткани.
Сравнение характеристики иммунного ответа может заключаться в сравнении в количественно измеряемых и эталонных иммунных образцах показателя количества любого одного или нескольких из следующих типов клеток: воспалительных моноцитов, макрофагов, клеток CD11b+Gr-1+, дендритных клеток, клеток CD11c+ МНС класса II+, Т-клеток CD4+, Т-клеток CD8+ или NK-клеток. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Кроме того, сравнение характеристики иммунного ответа может заключаться в сравнении сдвига в состоянии активации макрофагов.
Необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Кроме того и необязательно, может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемых и эталонных иммунных образцах клеточных маркеров на любом одном или нескольких из следующих типов клеток: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1+, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемых и эталонных иммунных образцах цитокинов, продуцируемых любым одним или несколькими из следующих типов клеток: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Как подробно описано в настоящей публикации, макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Необязательно цитокины продуцируются в результате сдвига в состоянии активации макрофагов. Необязательно происходит сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Кроме того и необязательно, происходит сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемых и эталонных иммунных образцах дифференциальной экспрессии генов в любом одном или нескольких из следующих типов клеток: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1+, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Необязательно дифференциальная экспрессия генов происходит в результате сдвига в состоянии активации макрофагов. Необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к М1-подобным макрофагам. Кроме того и необязательно происходит сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Необязательно лекарственное средство может быть введено ρ место введения в виде последовательно вводимых доз с интервалом между дозами от одного часа до одного месяца на протяжении периода дозирования, составляющего, по меньшей мере, одну неделю. Необязательно лекарственное средство может быть введено внутрикожно или подкожно. Необязательно лекарственное средство может быть введено в дозе, так чтобы каждая доза была эффективной, вызывая видимый локализованный воспалительный иммунный ответ в месте введения. Необязательно лекарственное средство может быть введено так, чтобы видимое локализованное воспаление в месте введения происходило в период от 1 до 48 часов. Кроме того и необязательно животным может быть млекопитающее. Необязательно животным может быть человек или мышь.
В другом аспекте предлагается способ подбора терапевтического препарата, подходящего для лечения индивидуума в связи со злокачественной опухолью в конкретном органе или ткани. Способ включает в себя получение животного, имеющего злокачественную опухоль, расположенную в конкретном органе или ткани, получение тестируемого препарата, содержащего одну или несколько антигенных детерминант микробного патогена, который является патогенным в соответствующем конкретном органе или ткани у здорового индивидуума, измерение характеристики иммунного ответа в эталонном иммунном образце, полученном из органа или ткани животного, введение тестируемого препарата животному, измерение характеристики иммунного ответа в количественно измеряемом иммунном образце, полученном из соответствующего органа или ткани животного, сравнение характеристики иммунного ответа в эталонном и количествекно измеряемом иммунных образцах и обработку повышенной характеристики иммунного ответа в количественно измеряемом иммунном образце по сравнению с эталонным иммунным образцом в качестве показателя пригодности тестируемого препарата в качестве терапевтического препарата. Необязательно животное умерщвляют перед получением количественно измеряемого иммунного образца.
Необязательно сравнение характеристики иммунного ответа может заключаться в сравнении в количественно измеряемом и эталонном иммунных образцах показателя количества любого одного или нескольких из следующих типов клеток: воспалительных моноцитов, макрофагов, клеток CD11b+Gr-1+, дендритных клеток, клеток CD11c+ МНС класса II+, Т-клеток CD4+, Т-клеток CD8+ или NK-клеток. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Необязательно сравнение характеристики иммунного ответа может заключаться в сравнении сдвига в состоянии активации макрофагов. Необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Кроме того и необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах клеточных маркеров на любом одном или нескольких из следующих типов клеток: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1+, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах цитокинов, продуцируемых любым одним или несколькими из следующих типов клеток: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класс II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Необязательно цитокины продуцируются в результате сдвига в состоянии активации макрофагов. Необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Кроме того, может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Кроме того и необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах дифференциальной экспрессии генов, осуществляемой в любой одном или нескольких из следующих типов клеток: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: М1-подобные макрофаги или М2-подоные макрофаги. Необязательно дифференциальная экспрессия генов может осуществляться з результате сдвига в состоянии активации макрофагов. Необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Кроме того и необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
В другом аспекте предлагается способ избирательного целенаправленного воздействия на иммунный ответ по отношению к злокачественной ткани или органу у человека. Способ включает в себя введение субъекту лекарственного средства, содержащего эффективное количество антигенной композиции микробного патогена, при этом микробный патоген может быть патогенным в конкретном злокачественном органе или ткани субъекта, и антигенная композиция содержит антигенные детерминанты, которые вместе являются специфичными для микробного патогена. Необязательно антигенная композиция может содержать композицию целых убитых бактериальных клеток. Необязательно лекарственное средство можно вводить субъекту в количестве и в течение периода времени, которые являются эффективными для повышающей регуляции иммунного ответа в злокачественном органе или ткани субъекта. Необязательно способ может дополнительно включать в себя измерение характеристики иммунного ответа. Способ также включает в себя лечение предзлокачественных поражений, включая без ограничения актинический кератоз, цервикальную дисплазию и аденомы ободочной кишки.
В другом аспекте предлагается способ лечения человека в связи со злокачественной опухолью, расположенной в ткани или органе. Способ включает в себя введение субъекту лекарственного средства, содержащего эффективное количество антигенной композиции микробного патогена, при этом антигенная композиция содержит композицию целых убитых бактериальных клеток, при этом микробный патоген является патогенным в конкретном органе или ткани субъекта, в котором расположена злокачественная опухоль. Лекарственное средство можно вводить субъекту в количестве и в течение периода времени, которые являются эффективными для модулирования иммунного ответа. Необязательно модулирование иммунного ответа может заключаться в сдвиге в состоянии активации макрофагов. Необязательно модулирование иммунного ответа может включать в себя сдвиг от ответа М2-подобных макрофагов к ответу M1-подобных макрофагов. Модулирование иммунного ответа может заключаться в сдвиге от M1-подобных макрофагов к М2-пододным макрофагам, которые определены в настоящем описании. Необязательно и без ограничения способ может дополнительно включать в себя измерение характеристики иммунного ответа.
Необязательно сравнение характеристики иммунного ответа может заключаться в сравнении в количественно измеряемом и эталонном иммунных образцах показателя количества любого одного или нескольких из следующих типов клеток: воспалительных моноцитов, макрофагов, клеток CD11b+Gr-1+, дендритных клеток, клеток CD11c+ МНС класса Т-клеток CD4+, Т-клеток CD8+ или NK-клеток. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Необязательно сравнение характеристики иммунного ответа может заключаться в сравнении сдвига в состоянии активации макрофагов. Кроме того и необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к М1-подобным макрофагам. Необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Кроме того и без ограничения сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах клеточных маркеров на любом одном или нескольких из следующих типов клеток: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах цитокинов, продуцируемых любым одним или несколькими из следующих типов клеток: воспалительными моноциты, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Кроме того, цитокины могут быть продуцированы в результате сдвига в состоянии активации макрофагов. Может происходить сдвиг макрофагов от М2-подобных макрофагов к М1-подобным макрофагам. Необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Кроме того и необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах дифференциальной экспрессии генов, осуществляемой любым одним или несколькими из следующих типов клеток: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Необязательно дифференциальная экспрессия генов может осуществляться в результате сдвига в состоянии активации макрофагов. Кроме того и необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
В другом аспекте предлагается способ мониторинга эффективности схемы лечения у индивидуума, подвергаемого лечению в связи со злокачественной опухолью в конкретном органе или ткани. Способ включает в себя измерение характеристики иммунного ответа в иммунном образце после лечения, полученном из конкретного органа или ткани после того, как индивидуум был подвергнут схеме лечения в течение определенного периода времени, при этом наличие характеристики иммунного ответа, которая превышает по величине характеристику, которую, как можно ожидать, имел бы индивидуум, не подвергнутый данной схеме лечения, является показателем эффективности схемы лечения; и схема лечения включает в себя введение препарата, содержащего одну или несколько антигенных детерминант микробного патогена, который является патогенным в соответствующем конкретном органе или ткани у здорового субъекта.
Способ, подробно описанный в настоящей публикации, может дополнительно включать в себя измерение характеристики иммунного ответа в эталонном образце, полученном до лечения, при этом эталонный образец, полученный до лечения, получают из конкретного органа или ткани до, в момент или после начала схемы лечения, но перед получением иммунного образца после лечения, и сравнение характеристики иммунного ответа в образцах, полученных до лечения и после лечения, при этом увеличение величины иммунного ответа в иммунном образце после лечения по сравнению с эталонным образцом, полученным до лечения, является показателем эффективности схемы лечения. Необязательно измерение характеристики иммунного ответа может заключаться в определении показателя количества воспалительных моноцитов в образце органа или ткани. Необязательно измерение характеристики иммунного ответа может заключаться в определении показателя количества макрофагов в образце органа или ткани. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги.
Необязательно измерение характеристики иммунного ответа может заключаться в определении показателя количества клеток CD11b+Gr-1+ в образце органа или ткани или в определении показателя количества дендритных клеток в образце органа или ткани. Кроме того и необязательно, измерение характеристики иммунного ответа может заключаться в определении показателя количества клеток CD11c+ МНС класса 11+ в образце органа или ткани, или в определении показателя количества Т-клеток CD4+ в образце органа или ткани, или в определении показателя количества Т-клеток CD8+ в образце органа или ткани.
Необязательно измерение величины иммунного ответа может заключаться в определении показателя количества NK-клеток в образце органа или ткани. Кроме того и необязательно, сравнение характеристики иммунного ответа может заключаться ч идентификации в эталонном и иммунном образцах клеточных маркеров на любом одном или нескольких из следующих типов клеток воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1+, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги.
Кроме того и необязательно, сравнение характеристики иммунного ответа может заключаться в идентификации в эталонном и иммунном образцах цитокинов, продуцируемых любым одним или несколькими из следующих типов клеток: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Макрофаги могут включать любой один или несколько из следующих типов клеток: М1-подобные макрофаги или М2-подобные макрофаги. Необязательно цитокины могут быть продуцированы в результате сдвига в состоянии активации макрофагов. Может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобны макрофагам. Кроме того и необязательно, может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в эталонном и иммунном образцах дифференциальной экспрессии генов, осуществляемой любым одним или несколькими из следующих типов клеток: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Макрофаги могут включать любой один или несколько из следующих типов клеток: М1-подобные макрофаги или М2-подобные макрофаги. Дифференциальная экспрессия генов может быть осуществлена в результате сдвига в состоянии активации макрофагов. Может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Как подробно описано в настоящей публикации, в другом аспекте изобретение относится к способам получения иммуногенной композиции для лечения злокачественной опухоли, расположенной в конкретном органе или ткани у млекопитающего, такого как больной человек. Способ может включать в себя отбор, по меньшей мере, одного микробного патогена, который в естественных условиях является патогенным в органе или ткани млекопитающего, в котором расположена злокачественная опухоль. Может быть получена антигенная композиция, которая содержит антигенные детерминанты, которые вместе являются специфичными или характерными для микробного патогена.
Можно использовать диагностическую стадию для идентификаций конкретного органа или ткани, в которых находится злокачественная опухоль, перед получением антигенной композиции, нацеленной на место локализации злокачественной опухоли. Место локализации злокачественной опухоли может быть первичным местом или вторичным местом локализации метастаза. Антигенная композиция может быть достаточно специфичной, чтобы она могла быть способной вызывать иммунный ответ у млекопитающего, специфичный для микробного патогена. Антигенная композиция может представлять собой бактериальную композицию, например, полученную из вида бактерии, либо вида, который является эндогенным для флоры пациента, либо из экзогенного вида или видов. В альтернативных вариантах антигенная композиция может быть получена из вируса или вирусов. Соответственно, микробный патоген, из которого получена антигенная композиция, может быть вирусом. Микробный патоген может быть убитым. В альтернативных вариантах микробный патоген может быть живым или ослабленным. Иммуногенные композиции согласно изобретению также могут быть получены или введены с противовоспалительными средствами, такими как НПВС.Местом введения может быть место, находящееся на определенном расстоянии от места локализации злокачественной опухоли, например, в органе или ткани, которые не являются органом или тканью, в которых находится злокачественная опухоль, например, кожа или подкожная ткань.
Антигенная композиция может быть получена, например, для подкожной инъекции, внутрикожной инъекции или перорального введения. В вариантах для подкожной или внутрикожной инъекции дозирование или препарат антигенной композиции можно корректировать, чтобы получить локализованную иммунную реакцию, видимую в коже в месте введения, например, область воспаления диаметром от 2 мм до 100 мм, появляющуюся, например, через 2-48 часов после введения и длящуюся, например, 2-72 часа или дольше. Антигенная композиция может быть получена для многократного подкожного или внутрикожного введения, например, в последовательно меняющихся местах.
В некоторых вариантах изобретение относится к способам лечения млекопитающего в связи со злокачественной опухолью, расположенной в ткани или органе. В альтернативных вариантах лечение может предупреждать развитие злокачественной опухоли в ткани, например, если место локализации первичной опухоли дает основание сделать предположение о вероятности метастазирования в конкретную ткань или орган, то пациент может быть подвергнут профилактическому лечению, чтобы предотвратить или ослабить метастазирование в данную ткань или орган. Способ может включать в себя введение субъекту эффективного количества антигенной композиции, содержащей антигенные детерминанты, которые вместе являются специфичными, по меньшей мере, для одного микробного патогена. Аспект изобретения заключается в применении микробного патогена, который является патогенным в конкретном органе или ткани млекопитающего, в которых расположена злокачественная опухоль. Антигенная композиция может быть введена, например, подкожной или внутрикожной инъекцией в место введения в виде доз, вводимых последовательно с интервалами между дозами, составляющими, например, от одного часа до одного месяца, на протяжении периода дозирования, составляющего, например, по меньшей мере 1 неделю, 2 недели, 2 месяца, 6 месяцев, 1, 2, 3, 4 или 5 лет или больше. Каждая инъецируемая доза может быть, например, отмерена так, чтобы она была эффективной для того, чтобы вызвать появление видимого локализованного воспаления в месте введения, например, через 1-48 часов после инъекции.
В другом аспекте предлагаются способы лечения злокачественных опухолей в конкретном органе или ткани у субъекта посредством введения одного или нескольких антигенов одного или нескольких микробных патогенов, таких как виды бактерий или вирусов, которые являются патогенными в конкретном органе или ткани.
В альтернативных вариантах вид патогенного микроорганизма может быть способен вызывать инфекцию естественным образом (т.е. без вмешательства человека) в конкретном органе или ткани у здорового субъекта или мог вызвать инфекцию в конкретном органе или ткани у здорового субъекта. В альтернативных вариантах антиген можно вводить, используя введение целого микроорганизма. В альтернативных вариантах способ может включать в себя, например, введение, по меньшей мере, двух или более видов микроорганизмов или введение, по меньшей мере, трех или более видов микроорганизмов, и микроорганизмы могут представлять собой бактерии или вирусы. В альтернативных вариантах способ может дополнительно включать в себя введение добавки или адъюванта. Один аспект изобретения включает в себя введение антигенных композиций для того, чтобы вызвать иммунный ответ у указанного субъекта.
В альтернативных вариантах микробный патоген в антигенной композиции может быть убитым и, следовательно, превращенным в неинфекционный. В некоторых вариантах антигенную композицию вводят в место, удаленное от места локализации злокачественной опухоли, и в выбранных вариантах такого вида способы согласно изобретению можно осуществлять так что они не вызывают инфекцию в месте локализации злокачественной опухоли.
Как подробно описано в настоящей публикации, различные аспекты изобретения включают в себя лечение злокачественных опухолей. В данном контексте лечение может быть проведено для того, чтобы получить различные результаты. Например, лечение может: вызывать иммунную реакцию, которая является эффективной в ингибировании или ослаблении роста или пролиферации злокачественной опухоли; ингибировать рост или пролиферацию злокачественных клеток или опухолей; вызывать ремиссию злокачественной опухоли; улучшать качество жизни; снижать риск рецидива злокачественной опухоли; ингибировать метастазы злокачественная опухоли или повышать частоту выживаемости пациентов в популяции пациентов. В данном контексте продление продолжительности жизни пациента или популяции пациентов означает увеличение количества пациентов, которые выживают в течение заданного периода времени после постановки конкретного диагноза. В некоторых вариантах может быть проведено лечение пациентов, которые не отвечали на другое лечение, таких как пациенты, для которых химиотерапия или хирургия не была эффективным способом лечения. Лечение в альтернативных вариантах может быть проведено, например, до или после появления злокачественной опухоли. Например, может быть предпринято профилактическое лечение, например, пациентов,: которые диагностированы как пациенты, для которых существует риск появления конкретной злокачественной опухоли. Например, пациента, имеющего генетическую или обусловленную образом жизни предрасположенность к злокачественной опухоли в определенной ткани или органе, можно лечить иммуногенной композицией, содержащей антигенные детерминанты патогена, который является патогенным в данном органе или ткани. Подобным образом, может быть предпринято профилактическое лечение метастазов, так что пациентов, имеющих первичную злокачественную опухоль, склонную к метастазированию в конкретную ткань или орган, можно лечить иммуногенной композицией, содержащей антигенные детерминанты патогена, который является патогенным в данном органе или ткани.
В другом аспекте предлагается способ лечения злокачественной опухоли, расположенной в легком субъекта. Способ включает в себя введение субъекту эффективного количества антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, и введение субъекту эффективного количества химиотерапевтического средства, содержащего платину. Видом микроорганизма может быть вирусный патоген или бактериальный патоген или грибковый патоген.
Вирусным патогеном может быть без ограничения: вирус гриппа, аденовирус, респираторно-синцитиальный вирус или вирус парагриппа. Бактериальным патогеном может быть без ограничение. Streptococcus pneumoniae, Moraxella catarrhalis, Mycoplasma pneumoniae, Klebsiella pneumoniae, Haemophilus influenza, Staphylococcus aureus, Chlamydia pneumoniae или Legionella pneumophila. Грибковым патогеном может быть без ограничения: Aspergillus fumigatus, виды Blastomyces, Coccidiodes immitis, Coccidiodes posadasii, Cryptococcus neoformans, Cryptococcus gattii, виды Fusarium, Histoplasma capsulatum, виды Paecilomyces, Paracoccidiodes brasiliensis, Penicillium marneffei, Pneumocystis jiroveci, Pseudallescheria boydii, Scedosporium apiospermum, виды Rhizopus, виды Mucor, виды Absidia, виды Cunninghamella, Scedosporium prolifleans, Stachybotrys chartarum, Trichoderma longibrachiatium или виды Trichosporon. Кроме того химиотерапевтическим средством, содержащим платину, может быть без ограничения: цисплатин, карбоплатин или оксалиплатин.
В другом аспекте предлагается применение эффективного количества антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, для получения лекарственного средства для применения с химиотерапевтическим средством, содержащим платину, для лечения рака легкого у субъекта. В другом аспекте предлагается применение эффективного количества антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, для применения с химиотерапевтическим средством, содержащим платину, для лечения рака легкого у субъекта. Видом микроорганизма может быть вирусный патоген или бактериальный патоген, или грибковый патоген.
Вирусным патогеном может быть без ограничения: вирус гриппа, аденовирус, респираторно-синцитиальный вирус или вирус парагриппа. Бактериальным патогеном может быть без ограничении: Streptococcus pneumoniae, Moraxella catarrhalis, Mycoplasma pneumoniae, Klebsiella pneumoniae, Haemophilus influenza, Staphylococcus aureus, Chlamydia pneumoniae или Legionella pneumophila. Грибковым патогеном может быть без ограничения: Aspergillus fumigatus, виды Blastomyces, Coccidiodes immitis, Coccidiodes posadasii, Cryptococcus neoformans, Cryptococcus gattii, виды Fusarium, Histoplasma capsulatum, виды Paecilomyces, Paracoccidiodes brasiliensis, Penicillium marneffei, Pneumocystis jiroveci, Pseudallescheria boydii, Scedosporium apiospermum, виды Rhizopus, виды Mucor, виды Absidia, виды Cunninghamella, Scedosporium prolificans, Stachybotrys chartarum, Trichoderma longibrachiatium или виды Trichosporon. Кроме того, химиотерапевтическим средством, содержащим платину, может быть без ограничения: цисплатин, карбоплатин или оксалиплатин.
В другом аспекте предлагается эффективное количество антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, для получения лекарственного средства для применения с химиотерапевтическим средством, содержащим платину, для лечения рака легкого у субъекта. В другом аспекте предлагается эффективное количество антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, для применения с химиотерапевтическим средством, содержащим платину, для лечения рака легкого у субъекта. Видом микроорганизма может быть вирусный патоген или бактериальный патоген, или грибковый патоген.
Вирусным патогеном может быть без ограничения: вирус гриппа, аденовирус, респираторно-синцитиальный вирус или вирус парагриппа. Бактериальным патогеном может быть без ограничения: Streptococcus pneumoniae, Moraxella catarrhalis, Mycoplasma pneumoniae, Klebsiella pneumoniae, Haemophilus influenza, Staphylococcus aureus, Chlamydia pneumoniae или Legionella pneumophila. Грибковым патогеном может быть без ограничения: Aspergillus fumigatus, виды Blastomyces, Coccidiodes immitis, Coccidiodes posadasii, Cryptococcus neoformans, Cryptococcus gattii, виды Fusarium, Histoplasma capsulatum, виды Paecilomyces, Paracoccidiod.es brasiliensis, Penicillium marneffei, Pneumocystis j iroveci, Pseudallescheria boydii, Scedosporium apiospermum, виды Rhizopus, виды Mucor, виды Absidia, виды Cunninghamella, Scedosporium prolificans, Stachybotrys chartarum, Trichoderma longibrachiatium, или виды Trichosporon. Кроме того, химиотерапевтическим средством, содержащим платину, может быть без ограничения: цисплатин, карбоплатин или оксалиплатин.
В другом аспекте предлагается набор. Набор содержит антиген одного или нескольких видов микроорганизмов, которые являются патогенными в легком, химиотерапевтическое средство, содержащее платину; и инструкции по предоставлению антигена и химиотерапевтического средства, содержащего платину,
нуждающемуся в них субъекту. Видом микроорганизма может быть вирусный патоген или бактериальный патоген, или грибковый патоген.
Вирусным патогеном могут быть без ограничения следующие патогены: вирус гриппа, аденовирус, респираторно-синцитиальный вирус или вирус парагриппа. Бактериальным патогеном может быть без ограничения: Streptococcus pneumoniae, Moraxella catarrhalis, Mycoplasma pneumoniae, Klebsiella pneumoniae, Haemophilus influenza, Staphylococcus aureus, Chlamydia pneumoniae или Legionella pneumophila. Грибковым патогеном может быть без ограничения: Aspergillus fumigatus, виды Blastomyces, Coccidiodes immitis, Coccidiodes posadasii, Cryptococcus neoformans, Cryptococcus gattii, виды Fusarium, Histoplasma capsulatum, виды Paecilomyces, Paracoccidiodes brasiliensis, Penicillium marneffei, Pneumocystis jiroveci, Pseudallescheria boydii, Scedosporium apiospermum, виды Rhizopus, виды Mucor, виды Absidia, виды Cunninghamella, Scedosporium prolificans, Stachybotrys chartarum, Trichoderma longibrachiatium или виды Trichosporon. Кроме того, химиотерапевтическим средством, содержащим платину, может быть без ограничения: цисплатин, карбоплатин или оксалиплатин.
В различных аспектах изобретение относится к способам получения препарата и применения иммуногенной композиции для лечения IBD. IBD может представлять собой, например, IBD, которое является симптоматическим в одной или нескольких областях ЖКТ у больных людей, таким как болезнь Крона, язвенный колит, коллагенозный колит, лимфоцитарный колит, ишемический колит, колит в отключенной кишке, синдром Бехчета или недифференцированный колит.Лечение пациента может включать в себя диагностическую стадию идентификации области ЖКТ, в которой IBD является симптоматическим. Препарат может содержать антигенную композицию, содержащую антигенные детерминанты, которые вместе являются специфичными, по меньшей мере, для одного патогена, такого как бактерия, вирус, простейшее или гельминт, которые являются патогенными в пораженной области ЖКТ. Препарат может быть получен для введения в виде иммуногенной композиции, способной вызывать иммунную реакцию, для лечения IBD. Композиция может быть, например, получена для введения путем, который не является энтеральным, таким как подкожная инъекция или внутрикожная инъекция, например, для того, чтобы получить локализованный иммунный ответ в коже, такой как воспалительная реакция, в месте введения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
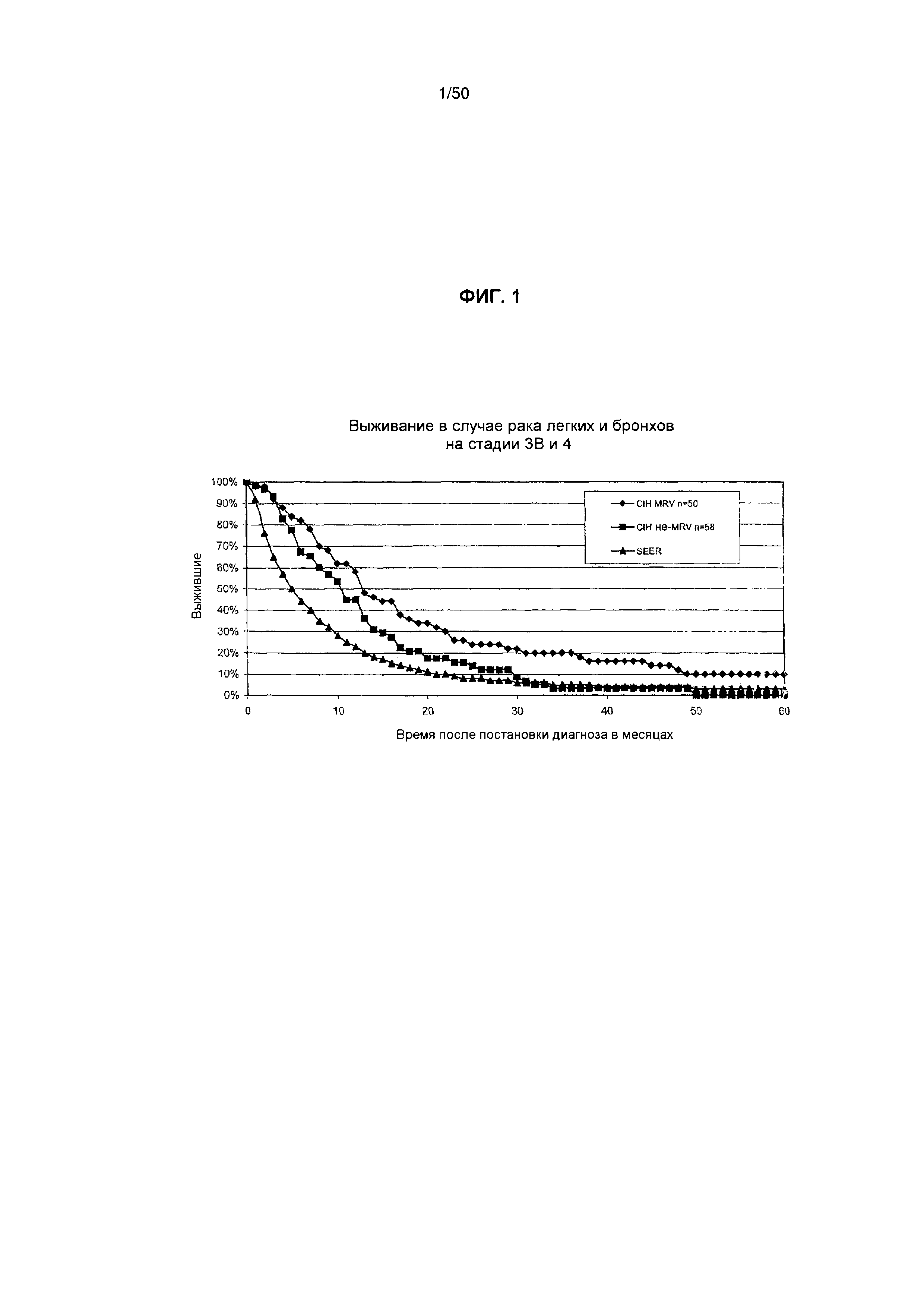
На фигуре 1 показана кривая выживаемости для кумулятивного ряда пациентов, у которых диагностирован неоперабельный рак. легкого на стадии 3В или 4 (все пациенты), при этом представлено сравнение пациентов, которых лечили MRV, пациентов, не подвергнутых лечению MRV, и стандартной кривой выживаемости SEER.
На фигуре 2 показана кривая выживаемости для кумулятивного ряда пациентов, у которых диагностирован неоперабельный рак легкого на стадии 3В или 4 (пациентов лечили в течение, по меньшей мере, 2 месяцев, используя MRV), при этом представлено сравнивающие пациентов, которых лечили MRV, пациентов, не подвергнутых лечению MRV, и стандартной кривой выживаемости SEER.
На фигуре 3 показана кривая выживаемости для кумулятивного ряда пациентов, у которых диагностирован рак легкого на стадии 3В или 4, иллюстрирующая преимущества лечения с использованием композиции MRV согласно изобретению, при этом представлено сравнение пациентов, которых лечили MRV, пациентов, не подвергнутых лечению MRV, и стандартной кривой выживаемости SEER.
На фигуре 4 показана кривая выживаемости для кумулятивного ряда пациентов, у которых диагностирован рак легкого на стадии 3В или 4, иллюстрирующая эффект лечения в течение, по меньшей мере, 2 месяцев, при этом проведено сравнение пациентов, которых лечили MRV, пациентов, не подвергнутых лечению MRV, и стандартной кривой выживаемости SEER.
На фигуре 5 показана кривая выживаемости для кумулятивного ряда пациентов, у которых диагностирован рак легкого на стадии 3В или 4, иллюстрирующая эффект лечения в течение периода времени, составляющего, по меньшей мере, 6 месяцев, при этом проведено сравнение пациентов, которых лечили MRV, пациентов, не подвергнутых лечению MRV, и стандартной кривой выживаемости SEER.
На фигуре 6 показана кривая выживаемости для кумулятивного ряда из 52 пациентов с раком молочной железы с метастазами в кости и/или легкое, при этом проведено сравнение пациентов, которых лечили MRV, пациентов, не подвергнутых лечению MRV, и стандартной кривой выживаемости SEER.
На фигуре 7 представлено сравнение выживаемости в кумулятивном ряду пациентов с мета ста зирующим раком простаты, которые были подвергнуты хирургической операции или облучению, чтобы разрушить их предстательную железу (и, следовательно, первичную опухоль), и которые имели выявляемую злокачественную опухоль, ограниченную метастазами в костях, при этом проведено сравнение пациентов, которых лечили MRV, пациентов, не подвергнутых лечению MRV, и стандартной кривой выживаемости SEER.
На фигуре 8 показана кривая выживаемости для кумулятивного ряда пациентов, у которых первично диагностирован рак прямой и ободочной кишки на стадии 4, при этом проведено сравнение пациентов, которых лечили PVF, пациентов, которых лечили MRV, пациентов, не подвергнутых лечению антигенной композицией, и стандартной кривой выживаемости SEER.
На фигуре 9 показана кривая выживаемости для кумулятивного ряда пациентов, у которых первично диагностирован рак прямой и ободочной кишки на стадии 4, и данные для пациентов, получающих лечение в течение 3 месяцев после диагноза, при этом проведено сравнение пациентов, которых лечили PVF, пациентов, которых лечили MRV, пациентов, не подвергнутых лечению антигенной композицией, и стандартной кривой выживаемости SEER.
На фигуре 10 показана кривая выживаемости для кумулятивного ряда пациентов с раком легкого на стадии 3В, которых лечили с использованием пероральной антигенной терапии, респиваксом, по сравнению с пациентами, которые не применяли антигенную композицию.
На фигуре 11 показана кривая выживаемости для кумулятивного ряда пациентов, у которых диагностирован рак легкого на стадии 3В, иллюстрирующая преимущества лечения с использованием композиции MRV согласно изобретению, при этом проведено сравнение пациентов, которых лечили MRV, пациентов, не подвергнутых лечению MRV, и стандартной кривой выживаемости SEER.
На фигуре 12 показана кривая выживаемости, построенная по данным первого визита для кумулятивного ряда пациентов, у которых диагностирован рак легкого на стадии 3В, иллюстрирующая преимущества лечения с использованием композиции MRV согласно изобретению, при этом проведено сравнение пациентов, которых лечили MRV, пациентов, не подвергнутых лечению MRV, и стандартной кривой выживаемости SEER.
На фигуре 13 показана кривая выживаемости для кумулятивного ряда пациентов, у которых диагностирован рак легкого на стадии 3В, первый визит которых в течение периода до 3 месяцев после постановки диагноза, иллюстрирующая преимущества раннего лечения с использованием композиции MRV согласно изобретению, при этом проведено сравнение пациентов, которых лечили MRV, и пациентов, не подвергнутых лечению MRV.
На фигуре 14 показана фотография легких мышей, обработанных (ряд 1) и необработанных (ряд 2) вакциной, содержащей только клетки К. pneumoniae, после заражения клетками карциномы легких Льюис, как описано в настоящей публикации в примере 4А. В нижнем ряду (не пронумерованном) изображены легкие мышей, которых не подвергали воздействию в мышиной модели рака легкого.
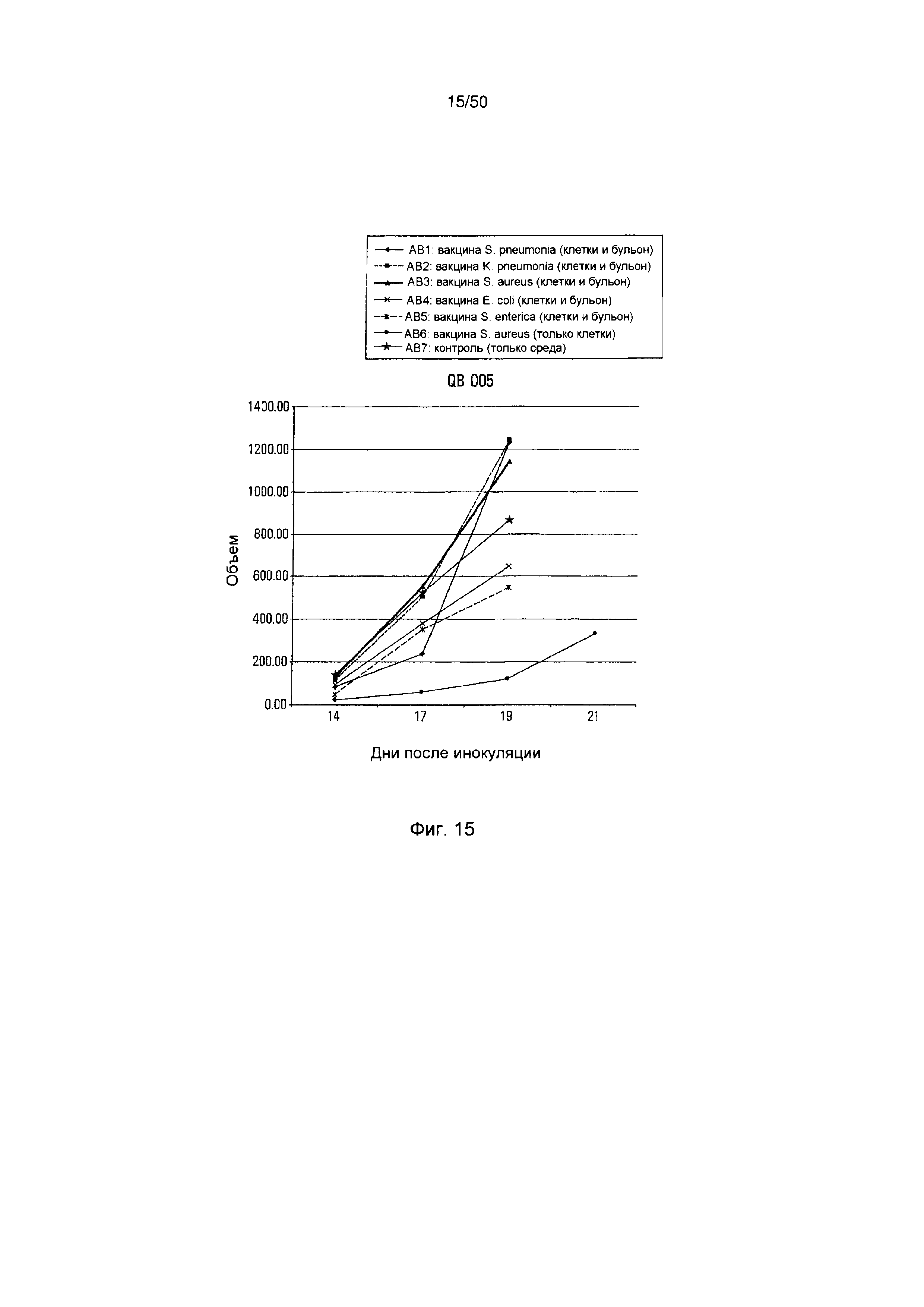
На фигуре 15 показан средний размер опухолей мышей, обработанных [АВ1-АВ6] и необработанных [АВ-7] бактериальными вакцинами после заражения клетками меланомы В16, как описало в настоящей публикации в примере 4В.
На фигуре 16 показана кривая выживаемости в группах мышей в модели рака ободочной кишки, обработанных или необработанных разными бактериальными вакцинами, как описано в настоящей публикации в примере 4С.
На фигуре 17 показано количество воспалительных моноцитов и дендритных клеток в дренирующих лимфатических узлах, легких и селезенке после лечения либо антигенной композицией К. pneumoniae, либо PBS, как описано в настоящей публикации в примере 5А.
На фигуре 18 показано общее количество моноцитов и дендритных клеток в легком, брюшине и селезенке мышей после лечения либо антигенной композицией К. pneumoniae, либо антигенной композицией Е. coli, либо PBS, как описано в настоящей публикации в примере 5В.
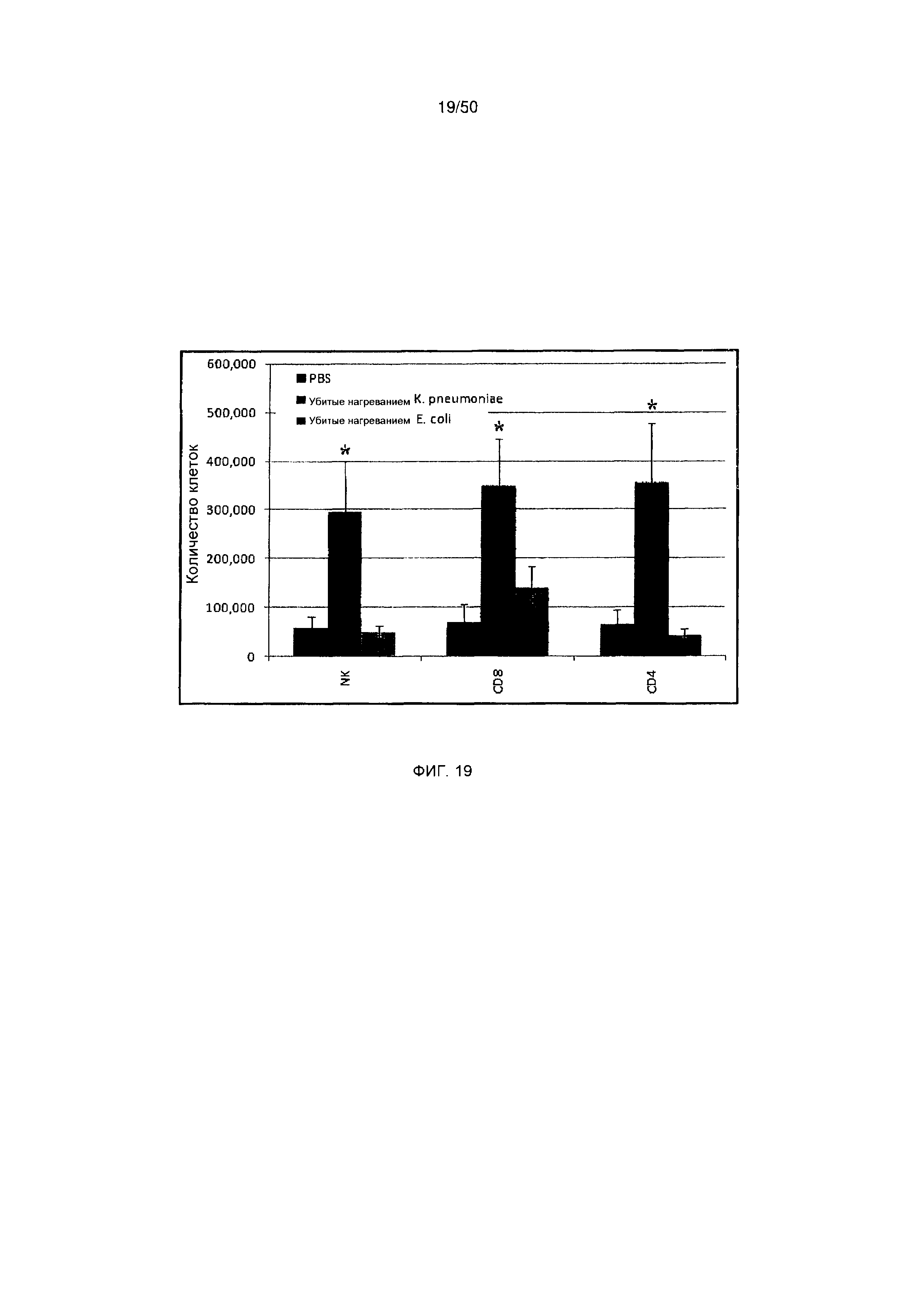
На фигуре 19 показано общее количество Т-клеток CD4+, Т-клеток CD8+ и NK-клеток у мышей, обработанных либо антигенной композицией К. pneumoniae, либо антигенной композицией Е. coli, либо PBS, как описано в настоящей публикации в примере 5В.
На фигуре 20 показано общее количество (А) роспалительных моноцитов и (В) Т-клеток CD4+, Т-клеток CD8+ и NK-клеток либо на 9 день, либо на 16 день у мышей, обработанных либо инактивированной нагреванием антигенной композицией К. pneumoniae, либо инактивированной фенолом антигенной композицией К. pneumoniae, либо PBS, как описано в настоящей публикации в примере 5С.
На фигуре 21 показано общее количество (А) воспалительных моноцитов и дендритных клеток и (В) Т-клеток CD4+, Т-клеток CD84- и NK-клеток у мышей, обработанных либо инактивированной нагреванием антигенной композицией К. pneumoniae, либо инактивированной фенолом антигенной композицией К. pneumoniae, либо PBS, как описано в настоящей публикации в примере 5D.
На фигуре 22 показано общее количество опухолевых узлов у мышей, обработанных либо PBS, либо разными дозами антигенной композиции К. pneumoniae, как описано в настоящей публикации.
На фигуре 23 показана фотография легких мышей, обработанных либо PBS, либо разными дозами антигенной композиции К. Pneumoniae, как описано в настоящей публикации.
На фигуре 24 показано общее количество опухолевых узлов у мышей, обработанных либо PBS, либо разными дозами антигенной композиции К. Pneumoniae, как описано в настоящей публикации.
На фигуре 25 показано общее количество опухолевых узлов у мышей, обработанных либо PBS, или дозами антигенной композиции К. pneumoniae в сочетании (или нет) с цисплатином, как описано в настоящей публикации.
На фигуре 26 показана кривая выживаемости для мышей, которым инъецировали клетки карциномы легких Льюис и обрабатывали (i) контрольным наполнителем; (ii) цисплатином; (iii) антигенной композицией, или (iv) антигенной композицией и цисплатином.
На фигуре 27 показано процентное содержание миелоидных клеток CD11b+ в крови на 13 день соответствующего эксперимента, подробно описанного в настоящей публикации.
На фигуре 28 показана (левая панель) частота встречаемости клеток CD11b+NK1.1 - в легких мышей, обработанных разными дозами антигенных композиций К. pneumoniae или контрольным PBS, или (правая панель) частота встречаемости клеток CD11b+NK1.1+ в легких мышей, обработанных разными дозами антигенных композиций К. pneumoniae или контрольным PBS.
На фигуре 29 показаны количества различных цитокиное, выявляемых (в пг/г) в ткани легкого, полученной от мышей, обработанных разными дозами антигенных композиций К. pneumoniae или контрольным PBS.
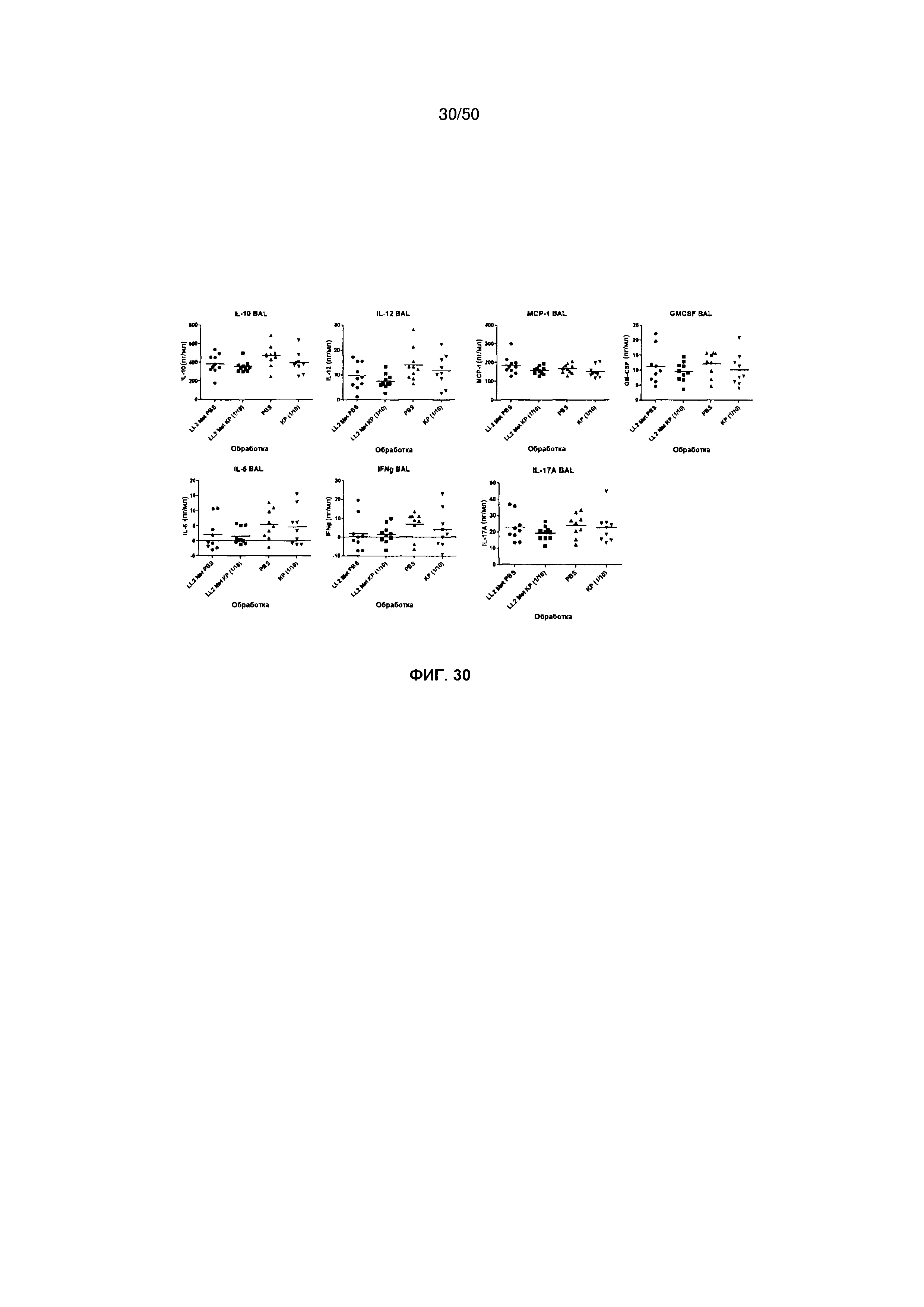
На фигуре 30 показаны количества различных цитокинов, выявляемых (в пг/мл) в жидкости бронхоальвеолярного лаважа от мышей, обработанных разными дозами антигенных композиций К. pneumoniae или контрольным PBS.
На фигуре 31 показаны сравнительные отношении экспрессии генов NOS2 к Argl у мышей, обработанных разными дозами антигенных композиций К. pneumoniae или контрольным PBS.
На фигуре 32 показана соотносительная частота экспрессии CD206 в макрофагах легких у мышей, обработанных разными дозами антигенных композиций К. pneumoniae или контрольным PBS.
На фигуре 33 показана относительная частота экспрессии F4/80 экспрессия в макрофагах легких у мышей, обработанных разными дозами антигенных композиций К. pneumoniae или контрольным PBS.
На фигуре 34 показана относительная частота клеток CD11b+Gr-1+, выявляемых в ободочной кишке у мышей, обработанных либо антигенными композициями К. pneumoniae или Е. coli, либо контрольным PBS.
На фигуре 35 показана относительная частота клеток CD11b+Gr-1+, выявляемых в легких мышей, обработанных либо антигенными композициями К. pneumoniae или Е. coli или контрольным PBS.
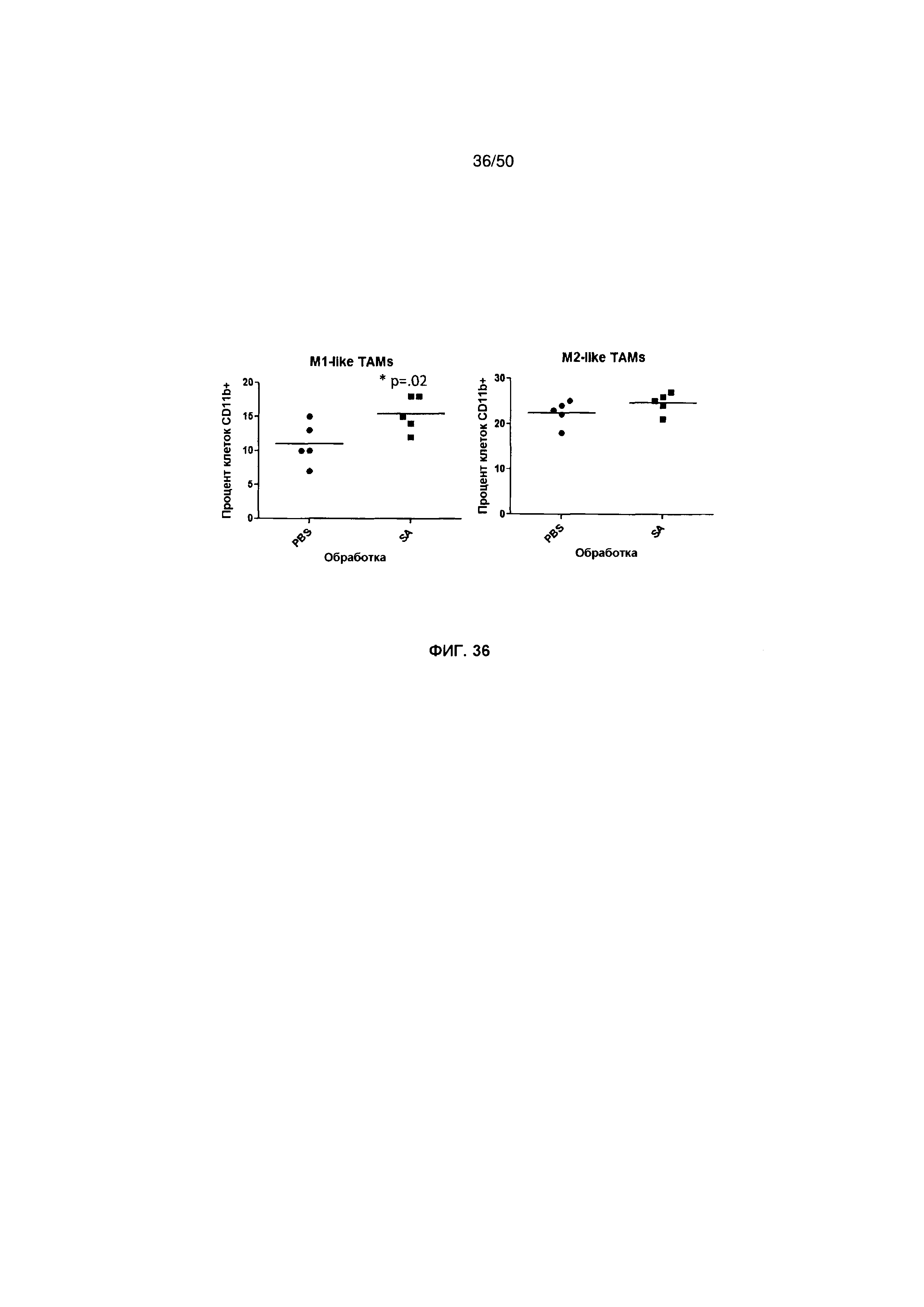
На фигуре 36 показана относительная частота клеток CD11b+, которые были M1-подобными, которые выделены из подкожных опухолей 4Т1 (левая панель), и относительная частота клеток CD11b+, которые были М2-подобными, которые выделены из подкожных опухолей 4Т1 (правая панель).
На фигуре 37 показан объем опухолей (мм3) у мышей, обработанных либо индометацином и PBS; либо индометацином и антигенной композицией S. aureus; либо EtOH и PBS; либо EtOH и антигенной композицией S. aureus [левая панель]. На правой панели на той же фигуре также показана относительная частота и состав клеток CD11b+ в опухолях на 11 день соответствующего эксперимента, подробно описанного в настоящей публикации.
На фигуре 38 показана относительная частота и состав клеток CD11b+ в опухолях на 22 день соответствующего эксперимента, подробно описанного в настоящей публикации.
На фигуре 39 показан объем опухолей в когорте животных, обработанных индометацином, индометацином + антигенными композициями, только наполнителем или только антигенными композициями.
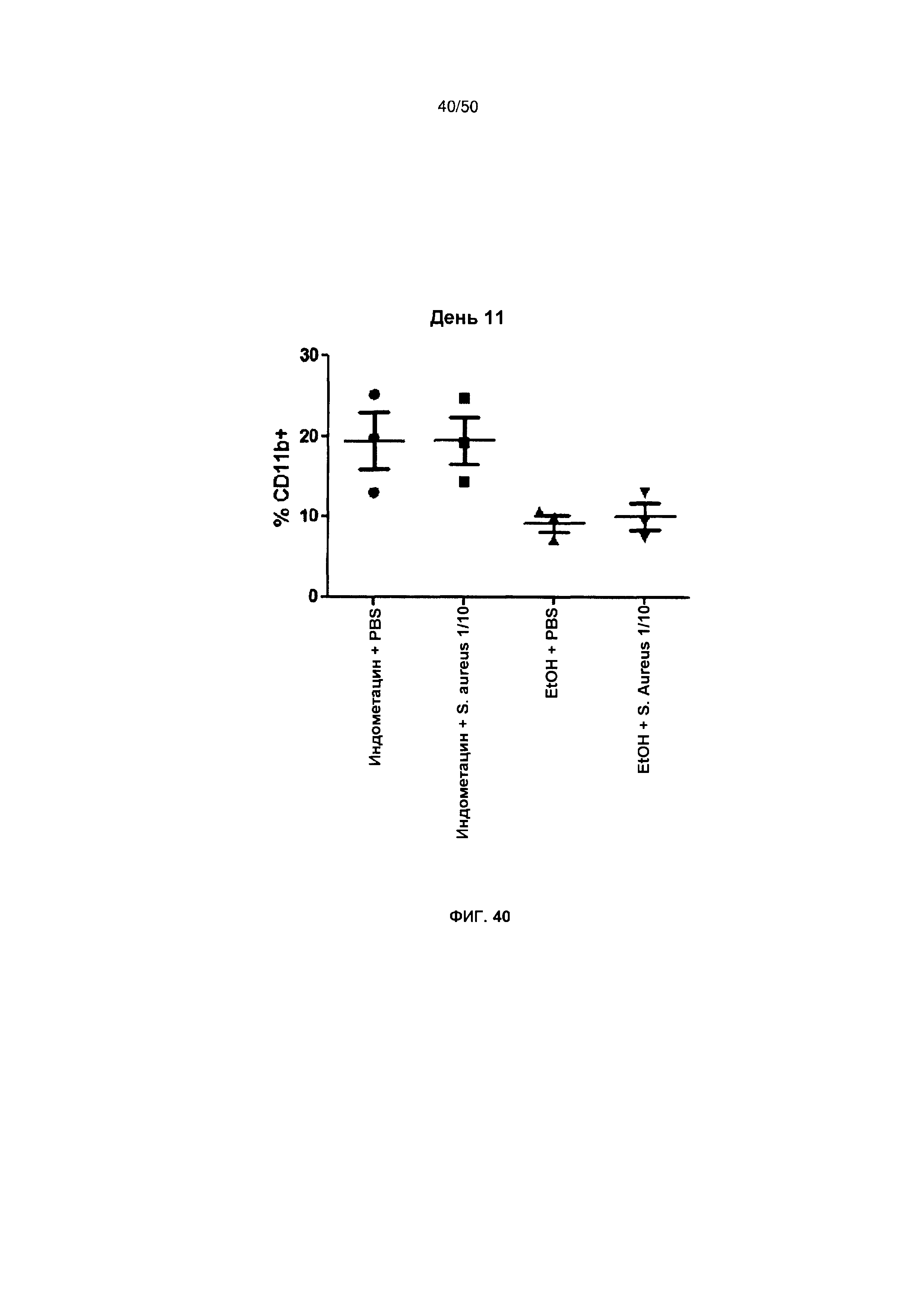
На фигуре 40 показано процентное содержание клеток CD11b+ в опухолях животных, обработанных индометацином, индохизтацином + антигенными композициями, только наполнителем или только антигенными композициями (данные на 11 день).
На фигуре 41 показано процентное содержание клеток CD11b+м в опухолях животных, обработанных индометацином, индометацином + антигенными композициями, только наполнителем или только антигенными композициями (данные на 22 день).
На фигуре 42 показано процентное содержание клеток CD11b+CD94+ в опухолях животных, обработанных индометацином, индометацином + антигенными композициями, только наполнителем или только антигенными композициями (данные на 22 день).
На фигуре 43 показана относительная экспрессия (А) Fizzl и (В) Ym1 в вырезанных опухолях, как описано в настоящей публикации.
На фигуре 44 показана относительная экспрессия (A) Arg1 и (В) Fizzl в опухолях и селезенках [(С) и (D)], как описано в настоящей публикации.
На фигуре 45 показана относительная экспрессия Nos2 и Ym1 в опухолях и селезенках, как описано в настоящей публикации.
На фигуре 46 показано количество IFN-γ, продуцируемого в легких мышей с опухолями и без опухолей и в случае лечения и без лечения антигенными композициями, как описано в настоящей публикации.
На фигуре 47 показано количество IL-10, продуцируемого макрофагами костного мозга, культивируемыми в течение ночи с антигенной композицией К. pneumoniae, ЛПС и средой отдельно.
На фигуре 48 показана относительная экспрессия IL-10, продуцируемого в опухолях мышей в условиях, описанных в настоящей публикации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В различных аспектах вариант осуществления изобретения относится к неожиданному открытию того, что введение, например, в место, удаленное от злокачественной опухоли, микробных патогенов, таких как убитые микробные патогены, которые являются патогенными в конкретной ткани или органе, является эффективным при лечении злокачественной опухоли, расположенной в такой конкретной ткани или органе. Соответственно, изобретение относится к антигенным композициям, полученным из таких микробных патогенов, включая целые убитые бактерии или вирусы или их компоненты, для лечения злокачественных опухолей и к способам их применения.
На основе наблюдений при лечении пациентов было обнаружено, что введение композиций убитых бактерий, которые включали множество видов бактерий, которые обычно вызывают инфекцию легких, было удивительно и неожиданно эффективным в улучшении клинического течения рака легкого. Подобным образом, было обнаружено, что введение композиций, содержащих убитые Staphylococcus aureus, являющиеся одной из наиболее распространенных причин инфекции кости, молочной железы, кожи, промежности и лимфатических узлов и септицемии, было удивительно и неожиданно эффективным в улучшении клинического течения рака костей, молочной железы, кожи, промежности и лимфомы (злокачественной опухоли лимфатических желез) и множественной миеломы (типа гематологической злокачественной опухоли). Подобным образом, удивительным и неожиданным было обнаружение того, что введение композиции, содержащей Escherichia coli, которая является распространенной причиной инфекции ободочной кишки, почки, брюшины, печени, брюшной полости, поджелудочной железы и яичника, было эффективным в улучшении клинического течения рака ободочной кишки, почки, брюшины, печени, абдоминальных лимфатических узлов, поджелудочной железы и яичника.
Полученные результаты показывают, что композиция, содержащая антигены патогенных видов микроорганизмов, которые вызывают инфекцию в конкретной ткани или органе, будет эффективным препаратом для лечения злокачественной опухоли в такой ткани или органе. Например, злокачественная опухоль в легком эффективно подвергается лечению микробной композицией, содержащей один или несколько видов патогенов, которые обычно вызывают инфекцию легких, тогда как злокачественная опухоль в ободочной кишке эффективно лечится композицией, содержащей патогенный вид микроорганизма, который обычно вызывает инфекции ободочной кишки.
Могут быть получены антигенные композиции согласно изобретению, которые содержат антигенные детерминанты, которые вместе являются специфичными или характерными для микробного патогена. В данном контексте термин «специфичные» означает, что антигенные детерминанты являются достаточно характерными для патогена так, что они могут быть использованы для того, чтобы вызвать иммунный ответ, такой как адаптивный иммунный ответ, против патогена у пациента, если антигенные детерминанты были введены соответствующим образом, чтобы вызвать такой эффект. Будет понятно, что антигенные детерминанты не должны быть настолько специфичными, чтобы они были характерными только для одного конкретного штамма или вида патогена, так как даже специфичный иммунный ответ против конкретного патогена может быть перекрестно реактивным по отношению к другим близко родственным организмам, которые также в естественных условиях являются патогенными в ткани или органе, в котором находится злокачественная опухоль, и что антигенную композицию готовят или выбирают по отношении к мишени.
В некоторых вариантах композиции патогенных микроорганизмов можно применять для лечения мест локализации первичных злокачественных опухолей и/или мест локализации метастазов. Таким образом, например, микробные композиции можно применять для лечения злокачественной опухоли в конкретном месте, независимо от того, является ли злокачественная опухоль первичной злокачественной опухолью или метастазом. Композиция может быть направлена на лечение каждого из мест локализации злокачественной опухоли или может представлять собой комбинированную композицию как для первичной злокачественной опухоли, так и места (мест) локализации метастазов. Например для лечения злокачественной опухоли рака почек, которая метастазировала в легкое и кость, можно использовать три разных композиции, содержащих один или несколько видов, которые, как известно, являются патогенами почек, один или несколько видов, которые, как известно, являются патогенами легких, и один или несколько видов, которые, как известно, являются патогенами кости, или можно использовать комбинированную композицию указанных патогенов. В некоторых вариантах композиции могут быть введены в разные места локализации одновременно или в разные моменты времени.
Например, в случае рака легкого с метастазами в кости, в альтернативных вариантах, можно использовать микробную композицию, содержащую один или несколько видов бактерий (или вирусов), которые обычно вызывают инфекцию легких, и микробную композицию, содержащую один или несколько видов бактерий (или вирусов), которые обычно вызывают инфекцию костей. Подобным образом, в случае рака ободочной кишки с метастазами в легкие, можно использовать композицию патогенных бактерий (или вирусов), содержащую один или несколько видов бактерий (или вирусов), которые обычно вызывают инфекцию ободочной кишки, и микробную композицию, содержащую один или несколько видов бактерий (или вирусов), которые обычно вызывают инфекцию легких; в случае рака простаты с метастазами в кости, можно использовать композицию патогенных бактерий (или вирусов), содержащую один или несколько видов бактерий (или вирусов), которые обычно вызывают инфекцию простаты, и композицию патогенных бактерий (или вирусов), содержащую один или несколько видов бактерий (или вирусов), которые обычно вызывают инфекцию костей.
В следующем списке приведены некоторые не ограничивающие примеры первичных злокачественных опухолей и их обычные места вторичного распространения (метастазов):


В некоторых вариантах антигенные композиции могут быть применимы для лечения или профилактики злокачественных опухолей в первичных местах локализации или для лечения или профилактики метастазов. Например, у длительно курящих людей антигенная композиция, специфичная для рака легких (например, содержащая антигенные детерминанты одного или нескольких видов бактерий или вирусов, которые обычно вызывают инфекцию легких) может быть использована для того, чтобы соответствующим образом стимулировать иммунную систему для борьбы против развития злокачественной опухоли в ткани легкого. В качестве другого примера антигенная композиция, специфичная для рака молочной железы (например, содержащая антигенные детерминанты одного или нескольких видов бактерий, которые обычно вызывают инфекцию молочной железы), может быть использована для профилактики рака молочной железы у женщин, имеющим в семейном анамнезе высокую частоту рака молочной железы или имеющим генетическую предрасположенность. В альтернативных вариантах антигенная композиция, содержащая один или несколько видов бактерий, которые обычно вызывают инфекцию костей, можно быть использована для профилактики или лечения метастазов в костях у пациента с раком простаты. В следующих альтернативных вариантах антигенная композиция, содержащая один или несколько видов бактерий или вирусов, которые обычно вызывают инфекцию легких, может быть использована для профилактики или лечения метастазов в легких у пациента со злокачественной меланомой.
Различные альтернативные варианты и примеры согласно изобретению описаны в настоящей публикации. Такие варианты и примеры являются иллюстративными, и их не следует считать ограничивающими объем изобретения.
Злокачественные опухоли
Большинство злокачественных опухолей относятся к трем широким группам гистологической классификации: карциномы, которые являются преобладающими злокачественными опухолями и представляют собой злокачественные опухоли эпителиальных клеток или клеток, покрывающих наружные и внутренние поверхности органов, желез или других структур организма (например, кожи, матки, легкого, молочной железы, простаты, желудка, кишечника), и которые имеет тенденцию к метастазированию; саркомы, которые происходят из соединительной или опорной ткани (например, кости, хряща, сухожилий, связок, жира, мышц); и гематологические опухоли, которые происходят из костного мозга и лимфатической ткани. Карциномы могут представлять собой аденокарциномы (которые обычно развиваются в органах или железах, способных к секреции, таких как молочная железа, легкое, ободочная кишка, простата или мочевой пузырь) или могут представлять собой плоскоклеточные карциномы (которые возникают в плоском эпителии и обычно развиваются в большинстве областей организма). Саркомы могут представлять собой остеосаркомы или остеогенные саркомы (кость), хондросаркомы (хрящ), лейомиосаркомы (гладкая мускулатура), рабдомиосаркомы (скелетная мускулатура), мезотелиальные саркомы или мезотелиомы (мембранные. выстилки полостей тела), фибросаркомы (фиброзная ткань), ангиосаркомы или гемангилэндотелиомы (кровеносные сосуды), липосаркомы (жировая ткань), глиомы или астроцитомы (нейрогенная соединительная ткань, обнаруженная в головном мозге), миксосаркомы (примитивная эмбриональная соединительная ткань) или мезенхимальные или смешанные мезодермальные опухоли (смешанные типы соединительной ткани). Гематологические опухоли могут представлять собой миеломы, которые возникают в плазматических клетках костного мозга; лейкозы, которые могут представлять собой «жидкие злокачественные опухоли» и злокачественные опухоли костного мозга и могут представлять собой миелогенный или гранулоцмтарный лейкоз (миелоидные и гранулоцитарные лейкоциты), лимфатические, лимфоцитарные или лимфобластные лейкозы (лимфоидные клетки и лимфоциты крови) или истинную полицитемию или эритремию (различные продукты клеток крови, но с преобладанием эритроцитов); или лимфомы, которые могут быть солидными опухолями и которые развиваются в железах или уздах лимфатической системы, и которые могут представлять собой ходжкинские или неходжкинские лимфомы. Кроме того, также существуют злокачественные опухоли смешанного типа, такие как аденосквамозные карциномы, смешанные мезодермальные опухоли, карциносаркомы или тератокарциномы.
Злокачественные опухоли, называемые на основе первичного места локализации, могут коррелировать с гистологической классификацией. Например, рак легкого обычно представляет собой мелкоклеточный рак легкого или немелкоклеточный рак легкого, который может представлять собой плоскоклеточную карциному, аденокарциному или крупноклеточную карциному; рак кожи обычно представляет собой базальноклеточный рак, плоскоклеточный рак или меланомы. Лимфомы могут возникать в лимфатических узлах, ассоциированных с головой, шеей и грудной клеткой, а также в абдоминальных лимфатических узлах или в подмышечных или паховых лимфатических узлах. Идентификация и классификация типов и стадий злокачественных опухолей могут быть осуществлены с использованием, например, информации, предоставленной программой SEER (течение, распространенность и исходы злокачественных новообразований) Национального ракового института, которая является надежным источником информации о частоте злокачественных опухолей и выживаемости в Соединенных Штатах и общепризнанна во всем мире. Программа SEER в настоящее время собирает и публикует данные о частоте возникновения злокачественных опухолей и выживаемости из 14 реестров злокачественных опухолей, основанных на данных о популяциях, и трех дополнительных реестров, охватывающих примерно 2 6 процентов популяции США. Программа обычно собирает данные о демографии популяции, месте первичной опухоли, морфологии, стадии при постановке диагноза, первом курсе лечения и последующем учете жизненного статуса, и является единственным всеобъемлющим источником информации, основанной на данных о популяциях, в Соединенных Штатах, который включает стадию злокачественней опухоли в момент постановки диагноза и показатели выживаемости на каждой стадии. Информация о более чем 3 миллионах случаев злокачественных опухолей in situ и инвазивных злокачественных опухолей включена в базу данных SEER, и примерно 170000 новых случаев добавляют каждый год в пределах областей охвата SEER. Данные о частоте и выживаемости в рамках программы SEER могут быть использованы для получения сведений о стандартной выживаемости в случае конкретного места локализации и стадии злокачественной опухоли. Например, чтобы обеспечить оптимальную группу сравнения, из базы данных могут быть выбраны конкретные критерии, включая дату постановки диагноза и точную стадию (например, в случае примера рак легкого, приведенного в настоящем описании, были выбраны годы, которые совпадают с интервалом времени ретроспективного обзора, и были выбраны стадии 3В и 4 рака легкого; и в случае примера рака ободочной кишки, приведенного в настоящем описании, годы были выбрачи также так, чтобы они совпадали с интервалом времени ретроспективного обзора, и выбрана стадия 4 рака ободочной кишки).
Злокачественные опухоли также могут быть названы на основе органа, в котором они возникают, т.е. «первичного места локализации», например, рак молочной железы, головного мозга, легкого, печени, кожи, простаты, семенника, мочевого пузыря, ободочной кишки и прямой кишки, шейки матки, матки и т.д. Такое название сохраняется даже если злокачественная опухоль метастазирует в другую часть организма, которая отличается от первичного места локализации. Согласно настоящему изобретению лечение направлено на место локализации злокачественной опухоли, а не на тип злокачественной опухоли, так что злокачественную опухоль любого типа, которая расположена, например, в легком, можно лечить на основе ее локализации в легком.
«Злокачественная опухоль» или «неоплазма» означает любой нежелательный рост клеток, не служащий для физиологической функции. В общем, при этом злокачественная клетка выходит из под своего нормального контроля клеточного деления, т.е, клетка, рост которой не регулируется обычными биохимическими и физическими факторами в окружении клетки. Таким образом, «злокачественная опухоль» является общим термином заболевений, характеризуемых аномальным неконтролируемым клеточным ростом. В большинстве случаев злокачественная клетка пролиферирует с. образованием клональных клеток, которые являются злокачественными. Скопление или клеточная масса, «неоплазма» или «опухоль» обычно способна внедряться и разрушать окружающие нормальные ткани. «Злокачественность» в используемом в настоящем описании смысле означает аномальный рост любого типа клеток или ткани, который оказывает вредное воздействие на организм, имеющий аномальный рост.Термин «злокачественность» или «злокачественная опухоль» включает рост клеток, который формально является доброкачественным, но который несет риск превращения в злокачественный. Злокачественные клетки могут распространяться из своего исходного места локализации в другие части организма по лимфатической системе или кровотоку в процессе, называемом «метастазированием». Многие злокачественные опухоли являются невосприимчивыми к лечению и оказываются летальными. Примеры злокачественных опухолей или неоплазм включают без ограничения трансформированные и иммортализованные клетки, опухоли, карциномы в различных органах и тканях, которые описаны в настоящей публикации или известны специалистам в данной области.
«Клетка» является основной структурной и функциональной единицей живого организма. У высших организмов, например, животных, клетки, имеющие сходную структуру и функцию, обычно объединяются в «ткани», которые осуществляют конкретные функции. Таким образом, ткань содержит совокупность сходных клеток и окружающих межклеточных веществ, например, эпителиальная ткань, соединительная ткань, мышечная, нервная. «Орган» является полностью дифференцированной структурной и функциональной единицей у высшего организма, которая может состоять из различных типов тканей и является специализированной для некоторой конкретной функции, например, почка, сердце, головной мозг, печень и т.д. Соответственно, в настоящем описании подразумевается, что термин «конкретный орган, ткань или клетка» включает любой конкретный орган и включает клетки и ткани, имеющиеся в данном органе.
«Патогенные» агенты представляют собой агенты, такие как микроорганизмы, такие как бактерии или вирусы, которые, как известно, вызывают в природе инфекцию у хозяина, и в этом смысле термин «патогенный» используют в контексте настоящего изобретения для обозначения «патогенного в природных условиях». Хотя широкий круг микроорганизмов могут быть способными вызывать инфекцию в искусственных условиях, таких как искусственная инокуляция микроорганизма в ткань, диапазон микроорганизмов, которые вызывают инфекцию в природных условиях, безусловно ограничен и хорошо известен в медицинской практике.
«Инфекция» представляет собой статус или состояние, при котором в организм или его часть вторгается патогенный агент (например, микроорганизм, такой как бактерия), который в благоприятных условиях размножается и вызывает эффекты, которые наносят вред (Taber's Cyclopedic Medical Dictionary, 14th Ed., CL. Thomas, Ed., F.A. Davis Company, ΡΑ, USA). Инфекция не всегда может быть клинически выраженной и может приводить только к локализованному повреждению клеток. Инфекции могут оставаться субклиническими и временными, если защитные механизмы организма являются эффективными. Инфекции могут распространяться локально, становясь клинически выраженными в виде острой, подострой или хронической клинической инфекции или патологического состояния. Локальная инфекция также может стать системной, когда патогенный агент проникает в лимфатическую или сосудистую систему (On-Line Medical Dictionary, http://cancerweb.ncl.ac.uk/omd/). Инфекция обычно сопровождается воспалением, но воспаление может иметь место и без инфекции.
«Воспаление» представляет собой характерную реакцию ткани на повреждение (характерно опухание, краснота, повышение температуры и боль), и включает в себя последовательные изменения, которые происходят в живой ткани при ее повреждении. Инфекция и воспаление являются разными состояниями, хотя одно может возникать из другого (Taber's Cyclopedic Medical Dictionary, выше). Соответственно, воспаление может возникать без инфекции, и инфекция может иметь место без воспаления (хотя воспаление обычно возникает в результате инфекции патогенными бактериями или вирусами). Воспаление характеризуется следующими симптомами: покраснение (краснота), повышение температуры (жар), опухание (опухоль), болезненность (боль). Локализованное видимое воспаление на коже может быть проявляться в результате сочетания таких симптомов, особенно покраснения в месте введения.
Разных субъектов можно подвергать лечению согласно альтернативным аспектам изобретения. В используемом в настоящем описании смысле «субъектом» является животное, например, млекопитающее, которым можно вводить конкретные патогенные бактерии, бактериальные антигены, вирусы, вирусные антигены или их композиции согласно изобретению. Соответственно, субъектом может быть пациент, например, человек, страдающий от злокачественной опухоли, или человек, у которого предполагается наличие злокачественной опухоли или предполагается существование риска развития злокачественной опухоли. Субъектом также может быть экспериментальное животное, например, животная модель злокачественной опухоли, которая описана в примере 5. В некоторых вариантах термины «субъект» и «пациент» могут быть использованы взаимозаменяемо и могут включать человека, млекопитающего, отличного от человека, примата, отличного от человека, крысу, мышь, собаку и т.д. Здоровым субъектом может быть человек, который не страдает от злокачественной опухоли или у которого не предполагается наличие злокачественной опухоли, или который не страдает от хронического расстройства или состояния. «Здоровым субъектом» также может быть субъект, который не является субъектом с ослабленным иммунитетом. Под ослабленным иммунитетом подразумевают любое состояние, в случае которого иммунная система функционирует аномальным или недостаточным образом. Ослабленный иммунитет может быть следствием заболевания, применения определенных лекарственных средств или состояний, имеющихся при рождении. Субъекты с ослабленным иммунитетом более часто могут встречаться среди детей младшего возраста, людей пожилого возраста и людей, подвергающихся интенсивной терапии лекарственными средствами или лучевой терапии.
«Иммунный ответ» включает без ограничения один или несколько из следующих ответов у млекопитающего: индукцию или активацию антител, нейтрофилов, моноцитов, макрофагов (включая как M1-подобные макрофаги, так и М2-подобные макрофаги, которые описаны в настоящей публикации), В-клеток, Т-клеток (включая хелперные Т-клетки, клетки природные киллеры, цитотоксические Т-клетки, γδ Т-клетки), например, индукцию или активацию антигеном(ами) в композиции или вакцине после введения композиции или вакцины. Таким образом, иммунный ответ на композицию или вакцину обычно включает в себя развитие в животном-хозяине клеточного и/или опосредованного антителами ответа на представляющую интерес композицию или вакцину. Б некоторых вариантах иммунный ответ является таким, что он также будет приводить к замедлению или остановке прогрессирования злокачественной опухоли у животного. Иммунный ответ включает как клеточные иммунные ответы, так и гуморальные иммунные ответы, которые известны специалистам в данной области.
Бактерии и бактериальные колонизации и инфекции
Большинство животных колонизированы в определенной степени другими организмами, такими как бактерии, которые обычно существуют в симбиотической или комменсальной взаимосвязи г. животным-хозяином. Таким образом, многие виды в норме безвредных бактерий встречаются у здоровых животных, и обычно они располагаются на поверхности конкретных органов и тканей. Часто такие бактерии помогают нормальному функционированию организма. Например, у человека, симбиотические бактерии Escherichia coli могут встречаться в кишечнике, где они стимулируют иммунитет и уменьшают риск инфекции более вирулентными патогенами.
Бактерии, которые обычно являются неопасными, такие как Escherichia coli, могут вызывать инфекцию у здоровых субъектов, результат которой может быть в диапазоне от умеренной до тяжелей инфекции и вплоть до смерти. Является ли бактерия патогенной (т.е., вызывает инфекцию) или не является таковой, в определенной степени зависит от таких факторов как путь проникновения и доступа к конкретным клеткам, тканям или органам хозяина; присущая бактерии вирулентность; количество бактерий, присутствующих в месте потенциальной инфекции; или состояние здоровья животного-хозяина. Таким образом, бактерии, которые в норме являются неопасными, могут становиться патогенными в благоприятных для инфекции условиях, и даже наиболее вирулентная бактерия требует особых условий для того, чтобы выззать инфекцию. Соответственно, виды микроорганизмов, которые являются представителями нормальной флоры, могут быть патогенами, когда они выходит из своей нормальной экологической роли в эндогенной флоре. Например, эндогенные виды могут вызывать инфекцию вне своей экологической ниши в анатомически близких областях, например, в результате распространения в прилегающие области. Когда такое происходит, такие неопасные в норме эндогенные бактерии считают патогенными.
Известно, что конкретные бактериальные виды и вирусы вызывают инфекции в конкретных клетках, тканях или органах у здоровых в иных обстоятельствах субъектов. Примеры бактерий и вирусов, которые обычно вызывают инфекции в конкретных органах и тканях организма, перечислены ниже; будет понятно, что такие примеры не предназначены для ограничения, и что специалист сможет легко распознать и идентифицировать инфекционные или патогенные бактерии, которые вызывают инфекции или обычно вызывают инфекции в различных органах и тканях у здоровых взрослых людей (и выяснить относительную частоту инфекции с каждым бактериальным видом), на основе информации, имеющейся if данной области, которая представлена, например, в следующих публикациях: Manual of Clinical Microbiology 8th Edition, Patrick Murray, Ed., 2003, ASM Press American Society for Microbiology, Washington DC, USA; Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases 5th Edition, G.L. Mandell, J.E. Bennett, R. Dolin, Eds., 2000, Churchill Livingstone, Philadelphia, PA, USA, которые все включены в настоящее описание в виде ссылки.
Инфекции кожи обычно вызывают следующие бактериальные виды: Staphylococcus aureus, бета-гемолитический стрептококк группы А, В, С или G, Corynebacterium diptheriae, Corynebacterium ulcerans или Pseudomonas aeruginosa; или вирусные патогены: вирус кори, краснухи, ветряной оспы, эховирусы, вирусы Коксаки, аденовирус, вирус вакцинии, простого герпеса, или парвовирус В19.
Инфекции мягкой ткани (например, жировой или мышечной) обычно вызывают следующие бактериальные виды: Streptococcus pyogenes, Staphylococcus aureus, Clostridium perfringens или другие виды Clostridium; или вирусные патогены: вирус гриппа или вирусы Коксаки.
Инфекции молочной железы обычно вызывают следующие бактериальные виды: Staphylococcus aureus или Streptococcus pyogenes.
Инфекции лимфатических узлов головы и шеи обычно вызывают следующие бактериальные виды: Staphylococcus aureus или Streptococcus pyogenes; или вирусные патогены: вирус Эпштейн-Барр, цитомегаловирус, аденовирус, вирус кори, краснухи, простого герпеса, вирусы Коксаки или ветряной оспы.
Инфекции плечевых/подмышечных лимфатических узлов обычно вызывают следующие бактериальные виды: Staphylococcus aureus или Streptococcus pyogenes; или вирусные патогены: вирус кори, краснухи, вирус Эпштейн-Барр, цитомегаловирус, аденовирус или вирус ветряной оспы.
Инфекции лимфатических узлов средостения обычно вызывают следующие бактериальные виды: стрептококки вириданс, виды Peptococcus, виды Peptostreptococcus, виды Bacteroides, виды Fusobacterium или Mycobacterium tuberculosis; или вирусные патогены: вирус кори, краснухи, вирус Эпштейн-Барр, цитомегаловирус, вирус ветряной оспы или аденовирус.
Инфекции лимфатических узлов ворот легкого обычно вызывают следующие бактериальные виды: Streptococcus pneumoniae, Moraxella catarrhalis, Mycoplasma pneumoniae, Klebsiella pneumoniae, Haemophilus influenza, Chlamydophila pneumoniae, Bordetella pertussis или Mycobacterium tuberculosis; или вирусные патогены: вирус гриппа, аденовирус, риновирус, коронавирус, вирус парагриппа, респираторно-синцитиальный вирус, метапневмовирус человека или вирус Коксаки.
Инфекции внутрибрюшинных лимфатических узлов обычно вызывают следующие бактериальные виды: Yersinia enterocolitica, Yersinia pseudotuberculosis, виды Salmonella, Streptococcus pyogenes, Escherichia coli, Staphylococcus aureus или Mycobacterium tuberculosis; или вирусные патогены: вирус кори, краснухи, вирус Эпштейн-Барр, цитомегаловирус, вирус ветряной оспы, аденовирус, вирус гриппа или вирусы Коксаки.
Инфекции лимфатических узлов ног/паховая область обычно вызывают следующие бактериальные виды: Staphylococcus aureus или Streptococcus pyogenes; или вирусные патогены: вирус кори, краснухи, вирус Эпштейн-Барр, цитомегаловирус или вирус простого герпеса.
Инфекции крови (т.е., септицемию) обычно вызывают следующие бактериальные виды: Staphylococcus aureus, Streptococcus pyogenes, коагулазонегативные стафилококки, виды Enterococcus, Escherichia coli, виды Klebsiella, виды Enterobacter, виды Proteus, Pseudomonas aeruginosa, Bacteroides fragilis, Streptococcus pneumoniae или стрептококки группы В; или вирусные патогены: вирус кори, краснухи, ветряной оспы, эховирусы, вирусы Коксаки, аденовирус, вирус Эпштейн-Барр, вирус простого герпеса или цитомегаловирус.
Инфекции костей обычно вызывают следующие бактериальные виды: Staphylococcus aureus, коагулазонегативные стафилококки, Streptococcus pyogenes, Streptococcus pneumoniae, Streptococcus agalactiae, другие виды стрептококков, Escherichia coli, виды Pseudomonas, виды Enterobacter, виды Proteus или виды Serratia; или вирусные патогены: парвовирус В19, вирус краснухи или вирус гепатита В.
Инфекции оболочек головного мозга обычно вызывают следующие бактериальные виды: Haemophilus influenza, Neisseria meningitides, Streptococcus pneumoniae, Streptococcus agalactiae или Listeria monocytogenes; или вирусные патогены: эховирусы, вирусы Коксаки, другие энтеровирусы или вирус эпидемического паротита.
Инфекции головного мозга обычно вызывают следующие бактериальные виды: виды Streptococcus (включая S. anginosus, S. constellatus, S. intermedius), Staphylococcus aureus, виды Bacteroides, виды Prevotella, виды Proteus, Escherichia coli, виды Klebsiella, виды Pseudomonas, виды Enterobacter или Borrelia burgdorferi; или вирусные патогены: вирусы Коксаки, эховирусы, вирус полиомиелита, другие энтеровирусы, вирус эпидемического паротита, простого герпеса, ветряной оспы, флавивирусы или буньявирусы.
Инфекции спинного мозга обычно вызывают следующие бактериальные виды: Haemophilus influenzae, Neisseria meningitidis, Streptococcus pneumoniae, Streptococcus agalactiae, Listeria monocytogenes или Borrelia burgdorferi; или вирусные патогены: вирусы Коксаки, эховирусы, вирус полиомиелита, другие энтеровирусы, вирус эпидемического паротита, простого герпеса, ветряной оспы, флавивирусы или буньявирусы.
Инфекции глаза/глазницы обычно вызывают следующие бактериальные виды: Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae, Streptococcus milleri, Escherichia coli, Bacillus cereus, Chlamydia trachomatis, Haemophilus influenza, виды Pseudomonas, виды Klebsiella или Treponema pallidum; или вирусные патогены: аденовирусы, вирус простого герпеса, вирус ветряной оспы или цитомегаловирус.
Инфекции слюнных желез обычно вызывают следующие бактериальные виды: Staphylococcus aureus, стрептококки вириданс (например, Streptococcus salivarius, Streptococcus sanguis, Streptococcus mutans), виды Peptostreptococcus или виды Bacteroides или другие пероральное анаэробы; или вирусные патогены: вирус эпидемического паротита, гриппа, энтеровирусы или бешенства.
Инфекции ротовой полости обычно вызывают следующие бактериальные виды: Prevotella melaninogenicus, анаэробные стрептококки, стрептококки вириданс, виды Actinomyces, виды Peptostreptococcus или виды Bacteroides или другие анаэробы полости рта; или вирусные патогены: вирус простого герпеса, вирусы Коксаки или вирус Эпштейн-Барр.
Инфекции миндалин обычно вызывают следующие бактериальные виды: Streptococcus pyogenes или В-гемолитические стрептококки группы С или G; или вирусные патогены: риновирусы, вирус гриппа, коронавирус, аденовирус, вирус парагриппа, респираторно--синцитиальный вирус или вирус простого герпеса.
Инфекции пазух обычно вызывают следующие бактериальные виды: Streptococcus pneumoniae, Haemophilus influenza, Moraxella catarrhalis, α-стрептококки, анаэробные бактерии (например, виды Prevotella) или Staphylococcus aureus; или вирусные патогены: риновирусы, вирус гриппа, аденовирус или вирус парагриппа.
Инфекции носоглотки обычно вызывают следующие бактериальные виды: Streptococcus pyogenes или В-гемолитические стрептококки группы С или G; или вирусные патогены: риновирусы, вирус гриппа, коронавирус, аденовирус, вирус парагриппа, респираторно--синцитиальный вирус или вирус простого герпеса.
Инфекции щитовидной железы обычно вызывают следующие бактериальные виды: Staphylococcus aureus, Streptococcus pyogenes, или Streptococcus pneumoniae; или вирусные патогены: вирус эпидемического паротита или вирус гриппа.
Инфекции гортани обычно вызывают следующие бактериальные виды: Mycoplasma pneumoniae, Chiamydophila pneumoniae или Streptococcus pyogenes; или вирусные патогены: риновирус, вирус гриппа, вирус парагриппа, аденовирус, коронавирус или метапневмовирус человека.
Инфекции трахеи обычно вызывают следующие бактериальные виды: Mycoplasma pneumoniae; или вирусные патогены;· вирус парагриппа, вирус гриппа, респираторно-синцитиальный вирус- или аденовирус.
Инфекции бронхов обычно вызывают следующие бактериальные виды: Mycoplasma pneumoniae, Chiamydophila pneumoniae, Bordetella pertussis, Streptococcus pneumoniae или Haemophilus influenzae; или вирусные патогены: вирус гриппа, аденовирус, риновирус, коронавирус, вирус парагриппа, респираторно-синцитиальный вирус, метапневмовирус человека или вирус Коксаки.
Инфекции легкого обычно вызывают следующие бактериальные виды: Streptococcus pneumoniae, Moraxella catarrhalis, Mycoplasma pneumoniae, Klebsiella pneumoniae или Haemophilus influenza; или вирусные патогены: вирус гриппа, аденовирус, респираторно-синцитиальный вирус или вирус парагриппа.
Инфекции плевры обычно вызывают следующие бактериальные виды: Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae, Haemophilus influenzae, Bacteroides f ragilis, виды Prevotella, Fusobacterium nucleatum, виды пептострептококков или Mycobacterium tuberculosis; или вирусные патогены: вирус гриппа, аденовирус, респираторно-синцитиальный вирус или вирус парагриппа.
Инфекции средостения обычно вызывают следующие бактериальные виды: стрептококки вириданс, виды Peptococcus, виды Peptostreptococcus, виды Bacteroides, виды Fusobacterium или Mycobacterium tuberculosis; или вирусные патогены: вирус кори, краснухи, вирус Эпштейн-Барр или цитомегаловирус.
Инфекции сердца обычно вызывают следующие бактериальные виды: виды Streptococcus (включая S. mitior, S. bovis, S. sanguis, S. mutans, S. anginosus), виды Enterococcus,: виды Staphylococcus, Corynebacterium diptheriae, Clostridium perfringens, Neisseria meningitidis или виды Salmonella; или вирусные патогены: энтеровирусы, вирусы Коксаки, эховирусы, вирус полиомиелита, аденовирус, вирус эпидемического паротита, вирус кори или вирус гриппа.
Инфекции пищевода обычно вызывают следующие бактериальные виды: виды Actinomyces, Mycobacterium avium, Mycobacterium tuberculosis или виды Streptococcus; или вирусные патогены: цитомегаловирус, вирус простого герпеса или ветряной оспы.
Инфекции желудка обычно вызывают следующие бактериальные виды: Streptococcus pyogenes или Helicobacter pylori; или вирусные патогены: цитомегаловирус, вирус простого герпеса, вирус Эпштейн-Барр, ротавирусы, норовирусы или аденовирусы.
Инфекции тонкого кишечника обычно вызывают следующие бактериальные виды: Escherichia coli, Clostridium difficile, Bacteroides fragilis, Bacteroides vulgatus, Bacteroides thetaiotaomicron, Clostridium perfringens, Salmonella enteriditis, Yersinia enterocolitica или Shigella flexneri; или вирусные патогены: аденовирусы, астровирусы, калицивирусы, норовирусы, ротавирусы или цитомегаловирус.
Инфекции ободочной кишки/прямой кишки обычно вызывают следующие бактериальные виды: Escherichia coli, Clostridium difficile, Bacteroides fragilis, Bacteroides vulgatus, Bacteroides thetaiotaomicron, Clostridium perfringens, Salmonella enteriditis, Yersinia enterocolitica или Shigella flexneri; или вирусные патогены: аденовирусы, астровирусы, калицивирусы, норовирусы, ротавирусы или цитомегаловирус.
Инфекции ануса обычно вызывают следующие бактериальные виды: Streptococcus pyogenes, виды Bacteroides, виды Fusobacterium, анаэробные стрептококки, виды Clostridium, Escherichia coli, виды Enterobacter, Pseudomonas aeruginosa или Treponema pallidum; или вирусные патогены: вирус простого герпеса.
Инфекции промежности обычно вызывают следующие бактериальные виды: Escherichia coli, виды Klebsiella, виды Enterococcus, виды Bacteroides, виды Fusobacterium, вицы Clostridium, Pseudomonas aeruginosa, анаэробные стрептококки, виды Clostridium или виды Enterobacter; или вирусные патогены вирус простого герпеса.
Инфекции печени обычно вызывают следующие бактериальные виды: Escherichia coli, виды Klebsiella, Streptococcus (группы anginosus), виды Enterococcus, другие стрептококки вириданс или виды Bacteroides; или вирусные патогены: вирус гепатита А, вирус Эпштейн-Барр, простого герпеса, эпидемического паротита, краснухи, кори, ветряной оспы, вирусы Коксаки или аденовирус.
Инфекции желчного пузыря обычно вызывают следующее бактериальные виды: Escherichia coli, виды Klebsiella, виды Enterobacter, энтерококки, виды Bacteroides, виды Fusobacterium, виды Clostridium, Salmonella enteri ditis, Yersinia enterocolitica или Shigella flexneri.
Инфекции желчных путей обычно вызывают следующие бактериальные виды: Escherichia coli, виды Klebsiella, виды Enterobacter, энтерококки, виды Bacteroides, виды Fusobacterium, виды Clostridium, Salmonella enteriditis, Yersinia enterocolitica или Shigella flexneri; или вирусные патогены: вирус гепатита А, вирус Эпштейн-Барр, вирус простого герпеса, эпидемического паротита, краснухи, кори, ветряной оспы, вирусы Коксаки или аденовирус.
Инфекции поджелудочной железы обычно вызывают следующие бактериальные виды: Escherichia coli, виды Klebsiella, виды Enterococcus, виды Pseudomonas, виды Staphylococcal, виды Mycoplasma, Salmonella typhi, виды Leptospirosis или виды Legionella; или вирусные патогены: вирус эпидемического паротита, вирус Коксаки, вирус гепатита В, цитомегаловирус, вирус простого герпеса 2 или вирус ветряной оспы.
Инфекции селезенки обычно вызывают следующие бактериальные виды: виды Streptococcus, виды Staphylococcus, виды Salmonella, виды Pseudomonas, Escherichia coli или виды Enterococcus; или вирусные патогены: вирус Эпштейн-Барр, цитомегаловирус, аденовирус, вирус кори, краснухи, вирусы Коксаки или вирус ветряной оспы.
Инфекции надпочечников обычно вызывают следующие бактериальные виды: виды Streptococcus, виды Staphylococcus, виды Salmonella, виды Pseudomonas, Escherichia coli или виды Enterococcus; или вирусные патогены: вирус ветряной оспы.
Инфекции почек обычно вызывают следующие бактериальные виды: Escherichia coli, Proteus mirabilis, Proteus vulgatus, виды Providentia, виды Morganella, Enterococcus faecalis или Pseudomonas aeruginosa; или вирусные патогены: вирус ВК или вирус эпидемического паротита.
Инфекции мочеточника обычно вызывают следующие бактериальные виды: Escherichia coli, Proteus mirabilis, Proteus vulgatus, виды Providentia, виды Morganella или виды Enterococcus.
Инфекции мочевого пузыря обычно вызывают следующие бактериальные виды: Escherichia coli, Proteus mirabilis, Proteus vulgatus, виды Providentia, виды Morganella, Enterococcus faecalis или Corynebacterium jekeum; или вирусные патогены: аденовирус или цитомегаловирус.
Инфекции брюшины обычно вызывают следующие бактериальные виды: Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumonia, Escherichia coli, виды Klebsiella, виды Proteus, энтерококки, Bacteroides fragiiis, Prevotella a melaninogenica, виды Peptococcus, виды Peptostreptococcus, виды Fusobacterium или виды Clostridium.
Инфекции ретроперитонеальной области обычно вызывают следующие бактериальные виды: Escherichia coli или Staphylococcus aureus.
Инфекции простаты обычно вызывают следующие бактериальные виды: Escherichia coli, виды Klebsiella, виды Enterobacter, Proteus mirabilis, виды энтерококков, виды Pseudomonas, виды Corynebacterium или Neisseria gonorrhoeae; или вирусные патогены: вирус простого герпеса.
Инфекции семенников обычно вызывают следующие бактериальные виды: Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, виды Staphylococcus, виды Streptococcus или Salmonella enteriditis; wnvi вирусные патогены: вирус эпидемического паротита, вирус Коксаки или вирус лимфоцитарного хориоменингита.
Инфекции пениса обычно вызывают следующие бактериальные виды: Staphylococcus aureus, Streptococcus pyogenes, Neisseria gonorrhoeae или Treponema pallidum; или вирусные патогены: вирус простого герпеса.
Инфекции яичника/придатков обычно вызывают следующие бактериальные виды: Neisseria gonorrhoeae, Chlamydia trachomatis, Gardenerella vaginalis, виды Prevotella, виды Bacteroides, виды Peptococcus, виды Streptococcus или Escherichia coli.
Инфекции матки обычно вызывают следующие бактериальные виды: Neisseria gonorrhoeae, Chlamydia trachomatis, Gardenerella vaginalis, виды Prevotella, виды Bacteroides, виды Peptococcus, виды Streptococcus или Escherichia coli.
Инфекции шейки матки обычно вызывают следующие бактериальные виды: Neisseria gonorrhoeae, Chlamydia trachomatis или Treponema pallidum; или вирусные патогены: вирус простого герпеса.
Инфекции вагины обычно вызывают следующие бактериальные виды: Gardenerella vaginalis, виды Prevotella, виды Bacteroides, виды пептококков, Escherichia coli, Neisseria gonorrhoeae, Chlamydia Trachomatis или Treponema pallidum; или вирусные патогены: вирус простого герпеса.
Инфекции вульвы обычно вызывают следующие бактериальные виды: Staphylococcus aureus, Streptococcus pyogenes или Treponema pallidum; или вирусные патогены: вирус простого герпеса.
Бактериальные штаммы/Вирусные подтипы
Специалисту в данной области будет понятно, что бактериальные виды функционально классифицируют в виде групп сходных штаммов (которые обычно относятся к группам, предположительно общего предка, с идентифицируемыми физиологическими, но обычно не морфологическим отличиями, и которые можно идентифицировать с использованием серологических способов против поверхностных антигенов бактерий). Таким образом, каждый вид бактерий (например, Streptococcus pneumoniae) имеет многочисленные штаммы (или серотипы), которые могут отличаться по своей способности вызывать инфекцию или отличаться по своей способности вызывать инфекцию в конкретном органе/месте. Например, хотя существуют, по меньшей мере, 90 серотипов Streptococcus pneumoniae, серотипы 1, 3, 4, 7, 8 и 10 являются серотипами, наиболее часто ответственными за пневмококковые болезни у человека.
В качестве второго примера, некоторые штаммы Escherichia coli, называемые внекишечными патогенными штаммами Е. coli (ExPEC), наиболее вероятно вызывают инфекцию мочевыводящих путей или другие внекишечные инфекции, такие как менингит у новорожденных, тогда как другие штаммы, включая энтеротоксигенными Е. coli (ЕТЕС), энтеропатогенными Е. coli (ЕРЕС), энтерогеморрагическими Е. coli (ЕНЕС), продуцирующими токсин Шига Е. coli (STEC), энтероагрегативными Е. coli (ЕАЕС), энтероинвазивными Е. coli (EIEC) и диффузные прилипающие Е. coli (DAEC), наиболее вероятно вызывают инфекцию желудочно-кишечного тракта/диарею. Даже среди подкатегории штаммов ЕхРЕС, специфичные факторы вирулентности (например, продукция фимбрий типа-1) позволяют некоторым штаммам быть более способными вызывать инфекцию мочевого пузыря, тогда как другие факторы вирулентности (например, продукция фимбрий Р) позволяют другим штамма быть более способными вызывать инфекцию в почках. Согласно настоящей изобретению штамм (штаммы) ЕхРЕС, который более вероятно вызывает инфекцию в мочевом пузыре, может быть выбран для препарата, направленного к злокачественной опухоли мочевого пузыря, тогда как штамм (штаммы) ЕхРЕС, который более вероятно вызывает инфекцию в почке, может быть выбран для препарата, направленного к злокачественной опухоли почек. Подобным образом, один или несколько штаммов Е. coli ЕТЕС, ЕРЕС, ЕНЕС, STEC, ЕАЕС, EIEC или DAEC (т.е., штаммы, которые вызывают инфекцию ободочной кишки) могут быть выбраны для препарата, направленного к злокачественной опухоли ободочной кишки.
Подобным образом, существуют многочисленные подтипы конкретных вирусов. Например, существует три типа вирусов гриппа, вирус гриппа А, вирус гриппа В и вирус гриппа С, которые отличаются по эпидемиологии, диапазону хозяев и клиническим характеристикам. Например, вирус гриппа А наиболее вероятно ассоциирован с вирусной инфекцией легких, тогда как вирус гриппа В наиболее вероятно ассоциирован с миозитом (т.е., мышечной инфекцией). Кроме того, каждый из указанных трех типов вируса гриппа имеет многочисленные подтипы, которые также могут отличаться по эпидемиологии, диапазону хозяев и клиническим характеристикам. Согласно настоящему изобретению можно выбрать подтип вируса гриппа А, наиболее часто ассоциированный с инфекцией легких, чтобы целенаправленно воздействовать на рак легкого, тогда как можно выбрать штамм вируса гриппа В, наиболее часто ассоциированный с миозитом, для лечения злокачественной опухоли мышц/мягких тканей.
Понятно, что клинический микробиолог, являющийся специалистом в данной области, способен выбрать на основании настоящего описания и основных сведений в области, относящейся к штаммам бактерий для каждого вида бактерий (и подтипам вирусов для каждого типа вируса) штаммы конкретного вида бактерий (или подтип конкретного вируса) для целенаправленного воздействия на конкретный орган или ткань.
Бактериальные композиции, дозы и введение
Композиции согласно изобретению содержат антигены патогенных видов микроорганизмов (бактерий или вирусов), которые являются патогенными в конкретной ткани или органе. Композиции могут содержать целые бактерии определенного вида или могут содержать экстракты или препараты патогенных видов бактерий согласно изобретению, такие как экстракты клеточных стенок или клеточных мембран, или целые клетки или экзотоксины, или целые клетки и экзотоксины. Композиции также могут содержать один или несколько изолированных антигенов из одного или нескольких патогенных видов бактерий согласно изобретению; в некоторых вариантах такие композиции могут быть применимы в ситуациях, когда может быть необходимо точно ввести конкретную дозу конкретного антигена, или могут быть применимы, если введение целых бактерий определенного вида или их компонентов (например, токсинов) может быть опасным. Патогенные виды бактерий могут коммерчески доступными (например, из АТСС (Manassas, VA, USA), или могут представлять собой клинические изоляты, полученные ст субъектов, имеющих бактериальную инфекцию ткани или' органа (например, пневмонию).
Микробные композиции согласно изобретению могут быть предоставлены отдельно или в сочетании с другими соединениями (например, молекулами нуклеиновых кислот, малыми молекулами, пептидами или пептидными аналогами) в присутствии липосомы, адъюванта или любого фармацевтически приемлемого носителя в форме, подходящей для введения млекопитающем, например, человеку. В используемом в настоящем описании смысле «фармацевтически приемлемый носитель» или «эксципиент» включает любой и все из следующих компонентов: растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, средства для изотоничности и замедления всасывания и тому подобные, которые являются физиологически совместимыми. Носитель может быть подходящим для соответствующей формы введения, включая подкожное, внутрикожноз, внутривенное, парентеральное, внутрибрюшинное, внутримышечное, подъязычное, ингаляционное, внутриопухолевое или пероральное введение. Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для получения стерильных инъекционных растворов или дисперсий для немедленного приема. Применение таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением случаев, когда какая-либо обычная среда или средство является несовместимым с активным соединением (т.е., конкретными бактериями, бактериальными антигенами или их композициями согласно изобретению), предусматривается их применение в фармацевтических композициях согласно изобретению. Вспомогательные активные соединения также могут быть включены в композиции.
При желании лечение бактериальными антигенами согласно изобретению можно сочетать с более традиционными и существующими способами лечения злокачественной опухоли, такими как химиотерапия, лучевая терапия, хирургическая операция и т.д., или в любыми другими средствами лечения, предназначенными для стимуляции иммунной системы, снижения воспаления или иного полезного эффекта у субъекта, такими как питательные вещества, витамины и добавки. Например, витамин А, витамин D, витамин Е, витамин С, комплекс витаминов В, селен цинк, коэнзим Q10, бета-каротин, рыбий жир, куркумин, зеленый чай, бромелаин, ресвератрол, измельченное льняное семя, чеснок, ликопен, расторопша, мелатонин, другие антиоксиданты, циметидин, индометацин или ингибиторы ЦОГ-2 (например, целебрекс™ [целекоксиб] или виокс™ [рофекоксиб]) также могут быть введены субъекту.
Можно использовать обычную фармацевтическую практику для получения подходящих препаратов или композиций для введения соединений субъектам, страдающим от злокачественной опухоли. Можно использовать любой подходящий путь введения, например, парентеральное, внутривенное, внутрикожное, подкожное, внутримышечное, внутричерепное, внутриглазничное, внутриглазное, внутрижелудочковое, внутрикапсулярное, интраспинальное, интратекальное, интрацистернальное, внутрибрюшинное, интраназальное, ингаляционное, аэрозольное, местное, внутриопухолевое, подъязычное или пероральное введение. Терапевтические препараты могут быть в форме жидких растворов или суспензий; в случае перорального введения препараты могут быть в форме таблеток или капсул; в случае интраназальных препаратов в форме порошков, назальных капель или аэрозолей; и в случае подъязычных препаратов в форме капель, аэрозолей или таблеток.
Способы, хорошо известные в данной области для получения препаратов, описаны, например, в «Remington's Pharmaceutical Sciences" (20th edition), ed. A. Gennaro, 2000, Mack Publishing Company, Easton, PA. Препараты для парентерального введения, например, могут содержать эксципиенты, стерильную воду или раствор соли, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения или гидрогенизированные нафталины. Биосовместимый биоразрушаемый полимер лактида, сополимер лактида/гликолида или сополимеры полиоксиэтилена-полиоксипропилена можно использовать для контроля высвобождения соединений. Другие потенциально применимые системы парентеральной доставки включают частицы сополимера этилена-винилацетата, осмотические насосы, имплантируемые инфузионные системы и липосомы. Препараты для ингаляции могут содержать эксципиенты, например, лактозу, или могут представлять собой водные растворы, содержащие, например, полиоксиэтилен-9-лауриловый эфир, гликохолат и дезоксихолат, или могут представлять собой масляные растворы для введения в форме назальных капель, или в виде геля. В случае терапевтических или профилактических композиций патогенный вид бактерий вводят индивидууму в количестве, эффективном для остановки или замедления прогрессирования или метастазирования злокачественной опухоли, или для повышения жизнеспособности субъекта (по сравнению, например, с прогнозами, полученными из базы данных SEER), в зависимости от расстройства.
«Эффективное количество» патогенного вида микроорганизма или его антигена согласно изобретению включает терапевтически эффективное количество или профилактически эффективное количество. «Терапевтически эффективное количество» относится к количеству, эффективному в дозах и в течение необходимых периодов времени в достижении требуемого терапевтического результата, такого как уменьшение или исключение злокачественных клеток или опухолей, предотвращение процесса канцерогенеза, замедление роста опухоли или увеличение времени выживаемости свыше того, которое ожидается при использовании, например, базы данных SEER. Терапевтически эффективное количество патогенного вида микроорганизма (бактерии или вируса) или его антиген(ов) может варьировать в соответствии с такими факторами, как состояние болезни, возраст, пол и масса индивидуума и способность соединения вызывать требуемую реакцию у индивидуума. Схему дозирования можно корректировать для обеспечения оптимального терапевтического ответа. Терапевтически эффективное количество также может представлять собой количество,: при котором любые токсические или вредные эффекты патогенного вида бактерий или вируса или его антигена перевешиваются терапевтически полезными эффектами. «Профилактически эффективное количество» относится к количеству, эффективному в дозах и в течение необходимых периодов времени в достижении требуемого профилактического результата, такого как предотвращение злокачественной опухоли, предотвращение метастазов, замедление роста опухоли, уменьшение или исключение злокачественных клеток, тканей, органов или опухолей, или увеличение периода выживаемости сверх того периода, которые ожидается при использовании, например, базы данных SEER. Обычно профилактическую дозу применяют у субъектов до появления или на ранней стадии злокачественной опухоли, таким образом, профилактически эффективное количество может быть меньше чем терапевтически эффективное количество.
В случае введения с использованием подкожной или внутрикожной инъекции примерный диапазон терапевтически или профилактически эффективных количеств одного или нескольких патогенных видов бактерий может составлять примерно от 1 миллиона до 100000 миллионов организмов в миллилитре или может составлять от 100 миллионов до 7000 миллионов организмов в миллилитре, или может составлять от 500 миллионов до 6000 миллионов организмов в миллилитре, или может составлять от 1000 миллионов до 5000 миллионов организмов в миллилитре, или может составлять от 2000 миллионов до 4000 миллионов организмов в миллилитре, или любое целое число в указанных диапазонах. Общая концентрация бактерий в миллилитре может быть в диапазоне от 1 миллиона до 100000 миллионов организмов в миллилитре, или может составлять от 50 миллионов до 7000 миллионов Организмов в миллилитре, или может составлять от 100 миллионов до 6000 миллионов организмов в миллилитре, или может составлять от 500 миллионов до 5000 миллионов организмов в миллилитре, или может составлять от 1000 миллионов до 4000 миллионов организмов в миллилитре, или любое целое число в указанных диапазонах. Диапазон терапевтически или профилактически эффективных количеств антигенов патогенного вида бактерий может составлять любое целое число в диапазоне 0,1 нМ - 0,1 М, 0,1 нМ - С, 05 М, 0,05 нМ - 15 мкМ или 0,01 нМ - 10 мкМ.
Следует отметить, что дозовые концентрации и диапазон могут варьировать в зависимости от тяжести состояния, которое необходимо улучшить, или может варьировать в зависимости от иммунного ответа субъекта. В общем, целью является достижение адекватного иммунного ответа. В случае введения с использованием подкожной или внутрикожной инфекции степень иммунного ответе можно определить, например, по размеру отсроченной локальной кожной иммунной реакции в месте инъекции (например, от 0,25 дюймов (0,635 см) до 4 дюймов (10,16 см) в диаметре). Доза, необходимая для достижения соответствующего иммунного ответа, может варьировать в зависимости от индивидуума (и его иммунной системы) и требуемого ответа. Также можно применять стандартизованные дозы. В контексте подкожного или внутрикожного введения, если целью является достижение локальной кожной реакции размером 2 дюйма (5,08 см), то суммарная доза бактериальной композиции может быть, например, в диапазоне от 2 миллионов бактерии (например, 0,001 мл вакцины с концентрацией 2000 миллионов организмов в миллилитре) до более чем 20000 миллионов бактерии (например, 1 мл вакцины с концентрацией 20000 миллионов организмов в миллилитре). Также можно учитывать концентрации отдельных видов бактерий или их антигенов в композиции. Например, если концентрация одного конкретного патогенного вида бактерий, размер клеток такого вида или его антигенная нагрузка намного выше по сравнению с другими патогенными видами бактерий в вакцине, то локальная иммунная кожная реакция индивидуума вероятно может быть следствием ответа на такой конкретный вид бактерий. В некоторых вариантах иммунная система индивидуума может отвечать более сильно на один вид бактерий в композиции, чем на другой, в зависимости, например, от наличия в анамнезе инфекции конкретным видом, таким образом, доза или композиция может быть соответственно скорректирована для такого индивидуума. Однако в некоторых вариантах, подробно описанных в настоящей публикации, иммунный ответ не будет контролироваться по кожной реакции. Например, в некоторых мышиных моделях, используемых в настоящем изобретении, эффективное лечение таких животных антигенными композициями может приводить к соответствующим кожным реакциям. Специалисту в данной области будет понятно, что существуют альтернативные пути, которыми можно контролировать иммунный ответ помимо способов, основанных на наличии или отсутствии кожной реакции.
Для конкретного субъекта время и доза для лечения могут быть скорректированы с течением времени (например, по времени введение может быть ежедневным, через день, еженедельным, ежемесячным) в соответствии с потребностью индивидуума й профессиональным решением человека, осуществляющего введение или наблюдающего за введением композиций. Например, в контексте подкожного или внутрикожного введения композиции можно вводить через день. Начальная доза примерно 0,05 мл может быть введена подкожно с последующими увеличения на 0,01-0,02 мл через день вплоть до достижения адекватной кожной реакции в месте инъекции (например, отсроченная реакция в виде видимого покраснения в месте инъекции диаметром от 1 дюйма (2,54 см) до 2 дюймов (5,08 см)). После достижения такой адекватной иммунной реакции введение такой дозы продолжают в качестве поддерживающей дозы. Поддерживающую дозу можно корректировать время от времени, чтобы добиться требуемой видимой кожной реакции (воспаления) в месте инъекции. Введение дозы может по продолжительности составлять, например, по меньшей мере, 1 неделю, 2 недели, 2 месяца, 6 месяцев, 1, 2, 3, 4 или 5 лет или дольше.
Пероральные дозы могут быть, например, в диапазоне от 10 миллионов до 1000000 миллионов организмов на дозу, содержащую антигенные детерминанты одного или нескольких видов. Пероральниз дозы можно принимать, например, от 4 раз в сутки, ежедневно или еженедельно. Введение дозы по продолжительности может составлять, например, по меньшей мере, 1 неделю, 2 недели, 2 месяца, 6 месяцев, 1, 2, 3, 4 или 5 лет или дольше.
В некоторых вариантах изобретение может относиться к антигенным композициям, вводимым подъязычно или путем ингаляции или вводимым в одну или несколько эпителиальных тканей (т.е., в кожу посредством внутрикожной или подкожной инъекции; в эпителий легкого путем ингаляции; в слизистую желудочно-кишечного тракта путем перорального приема; в слизистую ротовой полости в результате подъязычного введения) одновременно или последовательно. Соответственно, в некоторых вариантах антигенные композиции согласно изобретению вводят так, чтобы вызвать иммунный ответ в эпителиальной ткани. В некоторых вариантах один или несколько эпителиальных путей введения можно сочетать с одним или несколькими дополнительными путями введения, такими как внутриопухолевое, внутримышечное или внутривенное введение.
В различных аспектах изобретения антигенные композиции, которые вводят пациенту, могут быть охарактеризованы как имеющие антигенный признак, т.е. сочетание антигенов или эпитопов, которые являются достаточно специфичными, чтобы антигенная композиция была способна вызывать иммунный ответ, который является специфичным для конкретного патогена, такой как адаптивный иммунный ответ.Удивительный и неожиданный аспект изобретения состоит в том, что неадаптивная или неспецифичная активация иммунного ответа, который опосредован такими специфичными антигенными композициями, является эффективным для лечения злокачественных опухолей, расположенных в тканях, в которых конкретный патоген является патогенным.
Пути введения и диапазоны доз, указанные в настоящее описании, являются только иллюстративными и не ограничивают путь введение и диапазоны доз, которые могут быть выбраны медицинским работником. Количество активного соединения (например, патогенных видов бактерий или вирусов или их антигенов) в композиции может варьировать в зависимости от таких факторов, как состояние болезни, возраст, пол и масса индивидуума. Схемы дозирования можно корректировать, чтобы обеспечить оптимальный терапевтический ответ. Например, можно вводить однократный болюс, можно вводить несколько дробных доз в течение определенного периода времени или доза может быть пропорционально снижена или увеличена в связи с потребностями в. определенной терапевтической ситуации. Может быть предпочтительным получение парентеральных композиций в стандартной лекарственной форме для простоты введения и равномерности дозирования.
В случае антигенных препаратов (аналогичных вакцине) может быть представлено иммуногенно эффективное количество соединения, отдельно или в сочетании с другими соединениями, с иммунологическим адъювантом. Соединение также может быть связано, с молекулой носителя, такого как бычий сывороточный альбумин или гемоцианин морского блюдечка «замочная скважина», чтобы повысить иммуногенность. Антигенная композиция («вакцина») представляет собой композицию, которая содержит материалы, которые вызывают требуемый иммунный ответ.Антигенная композиция может отбирать, активировать или способствовать экспансии без ограничения: В-клеток памяти, Т-клеток, нейтрофилов, моноцитов или макрофагов иммунной системы, например, чтобы уменьшить или исключить рост или пролиферацию злокачественных клеток или ткани. В некоторых вариантах конкретный патогенный микроорганизм, вирус, вирусные антигены, бактерии, бактериальные антигены или их композиции согласно изобретению способны вызывать требуемый иммунный ответ в отсутствие любого другого агента и, следовательно, их можно считать антигенной композицией. В некоторых вариантах антигенная композиция содержит подходящий носитель, такой как адъювант, который представляет собой агент, который действует, неспецифичным образом, усиливая иммунный ответ к конкретному антигену или к группе антигенов, обеспечивая возможность уменьшения количества антигена в любой данной дозе вакцины или уменьшения частоты введения доз, необходимой для создания требуемого иммунного ответа. Бактериальная антигенная композиция может содержать живые или мертвые бактерии, способные индуцировать иммунный ответ против антигенных детерминант, в норме ассоциированных с бактериями. В некоторых вариантах антигенная композиция может содержать живые бактерии, которые относятся к менее вирулентным штаммам (ослабленные), и поэтому вызывают менее тяжелую инфекцию. В некоторых вариантах антигенная композиция может содержать живые, ослабленные или мертвые вирусы, способные индуцировать иммунный ответ против антигенных детерминант, в норме ассоциированных с вирусом.
Антигенная композиция, содержащая убитые бактерии для введения путем инъекции, может быть получена следующим образом. Бактерии могут быть выращены в подходящих средах и промыты физиологическим раствором соли. Затем бактерии могут быть подвергнуты центрифугированию, ресуспендированы физиологическом растворе и убиты нагреванием. Суспензии могут быть стандартизованы прямым микроскопическим подсчетом, смешаны в требуемых количествах и оставлены на хранение в подходящих емкостях, которые можно использовать для тестирования безопасности, срока годности и стерильности соответствующим образом. Кроме патогенных видов бактерий и/или их антигенов, вакцина с убитыми бактериями, подходящая для введения человеку, может содержать 0,4% фенольного консерванта и/или 0,9% хлорида натрия. Бактериальная вакцина также может содержать следовые количества сердечно-мозгового экстракта (быка), пептоны, дрожжевой экстракт, агар, кровь овцы, декстрозу, фосфат натрия и/или другие компоненты среды.
В некоторых вариантах бактериальную вакцину можно использовать в форме таблеток или капсул или капель для перорального приема, в виде аэрозоля для ингаляции или в виде капель, в форме аэрозоля или таблеток для подъязычного введения.
В антигенных композициях, содержащих бактерии, концентрации конкретных видов бактерий в композициях для подкожной или внутрикожной инъекции может составлять примерно от 1 миллиона до 100000 миллионов организмов в миллилитре, или может составлять от 100 миллионов до 7000 миллионов организмов в миллилитре, или может составлять от 500 миллионов до 6000 миллионов организмов в миллилитре, или может составлять от 1000 миллионов до 5000 миллионов организмов в миллилитре, или может составлять от 2000 миллионов до 4000 миллионов организмов в миллилитре, или любое целое число в указанных диапазонах. Суммарная концентрация бактерий в миллилитре может быть в диапазоне от 1 миллиона до 100000 миллионов организмов в миллилитре, или может составлять от 50 миллионов до 7000 миллионов организмов в миллилитре, или может составлять от 100 миллионов до 6000 миллионов организмов в миллилитре, или может составлять от 500 миллионов до 5000 миллионов организмов в миллилитре, или может составлять от 1000 миллионов до 4000 миллионов организмов в миллилитре, или любое целое число в указанных диапазонах.
В некоторых вариантах вакцина выбранных убитых бактерий против злокачественной опухоли легочной ткани может содержать обычные бактериальные патогены легких, и может представлять собой, например:

В некоторых выбранных вариантах вакцина выбранных убитых бактерий против злокачественной опухоли легочной ткани может содержать только более распространенные бактериальные патогены легких, и может представлять собой, например:


В следующих выбранных вариантах вакцина выбранных убитых бактерий против злокачественной опухоли легочной ткани может содержать только наиболее распространенный бактериальный патоген легкого и может представлять собой:

В некоторых вариантах антигенная микробная композиция для лечения злокачественной опухоли в конкретном месте (например, злокачественной опухоли легочной ткани) может содержать патогенные микроорганизмы, которые широко, более широко или наиболее широко вызывают инфекцию в такой ткани или органе (например, инфекцию в легочной ткани, т.е. пневмонию).
В общем, следует применять патогенные виды бактерий и их антигены согласно изобретению, не вызывающие существенной токсичности. Токсичность соединений согласно изобретению можно определить, используя стандартные методики, например, тестируя в культурах клеток или на экспериментальных животных и определяя терапевтический индекс, т.е. соотношение между LD50 (дозой, летальной для 50% популяции) и LD100 (дозой, летальной для 100% популяции).
В некоторых аспектах изобретение относится к применению противовоспалительного средства вместе с вакцинацией. В таких вариантах можно использовать широкое множество противовоспалительных средств лечения, включая эффективные количества нестероидных противовоспалительных лекарственных средств (НПВС), включая без ограничения: диклофенак калия, диклофенак натрия, этодолак, индометицин, трометамин кетор'олака, сулиндак, тометин натрия, целекоксиб, мелоксикам, вальдекоксиб, флоктафенин, мефенамовую кислоту, набуметон, мелоксикам, пироксикам, теноксикам, фенопрофен кальция, флубипрофен, ибупрофен, кетопрофен, напроксен, напроксен натрия, оксапрозин, тиапрофеновую кислоту, ацетилсалициловую кислоту, дифлунисал, трисалицилат холина магния, салицилат холина, салицилат триэтаноламина, ингибиторы ЦОГ1, ингибиторы ЦОГ2 (например, Vioxx™ и Celebrex™). Различную зелень и натуральные здоровые продукты также можно использовать для осуществления противовоспалительного лечения, включая без ограничения: зеленый чай, рыбий жир, витамин D, антиоксидантные витамины и минералы (например, В-каротин, витамин А, витамин С, витамин D, витамин Е, коэнзим Q10, селен и т.д.), ресвератрол, куркуму, бромелаин, босвеллию, пиретрум девичий, кверцетин, имбирь, розмарин, майоран, кайенский перец, гвоздику, мускатный орех, кору ивы. Альтернативные противовоспалительные средства также включать изменения образа жизни, такие как: физические упражнения, снижение массы, прекращение курения, уменьшение стрессов, поиск социальной поддержки, лечение депрессии, управление стрессовыми ситуациями, гимнастика в виде брюшного дыхания и изменение питания (такое как использованием средиземноморской диеты, низкогликемической диеты, употребление необугленных продуктов питания, включая продукты, содержащие жирные кислоты омега-3).
Как подробно описано в настоящей публикации и в одном аспекте изобретения предлагается способ сравнения иммунных ответов. Способ включает в себя введение животному, имеющему орган или ткань, лекарственного средства, содержащего антигенную композицию, которая определена в настоящем описании. Антигенная композиция может содержать антигенные детерминанты, выбранные или полученные таким образом, чтобы вместе антигенные детерминанты были специфичными, по меньшей мере, для одного микробного патогена, который является патогенным в органе или ткани, извлечение количественно измеряемого иммунного образца из органа или ткани, измерение характеристики иммунного ответа в органе или ткани в количественно измеряемом иммунном образце после введения лекарственного средства, и сравнение характеристики иммунного ответа в количественно измеряемом иммунном образце с соответствующей характеристикой иммунного ответа в эталонном иммунном образце, полученном из соответствующего органа или ткани. В используемом в настоящем описании смысле иммунный образец может содержать достаточное количество биологического материала, чтобы определить характеристику иммунного ответа. В используемом в настоящем описании смысле «характеристика» иммунного ответа может включать без ограничения конкретное количество конкретного ткла иммунных клеток (например, макрофагов) или конкретный клеточный маркер (например, повышающую регуляцию интегрина), или генный продукт (например, цитокин). Вышесказанное предлагается в качестве примера и не является ограничивающим.
Необязательно эталонный иммунный образец может быть получен из соответствующего органа или ткани животного перед стадией введения лекарственного средства. В другом аспекте эталонный иммунный образец может быть получен из соответствующего органа или ткани второго животного, так что специально предполагается, что, по меньшей мере, два животных (т.е., животное, от которого получают эталонный иммунный образец, и второе животное, от которого получают количественно измеряемый иммунный образец) можно использовать в способах, описанных в настоящей публикации. Необязательно животное может иметь злокачественную опухоль, расположенную в органе или ткани.
Сравнение характеристики иммунного ответа может заключаться в сравнении в количественно измеряемом и эталонном иммунных образцах показателя количества любого одного или нескольких из следующих типов клеток, и такие клетки известны специалистам в данной области: воспалительных моноцитов, макрофагов, клеток CD11b+Gr-1+, дендритных клеток, клеток CD11c+ МНС класса II+, Т-клеток CD4+, Т-клеток CD8+ или NK-клеток. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги.
Специалистам в данной области будет понятно, что макрофаги могут быть определены либо как «М1-подобные макрофаги», либо как «М2-подобные макрофаги». Например, как обычно подразумевают специалисты в данной области, M1-подобные макрофаги стимулируют ответ, опосредованный Т-клетками Th1 CD4+ (смотри, например, Biswas and Mantovani (2010), Nature Immunology 10: 889-96). Кроме того, обычно подразумевают, что M1-подобные макрофаги обладают эффективной антигенпрезентирующей способностью и способны убивать внутриклеточные патогены (например, вирусы). Кроме того, обычно подразумевают, что M1-подобные макрофаги способны, по меньшей мере, по сравнению с М2-подобными макрофагами играть иммунологическую роль в разрушении опухолей. Специалистам в данной области будет понятно, что существуют многочисленные биологические маркеры, которые можно использовать для того, чтобы отличить M1-подобные макрофаги и М2-подобные макрофаги. Например, и как подробно описано в настоящей публикации, обычно подразумевают, что экспрессия Nos2 коррелирует с M1-подобными макрофагами, по сравнению с М2-подобными макрофагами (смотри, например, Laskin с соавторами (2010) Annual Rev. Pharmacol. Toxicol. 51: 267-288). Кроме того, например, обычно подразумевают, что M1-подобные макрофаги продуцируют IL-12 и эффективно активируются IFN-γ через IFN-γR (Biswas and Mantovain, выше).
Специалистам в данной области, в общем, будет понятно, что в отличие от M1-подобных макрофагов М2-подобные макрофаги стимулируют ответ, опосредованный Т-клетками Th2 CD4+ (в общем, смотри: Biswas and Mantovani (2010), Nature Immunology 10: 889-96). Кроме того, обычно подразумевают, что М2-подобные макрофаги являются эффективными в инкапсулировании и клиренсе внеклеточных паразитов и т.д. Кроме того, обычно специалисты в данной области подразумевают, что по сравнению с M1-подобными макрофагами М2-подобные макрофаги играют более значимую роль в иммунологической регуляции в отношении клеток Treg и В-клеток (Biswas and Mantovain, выше). Специалистам в данной области будет понятно, что существуют многочисленные биологические маркеры, которые можно использовать для того, чтобы отличить М2-подобные макрофаги от M1-подобных макрофагов. Например, и как описано в настоящей публикации, обычно будет понятно, что пониженная экспрессия Nos2 коррелирует с М2-подобными макрофагами, по сравнению с более высокой экспрессией, обычно наблюдаемой в M1-подобных макрофагах. Кроме того, и как подробно указано при описании экспериментов в настоящей публикации, обычно понятно, что экспрессия CD206 коррелирует с М2-подобными макрофагами (смотри, например, Choi с соавторами (2010) Gastroenterology 138(7) 2399-409). Кроме того, и как подробно указано при описании экспериментов в настоящей публикации, обычно понятно, что экспрессия F4/80 коррелирует с М2-подобными макрофагами. Кроме того, например, как обычно понятно, М2-подобные макрофаги эффективно активируются IL-4 или IL-13 через IL-4Ra (Biswas and Mantovain, выше).
Кроме того, сравнение характеристики иммунного ответа может заключаться в сравнении сдвига в состоянии активации макрофагов. Сдвиг в состоянии активации макрофагов необязательно может быть охарактеризован как сдвиг от М2-подобных макрофагов к М1-подобным макрофагам или наоборот.Специалистам в данной области будет понятно, что существуют многочисленные биологические маркеры, которые можно использовать для мониторинга активации макрофагов. Как подробно описано в настоящей публикации, специалистам в данной области будет понятно, что определение макрофага как активированного в направлении либо к Ml-подобному фенотипу, либо к М2-подобному фенотипу, может сопровождаться выбором маркеров, которые, как известно, ассоциированы с любым из соответствующих фенотипов, описанных в настоящей публикации. Заболевания, которые ассоциированы с M1- и М2-макрофагами, включают, по меньшей мере, следующие заболевания: атеросклероз (смотри, например, Hirata с соавторами (2011) J. Am. Coll. Cardiol. 58(3): 248-255), аллергическую астму (смотри, например, Moreira and Hogaboam (2011) J. Interferon. Cytokine Res. 31(6): 485-91), аутоиммунный простатит (смотри, например, Zhang and Schluesener (2011) Prostate), колит (смотри, например, Waddell с соавторами (2011) J. Immunol. 186(10): 5993-6003), COPD (смотри, например, Kunz с соавторами (2011) Respir. Res. 22: 34), гломерулонефрит (смотри, например, Fujita с соавторами (2010) Am. J. Pathol. 177(3): 1143-54), воспалительное заболевание кишечника (смотри, например, Wendelsdorf с соавторами (2010) J. Theor. Biol. 264(4): 1225-39), хроническое воспаление легких (смотри, например, Redente с соавторами (2010) J. Leukoc. Biol. 88(1): 159-68), стеатогепатит (смотри, например, Rensen с соавторами (2009) Am. J. Pathol. 175(4): 1473-82), панкреатит (смотри, например, Gea-Sorli and Closa (2009) ВМС Immunol. 31: 42), миокардит (смотри, например, Li с соавторами (2009) Cire. Res. 105(4): 353-64), фиброз печени (смотри, например, Heymami с соавторами (2009) Inflamm. Allergy Drug Targets 8(4): 307-18), кистозный фиброз (смотри, например, Meyer с соавторами (2009) Am. J. Respir. Cell Mol. Biol. 41 (5): 590-602), воспалительное заболевание почек (смотри, например, Wang с соавторами (2007) Kidney Int. 72(3): 290-299) и силикоз (смотри, например, Misson с соавторами (2004) J. Leukoc. Biol. 76(5): 926-232).
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах клеточных маркеров на любом одном или нескольких из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1+, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Специалисту в данной области будет понятно, что существуют многочисленные клеточные маркеры (как внеклеточные, так и внутриклеточные), которые могут быть выбраны и которые могут идентифицировать иммунный ответ. Например, как описано в настоящей публикации, обычно подразумевают, что маркер CD206 коррелирует с М2-подобными макрофагами (смотри, например, Choi с соавторами (2010) Gastroenterology 138(7) 2399-409).
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах цитокинов, продуцируемых любым одним или несколькими из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1+, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Специалистам в данной области будет понятно, что цитокины относятся к небольшим белковым молекулам, передающим сигналы в клетках, и что существуют многочисленные цитокины, известные в данной области. Например, цитокины были сгруппированы группы классификации типа 1 и типа 2 на основе их роли в иммунологических ответах. Обычные цитокины типа J. включают IFN-γ и TGF-β. Обычные цитокины типа 2 включают без ограничения IL-4 и IL-13. Цитокины можно выявлять различными способами, известными специалистам в данной области. Например, и как подробно описано в настоящей публикации, используют эксперименты ELISA для определения продукции цитокинов в легочной ткани (смотри, например, фигуру 27).
Как подробно описано в настоящей публикации, макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги, которые были идентифицированы в настоящем описании. Необязательно цитокины продуцируются в результате сдвига в состоянии активации макрофагов. Необязательно происходит сдвиг макрофагов, от М2-подобных макрофагов к M1-подобным макрофагам. Кроме того и необязательно, происходит сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах дифференциальной экспрессии генов, осуществляемой любым одним или несколькими из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Подразумевают, что термин «дифференциальная экспрессия генов» означает заметное различие в экспрессии конкретного представляющего интерес гена, по меньшей мере, в двух экспериментальных условиях. Например, если в первых экспериментальных условиях конкретный ген имеет определенный уровень экспрессии, который определен способами определения экспрессии генов специалистами в данной области, и если во вторых экспериментальных условиях тот же ген имеет заметное отличие в уровне экспрессии, то имеет место дифференциальная экспрессия представляющего интерес гена. Специалистам в данной области будет понятно, что существуют многочисленные методики, с помощью которых можно выявлять дифференциальную экспрессию генов. Например, можно использовать коммерчески доступные способы количественной ПЦР, которые подробно описаны в настоящей публикации в отношении определения соотношений Nos2/Arg1 (смотри, например, фигуру 29). Необязательно дифференциальная экспрессия генов осуществляется в результате сдвига в состоянии активации макрофагов. Необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам в значении, в котором такие термины определены в настоящей публикации.
В другом варианте лекарственное средство может быть введено в место введения в виде последовательно вводимых доз с интервалом между дозами от одного часа до одного месяца на протяжении периода дозирования, составляющего, по меньшей мере, одну неделю. Необязательно лекарственное средство может быть введено внутрикожно или подкожно. Необязательно лекарственное средство может быть введено в таких дозах, чтобы каждая доза эффективно вызвала видимый локализованный воспалительный иммунный ответ в месте введения. Необязательно лекарственное средство может быть введено так, чтобы видимое локализованное воспаление в месте введения появлялось в пределах от 1 до 48 часов. Однако видимый локализованный воспалительный иммунный ответ не всегда может присутствовать в любых обстоятельствах, несмотря на инициацию иммунного ответа. Специалистам в данной области будет понятно, что существуют другие способы, с помощью которых можно наблюдать за становление иммунного ответа. Например, профиль (и относительное изменение характеристики) иммунных клеток у субъекта, подвергаемого иммунной реакции, можно сравнить с профилем у субъекта, который не подвергается иммунной реакции.
Что касается способов, раскрытых в настоящем описании, то кроме того и необязательно животным может быть млекопитающее. Необязательно животным может быть человек или мышь. Вышесказанное предлагается в качестве примеров и не означает ограничение.
В другом аспекте предлагается способ подбора терапевтического препарата, подходящего для лечения индивидуума в связи со злокачественной опухолью в конкретном органе или ткани. Способ включает в себя получение животного, имеющего злокачественную опухоль, расположенную в конкретном органе или ткани, получение тестируемого препарата, содержащего одну или несколько антигенных детерминант микробного патогена, который является патогенным в соответствующем конкретном органе или ткани у здорового индивидуума, измерение характеристики иммунного ответа в эталонном иммунном образце, полученном из органа или ткани животного, введение тестируемого препарата животному, измерение характеристики иммунного ответа в количественно измеряемом иммунном образце, полученном из соответствующего органа или ткани животного, сравнение характеристики иммунного ответа в эталонном и количественно измеряемом иммунных образцах и обработку повышенной характеристики иммунного ответа в количественно измеряемом иммунном образце по сравнению с эталонный иммунным образцом в качестве показателя применимости тестируемого препарата в качестве терапевтического препарата. Необязательно животное умерщвляют до получения количественно измеряемого иммунного образца.
Необязательно сравнение характеристики иммунного ответа может заключаться в сравнении в количественно измеряемом и эталонном иммунных образцах показателя количества любого одного или нескольких из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительных моноцитов, макрофагов, клеток CD11b+Gr-1+, дендритных клеток, клеток CD11c+ МНС класса II+, Т-клеток CD4+, Т-клеток CD8+ или NK-клеток. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги в значении, в котором такие термины определены в настоящей публикации. Необязательно сравнение характеристики иммунного ответа может заключаться в сравнении сдвига в состоянии активации макрофагов. Необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к М1-подобным макрофагам. Кроме того и необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах клеточных маркеров на любом одном или нескольких из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1+, дендритных клетках, клетках CD11c+ MHC класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги, в значении, в котором такие термины определены в настоящей публикации.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах цитокинов, продуцируемых любым одним или несколькими из следующих типов клеток: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги в значении, в котором такие термины определены в настоящей публикации. Необязательно цитокины продуцируются в результате сдвига в состоянии активации макрофагов. Необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам.
Кроме того и необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах дифференциальной экспрессии генов, осуществляемой любым одним или несколькими из следующих типов клеток: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги в значении, в котором такие термины определены в настоящей публикации. Необязательно дифференциальная экспрессия генов может осуществляться в результате сдвига в состоянии активации макрофагов. Необязательно может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Кроме того и необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
В другом аспекте предлагается способ избирательного целенаправленного воздействия на иммунный ответ к злокачественной ткани или органу у человека. Способ включает в себя введение субъекту лекарственного средства, содержащего эффективное количество антигенной композиции микробного патогена, при этом микробный патоген может быть патогенным в конкретном злокачественном органе или ткани субъекта, и антигенная композиция содержит антигенные детерминанты, которые вместе являются специфичными для микробного патогена. Необязательно антигенная композиция может содержать композицию целых убитых бактериальных клеток. Необязательно лекарственное средство может быть введено субъекту в количестве и в течение периода времени, которые являются эффективными для повышающей регуляции иммунного ответа в злокачественном органе или ткани субъекта. Необязательно способ может дополнительно включать в себя измерение характеристики иммунного ответа.
В другом аспекте предлагается способ лечения человека в связи со злокачественной опухолью, расположенной в ткани или органе. Способ включает в себя введение субъекту лекарственного средства, содержащего эффективное количество антигенной композиции микробного патогена, содержащей композицию целых убитых бактериальных клеток, при этом микробный патоген является патогенным в конкретном органе или ткани субъекта, в котором расположена злокачественная опухоль. Лекарственное средство может быть введено субъекту в количестве и в течение периода времени, которые являются эффективными для модулирования иммунного ответа. Необязательно модулирование иммунного ответа может заключаться в сдвиге в состоянии активации макрофагов. Необязательно модулирование иммунного ответа может заключаться в сдвиге от ответа М2-подобных макрофагов к ответу M1-подобных макрофагов. Модулирование иммунного ответа может заключаться в сдвиге от ответа M1-подобных макрофагов к ответу М2-подобных макрофагов. Необязательно способ может дополнительно включать в себя измерение характеристики иммунного ответа.
Необязательно сравнение характеристики иммунного ответа может заключаться в сравнении в количественно измеряемом и эталонном иммунных образцах показателя количества любого одного или нескольких из следующих типов клеток в их обычном" для специалистов в данной области значении: воспалительных моноцитов, макрофагов, клеток CD11b+Gr-1+, дендритных клеток, клеток CD11c+ МНС класса II+, Т-клеток CD4+, Т-клеток CD8+ или NK-клеток. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги в значении, в котором такие термины определены в настоящей публикации. Необязательно сравнение характеристики иммунного ответа может заключаться в сравнении сдвига в состоянии активации макрофагов. Кроме того и необязательно, может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Кроме того и необязательно, сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах клеточных маркеров на любом одном или нескольких из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1+-, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги в значении, в котором такие термины определены в настоящей публикации. Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах цитокинов, продуцируемых любым одним или несколькими из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Кроме того, цитокины могут быть продуцированы в результате сдвига в состоянии активации макрофагов. Может происходить сдвиг макрофагов от М2-подобных макрофагов к М1-подобным макрофагам. Необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Кроме того и необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в количественно измеряемом и эталонном иммунных образцах дифференциальной экспрессии генов, осуществляемой любым одним или несколькими из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Необязательно дифференциальная экспрессия генов может осуществляться в результате сдвига в состоянии активации макрофагов. Кроме того и необязательно, может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
В другом аспекте предлагается способ мониторинга эффективности схемы лечения у индивидуума, подвергаемого лечению в связи со злокачественной опухолью в конкретном органе или ткани. Способ включает в себя измерение характеристики иммунного ответа в иммунном образце после лечения, полученном из конкретного органа или ткани после того, как индивидуум был подвергнут схеме лечения в течение определенного периода времени, при этом наличие характеристики иммунного ответа, которая превышает по величине характеристику, которую, как можно ожидать, имел бы индивидуум, не подвергнутый данной схеме лечения, является показателем эффективности схемы лечения; и схема лечения включает в себя введение препарата, содержащего одну или несколько антигенных детерминант микробного патогена, который является патогенным в соответствующем конкретном органе или ткани у здорового субъекта.
Способ, подробно описанный в настоящей публикации, может дополнительно включать в себя измерение характеристики иммунного ответа в эталонном образце, полученном до лечения, при этом эталонный образец, полученный до лечения, получают из конкретного органа или ткани до, в момент или после начала схемы лечения, но перед получением иммунного образца после лечения, и сравнение характеристики иммунного ответа в образцах, полученных до лечения и после лечения, при этом увеличение величины иммунного ответа в иммунном образце после лечения по сравнению с эталонным образцом, полученным до лечения, является показателем эффективности схемы лечения. Необязательно измерение характеристики иммунного ответа может заключаться в определении показателя количества воспалительных моноцитов в образце органа или ткани. Необязательно измерение характеристики иммунного ответа может заключаться в определении показателя количества макрофагов в образце органа или ткани. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги.
Необязательно измерение характеристики иммунного ответа может заключаться в определении показателя количества клеток CD11b+Gr-1+ в образце органа или ткани или в определении показателя количества дендритных клеток в образце органа или ткани. Кроме того и необязательно, измерение характеристики иммунного ответа может заключаться в определении показателя количества клеток CD11c+ МНС класса II+ в образце органа или ткани, или в определении показателя количества Т-клеток CD4+ в образце органа или ткани, или в определении показателя количества Т-клеток CD8+ в образце органа или ткани.
Необязательно измерение величины иммунного ответа может заключаться в определении показателя количества NK-клеток в образце органа или ткани. Кроме того и необязательно, сравнение характеристики иммунного ответа может заключаться в идентификации в эталонном и иммунном образцах клеточных маркеров на любом одном или нескольких из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительных моноцитах, макрофагах, клетках CD11b+Gr-1+, дендритных клетках, клетках CD11c+ МНС класса II+, Т-клетках CD4+, Т-клетках CD8+ или NK-клетках. Необязательно макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги.
Кроме того и необязательно, сравнение характеристики иммунного ответа может заключаться в идентификации в эталонном и иммунном образцах цитокинов, продуцируемых любым одним или несколькими из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, Т-клетками CD8+ или NK-клетками. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Необязательно цитокины могут быть продуцированы в результате сдвига в состоянии активации макрофагов. Может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобны макрофагам. Кроме того и необязательно, может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
Необязательно сравнение характеристики иммунного ответа может заключаться в идентификации в эталонном и, иммунном образцах дифференциальной экспрессии генов, осуществляемой любым одним или несколькими из следующих типов клеток в их обычном для специалистов в данной области значении: воспалительными моноцитами, макрофагами, клетками CD11b+Gr-1+, дендритными клетками, клетками CD11c+ МНС класса II+, Т-клетками CD4+, гр-клетками CD8+ или NK-клетками. Макрофаги могут включать любой один или несколько из следующих типов клеток: M1-подобные макрофаги или М2-подобные макрофаги. Дифференциальная экспрессия генов может быть осуществлена в результате сдвига в состоянии активации макрофагов. Может происходить сдвиг макрофагов от М2-подобных макрофагов к M1-подобным макрофагам. Необязательно может происходить сдвиг макрофагов от M1-подобных макрофагов к М2-подобным макрофагам.
В различных аспектах варианты осуществления изобретения относятся к способу лечения злокачественной опухоли, расположенной в легком субъекта. Способ включает в себя введение субъекту эффективного количества антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, й введение субъекту эффективного количества химиотерапевтического средства, содержащего платину. Видом микроорганизма может быть вирусный патоген или бактериальный патоген, или грибковый патоген.
В используемом в настоящем описании смысле фраза «лечение злокачественной опухоли» может включать без ограничения уменьшение опухолевой нагрузки легкого у субъекта или увеличение продолжительности жизни у субъекта, который имеет рак легкого. Будет понятно, что существуют многочисленные биологические показатели, которые специалисты в данной области могут использовать для определения того, подвергается ли злокачественная опухоль лечению или нет.
Вирусным патогеном, используемым в настоящем изобретении, может быть без ограничения: вирус гриппа, аденовирус, респираторно-синцитиальный вирус, вирус парагриппа, вирус оспы обезьян, вирус простого герпеса (1 и 2), вирус ветряной оспы, цитомегаловирус, вирус Эпштейн-Барр, коронавирус, метапневмовирус человека, вирус Хендра, вирус Нипах, хантавирус, вирус Ласса, Т-клеточный лимфотрофический вирус человека, вирус Коксаки, эховирус, энтеровирус или риновирус или любой вирус, который является патогенным в легком.
Бактериальным патогеном, используемым в настоящем изобретении, может быть без ограничения: Streptococcus pneumoniae, Moraxella catarrhalis, Mycoplasma pneumoniae, Klebsiella pneumoniae, Haemophilus influenza, Staphylococcus aureus, Chlamydia pneumoniae, Legionella pneumophila или Bordatella pertussis или любая бактерия, которая являются патогенной в легком.
Грибковым патогеном, используемы в настоящем изобретении, может быть без ограничения: Aspergillus fumigatus, виды Blastomyces, Coccidiodes immitis, Coccidiodes posadasii, Cryptococcus neoformans, Cryptococcus gattii, виды Fusarium, Histoplasma capsulatum, виды Paecilomyces, Paracoccidiodes brasiliensis, Penicillium marneffei, Pneumocystis jiroveci, Pseudallescheria boydii, Scedosporium apiospermum, виды Rhizopus, виды Mucor, виды Absidia, виды Cunninghamella, Scedosporium prolificans, Stachybotrys chartarum, Trichoderma longibrachiatium, виды Trichosporon или любой гриб, который является патогенным в легком.
В используемом в настоящем описании смысле термин «химиотерапевтическое средство, содержащее платину» включает без ограничения: цисплатин, карбоплатин или ормаплатин, оксалиплатин, DWA2114R ((-)-(R)-2-аминометилпирролидин (1,1-циклобутандикарбоксилато) платину), зениплатин, энлоплатин, лобаплатин, CI-973 (SP-43(R)-1,1-циклобутандикарбоксилато(2-)-(2-метил-1,4-65-бутандиамин-N,N')платину), 254-S-недаплатин, JM-216 (бис-ацетатоаминдихлорциклогексиламинплатину(IV)), (смотри: Weiss, R.B. and Christian, M.С, «New Cisplatin Analogue in Development», Drugs, 46: (03) 360-377 (993)); (CPA)2Pt[DOLYM]- и (DACH)Pt[DOLYM]-цисплатин (Choi с соавторами, Arch. Pharmacal. Res. 22(2): 151-156, 1999); аналог 254-S-цисплатина (Koga с соавторами, Neurol. Res. 18(3): 244-247, 1996); аналоги цис-1,4-диаминоциклогексанцисплатина (Shamsuddin с соавторами, J. Inorq. Biochem. 61(4): 291-301, 1996); МеОН-цисплатин (Shamsuddin с соавторами, Inorg. Chem. 36(25): 5969-5971, 1997); аналог CI-973-цисплатина (Yang с соавторами, Int. J. Oncol. 5(3): 597-602, 1994); цис-диаминдихлорплатину (II) и ее аналоги цис-1,1-циклобутандикарбозилато-(2R)2-метил-1,4-бутандиаминплатину(II) и цис-диамин(гликолато)платину (Claycamp & Zimbrick, J. Inorg. Biochem. 26 (4): 257-67, 1986; Fan etal. Cancer Res. 48(11): 3135-9, 1988; Heiger-Bernays et al. Biochemistry 29(36): 8461-6, 1990; Kikkawa etal., J. Exp.Clin. Cancer Res. 12(4):233-40, 1993; Murray et al. Biochemistry 31(47): 11812-17,1992; Takahashi et al., Cancer Chemother. Pharmacol. 33(l):31-5, 1993), аналоги гем-дифосфонатцисплатина (FR 2683529), аналоги цисплатина, содержащие связанную группу дансила (Hartwig с соавторами, J. Am. Chem. Soc. 114(21): 8292-3, 1992), полученные из аминоалкиламиноантрахинона аналоги цисплатина (Kitov с соавторами, Eur. J. Med. Chem. 23(4): 381-3, 1988), спироплатин, карбоплатин, ипроплатин и аналоги JM40-платины (Schroyen с соавторами, Eur. J. Cancer Clin. Oncol. 24(8): 1309-12, 1988), и аналоги цисплатина JM8 и JM9 (Harstrick с соавторами, Int. J. Androl. 10(1); 39-45, 1987).
В другом аспекте предлагается применение эффективного количества антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, для получения лекарственного средства для применения вместе с химиотерапевтическим средством, содержащим платину, для лечения рака легкого у субъекта. В другом аспекте предлагается применение эффективного количества антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, для применения вместе с химиотерапевтическим средством, содержащим платину, которое подробно описано в настоящей публикации, для лечения рака легкого у субъекта. Видом микроорганизма может быть вирусный патоген или бактериальный патоген, или грибковый патоген, которые подробно описано в настоящей публикации.
В другом аспекте предлагается эффективное количество антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, для получения лекарственного средства для применения вместе с химиотерапевтическим средством/ содержащим платину, для лечения рака легкого у субъекта. В другом аспекте предлагается эффективное количество антигена одного или нескольких видов микроорганизмов, которые являются патогенными в легком, для применения вместе с химиотерапевтическим средством, содержащем платину, которое подробно описано в настоящей публикации, для лечения рака легкого у субъекта. Видом микроорганизма может быть вирусный патоген или бактериальный патоген, или грибковый патоген, которые подробно описаны в настоящей публикации. Химиотерапевтическим средством, содержащим платину, может быаъ без ограничения: цисплатин, карбоплатин или оксалиплатин.
В другом аспекте предлагается набор. Набор содержит антиген одного или нескольких видов микроорганизмов, которые являются патогенными в легком, химиотерапевтическое средство, содержащее платину; и инструкции по приему антигена и химиотерапевтического средства, содержащего платину, субъектом, нуждающемся в таком приеме. Видом микроорганизма может быть вирусный патоген или бактериальный патоген, или грибковый патоген, которые подробно описаны в настоящей публикации.
В различных аспектах варианты осуществления изобретения относятся к композициям, содержащим компоненты организмов, которые могут вызывать инфекции желудочно-кишечного тракта, так что организм может быть охарактеризован как патоген. Однако организм, который в некоторых случаях является патогенным, не всегда может вызывать заболевание. Большинство животных в определенной степени колонизированы другими организмами, такими как бактерии, которые обычно существуют в симбиотической или комменсальной взаимосвязи с животным-хозяином. Таким образом, многие виды в норме безвредных бактерий встречаются у здоровых животных, и обычно они располагаются на поверхности конкретных органов и тканей. Часто такие бактерии помогают нормальному функционированию организма. Например, у человека, симбиотические бактерии Escherichia coli могут встречаться в кишечнике, где они стимулируют иммунитет и уменьшают риск инфекции более вирулентными патогенами.
Бактерии, которые обычно являются неопасными, такие как Escherichia coli, могут вызывать инфекцию у здоровых субъектов, результат которой может быть в диапазоне от умеренной до тяжелой инфекции и вплоть до смерти. Является ли организм, такой как бактерия, патогенным (т.е., вызывает инфекцию) или не является таковым, в определенной степени зависит от таких фактороЕ как путь проникновения и доступа к конкретным клеткам, тканям или органам хозяина; присущая бактерии вирулентность; количество бактерий, присутствующих в месте потенциальной инфекции; или состояние здоровья животного-хозяина. Таким образом, организмы, которые в норме являются неопасными, могут становиться патогенными в благоприятных для инфекции условиях, и дажа наиболее вирулентные организмы могут требовать особых условий для того, чтобы вызвать инфекцию. Соответственно, организмы, которые являются представителями нормальной флоры, могут быть патогенами, когда они выходит из своей нормальной экологической роли в эндогенной флоре. Например, эндогенные виды могут вызывать инфекцию вне своей экологической ниши в анатомически близких областях, например, в результате распространения в прилегающие области. Когда такое происходит и в контексте настоящего изобретения, такие неопасные в норме эндогенные организмы считают патогенными.
Известно, что конкретные организмы, такие как бактериальные виды, вирусы, черви и простейшие, вызывают инфекции в конкретных областях ЖКТ у здоровых в иных обстоятельствах субъектов. Примеры организмов, которые обычно вызывают инфекции в конкретных областях ЖКТ, перечислены ниже; будет понятно, что такие примеры не предназначены для ограничения, и что специалист сможет легко распознать и идентифицировать инфекционные или патогенные организмы, которые вызывают инфекции или обычно вызывают инфекции в различных областях ЖКТ у здоровых взрослых людей, на основе например, информации о конкретных популяциях пациентов, которая представлена, например, в следующих публикациях: Manual of Clinical Microbiology 8th Edition,-Patrick Murray, Ed., 2003, ASM Press American Society for Microbiology, Washington DC, USA; Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases 5th Edition, G.L Mandell, J.E. Bennett, R. Dolin, Eds., 2000, Churchill Livingstone, Philadelphia, PA, USA, которые включены в настоящее описание в виде ссылки.
Инфекцию ротовой полости обычно вызывают следующие бактериальные виды: Prevotella melaninogenicus, анаэробные стрептококки, стрептококки вириданс, виды Actinomyces, виды Peptostreptococcus или виды Bacteroides, или другие анаэробы ротовой полости; или вирусные патогены: вирус простого герпеса, вирусы Коксаки или вирус Эпштейн-Барр.
Инфекции пищевода обычно вызывают следующие бактериальные виды: виды Actinomyces, Mycobacterium avium, Mycobacterium tuberculosis или виды Streptococcus; или вирусные патогены: цитомегаловирус, вирус простого герпеса или ветряной оспы.
Инфекции желудка обычно вызывают следующие бактериальные виды: Streptococcus pyogenes или Helicobacter pylori; или вирусные патогены: цитомегаловирус, вирус простого герпеса, вирус Эпштейн-Барр, ротавирусы, норовирусы или аденовирусы.
Инфекции тонкого кишечника обычно вызывают следующие бактериальные виды: Escherichia coli, Clostridium difficile, Bacteroides fragilis, Bacteroides vulgatus, Bacteroides thetaiotaomicron, Clostridium perfringens, Salmonella enteriditis, Yersinia enterocolitica или Shigella flexneri; или вирусные патогены: аденовирусы, астровирусы, калицизирусы, норовирусы, ротавирусы или цитомегаловирус.
Инфекции ободочной кишки/прямой кишки обычно вызывают следующие бактериальные виды: Escherichia coli, Clostridium difficile, Bacteroides fragilis, Bacteroides vulgatus, Bacteroides thetaiotaomicron, Clostridium perfringens, Salmonella enteriditis, Yersinia enterocolitica или Shigella flexneri; или вирусные патогены: аденовирусы, астровирусы, калицивирусы, норовирусы, ротавирусы или цитомегаловирус.
Инфекции ануса обычно вызывают следующие бактериальные виды: Streptococcus pyogenes, виды Bacteroides, виды Fusobacterium, анаэробные стрептококки, виды Clostridium, Escherichia coli, виды Enterobacter, Pseudomonas aeruginosa или Treponema pallidum; или вирусные патогены: вирус простого герпеса.
Организмы, такие как бактерии, часто функционально классифицируют в виде групп сходных штаммов (которые обычно относятся к группам, предположительно имеющим общего предка, с идентифицируемыми физиологическими, но обычно не морфологическим отличиями, и которые можно идентифицировать с использованием серологических способов против поверхностных антигенов бактерий). Таким образом, каждый вид бактерий (например, Escherichia coli) имеет многочисленные штаммы (или серотипы), которые могут отличаться по своей способности вызывать инфекцию или отличаться по своей способности вызывать инфекцию в конкретном органе/месте. Некоторые штаммы Escherichia coli более вероятно вызывают инфекцию желудочно-кишечного тракта/диарею, включая энтеротоксигенные Е. coli (ЕТЕС), энтеропатогенные Е. coli (ЕРЕС), энтерогеморрагические Е. coli (ЕНЕС), продуцирующие токсин Шига Е. coli (STEC), энтероагрегативные Е. coli (ЕАЕС), энтероинвазивные Е. coli (EIEC) и диффузные прилипающие Е. coli (DAEC). Согласно настоящему изобретению, один или несколько штаммов ЕТЕС, ЕРЕС, ЕНЕС, STEC, ЕАЕС, EIEC или DAEC Е. coli (т.е., штаммов, которые вызывают инфекцию ободочной кишки) могут быть выбраны для получения препарата для лечения IBD.
Подобным образом, существуют многочисленные подтипы конкретных вирусов, червей или простейших, которые ассоциированы с заболеванием в конкретной популяции, поэтому являются применимыми в настоящем изобретении.
Композиции согласно изобретению содержат антигены организмов, которые являются патогенными в конкретной области ЖКТ. Композиции могут содержать компоненты целых организмов, целые клетки или целые вирионы или могут содержать экстракты или препараты организмов, такие как экстракты клеточных стенок или клеточных мембран или экзотоксины. Композиции также могут содержать один или несколько изолированных антигенов таких организмов. Патогенные организмы могут быть коммерчески доступными (например, из Американской коллекции типов культур, Manassas, VA, USA), или могут составлять клинические изоляты οт субъектов, имеющих инфекцию.
Композиции согласно изобретению, полученные из патогенов, могут быть предоставлены отдельно или в сочетании с другими соединениями (например, молекулами нуклеиновых кислот, малыми молекулами, пептидами или пептидными аналогами) в присутствии липосомы, адъюванта или любого фармацевтически приемлемого носителя в форме, подходящей для введения млекопитающем, например, человеку. В используемом в настоящем описании смысле «фармацевтически приемлемый носитель» или «эксципиент» включает любой и все из следующих компонентов: растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, средства для изотоничности и замедления всасывания и тому подобные, которые являются физиологически совместимыми. Носитель может быть подходящим для соответствующей формы введения, включая подкожное, внутрикожное, внутривенное, парентеральное, внутрибрюшинное, внутримышечное, подъязычное, ингаляционное, внутриопухолевое или пероральное введение. Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для получения стерильных инъекционных растворов или дисперсий для немедленного приема. Применение таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением случаев, когда какая-либо обычная среда или средство является несовместимым с активным соединением (т.е., конкретными бактериями, бактериальными антигенами или их композициями согласно изобретению), предусматривается их применение в фармацевтических композициях согласно изобретению. Вспомогательные активные соединения также могут быть включены в композиции.
Способы, хорошо известные в данной области для получения препаратов, можно найти, например, в «Remington's Pharmaceutical Sciences» (20th edition), ed. A. Gennaro, 2000, Mack Publishing Company, Easton, PA. Препараты для парентерального введения, например, могут содержать эксципиенты, стерильную воду или физиологический раствор, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения или гидрогенизированные нафталины. Биосовместимый биоразрушаемый полимер лактида, сополимер лактида/гликолида или сополимеры полиоксиэтилена-полиоксипропилена можно использовать для контроля высвобождения соединений. Другие потенциально применимые системы парентеральной доставки включают частицы сополимера этилена-винилацетата, осмотические насосы, имплантируемые инфузионные системы и липосомы. Препараты для ингаляции могут содержать эксципиенты, например, лактозу, или могут представлять собой водные растворы, содержащие, например, полиоксиэтилен-9-лауриловый эфир, гликохолат и дезоксихолат, или могут представлять собой масляные растворы для введения в форме назальных капель, или в виде геля. В случае терапевтических или профилактических композиций препараты могут быть введены индивидууму в количестве, эффективном для остановки или замедления прогрессирования IBD.
«Эффективное количество» патогенного вида или его антигена согласно изобретению включает терапевтически эффективное количество или профилактически эффективное количество. «Терапевтически эффективное количество» относится к количеству, эффективному в дозах и в течение необходимых периодов времени в достижении требуемого терапевтического результата, такого как уменьшение или исключение симптомов IBD. Терапевтически эффективное количество патогенного вида или его антигена(он) может варьировать в соответствии с такими факторами, как состояние болезни, возраст, пол и масса индивидуума и способность соединения вызывать требуемую реакцию у индивидуума. Схему дозирования можно корректировать для обеспечения оптимального терапевтического ответа. Терапевтически эффективное количество также может представлять собой количество, при котором любые токсические или вредные эффекты патогенного вида или его антигена перевешиваются терапевтически полезными эффектами. «Профилактически эффективное количество» относится к количеству, эффективному в дозах и в течение необходимых периодов времени в достижении требуемого профилактического результата, такого как предотвращение IBD. Обычно профилактическую дозу применяют у субъектов до появления или на ранней стадии IBD, таким образом, профилактически эффективное количество может быть меньше чем терапевтически эффективное количество.
В случае введения с использованием подкожной или внутрикожной инъекции примерный диапазон терапевтически или профилактически эффективных количеств одного или нескольких патогенных видов бактерий может составлять примерно от 1 миллиона до 100000 миллионов организмов в миллилитре или может составлять от 100 миллионов до 7000 миллионов организмов в миллилитре, или может составлять от 500 миллионов до 6000 миллионов организмов в миллилитре, или может составлять от 1000 миллионов до 5000 миллионов организмов в миллилитре, или может составлять от 2000 миллионов до 4000 миллионов организмов в миллилитре, или любое целое число в указанных диапазонах. Общая концентрация бактерий в миллилитре может быть в диапазоне от 1 миллиона до 100000 миллионов организмов в миллилитре, или может составлять от 50 миллионов до 7000 миллионов организмов в миллилитре, или может составлять от 100 миллионов до 5000 миллионов организмов в миллилитре, или может составлять от 500 миллионов до 5000 миллионов организмов в миллилитре, или может составлять от 1000 миллионов до 4000 миллионов организмов в миллилитре, или любое целое число в указанных диапазонах. Диапазон терапевтически или профилактически эффективных количеств антигенов патогенного вида бактерий может составлять любое целое число в диапазоне 0,1 нМ - 0,1 М, 0,1 нМ - 0,05 М, 0,05 нМ - 15 мкМ или 0,01 нМ - 10 мкМ.
Следует отметить, что дозовые концентрации и диапазон могут варьировать в зависимости от тяжести состояния, которое необходимо улучшить, или может варьировать в зависимости от иммунного ответа субъекта. В общем, целью является достижение адекватного иммунного ответа. В случае введения с использованием подкожной или внутрикожной инфекции степень иммунного ответа можно определить, например, по размеру отсроченной локальной кожной иммунной реакции в месте инъекции (например, от 0,25 дюймов (0,635 см) до 4 дюймов (10,16 см) в диаметре). Доза, необходимая для достижения соответствующего иммунного ответа, может варьировать в зависимости от индивидуума (и его иммунной системы) и требуемого ответа. Также можно применять стандартизованные дозы.
В контексте подкожного или внутрикожного введения, есги целью является достижение с использованием бактериальной композиции локальной кожной реакции размером 2 дюйма (5,08 см), то суммарная доза может быть, например, в диапазоне от 2 миллионов бактерии (например, 0,001 мл вакцины с концентрацией 2000 миллионов организмов в миллилитре) до более ·чем 20000 миллионов бактерии (например, 1 мл вакцины с концентрацией 20000 миллионов организмов в миллилитре). Также можно учитывать концентрации отдельных видов бактерий или их антигенов в композиции. Например, если концентрация одного конкретного патогенного вида бактерий, размер клеток такого вида или его антигенная нагрузка намного выше по сравнению с другими патогенными видами бактерий в вакцине, то локальная иммунная кожная реакция индивидуума вероятно может быть следствием его ответа на такой конкретный вид бактерий. В некоторых вариантах иммунная система индивидуума может отвечать более сильно на один вид бактерий в композиции, чем на другой, в зависимости, например, от наличия в анамнезе инфекции конкретным видом, таким образом, доза или композиция может быть соответственно скорректирована для такого индивидуума.
Для конкретного субъекта время и доза для лечения могут быть скорректированы с течением времени (например, по времени введение может быть ежедневным, через день, еженедельным, ежемесячным) в соответствии с потребностью индивидуума и профессиональным решением человека, осуществляющего введение или наблюдающего за введением композиций. Например, в контексте подкожного или внутрикожного введения композиции можно вводить через день. Начальная доза примерно 0,05 мл может быть введена подкожно с последующими увеличения на 0,01-0,02 мл через день вплоть до достижения адекватной кожной реакции в месте инъекции (например, отсроченная реакция в виде видимого покраснения в месте инъекции диаметром от 1 дюйма (2,54 см) до 2 дюймоз (5,08 см)). После достижения такой адекватной иммунной реакции введение такой дозы продолжают в качестве поддерживающей дозы. Поддерживающую дозу можно корректировать время от времени, чтобы добиться требуемой видимой кожной реакции (воспаления) в месте инъекции. Введение дозы может по продолжительности составлять, например, по меньшей мере, 2 недели, 2 месяца, 6 месяцев, 1, 2, 3, 4 или 5 лет или дольше.
В некоторых вариантах изобретение может относиться к антигенным композициям, вводимым в одну или несколько эпителиальных тканей неэнтеральным путем. Например, в кожу посредством внутрикожной или подкожной инъекции; в эпителий легкого путем ингаляции. Соответственно, в некоторых вариантах антигенные композиции согласно изобретению вводят так, чтобы вызвать иммунный ответ в неэнтеральной ткани, такой как эпителиальная ткань. В некоторых вариантах один или несколько неэнтеральных путей введения можно сочетать с одним ип: несколькими дополнительными путями введения, такими как внутриопухолевое, внутримышечное или внутривенное введение.
В различных аспектах изобретения антигенные композиции, которые вводят пациенту, могут быть охарактеризованы как имеющие антигенный признак, т.е. сочетание антигенов или эпитопов, которые являются достаточно специфичными, чтобы антигенная композиция была способна вызывать иммунный ответ, который является специфичным для конкретного патогена, такой как адаптивный иммунный ответ.
Количество активного соединения (например, видов бактерий, вирусов, простейших или гельминтов или их антигенов) в композиции может варьировать в зависимости от таких факторов, как состояние болезни, возраст, пол и масса индивидуума. Схемы дозирования можно корректировать, чтобы обеспечить оптимальный терапевтический ответ.Например, можно вводить однократный болюс, можно вводить несколько дробных доз в течение определенного периода времени или доза может быть пропорционально снижена или увеличена в связи с потребностями в определенной терапевтической ситуации. Может быть предпочтительным получение парентеральных композиций в стандартной лекарственной форме для простоты введения и равномерности дозирования.
В случае антигенных препаратов (аналогичных вакцине) может быть представлено иммуногенно эффективное количество соединения, отдельно или в сочетании с другими соединениями, с иммунологическим адъювантом. Соединение также может быть связано с молекулой носителя, такого как бычий сывороточный альбумин или гемоцианин морского блюдечка «замочная скважина», чтобы повысить иммуногенность. Антигенная композиция («вакцина») представляет собой композицию, которая содержит материалы, которые вызывают требуемый иммунный ответ.Антигенная композиция может отбирать, активировать или способствовать экспансии В-клеток памяти, Т-клеток, нейтрофилов, моноцитов или макрофагов иммунной системы, например, чтобы уменьшить или исключить симптомы IBD. В некоторых вариантах конкретный патогенный микроорганизм, вирус, вирусные антигены, бактерии, бактериальные антигены или их композиции согласно изобретению способны вызывать требуемый иммунный ответ в отсутствие любого другого агента и, следовательно, их можно считать антигенной композицией. В некоторых вариантах антигенная композиция содержит подходящий носитель, такой как адъювант, который представляет собой агент, который действует неспецифичным образом, усиливая иммунный ответ к конкретному антигену или к группе антигенов, обеспечивая возможность уменьшения количества антигена в любой данной дозе вакцины или уменьшения частоты введения доз, необходимой для создания требуемого иммунного ответа. Бактериальная антигенная композиция может содержать живые или мертвые бактерии, способные индуцировать иммунный ответ против антигенных детерминант, 6 норме ассоциированных с бактериями. В некоторых вариантах антигенная композиция может содержать живые бактерии, которые относятся к менее вирулентным штаммам (ослабленные), и поэтому вызывают менее тяжелую инфекцию. В некоторых вариантах антигенная композиция может содержать живые, ослабленные или мертвые вирусы, способные индуцировать иммунный ответ против антигенных детерминант, в норме ассоциированных с вирусом.
Антигенная композиция, содержащая убитые организмы, для введения путем инъекции, может быть получена следующим образом. Организмы могут быть выращены в подходящих средах и промыты физиологическим раствором соли. Затем организмы могут быть подвергнуты центрифугированию, ресуспендированы в физиологическом растворе и убиты нагреванием. Суспензии могут быть стандартизованы прямым микроскопическим подсчетом, смешаны в требуемых количествах и оставлены на хранение в подходящих емкостях, которые можно использовать для тестирования безопасности, срока годности и стерильности соответствующим образом. Кроме организма и/или его антигенов, препарат с убитыми организмами, подходящий для введения человеку, может содержать фенольный консервант (например, 0,4%) и/или хлорид натрия (например, около 0,9%). Композиция также может содержать следовые количества сердечно-мозгового экстракта (быка), пептоны, дрожжевой экстракт, агар, кровь овцы, декстрозу, фосфат натрия и/или другие компоненты среды.
В некоторых вариантах антигенную композицию можно использовать в виде аэрозоля для ингаляции.
В общем, следует применять композиции согласно изобретению, не вызывающие существенной токсичности. Токсичность соединений согласно изобретению можно определить, используя стандартные методики, например, тестируя в культурах клеток или на экспериментальных животных и определяя терапевтический индекс, т.е. соотношение между LD50 (дозой, летальной для 50% популяции) и LD100 (дозой, летальной для 100% популяции).
В некоторых вариантах бактерии, которые являются представителями эндогенной флоры конкретной области ЖКТ, можно применять для получения антигенных композиций согласно изобретению. В рядах таблицы 1 указаны бактериальные виды и биологические области, в которых такие виды могут образовывать часть эндогенной флоры. Например, виды Abiotrophia обычно являются типичными представителями эндогенной флоры ротовой полости.
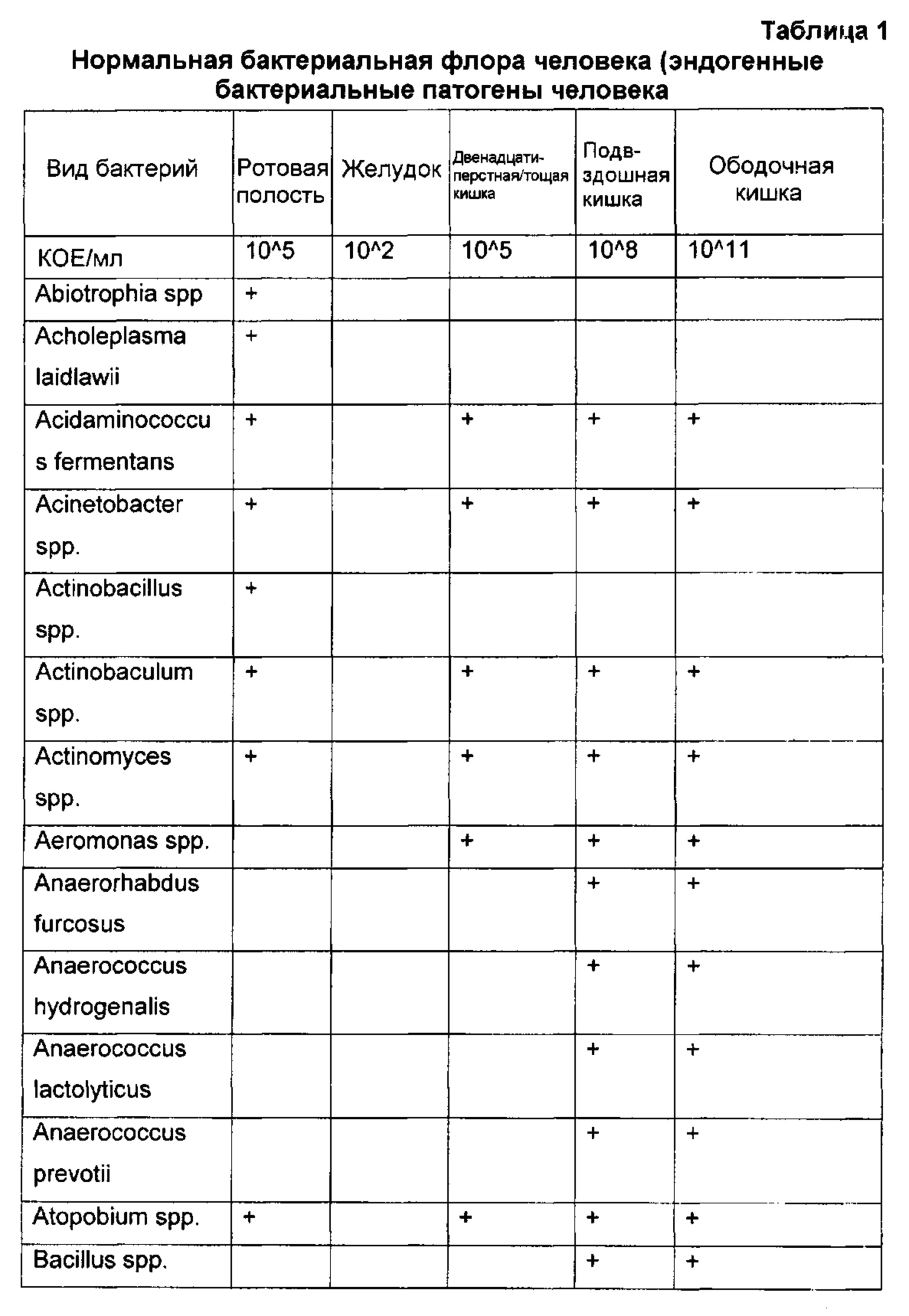











Эндогенная микробная флора, такая как бактерии, имеет доступ к тканям в случае патогенеза, либо посредством основанного на принципе смежности распространения, либо посредством бактериемического распространения. В благоприятных условиях все эндогенные организмы могут стать патогенными и локально проникать и распространяться в результате основанного на принципе смежности распространения в соседние ткани и органы. Эндогенная бактериальная флора кожи, ротовой полости и ободочной кишки представлена видами, которые, как выяснено, также подвержены бактериемическому распространению. Следовательно, бактерии, которые являются представителями конкретного домена эндогенной флоры, могут вызывать инфекцию в тканях или органах, в которые такие бактерии могут распространяться. Соответственно, один аспект изобретения заключается в применении эндогенных микробных патогенов для лечения IBD, имеющего симптомы, локализованные в области ЖКТ, в которую эндогенные бактерии могут распространяться, вызывая инфекцию. В колонках таблицы 2 перечислены домены эндогенной флоры. В рядах таблицы 2 перечислены области ЖКТ, в которых может иметь место IBD. Соответственно, один аспект изобретения заключается в применении эндогенных микробных патогенов для получения антигенных композиций, или подбора существующих препаратов, содержащих патогены, для лечения IBD, возникающего в областях ЖКТ, в которые патоген может распространяться, вызывая инфекцию. Соответственно, в альтернативных вариантах IBD, которое является симптоматическим в области, указанной в первой колонке таблицы 2, можно лечить антигенными композициями, содержащими антигенные детерминанты, которые являются специфичными для микробных патогенов, которые являются представителями эндогенной флоры одного или нескольких доменов эндогенной флоры, перечисленных 6 первом ряду таблицы 2, и обозначенных X или галочкой в соответствующем ряду.
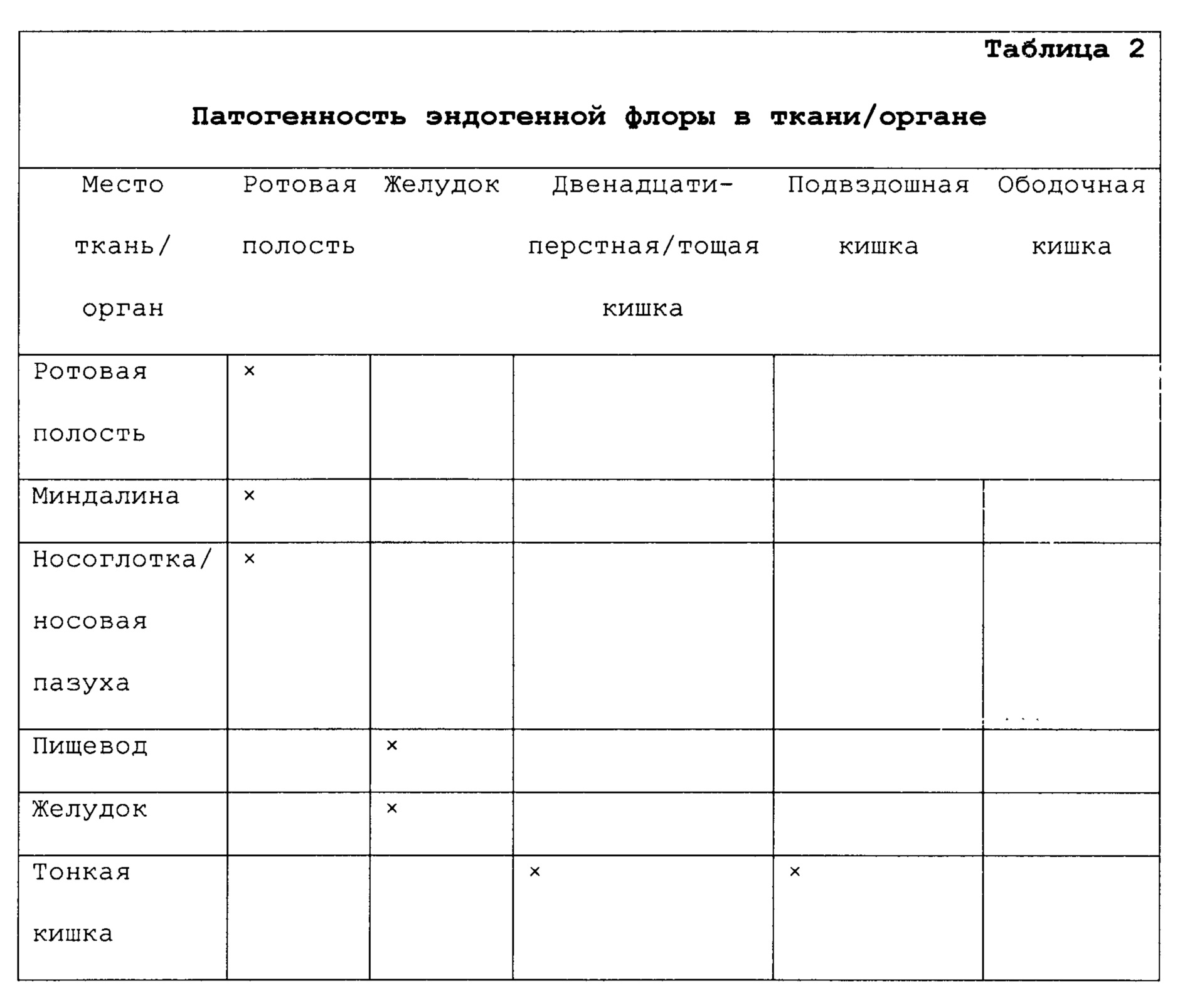

В соответствии со сводной информацией, представленной в таблицах 1 и 2, проявление IBD в конкретной области ЖКТ, указанной в колонке 1 таблицы 2, можно лечить антигенными композициями, содержащими антигенные детерминанты
соответствующего вида бактерий, указанного в таблице 1, так что заголовки колонок в таблице 2 по сути заменимы названиями видов бактерий, указанными в таблице 1.
В некоторых вариантах патогены для применения в изобретении могут быть экзогенными бактериальными патогенами. Например, организмы, перечисленные в таблице 3, можно использовать в качестве микробных патогенов для получения антигенных композиций, или антигенные композиции, содержащие такие патогены, могут быть выбраны для применения при лечении IBD в области ЖКТ, указанной для соответствующего организма в таблице 3. В некоторых вариантах антигенные детерминанты эндогенных и экзогенных видов бактерий, направленные к конкретной ткани или органу, можно использовать в сочетании. Например, антигенную композицию, полученную из Clostridium difficile или специфичную для указанного вида, можно использовать для лечения IBD в ободочной кишке.



В некоторых вариантах патогены для применения в изобретении могут быть вирусными патогенами. В таблице 4 приведен примерный список вирусных патогенов наряду с местами в тканях и органах, для которых каждый вид вирусов по имеющимся сообщениям является патогеном. Соответственно, один аспект изобретения заключается в применении иммуногенных композиций, который являются специфичными для названных вирусов, для лечения IBD в области ЖКТ, которая указана рядом с названием вируса в таблице 4.



Сводная информация в таблицах 1-4 дает широкую идентификацию патогенов, которые можно использовать для получения антигенных композиций согласно изобретению, наряду с указанием области ЖКТ, в которой такие организмы являются патогенными, и соответственно указана область ЖКТ, в которой имеет место IBD, которое можно лечить антигенным препаратом согласно изобретению.
В некоторых вариантах патоген, выбранный для применения в антигенных композициях согласно изобретению, может представлять собой патоген, который является распространенной причиной острой инфекции в области ЖКТ, в которой имеет место, подвергаемое лечению. В таблице 5 указаны бактериальные и вирусные патогены такого рода, а также область ЖКТ, в которой они обычно вызывают инфекцию. Соответственно, в выбранных вариантах IBD, имеющее место в области ЖКТ, указанной в первой колонке таблицы 5, можно лечить антигенной композиции, которая содержит антигенные детерминанты одного или нескольких патогенных организмов, перечисленных во второй колонке таблицы 5.


Конкретные организмы, которые обычно вызывают инфекцию ε конкретной области ЖКТ, могут варьировать по своему географическому распространению. Следовательно, таблица 5 не является исчерпывающим списком распространенных патогенов для всех географических положений и популяционных групп.Понятно, что клинический микробиолог, имеющий опыт в данной области, может определить распространенные виды патогенов в конкретном географическом регионе или популяционной группе для конкретной области ЖКТ согласно изобретению.
Человек является хозяином для широкого круга паразитов желудочно-кишечного тракта, включая различных простейших й гельминтов, которые в целях настоящего изобретения являются патогенами ЖКТ (Schafer, T.W., Skopic, A. Parasites of the small intestine. Curr Gastroenterol Reports 2006; 8:312-20; Jernigan, J., Guerrant, R.L., Pearson, R.D. Parasitic infections of the small intestine. Gut 1994; 35:289-93; Sleisenger & Fordtran's Gastrointestinal and liver disease. 8th ed. 2006; Garcia, L.S. Diagnostic medical parasitology. 5th ed. 2007). Композиции согласно изобретению, соответственно, могут содержать антигенные компоненты различных простейших, включая например: Giardia Iambiia, Cryptosporidium parvum, Cryptosporidium hominus, Isospora belli, виды Sarcocystis, подобные кокцидиям тельца (виды Cyclospora), Enterocytozoon bieneusi, Entamoeba histolytica, Entamoeba dispar, Entamoeba coli, Entamoeba hartmanni, Endolimax nana, Iodamoeba butschlii, Dientameoba fragilis, Blastocystis hominus, Cyclospora cayetanensis, Microsporidia, Trypanosoma cruzi, Chilomastix mesnili, Pentatrichomonas hominis, Balantidium coli. Подобным образом, композиции согласно изобретению могут содержать антигенные компоненты различных гельминтов, включая например: цестоды (ленточные черви), Taenia saginata, Taenia solium, виды Diphyllobothrium, Hymenolepis nana, Hymenolepis diminuta, Dipylidium caninum, нематоды (круглые черви), Ascaris lumbricoides, Strongyloides stercoralis, Necator americanus, Ancylostoma duodenale, Ancylostoma caninum, Tichuris trichiura, Capillaria philippinensis, виды Trichostrongylus, виды Trichinella, Necator americanus, Anisakis и родственные виды, Angiostrongylus costaricensis, Enterobius vermicularis, трематоды (сосальщики), Fasciolopsis buski, виды Heterophyes. виды Echinostoma, Clonorchis sinensis, виды Opisthorchis, виды Fasciola, Metagonimus yokogawi, Schistosoma mansoni, Schistosoma japonicum, Schistosoma mekongi, Schistosoma intercalation, виды Echinostoma и виды Paragonimus.
В выбранных вариантах изобретение включает в себя диагностические стадии, чтобы оценить предыдущее воздействие организма на пациента. Например, диагностические стадии могут включать получение истории болезни пациента в отношении воздействия выбранных патогенов и/или оценку иммунного ответа пациента на выбранный патоген. Например, можно провести серологический тест, чтобы выявить антитела к выбранным патогенам в сыворотке пациента. В связи с данным аспектом изобретения могут быть отобраны антигенные детерминанты выбранного патогена для применения в иммуногенной композиции для данного пациента на основе диагностического показателя того, что пациент один или несколько раз ранее подвергался воздействию(ям) патогена, например, на основании присутствия антител: к антигенным детерминантам данного патогена в сыворотке пациента.
В следующих выбранных вариантах изобретение относится к диагностическим стадиям для оценки иммунологического ответа пациента на лечение выбранной иммуногенной композицией. Например, диагностические стадии могут включать в себя оценку иммунного ответа пациента на антигенные детерминанты данной иммуногенной композиции, например, с использованием серологического теста, чтобы выявить антитела к таким антигенным детерминантам. В связи с данным аспектом изобретения лечение выбранной иммуногенной композицией можно продолжать, если оценка показывает, что имеет место активный иммунологический ответ на антигенные детерминанты данной композиции, и лечение вакциной может быть прекращено и может быть начато альтернативное лечение другой иммуногенной композицией, если оценка показывает, что нет достаточно активного иммунологического ответа на антигенные детерминанты иммуногенной композиции.
Хотя в настоящем описании раскрыты различные варианты осуществления изобретения, могут быть осуществлены многочисленные видоизменения и модификации в объеме изобретения в соответствии с общеизвестными для специалистов в данной области сведениями. Такие модификации включают замену известными эквивалентами любого аспекта изобретения с целью достижения такого же результата по существу таким же путем. Различные диапазоны предполагают включение чисел, определяющих диапазон. Слово «содержащий» используют в настоящем описании в качестве не ограничивающего термина, по существу эквивалентного фразе «содержащий без ограничения», и слово «содержит» имеет соответствующее значение. В используемом в настоящем описании смысле формы единственного числа включают и формы множественного числа, если контекст ясно не диктует иное. Таким образом, например, указание на «предмет» включает более одного такого предмета. Цитирование публикаций в настоящем описании не означает признания того, что такие публикации составляют известный уровень техники для настоящего изобретения. Любой приоритетный документ(ты) и все публикации, включая без ограничения патенты и заявки на выдачу патентов, цитированные в настоящем описании, включены в настоящее описание в виде ссылки так же, как в случае, когда специально и отдельно указано, что каждая отдельная публикация включена в виде ссылки в настоящее описание, и как бы приведена в настоящем описании в полном объеме. Изобретение включает все варианты осуществления и изменения, которые по существу описаны выше и которые описаны со ссылкой на примеры и чертежи.
В некоторых вариантах изобретение исключает стадии, которые включают в себя медицинское или хирургическое лечение.
Следующие примеры иллюстрируют варианты осуществления изобретения.
ПРИМЕР 1: Клинические исследования
Бактериальные композиции
Использовали пять следующих композиций убитых бактерий для лечения широкого множества типов и стадий злокачественных опухолей в слепых исследованиях:
1. MRV™ корпорации Bayer «Bayer MRV» (Hollister-Steir Laboratories, Spokane, WA, U.S.A.), содержащая следующие виды бактерий:
Организмов в миллилитре
негемолитические стрептококки
Такую вакцину получали для следующих показаний: ринит, инфекционная астма, хронический синусит, полипоз носа и хронический средний серозный отит. Лечение злокачественной опухоли не указано как предполагаемое применение такой вакцины. Вакцина также содержала следующие ингредиенты: 0,4% фенол, 0,9% NaCl, следовые количества сердечно-мозгового экстракта (быка), пептоны, дрожжевой экстракт, агар, кровь овцы, декстрозу и фосфаты натрия.
2. MRV Stallergenes «Stallergenes MRV» (Laboratories des Stallergenes, S.A., Fresnes, France), содержащую следующие компоненты:
Данную вакцину получали для таких же показаний, что и вакцину MRV, т.е., рецидивирующих инфекций дыхательных путей, и злокачественная опухоль указана как противопоказание.
Как указано ниже, неожиданно было обнаружено, что такие вакцины MRV, которые содержат многие распространенные патогены легкого, являются эффективными при лечении рака легкого.
3. Polyvaccinum Forte (PVF; Biomed S.A., Krakow, Poland), содержащая следующие компоненты:
Организмов в миллилитре
(стрептококки вириданс)
Указанную вакцину получали для хронических и рецидивирующих воспалительных состояний верхних и нижних дыхательных путей и мочеполового тракта, включая ринофарингит, рецидивирующий ларингит, трахеит, бронхит, отит среднего уха, хроническую и рецидивирующую невралгию тройничного и затылочного нерва, ишиалгию, плечевой плексит, межреберную невралгию, хронический цистоуретерит, вагинит, аднексит и воспаление эндометрия. Лечение злокачественной опухоли не было указано как предполагаемое применение для такой вакцины.
Следует отметить, что хотя общая концентрация бактерий в PVF идентичная концентрации бактерий в MRV (Bayer и Stallergenes), у пациентов обычно наблюдали видимый воспалительный иммунный ответ на подкожную инъекцию композиции PVF в намного более низкой дозе, чем обычная доза, необходимая для достижения сходной кожной реакции в случае композиции MRV, что свидетельствует о том, что вероятно имела место иммунная реакция на один из новых компонентов в вакцине Polyvaccinum Forte, такому как Е. coli. Как указано ниже, неожиданно было обнаружено, что PVF, которая содержит Е. Coli, распространенный патоген ободочной кишки, брюшной полости, почки, яичников, брюшины, печени и поджелудочной железы, является эффективной при лечении злокачественных опухолей в ободочной кишке, брюшных лимфатических узлах, почке, яичнике, брюшине, печени и поджелудочной железе.
4. Стафаговый лизат (Delmont Laboratories Inc., Swarthmore, PA, USA), содержащий следующие компоненты:
Staphylococcus aureus
Как указано ниже, неожиданно было обнаружено, что стафаговый лизат, который содержит Staphylococcus aureus, распространенный патоген молочной железы и кости, является эффективным при лечение злокачественной опухоли в молочной железе и кости.
Введение MRV, стафагового лизата и PVF
Бактериальные композиции (вакцины) представляли собой суспензию мертвых бактериальных клеток, и поэтому суспензии осторожно встряхивали перед применением, чтобы обеспечить равномерное распределение перед отбором дозы из флакона, и вводили подкожно три раза в неделю в понедельник, среду и пятницу. Пациентам было рекомендовано продолжить лечение в течение, по меньшей мере, 6 месяцев. Необходимую дозу вакцины определяли по адекватности иммунной реакции на вакцину. Начиная с очень низкой дозы (0,05 см3), дозу постепенно увеличивали (каждый раз на 0,01-0,02 см3) вплоть до достижения адекватной иммунной реакции. Отсроченная локальная реакция в месте инъекции появлялась в период от 2 до 48 часов после инъекции и продолжалась в течение 7 2 часов или дольше. Целью было достижение круглого розоватого/красного пятна диаметром от одного до двух дюймов (от 2,54 см до 5,08 см) в месте инъекции, свидетельствующего об адекватной иммунной стимуляции. После достижения такой реакции дозу поддерживали на уровне, необходимом для достижения такой реакции. Если реакция была значимо меньше двух дюймов (5,08 см) (например, полдюйма (1,27 см)), дозу увеличивали, если реакция была значимо выше двух дюймов (5,08 см) (например, три дюйма (7,62 см)), то дозу снижали. Такая локальная иммунная реакция обычно возникает в первые 24 часа после инъекции. Пациентов просили проверить такую реакцию и в случае наличия таковой измерить или отметить ее. Поддерживающая доза, необходимая для достижения адекватной иммунной реакции значительно варьирует, в зависимости от иммунного ответа индивидуума - только 0,001 см3 в некоторых людей до 2 см3 для других. Вакцина должна храниться в холодильнике (от 2°С до 8°С). Обычным местом инъекции является верхняя часть руки (плечо), бедро или живот.Точное место каждой инъекции варьировали, чтобы не вводить в места, в которых все еще иые.чс место розоватость/краснота. Известным противопоказанием для вакцин является гиперчувствительность к любому компоненту вакцины.
Пятую вакцину, полимикробную пероральную вакцину использовали в альтернативных аспектах изобретения, которая представляла собой следующую вакцину:
5. Респивакс производства BB-NCIPD Ltd (Bulgaria). Указанная пероральная вакцина содержала следующие лиофильно высушенные мертвые виды бактерий:
Организмов в мг
Введение респивакса
Пероральную вакцину респивакс получали для лечения хронической респираторной инфекцию, и она содержит множество наиболее распространенных патогенов дыхательных путей, включая множество наиболее распространенных возбудителей инфекции легких. Пациентов лечили дозой по одной таблетке (50 мг) в сутки, обеспечивая эквивалент 1,25×109 клеток каждого вида на дозу. Пациентам предписывали указанную выше дозу в течение непрерывного периода времени, составляющего, по меньшей мере, 6 месяцев.
Как указано ниже, неожиданно было обнаружено, что пероральная вакцина респивакс, которая содержит множество распространенных патогенов легких, эффективна при лечении злокачественной опухоли легкого.
ПРИМЕР 1А: Злокачественная опухоль легкого
Данный раздел относится к первичной злокачественной опухоли в легком или метастазам в легкое, подвергаемых лечению микробными патогенами легкого, такими как эндогенная бактериальная флора дыхательных путей.
Пациентов квалифицировали как пригодных для исследования рака легкого, если у них сначала диагностировали рак легкого на стадии 3В или 4 (неоперабельный). Определение стадий рака легкого осуществляли, используя стандартные способы, которые описаны, например, в AJCC: Cancer Staging Handbook (sixth edition) 2002; Springer-Verlag New York: Editors: Fredrick Greene, David Page and Irvin Fleming, or in International Union Against Cancer: TNM Classification of Malignant Tumors (sixth edition) 2002; Wiley-Liss Geneva Switzerland: Editors: L.H. Sobin and CH. Wittekind. Например, рак легкого можно классифицировать следующим образом:
Клиническая и патологическая классификация TNM легкого




Карты с диагностическими кодами 162.9 (рак легкого) и 197 (метастазирующая злокачественная опухоль) составляли вручную и в электронном виде. О пациентах собирали такую информацию, как данные диагностики, данные о смерти и стадия злокачественной опухоли. Карты для пациентов анализировали, чтобы подтвердить данные диагноза и стадию злокачественной опухоли. Пациентов исключали из анализа по следующим причинам: 1) не верная стадия; 2) пропущены данные; 3) нет карты; или 4) карта не доступна в срок для анализа данных. 20 пациентов были исключены из исследования, поскольку их карты еще не поступили или было недостаточно информации, из низ 6 получали MRV. В группу исследования включали всего 108 пациентов: 50, которые получали вакцину MRV, и 58, которые не получали вакцину MRV.
Сравнение выживаемости пациентов, у которых исходно диагностирован рак легкого на стадии 3В и 4, которые получали MRV, с пациентами, которые не получали MRV, и со стандартными данными о выживаемости SEER для пациентов, у которых исходно диагностирован рак легкого на стадии 3В и 4 (фигура 1) осуществляли, как показано ниже:

Сравнение выживаемости (как указано выше), включая только таких пациентов, которые получали MRV в течение, по меньшей мере, 2 месяцев (фигура 2) дало следующие результаты
Медианная выживаемость: 16,5 месяцев
выживаемость 1 год: 7 0%;
выживаемость 3 года: 27%;
выживаемость 5 лет: 15%.
Медианная выживаемость и выживаемость 1 год, 3 года и 5 лет были значимо лучше в группе, которую лечили MRV (содержащей бактерии, которые обычно вызывают инфекцию легких), подтверждая эффективность такой вакцины для лечения рака легкого. Пациенты, которых лечили вакциной MRV в течение более чем 2 месяцев, имели более высокие коэффициенты выживаемости, что дополнительно подтверждает эффективность такой вакцины для лечения рака легкого.
Альтернативный анализ проводили, используя данные, которые включали популяцию пациентов, которым композиция MRV не была предоставлена, чтобы устранить кажущуюся возможность систематической ошибки, вызванной тем, что более больные пациенты более вероятно выбирали новое лечение (с использованием MRV), а более здоровые пациенты потенциально менее вероятно подвергались лечению с использованием антигенных композиций согласно изобретению. Сравнение выживаемости MRV-пациентов, которым была предоставлена композиция MRV (обозначенные «легкое 1») с выживаемостью не-MRV-пациентов, которым композиция MRV не была предоставлена (обозначены «легкое 2») устраняет такую систематическую ошибку отбора, обеспечивая более ясную и более точную иллюстрацию преимущества лечения MRV, как показено на фигуре 3.
В некоторых вариантах особенно убедительное клиническое преимущество было получено при использовании антигенных бактериальных композиций, используемых при многократных частых инъекциях (т.е. три раза в неделю) в течение длительного периода времени - такого как, по меньшей мере, 2, 3, 4, 5, 6 или 12 месяцев, или 2, 3, 4 или 5 лет (в контексте поздних стадий злокачественной опухоли, такой как неоперабельный рак легкого, более длительные периоды могут быть наиболее полезными). Лечение такого рода можно осуществлять для того, чтобы обеспечить устойчивую длительную иммунную стимуляцию. Когда описанный выше анализ ограничен пациентами, которых лечили с использованием MRV в течение минимум 2 месяцев, то преимущество лечения MRV в отношении выживаемости еще более ясно проиллюстрировано на фигуре 4.
Как показано на фигуре 4, одногодичная выживаемость пациентов с раком легкого 3В- или 4-стадии, которых лечили с использованием MRV в течение, по меньшей мере, двух месяцев, составляла 7 0%, по сравнению с всего лишь 48% в случае группы не-MRV исследования легких 2 и 23% в случае группы из базы данных SEER. Трехлетняя выживаемость группы MRV более чем в 4 раза превышала выживаемость He-MRV-пациентов и пациентов в реестре SEER. Ни один из не-MRV-группы в исследовании легких 2 не выжил в течение 5 лет, тогда как 15% пациентов, которых лечили с использованием MRV в течение минимум двухмесячного периода, выживали, все еще были живыми через 5 лет после постановки диагноза. В контексте заболевания, такого как неоперабельный рак легкого, который считают смертельным, и которые обычно имеет коэффициент 5-летней выживаемости только 3% (реестр SEER), указанные выше результаты являются чрезвычайно обнадеживающими и удивительными.
Когда анализ данных о пациентах ограничен пациентами, которых лечили с использованием MRV в течение, по меньшей мере, 6 месяцев, то кривая выживаемости была на самом деле удивительной, как показано на фигуре 5. Более чем 60% пациентов были живыми к 3 годам, что более чем в 10 раз выше выживаемости как в группе не-MRV, так и в реестре SEER. 36% (5 из 14 пациентов) пациентов, которых лечили с использованием MRV в течение, по меньшей мере, 6 месяцев, были живыми через 5 лет после постановки диагноза, по сравнению только с 3% в базе данных SEER и 0% в группе не-MRV. Такие замечательные результаты в контексте диагноза злокачественной опухоли, который считается смертельным, являются чрезвычайно обнадеживающими и неожиданными. Соответственно, в некоторых вариантах злокачественные опухоли, такие как злокачественные опухоли на поздних стадиях, такие как неоперабельный рак легкого, можно лечить на протяжении периода дозирования, составляющего, по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев, 2 года, 3 года, 4 года, 5 лет или неопределенно долго.
Ограничивающий анализ тех пациентов, которых лечили с. использованием MRV в течение минимального периода времени (например, 6 месяцев) приводит к смещению в пользу группы MRV, так как MRV-пациенты, которые выживали в течение периода времени, меньшего чем такой период времени, исключены из группы (включая тех, которые умирали до того, как они могли бы завершить 6-месячное лечение). Подробный статистический анализ такого смешения с компенсаторным исключением выживающих в течение короткого периода времени в обеих группах не-MRV и SEER, показывает, что такое смещение играет очень незначительную роль в действительно замечательном преимуществе, связанном с выживаемостью пациентов, которых лечили с использованием MRV в течение, по меньшей мере, 6 месяцев.
На стадии 3В рака легкого злокачественная опухоль ограничена легкими, и таким образом, может быть стимулировгч целенаправленный противоопухолевый ответ на лечение согласно различным аспектам изобретения вакциной, такой как MRV, состоящее из легочных патогенов. На стадии 4 рака легкого злокачественная опухоль метастазировала в отдаленные органы, не подверженные целенаправленной стимуляции легочными патогенами способами согласно изобретению. Таким образом, согласно некоторым вариантам пациенты с раком легкого на стадии 3В могут быть отобраны для лечения вакциной MRV, так как вся злокачественная опухоль ограничена легкими и следовательно будет подвергаться целенаправленному воздействию вакциной MRV. Когда анализ данных о пациентах ограничен пациентами с раком легкого на стадии 3В, сравнение кривых выживаемости еще более ясно иллюстрирует пользу лечения MRV. Как показано на фигуре 11, одногодичная выживаемость пациентов с раком легкого на стадии 3В, которых лечили MRV, составляла 7 6%, по сравнению с всего лишь 53% в случае группы не-MRV исследования легких 2 и 23% в случае группы из базы данных SEER. 3-летняя выживаемость в группе MRV была в 3 раза выше, чем у пациентов не-MRV и более чем в 6 раз выше, чем в реестре SEER. Ни один из группы не-MRV не выживал через 5 лет, тогда как 14% пациентов с раком' на стадии 3В, которых лечили с использованием MRV, еще оставались живы через 5 лет после постановки диагноза. В контексте такого заболевания, как неоперабельный рак легкого на стадии 3В, который считается смертельным и имеет обычный показатель 5-летней выживаемости только 5% (реестр SEER), приведенные выше результаты являются чрезвычайно обнадеживающими и неожиданными.
Так как до первого визита некоторых пациентов после постановки диагноза проходило несколько месяцев или даже год или два, их включение в кривые выживаемости смещало кривую в. сторону более длительной выживаемости. Чтобы определить влияет ли такое смещение на различие в кривых выживаемости, выживаемость анализировали, начиная с даты первого визита, что исключало такое смещение, как показано на фигуре 12. Сравнение кривых выживаемости пациентов с раком легкого на стадии 3В, показанное на фигуре 12, демонстрирует даже большее преимущество лечения MRV с точки зрения выживаемости лечения MRV, чем показано на фигуре 11, что свидетельствует о том, что преимущество лечения с использованием MRV было частично скрыто на фигуре 11. Как показано на фигуре 12, 1-годичная выживаемость (от даты первого визита) пациентов с раком легкого на стадии 3В, которых лечили с использованием MRV, составляла 57%, по сравнению только с 21% в случае пациентов с раком на стадии 3В, которых не лечили с использованием MRV. В то время как ни один из пациентов с раком легкого на стадии 3В, которых не лечили с использованием MRV, не выживал в течение 3 лет, 3-летняя выживаемость пациентов с раком стадии 3В, которых лечили с использованием MRV, составляла 33%, а 5-летняя выживаемость составляла 14%, что явилось необычным и неожиданным результатом.
Когда анализ ограничивали пациентами с раком легкого на стадии 3В, первый визит которых был в течение периода времени до 3 месяцев от даты постановки диагноза, было ясно проиллюстрировано преимущество раннего лечения с использованием MRV. Как показано на фигуре 13, в то время как все пациенты с раком легкого на стадии 3В, которые совершали первый визит в течение периода до 3 месяцев от даты постановки диагноза, умирали в течение 1 года после постановки диагноза, 70% пациентов с раком легкого на стадии 3В, которых лечили с использованием MRV в пределах 3 месяцев после постановки диагноза, выживали в течение 1 года, 40% выживали в течение 3 лет и 20% выживали в течение 5 лет, что является действительно поразительным преимуществом раннего лечения с использованием MRV с точки зрения выживаемости.
Один аспект изобретения заключается в лечении первичного рака легкого или метастазов в легкое антигенными композициями, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются патогенами легких, такими как экзогенные патогены легких или патогены, которые являются представителями эндогенной флоры дыхательной системы. Например, антигенные детерминанты эндогенных видов бактерии флоры дыхательных путей, которые являются наиболее распространенными причинами инфекции в легком (смотри таблицу 5), можно использовать для лечения первичных и метастазирующих злокачественных опухолей, расположенных в легком: Streptococcus pneumoniae, Moraxella catarrhalis, Mycoplasma pneumoniae, Klebsiella pneumoniae, Haemophilus influenza. Подобным образом, распространенные вирусные патогены легких из таблицы 5 могут быть выбраны для применения в некоторых вариантах. Альтернативно, более исчерпывающий список эндогенных патогенов легких может быть выбран из таблицы 1, на основании информации о патогенности, приведенной в таблице 2. В следующих альтернативных вариантах можно использовать вирусные патогены легких, перечисленные в таблице 4. Ив следующих альтернативных вариантах можно использовать экзогенные бактериальные патогены легких из таблицы 3 для получения антигенных композиций согласно изобретению, т.е., выбранные из группы, состоящей из: еидов Achromobacter, видов Actinomadura, видов Alcaligenes, видов Anaplasma, Bacillus anthracis других видов Bacillus, видов Balneatrix, Bartonella henselae, Bergeyella zoohelcum, Bordetella holmesii, Bordetella parapertussis, Bordetella pertussis, Borrelia burgdorferi, Borrelia recurrentis, видов Brucella, Burkholderia gladioli, Burkholderia mallei, Burkholderia pseudomallei, Campylobacter fetus, Capnoctyophaga canimorsus, Capnoctyophaga cynodegmi, Chlamydia pneumoniae, Chlamydia psittaci, Chlamydophila pneumoniae, Chromobacterium violaceum, Chlamydophila psittaci, видов Chryseobacterium, Corynebacterium pseudotuberculosis, Coxiella burnetii, Francisella tularensis, видов Gordonia, видов Legionella, видов Leptospirosis, Mycobacterium avium, Mycobacterium kansasii, Mycobacterium tuberculosis, других видов Mycobacterium, видое Nocardia, Orientia tsutsugamushi, видов Pandoraea, Pseudomonas aeruginosa, других видов Pseudomonas, видов Rhodococcus, Rickettsia conorii, Rickettsia prowazekii, Rickettsia rickettsiae, Rickettsia typhi.
Например, так как композиции MRV содержат много наиболее распространенных патогенов легких, такие вакцины можно использовать для лечения первичного рака легкого или метастазов легкого, как показывают суммарные данные, представленные в настоящем описании, и в ряде историй болезни. Согласно описанным выше результатам один аспект изобретения заключается в лечении первичного рака легкого и метастазов в легкое антигенными композициями, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются патогенными в легком, таких как экзогенные патогены легкого или патогены, которые являются представителями эндогенной флоры дыхательных путей. В выбранных вариантах антигенные детерминанты распространенных патогенов легких можно использовать для лечения первичных и метастазирующих злокачественных опухолей, расположенных в легком, например, антигенные детерминанты из одного или нескольких из следующих видов бактерий или типов вирусов: Streptococcus pneumoniae, Moraxella catarrhalis, Mycoplasma pneumoniae, Klebsiella pneumoniae, Haemophilus influenza, вируса гриппа, аденовируса, респираторно-синцитиального вируса и вируса парагриппа. В следующих выбранных вариантах антигенные детерминанты Streptococcus pneumoniae, наиболее распространенной причины бактериальной инфекции легких, можно использовать отдельно или с другими наиболее распространенными патогенами легкого для лечения злокачественной опухоли легкого.
Первичная злокачественная опухоль легкого также может возникать из бронхиальной ткани и следовательно, в некоторых вариантах антигенные композиции, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, вызывают бронхиальную инфекцию, можно использовать для лечений пациентов со злокачественной опухолью, расположенной в бронхиальной ткани, включая, например, следующие распространенные причины бронхиальной инфекции: Mycoplasma pneumoniae, Chlamydophila pneumoniae, Bordetella pertussis, Streptococcus pneumoniae, Haemophilus influenzae, вирус гриппа, аденовирус, риновирус, коронавирус, вирус парагриппа, респираторно-синцитиальный вирус, метапневмовирус человека или вирус Коксаки. Рак легкого (или метастазы в легком), которые расположены как в легком, так и в бронхиальной ткани, можно лечить антигенными композициями, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, вызывают инфекцию и легкого и бронхов (например, Streptococcus pneumoniae, Haemophilus influenza и Mycoplasma pneumoniae являются распространенными патогенами легкого и бронхов), или альтернативно антигенными композициями, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, вызывают инфекцию легких, и антигенные детерминанты микробных патогенов, которые, как известно, вызывают инфекцию бронхов.
ПРИМЕР 1В: Рак молочной железы с метастазами в кость или легкое
Наиболее распространенной причиной инфекции молочной железы и инфекции костей является Staphylococcus aureus. Соответственно, в одном аспекте согласно изобретению антигенную композицию, содержащую антигенные детерминанты S. aureus, можно применять для лечения рака молочной железы с метастазами в кости. Удивительный случай пациента R (PtR), которого лечили вакциной на основе Staphylococcus aureus, указанный ниже в разделе «Истории болезни», иллюстрирует эффективность такого способа лечения рака молочной железы с метастазами в кости. Как показано на фигуре 6, в кумулятивном ряду из 52 пациентов выживаемость пациентов с раком молочной железы с метастазами в кость и/или легкое, которых лечили с использованием MRV (n=19), которая содержит Staphylococcus aureus, была лучше, чем выживаемость пациентов, не подвергнутых лечению вакциной MRV (n=33):

Согласно приведенным выше результатам, один аспект согласно изобретению заключается в лечении первичной злокачественной опухоли в молочной железе или метастазов в молочную железу антигенными композициями, которые содержат антигенные детерминанты микроорганизмов, которые, как известно, вызывают инфекцию молочной железы, и лечении первичной злокачественной опухоли кости или метастазов в кость антигенными композициями, которые содержат антигенные детерминанты видов бактерий и вирусов, которые, как известно, вызывают инфекцию костей. В выбранных вариантах вакцину, содержащую антигенные детерминанты Staphylococcus aureus, наиболее распространенной причины как инфекции молочной железы, так и инфекции костей, можно применять отдельно или в сочетании с другими наиболее распространенными патогенами молочной железы для лечения злокачественной опухоли в молочной железе, либо отдельно, либо в сочетании с другими наиболее распространенными патогенами костей для лечения злокачественной опухоли в кости.
ПРИМЕР 1С: Метастазы в кость
Одним из наиболее распространенных мест метастазов у пациентов с раком простаты является кость. В одном ·аспекте изобретения композицию MRV, которая содержит антигенные детерминанты S. aureus, наиболее распространенной причины инфекции костей, можно применять для лечения метастазов в кость, например, у пациентов, которые имеют или имели первичный рак простаты. На графике, приведенном на фигуре 7, представлено сравнение выживаемости для кумулятивного ряда пациентов с метастазирующим раком простаты, которым была сделана операция или проведено облучение, чтобы разрушить их предстательную железу (и, таким образом, первичную опухоль), и которые имели регистрируемую злокачественную опухоль, ограниченную метастазами в костях. Как показано, выживаемость пациентов, которых лечили с использованием MRV (n=4), была значимо выше, чем выживаемость пациентов, которых не лечили с использованием MRV (n=7):

Согласно приведенным выше результатам один аспект изобретения заключается в лечении первичных злокачественных опухолей костей или метастазов в кость антигенными композициями, которые содержат антигенные детерминанты микробных патогенов которые, как известно, вызывают инфекцию кости, таких как экзогенные патогены кости или патогены, которые являются представителями эндогенной флоры кожи, ротовой полости или ободочной кишки. Например, в выбранных вариантах антигенные детерминанты одного или нескольких из следующих видов микроорганизмов из списка распространенных патогенов кости можно применять для лечения первичных и метастазирующих злокачественных опухолей, расположенных в кости: Staphylococcus aureus, коагулазонегативные стафилококки, Streptococcus pyogenes, Streptococcus pneumoniae, Streptococcus agalactiae, другие виды стрептококков, Escherichia coli, виды Pseudomonas, виды Enterobacter, виды Proteus, виды Serratia, парвовирус B19, вирус краснухи, гепатита В. В следующих выбранных вариантах Staphylococcus aureus, наиболее распространенную причину инфекции костей, можно применять отдельно или с другими наиболее распространенными патогенами кости для лечения злокачественной опухоли кости.
ПРИМЕР 1D: Злокачественная опухоль, расположенная в ободочной кишке
Было показано, что лечение композицией PVF повышает выживаемость пациентов с раком ободочной кишки (смотри фигуру 8), как показано при сравнении следующих четырех групп пациентов с раком ободочной кишки:
- пациенты с раком ободочной кишки на стадии 4, которых лечили с использованием MRV;
- пациенты с раком ободочной кишки на стадии 4, которых не лечили вакциной;
- пациенты с раком ободочной кишки на стадии 4, которых лечили вакциной PVF;
- пациенты с раком ободочной кишки на стадии из базы данных SEER (эпидемиология, выживаемость и конечные исходы).
Данный пример иллюстрирует, что пациенты с раком ободочной кишки, которых лечили с использованием PVF, которая содержит Е. coli, являющиеся наиболее распространенной причиной бактериальной инфекции ободочной кишки, имеют значимо повышенную выживаемость.
Пациентов относили к первым двум группам данного исследования, если они имели рак ободочной кишки 4 стадии. Пациентов исключали из данного анализа по следующим причинам:
- неправильный диагноз;
- неправильная стадия;
- пропущены важные данные (например, дата смерти);
- нет карты;
- карта не поступила к исследователям на момент проведения анализа данных.
Группа пациентов состояла всего из 136 пациентов с раком ободочной кишки на 4 стадии: 15, которые принимали вакцину PW. 56, которые принимали вакцину MRV, и 65, которые не принимали вакцину. Получены следующие результаты, проиллюстрированы на фигуре 8:

Медианная выживаемость пациентов с раком ободочной кишки на стадии 4, которых лечили с использованием PVF (которая содержит Е. coli, один из наиболее распространенных патогенов ободочной кишки) была более чем в два раза выше, чем у пациентов, которых лечили с использованием MRV (которая не содержит патогенов ободочной кишки), или у пациентов, которых не лечили вакциной, и в четыре раза выше, чем у пациентов в реестре SEER. Все 15 пациентов, которых лечили с использованием PVF, еще оставались живы через 10 месяцев после постановки диагноза, по сравнению только с 71% в случае MRV-группы, 69% в случае группы без использования вакцины и только 45% в реестре SEER. Выживаемость через 30 месяцев в PVF-группе была в два раза выше, чем в MRV-группе и группе без использования вакцины и почти в 4 раза выше, чем в реестре SEER.
Критерий Уилкоксона показывает статистически значимое различие по выживаемости между пациентами, которых лечили с использованием вакцины PVF, и обеими группами: MRV-группой (р=0,0246) и группой без вакцины (р=0,0433). Указанное удивительное рассмотрение небольшой по размеру PVF-группы (n=15) показывает значимый терапевтический эффект.Полученные результаты свидетельствуют о том, что композиция PVF, которая содержит Е. coli, являющиеся наиболее распространенной причиной бактериальной инфекции ободочной кишки, является эффективным средством лечение рака ободочной кишки.
Также анализировали выживаемость таких пациентов, которым было предоставлено иммунологическое лечение согласно изобретению в период 3 месяцев после постановки диагноза (т.е., исключая тех пациентов, которые были долгожителями до предоставления лечения). Результаты такого анализа представлены на фигуре 9. Как показано, кривые выживаемости «MRV» и «без вакцины» на фигуре 9 значительно сдвинуты влево (что свидетельствует о том, что сдвиг за счет отбора в сторону «долгожителей» мог искусственно сместить такие кривые вправо на фигуре 8), в то время как заметно, что кривая PVF на фигуре 9 действительно находиться дальше вправо, чем кривая на фигуре. 8, свидетельствуя, что преимущество более раннего лечения с использованием PVF (т.е., в пределах 3 месяцев после постановки диагноза) больше, чем в случае перевешивания смещением за счет долгожителей, которое исключено на фигуре 9. Указанный анализ обеспечивает убедительное доказательство того преимущество лечения PVF в случае рака ободочной кишки на стадии 4 может быть даже больше чем показано на фигуре 8, и чем раньше начинают лечение композициями согласно изобретению после постановки диагноза, тем больше преимущество.
Согласно представленным выше результатам один аспект изобретения заключается в лечении рака ободочной кишки антигенными композициями, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются патогенами ободочной кишки, такие как патогены, которые являются представителями эндогенной флоры ободочной кишки или экзогенными патогенами ободочной кишки. Например, антигенные детерминанты следующих видов микроорганизмов можно использовать для лечения первичных и метастазирующих злокачественных опухолей, расположенных в ободочной кишке: Escherichia coli, Clostridium difficile, Bacteroides fragilis, Bacteroides vulgatus, Bacteroides thetaiotaomicron, Clostridium perfringens, Salmonella enteriditis, Yersinia enterocolitica, Shigella flexneri; аденовирусы, астровирусы, калицивирусы, норовирусы, ротавирусы или цитомегаловирус.Например, злокачественные опухоли, расположенные в ободочной кишке, можно лечить композицией PVF, которая содержит Е. coli, или альтернативными препаратами, которые содержат только антигенные детерминанты патогенов ободочной кишки. В выбранных вариантах антигенные детерминанты Е. coli, являющихся наиболее распространенной причиной бактериальной инфекции ободочной кишки, можно использовать отдельно или вместе с антигенными детерминантами других распространенных патогенов ободочной кишки для лечения злокачественной опухоли ободочной кишки.
ПРИМЕР 1Е: Применение респивакса, пероральной вакцины, для лечения рака легкого
Пероральную вакцину респивакс вводили как описано выше в дозе по одной таблетке 50 мг в сутки, обеспечивая эквивалент 1,25×109 клеток каждого вида на дозу. Пациентам предписывали продолжение приема указанной выше дозы в течение, по меньшей мере, 6 месяцев.
Как показано на фигуре 10, выживаемость пациентов с раком легкого на стадии 3В, которых лечили антигенами перорального респивакса, была значимо выше, чем у пациентов, которых не лечили антигенной композицией. Медианная выживаемость составляла 37 месяцев в случае пациентов, которых лечили респиваксом, по сравнению только с 20 месяцами в случае пациентов, которых не лечили вакциной на основе антигенной композиции. 40% пациентов, которых лечили респиваксом, были живы через 5 лет после постановки диагноза, тогда как ни один из пациентов, которых не подвергали такому лечению, выживали не более чем в течение 2 лет.
Согласно приведенным выше результатам один аспект изобретения заключается в лечении первичной злокачественной опухоли легкого или метастазов в легкое с использованием перорального введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые обычно вызывают инфекцию легких.
ПРИМЕР 2: Описания клинических случаев
Приведенные описания клинических случаев являются показательными для пациентов, которые составляют популяции пациентов, отраженные в описанных выше кумулятивных исследованиях, а также иллюстрируют дополнительные аспекты изобретения. В частности, описания индивидуальных клинических случаев пациентов A-N являются иллюстрациями неожиданных результатов, полученных у некоторых пациентов, подвергаемых лечению противовоспалительными средствами, в то время как описания клинических случаев пациентов О-АА являются типичными для общей популяции пациентов, которые включают многие примеры лечения вакциной, которое было эффективным в отсутствие противовоспалительной терапии.
MRV в случае рака легкого с применением и без применения противовоспалительных средств
Пациентка A (PtA): В сентябре 0 года у PtA развилась боль в правой верхней части груди, сопровождаемая хрипами. Такие симптомы персистировали, и в январе 1 года ей было проведено рентгеновское исследование груди, которое выявило крупное объемное образование 7 см × 8 см в верхушке правого легкого. Тонкоигольная аспирационная биопсия была позитивной в отношении немелкоклеточного рака легкого. 27 января 1 года МРТ показала инвазию подключичных артерий, что сделало невозможным хирургическую резекцию и, следовательно, у PtA диагностирован неоперабельный терминальный рак легкого на стадии 3В. Она была подвергнута краткосрочному курсу паллиативной лучевой терапии и химиотерапии с пониженной интенсивностью. Ей сообщили, что у нее присутствует злокачественная опухоль в терминальной стадии, при которой продолжительность жизни составляет от 3 до 6 месяцев.
29 апреля 1 года PtA была начата терапия вакциной MRV три раза в неделю. В тот же день она также начала лечение нестероидным противовоспалительным средством (НПВС) индометацином, 50 мг четыре раза в сутки, и использовать схему антиоксидантных добавок и витамина D. Спустя 8 месяцев к октябрю 2 года опухоль заметно уменьшилась в размере до 3 см в диаметре, и 19 мая 5 года, через четыре года после начала лечения по комбинированной схеме вакциной MRV, индометицином, антиоксидантными витаминами и витамином D, остался только остаточный рубец. PtA продолжала лечение таким сочетанием вакцины MRV и адъювантными противовоспалительными терапевтическими средствами в течение более чем 4 лет вплоть до конца мая 5 года, к этому времени не было признаков остаточной злокачественной опухоли, несмотря на диагноз терминального неоперабельного рака легкого более чем за 4 года до этого. Более чем через 14 лет после постановки диагноза терминального рака легкого PtA продолжала чувствовать себя хорошо без признаков остаточной злокачественной опухоли.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественных опухолей в легком с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые обычно вызывают инфекцию легких.
В соответствии с приведенными выше результатами другой аспект изобретения заключается во введении иммуногенных композиций многократно относительно часто на протяжении относительно длительного периода времени.
Сопутствующее применение противовоспалительных средств, таких как антиоксиданты, витамин D и индометицин вместе с целенаправленной терапией MRV, было ассоциировано со значимо повышенной выживаемостью, которая выше, чем выживаемость в случаях, сходных во всех других отношениях, в которых такие адъювантные противовоспалительные средства не применяли вместе с композициями согласно изобретению. Например, во всем остальном сходном случае с пациентом В, в котором противовоспалительные средства не вводили, диагностировали неоперабельный немелкоклеточный рак легкого на стадии 3В, который привел к смертельному исходу в течение 3 месяцев после постановки диагноза. Такие случаи являются доказательством синергетического действия антигенных композиций согласно изобретению и противовоспалительных средств лечения.
B соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественных опухолей посредством введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые являются патогенными в органе или ткани мишени, а также адъювантнымп противовоспалительными средствами лечения для получения синергетического эффекта.
MRV в случае злокачественной опухоли легкого совместно или без с противовоспалительных средств
Пациент С (PtC): Весной 0 года, у PtC начались боли в правой верхней области груди. Такая боль персистировала, и 5 октября 0 года ему была проведено рентгеновское исследование, которое выявило крупное объемное образование 12 см × 11 см, занимающее фактически всю верхнюю правую долю. Тонкоигольная аспирационная биопсия была позитивной в отношений низкодифференцированного немелкоклеточного рака легкого. Диагностическая торакотомия была проведена 7 декабря 0 года, которая выявила инвазию опухоли в стенку грудной клетки и верхнюю полую вену, и, следовательно, опухоль у PtC была неоперабельной (т.е., на стадии 3В). PtC был подвергнут краткосрочному курсу паллиативной лучевой терапии и химиотерапии с пониженной интенсивностью. Ему сообщили о присутствии терминальной злокачественной опухоли с продолжительностью жизни от 3 до 6 месяцев. 27 января 1 года быстро растущая опухоль была увеличена в размере до 14 см × 11,5 см.
9 февраля 1 года PtC начал лечение индометицином, по 50 мг четыре раза в сутки, антиоксидантными витаминами и витамином D. Спустя три недели, 1 марта 1 года, PtC начал лечение вакциной MRV три раза в неделю. К июню 1 года PtC чувствовал себя хорошо и бегал по 8 км 3-4 раза в неделю. 4 июня 1 года рентгеновское исследование груди показало, что опухоль уменьшилась в размере до 11 см в диаметре. PtC продолжал чувствовать себя хорошо, что привело к полной и активной жизни с возвращением к полной занятости и продолжению полной физической активности. PtC продолжал лечение с использованием сочетания вакцины MRV и адъювантных противовоспалительных терапевтических средств (индометицина, антиоксидантов и витамина D) в течение боле чем 16 месяцев вплоть до 24 июля 2 года, в этот момент времени лечение индометицином было прервано (из-за пониженной функции почек, известного потенциального побочного эффекта длительного применения индометицина). Спустя 6 месяцев, в декабре 2 года, после 22 месяцев целенаправленной терапии вакциной лечение MRV было прервано (так как MRV уже была недоступна после указанной даты). PtC продолжал чувствовать себя хорошо вплоть до июня 6 года, когда у него был диагностирован рецидив злокачественной опухоли в обоих легких, который привел к смерти 26 мая 7 года, более чем через 6,5 лет после того, как у него был диагностирован терминальный рак легкого и ему сообщили что у него осталось 3-6 месяцев жизни.
В данном случае применение адъювантных противовоспалительных средств, включая антиоксиданты, витамин D и индометицин, используемые вместе с целенаправленной терапией MRV в течение более чем 16 месяцев, было ассоциировано со значительно больше продолжительностью жизни вопреки диагнозу, который обычно свидетельствует о смерти в течение 1 года, при этом продолжительность жизни была выше, чем во всем остальном сходном случае с пациентом D, в котором такие адъювантные противовоспалительные средства не применяли вместе с композициями согласно изобретению, и неоперабельный рак легкого оказался смертельным в течение 8 месяцев после постановки диагноза. Такие случаи свидетельствуют о синергетическом эффекте антигенных композиций согласно изобретению и противовоспалительных средств лечения.
PVF в случае злокачественной опухоли ободочной кишки с метастазами в печень и легкое и без противовоспалительных средств.
Пациент Ε (PtE): PtE была проведена хирургическая резекция злокачественной опухоли ободочной кишки 17 июня 0 года с последующей химиотерапией. 15 августа 0 года у него была диагностирована злокачественная опухоль 4 стадии с метастазами в печени и легких, диагноз с очень плохим прогнозом. 20 октября 0 года PtE начал лечение по схеме с антиоксидантами и витамином D, и 10 декабря 0 года он начал лечение композицией PVF три раза в неделю, которое он продолжал в сочетании с антиоксидантами и витамином D. В сентябре 1 года он начал лечение целебрексом™ по 100 мг дважды в сутки. Несмотря на очень плохой начальный прогноз PtE еще был жив и чувствовал себя хорошо при последнем контакте более чем через 3 года после постановки диагноза терминального метастазирующего рака ободочной кишки.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественных опухолей ободочной кишки, печени и легкого с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются патогенными в ободочной кишке, печени и легком.
В отличие от PtE, из 15 пациентов, у которых диагностировали рак ободочной кишки на стадии 4 и которых лечили с использованием PVF, пациента с самым короткой продолжительностью жизни, пациента F, не лечили противовоспалительными средствами. Такие случаи предоставляют убедительное доказательство того, что противовоспалительные средства (т.е., целебрекс™, антиоксиданты и витамин D), принимаемые вместе с целенаправленной терапией PVF, оказывали синергетическое действие, внося вклад в более длительную продолжительность жизни у PtE, которая была больше, чем продолжительность жизни в других во всем остальном сходных случаях, в которых не применяли адъювантные противовоспалительные средства вместе с композициями согласно изобретению.
PVF в случае злокачественной опухоли ободочной кишки с метастазами в легкое с противовоспалительными средствами
Пациент G (PtG): у PtG развилось кровотечение из прямой кишки в мае 0 года, и был диагностирован рак ободочной кишки. Он был подвергнут операции, химиотерапии и лучевой терапии, но развились метастазы в легкие (стадия 4 злокачественной опухоли) 16 августа 1 года, конечный диагноз с плохим прогнозом. Он начал прием по схеме антиоксидантных витаминов и витамина D в июне 0 года, в 23 сентября 1 года он начал прием НПВС целебрекса по 100 мг дважды в сутки. В марте 3 года он начал прием вакцины PVF три раза в неделю, который продолжал вплоть до апреля 4 года, в это время развились метастазы головного мозга, которые привели к его смерти 2 июня 4 года, почти через 3 года после постановки диагноза терминального рака ободочной кишки на 4 стадии. PtG жил значительно дольше, чем можно было бы обычно ожидать при диагнозе рака ободочной кишки на 4 стадии с метастазами в легкие. В данном контексте изобретение относится к применению противовоспалительных средств вместе с иммуногенными композициями, такими как PVF, для получения синергетического эффекта.
Пациент H (PtH): у PtH диагностировали рак ободочной кишки с метастазами в печень и легкие 13 февраля 0 года. 11 января 1 года ему была назначена схема с антиоксидантами и витамином D. Однако в марте 1 года он вступил в исследование химиотерапии и в это время прервал прием таких добавок по требованию координаторов исследования. Его не лечили НПВС. 12 мая 1 года он начал лечение PVF, которую он принимал три раза в неделю вплоть до своей смерти лишь 2,5 месяца спустя. При сопоставлении со сходными случаями, в которых включали применение противовоспалительных средств, данный случай иллюстрирует, что если адъювантные противовоспалительные средства не принимаются одновременно с целенаправленной терапией с использованием антигенной активации, то отсутствует синергетический эффект, который в ином случае может иметь место при сопутствующем применении адъювантных противовоспалительных средств.
В заключение, в случаях рака ободочной кишки на стадии 4, подвергаемого лечению с применением целенаправленной терапии вакциной PVF, использование адъювантных противовоспалительных средств, включая антиоксиданты, витамин D и целебрекс, применяемых вместе с целенаправленной терапией на основе антигенной активации, ассоциировано со значимо повышенной выживаемостью, намного более высокой, чем выживаемость в двух случаях, в которых указанные адъювантные противовоспалительные средства не использовали вместе с вакциной, что является доказательством, свидетельствующим о синергетическом действии.
PVF с противовоспалительными средствами и без противовоспалительных средств в случае злокачественной опухоли поджелудочной железы с метастазами в легкие, печень и брюшные лимфатические узлы
Пациент I (Ptl): у PtI диагностировали рак поджелудочной железы в августе 1 года, в это время ему была проведена операция по удалению поджелудочной железы (т.е., операция Уиппла). Однако в июле 2 года у него развились билатеральные метастазы в легкие, и в феврале 4 года у него произошел рецидив злокачественной опухоли в области поджелудочной железы с брюшными метастазами и метастазами печени. Это терминальный диагноз с очень плохим прогнозом. PtI начал прием по схеме антиоксидантных витаминов, витамина D, больших доз куркумы, рыбьего жира (9 грамм в сутки), ресвератрола и зеленого чая (эквивалент 36 чашек в сутки) 27 сентября 2 года, при этом все указанные средства были противовоспалительными, и все он продолжал принимать. В марте 3 года он начал лечение целебрексом по 100 мг дважды в сутки, который он принимал больше 20 месяцев. Ptl начал лечение PVF три раза в неделю в мае 4 года, которую он продолжал применять регулярно в течение более 3 лет. PtI прожил в течение 5 лет после постановки диагноза терминального метастазирующего рака поджелудочной железы, удивительно длительная продолжительность жизни в контексте диагноза, который имеет чрезвычайно плохой прогноз. Данный случай является доказательством того, что высокие дозы множества противовоспалительных средств (т.е., целебрекса, антиоксидантов, витамина D, куркумы, рыбьего жира, ресвератрола, зеленого чая), принимаемые вместе с композициями PVF, приводили к синергетическому действию, которое внесло вклад в удивительную выживаемость PtI в течение 5 лет после развития метастазирующего рака поджелудочной железы, диагноза, который обычно является летальным в пределах 6 месяцев.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественной опухоли поджелудочной железы, брюшных лимфатических узлов, печени и легкого с применением введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, вызывают инфекцию в поджелудочной железе, брюшных лимфатических узлах, печени и легких.
Пациент J (PtJ) имел диагноз, по существу идентичный диагнозу PtI (т.е., рак поджелудочной железы с метастазами в брюшные лимфатические узлы, легкие и печень). PtJ, который не принимал никакие другие противовоспалительные средства вместе с вакциной PVF, за исключением антиоксидантов и витамина D, умер в период 4 месяца после постановки диагноза, тогда как PtI, который принимал большие дозы различных других противовоспалительных средств (т.е., целебрекса, куркумы, рыбьего жира, ресвератрола и зеленого чая) вместе с вакциной PVF, выжил через 5 лет после постановки диагноза. Указанные случаи являются доказательством синергетического действия множества противовоспалительных средств в высоких дозах и целенаправленной терапии вакциной.
MRV в случае злокачественной опухоли молочной железы с метастазами в кость
Пациентка К (PtK): В марте 0 года у PtK развились боли в шее и спине, которые персистировали. 28 июля 0 года у нее был диагностирован рак молочной железы на стадии 4 с метастазами в шейный отдел позвоночника, диагноз некурабельного заболевания. Она была подвергнута операции, чтобы удалить два уплотнения молочной железы (подмышечные лимфатические узлы позитивные) и паллиативную лучевую терапию метастазов позвоночника. 18 января 1 года PtK начала лечение дозами антиоксидантов и витамина D, а также НПВС индометицином по 50 мг четыре раза в сутки. Через три дня 21 января 1 года она чала лечение композицией MRV, которая содержит Staphylococcus aureus, наиболее распространенный патоген как молочной железы, так и кости. Хотя не было документов о точной продолжительности периода времени, такое лечение сочетанием MRV/индометицина/антиоксидантов/витамина D было продолжено, пациентка получала достаточную дозу вакцину (20 мл) в течение примерно 2 лет лечения в обычной дозе и с обычной частотой (т.е., три раза в неделю), и PtK утверждала, что она завершила рекомендованный курс лечения дома. Поразительно, что PtK еще была жива при последнем контакте через 13 лет после постановки диагноза метастазирующего рака молочной железы на стадии 4 с метастазами в кость.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественных опухолей молочной железы и кости с применением введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются патогенными при инфекции молочной железы и кости.
В отличие от пациентки К, у пациентки L (PtL) диагностировали рак молочной железы с метастазами в кость 11 октября 0 года. Ей не были назначены НПВС или другие противовоспалительные средства. PtL начала лечение MRV 27 февраля 1 года. Она умерла 9 месяцев спустя 4 ноября 1 года, немного больше чем через один год после постановки диагноза рака молочной железы на стадии 4 с метастазами в кость. Различие во всем остальном между сходными случаями PtK и PtL иллюстрируй потенциально синергетическое лечение противовоспалительными средствами и антигенными композициями согласно изобретению.
MRV с противовоспалительными средствами и без противовоспалительных средств в случае злокачественной опухоли молочной железы с метастазами в кость
Пациентка M (PtM): у PtM диагностировали рак молочной железы на стадии 4 с метастазами в кость 15 июня 0 года. Она начала прием НПВС напросина по 250 мг дважды в сутки на постоянной основе для купирования боли в октябре 3 года она начала принимать дозы антиоксидантов и витамина D. Три месяца спустя 15 января 4 года она начала лечение вакциной MRV (которая содержит Staphylococcus aureus, наиболее распространенный патоген молочной железы и костей) в сочетании с такими противовоспалительными средствами лечения (т.е., напросином, антиоксидантами и витамином D). PtM жила более 9 лет после первой постановки диагноза метастазирующего рака молочной железы на стадии 4 с метастазами в кости, необычно длительная продолжительность жизни, если учесть обычный плохой прогноз, ассоциированный с таким диагнозом.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественных опухолей молочной железы и костей с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются распространенными причинами инфекции молочной железы и костей.
В отличие от PtM пациентка N (PtN): у PtN диагностировали злокачественную опухоль на стадии 4 с метастазами в кость 8 апреля 0 года. Она начала принимать дозы антиоксидантов и витамина D 24 апреля 0 года. Однако перед началом MRV ей было назначено противосвертывающее средство варфарин, ограничивающее добавки витамина Ε и витамина С, двух важных антиоксидантов, которые могут привести к возможным осложнениям в случае применения вместе с варфарином. Кроме того, НПВС нельзя было назначать в данном случае, так как они противопоказаны в случае применения варфарина. 2 июня 1 года PtN начала лечение с использованием MRV. Она умерла 14 месяцев спустя в августе 2 года. В данном контексте возможно, что применение целенаправленной терапии вакциной без синергетического эффекта адъювантных противовоспалительных средств (т.е. НПВС, витамина Ε и терапевтических доз витамина С) ограничивало возможную пользу.
В заключение, в случаях рака молочной железы на стадии 4 с метастазами в кость, подвергаемого лечению с использованием целенаправленной MRV-терапии, подробно описанной выше, применение адъювантных противовоспалительных средств вместе с MRV было ассоциировано со значимо более высокой выживаемостью, намного большей чем выживаемость в двух случаях, когда такие адъювантные противовоспалительные средства не были использованы вместе с вакциной, что является доказательством, свидетельствующем о синергетическом действии.
MRV в случае метастазов в легкие
У пациента О (PtO) в июне 0 года диагностировали рак почек с билатеральными метастазами в легкие и в кость (левое бедро). Такой диагноз обычно считают некурабельным смертельным диагнозом с плохим прогнозом. Он начал лечение с использованием MRV в августе 0 года и продолжал регулярное лечение (три раза в неделю) в течение 16 месяцев (после чего MRV больше не было в наличии). В сентябре 0 года он начал 7-месячное лечение экспериментальным лекарственным средством пегилированным интерфероном альфа-2а. Его левое бедро было «закреплено штифтами» из-за риска перелома в результате метастазов, но из-за хирургических осложнений требовалась ампутация левой ноги ниже середины бедра. В сентябре 2 года у него была удалена злокачественная правая почка. В октябре 2 года ПЭТ-сканирование не выявило признаков злокачественной опухоли в легких и дополнительных признаков метастазов в костях. PtO жив без признаков злокачественной опухоли в легких более 9 лет после диагноза билатеральных легочных метастазов, что является замечательным результатом.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении метастазов в легкое с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются патогенами легких.
MRV в случае метастазов в кости и легкие
У пациента Ρ (PtP) диагностировали рак почек в июле 0 года, и он подвергся удалению правой почки. В декабре 4 года у него развились метастазы в кость (билатерально в бедренные кости) и легкие (билатерально). PtP отказался от обычного лечения и начал лечение MRV в апреле 5 года, которое он продолжал регулярно три раза в неделю в течение 18 месяцев. Состояние здоровья PtP улучшилось, и он возвратился к нормальной ежедневной активности. Рентгеновское исследование и визуализация грудной клетки и бедренных костей не выявили прогрессирования и показывали стабильное заболевание в легких и бедренных костях в течение 18 месяцев, в течение которых PtP был на лечении MRV.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении метастазов в легкое и кость с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые являются распространенными причинами инфекции легких и костей.
MRV в случае метастазов в легкие
У пациентки Q (PtQ) диагностировали рак ободочной кишки с возможными метастазами в легкие в июне 0 года. В это время первичная опухоль ободочной кишки была вырезана, и осталось только несколько метастазов в легких. PtQ начала лечение MRV 11· декабря 0 года, которое она продолжала три раза в неделю в течение 4 месяцев. 19 апреля 1 года после 6 месяцев лечения химиотерапией у нее была проведена операция по удалению только оставшегося видимого поражения легкого, которое было подтверждено как метастазное повреждение. Диагноз рака ободочной кишки с метастазами в легкие имеет плохой прогноз даже в контексте химиотерапии после хирургического удаления видимых метастазов. Несмотря на исходный плохой прогноз PtQ сохраняет прекрасное здоровье без признаков злокачественной опухоли более 10 лет после начального диагноза с метастазами в " легкое и лечения с использованием MRV.
Антигены S. aureus в случае рака молочной железы с метастазами в кость
Пациента R (PtR): В мае 0 года у PtR был диагностирован рак молочной железы с метастазами в грудину, бедренную кость и шейный отдел позвоночника, некурабельная злокачественная опухоль с плохим прогнозом. Ее лечили лучевой терапией и тамоксифеном. В мае 4 года у нее появилась дополнительная область метастазов в поясничном отделе позвоночника, и она начала лечение с использованием мегейса. В ноябре 4 года она начала лечение вакциной (вакцина на основе стафагового лизата), содержащей только Staphylococcus aureus, являющийся наиболее распространенной причиной инфекции как молочной железы, так и костей, и поэтому выбранной в качестве препарата для лечение злокачественной опухоли молочной железы и костей. Она продолжала регулярную терапию такой вакциной в течение 5 лет. Несмотря на диагноз метастазирующего рака молочной железы с множественными метастазами в костях, PtR жила в течение более чем 17 лет, удивительная выживаемость в контексте некурабельного метастазирующего рака молочной железы и свидетельство перспективы применения целенаправленной вакцинной терапии для лечения рака молочной железы.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественных опухолей молочной железы и костей с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются наиболее распространенной причиной инфекции молочной железы и костей.
Такой вариант демонстрирует, что препарат, который содержит антигенные детерминанты только наиболее часто встречающегося патогенного организма или организмов в определенной ткани, может обеспечивать особые преимущества, которые также показаны на основании данных, полученных в мышиной модели, описанных ниже. В соответствии с указанным авторы изобретения обнаружили повышенную эффективность респивакса по сравнению с MRV при лечении злокачественных опухолей, расположенных в легком, что отражает тот факт, что препарат респивакса оказывается несколько более оптимальным, поскольку он содержит более высокие относительные концентрации патогенных видов, которые наиболее часто вызывают инфекцию легких (т.е., 67% количества бактериальных клеток респивакса представлены видами, которые являются наиболее распространенной причиной инфекции легких, тогда как только 30% вакцин MRV состоят из видов, которые являются наиболее распространенной причиной инфекции легких).
В соответствии с приведенными выше результатами один аспект изобретения заключается в получении антигенных композиций так, чтобы антигенные детерминанты микробных патогенов, которые, как известно, являются распространенными причинами инфекции, получили предпочтение с точки зрения доли в препарате, при этом наиболее частая причина инфекции получила бы наибольшее предпочтение. Например, доля антигенных детерминант, которые получены из патогенов, которые, как известно, являются распространенной причиной инфекции, может составлять 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100%.
Соответственно, в некоторых вариантах изобретение относится к антигенным композициям, в которых используют предельное относительное содержание антигенных детерминант, выбранных согласно изобретению, по сравнению с любыми другими антигенными детерминантами в композиции. Например, антигенные композиции могут содержать в себе более чем Х% антигенных детерминант, полученных из патогенного (или часто патогенного или наиболее часто патогенный) вида, где X может означать, например, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95 или 100 (или любое целое число от 10 до 100). Например, по меньшей мере, Х% антигенных детерминант в антигенной композиции могут быть специфичными для микробных патогенов, которые являются патогенными (или часто патогенными, или наиболее часто патогенными) в конкретном органе или ткани пациента, в которых расположена злокачественная опухоль. При использовании альтернативного критерия, общего количества микробных патогенов в антигенной композиции, по меньшей мере, Х% может быть выбрано из микробных патогенов, которые являются патогенными (или часто патогенными или наиболее часто патогенными) в конкретном органе или ткани пациента, в котором расположена злокачественная опухоль. В некоторых вариантах антигенная композиция, соответственно, может состоять по существу из антигенных детерминант одного или нескольких микробных патогенов, каждый из которых является патогенным в конкретном органе или ткани, в которой находится злокачественная опухоль. В выбранных вариантах, антигенная композиция может состоять по существу или полностью из антигенных детерминант микробных патогенов, которые часто являются патогенными в конкретном органе или ткани пациентов, в которых расположена злокачественная опухоль. В следующих выбранных вариантах антигенная композиция может состоять по существу или полностью из антигенных детерминант микробного патогена (или патогенов), которые наиболее часто являются патогенными в конкретном органе или ткани пациентов, в которых расположена злокачественная опухоль.
В контексте различных аспектов изобретения организмы характеризуются частотой, с которой они являются патогенными. В данном контексте изобретение также относится к частоте, с которой эндогенная флора является патогенной. Для ясности в этой связи приведенная в настоящем описании характеристика частоты патогенности, такая как указание «широко патогенный», относится, в общем, к доле инфекции в конкретном органе или ткани, которую обычно приписывают действию конкретного организма, а не к частоте, с которой колонизация ткани организмами переходит в патогенную инфекцию. В Северной Америке большинство инфекций человека, как было выяснено, вызвано эндогенными организмами, даже несмотря на то, что такие организмы обычно присутствуют как часть эндогенной флоры, не вызывая инфекции. Например, хотя S. pneumonia является распространенной причиной инфекции легких (т.е., пневмонии) у человека (и следовательно, названа «широко патогенной» в легком), тем не менее также верно, что S. pneumoniae широко распространена в виде части эндогенной флоры дыхательных путей, не вызывая инфекции, и следовательно, в виде эндогенной колонизации обычно не является патогенной.
MRV в случае множественной миеломы
У пациента S (PtS) диагностировали множественную миелому (стадия 3А) в конце 0 года с множественными поражениями, выявленными при сканировании костей, включая череп, плечевые кости и подвздошную кость. Его лечили стандартной химиотерапией (мелфалан и преднизон) в течение 6 месяцев. Однако в декабре 3 года у него развился патологический перелом правой бедренной кости в результате его болезни, который требовал установки штифтов и локального облучения. 28 апреля 4 года PtS начал лечение MRV, которая содержит Staphylococcus aureus, являющуюся распространенной причиной септицемии, которое он продолжал в течение более чем 13 лет вплоть до тех пор, когда вакцины больше не было в наличии в декабре 17 года. Примечательно, что PtS все еще жив почти 25 лет после диагноза множественной миеломы, действительно экстраординарный результат, учитывая его «летальный» диагноз.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении гематологических злокачественных опухолей с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, вызывают септицемию.
В соответствии с приведенными выше результатами и как показано в историях болезни других пациентов, подробно описанных в настоящей публикации, другой аспект изобретения заклрзчается во введении иммуногенных композиций многократно относительно часто на протяжении относительно длительного периода времени, как описано в других местах настоящей публикации.
PVF в случае рака ободочной кишки с метастазами в печени и брюшных лимфатических узлах
У пациентки Τ (PtT) диагностировали рак ободочной кишки, и ее лечили, вырезая первичную опухоль (и последующей химиотерапией) в сентябре 0 года. Десять месяцев спустя у нее развился метастаз печени, который был хирургически вырезан июле 1 года. PtT чувствовала себя хорошо до июня 7 года, когда у нее повторное заболевание - неоперабельную объемную массу ъ брюшных лимфатических узлах вблизи аорты и позвоночника, обструкцию левого мочеточника, требующую вставления нефростомической трубки. PtT считали смертельно больной и лечили, используя паллиативную лучевую терапию, в октябре 7 года. Она начала лечение PVF 17 ноября 7 года, которое она продолжала через день. PtT жила почти 4 года после постановки диагноза терминального рецидивирующего метастазирующего рака ободочной кишки.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественной опухоли в брюшных лимфатических узлах с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов которые, как известно, вызывают инфекцию в брюшных лимфатических узлах.
MRV в случае метастазов в кожу и промежность
У пациента U (PtU) диагностировали рак ободочной кишки и лечили, вырезав первичную опухоль в ноябре 0 года. У него был диагностирован рак на стадии 4 в июле 2 года с метастазами в промежность (т.е., в мягкие ткани околоанальной/генитальной области) и кожу. Ему была проведена следующая операция по максимальному, насколько это возможно, удалению злокачественной опухоли в промежности (злокачественная опухоль распространилась за границы операционного поля) с последующим облучением и химиотерапией. Единственные известные оставшиеся участки злокачественной опухоли были в коже и промежности. PtU начал лечение MRV, которая содержит Staphylococcus aureus, являющиеся распространенной причиной инфекции кожи и промежности, 25 мая 3 года, которое он продолжал три раза в неделю в течение 5 месяцев. Несмотря на его исходный плохой прогноз PtU находится в прекрасном состоянии здоровья более 10 лет после постановки диагноза рака на стадии 4 с метастазами в промежность и кожу.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественной опухоли кожи и промежности с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются распространенными причинами инфекцию в коже и промежности.
PVF в случае метастазов в брюшину
У пациентки V (PtV) был диагностирован рак молочной железы в мае 0 года, в это время у нее проведена мастэктомия с адъювантной химиотерапией. В январе 12 года у нее развилась боль в животе и асциты, и были диагностированы перитонеальные метастазы, диагноз с плохим прогнозом. 5 августа 12 года PtV начала лечение PVF, которая содержит Е. coli, являющиеся распространенной причиной перитонеальных инфекций, которое о;;а продолжала регулярно в течение 1 года. Маркеры опухоли и асциты уменьшились, и в августе 13 года после одного года лечения PVF у нее была проведена операция на брюшной полости по поводу несвязанного медицинского состояния, при этом хирург не мог найти никаких признаков предыдущей злокачественной опухоли брюшины. PtV прекратила применение вакцины. PtV еще была жива при последнем контакте, через 3 года и 9 месяцев после диагноза терминальных перитонеальных метастазов.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении перитонеальных метастазов с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов которые, как известно, вызывают перитонеальную инфекцию.
PVF в случае рака яичника и таза
У пациентки W (PtW) диагностировали низкодифференцированный рак яичника на стадии 3В в конце 0 года. Ей была проведена операция в ноябре 0 года с удалением левого яичника, но злокачественную опухоль могла быть не полностью вырезана, и поэтому для женщины существовал очень высокий риск рецидива. Она прошла полный курс послеоперационной химиотерапии. Однако на 2 год у нее началось повышение уровня опухолевых маркеров и в январе 3 года у нее диагностирован рецидив в области правого яичника. Ей была проведена операция по удалению объемной образования в правом яичнике в феврале 3 года, но снова злокачественная опухоль могла быть не полностью вырезана, и ей была проведена последующая химиотерапия. Однако снова в декабре 3 года произошел следующий рецидив в области таза, и развилась ретроперитонеальная лимфаденопатия. Она начала лечение вакциной PVF, которая содержит Е. coli, являющуюся причиной инфекцли яичников и таза, 5 января 4 года, которое она продолжала в течение 6 месяцев. Опухолевые маркеры, которые у нее поднялись до 2600, снизились до диапазона в пределах 300. PtW была жива и чувствовала себя очень хорошо при последнем контакте через 2 года и 9 месяцев после постановки диагноза рецидивирующего рака яичника. Заслуживает внимание падение у нее уровня опухолевых маркеров после лечения PVF.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественной опухоли яичника и таза с использованием введения антигенных композиций которые содержат антигенные детерминанты микробных патогенов, которые, как известно, вызывают инфекцию в яичнике и тазовой области.
MRV в случае фолликулярной неходжкинской лимфомы
У пациента Y (PtY) диагностирована фолликулярная неходжкинская лимфома на стадии 4А с обширной выраженной лимфаденопатией (т.е., увеличенными лимфатическим узлами). Он отказался от всего обычного лечения. PtY начал лечение композицией MRV, которая содержит множество патогенов, которые обычно вызывают инфекцию лимфатических узлов головы и шеи, области подмышек, средостения и паховой области. Кроме того, он начал лечение по схеме с использованием множества витаминов/добавок, здоровой диеты и других средств лечения, усиливающих иммунитет.Он продолжал регулярное применение такой вакцины в течение более 3 лет, к этому времени его лимфатические узлы начали уменьшаться в размере и он чувствовал себя хорошо. Такое разрешение лимфаденопатии продолжалось, и визуализация показала почти полное разрешение ранее обширной лимфаденопатии. PtY чувствовал себя хорошо и лимаденопатия не пальпировалась: несомненно удивительное излечение. Через пять лет после его исходного диагноза фолликулярной неходжкинской лимфомы на стадии 4А у PtY не было признаков рецидива, и он перешел к активной и здоровой жизни. Лечение вакциной MRV привело к полной ремиссии фолликулярной неходжкинской лимфомы стадии 4А.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении лимфомы с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются распространенными причинами инфекции лимфатических узлов в области, в которой локализована лимфома.
PVF в случае рака ободочной кишки с метастазами в печень и почки
У пациента Ζ (PtZ) диагностировано метастазирование ранее подвергаемого лечению рака ободочной кишки с метастазами в печень и возможными другими метастазами в обе почки. Метастазы в печени были вырезаны. Прогноз для данной стадии (т.е., стадии 4) рака ободочной кишки плохой, и польза от дальнейшего обычного лечения (т.е., химиотерапии) ограничена. PtZ отказался от химиотерапии с самого начала. Через три месяца после диагноза метастазирующего рака ободочной кишки PtZ начал лечение Polyvaccinum Forte (PVF), которая содержит Ε. coli, являющуюся распространенной причиной инфекции ободочной кишки, печени и почек. Дополнительно PtZ начал лечение по схеме с использованием множества витаминов/добавок и здоровой диеты. Он продолжал регулярное применение такой вакцины и схемы приема витаминов и добавок, и начал химиотерапию. Хотя общее течение заболеванкя медленно прогрессировало, с развитием метастазов легкого и рецидива метастазов в печень через 28 месяцев после начального диагноза метастазирующего заболевания у него была стабильная масса и хороший уровень энергии. Через три года (36 месяцев) после диагноза рака ободочной кишки 4 стадии PtZ чувствовал себя хорошо, за исключением тошноты и умеренной потери массы, связанных с химиотерапией.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественной опухолие ободочной кишки, печени и почек с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются патогенными в ободочной кишке, печени и почках.
PVF в случае рака ободочной кишки с метастазами в печень, лимфатические узлы ворот печени и легкое
У пациента АА (PtAA) диагностирован метастазирующий рак ободочной кишки с метастазами в печень, лимфатические узлы ворот печени и легкие. Прогноз для такой стадии (т.е., стадии 4) рака ободочной кишки очень плохой (т.е. «терминальная» злокачественная опухоль), и польза от обычного лечения (т.е., химиотерапии) ограничена. PtAA начал химиотерапию, но прервал лечение примерно через 5 месяцев после постановки диагноза из-за побочных эффектов, в это время он начал лечение с использованием Polyvaccinum Forte (содержащей виды бактерий, которые вызывают инфекцию в ободочной кишке, печени, брюшных лимфатических узлах и легких) через день, а также схему с использованием множества витаминов/добавок и здоровой диеты. Последующее КТ-сканирование PtAA показало, что некротические лимфатические узлы ворот печени не изменились в размере со времени постановки диагноза, и не было изменений в размере метастазов в легких, хотя два метастаза печени немного увеличились в размере (от 3,4 см до 4,5 см и от 1,2 см до 3,0 см). Несмотря на очень плохой прогноз PtAA продолжал чувствовать себя довольно хорошо почти через год после постановки диагноза терминальной злокачественной опухоли.
В соответствии с приведенными выше результатами один аспект изобретения заключается в лечении злокачественной опухоли ободочной кишки, печени, брюшных лимфатических узлов и легких с использованием введения антигенных композиций, которые содержат антигенные детерминанты микробных патогенов, которые, как известно, являются патогенными в ободочной кишке, печени, брюшных лимфатических узлах и легких.
ПРИМЕР 3: Микробные патогены
В альтернативных аспектах в изобретении использованы микробные антигены, такие как бактериальные или вирусные антигены, для получения антигенных композиций, при этом виды микроорганизмов выбраны на основе ткани или органа, в котором микроорганизм, как известно, вызывает инфекции. Бактериальная резидентная флора представлена наиболее распространенными бактериальными патогенами, являющихся причиной подавляющего большинства бактериальных инфекций у большинства животных, включая человека. Резидентная флора может, например, инфицировать посредством первичной адгезии или адгезии и инвазии после повреждения слизистой оболочки, в результате, например, повреждения сосудов, травмы, химического инсульта или повреждения в результате первичной инфекции.
В случае микробных патогенов вирулентность и инфекционной потенциал является сочетанием способности микроорганизма к адгезии, способности продуцировать ферменты, выживать 'при действии иммунологических продуктов (комплемента, антитела) и выживать в условиях микробиоцидной активности макрофагов и нейтрофилов. Некоторые бактерии, включая эндогенные бактерии, могут быть достаточно вирулентными для того, чтобы вызвать мономикробные инфекции, тогда как другие являются более эффективными в случае синергии при полимикробной инфекции. В общем, часто невозможно точно определить конкретную роль отдельных микроорганизмов в условиях смешанной инфекции. Так как острая инфекция в некоторых случаях может обеспечивать более оптимальную иммунную стимуляцию, то, соответственно, в некоторых вариантах в изобретении используют виды микроорганизмов, которые вовлечены в острую инфекцию.
В некоторых вариантах бактерии, которые являются представителями эндогенной флоры конкретной области, могут быть использованы для получения антигенных композиций согласно изобретению. В рядах в таблице 6 указаны некоторые виды бактерий и биологические области, в которых каждый вид может образовывать часть эндогенной флоры. Например, виды Abiotrophia обычно являются представителями эндогенной флоры дыхательных путей и ротовой полости.













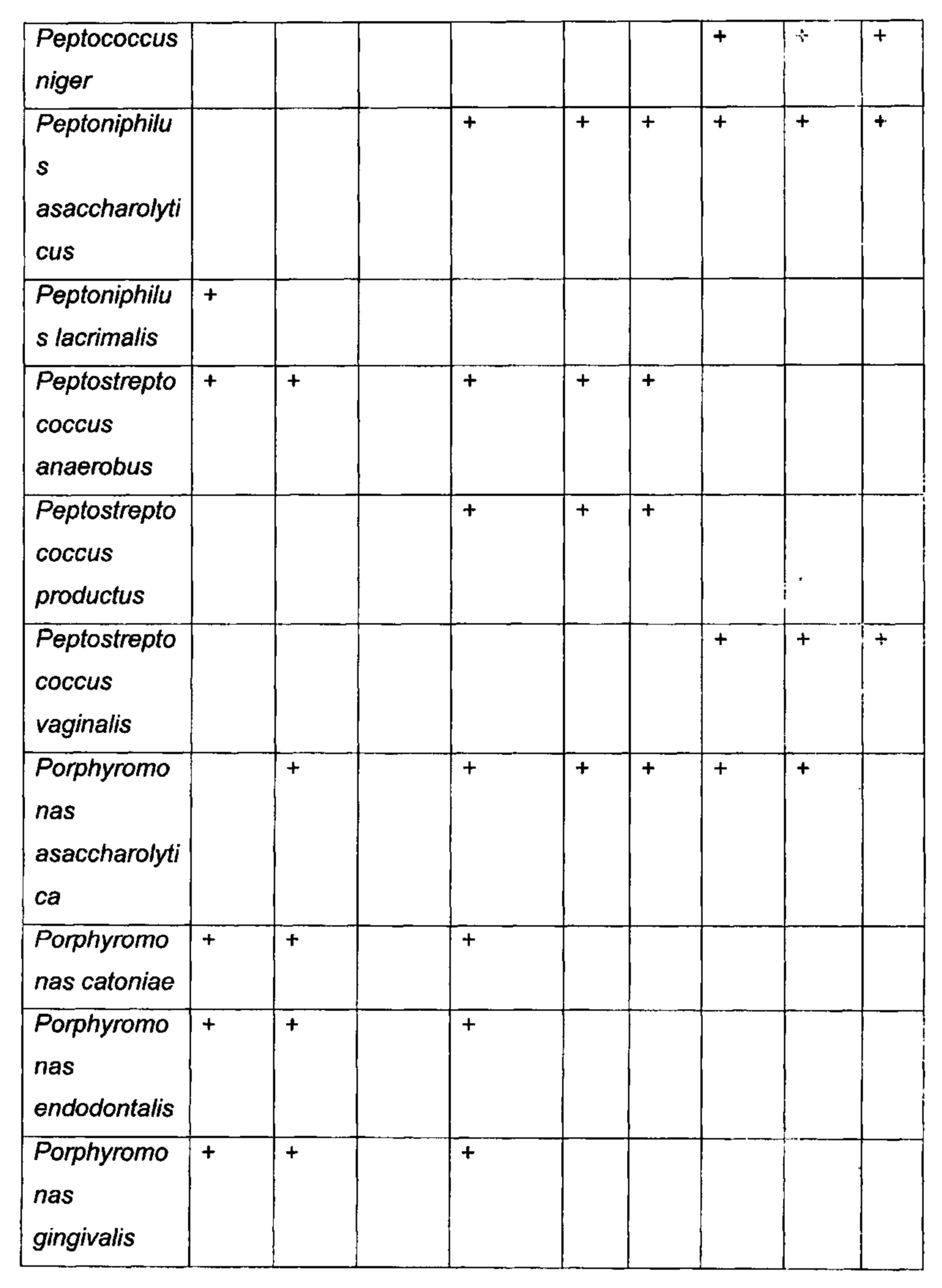


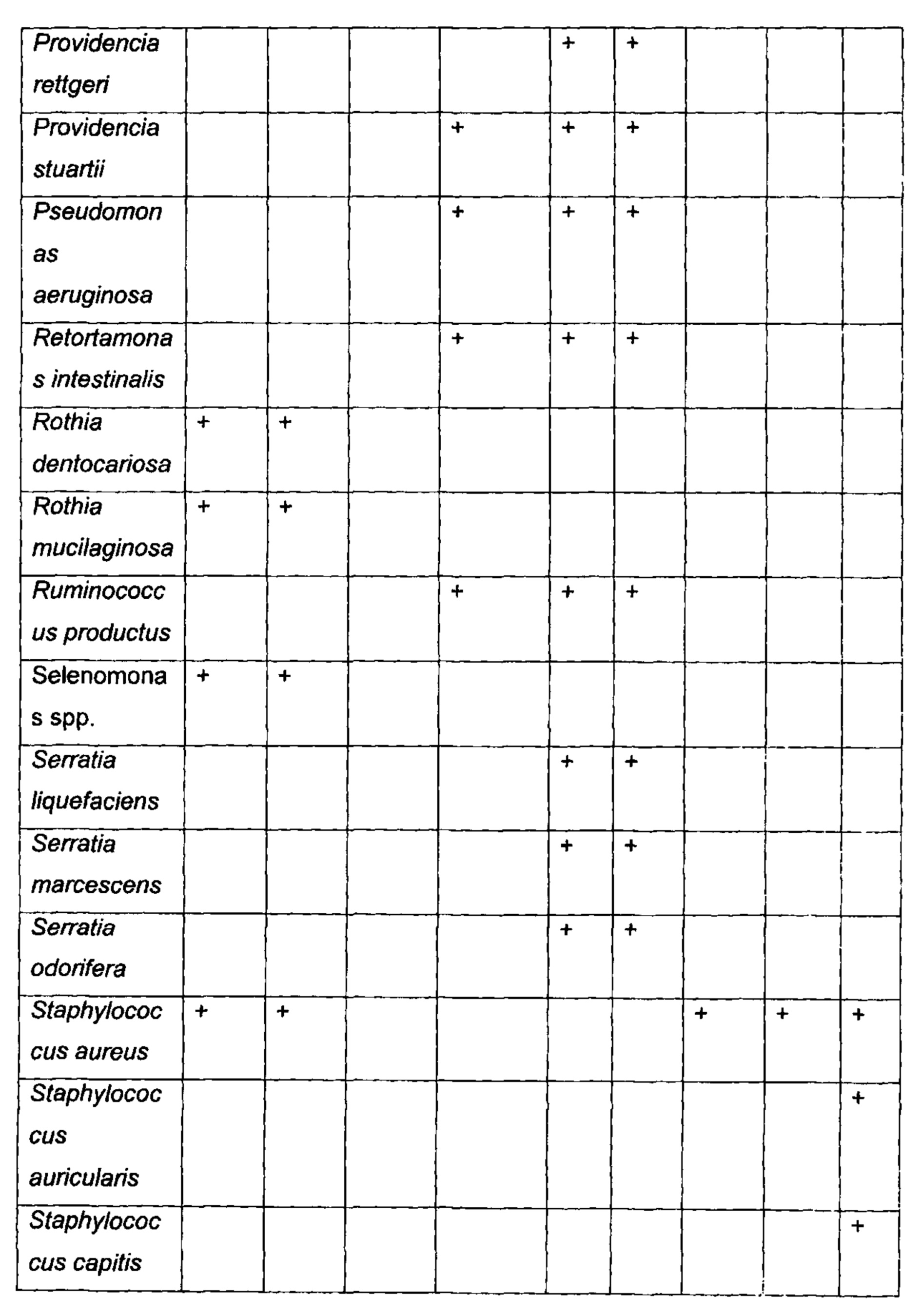



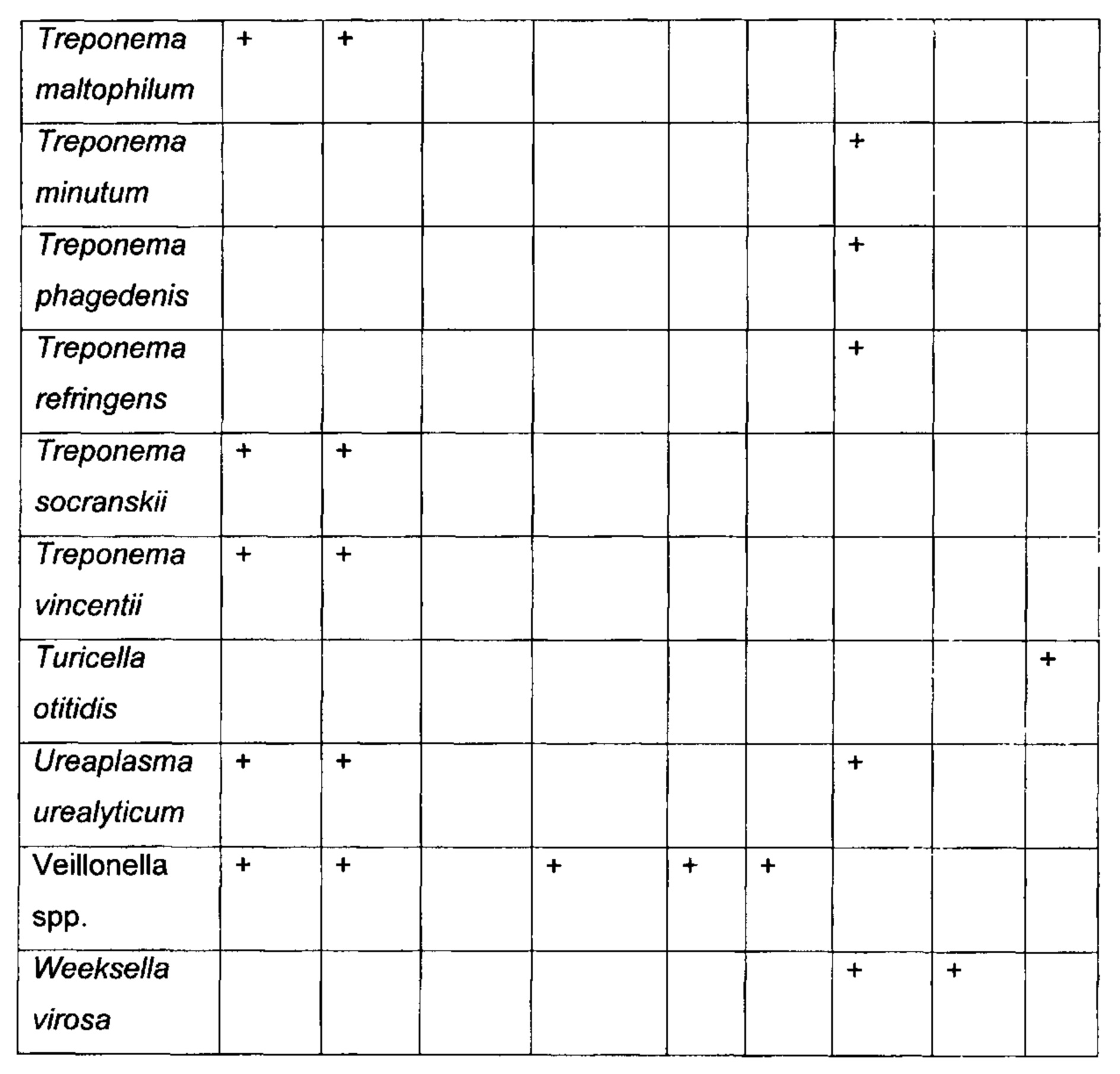
Эндогенная микробная флора, такая как бактерии, имеет доступ в ткани в случае патогенеза либо посредством основанно-ос на принципе смежности распространения, либо посредством бактериемического распространения. В благоприятных условиях все эндогенные организмы могут стать патогенными и локально проникать и распространяться в результате основанного на принципе смежности распространения в соседние ткани и органы. Эндогенная бактериальная флора кожи, ротовой полости и ободочной кишки представлена видами, которые, как выяснено, также подвержены бактериемическому распространению. Следовательно, бактерии, которые являются представителями конкретного домена эндогенной флоры, могут вызывать инфекцию в тканях или органах, в которые такие бактерии могут распространяться. Соответственно, один аспект изобретения заключается в применении эндогенных микробных патогенов для лечения злокачественной опухоли ткани или органа, в которые эндогенные бактерии могут распространяться, вызывая инфекцию. В колонках таблицы 7 перечислены 9 доменов эндогенной флоры: кожа, дыхательная система, половые органы, мочеполовая система, ротовая полость, желудок, двенадцатиперстная кишка/тощая кишка, подвздошная кишка и ободочная кишка. В рядах таблицы 7 перечислены органы и ткани, в которых могут быть расположены злокачественные опухоли. Соответственно, один аспект изобретения заключается в применении эндогенных микробных патогенов для получения антигенных композиций, или подбора существующих препаратов, содержащих патогены, для лечения злокачественных опухолей, расположенных в тканях или органах, в которые патоген может распространиться, вызывая инфекцию. Соответственно, в альтернативных вариантах опухоли, расположенные в тканях или органах, перечисленных в первой колонке таблицы 7, можно лечить антигенными композициями, содержащими антигенные детерминанты, которые являются специфичными для микробных патогенов, которые являются представителями эндогенной флоры одного или нескольких доменов эндогенной флоры, перечисленных в первом ряду таблицы 7, и обозначенных X или галочкой в соответствующем ряду. Например, опухоли, расположенные в простате, можно лечить антигенной композицией, содержащей антигенные детерминанты, специфичные для микробного патогена или патогенов, эндогенных для мочеполовой системы и/или половой системы. Некоторые виды бактерий, которые являются эндогенными для доменов эндогенной флоры, перечисленных в таблице 7, указаны с соответствующими доменами эндогенной флоры в таблице 6. Соответственно, один аспект изобретения заключается в лечении злокачественной опухоли, расположенной в ткани, указанной в таблице 7, антигенной композицией, содержащей антигенные детерминанты видов бактерий, которые перечислены в таблице 6, при этом области эндогенной флоры, связанные с местом опухоли в таблице 7, совпадают с областями эндогенной флоры, связанными с видами бактерий в таблице 6.
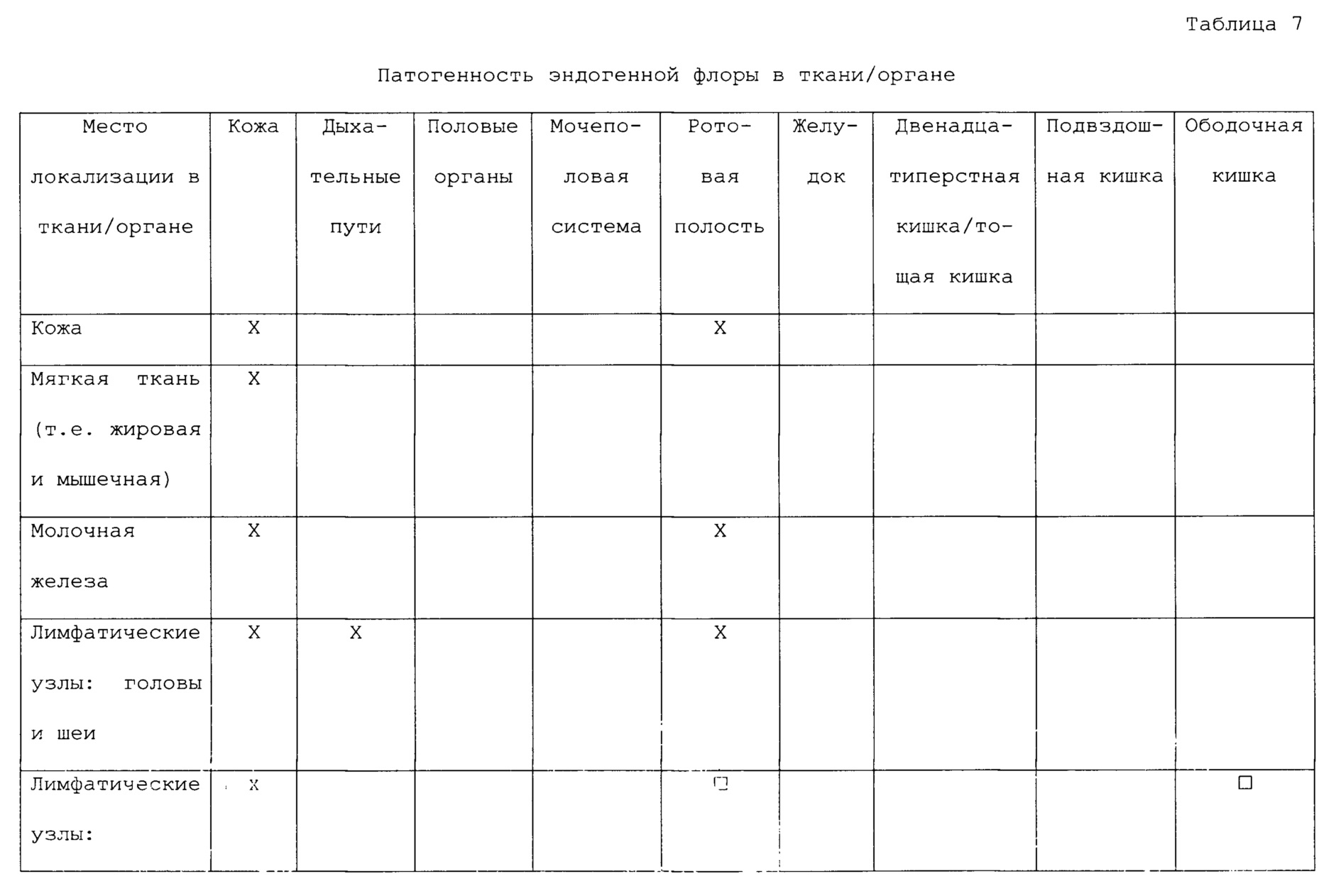
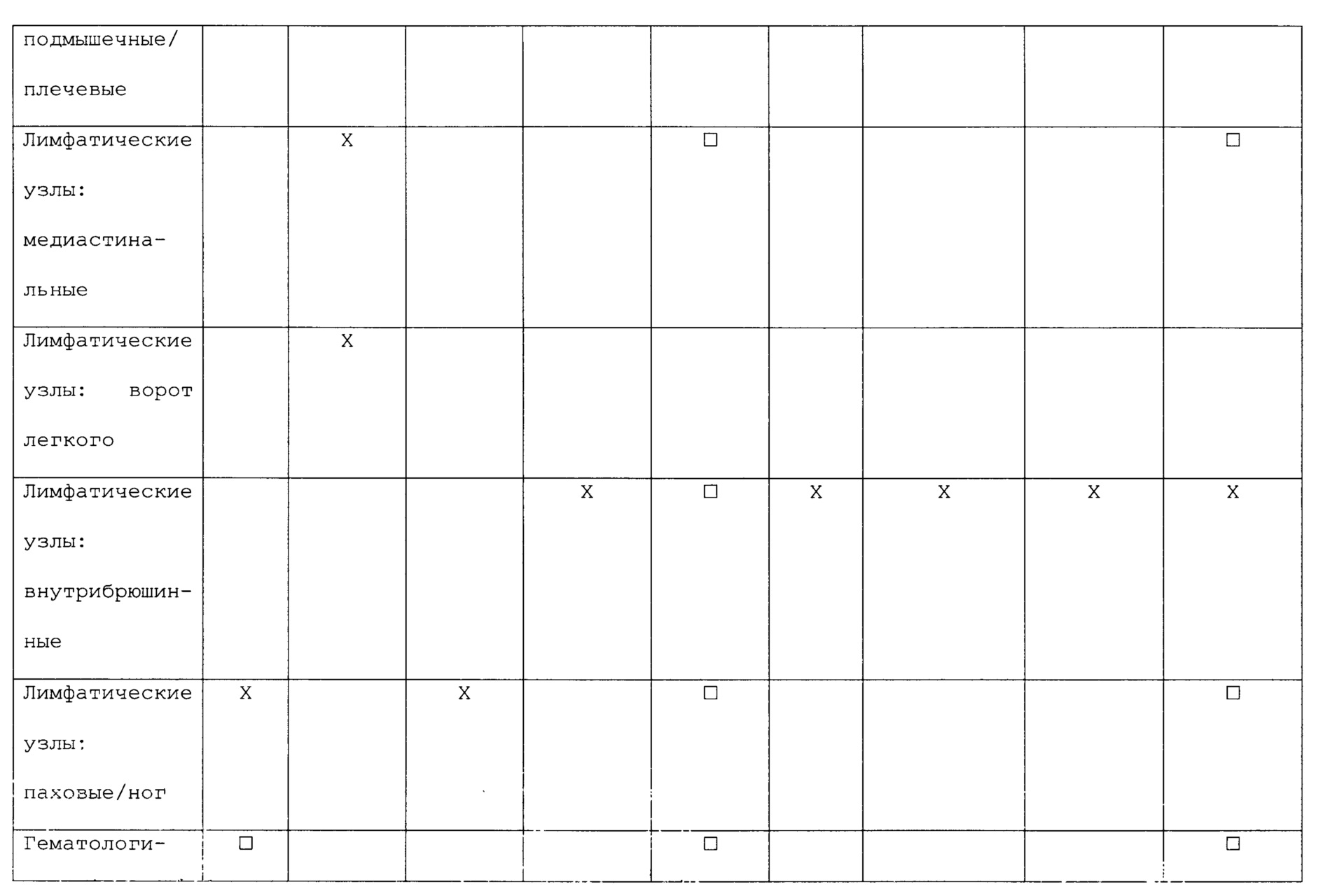
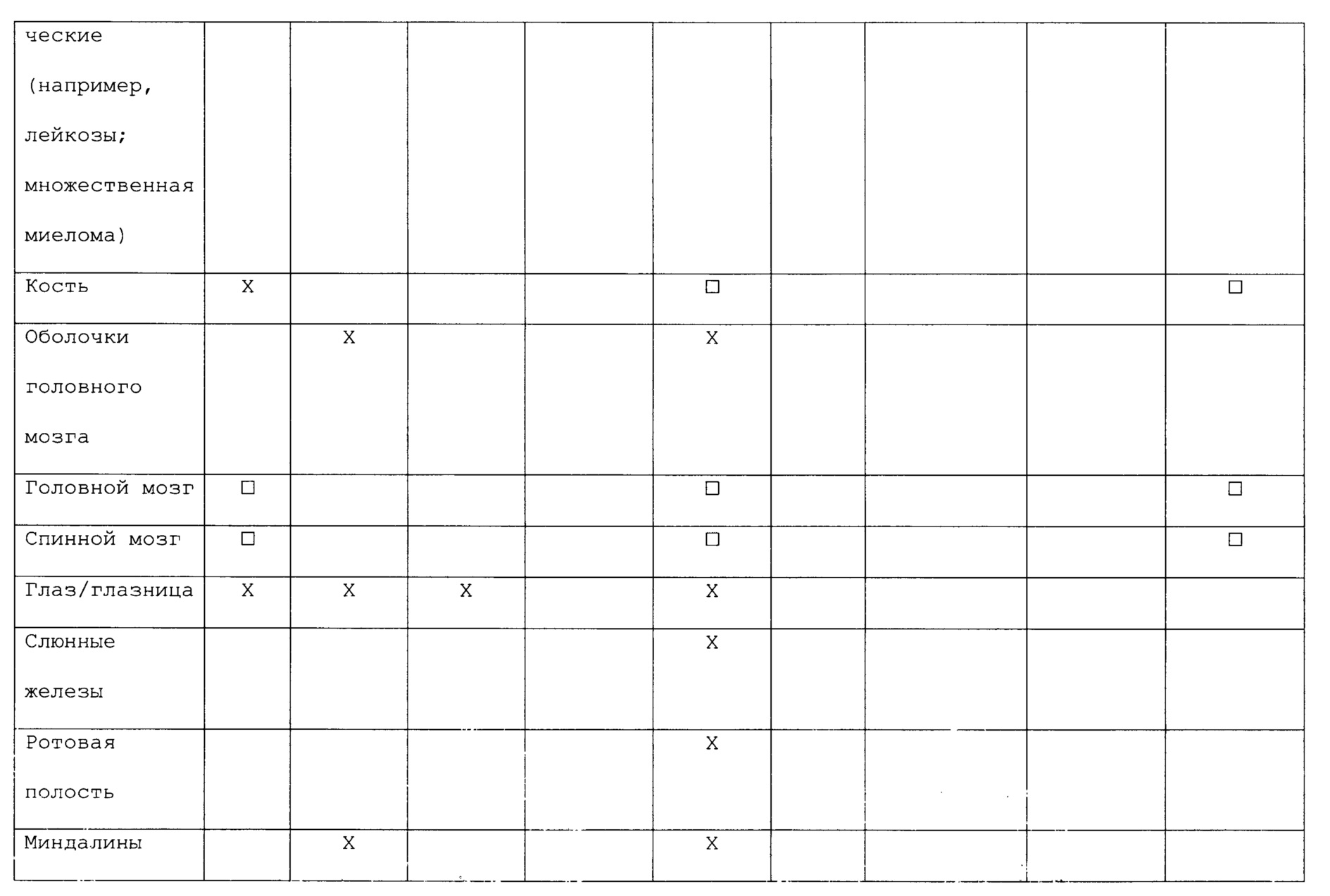

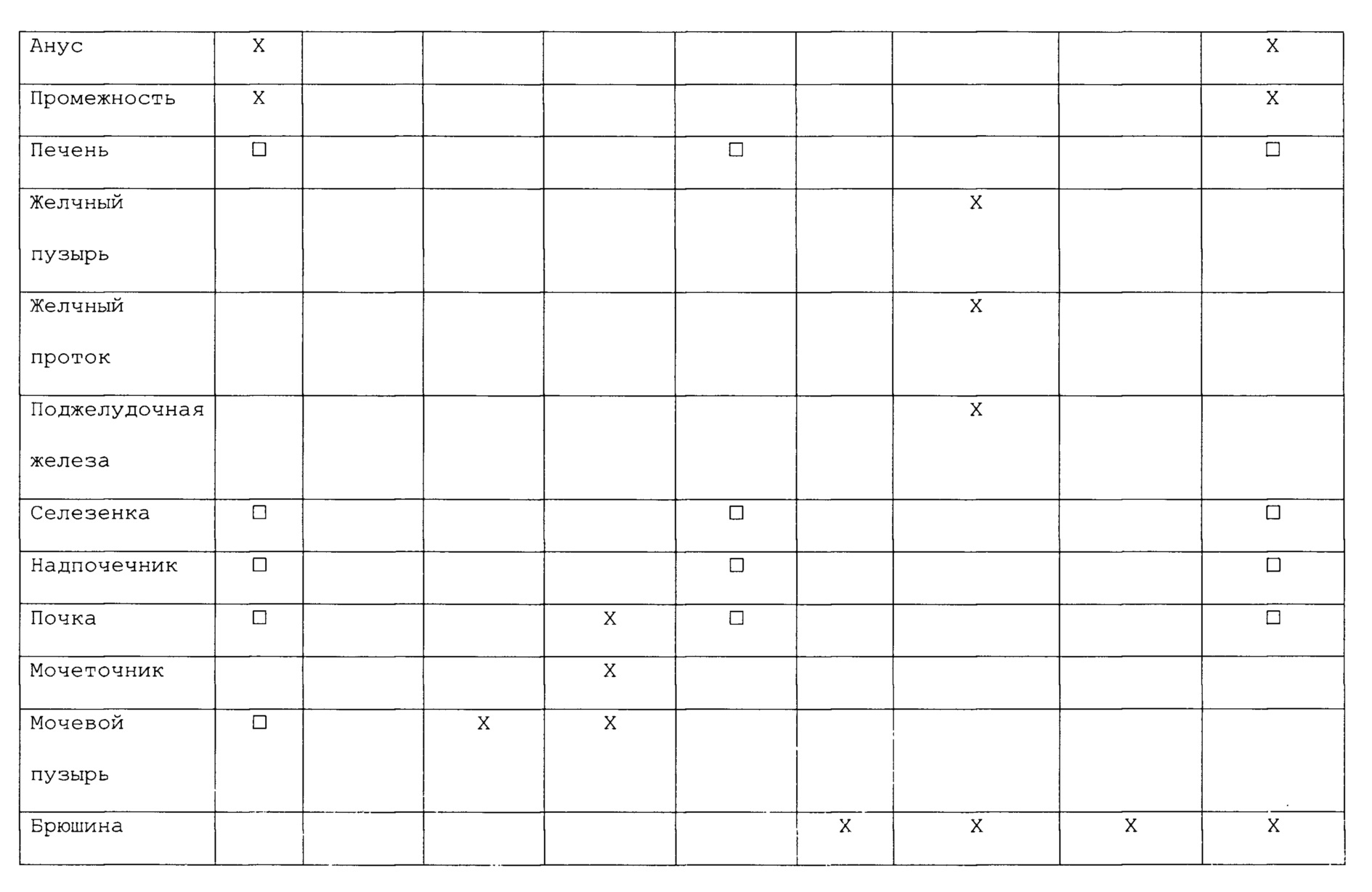

В соответствии с суммарной информацией, приведенной ь таблицах 6 и 7 злокачественные опухоли, локализованные в тканях или органах, указанных в колонке 1 таблицы 7, можно лечить антигенными композициями, содержащими антигенные детерминанты соответствующих видов бактерий, указанных в таблице 6, так что заголовки колонок в таблице 7 по сути заменимы названиями видов бактерий, указанными в таблице 6.
В некоторых вариантах микробные патогены для применения в изобретении могут быть экзогенными бактериальными патогенами. Например, организмы, перечисленные в таблице 8, можно использовать в качестве микробных патогенов для получения антигенных композиций, или антигенные композиции, содержащие такие патогены, могут быть выбраны для применения при лечении злокачественных опухолей, расположенных в тканях или органах, указанных с соответствующим организмом в таблице 8. В некоторых вариантах антигенные детерминанты как эндогенных, так и экзогенных видов бактерий, мишенью которых является конкретный ткань или орган, можно использовать в сочетании. Например, антигенную композицию, полученную или специфичную для Clostridium difficile, можно использовать для лечения злокачественной опухоли, расположенной в ободочной кишке.
В некоторых вариантах микробные патогены для применения в изобретении могут быть вирусными патогенами. В таблице 9 представлен примерный список вирусных патогенов вместе с местами локализации в тканях и органах, для которых каждый вид вируса по имеющимся сообщениям является патогеном. Соответственно, один аспект изобретения заключается в применении иммуногенных композиций, которые являются специфичными для названных вирусов для лечения злокачественной опухоли, расположенной в органах или тканях, которые указаны вблизи названия вируса в таблице 9. Например, антигенную композицию, полученную из, или специфичную для вируса вакцинии, можно применять для лечения злокачественной опухоли, расположенной в коже, гематологических тканях, лимфатических узлах, головном мозге, спинном мозге, глазе или сердце.
Суммарная информация, приведенная в таблицах 6-9, дает широкую идентификацию микробных патогенов, которые можно использовать для получения препаратов антигенных композиций согласно изобретению, наряду с указанием тканей или органов, в которых такие организмы являются патогенными, и соответственно указаны ткани и органы, в которых расположена злокачественная, которую можно лечить антигенным препаратом.
В некоторых вариантах микробный патоген, выбранный для применения в антигенных композициях согласно изобретению, может представлять собой патоген, который является распространенной причиной острой инфекции в ткани или органе, в котором находится злокачественная опухоль, подвергаемая лечению. В таблице 10 указаны бактериальные и вирусные патогены такого рода вместе с тканями и органами, в которых они обычно вызывают инфекцию. Соответственно, в выбранных вариантах злокачественную опухоль, находящуюся в ткани, указанной в первой колонке таблицы 10, можно лечить антигенной композицией, которая содержит антигенные детерминанты одного или нескольких патогенных организмов, перечисленных во второй колонке таблицы 10. Например, злокачественную опухоль, находящуюся в коже, можно лечить антигенной композицией, содержащей антигенные детерминанты одного или нескольких из следующих организмов: Staphylococcus aureus, бета-гемолитических стрептококков группы А, В, С и G, Corynebacterium diptheriae, Corynebacterium ulcerans, Pseudomonas aeruginosa, вируса кори, краснухи, ветряной оспы, эховирусов, вирусов Коксаки, аденовируса, вируса вакцинии, вируса простого герпеса или парвовируса В19.














В выбранных вариантах конкретные микробные патогены могут быть подходящими для лечения конкретных злокачественных опухолей, примеры выбранных вариантов указаны в таблице 10. Приведенные варианты являются иллюстративным, а не исчерпывающим списком альтернативных препаратов для применения согласно изобретению.
Конкретные микроорганизмы, которые обычно вызывают инфекцию в конкретной ткани или органе, могут варьировать по своему географическому положению. Например, Mycobacterium tuberculosis является более распространенной причиной инфекции легких в некоторых географических областях и популяциях, чем в других, и поэтому, хотя М. tuberculosis может не быть распространенным патогеном легких в некоторых географических и популяционных группах, указанная бактерия может быть распространенным патогеном легких в других группах. Таким образом, таблица 10 не является исчерпывающим списком патогенов, распространенных во всех географических областях и популяционных группах. Понятно, что клинический морфолог, являющийся специалистом в данной области, может определить распространенные патогенные виды в конкретной географической области или популяционной группе для конкретного места локализации в ткани или органе согласно изобретению. Для применения в ветеринарии конечно будут конкретные патогены, которые распространены в выбранных тканях выбранного вида, и они также могут варьировать в зависимости от географической области.
В выбранных вариантах изобретение относится к диагностическим стадиям для оценки предыдущего воздействия микробных патогенов на пациента. Например, диагностические стадии могут включать получение истории болезни пациента в отношении воздействия выбранных патогенов и/или оценку иммунного ответа пациента на выбранный патоген. Например, можно провести серологический тест, чтобы выявить антитела к выбранным патогенам в сыворотке пациента. В связи с данным аспектом изобретения могут быть отобраны антигенные детерминанты выбранного микробного патогена для применения в иммуногенной композиции для выбранного пациента на основе диагностического показателя того, что пациент один или несколько раз ранее подвергался воздействию(ям) патогена, например, на основании присутствия антител к антигенным детерминантам данного патогена в сыворотке пациента.
В следующих выбранных вариантах изобретение относится к диагностическим стадиям для оценки иммунологического ответа пациента на лечение выбранной иммуногенной композицией. Например, диагностические стадии могут включать в себя оценку иммунного ответа пациента на антигенные детерминанты данной иммуногенной композиции, например, с использованием серологического теста, чтобы выявить антитела к таким антигенным детерминантам. В связи с данным аспектом изобретения лечение выбранной иммуногенной композицией можно продолжать, если оценка показывает, что имеет место активный иммунологический ответ на антигенные детерминанты данной композиции, и лечение вакциной может быть прекращено и может быть начато альтернативное лечение другой иммуногенной композицией, если оценка показывает, что нет достаточно активного иммунологического ответа на антигенные детерминанты иммуногенной композиции.
Как обсуждается в контексте пациента R, в выбранных вариантах микробный патоген, выбранный для применения в антигенных композициях согласно изобретению, может представлять собой патоген, который является наиболее распространенной причиной острой инфекции в ткани или органе, в которых находится злокачественная опухоль, подвергаемая лечению, который может обеспечить конкретную пользу, как показано в случае пациектй R. Например, в случае лечения рака костей выбранным видом бактерий может быть Staphylococcus aureus; для лечения злокачественной опухоли в ткани легкого может быть выбран Streptococcus pneumoniae; для лечения рака молочной железы может быть выбран Staphylococcus aureus; для лечения рака почек или мочевого пузыря может быть выбран вид Escherichia coli; и для лечения рака ободочной кишки выбранном видом бактерий может быть Escherichia coli. Понятно, что клинический морфолог, специалист в данной области, может определить наиболее часто встречающиеся патогенные виды, бактериальные или вирусные, для каждой конкретной ткани или органа согласно изобретению. В выбранных вариантах только антигенные детерминанты наиболее распространенного патогена в конкретной ткани или органе можно использовать для лечения злокачественных опухолей в такой ткани или органе. В альтернативных вариантах антигенные детерминанты наиболее распространенного патогена для конкретной ткани или органа можно использовать в сочетании с антигенными детерминантами других патогенов, которые, как известно, являются патогенными в данной конкретной ткани или органе, предпочтительно выбирая из более распространенных патогенов.
В некоторых вариантах изобретение относится к антигенным композициям, в которых используют предельную относительное содержание выбранных антигенных детерминант согласно изобретению, по сравнению с любыми другими антигенными детерминантами в композиции. Например, антигенные композиции могут содержать в себе более чем Х% антигенных детерминант, полученных из патогенного (или часто патогенного или наиболее часто патогенного) вида, где X может означать, например, 10, 30, 40, 50, 60, 70, 80, 90, 95 или 100 (или любое целое число от 10 до 100). Например, по меньшей мере, Х% антигенных детерминант в антигенной композиции могут быть специфичными для микробных патогенов, которые являются патогенными (или часто патогенными, или наиболее часто патогенными) в конкретном органе или ткани пациента, в которых расположена злокачественная опухоль. При использовании альтернативного критерия, общего количества микробных патогенов в антигенной композиции, по меньшей мере, Х% может быть выбрано из микробных патогенов, которые являются патогенными (или часто патогенными или наиболее часто патогенными) в конкретном органе или ткани пациента, в котором расположена злокачественная опухоль. В некоторых вариантах антигенная композиция, соответственно, может состоять по существу из антигенных детерминант одного или нескольких микробных патогенов, каждый из которых является патогенным (или часто патогенным или наиболее часто патогенным) в конкретном органе или ткани, в которой находится злокачественная опухоль. Следующие данные иллюстрируют неожиданную эффективность таких выбранных препаратов:
(1) Обнаружено, что применение MRV (которая содержит множество распространенных патогенов дыхательных путей и Staphylococcus aureus, наиболее распространенный патоген как молочной железы, так и кости) полезно для лечения рака молочной железы с метастазами в кость (смотри фигуру 6). Однако польза в отношении выживаемости (выживаемость пациентов, которых лечили с использованием MRV, по сравнению с пациентами, которых не лечили такой вакциной) была небольшой (т.е., медианная выживаемость 31 месяц для пациентов, которых лечили вакциной, по сравнению с 26 месяцами для пациентов, которых не лечили вакциной). С другой стороны, у одного пациента (пациента R), которого лечили вакциной, специфично направленной против рака молочной железы и рака костей (т.е., содержащей только Staphylococcus aureus, несомненно являющихся наиболее распространенной причиной инфекции и молочной железы и костей) наблюдали необычную пользу в отношении выживаемости, при этом пациент живет в течение более чем 17 лет.Включение в MRV других видов бактерий, которые не являются (или менее часто являются) причиной инфекции костей и часто вызывают инфекцию в других местах (т.е., в дыхательных путях), по-видимому, существенно снижает пользу такой вакцины для лечения злокачественной опухоли молочной железы и кости.
(2) Выживаемость пациентов с раком легкого на стадии 3В, которых лечили респиваксом™ (т.е., медианная выживаемость 38 месяцев и 40% 5-летняя выживаемость) была значимо выше, чем выживаемость пациентов с раком легкого на стадии 3В, которых лечили с использованием MRV (т.е., медианная выживаемость 18 месяцев и 14% 5-летняя выживаемость). Респивакс™ содержит значительно более высокие относительные концентрации видов бактерий, которые обычно вызывают инфекцию легких, чем MRV. 67% общего количества клеток бактерий в респиваксе™ представлены видами бактерий, которые являются распространенными причинами инфекции легких, тогда как только 30% общего количества клеток бактерий в MRV представлены видами бактерий, которые являются распространенными причинами инфекции легких. Таким образом, показано, что, композиция, содержащая большую долю бактерий, которые наиболее часто вызывают инфекции легких, респивакс™, является более эффективной для лечения рака легкого, чем препарат MRV.
(3) Выживаемость пациентов с раком ободочной кишки на стадии 4, которых лечили с использованием MRV (которая не содержит никаких патогенов ободочной кишки), была хуже, чем пациентов, которых не лечили вакциной. Такой результат свидетельствует о том, что лечение с применением антигенных детерминант, которые не получены из микроорганизмов, которые являются патогенными в органе или ткани, в которой находится злокачественная опухоль, может быть не только неэффективным, но также может быть вредным.
(4) Исследования на мышах, описанные ниже, и, в частности, данные, полученные в модели на злокачественных клетках, в которых использовали лечение только антигенными детерминантами Klebsiella pneumoniae, по сравнению с лечением антигенами Klebsiella pneumoniae вместе с дополнительными антигенами.
Данные, приведенные в настоящем описании, соответственно являются доказательством постепенного возрастания пользы при переходе от патогенных к часто патогенным и к наиболее часто патогенным организмам при лечении злокачественной опухоли в конкретном органе или ткани с применением целенаправленных антигенных композиций, которые получены из микробных патогенов, которые являются патогенными в таком конкретном органе или ткани.
В некоторых вариантах изобретение относится к применению бактериальных или вирусных вакцин, которые одобрены для других целей (например, вакцины от полиомиелита, вакцины на основе Н. influenza, менингококковой вакцины, пневмококковой вакцины, вакцины против вируса гриппа, вакцины против гепатита В, вакцины против гепатита А, противодифтерийной.вакцины, противостолбнячной вакцины, вакцины против коклюша, противокоревой вакцины, вакцины против эпидемического паротита, вакцины против краснухи, вакцины против ветряной оспы, вакцины БЦЖ, холерной вакцины, вакцины против японского энцефалита, вакцины против бешенства, тифозной вакцины, вакцины против желтой лихорадки, вакцины против натуральной оспы и т.д.) для использования в качестве средств лечения злокачественной опухоли, посредством выбора вакцины, содержащей патоген (или антигенный компонент патогена), который является патогенным в конкретном органе или ткани пациента, в которых находится злокачественная опухоль, обращаясь к данным, представленным в таблицах 6-10. Например, вакцина на основе S. pneumoniae, либо вакцина, содержащая целые клетки, либо вакцина, состоящая из одного или нескольких антигенных компонентов S. pneumoniae (например, 23-валентный пневмококковый полисахарид), может быть использована для лечения злокачественной опухоли в любом из следующих мест локализации, в которых S. pneumoniae, как указано в таблице 10, является распространенным патогеном: лимфатические узлы ворот легкого, гематологические злокачественные опухоли, кость, оболочки головного мозга, спинной мозг, глаз/глазница, носовая пазуха, щитовидная железа, бронхи, легкие, плевра или брюшина. В качестве следующего примера, вакцину гепатита В можно использовать для лечения злокачественной опухоли в любом из следующих мест локализации, в которых, как указано в таблице 9, вирус гепатита В является патогеном: печени, поджелудочной железе или гематологических злокачественных опухолях.
В некоторых вариантах выбранные композиции и способы специально исключены из объема изобретения. Например, применение следующих микробных патогенов при лечении следующих злокачественных опухолей исключены из некоторых вариантов, так что заявленное изобретение может распространяться на конкретные варианты с исключением одного или нескольких из следующих компонентов:
a) БЦЖ (Mycobacterium bovis) для лечения рака желудка и рака ободочной кишки, например, путем инъекции;
b) Mycobacterium w для лечения рака легкого, например, путем инъекции;
c) Mycobacterium vaccae для лечения немелкоклеточного para легкого, например, путем инъекции;
d) Corynebacterium parvum для лечения меланомы, например, путем инъекции;
e) Streptococcus pyogenes для лечения рака желудка, например, путем инъекции;
f) Nocardia rubra для лечения рака легкого или острого миелогенного лейкоза, например, путем инъекции;
g) Lactobacillus casei для лечения рака шейки матки, например, путем инъекции;
h) Pseudomonas aeruginosa для лечения лимфомы и рака легкого, например, путем инъекции;
i) вируса вакцинии для лечения меланомы, например, путем инъекции;
j) вируса бешенства для лечения меланомы, например, путем инъекции;
k) композиции, состоящей из объединенных антигенов следующих видов бактерий, для ветеринарного лечения (или альтернативно для лечения человека), например, путем перорального введения, в случае первичных (или, альтернативно, метастазирующих) злокачественных опухолей, расположенных в легком: Streptococcus pneumoniae; Neisseria catarrhalis; Streptococcus pyogenes; Haemophilus influenza; Staphylococcus aureus; Klebsiella pneumoniae.
l) композиции, состоящей из объединенных антигенов следующих видов бактерий для ветеринарного лечения (или, альтернативно, для лечения человека), например, путем перорального введения, в случае первичных (или, альтернативно, метастазирующих) злокачественных опухолей, расположенных в легком: Streptococcus pneumoniae; Neisseria catarrhalis; Streptococcus pyogenes; Haemophilus influenza; Staphylococcus aureus; Klebsiella pneumoniae; Klebsiella ozaenae; Streptocbccus viridans.
ПРИМЕР 4: Исследования на мышах
В следующих исследованиях на мышах использовали следующие материалы: PBS (Gibco) и самок мышей C57BL/6 7-недельного возраста.
Пример 4А: Рак легкого
Настоящий раздел относится к мышиной модели карциномы легких Льюис. В данном эксперименте использовали следующие бактериальные вакцины: вакцина Streptococcus pneumoniae [клетки и бульон] (партия № J049-1 [2×109]; вакцина Klebsiella pneumoniae [клетки и бульон] (партия № J046-1 [2×109]; вакцина Staphylococcus aureus [клетки и бульон] (партия № J041-2 [10×109]; вакцина Escherichia coli (изолят ободочной кишки) [клетки и бульон] (партия № J047-1 [6×109]; вакцина Salmonella enterica [клетки и бульон] (партия № J31 [15×109]; вакцина Klebsiella pneumoniae [только клетки] (партия № J048-1 [2×109]; и только среда (среда Klebsiella pneumoniae) (партия № J046-1). Мышей лечили в соответствии с экспериментальными группами, определенными в таблице 11.
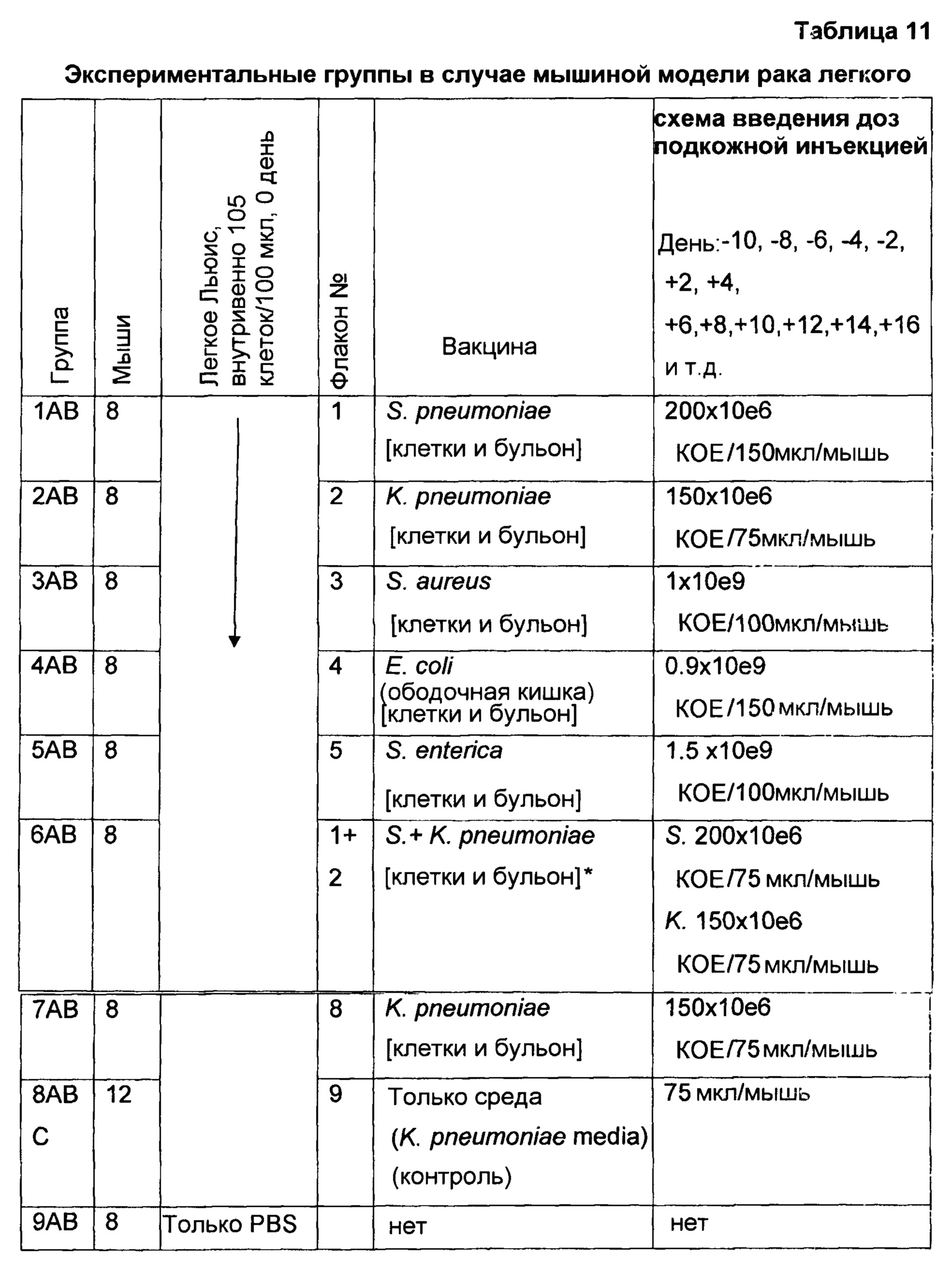
В частности, группы мышей предварительно обрабатывали подкожно бактериальными вакцинами в -10, -8, -6, -4 и -2 дни. В 0 день мышей внутривенно заражали дозой 105 клеток карциномы легких Льюис (Cedarlane, партия №508714). Затем мышей обрабатывали подкожными инъекциями вакцины через день в течение эксперимента, как указано в таблице 11. Контрольную группу обрабатывали только средой. Массы животных измеряли и регистрировали каждые 4 дня. Когда у мышей начинала проявляться смертность, эксперимент прекращали. Затем всех мышей гуманным образом умерщвляли, и легкие извлекали хирургическим путем и взвешивали. Легкие помещали во флаконы с жидкостью Буэна и подсчитывали количество узелков в легких в каждой группе. Полученные результаты показаны в таблице 12. Типичные примеры таких легких изображены на фигуре 14.

Массы легких мышей, которым инъецировали клетки опухоли, затем сравнивали с массами легких мышей, которым инъецировали только PBS, чтобы определить опухолевую нагрузку и, таким образом, терапевтический эффект лечения вакциной. Полученные результаты показаны в таблице 13.

Пример 4В: Рак кожи
Настоящий раздел относится к мышиной модели рака кожи. В данном эксперименте использовали следующие бактериальные вакцины: вакцина Streptococcus pneumoniae [клетки и бульон] (партия № J049-1 [2×109]; вакцина Klebsiella pneumoniae [клетки и бульон] (партия № J046-1 [2×109]; вакцина Staphylococcus aureus [клетки и бульон] (партия № J041-2 [10×109]; вакцина Escherichia coli (изолят ободочной кишки) [клетки и бульон] (партия № J047-1 [6×109]; вакцина Salmonella enterica [клетки и бульон] (партия № J31 [15×109]; вакцина Staphylococcus aureus [только клетки] (партия № J041-2 [10×109]; и только среда (среда от 5. aureus) (партия № J041-1). Мышей лечили в соответствии с экспериментальными группами, указанными в таблице 14.

В частности, группы мышей предварительно обрабатывали подкожно бактериальными вакцинами в -10, -8, -6, -4 и -2 дни. В 0 день мышей внутривенно заражали дозой 2×106 клеток меланомы В16 (партия №3995448; АТСС CRL-6323). Затем мышей обрабатывали подкожными инъекциями вакцины через день в течение эксперимента, как указано в таблице 14. Контрольную группу обрабатывали только средой. Массы животных измеряли и регистрировали каждые 4 дня. После того, как появлялись пальпируемые опухоли, диаметр опухолей измеряли через день, используя штангенциркули. Когда у мышей начала проявляться смертность или диаметры опухолей достигали 20 мм в любой группе, эксперимент заканчивали. Затем всех мышей гуманным образом умерщвляли. Средние объемы опухолей, имеющихся в группах мышей, описанных в настоящем разделе, показаны на фигуре 15.
Пример 4С: Рак ободочной кишки
Настоящий раздел относится к мышиной модели рака ободочной кишки. В данном эксперименте использовали следующие бактериальные вакцины: вакцина Streptococcus pneumoniae [клетки и бульон] (партия № J049-1 [2×109]; вакцина Klebsiella pneumoniae [клетки и бульон] (партия № J046-1 [2×109]; вакцина Staphylococcus aureus [клетки и бульон] (партия № J041-2 [10×109]; вакцина Escherichia coli (изолят ободочной кишки) [клетки и бульон] (партия № J047-1 [6×109]; вакцина Escherichia coli (изолят простаты) [клетки и бульон] (партия № J040-2 [6×109]; вакцина Salmonella enterica [клетки и бульон] (партия № J31 [15×109]; и только среда (среда от Е. coli) (партия № J040-1). Мышей лечили в соответствии с экспериментальными группами, указанными в таблице 15.
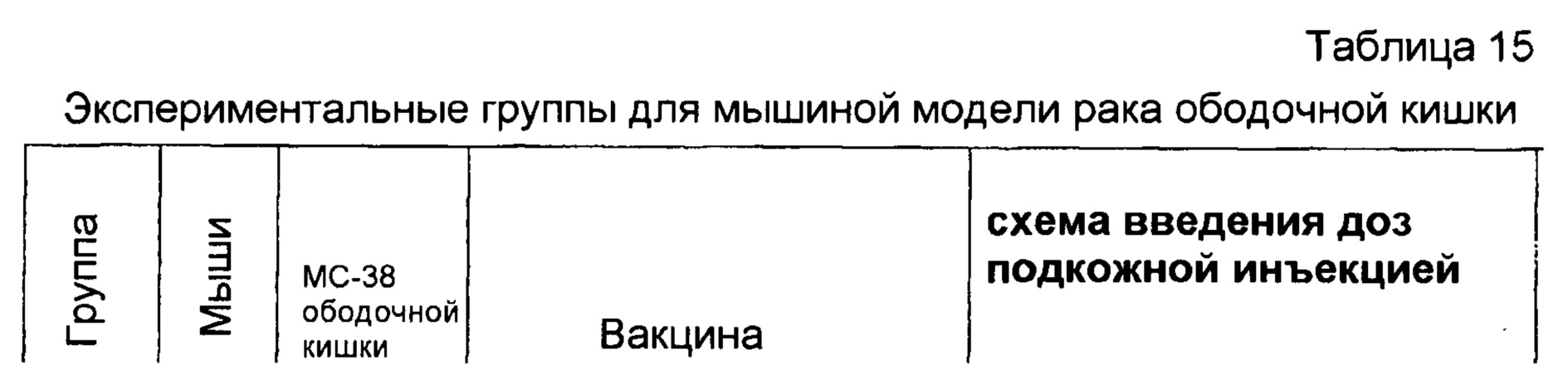

В частности, группы мышей предварительно обрабатывали подкожно бактериальными вакцинами в -10, -8, -6, -4 и -2 дни. В 0 день мышей внутривенно заражали дозой 2×105 клеток аденокарциномы ободочной кишки МС-38 (подарок из лаборатории доктора Jeff Schlom, NCI). Затем мышей обрабатывали подкожными инъекциями вакцины через день в течение эксперимента, как указано в таблице 15. Контрольную группу обрабатывали только средой. Мышей наблюдали в отношении следующих клинических факторов: масса, холодные на ощупь, диарея, учащенное дыхание, закрытые глаза, сниженная подвижность, пилоэрекция и конвульсии. Когда у мыши начинали проявляться признаки клинической смерти, мышь гуманным образом умерщвляли и этот день определяли как день смерти. Данные о выживаемости, полученные в данном примере, приведены на фигуре 16.
Кроме того, оценивали здоровье и заболеваемость/смертность мышей, используемых в данном примере, на 29 день эксперимента, как указано в таблице 16.


Overall Сравнение Выживаемость:
Логарифмический ранговый критерий (критерий Кокса-Мантеля) р=0,001
Критерий Бреслоу (генерализованный критерий Уилкоксона) р=0,003
Критерий Тарона-Варе р=0,002
Пример 4. Заключение
Модель кожи:
Имеет место выраженное терапевтическое преимущество в группе, обработанной Staph aureus (только клетками). Данное исследование показывает эффективность вакцины на основе мертвых S. aureus для лечения рака кожи в мышиной модели, что согласуется с тем фактом, что S. aureus является наиболее распространенной причиной инфекции кожи у мышей. Данные согласуются с применением иммуногенных композиций согласно изобретению для замедления или ингибирования роста злокачественной опухоли. Вакцина на основе только клеток S. aureus (из которой среда и экзотоксины были удалены центрифугированием клеток и бульона, чтобы собрать только клетки, которые затем разбавлены физиологическим раствором) была более эффективной, чем вакцина на основе клеток S. aureus и бульона (которая содержит среду и экзотоксины). Полученный результат может быть обусловлен тем, что экзотоксины S. aureus ингибируют иммунную функцию, такие как лейкоцидины, которые могут убивать лейкоциты. Изобретение соответственно включает варианты, в которых антигенные детерминанты, которые могут быть-использованы в иммуногенных композициях, отделяют от иммуномодулирующих соединений, продуцируемых представляющим интерес микробным патогеном.
Модель легкого
Данные, представленные в данном примере, показывают, что имеет место значимое ингибирование опухоли иммуногенной композицией, полученной из К. pneumoniae, что согласуется с тем фактом, что К. pnuemoniae является распространенной причиной инфекции легких у мышей. У мышей (но обычно не у человека) S. enterica может вызывать пневмонию, что согласуется с целебным эффектом такой вакцины в модели на основе легких мышей. В отличие от человека, для которого распространенным патогеном легкого является S. pneumoniae, S. pneumoniae относительно редко является патогеном легких у мышей (хотя S. pneumoniae может индуцировать пневмонию у мышей). Е. coli и S. aureus редко могут вызывать инфекцию легких у мышей, что согласуется с их слабый полезным действием, показанным в настоящем примере. Данный пример демонстрирует, что вакцина на основе убитых К. pneumoniae является необычайно эффективной для лечения злокачественной опухоли легких у мышей, особенно в случае вариантов, в которых иммуногенная композиция содержит антигены только наиболее распространенного патогенного организма (смотри группу 2 по сравнению с группой 6).
Модель ободочной кишки
S. enterica является одной из наиболее частых причин желудочно-кишечных и внутрибрюшинных инфекций у мышей, что согласуется с полезным эффектом, показанным в настоящем примере, при лечении желудочно-кишечных и внутрибрюшинных злокачественных опухолей у мышей.
Из иммуногенных композиций, используемых в данном примере (т.е., S. enterica, Ε. coli, S. aureus, К. pneumoniae, S. pneumoniae), S. enterica является наиболее распространенным желудочно-кишечным/внутрибрюшинным патогеном у мышей. Е. coli является следующим наиболее распространенным желудочно-кишечным/внутрибрюшинным патогеном у мышей. S. aureus и К. pneumoniae могут встречаться в виде части флоры ободочной кишки и могут вызывать желудочно-кишечную/внутрибрюшинную инфекцию, хотя намного реже. S. pneumoniae не вызывает желудочно-кишечную/внутрибрюшинную инфекцию. В соответствии с этим показано, что вакцина S. enterica в высокой степени полезна в данной мышиной модели опухоли ободочной кишки, показано, что вакцина Е. coli умеренно полезна, показано, что вакцины S. aureus и К. pneumoniae мало полезны, и показано, что вакцина S. pneumoniae не оказывает полезного действия. У человека виды Salmonella вызывают инфекцию желудочно-кишечного тракта, и поэтому можно ожидать, что вакцина на основе S. enterica и других видов Salmonella полезна для лечения рака ободочной кишки у человека.
ПРИМЕР 5: Модели на животных
Пример 5А: Иллюстрация влияния антигенной композиции на основе инактивированной нагреванием Klebsiella pneumoniae на популяции моноцитов/макрофагов и дендритных клеток у мышей
В данном примере использовали следующие способы и материалы:
Мыши. Для данных исследований самок мышей C57BL/6 7-8-недельного возраста получали из Harlan Labs (Livermore, СА).
Антитела и реагенты. В данном примере использовали следующие антитела: анти-I-А/I-Е-ФИТЦ (МНС класса II; М5/114.15.2); анти-Gr-1 PE (RB6-8C5); анти-CD11b PerCP-Су5 (M1/70); анти-CD11c APC (N418); анти-CD4-ФИТЦ (GK1.5); анти-NK1.1 PE (РК136); анти-CD8a eFluor780 (53-6.7); анти-CD44 АРС (IM7). Все антитела приобретали из eBioscience (San Diego, СА). Либеразу ТМ и ДНКазу I приобретали из Roche. Все среды были из HyClone (Fisher).
Обработка антигенными композициями. Убитые нагреванием К. pneumoniae с фенолом (KO12 [5,0 единиц OD600]) разбавляли 1/10 в PBS, содержащем 0,4% фенола, и 100 мкл инъецировали подкожно в 0, 2, 4 и 6 день 4 мышам. Контрольным мышам (n=5) инъецировали PBS в 0, 2, 4, и 6 день.
Бронхоальвеолярный лаваж. На 7 день мышей умерщвляли и бронхоальвеолярный лаваж (BAL) осуществляли, открывая трахею и затем вставляя катетер калибра 22G, соединенный со шприцем объемом 1 мл. 1 мл PBS инъецировали в легкие и извлекали и помещали в микроцентрифужную пробирку объемом 1,5 мл. Затем легкие промывали еще 3 раза, используя по 1 мл PBS, и жидкость объединяли. Жидкость после первой промывки от каждой мыши центрифугировали при 400×g и надосадок замораживали для анализа цитокинов. Конечные 3 мл промывной жидкости центрифугировали и клетки объединяли с клеточным осадком от первой промывной жидкости. Клетки считали и красили антителами, специфичными для МНС класса II, Ly6G/C, CD11b и CD11c. После окрашивания клетки промывали и анализировали в проточном цитометре FACS Calibur.
Расщепление легкого. После осуществления BAL легкие помещали в 5 мл RPMI, содержащей 417,5 мкг/мл либеразы TL (Roche) и 200 мкг/мл ДНКазы I (Roche). Затем легкие расщепляли при 37°С в течение 30 минут. После расщепления легкие протирали через сито с ячейками 70 мкм, чтобы получить суспензию отдельных клеток. Затем клетки центрифугировали, промывали, ресуспендировали в буфере FACS (PBS с 2% FCS и 5 мМ EDTA) и подсчитывали. После подсчета клетки красили и анализировали с помощью FACS, используя такие же антитела, как для клеток BAL.
Перитонеальный лаваж. 1 мл PBS инъецировали в брюшину мышей, используя шприц объемом 1 мл, соединенный с иглой калибра 25G, после BAL. Живот массировали в течение 1 минуты 0,5 мл PBS извлекали из брюшины, используя пипетку на 1 мл. Промывную жидкость помешали в центрифужную пробирку объемом 1,5 мл, центрифугировали при 400хд в течение 5 минут и ресуспендировали в буфере FACS перед окрашиванием и анализом FACS.
Анализ селезенки и лимфатических узлов. Селезенку и дренирующие лимфатические узлы извлекали после BAL и перитонеального лаважа и помещали в PBS. Селезенку разрушали, протирая через сито с ячейками 70 мкм (Fisher) и лимфатический узел разрушали, используя резиновый конец плунжера шприца объемом 1 мл. После разрушения суспензию отдельных клеток из селезенки и лимфатических узлов центрифугировали, промывали один раз буфером для FACS и ресуспендировали в буфере для FACS перед подсчетом, окрашиванием и FACS-анализом.
FACS-анализ. Клетки красили на льду в течение 20 минут в 96-луночных планшетах, используя 50 мкл антител, разбавленных в буфере для FACS. Спустя 20 минут в лунки добавляли 100 мкл буфера для FACS и планшеты центрифугировали при 400×g в течение 5 минут. Затем среду удаляли и клетки промывали еще 1 раз буфером для FACS. После последней промывки клетка ресуспендировали в 200 мкл буфера для FACS и получали данные, используя проточный цитометр FACS Calibur (BD). Минимум 20000 живых случаев собирали для всех образцов, за исключением BAL, где собирали минимум 5000 случаев.
В данном примере получали следующие результаты.
Нормальных мышей без опухолей обрабатывали антигенной композицией К. pneumoniae в 0, 2, 4 и 6 день. На 7 день мышей умерщвляли и жидкость бронхоальвеолярного лаважа, ткань легкого, жидкость перитонеального лаважа, лимфатические узлы и селезенку анализировали в отношении изменений моноцитов и макрофагов. Наблюдали увеличение количества моноцитов/макрофагов крови, характерных для острого воспаления, которое определяли по высокой экспрессии CD11b и Gr-1 (такой же маркер как Ly6c), и F4/8 0 в лимфатическом узле, дренирующем место инъекции антигенной композиции К. pneumoniae (смотри фигуру 17А). Такие характерные для острого воспаления моноциты/макрофаги также экспрессируют очень высокие уровни молекул МНС класса II, что свидетельствует об экспозиции с бактериальными антигенами. Важно отметить, что обработка мышей антигенной композицией К. pneumoniae в течение одной недели приводила к заметному увеличению острых воспалительных моноцитов в жидкости бронхоальвеолярного лаважа в легких (т.е. в органе-мишени), но не селезенке или брюшине обработанных мышей, что свидетельствует о том, что обработка может индуцировать хоминг моноцитов специфично в легкие без влияния на другие органы (смотри фигуру 17В). Моноциты могут дифференцироваться в дендритные клетки (ДК) в легких, и в соответствии с наблюдениями авторов изобретения заметного увеличения рекрутинга моноцитов также наблюдали, что имело место заметное увеличение частоты клеток с маркерами зрелых ДК (смотри фигуру 17С).
Как показано на фигуре 17, обработка антигенной композицией К. pneumoniae в течение 7 дней приводила к заметному увеличению (по сравнению с обработкой плацебо = PBS) как острых воспалительных моноцитов, так и дендритных клеток в легких мышей. Как показано на фигуре 17, мышей обрабатывали либо антигенной композицией К. pneumoniae, либо PBS в 0, 2, 4 и 6 день. На 7 день мышей умерщвляли и определяли общее количество А) и В) воспалительных моноцитов (клетки CD11b+Gr-1+) и С) дендритных клеток (клетки CD11c+ МНС класса 11+) в легком и селезенке, используя проточную цитометрию. Планки погрешности, изображенные на фигуре А) получены при определении среднего для 4-5 мышей на группу.
Пример 5В. Иллюстрация влияния антигенной композиции инактивированных нагреванием Klebsiella pneumoniae и антигенной композиции инактивированных нагреванием Е. coli на популяции клеток моноцитов/макрофагов, дендритных клеток и эффекторных клеток у мышей
В данном примере использовали следующие способы и материалы:
Мыши. Для данных исследований самок мышей C57BL/6 7-8-недельного возраста получали из Harlan Labs (Livermore, СА).
Антитела и реагенты. Использовали следующие антитела: анти-I-A/I-E ФИТЦ (МНС класса II; М5/114.15.2); анти-Gr-1-PE (RB6-8С5); анти-CD11b PerCP-Cy5 (М1/70); анти-CD11c АРС (N418); анти-CD4-ФИТЦ (GK1.5); анти-NK1.1 PE (PK136); анти-CD8a eFluor780 (53-6.7); анти-CD44 APC (IM7). Все антитела приобретали из eBioscience (San Diego, СА). Либеразу ТМ и ДНКазу I приобретали из Roche. Все среды были из HyClone (Fisher).
Обработка антигенными композициями. Убитые нагреванием К. pneumoniae с фенолом {К. pneumoniae, партия KO12; 5,0 единиц OD600) разбавляли 1/10 в PBS, содержащем 0,4% фенола, и 100 мкл инъецировали подкожно в 0, 2, 4 и 6 день 5 мышам. Убитые нагреванием Е. coli (партия; 5,0 единиц OD600) разбавляли 1/10 в PBS, содержащем 0,4% фенола, и 100 мкл инъецировали подкожно в 0, 2, 4 и 6 день 5 мышам. Контрольным мышам (n=5) инъецировали PBS в 0, 2, 4, и 6 день.
Бронхоальвеолярный лаваж. На 7 день мышей умерщвляли и бронхоальвеолярный лаваж (BAL) осуществляли, открывая трахею и затем вставляя катетер калибра 22G, соединенный со шприцем объемом 1 мл. 1 мл PBS инъецировали в легкие и извлекали и помещали в микроцентрифужную пробирку объемом 1,5 мл. Затем легкие промывали еще 3 раза, используя по 1 мл PBS, и жидкость объединяли. Жидкость после первой промывки от каждой мыши центрифугировали при 400×g и надосадок замораживали для анализа цитокинов. Конечные 3 мл промывной жидкости центрифугировали и клетки объединяли с клеточным осадком от первой промывной жидкости. Клетки считали и красили антителами, специфичными для МНС класса II, Ly6G/C, CD11b и CD11c. После окрашивания клетки промывали и анализировали в проточном цитометре FACS Calibur.
Расщепление легкого. После осуществления BAL легкие помещали в 5 мл RPMI, содержащей 417,5 мкг/мл либеразы TL (Roche) и 200 мкг/мл ДНКазы I (Roche). Затем легкие расщепляли при 37°С в течение 30 минут. После расщепления легкие протирали через сито с ячейками 70 мкм, чтобы получить суспензию отдельных клеток. Затем клетки центрифугировали, промывали, ресуспендировали в буфере FACS (PBS с 2% FCS и 5 мМ EDTA) и подсчитывали. После подсчета клетки красили и анализировали с помощью FACS, используя такие же антитела, как для клеток BAL.
Перитонеальный лаваж. 1 мл PBS инъецировали в брюшину мышей, используя шприц объемом 1 мл, соединенный с иглой калибра 25G, после BAL. Живот массировали в течение 1 минуты 0,5 мл PBS извлекали из брюшины, используя пипетку на 1 мл. Промывную жидкость помешали в центрифужную пробирку объемом 1,5 мл, центрифугировали при 400*д в течение 5 минут и ресуспендировали в буфере FACS перед окрашиванием и анализом FACS.
Анализ селезенки и лимфатических узлов. Селезенку и дренирующий лимфатический узел извлекали после BAL и перитонеального лаважа и помещали в PBS. Селезенку разрушали, протирая через сито с ячейками 70 мкм (Fisher) и лимфатический узел разрушали, используя резиновый конец плунжера шприца объемом 1 мл. После разрушения суспензию отдельных клеток из селезенки и лимфатических узлов центрифугировали, промывали один раз буфером для FACS и ресуспендировали в буфере для FACS перед подсчетом, окрашиванием и FACS-анализом.
FACS-анализ. Клетки красили на льду в течение 20 минут в 96-луночных планшетах, используя 50 мкл антител, разбавленных в буфере для FACS. Спустя 20 минут в лунки добавляли 100 мкл буфера для FACS и планшеты центрифугировали при 400×g в течение 5 минут. Затем среду удаляли и клетки промывали еще 1 раз буфером для FACS. После последней промывки клетки ресуспендировали в 200 мкл буфера для FACS и получали данные, используя проточный цитометр FACS Calibur (BD). Минимум 20000 живых случаев собирали для всех образцов, за исключением BAL, где собирали минимум 5000 случаев.
В данном примере получали следующие результаты: Как показано на фигуре 18, мышей обрабатывали в 0, 2, 4 и 6 день либо антигенной композицией К. pneumoniae, либо антигенной композицией Е. coli, либо PBS. На 7 день мышей умерщвляли и в жидкости перитонеального лаважа, легких, лимфатических узлах и селезенке определяли общее количество воспалительных моноцитов (клетки CD11b+Gr-1+) и дендритных клеток (клетки CD11c+ МНС класса 11+), используя проточную цитометрию. Планки погрешностей на фигуре 18 представляют собой стандартное отклонение, полученное при анализе 5 мышей. *Р-значение <0,05 при использовании t-критерия Стьюдента.
Фигура 18 иллюстрирует, что обработка антигенной композицией К. pneumoniae, но не обработка антигенной композицией Е. coli, заметно увеличивало количество моноцитов и ДК в легких мышей. В отличие от легких, К. pneumoniae не приводили к увеличению количества моноцитов в брюшине мышей, тогда как Е. coli приводили к такому увеличению. Важно отметить, что имело место только небольшое увеличение количества воспалительных моноцитов, и не было увеличения количества DC в селезенке мышей, обработанных либо К. pneumoniae, либо Е. coli, что свидетельствует о том, что эффекты терапии не являются общими, а в действительности являются специфичными для конкретного места в органе. Кроме исследования эффектов обработки на воспалительные моноциты и ДК в легких мышей, авторы изобретения также исследовали изменения в других лейкоцитах, таких как цитотоксические Т-клетки CD8, Т-хелперные клетки CD4 и клетки природные киллеры (NK), которые потенциально могут играть роль в противоопухолевом иммунитете.
Фигура 19 иллюстрирует, что антигенная композиция К. pneumoniae, но не PBS и не антигенная композиция Е. coli, приводила к заметному увеличению частоты встречаемости и общего количества NK-клеток, Т-клеток CD4 и CD8 в легких обработанных мышей. Данный пример, насколько известно авторам, является первой демонстрацией того, что подкожная инъекция убитых бактерий таких видов, которые обычно вызывают инфекцию "легких, может способствовать накоплению лейкоцитов в легких в отсутствие какого-либо воспаления в данном месте. Кроме того, авторы изобретения показали, что такой эффект является специфичным для сайта-мишени, и что он также является специфичным для бактериальных компонентов, используемых для лечения.
Как показано на фигуре 19, мышей обрабатывали в 0, 2, 4 и 6 день либо антигенной композицией К. pneumoniae, либо антигенной композицией Е. coli, либо PBS. На 7 день мышей умерщвляли и определяли общее количество Т-клеток CD4, Т-клеток CD8 и клеток природных киллеров (NK), используя проточную цитометрию. Планки погрешностей представляют стандартные отклонения значений, полученных для 5 мышей на группу. *Р-значение <0,05 при использовании t-критерия Стьюдента.
Пример 5С. Иллюстрация эффектов инактивированных нагреванием и фенолом антигенных композиций Klebsiella pneumoniae (К. pneumoniae) на противоопухолевый ответ у мышей, и статус воспалительных моноцитов и дендритных клеток после обработки мышей, несущих опухоли
В данном примере использовали следующие способы и материалы:
Инокуляции опухолевых клеток. Линию клеток карциномы легкого Льюис, полученную от мышей с фоном C57BL/6, приобретали из АТСС (Manassas, VA). Клетки поддерживали в модифицированной Дульбекко среде Игла (АТСС, Manassas, VA), содержащей 10% FCS. Клетки выращивали в инкубаторе с увлажнением при 37°С и 5% CO2. Перед инокуляции опухоли клетки открепляли от чашек для культивирования, используя 0,25% трипсин и 0,53 мМ EDTA. Клетки промывали в PBS и ресуспендировали в концентрации 8×106 клеток/мл и по 200 мкл (4×105 клеток) инъецировали мышам внутривенно.
Обработка антигенной композицией. В данном исследовании использовали следующие антигенные композиции: инактивйрованную нагреванием антигенную композицию К. pneumoniae с фенолом (партия KO12) и инактивйрованную фенолом антигенную композицию К. pneumoniae (партия KO25). Инактивированные нагреванием К. pneumoniae и инактивированные фенолом К. pneumoniae концентрировали до 5,0 единиц OD600. 0,1 мл К. pneumoniae, разбавленных 1/10 в PBS с 0,4% фенола инъецировали подкожно каждые 2 дня, начиная со 2 дня после инъекции опухоли.
Анализ воспалительных моноцитов, ДК, Т-клеток и NK-клеток.
Все анализы осуществляли согласно способам, используемым в примере 5В выше.

В данном примере получили следующие результаты: Данный пример предназначен для определения того, влияло ли присутствие опухоли на рекрутинг клеток в легкие, и возрастал ли эффект обработки с течением времени, приводя к дальнейшему увеличению рекрутинга клеток по мере продолжения обработки, и таким образом к вероятно более оптимальному терапевтическому эффекту при длительной обработке. Кроме того, авторы изобретения хотели определить является ли антигенная композиция К. pneumoniae, инактивированная фенолом, более эффективной, чем антигенная композиция К. pneumoniae, инактивированная нагреванием.
Фигура 20 ясно демонстрирует, что на 9 день (т.е., 4 обработки антигенной композицией К. pneumoniae) уже имеет место заметное увеличение количества моноцитов острого воспаления, ДК, Т-клеток и NK-клеток в легких мышей, обработанных антигенной композицией К. pneumoniae, инактивированной нагреванием или фенолом, во много раз больше, чем в легких мышей, обработанных плацебо (физиологический раствор = PBS), и снова ясно демонстрирует выраженный целенаправленный клеточный иммунный ответ в легких, запускаемый при терапии антигенной композицией К. pneumoniae. На 9 день были проявления того, что инактивация фенолом была более эффективной, чем инактивация нагреванием, но такая тенденция была обратима к 16 дню. Однако важно отметить, что, судя по количеству клеток в легких на 9 и 16 День, очевидно, что имеет место кумулятивный эффект обработки бактериями на рекрутинг клеток в легкие. Например, в группе, обработанной инактивированной фенолом антигенной композицией К. pneumoniae, насчитывается примерно 100000 моноцитов острого воспаления в легких мышей на 9 день, и их количество значительно увеличивается до 400000 на 16 день, свидетельствуя о значительном увеличении ответа в ходе продолжения обработки. Некоторый повышенный ответ на обработку в случае продолжения такой обработки наблюдался у мышей, обработанных инактивированными нагреванием бактериями. Важно отметить, что кумулятивный эффект обработки также наблюдается в случае всех других анализируемых типов клеток. В данном исследовании не было видимого статистически значимого различия в рекрутинге иммунных клеток при использовании инактивированных нагреванием или инактивированных фенолом антигенных композиций К. pneumoniae.
Как показано на фигуре 20, мышам инъецировали 4×105 клеток карциномы легких Льюис внутривенно в 0 день. Затем мышей обрабатывали через день, начиная со 2 дня, антигенной композицией К. pneumoniae, полученной инактивацией нагреванием или инактивацией фенолом, или PBS. На 9 день и 16 день мышей умерщвляли и определяли общее количество (А) воспалительных моноцитов (CD11b+Gr-1+) и ДК (CDllc+lab+) или (В) Т-клеток CD4, Т-клеток CD8 и клеток природных киллеров (NK), используя проточную цитометрию. Столбиками представлены соответственно: группа, обработанная PBS, мыши, обработанные инактивированной нагреванием антигенной композицией К. pneumoniae, и мыши, обработанные инактивированной фенолом антигенной композицией К. pneumoniae. Планки погрешности представляют стандартные отклонения значений, полученных для 5 мышей на группу. *Р-значение <0,05 при использовании t-критерия Стьюдента.
Результаты данного исследования демонстрируют возрастающий иммунный ответ в ткани-мишени при продолжении обработки.
Пример 5D. Иллюстрация эффектов инактивации нагреванием, облучением и фенолом на антигенные композиции К. pneumoniae, включая рекрутинг лейкоцитов в легкие мышей, и эффекты фенола в качестве консерванта, оказывающего определенное влияние.
В данном примере использовали следующие способы и материалы:
Мыши. Для данных исследований самок мышей C57BL/6 7-8-недельного возраста получали из Harlan Labs (Livermore, СА).
Антигенные композиции. В данном исследовании использовали антигенную композицию убитых нагреванием К. pneumoniae с фенолом (KO12), антигенную композицию убитых нагреванием К. pneumoniae без фенола (KO25), антигенную композицию облученных К, pneumoniae без фенола (KO24) и антигенную композицию убитых фенолом К. pneumoniae без фенола (KJ25). Все бактериальные препараты имели концентрацию 5,0 единиц OD в физиологическом растворе. Для разведения 1/10 1 мл бактериального препарата добавляли к 9 мл DPBS и перемешивали сразу и затем снова перед инъекцией. Для разведения 1/100 0,1 мл бактериального препарата может быть добавлен к 9,9 мл DPBS и перемешан сразу и затем снова перед инъекцией. В случае разбавлений антигенной композиции убитых нагреванием Klebsiella pneumoniae с фенолом разведения осуществляли как описано выше, используя раствор DPBS, содержащий 0,4% фенола (масс./об.). Для получения 0,4% фенола в DPBS, сначала получали 5% раствор фенола, добавляя 0,5 г твердого фенола (Sigma Aldrich, St. Louis, MO) к 10 мл DPBS (Hyclone, Logan, UT). Полученный раствор фильтровали через фильтр 0,22 мкм (Millipore, Billerica, MA) и хранили при 4°С. Непосредственно перед использованием 5% раствор фенола разбавляли, используя 1 мл в 12,5 мл DPBS и использовали для получения бактериальных препаратов.
Обработка антигенными композициями. 5 мышей на группу обрабатывали подкожно в 0, 2, 4 и 6 день, используя 0,1 мл антигенной композиции убитых нагреванием К. pneumoniae, разбавленной 1/10 в PBS или PBS с 0,4% фенолом, 0,1 мл облученной антигенной композицией К. pneumoniae, разбавленной 1/10 в PBS, или антигенную композицию инактивированных фенолом К. pneumoniae, разбавленную 1/10 в PBS или PBS с 0,4% фенола. На 7 день мышей умерщвляли и анализировали рекрутинг лейкоцитов в легкие, как описано в примере 5В.
В данном примере получили следующие результаты: В данном примере авторы изобретения использовали рекрутинг лейкоцитов в легкие в качестве показателя, заменяющего эффективность, чтобы сравнить эффективность антигенных композиции К. pneumoniae, инактивированных разными способами. Фигура 21 показывает, что в случае обеих антигенных композиций К. pneumoniae, убитых нагреванием и убитых фенолом, добавление фенола (0,4%) в качестве консерванта повышало эффективность, судя по измерениям рекрутинга клеток. В некоторых вариантах небольшое количество фенола (т.е., 0,4% в качестве консерванта) может стабилизировать компонент клеточной стенки бактерии, например, компонент, который является важным для узнавания картины антигенов и активации оптимального целенаправленного ответа. При сравнении 3 препаратов, содержащих фенол в качестве консерванта (т.е., убитых нагреванием, убитых фенолом и убитых облучением), облученная антигенная композиция К. pneumoniae приводила к наибольшему рекрутингу острых воспалительных моноцитов, ДК, NK-клеток и Т-клеток в легкие, затем следовала антигенная композиция убитых фенолом К. pneumoniae, и антигенная композиция убитых нагреванием К. pneumoniae приводила к наименьшему рекрутингу клеток.
Как показано на фигуре 21, мышей обрабатывали в 0, 2, 4 и 6 день антигенной композицией К. pneumoniae, инактивированных нагреванием, с консервантом фенолом (HKWP) или без консерванта фенола (ΗΚnp), инактивированных фенолом, с консервантом фенолом (PKWP) или без консерванта фенола (PKnp), или антигенной композицией К. pneumoniae, инактивированных облучением, с консервантом фенолом (IRWP). На 7 день мышей умерщвляли и определяли общее количество (А) воспалительных моноцитов (CD11b+Gr-1+) и ДК (CD11c+lab+) или (В) Т-клеток CD4, Т-клеток CD8 и клеток природных киллеров (NK), используя проточную цитометрию. Планки погрешности представляют стандартные отклонения значений для 5 мышей на группу. *Р-значение <0,05 при сравнении с мышами, обработанными IRWP, при использовании t-критерия Стьюдента.
ПРИМЕР 6: Клинические исследования на эпителиальных злокачественных опухолях на поздних стадиях
Общее описание лечения
Следующих пациентов с разными злокачественными опухолями на поздней стадии подвергли лечению инактивированными нагреванйем целенаправленными бактериальными антигенными композициями. Полностью информированное письменное согласие получали от каждого пациента и в каждом случае. Лечение состояло из многократных (3х/неделю) подкожных инъекций точных количеств вакцины в область живота. Дозы постепенно увеличивали у каждого пациента, чтобы добиться достаточной кожной реакции (покраснения 3-5 см, продолжающегося примерно 24 часа). Для каждого пациента в индивидуальной регистрационной карте (CRF) документально отмечали кожную реакцию и возможные клинические эффекты и/илй побочные эффекты, связанные с лечением. Кратко описаны характеристики лечения и сопутствующая терапия, а также ответ пациентов на терапию.
Пациент №1:
53-летний пациент мужского пола с меланомой на поздней стадии, ICD10:C43, впервые диагностированное 11/2005 поражение под ногтем большого пальца правой ноги, гистология спустя год 12/2006: злокачественная меланома на поздней стадии; пациент отказался от ампутации большого пальца; 5/2008 лимфатические метастазы в правую ногу, на момент первичного осмотра для целенаправленного лечения бактериальной антигенной композицией (9/2008) нога опухла с 100% увеличением в окружности: индекс Карновского 80%, без предварительного лечения.
Лечение в течение 6 месяцев 09/2008-04/2009:
- 12 × внутрибрюшинная инсуффляция озоном (03);
- 42 × местнорегиональная радиочастотная гипертермия (13,56 МГц);
- 18 × умеренная гипертермия 38,5°С;
- 6-месячное лечение антигенной композицией Staph, aureus подкожно;
- ортомолекулярная терапия: инфузии высоких доз витамина С (0,5 г/кг/массы тела), витамин D3 2000 межд. единиц/сутки, артесунат 200 мг/сутки, целебрекс 100 мг/сутки, налтрексок в низкой дозе, лекарственные грибы (кордицепс, рейши, шиитаке), селен 200 мкг/сутки, куркумин 3000 мг/сутки, протеолитические ферменты (Wobemugos)
Подробности эпикриза:
- ПЭТ 7/2008: SUV в большом пальце правой ноги 4,81, колено: 5,01;
- ПЭТ 12/2008: SUV в большом пальце правой ноги 3,80, колено: 4,02;
- авторы изобретения начали лечение в конце 9/2008;
- на этот момент (9/2008) клинически уже были пальпируемые лимфатические узлы в паху, которые не были видны на ПЭТ от 7/2008.
- 05/2010: хорошее клиническое состояние, ПЭТ подтверждает полную ремиссию, индекс Карновского 100%.
Пациент №2:
48-летняя пациентка женского пола с билатеральным раком молочной железы на поздней стадии, ICD10:C50.9, впервые диагностированным 4/2008; гистология: протоковая инфильтрующая аденокарцинома молочной железы, ER/PR позитивная, Her2 неизвестен, Т1/Т2, N1 (сигнальный подмышечный узел), М0 G3; многократное лечение инъекциями бикарбоната натрия и повторная операция на обеих молочных железах; пациентка отказалась от предложенной билатеральной мастэктомии и никогда не подвергалась резекции «in sano» (например, границы при лампэктомии никогда не были без опухолевых клеток). Пациентка также отказалась от химиотерапии и/или гормональной терапии. Индекс Карновского 90%, без предварительного лечения.
Лечение в течение 8 месяцев 03/2009-11/2009:
- 3 × терапия аутологичными дендритными клетками в сочетании с:
- 3 × длительной умеренной гипертермией всего тела 40°С в течение 8 часов;
- 57 × местнорегиональной радиочастотной гипертермией обеих молочных желез (13,56 МГц);
- 6-месячным лечением антигенной композицией Staph. aureus подкожно;
- ортомолекулярной терапией: инфузии витамина С в высоких дозах (0,5 г/кг/массы тела), налтрексон в низких дозах, лекарственные грибы (кордицепс, рейши, шиитаке), куркума 3000 мг/сутки, цинк
Подробности эпикриза:
- Лечение начинали в конце 3/2009.
- 05/2010: билатеральная МРТ молочных желез не выявила аномалий, хорошее клиническое состояние, индекс Карновского 100%.
Пациент №3:
73-летняя пациентка женского пола с немелкоклеточным раком легкого (NSCLC) на поздней стадии FIGO IIe, ICD10:C34, впервые диагностированным 6/2009; гистология: светлоклеточная аденокарцинома легких, Т4, N1, М0 G3; она подвергалась лечению неоадъювантной химиотерапией; повторное определение стадии после 3 циклов неоадъювантной химиотерапии. показало наличие опухоли Т2; затем она подвергалась эктомии левого легкого, резекции R0, и медиастинальной лимфаденэктомии; индекс Карновского 90%.
Лечение в течение 7 месяцев 08/2009-03/2010:
- 08/2009: начата химиотерапия таксаном/цисплатином вплоть до 10/2009 в сочетании с:
- 4 × длительной умеренной гипертермией всего тела 40°С в течение 8 часов (1-2/2009);
- 20 × местнорегиональной радиочастотной гипертермией грудной клетки (13,56 МГц) (8-10/2009);
- 10/2009 пневмэктомия, R0-резекция (онкологические данные против дальнейшей адъювантной химиотерапии);
- 6-месячное лечение антигенной композицией Klebsiella pneumoniae подкожно (08/2009-02/2010);
- ортомолекулярной терапией: пептиды тимуса внутримышечно, индометацин, циметидин, инфузии витамина С в высоких дозах (0,5 г/кг/массы тела), протокол ALA/N (налтрексон в низких дозах и альфа-липоевая кислота), лекарственные грибы (рейши), куркума 3000 мг/сутки, цинк, мелатонин, ингаляция ионизированного кислорода.
Подробности эпикриза:
- Начали лечение в конце 08/2009.
- 05/2010: КТ грудной клетки и опухолевые маркеры CEA, NSE и CYFRA показали полную ремиссию, хорошее клиническое состояние, индекс Карновского 100%.
Пациент №4:
50-летняя пациента женского пола с раком молочной железы на поздней стадии, ICD10: С50, с диссеминированными метастазами в печень и легкие, впервые диагностированным 8/1990; гистология: недифференцированная аденокарцинома молочной железы циррозного типа, pT1c, N1, М0 G3; она подвергалась многократным курсам химиотерапии в течение 20 лет; 11/2004 первое повторное появление рубца, 12/2004 удаление левой молочной железы, 6 × химиотерапия эпитаксом и облучение огрудной стенки; 9/2005 первый диагноз диссеминированных метастазов в печень и легкие: снова 8 × химиотерапия эпитаксом вплоть до 3/2006. Повторное определение стадии показало прогрессирующее заболевание, в это время она начала лечение целенаправленной бактериальной антигенной композицией. Индекс Карновского 90%.
Лечение в течение 4 лет 03/2006-03/2010:
- 03/2006: начали лечение вакциной Polyvaccinum forte в сочетании с:
- 3 × терапией аутологичными дендритными клетками в сочетании с (6-8/2006):
- 3 × длительной умеренной гипертермией всего тела (LD-WBH) 40°С в течение 8 часов (1-2/2009);
- 25 × местнорегиональной радиочастотной гипертермией грудной клетки и печени (13,56 МГц) (3-6/2006);
- 8-месячное лечение антигенной композицией Klebsiella pneumoniae (11/2008-7/2009);
- 10/2009: ТМ CEA и СА15/3 снова начали повышаться;
- 02-03/2009: 2х терапия аутологичными дендритными клетками без LD-WBH;
- 04/2010: термическая абляция метастазов печени (без изменения метастазов легкого);
- ортомолекулярная терапия: пептиды тимуса внутримышечно, индометацин, циметидин, инфузии витамина С в высоких дозах (0,5 г/кг/массы тела), куркума 3000 мг/сутки, цинк, протеолитические ферменты.
Подробности эпикриза:
- Авторы изобретения начали лечение в конце 03/2006.
- 05/2010: КТ грудной клетки показал стабильное заболевание в течение 4 лет, прогрессирующее заболевание метастазов в печени, хорошее клиническое состояние, индекс Карновского 100%.
Пациент №5:
66-летний пациент мужского пола с раком простаты на поздней стадии, ICD10: С61, с диссеминированными костными к лимфатическими метастазами, впервые диагностированным 01/1997; гистология: недифференцированная аденокарцинома простаты, рТ3, N1, M1 G3; он был подвергнут множественной гормональной и химиотерапии на протяжении 13 лет; пациент в хорошем клиническом состоянии живет с метастазирующим раком простаты в течение 13 лет после постановки диагноза; индекс Карновского 90%.
Лечение в течение 11 лет 11/1999-05/2010:
- 13 лет антиандроген с супрефактом, золадексом, касодексом, тренантоном, эстрацитом, β-ситостеролом;
- 06/2006-12/2007: начато лечение смешанной бактериальной вакциной с использованием вакцины Polyvaccinum forte;
- с 03/2008 регулярная химиотерапия таксотером 140 мг каждые 3-4 недели;
- 50 × умеренная гипертермия всего тела 39°С в течение 3 часов (1999-2009);
- 18-месячное лечение антигенной композицией Staph, aureus (11/2008-05/2010, непрерывно);
- 05-06/2009: 2× терапия аутологичными дендритными клетками с умеренной WBH 39°С, 3 часа;
- ортомолекулярная терапия: ростки пшеницы, циметидин, зомета, инфузии витамина С в высоких дозах (0,5 г/кг/массы тела), куркума 3000 мг/сутки, босвеллия пильчатая (индийская) 400 мг 4×4/день, цинк, протеолитические ферменты.
Подробности эпикриза:
- авторы изобретения начали лечение в конце 1999.
- 05/2010: сканирование костей показало стабильное заболевание; PSA в настоящее время 8 9 нг/мл, хорошее клиническое состояние, индекс Карновского 90%.
Пациент №6:
52-летняя пациента женского пола с первичной злокачественной опухолью брюшины на поздней стадии, ICD10:C48.2, с диссеминированным перитонеальным карцинозом, впервые диагностированной 06/2003; гистология: недифференцированная аденокарцинома брюшины, рТ3, N1, M1 G3; она была подвергнута циторедуктивной операции с овариэктомией билатерально и гистерэктомией и адъювантной химиотерапии таксолом/параплатином: прогрессирующее заболевание и переход к таксолу/параплатину со стабильным заболеванием вплоть до 8/2008; прогрессирующее, заболевание с диссеминированными перитонеальными метастазами в левой почке и 3-я линия химиотерапии карбоплатином и начало лечения целенаправленной бактериальной антигенной композицией; пациентка была в хорошем клиническом состоянии; индекс Карновского 100%.
Лечение на протяжении 4 месяцев 05-09/2009:
- 5 × химиотерапия карбоплатином (3-я линия), а затем:
- 5 × длительная умеренная гипертермия всего тела (LD-WBH) 40°С в течение 8 часов (05-09/2009);
- 20 × местнорегиональная радиочастотная гипертермия живота (13,56 МГц) (05-09/2009);
- 2-месячное лечение антигенной композицией Е. coli (ободочная кишка) (05-07/2009);
- ортомолекулярная терапия: инфузии витамина С в высоких дозах (0,5 г/кг/массы тела), в высоких дозах экстракты артишока и силимарина (печень).
Подробности эпикриза
- Авторы изобретения начали лечение в конце 5/2009.
- 04/2010: КТ брюшной полости и маркеры опухоли свидетельствовали о полной ремиссии; хорошее клиническое состояние, индекс Карновского 100%.
Пациент №7:
50-летняя пациентка женского пола с неоперабельным раком поджелудочной железы, ICD10:C25.9, со злокачественной опухолью, инфильтрующей крупные сосуды; сонографические данные и данные КТ свидетельствовали об инвазии в верхнюю брыжеечную вену, первая диагностика 02/2009; гистология: недифференцированная аденокарцинома поджелудочной железы, рТ3, N1, M1 G3 с перитонеальным карцинозом; она была подвергнута локальному облучении и низким дозам кселоды в качестве сенсибилизатора действия облучения; когда она начала лечение в клинике авторов изобретения злокачественная опухоль еще была неоперабельной; индекс Карновского 100%.
Лечение в течение 2 месяцев 06-07/2009: (Е. coll SSI в течение 11 месяцев);
- 1 × терапия аутологичными NDV-примированными дендритными клетками в сочетании с:
- 1 × длительной умеренной гипертермией всего тела 40°С в течение 8 часов (7-10/2009);
- 4 × умеренной гипертермией всего тела 38,5°С:
- 15 × местнорегиональной радиочастотной гипертермией живота (13,56МГц) (06-07/2009);
- 11-месячное лечение антигенной композицией E. coli (ободочная кишка) (06/2009 до настоящего дня продолжается);
- ортомолекулярной терапией: пептиды тимуса внутримышечно; лекарственные грибы (рейши, кордицепс, шиитаке), инфузии витамина С в высоких дозах (0,5 г/кг/массы тела), терапия высокими дозами протеолитических ферментов (вобэнзим, флогензим), циметидин.
Подробности эпикриза:
- Авторы изобретения начали в конце 6/2009.
- 05/2010: полная ремиссия, NED; ПЭТ 02/2010 показала отсутствие усвоения глюкозы; опухолевый маркер в норме CA19/9: 4; хорошее клиническое состояние, индекс Карновского 100%.
ПРИМЕР 7: Исследования доз (исследование QB28)
При попытках исследовать роль дозирования мышей обрабатывали либо разными дозами антигенной композиции К. pneumonia, либо контрольным PBS. Всех мышей (C57BL/6) начинали обрабатывать антигенной композиций К. pneumonia или PBS в - 10, -8, -6, -4 и -2 день, используя следующие места инъекций (1-ая инъекция: вентральная паховая справа; 2-ая инъекция: вентральная подмышечная справа, 3-я инъекция: вентральная подмышечная слева; 4-ая инъекция: вентральная паховая слева и т.д.). Затем все мыши получали инокуляцию опухоли в дозе 3×105 клеток карциномы легких Льюис посредством внутривенной инъекция в латеральную хвостовую вену мышей. Дозы антигенных композиций или PBS были следующими: i) PBS 0,1 мл; ii) К. pneumoniae 0,1 мл, OD600=1,67; iii) К. pneumoniae 0,1 мл, OD600=0,5. Мыши получали обработку антигенной композицией К. pneumoniae или PBS в 2, 4, 6 и 8 день. Эксперимент заканчивали на 10 день; всех мышей умерщвляли, их легкие извлекали хирургическим путем, промывали в воде, взвешивали и затем помещали в жидкость Буэна для фиксации и подсчитывали через 24 часа. Как показано на фигуре 22, каждая точка данных представляет количество опухолевых узлов от одной мыши. Фотографии типичных легких в таких экспериментах показаны на фигуре 23. Фигура 23 показывает, что в легких мышей, обработанных контрольным PBS, наблюдается значительное количество узлов. Для сравнения на фигуре 23 показано, что в легких мышей, обработанных антигенной композицией К. pneumoniae, наблюдается меньшее количество узлов в соотношении, эквивалентном соотношению, показанному на фигуре 22.
Исследование QB30. В следующих исследованиях влияния дозы антигенных композиций К. pneumoniae было показано, что если доза антигенной композиции К. Pneumoniae слишком мала, она не эффективна для лечения рака легкого. В таких исследованиях, результаты которых показаны на фигуре 24, обработку всех мышей (C57BL/6) антигенной композицией К. pneumoniae или PBS начинали в -10, -8, -6, -4 и - 2 день, используя следующие места инъекций (1-ая инъекция: вентральная паховая справа; 2-ая инъекция: вентральная подмышечная справа, 3-я инъекция: вентральная подмышечная слева; 4-ая инъекция: вентральная паховая слева и т.д.). Затем все мыши получали инокуляцию опухоли в дозе 3×105 клеток карциномы легких Льюис посредством внутривенной инъекция в латеральную хвостовую вену мышей. Дозы антигенных композиций или PBS были следующими: i) PBS 0,1 мл; ii) К. pneumoniae 0,1 мл, OD600=0,5; iii) К. pneumoniae 0,1 мл, OD600=0,05. Мыши продолжали получать обработку антигенными композициями К. pneumoniae или PBS в 2, 4, 6, 8, 10, 12, 14 и 16 день. Эксперимент заканчивали на 18 день; всех мышей умерщвляли, их легкие извлекали хирургическим путем, промывали в воде, взвешивали и затем помещали в жидкость Буэна для фиксации и подсчитывали через 24 часа. Как показано на фигуре 24, каждая точка данных представляет количество опухолевых узлов от одной мыши.
Результаты исследований QB28 и QB30 свидетельствуют, что экстремально высокие дозы антигенных композиций К: Pneumoniae являются неэффективными, возможно вследствие сверхстимуляции иммунной системы хозяина. Результаты таких исследований также свидетельствуют, что низкие дозы неэффективны, вероятно вследствие недостаточной стимуляции иммунной системы хозяина. ПРИМЕР 8: Исследования эффективности цисплатина Пытаясь исследовать распределение ролей между цисплатином и химиотерапией и дозами антигенных композиций К. pneumoniae, было осуществлено исследование QB38. Коротко, все мыши получали инокуляцию опухоли в дозе 3×105 клеток карциномы легких Льюис посредством внутривенной инъекции в латеральную хвостозую вену в 0 день исследования. После такой инокуляции всех мышей объединяли в одной клетки и затем распределяли по соответствующим клеткам случайным образом, чтобы избежать неравномерно распределенных данных. Утром +2 дня данного исследования мышам в группе обработки цисплатином инъецировали 10 мг/кг данного лекарственного средства внутрибрюшинно. Контрольным мышам инъецировали контроль (PBS). Затем во второй половине +2 дня данного исследования мыши получали антигенные композиции К. pneumoniae или PBS; такие инъекции продолжали на 4, 6, 8, 10 и 12 день. Исследование заканчивали на 14 день; затем всех мышей умерщвляли, их легкие извлекали хирургическим путем, промывали в воде, взвешивали и затем помещали в жидкость Буэна для фиксации и подсчитывали через 24 часа. Как показано на фигуре 25, каждая точка данных представляет количество опухолевых узлов от одной мыши в случае любых обработок: PBS, антигенными композициями К. pneumoniae, антигенными композициями К. pneumoniae в сочетании с цисплатином или отдельно цисплатином. Результаты, суммированные на фигуре 25, показывают, что меньше узлов было у мышей, обработанных антигенными композициями К. pneumoniae и цисплатином, по сравнению с мышами, обработанными только цисплатином, только антигенными композициями К. pneumoniae или контрольным PBS.
Следующее исследование предназначено для определения того, может ли терапия антигенной композицией К. pneumoniae работать в синергии с основанной на платине химиотерапией, чтобы увеличить выживаемость мышей, несущих опухоли легкого Льюис.Четыре группы по пять самок мышей C57BL/6 получали по 105 клеток карциномы легких Льюис внутривенно в 0 день. На 2 день группы 3 и 4 получали одну внутрибрюшинную дозу 10 мг/кг цисплатина. Начиная с 4 дня, мыши получали либо К. pneumoniae, либо плацебо (PBS) каждые 2 дня вплоть до смерти. Фигура 26 иллюстрирует выживаемость всех мышей, и в таблице показаны р-значения различных кривых выживаемости, вычисленные с использованием логарифмического рангового критерия. Обработка мышей только цисплатином увеличивала выживаемость мышей с опухолями легких, при этом медианная выживаемостью возрастала с 16 дней в группе PBS до 23 дней в группе PBS + цисплатин. Обработка только с использованием К. pneumoniae также увеличивала выживаемость мышей по сравнению с PBS (медианная выживаемость 19 дней в случае К. pneumoniae по сравнению с 16 днями в случае PBS). Наиболее важно, что химиотерапия цисплатином вместе с терапией К. pneumoniae приносила наибольшую терапевтическую пользу (медианная выживаемость 32 дня), что демонстрирует синергию между основанной на платине химиотерапией и терапией антигенными композициями в мышиной модели рака легкого. Р-значекия для данных, полученных в описанном исследовании QB4 5, показаны в таблице 19 ниже.

Как показано в данном примере, антигенные композиции можно применять в тот же день, что и цисплатин или в определенный период после введения цисплатина. В используемом в настоящем описании смысле термин «антигенная композиция» относится к композиции, которая содержит антигены одного или нескольких видов микроорганизмов. В используемом в настоящем описании смысле термин «виды микроорганизмов» может относиться к вирусному патогену или бактериальному патогену, или грибковому патогену, как подробно описано в настоящей публикации.
Следующее исследование предназначено для выяснения того, существует ли какая-либо синергия между основанной на платине химиотерапией и терапией антигенной композицией К. pneumoniae при лечении рака легкого у мышей. Все мыши получали 105 клеток карциномы легких Льюис внутривенно в 0 день. Мыши получали антигенные композиции или PBS подкожно каждые 2 дня, начиная с 0 дня. На 12 день некоторых мышей лечили цисплатином (10 мг/кг) внутрибрюшинно. На следующий день (13 день) у 3 мышей из каждой группы брали кровь и клетки крови красили анти-CD11b-антителом и анализировали, используя FACS. На графиках на фигуре 27 изображена частота встречаемости миелоидных клеток CD11b+ в крови на 13 день. Каждая точка представляет одну мышь. Результаты данного исследования показывают, что терапия антигенными композициями может увеличивать частоту миелоидных клеток (моноцитов, макрофагов, гранулоцитов, дендритных клеток) в крови в случае введения с цисплатином. Это может усиливать иммунитет у животных за счет большего количества таких природных миелоидных клеток, которые способны отвечать на опухоли или патогены. Кроме того, так как супрессия костного мозга является клинически важным побочным эффектом химиотерапевтического лечения с возникающим в результате уменьшением количества миелоидных клеток в крови, которое может приводить к откладыванию/прерыванию химиотерапии или к чувствительности к инфекции, то увеличение количества миелоидных клеток при терапии антигенными композициями во время химиотерапии может быть полезным для снижения риска такого важного и клинически значимого побочного эффекта химиотерапии.
ПРИМЕР 9: Исследования макрофагов (исследование MOA13)
Чтобы исследовать роль макрофагов в отношении вариантов осуществления изобретения осуществляли исследование MOA13. Коротко, мышам либо инокулировали 3×105 клеток карциномы легких Льюис, либо инъецировали HBSS в качестве контрольного наполнителя. В случае мышей, которым инокулировали клетки карциномы легких Льюис, их объединяли в одной клетке, откуда их затем переносили случайным образом в соответствующие клетки. Затем мышей обрабатывали либо антигенными композициями К. pneumoniae, либо PBS в 2, 4, 6 и 8 день. Затем всех мышей умерщвляли на 9 день. Чтобы получить информацию о частоте миелоидных и NK-клеток, хирургически извлекали легкие у 20 мышей (5 из каждой группы), и легкие расщепляли, используя либеразу TL и ДНКазу. После расщепления получения клеток готовили суспензию отдельных клеток. Затем часть клеток переносили в 96-луночный планшет с круглым дном для окрашивания с использованием специфичных для миелоидных клеток антител (CD11b+, NK1.1+) и специфичных для NK антител (NK1.1+, CD11b+). Для первого типа клеток использовали пропускание, чтобы отобрать только популяции клеток CD11b+ и NK1.1-. Затем осуществляли обработку данных о клетках, используя BD FACSCalibur, и анализ осуществляли, используя FlowJo. Статистический анализ и графическое представление осуществляли, используя Excel и GraphPad Prism. Результаты показаны на фигуре 28. Коротко, лечение антигенными композициями К. pneumoniae приводит к увеличению количества как миелоидных клеток (вероятно моноцитов и макрофагов), так и NK-клеток CD11b+ в легких мышей, подвергаемых такому лечению.
Фокусируя внимание на получении информации о цитокинах, продуцируемых в ткани легкого, проводили следующие эксперименты. Мышам либо инокулировали 3×105 клеток карциномы легких Льюис, либо инъецировали HBSS в качестве контрольного наполнителя. В случае мышей, которым инокулировали клетки карциномы легких Льюис, их объединяли в одной клетке, откуда их затем переносили случайным образом в соответствующие клетки. Затем мышей обрабатывали либо антигенными композициями К. pneumoniae, либо PBS в 2, 4, 6 и 8 день. Затем всех мышей умерщвляли на 9 день. Чтобы получить информацию о цитокинах в ткани легкого, осуществляли бронхоальвеолярный лаваж легких. Затем легкие хирургически извлекали сразу после лаважа и помещали в предварительно взвешенные флаконы, содержащие PBS и ингибиторы протеаз. Затем ткань легкого гомогенизировали, центрифугировали и надосадок наносили на наборы для ELISA (eBioscience); анализ ELISA осуществляли согласно руководству производителя. Статистический анализ и графическое представление осуществляли, используя Excel и GraphPad Prism. Данные представлены в виде пикограмм цитокина на миллиграмм исходной ткани легкого. Каждая точка данных на фигуре 29 представляет значение для одной мыши. Как показано на фигуре 29, лечение антигенными композициями К. pneumoniae приводит к увеличению продукции противоопухолевых цитокинов (IL-12, МСР-1, GMCSF, IL-6) в ткани легкого.
Фокусируя внимание на получение информации о продукции цитокинов в жидкости бронхоальвеолярного лаважа (BAL), проводили следующие эксперименты. Мышам либо инокулировали 3×105 клеток карциномы легких Льюис, либо инъецировали HBSS в качестве контрольного наполнителя. В случае мышей, которым инокулировали клетки карциномы легких Льюис, их объединяли в одной клетке, откуда их затем переносили случайным образом в соответствующие клетки. Затем мышей обрабатывали либо антигенными композициями К. pneumoniae, либо PBS в 2, 4, 6 и 8 день эксперимента. Затем всех мышей умерщвляли на 9 день. Чтобы получить информацию о цитокинах в легких, осуществляли бронхоальвеолярный лаваж легких мышей. Жидкость после лаважа помещали во флаконы и хранили при -80°С вплоть до момента осуществления анализа ELISA. Затеи осуществляли ELISA согласно руководству производителя. Статистический анализ и графическое представление осуществляли, используя Excel и GraphPad Prism. Данные представлены в виде пг/мл жидкости лаважа, как показано на фигуре 30. Каждая точка данных представляет значение, полученное для одной мыши. Как показано на фигуре 30, лечение антигенными композициями К. pneumoniae не оказывает влияния на продукцию цитокинов в жидкости бронхоальвеолярного лаважа.
Фокусируя внимание на исследовании фенотипов макрофагов М1/М2 в модели, описанной в настоящей публикации, наблюдали за уровнями NOS2 и Arg1 в легком. Эксперименты проводили следующим образом: коротко, мышам либо инокулировали 3×105 клеток карциномы легких Льюис, либо инъецировали HBSS в качестве контрольного наполнителя. В случае мышей, которым инокулировали клетки карциномы легких Льюис, их объединяли в одной клетке, откуда их затем переносили случайным образом в соответствующие клетки. Затем мышей обрабатывали либо антигенными композициями К. pneumoniae, либо PBS в 2, 4, 6 и 8 день эксперимента. Затем все;: мышей умерщвляли на 9 день. Чтобы получить информацию об экспрессии генов NOS2 и Arg1, у 2 0 мышей (5 из каждой группы) хирургически извлекали легкие. Затем небольшую часть таких легких отрезали, используя стерильный способ, и помещали в RNAlater, чтобы стабилизировать материал РНК для будущего анализа генов. Суммарную РНК экстрагировали из ткани легкого, используя набор Qiagen согласно протоколу производителя. Использовали набор для кДНК для превращения определенного количества РНК в кДНК (Qiagen), также следуя инструкциям производителя. к-ПЦР проводили, используя праймеры сконструированные для специфичной амплификации Nos2 и Arg1 (Nos2: прямой - CGCTTTGCCACGGACGAGA; обратный AGGAAGGCAGCGGGCACAT; Arg1: прямой - GGTCCACCCTGACCTATGTG; обратный -GCAAGCCAATGTACACGATG). Статистический анализ проводили, используя Excel и GraphPad Prism. Как показано на фигуре 31, лечение антигенными композициями К. pneumoniae приводит к увеличению соотношения Nos2/Arg1 в легких, которое коррелирует с повышенным противоопухолевым ответом.
Фокусируя внимание на изучении ответа М1/М2 в модели in vivo, описанной в настоящей публикации, исследовали экспрессию CD206 (рецептор маннозы). Коротко, мышам либо инокулировали 3×105 клеток карциномы легких Льюис, либо инъецировали HBSS в качестве контрольного наполнителя. В случае мышей, которым инокулировали клетки карциномы легких Льюис, их объединяли в одной клетке, откуда их затем переносили случайным образом в соответствующие клетки. Затем мышей обрабатывали либо антигенными композициями К. pneumoniae, либо PBS в 2, 4, 6 и 8 день эксперимента. Затем всех мышей умерщвляли на 9 день. Чтобы получить информацию об экспрессии CD206, у 20 мышей (5 из каждой группы) хирургически извлекали легкие и расщепляли, используя либеразу TL и ДНКазу. После расщепления получения клеток готовили суспензию отдельных клеток. Часть клеток переносили в 96-луночные планшеты с круглым дном для окрашивания с использованием специфичных для CD206 антител (клон MR5D3), приобретенных из Cedarlane Labs (Burlington, ON). Так как CD206 локализован как внутри клеток, так и снаружи клеток, клетки сначала фиксировали, используя параформальдегид, и красили антителом в растворе для пермеабилизации. Анализ осуществляли, используя FlowJo. Статистический анализ и графическое представление осуществляли, используя Excel и GraphPad Prism. Результаты показаны на фигуре 32. Как показано на фигуре 32, лечение антигенными композициями К. pneumoniae приводит к уменьшению экспрессии CD206 на макрофагах легких как в присутствии (PBS + LL2 и К. pneumoniae 1/10X+LL2), так и в отсутствие опухолей легких (PBS и К. pneumoniae 1/10Х). В присутствии злокачественной опухоли легкого антигенные композиции К. pneumoniae снижают частоту экспрессии CD206 примерно от 20% (группа PBS+LL2) до примерно 10% (группа К. pneumoniae 1/10X+LL2). Сходное снижение экспрессии CD206 наблюдали у животных, обработанных К. pneumoniae без рака легкого (PBS и К. pneumoniae 1/10Х).
Фокусируя внимание на исследовании фенотипов М1/М2 в модели in vivo, описанной в настоящей публикации, изучали э репрессию макрофагов F4/80+. Коротко, мышам либо инокулировали 3×105 клеток карциномы легких Льюис, либо инъецировали HBSS в качестве контрольного наполнителя. В случае мышей, которым инокулировали клетки карциномы легких Льюис, их объединяли в одной клетке, откуда их затем переносили случайным образом в соответствующие клетки. Затем мышей обрабатывали либо антигенными композициями К. pneumoniae, либо PBS в 2, 4, 6 и 8 день эксперимента. Затем всех мышей умерщвляли на 9 день. Чтобы получить информацию об экспрессии F4/80+ в макрофагах, у 20 мышей (5 из каждой группы) хирургически извлекали легкие и расщепляли, используя либеразу TL и ДНКазу. После расщепления получения клеток готовили суспензию отдельных клеток. Часть клеток переносили в 96-луночные планшеты с круглым дном для окрашивания с использованием моноклональных антител F4/80. Получение данных о клетках осуществляли, используя BD FACSCalibur. Анализ осуществляли, используя FlowJo. Статистический анализ и графическое представление осуществляли, используя Excel и GraphPad Prism. Как показано на фигуре 33, лечение антигенными композициями К. pneumoniae приводит к снижению количества макрофагов F4/80+ в легких. Полагают, что такое снижение коррелирует с уменьшением количества М2-подобных макрофагов.
ПРИМЕР 10: Исследование сайт-специфичности (исследование МОА14)
Фокусируя внимание на исследовании фенотипов М1/М2 в модели in vivo, описанной в настоящей публикации, которую использовали вместе с антигенными композициями, описанными в настоящей публикации, осуществляли следующие эксперименты. Коротко, 5 мышей в каждой группе обрабатывали в 0, 2, 4 и 6 день либо PBS, либо антигенными композициями Е. coli ободочной кишки, либо антигенными композициями К. pneumoniae. На 7 день эксперимента мышей умерщвляли и осуществляли бронхоальвеолярный лаваж. Затем легкие и проксимальный отдел ободочной кишки извлекали и расщепляли ферментами. После расщепления извлеченные клетки промывали и красили антителами, специфичными для I-A/I-E с ФИТЦ (МНС класса II; М5/114.15.2); анти-Gr-1 PE (RB6-8C5_; анти-CD11b PerCP-Cy5 (М1/70); анти-CD11c АРС (N418). Все антитела приобретали из eBioscience (San Diego, СА). Клетки легких подсчитывали, чтобы определить общее количество клеток (клетки ободочной кишки не подсчитывали, так как авторы не извлекали равные количества ободочной кишки в разных образцах). После окрашивания в течение 20 минут клетки промывали и анализировали, используя FACS. Каждая точка данных, показанная на соответствующей фигуре 34, представляет частоту встречаемости клеток CD11b+Gr-1+ среди пропускаемых живых клеток для. одной мыши. Как показано на фигуре 34, лечение антигенными композициями Е. coli приводит к повышенной частоте встречаемости воспалительных моноцитов в ободочной кишке у подвергнутых обработке мышей.
Кроме того, и как показано на фигуре 35, когда моноциты в легких исследовали на основе экспериментальных способов, подробно описанных в настоящей публикации, было обнаружено, что хотя антигенные композиции и Е. coli и К. pneumoniae увеличивали частоту встречаемости моноцитов в легких мышей, антигенные композиции К. pneumoniae были более эффективными, судя по подсчетам общего количества. Как видно на фигуре 35, на левой панели показана частота встречаемости клеток CD11b+Gr-1+ (воспалительные моноциты) клетки в легких; на правой панели показано общее количество клеток CD11b+Gr-1+ в легком.
Пытаясь определить фенотип макрофагов, присутствующих в опухолях, с использованием модели in vivo, описанной в настоящей публикации, которую использовали наряду с антигенными композициями, описанными в настоящей публикации, исследовали М1-подобные и М2-подобные макрофаги. Как видно на фигуре 35, представлена частота встречаемости M1-подобных (смотри левую панель на фигуре 36) ТАМ (ассоциированных с тканью макрофагов) или М2-подобных (смотри правую панель на фигуре 36) в подкожных опухолях 4Т1 на 8 день после имплантации опухолей. Как подробно описано в настоящей публикации, M1-подобные макрофаги определяли как макрофаги с высоким содержанием CD11b+/Gr-1-/MHC Класса II; М2-подобные макрофаги определяли как макрофаги с низким содержанием CD11 b+/Gr-1-/MHC Класса II.
ПРИМЕР 11: Исследования эффективности индометацина и противовоспалительных средств
Осуществлена попытка исследовать сочетания лечения антигенными композициями с лечением индометацином. Коротко, проводили эксперименты, в которых использовали по 10 или 11 мышей в каждой из 4 групп для всех обработок, начиная с 4 дня после инокуляции опухолей. Все мыши получали 50000 клеток карциномы молочной железы 4Т1 подкожно в 0 день. Затем 4 группы обрабатывали следующим образом: 1) индометацин ежедневно (в питьевой воде) + PBS подкожно каждые 2 дня; 2) индометацин ежедневно (в питьевой воде) + антигенная композиция S. aureus подкожно каждые 2 дня; 3) контрольный наполнитель ежедневно (в питьевой воде) + PBS подкожно каждые 2 дня; и 4) контрольный наполнитель ежедневно (в питьевой воде) + антигенная композиция S. aureus подкожно каждые 2 дня. Что касается фигуры 37, то на левой панели фигуры показан объем опухолей в различных группах на 15 день эксперимента. На правой панели показана частота встречаемости и состав клеток CD11b+ в опухолях на 11 день эксперимента. Частота встречаемости клеток CD11b+ значило возрастала в обеих группа, обработанных индометацином, по сравнению с контролем. Полученные результаты показывают, что эффективность сочетания антигенных композиций Staph, aureus с противовоспалительными средствами, такими как индометацин. Кроме того и как показано на фигуре 38 в настоящем описании, во временной точке 22 дня лечение индометацином приводило к увеличению количества клеток CD11b+.
Чтобы дополнительно исследовать эффективность сочетания лечения антигенными композициями с индометацином осуществляли следующее исследование. Коротко, четыре (4) группы по 10-11 мышей Balb/c на группу получали 10000 клеток карциномы 4Т1 подкожно в 0 день. Затем осуществляли следующие обработки: первая группа получала индометацин (14 мкг/мл в воде), начиная с 4 дня + PBS в 4, 6, 8 дни и т.д.; вторая группа, получала индометацин (14 мкг/мл в воде) и антигенные композиции S. aureus [0,1 мл исходного раствора 0,5 OD 600 нм], начиная с 4 дня + PBS в 4, 6, 8 дни и т.д.; третья группа получала PBS в 4, 6, 8 дни и т.д.; и четвертая группа получала антигенные композиции 5. aureus [0,1 мл исходного раствора 0,5 0D 600 нм] в 4, 6, 8 дни и т.д. Измерения объема опухолей осуществляли в 15, 19 и 22 дни, и полученные данные представлены на фигуре 39 для четырех (4) групп мышей. Данные, изображенные на фигуре 39, показывают, что имеет место синергия между лечением антигенными композициями и противовоспалительными средствами (например, индометацином) в модели подкожной злокачественной опухоли.
На 11 день эксперимента, подробно описанного выше, опухоли вырезали и расщепляли. Затем расщепленные опухоли красили анти-CD11b и анализировали с использованием FACS (n=3 на группу мышей). Результаты изображены на фигуре 40 в настоящей публикации и демонстрируют, что имеет место повышенная частота встречаемости клеток CD11b+ в опухолях мышей, обработанных индометацином, на 11 день после инокуляции.
На 22 день эксперимента, подробно описанного выше, опухоли вырезали и расщепляли. Затем расщепленные опухоли красили анти-CD11b и анализировали, используя FACS (n=7-8 на группу мышей). Результаты изображены на фигуре 41 в настоящей публикации и демонстрируют, что имеет место повышенная частота встречаемости клеток CD11b+ в опухолях мышей, обработанных индометацином, на 22 день после инокуляции. Кроме того, фигура 42 демонстрирует, что лечение индометацином вызывает увеличение количества миелоидных клеток CD11b+CD94+ в опухолях, которое обнаруживается на 22 день после инокуляции.
Чтобы дополнительно исследовать, ассоциировано ли лечение антигенными композициями с противовоспалительным ответом, на 22 день эксперимента, описанного выше, образцы целых опухолей подвергали количественной ПЦР известными способами. Мишенями были генные продукты Fizzl и Ym1. Сообщается, что Fizz и Ym1 ассоциированы с макрофагами М2 (смотри, например, Wong с соавторами, (2010) Eur. J. Immunol. 40(8): 2296-307). Результаты изображены на фигуре 43 в настоящей публикации. Как показано на фигуре 43, относительная экспрессия Fizz1 и Ym1 увеличивалась в опухолях в случае лечения и индометацином и антигенными композициями (по сравнению, например, с лечением одним индометацином).
Относительные уровни экспрессии Arg1 и Fizz1 исследовали в опухолях и селезенках мышей на 22 день эксперимента. Как показано на фигуре 44, экспрессия и Arg1 и Fizz1 возрастала в селезенках мышей, обработанных индометацином и антигенными композициями. Относительные уровни экспрессии Nos2 и Ym1 исследовали в опухолях и селезенках мышей на 22 день эксперимента. Относительные уровни экспрессии изображены на фигуре 45 в настоящей публикации для четырех (4) групп мышей.
Чтобы исследовать противовоспалительный ответ, ассоциированный с лечением антигенными композициями, осуществляли эксперимент следующего дизайна. Коротко, мыши получали опухоли легкого Льюис в 0 день [PBS и антигенная композиция К. pneumoniae] или не получали опухолей [PBS (без опухоли)] или антигенной композиции К. pneumoniae (без опухоли)]. Мыши получали антигенную композицию К. pneumoniae [0,1 ил исходного раствора 0,5 OD 500 нм] или PBS в 2, 4, 6, 8 день. Мышей умерщвляли на 9 день и их легкие извлекали и гомогенизировали. IFNγ измеряли в гомогенате легких, используя ELISA. Результаты показаны на фигуре 4 6 в настоящей публикации. Лечение антигенной композицией К. pneumoniae снижало продукцию IFNγ в легких мышей с опухолями и без опухолей легких.
Чтобы дополнительно исследовать противовоспалительный ответ, ассоциированный с лечением антигенными композициями, осуществляли эксперимент следующего дизайна. Коротко, макрофаги костного мозга культивировали в течение ночи либо в среде, либо в среде с добавлением ЛПС, либо в среде с добавлением антигенных композиций К. pneumoniae. Среду тестировали в отношений IL-I2 и IL-10. Результаты показаны на фигуре 47 в настоящей публикации и демонстрируют, что IL-12 не был выявлен. Как показано на фигуре 47, макрофаги костного мозга, культивируемые в течение ночи с антигенными композициями К. pneumoniae, продуцировали IL-10. Известно, что IL-10 ассоциирован с противовоспалительным ответом (смотри, например, Bazzoni с соавторами, (2010) Eur. J. Immunol. 40(9): 2360-8).
Чтобы дополнительно исследовать противовоспалительный ответ, ассоциированный с лечением антигенными композициями, осуществляли эксперимент следующего дизайна. Коротко, использовали модель опухоли 4Т1, чтобы определить эффекты терапии антигенными композициями Staph, aureus (SA), работающими синергетически с противовоспалительным лекарственным средством индометацином. В данном исследовании использовали четыре (4) группы по 10 самок мышей Ba1b/c, которые все получали 50000 клеток карциномы молочной железы 4Т1 подкожно в 0 день. Группа 1 получала PBS подкожно каждые 2 дня, начиная с 4 дня.. Группа 2 получала SA [0,1 мл 0,5 OD 600 нм] подкожно каждые 2 дня, начиная с 4 дня. Группы 3 и 4 получали 14 мкг/мл индометацина в питьевой воде и подкожно получали PBS и SA, соответственно, каждые 2 дня, начиная с 4 дня. На 22 день мышей умерщвляли и собирали опухоли от 7-8 мышей на группу и помещали в консервант РНК. Затем авторы анализировали экспрессию IL-10 в опухолях, используя ПЦР в реальном времени. Результаты на фигуре 4 8 показывают, что у мышей, обработанных индометацином; и PBS наблюдалось значимое повышение экспрессии IL-10 в опухолях. Обработка индометацином и SA приводила даже к большему количеству IL-10, что свидетельствует о том, что SA усиливает противовоспалительные эффекты индометацина в данной модели опухоли. Так как широко известно, что IL-10 является противовоспалительным цитокином, полученные результаты демонстрируют, что SA работает синергетически с индометацином, оказывая противовоспалительное действие. Важно отметить, что опухоли в группе, обработанной PBS, были наибольшими, затем следовала группа, обработанная SA, и группа, обработанная индометацином-PBS. Опухоли в группе, обработанной индометацином-SA, были самыми маленькими на 22 день. Противовоспалительные свойства, подробно описанные в настоящей публикации, можно использовать в случае применения против различных воспалительных заболеваний (смотри таблицу 20 в настоящей публикации).









ПРИМЕР 12: Исследования воспалительного заболевания кишечника
Данный пример иллюстрирует клинически эффективное применение антигенного препарата, содержащего убитые Е. coli, для лечения пациента с болезнью Крона в течение трехмесячного курса лечения. В ходе лечения у пациента исчезли симптомы, и он прекратил применение противовоспалительных средств.
Пациент при первичном осмотре сообщил о боли в области толстого кишечника, несмотря на лечение преднизоном и имураном™.
Лечение начинали с подкожной прививки препарата целых убитых Е. coli, полученных из штамма Е. coli, собранного у пациента с инфекцией Е. coli в ободочной кишке. Схема дозирования включала подкожную дозу каждый второй день, начиная с дозы 0,05 мл, постепенно увеличивая объем до получения кожной светло-розовой/красной реакции диаметром 2 дюйма (5,08 см) в течение 24 часов после инъекции в месте инъекции. В конечном итоге доза, необходимая для достижения такой кожной реакции у данного пациента составляла 0,09-0,11 мл, и такую дозу продолжали вводить в качестве поддерживающей дозы каждый второй день.
Через неделю после начала лечения антигенным препаратом целых убитых Е. coli пациент сообщил, что боль пропала. Примерно через два месяца пациент прекратил лечение преднизоном, хотя продолжал принимать ежедневные дозы 150 мг имурана™. Затем пациент также прекратил применение имурана™.
Через два месяца после начала лечения композицией Е. coli пациент самостоятельно вводил по 0,09-0,11 мл препарата Е. coli через день. Пациент сам корректировал такую дозу так, чтобы вызывать локальную воспалительную реакцию, видимую по розовому пятну диаметром примерно 2 дюйма (5,08 см), которое существовало в месте введения в течение примерно двух дней.
ПРИМЕР 13: Исследования грибов
Проводили эксперименты с использованием модельной системы на легких мышей, подробной описанной в настоящей публикации, в которых определили, что у мышей, которые получали воду с примесями конкретного вида гриба (Penicillium marneffei), который, как известно, вызывает респираторную инфекцию как у мышей, так и у человека, наблюдается сниженная опухолевая нагрузка, как было показано и как обсуждалось в связи с бактериальными патогенами легких.
Известно, что многие виды грибов ассоциированы с различными органами или тканями, которые подробно описаны в таблице 21 ниже, так что вода с примесями видов грибов также может быть использована. Соответственно и на основании принципов проведения эксперимента, подробно описанных в настоящей публикации, специфичность, показанная в настоящей публикации в отношении бактериальных и вирусных патогенов, может также быть распространена на грибковые патогены.


ДРУГИЕ ВАРИАНТЫ
Хотя различные варианты осуществления изобретения раскрыты в настоящей публикации, может быть осуществлено множество доработок и модификаций в объеме изобретения в соответствии с общеизвестными для специалистов в данной области сведениями. Такие модификации включают замену известными эквивалентами любого аспекта изобретения для достижения того же результата по существу таким же путем. Числовые диапазоны включают числа, определяющие диапазон. В описании слово «содержащий» используют в качестве не ограниченного термина, по существу эквивалентного фразе «включающий без ограничения», и слова «содержит» имеет соответствующее смысловое значение. Цитирование публикаций в настоящем описании не следует толковать как признание того, что такие публикации составляют известный уровень техники по отношению к настоящему изобретению. Все публикации включены в настоящее описание в виде ссылки также как в случае, когда специально и отдельно указано, что каждая отдельная публикация включена в виде ссылки в настоящее описание, и как будто полностью приведена в настоящей публикации. Изобретение включает все варианты и изменения, которые по существу описаны выше, вместе с примерами и чертежами.
Реферат
Изобретение относится к медицине и может быт использовано для лечения индивидуума, страдающего язвенным колитом. Для этого индивидууму вводят эффективное количество антигенной композиции, содержащей целые убитые клетки Е. coli. При этом композицию применяют внутрикожно или подкожно в виде последовательно вводимых доз с интервалом между дозами по меньшей мере один час. Изобретение обеспечивает применение противовоспалительной композиции для лечения язвенного колита у индивидуума. 12 з.п. ф-лы, 48 ил., 10 табл., 13 пр.

Комментарии