Протеазы для фармацевтического применения - RU2420578C2
Код документа: RU2420578C2
Чертежи















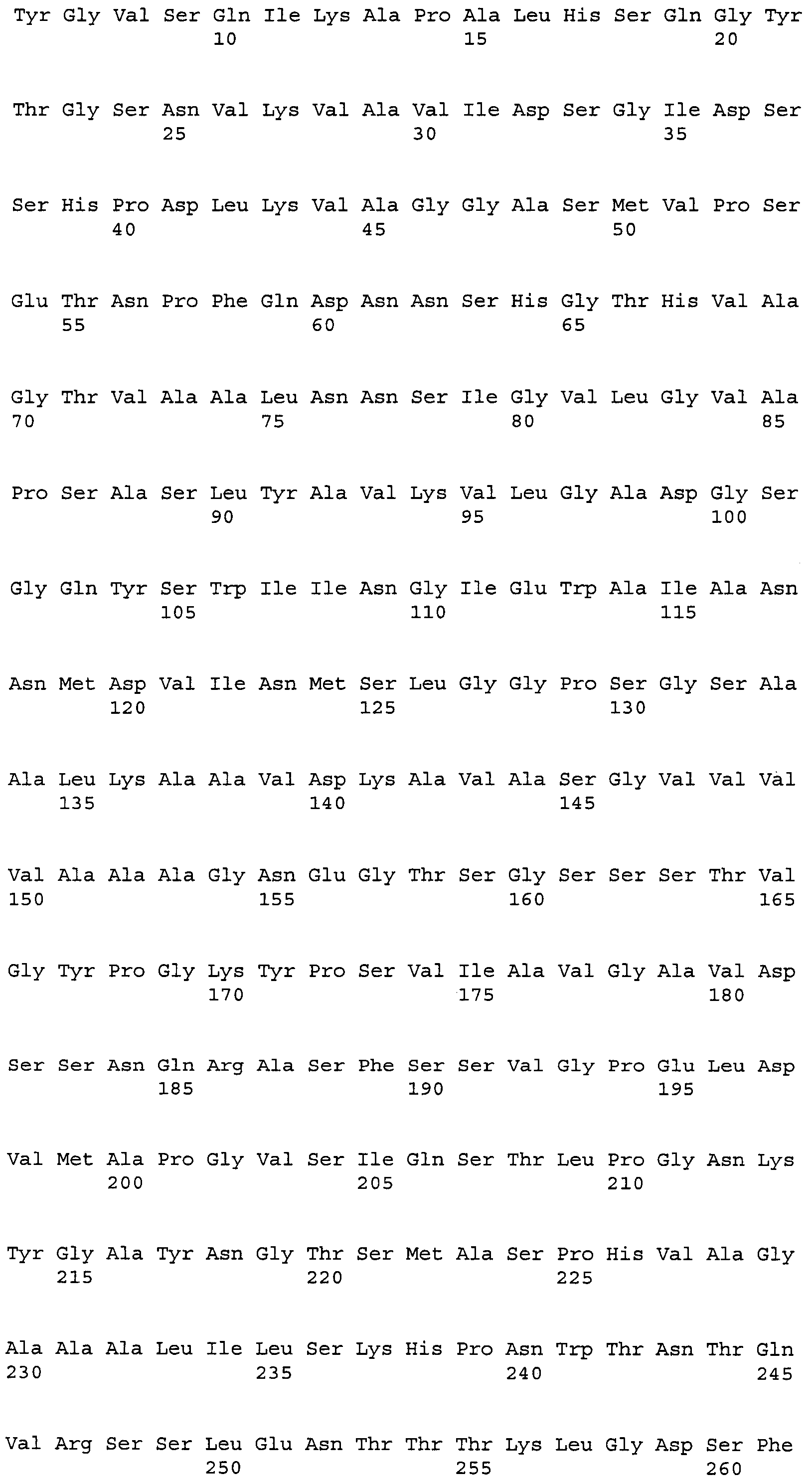










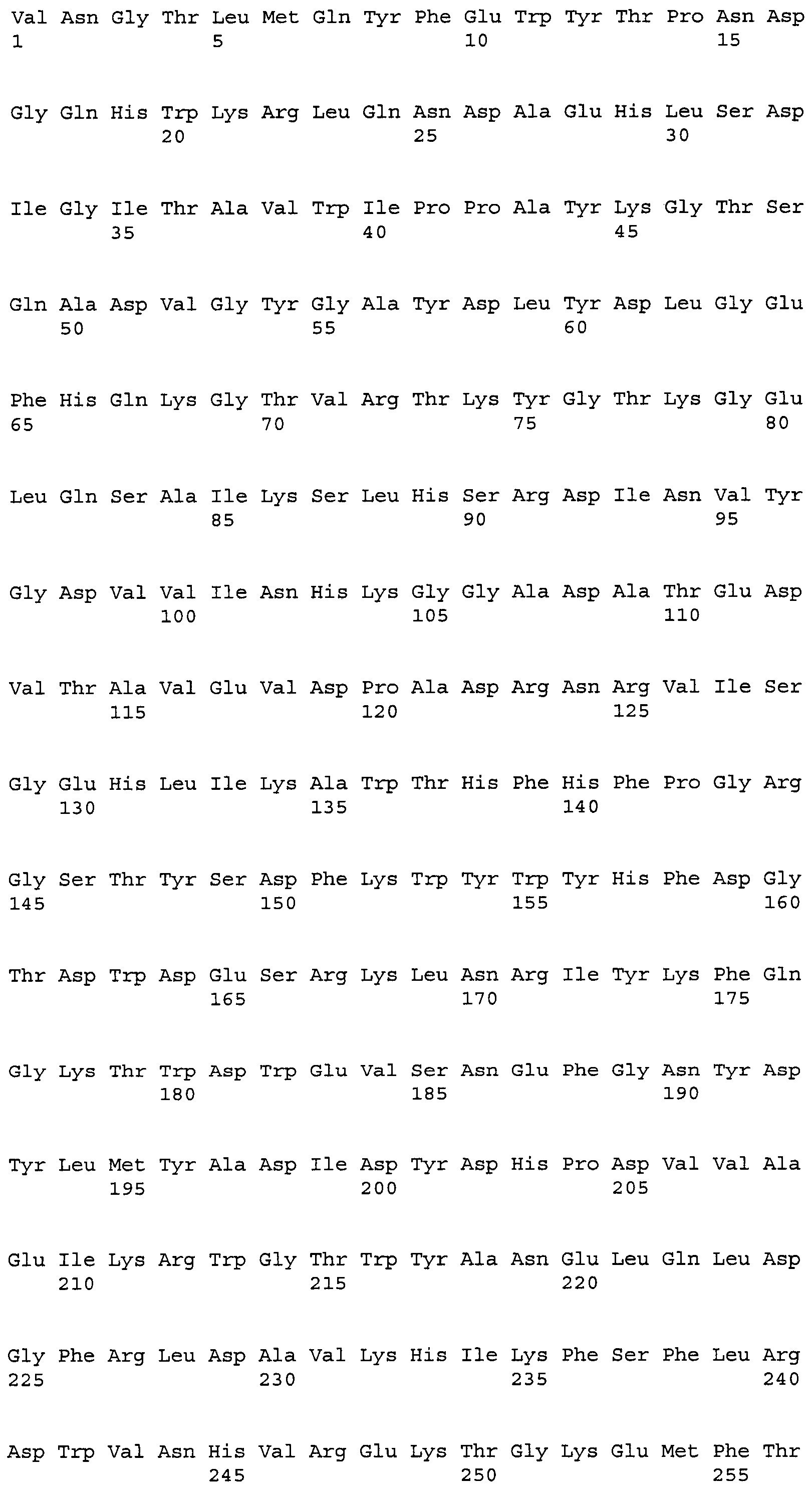



Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическому применению протеаз, относящихся к сериновой протеазе, происходящей из Bacillus licheniformis (аминокислоты 1-274 SEQ ID NO: 2), необязательно в сочетании с липазой и/или амилазой. Примерами медицинских показаний является лечение нарушений пищеварения, недостаточности экзокринной функции поджелудочной железы (PEI), панкреатита, кистозного фиброза, диабета I типа и/или диабета II типа.
Известный уровень техники
Известно несколько имеющихся в продаже лекарственных препаратов в форме добавок панкреатических ферментов для лечения недостаточности экзокринной функции поджелудочной железы. Активными ингредиентами этих продуктов являются пищеварительные ферменты, главным образом, амилаза, липаза и протеаза, которые обычно продуцируются в поджелудочной железе и экскретируются в верхнюю часть тонкого кишечника (двенадцатиперстную кишку). Ферменты, применяемые в таких лекарственных препаратах, происходят из поджелудочной железы быка или свиньи, однако на рынке существуют также продукты с микробными ферментами, например, продукт Nortase®, который содержит липазу из Rhiropus oryzae, протеазу из Aspergillus oryzae и амилазу из Aspergillus oryzae.
В US 5614189 (EP 600868) описывается применение, среди прочего, липазы, происходящей из Humicola lanuginose, в заместительной терапии панкреатическими ферментами, например, при лечении больных, страдающих кистозным фиброзом. Эта липаза происходит из Humicola lanuginosa DSM 4109 и имеет аминокислотную последовательность из аминокислот 1-269 SEQ ID NO: 14.
В публикации WO 00/54799 описывается применение физиологически приемлемых смесей ферментов, обладающих липолитической, протеолитической и амилолитической активностью при лечении сахарного диабета I и II типа.
В публикации WO 02/060474 описывается применение концентрированной липазы из Rhizopus delemar, нейтральной липазы из Aspergillus melleus и амилазы из Aspergillus oryzae при лечении нарушений пищеварения.
В публикации WO 01/62280 описывается применение определенного кристалла негрибковой липазы, поперечно сшитого с многофункциональным поперечно сшивающим агентом, протеазой и амилазой, где кристалл липазы активен в диапазоне рН от 2,0 до 9,0, для лечения или профилактики нарушения желудочно-кишечного тракта у млекопитающего. Предпочтительной является липаза из Pseudomonas, предпочтительными являются амилазы из Bacillus или Aspergillus, предпочтительными протеазами являются бромелайн, папаин или фицин.
В EP 0828509 описывается применение некоторых кислотоустойчивых амилаз необязательно в сочетании с некоторыми кислотоустойчивыми липазами и/или протеазами для лечения недостаточности экзокринной функции поджелудочной железы. Предпочтительной является амилаза из Aspergillus niger, и предпочтительными являются липазы из Rhizopus arrhizus или Rhizopus javanicus.
В публикации WO 91/00345 описывается ряд сериновых субтилизиновых протеаз и их улучшенные варианты для применения в композициях детергентов.
В публикации WO 2005/115445 (опубликованной после дат приоритета настоящей заявки) описывается фармацевтическое применение протеаз, относящихся к протеазе, происходящей из Nocardiopsis sp. NRRL 18262 (эта протеаза имеет аминокислотную последовательность аминокислот 1-188 SEQ ID NO: 1 в этой ссылке), необязательно в сочетании с липазой и/или амилазой. Медицинские показания являются теми же, что и в настоящем изобретении.
В публикации WO 02/077187 раскрываются варианты субтилизина Bacillus amyloliquefaciens, обладающие измененным Т-клеточным эпитопом, и различное их применение. Заявляются фармацевтические композиции.
В публикации WO 01/12795 раскрывается фармацевтическое применение композиций протеолитических ферментов. Предпочтительными являются протеазы из Aspergillus oryzae, Aspergillus niger, Aspergillus sojae, Aspergillus flavus, Aspergillus awamori или Bacillus subtilis.
В публикации WO 2004/078773 раскрывается, как поддерживать протеазы, такие как субтилизиновые протеазы, в неактивном состоянии, которые можно активировать при необходимости с помощью внешнего сигнала. Среди других вариантов применения раскрыто применение просубтилизина в составах для очищения ран и как вызвать образование активного субтилизина. Предпочтительный протеазный фермент представляет собой ProD-субтилизин или ProD-нагруженный субтилизин (Yabuta et al., J. Biol. Chem. 278:15246-51, 2003).
В US 2002/0081703 раскрывается способ снижения аллергенности белков, происходящих не от человека, где эпитоп идентифицируется и замещается на аналогичную область в субтилизине человека. Заявляются фармацевтические композиции, включающие субтилизин человека.
В данной области техники существует потребность в альтернативных, предпочтительно улучшенных ферментах для фармацевтического применения, в частности для указанных выше медицинских показаний.
Краткое изложение сущности изобретения
В настоящем изобретении предлагаются альтернативные, предпочтительно улучшенные ферменты для фармацевтического применения, в частности для лечения нарушений пищеварения, недостаточности экзокринной функции поджелудочной железы (PEI), панкреатита, кистозного фиброза, диабета I типа и/или диабета II типа. Новые ферменты представляют собой протеазы, амилазы и липазы. Предпочтительно ферменты для применения в соответствии с изобретением имеют улучшенную эффективность in vivo и/или in vitro; улучшенный профиль рН-стабильности; улучшенный профиль рН-активности; являются стабильными в отношении разрушения протеазами; являются стабильными в присутствии солей желчных кислот; и/или имеют пониженную аллергенность.
Настоящее изобретение относится к протеазе с, по меньшей мере, 50% идентичностью с аминокислотами 1-274 SEQ ID NO: 2, для применения в качестве лекарственного средства, необязательно в сочетании с липазой и/или амилазой.
Изобретение также относится к применению таких протеаз для получения лекарственного средства для лечения нарушений пищеварения, PEI, панкреатита (острого и/или хронического), кистозного фиброза, диабета I типа и/или диабета II типа, эти применения необязательно дополнительно включают применение липазы и/или амилазы.
Изобретение дополнительно относится к фармацевтической композиции, включающей такие протеазы, совместно с, по меньшей мере, одним фармацевтически приемлемым дополнительным веществом, необязательно включающим липазу и/или амилазу.
Изобретение также относится к способу лечения нарушений пищеварения, PEI, панкреатита (острого и/или хронического), кистозного фиброза, диабета I типа и/или диабета II типа с помощью введения терапевтически эффективного количества таких протеаз, необязательно совместно с липазой и/или амилазой.
Подробное описание изобретения
Ферменты
Настоящее изобретение относится к фармацевтическому применению протеаз, обладающих, по меньшей мере, 50% идентичностью с протеазой с аминокислотами 1-274 SEQ ID NO: 2, сериновой протеазой, происходящей от Bacillus licheniformis, которая также обозначается как субтилизин Карлсберга. Изобретение также относится к применению таких протеаз для получения лекарственного средства для лечения нарушений пищеварения, PEI, панкреатита, кистозного фиброза, диабета I типа и/или диабета II типа. Изобретение дополнительно относится к фармацевтической композиции, включающей такие протеазы, совместно с, по меньшей мере, одним фармацевтически приемлемым дополнительным веществом, а также к способу лечения указанных выше заболеваний с помощью введения терапевтически эффективного количества таких протеаз.
В последующем протеазы для применения в композициях, способах и применениях по изобретению обозначаются как «протеазы по изобретению».
В предпочтительных осуществлениях протеаза по изобретению имеет степень идентичности с аминокислотами 1-274 SEQ ID NO: 2, по меньшей мере, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59% или, по меньшей мере, 60%. В других предпочтительных осуществлениях протеаза по изобретению имеет степень идентичности с аминокислотами 1-274 SEQ ID NO: 2, по меньшей мере, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69% или, по меньшей мере, 70%. В еще одних предпочтительных осуществлениях протеаза по изобретению имеет степень идентичности с аминокислотами 1-274 SEQ ID NO: 2, по меньшей мере, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79% или, по меньшей мере, 80%. В дополнительных предпочтительных осуществлениях протеаза по изобретению имеет степень идентичности с аминокислотами 1-274 SEQ ID NO: 2, по меньшей мере, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89% или, по меньшей мере, 90%. В наиболее предпочтительных осуществлениях протеаза по изобретению имеет степень идентичности с аминокислотами 1-274 SEQ ID NO: 2, по меньшей мере, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99%.
Термин «протеаза» определяется здесь как фермент, который гидролизует пептидные связи. Он включает любой фермент, принадлежащий к группе ферментов EC 3.4 (включая каждый из тринадцати ее подклассов, эти ферменты будут в последующем обозначаться как «принадлежащие к группе EC 3.4.-.-.»). Номер EC относится к номенклатуре ферментов 1992 из NC-IUBMB, Academic Press, San Diego, California, включая приложения 1-5, опубликованные в Eur. J. Biochem. 1994, 223, 1-5; Eur. J. Biochem. 1995, 232, 1-6; Eur. J. Biochem. 1996, 237, 1-5; Eur. J. Biochem. 1997, 250, 1-6; и Eur. J. Biochem. 1999, 264, 610-650; соответственно. Номенклатура регулярно дополняется и обновляется; см., например, World Wide Web на http://www.chem.qmw.ac.uk/iubmb/enzyme/index.html.
Протеазы подразделяются на основе их каталитического механизма на следующие группы: сериновые протеазы (S), цистеиновые протеазы (C), аспарагиновые протеазы (A), металлопротеазы (M) и неизвестные или еще не классифицированные протеазы (U), см. Handbook of Proteolytic Enzymes, A.J.Barrett, N.D.Rawlings, J.F.Woessner (eds), Academic Press (1998) (в последующем именуемое как «руководство»), особенно общую часть введения.
В другом осуществлении протеаза по изобретению представляет собой сериновую протеазу. Термин сериновая протеаза относится к сериновым пептидазам и их группам, как определено в руководстве, см. в частности главы 1-175. Сериновая протеаза представляет собой пептидазу, в которой каталитический механизм зависит от гидроксильной группы серинового остатка, действующего как нуклеофил, который разрушает пептидную связь.
В еще одном изобретении протеаза по изобретению представляет собой субтилизин и/или происходит из семейства субтилизина. Термины субтилизин или семейство субтилизина включают все сериновые протеазы группы SB, в особенности их семейство S8 (группа SB рассматривается в главе 93 руководства). Для определения того, является ли данная протеаза субтилизином или нет, делается ссылка на руководство и указанные в нем принципы. Такое определение может быть осуществлено для всех типов протеаз, являются ли они природными протеазами или протеазами дикого типа; или генетически сконструированными или синтетическими протеазами. В конкретном осуществлении порядок каталитической триады в протеазе по изобретению представляет собой Asp-His-Ser. В другом конкретном осуществлении третичная структура протеазы по изобретению включает как альфа-спирали, так и бета-складки. Группа SB включает эндопептидазы и экзопептидазы. В еще одном конкретном осуществлении протеаза по изобретению представляет собой эндопептидазу. Эндопептидазы проявляют активность в отношении пептидных субстратов, блокированных на N- и C-конце, что существенно для специфичности рассматриваемой протеазы.
В конкретном осуществлении протеаза по изобретению не представляет собой ProD-субтилизин или Pro-D-нагруженный субтилизин (Yabuta et al., J. Biol. Chem. 278:15246-51, 2003). В другом конкретном осуществлении протеаза по изобретению не представляет собой субтилизин Bacillus subtilis дикого типа и/или не происходит от Bacillus subtilis.
Соответственно, в первом аспекте протеаза по изобретению выбрана из группы, состоящей из: (a) протеаз, принадлежащих к группе ферментов EC 3.4.-.-.; (b) сериновых протеаз; (c) субтилизиновых протеаз или пептидаз группы SB; и (d) субтилизиновых протеаз семейства S8.
Во втором аспекте протеаза по изобретению происходит из микроорганизма, например, из грибка или из бактерии. Примерами бактерий являются штаммы Bacillus, такие как штаммы Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus clausii, Bacillus circulans, Bacillus coagulans, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus mesentericus, Bacillus natto, Bacillus pumilus, Bacillus sp., Bacillus stearothermophilus, Bacillus subtilis, Bacillus subtilis var natto или Bacillus thuringiensis; в особенности штаммы Bacillus amyloliquefaciens, Bacillus clausii, Bacillus lentus, Bacillus licheniformis, Bacillus mesentericus, Bacillus natto, Bacillus pumilus, Bacillus sp., Bacillus stearothermophilus, Bacillus subtilis или Bacillus subtilis var natto; предпочтительно штамм Bacillus licheniformis. В этом контексте термин «происходящий из» включает ферменты, доступные или получаемые из штаммов дикого типа; а также предпочтительно их варианты, имеющие, по меньшей мере, одну замену, вставку и/или делецию, по меньшей мере, одного аминокислотного остатка. Термин вариант также включает ферменты с перетасованными фрагментами, гибридные, химерные ферменты и консенсусные ферменты. Варианты могут быть получены с помощью любого способа, известного в данной области техники, такого как сайт-направленный мутагенез, неспецифический мутагенез, способы консенсусной дериватизации (EP 897985) и перетасовка генов (WO 95/22625, WO 96/00343) и т.д.
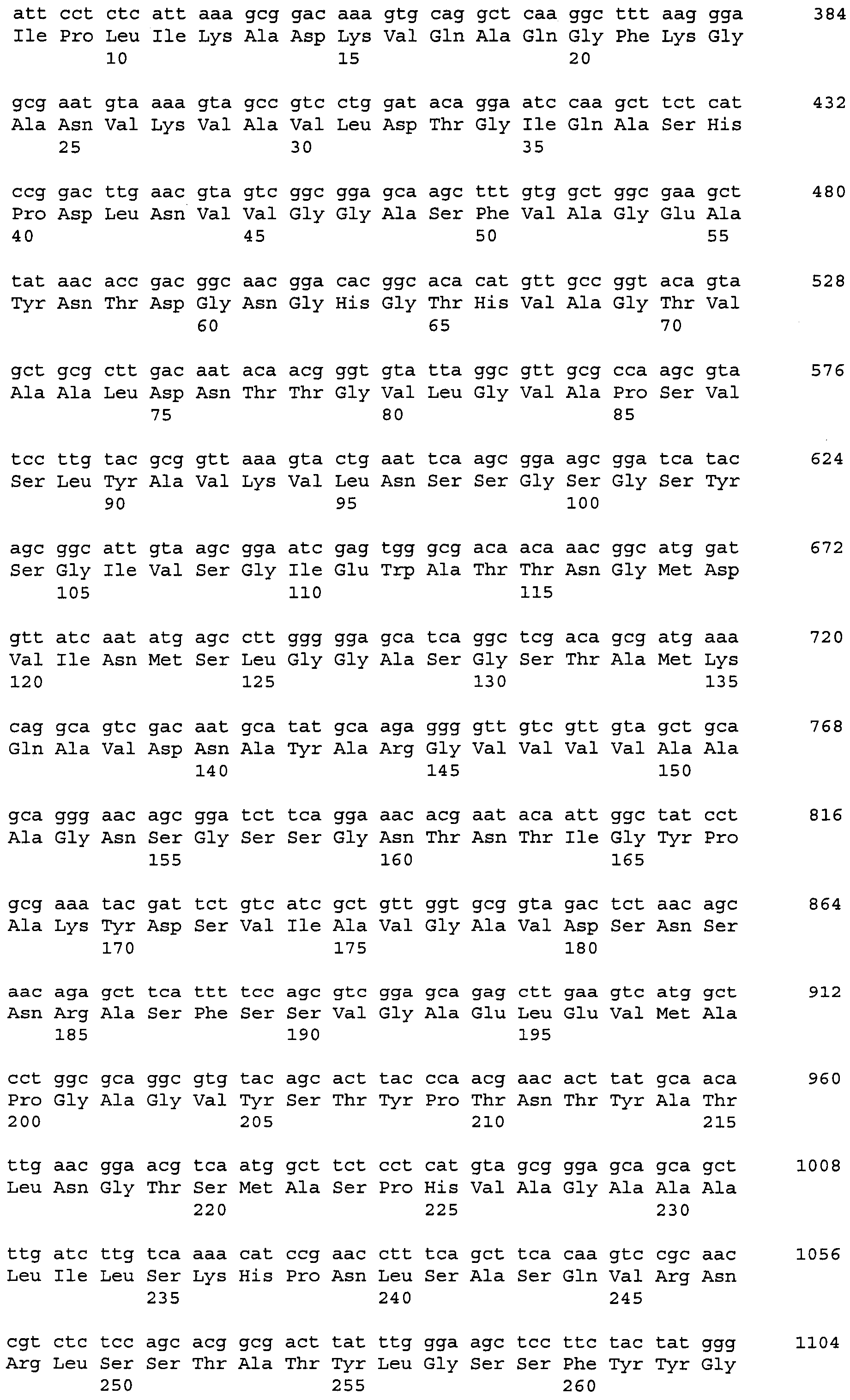
Последующее представляет собой примеры протеаз по изобретению, происходящих из штаммов Bacillus и относящихся к протеазе с аминокислотами 1-274 SEQ ID NO: 2: Swissprot subt_bacli, № доступа P00780 (происходящей из Bacillus licheniformis, аминокислоты 1-274 SEQ ID NO: 5); Swissprot subn_bacna, № доступа P35835 (происходящей из Bacillus natto, аминокислоты 1-275 SEQ ID NO: 6); Swissprot subt_bacpu, № доступа P07518 (происходящей из Bacillus pumilus, аминокислоты 1-275 SEQ ID NO: 7); Swissprot subt_bacsu, № доступа P04189 (происходящей из Bacillus subtilis, аминокислоты 1-275 SEQ ID NO: 8); Swissprot subt_bacst, № доступа P29142 (происходящей из Bacillus stearothermophilus, аминокислоты 1-275 SEQ ID NO: 9); Swissprot subt_bacam, № доступа P00782 (происходящей из Bacillus amyloliquefaciens, аминокислоты 1-275 SEQ ID NO: 10); Swissprot subs_bacle, № доступа P29600 (происходящей из Bacillus lentus, аминокислоты 1-269 SEQ ID NO: 11); Swissprot elya_baccs, № доступа P41362 (происходящей из Bacillus clausii, аминокислоты 1-269 SEQ ID NO: 12); и Swissprot elya_bacya, № доступа P20724 (происходящей из Bacillus sp., аминокислоты 1-268 SEQ ID NO: 13); а также их варианты, как определено выше.
Дополнительными конкретными примерами протеаз по изобретению являются протеазы, содержащиеся в следующих коммерческих продуктах: Purafect MA, Purafect, Purafect Ox (вариант M222S), Purafect Prime (Y217L), Properase (S87N + S101G + V104N), FN3 (N76D + S103A + V104I), FN4 (S101G + S103A + V104I + G159D + A232V + Q236H + Q245R + N248D + N252K) - все предпочтительно варианты зрелой части SEQ ID NO: 10 и коммерчески доступные от Genencor/Danisco; Blap (зрелая часть SEQ ID NO: 11 с S99D + S101 R + S103A + V104I + G160S), BLAP R (Blap с S3T + V4I + V199M + V205I + L217D), и BLAP X (Blap с S3T + V4I + V205I) - все от Henkel/Kemira; и KAP (A230V + S256G + S259N) от Kao.
В третьем аспекте протеаза по изобретению представляет собой или может быть рассмотрена как вариант протеазы SEQ ID NO: 2, т.е. она включает, по меньшей мере, одну замену, делецию и/или вставку одной или нескольких аминокислот в аминокислотах 1-274 SEQ ID NO: 2. Предпочтительно, чтобы замены были минорной природы, что означает замены или вставки консервативных аминокислот, которые существенно не влияют на укладку и/или активность белка; небольшие делеции; небольшие амино- или карбоксиконцевые удлинения; такие как аминоконцевой остаток метионина; небольшой линкерный пептид; или небольшое удлинение, которое облегчает очистку путем изменения суммарного заряда или другой функции, такой как полигистидиновый тракт, антигенный эпитоп или связывающий домен. В этом контексте термин «небольшой» независимо обозначает количество до 25 аминокислотных остатков. В предпочтительных осуществлениях термин «небольшой» независимо обозначает до 24, 23, 22, 21 или до 20 аминокислотных остатков. В дополнительных предпочтительных осуществлениях термин «небольшой» независимо обозначает до 19, 18, 17, 16, 15, 14, 13, 12, 11 или до 10 аминокислотных остатков. В еще одних предпочтительных осуществлениях термин «небольшой» независимо обозначает до 9, 8, 7, 6, 5, 4, 3, 2 или до 1 аминокислотного остатка. В альтернативных осуществлениях термин «небольшой» независимо обозначает до 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27 или до 26 аминокислотных остатков.
Примеры консервативных замен находятся в пределах группы основных аминокислот (аргинина, лизина и гистидина), кислых аминокислот (глутаминовой кислоты и аспарагиновой кислоты), полярных аминокислот (серина, треонина, глутамина и аспарагина), гидрофобных аминокислот (лейцина, изолейцина, валина и аланина), ароматических аминокислот (фенилаланина, триптофана и тирозина) и малых аминокислот (глицина, аланина, пролина, серина, треонина, цистеина и метионина).
Альтернативно, примеры консервативных замен находятся в пределах группы основных аминокислот (аргинина, лизина и гистидина), кислых аминокислот (глутаминовой кислоты и аспарагиновой кислоты), полярных аминокислот (глутамина и аспарагина), гидрофобных аминокислот (лейцина, изолейцина и валина), ароматических аминокислот (фенилаланина, триптофана и тирозина) и малых аминокислот (глицина, аланина, серина, треонина и метионина). Аминокислотные замены, которые в целом не изменяют специфическую активность, известны в данной области техники и описаны, например, H. Neurath and R. L. Hill, 1979, In, The Proteins, Academic Press, New York. Наиболее часто осуществляемыми заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly.
Предпочтительные варианты любой из зрелых протеазных частей SEQ ID NO: 5-13, таких как, например, аминокислоты 1-268 SEQ ID NO: 13, включают, по меньшей мере, одну замену, делецию и/или вставку одной или нескольких аминокислот (по сравнению с родительским или предшествующим ферментом, как, например, аминокислоты 1-268 SEQ ID NO: 13), как объяснялось выше для вариантов аминокислот 1-274 SEQ ID NO: 2. Более предпочтительно, эти варианты имеют консервативные аминокислотные замены или вставки, небольшие делеции, небольшие линкеры или имеют небольшие удлинения, как также подробно объяснялось выше для вариантов аминокислот 1-274 SEQ ID NO: 2. Конкретным примером варианта протеазы по изобретению является вариант 99aE SEQ ID NO: 11 (см. пример 4).
В четвертом аспекте протеаза по изобретению имеет аминокислотную последовательность, которая отличается не более чем на 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12 или не более чем на 11 аминокислот от аминокислот 1-274 SEQ ID NO: 2; или она отличается от аминокислот 1-274 SEQ ID NO: 2 не более чем на 10, 9, 8, 7, 6, 5, 4, 3, 2 или не более чем на 1 аминокислоту. В альтернативных осуществлениях протеаза по изобретению имеет аминокислотную последовательность, которая отличается не более чем на 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27 или не более чем на 26 аминокислот от аминокислот 1-274 SEQ ID NO: 2.
Предпочтительные варианты любой из зрелых частей протеазы SEQ ID NO: 5-13, такие как, например, аминокислоты 1-275 SEQ ID NO: 7, имеют аминокислотную последовательность, которая отличается не более чем на 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12 или не более чем на 11 аминокислот от зрелых частей любой из SEQ ID NO: 5-13, таких как, например, аминокислоты 1-275 SEQ ID NO: 7; или они отличаются от зрелых частей любой из SEQ ID NO: 5-13, таких как, например, аминокислоты 1-275 SEQ ID NO: 7, не более чем на 10, 9, 8, 7, 6, 5, 4, 3, 2 или не более чем на 1 аминокислоту.
В пятом аспекте протеаза по изобретению представляет собой аллельный вариант SEQ ID NO: 2 (предпочтительно аллельный вариант ее зрелой части), аллельный вариант любой из SEQ ID NO: 5-13 (предпочтительно аллельный вариант любой из их зрелых частей), или фрагмент любой из них, который обладает протеазной активностью. Термин аллельный вариант обозначает любую из двух или более альтернативных форм гена, встречающихся в том же самом хромосомном локусе. Аллельный вариант возникает естественным образом в результате мутации и может приводить к полиморфизму в популяциях. Мутации гена могут быть молчащими (без изменений в кодируемом полипептиде) или могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельный вариант полипептида представляет собой полипептид, кодируемый аллельным вариантом гена. Термин фрагмент определяется здесь как полипептид с одной или несколькими аминокислотами, удаленными с амино- или карбоксиконца аминокислот 1-274 SEQ ID NO: 2, или с амино- или карбоксиконца любой из SEQ ID NO: 5-13, предпочтительно из их зрелых частей. Предпочтительно, удаляется небольшое количество аминокислот, причем небольшое определяется, как было объяснено выше. Более предпочтительно фрагмент содержит, по меньшей мере, 244, 245, 246, 247, 248, 249 или, по меньшей мере, 250 аминокислотных остатков. Наиболее предпочтительно фрагмент содержит, по меньшей мере, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272 или, по меньшей мере, 273 аминокислотных остатка.
Таким образом, одно осуществление настоящего изобретения относится к протеазе для фармацевтического применения, где a) протеаза включает аминокислотную последовательность, выбранную из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13; и/или b) протеаза представляет собой вариант аминокислотной последовательности, выбранный из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13, где вариант отличается от соответствующей аминокислотной последовательности не более чем на двадцать пять аминокислот и где: (i) вариант включает, по меньшей мере, одну замену, делецию и/или вставку одной или нескольких аминокислот по сравнению с соответствующей аминокислотной последовательностью; и/или (ii) вариант включает, по меньшей мере, одну небольшую делецию по сравнению с соответствующей аминокислотной последовательностью; и/или (iii) вариант включает, по меньшей мере, одно небольшое N- или C-концевое удлинение по сравнению с соответствующей аминокислотной последовательностью; и/или c) протеаза представляет собой аллельный вариант протеазы, имеющей аминокислоты, выбранные из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13; и/или d) протеаза представляет собой фрагмент протеазы, имеющей аминокислоты, выбранные из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13.
В частности настоящее изобретение относится к протеазе для фармацевтического применения, где протеаза имеет аминокислотную последовательность, выбранную из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13.
В другом конкретном осуществлении протеаза по изобретению может быть применена в сочетании с дополнительной протеазой. Примерами дополнительных протеаз являются протеазы млекопитающих и микробные протеазы. Предпочтительная протеаза млекопитающих представляет собой экстракт поджелудочной железы, например, свиньи или быка, такой как панкреатин. Панкреатин может быть применен в форме не покрытого (сырого) продукта или в форме продукта состава (покрытого для всасывания в кишечнике (для обеспечения устойчивости к кислоте желудка) или покрытого не функционально (покрытого, но не придающего устойчивость к кислоте желудка)). Панкреатин потенциально еще включает дополнительные ферментативно активные составляющие, такие как панкреатическая липаза, BSSL (липаза, стимулируемая солями желчных кислот) и/или панкреатическая амилаза. Предпочтительные микробные протеазы происходят из штаммов бактерий или грибов, например, из штамма Aspergillus, такого как Aspergillus oryzae или Aspergillus melleus, в частности продукт Prozyme 6™ (нейтральная, щелочная протеаза EC 3.4.21.63), которая коммерчески доступна от Amano Pharmaceuticals, Japan.
Необязательно протеазу по изобретению применяют в сочетании с липазой с или без амилазы, как дополнительно объясняется ниже.
В настоящем контексте липаза означает гидролазу карбонового сложного эфира EC 3.1.1.-, которая включает активности, такие как активности триацилглицероллипазы EC 3.1.1.3, фосфолипазы A1 EC 3.1.1.4, лизофосфолипазы EC 3.1.1.5, галактолипазы EC 3.1.1.26, фосфолипазы A1 EC 3.1.1.32, ферулоилэстеразы EC 3.1.1.73. В конкретном осуществлении липаза представляет собой триацилглицероллипазу EC 3.1.1.3.
В конкретных осуществлениях липаза являются липазой млекопитающих, например, экстрактом поджелудочной железы, например, свиньи или быка, такой как панкреатин. Панкреатин может быть применен в форме не покрытого (сырого) продукта или в форме продукта состава (покрытого для всасывания в кишечнике или покрытого не функционально, как определено выше). Панкреатин потенциально еще включает дополнительные ферментативно активные составляющие, такие как панкреатическая протеаза, BSSL (липаза, стимулируемая солями желчных кислот) и/или панкреатическая амилаза. Липаза может также быть микробной липазой, например, происходящей от штаммов бактерий или грибов, таких как Bacillus, Pseudomonas, Aspergillus или Rhizopus. Липаза может в частности происходить из штамма Rhizopus, такого как Rhizopus javanicus, Rhizopus oryzae или Rhizopus delemar, например, продукт липаза D Amano 2000™ (также обозначаемый липазой D2™), который коммерчески доступен от Amano Pharmaceuticals, Japan.
В дополнительных конкретных осуществлениях липаза представляет собой микробную липазу, полученную рекомбинантным способом, например, происходящую из грибка, такого как Humicola или Rhizomucor, из дрожжей, таких как Candida или из бактерий, таких как Pseudomonas. В предпочтительном осуществлении липаза происходит из штамма Humicola lanuginosa или Rhizomucor miehei.
Липаза Humicola lanuginosa (синоним Thermomyces lanuginosus) (SEQ ID NO: 14) описана в EP 305216, и конкретные варианты липазы описаны, например, в WO 92/05249, WO 92/19726, WO 94/25577, WO 95/22615, WO 97/04079, WO 97/07202, WO 99/42566, WO 00/32758, WO 00/60063, WO 01/83770, WO 02/055679 и WO 02/066622. Предпочтительный вариант липазы Humicola lanuginosa представляет собой липазу, включающую аминокислоты 1-269 или 2-269 SEQ ID NO: 15, такие как следующие: (i) аминокислоты с +1 по +269 SEQ ID NO: 15, (ii) аминокислоты с -5 по +269 SEQ ID NO: 15, (iii) аминокислоты с -4 по +269 SEQ ID NO: 15; (iv) аминокислоты с -3 по +269 SEQ ID NO: 15; (v) аминокислоты с -2 по +269 SEQ ID NO: 15; (vi) аминокислоты с -1 по +269 SEQ ID NO: 15, (vii) аминокислоты с +2 по +269 SEQ ID NO: 15, а также (viii) любую смесь двух или более липаз (i)-(vii) - а также их варианты. В конкретном осуществлении липаза выбрана из липаз (i), (ii) и любой смеси (i) и (ii). Предпочтительные смеси (i) и (ii) включают, по меньшей мере, 5%, предпочтительно, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или, по меньшей мере, 95% липазы (i), причем проценты определяются секвенированием с N-конца с применением метода Эдмана, как описано в примере 5 заявки PCT, по которой испрашивается приоритет патентной заявки DK 2005 00929. Другие предпочтительные смеси представляют собой: (a) композиции, включающие 35-75%, предпочтительно 40-70%, более предпочтительно 45-65% липазы (ii); (b) композиции, включающие 20-60%, предпочтительно 25-55%, более предпочтительно 30-50%, наиболее предпочтительно 35-47% липазы (i); (c) композиции, включающие до 30%, предпочтительно до 25%, более предпочтительно до 20%, наиболее предпочтительно до 16% липазы (vii); и (d) любое сочетание (a), (b) и/или (c), такое как композиция, включающая 45-65% липазы (ii), 35-47% липазы (i) и до 16% липазы (vii).
Липазы SEQ ID NO: 14 и 15 можно, например, получить как описано в патенте США № 5869438 (SEQ ID NO: 1 в патенте США, на который ссылаются, представляет собой последовательность ДНК, кодирующую липазу SEQ ID NO: 14). Липазу SEQ ID NO: 15 можно, например, получить с помощью рекомбинантной экспрессии в подходящей клетке-хозяине последовательности ДНК, которая представляет собой модификацию SEQ ID NO: 1 патента США, модификацию, отражающую здесь аминокислотные различия между SEQ ID NO: 14 и 15. Такие модификации могут быть получены с помощью сайт-направленного мутагенеза, известного в данной области техники.
Еще одними примерами липаз грибков являются кутиназа из Humicola insolens, которая описана в EP 785994, и фосфолипаза из Fusarium oxysporum, которая описана в EP 869167. Примерами липаз дрожжей являются липаза A и B из Candida Antarctica, из которых липаза A описана в EP 652945, и липаза B описана, например, Uppenberg et al в Structure, 2 (1994), 293. Примером бактериальной липазы является липаза, происходящая из Pseudomonas cepacia, которая описана в EP 214761.
В предпочтительном осуществлении липаза характеризуется, по меньшей мере, 70% идентичностью липазе SEQ ID NO: 15, предпочтительно ее аминокислотам 1-269. В дополнительных предпочтительных осуществлениях степень идентичности SEQ ID NO: 15, предпочтительно ее аминокислотам 1-269, составляет, по меньшей мере, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99%. В альтернативных осуществлениях степень идентичности SEQ ID NO: 15, предпочтительно ее аминокислотам 1-269, составляет, по меньшей мере, приблизительно 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68% или, по меньшей мере, 69%.
В еще одном предпочтительном осуществлении липаза, такая как панкреатическая липаза млекопитающих, является специфической липазой в 1,3-положениях.
Необязательно протеаза по изобретению, с или без описанной здесь липазы, применяется в сочетании с амилазой.
В настоящем контексте амилаза представляет собой фермент, который катализирует эндогидролиз крахмала и других линейных или разветвленных олиго- и полисахаридов. Амилазная часть крахмала обогащена 1,4-альфа-глюкозидными связями, в то время как амилопектинная часть является более разветвленной, содержащей не только 1,4-альфа-, но также 1,6-альфа-глюкозидные связи. В конкретном осуществлении амилаза представляет собой фермент, принадлежащий к группе EC 3.2.1.1.
В конкретных осуществлениях амилаза представляет собой амилазу млекопитающих, например, экстракт поджелудочной железы, свиньи или быка, такой как панкреатин. Панкреатин может быть применен в форме не покрытого (сырого) продукта или в форме продукта состава (покрытого для всасывания в кишечнике или покрытого не функционально, как определено выше). Панкреатин потенциально включает еще дополнительные ферментативно активные составляющие, такие как панкреатическая протеаза, BSSL и/или панкреатическая липаза. Амилаза может быть также микробной амилазой, например, происходящей из штаммов бактерий или грибов, таких как Bacillus, Pseudomonas, Aspergillus или Rhizopus.
Амилаза может, в частности, происходить из штамма Aspergillus, такого как Aspergillus niger, Aspergillus oryzae или Aspergillus melleus, например, либо из продуктов Amylase A1™, происходящих из Aspergillus oryzae, который коммерчески доступен от Amano Pharmaceuticals, Japan, либо Amylase EC™, происходящей из Aspergillus melleus, который коммерчески доступен от Extract-Chemie, Germany.
Другими примерами амилазы грибков являются амилаза Aspergillus niger (SWISSPROT P56271), которая также описана в примере 3 WO 89/01969, и амилаза Aspergillus oryzae. Примеры вариантов амилазы Aspergillus oryzae описаны в WO 01/34784.
Альфа-амилаза, происходящая из Bacillus licheniformis, является примером бактериальной альфа-амилазы. Эта амилаза описана, например, в WO 99/19467, вместе с другими гомологичными бактериальными альфа-амилазами, происходящими из, например, Bacillus amyloliquefaciens и Bacillus stearothermophilus, а также с их вариантами. Примерами дополнительных вариантов амилаз являются описанные в патенте США № 4933279; EP 722490 и EP 904360.
Предпочтительными амилазами является амилаза, включающая аминокислоты 1-481 SEQ ID NO: 16 (такие как ее аминокислоты 1-481, 1-484 или 1-486), аминокислоты 1-481 SEQ ID NO: 17 и/или аминокислоты 1-483 SEQ ID NO: 18. В предпочтительном осуществлении амилаза, по меньшей мере, на 70% идентична или (i) аминокислотам 1-481 SEQ ID NO: 16, (ii) аминокислотам 1-481 SEQ ID NO: 17 и/или (iii) аминокислотам 1-483 SEQ ID NO: 18. Амилазы SEQ ID NO: 16-18 можно, например, получить как описано в находящейся одновременно на рассмотрении заявке DK № 2005 00931, озаглавленной «Амилазы для фармацевтического применения» и поданной 24 июня 2005 г. Solvay Pharmaceuticals GmbH и Novozymes A/S.
В дополнительных предпочтительных осуществлениях либо (i), (ii), либо (iii), степени идентичности соответствующим частям SEQ ID NO: 16, 17 или 18 составляет, по меньшей мере, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99%. В альтернативных осуществлениях степень идентичности соответствующим частям SEQ ID NO: 16, 17 или 18 составляет, по меньшей мере, приблизительно 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68% или, по меньшей мере, 69%.
Для целей настоящего изобретения особенно предпочтительными сочетаниями ферментов являются следующие: (i) протеаза с аминокислотами 1-274 SEQ ID NO: 2 в сочетании с липазой, включающей аминокислоты 1-269 или 2-269 SEQ ID NO: 15; (ii) протеаза с аминокислотами 1-274 SEQ ID NO: 2 в сочетании с амилазой, включающей аминокислоты 1-481 SEQ ID NO: 16 (такие как ее аминокислоты 1-481, 1-484 или 1-486); (iii) протеаза с аминокислотами 1-274 SEQ ID NO: 2 в сочетании с амилазой, имеющей аминокислоты 1-481 SEQ ID NO: 17; (iv) протеаза с аминокислотами 1-274 SEQ ID NO: 2 в сочетании с амилазой, имеющей аминокислоты 1-483 SEQ ID NO: 18; (v) протеаза с аминокислотами 1-274 SEQ ID NO: 2 в сочетании с амилазой, включающей аминокислоты 1-481 SEQ ID NO: 16 (такие как ее аминокислоты 1-481, 1-484 или 1-486), и липазой, включающей аминокислоты 1-269 или 2-269 SEQ ID NO: 15; (vi) протеаза с аминокислотами 1-274 SEQ ID NO: 2 в сочетании с амилазой, имеющей аминокислоты 1-481 SEQ ID NO: 17, и липазой, включающей аминокислоты 1-269 или 2-269 SEQ ID NO: 15; и (vii) протеаза с аминокислотами 1-274 SEQ ID NO: 2 в сочетании с амилазой, имеющей аминокислоты 1-483 SEQ ID NO: 18, и липазой, включающей аминокислоты 1-269 или 2-269 SEQ ID NO: 15.
Соответственно, в одном осуществлении настоящее изобретение относится к протеазе в сочетании с липазой и/или амилазой для фармацевтического применения, где (i) протеаза представляет собой протеазу, как здесь указано; (ii) липаза включает аминокислоты 2-269 SEQ ID NO: 15; и (iii) амилаза представляет собой амилазу, выбранную из группы, состоящей из a) амилазы, включающей аминокислоты 1-481 SEQ ID NO: 16, b) амилазы, имеющей аминокислоты 1-481 SEQ ID NO: 17, и c) амилазы, имеющей аминокислоты 1-483 SEQ ID NO: 18.
В конкретном осуществлении настоящее изобретение относится к протеазе в сочетании с липазой и/или амилазой для фармацевтического применения, где (i) протеаза включает или предпочтительно представляет собой или имеет аминокислоты 1-274 SEQ ID NO: 2; (ii) липаза включает аминокислоты 2-269 SEQ ID NO: 15; и (iii) амилаза представляет собой амилазу, выбранную из группы, состоящей из a) амилазы, включающей аминокислоты 1-481 SEQ ID NO: 16, b) амилазы, имеющей аминокислоты 1-481 SEQ ID NO: 17, и c) амилазы, имеющей аминокислоты 1-483 SEQ ID NO: 18.
Другими предпочтительными сочетаниями ферментов являются следующие: (i) протеаза, имеющая, по меньшей мере, 50% идентичности с аминокислотами 1-274 SEQ ID NO: 2, в сочетании с липазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-269 SEQ ID NO: 15; (ii) протеаза, имеющая, по меньшей мере, 50% идентичности с аминокислотами 1-274 SEQ ID NO: 2, в сочетании с амилазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-481 SEQ ID NO: 16; (iii) протеаза, имеющая, по меньшей мере, 50% идентичности с аминокислотами 1-274 SEQ ID NO: 2, в сочетании с амилазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-481 SEQ ID NO: 17; (iv) протеаза, имеющая, по меньшей мере, 50% идентичности с аминокислотами 1-274 SEQ ID NO: 2, в сочетании с амилазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-483 SEQ ID NO: 18; (v) протеаза, имеющая, по меньшей мере, 50% идентичности с аминокислотами 1-274 SEQ ID NO: 2, в сочетании с амилазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-481 SEQ ID NO: 16, и с липазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-269 SEQ ID NO: 15; (vi) протеаза, имеющая, по меньшей мере, 50% идентичности с аминокислотами 1-274 SEQ ID NO: 2, в сочетании с амилазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-481 SEQ ID NO: 17, и с липазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-269 SEQ ID NO: 15; и (vii) протеаза, имеющая, по меньшей мере, 50% идентичности с аминокислотами 1-274 SEQ ID NO: 2, в сочетании с амилазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-483 SEQ ID NO: 18, и с липазой, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-269 SEQ ID NO: 15. В предпочтительных осуществлениях (i)-(vii) степень идентичности каждого независимо составляет, по меньшей мере, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99%.
Соответственно, одно осуществление настоящего изобретения относится к протеазе в сочетании с липазой и/или амилазой для фармацевтического применения, где (i) протеаза выбрана из группы a) протеазы, имеющей, по меньшей мере, 50% идентичности с аминокислотами 1-274 SEQ ID NO: 2; b) протеазы, включающей аминокислотную последовательность, выбранную из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13; c) протеазы, представляющей собой вариант аминокислотной последовательности, выбранной из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13, где вариант отличается от соответствующей аминокислотной последовательности не более чем на двадцать пять аминокислот и где (i) вариант включает, по меньшей мере, одну замену, делецию и/или вставку одной или нескольких аминокислот по сравнению с соответствующей аминокислотной последовательностью; и/или (ii) вариант включает, по меньшей мере, одну небольшую делецию по сравнению с соответствующей аминокислотной последовательностью; и/или (iii) вариант включает, по меньшей мере, одно небольшое N- или C-концевое удлинение по сравнению с соответствующей аминокислотной последовательностью; d) протеазы, представляющей собой аллельный вариант протеазы, имеющей аминокислоты, выбранные из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13; e) протеазы, представляющей собой фрагмент протеазы, имеющей аминокислоты, выбранные из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13; и f) протеазы, имеющей аминокислотную последовательность, выбранную из группы, состоящей из аминокислот 1-274 SEQ ID NO: 2, аминокислот 1-274 SEQ ID NO: 5, аминокислот 1-275 SEQ ID NO: 6, аминокислот 1-275 SEQ ID NO: 7, аминокислот 1-275 SEQ ID NO: 8, аминокислот 1-275 SEQ ID NO: 9, аминокислот 1-275 SEQ ID NO: 10, аминокислот 1-269 SEQ ID NO: 11, аминокислот 1-269 SEQ ID NO: 12 и аминокислот 1-268 SEQ ID NO: 13; (ii) липаза имеет, по меньшей мере, 70% идентичности с липазой, имеющей аминокислоты 1-269 SEQ ID NO: 15; и (iii) амилаза имеет, по меньшей мере, 70% идентичности с амилазой, выбранной из группы, состоящей из a) амилазы, имеющей аминокислоты 1-481 SEQ ID NO: 16, b) амилазы, имеющей аминокислоты 1-481 SEQ ID NO: 17 и c) амилазы, имеющей аминокислоты 1-483 SEQ ID NO: 18.
Обычно протеаза, липаза и амилаза (здесь далее «фермент(ы)», а именно, ферменты по изобретению) могут быть природными ферментами или ферментами дикого типа (полученными из животных, в частности млекопитающих, например, ферменты человека или свиньи; из растений или из микроорганизмов), но также любыми их мутантами, вариантами, фрагментами и т.д., проявляющими желаемую ферментативную активность, а также синтетическими ферментами, такими как ферменты с перетасованными фрагментами, гибридные или химерные ферменты и консенсусные ферменты.
В конкретном осуществлении фермент(ы) представляют собой низкоаллергенные варианты, сконструированные для осуществления пониженного иммунного ответа при действии на животных, включая человека. Термин иммунный ответ должен пониматься как любая реакция иммунной системы животного, подвергаемого действию фермента(тов). Одним типом иммунного ответа является аллергический ответ, ведущий к повышенным уровням IgE у животного, подвергаемого воздействию. Низкоаллергенные варианты могут быть получены с применением способов, известных в данной области техники. Например, фермент(ы) могут конъюгироваться с полимерными частями, защитными частями или эпитопами фермента(тов), вовлеченных в иммунный ответ. Конъюгация с полимерами может включать химическое соединение полимера с ферментом(тами) in vitro, например, как описано в WO 96/17929, WO 98/30682, WO 98/35026 и/или WO 99/00489. Конъюгация может дополнительно или альтернативно этому включать соединение полимеров с ферментом(тами) in vivo. Такая конъюгация может быть достигнута с помощью генной инженерии нуклеотидной последовательности, кодирующей фермент(ы), вставки консенсусных последовательностей, кодирующих дополнительные сайты гликозилирования в ферменте(тах) и экспрессии фермента(тов) в хозяине, способном гликозилировать фермент(ы), см., например, WO 00/26354. Другим путем обеспечения низкоаллергенными вариантами является генная инженерия нуклеотидной последовательности, кодирующей фермент(ы), так, чтобы индуцировать самоолигомеризацию ферментов, воздействующую так, что мономеры фермента могут экранировать эпитопы других мономеров фермента и тем самым снижать антигенность олигомеров. Такие продукты и их получение описаны, например, в WO 96/16177. Эпитопы, вовлеченные в иммунный ответ, могут быть идентифицированы с помощью различных способов, таких как метод фагового дисплея, описанный в WO 00/26230 и WO 01/83559, или рандомизированного приближения, описанного в EP 561907. Как только эпитоп идентифицирован, его аминокислотная последовательность может быть изменена для получения измененных иммунных свойств фермента(тов) с помощью известных способов манипуляций с генами, таких как сайт-направленный мутагенез (см., например, WO 00/26230, WO 00/26354 и/или WO 00/22103) и/или конъюгация полимера может быть осуществлена в достаточной близости к эпитопу для экранизации эпитопа полимером.
В конкретных осуществлениях фермент(ы) являются (i) стабильными при рН 2-8, предпочтительно также при рН 3-7, более предпочтительно при рН 4-6; (ii) активными при рН 4-9, предпочтительно при рН 4-8; (iii) стабильными в отношении разрушения пепсином и другими протеазами пищеварительного тракта (такими как протеазы поджелудочной железы, т.е. главным образом трипсин и химотрипсин); и/или (iv) стабильными и/или активными в присутствии солей желчных кислот.
Предпочтительно протеазы по изобретению являются кислотоустойчивыми, что означает, что чистый протеазный фермент остается активным даже после продолжительного воздействия кислой средой. Предпочтительно, остающаяся активность выше в 1,1, 1,2, 1,3, 1,5, 1,6, 1,8, 2,0, 2,5 и 3,0 раз, чем остающаяся активность сравниваемой протеазы, уже известной для фармацевтического применения.
В дополнительных конкретных осуществлениях кислотоустойчивость обозначает, что протеазная активность чистого протеазного фермента в разведении, соответствующем A280 = 1,0, и при последующей инкубации в течение 2 часов при 37°С в следующем буфере (100 мМ янтарной кислоты, 100 мМ HEPES, 100 мМ CHES, 100 мМ CABS, 1 мМ CaCl2, 150 мМ KCl, 0,01% Тритон® X-100, pH 3,5) составляет, по меньшей мере, 40% (или, по меньшей мере, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или, по меньшей мере, 97%) референсной активности при измерении с применением теста, описанного в примере 2C WO 01/58276 (субстрат: Suc-AAPF-pNA, pH 9,0, 25°C). Термин референсная активность относится к протеазной активности той же самой протеазы после инкубации в чистой форме в разведении, соответствующем A280=1,0 для 2 часов при 5°С в следующем буфере (100 мМ янтарной кислоты, 100 мМ HEPES, 100 мМ CHES, 100 мМ CABS, 1 мМ CaCl2, 150 мМ KCl, 0,01% Тритон® X-100, pH 9,0), где активность определяется как описано выше. Термин A280=1,0 означает такую концентрацию (разведение) указанной чистой протеазы, которая дает повышение поглощения на 1,0 при 280 нм в кювете с длиной пути 1 см относительно буферного контроля. Термин чистая протеаза относится к образцу с отношением A280/A260 около или равным 1,70 (см. пример 2E WO 01/58276), и который при измерении с помощью сканирования окрашенного Кумасси геля Na-ДДС ПААГ имеет, по меньшей мере, 95% интенсивность своего сканирования в полосе, соответствующей указанной протеазе (см. пример 2A WO 01/58276).
Термин «в сочетании с» относится к сочетанному применению в соответствии с изобретением протеазы, липазы и/или амилазы. Сочетанное применение может быть одновременным, перекрывающимся или последовательным, причем эти три термина обычно интерпретируются в свете предписания, сделанного врачом.
Термин «одновременное» относится к условиям, при которых ферменты активны в одно и то же время, например, когда их вводят в одно и то же время в виде одного или нескольких отдельных фармацевтических продуктов, или если их вводят в одной и той же фармацевтической композиции.
Термин «последовательное» относится к таким примерам, когда один и/или два из ферментов действуют сначала, а второй и/или третий фермент в последующем. Последовательное действие может быть получено с помощью введения рассматриваемых ферментов в виде отдельных фармакологических составов с желаемыми интервалами, или в виде одной фармацевтической композиции, в которой рассматриваемые ферменты по-разному составлены (компартментализированы), например, с точки зрения получения различной скорости высвобождения, обеспечения улучшенной стабильности продукта или оптимизации дозировки ферментов.
Термин «перекрывающееся» относится к таким примерам, когда периоды активности ферментов являются неполностью одновременными и не полностью последовательными, то есть существует определенный период, при котором ферменты, оба или все, активны.
Форма единственного числа, например, когда применяется в контексте фермента(тов) по изобретению, обозначает, по меньшей мере, один. В конкретных осуществлениях форма единственного числа обозначает «один или несколько» или «по меньшей мере, один», что опять обозначает один, два, три, четыре, пять и т.д.
Родство двух аминокислотных последовательностей описывается с помощью параметра «идентичность».
В целях настоящего изобретения выравнивание двух аминокислотных последовательностей определяется с помощью программы Needle пакета EMBOSS (http://emboss.org) версия 2.8.0. Программа Needle осуществляет алгоритм глобального выравнивания, описанный в Needleman, S.B. and Wunsch, C.D. (1970) J. Mol. Biol. 48, 443-453. Применяемая матрица замены представляет собой BLOSUM62, штраф за открытие пропуска составляет 10 и штраф за удлинение пропуска составляет 0,5.
Степень идентичности между аминокислотной последовательностью по настоящему изобретению («последовательностью по изобретению», например, аминокислотами 1-274 SEQ ID NO: 2) и отличной аминокислотной последовательностью («чужеродной последовательностью», например, аминокислотами 1-188 SEQ ID NO: 1 WO 2005/115445) рассчитывается как количество точных совпадений при выравнивании двух последовательностей, разделенных на длину «последовательности изобретения» или на длину «чужеродной последовательности», в зависимости от того, какая из них наиболее короткая. Результат выражают в процентах идентичности.
Точное совпадение возникает, когда «последовательность изобретения» и «чужеродная последовательность» имеют идентичные аминокислотные остатки в тех же положениях наложения (в примере выравнивания ниже это представлено с помощью «|»). Длиной последовательности является количество аминокислотных остатков в последовательности (например, длина SEQ ID NO: 2 составляет 274).
В чисто гипотетическом примере выравнивания ниже наложение представляет собой аминокислотную последовательность «HTWGER-NL» последовательности 1; или аминокислотную последовательность «HGWGEDANL» последовательности 2. В примере пропуск показан как "-".
Гипотетический пример выравнивания:

Соответственно, процент идентичности последовательности 1 и последовательности 2 составляет 6/12=0,5, соответственно 50%.
В конкретном осуществлении процент идентичности аминокислотной последовательности полипептида с аминокислотами или аминокислотам 1-274 SEQ ID NO: 2 определяется с помощью i) выравнивания двух аминокислотных последовательностей с применением программы Needle с матрицей замены BLOSUM62, штрафом за открытие пропуска, составляющим 10 и штрафом за удлинение пропусков, составляющим 0,5; ii) подсчета количества точных совпадений в выравненных последовательностях; iii) деления точных совпадений на длину наиболее короткой из двух аминокислотных последовательностей, и iv) перевода результата деления iii) в проценты.
В альтернативном случае степень идентичности между двумя аминокислотными последовательностями можно определить с помощью программы «выравнивания», которая представляет собой выравнивание Needleman-Wunsch (т.е. глобальное выравнивание). Последовательности выравнивают с помощью программы, применяя матрицы BLOSUM50 со счетом пропусков. Штраф за первый остаток пропуска составляет 12 и штрафы за дальнейшие остатки пропуска составляют 2. Алгоритм Needleman-Wunsch описан в Needleman, S.B. and Wunsch, CD., (1970), Journal of Molecular Biology, 48: 443-453, и программа выравнивания описана Myers and W. Miller in Optimal Alignments in Linear Space» CABIOS (применение компьютеров в бионауках) (1988) 4:11-17. «Выравнивание» является частью пакета FASTA версии v20u6 (см. W.R. Pearson and D.J. Lipman (1988), «Improved Tools for Biological Sequence Analysis», PNAS 85:2444-2448, и W.R. Pearson (1990) «Rapid and Sensitive Sequence Comparison with FASTP and FASTA,» Methods in Enzymology 183:63-98).
Степень идентичности между последовательностью образца или тестируемой последовательностью любого(бых) фермента(тов) по изобретению и заданной последовательностью может быть определена следующим образом: две последовательности выравниваются с применением программы «выравнивание». В выравненных последовательностях определяют количество точных совпадений («N-точные-совпадения») (точное совпадение означает один и тот же аминокислотный остаток в одном и том же положении в выровненных последовательностях). Определяют также общую длину двух выровненных последовательностей, т.е. суммарное количество аминокислот в выравнивании (наложении), включая замыкающие и лидирующие пропуски, созданные в результате выравнивания, если они существуют («N-наложения»). Степень идентичности рассчитывают как отношение между «N-точные-совпадения» и «N-наложения» (для превращения в процент идентичности умножают на 100).
Степень идентичности между последовательностью образца или тестируемой последовательностью и заданной последовательностью может быть также определена следующим образом: последовательности выравнивают с применением программы «выравнивание». В выравненных последовательностях определяют количество точных совпадений («N-точные-совпадения») (точное совпадение означает один и тот же аминокислотный остаток в одном и том же положении в выровненных последовательностях). Определяют длину образцовой последовательности (количество аминокислотных остатков) («N-образца»). Степень идентичности рассчитывают как отношение между «N-точные-совпадения» и «N-образца» (для превращения в процент идентичности умножают на 100).
Степень идентичности между последовательностью образца или тестируемой последовательностью и заданной последовательностью может быть также определена следующим образом: последовательности выравнивают с применением программы «выравнивание». В выровненных последовательностях определяют количество точных совпадений («N-точные-совпадения») (точное совпадение означает один и тот же аминокислотный остаток в одном и том же положении в выровненных последовательностях). Определяют длину заданной последовательности (количество аминокислотных остатков) («N-заданной»). Степень идентичности рассчитывают как отношение между «N-точные-совпадения» и «N-заданной» (для превращения в процент идентичности умножают на 100).
Предпочтительно наложение составляет, по меньшей мере, 20% заданной последовательности («N-наложения», как определено выше, разделенное на количество аминокислот в заданной последовательности («N-заданной») и умноженное на 100), более предпочтительно, по меньшей мере, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или, по меньшей мере, 95%. Это означает, что, по меньшей мере, 20% (предпочтительно 25-95%) аминокислот заданной последовательности входит в наложение, когда образцовая последовательность выравнивается с заданной последовательностью.
В альтернативном случае наложение составляет, по меньшей мере, 20% заданной последовательности («N-наложения», как определено выше, разделенное на «N-образца», как определено выше, и умноженное на 100), более предпочтительно, по меньшей мере, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или, по меньшей мере, 95%. Это означает, что, по меньшей мере, 20% (предпочтительно 25-95%) аминокислот образцовой последовательности входит в наложение, когда выравнивается с заданной последовательностью.
Активность фермента(тов) по изобретению может быть измерена с применением любого подходящего теста. Обычно определение рН и определение температуры может быть адаптировано к рассматриваемому ферменту. Примеры тестируемых величин рН составляют рН 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12. Примеры тестируемых температур составляют 30, 35, 37, 40, 45, 50, 55, 60, 65, 70, 80, 90 или 95°C. Предпочтительные величины рН и температуры находятся в физиологическом диапазоне, таком как величины рН 4, 5, 6, 7 или 8 и температура 30, 35, 37 или 40°C.
Например, протеазная активность может быть измерена с применением любого теста, в котором применяется субстрат, который включает пептидные связи, имеющие отношение к специфичности рассматриваемой протеазы.
Примеры подходящих тестов ферментов включены в экспериментальную часть, в частности, см. пример 2. Другими примерами являются тесты Евр. Фармакоп. на активность липазы и амилазы.
Лекарственное средство
В контексте настоящего изобретения термин «лекарственное средство» обозначает соединение или смесь соединений, которые лечат, предотвращают и/или облегчают симптомы заболевания, предпочтительно, которые лечат и/или облегчают симптомы заболевания. Лекарственное средство может быть предписано врачом или оно может продаваться без рецепта.
Фармацевтические композиции
Выделение, очистка и концентрирование фермента(тов) по изобретению могут быть выполнены с помощью традиционных способов. Например, они могут быть получены из ферментационного бульона с помощью общепринятых процедур, включая, но не ограничиваясь этим, центрифугирование, фильтрацию, экстракцию, высушивание при распылении или преципитацию, и дополнительно очищены с помощью разнообразных способов, известных в данной области техники, включая, но не ограничиваясь этим, хроматографию (например, ионообменную, аффинную, гидрофобную хроматографию, хроматофокусирование и гель-проникающую хроматографию), электрофоретические процедуры (например, препаративное изоэлектрическое фокусирование), дифференциальную растворимость (например, осаждение сульфатом аммония), Na-ДДС-ПААГЭ или экстракцию (см., например, Protein Purification, J.-C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989).
Получение чистой протеазы по изобретению описано здесь в примере 1. В этом примере ген, кодирующий так называемый компонент C протеазы (SEQ ID NO: 4, кодируемая SEQ ID NO: 3), удаляли из продуцирующего штамма Bacillus licheniformis с помощью сайт-направленного мутагенеза, как известно в данной области техники. Другим подходом к удалению этого гена может быть, например, классическая мутация, как описано, например, в США 4266031, предпочтительно в сочетании с современными для данного уровня техники высокопроизводительными способами.
В примере 1 клетка, экспрессирующая протеазу SEQ ID NO: 2 происходит от штамма Bacillus licheniformis дикого типа, т.е. штамма ATCC 14580, который открыто доступен от American Type Culture Collection, ATCC. Может быть предпочтительной вставка одной или нескольких дополнительных копий гена, кодирующего протеазу по изобретению, например, гена, кодирующего аминокислоты 1-274 SEQ ID NO: 2, в эту клетку. Это может быть осуществлено, например, как описано в WO 02/00907, с применением, например, промотора, раскрытого в WO 99/43835.
В конкретном осуществлении концентрированные твердые или жидкие препараты каждого из фермента(тов) получают отдельно. Эти концентраты могут также, по меньшей мере, частично составляться отдельно, как более подробно объяснено ниже.
В дополнительном конкретном осуществлении фермент(ы) включают в фармацевтические композиции по изобретению в форме твердых концентратов. Фермент(ы) могут быть переведены в твердое состояние с помощью различных методов, как это известно в данной области техники. Например, твердое состояние может быть либо кристаллом, когда молекулы фермента организуются в высоко упорядоченную форму, либо преципитатом, когда молекулы фермента организуются в менее упорядоченную или неупорядоченную форму.
Кристаллизация может, например, осуществляться при рН, близкому к pI фермента(тов), и низкой проводимости, например, 10 мСм/см или менее, как описано в EP 691982.
Различные методы преципитации известны в данной области техники, включая преципитацию солями, такими как сульфат аммония и/или сульфат натрия; органическими растворителями, такими как этанол и/или изопропанол; или полимерами, такими как ПЭГ (полиэтиленгликоль). В альтернативном случае фермент(ы) могут быть преципитированы из раствора с помощью удаления растворителя (обычно воды) с помощью различных способов, известных в данной области техники, например, лиофилизации, выпаривания (например, при пониженном давлении) и/или высушивания при распылении.
В дополнительном конкретном осуществлении твердый концентрат фермента(тов) характеризуется содержанием активного белка-фермента, по меньшей мере, 50% (масс./масс.) по отношению к суммарному содержанию белка твердого концентрата. В еще одних дополнительных конкретных осуществлениях содержание активного белка-фермента по отношению к суммарному содержанию белка твердого концентрата составляет, по меньшей мере, 55, 60, 65, 70, 75, 80, 85, 90 или, по меньшей мере, 95% (масс./масс.). Содержание белка может быть измерено, как это известно в данной области техники, например, с помощью денситометрического сканирования гелей Na-ДДС ПААГ, окрашенных кумасси, путем применения коммерческого набора, такого как Protein Assay ESL, порядковый № 1767003, который коммерчески доступен от Roche, или на основе метода, описанного в примере 8 WO 01/58276.
Предпочтительно белок протеазного фермента составляет, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 55, 60, 65, 70, 75, 80, 85, 90, 92, 94, 95, 96 или, по меньшей мере, 97% белкового спектра твердого протеазного концентрата для применения по изобретению, измеренного денситометрическим сканированием окрашенного кумасси ДДС-Na-ПААГ геля.
Фармацевтическая композиция по изобретению включает фермент(ы), предпочтительно в форме концентрированных ферментных препаратов, более предпочтительно твердых концентратов, вместе с, по меньшей мере, одним фармацевтически приемлемым вспомогательным или дополнительным веществом, таким как (i) по меньшей мере, одним носителем и/или наполнителем; или (ii) по меньшей мере, одним носителем, наполнителем, разбавителем и/или адъювантом. Неограничивающими примерами необязательных иных ингредиентов, все из которых являются фармацевтически приемлемыми, служат разрыхлители, смазывающие агенты, забуферивающие агенты, увлажняющие агенты, консерванты, отдушки, растворители, солюбилизирующие агенты, суспендирующие агенты, эмульгаторы, стабилизаторы, пропелленты и носители.
Обычно, в зависимости от рассматриваемого медицинского показания, композиция по изобретению может быть сконструирована для любых известных в данной области техники способов введения, предпочтительно включающих энтеральное введение (через пищеварительный тракт). Так, композиция может находиться в твердой, полутвердой, жидкой или газообразной форме, такой как таблетки, капсулы, порошки, гранулы, микросферы, лосьоны и аэрозоли. Практикующий врач должен знать, как выбрать наиболее подходящий путь введения и, разумеется, избежать потенциально опасных или неблагоприятных в других отношениях путей введения.
Поэтому следующие способы и вспомогательные вещества также являются исключительно иллюстративными и ни в коей мере не ограничивающими.
Для твердых пероральных препаратов фермент(ы) могут быть использованы отдельно или в сочетании с подходящими добавками для получения пилюль, микропилюль, таблеток, микротаблеток, порошков, гранул или капсул, например, с традиционными носителями, такими как лактоза, маннит, кукурузный крахмал или картофельный крахмал; с наполнителями или связующими агентами, такими как кристаллическая или микрокристаллическая целлюлоза, производные целлюлозы, камедь, кукурузный крахмал или желатин; с разрыхляющими агентами, такими как кукурузный крахмал, картофельный крахмал или карбоксиметилцеллюлоза натрия; со смазывающими агентами, такими как карнаубский воск, белый воск, шеллак, безводный коллоидный диоксид кремния, полиэтиленгликоль (PEG, известный также под названием макрогол) от 1500 до 20000, в особенности PEG 4000, PEG 6000, PEG 8000, повидон, тальк, монолеин или стеарат магния; и, при желании, с разбавителями, адъювантами, забуферивающими агентами, увлажняющими агентами, консервантами, такими как метилпарагидроксибензоат (E218), красителями, такими как диоксид титана (E171) и отдушками, такими как сахароза, сахарин, апельсиновое масло, лимонное масло и ванилин. Пероральные препараты являются примерами предпочтительных препаратов для лечения PEI по медицинским показаниям.
Вполне обычным также может быть составление фермента(ферментов) в жидкие пероральные препараты путем их растворения, суспендирования или эмульгирования в водном растворителе, таком как вода, или в неводных растворителях, таких как растительное или другие подобные масла, глицериды синтетических алифатических кислот, сложные эфиры высших алифатических кислот, пропиленгликоль, полиэтиленгликоль, такой как PEG 4000, или низшие спирты, такие как линейные или разветвленные C1-C4 спирты, например, 2-пропанол; и, при желании, с традиционными вспомогательными веществами или добавочными агентами, такими как солюбилизаторы, адъюванты, разбавители, изотоничные агенты, суспендирующие агенты, эмульгирующие агенты, стабилизаторы и консерванты.
Более того, фермент(ы) обычно могут быть включены в суппозитории для ректального введения путем смешивания с множеством оснований, таких как эмульгирующие основания или водорастворимые основания. Суппозитории могут включать носители, такие как масло какао, углеродные воска и полиэтиленгликоли, которые плавятся при температуре тела, но все еще затвердевают при комнатной температуре.
Другим способом, представляющим возможный общий интерес, служит применение липосом в качестве средства доставки. Липиды могут представлять собой любое пригодное сочетание известных липидов, образующих липосому, включая катионные или цвитерионные липиды, такие как фосфатидилхолин. Остальная часть липидов обычно должна быть нейтральными или кислыми липидами, такими как холестерин, фосфатидилсерин, фосфатидилглицерин и тому подобное. Для получения липосом может быть применена процедура, описанная Kato et al. (1991) J. Biol. Chem. 266:3361.
Могут быть предложены стандартные лекарственные формы для перорального или ректального введения, таких как сиропы, эликсиры, порошки и суспензии, где каждая единичная доза, например, полная чайная ложка, полная столовая ложка, капсула, таблетка или суппозиторий, содержит заранее определенное количество фермента(ферментов). Сходным образом, стандартные лекарственные формы для инъекции могут включать фермент(ы) в композиции, такой как раствор в стерильной воде, обычном физиологическом растворе или другом фармацевтически приемлемом носителе.
Применяемый здесь термин «стандартная лекарственная форма» относится к физически дискретным формам, пригодным в качестве единичных доз для людей или животных, причем каждая единичная доза содержит заранее определенное количество фермента(ферментов) в количестве, достаточном для получения желаемого действия.
В отдельном осуществлении фармацевтическая композиция по изобретению предназначена для энтерального, предпочтительно перорального введения.
В других отдельных осуществлениях пероральная композиция представляет собой (i) жидкую композицию, содержащую кристаллы фермента(ферментов); (ii) жидкую суспензию осадка (высоко)очищенного фермента(ферментов); (iii) гель, содержащий фермент(ы) в твердой или солюбилизированной форме; (iv) жидкую суспензию иммобилизованного фермента(ферментов) или ферментов, адсорбированных на частицах, и тому подобное; или (v) твердую композицию в форме содержащих фермент(ы) порошка, пилюль, гранул или микросфер, при желании в форме таблеток, капсул или тому подобного, которые необязательно покрыты, например, устойчивым к кислоте покрытием.
В другом отдельном осуществлении композиции фермент(ы) разделяют, то есть отделяют друг от друга, например, с помощью раздельных покрытий.
В еще одном отдельном осуществлении композиции протеазу отделяют от других ферментных компонентов композиции, таких как липаза и/или амилаза.
Дозировка фермента(ферментов) обычно широко варьирует в зависимости от подлежащего введению фермента(ферментов), частоты введения, способа введения, тяжести симптомов и восприимчивости субъекта к побочным эффектам и того подобного. Некоторые из конкретных ферментов могут быть эффективнее других.
Примеры твердых пероральных препаратов фермента(ферментов) по изобретению включают (i) протеазу по изобретению, включающую аминокислотную последовательность, которая имеет, по меньшей мере, 50% идентичность с аминокислотами 1-274 SEQ ID NO: 2; (ii) липазу, имеющую, по меньшей мере, 70% идентичность с липазой, содержащей аминокислоты 1-269 SEQ ID NO: 15; и (iii) амилазу, имеющую, по меньшей мере, 70% идентичность с амилазой, выбранной из группы, состоящей из a) амилазы, содержащей аминокислоты 1-481 SEQ ID NO: 16, b) амилазы, содержащей аминокислоты 1-481 SEQ ID NO: 17, и c) амилазы, содержащей аминокислоты 1-483 SEQ ID NO: 18, где предпочтительно ожидаемые суточные клинические дозы ферментов (i), (ii) и (iii) являются следующими (все в мг ферментного белка на кг массы тела (м.т.)): для протеазы (i): 0,005-500, 0,01-250, 0,05-100 или 0,1-50 мг/кг м.т.; для липазы (ii): 0,01-1000, 0,05-500, 0,1-250 или 0,5-100 мг/кг м.т.; для амилазы (iii): 0,001-250, 0,005-100, 0,01-50 или 0,05-10 мг/кг м.т.
Предпочтительный пример твердых пероральных препаратов фермента(ферментов) по изобретению включает: (i) протеазу, включающую предпочтительно содержащую аминокислоты 1-274 SEQ ID NO: 2; (ii) липазу, включающую аминокислоты 2-269 SEQ ID NO: 15; и/или (iii) амилазу, включающую аминокислоты 1-481 SEQ ID NO: 16.
Примеры ожидаемых суточных клинических доз ферментов (i), (ii) и (iii) являются следующими (все в мг ферментного белка на кг массы тела (м.т.)): для протеазы (i): 0,05-100, 0,1-50, или 0,5-25 мг/кг м.т.; для липазы (ii): 0,1-250, 0,5-100, или 1-50 мг/кг м.т.; для амилазы (iii): 0,01-50, 0,05-10, или 0,1-5 мг/кг м.т.
Амидные (пептидные) связи, а также амино- и карбоксильные концы могут быть модифицированы для большей стабильности при пероральном введении. Например, карбоксильный конец может быть амидирован.
Конкретные осуществления фармацевтических композиций по изобретению, пригодные для лечения нарушений пищеварения, PEI, панкреатита, кистозного фиброза, диабета типа I и/или диабета типа II, могут быть получены включением фермента(ферментов) по изобретению в пилюли. Пилюли обычно могут включать от 10 до 90% (масс./масс. по отношению к сухой массе полученных пилюль) физиологически приемлемого органического полимера, от 10 до 90% (масс./масс. по отношению к сухой массе полученных пилюль) целлюлозы или производного целлюлозы и от 80 до 20% (масс./масс. по отношению к сухой массе полученных пилюль) фермента(ферментов), причем в каждом случае общее количество органического полимера, целлюлозы или производного целлюлозы и фермента(ферментов) доводится до 100%.
Физиологически приемлемый органический полимер может быть выбран из группы, состоящей из полиэтиленгликоля 1500, полиэтиленгликоля 2000, полиэтиленгликоля 3000, полиэтиленгликоля 4000, полиэтиленгликоля 6000, полиэтиленгликоля 8000, полиэтиленгликоля 10000, полиэтиленгликоля 20000, гидроксипропилметилцеллюлозы, полиоксиэтилена, сополимеров полиоксиэтилен-полиоксипропилен и смесей указанных органических полимеров. Полиэтиленгликоль 4000 является предпочтительным в качестве физиологически приемлемого органического полимера.
Целлюлоза или производное целлюлозы может быть выбрано, например, из целлюлозы, ацетата целлюлозы, сложного эфира целлюлозы и жирной кислоты, нитратов целлюлозы, простого эфира целлюлозы, карбоксиметилцеллюлозы, этилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, метилцеллюлозы, метилэтилцеллюлозы и метилгидроксипропилцеллюлозы. Целлюлоза, в особенности микрокристаллическая целлюлоза, является предпочтительной в качестве целлюлозы или производного целлюлозы.
Полученные пилюли могут быть покрыты подходящим энтеросолюбильным покрытием, другим нефункциональным покрытием или использоваться непосредственно без такого покрытия. Кроме того, полученные пилюли могут быть помещены в капсулы, подобные твердым желатиновым капсулам или капсулам без желатина подходящего размера, для лечения нарушения или заболевания, как описано подробнее выше. В одном осуществлении изобретения в указанные капсулы могут быть помещены пилюли, полученные из ферментов разного типа, в частности, липазы, протеазы и/или амилазы. При помещении в капсулы ферментов разного типа дозировка фермента одного типа (то есть липазы, протеазы или амилазы) может быть адаптирована к конкретным потребностям определенной группы по показанию или определенной подгруппы больных путем добавления в капсулы определенного количества любого из липазы, протеазы и/или амилазы, т.е. могут быть получены капсулы с варьирующими удельными отношениями липаза:протеаза:амилаза.
Предпочтительные фармацевтические композиции липазы по изобретению описаны в WO 2005/092370, в особенности составы, включающие упомянутые в нем предпочтительные наполнители. В особенно предпочтительном осуществлении фармацевтическая композиция включает макроголглицеридную смесь моно-, ди- и триглицеридов и сложных моно- и диэфиров алифатических C6-C22 карбоновых кислот полиэтиленгликоля (PEG), а также, возможно, небольшие количества глицерина и свободного полиэтиленгликоля.
Полиэтиленгликоль (PEG), содержащийся в макроголглицеридных смесях, предпочтительно является PEG, который содержит в среднем от 6 до не более 40 этиленоксидных единиц на молекулу или молекулярную массу между 200 и 2000.
В еще одном аспекте изобретения предлагается фармацевтическая композиция фермента(ферментов) по изобретению, включающая систему, состоящую из поверхностно-активного вещества, вспомогательного поверхностно-активного вещества и липофильной фазы, причем система имеет величину HLB (гидрофильный-липофильный баланс), большую или равную 10, и точку плавления, большую или равную 30°С. В предпочтительном осуществлении система имеет величину HLB от 10 до 16, предпочтительно от 12 до 15, и точку плавления между 30 и 600°С, предпочтительно между 40 и 500°С. В частности, система, характеризуемая величиной HLB и точкой плавления, представляет собой смесь моно- ди- и триацилглицеридов и сложных моно- и диэфиров полиэтиленгликоля (PEG) с алифатическими карбоновыми кислотами, содержащими от 8 до 20, предпочтительно от 8 до 18 атомов углерода, где полиэтиленгликоль предпочтительно содержит от приблизительно 6 до приблизительно 32 этиленоксидных единиц на молекулу, и система необязательно содержит свободный глицерин и/или свободный полиэтиленгликоль. Величина HLB такой системы предпочтительно регулируется длиной цепи PEG. Точка плавления такой системы регулируется длиной цепи жирных кислот, длиной цепи PEG и степенью насыщения цепей жирных кислот и, соответственно, исходным маслом для получения макроголглицеридной смеси.
«Алифатические C8-C18 карбоновые кислоты» обозначает смеси, в которых каприловая кислота (C8), каприновая кислота (C10), лауриновая кислота (C12), миристиновая кислота (C14), пальмитиновая кислота (C16) и стеариновая кислота (C18) содержатся в значительном и варьирующем соотношении, если эти кислоты являются насыщенными, и соответствующие ненасыщенные C8-C18 карбоновые кислоты. Соотношения этих жирных кислот могут варьировать в зависимости от исходных масел.
Такая смесь моно- ди- и триацилглицеридов и сложных моно- и диэфиров полиэтиленгликоля (PEG) с алифатическими карбоновыми кислотами, содержащими от 8 до 18 атомов углерода, может быть получена, например, путем взаимодействия между полиэтиленгликолем с молекулярной массой между 200 и 1500 и исходным маслом, причем исходное масло состоит из смеси триглицеридов с жирными кислотами, которые выбраны из группы, содержащей каприловую кислоту, каприновую кислоту, лауриновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, олеиновую кислоту и линоленовую кислоту, отдельно или в виде смеси. Необязательно продукт такой реакции может также содержать небольшие части глицерина и свободного полиэтиленгликоля.
Такие смеси имеются в продаже, например, под торговой маркой Gelucire®. В одном выгодном осуществлении изобретения предлагается чтобы продукты, известные под торговой маркой Gelucire®, в частности, “Gelucire® 50/13” и/или “Gelucire® 44/14”, представляли собой подходящие смеси для использования в фармацевтических препаратах по изобретению.
Gelucire® 50/13 представляет собой смесь моно- ди- и триацилглицеридов и сложных моно- и диэфиров полиэтиленгликоля с пальмитиновой кислотой (C16) и стеариновой кислотой (C18) от 40% до 50% и от 48% до 58%, соответственно, составляющих основную часть связанных жирных кислот. Доля каприловой кислоты (C8) и каприновой кислоты (C10) составляет менее 3% в каждом случае, а доля лауриновой кислоты (C12) и миристиновой кислоты (C14) в каждом случае составляет менее 5%.
Gelucire® 44/14 представляет собой смесь моно- ди- и триацилглицеридов и сложных моно- и диэфиров полиэтиленгликоля, причем соответствующие доли пальмитиновой кислоты (C16) составляют от 4 до 25%, стеариновой кислоты (C18) - от 5% до 35%, каприловой кислоты (C8) - менее 15%, каприновой кислоты (C10) - менее 12%, лауриновой кислоты (C12) - от 30 до 50%, а миристиновой кислоты (C14) - от 5 до 25%. Gelucire® 44/14 может быть получен, например, с помощью реакции алкоголиза/этерификации с использованием пальмового косточкового масла и полиэтиленгликоля 1500.
В предпочтительном осуществлении настоящего изобретения предлагается фармацевтическая композиция фермента(ферментов) по изобретению, которая включает систему, содержащую смесь моно- ди- и триацилглицеридов и сложных моно- и диэфиров полиэтиленгликоля и алифатических C8-C18 карбоновых кислот, а также, возможно, небольшие доли глицерина и свободного полиэтиленгликоля, причем система имеет точку плавления между 40°С и 55°С и величину HLB в диапазоне между 12 и 15. Более предпочтительно, система имеет точку плавления между 44°С и 50°С и величину HLB в диапазоне между 13 и 14. Альтернативно, система имеет точку плавления около 44°С и величину HLB 14, или система имеет точку плавления около 50°С и величину HLB 13.
Способы лечения
Протеаза по изобретению, необязательно в сочетании с липазой и/или амилазой (фермент(ы) изобретения), пригодна для терапевтического и/или профилактического лечения различных заболеваний или нарушений у животных. Термин «животное» включает всех животных и в особенности человека. Примерами животных являются нежвачные и жвачные, такие как овца, коза и крупный рогатый скот, например, мясной крупный рогатый скот и корова. Нежвачные животные включают животных с одним желудком, например, лошадь, свинью (включая, но не ограничиваясь этим, поросят, растущих свиней и свиноматок); домашнюю птицу, такую как индейки, утки и куры (включая, но не ограничиваясь этим, бройлерных цыплят и несушек); молодых телят; любимых животных, таких как кошка и собака; рыб (включая, но не ограничиваясь этим, лосося, форель, тилапию, сома и карпов); и ракообразных (включая, но не ограничиваясь этим, мелких креветок и креветок). В отдельном осуществлении животным является млекопитающее, в особенности человек.
Например, фермент(ы) пригодны для лечения нарушений пищеварения, таких как недостаточное переваривание или диспепсия, которые часто вызываются недостаточной продукцией и/или секрецией в желудочно-кишечный тракт ферментов, обычно секретируемых из, например, желудка и поджелудочной железы.
Кроме того, фермент(ы) особенно пригодны для лечения PEI. PEI может быть подтверждена с помощью, например, теста Borgström (JOP. J Pancreas (Online) 2002; 3(5):116-125), и она может быть вызвана такими заболеваниями и состояниями, как рак поджелудочной железы, хирургическая операция на поджелудочной железе и/или желудке, например, тотальная или частичная резекция поджелудочной железы, гастрэктомия, операция после гастроинтестинального шунтирования (например, желудочно-кишечного соустья Billroth II); хроническим панкреатитом; ромбовидным синдромом Швахмана; обструкцией протока поджелудочной железы или общего желчного протока (например, неоплазмой); и/или кистозным фиброзом (наследуемым заболеванием, при котором густая слизь блокирует протоки поджелудочной железы). Фермент(ы) могут быть также пригодны для лечения острого панкреатита.
Действие фермента(ферментов) на нарушения пищеварения может быть измерено, как описано в общей форме в EP 0600868, где в примере 2 описан тест переваривания in vitro для измерения активности липазы в присутствии желчных солей. Соответствующие тесты могут быть разработаны для протеазы и амилазы. В WO 02/060474 раскрыты подходящие тесты, например, (1) тест in vitro для измерения переваривания липидов в пище для тестирования для свиней, и (2) испытание in vivo на свиньях с недостаточностью поджелудочной железы, при котором измеряют переваривание жира, белка и крахмала.
В отдельном осуществлении действие протеазы по изобретению измеряют с помощью скринингового теста in vivo на эффективность протеазы примера 3.
В качестве другого примера фермент(ы) пригодны для лечения сахарного диабета типа I и/или типа II, в частности, для дополнительного лечения при лечении нарушений пищеварения при диабете, обычно сопровождающих эту болезнь, с целью снижения поздних осложнений.
Влияние фермента(ферментов) на сахарный диабет может быть определено одним или более способами, описанными в WO 00/54799, например, путем контроля уровня гликозилированного гемоглобина, уровня глюкозы крови, гипогликемических приступов, уровня жирорастворимых витаминов, таких как витамины A, D и E, необходимой суточной дозы инсулина, индекса массы тела и периодов гипергликемии.
В отдельном осуществлении протеаза по изобретению не предназначена для применения в качестве агента очищения ран и/или для применения для заживления ран.
Описанное и заявленное здесь изобретение не предназначено для ограничения в объеме раскрытыми здесь конкретными осуществлениями, поскольку данные осуществления предназначены в качестве иллюстраций отдельных аспектов изобретения. Любые эквивалентные осуществления рассматриваются как входящие в объем данного изобретения. Действительно, различные модификации изобретения, дополнительные к показанным и описанным здесь, должны быть очевидны специалистам в данной области техники из представленного выше описания. Такие модификации также рассматриваются как попадающие в объем прилагаемой формулы изобретения. В случае конфликта настоящее раскрытие, включая определения, должно служить в качестве контроля.
Здесь цитируются различные ссылки, раскрытие которых включено в качестве ссылок во всей их полноте.
ПРИМЕРЫ
Пример 1
Получение очищенной протеазы Bacillus licheniformis
Чистый препарат протеазы Bacillus licheniformis с аминокислотами 1-274 SEQ ID NO: 1 получали следующим образом:
Вещества и способы:
TY бульон: триптон 20 г/л, дрожжевой экстракт 5 г/л, FeCl2, 4H2O 7 мг/л, MnCl2, 4H2O 1 мг/л, MgSO4, 7H2O 15 мг/л, pH 7,3.
PS-1 бульон: сахароза 100 г, соевая мука 40 г, Na2HPO4, 12H2O (Merck 6579) 10 г, CaCO3 5 г, плуроник PE 6100 (BASF) 0,1 мл, водопроводная вода до 1000 мл.
Ферментация:
Штамм, полученный из Bacillus licheniformis ATCC 14580 путем делеции гена (SEQ ID NO: 3), кодирующего другую протеазу, выращивали в течение ночи при 37°С на среде TY с агаром (бульоне TY, отвержденном 2% агаром) и инокулировали в встряхиваемые сосуды, содержащие 100 мл бульона PS-1. Встряхиваемые сосуды инкубировали при 37°С в течение 90 часов при встряхивании со скоростью 225 об/мин.
Очистка:
Бульон ферментации осаждали, и клетки отделяли от содержащей фермент жидкости центрифугированием. Электрофорез надосадочной жидкости в полиакриламидном геле с ДДС-Na показал наличие интенсивной полосы с относительной молекулярной массой приблизительно 31 кДа, соответствующей целевой протеазе. Наличие высокой протеазной активности в надосадочной жидкости было также подтверждено наличием крупных зон просветления на агаровых чашках с 1% обезжиренным молоком при pH 7 и 9. В качестве следующей стадии производили тщательное фильтрование жидкости после центрифугирования для удаления оставшихся суспендированных твердых веществ и последующее концентрирование ультрафильтрацией с использованием подходящих мембран, т.е. с величиной отсечения ниже размера протеазы. Наконец, концентрат фильтровали для удаления микробов.
100 мл стерилизованного фильтрованием жидкого концентрата разбавляли 10х 100 мМ H3BO3, 10 мМ янтарная кислота/NaOH, 2 мМ CaCl2, pH 7,0. pH полученного раствора протеазы составлял 7,0. 120 мл этого раствора наносили на 100-мл колонку бацитрацин-агарозы (UpFront Chromatography, № в каталоге 600-0100), уравновешенную 100 мМ H3BO3, 10 мМ янтарная кислота/NaOH, 2 мМ CaCl2, pH 7,0. После промывки колонки буфером для уравновешивания колонку ступенчато элюировали 100 мМ H3BO3, 10 мМ янтарная кислота/NaOH, 2 мМ CaCl2, 1М NaCl, pH 7,0, 25% (об./об.) изопропанол. Стадию бацитрацин-диоксид кремния повторяли 7 раз (всего 8 раз). Все элюаты объединяли (420 мл) и элюаты разбавляли до 15 л деминерализованной водой. pH разбавленной протеазы доводили до 6,0 20% CH3COOH и наносили на 400-мл колонку SP-сефарозы FF, уравновешенную 50 мМ H3BO3, 5 мМ янтарная кислота/NaOH, 1 мМ CaCl2, pH 6,0. Колонку тщательно промывали буфером для уравновешивания и элюировали линейным градиентом NaCl (0-0,5М) в объеме, составляющем 3 объема колонки. Элюированный пик протеазы (200 мл) переносили на 1,4-л колонку сефадекса G25 для замены буфера на 20 мМ HEPES/NaOH, 100 мМ NaCl, 1 мМ CaCl2, pH 7,0 (HEPES представляет собой 4-(2-гидроксиэтил)-1-пиперазинэтансульфокислоту). Протеазу с замененным буфером (340 мл) фильтровали в ячейке для фильтрации 0,22 мкм (такой как Corning, № в каталоге 431097).
Пример 2
Анализ фермента
Протеазный анализ с помощью Suc-AAPF-pNA
Субстрат: Suc-AAPF-pNA (Sigma® S-7388).
Буфер для анализа: 100 мМ янтарная кислота, 100 мМ HEPES (Sigma H-3375), 100 мМ CHES (Sigma C-2885), 100 мМ CABS (Sigma C-5580), 1 мМ CaCl2, 150 мМ KCl, 0,01% Triton® X-100 с pH, доведенным до 9,0 с помощью HCl или NaOH.
Температура анализа: 25°С.
300 мкл разбавленного образца протеазы смешивали с 1,5 мл буфера для анализа, и реакцию по определению активности инициировали добавлением 1,5 мл субстрата pNA (50 мг, растворенного в 1,0 мл ДМСО и дополнительно разбавленного 45× 0,01% Triton® X-100), и, после смешивания, отслеживали увеличение A405 с помощью спектрофотометра в качестве показателя протеазной активности. Образцы протеазы разбавляли до измерения активности таким образом, чтобы обеспечить попадание измерений активности на линейную часть кривой доза-ответ теста.
Протеазный анализ FIP
Протеазная активность может быть также определена с помощью теста FIP (Fédération Internationale Pharmaceutique), 1 единица FIP = 1 единица Ph.Eur. (European Pharmacopoeia). Данный тест описан, наряду с другими тестами FIP, в: Fédération Internationale Pharmaceutique, Scientific Section: International Commission for the standardization of pharmaceutical enzymes. a) “Pharmaceutical Enzymes,” Editors: R. Ruyssen and Lauwers, E. Story Scientia, Ghent, Belgium (1978), b) European Pharmacopoeia. См. также Deemester et al в Lauwers A, Scharpé S (eds): Pharmaceutical Enzymes, New York, Marcel Dekker, 1997, p. 343-385. Данный тест применяли для определения протеазной активности в панкреатине. Для определения активности FIP микробных протеаз стадию активации добавлением энтерокиназы опускали.
Принцип: Субстрат казеин гидролизуется протеазой при pH 7,5 и температуре 35°С. Реакцию останавливают добавлением трихлоруксусной кислоты, и недеградированный казеин отфильтровывают. Количество пептидов, оставшихся в растворе, определяют спектрометрией при 275 нм.
Определение активности: Протеазную активность определяют как количество пептидов, не осажденных 5,0% (масс./об., т.е. 5,0 г/100 мл) раствором трихлоруксусной кислоты, в сравнении с реперным порошком поджелудочной железы (реперным протеазным стандартом) с известной активностью FIP.
Вещества и способы:
Раствор казеина:
1,25 г казеина (сухое вещество), например, Calbiochem № 218680, суспендируют в воде до получения практически прозрачного раствора. pH доводят до 8,0, и раствор разбавляют водой до конечного объема 100 мл. Здесь и далее вода означает деионизированную воду.
Боратный буфер pH 7,5:
2,5 г хлорида натрия, 2,85 г тетрабората динатрия и 10,5 г борной кислоты растворяют в 900 мл воды, pH доводят до 7,5+/-0,1 и разбавляют до 1000 мл водой.
Бумажный фильтр:
Складчатые фильтры диаметром 125 мм, например, Schleicher & Schuell № 1574Ѕ. Тестирование бумажного фильтра: Фильтровать 5 мл 5,0% трихлоруксусной кислоты через фильтр. Поглощение при 275 нм должно быть менее 0,04 при использовании в качестве контроля нефильтрованного раствора трихлоруксусной кислоты.
Реперный стандарт протеазы:
Протеаза (панкреатическая), продаваемая International Commission on Pharmaceutical Enzymes, Centre for Standards, Harelbekestraat 72, B-9000 Ghent, Бельгия. Стандарт имеет указанную на этикетке активность (A) в FIP/Ph.Eur. единицах/г. Аккуратно отвесить количество, соответствующее приблизительно 130 протеазным единицам FIP/Ph.Eur. Добавить на кончике шпателя морского песка, увлажнить несколькими каплями охлажденного на льду 0,02М хлорида кальция (pH 6,0-6,2) и растереть все стеклянной палочкой с плоским концом. Разбавить приблизительно 90 мл того же охлажденного на льду раствора хлорида кальция и перемешивать суспензию в течение от 15 до 30 минут в ледяной бане. pH довести до 6,1 и объем довести до 100 мл тем же раствором хлорида кальция. 5,0 мл данной суспензии разбавить боратным буфером pH 7,5 до 100 мл. Для тестирования активности используют 1,0, 2,0 и 3,0 мл этого раствора в качестве репера (обозначаемые далее S1, S2 и S3, где S означает стандарт).
Суспензия тестирования:
Приготовить суспензию образца, как описано выше для реперного стандарта протеазы, с использованием количества образца, эквивалентного приблизительно 260 единицам FIP/Ph.Eur. Довести pH до 6,1 и добавить воду до 100 мл. 5,0 мл этого раствора смешать с 5 мл раствора хлорида кальция. 5 мл этого разбавленного раствора дополнительно разбавить до 100 мл боратным буфером. Использовать 2 мл этого раствора для анализа (где образец обозначают как Un, образец с неизвестной (unknown) активностью под номером n.
Процедура анализа (тестирования активности):
Проводят анализ для трех реперных суспензий (S1, S2 и S3) и суспензии образца (Un), все в трех повторах. Достаточно одного контроля на образец (обозначаемого S1b, S2b, S3b и Unb, соответственно. Готовят слепую (B) пробу без образца/стандарта в качестве компенсационной жидкости для спектрофотометра. В пробирки добавляют боратный буфер следующим образом: Слепая (B) проба 3,0 мл; образец (Un) 1,0 мл; стандарты (S1, S2 и S3) 2,0, 1,0 и 0 мл, соответственно. К S1, S2 и S3 добавляют реперный стандарт протеазы следующим образом: 1,0, 2,0 и 3,0 мл, соответственно. Тестируемую суспензию добавляют в пробирки для образца следующим образом (Un): 2,0 мл. Добавляют 5 мл трихлоруксусной кислоты во все слепые пробы (S1b, S2b, S3b, Unb и B) с последующим немедленным перемешиванием. Все пробирки закрывают стеклянной пробкой и помещают вместе с раствором субстрата в водяную баню с постоянной температурой (35+/- 0,5˚С). После уравновешивания температуры в нулевой момент времени добавляют 2,0 мл раствора казеина в пробирки S1, S2, S3 и Un с последующим немедленным перемешиванием. Ровно через 30 минут в каждую из пробирок S1, S2, S3 и Un добавляют 5,0 мл трихлоруксусной кислоты с последующим немедленным перемешиванием. Пробирки вынимают из водяной бани и оставляют при комнатной температуре на 20 минут для завершения осаждения белков. Содержимое каждой пробирки фильтруют дважды через один и тот же фильтр, и измеряют поглощение фильтратами при 275 нм с использованием фильтрата пробирки B в качестве жидкости для компенсации. Активность образца (Un) в единицах FIP рассчитывают относительно указанной на этикетке активности стандартов (S1, S2 S3). Величины поглощения минус величины соответствующих слепых проб (например, поглощение S1 минус поглощение S1b) должно находиться в интервале 0,15-0,60.
Протеазный анализ AU
Денатурированный гемоглобин (0,65% (об./об.) в содержащем мочевину 6,7 мМ KH2PO4/NaOH буфере, pH 7,50) подвергают деградации при 25°С в течение 10 минут под действием протеазы, и недеградированный гемоглобин осаждают трихлоруксусной кислотой (ТХУ) и удаляют фильтрованием. Растворимые в ТХУ продукты деградации гемоглобина в фильтрате определяют с помощью фенолового реактива Folin & Ciocalteu (1 объем фенолового реактива Folin-Ciocalteu Merck 9001.0500 на 2 объема деминерализованной воды), который дает синее окрашивание с несколькими аминокислотами (измеряемое при 750 нм). Измеряют единицу активности (AU) и определяют по отношению к стандарту. Субстрат денатурированного гемоглобина может быть получен следующим образом: 1154 г мочевины (Harnstoff, Merck 8487) растворяют в 1000 мл деминерализованной воды, добавляют 240,3 г NaOH и затем медленно добавляют 63,45 г гемоглобина (Merck 4300), после чего добавляют 315,6 г KH2PO4 и деминерализованную воду до 3260 г. pH доводят до 7,63. Дополнительные подробности и подходящий стандарт Alcalase можно получить по запросу от Novozymes A/S, Krogshoejvej 36, DK-2880, Bagsvaerd, Дания) (тест № EB-SM-0349.01).
Анализ липазы pNP
Субстрат: пара-нитрофенил(pNP)валерат
pH тестирования: 7,7
Температура тестирования: 40°С
Время реакции: 25 мин.
Переваренный продукт желтого цвета имеет характеристическое поглощение при 405 нм. Его количество определяют спектрофотометрией. Одна липазная единица представляет собой количество фермента, которое высвобождает 1 микромоль титруемой масляной кислоты в минуту при указанных условиях анализа. Более подробное описание анализа, AF95/6-GB, можно получить по запросу от Novozymes A/S, Krogshoejvej 36, DK-2880 Bagsvaerd, Дания.
Анализ липазы LU
В данном тесте катализируемая липазой деградация 0,16М трибутирина (глицеролтрибутират, Merck 1.01958.000) при pH 7,00 и 30°С (+/-1°С) сопровождается pH-статным титрованием выделенной масляной кислоты 0,025М дегазированным, свободным от CO2 гидроксидом натрия (Sodium hydroxide titrisol, Merck 9956). Расход титранта фиксируется как функция времени.
Субстрат эмульгируют 0,6% масс./об. гуммиарабиковым эмульгатором (20,0 г гуммиарабика, 89,5 г NaCl, 2,05 г KH2PO4, добавить воду до 1,5 л, оставить до полного растворения, добавить 2700 мл глицерина, довести pH до 4,5). 90 мл трибутирина смешать с 300 мл гуммиарабикового эмульгатора и 1410 мл деминерализованной воды и смешивать в течение 3 минут с применением, например, эмульгатора Silverson L4RT при 7000 об/мин и затем довести pH до 4,75. Образцы липазы разбавляют сначала в 0,1М глициновом буфере pH 10,8, затем в деминерализованной воде с целью получения уровня активности 1,5-4,0 LU/мл. 15 мл раствора эмульгированного субстрата вносят в сосуд для титрования. Добавляют 1,0 мл раствора образца и поддерживают pH 7,0 во время титрования. Измеряют количество титранта, добавляемого за минуту для поддержания постоянного pH. Расчет активности основывается на среднем наклоне линейной области кривой титрования. В качестве контроля уровня может быть использован стандарт с известной активностью.
1 LU (липазная единица) представляет собой количество фермента, которое высвобождает 1 микромоль титруемой масляной кислоты за минуту при условиях анализа, указанных выше. 1 kLU (килолипазная единица) = 1000 LU.
Более подробное описание анализа, EB-SM-0095.02, можно получить по запросу от Novozymes A/S, Krogshoejvej 36, DK-2880 Bagsvaerd, Дания.
pH-статный анализ липазы
Данный анализ основывается на катализируемом липазой высвобождении жирных кислот из эмульсии оливкового масла в присутствии 0,65 мМ солей желчных кислот. Субстрат эмульгируют с помощью гуммиарабика в качестве эмульгатора (175 г оливкового масла, эмульгированного 630 мл раствора гуммиарабика (474 г гуммиарабика, 64 г хлорида кальция в 4000 мл воды) в течение 15 мин в смесителе; после охлаждения до комнатной температуры pH доводят до 6,8-7,0 с помощью 4М NaOH).
Для определения 19 мл эмульсии и 10 мл раствора солей желчных кислот (492 мг солей желчных кислот растворяют в воде и доводят до 500 мл) смешивают в реакционном сосуде и нагревают до температуры от 36,9°С до 37,5°С. Реакцию инициируют добавлением 1,0 мл раствора фермента. Выделяющуюся кислоту титруют автоматически при pH 7,0 добавлением 0,1М гидроксида натрия в течение в общей сложности 5 мин. Активность рассчитывают по наклону кривой титрования между 1-й и 5-й минутами. Для калибровки измеряют стандарт при трех разных уровнях активности.
Амилаза
Субстрат: таблетки Phadebas (Pharmacia Diagnostics; поперечно-сшитый, нерастворимый, окрашенный в синий цвет полимер крахмала, который смешан с бычьим сывороточным альбумином и веществом буфера и производится в виде таблеток)
Температура анализа: 37°С
pH анализа: 4,3 (или, при желании, 7,0)
Время реакции: 20 мин
После суспендирования в воде крахмал гидролизуется альфа-амилазой с образованием растворимых синих фрагментов. Поглощение полученным синим раствором, измеряемое при 620 нм, является функцией альфа-амилазной активности. Одна грибковая альфа-амилазная единица (1 FAU) представляет собой количество фермента, которое разрушает 5,26 г крахмала (Merck, Amylum solubile Erg. B. 6, Batch 9947275) за час при стандартных условиях анализа. Более подробное описание анализа, APTSMYQI-3207, можно получить по запросу от Novozymes A/S, Krogshoejvej 36, DK-2880 Bagsvaerd, Дания.
Пример 3
Тест скрининга in vivo протеазы Bacillus licheniformis
Очищенную протеазу Bacillus licheniformis примера 1 тестировали на самках геттингенских мини-свиней (Ellegaard) с панкреатином в качестве эталона. Экзокринную недостаточность поджелудочной железы (PEI) индуцировали у мини-свиней перевязкой протока поджелудочной железы и им также вставляли илеоцекальную канюлю, все под галотановым наркозом и при массе приблизительно 25 кг, как описано в Tabeling et al., J. 1999, Studies on nutrient digestibilities (pre-caecal and total) in pancreatic duct-ligated pigs and the effects of enzyme substitution, J. Anim. Physiol. A. Anim. Nutr. 82: 251-263 (далее здесь обозначаемой как “Tabeling 1999”); и в Gregory et al., J. 1999. Growth and digestion in pancreatic duct ligated pigs, Effect of enzyme supplementation in “Biology of the Pancreas in Growing Animals” (SG Pierzynowski & R. Zabielski eds), Elsevier Science BV, Amsterdam, pp 381-393 (далее здесь обозначаемой как “Gregory et al 1999”). Для восстановления после хирургической операции давали, по меньшей мере, 4 недели перед началом исследований. Перед началом исследования подтверждали состояние PEI каждой свинки посредством теста химотрипсина в стуле (имеющегося в продаже от Immunodiagnostik AG, Wiesenstrasse 4, D-64625 Bensheim, Германия, № в каталоге K 6990).
Во время испытаний свинок содержали в модифицированных метаболических клетках при цикле освещенности 12:12 час свет-темнота, обеспечивали свободный доступ к воде и кормили два раза в день. Для оценки эффективности протеазы свинок кормили 250 г тестирующей пищи, смешанной с 1 литром воды, 0,625 г Cr2O3 (маркер оксид хрома), в которую добавляли различные количества протеазы (0, 1000, 2500, 6000 FIP U протеазы/кормление (протеазные единицы FIP, см. пример 2)), смешиваемые непосредственно перед кормлением. Тестирующая пища содержала 21,4% белка, 51,9% крахмала, 2,6% жира и имела следующий состав (г/100 г сухого вещества): рыбья мука 3,5, мука мяса домашней птицы 10,2, пшеничная мука 29,5, лущеный рис 14, картофельный крахмал 11, маисовый крахмал 14, казеин 5,9, порошок целлюлозы 4,3, витамины, минеральные вещества и микроэлементы 7,6 (в соответствии с требованиями по кормлению свиней, см., например, таблицу A WO 01/58276).
Химус подвздошной кишки собирали на лед на протяжении в целом 8 час после первого появления маркера пищи в подвздошной кишке (зеленый химус) и хранили при -20°С до проведения анализа. Отдельные определения разделяли, по меньшей мере, одним днем вымывания.
Вкратце, замороженные образцы лиофилизовали и анализировали на предмет сухого вещества (DM) и сырого белка. DM определяли по массе после лиофилизации с последующей 8-часовой инкубацией при 103°С. Сырой белок рассчитывали как содержание азота (N), умноженное на коэффициент 6,25, т.е. сырой белок (г/кг) = N (г/кг) × 6,25, как указано в Animal Nutrition, 4th edition, Chapter 13 (Eds. P. McDonald, R.A. Edwards and J.F.D. Greenhalgh, Longman Scientific and Technical, 1988, ISBN 0-582-40903-9). Содержание азота определяли способом Кьельдаля (Naumann and Bassler, 1993, Die chemische Untersuchung von Futtermitteln. 3 edition VDLUFA-Verlag, Darmstadt, Германия (VDLUFA = Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten).
Расчет кажущегося переваривания белка до слепой кишки производили согласно формуле:



где Cr2O3 и белок выражали в виде г/100 г сухого вещества. Количество Cr2O3 может быть определено способами, известными в данной области техники, предпочтительно путем окисления до хромата и измерения поглощения при 365 нм, как описано Petry and Rapp в Zeitung für Tierphysiologie (1970), vol. 27, p. 181-189. Результаты данного испытания представлены в таблице 1.
Из результатов таблицы 1 очевидно, что протеаза SEQ ID NO: 2 по изобретению функционирует с той же эффективностью, что и известные препараты панкреатина. Протеаза по изобретению вызывала значительное и зависимое от дозы улучшение переваривания белка, проявляя высокую эффективность в улучшении уже при наименьшей тестированной дозировке.
Пример 4
Тестирование протеаз in vitro
In vitro тестировали различные протеазы на их способность вызывать деградацию белка в условиях, стимулирующих переваривание.
Протеазы
Тестировали следующие субтилизиновые протеазы по изобретению: протеазу Bacillus licheniformis с аминокислотами 1-274 SEQ ID NO: 1; протеазу Bacillus amyloliquefaciens с аминокислотами 1-275 SEQ ID NO: 10 и вариант протеазы 99aE Bacillus lentus с аминокислотами 1-269 SEQ ID NO: 11 (E (Glu) была вставлена после аминокислотного остатка № 99, S (Ser) в аминокислотах 1-269 SEQ ID NO: 11). Все эти протеазы имеют процент идентичности с аминокислотами 1-274 SEQ ID NO: 1 приблизительно 50%.
Для сравнения были также включены некоторые субтилизиновые протеазы, не входящие в изобретение, а именно из Bacillus halmapalus NCIB 12513 (описанная в WO 88/01293, а также в WO 98/012005 (SEQ ID NO: 42, Bacillus sp. JP170)) и из Bacillus sp. NCIMB 40339 (описанная в WO 92/017577 как Bacillus sp. TY145). Все эти протеазы имеют процент идентичности с аминокислотами 1-274 SEQ ID NO: 1 ниже 50%. Более того, для сравнения была включена несубтилизиновая протеаза Nocardiopsis, описанная в WO 2005/115445 (аминокислоты 1-188 SEQ ID NO: 1 в ней). Эта протеаза также имеет идентичность с аминокислотами 1-274 SEQ ID NO: 1 ниже 50%. Наконец, в качестве положительного контроля был включен панкреатин.
Все протеазы одинаково дозировали на основе ферментного белка, а именно 72, 36, 18 и 9 мг ферментного белка (EP) на корм из 250 г. Количество протеазного ферментного белка рассчитывали на основе величин A280 и аминокислотных последовательностей (аминокислотных составов) с использованием принципов, очерченных в S.C.Gill & P.H. von Hippel, Analytical Biochemistry 182, 319-326, (1989).
Вещества и способы
Соли желчных кислот (т.е. таурохолат натрия BRP, партия 2 от Ph.Eur или FIP, продаваемый также, например, LGC promochem, 500 г/моль), пепсин (Merck, VL 317492 437 (1.07192)), панкреатин (от Solvay Pharmaceuticals). Протеазная диета: 51,9% крахмала, 21,3% белка и 2,6% жиров/липидов.
Модель in vitro
Протеазную диету растворяли в 0,1М HCl до концентрации 0,2 г диеты/мл. pH доводили до 3,0 (имитирующего условия в желудке). В каждую лунку планшета для микротитрования (MTP) добавляли 100 мкл кашицы диеты, 20 мкл пепсина (конечная концентрация 70 мг/л в деминерализованной воде (Milli-Q) и 30 мкл протеазы (или Milli-Q в контроле без фермента). Содержимое инкубировали в течение 1 час при 37°С, 700 об/мин. В конце 1-часовой инкубации измеренный pH равнялся 3,4. Для повышения pH до 6,0 (имитирующего условия в кишечнике) в каждую лунку добавляли 25 мкл смешанного буфера pH 5/9 (0,8 М MES, 0,8М имидазол, 0,8М Na-ацетат, pH 5,0 или pH 9,0; 40% pH 5 и 60% pH 9 буфера). Дополнительно добавляли 25 мкл солей желчных кислот (конечная концентрация 5 мМ), и содержимое инкубировали 2 час при 37°С, 700 об/мин. После инкубации in vitro MTP центрифугировали при 2700 об/мин (1500g), 4°С в течение 10 мин и собирали супернатанты для дальнейших исследований.
Определение свободных аминогрупп (OPA)
Супернатанты, полученные перевариванием in vitro, анализировали путем определения свободных аминогрупп с помощью реакции с OPA (O-фтальальдегидом). Процедура определения OPA была следующей: 20 мкл разбавленного супернатанта in vitro переносили в новый MTP и добавляли 200 мкл реагента OPA (80 мг OPA растворяют в 2 мл 96% этанола; 3,81 г декагидрата тетрабората динатрия, 1 мл 10% ДДС-Na, 88 мг DTT и раствор OPA в этаноле доводят до 100 мл водой Milli-Q). Измеряли поглощение при 340 нм. В определение включали ряд серинового стандарта (0,5 мг/мл - 0,078 мг/мл).
В таблице 2 ниже показаны результаты в виде мМ гидролизованных аминогрупп. Результаты представляют собой средние величины измерений двух параллельных, и представлено также стандартное отклонение (ст.откл.). Показаны лишь результаты с 72 мг ферментного белка на кормление, поскольку в данном тесте результаты с меньшими дозами фермента не обеспечивали надежного разграничения ферментов.
Результаты таблицы 2 показывают, что протеазы по изобретению (SEQ 1, SEQ 10) очень хорошо функционируют в данной модели in vitro. Этого не наблюдается в случае протеаз JP170 и TY145, которые не входят в состав настоящего изобретения. Действительно, без учета протеазы Nocardiopsis, которая является протеазой совершенно другого типа и не включена в настоящее изобретение, по-видимому, имеется корреляция между процентом идентичности с SEQ ID NO: 1 изобретения и эффективностью в данной модели (чем выше % идентичности, тем выше эффективность).
В отдельном эксперименте, проведенном, как описано выше, заявители тестировали эффективность in vitro варианта протеазы Bacillus lentus по изобретению (вариант SEQ 11) с включением сюда также протеазы Nocardiopsis для сравнения. Результаты определения зависимости доза-ответ показаны в таблице 3 ниже.
Во-первых, эти результаты показывают хорошее отношение доза-ответ. Во-вторых, следует отметить, что протеаза по изобретению (вариант SEQ 11) также работает очень хорошо, особенно в дозе 72 мг EP/кормление. Вариант SEQ 11, кроме того, по-видимому, хорошо соответствует корреляции между процентом идентичности с SEQ ID NO: 1 и эффективности по отношению к последней (относительно протеазы Nocardiopsis, которая была включена в оба эксперимента).
Пример 5
Фармацевтические протеазные композиции
(A) Высокоэффективные пилюли
Стерилизованный фильтрацией жидкий концентрат протеазы с аминокислотами SEQ ID NO: 1 получали как описано в примере 1 и высушивали распылением. Измеренное содержание протеазного белка высушенного распылением протеазного порошка составляло 58,5%. 1125 г высушенной распылением протеазы в форме порошка сушили после предварительного смешивания с микрокристаллической целлюлозой (450 г) и полиэтиленгликолем 4000 (MacrogolTM 4000; 675 г) в имеющемся в продаже смесителе. Добавляли изопропиловый спирт (460 г; 100%), и полученную влажную массу продолжали тщательно перемешивать при комнатной температуре. Однородную массу затем подвергали экструзии в имеющемся в продаже экструдере, снабженном пробивным штампом с диаметром отверстия 0,8 мм, с образованием цилиндрических пилюль. Во время экструзии температура шариков не превышала 50°С. Полученный экструдат подвергали закруглению с получением сферических пилюль с помощью имеющегося в продаже сферонизатора путем добавления необходимого количества 100% изопропилового спирта (54,5 г). Пилюли сушили при температуре продукта приблизительно 40°С в имеющейся в продаже сушилке (от Voetsch). Температура продукта не превышала 45°С. Высушенные пилюли затем разделяли с помощью аппарата для механического просеивания с ситами 0,7 и 1,4 мм. Просеянные фракции размером ≥0,7 мм и ≤1,4 мм собирали и заполняли их порциями по 200 мг в каждую капсулу размера 2. Концентрация протеазы в полученных высушенных пилюлях составляла приблизительно 29,3% (масс./масс.).
(A) Пилюли с меньшей эффективностью
Подобно представленному выше примеру (A) пилюли с меньшим содержанием протеазы в качестве лекарственного вещества получали с использованием партии размером 2250 г с применением 562,5 г высушенной разбрызгиванием протеазы в форме порошка (с измеренным содержанием белка протеазы 58,5%), микрокристаллической целлюлозы (1125 г), полиэтиленгликоля 4000 (562,5 г), изопропилового спирта для увлажнения (700 г) и изопропилового спирта для округления (61,2 г). Концентрация протеазы в полученных сухих пилюлях составляла приблизительно 14,6% (масс./масс.).
Полученные пилюли из примеров (A) и (B) тестировали на протеолитическую активность с помощью способа FIP для протеаз порошка поджелудочной железы с модификацией, заключающейся в опущении стадии активации. Не было обнаружено потери протеолитической активности пилюль в каждом случае по отношению к исходному порошковому веществу протеазы.
Полученные пилюли примеров (A) и (B) затем тестировали на предмет разрушения согласно Pharm. Eur. 2.9.1. (Раздел «Разрушение таблеток и капсул») (раствор тестирования: вода - 500 мл, 37°С).
Разрушение пилюль примера (A) завершалось в течение 3 мин. Разрушение пилюль примера (B) завершалось в течение 11 мин.
Пример 6
Фармацевтические композиции протеазы и амилазы
Высокоэффективные пилюли, содержащие амилазу и протеазу, получали следующим образом:
Жидкий концентрат амилазы, содержащей аминокислоты 1-486 SEQ ID NO: 16, получали, как описано в DK 2005 00931 (стерилизованный фильтрованием концентрат). Жидкий концентрат высушивали распылением. Измеренное содержание белка амилазы в высушенном распылением порошке амилазы составляло 37%. Высушенную распылением амилазу в форме порошка (398,5 г) предварительно смешивали в сухом виде с высушенным распылением порошком протеазы, полученным, как описано в примере 5 (746,5 г; с измеренным содержанием белка протеазы 58,5%), микрокристаллической целлюлозой (458 г) и полиэтиленгликолем 4000 (MacrogolTM 4000; 687 г) в имеющемся в продаже смесителе. Добавляли 100% изопропиловый спирт (460 г), и полученную влажную массу продолжали тщательно перемешивать при комнатной температуре. Однородную массу затем подвергали экструзии в имеющемся в продаже экструдере, снабженном пробивным штампом с диаметром отверстия 0,8 мм, с образованием цилиндрических пилюль. Во время экструзии температура шариков не превышала 50°С. Полученный экструдат подвергали закруглению с получением сферических пилюль с помощью имеющегося в продаже сферонизатора путем добавления необходимого количества 100% изопропилового спирта (58 г). Пилюли сушили при температуре приблизительно 40°С в имеющейся в продаже вакуумной сушилке (от Voetsch). Температура продукта не превышала 45°С. Высушенные пилюли затем разделяли с помощью аппарата для механического просеивания с ситами 0,7 и 1,4 мм. Просеянные фракции размером ≥0,7 мм и ≤1,4 мм собирали и заполняли их порциями по 200 мг в каждую капсулу размера 2. Концентрация протеазы в полученных высушенных пилюлях составляла приблизительно 19,1% (масс./масс.), а концентрация амилазы в полученных высушенных пилюлях составляла приблизительно 6,4% (масс./масс.).
Полученные пилюли тестировали на протеолитическую и амилолитическую активности в соответствии со способами, описанными выше. Не было обнаружено потери протеолитической или амилолитической активности пилюль в каждом случае по отношению к исходному порошковому веществу протеазы или амилазы, соответственно.
Пример 7
Стабильность и эффективность in vivo липазы в присутствии протеазы
Стабильность и эффективность варианта липазы Humicola lanuginosa SEQ ID NO: 15 в присутствии протеазы по изобретению (протеазы, содержащей аминокислоты 1-274 SEQ ID NO: 1) тестировали следующим образом:
Очищенную липазу тестировали в испытании in vivo, как в целом описано в примере 2 заявки PCT с заявленным приоритетом заявки DK № 200500929, за исключением того, что доза устанавливалась в соответствии с липазными единицами, определенными в панкреатическом тесте FIP, также описанном в данной ссылке. Величины переваривания (коэффициент всасывания жира; CFA) определяли так же, как описано в цитируемой патентной заявке.
Липазу тестировали отдельно и в сочетании с протеазой при различных соотношениях доз. Протеазную активность определяли с помощью панкреатического теста FIP (см. ссылку в примере 1).
Результаты показаны в таблице 4 ниже в виде средних значений CFA (%) с указанием стандартного отклонения (ст. откл.).
Для каждой из двух тестированных доз липазы не было значимых различий между результатами в отсутствие и в присутствии протеазы в двух разных дозах. Можно, таким образом, заключить, что протеаза не оказывает неблагоприятного действия на липазу in vivo.
Реферат
Настоящее изобретение относится к биотехнологии. Предложено применение бактериальной протеазы, полученной из Bacillus licheniformis, с аминокислотной последовательностью, приведенной в материалах заявки, в качестве лекарственного средства для лечения недостаточности экзокринной функции поджелудочной железы. Изобретение расширяет арсенал средств для лечения экзокринной недостаточности поджелудочной железы. 2 з.п. ф-лы, 4 табл.
Формула
a) протеаза включает аминокислотную последовательность 1-274 SEQ ID NO: 2; и/или
b) протеаза представляет собой вариант аминокислотной последовательности 1-274 SEQ ID NO: 2, где вариант отличается от соответствующей аминокислотной последовательности не более чем на двадцать пять аминокислот и где:
(i) вариант включает, по меньшей мере, одну замену, делецию и/или вставку одной или нескольких аминокислот по сравнению с соответствующей аминокислотной последовательностью; и/или
(ii) вариант включает, по меньшей мере, одну небольшую делецию по сравнению с соответствующей аминокислотной последовательностью;
и/или
(iii) вариант включает, по меньшей мере, одно небольшое N-или С-концевое удлинение по сравнению с соответствующей аминокислотной последовательностью; и/или
c) протеаза представляет собой аллельный вариант протеазы, имеющей аминокислоты 1-274 SEQ ID NO: 2; и/или
d) протеаза представляет собой фрагмент протеазы, имеющей аминокислоты 1-274 SEQ ID NO: 2.
Документы, цитированные в отчёте о поиске
Варианты стимулируемой солями желчи липазы, кодирующие их молекулы днк и трансгенные млекопитающие,не принадлежащие к человеку

Комментарии