Способы и наборы для прогнозирования риска инфузионных реакций и опосредованной антителами потери ответа при терапии пэгилированной уриказой с помощью мониторинга содержания мочевой кислоты в сыворотке крови - RU2535038C2
Код документа: RU2535038C2
Чертежи

Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка испрашивает приоритет и эффект по предварительной заявке США № 61/269669, поданной 25-го июня 2009 года, предварительной заявке США № 61/248698, поданной 5-го октября 2009 года, и предварительной заявке США № 61/298718, поданной 27-го января 2010 года.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к способам мониторинга иммуногенности и инфузионных реакций при терапии ПЭГилированной уриказой.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В тексте данной заявки приведены ссылки на различные публикации. Таким образом, полное описание этих публикаций включено путем ссылки в настоящую заявку для более исчерпывающего описания состояния области изобретения, известного специалистам в данной области на момент описания изобретения и его формулы.
Подагра представляет собой хроническое нарушение метаболизма мочевой кислоты, приводящее к отложению кристаллов моноурата натрия в суставах и мягких тканях, сопровождающемуся воспалением, и, с течение времени у некоторых пациентов - разрушительной хронической артропатией. Подагра является наиболее распространенной формой артрита у мужчин, а частота случаев и распространенность заболевания увеличиваются у пожилых людей обоего пола. Хроническая подагра, рефрактерная к стандартной терапии (GRT), является редким, но тяжелым исходом прогрессирующей подагры, возникающим в результате показанной непереносимости или невосприимчивости к имеющимся методам лечения, направленным на предупреждение отложения кристаллов уратов путем снижения и поддержания содержания уратов в крови в диапазоне ниже насыщения.
Повышенное содержание уратов в крови является отличительным биохимическим маркером подагры. Постоянное повышенное содержание мочевой кислоты в плазме (PUA) или мочевой кислоты в сыворотке (SUA) приводит к отложению мочевой кислоты в суставах и мягких тканях. При увеличении общей нагрузки мочевой кислоты на организм возникают симптомы подагры, включая артрит, отличающийся рецидивирующими болезненными приступами подагры, развитием тофусов и деформацией суставов с возникающими в результате хроническими болью/воспалением и последующей потерей физических функций.
Эффективным конечным результатом успешной терапии ПЭГилированной уриказой является нормализация содержания мочевой кислоты в сыворотке у пациентов с CGR при сохранении низкой иммуногенности и низкого риска инфузионных реакций, ассоциированных с внутривенными инъекциями ПЭГилированной уриказы. Однако принимая во внимание то, что введение ПЭГилированной уриказы может сопровождаться потерей эффекта ПЭГилированной уриказы и инфузионными реакциями, практикующие врачи должны быть проинформированы о моменте, когда необходимо прекратить лечение. Поэтому в данной области необходимы новые способы, указывающие практикующим врачам, когда для минимизации инфузионных реакций и ассоциированных с ними рисков следует прекратить терапию ПЭГилированной уриказой.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам предупреждения инфузионных реакций при терапии ПЭГилированной уриказой у пациента, включающим в себя стадии: а) введения указанному пациенту ПЭГилированной уриказы; b) получения биологического образца от указанного пациента; с) определения содержания мочевой кислоты в указанном биологическом образце; и d) указания, что терапию можно прекратить для предупреждения инфузионных реакций, когда указанное содержание мочевой кислоты превышает 4 мг/дл. В одном аспекте изобретения терапию ПЭГилированной уриказой можно прекратить, когда указанное содержание мочевой кислоты превышает примерно 5 мг/дл. В другом аспекте изобретения терапию ПЭГилированной уриказой можно прекратить, когда указанное содержание мочевой кислоты превышает примерно 6 мг/дл, а еще в одном аспекте изобретения терапию ПЭГилированной уриказой можно прекратить, когда указанное содержание мочевой кислоты превышает примерно 7 мг/дл.
В другом аспекте изобретения ПЭГилированную уриказу вводят в дозировке примерно 8 мг каждые 2 недели. В одном варианте осуществления изобретения ПЭГилированную уриказу вводят в дозировке примерно 8 мг каждые 3 недели. В другом варианте осуществления изобретения ПЭГилированную уриказу вводят в дозировке примерно 8 мг каждые 4 недели. В еще одном варианте осуществления изобретения ПЭГилированную уриказу вводят в дозировке примерно 4 мг каждые 2 недели. В еще одном варианте осуществления изобретения ПЭГилированную уриказу вводят в дозировке примерно 12 мг каждые 4 недели.
Способы по настоящему изобретению относится к биологическому образцу, выбранному из группы, состоящей из крови, сыворотки и плазмы. В одном варианте осуществления изобретения указанное содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 2 часа после введения, описанного в стадии (а). В другом варианте осуществления изобретения указанное содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 6 часов после введения, описанного в стадии (а). В еще одном варианте осуществления изобретения указанное содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 24 часа после введения, описанного в стадии (а). В еще одном варианте осуществления изобретения указанное содержание мочевой кислоты в указанном биологическом образце определяют через 2 недели после введения, описанного в стадии (а). И в еще одном варианте осуществления изобретения указанное содержание мочевой кислоты в указанном биологическом образце определяют через 4 недели после введения, описанного в стадии (а).
Способы по настоящему изобретению относятся к пациентам, страдающим подагрой. В одном варианте осуществления изобретения указанная подагра не поддается лечению. В другом варианте осуществления изобретения указанная подагра является хронической или тофусной. В еще одном варианте осуществления изобретения ПЭГилированную уриказу вводят внутривенно.
Способы по настоящему изобретению прогнозируют развитие инфузионных реакций у пациента, получающего лечение ПЭГилированной уриказой, причем способ включает в себя стадии: а) введения указанному пациенту ПЭГилированной уриказы; b) получения биологического образца от указанного пациента; с) определения содержания мочевой кислоты в указанном биологическом образце; и d) указания, что содержание мочевой кислоты ассоциировано с меньшей вероятностью инфузионной реакции, когда указанное содержание сохраняется на уровне меньше примерно 4 мг/дл, или указания, что указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью инфузионной реакции в момент времени, когда указанное содержание составляет по меньшей мере примерно 4 мг/дл.
В одном аспекте изобретения указанное содержание мочевой кислоты ассоциировано с меньшей вероятностью инфузионной реакции, когда указанное содержание сохраняется на уровне меньше примерно 5 мг/дл, или указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью инфузионной реакции в момент времени, когда указанное содержание составляет по меньшей мере примерно 5 мг/дл. В другом аспекте изобретения указанное содержание мочевой кислоты ассоциировано с меньшей вероятностью инфузионной реакции, когда указанное содержание сохраняется на уровне меньше примерно 6 мг/дл, или указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью инфузионной реакции, когда указанное содержание составляет по меньшей мере примерно 6 мг/дл. В еще одном аспекте изобретения указанное содержание мочевой кислоты ассоциировано с меньшей вероятностью инфузионной реакции, когда указанное содержание сохраняется на уровне меньше примерно 7 мг/дл, или указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью инфузионной реакции в момент времени, когда указанное содержание составляет по меньшей мере примерно 7 мг/дл.
В другом аспекте изобретения содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 3 дня после введения, описанного в стадии (а). В другом аспекте изобретения содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 1 неделю после введения, описанного в стадии (а). В другом аспекте изобретения содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 2 недели после введения, описанного в стадии (а). В другом аспекте изобретения содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 4 недели после введения, описанного в стадии (а).
Способы по настоящему изобретению прогнозируют, будет ли у пациента, получающего терапию ПЭГилированной уриказой, возникать опосредованное антителами выведение ПЭГилированной уриказы, без измерения титра антител к ПЭГилированной уриказе и ПЭГ, причем способ включает в себя стадии: а) введения указанному пациенту ПЭГилированной уриказы; b) получения биологического образца от указанного пациента; с) определения содержания мочевой кислоты в указанном биологическом образце; и d) указания, что содержание мочевой кислоты ассоциировано с меньшей вероятностью опосредованного антителами выведения ПЭГилированной уриказы, когда указанное содержание сохраняется на уровне меньше примерно 4 мг/дл, или указания, что указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью опосредованного антителами выведения ПЭГилированной уриказы в момент времени, когда указанное содержание составляет по меньшей мере примерно 4 мг/дл.
В одном аспекте изобретения указанное содержание мочевой кислоты ассоциировано с меньшей вероятностью опосредованного антителами выведения ПЭГилированной уриказы, когда указанное содержание сохраняется на уровне меньше примерно 5 мг/дл, или указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью опосредованного антителами выведения ПЭГилированной уриказы в момент времени, когда указанное содержание составляет по меньшей мере примерно 5 мг/дл. В другом аспекте изобретения указанное содержание мочевой кислоты ассоциировано с меньшей вероятностью опосредованного антителами выведения ПЭГилированной уриказы, когда указанное содержание сохраняется на уровне меньше примерно 6 мг/дл, или указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью опосредованного антителами выведения ПЭГилированной уриказы в момент времени, когда указанное содержание составляет по меньшей мере примерно 6 мг/дл. В еще одном аспекте изобретения указанное содержание мочевой кислоты ассоциировано с меньшей вероятностью опосредованного антителами выведения ПЭГилированной уриказы, когда указанное содержание сохраняется на уровне меньше примерно 7 мг/дл, или указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью опосредованного антителами выведения ПЭГилированной уриказы в момент времени, когда указанное содержание составляет по меньшей мере примерно 7 мг/дл.
В другом аспекте изобретения содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 3 дня после введения, описанного в стадии (а). В другом аспекте изобретения содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 1 неделю после введения, описанного в стадии (а). В другом аспекте изобретения содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 2 недели после введения, описанного в стадии (а). В другом аспекте изобретения содержание мочевой кислоты в указанном биологическом образце определяют по меньшей мере через 4 недели после введения, описанного в стадии (а).
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 показан средний титр антител к пеглотиказе у пациентов, получающих пеглотиказу каждые 2 недели.
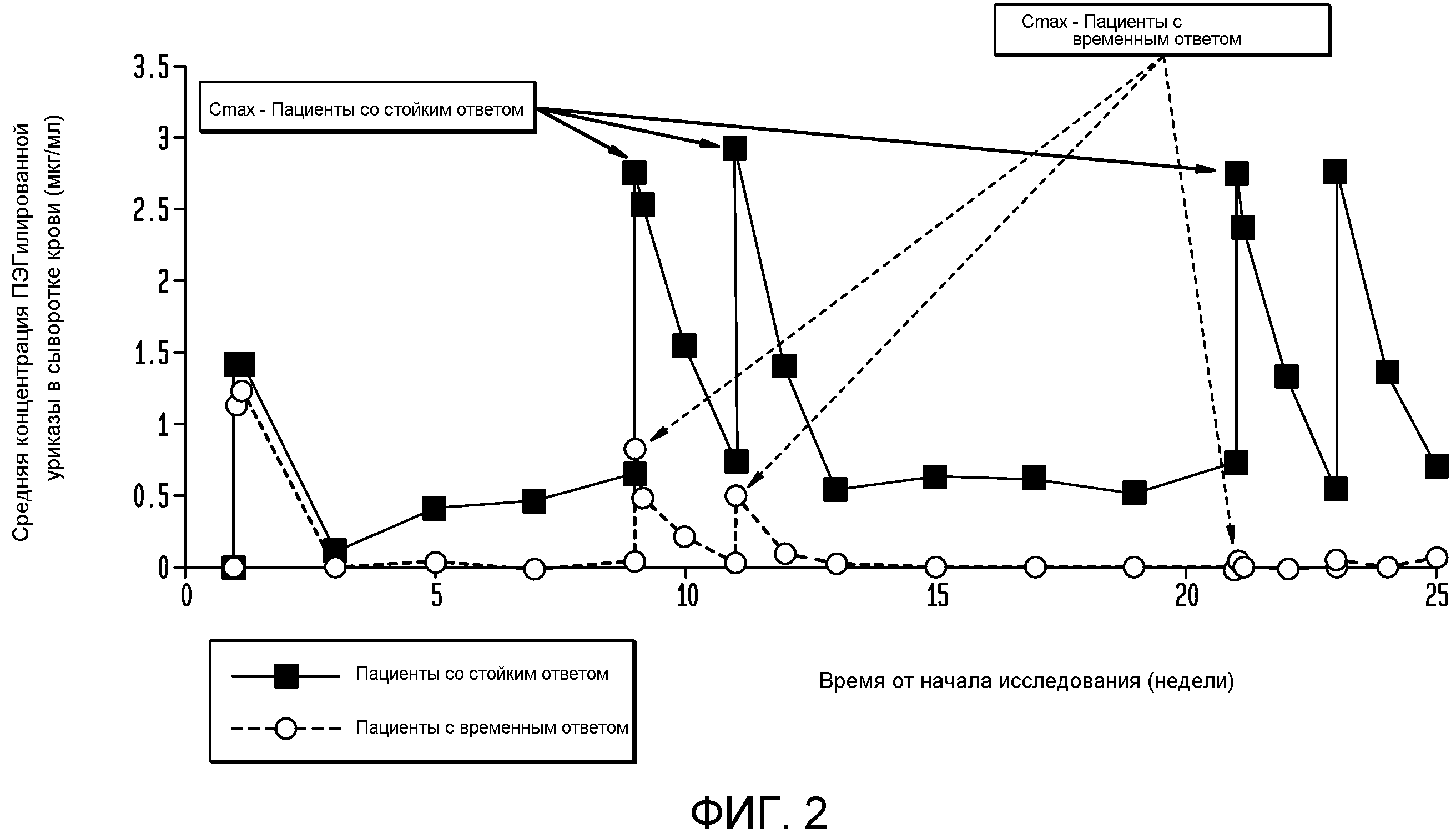
На фигуре 2 показана зависимость концентрации пеглотиказы от времени при введении каждые 2 недели.
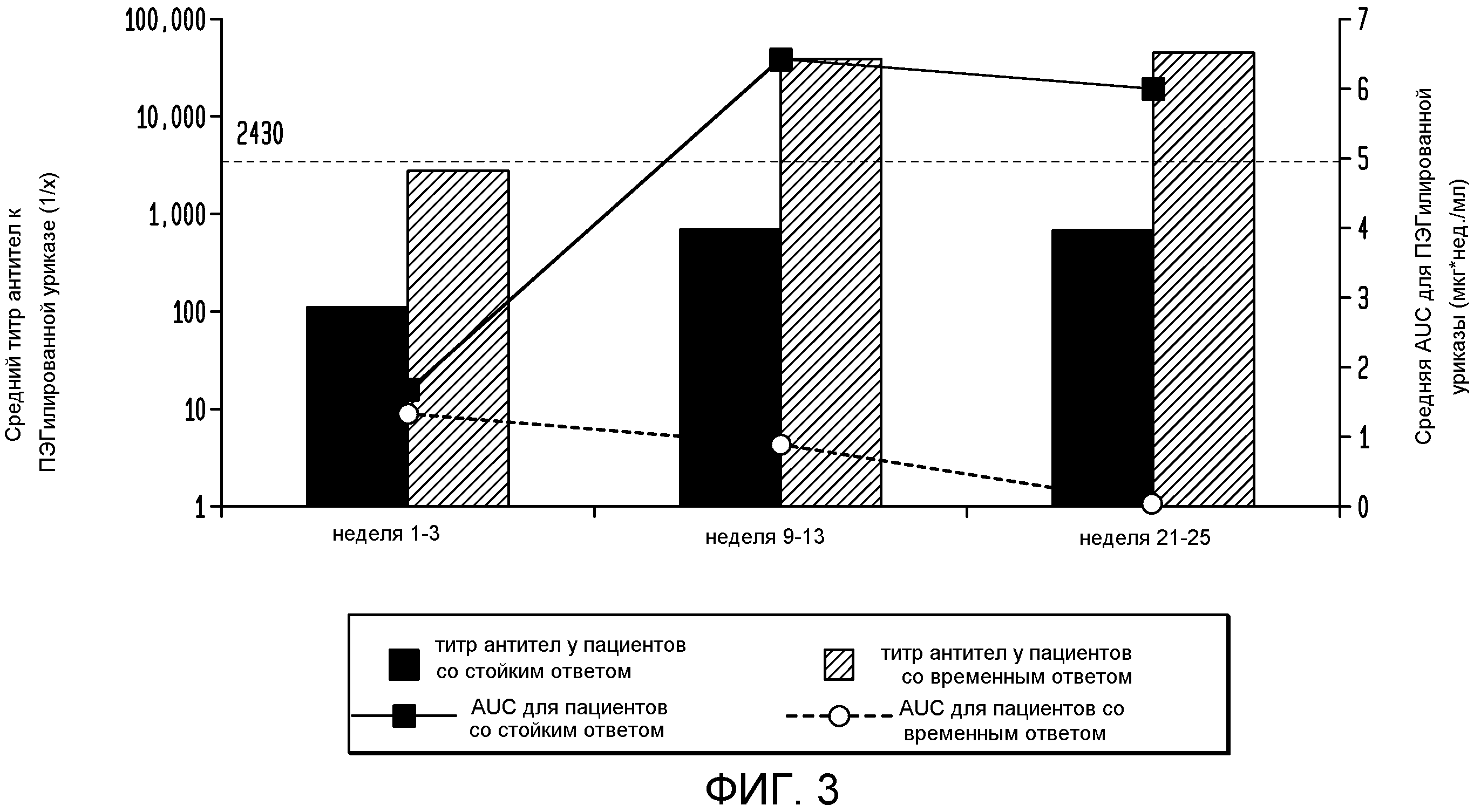
На фигуре 3 показана взаимосвязь между титром антител и AUC для пеглотиказы при введении каждые 2 недели.
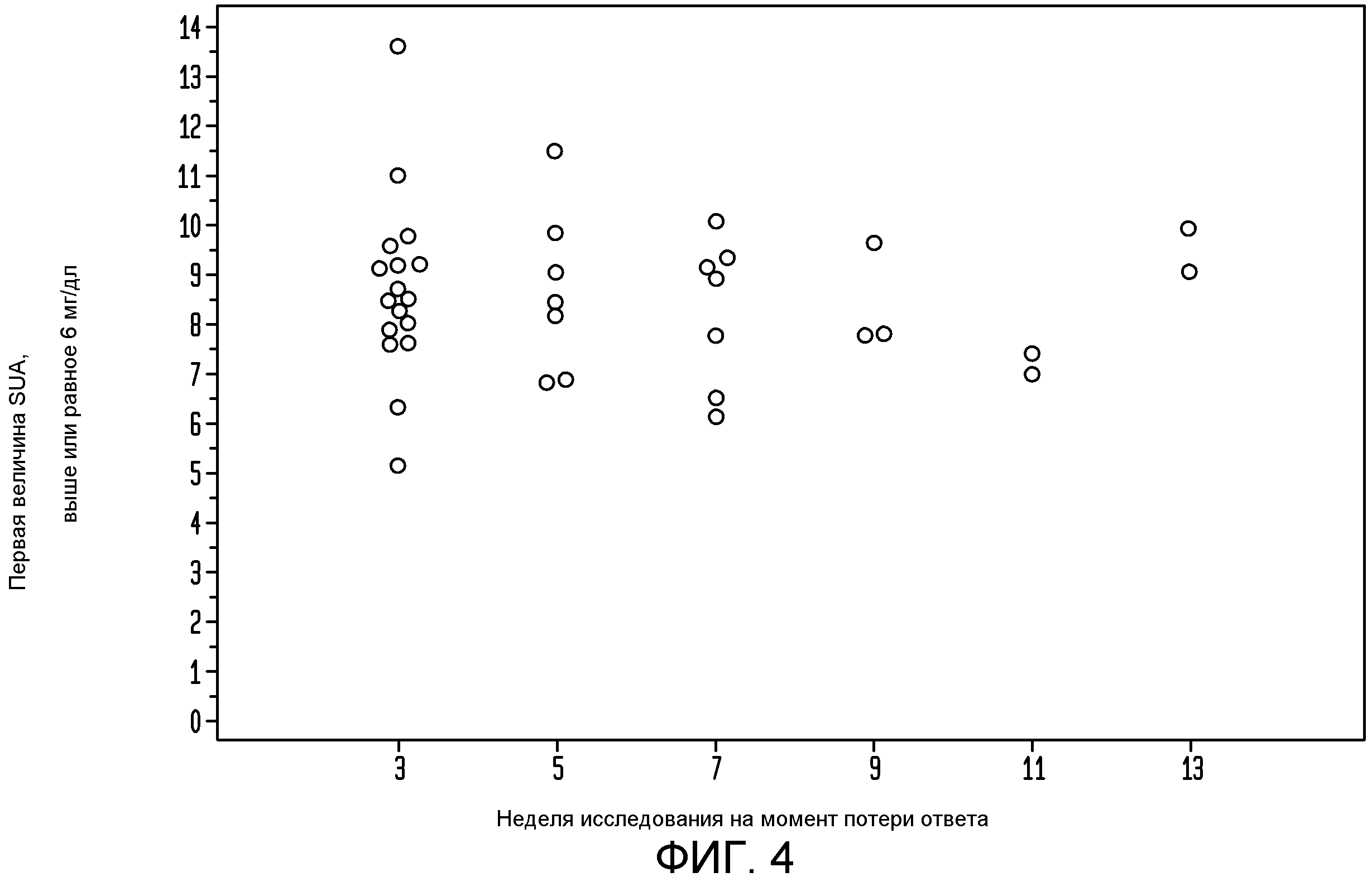
На фигуре 4 показан уровень SUA при первом детектированном падении ответа при введении пеглотиказы каждые 2 недели.
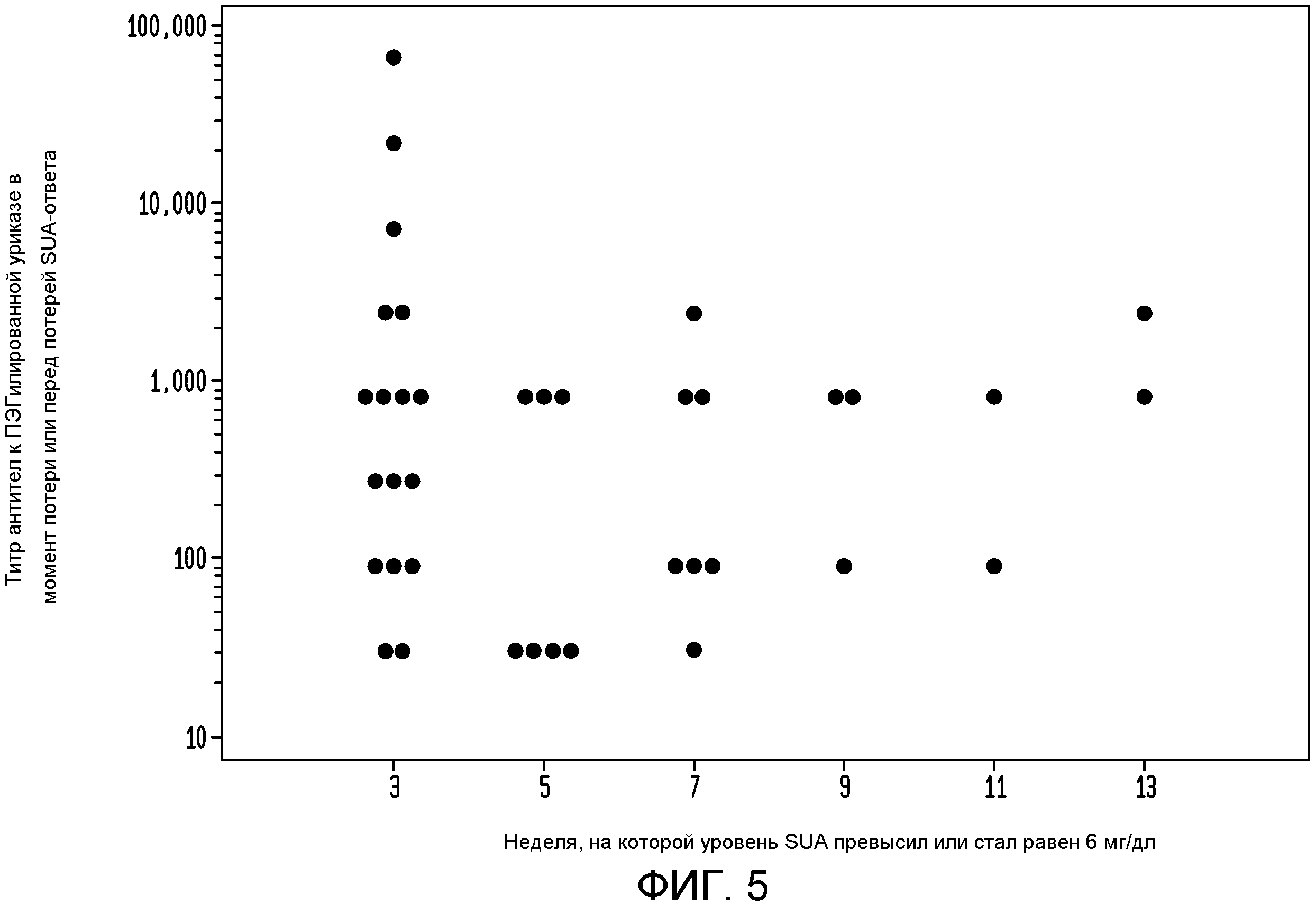
На фигуре 5 показан титр антител к ПЭГилированной уриказе в момент потери ответа при введении пеглотиказы каждые 2 недели.
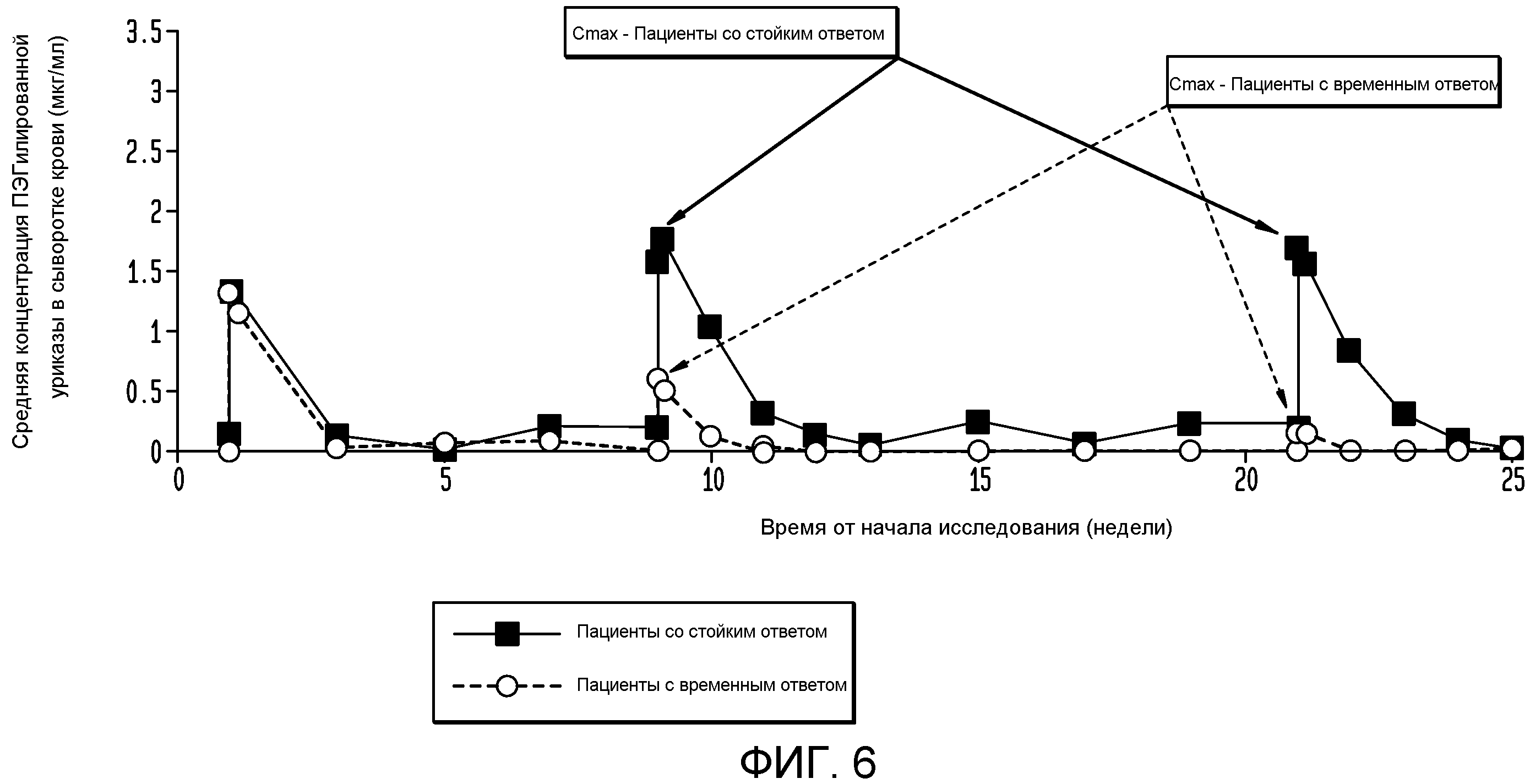
На фигуре 6 показана зависимость концентрации от времени при введении пеглотиказы каждые 4 недели.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В этом подробном описании используются следующие сокращения и определения. Следует отметить, что используемое в настоящем документе единственное число включает множественное число, если контекст прямо не диктует иное.
Неожиданно было обнаружено, что мониторинг уровня SUA прогнозирует опосредованную антителами потерю ответа и большинство инфузионных реакций при терапии ПЭГилированной уриказой. Было найдено, что большинство инфузионных реакций возникают после потери SUA-ответа. Поэтому рутинный мониторинг SUA можно использовать для будущей идентификации пациентов, получающих ПЭГилированную уриказу, на которых лечение больше не оказывает эффекта и которые имеют повышенный риск инфузионных реакций.
Используемый в настоящем документе термин «терапевтическая эффективность» относится к эффективности конкретной схемы лечения. Более конкретно, терапевтическая эффективность определяется достижением содержания уратов в сыворотке, составляющего меньше или примерно 6 мг/дл. Это включает баланс эффективности, токсичности (например, побочных эффектов и переносимости пациентом состава или лекарственной формы), соблюдения пациентом режима лечения и т.п.
Термины «лечение», «воздействие» и т.п. используются в настоящем документе для описания получения желаемого фармакологического и физиологического эффекта. Эффект может быть профилактическим в отношении предупреждения или частичного предупреждения заболевания, симптома или их состояния и/или может быть терапевтическим в отношении частичного или полного излечения заболевания, состояния, симптома или отрицательного эффекта, характерных для заболевания. Используемый в настоящем документе термин «лечение» охватывает любое лечение заболевания у млекопитающего, например человека, и включает в себя: (а) предупреждение заболевания у пациента, который может быть к нему предрасположен, но у которого оно не было диагностировано, то есть причина клинических симптомов заболевания не развивается у пациента, который может быть предрасположен к нему, но еще не испытывает симптомов заболевания или у которого они еще не проявляются; (b) ингибирование заболевания, то есть остановку или замедление развития заболевания или его клинических симптомов; и (с) ослабление течения заболевания, то есть регрессию заболевания и/или его симптомов или состояния. Предполагается лечение пациента, страдающего от заболевания, связанного с патологическим воспалением. Также предполагается предупреждение, ингибирование или ослабление негативных эффектов, характерных для патологического воспаления, в течение длительных периодов времени и/или эффектов, вызванных физиологическими ответами на неприемлемое воспаление в биологической системе в течение длительных периодов времени.
Используемый в настоящем документе термин «иммуногенность» относится к индукции иммунного ответа в результате введения с помощью инъекций препарата ПЭГ-модифицированной или немодифицированной уриказы (антигена), в то время как «антигенность» относится к реакции антигена с уже существующими антителами. В общем, антигенность и иммуногенность именуются «иммунореактивностью». В предшествующих исследованиях ПЭГилированной уриказы, иммунореактивность оценивают различными способами, включая: 1) реакцию in vitro ПЭГилированной уриказы с ранее синтезированными антителами; 2) измерение индуцированного синтеза антител; и 3) увеличение скорости выведения ПЭГилированной уриказы после повторных инъекций.
Используемый в настоящем документе термин «инфузионная реакция» относится к нежелательному и непредусмотренному эффекту ПЭГилированной уриказы, возникающему в течение 2 часов после инфузии ПЭГилированной уриказы или плацебо, который невозможно обоснованно отнести к другой причине. В частности, побочное действие препарата возникает при дозировках, используемых для профилактики, диагностики или терапии.
ПЭГилированные конъюгаты уриказы по настоящему изобретению пригодны для снижения содержания мочевой кислоты в жидкостях организма и тканях млекопитающих, предпочтительно человека, и поэтому их можно использовать для лечения повышенного содержания мочевой кислоты, ассоциированного с патологическими состояниями, в том числе подагрой, тофусами, почечной недостаточностью, трансплантацией органов и злокачественными заболеваниями. Конъюгаты ПЭГилированной уриказы можно вводить с помощью инъекций млекопитающему, имеющему повышенное содержание мочевой кислоты, различными путями, включая внутривенное, подкожное, внутрикожное, внутримышечное и внутрибрюшинное введение.
В одном варианте осуществления изобретения ПЭГилированную уриказу вводят в фармацевтически приемлемом эксципиенте или разбавителе в количестве 8 мг каждые две недели. В другом варианте осуществления изобретения ПЭГилированную уриказу можно вводить в количестве 8 мг каждые четыре недели. В еще одном варианте осуществления изобретения ПЭГилированную уриказу можно вводить в количестве 8 мг каждые три недели.
В другом аспекте изобретения ПЭГилированную уриказу можно вводить в количестве 4 мг каждые две недели. В еще одном варианте осуществления изобретения ПЭГилированную уриказу можно вводить в количестве 12 мг каждые четыре недели.
Фармацевтические составы, содержащие ПЭГилированную уриказу, можно получить с помощью общепринятых методик, например, описанных в Gennaro, A R (Ed.) (1990) Remington's Pharmaceutical Sciences, 18th Edition Easton, Pa.: Mack Publishing Co. Подходящие эксципиенты для приготовления растворов для инъекций включают, например, фосфатно-солевой буфер, лактат-раствор Рингера, воду, многоатомные спирты и глицерин. Фармацевтические композиции для парентеральных инъекций включают в себя фармацевтически приемлемые водные или неводные жидкости, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильные растворы или дисперсии для инъекций непосредственно перед использованием. Эти составы могут содержат дополнительные компоненты, такие как, например, консерванты, солюбилизаторы, стабилизаторы, увлажняющие вещества, эмульгаторы, буферы, антиоксиданты и разбавители.
ПЭГилированную уриказу также можно предоставить в виде композиций с контролируемым высвобождением лекарственного соединения для имплантации индивидууму с целью постоянного контроля повышенного содержания мочевой кислоты в жидкостях организма. Например, полимолочная кислота, полигликолевая кислота, восстановленный коллаген, поли-L-лизин, альгинат натрия, геллановая камедь, хитозан, агароза, мультиламеллярные липосомы и многие другие обычные депо-составы содержат биоразрушаемые или биоразлагаемые материалы, которые можно ввести в состав с биологически активными композициями. Эти материалы при имплантации или инъекции постепенно разрушаются и высвобождают действующее вещество в окружающую ткань. Например, один способ заключения ПЭГилированной уриказы в оболочку включает в себя способ, раскрытый в патенте США № 5653974, который таким образом включен в настоящее описание путем ссылки. Использование биоразрушаемых, биоразлагаемых и других депо-составов прямо предусмотрено в настоящем изобретении. Использование инфузионных насосов и систем заключения лекарственных соединений в матрикс для доставки ПЭГилированной уриказы также входит в объем настоящего изобретения. ПЭГилированную уриказу, предпочтительно, можно включить в мицеллы или липосомы. Методика включения в липосомы хорошо известна в данной области. Смотри, например, Lasic, D, et al., (Eds.) (1995) Stealth Liposomes. Boca Raton, Fla.: CRC Press.
Уриказа, которая используется в ПЭГилированной уриказе, может содержать аминокислотную последовательность уриказы млекопитающих, укороченную с аминоконца или карбоксиконца или с амино- и карбоксиконца на 1-13 аминокислот, и может дополнительно включать аминокислотную замену в области позиции 46. Укороченная уриказа может дополнительно содержать аминоконцевую аминокислоту, причем аминоконцевой аминокислотой является аланин, глицин, пролин, серин или треонин, описанные в одновременно находящейся на рассмотрении заявке PCT/US2006/013660 и предварительной заявке США 60/670573, полное содержание которых, таким образом, включено в настоящее описание путем ссылки.
Фаза 3 клинических исследований была выполнена, как указано в примерах. В одном аспекте изобретения нормализация содержания мочевой кислоты по меньшей мере до примерно 3,5 мг/дл была выбрана в качестве основного критерия эффективности для отражения фармакодинамического эффекта ПЭГилированной уриказы. В другом аспекте изобретения нормализация содержания мочевой кислоты по меньшей мере до примерно 4,0 мг/дл была выбрана в качестве основного критерия эффективности для отражения фармакодинамического эффекта ПЭГилированной уриказы. В еще одном аспекте изобретения нормализация содержания мочевой кислоты по меньшей мере до примерно 5,0 мг/дл была выбрана в качестве основного критерия эффективности для отражения фармакодинамического эффекта ПЭГилированной уриказы. В еще одном аспекте изобретения нормализация содержания мочевой кислоты по меньшей мере до примерно 6,0 мг/дл была выбрана в качестве основного критерия эффективности для отражения фармакодинамического эффекта ПЭГилированной уриказы. В другом аспекте изобретения нормализация содержания мочевой кислоты по меньшей мере до примерно 7,0 мг/дл была выбрана в качестве основного критерия эффективности для отражения фармакодинамического эффекта ПЭГилированной уриказы.
Известно, что постоянно повышенное содержание мочевой кислоты в плазме (PUA) или содержание мочевой кислоты в сыворотке (SUA) приводит к отложению мочевой кислоты в суставах и мягких тканях. При увеличении общей нагрузки мочевой кислоты на организм возникают симптомы подагры, включая артрит, отличающийся рецидивирующими болезненными приступами подагры, развитием тофусов и деформацией суставов с возникающими в результате хроническими болью/воспалением и последующей потерей физических функций.
ПЭГилированная уриказа, вводимая по 8 мг каждые две недели (q2 wk), приводит к заметному снижению содержания мочевой кислоты (PUA и SUA), которое ассоциировано с полным исчезновением тофусов у некоторых пациентов и снижением числа болезненных суставов. Лечение также ассоциировано со снижением количества случаев приступов подагры и частоты их возникновения после 3 месяцев лечения (относительно плацебо) и продолжающимся снижением количества случаев приступов и частоты их возникновения при длительном приеме до по меньшей мере 18 месяцев. Этот эффект наблюдается у пациентов с хроническим и часто тяжелым течением заболевания, для которых не существует других доступных на сегодняшний день способов лечения. Стойкий ответ наблюдается у пациентов, у которых сохраняется пониженный уровень SUA в ответ на повторные инфузии ПЭГилированной уриказы. Сохранение пониженного уровня SUA ассоциировано с отсутствием или низким титром антител к ПЭГилированной уриказе (значения титра меньше 2430).
В фазе 3 клинических исследований оценивали взаимосвязь между определяемыми величинами содержания мочевой кислоты в плазме (PUA) и содержания мочевой кислоты в сыворотке (SUA) на серии образцов от всех пациентов. Причина проведения этой оценки связана с использованием PUA в качестве основного критерия эффективности для всех испытаний ПЭГилированной уриказы, в то время как в клинической практике используется SUA. Обращение и обработка образцов для определения PUA представляют собой более сложные процедуры и проводятся при низких температурах, а для инактивации и осаждения ПЭГилированной уриказы используют трихлоруксусную кислоту, чтобы лекарственное соединение не продолжало окислять мочевую кислоту. При этом экспериментальные результаты однозначно показали близкую корреляцию между двумя показателями содержания мочевой кислоты во всех временных точках вне зависимости от уровня содержания мочевой кислоты.
Инфузионную реакцию определяли, как любую побочную реакцию, которая возникает в течение или в пределах 2 часов после инфузии ПЭГилированной уриказы или плацебо, которую невозможно обоснованно отнести к другой причине. Несмотря на проведение указанных в протоколе мер по профилактике инфузионных реакций, они возникали у 26% пациентов, получавших ПЭГилированную уриказу раз в две недели, и у 40% пациентов, получавших ПЭГилированную уриказу раз в 4 недели.
Антитела к ПЭГилированной уриказе наблюдались у примерно 90% пациентов, получавших ПЭГилированную уриказу. Высокие титры антител (>1:2430) были ассоциированы с ускоренным выведением ПЭГилированной уриказы и потерей ее активности, но высокие титры часто не детектировались в течение некоторого времени после увеличения содержания мочевой кислоты, иногда после потери ответа на ПЭГилированную уриказу задержка составляла несколько недель. Пациентов, которые первоначально отвечали на ПЭГилированную уриказу и теряли ответ впоследствии, относили к пациентам с временным ответом, в отличие от пациентов, у которых сохранялась активность ПЭГилированной уриказы, снижающая содержание уратов, на протяжении всего исследования и которых относили к пациентам со стойким ответом. Повышение PUA предваряет появление высоких титров антител.
Пациенты, у которых появлялись высокие титры антител (не не низкие титры), имели большую вероятность потери PUA-ответа. Очевидность временного ответа была ясна для всех пациентов на 4-й месяц после начала терапии. Клинические эффекты иммуногенности легко детектировать с помощью регулярного мониторинга уровня SUA в течение первых нескольких месяцев терапии. Хотя у тех пациентов, у которых возникали высокие титры антител, имели большее количество случаев инфузионных реакций, не наблюдалось явной взаимозависимости между титром антител и тяжестью инфузионных реакций.
Результаты, приведенные в настоящем документе, указывают на то, что появление высокого титра антител к ПЭГилированной уриказе и высокого титра анти-ПЭГ антител объясняет потерю SUA/PUA-ответа. Пациенты, у которых со временем появлялся высокий титр антител к ПЭГилированной уриказе, имели более высокий риск развития инфузионных реакций. Важно отметить, что большинство инфузионных реакций возникали после потери SUA/PUA-ответа, и в результате, тщательный мониторинг уровня SUA может помочь избежать введения излишнего количества лекарственного соединения и также предупредить большинство инфузионных реакций. Потеря эффекта у большинства пациентов с временным ответом возникала в течение первых 4 месяцев, так что мониторинг содержания мочевой кислоты в сыворотке в течение данного периода времени является критичным. Наконец, потеря эффекта ПЭГилированной уриказы часто может возникать перед повышением титра антител к ПЭГилированной уриказе, так что нет корреляции между титром антител к ПЭГилированной уриказе или любым титром антител к ПЭГилированной уриказе до или во время потери SUA/PUA-ответа. Отсутствие ассоциации между титром антител и SUA/PUA-ответом подтверждает неэффективность мониторинга титра антител в ходе терапии ПЭГилированной уриказой пациентов с невосприимчивой к лечению подагрой.
ПРИМЕР 1 - Профили иммуногенности и инфузионных реакций при внутривенном введении пеглотиказы в количестве 8 мг каждые 2 недели
Материал, способы и схема клинического исследования.
Исследуемое лекарственное соединение
Пеглотиказа (ПЭГилированная уриказа), используемая в данном примере, состоит из рекомбинантной уриказы млекопитающих (преимущественно свиной, с С-концевой последовательностью из уриказы бабуина), конъюгированной с многочисленными цепями монометокси-ПЭГ со средним молекулярным весом 10 кДа (10 К мПЭГ) на субъединицу тетрамерного фермента (Kelly SJ, et al. J Am Soc Nephrol 2001, 12:1001-1009; и Ganson NJ, et al. Arthritis Res Ther 2005, 8(1):R12).
Схема исследвоания фазы III
Пациенты
Многоцентровые (45 мест), воспроизводимые, двойные слепые, плацебо-контролируемые клинические исследования проводили на пациентах с симптоматической подагрой.
Все пациенты получали внутривенные (i.v.) инфузии (пеглотиказы или плацебо) каждые 2 недели. Группы состояли из группы, получавшей плацебо (N=43), и группы, получавшей пеглотиказу 8 мг i.v. каждые 2 недели (q2wks) (N=84).
Анамнез всех пациентов свидетельствовал о том, что терапия аллопуринолом была противопоказана (например, из-за гиперчувствительности, непереносимости или токсичности) или была неэффективна, о чем свидетельствовала невозможность нормализации SUA на протяжении периода больше 3 месяцев лечения аллопуринолом в максимально указанной дозировке (800 мг/день) или в более низкой дозе, подходящей с медицинской точки зрения с учетом токсичности или ограничивающих дозу сопутствующих заболеваний. Основные критерии исключения из исследований включали: нестабильную стенокардию, неконтролируемую аритмию, некомпенсированную застойную сердечную недостаточность, неконтролируемую гипертонию (выше 150/95 мм рт. ст.), диализ, трансплантацию органов, беременность и т.п.
В этих экспериментвх у всех пациентов были отменены все схемы лечения для снижения содержания уратов более чем за одну неделю до случайного распределения пациентов по группам, и пациенты воздерживались от использования таких агентов в течение исследования.
Все пациенты получали профилактику инфузионных реакций (IR): фексофенадин перорально (60 мг вечером до инфузии и непосредственно перед инфузией) и ацетаминофен (1000 мг) и гидрокортизон внутривенно (200 мг) перед каждой инфузией. Исследуемое соединение вводили инфузионно в 250 мл физиологического раствора в течение 2-4 часов.
Иммуногенность
Качественные и количественные методы ELISA, используемые для анализа исследуемых образцов, были согласованы с требованиями GLP (Надлежащей Лабораторной Практики), следуя принятым методическим указаниям по иммунологическим методам анализа (Mire-Sluis et al). Образцы для определения антител с использованием методов ELISA собирали у всех пациентов в исходной точке и на 3, 5, 9, 13, 17, 21 и 25 неделю после начала лечения пеглотиказой или плацебо.
Детекция антител к пеглотиказе
Для определения общего количества антител к пеглотиказе исследуемые образцы разводили 1/30 в буфере для анализа и анализировали с использованием лунок микротитровочного планшета для ELISA, покрытых либо пеглотиказой, либо ПЭГ. Для детекции общего количества антител, а также IgM- и IgG-антител в качестве положительного контроля использовали сыворотку человека, содержащую антитела к пеглотиказе. Комбинацию кроличьих антител к IgM и IgG человека использовали в качестве вторичных антител, в то время как для анализа IgM- и IgG-антител к пеглкотиказе каждое использовали, соответственно, антитело индивидуально (Sigma, St. Louis, Mo.).
В этих экспериментах для детекции использовали конъюгированные с пероксидазой мышиные моноклональные антитела к кроличьим IgG. Лунки микротитровочного планшета, покрытые очищенными IgM и IgG человека, служили в качестве иммуноглобулиновых положительных контролей связывания вторичных антител к IgM и IgG человека.
Лекарственная интерференция была определена на уровне 300 мкг/мл, который значительно превышает измеряемую концентрацию пеглотиказы в крови в исследуемых образцах. Поэтому предполагалось, что содержание пеглотиказы в крови не будет мешать измерению уровня антител к пеглотиказе.
Свойства антител к пеглотиказе
Для большинства образцов от пациентов, включенных в 3-ю фазу исследований, гуморальный ответ включал как IgM, так и IgG антитела.
Детекция антител к пеглотиказе
В этих экспериментах, методика анализа антител к пеглотиказе повторяет общий метод проведения анализа антител к пеглотиказе за исключением того, что для первоначального анализа исследуемых образцов использовали суррогатный положительный контроль. Этот положительный контроль состоял из смеси мышиных моноклональных анти-ПЭГ IgG1- и анти-ПЭГ IgM-антител, добавленных к пулированной сыворотке человека и разведенных 1/10 в блокирующем растворе казеина в PBS. Положительный контроль антител человека вводили в анализ ближе к концу анализа исследуемых образцов. В этих экспериментах чувствительность анализа составляла 500 нг/мл, а также выражалась в низком показателе ложноположительных результатов 8,6%.
Оценка безопасности - инфузионные реакции
В этих экспериментах инфузионные реакции определяли как любую побочную реакцию, возникающую в течение или в пределах 2 часов после инфузии лекарственного соединения в слепом исследовании, которую невозможно обоснованно отнести к другой причине. Инфузионные реакции возникали при инфузии пеглотиказы и плацебо. Признаки и симптомы серьезных инфузионных реакций включали: диспноэ, гипотонию, гипертонию, отек, бронхоспазм, боль в груди, тошноту, рвоту, боль в области живота и спазмы.
Как показано на фигуре 1, во всех временных точках после введения соединения средние титры антител к пеглотиказе у пациентов со стойким ответом в группе q2wk (введение раз в две недели) были ниже по сравнению с титрами антител у пациентов с временным ответом. Например, было установлено, что пациенты, у которых титр антител к пеглотиказе был меньше 1:810 в любой точке исследования, имели стойкий ответ. Таким образом, титр антител у 68% пациентов со стойким ответом, которым вводили соединение раз в две недели, никогда не превышал 1:810. Напротив, только у 23% пациентов с временным ответом, которым вводили соединение раз в две недели, имели титры < 1:810. Поэтому низкий титр ассоциировался со стойким ответом.
Эффекты антител к пеглотиказе на фармакокинетику и фармакодинамику пеглотиказы
Как показано на фигуре 2, на фармакокинетику пеглотиказы, вводимой каждые 2 недели, значительно влияло присутствие антител к пеглотиказе. Пациенты со стойким ответом имели более высокие пиковые концентрации пеглотиказы (Cmax) в обеих группах по сравнению с пациентами с временным ответом. Как показано на фигуре 2, у пациентов в группе, которой вводили пеглотиказу раз в две недели, наблюдалось снижение пиковых концентраций пеглотиказы после 3-й недели. Кроме того, к 15-й неделе у пациентов с временным ответом концентрация пеглотиказы была ниже уровня детекции (0,6 мкг/мл). Концентрация пеглотиказы у пациентов со стойким ответом в группе q2wk находилась в диапазоне 0,5-0,7 мкг/мл.
Как показано на фигуре 3, у пациентов с временным ответом повышенные титры антител к пеглотиказе были ассоциированы с значительным снижением уровня пеглотиказы, оцениваемого по площади под кривой зависимости концентрации от времени (AUC) по сравнению с уровнем пеглотиказы у пациентов со стойким ответом. Несмотря на существование связи между потерей ответа и появлением высоких титров антител к пеглотиказе потеря ответа могла возникнуть одновременно или даже перед повышением титра антител. Поэтому определение титра не прогнозирует потерю ответа на пеглотиказу.
Эффекты антител к пеглотиказе на SUA/PUA-ответ: SUA/PUA в качестве заменителя физиологически значимых антител к пеглотиказе
Дополнительно исследовали, когда в группе пациентов с временным ответом уровень SUA превышал 6 мг/дл после введения пеглотиказы в количестве 8 мг q2 wks. Каждая точка на верхней панели фигуры 4 представляет первое измеренное значение SUA, превышающее пороговое значение 6 мг/дл, и временную точку возникновения этого события у каждого индивидуального пациента с временным ответом в группе q2 wks. На фигуре 5 показаны соответствующие титры антител, измеренные непосредственно в момент потери или перед потерей ответа на уриказу. Однако учитывая то, что введение пеглотиказы раз в две недели дает значения SUA обычно меньше 3 мг/дл, можно установить даже меньшее пороговое значение SUA, соответствующее потере ответа на пеглотиказу, например, в диапазоне между примерно 3,5 мг/дл и до примерно 7 мг/дл. Но поскольку повышение SUA вследствие потери ответа на пеглотиказу обычно бывает очень быстрым, то величина 6 мг/дл является одним из принятых пороговых значений для контроля уровня мочевой кислоты с помощью лекарственных соединений, снижающих содержание уратов. Однако в этих экспериментах в качестве порогового значения для контроля уровня мочевой кислоты с помощью лекарственных соединений, снижающих содержание уратов, можно успешно использовать величины 4 мг/дл и 5 мг/дл.
При потере нормализации SUA в группе q2 wk, то есть когда уровень SUA превышал 6 мг/дл, наблюдался широкий разброс титров антител к пеглотиказе, так что, по-видимому, не существует порогового значения титра антител, соответствующего данной потере ответа, как показано на фигуре 5. Более конкретно, в момент потери снижения концентрации уратов, средний титр антител к пеглотиказе составлял 1:3032 для группы q2 wk по сравнению со средним наивысшим титром 1:686 для пациентов со стойким ответом из группы q2 wk.
Инфузионные реакции и потеря нормализации SUA.
У большинства пациентов (90,9%) наблюдались инфузионные реакции после потери активности пеглотиказы, то есть при показателях SUA выше или равных 5 мг/дл (таблица 1).
Как показано в таблице 1, в группе q2 wk 90,9% инфузионных реакций можно было бы предупредить при прекращении терапии пеглотиказой в момент, когда SUA превышает 5 мг/дл.
В итоге, антитела к пеглотиказе имеют прямой эффект в отношении фармакокинетических и фармакодинамических свойств пеглотиказы и объясняют временный эффект действия пеглотиказы у пациентов, у которого вырабатываются физиологически значимые антитела. Хотя ускоренное выведение пеглотиказы с последующей потерей SUA/PUA-ответа опосредован антителами к пеглотиказе, начало ускоренного выведения не коррелирует с титром антител к пеглотиказе. Поэтому измерение титра антител к пеглотиказе не может предсказывать потерю SUA/PUA-ответа, в то время как мониторинг уровня SUA/PUA представляет собой хороший заменитель измерений выработки антител к пеглотиказе, вызывающих ускоренное выведение вводимой пеглотиказы. Особенно важно, что мониторинг уровня SUA, в частности, в течение первых 4 месяцев после начала лечения пеглотиказой и отмена лечения пеглотиказой при повышении SUA до уровня выше примерно 3,5-4 мг/дл является простым способом идентификации индивидуумов, теряющих ответ на пеглотиказу и имеющих более высокий риск возникновения информационных реакций.
ПРИМЕР 2 - Профили иммуногенности и инфузионных реакций при внутривенном введении пеглотиказы в количестве 8 мг каждые 4 недели
Клиническое исследование с использованием инфузионного введения пеглотиказы
Многоцентровое, рандомизированое, двойное слепое, плацебо-контролируемое клиническое исследование проводили как указано в примере 1 выше. Пациенты с гиперурикемией и подагрой получали пеглотиказу 8 мг внутривенно каждые 4 недели (N=84) или плацебо (N=43). Лечение проводили в течение 24 недель.
Пациенты должны были прекратить прием всех агентов, снижающих содержание уратов, по меньшей мере за одну неделю до получения исследуемого препарата и должны были воздерживаться от использования таких агентов в течение исследования.
Антитела к пеглотиказе детектировали у 88% пациентов в группе, получавшей пеглотиказу 8 мг q4 wk, и только у 15% пациентов в группе, получавшей плацебо.
Как показано на фигуре 6, на фармакокинетику пеглотиказы, вводимой каждые 4 недели, значительно влияло присутствие антител к пеглотиказе. Пациенты со стойким ответом имели более высокие пиковые концентрации пеглотиказы (Cmax) в обеих группах по сравнению с пациентами с временным ответом.
В таблице 2 показано, что у большинства пациентов (76,5%) с инфузионными реакциями на момент их возникновения уровень SUA составлял или превышал примерно 6 мг/дл. Данные инфузионные реакции можно было бы предупредить при отмене лечения пеглотиказой в момент времени, когда уровень SUA превышал 6 мг/дл. У четырех пациентов наблюдались инфузионные реакции, когда уровень SUA был меньше 6 мг/дл, и у четырех пациентов инфузионные реакции возникали при введении перовой дозы; ни одну из этих инфузионных реакций невозможно было предупредить с помощью мониторинга уровня SUA.
Реферат
Группа изобретений относится к медицине, а именно к терапевтическому лечению подагры и предупреждению сопутствующих побочных реакций и осложнений у пациентов. Способ предупреждения и прогноз риска инфузионных реакций при внутривенном введении ПЭГилированной уриказы пациентам с подагрой заключается в определении содержания мочевой кислоты в сыворотке крови пациента с последующим указанием на прекращение терапии на уровне примерно 4 мг/дл. Данный способ также позволяет выявить группу риска пациентов, получающих ПЭГилированную уриказу, со снижением эффективности лечения за счет образования антител и более высоким риском развития инфузионных реакций. Группа изобретений обеспечивает своевременное прекращение лечения для предотвращения инфузионных реакций у пациентов с подагрой при лечении ПЭГилированной уриказой. 3 н. и 34 з.п. ф-лы, 2 табл., 6 ил.
Формула
а) введения указанному пациенту ПЭГилированной уриказы;
b) получения биологического образца от указанного пациента;
с) определения содержания мочевой кислоты в указанном биологическом образце; и
d) указания, что терапию можно прекратить для предупреждения инфузионных реакций, когда содержание мочевой кислоты превышает примерно 4 мг/дл.
а) введения указанному пациенту ПЭГилированной уриказы;
b) получения биологического образца от указанного пациента;
с) определения содержания мочевой кислоты в указанном биологическом образце; и
d) указания, что содержание мочевой кислоты ассоциировано с меньшей вероятностью инфузионной реакции, когда указанное содержание сохраняется на уровне меньше примерно 4 мг/дл, или указания, что указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью инфузионной реакции в момент времени, когда указанное содержание составляет по меньшей мере примерно 4 мг/дл.
а) введения указанному пациенту ПЭГилированной уриказы;
b) получения биологического образца от указанного пациента;
с) определения содержания мочевой кислоты в указанном биологическом образце; и
d) указания, что содержание мочевой кислоты ассоциировано с меньшей вероятностью опосредованного антителами выведения ПЭГилированной уриказы, когда указанное содержание сохраняется на уровне меньше примерно 4 мг/дл, или указания, что указанное определенное содержание мочевой кислоты ассоциировано с более высокой вероятностью опосредованного антителами выведения ПЭГилированной уриказы в момент времени, когда указанное содержание составляет по меньшей мере примерно 4 мг/дл.

Комментарии