Фармацевтическая композиция, включающая фермент, разрушающий гликозаминогликаны, и применение указанного фермента для получения лекарственного препарата для терапии грыжи межпозвоночного диска - RU2209080C2
Код документа: RU2209080C2
Чертежи

Описание
Изобретение относится к области медицинского применения ферментов, разлагающих гликозаминогликаны. Более конкретно, данное изобретение касается фармацевтической композиции для введения в вертебральное эпидуральное пространство, которая включает фермент, разлагающий гликозаминогликаны, и фармацевтический носитель, и терапавтического агента для эпидурально мигрирующей грыжи межпозвоночного диска, который включает в качестве активного ингредиента фермент, разлагающий гликозаминогликаны.
Грыжа межпозвоночного диска - это заболевание, свойственное протрузии студенистого ядра межпозвоночного диска. Выпирающее студенистое ядро стимулирует находящиеся вокруг него нервы, являясь причиной симптомов болезни, включая боль в нижней части спины.
Среди таких заболеваний грыжа межпозвоночного диска, классифицированная как грыжа межпозвоночного диска изолированного типа (sequestered type) по классификации Макнаба (Macnab), является грыжей межпозвоночного диска, где студенистое ядро межпозвоночного диска выпирает через наружный слой anulus fibrosus и следующие за ним медиастенальные связки, полностью отделяясь от центрального межпозвоночного диска, и мигрирует в вертебральное эпидуральное пространство в позвоночных каналах. Грыжа межпозвоночного диска изолированного типа самопроизвольно исчезает через некоторый период времени. Однако до своего спонтанного исчезновения она является причиной жестокой боли, и пациенты страдают от сильной боли. Таким образом, пациентов требуется лечить так, чтобы как можно быстрее избавить их от такой жестокой боли.
С другой стороны, среди таких заболеваний грыжа межпозвоночного диска, классифицированная как грыжа межпозвоночного диска транслигаментозного экструзионного типа (transligamentous extrusion type) по классификации Макнаба (Macnab), является грыжей межпозвоночного диска, где студенистое ядро межпозвоночного диска выпирает через наружный слой anulus fibrosus и следующие за ним медиастенальные связки так же, как при грыже межпозвоночного диска изолированного типа, но не отделяется от центрального межпозвоночного диска. Таким образом, поскольку грыжа межпозвоночного диска транслигаментозного экструзионного типа так же, как и грыжа межпозвоночного диска изолированного типа характеризуется наличием в эпидуральном пространстве студенистого ядра, то для пациентов с грыжей межпозвоночного диска транслигаментозного экструзионного типа требуется лечение, аналогичное лечению пациентов с грыжей межпозвоночного диска изолированного типа. В данном описании грыжу межпозвоночного диска, где студенистое ядро (nucleus pulposus) существует эпидурально, такую как грыжа межпозвоночного диска транслигаментозного экструзионного типа и грыжа межпозвоночного диска изолированного типа, называют "эпидурально мигрирующей грыжей межпозвоночного диска" (epidurally migrating herniated intervertebral disc).
Для общеизвестного лечения грыжи межпозвоночного диска разработан способ растворения межпозвоночного диска (ID способ), в котором для растворения грыжи в межпозвоночный диск пациента с грыжей вводят протеолитический фермент, такой как химопапаин или бактериальная коллагеназа. Коммерчески доступным лекарственным препаратом является химопапаин (торговая марка: Chimodiactin).
Однако при применении ID способа, использующего протеолитический фермент, наряду с растворением части позвоночника с образовавшейся грыжей и межпозвоночного диска растворяются также белки окружающей соединительной ткани (structural tissue). Таким образом, способ неблагоприятен, являясь вероятной причиной побочных эффектов, таких как паралич нерва или приступ аллергии.
В частности, когда в вертебральное эпидуральное пространство вводят указанный выше протеолитический фермент для растворения мигрирующего в вертебральное эпидуральное пространство студенистого ядра (nucleus pulposus), протеолитический фермент растворяет не только студенистое ядро, но также и позвоночник. Поэтому введение такого препарата и такое лечение неприемлемы.
Недавно предпринята попытка лечения грыжи межпозвоночного диска посредством инъекции в межпозвоночный диск хондроитиназы АВС или хондроитиназы АС. Таким образом, предполагается применение этих ферментов в качестве терапевтического средства для лечения грыжи межпозвоночного диска (Описание патента США 4696816, Clinical Orthopaedics, 253, 301-308 (1990)).
Например, хондроитиназа АВС [ЕС 4.2.2.4] является ферментом, который разлагает гликозаминогликаны до ненасыщенного олигосахарида и ненасыщенного дисахарида. Она энергично катализирует разложение хондроитинсульфата А, полученного из хрящей млекопитающих, хондроитинсульфата С, из хрящей акул и хондроитинсульфата В, который называют дерматансульфатом, полученного из кожи млекопитающих, при этом слабо катализирует разложение гиалуронана.
Описанную выше хондроитиназу обычно вводят непосредственно в межпозвоночный диск. Однако такое введение неэффективно для лечения эпидурально мигрирующий грыжи межпозвоночного диска. Это происходит потому, что инъекция хондроитиназы в межпозвоночный диск не может разрушать студенистое ядро, мигрирующее в вертебральное эпидуральное пространство.
До сих пор не известно ни одной композиции для введения в вертебральное эпидуральное пространство разрушающего гликозаминогликаны фермента, такого как хондроитиназа. Неизвестен также терапевтический агент для лечения эпидурально мигрирующей грыжи межпозвоночного диска, включающий в качестве активного ингредиента фермент, разрушающий гликозаминогликаны, подобный хондроитиназе.
Следовательно, требуется разработать фармацевтическую композиция и агент, которые можно применять для лечения эпидурально мигрирующей грыжи межпозвоночного диска.
Данное изобретение обеспечивает фармацевтическую композицию для введения в вертебральное эпидуральное пространство для лечения, как описано выше, и терапевтического агента для эпидурально мигрирующей грыжи межпозвоночного диска.
В результате интенсивного исследования для обеспечения вышеупомянутого результата было обнаружено, что при введении фермента, разлагающего гликазоминогликаны, в ветебральное эпидруальное пространство студенистое ядро в вертебральном эпидуральном пространстве существенно разрушается без влияния на позвоночник, и успешно получена фармацевтическая композиция и терапевтический агент для применения в указанном выше введении, что и составляет настоящее изобретение.
Настоящее изобретение обеспечивает фармацевтическую композицию для введения в вертебральное эпидуральное пространство, включающую фермент, разлагающий гликозаминогликаны, и фармацевтический носитель (здесь далее обозначена просто как "композиция настоящего изобретения"), и терапевтический агент для эпидурально мигрирующей грыжи межпозвоночного диска, включающий в качестве активного ингредиента фермент, разлагающий гликозаминогликаны (здесь далее обозначен просто как "терапевтический агент настоящего изобретения").
Способ осуществления настоящего изобретения будет проиллюстрирован ниже.
[1] Композиция настоящего изобретения
Композиция настоящего изобретения является фармацевтической композицией для введения в вертебральное эпидуральное пространство,
включающей фермент, разлагающий гликозаминогликаны, и фармацевтический носитель. Фермент, разлагающий гликозаминогликаны, и фармацевтический носитель, который можно использовать в настоящем
изобретении, будут подробно описаны ниже.
(1) Фермент, разлагающий гликоэаминогликаны.
Разлагающие гликозаминогликаны ферменты, которые можно использовать в композиции настоящего изобретения, не имеют особых ограничений до тех пор, пока они способны разлагать один, два или более гликозаминогликанов, содержащихся в студенистом ядре. Предпочтительны те ферменты, которые способны разрушать хондроитинсульфат, называемые хондроитиназой, и кератинсульфат, называемые кератиназой. Особенно предпочтительна хондроитиназа.
Любой фермент, который разрушает хондроитинсульфат, можно использовать как хондроитиназу в композиции настоящего изобретения. Конкретные примеры известных хондроитиназ включают хондроитиназу АВС (получаемые из Proteus vulgaris; Выложенная патентная заявка Японии 6-153947, Т. Yamagata, Н. Saito, О. Habuchi и S. Suzuki, J. Biol. Chem., 243, 1523 (1968); S. Suzuki, H. Saito, T. Yamagata, K. Anno, N. Seno, Y. Kawai и Т. Furuhashi, J. Biol. Chem., 243, 1543 (1968)), хондроитиназу АС (получаемую из Flavobacterimn heparinum; T. Yamagata, H. Saito, O. Habuchi и S. Suzuki, J. Biol. Chem., 243, 1523 (1968)), хондроитиназу ACII (получаемую из Arthrobacter aurescens; K. Hiyama и S. Okada, J. Biol. Chem., 250, 1824 (1975), К. Hiyama и S. Okada, J. Biochem. (Tokyo), 80, 1201 (1976)), хондроитиназу ACIII (получаемую из Flavobacterium вида Нр102; Hirofumi Miyazono, Hiroshi Kikuchi, Keiichi Yoshida, Kiyoshi Morikawa и Kiyochika Tokuyasu, Seikagaku, 61, 1023 (1989)), хондроитиназу В (получаемую из Flavobacterium heparinum; Y.M. Michelacci и С. Р. Dietrich, Biochem. Biophys. Res. Commun., 56, 973 (1974)), Y.M. Michelacci и С.P. Dietriech, Biochem. J. 151, 121 (1975), Kenichi Маеyama, Akira Tawada, Akiko Ueno и Keiichi Yoshida, Seikagaku, 57, 1189 (1985)), хондроитиназу С (получаемую из Flavobacterium вида НР102; Hirofumi Miyazono, Hiroshi Kikuchi, Keiichi Yoshida, Kiyoshi Morikawa и Kiyochika Tokuyasu, Seikagaku, 61, 1023 (1989)), и подобные. Можно использовать любую их этих хондроитиназ. Можно также использовать такую хондроитиназу как фермент, разлагающий хондроитинсульфат, получаемый из человека, как описано в Выложенной патентной заявке Японии 9-168384, и хондроитинсульфат АВС экзолиазу (exolyase) (A. Hamai, N. Hashimoto, H. Mochizuki, F. Kato, Y. Makiguchi, K. Horie и S. Suzuki, J. Biol. Chem., 272, 9123-9130 (1997).
Каждая из этих хондроитиназ является просто примером, и ими не ограничиваются хондроитиназы, которые можно использовать в композиции настоящего изобретения. Хондроитиназа, предназначенная для использования в композиции настоящего изобретения, может быть одной хондроитиназой или смесью нескольких хондроитиназ. Использованный здесь термин "хондроитиназа" обозначает оба приведенные выше понятия.
Конкретные примеры известных кератаназ, которые можно использовать в композиции изобретения, включает эндо-β -галактозидазу, получаемую из Escherichia freundii (H. Nakagawa, T. Yamada, J-L. Chien, A. Gardas, M. Kitamikado, S-C. Li и Y-T. Li, J. Biol. Chem., 255, 5955 (1980)), эндо-β-галактозидазу, получаемую из штамма Pseudomonas вида IFO-13309 (К. Nakazawa, N. Suzuki и S. Suzuki, J. Biol. Chem., 250, 905 (1975), К. Nakazawa и S. Suzuki, J. Biol. Chem., 250, 912 (1975)), эндо-β -галактозидазу, получаемую из Pseudomonas reptilivora, как описано в опубликованной после экспертизы патентной заявке Японии 57-41236, эндо-β-N-ацетилглюкозаминидазу, получаемую из Bacillus вида Кs36 (Shinichi Hashimoto, Kiyoshi Morikawa, Hiroshi Kikuchi, Keiichi Yoshida и Kiyochika Tokuyasu, Seikagaku, 60, 935 (1988)), эндо-β-N-ацетилглюкозаминидазу, получаемую из Bacillus circulans KsT202 (описанную в WO 96/16166) и подобные. Любую из этих кератаназ можно использовать в композиции настоящего изобретения.
Каждая из этих кератаназ является просто примером, и ими не ограничиваются кератаназы, которые можно использовать в композиции настоящего изобретения. Кератаназа, предназначенная для использования в композиции настоящего изобретения, может быть одной кератаназой или смесью нескольких кератаназ. Использованный здесь термин "кератаназа" обозначает оба приведенные выше понятия.
В качестве ферментов, разрушающих гликозаминогликаны, особенно предпочтительно использовать в настоящем изобретении хондроитиназу АВС. Среди хондроитиназ АВС предпочтительно использовать хондроитиназу АВС, получаемую из Proteus vulgaris.
Предпочтительными ферментами, разрушающими гликозаминогликаны, для использования в композиции настоящего изобретения являются ферменты, очищенные до приемлемой с точки зрения медицины степени и по существу не содержащие неприемлемых с медицинской точки зрения примесей. Например, когда в качестве фермента, разрушающего гликозаминогликаны, применяют хондроитиназу, предпочтительно очищать фермент до той степени, когда он будет показывать удельную ферментативную активность не менее 300 ед./мг белка. Более предпочтительно очищать фермент до той степени, когда он будет показывать удельную ферментативную активность не менее 300 ед./мг белка, практически не содержит эндотоксина, а нуклеиновые кислоты и протеазы содержит в количествах не более соответствующих пределов определения. Особенно предпочтительна очищенная хондроитиназа АВС, обладающая такими характеристиками.
Используемое здесь обозначение 1 единица (1 ед.) фермента, разрушающего гликозаминогликаны, определяют как количество фермента, выделяющее из гликозаминогликана 1 микромоль продукта реакции в минуту в условиях оптимального рН и оптимальной температуры. Определение 1 ед. различных ферментов, разрушающих гликозаминогликаны, описано ниже.
1 Единицу хондроитиназы АВС определяют как количество фермента, выделяющее из хондроитин(6-сульфата) 1 микромоль ненасыщенного дисахарида в минуту при рН 8,0 и 37oС.
1 Единицу хондроитиназы АС (получаемой из Flavobacterium heparinum) определят как количество фермента, выделяющее из хондроитин(6-сульфата) 1 микромоль ненасыщенного дисахарида в минуту при рН 7,3 и 37oС.
1 Единицу хондроитиназы ACII (получаемой из Arthrobacter aurescens) определяют как количество фермента, выделяющее из хондроитин (6-сульфата) 1 микромоль ненасыщенного дисахарида в минуту при рН 6,0 и 37oС.
1 Единицу хондроитиназы В (получаемой из Flavobacterium heparinum) определяют как количество фермента, выделяющее из дерматансульфата УФ-поглощающее вещество, в количестве, эквимолярном 1 микромолю остатка гексуроновой кислоты, в минуту при рН 8,0 и 30o С.
1 Единицу эндо-β-галктозидазы, получаемой из Escherichia freundii, определяют как количество фермента, выделяющее из кератансульфата восстановительную группу, в количестве, эквимолярном 1 микромолю галактазы, в минуту при рН 5,8 и 37oС.
1 Единицу эндо-β-галактозидазы, получаемой из штамма Pseudomonas вида IFO-13309, определяют как количество фермента, выделяющее из кератансульфата восстановительную группу, в количестве, эквимолярном 1 микромолю галактозы, в минуту при рН 7,4 и 37oС.
1 Единицу эндо-β-N-ацетилглюкозаминидазы, получаемой из штамма Bacillus вида Кs36, определяют как количество фермента, выделяющее из кератансульфата восстановительную группу, в количестве, эквимолярном 1 микромолю N-ацетилглюкозамина, в минуту при рН 6,5 и 37oС.
Например, когда используют хондроитиназу АВС, обладающую удельной ферментативной активностью не менее 300 ед./мг белка, протеогликан в намеченной для лечения области, например, в вертебральном эпидуральном пространстве, эпидурально мигрирующую грыжу межпозвоночного диска можно разрушить подходящим образом, не оказывая влияния на ткани вокруг рассматриваемой области, путем введения в живой организм вещества в виде фармацевтического препарата для инъекций. Таким образом, фермент может быть безопасным и эффективным медицинским средством. Такую хондроитиназу АВС можно, например, получить способом, описанным в выложенной патентной заявке Японии 6-153947.
В композиции настоящего изобретения можно использовать один фермент, разрушающий гликозаминогликаны, или смесь нескольких ферментов, разрушающих гликозаминогликаны. Например, в композиции настоящего изобретения можно применять смесь одной, двух или более хондроитиназ и одной, двух или более кератаназ.
Композиция настоящего изобретения предпочтительно содержит такие ферменты, разрушающие гликозаминогликаны, в количестве, эффективном для растворения имеющегося в эпидуральном пространстве вещества студенистого ядра в изолированном, экстудированном или другом состоянии. Используемый здесь термин "эффективное количество" обозначает количество, эффективное для растворения вещества студенистого ядра, присутствующего в вертебральном эпидуральном пространстве, таким образом, чтобы избежать его влияния. Это количество меняется в зависимости от симптомов, возраста пациента и тому подобного. Хотя это количество конкретно не ограничено до тех пор, пока оно может растворять имеющееся в эпидуральном пространстве вещество студенистого ядра и устранять его влияние, предпочтительно оно составляет не менее 5 ед., более предпочтительно от 5 до 400 ед. и еще предпочтительнее от 5 до 200 ед. в переводе на дозу, обычно предназначенную для разового приема часть, содержащуюся в композиции настоящего изобретения.
Кроме того, в дополнение к ферментам, разрушающим гликозаминогликаны, композиция настоящего изобретения может содержать в качестве активного ингредиента вещество, способное растворять студенистое ядро и отличное от разрушающего гликозаминогликаны фермента. Использованный здесь термин "вещество, способное разрушать студенистое ядро и отличное от разрушающего гликозаминогликаны фермента" не имеет конкретных ограничений до тех пор, пока оно не дает серьезных побочных эффектов при использовании в препарате вместе с ферментом, разрушающим гликозаминогликаны, или при введении в комбинации с таким ферментом, или один из них (вещество или фермент) не ингибирует эффект растворения студенистого ядра, свойственный другим компонентам. Надо отметить, что композицию настоящего изобретения не обязательно готовить или вводить вместе с протеолитическим ферментом, который разрушает спинной мозг, так как композицию настоящего изобретения вводят в вертебральное эпидуральное пространство.
(2) Фармацевтический носитель
Фармацевтические носители для использования в композиции настоящего изобретения являются фармацевтически приемлемые носителями и включают обычно применяемые наполнители, связующие, смазывающие
агенты, подкрашивающие агенты, дезинтеграторы, буферы, агенты для изотоничности, консерванты, анестетики и подобные компоненты, обычно применяемые для приготовления медицинских препаратов.
Фармацевтические носители для использования в композиции настоящего изобретения предпочтительно являются носителями, содержащими восстановительные примеси в количестве не более 0,4 мл на грамм фармацевтического носителя, предпочтительно не более 0,36 мл, при определении способом титрования аммонийцерийнитратом. Более предпочтительно, чтобы фармацевтические носители содержали пероксиды при концентрации не более 20 млн.д., в частности, не более 18,5 млн.д. Вследствие наличия таких свойств, при получении композиции настоящего изобретения в виде лиофилизованного продукта появляется возможность свести к минимуму снижение ферментативной активности фермента, разрушающего гликозаминогликаны, до и после лиофилизации. Кроме того, если композицию настоящего изобретения сохраняют при обычной температуре в течение продолжительного времени, можно свести к минимуму уменьшение ферментативной активности фермента, разрушающего гликозаминогликаны. Например, если композицию хранят в стеклянном контейнере под газообразным азотом при температуре 40oС в течение 30 дней, возможно сохранить не менее 90% ферментативной активности разрушающего гликозаминогликаны фермента по сравнению с моментом начала хранения.
Ферментативную активность разрушающего гликозаминогликаны фермента можно измерить известными способами. Например, ее можно определить по реакции разрушающего гликозаминогликаны фермента с гликозаминогликаном в качестве субстрата, измеряя абсорбцию образующегося таким образом дисахарида.
Количество восстановительных примесей в фармацевтическом носителе можно определить путем титрования с использованием аммонийцерийнитрата. Выражение "титрование с использованием аммонийцерийнитрата" обозначает способ, который включает растворение 2 г фармацевтического носителя в 25 мл теплой воды, добавление к раствору 25 мл разбавленной серной кислоты и 0,1 мл ферроина (ferroin), а именно комлекса трис(1,10-фенантролин) железа (II): [Fe(C12H8N2)3]2+, и титрование раствора 0,01N аммонийцерийнитратом до сохраняющегося в течение 30 секунд сине-зеленого цвета раствора, полученного из красного.
Концентрацию пероксида в фармацевтическом носителе можно определить посредством точного отвешивания 1 г фармацевтического носителя, добавления к нему дистиллированной воды до 10 мл (то есть получая 10% (масса/объем) водный раствор), добавления к 0,8 мл этого раствора 0,25 мл 20% (объем/объем) водного раствора серной кислоты и 0,15 мл 1М TiSO4 (производства BDH), измерения ультрафиолетового поглощения при 408 нм и расчета концентрации H2O2 по калибровочной кривой, полученной при использовании предварительно определенных концентраций Н2O2.
Если количество восстановительных примесей и/или концентрация пероксида в фармацевтическом носителе, необходимого для использования в композиции настоящего изобретения, превышают(ет) определенный выше предел или эти величины необходимо снизить ниже установленного уровня, количество восстановительных примесей и концентрацию пероксида можно понизить, например, обычным способом посредством обработки фармацевтического носителя активированным углем. Концентрацию пероксида можно также понизить путем тепловой обработки фармацевтического носителя.
Конкретные примеры фармацевтических носителей, которые можно использовать в настоящем изобретении, включают декстраны, сахарозу, лактозу, мальтозу, ксилозу, трегалозу, маннит, ксилит, сорбит, инозит, сывороточный альбумин, желатин, креатинин, полиэтиленгликоль, неионный поверхностно-активный агент (например, полиоксиэтиленсорбитановые эфиры жирных кислот, полиоксиэтиленгидрированное касторовое масло, эфиры сахарозы жирных кислот, полиоксиэтиленполиоксипропиленгликоль) и подобные.
Примеры полиоксиэтиленсорбитановых эфиров жирных кислот, обозначенных как полисорбаты, включают монолаурат, монопальмитат, моноолеат, моностеарат, триорат и подобные эфиры полиоксиэтиленсорбитана, в котором степень полимеризации этиленоксида равна 20. Коммерчески доступными продуктами являются полисорбат 80, который представляет собой полиоксиэтиленсорбитанмоноолеат (20 ЭО = этиленоксид), полисорбат 60, который представляет собой полиоксиэтиленсорбитанмоностеарат (20 ЭО), полисорбат 40, который представляет собой полиоксиэтиленсорбитанмонопальмитат (20 ЭО = этиленоксид), полисорбат 20, который представляет собой полиоксиэтиленсорбитанмонолаурат (20 ЭО = этиленоксид), полисорбат 21, 81, 65, 85 и подобные, где 20 ЭО означает, что степень полимеризации этиленоксида полиоксиэтиленовой части составляет примерно 20. Полиоксиэтиленгидрированное касторовое масло представлено примерами таких коммерчески доступных продуктов как НСО-10, НСО-50, НСО-60 (Nikko Chemicals Co., Ltd.) и подобные. Эфиры сахарозы жирных кислот включают такие коммерчески доступные продукты как DK Ester F-160 (Daiichi Kogyo Seiyaku Co., Ltd. ), Ryoto Sugar Ester (Mitsubishi Kagaku Foods) и подобные. Полиоксиэтиленполиоксипропиленгликоль, обозначенный как полоксамер, включает такие коммерчески доступные продукты как Pluronic F-68 (Asahi Denka Kogyo К.К.) и подобные.
Конкретных ограничений по буферу нет до тех пор, пока он является физиологически приемлемым, таким как буфер, содержащий один или более компонентов, выбранных из соляной кислоты, гидроксида натрия, карбоната натрия, бикарбоната натрия, фосфорной кислоты, первичного кислого фосфата калия, вторичного кислого фосфата калия, первичного кислого фосфата натрия, вторичного кислого фосфата натрия, аминоуксусной кислоты, бензоата натрия, лимонной кислоты, цитрата натрия, уксусной кислоты, ацетата натрия, винной кислоты, тартрата натрия, молочной кислоты, лактата натрия, этаноламина, аргинина, этилендиамина и подобных.
Предпочтительно, чтобы фармацевтический носитель для использования в композиции изобретения имел фармацевтически приемлемую степень чистоты и по существу не содержал веществ, которые оказывают пагубное влияние и не пригодны для использования в лекарственных препаратах.
В композиции настоящего изобретения такие фармацевтические носители можно использовать в комбинации. Предпочтительно использовать либо полиэтиленгликоль, либо сахарозу, либо смесь этих соединений, или полиоксиэтиленсорбитановый эфир жирной кислоты, в особенности, полиоксиэтиленсорбитан-моноолеат (20 ЭО).
Если комбинацию настоящего изобретения получают в лиофилизованном виде, особо предпочтительно использовать смесь полиэтиленгликоля и сахарозы, так как она демонстрирует такие эффекты как предупреждение снижения ферментативной активности фермента, разрушающего гликозаминогликаны, после лиофилизации, сохранение низкого содержания воды в лиофилизованном продукте. Кроме того, раствор лиофилизованного продукта является прозрачным, не содержит посторонних веществ и в малой степени снижает ферментативную активность разрушающего гликозаминогликаны фермента при хранении в течение продолжительного времени.
В этом случае для использования предпочтителен полиэтиленгликоль, содержащий восстановительные примеси в количестве не более 0,4 мл, в особенности, не более 0,36 мл на грамм полиэтиленгликоля, измеренном способом титрования с использованием аммонийцерийнитрата. Более предпочтительно использовать полиэтиленгликоль, содержащий пероксиды при концентрации не более 20 млн.д., в особенности не более 18,5 млн.д. на грамм полиэтиленгликоля.
Подлежащий использованию полиэтиленгликоль предпочтительно имеет среднюю молекулярную массу от 200 до 25000. Более предпочтителен полиэтиленгликоль, твердый при обычной температуре. Например, более предпочтительная средняя молекулярная масса составляет от 2000 до 9000, особо предпочтительная от 2000 до 4000 и наиболее предпочтительная от 3000 до 4000. Полиэтиленгликоль, имеющий среднюю молекулярную массу от 3000 до 4000, включает, например, полиэтиленгликоль со средней молекулярной массой 3250, 3350 и 4000.
Предпочтительной является сахароза для использования вместе с полиэтиленгликолем, содержащая восстановительные примеси в количестве не более 0,4 мл, в особенности, не более 0,36 мл на грамм сахарозы, измеренном способом титрования с использованием аммонийцерийнитрата. Более предпочтительно использовать сахарозу, содержащую пероксиды при концентрации не более 20 млн. д., в особенности, не более 18,5 млн.д. на грамм сахарозы.
Так как коммерчески доступная сахароза обычно имеет высокое содержание эндотоксина, предпочтительно обработать ее активированным углем или подобным до снижения концентрации эндотоксина в 10% (масса/масса) растворе сахарозы до величины не более 0, 03 ед./мл, желательно не более 0,01 ед./мл, еще лучше не более 0,006 ед./мл.
Концентрацию эндотоксина в сахарозе можно определить известным способом определения эндотоксина. Предпочтительно применять limulus-тecт с использованием компонента лизата limulus-амебоцитов. Эндотоксин-специфический limulus-реагент предпочтительно является limulus-реагентом, используемым в limulus-тесте. В качестве limulus-реагента можно использовать следующие коммерчески доступные limulus-реагенты: Toxicolor systems LS-6, LS-20 и LS-200, Endospecy ES-6, Endospecy ES-200 (эти продукты поставляет Seikagaku Corporation), Limulus ES-II Test Wako, Limulus ES-II Single Test Wako, Limulus ES-III Test Wako, Limulus ES-J Test Wako (эти продукты поставляет Wako Pure Chemical Industries).
При использовании в качестве фармацевтического носителя смеси полиэтиленгликоля и сахарозы эта смесь предпочтительно содержит восстановительные примеси в количестве не более 0,4 мл, в особенности, не более 0,36 мл на грамм смеси, измеренном способом титрования с использованием аммонийцерийнитрата. Более предпочтительно, чтобы концентрация пероксидов составляла не более 20 млн.д., в особенности, не более 18,5 млн.д. на грамм смеси полиэтиленгликоля и сахарозы.
При использовании в качестве фармацевтического носителя полиоксиэтиленсорбинатового эфира жирной кислоты предпочтителен эфир, содержащий восстановительные примеси в количестве не более 0,4 мл, в особенности, не более 0,36 мл на грамм эфира, измеренном способом титрования с использованием аммонийцерийнитрата. Более предпочтительно использовать эфир, имеющий концентрацию пероксидов не более 20 млн.д., в особенности, не более 18,5 млн. д. грамм эфира.
При использовании в качестве фармацевтического носителя смеси полиэтиленгликоля и сахарозы весовое соотношение полиэтиленгликоль/сахароза обычно регулируют в пределах от 0/1 до 10/1, особо предпочтительно соотношение примерно 2/1.
Агенты для изотоничности включают соли, такие как хлорид натрия, сахариды и подобное.
Хотя соотношение в смеси фермента, разрушающего гликозаминогликаны, и фармацевтического носителя конкретно не лимитировано, специалист должен соответствующим образом определить соотношение компонентов смеси, основанное на дозе или препаративной форме композиции настоящего изобретения. Например, в случае, когда композицию настоящего изобретения получают или хранят в лиофилизованном виде, предпочтительно содержание в композиции настоящего изобретения фермента, разрушающего гликозаминогликаны, на таком уровне, чтобы сохранялась форма лиофилизованного отвердевшего остатка.
Композицию настоящего изобретения можно приготовить, используя фермент, разрушающий гликозаминогликаны, и описанный выше фармацевтический носитель в соответствии с известными фармацевтическими способами. Композиция настоящего изобретения может находиться в виде раствора, в замороженном или дегидратированном виде.
Среди этих форм предпочтительной является композиция настоящего изобретения в виде дегидрата, более предпочтительна лиофилизация или лиофилизат.
Если композицию настоящего изобретения получают в виде лиофилизата, предпочтительно содержание воды в лиофилизате композиции настоящего изобретения не более 3% (масса/масса), так как считают, что лиофилизованные препараты с меньшим содержанием воды демонстрируют более высокую стабильность, и с фармацевтической точки зрения содержанием воды в лиофилизованных композициях обычно доводят до величины не более 3% (масса/масса). Содержание воды можно определить, например, способом сухого снижения веса (TG способ), который осуществляют посредством нагревания образца В условиях, которые включают стадии нагревания образца от 25oС до 105oС со скоростью 2,5oС в минуту, когда температура достигает 105oС, сохранения образца при этой температуре в течение 20 минут, взвешивания образца на микронных весах до и после нагревания, определения содержания воды по потере веса. По-другому, содержание воды можно определить способом Карла Фишера (Karl Fisher), который осуществляют, посредством перемешивания образца в метаноле в течение 3 минут, эктсрагируя воду, кулонометрически титруя экстрагированную воду и рассчитывая содержания воды по требующемуся количеству электричества (С: кулон).
Если композицию настоящего изобретения, полученную в виде лиофилизата, растворяют в физиологическом растворе, предпочтительно, чтобы этот раствор был прозрачным и без инородных материалов. Это легко определить невооруженным глазом, является ли раствор прозрачным и свободен ли он от инородных материалов.
Если композиция настоящего изобретения находится в виде раствора; в случае, когда композицию настоящего изобретения получают в замороженном виде, она до замораживания и после размораживания может быть в виде раствора, а в случае, когда композицию настоящего изобретения получают в виде лиофилизата, она до лиофилизации и после растворения при добавлении растворителя может быть в виде раствора, необходимо регулировать величину рН, обычно до 5-9, предпочтительно до 6-8. С этой целью к композиции настоящего изобретения обычно добавляют буфер, способный поддерживать рН в указанном выше диапазоне. Такой буфер не имеет конкретных ограничений до тех пор, пока он физиологически пригоден, и включает, например, соляную кислоту, гидроксид натрия, карбонат натрия, бикарбонат натрия, фосфорную кислоту, первичный кислый фосфат калия, вторичный кислый фосфат калия, первичный кислый фосфат натрия, вторичный кислый фосфат натрия, аминоуксусную кислоту, бензоат натрия, лимонную кислоту, цитрат натрия, уксусную кислоту, ацетат натрия, винную кислоту, тартрат натрия, молочную кислоту, лактат натрия, этаноламин, аргинин, этилендиамин и их смеси. Особо предпочтительным является фосфатный буфер или буферирующий агент. Применяя указанные выше буферы, рН раствора композиции настоящего изобретения можно отрегулировать и поддерживать в диапазоне от 5 до 9, предпочтительно от 6 до 8. Если рН ниже 5 или выше 9, фермент, разрушающий гликозаминогликаны, может быть дезактивирован или образовать в растворе нерастворимое вещество. Концентрация буфера в растворе композиции настоящего изобретения составляет не менее 1 мМ, предпочтительно от 10 до 50 мМ. Кроме буфера, композиция настоящего изобретения может содержать компонент, необходимый для изотоничности (соли, такие как хлорид натрия, сахариды и т.п.), консервант, анестетик и подобное.
Композиция настоящего изобретения, как есть, может быть конечной дозированной формой для введения в качестве лекарственного средства. Ее также можно использовать как материал для других конечных дозированных форм, например, жидких препаратов, лиофилизованных препаратов и подобного.
Композицию настоящего изобретения можно использовать в основном как препарат для инъекций, содержащий в качестве активного ингредиента фермент, разрушающий гликозаминогликаны. Если композицию настоящего изобретения получают в виде жидкого препарата для инъекций, жидкую композицию настоящего изобретения, приготовленную описанным выше способом, заливают в ампулы, пробирки, шприцы для инъекций и подобные подходящие контейнеры, которые затем закупоривают и распространяют, как есть, или хранят в качестве препаратов для инъекций.
Если композицию настоящего изобретения получают в виде замороженного препарата для инъекций, замороженную композицию настоящего изобретения, приготовленную описанным выше способом, хранят в закупоренном виде в ампулах, пробирках, шприцах для инъекций и подобных подходящих контейнерах, которые затем распространяют или хранят, и размораживают перед введением в качестве препаратов для инъекций.
Если композицию настоящего изобретения получают в виде сухого препарата для инъекций, сухую композицию настоящего изобретения, приготовленную описанным выше способом, хранят в закупоренном виде в ампулах, пробирках, шприцах для инъекций и подобных подходящих контейнерах, которые затем распространяют или хранят, и растворяют в дистиллированной воде для инъекций, физиологическом растворе, водном растворе глюкозы, водном растворе сорбита и подобном для применения в качестве препаратов инъекций. Можно обеспечить сухую композицию настоящего изобретения в комбинации с растворителем для растворения данной композиции.
Среди описанных выше препаратов для инъекций предпочтительна сухая композиция, и более предпочтительна лиофилизованная композиция. То есть, композиция настоящего изобретения особо предпочтительна в виде лиофилизованного препарата для инъекций.
Композицию настоящего изобретения можно вводить в виде инъекции в вертебральное эпидуральное пространство. Так как композиция настоящего изобретения особо полезна для лечения эпидурально мигрирующей грыжи межпозвоночного диска предпочтительно вводить ее в вертебральное эпидуральное пространство эпидурально мигрирующей грыжи межпозвоночного диска.
Так как композиция настоящего изобретения полезна для лечения грыжи межпозвоночного диска, классифицированной по классификации Макнаба как грыжа "изолированного типа" и грыжа "транслигаментозного экструзионного типа", ее можно вводить в вертебральное эпидуральное пространство грыжи межпозвоночного диска таких типов.
Дозу композиции нужно определять индивидуально в зависимости от симптомов, возраста и подобных характеристик пациента, она не имеет конкретных ограничений. Например, если в качестве фермента, разрушающего гликозаминогликаны, применяют хондроитиназу АВС и вводят в определенную область, то с одной дозой можно вводить примерно от 5 до 200 ед. фермента.
Композицию настоящего изобретения можно вводить в вертебральное эпидуральное пространство в случае эпидурально мигрирующей грыжи межпозвоночного диска у позвоночных животных, в особенности млекопитающих, которые, вероятно, могут страдать от эпидурально мигрирующей грыжи межпозвоночного диска. Предпочтительно, чтобы композиция могла быть одинаковой для введения в вертебральное эпидуральное пространство в случае грыжи межпозвоночного диска изолированного типа или транслигаментозного экструзионного типа у человека.
[2] Терапевтический агент настоящего изобретения
Терапевтический агент
настоящего изобретения является терапевтическим агентом для эпидурально мигрирующей грыжи межпозвоночного диска, которая характеризуется наличием в эпидуральном пространстве вещества студенистого ядра,
такого как грыжа межпозвоночного диска изолированного типа или грыжа межпозвоночного диска транслигаментозного экструзионного типа, включающим в качестве активного ингредиента фермента, разрушающего
гликозаминогликаны. Объяснение, аналогичное описанному выше для композиции настоящего изобретения, будет применено к разрушающему гликозаминогликаны ферменту, который можно использовать в качестве
активного ингредиента в терапевтическом агенте настоящего изобретения; содержанию активного ингредиента; содержащимся фармацевтическим носителям; объекту, подлежащему лечению; части, подлежащей
лечению; дозе и подобному.
Композиция и терапевтический агент настоящего изобретения действуют, быстро и в значительной степени растворяя вещество студенистого ядра в вертебральном эпидуральном пространстве в случае эпидурально мигрирующей грыжи межпозвоночного диска, и усиливают фагоцитоз студенистого ядра при помощи фагоцитов, делая возможной быструю ремиссию серьезной боли, сопутствующей эпидурально мигрирующей грыже межпозвоночного диска. Кроме того, эта композиция и этот терапевтический агент в высокой степени полезны как безопасные лекарственные средства, так как они вообще не оказывают воздействия на спинной мозг.
На чертеже показано содержание каждого гликозамино-гликана в студенистом ядре с флуоресцентной меткой в вертебральном эпидуральном пространстве после того, как в вертебральное эпидуральное пространство ввели хондроитиназу АВС.
Следующие ниже Примеры подробно проиллюстрированы как Примеры Исследования и Примеры Получения, но не предназначены для ограничения области настоящего изобретения.
Примеры исследования
(1) Тест на острую токсичность.
Исследовали на острую токсичность фермент, разрушающий гликозаминогликаны (здесь используют хондроитиназу АВС (Seikagaku Corporation); которую обозначают просто САВС).
1) Тест на острую токсичность с использованием крыс.
Хондроитиназу АВС вводили внутривенно пяти самцам и пяти самкам крыс за один раз при дозе 2000 ед./кг. Через 14 дней после введения, крыс исследовали на их общий вид и выживание и взвешивали. Через 14 дней производили вскрытие крыс и исследовали макроскопически их основные органы.
Результат: ни одно животное не умерло, и не наблюдалось изменений внешнего вида, веса тела и данных вскрытия. Таким образом, доза хондроитиназы АВС 2000 ед./кг при внутривенном введении крысам не является вредной.
2) Тест на острую токсичность с использованием гончих собак.
Хондроитиназу АВС вводили в эпидуральное пространство вертебрального канала двум самцам и двум самкам гончих собак за один раз при дозе 40 ед. /животному. Через четыре недели после введения собак исследовали на их общий вид и выживание и взвешивали. Через 4 недели производили вскрытие собак и исследовали макроскопически их основные органы.
Результат: ни одно животное не умерло, и не наблюдалось изменений внешнего вида, веса тела и данных вскрытия. Таким образом, доза хондроитиназы АВС 40 ед./животному при введении собакам в эпидуральное пространство не является вредной.
(2) Фармакологический тест на фармацевтическое действие.
Исследование эффекта фермента, разрушающего гликозаминогликаны, на повышение степени исчезновения студенистого ядра, мигрирующего в вертебральное эпидуральное пространство.
Изучали эффект фермента, разрушающего гликозаминогликаны, на повышение степени исчезновения вещества студенистого ядра, мигрирующего в вертебральное эпидуральное пространство, используя кроликов, посредством трансплантации студенистого ядра с флуоресцентной меткой в эпидуральное пространство кролика, введение фермента, разрушающего гликозаминогликаны, в вертебральное эпидуральное пространство и определения изменения количества гликозаминогликана в трансплантированном флуоресцентно-меченном веществе студенистого ядра. В этом эксперименте уменьшение количества гликозаминогликана в трансплантированном флуоресцентно-меченном веществе студенистого ядра означает повышение степени исчезновения студенистого ядра.
(2-1) Схема исследования.
После приготовления флуоресцентно-меченного студенистого ядра, приблизительно 50 мг его трансплантировали кролику в вертебральное эпидуральное пространство. Непосредственно после этого в вертебральное эпидуральное пространство кролика вводили 2 мл фермента, разрушающего гликозаминогликаны, с концентрацией 25 ед. /мл (в данном случае хондроитиназы АВС). На следующий день кролика умерщвляли и собирали флуоресцентно-меченное вещество студенистого ядра для измерения количества гликозаминогликана в нем.
(2-2) Материалы.
(2-2-1) Животные.
В качестве животного для сбора вещества студенистого ядра использовали самку обычного JW кролика, весящую около 3 кг и называемую животным-донором студенистого ядра.
В качестве животного, которому трансплантируют вещество студенистого ядра, использовали самку обычного JW кролика, весящую около 3 кг и называемую животным-реципиентом студенистого ядра.
(2-2-2) Вещества для исследования.
Указанные далее вещества для исследования все были асептическими.
В качестве отрицательного контроля использовали физиологический раствор с фосфатным буфером (PBS).
В качестве исследуемого вещества,
включающего разрушающий гликозаминогликаны фермент, использовали смешанный раствор 0,5 мл хондроитиназы АВС (Seikagaku Corporation; 1000 ед./мл)
и 10 мл физиологического раствора с фосфатным
буфером.
(2-3) Состав групп животных-реципиентов студенистого ядра.
В таблице показан состав групп, использованных в данном исследовании.
(2-4) Приготовление флуоресцентно-меченного студенистого ядра.
Следующие процедуры проводили в асептических условиях.
У животного-донора студенистого вещества (кролика) вынимали межпозвоночные диски L6/L7, L5/L6, L4/L5, L3/L4 и L2/L3. Студенистое ядро собирали и помещали в 50 мл пробирку для центрифуги. В эту 50 мл пробирку для центрифуги, содержащую студенистое ядро, добавляли 10 мкл раствора флуоресцеинизотиоцианата (FITC) в N,N-диметилформамиде (DMF) с концентрацией 50 мг/мл и перемешивали. Эту пробирку для центрифуги оставляли стоять при 0oС в течение 5 дней в темной комнате. На 6 день студенистое ядро в пробирке для центрифуги делили на порции по 50 мг и каждую часть помещали в пробирку, содержащую физиологический раствор с фосфатным буфером. Пробирки центрифугировали для промывания студенистого ядра. Полученное таким образом студенистое ядро называли "флуоресцентно-меченным студенистым ядром".
Флуоресцентно-меченное студенистое ядро использовали для трасплантации 5 животным в группе, предназначенной для введения контрольного вещества, и 6 животным в группе, предназначенной для введения САВС.
(2-5) Трансплантация флуоресцентно-меченного студенистого ядра в вертебральное эпидуральное пространство.
Флуоресцентно-меченное студенистое ядро трансплантировали в вертебральное эпидуральное пространство под анестезией в виде ингаляции Halothane (торговая марка; Takeda Chemical Industries). У животных-реципиентов студенистого ядра дезинфицировали при помощи этанола и Isozin (торговая марка; Meiji Seika) часть с остриженной шерстью на спине вдоль хвоста и фиксировали. Скальпелем разрезали кожу на спине примерно на 4 см и делали разрез. Удаляли спинномозговой отросток (spinous process) и позвоночную дугу (vertebral arch) и вертикально рассекали желтую связку между L5 и L6. В хвостовую часть трансплантировали 50 мг флуоресцентно-меченного студенистого ядра, образуя пространство при помощи шпателя. Флуоресцентно-меченное студенистое ядро трансплантировали в вертебральное эпидуральное пространство L6. После трансплантации рассеченную часть зашивали.
(2-6) Введение исследуемого вещества.
Для введения исследуемого вещества рассекали кожу около L6/L7 межпозвоночного диска с хвостовой стороны от места трансплантации флуоресцентно-меченного студенистого ядра. Исследуемое вещество вводили в вертебральное эпидуральное пространство L6/L7 межпозвоночного диска с хвостовой стороны от места трансплантации флуоресцентно-меченного студенистого ядра со скоростью 0,5 мл/мин, используя насос для вливаний. По завершении введения рассеченное место зашивали и дезинфицировали при помощи Isozin (торговая марка; Meiji Seika).
(2-7) Извлечение трансплантированного флуоресцентно-меченного студенистого ядра.
На следующий день животных-реципиентов студенистого ядра умерщвляли посредством кровопускания. Иссекали часть от поясничного позвонка L2 до cauda equina и открывали позвоночный канал со стороны живота. Затем извлекали флуоресцентно-меченное студенистое ядро из имплантированной части под спинным мозгом.
(2-8) Количественное определение гликозаминогликана в флуоресцентно-меченном студенистом ядре.
(2-8-1) Лиофилизация.
Проводили лиофилизацию извлеченного флуоресцентно-меченного студенистого ядра. По завершении лиофилизации лиофилизат взвешивали. Взвешенные образцы переносили в другие пробирки.
(2-8-2) Расщепление при помощи актиназы.
1 мл 0,25% раствора актиназы добавляли с целью воздействия на расщепление при 55oС в течение примерно 3,5 часов. После ферментации проводили тепловую обработку реакционной смеси при 100oС в течение 10 минут для дезактивации актиназы. Таким образом получали раствор флуоресцентно-меченного студенистого ядра, расщепленный с использованием актиназы.
(2-8-3) Расщепление при помощи гликозаминогликанлиазы.
Для количественного определения различных гликозаминогликанов, а именно хондроитинсульфата, кератансульфата и гиалуронана, в флуоресцентно-меченном студенистом ядре раствор флуоресцентно-меченного студенистого ядра, расщепленный с использованием актиназы, подвергали биологической обработке при помощи указанных далее гликозаминогликанлиаз.
(2-8-3-1) Расщепление при помощи хондроитиназы.
В пробирку помещали 100 мкл раствора, расщепленного с использованием актиназы. Затем туда добавляли 20 мкл хондроитиназы АВС (Seikagaku Corporation) с концентрацией 5 ед./мл. Реакцию расщепления проводили при 37oС в течение 2 часов при легком перемешивании. По завершении биологической переработки к реакционной смеси добавляли 20 мкл хондроитиназы ACII (Seikagaku Corporation) с концентрацией 5 ед./мл и 20 мкл 1М буферного раствора ацетата натрия (рН 6,0). Снова проводили реакцию расщепления при 37oС в течение 2 часов при легком перемешивании, получая продукт флуоресцентно-меченного студенистого ядра, расщепленный с помощью хондроитиназы. Этот биологически переработанный продукт использовали как образец для количественного определения хондроитинсульфата и гиалуронана в флуоресцентно-меченном студенистом ядре.
Хондроитинсульфат в флуоресцентно-меченном студенистом ядре можно количественно определить посредством детектирования ΔDi-6S, который представляет собой 2-ацетамидо-2-дезокси-3-O-β-D-глюко-4-енопирансилуроновая кислота)-6-O-сульфо-D-галактозу, ΔDi-43, который представляет собой 2-ацетамидо-2-дезокси-3-О-(β-D-глюко-4-енопирансилуроновая кислота)-4-O-сульфо-D-галактозу и ΔDi-0S, который представляет собой 2-ацетамидо-2-дезокси-3-O-(β -D-глюко-4-енопирансилуроновая кислота)-D-галактозу, получаемые из хондроитинсульфата, содержащегося в таком биологически переработанном продукте, способом высокоэффективной жидкостной хроматографии, как описано далее. С другой стороны, гиалуронан в флуоресцентно-меченном студенистом ядре можно количественно определить посредством детектирования ΔDi-HA, который представляет собой 2-ацетамидо-2-дезокси-3-O-(β-D-глюко-4-енопирансилуроновая кислота)-D-глюкозу, получаемую из гиалуронана, содержащегося в таком биологически переработанном продукте, способом высокоэффективной жидкостной хроматографии, как описано далее.
(2-8-3-2) Расщепление при помощи кератаназы.
В пробирку помещали 100 мкл раствора, биологически переработанного с использованием актиназы. Затем туда добавляли 20 мкл кератаназы с концентрацией 0,1 ед. /мл, полученной способом, описанным в WO 96/16166 и 20 мкл 1М буферного раствора ацетата натрия (рН 6,0). Реакцию расщепления проводили при 37oС в течение 48 часов при легком перемешивании, получая продукт флуоресцентно-меченного студенистого ядра, расщепленный с помощью кератаназы. Этот биологически переработанный продукт использовали как образец для количественного определения кератансульфата в флуоресцентно-меченном студенистом ядре.
Кератансульфат в флуоресцентно-меченном студенистом ядре можно количественно определить посредством детектирования Gal-GlcNAc(6S) (здесь далее иногда обозначают как L2) и Gal(6S)-GlcNAc(6S) (здесь далее обозначают как L4), где Gal обозначает остаток галактозы, GlcNAc обозначает остаток N-ацетилглюкозамина, (6S) обозначает эфир 6-O-сульфата и "-" обозначает гликозидную связь, образующуюся из кератансульфата, содержащегося в биологически переработанном продукте, способом высокоэффективной жидкостной хроматографии, как описано далее.
(2-8-4) Ультрафильтрация.
После расщепления при помощи гликозаминогликанлиазы все количество каждого продукта ферментации подвергали ультрафильтрации, используя пробирки для ультрафильтрации на центрифуге, с отделением фракции с молекулярной массой 10000 (торговая марка: Ultrafree, Millipore).
(2-8-5) Высокоэффективная жидкостная хроматография (HPLC).
Порцию в 5-10 мкл фильтрата, полученного указанным выше способом ультрафильтрации, вносили в колонку для высокоэффективной жидкостной хроматографии. Ниже описаны условия HPLC анализа ΔDi-63, ΔDi-43 и L4.
1) Колонка: Senshu Pack N(CH3) 2-315-N, ⌀ 8 мм х 15 см (Senshu Kagaku).
(2) Элюирование: 20 мМ Nа2SO4/ацетонитрил = 9/1.
(3) Скорость потока: 0,65 мл/мин.
(4) Реакционная смесь: 50 мМ тетраборат натрия, содержащий 0,1% 2-цианацетамида.
(5) Скорость потока реакционной смеси: 0,65 мл/мин.
(6) Температура реакции: 150oС.
(7) Реакционный змеевик: ⌀ 0,4мм х 10 м.
(8) Детектирование: длина волны возбуждения 331 нм, длина волны испускания 383 нм.
Далее описаны условия анализа высокоэффективной жидкостной хроматографии ΔDi-HA, ΔDi-0S и L2.
(1) Колонка: Asahi Pack NH2P, ⌀ 4,6 мм х 25 см х 2 колонки (Asahi Chemical Industry).
(2) Элюирование: 25 мМ буфер тетраметиламмоний-уксусная кислота (рН 8,5)/ацетонитрил = 9/1.
(3) Скорость потока: 0,5 мл/мин.
(4) Реакционная смесь: 50 мМ тетраборат натрия, содержащий 0,1% 2-цианацетамида.
(5) Скорость потока реакционной смеси: 0,5 мл/мин.
(6) Температура реакции: 150oС.
(7) Реакционный змеевик: ⌀ 0,4 мм х 10 м.
(8) Детектирование: длина волны возбуждения 331 нм, длина волны испускания 383 нм.
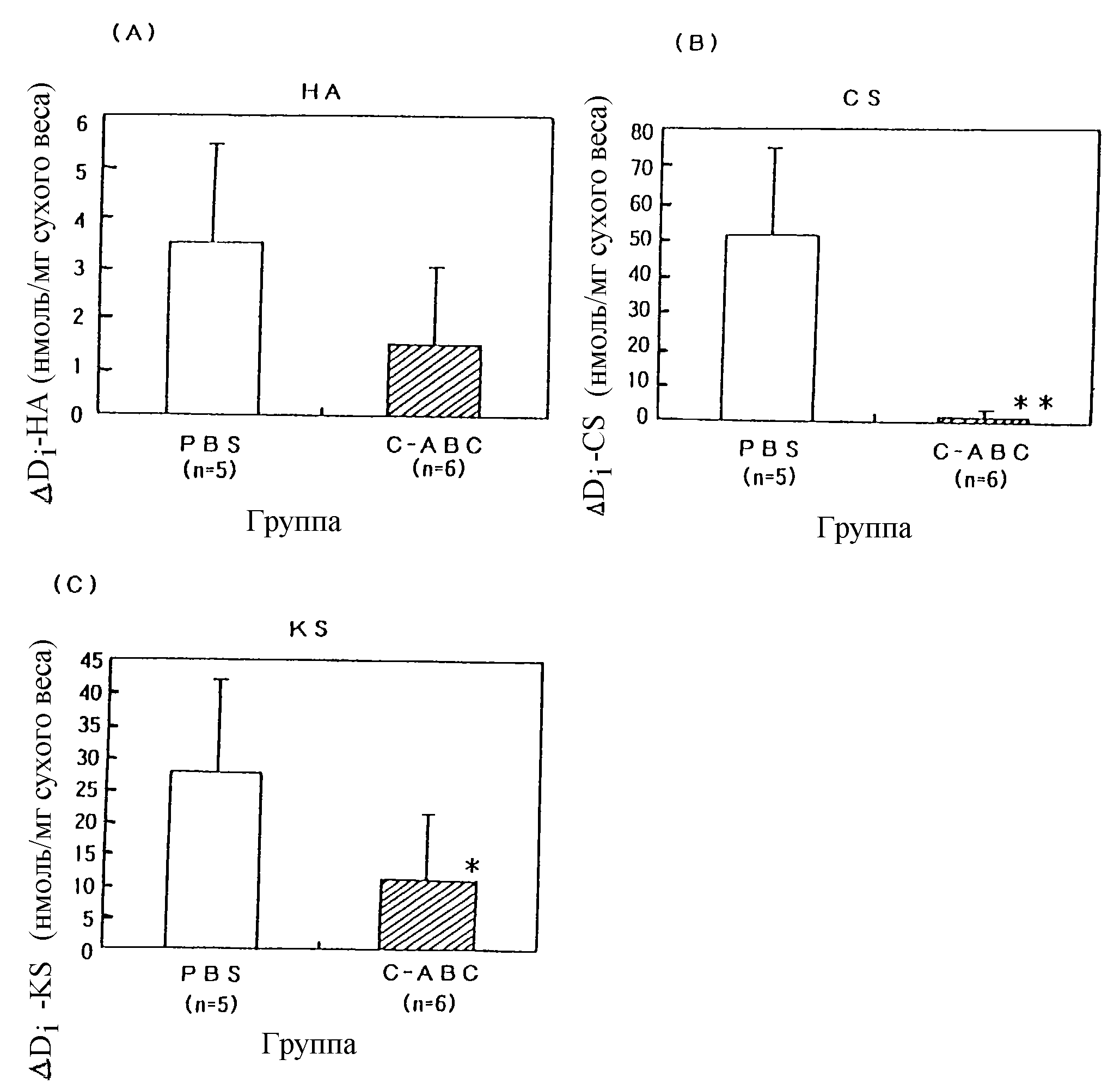
На чертеже показано содержание ΔDi-HA, которое является показателем содержания гиалуронана, ΔDi-CS, показывающего общее содержание ΔDi-6S, ΔDi-4S и ΔDi-OS, которое является показателем содержания хондроитинсульфата, и Di-Ks, показывающего общее содержание L2 и L4, которое является показателем содержания кератансульфата в флуоресцентно-меченном студенистом ядре в группе, где вводили контрольное вещество, и группе, где вводили САВС. На чертеже PBS обозначает группу, где вводили контрольное вещество, и С-АВС обозначает группу, где вводили САВС. Кроме того, на чертеже НА, CS и KS обозначают гиалуронан, хондроитинсульфат и кератансульфат, соответственно.** Означает, что по результатам t-теста между двумя группами существует существенная разница с р<0,05, и* означает, что существует существенная разница с р<0,1.
В результате обнаружено, что содержание каждого гликозаминогликана в трансплантированном флуоресцентно-меченном студенистом ядре в группе, где вводили САВС, существенно ниже по сравнению с соответствующей величиной в группе, где вводили контрольное вещество. В частности, существует статистически существенное уменьшение содержания хондроитинсульфата и кератансульфата в трансплантированном флуоресцентно-меченном студенистом ядре в группе, где вводили САВС, по сравнению с соответствующими величинами в группе, где вводили контрольное вещество.
Кроме того, результатом гистологического исследования является то, что в группе, где вводили САВС, инфильтрация фагоцитов наблюдается через меньший период времени по сравнению с группой, где вводили контрольное вещество. В группе, где вводили САВС, также происходит инфильтрация ряда гранулоцитов и макрофагов. Посредством этих фагоцитов происходит фагоцитоз эпидурально мигрирующего студенистого ядра. Показано, что введение САВС также усиливает фагоцитоз эпидурально мигрирующего студенистого ядра фагоцитами.
Результатом еще одного исследования является наблюдение, что САВС вообще не действует на спинной мозг.
Этот результат показал, что САВС, введенная в вертебральное эпидуральное пространство действует не только, предельно эффективно расщепляя студенистое ядро в вертебральном эпидуральном пространстве, а также усиливает фагоцитоз эпидурально мигрирующего студенистого ядра фагоцитами, предельно эффективно ликвидируя эпидурально мигрирующее студенистое ядро. Показано также, что САВС расщепляет только студенистое ядро в вертебральном эпидуральном пространстве, не оказывая какого-либо влияния на спинной мозг.
Из приведенных выше результатов обнаружено, что композиция для введения в вертебральное эпидуральное пространство, включая фермент, разрушающий гликозаминогликаны, и терапевтический агент для эпидурально мигрирующей грыжи межпозвоночного диска, включающий в качестве активного ингредиента фермент, разрушающий гликозаминогликаны, действуют, предельно эффективно и предельно полезно удаляя эпидурально мигрирующее студенистое ядро, не оказывая воздействия на спинной мозг, а только эффективно расщепляя студенистое ядро грыжи межпозвоночного диска, мигрирующей в вертебральное эпидуральное пространство, а также усиливая фагоцитоз студенистого ядра фагоцитами.
Примеры получения
1) Смесь 0,5 мл хондроитиназы АВС (Seikagaku Corporation, 1000 ед./мл) и 10 мл физиологического раствора с фосфатным буфером стерилизовали фильтрованием и разливали в ампулы
порциями по 2 мл. Ампулы закупоривали. Таким образом получали вводимый в виде инъекции препарат для лечения эпидурально мигрирующей грыжи межпозвоночного диска.
2) В 10 мМ фосфатного буфера (рН 7,0) растворяли кера-танзу II, которая является кератансульфатэндро-β-N-ацетилглюкозаминидазой (Seikagaku Corporation) (конечная концентрация 20 ед./мл), сахарозу (конечная концентрация 1% (масса/масса) и полиэтиленгликоль 4000 (конечная концентрация 2% (масса/масса). Смесь разливали по пробиркам порциями по 0,5 мл и проводили лиофилизацию. Лиофилизацию осуществляли посредством охлаждения от комнатной температуры до замораживания при -45oС, выполняя первую сушку в течение 12 часов при пониженном давлении 60 миллиТорр, повышая температуру до 25oС за 12 часов и выполняя вторую сушку при 25oС в течение 10 часов. После осушения пробирки закачивали газообразным азотом и закупоривали. Таким образом получали лиофилизованную композицию для введения в виде инъекции в вертебральное эпидуральное пространство.
Реферат
Изобретение может быть использовано в медицине, а именно для терапии грыжи межпозвоночного диска. Фармацевтическая композиция для введения в вертебральное эпидуральное пространство включает фермент, разрушающий гликозаминогликаны, и фармацевтический носитель. Также изобретение относится к применению фермента, разрушающего гликозаминогликаны, в качестве лекарственного препарата для терапии грыжи межпозвоночного диска, который характеризуется наличием в эпидуральном пространстве студенистого ядра, где указанный препарат вводится в вертебральное эпидуральное пространство. Изобретение повышает эффективность терапии грыжи межпозвоночного диска. 2 с. и 11 з.п.ф-лы, 1 табл., 1 ил.

Комментарии