Лечение в случае дефицита α-галактозидазы а - RU2179034C2
Код документа: RU2179034C2
Чертежи














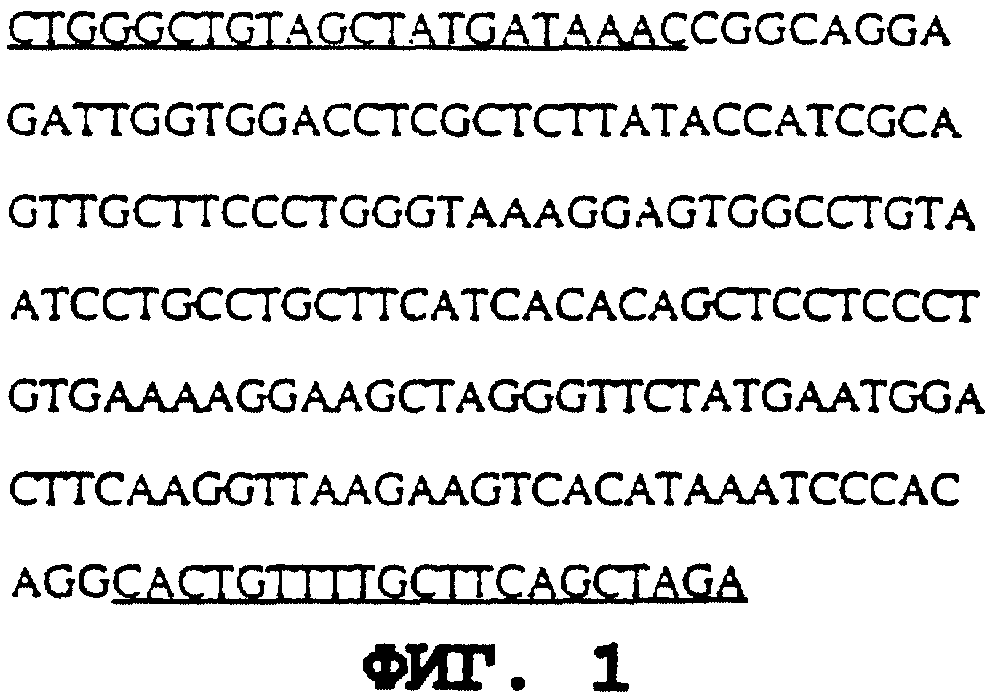


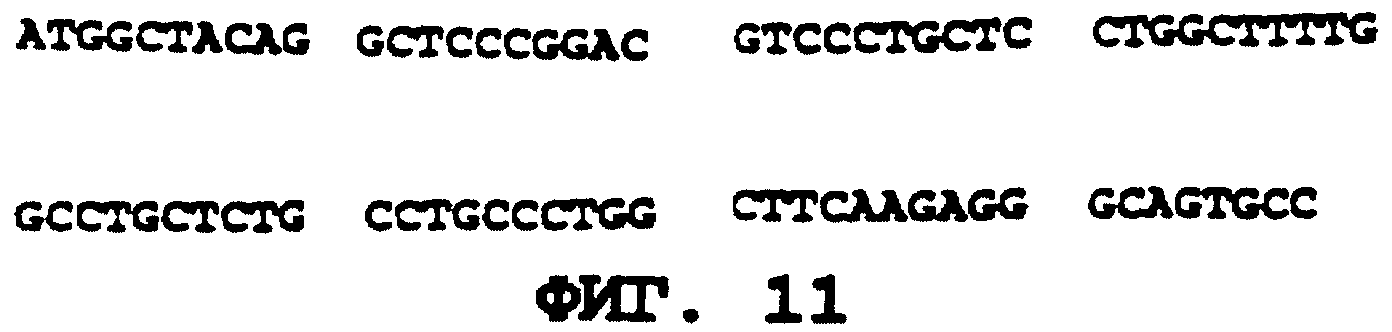


Описание
Предпосылки создания изобретения
Изобретение относится к α-галактозидазе А и лечению в случае дефицита α-галактозидазы А.
Болезнь Фабри представляет болезнь, связанную с X-хромосомным унаследованным лизосомным накоплением, характеризующуюся такими симптомами, как тяжелая почечная недостаточность, ангиокератомы и сердечно-сосудистые нарушения, в том числе гипертрофия желудочков сердца и недостаточность митрального клапана. Болезнь также поражает периферическую нервную систему, вызывая мучительные приступы со жгучей болью в конечностях. Болезнь Фабри вызывается дефицитом фермента α-галактозидазы А ( α-гал А), который проявляется в блокировке катаболизма нейтральных гликосфинголипидов и накоплением ферментного субстрата церамид-тригексозида внутри клеток и в кровотоке.
Вследствие характера, связанного с Х- хромосомой унаследованного заболевания, по существу, все пациенты с болезнью Фабри являются мужчинами. Хотя наблюдали несколько случаев тяжелого поражения женских гетерозигот, женские гетерозиготы обычно или бессимптомны, или имеют относительно умеренные симптомы, ограниченные большей частью характерным помутнением роговицы. Нетипичный вариант болезни Фабри, при котором проявляется низкая остаточная активность α-гал А и весьма умеренные симптомы или явное отсутствие симптомов, характерных для болезни Фабри, коррелирует с гипертрофией левого желудочка и болезнью сердца (Nakano et al. New Engl. J. Med., 333:288-293, 1995). Сделано предположение, что редукция α-гал А может являться причиной таких нарушений в работе сердца.
Выделены и секвенированы кДНК и ген, кодирующий человеческую α-гал A (Bishop et al., Proc. Natl. Acad. Sci. USA, 83:4859, 1986; Kornreich et al., Nuc. Acids Res., 17:3301, 1988; Oeltjen et al. Mammalian Genome, 6:335-338, 1995). Человеческая α-гал А экспрессируется в виде полипептида из 429 аминокислот, из которых 31 N-концевая аминокислота составляет сигнальный пептид. Человеческий фермент экспрессирован в клетках яичника китайского хомячка (CHO) (Desnick, патент США N 5356804; Ioannou et al., J. Cell Biol., 119: 1137, 1992); в клетках насекомых (Calhoun et al., патент США N 5179023) и в COS-клетках (Tsuji et al., Eur. J. Biochem., 165:275, 1987). Сообщается о пробных испытаниях по применению белка, полученного из тканей человека, при α-гал А заместительной терапии (Mapes et al., Science, 169:987, 1970; Brady et al. , N. Engl. J. Med., 289:9, 1973; Desnick et al., Proc. Natl. Acad. Sci. USA, 76:5326, 1979), но на сегодняшний день эффективного способа лечения болезни Фабри не существует.
Краткое изложение сущности изобретения
Обнаружено, что при экспрессии ДНК, кодирующей человеческую α-гал А, в культивированных человеческих клетках продуцируется полипептид, который соответствующим образом гликозилирован, так
что он не только ферментативно активен и способен действовать на гликосфинголипидный субстрат, накапливающийся при болезни Фабри, но он также эффективно поглощается клетками через рецепторы на
поверхности клетки, которые его точно нацеливают туда, где они необходимы при этой болезни: в лизосомный компартмент пораженных клеток, в частности эндотелиальных клеток, выстилающих кровеносные
сосуды пациента. Это открытие, подробнее обсуждаемое ниже, означает, что индивидуума с подозрением на дефицит α-гал А, как при болезни Фабри, можно лечить или (1) человеческими клетками,
которые генетически модифицированы для сверхэкспресии и секреции человеческой α-гал А, или (2) очищенной человеческой α-гал А, полученной из культивированных, генетически
модифицированных человеческих клеток.
Терапия по первому пути, т. е. с самими модифицированными клетками, включает генетическую манипуляцию с человеческими клетками (например, первичными клетками, вторичными клетками или иммортализованными клетками) in vitro или ex vivo, чтобы побудить клетки к экспресии и секреции большого количества человеческой α-гал А, с последующей имплантацией клеток пациенту, что в общих чертах описано в WO 93/09222, Selden et al. (включенной в настоящее описание в качестве ссылки).
Когда клетки должны быть генетически модифицированными для целей лечения болезни Фабри или посредством генной терапии, или посредством заместительной терапии ферментами, ДНК-молекула, содержащая кДНК α-гал А, или последовательность геномной ДНК может содержаться в экспрессирующей конструкции и может быть введена в первичные или вторичные человеческие клетки (например, в фибробласты, эпителиальные клетки, включая эпителиальные клетки молочной железы и кишечника, эндотелиальные клетки, форменные элементы крови, включая лимфоциты и клетки костного мозга, глиальные клетки, гепатоциты, кератиноцины, мышечные клетки, невральные клетки или в предшественников клеток таких типов) посредством стандартных способов трансфекции, в том числе, но не только перечисленными способами, липосомо-, полибрен- или DEAE-декстранопосредованной трансфекцией, электропорацией, осаждением фосфатом кальция, микроинъекцией или быстрыми частицами с управляемой скоростью ("биолистики" ["biolistics"] ). С другой стороны, можно использовать систему, которая доставляет ДНК с помощью вирусного вектора. Вирусами, известными как пригодные для переноса генов, являются аденовирусы, аденоассоциированный вирус, вирус герпеса, вирус паротита, полиовирус, ретровирусы, вирус Синдбиса и вирус осповакцины, такой как вирус чумы канареек. Хотя для способов лечения данного изобретения предпочтительны культуры первичных или вторичных клеток, можно также использовать иммортализованные человеческие клетки. Примерами линий иммортализованных человеческих клеток, полезных в способах настоящего изобретения, являются, но не ограничиваются перечисленным, клетки меланомы Bowes (АТСС, инвентарный N CRL 9607), клетки Дауди (АТСС, инвентарный N CCL 213), клетки HeLa и производные клеток HeLa (АТСС, инвентарные NN CCL 2, CCL 2.1 и CCL 2.2), клетки HL-60 (АТСС, инвентарный N CCL 240), клетки НТ1080 (АТСС, инвентарный N CCL 121), клетки Юрката (АТСС, инвентарный N TIB 152), клетки карциномы KB (АТСС, инвентарный N CCL 17), лейкозные клетки К-562 (АТСС, инвентарный N CCL 243), клетки рака молочной железы MCF-7 (АТСС, инвентарный N ВТН 22), клетки MOLT-4 (АТСС, инвентарный N 1562), клетки Намальвы (АТСС, 1 инвентарный N CRL 1432), Raji-клетки (АТСС, инвентарный N CCL 86), клетки RPMI 8226 (АТСС, инвентарный N CCL 155), клетки U-937 (АТСС, инвентарный N CRL 1593), клетки 2R4 сублинии WI-38VA13 (АТСС, инвентарный N CLL 75.1) и клетки карциномы яичника 2780AD (Van der Blick et al. Cancer Res. , 48:5927-5932, 1988), а также гетерогибридомные клетки, полученные путем слияния человеческих клеток и клеток другого вида. Штаммы вторичных фибробластов человека, такие как WI-38 (АТСС, инвентарный N CCL 75) и MRC-5 (АТСС, инвентарный N CCL 171), также можно использовать.
Методами генной инженерии из человеческих клеток с ДНК-молекулой, кодирующей α-гал А (или посредством другой подходящей генетической модификации, как описано ниже), для получения клетки, которая сверхэкспрессирует и секретирует α-гал А, можно генерировать клональный клеточный штамм, состоящий, по существу, из множества генетически идентичных культивированных первичных человеческих клеток, или, когда клетки иммортализованы, клональную клеточную линию, состоящую, в основном, из множества генетически идентичных иммортализованых человеческих клеток. Предпочтительно клетки клонального клеточного штамма или клональной клеточной линии являются фибробластами.
Затем можно получить генетически модифицированные клетки и ввести их пациенту подходящими способами, например так, как описано в WO 93/09222, Selden et al.
Генная терапия по изобретению обладает рядом преимуществ по сравнению с ферментно-заместительной терапией с применением фермента, полученного из тканей человека или животного. Например, способ по изобретению не зависит от возможно неустойчивой доступности источников соответствующих тканей и поэтому является коммерчески осуществимым способом лечения дефицита α-гал А. Он относительно безопасен по сравнению с ферментно-заместительной терапией с ферментом, полученным из человеческих тканей, которые могут быть инфицированы известными или неизвестными вирусами и другими инфицирующими агентами. Кроме того, генная терапия по изобретению обладает рядом преимуществ перед ферментно-заместительной терапией в целом. Например, способ изобретения (1) дает преимущества стратегии длительного лечения, исключающего необходимость ежедневных инъекций; (2) исключает экстремальные колебания в концентрациях в сыворотке и тканях терапевтического белка, которые типично сопровождают обычную фармокологическую доставку; и (3) является, вероятно, менее дорогостоящим, чем ферментно-заместительная терапия, поскольку нет необходимости в получении и очистки белка для частого введения.
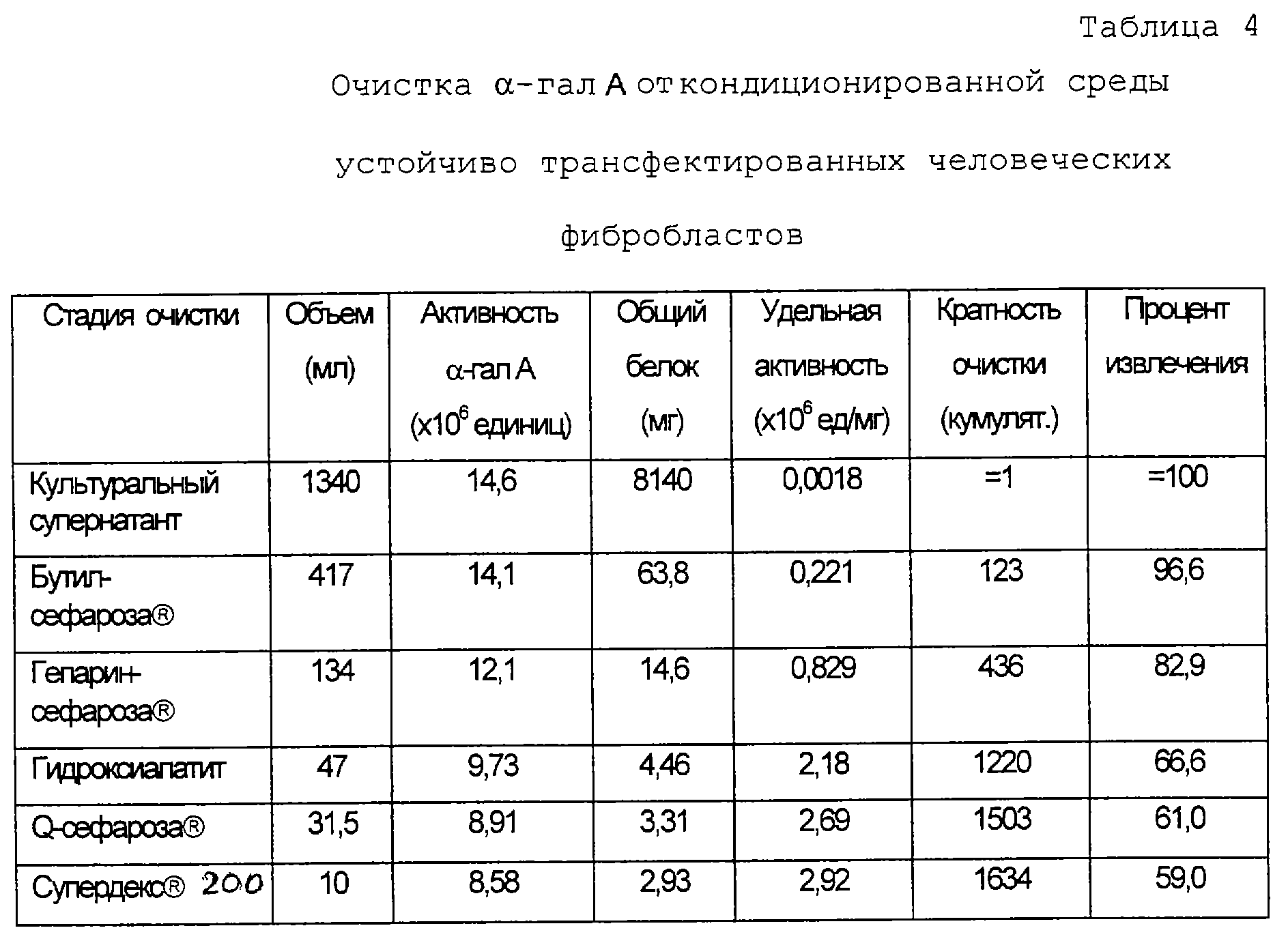
Как описано выше, индивидуумов с дефицитом α-гал A можно также лечить очищенной α-гал А (т.е. ферментно-заместительной терапией). Первичные, вторичные и иммортализованные человеческие клетки, генетически модифицированные для сверхэкспресии человеческой α-гал А, также полезны в случае получения белка in vitro для получения белка, который можно очистить для ферментно-заместительной терапии. Вторичные или иммортализованные человеческие клетки можно выбрать среди клеток, описанных выше, и можно генетически модифицировать методами трансфекции или трансдукции, также описанными выше. После генетической модификации клетки культивируют в условиях, допускающих сверхэкспрессию и секрецию α-гал А. Белок выделяют из выращенных клеток, собирая среду, в которой выращивают клетки, и/или путем растворения клеток для высвобождения их содержимого и затем применяют стандартные методы очистки белков. Один из таких методов заключается в пропускании культуральной среды или любого образца, содержащего человеческую α-гал А, через гидрофобную, вступающую во взаимодействие смолу, такую как бутилсефароза®, или другую смолу с функциональной группой, содержащей бутильную группу. Пропускание образца через такую смолу может составлять первую стадию хроматографии. Если необходима дополнительная очистка, содержащий α-гал А материал, элюированный из гидрофобной активной смолы, можно загрузить в колонку, содержащую другую смолу, например иммобилизованную гепариновую смолу, такую как гепаринсефароза®, гидроксиапатит, анионообменную смолу, такую как Q-сефароза®, или смолу для гельхроматографии, такую как супердекс® 200. Предпочтительно, схема очистки включает применение каждой смолы из вышеуказанных типов смол. С другой стороны, можно применить одну или несколько из последних смол перед применением гидрофобной активной смолы или вместо нее.
Ранее описанные способы получения α-гал А относительно высокой чистоты зависят от применения аффинной хроматографии с использованием сочетания аффинной хроматографии на лецитине (конканавалин A-(Con А)-сефароза) и аффинной хроматографии, основанной на связывании α-гал А с аналогом субстрата N-6-аминогесаноил -α -D-галактозиламином, связанным с сефарозной матрицей (Bishop et al. , J. Biol. Chem., 256:1307-1316, 1981). Применение белковых лецитинаффинных смол и смол - аналогов субстрата типично связывается с непрерывным "сползанием" афинного агента с твердого носителя (ср. Marikar et al. , Anal. Biochem. , 201: 306-310, 1992), что приводит, в результате, к загрязнению очищенного продукта аффинным агентом или свободным в растворе или связанным с элюированным белком. Такие загрязнения делают продукт непригодным для применения в фармацевтических препаратах. Связанные аналоги субстрата и лецитины также могут весьма негативно влиять на ферментативные, функциональные и структурные свойства белков. Кроме того, такие аффинные смолы обычно дорогостоящи для получения, что делает применение таких смол менее подходящим для производства в коммерческом масштабе, чем более привычных смол для хроматографии. Таким образом, разработка схемы очистки с использованием традиционных смол для хроматографии, которые легко доступны для поставок и качественно подходящи для крупномасштабного коммерческого применения, является существенным преимуществом настоящего изобретения.
Индивидуума, у которого подозревают дефицит α-гал А, можно лечить путем введения фармацевтически приемлемой очищенной человеческой α-гал А стандартным способом, в том числе, но не только, внутривенной, подкожной или внутримышечной инъекцией, или в виде твердого имплантата. Очищенный белок можно ввести в терапевтическую композицию, состоящую из водного раствора, содержащего физиологически приемлемый эксципиент, например носитель, такой как сывороточный альбумин человека, при pH 6,5 или ниже.
Таким образом, настоящее изобретение относится к способу получения больших количеств подходящим образом гликозилированной и поэтому терапевтически полезной, человеческой α-гал А. Это делает ферментно-заместительную терапию в случае дефицита α-гал А коммерчески жизнеспособной, а также относительно безопасной по сравнению с терапией ферментом, полученным из тканей человека или животного.
Специалистам в этой области техники будет понятно, что последовательность ДНК человеческой α-гал А (или кДНК, или геномной ДНК) или последовательности, которые отличаются от нее либо из-за изменений молчащих кодонов, либо изменений кодонов, которые дают консервативные замещения аминокислот, можно использовать для генетической модификации культивированных человеческих клеток, так что они будут сверхэкспрессировать и секретировать фермент. Также возможно, что некоторые мутации в последовательности α-гал А будут кодировать полипептиды, которые возвращают или обнаруживают повышенную ферментативную активность α-гал А (что можно будет выявить путем экспрессии молекулы мутантной ДНК в культивированных клетках, очистки кодированного полипептида и измерения каталитической активности, как описано здесь). Например, можно ожидать, что консервативные замещения аминокислот оказывают слабое действие или не оказывают действия на биологическую активность, особенно если они составляют менее 10% от общего числа остатков в белке. Консервативные замещения обычно включают замещения в пределах следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серии, треонин; лизин, аргинин; и фенилаланин, тирозин.
Продуцирование α-гал А клетками можно привести к максимуму путем некоторых генетических манипуляций. Например, молекула ДНК, которая кодирует α-гал А, может также кодировать гетерологичный сигнальный пептид, такой как сигнальный пептид человеческого гормона роста (hGH), эритропоэтина, фактора VIII, фактора IX, глюкагона, рецептора для липопротеина низкой плотности (LDL), или лизосомного фермента, иного чем α-гал А. Предпочтительно, сигнальный пептид представляет сигнальный пептид hGH (ПОСЛЕД. N21) и находится в N-конце кодированного белка. ДНК-последовательность, кодирующая сигнальный пептид, может содержать интрон, такой как первый интрон hGH-гена, результатом чего является такая ДНК-последовательность, как ПОСЛЕД. N 27 (см. также фиг. 10). Кроме того, молекула ДНК может также содержать 3'- нетранслируемую последовательность (UTS), которая составляет в длину по меньшей мере 6 нуклеотидов (в противоположность мРНК α-гал А, обнаруженной у людей, у которой нет 3' UTS, причем требуемый сайт полиаденилирования находится в пределах кодирующей последовательности). UTS располагается сразу же 3' к терминирующему кодону кодирующей последовательности и включает сайт полиаденилирования. Она составляет в длину, предпочтительно, по меньшей мере 6 нуклеотидов, предпочтительнее - по меньшей мере 12, а наиболее предпочтительно - по меньшей мере 30 нуклеотидов, и во всех случаях она содержит последовательность ААТААА или родственную последовательность, которая служит для промотирования полиаденилирования. Описанная молекула ДНК, т.е. кодирующая сигнальный пептид hGH, связанный с α-гал А, и содержащая 3' UTS, которая включает сайт полиаденилирования, и, предпочтительно, содержащая экспрессирующие регулярные последовательности, также входит в объем изобретения. Также в объем изобретения входит молекула ДНК, колирующая белок, которая содержит сигнальный пептид hGH, связанный с α-гал А или любым другим гетерологичным полипептидом (т. е., любым полипептидом, иным чем hGH, или аналогом hGH). Гетерологичный полипептид типично представляет белок млекопитающего, например любой, подходящий с медицинской точки зрения человеческий полипептид.
Другие особенности и преимущества данного изобретения станут очевидны из последующего подробного описания и из формулы изобретения.
Используемый здесь термин "генетически модифицированная" в отношении клеток охватывает клетки, которые экспрессируют определенный генный продукт после введения молекулы ДНК, кодирующей данный генный продукт и/или регуляторные элементы, которые регулируют экспрессию кодирующей последовательности. Введение молекулы ДНК можно осуществить с помощью направленной генной доставки (т.е. введения молекулы ДНК в определенный участок генома); кроме того, гомологичная рекомбинация допускает замену самого дефектного гена (дефектный ген α-гал А или его часть можно заменить при болезни Фабри собственными клетками пациента с целым геном или его частью).
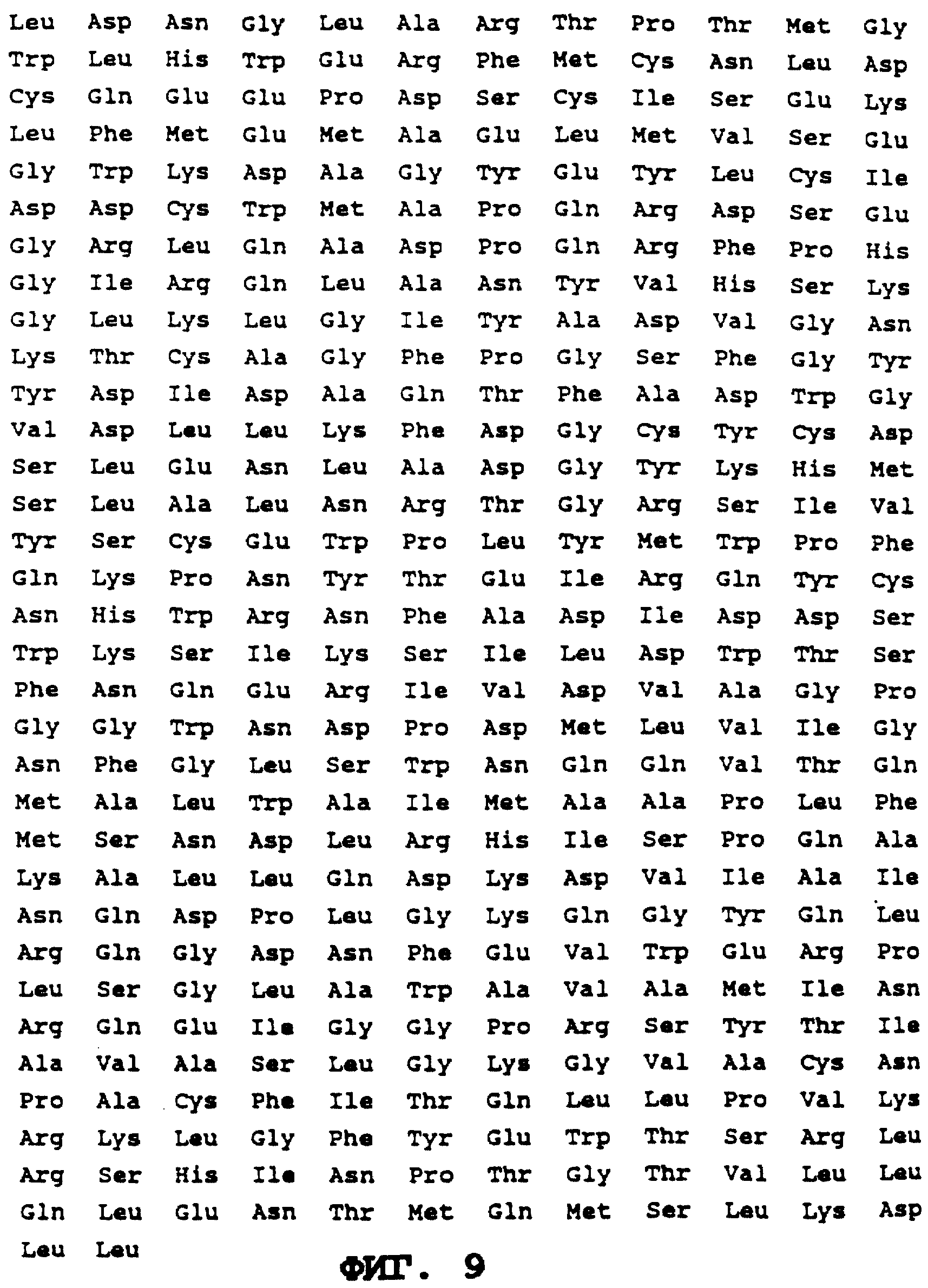
Используемый здесь термин "α-гал А" относится к α-гал А без сигнального пептида, т. е, к ПОСЛЕД. N 26 (фиг. 9). Есть определенные признаки, что остатки 371-398 или 373-398 ПОСЛЕД. 26 (фиг. 9) в лизосоме можно удалить; однако считается, что удаление этого предполагаемого пропептида не влияет на активность фермента. Это приводит к мысли, что можно удалить любую часть предполагаемого пропептида без ухудшения активности. Таким образом, используемый здесь термин "α-гал А" также охватывает белок с последовательностью, соответствующей ПОСЛЕД. N 26, за исключением недостающих остатков (до 28) у C-конца этой последовательности.
"Дефицит α-гал А" означает любую недостаточность количества или активности этого фермента у пациента. Такой дефицит может вызвать тяжелые симптомы, которые обычно наблюдаются у мужчин, страдающих от болезни Фабри, или он может быть только частичным и вызывать относительно умеренные симптомы, что можно наблюдать у гетерозиготных женских носителей дефектного гена.
Используемый здесь термин "первичная клетка" включает клетки, присутствующие в суспензии клеток, выделенных из источника - ткани позвоночного (до того, как их высевают, т.е., связывают с подложкой для тканевой культуры, такой как чашка или колба), клетки, присутствующие в эксплантате, полученном из ткани, оба предыдущих типа клеток, высеянные в первый раз, и клеточные суспензии, полученные из этих высеянных клеток.
"Вторичными клетками" называются клетки на всех последующих стадиях культивирования. Иначе, высеянную первый раз первичную клетку удаляют с культурального субстрата и высевают снова (пересевают), и эта клетка, как и все клетки при последующих пересевах, называется вторичной клеткой.
"Клеточный штамм" состоит из вторичных клеток, которые пересевали один или несколько раз, которые показывают конечное число среднего удвоения популяций в культуре, показывают свойства угнетаемого контактом роста на "якорной подложке (за исключением клеток, разведенных в суспензионной культуре) и не являются иммортализованными.
"Иммортализованной клеткой" обозначают клетку из установленной клеточной линии, которая обнаруживает явно неограниченную продолжительность жизни в культуре.
"Сигнальный пептид" означает пептидную последовательность, которая направляет вновь синтезированный полипептид, с которым он связывается к эндоплазматическому ретикулуму для дальнейшего посттрансляционного процессирования и/или распределения.
Используемый здесь в контексте с α-гал А термин "гетерологичный сигнальный пептид" относится к сигнальному пептиду, который не является сигнальным пептидом человеческой α-гал А (т.е., который кодируется нуклеотидами 36-128 ПОСЛЕД. N 18). Типично, он представляет сигнальный пептид какого-то другого белка млекопитающего, но не α-гал А.
Термин "первая стадия хроматографии" относится к первому внесению образца в хроматографическую колонку (все стадии, связанные с получением образца, исключены).
Краткое описание чертежей
На фиг. 1 изображен зонд в
210 п.о., который используют для выделения α-гал А из библиотеки кДНК фибробластов 13 человека (ПОСЛЕД. N 19). Последовательность состоит из экзона 7 гена α-гал А. Зонд выделяют из
геномной ДНК человека посредством полимеразной цепной реакции (PCR). Участки, подчеркнутые на чертеже, соответствуют последовательностям затравок для амплификации.
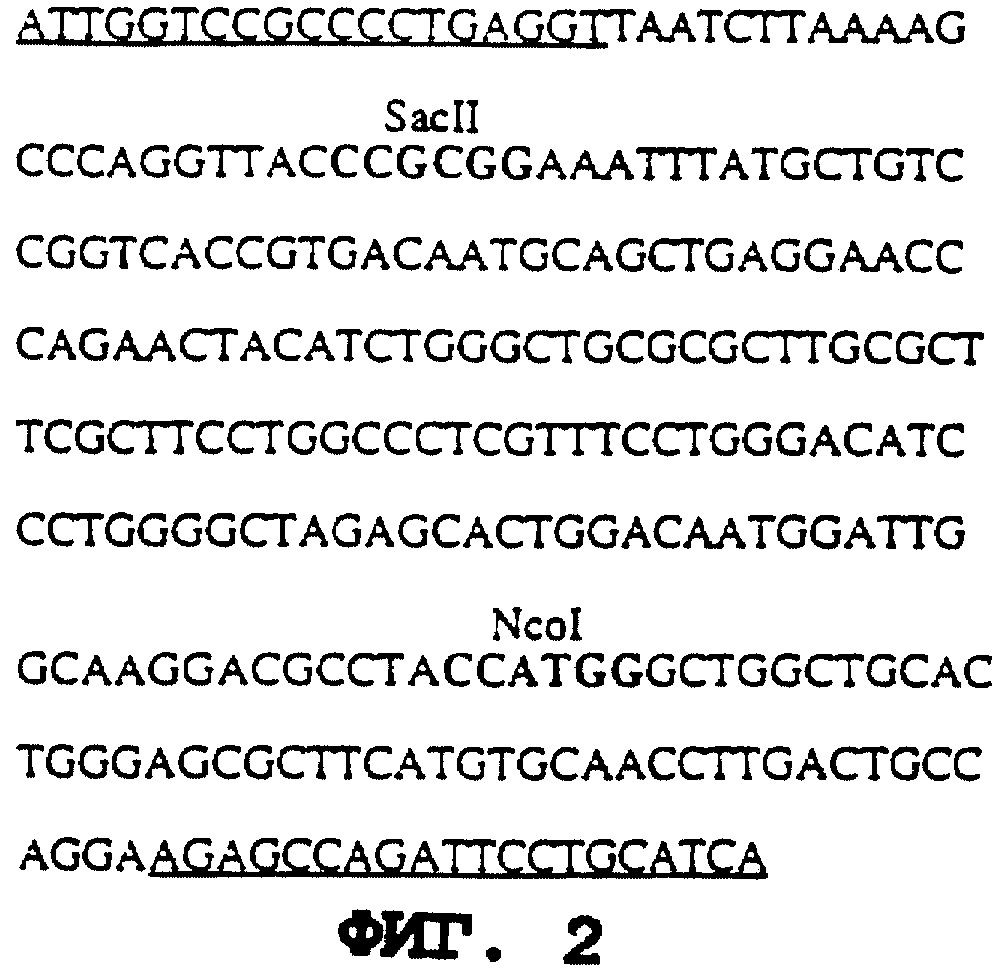
На фиг. 2 представлена последовательность ДНК-фрагмента, который завершает 5'-конец клона кДНК α-гал А (ПОСЛЕД. N 20). Этот фрагмент амплифицируют посредством PCR из геномной ДНК человека. Подчеркнутые участки соответствуют последовательностям затравок для амплификации. Также показаны положения сайтов рестрикции эндонуклеазами Ncol и SacII, которые используют для субклонирования, как описано в примере 1А.
На фиг. 3 представлена последовательность кДНК α-гал А, включающая последовательность, кодирующую сигнальный пептид (ПОСЛЕД. N 18).
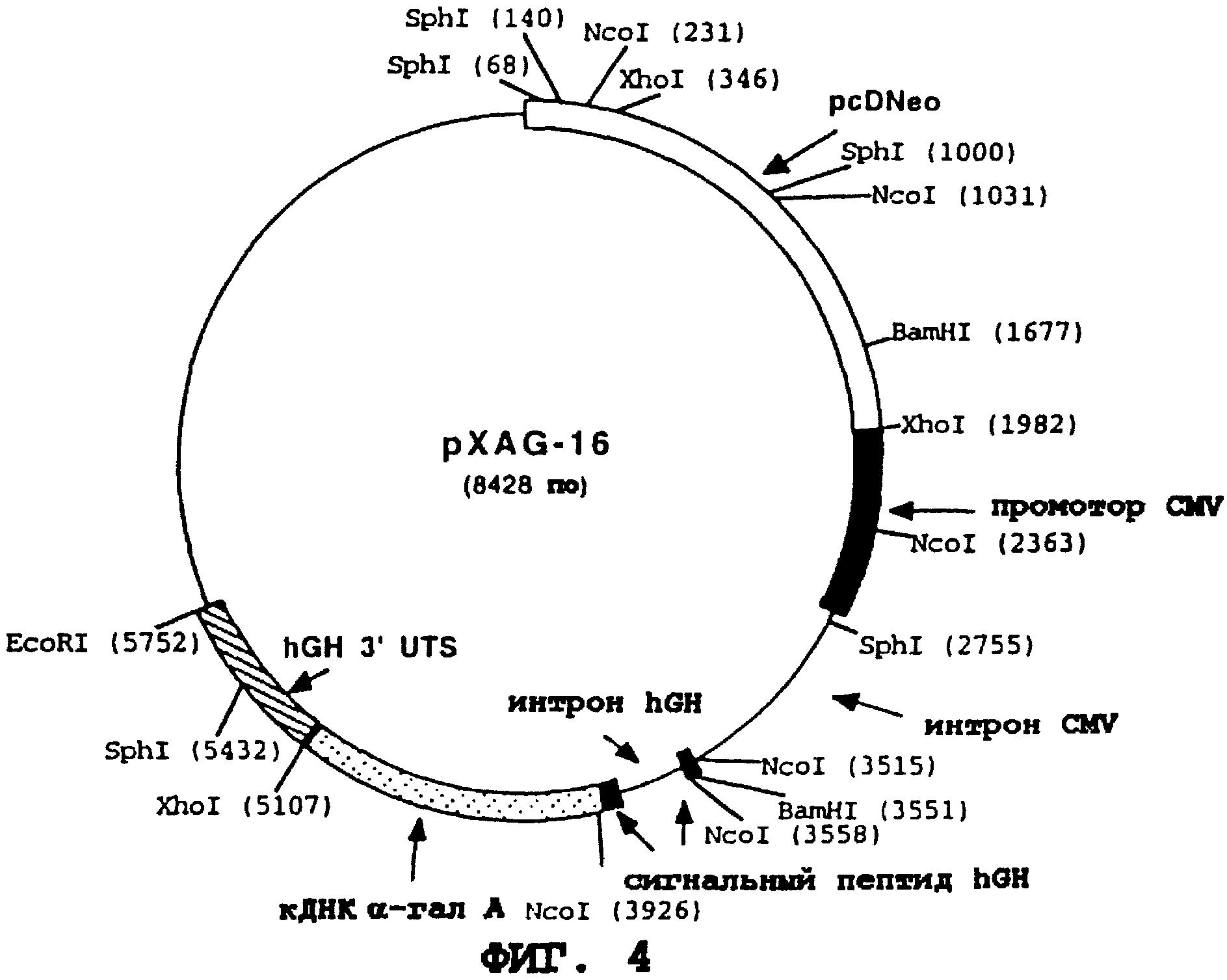
На фиг. 4 приводится схематическая карта pXAG-16 - конструкции, экспрессирующей α-гал А, которая включает промотор CMV (цитомегаловирус) и интрон, кодирующую последовательность сигнального пептида hGH и первый интрон, кДНК α-гал А (т.е., не имеющую последовательности сигнального пептида α- гал А) и 3' UTS hGH.
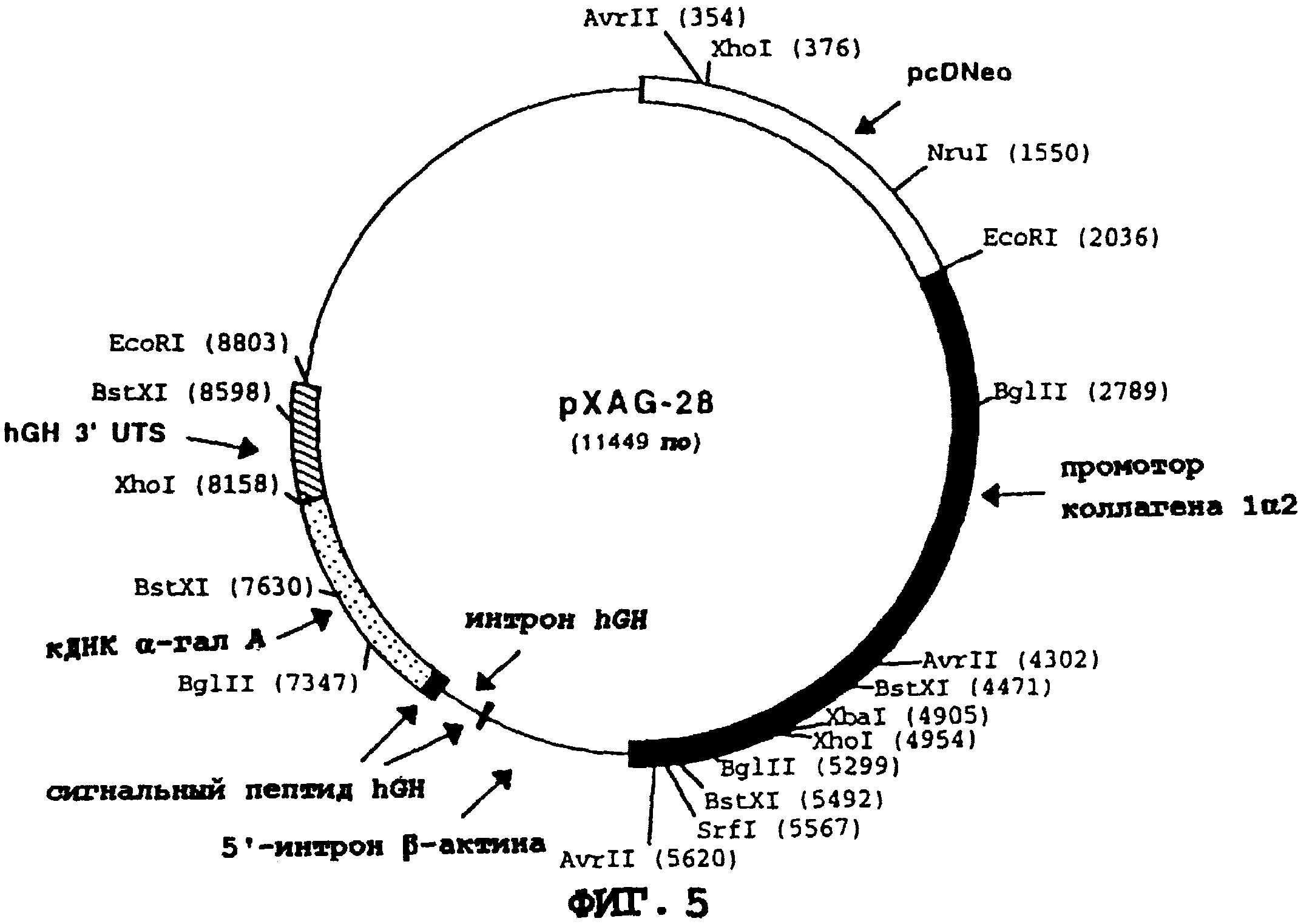
На фиг. 5 приводится схематическая карта pXAG-28 - конструкции, экспрессирующей α-гал А, которая включает коллагеновый промотор Iα2, интрон β-актина, кодирующую последовательность сигнального пептида hGH и первый интрон, кДНК α-гал А (т.е., не имеющую последовательности сигнального пептида α-гал А) и 3' UTS hGH.
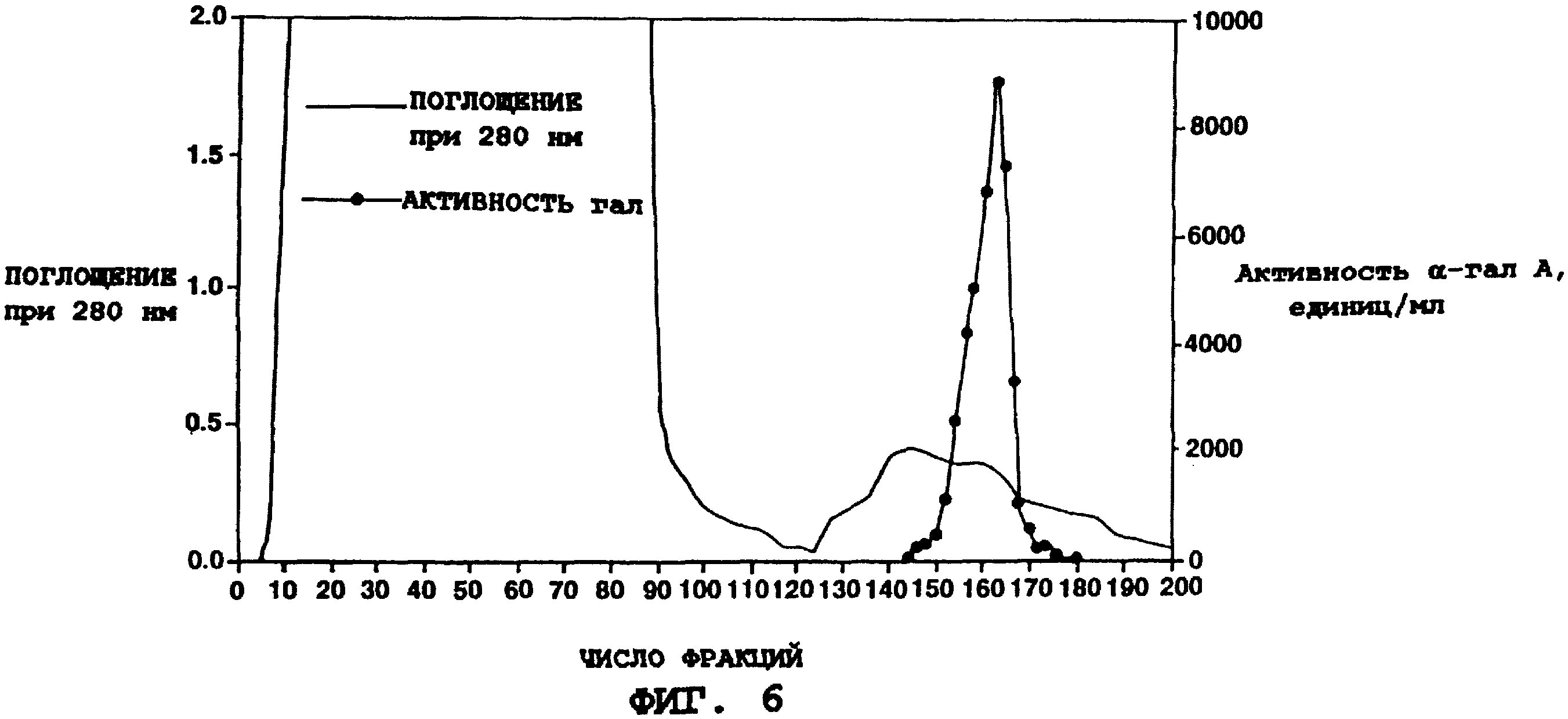
На фиг. 6 приводится хроматограмма стадии очистки α-гал А с использованием смолы бутилсефарозы®. Показаны поглощение при 280 нм (ровная линия) и активность α-гал А (линия с точками) выделенных фракций.
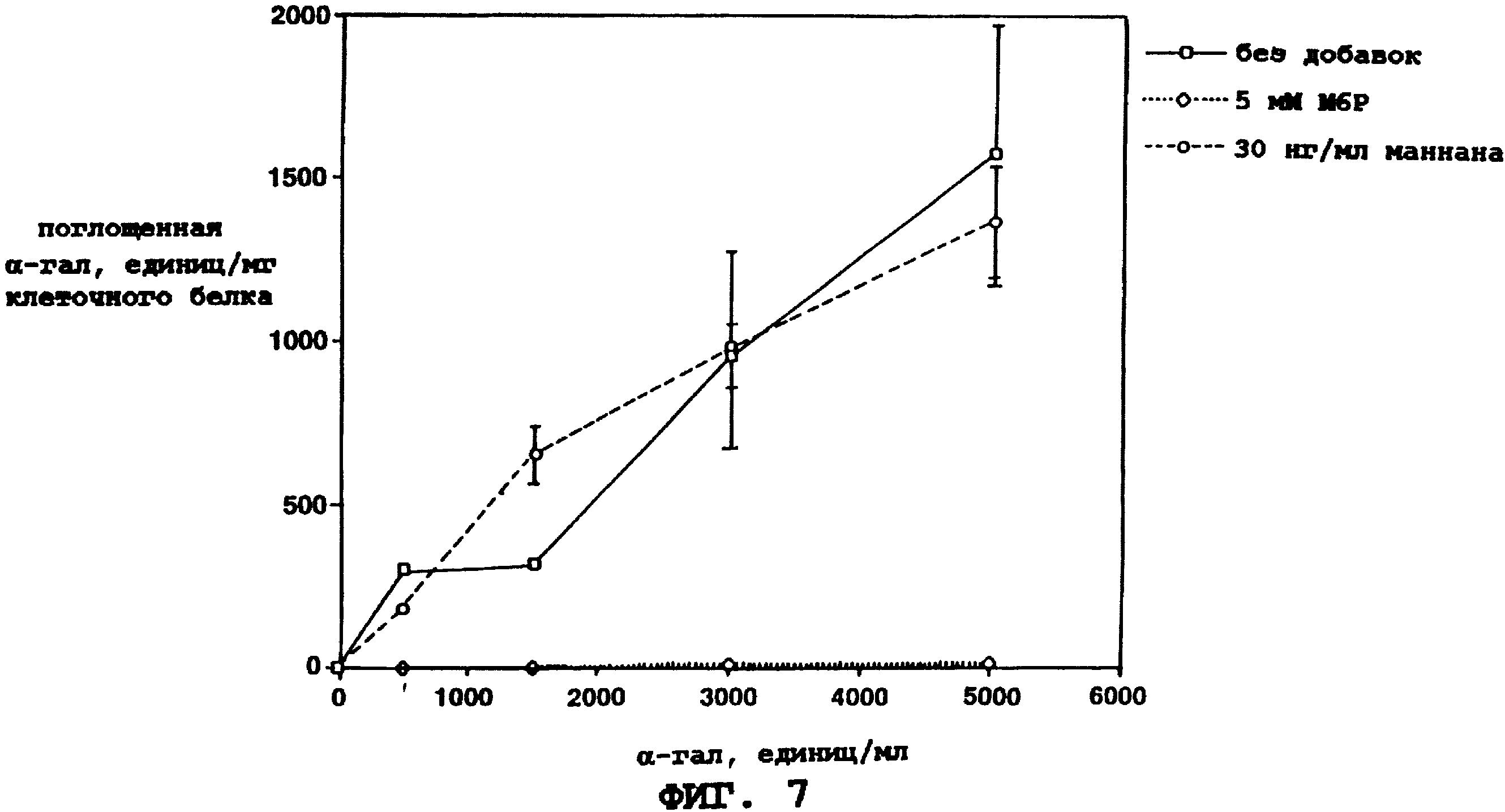
Фиг. 7 представляет графическое
отображение фибробластами Фабри человеческой α-гал А, полученной согласно изобретению. Внутриклеточную активность α-гал А и общую концентрацию белка измеряют после инкубации клеток с
возрастающими концентрациями человеческой α-гал А, полученной по изобретению. Показаны влияние потенциальных ингибиторов интернализации маннозо-6-фосфата (М6Р; незаштрихованные ромбы)
и маннана (незаштрихованные кружки).
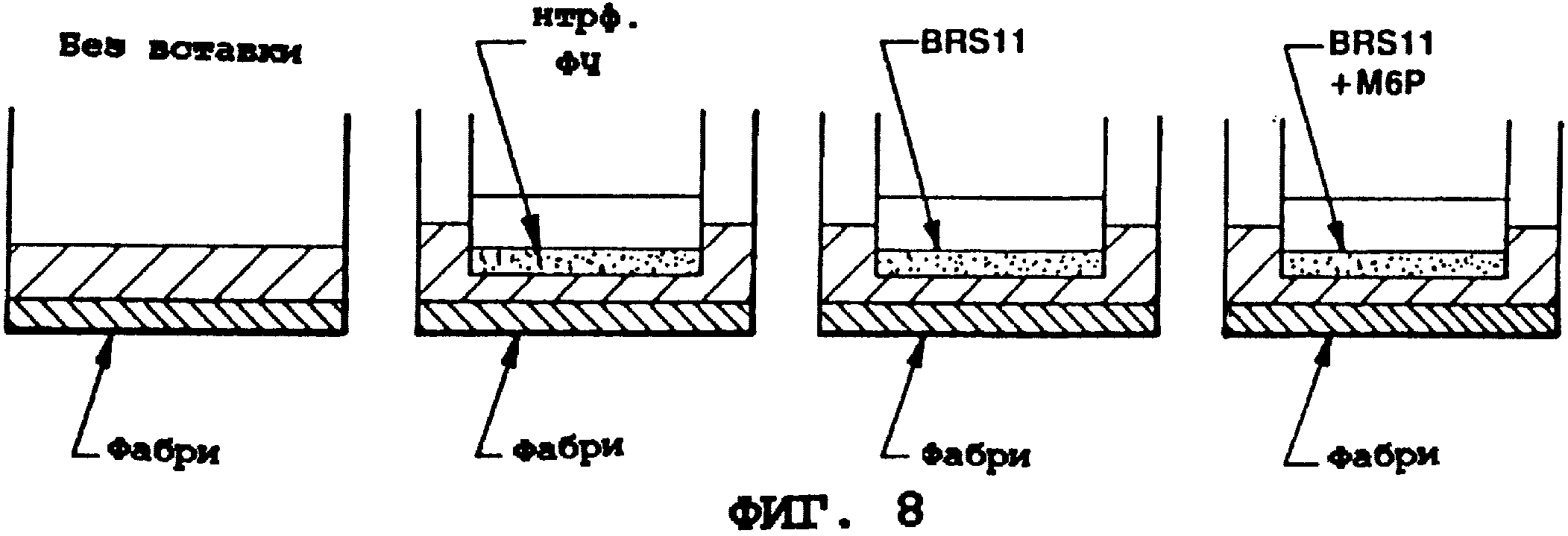
Фиг. 8 представляет схему экспериментальной системы, созданной для исследования фибробластов Фабри после поглощения α-гал А. Активность α-гал А клеток Фабри измеряют после воздействия или обычных, или сверхэкспрессирующих α-гал А фибробластов человека, выращенных во вставках TranswelTM. "М6Р" = маннозо-6-фосфат; "нтрф. ФЧ" = нетрасфектированные фибробласты человека; "BRS11" = трансфектированный сверхэкспрессирующий α-гал А штамм фибробластов.
На фиг. 9 приводится аминокислотная последовательность человеческой α-гал А (ПОСЛЕД. N 26).
На фиг. 10 приводится ДНК-последовательность, кодирующая сигнальный пептид hGH и содержащая первый интрон hGH (подчеркнут) (ПОСЛЕД. N 27).
На фиг. 11 приводится ДНК-последовательность, кодирующая сигнальный пептид hGH, без интрона (ПОСЛЕД. N 22).
На фиг. 12 приводится аминокислотная последовательность сигнального пептида hGH (ПОСЛЕД. N 21).
На фиг. 13 приводится кДНК-последовательность, кодирующая человеческую α-гал А (без сигнального пептида) (ПОСЛЕД. N 25).
Подробное описание изобретения
Лизосомные ферменты, такие как α-гал А, направляются к лизосомному компартменту клетки через взаимодействие с
маннозо-6- фосфатным (М6Р) рецептором, который связывает остатки М6Р, присутствующие в олигосахаридных частях ферментов, предназначенных для лизосомного компартмента (Kornfeld, S. and Mellman I., Ann.
Rev. Cell Biol., 5:483-525, 1989). Первичное взаимодействие происходит в аппарате Гольджи, где ферменты, связанные с рецепторами для М6Р аппарата Гольджи, расщепляются для переноса к лизосомам.
Полагают, что на поверхности клетки имеет место вторичный тип взаимодействия между внеклеточной α-гал А и М6Р-рецепторами. Внеклеточные вещества, поглощенные клетками, переносятся через
цитоплазму в эндоцитических пузырьках, и сливаются с первичными лизосомами, и выливают их содержимое в лизосомы. В этом процессе М6Р-рецепторы поверхности клеток также включаются в эндоцитические
пузырьки и переносятся к лизосомам.
Присутствующая во внеклеточной среде α-гал А, если она несет остатки М6Р, связываются с М6Р-рецепторами на поверхности клеток и за счет этого переносится в лизосомный компартмент вместе с рецепторами. Фермент в лизосомном компартменте в результате такого пути "утилизации" тотчас может осуществлять свою соответствующую функцию. Таким образом, даже если клетка генетически продуцирует недостаточно своей собственной α-гал А, существует механизм перемещения к ней экзогенно продуцированного фермента при условии, что (а) фермент подходящим образом гликозилирован и (б) дефектная клетка несет рецепторы для М6Р.
Показано, что при болезни Фабри васкулярные эндотелиальные клетки почки и сердца отображают серьезные гистопатологические отклонения от нормы и вносят вклад в клиническую патологию болезни; эти клетки, несущие рецепторы для М6Р, представляют собой особую мишень для представленного изобретения. Полученную по изобретению α-гал А можно доставлять к поврежденным клеткам или местно, или системно посредством генной терапии (т.е., с помощью генетически модифицированных клеток, которые экспрессируют и секретируют гликозилированный фермент в организме пациента), или с помощью традиционных фармакологических способов введения. Поэтому α-гал А, в которой в N-связанных олигосахаридах присутствует М6Р, имеет большое значение для лечения в соответствии с данным изобретением.
Кроме того, большое значение имеет также степень, до которой посредством сиалилирования модифицированы N-связанные олигосахариды α-гал А. В отсутствии соответствующего сиалилирования α-гал А будет быстро выводиться из кровообращения из-за связывания асиалогликопротеиновыми рецепторами печени с последующим поглощением и расщеплением гепатоцитами (Ashwell and Harford, Ann. Rev. Biochem., 51:531-554, 1982.). Это снижает количество α-гал А, доступной при циркуляции для связывания с М6Р-рецепторами на клетках, которые участвуют в клинической патологии болезни Фабри, таких как васкулярные эндотелиальные клетки почки и сердца. К удивлению заявители обнаружили, что α-гал А, секретируемая устойчиво трансфектированными человеческими клетками, обладает характеристиками гликозилирования, которые подходят для лечения болезни Фабри либо генной терапией, либо посредством традиционного фармацевтического введения очищенного секретируемого белка. Это противоположно ситуации с наиболее хорошо исследованным лизосомным ферментом глюкоцереброзидазой, когда доставка к клинически соответствующим клеткам организма фермента, очищенного от человеческой плаценты или выделенного из трансфектированных CHO-клеток, требует сложной ферментной модификации фермента после очистки (ср. Beutler, New Engl. J. Med., 325;1354-1360, 1991).
Лечение по изобретению можно осуществить двумя основными путями: посредством введения пациенту терапевтически эффективного количества очищенной человеческой α-гал А, полученной из культивированных человеческих клеток, генетически модифицированных для сверхэкспресии и секреции фермента, или путем введения пациенту самой сверхэкспрессирующей клетки. Методы осуществления необходимых генетических модификаций описываются ниже, как и способы очистки, составления композиций и лечения.
Пример 1. Получение и применение конструкций, созданных для доставки и экспрессии α-гал А
Конструируют две экспрессирующие плазмиды - pXAG-16 и
pXAG-28. Эти плазмиды содержат кДНК человеческой α-гал А, кодирующую 398 аминокислот фермента α-гал А (без сигнального пептида α-гал А); геномную ДНК- последовательность
сигнального пептида человеческого гормона роста (hGH), которая прерывается первым интроном гена hGH; и 3'-нетранслируемую последовательность (UTS) гена hGH, которая содержит сигнал для
полиаденилирования. Плазмида pXAG-16 содержит немедленно-ранний промотор цитомегаловируса человека (CMV IЕ) и первый интрон (фланкированный некодирующими экзонными последовательностями), в то время
как pXAG-28 управляется коллагеновым промотором Iα2 и также содержит 5' UTS гена β-актина, которая содержит первый интрон гена β-актина.
А. Клонирование полной
кДНК α-гал А и создание экспрессирующей α-гал А плазмиды pXAG-16
Человеческую
α-гал А клонируют из кДНК-библиотеки фибробластов человека, которую создают следующим
образом. Из полной РНК выделяют мРНК поли-А+ и осуществляют синтез кДНК с использованием реагентов для системы лямбда ZapII® по указаниям изготовителя (Stratagene Inc.,
Ла-Джолла, Калифорния). Коротко, "первоцепочечную" кДНК получают посредством обратной транскрипции в присутствии затравки олиго-dT, содержащей внутренний сайт для рестрикционной эндонуклеазы XhoI.
После обработки РНКазой H кДНК "ник"-транслируют с ДНК-полимеразой I образования двухцепочечной кДНК. У этой кДНК тупят концы Т4-ДНК-полимеразой и лигируют с адапторами EcoRI. Продукты этого
лигирования обрабатывают Т4-ДНК-киназой и расщепляют Xhol. Фракционируют кДНК хроматографией на сефакриле-400®. Фракции большого и среднего размера объединяют и лигируют кДНК с
расщепленными EcoRI и XhoI плечами лямбда-ZapII. Продукты этого лигирования затем упаковывают и титруют. Первичная библиотека имеет титр 1,2•107 бое/мл и средний размер вставки 925
п.о.
Для выделения кДНК используют зонд в 210 п.о. из экзона 7 гена человеческой α-гал А (фиг. 1, ПОСЛЕД. N 19). Сам зонд выделяют из геномной ДНК посредством полимеразной цепной реакции (PCR) с использованием олигонуклеотидов 5'- CTGGGCTGTAGCTATGATAAAC-3' (олиго-1; ПОСЛЕД. 1) и 5'-TCTAGC- TGAAGCAAAACAGTG-3" (олиго-2; ПОСЛЕД. N 2). PCR-продукт затем используют для скрининга библиотеки кДНК фибробластов, и выделяют положительные клоны, и характеризуют их далее. Один из положительных клонов фаг 3А "вырезают" по схеме с системой лямбда-ZapII® (Stratagene, Inc., Ла-Джолла, Калифорния) по указаниям изготовителя. Такая процедура дает плазмиду pBSAG3A, которая содержит кДНК-последовательность α-гал А в скелете плазмиды pBluescriptSK-TM. Секвенирование ДНК показывает, что эта плазмида не содержит полного 5'-конца кДНК-последовательности. Поэтому 5'-конец реконструируют с использованием PCR-фрагмента, амплифицированного из геномной ДНК человека. Чтобы это осуществить, фрагмент геномной ДНК в 268 п.о. (фиг. 2, ПОСЛЕД. N 20) амплифицируют с использованием олигонуклеотидов 5'-ATTGGTCCGCCCCTGAGGT-3' (олиго-3; ПОСЛЕД. N 3) и 5'-TGATGCAGGAATCTGGCTCT-3'(олиго-4; ПОСЛЕД. N 4). Этот фрагмент субклонируют в клонирующую плазмиду "ТА" (Invitrogen Corp., Сан-Диего, Калифорния), и генерируют плазмиду pTAAGEI. Плазмиду pBSAG3A, которая содержит большую часть кДНК-последовательности α-гал А, и плазмиду pTAAGEI, содержащую 5'-конец кДНК α-гал А, расщепляют каждую с SacII и NcoI. Положения соответствующих сайтов SacII и NcoI в амплифицированном ДНК-фрагменте показаны на фиг. 2. Выделяют из pTAAGEI Sacll-Ncol-фрагмент в 0,2 кб и лигируют с эквивалентно расщепленной pBSAG3A. Эта плазмида pAGAL содержит полную кДНК-последовательность α-гал А, включая последовательность, кодирующую сигнальный пептид α-гал А. Полностью секвинируют кДНК (показано на фиг. 3), включая сигнальный пептид α-гал А (ПОСЛЕД. N 18), и обнаруживают, что она идентична опубликованной последовательности кДНК α-гал А (геномная библиотека последовательностей HUMGALA).
Плазмиду pXAG-16 создают через несколько промежуточных этапов следующим образом. Во-первых, pAGAL расщепляют SacII и XhoI и тупят концы. Во-вторых, концы полной кДНК α-гал А лигируют 1 с линкерами XbaI, и субклонируют в гидролизованную с XbaI pEF-BOS (Mizushima et al., Nucl. Acids Res., 18:5322, 1990), и создают pXAG-1. Эта конструкция содержит 3' UTS человеческого гранулоцитарного колониестимулирующего фактора (G-CSF) и промотор человеческого фактора элонгации 1α (EF-1α), фланкирующий кДНК, кодирующую α-гал А с добавлением сигнального пептида α-гал А, так что 5'-конец кДНК α-гал А сливается с промотором EF-1α. Чтобы создать конструкцию с промотором CMV IЕ и первым интроном, кДНК α-гал А и 3' UTS G-CSF удаляют из pXAG-1 в виде XbaI-BamHI-фрагмента в 2 кб. У фрагмента тупят концы, лигируют его с линкерами BamHI и вставляют в расщепленную BamHI pCMVfIpNeo (которую конструируют так, как описано ниже). Ориентация такова, что 5'-конец кДНК α-гал А сливается с промоторной областью CMV IE.
Создают pCMVfIpNeo следующим образом. Фрагмент промотора гена CMV IE амплифицируют PCR с использованием геномной ДНК CMV в качестве матрицы и олегонуклеотидов 5'- TTTTGGATCCCTCGAGGACATTGATTATTGACTAG-3' (ПОСЛЕД. N 23) И 5'- TTTTGGATCCCGTGTCAAGGACGGTGAC-3' (ПОСЛЕД. N 24). Получающийся в результате продукт (фрагмент 1,6 кб) расщепляют BamHI и получают содержащий промотор CMV фрагмент с липкими гидролизованными BamHI концами. Из плазмиды pMCIneopA (Stratagene Inc. , Ла-Джолла, Калифорния) выделяют новую экспрессирующую единицу в виде Xhol-BamHI-фрагмента в 1,1 кб. Содержащий промотор CMV и новые фрагменты вставляют в BamHI-, Xhol-расщепленную плазмиду (pUC12). Заметим, что pCMVflpNeo содержит промоторную область CMV 1E, начинающуюся с нуклеотида 546 и оканчивающуюся на нуклеотиде 2105 (из геномной библиотеки последовательностей HS5MIEP), и ген устойчивости к неомицину, управляемый тимидинкиназным промотором вируса простого герпеса (HSV) (ген TKneo), сразу 5' к фрагменту промотора CMV IЕ. Направление транскрипции неогена такое же, как фрагмента промотора CMV. Промежуточную конструкцию называют pXAG- 4.
Чтобы добавить 3' UTS hGH, удаляют 3' UTS GCSF из pXAG-4 в виде Xbal-Smal-фрагмента и тупят концы pXAG-4. 3' UTS hGH удаляют из pXGH5 (Selden et al. , Mol. Cellular Biol., 6:3173- 3179, 1986) в виде Smal-EcoRI-фрагмента в 0,6 кб. После дефосфорилирования этого фрагмента его лигируют в pXAG-4 сразу после сайта с затупленными Xbal концами pXAG-4. Эту промежуточную конструкцию называют pXAG-7. Из этой плазмиды удаляют TKneo- фрагмент в виде Hindlll-Clal-фрагмента, и концы плазмиды дефосфорилируют посредством "замещения" фрагментом Кленова ДНК- полимеразы 1. Лигируют ген устойчивости к неомицину, управляемый ранним промотором SV40, в виде дефосфорилированного Clal-BsmBI-фрагмента из гидролизата pcDNeo (Chen et al., Mol. Cellular Biol. , 7: 2745-2752, 1987), помещая звено неотранскриптона в той же ориентации, что и транскриптон α-гал А. Эту промежуточную конструкцию называют pXAG-13.
Для завершения конструкции pXAG-16, содержащей кодирующую последовательность сигнального пептида hGH в 26 аминокислот и первый интрон гена hGH, сначала удаляют EcoRI-BamHI-фрагмент в 2,0 кб из pXAG-13. Этот фрагмент содержит кДНК α-гал А и 3' UTS hGH. Этот большой фрагмент заменяют 3 фрагментами. Первый фрагмент состоит из PCR-продукта pXGH5 в 0,3 кб, который содержит кодирующую последовательность сигнального пептида hGH и включает первую интронную последовательность bGH, от синтетического BamHI-сайта, расположенного сразу в обратном направлении от обобщающей последовательности Козака до конца кодирующей последовательности сигнального пептида hGH. Для амплификации этого фрагмента (фрагмента 1) используют олигонуклеотиды 5'-TTTTGGATCCACCATGGCTA-3' (олиго-HGH101; ПОСЛЕД. N 5) и 5'-TTTTGCCGGCACTGCCCTCTTGAA-3' (олиго-НGН102; ПОСЛЕД. N 6). Второй фрагмент состоит из PCR-продукта в 0,27 кб, содержащего последовательности, соответствующие началу кДНК, кодирующей фермент α-гал А в 398 аминокислот (т.е., не имеющей сигнального пептида α-гал А), до сайта NheI. Для амплификации этого фрагмента (фрагмента 2) используют олигонуклеотиды 5'-TTTTCAGCTGGACAATGGATTGGC-3' (олиго-AG10; ПОСЛЕД. N 7) и 5'-TTTTGCTAGCTGGСGAATCC-3' (олиго-AG11; ПОСЛЕД. N 8). Третий фрагмент состоит из NheI-EcoRI-фрагмента pXAG-7, содержащего оставшуюся последовательность α-гал А, а также 3' UTS hGH (фрагмент 3).
Фрагмент 1 (расщепленный BamHI и NaeI), фрагмент 2 (расщепленный PvuII и NheI) и фрагмент 3 смешивают с BamHI-EcoRI-фрагментом в 6,5 кб pXAG-13, содержащим неоген и промотор CMV 1Е, и лигируют вместе с образованием плазмиды pXAG-16 (фиг. 4).
Б. Конструирование экспрессирующей α
- гал А плазмиды pXAG-28
Промотор коллагена человека Iα2/ для применения в экспрессирующей α- гал A конструкции pXAG-28 выделяют следующим образом. С использованием
олигонуклеотидов 5'- TTTTGGATCCGTGTCCCATAGTGTTTCCAA-3' (олиго-72; ПОСЛЕД. N 9) и 5'- TTTTGGATCCGCAGTCGTGGCCAGTACC-3' (олиго-73; ПОСЛЕД. N 10) выделяют PCR-фрагмент геномной ДНК человека в 408 п.о.,
содержащий часть промотора коллагена человека Iα2.
Этот фрагмент используют для скрининга библиотеки лейкоцитов человека в EMBL3 (Clontech Inc. , Пало-Альто, Калифорния). Выделяют один
из положительных клонов (фаг 7H), содержащий EcoRI-фрагмент в 3,8 кб и клонируют в pBSIISK+ (Stratagene Inc. , Ла-Джолла, Калифорния) в сайте EcoRI (создавая pBS/7H. 2). В pBSIISK+ вводят сайт AvrII
посредством расщепления с SpeI, который осуществляет расщепление в пределах полилинкера pBSIISK+, "вливания" фрагментом Кленова ДНК-полимеразы I и вставки олигонуклеотида 5'-CTAGTCCTAGGA-3' (ПОСЛЕД. N
11). Этот вариант pBSIISK+ расщепляют с BamHI и AvrII и лигируют с BamHI-AvrII-фрагментом в 121 п.о. первоначального PCR-фрагмента промотора коллагена Iα2 в 408 п.о., описанным выше, и создают
pBS/121COL.6.
Плазмиду pBS/121COL. 6 расщепляют XbaI, расщепляющим в пределах полилинкерной последовательности pBSIISK+, "вливают" фрагментом Кленова ДНК-полимеразы 1 и расщепляют AvrII. Выделяют BamHI-AvrII-фрагмент pBS/7H.2 и дефосфорилируют сайт BamHI посредством обработки ферментом Кленова. Затем фрагмент расщепляют AvrII и лигируют с расщепленным AvrII вектором, и создают, таким образом, плазмиду с коллагеновым промотором pBS/121bpCOL7H.18.
Затем коллагеновый промотор сливают с 5' UTS гена человеческого β-актина, содержащей первый интрон гена человеческого β-актина. Чтобы выделить эту последовательность, из геномной ДНК человека выделяют PCR-фрагмент в 2 кб с использованием олигонуклеотидов 5'-TTTTGAGCACAGAGCCTCGCCT-3'(олиго-BA1; ПОСЛЕД. N 12) и 5'-TTTTGGATCCGGTGAGCTGCGAGAATAGCC-3' (олиго-ВА2; ПОСЛЕД. N 13).
Этот фрагмент расщепляют BamHI и BsiHKAl и высвобождают фрагмент в 0,8 кб, содержащий 5' UTS β
-актина и интрон. Затем из плазмиды с коллагеновым промотором pBS/121bpCOL7H.18 выделяют SalI-SrfI-фрагмент с 3,6 кб следующим образом. Частично расщепляют pBS/121bpCOL7H.18 с BamHI (сайт BamHI лежит
в 5'-конце фрагмента коллагенового промотора Iα2), дефосфорилируют посредством обработки фрагментом Кленова и лидируют с линкером SalI (5'-GGTCGACC-3'), посредством чего размещают сайт SalI
ниже коллагенового промотора Iα2. Затем эту плазмиду расщепляют SalI и SrfI (сайт SrfI лежит на 110 п.о. ниже САР-сайта коллагенового промотора Iα2) и выделяют фрагмент в 3,6 кб.
Фрагменты в 0,8 кб и 3,6 кб объединяют с SalI- и BamHI-расщепленной pBSIlSK- (Stratagene Inc. , Ла-Джолла, Калифорния) и составляют фрагмент из указанных далее четырех олигонуклеотидов, отожженных
вместе (с образованием фрагмента с дефосфорилированным концом и концом BsiHKAI): 5'- GGGCCCCCAGCCCCAGCCCTCCCATTGGTGGAGGCCCTTTTGGAGGCACCCTAGGGCCAGGAAACTTTTGCCGT АТ-3'(олиго-COL-1; ПОСЛЕД. N 14);
5'- AAATAGGGCAGATCCGGGCTTTATTATTTTAGCACCACGGCCGCCGAGACCGCGTCCGCCCCGCGAGCA-3' (олиго-COL-2; ПОСЛЕД. N 15);
5'- TGCCCTATTTATACGGCAAAAGTTTCCTGGCCCTAGGGTGCCTCCAAAAGGGC
CTCCACCAATGGGAGGGCTGGGGCTGGGGGCCC-3' (олиго-COL-3; ПОСЛЕД. N 16); и 5'- CGCGGGGCGGACGCGGTCTCGGCGGCCGTGGTGCTAAAATAATAAAGCCCGGATC-3' (олиго-COL-4; ПОСЛЕД. N 17). Эти четыре олигонуклеотида, будучи
отожженными, соответствуют области, начинающейся с сайта SrfI коллагенового промотора и проходящей через сайт BsiHKAI β-актинового промотора. Получающуюся в результате плазмиду обозначают
pCOL/β-актин.
Чтобы закончить построение pXAG-28, выделяют SalI-BamHI- фрагмент pCOL/β- актина, содержащий коллагеновый промотор Iα2 и 5' UTS β-актина. Этот фрагмент лигируют с двумя фрагментами из pXAG-16 (см. пример 1А и фиг. 4): (1) BamHI- фрагментом в 6,0 кб (содержащим неоген, плазмидный скелет, кДНК, кодирующую фермент α- гал А в 398 аминокислот, и 3' UTS hGH); и (2) BamHI-XhoI-фрагментом в 0,3 кб (содержащим последовательность поли-А SV40 из pcDneo). pXAG-28 содержит промотор человеческого коллагена Iα2, слитый с 5' UTS человеческого β-актина, сигнальный пептид hGH (который прерывается первым интроном hGH), кДНК, кодирующую фермент α-гал А, и 3' UTS hGH. Карта завершенной экспрессирующей конструкции pXAG-28 показана на фиг. 5.
В. Трансфекция и селекция фибробластов при электропорации с экспрессирующими α-гал А плазмидами
Чтобы экспрессировать α-гал А в
фибробластах, культивируют вторичные фибробласты и трансфектируют методами, описанными в литературе (Selden et al., WO 93/09222).
Плазмиды pXAG-13, pXAG-16 и pXAG-28 трансфектируют посредством электропорации в фибробласты крайней плоти человека, чтобы генерировать устойчиво трансфектированные клональные клеточные штаммы, и получающиеся в результате уровни экспрессии α-гал А контролируют так, как описано в примере IГ. Секреция α- гал А нормальными фибробластами крайней плоти находится в интервале 2-10 единиц на 106 клеток за 24 часа. В противоположность этому, трансфектированные фибробласты показывают средние уровни экспрессии, приведенные в табл. 1.
Эти данные показывают, что все три экспрессирующие конструкции способны превысить экспрессию α-гал А нетрасфектированными фибробластами во много раз. Экспрессия фибробластами, устойчиво трасфектированными pXAG-13, кодирующей α-гал А, связанную с сигнальным пептидом α-гал А, существенно ниже экспрессии фибробластами, трасфектированными pXAG-16, которая отличается только тем, что сигнальный пептид представляет сигнальный пептид hGH, кодирующая последовательность которого прерывается первым интроном гена hGH.
Каждый раз трасфектированные клетки пересевают, определяют активность секретированной α-гал А, подсчитывают клетки и вычисляют плотность клеток. На основании числа харвестированных клеток и времени, разрешенном для секреции α-гал А, определяют удельную скорость экспрессии α-гал А и указывают ее в таблицах 2 и 3 в виде секретируемых единиц (α-гал А) на 106 клеток за период 24 часа. Клеточные штаммы, нужные для генной терапии или для применения при получении материала для выделения чистой α-гал А, должны показывать стабильный рост и экспрессию при нескольких пересевах. Данные, полученные для клеточных штаммов, приведенных в таблицах 2 и 3, которые устойчиво трасфектированы экспрессирующей α-гал А конструкцией pXAG-16, поясняют факт, что экспрессия α-гал А устойчиво сохраняется при проведении серийных пересевов.
Г.
Количественная оценка экспрессии α-гал А
Активность α-гал А измеряют с использованием водорастворимого субстрата 4-метилумбеллиферил-α-D-галактопиранозида (4-MUF-gal;
Research Products, Inc.) по видоизмененной схеме, описанной loannou et al., J. Cell Biol., 119: 1137-1150, 1992. Субстрат растворяют в буфере для субстрата (0,1 М цитратфосфата, pH 4,6) до
концентрации 1,69 мг/мл (5 мМ). Обычно к 75 мкл раствора субстрата добавляют 10 мкл культурального супернатанта. Пробирки закрывают и инкубируют на водяной бане при 37oC в течение 60 минут.
По окончании инкубационного периода для остановки реакции используют 2 мл глицинкарбонатного буфера (130 мМ глицина, 83 мМ карбоната натрия, pH 10,6). Относительную флуоресценцию каждого образца
измеряют с использованием флуорометра модели ТК0100 (Hoefer Scientific Instruments) с фиксированной длиной волны возбуждения 365 нм и обнаруживают фиксированную длину волны испускания 460 нм.
Показатели образцов сравнивают с показателями стандартов, полученных из 1-мкМ исходного раствора метилумбеллиферона (Sigma Chemical Co.), и вычисляют количество гидролизованного субстрата. Активность
α-гал А выражают в единицах; одна единица активности α-гал А эквивалентна одному наномолю субстрата, гидролизованного за час при 37oC. Данные по экспрессии в клетках обычно
выражают в виде единиц активности α-гал А, выделенной 106 клетками за 24 часа. Этот анализ также используют для измерения количества активной α-гал А в клеточных лизатах и в
образцах с различных стадий очистки α-гал А, описанных ниже.
Пример II. Очистка α-гал А от кондиционированной среды штаммов устойчиво трансфектированных человеческих
клеток
В примерах IIA-IIД показывается, что α-гал А из кондиционированной среды культивированных штаммов человеческих клеток, устойчиво трансфектированных для продуцирования фермента,
можно очистить почти до однородного состояния.
А. Применение хроматографии на бутилсефарозе® как первой стадии очистки α-гал А
Холодную
кондиционированную среду (1,34 л) делают прозрачной посредством центрифугирования и фильтруют через 0,45- мкм ацетатцеллюлозный фильтр с использованием предфильтров из стекловолокна. После
перемешивания доводят pH холодной отфильтрованной среды до 5,6, добавляя по каплям 1N HCl, и добавляют сульфат аммония до конечной концентрации 0,66 М путем добавления по каплям исходного 3,9 М
раствора (комнатной температуры) сверхчистого сульфата аммония. Среду перемешивают еще в течение 5 минут при 4oC, фильтруют так же, как раньше, и вносят в колонку Fast Flow с
бутилсефарозой® (объем колонки 81 мл, 2,5 х 16,5 см; Pharmacia, Упсала, Швеция), которую уравновешивают 10 мМ MES-трис, pH 5,6, содержащим 0,66 М сульфата аммония (буфер А).
Хроматографию осуществляют при 4oC на системе Gradi-FracTM (Pharmacia, Упсала, Швеция), снабженной подключенными регистраторами УФ и проводимости для оценки общего содержания
белка и концентрации солей соответственно. После внесения образца при скорости потока 10 мл/мин колонку промывают буфером А в объеме, составляющем 10 объемов колонки. Из колонки с бутилсефарозой® α-гал А элюируют с градиентом от буфера А (содержащего сульфат аммония) до 10 мМ MES-трис, pH 5,6 (без сульфата аммония) при общем объеме, равном 14 объемам колонки. Фракции
анализируют на активность α-гал А посредством анализа с 4-MUF-gal и объединяют фракции, содержащие существенное количество активного фермента. Как видно на фиг. 6 и по итогам очистки (табл. 4),
на этой стадии удаляется приблизительно 99% загрязняющего белка (общее количество белка в образце до загрузки в колонку 8,14 г; после выхода из колонки общее количество белка 0,0638 г).
Б. Применение хроматографии на гепаринсефарозе® как стадия очистки α-гал А
Максимальные фракции из колонки с бутилсефарозой® диализуют при 4oC против (4 л) 10 мМ MES-трис, pH 5,6 (с одной заменой). Проводимость диализата доводят до 1,0 ммо (мСм) при 4oC путем добавления H2O или NaCl, что требуется. После этого
образец вносят в колонку Fast Flow с гепаринсефарозой® (Pharmacia, Упсала, Швеция; объем колонки 29 мл, 2,5 х 6 см), которая уравновешена 10 мМ MES-трис, pH 5,6, содержащим 9 мМ NaCI
(буфер Б). Это делают при 4oC и скорости потока 10 мл/мин. Общее содержание белка и концентрацию солей измеряют подключенными регистраторами УФ (280 нм) и проводимости. После внесения
образца колонку промывают буфером Б в объеме, равном 10 объемам колонки (10 "колоночными" объемами). А затем 3 "колоночными" объемами с градиентом до 8% буфера В в 92% буфера Б (где буфер В
представляет 10 мМ MES-трис, pH 5,6, содержащий 250 мМ NaCl) и 10 "колоночными" объемами промывной жидкости с 8% буфера В. За этим следует элюирование α-гал А 1,5 "колоночными" объемами с
линейным градиентом до 29% буфера В и последующее - 10 "колоночными" объемами с линейным градиентом до 35% буфера В. Фракции анализируют на активность α-гал А и объединяют фракции, содержащие
заметную активность.
В. Применение хроматографии на гидроксиапатите как стадия очистки α-гал А
Гепариновый пул фильтруют и вносят в колонку с керамическим
гидроксиапатитом НС (40 мкм; American International Chemical, Нейтик, Миннесота; объем колонки 12 мл, 1,5 х 6,8 см), уравновешенную 1 мМ фосфата натрия, pH 6,0 (буфер Г). Хроматографию осуществляют
при комнатной температуре на комбинированной системе Gradi-FracTM/FPLC® (Pharmacia, Упсала, Швеция), снабженной подключенными регистраторами УФ (280 нм) и проводимости.
После внесения образца (5 мл/мин) колонку промывают 10 "колоночными" объемами буфера Г. Элюируют α-гал А 7 "колоночными" объемами с линейным градиентом до 42% буфера Д с 58% буфера Г (где буфер
Д представляет буфер с 250 мМ фосфата натрия, pH 6,0), а затем 10 "колоночными" объемами с градиентом до 52% буфера Д. Фракции анализируют на активность α-гал А и объединяют фракции с заметной
активностью.
Г. Применение анионообменной хроматографии на Q-сефарозе® как стадии очистки α-гал А
Гидроксиапатитный пул разбавляют H2O
приблизительно в 1,5 раза до конечной проводимости 3,4-3,6 ммо при комнатной температуре. После фильтрации образец вносят в колонку c Q-сефарозой® HP (Pharmacia, Упсала, Швеция;
объем колонки 5,1 мл, 1,5 х 2,9 см), уравновешенную 10% буфера Ж с 90% буфера E, где буфер E содержит 25 М фосфата натрия, pH 6,0, а буфер Ж содержит 25 М фосфата натрия, pH 6,0, и 250 мМ NaCl.
Хроматографию осуществляют при комнатной температуре на комбинированной системе Gradi-FracTM/FPLC® (Pharmacia, Упсала, Швеция), и общее количество белка и концентрацию
солей контролируют с помощью подключенных регистраторов. Образец вносят при скорости потока 5 мл/мин, затем выполняют следующие стадии: (1) промывка 5 "колоночными" объемами буфера Ж, (2) промывка 7
"колоночными" объемами с 12% буфера Ж, (3) промывка 3 "колоночными" объемами с линейным градиентом до 50% буфера Ж, (4) промывка 10 "колоночными" объемами с линейным градиентом до 53% буфера Ж, (5)
промывка 3 "колоночными" объемами с линейным градиентом до 100% буфера Ж и (6) промывка 10 "колоночными" объемами 100% буфера Ж. Элюируют α-гал А преимущественно при осуществлении стадий 3 и 4.
Фракции, содержащие заметную активность, объединяют ("Q-пул").
Д. Применение гель-хроматографии на супердексе®-200 как стадия очистки α-гал А
Концентрируют Q-пул приблизительно в 5 раз с использованием центробежных концентраторов Centriprep®-10 (Amicon, Беверли, Миннесота) и вносят в колонку с супердексом®
200 (Pharmacia, Упсала, Швеция; объем колонки 189 мл, 1,6 х 94 см). Колонку уравновешивают и элюируют буфером с 25 мМ фосфата натрия, pH 6,0, содержащим 150 мМ NaCl. Хроматографию осуществляют на
системе FPLC® (Pharmacia, Упсала, Швеция) при комнатной температуре с использованием подключенного регистратора УФ (280 нм) для отслеживания элюирования белка. Объем образца,
вносимого в колонку, составляет ≤ 2 мл, скорость потока составляет 0,5 мл/мин, и объем фракции составляет 2 мл. Осуществляют много прогонов через колонку; фракции анализируют на активность
α-гал А и объединяют фракции с заметной активностью.
Объединенные фракции из колонки с супердексом® 200 = концентрируют с использованием установок Centriprep-10, делят на аликвоты, быстро замораживают и хранят при -80oC непродолжительное время. Результаты этого примера очистки α-гал А приводятся в табл. 4. Конечный выход α-гал А составляет 59% от активности исходного материала, а удельная активность очищенного продукта составляет 2,92 х 106 единиц на мг белка. Получающийся в результате продукт показывает высокую степень чистоты после электрофореза в условиях восстановления в 4-15% ДСН-полиакриламидном геле, который по существу не окрашивается серебряным красителем.
Пример
III. Составление композиций и хранение очищенной α-гал А
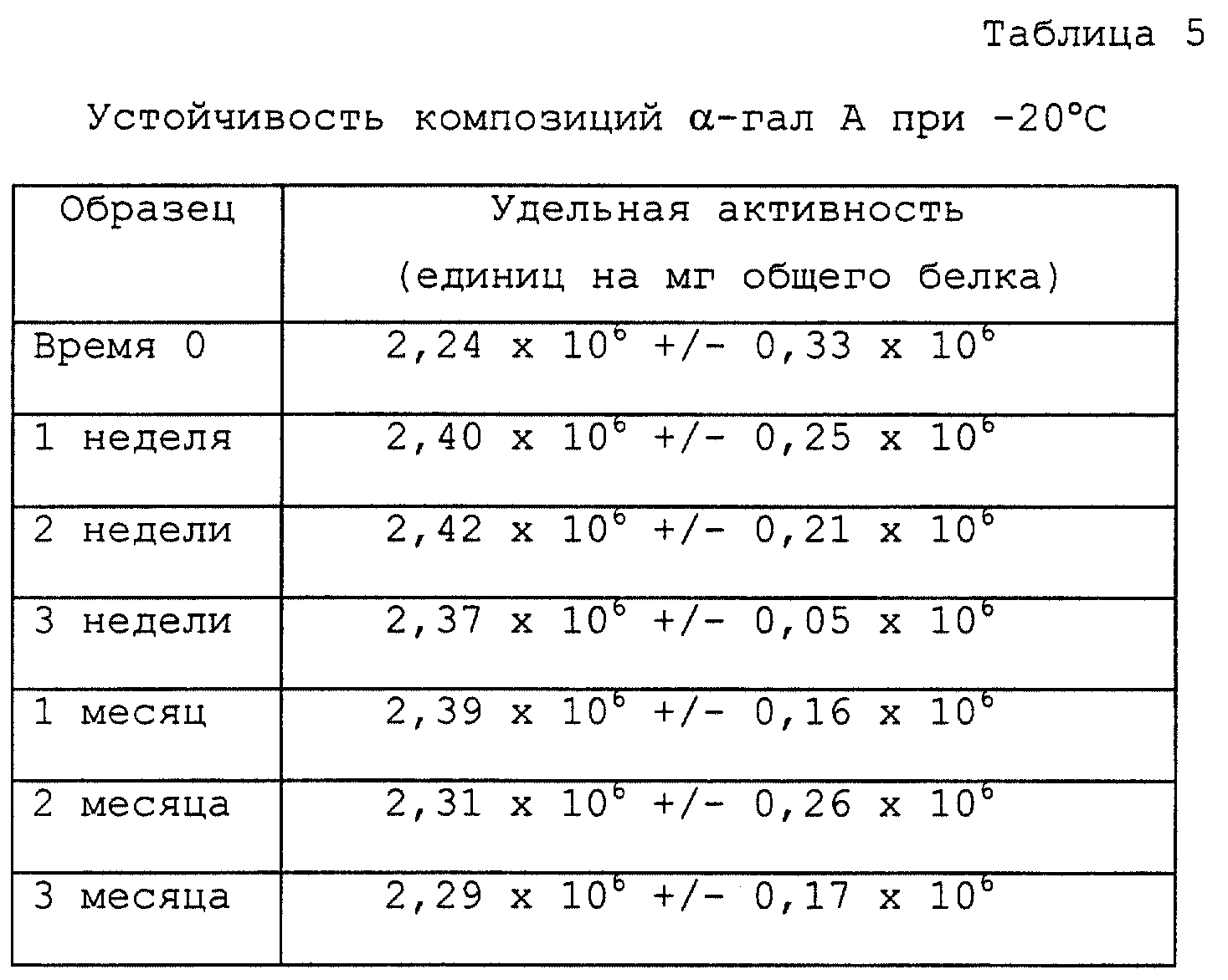
Высокочистая α-гал А неустойчива при длительном хранении в виде разбавленных растворов очищенного белка (≤ 1 мг
белка на мл). Поэтому разрабатывают композицию, улучшающую устойчивость при длительном хранении, т.е. хранении, длящемся от нескольких недель до, по меньшей мере, нескольких месяцев. Очищенный фермент
концентрируют по меньшей мере до уровня 1 мг/мл с использованием центробежного концентратора (в буфере для фермента, состоящем из 25 мМ фосфата натрия (pH 6,0) и 150 мМ NaCI). Добавляют сывороточный
альбумин человека (HSA; Buminate®, Baxter-Hyland) до конечной концентрации 2,5 мг/мл. Затем раствор белка стерилизуют фильтрацией с использованием 0,2-мкм ацетатцеллюлозного фильтра
(Schleicher and Schuell), установленного в шприце. Раствор α-гал А помещают в стерильные апирогенные стеклянные флаконы, плотно закрывают тефлоновыми пробками, быстро замораживают и хранят при
-20oC.
Устойчивость активного состояния α-гал А оценивают на протяжении 3 месяцев с применением анализа с 4-MUF-gal. Данные, приведенные в табл. 5, показывают, что за время испытаний не происходит потери активности фермента. Кислотный pH композиции (< 6,5) является критическим показателем для устойчивости фермента высокой степени чистоты.
Пример IV. Продуцированная штаммами человеческих клеток α-гал А, пригодная для лечения дефицита α-гал А
Исследуют структурные и функциональные свойства очищенной человеческой
α-гал А, полученной по изобретению, чтобы показать, что описанные здесь молекулы ДНК и соответствующие экспрессированные гликопротеины, продуцированные штаммами трансфектированных человеческих
клеток, можно использовать при генной или ферментно-заместительной терапии соответственно.
А. Размер молекулы α-гал А, продуцированной устойчиво трансфектированными
человеческими клетками в культуре
Молекулярную массу α-гал А оценивают с помощью масс-спектрометра MALDI-TOF. Полученные результаты показывают, что молекулярная масса димера составляет
102353 Д, в то время как молекулярная масса мономера составляет 51002Д. Ожидаемая на основании аминокислотного состава молекулярная масса мономера составляет 45400 Д.
Следовательно, можно заключить, что углеводные компоненты фермента увеличивают его молекулярную массу на 5600 Д.
Результаты стандартного анализа аминокислот, выполненного с очищенным белком, согласуются с выводом, что белок, продуцированный человеческими клетками, по аминокислотному составу идентичен белку, выделенному в чистом виде из тканей человека.
Б. N-Терминальный
процессинг α-гал А, продуцированной устойчиво трансфектированными человеческими клетками
Нуклеотидная последовательность кДНК человеческой α-гал А кодирует 429 аминокислот. 31
N-концевая аминокислота составляет сигнальную пептидную последовательность, которая отщепляется, когда образующийся белок проходит мембрану эндоплазматического ретикулума (LeDonne et al. Arch.
Biochem. Biophys. , 224: 186, 1983; Lemansky et al., J. Biol. Chem., 262:2062, 1987). Чтобы подтвердить, что α-гал А процессируется должным образом, когда связана с гетерологичной сигнальной
пептидной последовательностью (например, сигнальной последовательностью гормона роста человека), и экспрессируется в трансфектированных фибробластах человека, микросеквенируют 10 N-концевых
аминокислот секретируемого белка. Образцы подвергают электрофорезу методом SDS-PAGE и переносят на ProBlott® (ABI, Фостер-Сити, Калифорния) с использованием буферной системы с 10 мМ
CAPS (pH 11,0) и 10% метанола. Белок на ProBlott® визуализируют посредством окрашивания кумасси и вырезают полосы с соответствующим размером молекул (50 кД). N-Концевую
последовательность получают с использованием импульсного жидкостного анализатора аминокислот Applied Biosystems, который осуществляет автоматическое расщепление по Эдману. Полученная N-концевая
последовательность LDNGLARTRT (ПОСЛЕД. N 28) соответствует точному отщеплению сигнального пептида и точно соответствует N-концевой последовательности, предсказанной для секретируемого белка.
В. C-Концевая аминокислота α-гал А, продуцированной устойчиво трансфектированными человеческими клетками
Остаток C-концевой аминокислоты секретируемой α--гал А,
полученной по изобретению, идентифицируют с использованием автоматизированного анализатора C- окончаний Hewlett Packard. Результаты показывают в C-конце остаток лейцина, что соответствует C-концевой
аминокислоте, предсказанной ДНК-последовательностью.
Г. Вызванная углеводами модификация α-гал А, продуцированной устойчиво трансфектированными человеческими клетками
Оценивают также картину гликозилирования α-гал А, полученной
по изобретению. Правильное гликозилирование является важным для оптимальной активности α-гал A in vivo; α-гал
А, экспрессированная в негликозилирующих системах, неактивна или неустойчива (Hantzopolous et al. Gene, 57: 159, 1987). Гликозилирование также важно для поглощения α-гал А в нужных
клетках-мишенях и влияет на время полужизни фермента в кровотоке in vivo. В каждом звене α-гал А имеется 4 участка, доступных для присоединения аспарогинсвязанных углеводных цепей, из которых
занимаются только три (Desnick et al. , в "The Metabolic and Molecular Bases of Inherited Disease", pp. 2741-2780, McGraw Hill, New York, 1995).
Образец α-гал А, продуцированной устойчиво трансфектированными клетками, для удаления сиаловой кислоты обрабатывают нейраминидазой, которую выделяют из A. urafaciens (Boehringer-Mannheim, Индианаполис, Индиана). Эту реакцию осуществляют посредством обработки в течение ночи при комнатной температуре 5 мкг α-гал А нейраминидазы в 10 мкл (общий объем) забуференного ацетатом физиологического раствора (ЗАР, 20 мМ ацетата натрия, pH 5,2, 150 мМ NaCI).
Очищенную α-гал А, продуцированную устойчиво трансфектированными клетками, также дефосфорилируют с использованием щелочной фосфатазы (щелочная фосфатаза из кишечника теленка, Boehringer-Mannheim, Индианаполис, Индиана) посредством обработки в течение ночи при комнатной температуре 5 мкг α-гал А 15 E щелочной фосфатазы в ЗАР (рН поднимают до 7,5 с помощью 1 М трис).
Образцы анализируют посредством Вестерн-блоттинга со специфическим антителом против α-гал А. Используемое антитело представляет кроличье поликлональное антипептидное антитело, полученное с использованием в качестве иммуногена пептида, представляющего аминокислоты 68-81 α-гал А. После переноса белка на мембрану из поливинилиденфторида (PVDF, Millipore, Бедфорд, Миннесота) мембрану зондируют разведенной 1:2000 антисывороткой в 2,5% блотто (обезжиренное сухое молоко в 20 мМ трис-HCl, pH 7,5, 0,05% твина-20). После этого следует детекция с козьим антикроличьим lgG, конъюгированным с пероксидазой хрена (Organon Teknika/Cappel, Дарем, Северная Каролина; разведение 1: 5000) и реагентами из набора для хемилюминесценции ECL (Amersham, Арлингтонские Высоты, Индиана).
Обработка α-гал А нейраминидазой приводит к небольшому сдвигу молекулярной массы (приблизительно 1500-2000 Д или 4-6 сиаловых кислот на мономер), что позволяет сделать предположение о существовании удлиненной сиаловой кислотой модификации α-гал А. Для справки, α-гал А плазмы содержит 5-6 остатков сиаловой кислоты на мономер, а плацентарная форма содержит 0,5-1,0 остаток сиаловой кислоты на мономер (Bishop et al., J. Biol. Chem., 256:1307, 1981).
Другим способом, применяемым для исследования модификаций α-гал А с сиаловой кислотой и маннозо-6-фосфатом, является изоэлектрофокусирование (IEF), когда образцы разделяют, основываясь на их изоэлектрической точке (pI) или суммарном заряде. Таким образом, можно ожидать, что удаление из α-гал А заряженных остатков, таких как сиаловая кислота или фосфат, изменит мобильность белка в системе IEF.
Чтобы осуществить эксперименты по IEF, образцы α-гал А, полученной по изобретению, обрабатывают нейраминидазой и щелочной фосфатазой, смешанными в соотношении 1: 1 с 2X буфером Novex для образцов (с 8 М мочевины, pH 3,0-7,0), и загружают в гель для IEF с 6М мочевины (5,5% полиакриламида), полученным с использованием фармалита® (Pharmacia, Упсала, Швеция; pH 3,0-6,5; ( фармалит® 4-6,5 и 2,5-5,5, 0,25 мл каждого на гель). Включают также стандарты изоэлектрических точек (Bio-Rad). После электрофореза гель переносят на PVDF и осуществляют Вестерн-блоттинг, как описано выше.
Продуцированная устойчиво трансфектированными фибробластами человека α-гал А состоит из трех основных изоформ с интервалом pI приблизительно 4,4-4,65. Эти величины подобны значениям pI форм α-гал А в плазме и селезенке (Bishop et al., J. Biol. Chem., 256:1307, 1981). Обработка фермента нейраминидазой увеличивает pI всех трех изоформ, что указывает, что все они до некоторой степени модифицированы сиаловой кислотой. Эти данные наводят на мысль, что α-гал А, продуцированная устойчиво трансфектированными фибробластами человека, должна иметь желаемое время полужизни в плазме, что показывает, что этот материал будет подходить для фармакологического применения. Кроме того, обработка щелочной фосфатазой α-гал А, обработанной нейраминидазой, еще увеличивает pI части белка приблизительно до 5,0-5,1, что указывает, что фермент содержит один или несколько маннозо-6-фосфатных остатков. Такая модификация важна тем, что она требуется для эффективного поглощения α-гал А клетками-мишенями.
Д. Удельная активность α-гал А, выделенной в чистом виде из устойчиво трансфектированных
фибробластов
Потенциальную возможность или удельную активность очищенной α-гал А вычисляют с помощью измерений как каталитической активности фермента (анализ с 4-MUF-gal), так и
концентрации белка. Концентрацию белка можно определить любым стандартным способом, таким как способ с системой ВСА (Pierce), или посредством измерения поглощения при 280 нм и использования
коэффициента экстинкции, мг/мл, 2,3 (определенного из анализа аминокислот) для вычисления этой величины. При использовании таких методов удельная активность α-гал А, очищенной от
кондиционированной среды трансфектированных фибробластов человека, составляет 2,2-2,9 х 106 единиц на мг белка, что сравнимо с удельной активностью α-гал А, которую очищают от тканей
человека (Bishop et al., J. Biol. Chem., 256:1301, 1981).
E. Поглощение α-гал А, опосредованное маннозой и маннозо-6-фосфатом
Чтобы α-гал А, продуцированная
устойчиво трансфектированными фибробластами человека, стала эффективным лечебным средством в случае дефицита α-гал А, фермент должен поглощаться пораженными клетками. При физиологических
значениях pH α-гал А неактивна и нет возможности для нее быть эффективной в крови или межклеточных жидкостях. Она оптимально метаболизирует аккумулированные липидные субстраты только тогда,
когда интернализована в кислой окружающей среде лизосомы. Такое поглощение опосредуется путем связывания α-гал А с маннозо-6-фосфатными рецепторами, экспрессированными на поверхности клетки, и
доставки фермента к лизосоме эндоцитическим путем. Рецептор для М6Р экспрессируется повсеместно; до некоторой степени его экспрессируют большинство соматических клеток. Маннозный рецептор,
специфический для доступных маннозных остатков на гликопротеинах, является менее распространенным. Последние рецепторы, как правило, обнаруживаются только на макрофагах и подобных макрофагам клетках и
предоставляют дополнительные средства для вхождения α-гал А в клетки такого типа.
Чтобы показать опосредованное М6Р поглощение α-гал А, фибробласты кожи пациента с болезнью Фабри (NIGMS, хранилище генетически мутантных клеток) культивируют в течение ночи в присутствии возрастающих концентраций очищенной α-гал А по изобретению. Некоторые из образцов содержат 5 мМ растворимого М6Р, который конкурентно ингибирует связывание и, в результате, поглощение, с помощью маннозо-6-фосфатного рецептора. Другие образцы содержат 30 мкг/мл маннана, который ингибирует связывание и, в результате, поглощение, с помощью маннозного рецептора. После инкубации клетки промывают и харвестируют путем соскоба в буфер для лизиса (10 мМ трис, pH 7,2, 100 мМ NaCl, 5 мМ ЭДТК, 2 мМ пефаблокаTM (Boehringer-Mannheim, Индианаполис, Индиана) и 1% NP-40). Лизированные образцы затем анализируют на содержание белка и активность α-гал А. Результаты выражают в единицах активности α-гал А на мг клеточного белка. Клетки Фабри поглощают α-гал А в зависимости от дозы (фиг. 7). Такое поглощение может ингибироваться маннозо-6-фосфатом, но не ингибируется маннаном. Следовательно, поглощение α-гал А в фибробластах Фабри опосредуется маннозо-6-фосфатным рецептором, но не маннозным рецептором.
Также α-гал А поглощается in vitro эндотелиальными клетками - важными клетками-мишенями при лечении болезни Фабри. Эндотелиальные клетки пупочной вены человека (HUVEC) культивируют в течение ночи с 7500 единицами α-гал А; некоторые из лунок содержат М6Р. По завершении периода инкубации клетки харвестируют и анализируют на α-гал А, как описано выше. Клетки, инкубированные только с α-гал А, содержат фермента почти в 10 раз больше, чем контрольные клетки (без инкубации с α-гал А). М6Р ингибирует внутриклеточное накопление α-гал А, что наводит на мысль, что поглощение α -гал A HUVEC опосредуется М6Р-рецептором. Таким образом, человеческая α-гал А по изобретению поглощается клинически важными клетками.
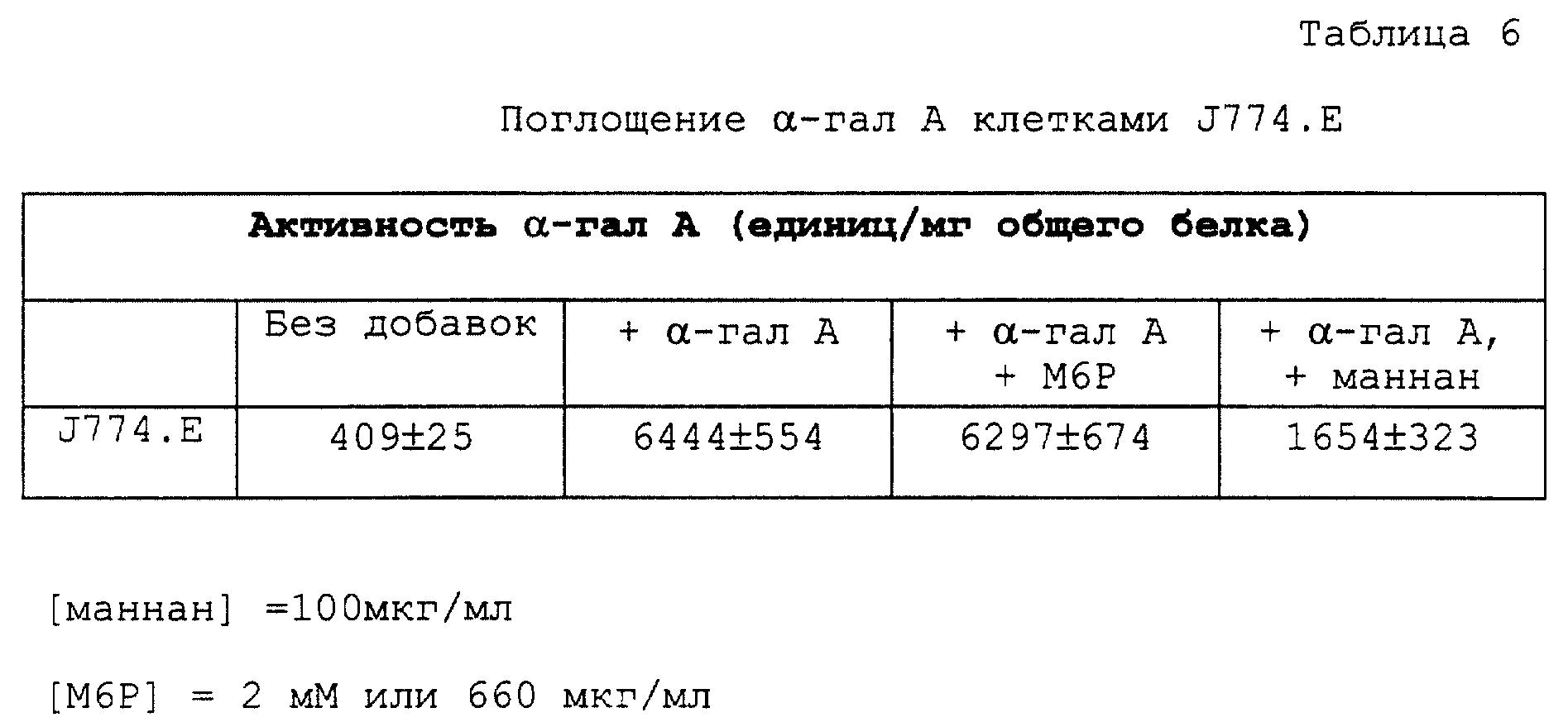
Известно, что немногие культивированные линии человеческих клеток экспрессируют маннозный рецептор. Однако линия подобных макрофагам мышиных клеток (J774.E), которая несет маннозные рецепторы, но немного, если (есть) сколько-нибудь маннозно-6-фосфатных рецепторов, может быть использована для определения того, поглощается ли очищенная α-гал А по изобретению с помощью маннозного рецептора (Diment et al., J. Leukocyte Biol., 42:485-490, 1987). Клетки J774.E культивируют в течение ночи в присутствии 10000 единиц α-гал А на мл. Отобранные образцы также содержат 2 мМ М6Р, а другие содержат 100 мкг/мл маннана. Клетки промывают и харвестируют, как описано выше, и определяют общее содержание белка и активность α-гал А каждого образца. Результаты приводятся в табл. 6. М6Р не ингибирует поглощение α-гал А этими клетками, в то время как маннан снижает уровень накопленной α-гал A на 75%. Таким образом, α-гал А по изобретению может поглощаться при помощи маннозного рецептора в клеточных типах, экспрессирующих этот особый рецептор клеточной поверхности.
Эти эксперименты показывают, что α-гал А, продуцированная устойчиво трансфектированными человеческими клетками, может поглощаться клетками при помощи маннозного или маннозо-6-фосфатного рецептора.
Ж. Коррекция фибробластов Фабри с помощью фибробластов человека, экспрессирующих α-/ гал
А
В случае генной терапии имплантат аутологичных клеток, продуцирующих α-гaл А, должен продуцировать фермент в форме, соответствующим образом модифицированной для "исправления"
дефицита α-гал А в клетках-мишенях. Чтобы оценить действие продуцирования трансфектированными фибробластами человека α-гал А на клетки Фабри, собранные от пациентов с болезнью Фабри
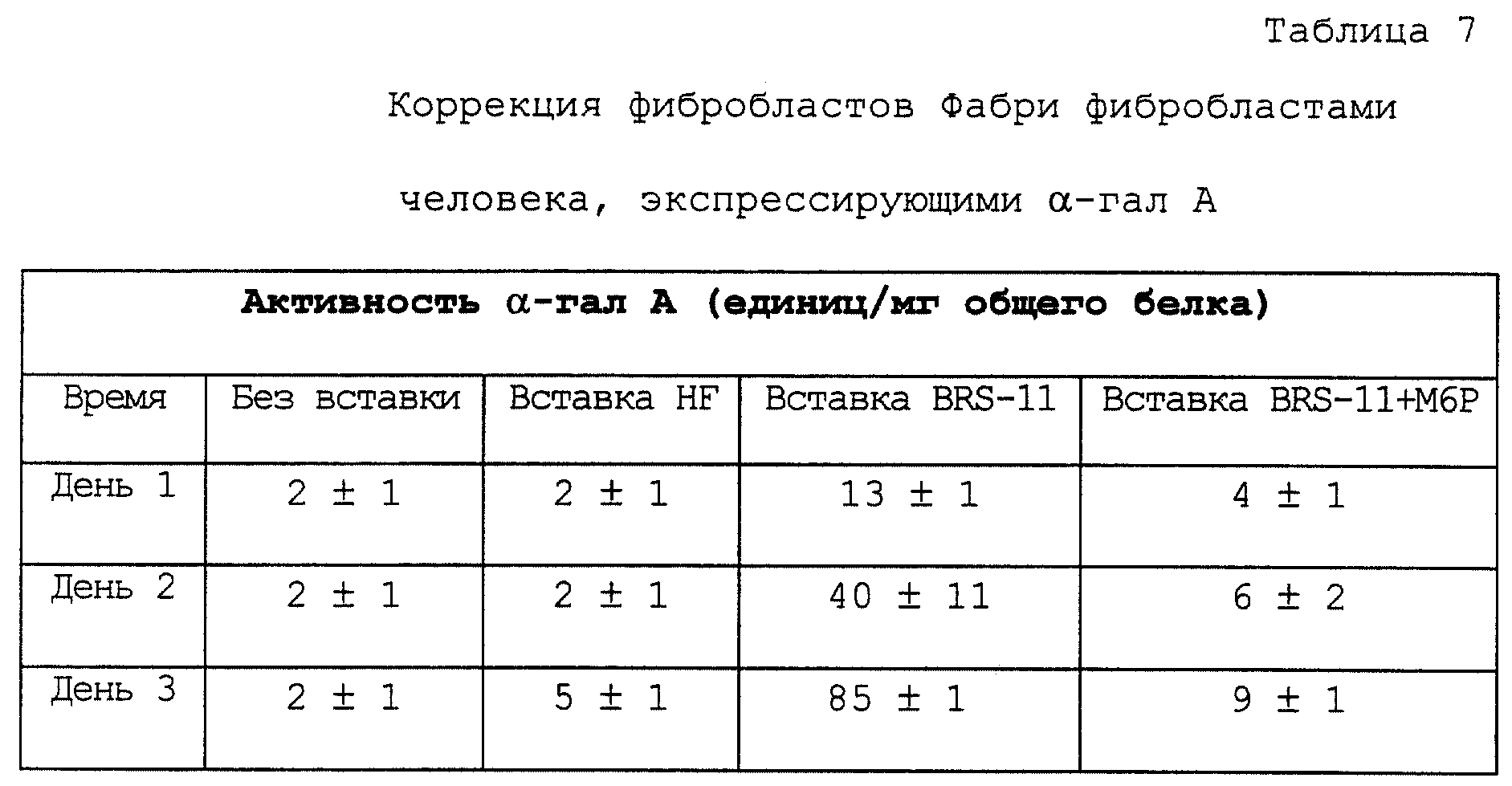
фибробласты (NIGMS, хранилище генетически мутантных человеческих клеток) сокультивируют с продуцирующим α-гал А клеточным штаммом (BRS-11) на Transwells® (Costar, Кемридж,
Минессота). Схема эксперимента приводится на фиг. 8. Клетки Фабри культивируют в 12-луночных планшетах для культивирования тканей, некоторые из которых содержат вставки (Transwels®
размер пор 0,4 мкм) с поверхностью, на которой могут расти клетки. Матрица вставки для роста пористая и позволяет макромолекулам проникать с верхней части в нижележащую среду. Одна группа вставок
содержит фибробласты крайней плоти здорового человека (HF), которые секретируют α-гал А на минимальном уровне, в то время как другая группа содержит штамм устойчиво трансфектированных
фибробластов человека BRS-11, который секретирует большое количество α-гал А. В лунках с сокультивируемыми продуцирующими α-гал А клетками α-гал А может поступать в среду,
омывающую клетки Фабри, и, возможно, поглощаться клетками Фабри.
Данные, приведенные в табл. 7, показывают, что клетки Фабри поглощают секретируемую α-гал А. Внутриклеточное содержание α-гал А контролируют в течение трех суток. Клетки, выращенные одни (без вставки) или в присутствии нетрансфектированных фибробластов крайней плоти (вставка HF), имеют очень низкие внутриклеточные уровни активности α-гал А. Клетки Фабри, культивированные с продуцирующими α-гал А клетками (вставка BRS-11), однако, к концу 2 суток показывают содержание фермента, подобное его количеству в здоровых клетках (нормальные фибробласты содержат 25-80 единиц α-гал А на мг белка). То что эту коррекцию можно приписать α-гал А, поглощенной при посредничестве М6Р-рецептора, демонстрируется ее ингибированием маннозо-6-фосфатом (вставка BRS-11 + М6Р).
3. Полезность других типов клеток
В описанном здесь способе можно
применять другие типы клеток. Клетки можно получить из многих тканей, и к ним могут относиться все типы клеток, которые можно поддерживать в культуре. Например, к первичным и вторичным клеткам,
которые можно трансфектировать по способу настоящего изобретения, относятся фибробласты человека, кератиноциты, эпителиальные клетки (например, эпителиальные клетки молочной железы или кишечника),
эндотелиальные клетки, глиальные клетки, невральные клетки, форменные элементы крови (например, лимфоциты и клетки костного мозга), мышечные клетки и предшественники этих типов соматических клеток.
Особый интерес представляют фибробласты. Первичные клетки получают, предпочтительно, от индивидуума, которому должны быть введены трансфектированные первичные и вторичные клетки, так что они не будут
отторгаться иммунной системой пациента. Однако, если уделить должное внимание предотвращению или подавлению отторжения иммунной системой (как описано ниже), можно также использовать клетки другого
донора, а не только пациента. В таком случае будет позволительно использовать клетки из стандартизированной, установленной, устойчиво трансфектированной клеточной линии для всех пациентов.
И. Введение клеток, экспрессирующих α-гал А
Описанные выше клетки можно вводить индивидууму посредством различных стандартных способов введения, так что они будут находиться,
например, в ренальной субкапсуле, подкожном пространстве, центральной нервной системе, подоболочечном пространстве, печени, брюшной полости или внутри мышцы. Клетки также можно инъецировать
внутривенно или интраартериально с тем, чтобы циркулировали в кровотоке индивидуума. Однажды имплантированные индивидууму трансфектированные клетки будут продуцировать и секретировать лечебный продукт
гликозилированную человеческую α-гал.
Число генетически модифицированных клеток, которые будут вводится индивидууму, будет изменяться, но его могут определить специалисты в этой области техники. Возраст, масса, пол и общее физическое состояние каждого пациента, а также объем распределения, время полужизни и биологическая доступность фермента и продуктивность генетически модифицированных клеток in vivo будут рассматриваться в первую очередь при определении дозы и способа введения. Как правило, будут применяться от одного миллиона до одного биллиона клеток при уровне экспресии в интервале 100-100000 единиц на 106 клеток в сутки. При необходимости, процедуру можно повторять или изменять до получения нужного результата, например до достижения освобождения от симптомов болезни Фабри.
Как описано выше, используемые клетки обычно будут специфичными для пациента, т. е, полученными от индивидуума, которому должны вводиться трансфектированные первичные или вторичные клетки, так что они будут отторгаться иммунной системой пациента. Однако, если такой сценарий невозможен или нежелателен, клетки, генетически модифицированные так, как описано здесь, можно получить от другого индивидуума и имплантировать пациенту, страдающему от дефицита α-гал А.
Применение клеток от другого индивидуума, не являющегося реципиентом,
может потребовать введения иммунодепрессанта, изменения антигенов гистосовместимости или применения барьерного устройства для предотвращения отторжения имплантированных клеток. Барьерное устройство
следует изготовлять из материала (например, мембраны, такой как ХМ-50 от Amicon, Беверли, Миннесота), который позволяет секретируемому
продукту проходить в кровоток или ткани пациента, но
предотвращает контакт между имплантированными клетками и иммунной системой пациента, и таким образом предотвращает иммунную реакцию (и возможное отторжение) пациента на клетки. Для дополнительного
руководства относительно генной терапии см. Selden et al. (WO 93/09222).
С другой стороны, клетки можно внедрить в матрицу или гель, такие как описаны в патентной заявке США, per. N 08/548/002, совладельцами которой являются заявители, где описывается применение гибридноматричных имплантатов, или в заявке на патент Jain et al. (заявка PCT WO 95/19430), в которой описывается макроинкапсулирование секреторных клеток в гидрофильный гель (работы, включенные в настоящее в качестве ссылок).
К. Фармацевтическая композиция для обычного введения белка α
-гал А
Белок α-гал А, который экспрессируется и секретируется устойчиво трансфектированными (или генетически модифицированными иным способом) человеческими клетками и очищается так,
как здесь описано, можно вводить индивидуумам, у которых белок α- гал А продуцируется недостаточно или с нарушениями. Белок можно вводить в фармацевтически приемлемом носителе при pH ниже 6,5,
например, в композиции, какая описана в примере III. Примерами эксципиентов, которые можно включать в композицию, являются буферные системы, такие как цитратный буфер, фосфатный буфер, ацетатный буфер
и бикарбонатный буфер, аминокислоты, мочевина, спирты, аскорбиновая кислота, фосфолипиды, белки, такие как сывороточный альбумин и желатин, ЭДТК, хлорид натрия, липосомы, поливинилпирролидон, маннит,
сорбит, глицерин, пропиленгликоль и полиэтиленгликоль (например, ПЭГ-4000, ПЭГ-6000). Способ введения может представлять, например, внутривенное, интраартериальное, подкожное, интраперитонеальное,
интрацеребральное, внутримышечное, внутрилегочное введение или введение через слизистую оболочку. Способ введения и количество отпускаемого белка будет определяться факторами, которые в состоянии
определить специалист. Кроме того, специалистам известно, что способ введения и дозировка лечебного белка могут изменяться для данного пациента, пока не получится лечебный уровень дозировки. Как
правило, следует вводить дозы α-гал А в 0,01-100 мг на кг массы тела. Ожидается, что в продолжение жизни пациента будут необходимы регулярно повторяемые дозы.
Л. Лечение других
состояний, вызванных дефицитом ферментов
Вероятно, что другие состояния, вызванные дефицитом иных, чем α-гал А, ферментов, накапливаемых в лизосомах, могут поддаваться лечению методами,
сопоставимыми с описанными здесь. В таких случаях ДНК, которая кодирует функциональную форму недостающего фермента, следует заменить на ДНК, кодирующую α- гал А в описанных здесь
экспрессирующих конструкциях. Примеры синдромов нехватки ферментов, которые идентифицированы и которые могут поддаваться лечению, описанному здесь, даны в табл. 8. Сведения, приведенные в этой таблице,
взяты из работы Е. Neufeld (Ann. Rev. Biochem., 60:257-280, 1991), включенной в настоящее в качестве ссылки.
V. Другие варианты воплощения изобретения
Описанное здесь
изобретение пояснено примерами в части способов лечения, при которых используются клетки, экспрессирующие определенный генный продукт после трансфекции, т.е., после введения конструкции, кодирующей
генный продукт и содержащей регуляторные элементы, которые регулируют экспрессию этой кодирующей последовательности. Эти способы также можно осуществить с использованием клеток, которые генетически
модифицированы посредством иных процедур, в том числе направленным переносом генов и активацией генов (см. Treco et al., WO 95/31560, включена в настоящее в качестве ссылки; см, также Selden et al.,
WO 93/09222).
Сигнальный пептид hGH можно использовать с иными, чем α- гал А, гетерологичными белками для повышения уровня экспрессии и секреции гетерологичного белка. Примерами таких белков являются α- 1-антитрипсин, антитромбин Ш, аполипопротеин E, аполипопротеин А-1, факторы свертывания крови V, VII, VIII, IX, X и XIII, фактор роста кости 2, фактор роста кости 7, кальцитонин, каталитические антитела, ДНКаза, эритропоэтин, FSH-β, глобины, глюкагон, глюкоцереброзидаза, G-КСФ, GM-КСФ, гормоны роста, иммуномодуляторы, иммуноглобулины, инсулин, инсулинотропин, инсулиноподобные факторы роста, интерферон-β, интерферон-β- нервные факторы роста, интерлейкин-1, интерлейкин-2, интерлейкин-3, интерлейкин-4, интерлейкин-6, интерлейкин-11, интерлейкин-12, IL-2-рецептор, антагонисты. IL-1-рецептора, рецептор для липопротеина низкой плотности, М-КСФ, паратиреоидный гормон, протеинкиназа С, растворимый CD4, супероксиддисмутаза, тканевый активатор плазминогена, TGF-β, фактор некроза опухоли, TSH-β, тирозингидроксилаза и урокиназа.
Другие варианты воплощения изобретения также входят в объем приведенной далее формулы изобретения.
Список последовательностей приведен в конце текста.
Реферат
Изобретение относится к области медицины, в частности к лечению заболеваний, связанных с дефицитом α-галактозидазы А (α-гал А). Сущность изобретения составляет способ лечения пациента, имеющего дефицит α-гал А, который включает введение пациенту человеческой клетки, генетически модифицированной для сверхэкспрессии и секреции человеческой α-гал А. Изобретение включает также молекулу ДНК, кодирующую полипептиз, содержащий α-гал А, способ очистки и терапевтическую композицию. Техническим результатом является расширение арсенала средств для лечения патологии, связанной с дефицитом α-гал А. 8 c. и 4 з.п. ф-лы, 13 ил., 8 табл.

Комментарии