Способы и композиции для лечения болезни хантингтона - RU2691102C2
Код документа: RU2691102C2
Чертежи



Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка заявляет приоритет по предварительной заявке на патент США № 61/990521 поданной 8 мая 2014 г., и предварительной заявки на патент США № 62/051724, поданной 17 сентября 2014 г., содержание которых в полном объеме включено в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящая заявка относится к области диагностических и терапевтических средств болезни Хантингтона.
УРОВЕНЬ ТЕХНИКИ
[0003] Болезнь Хантингтона (БХ), также известная как хорея Хантингтона, представляет собой прогрессирующее нарушение двигательных, когнитивных и психических функций. Средний возраст начала данного заболевания составляет 35-44 лет, хотя приблизительно в 10% случаев начало приходится на возраст до 21 года, а средняя продолжительность жизни после диагностирования заболевания составляет 15-18 лет. Уровень распространенности составляет около 3-7 случаев на 100000 человек среди населения Западной Европы.
[0004] Болезнь Хантингтона является примером нарушений, связанных с экспансией тринуклеотидных повторов, описанной в ранние 1990-е (см. Di Prospero and Fischbeck (2005) Nature Reviews Genetics 6:756-765). Эти нарушения включают локализованную экспансию нестабильных повторов групп из трех нуклеотидов и могут приводить к потере функциональности гена, в котором находится экспандированный повтор, приобретению токсической функции или к обоим последствиям сразу. Тринуклеотидные повторы могут быть расположены в любой части гена, включая некодирующие и кодирующие области гена. Повторы, расположенные в пределах кодирующей области, как правило, включают повторяемый кодирующий глутамин триплет (CAG) или кодирующий аланин триплет (CGA). Экспандированные повторяющиеся области в пределах некодирующих последовательностей могут приводить к аберрантной экспрессии гена, в то время как экспандированные повторы в пределах кодирующих областей (также известные как нарушения реитерации кодонов) могут вызывать неправильную укладку и агрегацию белка. Точная причина патофизиологии, связанной с аберрантными белками, зачастую неизвестна. Как правило, в генах дикого типа, в которых наблюдается тринуклеотидная экспансия, эти области содержат варьирующееся число повторяемых последовательностей в нормальной популяции, но в пораженных популяциях число повторов может увеличиваться от удвоения до логарифмического роста числа повторов. При БХ повторы находятся в N-концевой кодирующей области крупного цитозольного белка хантингтина (Htt). Нормальные аллели Htt содержат 15-20 повторов CAG, в то время как аллели, содержащие 35 или более повторов, могут считаться аллелями, потенциально вызывающими БХ и связанными с риском развития болезни. Аллели, содержащие 36-39 повторов, считаются не полностью проявляющимися, а у людей, несущих такие аллели, может развиться, а может не развиться болезнь (или симптомы могут развиться позже), в то время как аллели, содержащие 40 или более повторов, считаются полностью проявляющимися. В действительности, не было фактов, чтобы среди людей, имеющих аллели БХ с таким количеством повторов, были бессимптомные. Часто обнаруживается, что у людей с ювенильным началом БХ (в возрасте <21 лет) количество CAG повторов составляет 60 и более. Кроме увеличения числа CAG повторов также было обнаружено, что в БХ могут быть вовлечены +1 и +2 сдвига рамки в пределах повторяемых последовательностей, приводящие к тому, что данная область будет кодировать полисериновый полипептидный (кодируемый AGC повторами в случае +1 сдвига рамки) фрагмент, а не полиглутаминовый (Davies and Rubinsztein (2006) Journal of Medical Genetics 43: 893-896).
[0005] При БХ аллель мутантного Htt обычно наследуется от одного из родителей как доминантный признак. Любой ребенок, рожденный от пациента с БХ, имеет 50% шанс развития болезни, если у второго из родителей не наблюдается этого нарушения. В некоторых случаях один из родителей может иметь промежуточный аллель БХ и быть бессимптомным, в то время как вследствие экспансии повторов у ребенка проявляется болезнь. Кроме того, для аллеля БХ также может проявляться явление, известное как антиципация, когда у нескольких поколений наблюдается возрастание степени тяжести или уменьшение возраста начала заболевания вследствие нестабильной природы области повторов во время сперматогенеза.
[0006] Кроме того, тринуклеотидная экспансия в Htt приводит к нейрональным потерям среди средних проекционных шипиковых нейронов, чувствительных к гамма-аминомасляной кислоте (ГАМК), в стриатуме, при этом нейрональные потери также происходят в неокортексе. Средние шипиковые нейроны, которые содержат энкефалин и которые проецируют во внешний бледный шар, вовлечены больше, чем нейроны, которые содержат субстанцию Р и проецируют во внутренний бледный шар. Другие участки мозга, сильно поражаемые у людей с болезнью Хантингтона, включают черное вещество, кортикальные слои 3, 5 и 6, область гиппокама CA1, угловую извилину в теменной доле, клетки Пуркинье мозжечка, латеральные серобугорные ядра гипоталамуса и срединный центр и парафасцикулярный комплекс таламуса (Walker (2007) Lancet 369:218-228).
[0007] Роль нормального белка Htt известна плохо, но он может быть вовлечен в нейрогенез, апоптотическую гибель клеток и миграцию везикул. Кроме того, есть свидетельства, что Htt дикого типа стимулирует выработку нейротрофического фактора головного мозга (BDNF), профактора выживания для стриарных нейронов. Было показано, что в мышиных моделях БХ прогрессирование БХ коррелирует с уменьшением экспрессии BDNF (Zuccato et al (2005) Pharmacological Research 52(2): 133-139), а доставка BDNF или нейротрофического фактора линии глиальных клеток (GDNF) путем генной доставки, опосредованной вектором на основе аденоассоциированного вируса (AAV), может защищать стриарные нейроны в мышиных моделях БХ (Kells et al, (2004) Molecular Therapy 9(5): 682-688).
[0008] В настоящий момент диагностирование и варианты лечения БХ очень ограничены. В контексте диагностики уровни измененного (мутантного) Htt (mHTT) сильно связаны с показателем тяжести заболевания, а концентрация растворимых видов mHTT возрастает с прогрессированием заболевания. Однако малораспространенный mHTT трудно количественно оценить в ЦНС пациентов, что ограничивает изучение роли нейропатобиологии при БХ in vivo и препятствует демонстрации поражения мишени лекарственными препаратами, понижающими уровень HTT. См., например, Wild et al. (2014) J Neurol Neurosurg Psychiatry 85:e4.
[0009] В контексте лечения некоторые эффективные методологии, разработанные, чтобы предотвратить токсичность, связанную с агрегацией белка, которая возникает вследствие удлинения полиглутаминового тракта, такую как сверхэкспрессия шаперонинов или индукция ответа теплового шока соединением гелданамицином, продемонстрировали уменьшение такой токсичности в in vitro моделях. Другие виды лечения нацелены на роль апоптоза в клинических проявлениях заболевания. Например, было продемонстрировано замедление симптомов заболевания посредством блокирования активности каспазы в животных моделях у потомков пар мышей, в которых один из родителей содержат аллель БХ, а второй из родителей имел доминантный негативный аллель в отношении каспазы 1. Кроме того, расщепление каспазой мутантного Htt БХ может играть роль в патогенности заболевания. Было обнаружено, что у трансгенных мышей, несущих устойчивый к каспазе-6 мутантный Htt, сохраняется нормальная нейрональная функция и не развивается стриарная нейродегенерация по сравнению с мышами, несущими не устойчивый к каспазе мутантный аллель Htt (см. Graham et al (2006) Cell 125: 1179-1191). Также было показано, что молекулы, нацеленные на участников апоптотического пути, оказывают замедляющее действие на симптомологию. Например, было показано, что соединения zVAD-fmk и миноциклин, которые оба ингибируют активность каспазы, замедляют проявление заболевания у мышей. Лекарственный препарат ремацемид также применяли в небольших клинических исследованиях БХ на людях, чтобы предотвратить токсическое воздействие на нервные клетки, так как считалось, что это соединение предотвращает связывание мутантного Htt с рецептором NDMA. Однако в этих клинических исследованиях никаких статистически значимых улучшений в функции нейронов не наблюдали. Кроме того, группа по изучению болезни Хантингтона проводила рандомизированное, двойное слепое исследование с применение кофермента Q. Хотя среди пациентов, проходящих лечение коферментом Q10, наблюдали тенденцию к замедлению прогрессирования болезни, значительных изменений в уровне уменьшения общей функциональной способности не наблюдали. (Di Prospero and Fischbeck, ibid).
[0010] Рекомбинантные транскрипционные факторы, содержащие ДНК-связывающие домены из белков «цинковые пальцы» («ZFP»), TAL-эффекторные домены («TALE»), и транскрипционные факторы на основе системы CRISPR/Cas обладают способностью регулировать генную экспрессию эндогенных генов (см., например, патенты США № 8586526; 6534261; 6599692; 6503717; 6689558; 7067317; 7262054; Perez-Pinera et al. (2013) Nature Methods 10:973-976; Platek et al. (2014) Plant Biotechnology J. doi: 10.1111/pbi.12284). Клинические исследования, в которых применяли подобные сконструированные транскрипционные факторы, содержащие белки «цинковые пальцы», продемонстрировали, что эти новые транскрипционные факторы способны лечить различные патологические состояния. (См., например, Yu et al. (2006) FASEB J. 20:479-481). Кроме того, искусственные нуклеазы, содержащие ДНК-связывающие домены из белков «цинковые пальцы» («ZFP»), TAL-эффекторные домены («TALE»), Ttago и нуклеазные системы на основе CRISPR/Cas или Ttago, обладают способностью модифицировать генную экспрессию эндогенных генов путем опосредованной нуклеазами модификации гена, включая направляемую гомологией репарацию (НГР), следующую за негомологичным соединением концов (НГСК), и/или путем захвата концов во время негомологичного соединения концов (НГСК). См., например, 8623618; 8034598; 8586526; 6534261; 6599692; 6503717; 6689558; 7067317; 7262054; 7888121; 7972854; 7914796; 7951925; 8110379; 8409861; публикации патентов США 20030232410; 20050208489; 20050026157; 20060063231; 20080159996; 201000218264; 20120017290; 20110265198; 20130137104; 20130122591; 20130177983; 20130177960 и 20150056705, содержание которых в полном объеме и во всех смыслах включено в данный документ посредством ссылки. Таким образом, эти способы часто включают применение сконструированных расщепляющих систем для внесения двухцепочечного разрыва (ДЦР) или ника в целевую последовательность ДНК так, чтобы репарация разрыва путем порождающего ошибки процесса, такого как негомологичное соединение концов (НГСК), или репарация при помощи репарационной матрицы (направляемая гомологией репарация или НГР) могла приводить к выключению гена или вставке представляющей интерес последовательности (направленной интеграции). Внесение двухцепочечного разрыва в отсутствие предоставляемой извне репарационной матрицы (например, «донора» или «трансгена») обычно используется для инактивации целевого гена при помощи мутаций (инсерций и/или делеций, известных как «инделы»), вносимых посредством клеточного пути НГСК. Например, в патентной публикации США 20110082093 раскрыты специальные белки «цинковые пальцы», нацеленные на Htt, а патентная публикация США № 20130253040 относится к ДНК-связывающим белкам, которые модулируют экспрессию аллеля БХ, такого как Htt.
[0011] Однако остается потребность в способах диагностирования, изучения, лечения и/или предотвращения болезни Хантингтона, включая выявление mHTT для отслеживания прогрессирования болезни для повышения понимания нейропатобиологии БХ и для оценки модифицирующих течение БХ терапевтических средств.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0012] В данном документе раскрыты способы и композиции для диагностирования и/или лечения болезни Хантингтона. В частности, в данном документе предложены способы и композиции для выявления, уменьшения количества и/или уничтожения агрегатов Htt, уменьшения степени двигательных дефектов, повышения клеточной активности (например, активности АТФ) и/или уменьшения степени апоптоза у субъекта с БХ.
[0013] Таким образом, в одном аспекте в данном документе описан способ модификации нейрона у субъекта с БХ, включающий введение субъекту репрессора аллеля мутантного Htt так, чтобы происходила модификация нейрона. В определенных вариантах реализации изобретения нейрон представляет собой нейрон, который содержит аллель мутантного Htt и/или который содержит повышенное количество внутриклеточного агрегированного Htt (БХ-нейрон). В определенных вариантах реализации изобретения модификация включает уменьшение агрегации Htt в нейроне (например, БХ-нейроне); повышение энергетического метаболизма нейрона (например, БХ-нейрона), например, путем повышения внутриклеточных уровней АТФ; и/или уменьшение восприимчивости к апоптозу в нейроне (например, БХ-нейроне). В определенных вариантах реализации изобретения субъект является млекопитающим.
[0014] Таким образом, в других аспектах в данном документе описан способ предотвращения и/или уменьшения образования агрегатов Htt в БХ-нейронах субъекта с БХ, включающий введение субъекту репрессора аллеля мутантного Htt.
[0015] В других аспектах в данном документе описан способ повышения клеточной активности (например, АТФ-активности) в нейроне (например, БХ-нейроне), включающий введение в нейрон репрессора аллеля мутантного Htt.
[0016] В других аспектах в данном документе описан способ уменьшения апоптоза в нейроне (например, БХ-нейроне), включающий введение в нейрон репрессора аллеля мутантного Htt.
[0017] В другом аспекте в данном документе описан способ уменьшения двигательных дефектов (например, хватательных) у нуждающихся в этом субъектов с БХ, включающий введение в нейрон репрессора аллеля мутантного Htt.
[0018] В другом аспекте в данном документе описан способ выявления mHtt у субъекта (например, в ЦСЖ), включая выявление mHtt в ответ на терапию (например, в ответ на введение репрессора Htt, как описано в данном документе). В определенных вариантах реализации изобретения выявление включает оценку количества mHtt в организме субъекта. Любой из описанных в данном документе способов выявления можно применять для диагностирования БХ и/или для отслеживания прогрессирования болезни, так как уровни mHTT в значительной мере связаны с тяжестью заболевания, при этом уровни mHTT возрастают при прогрессировании заболевания. Кроме того, любой из способов выявления (например, количественная оценка) mHtt в организме субъекта можно применять для оценки нейропатобиологии БХ и/или для оценки эффективности терапевтических средств модифицирующих течение БХ.
[0019] В любом из описанных в данном документе способов репрессор аллеля мутантного Htt может представлять собой ZFP-TF, например, слитый белок, содержащий ZFP, который специфически связывается с аллелем мутантного Htt, и домен транскрипционной репрессии (например, KOX, KRAB и т.д.). В других вариантах реализации изобретения репрессор аллеля мутантного Htt может представлять собой TALE-TF, например, слитый белок, содержащий полипептид TALE, который специфически связывается с аллелем мутантного Htt, и домен транскрипционной репрессии (например, KOX, KRAB и т.д.). В некоторых вариантах реализации изобретения репрессор аллеля мутантного Htt представляет собой CRISPR/Cas-TF, в котором были инактивированы нуклеазные домены в белке Cas так, чтобы белок больше не расщеплял ДНК. Полученный в результате РНК-управляемый ДНК-связывающий домен Cas сливают с транскрипционным репрессором (например, KOX, KRAB и т.д.), чтобы репрессировать аллель мутантного Htt. В других вариантах реализации изобретения репрессор может содержать нуклеазу (например, ZFN, TALEN и/или систему CRISPR/Cas), которая репрессирует аллель мутантного Htt посредством расщепления и, следовательно, инактивации аллеля мутантного Htt. В определенных вариантах реализации изобретения нуклеаза вноси инсерцию и/или делецию («индел») посредством негомологичного соединения концов (НГСК) после расщепления нуклеазой. В других вариантах реализации изобретения нуклеаза вносит донорную последовательность (гомологичными или негомологичными способами), при этом интеграция донора инактивирует аллель мутантного Htt.
[0020] В любом из описанных в данном документе способов репрессор можно доставлять в нейрон (например, БХ-нейрон) в виде белка, полинуклеотида или любой комбинации белка и полинуклеотида. В определенных вариантах реализации изобретения репрессор(ы) доставляют при помощи экспрессионной конструкции, например, плазмиды или вирусного вектора (например, лентивирусного вектора, аденовирусного (Ад) вектора, аденоассоциированного вирусного (AAV) вектора и тому подобного). В других вариантах реализации изобретения репрессор доставляют в виде мРНК. В других вариантах реализации изобретения репрессор(ы) доставляют при помощи комбинации любых описанных в данном документе экспрессионных конструкций, например, один репрессор (или его часть) в одной экспрессионной конструкции, а один репрессор (или его часть) в другой экспрессионной конструкции.
[0021] Кроме того, в любом из описанных в данном документе способов репрессоры можно доставлять в любой концентрации (дозе), которая обеспечивает необходимый эффект. В определенных вариантах реализации изобретения репрессор доставляют при помощи лентивирусного вектора при МЗ, составляющей от 250 и 1000 (или любое промежуточное значение). В других вариантах реализации изобретения репрессор доставляют при помощи плазмидного вектора при 150-1500 нг/100000 клеток (или любом промежуточном значении).В других вариантах реализации изобретения репрессор доставляют при помощи аденоассоциированного вирусного вектора при 10000-500000 векторного генома/клетку (или любом промежуточном значении). В других вариантах реализации изобретения репрессор доставляют в виде мРНК при 150-1500 нг/100000 клеток (или любом промежуточном значении).
[0022] В любом из описанных в данном документе способов указанный способ может обеспечить около 85% или более, около 90% или более, около 92% или более или около 95% или более репрессии аллелей мутантного Htt в одном или более БХ-нейронах субъекта.
[0023] В дополнительных аспектах в описанное в данном документе изобретение включены один или более Htt-модулирующих транскрипционных факторов, таких как Htt-модулирующие транскрипционные факторы, содержащие один или более белков «цинковые пальцы» (ZFP TF), TALE (TALE-TF) и CRISPR/Cas-TF, например, ZFP-TF, TALE-TF или CRISPR/Cas-TF. В определенных вариантах реализации изобретения Htt-модулирующий транскрипционный фактор может репрессировать экспрессию аллеля мутантного Htt в одном или более БХ-нейронах субъекта. Репрессия аллеля мутантного Htt в одном или более БХ-нейронах субъекта может быть на около 85% или более, около 90% или более, около 92% или более или около 95% или более большей по сравнению с необработанными (дикого типа) нейронами субъекта. В определенных вариантах реализации изобретения Htt-модулирующий транскрипционный фактор можно применять для осуществления одного или более описанных в данном документе способов.
[0024] Также предложен набор, содержащий один или более Htt-модуляторов (например, репрессоров) и/или полинуклеотидов, содержащих компоненты и/или кодирующих Htt-модуляторы (или их компоненты), как описано в данном документе. Наборы могут дополнительно содержать клетки (например, нейроны), реагенты (например, для выявления и/или количественной оценки белка mHtt, например, в ЦСЖ) и/или инструкции по применению, включая описанные в данном документе способы.
[0025] Эти и другие аспекты станут понятны для специалиста в данной области техники в свете описания изобретения в целом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
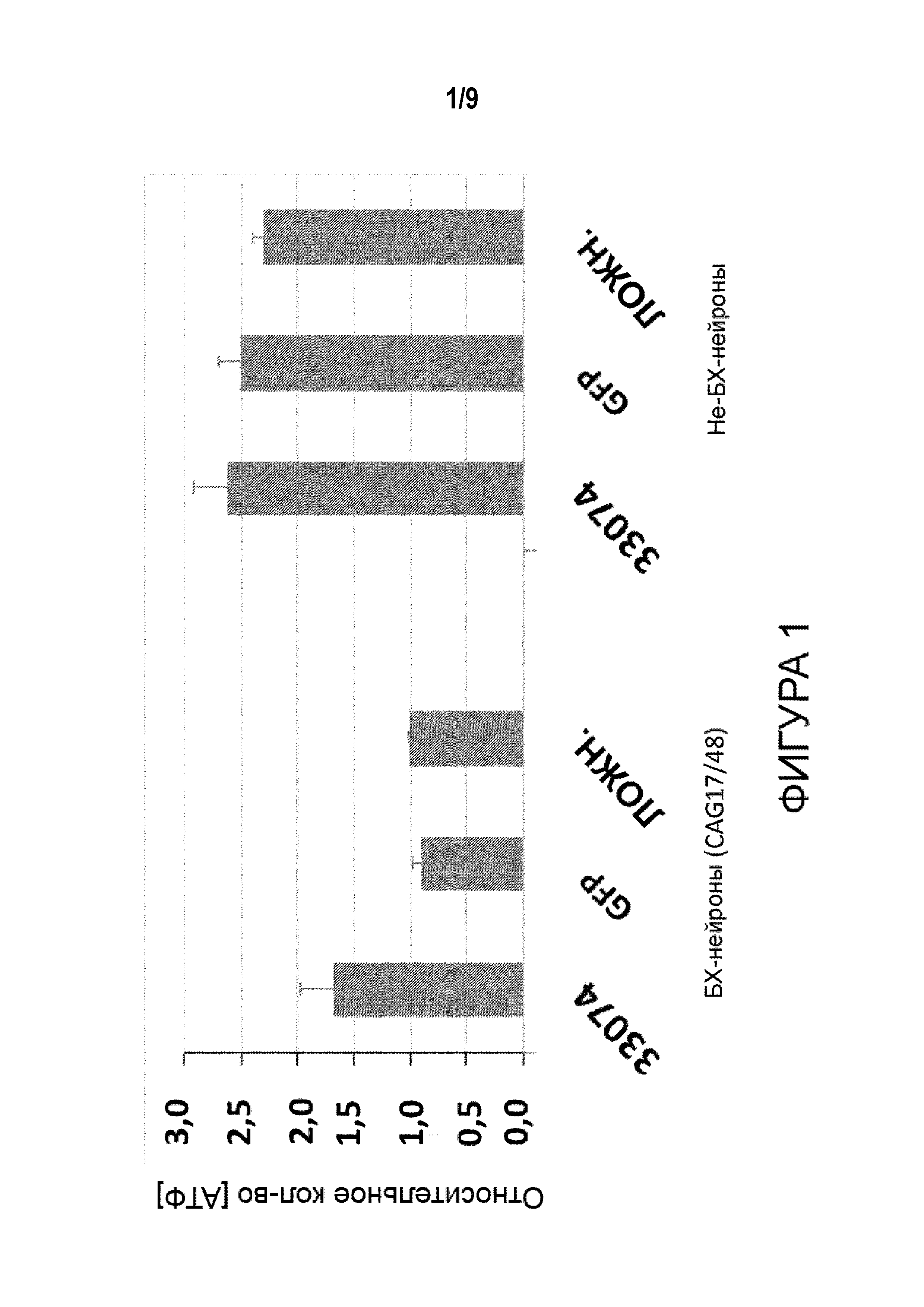
[0026] Фигура 1 представляет собой график, иллюстрирующий относительные внутриклеточные уровни АТФ в БХ-нейронах (3 столбца слева, как указано) и не-БХ-нейронах (3 столбца справа, как указано) после введения указанных конструкций в нейроны. «33074» относится к репрессору ZFP-TF, включая ZFP 33074 (Таблица 1A, который является специфическим в отношении мутантного Htt), слитый с доменом транскрипционной репрессии (KOX), а также последовательностями, кодирующими GFP; «GFP» относится к конструкции, которая кодирует только GFP (не ZFP-TF); а «ложный» относится к конструкциям без кодирующих последовательностей.
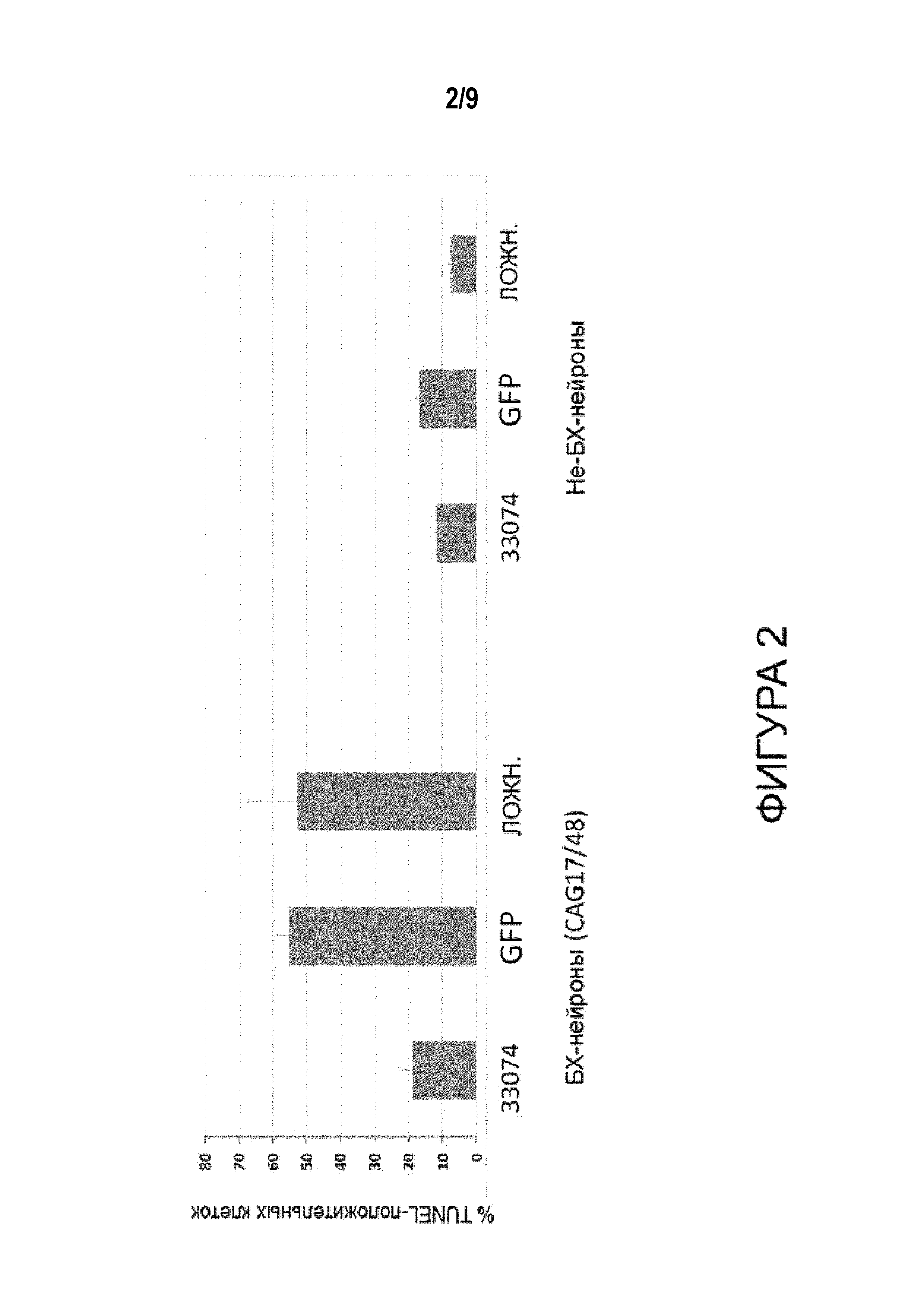
[0027] Фигура 2 представляет собой график, иллюстрирующий процентное содержание апоптотических клеток в БХ-нейронах (3 столбца слева, как указано) и не-БХ-нейронах (3 столбца справа, как указано), определенное методом анализа TUNEL после введения указанных конструкций (см. Фигуру 1) в нейроны.
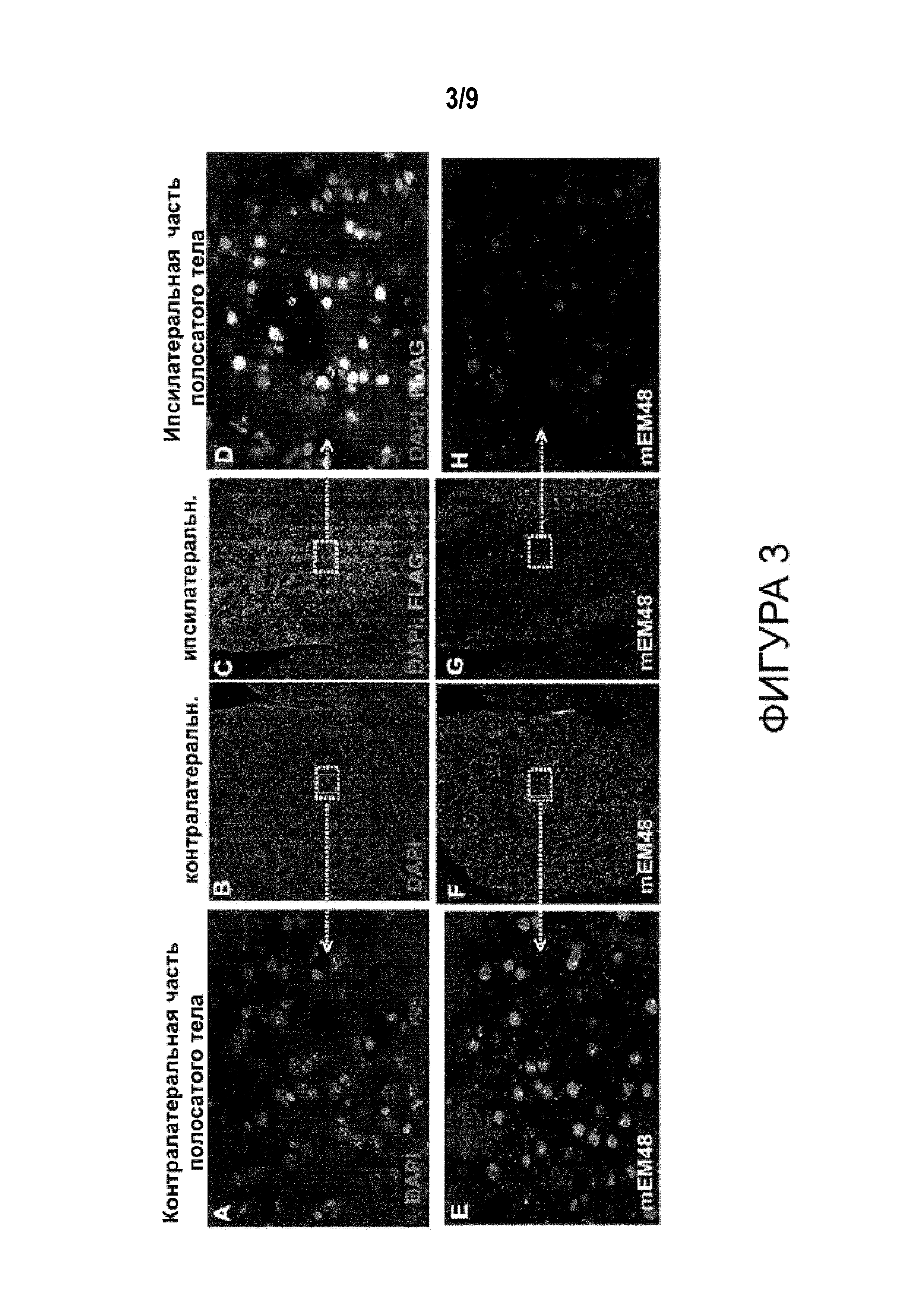
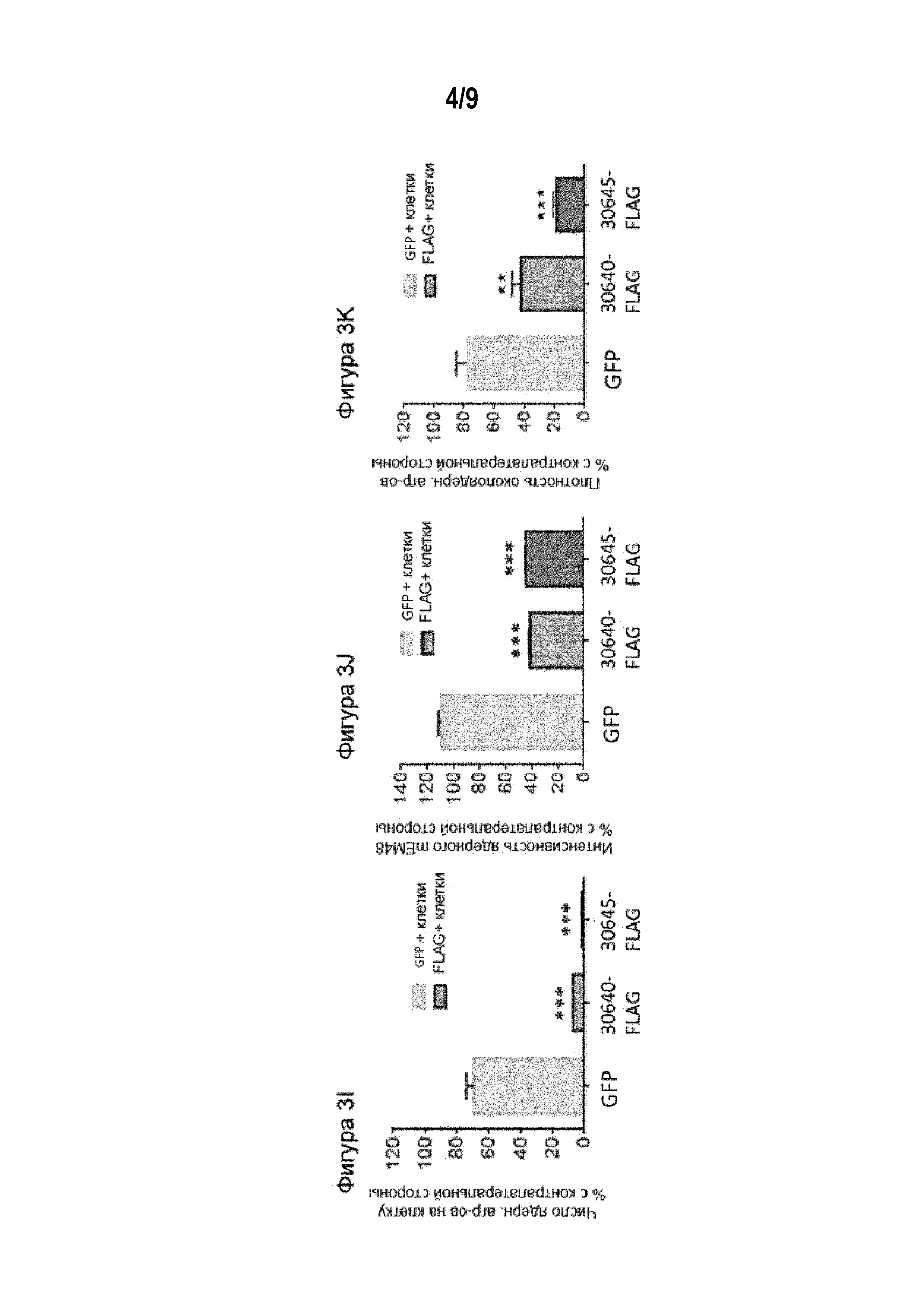
[0028] Фигуры от 3A до 3K иллюстрируют предотвращение агрегации мутантного Htt у мышей Q175 после обработки ZFP-TF-репрессорами аллелей мутантного Htt. На Фигурах 3A-3H приведены типовые изображения иммуногистохимического анализа срезов головного мозга, полученных от мышей, обработанных экспрессионными конструкциями ZFP-TF. На Фигурах от 3A до 3D приведены изображения окрашивания 4',6-диамидино-2-фенилиндолом (DAPI), которым метят ядерную ДНК и антитело в отношении эпитопной метки FLAG (которая указывает на присутствие ZFP-TF). ZFP-TF присутствует только с той стороны, с которой его вводили (ипсилатерально). На Фигурах от 3E до 3H приведены типовые изображения после окрашивания антителом (mEM48), направленным на агрегаты мутантного Htt. В контралатеральной части полосатого тела, куда не проводили инъекцию, агрегацию мутантного Htt легко выявляли при помощи антитела mEM48 по сравнению с ипсилатеральной частью полосатого тела, куда путем инъекции вводили экспрессионную конструкцию ZFP-TF и в которой наблюдали очень низкие уровни агрегации мутантного Htt. Фигура 3I представляет собой график, иллюстрирующий число агрегатов ядерного Htt на клетку (оцененное для клеток FLAG(+) и GFP(+)) в ипсилатеральной части полосатого тела, нормированное относительно числа агрегатов на клетку в необработанной указанными конструкциями контралатеральной части полосатого тела. Фигура 3J представляет собой график, иллюстрирующий интенсивность окрашивания ядерным mEM48 в отношении агрегатов Htt в клетках, получавших указанные конструкции, нормированную относительно интенсивности для нейронов из контралатеральной части полосатого тела. Фигура 3K представляет собой график, иллюстрирующий плотность агрегатов околоядерного мутантного Htt в клетках, экспрессирующих репрессор ZFP-TF или GFP, нормированную относительно плотности в нейронах контралатеральной части полосатого тела. На Фигурах от 3I до 3K «GFP» относится к конструкции, которая кодирует GFP, но не кодирует репрессор Htt ZFP-TF; «30640» и «30645» относятся к конкретным формам ZFP, применяемым в инъецируемых конструкциях (Таблица 1). Статистический анализ проводили, используя критерий Краскела-Уоллиса и множественное сравнение Данна; * p<0,05; ** p<0,01, *** p<0,001; данные представлены в виде гистограммы со средними значениями+СПС.
[0029] Фигуры от 4A до 4D иллюстрируют обращение агрегации мутантного Htt у мышей Q175 после обработки ZFP-TF-репрессорами аллелей мутантного Htt. На Фигуре 4A приведены типовые изображения срезов головного мозга обработанных ZFP-TF и контрольных животных, окрашенные DARPP-32 (специфическим в отношении полосатого тела белком) и направленным против агрегатов Htt антителом mEM48, в контралатеральной и ипсилатеральной частях полосатого тела. Фигура 4B представляет собой график, иллюстрирующий число агрегатов ядерного Htt на клетку (оцененное для клеток FLAG(+) и GFP(+)) в ипсилатеральной части полосатого тела, нормированное относительно числа агрегатов на клетку в необработанной указанными конструкциями контралатеральной части полосатого тела. Фигура 4C представляет собой график, иллюстрирующий интенсивность окрашивания ядерным mEM48 в отношении агрегатов Htt в клетках, получавших указанные конструкции, нормированную относительно интенсивности в нейронах из контралатеральной части полосатого тела. Фигура 4D представляет собой график, иллюстрирующий плотность агрегатов околоядерного мутантного Htt в клетках, экспрессирующих репрессор ZFP-TF или GFP, нормированную относительно плотности в нейронах контралатеральной части полосатого тела. На Фигурах от 4B до 4D «GFP» относится к конструкции, которая кодирует GFP, но не кодирует репрессор Htt ZFP-TF; «GFP-2A-30640» и «GFP-2A-30645» относятся к конструкциям, кодирующим GFP и конкретные формы ZFP, применяемые в инъецируемых конструкциях (Таблица 1). Статистический анализ проводили, используя критерий Краскела-Уоллиса и множественное сравнение Данна; * p<0,05; ** p<0,01, *** p<0,001; данные представлены в виде гистограммы со средними значениями+СПС.
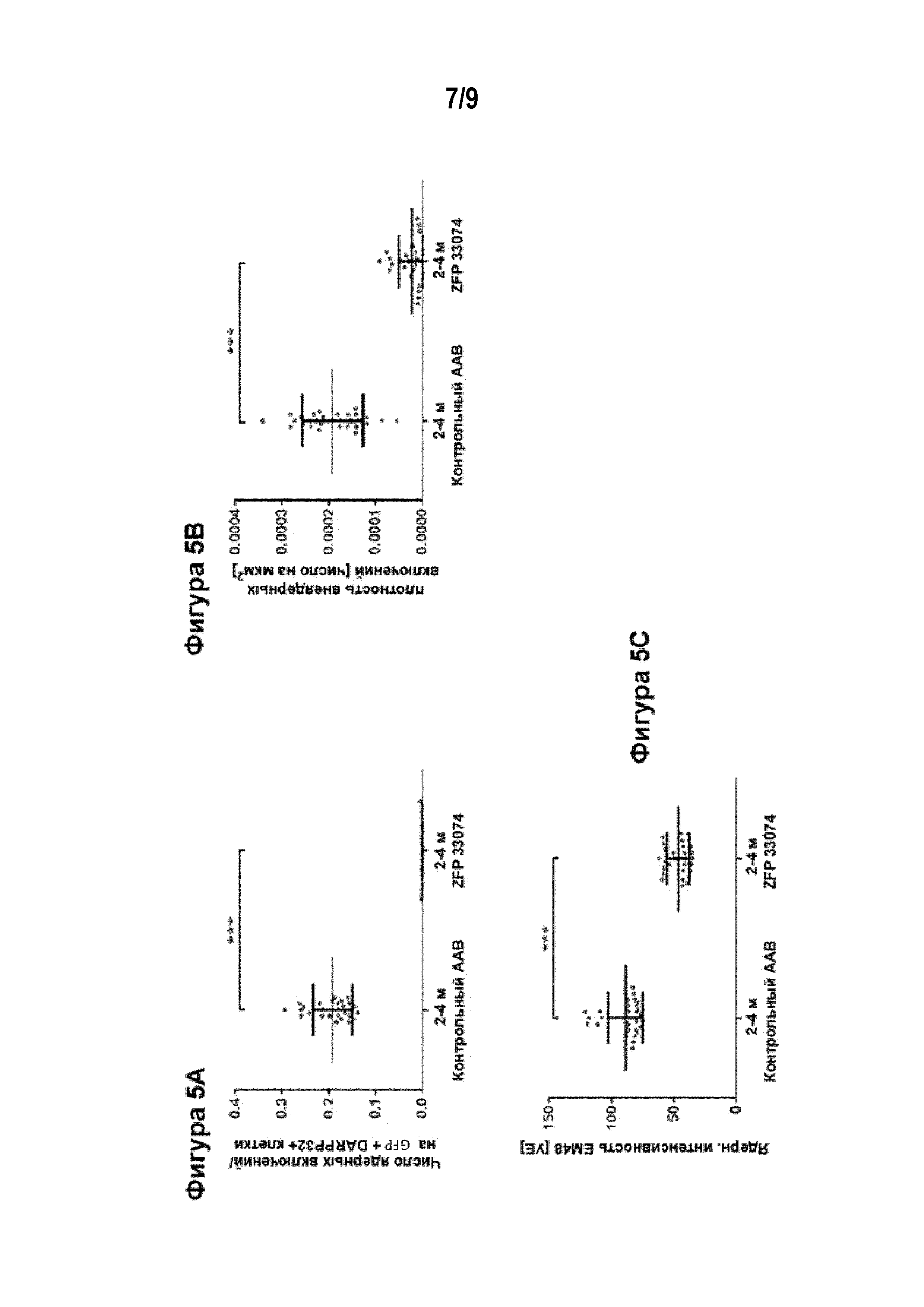
[0030] Фигуры от 5A до 5C иллюстрируют предотвращение агрегации мутантного Htt в стриатуме мышей Q175 после инъекции AAV-ZFP-33074. AAV вектор доставляли в полосатое тело в возрасте 2 месяцев, а анализ проводили в возрасте 4 месяцев. Фигура 5A представляет собой график, иллюстрирующий число агрегатов ядерного Htt в AAV-трансдуцированных (меченых GFP) средних шипиковых нейронах (СШН, меченые антителом DARPP32). Фигура 5B представляет собой график, иллюстрирующий плотность агрегатов внеклеточного мутантного Htt в AAV-трансдуцированных СШН. Фигура 5C представляет собой график, иллюстрирующий интенсивность окрашивания ядерным антителом mEM48 в отношении агрегатов Htt в AAV-трансдуцированных СШН. «Контрольный AAV» относится к AAV вектору, который экспрессирует GFP, «ZFP 33074» относится к AAV вектору, который экспрессирует как ZFP 33074, так и GFP, связанные саморасщепляющимся пептидом 2А. Данные представлены в виде точечных графиков со средними значениями +/- СПС. Статистический анализ проводили, используя критерий Краскела-Уоллиса и апостериорный критерий Данна в сравнении с контролем; ***= p<0,001. Для количественной оценки использовали по 6 срезов от каждого животного для n из 4 животных в каждой группе.
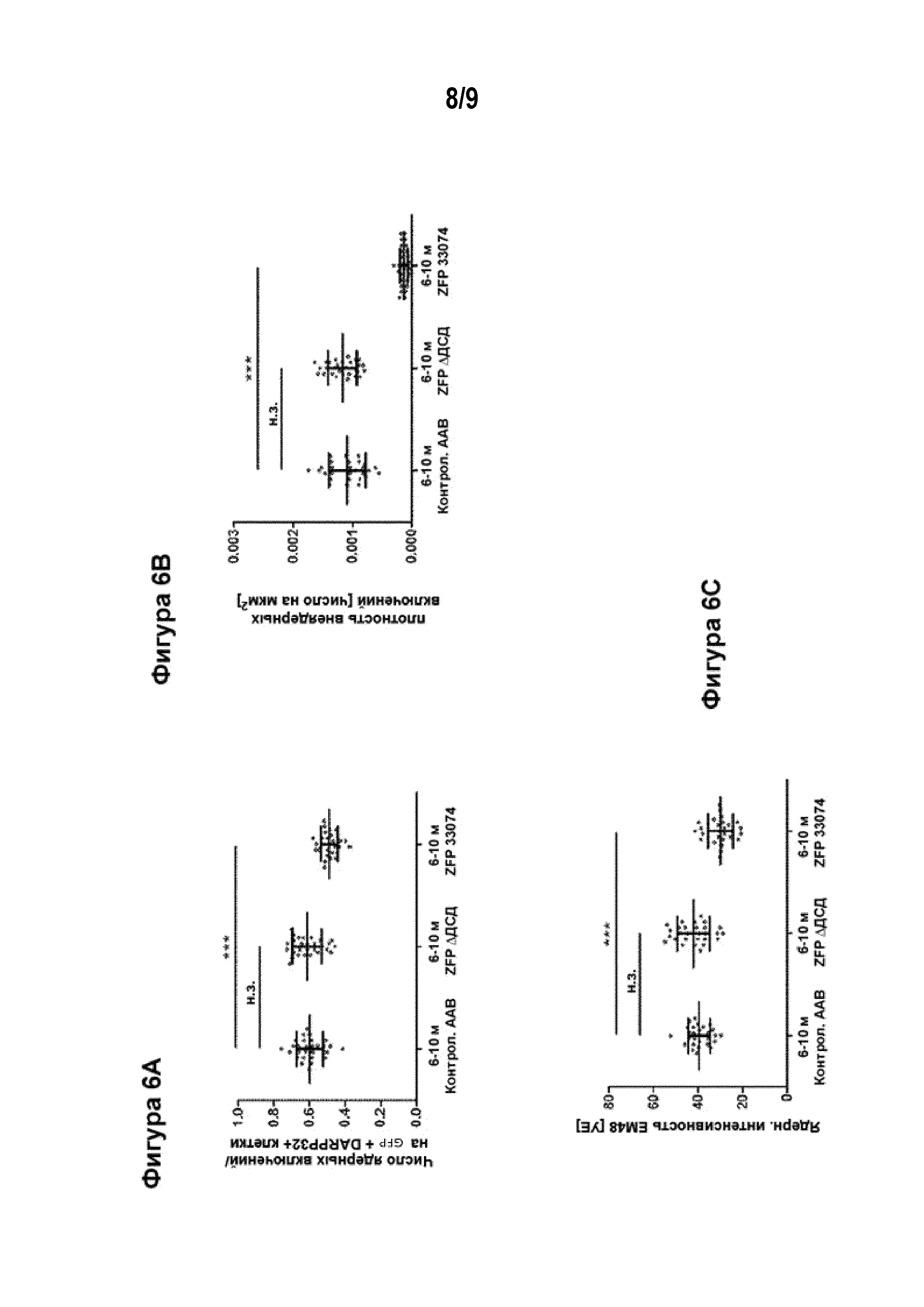
[0031] Фигуры от 6A до 6C иллюстрируют уменьшение агрегации мутантного Htt в стриатуме мышей Q175 после инъекции AAV-ZFP-33074. AAV вектор доставляли в полосатое тело в возрасте 6 месяцев, а анализ проводили в возрасте 10 месяцев. Фигура 6A представляет собой график, иллюстрирующий число агрегатов ядерного Htt в AAV-трансдуцированных (меченых GFP) средних шипиковых нейронах (СШН, меченые антителом DARPP32). Фигура 6B представляет собой график, иллюстрирующий плотность агрегатов внеклеточного мутантного Htt в AAV-трансдуцированных СШН. Фигура 6C представляет собой график, иллюстрирующий интенсивность окрашивания ядерным антителом mEM48 в отношении агрегатов Htt в AAV-трансдуцированных СШН. «Контрольный AAV» относится к AAV вектору, который экспрессирует GFP, «ZFP 33074» относится к AAV вектору, который экспрессирует как ZFP 33074, так и GFP, связанные саморасщепляющимся пептидом 2А. «ZFP ΔДСД» относится к контрольному AAV вектору, сходному с «ZFP 33074» за исключением того, что в нем отсутствует «цинковые пальцы» ДНК-связывающий домен (ДСД). Данные представлены в виде точечных графиков со средними значениями +/- СПС. Статистический анализ проводили, используя критерий Краскела-Уоллиса и апостериорный критерий Данна в сравнении с контролем; ***= p<0,001; н.з.=не значимый. Для количественной оценки использовали по 6 срезов от каждого животного для n из 4 животных в каждой группе.
[0032] Фигуры 7A и 7B иллюстрируют повышенную экспрессию DARPP32 посредством иммуноокрашивания в стриатуме мышей Q175 после инъекции AAV-ZFP-33074. AAV вектор доставляли в полосатое тело в возрасте 6 месяцев, а анализ проводили в возрасте 10 месяцев. Фигура 7A иллюстрирует, что экспрессия DARPP32 была снижена у 10-месячных мышей Q175 по сравнению с мышами дикого типа того же возраста. Фигура 7B иллюстрирует уровни DARPP32 в стриатуме Q175, обработанном AAV вектором, для AAV вектора ZFP 33074 или контрольного AAV вектора. «Контрольный AAV» относится к AAV вектору, который экспрессирует GFP, «ZFP 33074» относится к AAV вектору, который экспрессирует как ZFP 33074, так и GFP, связанные саморасщепляющимся пептидом 2А. «ZFP ΔДСД» относится к контрольному AAV вектору, сходному с «ZFP 33074» за исключением того, что в нем отсутствует «цинковые пальцы» ДНК-связывающий домен (ДСД). Данные представлены в виде точечных графиков со средними значениями +/- СПС. Статистический анализ проводили, используя критерий Краскела-Уоллиса и апостериорный критерий Данна в сравнении с контролем; *=p<0,05, ***= p<0,001; н.з.=не значимый. Для количественной оценки использовали по 6 срезов от каждого животного для n из 4 животных в каждой группе.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0033] В данном документе раскрыты композиции и способы для выявления, отслеживания прогрессирования болезни, лечения и/или предотвращения болезни Хантингтона (БХ). В частности, описанные в данном документе способы позволяют осуществлять изменения в головном мозге (например, вБХ-нейронах) у субъекта с БХ, тем самым обеспечивая терапию БХ. Используя Htt-модулирующие транскрипционные факторы, такие как Htt-модулирующие транскрипционные факторы, содержащие белки «цинковые пальцы» (ZFP TF), TALE (TALE-TF) или CRISPR/Cas-TF, например, ZFP-TF, TALE-TF или CRISPR/Cas-TF, которые репрессируют экспрессию аллеля мутантного Htt, можно модифицировать БХ-нейроны в организме субъекта с БХ так, чтобы снизить или устранить проявления и/или симптомы БХ, например, путем уменьшения агрегации Htt в БХ-нейронах, путем повышения энергетики БХ-нейронов (например, повышения уровней АТФ), путем уменьшения апоптоза в БХ-нейронах и/или путем уменьшения двигательных дефектов у субъектов. Кроме того, описанные в данном документе композиции и способы позволяют выявлять БХ в полученном от пациента образце (например, ЦСЖ). Определение уровней mHtt в полученных от пациентов образцах может позволить диагностировать БХ; отслеживать прогрессирование болезни на основании уровней mHtt; а также оценивать БХ-терапию.
Общие сведения
[0034] При практической реализации способов, а также приготовлении и применении композиций, раскрытых в данном документе, используют, если не указано иное, традиционные методы молекулярной биологии, биохимии, структуры и анализа хроматина, компьютерной химии, клеточного культивирования, рекомбинантных ДНК и родственных областей, которые находятся в компетентности данной области техники. Эти способы полностью описаны в литературе. См., например, Sambrook et al. MOLECULAR CLONING: A LABORATORY MANUAL, второе издание, Cold Spring Harbor Laboratory Press, 1989 и третье издание, 2001; Ausubel et al., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, New York, 1987 и периодические дополнения; серию METHODS IN ENZYMOLOGY, Academic Press, San Diego; Wolffe, CHROMATIN STRUCTURE AND FUNCTION, третье издание, Academic Press, San Diego, 1998; METHODS IN ENZYMOLOGY, Vol. 304, ʺChromatinʺ (P.M. Wassarman and A. P. Wolffe, eds.), Academic Press, San Diego, 1999; и METHODS IN MOLECULAR BIOLOGY, Vol. 119, ʺChromatin Protocolsʺ (P.B. Becker, ed.) Humana Press, Totowa, 1999.
Определения
[0035] Термины «нуклеиновая кислота», «полинуклеотид» и «олигонуклеотид» используются взаимозаменяемо и относятся к дезоксирибонуклеотидному или рибонуклеотидному полимеру, находящемуся в линейной или кольцевой конформации и в одно- или двухцепочечной форме. В контексте настоящего изобретения эти термины не следует воспринимать как ограничивающие в отношении длины полимера. Данные термины могут включать известные аналоги природных нуклеотидов, а также нуклеотиды с модифицированными компонентами оснований, сахаров и/или фосфатов (например, тиофосфатных остовов). В общем случае аналог конкретного нуклеотида обладает такой же специфичностью в отношении спаривания оснований; т.е. аналог А будет спариваться с T.
[0036] Термины «полипептид», «пептид» и «белок» используются взаимозаменяемо и обозначают полимер из аминокислотных остатков. Также этот термин применим к аминокислотным полимерам, в которых одна или более аминокислот являются химическими аналогами или модифицированными производными соответствующих аминокислот природного происхождения.
[0037] «Связывание» относится к специфическому в отношении последовательности, нековалентному взаимодействию между макромолекулами (например, между белком и нуклеиновой кислотой). Не все компоненты связывающего взаимодействия должны быть специфическими в отношении последовательности (например, контакты с фосфатными остатками в остове ДНК) в той мере, пока взаимодействие в целом остается специфическим в отношении последовательности. Такие взаимодействия в общем случае характеризуются константой диссоциации (Kд), составляющей 10-6 M-1 или менее. «Аффинность» относится к силе связывания: повышение аффинности связывания коррелирует с более низкой Kд.
[0038] «Связывающий белок» представляет собой белок, который способен нековалентно связываться с другой молекулой. Связывающий белок может связываться, например, с молекулой ДНК (ДНК-связывающий белок), молекулой РНК (РНК-связывающий белок) и/или белковой молекулой (белоксвязывающий белок). В случае белоксвязывающего белка он может связываться с самим собой (образуя гомодимеры, гомотримеры и т.д.) и/или он может связываться с одной или более молекулами другого связывающего белка или белков. Связывающий белок может проявлять более одного вида связывающей активности. Например, белки «цинковые пальцы» проявляют ДНК-связывающую, РНК-связывающую и белоксвязывающую активность.
[0039] «ДНК-связывающий белок «цинковые пальцы»» (или связывающий домен) представляет собой белок или домен в рамках более крупного белка, который связывает ДНК специфическим в отношении последовательности образом посредством одного или более цинковых пальцев, которые представляют собой участки аминокислотной последовательности в пределах связывающего домена, чья структура стабилизируется посредством координации ионом цинка. Термин «ДНК-связывающий белок «цинковые пальцы»» часто сокращают до белка «цинковые пальцы» или ZFP (от англ. «zinc finger protein»).
[0040] «ДНК-связывающий домен TALE» или «TALE» представляет собой полипептид, содержащий один или более повторяемые доменов/единиц TALE. Повторяемые домены вовлечены в связывание TALE со своей когнатной целевой последовательностью ДНК. Одна «повторяемая единица» (также называемая «повтором») имеет длину, как правило, в 33-35 аминокислот и демонстрирует по меньшей мере некоторую степень гомологии последовательностей с другими повторяемыми последовательностями TALE в белке TALE природного происхождения. См., например, патент США № 8586526.
[0041] «TtAgo» представляет собой прокариотический белок Argonaute, который считается вовлеченным в сайленсинг генов. TtAgo получают из бактерий Thermus thermophilus. См., например, Swarts et al (2014) Nature 507(7491):258-261, G. Sheng et al., (2013) Proc. Natl. Acad. Sci. U.S.A. 111, 652). «Система TtAgo» представляет собой все необходимые компоненты, включая, например, гидовые ДНК, для расщепления ферментом TtAgo. «Рекомбинация» относится к процессу обмена генетической информацией между двумя полинуклеотидами, включая, но не ограничиваясь этим, донорный захват посредством негомологичного соединения концов (НГСК) и гомологичную рекомбинацию. В контексте данного изобретения «гомологичная рекомбинация (ГР)» относится к особенной форме такого обмена, которая имеет место, например, во время репарации двухцепочечных разрывов в клетках посредством механизмов направляемой гомологией репарации. Для этого процесса необходима гомология нуклеотидных последовательностей, чтобы использовать «донорную» молекулу для матричной репарации молекулы-«мишени» (т.е. молекулы, в которой образовался двухцепочечный разрыв), а сам процесс известен под названиями «некроссоверной конверсии генов» или «конверсии генов на коротких участках», так как он приводит к переносу генетической информации от донора к мишени. Не ограничиваясь какой-либо конкретной теорией, такой перенос может включать коррекцию несоответствий гетеродуплекса ДНК, образующегося между разорванной мишенью и донором, и/или «зависимый от синтеза отжиг цепей», в котором донор применяют для воссоздания генетической информации, которая становится частью мишени, и/или связанные процессы. Такая специализированная ГР часто приводит к изменению последовательности молекулы-мишени так, что часть или вся последовательность донорного полинуклеотида встраивается в полинуклеотид-мишень.
[0042] Связывающие домены «цинковые пальцы» или ДНК-связывающие домены TALE можно «сконструировать» так, чтобы они связывали заданную нуклеотидную последовательность, например, путем конструирования (изменения одной или более аминокислот) распознающей спиральной области белка «цинковые пальцы» природного происхождения или путем конструирования повторяемых RVD (вариабельных двойных остатков белка) TALE. Следовательно, сконструированные белки «цинковые пальцы» или TALE являются белками неприродного происхождения. Неограничивающими примерами способов конструирования белков «цинковые пальцы» или TALE являются разработка и селекция. «Разработанный» белок «цинковые пальцы» или TALE представляет собой белок, не существующий в природе, чья конструкция/состав основана, главным образом, на рациональных критериях. Рациональные критерии для разработки включают применение правил проведения замен и компьютеризованных алгоритмов для обработки информации, хранящейся в базах данных существующих конструкций ZFP и данных по связыванию. Полученный в процессе «селекции» белок «цинковые пальцы» или TALE представляет собой белок, не существующий в природе, получение которого является результатом, главным образом, эмпирического процесса, такого как фаговый дисплей, ловушка взаимодействия или гибридная селекция. См., например, патенты США № 8586526; 6140081; 6453242; 6746838; 7241573; 6866997; 7241574 и 6534261; также см. WO 03/016496.
[0043] Термин «последовательность» относится к нуклеотидной последовательности любой длины, которая может представлять ДНК или РНК; может быть линейной, кольцевой или разветвленной и может быть как одноцепочечной, так и двухцепочечной. Термин «донорная последовательность» относится к нуклеотидной последовательности, которая вставлена в геном. Донорная последовательность может быть любой длины, например, от 2 до 10000 нуклеотидов в длину (или любое промежуточное или превышающее целое число), предпочтительно от около 100 до 1000 нуклеотидов в длину (или любое промежуточное целое число), более предпочтительно от около 200 до 500 нуклеотидов в длину.
[0044] «Участок-мишень» или «последовательность-мишень» представляет собой нуклеотидную последовательность, которая определяет часть нуклеиновой кислоты, с которой связывается связывающая молекула в случае наличия условий, достаточных для связывания.
[0045] «Экзогенная молекула» представляет собой молекулу, которая обычно не присутствует в клетке, но которую можно вносить в клетку при помощи одного или более генетических, биохимических или других методов. «Обычное присутствие в клетке» определяют по отношению к конкретной стадии развития и условий окружающей среды клетки. Таким образом, например, молекула, которая присутствует только во время эмбрионального развития мышц, является экзогенной молекулой по отношению к взрослой мышечной клетке. Аналогично, молекула, индуцируемая тепловым шоком, является экзогенной молекулой по отношению к не испытывающей тепловой шок клетке. Экзогенная молекула может содержать, например, функциональную версию нефункциональной эндогенной молекулы или нефункциональную версию нормально функционирующей эндогенной молекулы.
[0046] Экзогенная молекула может быть, помимо прочего, небольшой молекулой, например, полученной посредством комбинаторного химического процесса, или макромолекулой, такой как белок, нуклеиновая кислота, углевод, липид, гликопротеин, липопротеин, полисахарид, любым модифицированным производным вышеперечисленных молекул или любым комплексом, содержащим одну или более вышеперечисленных молекул. Нуклеиновые кислоты включают ДНК и РНК, могут быть одно- или двухцепочечными; могут быть линейными, разветвленными или кольцевыми; и могут быть любой длины. Нуклеиновые кислоты включают те, которые способны образовывать двойные спирали, а также образующие тройные спирали нуклеиновые кислоты. См., например, патенты США № 5176996 и 5422251. Белки включают, но не ограничиваются этим, ДНК-связывающие белки, транскрипционные факторы, хроматин-ремоделирующие факторы, метилированные ДНК-связывающие белки, полимеразы, метилазы, деметилазы, ацетилазы, деацетилазы, киназы, фосфатазы, интегразы, рекомбиназы, лигазы, топоизомеразы, гиразы и геликазы.
[0047] Экзогенная молекула может быть молекулой того же типа, что и эндогенная молекула, например, экзогенный белок или нуклеиновая кислота. Например, экзогенная нуклеиновая кислота может включать инфицирующий вирусный геном, плазмиду или эписому, внесенную в клетку, или хромосому, которая обычно не присутствует в клетке. Способы внесения экзогенных молекул в клетки известны специалистам в данной области техники и включают, но не ограничиваются этим, липид-опосредованный перенос (т.е. применение липосом, включая нейтральные и катионные липиды), электропорацию, прямую инъекцию, клеточное слияние, бомбардировку частицами, совместное осаждение фосфатом кальция, опосредованный ДЭАЭ-декстраном перенос и опосредованный вирусным вектором перенос. Экзогенная молекула также может быть молекулой того же типа, что и эндогенная молекула, но быть полученной от вида, отличного от того, от которого получена клетка. Например, человеческая нуклеотидная последовательность может быть внесена в клеточную линию, изначально полученную от мыши или хомяка.
[0048] В противоположность этому эндогенная молекула представляет собой молекулу, которая обычно присутствует в конкретной клетке на конкретной стадии развития и конкретных условиях окружающей среды. Например, эндогенная нуклеиновая кислота может включать хромосому, геном митохондриона, хлоропласта или другой органеллы или эписомальную нуклеиновую кислоту природного происхождения. Дополнительные эндогенные молекулы могут включать белки, например, транскрипционные факторы и ферменты.
[0049] «Слитая молекула» представляет собой молекулу, в которой слиты, предпочтительно ковалентным образом, две или более молекулы-субъединицы. Молекулы-субъединицы могут быть молекулами одного химического типа или могут быть молекулами разных химических типов. Примеры слитых молекул первого типа включают, но не ограничиваются этим, слитые белки (например, продукт слияния между ДНК-связывающим доменом ZFP или TALE и одним или более активационными доменами) и слитые нуклеиновые кислоты (например, нуклеиновая кислота, кодирующая слитый белок, описанный выше). Примеры слитых молекул второго типа включают, но не ограничиваются этим, продукт слияния между образующей тройную спираль нуклеиновой кислотой и полипептидом и продукт слияния между компонентом, связывающимся с малой бороздой, и нуклеиновой кислотой.
[0050] Экспрессия слитого белка в клетке может являться результатом доставки в клетку слитого белка или доставки в клетку полинуклеотида, кодирующего слитый белок, при этом происходит транскрипция полинуклеотида и трансляция транскрипта для получения слитого белка. В экспрессию белка в клетке также могут быть вовлечены транс-сплайсинг, расщепление полипептидов и лигирование полипептидов. Способы доставки полинуклеотидов и полипептидов в клетки представлены в другом месте данного описания.
[0051] «Домен мультимеризации» (также называемый «доменом димеризации» или «доменом белкового взаимодействия») представляет собой домен, включенный в состав амино-, карбокси- или амино- и карбокси-концевых областей ZFP TF или TALE TF. Эти домены обеспечивают возможность мультимеризации множественных единиц ZFP TF или TALE TF так, что более длинные участки доменов, содержащих тринуклеотидные повторы, становятся предпочтительно связанными мультимеризованными ZFP TF или TALE TF по сравнению с более короткими участками с длиной, соответствующей дикому типу. Примеры доменов мультимеризации включают лейциновые молнии. Домены мультимеризации также могут регулироваться небольшими молекулами, при этом домен мультимеризации принимает правильную конформацию, чтобы обеспечить взаимодействие с другим доменом мультимеризации только в присутствии небольшой молекулы или внешнего лиганда. Таким образом, экзогенные лиганды можно применять, чтобы регулировать активность этих доменов.
[0052] В контексте настоящего изобретения «ген» включает область ДНК, кодирующую генный продукт (см. выше), а также все области ДНК, которые регулируют выработку генного продукта, вне зависимости от того, являются ли такие регуляторные последовательности смежными с кодирующими и/или транскрибируемыми последовательностями. Соответственно, ген включает, но не обязательно ограничен этим, промоторные последовательности, терминаторы, трансляционные регуляторные последовательности, такие как участки связывания рибосом и участки внутренней посадки рибосом, энхансеры, сайленсеры, изоляторы, граничные элементы, точки начала репликации, участки присоединения к матриксу и регуляторные области локусов.
[0053] «Генная экспрессия» относится к преобразованию информации, содержащейся в гене, в генный продукт. Генный продукт может представлять собой прямой продукт транскрипции гена (например, мРНК, тРНК, рРНК, антисмысловую РНК, рибозим, структурную РНК или любой другой тип РНК) или белок, получаемый в результате трансляции мРНК. Генные продукты также включают РНК, которые были модифицированы посредством такого процесса как кэпирование, полиаденилирование, метилирование и редактирование, и белки, которые были модифицированы, например, посредством метилирования, ацетилирования, фосфорилирования, убиквитинирования, АДФ-рибозилирования, миристилирования и гликозилирования.
[0054] «Модулирование» генной экспрессии относится к изменению активности гена. Модулирование экспрессии может включать, но не ограничивается этим, активацию генов и репрессию генов. Для модулирования экспрессии можно применять редактирование генома (например, расщепление, изменение, инактивацию, случайную мутацию). Инактивация гена относится к любому снижению генной экспрессии по сравнению с клеткой, которая не содержит описанный в данном документе ZFP или белок TALE. Таким образом, инактивация гена может быть частичной или полной.
[0055] «Представляющая интерес область» является любой областью клеточного хроматина, такой как, например, ген или некодирующая последовательность в пределах гена или прилегающая к гену, в которой необходимо связывание экзогенной молекулы. Целью связывания может являться направленное расщепление ДНК и/или направленная рекомбинация. Представляющая интерес область может присутствовать, например, в хромосоме, эписоме или геноме органеллы (например, митохондрии, хлоропласта) или инфицирующем вирусном геноме. Представляющая интерес область может находиться в кодирующей области гена, в транскрибируемых некодирующих областях, таких как, например, лидерные последовательности, трейлерные последовательности или интроны, или в нетранскрибируемых областях как выше, так и ниже кодирующей области. Размер представляющей интерес области может составлять от одной пары нуклеотидов до 2000 пар нуклеотидов в длину или любое целочисленное значение пар нуклеотидов.
[0056] «Эукариотические» клетки включают, но не ограничиваются этим, клетки грибков (таких как дрожжи), клетки растений, клетки животных, клетки млекопитающих и клетки человека (например, Т-клетки).
[0057] Термины «функциональная связь» и «функционально связанный» (или «связанный функциональным образом») используются взаимозаменяемо в отношении взаимного расположения двух или более компонентов (таких как элементы последовательности), когда компоненты расположены так, что оба компонента функционируют нормально, и допускается возможность, что по меньшей мере один из компонентов может опосредовать функцию, которая оказывает влияние на по меньшей мере один из других компонентов. В качестве иллюстрации, транскрипционная регуляторная последовательность, такая как промотор, функционально связана с кодирующей последовательностью, если транскрипционная регуляторная последовательность регулирует уровень транскрипции кодирующей последовательности в ответ на присутствие или отсутствие одного или более транскрипционных регуляторных факторов. Транскрипционная регуляторная последовательность в общем случае связана в цис-форме с кодирующей последовательностью, но не обязательно должна быть непосредственно смежной с ней. Например, энхансер представляет собой транскрипционную регуляторную последовательность, которая функционально связана с кодирующей последовательностью, даже если они не являются смежными.
[0058] По отношению к слитым полипептидам термин «функционально связанный» может относиться к факту, что каждый из компонентов в связке выполняет такую же функцию по отношению к другому компоненту, какую бы он выполнял, если бы они не были связаны подобным образом. Например, в случае слитого полипептида, в котором ДНК-связывающий домен ZFP или TALE слит с активационным доменом, ДНК-связывающий домен ZFP или TALE и активационный домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена ZFP или TALE способна связывать свой целевой участок и/или свой участок связывания, в то время как активационный домен способен оказывать повышающую регуляцию на генную экспрессию. ZFP, слитые с доменами, способными регулировать генную экспрессию, вместе называются «ZFP-TF» или «транскрипционные факторы «цинковые пальцы»», в то время как TALE, слитые с доменами, способными регулировать генную экспрессию, вместе называются «TALE-TF» или «транскрипционными факторами TALE». Когда слитый полипептид, в котором ДНК-связывающий домен ZFP слит с расщепляющим доменом («ZFN» или «нуклеаза «цинковые пальцы»»), ДНК-связывающий домен ZFP и расщепляющий домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена ZFP способна связывать свой целевой участок и/или свой участок связывания, в то время как расщепляющий домен способен расщеплять ДНК вблизи целевого участка. Когда слитый полипептид, в котором ДНК-связывающий домен TALE слит с расщепляющим доменом («TALEN» или «TALE-нуклеаза»), ДНК-связывающий домен TALE и расщепляющий домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена TALE способна связывать свой целевой участок и/или свой участок связывания, в то время как расщепляющий домен способен расщеплять ДНК вблизи целевого участка. В случае слитого полипептида, в котором ДНК-связывающий домен Cas слит с активационным доменом, ДНК-связывающий домен Cas и активационный домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена Cas способна связывать свой целевой участок и/или свой участок связывания, в то время как активационный домен способен оказывать повышающую регуляцию на генную экспрессию. Когда слитый полипептид, в котором ДНК-связывающий домен Cas слит с расщепляющим доменом, ДНК-связывающий домен Cas и расщепляющий домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена Cas способна связывать свой целевой участок и/или свой участок связывания, в то время как расщепляющий домен способен расщеплять ДНК вблизи целевого участка.
[0059] «Функциональный фрагмент» белка, полипептида или нуклеиновой кислоты представляет собой белок, полипептид или нуклеиновую кислоту, чья последовательность не идентична полноразмерному белку, полипептиду или нуклеиновой кислоте, но который сохраняет такую же функцию, что и полноразмерный белок, полипептид или нуклеиновая кислота. Функциональный фрагмент может иметь большее, меньшее или такое же число остатков, что и соответствующая нативная молекула, и/или может содержать одну или более аминокислотных или нуклеотидных замен. Способы определения функции нуклеиновой кислоты (например, кодирующей функции, способности гибридизироваться с другой нуклеиновой кислотой) хорошо известны в данной области техники. Аналогично, способы определения функции белка также хорошо известны. Например, ДНК-связывающую функцию полипептида можно определить методом связывания на фильтрах, сдвига электрофоретической подвижности или иммунопреципитации. Расщепление ДНК можно оценить методом гель-электрофореза. См. Ausubel et al., выше. Способность белка взаимодействовать с другим белком можно оценить, например, путем совместной иммунопреципитации, методом двухгибридного анализа или комплементации, как генетической, так и биохимической. См., например, Fields et al. (1989) Nature340:245-246; патент США № 5585245 и PCT WO 98/44350.
[0060] «Вектор» способен переносить генные последовательности в клетки-мишени. Как правило, «векторная конструкция», «экспрессионный вектор» и «вектор для генного переноса» означают любую конструкцию нуклеиновой кислоты, способную управлять экспрессией представляющего интерес гена, которая может переносить генные последовательности в клетки-мишени. Таким образом, термин включает клонирующие и экспрессионные векторы, а также интегрирующие векторы.
[0061] «Репортерный ген» или «репортерная последовательность» относится к любой последовательности, которая вырабатывает белковый продукт, который легко определить предпочтительно, но не обязательно, при помощи рутинного анализа. Подходящие репортерные гены включают, но не ограничиваются этим, последовательности, кодирующие белки, которые опосредуют устойчивость к антибиотикам (например, устойчивость к ампициллину, устойчивость к неомицину, устойчивость к G418, устойчивость к пуромицину), последовательности, кодирующие окрашенные или флуоресцентные, или люминесцентные белки (например, зеленый флуоресцентный белок, усиленный зеленый флуоресцентный белок, красный флуоресцентный белок, люциферазу) и белки, которые опосредуют усиленный рост клеток и/или амплификацию генов (например, дигидрофолатредуктазу). Эпитопные метки включают, например, одну или более копий FLAG, His, myc, Tap, HA или любую выявляемую аминокислотную последовательность. «Экспрессионные метки» включают последовательности, которые кодируют репортеры, которые могут быть функционально связаны с необходимой генной последовательностью с целью отслеживания экспрессии представляющего интерес гена.
ДНК-связывающие домены
[0062] В описанных в данном документе способах применяют композиции, например Htt-моделирующие транскрипционные факторы, содержащие ДНК-связывающий домен, который специфически связывается с целевой последовательностью в гене Htt, в частности, который связывается с аллелем мутантного Htt, содержащим множество тринуклеотидных повторов. В раскрытых в данном документе композициях и способах можно применять любой ДНК-связывающий домен.
[0063] В определенных вариантах реализации изобретения Htt-модулирующий транскрипционный фактор или его ДНК-связывающий белок содержит белок «цинковые пальцы». Выбор целевых участков; ZFP и способы разработки и конструирования слитых белков (и кодирующих их полинуклеотидов) известны специалистам в данной области техники и подробно описаны в патентах США № 6140081; 5789538; 6453242; 6534261; 5925523; 6007988; 6013453; 6200759; WO 95/19431; WO 96/06166; WO 98/53057; WO 98/54311; WO 00/27878; WO 01/60970 WO 01/88197; WO 02/099084; WO 98/53058; WO 98/53059; WO 98/53060; WO 02/016536 и WO 03/016496.
[0064] В определенных вариантах реализации изобретения ZFP могут избирательно связываться с аллелем мутантного Htt или последовательностью Htt дикого типа. Целевые участки Htt, как правило, содержат по меньшей мере один цинковый палец, но могут содержать несколько цинковых пальцев (например, 2, 3, 4, 5, 6 или более пальцев). Обычно ZFP содержат по меньшей мере три пальца. Определенные ZFP содержат четыре, пять или шесть пальцев, в то время как некоторые ZFP содержат 8, 9, 10, 11 или 12 пальцев. ZFP, которые содержат три пальца, как правило, распознают целевой участок, который содержит 9 или 10 нуклеотидов; ZFP, которые содержат четыре пальца, как правило, распознают целевой участок, который содержит от 12 до 14 нуклеотидов; в то время как ZFP, содержащие шесть пальцев, могут распознавать целевые участки, которые содержат от 18 до 21 нуклеотида. ZFP также могут представлять собой слитые белки, которые содержат один или более регуляторных доменов, которые могут быть доменами активации или репрессии транскрипции. В некоторых вариантах реализации изобретения слитый белок содержит два связанных вместе ДНК-связывающих домена ZFP. Таким образом, эти белки «цинковые пальцы» могут содержать 8, 9, 10, 11, 12 или более пальцев. В некоторых вариантах реализации изобретения два ДНК-связывающих домена связаны посредством удлиняемого гибкого линкера так, что один ДНК-связывающий домен содержит 4, 5 или 6 цинковых пальцев, а второй ДНК-связывающий домен содержит дополнительные 4, 5 или 5 цинковых пальцев. В некоторых вариантах реализации изобретения линкер представляет собой стандартный межпальцевый линкер так, что совокупность пальцев составляет один ДНК-связывающий домен, содержащий 8, 9, 10, 11 или 12 или более пальцев. В других вариантах реализации изобретения линкер представляет собой атипичный линкер, такой как гибкий линкер. ДНК-связывающие домены слиты по меньшей мере с одним регуляторным доменом и могут рассматриваться как имеющие архитектуру «ZFP-ZFP-TF». Конкретные примеры этих вариантов реализации изобретения могут называться «ZFP-ZFP-KOX», которая содержит два ДНК-связывающих домена, связанных гибким линкером и слитых с репрессором KOX, и «ZFP-KOX-ZFP-KOX», в которой два слитых белка ZFP-KOX слиты вместе посредством линкера.
[0065] В альтернативном варианте ДНК-связывающий домен может быть получен из нуклеазы. Например, известны последовательности распознавания хоминг-эндонуклеаз и мегануклеаз, такие как I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII. См. также патент США № 5420032; патент США № 6833252; Belfort et al. (1997) Nucleic Acids Res.25:3379-3388; Dujon et al. (1989) Gene82:115-118; Perler et al. (1994) Nucleic Acids Res. 22, 1125-1127; Jasin (1996) Trends Genet.12:224-228; Gimble et al. (1996) J. Mol. Biol.263:163-180; Argast et al. (1998) J. Mol. Biol.280:345-353 и каталог New England Biolabs. Кроме того, ДНК-связывающая специфичность хоминг-эндонуклеаз и мегануклеаз может быть использована для связывания целевых участков неприродного происхождения. См., например, Chevalier et al. (2002) Molec. Cell10:895-905; Epinat et al. (2003) Nucleic Acids Res.31:2952-2962; Ashworth et al. (2006) Nature441:656-659; Paques et al. (2007) Current Gene Therapy7:49-66; патентную публикацию США № 20070117128.
[0066] «Двурукие» белки «цинковые пальцы» представляют собой такие белки, в которых два кластера ДНК-связывающих доменов «цинковые пальцы» разделены промежуточными аминокислотами так, что два домена «цинковые пальцы» связываются с двумя несмежными целевыми участками. Примером двурукого типа связывающего белка «цинковые пальцы» является SIP1, в котором кластер из четырех цинковых пальцев расположен в амино-конце белка, а кластер из трех цинковых пальцев расположен в карбокси-конце (см. Remacle et al, (1999) EMBO Journal 18 (18): 5073-5084). Каждый кластер цинковых пальцев в этих белках способен связываться с уникальной целевой последовательностью, а промежуток между двумя целевыми последовательностями может содержать много нуклеотидов. Двурукие ZFP могут содержать функциональный домен, например, слитый с одним или обоими ZFP. Таким образом, очевидно, что функциональный домен может быть присоединен к внешней части одного или обоих ZFP (см. Фигуру 1C) или может быть расположен между ZFP (присоединен к обоим ZFP) (см. Фигуру 4).
[0067] Конкретные примеры нацеленных на Htt ZFP раскрыты в патентной публикации США № 20130253040, которая в полном объеме и во всех смыслах включена в данный документ посредством ссылки, а также в Таблицу 1, ниже. В первой колонке этой таблицы приведено ссылочное название (номер) для ZFP, которое соответствует названию в 1 колонке Таблицы 2. «F» означает палец, а следующий за «F» номер означает, какой именно палец (например, «F1» означает 1 палец).
Таблица 1: Нацеленные на Htt белки «цинковые пальцы»
[0068] Последовательности и расположение целевых участков этих белков приведены в Таблице 2. Нуклеотиды в целевом участке, которые контактируют с распознающими спиралями ZFP, обозначены заглавными буквами; неконтактирующие нуклеотиды обозначены маленькими буквами.
Таблица 2: Целевые участки на человеческом и мышином Htt
[0069] В определенных вариантах реализации изобретения ДНК-связывающий домен включает природный или сконструированный (неприродного происхождения) ДНК-связывающий домен TAL-эффектора (TALE). См., например, патент США № 8586526, в полном объеме включенный в данный документ посредством ссылки.
[0070] Известно, что патогенные бактерии растений рода Xanthomonas вызывают множество заболеваний важных сельскохозяйственных растений. Патогенность Xanthomonas зависит от консервативной системы секреции III типа (T3S), которая инжектирует более 25 разных эффекторных белков в клетку растения. Среди этих инжектируемых белков есть подобные активаторам транскрипции эффекторы (TALE), которые имитируют растительные активаторы транскрипции и манипулируют растительной транскриптомой (см. Kay et al (2007) Science 318:648-651). Эти белки содержат ДНК-связывающий домен и транскрипционный активационный домен. Одним из наиболее хорошо изученных TALE является AvrBs3 из Xanthomonas campestgris pv. Vesicatoria (см. Bonas et al (1989) Mol Gen Genet 218: 127-136 и WO2010079430). TALE содержат центральный домен тандемных повторов, при этом каждый из повторов содержит приблизительно 34 аминокислоты, которые являются ключевыми для ДНК-связывающей специфичности этих белков. Кроме того, они содержат последовательность ядерной локализации и кислый транскрипционный активационный домен (обзор см. в Schornack S, et al (2006) J Plant Physiol 163(3): 256-272). Кроме того, было обнаружено, что два гена фитопатогенной бактерии Ralstonia solanacearum, обозначаемые brg11 и hpx17, являются гомологичными с семейством AvrBs3 Xanthomonas в штамме GMI1000 биовара 1 и штамме RS1000 биовара 4 R. solanacearum (См. Heuer et al (2007) Appland Envir Micro 73(13): 4379-4384). Эти гены на 98,9% идентичны по нуклеотидной последовательности друг другу, но отличаются делецией в 1575 п.о. в повторяемом домене hpx17. При этом оба генных продукта обладают менее чем 40% идентичности последовательностей с белками семейства AvrBs3 Xanthomonas.
[0071] Специфичность этих TALE зависит от последовательностей, находящихся в тандемных повторах. Повторяемая последовательность содержит приблизительно 102 п.о., а повторы, как правило, на 91-100% гомологичны друг с другом (Bonas et al, ibid). Полиморфизм повторов обычно локализован в позициях 12 и 13, при этом наблюдается точное соответствие между идентичностью гипервариабельных двойных остатков в позициях 12 и 13 с идентичностью смежных нуклеотидов в целевой последовательности TALE (см. Moscou and Bogdanove (2009) Science 326:1501 и Boch et al (2009) Science 326:1509-1512). Экспериментально был определен код распознавания ДНК этих TALE, причем БХ-последовательность в позициях 12 и 13 приводит к связыванию с цитозином (C), NG связывается с T, NI с A, C, G или T, NN связывается с A или G, а NG связывается с T. Эти ДНК-связывающие повторы были собраны в белки с новыми комбинациями и количеством повторов для создания искусственных транскрипционных факторов, которые способны взаимодействовать с новыми последовательностями, патент США № 8586526 и публикация США № 20130196373, в полном объеме включенные в данный документ посредством ссылки, описывают TALE с N-кэпированными полипептидами, С-кэпированными полипептидами (например, +63, +231 или +278) и/или новые (атипичные) RVD.
[0072] Типовые TALE описаны в патентной публикации США № 20130253040, в полном объеме включенной посредством ссылки, и приведены ниже в Таблице 3.
[0073] Мишени и числовые обозначения для исследуемых TALE TF приведены ниже в Таблице 3. Числовые обозначения обозначены «SBS№», указана специфичность в отношении Смысловой или Антисмысловой цепи («С/А»), а также мишень, число повторяемых единиц или RVD и тип С-конца.
Таблица 3: Htt-специфические TALE-TF
[0074] В определенных вариантах реализации изобретения ДНК-связывающие домены включают домен димеризации и/или мультимеризации, например, суперспираль (СС) и димеризующиеся цинковые пальцы (DZ). См. патентную публикацию США № 20130253040.
[0075] Недавно появились убедительные доказательства существования РНК-опосредованного пути геномной защиты у архей и многих бактерий, которое, как предполагается, соответствует эукариотическому пути РНКи (обзор см. в Godde and Bickerton, 2006. J. Mol. Evol. 62: 718-729; Lillestol et al., 2006. Archaea 2: 59-72; Makarova et al., 2006. Biol. Direct 1: 7.; Sorek et al., 2008. Nat. Rev. Microbiol. 6: 181-186). Предполагается, что известный как система CRISPR-Cas или прокариотическая РНКи (пРНКи) путь происходит из двух эволюционно и часто физически связанных генных локусов: локуса CRISPR (короткие палиндромные повторы, регулярно расположенные группами), который кодирует РНК-компоненты системы, и локуса cas (CRISPR-ассоциированный), который кодирует белки (Jansen et al., 2002. Mol. Microbiol. 43: 1565-1575; Makarova et al., 2002. Nucleic Acids Res. 30: 482-496; Makarova et al., 2006. Biol. Direct 1: 7; Haft et al., 2005. PLoS Comput. Biol. 1: e60). Локусы CRISPR в микроорганизмах-хозяевах содержат комбинацию CRISPR-ассоциированных (Cas) генов, а также некодирующие РНК-элементы, способные программировать специфичность CRISPR-опосредованного расщепления нуклеиновых кислот. Отдельные белки Cas не обладают значительным сходством последовательностей с белковыми компонентами эукариотического аппарата РНКи, но имеют аналогичные прогнозируемые функции (например, связывание РНК, нуклеазные, геликазные и т.д.) (Makarova et al., 2006. Biol. Direct 1: 7). CRISPR-ассоциированные (cas) гены часто связаны с группами повтор CRISPR-спейсер. Было описано более сорока разных белковых семейств Cas. Среди этих белковых семейств Cas1 оказался распространенным среди разных систем CRISPR/Cas. Конкретные комбинации генов cas и повторных структур использовали для определения 8 подтипов CRISPR (Ecoli, Ypest, Nmeni, Dvulg, Tneap, Hmari, Apern и Mtube), некоторые из которых связаны с дополнительным генным модулем, кодирующим ассоциированные с повторами загадочные белки (RAMP). В одном геноме может находиться более одного подтипа CRISPR. Спорадическое распределение подтипов CRISPR/Cas позволяет предположить, что данная система подвергается горизонтальному переносу генов во время эволюции микроорганизмов.
[0076] CRISPR II типа, изначально описанная в S. pyogenes, является одной из наиболее хорошо охарактеризованных систем и делает нацеленный двухцепочечный разрыв в ДНК в ходе четырех последовательных этапов. Во-первых, некодирующая РНК, пре-crРНК-матрица и tracrРНК транскрибируются с локуса CRISPR. Во-вторых, tracrРНК гибридизируется с повторяемыми областями пре-crРНК и опосредует процессинг пре-crРНК в зрелые crРНК, содержащие индивидуальные спейсерные последовательности, при этом процессинг осуществляется при помощи специфической в отношении двойной спирали РНКазы III в присутствии белка Cas9. В-третьих, зрелый комплекс crРНК:tracrРНК направляет Cas9 к ДНК-мишени посредством уотсон-криковского спаривания оснований между спейсером на crРНК и протоспейсером на ДНК-мишени, следующим за мотивом, прилегающим к протоспейсеру (PAM), что является дополнительным требованием для распознавания мишени. Кроме того, также должна присутствовать tracrРНК, так как она спаривается с crРНК в 3' конце, а эта ассоциация запускает активность Cas9. И наконец, Cas9 опосредует расщепление ДНК-мишени, чтобы создать двухцепочечный разрыв в протоспейсере. Активность системы CRISPR/Cas состоит из трех этапов: (i) вставка чужеродных последовательностей ДНК в матрицу CRISPR для предотвращения будущих атак в процессе, называемом «адаптацией», (ii) экспрессия релевантных белков, а также экспрессия и процессинг матрицы с последующей (iii) РНК-опосредованной интерференцией с чужеродной нуклеиновой кислотой. Таким образом, в бактериальной клетке несколько так называемых белков «Cas» связаны с природной функцией системы CRISPR/Cas.
[0077] Системы CRISPR II типа были обнаружены во многих бактериях. Поиск BLAST по общедоступным геномам, проведенный Fonfara et al ((2013) Nuc Acid Res 42(4):2377-2590), обнаружил ортологи Cas9 в 347 видах бактерий. Кроме того, эта группа демонстрировала in vitro CRISPR/Cas расщепление ДНК-мишени с применением ортологов Cas9 из S. pyogenes, S. mutans, S. therophilus, C. jejuni, N. meningitides, P. multocida и F. novicida. Таким образом, термин «Cas9» относится к РНК-направляемой ДНК-нуклеазе, содержащей ДНК-связывающий домен и два нуклеазных домена, при этом ген, кодирующий Cas9, может происходить из любой подходящей бактерии.
[0078] Белок Cas9 содержит по меньшей мере два нуклеазных домена: один нуклеазный домен аналогичен эндонуклеазе HNH, в то время как другой напоминает домен эндонуклеазы Ruv. Домен HNH-типа отвечает за расщепление цепи ДНК, которая комплементарна crРНК, в то время как домен Ruv расщепляет некомплементарную цепь. Нуклеазу Cas 9 можно сконструировать так, чтобы только один из нуклеазных доменов был функциональным, что приводит к созданию никазы Cas (см. Jinek et al, ibid). Никазы можно создавать путем введения специфических аминокислотных мутаций в каталитический домен фермента или путем отсечения части или всего домена так, чтобы он более не был функциональным. Так как Cas 9 содержит два нуклеазных домена, этот подход можно применять к любому домену. Двухцепочечный разрыв в ДНК-мишени можно создавать, используя две таких никазы Cas 9. Каждая из никаз будет расщеплять одну цепь ДНК, а использование двух приведет к созданию двухцепочечного разрыва.
[0079] Необходимость в комплексе crРНК-tracrРНК можно обойти путем применения сконструированной «единичной гидовой РНК» (sgРНК), которая содержит шпильку, обычно образуемую посредством отжига crРНК и tracrРНК (см. Jinek et al (2012) Science 337:816 и Cong et al (2013) Sciencexpress/10.1126/science.1231143). В S. pyrogenes сконструированный продукт слияния tracrРНК:crРНК или sgРНК направляет Cas9 для расщепления ДНК-мишени, когда между ассоциированными с Cas РНК и ДНК-мишенью образуется двухцепочечный гетеродимер РНК:ДНК. Эту систему, содержащую белок Cas9 и сконструированную sgРНК, содержащую последовательность PAM, использовали для направляемого РНК редактирования генома (см. Ramalingam, ibid) и для in vivo редактирования генома эмбрионов рыб данио (см. Hwang et al (2013) Nature Biotechnology 31 (3):227), причем эффективность редактирования была сходна с ZFN и TALEN.
[0080] Первичными продуктами локусов CRISPR являются короткие РНК, которые содержат внедряющиеся направляющие последовательности и называются гидовыми РНК или прокариотическими сайленсинг-РНК (psiРНК) на основании их предполагаемой роли в пути (Makarova et al., 2006. Biol. Direct 1: 7; Hale et al., 2008. RNA, 14: 2572-2579). РНК-анализ свидетельствует о том, что расщепление транскриптов локуса CRISPR происходит в пределах повторяемых последовательностей с высвобождением промежуточных продуктов РНК от ~60 до 70 нуклеотидов, которые содержат индивидуальные внедряющиеся направляющие последовательности и фланкирующие повторяемые фрагменты (Tang et al. 2002. Proc. Natl. Acad. Sci. 99: 7536-7541; Tang et al., 2005. Mol. Microbiol. 55: 469-481; Lillestol et al. 2006. Archaea 2: 59-72; Brouns et al. 2008. Science 321: 960-964; Hale et al, 2008. RNA, 14: 2572-2579). В архебактерии Pyrococcus furiosus эти промежуточные РНК дополнительно процессируются до многочисленных стабильных зрелых psiРНК от ~35 до 45 нуклеотидов (Hale et al. 2008. RNA, 14: 2572-2579).
[0081] Необходимость в комплексе crРНК-tracrРНК можно обойти путем применения сконструированной «единичной гидовой РНК» (sgРНК), которая содержит шпильку, обычно образуемую посредством отжига crРНК и tracrРНК (см. Jinek et al (2012) Science 337:816 и Cong et al (2013) Sciencexpress/10.1126/science.1231143). В S. pyrogenes сконструированный продукт слияния tracrРНК:crРНК или sgРНК направляет Cas9 для расщепления ДНК-мишени, когда между ассоциированными с Cas РНК и ДНК-мишенью образуется двухцепочечный гетеродимер РНК:ДНК. Эту систему, содержащую белок Cas9 и сконструированную sgРНК, содержащую последовательность PAM, использовали для направляемого РНК редактирования генома (см. Ramalingam, ibid) и для in vivo редактирования генома эмбрионов рыб данио (см. Hwang et al (2013) Nature Biotechnology 31 (3):227), причем эффективность редактирования была сходна с ZFN и TALEN.
[0082] Химерные или sgРНК можно сконструировать так, чтобы они содержали последовательность, комплементарную любой необходимой мишени. В некоторых вариантах реализации изобретения длина гидовой последовательности составляет около или более чем около 5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 75 или более нуклеотидов. В некоторых вариантах реализации изобретения длина гидовой последовательности составляет менее чем около 75, 50, 45, 40, 35, 30, 25, 20, 15, 12 или менее нуклеотидов. В некоторых вариантах реализации изобретения РНК содержат 22 основания комплементарности с мишенью и формы G[n19], за которыми следует прилегающий к протоспейсеру мотив (PAM) формы NGG или NAG для использования с системой CRISPR/Cas S. pyogenes. Таким образом, в одном способе sgРНК можно сконструировать путем применения известной мишени ZFN в представляющем интерес гене посредством (i) выравнивания последовательности распознавания гетеродимера ZFN со стандартной последовательностью из релевантного генома (человека, мыши или конкретного вида растений); (ii) выявления спейсерной области между полусайтами ZFN; (iii) выявления локации мотива G[N20]GG, который расположен наиболее близко к спейсерной области (когда один или более таких мотивов перекрываются со спейсером, выбирают мотив, которые является более центральным по отношению к спейсеру); (iv) применения такого мотива в качестве основы sgРНК. Преимуществом этого метода есть то, что он основан на проверенных нуклеазных мишенях. В альтернативном варианте sgРНК можно сконструировать так, чтобы они были нацелены на любую представляющую интерес область, просто путем определения подходящей целевой последовательности, которая соответствует формуле G[n20]GG. Наряду с областью комплементарности sgРНК могут содержать дополнительные нуклеотиды для расширения до хвостовой области tracrРНК-части sgРНК (см. Hsu et al (2013) Nature Biotech doi:10.1038/nbt.2647). Длина хвостов может составлять от +67 до +85 нуклеотидов или любое промежуточное число, при этом предпочтительная длина составляет +85 нуклеотидов. Также можно применять усеченные sgРНК, «tru-gРНК» (см. Fu et al, (2014) Nature Biotech 32(3): 279). В tru-gРНК длина комплементарной области уменьшена до 17 или 18 нуклеотидов.
[0083] Кроме того, также можно применять альтернативные последовательности РАМ, при этом последовательность РАМ может представлять собой NAG в качестве альтернативы NGG (Hsu 2014, ibid) с применением Cas9 S. pyogenes. Дополнительные последовательности РАМ также могут включать те, в которых отсутствует исходный G (Sander and Joung (2014) Nature Biotech 32(4):347). Кроме последовательностей РАМ кодируемого S. pyogenes Cas9, можно использовать другие последовательности РАМ, специфические в отношении белков Cas9 из других бактериальных источников. Например, приведенные ниже последовательности РАМ (на основе материалов Sander and Joung, ibid, и Esvelt et al, (2013) Nat Meth 10(11):1116) являются специфическими в отношении таких белков Cas9:
Вид PAM
S. pyogenes NGG
S. pyogenes NAG
S. mutans NGG
S. thermophilius NGGNG
S.thermophilius NNAAAW
S. thermophilius NNAGAA
S. thermophilius NNNGATT
C. jejuni NNNNACA
N. meningitides NNNNGATT
P. multocida GNNNCNNA
F. novicida NG
[0084] Таким образом, подходящую целевую последовательность для применения с системой CRISPR/Cas S. pyogenes можно выбрать в соответствии со следующими критериями: [n17, n18, n19 или n20](G/A)G. В альтернативном варианте последовательность РАМ может соответствовать критерию G[n17, n18, n19, n20](G/A)G. Для белков Cas9, полученных из отличных от S. pyogenes бактерий, можно использовать те же критерии, при этом чередующиеся РАМ замещены последовательностями РАМ S. pyogenes.
[0085] Наиболее предпочтительно выбирать целевую последовательность с наибольшей вероятностью специфичности, что позволяет избежать потенциальных нецелевых последовательностей. Эти нежелательные нецелевые последовательности можно выявить, рассматривая следующие признаки: i) сходство в целевой последовательности, за которой следует последовательность РАМ, для которой известно, что она функционирует вместе с применяемым белком Cas9; ii) сходная целевая последовательность с менее чем тремя несовпадениями по сравнению с необходимой целевой последовательностью; iii) сходная целевая последовательность по ii), в которой все несовпадения находятся скорее в дистальной области РАМ, чем в проксимальной области РАМ (существуют свидетельства того, что нуклеотиды 1-5, непосредственно прилегающие или проксимальные к РАМ, иногда называемые «затравочной» областью (Wu et al (2014) Nature Biotech doi:10.1038/nbt2889), являются наиболее критическими для распознавания, следовательно, предполагаемые нецелевые участки с несовпадениями, расположенными в затравочной области, с наименьшей вероятно могут распознаваться sgRNA); и iv) сходная целевая последовательность, в которой несовпадения не разделены последовательно или разделены более чем четырьмя нуклеотидами (Hsu 2014, ibid). Таким образом, проводя анализ числа потенциальных нецелевых участков в геноме, в котором используется какая-либо система CRIPSR/Cas, с применением вышеприведенных критериев, можно определить подходящую целевую последовательность для sgRNA.
[0086] В определенных вариантах реализации изобретения белок Cas может представлять собой «функциональное производное» белка Cas природного происхождения. «Функциональное производное» нативной последовательности полипептида представляет собой соединение, имеющее общее качественное биологическое свойство с нативной последовательностью полипептида. «Функциональные производные» включают, но не ограничиваются этим, фрагменты нативной последовательности и производные нативной последовательности полипептида и ее фрагменты, при условии, что они обладают общей биологической активностью с соответствующей нативной последовательностью полипептида. Подразумевающаяся в данном документе биологическая активность представляет собой способность функционального производного к гидролизу субстрата ДНК на фрагменты. Термин «производное» включает варианты аминокислотной последовательности полипептида, его ковалентные модификации и продукты слияния. В некоторых аспектах функциональное производное может иметь одно биологическое свойство белка Cas природного происхождения. В других аспектах функциональное производное может иметь подгруппу биологических свойств белка Cas природного происхождения. Подходящие производные полипептида Cas или его фрагмента включают, но не ограничиваются этим, мутанты, продукты слияния, ковалентные модификации белка Cas или его фрагмента. Белок Cas, который включает белок Cas или его фрагмент, а также производные белка Cas или его фрагмента, можно получить из клетки или синтезировать химическим путем, или путем комбинирования этих двух процедур. Клетка может представлять собой клетку, которая естественным образом вырабатывает белок Cas, или клетку, которая естественным образом вырабатывает белок Cas и генетически сконструирована так, чтобы вырабатывать эндогенный белок Cas при более высоком уровне экспрессии или чтобы вырабатывать белок Cas из экзогенно внесенной нуклеиновой кислоты, которая кодирует Cas, который одинаков или отличается от эндогенного Cas. В некоторых случаях клетка не вырабатывает белок Cas естественным образом и генетически сконструирована так, чтобы вырабатывать белок Cas.
[0087] Типовые нуклеазные системы CRISPR/Cas, нацеленные на конкретные гены, раскрыты, например, в предварительной заявке на патент США № 61/823689.
[0088] Таким образом, нуклеаза содержит ДНК-связывающий домен, который специфически связывается с целевым участком в любом гене, в который необходимо вставить донор (трансген) в комбинации с нуклеазным доменом, который расщепляет ДНК.
Слитые молекулы
[0089] ДНК-связывающие домены можно сливать с любыми дополнительными молекулами (например, полипептидами) для применения в описанных в данном документе способах. В определенных вариантах реализации изобретения в указанных способах применяют слитые молекулы, содержащие по меньшей мере одну ДНК-связывающую молекулу (например, ZFP, TALE или единичную гидовую РНК) и гетерологичный регуляторный (функциональный) домен (или его функциональный фрагмент).
[0090] В определенных вариантах реализации изобретения функциональный домен содержит транскрипционный регуляторный домен. Обычные домены включают, например, домены транскрипционных факторов (активаторы, репрессоры, коактиваторы, корепрессоры), сайленсеры, онкогены (например, представителей семейств myc, jun, fos, myb, max, mad, rel, ets, bcl, myb, mos и т.д.); ферменты для репарации ДНК и связанные с ними факторы и модификаторы; ферменты для перестройки ДНК и связанные с ними факторы и модификаторы; хроматин-ассоциированные белки и их модификаторы (например, киназы, ацетилазы и деацетилазы); и ДНК-модифицирующие ферменты (например, метилтрансферазы, топоизомеразы, геликазы, лигазы, киназы, фосфатазы, полимеразы, эндонуклеазы) и связанные с ними факторы и модификаторы. См., например, публикацию США № 20130253040, в полном объеме включенную в данный документ посредством ссылки.
[0091] Подходящие домены для осуществления активации включают активационный домен VP16 ВПГ (см., например, Hagmann et al., J. Virol. 71, 5952-5962 (1997)), ядерные гормональные рецепторы (см., например, Torchia et al., Curr. Opin. Cell. Biol. 10:373-383 (1998)); субъединицу p65 ядерного фактора каппа B (Bitko & Barik, J. Virol. 72:5610-5618 (1998) и Doyle & Hunt, Neuroreport 8:2937-2942 (1997)); Liu et al., Cancer Gene Ther. 5:3-28 (1998)), или искусственные химерные функциональные домены, такие как VP64 (Beerli et al., (1998) Proc. Natl. Acad. Sci. USA 95:14623-33), и дегрон (Molinari et al., (1999) EMBO J. 18, 6439-6447). Дополнительные типовые активационные домены включают Oct 1, Oct-2A, Sp1, AP-2 и CTF1 (Seipel et al., EMBO J. 11, 4961-4968 (1992), а также p300, CBP, PCAF, SRC1 PvALF, AtHD2A и ERF-2. См., например, Robyr et al. (2000) Mol. Endocrinol. 14:329-347; Collingwood et al. (1999) J. Mol. Endocrinol. 23:255-275; Leo et al. (2000) Gene 245:1-11; Manteuffel-Cymborowska (1999) Acta Biochim. Pol. 46:77-89; McKenna et al. (1999) J. Steroid Biochem. Mol. Biol. 69:3-12; Malik et al. (2000) Trends Biochem. Sci. 25:277-283; и Lemon et al. (1999) Curr. Opin. Genet. Dev. 9:499-504. Дополнительные типовые активационные домены включают, но не ограничиваются этим, OsGAI, HALF-1, C1, AP1, ARF-5,-6,-7 и -8, CPRF1, CPRF4, MYC-RP/GP и TRAB1. См., например, Ogawa et al. (2000) Gene 245:21-29; Okanami et al. (1996) Genes Cells 1:87-99; Goff et al. (1991) Genes Dev. 5:298-309; Cho et al. (1999) Plant Mol. Biol. 40:419-429; Ulmason et al. (1999) Proc. Natl. Acad. Sci. USA 96:5844-5849; Sprenger-Haussels et al. (2000) Plant J. 22:1-8; Gong et al. (1999) Plant Mol. Biol. 41:33-44; и Hobo et al. (1999) Proc. Natl. Acad. Sci. USA 96:15,348-15,353.
[0092] Типовые репрессионные домены включают, но не ограничиваются этим, KRAB A/B, KOX, TGF-бета-индуцибельный ранний ген (TIEG), v-erbA, SID, MBD2, MBD3, представителей семейства DNMT (например, DNMT1, DNMT3A, DNMT3B), Rb и MeCP2. См., например, Bird et al. (1999) Cell 99:451-454; Tyler et al. (1999) Cell 99:443-446; Knoepfler et al. (1999) Cell 99:447-450; и Robertson et al. (2000) Nature Genet. 25:338-342. Дополнительные типовые репрессионные домены включают, но не ограничиваются этим, ROM2 и AtHD2A. См., например, Chem et al. (1996) Plant Cell 8:305-321; и Wu et al. (2000) Plant J. 22:19-27.
[0093] Слитые молекулы конструируют способами клонирования и биохимической конъюгации, как хорошо известно специалистам в данной области техники. Слитые молекулы содержат ДНК-связывающий домен и функциональный домен (например, транскрипционный активационный или репрессионный домен). Также слитые молекулы необязательно содержат сигналы ядерной локализации (такие как, например, полученные из среднего Т-антигена SV40) и эпитопные метки (такие как, например, FLAG и гемагглютинин). Слитые белки (и кодирующие их нуклеиновые кислоты) сконструированы так, чтобы трансляционная рамка считывания сохранялась среди компонентов продукта слияния.
[0094] Продукты слияния между полипептидным компонентом функционального домена (или его функционального фрагмента) с одной стороны и небелковым ДНК-связывающим доменом (например, антибиотиком, интеркалятором, компонентом, связывающимся с малой бороздой, нуклеиновой кислотой) с другой конструируют способами биохимической конъюгации, известными специалистам в данной области техники. См., например, каталог Pierce Chemical Company (Rockford, IL). Были описаны способы и композиции для получения продуктов слияния между компонентом, связывающимся с малой бороздой, и полипептидом. Mapp et al. (2000) Proc. Natl. Acad. Sci. USA 97:3930-3935.
[0095] Слитая молекула может быть приготовлена с фармацевтически приемлемым носителем, как известно специалистам в данной области техники. См., например, Remington's Pharmaceutical Sciences, 17th ed., 1985; и принадлежащую тем же авторам WO 00/42219.
[0096] Функциональный компонент/домен слитой молекулы можно выбрать из множества разных компонентов, способных влиять на транскрипцию гена после связывания слитой молекулы с целевой последовательностью посредством ее ДНК-связывающего домена. Следовательно, функциональный домен может включать, но не ограничиваться этим, различные домены транскрипционных факторов, такие как активаторы, репрессоры, коактиваторы, корепрессоры и сайленсеры.
[0097] В определенных вариантах реализации изобретения слитый белок содержит ДНК-связывающий домен и нуклеазный домен для создания функциональных компонентов, которые способны распознавать свою нуклеотидную мишень посредством своих сконструированных (ZFP или TALE) ДНК-связывающих доменов, а созданные нуклеазы (например, нуклеазы «цинковые пальцы» или нуклеазы TALE) приводят к разрезанию ДНК вблизи ДНК-связывающего участка вследствие нуклеазной активности.
[0098] Таким образом, описанные в данном документе способы и композиции широко применимы и могут включать использование любой представляющей интерес нуклеазы. Неограничивающие примеры нуклеаз включают мегануклеазы, TALEN и нуклеазы «цинковые пальцы». Нуклеаза может содержать гетерологичные ДНК-связывающие и расщепляющие домены (например, нуклеазы «цинковые пальцы»; TALEN; ДНК-связывающие домены мегануклеаз с гетерологичными расщепляющими доменами) или, в альтернативном варианте, можно изменить ДНК-связывающий домен нуклеазы природного происхождения так, чтобы он связывал выбранный целевой участок (например, мегануклеаза, которая была сконструирована, чтобы связываться с участком, отличным от когнатного участка связывания).
[0099] Нуклеазный домен можно получить из любой нуклеазы, например, любой эндонуклеазы или экзонуклеазы. Неограничивающие примеры подходящих нуклеазных (расщепляющих) доменов, которые можно сливать с доменами, связывающими ДНК Htt, как описано в данном документе, включают домены из любого рестрикционного фермента, например, рестрикционного фермента типа IIS (например, FokI). В определенных вариантах реализации изобретения расщепляющие домены представляют собой расщепляющие полудомены, для расщепляющей активности которых необходима димеризация. См., например, патенты США № 8586526; 8409861 и 7888121, в полном объеме включенные в данный документ посредством ссылки. В общем случае для расщепления необходимы два слитых белка, если слитые белки содержат расщепляющие полудомены. В альтернативном варианте можно использовать один белок, содержащий два расщепляющих полудомена. Два расщепляющих полудомена могут быть получены из одной эндонуклеазы (или ее функциональных фрагментов) или каждый расщепляющий полудомен может быть получен из отдельной эндонуклеазы (или ее функциональных фрагментов). Кроме того, целевые участки для двух слитых белков предпочтительно расположены по отношению друг к другу так, чтобы связывание двух слитых белков со своими соответствующими целевыми участками располагало расщепляющие полудомены в такой взаимной пространственной ориентации, которая позволяет расщепляющим полудоменам образовывать функциональный расщепляющий домен, например, путем димеризации.
[00100] Нуклеазный домен, полученный из любого домена мегануклеаз (хоминг-эндонуклеаз), обладающего расщепляющей активностью, также можно применять с описанными в данном документе нуклеазами, включая, но не ограничиваясь этим, I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII.
[00101] В определенных вариантах реализации изобретения нуклеаза содержит компактный TALEN (cTALEN). Они представляют собой одноцепочечные слитые белки, связывающие ДНК-связывающий домен TALE с доменом нуклеазы TevI. Слитый белок может действовать как никаза, локализованная областью TALE, или может создавать двухцепочечный разрыв в зависимости от того, где расположен ДНК-связывающий домен TALE по отношению к нуклеазному домену мегануклеазы (например,TevI) (см. Beurdeley et al (2013) Nat Comm: 1-8 DOI: 10.1038/ncomms2782).
[00102] В других вариантах реализации изобретения TALE-нуклеаза представляет собой мега-TAL. Такие мега-TAL нуклеазы представляют собой слитые белки, содержащие ДНК-связывающий домен TALE и расщепляющий домен мегануклеазы. Расщепляющий домен мегануклеазы активен в виде мономера и для его активности не требуется димеризация. (См. Boissel et al., (2013) Nucl Acid Res: 1-13, doi: 10.1093/nar/gkt1224).
[00103] Кроме того, нуклеазный домен мегануклеазы также может демонстрировать ДНК-связывающую функциональность. Любые TALEN можно использовать в комбинации с дополнительными TALEN (например, одной или более TALEN (cTALEN или FokI-TALEN) с одной или более мега-TAL) и/или ZFN.
[00104] Кроме того, расщепляющие домены могут содержать одно или более изменений по сравнению с диким типом, например, для образования облигатных гетеродимеров, которые снижают или устраняют нецелевые расщепляющие эффекты. См., например, патенты США № 7914796; 8034598; и 8623618, в полном объеме включенные в данный документ посредством ссылки.
[00105] Описанные в данном документе нуклеазы могут создавать двух- или одноцепочечные разрывы в двухцепочечной мишени (например, гене). Создание одноцепочечных разрывов («ников») описано, например, в патенте США № 8703489, включенном в данный документ посредством ссылки, который описывает, как мутация каталитического домена одной из нуклеаз приводит к получению никазы.
[00106] Таким образом, нуклеазный (расщепляющий) домен или расщепляющий полудомен может быть любой частью белка, которая сохраняет расщепляющую активность или которая сохраняет способность мультимеризоваться (например, димеризоваться) с образованием функционального расщепляющего домена.
[00107] В альтернативном варианте сборка нуклеаз может проходить in vivo в целевом участке нуклеиновой кислоты при помощи технологии так называемых «расщепленных ферментов» (см.,например, патентную публикацию США № 20090068164). Компоненты таких расщепленных ферментов могут экспрессироваться на отельных экспрессионных конструкциях или могут быть связаны в одной открытой рамке считывания, в которой индивидуальные компоненты разделены, например, саморасщепляющимся пептидом 2A или последовательностью IRES. Компоненты могут представлять собой индивидуальные связывающие домены «цинковые пальцы» или домены связывающего домена нуклеиновой кислоты мегануклеазы.
[00108] Перед применением можно проводить скрининг нуклеаз в отношении активности, например, в хромосомной системе на основе дрожжей, как описано в публикации США № 20090111119. Нуклеазные экспрессионные конструкции легко можно сконструировать, используя известные в данной области техники способы.
[00109] Экспрессия слитых белков может находиться под управлением конститутивного промотора или индуцибельного промотора, например, промотора галактокиназы, который активируется (дерепрессируется) в присутствии раффинозы и/или галактозы и репрессируется в присутствии глюкозы. В определенных вариантах реализации изобретения промотор сам регулирует экспрессию слитого белка, например, посредством включения высокоаффинных связывающих участков. См., например, заявку на патент США № 61955002, поданную 18 марта 2014 г.
Доставка
[00110] Белки и/или полинуклеотиды (например, ZFP, TALE, CRISPR/Cas), а также композиции, содержащие белки и/или полинуклеотиды, описанные в данном документе, можно доставлять в клетку-мишень любым подходящим способом, включая, например, инъекцию белков, применение мРНК и/или применение экспрессионной конструкции (например, плазмиды, лентивирусного вектора, AAV вектора, Ад вектора и т.д.).
[00111] Способы доставки описанных в данном документе белков, включая белки «цинковые пальцы», описаны, например, в патентах США № 6453242; 6503717; 6534261; 6599692; 6607882; 6689558; 6824978; 6933113; 6979539; 7013219; и 7163824, содержание которых в полном объеме включено в данный документ посредством ссылки.
[00112] Можно применять любые векторные системы, включая, но не ограничиваясь этим, плазмидные векторы, ретровирусные векторы, лентивирусные векторы, аденовирусные векторы, поксвирусные векторы; герпесвирусные векторы и аденоассоциированные вирусные векторы и т.д. См. также патенты США № 8586526; 6534261; 6607882; 6824978; 6933113; 6979539; 7013219; и 7163824, в полном объеме включенные в данный документ посредством ссылки. Кроме того, очевидно, что любые из этих векторов могут содержать одну или более последовательностей, кодирующих ДНК-связывающие белки. Таким образом, когда в клетку вносят один или более белков ZFP, TALE или CRISPR/Cas, последовательности, кодирующие белки ZFP, TALE или CRISPR/Cas, могут находиться в одном векторе или в разных векторах. Когда применяют несколько векторов, каждый вектор может содержать последовательность, кодирующую один или несколько ZFP, TALE или систем CRISPR/Cas.
[00113] Для внесения нуклеиновых кислот, кодирующих сконструированные ZFP, TALE или системы CRISPR/Cas, в клетки (например, клетки млекопитающих) и целевые ткани можно применять традиционные методы переноса генов на вирусной и невирусной основе. Такие методы также можно применять для внесения нуклеиновых кислот, кодирующих ZFP, TALE или системы CRISPR/Cas, в клетки in vitro. В определенных вариантах реализации изобретения нуклеиновые кислоты, кодирующие ZFP, TALE или системы CRISPR/Cas, вносят в целях in vivo или ex vivo генной терапии. Невирусные векторные системы доставки включают ДНК-плазмиды, оголенные нуклеиновые кислоты и нуклеиновые кислоты в комплексе со средством доставки, таким как липосома или полоксамер. Вирусные векторные системы доставки включают ДНК- и РНК-вирусы, которые после доставки в клетку характеризуются эписомальным или интегрированным геномами. Обзор процедур генной терапии см. в Anderson, Science 256:808-813 (1992); Nabel & Felgner, TIBTECH 11:211-217 (1993); Mitani & Caskey, TIBTECH 11:162-166 (1993); Dillon, TIBTECH 11:167-175 (1993); Miller, Nature 357:455-460 (1992); Van Brunt, Biotechnology 6(10):1149-1154 (1988); Vigne, Restorative Neurology and Neuroscience 8:35-36 (1995); Kremer & Perricaudet, British Medical Bulletin 51(1):31-44 (1995); Haddada et al., в Current Topics in Microbiology and Immunology Doerfler and Böhm (eds.) (1995); и Yu et al., Gene Therapy 1:13-26 (1994).
[00114] Способы невирусной доставки нуклеиновых кислот включают электропорацию, липофекцию, микроинъекцию, биолистику, применение виросом, липосом, иммунолипосом, конъюгатов поликатион или липид:нуклеиновая кислота, оголенных ДНК, оголенных РНК, искусственных вирионов и усиленное препаратами поглощение ДНК. Также для доставки нуклеиновых кислот можно применять сонопорацию с использованием, например, системы Sonitron 2000 (Rich-Mar). В предпочтительном варианте реализации изобретения одну или более нуклеиновых кислот доставляют в виде мРНК. Также предпочтительным является применение кэпированных мРНК для повышения трансляционной эффективности и/или стабильности мРНК. В особенности предпочтительными являются кэпы ARCA (антиреверсивный аналог кэпа) или их варианты. См. патенты США US7074596 и US8153773, включенные в данный документ посредством ссылки.
[00115] Дополнительные типовые системы доставки нуклеиновых кислот включают предоставляемые Amaxa Biosystems (Cologne, Germany), Maxcyte, Inc. (Rockville, Maryland), BTX Molecular Delivery Systems (Holliston, MA) и Copernicus Therapeutics Inc, (см.,например, US6008336). Липофекция описана, например, в патентах США №. 5049386; 4946787; и 4897355), а реагенты для липофекции продаются на коммерческой основе (например, Transfectam™ и Lipofectin™, и Lipofectamine™ RNAiMAX). Катионные и нейтральные липиды, которые подходят для эффективной липофекции полинуклеотидов с распознаванием рецепторов, включают описанные у Felgner, в WO 91/17424, WO 91/16024. Доставку можно осуществлять в клетки (ex vivo введение) или целевые ткани (in vivo введение).
[00116] Получение комплексов липид:нуклеиновая кислота, в том числе нацеленных липосом, таких как иммунолипидные комплексы, хорошо известно специалисту в данной области техники (см., например, Crystal, Science 270:404-410 (1995); Blaese et al., Cancer Gene Ther. 2:291-297 (1995); Behr et al., Bioconjugate Chem. 5:382-389 (1994); Remy et al., Bioconjugate Chem. 5:647-654 (1994); Gao et al., Gene Therapy 2:710-722 (1995); Ahmad et al., Cancer Res. 52:4817-4820 (1992); патенты США № 4186183, 4217344, 4235871, 4261975, 4485054, 4501728, 4774085, 4837028 и 4946787).
[00117] Дополнительные способы доставки включают применение упаковки предназначенных для доставки нуклеиновых кислот в средства доставки EnGeneIC (EDV). Эти EDV специфическим образом доставляются в целевые ткани при помощи биспецифических антител, в которых одно плечо антитела имеет специфичность в отношении целевой ткани, а другое имеет специфичность в отношении EDV. Антитело доставляет EDV к поверхности клетки-мишени, а затем EDV попадает в клетку путем эндоцитоза. После попадания в клетку происходит высвобождение содержимого (см. MacDiarmid et al (2009) Nature Biotechnology 27(7):643).
[00118] Применение систем на основе ДНК- или РНК-вирусов для доставки нуклеиновых кислот, кодирующих сконструированные ZFP, TALE или системы CRISPR/Cas, использует преимущества хорошо отработанных процессов нацеливания вируса на конкретные клетки в организме и переноса вирусной нагрузки в ядро. Вирусные векторы можно вводить непосредственно пациентам (in vivo) или их можно применять для обработки клеток in vitro и вводить модифицированные клетки пациентам (ex vivo). Традиционные системы на вирусной основе для доставки ZFP, TALE или систем CRISPR/Cas включают, но не ограничиваются этим, векторы для переноса генов на основе ретровирусов, лентивирусов, аденовирусов, аденоассоциированных вирусов, вируса осповакцины и вируса простого герпеса. Интеграция в геном хозяина возможна при применении методов переноса генов с использованием ретровирусов, лентивирусов и аденоассоциированных вирусов и часто приводит к длительной экспрессии вставленного трансгена. Кроме того, высокую эффективность трансдукции наблюдали во многих разных типах клеток и целевых тканях.
[00119] Тропизм ретровирусов может быть изменен путем включения чужеродных оболочечных белков, что расширяет потенциальную целевую популяцию клеток-мишеней. Лентивирусные векторы представляют собой ретровирусные векторы, которые способны трансдуцировать или инфицировать неделящиеся клетки и, как правило, вырабатывают высокие вирусные титры. Выбор ретровирусной системы переноса генов зависит от целевой ткани. Ретровирусные векторы состоят из цис-действующих длинных концевых повторов с пакующей емкостью до 6-10 т.п.о. чужеродной последовательности. Минимального количества цис-действующих ДКП достаточно для репликации и упаковки векторов, которые затем используются для интеграции терапевтического гена в клетку-мишень, чтобы обеспечить стойкую экспрессию трансгена. Широко применяемые ретровирусные векторы включают векторы на основе вируса лейкоза мышей (ВЛМ), вируса лейкоза гиббонов (ВЛГ), вируса иммунодефицита обезьян (ВИО), вируса иммунодефицита человека (ВИЧ) и их комбинаций (см., например, Buchscher et al., J. Virol. 66:2731-2739 (1992); Johann et al., J. Virol. 66:1635-1640 (1992); Sommerfelt et al., Virol. 176:58-59 (1990); Wilson et al., J. Virol. 63:2374-2378 (1989); Miller et al., J. Virol. 65:2220-2224 (1991); PCT/US94/05700).
[00120] В применениях, в которых предпочтительной является временная экспрессия, можно использовать системы на основе аденовирусов. Векторы на основе аденовирусов способны обеспечивать очень высокую эффективность трансдукции во многих типах клеток и не требуют деления клеток. С такими векторами получали высокие титры и высокие уровни экспрессии. Этот вектор может быть получен в больших количествах в относительно простой системе.Аденоассоциированные вирусные («AAV») векторы также применяют, чтобы трансдуцировать клетки целевыми нуклеиновыми кислотами, например, при in vitro получении нуклеиновых кислот и пептидов или для in vivo и ex vivo процедур генной терапии (см., например, West et al., Virology 160:38-47 (1987); патент США № 4797368; WO 93/24641; Kotin, Human Gene Therapy 5:793-801 (1994); Muzyczka, J. Clin. Invest. 94:1351 (1994). Конструирование рекомбинантных AAV векторов описано в большом количестве публикаций, включая патент США № 5173414; Tratschin et al., Mol. Cell. Biol. 5:3251-3260 (1985); Tratschin, et al., Mol. Cell. Biol. 4:2072-2081 (1984); Hermonat & Muzyczka, PNAS 81:6466-6470 (1984); и Samulski et al., J. Virol. 63:03822-3828 (1989).
[00121] На данный момент в клинических исследованиях для переноса генов доступно по меньшей мере шесть подходов на основе вирусных векторов, которые включают комплементацию дефективных векторов генами, вставленными в хелперные клеточные линии для получения трансдуцирующего агента.
[00122] pLASN и MFG-S являются примерами ретровирусных векторов, которые использовали в клинических исследованиях (Dunbar et al., Blood 85:3048-305 (1995); Kohn et al., Nat. Med. 1:1017-102 (1995); Malech et al., PNAS 94:22 12133-12138 (1997)). PA317/pLASN был первым терапевтическим вектором, применяемым в исследованиях генной терапии. (Blaese et al., Science 270:475-480 (1995)). Для упакованных векторов MFG-S наблюдали эффективность трансдукции в 50% и выше. (Ellem et al., Immunol Immunother. 44(1):10-20 (1997); Dranoff et al., Hum. Gene Ther. 1:111-2 (1997).
[00123] Рекомбинантные аденоассоциированные вирусные векторы (рAAV) являются перспективными альтернативными системами доставки генов на основе дефективного и непатогенного парвовирусного аденоассоциированного вируса 2 типа. Все векторы получены из плазмиды, в которой сохранены только 145 п.о. инвертированных концевых повторов AAV, фланкирующих экспрессионную кассету трансгена. Эффективный перенос генов и стабильная доставка трансгенов благодаря интеграции в геном трансдуцированной клетки являются ключевыми характеристиками этой векторной системы. (Wagner et al., Lancet 351:9117 1702-3 (1998), Kearns et al., Gene Ther. 9:748-55 (1996)). Другие серотипы AAV, включая AAV1, AAV3, AAV4, AAV5, AAV6, AAV8, AAV 8.2, AAV9, и AAV rh10 и псевдотипированные AAV, такие как AAV2/8, AAV2/5 и AAV2/6, также можно применять в соответствии с настоящим изобретением.
[00124] Дефектные по репликации рекомбинантные аденовирусные векторы (Ад) можно получать при высоких титрах и легко инфицировать большое количество разных типов клеток. Большинство аденовирусных векторов сконструировано так, чтобы трансген замещал гены Ад E1a, E1b и/или E3; впоследствии дефектный по репликации вектор размножается в человеческих клетках 293, которые обеспечивают функцию удаленного гена в транс-форме. Ад-векторы могут трансдуцировать множество типов тканей in vivo, включая неделящиеся дифференцированные клетки, такие как клетки печени, почек и мышц. Традиционные Ад-векторы имеют большую несущую емкость. Пример применения Ад-вектора в клиническом исследовании включает полинуклеотидную терапию для противоопухолевой иммунизации путем внутримышечной инъекции (Sterman et al., Hum. Gene Ther. 7:1083-9 (1998)). Дополнительные примеры применения аденовирусных векторов для переноса генов в клинических исследованиях включают Rosenecker et al., Infection 24:1 5-10 (1996); Sterman et al., Hum. Gene Ther. 9:7 1083-1089 (1998); Welsh et al., Hum. Gene Ther. 2:205-18 (1995); Alvarez et al., Hum. Gene Ther. 5:597-613 (1997); Topf et al., Gene Ther. 5:507-513 (1998); Sterman et al., Hum. Gene Ther. 7:1083-1089 (1998).
[00125] Пакующие клетки применяют для формирования вирусных частиц, которые способны инфицировать клетку-хозяина. Такие клетки включают клетки 293, которые пакуют аденовирус, и клетки ψ2 или клетки PA317, которые пакуют ретровирус. Применяемые в генной терапии вирусные векторы обычно получают при помощи продуцирующей клеточной линии, которая пакует нуклеиновую кислоту вектора в вирусную частицу. Векторы, как правило, содержат минимальные вирусные последовательности, необходимые для упаковки и последующей интеграции в хозяина (в случае применения), при этом другие вирусные последовательности заменены экспрессионной кассетой, кодирующей предназначенный для экспрессии белок. Отсутствующие вирусные функции обеспечиваются в транс-форме пакующей клеточной линией. Например, применяемые в генной терапии AAV векторы, как правило, содержат только последовательности инвертированных концевых повторов (ИКП) из AAV генома, которые необходимы для упаковки и интеграции в геном хозяина. Вирусная ДНК пакуется в клеточную линию, которая содержит хелперную плазмиду, кодирующую другие AAV гены, а именно rep и cap, но в которой отсутствуют последовательности ИКП. Клеточная линия также инфицируется аденовирусом в качестве хелпера. Хелперный вирус стимулирует репликацию AAV вектора и экспрессию AAV генов из хелперной плазмиды. Хэлперная плазмида не пакуется в больших количествах вследствие отсутствия последовательностей ИКП. Заражение аденовирусом можно снизить, например, при помощи тепловой обработки, к которой аденовирус более чувствителен, чем AAV.
[00126] Во многих применениях генной терапии желательно, чтобы вектор для генной терапии доставлялся с высокой степенью специфичности в конкретный тип ткани. Соответственно, вирусный вектор можно модифицировать так, чтобы он имел специфичность в отношении данного типа клеток, путем экспрессии лиганда в виде слитого белка с вирусным оболочечным белком на внешней поверхности вируса. Лиганд выбирают так, чтобы он обладал аффинностью в отношении рецептора, который, как известно, присутствует у представляющего интерес типа клеток. Например, в Han et al., Proc. Natl. Acad. Sci. USA 92:9747-9751 (1995), сообщалось, что вирус мышиного лейкоза Молони можно модифицировать так, чтобы он экспрессировал человеческий херегулин, слитый с gp70, при этом рекомбинантный вирус инфицирует определенные клетки рака молочной железы человека, экспрессирующие рецептор человеческого эпидермального фактора роста. Этот принцип можно распространить на другие пары вирус-клетка-мишень, в которых клетка-мишень экспрессирует рецептор, а вирус экспрессирует слитый белок, содержащий лиганд для рецептора клеточной поверхности. Например, можно сконструировать нитевидный фаг так, чтобы он представлял фрагменты антитела (например, FAB или Fv), имеющие специфическую аффинность связывания в отношении практически любого выбранного клеточного рецептора. Хотя вышеприведенное описание относится главным образом к вирусным векторам, такие же принципы можно применять к невирусным векторам. Такие векторы можно сконструировать так, чтобы они содержали конкретные последовательности поглощения, которые поддерживают поглощение конкретными клетками-мишенями.
[00127] Векторы для генной терапии можно доставлять in vivo путем введения отдельному пациенту, как правило, путем системного введения (например, внутривенной, внутрибрюшинной, внутримышечной, подкожной или внутричерепной инфузии) или местного применения, как описано ниже. В альтернативном варианте векторы можно доставлять в клетки ex vivo, например, в клетки, эксплантированные из организма отдельного пациента (например, лимфоциты, аспираты костного мозга, образцы биопсии тканей), или универсальные донорные гемопоэтические стволовые клетки с последующей реимплантацией клеток в организм пациента, обычно после отбора клеток, в которые был включен вектор.
[00128] В определенных вариантах реализации изобретения описанные в данном документе композиции (например, полинуклеотиды и/или белки) доставляют непосредственно in vivo. Композиции (клетки, полинуклеотиды и/или белки) можно вводить непосредственно в центральную нервную систему (ЦНС), включая, но не ограничиваясь этим, прямую инъекцию в головной или спинной мозг. Можно проводить нацеливание на один или более участков головного мозга, включая, но не ограничиваясь этим, гиппокамп, черное вещество, базальное ядро Мейнерта (БЯМ), полосатое тело и/или кору. В альтернативном варианте или дополнительно к доставке в ЦНС композиции можно вводить системно (например, путем внутривенной, внутрибрюшинной, внутрисердечной, внутримышечной, интратекальной, подкожной или внутричерепной инфузии). Способы и композиции для доставки описанных в данном документе композиций непосредственно субъекту (включая доставку непосредственно в ЦНС) включают, но не ограничиваются этим, прямую инъекцию (например, стереотаксическую инъекцию) при помощи набора игл. Такие способы описаны, например, в патентах США № 7837668; 8092429, описывающих доставку композиций (включая экспрессионные векторы) в головной мозг, и патентной публикации США № 20060239966, в полном объеме включенных в данный документ посредством ссылки.
[00129] Специалистам в данной области техники хорошо известен способ еx vivo трансфекции клеток для диагностики, исследований или для генной терапии (например, посредством повторной инфузии трансфицированных клеток в организм-хозяина). В предпочтительном варианте реализации изобретения клетки выделяют из организма субъекта, трансфицируют нуклеиновой кислотой ZFP, TALE или системы CRISPR/Cas (генной кДНК или мРНК) и повторно инфузируют в организм субъекта (например, пациента). В предпочтительном варианте реализации изобретения одну или более нуклеиновых кислот доставляют в виде мРНК. Также предпочтительным является применение кэпированных мРНК для повышения трансляционной эффективности и/или стабильности мРНК. В особенности предпочтительными являются кэпы ARCA (антиреверсивный аналог кэпа) или их варианты. См. патенты США US7074596 и US8153773, в полном объеме включенные в данный документ посредством ссылки. Специалистам в данной области техники хорошо известны различные типы клеток, подходящие для ex vivo трансфекции (см., например, Freshney et al., Culture of Animal Cells, A Manual of Basic Technique (3rd ed. 1994)) и перечисленные в ней ссылки в отношении обсуждения того, как выделять и культивировать клетки, полученные от пациентов).
[00130] В одном варианте реализации изобретения в ex vivo процедурах трансфекции клеток и генной терапии используют стволовые клетки. Преимуществом применения стволовых клеток является то, что они могут дифференцироваться в другие типы клеток in vitro или могут быть внесены в организм млекопитающего (например, как доноры клеток), где они прививаются в костном мозге. Известны способы дифференцировки клеток CD34+ in vitro в клинически важные типы иммунных клеток с применением таких цитокинов, как GM-CSF, IFN-γ и TNF-α (см. Inaba et al., J. Exp. Med. 176:1693-1702 (1992)).
[00131] Стволовые клетки выделяют для трансдукции и дифференцировки при помощи известных способов. Например, стволовые клетки выделяют из клеток костного мозга путем пэннинга клеток костного мозга антителами, которые связывают нежелательные клетки, такие как CD4+ и CD8+ (Т-клетки), CD45+ (пап-В-клетки), GR-1 (гранулоциты) и Iad (дифференцированные антигенпрезентирующие клетки) (см. Inaba et al., J. Exp. Med. 176:1693-1702 (1992)).
[00132] В некоторых вариантах реализации изобретения также можно применять стволовые клетки, которые были модифицированы. Например, нейрональные стволовые клетки, которым была придана устойчивость к апоптозу, можно использовать в качестве терапевтических композиций, в которых стволовые клетки содержат также ZFP TF согласно изобретению. Устойчивость к апоптозу может возникать, например, вследствие выключения BAX и/или BAK при помощи BAX- или BAK-специфических TALEN или ZFN (см. патент США № 8597912) в стволовых клетках, или тех, которые разрушаются каспазой, опять же, при помощи специфических в отношении каспазы-6 ZFN. Эти клетки можно трансфицировать ZFP TF или TALE TF, которые, как известно, регулируют мутантный Htt или Htt дикого типа.
[00133] Векторы (например, ретровирусы, аденовирусы, липосомы и т.д.), содержащие нуклеиновые кислоты терапевтических ZFP, можно вводить непосредственно в организм для трансдукции клеток in vivo. В альтернативном варианте можно вводить оголенную ДНК. Введение осуществляют любым из путей, обычно применяемых для приведения молекулы в максимальный контакт с клетками крови или ткани, включая, но не ограничиваясь этим, инъекцию, инфузию, местное применение и электропорацию. Подходящие способы введения таких нуклеиновых кислот доступны и хорошо известны специалистам в данной области техники и, хотя для введения конкретной композиции можно использовать более одного пути, конкретный путь часто обеспечивает более незамедлительную и более эффективную реакцию, чем другой путь.
[00134] Способы внесения ДНК в гемопоэтические стволовые клетки раскрыты, например, в патенте США № 5928638. Векторы, применимые для внесения трансгенов в гемопоэтические стволовые клетки, например, клетки CD34+, включают аденовирус типа 35.
[00135] Векторы, применимые для внесения трансгенов в иммунные клетки (например, T-клетки), включают неинтегрирующиеся лентивирусные векторы. См., например, Ory et al. (1996) Proc. Natl. Acad. Sci. USA93:11382-11388; Dull et al. (1998) J. Virol.72:8463-8471; Zuffery et al. (1998) J. Virol.72:9873-9880; Follenzi et al. (2000) Nature Genetics25:217-222.
[00136] Фармацевтически приемлемые носители частично определяются конкретной вводимой композицией, а также конкретным способом, применяемым для введения композиции. Соответственно, существует широкий ряд доступных подходящих составов фармацевтических композиций, как описано ниже (см., например, Remington's Pharmaceutical Sciences, 17th ed., 1989).
[00137] Как указано выше, раскрытые способы и композиции можно применять в любом типе клеток, включая, но не ограничиваясь этим, прокариотические клетки, клетки грибков, клетки простейших, клетки растений, клетки насекомых, клетки животных, клетки позвоночных, клетки млекопитающих и клетки людей. Подходящие для экспрессии белка клеточные линии известны специалистам в данной области техники и включают, но не ограничиваются этим, COS, CHO (например, CHO-S, CHO-K1, CHO-DG44, CHO-DUXB11), VERO, MDCK, WI38, V79, B14AF28-G3, BHK, HaK, NS0, SP2/0-Ag14, HeLa, HEK293 (например, HEK293-F, HEK293-H, HEK293-T), perC6, клетки насекомых, такие как Spodoptera fugiperda (Sf), и клетки грибков, такие как Saccharomyces, Pischia и Schizosaccharomyces. Также можно применять потомство, варианты и производные этих клеточных линий.
[00138] Предназначенное для введения эффективное количество будет варьироваться от пациента к пациенту и в зависимости от режима введения и места введения. Соответственно, эффективные количества наилучшим образом определит лечащий врач, который вводит композиции, а соответствующие дозировки легко может определить специалист в данной области техники. По прошествии достаточного времени для интеграции и экспрессии (как правило, 4-15 дней, например) анализ уровней терапевтического полипептида в сыворотке или других тканях и их сравнение с исходным уровнем до введения определит, является ли вводимое количество слишком низким, соответствующим правильному диапазону или слишком высоким. Подходящие схемы для начального и последующих введений также варьируются, но обычно состоят из начального введения, за которым в случае необходимости следуют повторные введения. Повторные введения можно осуществлять с различными интервалами в диапазоне от ежедневных до ежегодных или каждые несколько лет. В определенных вариантах реализации изобретения
[00139] Для доставки ZFP при помощи аденоассоциированных вирусных (AAV) векторов непосредственно в головной мозг человека можно применять диапазон дозировок 1×1010-5×1012 (или любую промежуточную величину) векторного генома на полосатое тело. Как указано, дозировки могут варьироваться в случае разных структур головного мозга или разных протоколов доставки.
Применения
[00140] Описанные в данном документе Htt-связывающие молекулы (например, ZFP, TALE, системы CRISPR/Cas, TtAgo и т.д.) и кодирующие их нуклеиновые кислоты можно использовать во множестве разных применений. Эти применения включают терапевтические способы, в которых Htt-связывающую молекулу (включая нуклеиновую кислоту, кодирующую ДНК-связывающий белок) вводят субъекту и применяют для модуляции экспрессии гена-мишени в организме субъекта. Модуляция может иметь форму репрессии, например, репрессии мутантного mHtt, с которым связано течение болезни БХ. В альтернативном варианте модуляция может иметь форму активации, когда активация экспрессии или повышение экспрессии эндогенного клеточного гена может снизить интенсивность болезненного состояния. В дополнительных вариантах реализации изобретения модуляция может представлять собой расщепление (например, одной или более нуклеазами), например, для инактивации гена мутантного Htt. Как указано выше, в случае таких применений Htt-связывающие молекулы или, скорее, кодирующие их нуклеиновые кислоты, смешивают с фармацевтически приемлемым носителем в виде фармацевтической композиции.
[00141] Htt-связывающие молекулы или кодирующие их векторы, одни или в комбинации с другими подходящими компонентами (например, липосомами, наночастицами или другими известными в данной области техники компонентами), можно готовить в виде аэрозольных препаратов (т.е. чтобы их можно было распылять) для введения путем ингаляции. Аэрозольные препараты можно вносить в находящиеся под давлением приемлемые пропелленты, такие как дихлордифторметан пропан, азот и тому подобные. Препараты для парентерального введения, например, внутривенным, внутримышечным, интрадермальным и подкожным путями, включают водные и неводные изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические средства и растворенные вещества, которые обеспечивают изотоничность препарата с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. Композиции можно вводить, например, путем внутривенной инфузии, перорально, местно, внутрибрюшинно, интравезикально или интратекально. Препараты соединений могут быть представлены в однодозовых или многодозовых запечатанных емкостях, таких как ампулы или флаконы. Растворы и суспензии для инъекций можно готовить из стерильных порошков, гранул и таблеток наподобие описанных ранее.
[00142] Вводимой пациенту дозы должно быть достаточно, чтобы со временем вызвать у пациента благоприятный терапевтический ответ. Дозу определяют, исходя из эффективности и Kд конкретной применяемой Htt-связывающей молекулы, клетки-мишени и состояния пациента, а также массы тела и площади поверхности тела пациента, лечение которого проводят. Размер дозы также определяют по наличию, природе и степени каких-либо вредных побочных эффектов, которые сопутствуют введению конкретного соединения или вектора конкретному пациенту.
[00143] В случае других применений эффективность описанных в данном документе молекул анализируют при помощи методов выявления для определения количества белка mHTT в организме пациента, например, в таких образцах, как цереброспинальная жидкость (ЦСЖ). Например, ультрачувствительный метод иммуноанализа, описанный в Wild et al. (2014) J. Neurol Neurosurg Psychiatry 85:10, можно применять для выявления (и/или количественной оценки) в образцах, полученных от пациента, наличия белка мутантного Htt, связанного с БХ. В некоторых вариантах реализации изобретения выявление изменений в уровнях mHtt в ЦСЖ обеспечивает диагностическое средство для определения прогрессирования БХ у субъекта в ответ на БХ-терапию, описанную в данном документе (например, при помощи ZFP, TALE и т.д.).
[00144] Для проведения диагностического анализа можно использовать любой подходящий формат, включая методы иммуноанализа. Например, можно проводить иммобилизацию захватывающих реагентов (например, антител, рецепторов и тому подобного) на планшете ИФА. В альтернативном варианте применяют выявляющие реагенты с ультрачувствительной иммунодетекцией на чипе для количественной оценки известными в данной области техники методами, такими как сканирование с магнитными частицами (см., например, Cornaglia et al (2014) Anal Chem 86(16):8213-23). Выявляющий реагент приводят в контакт с образцом, в котором предполагают наличие мутантного Htt, в условиях, в которых возможно связывание, и проводят количественную оценку известными в данной области техники методами.
[00145] Следовательно, так как уровни mHTT связаны с тяжестью заболевания, и при прогрессировании заболевания происходит повышение концентрации уровней, выявление mHtt в ЦСЖ или других полученных от пациента образцах позволяет отслеживать эффективность терапии Htt-связывающей молекулой при БХ, а также помогает изучать воздействие лечения на нейропатобиологию БХ и может применяться при проведении клинических исследований модифицирующих течение заболевания терапевтических средств против БХ, описанных в данном документе.
[00146] Следующие примеры относятся к типовым вариантам реализации настоящего изобретения, в которых Htt-модулятор содержит белок «цинковые пальцы» или систему CRISPR/Cas. Очевидно, что они приведены исключительно в иллюстративных целях и что возможно применение других Htt-модуляторов, включая, но не ограничиваясь этим, TALE-TF, дополнительные ZFP, ZFN, TALEN, дополнительные системы CRISPR/Cas, хоминг-эндонуклеазы (мегануклеазы) со сконструированными ДНК-связывающими доменами.
ПРИМЕРЫ
Пример 1: ZFP-TF восстанавливают фенотипы культивируемых БХ-нейронов
[00147] Различные исследования показали наличие фенотипических изменений, связанных с экспандированными CAG-повторами в клетках, полученных от пациентов с БХ, таких как уменьшение внутриклеточных уровней АТФ и повышение чувствительности к отсутствию факторов роста. См., например, Jung-Il et al. (2012) Biochemical Journal 446(3):359-371; HD IPSC Consortium (2012) Cell Stem Cell 11(2):264-278; An et al. (2012) Cell Stem Cell 11(2):253-263.
[00148] Соответственно, мы оценивали, восстанавливает ли экспрессия аллель-специфического ZFP-репрессора Htt такие фенотипы в полученных от пациентов нейронах. Вкратце, лентивирусные векторы для Venus (GFP) и ZFP-TF 33074-KOX-2A-Venus получали так, как описано в данном документе и патентной публикации США № 20130253040. Расщепляемый пептид 2A делает возможной экспрессию Venus (GFP) и ZFP из одного вектора, а ZFP-экспрессирующие клетки можно выявить по экспрессии GFP. Лентивирусные экспрессионные конструкции представляли третье поколение самоинактивирующихся ЛВ на основе ВИЧ. Экспрессионные векторы 33074 конструировали путем вставки ZFP-TF с линкером 2A и GFP-Venus ниже промотора ЦМВ. Экспрессионная конструкция GFP содержит только GFP-Venus ниже промотора ЦМВ. Рекомбинантные ЛВ готовили путем временной трансфекции клеток 293T с применением липофектамина 2000 (Life Technologies). Вирусные супернатанты собирали через 48 и 72 часа после трансфекции и фильтровали через 0,45-мкм фильтр перед 300-кратным концентрированием путем центрифугирования при 4°C (препаративная ультрацентрифуга Optima L-80K, Beckman Coulter) при 50000


[00149] БХ-ЭСК пассировали с аккутазой и культивировали на покрытых матригелем планшетах в среде Е8 (Life Technologies). Нейральные стволовые клетки получали, используя среду для нейральной индукции StemPro (Life Technologies). Вкратце, ЭСК высевали на покрытый geltrex 6-луночный планшет с 200000 клеток/лунку и по достижению 10-20% конфлюэнтности среду меняли на среду для нейральной индукции StemPro. Среду меняли каждые 2 дня, а на 7 день НСК собирали и размножали. Для культивирования БХ-НСК и не-БХ-НСК (HIP™ Globalstem) использовали среду StemPro NSC SFM (Life Technologies). НСК пассировали с аккутазой на покрытых geltrex планшетах. Дифференцировку нейронов индуцировали заменой среды на среду для нейральной дифференцировки, состоящую из нейробазальной среды с бессывороточной добавкой B-27 и GlutaMAX™ (Life Technologies). Среду меняли каждые 3-4 дня.
[00150] Дифференцированные нейроны трансдуцировали лентивирусными векторами для Venus (GFP) и ZFP-TF 33074-KOX-2A-Venus при МЗ 500. После этого супернатант замещали свежей средой для нейральной дифференцировки и поддерживали культуры до 21 дня.
[00151] Внутриклеточные уровни АТФ для культивируемых нейронов, полученных от пациента с БХ (CAG17/48) или нормального субъекта, измеряли при помощи люминесцентного анализа CellTiter-Glo® (Promega), число клеток в каждом образце определяли при помощи анализа ApoLive-Glo® (Promega). Вкратце, внутриклеточные уровни АТФ в нейронах измеряли при помощи люминесцентного анализа CellTiter-Glo (Promega) в соответствии с инструкциями производителя. Люминесценцию (ОСЕ) измеряли через 30 мин на микропланшет-ридере Perkin Elmer Wallac 1420 Victor2, а полученные значения нормировали относительно числа клеток в лунку, используя анализ ApoLive-Glo (Promega) и измеряя флуоресценцию (У.Е.). Затем значения уровней АТФ на лунку для разных клеток/типов обработки нормировали относительно уровня ложно-инфицированных БХ-нейронов.
[00152] Как показано на Фигуре 1, ложно-инфицированные или инфицированные ленти-GFP БХ-нейроны имели значительно сниженные внутриклеточные уровни АТФ по сравнению с не-БХ (нормальными) нейронами. В противоположность этому, инфицирование ленти-33074-KOX-2A-GFP приводило к ~60% повышению внутриклеточных уровней АТФ, указывая на то, что управляемая ZFP репрессия аллелей мутантного Htt нормализует нарушенный энергетический метаболизм этих клеток.
[00153] Гибель клеток БХ- и не-БХ-нейронов, индуцированную отсутствием факторов роста, определяли, используя метод ник-концевого мечения dUTP при помощи терминальной дезоксинуклеотидилтрансферазы (TUNEL). Вкратце, нейроны инфицировали ЛВ в трех повторностях, как описано выше для анализа АТФ. Клетки культивировали в течение 12 дней, затем среду меняли на свежую нейробазальную среду без каких-либо добавок (факторов роста). Клетки держали в этой не содержащей факторов роста среде в течение 48 часов. Анализ TUNEL проводили, используя набор для фрагментации ДНК ApoBrdU Red (BioVision). Нейроны фиксировали 4% параформальдегидом на льду в течение 15 мин. Апоптоз оценивали, подсчитывая TUNEL-положительные клетки в соответствии с рекомендациями производителя (набор для фрагментации ДНК ApoBrdU Red, BioVision). Проточную цитометрию применяли для определения апоптоза по окрашиванию анти-BrdU-Red и трансдукции ЛВ по GFP.
[00154] Как показано на Фигуре 2, через 48 часов отсутствия факторов роста БХ-нейроны (ложно-инфицированные) демонстрировали более высокий уровень гибели клеток (~50%), чем не-БХ-нейроны (~20%). В то время как инфицирование ленти-GFP не влияло на уровень гибели клеток в БХ-нейронах, инфицирование ленти-33074-KOX-2A-GFP приводило к значительному снижению доли нейронов среди апоптотических клеток (от ~50% до 20%).
[00155] Таким образом, управляемая ZFP репрессия мутантного Htt снижает чувствительность БХ-нейронов к отсутствию факторов роста.
Пример 2: ZFP-TF предотвращают и обращают агрегацию мутантного Htt у мышей Q175
[00156] Исследовали in vivo эффективность аллель-специфического репрессора мутантного Htt ZFP-TF (ZFP-30640 и 30645) на мышиной модели Q175 с генным нокином (Menalled et al. (2012) PLoS One 7(12):e49838), в которой экзон 1 аллеля мышиного Htt был замещен последовательностью экзона 1 человеческого Htt, которая содержит экспандированный CAG-повтор (~179 CAG). Патологическая агрегация мутантного Htt начинает выявляться в стриатуме мышей Q175 в возрасте 2 месяцев и продолжает повышаться с возрастом; агрегация становится хорошо сформировавшейся к возрасту 6 месяцев.
[00157] Чтобы исследовать, могут ли ZFP предотвращать накопление мутантного Htt в стриатуме, 2-месячным мышам Q175 проводили одностороннюю инъекцию в полосатое тело AAV-ZFP или AAV-GFP в качестве отрицательного контроля (2×1010 векторный геном/полосатое тело); экспрессией ZFP и GFP управлял промотор человеческого синапсина 1.
[00158] Через два месяца после инъекции (в возрасте 4 месяцев) получали образцы головного мозга, готовили срезы и проводили иммуногистохимический анализ, чтобы оценить экспрессию ZFP и Htt. Экспрессию ZFP выявляли при помощи антитела против эпитопной метки FLAG, а агрегацию мутантного Htt выявляли при помощи анти-Htt антитела (mEM48). Типовые изображения, полученные для мыши, которой инъецировали AAV-30645, показаны на Фигурах 3A-3H. В контралатеральной части полосатого тела, куда не проводили инъекцию, агрегация мутантного Htt (mEM48) была легко выявляема; в той части полосатого тела, куда проводили инъекцию AAV-30645, наблюдали только очень низкий уровень агрегации мутантного Htt в ZFP-экспрессирующих клетках (различаемых по положительному окрашиванию FLAG).
[00159] Как показано на Фигуре 3I, когда оценивали число агрегатов ядерного Htt на клетку для клеток FLAG(+) и GFP(+) в ипсилатеральной части полосатого тела мышей, которым инъецировали AAV-ZFP и AAV-GFP, соответственно, а затем нормировали относительно числа агрегатов на клетку в контралатеральной части полосатого тела, куда не проводили инъекцию, как ZFP-30640, так и 30645 значительно снижали (>90%) число агрегатов ядерного Htt (P<0,001, критерий Краскела-Уоллиса и множественное сравнение Данна).
[00160] Как показано на Фигуре 3J, когда интенсивность окрашивания ядерного mEM48 в ZFP- или GFP-экспрессирующих клетках нормировали относительно интенсивности в нейронах из контралатеральной части полосатого тела, наблюдали 50-60% уменьшение в интенсивности ядерного mEM48 в ипсилатеральной части полосатого тела, куда проводили инъекцию ZFP (P<0,001). Как показано на Фигуре 3K, плотность агрегатов околоядерного мутантного Htt в ZFP- или GFP-экспрессирующих клетках нормировали относительно плотности в нейронах из контралатеральной части полосатого тела, наблюдали 45-70% уменьшение в плотности агрегатов околоядерного Htt в части полосатого тела, куда проводили инъекцию ZFP (P<0,01).
[00161] Эти результаты показывают, что в случае проведения инъекции в 2-месячном возрасте ZFP-TF предотвращали агрегацию мутантного Htt в стриатуме мышей Q175 в возрасте 4 месяцев.
[00162] Чтобы исследовать, могут ли ZFP обращать хорошо сформировавшуюся агрегацию Htt, 6-месячным мышам Q175 проводили одностороннюю инъекцию в полосатое тело AAV-GFP-2A-ZFP; расщепляемый пептид 2А делает возможной экспрессию GFP и ZFP из одного вектора, а ZFP-экспрессирующие клетки можно выявлять по экспрессии GFP. В возрасте 8 месяцев получали образцы головного мозга, готовили срезы и проводили иммуногистохимический анализ, чтобы оценить агрегацию Htt. Типовые изображения, полученные для мыши, которой инъецировали AAV-GFP-2A-ZFP, показаны на Фигуре 4A. Антитело к DARPP-32, которое представляет собой стриатум-специфический белок, использовали, чтобы метить полосатое тело. В контралатеральной части полосатого тела, куда не проводили инъекцию, наблюдали высокий уровень агрегации мутантного Htt (выявляемого при помощи антитела mEM48); в ипсилатеральной части полосатого тела, куда проводили инъекцию AAV-GFP-2A-ZFP, наблюдали уменьшение агрегации мутантного Htt.
[00163] Кроме того, оценивали число агрегатов ядерного Htt на клетку для клеток GFP(+) в ипсилатеральной части полосатого тела мышей, которым инъецировали AAV-GFP-2A-ZFP и AAV-GFP, а затем нормировали относительно числа агрегатов на клетку в контралатеральной части полосатого телаполосатого тела, куда не проводили инъекцию. Как показано на Фигуре 4B, доставка GFP-2A-30640 приводила к ~20% снижению числа агрегатов ядерного Htt (P<0,001, критерий Краскела-Уоллиса и множественное сравнение Данна), доставка GFP-2A-30645 также приводила к небольшому снижению числа агрегатов ядерного Htt на клетку.
[00164] Интенсивность окрашивания ядерного mEM48 в клетках GFP(+) из ипсилатеральной части полосатого тела мышей, которым инъецировали AAV-GFP-2A-ZFP и AAV-GFP, также нормировали относительно интенсивности в нейронах из контралатеральной части полосатого тела. Как показано на Фигуре 4C, наблюдали приблизительно 20% уменьшение (P<0,001) в интенсивности ядерного mEM48 в части полосатого тела, куда инъецировали GFP-2A-30645. Также наблюдали приблизительно 10% уменьшение в интенсивности ядерного mEM48 в части полосатого тела, куда инъецировали GFP-2A-30640.
[00165] Определяли плотность агрегатов околоядерного мутантного Htt в клетках GFP(+) в ипсилатеральной части полосатого тела мышей, которым инъецировали AAV-GFP-2A-ZFP и AAV-GFP, и нормировали относительно плотности в нейронах из контралатеральной части полосатого тела. Как показано на Фигуре 4D, наблюдали 30-50% уменьшение (P<0,001) в плотности агрегатов околоядерного мутантного Htt в части полосатого тела, куда инъецировали ZFP.
[00166] Эти результаты показывают, что в случае проведения инъекции в 6-месячном возрасте ZFP-TF обращали существующую до этого агрегацию мутантного Htt в стриатуме мышей Q175 уже через 2 месяца. Более значительное уменьшение агрегации мутантного Htt ожидается, если экспрессия ZFP будет длиться более 2 месяцев перед проведением анализа головного мозга мышей.
[00167] Вместе эти данные демонстрируют, что репрессоры аллеля мутантного Htt, доставляемые в головной мозг субъектов с БХ, приводят к повышению уровней внутриклеточной концентрации АТФ в БХ-нейронах, снижению апоптоза в БХ-нейронах и предотвращают и снижают количество существующих агрегатов Htt.
Пример 3: Эффективность обработки ZFP-TF
[00168] Проводили диагностическое исследование на субъектах, обрабатываемых Htt-связывающей молекулой (например, ZFP-TF, TALE-TF и т.д.), которая является специфической в отношении аллеля мутантного Htt. Субъектов с БХ обрабатывали Htt-связывающими молекулами, как описано в данном документе. ЦСЖ получали от субъектов стандартными методами (например, методом люмбарной пункции), а затем известными в данной области техники методами выявляли и количественно оценивали белок mHtt (см. Wild et al, ibid). Уровни белка mHtt в ЦСЖ снижались после проведения терапии, как описано в данном документе.
Пример 4: ZFP-TF предотвращает и снижает агрегацию мутантного Htt у мышей Q175 и повышает экспрессию гена DARPP32.
[00169] Оценивали in vivo эффективность другого аллель-специфического репрессора мутантного Htt ZFP-TF (ZFP-33074) на мышиной модели Q175 с генным нокином (Menalled et al. (2012) PLoS One 7(12):e49838), в которой экзон 1 аллеля мышиного Htt был замещен последовательностью экзона 1 человеческого Htt, которая содержит экспандированный CAG-повтор (~179 CAG). Патологическая агрегация мутантного Htt начинает выявляться в стриатуме мышей Q175 в возрасте 2 месяцев и продолжает повышаться с возрастом; агрегация становится хорошо сформировавшейся к возрасту 6 месяцев.
[00170] Чтобы исследовать, могут ли ZFP предотвращать накопление мутантного Htt в стриатуме, 2-месячным мышам Q175 проводили одностороннюю инъекцию в полосатое тело AAV-ZFP-2A-GFP или AAV-GFP в качестве отрицательного контроля (2×1010 векторного генома/полосатое тело); экспрессией ZFP и GFP управлял промотор человеческого синапсина 1. Саморасщепляемый пептид 2А делает возможной экспрессию GFP и ZFP из одного вектора, а ZFP-экспрессирующие клетки можно выявлять по экспрессии GFP.
[00171] Через два месяца после инъекции (в возрасте 4 месяцев) получали образцы головного мозга, готовили срезы и проводили иммуногистохимический анализ, чтобы оценить экспрессию Htt. Трансдуцированные клетки метили GFP, средние шипиковые нейроны (СШН) метили антителом DARPP32, а агрегацию мутантного Htt выявляли при помощи анти-Htt антитела (mEM48).
[00172] Как показано на Фигуре 5A, в AAV-трансдуцированных СШН (меченых GFP и антителом DARPP32), число агрегатов или включений ядерного Htt на клетку было значительно снижено благодаря ZFP 33074 (P<0,001). На Фигуре 5B показано, что плотность агрегатов внеядерного мутантного Htt в AAV-трансдуцированных клетках была значительно снижена в обработанной ZFP части полосатого тела. (P<0,0001). На Фигуре 5C показано, что интенсивность окрашивания ядерного mEM48 (мутантный Htt) была значительно снижена у обработанных ZFP мышей (P<0,001).
[00173] Эти результаты показывают, что в случае проведения инъекции в 2-месячном возрасте ZFP 33074 предотвращает агрегацию мутантного Htt в стриатуме мышей Q175.
[00174] Чтобы исследовать, могут ли ZFP снижать агрегацию Htt после того, как она формируется в стриатуме Q175, 6-месячным мышам Q175 проводили одностороннюю инъекцию в полосатое тело AAV-GFP-2A-ZFP или AAV-GFP. В возрасте 10 месяцев получали образцы головного мозга, готовили срезы и проводили иммуногистохимический анализ.
[00175] На Фигуре 6А показано, что в AAV-трансдуцированных СШН (меченых GFP и антителом DARPP32), число агрегатов/включений ядерного Htt на клетку было значительно снижено благодаря ZFP 33074 (P<0,001). На Фигуре 6В показано, что плотность агрегатов внеядерного мутантного Htt в AAV-трансдуцированных клетках была значительно снижена в обработанной ZFP части полосатого тела. (P<0,0001). На Фигуре 6С показано, что интенсивность окрашивания ядерного mEM48 (мутантный Htt) была значительно снижена у обработанных ZFP мышей (P<0,001).
[00176] На Фигуре 7А показано, что у 10-месячных мышей Q175 снижена экспрессия маркера СШН DARPP32 (P<0,05) по сравнению с мышами дикого типа того же возраста, что позволяет предположить дегенерацию СШН у этих мышей. На Фигуре 7В показано, что, когда мышей Q175 инъецировали AAV-ZFP-2A-GFP в возрасте 6 месяцев и анализировали в отношении экспрессии DARPP32 в возрасте 10 месяцев, было обнаружено значительное повышение экспрессии DARPP32 у обработанных ZFP 33074 мышей по сравнению с обработанными контролем мышами.
[00177] Вместе эти результаты демонстрируют, что в случае проведения инъекции в 6-месячном возрасте ZFP 33074 способен снижать экспрессию и агрегацию мутантного Htt при наличии существующих агрегатов. Кроме того, ZFP 33074 способен восстанавливать экспрессию DARPP32, что позволяет предположить наличие защиты СШН. ДНК-связывающий домен (ДСД), который привлекает ZFP к экспандированному CAG-повтору, является необходимым, так как контрольный вектор, в котором отсутствовал ДСД (ZFP ΔДСД) не оказывал влияние на агрегацию мутантного Htt или экспрессию DARPP32.
Пример 5: CRIPSR/Cas-TF предотвращает и снижает агрегацию мутантного Htt в БХ-нейронах
[00178] sgРНК для применения в системе CRISPR/Cas получают синтетически известными в данной области техники способами (см. Hsu et al (2013) Nature Biotech doi:10.1038/nbt.2647 или Sternberg et al, (2014) Nature 507: 62). sgРНК сконструированы так, как описано выше, и предназначены для нацеливания на последовательность в mHtt. Например, sgРНК могут иметь одну из следующих последовательностей, в которых подчеркнуты последовательности РАМ:
5' GCAGCAGCAGCAGCAGCAGCAGCAGCAG 3' SEQ ID NO:122
5'GCAGCAGCAGCAGCAGCAGCAGCAG 3' SEQ ID NO:123
5'GCAGCAGCAGCAGCAGCAGCAG 3' SEQ ID NO:124
5'GCAGCAGCAGCAGCAGCAG 3' SEQ ID NO:125
[00179] Транскрипционные факторы CRISPR/Cas получают в соответствии с известными в данной области техники способами (см., например, Perez-Pinera (2013) Nature 10(10):973 и Qi and Arkin (2014) Nature Reviews Microbiology 12:341). Вкратце, используют дефектный нуклеазный белок Cas9 и сливают его с репрессионным доменом (т.е. KRAB).
[00180] Культивируемые БХ-нейроны трансфицируют слитым белком Cas9(нуклеаза)-KRAB, кодирующим мРНК (20 мкг/мл) и sgРНК, как описано выше, при этом sgRNA вносят при помощи мРНК- (например, 2-4 мкг) или ДНК-экспрессионного вектора (например, 400 нг - 800 нг) путем электропорации с применением BTX ECM830. Клетки собирают через 5 дней и проводят количественный анализ Taqman для измерения экспрессии mHtt. Кроме того, с клетками проводят дополнительные описанные выше эксперименты, чтобы измерить внутриклеточные уровни АФТ и проанализировать апоптоз. Данные показывают, что специфические в отношении мутантного mHtt транскрипционные факторы CRISPR/Cas с применением sgРНК могут репрессировать экспрессию mHtt и уменьшать степень фенотипических характеристик, появляющихся вследствие агрегации белка mHtt.
Пример 6: Уменьшение двигательных дефектов
[00181] Животным (например, мышам) вводят описанные в данном документе репрессоры Htt и регулярно исследуют их хватательную реакцию, являющуюся хорошо изученным двигательным дефектом, демонстрируемым этими животными (Mangiarini et al. 1996 Cell 87, 493-506). Вкратце, каждое животное извлекают из его домашней клетки и помещают на крышу клетки. Затем наблюдатель аккуратно, плавным движением тянет животное назад и вверх, пока животное не оказывается подвешенным приблизительно в 12 дюймах (30,5 см) над поверхностью. Затем животное оценивают в течение 30 секунд. Если наблюдается хватательная реакция только передних конечностей, животному приписывают оценку 1. Если наблюдается хватательная реакция только задних конечностей, животному приписывают оценку 2. Если наблюдается хватательная реакция задних и передних конечностей, но не в одно время, животному приписывают оценку 3. Полная хватательная реакция, определяемая как одновременное сильное сжатие задних и передних конечностей, оценивается в 4. После 30 секунд в подвешенном состоянии животное возвращают в клетку. Для каждой группы обработки, а также для однопометных животных дикого типа того же возраста определяли долю животных, которые демонстрировали полную хватательную реакцию (оценка 4) при каждом еженедельном наблюдении.
[00182] По сравнению с контролем (отсутствие репрессоров Htt) описанные в данном документе репрессоры Htt улучшали хватательную реакцию, являющуюся хорошо изученным двигательным дефектом.
[00183] Все упоминаемые в данном документе патенты, патентные заявки и публикации в полном объеме и во всех смыслах включены в данный документ посредством ссылки.
[00184] Хотя изобретение было довольно подробно описано при помощи иллюстраций и примеров в целях ясности понимания, для специалистов в данной области техники очевидно, что возможна практическая реализация различных изменений и модификаций без отступления от сущности и объема изобретения. Соответственно, вышеприведенные описание и примеры не должны считаться ограничивающими.
Реферат
Изобретение относится к медицине, а именно к неврологии, и может быть использовано для уменьшения экспрессии мутантного гена хантингтина (mHTT) для уменьшения или предотвращения образования агрегатов Htt у субъекта с болезнью Хантингтона (БХ). Для этого проводят введение в стриатуму субъекта полинуклеотида, кодирующего репрессор мутантного аллеля Htt (mHtt), где репрессор включает белок «цинковые пальцы», обозначенный 30640, 30645 или 33074, где полинуклеотид содержит аденоассоциированный вирусный вектор (AAV), введенный в 2x10векторных геномов, где репрессор транскрипционного фактора снижает экспрессию mHtt по меньшей мере на 85% в БХ-нейронах в стриатуме субъекта. Изобретение обеспечивает уменьшение и/или устранение агрегатов хантингтина (Htt), уменьшение двигательных дефектов, повышение клеточной активности (например, АТФ-активности) и/или уменьшение апопотоза у субъекта с БХ. 6 з.п. ф-лы, 7 ил., 3 табл., 6 пр.

Комментарии