Способ получения химически полисиалированной рекомбинантной бутирилхолинэстеразы человека - RU2645458C2
Код документа: RU2645458C2
Чертежи









Описание
Область техники
Изобретение относится к области фармацевтической промышленности, более конкретно к способам получения рекомбинантных ферментов, и в частности, к новому способу получения бутирилхолинэстеразы, системе для производства бутирилхолинэстеразы, бутирилхолинэстеразе, полученной предложенным способом, фармацевтическим композициям, содержащим бутирилхолинэстеразу, способам лечения или предотвращения заболеваний, нарушений и состояний, требующих введения бутирилхолинэстеразы, а также к применению бутирилхолинэстеразы, полученной указанным способом.
Уровень техники
Бутирилхолинэстераза (БуХЭ, номер по Классификации ферментов 3.1.1.8, также известна под названиями псевдохолинэстераза, холинэстераза сыворотки, ВСНЕ, BuChE), представляет собой фермент класса гидролаз, катализирующий расщепление сложных эфиров холина. Нативная чБуХЭ (бутирилхолинэстераза человека) представляет собой сложную сериновую эстеразу, состоящую из четырех идентичных субъединиц, включающих 574 аминокислоты, которые удерживаются вместе за счет нековалентных взаимодействий, и около 40 углеводных цепей (Rosenberg, 2010).
Бутирилхолинэстераза выполняет в организме защитные функции. Этот фермент способен метаболизировать кокаин и его производные с образованием нетоксичных продуктов распада, поэтому ее используют при передозировке кокаина. Также бутирилхолинэстераза способна нейтрализовать токсичное воздействие фосфорорганических соединений. В небольших количествах она продуцируется в организме человека. Однако ее количества настолько малы, что не способны защитить человека при отравлении. Риск отравления фосфорорганическими агентами, воздействующими на нервную систему, связан, например, с их применением в военных целях и при террористической угрозе, при авариях во время хранения, транспортировки и использования инсектицидов, а также при передозировке органофосфатов, использующихся для наркоза, в лечении нейродегенеративных заболеваний и в офтальмологии.
Известно, что введение в кровь животным сывороточной холинэстеразы лошади или рекомбинантной холинэстеразы человека (рБУХЭ) защищает их от смертельных доз зарина, зомана, нервнопаралитических агентов (Vx-агентов) и других соединений, относящихся к фосфорорганическим соединениям, а также карбаматов. Хотя плазма крови человека может служить источником нативной чБуХЭ, это сырье является достаточно дорогим, объемы его ограничены, а получение и очистка требуют больших затрат времени и материалов при том, что очистка не устраняет опасность заражения инфекционными агентами, содержащимися в плазме, полностью. В связи с этим, получение бутририлхолинэстеразы биотехнологическими способами является актуальной и важной задачей.
Традиционно, бутирилхолинэстераза считается очень сложной для производства молекулой. За последнее десятилетие были предприняты многочисленные попытки осуществить трансгенную экспрессию чБуХЭ с использованием трансгенных животных (мышей и коз), а также растений и микроорганизмов, но ни одно из этих исследований не обеспечило экономически эффективного способа получения БуХЭ, одобренной для введения человеку.
В частности, экспрессия рБуХЭ (рекомбинантной бутирилхолинэстеразы) в прокариотических клетках привлекательна с точки зрения относительной дешевизны исходных материалов, однако продукция в микроорганизмах не обеспечивает правильного скручивания и гликозилирования и дает неактивный или слабоактивный фермент.
Экспрессия рБуХЭ в дрожжевых клетках также является относительно экономически эффективной, обеспечивает скручивание и гликозилирование продукта, однако активность получаемой бутирилхолинэстеразы все же недостаточна.
Производство рБуХЭ с использованием трансгенных животных дает активный фермент, часто характеризуется высоким уровнем продукции, однако является сравнительно затратным и связано с определенными этическими проблемами.
Продукция бутирилхолинэстеразы в культурах эукариотических клеток позволила бы решить большую часть указанных проблем. Однако существующие системы эукариотической продукции не позволяют достичь высокого выхода продукта, а также получить фермент, который обладал бы достаточной стабильностью в кровотоке и, соответственно, был бы достаточно эффективен при применении in vivo.
Соответственно, существует потребность в эффективном способе производства активной бутирилхолинэстеразы, которую можно было бы вводить человеку с целью защиты от нарушений, вызванных фосфорорганическими и карбаматными соединениями.
Задачи изобретения
Задачей настоящего изобретения является создание эффективной системы экспрессии бутирилхолинэстеразы человека, которая обеспечивала бы высокий выход формы бутирилхолинэстеразы, подходящей для введения человеку и обладающей достаточной фармакологической активностью и стабильностью in vivo.
Краткое описание изобретения
Один аспект настоящего изобретения представляет собой способ получения сиалированной рекомбинантной бутирилхолинэстеразы человека, включающий стадии:
- культивирования клеток СНО, трансформированных вектором экспрессии, содержащим ген бутирилхолинэстеразы человека с сайтом полиаденилирования под контролем промотора фактора элонгации (EF) человека и ген маркера селекции, и вектором экспрессии, содержащим ген PRAD с сайтом полиаденилирования под контролем промотора фактора элонгации (EF) человека и ген маркера селекции, в безбелковой питательной среде;
- очистки полученной рекомбинантной бутирилхолинэстеразы человека последовательно путем ультра-фильтрации, аффинной хроматографии, анионообменной хроматографии и диафильтрации;
- химического сиалирования выделенной рекомбинантной бутирилхолинэстеразы человека при pH 6,0-7,0 в присутствии цианоборгидрида.
Другой аспект настоящего изобретения представляет собой сиалированную рекомбинантную бутирилхолинэстеразу, полученную предложенным способом.
Далее предложена фармацевтическая композиция для лечения, предотвращения, подавления или снижения токсических эффектов фосфорорганических соединений, содержащая бутрилхолинэстеразу согласно настоящему изобретению в эффективном количестве и фармацевтически приемлемый носитель.
Другой аспект относится к способу лечения, предотвращения, подавления или снижения токсических эффектов фосфорорганических соединений у животного, включающему введение указанному животному бутирилхолинэстеразы или композиции согласно настоящему изобретению.
Краткое описание чертежей
На Фиг. 1 показаны схемы создания плазмид pcDNA/CMV/BCHE (A), pBudCE/EF/BCHE (Б), pcDNA/CMV/PRAD (В), pcDNA/EF/PRAD (Г), а также электрофореграммы продуктов рестрикции плазмид pcDNA3.1/Hygro (Д, 1) и pGS/CMV/BCHE (Д, 2) по сайтам HindIII-ApaI, плазмид pBudCE/EF (Е, 1) и pBudCE/EF/BCHE (Е, 2) по сайту Bg/II, и электрофореграмма плазмид pRc/RSV-rQ45 (Ж, 1), pcDNA/CMV/PRAD (Ж, 3), pcDNA/EF/PRAD (Ж, 5), а также указанных плазмид, обработанных эндонуклеазами рестрикции SpeI-XnoI (Ж, 2; Ж, 4; Ж, 6, соответственно). М - маркер.
На Фиг. 2 показаны: (А) анализ эффективности временной трансфекции клеток линии СНО экспрессионными конструкциями pBudCE/EF/BCHE, pGS/CMV/BCHE и pcDNA/CMV/BCHE; (Б) сравнительный анализ продукции БуХЭ отобранными моноклонами после стабильной трансфекции клеток линии СНО линеаризованной конструкцией pBudCE/EF/BChE; (В) анализ подбора условий экспрессии рекомбинантной БуХЭ человека клоном A3 в различных ростовых средах; (Г) анализ олигомерного состава рБуХЭ методом Карновского. Разделение БуХЭ осуществляли в 8% ПААГ в неденатурирующих условиях. 1 - культуральная среда клона A3, 2 - культуральная среда клона A3 после временной трансфекции конструкцией pcDNA/CMV/PRAD, 3 - культуральная среда клона A3 после временной трансфекции конструкцией pcDNA/EF/PRAD, 4 - культуральная среда клона А3Н9, 5 - образец плазмы крови человека, 6 - образец коммерчески доступной бутирилхолинэстеразы плазмы крови человека (Sigma, США), 7 - образец очищенной бутирилхолинэстеразы плазмы крови человека; (Д) оценка уровня экспрессии БуХЭ при длительной экспрессии клона A3 при различных концентрациях бычьей фетальной сыворотки.
На Фиг. 3 показан градиентный ПААГ (4-30%) в неденатурирующих условиях, окрашенный по методике M.J. Karnovski и L. Roots. Образцы плазмы крови человека (1), бутирилхолинэстеразы (Sigma) (3-5) 1,6 нг, 0,8 нг, 0,4 нг, соответственно, и образцы культуральной среды клона A3 (7,8).
На Фиг. 4 приведены результаты иммунодетекции рекомбинантного пептида PRAD. Образцы (1 - маркер, 2 - клетки до индукции, 3 - клетки после индукции, 4 - растворимая фракция, 5 - нерастворимая фракция) разделяли на ДДС-ПААГ 12% и далее переносили на мембрану Hybond C-extra (Amersham, США). Детекцию пептида проводили инкубацией мембраны с моноклональными антителами к FLAG эпитопу, конъюгированными с пероксидазой хрена.
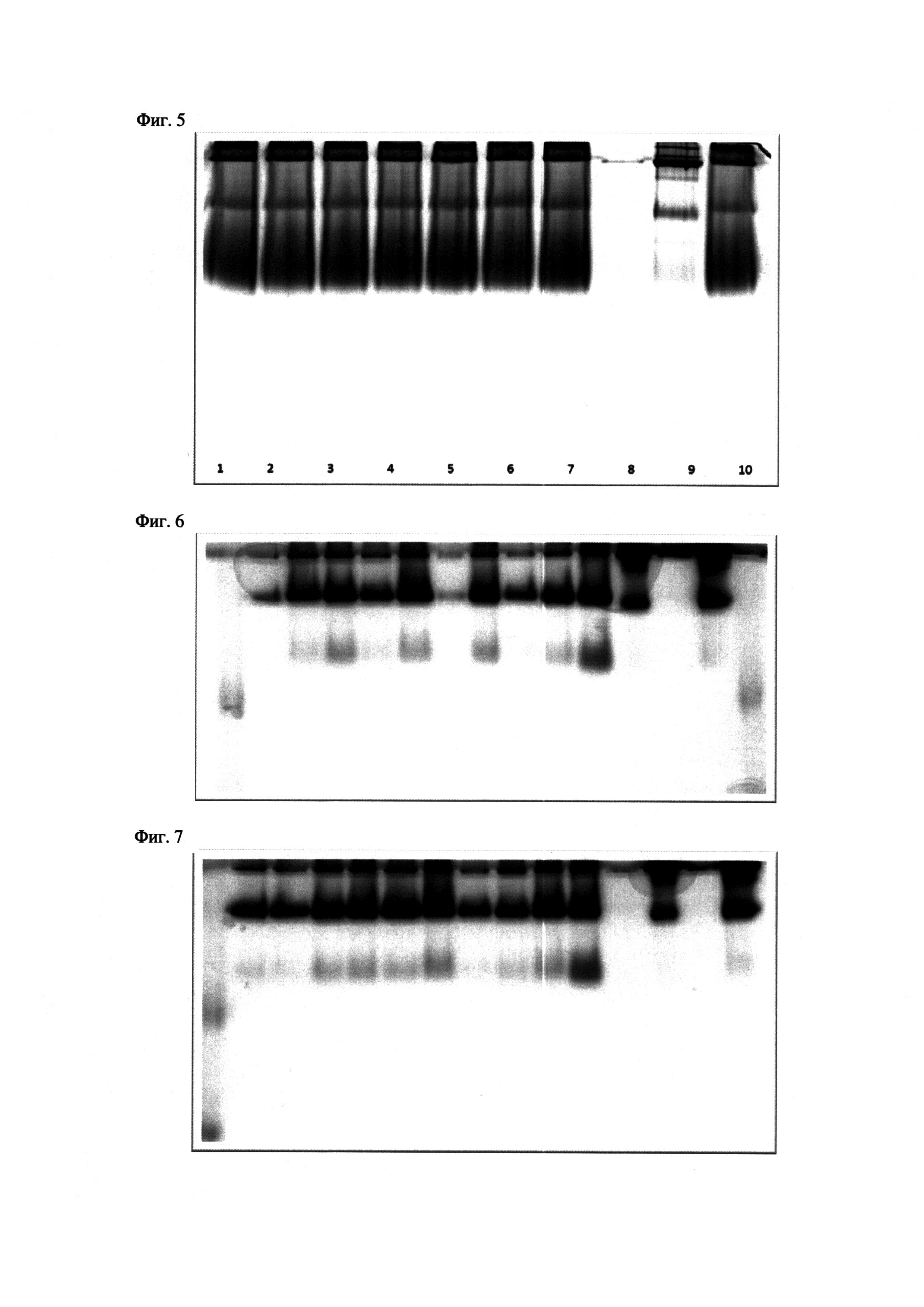
На Фиг. 5 показан ПААГ (8%) в неденатурирующих условиях, окрашенный по методике M.J. Karnovski и L. Roots. 1 - Гидролизат: среда = 1:1,2-1:2,3-1:4,4-1:10,5-1:20,6 гидролизат с 8М мочевиной - 1:10,7-1:20,9 - высокоочищенный тетрамер БуХЭ, 10 - кондиционная среда A3 клона.
На Фиг. 6 показан ПААГ (8%) в неденатурирующих условиях, окрашенный по методике M.J. Karnovski и L. Roots. 1 - маркер, 2 - A3A3F4, 3 - A3A3F5, 4 - А3А3Н5, 5 - А3А3Е6, 6 - A3A3D7, 7 - A3A3D10, 8 - A3A3G11, 9 - А3А3С12, 10 - А3А3Е12, 11 - A3, 12 - очищенный тетрамер БуХЭ, 1 мкг, 13 - пустая дорожка, 14 - очищенный тетрамер БуХЭ, 4 мкг.
На Фиг. 7 показан ПААГ (8%) в неденатурирующих условиях, окрашенный по методике M.J. Karnovski и L. Roots. 1 - маркер, 2 - А3А3В2, 3 - А3А3С2, 4 - А3А3А3, 5 - А3А3С3, 6 - A3A3D3, 7 - A3A3F3, 8 - A3A3G3, 9 - А3А3Н3, 10 - А3А3С4, 11 - A3, 12 - пустая дорожка, 13 - очищенный тетрамер БуХЭ, 1 мкг, 14 - пустая дорожка, 15 - очищенный тетрамер БуХЭ, 4 мкг.
На Фиг. 8 показана схема культивирования клона А3Н9.
На Фиг. 9 показаны (А) схема реакции химического полисиалирования рсБуХЭ и (Б-Е) результаты поэтапного подбора оптимальных условий реакции химического полисиалирования. Остаточная активность и выход реакции изображены сетчатой и сплошной плоскостями соответственно.
На Фиг. 10 показаны результаты масс-спектрометрического анализа химической модификации полисиаловыми кислотами. РчБуХЭ и рчБуХЭ-CAO27 были обработаны α(2->3,6,8,9) нейрамидазой и ацилированы йодацетамидом. Полученные смеси были очищены методом белкового ПААГ. Полосы белка, соответствующие десиалированной БуХЭ, элюировали из геля и подвергали трипсинолизу. Полученные пептидные смеси изучали на масс-спектрографе с ионизацией электроспреем. Исследование выполнено на базе Института биохимической медицины РАМН.
На Фиг. 11 показаны: (А) Схематическое изображение процесса очистки рчБуХЭ; (Б) Анализ олигомерного состава очищенной рчБуХЭ и конъюгата рчБуХЭ-САО27 методом Карновского; (В) Электрофореграмма основных фракций, собранных в процессе очистки и химической модификации рчБуХЭ. 10% ПААГ в восстанавливающих условиях, 1 - кондиционная среда клона А3Н9, 2 - концентрат кондиционной среды, 3 - элюат после аффинной хроматографии, 4 - элюат после ионообменной хроматографии, 5 - конъюгат рчБуХЭ-CAO27, 6 - бутирилхолинэстераза плазмы крови человека. Стрелками отмечено смещение полосы белка в результате химической модификации. (Г) Анализ целостности С-концевого фрагмента рчБуХЭ.
На Фиг. 12 показаны фармакодинамические кривые выведения из крови препаратов рчБуХЭ и рчБуХЭ-CAO27.
На Фиг. 13 приведены результаты наблюдений за животными, защищенными от действия агента VR препаратами рчБуХЭ-CAO27 и чБуХЭ, в тестах ⋅ʺОткрытое полеʺ (А-В) и испытании на физическую выносливость на третбане (Г). Животных наблюдали до начала эксперимента за сутки до введения препаратов (1) белков, в момент введения (2) и после отравления агентом VR (3). Медианное значение контрольной группы во всех экспериментах - 100%, штрихованные полосы представляют интерквантильный разброс значений для контрольной группы.
Подробное описание
Авторы настоящего изобретения разработали новый подход к получению соответствующим образом сиалированной бутирилхолинэстеразы, обладающей высокой активностью в организме животного.
Проведенные авторами в ходе создания изобретения исследования показали, что культивирование клеток СНО, трансформированных вектором экспрессии, содержащим ген бутирилхолинэстеразы человека с сайтом полиаденилирования под контролем промотора фактора элонгации (EF) человека и ген маркера селекции, и вектором экспрессии, содержащим ген PRAD с сайтом полиаденилирования под контролем промотора фактора элонгации (EF) человека и ген маркера селекции, в безбелковой питательной среде в сочетании с определенной последовательностью стадий очистки (ультрафильтрация, аффинная хроматография, анионобменная хроматография, диафильрация) привело к увеличению удельной специфической активности рекомбинатного фермента. При этом использование безбелковой среды позволило ввести стадию анионообменной хроматографии, что обеспечило существенное увеличение чистоты препарата без существенных потерь белка на стадиях очистки.
Культивирование и трансформацию клеток осуществляют в соответствии с любыми подходящими процедурами и с использованием любых материалов, известных специалисту.
Клетки СНО (линия клеток яичника китайского хомячка) могут быть получены из любой линии или популяции клеток СНО, в частности, доступные в Европейской коллекции клеточных культур (ЕСАСС), Американской коллекции типовых клеточных культур (АТТС), Российской коллекции клеточных культур (РККК) и др., и может представлять собой клетку, выбранную из клеток линий СНО-К1, CHO-K1v, K2, L2, СНО Еро-2, СНО-S, CHO-DP и любых других подходящих линий.
В качестве векторов экспрессии, содержащих ген бутирилхолинэстеразы, может быть использован вектор экспрессии, содержащий ген бутирилхолинэстеразы человека под контролем эукариотических промоторов, например, синтетических промоторов.
В одном из вариантов реализации промотор, содержащийся в векторе, несущем ген бутирилхолинэстеразы человека, выбран из группы, состоящей из: SV40/FerH/mEF1, hEF1-HTLV, hFerL и hFerH.
В конкретном варианте реализации эукариотический промотор представляет собой промотор фактора элонгации (EF) человека.
Нуклеотидная последовательность, кодирующая чБуХЭ, может представлять собой любую известную последовательность гена чБуХЭ или вариант известного гена чБуХЭ, кодирующий функциональную бутирилхолинэстеразу.
Ген маркера селекции может представлять собой любой ген, совместимый с клетками СНО, например, ген устойчивости к зеоцину, гигромицину, неомицину.
В одном из способов реализации вектор, содержащий ген бутирилхолинэстеразы человека, содержит дополнительно непромоторные регуляторы экспрессии, такие как например, энхансеры например, энахансер CMV мыши, и/или MAR/SAR-последовательности, такие как MAR-последовательность гена β-интерферона человека.
Стадии очистки осуществляют в соответствии с процедурами, известными специалисту, в частности, как описано в разделе «Примеры» настоящей заявки.
Безбелковая среда представляет собой любую среду, позволяющую исключить загрязнение целевого белка другими белками, в частности представляет собой безбелковую среду, и в предпочтительном варианте представляет собой такую среду, как ProCHO4 или ProCHO6 (Lonza, Basel, Швейцария).
Далее, для сиалирования очищенной согласно настоящему изобретению бутирилхолинэстеразы используют окисленную каламиновую кислоту (САО), предпочтительно САО со средней молекулярной массой 27кДа (CAO27). САО может быть приобретена в коммерческом источнике или получена, например, как описано в WO-A-9222331.
Получение паттерна сиалирования, обеспечивающего оптимальные фармакокинетические свойства и одновременно высокую активность, зависит от многих параметров процесса сиалирования, взаимное влияние которых плохо поддается предсказанию. Соответственно, невозможно предсказать, какой набор параметров может обеспечить оптимальное сиалирование конкретного фермента.
Проведя серию экспериментов, авторы настоящего исследования обнаружили набор условий полисиалирования, который позволил сохранить выход активного коньюгата при увеличении его специфической активности до более 85% от теоритически возможной, а также увеличить время полувыведения в 6 раз относительно немодифицированного аналога и полностью сохранить активный центр фермента и его активность в отношении фосфорорганических токсинов.
В одном из вариантов осуществления настоящего изобретения полисиалирование осуществляют при соотношении [САО]/[БуХЭ] от 20 до 100, предпочтительно от 20 до 80, более предпочтительно: от 30 до 70, более предпочтительно: от 40 до 60, и наиболее предпочтительно приблизительно 50.
В следующем варианте осуществления настоящего изобретения полисиалирование осуществляют при температуре инкубации от 4 до 37°С, более предпочтительно: от 10 до 30°С, более предпочтительно: от 15 до 30°С; более предпочтительно: от 20 до 30°С; более предпочтительно: от 22 до 27°С и наиболее предпочтительно при температуре приблизительно 25°С.
В следующем варианте осуществления настоящего изобретения полисиалирование осуществляют при pH от 6,0 до 7,5, предпочтительно, при pH от 6,5 до 7,0, наиболее предпочтительно, при pH, приблизительно равном 6,9.
В следующем варианте осуществления настоящего изобретения полисиалирование осуществляют в присутствии цианоборгидрида. В одном из вариантов реализации концентрация цианоборгидрида составляет от 2,5 до 4 мг/мл, наиболее предпочтительно: 3,16 мг/мл.
В одном из аспектов осуществления процесс сиалирования включает любую комбинацию перечисленных выше вариантов условий.
Что касается бутирилхолинэстеразы, полученной способом согласно настоящему изобретению, такой фермент может характеризоваться масс-спектром, представленным на Фиг. 10.
Также настоящее изобретение относится к композиции для лечения, предотвращения, подавления или снижения токсических эффектов фосфорорганических соединений, содержащей бутирилхолинэстеразу согласно настоящему изобретению в эффективном количестве и фармацевтически приемлемый носитель.
Композиция согласно настоящему изобретению может содержать любые фармацевтически пригодные вспомогательные ингредиенты и может быть приготовлена любым способом, известным специалисту, например, из Remington: The Science And Practice Of Pharmacy (Lippincott Williams & Wilkins, 2006, 2393 стр. , или любого аналогичного издания. Качественный и количественный состав вспомогательных ингредиентов (носители, наполнители, увлажняющие и солюбилизирующие агенты и пр.) будет зависеть от желаемой формы и пути введения. В предпочтительном случае композицию согласно настоящему изобретению вводят путем инъекции.
Эффективное количество бутирилхолинэстеразы может быть определено специалистом и может быть рассчитано таким образом, чтобы обеспечивать доставку ориентировочно, например, 1-1000 мг/кг массы субъекта, приблизительно 0,01, приблизительно 1, приблизительно 5, приблизительно 10, приблизительно 20, приблизительно 30, приблизительно 40, приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 90, приблизительно 100, приблизительно 150, приблизительно 200, приблизительно 250, приблизительно 300, приблизительно 350, приблизительно 400, приблизительно 450, приблизительно 500, приблизительно 550, приблизительно 600, приблизительно 650, приблизительно 700, приблизительно 750, приблизительно 800, приблизительно 850, приблизительно 900, приблизительно 950, приблизительно 1000 мг/кг массы субъекта или может представлять собой любое значение, лежащее между приведенными выше значениями, а также может быть выше или ниже в зависимости от конкретных задач и условий введения.
Далее настоящее изобретение относится к способу лечения, предотвращения, подавления или снижения токсических эффектов фосфорорганических соединений у животного, включающему введение указанному животному бутирилхолинэстеразы или фармацевтической композиции согласно настоящему изобретению.
В предпочтительном варианте осуществления изобретения введение осуществляют до контакта животного с фосфорорганическим соединением. В некоторых вариантах реализации введение бутирилхолинэстеразы или фармацевтической композиции согласно настоящему изобретению осуществляют приблизительно за 5 ч, 4 ч, 3 ч, 2 ч, 1 ч или 0,5 ч до контакта животного с фосфорорганическим соединением.
В предпочтительном случае животное представляет собой млекопитающее, например человека.
Ниже осуществление настоящего изобретения описано на конкретных примерах. Для специалиста будут очевидны возможные модификации указанных в приведенных примерах условий. Такие модификации включены в объем настоящего изобретения, определяемый формулой изобретения.
Примеры
Реагенты. VR, S-(2-(диэтиламино)этил) О-изобутирил метанофосфонотионат синтезировали в Государственном Исследовательском Институте Органической Химии и Технологии, Москва.
ЯМР агента VR (1Н,31Р) выполняли на спектрографе AVANCE 300 (Brucker, Германия) в растворе CDCl3 С использованием стандартных процедур.
1. Конструирование вектора для экспрессии BChE. Исходный вектор pBudCE 4.1 (Invitrogen, США) модифицировали путем удаления промотора CMV с использованием сайтов рестрикции SpeI и XbaI, гибридизации и лигирования по тупым концам (pBudCE4.1/EF). Кодирующую последовательность человеческой BChE из pGS/CMV/BCHE (Nachon, F. et al. Engineering of a monomeric and low-glycosylated form of human butyrylcholinesterase: expression, purification, characterization and crystallization. Eur J Biochem 269, 630-637 (2002)) (i) клонировали в pBudCE4.1/EF, используя сайты рестрикции Bg/II, с получением pBudCE/EF/BCHE или (ii) клонировали в вектор pcDNA3.1 (Invitrogen, США), используя сайты рестрикции HindIII и ApaI, с получением pcDNA/CMV/BCHE. (См. Фиг. 1)
2.Конструирование вектора экспрессии PRAD. Кодирующую последовательность PRAD из pRc/RSV-rQ45 (Xie, W. et al. An improved cocaine hydrolase: the A328Y mutant of human butyrylcholinesterase is 4-fold more efficient. Mol Pharmacol 55, 83-91 (1999).) клонировали в вектор экспрессии pcDNA3.1 (Invitrogen, США), используя сайты рестрикции HindIII и XnoI, с получением pcDNA/CMV/PRAD. Участок промотора EF - получали из вектора pBudCE4.1/EF с использованием сайтов рестрикции Bg/II и WneI. Вектор pcDNA/CMV/PRAD модифицировали путем замены последовательности промотора CMV на последовательность промотора EF, используя сайты рестрикции SpeI и HindIII и лигирование по липким концам (pcDNA/EF/PRAD) (См. Фиг. 1).
3. Культивирование клеток СНО. Клетки CHO-K1 культивировали в пластиковых 25 см2 флаконах с крышками с клапаном, содержащими среду DMEM (GIBCO, Life Technologies, США) с 2% (об./об.) фетальной сыворотки крупного рогатого скота (GIBCO, Life Technologies, США) и 2 мМ L-глютамина (GIBCO, Life Technologies, США) при 37°С, 5% CO2 и влажности 95%. После того как клетки достигали 100% монослоя, их пересевали в новые флаконы. Для получения субкультуры клеток удаляли среду, после чего клетки промывали свежим стерильным ФБР. После этого добавляли 0,25% трипсина. После инкубирования в течение 5-10 минут при 37°C клетки суспендировали в среде DMEM и высевали в новые флаконы в концентрации 1,5-2,0×105 клеток/мл.
4. Трансфекция клеток СНО. Пробы по 0,2 мг линеаризованного ДНК-вектора экспрессии трансфецировали в клетки СНО с использованием реагентов Lipofectamine™ и PlusDNA™ (Invitrogen, Сан-Диего, США), следуя инструкции производителя, и получали клоны со стабильной продукцией. Трансфецированные клетки культивировали в неселективной среде в течение 48-72 ч и определяли уровень продукции BChE в тесте Эллмана (ELLMAN, G.L, COURTNEY, K.D., ANDRES, V. & FEATHER-STONE, R.М.A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem Pharmacol 7, 88-95 (1961). Затем клетки подкармливали средой DMEM, которая содержала селективные антибиотики для отбора стабильных клонов.
5. Экспрессия рекомбинантной BChE. С целью исключения загрязнения ацетилхолинэстеразой и белками сыворотки rBChE экспрессировали в безбелковой среде (ProCHO, Lonza, Basel, Швейцария). Клетки культивировали и субкультивировали в соответствии со стандартными процедурами в 225 см2 флаконах (См. Фиг. 8). После того как клетки достигали 50-60% монослоя, ростовую среду заменяли на безбелковую среду. Среду для экспрессии меняли каждые 3 дня. BChE во флаконах получали непрерывно на протяжении 9 дней. Концентрацию фермента определяли с использованием теста Эллмана, предполагая, что активность, равная 720 единицам, соответствует 1 мг чистой BChE. Уровень экспрессии rBChE составлял до 30 мг/мл. Культуральную среду центрифугировали при 1500 g в течение 10 и хранили при -20°C до использования.
6. Ферментные анализы. Уровень экспрессии rhBChE определяли непосредственно в культуральной среде. Образцы обрабатывали 1 мМ бутирилтиохолин иодидом (ВТС, Sigma) и 0,5 мМ 5,5-дитио-бис-(2-нитробензойной кислоты) (DTNB, Sigma) в 0,1 М калий-фосфатного буфера с pH 7.0 при 25°C. За образованием продукта следили по увеличению поглощения 5-тио-2-нитробензойной кислоты при 412 нм с использованием коэффициента молярной экстинкции 13,600 М-1 см-1. Активность регистрировали в единицах на мл, где 1 единица соответствует гидролизу 1 мМ бутирилтиохолина в минуту.
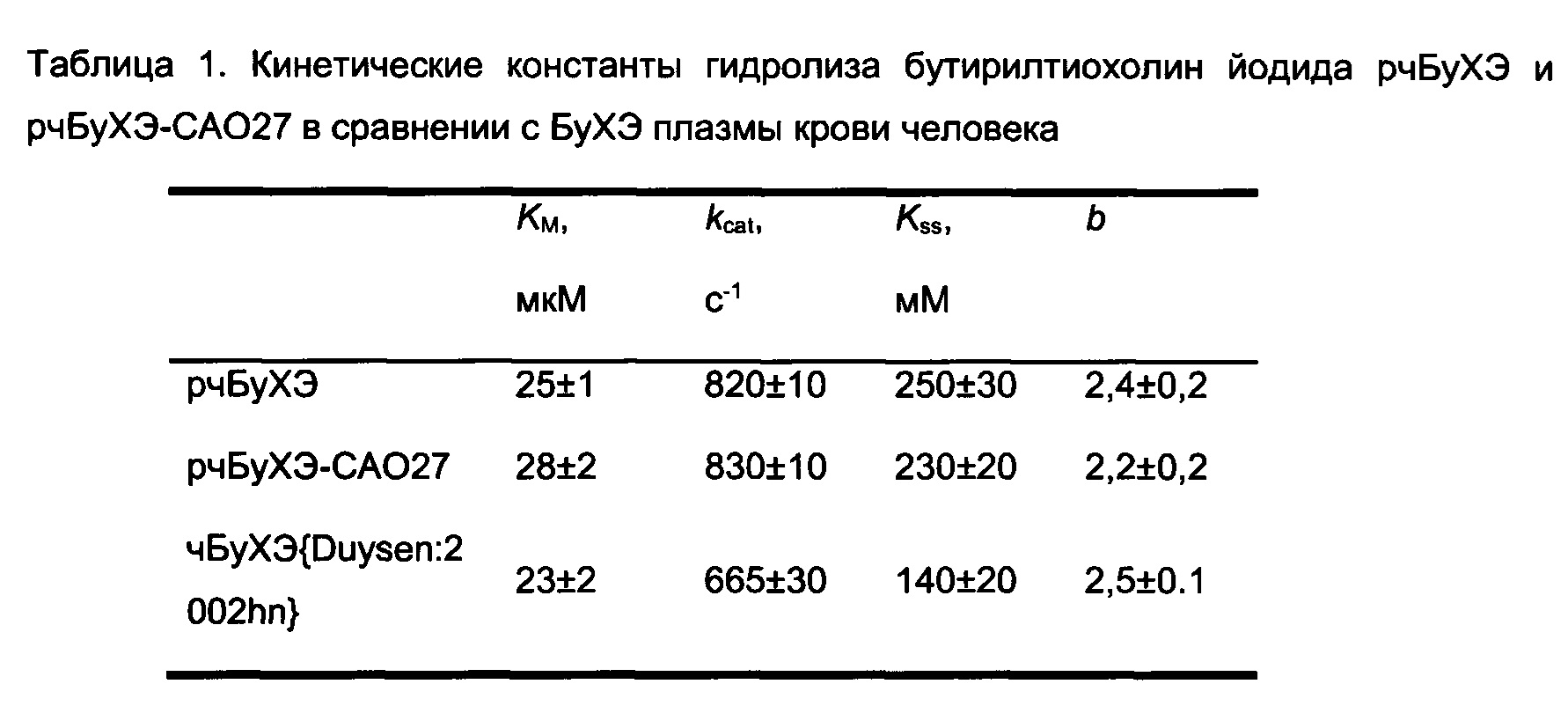
Конъюгированный фермент rBChE+CA027 гидролизовал ВТС с Km 28±2 мкМ и kcat 830±10 s-1, что соответствовало каталитическим свойствам немодифицированного фермента.
Для оценки параметров кинетики осуществляли реакции rhBChE или rhBChE-CA027 или высокоочищенной BChE плазмы (3-10 мкМ) в ВТС в концентрациях от 10 до 1000 мкМ и 0,5 мМ DTNB в 0,1 М фосфатном буфере с pH 7.0 при 25°C. Для определения kcat, KM, KSS и b стройли график по результатам и применяли нелинейную регрессию (SigmaPlot ver. 11.0, SYSTAT). Титрование активного центра выполняли в соответствии с тестом Эллмана с использованием диизопропил флюорофосфатазы в качестве ингибитора. (См. Фиг. 2)
Необратимое ингибирование BChE органофосфатами. Константы ингибирования получали путем инкубирования интактной rhBChE и конъюгата rhBCHE-CAO27 в течение 1 минуты с VR в 0,1 М калий-фосфатном буфере (pH = 7.4) при 25°C, после чего проводили тест Эллмана с 1 мМ ВТС и 0,5 mM DTNB для определения остаточной активности BChE. Констатны бимолекулярного ингибирования рассчитывали с использованием уравнения (Worek, F., Thiermann, Н., Szinicz, L. & Eyer, P. Kinetic analysis of interactions between human acetylcholinesterase, structurally different organophosphorus compounds and oximes. Biochem Pharmacol 68, 2237-2248 (2004)):
ki=1/(tC)in(ΔA0/ΔAi),
где t - время ингибирования, мин.; С - концентрация ингибитора, М; ΔA0 - гидролиз ВСТ без ингибитора, ΔAi - гидролиз ВТС с ингибитором.
Очистка BChE от ростовой среду ProCHO. 10 л безбелковой ростовой среды, содержащей до 30 мг/л rhBChE, сначала фильтровали через систему картриджей Pellicon (Millipore, США) и мембрану с отсекаемым размером 300 кДа. В буферы добавляли EDTA и азид натрия в конечных концентрациях 5 мМ и 0,05%, соответственно. Фильтрованную ростовую среду концентрировали до объема 0,5 L с использованием мембраны с отсекаемым размером 10 кДа. Концентрированную среду загружали на колонку с прокаинамид-сефарозным сорбентом XK10/50, уравновешенную 20 мМ калий-фосфатным буфером pH = 7.2 (GE Healthcare, США) в течение ночи при скорости потока 5 мл/мин. Затем колонку промывали последовательно 20 объемами колонки 20 мМ калий-фосфатного буфера и 300 мМ NaCl. Рекомбинантный белок элюировали 1 М NaCl, концентрировали на ультрафильтрационных мембранах Centricon (Millipore, Bedford, США) с отсекаемым объемом 10 КДа и диализировали против 20 мМ калий-фосфатного буфера, pH = 7.2. Анионообменную хроматографию осуществляли с использованием колонки MonoQ 5/50 (GE Healthcare, США) с градиентной элюцией 0-1000 мМ NaCl. Очищенный белок концентрировали на ультрафильтрационных мембранах Amicon™ (Millipore, Bedford, MA) с отсекаемым размером 10 кДа и диализировали против 20 мМ калий-фосфатного буфера, pH = 7.2 (См. Фиг. 11).

Химическая модификация полисиаловой кислотой. Окисленную каламиновую кислоту со средней массой 27кДа (CAO27) получали на установке Lipoxen. Конъюгирование осуществляли в 0,1 М калий-фосфатном буфере, рН=6,9 с молярным отношением белок:САО - 1:50 при 25°C с конечной концентраций NaCNBH3 равной 3 мг/мл в течение 48 ч; Конъюгат rhBChE-CAO27 очищали путем аффинной хроматографии с использованием прокаинамид-сефарозного сорбента. После концентрации на ультрафильтрационных мембранах Amicon™ Ultra (Millipore, Bedford, США) с отсекаемым объемом 10 кДа, rhBChE-CAO27 диализировали против ФБР.
Полисиалирование в других наборах условий осуществляли аналогичным образом, варьируя соответствующие параметры. Результаты показаны на Фиг. 9
Количественное определение САО. Относительное количество САО в конъюгате ВСНЕ-CAO27 определяли в ресорциноловом тесте. Реагент Ресорцинол (100 мл) готовили с использованием сульфата меди (0.1 М; 250 мкл), ресорцинола (1%; 20 мл) и соляной кислоты (концентрированной, количество, достаточное для 80 мл) в бутылке янтарного цвета и выдерживали в холодильнике в течение месяца. Образец конъюгата СНЕ-CAO27 и калибровочные образцы CAO27 смешивали с 4 объемами реагента ресорцинола и инкубировали при в течение 15 минут. Комплексы ресорцинол-нейраминовая кислота экстрагировали путем добавления 4 объемов 2-метилбутанола. ОП измеряли на устройстве Varioskan Flash (Thermo Scientific, Германия) при 560 нм. Количество остатков CAO27 на одну молекулу BChE рассчитывали как отношение молярной концентрации CAO27 в образце к молярной концентрации BChE при предположении, что молекулярная масса мономера BChE равна 82 кДа.
Соотношение белок:каламиновая кислота в среднем составляло 1:6.
Анализ модификаций методом масс-спектрометрии в модификации ESI-TOF (ионизация электроспреем, времяпролетное измерение). Образцы rhBChE и rhBChE-CAO24 обрабатывали α(2->3,6,8,9) нейрамидазой (N3786, Sigma, США) в соответствии с протоколом производителя. Затем десиалированную rhBChE и rhBChE-CAO24 инкубировали с 5 мМ DTT в течение 1 ч при 37°C с последующей инкубацией с 12 мМ иодацетамида в течение мин в темноте. Полученные смеси разделяли на 10% ПААГ в невосстанавливающих условиях. Гели окрашивали красителемКумасси. Полосы, соответствующие десиалированной rhBChE, элюировали с геля, расщепляли трипсином и использовали для анализа методами SELDI and MS.
Образцы исследовали на масс-спектрометре в режиме ESI-TOF (Bruker Daltonics Inc). Пептиды идентифицировали в следующих условиях: фиксированная модификация - Карбамидометил (С); вариабельные модификации - Окисление (М), Ацетил (N-конец), пиро-Glu (N-конец Q), Деамидирование (N,Q); значения массы - моноизотоп; допуск масс пептидов - 10 ppm; максимальные пропущенные расщепления - 2. Расчеты производили с использованием программного обеспечения GPMaw (Lighthouse data, Дания).
Неденатирирующий гель-электрофорез. Относительное количество тетрамеров, димеров и мономеров оценивали на активно-окрашенных неденатурирующих полиакриламидных гелях. От 4% до 30% полиакриламидные гели готовили вручную. Электрофорез проводили при постоянном напряжении 120 В в течение 15 ч при 4°C. Гели окрашивали 2 мМ бутирилтиохолином (субстрат) по методу Karnovsky и Roots (KARNOVSKY, М.J. & ROOTS, L.A "DIRECT-COLORING" THIOCHOLINE METHOD FOR CHOLINESTERASES. J Histochem Cytochem 12, 219-221 (1964)) в течение 1 ч. Интенсивность полос определяли с использованием системы Bio-Rad, США. (см. Фиг. 5-7)
ЭкспериментыIn vivo. Эти исследования были проведены в Институте Биоорганической Химии Российской Академии Наук, в лаборатории биологического тестирования (Пущино, Россия). Самцы мышей Balb/C массой 25-30 были получены из вивария Института Биоорганической Химии. Мышам (n=10) вводили rhBChE и конъюгат rhBChE-CA027 в дозе 100 ед/мышь путем быстрой внутривенной инъекции. После введения фермента брали по 10 мкл крови из глазного синуса через различные промежутки времени в течение 5 дней. Образцы крови разбавляли 50х в ФБР для определения общей активности BChE в крови. Среднее время удержания, выведения и распределение времен полужизни, стаж и AUC рассчитывали по зависимости от времени концентрации BChE в крови с использованием двухкомпартментной фармакодинамической модели. Все расчеты осуществляли с использованием программного обеспечения KaleidaGraph (Synergy Software, США).
Определение эффективности rhBChE-CA027 против воздействия VR. Защитную эффективность полисиалированной rhBChE оценивали с использованием самцов мышей SPF, которым вводили 21,05 мг/кг (400 ед) фермента внутривенно, после чего через 30 минут их обрабатывали VR. Дозы VR варьировали от нелетальных до абсолютно летальных (LD100), чтобы точно определить защитную эффективность. Каждому животному вводили VR путем внутримышечной инъекции (в мышцу gluteus maximus) в виде водного раствора в объеме 50-100 мл. За животными наблюдали в течение 5 дней после обработки VR и регистрировали выживаемость через 30 мин после обработки. Результаты рассчитывали методом Личфилда и Уилкоксона с использованием программного обеспечения Biostat (AnalystSoft, США).



Исследование поведения и физической выносливости животных. Исследование поведения и физической выносливости животных проводили в Государственном исследовательском Институте Органической Химии и Технологии (Москва, Россия). Открытое поле включало камеру размером 50×30 см с черным акрилатным полом, размеченным на 40 квадратов. Также на полу было 28 отверстий для выглядывания диаметром 2 см. Животных помещали в центр открытого поля и в течение 3 минут подсчитывали следующие события: (i) число пересечений линий, характеризующее горизонтальную активность, (ii) число вставаний, характеризующее вертикальную активность, и (iii) число осмотра отверстий, характеризующее исследовательскую активность. Все эти параметры исследовали перед введением фермента, после введения фермента и после обработки VR. Тест на физическую активность состоял из 30 минут на беговой дорожке. Результаты рассчитывали с использованием программного обеспечения Statistics (StatSoft Inc., США). Результаты показаны на Фиг. 13.
Реферат
Изобретение относится к области биохимии, генной инженерии и биотехнологии, в частности к конъюгату рекомбинантной бутирилхолинэстеразы человека и окисленной каламиновой кислоты со средней молекулярной массой 27 кДа. Указанный конъюгат предназначен для лечения, предотвращения, подавления или снижения токсических эффектов фосфорорганических соединений. Настоящее изобретение также относится к способу получения указанного конъюгата. Представленный способ включает культивирование клеток СНО, трансформированных вектором экспрессии, содержащим ген бутирилхолинэстеразы человека, очистку и химическое сиалирование полученной рекомбинантной бутирилхолинэстеразы. Изобретение относится также к фармацевтической композиции, содержащей указанный конъюгат, и к способу лечения, предотвращения, подавления или снижения токсических эффектов фосфорорганических соединений у животного. Настоящий способ предусматривает введение животному указанных конъюгата или композиции. Настоящее изобретение позволяет получать конъюгат и фармацевтическую композицию для лечения, предотвращения, подавления или снижения токсических эффектов фосфорорганических соединений. 4 н. и 10 з.п. ф-лы, 13 ил., 4 табл., 1 пр.

Комментарии