Способы и композиции, применимые для модуляции ангиогенеза с использованием протеинкиназы raf и ras - RU2257911C2
Код документа: RU2257911C2
Чертежи


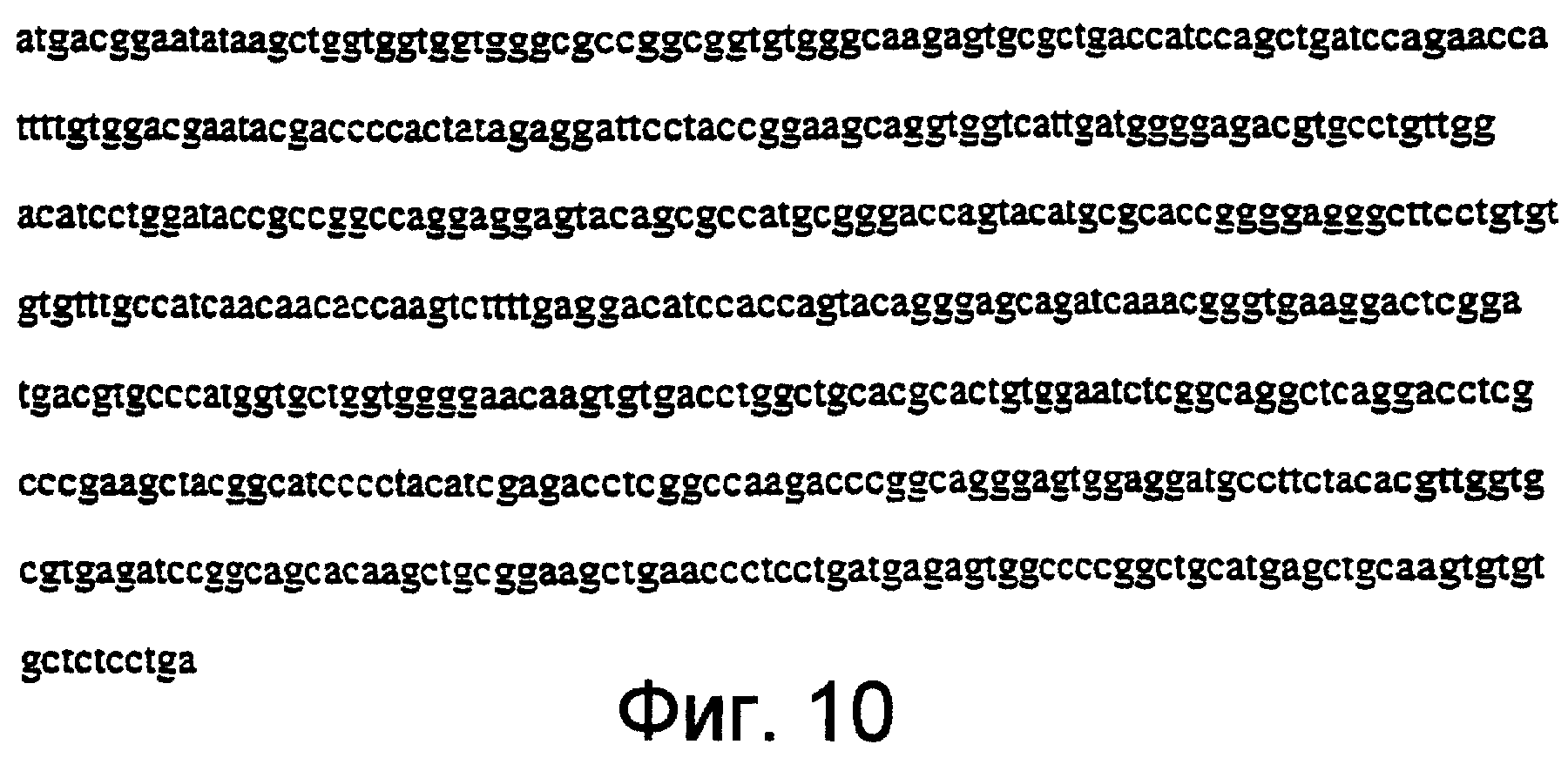


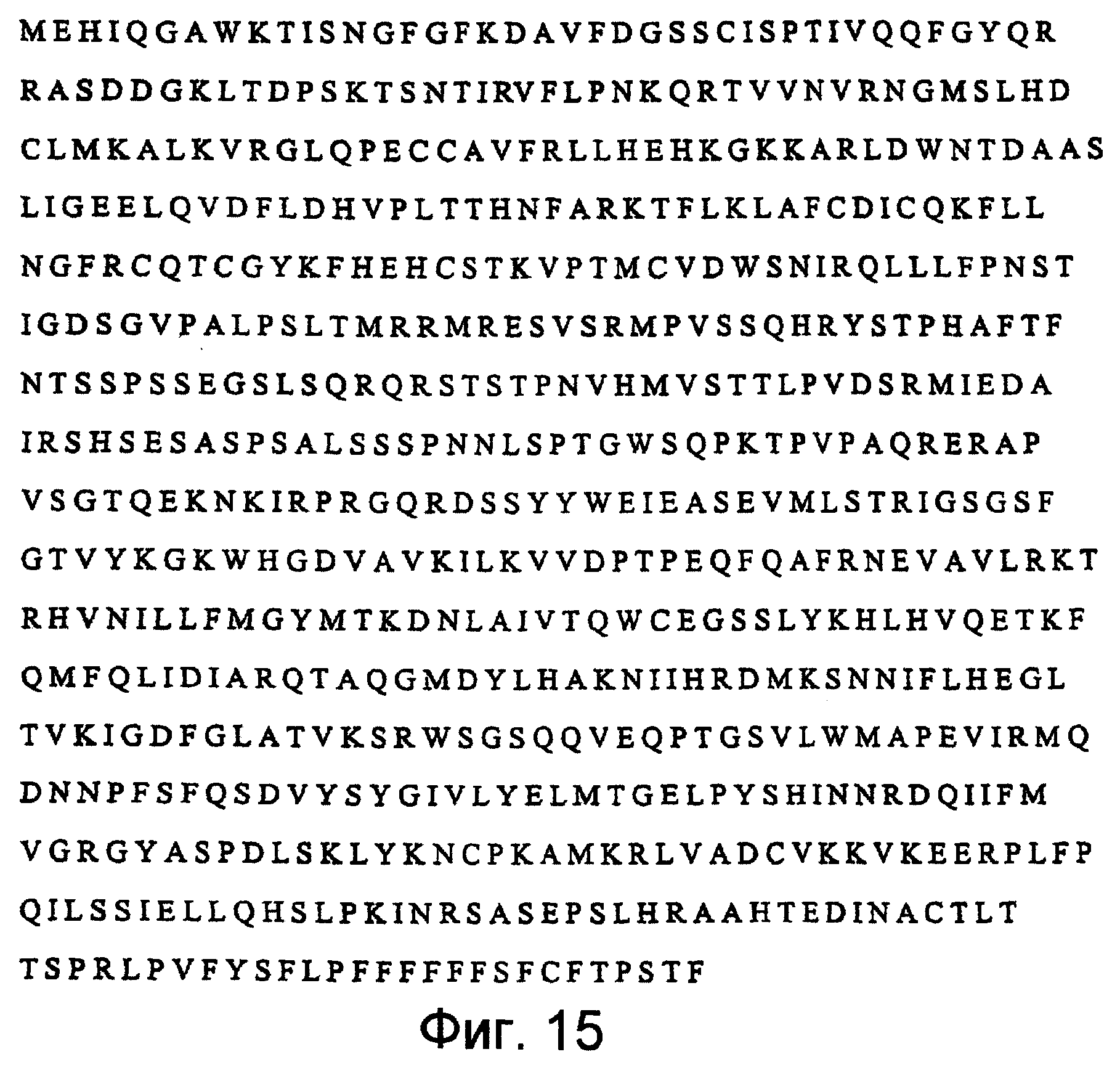
Описание
Перекрестная ссылка на родственные заявки
Данная заявка заявляет приоритет Предварительной патентной заявки с регистрационным номером 60/215951, поданной 5 июля 2000 года, и Предварительной патентной заявки с регистрационным номером 60/148924, поданной 13 августа 1999 года.
Область техники
Данное изобретение относится в общем к области медицины и, в частности, относится к способам и композициям для модуляции ангиогенеза тканей с использованием протеинкиназы Raf или Ras, вариантов Raf или Ras, с использованием реагентов, которые модулируют Raf или Ras, и с использованием кодирующих их нуклеиновых кислот.
Предпосылки изобретения
Ангиогенез является процессом васкуляризации тканей, который включает в себя рост новых кровеносных сосудов в ткань, и называется также реваскуляризацией (неоваскуля-ризацией). Этот процесс опосредован инфильтрацией эндотелиальных клеток и клеток гладких мышц. Считается, что этот процесс происходит одним из трех путей: сосуды могут ответвляться от предсуществующих сосудов, de novo развитие сосудов может возникать из клеток-предшественников (образование и развитие сосудов) или существующие небольшие сосуды могут увеличиваться в диаметре. Blood et al., Bioch. Biophys. Acta, 1032:89-118 (1990).
Ангиогенез является важным процессом в неонатальном росте, но является также важным в заживлении ран и в патогенезе большого числа клинических заболеваний, в том числе воспалении тканей, артрите, росте опухоли, диабетической ретинопатии, макулярной дегенерации за счет реваскуляризации сетчатки и подобных состояний. Эти клинические проявления, ассоциированные с ангиогенезом, называют ангиогенными заболеваниями. Folkman et al., Science, 235:442-447 (1987). Ангиогенез обычно отсутствует во взрослых или зрелых тканях, хотя он действительно происходит при заживлении ран и в цикле роста желтого тела. См., например, Moses et al., Science, 248:1408-1410 (1990).
Предполагалось, что ингибирование ангиогенеза могло бы быть полезной терапией для ограничения опухолевого роста. Ингибирование ангиогенеза предлагалось посредством (1) ингибирования высвобождения «ангиогенных молекул», таких как bFGF (основной фибробластный фактор роста), (2) нейтрализации ангиогенных молекул, например, с использованием антител против bFGF, (3) применения ингибиторов рецептора витронектина αv β3 и (4) ингибирования реакции эндотелиальных клеток на ангиогенные стимулы. Эта последняя стратегия привлекла внимание, и Folkman et al., Cancer Biology, 3:89-96 (1992) описали несколько ингибиторов реакции эндотелиальных клеток, в том числе ингибитор коллагеназы, ингибиторы обновления базальной мембраны, ангиостатические стероиды, полученные из грибов ингибиторы ангиогенеза, тромбоцитарный фактор 4, тромбоспондин, лекарственные средства против артрита, например D-пеницилламин и тиомалат золота, аналоги витамина D, альфа-интерферон и т.п. ингибиторы, которые могут быть использованы для ингибирования ангиогенеза. В отношении дополнительных предлагаемых ингибиторов ангиогенеза см. Blood et al., Bioch. Biophys. Acta, 1032:89-118 (1990), Moses et al., Science, 248:1408-1410 (1990), Ingber et al., Lab. Invest., 59:44-51 (1988) и Патенты Соединенных Штатов Америки с номерами 5092885, 5112946, 5192744, 5202352, 5753230 и 5766591. Однако ни один из ингибиторов ангиогенеза, описанных в предыдущих ссылках, не включал в себя Raf-белки.
Для того чтобы происходил ангиогенез, эндотелиальные клетки должны сначала разрушиться и пересечь базальную мембрану кровеносного сосуда способом, сходным со способом, используемым опухолевыми клетками во время инвазии и образования метастазов.
Ранее сообщалось, что ангиогенез зависит от взаимодействия между васкулярными интегринами и белками внеклеточного матрикса. Brooks et al., Science, 264:569-571 (1994). Кроме того, сообщалось, что запрограммированная смерть клеток (апоптоз) ангиогенных васкулярных клеток инициируется взаимодействием, которое могло бы ингибироваться некоторыми антагонистами васкулярного интегрина αvβ3. Brooks et al., Cell, 79:1157-1164 (1994). Не так давно сообщалось, что связывание металлопротеиназы-2 матрикса (ММР-2) с рецептором витронектина (αvβ3) может быть ингибировано с использованием антагонистов αvβ3, и посредством этого происходит ингибирование ферментативной функции этой протеиназы. Brooks et al., Cell, 85:683-693 (1996).
Сущность изобретения
Данное изобретение рассматривает модуляцию ангиогенеза в тканях, где ангиогенез зависит от активности протеинкиназы Raf, называемой здесь также в общем Raf.
Рассматриваются композиции и способы для модуляции ангиогенеза в ткани, связанной с патологическим состоянием. Композицию, содержащую модулирующее ангиогенез количество Raf-белка, вводят в ткань, подлежащую лечению в отношении патологического состояния, которая отвечает на модуляцию ангиогенеза. Композиция, обеспечивающая Raf-белок, может содержать очищенный белок, биологически активные фрагменты белка, рекомбинантно полученные белок или фрагменты или слитые белки Raf или экспрессирующие векторы гена/нуклеиновой кислоты для экспрессии Raf-белка.
Если Raf-белок является инактивированным или ингибированным, модуляция является ингибированием ангиогенеза. Если Raf-белок является активным или активированным, модуляция является потенциированием ангиогенеза.
Тканью, подлежащей обработке, может быть любая ткань, в которой модуляция ангиогенеза является желательной. Для ингибирования ангиогенеза полезной является обработка подвергнутой заболеванию ткани, где происходит вредная реваскуляризация. Примеры тканей включают в себя воспаленную ткань, солидные опухоли, метастазы, ткани, подвергшиеся рестенозу, и тому подобные ткани.
Для потенциирования полезно лечить пациентов с гипоксическими тканями, например пациентов после удара (инсульта), инфаркта миокарда, или пациентов с хроническими язвами, с тканями ишемических конечностей, в которых имеется ненормальное, т.е. слабое, кровообращение вследствие диабетических или иных состояний. Могут лечиться также пациенты с хроническими ранами, которые не заживают и, следовательно, могли бы получить благопрятное действие от увеличения пролиферации васкулярных клеток и реваскуляризации.
Особенно предпочтительным является применение Raf-белка, содержащего модифицированную аминокислотную последовательность, описанную здесь. Несколько особенно полезных модифицированных Raf-белков, в том числе слитых Raf-белков, таких как Raf-caax, и конструкций нуклеиновых кислот, которые кодируют их экспрессию, описаны здесь и находятся в границах данного изобретения.
Данное изобретение включает в себя также фармацевтическую композицию, пригодную для ингибирования ангиогеиеза в ткани-мишени млекопитающего, содержащую вирусный или невирусный вектор переноса генов, содержащий нуклеиновую кислоту, причем эта нуклеиновая кислота имеет сегмент нуклеиновой кислоты, кодирующий Raf-белок, и Raf-белок имеет любой аминокислотный остаток в кодоне 375, за исключением лизина, и фармацевтически приемлемый носитель или наполнитель. В особенно предпочтительном варианте используется Raf-белок, названный Raf К375М, и этот вариант описан в примерах ниже. Другой неактивной конструкцией Raf является нуклеиновая кислота, которая кодирует Raf-белок, имеющий удаленную карбоксиконцевую часть. Один из предпочтительных вариантов использует Raf-белок, названный Raf 1-305, который является неактивным Raf-белком.
Рассматривается также фармацевтическая композиция, пригодная для стимуляции ангиогенеза в ткани-мишени млекопитающего и содержащая вирусный или невирусный вектор переноса генов, содержащий нуклеиновую кислоту, причем эта нуклеиновая кислота имеет сегмент нуклеиновой кислоты, кодирующий Raf-белок, имеющий киназную активность, и его фармацевтически приемлемый носитель или наполнитель. Предпочтительная нуклеиновая кислота кодирует ингибиторный слитый Raf-белок, который представляет собой Raf-caax. Другая ингибиторная конструкция Raf содержит нуклеиновую кислоту, кодирующую Raf-белок, имеющий делегированную аминоконцевую часть белка. Один предпочтительный вариант использует Raf-белок, названный Raf 306-648, и он описан в примерах ниже.
Далее данное изобретение рассматривает модуляцию ангиогенеза в тканях небольшой ГТФазой Ras, также называемой в общем Ras, вследствие ее роли в передаче сигнала Raf, как описано здесь. Также рассматривается модуляция ангиогенеза в тканях с использованием комбинации модуляции Ras и Raf. Такая комбинированная модуляция может иметь форму единого введения комбинированных композиций белка или нуклеиновой кислоты, кодирующей модулирующий белок, или отдельного введения индивидуальных доз, в ангиогенез-модулирующем количестве.
Рассматриваются композиции и способы для модуляции ангиогенеза в ткани, ассоциированной с патологическим состоянием, где эта модуляция направлена на опосредованный Raf путь ангиогенеза через Ras-белок. Композицию, содержащую ангиогенез-модулирующее количество Ras-белка, вводят в ткань, подлежащую лечению в отношении патологического состояния, которая реагирует на модуляцию ангиогенеза. Композиция, обеспечивающая Ras-белок, может содержать очищенный белок, биологически активные фрагменты белка, рекомбинантно полученные белок или фрагменты Ras-белка или слитые Ras-белки или экспрессирующие векторы гена/нуклеиновой кислоты для экспрессии Ras-белка.
Если Ras-белок является инактивированным или ингибированным, модуляция является ингибированием ангиогенеза. Если Ras-белок является активным или активированным, модуляция является потенциированием ангиогенеза. Фармацевтические композиции и способы применения доминантных негативных белков Ras, таких как S17N Ras или V12C40 Ras, обсуждаются в отношении применения способом, сходным со способом применения белков семейства Raf. В дополнительном аспекте данного изобретения фармацевтические композиции и способы применения для доминантных активных белков Ras, таких как G12V Ras или V12S35 Ras, обсуждаются для применений, сравнимых с применениями для белков семейства Raf.
Далее, рассматриваются способы модуляции ангиогенеза в ткани, ассоциированной с патологическим состоянием, предусматривающие введение модулирующего ангиогенез количества фармацевтической композиции, содержащей Raf-белок или нуклеотидную последовательность, способную экспрессировать Raf-белок, и Ras-белок или нуклеотидную последовательность, способную экспрессировать Ras-белок. В таких способах, где желательной модуляцией является ингибирование ангиогенеза, по меньшей мере, один или оба из Raf- или Ras-белков являются неактивными. Если желательной модуляцией является стимуляция ангиогенеза, по меньшей мере, один или оба из Raf- или Ras-белков являются активными.
Краткое описание чертежей
В этих чертежах, составляющих часть данного описания:
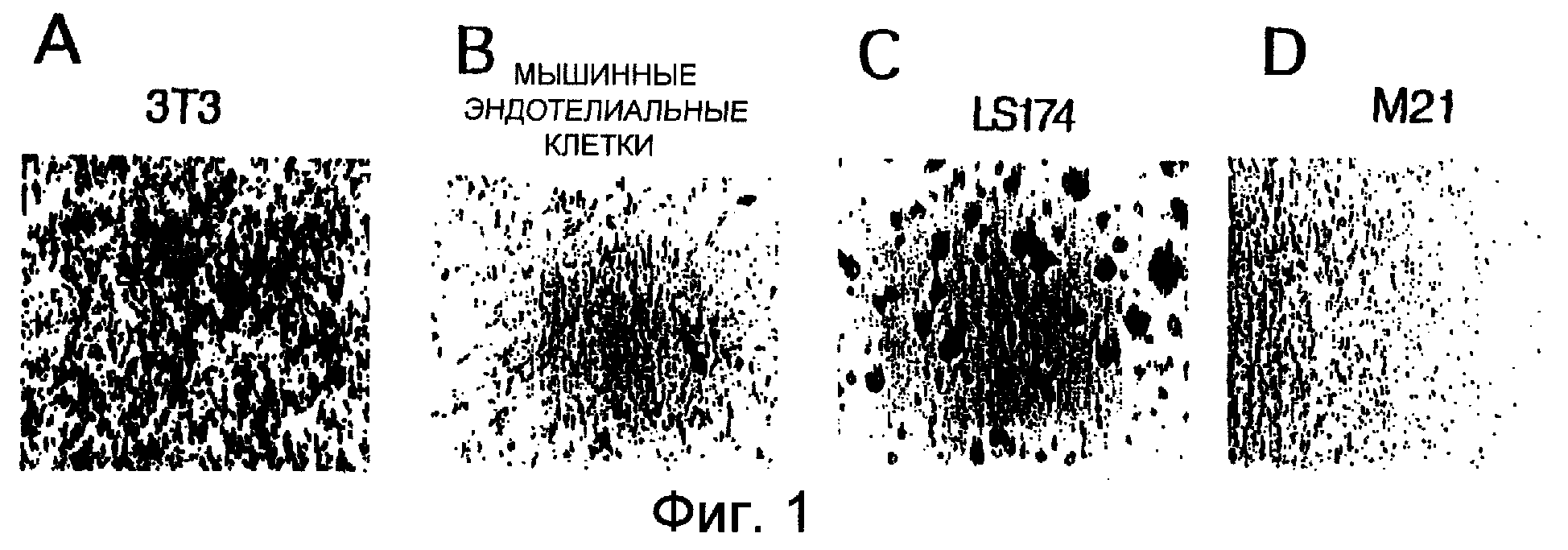
Фиг.1A-1D показывают, что экотропно упакованный ретровирус инфицирует только мышиные клетки. Экотропно упакованные клетки трансфицировали ретровирусной конструкцией, кодирующей ген β -галактозидазы (b-Gal), и супернатант собирали спустя 24 часа. Супернатант, содержащий вирус, помещали на полученные из мышей фибробласты (Фиг.1А), полученные из мышей эндотелиальные клетки (Фиг.1В), эпителиальные клетки аденокарциномы человека (Фиг.1C) или клетки меланомы человека (Фиг.1D) на 24 часа. Активность b-Gal визуализировали с использованием стандартных способов.
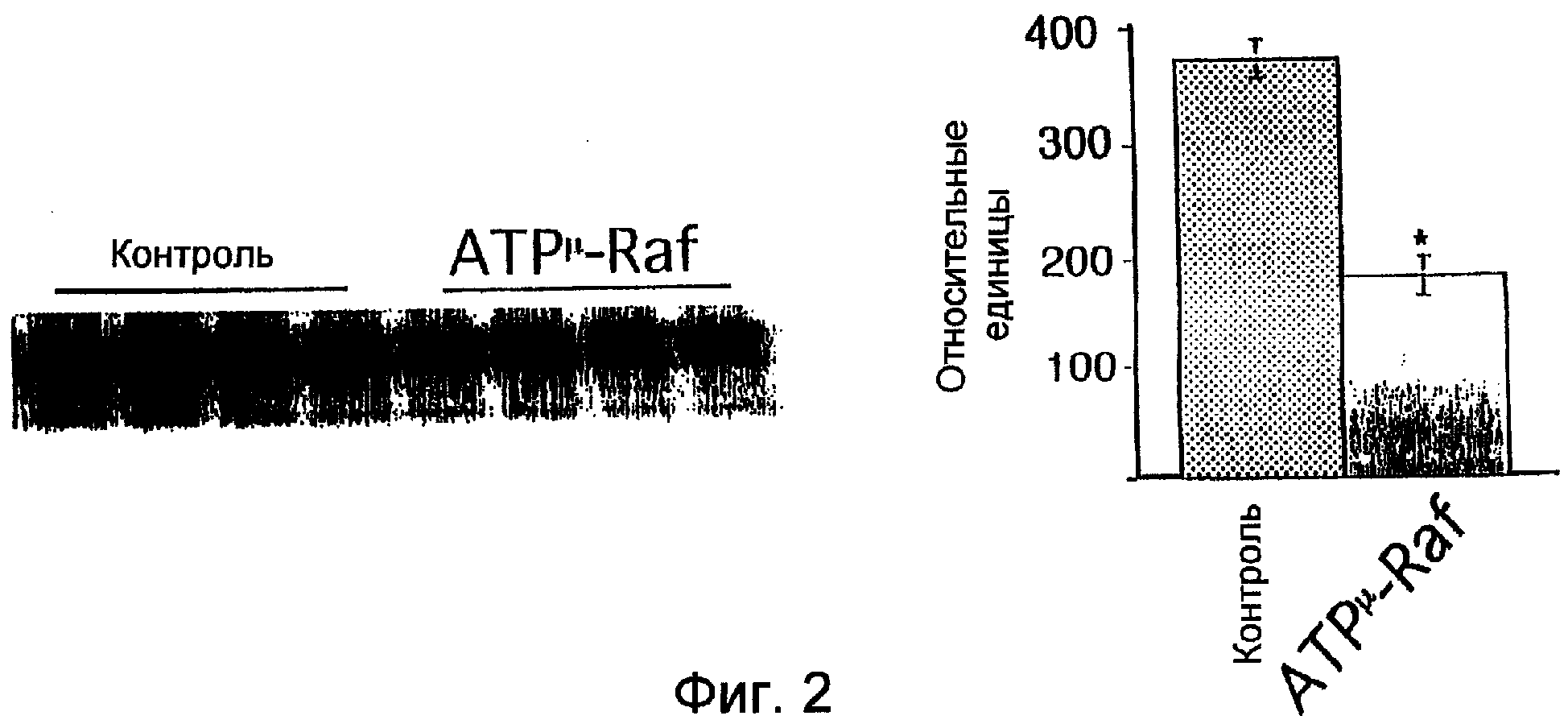
Фиг.2 показывает, что bFGF-индуцируемые увеличения активности Raf блокировались предварительной инфекцией Raf К375М в мышиной линии эндотелиальных клеток. Экотропно упакованные клетки трансфицировали ретровирусной конструкцией, кодирующей дефектный ген киназы Raf, и супернатант собирали спустя 24 часа. Супернатант, содержащий вирус, помещали на мышиные эндотелиальные клетки на 24 часа. Затем клетки обрабатывали bFGF в течение 5 минут и лизировали. Киназную активность Raf определяли количественно по способности иммунопреципитированной Raf-киназы фосфорилировать субстрат МЕК радиоактивно меченным32P. Реакционные смеси фракционировали при помощи электрофореза в ДСН-ПААГ и проводили количественное определение с использованием сканирующей денситометрии.
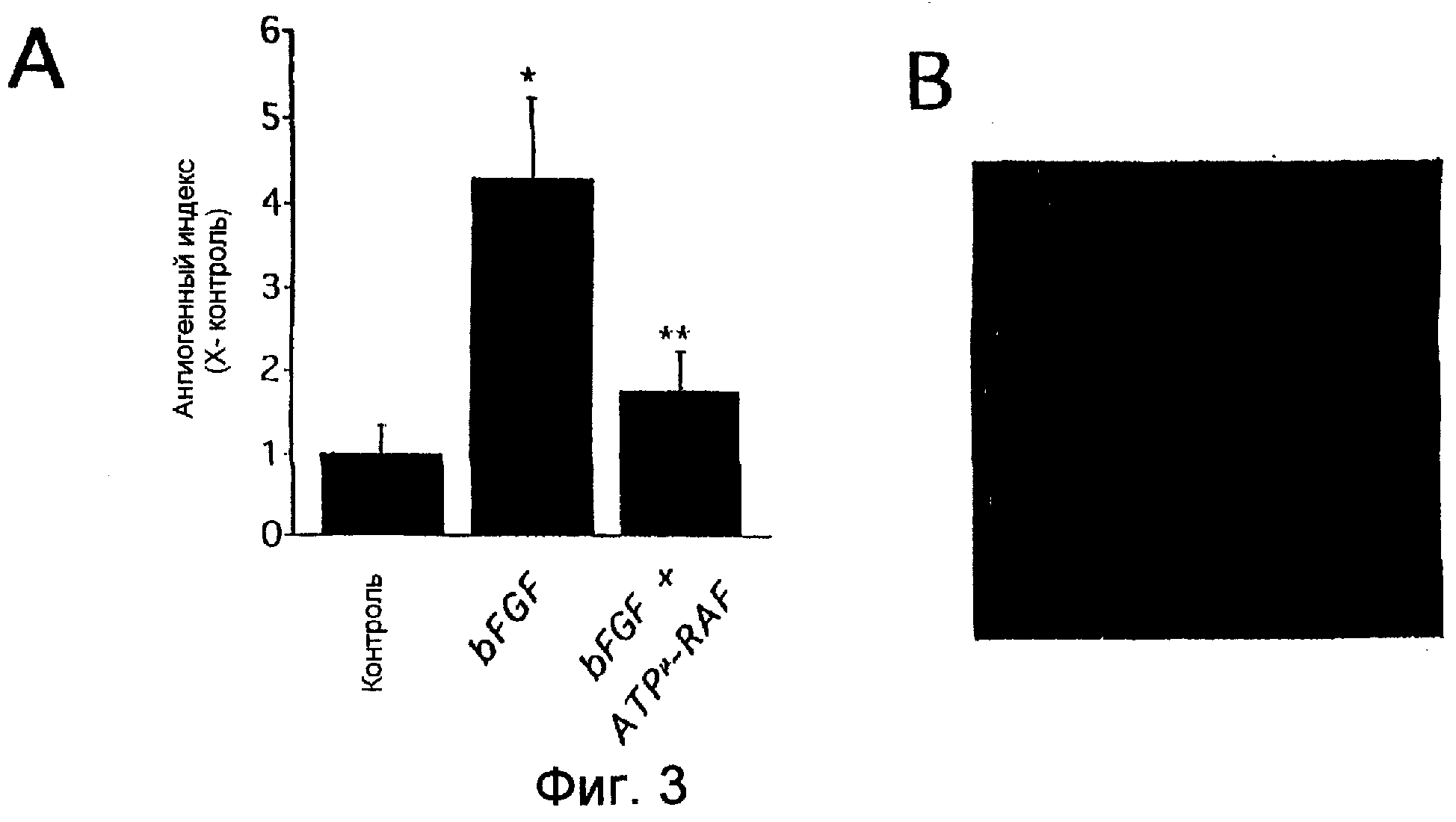
Фиг.3А-3В показывают, что мутантная неактивная Raf K375M ингибирует bFGF-индуцированный ангиогенез в модели мышиного подкожного ангиогенеза. Ангиогенез индуцировали подкожной инъекцией в бок мыши 250 мкл охлажденного на льду, имеющего сниженное количество факторов роста матригеля, содержащего 400 нг/мл bFGF, с экспрессирующими ретровирус упакованными клетками или без этих клеток, которые экспрессируют Raf K375M. Спустя пять дней специфический для эндотелия FITC-конъюгированный лектин Bandeiriea Simplifica B5 инъецировали через хвостовую вену и давали циркулировать и выводили в течение 30 минут. Затем ангиогенез определяли количественно удалением, экстракцией и анализом ангиогенной ткани на флуоресцентное содержание (Фиг.3А). Реваскуляризацию подтверждали исследованием срезов под световым микроскопом (Фиг.3В).
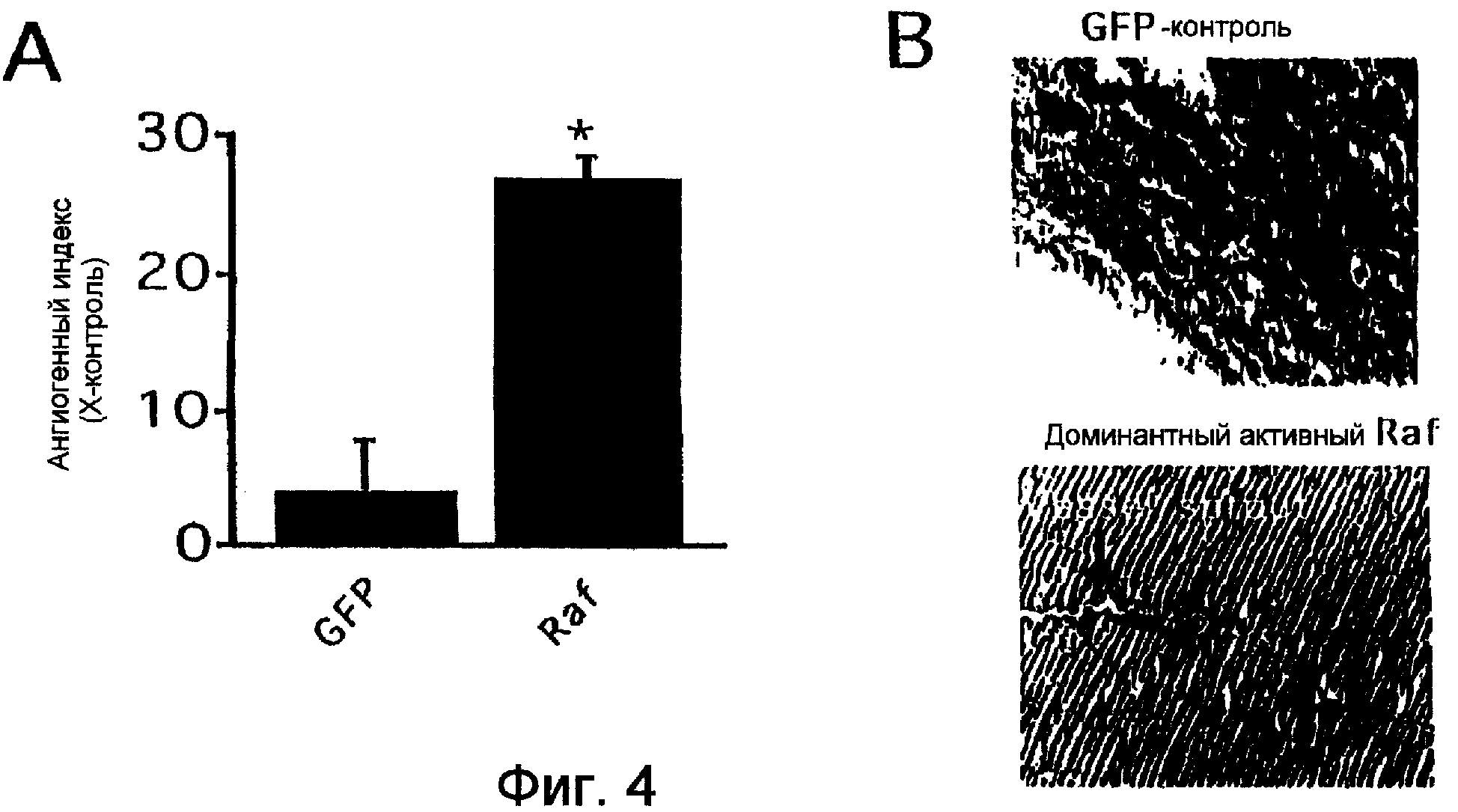
Фиг.4А-4В показывают, что мутационно активный Raf стимулирует ангиогенез в мышиной модели подкожного ангиогенеза. Ангиогенез индуцировали подкожной инъекцией в бок мыши 250 мкл охлажденного на льду, имеющего сниженное количество факторов роста матригеля, содержащего экспрессирующие ретровирус упакованные клетки, которые экспрессируют GFP-контрольную или делегированную на аминоконце Raf-киназу (Raf 306-648). Спустя пять дней ангиогенез определяли количественно удалением, экстракцией и анализом ангиогенной ткани на флуоресцентное содержание (Фиг.4А). Реваскуляризацию подтверждали приготовлением срезов и окрашиванием красителем трихромом Mason (Фиг.4В).
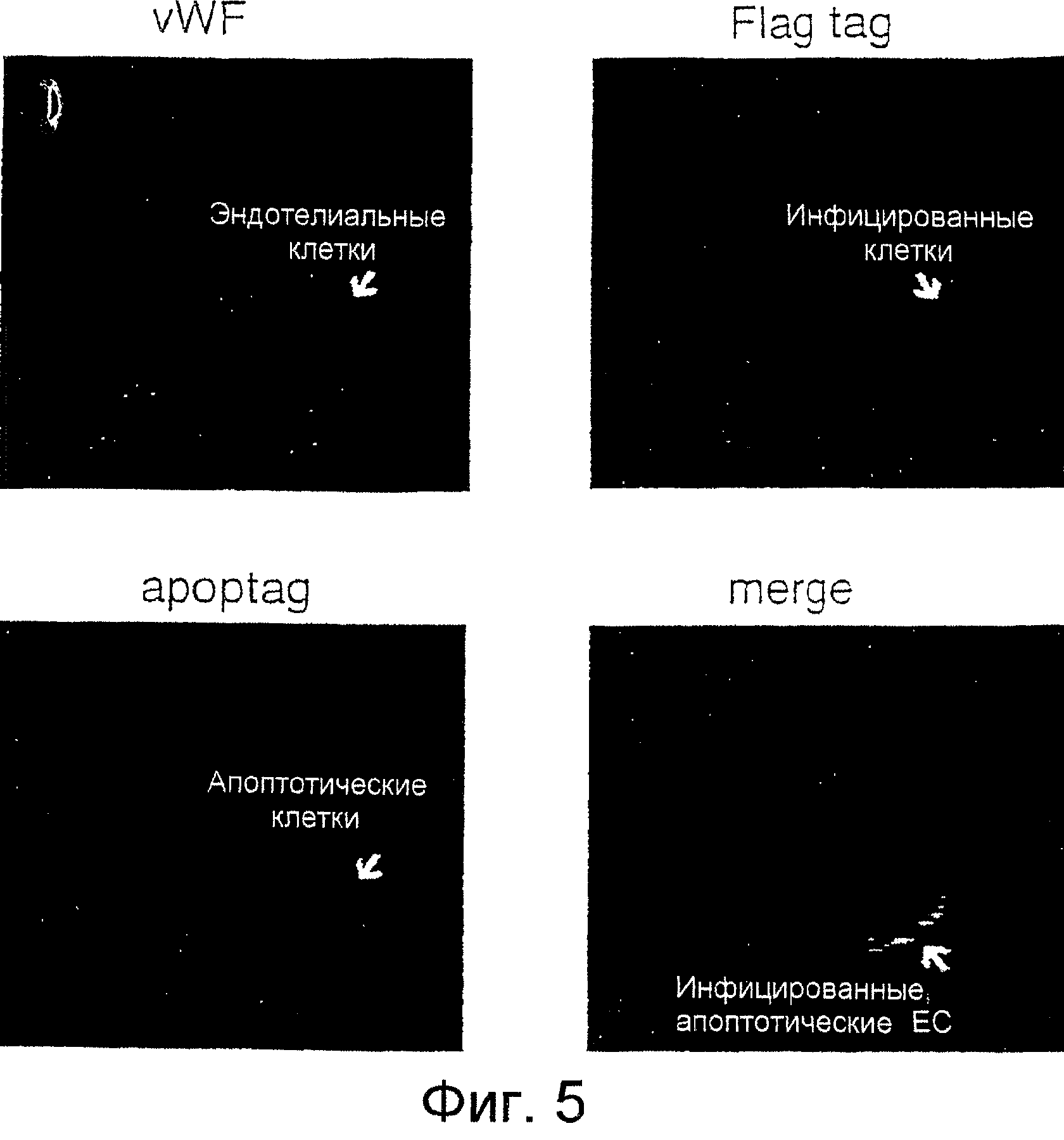
Фиг.5A-5D показывают, что ретровирусная доставка Raf К375М-киназы в опухоль индуцировала апоптоз специфическим для эндотелия образом. Опухоли человека инъецировали подкожно на боку бестимусной мыши wehi (nu/nu) и давали им имплантироваться. Когда опухоли достигали 100 мм3, их инъецировали внутрь опухоли культуральным супернатантом, содержащим 106 БОЕ экотропно упакованного Raf K375M. Спустя сорок восемь часов опухоль извлекали, готовили срезы и выполняли иммуногистохимию. Эндотелиальные клетки идентифицировали по экспрессии vWF (Фиг.5А), тогда как маркерную метку FLAG использовали для обнаружения клеток, инфицированных геном Raf К375М-киназы (Фиг.5В). Каждый из этих маркеров можно видеть колокализованным с маркером TUNEL, указывающим на апоптотические клетки (Фиг.5С и 5D).
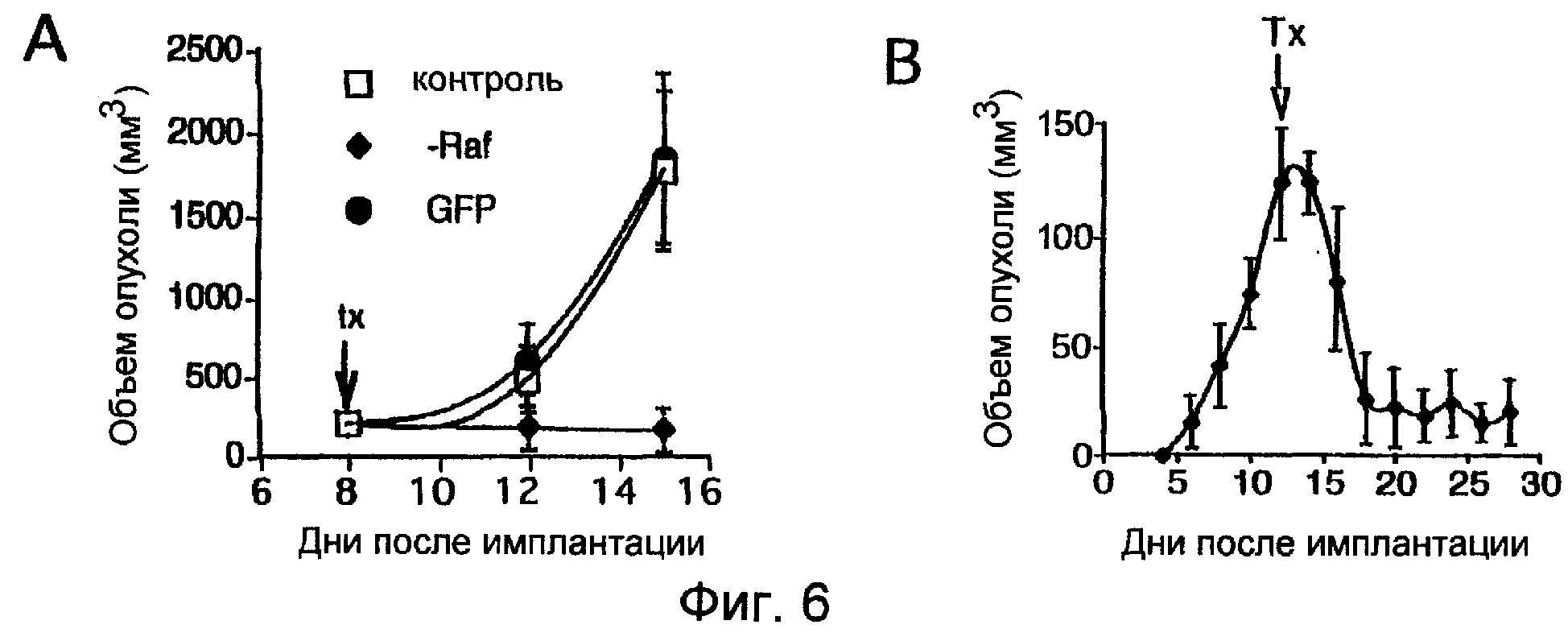
Фиг.6А-6В показывают, что эндотелиальная доставка гена Raf К375М-киназы ингибировала рост опухоли и стимулировала регрессию опухоли. Опухоли человека инъецировали подкожно на боку бестимусной мыши wehi (nu/nu) и давали им расти до 100 мм3. В этой точке либо выполняли единственную инъекцию упакованных клеток, экспрессирующих Raf К375М-киназу, в смежном с опухолью участке, либо начинали ряд инъекций внутрь опухоли вирусного супернатанта. Эта стратегия приводила к быстрым регрессам опухолей, которые не наблюдали с инъекцией контрольного гена GFP (Фиг.6А). Этот регресс происходил быстро и сохранялся на протяжении всего эксперимента (Фиг.6В).
Фиг.7 изображает кДНК-последовательность, кодирующую с-Raf человека, которая является полной кодирующей последовательностью с делегированными интронами. Эта последовательность доступна через номер доступа GenBank Х03484 (GI-35841, HSRAFR) (SEQ ID NO:1).
Фиг.8 изображает кодируемую транслируемую последовательность аминокислотных остатков c-Raf человека, кодирующей последовательности, изображенной в последовательности нуклеиновой кислоты, показанной на Фиг.7 (SEQ ID NO:2).
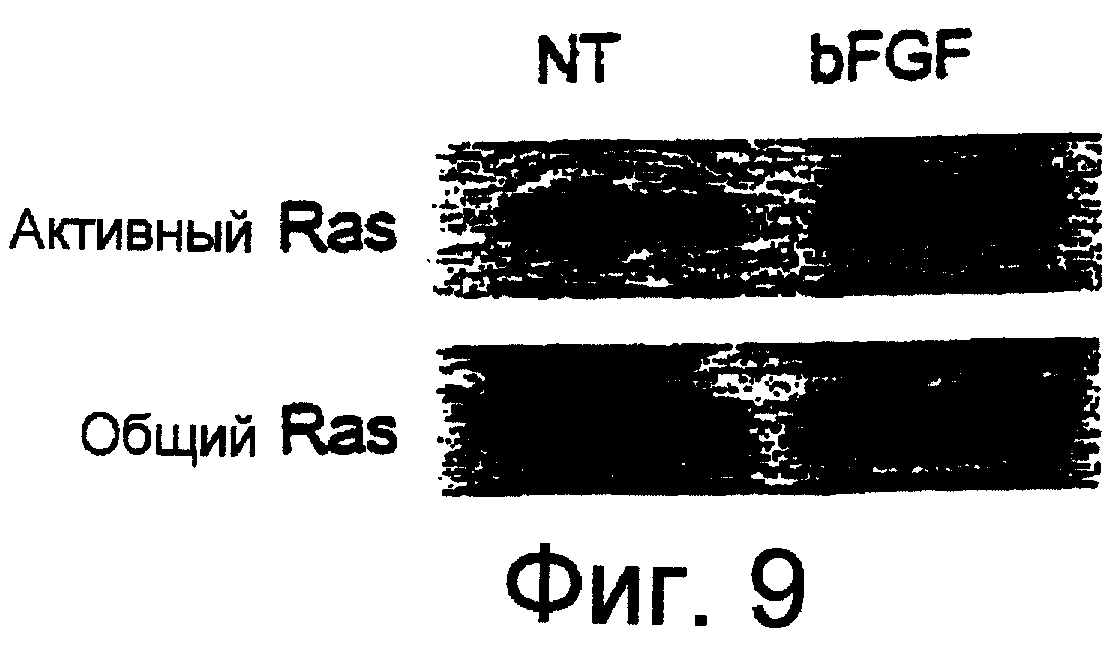
Фиг.9 показывает, что ангиогенез зависит от активации пути Ras-Raf-MEK-ERK. Активность Ras была повышенной в лизатах хорионаллантоисной куриной мембраны (САМ), подвергнутых действию bFGF, как определено с использованием анализа Ras с оттягиванием САМ. САМ из 10-дневных куриных эмбрионов стимулировали локально фильтровальными дисками, пропитанными ЗФР или 30 нанограммами (нг) bFGF. Спустя 5 мин ткань САМ иссекали, гомогенизировали в лизисном буфере и затем активность Ras определяли по его способности осаждаться слитым с GST-белком, содержащим Ras-связывающий домен Raf. Поскольку только активный Ras связывает Raf, получали рекомбинантный белок, состоящий из Ras-связывающего домена Raf, конъюгированного с глутатион-S-трансферазой (GST). В свою очередь, GST конъюгировали с сефарозными гранулами, позволяющими осаждать активный Ras из лизата ткани.
Фиг.10 изображает кДНК, кодирующую нуклеотидную последовательность домена Ras дикого типа человека (wt H-Ras). (SEQ ID NO:3). Полная кодирующая последовательность для протоонкогена с-HA-Ras1 доступна через GenBank (GI=190890, HUMRASH). (SEQ ID NO:5).
Фиг.11 изображает последовательность аминокислотных остатков, кодируемую нуклеотидной последовательностью кДНК Ras дикого типа человека (wt H-Ras), показанной на Фиг.10. (SEQ ID NO:4).
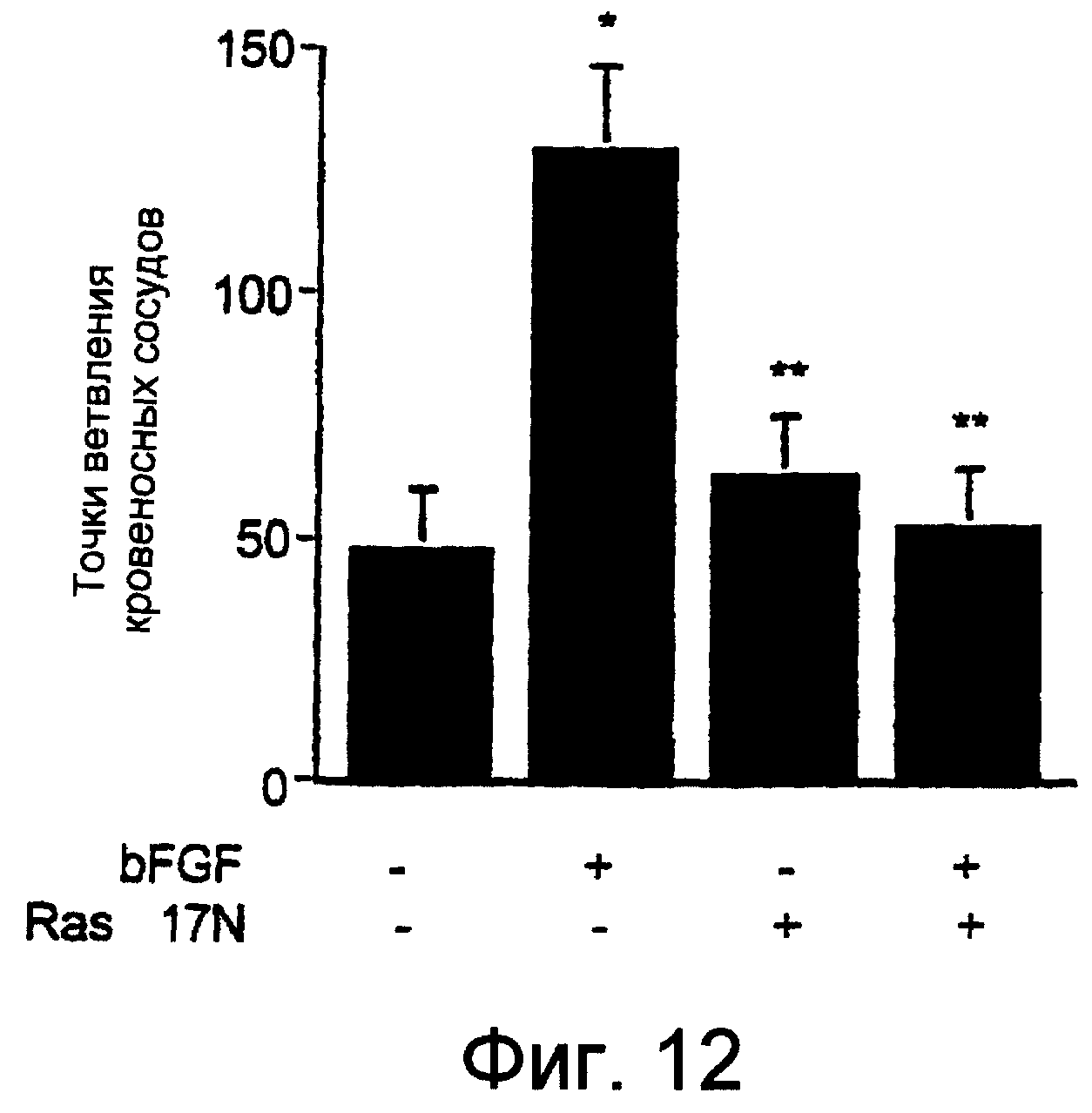
Фиг.12 показывает, что инфекция мутантным нуль-Ras блокировала индуцируемый фактором роста ангиогенез в САМ. Пятнадцать микролитров (мкл) имеющего высокий титр ретровируса куриной саркомы, RCAS(А), кодирующего мутантный нуль-Ras, S17N Ras (H-Ras дикого типа с заменой Ser на Asn в позиции 17), локально наносили на фильтровальные диски на САМ, стимулированные bFGF, как описано на Фиг.9. Ангиогенез оценивали спустя 72 часа счетом точек ветвления сосудов.
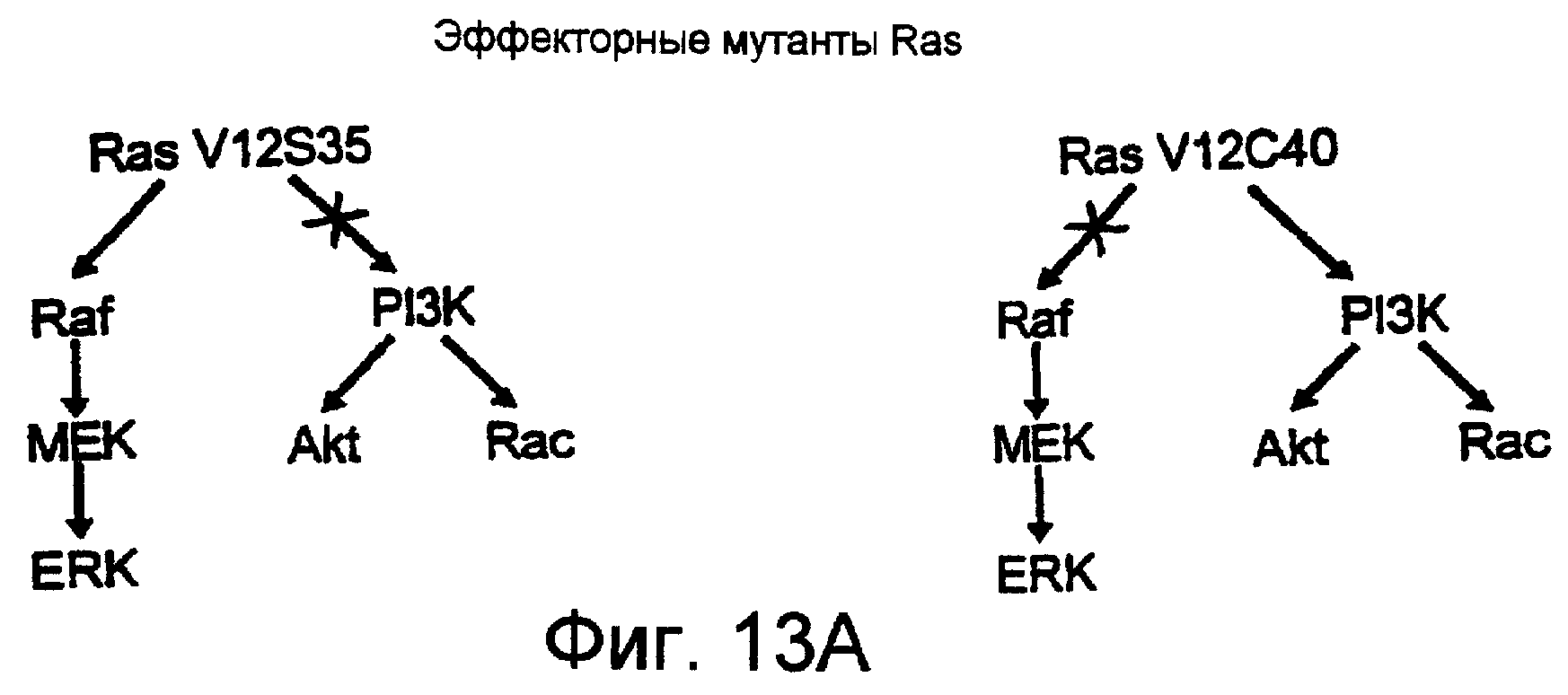
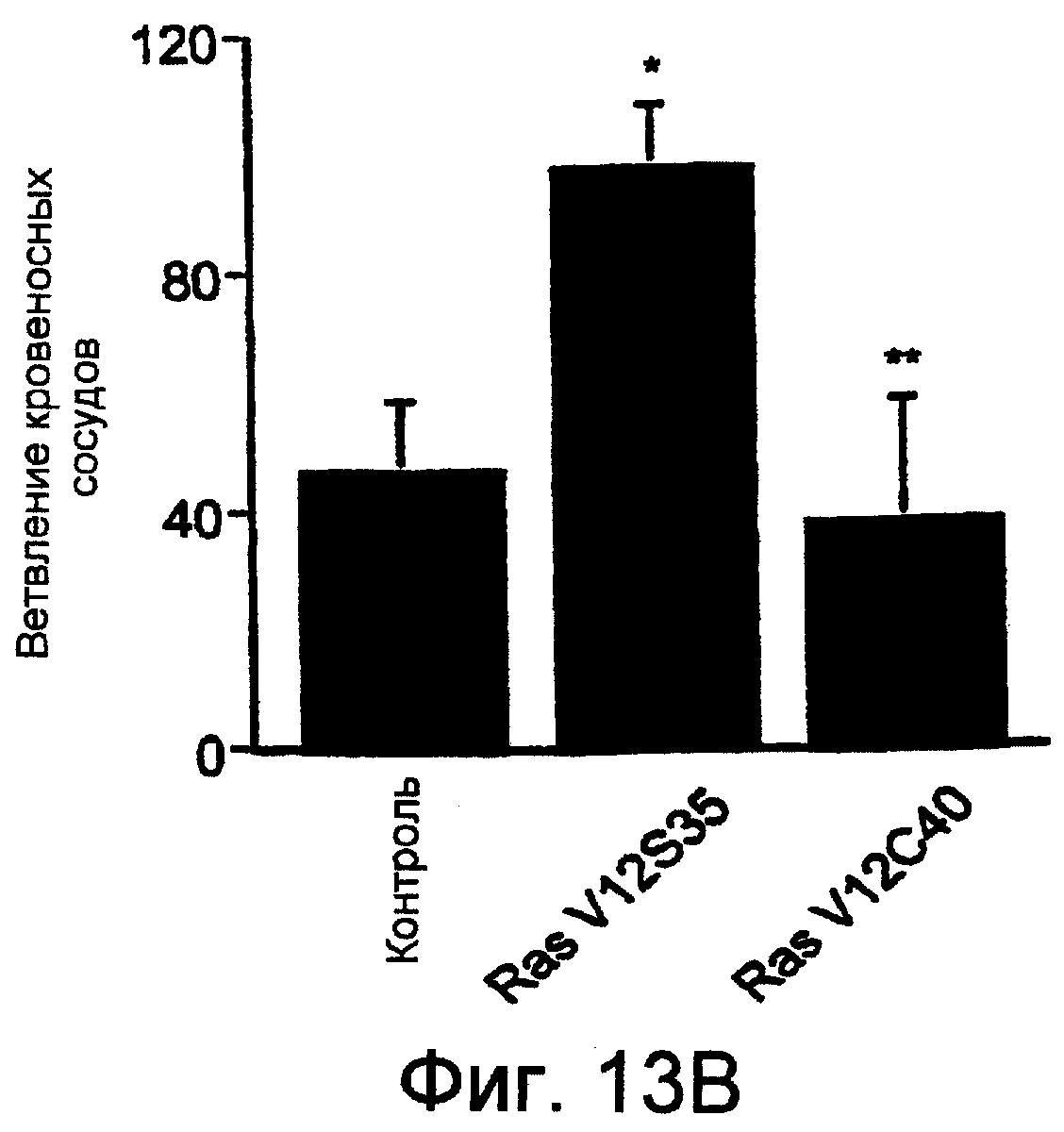
Фиг.13А и 13В показывают схематически и в виде диаграммы, соответственно, что инфекция мутантной конструкцией Ras, Ras V12S35, которая селективно активирует путь Ras-Raf-MEK-ERK, индуцировала ангиогенез, тогда как мутантная конструкция, Ras V12C40, которая селективно активирует пути PI3K, не индуцировала ангиогенез. Пятнадцать мкл имеющего высокий титр вируса RCAS(А), кодирующего Raf-MEK-ERK-активирующую конструкцию Ras, Ras V12S35, или активирующую РI3-киназу конструкцию Ras, Ras V12C40, наносили локально на фильтровальные диски и результаты оценивали, как описано на Фиг.12.
Фиг.14 изображает нуклеотидную последовательность, кодирующую слитый белок Raf-caax, где нуклеотидная последовательность, кодирующая карбоксиконец Raf человека (wt H-RAf), слита с нуклеотидной последовательностью, кодирующей последовательность из 20 аминокислотных остатков домена мембранной локализации К-Ras. (SEQ ID NO:6).
Фиг.15 изображает последовательность аминокислотных остатков Raf-caax, слитый белок, полученный из слитой нуклеотидной последовательности, изображенной на Фиг.14. (SEQ ID N0:7).
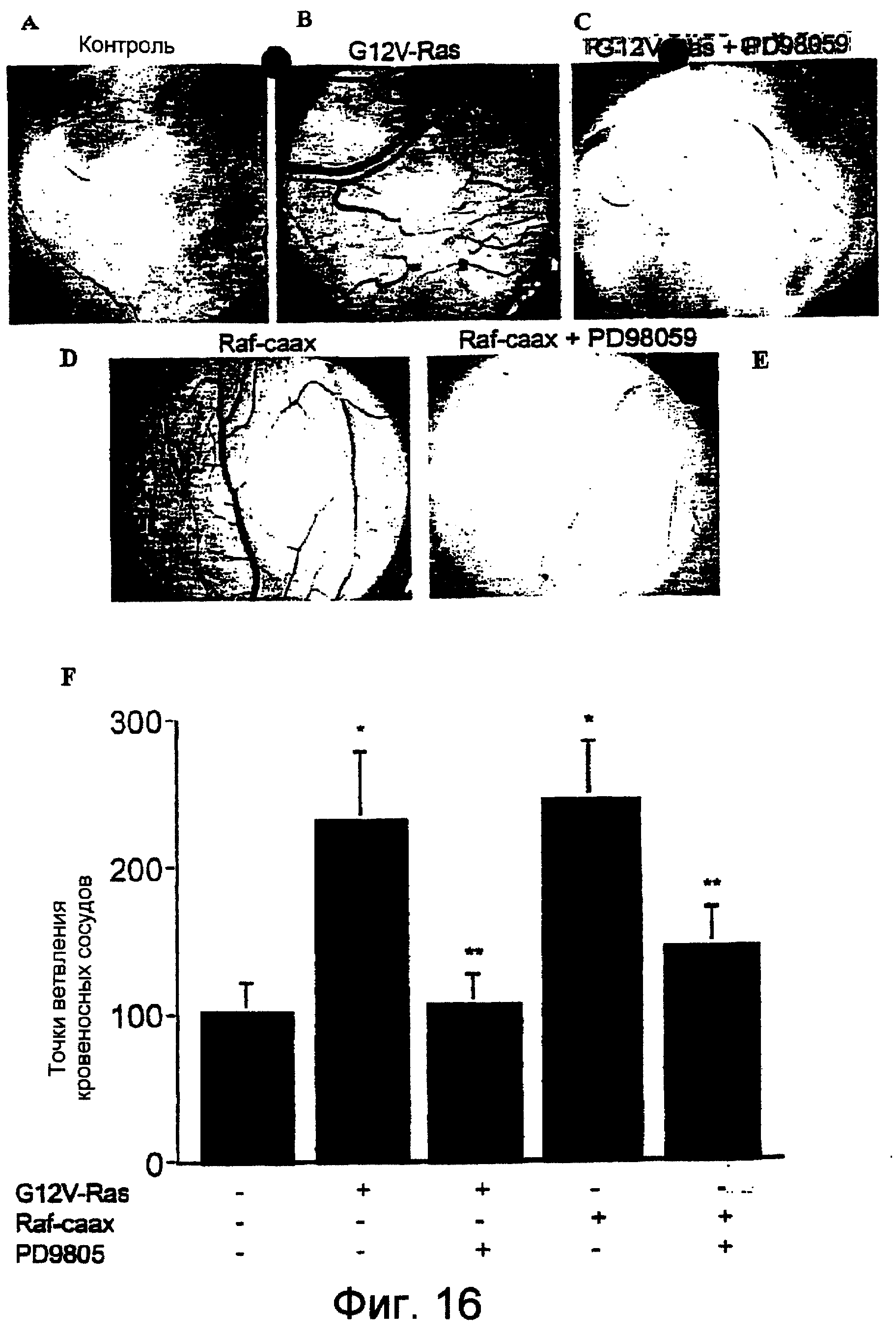
Фиг.16А-16Е и Фиг.16F, соответственно, в виде фотографий и диаграммы показывают, что ингибитор МЕК, PD98059, блокировал ангиогенез, индуцированный либо мутантным активным Ras, либо Raf. Вирус, кодирующий активирующую Ras конструкцию, Ras V12 (также называемую G12V), и активирующую Ras конструкцию, Raf-caax, наносили локально на фильтровальные диски, как описано на Фиг.12. Спустя 24 часа один (1) наномоль ингибитора МЕК, PD98059, добавляли на диск. Затем САМ оценивали, как описано на Фиг.12. Данные изображены в виде среднего ± стандартная ошибка (SE) для 20 эмбрионов.
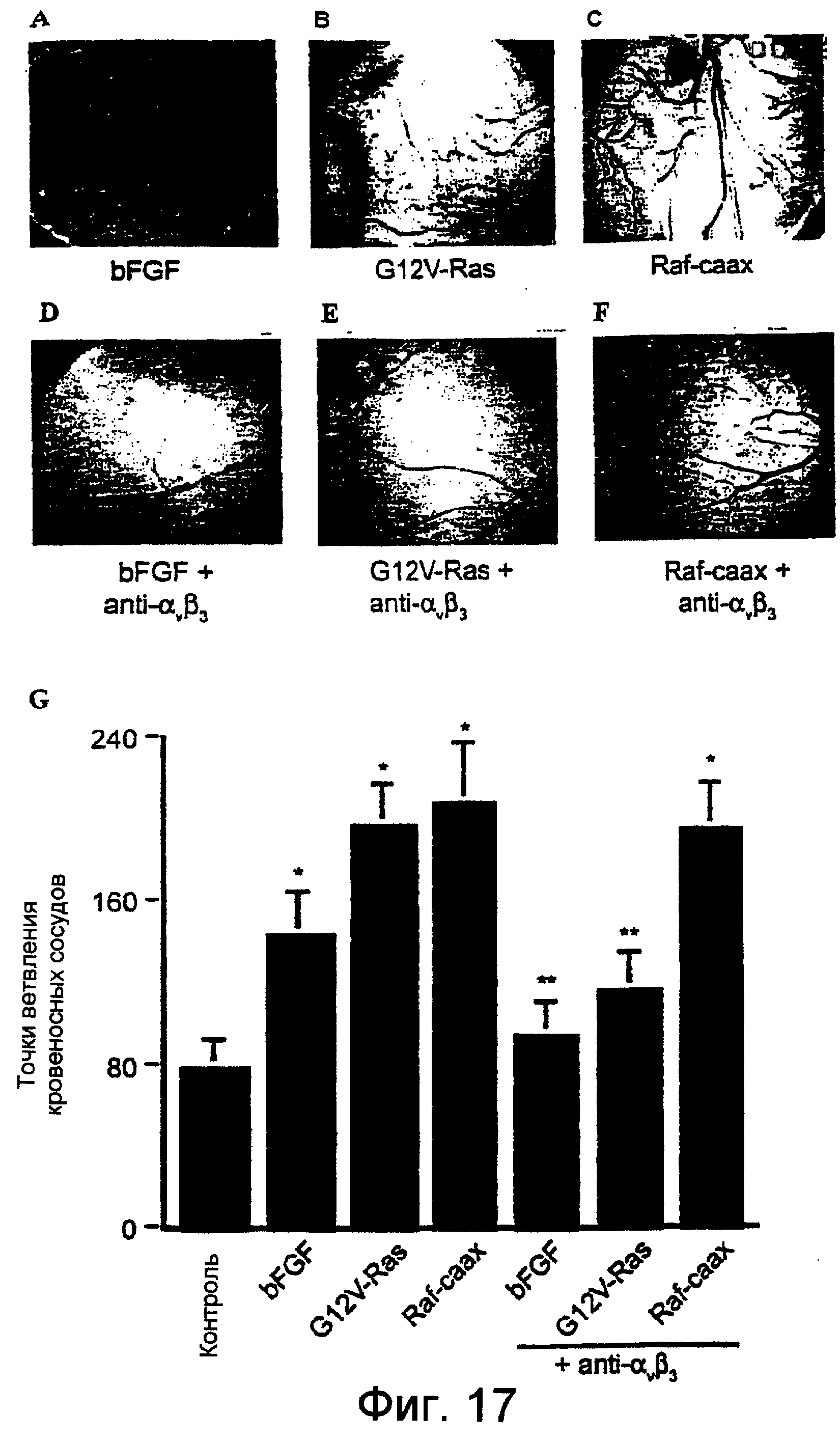
Фиг.17A-17F и Фиг.17G, соответственно, в виде фотографий и диаграммы показывают, что ангиогенез, индуцированный Raf, но не Ras, был нечувствительным к ингибированию блокадой интегрина. Инфицирование обеими мутантными активными конструкциями Ras и Raf, индуцировало ярко выраженный ангиогенез, но только Ras-индуцированный ангиогенез ингибировался αvβ3-интегрин-блокирующими антителами. САМ из 10-дневных куриных эмбрионов стимулировали, как описано на Фиг.9 и 12, фильтровальными дисками, пропитанными либо ЗФР (контроль), bFGF, RCAS(А)-ретровирусными конструкциями G12V-Ras, либо Ras-caax. LM609, моноклональное антитело к интегрину αv β3, доставляли внутривенно спустя 24 часа и ангиогенез оценивали анализом точек ветвления сосудов спустя 72 часа. Репрезентативные САМ показаны во вставке. Данные представляют собой среднее ± SE для 20 эмбрионов.
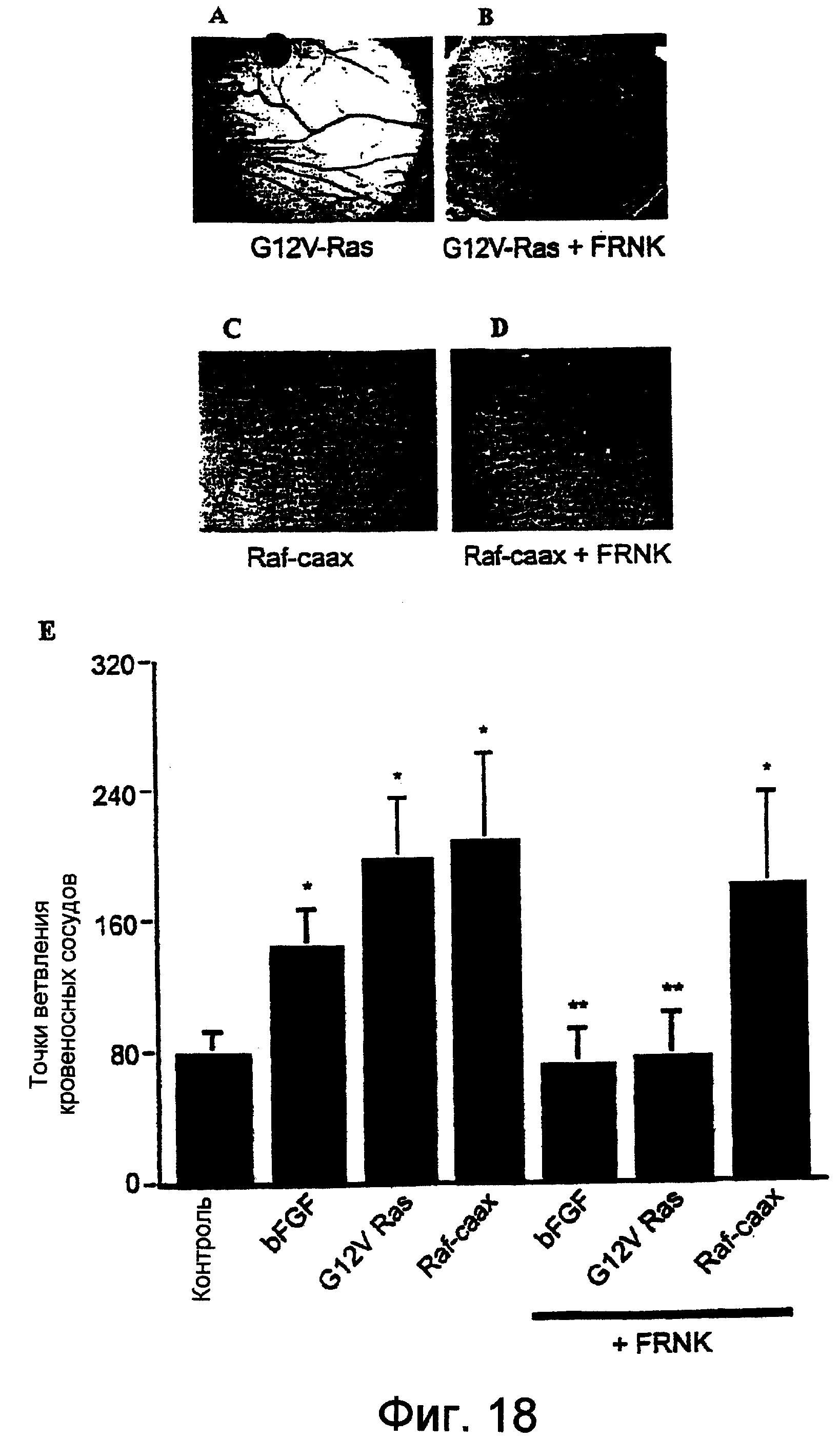
Фиг.18A-18D и 18Е, соответственно, в виде фотографий и диаграммы показывают, что коинфицирование САМ мутантной нуль-фокальной адгезионной киназой, FRNK, блокировало индуцированный Ras, но неиндуцированный Raf ангиогенез. Вирусы RCAS(А), кодирующие Ras V12 или Raf-caax, наносили локально, как описано на Фиг.12, вместе с вирусом RCAS (В), кодирующим FAK-родственную нуль-киназу (FRNK), на фильтровальный диск САМ. Данные представляют собой среднее ± SE для 20 эмбрионов.
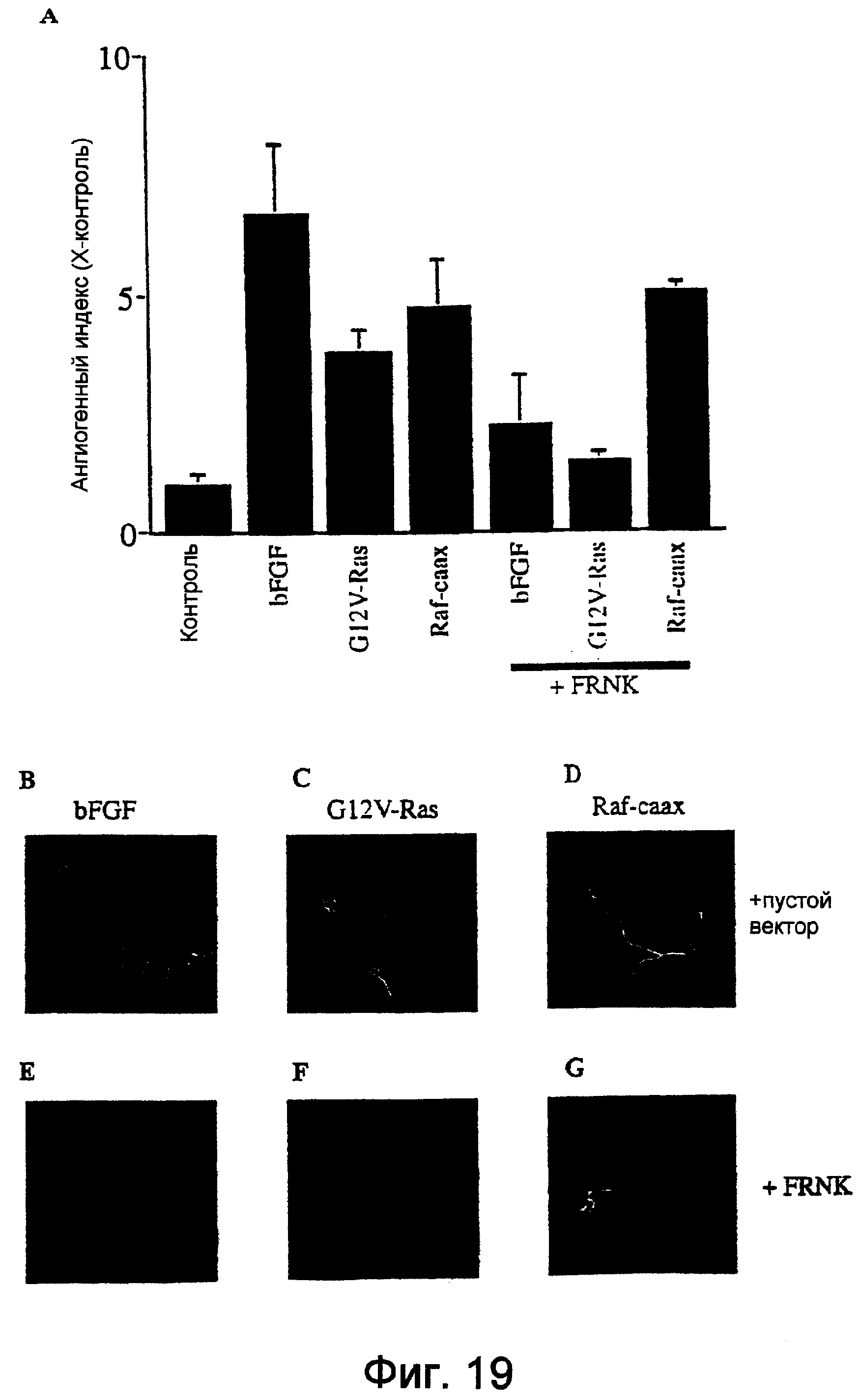
Фиг.19А и 19B-19G, соответственно, в виде фотографий и диаграмм показывают, что FRNK блокировала индуцированный bFGF и Ras, но не Raf, ангиогенез в мышиной модели подкожного ангиогенеза. Ангиогенез индуцировали подкожной инъекцией в бок мыши 250 мкл охлажденного на льду имеющего сниженное количество факторов роста матригеля, содержащего 400 нг/мл bFGF, или экспрессирующих ретровирус Молони, упакованный в клетки, экспрессирующие описанный ген. Ретровирус FRNK добавляли к матригелю в виде имеющего высокий титр вируса, упакованного белком оболочки vsv.g. Спустя пять дней специфический для эндотелия FITC-конъюгированный лектин Bandeiriea Simplifica B5 инъецировали через хвостовую вену и давали циркулировать. Затем ангиогенез определяли количественно удалением, экстракцией и анализом ангиогенной ткани на флуоресцентное содержание.
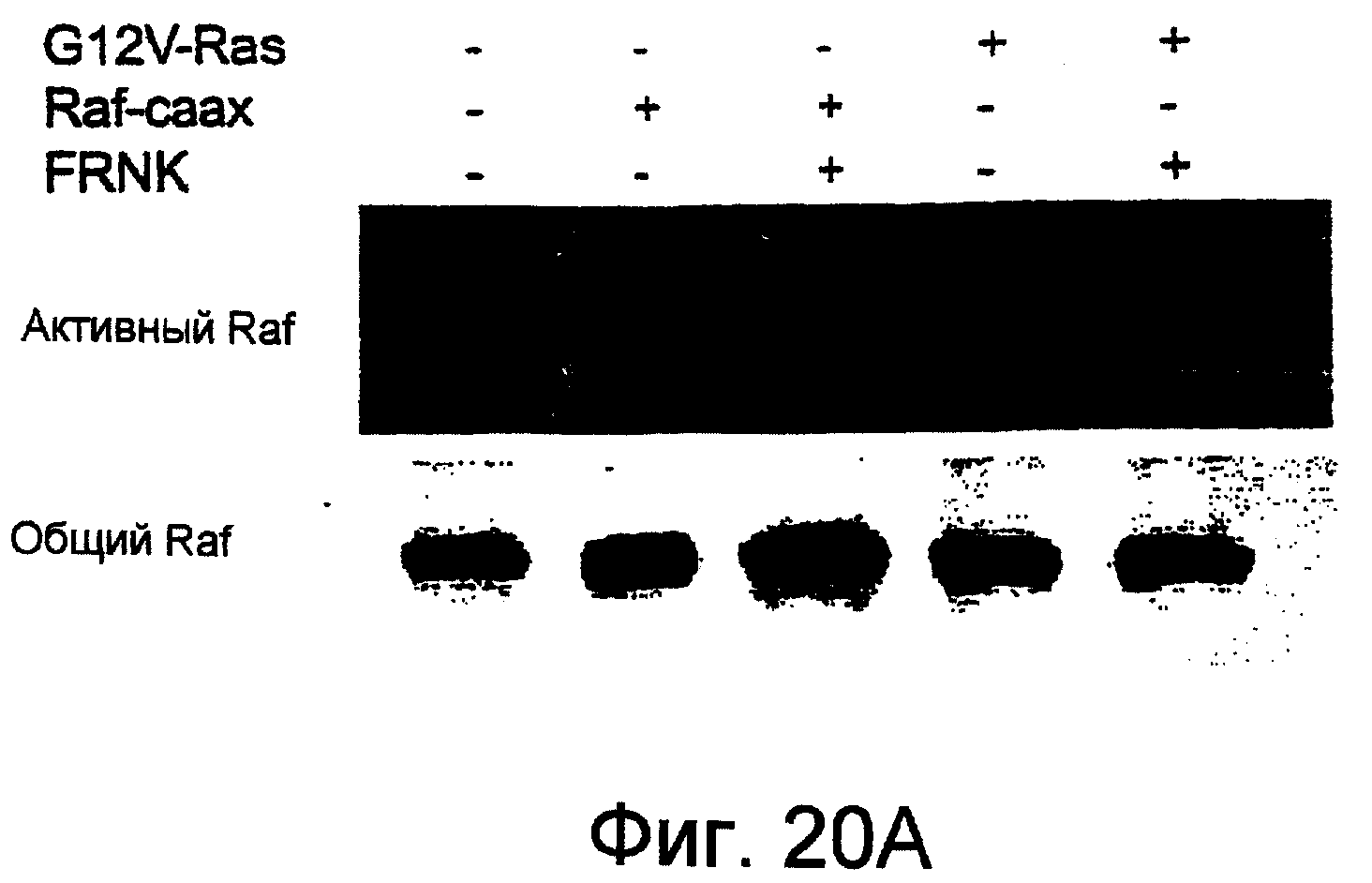
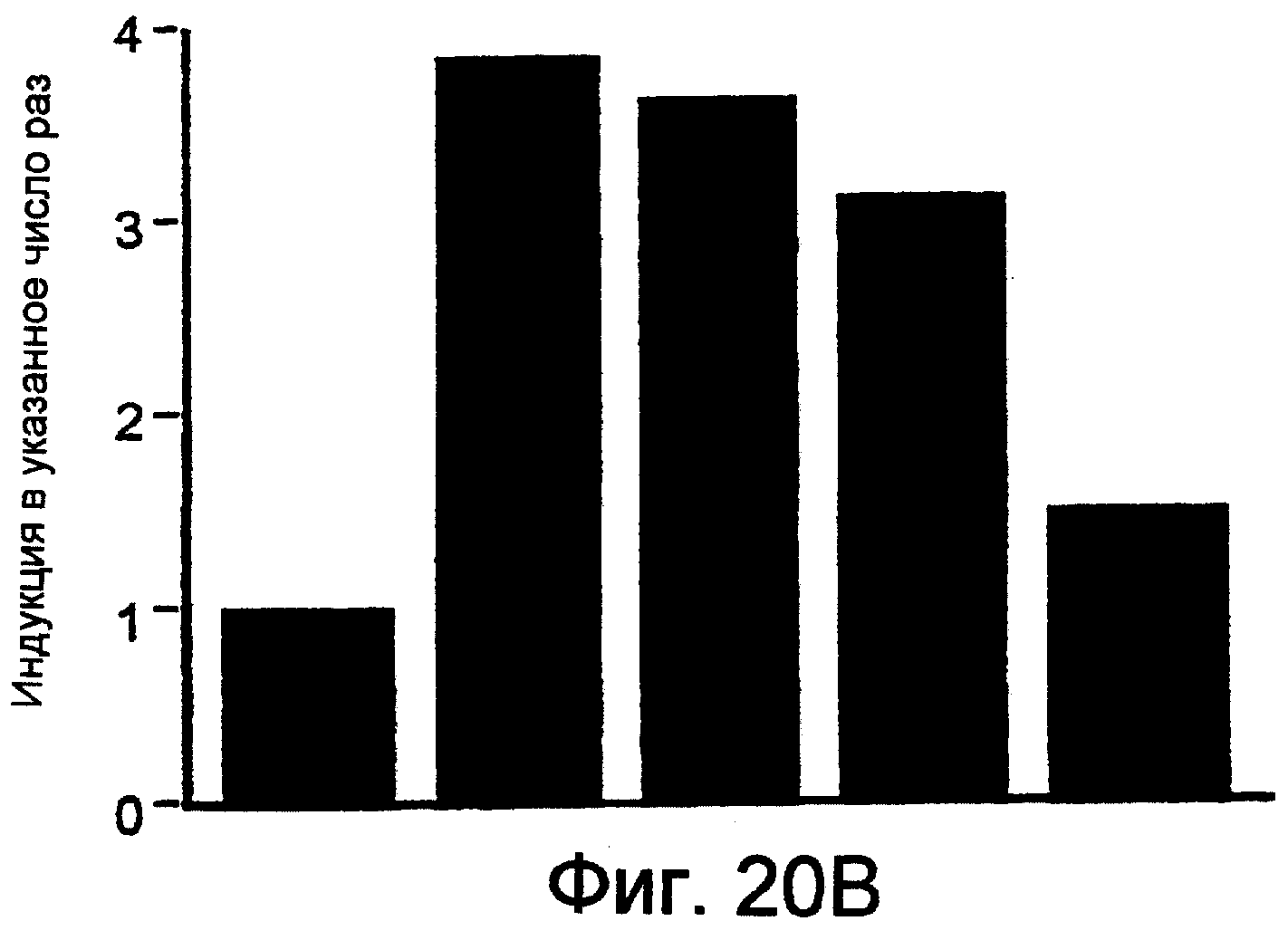
Фиг.20А и 20В показывают, что коинфицирование САМ с мутантной нуль-фокальной адгезионной киназой, FRNK, блокировало Ras-индуцированную активацию Raf. САМ обрабатывали, как описано на Фиг.18, за исключением того, что спустя 24 часа ангиогенную ткань иссекали, солюбилизировали, Raf-иммунопреципитировали и активность Raf оценивали по ее способности фосфорилировать МЕК с убитой киназной активностью. Фиг.20А показывает анализированные иммунопреципитированные активные Raf-белки в сравнении с тотальными Raf-белками, под каждой из комбинаций приведенных выше результатов. Фиг.20В показывает в виде диаграммы результаты определений активного Raf при этих условиях.
Подробное описание изобретения
А. Определения
Аминокислотный остаток: Аминокислота, образуемая при химическом расщеплении (гидролизе) полипептида при его пептидных связях. Аминокислотные остатки, описанные здесь, предпочтительно находятся в "L"-изомерной форме. Однако остатки в "D"-изомерной форме могут заменять любой L-аминокислотный остаток, пока полипептид сохраняет желательное функциональное свойство. NH2 обозначает свободную аминогруппу, присутствующую на аминоконце полипептида. СООН обозначает свободную карбоксигруппу, присутствующую на карбоксиконце полипептида, в соответствии со стандартной номенклатурой полипептидов (описанной в J.Biol. Chem., 243:3552-59 (1969) и взятой в 37 CFR параграф 1.822(b) (2)).
Следует отметить, что все последовательности аминокислотных остатков представлены здесь формулами, левая и правая ориентация которых имеет общепринятое направление аминоконец → карбоксиконец. Кроме того, следует заметить, что черта в начале или в конце последовательности аминокислотных остатков указывает пептидную связь со следующей последовательностью из одного или нескольких аминокислотных остатков.
Полипептид: обозначает линейный ряд аминокислотных остатков, связанных друг с другом пептидными связями между альфа-аминогруппой и карбоксигруппой смежных аминокислотных остатков.
Пептид: в применении здесь обозначает линейный ряд не более чем приблизительно 50 аминокислотных остатков, связанных друг с другом, как в полипептиде.
Циклический пептид: обозначает соединение, имеющее содержащую гетероатомы циклическую структуру, которая включает в себя несколько амидных связей, как в типичном пептиде. Циклический пептид может быть циклизованным по типу связывания «головы с хвостом» линейным полипептидом, в котором N-конец линейного пептида имеет образованную амидную связь с концевой СООН-группой этого линейного пептида, или он может содержать кольцевую структуру, в которой структура полимера является гомогенной или гетерогенной и полимер содержит амидные связи и/или другие связи вблизи кольца, например дисульфидные мостики, тиоэфирные, тиоамидные, гуанидиносвязи и т.п.
Белок: обозначает линейный ряд из более чем 50 аминокислотных остатков, связанных друг с другом, как в полипептиде.
Слитый белок: обозначает полипептид, содержащий по меньшей мере два разных полипептидных домена, функционально связанных типичной пептидной связью («слитых»), где эти два домена соответствуют пептидам, не находящимся в слитом виде в природе.
Синтетический пептид: обозначает химически образованную цепь аминокислотных остатков, связанных вместе пептидными связями, которая не содержит природно встречающихся белков и их фрагментов.
В. Общие обсуждения
Данное изобретение относится в общем к обнаружению того, что ангиогенез опосредуется белком протеинкиназы Raf и что ангиогенез может модулироваться обеспечением либо активных, либо неактивных Raf-белков для потенциирования или ингибирования ангиогенеза, соответственно. Данное изобретение относится также к обнаружению того, что Ras-белок может влиять на Raf и благодаря этому модулировать ангиогенез.
Это открытие является важным вследствие роли, которую играет ангиогенез, образование новых кровеносных сосудов, в различных патологических процессах. С другой стороны, в том случае, когда ткани, ассоциированные с патологическим состоянием, требуют ангиогенеза для роста тканей, желательно ингибировать ангиогенез и тем самым ингибировать рост патологических тканей. В случае, когда ткань требует ангиогенеза для роста и заживления ткани, желательно потенциировать или стимулировать ангиогенез и тем самым стимулировать заживление и рост ткани.
Если рост новых кровеносных сосудов является причиной патологии, ассоциированной с патологической тканью, или способствует этой патологии, ингибирование ангиогенеза будет уменьшать вредные эффекты данного заболевания. Ингибированием ангиогенеза можно противодействовать заболеванию, ослаблять симптомы и в некоторых случаях вылечивать данное заболевание.
Примеры ткани, ассоциированной с заболеванием и реваскуляризацией, которая будет иметь пользу от модуляции ангиогенеза, включают в себя рак, ревматоидный артрит, глазные заболевания, например, диабетическую ретинопатию, воспалительные заболевания, рестеноз и т.п. Если рост новых кровеносных сосудов необходим для поддержания роста вредной ткани, ингибирование ангиогенеза уменьшает кровоснабжение этой ткани и тем самым способствует уменьшению массы ткани на основе требований кровоснабжения. Особенно предпочтительные примеры включают в себя рост опухолей, где реваскуляризация является непременным требованием для того, чтобы опухоль росла до толщины более нескольких миллиметров, и для установления метастазов твердых опухолей.
Если рост новых кровеносных сосудов способствует заживлению ткани, потенциирование ангиогенеза способствует заживлению. Примеры включают в себя лечение пациентов с ишемическими конечностями, в которых присутствует ненормальная, т.е. слабая циркуляция (кровоток) в результате диабета или других состояний. Рассматриваются также пациенты с хроническими ранами, которые не заживают и, следовательно, будут получать пользу от увеличения пролиферации и реваскуляризации клеток.
Способы данного изобретения являются эффективными отчасти вследствие того, что эта терапия является высокоизбирательной для ангиогенеза, но не для других биологических процессов.
Как описано ранее, ангиогенез включает в себя различные процессы, включающие в себя ревакуляризацию ткани, в том числе "разветвление" сосудов, васкулогенез (образование и развитие сосудов) или увеличение сосудов, причем все эти процессы ангиогенеза подвергаются действию одного Raf-белка или его действию вместе с Ras-белком. Считается, что за исключением заживления травматических ран, образования желтого тела и эмбриогенеза большинство процессов ангиогенеза связаны с патологическими процессами и, следовательно, применение данных терапевтических способов являются селективным для таких заболеваний и не имеет вредных побочных действий.
С. Raf-белки
Белок протеинкиназы Raf для применения в данном изобретении может варьироваться в зависимости от предполагаемого применения. Термины "Raf-белок" или "Raf" используются для совокупного обозначения различных форм белка протеинкиназы Raf, в активной или неактивной формах.
"Активный Raf-белок" обозначает любую из различных форм Raf-белка, которые потенциируют, стимулируют, активируют, индуцируют или увеличивают ангиогенез. Здесь описаны анализы для измерения потенциирования ангиогенеза, и они не должны рассматриваться как ограничительные. Белок считается активным, если уровень ангиогенеза является по меньшей мере на 10%, предпочтительно на 25% и более предпочтительно на 50% более высоким, чем контрольный уровень, где в тест-систему не добавляют Raf. Предпочтительным тестом для измерения потенциирования является тест определения Raf-киназы in vitro, описанный в примерах, в котором субстрат МЕК фосфорилируется32P. Примеры активных Raf-белков описаны в примерах.
"Неактивный Raf-белок" обозначает любую из форм Raf-белка, которые ингибируют, уменьшают, задерживают или ограничивают ангиогенез. Анализы для измерения ингибирования ангиогенеза описаны здесь, и они не должны рассматриваться как ограничительные. Белок считается неактивным, если уровень ангиогенеза является, по меньшей мере, на 10%, предпочтительно на 25% и более предпочтительно на 50% более низким, чем контрольный уровень, где в тест-систему не добавляют экзогенный Raf. Предпочтительным тестом для измерения ингибирования является тест определения Raf-киназы in vitro, описанный в примерах, в котором субстрат МЕК фосфорилируется32 P. Примеры неактивных Raf-белков описаны в примерах.
Raf-белок, применимый в данном изобретении, может быть получен любым из множества способов, в том числе выделением из природных источников, в том числе ткани, образованием экспрессией рекомбинантной ДНК и очисткой, и т.п. Raf-белок может быть также обеспечен "in situ" введением системы генной терапии в представляющую интерес ткань, которая затем экспрессирует этот белок в данной ткани.
Ген, кодирующий Raf-белок, может быть получен различными способами, известными в данной области, и данное изобретение не должно пониматься как ограничительное в этом отношении. Например, хорошо известно, что природная история Raf включает в себя множество гомологов млекопитающих, птиц, вирусов и т.п. видов, и этот ген может быть легко клонирован с использованием способов кДНК-клонирования из любой ткани, экспрессирующей этот белок. Предпочтительный Raf для применения в данном изобретении является клеточным белком, таким как гомологи из млекопитающих или птиц, называемые c-Raf. Особенно предпочтительным является человеческий c-Raf. Дополнительным предпочтительным Raf-белком данного изобретения является слитый белок Raf, который является конститутивно активным, но независимым от опосредованной Ras активации. Такой Raf-белок может быть слитым белком. Предпочтительным Ras-независимым Raf-белком является Raf-caax, который является белком Raf дикого типа, слитым на карбоксиконце с доменом мембранной локализации K-Ras, описанным дополнительно в примерах.
D. Ras-белки
Ras-семейство ГТФаз для применения в данном изобретении может варьироваться в зависимости от предполагаемого применения. Термин «Ras-белок» или «Ras» обозначает любую из множества форм Ras-белка, либо в активной, либо в неактивной формах.
"Активный Ras-белок" обозначает любую из различных форм Ras-белка, которые потенциируют, стимулируют, активируют, индуцируют или увеличивают ангиогенез. Здесь описаны анализы для измерения потенциирования ангиогенеза при помощи Ras, и они не должны рассматриваться как ограничительные. Белок считается активным, если уровень ангиогенеза является по меньшей мере на 10%, предпочтительно на 25% и более предпочтительно на 50% более высоким, чем контрольный уровень, где в тест-систему не добавляют Ras. Примерами активных Ras-белков являются Ras G12V, также называемый V12, и Ras V12S35, оба описаны в примерах.
"Неактивный Ras-белок" обозначает любую из форм Ras-белка, которые ингибируют, уменьшают, задерживают или ограничивают ангиогенез. Анализы для измерения ингибирования ангиогенеза описаны здесь, и они не должны рассматриваться как ограничительные. Белок считается неактивным, если уровень ангиогенеза является/ по меньшей мере, на 10%, предпочтительно на 25% и более предпочтительно на 50% более низким, чем контрольный уровень, где в тест-систему не добавляют экзогенный Ras. Примеры неактивных Ras-белков включают в себя нуль-мутантный (молчащий мутантный) Ras, называемый Ras S17N (или иногда N17), и V12C40, оба описаны дополнительно в примерах.
Ras-белок, применимый в данном изобретении, может быть получен любым из множества способов, в том числе выделением из природных источников, в том числе ткани, образованием экспрессией рекомбинантной ДНК и очисткой, и т.п. Ras-белок может быть также обеспечен "in situ" введением системы генной терапии в представляющую интерес ткань, которая затем экспрессирует этот белок в данной ткани.
Ген, кодирующий Ras-белок, может быть получен различными способами, известными в данной области. Данное изобретение не должно пониматься как ограничительное в этом отношении. Например, хорошо известно, что природная история Ras включает в себя множество гомологов из видов млекопитающих, птиц, вирусных и т.п. видов, и этот ген может быть легко клонирован с использованием способов кДНК-клонирования из любой ткани, экспрессирующей этот белок.
Должно быть понятно в результате данных указаний, что Ras-белок в его совокупных формах может быть использован в тех же самых различных вариантах, которые описаны здесь для Raf-белка, и, следовательно, детали для применения Ras-белка не повторяются снова и снова. Например, Ras может быть представлен в активной и неактивной форме для модуляции ангиогенеза, или может быть обеспечен экспрессией нуклеиновой кислоты продукта Ras-белка, посредством применения векторной системы доставки, и в различных фармацевтических (терапевтических) композициях и промышленных изделиях для применения на практике данного изобретения. Рассматриваются также способы модуляции ангиогенеза, использующие реагент на основе Ras вместо цитированных реагентов на основе Raf.
Е. Рекомбинантные молекулы ДНК и системы экспрессии для экспрессии Raf- или Ras-белка
Данное изобретение описывает несколько нуклеотидных последовательностей, конкретно используемых в данном изобретении. Они определяют последовательности нуклеиновых кислот, которые кодируют Raf-белок или Ras-белок, применимые в данном изобретении, и различные ДНК-сегменты, рекомбинантные молекулы ДНК (рДНК) и векторы, сконструированные для экспрессии Raf- и/или Ras-белка.
ДНК-молекулы (сегменты) данного изобретения могут содержать последовательности, которые кодируют целые структурные гены, фрагменты структурных генов и транскрипционные единицы, как дополнительно описано здесь.
Предпочтительным ДНК-сегментом является нуклеотидная последовательность, которая кодирует Raf-белок, определенный здесь, или его биологически активный фрагмент.
Другим предпочтительным ДНК-сегментом является нуклеотидная последовательность, которая кодирует Ras-белок, определенный здесь, или его биологически активный фрагмент. Под биологически активным подразумевают, что экспрессируемый продукт будет иметь по меньшей мере некоторую часть биологической активности интактного белка, обнаруживаемого в клетке, такую как связывание лиганда, или, в случае активных форм этого белка, ферментативная активность.
Последовательность аминокислотных остатков и нуклеотидная последовательность предпочтительных c-Raf и h-Ras описаны в примерах.
Предпочтительный ДНК-сегмент кодирует последовательность аминокислотных остатков, по существу, такую же, что и последовательность аминокислотных остатков или ее часть, и предпочтительно состоящую из последовательности аминокислотных остатков или ее части, соответствующих Raf- или Ras-белку, описанному здесь. Репрезентативные и предпочтительные ДНК-сегменты описаны дополнительно в примерах.
Последовательность аминокислотных остатков белка или полипептида прямо связана через генетический код с последовательностью дезоксирибонуклеиновой кислоты (ДНК) структурного гена, который кодирует данный белок. Таким образом, структурный ген или ДНК-сегмент может быть определен последовательностью аминокислотных остатков, т.е. белком или полипептидом, которые он кодирует.
Важным и хорошо известным признаком генетического кода является его избыточность. То есть для большинства аминокислот, используемых в образовании белков, более чем один кодирующий триплет нуклеотидов (кодон) может кодировать или обозначать конкретный аминокислотный остаток. Таким образом, ряд различных нуклеотидных последовательностей могут кодировать конкретную последовательность аминокислотных остатков. Такие нуклеотидные последовательности являются функционально эквивалентными, так как они могут приводить к образованию одной и той же последовательности аминокислотных остатков во всех организмах. Иногда метилированный вариант пурина или пиримидина может быть включен в конкретную нуклеотидную последовательность. Однако такие метилирования никаким образом не влияют на кодирующую взаимосвязь.
Нуклеиновая кислота является любым полинуклеотидом или фрагментом нуклеиновой кислоты, является ли она полирибонуклеотидом или полидезоксирибонуклеотидом, т.е. РНК или ДНК, или их аналогами. В предпочтительных вариантах молекула нуклеиновой кислоты находится в форме сегмента дуплексной ДНК, т.е. ДНК-сегмента, хотя для определенных молекулярно-биологических методологий предпочтительными является одноцепочечная ДНК или РНК.
ДНК-сегменты получают рядом способов, в том числе способами химического синтеза и рекомбинантными подходами, предпочтительно клонированием или полимеразной цепной реакцией (ПЦР). ДНК-сегменты, которые кодируют весь белок или только части Raf- или Ras-белка, могут быть легко синтезированы химическими способами, например, фосфотриэфирным способом Matteucci et al., J.Am. Chem. Soc., 103:3185-3191 (1981), или с использованием автоматических способов синтеза. Кроме того, более крупные сегменты ДНК могут быть легко получены хорошо известными способами, такими как синтез группы олигонуклеотидов, которые определяют этот ДНК-сегмент, с последующими гибридизацией и лигированием олигонуклеотидов для построения всего этого сегмента. Альтернативные способы включают в себя выделение предпочтительного ДНК-сегмента при помощи ПЦР с парой олигонуклеотидных праймеров, используемых с библиотекой кДНК, которая, как считают, содержит члены, которые кодируют Raf- или Ras-белок.
Конечно, посредством химического синтеза любые желательные модификации могут быть произведены просто заменой подходящими основаниями, кодирующих нативную последовательность аминокислотных остатков. Этот способ хорошо известен и может быть легко применен для получения многочисленных различных "модифицированных" Raf- и Ras-белков, описанных здесь.
Кроме того, ДНК-сегменты, состоящие по существу из структурных генов, кодирующих Raf- или Ras-белок, могут быть затем модифицированы, например, сайт-направленным или случайным мутагенезом, для введения любых желательных замен. Понятно, что различные аллельные формы Raf- или Ras-белка и гены Raf- или Ras-белка также пригодны для применения в данном изобретении.
1. Клонирование Raf- или Ras-гена
Raf- или Ras-ген данного изобретения может быть клонирован из подходящего источника геномной ДНК или мессенджера РНК (мРНК) различными биохимическими способами. Клонирование этих генов может проводиться в соответствии с общими способами, описанными в примерах и известными в данной области.
Источники нуклеиновых кислот для клонирования Raf- или Ras-гена, пригодные для применения в данном изобретении, могут включать в себя геномную ДНК или мессенджер РНК (мРНК) в форме библиотеки кДНК, из ткани, которая, как считают, экспрессирует эти белки. Предпочтительной тканью является ткань легких человека, хотя может быть использована любая другая подходящая ткань.
Предпочтительный способ клонирования включает в себя получение библиотеки кДНК при помощи стандартных способов и выделение Raf-кодирующей или Ras-кодирующей нуклеотидной последовательности ПЦР-амплификацией с применением пары олигонуклеотидых праймеров на основе описанных здесь нуклеотидных последовательностей. Альтернативно, желательные кДНК-клоны могут быть идентифицированы и выделены из библиотеки кДНК или геномной библиотеки общепринятыми способами гибридизации нуклеиновых кислот с применением гибридизационного зонда на основе описанных здесь последовательностей нуклеиновых кислот. Другие способы выделения и клонирования подходящих Raf-кодирующих или Ras-кодирующих нуклеиновых кислот будут вполне очевидными среднему специалисту в данной области.
2. Экспрессирующие векторы
Данное изобретение рассматривает рекомбинантную молекулу ДНК (рДНК), содержащую ДНК-сегмент, кодирующий Raf- или Ras-белок, как описано здесь. Экспрессируемая рДНК может быть получена функциональным связыванием (в рамке считывания, экпрессируемо) вектора с Raf- или Ras-кодирующим ДНК-сегментом данного изобретения. Предполагается, что может быть получена комбинированная экспрессия, когда присутствует Raf- и Ras-кодирующая нуклеиновая кислота, функционально связанная с одним и тем же или раздельными промоторами. Таким образом, рекомбинантная молекула ДНК является гибридной молекулой ДНК, содержащей, по меньшей мере, две нуклеиновые кислоты, из нуклеотидных последовательностей, обычно не обнаруживаемых вместе в природе (т.е. гена и вектора).
Выбор вектора, с которым ДНК-сегмент данного изобретения функционально связан, зависит непосредственно, как хорошо известно в данной области, от желаемых функциональных свойств, например, от экспрессии белка и от трансформируемой клетки-хозяина. Типичными вопросами для рассмотрения в области конструирования рекомбинантных молекул ДНК являются следующие: вектор, рассматриваемый данным изобретением, по меньшей мере способен направлять репликацию, а предпочтительно также экспрессию, структурного гена, включенного в векторные ДНК-сегменты, с которыми он функционально связан.
Как прокариотические, так и эукариотические экспрессирующие векторы являются известными среднему специалисту в области конструирования векторов и описаны Ausebel et al., in Current Protocols in Molecular Biology, John Wiley and Sons, New York (1993) и Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory (1989). Эти ссылки описывают также многие из общих способов рекомбинантных ДНК, цитируемых здесь.
В одном варианте, вектор, обсуждаемый в данном изобретении, включает прокариотический репликон, т.е. последовательность ДНК, имеющую способность управлять автономной репликацией и поддержанием молекулы рекомбинантной ДНК вне хромосомы в прокариотической клетке-хозяине, например бактериальной клетке-хозяине, трансформированной им. Такие репликоны хорошо известны в данной области. Кроме того, варианты, которые включают прокариотический репликон, включают также ген, экспрессия которого придает устойчивость к лекарственным средствам бактериальной клетке-хозяину, трансформированной ими. Типичными генами устойчивости к лекарственным средствам являются гены, придающие устойчивость к ампициллину или тетрациклину.
Векторы, которые включают в себя прокариотический репликон, могут также содержать прокариотический промотор, способный направлять экспрессию (транскрипцию или трансляцию) структурного гена в бактериальной клетке-хозяине, например, Е. coli, трансформированной ими. Промотор является регуляторным элементом экспрессии, образуемым ДНК-последовательностью, которая делает возможным связывание РНК-полимеразы и выполнение транскрипции. Промоторы или другие подобные регуляторные последовательности нуклеиновых кислот могут быть индуцируемыми или конститутивными в зависимости от желаемого контроля и/или результата экспрессии. Промоторные последовательности, совместимые с бактериальными хозяевами, обычно обеспечивают в плазмидных векторах, содержащих удобные сайты рестрикции для встраивания ДНК-сегмента данного изобретения. Типичными векторными плазмидами являются pUC8, pUC9, pBR322 и pBR329, доступные от Biorad Laboratories (Richmond, CA), pRSET, доступная от Invitrogen (San Diego, CA) и pPL и рКК223, доступные от Pharmacia, Piscataway, N.J.
Экспрессирующие векторы, совместимые с эукариотическими клетками, предпочтительно векторы, совместимые с клетками позвоночных, могут быть также использованы для образования рекомбинантных молекул ДНК данного изобретения. Экспрессирующие векторы эукариотических клеток хорошо известны в данной области и доступны из нескольких коммерческих источников. Обычно, такие векторы обеспечены содержащимися в них удобными сайтами рестрикции для встраивания желательного ДНК-сегмента. Типичными подобными векторами являются pSVL и pKSV-10 (Pharmacia), pBPV-1/pML2d (International Biotechnologies, Inc.), pTDT1 (ATCC, #31255), pRc/CMV (Invitrogen, Inc.), этот предпочтительный вектор описан в примерах, и т.п. Экспрессирующие векторы эукариотических клеток.
Особенно предпочтительная система для экспрессии генов в контексте данного изобретения включает в себя компонент доставки генов, т.е. способность доставки гена в представляющую интерес ткань. Подходящие векторы являются «инфекционными» векторами, например рекомбинантными ДНК-вирусами, аденовирусными или ретровирусными векторами, которые сконструированы для экспрессии желаемого белка и имеют признаки, которые делают возможным инфицирование заранее выбранных тканей-мишеней. Особенно предпочтительным является описанная здесь ретровирусная векторная система.
Могут быть сконструированы системы клеток млекопитающих, которые используют вирусы или элементы вирусов для прямой экспрессии. Например, при использовании аденовирусных экспрессионных векторов, кодирующая последовательность полипептида может быть лигирована с аденовирусным регуляторным комплексом транскрипции/трансляции, например, поздним промотором и трехчастной лидерной последовательностью. Этот химерный ген может быть затем встроен в аденовирусный геном рекомбинацией in vitro или in vivo. Инсертирование не являющегося существенным района вирусного генома (например, Е1 или Е3) будет приводить к рекомбинантному вирусу, который является жизнеспособным и способным экспрессировать этот полипептид в инфицированных хозяевах (например, см. Logan et al., Proc. Natl. Acad. Sci. USA, 81:3655-3659 (1984)). Альтернативно, промотор вируса коровьей оспы 7,5К может быть использован (например, см. Mackett et al., Proc. Natl. Acad. Sci. USA, 79:7415-7419 (1982); Mackett et al., J.Virol., 49:857-864 (1984); Panicali et al., Proc. Natl. Acad. Sci. USA, 79:4927-4931 (1982)). Особый интерес представляют векторы на основе вируса бычьей папилломы, которые способны реплицироваться в виде внехромосомных элементов (Sarver et al., Mol. Cell. Biol. 1:486 (1981)). Вскоре после вхождения этой ДНК в клетки-мишени плазмида реплицируется до приблизительно 100-200 копий на клетку. Транскрипция встроенной кДНК не требует интеграции этой плазмиды в хромосому хозяина, что дает высокий уровень экспрессии. Эти векторы могут быть использованы для стабильной экспрессии посредством включения селектируемого маркера в плазмиду, такого как ген neo. Альтернативно, ретровирусный геном может быть модифицирован для применения в качестве вектора, способного к введению и направлению экспрессии кодирующей полипептид нуклеотидной последовательности в клетки-хозяева (Cone et al., Proc. Natl. Acad. Sci. USA, 81:6349-6353 (1984)). Высокий уровень экспрессии может быть также достигнут с использованием индуцируемых промоторов, в том числе, но не только, промотора металлотионина IIA и промоторов белков теплового шока.
Недавно было исследовано долгосрочное выживание при терапии регулируемым промотором цитомегаловируса (CMV) в сравнении с терапией регулируемым промотором вируса саркомы Рауса (RSV) геном тимидинкиназы (ТК) в голых мышах, несущих рак яичника человека. Было обнаружено, что убивающая клетки эффективность терапии геном ТК вируса простого герпеса, регулируемым аденовирус-опосредованным промотором CMV, в 2-10 раз более эффективна, чем терапия, регулируемая RSV (Топд et al., Hybridoma 18(1):93-97 (1999)). Конструирование химерных промоторов для применений генной терапии, которые требуют экспрессии низкого уровня с последующей индуцируемой экспрессией высокого уровня, также было описано (Suzuki et al., Human Gene Therapy, 7:1883-1893 (1996)).
Для долгосрочного продуцирования с высоким выходом рекомбинантных белков предпочтительной является стабильная экспрессия. Вместо использования экспрессирующих векторов, которые содержат вирусные начала репликации, клетки-хозяева могут быть трансформированы кДНК, регулируемой подходящими регуляторными элементами транскрипции (например, последовательностями промоторов и энхансеров, терминаторами транскрипции, сайтами полиаденилирования и т.д.), и селектируемым маркером. Как упоминалось выше, селектируемый маркер в рекомбинантной плазмиде придает устойчивость к отбору и позволяет клеткам стабильно интегрировать плазмиду в их хромосомы и расти с образованием очагов, которые, в свою очередь, могут быть клонированы и размножены в клеточные линии.
Например, после введения чужеродной ДНК сконструированные клетки могут выращиваться в течение 1-2 дней в обогащенных средах, а затем переключаться на селективные среды. Могут быть использованы ряд систем отбора, в том числе, но не только, гены тимидинкиназы вируса простого герпеса (Wigler et al., Cell, 11:223 (1977)), гипоксантин-гуанин-фосфорибозилтрансферазы (Szybalska et al., Proc. Natl. Acad. Sci. USA, 48:2026 (1962)) и аденинфосфорибозилтрансферазы (Lowy et al., Cell, 22:817 (1980)), которые могут использоваться в клетках tk-, hgprt- или aprt-, соответственно. Могут быть также использованы придающие устойчивость к антиметаболитам гены в качестве основы для отбора; например, гены для dhfr, который придает устойчивость к метотрексату (Wigler et al., Proc. Natl. Acad. Sci. USA, 77:3567 (1980); O'Hare et al., Proc. Natl. Acad. Sci. USA, 78:1527 (1981)); gpt, который придает устойчивость к микофеноловой кислоте (Mulligan et al., Proc. Natl. Acad. Sci. USA, 78:2072 (1981)); neo, который придает устойчивость к аминогликозиду G-418 (Colberre-Garapin et al., J.Mol. Biol. 150:1 (1981)); и hygro, который придает устойчивость к гигромицину (Santerre et al., Gene, 30:147 (1984)). Недавно были описаны дополнительные селектируемые гены, а именно trpB, который позволяет клеткам использовать индол вместо триптофана; hisD, который позволяет клеткам использовать гистинол вместо гистидина (Hartman et al., Proc. Natl. Acad. Sci. USA, 85:804 (1988)); и ODC (орнитиндекарбоксилазы), который придает устойчивость к ингибитору орнитиндекарбоксилазы, 2-(дифторметил)-DL-орнитину, DFMO (McConlogue L., In: Current Communications in Molecular Biology, Cold Spring Harbor Laboratory ed. (1987)).
Основные векторы, предполагаемые для генной терапии человека, имеют ретровирусное происхождение (Wilson, Clin. Exp. Immunol. 107(Sup. 1):31-32 (1997); Bank et al., Bioassays 18(12): 999-1007 (1996); Robbins et al., Pharmacol. Ther. 80(1):35-47 (1998)). Терапевтический потенциал переноса генов и антисмысловой терапии стимулировался развитием многочисленных векторных систем для лечения различных тканей (сосудистой сети, Stephan et al., Fundam. Clin. Pharmacol. 11(2):97-110 (1997); Feldman et al., Cardiovasc. Res. 35(3):391-404 (1997); Vassalli et al., Cardiovasc. Res. 35(3): 459-69 (1997); Baek et al., Circ. Res. 82 (3):295-305 (1998); почки. Lien et al., Kidney Int. Suppl. 61:S85-8 (1997); печени. Ferry et al., Hum. Gene Ther, 9(14): 1975-81 (1998); мышцы, Marshall et al., Curr. Opn. Genet. Dev. 8(3):360-5 (1998)). Кроме этих тканей, критической мишенью для генной терапии человека является рак, либо сама опухоль, либо связанные с ней ткани (Runnebaum, Anticancer Res. 17(4В):2887-90 (1997); Spear et al., J.Neurovirol. 4(2):133-47 (1998)).
Конкретные примеры вирусных векторных систем для генной терапии, легко адаптируемые для применения в способах данного изобретения, описаны ниже. Обзор литературы по ретровирусной доставке генов был сделан недавно Federspiel and Hughes (Methods in Cell Biol. 52:179-214 (1998)), который описывает, в частности, семейство ретровирусов вируса лейкоза птиц (ALV) (Federspiel et al., Proc. Natl. Acad. Sci. USA, 93:4931 (1996); Federspiel et al., Proc. Natl. Acad. Sci. USA, 91:11241 (1994)). Ретровирусные векторы, в том числе ALV и вирус лейкоза мышей (MLV), дополнительно описаны Svoboda (Gene 206:153-163 (1998)).
Модифицированные ретровирусные/аденовирусные экспрессионные системы могут быть легко приспособлены для применения на практике способов данного изобретения. Например, системы вируса мышиного лейкоза (MLV) рассматриваются Karavanas et al., Crit. Rev. in Oncology/Hematology 28:7-30 (1998). Аденовирусные экспрессионные системы рассматриваются Von Seggern and Nemerov in Gene Expression Systems (ed. Fernandez and Hoeffner, Academic Press, San Diego, CA, chapter 5, pages 112-157 (1999)).
Было продемонстрировано, что системы экспрессии белков имеют эффективное применение как in vivo, так и in vitro. Например, был описан перенос генов в плоскоклеточные карциномы вектором ампликона вируса простого герпеса типа 1 (HSV). (Carew et al., Am.J.Surg. 176:404-408). Вирус простого герпеса использовали для переноса генов в нервную систему (Goins et al., J. Neurovirol. 3 (Sup. 1):S80-8 (1997)). Нацеленные векторы-самоубийцы, использующие HSV-TK испытывали на солидных опухолях (Smiley et al., Hum. Gene Ther. 8(8):965-77 (1997)). Вектор вируса простого герпеса типа 1 использовали для генной терапии рака на клетках карциномы ободочной кишки (Yoon et al.. Am. Surg. 228(3);366-74 (1998)). Были разработаны гибридные векторы для удлинения периода времени трансфекции, в том числе гибриды HSV/AAV (аденоассоциированный вирус) для лечения гепатоцитов (Fraefel et al., Mol. Med. 3(12):813-825 (1997)).
Вирус коровьей оспы был разработан для генной терапии человека вследствие его большого генома (Peplinski et al., Surg. Oncol. Clin. N. Am. 7(3):575-88 (1998)). Вирус коровьей оспы с делегированной тимидинкиназой, экспрессирующий пирофосфорилазу пуриновых нуклеозидов, был описан для применения в качестве нацеленного на опухоль вектора генной терапии (Puhlman et al., Human Gene Therapy 10;649-657 (1999)).
Аденоассоциированный вирус 2 (AAV) был описан для применения в генной терапии человека, однако AAV требует вируса-помощника (такого как аденовирус или герпесвирус) для оптимальной репликации и упаковки в клетках млекопитающих (Snoeck et al., Exp. Nephrol. 5(6):514-20 (1997); Rabinowitz et al., Curr. Opn. Biotechnol. 9(5): 470-5 (1998)). Однако была описана in vitro упаковка инфекционного рекомбинантного AAV, что делает эту систему гораздо более перспективной (Ding et al.. Gene Therapy 4:1167-1172 (1997)). Было показано, что опосредованный AAV перенос кДНК рецептора экотропного ретровируса делает возможной трансдукцию экотропным ретровирусом установленных и первичных клеток человека (Qing et al., J. Virology 71(7):5663-5667 (1997)). Была продемонстрирована генная терапия рака с использованием AAV-вектора, экспрессирующего р53 дикого типа человека (Qazilbash et al., Gene Therapy 4:675-682 (1997)). Был также показан перенос генов в сосудистые клетки с использованием AAV-векторов (Maeda et al., Cardiovascular Res. 35:514-521 (1997)). Было показано, что AAV является подходящим вектором для нацеленной на печень генной терапии (Xiao et al., J. Virol. 72(12):10222-6 (1998)). AAV-векторы были продемонстрированы для применения в генной терапии тканей головного мозга и центральной нервной системы (Chamberlin et al.. Brain Res. 793(1-2):169-75 (1998); During et al., Gene Therapy 5(6):820-7 (1998)). AAV-векторы сравнивали также с аденовирусными векторами (AdV) для генной терапии легкого и переноса в эпителиальные клетки муковисцидоза (Teramoto et al., J. Virol. 72(11):8904-12 (1998)).
Описаны химерные AdV/ретровирусные векторные системы генной терапии, которые включают в себя полезные качества каждого вируса для создания неинтегрирующегося AdV, который становится функционально интегрирующимся через промежуточное образование ретровирусной клетки-продуцента (Feng et al., Nat. Biotechnology 15(9):866-70 (1997); Bilbao et al., FASEB J. 11(8):624-34 (1997)). Эта мощная новая генерация вектора генной терапии была приспособлена для нацеленной генной терапии рака (Bilbao et al., Adv. Exp. Med. Biol. 451:365-74 (1998)). Единственная инъекция AdV, экспрессирующего р53, ингибировала рост подкожных опухолевых узелков раковых клеток предстательной железы человека (Asgari et al., Int. J. Cancer 71(3);377-82 (1997)). Был описан опосредованный AdV перенос гена р53 дикого типа в пациентах с прогрессировавшим немелкоклеточным раком легкого (Schuler et al., Human Gene Therapy 9:2075-2082 (1998)). Тот же самый рак был объектом заместительной терапии гена р53, опосредованной AdV-векторами (Roth et al., Semin. Oncol. 25 (3 Suppl 8):33-7 (1998)). Опосредованный AdV перенос гена р53 ингибирует дифференцировку эндотелиальных клеток и ангиогенез in vivo (Riccioni et al., Gene Ther. 5(6):747-54 (1998)). Опосредованная аденовирусом экспрессия антигена gp75 меланомы в качестве иммунотерапии для метастатической меланомы также была описана (Hirschowitz et al., Gene Therapy 5:975-983 (1998)). AdV облегчает инфицирование клеток человека экотропным ретровирусом и увеличивает эффективность ретровирусной инфекции (Scott-Taylor et al., Gene Ther. 5(5):621-9 (1998)). AdV-векторы использовали для переноса генов в клетки гладких мышц сосудов (Li et al., Chin. Med. J.(Engl) 110(12):950-4 (1997)), клетки плоскоклеточной карциномы (Goebel et al., Otolarynol Head Neck Surg 119(4):331-6 (1998)), клетки рака пищевода (Senmaru et al., Int. J. Cancer 78(3):366-71 (1998)), мезангиальные клетки (Nahman et al., J. Investig. Med. 46(5):204-9 (1998)), глиальные клетки (Chen et al., Cancer Res. 58(16):3504-7 (1998)) и суставы животных (Ikeda et al., J. Rheumatol. 25(9):1666-73 (1998)). Более недавно, был продемонстрирован перенос гена перикарда при помощи катетера, опосредованный AcV-векторами (March et al., Clin. Cardiol. 22(1 Suppl 1):123-9 (1999)). Манипулирование AdV-системой с правильными регуляторными генетическими элементами делает возможной AdV-опосредованную регулируемую экспрессию гена-мишени in vivo (Burcin et al., PNAS (USA) 96(2):355-60 (1999)).
Альфа-вирусные векторы были разработаны для применений в генной терапии человека с упаковочными клеточными линиями, пригодными для трансформации экспрессионными кассетами, пригодными для применения с векторами, произведенными из вируса Синдбис и вируса лесов Семлики (Polo et al., Proc. Natl. Acad. Sci. USA, 96:4598-4603 (1999)). Были также разработаны системы на основе РНК репликона нецитопатического флавивируса (Varnavski et al., Virology 255(2):366-75 (1999)). Содержащие ген-самоубийцу HSV-ТК векторы на основе вируса Синдбис использовали для клеткоспецифического нацеливания в опухолевые клетки (lijima et al., Int. J. Cancer 80(1):110-8 (1998)).
Ретровирусные векторы на основе пенящего вируса человека (HFV) также являются многообещающими в качестве векторов генной терапии (Trowbridge et al., Human Gene Therapy 9:2517-2525 (1998)). Пенящие вирусные векторы были разработаны для терапии с геном-самоубийцей (Nestler et al., Gene Ther 4(11):1270-7 (1997)). Рекомбинантные мышиные цитомегаловирусные и промоторные системы также использовали в качестве векторов для экспрессии высокого уровня (Manning et al., J. Virol. Meth. 73(1):31-9 (1998); Tong et al., Hybridoma 18(1):93-7 (1998)).
Доставка генов в неделящиеся клетки была возможной в результате получения векторов на основе вируса Сендай (Nakanishi et al., J.Controlled Release 54(1):61-8 (1998)).
В других попытках сделать возможной трансформацию неделящихся соматических клеток исследовали дентивирусные векторы. Была описана генная терапия муковисцидоза с использованием вектора на основе дефектного по репликации вируса иммунодефицита человека (ВИЧ) (Goldman et al., Human Gene Therapy 8:2261-2268 (1997)). Была показана также стойкая экспрессия генов, доставляемых в печень и мышцу лентивирусными векторами (Kafri et al., Nat. Genet. 17(3):314-7 (1997)). Однако заботы о безопасности являются преобладающими, и развитие улучшенных векторов происходит быстро (Kim et al., J. Virol. 72(2):994-1004 (1998)). Исследование LTR и Tat ВИЧ дало важную информацию об организации этого генома для развития векторов (Sadaie et al., J.Med. Virol. 54(2):118-28 (1998)). Таким образом, генетические требования в отношении эффективного вектора на основе ВИЧ теперь являются более понятными (Gasmi et al., J. Virol. 73 (3);1828-34 (1999)). Были описаны самоинактивирующиеся векторы или условные пакующие клеточные линии (например, Zuffery et al., J.Virol. 72(12):9873-80 (1998); Miyoshi et al., J.Virol. 72 (10); 8150-7 (1998); Dull et al., J.Virol. 72 (11): 8463-7 (1998) и Kaul et al., Virology 249 (1):167-74 (1998)). Была показана эффективная трансдукция лимфоцитов человека и CD34+ клеток ВИЧ-векторами (Douglas et al., Hum. Gene Ther. 10(6):935-45 (1999); Miyoshi et al., Science 283 (5402):682-6 (1999)). Была описана эффективная трансдукция неделящихся клеток человека лентивирусными векторами с кошачьим вирусом иммунодефицита (FIV), которая минимизирует беспокойство в отношении безопасности, которое присутствует с использованием векторов на основе ВИЧ (Poescha et al., Nature Medicine 4(3):354-357 (1998)). Было показано эффективное инфицирование мононуклеарных клеток крови человека векторами FIV (Johnston et al., J. Virol. 73(3):2491-8 (1999)).
Хотя многие вирусные векторы являются трудными в обращении и емкость для инсертируемой ДНК является ограниченной, были предприняты попытки преодоления этих ограничений и недостатков. Например, кроме упрощенных вирусных упаковочных клеточных линий, были разработаны минивирусные векторы, полученные из герпесвируса человека, вируса простого герпеса типа 1 (HSV-1) и вируса Эпштайна-Барра (EBV) для упрощения манипуляций с генетическим материалом и создания вирусных векторов (Wang et al., J.Virol. 70(12):8422-8430 (1996)). Ранее было показано, что адаптерные плазмиды упрощают инсертирование чужеродной ДНК в хелпер-независимые ретровирусные векторы (J. Virology 61(10):3004-3012 (1987)).
Вирусные векторы не являются единственным средством для выполнения генной терапии, так как были описаны несколько невирусных векторов. Было показано, что нацеленный невирусный вектор доставки генов на основе полиплекса эпидермальный фактор роста/ДНК (EGF/ДНК) приводит к эффективной и специфической доставке генов (Cristiano, Anticancer Res. 18:3241-3246 (1998)). Была продемонстрирована генная терапия сосудистой сети и ЦНС с использованием катионных липосом (Yang et al., J. Neurotrauma 14(5):281-97 (1997)). Временная генная терапия панкреатита также достигалась с использованием катионных липосом (Denham et al., Ann. Surg. 227(6):812-20 (1998)). Было показано, что комплексы вектор на основе хитозана/ДНК для доставки генов являются эффективными (Erbacher et al., Pharm. Res. 15(9):1332-9 (1998)). Был описан невирусный вектор доставки ДНК на основе системы тройного комплекса (Kim et al., 53(1-3):175-82 (1998)). Комплексы липосом, покрытых вирусными частицами, использовали также для выполнения переноса генов (Hirai et al., Biochem. Biophys. Res. Commun. 241(1):112-8 (1997)).
Была продемонстрирована генная терапия рака прямыми инъекциями в опухоль невирусного вектора Т7, кодирующего ген тимидинкиназы (Chen et al., Human Gene Therapy 9:729-736 (1998)). Получение плазмидной ДНК является важным для переноса гена прямой инъекцией (Horn et al., Hum. Gene Ther. 6(5):65 6-73 (1995)). Модифицированные плазмидные векторы были приспособлены специально для прямой инъекции (Hartikka et al., Hum. Gene Ther. 7(10):1205-17 (1996)).
Таким образом, большое разнообразие векторов и конструкций для переноса генов/генной терапии известны в данной области. Эти векторы легко адаптируются для применения в способах данного изобретения. Посредством подходящего манипулирования с использованием способов рекомбинантных ДНК/молекулярной биологии для инсертирования функционально связанного кодирующего Raf- или Ras-сегмента нуклеиновой кислоты могут быть получены многочисленные эквивалентные векторы для применения на практике данного изобретения.
F. Способы модуляции ангиогенеза
В одном аспекте, данное изобретение обеспечивает способ модуляции ангиогенеза в ткани, ассоциированной с патологическим процессом или состоянием, и тем самым влияет на события в ткани, которые зависят от ангиогенеза. Обычно, данный способ предусматривает введение в ткань, ассоциированную с патологическим процессом или состоянием, или страдающую от патологического процесса или состояния, модулирующего ангиогенез количества композиции, содержащей Raf-белок или вектор нуклеиновой кислоты, экспрессирующий активный или неактивный Raf.
Следующий способ предусматривает введение в ткань, ассоциированную с патологическим процессом или состоянием, модулирующего ангиогенез количества композиции, содержащей Raf-белок или вектор нуклеиновой кислоты, экспрессирующий активный или неактивный Raf. Другой аспект способа предусматривает введение в ткань, ассоциированную с патологическим процессом или состоянием, модулирующего ангиогенез количества Raf- или Ras-белка или одного или нескольких векторов нуклеиновых кислот, экспрессирующих активные или неактивные Raf и Ras.
Любые из разнообразных тканей или органов, содержащих организованные ткани, могут поддерживать ангиогенез в патологических состояниях, в том числе кожа, мышца, кишечник, соединительная ткань, ткань мозга, нервные клетки, суставы, кости и другие подобные ткани, в которые кровеносные сосуды могут внедряться под действием ангиогенных стимулов.
Пациентом, подлежащим лечению в соответствии с данным изобретением в его многих вариантах, является пациент-человек, хотя данное изобретение является эффективным в отношении всех млекопитающих. В этом контексте, "пациент" является пациентом-человеком, а также пациентом в ветеринарии, млекопитающим из любого вида млекопитающих, в котором желательно лечение ткани, ассоциированной с заболеваниями, включающими в себя ангиогенез, в частности, среди видов сельскохозяйственных и домашних млекопитающих.
Таким образом, способ, воплощающий данное изобретение, предусматривает введение пациенту терапевтически эффективного количества физиологически переносимой композиции, содержащей Raf- или Ras-белок или вектор нуклеиновой кислоты для экспрессии Raf- или Ras-белка.
Диапазоны доз для введения Raf- или Ras-белка зависят от формы белка и его активности, как описано дополнительно далее, и являются количествами, достаточно большими для получения желательного действия, в котором ангиогенез и симптомы заболевания, медиируемые ангиогенезом, являются ослабленными. Доза не должна быть настолько высокой, чтобы вызывать неблагоприятные побочные действия, такие как синдром повышенной вязкости (например, крови), отек легких, застойная сердечная недостаточность и т.п. Обычно доза будет варьироваться в зависимости от возраста, состояния, пола и степени заболевания пациента и может быть определена специалистом в данной области. Доза может также корректироваться врачом индивидуума в случае какого-либо осложнения.
Терапевтически эффективным количеством является количество Raf- или Ras-белка или нуклеиновой кислоты, кодирующей (активный или неактивный) Raf- или Ras-белок, достаточное для получения измеримой модуляции ангиогенеза в обрабатываемой ткани, т.е. модулирующее ангиогенез количество. Модуляция ангиогенеза может быть измерена или подвергнута мониторингу in vitro с использованием СДМ-анализа, описанного здесь, исследования тканей опухоли или другими способами, известными специалисту в данной области.
Raf- или Ras-белок или вектор нуклеиновой кислоты, экспрессирующий такой белок, может вводиться парентерально инъекцией или постепенной инфузией на протяжении времени. Хотя доступ к подлежащей лечению ткани может обычно выполняться системным введением, и, следовательно, наиболее часто используется внутривенное введение терапевтических композиций, обсуждаются другие ткани и средства доставки, где имеется вероятность, что ткань-мишень содержит молекулу-мишень. Таким образом, композиции данного изобретения могут вводиться внутривенно, внутрибрюшинно, внутримышечно, подкожно, внутриполостным путем, трансдермально и могут доставляться перистальтическими средствами, если желательно.
Терапевтические композиции, содержащие Raf- или Ras-белок или вектор нуклеиновой кислоты, экспрессирующий Raf- или Ras-белок, могут обычно вводиться внутривенно, например, инъекцией единичной дозы. Термин "единичная доза", в применении к терапевтической композиции данного изобретения, относится к физически дискретным единицам, пригодным в качестве разовой дозы для субъекта, причем каждая единица содержит предварительно определенное количество активного материала, рассчитанное для получения желаемого терапевтического действия, в сочетании с требующимся физиологически приемлемым разбавителем; т.е. наполнителем или носителем.
В одном предпочтительном варианте активный материал вводят в единственной дозе внутривенно. Локализованное введение может выполняться прямой инъекцией или с использованием преимущества анатомически изолированных компартментов, выделением микрокровотока систем органов-мишеней, реперфузией в кровоток или временной закупоркой районов-мишеней сосудистой сети, связанных с подвергшимися заболеванию тканями, с использованием катетера.
Композиции вводят способом, совместимым с дозированной композицией, и в терапевтически эффективном количестве. Вводимое количество и тайминг зависят от подлежащего лечению субъекта, способности системы субъекта использовать активный ингредиент и степени желаемого терапевтического действия. Точные количества вводимого активного ингредиента зависят от оценки лечащего врача и являются специфическими для каждого индивидуума. Однако подходящие пределы доз для системного введения описаны здесь и зависят от пути введения. Подходящие схемы введения также являются вариабельными, но объединяются начальным введением с последующими повторяемыми дозами при одночасовых или больших интервалах посредством последующей инъекции или иного введения. Альтернативно, обсуждается внутривенное вливание, достаточное для поддержания концентраций в крови в указанных пределах для терапий in vivo.
1. Ингибирование ангиогенеза
Имеются различные заболевания, в которых важным является ингибирование ангиогенеза, называемые ангиогенными заболеваниями, в том числе, но не только, воспалительные нарушения, например иммунное и неиммунное воспаление, хронический ревматизм суставов и псориаз, нарушения, связанные с неприемлемой или несвоевременной инвазией сосудов, таким как в случае диабетической ретинопатии, неоваскулярной глаукомы, рестеноза, капиллярной пролиферации в атеросклеротических бляшках и при остеопорозе, и ассоциированные с раком нарушения, такие как солидные опухоли, метастазы солидных опухолей, ангиофибромы, ретролентальная фиброплазия, гемангиомы, саркома Капоши и тому подобные раки, которые требуют реваскуляризации для поддержания опухолевого роста.
Таким образом, способы, которые ингибируют ангиогенез в ткани, ассоциированной с патологическим состоянием, ослабляют симптомы данного заболевания и в зависимости от данного заболевания могут способствовать излечиванию заболевания. В одном варианте, данное изобретение рассматривает ингибирование ангиогенеза, per se, в ткани, ассоциированной с патологическим состоянием. Степень ангиогенеза в ткани и, следовательно, степень ингибирования, достигаемая данными способами, может оцениваться различными способами.
Так, в одном варианте, подлежащая лечению ткань является воспаленной тканью, а подлежащий ингибированию ангиогенез является ангиогенезом воспаленной ткани, причем имеется реваскуляризация воспаленной ткани. Этот конкретный способ включает в себя ингибирование ангиогенеза в артритной ткани, например, у пациента с хроническим ревматизмом суставов, в иммунной или неиммунной воспаленных тканях, в псориатической ткани и т.п.
В другом варианте, тканью, подлежащей лечению, является ткань сетчатки пациента, страдающего от заболевания сетчатки, например диабетической ретинопатии, макулярной дегенерации или реваскулярной глаукомы, а ангиогенез, подлежащий ингибированию, является ангиогенезом ретинальной ткани.
В дополнительном варианте, тканью, подлежащей лечению, является опухолевая ткань пациента с солидной опухолью, метастазами, раком кожи, раком молочной железы, гемангиомы или ангиофибромы и тому подобного рака, а ангиогенез, подлежащий ингибированию, является ангиогенезом опухолевой ткани, где имеется реваскуляризация опухолевой ткани. Типичные солидные опухолевые ткани, которые могут лечиться данными способами, включают в себя опухолевые ткани легкого, поджелудочной железы, молочной железы, ободочной кишки, гортани, яичников и тому подобные ткани. Ингибирование ангиогенеза опухолевой ткани является особенно предпочтительным вариантом вследствие важной роли, которую играет реваскуляризация в росте опухоли. В отсутствие реваскуляризации в опухолевой ткани ткань опухоли не получает требуемых питательных веществ, замедляет рост, прекращает дополнительный рост, подвергается регрессу и в конечном счете становится некротической, что приводит к гибели опухоли.
Другими словами, данное изобретение обеспечивает способ ингибирования реваскуляризации опухолей ингибированием ангиогенеза опухоли в соответствии со способами данного изобретения. Подобным образом, данное изобретение обеспечивает способ ингибирования роста опухолей посредством использования на практике ингибирующих ангиогенез способов.
Эти способы являются также особенно эффективными против образования метастазов, так как (1) их образование требует реваскуляризации первичной опухоли таким образом, чтобы метастатические раковые клетки могли выходить из первичной опухоли, и (2) их установление во вторичном месте требует реваскуляризации для поддержания роста метастазов.
Еще в одном варианте, данное изобретение рассматривает применение на практике этого способа в сочетании с другими терапиями, такими как общепринятая химиотерапия, направленными против твердых опухолей и для контроля установления метастазов. Введение ингибитора ангиогенеза обычно проводят во время химиотерапии или после химиотерапии, хотя предпочтительно ингибировать ангиогенез после программы лечения химиотерапией в тех временных точках, когда опухолевая ткань будет отвечать на токсическое воздействие индукцией ангиогенеза для восстановления посредством обеспечения кровоснабжения и питательных веществ в опухолевую ткань. Кроме того, предпочтительно назначать способы ингибирования ангиогенеза после хирургии, при которой твердые опухоли были удалены, в качестве профилактики против метастазов.
Поскольку данные способы применяются для ингибирования опухолевой реваскуляризации, эти способы могут также применяться для ингибирования роста опухолевой ткани, для ингибирования образования опухолевых метастазов и для регресса установленных опухолей.
Рестеноз является процессом миграции клеток гладких мышц (SMC) и пролиферации в ткань в участке чрескожной внутрипросветной ангиопластики, который препятствует успеху ангиопластики. Миграция и пролиферация SMC во время рестеноза могут также рассматриваться как процесс ангиогенеза, который ингибируется данными способами. Таким образом, данное изобретение рассматривает также ингибирование повторного стеноза посредством ингибирования ангиогенеза в соответствии с данными способами в пациенте после процедур ангиопластики. Для ингибирования рестенозирования обычно вводят инактивированную тирозинкиназу после процедуры ангиопластики, так как стенка коронарного сосуда подвергается риску рестеноза, обычно в течение приблизительно 2 - приблизительно 28 дней и, более типично, в течение приблизительно 14 дней после этой процедуры.
Данный способ ингибирования ангиогенеза в ткани, ассоциированной с патологическим состоянием, и, следовательно, применение на практике способов данного изобретения для лечения связанных с ангиогенезом заболеваний предусматривает контактирование ткани, в которой происходит ангиогенез или которая имеет риск возникновения ангиогенеза, с терапевтически эффективным количеством композиции, содержащей инактивированный Raf-белок или вектор, экспрессирующий этот белок. Ингибирование ангиогенеза и регресс опухоли происходит так быстро, как при 7 днях после начала контактирования с терапевтической композицией. Дополнительное или пролонгированное подвергание действию неактивного Raf- или Ras-белка является предпочтительным в течение 7 дней - 6 недель, предпочтительно около 14 дней - 28 дней. Более короткие периоды воздействия могут быть применимы, когда модулирующие эффекты детектируются раньше, однако введение и последующее подвергание воздействию в течение по меньшей мере 12 часов является предпочтительным.
2. Потенциирование ангиогенеза
В случаях, когда желательно стимулировать или потенциировать ангиогенез, полезным является введение активного Raf- или Ras-белка в ткань. Способы и временные режимы введения сравнимы с описанными выше для ингибирования способами.
G. Терапевтические композиции
Данное изобретение рассматривает терапевтические композиции, применимые для практики описанных здесь терапевтических способов. Терапевтические композиции данного изобретения содержат физиологически переносимый носитель вместе с Raf- или Ras-белком или вектором, способным экспрессировать Raf- или Ras-белок, описанный здесь, растворенным или диспергированным в нем, в качестве активного ингредиента. В предпочтительном варианте, терапевтическая композиция не является иммуногенной при введении пациенту-млекопитающему или пациенту-человеку для терапевтических целей.
В применении здесь, термины «фармацевтически приемлемый», «физиологически переносимый» и их грамматические версии, используемые в отношении композиций, носителей, разбавителей и реагентов, применяются взаимозаменяемо и означают, что эти материалы могут вводиться в млекопитающее или наноситься на млекопитающее не вызывая нежелательные физиологические эффекты, такие как тошнота, головокружение, желудочное расстройство и т.п.
Приготовление фармацевтической композиции, которая содержит активные ингредиенты, растворенные или дисперигированные в ней, хорошо известно в данной области и не требует ограничений на основе приготовления. Обычно такие композиции готовят в виде инъекционных препаратов, либо в виде жидких растворов, либо в виде суспензий, однако могут быть также приготовлены твердые формы, пригодные для растворения или суспендирования в жидкости перед использованием. Препарат может быть также эмульгирован или представлен в виде липосомной композиции.
Активный ингредиент может быть смешан с наполнителями, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом, и в количествах, пригодных для применения в описанных здесь терапевтических способах. Подходящими наполнителями являются, например, вода, солевой раствор, декстроза, глицерин, этанол или т.п. и их комбинации. Кроме того, если желательно, композиции могут содержать минорные количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты, рН-буферирующие агенты и т.п., которые увеличивают эффективность активного ингредиента.
Терапевтическая композиция данного изобретения может включать в себя фармацевтически приемлемые соли ее компонентов. Фармацевтически приемлемые соли включают в себя кислотно-аддитивные соли (образуемые со свободными аминогруппами полипептида), которые образуются с неорганическими солями, такими как, например, хлористо-водородная или фосфорная кислоты, или такими органическими кислотами, как уксусная, винная, миндальная кислоты и подобные кислоты. Соли, образуемые со свободными карбоксильными группами, могут быть образованы из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или трехвалентного железа, и таких органических оснований, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и т.п.
Физиологически переносимые носители хорошо известны в данной области. Примерами жидких носителей являются стерильные водные растворы, которые не содержат никаких веществ, кроме активных ингредиентов и воды, или содержат буфер, например фосфат натрия, при физиологической величине рН, физиологический раствор или и то, и другое, например забуференный фосфатом солевой раствор. Кроме того, водные носители могут содержать более одной буферной соли, а также соли, такие как хлориды натрия и калия, декстрозу, полиэтиленгликоль и другие растворенные вещества.
Жидкие композиции могут также содержать жидкие фазы в дополнение к воде или для исключения воды. Примерами таких дополнительных жидких фаз являются глицерин, растительные масла, такие как хлопковое масло, и эмульсии типа вода в масле.
Терапевтическая композиция содержит модулирующее ангиогенез количество Raf- или Ras-белка данного изобретения или экспрессирующий вектор рекомбинантной ДНК, достаточный для экспрессии эффективного количества Raf- или Ras-белка, обычно приготовленные таким образом, чтобы содержать количество, по меньшей мере, 0,1 мас.% Raf- или Ras-белка на вес всей терапевтической композиции. Масс. процент является отношением массы Raf-белка к массе всей композиции. Так, например, 0,1 мас.% обозначает 0,1 г Raf- или Ras-белка на 100 г всей композиции. Для экспрессирующих ДНК-векторов вводимое количество зависит от свойств экспрессирующего вектора, обрабатываемой ткани и подобных рассмотрений. Подходящее вводимое количество может измеряться количеством вектора или количеством экспрессируемого белка, которое ожидается.
Н. Промышленное изделие
Данное изобретение рассматривает также промышленное изделие, которое является имеющим этикетку контейнером для обеспечения Raf- или Ras-белка данного изобретения. Промышленное изделие включает в себя упаковочный материал и фармацевтический агент, содержащийся в этом упаковочном материале.
Фармацевтический агент в промышленном изделии является любой из композиций данного изобретения, пригодной для обеспечения Raf- или Ras-белка и приготовленной в фармацевтически приемлемой форме, как описано здесь, в соответствии с описанными указаниями. Таким образом, эта композиция может содержать Raf- или Ras-белок или ДНК-молекулу, которая способна экспрессировать Raf- или Ras-белок. Промышленное изделие содержит количество фармацевтического агента, достаточное для применения в лечении состояния, указанного здесь, либо в единичной дозе, либо во множественных дозах.
Упаковочный материал содержит этикетку, которая указывает применение содержащегося в нем фармацевтического агента, например, для лечения состояний, для которых благоприятным является ингибирование или потенциирование ангиогенеза, и подобных описанных здесь состояний. Этикетка может дополнительно включать в себя инструкции для применения и подобную информацию, которая может требоваться для сбыта. Упаковочный материал может включать в себя контейнер (контейнеры) для хранения фармацевтического агента.
В применении здесь, термин упаковочный материал относится к материалу, такому как стекло, пластик, бумага, фольга и т.п., способному удерживать фиксированно фармацевтический агент. Так, например, упаковочным материалом могут быть пластиковые или стеклянные флаконы, слоистые обертки и тому подобные контейнеры, используемые для содержания фармацевтической композиции, включающей в себя фармацевтический агент.
В предпочтительных вариантах, упаковочный материал имеет этикетку, которая является материальным выражением описания содержимого изготовленного изделия и применения содержащегося в нем фармацевтического агента.
Примеры
Следующие примеры, относящиеся к данному изобретению, являются иллюстративными и, конечно, не должны рассматриваться как особо ограничивающие данное изобретение. Кроме того, такие вариации данного изобретения, известные в настоящее время или разработанные позднее, которые находятся в компетенции специалиста в данной области, должны считаться входящими в объем данного изобретения, соответствующий прилагаемой ниже формуле изобретения.
1. Получение c-Raf-экспрессионных конструкций
Для получения экспрессионных конструкций, применимых в модуляции ангиогенеза согласно способам данного изобретения, проводят манипулирование кДНК c-Raf и встраивают ее в экспрессирующую конструкцию/вектор.
Последовательность кДНК, кодирующая c-Raf дикого типа (т.е. эндогенный Raf) человека, изображена в последовательности нуклеиновой кислоты, показанной на Фиг.7 (SEQ ID NO:1, нуклеотиды 130...2076), с кодируемой транслируемой последовательностью аминокислотных остатков для Raf-белка, изображенной на Фиг.8 (SEQ ID NO:2).
Данное изобретение описывает две категории функции c-Raf для модуляции ангиогенеза. Как обсуждалось ранее, одна категория содержит молекулы Raf, которые увеличивают ангиогенез и, следовательно, считаются активными белками. В данном изобретении показано, что Raf дикого типа вместе с различными мутациями индуцирует ангиогенез.
Одна предпочтительная мутация c-Raf дикого типа, которая функционирует в данном контексте в связи с ее способностью индуцировать рост кровеносных сосудов и, следовательно, увеличивать массу опухоли in vivo, является мутантной конструкцией Raf, в которой экспрессируются только аминокислотные остатки 306-648 Raf (Raf 306-648). Эта конструкция не содержит всего регуляторного киназного домена и, следовательно, называется конститутивно активным Raf-белком.
Было показано, что мутации в Raf имеют противоположное модулирующее действие на ангиогенез, ингибируя ангиогенез вместо его стимуляции. Такие мутации называют неактивными мутациями Raf. Белки, имеющие мутации, которые сообщают эту ингибирующую активность, называют также доминантными негативными Raf-белками, поскольку они ингибируют реваскуляризацию, в том числе реваскуляризацию, происходящую из эндогенной активности Raf, а также усиленной активности Raf вследствие стимуляции факторами роста. Таким образом, некоторые мутации c-Raf дикого типа данного изобретения могут также функционировать в качестве доминантных негативных в связи с их способностью блокировать рост кровеносных сосудов и, например, уменьшать массу опухоли in vivo.
Примером ингибирующей конструкции Raf является мутация Raf, в которой аминокислотный остаток лизина 375 мутирован в любую другую аминокислоту, предпочтительно метионин (т.е. Raf К375М). Эта точковая мутация в киназном домене препятствует связыванию АТФ и также блокирует киназа-зависимые функции Raf, связанные с передачей сигналов и пролиферацией сосудистых клеток и опухолевых клеток. Другой ингибирующий Raf мутант содержит аминокислотные остатки 1-305 в форме укороченного Raf-белка (т.е. Raf 1-305), который не содержит киназного домена.
Что касается точковых мутаций, любая мутация, приводящая к ингибирующей или стимулирующей активности, предполагается пригодной для применения в данном изобретении. Конструкции слитых белков, комбинирующие желательный Raf-белок (его мутацию или фрагмент) с экспрессируемыми аминокислотными метками, антигенными эпитопами, флуоресцентным белком или другим подобным белком или пептидами, также обсуждаются, пока желательный модулирующий эффект Raf-белка является интактным.
Для получения желательных мутаций c-Raf в кДНК использовали стандартные процедуры сайт-направленного мутагенеза, знакомые среднему специалисту в данной области. Конструировали также ПЦР-праймеры, предназначенные для включения желательных мутаций, с сайтами рестрикции для облегчения последующих стадий клонирования. Полные сегменты кодирующих Raf последовательностей нуклеиновых кислот делегируют из этих конструкций нуклеиновых кислот посредством способов ПЦР-амплификации на основе известных последовательностей кДНК курицы, человека и других гомологов Raf и последующего образования новых конструкций.
Конкретно, кДНК последовательность Raf дикого типа, показанную на Фиг.7, модифицировали несколькими способами для конструирования Raf-мутантов для демонстрации принципов данного изобретения. Эти мутанты встраивали в ретровирусную экспрессионную систему, описанную здесь.
Первый мутантный Raf, названный Raf K375M, конструировали в Raf дикого типа человека, в котором лизин в положении аминокислотного остатка 375 заменяли метионином. Raf K375M является "неактивным" Raf-белком, как определено здесь.
Второй мутантный Raf, названный Raf 306-648, конструировали в Raf дикого типа человека, в котором аминоконцевую часть делегировали с оставлением укороченных карбоксиконцевых остатков 306-648. Raf 306-648 является "активным" Raf-белком, как определено здесь.
Третий мутантный Raf, названный 1-305, конструировали в Raf дикого типа человека, в котором карбоксиконцевую часть делегировали с оставлением укороченных аминоконцевых остатков 1-305. Raf 1-305 является "неактивным" Raf-белком, как определено здесь.
Альтернативные экспрессирующие векторы для применения в экспрессии Raf- или Ras-белков данного изобретения включают в себя также аденовирусные векторы, описанные в патентах США с номерами 4797368, 5173414, 5436146, 5589377 и 5670488. Альтернативные способы для доставки Raf- или Ras-модулирующих белков включают в себя доставку кДНК Raf или Ras невирусной векторной системой, описанную в патенте США №5675954, и доставку кДНК самих по себе, как чистую ДНК, описанную в патенте США №5589466. Доставка конструкций данного изобретения не ограничивается локальным нанесением вирусного вектора, препараты вирусного вектора инъецируют также внутривенно для системной доставки в сосудистое ложе или они могут инъецироваться подкожно, внутритканевой инъекцией и т.п. Эти векторы могут быть также нацеливаемыми на участки повышенной реваскуляризации, например, локализованной инъекцией опухоли.
In vitro экспрессируемые белки также обсуждаются для их доставки после экспрессии и очистки отобранных Raf- или Ras-белков способами, применимыми для доставки белков или полипептидов. Один из таких способов включает в себя липосомную систему доставки, такую как описанная в патентах США с номерами 4356167, 5580575, 5542935 и 5643599. Другие системы векторов и доставки белков хорошо известны средним специалистам в данной области для использования в экспрессии и/или доставке Raf- или Ras-белков данного изобретения.
2. Модель опухоли человека
Для демонстрации эффективности данного изобретения опухолевые клетки человека имплантировали подкожно на бок бестимусных мышей и давали им расти до приблизительно 100 мм3. В этой модели ксенотрансплантата мышиные эндотелиальные клетки в ткани, окружающей имплантат, образуют сосудистую сеть, которая растет в растущую опухоль человека в ответ на обычные ангиогенные сигналы, и опухоль становится васкуляризованной. Таким образом, мышиными эндотелиальными клетками образуются микрососуды, тогда как сама ткань опухоли содержит клетки человека.
3. Ретровирусный вектор доставки инфицирует клетки мышиного происхождения, но не клетки опухоли человека
Систему ретровирусного экспрессирующего вектора от Clontech использовали для конструирования экотропного ретровируса, который содержит описанные здесь конструкции Raf. Для демонстрации тканеспецифичности инфицирующего ретровируса, конструкцию ретровирусного экспрессирующего вектора, которая экспрессирует β-галактозидазу, упаковывали с использованием экотропных пакующих клеток, как описано в подписи к Фиг.1.
Мышиные эндотелиальные клетки 3Т3, эпителиальные клетки аденокарциномы LSI 74 человека и клетки М21 меланомы человека культивировали in vitro и подвергали каждую из этих клеток действию экотропно упакованного ретровируса. Только мышиные клетки экспрессируют детектируемую р-галактозидазу, что свидетельствует о том, что только мышиные клетки инфицируются экотропно упакованным ретровирусом в этой системе экспрессии.
4. Неактивная Raf-киназа разрушает Raf-киназную активность in vitro
Для демонстрации клеточных эффектов неактивной Raf-киназы использовали модель in vitro с применением мышиных эндотелиальных клеток, индуцированных bFGF. Нормальная индукция Raf-активности введением bFGF в мышиные эндотелиальные клетки блокировалась, когда эти клетки сначала инфицировали ретровирусной конструкцией, которая экспрессирует неактивную конструкцию Raf К375М-киназы, как описано в подписи к Фиг.2. Данные Фиг.2 показывают, что количество Raf-киназной активности существенно снижается, когда клетки сначала инфицируют вектором, который экспрессирует неактивную Raf-киназу.
5. Неактивная Raf-киназа нарушает ангиогенез in vivo
С использованием мышиной in vivo подкожной модели для ангиогенеза исследовали действия неактивной Raf-киназы. Для этой цели ангиогенез индуцировали в мыши инъекцией bFGF либо с клетками, экспрессирующими ретровирус, либо без клеток, экспрессирующих ретровирус, который продуцирует белок неактивной Raf К375М-киназы, как описано в подписи к Фиг.3. Как показано на Фиг.3, присутствие неактивной киназы существенно снижало ангиогенный индекс.
6. Активная Raf-киназа индуцирует ангиогенез in vivo
С использованием мышиной подкожной модели для ангиогенеза исследовали действия активной Raf-киназы. Для этой цели ангиогенез индуцировали инъекцией клеток, экспрессирующих ретровирус, который продуцировал активную Raf 306-648-киназу, как описано в подписи к Фиг.4. Как показано на Фиг.4, мутационно активная Raf-киназа индуцирует ангиогенез in vivo.
7. Неактивная Raf-киназа индуцирует апоптоз
С использованием мышиной модели ксенотрансплантата, описанной выше, исследовали действия in vivo неактивного Raf. Для этой цели модель устанавливали, как описано в подписи к Фиг.5, инъекцией 1,5 миллионов клеток LS174 аденокарциномы человека. После образования опухолевой массы около 100 мм3 ретровирус, экспрессирующий неактивную Raf К375М-киназу, инъецировали в эту опухолевую массу и выполняли иммуногистохимию на срезах опухолевой массы после 48 часов. Результаты, показанные на Фиг.6 (FLAG-метка), указывают на то, что инфекция ретровируса была эндотелиально специфической, и, кроме того, результаты показывают посредством красителя vWF, что эндотелиальные клетки колокализовались с ретровирусной инфекцией. Слияние данных окрашивания показывает, что эндотелиальные клетки, вирусная инфекция и появление апоптоза, - все являются колокализованными, что указывает на то, что вирусная доставка неактивного Raf-белка является эндотелиально специфической и что неактивный Raf индуцирует апоптоз.
8. Неактивная Raf-киназа индуцирует регресс опухоли
С использованием мышиной модели ксенотрансплантата, описанной выше, исследовали действия in vivo неактивного Raf на регресс опухоли. Для этой цели модель устанавливали, как описано в подписи к Фиг.6, и неактивную Raf К375М-киназу обеспечивали в виде вирусного супернатанта или в виде экспрессирующих вирус клеток. Было видно, что установленная опухоль быстро регрессирует при введении неактивной Raf-киназы.
9. Ангиогенез зависит от активации пути Ras-Raf-MEK-ERK
Для определения взаимодействия лигирования и активации рецептора фактора роста и рецептора интегрина в каскаде активации митоген-активируемой протеинкиназы (МАРК)/регулируемой внеклеточным сигналом киназы (ERK), который участвует в модуляции ангиогенеза, выполняли исследования в примерах 9-11. Активацию каскада МАРК интегрин-опосредованной адгезией клеток исследовали в ряде лабораторий, как описано в обзоре Aplin et al., Pharmacol. Rev. 50:197-263 (1998). Иерархический каскад ERK возникает на клеточной мембране с рецепторами для митогенов и факторов роста, которые рекрутируют небольшую гуанозинтрифосфатазу (ГТФазу) Ras, которая затем активирует Raf, протеинкиназу, посредством связывания Raf и рекрутинга его в мембрану, где он активируется согласно еще неизвестному механизму. Затем активированный Raf фосфорилирует и активирует МЕК (MAPK/ERK-киназу). Затем МЕК фосфорилирует и активирует ERK1 и ERK2, которые затем транслоцируются в ядро и трансактивируют факторы транскрипции для действия на рост, дифференцировку или митоз через измененную экспрессию генов (см. Tibbles et al., Cell Mol. Life Sci., 55:1230-1254 (1999)).
Регуляция Ras выше по ходу каскада в активации Raf, которая опосредована передачей сигналов фактора роста и/или интегрина, является предметом текущих исследований, но механизмы передачи сигналов все еще не выяснены полностью (см. Stewart et al., J. Biol. Chem., 275:8854-8862 (2000); Howe et al., J. Biol. Chem., 273:27268-27274 (1998)). Однако, и это более важно, активация каскада Ras-Raf-MEK-ERK через передачу сигналов рецепторами клеточной мебраны, приводящая к модуляции ангиогенеза, не была описана до данного изобретения.
A. Ras индуцируется подверганием действию bFGF
Таким образом, для оценки сначала, зависит ли ангиогенез от пути Ras-Raf-MEK-ERK, Ras-активность измеряли в лизатах хорионаллантоисной куриной мембраны (САМ), подвергнутой действию bFGF, как определено анализом Ras с оттягиванием САМ.
Ангиогенез мог быть индуцирован на САМ, после того как нормальный эмбриональный ангиогенез приводил к образованию зрелых кровеносных сосудов. Было показано, что ангиогенез индуцируется в ответ на специфические цитокины или опухолевые фрагменты, как описано Leibovich et al., Nature, 329:630 (1987) и Ausprunk et al., Am. J. Pathol., 79:597 (1975). CAM получали из куриных эмбрионов для последующей индукции ангиогенеза и его ингибирования. Десятидневные куриные эмбрионы получали из Mclntyre Poultry (Lakeside, CA) и инкубировали при 37°С и влажности 60%. Проделывали небольшое отверстие через скорлупу на конце яйца непосредственно над воздушным мешком при помощи небольшого используемого для этой цели сверла (Dremel, Division of Emerson Electric Co. Racine WI). Второе отверстие просверливали на широкой стороне яйца в области, не имеющей эмбриональных кровеносных сосудов, определенной предварительно проверкой яйца на свет. Отрицательное давление прилагали к первоначальному отверстию, что приводило к оттягиванию САМ (хорионаллантоисной мембраны) от мембраны скорлупы и созданию ложного воздушного мешка над САМ. Квадратное окно 1,0 см×1,0 см прорезали через скорлупу над осевшей САМ с использованием небольшого модельного точильного колесика (Dremel). Это небольшое окно делало возможным прямой доступ к нижележащей САМ.
Полученный препарат САМ использовали затем при 10 днях эмбриогенеза, когда ангиогенез затухал. Таким образом, последний препарат использовали в данном изобретении для индукции повторного ангиогенеза в ответ на обработку цитокином или контакт с опухолью, по необходимости, как описано ниже.
1) Ангиогенез, индуцированный факторами роста
Было показано, что ангиогенез индуцируется цитокинами или факторами роста. Ангиогенез индуцировали помещением дисков фильтровальной бумаги Whatman (Whatman Filter paper No.1), пропитанных сбалансированным солевым раствором Хенкса (HBSS, GIBCO, Island, NY) или HBSS, содержащим рекомбинантный основной фибробластный фактор роста (bFGF) или васкулярный фактор роста эндотелиальных клеток (VEGF) (Genzyme, Cambridge, MA), на САМ либо 9-, либо 10-дневного куриного эмбриона в районе, не имеющем кровеносных сосудов, и окна затем герметизировали липкой лентой. Другие факторы роста являются также эффективными в индукции роста кровеносных сосудов. Для анализов, в которых ингибирование ангиогенеза оценивают внутривенными инъекциями антагонистов, таких как моноклональное антитело LM609, ангиогенез сначала индуцируют bFGF или VEGF в среде для выращивания фибробластов, а затем вводят ингибиторы, как описано в примере 10. Ангиогенез подвергали мониторингу с использованием фотомикроскопии после 72 часов.
САМ из 10-дневных куриных эмбрионов стимулировали локально фильтровальными дисками, насыщенными либо ЗФР, либо 30 нг bFGF. Спустя 5 минут ткань САМ иссекали, гомогенизировали в лизисном буфере и затем Ras-активность определяли по ее способности преципитироваться слитым с GST пептидом, кодирующим Ras-связывающий домен Raf. Поскольку только активный Ras связывает Raf, генерировали рекомбинантный белок, состоящий из Ras-связывающего домена Raf, конъюгированного с глутатион-3-трансферазой (GST). В свою очередь, GST конъюгировали с сефарозными гранулами, позволяющими преципитировать активный Ras из лизата ткани.
Результаты показаны на Фиг.9, где Ras-активность повышалась в лизатах САМ, подвергнутых действию bFGF, как определено в анализе Ras с оттягиванием САМ. Таким образом, Ras индуцируется подверганием действию bFGF в САМ. Роль Ras в образовании ангиогенных кровеносных сосудов в САМ дополнительно оценивают, как описано в примере 10.
В. Ras необходим для ангиогенеза
Для последующего определения, зависит ли ангиогенез от активации Ras в препарате САМ, САМ подвергали действию ретровирусных препаратов RCAS для экспрессии доминантного негативного Ras-мутанта, S17N Ras, в комбинации с активацией bFGF Ras, как описано ниже. Было показано, что этот мутант связывает ГДФ с преимущественной аффинностью в сравнении с ГТФ, обеспечивая тем самым ингибирование этим мутантом эндогенной активации Ras секвестрированием Ras-GEF. Таким образом, использование этого мутанта в модели ангиогенеза САМ обеспечивает способ оценки роли Ras в ангиогенезе.
Мутант S17N Ras получают из последовательности Ras дикого типа человека (wt H-Ras) стандартными процедурами сайт-направленного мутагенеза, описанными ранее, заменяя кодирующий триплет для остатка серина (S) в положении 17 кодоном для кодирования аспарагина (N). Такие мутанты были описаны другими авторами, например, Stewart et al., J.Biol. Chem., J. Biol. Chem., 275:8854-8862 (2000).
Для получения ретровирусной конструкции доминантной негативной экспрессионной конструкции такой мутагенез проводили на wt H-Ras, где последовательность нуклеиновой кислоты, кодирующая его, показана на Фиг.10 (SEQ ID NO:3). Фиг.11 (SEQ ID NO:4) изображает последовательность аминокислотных остатков, кодируемую нуклеотидной последовательностью кДНК Ras дикого типа человека (wt H-Ras), показанной на Фиг.10. Для получения желательных мутаций в wt H-Ras для генерирования S17N Ras, а также мутаций, описанных ниже, использовали стандартные процедуры сайт-направленного мутагенеза, известные специалисту с обычной квалификацией в данной области. ПЦР-праймеры, предназначенные для включения желаемых мутаций, конструировали также с сайтами рестрикции для облегчения последующих стадий клонирования. Все сегменты Ras-кодирующих нуклеиновых кислот могут быть делегированы из конструкций нуклеиновых кислот способами ПЦР-амплификации на основе известных кДНК-последовательностей курицы, человека и подобных гомологов Ras и последующего образования новых конструкций. Все мутантные конструкции, сконструированные при помощи ПЦР, секвенировали также при помощи ПЦР для подтверждения предсказанной ДНК-последовательности клонов.
Полученную мутантную последовательность Ras готовили затем в виде конструкции ретровирусного экспрессирующего вектора, как описано здесь. Одной предпочтительной экспрессирующей конструкцией для применения в данном изобретении является конструкция RCAS(А). Этот экспрессирующий вектор основан на ряде компетентных в отношении репликации вирусов саркомы птиц с усиленной полимеразой Bryan (BP) для улучшенного титра и является специфическим для гликопротеина оболочки типа А, экспрессируемого на нормальных клетках птиц (обзор в Methods in Cell Biology, 52:179-214 (1997); см. также Hughes et al., J.Virol. 61:3004-3012 (1987); Fekete and Cepko, Mol. Cellular Biol. 13;2604-2613 (1993); Itoh et al., Development 122:291-300 (1996) и Stott et al., BioTechniques 24:660-666 (1998)). Полная последовательность RCAS (A), называемая здесь RCAS, известна среднему специалисту в данной области и доступна в базах данных.
Пять микрограммов (мкг) полученных конструкций RCAS трансфицировали затем в линию иммортализованных куриных фибробластов, DF-1 (подарок от Doug Foster, U. of Minn). Эта клеточная линия, а также первичные фибробласты куриных эмбрионов были способны продуцировать вирус, однако клеточная линия DF-1 продуцировала более высокие титры. Вирусные супернатанты собирали из субконфлюентных клеточных линий-продуцентов DF-1 в бессывороточных средах [состав: среда F-10 как основа, дополненная ДМСО, фолиевой кислотой, глутаминовой кислотой и раствором МЕМ-витамина]. Тридцать пять мл вирусного супернатанта концентрировали ультрацентрифугированием при 4°С в течение 2 часов при 22000 об/мин. Эти концентрированные вирусные осадки ресуспендировали в 1/100 исходного объема в бессывороточныой среде CLM, разливали на аликвоты и хранили при -80°С. Титр определяли серийным разведением контрольного вирусного вектора, имеющего нуклеотидную последовательность, кодирующую зеленый флуоресцентный белок (GFP), называемого RCAS-GFP, инфицированием на первичные фибробласты куриного эмбриона, которые инкубировали в течение 48-72 часов. Титры вирусного исходного раствора, которые получали после концентрирования, превышали 108 И.е./мл.
Для САМ-анализа с использованием этих вирусных исходных растворов пропитанные в ацетате кортизона диски фильтровальной бумаги Whatman с диаметром 6 мм готовили в 3 мг/мл ацетата кортизона в течение 30 минут в 95% этаноле. Диски сушили в проточном ламинарном боксе и затем впитывали 20 мкл вирусного исходного раствора на диск в течение 10 минут. Эти диски наносили на САМ 10-дневных куриных эмбрионов и герметизировали целофановой липкой лентой и инкубировали при 37°С в течение 18-24 часов. Затем либо контроль-ЗФР, либо факторы роста добавляли в концентрации 5 мкг/мл на САМ в объеме 15 мкл подходящего вирусного исходного раствора в качестве дополнительного бустинга вируса на ткань САМ. Спустя 72 часов САМ собирали и исследовали на изменения в ангиогенном индексе, определяемом дважды слепым счетом числа точек ветвления в САМ, лежащей под диском. Для киназных тестов ткань, лежащую под диском, собирали в RIPA (радиоиммунопреципитационном анализе), гомогенизировали измельчителем с мотором и Raf определяли, как описано в примере 4. Для иммунофлуоресцентных исследований ткань САМ, подстилающую эти диски, замораживали в ОСТ, криоконсерванте, делали срезы при 4 мкм, фиксировали в ацетоне в течение 1 минуты, инкубировали в 3% нормальной козьей сыворотке в течение 1 часа с последующей инкубацией в первичном кроличьем антителе, как описано ранее (Eliceiri et al., J.Biol. Chem., 140:1255-1263 (1998)), промывали в ЗФР и детектировали с флуоресцентным вторичным антителом.
Результаты, показанные на Фиг.12, в виде диаграммы показывают, что инфицированием мутантным нуль-Ras, S17N, блокировали индуцируемый фактором роста ангиогенез в САМ, но не влияли на САМ, которые не были подвергнуты воздействию bFGF для индукции ангиогенеза. Таким образом, Ras необходим для индуцируемого bFGF ангиогенеза.
С. Передача сигнала Ras через Ras-Raf-MEK-ERK-путь является решающим регулятором ангиогенеза
Для дополнительной оценки роли Ras в Ras-Raf-MEK-ERK-пути в модуляции ангиогенеза дополнительные мутантные белки H-Ras использовали в получении САМ, как описано выше, результаты чего показаны ниже и на Фиг.13. В этом контексте, данное изобретение описывает две категории функции Ras, которые могут модулировать ангиогенез. Как прежде обсуждалось для Raf-белков, одна категория содержит молекулы Ras, которые увеличивают ангиогенез и, следовательно, они считаются активными белками. В данном изобретении показано, что Ras дикого типа вместе с различными мутациями индуцирует ангиогенез.
Одна предпочтительная мутация H-Ras дикого типа, которая функционирует в данном контексте в связи с ее способностью индуцировать рост кровеносных сосудов и, следовательно, увеличивать массу опухоли in vivo, является Ras G12V, также называемая V12, причем этот мутант имеет точковую мутацию при положении аминокислотного остатка 12, заменяющую глицин (G) на валин (V). Этот мутантный Ras является конститутивно активным.
Другой мутантный белок H-Ras, который описан для данного изобретения в качестве конститутивного активатора ангиогенеза, представляет собой Ras V12S35, где глицин в положении 12 был заменен на валин (V), а треонин (Т) в положении 35 был заменен на серин (S), причем обе мутации приводят к Ras V12S35. Было показано, что этот мутированный белок H-Ras селективно активирует только Raf-MEK-ERK-путь, как показано на Фиг.13А.
H-Ras-негативным регулятором ангиогенеза является мутант Ras V12C40, где глицин в положении 12 заменен на валин (V), как в Ras V12S35, но другая мутация была в положении 40, где остаток тирозина (Y) заменен на цистеин (С), причем обе мутации приводят, следовательно, к Ras V12C40. Известно, что этот мутантный H-Ras селективно активирует путь PI-3-киназы (PI3K, как показано на Фиг.13А), который активирует Akt и Ras. Таким образом, Ras V12C40 не функционирует в Raf-MEK-ERK-пути и не стимулирует ангиогенез, а скорее ингибирует его. Белки, имеющие мутацию, которая сообщает ингибиторную активность в отношении ангиогенеза, называют доминантными негативными Ras-белками, поскольку они ингибируют реваскуляризацию, в том числе происходящую из эндогенной активности Ras, а также из усиленной Ras-активности, возникающей вследствие стимуляции фактором роста. Таким образом, определенные мутации H-Ras дикого типа данного изобретения могут также функционировать в качестве доминантного негативного Ras-белка в связи с их способностью ингибировать рост кровеносных сосудов и, таким образом, например, уменьшать массу опухоли in vivo. Три конструкции Н-Ras и мутантные белки были описаны ранее Joneson et al., Science, 271:810-812 (1996).
Что касается точковых мутаций, любая мутация, приводящая к ингибирующей или стимулирующей активности, предполагается пригодной для применения в данном изобретении. Конструкции слитых белков, комбинирующие желательный Ras-белок (или Raf-белки, как показано в примерах ниже) (его мутацию или фрагмент) с экспрессируемыми аминокислотными метками, антигенными эпитопами, флуоресцентным белком или другим подобным белком или пептидами, также рассматриваются, пока желательный модулирующий эффект Ras-белка является интактным.
Для оценки роли дополнительных мутантных белков Ras в активации ангиогенеза через путь передачи сигнала готовили соответствующие ретровирусные экспрессионные конструкции, как описано выше. Пятнадцать мкл вируса RCAS(А) высокого титра, кодирующего активирующую Raf-MEK-ERK Ras-конструкцию, Ras V12S35, или активирующую РI3-киназу Ras-конструкцию, Ras V12C40, наносили локально на фильтровальные диски в 10-дневных САМ-препаратах, и результаты оценивали, как описано выше, на действие мутантных Ras-белков на ангиогенез в связи с селективной активацией путей передачи сигналов.
Фиг.13А и 13В показывают схематически и в виде диаграммы, соответственно, что инфицирование мутантной конструкцией Ras, Ras V12S35, которая селективно активирует Ras-Raf-MEK-ERK-путь, индуцировала ангиогенез, тогда как мутантная конструкция, Ras V12C40, которая селективно активирует РI3К-пути, не индуцировала ангиогенез. Таким образом, эти результаты подтверждают, что белок Ras V12S35 является стимулятором ангиогенеза и что опосредованная Ras активация ангиогенеза происходит через активацию Ras-Raf-MEK-ERK-пути, а не через РI3К-путь, используемый мутантом H-Ras V12C40.
D. МЕК-компонент MEK-ERK-пути является необходимым либо для Ras, либо для Ras-независимого Raf-индуцируемого ангиогенеза
Для дополнительной оценки раздельных ролей Ras и Raf в Raf-MEK-ERK-пути в модуляции ангиогенеза, мутантный белок Raf, называемый Raf-Caax, который нацелен на мембрану плазмы, который, как известно, является конститутивно и ферментативно активным в отсутствие связывания Ras, использовали в препаратах САМ, как описано здесь, в сочетании с известным ингибитором активации МЕК, PD98059. Фиг.14 представляет нуклеотидную последовательность, кодирующую слитый белок Raf-саах, где нуклеотидная последовательность, кодирующая карбоксиконец Raf человека (wt H-Ras), слита с нуклеотидной последовательностью, кодирующей последовательность из 20 аминокислотных остатков домена мембранной локализации K-ras (SEQ ID NO:6). Фиг.15 (SEQ ID NO:7) представляет последовательность аминокислотных остатков Raf-caax, слитого белка, генерируемого из слитой нуклеотидной последовательности, показанной на Фиг.14. Этот слитый белок был описан Leevers et al., Nature, 369:411-414 (1994) и Stokoe et al., Science, 264:1463-1467 (1994).
Для оценки Ras-независимого Raf-индуцируемого ангиогенеза вместе с ангиогенезом, индуцируемым Raf, использовали ингибитор МЕК, PD98059, в препаратах САМ, как описано выше. Вирус, кодирующий активирующую Ras-конструкцию, Ras V12 (Ras G12V), полученную, как описано в примере 9С, и активирующую Raf-конструкцию, Raf-caax, локально наносили на фильтровальные диски, как описано в примере 9В. Спустя 24 часа, один (1) наномоль ингибитора МЕК, PD98059, добавляли на диск. Затем САМ оценивали, как описано в примере 9В и на Фиг.12. Данные выражали в виде среднего ± SE для 20 эмбрионов.
Фиг.16А и Фиг.16F, соответственно, в виде фотографий и диаграммы показывают, что ингибитор МЕК, PD98059, блокировал ангиогенез (Фиг.16С и Фиг.16Е), индуцированный либо мутантным активным Ras (Фиг.16В), либо Raf (Фиг.16D). Таким образом, как Ras, так и Raf индуцируют ангиогенез через МЕК-ERK-путь. Приведенные данные в виде диаграммы изображают результаты фотографий индивидуальных обработанных САМ.
10. Ангиогенез, индуцированный Raf, но не Ras, является не поддающимся ингибированию блокадой интегрина
Для определения, как передача сигнала интегрина активирует Ras-Raf-MEK-ERK-путь, приводящий к ангиогенезу, САМ-анализы с мутантными активными Ras- и Raf-конструкциями проводили в присутствии αvβ3-интегрин-блокирующих антител. САМ из 10-дневных куриных эмбрионов стимулировали, как описано на Фиг.9 и 12, фильтровальными дисками, насыщенными либо ЗФР (контроль), либо bFGF, RCAS(А)-ретровирусными конструкциями G12V-Ras или Raf-caax. LM609, моноклональное антитело к интегрину αv β3, доставляли внутривенно спустя 24 часа и ангиогенез оценивали анализом точек ветвления сосудов спустя 72 часа. Репрезентативные САМ показаны во вставке. Данные являются средними ± SE для 20 эмбрионов.
Фиг.17A-17F и Фиг.17G, соответственно, в виде фотографий и диаграммы показывают, что ангиогенез, индуцированный Raf, но не Ras, был нечувствительным к ингибированию блокадой интегрина. Инфицирование конструкциями как мутантного активного Ras, так и мутантного активного Raf индуцировало ярко выраженный ангиогенез, как показано соответственно на Фиг.17В и 17С, но только Ras-индуцированный ангиогенез ингибировался αvβ3-интегрин-блокирующими антителами, как показано на Фиг.17Е. Поскольку Raf-конструкция, используемая в этом анализе, является Ras-независимой, отсутствие ингибирования интегрином Raf-индуцированного ангиогенеза показывает, что передача сигнала интегирном имеет место при Ras-опосредованной активации или перед Ras-опосредованной активацией Raf. Приведенные в виде диаграммы результаты изображают результаты фотографий индивидуальных обработанных САМ.
11. Регуляция Ras-Raf-MEK-ERK-пути фокальной адгезионной киназой
Для определения роли активации рецептора фактора роста Ras-Raf-MEK-ERK-пути ангиогенеза САМ-анализы ангиогенеза проводили, как описано выше, с Ras V12 или Raf-caax экспрессируемыми белками в присутствии мутантной нуль-фокальной адгезионной киназой, называемой FRNK, которая является неактивной фокальной адгезионной киназой.
RCAS(А)-вирусы, кодирующие Ras V12 или Raf-caax, готовили, как описано выше, и локально наносили, как описано в примере 9В (Фиг.12), вместе с RCAS(В)-вирусом, кодирующим FAK-родственную нуль-киназу (FRNK), на фильтровальный диск САМ. Данные обозначают среднее ± SE для 20 эмбрионов.
Эти результаты показаны на Фиг.18A-18D и 18Е. Фиг.18А-18D показывают в виде фотографий, что коинфицирование САМ с мутантной нуль-фокальной адгезионной киназой, FRNK, блокировало индуцированный Ras, но не индуцированный Raf ангиогенез, как показано малочисленностью кровеносных сосудов на Фиг.18В в сравнении с необработанным Ras (Фиг.18А), необработанным Raf (Фиг.18С) и FRNK-обработанным Raf (Фиг.18D). Приведенные в виде диаграммы данные изображают результаты фотографий индивидуальных обработанных САМ.
Эти результаты в САМ-анализе были подтверждены в модели мышиного подкожного ангиогенеза, приготовленной, как описано ранее. Ангиогенез индуцировали подкожной инъекцией в бок мыши 250 мкл охлажденного на льду, имеющего сниженное количество факторов роста матригеля, содержащего или 400 нг/мл bFGF, или экспрессирующих ретровирус Молони пакующих клеток, экспрессирующих указанный ген. Ретровирус FRNK добавляли к матригелю в качестве вируса высокого титра, упакованного козьим белком оболочки vsv.g. Спустя пять дней специфический для эндотелия FITC-конъюгированный лектин Bandeiriea Simplifica B5 инъецировали через хвостовую вену и давали циркулировать. Затем ангиогенез определяли количественно удалением, экстракцией и анализом ангиогенной ткани на флуоресцентное содержание.
Фиг.19А и 19В-19С, соответственно, показывают, в виде диаграммы и фотографий, что FRNK блокировал индуцируемый bFGF и Ras, но не Raf-индуцируемый ангиогенез в мышиной модели подкожного ангиогенеза.
Для проверки уровня, при котором активация киназы происходит в Ras-Raf-MEK-ERK-пути, САМ коинфицировали ретровирусом, экспрессирующим FRNK, мутантную нуль-фокальную адгезионную киназу, с либо Ras G12V, либо Raf-caax. CAM обрабатывали, как описано на Фиг.18, за исключением того, что спустя 24 часа ангиогенную ткань иссекали, солюбилизировали, Raf иммунопреципитировали и Raf-активность оценивали по его способности фосфорилировать МЕК с убитой киназной активностью. Фиг.20А и 20В показывают, что коинфицирование САМ мутантной нуль-фокальной адгезионной киназой, FRNK, блокировало Ras-индуцированную активацию Raf. Фиг.20А показывает анализированные иммунопреципитированные активные Raf-белки в сравнении с общими Raf-белками под каждой из комбинаций, приведенных над этими результатами. Фиг.20В показывает в виде диаграммы результаты определений активного Raf при этих условиях. Таким образом, FRNK не ингибирует непосредственно активность Raf, но ингибирует активацию Raf Ras-белком.
12. Обсуждение
Приведенные выше исследования показывают, что Raf-киназа является необходимой и достаточной для ангиогенеза in vivo. Кроме того, нацеливание мутационно неактивной Raf-киназы на растущие кровеносные сосуды индуцирует локальный эндотелиальный апоптоз. То же самое нацеливание подавляет также ангиогенез, что приводит к супрессии и даже регрессу предсуществующих опухолей человека.
Ретровирусная доставка гена, кодирующего мутационно неактивные формы Raf-киназы (Raf K375M), показала существенное действие на ангиогенез опухоли in vivo. Важно, что используемый ретровирусный вектор специфически инфицирует пролиферирующие клетки мышиного происхождения. Таким образом, только васкулярный компартмент опухолевых трансплантатов человека был инфицированным (Фиг.1 и 4). Было обнаружено, что доставка неактивной Raf К375М-киназы подавляла индуцированную фактором роста Raf-киназную активность in vitro и блокировала индуцированный фактором роста ангиогенез in vivo (Фиг.2 и 3). В противоположность этому, ретровирусная доставка мутационно активной формы Raf-киназы (Raf 306-648) была достаточной для индукции ангиогенеза in vivo (Фиг.4). Кроме того, было обнаружено, что доставка вируса, экспрессирующего неактивную Raf-киназу, в опухоль в мышах индуцировала апоптоз эндотелиально-специфическим образом (Фиг.5). Наконец, животные, инокулированные опухолями человека и затем обработанные вирусом, экспрессирующим неактивную Raf-киназу, испытывали быстрый регресс опухоли, который поддерживался в ходе всего эксперимента (Фиг.6). Таким образом, Raf-киназа является как достаточной, так и необходимой для ангиогенеза, и действие на эту киназу может подавлять ангиогенез и устранять ангиогенез-зависимое заболевание.
В результате предыдущих анализов ангиогенеза в мышах и курах, описанных в примерах 9-11, изображенных на Фиг.9, 12, 13 и 16-20, данное изобретение обеспечивает активаторные белки ангиогенеза в виде Raf-caax, Ras G12V и Ras V12S35, и ингибиторные белки ангиогенеза в виде Ras S17N и Ras V12C40. Кроме того, эти исследования обеспечивают основу для понимания Ras-опосредованной активации Raf в Ras-Raf-MEK-ERK-пути, показывая, что Ras необходим для активации Raf, но опосредованный интегрином путь передачи сигнала взаимодействует при активации Raf или до активации Raf, но не ниже по ходу каскада передачи сигнала.
Хотя предыдущее описание является достаточным, чтобы позволить специалисту с квалификацией в данной области использовать на практике данное изобретение, различные модификации данного изобретения, кроме показанных и описанных здесь, будут очевидными для специалистов в данной области из предыдущего описания, и они входят в объем прилагаемой формулы изобретения.



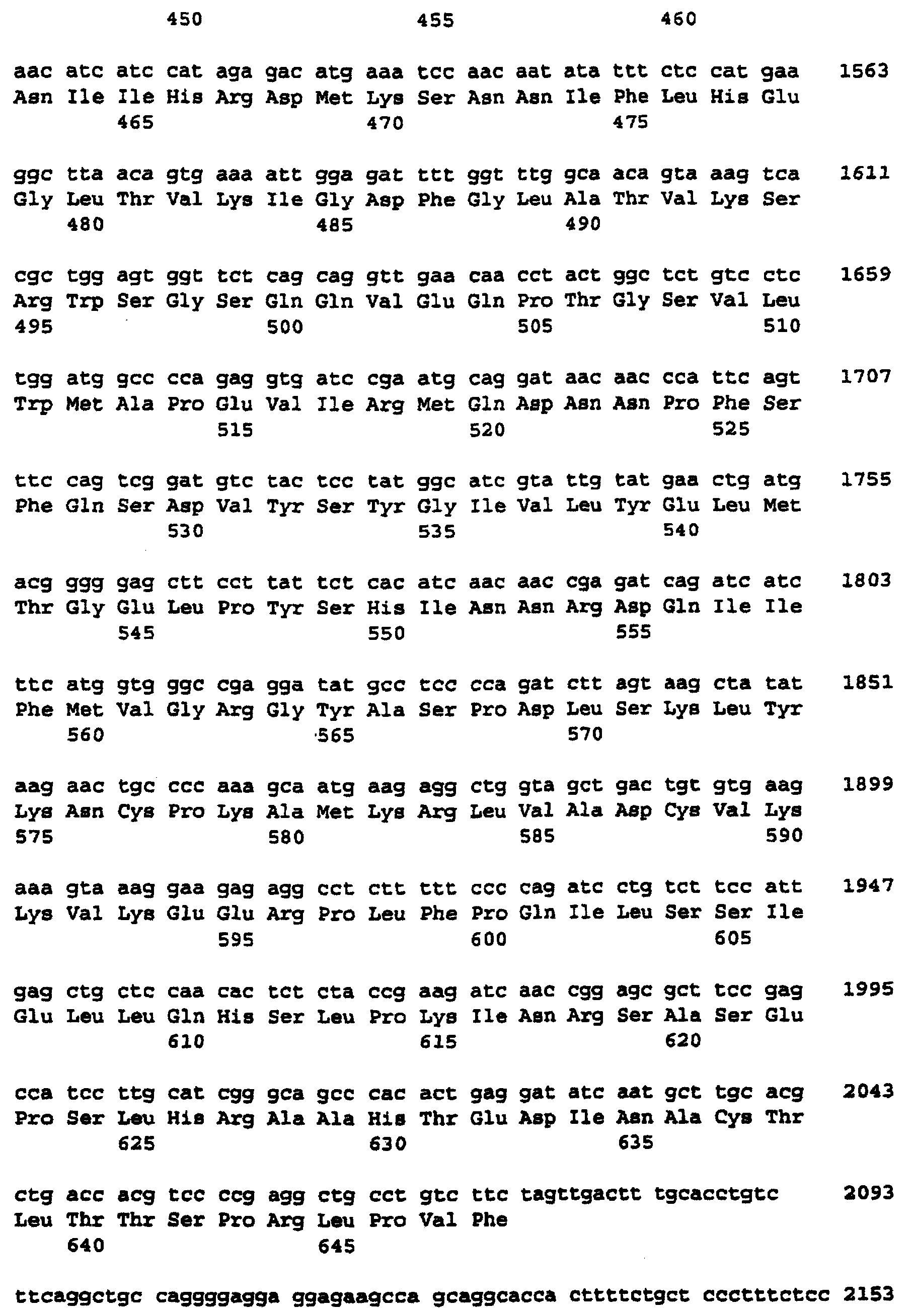


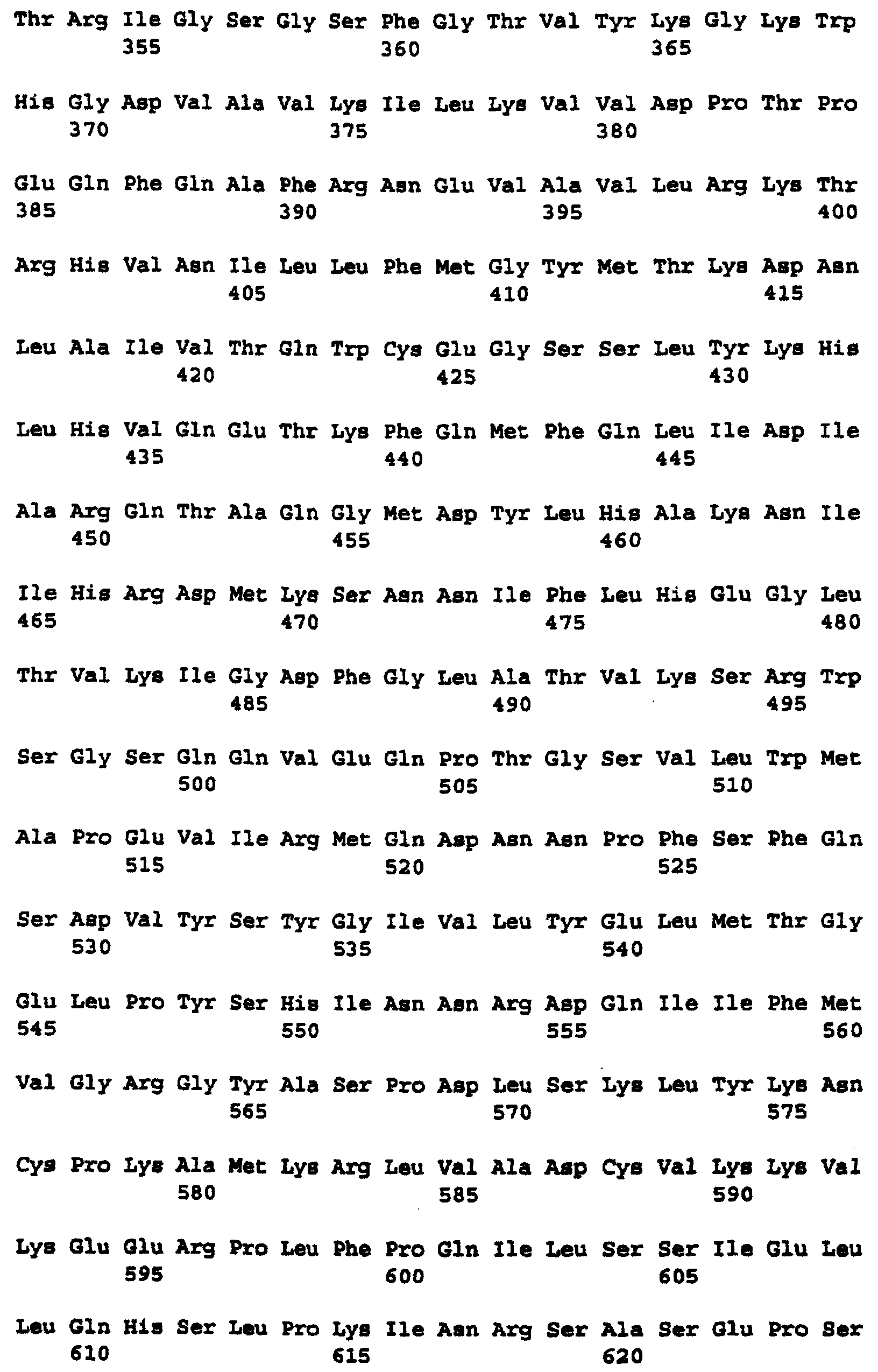


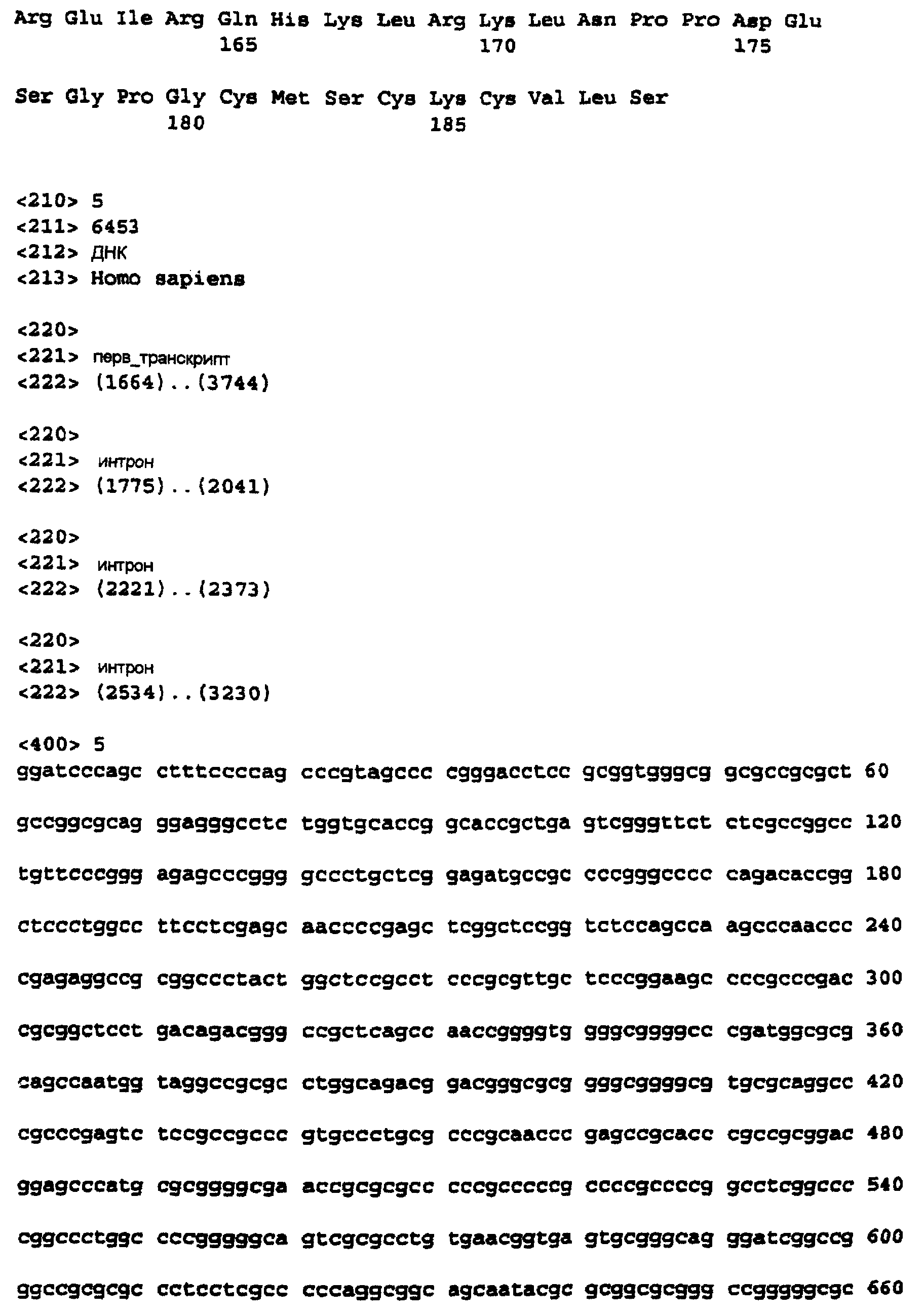
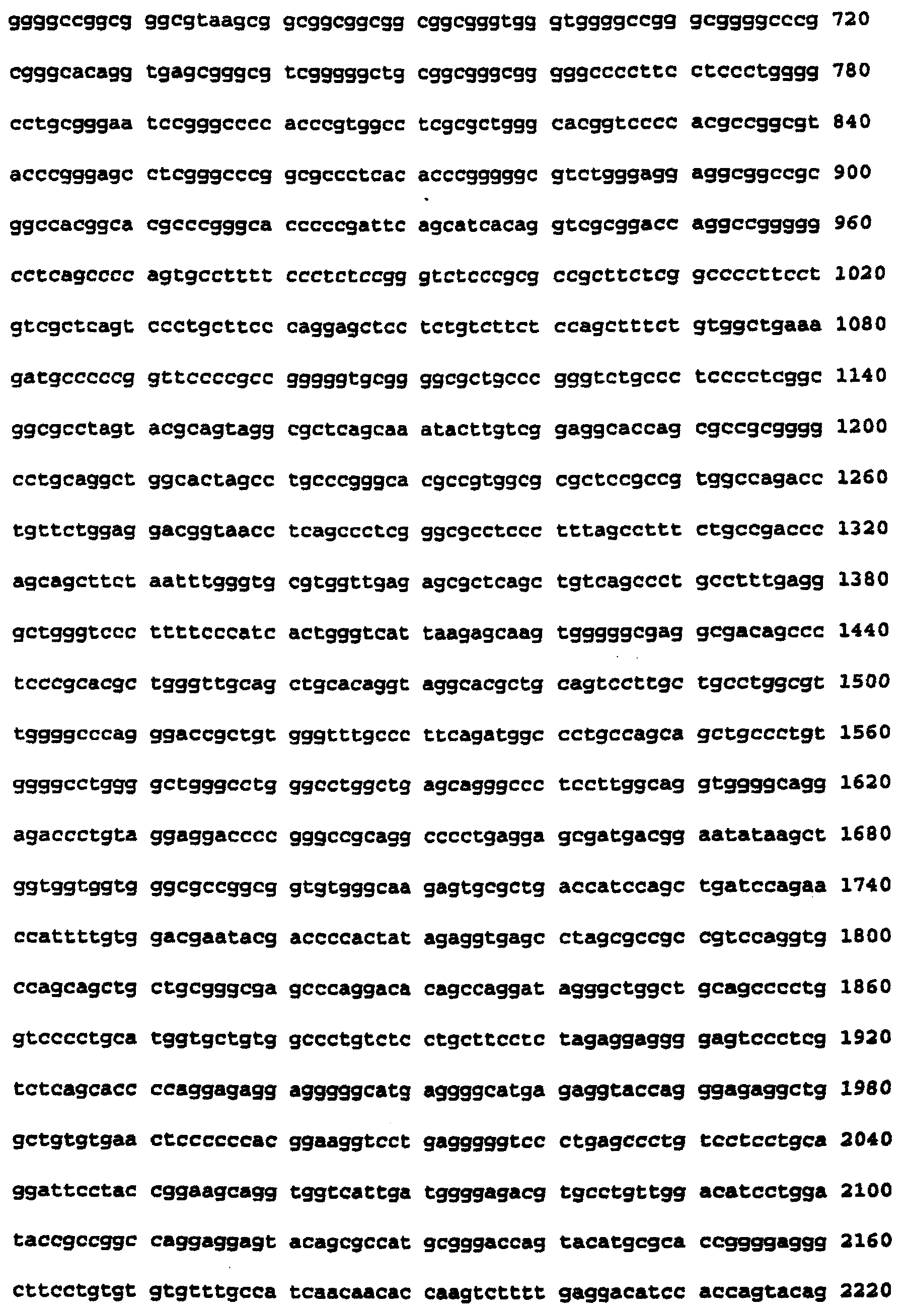







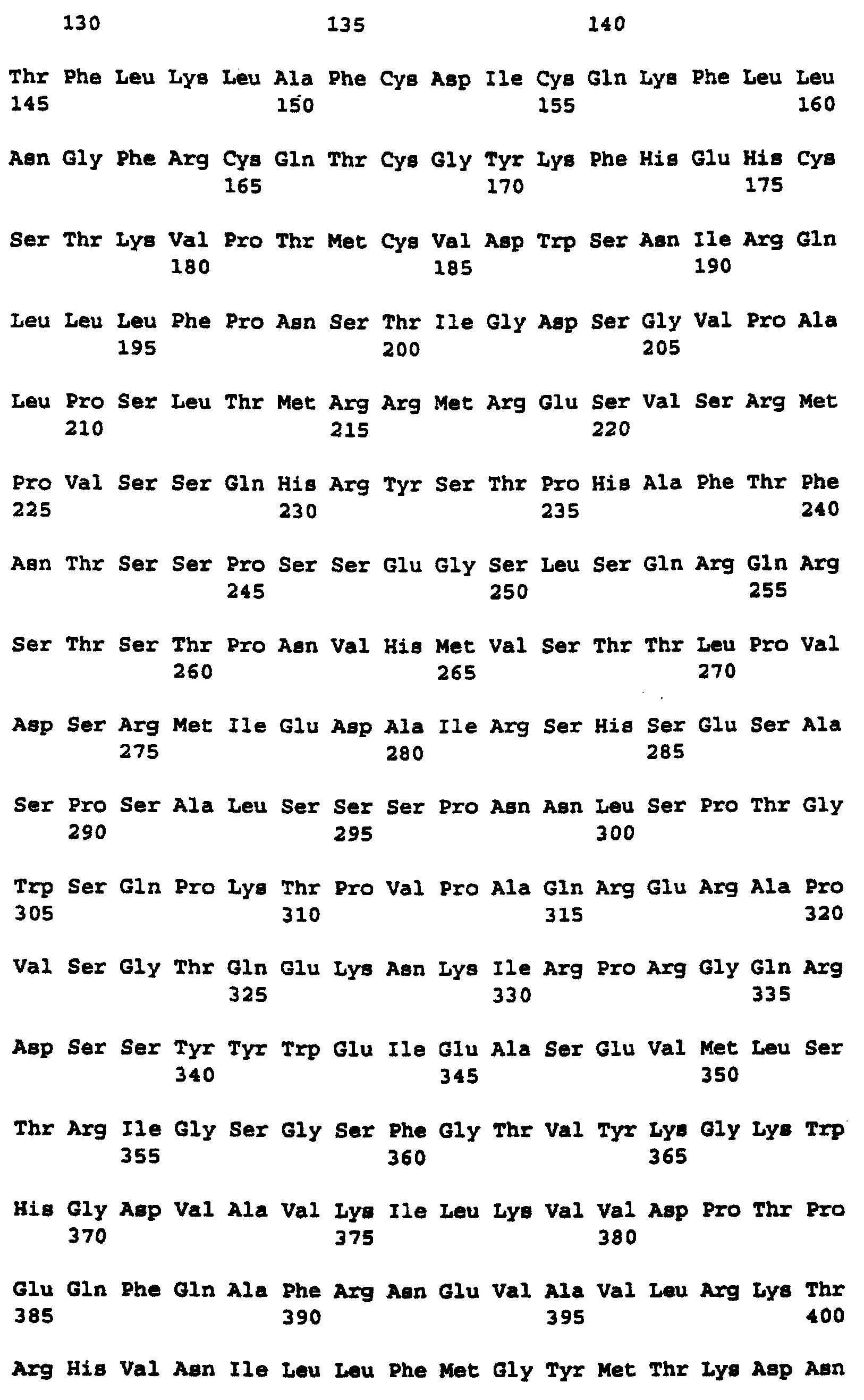
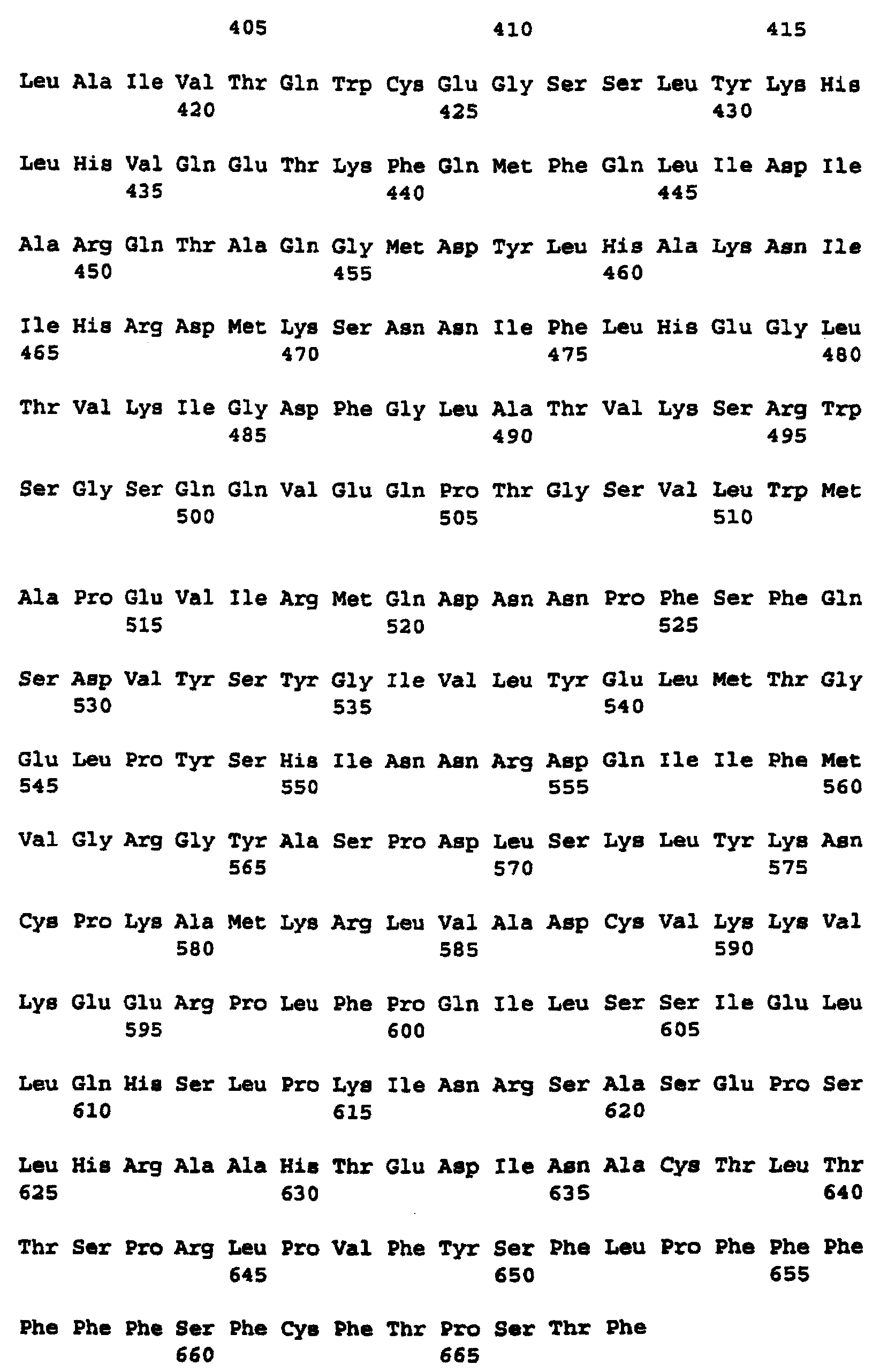
Реферат
Изобретение относится к области медицины, в частности описывает способы для модуляции ангиогенеза в тканях с использованием Raf- и/или Ras-белка, модифицированного Raf- или Ras-белка и нуклеиновых кислот, кодирующих их. Сущность изобретения составляют способы для ингибирования ангиогенеза с использованием неактивного Raf- или Ras-белка или нуклеиновых кислот, кодирующих их, или для потенциирования ангиогенеза с использованием активного Raf- или Ras-белка или нуклеиновых кислот, кодирующих их. Данное изобретение описывает также применение систем доставки генов для обеспечения нуклеиновых кислот, кодирующих Raf- или Ras-белок или их модифицированные формы. Технический результат - расширение арсенала способов и средств для регуляции ангиогенеза тканей. 13 н. и 31 з.п. ф-лы, 20 ил.

Комментарии