Комплексы на основе рнк и катионных пептидов для трансфекции и иммуностимуляции - RU2493256C2
Код документа: RU2493256C2
Чертежи





































Описание
Настоящее изобретение относится к РНК в составе комплекса, содержащего по крайней мере одну РНК и один или более олигопептидов, где длина олигопептида составляет от 8 до 15 аминокислотных остатков и характеризуется формулой (Arg)1(Lys)m(His)n(Orn)o(Xaa)x. Настоящее изобретение также относится к способу трансфекции клетки или организма с применением РНК в составе комплекса по настоящему изобретению. Кроме того, в настоящем изобретении предлагаются фармацевтические композиции и наборы, содержащие РНК в составе комплекса по настоящему изобретению, а также применение РНК в составе комплекса по настоящему изобретению для трансфекции клетки, ткани или организма и/или для модуляции, предпочтительно, индукции или усиления иммунного ответа.
Трансфекция нуклеиновых кислот в клетки или ткани пациентов методом переноса генов является основным методом в молекулярной медицине и имеет важнейшее значение в терапии и профилактике многочисленных заболеваний. Применение способов трансфекции нуклеиновых кислот может приводить к усилению иммунитета ткани или организма. В альтернативном или дополнительном варианте после трансфекции нуклеиновых кислот может происходить обработка информации, кодированной введенными нуклеиновыми кислотами, т.е. трансляция необходимых полипептидов или белков. ДНК или РНК, являясь нуклеиновыми кислотами, представляют собой альтернативные подходы при разработке способов генной терапии. Трансфекция нуклеиновых кислот также может приводить к модуляции, например, к подавлению или усилению, экспрессии генов, в зависимости от типа трансфектированной нуклеиновой кислоты. Трансфекцию указанных нуклеиновых кислот обычно проводят по методике переноса генов.
Методы переноса генов в клетки или ткани интенсивно исследовались в течение последних десятилетий, однако, отчасти, с незначительным успехом. Хорошо известные способы включают физические или физико-химические методы, такие как (непосредственная) инъекция свободных нуклеиновых кислот или биобаллистический перенос генов. Биобаллистический перенос генов (известный также как биобаллистическая бомбардировка частицами) представляет собой метод, разработанный в Корнельском университете, и позволяет вводить генный материал в ткани и клетки. Биобаллистический перенос генов, как правило, проводят с применением поверхностно-покрытых металлических частиц, таких как частицы золота или серебра, при этом клетки обстреливают этими частицами, покрытыми адсорбированной ДНК, с помощью генной пушки. Однако до сих пор не было подтверждено, что биобаллистический перенос генов эффективен при переносе РНК, вероятно, из-за ее быстрого разрушения. Кроме того, данные методы не пригодны для применения in vivo, что является причиной серьезных ограничений при внедрении их на практике.
Другой физический или физико-химический метод включает метод электропорации in vitro, который основан на использовании высоковольтного тока для обеспечения проницаемости клеточных мембран, что позволяет вводить новую ДНК или РНК в клетку. Таким образом, прочность клеточных стенок обычно понижают перед трансфекцией, применяя химические реагенты или проводя осторожное замораживание, при этом клетки становятся «электрокомпетентными». Если электрокомпетентные бактерии или клетки (например, эукариотические клетки) смешать вместе с ДНК (или РНК), то в клетку можно перенести плазмиду за счет электрического разряда, посредством которого ДНК (или РНК) переносится в клетки по ходу искрового разряда, пересекающего реакционную камеру.
Еще один альтернативный физический или физико-химический метод включает использование наноплексов (систем наночастип), липоплексов (липосомальных систем) либо использование полиплексов или катионных полимеров. Такие наноплексы (системы наночастип) основаны на применении полиакрилатов, полиамидов, полистирола, цианоакрилатов, полилактата (ПЛА), сополимера молочной и гликолевой кислот (ПМГК), полиэтиленгликоля и т.п., в качестве систем-носителей для транспорта нуклеиновых кислот в клетки и ткани. Липоплексы или липосомальные системы, как правило, основаны на использовании катионных липидов, которые способны имитировать клеточную мембрану. При этом положительно заряженные остатки липидов взаимодействуют с отрицательно заряженными остатками нуклеиновых кислот и таким образом обеспечивают слияние с клеточной мембраной. Липоплексы или липосомальные системы включают, например, хлорид N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (ДОТМА), диолеоилфосфатидилэтаноламин (ДОФЭ), трифторацетат 2,3-диолеилокси-N-[2(сперминкарбоксамидо)этил]-N,N-диметил-1-пропанамина (ДОСПА), хлорид N-[1-(2,3-диолеоилокси)пропил]-N,N-триметиламмония (ДОТА), 3-6eTa-[N-(N',N'-диметиламиноэтан)карбамоил]холестерин (ДК-Хол), пара-этилдимеристоилфосфатидилхолин (ЭДМФХ) и т.п. Полиплексы (катионные полимеры), как правило, образуют комплекс с отрицательно заряженными нуклеиновыми кислотами, что приводит к конденсации нуклеиновых кислот, что, в свою очередь, защищает эти нуклеиновые кислоты от разрушения. Транспорт в клетки с использованием полиплексов (катионных полимеров), как правило, происходит в результате опосредованного рецепторами эндоцитоза. При этом ДНК связывается с отдельной молекулой, такой как трансферрин, например, через полиплекс-поли-L-лизин (ПLЛ), который связывается с поверхностным рецептором и индуцирует эндоцитоз. Полиплексы (катионные полимеры) включают, например, поли-b-лизин (ПLЛ), хитозан, полиэтиленимин (ПЭИ), полидиметиламиноэтилметакрилат (ПДМАЭМА), полиамидоамин (ПАА).
Другие известные физические или физико-химические методы переноса генов в клетки или организмы включают такие методы, как трансфекция, основанная на использовании вирусов. Прежде всего, в качестве носителей ДНК могут быть использованы ДНК-содержащие вирусы. Благодаря их инфекционным свойствам, такие вирусы отличаются очень высоким уровнем трансфекции. Обычно используемые вирусы генетически модифицируют таким способом, чтобы исключить образование функциональных инфекционных частиц в трансфектированной клетке. Однако, несмотря на эти меры предосторожности, риск неконтролируемого размножения введенных терапевтически активных генов и вирусных генов нельзя исключить, например, вследствие возможных явлений рекомбинации.
Более предпочтительным, в данном контексте, является использование так называемых транслокационных белков или доменов белковой трансдукции (ДБТ) для транспорта макромолекул в клетки и ткани. Транслокационные белки обозначают группу пептидов, обеспечивающих эффективный транспорт макромолекул между клетками (транслокационные белки), таких как ВИЧ tat, сложный локус антеннопедии (антеннопедия у Drosophila), ВПГ VP22 (вирус простого герпеса), ФРФ (фактор роста фибробластов) или лактоферрин, и т.п. Напротив, домены белковой трансдукции (ДБТ) обозначают группу пептидов, обеспечивающих перенос указанных белков и пептидов, ковалентно связанных с этими последовательностями, в клетку через клеточную мембрану (см. статью Leifert и Whitton, Translocatory proteins and protein transduction domains: a critical analysis of their biological effects and the underlying mechanisms. Molecular Therapy, т.8, No.1 (2003)). Общим у транслокационных белков и у ДБТ является основный участок, который является, главным образом, ответственным за транспорт гибридных пептидов, так как он способен связывать полианионы, такие как нуклеиновые кислоты. Кроме того, находясь в несвязанном состоянии, ДБТ могут действовать аналогично реагентам катионной трансфекции, по механизму рецептор-опосредованного ненасыщенного адсорбционного эндоцитоза. ДБТ, как правило, связываются с белками или пептидами для воздействия или усиления ответа цитотоксических Т-лимфоцитов (ЦТЛ) при введении вакцины, содержащей пептид (см. обзор: Melikov и Chernomordik, Arg1nine-rich cell penetrating peptides: from endosomal uptake to nuclear delivery, Cell. Mol. Life Sci. (2005)).
Домены белковой трансдукции (ДБТ) иногда также обозначают термином «пептиды, проникающие в клетку» (ППК) из-за способности проникать через клеточную мембрану и таким образом влиять на транспорт (макро-)молекул в клетки. ППК представляют собой короткие пептиды и обычно характеризуются высоким содержанием основных аминокислот, а также длиной от 7 до 30 аминокислотных остатков. Макромолекулы, которые, как было установлено, могут переноситься в клетки с помощью ППК, включают пептиды, а также ДНК, короткие интерферирующие РНК (киРНК) или ПНК (пептидные нуклеиновые кислоты), при этом ДБТ обычно связаны с этими макромолекулами ковалентной связью, и трансфектируются в клетки. Несмотря на то, что пептиды, проникающие в клетки (ППК), могут с успехом использоваться в качестве посредников для внутриклеточной доставки множества молекул, представляющих интерес для фармакологии как in vitro, так и in vivo, механизмы, благодаря которым осуществляется захват клетками, остаются невыясненными. Группа ППК очень неоднородна и включает амфипатические спиральные пептиды, такие как транспортан, пенетратин, гидрофобные пептиды, такие как MTS, VP22, MAP, KALA, PpTG20, пролин-обогащенные пептиды, MPG-пептиды, Рер-1, L-олигомеры, кальцитонин-пептиды, или катионные гидрофильные, аргинин-обогащенные пептиды, включая аргинин-обогащенные ППК, которые являются посредниками при захвате клеткой ковалентных молекулярных конъюгатов за счет связывания с протеогликанами клетки, такими как домен трандукции белка ВИЧ-1 tat (см. обзор: Deshayes и др., Cell-penetrating peptides: tools for intracellular delivery of therapeutics, Cell. Mol. Life Sci. (2005)). Прежде всего, аргинин-обогащенные ППК описаны как носители белков или ДНК, например, плазмидной ДНК, и т.п. для переноса их в клетки. Полиаргинины также могут применяться для транспорта (макро-)молекул в клетки, при этом обычно их длина составляет по крайней мере от 60 до 80 аминокислотных остатков (прежде всего аргинина), более типично, от 1000 до 15000 аминокислотных остатков, и таким образом, представляют собой высокомолекулярные соединения. Даже учитывая, что механизм захвата клетками для ППК в целом остается невыясненным, предполагается, что для полиаргинина механизмом захвата является эндоцитоз. Эндоцитоз представляет собой клеточный процесс, в результате которого макромолекулы могут проникать в клетку, не проходя через клеточную мембрану, при этом были предложены три различных механизма эндоцитоза (клатрин-зависимый эндоцитоз, кавеолин-зависимый эндоцитоз и/или Р-актин-зависимый эндоцитоз, см., например, обзор: Melikov и Chernomordik, Arg1nine-rich cell penetrating peptides: from endosomal uptake to nuclear delivery, Cell. Mol. Life Sci. (2005)). He ссылаясь ни на одну из теорий, можно утверждать, что в процессе эндоцитоза макромолекула в комплексе с ППК сначала связывается с отрицательно заряженной поверхностью клетки (с глюкозаминогликанами (ГАГ), включая гепараны (Г)). Затем ППК-связанная макромолекула проникает в клетку за счет клатрин-зависимого эндоцитоза, кавеолин-зависимого эндоцитоза и/или F-актин-зависимого эндоцитоза, например, за счет замыкания мембраны вокруг ППК-связанной макромолекулы вне клетки. При этом образуется везикула, в которой содержится ППК-связанная макромолекула. За счет переноса с помощью поздних эндосом и/или аппарата Гольджи и/эндоплазматического ретикулума (ЭР) ППК-связанная макромолекула переносится в цитоплазму, при этом данная стадия может включать ППК-индуцируемое открытие временных пор в липидном бислое. В другом варианте комплекс макромолекулы с ППК может переноситься в другие компартменты клетки, например, в эндосому, в зависимости от требуемого типа воздействия с определенной целью. Например, рецепторы TLR-7 и TLR-8, расположены в эндосоме. Таким образом, трансфекция клеток иммуностимулирующими РНК, которые, например, могут представлять собой лиганды Toll-подобных рецепторов (TLR), выбранных из лигандов TLR1-TLR13 (Toll-подобные рецепторы: TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13), может приводить к переносу в эндосомы и (в зависимости специфического взаимодействия и компонентов взаимодействия), например, к иммуностимуляции РНК-лигандом.
Пептиды, проникающие в клетки (ППК), как определено выше, известны в данной области техники. Однако, эти ППК (в качестве носителей) были использованы для транспорта пептидов, белков и ДНК, т.е. в качестве «нагрузки», при этом ППК обычно связаны с «нагрузкой» ковалентной связью. Напротив, было установлено, что клеточный транспорт РНК с использованием ППК наблюдается только в очень ограниченном числе случаев, прежде всего, для коротких последовательностей РНК, например, для двухцепочечных киРНК. В качестве примера в статье Futaki и др. (The Journal of Biological Chemistry, т.276, No.8, сс.5836-5840, (2001)) описано использование в качестве носителей олигопептидов (Arg)n, длина которых составляет 4-16 аминокислотных остатков, для переноса пептидов in vitro в качестве «нагрузки», при этом пептиды-носители связаны ковалентной связью с переносимыми пептидами. Оптимальные условия переноса были установлены для пептидов (Arg)n, содержащих 6 или 8 остатков аргинина, соответственно.
Трансмембранный транспорт пептидов или пептидомиметиков с помощью ППК также был описан в работах Deshayes и др. (2005 г. см. выше), включая использование олигопептидов Arg7 и Arg9 для переноса in vitro пептидов-«нагрузки» и переноса in vivo белков-«нагрузки», таких как циклоспорин или каталаза.
Для трансфекции клеток макромолекулами, такими как ДНК, пептиды или белки, были использованы высокомолекулярные пептиды, такие как поли-L-аргинины (обычно молекулярная масса которых составляет, например, от приблизительно 5000 Да до 15 кДа) или поли-L-лизины (обычно молекулярная масса которых составляет приблизительно 54 кДа), а также высокомолекулярный ПЭИ (полиэтиленимин) (обычно молекулярная масса которого составляет приблизительно 25 кДа), как описано в данном уровне техники (см. также Bettinger и др.. Nucleic Acids Research, т.29, No. 18 (2001)). Однако было установлено, что высокомолекулярный поли-L-лизин и ПЭИ неэффективны в качестве молекул-носителей. Кроме того, при использовании высокомолекулярных поли-L-аргининов при высокой концентрации наблюдаются токсические эффекты, приводящие к активации системы комплемента. Таким образом, были предприняты попытки разработки низкомолекулярных трансфектирующих агентов, таких как, например, низкомолекулярные полиаргинины. Однако, такие низкомолекулярные полиаргинины, как правило, характеризуются низкой стабильностью комплекса носитель-«нагрузка», т.е. комплекса, включающего, например, полиаргинин в качестве носителя и молекулу ДНК в качестве «нагрузки». Так, например, в статье McKenzie и др., A potent new class of reductively activated peptide gene delivery agents, The Journal of Biological Chemistry, т.274, No.14. (2000)) описаны попытки увеличить стабильность комплексов пептид-ДНК, за счет сшивки этих пептидов и ДНК глутаровым альдегидом через образование Шиффова основания. Однако такая сшивка приводит к исключительно низкой диссоциации комплекса в клетке и, следовательно, исключительно низкой экспрессии кодируемого белка в течение времени. Для решения этой проблемы (McKenzie и др. (2000) см. выше) вводили остатки цистеина в ППК-носитель, которые стабилизируют комплекс за счет образования дисульфидных связей между ППК и ДНК. В результате трансфекции эти дисульфидные связи разрушаются в восстанавливающих условиях внутри клетки, что приводит к увеличению экспрессии кодируемых пептидов. Однако такая сшивка является трудоемким процессом и может даже приводить к дополнительным нежелательным модификациям ДНК.
Кроме того, низкомолекулярный ПЭИ (например, обычно молекулярная масса которого составляет приблизительно 2000 Да) и низкомолекулярные поли-L-лизины (например, обычно молекулярная масса которых составляет приблизительно 3400 Да) могут использоваться для трансфекции таких макромолекул, как упомянуто выше. Однако даже, несмотря на то, что при использовании низкомолекулярного ПЭИ или поли-L-лизина в данных экспериментах наблюдается улучшенная трансфекция, уровень экспрессии не детектируется из-за образования исключительно устойчивых комплексов этих молекул-носителей с ДНК. В результате было установлено, что при использовании таких молекул в качестве носителей, не наблюдается диссоциация ДНК из комплекса, которая является необходимой стадией для трансляции и экспрессии кодируемого белка (см. статью Bettinger и др. (2001) см. выше).
Перенос ДНК с помощью ППК также был описан в статье Niidome и др., The Journal of Biological Chemistry, т.272, No.24, сс.15307-15312. (1997). В указанной статье описано использование ППК, прежде всего катионных альфа-спиральных пептидов, содержание аргинина в которых составляет 25%, а длина от 12 до 24 аминокислотных остатков, соответственно, для переноса плазмидной ДНК, в качестве «нагрузки». В результате было найдено, что длинные и/или гидрофобные пептиды могут прочно связывать ДНК и эффективно переносить ДНК в клетки. Кроме того, в статье Niidome и др., Bioconjugate Chem., 10, 773-780 (1999) было описано, что пептиды, длина которых составляет от 16 до 17 аминокислотных остатков, проявляют чрезвычайно высокую эффективность для переноса плазмидной ДНК. Однако было установлено, что в случае использования коротких пептидов (например, приблизительно 12 аминокислотных остатков) в качестве ППК, эффективность трансфекции ДНК в клетки значительно снижалась.
С целью повышения эффективности клеточной трансфекции коротких аргининовых молекул, в статье Futaki и др., Bioconjugate Chem. 12, 1005-1011 (2001) описано использование стеарилированных олигопептидов (Arg)n, длина которых составляет 4-16 аминокислотных остатков. Эти олигопептиды использовали в экспериментах по трансфекции при сравнении с нестеарилированными олигопептидами (Arg)n, длина которых составляет 4-16 аминокислотных остатков, и полиаргинином (с молекулярной массой 5000-15000 Да), для переноса in vitro плазмидной ДНК, кодирующей люциферазу. Таким образом, пептидные носители, использованные для трансфекции, смешивали с плазмидной ДНК, при этом образуется комплекс носитель/нагрузка. Оптимальную эффективность переноса была установлена для стеарилированного (Arg)n, длина которого составляет 8 остатков аргинина, при этом было установлено, что при использовании аргининовых пептидов, содержащих 6-7 и 9-15 остатков аргинина, наблюдается значительное снижение активности клеточного транспорта. Кроме того, при использовании нестеарилированных аргининов и полиаргинина, наблюдается потеря транспортной активности. В статье Futaki и др. (2001) см. выше) было установлено, что наблюдаемое различие в эффективности трансфекции для стеарилированных и нестеарилированных пептидных носителей, таким образом, можно объяснить присутствием липидных остатков, которые значительно изменяют химические свойства использованных в этих экспериментах ППК.
Согласно статье Kim и др.. Basic peptide system for efficient delivery of foreign genes, Biochimica et Biophysica Acta, 1640, 129-136. (2003), короткие аргининовые пептидные носители, такие как (Arg)9-(Arg)15, можно использовать для комплексообразования и клеточной трансфекции ДНК, кодирующей зеленый флуоресцентный белок PEGFP-N3. При использовании аргининовых пептидов (Arg)9-(Arg)15, оптимальные результаты были получены при использовании (Arg)15, при этом было установлено, что эффективность клеточной трансфекции повышается в ряду от (Arg)9 до (Arg)15. Эти результаты показывают, что оптимальные транспортные свойства для трансфекции ДНК в клетки достигаются при использовании (Arg)n пептидного носителя, при этом n должно быть намного больше 15. Однако использование коротких аргининовых пептидов для трансфекции была описана только для молекул ДНК в качестве переносимого компонента в статье Kim и др. (2003 г. см. выше).
Клетки также можно трансфектировать с использованием ППК в комбинации с РНК. Однако только незначительное число реализуемых на практике примеров было описано для клеточного переноса РНК, по-видимому, из-за ее быстрой деградации и низкой стабильности в составе комплексов. Таким образом, было установлено, что применение трансфекции РНК с использованием ППК ограничено лишь использованием более стабильных двухцепочечных РНК, таких как киРНК. В качестве примера в статье Tonges и др., RNA, 12: 1431-1438 (2006) описано использование стеарилированного октааргинина (Arg)8 для переноса in vitro двухцепочечной короткой киРНК в нервные клетки гиппокампуса, при этом стеарилированный октааргинин (Arg)8 образовывал комплекс с киРНК. На основании результатов Tonges и др. (2006 г. см. выше) было установлено, что стеариловый компонент пептидных носителей является обязательным при переносе киРНК или переносе других молекул РНК.
В статье Veldhoen и др., Cellular delivery of small interfering RNA by a non-covalently attached cell penetrating peptide: quantitative analysis of uptake and biological effect, Nucleic Acids Research, (2006) также описано использование специфических ППК в нековалентных комплексах для трансфекции клеток двухцепочечными короткими киРНК. Для указанных экспериментов использовали пептиды: MPGalpha (Ac-GALFLAFLAAALSLMGLWSQPKKKRKV-Cya) и MPGalpha-mNLS (Ac-GALFLAFLAAALSLMGLWSQPKSKRKV-Cya). Эти специфические пептиды были дополнительно модифицированы при ацетилировании (Ас) N-концевого фрагмента и при включении цистамидного остатка в С-концевой фрагмент. Авторы установили, что происходит перенос двухцепочечной киРНК, содержащей приблизительно от 18 до 40 нуклеотидов, в клетки с использованием упомянутых ранее пептидных носителей.
Суммируя сказанное выше, можно заключить, что использование ППК или других пептидных носителей для клеточного транспорта макромолекул, было, в основном, описано для пептидов и молекул ДНК. И только в нескольких специальных публикациях описана способность двухцепочечной киРНК проникать в клетку.
Перенос РНК представляет собой важный инструмент современной молекулярной медицины и характеризуется преимуществом по сравнению с трансфекцией клеток с помощью ДНК, т.к. использование молекул ДНК может вызывать серьезные проблемы. Например, применение молекул ДНК связано с риском интегрирования ДНК в геном хозяина. Интегрирование чужеродной ДНК в геном хозяина может оказывать влияние на экспрессию генов хозяина и, возможно, индуцировать экспрессию онкогена или разрушение гена супрессии опухоли. Ген, а следовательно, генный продукт, который необходим для хозяина, также может инактивироваться в результате интеграции чужеродной ДНК в кодирующую область этого гена. Существует особая опасность в случае, если интегрирование ДНК происходит в ген, который принимает участие в регуляции клеточного роста. В этом случае клетка хозяина может перейти в дегенеративное состояние, что приводит к раку или образованию опухоли. Такая нежелательная интеграция в ДНК может оказаться даже более проблематичной, если ДНК, трансфектированная в клетку, содержит сильный промотор, такой как промотор вируса ЦМВ. Интеграция таких промоторов в геном обработанных клеток может приводить к нежелательным изменениям в регуляции экспрессии гена в клетке. Дополнительный недостаток заключается в том, что молекулы ДНК остаются в клеточном ядре в течение длительного времени, либо в виде эписомы, или, как было упомянуто, интегрируются в геном хозяина. Это явление приводит как к продуцированию трансгенного белка, которое не ограничено во времени или такое продуцирование нельзя ограничить во время, так и к опасности связанной с этим толерантности к этому трансгенному белку. Выработка антител против ДНК, описанная в статье Gilkeson и др., J. Clin. Invest., 95, 1398-1402 (1995), и развитие аутоиммунных заболеваний также дополнительно могут быть связаны с введением ДНК. Все эти перечисленные риски связаны с применением ДНК. Напротив, риски отсутствуют, если вместо ДНК использовать РНК, прежде всего, мРНК. Например, мРНК не интегрирует в геном хозяина, и не требуется использовать вирусные последовательности, такие как промоторы и т.п., для эффективной транскрипции, и т.п. Недостатки использования РНК могут быть связаны с ее нестабильностью по сравнению с ДНК (нестабильность РНК связана, прежде всего, с деградирующими РНК ферментами, так называемыми РНКазами (рибонуклеазами), но также с многочисленными другими процессами, которые снижают стабильность РНК. Однако, способы стабилизации РНК, тем не менее, известны в уровне техники, например, описаны в патентах WO 03/051401, WO 02/098443, WO 99/14346, EP-A-1083232, US 5580859 и US 6214804. Были также разработаны способы для защиты РНК от деградации рибонуклеазами, либо с использованием липосом (см. статью: Martinon и др., Eur. J. ImmunoL, 23, 1719-1722 (1993)) или при внутрицитозольном введении in vivo нуклеиновой кислоты с использованием баллистического устройства (генная пушка) (см. статью: Vassilev и др., Vaccine. 19, 2012-2019 (2001)).
Так как молекулы РНК сами по себе обладают лучшими свойствами по сравнению с ДНК, как обсуждалось выше, цель настоящего изобретения заключается в том, чтобы обеспечить пригодный и эффективный носитель для переноса РНК в клетки. В соответствии с этим, в настоящем изобретении предлагается эффективный способ трансфекции РНК в клетки.
Цель настоящего изобретения осуществляется за счет вариантов осуществления настоящего изобретения, как определено в формуле изобретения. Прежде всего, указанная выше задача решается при использовании РНК в составе комплекса, содержащего по крайней мере одну РНК, предпочтительно мРНК, и один или более олигопептидов, при этом, длина по крайней мере одного олигопептида составляет от 8 до 15 аминокислотных остатков, и при этом по крайней мере один олигопептид содержит 1 остатков Arg, m остатков Lys, n остатков His, о остатков Orn и х остатков Хаа, расположенных в любом порядке, при этом по крайней мере один олигопептид характеризуется общей формулой:
где
l+m+n+o+x=8-15, и
l, m, n или о независимо друг от друга могут равняться любому числу, выбранному из ряда: 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что суммарное содержание Arg, Lys, His и Orn составляет, по крайней мере 50%, например, по крайней мере 60% или 70% в расчете на содержание всех аминокислот в олигопептиде; и Хаа может означать любую аминокислоту, выбранную из группы природных или не природных аминокислот, за исключением Arg, Lys, His или Orn; и х может равняться любому числу, выбранному из ряда: 0, 1, 2, 3, 4, 5, 6, 7 или 8, при условии, что суммарное содержание Хаа не превышает 50%, например, не более 40% или 30%, в расчете на содержание всех аминокислот в олигопептиде.
В контексте настоящего изобретения, термин «РНК в составе комплекса» означает РНК, как определено в настоящем контексте, предпочтительно мРНК, которая образует комплекс с одним или более олигопептидов общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, причем образуется нековалентный комплекс РНК и олигопептида(ов). В данном контексте «нековалентный» обозначает, что происходит обратимая ассоциация РНК и олигопептида за счет нековалентных взаимодействий между этими молекулами, при этом молекулы ассоциируют друг с другом по любому типу электронных взаимодействий, в отличие от ковалентной связи, например, за счет ван-дер-ваальсовых взаимодействий, т.е. слабого электростатического притяжения за счет неспецифических сил притяжения между молекулами, входящими в комплекс. Ассоциация РНК по крайней мере с одним олигопептидом, находится в равновесии с диссоциацией комплекса. Не ссылаясь на какую-либо теорию, можно предположить, что внутри клетки равновесие сдвигается в сторону диссоциации РНК и олигопептида(ов).
По крайней мере, один олигопептид в составе комплекса с РНК, по настоящему изобретению, содержит от 8 до 15 аминокислотных остатков, предпочтительно от 8 до 14, от 8 до 13, от 8 до 12, от 9 до 12 или от 9 до 11 аминокислотных остатков, и более предпочтительно, от 8 до 10, от 9 до 11, от 10 до 12, от 11 до 13, от 12 до 14 или от 13 до 15 аминокислотных остатков, или даже более предпочтительно, выбран из пептидов указанной выше формулы, включающих 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотных остатков.
Олигопептид в составе комплекса с РНК, по настоящему изобретению, характеризуется общей формулой (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как определено выше, при этом l+m+n+o+x=8-15, и l, m, n или о, независимо друг от друга, могут равняться числу, выбранному из: 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или находится в любом диапазоне указанных двух значений, при условии, что общее содержание (основных аминокислотных остатков) Arg, Lys, His и/или Orn составляет по крайней мере 50% (например, по крайней мерее, 51, 52, 53, 54, 55, 56, 57, 58 или 59%), по крайней мере 60% (например, по крайней мере 61, 62, 63, 64, 65, 66, 67, 68 или 69%), по крайней мере 70% (например по крайней мере 71, 72, 73, 74, 75, 76, 77 78 или 79%), по крайней мере 80% (например по крайней мере 81, 82, 83, 84, 85, 86, 87, 88 или 89%), по крайней мере 90% (например, по крайней мере 91, 92, 93, 94, 95, 96, 97, 98 или 99%), или даже 100% в расчете на содержание всех аминокислотных остатков в составе олигопептида в составе комплекса с РНК по настоящему изобретению. Термины «Arg, Lys, His и Orn (в трехбуквенном коде)» обозначают аминокислоты аргинин, лизин, гистидин и орнитин, соответственно. В данном контексте, орнитин представляет собой аминокислоту формулы NH2-CH2-CH2-CH2-CHNH2-СООН. Орнитин был искусственно включен в положение 21 олигопептида и не относится к природным 20 аминокислотам, то есть орнитин не кодируется ДНК, и, соответственно, не используется в первичном белковом синтезе. Однако, орнитин образуется в результате ферментативной реакции, причем, из L-аргинина. Было найдено, что орнитин не является частью генетического кода, т.к. полипептиды, содержащие незащищенные остатки орнитина, подвергаются спонтанной лактамизации. Орнитин относят к основным аминокислотам, т.к. он является одним из продуктов реакции фермента аргиназы с L-аргинином с образованием мочевины.
Согласно еще одному предпочтительному варианту, (отдельные) аминокислотные остатки в составе олигопептида в составе комплекса с РНК, по настоящему изобретению, общей формулы 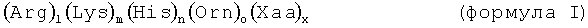
Аминокислоты в указанной выше формуле (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, т.е. Arg, Lys, His и/или Orn, можно дополнительно выбирать из природных аминокислот Arg, Lys, His и Orn или неприродных аминокислот, производных этих аминокислот. В качестве неприродных аминокислот, производных аминокислот Arg, Lys, His и Orn, можно использовать любые известные производные этих аминокислот, из которых в результате химической модификации получают производные, которые не являются токсичными для клеток или организмов, при условии их включения в указанный выше олигопептид. (Такие производные аминокислот выпускаются различными фирмами, см., например, Sigma Aldrich (см. ссылку http://www.sigmaaldrich.com).
Кроме того, олигопептид в составе комплекса с РНК, по настоящему изобретению, может содержать аминокислотный остаток Хаа в указанной выше общей формуле (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, который можно выбрать из любых аминокислот, включающих природные или неприродные аминокислоты, за исключением Arg, Lys, His или Orn. Предпочтительно, Хаа можно выбрать, но, не ограничиваясь только ими, из природных (и гидрофобных) аминокислот, т.е. аминокислот, которые содержат нейтральные (и гидрофобные) боковые цепи, таких как аланин (Ala), валин (Val), лейцин (Leu), изолейцин (Ile), пролин (Pro), триптофан (Trp), фенилаланин (Phe) или метионин (Met), и/или из природных (и полярных) аминокислот, т.е. аминокислот, которые содержат нейтральные (и полярные) боковые цепи, таких как глицин (Gly), серии (Ser), треонин (Thr), тирозин (Туг), цистеин (Cys), аспарагин (Asn) или глутамин (Glu), и/или из природных кислотных аминокислот, т.е. аминокислот, которые содержат кислотные боковые группы, таких как аспарагиновая кислота (Asp) или глутаминовая кислота (Glu). Предпочтительно, олигопептид в составе комплекса с РНК, по настоящему изобретению, может содержать аминокислотный остаток Хаа в указанной выше общей формуле (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, который выбран из аминокислот, не содержащих кислотную боковую цепь. Даже более предпочтительно, Хаа в общей формуле (Arg)1(Lys)m(His)n(Orn)o(Xaa)x выбирают из аминокислот, содержащих нейтральную боковую цепь, т.е. из аминокислот, содержащих в составе нейтральную (и гидрофобную) боковую цепь и/или из аминокислот, содержащих нейтральную (и полярную) боковую цепь, как было определено выше. Кроме того, в качестве Хаа в указанной выше общей формуле (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, можно использовать любые известные производные аминокислот, т.е. аминокислоты, из которых в результате химической модификации получены производные, которые не являются токсичными для клеток или организмов, при условии их включения в указанный выше олигопептид. (Такие производные аминокислот выпускаются различными фирмами, см., например, Sigma Aldrich (см. ссылку http://www.sigmaaldrich.com).
Хаа, как правило, содержится в указанной выше формуле в количестве 0-30%, 0-40% или 0-50%, в расчете на все аминокислоты в исходной олигопептидной последовательности, общее содержание Хаа не должно превышать 30%, 40% или 50% в расчете на все аминокислоты в последовательности олигопептида, предпочтительно, содержание Хаа не может превышать 20%, даже более предпочтительно, 10% и наиболее предпочтительно, 5%, в расчете на содержание всех аминокислот в исходной олигопептидной последовательности. Таким образом, х в общей формуле (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, может принимать любое значение, выбранное из ряда: 0, 1, 2, 3, 4, 5, 6, 7 или 8, при условии, что содержание Хаа не превышает обозначенное выше значение на 30% (или менее), 40% или 50%, в расчете на все аминокислоты в олигопептиде в составе комплекса с РНК.
Как правило, аминокислотные остатки Arg, Lys, His, Orn и Хаа в составе олигопептида, входящего в состав комплекса с РНК по настоящему изобретению, общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, могут занимать любое положение в олигопептидной последовательности. В данном контексте, в общей формуле (I) не указан какой-либо конкретный порядок расположения аминокислотных остатков, а, скорее, указаны тип аминокислотных остатков и частота их присутствия в пептиде, т.е. указано, что в пептидной цепи содержится 1 остатков Arg, m остатков Lys, n остатков His, о остатков Orn и х остатков Хаа, без указания какого-либо порядка расположения этих остатков в пептидной цепи.
Однако, предпочтительно в указанном выше олигопептиде, предпочтительно, в двух концевых фрагментах отсутствует аминокислотный остаток с кислотной боковой цепью. Более предпочтительно в указанной выше олигопептидной последовательности содержатся нейтральный или основный аминокислотные остатки в одном или, предпочтительно, в обоих концевых фрагментах, даже более предпочтительно, основный аминокислотный остаток в одном или в обоих концевых фрагментах. В еще одном предпочтительном варианте олигопептид общей формулы, приведенной выше, содержит по крайней мере два более предпочтительно по крайней мере три, по крайней мере четыре или даже по крайней мере пять концевых основных остатков, прежде всего, Arg, Orn или Lys, в любом концевом участке. Согласно еще одному предпочтительному варианту, олигопептид общей формулы, приведенной выше, предпочтительно, не содержит катионную аминокислоту (т.е. Arg, Orn или Lys) в одном, или, предпочтительно, в двух концевых фрагментах. Другими словами, один, или, предпочтительно, оба концевых фрагмента олигопептида общей формулы, приведенной выше, могут содержать любой некатионный аминокислотный остаток, выбранный из любых аминокислот, за исключением Arg, Orn или Lys или любого варианта или производного указанных катионных аминокислот. Концевые фрагменты могут содержать, например, один по крайней мере два, по крайней мере три, по крайней мере четыре, по крайней мере пять или даже более основных некатионных остатков, как определено выше, начиная с N- и/или С-конца конкретной последовательности.
Согласно еще одному предпочтительному варианту, один или оба концевых фрагмента олигопептида в составе комплекса с РНК, по настоящему изобретению, могут содержать по крайней мере один остаток гистидина в его одном или в обоих концевых фрагментах, например, олигопептид в составе комплекса с РНК, по настоящему изобретению, может содержать один, два, три, или более гистидиновых остатка, расположенных последовательно в одном или в обоих концевых фрагментах, при условии, что общая длина олигопептида ограничена 8-15 аминокислотными остатками, как определено выше.
Кроме того, остатки Хаа олигопептида в составе комплекса с РНК, по настоящему изобретению, как правило, разделены друг от друга по крайней мере одним Arg, Lys, His или Orn. Такое разделение остатков Хаа, предпочтительно, позволяет исключить образования кластеров неосновных аминокислот в олигопептиде, т.к. присутствие таких неосновных кластеров может ухудшать преимущественные свойства олигопептида в качестве пептида-носителя для входящей в состав комплекса РНК по настоящему изобретению.
Однако, остатки основных аминокислот в олигопептиде в составе комплекса с РНК, приведенной выше формулы, выбирают из Arg, Lys, His или Orn, как определено выше, и они обычно присутствуют в виде кластера, по крайней мере 2, предпочтительно, по крайней мере 3, 4, 5, или даже 6 или более основных аминокислот, как определено в данном контексте. Согласно наиболее предпочтительному варианту, такие кластеры могут также содержать 6, 7, 8, 9, 10, 11, 12, 13, 14 или даже 15 аминокислотных остатков. Такой кластер основных аминокислот, предпочтительно кластер по крайней мере из 3, 4, 5, или даже 6 или более основных аминокислот, предпочтительно, формирует основную поверхность или участок связывания в олигопептиде, что придает олигопептиду улучшенные свойства в качестве пептида-носителя для входящей в состав комплекса РНК, по настоящему изобретению.
Согласно еще одному предпочтительному варианту, олигопептид в составе комплекса с РНК, по настоящему изобретению, общей формулы 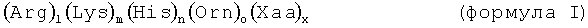
Arg8, Arg9, Arg10, Arg11, Arg12, Arg13, Arg14, Arg15, (SEQ ID NOs: 1-8),
Lys8, Lys9, Lys10, Lys11, Lys12, Lys13, Lys14, Lys15, (SEQ ID NOs: 9-16),
His8, His9, His10, His11, His12, His13, His14, His15, (SEQ ID NOs: 17-24),
Orn8, Orn9, Orn10, Orn11, Orn12, Orn13, Orn14, Orn15, (SEQ ID NOs: 25-32).
Согласно еще одному предпочтительному варианту, олигопептид в составе комплекса с РНК, по настоящему изобретению, общей формулы 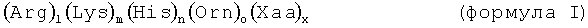
Указанная подгруппа, предпочтительно, содержит:
Arg(7-14)Lys(4-11), Arg(7-14)His1, Arg(7-14)Orn1, Lys(7-14)His1, Lys(7-14)Orn1, His(7-14)Orn1,
Arg(6-13)Lys2, Arg(6-13)His2, Arg(6-13)Orn2, Lys(6-13)His2, Lys(6-13)Orn2, His(6-13)Orn2,
Arg(5-12)Lys3, Arg(5-12)His3, Arg(5-12)Orn3, Lys(5-12)His3, Lys(5-12)Orn3, His(5-12)Orn3,
Arg(4-11)Lys4, Arg(4-11)His4, Arg(4-11)Orn4, Lys(4-11)His4, Lys(4-11)Orn4, His(4-11)Orn4,
Arg(3-10)Lys5, Arg(3-10)His5, Arg(3-10)Orn5, Lys(3-10)His5, Lys(3-10)Orn5, His(3-10)Orn5,
Arg(2-9)Lys6, Arg(2-9)His6, Arg(2-9)Orn6, Lys(2-9)His6, Lys(2-9)Orn6, His(2-9)Orn6,
Arg(1-8)Lys7, Arg(1-8)His7, Arg(1-8)Orn7, Lys(1-8)His7, Lys(1-8)Orn7, His(1-8)Orn7,
Arg(6-13)Lys1His1, Arg(6-13)Lys1Orn1, Arg(6-13)His1Orn1, Arg1Lys(6-13)His1, Arg1Lys(6-13)Orn1, Lys(6-13)His1Orn1, Arg1Lys1His(6-13), Arg1His(6-13)Orn1, Lys1His(6-13)Orn1,
Arg(5-12)Lys2His1, Arg(5-12)Lys1His2, Arg(5-12)Lys2Orn1, Arg(5-12)Lys1Orn2, Arg(5-12)His2Orn1, Arg(5-12)His1Orn2, Arg2Lys(5-12)His1, Arg1Lys(5-12)His2, Arg2Lys(5-12)Orn1, Arg1Lys(5-12)Orn2, Lys(5-12)His2Orn1, Lys(5-12)His1Orn2, Arg2Lys1His(5-12), Arg1Lys2His(5-12), Arg2His(5-12)Orn1, Arg1His(5-12)Orn2, Lys2His(5-12)Orn1, Lys1His(5-12)Orn2,
Arg(4-11)Lys3His1, Arg(4-11)Lys2His2, Arg(4-11)Lys1His3, Arg(4-11)Lys3Orn1, Arg(4-11)Lys2Orn2, Arg(4.ii)Lys]Orn3, Arg(4-11)His3Orn1, Arg(4-11)His2Orn2, Arg(4-11)His1Orn3, Arg3Lys(4-11)His2, Arg2Lys(4-11)His2, Arg1Lys(4-11)His3, Arg3Lys(4-11)Orn1, Arg2Lys(4-11)Orn2, Arg1Lys(4-11)Orn3, Lys(4-1)His3Orn1, Lys(4-11)His2Orn2, Lys(4-11)His1Orn3, Arg3Lys1His(4-11), Arg2Lys2His(4-11), Arg1Lys3His(4-11), Arg3His(4-11)Orn1, Arg2His(4-11)Orn2, Arg1His(4-11)Orn3, Lys3His(4-11)Orn1, Lys2His(4-11)Orn2, Lys1His(4-11)Orn3,
Arg(3-10)Lys4His1, Arg(3-10)Lys3His2, Arg(3-10)Lys2His3, Arg(3-10)Lys1His4, Arg(3-10)Lys4Orn1, Arg(3-10)Lys3Orn2, Arg(3-10)Lys2Orn3, Arg(3-10)Lys1Orn4, Arg(3-10)His4Orn1, Arg(3-10)His3Orn2, Arg(3-10)His2Orn3, Arg(3-10)His1Orn4, Arg4Lys(3-10)His1, Arg3Lys(3-10)His2, Arg2Lys(3-10)His3, Arg1Lys(3-10)His4, Arg4Lys(3-10)Orn1, Arg3Lys(3-10)Orn2, Arg2Lys(3-10)Orn3, Arg1Lys(3-10)Orn4, Lys(3-10)His4Orn1, Lys(3-10)His3Orn2, Lys(3-10)His2Orn3, Lys(3-10)His1Orn4, Arg4Lys1His(3-10), Arg3Lys2His(3-10), Arg2Lys3His(3-10), Arg1Lys4His(3-10), Arg4His(3-10)Orn1, Arg3His(3-10)Orn2, Arg2His(3-10)Orn3, Arg1His(3-10)Orn4, Lys4His(3-10)Orn1, Lys3His(3-10)Orn2, Lys2His(3-10)Orn3, Lys1His(3-10)Orn4,
Arg(2-9)Lys5His1, Arg(2-9)Lys4His2, Arg(2-9)Lys3His3, Arg(2-9)Lys2His4, Arg(2-9)Lys1His5, Arg(2-9)Lys5Orn1, Arg(2-9)Lys4Orn2, Arg(2-9)Lys3Orn3, Arg(2-9)Lys2Orn4, Arg(2-9)Lys1Orn5, Arg(2-9)His5Orn1, Arg(2-9)His4Orn2, Arg(2-9)His3Orn3, Arg(2-9)His2Orn4, Arg(2-9)His1Orn5, Arg5Lys(2-9)His1, Arg4Lys(2-9)His2, Arg3Lys(2-9)His3, Arg2Lys(2-9)His4, Arg1Lys(2-9)His5, Arg5Lys(2-9)Orn1, Arg4Lys(2-9)Orn2, Arg3Lys(2-9)Orn3, Arg2Lys(2-9)Orn4, Arg1Lys(2-9)Orn5, Lys(2-9)His5Orn1, Lys(2-9)His4Orn2, Lys(2-9)His3Orn3, Lys(2-9)His2Orn4, Lys(2-9)His1Orn5, Arg5Lys1His(2-9), Arg4Lys2HiS(2-9), Arg3Lys3His(2-9), Arg2Lys4His(2-9), Arg1Lys5His(2-9), Arg5His(2-9)Orn1, Arg4His(2-9)Orn2, Arg3His(2-9)Orn3, Arg2His(2-9)Orn4, Arg1His(2-9)Orn5, Lys5His(2-9)Orn1, Lys4His(2-9)Orn2, Lys3His(2-9)Orn3, Lys2His(2-9)Orn4, Lys1His(2-9)Orn5, Arg(1-8)Lys6His1, Arg(1-8)Lys5His2, Arg(1-8)Lys4His3, Arg(1-8)Lys3His4, Arg(1-8)Lys2His5, Arg(1-8)Lys1His6, Arg(1-8)Lys6Orn1, Arg(1-8)Lys5Orn2, Arg(1-8)Lys4Orn3, Arg(1-8)Lys3Orn4, Arg(1-8)Lys2Orn5, Arg(1-8)Lys1Orn6, Arg(1-8)His6Orn1, Arg(1-8)His5Orn2, Arg(1-8)His4Orn3, Arg(1-8)His3Orn4, Arg(1-8)His2Orn5, Arg(1-8)His1Orn6, Arg6Lys(1-8)His1, Arg5Lys(1-8)His2, Arg4Lys(1-8)His3, Arg3Lys(1-8)His4, Arg2Lys(1-8)His5, Arg1Lys(1-8)His6, Arg6Lys(1-8)Orn1, Arg5Lys(1-8)Orn2, Arg4Lys(1-8)Orn3, Arg3Lys(1-8)Orn4, Arg2Lys(1-8)Orn5, Arg1Lys(1-8)Orn6, Lys(1-8)His6Orn1, Lys(1-8)His5Orn2, Lys(1-8)His4Orn3, Lys(1-8)His3Orn4, Lys(1-8)His2Orn5, Lys(1-8)His1Orn6, Arg6Lys1His(1-8), Arg5Lys2His(1-8), Arg4Lys3His(1-8), Arg3Lys4His(1-8), Arg2Lys5His(1-8), Arg1Lys6His(1-8), Arg6His(1-8)Orn1, Arg5His(1-8)Orn2, Arg4His(1-8)Orn3, Arg3His(1-8)Orn4, Arg2His(1-8)Orn5, Arg1His(1-8)Orn6, Lys6His(1-8)Orn1, Lys5HiS(1-8)Orn2, Lys4HiS(1-8)Orn3, Lys3HiS(1-8)Orn4, Lys2His(1-8)Orn5, Lys1His(1-8)Orn6,
Arg(5-12)Lys1His1Orn1, Arg1Lys(5-12)His1Orn1, Arg1Lys1His(5-12)Orn1, Arg1Lys1His1Orn(5-12), Arg(4-11)Lys2His1Orn1, Arg(4-11)Lys1His2Orn1, Arg(4-11)Lys1His1Orn2, Arg2Lys(4-11)His1Orn1, Arg1Lys(4-11)His2Orn1, Arg1Lys(4-11)His1Orn2, Arg2Lys1His(4-11)Orn1, Arg1Lys2His(4-11)Orn1, Arg1Lys1His(4-11)Orn2, Arg2Lys1His1Orn(4-11), Arg1Lys2His1Orn(4-11), Arg1Lys1His2Orn(4-11),
Arg(3-10)Lys3His1Orn1, Arg(3-10)Lys2His2Orn1, Arg(3-10)Lys2His1Orn2, Arg(3-10)Lys1His2Orn2, Arg(3-10)Lys1His1Orn3, Arg3Lys(3-10)His1Orn1, Arg2Lys(3-10)His2Orn1, Arg2Lys(3-10)His1Orn2, Arg1Lys(3-10)His2Orn2, Arg1Lys(3-10)His1Orn3, Arg3Lys1His(3-10)Orn1, Arg2Lys2His(3-10)Orn1, Arg2Lys1His(3-10)Orn2, Arg1Lys2His(3-10)Orn2, Arg1Lys1His(3-10)Orn3, Arg3Lys1His1Orn(3-10), Arg2Lys2His1Orn(3-10), Arg2Lys1His2Orn(3-10),Arg1Lys2His2Orn(3-10), Arg1Lys1His3Orn(3-10),
Arg(2-9)Lys4His1Orn1, Arg(2-9)Lys1His4Orn1, Arg(2-9)Lys1His1Orn4, Arg(2-9)Lys3His2Orn1, Arg(2-9)Lys3His1Orn2, Arg(2-9)Lys2His3Orn1, Arg(2-9)Lys2His1Orn3, Arg(2-9)LysiHis2Orn3, Arg(2-9)LysiHis3Orn2, Arg(2-9)Lys2His2Orn2, Arg4Lys(2-9)His1Orn1, Arg1Lys(2-9)His4Orn1, Arg1Lys(2-9)His1Orn4, Arg3Lys(2-9)His2Orni, Arg3Lys(2-9)His1Orn2, Arg2Lys(2-9)His3Orn1, Arg2Lys(2-9)His1Orn3, Arg1Lys(2-9)His2Orn3, Arg1Lys(2-9)His3Orn2, Arg2Lys(2-9)His2Orn2, Arg4Lys1His(2-9)Orn1, Arg1Lys4His(2-9)Orn1, Arg1Lys1His(2-9)Orn4, Arg3Lys2His(2-9)Orn1, Arg3Lys1His(2-9)Orn2, Arg2Lys3His(2-9)Orn1, Arg2Lys1His(2-9)Orn3, Arg1Lys2His(2-9)Orn3, Arg1Lys3His(2-9)Orn2, Arg2Lys2His(2-9)Orn2, Arg4Lys1His1Orn(2-9), Arg1Lys4His1Orn(2-9), Arg1Lys1His4Orn(2-9), Arg3Lys2His1Orn(2-9), Arg3Lys1His2Orn(2-9), Arg2Lys3His1Orn(2-9), Arg2Lys1His3Orn(2-9), Arg1Lys2His3Orn(2-9), Arg1Lys3His2Orn(2-9), Arg2Lys2His2Orn(2-9), Arg(1-8)Lys5His1Orn1, Arg(1-8)Lys1His5Orn1, Arg(1-8)Lys1His1Orn5, Arg(1-8)Lys4His2Orn1, Arg(1-8)Lys2His4Orn1, Arg(1-8)Lys2His1Orn4, Arg(1-8)Lys1His2Orn4, Arg(1-8)Lys1His4Orn2, Arg(1-8)Lys4His1Orn2, Arg(1-8)Lys3His3Orn1, Arg(1-8)Lys3His1Orn3, Arg(1-8)Lys1His3Orn3, Arg5Lys(1-8)His1Orn1, Arg1Lys(1-8)His5Orn1, Arg1Lys(1-8)His1Orn5, Arg4Lys(1-8)His2Orn1, Arg2Lys(1-8)His4Orn1, Arg2Lys(1-8)His1Orn4, Arg1Lys(1-8)His2Orn4, Arg1Lys(1-8)His4Orn2, Arg4Lys(1-8)His1Orn2, Arg3Lys(1-8)His3Orn1, Arg3Lys(1-8)His1Orn3, Arg1Lys(1-8)His3Orn3, Arg5Lys1His(1-8)Orn1, Arg1Lys5His(1-8)Orn1, Arg1Lys1His(1-8)Orn5, Arg4Lys2His(1-8)Orn1, Arg2Lys4HiS(1-8)Orn1, Arg2Lys1His(1-8)Orn4, Arg1Lys2His(1-8)Orn4, Arg1Lys4His(1-8)Orn2, Arg4Lys1His(1-8)Orn2, Arg3Lys3His(1-8)Orn1, Arg3Lys1His(1-8)Orn3, Arg1Lys3His(1-8)Orn3, Arg5Lys1His1Orn(1-8), Arg1Lys5His1Orn(1-8), Arg1Lys1His5Orn(1-8), Arg4Lys2His1Orn(1-8), Arg2Lys4His1Orn(1-8), Arg2Lys1His4Orn(1-8), Arg1Lys2His4Orn(1-8), Arg1Lys4His2Orn(1-8), Arg4Lys1His2Orn(1-8), Arg3Lys3His1Orn(1-8), Arg3Lys1His3Orn(1-8), Arg1Lys3His3Orn(1-8).
Согласно одному предпочтительному варианту, олигопептид в составе комплекса с РНК по настоящему изобретению общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, выбирают из подгруппы, содержащей: Arg8, Arg9, Arg10, Arg11, Arg12, Arg13, Arg14, Arg15, (SEQ ID NOs: 1-8), Lys8, Lys9, Lys10, Lys11, Lys12, Lys13, Lys14, Lys15, (SEQ ID NOs: 9-16), His8, His9, His10, His11, His12, His13, His14, His15, (SEQ ID NOs: 17-24) или Orn8, Orn9, Orn10, Orn11, Orn12, Orn13, Orn14, Orn15, (SEQ ID NOs: 25-32).
Согласно другому предпочтительному варианту, олигопептид в составе комплекса с РНК по настоящему изобретению общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, выбирают из подгруппы, содержащей олигопептиды общей формулы Arg9 (также обозначенный R9), Arg9His3 (также обозначаемый R9H3), His3Arg9His3 (также обозначенный H3R9H3), TyrSerSerArg9SerSerTyr (также обозначенный YSSR9SSY), His3Arg9SerSerTyr (также обозначаемый H3R9SSY), (ArgLysHis)4 (также обозначенный (RKH)4), Tyr(ArgLysHis)2Arg (также обозначенный Y(RKH)2R). Даже более предпочтительно, предлагаются следующие пептиды указанной общей формулы:
Arg9: Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg (SEQ ID NO: 2)
Arg9His3: Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-His-His-His (SEQ ID NO: 39)
His3Arg9His3: His-His-His-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-His-His-His (SEQ ID NO: 40)
TyrSerSerArg9SerSerTyr: Tyr-Ser-Ser-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Ser-Ser-Tyr (SEQ ID NO: 41)
His3Arg9SerSerTyr: His-His-His-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Ser-Ser-Tyr (SEQ ID NO: 42)
(ArgLysHis)4: Arg-Lys-His-Arg-Lys-His-Arg-Lys-His-Arg-Lys-His (SEQ ID NO: 43)
Tyr(ArgLysHis)2Arg: Tyr-Arg-Lys-His-Arg-Lys-His-Arg (SEQ ID NO: 44)
По крайней мере, один олигопептид в составе комплекса с РНК по настоящему изобретению, общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, можно дополнительно модифицировать. Способы модификации, в контексте настоящего изобретения, как правило, включают любую, пригодную для пептидов модификацию, при условии, что такие модификации не влияют на способность к трансфекции РНК в составе полученного комплекса.
Типичные способы модификации, таким образом, могут включать, например, использование модифицированных аминокислот, как определено выше. Кроме того, концевые аминокислотные остатки олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, т.е. С-концевой и N-концевой аминокислотные остатки (а так же содержащие карбоксильную или амидную боковые цепи, см. выше), можно получать в их защищенной форме (например, С-концевая группа, защищенная амидной группой) и/или в незащищенной форме, с использованием пригодных амино- или карбоксизащитных групп. Можно также использовать кислотно-аддитивные соли олигопептида, общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше. Как правило, кислотно-аддитивные соли являются солями галогенводородных кислот, т.е. HBr, HI, или, более предпочтительно, HCl.
ПЭГилирование концевых или боковых карбоксильных групп или 8-аминогруппы лизина, входящих в состав полипептида, общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, придает устойчивость к агломерации и деградации в сыворотке, и также включено в объем настоящего изобретения.
По крайней мере, один олигопептид в составе комплекса с РНК, по настоящему изобретению, общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, можно дополнительно модифицировать при связывании или конденсации по крайней мере с одним специфическим лигандом, при этом по крайней мере один специфический лиганд можно присоединять к одному или обоим концевым фрагментам (или конденсировать с ними) по крайней мере одного полипептида. По крайней мере, один из специфических лигандов, присоединенный к одному или обоим концевым фрагментам олигопептида (или конденсированный с ними), являются одинаковыми или различными, и их выбирают из любых соединений, способных связываться или взаимодействовать с рецептором или белком или белково-рецепторным комплексом, например, на поверхности клетки, например, но, не ограничиваясь только ими, с RGD-пептидом, трансферрином или маннозой и т.п.
Другие предпочтительные способы модификации, в результате которых получают производные олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как было указано выше, основаны на использовании углеводородов и/или липидов, которые можно ковалентно присоединять к олигопептиду. Предпочтительно присоединять углеводороды и/или липиды к серину, треонину, аспарагину, глутамину, или тирозину, или аспартату, или глутамату через их реакционноспособные боковые цепи. В другом варианте углеводороды и/или липиды также можно присоединять к концевым фрагментам олигопептида, как указано в данном контексте. Кроме того, олигопептид можно присоединять к другому функциональному пептиду или белковому фрагменту, который также может стабилизировать олигопептид и/или может улучшать транспортные свойства олигопептида в жидкостях организма, прежде всего, в крови. Пригодные пептиды или белки можно выбрать, например, из альбумина, трансферрина и т.п., которые можно непосредственно присоединять к олигопептиду общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как было указано выше, или через пептид или органическую линкерную последовательность. Предпочтительно, эти пептиды или белки присоединены к одному из концевых фрагментов олигопептида.
В данном контексте следует отметить, что модификация олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как было указано выше, липидами, как правило, не включает использование (насыщенных или ненасыщенных) жирных кислот, прежде всего, использование длинноцепных (насыщенных или ненасыщенных) жирных кислот (прежде всего, с длиной цепи >C12, >С14 или >C16). Таким образом, в контексте настоящего изобретения, модификация олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как было указано выше, жирными кислотами, не является неотъемлемой частью настоящего изобретения. Однако, если жирные кислоты все же используются, то только для модификации пептида-носителя, и их можно выбрать, но, не ограничиваясь только ими, из группы, содержащей, например, бутановую жирную кислоту (масляную жирную кислоту), пентановую жирную кислоту (валериановую жирную кислоту), гексановую жирную кислоту (капроновую жирную кислоту), октановую жирную кислоту (каприловую жирную кислоту), нонановую жирную кислоту (пеларгоновую жирную кислоту), декановую жирную кислоту (каприновую жирную кислоту), додекановую жирную кислоту (лауриновую жирную кислоту), тетрадекановую жирную кислоту (миристиновую жирную кислоту), гексадекановую жирную кислоту (пальмитиновую жирную кислоту), гептадекановую жирную кислоту (маргариновую (стеариновую) жирную кислоту), октадекановую жирную кислоту (стеариновую жирную кислоту), эйкозановую жирную кислоту (арахидиновую жирную кислоту), докозановую жирную кислоту (бегеновую жирную кислоту), тетракозановую жирную кислоту (лигноцериновую жирную кислоту), гексакозановую жирную кислоту (церотиновую жирную кислоту), гептакозановую жирную кислоту (карбоцериновую жирную кислоту), октакозановую жирную кислоту (монтановую жирную кислоту), триаконтановую жирную кислоту (мелиссиновую жирную кислоту), дотриаконтановую жирную кислоту (лакцероевую жирную кислоту), тритриаконтановую жирную кислоту (церомелиссиновую (псиллиновую) жирную кислоту), тетратриаконтановую жирную кислоту (геддовую жирную кислоту), пентатриаконтановую жирную кислоту (перопластиковую жирную кислоту) и т.п., или их ненасыщенные аналоги. В качестве конкретного примера, в настоящем изобретении, как правило, не используется октодекановая жирная кислота (стеариновая жирная кислота) или ее ненасыщенные аналоги, для модификации пептидов-носителей формулы I, т.е., как правило, стеарилированные олигопептиды формулы I не используются в данном изобретении для получения комплекса с РНК по настоящему изобретению.
С целью исключения проблемы деградации олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, согласно другому варианту, можно использовать ретро-инверсионный изомер указанного выше олигопептида, содержащий D-аминокислоты или по крайней мере частично содержащий D-аминокислоты. Термин «ретро-инверсионный изомер» обозначает изомер линейного пептида, в котором направление последовательности и хиральность каждого аминокислотного остатка обращены (см., например, статьи: Jameson и др., Nature, 368, 744-746 (1994), Brady и др., Nature, 368, 692-693 (1994)). По сравнению с исходным пептидом, в ретро-инверсионном пептиде аминокислотные остатки расположены в обратном порядке, как правило, F-moc производные аминокислот.Обычно неочищенные пептиды очищают методом обращенно-фазной ВЭЖХ.
Другие модификации, которые можно использовать для олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как указано выше, относятся к модификациям основной пептидной цепи. Предпочтительно, модифицированные олигопептиды являются структурными миметиками. Их цепь отличается от природной цепи, а структуры их боковых цепей идентичны олигопептидам или их фрагментам, вариантам или производным. В целом, структурные миметики включают модификации одного или более членов основной цепи (NH, СН, СО), либо замены (предпочтительно) или вставки. Можно использовать, например, следующие замены (I) -O-, -S- или -СН2- вместо -NH-, (II) -N-, С-алкил- или -ВН- вместо -CHR- и (III) -CS-, -СН2-, -SOn-, -Р=O(ОН)- или -В(ОН)- вместо -СО-. В качестве пептидомиметика олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как описано в данном контексте, можно использовать комбинацию каждой из этих модификаций. Прежде всего, можно комбинировать модификации каждой группы I, II и III. Пептидомиметик может содержать модификацию каждого члена основной цепи или, напротив, только определенное число членов цепи можно заменить на неприродный компонент. Предпочтительно, все члены основной цепи олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, т.е -NH-, -CHR- или СО заменены на неприродные группы. В случае замены амидной (пептидной) связи (-NH-CO-) в олигопептидной цепи (во всей исходной молекуле или по крайней мере в одном положении), предпочтительно, чтобы заменяющие фрагменты являлись биоизостерическими, например, ретро-инверсионными пептидными связями (-CO-NH-), гидроксиэтиленовыми (-СН(ОН)-СН2-), алкеновыми (СН2=СН-), углеводородными (СН2-СН2-) и/или -Р=O(ОН)-СН2-). В других вариантах можно использовать удлинение основной цепи в структурном миметике олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как описано в данном контексте, например, за счет вставок фрагментов, фланкирующих α-С-атом. С обеих сторон α-С-атома можно вставить, например, группы -O-, -S-, -СН-, -NH-.
Прежде всего, предпочтительна олигокарбаматная структура цепи олигопептида общей формулы (Arg)1(Lys)m(His)n(Orn)o(Xaa)x, как описано в данном контексте. Таким образом, пептидную связь можно заменить на карбаматный фрагмент. Мономерные N-защищенные аминоалкилкарбонаты получают из соответствующих аминокислот или аминоспиртов. Их превращают в реакционноспособные сложные эфиры, например, пара-нитрофениловый эфир, используя F-moc группы или фоточувствительную нитроарилоксикарбонильную группу, методом твердофазного синтеза.
Таким образом, РНК в составе комплекса по настоящему изобретению дополнительно содержит по крайней мере одну РНК, пригодную для трансфекции, причем указанная по крайней мере одна РНК включена в состав комплекса с одним или более олигопептидами, как указано в данном контексте, общей формулы I ((Arg)1(Lys)m(His)n(Orn)o(Xaa)x).
По крайней мере, одна РНК в составе комплекса по настоящему изобретению, характеризуется любой длиной (предпочтительно, в зависимости от типа РНК, используемой в состав комплекса по настоящему изобретению). По крайней мере, одна РНК характеризуется длиной, но, не ограничиваясь только ими, от 5 до 20000 нуклеотидов, более предпочтительно, от 5 до 10000 или от 300 до 10000 нуклеотидов, еще более предпочтительно, от 5 до 5000 нуклеотидов, и наиболее предпочтительно, от 20 до 5000, от 50 до 5000, от 100 до 5000 или от 300 до 10000 нуклеотидов, в зависимости от типа РНК, предназначенной для трансфекции (см. ниже описание настоящего изобретения).
По крайней мере одна РНК в составе комплекса по настоящему изобретению, может представлять собой любую РНК, предпочтительно, но, не ограничиваясь только ими, короткий РНК олигонуклеотид (предпочтительно, длиной от 5 до 80 или, более предпочтительно, от 20 до 80 нуклеотидов), кодирующую РНК, иммуностимулирующую РНК, киРНК, антисмысловую РНК или рибопереключатели, рибосомы или аптамеры. Кроме того, по крайней мере одна РНК в составе комплекса по настоящему изобретению может представлять собой одно- или двухцепочечную РНК (которую можно рассматривать как РНК, т.к. при этом происходит нековалентная ассоциация двух одноцепочечных РНК) или частично двухцепочечной РНК (которая, как правило, образована более длинной и более короткой одноцепочечной РНК или двумя одноцепочечными молекулами РНК, примерно одинаковой длины, причем одноцепочечная РНК частично комплементарна другой одноцепочечной РНК, и обе молекулы, таким образом, образуют двухцепочечную РНК на данном участке). Предпочтительно по крайней мере одна РНК в составе комплекса по настоящему изобретению, может являться одноцепочечной РНК. По крайней мере, одна РНК в составе комплекса по настоящему изобретению, также может являться кольцевой или линейной РНК, предпочтительно, линейной РНК. Более предпочтительно по крайней мере одна РНК в составе комплекса по настоящему изобретению, может являться (линейной) одноцепочечной РНК. По крайней мере, одна РНК в составе комплекса по настоящему изобретению, может являться рибосомальной РНК (рРНК), транспортной РНК (тРНК), информационной РНК (иРНК или мРНК) или вирусной РНК (вРНК), предпочтительно, мРНК. Настоящее изобретение включает способы переноса всех этих РНК в клетку. В данном контексте, мРНК, как правило, является РНК, молекула которой содержит несколько структурных элементов, например, но не обязательно, 5'-UTR участок, расположенный слева от сайта связывания с рибосомой, за которым следует кодирующий участок, не обязательно 3'-UTR участок, за которым может следовать поли-А-концевой фрагмент (и/или поли-С-концевой фрагмент). мРНК может присутствовать в виде моно-, ди- или даже мультицистронной РНК, т.е. РНК, которая содержит кодирующую последовательность одного, двух или более белков. Такая кодирующая последовательность в ди- или даже в мультицистронной мРНК может быть разделена по крайней мере одной последовательностью IRES, например, как описано в данном контексте.
Короткие РНК нуклеотиды
В первом варианте по крайней мере одна РНК в составе комплекса по настоящему изобретению, может являться коротким РНК олигонуклеотидом. Короткие РНК олигонуклеотиды, в контексте настоящего изобретения, могут включать любую РНК, как определено выше. Предпочтительно, короткий РНК олигонуклеотид может быть одно- или двухцепочечным РНК олигонуклеотидом, более предпочтительно, одноцепочечным РНК олигонуклеотидом. Еще более предпочтительно, короткий РНК олигонуклеотид может представлять собой линейный одноцепочечный РНК олигонуклеотид.
Предпочтительно, короткий РНК олигонуклеотид, как описано в данном контексте, характеризуется длиной, как определено в данном контексте в целом для молекул РНК, более предпочтительно, от 5 до 100, от 5 до 50 или от 5 до 300, или, в другом варианте, от 20 до 100, от 20 до 80 или, еще более предпочтительно, от 20 до 60 нуклеотидов. Короткие РНК олигонуклеотиды можно использовать для различных целей, например, для (неспецифической) иммуностимуляции или усиления/подавления транскрипции/трансляции генов.
Кодирующая РНК
Во втором варианте по крайней мере одна РНК в составе комплекса по настоящему изобретению, может являться кодирующей РНК. Кодирующая РНК в составе комплекса по настоящему изобретению может включать любую РНК, как определено выше. Предпочтительно, кодирующая РНК может являться одно- или двухцепочечной РНК, более предпочтительно, одноцепочечной РНК, и/или кольцевой или линейной РНК, более предпочтительно, линейной РНК. Еще более предпочтительно, кодирующая РНК может являться (линейной) одноцепочечной РНК. Наиболее предпочтительно, кодирующая РНК может являться (линейной) одноцепочечной информационной РНК (мРНК).
Кодирующая РНК может также кодировать белок или пептид, которые можно выбрать, но, не ограничиваясь только ими, например, из группы терапевтически активных белков или пептидов, опухолевых антигенов, антител, иммуностимулирующих белков или пептидов, и т.п., или из группы любых других белков или пептидов, пригодных для специального (терапевтического) применения, при этом по крайней мере одна РНК, кодирующая белок, предназначена для переноса в клетку, ткань или организм, и, следовательно, белок должен экспрессироваться в клетке, ткани или организме.
В контексте данного изобретения, терапевтически активные белки можно выбрать из группы любых рекомбинантных или выделенных белков, известных специалистам в данной области техники. Терапевтически активные белки, кодируемые по крайней мере одной РНК в составе комплекса, как описано в данном контексте, можно выбрать, но, не ограничиваясь только ими, из группы факторов апоптоза или белков, связанных с апоптозом, включая AIF, Apaf, например, Apaf-1, Apaf-2, Apaf-3, или АРО-2 (L), АРО-3 (L), апопаин, Bad, Bak, Вах, Bc1-2, Bcl-xL, Bcl-xS, bik, CAD, калпаин, каспазы, например, каспаза-1, каспаза-2, каспаза-3, каспаза-4, каспаза-5, каспаза-6, каспаза-7, каспаза-8, каспаза-9, каспаза-10, каспаза-11, ced-3, ced-9, c-Jun, c-Myc, crm А, цитохром С, CdRl, DcRl, DD, DED, DISC, DNA-PKCS, DR3, DR4, DR5, FADD/MORT-1, FAK, Fas (Fas-лиганд CD95/fas (рецептор)), FLICE/MACH, FLIP, фодрин, fos, G-актин, Gas-2, гелзолин, гранцим А/В, ICAD, ICE, JNK, ламин А/В, MAP, MCL-1, Mdm-2, MEKK-1, MORT-1, NEDD, NF-каппа-В, NuMa, p53, PAK-2, PARP, перфорин, PITSLRE, РКС-дельта, pRb. пресенилин, prICE, RAIDD, Ras, RIP, сфингомиелиназа, тимидинкиназа простого герпеса, TRADD, TRAF2, TRAIL-R1, TRAIL-R2, TRAIL-R3, трансглютаминаза и т.п.
Терапевтически активные белки, кодируемые по крайней мере одной РНК в составе комплекса, как описано в данном контексте, также можно выбрать из группы рекомбинантных белков, включая белки, выбранные из группы, включающей: OATL3, OFC3, 0РА3, 0PD2, 4-1BBL, 5Т4, 6Скин, 707-АР, 9D7, А2М, АА, AAAS, AACT, AASS, АВАТ, АВСА1, АВСА4, АВСВ1, АВСВ11, АВСВ2, АВСВ4, АВСВ7, АВСС2, АВСС6, АВСС8, ABCD1, ABCD3, ABCG5, ABCG8, ABL1, АВО, ABR ACAA1, АСАСА, ACADL, ACADM, ACADS, ACADVL, АСАТ1, ACCPN, АСЕ, ACHE, АСНМ3, АСНМ1, ACLS, ACPI, ACTA1, АСТС, ACTN4, ACVRL1, AD2, ADA, ADAMTS13, ADAMTS2, ADFN, ADH1B, ADH1C, ADLDH3A2, ADRB2, ADRB3, ADSL, AEZ, AFA, AFD1, AFP, AGA, AGL, AGMX2, AGPS, AGS1, AGT, AGTR1, AGXT, AH02, AHCY, AHDS, AHHR, AHSG, AIC, AIED, AIH2, AIH3, AIM-2, AIPL1, AIRE, AK1, ALAD, ALAS2, ALB, HPG1, ALDH2, ALDH3A2, ALDH4A1, ALDH5A1, ALDH1A1, ALDOA, ALDOB, ALMS1, ALPL, ALPP, ALS2, ALX4, AMACR, AMBP, AMCD, AMCD1, AMCN, AMELX, AMELY, AMGL, АМН, AMHR2, AMPD3, AMPD1, AMT, ANC, ANCR, ANK1, ANOP1, AOM, APOA4, APOC2, АРОС3, АРЗВ1, АРС, АРКС, АРОА2, APOA1, АРОВ, АРОС3, APOC2, APOE, APOH, APP, APRT, APS1, AQP2, AR, ARAF1, ARG1, ARHGEF12, ARMET, ARSA, ARSB, ARSC2, ARSE, ART-4, ARTC1/m, ARTS, ARVD1, ARX, AS, ASAH, ASAT, ASD1, ASL, ASMD, ASMT, ASNS, ASPA, ASS, ASSP2, ASSP5, ASSP6, AT3, ATD, ATHS, ATM, ATP2A1, ATP2A2, ATP2C1, ATP6B1, ATP7A, ATP7B, ATP8B1, ATPSK2, ATRX, ATXN1, ATXN2, ATXN3, AUTS1, AVMD, AVP, AVPR2, AVSD1, AXIN1, AXIN2, AZF2, B2M, B4GALT7, B7H4, BAGE, BAGE-1, BAX, BBS2, BBS3, BBS4, BCA225, BCAA, BCH, BCHE, BCKDHA, BCKDHB, BCL10, BCL2, BCL3, BCL5, BCL6, BCPM, BCR, BCR/ABL, BDC, BDE, BDMF, BDMR, BEST1, бета-катенин/m, BF, BFHD, BFIC, BFLS, BFSP2, BGLAP, BGN, BHD, BHR1, BING-4, BIRC5, BJS, BLM, BLMH, BLNK, BMPR2, BPGM, BRAF, BRCA1, BRCA1/m, BRCA2, BRCA2/m, BRCD2, BRCD1, BRDT, BSCL, BSCL2, BTAA, BTD, ВТК, BUB1, BWS, BZX, COL2A1, COL6A1, C1NH, C1QA, C1QB, C1QG, CIS, C2, С3, С4А, C4B, C5, C6, C7, C7orf2, C8A, C8B, C9, CA125, CA15-3/CA 27-29, CA195, CA19-9, CA72-4, CA2, CA242, CA50, CABYR, CACD, CACNA2D1, CACNA1A, CACNA1F, CACNA1S, CACNB2, CACNB4, CAGE, CA1, CALB3, CALCA, CALCR, CALM, CALR, CAM43, CAMEL, CAP-1, CAPN3, CARD15, CASP-5/m, CASP-8, CASP-8/m, CASR, CAT, CATM, CAV3, CB1, CBBM, CBS, CCA1, CCAL2, CCAL1, CCAT, CCL-1, CCL-11, CCL-12, CCL-13, CCL-14, CCL-15, CCL-16, CCL-17, CCL-18, CCL-19, CCL-2, CCL-20, CCL-21, CCL-22, CCL-23, CCL-24, CCL-25, CCL-27, CCL-3, CCL-4, CCL-5, CCL-7, CCL-8, CCM1, CCNB1, CCND1, CCO, CCR2, CCR5, CCT, CCV, CCZS, CD1, CD19, CD20, CD22, CD25, CD27, CD27L,cD3, CD30, CD30L, CD33, CD36, CD3E, CD3G, CD3Z, CD4, CD40, CD40L, CD44, CD44v, CD44v6, CD52, CD55, CD56, CD59, CD80, CD86. CDAN1, CDAN2. CDAN3, CDC27, CDC27/m, CDC2L1, CDH1, CDK4, CDK4/m, CDKN1C, CDKN2A, CDKN2A/m, CDKN1A, CDKN1C, CDL1, CDPD1, CDR1, CEA, CEACAM1, CEACAM5, CECR, CECR9, СЕРА, CETP, CFNS, CFTR, CGF1, CHAC, CHED2, CHED1, CHEK2, CHM, CHML, CHR39C, CHRNA4, CHRNA1, CHRNB1, CHRNE, CHS, CHS1, CHST6, CHX10, CIAS1, CIDX, CKN1, CLA2, CLAs, CLA1, CLCA2, CLCN1, CLCN5, CLCNKB, CLDN16, CLP, CLN2, CLN3, CLN4, CLN5, CLN6, CLN8, C1QA, C1QB, C1QG, C1R, CLS, CMCWTD, CMDJ, CMD1A, CMD1B, CMH2, МН3, СМН6, CMKBR2, CMKBR5, CML28, CML66, CMM, CMT2B, CMT2D, CMT4A, CMT1A, CMTX2, CMTX3, C-MYC, CNA1, CND, CNGA3, CNGA1, CNGB3, CNSN, CNTF, COA-1/m, COCH, COD2, COD1, COH1, COL10A, COL2A2, COL11A2, COL17A1, COL1A1, COL1A2, COL2A1, COL3A1, COL4A3, COL4A4, COL4A5, COL4A6, COL5A1, COL5A2, COL6A1, COL6A2, COL6A3, COL7A1, COL8A2, COL9A2, COL9A3, COL11A1, COL1A2, COL23A1, COL1A1, COLQ, COMP, COMT, CORDS, CORD1, COX10, COX-2, CP, CPB2, CPO, CPP, CPS1, CPT2, CPT1A, CPX, CRAT, CRB1, CRBM, CREBBP, CRH, CRHBP, CRS, CRY, CRX, CRYAB, CRYBA1, CRYBB2, CRYGA, CRYGC, CRYGD, CSA, CSE, CSF1R, CSF2RA, CSF2RB, CSF3R, CSF1R, CST3, CSTB, CT, CT7, CT-9/BRD6, CTAA1, CTACK, CTEN, CTH, CTHM, CTLA4, CTM, CTNNB1, CTNS, CTPA, CTSB, CTSC, CTSK, CTSL, CTS1, CUBN, CVD1, CX3CL1, CXCL1, CXCL10, CXCL11, CXCL12, CXCL13, CXCL16, CXCL2, CXCL3, CXCL4, CXCL5, CXCL6, CXCL7, CXCL8, CXCL9, CYB5, CYBA, CYBB, CYBB5, CYFRA 21-1, CYLD, CYLD1, CYMD, CYP11B1, CYP11B2, CYP17, CYP17A1, CYP19, CYP19A1, CYP1A2, CYP1B1, CYP21A2, CYP27A1, CYP27B1, CYP2A6, CYP2C, CYP2C19, CYP2C9, CYP2D, CYP2D6, CYP2D7P1, CYP3A4, CYP7B1, CYPB1, CYP11B1, CYP1A1, CYP1B1, CYRAA, D40,DAD1, DAM, DAM-10/MAGE-B1, DAM-6/MAGE-B2, DAX1, DAZ, DBA, DBH, DBI, DBT, DCC, DC-CK1, DCK, DCR, DCX, DDB 1, DDB2, DDIT3, DDU, DECR1, DEK-CAN, DEM, DES, DF,DFN2, DFN4, DFN6, DFNA4, DFNA5, DFNB5, DGCR, DHCR7, DHFR, DHOF, DHS, DIA1, DIAPH2, DIAPH1, DIH1, DIO1, DISCI, DKC1, DLAT, DLD, DLL3, DLX3, DMBT1, DMD, DM1, DMPK, DMWD, DNAI1, DNASE1, DNMT3B, DPEP1, DPYD, DPYS, DRD2, DRD4, DRPLA, DSCR1, DSG1, DSP, DSPP, DSS, DTDP2, DTR, DURS1, DWS, DYS, DYSF, DYT2, DYT3, DYT4, DYT2, DYT1, DYX1, EBAF, EBM, EBNA, EBP, EBR3, EBS1, ECA1, ECB2, ECE1, ECGF1, ЕСТ, ED2, ED4, EDA, EDAR, ECA1, EDN3, EDNRB, EEC1, EEF1A1L14, EEGV1, EFEMP1, EFTUD2/m, EGFR, EGFR/HerI, EGI, EGR2, EIF2AK3, e1F4G, EKV, E1IS, ELA2, ELF2, ELF2M, ELK1, ELN, ELONG, EMD, EML1, EMMPRIN. EMX2, ENA-78, ENAM, END3, ENG, EN01, ENPP1, ENUR2, ENUR1, EOS, ЕРЗОО, ЕРВ41, EPB42, EPCAM, EPD, EphA1, EphA2, EphA3, эфрин A2, эфрин A3, EPHX1, EPM2A, EPO.EPOR, EPX, ERBB2, ERCC2 ERCC3.ERCC4, ERCC5, ERCC6, ERVR, ESR1, ETFA, ETFB, ETFDH, ETM1, ETV6-AML1, ETV1, EVC, EVR2, EVR1, EWSR1, EXT2,EXT3,EXT1,EYA1,EYCL2,EYCL3,EYCL1,EZH2,F10,F11,F12,F13A1, F13B, F2, F5, F5F8D, F7, F8, F8C, F9, FABP2, FACL6, FAH, FANCA, FANCB, FANCC, FANCD2, FANCF, FasL, FBN2, FBN1, FBP1, FCG3RA,FCGR2A, FCGR2B, FCGR3A, FCHL, FCMD, FCP1, FDPSL5, FECH, FEO, FEOM1, FES, FGA, FGB, FGD1, FGF2, FGF23, FGF5, FGFR2, FGFR3, FGFR1, FGG, FGS1, FH, FIC1, FIH, F2, FKBP6, FLNA, FLT4, FM03.FM04, FMR2, FMR1, FN, FN1/m, FOXC1, FOXE1, FOXL2, FOX01A, FPDMM, FPF, Fra-1, FRAXF, FRDA, FSHB, FSHMD1A, FSHR, FTH1, FTHL17, FTL, FTZF1, FUCA1, FUT2, FUT6, FUT1, FY, G250, G250/CAIX, G6PC, G6PD, G6PT1, G6PT2, GAA, GABRA3, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7b, GAGE-8, GALC, GALE, GALK1, GALNS, GALT, GAMT, GAN, GAST, GASTRIN17, GATA3, GATA, GBA, GBE, GC, GCDH, GCGR, GCH1, GCK, GCP-2, GCS1, G-CSF, GCSH, GCSL, GCY, GDEP.GDF5, GDI1, GDNF, GDXY, GFAP, GFND, GGCX, GGT1, GH2, GH1, GHR, GHRHR, GHS, GIF, GINGF, GIP, GJA3, GJA8, GJB2, GJB3, GJB6, GJB1, GK, GLA, GLB, GLB1, GLC3B, GLC1B, GLC1C, GLDC, GLI3, GLP1, GLRA1, GLUD1, GM1 (fuc-GM1), GM2A, GM-CSF, GMPR, GNAI2, GNAS, GNAT1, GNB3, GNE, GNPTA, GNRH, GNRH1, GNRHR, GNS, GnT-V, gp100, GP1BA, GP1BB, GP9, GPC3, GPD2, GPDS1, GPI, GP1BA, GPN1LW, GPNMB/m, GPSC, GPX1, GRHPR, GRK1, GROa, GROp, GROy, GRPR, GSE, GSM1, GSN, GSR, GSS, GTD, GTS, GUCA1A, GUCY2D, GULOP, GUSB, GUSM, GUST, GYPA, GYPC, GYS1, GYS2, HOKPP2, HOMG2, HADFIA, HADHB, HAGE, FIAGH, HAL, HAST-2, HB 1, HBA2, HBA1, HBB, HBBP1, HBD, HBE1, HBG2, HBG1, HBHR, HBP1, HBQ1, HBZ, HBZP, HCA, HCC-1, HCC-4, HCF2, HCG, HCL2, HCL1, HCR, HCVS, HD, HPN, HER2, HER2/NEU, HERS, HERV-K-MEL, HESX1, HEXA, HEXB, HF1, HFE, HF1, HGD, HHC2, HHC3, HHG, HK1 HLA-A, HLA-A*0201-R170I, HLA-A11/m, HLA-A2/m, HLA-DPB1 HLA-DRA, HLCS, HLXB9, HMBS, HMGA2, HMGCL, HMI, HMN2, HMOX1, HMS1 HMW-MAA, HND, HNE, HNF4A, HOAC, HOMEOBOX NKX 3,1, HOM-TES-14/SCP-1, HOM-TES-85, HOXA1 HOXD13, HP, HPC1, HPD, HPE2, HPE1, HPFH, HPFH2, HPRT1, HPS1, HPT, HPV-E6, HPV-E7, HR, HRAS, HRD, HRG, HRPT2, HRPT1, HRX, HSD11B2, HSD17B3, HSD17B4, Н8 В3В2, HSD3B3, HSN1, HSP70-2M, HSPG2, HST-2, HTC2, HTC1, hTERT, HTN3, HTR2C, HVBS6, HVBS1, HVEC, HV1S, HYAL1, HYR, I-309, IAB, IBGC1, IBM2, ICAM1, ICAM3, iCE, ICHQ, ICR5, ICR1, ICS 1, IDDM2, IDDM1, IDS, IDUA, IF, IFNa/b, IFNGR1, IGAD1, IGER, IGF-1R, IGF2R, IGF1, IGH, IGHC, IGHG2, IGHG1, IGHM, IGHR, IGKC, IHG1, IHH, IKBKG, IL1, IL-1 RA,IL10,IL-11, IL12, IL12RB1, IL13, IL-13Ra2, IL-15,IL-16, IL-17, IL18, IL-1a, IL-1a, IL-1b, IL-1p, IL1RAPL1, IL2, IL24, IL-2R, IL2RA, IL2RG, IL3, IL3RA, IL4, IL4RJL4R, IL-5, IL6, IL-7, IL7R, IL-8, IL-9, рецептор раннего лиминина, IMMP2L, INDX, INFGR1, INFGR2, INFα, IFNβINFγ, INS, INSR, INVS, IP-10, IP2, IPF1, IP1, IRF6, IRS1, ISCW, ITGA2, ITGA2B, ITGA6, ITGA7, ITGB2, ITGB3, ITGB4, ITIH1, ITM2B, IV, IVD, JAG1, JAK3, JBS, JBTS1, JMS, JPD, KALI, KAL2, KALI, KLK2, KLK4, KCNA1, KCNE2, KCNE1, KCNH2, KCNJ1, KCNJ2, KCNJ1, KCNQ2, KCNQ3, KCNQ4, KCNQ1, KCS, KERA, KFM, KFS, KFSD, KHK, ki-67, KIAA0020, KIAA0205, KIAA0205/m, KIF1B, KIT, KK-LC-1, KLK3, KLKB1, KM-HN-1, KMS, KNG, KNO, K-RAS/m, KRAS2, KREV1, KRT1, KRT10, KRT12, KRT13, KRT14, KRT14L1, KRT14L2, KRT14L3, KRT16, KRT16L1, KRT16L2, KRT17, KRT18, KRT2A, KRT3, KRT4, KRT5, KRT6 A, KRT6B, KRT9, KRTHB1, KRTHB6, KRT1, KSA, KSS, KWE, KYNU, LOH19CR1, L1CAM, LAGE, LAGE-1, LALL, LAMA2, LAMA3, LAMB3, LAMB1, LAMC2, LAMP2, LAP, LCA5, LCAT, LCCS, LCCS 1, LCFS2, LCS1, LCT, LDHA, LDHB, LDHC, LDLR, LDLR/FUT, LEP, LEWISY, LGCR, LGGF-PBP, LGI1, LGMD2H, LGMD1A, LGMD1B, LHB, LHCGR, LHON, LHRH, LHX3, LIF, LIG1, LIMM, LIMP2, LIPA, LIPA, LIPB, LIPC, LIVIN, L1CAM, LMAN1, LMNA, LMX1B, LOLR, LOR, LOX, LPA, LPL, LPP, LQT4, LRP5, LRS 1, LSFC, LT-D, LTBP2, LTC4S, LYL1, XCL1, LYZ, M344, MA50, MAA, MADH4, MAFD2, MAFD1, MAGE, MAGE-A1, MAGE-A10, MAGE-А12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGEB1, MAGE-B10, MAGE-B16, MAGE-B17, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2, MGB1, MGB2, MAN2A1, MAN2B1, MANBA, MANBB, MAOA, MAOB, MAPK8IP1, МАРТ, MART-1, MART-2, MART2/m, MAT1A, MBL2, MBP, MBS1, MC1R, MC2R, MC4R, MCC, MCCC2, MCCC1, MCDR1, MCF2, MCKD, MCL1, MC1R, MCOLN1, MCOP, MCOR, MCP-1, MCP-2, MCP-3, MCP-4, MCPH2, MCPH1, MCS, M-CSF, MDB, MDCR, MDM2, MDRV, MDS1, ME1, ME1/m, ME2, ME20, ME3, MEAX, MEB, MEC CCL-28, MECP2, MEFV, MELANA, MELAS, MEN1 MSLN, MET, MF4, MG50, MG50/PXDN, MGAT2, MGAT5, MGC1 MGCR, MGCT, MGI, MGP, MHC2TA, MHS2, MHS4, MIC2, MIC5, MIDI, MIF, MIP, MIP-5/HCC-2, MITF, MJD, MKI67, MKKS, MKS1, MLH1, MLL, MLLT2, MLLT3, MLLT7, MLLT1, MLS, MLYCD, MMA1a, MMP 11, MMVP1, MN/CA IX-антиген, MNG1, MN1, MOC31, MOCS2, MOCS1, MOG, MORC, MOS, MOV18, MPD1, MPE, MPFD, MPI, MPIF-1, MPL, MPO, MPS3C, MPZ, MRE11A, MROS, MRP1, MRP2, MRP3, MRSD, MRX14, MRX2, MRX20, MRX3, MRX40, MRXA, MRX1, MS, MS4A2, MSD, MSH2, MSH3, MSH6, MSS, MSSE, MSX2, MSX1, MTATP6, MTC03, MTC01, MTCYB, MTHFR, MTM1, MTMR2, MTND2, MTND4, MTND5, MTND6, MTND1, MTP, MTR, MTRNR2, MTRNR1, MTRR, MTTE, MTTG, MTTI, MTTK, MTTL2, MTTL1, MTTN, MTTP, MTTS1, MUC1.MUC2, MUC4, MUC5AC, Мим-1, MUM-l/m, MUM-2, MUM-2/m, MUM-3, MUM-3/m, MUT, мутантный р21 RAS, MUTYH, MVK, MX2, MXI1, MY05A, MYB, MYBPC3, MYC, MYCL2, MYH6, MYH7, MYL2, MYL3, MYMY, MY015A, MY01G, MY05A, MY07A, MYOC, миозин/m, MYP2, MYP1, NA88-A, Н-ацетилглюкозаминилтрансфераза-γ, NAGA, NAGLU, NAMSD, NAPB, NAT2, NAT, NBIA1, NBS1, NCAM, NCF2, NCF1, NDN, NDP, NDUFS4, NDUFS7, NDUFS8, NDUFV1, NDUFV2, NEB, NEFH, NEM1, neo-PAP, neo-PAP/m, NEU1, NEUROD1, NF2, NF1, NFYC/m, NGEP, NHS, NKS1, NKX2E, NM, NME1, NMP22, NMTC, NODAL, NOG, NOS3, NOTCH3, NOTCH1, NP, NPC2, NPC1, NPHL2, NPHP1, NPHS2, NPHS1, NPM/ALK, NPPA, NQ01, NR2E3, NR3C1, NR3C2, NRAS, NRAS/m, NRL, NROB1, NRTN, NSE, NSX, NTRK1, NUMA1, NXF2, NY-C01, NY-ES01, NY-ESO-B, NY-LU-12, ALDOA, NYS2, NYS4, NY-SAR-35, NYS1, NYX, ОАЗ, ОА1, OAP, OASD, OAT, OCA1, OCA2, OCD1, OCRL, OCRL1, OCT, ODDD, ODT1, OFC1, OFD1, OGDH, OGT, OGT/m, OPA2, OPA1, OPD1, OPEM, OPG, OPN, OPN1LW, OPN1MW, OPN1SW, OPPG, OPTB1, TTD, ORM1, ORP1, OS-9, OS-9/m, OSMLIF, OTC, OTOF, OTSC1, OXCT1, OYTES1, P15, P190 MINOR BCR-ABL, P2RY12, P3, P16, P40, P4HB, P-501, P53, P53/m, P97, PABPN1, PAFAH1B1, PAFAH1P1, PAGE-4, PAGE-5, РАН, PAI-1, PAI-2, PAK3, PAP, PAPPA, PARK2, PART-1, PATE, PAX2, PAX3, PAX6, PAX7, PAX8, PAX9, PBCA, PBCRA1, PBT, PBX1, PBXP1, PC, PCBD, PCCA, PCCB, PCK2, PCK1, PCLD, PCOS1, PCSK1, PDB1, PDCN, PDE6A, PDE6B, PDEF, PDGFB, PDGFR, PDGFRL, PDHA1, PDR, PDX1, PECAM1, PEE1, PE01, PEPD, PEX10, PEX12, PEX13, РЕХЗ, РЕХ5, PEX6, PEX7, PEX1, PF4, PFBI, PFC, PFKFB1, PFKM, PGAM2, PGD, PGK1, PGK1P1, PGL2, PGR, PGS, PHA2A, PHB, PHEX, PHGDH, PHKA2, PHKA1, PHKB, PHKG2, PHP, PHYH, PI, PI3, PIGA, PIM1-KINASE, PIN1, PIP5K1B, PITX2, PITX3, PKD2, PKD3, PKD1, PKDTS, PKHD1, PKLR, PKP1, PKU1, PLA2G2A, PLA2G7, PLAT, PLEC1, PLG, PLI, PLOD, PLP1, PMEL17, PML, PML/RARa, PMM2, PMP22, PMS2, PMS1, PNKD, PNLIP, POF1, POLA, POLH, POMC, PON2, PON1, PORC, POTE, POU1F1, POU3F4, POU4F3, POU1F1, PPAC, PPARG, PPCD, PPGB, PPH1, PPKB, PPMX. PPOX, PPP1R3A, PPP2R2B, PPT1, FRAME, PRB, PRB3, PRCA1, PRCC, PRD, PRDX5/m, PRF1, PRG4, PRKAR1A, PRKCA. PRKDC, PRKWNK4, PRNP, PROC, PRODH, PROM1, PROP1, PROS1, PRST, PRP8, PRPF31, PRPF8, PRPH2, PRPS2, PRPS1, PRS, PRSS7, PRSS1, PRTN3, PRX, PSA, PSAP, PSCA, PSEN2, PSEN1, PSG1, PSGR, PSM, PSMA, PSORS1, PTC, PTCH, PTCH1, PTCH2, PTEN, PTGS1, PTH, PTHR1, PTLAH, PTOS1, PTPN12, PTPNI 1, PTPRK, PTPRK/m, PTS, PUJO, PVR, PVRL1, PWCR, PXE, РХМР3, PXR1, PYGL, PYGM, QDPR, RAB27A, RAD54B, RAD54L, RAG2, RAGE, RAGE-1, RAG1, RAP1, RARA, RASA1, RBAF600/m, RB1, RBP4, RBP4, RBS, RCA1, RCAS1, RCCP2, RCD1, RCV1, RDH5, RDPA, RDS, RECQL2, RECQL3, RECQL4, REG1A, REHOBE, REN, RENBP, RENS1, RET, RFX5, RFXANK, RFXAP, RGR, RHAG, RHAMM/CD168, RHD, RHO, rip-1, RLBP1, RLN2, RLN1, RLS, RMD1, RMRP, ROM1, ROR2, RP, RP1, RP14, RP17, RP2, RP6, RP9, RPD1, RPE65, RPGR, RPGRIP1, RP1, RP10, RPS19, RPS2, RPS4X, RPS4Y, RPS6KA3, RRAS2, RS1, RSN, RSS, RU1, RU2, RUNX2.RUNX1, RWS, RYR1, S-100, SAA1, SACS, SAG, SAGE, SALL1, SARDH, SART1, SART2, SART3, SAS, SAX1, SCA2, SCA4, SCA5, SCA7, SCA8, SCA1, SCC, SCCD, SCF, SCLC1, SCN1A, SCN1B, SCN4A, SCN5A, SCNN1A. SCNN1B, SCNN1G, SCO2, SCP1, SCZD2, SCZD3, SCZD4, SCZD6, SCZD1, SDF-1α/βSDHA, SDHD, SDYS, SEDL, SERPENA7, SERPINA3, SERPINA6, SERPINA1, SERPINC1, SERPIND1, SERPINE1, SERPINF2, SERPING1, SERPINI1, SFTPA1, SFTPB, SFTPC, SFTPD, SGCA, SGCB, SGCD, SGCE, SGM1, SGSH, SGY-1, SH2D1A, SHBG, SHFM2, SHFM3, SHFM1, SHH, SHOX, SI, SIAL, SIALYL LEWISX, SIASD, S11, SIM1, SIRT2/m, SIX3, SJS1, SKP2, SLC10A2, SLC12A1, SLC12A3, SLC17A5, SLC19A2, SLC22A1L, SLC22A5, SLC25A13, SLC25A15, SLC25A20, SLC25A4, SLC25A5, SLC25A6, SLC26A2, SLC26A3, SLC26A4, SLC2A1, SLC2A2, SLC2A4, SLC3A1, SLC4A1. SLC4A4, SLC5A1, SLC5A5, SLC6A2, SLC6A3, SLC6A4, SLC7A7, SLC7A9, SLC11A1, SLOS, SMA, SMAD1, SMAL, SMARCB1, SMAX2, SMCR, SMCY, SM1, SMN2, SMN1, SMPD1, SNCA, SNRPN, SOD2, SOD3, SOD1, SOS1, SOST, SOX9, SOX10, Spl7, SPANXC, SPG23, SPG3A, SPG4, SPG5A, SPG5B, SPG6, SPG7, SPINK1, SPINK5, SPPK, SPPM, SPSMA, SPTA1, SPTB, SPTLC1, SRC, SRD5A2, SRPX, SRS, SRY, βhCG, SSTR2, SSX1, SSX2 (HOM-MEL-40/SSX2), SSX4, ST8, STAMP-1, STAR, STARP1, STATH, STEAP, STK2, STK11, STn/KLH, STO, STOM, STS, SUOX, SURF1, SURVIVIN-2B, SYCP1, SYM1, SYN1, SYNS1, SYP, SYT/SSX, SYT-SSX-1, SYT-SSX-2. TA-90, TAAL6, TACSTD1, TACSTD2, TAG72, TAF7L, TAF1, TAGE, TAG-72, TALI, ТАМ, TAP2, TAP1, TAPVR1, TARC, TARP, TAT, TAZ, TBP, TBX22, ТВХЗ, ТВХ5, TBXA2R, TBXAS1, TCAP, TCF2, TCF1, TCIRG1, TCL2, TCL4, TCL1A, TCN2, TCOF1, TCR, TCRA, TDD, TDFA, TDRD1, TECK, ТЕСТА, ТЕК, TEL/AML1, TELAB1, ТЕХ 15, TF, TFAP2B, TFE3, TFR2, TG, TGFα, TGFβ, TGFα1, TGFβ1, TGFβR2, TGFβRE, TGFγ, TGFβR11, TGIF, TGM-4, TGM1, TH, THAS, THBD, THC, THC2, THM, THPO, THRA, THRB, TIMM8A, TIMP2, TIMP3, TIMP1, TITF1, TKCR, TKT, TLP, TLR1, TLR10, TLR2, TLR3, TLR4, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLX1, TM4SF1, TM4SF2, TMC1, TMD, TMIP, TNDM, TNF, TNFRSF11A, TNFRSF1A, TNFRSF6, TNFSF5, TNFSF6, TNFα, TNFβ, TNNI3, TNNT2, TOC, TOP2A, TOPI, TP53, TP63, TPA, TPBG, TPI, TPI/m, ТРИ, ТРМЗ, ТРМ1, TPMT, TPO, TPS, TPTA, TRA, TRAG3, TRAPPC2, TRC8, TREH, TRG, TRH, TRIM32, TRIM37, TRP1, TRP2, TRP-2/6b, TRP-2/INT2, Trp-p8, TRPS1, TS, TSC2, TSC3, TSC1, TSG101, TSHB, TSHR, TSP-180, TST, TTGA2B, TTN, TTPA, TTR, TU M2-PK, TULP1, TWIST, TYH, TYR, TYROBP, TYROBP, TYRP1, TYS, UBE2A, UBE3A, UBE1, UCHL1, UFS, UGT1A, ULR, UMPK. UMPS, UOX, UPA, UQCRC1, UR05, UROD, UPK1B, UROS, USH2A, USH3A, USH1A, USH1C, USP9Y, UV24, VBCH, VCF, VDI, VDR, VEGF, VEGFR-2, VEGFR-1, VEGFR-2/FLK-1, VHL, VIM, VMD2, VMD1, VMGLOM, VNEZ, VNF, VP, VRNI, VWF, VWS, WAS, WBS2, WFS2, WFS1, WHCR, WHN, WISP3, WMS, WRN, WS2A, WS2B, WSN, WSS, WT2, WT3, WT1, WTS, WWS, XAGE, XDH, XIC, XIST, XK, XM, XPA, XPC, XRCC9, XS, ZAP70, ZFHX1B, ZFX, ZFY, ZIC2, ZIC3, ZNF145, ZNF261, ZNF35, ZNF41, ZNF6, ZNF198 и ZWS1.
Кроме того, терапевтически активные белки, кодируемые по крайней мере одной РНК в составе комплекса, как описано в данном контексте, также можно выбрать из группы гормонов роста или факторов роста, используемых, например, для стимуляции роста в (трансгенных) живых организмах, таких как, например, ТФРα и ИПФР (инсулин-подобные факторы роста), белки, которые воздействуют на метаболизм и/или кроветворение, такие как, например, α-антитрипсин, ЛНП-рецептор, эритропоэтин (ЭП), инсулин, GATA-1 и т.п., или такие белки, как, например, факторы VIII и XI системы свертывания крови, и т.п.Такие белки также включают ферменты, такие как, например, (3-галактозидаза (lacZ), ферменты рестрикции ДНК (например, EcoRI, HindIII и т.п.), лизоцимы и т.п., или протеазы, такие как, например, папаин, бромелаин, кератиназы, трипсин, химотрипсин, пепсин, ренин (химозин), суицим, нортаза и т.п. Эти белки могут кодироваться по крайней мере одной РНК в составе комплекса, как определено в данном контексте. Соответственно, в настоящем изобретении предлагается способ, который позволяет заменять дефектные для организма белки (образующиеся, например, как в результате мутаций, так и вследствие нарушения или отсутствия экспрессии) и, таким образом, наблюдается эффективная и повышенная экспрессия белков, которые не проявляют свою функцию в организме, нуждающемся в лечении, например, при моногенетических нарушениях, при которых, предпочтительно, не индуцируется врожденный иммунный ответ.
Кроме того, терапевтически активные белки, кодируемые по крайней мере одной РНК в составе комплекса, как описано в данном контексте, также можно выбрать из группы протеаз и т.п., с помощью которых можно лечить специфические заболевания, развивающиеся, например, вследствие (сверх)экспрессии дисфункционирующих или экзогенных белков, вызывающих расстройства или заболевания. Соответственно, настоящее изобретение можно использовать для терапевтического введения в организм РНК-содержащего комплекса, который атакует патогенный организм (вирус, бактерии и т.п.). Например, РНК, кодирующую терапевтические протеазы, можно использовать для расщепления вирусных белков, которые необходимы при сборке вируса или на других существенных стадиях продукции вируса.
Терапевтически активные белки, кодируемые по крайней мере одной РНК в составе комплекса, как описано в данном контексте, также можно выбрать из группы белков, которые модулируют различные внутриклеточные пути, например, за счет модуляции передачи сигнала (ингибирования или стимулирования), которые могут влиять на важнейшие внутриклеточные процессы, такие как апоптоз, клеточный рост и т.п., прежде всего, относящиеся к иммунной системе организма. Соответственно, иммунные модуляторы, например, цитокины, лимфокины, монокины, интерфероны и т.п., могут эффективно экспрессироваться в результате введения РНК-содержащего комплекса, как описано в данном контексте. Предпочтительно, эти белки также включают, например, цитокины I класса семейства цитокинов, которые содержат 4 специфичных последовательно расположенных консервативных остатка цистеина (СССС) и консервативный мотив Trp-Ser-X-Trp-Ser (WSXWS), при этом Х обозначает неконсервативную аминокислоту. Цитокины I класса семейства цитокинов включают подсемейство ГМ-КСФ, например, ИЛ-3, ИЛ-5 ГМКСФ, подсемейство ИЛ-6, например, ИЛ-6, ИЛ-11, ИЛ-12 или подсемейство ИЛ-2, например, ИЛ-2, ИЛ-4, ИЛ-7, ИЛ-9, ИЛ-15 и т.п.или цитокины ИЛ-1α, ИЛ-1β, ИЛ-10 и т.п. Аналогичным образом, такие белки также могут включать цитокины класса II семейства цитокинов (семейство интерфероновых рецепторов), которые, также содержат 4 специфичных консервативных остатка цистеина (СССС), но не консервативный мотив Trp-Ser-X-Trp-Ser (WSXWS). Цитокины II класса семейства цитокинов включают, например, ИФ-α, ИФ-Р, ИФ-γ и т.п. Белки, кодируемые по крайней мере одной модифицированной мРНК (в составе иммунодепрессантной композиции по настоящему изобретению) по настоящему изобретению, кроме того могут также включать цитокины семейства факторов некроза опухолей, например, ФНО-α, ФНО-β, ФИО-RI, ФИО-RII, CD40, Fas и т.п. или цитокины семейства хемокинов, которые содержат 7 трансмембранных спиралей и взаимодействуют с G-белком, например, ИЛ-8, MIP-1, RANTES, CCR5, CXR4 и т.п.Такие белки также можно выбрать из группы факторов апоптоза, или относящихся к апоптозу или связанных с апоптозом белков, включая AIF, Apaf, например, Apaf-1, Apaf-2, Apaf-3 или АРО-2 (L), АРО-3 (L), апопаин. Bad, Bak, Bax, Bcl-2, Bcl-xL, Bcl-xS, bik, CAD, калпаин, каспазы, например, каспаза-1, каспаза-2, каспаза-3, каспаза-4, каспаза-5, каспаза-6, каспаза-7, каспаза-8, каспаза-9, каспаза-10, каспаза-11, ced-3, ced-9, c-Jun, c-Myc, crm А, цитохром С, CdRl, DcRl, DD, DED, DISC, DNA-PKCS, DR3, DR4. DR5, FADD/MORT-1, FAK, Fas (Fas-лиганд CD95/fas (рецептор)), FLICE/MACH, FLIP, фодрин, fos, G-актин, Gas-2, гелзолин, гранцимы А/В, ICAD, ICE, JNK, ламин А/В, MAP, MCL-1, Mdm-2, MEKK-1, MORT-1, NEDD, NF-каппа-В, NuMa, p53, PAK-2, PARP, перфорин, PITSLRE, РКС-дельта, pRb, пресенилин, prICE, RAIDD, Ras, RIP, сфингомиелиназа, тимидинкиназа простого герпеса, TRADD, TRAF2, TRAIL-R1, TRAIL-R2, TRAIL-R3, трансглютаминаза и т.д.
Кроме того, терапевтически активные белки, кодируемые по крайней мере одной РНК в составе комплекса, как описано в данном контексте, также могут кодироваться для воздействия на антигенспецифичные Т-клеточные рецепторы. Т-клеточный рецептор или ТКР, представляет собой молекулу, находящуюся на поверхности Т-лимфоцитов (или Т-клеток), которые, в основном, ответственны за распознавание антигенов, связанных с молекулами главного комплекса гистосовместимости (ГКГ). Он представляет собой гетеродимер, состоящий из альфа- и бета-цепей в 95% Т-клеток, в то время как 5% Т-клеток содержат ТКР, состоящие из гамма- и дельта-цепей. Соединение ТКР с антигеном и ГКГ приводит к активации его Т-лимфоцита вследствие серии биохимических реакций, опосредуемых связанными с ними ферментами, корецепторами и особыми специфическими вспомогательными молекулами. Следовательно, эти белки могут специфически связываться с антигеном-мишенью и могут поддерживать функциональную активность иммунной системы, благодаря специфической направленности их свойств. В соответствии с этим, трансфекцию клеток in vivo можно проводить при введении по крайней мере одной РНК в составе комплекса, как определено в данном контексте, кодирующей эти рецепторы или, предпочтительно, проводить трансфекцию клеток ex vivo (например, специфическую трансфекцию определенных иммунных клеток). Введенные молекулы Т-клеточных рецепторов распознают специфические антигены на молекуле ГКГ и, следовательно, могут поддерживать готовность иммунной системы к антигенной атаке.
Терапевтически активные белки, кодируемые по крайней мере одной РНК в составе комплекса, как описано в данном контексте, могут дополнительно содержать адъювантный белок. В данном контексте, адъювантный белок, предпочтительно, обозначает любой белок, который способен вызвать врожденный иммунный ответ, как определено в данном контексте. Предпочтительно, такой врожденный иммунный ответ включает активацию образраспознающего рецептора, такого как, например, рецепторы, выбранные из семейства Toll-подобных рецепторов (TLR), включая, например, Toll-подобный рецептор, выбранный из рецепторов человека TLR1-TLR10 или из Toll-подобных рецепторов мыши TLR1-TLR13. Предпочтительно, врожденный иммунный ответ вырабатывается у млекопитающего, более предпочтительно, у человека. Предпочтительно, адъювантный белок выбран из группы адъювантных белков человека или группы адъювантных белков патогенов, прежде всего, бактериальных адъювантных белков. Кроме того, можно использовать мРНК, кодирующие белки человека, принимающие участие в адъювантных эффектах.
Адъювантные белки человека, которые могут кодироваться по крайней мере одной РНК в составе комплекса, как определено в данном контексте, как правило, включают любой белок человека, который способен вызвать врожденный иммунный ответ (у млекопитающих), например, вследствие реакции связывания экзогенного TLR-лиганда с TLR. Более предпочтительно, адъювантные белки человека, которые кодируются РНК в составе комплекса по настоящему изобретению, выбирают из группы, состоящей, но, не ограничиваясь только ими, из цитокинов, которые индуцируют или усиливают врожденный иммунный ответ, ИЛ-2, ИЛ-12, ИЛ-15, ИЛ-18, ИЛ-21, CCL21, ГМ-КСФ и ФНО-αльфа, цитокинов, которые высвобождаются из макрофагов, включая ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12 и ФНО-αльфа, из компонентов системы комплемента, включая Clq, MBL, Cir, C1s, C2b, Bb, D, MASP-1, MASP-2, C4b, C3b, C5a, C3a, C4a, C5b, C6, C7, C8, C9, CR1, CR2, CR3, CR4, C1qR, C1INH, C4bp, MCP, DAF, H, I, P и CD59, из белков, которые являются компонентами сигнальных сетей образраспознающих рецепторов, входящих в группу, включающую TLR и ИЛ-1R1, при этом данные компоненты являются лигандами для группы рецепторов узнавания, включающей ИЛ-1-альфа, ИЛ-1-бета, бета-дефензин, белки теплового шока, такие как HSP10, HSP60. HSP65, HSP70, HSP75 и HSP90, gp96, фибриноген, повторяющийся экстрадомен А фибронектина TypIII, рецепторы, включая ИЛ-IRI, TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, передатчики сигналов, включая компоненты сигнальной системы малой-ГТФазы (RhoA, Ras, Raci, Cdc42 и т.д.), компоненты PIP сигнальной системы (PI3K, Src-киназы и т.д.), компоненты МуВ88-зависимой сигнальной системы (MyD88, IRAKI, IRAK2 и т.д.), компоненты Му088-независимой сигнальной системы (TICAM1, TICAM2 и т.д.), активированные факторы транскрипции, включая, например, NF-каппа-В, c-Fos, c-Jun, c-Myc, и активированные гены-мишени, включая, например, ИЛ-1-альфа, ИЛ-1-бета, бета-дефензин, ИЛ-6, гамма-интерферон, альфа-интерферон и бета-интерферон, ко-стимулирующие молекулы, включая CD28 или CD40-лиганд или PD1, белковые домены, включая LAMP, белки клеточной поверхности, или адъювантные белки человека, включая CD80, CD81, CD86, trif, flt-3-лиганд, тимопентин, Gp96 или фибронектин и т.п., или любые типы гомологов любых указанных выше адъювантных белков человека.
Адъювантные белки патогенов, которые могут кодироваться по крайней мере одной РНК в составе комплекса, как описано в данном контексте, обычно включают любые (адъювантные) белки патогенов, которые могут вызвать врожденный иммунный ответ (у млекопитающих), более предпочтительно, выбранных из (адъювантных) белков патогенов, полученных из бактерий, простейших, вирусов или грибов, животных и т.п., и еще более предпочтительно, (адъювантные) белки патогенов, выбранные из группы, состоящей, но, не ограничиваясь только ими, из бактериальных белков, белков простейших (например, профилин-подобный белок из Toxoplasma gondii), вирусных белков или белков из грибов, белков животных и т.п.
В данном контексте, группа (бактериальных) адъювантных белков, которые могут кодироваться по крайней мере одной РНК в составе комплекса, как определено в данном контексте, может содержать любой бактериальный белок, который способен вызвать врожденный иммунный ответ (предпочтительно, у млекопитающих). Более предпочтительно, группа (бактериальных) адъювантных белков, которые могут кодироваться РНК в составе комплекса, может включать бактериальные адъювантные белки, выбранные из группы, состоящей, но, не ограничиваясь только ими, бактериальные флагеллины, в том числе флагеллины из организмов, включающих
Agrobacterium, Aquifex, Azospirillum, Bacillus, Bartonella, Bordetella, Borrelia, Burkholderia, Campylobacter, Caulobacte, Clostridium, Escherichia, Helicobacter, Lachnospiraceae, Legionella, Listeria, Proteus, Pseudomonas, Rhizobium, Rhodobacter, Roseburia, Salmonella, Serpulina, Serratia, Shigella, Treponema, Vibrio, Wolinella, Yersinia, более предпочтительно, флагеллины, выделенные, но, не ограничиваясь только ими, из следующих видов: Agrobacterium tumefaciens, Aquifex pyrophilus, Azospirillum brasilense, Bacillus subtilis. Bacillus thuringiensis, Bartonella bacilliformis, Bordetella bronchiseptica, Borrelia burgdorferi, Burkholderia cepacia, Campylobacter jejuni, Caulobacter crescentus, Clostridium botulinum, штамм Bennett, клон 1, Escherichia coli, Helicobacter pylori, Lachnospiraceae bacterium, Legionella pneumophila, Listeria monocytogenes, Proteus mirabilis, Pseudomonas aeroguinosa, Pseudomonas syringae, Rhizobium meliloti, Rhodobacter sphaeroides, Roseburia cecicola, Roseburis hominis. Salmonella typhimurium. Salmonella bongori. Salmonella typhi. Salmonella enteritidis, Serpulina hyodysenteriae, Serratia marcescens, Shigella boydii, Treponema phagedenis, Vibrio alginolyticus, Vibrio cholerae. Vibrio parahaemolyticus, Wolinella succinogenes и Yersinia enterocolitica.
Бактериальные флагеллины, которые могут кодироваться по крайней мере одной РНК в составе комплекса, как определено в данном контексте, прежде всего предпочтительны и их можно выбрать из любых бактериальных флагеллинов с адъювантными свойствами, более предпочтительно, из бактериальных флагеллинов, выбранных из группы, состоящей из бактериальных белков теплового шока или чаперонов, включая Hsp60, Hsp70, Hsp90, Hsp100, OrnpA (внешний мембранный белок) из грамотрицательных бактерий, бактериальных поринов, включая OrnpF, бактериальных токсинов, включая токсин коклюша (ТК) из Bordetella pertussis, аденилатциклазные токсины коклюша СуаА и СуаС из Bordetella pertussis, PT-9K/129G мутант из токсина коклюша, столбнячный токсин, холерный токсин (XT), В-субъединица холерного токсина, СТК63 мутант из холерного токсина, СТЕ112К мутант из XT, термолабильный энтеротоксин (ТЭ) из Escherichia coli, В-субъединица термолабильного токсина (ТЭВ), мутанты термолабильного энтеротоксина из Escherichia coli с пониженной токсичностью, включая LTK63, LTR72, фенол-растворимый модулин, нейтрофил-активирующий белок (HP-NAP) из Helicobacter pylori, поверхностно-активный белок D, белок А внешней поверхности, липопротеин из Borrelia burgdorferi, Ag38 (антиген массой 38 кДа) из Mycobacterium tuberculosis, белки из бактериального пилуса, энтеротоксин XT из Vibrio cholerae, пилин из пилий грамотрицательных бактерий, а также поверхностно-активный белок А и т.п., или любые типы гомологов любых указанных выше бактериальных адъювантных белков.
Еще более предпочтительны бактериальные флагеллины, которые могут кодироваться по крайней мере одной РНК в составе комплекса, как определено в данном контексте, и которые содержат последовательность, выбранную из группы, включающей любую из следующих последовательностей, в соответствии с их идентификационными номерами:
Белки простейших, которые могут кодироваться по крайней мере одной РНК в составе комплекса, как определено в данном контексте, можно выбрать из любых белков простейших с адъювантными свойствами, более предпочтительно, из группы, содержащей, но, не ограничиваясь только ими, Тс52 из Trypanosoma cruzi, PFTO из Trypanosoma gondii, белки теплового шока простейших, LeIF из Leishmania spp., профилин-подобный белок из Toxoplasma gondii и т.п.
Вирусные белки, которые могут кодироваться по крайней мере одной РНК в составе комплекса, как определено в данном контексте, можно выбрать из числа вирусных белков с адъювантными свойствами, более предпочтительно, из группы, содержащей, но, не ограничиваясь только ими, гибридный гликопротеин (F-протеин) респираторно-синцитиального вируса, оболочечный белок из вируса мышиного рака молочной железы (ММТ), белок из вируса мышиного лейкоза, гемагглютинин вируса кори дикого типа и т.п.
Белки из грибов, которые могут кодироваться по крайней мере одной РНК в составе комплекса, как определено в данном контексте, можно выбрать из любых белков из грибов с адъювантными свойствами, более предпочтительно, из группы, содержащей, но, не ограничиваясь только ими, иммуномодуляторный белок из грибов (ИБГ, LZ-8) и т.п.
В заключение следует отметить, что адъювантные белки патогенов, которые могут кодироваться по крайней мере одной РНК в составе комплекса, как определено в данном контексте, можно выбрать из любых различных белков патогенов с адъювантными свойствами, более предпочтительно, из группы, содержащей, но, не ограничиваясь только ими, гемоцианин лимфы фисуреллы (ГЛФ), OspA, и т.п.
По крайней мере, одна РНК в составе комплекса по настоящему изобретению, может также кодировать антиген. Согласно настоящему изобретению, термин «антиген» обозначает вещество, которое распознается иммунной системой и способно индуцировать антиген-специфичный иммунный ответ, например, образование антител. Антигены классифицируют в соответствии с их источником. Таким образом, существуют два основных класса антигенов: экзогенные и эндогенные антигены. Экзогенные антигены представляют собой антигены, которые проникают в клетку или организм извне (по отношению к клетке или организму), например, вследствие вдыхания, проглатывания или инъекции и т.п.
Такие антигены поглощаются антиген-презентирующими клетками (АПК, такие как дендритные клетки или макрофаги) и подвергаются процессингу с образованием фрагментов. Затем АПК направляют эти фрагменты к Т-хелперным клеткам, например, (CD4+), при участии молекул ГКГ II, расположенных на их поверхности. Распознавание этих антигенных фрагментов Т-клетками приводит к активации Т-клеток и секреции цитокинов. Цитокины представляют собой вещества, которые могут активировать пролиферацию иммунных клеток, таких как Т-клетки, В-клетки или макрофаги. Напротив, эндогенные антигены представляют собой антигены, которые накапливаются внутри клетки, например, в результате нормального клеточного метаболизма. Фрагменты таких антигенов презентируются на молекулах ГКГ I на поверхности АПК. Эти антигены распознаются активированными антиген-специфичными цитотоксическими CD8+Т-клетками. После распознавания, эти Т-клетки активируются, секретируя различные токсины, которые вызывают лизис или апоптоз антиген-презентирующих клеток. Эндогенные антигены включают антигены, например, белки или пептиды, кодируемые чужеродной нуклеиновой кислотой внутри клетки, также как белки и пептиды, кодируемые генетической информацией, заложенной в самой клетке, или антигены из вирусов, присутствующих внутри клетки. Один из классов эндогенных антигенов представляет собой опухолевые антигены. Эти антигены презентируются молекулами ГКГ I на поверхности опухолевых клеток. Данный класс можно подразделить на опухоль-специфичные антигены (ОСА) и опухоль-ассоциированные антигены (ОАА). ОСА могут презентироваться только опухолевыми клетками и никогда - нормальными «здоровыми» клетками. Они, как правило, образуются в результате опухоль-специфической мутации. ОАА, которые являются более общими, как правило, презентируются как на опухолевых, так и на здоровых клетках. Эти антигены распознаются, и антиген-презентирующие клетки разрушаются цитотоксическими Т-клетками. Кроме того, опухолевые антигены также могут находиться на поверхности опухоли в форме, например, мутировавшего рецептора. В этом случае они могут распознаваться антителами.
Антигены, которые могут кодироваться по крайней мере одной РНК в составе комплекса по настоящему изобретению, могут включать, например, белки, пептиды или их фрагменты. Предпочтительно, антигены представляют собой белки и пептиды, или их фрагменты, такие как эпитопы этих белков или пептидов. Эпитопы (также называемые «антигенные детерминанты»), как правило, являются фрагментами, расположенными на внешней поверхности таких антигенных белковых или пептидных структур, и содержат от 5 до 15, предпочтительно, от 9 до 15 аминокислотных остатков (эпитопы В-клеток и эпитопы Т-клеток, как правило, презентируются на молекулах ГКГ, при этом, например, ГКГ-1 обычно презентирует эпитопы длиной приблизительно 9 аминокислотных остатков, а ГКГ-11 обычно презентирует эпитопы длиной приблизительно 12-15 аминокислотных остатков). Более того, антигены, кодируемые по крайней мере одной РНК в составе комплекса по настоящему изобретению, также могут включать другие биомолекулы, например, липиды, углеводороды и т.д., которые могут быть ковалентно или нековалентно присоединены к РНК.
Согласно настоящему изобретению, антигены, которые могут кодироваться по крайней мере одной РНК в составе комплекса по настоящему изобретению, могут представлять собой экзогенные или эндогенные антигены. Эндогенные антигены включают антигены, образуемые в клетке, прежде всего в дегенеративных клетках, таких как опухолевые клетки. Эти антигены обозначают термином «опухолевые антигены». Предпочтительно, но, не ограничиваясь только ими, они располагаются на поверхности клетки. Более того, термин «опухолевые антигены» также обозначает антигены, экспресируемые в клетках, которые сами по себе не являются (не были) (или изначально не являлись) дегенеративными, но ассоциированы с предполагаемой опухолью. Антигены, которые связаны с питающими опухоль сосудами или их повторным образованием, прежде всего, те антигены, которые связаны с образованием новых сосудов, например, факторы роста, такие как VEGF, bFGF и т.п., также относят к эндогенным. К антигенам, связанным с опухолями, также относят антигены из клеток или тканей, которые обычно окружают опухоль. Кроме того, некоторые вещества (как правило, белки или пептиды) экспрессируются у пациентов, страдающих (диагностированным или недиагнотированным) раковым заболеванием, и эти вещества накапливаются в возрастающих концентрациях в жидкостях организма у указанных пациентов, например, белки, которые связаны с инвазией опухолевых клеток и их миграцией. Такие вещества также относятся к «опухолевым антигенам», однако они не являются антигенами в строгом понимании, не являясь веществами, вызывающими иммунный ответ. Их применение также включено в объем настоящего изобретения.
Антигены, которые могут кодироваться по крайней мере одной РНК в составе комплекса по настоящему изобретению, можно в качестве примера, но, не ограничиваясь только ими, выбрать из любых антигенов, пригодных для конкретной цели, например, антигенов, связанных со специфическим инфекционным заболеванием или вызывающих его, как определено в данном контексте, из опухолевых антигенов, таких как опухольспецифичные поверхностные антигены, из антигенов, которые экспрессируются при раковых заболеваниях, из мутантных антигенов, экспрессирующихся при раковых заболеваниях, или из белковых антигенов, принимающих участие в этиологии других заболеваний, например аутоиммунных заболеваний, аллергических заболеваний, и т.п. Например, указанные антигены можно использовать для десенсибилизации пациента при введении антигена, вызывающего аллергические реакции у пациента или изменяющие его аутоиммунный статус.
Предпочтительные примеры антигенных полипептидов, которые кодируются по крайней мере одной РНК в составе комплекса РНК, как определено в данном контексте, включают известные антигенные пептиды, например опухолевые антигены и т.п. Примеры опухолевых антигенов включают, в том числе опухольспецифичные поверхностные антигены (ОСПА), например 5Т4, α-5-β-1-интегрин, 707-АР, AFP, ART-4, B7H4, BAGE, Bcr-abl, антиген MN/C IX, СА125, CAMEL, CAP-1, CASP-8, бета-катенин/m, CD4, CD 19, CD20, CD22, CD25, CDC27/m, CD 30, CD33, CD52, CD56, CD80, CDK4/m, CEA, CT, Cyp-B, DAM, EGFR, ErbB3, ELF2M, EMMPRIN, EpCam, ETV6-AML1, G250, GAGE, GnT-V, Gp100, HAGE, HER-2/new, HLA-A*0201-R1701, HPV-E7, HSP70-2M, HAST-2, hTERT (или hTRT), iCE, IGF-I R, IL-2R, IL-5, KIAA0205, LAGE, LDLR/FUT, MAGE, MART-1/мелан-А, MART-2/Ski, MC1 R, миозин/m, MUCI, MUM-I, -2, -3, NA88-A, PAP, протеиназа-3, pi 90 минорный bcr-abi, Pml/RARα, FRAME, ПСА, PSM, ПСМА, RAGE, RU1 или RU2, SAGE, SART-1 или SART-3, сурвивин, TEL/AML1, TGFβ, TPI/m, TRP-1, TRP-2, TRP-2/INT2, VEGF и WT1, или последовательности, такие как, например, NY-Eso-1 или NY-Eso-В. В настоящем изобретении можно использовать любой класс опухолевых антигенов, например известно, что опухолевые антигены принимают участие в процессе образования новых сосудов и влияют на структуру внеклеточного матрикса и т.п. Настоящее изобретение также включает фрагменты и аналоги вышеперечисленных антигенов.
Примеры опухолевых антигенов, которые кодируются по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, приведены ниже в таблицах 1 и 2. В указанных таблицах приведены специфические (белковые) антигены (т.е. "опухолевые антигены") и соответствующие связанные с ними раковые заболевания. В настоящем изобретении термины "раковые заболевания" и "опухолевые заболевания" являются синонимами.
В предпочтительном варианте настоящего изобретения, примеры опухолевых антигенов, которые кодируются по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, выбирают из группы, включающей: 5Т4, 707-АР, 9D7, AFP, AlbZIP HPGI, 5 1-интегрин, 5 6-интегрин, -актинин-4/m, метилацил-кофермент А рацемаза, ART-4, ARTCl/m, B7H4, BAGE-1, BCL-2, bcr/ab1, катенин/m, BING-4, BRCA1/m, BRCA2/m, CA 15-3/CA 27-29, СА 19-9, СА72-4, СА125, калретикулин, CAMEL, CASP-8/m, катепсин В, катепсин L, CD19, CD20, CD22, CD25, CDE30, CD33, CD4, CD52, CD55, CD56, CD80, CDC27/m, CDK4/m, CDKN2A/m, CEA, CLCA2, CML28, CML66, COA-1/m, коактозин-подобный белок, коллаж XXIII, COX-2, CT-9/BRD6, Cten, циклин B1, циклин D1, cyp-B, CYPBI, DAM-10, DAM-6, DEK-CAN, EFTUD2/m, EGFR, ELF2/m, EMMPRIN, EpCam, EphA2, EphA3, ЕгЬВЗ, ETV6-AML1, EZH2, FGF-5, FN, Frau-1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE7b, GAGE-8, GDEP, GnT-V, gp100, GPC3, GPNMB/m, HAGE, HAST-2, гепсин, Her2/neu, HERV-K-MEL, HLA-A*0201-R171, HLA-A11/m, HLA-A2/m, HNE, гомеобокс NKX3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPV-E7, HSP70-2M, HST-2, hTERT, iCE, IGF-1 R, IL-13Ra2, IL-2R, IL-5, незрелый ламининовый рецептор, калликреин-2, калликреин-4, Ki67, KIAA0205, KIAA0205/m, KK-LC-1, K-Ras/m, LAGE-A1, LDLR-FUT, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE- A10, MAGE-AI2, MAGE-B1, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-B10, MAGE-B16, MAGE-B17, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-FI, MAGE-H1, MAGEL2, маммаглобин A, MART-1 /мелан-А, MART-2, MART-2/m, белок матрикса 22, MC1 R, M-CSF, ME1/m, мезотелин, MG50/PXDN, MMP11, MN/CA IX-антиген, MRP-3, MUC-1, MUC-2, MUM-l/m, MUM-2/m, MUM-3/m, миозин класса 1/m, NA88-A, N-ацетилглюкозаминилтрансфераза-V, Neo-PAP, Neo-PAP/m, NFYQm, NGEP, NMP22, NPM/ALK, N-Ras/m, NSE, NY-ESO-1, NY-ESO-B, OA1, OFA-iLRP, OGT, OGT/m, OS-9, OS-9/m, остеокальцин, остеопонтин, pi 5, pi 90 минорный bcr-abl, p53, p53/m, PAGE-4, РАМ, PAI-2, PART-1, PATE, PDEF, Pim-1-киназа, Pin-1, Pml/PARa, POTE, FRAME, PRDX5/m, простеин, протеиназа-3, PSA, PSCA, PSGR, PSM, PSMA, PTPRK/m, RAGE-1, RBAF600/m, RHAMM/CD168, RU1, RU2, S-100, SAGE, SART-1, SART-2, SART-3, SCC, SIRT2/m, Sp17, SSX-1, SSX-2/HOM-MEL-40, SSX-4, STAMP-1, STEAP, сурвивин, сурвивин-2β, SYT-SSX-I, SYT-SSX-2, TA-90, TAG-72, TARP, TEL-AML1, TGFp, TGFpRII, TGM-4, TPI/m, TRAG-3, TRG, TRP-1, TRP-2/6b, TRP/INT2, TRP-p8, тирозиназа, UFA, VEGF. VEGFR-2/FLK-1 и WT1.
В предпочтительном варианте настоящего изобретения примеры опухолевых антигенов, которые кодируются по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, выбирают из группы, включающей: MAGE-A1 (номер М77481), MAGE-A6 (номер NM_005363), мелан-А (номер NM_005511), GP100 (номер М77348), тирозиназа (номер NM_000372), сурвивин (номер AF077350), СЕА (номер NM_004363), Her-2/neu (номер M1 1730), WT1 (номер NM_000378), FRAME (номер NM_006115), EGFRI (рецептор 1 эпидермального фактора роста) (номер AF288738), муцин-1 (номер NM_002456) и SEC61 G (номер NM_014302).
В другом варианте по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению может кодировать антитело. Согласно настоящему изобретению, указанное антитело выбирают из любых антител, например из любых известных рекомбинантных или природных антител, прежде всего из антител терапевтического, диагностического или специфического назначения, или антител, связанных со специфическими раковыми заболеваниями. В настоящем описании термин "антитело" используют в широком смысле, и указанный термин относится к моноклональным и поликлональным антителам (включая агонисты, антагонисты и блокирующие или нейтрализующие антитела), а также к антителам типа молекул с полиэпитопной специфичностью. Согласно настоящему изобретению, термин "антитело" обычно включает любое известное антитело (например, IgM, IgD, IgG, IgA и IgE), такое как природные антитела, антитела, вырабатываемые при иммунизации в организме хозяина, антитела, выделенные и охарактеризованные из природных антител или антител, которые вырабатываются при иммунизации в организме хозяина, а также из рекомбинантных антител, а также такие, как химерные антитела, антитела человека, гуманизированные антитела, биспецифичные антитела, интраантитела, т.е. антитела, экспрессируемые в клетках и необязательно локализованные в специфических компартментах клетки, а также фрагменты и варианты описанных антител. Как правило, антитело состоит из легкой цепи и тяжелой цепи, каждая из которых включает вариабельный и консервативный домен. Легкая цепь состоит из N-концевого вариабельного домена, VL- и С-концевого консервативного домена, cl. Напротив, тяжелая цепь, например, антитела IgG, включает N-концевой вариабельный домен, VH и три консервативных домена, CH1, CH2 и CH3. Одноцепочечные антитела кодируются по крайней мере одной РНК в составе комплекса РНК, как определено в настоящем описании, предпочтительно одноцепочечной РНК, более предпочтительно мРНК.
Согласно первому варианту по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению кодирует поликлональное антитело. В данном контексте, термин, "поликлональное антитело" обычно обозначает смесь антител против специфических антигенов или иммуногенов или эпитопов белка, которые вырабатываются при иммунизации организма хозяина, такого как млекопитающее, например, включая козу, крупный рогатый скот, свинью, собаку, кошку, осла, обезьяну, примата, грызуна, такого как мышь, хомяк и кролик. Как правило, поликлональные антитела не идентичны, и таким образом обычно распознают различные эпитопы или участки одного и того же антигена. Таким образом, в данном случае, обычно получают комплекс, содержащий смесь (композицию) различных РНК по настоящему изобретению, каждая из которых кодирует специфическое (моноклональное) антитело против специфических антигенов или иммуногенов или эпитопов белка.
Согласно другому варианту, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению кодирует моноклональное антитело. Термин "моноклональное антитело" в данном контексте обычно относится к антителу, полученному из популяции в значительной степени гомогенных антител, т.е., составляющие популяцию индивидуальные антитела, являются идентичными, за исключением возможных природных мутаций, которые могут происходить в минорных количествах. Моноклональные антитела являются высоко специфичными, так как проявляют специфичность к одному антигенному сайту. Кроме того, в отличие от обычных (поликлональных) препаратов антител, которые обычно включают различные антитела против различных детерминант (эпитопов), каждое моноклональное антитело связывается с одной детерминантой антигена. Например, моноклональные антитела, как определено выше, можно получить методом гибридом, впервые описанным в статье Kohler и Milstein, Nature, 256, с.495 (1975) или получить методом рекомбинантных ДНК, например, как описано в патенте США №4816567. "Моноклональные антитела" можно также получить из библиотек фагов по методикам, описанным, например, в статье McCafferty и др., Nature, 348, сс.552-554 (1990). По методике Kohler и Milstein исследуемый иммуноген (антиген) вводят в организм хозяина, такого как мышь и через определенное время выделяют В-клетки лимфоцитов, которые вырабатываются в ответ на иммунноген. В-клетки смешивают с миеломными клетками мыши и вводят в среду, в которой происходит слияние В-клеток с миеломными клетками с образованием гибридом. Указанные гибридные клетки (гибридомы) затем помещают в отдельные лунки в микротитрационный планшет и культивируют, при этом получают моноклональные антитела. Моноклональные антитела анализируют и отбирают антитела, которые пригодны для детектирования исследуемого антигена. Выбранные моноклональные антитела можно выращивать в культурах клеток или в организме мыши после инъекции гибридом. Однако, согласно настоящему изобретению, необходимо определить пептидные последовательности указанных моноклональных антител и последовательности РНК, которые кодируют указанные антитела, известными методами.
Моноклональные или поликлональные антитела животных (в отличие от человека), такие как мышиные антитела, предназначенные для лечения человека, можно также кодировать по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению. Однако, применение указанных антител как правило значительно ограничено, так как в организме человека они обычно индуцируют иммунный ответ за счет выработки антител человека против антител животных. Следовательно, конкретные антитела животных следует вводить человеку только один раз. Для решения этой проблемы, гибридные, гуманизированные антитела животных и человека можно кодировать по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению. "Гибридные" антитела, которые можно кодировать по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, предпочтительно являются антителами, в которых описанные выше консервативные домены антитела заменены на последовательности антител из других организмов, предпочтительно на последовательности человека. "Гуманизированные" антитела (антитела животных), которые также можно кодировать по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, являются антителами, в которых описанные выше консервативные и вариабельные домены антитела (за исключением гипервариабельных доменов) заменены на последовательности человека. Согласно другому варианту, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению кодирует антитела человека, т.е. антитела, содержащие только последовательности человека. Указанные антитела человека можно выделить по известным методикам из тканей человека или из иммунизированных организмов животных, которые являются трансгенными для локуса гена IgG человека, а секвенированные последовательности РНК можно получить по известным методикам. Кроме того, антитела человека можно получить методом фагового дисплея.
Кроме того, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению может кодировать биспецифические антитела. "Биспецифические" антитела в контексте настоящего изобретения являются предпочтительно антителами, которые действуют в качестве адаптера между эффектором и соответствующей мишенью, например, для накопления молекул-эффекторов таких, как токсины, лекарственные средства, цитокины и т.п., связывающихся с эффекторными клетками-мишенями, такими как цитотоксические Т-лимфоциты (ЦТЛ), клетки-киллеры, макрофаги, гранулоциты и т.п. (см. обзор: Kontermann R.Е., Acta Pharmacol. Sin, 26 (1), с.1-9, (2005)). Биспецифические антитела, как описано в данном контексте, обычно, предназначены для распознавания, например, двух различных антигенов, иммуногенов, эпитопов, лекарственных средств, клеток (или рецепторов на поверхности клеток), или других молекул (или структур), как описано выше. В настоящем описании термин "биспецифичность" обозначает, что антиген-связывающие участки антител проявляют специфичность к двум различным эпитопам. Таким образом, различные антигены, иммуногены или эпитопы, и т.п. можно располагать вблизи друг от друга, при этом необязательно, обеспечивается прямое взаимодействие двух компонентов. Например, различные клетки, такие как эффекторные клетки и клетки-мишени можно соединять через биспецифическое антитело. В объем настоящего изобретения включены, но, не ограничиваясь только ими, антитела или фрагменты, которые связываются, с одной стороны, с растворимым антигеном, как описано в настоящем описании, и, с другой стороны, с антигеном или рецептором на поверхности опухолевой клетки.
Таким образом, согласно настоящему изобретению, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению может также кодировать антитела, как определено выше. Так как указанные антитела экспрессируются внутри клетки, т.е. являются антителами, которые кодируются нуклеиновыми кислотами, локализованными в специфических компартментах клетки, и там же экспрессируются, указанные антитела можно назвать интраантителами.
Антитела, которые кодируются по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, предпочтительно являются полноразмерными антителами, т.е. антителами, включающими целые тяжелые и целые легкие цепи, как описано выше. Однако, по крайней мере одна описанная выше РНК в составе комплекса РНК по настоящему изобретению может кодировать производные антител, такие как фрагменты антител, варианты или аддукты.
По крайней мере одна РНК в составе комплекса РНК по настоящему изобретению может также кодировать фрагменты антител, которые выбирают из следующих фрагментов вышеупомянутых антител: Fab, Fab', F(ab')2, Fc, Facb, pFc', Fd и Fv. В основном, указанные фрагменты антител известны в области техники. Например, Fab фрагмент ("антигенсвязывающий фрагмент") состоит из одного консервативного и одного вариабельного домена тяжелой и легкой цепей. Два вариабельных домена связываются с эпитопом на специфических антигенах. Две цепи соединены дисульфидной связью. scFv фрагмент ("одноцепочечный вариабельный фрагмент"), например, обычно состоит из вариабельных доменов легкой и тяжелой цепей. Домены обычно связаны искусственной полипептидной связью, например, представляют собой пептиды, содержащие 15-25 остатков глицина, пролина и/или серина.
Согласно настоящему изобретению, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению может кодировать фрагменты и/или варианты вышеупомянутых терапевтически активных белков, антигенов или антител, причем гомология фрагментов и/или вариантов по сравнению с последовательностью одного из вышеупомянутых терапевтически активных белков, антигенов или антител составляет по крайней мере 70%, 80% или 85%, предпочтительно по крайней мере 90%, более предпочтительно по крайней мере 95% и наиболее предпочтительно по крайней мере 99% по сравнению с полноразмерной кодирующей нуклеотидной последовательностью или кодируемой аминокислотной последовательностью указанных терапевтически активных белков, антигенов или антител. Предпочтительно, фрагменты и/или варианты проявляют биологическую функцию или специфическую активность, аналогичную полноразмерным природным терапевтически активным белкам, антигенам или антителам, например специфическую связывающую способность (например, прежде всего, в отношении антигенов), каталитическую активность (например, терапевтически активные белки), и т.п. В данном контексте, термин "биологическая функция" антител, используемый в настоящем описании, также относится к нейтрализации антигенов, активации комплемента или опсонизации. Таким образом, антитела обычно распознают нативные эпитопы на поверхности клетки, либо свободные антигены. Антитела, как определено выше, могут взаимодействовать с презентированными на клетках антигенами и инициировать различные защитные механизмы. С одной стороны, антитела могут инициировать сигнальные механизмы в клетке-мишени, что приводит к саморазрушению клетки (апопотозу). С другой стороны, антитело может маркировать клетку таким образом, чтобы другие компоненты или эффекторные клетки иммунной системы организма могли ее распознать и атаковать. Механизмы атаки включают антителозависимую комплемент-опосредованную цитотоксичность (АЗКОЦ) и антителозависимую клеточную цитотоксичность (АЗКЦ). АЗКЦ включает распознавание антитела иммунными клетками, которые захватывают клетки, меченные антителом, или напрямую или за счет привлечения других типов клеток, что приводит к гибели меченных клеток. АЗКОЦ представляет собой процесс активации каскада реакций различных белков комплемента, обычно когда несколько антител находятся в непосредственной близости друг от друга, что приводит либо к лизису клеток, либо к вовлечению других иммунных клеток в указанную область для проявления эффекторной функции. При нейтрализации антигена, антитело связывается с антигеном и нейтрализует его. Указанная реакция нейтрализации в свою очередь в основном приводит к блокированию антитела. Таким образом, антитело может связываться только с одним антигеном, или, в случае биспецифического антитела с двумя антигенами. Прежде всего, scFv фрагменты антитела используются для реакций нейтрализации, так как они не обладают свойствами консервативного домена антитела. При активации комплемента, комплексная система белков комплемента активируется при связывании антитела, которое является независимым от Fc участка антитела. Конечные продукты комплементного каскада приводят к лизису клетки и к формированию воспалительной среды. При опсонизации патогены или другие неклеточные частицы становятся чувствительными к фагоцитозу при связывании с консервативными доменами антител. В другом варианте, клетки, которые распознаются как чужеродные, лизируются по механизму АЗКЦ. Лизис, прежде всего, выполняется природными клетками-киллерами при активации Fc рецепторов.
Для того чтобы определить процент гомологии последовательностей двух РНК (нуклеотидных или аминокислотных), последовательности совмещают и сравнивают одну с другой. Затем, например, можно вставить пробелы в первую последовательность и сравнивать с компонентом в соответствующем положении второй последовательности. Если компонент в первой последовательности идентичен компоненту второй последовательности, то две последовательности в указанном положении являются идентичными. Гомологию (идентичность) двух последовательностей в процентах рассчитывают при делении числа идентичных положений на общее число положений.
Гомологию двух последовательностей в процентах можно определить с использованием математического алгоритма. Предпочтительный пример математического алгоритма, который можно использовать, но, не ограничиваясь только им, описан в статьях: Karlin и др., PNAS USA, 90, сс.5873-5877 (1993) или Altschul и др., Nucleic Acids Res, 25, сс.3389-3402 (1997). Указанный алгоритм используется программой BLAST. Последовательности, которые в определенной степени гомологичны последовательностям РНК в составе комплекса РНК по настоящему изобретению анализировали с использованием этой программы.
По крайней мере одна РНК из указанных в составе комплекса РНК по настоящему изобретению, кодирующая аминокислотные последовательности, которые содержат консервативную(ые) замену(ы) по сравнению с физиологической последовательностью, включены в термин «варианты». Термин "консервативные замены" обозначает замены природных кодируемых аминокислотных остатков на аминокислоты одного и того же класса. Прежде всего, указанные замены кодируемых аминокислот включают аминокислоты, содержащие алифатические боковые цепи, положительно или отрицательно заряженные боковые цепи, ароматические боковые цепи или аминокислоты, участки цепей, которые могут образовывать водородные связи, например, аминокислоты, содержащие гидроксильные группы. Такие замены включают, например, замену аминокислоты с полярной боковой группой на другую аминокислоту с аналогичной полярной боковой группой, или, например, замену аминокислоты с гидрофобной боковой группой на другую аминокислоту с аналогичной гидрофобной боковой группой (например, замену серина (треонина) на треонин (серин) или лейцина (изолейцина) на изолейцин (лейцин)). Вставки и замены возможны, прежде всего, в таких положениях последовательности, изменения которых не влияют на трехмерную структуру белка или не влияют на участок связывания. Модификации трехмерной структуры за счет вставки (вставок) или делеции (делеций) можно идентифицировать, например, по измерению КД-спектра (спектра циркулярного дихроизма) (Urry, Absorption, Circular Dichroism and ORD ofPolypeptides, Modern Physical Methods in Biochemistry, под ред. Neuberger и др., Elsevier, Амстердам (1985)).
Иммуностимулирующая РНК
Согласно третьему варианту, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению является иммуностимулирующей РНК. Таким образом, Иммуностимулирующая РНК может оказывать иммуностимулирующее действие еще до образования комплекса РНК с олигопептидом по настоящему изобретению формулы (I), как определено выше, или, более предпочтительно, иммуностимулирующее действие РНК, которую используют в настоящем изобретении, можно усилить или даже индуцировать при образовании комплекса РНК с олигопептидом по настоящему изобретению формулы (I), как определено выше. Иммуностимулирующей РНК в составе комплекса РНК по настоящему изобретению является любая РНК, например, кодирующая РНК, как определено выше. Предпочтительно, иммуностимулирующей РНК является одноцепочечная, двухцепочечная или частично двухцепочечная РНК, более предпочтительно одноцепочечная РНК, и/или циклическая или линейная РНК, более предпочтительно линейная РНК. Более предпочтительно, иммуностимулирующей РНК является (линейная) одноцепочечная РНК. Еще более предпочтительно, иммуностимулирующей РНК является ((линейная) одноцепочечная) матричная РНК (мРНК). Иммуностимулирующая РНК также может существовать в виде короткого олигонуклеотида РНК, как определено выше.
Иммуностимулирующая РНК, которую используют в настоящем изобретении, кроме того, выбирают из любого класса природных или синтетических РНК, которые индуцируют иммунный ответ. В данном контексте, иммунный ответ осуществляется по различным механизмам. Существенным фактором для пригодного иммунного ответа является стимуляция различных субпопуляций Т-клеток. Т-лимфоциты обычно подразделяются на две субпопуляции, Т-хелперы 1 (Th1) и Т-хелперы 2 (Th2), которые иммунная система использует для уничтожения внутриклеточных (ТЫ) и внеклеточных (Th2) патогенов (например, антигены). Две популяции клеток Th различаются по набору вырабатываемых ими эффекторных белков (цитокинов). Таким образом, ТЫ клетки ускоряют клеточный иммунный ответ за счет активации макрофагов и цитотоксичных Т-клеток. Th2 клетки, с другой стороны, ускоряют гуморальный иммунный ответ за счет стимуляции В-клеток, при этом происходит их превращение в плазматические клетки и формирование антител (например против антигенов). Следовательно, соотношение Th1/Th2 имеет большое значение в развитии иммунного ответа. Согласно настоящему изобретению, соотношение Th1/Th2 иммунного ответа предпочтительно сдвигать в сторону клеточного ответа (ТЫ ответ) и таким образом индуцировать клеточный иммунный ответ. Например, иммунная система активируется лигандами Toll-подобных рецепторов (TLR). TLR относятся к семейству высококонсервативных полипептидных образраспознающих рецепторов (ОРР), которые распознают патоген-ассоциированный образ и играют важную роль в развитии врожденного иммунитета млекопитающих. В настоящее время идентифицировано по крайней мере тринадцать членов семейства, обозначаемых TLR1-TLR13 (Toll-подобные рецепторы: TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13). Кроме того, определено число специфических лигандов TLR. Например, было установлено, что неметилированная бактериальная ДНК и ее синтетические аналоги (CpG ДНК) являются лигандами TLR9 (Hemmi Н. и др. Nature, 408, сс.40-745, (2000), Bauer S. и др. Proc. Natl. Acad. Sci. USA 98, cc. 9237-9242, (2001)). Кроме того, сообщалось, что лиганды определенных рецепторов TLR включают определенные нуклеиновые кислоты и что определенные типы РНК оказывают иммуностимулирующее действие по последовательность-независимому или последовательность-зависимому механизму, причем указанные различные иммуностимулирующие РНК могут, например, стимулировать рецепторы TLR3, TLR7, или TLR8, или внутриклеточные рецепторы, такие как RIG-I, MDA-5 и т.п. Например, в заявке Lipford и др. WO 03/086280, указано, что определенные G,U-содержащие олигорибонуклеотиды являются иммуностимулирующими за счет активации рецепторов TLR7 и TLR8. Иммуностимулирующие G,U-содержащие олигорибонуклеотиды, как было установлено Lipford и др., образуются из РНК, включая рибосомальную РНК, транспортную РНК, матричную РНК и вирусную РНК.
В настоящем изобретении было установлено, что любая РНК, как, например, определено выше, (независимо от ее длины, типа цепи, типа модификации и/или нуклеотидной последовательности) образует комплекс с пептидом-носителем формулы 

Таким образом, по крайней мере одна (иммуностимулирующая) РНК в составе комплекса РНК по настоящему изобретению содержит любую последовательность РНК, т.е. известную иммуностимулирующую последовательность, включая, но, не ограничиваясь только ими, последовательности РНК, представляющие и/или кодирующие лиганды TLR, предпочтительно выбирают из семейства рецепторов TLR1 - TLR13, более предпочтительно TLR7 и TLR8, лиганды внутриклеточных рецепторов для РНК (таких как RIG-I или MAD-5, и т.п.) (см. например Meylan E., Tschopp. J., Toll-like receptors and PHK helicases: two parallel ways to trigger antiviral responses, Mol. Cell 11, cc.561 -569 (2006)), или любую другую иммуностимулирующую последовательность РНК. Кроме того, классы РНК, которые можно использовать в качестве иммуностимулирующих РНК, включают любую другую РНК, способную индуцировать иммунный ответ. Указанные иммуностимулирующие РНК включают, но, не ограничиваясь только ими, рибосомальную РНК (рРНК), транспортную РНК (тРНК), матричную РНК (мРНК) и вирусную РНК (вРНК).
Указанные классы РНК, которые можно использовать в качестве по крайней мере одной (иммуностимулирующей) РНК в составе комплекса РНК по настоящему изобретению, включают, но, не ограничиваясь только ими, например РНК формулы (IIa):
GlXmGn
где:
G обозначает гуанозин, урацил или аналог гуанозина или урацила,
Х обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог вышеперечисленных нуклеотидов,
l равно целому числу от 1 до 40,
где если l=1, то G обозначает гуанозин или его аналог,
если l>1, то по крайней мере 50% нуклеотидов являются гуанозином или его аналогом,
m равно целому числу и равно по крайней мере 3,
где если m=3, то Х обозначает урацил или его аналог,
если m>3, то по крайней мере 3 урацила или аналогов урацила расположены последовательно друг за другом,
n равно целому числу от 1 до 40,
где если n=1, то G означает гуанозин или его аналог,
если n>1, то по крайней мере 50% нуклеотидов являются гуанозином или его аналогом.
Кроме того, указанные дополнительные классы РНК, которые используют в качестве по крайней мере одной (иммуностимулирующей) РНК в составе комплекса РНК по настоящему изобретению, включают, но, не ограниваясь только ими, например РНК формулы (IIb):
ClXmCn
где:
С обозначает цитозин, урацил или аналог цитозина или урацила,
Х обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог вышеперечисленных нуклеотидов,
l равно целому числу от 1 до 40,
где если l=1, то С означает цитозин или его аналог,
если l>1, то по крайней мере 50% нуклеотидов являются цитозином или его аналогом,
m равно целому числу и равно по крайней мере 3,
где если m=3, то Х означает урацил или его аналог,
если m>3, то по крайней мере 3 урацила или аналогов урацила расположены последовательно друг за другом,
n равно целому числу от 1 до 40,
где если n=1, С означает цитозин или его аналог,
если n>1, то по крайней мере 50% нуклеотидов являются цитозином или его аналогом.
Предпочтительно, длина иммуностимулирующих РНК, которые используют в настоящем описании в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, составляет длину, как определено выше в основном для молекул РНК в составе комплекса РНК по настоящему изобретению, более предпочтительно длина составляет от 5 до 5000 нуклеотидов, от 500 до 5000 нуклеотидов или, более предпочтительно, от 1000 до 5000 нуклеотидов или, в другом варианте, от 5 до 1000 нуклеотидов, от 5 до 500 нуклеотидов, от 5 до 250 нуклеотидов, от 5 до 100 нуклеотидов, от 5 до 50 нуклеотидов или, более предпочтительно, от 5 до 30 нуклеотидов.
По крайней мере одну иммуностимулирующую РНК, которую используют в настоящем описании в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, кроме того, можно дополнительно модифицировать, предпочтительно "химическим методом" для усиления иммуностимулирующих свойств указанной РНК. Термин "химическая модификация" обозначает, что РНК, которую используют в качестве иммуностимулирующей РНК по настоящему изобретению, модифицируют при замещении, вставке или удалении индивидуальных или нескольких атомов или атомных групп по сравнению с природной РНК.
Предпочтительно, химическая модификация РНК включает по крайней мере один аналог природных нуклеотидов. Список включает, но, не ограничиваясь только ими, примеры указанных нуклеотидных аналогов, которые можно использовать в настоящем изобретении: аналоги гуанозина, урацила, аденозина, тимидина, цитозина. Химическая модификация включает модификацию оснований, модификацию остатков рибозы и/или фосфатных остатков. В данном контексте, аналоги гуанозина, урацила, аденозина и цитозина включают, но, не ограничиваясь только ими, любой природный или синтетический гуанозин, урацил, аденозин, тимидин или цитозин, которые модифицированы химическим методом, например при ацетилировании, метилировании, гидроксилировании и т.п., и включают 1-метиладенозин, 1-метилгуанозин, 1-метилинозин, 2,2-диметилгуанозин, 2,6-диаминопурин, 2'-амино-2'-дезоксиаденозин, 2'-амино-2'-деоксицитидин, 2'-амино-2'-дезоксигуанозин, 2'-амино-2'-дезоксиуридин, 2-амино-6-хлорпуринрибозид, 2-аминопуринрибозид, 2'-арааденозин, 2'-арацитидин, 2'-арауридин, 2'-азидо-2'-дезоксиаденозин, 2'-азидо-2'-деоксицитидин, 2'-азидо-2'-дезоксигуанозин, 2'-азидо-2'-дезоксиуридин, 2-хлораденозин, 2'-фтор-2'-дезоксиаденозин, 2'-фтор-2'-деоксицитидин, 2'-фтор-2'-дезоксигуанозин, 2'-фтор-2'-дезоксиуридин, 2'-фтортимидин, 2-метиладенозин, 2-метилгуанозин, 2-метилтио-М6-изопентиладенозин, 2'-O-метил-2-аминоаденозин, 2'-O-метил-2'-дезоксиаденозин, 2'-O-метил-2'-деоксицитидин, 2'-O-метил-2'-дезоксигуанозин, 2'-O-метил-2'-дезоксиуридин, 2'-O-метил-5-метилуридин, 2'-O-метилинозин, 2'-O-метилпсевдоуридин, 2-тиоцитидин, 2-тиоцитозин, 3-метилцитозин, 4-ацетилцитозин, 4-тиоуридин, 5-(карбоксигидроксиметил)урацил, 5,6-дигидроуридин, 5-аминоаллилцитидин, 5-аминоаллилдезоксиуридин, 5-бромуридин, 5-карбоксиметиламинометил-2-тиоурацил, 5-карбоксиметиламинометилурацил, 5-хлорарацитозин, 5-фторуридин, 5-иодуридин, 5-метоксикарбонилметилуридин, 5-метоксиуридин, 5-метил-2-тиоуридин, 6-азацитидин, 6-азауридин, 6-хлор-7-деазагуанозин, 6-хлорпуринрибозид, 6-меркаптогуанозин, 6-метилмеркаптопуринрибозид, 7-деаза-2'-дезоксигуанозин, 7-деазааденозин, 7-метилгуанозин, 8-азааденозин, 8-бромаденозин, 8-бромгуанозин, 8-меркаптогуанозин, 8-оксогуанозин, бензимидазолрибозид, P-D-маннозилквеуозин, дигидроурацил, инозин, N1-метиладенозин, N6-([6-аминогексил]карбамоилметил)аденозин, N6-изопентениладенозин, N6-метиладенозин, N7-метилксантозин, метиловый эфир N-урацил-5-оксиуксусной кислоты, пуромицин, квеуозин, урацил-5-оксиуксусная кислота, метиловый эфир урацил-5-оксиуксусной кислоты, вибутоксозин, ксантозин и ксилоаденозин. Способы получения указанных аналогов известны специалистам в данной области, например, описаны в патентах US №4373071, US №4401796, US №4415732, US №4458066, US №4500707, US №4668777, US №4973679, US №5047524, US №5132418, US №5153319, US №5262530 и №5700642. В случае использования аналогов, как описано выше, прежде всего, предпочтительны аналоги по настоящему изобретению, которые усиливают иммунногенность последовательности иммуностимулирующей РНК, которую используют в настоящем описании в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению и/или такие аналоги не влияют на дальнейшую модификацию, указанной иммуностимулирующей РНК.
Короткая интерферирующая РНК (киРНК)
В четвертом варианте, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению находится в форме киРНК. киРНК представляет интерес прежде всего в связи с явлением интерференции РНК. Феномен интерференции РНК имеет значение в ходе проведения иммунологических исследований. В последние годы был установлен РНК-обусловленный защитный механизм, который выявлен, как в мире грибов, так и во флоре и фауне и действует как "иммунная система генома". Указанная система сначала была описана для различных видов, независимо друг от друга, впервые для вида С.elegans, а затем появилась возможность идентифицировать лежащие в основе механизмы процессов, которые являются идентичными: РНК-опосредованная резистентность к вирусам у растений, посттранскрипционный сайленсинг генов в растениях и интерференция РНК у эукариот, соответственно, основаны на общем механизме. Методика in vitro интерференции РНК (РНКи) основана на двухцепочечных молекулах РНК (дцРНК), которые индуцируют сиквенс-специфическую супрессию генной экспрессии (Zamore, Nat. Struct. Biol. 9, сс.746-750 (2001), Sharp, Genes Dev. 5, сс.485-490 (2001), Hannon, Nature, 41, cc.244-251 (2002)). При трансфекции клеток млекопитающих длинной дцРНК активация протеинкиназы R и РНКзы L приводит к неспецифическим эффектам, таким как, например, интерферонный ответ (Stark и др., Annu. Rev. Biochem., 67, сс.227-264 (1998), Не и Katze, Viral ImmunoL, 15, cc.95-119 (2002)). Указанные неспецифические эффекты исключены при использовании короткой, например, содержащей от 21 до 23 оснований, так называемой киКНК (короткая интерферирующая РНК), так как неспецифические эффекты не индуцируются киКНК, которая короче на 30 п.о. (Elbashir и др. Nature, 411, сс.494-498 (2001)). Недавно дцКНК также начали использовать in vivo (McCaffrey и др., Nature, 418, cc.38-39 (2002), Xia и др., Nature Biotech., 20, cc.1006-1010 (2002), Brummelkamp и др., Cancer Cell, 2, cc.243-247 (2002)). Таким образом, киРНК, которую используют для образования комплексов РНК по настоящему изобретению, обычно включает (одно- или) двухцепочечную НК, предпочтительно двухцепочечную РНК, длиной от приблизительно 8 до 30 нуклеотидов, предпочтительно от 17 до 25 нуклеотидов, еще более предпочтительно от 20 до 25 нуклеотидов и наиболее предпочтительно от 21 до 23 нуклеотидов. В принципе, все участки длиной от 17 до 29 нуклеотидов, предпочтительно от 19 до 25 нуклеотидов, более предпочтительно от 21 до 23 нуклеотидов, которые присутствуют в кодирующем участке последовательности РНК, как указано выше, например, в последовательности мРНК, можно использовать в качестве последовательности-мишени для киРНК. Аналогичным образом, киРНК также могут обладать сродством к нуклеотидным последовательностям (терапевтического) белка или антигена, указанного в данном контексте, которые находятся вне кодирующего участка, прежде всего в 5'-некодирующем участке РНК, например, сродством к некодирующим участкам РНК, проявляющих регуляторную функцию. Следовательно, последовательность-мишень для киРНК находится в транслируемом и/или нетранслируемом участке РНК и/или в участке контрольных элементов. Последователыюсть-мишень для киРНК также может располагаться в перекрывающейся области нетранслируемой и транслируемой последовательности, прежде всего, последовательность-мишень содержит по крайней мере один нуклеотид левее стартового триплета кодирующего участка РНК.
Антисмысловая РНК
Согласно пятому варианту, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению является антисмысловой РНК. В данном контексте, антисмысловая РНК является предпочтительно одноцепочечной РНК, транскрипция которой происходит на основе кода матричной одноцепочечной ДНК, и таким образом, она является комплементарной к смысловой (матричной) РНК. Антисмысловая РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, обычно образует дуплекс смысловой и антисмысловой молекул РНК и таким образом блокирует трансляцию мРНК. Антисмысловая РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, проявляет аффинность (комплементарность) к любому участку последовательности мРНК, которая кодирует (терапевтический) белок или антиген (например, как указано в данном контексте), если тем самым указанная трансляция кодируемого белка уменьшается/подавляется. Таким образом, последовательность-мишень для антисмысловой РНК в мРНК-мишени находится в транслируемом и/или нетранслируемом участке мРНК, например в участке контрольных элементов мРНК, прежде всего в 5'-некодирующем участке РНК, выполняющим регуляторную функцию. Последовательность-мишень для антисмысловой РНК в мРНК-мишени можно также конструировать таким образом, чтобы антисмысловая РНК связывалась с мРНК при перекрывании ее последовательности участком, который частично комплементарен к нетранслируемой и транслируемой (кодирующей) последовательности мРНК-мишени, прежде всего, антисмысловая РНК должна проявлять комплементарность к последовательности-мишени мРНК по крайней мере к одному нуклеотиду, расположенному левее стартового триплета кодирующего участка мРНК-мишени. Предпочтительно, длина антисмысловой РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, составляет длину, в целом определенную выше для РНК (в составе комплекса РНК по настоящему изобретению). Обычно антисмысловой РНК, которую используют в настоящем изобретении в качестве по крайней мере одной молекулы РНК в составе комплекса РНК по настоящему изобретению, является фрагмент мРНК-мишени. Более подробно, длина антисмысловой РНК составляет более предпочтительно от 5 до 5000 нуклеотидов, от 500 до 5000 нуклеотидов, и, более предпочтительно, от 1000 до 5000 нуклеотидов или, в другом варианте, от 5 до 1000, от 5 до 500, от 5 до 250, от 5 до 100, от 5 до 50 нуклеотидов или от 5 до 30 нуклеотидов, или, в другом варианте и еще более предпочтительно от 20 до 100, от 20 до 80 или от 20 до 60 нуклеотидов.
Модификация РНК
В одном варианте осуществления настоящего изобретения, РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению (независимо от ее, например, специфической терапевтической эффективности, длины и/или последовательности), прежде всего, представляет собой короткий олигонуклеотид РНК, кодирующую РНК, иммуностимулирующую РНК, киРНК, антисмысловую РНК, рибо-переключатели, рибозимы или аптамеры, и ее получают в виде модифицированной РНК, причем любую модификацию (прежде всего модификацию, описанную ниже) проводят (в любой комбинации или каждую в отдельности), как определено выше. Однако, определенные типы модификаций более пригодны для специфических типов РНК (например, наиболее пригодны для кодирующей РНК), в то время как другие типы модификации можно использовать для любых РНК, например как определено в настоящем описании, но, не ограничиваясь только специфическими типами РНК. Таким образом, модификацию РНК проводят для обеспечения специфических эффектов или эффектов комплекса, которые требуются при применении по настоящему изобретению. Таким образом, модификацию проводят, например, для стабилизации РНК от деградации, для усиления способности РНК к трансфекции, для улучшения способности РНК к трансляции, для увеличения иммуногенной эффективности РНК и/или для усиления терапевтической эффективности РНК (например, усиление сайленсинга или антисмысловых свойств). Предпочтительно, чтобы в результате модификации РНК в качестве компонента комплекса РНК по настоящему изобретению, достигалось улучшение по крайней мере одного функционального свойства, более предпочтительно по крайней мере двух функциональных свойств, например, стабилизация РНК и улучшение терапевтической или иммуногенной эффективности.
Основная задача заключается в стабилизации РНК, которую используют в настоящем изобретении в качестве по крайней мере одной молекулы РНК в составе комплекса РНК по настоящему изобретению, с целью увеличения периода полураспада РНК in vivo. Предпочтительно, период полураспада модифицированной РНК в условиях in vivo увеличивается (по сравнению с немодифицированной РНК) по крайней мере, на 20%, более предпочтительно по крайней мере на 40%, более предпочтительно по крайней мере на 50% и еще более предпочтительно по крайней мере на 70%, 80%, 90%, 100%, 150% или 200%. Модификация за счет стабилизации РНК позволяет увеличить период полураспада модифицированной мРНК по крайней мере, на 5 мин, 10 мин, 15 мин, 30 мин или более предпочтительно по крайней мере на 60 мин по сравнению с немодифицированной РНК.
Согласно одному варианту по крайней мере одну РНК в составе комплекса РНК по настоящему изобретению, предпочтительно кодирующую РНК, например мРНК, можно стабилизировать при модификации содержания G/C, например, в кодирующем участке РНК. В предпочтительном варианте по настоящему изобретению, изменяют содержание G/C в кодирующем участке РНК (в составе комплекса РНК по настоящему изобретению), прежде всего, увеличивают по сравнению с содержанием G/C в кодирующем участке соответствующей РНК дикого типа, т.е. по сравнению с немодифицированной РНК. Кодируемую аминокислотную последовательность в соответствующей модифицированной РНК предпочтительно не изменяют по сравнению с кодируемой аминокислотной последовательностью в соответствующей РНК дикого типа.
Указанная модификация РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, основана на том факте, что для эффективной трансляции указанной РНК определяющей является кодирующая последовательность любой РНК, предназначенной для трансляции. Прежде всего, последовательность с повышенным содержанием G (гуанозин)/С (цитозин), более стабильна по сравнению с последовательностью с повышенным содержанием А (аденозин)/и (урацил). Следовательно, согласно настоящему изобретению, кодоны РНК изменяют по сравнению с кодонами РНК дикого типа, но при этом сохраняется транслируемая аминокислотная последовательность, а кодоны характеризуются увеличенным содержанием G/C. В связи с тем, что несколько кодонов кодируют одну и ту же аминокислоту (так называемая выраженность генетического кода), можно выбрать более предпочтительные кодоны для увеличения стабильности (так называемое альтернативное использование кодона).
В зависимости от аминокислоты, которую кодирует РНК, используемая в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, существуют различные методы модификации последовательности РНК, по сравнению с соответствующей последовательностью дикого типа. В случае аминокислот, которые кодируются кодонами, в основном содержащими нуклеотиды G или С, нет необходимости в модификации кодона. Таким образом, кодоны для Pro (ССС или CCG), Arg (CGC или CGG), Ala (GCC или GCG) и Gly (GGC или GGG) не требуют модификации, так как в них отсутствуют А или U.
Наоборот, кодоны, которые содержат нуклеотиды А и/или U, можно модифицировать при замене на другие кодоны, которые кодируют те же самые аминокислоты, но не содержат А и/или U. Примеры указанных модификаций кодонов:
кодоны для Pro модифицируют при замене CCU или ССА на ССС или CCG,
кодоны для Arg модифицируют при замене CGU или CGA, или AGA или AGG на CGC или CGG,
кодоны для Ala модифицируют при замене GCU или GCA на GCC или GCG,
кодоны для Gly модифицируют при замене GGU или GGA на GGC или GGG.
В других случаях, не смотря па то, что нуклеотиды А или U не следует удалять из кодонов, однако можно уменьшить содержание А и U с использованием кодонов с более низким содержанием нуклеотидов А и/иди U. Примеры указанных модификаций кодонов:
кодоны для Phe модифицируют при замене UUU на UUC, кодоны для Leu модифицируют при замене UUA, UUG, CUU или CUA на CUC или CUG,
кодоны для Ser модифицируют при замене UCU или UCA, или AGU на UCC, UCG или AGC,
кодон для Tyr модифицируют при замене UAU на UAC, кодон для Cys модифицируют при замене UGU на UGC, кодон для His модифицируют при замене CAU на САС, кодон для Gin модифицируют при замене САА на CAG, кодоны для Не модифицируют при замене AUU или AUA на AUC, кодоны для Thr модифицируют при замене ACU или АСА на АСС или ACG,
кодон для Asn модифицируют при замене AAU на ААС, кодон для Lys модифицируют при замене ААА на AAG, кодоны для Val модифицируют при замене GUU или GUA на GUC или GUG,
кодон для Asp модифицируют при замене GAU на GAC, кодон для Glu модифицируют при замене GAA на GAG, стоп-кодон UAA модифицируют при замене на UAG или UGA. С другой стороны, в случае кодонов, кодирующих Met (AUG) и Trp (UGG), возможность модификации последовательности отсутствует.
Замены, перечисленные выше, можно использовать каждую в отдельности или во всех возможных комбинациях для увеличения содержания G/C в РНК, которую используют в настоящем описании в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, по сравнению прежде всего с РНК дикого типа (т.е. с исходной последовательностью). Таким образом, например, все кодоны для Thr, содержащиеся в последовательности дикого типа, можно модифицировать при замене на АСС (или ACG). Однако, предпочтительные примеры используемых комбинаций вышеперечисленных возможных замен, представлены ниже:
замена всех кодонов, кодирующих Thr в исходной последовательности, (РНК дикого типа) на АСС (или ACG) и
замена всех кодонов, в исходной последовательности, кодирующих Ser, на UCC (или UCG или AGC),
замена всех кодонов, кодирующих Не в исходной последовательности, на AUC и
замена всех кодонов, кодирующих Lys в исходной последовательности, на AAG и
замена всех кодонов, кодирующих Tyr в исходной последовательности, на UAC,
замена всех кодонов, кодирующих Val в исходной последовательности, на GUC (или GUG) и
замена всех кодонов, кодирующих Glu в исходной последовательности, на GAG и
замена всех кодонов, кодирующих Ala в исходной последовательности, на GCC (или GCG) и
замена всех кодонов, кодирующих Arg в исходной последовательности, на CGC (или CGG),
замена всех кодонов, кодирующих Val в исходной последовательности, на GUC (или GUG) и
замена всех кодонов, кодирующих Glu в исходной последовательности, на GAG и
замена всех кодонов, кодирующих Ala в исходной последовательности, на GCC (или GCG) и
замена всех кодонов, кодирующих Gly в исходной последовательности, на GGC (или GGG) и
замена всех кодонов, кодирующих Asn в исходной последовательности, на ААС,
замена всех кодонов, кодирующих Val в исходной последовательности, на GUC (или GUG) и
замена всех кодонов, кодирующих Phe в исходной последовательности, на UUC и
замена всех кодонов, кодирующих Cys в исходной последовательности, на UGC и
замена всех кодонов, кодирующих Leu в исходной последовательности, на CUG (или CUC) и
замена всех кодонов, кодирующих GIn в исходной последовательности, на САО и
замена всех кодонов, кодирующих Pro в исходной последовательности, на ССС (или CCG) и т.п.
Предпочтительно, содержание G/C в кодирующем участке РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, увеличивают по крайней мере на 7%, более предпочтительно по крайней мере на 15%, еще более предпочтительно по крайней мере на 20% по сравнению с содержанием G/C в кодирующем участке РНК дикого типа, который кодирует белок.
Таким образом, согласно специфическому варианту по крайней мере 60%, более предпочтительно по крайней мере 70%, еще более предпочтительно по крайней мере 80% и наиболее предпочтительно по крайней мере 90%, 95% или даже 100% заменяемых кодонов в указанном участке, кодирующем белок, или во всей последовательности РНК дикого типа заменены, при этом содержание GC в указанной последовательности увеличивается или даже максимально увеличивается.
В данном контексте, предпочтительно, прежде всего, увеличивают содержание G/C в РНК, которую используют по настоящему изобретению в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, до максимального значения (т.е. до 100% взаимозаменяемых кодонов), прежде всего в участке, кодирующем белок по сравнению с последовательностью дикого типа,
Согласно настоящему изобретению, другая предпочтительная модификация РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, основана на том, что эффективность трансляции также определяется различной частотой присутствия тРНК в клетках. Таким образом, если в последовательности РНК в основном содержатся так называемые "редкие кодоны", то соответствующая модифицированная последовательность РНК будет транслироваться в значительно меньшей степени по сравнению со случаем, когда присутствуют кодоны, кодирующие относительно "часто встречающиеся" тРНК.
Согласно настоящему изобретению, в РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, модифицируют фрагмент, который кодирует белок, по сравнению с соответствующим участком РНК дикого типа, и в результате по крайней мере один кодон в последовательности дикого типа, который кодирует тРНК, относительно редко встречающуюся в клетке, заменен на кодон, который кодирует тРНК, относительно часто встречающуюся в клетке и переносящую ту же аминокислоту, что и относительно редкая тРНК. При такой модификации, последовательности РНК модифицируют при вставке кодонов, которые доступны для часто встречающихся молекул тРНК. Другими словами, согласно настоящему изобретению, в результате указанной модификации все кодоны в последовательности дикого типа, которые кодируют тРНК, которая относительно редко встречается в клетке, можно в каждом случае заменить на кодоны, которые кодируют тРНК, которая относительно часто встречается в клетке и которые, в каждом случае, переносят те же самые аминокислоты, что и относительно редкая тРНК.
Относительно часто встречающиеся в клетке тРНК и относительно редко встречающиеся в клетке тРНК описаны в литературе, например, в статье Akashi, Curr. Opin. Genet. Dev., 11 (6), сс.660-666 (2001). Прежде всего, предпочтительны кодоны, которые используются наиболее часто встречающейся тРНК для конкретной аминокислоты, например предпочтителен кодон Gly, который используется наиболее часто встречающейся в клетках человека тРНК.
Согласно настоящему изобретению, прежде всего предпочтительно присоединять последовательность с повышенным содержанием G/C, прежде всего с максимальным содержанием G/C, к молекуле РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, к "часто встречающимся" кодонам без модификации аминокислотной последовательности белка, который кодируется кодирующим участком РНК. Указанный предпочтительный вариант позволяет получать, прежде всего, эффективно транслируемую и стабилизированную (модифицированную) РНК в составе комплекса РНК по настоящему изобретению.
Определение содержания G/C в РНК, которую используют в настоящем изобретении в качестве по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению (увеличенное содержание G/C, замена тРНК) можно осуществлять с использованием компьютерной программы, описанной в заявке WO 02/098443, содержание которой в полном объеме включено в объем настоящего изобретения. Используя указанную компьютерную программу, можно модифицировать нуклеотидную последовательность любой требуемой РНК с помощью генетического кода или его выраженности, чтобы получить РНК с максимально возможным содержанием G/C, в комбинации с применением кодонов, которые кодируют тРНК, максимально часто встречающуюся в клетке, при этом аминокислотную последовательность, кодируемую молекулой РНК, предпочтительно не модифицируют по сравнению с немодифицированной последовательностью. В другом варианте, также можно изменять только содержание G/C или использовать только часто используемые кодоны по сравнению с исходной последовательностью. Исходный код программы Visual Basic 6.0 (разработана фирмой Microsoft Visual Studio Enterprise 6.0, с программным обеспечением Servicepack 3) также описан в заявке WO 02/098443.
В другом предпочтительном варианте осуществления настоящего изобретения, содержание A/U в окружении сайта связывания с рибосомой по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению увеличивают по сравнению с содержанием A/U в окружении сайта связывания с рибосомой в конкретной РНК дикого типа. Указанная модификация (увеличение A/U в окружении сайта связывания с рибосомой) повышает эффективность связывания рибосомы с модифицированной РНК. Эффективность связывания рибосом с сайтом связывания с рибосомой (последовательность Козака: GCCGCCACCAUGG (SEQ ID NO: 33), AUG образует стартовый кодон) в свою очередь оказывает влияние на эффективность трансляции модифицированной РНК.
Согласно другому варианту по крайней мере одну РНК в составе комплекса РНК по настоящему изобретению модифицируют с учетом потенциально дестабилизирующих элементов в последовательности. Прежде всего, кодирующий участок и/или 5' и/или 3' нетранслируемый участок в указанной РНК модифицируют по сравнению с конкретной РНК дикого типа таким образом, чтобы РНК не содержала дестабилизирующие элементы, причем РНК, кодирующую аминокислотную последовательность, предпочтительно не модифицируют по сравнению с конкретной РНК дикого типа. Например, известно, что в последовательностях эукариотических РНК присутствуют дестабилизирующие элементы (ДСЭ), к которым присоединяются сигнальные белки и таким образом происходит регуляция ферментативной деградации РНК in vivo. Для дальнейшей стабилизации РНК, необязательно в участке, который кодирует белок, проводят одну или более указанных модификаций по сравнению с соответствующим участком РНК дикого типа таким образом, чтобы последовательность не содержала или практически не содержала дестабилизирующих элементов. Согласно настоящему изобретению, по крайней мере одну РНК в составе комплекса РНК по настоящему изобретению можно модифицировать, за счет удаления ДСЭ в нетранслируемых участках (3'- и/или 5'-UTR).
Указанными дестабилизирующими последовательностями являются, например, AU-обогащенные последовательности (AURES), которые расположены в 3'-UTR участках различных нестабильных РНК (Caput и др., Proc, Natl. Acad. Sci. USA, 83, cc.1670-1674 (1986)). Следовательно, РНК в составе комплекса РНК по настоящему изобретению предпочтительно модифицируют по сравнению с РНК дикого типа таким образом, чтобы исключить из последовательности РНК указанные дестабилизирующие последовательности. То же самое относится к таким мотивам последовательности, которые распознаются возможными эндонуклеазами, например, последовательность GAACAAG, которая содержится в 3'-UTR сегменте гена, который кодирует рецептор трансферрина (Binder и др., EMBO J., 13, сс.1969-1980 (1994)). Указанные мотивы последовательности также предпочтительно удаляют согласно настоящему изобретению по крайней мере в одной РНК в составе комплекса РНК по настоящему изобретению.
Согласно настоящему изобретению, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению содержит 5' кэппированную структуру. Примеры кэппированных структур, которые используют в настоящем изобретении, включают m7G(5')ppp, (5'(A,G(5')ppp(5')A и G(5')ppp(5')G.
Другая модификация для повышения стабильности по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению включает элонгацию РНК по 5'- или 3'-концевым фрагментам, при этом обычно проводят гомонуклеотидную элонгацию на 10 - 200 нуклеотидов. После осуществления указанных элонгации, прежде всего если в качестве РНК используют мРНК, РНК содержит поли-А концевой участок в 3' концевом фрагменте, включающий обычно приблизительно от 10 до 200 остатков аденозина, предпочтительно приблизительно от 10 до 100 остатков аденозина, более предпочтительно приблизительно от 20 до 70 остатков аденозина или еще более предпочтительно приблизительно от 20 до 60 остатков аденозина. В другом или дополнительном варианте, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению содержит, если в качестве РНК используют мРНК, прежде всего поли-С концевой участок в 3' концевом фрагменте, обычно включающий приблизительно от 10 до 200 остатков цитозина, предпочтительно приблизительно от 10 до 100 остатков цитозина, более предпочтительно приблизительно от 20 до 70 остатков цитозина или еще более предпочтительно приблизительно от 20 до 60 или даже от 10 до 40 остатков цитозина.
Другая модификация по крайней мере в одной РНК в составе комплекса РНК по настоящему изобретению, прежде всего если в качестве РНК используют мРНК, предпочтительно включает по крайней мере один участок IRES и/или по крайней мере одну 5'- и/или 3'-концевую стабилизирующую последовательность. Согласно настоящему изобретению, в РНК вставляют один или более так называемых участков IRES (участок внутренней посадки рибосомы). Таким образом, участок IRES проявляет функцию одного участка связывания с рибосомой, и также может служить для обеспечения РНК, которая кодирует несколько белков, транслируемых рибосомами независимо от другой мультицистронной РНК. Примеры последовательностей IRES, которые можно использовать по настоящему изобретению, включают последовательности из пикорнавирусов (например, вирус ящура), пестивирусов, полиовирусов, вирусов энцефаломиокардита, вирусов ящура, вирусов гепатита С (ВГС), вирусов классической чумы свиней, вирусов лейкомы мышей, вирусов иммунодефицита обезьян (ВИО) или вирусов паралича сверчков.
Согласно настоящему изобретению, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению содержит по крайней мере одну известную 5' и/или 3' стабилизирующую последовательность. Использование указанных стабилизирующих последовательностей в 5' и/или 3' нетранслирующих участках позволяет увеличить период полураспада РНК в цитозоле. Гомология указанных стабилизирующих последовательностей может составлять 100% по сравнению с природными последовательностями, которые присутствуют в вирусах, бактериях и эукариотах, а также могут быть частично или полностью синтетическими. В качестве примера стабилизирующих последовательностей, которые можно использовать в настоящем изобретении для стабилизации РНК можно упомянуть нетранслируемые последовательности (UTR) гена глобина, например, в последовательности видов Homo sapiens или Xenopus laevis. Другой пример стабилизирующей последовательности включает последовательность общей формулы (C/U)CCAN×CCC(U/A)Py×UC(C/U)CC (SEQ ID NO: 34), которая расположена в участке 3'UTR чрезвычайно стабильной РНК, кодирующей глобин, (1)-коллаген, 15-липоксигеназу или тирозингидроксилазу (см. Holcik и др., Proc. Natl. Acad. Sci. USA, 94, сс.2410-2414 (1997)). Указанные стабилизирующие последовательности можно использовать в отдельности или в комбинации друг с другом, а также в комбинации с другими стабилизирующими последовательностями, известными специалистам в данной области техники. Следовательно, по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению предпочтительно присутствует в виде глобин-UTR-(нетранслирующие участки)-стабилизированной РНК, прежде всего в виде глобин-UTR-стабилизированной РНК.
При необходимости по крайней мере одна РНК в составе комплекса РНК по настоящему изобретению включает модификации в основной цепи. Модификация в основной цепи по настоящему изобретению включает химическую модификацию фосфатных групп нуклеотидной цепи, содержащихся в РНК. Указанные модификации цепи в основной цепи обычно включают, но, не ограничиваясь только ими, модификации, выбранные из следующей группы: метилфосфонаты, фосфороамидаты и фосфоротиоаты (например цитидин-5'-O-(1-тиофосфат)).
По крайней мере одна РНК в составе комплекса РНК по настоящему изобретению, в дополнительном или другом варианте, также включает модификации сахаридных остатков. Модификация углеводных остатков по настоящему изобретению включает химическую модификацию сахаридных групп нуклеотидов и обычно включает, но, не ограничиваясь только ими, модификации углеводных остатков, которые выбирают из группы, включающей 2'-дезокси-2'-фторолигорибонуклеотид (2'-фтор-2'-дезоксицитидин-5'-трифосфат, 2'-фтор-2'-дезоксиуридин-5'-трифосфат), 2'-дезокси-2'-деаминоолигорибонуклеотид (2'-амино-2'-дезоксицитидин-5'-трифосфат, 2'-амино-2'-дезоксиуридин-5'-трифосфат), 2'-0-алкилолигорибонуклеотид, 2'-дезокси-2'-С-алкилолигорибонуклеотид (2'-O-метилцитидин-5'-трифосфат, 2'-метилуридин-5'-трифосфат), 2'-С-алкилолигорибонуклеотид, и их изомеры (2'-арацитидин-5'-трифосфат, 2'-арауридин-5'-трифосфат) или азидотрифосфат (2'-азидо-2'-дезоксицитидин-5'-трифосфат, 2'-азидо-2'-дезоксиуридин-5'-трифосфат).
По крайней мере одна РНК в составе комплекса РНК по настоящему изобретению, в дополнительном или другом варианте, также включает по крайней мере модификацию одного основания, которая предпочтительно пригодна для увеличения экспрессии белка, кодируемого по крайней мере одной РНК в значительной степени по сравнению с неизмененной, т.е. природной, последовательностью РНК. Термин "в значительной степени" в данном случае обозначает увеличение экспрессии белка по сравнению с экспрессией белка, кодируемого нативной РНК по крайней мере на 20%, предпочтительно по крайней мере на 30%, 40%, 50% или 60%, более предпочтительно по крайней мере на 70%, 80%, 90% или даже 100% и наиболее предпочтительно по крайней мере на 150%, 200% или даже 300%. Согласно настоящему изобретению, нуклеотид с модифицированным основанием предпочтительно выбирают из группы нуклеотидов с модифицированными основаниями, включающей 2-амино-6-хлорпуринрибозид-5'-трифосфат, 2-аминоаденозин-5'-трифосфат, 2-тиоцитидин-5'-трифосфат, 2-тиоуридин-5'-трифосфат, 4-тиоуридин-5'-трифосфат, 5-аминоаллилцитидин-5'-трифосфат, 5-аминоаллилуридин-5'-трифосфат, 5-бромцитидин-5'-трифосфат, 5-бромуридин-5'-трифосфат, 5-иодцитидин-5'-трифосфат, 5-иодуридин-5'-трифосфат, 5-метилцитидин-5'-трифосфат, 5-метилуридин-5'-трифосфат, 6-азацитидин-5'-трифосфат, 6-азауридин-5'-трифосфат, 6-хлорпуринрибозид-5'-трифосфат, 7-деазааденозин-5'-трифосфат, 7-деазагуанозин-5'-трифосфат, 8-азааденозин-5'-трифосфат, 8-азидоаденозин-5'-трифосфат, бензимидазолрибозид-5'-трифосфат, N1-метиладенозин-5'-трифосфат, N1-метилгуанозин-5'-трифосфат, N6-метиладенозин-5'-трифосфат, О6-метилгуанозин-5'-трифосфат, псевдоуридин-5'-трифосфат или пуромицин-5'-трифосфат, ксантозин-5'-трифосфат. Для модификации оснований предпочтительны, прежде всего, нуклеотиды, которые выбирают из группы нуклеотидов с модифицированными основаниями, включающей 5-метилцитидин-5'-трифосфат, 7-деазагуанозин-5'-трифосфат, 5-бромцитидин-5'-трифосфат и псевдоуридин-5'-трифосфат.
По крайней мере одна РНК в составе комплекса РНК по настоящему изобретению, в дополнительном или другом варианте, также включает по крайней мере одну модификацию нуклеозида в составе нуклеотида, содержащегося по крайней мере в одной РНК, которая оказывает иммунодепрессантное действие, т.е. предпочтительно пригодна для предотвращения или подавления иммунного ответа, при введении пациенту, нуждающемуся в таком лечении. По крайней мере один способ указанной модификации предпочтительно выбирают из следующих способов:
а) химическая модификация в 4, 5 или 6 положении пиримидинового основания, цитидина и/или уридина,
б) химическая модификация в 2, 6, 7 или 8 положении пуринового основания, аденозина, инозина и/или гуанозина, и/или
в) химическая модификация в 2' положении сахаридных остатков в составе нуклеозидов, аденозина, инозина, гуанозина, цитидина и/или уридина.
В данном контексте, (м)РНК представляет собой цепь нуклеиновой кислоты, состоящей из множества нуклеотидов, которые обычно выбирают из следующих нуклеотидов: аденозин-5'-монофосфат, гуанозин-5'-монофосфат, инозин-5'-монофосфат, цитидин-5'-монофосфат и/или уридин-5'-монофосфат. Указанные нуклеотиды связаны друг с другом через монофосфатные группы. Нуклеотиды в качестве структурного компонента включают нуклеозиды и 5'-монофосфат, причем нуклеозидами обычно являются нуклеиновые основания, т.е. пиримидин (урацил или цитозин) или пурин (аденин или гуанин) и остаток сахара. Соответственно, модификация нуклеозида по крайней мере в одной РНК в составе комплекса РНК по настоящему изобретению всегда обозначает модификацию в структуре нуклеозида в соответствующем нуклеотиде в указанной по крайней мере одной РНК.
Согласно первому способу модификации а) по крайней мере один нуклеозид по крайней мере в одной РНК в составе комплекса РНК по настоящему изобретению, модифицируют методом химической модификации в 5 или 6 положении пиримидинового основания в составе нуклеозидов, цитидине и/или уридине. Указанные химические модификации, но, не ограничиваясь только ими, в 4, 5 или 6 положении пиримидинового основания в нуклеозидах, цитидине и/или уридине, выбирают из группы, включающей: 4-тио, 5-иод-/(5-1-), 5-бром-/(5-Br-), 5-аминоаллил-, 5-фтор-/(5-F-), 5-гидрокси-, 5-гидро-/(5-Н-), 5-нитро-, 5-пропинил-/(5-(С≡С-СН3)-), 5-метил-, 5-метил-2-тио-, 5-формил-, 5-гидроксиметил-, 5-метокси-, 5-оксиметиловый эфир уксусной кислоты, 5-оксиуксусная кислота, 5-карбоксигидроксиметил-, метиловый эфир 5-(карбоксигидроксиметил)пиримидина, 5-метоксикарбонилметил-, 5-метоксикарбонилметил-2-тио, 5-аминометил-, 5-аминометил-2-тио-, 5-аминометил-2-селено-, 5-метиламинометил-, 5-карбамоилметил-, 5-карбоксиметиламинометил-, 5-карбоксиметиламинометил-2-тио-, 5-карбоксиметил-, 5-метилдигидро-, 5-тауринометил-, 5-тауринометил-2-тиоуридин, 5-изопентениламинометил-, 5-изопентениламинометил-2-тио-, 5-аминопропил-/(5-(C3H6NH3)-), 5-метоксиэтоксиметил-/(5-(СН2-O-С2Н4-O-СН3)-) или 6-аза-.
Согласно второму способу модификации б) по крайней мере, один нуклеозид по крайней мере в одной РНК в составе комплекса РНК по настоящему изобретению, пригодный для подавления и/или исключения иммуностимулирующего ответа (врожденного иммунитета) у млекопитающих, который обычно индуцируется при введении соответствующей немодифицированной по крайней мере одной РНК, можно в другом варианте модифицировать методом химической модификации в 2, 6, 7 или 8 положении пуринового основания в составе нуклеозидов, аденозина, инозина и/или гуанозина. Указанные химические модификации в 2, 6, 7 или 8 положении пуринового основания в составе нуклеозидов, аденозина, инозина и/или гуанозина, выбирают из группы, но, не ограничиваясь только ими, включающей 2-амино-, 7-деаза-, 8-аза- или 8-азидо-.
Согласно третьему способу модификации в) по крайней мере один нуклеозид по крайней мере в одной РНК в составе комплекса РНК по настоящему изобретению, пригодный для подавления и/или исключения иммуностимулирующего ответа (врожденный иммунитет) у млекопитающих, который обычно индуцируется при введении соответствующей немодифицированной по крайней мере одной РНК, можно модифицировать по крайней мере одним методом химической модификации в 2' положении сахарида в нуклеозидах аденозине, инозине, гуанозине, цитидине и/или уридине, в процессе введения в последовательность РНК. Указанные химические модификации в 2' положении сахара в нуклеозидах, аденозине, инозине, гуанозине, цитидине и/или уридине выбирают, но, не ограничиваясь только ими, из группы, включающей: 2'-дезокси-, 2'-амино-2'-дезокси-, 2'-амино-, 2'-фтор-2'-дезокси-, 2'-фтор-, 2'-O-метил-2'-дезокси- или 2'-O-метил.
Согласно более предпочтительному варианту, по крайней мере один нуклеозид по крайней мере в одной РНК в составе комплекса РНК по настоящему изобретению модифицируют в 4, 5 или 6 положении пиримидинового основания в нуклеозидах, цитидине и/или уридине и в 2' положении сахаридного остатка рибозы согласно способам модификации а) и в), как определено выше.
Согласно другим предпочтительным вариантам, по крайней мере один нуклеозид по крайней мере в одной РНК в составе комплекса РНК по настоящему изобретению модифицируют в 2, 6, 7 или 8 положении пуринового основания в нуклеозидах, аденозине, инозине и/или гуанозине и в 2' положении сахаридного остатка рибозы согласно способам модификации б) и в), как определено выше, более предпочтительно как определено выше.
Согласно еще более предпочтительному варианту, при модификации по крайней мере одного нуклеозида по крайней мере в одной РНК в составе комплекса РНК по настоящему изобретению получают химически модифицированные нуклеотиды (в (м)РНК), которые выбирают из следующей группы: 4-тиоуридин-5'-монофосфат, 2-аминопуринрибозид-5'-монофосфат, 5-аминоаллилцитидин-5'-монофосфат, 5 -аминоаллилуридин-5 '-монофосфат, 5-бромцитидин-5'-монофосфат, 5-бром-2'-дезоксицитидин-5'-монофосфат, 5-бромуридин-5'-монофосфат, 5-бром-2'-дезоксиуридин-5'-монофосфат, 5-иодцитидин-5'-монофосфат, 5-иод-2'-дезоксицитидин-5'-монофосфат, 5-иодуридин-5'-монофосфат, 5-иод-2'-дезоксиуридин-5'-монофосфат, 5-пропинил-2'-дезоксицитидин-5'-монофосфат, 5-пропинил-2'-дезоксиуридин-5'-монофосфат, 5-формилцитидин-5'-монофосфат, 5,2'-O-диметилцитидин-5'-монофосфат, 5-гидроксиметилцитидин-5'-монофосфат, 5-формил-2'-O-метилцитидин-5'-монофосфат, 5,2'-O-диметилуридин-5'-монофосфат, 5-метил-2-тиоуридин-5'-монофосфат, 5-гидроксиуридин-5'-монофосфат, 5-метоксиуридин-5'-монофосфат, уридин-5'-монофосфат 5-оксиуксусной кислоты, метиловый эфир уридин-5'-монофосфата 5-оксиуксусной кислоты, 5-(карбоксигидроксиметил)уридин-5'-монофосфат, метиловый эфир 5-(карбоксигидроксиметил)уридин-5'-монофосфата, 5-метоксикарбонилметилуридин-5'-монофосфат, 5-метоксикарбонилметил-2'-O-метилуридин-5'-монофосфат, 5-метоксикарбонилметил-2-тиоуридин-5'-монофосфат, 5-аминометил-2-тиоуридин-5'-монофосфат, 5-метиламинометилуридин-5'-монофосфат, 5-метиламинометил-2-тиоуридин-5'-монофосфат, 5-метиламинометил-2-селеноуридин-5'-монофосфат, 5-карбамоилметилуридин-5'-монофосфат, 5-карбамоилметил-2'-O-метилуридин-5'-монофосфат, 5-карбоксиметиламинометилуридин-5'-монофосфат, 5-карбоксиметиламинометил-2'-O-метилуридин-5'-монофосфат, 5-карбоксиметиламинометил-2-тиоуридин-5'-монофосфат, 5-карбоксиметилуридин-5'-монофосфат, 5-метилдигидроуридин-5'-монофосфат, 5-тауринометилуридин-5'-монофосфат, 5-тауринометил-2-тиоуридин-5'-монофосфат, 5-(изопентениламинометил)уридин-5'-монофосфат, 5-(изопентениламинометил)-2-тиоуридин-5'-монофосфат, 5-(изопентениламинометил)-2'-O-метилуридин-5'-монофосфат, 6-азацитидин-5'-монофосфат, 7-деазааденозин-5'-монофосфат, 7-деазагуанозин-5'-монофосфат, 8-азааденозин-5'-монофосфат, 8-азидоаденозин-5'-монофосфат, псевдоуридин-5'-монофосфат, 2'-амино-2'-дезоксицитидин-монофосфат, 2'-фтортимидин-5'-монофосфат, инозин-5'-монофосфат, 2'-O-метилинозин-5'-монофосфат.
При необходимости, по крайней мере одну РНК в составе комплекса РНК по настоящему изобретению модифицируют за счет замен, вставок или делеций нуклеотидов, которые предпочтительно осуществляют для обеспечения необходимых функциональных эффектов. Указанные различные типы модификации нуклеотидов проводят, если РНК, например мРНК, включает последовательность дикого типа. При этом, для получения РНК в составе комплекса РНК по настоящему изобретению используют матрицу ДНК по известным методикам сайт-направленного мутагенеза (см. например Maniatis и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 3-е издание, Cold Spring Harbor, Нью-Йорк (2001)). Согласно указанным методикам для получения РНК проводят транскрипцию соответствующей молекулы ДНК in vitro. Указанная матрица ДНК включает пригодный промотор, например, промотор Т7 или SP6, для транскрипции in vitro, который расположен перед требуемой нуклеотидной последовательностью РНК, которую необходимо получить и споп-кодон для транскрипции in vitro. Согласно настоящему изобретению, молекула ДНК, которая является матрицей исследуемой РНК, получают ферментативной пролиферацией с последующим выделением в качестве участка плазмиды, которая реплицируется в бактериях. Плазмидами, которые пригодны по настоящему изобретению являются, например, следующие плазмиды: pT7Ts (GenBank, №1726404, Lai и др., Development, 121, сс.2349-2360 (1995)), серии pGEM®, например pGEM®-1 (GenBank, №Х65300, фирмы Promega) и pSP64 (GenBank, №Х65327), см. также Mezei и Storts, Purification of PCR Products, под ред. Griffin и Griffin, PCR Technology: Current Innovation, CRC Press, Boca Raton, Флорида (2001).
Массовое или молярное соотношение компонентов комплекса РНК по настоящему изобретению, которое обозначает массовое или молярное соотношение РНК (одно- или двухцепочечная) и одного или более олигопептидов, обычно не ограничивается, и его выбирают в зависимости от назначения. Однако, массовое или молярное соотношение одного или более олигопептидов и РНК может составлять менее 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:11, 1:12, 1:13, 1:14, 1:15, 1:16, 1:17, 1:18 или менее 1:20. В другом варианте, массовое или молярное соотношение одного или более олигопептидов и РНК может составлять более 1:1, 2:1, 3:1,4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 11:1, 12:1, 13:1, 14:1, 15:1, 16:1, 17:1, 18:1, 19:1, 20:1. Предпочтительно, массовое или молярное соотношение одного или более олигопептидов и РНК составляет менее 1:5 с учетом содержания одного или более олигопептидов. Более предпочтительно, (молярное или) массовое соотношение одного или более олигопептидов и РНК составляет от 1:5 до 20:1, более предпочтительно от 1:3 до 15:1.
Согласно более предпочтительному варианту, массовое соотношение компонентов комплекса РНК по настоящему изобретению, прежде всего массовое соотношение по крайней мере одной РНК в составе комплекса РНК и одного или более олигопептидов предпочтительно находится в интервале от приблизительно 1:100 до приблизительно 1:0,5, более предпочтительно соотношение составляет от приблизительно 1:50 до приблизительно 1:1, или еще более предпочтительно приблизительно 1:100, приблизительно 1:90, приблизительно 1:80, приблизительно 1:70, приблизительно 1:60, приблизительно 1:50, приблизительно 1:45, приблизительно 1:40, приблизительно 1:35, приблизительно 1:30, приблизительно 1:25, приблизительно 1:20, приблизительно 1:15, приблизительно 1:10, приблизительно 1:5, приблизительно 1:4, приблизительно 1:3, приблизительно 1:2, приблизительно 1:1 или даже приблизительно 1:0,5, с учетом соотношения РНК/пептид в комплексе, причем любой интервал соотношений выбирают при комбинации двух вышеперечисленных конкретных значений. Более предпочтительно, массовое соотношение по крайней мере одной РНК в составе комплекса РНК и одного или более олигопептидов составляет от приблизительно 1:50 до приблизительно 1:1.
Аналогичным образом, предпочтительным молярным соотношением компонентов комплекса РНК по настоящему изобретению, прежде всего молярным соотношением по крайней мере одной РНК в составе комплекса РНК и одного или более олигопептидов является соотношение согласно прежде всего предпочтительному варианту, составляющее от приблизительно 1:20000 до приблизительно 1:500 или даже 1:250, более предпочтительно от приблизительно 1:10000 до приблизительно 1:1000, или даже более предпочтительно от приблизительно 1:9500, приблизительно 1:9000, приблизительно 1:8500, приблизительно 1:8000, приблизительно 1:7500, приблизительно 1:7000, приблизительно 1:6500, приблизительно 1:6000, приблизительно 1:5500, приблизительно 1:5000, приблизительно 1:4500, приблизительно 1:4000, приблизительно 1:3500, приблизительно 1:3000, приблизительно 1:2500, приблизительно 1:2000, приблизительно 1:1500, приблизительно 1:1000, приблизительно 1:500, приблизительно 1:450, приблизительно 1:400, приблизительно 1:350, приблизительно 1:300, или приблизительно 1:250, с учетом соотношения РНК/пептид в комплексе, причем любой интервал выбирают при комбинации двух вышеперечисленных конкретных значений. Более предпочтительно, молярное соотношение по крайней мере одной РНК в составе комплекса РНК и одного или более олигопептидов может находиться в интервале от приблизительно 1:10000 до приблизительно 1:1000. Для иммуностимуляции, молярное соотношение компонентов комплекса РНК по настоящему изобретению находится в интервале от приблизительно 1:10000 до приблизительно 1:100 или даже от приблизительно 1:10000 до приблизительно 1:500.
В данном контексте, молярное соотношение и массовое соотношение обычно зависят друг от друга, причем на каждое из указанных соотношений влияют такие факторы, как длина РНК или длина пептида. Однако, массовое соотношение и молярное соотношение можно рассчитать для среднего размера комплекса, причем массовое соотношение составляет приблизительно от 1:50 до 1:1, что приблизительно соответствует молярному соотношению приблизительно от 1:10000 до 1:1000. Примерный алгоритм определения молярных и массовых соотношений приведен в разделе Примеры, который дополнительно можно использовать для расчетов.
Кроме того, соотношение компонентов комплекса РНК по настоящему изобретению, прежде всего соотношение по крайней мере одной РНК в составе комплекса РНК и одного или более олигопептидов, можно также рассчитать с использованием соотношения азот/фосфат (N/P-соотношение) для целого комплекса РНК. Например, 1 мкг РНК обычно содержит приблизительно 3 нмоля фосфатных остатков, с учетом статистического распределения оснований в РНК. Кроме того, 1 мкг пептида обычно содержит приблизительно х нмолей азота, количество которого зависит от молекулярной массы и числа основных аминокислот. Примерный расчет количества атомов азота для пептида (Arg)9 (молекулярная масса 1424 г/моль, 9 атомов азота) проводят следующим образом: 1 мкг (Arg)9 содержит приблизительно 700 пмолей (Arg)9 и, таким образом, 700×9=6300 пмолей основных аминокислот, что составляет 6,3 нмоля атомов азота. Для массового соотношения PHK/(Arg)9, равного приблизительно 1:1 можно рассчитать соотношение N/P, которое приблизительно равно 2. Пример расчета количества атомов азота в комплексе протамин/РНК (молекулярная масса протамина составляет приблизительно 4250 г/моль, 21 атом азота, при использовании протамина из лосося, массовое соотношение приблизительно 2:1, 2 мкг РНК, 6 нмолей фосфата) 1 мкг протамина содержит приблизительно 235 пмолей протамина и таким образом 235×21=4935 пмолей основных атомов азота, что составляет 4,9 нмоля атомов азота. Для комплекса РНК/протамин в массовом соотношении приблизительно 2:1 можно рассчитать соотношение N/P, которое составляет приблизительно 0,81. Для комплекса РНК/протамин в массовом соотношении приблизительно 8:1 можно рассчитать соотношение N/P, которое составляет приблизительно 0,2. В данном контексте соотношение N/P предпочтительно выбирают в интервале приблизительно от 0,2 до 50, предпочтительно в интервале приблизительно от 0,5 до 50 и более предпочтительно в интервале приблизительно от 0,75 до 25 или от 1 до 25, с учетом соотношения РНК/пептид в комплексе, даже более предпочтительно в интервале приблизительно от 10 до 50 и наиболее предпочтительно в интервале приблизительно от 25 до 50.
Другой вариант настоящего изобретения относится к композиции, предпочтительно к фармацевтической композиции, включающей РНК в составе комплекса РНК по настоящему изобретению и необязательно фармацевтически приемлемый носитель и/или другие вспомогательные вещества и добавки. Фармацевтическая композиция по настоящему изобретению обычно содержит безопасное и эффективное количество РНК в составе комплекса РНК по настоящему изобретению. Термин "безопасное и эффективное количество" в данном контексте обозначает количество РНК в составе комплекса РНК по настоящему изобретению, которое проявляет эффективность в клетках или тканях in vitro или in vivo, например, вызывает увеличение экспрессии (in vitro или in vivo) кодируемого белка, как описано выше, такого как терапевтически активный белок, антитело или антиген, или любого другого белка или пептида, как описано выше, для индуцирования положительного изменения состояния, предназначенного для лечения, (in vivo) в клетках, в тканях или в организме, например, опухолевого заболевания или рака, сердечно-сосудистого заболевания, инфекционного заболевания, аутоиммунного заболевания, (моно-)генетических заболеваний и т.п., как указано в настоящем описании, и/или для индуцирования или усиления иммунного ответа. В то же время, однако, "безопасное и эффективное количество" является достаточно низким, чтобы исключить развитие серьезных побочных эффектов, прежде всего при лечении заболеваний, как указано в данном контексте при приемлемом соотношении польза/риск.
Определение указанных пределов прежде всего зависит от мнения специалиста в данной области медицины. Следовательно, концентрация РНК в составе комплекса по настоящему изобретению в указанных (фармацевтических) композициях может изменяться, например, но, не ограничиваясь только ими, в широких пределах, например, от 0,1 нг до 1000 мг/мл и даже более. Указанное "безопасное и эффективное количество" РНК в составе комплекса по настоящему изобретению может изменяться в зависимости от конкретного состояния, подлежащего лечению, и возраста и физического состояния пациента, нуждающегося в лечении, тяжести состояния, продолжительности лечения, типа сопутствующей терапии, конкретного использованного (фармацевтически) пригодного носителя и аналогичных факторов, которые определяет лечащий врач. (Фармацевтическую) композицию, описанную в данном контексте, можно применять в медицине и в ветеринарии.
(Фармацевтическая) композиция по настоящему изобретению, описанная в данном контексте, может необязательно включать пригодный носитель, предпочтительно фармацевтически пригодный носитель. Термин "пригодный носитель", использованный в данном контексте, предпочтительно включает один или более совместимых твердых или жидких наполнителей, или разбавителей или агентов для инкапсулирования, которые пригодны для введения человеку. Термин "совместимый", использованный в данном контексте, обозначает, что компоненты композиции пригодны для смешивания с РНК в составе комплекса по настоящему изобретению, и с вспомогательными материалами, необязательно присутствующими в композиции, отдельно и в составе смеси, и при этом не происходит взаимодействий, которые значительно снижают (фармацевтическую) эффективность композиции в стандартных условиях использования, например, снижают (фармацевтическую) активность кодируемых белков или даже подавляют или нарушают экспрессию кодируемых белков или, например, подавляют иммуногенную эффективность РНК в составе комплекса. Разумеется, пригодный носитель должен характеризоваться достаточно высокой чистотой и достаточно низкой токсичностью, чтобы вводить их человеку, нуждающемуся в лечении.
Носители в твердой или в жидкой форме выбирают в зависимости от способа введения. Соответственно, выбор (фармацевтически) пригодного носителя, как описано выше, определяется прежде всего способом, который используют для введения (фармацевтической) композиции по настоящему изобретению. (Фармацевтическую) композицию по настоящему изобретению можно вводить, например, системным способом. Способы введения включают, например, внутри- или чрескожные, пероральные, парентеральные, включая подкожные, внутримышечные, в том числе или внутривенные инъекции, местный и/или интраназальный способы. Пригодное количество (фармацевтической) композиции по настоящему изобретению можно установить стандартными методами с использованием моделей животных. Указанные модели включают, но, не ограничиваясь только ими, модели кроликов, овец, мышей, крыс, собак и низших приматов.
При введении в жидкой форме, например, инъекцией, носитель можно выбирать из апирогенной воды, изотонического солевого раствора и буферных растворов, например, фосфатного буферного раствора. Предпочтительные стандартные лекарственные формы для инъекций включают стерильные водные растворы, физиологический солевой раствор или их смеси, например, раствор Рингера, содержащий лактат. Величину рН указанных растворов следует доводить до значения от приблизительно 7,0 до приблизительно 7,6, предпочтительно приблизительно 7,4.
Предпочтительно, (фармацевтическая) композиция содержит РНК в составе комплекса по изобретению в воде. В другом варианте (фармацевтическая) композиция по настоящему изобретению может содержать буферный раствор для инъекций в качестве носителя для жидкого препарата, который предпочтительно улучшает трансфекцию и, если РНК в составе комплекса по настоящему изобретению кодирует белок, также улучшает трансляцию кодируемого белка, в клетках, тканях или организме. (Фармацевтическая) композиция по настоящему изобретению может включать, например, водный буферный раствор для инъекций или воду, которая содержит, в расчете на общую массу (фармацевтической) композиции, если она присутствует в жидкой форме, натриевую соль, предпочтительно в концентрации по крайней мере 50 мМ, кальциевую и/или магниевую соль, предпочтительно в концентрации по крайней мере 0,01 мМ, и необязательно калиевую соль, предпочтительно в концентрации по крайней мере 3 мМ. В предпочтительном варианте натриевые соли, кальциевые и/или магниевые соли и необязательно калиевые соли, содержащиеся в указанном буферном растворе для инъекций, присутствуют в виде галогенидов, например, хлоридов, иодидов или бромидов, или в виде их гидроксидов, карбонатов, бикарбонатов или сульфатов. Примеры, описанные в данном контексте, включают соли натрия NaCl, NaI, NaBr, Na2CO3, NaHCO3, и/или Na2SO4, необязательно соли калия KCl, KI, KBr, К2СОз, КНСО3, и/или K2SO4, и соли кальция и/или магния CaCl2, CaI2, CaBr2, СаСО3, CaSO4, Са(ОН)2, MgCl2, Mgl2, MgBr2, MgCO3, MgSO4 и/или Mg(OH)2. Буферный раствор для инъекций может также содержать органические анионы названных выше катионов. В наиболее предпочтительном варианте, указанный буферный раствор для инъекций содержит в качестве солей хлорид натрия (NaCl), хлорид кальция (CaCl2) и необязательно хлорид калия (KCl), но кроме хлоридов можно также использовать другие анионы.
Указанные соли прежде всего присутствуют в буферном растворе для инъекций, необязательно использованном в (фармацевтической) композиции по настоящему изобретению, в расчете на общую массу (фармацевтической) композиции (если она присутствует в жидкой форме), в концентрации по крайней мере 50 мМ хлорида натрия (NaCl), по крайней мере 3 мМ хлорида калия (KCl) и по крайней мере 0,01 мМ хлорида кальция и/или магния (CaCl2). Буферный раствор для инъекций можно использовать в виде как гипертонического, так и изотонического или гипотонического буферного раствора для инъекций. Согласно настоящему изобретению, в данном контексте буферный раствор для инъекций является гипертопическим, изотоническим или гипотоническим в каждом случае по сравнению с конкретной стандартной средой, то есть буферный раствор для инъекций характеризуется либо более высоким, либо равным или более низким содержанием соли по сравнению с конкретной стандартной средой, причем предпочтительно используют такие концентрации указанных выше солей, которые не приводят к повреждению клеток за счет осмоса или других концентрационных эффектов. Стандартными средами в данном контексте являются, например, жидкости, которые используют в методах "in vivo", такие как, например, кровь, лимфатическая жидкость, цитозольные фракции или другие жидкости, которые присутствуют в организме, или жидкости или буферные растворы, которые обычно используют в методах "in vitro". Указанные жидкости и буферные растворы известны специалистам в данной области техники.
Буферный раствор для инъекций, необязательно содержащийся в (фармацевтической) композиции по настоящему изобретению, может также содержать дополнительные компоненты, например сахара (моно-, ди-, три- или полисахариды), прежде всего глюкозу или маннит. Однако в предпочтительном варианте осуществления настоящего изобретения в использованном буферном растворе для инъекций сахара отсутствуют. Предпочтительно также, чтобы буферный раствор для инъекций не содержал незаряженных компонентов, таких как, например, сахара. Буферный раствор для инъекций обычно содержит исключительно катионы металлов, прежде всего выбранных из группы, включающей щелочные или щелочноземельные металлы, и анионы, прежде всего анионы, описанные выше. Значение рН использованного буферного раствора для инъекций, в расчете на общую (фармацевтическую) композицию, если она используется в жидкой форме, составляет предпочтительно от 1 до 8,5, предпочтительно от 3 до 5, более предпочтительно от 5,5 до 7,5, прежде всего от 5,5 до 6,5. Соответственно, буферный раствор для инъекций может также содержать буферную систему, которая поддерживает постоянное значение рН буферного раствора для инъекций. В качестве буферной системы можно использовать, например, фосфатную буферную систему, HEPES или Na2HPO4/NaH2PO4. Однако использованный буферный раствор для инъекций прежде всего предпочтительно не содержит упомянутых выше буферных систем или совсем не содержит буферную систему.
Буферный раствор для инъекций, необязательно содержащийся в (фармацевтической) композиции по настоящему изобретению, может содержать, в дополнительном или другом варианте одновалентные и двухвалентные катионы, описанные выше, которые выбирают прежде всего из группы, включающей щелочные или щелочноземельные металлы, такие как, например, магний (Mg), или также железо (Fe), и одновалентные катионы, которые прежде всего выбирают из группы, включающей щелочные металлы, такие как, например, литий (Li). Указанные одновалентные катионы присутствуют предпочтительно в форме солей, например, в виде галогенидов, например, хлоридов, иодидов или бромидов, или в виде их гидроксидов, карбонатов, бикарбонатов или сульфатов. Примеры, описанные в данном контексте, включают в качестве соли лития LiCl, Lil, LiBr, Li2CO3, LiHCO3, Li2SO4, в качестве соли магния MgCl2, Mgl2, MgBr2, MgCO3, MgSO4, и Mg(OH)2, в качестве соли железа FeCl2, FeBr2, Fel2, FeF2, Fe2O3, FeCO3, FeSO4, Fe(OH)2. В объем изобретения включены также все комбинации двух- и/или одновалентных катионов, как описано выше. Таким образом, указанные буферные растворы для инъекций, которые содержат только двухвалентные, только одновалентные или двух- и одновалентные катионы, можно использовать в (фармацевтической) композиции по настоящему изобретению. Аналогичным образом можно использовать указанные буферные растворы для инъекций, которые содержат только один тип двух- или одновалентных катионов, прежде всего предпочтительно, например, только катионы Са2+, или соль, например, CaCl2. Молярные концентрации, указанные выше для Са2+ (двухвалентного катиона) и Na1+ (одновалентного катиона) (а именно, прежде всего по крайней мере 50 мМ Na+, по крайней мере 0,01 мМ Са2+ и необязательно по крайней мере 3 мМ К+) в буферном растворе для инъекций также можно учитывать, если другой двух- или одновалентный катион, прежде всего другие катионы, выбранные из группы, включающей из щелочноземельные или щелочные металлы, используют вместо части или всего количества Са2+ или, соответственно, Na1+ в буферном растворе для инъекций, использованном согласно настоящему изобретению для получения инъекционного раствора. Все количество Са2+ или Na1+, как указано выше, действительно можно заменять в каждом случае на другие двух- или, соответственно, одновалентные катионы в использованном буферном растворе для инъекций, например, также на комбинацию других двухвалентных катионов (вместо Са2+) и/или комбинацию других одновалентных катионов (вместо Na1+) (прежде всего на комбинацию других двухвалентных катионов, выбранных из группы, включающей щелочноземельные металлы или, соответственно, других одновалентных катионов, выбранных из группы, включающей щелочные металлы), но предпочтительно заменять по крайней мере некоторое количество Са2+ или Na1+, то есть по крайней мере 20%, предпочтительно по крайней мере 40%, и более предпочтительно по крайней мере 60% и еще более предпочтительно по крайней мере 80% в расчете на конкретную общую молярную концентрацию моно- и двухвалентных катионов в инъекционном растворе, которая соответствует ионам Са2+ и, соответственно, Na1+. Однако, прежде всего предпочтительно, чтобы буферный раствор для инъекций, необязательно присутствующий в фармацевтической композиции по настоящему изобретению, содержал исключительно Са2+ в качестве двухвалентного катиона и Na1+ в качестве одновалентного катиона, а именно, в расчете на общую массу фармацевтической композиции, содержание Са2+ должно составлять 100% от общей молярной концентрации двухвалентных катионов, а содержание Na1+ должно составлять 100% в расчете на общую молярную концентрацию одновалентных катионов. Водный буферный раствор для инъекций может содержать, в расчете на общую массу фармацевтической композиции, до 30 мол.% в расчете на содержащиеся в растворе соли, предпочтительно до 25 мол.%, более предпочтительно до 20 мол.%, еще более предпочтительно до 15 мол.%, более предпочтительно до 10 мол.%, даже более предпочтительно до 5 мол.%, аналогичным образом более предпочтительно до 2 мол.% нерастворимых или трудно растворимых солей. Трудно растворимые соли в данном контексте обозначают соли, произведение растворимости которых составляет <10-4. Высоко растворимые соли обозначают такие соли, произведение растворимости которых составляет >10-4. Предпочтительно концентрация солей в буферном растворе для инъекций, необязательно присутствующем в фармацевтической композиции по настоящему изобретению составляет: от 50 мМ до 800 мМ, предпочтительно от 60 мМ до 500 мМ, более предпочтительно от 70 мМ до 250 мМ, прежде всего предпочтительно от 60 мМ до 110 мМ хлорида натрия (NaCl), от 0,01 мМ до 100 мМ, предпочтительно от 0,5 мМ до 80 мМ, более предпочтительно от 1,5 мМ до 40 мМ хлорида кальция (CaCl2) и необязательно от 3 мМ до 500 мМ, предпочтительно от 4 мМ до 300 мМ, более предпочтительно от 5 мМ до 200 мМ хлорида калия (KCl). Органические анионы могут также присутствовать в качестве дополнительных анионов кроме упомянутых выше неорганических анионов, например, галогениды, сульфаты или карбонаты. К таким анионам относятся сукцинат, лактобионат, лактат, малат, малеат и т.п., которые могут присутствовать также в комбинации.
Буферный раствор для инъекций, необязательно содержащийся в (фармацевтической) композиции по настоящему изобретению, предпочтительно содержит лактат. Если буферный раствор содержит органический анион, то он в качестве органического аниона прежде всего предпочтительно содержит исключительно лактат. Лактат в данном контексте может обозначать любой требуемый лактат, например L-лактат и D-лактат. Лактаты, которые присутствуют согласно настоящему изобретению, представляют собой прежде всего лактат натрия и/или лактат кальция, прежде всего, если буферный раствор для инъекций содержит только Na+ в качестве одновалентного катиона и Са2+ в качестве двухвалентного катиона. Концентрация лактата в буферном растворе для инъекций, необязательно использованном в (фармацевтической) композиции по настоящему изобретению, как описано выше, предпочтительно составляет в расчете на общую массу фармацевтической композиции от 15 мМ до 500 мМ, более предпочтительно от 15 мМ до 200 мМ, и наиболее предпочтительно от 15 мМ до 100 мМ.
При получении состава в не-жидкой форме (например, в твердой или полутвердой форме) фармацевтическая композиция по настоящему изобретению может содержать соединения, которые можно использовать в качестве пригодных носителей или компонентов, например, сахара, такие как, например, лактоза, глюкоза и сахароза, крахмалы, такие как, например, кукурузный крахмал или картофельный крахмал, целлюлоза и ее производные, такие как, например, натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза, ацетат целлюлозы, порошкообразная трагакантовая камедь, солод, желатин, твердый животный жир, твердые смазывающие вещества, такие как, например, стеариновая кислота, стеарат магния, сульфат кальция, растительные масла, такие как, например, арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао, полиолы, такие как, например, полипропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль, альгиновая кислота. Однако указанные выше соединения можно также использовать для получения жидких композиций.
Другие компоненты, которые можно включать в фармацевтическую композицию по настоящему изобретению, представляют собой, например, эмульгаторы, такие как, например, твин, увлажнители, такие как, например, лаурилсульфат натрия, красители, ароматизаторы, носители для лекарственных средств, агенты для получения таблеток, стабилизаторы, антиоксиданты, консерванты.
Другие пригодные носители для инъекционных препаратов включают гидрогели, формы с контролируемым или замедленным высвобождением, матрицы на основе полимолочной кислоты и коллагена. Пригодные носители, которые можно использовать в настоящем изобретении, включают носители, которые пригодны для использования в лосьонах, кремах, гелях и т.п. Если соединение предназначено для перорального введения, предпочтительной стандартной лекарственной формой являются таблетки, капсулы и т.п. Пригодные носители для получения стандартной лекарственной формы, предназначенной для перорального введения, известны специалистам в данной области техники. Их выбор определяется второстепенными факторами, такими как запах, стоимость и устойчивость при хранении, которые не играют важную роль в настоящем изобретении и их может определить специалист в данной области.
В настоящем изобретении также предлагается способ трансфекции клеток или ткани (in vitro или in vivo) с использованием РНК в составе комплекса по настоящему изобретению, как описано выше. Способ трансфекции по настоящему изобретению (in vitro или in vivo) предпочтительно включает следующие стадии:
а) Необязательно получение и/или конструирование РНК в составе комплекса по настоящему изобретению, включающего комплекс по крайней мере одной РНК с одним или более олигопептидами общей формулы (Arg)1,(Lys)m,(His)n,(Orn)o,(Xaa)x,
б) Трансфекция клетки, (живой) ткани или организма (in vitro или in vivo) с использованием РНК в составе комплекса, полученной и/или конструированной на стадии а).
Получение и/или конструирование РНК в составе комплекса, как описано выше на стадии а), трансфекцию in vitro или in vivo клеток или ткани с использованием РНК в составе комплекса по настоящему изобретению, можно проводить любым известным способом. РНК в составе комплекса в данном контексте включает комплекс по крайней мере одной РНК с одним или более олигопептидами общей формулы (Arg)1,(Lys)m,(His)n,(Orn)o,(Xaa)x. Таким образом, получение и/или конструирование РНК в составе комплекса, как описано выше, на стадии а) может включать получение и/или конструирование по крайней мере одной РНК и одного или более олигопептидов общей формулы (Arg)1,(Lys)m,(His)n,(Orn)o,(Xaa)x.
Способы получения коротких пептидных последовательностей, таких как (Arg)1,(Lys)m,(His)n,(Orn)o,(Xaa)x, известны специалистам в данной области техники и могут включать, например, твердофазный синтез, такой как твердофазный синтез с использованием Fmoc-производных или другие пригодные способы (см., например, ред. R.Martin, Protein Synthesis: Methods and Protocols, Methods in Molecular Biology, т.77 Humana Press (1998)).
Получение и/или конструирование по крайней мере одной РНК в качестве компонента комплекса по изобретению, как описано выше, может включать на стадии а) первую подстадию а1), а именно, конструирование и/или получение матрицы нуклеиновой кислоты, которая прежде всего включает последовательность, соответствующую требуемой РНК. Последовательность матрицы нуклеиновой кислоты может включать любую нуклеиновую кислоту, например, одно- или двухцепочечную ДНК, кДНК, геномную ДНК или их фрагменты, и т.п., которые могут кодировать терапевтически активный белок, антитело или антиген, или любой другой белок или пептид, как описано выше. Обычно для указанной цели можно использовать, прежде всего, последовательности ДНК, например, ДНК плазмиды, предпочтительно в линейной форме. Предпочтительно, последовательность матрицы нуклеиновой кислоты может представлять собой вектор (экспрессии), более предпочтительно вектор (экспрессии), содержащий сайт связывания с РНК-полимеразой. Можно использовать любые известные векторы (экспрессии), например, коммерческие векторы (экспрессии) (см. выше). Предпочтительными векторами (экспрессии) являются, например, векторы, которые содержат сайт связывания SP6 или Т7 или Т3, расположенные перед сайтом встраивания или после сайта встраивания. Вектор может включать последовательность нуклеиновой кислоты, кодирующую терапевтически активный белок, антитело, антиген или любой другой белок или пептид, как описано выше, который прежде всего клонирован в векторе (экспрессии), например, через сайт множественного клонирования в использованном векторе.
Перед транскрипцией вектор (экспрессии) прежде всего расщепляют ферментами рестрикции по сайту, где должен находиться будущий 3'-концевой фрагмент РНК, с использованием пригодного фермента рестрикции, и фрагмент очищают. Стадия очистки позволяет исключить присутствие в РНК-транскрипте векторной последовательности и получить РНК-транскрипт определенной длины. В данном контексте предпочтительно не следует использовать ферменты рестрикции, которые образуют выступающие концевые фрагменты (такие как, например, AatII, ApaI, BanII, BgII, Bspl286, BstXI, Cfol, HaeII, HgiAI, HhaI, KpnI, PstI, Pvul, Sad, SacII, SfiI, SphI и т.п.). Однако если такие ферменты рестрикции необходимо использовать, выступающие 3'-концевые фрагменты предпочтительно можно заполнить, например, с использованием ДНК полимераз Кленова или Т4.
В другом варианте матрицу нуклеиновой кислоты, использованную для получения и/или конструирования по крайней мере одной РНК в составе комплекса РНК по настоящему изобретению, можно получать с использованием полимеразной цепной реакции (ПЦР). Следовательно, матрица нуклеиновой кислоты и один из использованных праймеров предпочтительно обычно содержат последовательность сайта связывания с РНК-полимеразой. Кроме того, 5'-концевой фрагмент использованного праймера предпочтительно содержит более длинный сегмент длиной приблизительно на 10-50 дополнительных нуклеотидов, более предпочтительно на 15-30 дополнительных нуклеотидов и наиболее предпочтительно длиной приблизительно на 20 нуклеотидов.
Перед проведением транскрипции in vitro нуклеиновую кислоту, например, матрицу ДНК или кДНК, используемую в качестве матрицы для транскрипции, обычно для обеспечения высокого выхода прежде всего очищают и отделяют от РНКаз. В данном контексте очистку указанной матрицы можно проводить с использованием любого известного способа, например, в градиенте хлорида цезия, ионообменной хроматографией или методом электрофореза в агарозном геле.
После получения и/или конструирования матрицы нуклеиновой кислоты можно проводить реакцию транскрипции in vitro согласно второй подстадии а2), при этом получают требуемую по крайней мере одну РНК в составе комплекса по настоящему изобретению с использованием матрицы нуклеиновой кислоты, полученной согласно первой подстадии а1), как указано выше.
Реакцию транскрипции in vitro на второй подстадии а2) прежде всего проводят методом транскрипции in vitro. Пригодная среда для транскрипции in vitro исходно включает матрицу нуклеиновой кислоты, как описано выше, например, приблизительно 0,1-10 мкг, предпочтительно приблизительно 1-5 мкг, более предпочтительно 2,5 мкг и наиболее предпочтительно приблизительно 1 мкг указанной нуклеиновой кислоты. Пригодная среда для транскрипции in vitro кроме того, необязательно включает восстанавливающий агент, например, ДТТ, более предпочтительно приблизительно 1-20 мкл 50 мМ ДТТ, еще более предпочтительно приблизительно 5 мкл 50 мМ ДТТ. Среда для транскрипции in vitro прежде всего включает нуклеотиды, например смесь нуклеотидов, согласно настоящему изобретению включающую смесь нуклеотидов A, G, С и U, прежде всего приблизительно 0,1-10 мМ каждого нуклеотида, предпочтительно от 0,1 до 1 мМ каждого нуклеотида, предпочтительно приблизительно всего 4 мМ. Аналогичным образом пригодная среда для транскрипции in vitro включает РНК-полимеразу, например, РНК-полимеразу Т7 (например, набор T7-Opti mRNA фирмы CureVac, Тюбинген, Германия), РНК-полимеразу Т3 или SP6, прежде всего приблизительно от 10 до 500 Ед., предпочтительно приблизительно от 25 до 250 Ед., более предпочтительно приблизительно от 50 до 150 Ед., и наиболее предпочтительно приблизительно 100 Ед. РНК-полимеразы. Кроме того, предпочтительно в среде для транскрипции in vitro должны отсутствовать РНКазы, чтобы исключить деградацию транскрибированной по крайней мере одной РНК в составе комплекса по настоящему изобретению. Следовательно, пригодная среда для транскрипции in vitro необязательно дополнительно включает ингибитор РНКазы.
Затем матрицу нуклеиновой кислоты инкубируют в среде для транскрипции in vitro и проводят транскрипцию по крайней мере одной РНК в составе комплекса по настоящему изобретению, которая может кодировать терапевтически активный белок, антитело или антиген или любой другой белок или пептид, как описано выше. Время инкубации составляет прежде всего приблизительно от 30 до 240 мин, предпочтительно приблизительно от 40 до 120 мин и наиболее предпочтительно приблизительно 90 мин. Температура инкубации составляет прежде всего приблизительно 30-45°С, предпочтительно 37-42°С. Температура инкубации зависит от применяемой РНК-полимеразы, например, для РНК-полимеразы Т7 температура составляет приблизительно 37°С. По крайней мере одна РНК в составе комплекса по настоящему изобретению, полученная методом транскрипции, предпочтительно является мРНК. Выход продуктов, полученных в результате транскрипции in vitro для указанных выше исходных количеств, составляет прежде всего приблизительно 30 мкг РНК на 1 мкг использованной матрицы ДНК. Выход продуктов, полученных в результате транскрипции in vitro, согласно настоящему изобретению, можно увеличивать при линейном увеличении масштаба реакции. С этой целью указанные выше исходные количества предпочтительно увеличивают в зависимости от требуемого количества, например, в 5, 10, 50, 100, 500, 1000, 5000, 10000, 50000, 100000 раз и т.п.
После инкубации необязательно можно провести очистку транскрибированной по крайней мере одной РНК в составе комплекса по настоящему изобретению. С этой целью можно использовать любой пригодный известный способ, например, способы хроматографической очистки, например, аффинную хроматографию, гель-фильтрацию и т.п. При очистке невключенные, то есть избыточные нуклеотиды и матрицу ДНК можно удалить из среды для транскрипции in vitro и получить очищенную РНК. Например, обычно после транскрипции реакционную смесь с транскрибированной РНК можно обработать ДНКазой для удаления матрицы ДНК еще присутствующей в реакционной смеси. Затем транскрибированную по крайней мере одну РНК в составе комплекса по настоящему изобретению можно после хроматографии или в другом варианте осадить LiCl. На следующей стадии транскрибированную РНК можно очищать методом обращено фазовой ЖХВР среднего давления. Этот метод позволяет наиболее эффективно отделить более длинные фрагменты от более коротких.
В данном контексте очистку РНК можно проводить предпочтительно препаративными методами очистки, которые заключаются в том, что РНК очищают ЖХВР с использованием пористой обращенной фазы в качестве стационарной фазы (PURE Messenger). Например, при очистке обращенную фазу можно использовать в качестве стационарной фазы для очистки методом ЖХВР. При хроматографии с обращенными фазами, неполярное соединение прежде всего служит стационарной фазой, а полярный растворитель, такой как водные смеси, которые обычно используют в качестве буферных смесей с ацетонитрилом и/или метанолом, служат подвижной фазой для элюции. Предпочтительный размер частиц пористой обращенной фазы составляет 8,0±2 мкм, предпочтительно±1 мкм, более предпочтительно±0,5 мкм. Материал обращенной фазы может присутствовать в виде гранул. Очистку можно проводить наиболее пригодным способом с использованием пористой обращенной фазы, характеризующейся указанным размером частиц, необязательно в виде гранул, при этом получают наилучшие результаты разделения. Используемая обращенная фаза является предпочтительно пористой, поскольку при использовании непористой стационарной обращенной фазы, такой как описанные выше, например, в статье Azarani А. и Hecker К. Н., при хроматографии наблюдается слишком высокое давление, и таким образом препаративная очистка РНК, если она в принципе возможна, представляет значительные проблемы. Размер пор обращенной фазы предпочтительно составляет от 200 А до 5000 А, прежде всего от 300 до 4000. Прежде всего предпочтительные размер пор обращенной фазы составляет 200-400 А, 800-1200 А и 3500-4500 А. При использовании обращенной фазы, характеризующейся прежде всего указанными размерами пор, достигается достаточно высокая эффективность очистки транскрибированной РНК. Материалом обращенной фазы предпочтительно является полистиролдивинилбензол, и прежде всего можно применять неалкилированные полистиролдивинилбензолы. Известны стационарные фазы с на основе полистиролдивинилбензола. Для очистки можно использовать стандартные полистиролдивинилбензолы, которые уже используются для очистки способами ЖХВР и выпускаются в виде коммерческих продуктов. Для очистки прежде всего предпочтительно использовать неалкилированный пористый полистиролдивинилбензол, который прежде всего характеризуется размером частиц 8,0±0,5 мкм и размером пор 250-300, 900-1100 или 3500-4500. При использовании указанного материала в качестве обращенной фазы, описанной выше, достигаются преимущества, и эффективность очистки.
Очистку ЖХВР можно проводить ионопарным способом, при этом получают мобильную фазу с положительно заряженными ионами в качестве противоиона отрицательно заряженной РНК. Таким образом образуется ионная пара, характеризующаяся липофильными свойствами, движение которой замедляется на неполярной стационарной фазе обращено фазовой системы. На практике конкретные условия для ионопарного способа следует подбирать эмпирически для каждого конкретного случая разделения. Размер противоиона, его концентрация и рН раствора значительно влияют на результат разделения. В предпочтительном варианте к мобильной фазе добавляют соли алкиламмония, такие как ацетат триэтиламмония и/или соединения тетраалкиламмония, такие как тетрабутиламмоний. Предпочтительно добавляют 0,1 М ацетат триэтиламмония и рН доводят до значения приблизительно 7. Выбор мобильной фазы зависит от природы требуемого разделения. То есть выбранную для специфического разделения мобильную фазу, которая известна, например, из предыдущего уровня техники, нельзя напрямую использовать для разделения другого материала с такой же эффективностью. Идеальные условия элюции, и прежде всего используемую мобильную фазу следует выбирать для каждого материала эмпирически. Для элюции РНК методом ЖХВР можно использовать смесь водного растворителя и органического растворителя в качестве мобильной фазы. В данном контексте предпочтительно рН буферного раствора, который используется в качестве водного растворителя, прежде всего, составляет приблизительно 7, например 6,5-7,5, например, 7,0, предпочтительным в качестве буферного раствора является ацетат триэтиламмония, прежде всего предпочтительно 0,1 М буферный раствор ацетата триэтиламмония, который, как описано выше, также используют в качестве противоиона для РНК при разделении ионно-парным методом разделения. Органический растворитель, использованный в мобильной фазе, может представлять собой ацетонитрил, метанол или смесь указанных растворителей, прежде всего наиболее предпочтителен ацетонитрил. Очистку РНК методом ЖХВР, как описано выше, проводят прежде всего наиболее пригодным способом с использованием указанных органических растворителей. Мобильной фазой является прежде всего предпочтительно смесь 0,1 М ацетата триэтиламмония, рН 7, и ацетонитрила. Было установлено, что прежде всего предпочтительная мобильная фаза содержит от 5,0 об.% до 20,0 об.% органического растворителя, в расчете на общий объем мобильной фазы, а остальную часть до 100 об.% составляет водный растворитель. Прежде всего наиболее предпочтительная мобильная фаза содержит от 9,5 об.% до 14,5 об.% органического растворителя, в расчете на общий объем мобильной фазы, а остальную часть до 100 об.% составляет водный растворитель. Затем можно провести элюцию РНК в изократических условиях или в градиенте концентрации растворителя. В случае изократического разделения, элюцию РНК проводят с использованием одного элюирующего агента или смеси нескольких элюирующих агентов, причем компоненты элюента не изменяются. В качестве элюентов для такого типа элюции можно использовать указанные выше элюирующие агенты.
В другом варианте по крайней мере одну РНК на стадии а) способа трансфекции по изобретению можно получить методом химического синтеза. Следовательно, можно использовать известные различные способы. Для химического синтеза олигонуклеотидов, например, фрагментов РНК, наиболее широко используется фосфороамидитный способ (Nucleic Acid Research, т.17, стр.7059-7071 (1989)). В основном указанный фосфороамидитный метод включает в качестве основной реакции реакцию между фосфороамидитом нуклеозида и нуклеозидом с использованием тетразола в качестве ускорителя. Поскольку данная реакция проходит по конкурентному механизму с участием гидроксидной группы сахаридного остатка и аминогруппы нуклеозидного остатка, для синтеза требуемого нуклеотида необходима избирательная реакция только с участием гидроксильной группой сахаридного остатка. Соответственно, побочную реакцию аминогруппы обычно предотвращают за счет защиты аминогруппы. Защитную группу удаляют после завершения синтеза. Более подробную информацию о синтезе молекул РНК можно получить в следующих документах: Arnold и др., Chloridite and Amidite Automated Synthesis of Olygodeoxyribonucleotides Using Amidine Protected Nucleotides, 7th Symposium Chem. Nucleic Acid Components, Nucleic Acids Symposium Series, т.18, стр.181-184 (30 августа 1987), Chemical Abstracts, 108 (19), стр.692, реферат №167875z (9 мая 1988), Hayakawa и др., Benzimidazolium Triflate as an Efficient Promoter for Nucleotide Synthesis via the Phosphoramidite Method, J. Organic Chemistry, т.61 (23), 7996-7997 (15 ноября 1996), Pirrung и др., Proofing of Photolithographic DNA Synthesis with 3',5'-Dimethoxybenzoinyloxycarbonyl-Protected Deoxynucleoside Phosphoramidites, J. Organic Chemistry, т.63 (2), стр.241-246 (23 января 1998), Effenberger и др., Trifluoromethanesulfonic Imidazolide-A Convenient Reagent for Introducing the Triflate Group, Tetrahedron Letters, т.1980 (45), стр.3947-3948 (сентябрь 1980)), все указанные документы включены в данное описание в виде ссылок.
Получение РНК в составе комплекса на стадии а) по настоящему изобретению прежде всего проводят, как описано на подстадии а3), при добавлении определенного количества по крайней мере одной РНК к определенному количеству одного или более олигопептидов общей формулы (Arg)1,(Lys)m,(His)n,(Orn)o,(Xaa)x. При этом молярные или массовые соотношения, как указано выше, по крайней мере одной РНК и одного или более олигопептидов общей формулы (Arg)1,(Lys)m,(His)n,(Orn)o, (Xaa)x обычно определяют предварительно. Образование комплекса обычно происходит при смешивании обоих компонентов. При этом пептидный компонент обычно добавляют к нуклеиновому (РНК) компоненту, однако в некоторых случаях в обратном порядке.
Указанная стадия получения на стадии а), однако, необязательна и ее можно не проводить, если уже имеется РНК в составе комплекса по настоящему изобретению. Соответственно, подстадии а1), а2) и а3), как описано выше, также необязательны и нет необходимости их проводить, если уже имеется РНК, использованная в качестве РНК в составе комплекса. Аналогичным образом, один или более олигопептидов общей формулы (Arg)1,(Lys)m,(His)n,(Orn)o,(Xaa)x можно использовать напрямую, если они уже имеются, например, в виде коммерческих продуктов.
На стадии б) способа трансфекции клеток или тканей in vitro или in vivo no изобретению клетки или ткани можно трансфектировать с использованием готовой РНК в составе комплекса и/или полученной на стадии а). Трансфекцию клеток или тканей in vitro или in vivo прежде всего проводят при добавлении готовой РНК в составе комплекса, и/или полученной на стадии а) к клеткам или ткани. Затем предпочтительно РНК в составе комплекса проникает в клетки с использованием клеточных механизмов, например, эндоцитоза. Добавление РНК в составе комплекса в чистом виде к клеткам или тканям можно осуществлять согласно настоящему изобретению без добавления любых других компонентов за счет трансфекционных свойств РНК в составе комплекса по настоящему изобретению. В другом варианте добавление готовой РНК в составе комплекса и/или полученной на стадии а) к клеткам или ткани можно осуществлять в виде композиции, например, в виде компонента водного раствора, предпочтительно фармацевтической композиции, как указано выше, которая может необязательно содержать дополнительные компоненты для дополнительного повышения трансфекционной активности.
В данном контексте клетки (или клетки хозяина) для трансфекции РНК в составе комплекса (готовой и/или полученной на стадии a)) in vitro включают любую клетку, и предпочтительно, но, не ограничиваясь только ими, клетки, которые предназначены для трансфекции любой РНК (как указано выше) в составе комплекса по изобретению. Прежде всего, трансфекция РНК обеспечивает экспрессию белка, кодируемого РНК в составе комплекса по настоящему изобретению, в клетке или придает РНК (например, короткой интерферирующей киРНК, антисмысловой РНК) в составе комплекса по изобретению, свойства ослабления или подавления экспрессии клеточного гена. Клетки в данном контексте предпочтительно включают культивируемые клетки эукариот (например, дрожжевые клетки, растительные клетки, животные клетки и клетки человека) или клетки прокариот (например, бактериальные клетки и т.п.) или индуцируют иммунный ответ. Клетки многоклеточных организмов предпочтительно выбирают, если необходимы посттрансляционные модификации, например, гликозилирование, кодируемого белка (по N- и/или O-связи). В отличие от прокариотических клеток, указанные клетки (высших) эукариот способны осуществлять посттрансляционные модификации синтезированных белков. Специалистам в данной области известно множество указанных клеток и клеточных линий (высших) эукариот, например, 293Т (линия эмбриональных клеток почек), HeLa (клетки карциномы шейки матки человека), СНО (клетки яичника китайского хомячка) и другие клеточные линии, включая указанные клетки и клеточные линии, разработанные для лабораторных исследований, такие как, например, клетки hTERT-MSC, НЕК.293, Sf9 или COS. Пригодные эукариотические клетки, кроме того, включают клетки или клеточные линии, пораженные болезнями или инфекциями, например, раковые клетки, прежде всего раковые клетки любого типа рака, упомянутого в данном контексте, клетки, пораженные ВИЧ, и/или клетки иммунной системы или центральной нервной системы(ЦНС). Пригодные клетки можно аналогичным образом получить из эукариотических микроорганизмов, таких как дрожжи, например, Saccharomyces cerevisiae (Stinchcomb и др.. Nature, т.282, стр.39, (1997)), Schizosaccharomyces pombe, Candida, Pichia, и гифомицеты родов Aspergillus, Penicillium, и т.п. Пригодные клетки аналогичным образом включают клетки прокариот, таких как, например, клетки бактерий, например, Escherichia coli или бактерий рода Bacillus, Lactococcus, Lactobacillus, Pseudomonas, Streptomyces, Streptococcus, Staphylococcus, предпочтительно Е. coli, и т.п. Клетки человека или клетки животных, например, животных, упомянутых в данном контексте, являются прежде всего предпочтительно эукариотическими клетками. Кроме того, антиген-презентирующие клетки (АПК) можно использовать для трансфекции РНК в составе комплекса по настоящему изобретению ex vivo. Прежде всего предпочтительными являются дендритные клетки, которые можно использовать для трансфекции РНК в составе комплекса по настоящему изобретению ех vivo.
В наиболее предпочтительном варианте клетки крови и/или кроветворные клетки, или их отдельные популяции, то есть любой тип клеток, который можно выделить из (цельной) крови и/или клетки, которые можно получить из культивируемых клеточных линий, полученных из указанных клеток, можно трапсфектировать РНК в составе комплекса, описанного в данном контексте, по указанному выше способу трансфекции, например, эритроциты, гранулоциты, моноядерные клетки (клетки периферической крови, МКПК) и/или тромбоциты, АПК, дендритные клетки (ДК), и т.п.Предпочтительно, используют клетки крови, прежде всего их отдельные популяции, которые характеризуются прежде всего тем, что содержат небольшое число высоко дифференцированных специализированных АПК, таких как ДК. Трансфектированные клетки могут содержать предпочтительно менее 5%, прежде всего предпочтительно не более 2%, ДК, если они были используются для трансфекции. Термин "клетки крови" в контексте настоящего изобретения предпочтительно обозначает смесь или в значительной степени обогащенные (до практически чистой популяции) популяции эритроцитов, гранулоцитов, МКПК и/или тромбоцитов из цельной крови, сыворотки крови или другого источника, например, из селезенки или лимфатических узлов, в которых присутствует только небольшая доля специализированных АПК. Используемые клетки крови по настоящему изобретению предпочтительно представляют собой свежевыделенные клетки крови, то есть период между отбором клеток крови (прежде всего от забора крови) и трансфекцией может быть достаточно коротким, например, менее 12 ч, предпочтительно менее 6 ч, прежде всего предпочтительно менее 2 ч и наиболее предпочтительно менее 1 ч. Кроме того, клетки крови, предназначенные для трансфекции по указанному выше способу с использованием РНК в составе комплекса по настоящему изобретению, предпочтительно отбирают непосредственно у конкретного пациента, проходящего курс лечения фармацевтической композицией по настоящему изобретению. Использование клеток крови, кроветворных клеток или их отдельных популяций, как описано выше, основано на неожиданном открытии того факта, что для вакцинации пациента, нуждающегося в лечении, против отдельных антигенов, кодируемых мРНК, как указано в данном контексте, нет необходимости дифференцировать клетки крови, например, МКПК, полученные, например, из крови субъекта, прежде всего конкретного пациента, нуждающегося в лечении, с использованием трудоемких, продолжительных и дорогостоящих методов обработки клеточных культур, до популяции клеток с высоким содержанием специализированных антиген-презентирующих клеток (АПК), прежде всего дендритных клеток (ДК). Причем важно отметить, что для эффективной иммунной стимуляции достаточно трансфектировать клетки крови непосредственно мРНК, кодирующей один или более антигенов, чтобы получить фармацевтическую композицию, которая индуцирует пригодную иммунную стимуляцию, например, у конкретного пациента, от которого получены клетки крови, прежде всего упомянутые выше их отдельные популяции, и указанная иммунная стимуляция предпочтительно направлена против одного или более опухолевых антигенов или одного или более антигенов из патогенного микроорганизма или агента. Трансфекция РНК в составе комплекса, как указано в данном контексте, в клетки крови или клетки, полученные из нее (выделенные из нее или из соответствующих культивированных клеточных линий) не ограничена антигенами и разумеется, относится к любой РНК, как указано в данном контексте, использованной для получения РНК в составе комплекса, например, к любой РНК, оказывающей дополнительное иммуностимулирующее действие, как указано в данном контексте, к любой кодирующей РНК, и т.п.
При необходимости трансфектировать культивируемые клетки in vitro (например, клетки человека или животных) или трансфектировать эксплантированные клетки (например, клетки человека или животных) in vitro (перед их повторной трансплантацией в организм), также предусмотрено прямое введение РНК в составе комплекса по настоящему изобретению пациентам для трансфекции in vivo. Соответственно трансфекцию РНК в составе комплекса (в готовой форме и/или полученного на стадии а)) можно также проводить in vivo на стадии б), то есть комплекс можно вводить в живые ткани и/или организмы. Следовательно, РНК в составе комплекса, полученного на стадии а) способа трансфекции по изобретению можно вводить в живую ткань или организм либо в отдельности, либо, например, в виде компонента (жидкой) композиции, прежде всего водный композиции, например, фармацевтической композиции, как указано выше. В данном контексте организм прежде всего обозначает млекопитающих, выбранных, но, не ограничиваясь только ими, из группы, включающей человека и животных, включая, например, свинью, козу, крупный рогатый скот, свинью, собаку, кошку, осла, обезьяну, приматов или грызунов, включая мышь, хомяка и кролика. Кроме того, предпочтительно, чтобы живые ткани как указано выше, поучали из указанных организмов. Введение РНК в составе комплекса в указанные живые ткани и/или организмы можно проводить любым пригодным способом введения, например, системным способом и в том числе, например, внутри- или чрескожно, перорально, парентерально, включая подкожные, внутримышечные или внутривенные инъекции, местный и/или интраназальный способы, как указано выше.
Кроме того, способ трансфекции, который можно использовать in vitro или ex vivo, можно также использовать in vivo, например, для лечения различных заболеваний, упомянутых в данном контексте. В предпочтительном варианте способа лечения по настоящему изобретению можно использовать дополнительную стадию, которая включает введение другого фармацевтически эффективного вещества, например антитела, антигена (прежде всего патогенного или опухолевого антигена, как описано в данном контексте) или введение по крайней мере одного цитокина. Оба препарата можно вводить отдельно от РНК в составе комплекса, поскольку ДНК или РНК, кодирующие, например, цитокин или антиген или цитокин или антиген можно вводить каждый в отдельности. Способ лечения может также включать введение дополнительного адъюванта (как описано в данном контексте), который может дополнительно активировать иммунную систему,
В другом варианте осуществления настоящего изобретения РНК в составе комплекса, как указано выше, включающего по крайней мере одну РНК в комплексе с одним или более олигопептидами, причем олигопептид характеризуется длиной от 8 до 15 аминокислот и общей формулой (Arg)1,(Lys)m,(His)n,(Orn)o,(Xaa)x, можно использовать для лечения и/или профилактики специфических заболеваний, упомянутых в данном контексте. Лечение и/или профилактика специфических заболеваний зависит прежде всего от выбора пригодного белка, кодируемого РНК в составе комплекса по настоящему изобретению. Лечение в данном контексте может заключаться либо во введении РНК в составе комплекса по настоящему изобретению (кодирующей указанный белок) в отдельности или в виде (фармацевтической) композиции по настоящему изобретению, как указано выше.
В данном контексте заболевания или состояния включают, но, не ограничиваясь только ими, например, раковые или опухолевые заболевания, выбранные из меланом, злокачественных меланом, карцином ободочной кишки, лимфом, сарком, бластом, карцином почки, опухолей желудочно-кишечного тракта, глиом, опухолей предстательной железы, рака матки, опухолей прямой кишки, рака желудка, рака пищевода, рака поджелудочной железы, рака печени, карцином молочной железы (рака груди), рака мочевого пузыря, рака шейки матки, острого миелоидного лейкоза (омл), острого лимфоцитарного лейкоза (ОЛЛ), хронического миелоидного лейкоза (ХМЛ), хронического лимфоцитарного лейкоза (ХЛЛ), гепатом, различных опухолей вирусного происхождения, таких как, например, карциномы, вызванные вирусом папилломы (например, цервикальная карцинома - рак шейки матки), аденокарцинома, опухоли, вызванные вирусом герпеса (например, лимфома Беркита, В-клеточная лимфома, вызванная вирусом ЭБВ), опухоли, вызванные вирусом гепатита В (гепатоглеточная карцинома), лимфом, вызванных лимфотропным Т-клеточным вирусом HTLV-1- и HTLV-2, невриномы уха, карциномы легкого (рака легкого, карциномы бронхов), мелкоклеточные карциномы легкого, рак горла, анальная карцинома, глиобластома, карцинома прямой кишки, астроцитома, опухоли мозга, ретинобластома, базалиома, метастазы в мозгу, медуллобластомы, рак влагалища, рак яичка, карцинома щитовидной железы, синдром Ходжкина, менингеомы, болезнь Шнеебергера, опухоль гипофиза, фунгоидная гранулема, карциноидные опухоли, невриномы, спиналиомы, лимфома Беркита, рак гортани, рак почек, тимомы, карциномы туловища, рак костной ткани, лимфома не-Ходжкина, рак мочеиспускательного канала, синдром CUP, опухоли головы/шеи, олигодендроглиома, рак вульвы, рак кишечника, карцинома ободочной кишки, карцинома пищевода (рак пищевода), бородавки, опухоли тонкого кишечника, краниофарингиомы, карцинома яичников, опухоли мягких тканей, рак яичников (карцинома яичников), карцинома поджелудочной железы (рак поджелудочной железы), карциномы эндометрия, метастазы печени, рак пениса, рак языка, рак желчного пузыря, лейкоз, плазмоцитома, опухоли век, рак предстательной железы (опухоли предстательной железы) и т.п.
В данном контексте заболевания или состояния могут также включать инфекционные заболевания выбранные, например, из группы, включающей вирусные инфекционные заболевания, выбранные, но, не ограничиваясь только ими, из группы: атипичная пневмония, желтая лихорадка, боррелиоз Лайма, сибирская язва, СПИД, остроконечная кондилома, контагиозный моллюск, лихорадка денге, флеботомная лихорадка, вирус Эбола, простуда, весенне-летний менингоэнцефалит, грипп, опоясывающий лишай, гепатит, простой герпес I типа, простой герпес II типа, вирус опоясывающего лишая, грипп, японский энцефалит, геморрагическая лихорадка Ласса, вирус, вызывающий "марбургскую болезнь", вирусы кори, ящура, мононуклеоз, эпидемического паротита, вирус железистой лихорадки Пфейфера, натуральной оспы, полиомиелита, ложного крупа, инфекционная эритема, вирус бешенства, бородавок, лихорадки Западного Нила, ветрянки, цитомегаловирус (ЦМВ), бактериальные инфекционные заболевания, такие как инфекционная остановка развития (воспаление предстательной железы), сибирская язва, аппендицит (воспаление слепой кишки), боррелиоз, ботулизм, Campylobacter, Chlamydia trachomatis (воспаление мочеиспускательного канала, конъюнктивы), холера, дифтерия, донованоз, эпиглоттит, эпидемический сыпной тиф, брюшной тиф, газовая гангрена, гонорея, кроличья лихорадка, Helicobacter pylori, коклюш, климатический бубон, остеомиелит, болезнь легионеров, проказа, листериоз, пневмония, менингит, бактериальный менингит, сибирская язва, воспаление среднего уха, Mycoplasma hominis, сепсис новорожденных (хориоамнионит), влажная гангрена, паратиф, чума, синдром Рейтера, американский клещевой риккетсиоз, сальмонеллез, сальмонеллезный брюшной тиф, скарлатина, сифилис, столбняк, гонорея, болезнь цуцугамуши, туберкулез, тиф, вагинит (кольпит), мягкий шанкр и инфекционные заболевания, вызванные паразитами, простейшими или грибами, такие как амебная дизентерия, бильхарциеллез, болезнь Чагаса, эхинококкоз, широкий лентец, ихтиосаркотоксизм (сигуатера), солитер лис, микоз стоп, собачий солитер, кандидоз, фтириаз, зуд (чесотка), лейшманиоз, кожный лейшманиоз, лямблиозная дизентерия (жиардиа), вши, малярия, онхоцеркоз (речная слепота), грибковые заболевания, бычий цепень, шистосомоз, сонная болезнь, свиной цепень, токсоплазмоз, трихомониаз, трипаносомоз (сонная болезнь), висцеральный лейшманиоз, потница или карликовый цепень.
Заболевания в контексте настоящего изобретения также включают, но, не ограничиваясь только ими, (инфекционные) вирусные заболевания, вызванные вирусом, выбранным из следующей группы, но, не ограничиваясь только ими, ВИЧ, ортопоксвирусы, такие как вирус натуральной оспы человека, ортопоксвирус белой оспы, вирус парапокс овец, вирус контагиозного моллюска, вирус простого герпеса 1, вирус простого герпеса 2, вирус герпеса В, вирус ветряной оспы, вирус псевдобешенства, цитомегаловирус человека, вирус герпеса человека 6, вирус герпеса человека 7, вирус Эпштейна-Барр, вирус герпеса человека 8, вирус гепатита В, вирус чикунгунья, вирус о'Нъонг-нъон, рубивирус, вирус гепатита С, GB-вирус С, вирус лихорадки Западного Нила, вирус Денге, вирус желтой лихорадки, вирус шотландского энцефалита овец, вирус энцефалита Сент-Луис, вирус японского энцефалита В, вирус Повассан, вирус клещевого энцефалита FSME, коронавирус, ассоциированный с атипичной пневмонией, коронавирус человека 229Е, коронавирус человека Ос43, торовирус, вирус Т-клеточного лейкоза человека тип I, вирус Т-клеточного лейкоза человека тип II, вирус иммунодефицита человека тип I, вирус иммунодефицита человека тип 2, вирус Ласса, вирус лимфоцитарного хориоменингита, вирус Такарибе, вирус Жунин, вирус Мачупо, вирус болезни Борна, вирус Буньямвера, вирус калифорнийского энцефалита, вирус Рифт-Валли, вирус москитной лихорадки, вирус тосканской лихорадки, вирус конго-крымской геморрагической лихорадки, вирус Хазара, вирус Казань, вирус Хантаан, вирус Сеул, вирус Prospect Hill, вирус Пуумала, вирус Добрава-Белград, вирус Тула, вирус Син Номбр, марбургвирус озеро Виктория, заирский эболавирус, суданский эболавирус, эболавирус Берега Слоновой Кости, вирус гриппа А, вирус гриппа В, вирусы гриппа С, вирус парагриппа, вирус кори, вирус эпидемического паротита, респираторно-синцитиальный вирус, метапневмовирус человека, вирус везикулярного стоматита Индианы, вирус бешенства, вирус Мокола, вирус Дувенхаге, лиссавирус Европейских летучих мышей 1 и 2, лиссавирус Австралийских летучих мышей, аденовирусы A-F, папилломавирус человека, вирус кондиломы человека 6, вирус кондиломы 11, вирусы полиомы, аденоассоциированный вирус 2, ротавирусы, или орбивирусы и т.п. Указанные заболевания можно лечить, например, вакциной по настоящему изобретению.
Кроме того, заболевания или состояния могут включать сердечнососудистые заболевания выбранные, но, не ограничиваясь только ими, из группы: коронарная болезнь сердца, атеросклероз, инсульт и гипертензия, и неврональные заболевания, выбранные из группы: болезнь Альцгеймера, боковой амиотрофический склероз, дистония, эпилепсия, рассеянный склероз, болезнь Паркинсона и т.п.
Заболевания или состояния в данном контексте могут также включать аллергическое нарушение или заболевание. Аллергия является состоянием, которое прежде всего включает аномальную, приобретенную иммунологическую гиперчувствительность к отдельным чужеродным антигенам или аллергенам. При аллергии обычно наблюдается к местный или системный воспалительный ответ на указанные антигены или аллергены и вырабатывается иммунитет в организме к указанным аллергенам. Аллергены в данном контексте включают, например, травы, цветочную пыльцу, плесневые грибы, лекарственные средства, или многочисленные факторы окружающей среды и т.п. Не отдавая предпочтения какой-либо теории, предполагаются различные механизмы развития аллергии. По классификации П.Гелла и Р.Кумбса термин "аллергия" относится к гиперчувствительности I типом, которая связана с классическим механизмом IgE. Гиперчувствительность типа I характеризуется избыточной активацией тучных клеток и базофилов в присутствии IgE, что приводит к системному воспалительному ответу, который может привести к неопасным симптомам, таким как насморк, опасному для жизни анафилактическому шоку и смерти. Известные типы аллергий включают, но, не ограничиваясь только ими, аллергическую астму (приводящую к отеку слизистой оболочки носа), аллергический конъюнктивит (приводящий к покраснению и зуду конъюнктивы), аллергический ринит ("сенная лихорадка"), анафилактический шок, ангионевротический отек, атопический дерматит (экзему), уртикарную сыпь (крапивницу), эозинофилию, аллергия дыхательных путей, аллергия на укусы животных, кожные аллергии (приводящие к сыпи и включающие различные высыпания, такие как экзема, крапивница и (контактный) дерматит), пищевые аллергии, аллергии к лекарственным средствам, и т.п. В настоящем изобретении предлагается, например, фармацевтическая композиция, которая содержит, например, РНК, кодирующую аллерген (например, аллерген кошачьей шерсти, аллерген пыли, клещевой антиген, растительный антиген (например, антиген березовых почек) и т.п.) в составе комплекса по настоящему изобретению. Таким образом кодируемый аллерген может десенсибилизировать иммунный ответ пациента. В другом варианте фармацевтические композиции по настоящему изобретению могут сдвигать (избыточный) иммунный ответ в сторону более сильного ответа ТН1, при этом подавляется или ослабляется нежелательный ответ IgE, от которого страдает пациент.
Кроме того, заболевания или состояния, как указано в данном контексте, могут включать аутоиммунные заболевания. В зависимости от основных клинико-патологических характеристик каждого заболевания аутоиммунные заболевания можно условно разделить на системные и орган-специфичные или локализованные аутоиммунные заболевания. Аутоиммунное заболевание можно подразделять на категории по системным синдромам, включая системную красную волчанку (СКВ), синдром Шегрена, склеродермию, ревматоидный артрит и полимиозит или местные синдромы, которые представляют собой эндокринологические (сахарный диабет 1 типа, тиреоидит Хашимото, болезнь Аддисона, и т.п.), дерматологические (обыкновенная пузырчатка), гематологические (аутоиммунная гемолитическая анемия), неврональные (рассеянный склероз) заболевания или могут поражать практически любую ограниченную массу ткани организма. Аутоиммунные заболевания, подлежащие лечению, можно выбирать из группы, включающей аутоиммунные заболевания типа I, или аутоиммунные заболевания типа II, или аутоиммунные заболевания типа III, или аутоиммунные заболевания типа IV, такие как, например, рассеянный склероз, ревматоидный артрит, диабет типа I (сахарный диабет), системную красную волчанку, хронический полиартрит.Базедову болезнь, аутоиммунные формы хронического гепатита, язвенный колит, аллергические заболевания типа I, аллергические заболевания типа II, аллергические заболевания типа III, аллергические заболевания типа IV, фибромиалгия, облысение, болезнь Бехтерева, болезнь Крона, миастения гравис, нейродермит, ревматоидная полимиалгия, генерализованная склеродермия, псориаз, синдром Рейтера, ревматоидный артрит, псориаз, васкулит, и т.п. или диабет типа II.
Причина, по которой иммунная система индуцирует иммунный ответ на аутоантигены, до сих пор не выявлена, хотя некоторые данные касаются ее этиологии. Считается, что аутоиммунная реакция может возникать при развитии иммунного ответа «в обход»Т-клеток. Нормальной иммунной системе требуется активация В-клеток Т-клетками, прежде чем антитела смогут синтезироваться в больших количествах. Эту потребность в Т-клетках в редких случаях организмы могут обойти, например, при инфекции организмами, продуцирующими суперантигены, которые способны стимулировать поликлональную активацию В-клеток, или даже Т-клетки, за счет прямого неспецифического связывания с β-субъединицей рецептора Т-клеток. Другое объяснение аутоиммунного заболевания связано с молекулярной мимикрией. Экзогенный антиген может характеризоваться структурным сходством с некоторыми антигенами хозяина, таким образом, любое антитело, вырабатываемое к этому антигену (который является миметиком-ауто-антигеном) также может теоретически связываться с антигенами хозяина и усиливать иммунный ответ.Наиболее удивительная форма молекулярной мимикрии наблюдается у β-гемолитических стрептококков группы А, которые характеризуются антигенами, сходными с антигенами миокарда человека, и вызывают кардиологические проявления, аналогичные острой ревматической лихорадке. Таким образом, в настоящем изобретении предлагаются РНК, кодирующие аутоантиген, в качестве компонента РНК в составе комплекса по настоящему изобретению (или (жидкой) композиции, содержащей указанную РНК в составе комплекса по настоящему изобретению) или фармацевтическая композиция, содержащая аутоантиген (в виде белка, мРНК или ДНК, кодирующих ау то антигенный белок) и РНК в составе комплекса по настоящему изобретению, причем все эти компоненты прежде всего позволяют десенсибилизировать иммунную систему.
Наконец, заболевания, поддающиеся лечению в контексте настоящего изобретения, аналогичным образом включают моногенетические заболевания, то есть (наследственные) заболевания, или в основном генетические заболевания. Указанные генетические заболевания обычно вызваны генетическими дефектами, например, генными мутациями, приводящими к утрате активности определенного белка, или регуляторными мутациями, которые затрудняют транскрипцию или трансляцию белка. Часто указанные заболевания приводят к метаболическим нарушениям или другим симптомам, например, дистрофии мышц. Соответственно, в настоящем изобретении предлагается способ лечения указанных заболеваний при введении РНК в составе комплекса, как указано в данном контексте. Таким образом, можно лечить следующие заболевания: недостаточность 3-β-гидроксистероиддегидрогеназы (типа II), недостаточность 3-кетотиолазы, чувствительность к 6-меркаптопурину, синдром Аарскога-Скотта, абеталипопротеинемия, акаталазия, ахондрогенез, ахондрогенез-гипохондрогенез, ахондроплазия, ахроматопсия, дисплазия Хантера-Томпсона, недостаточность АКТГ, недостаточность ацил-КоА-дегидрогеназы (короткоцепочечной, среднецепочечной и длинноцепочечной), аденоматозный кишечной полипоз, недостаточность аденозиндеаминазы, недостаточность аденилсукциназы, адхалинопатия, гиперплазия надпочечников, врожденная (связанная с недостаточностью 11-β-гидроксилазы, связанная с недостаточностью 17-α-гидроксилазы, связанная с недостаточностью 21-гидроксилазы), гипоплазии надпочечников, врожденная с гипогонадотропным гипогонадизмом, адреногенитальный синдром, адренолейкодистрофия, адреномиелоневропатия, афибриногенемия, агаммаглобулинемия, синдром Алажиля, альбинизм (коричневый, глазной, окулокутанный, красно-коричневый), острая непереносимость алкоголя, недостаточность альдолазы А, альдостеронизм, излечимый глюкокортикоидами, болезнь Александера, алкаптонурия, генерализованная алопеция, недостаточность α-1-антихимотрипсина, недостаточность α-метилацил-КоА-рацемазы, синдром α-талассемии/врожденного слабоумия, наследственный семейный геморрагический нефрит, болезнь Альцгеймера-1 (связанная с АРР-белком-предшественником амилоида), болезнь Альцгеймера-3, болезнь Альцгеймера-4, несовершенный амелогенез, амилоидная нейропатия (наследственная, несколько аллельных вариантов), амилоидоз (голландского типа, финского типа, наследственный почечный, почечный, старческий системный), амиотрофический боковой склероз, анальбуминемия, синдром нечувствительности к андрогенам, анемия (Даймонда-Блэкфана), анемия (гемолитическая, вследствие недостаточности пируваткиназы), анемия (гемолитическая, Rh-0, суппрессорного типа), анемия (гемолитическая новорожденных, летальная и окололетальная), анемия (сидеробластная, с атаксией), анемия (сидеробластная/гипохромная), анемия вследствие недостаточности G6PD, аневризмы (наследственная артериальная), синдром Ангельмана, ангиоэдема, аниридия, аномалии переднего сегмента и катаракта, мезенхимальный дисгенез переднего сегмента, мезенхимальный дисгенез переднего сегмента и катаракты, недостаточность антитромбина III, повышенная тревожность, синдром Аперта, апноэ (посленаркозная), недостаточность апоА-I и апоС-III (комбинированный), недостаточность аполипопротеина A-II, аполипопротеина В-100 (лиганд-дефектный), кажущийся избыток уровня минералокортикоидов (вследствие гипертензии), аргининемия, аргининосукцинурия, артропатии (прогрессивная псевдоревматоидная, детская), аспартилглюкозаминурия, атаксия (эпизодическая), атаксия с недостаточность витамина Е, атаксия-телеангиэктазия, ателостеогенез II, недостаточность АТФ-зависимой ДНК-лигазы I, дефект межпредсердной перегородки с дефектом атриовентрикулярной проводимости, атрихия с поражением папул, аутизм (сукцинилпуринемический), аутоиммунная полигландулярная болезнь типа I, дисфункция периферической нервной системы, аномалия Аксенфельда, азооспермия, синдром Бэмфорт-Лазаруса, синдром Баннаяна-Зонана, синдром Барта, синдром Барттера (типа 2 или типа 3), базальноклеточная карцинома, синдром базально-клеточного невуса, инфекция БЦЖ, синдром Бира-Стивенсона (пахидермия складчатая), мышечная дистрофия Бекера, синдрома Беквит-Видемана, синдром Бернара-Сулье (тип В, тип С), миопатия Бетлема, первичная мальабсорбция желчных кислот, недостаточность биотинидазы, рак мочевого пузыря, нарушение свертываемости крови вследствие дефекта рецепторов тромбоксана А2, синдрома Блума, брахидактилия (типа В1 или типа С), бранхио-ото-синдром, бранхио-ото-ренальный синдром, рак молочной железы (инвазивный внутрипротоковый, лобулярный, мужской, с синдромом Райфенштейна, спорадический), рак молочной железы-1 (раннее развитие), рак молочной железы-2 (раннее развитие), миопатия Броди, синдром Бругада, синдром Бруннера, лимфома Беркитта, дистрофия пигментного пятна (сетчатки) в форме бабочки, недостаточность C1q (тип А, тип В, тип С), недостаточность С1 г/C1s, изолированная недостаточность C1s, недостаточность С2, недостаточность С3, недостаточность инактиватора C3b, недостаточность С4, недостаточность С8 II типа, недостаточность С9, кампомелическая дисплазия с аутосомной реверсией пола, синдром камптодактилии-артропатии вирусного перикардита, болезнь Канавана, недостаточность карбамоилфосфатсинтетазы I, синдром недостаточности углеводов-гликопротеина (тип I, тип Ib, тип II), карциноидная опухоль легкого, кардиоэнцефаломиопатия (младенческая летальная, связанная с недостаточностью цитохром-с-оксидазы), кардиомиопатия (дилатационная, дилатационная сцепленная с Х-хромосомой, наследственная гипертрофическая, гипертрофическая), недостаточность карнитина (первичная системная), недостаточность карнитин-ацилкарнитинтранслоказы, кистевой туннельный синдром (наследственный), катаракта (лазурная, врожденная, кристаллическая шиловидная, юношеская, полиморфная и пластинчатая, точечная, слоистая мучнистая), катаракта Коппока, недостаточность CD59, болезнь центрального стержня, мозжечковая атаксия, церебральная амилоидная ангиопатия, церебральная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией, кавернозная ангиома-1, церебро-окуло-фациоскелетный синдром, церебросухожильный ксантоматоз, цереброваскулярное расстройство, восковидный липофусциноз (нейронный, вариант юношеского типа, с гранулированными осмиофильными отложениями), восковидпый липофусциноз (нейронный-1, детский), восковидный липофусциноз (нейронный-3, юношеский), синдром Шарко, болезнь Шарко-Мари-Тута, невропатия Шарко-Мари-Тута, тип Чарлвуа-Сагеней, синдром Чедиака-Хигаши, хлоридная диарея (финского типа), холестаз (доброкачественный возвратный внутрипеченочный), холестаз (наследственный внутрипеченочный), холестаз (прогрессивный наследственный внутрипеченочный), болезни накопления эфиров холестерина, хондродисплазия точечная (анкилозирующая, сцепленная с Х-хромосомой доминантная, сцепленная с Х-хромосомой рецессивная, типа Гребе), хондросаркома, хороидеремия, гранулематозная хроническая болезнь (аутосомная вследствие недостаточности CYBA), гранулематозная хроническая болезнь (сцепленная с Х-хромосомой), гранулематозная хроническая болезнь вследствие недостаточности NCF-1, гранулематозная хроническая болезнь вследствие недостаточности NCF-2, наследственный хиломикронемический синдром, цитруллинемия, классический синдром Коккейна 1, расщелина губы, расщелина челюсти, расщелина неба, синдром эктодермальной дисплазии расщелины губы/неба, клейдокраниальная дисплазия, недостаточность СМО II, болезнь Коутса, синдром Коккейна 2 тип В, синдром Коффина-Лоури, устойчивость к колхицину, аденокарцинома ободочной кишки, рак ободочной кишки, цветовая слепота (деутан, протан, тритан), колоректальный рак, сочетанная недостаточность факторов V и VIII, сочетанная гиперлипемия (наследственная), сочетанная иммунонедостаточность (сцепленная с X-хромосомой, средней тяжести), недостаточность комплекса I, комплексное неврологическое расстройство, дистрофия конуса 3, конусно-палочковая дистрофия 3, конусно-палочковая дистрофия 6, конусно-палочковая дистрофия сетчатки-2, врожденное двустороннее отсутствие семявыносящих протоков, деревянистый конъюнктивит, контрактурная арахнодактилия, копропорфирия, врожденная роговая оболочка, помутнение роговицы, дистрофия роговицы (типа Авеллино, гранулярная, типа Греноува I, решетчатая типа I, типа Рейс-Баклера), устойчивость к кортизону, устойчивость к кумарину, болезнь Каудена, недостаточность печеночной СРТ (тип I, тип II), судороги (наследственные, опосредованные калием), синдром краниофациальной дисморфии-тугоухости-ульнарной девиации (тип 2), кретинизм, болезнь Крейтцфельдта-Якоба, синдром Криглера-Найяра, синдром Крузона, синдром Каррарино, синдромом вялой кожи, циклический гемопоэз, циклический ихтиоз, цилиндроматоз, муковисцидоз, цистиноз (нефропатический), цистинурия (тип II, тип III), дальтонизм, болезнь Дарье, D-бифункциональная белковая недостаточность, аутосомная доминантная глухота 1, аутосомная доминантная глухота 11, аутосомная доминантная глухота 12, аутосомная доминантная глухота 15, аутосомная доминантная глухота 2, аутосомная доминантная глухота 3, аутосомная доминантная глухота 5, аутосомная доминантная глухота 8, аутосомная доминантная глухота 9, аутосомная рецессивная глухота 1, аутосомная рецессивная глухота 2, аутосомная рецессивная глухота 21, аутосомная рецессивная глухота 3, аутосомная рецессивная глухота 4, аутосомная рецессивная глухота 9, глухота внесиндромная нейросенсорная 13, глухота, сцепленная с Х-хромосомой 1, глухота, сцепленная с Х-хромосомой 3, чувствительность к дебризоквину, болезнь Дежерина-Сотта, деменция (наследственная датская), деменция (лобно-височная с паркинсонизмом), болезнь Дента, стоматологические аномалии, синдром Ханта, синдром Дениса-Драша, выбухающая дерматофибросаркома, десмоид, диабет несахарный (нефрогенной), несахарный диабет (нейрогипофизарный), сахарный диабет (инсулин-независимый), сахарный диабет (редкая форма), сахарный диабет (тип II), дистрофическая дисплазия, дигидропиримидинурия, дозо-зависимая реверсия пола, ячеистая дегенерация сетчатки Дойна, синдром Дубина-Джонсона, миодистрофия Дюшенна, дизэритропоэтическая анемия с тромбоцитопенией, дисфибриногенемия (α-типа, β-типа, γ-типа), врожденный дискератоз 1, диспротромбинемия, дистония (чувствительная к DOPA), дистония (миоклоническая), дистония 1 (торсионная), эктодермальная дисплазия, эктопия хрусталика, эктопия зрачка, эктродактилия (дисплазия эктодермы и синдром заячьей губы/неба 3), синдром Элерса-Данло (прогероидная форма), синдром Элерса-Данло (I типа, II типа, III типа, IV типа, VI типа, VII типа), эластиновый надклапанный стеноз устья аорты, овалоцитоз 1, овалоцитоз 2, овалоцитоз 3, синдром Эллиса-Ван Кревельда, мышечная дистрофия Эмери-Дрейфуса, эмфизема, энцефалопатия, эндокардиальный фиброэластоз 2, рак эндометрия, недостаточность ацетилхолинэстеразы в концевых пластинах, синдром ESC, увеличение преддверия вестибулярного аппарата, буллезный эпидермоз, дистрофический буллезный эпидермоз (доминантный или рецессивный), симплекс буллезного эпидермоза, эпидермолитический ихтиоз, эпидермолитическая ладонно-подошвенная кератодермия, эпилепсия (генерализованная, ювенильная, миоклоническая, ночная лобная, прогрессивная миоклоническая), эпилепсия новорожденных доброкачественная, (тип 1 или тип 2), эпифизарная дисплазия (множественная), эпизодическая атаксия (тип 2), синдром эпизодической атаксии/миокимии, эритремия (а-, дисплазия), эритроцитоз, эритрокератодермия, нечувствствительность к эстрогену, миоглобинурия при физической нагрузке вследствие недостаточности ЛДГ-А, экзостозы множественные (тип 1, тип 2), экссудативная витреоретинопатия, сцепленная с Х-хромосомой, болезнь Фабри, недостаточность фактора Н, недостаточность фактора VII, недостаточность фактора X, недостаточность фактора XI, недостаточность фактора XII, недостаточность фактора XIIIa, недостаточность фактора XIIIB, наследственная средиземноморская лихорадка, анемия Фанкони, синдром Фанкони-Бикела, липогранулематоз Фарбера, жировая инфильтрация печени (острая), примахиновая анемия, болезнь "рыбьих глаз", фовеальная гипоплазия, синдром ломкой Х-хромосомы, синдром Фрасьера, атаксия Фридрейха, непереносимость фруктозы, связанная с недостаточностью фруктозобисфосфатазы, фукозидоз, недостаточность фумаразы, глазное альбиностическое дно, желтопятнистая абиотрофия сетчатки, недостаточность G6PD, недостаточность ГАМК-трансаминазы, недостаточность галактокиназы с катарактой, недостаточность галактозоэпимеразы, галактоземия, галактосиалидоз, недостаточность ГАМТ, синдром Гарднера, рак желудка, болезнь Гоше, генерализованная эпилепсия с фебрильной судорогой, эмбрионально-клеточная опухоль, синдром Герстманна-Штреусслера, гигантоклеточная трансформация печени (новорожденных), болезнь Бернара-Сулье, гигантоклеточная фибробластома, синдром Гительмана, тромбастения Гланцманна (тип А, тип В), глаукома 1А, глаукома ЗА, мультиформная глиобластома, гломерулосклероз (фокально-сегментарный), дефект транспорта глюкозы (гематоэнцефалический барьер), мальабсорбция глюкозы/галактозы, недостаточность глюкозидазы I, наличие глютаровой кислоты в моче (тип I, тип ИВ, типа IIC), недостаточность глутатионсинтетазы, недостаточность глицеринкиназы, глициновых рецепторов (α-1 полипептид), болезнь накопления гликогена I, болезнь накопления гликогена II, болезнь накопления гликогена III, болезнь накопления гликогена IV, болезнь накопления гликогена VI, болезнь накопления гликогена VII, гликогеноз (печени аутосомный), гликогеноз (сцепленный с Х-хромосомой печеночный), ганглиозидоз GM1, ганглиозидоз GM2, зоб (многоузловой подростковый), зоб (врожденный). Зоб (неэндемичный, простой), дисгенезия гонад (типа XY), гранулематоз септический, болезнь Грейвса, синдром цефалополисиндактилии Грейга, синдром Грисцелли, карликовость вследствие недостаточности гормона роста, задержка роста с глухотой и умственной отсталостью, гинекомастия (наследственная, вследствие увеличения активности ароматазы), атрофия гирата хориоидеи и сетчатки с орнитинемией (чувствительная или не чувствительная к В6), болезнь Хейли-Хейли, синдром Хаим-Мункасиндром пузырчатки матки, порфиринурия, недостаточность HDL (наследственная), блокада сердца (непрогрессивная или прогрессивная), анемия с тельцами Гейнца, HELLP-синдром, гематурия (наследственная доброкачественная), недостаточность гемоксигеназы-1, гемиплегическая мигрень, гемохроматоз, Н-гемоглобинопатия, гемолитическая анемия вследствие избытка аденозиндеаминазы, гемолитическая анемия вследствие недостаточности аденилаткиназы, гемолитическая анемия вследствие дефекта полосы 3, гемолитическая анемия вследствие недостаточности глюкозофосфатизомеразы, гемолитическая анемия вследствие недостаточности глутатионсинтетазы, гемолитическая анемия вследствие недостаточности гексокиназы, гемолитическая анемия вследствие недостаточности фосфоглицераткиназы, гемолитический уремический синдром, гемофагоцитарный лимфоцитарный гистиоцитоз, гемофилия А, гемофилия В, геморрагический диатез вследствие недостаточности фактора V, гемосидероз (системный, вследствие ацерулоплазминемии), недостаточность липазы печени, гепатобластома, гепатоклеточная карцинома, наследственная геморрагическая телеангиэктазия 1, наследственная геморрагическая телеангиэктазия 2, синдром Херманского-Пудлака, гетеротаксис (сцепленный с Х-хромосомой висцеральный), гетеротопия (перивентрикулярная), синдром фон Гиппеля-Линдау, болезнь Гиршпрунга, гистидинобогащенный гликопротеин-тромбофилия, связанная с недостаточностью HMG недостаточность HMG-CoA-лиазы, аринэнцефалия 2, аринэнцефалия 3, аринэнцефалия 4, аринэнцефалия 5, синдром Холта-Орама, гомоцистинурия, синдром Hoyeraal-Hreidarsson, присутствие фетальных гемоглобинов (делеционного типа или неделеционного типа), подагра вследствие присутствия фетальных гемоглобинов, болезнь Гентингтона, гидроцефалия вследствие стеноза водопровода мозга, водянка плода, гипер-р-липопротеинемия, гиперхолестеринемия, наследственная, синдром гиперферритинемии с катарактой, гиперглицеринемия, гиперглицинемия, синдром гипериммуноглобулинемии D и перемежающейся лихорадки, гиперинсулинизм, синдром гиперинсулинизма и гипераммонемии, семейный гиперкалиемический периодический паралич, гиперлипопротеинемия, гиперлизинемия, гиперметионинемия (постоянная, аутосомная, доминантная, метионинзависимая, вследствие недостаточности аденозилтрансферазы I/III), синдром гиперорнитинемии-гипераммониемии-гомоцитрулинемии, гипероксалурия, гиперпаратиреоз, гиперфенилаланинемия вследствие недостаточности птерин-4-акарбиноламиндегидратазы, гиперпроинсулинемия, гиперпролинемия, гипертензия, гипертиреоз (врожденный), гипертриглицеридемия, гипо-α-липопротеинемия, гипо-β-липопротеинемия, гипокальциемия, гипохондроплазия, микроцитарная гипохромная анемия, гиподонтия, гипофибриногенемия, гипоглобулинемия и отсутствие В-клеток, гипогонадизм (гипергонадотропный), гипогонадотропный (гипогонадизм), гипокалиемический периодический паралич, гипомагниемия, гипомиелинизация (врожденная), гипопаратиреоз, гипофосфатазия (взрослых, детей, младенческая, наследственная), гипопротромбинемия, гипотиреоз (врожденный, наследственный врожденный, не зобный), ихтиозиформная эритродермия, ихтиоз, ихтиоз буллезный Сименса, недостаточность IgG2, синдром цилиарной дискинезии 1, иммунодефицит (Т-клеточного рецептора/комплекса CD3), иммунодефицит (сцепленный с Х-хромосомой, с гиперпродукцией IgM), иммунодефицит вследствие дефекта в CD3-гамма, синдром иммунодефицита-центромерной нестабильности-лицевой аномалии, синдром Блоха-Сульцбергера, нечувствительность к боли (врожденная, с ангидрозом), спорадическая летальная инсомния, недостаточность рецептора интерлейкина-2 (α-цепь), заболевание межпозвонковых дисков, Iridogoniodysgenesis, изолированный дефицит гормона роста (типа Иллига с отсутствием ГР и типа Коварски с биологически неактивным ГР), изовалериацидемия, синдром Джексона-Вейсса, синдром Дженсена, синдром Джервелла-Ланге-Нильсена, синдром Жубера, синдром Жубера-Марсиди, синдром Кальмана, болезни Канзаки, кератит, кератодермия (ладонно-подошвенная), полосчатый ладонно-подошвенный кератоз I, полосчатый ладонно-подошвенный кератоз II, кетоацидоз вследствие недостаточности Арского-Скотта, синдром Койтеля, синдром Клиппеля-Треноне, дисплазии Книста, нейтропения Костманна, болезнь Краббе, синдром коротких ребер-полидактилии, лактацидемия вследствие недостаточности PDX1, мезомелическая дисплазия Лангера, карликовость Ларона, синдром Лоренса-Муна-Барде-Бидля, недостаточность LCHAD, врожденный амавроз Лебера, порок развития левой-правой оси, синдром Лея, лейомиоматоз (диффузный, с синдромом Алпорта), лепречаунизм, дисхондростеоз Лери-Вейлля, синдром Леша-Найхана, лейкоз (острый миелоидный, острый промиелоцитарный, острый Т-клеточный лимфобластный, хронический миелоидный, ювенильный миеломоноцитарный, лейкоз-1 (Т-клеточный острый лимфоцитарный), недостаточность адгезии лейкоцитов, аденома лейдиговских клеток, болезнь Лермитта-Дюкло, синдром Лиддла, синдром Ли-Фраумени, недостаточность липоамиддегидрогеназы, липодистрофия, липоидная гиперплазия надпочечников, недостаточность липопротеинлипазы, лиссэнцефалия (сцепленная с Х-хромосомой), лиссэнцефалия-1, гликогеновая болезнь печени (тип 0), синдром удлинения интервала QT-1, синдром удлинения интервала QT-2, синдром удлинения интервала QT-3, синдром удлинения интервала QT-5, синдром удлинения интервала QT-6, синдром Лоу, рак легких, рак легкого (немелкоклеточный), рак легкого (мелкоклеточпый), лимфедема, лимфома (В-клеточная неходжкинская), лимфома (диффузная крупноклеточная), лимфома (фолликулярная), лимфома (MALT), лимфома (клеток мантийной зоны), Х-сцепленный лимфопролиферативный синдром (Х-сцепленный), лизинурическая непереносимость белка, болезнь Мачадо-Джозефа, макроцитарная анемия рефракторная (синдром 5q), макулодистрофия, злокачественная мезотелиома, недостаточность малонил-КоА-декарбоксилазы, маннозидоз, (α- или β-), болезнь кленового сиропа (тип Ia, тип Ib, тип II), синдром Марфана, болезнь Марото-Лами, синдром Маршалла, синдром MASA, тучноклеточный лейкоз, мастоцитоз с сопутствующим гематологическим нарушением, болезнь Мак-Ардла, полиоссальная фиброзная остеодисплазия Мак-Кьюна-Олбрайта, синдром Мак-Кьюсика, фенотип Мак-Лауда, медуллярная карцинома щитовидной железы, медуллобластома, эпителиальная дистрофия роговицы Месманна, мегалобластная анемия-1, меланома, мембранопролиферативный гломерулонефрит, болезнь Меньера, менингиома (NP2-ассоциированная, SIS-ассоциированная), болезнь Менкеса, умственная отсталость (Х-ассоциированная), «медленный» метаболизатор мефенитоина, мезотелиома, метахроматическая лейкодистрофия, метафизарная хондродисплазия (типа Мурк Янсена, типа Шмид), метгемоглобинемия, недостаточность метионинаденозилтрансферазы (аутосомно-рецессивная), недостаточность метилкобаламина (типа cb1 G), метилмалонацидурия (тип недостаточности мутазы), мевалонацидурия, недостаточность ГКГ класса II, микрофтальмия (катаракты и аномалии радужной оболочки глаза), миопатия Миоши, юношеский инсулинонезависимый сахарный диабет, синдром Мора-Транебьерга, недостаточность молибденового кофактора (тип А или тип В), монилетрикс, болезнь Фабри, болезнь Гоше, мукополисахаридоз, муковисцидоз, синдром Мунка, синдром Мюир-Торре, нанизм Малибрея, множественная недостаточность карбоксилазы (биотинчувствительная), множественные эндокринные неоплазии, гликогеноз мышц, мышечная дистрофия (врожденная мерозин-дефицитная), мышечная дистрофия (врожденная Фукуямы), мышечная дистрофия (конечностно-поясная), мышечная дистрофия (Дюшенна), мышечная дистрофия с доброкачественным буллезным эпидермолизом, миастенический синдром (с медленным каналом, врожденный), микобактериальная инфекция (атипичная, наследственная диссеминированная), миелодиспластический синдром, миелогенный лейкоз, миелоидная злокачественная опухоль, недостаточность миелопероксидазы, недостаточность миоаденилатдеаминазы, миоглобинурия/гемолиз вследствие недостаточности фосфоглицераткиназы, синдром мионейрогастроинтестинальной энцефаломиопатии, миопатия (актиновая, врожденная, десмин-связанная, кардиоскелетная, дистальная, немалиновая), миопатия вследствие недостаточности СРТ II, миопатия вследствие недостаточности фосфоглицератмутазы, врожденная миотония, доброкачественная миотония, миотоническая дистрофия, миксоидная липосаркома, недостаточность N-ацетилгалактозаминидазы, наследственный онихоартроз, немалиновая миопатия 1 (аутосомно-доминантная), немалиновая миопатия 2 (аутосомно-рецессивная), гиперпаратиреоз новорожденных, почечнокаменная болезнь, нефронофтиз (ювенильный), нефропатия (хроническая гипокомплементемическая), нефроз-1, нефротический синдром, синдром Незертона, нейробластома, нейрофиброматоз (тип 1 или тип 2), нейролеммоматоз, нейронный восковидный липофусциноз-5, невропатия, нейтропения (аллоимунная новорожденных), болезнь Нимана-Пика (тип, тип В, тип С1, тип D), куриная слепота (врожденная постоянная), синдром поломок Ниджмеджена, некомпактный миокард левого желудочка, неэпидермолитическая ладонно-подошвенная кератодермия, болезнь Норри, болезнь Норума, недостаточность нуклеозидфосфорилазы, ожирение, синдром затылочного рога, глазной альбинизм (типа пятнистой сетчатки), окулофарингеальная мышечная дистрофия, болезнь Огучи, олигодонтия, синдром Оменна, синдром Опитца G, колобома зрительного нерва с болезнью почек, недостаточность орнитинтранскарбамилазы, оротикацидурия, ортостатическая непереносимость, синдром отоспондиломегаэпифизарной дисплазии, окостенение задней продольной связки позвоночника, остеоартроз, несовершенный остеогенез, остеолиз, остеопетроз (рецессивный или идиопатический), остеосаркома, рак яичников, дисгенезия яичников, врожденная пахионихия (типа Джексона-Лоулера или типа Ядассона-Левандовского), деформирующая остеодистрофия Педжета, синдром Паллистера-Холла, агенезия поджелудочной железы, рак поджелудочной железы, панкреатит, синдром Лефевра-Папийопа, параганглиомы, парамиотония врожденная, отверстие теменной кости, болезнь Паркинсона (наследственная или ювенильная), пароксизмальная ночная гемоглобинурия, болезнь Пелицеуса-Мерцбахера, синдром Пендреда, промежностный гипоспадит, перемежающаяся лихорадка, пероксисомальное расстройство биогенеза, стойкая гиперинсулиновая гипогликемия младенчества, стойкая персистенция мюллеровых протоков (тип II), аномалия Петерса, синдром Пейтца-Егерса, синдрома Пфейфера, фенилкетонурия, подагра, связанная с фосфорибозилпирофосфатсинтетазой, недостаточность фосфорилазы киназы в печени и мышцах, "пегая кожа", пиломатрикома, пинеалома с двусторонней ретинобластомой, гипофизарная АКТГ-секретирующая аденома, недостаточность гипофизарных гормонов, опухоли гипофиза, недостаточность плацентарной стероидсульфатазы, недостаточность ингибитора плазмина, недостаточность плазминогена (типы I и II), плазминогенная болезнь Точиги, тромбоцитарное нарушение, недостаточность тромбоцитарного гликопротеина IV, недостаточность фактора активации тромбоцитарной ацетилгидролазы, поликистоз почек, поликистозная липомембранная остеодисплазия со склерозирующей лейкоэнцефалопатией, полидактилия постаксиальная, полипоз, синдром подколенного птеригиума, порфирия (острая печеночная или острая перемежающаяся или врожденная эритропоэтическая), поздняя кожная порфирия, порфирия гепатоэритропоэтическая, вариегатная порфирия, синдром Прадера-Вилли, раннее половое созревание, преждевременное угасание функции яичников, прогерия типа I, прогерия типа II, прогрессивная внешняя офтальмоплегия, прогрессивный внутрипеченочный холестаз-2, пролактинома (гиперпаратиреоз, карциноидный синдром), недостаточность пролидазы, пропионовая ацидемия, рак предстательной железы, недостаточность белка S, протеинурия, протопорфирия (эритропоэтическая), псевдоахондроплазия, псевдогермафродитизм, солевой почечный диабет, псевдогипопаратиреоз, псевдовагинальная перинеоскротальная гипоспадия, псевдовитамин-D-дефицитный рахит, эластическая псевдоксантома (аутосомно-доминантная, аутосомно-рецессивная), легочный альвеолярный протеиноз, легочная гипертензия, молниеносная пурпура, пикнодизостоз, пиропойкилоцитоз, недостаточность пируваткарбоксилазы, недостаточность пируватдегидрогеназы, синдром Рабсона-Менденхолла, болезнь Рефсума, почечноклеточная карцинома, почечноканальцевый ацидоз, почечноканальцевый ацидоз с глухотой, синдром остеопетроза и почечного тубулярного ацидоза, ретикулез (наследственный гистиоцитарный), дегенерация сетчатки, дистрофия сетчатки, пигментный ретинит, точечная белая дегенерация сетчатки, ретинобластома, недостаточность ретинолсвязывающего белка, ретиношизис, синдром Ретта, синдром Rh(mod), синдром предрасположенности к рабдоидным нарушениям, рабдоидные опухоли, рабдомиосаркома, рабдомиосаркома (альвеолярная), точечная хондродисплазия ризомелическая, синдром Риббинга, рахит (витамин D-резистентный, аномалия Ригера, синдром Робинова, синдром Ротмунда-Томсона, синдром Рубинштейна-Тейби, сахаропинурия, синдром Сетре-Хотцена, болезнь Салла, болезнь Сандхоффа (детская, подростковая и взрослая формы), синдром Санфилиппо (тип А или тип В), болезнь Шиндлера, шизэнцефалия, шизофрения (хроническая), шваннома (спорадическая), ТКИН (тяжелая комбинированная иммунная недостаточность, аутосомно-рецессивная, Т-отрицательного/В-положительного типа), секреторный путь w/TMD (дистрофия челюстного сустава), врожденная спондилоэпифизарная дисплазия (СЭМД), синдром Сегавы, селективный Т-клеточный дефект, СЭМД (пакистанский тип), СЭМД (Струдвика), септооптическая дисплазия, тяжелый комбинированный иммунодефицит (отрицательный В-клеточный), тяжелый комбинированный иммунодефицит (отрицательный Т-клеточный, положительный В-клеточный/положительный естественных клеток-киллеров), тяжелый комбинированный иммунодефицит (связанный с Х-хромосомой), тяжелый комбинированный иммунодефицит вследствие недостаточности аденозиндеаминазы, реверсия пола (XY, с недостаточностью надпочечников), синдром Сезари, синдромом Шаха-Ваарденбурга, низкорослость, синдром Шпринтцена-Гольдберга, болезнь накопления сиаловой кислоты, сиалидоз (I или II типа), сиалурия, серповидно клеточная анемия, синдром Симпсона-Голаби-Бемеля, неопределенное расположение внутренних органов, синдром Шегрена-Ларссона, синдром Смита-Финемана-Майерса, синдром Смита-Лемли-Опица (I типа или II типа), соматотрофинома, дистрофия глазного дна Сорсби, спастическая параплегия, сфероцитоз, сфероцитоз-1, сфероцитоз-2, спинально-бульбарная мышечная атрофия Кеннеди, спинальная мышечная атрофия, спиноцеребеллярная атаксия, спондилокостальный дизостоз, поздняя спондилоэпифизарная дисплазия, спондилоэпифизарная дисплазия (японский тип), болезнь Штаргардта - 1, множественная стеатоцистома, синдром Штиклера, синдром Стерджа-Вебера, подкорковая ламинарная гетеротопия, недостаточность дегидрогеназы янтарного полуальдегида, непереносимость сахарозы, синдром Сазерленда-Хаана, повышенное содержание хлорида натрия в потовой жидкости, симфалангия, синостозный синдром, синполидактилия, болезнь Танжера, болезнь Тея-Сакса, острый Т-клеточный лимфобластный лейкоз, Т-клеточный иммунодефицит, пролимфоцитарный Т-клеточный лейкоз, талассемия (α- или δ-), талассемия, связанная с гемоглобином Лепора, летальная дисплазия (типа I или II), синдром тиамин-чувствительной мегалобластной анемии, тромбоцитемия, тромбофилия (дисплазмино-генная), тромбофилия вследствие недостаточности кофактора гепарина II, тромбофилия вследствие недостаточности протеина С, тромбофилия вследствие дефекта тромбомодулина, аденома щитовидной железы, нечувствительность к гормонам щитовидной железы, недостаточность иодидпероксидазы щитовидной железы, синдром Тица, "медленный" метаболизатор толбутамида, синдром Таунса-Брокса, недостаточность транскобаламина II, челюстно-лицевой дизостоз Тричера-Коллинза, трихо-донто-пальцевый синдром, трихо-рино-фалангиальный синдром, трихотиодистрофия, трехфункциональная белковая недостаточность (I или II типа), недостаточность трипсиногена, туберозный склероз 1, туберозный склероз 2, синдром Турко, тирозинфосфатаза, тирозинемия, синдром аномалий локтевой кости и грудных желез, мочекаменная болезнь (2,8-дигидроксиадениновая), синдром Ушера (типа 1В или типа 2А), венозные мальформации, желудочковая тахикардия, вирилизация, дефект витамин К-зависимой коагуляции, недостаточность очень длинноцепочечной ацил-КоА-дегидрогеназы, синдрома Фовинкеля, синдром фон Гиппеля-Линдау, болезнь Виллебранда, синдром Ваарденбурга, синдром Ваарденбурга/глазной альбинизм, неврологический вариант Варденбурга-Шаха, синдром Варденбурга-Шаха, синдром Вагнера, чувствительность к варфарину, синдром Уотсона, синдром Вейссенбахера-Цвеймюллера, синдром Вернера, акродентальный дизостоз Вейерса, невус типа белой губки, синдром Уильямса-Берена, опухоль Вильмса (тип 1), болезнь Вильсона, синдром Вискотта-Олдрича, синдром Уолкотта-Раллисона, синдром Вольфрама, болезнь Вольмана, ксантинурия (тип I), пигментная ксеродермия, Х-ТКИН, синдром Йеменской глухоты, тугоухости и гипопигментации, гипокальциурическая гиперкальциемия (тип I), Синдром Цельвегера, синдром Злотогора-Огура.
Предпочтительные заболевания, предназначенные для лечения, вызванные генетическими наследственными причинами и, прежде всего, дефектом одного гена, и наследуемые по законам Менделя, предпочтительно выбирают из группы, включающей аутосомальные рецессивные наследственные заболевания, такие как, например, аденозиндезаминазная недостаточность, наследственная гиперхолестеринемия, синдром Канавана, болезнь Гоше, анемия Фанкони, неврональный цероид-липофусциноз, муковисцидоз (кистозный фиброз), серповидно-клеточная анемия, фенилкетонурия, алкаптонурия, альбинизм, гипотиреоз, галактоземия, дефицит α-1-антитрипсина, пигментная ксеродерма, синдром Риббинга, мукополисахаридозы, заячья губа, расщелина челюсти, неба, синдром Лоренса-Муна-Барде-Бидля, синдром коротких ребер и полидактилии, кретинизм, синдром Жюбера, прогерия II типа, брахидактилия, адреногенитальный синдром, и наследственные заболевания, связанные с X-хромосомой, такие как, например, дальтонизм, например, слепота на красный/зеленый свет, синдром Мартина-Белла, мышечная дистрофия (типа Дюшенна и типа Беккера-Кинера), гемофилия А и В, дефицит глюкозо-6-фосфатдегидрогеназы, болезнь Фабри, мукополисахаридоз, синдром Норри, пигментная дистрофия сетчатки, септический гранулематоз, тяжелая комбинированная иммунная недостаточность (ТКИН), дефицит орнитинтранскарбамилазы, синдром Леша-Найхана, или из аутосомно-доминантных наследственных заболеваний, таких как, например, наследственный ангионевротический отек, синдром Марфана, нейрофиброматоз, прогерия I типа, несовершенный остеогенез, синдром Клиппеля-Треноне, болезнь Стерджа-Вебера, синдром Гиппеля-Линдау и туберозный склероз.
Способом по настоящему изобретению можно также лечить заболевания, которые не являются наследственными или, которые нельзя отнести к указанным выше категориям. Указанные заболевания могут включать, например, пациентов, нуждающихся в специфическом белковом факторе, например, специфическом терапевтически активном белке, как указано выше. К числу таких пациентов относятся, например, «диализные» пациенты, например, пациенты, которые проходят (регулярно) курс почечного диализа и которые могут нуждаться в специфических терапевтически активных белках, как указано выше, например, эритропоэтине (ЭП), и т.п.
В другом варианте настоящее изобретение включает применение по крайней мере одной РНК в составе комплекса по настоящему изобретению для трансфекции клетки или организма. Трансфекцию клетки или организма предпочтительно проводят с использованием указанного выше (in vitro или in vivo) способа трансфекции клеток или ткани с использованием РНК в составе комплекса по настоящему изобретению.
В еще одном варианте настоящее изобретение включает применение по крайней мере одной РНК в составе комплекса по настоящему изобретению (для получения агента) для лечения любого из указанных выше заболеваний, нарушений, состояний или патологических состояний. Агент в данном контексте может представлять собой, например, фармацевтическую композицию, как описано выше, или буферный раствор для инъекций, как указано в данном контексте, дополнительно содержащие РНК в составе комплекса по изобретению, вакцину, и т.п. Если используется более одного типа РНК в составе комплекса, то комплекс может включать различные РНК, при этом получают смесь по крайней мере двух различных типов РНК в составе комплекса. Если для лечения любого из указанных выше заболеваний (для получения агента) используется более одной РНК в составе комплекса, то в указанных смесях РНК в составе комплекса может содержаться один и тот же или (по крайней мере два) различных типа РНК. В данном контексте любую из указанных выше РНК можно использовать для включения в комплекс по изобретению, например, короткий олигонуклеотид РНК, кодирующую РНК, иммуностимулирующую РНК, киРНК, антисмысловую РНК или рибопереключатели, рибозимы или аптамеры, и т.п. Более предпочтительна кодирующая РНК, еще более предпочтительна линейная кодирующая РНК, и наиболее предпочтительна мРНК. Предпочтительно использовать для РНК в составе комплекса указанную кодирующую РНК, более предпочтительно линейную кодирующую РНК, и более предпочтительно мРНК, причем РНК обычно кодирует белок или пептид, пригодный для лечения специфического заболевания, например, антитело, которое способно связываться со специфическим опухолевым антигеном, или раковым антигеном при лечении (определенного) рака, и т.п. Комбинации пригодных (молекул) РНК известны специалистам в данной области и описаны в настоящем изобретении.
В другом варианте предпочтительно (дополнительно) вызвать, например, индуцировать или повысить, иммунный ответ в ходе лечения. В данном контексте, иммунный ответ может проявляться различным образом. Существенным фактором для пригодного иммунного ответа является стимуляция различных субпопуляций Т-клеток. Т-лимфоциты обычно подразделяются на две субпопуляции, клетки Т-клетки-хелперы 1 (Тh1) и Т-клетки-хелперы 2 (Th2), которые иммунная система использует для деградации внутриклеточных (Th1) и внеклеточных (Th2) патогенов (например, антигенов). Две популяции клеток Th различаются набором эффекторных белков (цитокинов), которые они продуцируют. Таким образом клетки Тh1 участвуют в клеточном иммунном ответе при активации макрофагов и цитотоксических Т-клеток. С другой стороны клетки Th2 ускоряют гуморальный иммунный ответ при стимуляции В-клеток, которые превращаются в клетки плазмы и способствуют образованию антител (например, против антигенов). Следовательно, соотношение Th1/Th2 имеет большое значение для иммунного ответа. Для различных заболеваний, подлежащих лечению по настоящему изобретению, соотношение Th1/Th2 иммунного ответа предпочтительно сдвигать в направлении клеточного ответа (ответа Th1) и таким образом индуцировать клеточный иммунный ответ. Соответственно, настоящее изобретение можно также использовать для обращения указанного сдвига иммунного ответа. Следовательно, настоящее изобретение включает также применение по крайней мере одной РНК в составе комплекса по настоящему изобретению (для получения агента) для лечения любого из указанных выше заболеваний, причем агент (и/или РНК в составе комплекса) может вызвать, например, индуцировать или повысить, иммунный ответ в ткани или организме, как указано выше. Кроме того, агент в данном контексте может представлять собой, например, фармацевтическую композицию, как указано выше, или буферный раствор для инъекций, как указано в данном контексте, которые содержат РНК в составе комплекса по изобретению, и т.п. Если в составе комплекса используется более одного типа РНК (для получения агента) для лечения любого из указанных выше заболеваний, то комплекс может включать различные РНК, которые образуют смесь РНК разных типов.
Однако в настоящем варианте предпочтительно, чтобы по крайней мере одна из указанных РНК в составе комплексов в ходе лечения индуцировала или повышала иммунный ответ, тогда как другие РНК в составе комплекса(ов) не индуцирует или повышает иммунный ответ или их можно использовать для предотвращения иммунного ответа. В данном контексте любую из указанных выше РНК можно использовать для получения РНК в составе комплекса по изобретению, например, короткий олигонуклеотид РНК, кодирующую РНК, иммуностимулирующую РНК, короткую интерферирующую киРНК, антисмысловую РНК или рибопереключатели, рибозимы или аптамеры, и т.п. Более предпочтительна кодирующая РНК, еще более предпочтительна линейная кодирующая РНК, и наиболее предпочтительна мРНК. Если РНК является кодирующей РНК, более предпочтительно использовать линейную кодирующую (молекулу) РНК, и более предпочтительно мРНК, причем РНК обычно кодирует белок или пептид, пригодный для лечения специфического заболевания, например, антитело, которое способно связываться со специфическим раковым антигеном, или опухолевым антигеном при лечении (определенного) рака, и т.п. Если более одной РНК в составе комплекса содержится в агенте, то можно выбрать различные комбинации белков или пептидов. Указанные комбинации пригодных РНК (и, если используется кодирующая РНК, кодируемых белков или пептидов) известны специалисту в данной области или их можно комбинировать из РНК, кодирующих терапевтически активные белки и т.п., как указано в описании настоящего изобретения. Индукция или повышение иммунного ответа, которые происходят в ходе лечения конкретного заболевания с использованием одной фармацевтической композиции или агента, как описано выше, может оказать прежде всего благоприятное воздействие в случаях, когда индуцированный или усиленный иммунный ответ повышает эффективность лечения конкретного заболевания, как указано выше.
В другом варианте лечение заболевания и индукцию или усиление иммунного ответа можно проводить с использованием различных фармацевтических композиций или агентов, как описано выше, поочередно. Например, можно индуцировать или усиливать иммунный ответ при введении фармацевтической композиции или агента, как указано в данном контексте, содержащем (иммуностимулирующую) РНК в составе комплекса по изобретению, перед введением (или одновременно с ним) другой фармацевтической композиции или агента, как указано в данном контексте, которые могут содержать РНК в составе комплекса по настоящему изобретению, например, короткий олигонуклеотид РНК, кодирующую РНК, иммуностимулирующую РНК, короткую интерферирующую киРНК, антисмысловую РНК или рибопереключатель, рибозимы или аптамеры, и т.п., которые пригодны для лечения конкретного заболевания.
В одном варианте, настоящее изобретение кроме того включает применение по крайней мере одной РНК в составе комплекса по настоящему изобретению (для получения агента) для модуляции, предпочтительно индукции или усиления, иммунного ответа в ткани или организме, как указано выше, более предпочтительно при лечении заболевания или состояния, как указано в данном контексте. Таким образом РНК в составе комплекса по изобретению можно использовать для неспецифической активации иммунной системы, например, для индукции секреции определенных цитокинов. Следовательно, РНК в составе комплекса можно использовать для поддержания специфического иммунного ответа, который вырабатывается в ответ, например, на антиген из патогенов или опухолей. В данном контексте агент может обозначать, например, фармацевтическую композицию, как описано выше, или буферный раствор для инъекций, как указано в данном контексте, содержащие РНК в составе комплекса по изобретению, вакцину и т.п. Иммунный ответ можно модулировать по крайней мере одной РНК в составе комплекса с одним или более олигопептидами, характеризующимися длиной от 8 до 15 аминокислот и характеризующимися общей формулой (Arg)1,(Lys)m,(His)n,(Orn)o,(Xaa)x, и/или иммуностимулирующими свойствами белка, кодируемого РНК в составе комплекса.
Следовательно, настоящее изобретение можно, в любом случае использовать в различных целях. РНК в составе комплекса в отдельности или в виде компонента композиции по изобретению может сама улучшить трансфектирующие свойства РНК в качестве компонента комплекса по изобретению. Указанные основные свойства РНК в составе комплекса по изобретению можно эффективно использовать в различных областях. В любом случае при необходимости вводить РНК в клетки, настоящее изобретение обеспечивает повышенную эффективность трансфекции. Указанное свойство позволяет использовать настоящее изобретение для лечения многочисленных заболеваний, например, для лечения моногенетических или генетических заболеваний, как указано выше.
Кроме того, в объем настоящего изобретения включено лечение любых иммунных нарушений, например, аллергических или аутоиммунных заболеваний. Кроме того, настоящее изобретение включает способ активации иммунной системы пациентов при повышении неспецифического или специфического иммунного ответа. Соответственно, указанный способ может вызывать неспецифический иммунный ответ, в любом случае при необходимости в таком лечении заболевания. И в любом случае при такой необходимости указанный способ может вызывать специфический иммунный ответ (например, при кодировании антигена РНК в виде компонента комплекса по изобретению) или при комбинировании РНК в составе комплекса по изобретению с антигеном, например, в составе одной композиции. В любом случае при необходимости, РНК в составе комплекса по изобретению может содержать предпочтительно антиген или антитело, или любой другой белок или пептид, как указано выше, способный модулировать иммунный ответ (предпочтительно индуцировать или повышать его или, в случае аллергических или аутоиммунных заболеваний десенсибилизировать иммунную систему пациента в отношении определенного аллергена или аутоантигена). Для модуляции, например, индукции или усиления, иммунного ответа в ткани или организме РНК в составе комплекса можно вводить в указанные ткань или организм, как описано выше, как в виде комплекса, так и виде агента, как указано выше. Способы введения, включают способы, описанные выше для фармацевтических композиций. Введение агента может проводить до лечения, одновременно с курсом лечения или после курса лечения заболеваний или состояний, как указано в данном контексте, например, при введении агента до, одновременно с курсом лечения или введением лекарственного средства, пригодного для лечения указанных заболеваний или состояний (или после курса лечения и/или введения лекарственного средства.
В другом варианте настоящего изобретения также предлагается применение пептида (Arg)7 в комплексе с РНК, как указано в данном контексте или только пептида (Arg)7 (для получения агента) для модуляции, предпочтительно выработки, например, индукции или усиления, иммунного ответа, предпочтительно неспецифического иммунного ответа, например, индукции секреции цитокинов, в ткани или организме, как указано выше, и предпочтительно лечения заболевания или состояния, как указано в данном контексте. При определении размеров пептида формулы (I) по изобретению, неожиданно было установлено, что (Arg)7 в значительной степени индуцирует или усиливает иммунный ответ в МКПК человека, даже если не наблюдается трансфекция нуклеиновых кислот, прежде всего РНК, в МКПК человека. РНК может представлять собой любую РНК, как указано в данном контексте, предпочтительно, но, не ограничиваясь только ими, короткий олигонуклеотид РНК, кодирующую РНК, иммуностимулирующую РНК, киРНК, антисмысловую РНК или рибопереключатель, рибозим или аптамер. Кроме того, агент в данном контексте может обозначать, например, фармацевтическую композицию, как указано выше, или буферный раствор для инъекций, как указано в данном контексте, которые дополнительно содержат РНК в составе комплекса по изобретению, и т.п., причем в РНК в составе комплекса РНК по изобретению (в составе агента), как указано в данном контексте, присутствует пептид (Arg)7 в комплексе с РНК, как указано в данном контексте, или пептид (Arg)7 в отдельности.
В другом варианте настоящего изобретения предлагается также применение пептида (Arg)7 в составе комплекса с РНК, как указано в данном контексте, или пептида (Arg)7 отдельно (для получения агента) для лечения любого из указанных выше заболеваний или состояний.
В последнем варианте настоящего изобретения также предлагаются наборы, содержащие РНК в составе комплекса по настоящему изобретению и/или фармацевтическую композицию по настоящему изобретению, а также необязательно инструкции по применению, введению и дозировке РНК в составе комплекса по настоящему изобретению и/или фармацевтической композиции по настоящему изобретению. Кроме того, набор может включать в отдельности одну или более следующих групп компонентов: по крайней мере один антиген или по крайней мере одно антитело или композицию, содержащую антиген или антитело, дополнительный адъювант или композицию, содержащую по крайней мере один адъювант и/или по крайней мере один цитокин, или композицию, содержащую по крайней мере один цитокин. Антиген, антитело и/или цитокин могут представлять собой белки или ДНК или РНК, кодирующие антиген, антитело или цитокин.
В настоящем изобретении также предлагаются наборы, содержащие пептид (Arg)7 в составе комплекса РНК, как указано в данном контексте, или пептид (Arg)7 в отдельности, необязательно инструкции по введению и дозировке пептида (Arg)7. Указанные наборы можно использовать, например, для любого указанного выше назначения, предпочтительно для применения по крайней мере одной РНК в составе комплекса по настоящему изобретению (для получения агента) для лечения любого из указанных выше заболеваний. Наборы можно также использовать для введения по крайней мере одной РНК в составе комплекса по настоящему изобретению (для получения агента) для лечения любого из указанных выше заболеваний, причем агент (и/или РНК в составе комплекса) может индуцировать или повышать иммунный ответ в ткани или организме, как указано выше. Кроме того, указанные наборы можно использовать для применения по крайней мере одной РНК в составе комплекса по настоящему изобретению (для получения агента) для модулирования, предпочтительно для проявления, например, для индукции или повышения, иммунного ответа в ткани или организме, как указано выше, и предпочтительно для контроля заболевания или состояния, как указано в данном контексте.
Фигуры
Приведенные ниже фигуры предназначены для дополнительной иллюстрации изобретения и не ограничивают объем настоящего изобретения.
На фиг.1 представлена стабилизированная последовательность мРНК люциферазы, причем мРНК, кодирующая природную люци4)еразу, модифицирована дополнительной цепью поли-А/поли-С tag (A70-C30). Этот первый конструкт (конструкт CAP-Ppluc(wt)-muag-A70-C30, SEQ ID №: 35) содержит следующие элементы последовательности:
стабилизирующие последовательности из гена α-глобина,
70×аденозин в 3'-концевом фрагменте (поли-А-фрагмент),
30×цитозин в 3'-концевом фрагменте (поли-С-фрагмент), обозначены следующими символами:



На фиг.2 представлена стабилизированная последовательность мРНК люциферазы, причем конструкт SEQ ID №: 35 (см. фиг.1) дополнительно модифицирован GC-оптимизированной последовательностью для более эффективного использования кодона. Конечный конструкт (конструкт САР-Ppluc(GC)-muag-A70-C30, SEQ ID №: 36) содержит следующие элементы последовательности:
GC-оптимизированная последовательность для более эффективного использования кодона из гена α-глобина
70×аденозин в 3'-концевом фрагменте (поли-А-фрагмент),
30×цитозин в 3'-концевом фрагменте (поли-С-фрагмент),
обозначены следующими символами:



На фиг.3 представлена кодирующая последовательность SEQ ID №: 35 (SEQ ID №: 37) (см. фиг.1).
На фиг.4 представлена кодирующая последовательность SEQ ID №: 36 (SEQ ID №: 38), GC-оптимизированная (см. фиг.2). GC-оптимизированные кодоны подчеркнуты.
На фиг.5 представлен иммуностимулирующий эффект РНК в составе комплекса с нонааргинином ((Arg)9) в клетках МКПК человека, который оценивали по уровню продуцирования ИЛ-6. На фигуре показано, что клетки МКПК человека характеризуются значительным уровнем продуцирования ИЛ-6, то есть наблюдается значительное иммуностимулирующее действие РНК в составе комплекса с нонааргинином ((Arg)9).
На фиг.6 представлен иммуностимулирующий эффект РНК в составе комплекса с нонааргинином ((Arg)9) в клетках МКПК человека, который оценивали по уровню продуцирования ФНО-α. На фигуре показано, что клетки МКПК человека характеризуются значительным уровнем продуцирования ФНО-α, то есть наблюдается значительное иммуностимулирующее действие РНК в составе комплекса с нонааргинином ((Arg)9).
На фиг.7 показан пример сравнения иммуностимулирующих эффектов РНК в составе комплекса с нонааргинином ((Arg)9) или поли-L-аргинином, соответственно, в МКПК человека. Значительное иммуностимулирующее действие наблюдается для массовых соотношений менее 1:5 (РНК/нонааргинин) (1:10, 1:8, 1:5, 1:2, 1:1, 2:1). Однако при использовании массовых соотношений РНК/нонааргинин (5:1) не наблюдается заметного уровня продуцирования ФНО-α. То же самое относится к экспериментам по стимуляции с использованием только нонааргинина ((Arg)9) или только мРНК. Кроме того, было установлено, что образование комплекса мРНК с поли-L-аргинином приводит к значительно более низкой индукции продуцирования ФНО-α по сравнению с нонааргинином ((Arg)9). Очевидно, что более высокие концентрации поли-L-аргинина оказывают токсичный эффект на клетки, трансфектированные при использовании, прежде всего РНК/поли-L-аргинин:РНК при массовом соотношении 1:2 или более, поскольку наблюдается лизис клеток.
На фиг.8 показана экспрессия люциферазы при трансфекции комплексов РНК с нонааргинином ((Arg)9) в клетках HeLa. Как показано на фиг.8, наиболее эффективным является комплекс РНК/нонааргинин в соотношении 2:1. Напротив, образование комплекса с (высокомолекулярным) поли-L-аргинином не приводит к заметной люциферазной активности. Таким образом, (высокомолекулярный) поли-L-аргинин не пригоден для трансфекции мРНК.
На фиг.9 показан сравнительный пример экспрессии люциферазы при трансфекции комплексами РНК с гептааргинином ((Arg)y) в клетках HeLa. Как показано на фиг.9, трансфекция комплексов РНК с гептааргинином ((Arg)7) не приводит к заметной люциферазной активности. Таким образом, гептааргинин ((Arg)7) не пригоден для трансфекции мРНК.
На фиг.10 показан иммуностимулирующий эффект РНК в составе комплекса с гептааргинином ((Arg)7) в клетках МКПК человека, который оценивали по уровню продуцирования ИЛ-6. Как показано на фигуре, клетки МКПК человека характеризуются значительным уровнем продуцирования ИЛ-6, то есть наблюдается значительное иммуностимулирующее действие РНК в составе комплекса с гептааргинином ((Arg)9).
На фиг.11 показан иммуностимулирующий эффект РНК в составе комплекса с гептааргинином ((Arg)7) в клетках МКПК человека, который оценивали по уровню продуцирования ФНО-α. Как показано на фигуре, клетки МКПК человека характеризуются значительным продуцированием ФНО-α, то есть наблюдается значительное иммуностимулирующее действие РНК в составе комплекса с гептааргинином ((Arg)9).
На фиг.12 показано влияние РНК в составе комплекса с пептидом R9 на экспрессию люциферазы в клетках HeLa.
На фиг.13 показано влияние РНК в составе комплекса с пептидом R9H3 на экспрессию люциферазы в клетках HeLa.
На фиг.14 показано влияние РНК в составе комплекса с пептидом H3R9H3 на экспрессию люциферазы в клетках HeLa.
На фиг.15 показано влияние РНК в составе комплекса с пептидом YYYR9SSY на экспрессию люциферазы в клетках HeLa.
На фиг.16 показано влияние РНК в составе комплекса с пептидом H3R9SSY на экспрессию люциферазы в клетках HeLa.
На фиг.17 показано влияние РНК в составе комплекса с пептидом (RKH)4 на экспрессию люциферазы в клетках HeLa.
На фиг.18 показано влияние РНК в составе комплекса с пептидом Y(RKH)2R на экспрессию люциферазы в клетках HeLa
На фиг.19 показано влияние гистидина в концевых положениях на эффективность трансфекции.
На фиг.20 показано влияние нейтральных аминокислот в концевых положениях на эффективность трансфекции.
На фиг.21 показан иммуностимулирующий эффект РНК в составе комплекса с R9H3 на секрецию ФНО-α в МКПК человека.
На фиг.22 показан иммуностимулирующий эффект РНК в составе комплекса с R9H3 на секрецию ИЛ-6 в МКПК человека.
Примеры
Приведенные ниже примеры представлены для иллюстрации изобретения и не ограничивают объем настоящего изобретения.
Пример 1
Получение конструктов мРНК люциферазы
В следующих экспериментах стабилизированную последовательность мРНК люциферазы получали и использовали для экспериментов по трансфекции, причем мРНК, кодирующая природную люциферазу, модифицировали олигонуклеотидом поли-А/поли-С tag (A70-C30) и оптимизировали по содержанию GC для повышения эффективности использования кодона и дальнейшей стабилизации.
Первоначальный конструкт (конструкт CAP-Ppluc(wt)-muag-A70-C30, SEQ ID №: 35) содержит следующие элементы последовательности:
стабилизирующие последовательности из гена а-глобина
70×аденозин в 3'-концевом фрагменте
30×цитозин в 3'-концевом фрагменте.
Конечный конструкт (конструкт CAP-Ppluc(GC)-muag-A70-C30, SEQ ID №: 36), использованный для следующих экспериментов, содержит следующие элементы последовательности:
GC-оптимизированная последовательность для повышения эффективности использования кодона
стабилизирующие последовательности из гена а-глобина
70×аденозин на 3'-концевом фрагменте
30×цитозин на 3'-концевом фрагменте.
Указанные последовательности также указаны на фиг.1 и 2 (SEQ ID №№: 35 и 36). Соответствующие кодирующие последовательности приведены на фиг.3 и 4 (SEQ ID №№: 35 и 36)
Пример 2
Транскрипция стабилизированной мРНК люциферазы in vitro
Стабилизированную мРНК люциферазы, SEQ ID №: 35 или 36 (Luc-RNActive), транскрибировали in vitro с использованием полимеразы Т7 (набор T7-Opti mRNA, фирмы CweVac, Тюбинген, Германия) по методике фирмы-производителя.
Все транскрипты мРНК содержали структуру поли-А фрагмента (70 оснований) и 5'-кэп-структуру. 5'-Кэп-структуру получали при добавлении избытка N7-метилгуанозин-5'-трифосфат-5'-гуанозина.
Пример 3
Получение комплекса РНК с нонааргинином ((Arg)9), поли-L-аргинином или другими пептидами на основе (Arg)9, соответственно
15 мкг стабилизированной мРНК люциферазы SEQ ID №: 36 (Luc-RNActive) смешивали при различных массовых соотношениях с нонааргинином (Arg9) или поли-L-аргинином (фирмы Sigma-Aldrich, P4663, 5000-15000 г/моль), при этом получали комплекс. Использовали массовые соотношения, показанные для ((Arg)9). Образцы для сравнения получали с использованием поли-L-аргинина по указанной методике.
Кроме того, получали другие РНК в составе комплексов на основе (Arg)9 с использованием следующих пептидов для комплексообразования:
R9: Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg
R9H3: Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-His-His-His
H3R9H3: His-His-His-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-His-His-His
YSSR9SSY: Tyr-Ser-Ser-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Ser-Ser-Tyr
H3R9SSY: His-His-His-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Ser-Ser-Tyr
(RKH)4. Arg-Lys-His-Arg-Lys-His-Arg-Lys-His-Arg-Lys-His
Y(RKH)2R: Tyr-Arg-Lys-His-Arg-Lys-His-Arg.
Для получения комплекса 4 мкг стабилизированной мРНК люциферазы SEQ ID №: 36 (Luc-RNActive) смешивали в различных молярных соотношениях с соответствующим пептидом (формулы I), при этом получали комплекс.Затем объем полученного раствора доводили водой до конечного объема 50 мкл и инкубировали в течение 30 мин при комнатной температуре. Использованные соотношения указаны в таблицах, приведенных ниже. Клетки HeLa (150х10 в лунке) высеивали за 1 сут до трансфекции в 24-луночные микротитрационные планшеты до конфлюэнтности 70%, затем проводили трансфекцию. R9
R9H3
H3R9H3
YSSR9SSY
H3R9SSY
Y(RKH)2R
Пример 4
Нонааргинин ((Arg)д)-опосредованная трансфекция и экспрессия стабилизированной мРНК люциферазы. SEQ ID №: 35 или 36 (Luc-RNActive). в клетках HeLa
Клетки HeLa (150×103 в лунке) высеивали за 1 сут до трансфекции в 24-луночные микротитрационные планшеты до конфлюэнтности 70% и проводили трансфекцию. Для трансфекции (40 мкл) 50 мкл раствора РНК/(пептид), как описано в примере 3, перемешивали в смеси с 250 мкл бессывороточной среды и добавляли к клеткам (конечная концентрация РНК 13 мкг/мл). Перед добавлением раствора для трансфекции клетки HeLa 2 раза осторожно промывали раствором Optimen (фирмы Invitrogen) (по 1 мл в лунке). К клеткам добавляли раствор для трансфекции (300 мкл в лунке) и клетки инкубировали в течение 4 ч при температуре 37°С, затем добавляли по 300 мкл в лунку среды RPMI (фирмы Camprex), содержащей 10% ЭТС, и клетки инкубировали в течение еще 20 ч при температуре 37°С. Через 24 ч после трансфекции раствор для трансфекции удаляли в вакууме и клетки лизировали в 300 мкл буферного раствора для лизиса (25 мМ трис-PO4, 2 мМ ЭДТУ, 10% глицерин, 1% тритон X-100, 2 мМ ДТТ). Затем супернатанты смешивали с буферным раствором, содержащим люциферин (25 мМ глицилглицин, 15 мМ MgS04, 5 мМ АТФ, 62,5 мкМ люциферин), и определяли люминесценцию в люминометре Lumat LB 9507 (фирмы Berthold Technologies, Бад-Вильдбад, Германия). Результаты указанных экспериментов приведены на фиг.8 и 12-18.
Пример 5
Иммунная стимуляция при трансфекции комплексами РНК с нонааргинином ((Arg)9) или поли-L-аргинином (пример для сравнения)
а) Эксперименты по трансфекции
Клетки МКПК человека здоровых доноров выделяли в градиенте плотности фикола и последовательно промывали 1хФСБ (фосфатно-солевой буферный раствор). Затем клетки высевали в 96-луночные микротитрационные планшеты (200×103 в лунке). Клетки МКПК человека инкубировали в течение 24 ч, как описано выше в примере 4, в смеси с 10 мкл комплекса РНК/пептид (конечная концентрация РНК 6 мкг/мл, использованы те же количества РНК) в среде X-VIVO 15 (фирмы BioWhittaker) (конечная концентрация РНК 10 мкг/мл). Иммуностимулирующий эффект на МКПК человека оценивали по уровню продуцирования цитокинов (интерлейкина-6 и фактора некроза опухоли а). Таким образом микротитрационные планшеты для ИФА (фирмы Nunc Maxisorb) инкубировали в течение ночи в смеси с буферным раствором для связывания (0,02% NaN3, 15 мМ Na2CO3, 15 мМ NaHCO3, pH 9,7), дополнительно содержащим антитела к цитокинам. Затем клетки блокировали 1×ФСБ, содержащим 1% БСА (бычьего сывороточного альбумина). Добавляли клеточный супернатант и инкубировали в течение 4 ч при температуре 37°С. Затем микротитрационный планшет промывали 1×ФСБ, 0,05% Твин-20 и инкубировали с биотинилированным вторичным антителом (фирмы BD Pharmingen, Гейдельберг, Германия). В планшет добавляли коньюгат пероксидазы хрена со срептавидином. Затем планшеты снова промывали 1×ФСБ, содержащим 0,05% Твин-20, и в качестве субстрата добавляли ABTS (2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновая кислота). Количество цитокина определяли по величине оптической плотности при 405 нм (00405)cиспользованием калибровочной кривой для рекомбинантных цитокинов (фирмы BD Pharmingen, Гейдельберг, Германия) на ридере для ИФА Sunrise фирмы (Тесап, Карлсгейм, Германия).
б) Результаты
i) Иммуностимулирующий эффект РНК в составе комплекса с нонааргинином ((Arg)9)
11) Клетки МКПК человека инкубировали с РНК в составе комплекса с нонааргинином ((Arg)9) в течение 24 ч, как описано выше, причем массовое соотношение PHK/(Arg)9 составляло 1:1. Затем уровень продуцирования ИЛ-6 определяли в клеточных супернатантах методом ИФА. Клетки МКПК человека характеризуются значительным уровнем продуцирования ИЛ-6, то есть наблюдается значительный иммуностимулирующий эффект РНК в составе комплекса с нонааргинином ((Arg)9) (см. фиг.5).
12) Клетки МКПК человека инкубировали в смеси с РНК в составе комплекса с нонааргинином ((Arg)9) в течение 24 ч, как описано выше, причем массовое соотношение PHK/(Arg)9 составляло 1:1. Затем уровень продуцирования ФНО-α определяли в клеточных супернатантах методом ИФА. Клетки МКПК человека характеризуются значительным уровнем продуцирования ФНО-α, то есть наблюдается значительный иммуностимулирующий эффект РНК в составе комплекса с нонааргинином ((Arg)9) (см. фиг.6).
ii) Сравнение иммуностимулирующего эффекта РНК в составе комплекса с нонааргинином ((Arg)9) или поли-L-аргинином соответственно (пример для сравнения)
Клетки МКПК человека инкубировали в различных массовых соотношениях (РНК/нонааргинин 1:10, 1:8, 1:5, 1:2, 1:1, 2:1, 5:1, 8:1 и 10:1) в смеси с комплексом РНК и нонааргинина ((Arg)9) или поли-L-аргинина, и т.п., соответственно, в течение 24 ч. Затем определяли уровень продуцирования ФНО-α методом ИФА.
Значительный иммуностимулирующий эффект наблюдается предпочтительно для массовых соотношений менее 5:1 (РНК/нонааргинин) (1:10, 1:8, 1:5, 1:2, 1:1, 2:1) (см. фиг.7). При использовании массовых соотношений РНК/нонааргинин (5:1) значительный уровень продуцирования ФНО-α не наблюдается. То же самое относится к экспериментам по стимуляции с использованием только нонааргинина ((Arg)9) или только мРНК (см. фиг.7, слева).
Более того, образование комплекса мРНК с поли-L-аргинином приводит к заметно более слабой индукции продуцирования ФНО-α по сравнению с нонааргинином ((Arg)9) (см. фиг.7, справа). Кроме того, установлено, что при более высоких концентрациях поли-L-аргинин оказывает токсичное действие на клетки, трансфектированные им, прежде всего при использовании в массовом соотношении РНК/поли-L-аргинин 1:2 или менее, поскольку при этом наблюдается лизис клеток.
Пример 6
Экспрессия люциферазы при трансфекции комплексами РНК с нонааргинином ((Arg)9) или поли-L-аргинином, соответственно, клеток HeLa (пример для сравнения)
а) Экспрессия люциферазы при трансфекции комплексами РНК с нонааргинином ((Arg)9) в клетках HeLa
Клетки HeLa трансфектировали препаратом RNActive, кодирующим люциферазу, причем указанную РНК использовали в составе комплекса с нонааргинином или поли-L-аргинином в различных соотношениях, соответственно. Через 24 ч определяли активность люциферазы. Было установлено, что массовые соотношения менее 2:1 (РНК/нонааргинин) являются предпочтительными (см. фиг.8).
б) При сравнении было установлено, что образование комплекса с (высокомолекулярным) поли-L-аргинином не приводит к повышению активности люциферазы до значительного уровня. Таким образом, (высокомолекулярный) поли-L-аргинином не является пригодным для трансфекции мРНК (см. фиг.8).
Пример 7
Экспрессия люциферазы при трансфекции комплексами РНК с гептааргинином ((Arg)7) клеток HeLa (пример для сравнения)
Клетки HeLa трансфектировали препаратом RNActive, кодирующим люциферазу, причем указанную РНК использовали в составе комплекса с гептааргинином ((Arg)7) в различных соотношениях. Через 24 ч определяли активность люциферазы. Было установлено, что образование комплекса с гептааргинином ((Arg)7) не повышает активность люциферазы до заметного уровня. Таким образом, гептааргинин ((Arg)7) не является пригодным для трансфекции мРНК (см. фиг.9).
Пример 8
Иммунная стимуляция при трансфекции комплексами РНК с гептааргинином ((Arg)7) (пример для сравнения)
а) Эксперименты по трансфекции
Эксперименты по трансфекции проводили с использованием гептааргинина ((Arg)7) аналогично тому, как описано в пример 5 выше.
б) Результаты иммуностимулирующего действия РНК в составе комплекса с гептааргинином ((Arg)7)
1) Клетки МКПК человека инкубировали в смеси с РНК в составе комплекса с гептааргинином ((Arg)7) в течение 24 ч, как описано выше, причем массовое соотношение PHK/(Arg)7 составляло 1:1. Затем в клеточных супернатантах определяли уровень продуцирования ИЛ-6 методом ИФА. Клетки МКПК человека характеризуются значительным уровнем продуцирования ИЛ-6, то есть наблюдается значительный иммуностимулирующий эффект РНК в составе комплекса с гептааргинином ((Arg)7) (см. фиг.10).
ii) Кроме того, клетки МКПК человека инкубировали в смеси с РНК в составе комплекса с гептааргинином ((Arg)7) в течение 24 ч, как описано выше, причем массовое соотношение PHK/(Arg)7 составляло 1:1. Затем в клеточных супернатантах определяли уровень продуцирования ФНО-α методом ИФА. Было установлено, что клетки МКПК человека также характеризуются значительным уровнем продуцирования ФНО-α, то есть наблюдается значительный иммуностимулирующий эффект РНК в составе комплекса с гептааргинином ((Arg)7) (см. фиг.11).
Пример 9
Определение влияния гистидина на эффективность трансфекции
Для определение влияния гистидина на эффективность трансфекции трансфекцию проводили аналогично тому, как описано в экспериментах по трансфекции выше, с использованием пептидов с различным содержанием гистидина. Таким образом, 4 мкг стабилизированной мРНК люциферазы, SEQ ID №: 36 (Luc-RNActive), смешивали в молярных соотношениях с соответствующим пептидом (формулы I), прежде всего R9, R9H3 или H3R9H3, при этом образуется комплекс. Затем объем полученного раствора доводили водой до конечного объема 50 мкл и инкубировали в течение 30 мин при комнатной температуре. В каждом эксперименте использовали соотношения 1:10000, 1:5000 и 1:1000. Клетки HeLa (150×103 в лунке) высевали за 1 сутки до трансфекции в 24-луночный микротитрационный планшет до 70% конфлуентности и проводили трансфекцию. Для трансфекции 50 мкл раствора РНКУ(пептид) смешивали с 250 мкл бессывороточной среды и добавляли к клеткам (конечная концентрация РНК 13 мкг/мл). Перед добавлением раствора для трансфекции клетки HeLa 2 раза осторожно промывали раствором Optimen (фирмы Invitrogen) по 1 мл в лунке. Затем к клеткам добавляли раствор для трансфекции (300 мкл в лунке) и клетки инкубировали в течение 4 ч при температуре 37°С, добавляли 300 мкл в лунке среды RPMI (фирмы Camprex), содержащей 10% ЭТС и клетки инкубировали в течение еще 20 ч при температуре 37°С. Раствор для трансфекции удаляли в вакууме через 24 ч после трансфекции и клетки лизировали в 300 мкл буферного раствора для лизиса (25 мМ трис-PO4, 2 мМ ЭДТУ, 10% глицерин, 1% Тритон X-100, 2 мМ ДТТ). Затем супернатанты смешивали с буферным раствором, содержащим люциферин (25 мМ глицилглицин, 15 мМ MgSO4, 5 мМ АТФ, 62,5 мкМ люциферин) и люминесценцию определяли в люминометре Lumat LB 9507 (фирмы Berthold Technologies, Бад-Вильдбат, Германия).
Результаты приведены на фиг.19. Как видно на фигуре, наличие последовательности из 3 гистидинов в одном концевом фрагменте уже повышает эффективность трансфекции РНК в составе комплекса, причем наличие 3 гистидинов в обоих концевых фрагментах существенно повышает эффективность трансфекции РНК в составе комплекса.
Пример 10
Определение влияния нейтральных аминокислот на эффективность трансфекции
Для определения влияния нейтральных аминокислот_на эффективность трансфекции эксперименты по трансфекции проводили аналогично тому, как описано выше в примере 9, с использованием пептида H3R9CCS. Результаты данного дополнительного эксперимента приведены на фиг.20.
Пример 11
Иммуностимуляция с использованием R9H3 в клетках МКПК человека
Влияние R9H3 на иммуностимуляцию проводили в клетках МКПК человека. Получали комплекс R9H3 с РНК, как описано выше в примере 3. Кроме того, клетки МКПК человека получали от здоровых доноров, выделяли в градиенте фикола и затем промывали 1×ФСБ. Затем клетки высевали в 96-луночные микротитрационные планшеты (200×103 в лунке). Клетки МКПК человека инкубировали в течение 24 ч, как описано выше в примере 4, в смеси с 10 мкл комплекса РНК/пептид (конечная концентрация РНК 6 мкг/мл, использованы те же количества РНК) в среде X-VIVO 15 (фирмы BioWhittaker). Иммуностимулирующий эффект на клетки МКПК человека оценивали по уровню продуцирования цитокинов (интерлейкина-6 и фактора некроза опухоли а). Микротитрационные планшеты для ИФА (фирмы Nunc Maxisorb) инкубировали в течение ночи в смеси с буферным раствором для связывания (0,02% NaN3, 15 мМ Na2CO3, 15 мМ NaHCO3, рН 9,7), дополнительно содержащим антитела к цитокину. Затем клетки блокировали 1×ФСБ, содержащим 1% БСА (бычий сывороточный альбумин). Добавляли клеточный супернатант и смесь инкубировали в течение 4 ч при температуре 37°С. Затем микротитрационный планшет промывали 1×ФСБ, 0,05% твин-20, и затем инкубировали в смеси с биотинилированными вторичными антителами (фирмы BD Pharmingen, Гейдельберг, Германия). В планшет добавляли коньюгат пероксидазы хрена со срептавидином. Затем планшеты снова промывали 1×ФСБ, содержащим 0,05% Твин-20, и в качестве субстрата добавляли ABTS (2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновая кислота). Количество цитокина определяли по оптической плотности при 405 нм (OD405)с использованием калибровочной кривой для рекомбинантных цитокинов (фирмы BD Pharmingen, Гейдельберг, Германия) в ридере для ИФА Sunrise (фирмы Тесап, Карлсгейм, Германия). Результаты приведены на фиг.21 и 22. На фигурах показано, что значительная иммуностимуляция наблюдается при соотношении PHK/R9H3 1:5000.
Реферат
Изобретение относится к области биотехнологии. Описан иммуностимулирующий комплекс, включающий РНК в виде комплекса с одним или более олигонуклеотидами, причем олигонуклеотид обладает свойствами пептида, проникающего в клетку (ППК), содержит от 8 до 15 аминокислотных остатков и характеризуется следующей общей формулой: (Arg)(Lys)(His)(Orn)(Xaa). При этом основное число остатков выбирают из Arg, Lys, His, Orn. Изобретение может быть использовано для трансфекции клетки, ткани или организма и/или для модуляции, предпочтительно индукции или повышения иммунного ответа. 15 з.п. ф-лы, 22 ил., 11 пр., 2 табл.
Формула
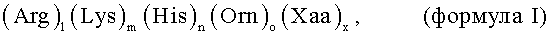
где l+m+n+o+x=8-15 и l, m, n или о независимо друг от друга равны числу, выбранному из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по крайней мере 50% от всех аминокислотных остатков, входящих в состав олигопептида, и
Хаа обозначает любую аминокислоту, выбранную из природных или неприродных аминокислот, за исключением Arg, Lys, His или Orn, и
х равен любому числу, выбранному из 0, 1, 2, 3, 4, 5, 6, 7 или 8, при условии, что общее содержание Хаа не превышает 50% от всех аминокислотных остатков, входящих в состав олигопептида.
Arg9His3, His3Arg9His3, TyrSerSerArg9SerSerTyr, His3Arg9SerSerTyr, (ArgLysHis)4, Tyr(ArgLysHis)2Arg,
или из
Arg8, Arg9, Arg10, Arg11, Arg12, Arg13, Arg14, Arg15 (SEQ ID №1-8), Lys8, Lys9, Lys10, Lys11, Lys12, Lys13, Lys14, Lys15 (SEQ ID №9-16), His8, His9, His10, His11, His12, His13, His14, His15 (SEQ ID №17-24) и Orn8, Orn9, Orn10, Orn11, Orn12, Orn13, Orn14, Orn15, (SEQ ID №25-32).
Документы, цитированные в отчёте о поиске
Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов

Комментарии