Композиции для усиления антибактериальной активности миелопероксидазы и способы их применения - RU2529799C2
Код документа: RU2529799C2
Чертежи











Описание
Предшествующий уровень техники
Настоящее изобретение относится к способам и к композициям, применяемым для ингибирования или лечения микробных инфекций. Более конкретно, настоящее изобретение относится к способам и к композициям, применяемым в комбинации с аминокислотами и миелопероксидазой для улучшения антимикробных свойств системы.
Как описано в патентах США №№ 5888505 и 6294168, миелопероксидаза может быть использована для селективного связывания и, в присутствии пероксида и галогенида, для ингибирования роста микроорганизмов-мишеней без уничтожения полезных микроорганизмов или без значительного повреждения других компонентов среды, таких как клетки-хозяева и нормальная флора, присутствующая в окружении микроорганизмов-мишеней. Известно, что в природных системах миелопероксидаза обладает антимикробной активностью в присутствии соответствующего кофактора галогенида (X) и пероксида водорода, являющегося ее субстратом (Klebanoff, J. Bacteriol 95:2131-2138, 1968). Однако селективная природа связывания миелопероксидазы и возможность применения этих систем в терапии, в исследованиях и в промышленности были выявлены лишь недавно. Благодаря этим только что открытым свойствам селективного связывания миелопероксидазы было обнаружено, что в случае, если микроорганизм-мишень, такой как патогенный микроорганизм, обладает большей способностью связываться с миелопероксидазой, чем полезные микроорганизмы, такие как члены нормальной флоры, то миелопероксидаза селективно связывается с микроорганизмом-мишенью, но при этом не связывается с полезным микроорганизмом или связывается с ним на минимальном уровне. В присутствии пероксида и галогенида, миелопероксидаза, связанная с мишенью, катализирует окисление галогенида и облегчает диспропорционирование пероксида с образованием синглетного молекулярного кислорода (1О2) на поверхности микроорганизма-мишени, что приводит к селективному уничтожению микроорганизма-мишени с минимальным коллатеральным повреждением полезного микроорганизма или физиологической среды. Таким образом, как описано в патентах США №№ 5888505 и 6294168, миелопероксидаза может быть использована в качестве антисептика в целях терапевтического или профилактического лечения человека или животного путем селективного связывания с патогенными микроорганизмами с уничтожением патогенных микроорганизмов при минимальном коллатеральном повреждении клеток-хозяев и нормальной флоры хозяина.
Такая система может быть также использована в качестве дезинфицирующих или стерилизующих композиций для ингибирования роста микроорганизмов-мишеней in vitro, в частности для антисептической обработки биомедицинского оборудования, такого как бандажи, хирургические инструменты, приспособления для наложения швов, катетеры, стоматологические инструменты, контактные линзы и т.п., в целях ингибирования роста микроорганизмов-мишеней без повреждения клеток-хозяев индивидуума при последующем применении такого биомедицинского оборудования in vivo.
В патентах США №№ 5389369 и 5451402 указывается, что хотя было обнаружено что миелопероксидазная антисептическая система, описанная в патентах США №№ 5888505 и 6294168, является высокоэффективной для уничтожения патогенных микробов, однако было установлено, что для эффективного уничтожения дрожжевых и спорообразующих микроорганизмов может потребоваться агент, усиливающий антимикробную активность. Стадия спорообразования в жизненном цикле микробов характеризуется метаболическим состоянием покоя и резистентностью к окружающим факторам, которые могут нарушать действие микробов на стадии их вегетативного размножения. Самая ранняя фаза образования спор характеризуется набуханием и переходом от состояния покоя в состояние активного метаболизма. Затем наблюдается вегетативный рост, например проращивание и, в конечном счете, репродуцирование.
Образование бактериальных эндоспор и грибных спор ассоциируется с повышенным метаболизмом и пониженной термостойкостью, а также резистентностью к химическим реагентам. В случае прорастания эти споры должны быть чувствительными к окружающей среде, то есть эта среда должна быть адекватна с точки зрения вегетативного роста и размножения. Сообщалось, что аминокислота L-аланин стимулирует образование бактериальных спор (Hills, J. Gen. Microbiol. 4:38, 1950; Halvorson and Church, Bacteriol. Rev. 21:112, 1957). Также сообщалось, что L-аланин и L-пролин инициируют образование грибных спор (Yanagita, Arch. Mikrobiol. 26:329, 1957).
Простые α-аминокислоты, такие как глицин и L-аланин, занимают центральное положение в метаболизме. Переаминирование или дезаминирование α-аминокислот приводит к образованию гликогенных или кетогенных углеводов и азота, необходимого для метаболизма и роста. Так, например, переаминирование или дезаминирование L-аланина приводит к образованию пирувата, который является конечным продуктом гликолитического метабилизма (путь Эмбдена-Мейерхофа-Парнаса). Окисление пирувата под действие пируват-дегидрогеназного комплекса приводит к образованию ацетил-CoA, NADH, H+ и CO2. Ацетил-CoA представляет собой субстрат, инициирующий прохождение цикла трикарбоновых кислот (цикла Кребса), которые, в свою очередь, осуществляют митохондриальные реакции цепи транспорта электронов. Ацетил-CoA также представляет собой конечный источник углерода в синтезе жирных кислот, а также в синтезе стирола. Простые α-аминокислоты могут поставлять азот, CO2, гликогенные и/или кетогенные эквиваленты, необходимые для образования спор и последующего усиления метаболической активности.
В соответствии с этим в патентах США №№ 5389369 и 5451402 указывается, что антимикробное действие миелопероксидазы, направленное против дрожжевых и спорообразующих форм микробов, может усиливаться при обработке микроорганизмов миелопероксидазой в комбинации с некоторыми α-аминокислотами, которые подавляют стимуляцию почкования дрожжей и прорастания спорулированных микробов и, возможно, подавляют ускорение метаболизма вегетативных микробов. Репрезентативными α-аминокислотами, применяемыми для этой цели, являются глицин и L- или D-энантиомеры аланина, валина, лейцина, изолейцина, серина, треонина, лизина, фенилаланина, тирозина и их алкиловых сложных эфиров. Хотя в патентах США №№ 5389369 и 5451402 описано повышение антимикробной активности миелопероксидазы, направленной против дрожжевых и спорообразующих форм микробов, под действием α-аминокислот, однако, ни в одном из этих патентов не сообщалось о повышении свойств миелопероксидазной антимикробной системы, направленных против не образующих споры бактерий или о последующем усилении антибактериальной активности с использованием миелопероксидазы или по меньшей мере двух аминокислот, описанных в настоящей заявке.
Описание сущности изобретения
В целом, настоящее изобретение относится к выбору концепций в упрощенной форме, которые также описаны ниже в разделе «Подробное описание». Описание сущности изобретения не включает определение ключевых признаков заявленного предмета изобретения, а также определение объема заявленного предмета изобретения.
Настоящее изобретение относится к композициям и к способам, применяемым для уничтожения или ингибирования микробных инфекций, таких как бактериальные инфекции, путем контактирования области инфицирования с композицией, содержащей миелопероксидазу и по меньшей мере две аминокислоты, которые действуют в комбинации друг с другом, что приводит к повышению миелопероксидазной антимикробной активности. Для осуществления настоящего изобретения восприимчивые микроорганизмы подвергают уничтожению или ингибированию путем их контактирования с миелопероксидазой и по меньшей мере с двумя аминокислотами в количестве, которое, в присутствии пероксида и бромида или хлорида, является эффективным для ингибирования роста или уничтожения микроорганизмов.
Таким образом, в одном из своих вариантов, настоящее изобретение относится к композициям для ингибирования роста восприимчивых микроорганизмов, содержащим миелопероксидазу и по меньшей мере две аминокислоты, которые действуют в комбинации друг с другом и тем самым усиливают антимикробную активность миелопероксидазы. В некоторых вариантах изобретения по меньшей мере две аминокислоты выбраны из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина, D-валина, бета-аминокислот, таких как бета- аланин, L-бета-гомолейцин и D-бета-гомолейцин, 3-аминобутановой кислоты, моногидрохлорида L-2,3-диаминопропионовой кислоты, моногидрохлорида D-2,3-диаминопропионовой кислоты, L-3-аминоизомасляной кислоты, D-3-аминоизомасляной кислоты, этил-3-аминобутирата, гидрохлорида метилового эфира саркозина и нипекотиновой кислоты, или их алкилового сложного эфира, или фармацевтически приемлемой соли. В других вариантах изобретения по меньшей мере две аминокислоты выбраны из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина, D-валина, или их алкилового сложного эфира, или фармацевтически приемлемой соли.
В других своих аспектах настоящее изобретение относится к композициям для ингибирования роста восприимчивых микроорганизмов, содержащим миелопероксидазу и по меньшей мере три аминокислоты, выбранных из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина, D-валина, бета-аминокислот, таких как бета- аланин, L-бета-гомолейцин и D-бета-гомолейцин, 3-аминобутановой кислоты, моногидрохлорида L-2,3-диаминопропионовой кислоты, моногидрохлорида D-2,3-диаминопропионовой кислоты, L-3-аминоизомасляной кислоты, D-3-аминоизомасляной кислоты, этил-3-аминобутирата, гидрохлорида метилового эфира саркозина и нипекотиновой кислоты или их алкилового сложного эфира или фармацевтически приемлемой соли. В других аспектах изобретения по меньшей мере три аминокислоты выбраны из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина и D-валина или их алкилового сложного эфира или фармацевтически приемлемой соли.
В некоторых вариантах изобретения композиции согласно изобретению также включают пероксид водорода или источник пероксида водорода. В этом аспекте изобретения, указанные композиции могут содержать пероксид-продуцирующую оксидазу, которая продуцирует пероксид водорода в присутствии субстрата для оксидазы. В некоторых вариантах изобретения указанные композиции содержат пероксид-продуцирующую оксидазу, которая является эффективной для продуцирования от 100 пмоль до 50 мкмоль пероксида на мл/минуту в присутствии субстрата для оксидазы.
В одном из вариантов изобретения композиции согласно изобретению содержат от 1 до 50000 мкг/мл миелопероксидазы. В других вариантах изобретения композиции согласно изобретению содержат от 0,1 до примерно 500 мМ каждой из по меньшей мере двух аминокислот. В одном репрезентативном варианте изобретения композиции согласно изобретению содержат от 10 до 5000 мкг/мл миелопероксидазы, от 0,3 до 50 мМ глицина, от 0,3 до 50 мМ L-аланина, от 0,3 до 50 мМ L-пролина и от 1 до 500 ед./мл глюкозо-оксидазы.
В других своих аспектах настоящее изобретение относится к способам лечения человека или животного, нуждающегося в таком лечении, где указанный способ включает введение в область инфицирования индивидуума композиции, содержащей миелопероксидазу и по меньшей мере две аминокислоты, которые действуют в комбинации друг с другом и которые, в присутствии пероксида водорода и хлорида или бромида, усиливают антимикробную активность миелопероксидазы. В некоторых вариантах этого аспекта изобретения по меньшей мере две аминокислоты выбраны из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина, D-валина, бета-аминокислот, таких как бета-аланин, L-бета-гомолейцин и D-бета-гомолейцин, 3-аминобутановой кислоты, моногидрохлорида L-2,3-диаминопропионовой кислоты, моногидрохлорида D-2,3-диаминопропионовой кислоты, L-3-аминоизомасляной кислоты, D-3-аминоизомасляной кислоты, этил-3-аминобутирата, гидрохлорида метилового эфира саркозина и нипекотиновой кислоты или их алкилового сложного эфира или фармацевтически приемлемой соли. В других вариантах этого аспекта изобретения, по меньшей мере две аминокислоты выбраны из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина, D-валина, или их алкилового сложного эфира или фармацевтически приемлемой соли.
В других своих вариантах настоящее изобретение относится к способам лечения человека или животного, нуждающегося в таком лечении, где указанные способы включают введение в область инфицирования индивидуума композиции, содержащей миелопероксидазу и по меньшей мере три аминокислоты, которые действуют в комбинации друг с другом и которые, в присутствии пероксида водорода и хлорида или бромида, усиливают антимикробную активность миелопероксидазы. В некоторых вариантах изобретения по меньшей мере три аминокислоты выбраны из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина, D-валина, бета-аминокислот, таких как бета-аланин, L-бета-гомолейцин и D-бета-гомолейцин, 3-аминобутановой кислоты, моногидрохлорида L-2,3-диаминопропионовой кислоты, моногидрохлорида D-2,3-диаминопропионовой кислоты, L-3-аминоизомасляной кислоты, D-3-аминоизомасляной кислоты, этил-3-аминобутирата, гидрохлорида метилового эфира саркозина и нипекотиновой кислоты или их алкилового сложного эфира или фармацевтически приемлемой соли. В других вариантах изобретения по меньшей мере три аминокислоты выбраны из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина и D-валина или их алкилового сложного эфира или фармацевтически приемлемой соли.
В других вариантах изобретения композиция, вводимая человеку или животному, может также включать пероксид водорода или источник пероксида водорода. В некоторых вариантах изобретения источник пероксида водорода содержит пероксид-продуцирующую оксидазу, которая продуцирует пероксид водорода в присутствии субстрата для оксидазы. Так, например, композиция, вводимая человеку или животному, может дополнительно содержать пероксид-продуцирующую оксидазу, которая является эффективной для продуцирования от 100 пмоль до 50 мкмоль пероксида на мл/минуту в присутствии субстрата для оксидазы.
В некоторых вариантах изобретения композиция, вводимая человеку или животному, может содержать от 1 до 50000 мкг/мл миелопероксидазы. В других вариантах изобретения композиция, вводимая человеку или животному, может содержать от 0,1 до примерно 500 мМ каждой из по меньшей мере двух аминокислот. В одном репрезентативном варианте изобретения композиция, вводимая человеку или животному, может содержать от 10 до 5000 мкг/мл миелопероксидазы, от 0,3 до 50 мМ глицина, от 0,3 до 50 мМ L-аланина, от 0,3 до 50 мМ L-пролина, от 1 до 500 ед./мл глюкозо-оксидазы и от 1 до 500 мМ глюкозы.
В некоторых аспектах изобретения человек или животное, подвергаемое лечению, страдает микробными инфекциями, поражающими десну, глаза, уши, кожу, мягкие ткани, раны, области влагалища и паховые области, а также пролежнями или ожогами. В некоторых вариантах изобретения такой инфекцией является полимикробная инфекция. В некоторых вариантах изобретения такая инфекция вызывается, по меньшей мере частично, микроорганизмами, резистентными ко многим лекарственным средствам.
В других своих аспектах настоящее изобретение относится к способам уничтожения или ингибирования роста восприимчивых микроорганизмов, где указанные способы включают контактирование микроорганизмов в присутствии пероксида водорода и хлорида или бромида, с композицией, содержащей миелопероксидазу и по меньшей мере две аминокислоты, которые действуют в комбинации друг с другом, что приводит к повышению антибактериальной активности миелопероксидазы.
Описание графического материала
Вышеуказанные аспекты и многие другие преимущества настоящего изобретения будут более очевидными исходя из нижеследующего подробного описания изобретения, которое приводится со ссылками на прилагаемое описание графического материала, где:
На фигуре 1 проиллюстрирован анализ на зависимость уничтожения бактерий от времени для S. aureus ATCC 6538 (фигура 1A) и E.coli ATCC 25922 (фигура 1B), обработанных раствором с повышенной MPO-активностью, содержащим 9 (□), 6 (◊), 3 (Δ), 1 (O), 0,3 (*) и 0,1 (+) мкг MPO/мл, как описано в примере 11. Быстрая бактерицидная активность (>3 log снижения по сравнению с начальным уровнем инокулята) была продемонстрирована с применением метода суспендирования-нейтрализации. Скорость уничтожения бактерий была выше при более высоких концентрациях MPO в растворе с повышенной MPO-активностью, а степень уничтожения бактерий повышалась с увеличением времени обработки. При концентрациях 3 мкг MPO/мл и выше в течение 5-минутной обработки какого-либо детектируемого выживания бактерий не наблюдалось.
На фигуре 2 проиллюстрирован анализ на зависимость уничтожения бактерий от времени для S. aureus ATCC 6538 (фигура 2A) и P. aeruginosa ATCC 27317 (фигура 2B), обработанных раствором с повышенной MPO-активностью, содержащим 200 (□), 100 (◊) и 50 (Δ) мкг MPO/мл, как описано в примере 11. Изоляты тестировали в присутствии 3% цельной человеческой крови методом суспендирования-нейтрализации. Интерферирующее влияние крови на антимикробную активность раствора с повышенной MPO-активностью, предотвращалось при более высоких концентрациях MPO.
На фигуре 3 проиллюстрирован анализ на зависимость уничтожения бактерий от времени для S. aureus ATCC 29213 (фигура 3A), E. coli ATCC 25922 (фигура 3B), E.faecalis ATCC 29212 (фигура 3C) и P. aeruginosa ATCC 27853 (фигура 3D), обработанных раствором с повышенной MPO-активностью, содержащим 256 (□), 64 (◊), 16 (Δ), 4 (Х), 1 (*), 0,025 (O) и 0,06 (+) мкг MPO/мл, как описано в примере 11. Бактерицидная активность (>3 log снижения начального по сравнению с начальным уровнем инокулята) была продемонстрирована с применением модифицированного метода микроразведения в бульоне CLSI. Сравнимые профили уничтожения бактерий наблюдались для всех микроорганизмов, причем скорость уничтожения бактерий была выше при более высоких концентрациях MPO в растворе с повышенной MPO-активностью, а степень уничтожения бактерий повышалась при более длительной обработке и с увеличением периода времени. При концентрациях 256 и 16 мкг MPO/мл какого-либо детектируемого выживания всех протестированных микроорганизмов через 30 минут и 4 часа, соответственно, не наблюдалось.
На фигуре 4 проиллюстрирован анализ на зависимость уничтожения бактерий от времени для S. aureus ATCC 6538 у крыс с моделью раны, захватывающей всю толщину кожи и обработанной раствором с повышенной MPO-активностью, содержащим 18,75 (♦), 75 GU/мл (■) и 150 (●) GU/мл, как описано в примере 12. Показано выделение микроорганизма из необработанных ран через 60 минут (О). На этом графике представлены средние значения log10 к.о.е. выживших микроорганизмов, выделенных у каждой группы через 5, 15, 30 и 60 минут после обработки. Для каждой группы обработки даны 95% доверительные интервалы для каждого периода времени обработки.
На фигуре 5 представлено сравнение антимикробной активности раствора с повышенной MPO-активностью, направленной против резистентной к метициллину бактерии S. aureus (MRSA) и чувствительной к метициллину бактерии S. aureus (MSSA) у крыс с моделью раны, захватывающей часть толщины кожи, как описано в примере 12. На этом графике представлены средние значения log10 к.о.е. выживших микроорганизмов, выделенных через 15 минут после обработки; и
На фигуре 6 проиллюстрирован анализ на зависимость уничтожения бактерий от времени для E. coli ATCC 25922 у крыс с моделью раны, захватывающей всю толщину кожи и обработанной раствором с повышенной MPO-активностью, содержащим 18,75 (♦), 75 GU/мл (■) и 150 (●) GU/мл, как описано в примере 12. Указаны данные для микроорганизмов, выделенных из необработанных ран через 60 минут (О). На этом графике представлены средние значения log10 к.о.е. выживших микроорганизмов, выделенных у каждой группы через 5, 15, 30 и 60 минут после обработки. Для каждой группы обработки даны 95% доверительные интервалы для каждого периода времени обработки.
Подробное описание изобретения
В своем широком смысле настоящее изобретение относится к композициям и способам, применяемым для уничтожения или ингибирования бактериальных инфекций с использованием миелопероксидазы и по меньшей мере двух аминокислот, которые действуют в комбинации друг с другом, что приводит к повышению антимикробной активности миелопероксидазы. Для осуществления настоящего изобретения восприимчивые микроорганизмы уничтожают или ингибируют путем контактирования микроорганизмов с миелопероксидазой и по меньшей мере с двумя аминокислотами в количестве, которое, в присутствии пероксида и бромида или хлорида, является эффективным для ингибирования роста или уничтожения микроорганизмов.
В одном особенно предпочтительном варианте изобретения композиции и способы согласно изобретению применяются в качестве антисептических средств, обладающих повышенной антимикробной миелопероксидазной активностью, направленной против патогенных микроорганизмов широкого ряда, включая бактерии и грибы. В одном из аспектов изобретения композиции и способы согласно изобретению являются особенно подходящими для местного лечения восприимчивых инфекций у человека или у млекопитающего, не являющегося человеком, на участках, доступных для непосредственного контакта композиций согласно изобретению с микробной инфекцией, такой как, например, инфекции, поражающие кожу, глаза, уши, ротовую полость, носовые ходы и синусные пазухи, области травматического повреждения, области хирургического вмешательства и т.п. Антисептические системы, применяемые для контактирования с тканью хозяина, основаны на использовании диоксигенирующей миелопероксидазы, обладающей селективной аффинностью по отношению к патогенным микроорганизмам. Высокоэффективное антимикробное действие может быть направлено на микроорганизмы-мишени без повреждения других тканей хозяина или разрушения нормальной флоры, то есть такое антисептическое действие является селективным и ограничивается микроорганизмом-мишенью.
Таким образом, в одном из своих вариантов настоящее изобретение относится к композициям для ингибирования роста восприимчивых микроорганизмов, содержащим миелопероксидазу и по меньшей мере две аминокислоты, которые действуют в комбинации друг с другом и в присутствии пероксида и хлорида или бромида повышают антимикробную активность миелопероксидазы. Указанные композиции могут дополнительно содержать пероксид водорода или источник пероксида водорода и хлорид или бромид, которые, в других случаях, не присутствуют в достаточных количествах на участке применения композиций. В своем родственном варианте настоящее изобретение относится к способам лечения человека или животного, нуждающегося в таком лечении, где указанные способы включают введение индивидууму в область поражения инфекцией композиции, содержащей миелопероксидазу и по меньшей мере две аминокислоты, которые действуют в комбинации друг с другом, что приводит к повышению антимикробной активности миелопероксидазы. И в этом случае данная композиция может содержать, помимо уже имеющегося количества природных веществ, присутствующих на участке инфицирования, дополнительное количество пероксида водорода или источника пероксида водорода и хлорида или бромида.
В других своих вариантах настоящее изобретение относится к композициям и к способам, применяемым для ингибирования роста восприимчивых микроорганизмов in vitro, а в частности для обработки биомедицинского оборудования, такого как бандажи, хирургические инструменты, приспособления для наложения швов, катетеры, стоматологические инструменты, контактные линзы и т.п., которые нуждаются в дезинфекции или стерилизации и которые впоследствии подвергаются контакту с тканью хозяина. Таким образом, высокоэффективные миелопероксидазные препараты согласно изобретению могут служить в качестве in vitro дезинфицирующих или стерилизующих препаратов. При ограниченной доступности пероксида водорода в течение определенного периода времени композиции с повышенной миелопероксидазной активностью могут быть приготовлены так, чтобы они были достаточно эффективными для дезинфекции и даже стерилизации материала или устройства до его контактирования с тканью хозяина. Любая потенциальная токсичность по отношению к нормальной флоре и ткани хозяина, ассоциированная с применением указанных высокоэффективных композиций, элиминируется при истощении пероксида, а поэтому материал или устройство, обработанные данной композицией, могут быть подвергнуты контакту с тканью хозяина без дополнительной промывки или детоксикации.
Таким образом, в одном из своих вариантов, настоящее изобретение относится к способам уничтожения или ингибирования роста восприимчивых микроорганизмов in vitro, где указанные способы включают контактирование микроорганизмов, в присутствии пероксида водорода и хлорида или бромида, с композицией, содержащей миелопероксидазу и по меньшей мере две аминокислоты, которые действуют в комбинации друг с другом, что приводит к повышению антимикробной активности миелопероксидазы.
В других своих аспектах настоящее изобретение относится к применению композиции, содержащей миелопероксидазу и по меньшей мере две аминокислоты для приготовления лекарственного препарата для лечения инфекции у человека или животного, где указанные аминокислоты действуют в комбинации друг с другом, и в присутствии пероксида водорода и хлорида или бромида, способствуют повышению антимикробной активности миелопероксидазы. В некоторых своих вариантах, настоящее изобретение относится к применению композиции, содержащей миелопероксидазу и по меньшей мере две аминокислоты для приготовления лекарственного препарата для уничтожения или ингибирования роста восприимчивых микроорганизмов, где указанные аминокислоты действуют в комбинации друг с другом, что приводит к повышению антимикробной активности миелопероксидазы.
Репрезентативные композиции согласно изобретению содержат (1) миелопероксидазу (MPO); (2) по меньшей мере две аминокислоты, повышающие активность миелопероксидазы; и необязательно, (3) пероксид водорода (H2O2) или источник H2O2; и (4) хлорид или бромид.
Миелопероксидаза, используемая в настоящем изобретении, представляет собой галогенид:пероксид водорода-оксидоредуктазу (например, фермент с номерами EC No. 1.11.1.7 и EC No. 1.11.1.10, присвоенными Международной биохимической ассоциацией), для которой галогенид, то есть хлорид или бромид, представляет собой донор электронов или восстановитель, а пероксид представляет собой акцептор электронов или окислитель. Ферментативная активность раствора миелопероксидазы может быть определена посредством реакции с гваяколом в присутствии пероксида водорода в фосфатно-натриевом буфере. В результате такой реакции образуется продукт с высокой оптической плотностью на 470 нм. Активность определяют по кинетике увеличения оптической плотности по сравнению с оптической плотностью стандартного соединения, используемого в качестве эталона. Миелопероксидазную активность обычно выражают в гваяколовых единицах/мл (GU/мл), а также в микрограммах MPO на миллилитр (мкг/мл). Преобразование мкг в GU MPO осуществляют из расчета 0,375 GU на мкг MPO. Удельную активность вычисляют исходя из его активности и общей концентрации белка и выражают в GU/мг белка. Подходящие количества миелопероксидазы, используемой в композициях согласно изобретению, в значительной степени варьируются в зависимости от условий, при которых используются указанные композиции, от среды, в которой они используются, и от желаемого результата. В большинстве случаев композиции согласно изобретению обычно содержат по меньшей мере примерно 0,05 мкг/мл (0,01875 GU/мл) миелопероксидазы. В некоторых вариантах изобретения композиции согласно изобретению содержат примерно от 1 до 50000 мкг/мл миелопероксидазы (то есть примерно от 0,375 до 18750 GU/мл), более предпочтительно примерно от 5 до 10000 мкг/мл миелопероксидазы (то есть примерно от 1,875 до 3750 GU/мл), а еще более предпочтительно примерно от 10 до 5000 мкг/мл миелопероксидазы (то есть примерно от 3,75 до 1875 GU/мл).
Включение в композицию по меньшей мере двух аминокислот, повышающих активность миелопероксидазы, как подробно описано в настоящем изобретении, приводит к значительному повышению антимикробной активности системы оксидазы-миелопероксидазы по отношению к восприимчивым микроорганизмам. Аминокислотами, используемыми для осуществления настоящего изобретения, являются аминокислоты, которые при их использовании в комбинации друг с другом и в присутствии пероксида и хлорида или бромида, способствуют повышению антимикробной активности миелопероксидазной антимикробной системы по отношению к восприимчивым микроорганизмам. По меньшей мере две аминокислоты используются в концентрациях, не оказывающих какого-либо побочного действия на миелопероксидазную активность системы или не оказывающих нежелательного действия в среде, в которой применяются указанные композиции и способы.
В некоторых вариантах изобретения композиции согласно изобретению содержат по меньшей мере две аминокислоты, выбранные из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина, D-валина, бета-аминокислот, таких как бета-аланин, L-бета-гомолейцин и D-бета-гомолейцин, 3-аминобутановой кислоты, моногидрохлорида L-2,3-диаминопропионовой кислоты, моногидрохлорида D-2,3-диаминопропионовой кислоты, L-3-аминоизомасляной кислоты, D-3-аминоизомасляной кислоты и этил-3-аминобутирата, а также их алкиловых сложных эфиров и фармацевтически приемлемых солей, таких как, например, метиловый эфир L-аланина, метиловый эфир D-аланина, дигидрохлорид метилового эфира L-лизина, дигидрохлорид метилового эфира глицина, гидрохлорид метилового эфира L-пролина, гидрохлорид этилового эфира L-валина и этил-2-аминопропаноат, и N-замещенных аминокислот, таких как гидрохлорид метилового эфира саркозина и нипекотиновая кислота.
В других вариантах изобретения композиции согласно изобретению содержат по меньшей мере две аминокислоты, выбранные из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина и D-валина, а также их алкиловых сложных эфиров и фармацевтически приемлемых солей.
В некоторых вариантах изобретения композиции согласно изобретению содержат миелопероксидазу и по меньшей мере три аминокислоты, которые действуют в комбинации друг с другом, что приводит к повышению миелопероксидазной антимикробной активности. В соответствии с этим в некоторых вариантах изобретения композиции согласно изобретению содержат по меньшей мере три аминокислоты, выбранных из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина, D-валина, бета-аминокислот, таких как бета-аланин, L-бета-гомолейцин и D-бета-гомолейцин, 3-аминобутановой кислоты, моногидрохлорида L-2,3-диаминопропионовой кислоты, моногидрохлорида D-2,3-диаминопропионовой кислоты, L-3-аминоизомасляной кислоты, D-3-аминоизомасляной кислоты и этил-3-аминобутирата, а также их сложных эфиров и фармацевтически приемлемых солей, таких как, например, метиловый эфир L-аланина, метиловый эфир D-аланина, дигидрохлорид метилового эфира L-лизина, дигидрохлорид метилового эфира глицина, гидрохлорид метилового эфира L-пролина, гидрохлорид этилового эфира L-валина и этил-2-аминопропаноат, и N-замещенных аминокислот, таких как гидрохлорид метилового эфира саркозина и нипекотиновая кислота.
В других вариантах изобретения композиции согласно изобретению содержат по меньшей мере три аминокислоты, выбранные из группы, состоящей из глицина, L-аланина, D-аланина, ангидрида L-аланина, L-глутамина, L-глутаминовой кислоты, ангидрида глицина, гиппуровой кислоты, L-гистидина, L-лейцина, D-лейцина, L-изолейцина, D-изолейцина, L-лизина, L-орнитина, D-фенилаланина, L-фенилаланина, L-пролина, L-гидроксипролина, L-серина, таурина, L-треонина, D-треонина, L-тирозина, L-валина и D-валина, а также их эфиров и фармацевтически приемлемых солей. В одном предпочтительном репрезентативном примере этого аспекта изобретения композиции согласно изобретению содержат миелопероксидазу и аминокислоты глицин, L-аланин и L-пролин, в количестве, эффективном для повышения антимикробной активности миелопероксидазы.
Подходящие количества аминокислот, используемых в композициях согласно изобретению, варьируются в зависимости от количества миелопероксидазы в композициях и от условий применения таких композиций. В большинстве случаев композиции согласно изобретению обычно содержат примерно от 0,1 до 500 мМ, более предпочтительно примерно от 0,2 до 100 мМ, а еще более предпочтительно примерно от 0,3 до 50 мМ каждой из аминокислот согласно изобретению. В одном репрезентативном варианте изобретения, например, композиции согласно изобретению содержат от 10 до 5000 мкг/мл миелопероксидазы, от 0,3 до 50 мМ глицина, от 0,3 до 50 мМ L-аланина, от 0,3 до 50 мМ L-пролина и от 1 до 500 ед./мл глюкозооксидазы.
Поскольку антисептическая активность миелопероксидазных композиций согласно изобретению заключается в реакции пероксида и хлорида или бромида с образованием гипогалогенита и реакции пероксида и гипогалогенита с образованием синглетного молекулярного кислорода, то активность композиций согласно изобретению, на участке, подвергаемом антимикробному воздействию, зависит от присутствия подходящего пероксида и галогенида. В некоторых случаях на участке, подвергаемом антимикробному воздействию, может присутствовать пероксид (например, пероксид водорода), что обусловлено, например, активностью природной флоры, а в физиологической среде могут присутствовать достаточные количества хлорида, который действует как кофактор в реакции превращения. В этих случаях в композиции согласно изобретению необязательно вводить дополнительное количество пероксида или галогенида, а также необязательным является их присутствие в данных композициях. В других случаях может оказаться необходимым или желательным дополнительное включение пероксида водорода и/или галогенида в область подавления микробной инфекции. В соответствии с этим композиции согласно изобретению могут дополнительно содержать, если это необходимо, пероксид или агент, способный продуцировать пероксид in vivo или in vitro, и хлорид или бромид.
Пероксидами, используемыми в композициях и способах согласно изобретению, являются пероксид водорода, алкилгидропероксиды формулы:
R-OOH
где R представляет собой водород или короткоцепочечную алкильную группу, имеющую от 1 до 3 атомов углерода, и неорганические пероксиды, такие как пероксид бора или пероксид мочевины. Окислительная активность органических пероксидов, в основном, снижается по мере увеличения длины цепи R, как указано ниже:
R=H»CH3>CH3CH2>CH3(CH2)2
Предпочтительным пероксидом согласно изобретению, используемым в композициях согласно изобретению, является пероксид водорода. Пероксид водорода может быть также сделан доступным в области, подвергаемой антимикробному воздействию, в результате включения в композицию агента, способного продуцировать пероксид водорода in vivo или in vitro. Особенно подходящими агентами, используемыми для этой цели, являются, например, оксидазы, такие как глюкозооксидаза, холестерин-оксидаза и галактозооксидаза.
При непосредственном включении в композиции согласно изобретению пероксида водорода для их применений in vivo используемое количество предпочтительно рассчитывают так, чтобы достигалась максимальная дезинфецирующая активность. Повреждения клеток и тканей хозяев и нормальной флоры можно избежать путем предотвращения непосредственного контакта в процессе обработки большим количеством H2O2. В соответствии с этим композиции согласно изобретению могут содержать примерно от 1 нмоль до 10 мкмоль пероксида водорода на 1 мл композиции, более предпочтительно примерно от 5 нмоль до 5 мкмоль пероксида водорода на 1 мл композиции, а наиболее предпочтительно примерно от 10 нмоль до 1 мкмоль пероксида водорода на 1 мл композиции. Агенты, способные продуцировать пероксид водорода in vivo, например пероксидпродуцирующие оксидазы, являются особенно подходящими для динамической регуляции количеств пероксида водорода, присутствующего в области антимикробной активности. Такие агенты максимизируют антимикробную активность композиции посредством обеспечения и поддержания устойчивой концентрации Н2О2 на низком уровне. В соответствии с этим количество таких используемых агентов в значительной степени зависит от природы данного агента и желаемого эффекта, а предпочтительно такой агент обладает способностью продуцировать устойчивый уровень, составляющий примерно от 1 пмоль до 1 мкмоль пероксида водорода на 1 мл жидкости в минуту, в зависимости от типа и концентрации галогенида, доступного в области антимикробной активности. При использовании композиции в качестве дезинфицирующего-стерилизующего раствора, количество оксидазы и ее субстрата может быть скорректировано для достижения относительно высоких устойчивых концентраций Н2О2, постоянно присутствующих в течение необходимого периода стерилизации. Дезинфицирующее-стерилизующее действие прекращается в результате истощения субстрата оксидазы или связанного с этим снижения скорости разложения оксидазы. В репрезентативном примере, в случае, если указанной оксидазой является глюкозооксидаза, а ее субстратом является глюкоза (или декстроза), то композиции согласно изобретению могут содержать примерно от 0,05 до 3000 ед./мл, более предпочтительно примерно от 0,1 до 1000 ед./мл, а еще более предпочтительно примерно от 1 до 500 ед./мл глюкозооксидазы и примерно от 0,1 до 1000 мМ, более предпочтительно, примерно от 0,5 до 800 мМ, а еще более предпочтительно примерно от 1 до 500 мМ глюкозы.
Если в композиции согласно изобретению включены хлорид иди бромид, то применение таких композиций, выбор конкретного бромида или хлорида и их количество, используемое в конкретных целях, зависят от различных факторов, таких как желаемый терапевтический эффект, доступность пероксида и других факторов. Поскольку в большинстве физиологических сред хлорид присутствует на достаточных неограничивающих уровнях как галогенидный кофактор, то обычно не требуется добавления внешнего источника хлорида. Если существует потребность во внешнем источнике хлорида, то для создания условий, близких к физиологическим, количество используемого хлорида предпочтительно должно составлять в пределах примерно от 10 мкмоль хлорида до 150 мкмоль хлорида на 1 мл раствора. При включении указанных компонентов композиции согласно изобретению могут содержать примерно от 1 нмоль бромида до 20 мкмоль бромида на 1 мл жидкой композиции, более предпочтительно примерно от 10 нмоль бромида до 10 мкмоль бромида на 1 мл жидкой композиции, а наиболее предпочтительно примерно от 100 нмоль бромида до 1 мкмоль бромида на 1 мл жидкой композиции.
Отношение галогенида к пероксиду является важным фактором при формировании эффективной антимикробной среды. В соответствии с этим, помимо достижения эффективных уровней галогенида и пероксида в области микробной атаки, как описано выше, для осуществления способов согласно изобретению, предпочтительно, чтобы отношение галогенид:пероксид обеспечивало оптимальную антимикробную активность. Так, например, если галогенидом является Cl-, то отношение Cl- к пероксиду предпочтительно поддерживают в пределах примерно от 1 до 40000, более предпочтительно примерно от 50 до 40000, а наиболее предпочтительно примерно от 200 до 40000 в условиях антимикробной активности. Если галогенидом является Br-, то отношение Br- к пероксиду, предпочтительно, поддерживают в пределах примерно от 0,1 до 4000, более предпочтительно примерно от 0,5 до 2000, а наиболее предпочтительно примерно от 1 до 1000 в условиях антимикробной активности.
Композиции и способы согласно изобретению могут быть применены для ингибирования роста патогенных микроорганизмов широкого спектра, предпочтительно с минимальным повреждением нормальной флоры. Как продемонстрировано в примерах, композиции согласно изобретению являются в высокой степени эффективными для ингибирования грамположительных и грамотрицательных микроорганизмов, таких как, например, Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus agalactiae, стрептококки группы С, стрептококки группы F, стрептококки группы G, Streptococcus pyogenes, Citrobacter freundii, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Acintobacter spp., Pseudomonas aeruginosa, Aeromonas hydrophilia и Pasteurella multocida. Кроме того, композиции согласно изобретению могут быть использованы для ингибирования спорообразующих микроорганизмов, таких как, например, бактерии, такие как Bacillus sps. и Clostridium sps., и грибы, такие как Aspergillus sps., Fusarium sps., Trichophyton sps., и т.п. В некоторых вариантах изобретения композиции согласно изобретению, благодаря широкому спектру их активности, могут быть использованы преимущественно для лечения полимикробных инфекций. Полимикробные заболевания включают инфекции, вызываемые множеством инфекционных патогенов, и представляют собой комплексные заболевания, заболевания с осложнениями и заболевания, вызываемые смешанными инфекциями, двумя инфекциями, вторичной инфекцией, синергически действующими инфекциями, конкурентно действующими инфекциями, полимикробными инфекциями или сопутствующими инфекциями. Полимикробными заболеваниями являются, например, инфекции, ассоциированные с абсцессами, условно-патогенные инфекции, инфекции, ассоциированные со СПИД'ом, и инфекции, ассоциированные с конъюнктивитом, гастроэнтеритом, гепатитом, рассеянным склерозом, отитом среднего уха, периодонтозами, респираторными заболеваниями, и инфекции половых органов. Кроме того, поскольку композиции согласно изобретению действуют по совершенно разным механизмам, отличающимся от механизма, по которому действуют стандартные антибиотики, то в некоторых вариантах изобретения, композиции согласно изобретению могут быть также с успехом использованы для лечения инфекций, вызываемых, по меньшей мере частично, патогенами, резистентными ко множеству лекарственных средств, такими как MRSA (резистентные к метициллину Staphylococcus aureus), VRSA (резистентные к ванкомицину S. aureus), VRE (резистентные к ванкомицину энтерококки), резистентные к пенициллину энтерококки, PRSP (резистентные к пенициллину Streptococcus pneumoniae), резистентные к изониациду/рифампину Mycobacterium tuberculosis и резистентные к другим антибиотикам штаммы E. coli, Salmonella, Campylobacter и Streptococci. Такие бактерии называются здесь бактериями, «резистентными к антибиотикам», или бактериями, «резистентными к лекарственному средству», или бактериями, «резистентными ко многим лекарственным средствам», или другими аналогичными терминами, хорошо известными специалистам.
Используемый здесь термин «нормальная флора» означает бактерии, которые обычно присутствуют в организме или на поверхности тела здорового хозяина на уровнях симбиоза. Нормальная флора включает, например, семейство молочнокислых бактерий в ротовой полости, в тонком кишечнике или во влагалище человека, например, Streptococcus (viridans) в ротовой полости и Lactobacillus sp. (например, бацилла Тиссье (Tissier) и бацилла Додерлейна (Doderlein) в тонком кишечнике детей, вскармливаемых грудью, на внешних гениталиях, в передней части мочеиспускательного канала и во влагалище. Микроорганизмы, составляющие нормальную флору хозяина, хорошо известны специалистам (см., например, Principles and Practice of Infectious Diseases, supra, New York, pp. 34-36 and 161). Было обнаружено, что миелопероксидаза согласно изобретению селективно и преимущественно связывается со многими патогенными бактериями и грибами, но не с нормальной флорой. При применении in vivo хозяина предпочтительно обрабатывают миелопероксидазой в количестве, являющемся неэффективным для удаления нормальной флоры хозяина. При применении in vitro для дезинфекции-стерилизации, миелопероксидаза может быть использована в концентрациях, которые являются достаточно высокими для гарантии полного уничтожения всех вегетативных и дрожжевых форм микроорганизмов. В таких условиях повреждение ткани и разрушение нормальной флоры хозяина может быть предотвращено, если перед контактированием миелопероксидазы с тканью хозяина происходит поглощение H2O2 или H2O2-образующей системы.
Композиции согласно изобретению обычно содержат миелопероксидазу и по меньшей мере две аминокислоты в количестве, которое, в присутствии пероксида и галогенида, является эффективным для уничтожения или ингибирования роста восприимчивых микроорганизмов. Указанные композиции могут дополнительно содержать фармацевтически приемлемый носитель. В некоторых вариантах изобретения указанные композиции могут присутствовать в жидком носителе. Для этой цели обычно используют любой жидкий носитель при условии, что такой носитель не будет оказывать какого-либо значительного влияния на способность миелопероксидазы к селективному связыванию или на ее ферментативную активность. Альтернативно, указанные композиции могут присутствовать в твердой форме, которая может быть активирована после солюбилизации в жидкости.
Как указывалось выше, композиции согласно изобретению могут дополнительно содержать пероксид или агент, обладающий способностью продуцировать пероксид, а именно такой агент, как оксидаза, как подробно описано выше. Саму систему «оксидаза-миелопероксидаза» конструируют как бинарную композицию, в которой активные агенты составляют две отдельные части, объединяющиеся во время их использования. Так, например, одна часть этой бинарной композиции может включать раствор, содержащий оксидазу, миелопероксидазу и по меньшей мере две аминокислоты, повышающие их активность, например глицин, L-аланин и L-пролин. Вторая часть бинарной системы может содержать субстрат для оксидазы, например глюкозу или декстрозу, в случае глюкозооксидазы или молекулярного кислорода, O2. Субстрат может поставляться, например, в форме твердой облатки. Для стерилизации изделий, например хирургического инструмента или контактных линз, субстрат в виде облатки может быть помещен в стерилизующую камеру вместе со стерилизуемым изделием. Для инициации стерилизации добавляют миелопероксидазу, аминокислоты, повышающие ее активность, и оксидазу. В некоторых вариантах изобретения композиция миелопероксидазы может дополнительно содержать спирт для облегчения солюбилизации субстрата оксидазы и его утилизации оксидазой. Такая система будет обладать пролонгированным антимикробным действием при условии, что субстрат будет присутствовать в количестве, достаточном для инициации реакции.
Композиции согласно изобретению могут быть введены отдельно или в комбинации с одним или несколькими другими терапевтическими средствами. Репрезентативными дополнительными терапевтическими средствами, которые могут быть использованы в комбинации с композициями согласно изобретению, являются, например, антибиотики или антисептики, такие как антибактериальные средства, противогрибковые средства, противовирусные средства и/или антипаразитарные средства. В некоторых вариантах изобретения дополнительными терапевтическими средствами могут быть одно или несколько средств, таких как пенициллины, цефалоспорины, карбацефемы, цефамицины, карбапенемы, монобактамы, аминогликозиды, гликопептиды, хинолоны, тетрациклины, макролиды и/или фторхинолоны. В некоторых вариантах изобретения дополнительными терапевтическими средствами могут быть иод, серебро, медь, хлоргексидин, полигексанид, бигуаниды, хитозан и/или уксусная кислота. Одно или несколько дополнительных терапевтических средств согласно изобретению могут быть включены как часть той же самой композиции либо они могут быть введены отдельно.
При применении in vivo антисептические композиции могут быть введены теплокровным животным, включая человека и животных, в любой эффективной фармацевтически приемлемой форме, например в лекарственной форме для местного введения, в форме лаважа, в формах для перорального или вагинального введения или в форме суппозиториев, а также в формах для наружного применения, трансбуккального введения, интраназального спрея, аэрозоля для ингаляции или в любой другой форме, эффективной для доставки активной миелопероксидазы в область инфицирования микроорганизмом. Способ введения, предпочтительно, выбирают так, чтобы имел место прямой контакт антисептических композиций с инфицирующими микроорганизмами. В одном из аспектов изобретения композиции согласно изобретению доставляют или вводят путем наружного нанесения на участки тела человека или животного, восприимчивые к инфекциям, такие как, например, десны, глаза, уши, кожа, раны, области влагалища, паховые области, пролежни, ожоги, участки под медицинскими повязками, пеленки или другие покрытия, которые, как правило, пропитываются влагой, и т.п.
Для местного применения фармацевтически приемлемый носитель может быть включен в жидкости, кремы, пены, лосьоны, мази, суспензии, суппозитории или гели и может дополнительно содержать водные или органические растворители, забуферивающие агенты, эмульгаторы, гелеобразующие агенты, увлажнители, стабилизаторы, поверхностно-активные вещества, смачивающие агенты, консерванты, агенты, замедляющие высвобождение, и небольшие количества увлажнителей, секвестрантов, красителей, отдушек и других компонентов, обычно используемых в фармацевтических композициях для местного применения. Кроме того, композициями согласно изобретению могут быть пропитаны повязки или покрытия, накладываемые индивидууму.
В другом варианте изобретения композиции согласно изобретению могут быть специально приготовлены для применения in vitro, такого как дезинфекция или стерилизация медицинских инструментов, контактных линз и т.п., а в частности, если такие инструменты или линзы используются в условиях контактирования с пациентом или его одеждой. Для такого применения композиции могут быть получены в форме жидкости, крема, пены, лосьона или геля, и могут содержать эмульгаторы, поверхностно-активные вещества, забуферивающие агенты, смачивающие агенты, консерванты и другие компоненты, обычно присутствующие в композициях такого типа. Композициями согласно изобретению могут быть пропитаны абсорбирующие материалы, такие как материал для наложения швов, бандажы и марли, либо такие композиции могут быть нанесены на поверхность твердофазных материалов, таких как скобы, застежки-молнии и катетеры, предназначенные для доставки композиций в область, которая должна быть защищена от микробной инфекции. Другие системы доставки такого типа хорошо известны специалистам в данной области.
При желании могут быть включены и другие компоненты, такие как оксидаза для продуцирования пероксида, субстрат для оксидазы и галогенид, как подробно описано выше. Кроме того, эти компоненты могут присутствовать в одной композиции либо они могут быть разделены по бинарным композициям с их последующим объединением в процессе применения, если это потребуется для конкретной цели. Для получения одной композиции один из необходимых компонентов системы, который является доступным на участке применения композиции, например такой компонент как галогенид, оксидаза, простетическая группа для оксидазы, восстанавливающий субстрат для оксидазы или молекулярный кислород предпочтительно не включают в данную композицию в целях предупреждения преждевременной реакции и истощения компонентов системы.
В репрезентативном примере композиция, подходящая для ее применения в виде антимикробного (или противоинфекционного) раствора, может содержать примерно от 1 до 50000 мкг/мл (то есть, примерно от 0,375 до 18750 GU/мл) миелопероксидазы, от 0,1 до 500 мкмоль/мл (то есть от 0,1 до 500 мМ) глицина, от 0,1 до 500 мкмоль/мл (то есть от 0,1 до 500 мМ) L-пролина, от 0 до 100 мкмоль/мл (то есть от 0 до 100 мМ) L-аланина, от 0,01 до 500 единиц на 1 мл глюкозооксидазы, и от 10 до 150 мкмоль/мл хлорида. Вышеуказанную композицию объединяют с 1-500 мкмоль/мл (то есть от 1 до 500 мМ) глюкозы или декстрозы, и используют в качестве жидкого дезинфицирующего или стерилизующего раствора.
Для лучшего понимания вышеописанного изобретения ниже представлены репрезентативные примеры, которые приводятся лишь в целях иллюстрации и не ограничивают объема изобретения.
ПРИМЕРЫ
Пример 1
Влияние L-лизина на антимикробную активность миелопероксидазной системы, направленную на уничтожение Staphylococcus aureus в присутствии крови
Влияние L-лизина на активность миелопероксидазной системы, направленную на уничтожение Staphylococcus aureus, продемонстрировано ниже.
Материалы
В этом примере бактериальные суспензии, а в частности, суспензии Staphylococcus aureus, были получены в шейкерной колбе для достижения бактериями стадии роста от поздней логарифмической до ранней стационарной фазы. Бактерии выращивали в течение 24 часов в соевом бульоне с триптиказой (TSB) при 35°С. Культуры центрифугировали при 4000 об/мин в течение 10 минут и супернатанты удаляли. Осадок собирали и два раза промывали стерильным нормальным 0,9% физиологическим раствором (NS). Промытые микроорганизмы суспендировали и разводили нормальным физиологическим раствором до значения 3 в соответствии со стандартом Макфэланда, то есть приблизительно 109 бактериальных колониеобразующих единиц (к.о.е.) на мл. Фактическое число колоний подтверждали путем серийных разведений (10-1-10-5 или 10-6), а затем колонии высевали на TSA и инкубировали в течение ночи при 35°C. Для получения конечного нужного рабочего инокулята приблизительно 107 к.о.е./мл использовали 15 микролитров микроорганизмов на 1 мл конечной реакционной смеси.
Глюкозооксидазу (GO) от Aspergillus Niger закупали у Biozyme, Inc., United Kingdom, Catalog # GO3A, 270 ед./мг). Свиную миелопероксидазу (p-MPO) закупали у Exoxemis, Inc., Little Rock, Arkansas, U.S.A., 375 ед./мг. Затем получали стерильные маточные растворы D-глюкозы и хлорида натрия и эти растворы использовали в конечной концентрации 150 мМ каждого. Гидрохлорид L-лизина (Spectrum Chemical Catalog # Ll142) получали в виде 100 мМ маточного раствора. Каталазу (Sigma, Catalog # C-40) получали в виде 1% маточного раствора в стерильном нормальном 0,9% физиологическом растворе. Кровь брали из вены путем пункции и использовали как цельную кровь в тот же день.
Методика
С использованием стерильного оборудования получали растворы p-MPO и глюкозооксидазы в концентрациях, указанных в таблице 1, в 20 мМ фосфатного буфера при pH 6,5, содержащего 0,02 % твина-80, 150 мэкв./л хлорида и L-лизина в концентрации 0, 1,25, 5 или 20 мкмоль/мл. Staphylococcus aureus использовали для получения конечной нужной концентрации 2-3×107 к.о.е. (7,4 log10) на 1 мл, а венозную цельную кровь использовали для получения конечной концентрации 3%. К реакционным смесям добавляли глюкозу до конечной концентрации 150 мМ, которая позволяла инициировать антимикробную реакцию. Конечный объем реакционных смесей составлял 1 мл. Реакции, если это необходимо, осуществляли в течение периода времени от 30 минут до 2 часов при комнатной температуре или при 37°C в сухой бане. В определенные моменты времени реакционные смеси обрабатывали 100 микролитрами раствора каталазы, содержащего минимум 100 единиц/мкл, для поглощения остаточного пероксида и завершения окислительного уничтожения бактерий. Подсчет числа серийных разведений в планшете осуществляли исходя из содержания каждого сосуда в стерильном физиологическом растворе, а затем бактерии инокулировали на соевом агаре с триптиказой (TSA) для количественной оценки культуры. После этого планшеты инкубировали при 37°C и число колоний подсчитывали в течение 24 часов. После инкубирования подсчитывали число колониеобразующих единиц (к.о.е.) как показатель жизнеспособности микроорганизмов и результаты сравнивали с результатами для контрольного инокулята. Результаты представлены в таблице 1 как среднее для 2 повторностей.
Как показано в таблице 1, MPO вместе с глюкозооксидазой обладает высокой антимикробной активностью в присутствии аминокислоты (а.к.) L-лизина. Эта комбинация уничтожала 10 (7) Staphylococcus aureus в присутствии 3% крови, тогда как идентичная комбинация без L-лизина давала значительно меньший эффект.
Пример 2
Действие аминокислот как потенциальных агентов, усиливающих антимикробную активность миелопероксидазной системы, направленную на уничтожение Staphylococcus aureus, в присутствии крови
Действие различных аминокислот и их гомологов, используемых в качестве потенциальных агентов, усиливающих антимикробную активность MPO в присутствии крови, было продемонстрировано ниже с применением общего метода, описанного в примере 1, за исключением того, что для каждой тестируемой аминокислоты использовали одну концентрацию p-MPO (714 пмоль/мл, эквивалентную 100 мкг/мл или 38 ед./мл) и одну концентрацию глюкозооксидазы (33,3 ед./мл). Отдельные аминокислоты, указанные ниже в таблицах 2-6, были протестированы в одной концентрации 5 мкмоль/мл, и результаты сравнивали с результатами, полученными для MPO-системы, не содержащей аминокислот. Отдельные аминокислоты, протестированные в отсутствие MPO, не обладали антимикробной активностью. Результаты представлены в таблицах 2-6 как среднее для 2 повторностей.

В качестве контроля, для определения антимикробной активности только отдельных аминокислот, процедуру, описанную в примере 2, осуществляли без повторов, за исключением того, что данную процедуру проводили в отсутствие глюкозы, МРО и глюкозооксидазы. Результаты приводятся в таблице 6.
В таблицах 2-5 продемонстрирована эффективность MPO-системы в присутствии и в отсутствие добавленных аминокислот. В таблице 6 показано, что ни одна из аминокислот, ни их гомологи не обладают собственными антимикробными свойствами, если они используются в отсутствие MPO.
Уровень опосредуемого аминокислотами повышения активности зависит от типа используемых аминокислот и составляет в пределах от нуля до по меньшей мере 6 log повышения активности в тестируемых условиях.
Как видно из таблицы 2, тесты, проводимые с использованием репрезентативных L-аминокислот, указывали на повышение активности MPO-системы в присутствии аминокислот. Исключениями являются цистеин, метионин и триптофан, то есть аминокислоты, которые по всей вероятности вступают в химическую реакцию с окислительными промежуточными соединениями, продуцируемыми MPO-системой, что приводит к образованию неактивных соединений. Ограниченное усиление активности под действием гистидина может быть объяснено тем фактом, что эта аминокислота, по всей вероятности, в высокой степени реагирует с синглетным кислородом и поглощается продуктом MPO-системы.
В таблицах 3 и 4 даны дополнительные L-аминокислоты и показано, что сложные эфиры и другие близкородственные гомологи аминокислот также обнаруживают высокую активность.
В таблицах 3, 4 и 5 указан ряд D-аминокислот, которые были протестированы, и, как и в случае L-аминокислот, многие из этих аминокислот обладают способностью значительно усиливать антимикробную активность данной композиции. Примечательно, что D-аргинин, указанный в таблице 5, является в высокой степени активным, в отличие от L-аргинина, который является, в основном, неактивным, как показано в таблице 2.
Вообще говоря, в высокой степени активными являются алифатические аминокислоты, особенно те из них, которые имеют разветвленные цепи.
Как показано в таблице 6, все аминокислоты, протестированные отдельно в отсутствие MPO, не обладали собственной антимикробной активностью.
Пример 3
Действие аналогов аминокислот как потенциальных агентов, усиливающих антимикробную активность миелопероксидазной системы, направленную на уничтожение Staphylococcus aureus в присутствии крови
Действие различных бета-аминокислот, их сложноэфирных производных и N-замещенных аминокислот как потенциальных агентов, усиливающих антимикробную активность р-MPO в присутствии крови, было продемонстрировано ниже с применением общей процедуры, описанной в примере 2. Проведенные тесты показали, что аминокислотные аналоги, используемые отдельно в отсутствие MPO, не обладают собственной антимикробной активностью.
Результаты представлены ниже в таблицах 7 и 8.

В качестве контроля для определения антимикробной активности отдельных аминокислот вышеописанную процедуру осуществляли без повторов, за исключением того, что данную процедуру проводили в отсутствие глюкозы, МРО и глюкозооксидазы. Результаты приводятся в таблице 8.

Как показано в таблицах 7 и 8, MPO-система обладает сильной антимикробной активностью в присутствии большинства протестированных гомологов аминокислот. Большинство выбранных соединений, которые представляют собой гомологи аминокислот, а именно бета-аминокислоты, сложные эфиры аминокислот и N-замещенные аминокислоты, способны уничтожать 107 к.о.е. Staphylococcus aureus в присутствии 3% крови, тогда как тест, проводимый в идентичных условиях, но в отсутствие аминокислот, давал менее чем 1,5 log снижения, как указано в таблицах 2-5. Аминокислоты, взятые отдельно не обнаруживали какой-либо антимикробной активности, как показано в таблице 8.
Пример 4
Общая процедура, описанная в примере 2, была проведена для различных аминокислот с использованием MPO в концентрации 25 или 100 мкг/мл и аминокислот в концентрациях 1,25, 5 или 20 мкмоль/мл (мМ) за 30 или 60 минут до гашения реакции каталазой. Величины log10 (к.о.е.+1) выживших микроорганизмов в присутствии каждой аминокислоты и в определенных условиях представлены в нижеследующей таблице 9, и приводятся в порядке нисходящих усредненных результатов эффективностей, полученных в тестируемых условиях.
Пример 5
Действие комбинаций из двух аминокислот на антимикробную активность миелопероксидазной системы, направленную на уничтожение Staphylococcus aureus в присутствии крови
Действие комбинаций из двух аминокислот как потенциальных агентов, усиливающих антимикробную активность р-MPO в присутствии крови, было продемонстрировано ниже с применением общей процедуры, описанной в примере 2, за исключением того, что каждый тест проводили с использованием одной низкой концентрации МРО (12,5 мкг/мл или 4,7 ед./мл) и глюкозооксидазы (4,2 ед./мл) и двух аминокислотных активаторов, как указано ниже в таблицах 9-13, где каждый из указанных компонентов добавляли к смесям в конечной концентрации 1,25 мкмоль/мл. Если аминокислотные активаторы тестировали по отдельности для сравнения, то их добавляли к смесям в конечной концентрации 2,5 мкмоль/мл.
Результаты приводятся ниже.


Пример 6
Действие комбинаций из двух аминокислот, содержащих глицин, на антимикробную активность миелопероксидазной системы, направленную на уничтожение Staphylococcus aureus в присутствии крови
После проведения общей процедуры, описанной в примере 5, в которой одной из двух аминокислот является глицин, получали результаты, представленные в таблицах 12 и 13.


Пример 7
Действие комбинаций из двух аминокислот, одной из которых является L-изолейцин, на антимикробную активность миелопероксидазной системы, направленную на уничтожение Staphylococcus aureus в присутствии крови
Аминокислота L-изолейцин была идентифицирована в примере 2 как сильный усилитель активности МРО-системы, направленной против Staphylococcus aureus. Поэтому действие комбинаций из двух отдельных аминокислот, одной из которых является L-изолейцин, как потенциальных агентов, усиливающих антимикробную активность МРО в присутствии крови, оценивали в соответствии с процедурой, описанной в примере 5. Результаты приводятся ниже в таблице 14.

Для идентификации возможного синергического или антагонистического действия проводили анализ данных, представленных в таблицах 10-14, где указанный анализ заключался в сравнении данных для всех композиций, состоящих из комбинаций двух аминокислот, с данными, полученных для каждой отдельной аминокислоты, с точки зрения влияния этих аминокислот на эффективность таких композиций.
Была проведена оценка каждой из тридцати семи аминокислот или их производных. Семьдясят четыре пары аминокислот тестировали в стандартных условиях, описанных выше.
Метод определения синергического действия
Синергическое или антагонистическое действие определяли следующим образом.
Для каждой тестируемой пары аминокислот предсказанные к.о.е. вычисляли как среднее для к.о.е. выживших микроорганизмов, полученное из двух результатов эксперимента по отдельным аминокислотам, независимо действующим в стандартных условиях. Так, например, данные для первой синергической комбинации с D-изолейцином и глицином представлены в таблице 11. Значения к.о.е. для каждой из аминокислот, действующих независимо, как указано выше в таблице 11, составляли 196000 и 9300, соответственно. Среднее из этих двух чисел равно 102650, как указано ниже в первой строке таблицы 16 для предсказанных к.о.е. выживших микроорганизмов. Затем фактическое значение к.о.е., наблюдаемое для данной пары, делили на предсказанное значение к.о.е., а затем полученные значения умножали на 100 и получали % предсказанной величины. Для того чтобы определить, обладают ли данные пары синергическим, антагонистическим или аддитивным действием, полученную величину сравнивали с пороговой величиной, как обсуждается в следующем разделе.
Вычисление пороговой величины
Вычисление соответствующих пороговых величин для определения синергического и антагонистического действия осуществляли исходя из вариабельности величины к.о.е. реплицированных выживших микроорганизмов. Большинство измерений было сделано в дубликате. Полную сумму квадратов для всех дублированных данных, после преобразования log10 (к.о.е.+1), делили на число степеней свободы и получали дисперсию ошибок данных log-преобразования. Исходя из этого вычисляли коэффициент вариации (CV), представленный в таблице 15.
Этот коэффициент вариации (CV) вычисляли по всему интервалу к.о.е.-ответов. Поэтому для этих ответов нормальная вариация составляет в пределах двух стандартных отклонений или приблизительно 50%-200%. Для гарантии идентификации фактического синергического и антагонистического действия в настоящей заявке использовали консервативный фактор, имеющий в два раза большее значение. Поэтому пороговое значение для синергического действия составляло 25%, а для антагонистического действия - 400%. Применение этого порогового значения для вышеуказанного примера, со всей очевидностью, позволяет сделать вывод, что D-изолейцин и глицин обладают синергическим действием, поскольку фактическое значение к.о.е. для этой пары составляет 0 к.о.е. или 0% от предсказанной величины.
Результаты, представленные в таблицах
Результаты, полученные для каждой протестированной комбинации, были распределены по трем таблицам: В таблице 16 указаны синергичесике комбинации с ответами менее чем 25% от предсказанной величины, в таблице 17 указаны антагонистические комбинации с ответами более чем 400% от предсказанной величины, а в таблице 18 указаны аддитивные комбинации с ответами в пределах 25-400% от предсказанной величины.
Рацемические комбинации аминокислот
Рацемические аминокислоты могут рассматриваться как 1:1-смесь D- и L-изомеров. Следовательно, некоторые рацемические смеси были протестированы как комбинации для идентификации антагонистических, аддитивных или синергических смесей с учетом свойств отдельных D- и L-энантиомеров. Результаты для D-, L- и рацемических форм четырех аминокислот приводятся в таблице 19.
Исходя из предсказанных величин, представленных в нижеследующей таблице, был сделан вывод, что рацемические смеси вероятно являются аддитивными, за исключением r-фенилаланина, который, вероятно, действует синергически.
Пример 8
Влияние комбинации бета-аланина и L-аланина на антимикробную активность миелопероксидазной системы, направленную на уничтожение Bacillus subtilis в присутствии крови
Влияние комбинации из двух аминокислот бета-аланина и L-аланина, как потенциальных усиливающих агентов, на антимикробное действие МРО, направленное против спор Bacillus subtilis в присутствии крови, определяли в соответствии с процедурой, описанной в примере 2. Однако в этом случае каждый тест проводили с использованием одной низкой концентрации МРО (25 мкг/мл или 9,4 ед./мл) и глюкозооксидазы (8,3 ед./мл). Суспензии Bacillus subtilis, содержащие 100% спор, как было подтверждено методом микроскопии, получали путем промывки 50% этанолом для удаления вегетативных форм Bacillus subtilis. Для сравнения оценивали влияние L-аланина и бета-аланина, взятых отдельно, на миелопероксидазную антимикробную активность, направленную против спор Bacillus subtilis. Результаты представлены в таблице 21.
Как покзано в таблице 21, взаимодействие комбинации из двух аминокислот бета-аланина и L-аланина приводит к значительному усилению способности миелопероксидазы к уничтожению спор Bacillus subtilis по сравнению со способностью MPO-системы, содержащей только L-аланин или вообще не содержащей аминокислот. Через 2 часа композиция, содержащая бета-аланин/L-аланин, обнаруживала 2,4 log снижения количества микроорганизмов, тогда как композиция, содержащая только L-аланин, обнаруживала 1,5 log снижения.
Природу взаимосвязи между бета-аланином и L-аланином оценивали методом определения синергического действия, описанным выше. Через 2 часа, в присутствии одного бета-аланина наблюдалось 3100000 к.о.е. выживших микроорганизмов, а в присутствии одного L-аланина наблюдалось 520000 к.о.е. Среднее из этих чисел составляет 1810000 к.о.е., где указанное число является предсказанной величиной для комбинации из двух аминокислот. Фактическое к.о.е., наблюдаемое для пары бета-аланин/L-аланин, составляет 70000 к.о.е., где указанная величина представляет собой лишь 3,9% от предсказанной величины, что является показателем того, что аминокислоты в этой комбинации действуют синергически.
Пример 9
Влияние комбинации, состоящей из двух аминокислот, и отдельных аминокислот на антимикробную активность миелопероксидазной системы, направленную на уничтожение грамотрицательных, грамположительных и дрожжевых микроорганизмов в присутствии крови
Эффект комбинации, состоящей из двух аминокислот, а именно глицина и валина, а также бета-аланина, взятого отдельно, как потенциальных агентов, усиливающих антимикробную активность МРО, направленную против Pseudomonas aeruginosa, Staphylococcus aureus и Candida albicans, в присутствии крови, оценивали в соответствии с процедурой, описаннй в примере 2. Каждый микроорганизм тестировали в присутствии одной низкой концентрации MPO (25 мкг/мл или 9,4 ед./мл) и глюкозооксидазы (8,3 ед./мл). Каждый из двух аминокислотных активаторов добавляли в конечной концентрации 2,5 мкмоль/мл, а отдельную аминокислоту бета-аланин тестировали в одной концентрации 5 мкмоль/мл. Для сравнения оценивали влияние композиций, не содержащих аминокислот, на миелопероксидазную антимикробную активность, направленную против указанных микроорганизмов. Результаты приводятся в таблице 22.

Как показано в таблице 22, комбинация, содержащая две аминокислоты L-валин и глицин, и аналогичная комбинация с добавлением одной аминокислоты бета-аланина способствовали значительному усилению антимикробной активности MPO-системы в присутствии крови, направленной против всех тестируемых микроорганизмов, по сравнению с активностью МРО-системы в отсутствие аминокислот. В случае P. aeruginosa усиливающее действие комбинации L-валин/глицин достигало 2,1 log за 60 минут, а добавление 5 мМ одного бета-аланина к MPO-системе приводило к повышению антибактериальной активности на 4,6 log за 60 минут. В случае C. albicans повышение антимикробной активности, достигаемое в присутствии L-валина/глицина, составляло 1,2 log, а в присутствии бета-аланина, - 1,9 log. Наиболее значительное увеличение активности против S. aureus можно было наблюдать после добавления бета-аланина в MPO-систему, причем такое повышение активности достигало 6,8 log за 30 минут. Кроме того, как можно видеть из таблицы 21, МРО с одной аминокислотой бета-аланином и с комбинацией из двух аминокислот L-валина и глицина при более низких концентрациях аминокислот и МРО давали полное уничтожение S. aureus за 60 минут.
Пример 10
Данные in vivo теста MPO-композиций, содержащих различные комбинации аминокислот и добавок
Для тестирования эффективности различных комбинаций аминокислот на повышение антимикробной активности МРО-системы использовали in vivo-модель, полученную следующим образом.
Во всех исследованиях использовали взрослых самцов крыс Sprague-Dawley. Крыс анестезировали, шерсть на спинке каждого животного удаляли электрической машинкой для стрижки шерсти, и кожу подготавливали к эксперименту. На спинку каждой крысы наносили две раны. Шерсть на спинке каждого животного удаляли электрической машинкой для стрижки шерсти, и перед подготовкой кожи животных к эксперименту, животных анестезировали. Раны, проходящие на всю глубину кожи, создавали путем подтяжки рыхлой кожи и вырезания эллиптических областей ножницами с использованием стерильных инструментов, обнажая тем самым фасции.
К каждому участку, подвергаемому обработке, прикрепляли открытый полистироловый цилиндр (диаметром 2,5 см) с помощью цемента QuickTite® (Loctite Corp.). Каждый цилиндр создавал водонепроницаемую тест-камеру, основанием которого была рана. Затем обнаженную фасцию инокулировали 200 мкл смеси, содержащей примерно 107 к.о.е. S. aureus. Через пятнадцать минут инокулированную фасцию обрабатывали. Если было желательно увеличить уровень биологического заражения, то в это время добавляли 30 мкл цельной свежей крысиной крови. Затем в нужный участок добавляли 800 мкл тестируемой композиции до полного объема 1,0 мл на тестируемый участок. Тестируемые композиции содержали миелопероксидазу, различные аминокислоты, глюкозооксидазу и глюкозу в количествах, указанных в нижеследующих таблицах. Контрольные участки не содержали p-MPO и были обработаны 800 мкл 0,9% стерильного физиологического раствора или буфера. Оба участка у одной крысы обрабатывали аналогичным способом.
После предварительной обработки композицией p-MPO в течение определенного периода времени на каждый участок обработки наносили каталазу в большом избытке для предотвращения дальнейшей антимикробной активности. Это способствовало разложению любого остаточного пероксида водорода и/или прекращению его последующего образования под действием данной композиции.
Жидкости, оставшиеся в цилиндре, отдельно удаляли и подлежащие фасции асептически вырезали, взвешивали и гомогенизировали. Число выживших бактерий в жидких образцах и в вырезанных тканях оценивали путем количественного анализа культуры. Результаты выражали как log снижения количества бактерий по сравнению с исходным инокулятом.
В соответствии с вышеописанными процедурами in vivo эффективность ингибирования S. aureus (инокулята, содержащего 2Ч107 к.о.е. S. aureus) после 5-минутной обработки тестируемой композицией согласно изобретению, обладающей повышенной миелопероксидазной активностью и содержащей аминокислоты L-аланин, L-пролин и глицин, определяли в присутствии 3% крови и в отсутствие крови как среднее из 8 повторностей. Результаты представлены в таблице 23.

Как показано в таблице 23, тестируемая композиция, обладающая повышенной миелопероксидазной активностью и содержащая аминокислоты, имела одни и те же свойства в присутствии и в отсутствие добавляемой крови после обработки в течение 5 минут.
В соответствии с вышеописанной процедурой, проводимой in vivo влияние концентрации глюкозы на свойства тестируемых композиций, содержащих различные концентрации L-аланина, L-пролина и глицина, определяли с использованием инокулята, содержащего 2×107 к.о.е. S. aureus, как указывают данные, представленные в таблице 24 как среднее для 6 повторностей.

Как указывалось выше, различия, наблюдаемые между средними значениями активности, не являются статистически различными для тестируемых условий.
После проведения вышеописанных процедур определяли in vivo влияние различных концентраций L-аланина, L-пролина и глицина на антимикробную активность тестируемых композиций, содержащих 200 или 400 мкг/мл миелопероксидазы в присутствии 6% крови или в отсутствие крови. Результаты приводятся в таблице 25.

После проведения вышеописанных процедур определяли in vivo влияние различных концентраций L-аланина, L-пролина и глицина на антимикробную активность тестируемых композиций, содержащих 200 или 400 мкг/мл миелопероксидазы, при проведении масштабирования этих концентраций, по сравнению со случаем, когда такое масштабирование не проводилось. В этом контексте термин «масштабирование» означает пропорциональное изменение концентрации аминокислот в соответствии с концентрацией МРО. Результаты приводятся в таблице 26.
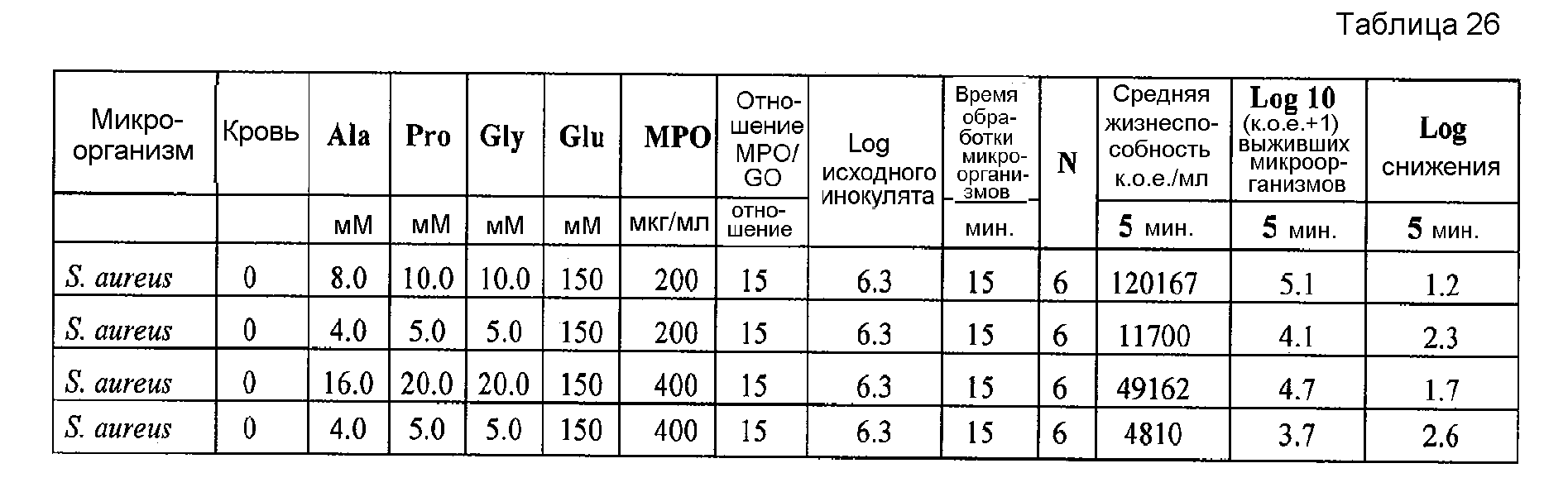
Как показано в таблице 26, композиция, содержащая самую низкую общую концентрацию аминокислот (4 мМ L-аланин, 4 мМ L-пролин и 5 мМ глицин), обладала наилучшими свойствами при концентрациях миелопероксидазы 200 и 400 мкг/мл.
После проведения вышеописанных процедур определяли in vivo эффект тестируемых композиций, содержащих L-пролин, L-лизин и глицин, или L-пролин и глицин, в результате чего было обнаружено, что указанные композиции являются в высокой степени эффективными в отношении ингибирования S. aureus, как показано в таблице 27.

Как показано в таблице 27, тестируемые композиции, содержащие либо L-пролин, L-лизин и глицин, либо L-пролин и глицин, усиливают эффективность миелопероксидазной антимикробной системы. Эти две композиции при 200 мкг/мл MPO и в отношении МРО:GO 15:1 способствовали полному уничтожению микроорганизмов за 30 минут. Такие композиции были гораздо более эффективными, чем композиции, имеющие двойную концентрацию MPO и 20-кратную концентрацию GO, в присутствии наиболее эффективной добавки, а именно, 2% тритона X-200. См. ниже таблицу 28.
После проведения вышеописанных процедур определяли in vivo эффект тестируемой композиции, содержащей одну аминокислоту L-аланин, 2% тритон X-200, MPO:GO в отношении 1,5:1. Результаты приводятся в таблице 28.

Композиция, содержащая 2% тритон X-200, действовала также как и композиция, содержащая указанные компоненты в присутствии и в отсутствие 3% крови, однако в присутствии одной аминокислоты L-аланина, тестируемая композиция оказалась значительно менее эффективной в отношении ингибирования S. aureus, чем композиции, содержащие две или более аминокислот, как показано выше. Эти результаты были подтверждены ниже в таблицах 28 и 29.
После проведения вышеописанных процедур определяли in vivo эффект тестируемой композиции, содержащей одну аминокислоту L-аланин, 1% тритон X-200, МРО и GO в отношении 3:1 и глюкозу в концентрации 90 мМ. Результаты, представленные как среднее из 6 повторностей, приводятся в таблице 29.
После проведения вышеописанных процедур определяли in vivo эффект тестируемой композиции, содержащей одну аминокислоту L-аланин и МРО и GO в отношении 3:1 для трех концентраций МРО. Результаты, представленные как среднее для 4 повторностей, приводятся в таблице 30.

Такая композиция давала максимальный 3,8 log снижения через 30 минут при 400 мкг/мл. В отсутствие каких-либо добавок, эффективность данной тестируемой композиции, содержащей одну аминокислоту L-аланин, заметно ограничивалась в присутствии биологических интерферирующих веществ.
Зависимый от времени in vivo-эффект тестируемой композиции, содержащей L-пролин, глицин и L-аланин в отношении MPO:GO=15:1 определяли для трех концентраций MPO. Результаты исследований по уничтожению микроорганизмов в зависимости от времени представлены на фигуре 4. Эти данные представлены как log10 снижения к.о.е./мл в определенные моменты времени. Раствор с повышенной МРО-активностью обладал бактерицидной активностью против S. aureus при всех тестируемых концентрациях. В этом тесте содержание к.о.е. в инокуляте повышалось до 107. Результаты, представленные как среднее из 6 повторностей, приводятся в таблице 31.

Как показано в таблице 31, композиция, содержащая активирующие аминокислоты, давала 3,1 log снижения через 5 минут, если она содержала в 8 раз меньшее количество MPO (50 мкг/мл), чем композиция, содержащая одну аминокислоту L-аланин в концентрации 400 мкг/мл, как видно из таблицы 30. Композиция, содержащая активирующие аминокислоты, обладала более быстрой и высокой антимикробной активностью in vivo.
Пример 11
Данные in vitro тестирования композиций MPO, содержащих различные комбинации аминокислот и добавок
Бактериальные штаммы
Микроорганизмы (530 штаммов), отобранные для определения спектра активности репрезентативного варианта композиции согласно изобретению, обладающей повышенной активностью («раствор с повышенной MPO-активностью»), в тесте MIC и MBC, включали 140 стафилококков (из которых 70 были резистентными к оксациллину, 5 микроорганизмов были резистентными к ванкомицину - промежуточному соединению, а 4 микроорганизма были позитивными по лейкоцидину Panton Valentine [PVL]), 95 β-гемолитических штаммов стрептококков, 55 энтерококков (33 штамма, восприимчивых к ванкомицину, 22 штамма, резистентных к ванкомицину), 148 штаммов Enterobacteriaceae (из них 51 штамм был резистентным к цефтазидиму) и 92 микроорганизма, не относящихся к виду Enterobacteriaceae (из которых 54 штамма были резистентными к цефтазидиму). Все клинические изоляты были получены из коллекции культур Противоинфекционных служб Eurofins Medinet (Herndon, Virginia, U.S.A.) и представляют различные географические регионы. Эти изоляты были изначально выделены из клинических образцов и идентифицированы стандартными микробиологическими методами (более подробно см. ниже таблицу 33). Микроорганизмы Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923, S. aureus ATCC 29213, Pseudomonas aeruginosa ATCC 27853 и Enterococcus faecalis ATCC 29212 были использованы в качестве контроля качества для раствора с повышенной МРО-активностью и в качестве сравнительных агентов для проверки надежности модифицированного метода микроразведения в бульоне, осуществляемого в Институте по клиническим и лабораторным стандартам (CLSI, официальное название NCCLS).
Антимикробные средства.
Раствор с повышенной МРО-активностью поставлялся в виде двух отдельных водных растворов, содержащихся в различных сосудах, маркированных как Концентрат и Разбавитель. Концентрат содержал p-MPO, глюкозооксидазу (GO) и аминокислоты в водном препарате-носителе, состоящем из хлорида натрия, полисорбата-80 (твин-80) в фосфатно-натриевом буфере в воде для инъекций. Разбавитель содержал декстрозу (глюкозу) в таком же водном препарате-носителе, как и Концентрат. Концентрат и Разбавитель смешивали и получали лекарственный продукт, а именно раствор с повышенной МРО-активностью.
Количественный состав раствора с повышенной МРО-активностью представлен в таблице 32 в трех концентрациях МРО. Как можно видеть из этой таблицы, глюкозооксидазная активность и концентрации аминокислот прямо пропорциональны концентрации МРО. Концентрацию декстрозы поддерживали в пределах 280-336 мМ. Остальные ингредиенты поддерживали при постоянных концентрациях.
Раствор с повышенной MPO-активностью состоял из двух водных растворов, обозначенных как раствор Концентрат и раствор Разбавитель, которые смешивали перед их применением. Раствор Концентрат содержал MPO, GO, хлорид натрия и специфические агенты, повышающие антимикробную активность, в водной композиции-носителе. Раствор Разбавитель содержал глюкозу (декстрозу) в такой же водной композиции-носителе, как и раствор Концентрат. Растворы Концентрат и Разбавитель смешивали в различных отношениях непосредственно перед применением, в результате чего получали лекарственный продукт, то есть раствор с повышенной МРО-активностью, в нужной концентрации. Концентрацию раствора с повышенной МРО-активностью выражали в микрограммах МРО на миллилитр (мкг/мл), а также в гваяколовых единицах MPO-активности на миллилитр (GU/мл). Преобразование мкг в GU MPO осуществляли из расчета 0,375 GU/мкг MPO. Агентами контроля качества являются цефазолин и гентамицин, поставляемые фирмой Sigma Chemical (St. Louis, Missouri, U.S.A.), а выбранными сравнительными агентами являются гентамицин (Sigma Chemical) и мупироцин-литий от GlaxoSmithKline, Inc. (Philadelphia, Pennsylvania, U.S.A.). Все маточные растворы получали непосредственно перед тестированием. Концентрация составляла 0,004-8 мкг/мл для раствора с повышенной МРО-активностью, 0,06-64 мкг/мл для цефазолина, 0,25-16 мкг/мл для гентамицина и 0,12-16 мкг/мл для мупироцина. Антимикробными средствами, используемыми в исследованиях по взаимодействию лекарственных средств, являются цефазолин, цефтриаксон, цефтазидим, ципрофлоксацин, доксициклин, гентамицин, имипенем и ванкомицин от GlaxoSmithKline, Inc. (Philadelphia, Pennsylvania, U.S.A.).
Тест на чувствительность антимикробных средств.
Микроразведение в бульоне и методы определения бактерицидной активности осуществляли в соответствии с процедурами, рекомендованными Институтом клинических и лабораторных стандартов, CLSI (Clinical and Laboratory Standards Institute, "Methods for Determining Bactericidal Activity of Antimicrobial Agents; Approved Guideline, CLSI document M26-A, CLSI, Wayne, Pennsylvania, U.S.A., September 1999; Clinical and Laboratory Standards Institute, Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically; Approved Standard, 7th ed., CLSI document M7-A7, CLSI, Wayne, Pennsylvania, U.S.A. January 2006). Стандартный метод микроразведения в бульоне был модифицирован для достижения быстрого in vitro действия раствора с повышенной MPO-активностью, как описано ниже. Антимикробное средство и раствор Концентрат разводили в бульоне Мюллера-Хинтона, доведенном до нужного рН катионами с двойной ионной силой (CAMHB), и закапывали в планшеты для микроразведения. Все β-гемолитические стрептококки тестировали в CAMHB с двойной ионной силой, в который было добавлено 5% лошадиной крови, подвергнутой лизису. Изоляты получали путем суспендирования нескольких колоний (от четырех до шести), взятых из ночной культуры, на соевом агаре с триптиказой (TSA) с 5% овечьей крови в стерильном физиологическом растворе при плотности, доведенной до значения 0,5 в соответствии со стандартом МакФэланда (~108 к.о.е./мл). Затем стандартизированные бактериальные суспензии разводили в растворе Разбавитель с двойной ионной силой так, чтобы приблизительно 5Ч105 к.о.е./мл были смешаны с серийными разведениями лекарственного средства. Добавление раствора Разбавитель к раствору Концентрат приводит к активации ферментной системы, которая, в свою очередь, начинает действовать с большей скоростью. Планшеты для микроразведения инкубировали на воздухе при 35°C в течение 18-24 часов. MIC определяли путем оценки наименьшей концентрации антимикробного агента, который полностью ингибировал рост микроорганизмов.
Минимальные бактерицидные концентрации (MBC) сначала определяли модифицированным методом микроразведения в бульоне, описанным выше для MIC раствора с повышенной MPO-активностью. Из планшета для микроразведения, из последних лунок, содержащих лекарственное средство и обнаруживающих видимый рост, а затем из каждой прозрачной лунки брали образцы. 10 мкл образца на лунку высевали на TSA с 5% овечьей кровью и инкубировали на воздухе в течение 24 часов, а затем оценивали на рост и число колоний. МВС выражали как наименьшую антимикробную концентрацию, которая продемонстрировала ≥99,9% снижение колониеобразующих единиц по сравнению с исходным размером инокулята.
Параметры контроля качества
Интервалы MIC были установлены для раствора с повышенной MPO-активностью путем тестирования свыше 20 репликатов одной партии раствора с повышенной МРО-активностью, направленной против S. aureus ATCC 29213 и E. coli ATCC 25922. Затем параметры контроля качества определяли для раствора с повышенной MPO-активностью путем тестирования трех партий раствора Концентрат, используемого для получения конечной композиции раствора с повышенной MPO-активностью. Тестирование осуществляли в дубликате на активность против S. aureus ATCC 29213 и E. coli ATCC 25922. Эффекты модификации стандартного теста микроразведения в бульоне также оценивали с использованием антибиотиков с известными пределами контроля качества для определения надежности метода микроразведения в бульоне CLSI.
Результаты представлены в таблице 33, где композиция раствора с повышенной MPO-активностью обозначена «Е-МРО».
Модификация метода микроразведения в бульоне CLSI для тестирования раствора с повышенной МРО-активностью позволяет осуществлять эффективную процедуру характеризации продукта и определения спектра активности. Результаты тестирования раствора с повышенной МРО-активностью и выбранные наиболее эффективные сравнительные лекарственные средства против 530 бактериальных клинических изолятов, представленных в таблице 33, продемонстрировали, что раствор с повышенной МРО-активностью обладает высокой активностью широкого спектра против тестируемых грамположительных и грамотрицательных бактерий. В случае энтерококков MIC раствора с повышенной MPO-активностью, при которой ингибировались 50% и 90% изолятов (величины MIC50 и MIC90), составляли 0,5 мкг/мл для E.faecalis и 0,12 мкг/мл для E.faecium. Каких-либо различий в эффективности раствора с повышенной МРО-активностью, направленной против энтерококков, восприимчивых к ванкомицину, или энтерококков, резистентных к ванкомицину (VRE), не наблюдалось. Исходя из MIC90S было обнаружено, что раствор с повышенной MPO-активностью был в 64 раза более активным против E.faecalis, чем мупироцин. Что касается грамположительных кокков, раствор с повышенной МРО-активностью был наиболее эффективным против стафилококков. Все MIC для S. aureus и S. epidermidis, включая MRSA и MRSE, составляли ≤0,06 мкг/мл, причем MIC90 составлял 0,0 мкг/мл. Эффективность раствора с повышенной MPO-активностью была сравнимой для штаммов, резистентных к оксациллину, и штаммов, восприимчивых к оксациллину. Раствор с повышенной MPO-активностью имел высокую активность против PVL-позитивных штаммов и штаммов VISA/VRSA, обнаруживающих активность, эквивалентную активности дикого типа. Величины MIC для PVL-позитивных изолятов составляли в пределах величин всех тестируемых штаммов S. aureus. Среди стрептококков раствор с повышенной МРО-активностью был в высокой степени активным даже в присутствии CAMHB, в который было добавлено 5% лошадиной крови, подвергнутой лизису. MIC90 для S. agalactiae и S. pyogenes составляла 0,5 мкг/мл. Для стрептококков группы C, F и G, MIC составляли ≤1 мкг/мл, а интервал значений MIC составлял 0,25-1 мкг/мл. За исключением S. agalactiae и S. pyogenes раствор с повышенной МРО-активностью обнаруживал более высокую активность in vitro, чем мупироцин, на что указывала MIC90. Интервалы MIC для мупироцина, направленного против E.faecalis, S. aureus и S. epidermidis, простирались до >32 мкг/мл.
Вообще говоря, раствор с повышенной MPO-активностью обладал высокой степенью активности против видов Enterobacteriaceae (таблица 33), где MIC90 составляла 0,25 мкг/мл, а MIC составляла в пределах от 0,03 до 0,25 мкг/мл. Для грамотрицательных неферментативных микроорганизмов, MIC составляли <0,12 мкг/мл и варьировались в узком интервале активности (≤0,004-0,12 мкг/мл). Раствор с повышенной MPO-активностью обладал превосходной активностью против микроорганизмов P. aeruginosa (MIC90, 0,06 мкг/мл) и видов Acinetobacter (MIC90, 0,12 мкг/мл), которые часто трудно поддаются обработке. Каких-либо различий в активностях раствора с повышенной MPO-активностью, направленной против штаммов, восприимчивых к цефтазидиму, и штаммов, резистентных к цефтазидиму, не наблюдалось. Исходя из MIC90, было обнаружено, что в отношении всех тестируемых грамотрицательных микроорганизмов, раствор с повышенной MPO-активностью был в 32 - > 256 раз более активным, чем гентамицин.
Результаты тестирования на MIC и MBC клинических изолятов патогенов, обычно ассоциированных с инфицированием кожи и кожной структуры, систематизированы в таблице 34.
Сильная бактерицидная активность раствора с повышенной МРО-активностью была подтверждена путем вычисления интервала MBC (0,015-2 мкг/мл). Раствор с повышенной МРО-активностью был наиболее эффективным против всех изолятов S. aureus с идентичными величинами MIC и MBC (MIC50 и MBC50=0,015 мкг/мл; MIC90 и MBC90=0,03 мкг/мл).
Методы на основе агара были не подходящими для сравнения из-за потенциальных интерферирующих свойств среды. Однако был оценен эффект изменения стандартизированных условий тестирования восприимчивости в бульоне в отношении MIC цефазолина, гентамицина и мупироцина, и этот эффект подтверждали путем сравнения полученных результатов с результатами, полученными стандартным методом микроразведения в бульоне CLSI. In vitro тест-параметры модифицированных и эталонных методов определения MIC являются аналогичными в отношении среды (CAMHB), pH (7,2), конечного инокулята (5Ч105 к.о.е./мл) и условий инкубирования (35°C, воздух). Изменение способа приготовления инокулята в растворе Разбавитель указывало на то, что способ приготовления инокулята не оказывал значительного влияния на ожидаемые результаты MIC для сравнительных антибиотиков (Clinical Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; seventeenth informational supplement. CLSI document М100-S17. Wayne, Pennsylvania, U.S.A., January 2007). MIC для цефазолина и мупироцина для S. aureus ATCC 29213 и MIC для цефазолина и гентамицина для E. coli ATCC 25922 входили в ранее опубликованные интервалы контроля качества (документ М100-S17 CLSI, см. выше). Интервал контроля качества, определенный для раствора с повышенной MPO-активностью против S. aureus ATCC 29212 и E. coli ATCC 25922, составлял 0,010-0,03 мкг/мл и 0,15-0,5 мкг/мл соответственно. Для этих микроорганизмов проводили тесты с использованием свыше 20 репликатов, и все полученные результаты были в пределах установленного интервала контроля качества. Результаты тестирования трех партий раствора Концентрат в дубликатах показали, что все значения MIC были в пределах установленного интервала контроля качества.
Как указывалось выше, сравниваемая активность in vitro раствора с повышенной MPO-активностью была эквивалентна или превышала активность мупироцина, действующего против грамположительных микроорганизмов и была в несколько раз выше, чем активность гентамицина, действующего против грамотрицательных микроорганизмов. Каких-либо различий в восприимчивости раствора с повышенной MPO-активностью как против резистентных, так и восприимчивывх штаммов, не наблюдалось. Большое значение имеет тот факт, что исследования MBC показали, что раствор с повышенной MPO-активностью обладает бактерицидным действием, направленным против микроорганизмов S. aureus и S. pyogenes, то есть двух из наиболее распространенных патогенов, ассоциированных с тяжелыми кожными инфекциями.
Исследования по зависимости бактерицидного действия от времени
Бактерицидное действие раствора с повышенной MPO-активностью оценивали двумя методами: методом суспендирования-нейтрализации (Tortorano, A.M., et al., and the EBGA Network 2005. In vitro testing of fungicidal activity of biocides against Aspergillus fumigatus. J. Med. Microbiol. 54:955-951) и методом адаптации анализа на зависимое от времени уничтожение бактерий путем микроразведения CLSI (Clinical and Laboratory Standards Institute. Methods for determining bactericidal activity of antimicrobial agents; approved guideline; CLSI document M26-A, CLSI, Wayne, Pennsylvania, U.S.A., September 1999). Метод суспендирования-нейтрализации применяли для оценки скорости действия бактерицидной активности раствора с повышенной MPO-активностью и влияния на его биологическую активность в присутствии крови, используемой в качестве примера интерферирующего материала. Метод CLSI был также применен для оценки антимикробной активности раствора с повышенной MPO-активностью путем адаптации стандартизированного теста.
Тестируемыми микроорганизмами, используемыми в исследованиях на зависимое от времени уничтожение бактерий методом суспендирования-нейтрализации, были S. aureus ATCC 6538 и E. coli ATCC 25922. Бактериальные суспензии получали методом с применением шейкерных колб до достижения фазы роста от поздней логарифмической фазы до ранней стационарной фазы. 1,0 мл объема культуры осаждали и ресуспендировали в стерильном физиологическом растворе до ~109 к.о.е./мл. Анализ in vitro проводили в стерильных 20-миллилитровых стеклянных сцинтилляционных сосудах. Сосуды для проведения реакции зависимого от времени уничтожения бактерий приготавливали так, чтобы они содержали 1,0 мл соответствующего количества раствора Разбавитель +15 мл инокулята с последующим добавлением раствора Концентрат. Конечная суспензия содержала ~107 к.о.е./мл, и фактическое число колоний подтверждали путем серийных разведений. Были протестированы низкие концентрации раствора с повышенной MPO-активностью и суспензией микроорганизмов в конечной концентрации 0,1, 0,3, 1, 3, 6 и 9 мкг/мл (см. фигуры 1А и 1В). Сосуды для обработки инкубировали при комнатной температуре. Ферментативную реакцию завершали непосредственно перед количественной оценкой бактерий путем добавления 100 мкл стерильного 1% раствора каталазы через 1, 2, 5, 15, 30, 60 и 120 минут. Контрольную культуру, в которую не добавляли раствор Концентрат, инкубировали в течение 30 минут при комнатной температуре и проводили количественную оценку культур. 100 мкл образца брали из каждого реакционного сосуда через определенные периоды времени и получали серийные разведения в стерильном физиологическом растворе. Каждое разведение в объеме 100 мкл наносили на TSA в дубликате в планшеты с 5% овечьей кровью и распределяли по поверхности стерильной инокулирующей петли. После инкубирования в течение ночи при 35°C, колонии подсчитывали и вычисляли число жизнеспособных колоний. Бактерицидное действие раствора с повышенной MPO-активностью определяли как снижение числа жизнеспособных колоний по отношению к росту контроля, составляющего более 99,9% или 3log10 к.о.е./мл.
Для оценки возможного воздействия интерферирующего материала на активность раствора с повышенной MPO-активностью проводили исследования на зависимое от времени уничтожение бактерий в присутствии свежей цельной человеческой и крысиной крови, собранной в пробирки с гепарином на день проведения эксперимента, с применением метода суспендирования-нейтрализации, описанного выше. Раствор с повышенной MPO-активностью при концентрации 50, 100 и 200 мкг/мл тестировали против ~107 к.о.е./мл инокулята S. aureus ATCC 6538 и P. aeruginosa ATCC 27317 в присутствии 3% человеческой крови, и бактерицидная активность нейтрализовалась через 5, 15, 30 и 60 минут (см. фигуры 2A и 2B). Раствор с повышенной MPO-активностью в концентрации 400, 800 и 1600 мкг/мл также тестировали на активность против ~107 к.о.е./мл инокулята S. aureus ATCC 6538 в присутствии 6, 12 и 24% крысиной крови, и антимикробная активность нейтрализовалась через 2, 5 и 15 минут, как описано выше. Для каждого условия тестирования получали 2 или 3 репликата.
Тестируемыми микроорганизмами, используемыми в исследованиях по зависимому от времени уничтожению бактерий, проводимых модифицированным методом CLSI, являлись S. aureus ATCC 29213, E.faecalis ATCC 29212, E. coli ATCC 25922 и P. aeruginosa ATCC 27853. Несколько колоний (от четырех до шести), выращенных на TSA в присутствии ночной 5% овечьей крови, суспендировали в 3 мл деионизованной воды, и суспензии доводили до значения 0,5 в соответствии со стандартом Макфэланда (~1×108 к.о.е./мл). Затем эту суспензию разводили 1:10 в предварительно нагретом CAMHB и инкубировали в течение 1-4 часа в шейкерном инкубаторе при 37°С. После того как культура достигала своей логарифмической фазы роста, а мутность имела величину, приблизительно равную величине 0,5 в соответствии со стандартом Макфэланда, брали 100 мкл культуры и добавляли к 10 мл раствора Разбавитель до получения конечной концентрации ~5×106 к.о.е./мл. Эта суспензия представляла собой инокулят для проведения исследований на зависимое от времени уничтожение бактерий. Лунки для проведения реакции зависимого от времени уничтожения бактерий приготавливали так, чтобы они содержали 100 мкл раствора Концентрат, приготовленного в CAMHB, и инокулят (50 мкл раствора Концентрат и 50 мкл инокулята, приготовленного в растворе Разбавитель). Конечные концентрации MPO в растворе Концентрат представляли собой 4-кратные разведения с наивысшей концентрацией - 0, 0,06, 0,25, 1, 4, 16, 64 и 256 мкг/мл. Лунка для идентичной реакции, содержащая бульон и инокулят, но не содержащая раствор Концентрат, представляла собой лунку с контрольной культурой роста. Конечная концентрация бактериальных клеток составляла ~5×105 к.о.е./мл. Планшеты для микроразведения инкубировали при 35°C на воздухе, и в каждую лунку для зависимого от времени уничтожения бактерий добавляли 10 мкл 1% раствора каталазы через 0, 2, 5, 15, 30 и 60 минут и через 4-24 часа для нейтрализации антимикробного действия раствора с повышенной МРО-активностью. Для количественной оценки получали серийные образцы. Из каждой лунки в определенные периоды времени брали 100 мкл образца, и приготавливали серийные разведения в стерильном физиологическом растворе. 100 мкл-объем каждого разведения наносили на TSA в дубликате в планшеты с 5% овечьей кровью и распределяли по поверхности стерильной инокулирующей петлей. Планшеты на период времени 0 представляли собой чистые планшеты. После инкубирования в течение ночи при 35°C, колонии подсчитывали вручную и определяли число жизнеспособных колоний. Бактерицидную активность определяли как 99,9% или 3 log10 к.о.е./мл снижения числа колоний по сравнению с исходным инокулятом.
Результаты исследований на зависимое от времени уничтожение бактерий, проводимых методом суспендирования-нейтрализации, представлены на фигуре 1. Данные выражали как log10 снижения к.о.е. по отношению к исходному инокуляту в предварительно определенные моменты времени с использованием возрастающих концентраций тестируемого раствора с повышенной MPO-активностью. Раствор с повышенной MPO-активностью обладал очень быстрой бактерицидной активностью, направленной против S. aureus и E. coli. Скорость уничтожения бактерий была более высокой при более высоких концентрациях раствора с повышенной MPO-активностью, а степень уничтожения возрастала с увеличением времени обработки. В случае S. aureus, раствор с повышенной MPO-активностью давал бактерицидный эффект, выражающийся в более чем 3 log10 снижения к.о.е. в исходном инокуляте (7,2 log10 к.о.е./мл) после 2-минутной обработки 6 и 9 мкг/мл. После 5-минутной обработки концентрациями 3, 6 и 9 мкг/мл какого-либо детектируемого роста микроорганизмов не наблюдалось, а при концентрации 1 мкг/мл через 5 минут было достигнуто более чем 3 log10 снижения к.о.е., причем после 15-минутной обработки детектируемого роста не наблюдалось. После 30- и 120-минутной обработки раствором с повышенной MPO-активностью при 0,3 и 0,1 мкг/мл, соответственно, детектируемого роста не наблюдалось. Раствор с повышенной MPO-активностью давал аналогичный зависимый от времени эффект уничтожения бактерий E.coli. После 2-минутной обработки раствором с повышенной MPO-активностью при концентрациях, равных или превышающих 3 мкг/мл, какого-либо детектируемого роста не наблюдалось. После 2-минутной обработки раствором с повышенной MPO-активностью в концентрации 1 мкг/мл достгалось более чем 3 log10 снижения к.о.е. в исходном инокуляте (6,8 log10 к.о.е./мл). После 5-минутной обработки какого-либо детектируемого роста при 1,0 мкг/мл не наблюдалось. При более низких концентрациях раствора с повышенной MPO-активностью, то есть при 0,3 и 0,1 мкг/мл, после 15- и 60-минутной обработки, соответственно, какого-либо детектируемого роста не наблюдалось.
Антимикробная активность раствора с повышенной MPO-активностью в зависимости от времени и концентрации еще сохранялась в присутствии 3% цельной человеческой или крысиной крови. Источники крови не имели существенного значения. Раствор с повышенной MPO-активностью в концентрации 200 мкг/мл, то есть в наивысшей концентрации MPO, тестируемой в присутствии 3% человеческой крови, не давал какого-либо детектируемого уровня выживших микроорганизмов S. aureus и P. aeruginosa в исходном инокуляте, то есть давал снижение 7,15 log10 к.о.е./мл за менее чем 5 минут. С использованием раствора с повышенной MPO-активностью при концентрации 100 мкг/мл через 5 минут достигалось более чем 4 log10 снижения и 5 log10 снижения к.о.е. P. aeruginosa и S. aureus соответственно. При концентрации 50 мкг/мл, то есть самой низкой концентрации тестируемого раствора с повышенной MPO-активностью, бактерицидная активность наблюдалась во все периоды времени для обоих микроорганизмов (фигура 2).
Интерферирующее действие крови на антимикробную активность раствора с повышенной MPO-активностью прекращалось при увеличении концентрации MPO. При концентрациях раствора с повышенной MPO-активностью, составляющих 400 и 800 мкг/мл, достигалось снижение 7,10 log10 к.о.е./мл S. aureus, при этом через 2 минуты в присутствии 6 и 12% крысиной крови, какого-либо детектируемого роста не наблюдалось. В присутствии 24% крысиной крови раствор с повышенной MPO-активностью давал более чем 4 log10 снижения при 400 и 800 мкг/мл и через 2 минуты, при 1600 мкг/мл, какого-либо детектируемого выживания микроорганизмов не наблюдалось.
Результаты исследований уровня уничтожения микроорганизмов в зависимости от времени, проводимых модифицированным методом CLSI путем микроразведений в бульоне, представлены на фигурах 3A-3D. Эти данные выражали как log10 снижения к.о.е./мл в определенные моменты времени. Раствор с повышенной MPO-активностью обнаруживал бактерицидную активность против S. aureus при всех тестируемых концентрациях. Бактерицидную активность раствора с повышенной MPO-активностью против E.coli тестировали при всех концентрациях, кроме 0,06 мкг/мл, которая была в 4 раза ниже, чем ее MIC. Аналогичным образом бактерицидную активность раствора с повышенной MPO-активностью против E.faecalis и P. aeruginosa тестировали при концентрациях выше MIC. MIC для E. faecalis и P. aeruginosa составляли 0,5 и 0,06 мкг/мл, соответственно. Сравнимые профили антимикробной активности наблюдались для всех четырех микроорганизмов, причем скорость уничтожения бактерий была выше при более высоких концентрациях раствора с повышенной MPO-активностью, а степень уничтожения бактерий увеличивалась с увеличением периода времени обработки. При концентрациях раствора с повышенной MPO-активностью, составляющих 256 и 16 мкг/мл, через 30 минут и 4 часа соответственно, какого-либо детектируемого роста всех микроорганизмов не наблюдалось. После 4-часовой обработки раствором с повышенной МРО-активностью более чем 3 log10 снижения достигался при 16 мкг/мл для E. faecalis, при 4,0 мкг/мл для S. aureus и при 1,0 мкг/мл для E.coli и P. aeruginosa. Более быстрая антимикробная активность, наблюдаемая с применением метода суспендирования-нейтрализации, может быть обусловлена действием среды, используемой в методе микроразведения в бульоне CLSI.
Исследования на зависимое от времени уничтожение микроорганизмов, осуществляемые методом суспендирования-нейтрализации, позволили определить скорость и степень бактерицидной активности раствора с повышенной MPO-активностью. В зависимости от концентрации активность уничтожения бактерий была достаточно быстрой, что приводило к 6-7 log10 снижения к.о.е./мл S. aureus или E.coli через 1 минуту. Быстрая бактерицидная активность, наблюдаемая при проведении исследований методами хемилюминесценции, указывающих на продуцирование синглетного кислорода (данные не приводятся), подтвердила эффективность предполагаемого способа действия, в котором основным средством уничтожения бактерий является синглетный кислород. В высокой степени электрофильная природа синглетного кислорода делает его способным окислять области с высокой электронной плотностью в биологических молекулах-мишенях, что приводит к нарушению целостности мембраны и/или к окислительному ингибированию ферментов, необходимых для осуществления метаболической функции. Действие раствора с повышенной МРО-активностью в отношении ингибирования роста или гибели клеток, в отличие от традиционных антибиотиков, не зависит от клеточного метаболизма микрооранизмов.
Поскольку в настоящее время пока не существует стандартизированной методики тестирования раствора с повышенной МРО-активностью в отношении зависимого от времени уничтожения бактерий, то для того, чтобы подтвердить, что антимикробная активность раствора с повышенной МРО-активностью зависит от времени и концентрации и не зависит от тестируемого микроорганизма, были проведены исследования методами суспендирования-нейтрализации и микроразведения в бульоне CLSI. Исследования на зависимое от времени уничтожение бактерий, а именно микроорганизмов, принадлежащих к членам или к роду Candida, Aspergillus, Bacillus и Mycobacterium, проводимые методом суспендирования-нейтрализации, с применением композиций-прототипов, также продемонстрировали зависящую от времени и концентрации антимикробную активность, причем какого-либо детектируемого выживания микроорганизмов в течение всего периода времени не наблюдалось.
Антимикробные взаимодействия
Для тестирования раствора с повышенной MPO-активностью и комбинаций антибиотиков методом титрования по типу «шахматной доски» с применением 96-луночных планшетов для микроразведения использовали три клинических штамма, резистентных ко многим лекарственным средствам (Moody, J., "Synergism Testing: Broth Microdilution Checkerboard and Broth Macrodilution Methods," pp. 5.12.1-5.12.23, in H.D. Isenberg (ed.), Clinical Microbiology Procedures Handbook. 2nd ed., 2004, ASM Press, Washington, DC, U.S.A.). Тестируемыми микроорганизмами являются штамм, резистентный к ванкомицину-промежуточному соединению, а именно штамм S. aureus Mu50 (изолят NARSA NRSl) (Hiramatsu, K.H., et al, "Methicillin-Resistant Staphylococcus aureus Clinical Strain With Reduced Vancomycin Susceptibility," J. Antimicrob. Chemother. 40:135-136, 1997), E.coli (Eurofins 1075701) и P. aeruginosa (Eurofins 1445536). Раствор Концентрат и выбранные антибиотики тестировали методом микроразведения в бульоне с применением CAMHB и делали серийные разведения (двухкратные) как отдельно, так и в комбинации. Каждая лунка в планшете типа «шахматной доски» содержала уникальную комбинацию концентраций двух лекарственных средств, а два ряда содержали одно отдельно взятое лекарственное средство. Интервалы концентраций лекарственных средств для раствора с повышенной MPO-активностью составляли от 0,0005 до 0,5 мкг/мл против S. aureus, от 0,008 до 8 мкг/мл против E.coli и от 0,001 до 1,0 мкг/мл против P. aeruginosa. Интервалы концентраций антибиотиков составляли от одной четвертой или менее до значения, в два раза превышающего соответствующее значение MIC против тестируемого изолята. Инокулят получали в растворе Разбавитель как описано выше, а затем добавляли в каждую лунку планшетов для микроразведения и инкубировали на воздухе при 35°C. MIC каждого антимикробного средства, взятого отдельно и в комбинации друг с другом, определяли как наименьшую(ие) концентрацию(и), причем через 18-24 часов какого-либо визуально детектируемого роста не наблюдалось. Дробные показатели степени ингибирующей концентрации (FICI) были интерпретированы следующим образом: ≤ 0,5, синергическое действие; >0,5-4,0, отсутствие взаимодействия; и >4,0, антагонистическое действие (Odds, F. C., «Synergy, Antagonism, and What the Chequerboard Puts Between Them.» J. Antimicrob. Chemother. 52:1, 2003).
В исследованиях на развитие резистентности, проводимых методом микроразведения в бульоне, результаты MIC для S. aureus, E.faecalis и P. aeruginosa оставались неизменными после пассажа этих бактерий в раствор в субингибирующих концентрациях с повышенной MPO-активностью в течение 21 дня. MIC для трех клинических штаммов E.coli указывали на увеличение числа двойных разведений до ≥4 после лишь одного пассажа в течение периода времени от 1 до 2 дней, и значения MIC оставались высокими в течение 21 дня. Изменение MIC в течение всего периода исследований составляло 0,12-8 мкг/мл, 0,25-8 мкг/мл и 0,5-8 мкг/мл для каждого соответствующего штамма. После трех пассажей каждого из этих штаммов на планшетах с агаром, не содержащих лекарственного средства, MIC после повторного тестирования не была стабильной и снижалась до значения ≥2 для двойных разведений при начальной базовой MIC.
Развитие резистентности.
Скорости многостадийной мутации определяли двумя методами in vitro. Штаммы, которые ежедневно пересевали в субингибирующих концентрациях композиции-прототипа, тестировали методом суспендирования-нейтрализации (Millichap, J., et al., "Selection of Enterococcus faecium Strains With Stable and Unstable Resistance to the Streptogramin RP 59500 Using Stepwise In Vitro Exposure," Diagn. Microbiol. Infect. Dis. 25:15-20, 1996; Tortorano, A. M., et al., "In Vitro Testing of Fungicidal Activity of Biocides Against Aspergillus fumigatus," J. Med. Microbiol. 54:955-951, 2005), а раствор с повышенной МРО-активностью тестировали в панелях микроразведения в бульоне (Silverman, J. A., et al., "Resistance Studies With Daptomycin," Antimicrob. Agents Chemother. 45:1799-1802, 2001). Тремя тесируемыми штаммами, используемыми в методе суспендирования-нейтрализации, являются S. aureus ATCC 6538, P. aeruginosa ATCC 15442 и клинический резистентный к ванкомицину штамм E. faecium. Суспензии микроорганизмов получали, как описано выше, до конечной нужной концентрации 107 к.о.е./мл. Для проведения первичной обработки в каждый сосуд для обработки добавляли 1,0 мл-объем раствора с повышенной MPO-активностью при 0,1 или 0,3 мкг/мл плюс суспензия микроорганизма. Сосуды инкубировали при 37°C в сухой бане. Затем, через 60 минут, в каждый сосуд добавляли 100 мкл каталазы для прекращения реакции, и все содержимое каждого соуда культивировали на среде для выделения. В попытке индуцировать стабильную резистентность микроорганизмы, выжившие на планшете для выделения, обработанном наивысшей концентрацией раствора с повышенной MPO-активностью, после инкубирования в течение 48 часов, использовали для приготовления инокулята для следующего пассажа. Для поддержания роста каждый последующий эксперимент осуществляли с использованием предыдущей наивысшей концентрации раствора с повышенной MPO-активностью и при концентрации, которая в два раза превышала эту концентрацию. Пассажи продолжали в течение последующих 25-30 дней с использованием всех трех штаммов.
Для того чтобы определить, приводит ли повторная обработка микроорганизмов субингибирующими концентрациями раствора с повышенной MPO-активностью к быстрому развитию резистентности, был применен метод серийных пассажей в планшетах для микроразведения (Silverman, J. A., et al., "Resistance Studies With Daptomycin," Antimicrob. Agents Chemother. 45:1799-1802, 2001). Десять тестируемых штаммов включали S. aureus (ATCC 29213, Eurofins 1288199), E.faecalis (ATCC 29212, ATCC 51299), E.coli (ATCC 25922, Eurofins 1075701, Eurofins 1337451, Eurofins 1337019) и P. aeruginosa (ATCC 27853, Eurofins 1077561). Базовые MIC для раствора с повышенной MPO-активностью определяли, как описано выше. Инокуляты для последующих MIC-тестов получали из лунки, содержащей наивысшую концентрацию раствора с повышенной MPO-активностью, что способствовало росту микроорганизмов. Свежую панель, содержащую раствор Концентрат, серийно разведенный в CAMHB, подвергали повторной инокуляции новой суспензией, полученной в растворе Разбавитель. Пассажи продолжали еще 21 день, и после каждого серийного пассажа определяли MIC раствора с повышенной MPO-активностью. Затем, если MIC повышались, то исследования на стабильность осуществляли путем проведения трех серийных пассажей на планшетах с агаром, не содержащих лекарственного средства (TSA), и во время этих пассажей снова определяли MIC.
В исследованиях на развитие резистентности, проводимых методом микроразведения в бульоне, результаты MIC для S. aureus, E.faecalis и P. aeruginosa оставались неизменными после пассажа этих бактерий в растворе в субингибирующих концентрациях с повышенной MPO-активностью в течение 21 дня. MIC для трех клинических штаммов E.coli обнаруживали увеличение до ≥ 4 для двойных разведений после лишь одного пассажа в течение периода времени от 1 до 2 дней, и значения MIC оставались высокими в течение 21 дня. Изменение MIC в течение всего периода исследований составляло 0,12-8 мкг/мл, 0,25-8 мкг/мл и 0,5-8 мкг/мл для каждого соответствующего штамма. После трех пассажей каждого из этих штаммов на планшетах с агаром, не содержащих лекарственного средства, MIC после повторного тестирования не была стабильной и снижалась до значения ≤ 2 для двойных разведений при начальной базовой MIC.
Исследования на развитие резистентности показали, что раствор с повышенной MPO-активностью и аналогичная композиция-прототип не позволяли проводить отбор на резистентность S. aureus, Enterococcus sp., P. aeruginosa и E.coli. Хотя три клинических штамма E.coli обнаруживали повышенные MIC при обработке раствором с повышенной MPO-активностью, однако увеличение MIC не было стабильным и оно не происходило после последующих пассажей на среде без антибиотиков. Полученные данные, вместе с данными по быстроте уничтожения бактерий и способу действия раствора с повышенной MPO-активностью, позволяют предположить, что обработка лекарственным продуктом давала очень незначительную возможность развития резистентности.
Исследования по взаимодействию лекарственных средств указывали на отсутствие антагонистического действия на активность стандартных тестируемых антибиотиков. Этот факт имеет важное значение в случае применения раствора с повышенной MPO-активностью в комбинации с терапией традиционными антибиотиками. Раствор с повышенной MPO-активностью также обладает сильной антимикробной активностью в присутствии цельной крови, которая обычно всегда присутствует при лечении ран, возникающих после хирургических операций и травм.
Как указывалось выше, композиции согласно изобретению с повышенной миелопероксидазной активностью обладают сильной и быстрой бактерицидной активностью широкого спектра, направленной против клинических и эталонных микроорганизмов, включая штаммы, восприимчивые к лекарственным средствам, штаммы, резистентные к лекарственным средствам, и штаммы, резистентные ко многим лекарственным средствам. Низкая чувствительность к отбору на резистентность и отсутствие взаимодействия между лекарственными средствами делает композиции согласно изобретению с повышенной активностью идеальными для их местного/наружного противоинфекционного применения в целях лечения и предупреждения инфекций широкого спектра in vivo.
Пример 12
Тестирование композиций с повышенной МРО-активностью in vivo
Для оценки раствора с повышенной MPO-активностью в условиях in vivo, описанной в примере 11, были использованы модели с тремя различными ранами. Эти модели имели раны, захватывающие всю толщину кожи, раны, захватывающие лишь часть толщины кожи, и раны, сделанные путем глубокого разреза кожи бедра.
Антибактериальное средство.
Раствор с повышенной MPO-активностью состоял из двух водных растворов, обозначенных как раствор Концентрат и раствор Разбавитель, которые смешивали перед их использованием. Раствор Концентрат содержал MPO, GO, хлорид натрия и специфические агенты, повышающие антимикробную активность, в водной композиции-носителе. Раствор Разбавитель содержал глюкозу (декстрозу) в такой же водной композиции-носителе, как и раствор Концентрат. Растворы Концентрат и Разбавитель смешивали в различных отношениях непосредственно перед применением, в результате чего получали лекарственный продукт, раствор с повышенной МРО-активностью, в нужной концентрации. Концентрацию раствора с повышенной МРО-активностью выражали в гваяколовых единицах МРО на миллилитр (GU/мл), а также в микрограммах MPO на миллилитр. Преобразование GU в мкг MPO осуществляли из расчета 0,375 GU/мкг MPO.
Бактериальные штаммы
Staphylococcus aureus® 136, клинический штамм MRSA, S. aureus ATCC 6538, Escherichia coli ATCC 25922 и Pseudomonas aeruginosa ATCC 27317 получали от Ricerca LLC (Concord, Ohio, U.S.A.) или из Американской коллекции типовых культур.
Экспериментальные животные-модели с ранами
В каждой модели ран были использованы взрослые крысы-самцы Sprague-Dawley (весом приблизительно 250 граммов), полученные из лаборатории Charles River Laboratories, Portage, Michigan, U.S.A. Животных помещали в отдельные клетки и в течение всего исследования им давали корм и воду ad libitum. Все крысы-модели с ранами имели два раневых участка. Перед нанесением ран шерсть на соответствующем участке выбривали электрической машинкой для стрижки шерсти. Животных анестезировали изофлураном (1-5% в O2, подаваемым через маску, надетую на морду). Если животные не находились под анестезией на протяжении всего исследования (более чем 5 часов), то для купирования послеоперационной боли через каждые 12 часов им вводили бупренорфин (0,05-0,25 мг/кг, i.р.). Все экспериментальные процедуры на животных осуществляли в соответствии с требованиями Научного комитета по содержанию и использованию экспериментальных животных (Institutional Animal Care and Use Committees at Ricerca LLC).
(i) Модель с раной, захватывающей всю толщину кожи
Экспериментальные раны индуцировали модифицированным методом, описанным в публикации Saymen, G.D., et al., «Infected Surface Wound: An Experimental Model and a Method for the Quantitation of Bacteria in Infected Tissues» Applied Microbiology 23(3):509-514, 1972. В качестве провокационных микроорганизмов, резистентных к метициллину, использовали S. aureus® 136, S. aureus ATCC 6538 или E. coli ATCC 25922. Эти микроорганизмы были получены в виде суспензии на поздней стадии логарифмического роста, приготовленной в соевом бульоне с триптиказой. Клетки собирали из шейкерной колбы, центрифугировали и ресуспендировали в забуференном физиологическом растворе с получением 9 log10 к.о.е./мл суспензии. Затем этот маточный раствор разводили в буфере с получением рабочей суспензии в концентрации приблизительно 7,5 log10 к.о.е./мл и использовали в качестве инокулята. Каждой крысе на кожу наносили две раны путем подтяжки рыхлой кожи и вырезания эллиптических областей кожи ножницами с использованием стерильных инструментов, обнажая тем самым фасции приблизительно размером 1-2 см2. Во всех группах обработки использовали трех крыс, каждая из которых имела две раны. К коже вокруг каждого раневого участка прикрепляли открытый полистироловый цилиндр диаметром 2,5 см с помощью цемента Quick Tite® (Loctite Corp.) в соответствии с процедурой, описанной Breuing, et. al. (Breuing, K., "Wound Fluid Bacterial Levels Exceed Tissue Bacterial Counts in Controlled Porcine Partial-Thickness Burn Infections," Plast. Reconstr. Surg. 111:781-788, 2003). Каждый цилиндр создавал водонепроницаемую тест-камеру, основанием которой была обнаженная фасция. Затем обнаженную фасцию инокулировали путем осаждения 200 мкл смеси, содержащей 107 к.о.е. бактериальной суспензии, непосредственно на фасцию. Этот объем инокулята был достаточным для полного закрытия обнаженной фасции. После нанесения инокулят оставляли на фасции на 15 минут, после чего проводили обработку. Затем на данный участок добавляли раствор с повышенной MPO-активностью в объеме 800 мкл с получением общего объема 1 мл на тестируемый участок. На контрольные участки, в которые было добавлено 800 мкл 0,9% стерильного физиологического раствора или буфера, раствор с повышенной MPO-активностью не вводили. Оба раневых участка у одной и той же крысы обрабатывали аналогичным способом. После 5-, 15-, 30- или 60-минутной обработки раствором с повышенной MPO-активностью, на каждый участок добавляли раствор каталазы в большом избытке для нейтрализации какого-либо оставшегося фермента и/или последующего продуцирования пероксида водорода и тем самым ингибирования другой антимикробной активности. Жидкость, оставшуюся в цилиндре, удаляли, и подлежащие фасции асептически вырезали, взвешивали и гомогенизировали. Для каждого участка число выживших бактерий в регенерированном жидком образце и в гомогенате ткани отдельно оценивали путем количественного анализа культуры с использованием планшетов с серийными 10-кратными разведениями на соевом агаре с триптиказой (TSA) и инкубировали в течение ночи при 37°С. Эффективность обработки вычисляли как сумму результатов, полученных для регенерированной жидкости и гомогената ткани для каждой раны и выражали как среднее для всех образцов каждой группы обработки.
В случае модели раны, захватывающей всю толщину кожи, среднее значение log10 (к.о.е.+1) выживших микроорганизмов вычисляли исходя из необработанных данных. 95% доверительные интервалы среднего вычисляли исходя из среднеквадратической ошибки среднего и т-величины, отражающей соответствующее число степеней свободы. У модели раны, захватывающей всю толщину кожи и тестируемой при трех различных концентрациях p-MPO, а именно 18,75; 75; и 150 GU MPO/мл, активность раствора с повышенной MPO-активностью зависела от времени и концентрации. Как показано на фигуре 4, раствор с повышенной MPO-активностью, содержащий 75 GU MPO/мл и 150 GU MPO/мл, давал почти полное уничтожение бактерий, то есть более чем 7 log10 инокулята S. aureus ATCC 6538 за 15 минут. Обработка раствором с повышенной MPO-активностью в обеих концентрациях приводила к более чем 4 log10 снижения к.о.е. через 5 минут. Если концентрация снижалась до 18,75 GU MPO/мл, то через 5 минут уже достигалось снижение приблизительно 3 log10 к.о.е. на рану, выделенных из раны, обработанной раствором с повышенной MPO-активностью, статистически отличалось (p<0,05) от числа к.о.е. в обоих инокулятах (7,3 log10) и в необработанных инфицированных контролях (7,25 log10) для всех тестируемых концентраций и периодов времени.
Действие раствора с повышенной MPO-активностью на раны, инокулированные E.coli ATCC 25922, проиллюстрировано на фигуре 6. Как наблюдалось в случае S. aureus, число бактерий быстро снижалось через 5 минут после обработки раствором с повышенной MPO-активностью. В ранах, обработанных раствором с повышенной MPO-активностью, содержащим 150 GU MPO/мл, через 5 минут наблюдалось почти полное уничтожение вводимого инокулята (7,2 log10).
Полученные результаты подтвердили быструю и зависящую от времени и концентрации активность раствора с повышенной MPO-активностью, направленную против S. aureus и E.coli в среде, содержащей экссудаты ткани и раны.
Через 15 минут после обработки ран какого-либо значимого различия между бактерицидной активностью раствора с повышенной MPO-активностью против MRSA и MSSA не наблюдалось (фигура 5). В обоих случаях выделение жизнеспособных микроорганизмов в экспериментальных группах указывало на снижение приблизительно 5 log10 к.о.е. по сравнению с контрольным инокулятом. После 15-минутной обработки, степень уничтожения микроорганизмов сравнивали с инокулятом, поскольку предварительные результаты не указывали на какое-либо заметное снижение или повышение жизнеспособности бактерий в течение периода времени до одного часа после инокуляции раневого участка бактериями (фигура 5 и фигура 6). Эти данные подтверждают, что in vitro активность раствора с повышенной MPO-активностью, описанная в примере 11, была направлена против микроорганизмов, резистентных и восприимчивых к метициллину (MIC90, 0,03 мкг MPO/мл).
(ii) Модель раны, захватывающей лишь часть толщины кожи
В качестве провокационных микроорганизмов использовали Staphylococcus aureus ATCC 6538. Инокулят получали, как описано выше, для раны, захватывающей всю толщину кожи. Экспериментальные раны состояли из двух участков, 10 мм x 7 мм, находящихся на средней линии спинки каждой крысы, причем, один участок располагался непосредственно перед лопаточной частью крысы, а другой участок располагался в каудальной области (области хвоста). Рану наносили путем контролируемого повреждения кожи. Кожу сжимали пальцами для образования складок и наносили повреждения теркой 10-ю сильными движениями. В результате образовывалась рана с легкими углублениями на коже (то есть проникающими примерно на 1/3-1/2 всей толщины кожи) и с незначительным кровотечением, которое насухо вытиралось. Тесты проводили с использованием 4-5 групп обработки на эксперимент, где каждую обработку проводили на 3 крысах. Каждая крыса имела 2 раны, что в целом давало 6 раневых участков на одну экспериментальную группу. Двадцать пять микролитров 106 к.о.е./мл инокулята закапывали в центр открытой раны и всю площадь раны растирали в течение 10 секунд стерильным полипропиленовым шпателем. Через двадцать минут после нанесения инокулята 1 мл раствора с повышенной MPO-активностью или плацебо наносили ватной палочкой в течение 30 секунд на раневой участок. Затем на каждую рану наносили влажную марлю, содержащую 3 мл раствора с повышенной MPO-активностью или плацебо, и эту рану покрывали тегадермом (Tegaderm). Через 3 или 24 часа после инокуляции со всех участков делали забор материала и культивировали для выращивания жизнеспособных микроорганизмов. Затем тегадерм и марлю удаляли и всю рану вырезали до фасции, помещали в тарированную стерильную пробирку, взвешивали и в каждую пробирку добавляли 1 мл стерильного холодного 0,9% физиологического раствора. Затем ткань гомогенизировали и число выживших бактерий в гомогенате ткани, выделенном из каждого участка, оценивали путем количественного анализа культуры с использованием серийных 10-кратных разведений, после чего культуры высевали на TSA и инкубировали в течение ночи при 37°С. Эффективность обработки выражали как среднее из числа выделенных образцов ткани для каждой группы обработки.
Среднее значение log10 (к.о.е.+1) выживших микроорганизмов вычисляли исходя из необработанных данных. 95% доверительные интервалы среднего вычисляли исходя из среднеквадратической ошибки среднего и т-величины, отражающей соответствующее число степеней свободы. Через 3 и 24 часа после обработки животного с моделью раны, захватывающей лишь часть толщины кожи, как показано ниже в таблице 35, оценивали степень активности раствора с повышенной MPO-активностью (Е-МРО) в концентрациях 75, 150 или 300 GU MPO/мл. В этой таблице представлены средние log10 к.о.е. выживших микроорганизмов, выделенных через 3 и 24 часа после различных обработок. Для каждой группы обработки приводится 95% доверительный интервал. Между группами, обработанными контролем-плацебо и раствором с повышенной MPO-активностью, значимые различия наблюдались в отношении числа жизнеспособных к.о.е. S. aureus, выделенных из образцов тканей.
После одного введения раствора с повышенной MPO-активностью в концентрации 150 GU/мл, среднее число микроорганизмов, выделенных из ран, составляло приблизительно 0,8 log10 к.о.е. (~6 к.о.е.) через 3 часа. Это означает более чем 3 log10 снижения по сравнению с инфекционным контролем.
Для определения уровня зависимости «доза-ответ» оценивали одну дозу раствора с повышенной MPO-активностью, содержащего MPO в концентрации 75, 150 и 300 GU/мл, и полученные значения сравнивали со значениями для контроля-плацебо через 24 часа. Обработка раствором с повышенной MPO-активностью в концентрации 75 GU/мл приводила к снижению числа выделенных микроорганизмов до 5,3 log10 к.о.е. Однако такое снижение не было статистически значимым по сравнению со значениями для плацебо-группы, составляющими 6,2 log10 к.о.е. (p=0,15). После одного введения раствора с повышенной MPO-активностью в концентрации 150 GU/мл число микроорганизмов, выделенных из ран, составляло 1,1 log10 к.о.е., то есть меньше чем для контроля-плацебо (p<0,01). Раны, обработанные раствором с повышенной MPO-активностью при 300 GU/мл, содержали приблизительно 4,4 log10 к.о.е. по сравнению с 6,2 log10 к.о.е., выделенных у контрольной группы, обработанной плацебо (p=0,01). Полученные данные показали, что уровень «доза-ответ» достигался через 24 часа для раствора с повышенной MPO-активностью, направленной против S. aureus, a пролонгированный эффект снижения уровня заражения ран наблюдался после одной обработки.
(iii) Модель глубокой раны, сделанной путем надреза бедра
Резистентные к метициллину S. aureus® 136 или Pseudomonas aeruginosa использовали в качестве провокационных микроорганизмов, а инокулят получали как описано выше. Раны наносили путем надреза на обоих бедрах каждой крысы, в случае если использовали MRSA, и надреза только на одном бедре для P. aeruginosa. Для каждого животного лапу, позвоночник, большой вертел и колено маркировали и проводили линию от колена до большого вертела по направлению к позвоночнику. Кожу надрезали ножницами приблизительно на 3 см вдоль линии, центрированной относительно большого вертела, а по краям кожу отрезали приблизительно на 1 см. Глубокий надрез делали вниз до уровня ниже бедра и выше ягодичной мышцы. Глубину раны проверяли путем нащупывания диафиза бедра с помощью пинцета. Тесты с использованием S. aureus проводили для 3 групп обработки на эксперимент; для групп, обработанных раствором с повышенной MPO-активностью, для групп, обработанных физиологическим раствором и для необработанного контроля. Десять крыс использовали для сравнения действия раствора с повышенной MPO-активностью с действием физиологического раствора, причем одну лапу обрабатывали раствором с повышенной MPO-активностью, а другую лапу обрабатывали физиологическим раствором. Кроме того, 5 животным в левую лапу вводили раствор с повышенной MPO-активностью и тот же раствор вводили 5 животным в правую лапу. Двух крыс инокулировали и не обрабатывали, в результате чего получали 4 раны для необработанного контроля.
Тесты с использованием P. aeruginosa также проводили для 3 групп обработки на один эксперимент, причем 4 крыс использовали для введения раствора с повышенной MPO-активностью, для обработки физиологическим раствором и в качестве необработанного контроля, соответственно. Каждая крыса имела одну рану, в результате чего было получено 4 раневых участка на экспериментальную группу. 100 мкл инокулята с 109 к.о.е./мл суспензии микроорганизмов закапывали в глубину раны стерильной пипеткой. Через шестьдесят (60) минут после инокуляции бактерией S. aureus, раны обрабатывали либо один раз 2,5 мл раствора с повышенной MPO-активностью при 75 GU/мл либо два раза с интервалами в 15 минут, 10 мл раствора с повышенной MPO-активностью при 300 GU/мл (см. таблицу 36). Через шестьдесят (60) минут после инокуляции бактерией P. aeruginosa раны обрабатывали два раза с интервалами в 15 минут, 5 мл раствора с повышенной MPO-активностью при 300 GU/мл (см. таблицу 37). Все обработки раствором с повышенной MPO-активностью и физиологическим раствором проводили с помощью шприца, снабженного иглой для зонда. Обработанные раны закрывали с помощью двух зажимов для кожи сразу после второй обработки, а раны необработанного контроля закрывали сразу после инокуляции бактерией. Оценку раны проводили на 4-й день. Затем проводили анализ каждой раны и присваивали баллы инфекционности. Для присвоения оценки инфекционности использовали два ключевых метрических параметра, а в частности площадь затвердения и присутствие или отсутствие нагноения. Площадь затвердения измеряли в мм2 с помощью штангенциркуля, а присутствие нагноения определяли путем хирургического вскрытия каждой раны. Присваиваемая оценка инфекционности была равна величине площади затвердения, а в случае нагноения оценку инфекционности увеличивали на 25%. В случае отсутствия нагноения какого-либо снижения оценки инфекционности не проводили.
Среднюю оценку инфекционности определяли исходя из данных, собранных после проведения множества экспериментов с помощью программы PROC MIXED (SAS, SAS Institute, Cary, North Carolina, U.S.A.) с использованием модели ран, присутствующих у крыс, и эти крысы были включены в эксперименты. И крыс, и эксперименты рассматривали в этой модели как случайные величины. Попарное сравнение средних величин осуществляли с помощью т-критерия. Влияние раствора с повышенной MPO-активностью на прогрессирование инфицирования резистентным к метициллину штаммом S. aureus или Pseudomonas aeruginosa определяли через 4 дня после инокуляции у модели с раной, сделанной путем глубокого надреза бедра. Как показано ниже в таблице 36, все группы, обработанные раствором с повышенной MPO-активностью (E-MPO), не обныруживали статистического различия; «*» означает экспериментальные группы, которые статистически отличались от группы плацебо, а «#» означает экспериментальные группы, которые статистически отличались от инфекционного контроля.
Оценки инфекционности для групп, обработанных раствором с повышенной MPO-активностью, сравнивали с оценками инфекционности, присвоенными группам, обработанным физиологическим раствором, и необработанным группам через 4 дня после обработки, как указано в таблицах 36 и 37.
Животных, инокулированных MRSA, обрабатывали либо два раза 10 мл раствора с повышенной MPO-активностью при 300 GU/мл, либо один раз 2,5 мл раствора с повышенной MPO-активностью при 75 GU/мл. Оценка ран, проводимая через 4 дня после обработки, указывала на большее число случаев нагноения у всех необработанных животных (59%) по сравнению с ранами групп, обработанных физиологическим раствором (25%) и групп, обработанных раствором с повышенной MPO-активностью (10% при концентрациях 300 GU/мл и 75 GU/мл).
Средняя оценка инфекционности 110 для животных, обработанных два раза 10 мл раствора с повышенной MPO-активностью при 300 GU/мл, статистически отличалась (величина p<0,05) от оценки, полученной для животных, два раза обработанных физиологическим раствором и животных необработанной группы, имеющих оценки инфекционности 216, 195 и 303, соответственно (таблица 36). Какого-либо статистического различия (p>0,05) между группами, обработанными высокой концентрацией/большим объемом и низкой концентрацией/небольшим объемом раствора с повышенной MPO-активностью, не наблюдалось.
Как было также показано в таблице 36, одновременное снижение концентрации и объема раствора с повышенной MPO-активностью от 10 мл, вводимых два раза при 300 GU/мл, до 2,5 мл, вводимых один раз при 75 GU/мл, давало оценку инфекционности 84, которая статистически отличалась (величина p<0,05) от оценок инфекционности 216, 195 и 303, полученных для животных, обработанных один раз 2,5 мл физиологического раствора, животных, обработанных два раза 10 мл физиологического раствора и необработанных животных, соответственно. Какого-либо статистического различия (p>0,05) между группами, обработанными высокой концентрацией/большим объемом и низкой концентрацией/небольшим объемом раствора с повышенной MPO-активностью, не наблюдалось.
Изменение типа микроорганизмов, а именно преобладание P. aeruginosa над S. Aureus, приводит к увеличению тяжести состояния модели и к летальности, если были инокулированы обе лапы (данные не приводятся), а поэтому, если животных инокулировали P. aeruginosa, то у этих животных инокулировали только одну лапу. Кроме того, поскольку P. aeruginosa может стать системной инфекцией после местного введения, то использование двух лап животного для различных обработок является неприемлемым и, вероятно, может давать неточные результаты. Как показано в таблице 37, средняя оценка инфекционности 86 для животных, обработанных два раза 5 мл раствора с повышенной MPO-активностью при 300 GU/мл, статистически отличалась (величина p<0,05) от оценки для группы, обработанной физиологическим раствором (IS=705), и необработанной группы (1032). Наблюдение, проводимое на 4-й день, указывало на большую вероятность нагноения всех необработанных ран (50%) по сравнению с ранами, обработанными физиологическим раствором (25%), и ранами в экспериментальных группах, обработанными раствором с повышенной MPO-активностью (0%).
В частности, эти результаты продемонстрировали зависимую от дозы и времени цитотоксическую активность раствора с повышенной MPO-активностью против S. aureus и E.coli у модели с инфицированными ранами, захватывающими всю толщину кожи. Раствор с повышенной MPO-активностью оказался эффективным в отношении снижения бактериальной нагрузки при наличии экссудатов из раны после одного введения, и что самое важное, без добавления обычно используемых антибиотиков. Такое бактерицидное действие является быстрым и снижает численность бактерий по сравнению с плацебо или необработанным контролем даже через 24 часа после обработки раствором с повышенной MPO-активностью.
В целом, такое антимикробное действие в сочетании с широким спектром действия, быстрой бактерицидной активностью, низкой предрасположенностью к вырабатыванию резистентности и отсутствием взаимодействия между лекарственными средствами, наблюдаемого в in vitro исследованиях, является достаточно надежным основанием для применения композиций согласно изобретению в целях лечения, предупреждения инфекции in vivo, а также снижения ее уровня.
Хотя выше были проиллюстрированы и описаны репрезентативные варианты осуществления изобретения, однако очевидно, что в настоящее изобретение могут быть внесены различные изменения, не выходящие за рамки существа и объема изобретения.
Реферат
Группа изобретений относится к способам и композициям для ингибирования роста восприимчивых микроорганизмов путем контактирования этих микроорганизмов, в присутствии пероксида и хлорида с миелопероксидазой и, по меньшей мере, двумя аминокислотами, усиливающими ее активность. Композиция для уничтожения или ингибирования роста патогенных микроорганизмов, где композиция в основном состоит из миелопероксидазы, глицина, L-аланина, L-пролина, глюкозо-оксидазы и водного носителя, и применение указанной композиции для приготовления лекарственного средства для лечения инфекции у человека или животного. Бинарная композиция для уничтожения или ингибирования роста патогенных микроорганизмов, включающая: (a) первую композицию, в основном состоящую из миелопероксидазы, глицина, L-аланина, L-пролина, глюкозо-оксидазы и водного носителя, и (b) вторую композицию, включающую глюкозу в водном носителе и применение этой композиции для приготовления лекарственного средства для лечения инфекции у человека или животного. Группа изобретений обеспечивает повышение эффективности уничтожения или ингибирования роста патогенных микроорганизмов. 5 н. и 13 з.п. ф-лы, 37 табл., 11 ил.,12 пр.
Формула
(a) первую композицию, в основном состоящую из миелопероксидазы, глицина, L-аланина, L-пролина, глюкозо-оксидазы и водного носителя, и
(b) вторую композицию, включающую глюкозу в водном носителе.



Комментарии