Ингибитор пролиферации стволовых клеток и его использование - RU2155066C2
Код документа: RU2155066C2
Чертежи




















Описание
Область техники, к которой относится изобретение
Изобретение относится к использованию ингибиторов пролиферации
стволовых клеток для лечения человека и животных при аутоиммунных заболеваниях, при старении, раке, пациентов, имеющих миелодисплазию, предлейкозное состояние, лейкоз, псориаз или другие заболевания,
включающие гиперпролиферативные состояния. Настоящее изобретение относится к способу лечения человека и животных либо в преддверии, либо после лечения химиотерапевтическими средствами или другими
агентами, которые нарушают цикл развития стволовых клеток, либо в случае радиационного воздействия. И наконец, настоящее изобретение относится к способу совершенствования поддержания и роста культур
стволовых клеток для использования их в процедурах ауто- и аллотрансплантации, а также в технике генного переноса.
Предпосылки создания изобретения
Большинство клеток на
конечной стадии систем обновления являются короткоживущими и должны постоянно замещаться новыми в течение всей жизни. Так, например, клетки крови происходят из самообновляющейся популяции
мультипотетных гемопоэтических стволовых клеток [ГСК (HSC)]. В связи с тем, что гемопоэтические стволовые клетки необходимы для развития всех зрелых клеток гемопоэтической и иммунной систем, их
выживание существенно для установления полностью функционирующей системы защиты хозяина у индивидуумов, подвергавшихся лечению химиотерапевтическими и другими средствами.
Продукция гемопоэтических клеток регулируется множеством факторов, стимулирующих рост и дифференциацию гемопоэтических клеток, некоторые из которых, например эритропоэтин и Г-КСФ (колониестимулирующий фактор), используются в настоящее время в клинической практике. Однако часть контролирующей системы, которая еще недостаточно хорошо изучена, представляет собой механизм регуляции по типу обратной связи, который приводит к образованию отрицательной ветви регуляторного процесса (Eaves et al., Blood 78:110-117, 1991).
Ранние исследования Лорда с соавт. выявили наличие растворимого белкового фактора в нормальных экстрактах мышиного и свиного костного мозга, которые обладают способностью к обратимому ингибированию цикла ГСК (Lord et al., Br. J. Haem. 34:441-446, 1976). Эта ингибирующая активность (молекулярная масса 50-100 кДа) была обозначена как ингибитор стволовых клеток [ИСК (SCI)] .
Очистку этого фактора из первичных источников не удалось провести до конца в связи с теми трудностями, которые возникают при исследованиях in vivo, требующих большого количества облученных мышей. Пытаясь преодолеть эти трудности, Прагнелл с сотр. (Pragnell et al.) разработали тест in vitro для простых гемопоэтических клеток [КОЕ-A (колониеобразующая клетка)] и проводили скрининг клеточных линий по наличию ингибирующей активности.
Поскольку в предшествующих исследованиях было показано, что макрофаги представляют собой возможный источник ИСК (Lord et al., Blood Cells 6:581-593, 1980), была отобрана клеточная линия макрофагов мышей J774.2 (Graham et al. , Nature 344:442-444, 1990). Стандартизованная среда из этой клеточной линии была использована для очистки, при этом был выделен ингибирующий пептид, который, как было показано, идентичен ранее описанному цитокин протеину 1-альфа, обнаруженному в макрофагах при воспалении [МВП (MIP)-1-альфа] . МВП-1-альфа был выделен из клеточной линии, но не из первичного материала. При этом, в то время как Грэхем с соавт. (Graham et al.) обнаружили, что антитела к МВП-1-альфа подавляют активность неочищенного экстракта из костного мозга, другие исследователи показали важность иных ингибиторов активности. Так, например, Грэхем с соавт. (Graham et al., J. Exp. Med., 178:925-32, 1993) предположили, что ФРТ β (TGF β ) (ростовой фактор Т-клеток-бета), а не МВП-1-альфа представляет собой первичный ингибитор гемопоэтических стволовых клеток. Более того, Иве с соавт. (Eaves et al., PNAS 90: 12015-19, 1993) предположили, что и МВП-1-альфа и ФРТ β присутствуют в субоптимальных количествах в норме в костном мозге, а для ингибирования требуется синергическое взаимодействие этих двух факторов.
Ряд исследователей описали также другие факторы, ингибирующие стволовые клетки. Фриндель с соавт. (Frindel et al.) выделили тетрапептид из экстрактов костного мозга зародыша теленка и печени, которые содержали ингибирующие активности в отношении стволовых клеток (Lenfant et al., PNAS 86:779-782, 1989). Пауковитц с соавт. (Paukovitz et al., Cancer Res. 50:328-332, 1990) охарактеризовали пентапептид, который в своей мономерной форме является ингибитором, а в димерной форме - стимулятором циклического развития стволовых клеток. Были названы также другие факторы, которые обладают ингибирующей активностью в различных системах in vitro (Wright and Pragnell in Bailliere's Clinical Haematology, v. 5, pp. 723-739, 1992 (Bailliere Tinadall, Paris)).
К настоящему времени ни один из этих факторов не используется в клинической практике. Однако существует насущная потребность в эффективных ингибиторах стволовых клеток. Основной токсический эффект, сопровождающий химиотерапию или радиотерапию, выражается в разрушении нормальных пролиферирующих клеток, что может приводить к развитию супрессии костного мозга или к проявлению токсического воздействия на желудочно-кишечный тракт. При этом считается, что эффективный ингибитор стволовых клеток будет защищать эти клетки и позволит оптимизировать режим терапевтического воздействия. Поскольку доказана необходимость в различных стимулирующих цитокинах (т.е. Г-КСФ, ГМ-КСФ, эритропоэтин, ИЛ-II), определяемая той или иной клинической ситуацией, представляется очевидным, что для удовлетворения различающихся клинических запросов потребуется множество ингибирующих факторов.
I. Химиотерапия и радиотерапия рака
Продуктивное исследование стимулирующих ростовых факторов привело в итоге к клиническому применению множества таких
факторов (эритропоэтина, Г-КСФ и др.). В результате использования этих факторов снижались как летальность, так и уровень заболеваемости, связанной с химиотерапией и лучевой терапией. Дополнительные
клинические плюсы, которые получают пациенты, подвергающиеся химио- или лучевой терапии, могут быть лучшим образом продемонстрированы с помощью альтернативной стратегии блокирования поступления
стволовых клеток в клеточный цикл, защищая таким образом их от побочных токсических эффектов.
II. Трансплантация костного мозга
Трансплантация костного мозга (ТКМ)
представляет собой полезный в случае большого числа гематологических, аутоиммунных и злокачественных заболеваний способ лечения. В настоящее время используют ex vivo манипуляции с клетками для
получения из первоначальных стволовых клеток популяцию, пригодную для трансплантации. Для оптимизации этого процесса требуется: (1) достаточное количество стволовых клеток, способных поддерживать
длительный процесс восстановления гемопоэза; (2) снижение числа Т-тимфоцитов, индуцирующих болезнь "трансплантат против хозяина" и (3) отсутствие остаточных малигнизирующих клеток. Описываемая
процедура может быть оптимизирована посредством включения ингибитора(ов) стволовых клеток в среду для роста ex vivo.
Эффективность очищения клеток костного мозга цитотоксическими средствами с целью удаления остаточного количества злокачественных клеток ограничена в связи с токсичностью этих соединений для нормальных гемопоэтических клеток и особенно для стволовых клеток, имеется потребность в эффективной защите нормальных клеток в процессе их очистки; такой защиты можно достигнуть, отобрав стволовые клетки из цикла для обработки эффективным ингибитором.
III. Сбор периферических стволовых клеток
Использование стволовых клеток периферической крови [СКПК (PBSC)] для аутологичной трансплантации дает множество существенных преимуществ в
сравнении с костным мозгом. У пациентов, которые в связи с развитием опухоли или проведением предшествующей радиотерапии, не имеют подходящих сайтов для отбора костного мозга, могут быть отобраны
СКПК. Использование стволовых клеток крови устраняет необходимость проведения общей анестезии и хирургического вмешательства у пациентов, которые не в состоянии хорошо перенести такую процедуру.
Практикуемая для сбора клеток крови технология афереза представляется достаточно эффективным способом, который широко используется в большинстве крупных медицинских центров. Основное ограничение этого
метода связано с низкой частотой стволовых клеток в периферической крови при гомеостазе, в норме и высокая их частота в циклической стадии, наступающей после мобилизирующих процедур с применением
лекарственных или ростовых факторов (таких, как циклофосфамид, Г-КСФ, фактор стволовых клеток). Эффективный ингибитор стволовых клеток был бы полезен для возвращения таких клеток в стадию покоя, что
предотвратило бы таким образом снижение их количества в связи с дифференцировкой.
IV. Лечение гиперпролиферативных заболеваний
Существует большое число заболеваний, для
которых характерно наличие гиперпролиферативной стадии, в ходе которой разрегулированные стволовые клетки могут привести к избыточной продукции клеток конечной стадии. Такие заболевания, в развитии
которых наблюдаются указанные состояния, включают, не ограничиваясь ими, псориаз, при котором имеет место перепроизводство эпидермических клеток, и предраковые состояния желудочно-кишечного тракта,
для которых характерно появление кишечных полипов. Для лечения таких состояний может быть полезен ингибитор стволовых клеток.
V. Перенос генов
Возможность переноса
генетической информации в гемопоэтические клетки в настоящее время широко используется в клинических условиях. Костный мозг представляет собой весьма важную мишень для генной терапии в связи с
облегченностью доступа к нему, с наличием обширного опыта работы с этой тканью и лечения ее ex vivo, а также как следствие способности клеток крови проникать в ткани.
Кроме того, при введении функционирующего гена в ранние стволовые клетки костного мозга гемопоэтической системы человека возможна коррекция ряда генетических дефектов человека.
Имеется несколько ограничений возможности введения генов в гемопоэтические клетки человека с использованием либо вектора ретровирусной природы, либо физической техники генного переноса: (1) низкая частота стволовых клеток в гемопоэтических тканях требует развития высокоэффективной техники генного переноса; (2) показано, что клетки, более быстро вступающие в цикл, обладают большей чувствительностью к векторной инфекции, однако повышение частоты инфекции посредством стимуляции пролиферации стволовых клеток с помощью ростовых факторов, как было выявлено, имеет негативный эффект на длительную генную экспрессию, поскольку клетки, содержащие трансгены, вступают необратимо в вынужденную дифференцировку, теряя при этом способность к самообновлению. Острота этих проблем снижается при использовании ингибитора стволовых клеток, который препятствует прохождению процесса дифференцировки и в результате этого потере способности к самообновлению.
Краткое изложение сущности изобретения
Настоящее изобретение относится к ингибитору стволовых клеток, который отличается следующими свойствами:
а) удельная активность (ИК50) меньше или равна 20 нг/мл в тесте с
колониеобразующими клетками селезенки мышей (КОЕ-S) (см. пример 4);
б) молекулярная масса больше 10000 и меньше 100000 дальтонов (на основании ультрафильтрации);
в) активность
чувствительна к действию трипсина;
г) более гидрофобен, чем МВП-1 α или ФРТ β и может быть выделен с помощью хроматографии с обращением фаз (см. пример 12);
д)
биологическая активность сохраняется при нагревании в водном растворе в течение одного часа при 37oC, 55oC или 75oC;
е) биологическая активность сохраняется
при осаждении раствором 1% соляной кислоты в ацетоне.
Предмет настоящего изобретения характеризуется, отличаясь этим от других кандидатов на роль ингибиторов стволовых клеток (т.е. МВП1α , ФРТβ и различные олигопептиды), способностью достигать ингибирования в исследованиях in vitro после короткого прединкубационного периода (см. пример 5).
Настоящее изобретение относится также к фармацевтическим композициям, содержащим ИНПРОЛ (INPROL), для лечения различных заболеваний.
Настоящее изобретение относится к способу лечения пациентов, в отношении которых ожидается воздействие агентов, способных убить или повредить стволовые клетки. При этом данный способ заключается во введении такому пациенту эффективного количества композиции, содержащей ингибитор стволовых клеток. Защищаемые таким образом стволовые клетки могут представлять собой гемопоэтические стволовые клетки, обычно присутствующие и делящиеся в костном мозге. Альтернативно, стволовые клетки могут быть эпителиальной природы, которые локализованы, например, в кишечнике или в скальпе, или на других участках тела, или это могут быть половые клетки, расположенные в репродуктивных органах. Способ настоящего изобретения может быть по желанию применен на человеке или на животном, поскольку способ лечения животных также входит в рамки настоящего изобретения.
В другом своем аспекте настоящее изобретение относится к способу защиты и восстановления гемопоэтической, иммунной или другой систем, включающих стволовые клетки, у пациента, подвергающегося химиотерапии, который включает введение упомянутому пациенту эффективного количества ИНПРОЛа.
В еще одном своем аспекте настоящее изобретение относится к методу адъюнктивного лечения рака, включая твердые опухоли, посредством введения пациенту, имеющему рак, эффективного количества ИНПРОЛа для защиты стволовых клеток костного мозга, желудочно-кишечного тракта или других органов от токсического воздействия химиотерапии или лучевой терапии.
Следующий аспект настоящего изобретения относится к лечению лейкоза, который включает обработку клеток костного мозга, несущих пролиферирующие лейкозные клетки, эффективным количеством ИНПРОЛа с целью ингибирования пролиферации нормальных стволовых клеток и, кроме того, обработку костного мозга цитотоксическим средством для разрушения лейкозных клеток. Этот метод может быть усилен за счет последующего введения в костный мозг других средств, которые стимулируют его пролиферацию, т.е. колониестимулирующих факторов. В другом своем варианте настоящий способ выполняется in vivo. Альтернативно, этот метод может также использоваться для очищения и роста ex vivo клеток костного мозга для трансплантации.
Еще в одном своем аспекте описываемый метод включает лечение пациента, имеющего какие-либо нарушения, вызванные пролиферацией стволовых клеток. Такие заболевания, как псориаз, миелодисплазия, некоторые аутоиммунные болезни, старческая иммунодепрессия, лечат посредством введения пациенту эффективного количества ИНПРОЛа для частичного ингибирования описываемых стволовых клеток.
Настоящее изобретение относится к способу обратимой защиты стволовых клеток от повреждения цитотоксическими средствами, которые могут либо убить, либо повредить стволовые клетки. Этот способ включает введение пациенту, которого планируется лечить такими средствами, эффективного количества ИНПРОЛа.
Настоящее изобретение включает также в свои рамки очистку ИНПРОЛа из свиньи, при этом ожидается, что после использования очищенного белка могут быть получены данные по его последовательности, нужные для клонирования кДНК или гена ИНПРОЛа.
Настоящее изобретение также относится к:
Ингибитору пролиферации стволовых клеток, выделенному из костного мозга свиньи или другого источника с применением процедуры, включающей
следующие стадии:
а) экстракцию костного мозга и удаление частиц фильтрацией;
б) тепловую обработку при 56oC в течение 40 минут с последующим охлаждением в ледяной бане;
в) удаление осадка с помощью центрифугирования при 10000g в течение 30 минут при 4oC;
г) кислотное осаждение при добавлении супернатанта к 10 объемам перемешиваемой смеси
лед - холодный ацетон, содержащей 1 об.% концентрированной соляной кислоты с последующей инкубацией в течение 16 часов при 4oC;
д) отделение осадка при центрифугировании со
скоростью 20000g в течение 30 минут при 4oC, промывание холодным ацетоном и последующее высушивание;
е) выделение хроматографированием с обращением фаз и мониторинг нужной
активности по ингибированию колониеобразующей способности клеток костного мозга, обработанных предварительно 5-фторурацилом и инкубируемых в присутствии мышиного ИЛ-3, а также по измерению поглощения
при 280 нм и с помощью электрофореза в ДСН-ПААГ (SDS-PAGE).
Настоящее изобретение также относится к:
Способу очистки ингибитора пролиферации стволовых клеток, который по
существу не содержит другого белковоподобного материала и который включает приведенные стадии, описанные ниже более подробно.
Настоящее изобретение относится также к:
Способу
лечения человека и животных, в ходе которого начинает функционировать ингибитор, который ослабляет иммуносупрессию, вызванную гиперпролиферацией стволовых клеток.
Настоящее изобретение
также относится к:
Способу лечения человека и животных, в ходе которого упомянутый ингибитор вводится после того, как в стволовых клетках воздействием либо цитотоксического средства, либо
облучением индуцируется пролиферация. Покоящиеся в норме стволовые клетки после химиотерапии стимулируются и вступают в клеточный цикл. Это придает им большую чувствительность при проведении второго
курса химиотерапии; настоящий метод защищает клетки от такой обработки, делая ее ненужной.
Настоящее изобретение также относится к:
Способу лечения человека и животных, при
котором упомянутый ингибитор пролиферации стволовых клеток вводится как адъювант перед вакцинацией или одновременно с ней с целью усиления иммунного ответа.
Настоящее изобретение также
относится к:
Способу лечения человека и животных, принимающих цитотоксические средства или лучевую терапию, который включает введение эффективного количества ингибитора пролиферации стволовых
клеток с целью защиты их от повреждения.
В настоящем изобретении описывается ингибитор стволовых клеток, обозначенный как ИНПРОЛ, который отличается от других известных в технике ингибиторов, таких как МВП-1-альфа, ФРТ-бета, тетрапептид, выделенный Фринделем и сотр., или пентапептид Пауковитца и сотр. (Wright & Pragnell, 1992 (op cit)). ИНПРОЛ имеет молекулярную массу, превышающую 10000 дальтон при измерении методом ультрафильтрации, что отличает его как от тетрапептида, так и от пентапептида. В системах хроматографирования с обращением фаз он ведет себя как более гидрофобное соединение в сравнении с МВП-1-альфа или ФРТ-бета, что отличает его от цитокинов. Более того, способ его действия отличен от такового, известного для всех описанных ингибиторов, заключающийся в том, что он проявляет активность в системе in vitro при использовании уже только в периоде предварительной инкубации. МВП-1-альфа неэффективен, например, когда его используют только в периоде предварительной инкубации (пример 5). Далее, ИНПРОЛ проявляет активность в тесте по измерению уровня "потенциально высокопролиферирующих клеток" (HPP-PFC), в то время как МВП-1-альфа не обладает такой активностью (пример 6).
Краткое описание чертежей
На фиг. 1-4 представлена картина разгона продукта на каждой стадии очистки в ДСН-полиакриламидном геле
(SDS-PAGE).
На фиг. 5 представлена хроматограмма ВЭЖХ на конечной стадии очистки.
На фиг. 6 приведены данные по включению тритированного тимидина (cpm) в клетки линии FDCP-mix без ИНПРОЛа (контроль = 100%) и при наличии различных его концентраций. Приведенные данные нормализованы к контрольным значениям.
На фиг. 7 показан процент клеток, находящихся в S фазе клеточного цикла после обработки мышей тестостерона пропионатом (ТСП), ТСП плюс ИНПРОЛ или наполнителем (контроль). Каждая группа включает 25 животных (3-4 на каждую временную точку).
На фиг. 8 приведены данные по выживаемости мышей, обработанных двумя дозами 5-ФУ при наличии ИНПРОЛа или без такой обработки. Каждая группа содержит по 30 животных.
На фиг. 9 представлены данные по выживанию облученных мышей при обработке их ИНПРОЛом и без такой обработки. Каждая группа содержит 50 животных.
На фиг. 10A и 10B показана регенерация нормальной длительной культуры костного мозга, растущей в течение 1 недели (10A) и 3 недель (10B) после обработки Ара-Ц плюс ИНПРОЛ.
На фиг. 11 приведены данные по выживанию мышей (75 в каждой группе) после облучения их летальной дозой и проведения трансплантации 3 • 104 клеток костного мозга после предварительной инкубации их в среде (контроль) или в ИНПРОЛе (25 нг/мл) в течение 4 часов. Уровень выживания отслеживали в течение 30 дней.
На фиг. 12 показаны количество ГМ-КОЕ, образованных через 14 дней в культуре клетками костного мозга, взятыми из мышей после облучения их летальной дозой, а также восстановление с помощью донорных клеток костного мозга, прошедших преинкубацию с ИНПРОЛом или в среде в течение 4 часов.
На фиг. 13 приведены данные по количеству клеток в суспензии из лимфоидной длительной культуры, которую отбирали каждую неделю, промывали и помещали на чашки с ИЛ-7 (10 нг/мл) после предварительной инкубации со средой или ИНПРОЛом в течение 4 часов.
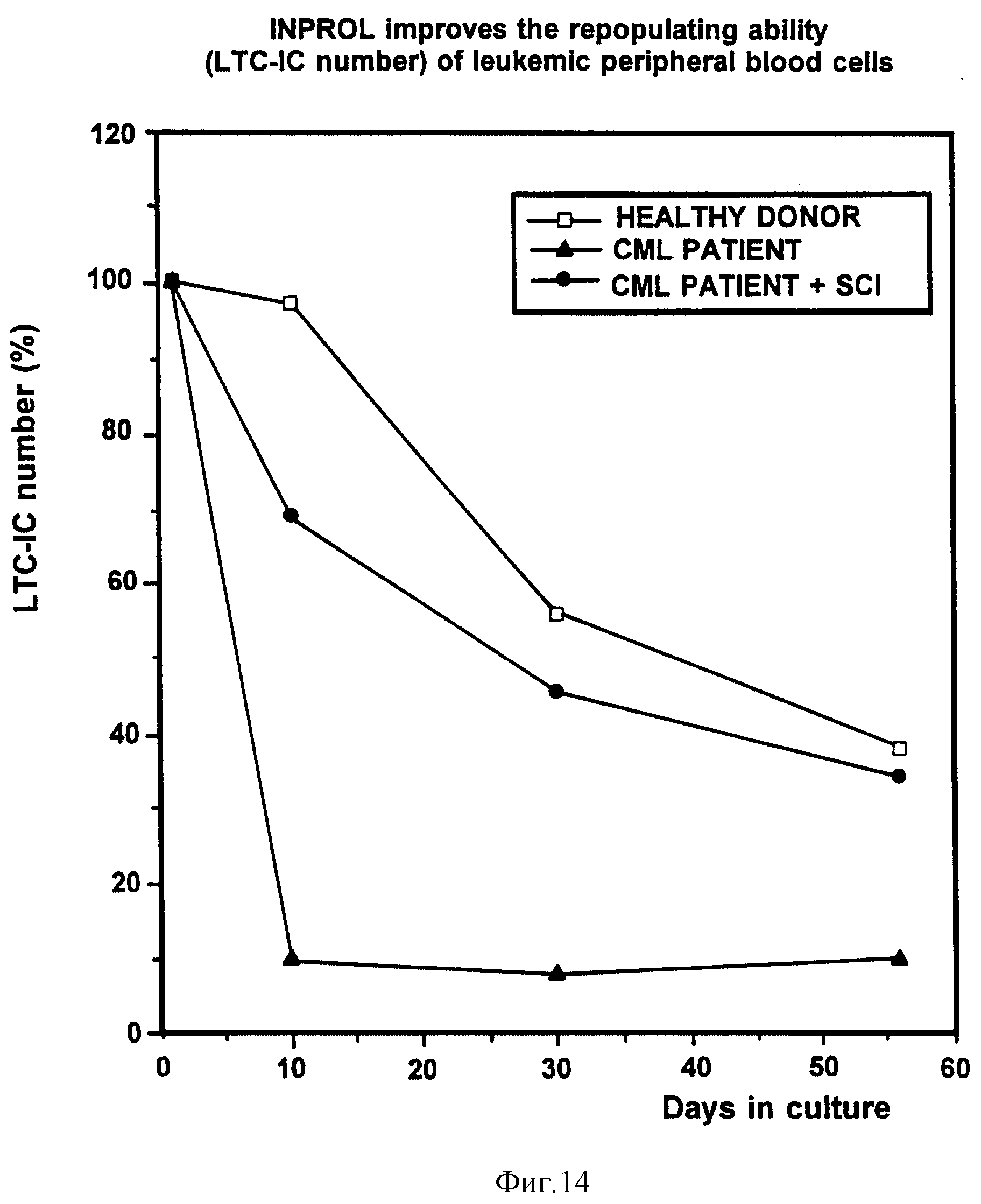
На фиг. 14 показано улучшение способности лейкозных клеток периферической крови к росту после обработки их ИНПРОЛом. Количество инициирующих клеток в длительной культуре [ДК-ИК (LTC-IC)] определяли при помещении слипшихся и неслипшихся клеток из длительной культуры на чашку Петри вместе с ИНПРОЛом и без него, с подсчетом на 7 день числа ГМ-КОЕ. Данные нормализованы к контрольным величинам.
На фиг. 15A показана хроматограмма очищенного ИНПРОЛа на C4 с обращением фаз при элюции 53% ацетонитрилом. На фиг. 15B показана хроматограмма МВП-1-альфа на C4 с обращением фаз при элюции 43,9% ацетонитрилом. На фиг. 15C показана хроматограмма в ДСН-ПААГ неочищенного препарата ИНПРОЛа и очищенного препарата, полученного после хроматографирования с обращением фаз.
С целью лучшего понимания материала настоящего изобретения ниже представлено подробное его описание. Это описание, включающее примеры реализации настоящего изобретения, не следует никоим образом рассматривать как ограничивающее настоящее изобретение, а те вариации, которые, как очевидно каждому специалисту, имеющему средний уровень знаний в данной области, входят в компетенцию настоящего изобретения, должны рассматриваться в рамках предлагаемого изобретения.
Подробное описание предпочтительных вариантов
ИНПРОЛ
обратимо ингибирует деление стволовых клеток. Более конкретно, ИНПРОЛ эффективен с целью временного ингибирования клеточного деления гемопоэтических клеток. Так, метод настоящего изобретения может
быть применен для смягчения нежелательного побочного действия химиотерапии на гемопоэтическую, миелоидную и иммунную системы посредством защиты стволовых клеток от повреждений, вызываемых
химиотерапевтическими средствами или облучением, используемыми для разрушения раковых или инфицированных вирусом клеток. В одном из вариантов реализации изобретения ИНПРОЛ вводится пациенту в
дозировке, достаточной для ингибирования деления стволовых клеток, возникающем при действии химиотерапевтического средства на больные клетки. После того, как химиотерапевтическое средство выполнит
свою функцию, стволовые клетки, ингибированные ИНПРОЛом, в отсутствие дальнейшей обработки, снова станут делящимися клетками. При желании усилить регенерацию гемопоэза можно дополнительно использовать
стимулирующие ростовые факторы или цитокины.
В типичной клинической ситуации ИНПРОЛ вводится пациенту посредством внутривенной инъекции или инфузии с использованием, например, для введения от 0,01 до 1 мг/кг очищенного рекомбинантного ИНПРОЛа за 4-60 часов до проведения стандартной химиотерапии или лучевой терапии. В другом варианте реализации настоящего изобретения предварительная обработка ИНПРОЛом позволяет применять более высокие дозы химиотерапевтического средства или облучения, чем те, которые обычно хорошо переносятся больными. Факультативно, после химиотерапии или радиотерапии могут использоваться стимулирующие ростовые факторы, такие как Г-КСФ, фактор стволовых клеток, для дальнейшего улучшения процесса восстановления гемопоэза.
В другом варианте изобретения ИНПРОЛ используют в методе приготовления аутологичного костного мозга для трансплантации. Костный мозг обрабатывают ex vivo эффективным количеством ИНПРОЛа для ингибирования деления стволовых клеток и затем очищают от раковых клеток введением в культуры костного мозга эффективного количества химиотерапевтического средства или облучением. Предпочтительны при этом химиотерапевтические средства, подходящие для использования на делящихся клетках. Обработанный таким образом костный мозг инъецируют вновь в аутологичный организм донора. Факультативно, пациента лечат с применением средств, которые стимулируют гемопоэз с целью улучшения восстановления гемопоэза пациента.
В другом варианте изобретения ИНПРОЛ применяется как средство адъюнктивной терапии при лечении лейкоза. Например, на тех стадиях заболевания, когда лейкозные клетки не отвечают на введение ИНПРОЛа, лейкозные клетки костного мозга обрабатывают ex vivo ИНПРОЛом. Пролиферацию нормальных стволовых клеток предотвращают введением ИНПРОЛа. Таким образом, в течение всего того времени, когда пролиферирующие лейкозные клетки обрабатывают цикло-специфичным цитотоксическим средством, популяцию нормальных стволовых клеток защищают от повреждения. Кроме того, факультативно может вводиться стимулирующий цитокин, такой, в частности, как ИЛ-3 или ГМ-КСФ, с целью индукции цикла деления в лейкозных клетках в ходе лекарственной или лучевой терапии, в то время как нормальные стволовые клетки защищают с помощью ИНПРОЛа. Пациентов лечат с применением химиотерапевтических средств или облучения для разрушения лейкозных клеток, а обработанный костный мозг трансплантируют затем вновь в организм пациента с целью восстановления гемопоэза.
Аналогично в другом варианте изобретения в случае пациентов с серьезными вирусными инфекциями, такими, в которые вовлечены клетки крови или лимфоциты, например ВИЧ инфекция, терапия включает обработку костного мозга ex vivo ИНПРОЛом и далее другими антивирусными средствами и лекарствами, которые разрушают инфицированные клетки или такие системы, которые функционируют на основе антител, с целью удаления инфицированных клеток. Затем после антивирусной или химиотерапевтической обработки костного мозга, направленной на удаление из пациента зараженных вирусом клеток, очищенный ИНПРОЛом костный мозг вновь возвращают пациенту.
В другом варианте изобретения ИНПРОЛ используют для лечения заболеваний, имеющих отношение к гиперпролиферации стволовых клеток. Например, псориаз представляет собой болезнь, вызванную гиперпролиферацией эпителиальных клеток кожи, которую иногда лечат цитотоксическими препаратами. Другие предраковые повреждения, в которые вовлекается пролиферация стволовых клеток, также поддаются воздействию эффективных количеств ИНПРОЛа, применяемого для полного или частичного ингибирования пролиферации стволовых клеток. Для целей такого использования в качестве альтернативы парентеральному введению, в зависимости от условий, могут также применяться композиции, содержащие ИНПРОЛ, для местного или чрескожного режимов введения. В большинстве случаев лейкоза лейкозные предшественники представляют собой дифференцированные клеточные популяции, на которые не воздействует ИНПРОЛ, и которые поэтому лечат с помощью методов, использующих ИНПРОЛ, таким образом, как было описано выше. В тех случаях, когда лейкозные предшественники представляют собой недифференцированные клетки, проявляющие направленную чувствительность к ингибированию ИНПРОЛом, пролиферацию лейкозных клеток ослабляют введением эффективных количеств ИНПРОЛа.
К полипептидным цепям ИНПРОЛа с помощью стандартной техники получают моноклональные или поликлональные антитела. Эти антитела к ИНПРОЛу метят какой-либо хорошо различаемой меткой любого известного в технике типа. Меченый ИНПРОЛ или антитела к ИНПРОЛу используют затем в качестве маркеров стволовых клеток с целью идентификации и выделения стволовых клеток при введении их непосредственно в организм пациента с диагностической целью. Альтернативно эти меченые полипептиды или антитела используют ex vivo для идентификации стволовых клеток в препарате костного мозга, что позволяет удалить их перед очищением костного мозга от раковых клеток. Аналогично такие меченые полипептиды или антитела используют для выделения и идентификации эпителиальных или других стволовых клеток. Кроме того, такие антитела, меченые или не меченные, находят применение в терапевтической практике для нейтрализации активности ИНПРОЛа или в диагностике для обнаружения циркулирующих в крови количеств ИНПРОЛа.
Выделенный из свиньи фактор используют по способу настоящего изобретения при том условии, что он не вызывает в значительных количествах образования вредных антител в иммунной системе хозяина. В рамки настоящего изобретения входит также аналогичный или гомологичный белок человека, имеющий активность, сходную с ИНПРОЛом. С использованием стандартных методик такой белок подвергают клонированию из человеческого гена или из библиотеки кДНК с целью достижения экспрессии рекомбинантного человеческого ИНПРОЛа. Например, с использованием информации, полученной на очищенном белке, могут быть сконструированы меченые олигонуклеотидные образцы, т.е. несущие фосфор 32, и далее использованы для скрининга подходящей библиотеки кДНК (из костного мозга). Альтернативно проводится скрининг по показателю экспрессии библиотеки из соответствующего источника (т.е. костного мозга) для определения кДНК, кодирующей ИНПРОЛ, при этом могут использоваться антитела или подходящие функциональные тесты (см. описание примера 2).
Гомологичные или аналогичные версии ИНПРОЛа из других видов используют для разного рода ветеринарных целей аналогично варианту терапевтического использования его для лечения человека, описанному выше.
Кроме того, ингибирующий стволовые клетки фактор действует на делящиеся стволовые клетки посредством обратимого превращения их в неделящееся состояние "покоя". При возникновении необходимости стимулировать покоящиеся стволовые клетки к делению, в частности, после лечения пациента химиотерапевтическими средствами или облучением данному индивидууму вводят колониестимулирующие факторы и другие стимуляторы гемопоэза. Примеры таких факторов включают, не ограничиваясь ими: М-КСФ, КСФ-1, ГМ-КСФ, Г-КСФ, Мегакариоцит-КСФ или другие цитокины, такие как ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-11, ИЛ-12, ИЛ- 13, ИЛ-14 или эритропоэтин.
Полипептиды ИНПРОЛа или его активные фрагменты, обладающие ингибирующей активностью в отношении стволовых клеток, очищают или синтезируют с применением традиционных химических методов в сочетании с подходящими тестами для отслеживания ингибирующей активности по отношению к стволовым клеткам, как это будет видно из примеров, приведенных в нижеследующих методиках.
В одном варианте изобретения терапевтически эффективное количество белка ИНПРОЛа или терапевтически эффективный фрагмент его используют в качестве добавки вместе с фармацевтически приемлемым наполнителем. Такая композиция ИНПРОЛа вводится обычно путем парентеральной инъекции или инфузии. В соответствии с достигаемым в том или ином случае терапевтическим эффектом выбирается также подкожный, внутривенный или внутримышечный способы инъекций.
При использовании терапевтической композиции настоящего изобретения для систематического ввода ее применяют в форме пригодного для парентеральной инъекции водного раствора, свободного от пирогена. Раствор фармацевтически приемлемого носителя, имеющий соответствующее для придания изотоничности и стабильности значение pH, а также белковый наполнитель и др. соответствуют достигнутому уровню техники. Для введения композиции, содержащей ИНПРОЛ, в случае реализации способа лечения сверхпролиферирующих стволовых клеток используется местный способ доставки или применяют чрескожный пластырь с целью локализации введенной композиции и достижения оптимального эффекта на участке с гиперпролиферацией.
Режим дозировки, применяемый при лечении пациентов накануне введения цитотоксических средств или для лечения гиперпролиферативных состояний стволовых клеток, определяется в каждом конкретном случае лечащим врачом с учетом различных факторов, влияющих на действие лекарств, таких как вид заболевания пациента, вес тела, пол, режим питания, серьезность инфекции, время введения препарата и другие имеющие значение для клиники факторы. В целом, дневной режим приема колеблется в пределах 1-100 (мкг/кг) микрограммов белка ИНПРОЛа или его фрагмента на килограмм веса тела.
В соответствии со способом лечения по настоящему изобретению пациенту, после воздействия цитотоксического средства или облучения, могут быть факультативно введены один или более лимфокинов, колониестимулирующих факторов или других цитокинов, гемопоэтинов, интерлейкинов или ростовых факторов с целью общей стимуляции роста и деления стволовых клеток (и происходящих от них клеток), которые были ингибированы предшествующим применением ИНПРОЛа. Такие терапевтические средства, способные оживлять гемопоэз, включают ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, Мег-КСФ, М-КСФ, КСФ-1, ГМ-КСФ, Г-КСФ или эритропоэтин. Дозировка этих средств подбирается в соответствии с результатами, полученными при клиническом испытании их эффективности по стимулированию восстановления гемопоэза после химиотерапии или трансплантации костного мозга. Эти дозировки должны корректироваться с учетом различий в физическом состоянии пациентов с целью компенсации этих вариаций, а также с учетом количества и типа использованного химиотерапевтического средства или характеристик примененной лучевой терапии. Наличие прогресса в снижении ингибирования стволовых клеток, вызванного введением пациенту в ходе терапии ИНПРОЛа, отслеживается традиционными методами.
При лечении лейкоза наилучший результат достигается при комбинированном введении как ИНПРОЛа для ингибирования деления нормальных стволовых клеток, так и стимулятора роста лейкозных клеток, такого как ИЛ-3 или ГМ-КСФ, одновременно с применяемым для лечения цитотоксическим средством или в процессе облучения, в случае применения лучевой терапии. По применяемому протоколу удается добиться громадных различий между нормальными и лейкозными клетками по таким показателям, как стадия деления, в которой находится клетка в тот или иной момент времени, и чувствительность к лекарству.
Пример 1. Тест по ингибированию in vivo пролиферации стволовых клеток.
Для обнаружения пролиферации множества КОЕ в S-фазе клеточного цикла используется "суицидный" метод с применением меченого H3-тимидина (Becker et al., Blood 26:296-308, 1965).
Незрелые предшественники гемопоэтического пути - колониеобразующие единицы в селезенке (КОЕ-S) - могут быть обнаружены in vivo по их способности образовывать через 8-12 дней после внутривенной инъекции гемопоэтических клеток в селезенке мышей, получивших летальную дозу облучения, макроскопические колонии (Till & McCulloch, 1961).
В стандартных исследованиях пролиферации КОЕ обычно используют "суицидный" метод по H3-тимидину (Becker et al., 1965). Этот метод основан на включении радиоактивно меченого тимидина (H3 -тимидина) - предшественника ДНК - в клетки в процессе синтеза ДНК. КОЕ-S, которые в момент тестирования находились в S-фазе, были убиты высокой радиоактивностью и поэтому не способны образовывать колонии в селезенке. Таким образом, различие между количеством КОЕ-S, образованных при инъекции клеточного образца, после инкубации его без H3-тимидина и в присутствии H3 -тимидина указывает на уровень пролиферации КОЕ-S в исходном образце (в процентах).
Тест на ингибирование не может быть проведен с популяцией стволовых клеток из костного мозга нестимулированных животных, поскольку ингибитор не воздействует на цикл КОЕ, уровень которых в костном мозге нормальных мышей составляет всего 7-10%.
Для стимуляции пролиферации КОЕ используют фенилгидразин (ФЗ) или облучение сублетальными дозами (Lord, 1976).
Авторы использовали инъекцию тестостерона пропионата (ТСП) в связи с его стимулирующим относительно образования КОЕ действием (Byron et al., Nature, 228: 1204, 1970), что упростило тестирование и не вызывало никаких побочных эффектов. ТСП индуцировал стимуляцию пролиферации КОЕ в течение 20-24 часов с момента инъекции, при этом данный эффект мог отмечаться в течение еще как минимум 7 дней.
Процедура, примененная для скрининга фракций в ходе очистки ингибитора, была следующей:
Мыши. В течение всего исследования использовали штаммы мышей BDF1 или CBF1.
Мышей-доноров обрабатывают дозой ТСП, равной 10 мг/100 г, путем его внутрибрюшинной инъекции в расчете 0,2 мл на мышь с целью достижения 30-35% индукции образования КОЕ в S-фазе.
Через двадцать четыре часа из бедренной кости отбирают костный мозг для приготовления препарата клеточной суспензии. После этого в течение 3,5 часов инкубируют от пяти до десяти миллионов клеток на 1 мл с различными контрольными и опытными фракциями при 37oC в водяной бане с использованием для каждой группы по две пробирки (с горячим и холодным содержимым).
Через 3,5 часа к каждой горячей пробирке добавляют H3-тимидин (1 мКи/мл, удельная активность 18-25 Ки/ммоль) в расчете 200 мкл на 1 мл клеточной суспензии, тогда как к холодным пробиркам ничего не добавляют, а инкубацию при 37oC заканчивают на 30 минут позже.
По прошествии 30 минут инкубации реакцию с убитыми клетками останавливают добавлением 10 мл холодной (4oC) среды, содержащей 400 мкг/мл нерадиоактивного тимидина. Клетки тщательно отмывают (3 раза).
Подлежащие повторному суспендированию клетки разбавляют для инъекции в объеме 0,3-0,5 мл до подходящей концентрации, которая обычно составляет 2-4 • 104 клеток в расчете на одну мышь.
Группу мышей-реципиентов, включающую 8-10 животных, подвергают облучению не позднее чем за 6 часов до инъекций.
На 9-10-й день отбирают селезенки из мышей-реципиентов, фиксируют их в растворе Теллесницкого (Tellesnitsky's solution) и подсчитывают визуально число колоний. С помощью формулы вычисляют процент клеток, находящихся в S-фазе.
При этом: a - число КОЕ без H3-тимидина;
b - число КОЕ при наличии H3-тимидина.
Представленные в табл. 1 данные по исследованию ИНПРОЛа показывают, что делящиеся стволовые клетки после обработки их ИНПРОЛом становятся устойчивыми к действию H3-тимидина. То же наблюдение справедливо также в отношении специфичных к S-фазе цитотоксических препаратов - цитозинарабинозида и гидроксимочевины (данные не представлены). Если обработанные стволовые клетки затем промыть холодным раствором, содержащим нерадиоактивный тимидин, выжившие стволовые клетки пролиферируют в селезенке мышей, образуя, как и в норме, колонии.
Пример 2. Тест по ингибированию in vitro пролиферации стволовых клеток.
С использованием указанной ниже тестовой системы (Lord et al., The Inhibitors of Hematopoiesis, pp. 227-239, 1987) был продемонстрирован непосредственный эффект ИНПРОЛа. Несущие свойственный линии стволовых клеток фактор (ИЛ-3) клетки FDCPmix A4 (A4) поддерживают на среде Дульбекко, модифицированной по способу Искова (IMDM-среда), которая содержит 20% лошадиной сыворотки и 10% WEHI-3 - стандартизованной среды в качестве источника колониестимулирующего фактора ИЛ-3.
Тест по включению тритированного тимидина проводится следующим образом: 5 • 104 клеток A4 в 100 мкл среды, содержащей 20% лошадиной сыворотки и 50% WEHI-3 CM, инкубируют при 37oC в течение 16 часов при наличии 5% CO2.
ИНПРОЛ или неочищенный ВМЕ (фракция IV) добавляют на старте. Затем к каждой группе для последующей трехчасовой инкубации добавляют 3HtdR (3,7 кБк в 50 мкл с удельной активностью 740 ГБк/ммоль). Уровень пролиферации измеряют на собранных клетках.

На фиг. 6 отражен уровень включения тритированного тимидина (3H-TdR) клетками FDCPmix-A4, растущими в присутствии нормированных доз экстракта из нормальных клеток костного мозга или ИНПРОЛа. Видно, что очищенная композиция ИНПРОЛа не менее чем в 1000 раз активнее исходного материала. Время экспозиции (16 часов) представляет собой существенный фактор, необходимый для эффективного ингибирования, что доказывает наличие непосредственного воздействия на стволовые клетки клеточной линии A4.
Пример 3. Ингибирование пролиферации КОЕ ИНПРОЛом, инъецируемым in vivo: дозировка и длительность действия.
Изучение действия ИНПРОЛа, инъецируемого in vivo, показало, что ИНПРОЛ обладает способностью эффективно блокировать вступление новых КОЕ в цикл деления, защищая таким образом эти клетки от цитотоксического воздействия применяемого впоследствии лечения, что свидетельствует, в свою очередь, о возможности его клинического использования.
Экспериментальное исследование имеет две цели: оценить действие ИНПРОЛа на КОЕ в случае инъецирования его in vivo, а также определить эффективную продолжительность действия ИНПРОЛа, при соотнесении его активности с циклом деления стволовых клеток.
На основании упоминавшегося выше, в примере 1, эффекта была применена инъекция тестостерона пропионата для стимулирования пролиферации КОЕ.
На день 0 мышам линии BDF1 инъецировали ТСП (10 мг/100 г); через 24 часа мыши в каждой группе получили единичную инъекцию ИПСК (ингибитора пролиферации стволовых клеток) (SCPI) внутрибрюшинно в следующих дозах: 0 мкг, 5 мкг, 10 мкг и 15 мкг в расчете на одну мышь.
Через двадцать четыре часа после инъекции ИПСК мышей умерщвляли и с помощью теста, приведенного в примере 1, подсчитывали процент делящихся КОЕ-S. Инъекция ТСП индуцировала повышение числа КОЕ-S до 50%, тогда как у необработанных мышей этот уровень составлял всего 7%. ИНПРОЛ даже в таких малых дозах, как 2 мкг/мышь, обладал способностью ингибировать индуцированную введением ТСП пролиферацию вплоть до нормального уровня.
Для оценки длительности наблюдаемого эффекта одной группе мышей (группа состояла из 21 мыши) инъецировали только ТСП, а второй инъецировали ТСП и ИНПРОЛ (ИНПРОЛ был введен через 24 часа после инъекции ТСП). Количество КОЕ-S измеряли каждые 24 часа в течение недели, отбирая каждый раз по три донора из каждой группы и промеряя уровень КОЕ-S в костном мозге животных по описанному выше методу (см. пример 1). Представленные на фиг. 7 данные показывают, что тогда как продолжительность действия ТСП составляет по крайней мере 7 дней, уже единичная инъекция ИНПРОЛа может привести КОЕ-S в состояние покоя и вывести их из цикла деления не более чем на 48-72 часа. Поскольку большая часть применяемых для химиотерапии рака и лейкоза химиотерапевтических средств имеют in vivo сравнительно короткий период полувыведения, обычно менее 24 часов, действие ИНПРОЛа в соответствии с полученными данными поддерживается в организме дольше, чем то эффективное время, в течение которого химиотерапевтические средства, такие как цитозинарабинозид или гидроксимочевина, проявляют активность in vivo. И, что более существенно, поскольку курсы химиотерапии, равно как и лучевой терапии, включают более длительные обязательные интервалы времени (больше чем 24 часа и меньше чем 96 часов) между первой (не направленной на повреждение стволовых клеток) и второй (цитотоксической, повреждающей КОЕ) процедурами, даже единичной инъекции ИНПРОЛа во время интервала между двумя применениями химиотерапевтических средств или сеансов облучения было бы достаточно. Зная длительность действия ИНПРОЛа, та же самая стратегия может найти применение также в случае нескольких повторяющихся циклов цитотоксической терапии или лучевой терапии.
Пример 4. ИНПРОЛ защищает от повторного воздействия 5-ФУ самые ранние стволовые клетки, стимулированные к делению вскоре после обработки 5-ФУ.
Лекарственное средство, такое как 5-фторурацил (5-ФУ), серьезно снижает число клеток в миелоидном и лимфоидном материале. Обычно считается, что при специфичности к клеточному циклу, мечение высоко пролиферирующих клеток в связи с включением нуклеотидного аналога в ДНК в S-фазе клеточного цикла или перед нею приводит к смерти клетки. Длительное выживание и восстановление иммуногемопоэза в костном мозге мышей не подвержены воздействию единичной дозы 5-ФУ; однако было показано (Harrison et al., Blood 78:1237-1240, 1991), что полипотентные гемопоэтические стволовые клетки [ПГСК (PHSC)] становятся чувствительными ко второй дозе 5-ФУ в течение короткого периода времени, примерно в течение 3-5 дней после приема инициирующей дозы. Это явление можно объяснить тем, что ПГСК, в норме делящиеся очень медленно, после приема единичной дозы 5-ФУ ускоряют вступление в цикл, а под действием инициирующей обработки 5-ФУ происходит их стимуляция к быстрому делению. Авторы предположили, что при действии ИНПРОЛа ПГСК вновь могут вернуться к состоянию медленного деления, что защищает их таким образом от повторной обработки 5-ФУ.
В этом эксперименте были использованы самцы мышей линии BDFI. Раствор для хранения 5-ФУ (Сигма) готовят в физиологическом растворе в концентрации 10 мкг/мл. Каждая мышь в опытной группе получала 2 мг 5-ФУ на 10 г веса тела через хвостовую вену на день 0 эксперимента; спустя 24 часа мышам инъецировали ИНПРОЛ (10 мкг/100 г веса тела) внутрибрюшинно, а на день 3 эксперимента им инъецировали вторую дозу 5-ФУ. Исследование выживаемости проводилось при отслеживании уровня летальности мышей в экспериментальных (обработка ИНПРОЛом) и контрольных группах, содержащих каждая по 30 мышей. Кривые выживания приведены на фиг. 8.
Пример 5. Действие предварительной инкубации с ИНПРОЛом в сравнении с МВП-1-альфа на клетки костного мозга мышей.
Целью настоящего эксперимента является сравнение воздействия in vitro предварительной инкубации с ИНПРОЛом и МВП-1-альфа на клетки костного мозга мышей.
Применялась следующая процедура.
In vivo: мышам линии BDF1 6-15-недельного возраста инъецируют внутрибрюшинно 5-ФУ в дозе 200 мг/кг за 48 часов до отбора костного мозга из бедренной кости.
In vitro: из суспензии, полученной из одной клетки, после подсчета
отбирают 5•106 клеток и инкубируют их в 2 мл с добавлением ИНПРОЛа или без него, или с МВП-1-альфа, а также в присутствии 5% лошадиной сыворотки, среды Дульбекко в модификации Искова,
с добавлением L-глутамина при 37oC в течение 4 часов при наличии 5% CO2. После инкубации клетки промывают дважды и вновь подсчитывают их количество. Затем их помещают на
метилцеллюлозу с соблюдением следующих конечных условий:
0,8% метилцеллюлоза
25% лошадиная сыворотка
20 нг/мл рекомбинантного мышиного ИЛ-3
добавленный
L-глутамин
5 • 105 клеток на 1 мл
среда Дульбекко, модифицированная по способу Искова.
Чашки инкубируют в течение 11 дней при температуре 37oC при 100% влажности и наличии 5% CO2. Подсчитывают колонии, состоящие более чем из 50 клеток (см. табл. 2).
Пример 6. ИНПРОЛ ингибирует пролиферацию потенциальных высокопролиферирующих колоний (HPP-CFC).
Тестом, позволяющим оценивать in vitro восстановление стволовых клеток и обнаруживать ранние предшественники, является тест по определению потенциальных высокопролиферирующих колоний (HPP-PFC); другие аналогичные тесты, такие как КОЕ-А, КОЕ-ГМ, КОЕ-Е и КОЕ-ГЕММ, позволяют обнаруживать весьма ограниченные популяции предшественников (M. Moore, Blood 177:2122-2128, 1991). Этот пример показывает, что предварительная обработка клеток ИНПРОЛом ингибирует их пролиферацию, тогда как МВП-1-альфа не в состоянии оказывать такое воздействие в описываемых экспериментальных условиях.
Мышей линии BDF1 перед оценкой в их костном мозге числа потенциальных высокопролиферирующих колоний (HPP-CFC) обрабатывают 5-фторурацилом (200 мг/кг, внутрибрюшинно). Клетки промывают с применением центрифугирования и инкубируют при плотностях от 106 до 5 • 106/мл в среде с добавлением или без добавления (контроль) исследуемого средства - ИНПРОЛа (25 нг/мл) или МВП-1а (200 нг/мл) в течение 4 часов. По окончании инкубации клетки промывают и наносят на чашки Петри с агаром (0,3%), содержащим 30% эмбриональной телячьей сыворотки (FCS) и сложную стандартизованную среду из клеточных линий 5637 и WEHI-3B (в соответствии с рекомендацией Sharp et al., по 7,5% каждой стандартизованной среды). Концентрация клеток при засеве на чашки Петри (60 мм диаметр) составляет 5 • 104 клеток/мл. На 14-й день проводят подсчет числа колоний, полученные при этом результаты представлены в табл.3.
Как видно из полученных результатов, МВП-1а не ингибирует пролиферацию большей части незрелых предшественников, которые присутствуют лишь в периоде предварительной инкубации. А ИНПРОЛ в этих же условиях демонстрирует эффективное ингибирование, что указывает на существование фундаментальных различий в биологической активности ИНПРОЛа и МВП-1а.
Пример 7. Терапевтическое воздействие ИНПРОЛа на восстановление аплазии костного мозга, индуцированной облучением.
Аплазия костного мозга представляет собой наиболее существенное проявление токсичности, ограничивающее размеры применения лучевой терапии при лечении рака. Было показано, что ряд ростовых факторов (таких, как Г-КСФ, ГМ-КСФ, эритропоэтин) могут ускорять восстановление костного мозга от аплазии, индуцированной облучением. Идея о возможности защиты с помощью ингибитора пролиферации стволовых клеток представляет собой отличный от существующих методов, дополняющий их подход к снятию возникших гематологических повреждений. С применением описанной ранее (примеры 3, 4) процедуры, была отработана модель обработки мышей летальной дозой облучения. Известно, что мыши, получающие 9 Гр кобальта 60, начинают умирать на 10-14-й день после получения дозы, а на 30-й день уровень смертности достигает 50%. В примененной авторами модели летальная доза была разделена на два последовательных приема по 4,5 Гр каждый с интервалом между ними в 3 дня. Предварительные данные показывают, что полученная в этой модели кривая выживаемости близка к таковой, известной для единичного облучения дозой в 9 Гр; кроме того, тестирование уровня пролиферации КОЕ выявило, что через 24 часа после первого сеанса облучения была достигнута 35-50% индукция пролиферации КОЕ. И такие клетки уже могут быть защищены с помощью ингибитора стволовых клеток, вводимым перед второй дозой.
Для изучения такой возможности мыши (50 мышей/группу) получали 4,5 Гр на день 0, а через 24 часа им вводили внутрибрюшинно ИНПРОЛ в дозе 2 мкг/мышь, при этом контрольной группе инъецировали физиологический раствор, а вторая доза облучения в 4,5 Гр была применена на 3-й день.
Из фиг. 9 видно, что единичная доза ИНПРОЛа повышает выживаемость мышей. В описываемой модели подобраны условия, клинически релевантные тому или иному виду рака, который представлен в эксперименте для лечения, включая твердые опухоли, такой вид терапии может быть проведен пациенту путем введения пациенту, имеющему рак, эффективной дозы ИНПРОЛа в интервале между двумя последовательными сеансами облучения, что позволяет повысить необходимую для лечения дозу облучения. Возможно, кроме того, распространить указанную модель на случай лечения химиотерапевтическими средствами.
Пример 8. Использование ИНПРОЛа для аутологичной трансплантации костного мозга.
Трансплантация костного мозга представляет собой единственный известный способ, применяемый для лечения некоторых видов лейкоза (хронический миелолейкоз, острый миелобластный лейкоз и др.). Подготовка in vivo трансплантатов костного мозга (ТКМ) для последующей инфузии могла бы предоставить потенциальные аутологичные источники нормальных стволовых клеток, которые, будучи не загрязненными лейкозными клетками, способны вызвать обновление гемопоэтической системы реципиента, создав таким образом условия для агрессивной и эффективной терапии.
1. Модель длительной культуры лейкозных клеток L1210 костного мозга для изучения способности ИНПРОЛа сохранять нормальный гемопоэз при использовании для очистки АраЦ.
Длительные культуры костного мозга [ДККМ (LTBMC)] получают по способу Токсоза с соавт. (Toksoz et al., Blood 55:931-936, 1980), а лейкозная клеточная линия L1210 была адаптирована к ней в ходе совместного культивирования с ДККМ в течение 2 недель. Имеющий место в объединенной ДККМ/L1210 культуре одновременный рост как нормальных, так и лейкозных предшественников имеет сходство с ситуацией в костном мозге больного лейкозом. Возможность различия между нормальными колониеобразующими единицами КОЕ и лейкозными КОЕ может быть достигнута при выращивании их в виде колоний на агаре в присутствии или в отсутствие стандартизованной среды из WEHI-3 (клеточная линия мышей, продуцирующая ИЛ-3). Нормальные клетки подвергаются в отсутствие ИЛ-3 апоптозу, тогда как в этих же условиях лейкозные клетки образуют колонии. Суспензия клеток из объединенной среды ДККМ/L1210 образует примерно 150 колоний при наличии ИЛ-3 (нормальные гемопоэтические клоны) и 70 колоний при росте без ИЛ-3 (лейкозные клоны) в расчете на 50000 клеток на чашке Петри.
Процедура очищения состоит в следующем: на день 0 всю клеточную суспензию и среду (10 мл/колбу) отбирают из колбы с объединенной средой ДККМ/L1210 и переносят в 2 мл среды, содержащей 200 мкг цитозинарабинозида (АраЦ) (Tsyrlova et al., in Leukemia: Advances in Biology and Therapy, v. 35, 1988); после 20 часов инкубации содержимое колб промывают и вносят в 2 мл либо одной только свежей среды (контроль), либо среды, содержащей 25 нг/мл ИНПРОЛа на 4 часа. После такой предварительной инкубации клетки вновь инкубируют с АраЦ в количестве 100 мкг/колбу в течение 3 часов при 37oC. Каждая группа состоит из 4 колб. ДККМ/L1210 культуры промывают 3 раза и вносят в свежую среду для ДККМ, где их выдерживают, как и прежде, в исследованиях по регенерации, в течение 3-4 недель.
Полученные данные представлены на фиг. 10. Видно, что в контрольных культурах, обработанных только АраЦ, отсутствует клеточный рост, тогда как в тех колбах, где был введен для защиты ИНПРОЛ, отмечается более быстрая регенерация гемопоэза благодаря пролиферации предшественников из слоя слипшихся клеток. Более того, клетки из экспериментальной группы в случае помещениях их на агар растут только в присутствии ИЛ-3, образуя около 100 КОЕ на 50000 клеток; и по крайней мере, в течение 4 недель не отмечается роста лейкозных клеток. Таким образом, костный мозг, обработанный ex vivo эффективной дозой АраЦ в сочетании с ИНПРОЛом, может быть очищен от раковых клеток, при одновременной защите стволовых клеток. Представляется возможным распространить описанный способ на другие виды химиотерапевтического или радиотерапевтического лечения.
2. Способность костного мозга к обновлению [СМО (MRA)] и повышению уровня защиты от радиации (в течение 30 дней) in vitro в присутствии ИНПРОЛа.
СМО - способность клеток костного мозга у облученных летальной дозой мышей к обновлению совместно со способностью приобретать устойчивость к радиации. При радиопротекторном воздействии в течение 30 дней можно непосредственно измерить in vivo, что позволяет оценить потенциал выживания у животных с миелосупрессией (Visser et al., Blood Cells, 14:369-384, 1988).
При изучении радиопротекторного воздействия мышей линии BDF1 облучают дозой 9,5 Гр, после чего проводят восстановление путем трансплантации костного мозга от стимулированных тестостероном доноров. Восстановление одной группы реципиентов проводят клетками костного мозга, прошедшими в течение 4 часов предварительную инкубацию со средой (контроль - группа A), тогда как для другой группы (группы B) проводят предварительную инкубацию с ИНПРОЛом в количестве 25 нг/мл. В обеих группах клетки после инкубации промывают и трансплантируют в облученных животных в количестве 30000 клеток в расчете на одну мышь. На фиг. 11 представлены данные по выживаемости. При этом отражены суммарные результаты 3 экспериментов, при наличии контроля, принимаемого за 100%. Инкубация с ИНПРОЛом повышает выживаемость мышей с 36,5% в контрольной группе до 61,8% в экспериментальной группе на 30-й день после обработки.
Повышение СМО, индуцированное проведением предварительной инкубации с ИНПРОЛом, может представлять собой один из механизмов, определяющих усиление радиопротективной способности. Для рассмотрения этой гипотезы по методу Виссера с соавт. (Visser et al.) (op.cit) было проведено измерение СМО. В общих чертах эта процедура может быть представлена следующим образом: мышам-донорам линии BDF1 предварительно вводят тестостерон, после чего взятый из них костный мозг, инкубированный предварительно со средой или с ИНПРОЛом в течение 4 часов, затем вновь инъецируют в облученных мышей. На 13-й день клетки костного мозга из бедренной кости животных-реципиентов в трех различных концентрациях (0,01, 0,05, 0,1 эквивалентные количества костного мозга в бедренной кости) помещают на агар в чашки Петри в присутствии 20% лошадиной сыворотки и 10% WEHI-CM. Количество образованных на 7-й день колоний отражает уровень СМО, равно, как число колониеобразующих клеток в костном мозге реципиентов в тот период времени, когда у доноров имелись предшественники незрелых стволовых клеток.
Как видно из фиг. 12, СМО клеточной популяции, прошедшей предварительную инкубацию с ИНПРОЛом, выше, чем в контрольной группе (B).
Пример 9. Антипролиферативное действие ИНПРОЛа может оказывать влияние на снижение имеющихся при дифференцировке аномалий.
Гиперпролиферация КОЕ наблюдается не только в ходе процесса восстановления клеток после воздействия цитотоксических средств или облучения, но имеет место также в норме при старении и, как считается, является важным компонентом при миелодиспластическом синдроме (МДС). При этом гиперпролиферация сопровождается нарушениями дифференцировки клеток, такими как превалирование эритроидной дифференциации над дифференциацией гранулоцитов.
Клетки костного мозга инкубируют в течение 4 часов при температуре 37oC с 25 нг/мл ИНПРОЛа или средой (контроль), промывают и затем помещают на чашки Петри, содержащие агар с 20% лошадиной сывороткой, 2 Ед/мл эритропоэтина и 10% WEHI-CM. Количество BFU (ранний эритроидный предшественник, образующий "взрывообразные" колонии) и ГМ-КОЕ подсчитывают на 7-й день. Представленные в табл. 4 результаты обобщают данные 3 экспериментов, при этом в каждой группе для каждой точки берут по 4 животных и помещают их на 4 чашки Петри.
Как явствует из данных табл. 4, инкубация нормального костного мозга (НКМ) из интактных животных (BDF1, 8-12- недельного возраста) с ИНПРОЛом не изменяет числа или соотношения различных типов колоний: BDF1 доноры, получившие предварительно тестостерона пропионат (ТСП), демонстрируют усиление пролиферации КОЕ, как это отмечалось и ранее (примеры 1, 3, 4), и увеличение числа эритроидных предшественников (BFU колонии) при снижении числа ГМ-КОЕ, которые полностью исчезают при инкубации с ИНПРОЛом. Аномально высокий уровень пролиферации КОЕ снижается, возвращаясь вплоть до 10% уровня КОЕ в S-фазе клеточного цикла. Известно, что гиперпролиферация КОЕ свойственна некоторым штаммам мышей, обладающим высокой чувствительностью к индукции вирусного лейкоза, таким как, например, Balb/c мыши (табл. 4), а также может отмечаться у старых животных (табл. 4). Такое же перераспределение отмеченных предшественников, как у мышей линии BDF1, получавших ТСП, показано и у мышей линии Balb/c, а также у старых (23-25 месяцев) мышей линии BDF1, при этом общим для всех них свойством является аномально высокий уровень пролиферации КОЕ. Коррекция как уровня пролиферации КОЕ, так и дифференцировки возможна при инкубации клеток с ИНПРОЛом. Что представляется еще более существенным с клинической точки зрения, так это выявление того факта, что инъекция in vivo ИНПРОЛа (2 мкг/мышь) оказывает воздействие и на пролиферацию КОЕ, и на изменение соотношения эритроидных (BFUe) и ГМ-колоний (табл. 4).
Пример 10. Иммуностимулирующее действие ИНПРОЛа.
Было показано, что инкубация клеток костного мозга, содержащих большую часть пролиферирующих КОЕ, с ИНПРОЛом не только изменяет цикл КОЕ, но также воздействует на их дифференцировку, переключая с преимущественно эритроидной дифференцировки на образование гранулоцитарных и лимфоидных предшественников. Это свойство ИНПРОЛа имеет большое значение в связи с наличием иммуносупрессорного состояния, возникающего как побочный эффект после цитотоксической химиотерапии, после радиотерапии, а также в случае заболеваний, приводящих к гиперпролиферации стволовых клеток, и при старении, сопровождающихся также развитием иммуносупрессии.
Настоящий пример демонстрирует непосредственное воздействие ИНПРОЛа на дифференцировку незрелых предшественников из длительной лимфоидной культуры [ДЛК (LLNC)] (выращенной в соответствии с методикой Wittlock & Witte, Ann. Rev. Immun., 3:213-235, 1985) на предшественники пред-B, оцениваемое по образованию колоний на метилцеллюлозе, содержащей ИЛ-7.
ДЛК получают по описанному выше методу, вводя два раза в неделю свежую среду для ДЛК (Terry Fox Labs., Vancouver, Canada). Один раз в неделю собирают неслипшиеся клетки, отмывают от факторов среды и в течение 4 часов инкубируют либо с 25 нг/мл ИНПРОЛа, либо только с одной средой в качестве контроля. По окончании инкубации клетки промывают и помещают на чашки Петри в концентрации 105 клеток/мл на метилцеллюлозу, содержащую 30% эмбриональной телячьей сыворотки (FCS) и 10 нг/мл ИЛ-7. На фиг. 13 представлены результаты, полученные через 3 недели выращивания. Количество больших пред-B колоний варьирует в контроле, увеличиваясь с течением времени, тогда как предварительная инкубация с ИНПРОЛом неизменно в 4-8 раз стимулирует рост колоний в сравнении с уровнем контроля. Этот факт указывает на наличие у ИНПРОЛа иммуностимулирующей способности, которая может быть использована для коррекции иммунодефицитных состояний и усиления желательного иммунного ответа, в случае вакцинации.
Пример 11. ИНПРОЛ улучшает способность к обновлению стволовых клеток в длительной культуре, содержащей инициирующие клетки от пациентов с ХМЛ (хроническим миелоидным лейкозом).
Хронический миелоидный лейкоз (ХМЛ) представляет собой летальное заболевание гемопоэтических стволовых клеток. Лечение ХМЛ в хронической фазе единичным химиотерапевтическим средством с применением комбинированной химиотерапии, спленэктомии или облучения селезенки может лишь контролировать клинические проявления и симптомы, но не в состоянии значительно продлить выживание. Поскольку ХМЛ прогрессирует от хронической к ускоренной стадии, стандартная терапия неэффективна. В настоящее время известен лишь один способ, способный приводить к излечиванию ХМЛ, - это трансплантация костного мозга. Однако применение для лечения неродственного трансплантата костного мозга встречает трудности, связанные с тканевой несовместимостью. Менее чем у 40% обследованных пациентов с ХМЛ имеется подходящий родственный донор, поэтому предпочтительна аутологичная трансплантация. Реализация возможности введения ex vivo в аутологичный трансплантат костного мозга для инфузии механизма отбора от Ph-положительных пациентов нелейкозных (Ph-отрицательных) миелоидных предшественников, растущих в длительной культуре (ДК), дает основание предположить, что аутологичные источники нормальных стволовых клеток могут найти применение в агрессивной и эффективной терапии ХМЛ.
В контексте трансплантации костного мозга гемопоэтические стволовые клетки могут быть определены как клетки, обладающие способностью в течение длительных периодов времени генерировать зрелые клетки крови. Авторами была использована методика выращивания длительной культуры человеческих клеток (C. Eaves & A. Eaves), разработанная для подсчета числа стволовых клеток с целью дальнейшего применения полученных результатов для терапевтического использования. Указанный метод включает посев клеток на слой подготовленных, облученных, слипшихся клеток костного мозга, после этого проводят инкубацию полученных культур в течение 5 недель. Конечная точка культивирования дает значение общего содержания клонообразующих клеток (слипшиеся + неслипшиеся клетки) в культурах, собранных в конце указанного периода времени. Выход в этих условиях клонообразующих клеток соотносится линейным образом с количеством изначально введенных предшественников [длительная культура инициирующих клеток ДКИК (LTC-IC)]; средний выход для индивидуальной ДКИК человека составляет 4 клонообразующих предшественника на ДКИК. Поскольку ранее было показано, что в случае помещения костного мозга от пациентов с ХМЛ в аналогичные условия число лейкозных (Ph-положительных) клонообразующих клеток быстро снижается, то при подсчете количества остаточных нормальных инициирующих клеток из длительной культуры (ДКИК) у пациента с ХМЛ можно отобрать те их них, на которых наиболее выгодно проводить интенсивную терапию, при поддержке в виде трансплантации полученного при культивировании аутотрансплантата (Philips et al., Bone Marrow Transplantation, 9:477-487, 1991).
Ниже приведена процедура, которая была использована для изучения действия ИНПРОЛа на множестве клонообразующих клеток (ДКИК) в среде трансплантированных клеток костного мозга, взятых из периферической крови больного с ХМЛ.
Культуры начинают выращивать как длительные культуры на предварительно облученной строме. Периферическая кровь здорового донора используется в качестве контроля. Клетки периферической крови от пациента с ХМЛ подвергают предварительной инкубации либо при наличии ИНПРОЛа (25 нг/мл), либо в его отсутствие в течение 4 часов, промывают, помещают в систему для длительного выращивания инициирующих клеток (ДКИК) на 10 дней и параллельно, также в ДКИК, на 5 дней. Количество инициирующих клеток в длительной культуре оценивают по числу клонообразующих предшественников, помещая как слипшиеся, так и неслипшиеся клетки на чашки Петри на метилцеллюлозу, содержащую соответствующие ростовые факторы (Terry Fox Laboratories, Vancouver, Canada). Смесь слипшихся и неслипшихся клеток из культур, растущих в течение 10 дней, предварительно инкубируют при наличии ИНПРОЛа или в его отсутствие, после чего помещают на подходящую питательную среду еще на 8 недель, собирают клетки по окончании 4-й и 8-й недели для последующего подсчета числа клонообразующих клеток. Представленные на фиг. 14 данные показывают, что в течение первых 10 дней не происходит потери инициирующих клеток в длительной культуре (ДКИК), взятых из костного мозга здоровых доноров, при этом через 5 недель в культуре присутствует еще примерно 30% от исходного числа инициирующих клеток. Число инициирующих клеток в длительной культуре, взятых от пациентов с ХМЛ, катастрофически снижается примерно до 8% в течение 10-дневного периода и не восстанавливается в ходе дальнейшей инкубации, тогда как проведение предварительной инкубации с ИНПРОЛом увеличивает уровень инициирующих клеток в длительной культуре до 30% от значения исходного числа и поддерживает этот уровень в течение 8 недель.
Предполагаемые на основании приведенных предварительных данных клинические приложения включают их использование в стратегии селективного повышения содержания нормальных стволовых клеток в свежих или культивируемых трансплантатах костного мозга, в стратегии по стимулированию восстановления in vivo нормальных стволовых клеток, а также в методах переноса нового генетического материала в стволовые клетки костного мозга человека с целью дальнейшей их трансплантации в организм пациентов.
Пример 12. Способ выделения иммуноактивного ингибитора пролиферации стволовых клеток крови из препаратов костного мозга.
Костный мозг выделяют из ребер свиньи. Ребра отделяют от свиных туш и очищают от мышечных волокон и жира, нарезают на куски и экстрагируют костный мозг с помощью гидропресса (производство Биофизприбор). Центрифугированием на центрифуге К-70 со скоростью 2000 об/мин в течение 20 минут отделяют клетки костного мозга. Затем супернатант экстракта подвергают ультрафильтрации соответственно через мембраны Амикон ХМ-100, РМ-30, РМ-50 (США). Как показывают результаты анализа с помощью электрофореза, основным компонентом продукта является альбумин (см. фиг. 1).
Биохимическая очистка
Экстракт костного мозга и белковые компоненты фракций анализируют на каждой стадии очистки с помощью гель-электрофореза в 10%
полиакриламиде, содержащем 0,1% додецилсульфат натрия.
Электрофорез проводят в 20Y см геля в течение 5 часов. После этого гель окрашивают 0,25 Кумасси СВВС250 в смеси этанол : вода : уксусная кислота (5: 5: 1) в течение 1 часа при температуре 20oC и промывают несколькими порциями 7% уксусной кислоты. К образцам добавляют додецилсульфат натрия до концентрации 7% и меркапоэтанол до концентрации 0,5-1% и инкубируют образцы в течение 5 минут при температуре 70oC перед внесением их в гель.
Активность продукта оценивают по методу, основанному на определении уровня ингибирования пролиферации стволовых гемопоэтических клеток (КОЕ). В настоящем материале приведено подробное описание этого метода.
Стадия 1. Очистка с применением осаждения сульфатом аммония.
Активную фракцию выделяют посредством осаждения сульфатом аммония, начиная с 25% концентрации до 40-80% насыщения, отслеживая активность на основании результатов, представленных в табл. 5.
Количество препарата, используемого для тестирования на каждой стадии очистки, определяемое с учетом уровня очистки, эквивалентно дозе
в 2•10-2 мг инициирующего продукта. Активность вычисляют по формуле
% изменения = %Sa - %Sb,
где a обозначает %S в контроле;
b обозначает %S после
инкубации с опытной тестируемой фракцией.
Перед проведением тестирования активности и перед каждой новой стадией очистки исследуемую фракцию обессоливают до снижения в 20 раз концентрации сульфата аммония.
Стадия 2. Неочищенный ингибитор, полученный на стадии 1, подвергают после обессоливания фракционированию с помощью ионообменной хроматографии, в способе настоящего изобретения - хроматографии на ДЭФЭ-23-целлюлозе, после чего проводят элюцию в градиенте натрий-ацетатного буфера (pH 6,0).
Активные фракции ингибитора элюируются в интервале 3-5 мМ.
Объем использованной колонки составляет 1 мл, а скорость элюций поддерживают равной 4 мл в час. Обнаружение продукта проводят с помощью хроматографа Милликром при длинах волн 230 и 280 нм. Фракцию 1 (см. фиг. 2), в которой обнаружена наибольшая активность, выделяют и элюируют в 5 мМ натрий-ацетатном буфере (см. табл. 6).
Результаты электрофоретического разделения показывают, что основной загрязняющий белок - альбумин (см. фиг. 3) - удаляется из этой фракции, что приводит в результате к 4-кратному повышению уровня очистки.
Стадия 3. Частично очищенный ингибитор, полученный на стадии 2, наносят непосредственно на колонку с Сефадексом G-75.
Объем колонки составляет 20 мл (20х1), а скорость элюции поддерживается равной 2 мл/час. Для элюции используют буфер, состоящий из 50 мМ NaCl, 10 мМ Трис-HCl, pH 7,5. Обнаружение проводят на хроматографе Милликром при длинах волн 230 и 280 нм. После этого выделяют фракцию 5, в которой обнаружена наивысшая активность (см. табл. 7).
Стадия 4. Хроматографию с обращением фаз (Система Фармация FPLC) с использованием колонок Про-РЕК (Pro-REC) проводят на 10 уг матрицы Ультрасфера (Ultrasfera matrix) в 0,1% трифторуксусной кислоте, применяя для элюции градиент ацетонитрила.
Как показывают результаты анализа в полиакриламидном геле с додецилсульфатом натрия, гомогенность продукта с мол. массой 16-17 кДа составляет 90% (см. фиг. 6). На фиг. 4 представлены соответствующие данные. Активность обнаруживается во фракции 5. Окончательный выход продукта составляет 5%. В итоге после проведенной очистки общее количество белка с мол. массой 16 кДа составляет 650 нг/мл инициирующего продукта. В ходе очистки продукт инкубировали при температуре 70oC в течение нескольких минут, однако снижения биологической активности не было отмечено.
2. Тестирование пролиферации стволовых клеток in vivo (КОЕ).
Незрелые гемопоэтические предшественники -колониеобразующие единицы в селезенке - КОЕ могут быть обнаружены in vivo по образованию через 8-10 дней после внутривенной инъекции гемопоэтических клеток макроскопических колоний в селезенке облученных летальной дозой мышей (Till & McCulloch, 1961).
Обычно используют стандартное тестирование пролиферации КОЕ по методу H3-тимидинового "суицида" (Becker et al., 1970). Этот метод основан на включении радиоактивно меченого тимидина (H3-тимидина) - предшественника ДНК - в клетки в ходе синтеза ДНК (S-фаза клеточного цикла). КОЕ, которые в момент тестирования находятся в S-фазе цикла, погибают под действием высокой радиоактивности и не способны образовывать в селезенке колонии. Таким образом, различие в количестве КОЕ, образованных при инъекции клеточного образца, инкубированного без H3-тимидина, и такими же клетками, инкубированными в присутствии H3-тимидина, отражает разницу в уровне пролиферации КОЕ (в процентах).
Тестирование ингибитора нельзя выполнить с популяцией клеток костного мозга из нестимулированных животных, поскольку ингибитор воздействует на S-фазу цикла КОЕ, количество которых в костном мозге нормальных мышей составляет всего лишь 7-10%.
Для стимуляции пролиферации КОЕ применяют стимуляцию фенилгидразином (ФЗ) или облучением сублетальной дозой (Lord, Br. J. Haem. 34:441-445, 1976).
Авторы настоящего изобретения инъецировали тестостерона пропионат (ТСП), который обладает стимулирующим на цикл КОЕ воздействием (Byron et al., Nature 228:1204, 1970); это упростило тестирование, не вызывая никаких побочных эффектов. ТСП индуцировал стимуляцию пролиферации КОЕ в течение 20-24 часов после инъекции, при этом данный эффект отмечался как минимум в течение 7 дней.
Процедура, применяемая для скрининга фракций, получаемых при очистке ингибитора, представляет собой следующее.
Мыши: для всех тестирований используют BDF1 или CBF1 штаммы мышей.
Мыши-доноры получают ТСП в дозе 10 мг/100 г путем его внутрибрюшинной инъекции в расчете 0,2 мл на одну мышь с целью индуцирования 30-50% КОЕ в S-фазе.
Через двадцать четыре часа для приготовления препарата клеточной суспензии из бедренной кости животных отбирают костный мозг. От пяти до десяти миллионов клеток на 1 мл инкубируют с различными контрольными и опытными фракциями в течение периода времени от 3 до 5 часов при 37oC в водяной бане, с использованием для каждой опытной группы двух пробирок (горячей и холодной).
Через 3-5 часов в каждую горячую пробирку добавляют по 200 мкл H3-тимидина на 1 мл клеточной суспензии (1 мCi/мл, удельная активность 18-25 Ci/мл), ничего не добавляя к холодным пробиркам, и продолжают инкубацию еще в течение 30 минут на 37oC.
По прошествии 30 минут инкубации реакцию с убитыми клетками останавливают добавлением 10 мл холодной (температура 4oC) среды, содержащей 400 мкг/мл нерадиоактивного тимидина. После этого клетки тщательно промывают (3 раза).
Затем клетки ресуспендируют и разбавляют до нужной для инъекции концентрации (обычно 2-4•104 клеток на мышь в 0,3-0, 5 мл).
Реципиентные мыши в количестве 8-10 на группу облучают не позже чем за 6 часов до инъекции.
На 9-12 день у мышей-реципиентов отбирают селезенки и фиксируют их
раствором Теллесницкого (Tellesnitsky's solution), подсчитывая визуально количество колоний. Процент клеток в S-фазе вычисляют с использованием формулы
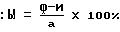
где a - число КОЕ при инкубации без H3-тимидина;
b - число КОЕ при инкубации с H3-тимидином.
Пример 12B. Альтернативный способ выделения больших количеств ИНПРОЛа.
Начальные этапы выделения
Ребра из свежих свиных туш очищают от мышечных волокон и жира, затем нарезают
на куски и погружают их в забуференный фосфатом физраствор в пропорции 1: 1 (вес/объем). Полученную смесь разрушают гидравлическим прессом для отделения костного мозга от твердого материала костного
мозга.
Собирают суспензию клеток костного мозга и отфильтровывают ее от твердых частиц фильтрованием через четырехслойный творожистый фильтр (cheese-cloth). Затем фильтрат инкубируют в течение 40 минут при температуре 56oC и охлаждают в ледяной бане до 4oC. Отделенный осадок удаляют центрифугированием при 10000g в течение 30 минут при 4oC и отбрасывают.
Очищенный супернатант добавляют по каплям в течение 30 минут к 10 объемам перемешиваемой смеси лед - холодный ацетон, содержащей 1% по объему концентрированной соляной кислоты. Полученную смесь выдерживают при температуре 4oC в течение 16 часов для полного формирования выпавшего осадка, затем осадок отделяют центрифугированием при 20000g в течение 30 минут при 4oC. Полученный осадок промывают холодным ацетоном и высушивают.
Очистка с помощью ВЭЖХ
Осадок растворяют в элюирующем буфере A для ВЭЖХ, содержащем 5%
ацетонитрила (VeCN) и 0,1% трифторуксусной кислоты (ТФУ), до конечной концентрации 8-10 мг/мл. Этот раствор (0,5-0,6 мл) наносят на колонку ВЭЖХ размером 250 х 4,6 мм, наполненную Полисилом ODS-300
(PolisilODS-300) (10 мкм) и уравновешивают тем же самым буфером A.
Элюцию проводят градиентом буфера B (90% MeCN, 0,1% ТФУ) в буфере A со скоростью 1 мл/мин в соответствии со
следующей программой:
Время, минуты - % от B
0 - 0
4 - 0
5 - 25
25 - 90
Для промывки колонки перед уравновешиванием вводят дополнительную стадию,
включающую применение 100% B в течение 5 минут. Затем колонку вновь уравновешивают для возвращения к исходному состоянию, позволяющему наносить новые порции белкового раствора.
В ходе разделения эффлюент из колонки исследуют при длине волны 280 нм для обнаружения белковых пиков. Фракции, содержащие белковый материал, собирают, выделенные пики объединяют и выпаривают на роторном испарителе при 30oC досуха. Полученный остаток растворяют в дистиллированной воде и исследуют в тесте на наличие биологической активности с помощью ДСН-ПААГ (SDS-PAGE) (14% гель, восстановительные условия). Пик, содержащий активный материал, который элюируют буфером B в концентрации от 70 до 80%, включает основную белковую полосу в 16 кДа и более быстрые в ДСН-ПААГ белки.
Результаты анализа активного материала представлены на фиг. 15. 500 мкг очищенного ИНПРОЛа наносят на колонку C4 с обращением фаз (Vydak) и элюируют с использованием линейного градиента 5-95% ацетонитрила в 0,1% трифторуксусной кислоте. В ходе элюции материал выходит в виде единичного пика при 53% ацетонитриле (фиг. 15A). Однако при разгоне в идентичных условиях 250 мкг МВП-1а (R & D Systems) он элюируется 43,9% ацетонитрилом (следует иметь в виду, что более ранние пики, появляющиеся до применения 14% ацетонитрила, являются артефактами, связанными с наличием в детекторе воздушных пузырьков). Таким образом, ИНПРОЛ представляется существенно более гидрофобным, чем МВП-1а в указанных условиях. Известно, что фактор роста Т-клеток-бета (ИЛ-2) (TGF-beta) элюируется при более низких концентрациях, чем те, что отмечаются для ИНПРОЛа в тех же условиях ("Miyazono et al., J. Biol. Chem., 263:6407-15, 1988).
Гель с элюированным материалом ИНПРОЛа представлен на фиг. 15C. Ряд 1 относится к неочищенному материалу, ряд 2 представляет собой маркеры соответствующей молекулярной массы и ряд 3 относится к очищенному материалу. На геле видны две основные полосы: одна соответствует примерно 14 кДа, а вторая примерно 35 кДа. Предполагается, что полоса в 35 кДа является мультимерной формой продукта полосы в 14 кДа.
Реферат
Изобретение относится к области медицины, а именно к использованию ингибиторов пролиферации стволовых клеток. В описании раскрываются способы выделения и использования факторов белковой природы, ингибирующих стволовые клетки, с целью регуляции аномального цикла стволовых клеток, а также для ускорения восстановления клеток периферической крови после химиотерапии. Кроме того, в описании и формуле изобретения раскрываются ингибиторы пролиферации стволовых клеток. Сущность изобретения заключается также в разработке способов лечения и создании фармацевтических композиций на основе этого ингибитора. Техническим результатом данного изобретения является расширение арсенала ингибиторов пролиферации стволовых клеток для использования в лечении онкологических заболеваний. 19 с. и 12 з.п. ф-лы, 7 табл., 15 ил.

Формула
30. Фармацевтическая композиция для лечения аутоиммунных заболеваний, старения, рака, миелодисплазии, прелейкемии, лейкемии, псориаза или других нарушений, включая гиперпролиферативные состояния, содержащая ингибитор по п.29 и фармацевтически приемлемый наполнитель или разбавитель.

Комментарии