Растворы полимеризованного гемоглобина с пониженным количеством тетрамера и способ их получения - RU2337705C2
Код документа: RU2337705C2
Чертежи













Описание
Ссылка на родственную заявку
Данная заявка заявляет приоритет предварительной заявки США № 60/443436, поданной 29 января 2003 г.
Область изобретения
Данное изобретение относится к стабилизированным растворам, переносящим кислород. Более конкретно, оно относится к растворам гемоглобина, в которых после соответствующей обработки повышается стабильность полимерных связей и снижается количество образующегося тетрамера.
Предпосылки создания изобретения
Существует настоятельная потребность в готовых кровяных продуктах для постоянно растущих нужд хирургии и травматологии, а также в пополнении банков крови. Растворы, содержащие кислород, такие как растворы на основе гемоглобина, можно использовать вместо цельной крови или красных кровяных клеток для пациентов, нуждающихся в повышении способности переносить кислород. Поскольку их применение не зависит от наличия донора, такие растворы могут быть легко доступными в чрезвычайной ситуации или при нехватке конкретных образцов в банке крови. Кроме того, из-за риска инфицирования патогенами, переносимыми кровью, при переливании крови пациент может предпочесть раствор на основе гемоглобина вместо цельной крови или красных кровяных клеток. В частности, такие растворы могут содержать, без ограничения, переносчики кислорода, кровезаменители и композиции на основе гемоглобина, такие как раскрытые в патентах США №№ 6498141, 6133425, 5464814, 5438041, 5217648, 5194590, 5061688 и 4826811, описания которых включены в данный документ в качестве ссылки во всей их полноте.
В данной области известно, что не содержащий стромы гемоглобин способен осуществлять транспорт кислорода и обратимо связывать кислород (или лиганд). Однако применение растворов гемоглобина, способных переносить достаточное для поддержания жизни количество кислорода, связано с некоторыми проблемами вследствие ряда нежелательных побочных эффектов, таких как ухудшение функционирования почек. Полагают, что данные эффекты обусловлены присутствием в растворе нежелательных примесей, таких как бактериальный эндотоксин или фрагменты мембран красных кровяных клеток (строма). Хотя эти примеси действительно могут вызывать изменения в функционировании почек, растворы гемоглобина, по существу не содержащие таких примесей, тем не менее тоже вызывают значительную почечную дисфункцию. Причиной почечной дисфункции в числе прочего могут являться физиологически неприемлемые количества неполимеризованного тетрамера гемоглобина.
Растворы гемоглобина, по существу не содержащие тетрамера, можно использовать для пополнения практически всего объема крови пациента-человека, при этом они не вызывают сужения кровеносных сосудов, нефротоксичности, гемоглобинурии или других проблем, связанных с внутривенным введением синтетических или полусинтетических переносчиков кислорода и кровезаменителей. Хотя указанные растворы обладают превосходной эффективностью, срок годности данного продукта ограничен, так как известно, что гемоглобиновый полимер со временем медленно деградирует с образованием тетрамерных элементов. Соответственно, существует потребность в способе сохранения раствора в виде раствора, по существу не содержащего тетрамера, в течение длительного периода времени с целью увеличения срока годности раствора.
Краткое описание изобретения
В одном аспекте изобретение предлагает способ получения раствора гемоглобина, по существу не содержащего тетрамера, включающий в себя полимеризацию гемоглобина в растворе, обработку полимеризованного гемоглобина для образования тетрамера и удаление тетрамера из раствора полимеризованного гемоглобина.
В другом аспекте данное изобретение относится к раствору гемоглобина, по существу не содержащему тетрамера, полученному путем полимеризации раствора гемоглобина, тепловой обработки раствора полимеризованного гемоглобина для образования тетрамера и удаления тетрамера из раствора полимеризованного гемоглобина.
В другом аспекте изобретение относится к способу стабилизации раствора полимеризованного гемоглобина, включающему в себя обработку раствора полимеризованного гемоглобина с частичным разложением полимеризованного гемоглобина до тетрамера и удаление тетрамера из раствора.
В следующем аспекте изобретение предлагает способ получения стабилизированного раствора полимеризованного гемоглобина. Данный способ включает в себя получение раствора полимеризованного гемоглобина, удаление тетрамера из раствора полимеризованного гемоглобина с получением раствора полимеризованного гемоглобина, по существу не содержащего тетрамера, выдерживание раствора полимеризованного гемоглобина для образования тетрамера и удаление образовавшегося тетрамера. Выдерживание может включать в себя хранение раствора гемоглобина до тех пор, пока концентрация тетрамера не превысит приблизительно 1,0% от общего содержания гемоглобина, например, дольше одного года.
Гемоглобин можно получить из крови млекопитающего, например, из человеческой или бычьей крови. Полимеризацию гемоглобина можно проводить в присутствии глутаральдегида. Тетрамер можно удалить фильтрацией. Обработку полимеризованного раствора, приводящую к образованию тетрамера, можно проводить путем нагревания раствора при температуре приблизительно выше 45°C в течение, по меньшей мере, приблизительно 24 часов. После удаления тетрамера его остаточная концентрация в растворе может составлять менее чем приблизительно 1,0% по отношению к общему содержанию гемоглобина в растворе или менее чем приблизительно 0,3% по отношению к общему содержанию гемоглобина в растворе.
Краткое описание фигур
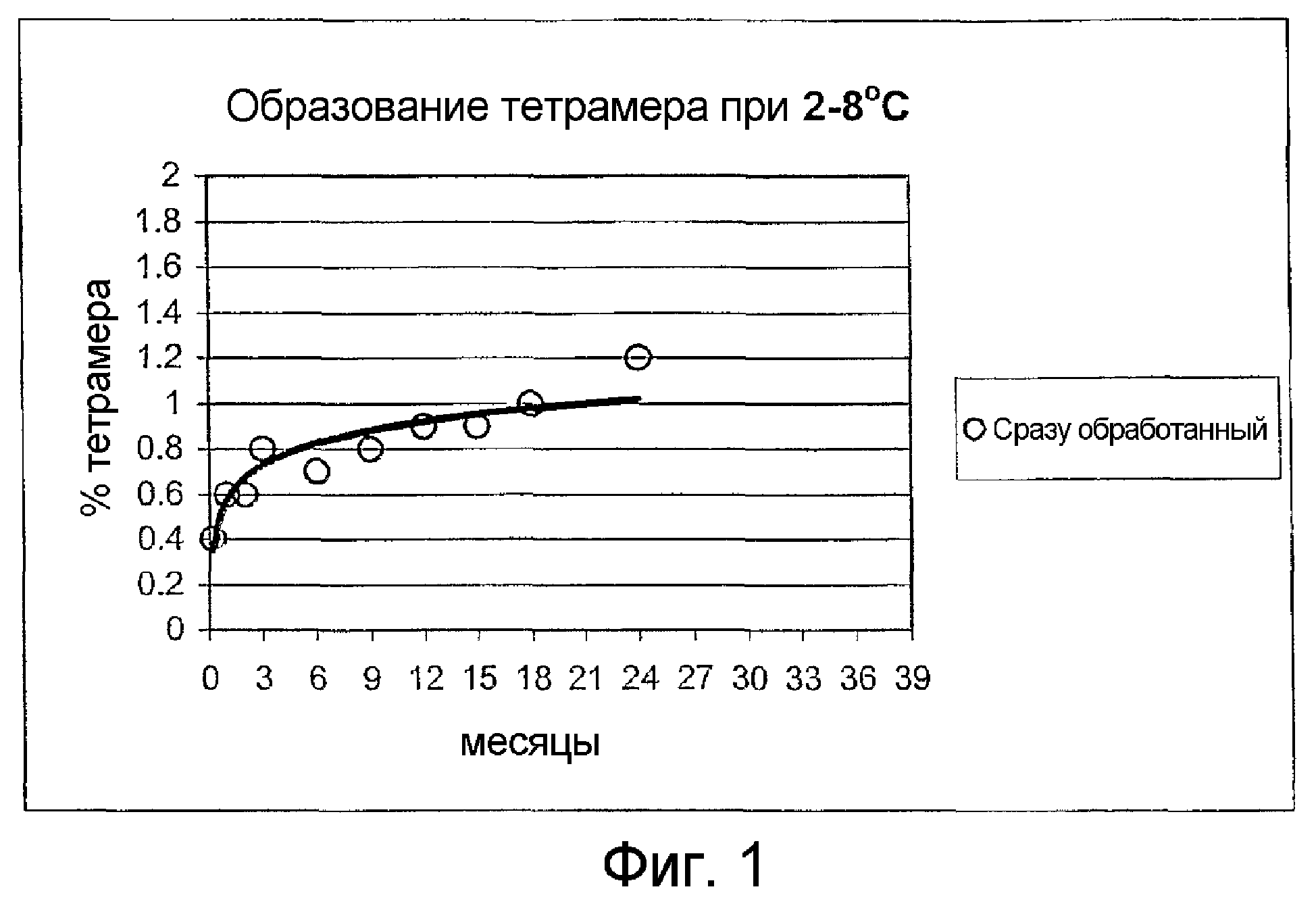
На фиг.1 показано количество тетрамера, образующегося в растворах гемоглобина после хранения при 2-8°C.
На фиг.2 показано количество тетрамера, образующегося в растворах гемоглобина после хранения при 23-27°C.
На фиг.3 сравнивается образование тетрамера в сразу обработанных растворах гемоглобина и в повторно обработанных выдержанных растворах гемоглобина после хранения при 2-8°C.
На фиг.4 сравнивается образование тетрамера в сразу обработанных растворах гемоглобина и в повторно обработанных выдержанных растворах гемоглобина после хранения при 23-27°C.
На фиг.5 сравнивается образование тетрамера в растворе гемоглобина, обработанного сразу, и в растворе, подвергавшемся горячему гашению, после хранения при 2-8°C.
На фиг.6 сравнивается образование тетрамера в растворе гемоглобина, обработанного сразу, и в растворе, подвергавшемся горячему гашению, после хранения при 23-27°C.
На фиг.7 сравнивается образование тетрамера в сразу обработанных растворах гемоглобина и в растворах, предварительно обработанных с целью вызвать образование тетрамера, после хранения при 2-8°C.
На фиг.8 сравнивается образование тетрамера в сразу обработанных растворах гемоглобина и в растворах, предварительно обработанных с целью вызвать образование тетрамера, после хранения при 23-27°C.
На фиг.9 приведена хроматограмма ВЭЖХ очищенного раствора полимеризованного гемоглобина. Полимеризованный гемоглобин характеризуется пиками, соответствующими времени удерживания 15,19, 16,01, 17,16 и 18,79. Тетрамер характеризуется пиками, соответствующими времени удерживания 21,22 и 21,83.
На фиг.10 приведена хроматограмма ВЭЖХ раствора полимеризованного гемоглобина после обработки глицином, но до очистки. Полимеризованный гемоглобин характеризуется пиками, соответствующими времени удерживания 14,62, 15,44, 16,60 и 18,24. Тетрамер характеризуется пиками, соответствующими времени удерживания 20,71. Содержание полимера в данном веществе составляет приблизительно 75%.
На фиг.11 приведена схема, изображающая часть способа получения раствора гемоглобина, не содержащего свободного кислорода и подлежащего впоследствии пиридоксилированию и полимеризации, а также оборудование, используемое в данном способе.
На фиг.12 приведена схема, изображающая часть способа получения очищенного, пиридоксилированного и полимеризованного гемоглобинового продукта, не содержащего свободного кислорода, начиная с пиридоксилирования и полимеризации, а также оборудование, используемое в данном способе, и часть способа получения конечного гемоглобинового продукта, содержащего физиологические уровни электролитов, а также оборудование, используемое в данном способе.
На фиг.13 приведена схема, изображающая процесс очистки методом колоночной хроматографии, использующийся в данном изобретении.
На фиг.14 приведена схема, изображающая процесс очистки методом фильтрации через полупроницаемую мембрану, использующийся в данном изобретении.
Подробное описание
Данное изобретение предлагает раствор, способный переносить кислород, который содержит поперечно-сшитый, полимеризованный гемоглобин и практически не содержит тетрамера, стромы, стромальных примесей и других загрязняющих веществ.
Перед подробным описанием настоящего изобретения приводится определение некоторых терминов. Следует понимать, что используемая здесь терминология предназначена не для ограничения, а только для описания конкретных воплощений. В данном описании единственное число включает в себя множественное число описываемых объектов, если контекст не предписывает иное толкование.
Термин "гемоглобин" относится к гемоглобину, полученному из любого источника. Гемоглобин может быть получен от млекопитающих, включая людей, крупный рогатый скот, свиней и овец, или из других источников, например, он может представлять собой трансгенный гемоглобин, описанный в BIO/TECHNOLOGY, 12: 55-59 (1994), и рекомбинантный гемоглобин, например, такой, как описанный в Nature, 356: 258-260 (1992). В данном описании % суммарного гемоглобина (THb) приведен в граммах гемоглобина/100 мл раствора.
Термин "раствор гемоглобина" относится к раствору тетрамерных или полимеризованных молекул гемоглобина, причем указанные молекулы не находятся внутри красных кровяных клеток. Отсутствие, или отсутствие по существу, стромы или стромальных элементов красных кровяных клеток в таком растворе не является обязательным. Однако в одном аспекте данного изобретения растворы полимеризованного гемоглобина практически не содержат стромы или стромальных элементов красных кровяных клеток.
Термин "поперечно-сшитый" означает, что на молекулу, или в молекулу, или между молекулами вводят молекулярные "мостики" с целью изменения формы, размера, функционирования или физических характеристик молекулы. Поперечно-сшитые молекулы могут быть полимеризованными или неполимеризованными, например поперечно-сшитые молекулы могут представлять собой тетрамеры.
Термин "тетрамер" или "тетрамерный" относится к молекулам гемоглобина с молекулярной массой приблизительно 64 кДа, то есть данный термин относится как к нативным молекулам гемоглобина, так и к молекулам гемоглобина с внутримолекулярной поперечной сшивкой. В данном описании % тетрамера определяется как количество тетрамера, выраженное в виде процента от количества суммарного гемоглобина (THb) в растворе. Например, в 100 мл раствора гемоглобина с концентрацией THb 10% и тетрамера 1% содержится 0,1 г тетрамера.
Термин "по существу (или практически) не содержащий тетрамера" означает уровень чистоты в отношении примеси тетрамера, при котором биологические ответы на вводимый тетрамер уже отсутствуют. Основным критерием является отсутствие изменений в функционировании почек при введении эффективных количеств, то есть при уровне чистоты приблизительно 99% или выше (количество тетрамера составляет менее чем приблизительно 1%). Предпочтительный продукт, получаемый по способу данного изобретения, содержит не более чем приблизительно 0,8% тетрамера по отношению к массе суммарного гемоглобина (THb). Другими словами, продукт, по существу не содержащий тетрамера, в соответствии с данным изобретением содержит неполимеризованный тетрамер гемоглобина в количествах, не превышающих физиологически приемлемый уровень. Особенно предпочтительные продукты данного изобретения содержат менее чем приблизительно 0,5% тетрамера; наиболее предпочтительные продукты данного изобретения содержат приблизительно 0,3-0,4% тетрамера. Было обнаружено, что такие количества тетрамера являются физиологически приемлемыми.
Термин "образование" или "образование тетрамера" относится к увеличению количества тетрамера в растворе вследствие деградации полимеризованного гемоглобина до тетрамера. Деградация полимера может происходить в результате обработки химическими реагентами, тепловой обработки, с течением времени или в результате сочетания данных условий. Как правило, тетрамер образуется при нагревании или при выдерживании полимеризованного раствора. Следовательно, процентное содержание тетрамера увеличивается при хранении раствора. Образование тетрамера может ускоряться при нагревании раствора полимеризованного гемоглобина. Считается, что образование тетрамера произошло, если его количество в растворе увеличилось в той или иной степени. В данном описании термин частичная деградация полимеризованного гемоглобина относится к деградации в растворе части, но не всего полимера до тетрамера.
Термин "выдерживание" раствора гемоглобина относится к хранению раствора в течение любого промежутка времени при любой температуре. Повышенная температура ускоряет процессы, происходящие при выдерживании раствора гемоглобина. "Выдержанный" раствор гемоглобина содержит тетрамер, образовавшийся при хранении.
Термин "предварительное образование" или "предварительное образование тетрамера" относится к методу, в котором для стимуляции образования тетрамера используют тепловую обработку.
Термин "горячее гашение" относится к способу обработки, который включает в себя нагревание раствора в процессе гашения реакции полимеризации для завершения реакции гашения.
Термин "полимеризация" или "полимеризованный" относится к процессу, или к результату, введения молекулярных мостиков между молекулами или субъединицами тетрамера, которое приводит к увеличению размера и массы полученной полимеризованной молекулы по сравнению с молекулой нативного или тетрамерного гемоглобина. Полимеризованный гемоглобин не является тетрамерным гемоглобином. Полимеризацию можно проводить с использованием различных полимеризующих средств, включающих в себя глутаральдегид, имидоэфиры и другие, в биохимически подходящем носителе, способами, хорошо известными специалистам в данной области.
Термин "пиридоксилированный" или "пиридоксилирование" относится к способу, или к результату связывания молекул, содержащих пиридоксаль-5'-фосфат, с молекулой гемоглобина путем взаимодействия данной молекулы пиридоксаль-5'-фосфатом ("P5P) или 2-нор-формилпиридоксаль-5'-фосфатом. Показано, что пиридоксилирование благоприятно изменяет способность обратимо связывать кислород, т.е. увеличивает P50 некоторых гемоглобинов млекопитающих, например человеческого гемоглобина.
Термин "стабильный" или "стабильность" относится к состоянию или характеристике растворов гемоглобина, устойчивых к деградации и имеющих более длительный срок годности, чем нестабильные растворы. Например, в процессе хранения раствора гемоглобина, стабилизированного в соответствии с данным изобретением, образование тетрамера происходит в меньшей степени, или медленнее, чем при хранении растворов, полученных с использованием других способов. Стабильность раствора гемоглобина зависит от нескольких других параметров, не зависящих от образования тетрамера, которые включают в себя, например, скорость превращения дезоксигемоглобина в оксигемоглобин или метгемоглобин. Данный параметр можно контролировать в числе прочих способов путем предотвращения доступа кислорода в упакованный раствор в процессе хранения. В стабилизированных растворах гемоглобина деградация еще может происходить, но с более низкой скоростью, чем в нестабилизированных растворах.
Данное изобретение предлагает раствор полимеризованного гемоглобина, который, по существу, не содержит тетрамерного (нативного или с внутримолекулярной поперечной сшивкой) гемоглобина, стромальных и разных других примесей. Данный раствор является физиологически приемлемым, а также терапевтически и клинически пригодным. Полученный продукт обладает способностью обратимо связывать кислород, что необходимо для осуществления транспорта кислорода. При применении продукт демонстрирует хорошие характеристики нагрузки и разгрузки кислорода, которые коррелируют с кривой диссоциации комплекса кислород-гемоглобин (P50), полученной для цельной крови. Данный продукт связывает кислород с высоким сродством в капиллярах легких и затем соответствующим образом высвобождает кислород в тканях организма. Полученный продукт также не требует исследований по совместимости с реципиентом.
В одном аспекте при введении людям продукт может иметь период полужизни, составляющий, по меньшей мере, приблизительно 15 часов. В другом аспекте период полужизни превышает приблизительно 24 часа. Гемоглобиновый продукт можно использовать для пополнения практически всего объема крови пациента-человека, при этом он не вызывает сужения кровеносных сосудов, нефротоксичности, гемоглобинурии или других проблем, связанных с внутривенным введением синтетических или полусинтетических переносчиков кислорода и кровезаменителей.
Период полужизни конечного продукта данного изобретения определяют in vivo у млекопитающих, например у людей. Как правило, образец крови берут у млекопитающего через определенный промежуток времени после введения продукта. Затем определяют количество продукта путем центрифугирования образца крови, отделения фракции плазмы, спектрофотометрического определения уровня гемоглобина в плазме и соотносят количество продукта, оставшееся у млекопитающего, с периодом полужизни продукта.
С помощью способа настоящего изобретения можно получить стабилизированный раствор полимеризованного гемоглобина с увеличенным периодом полужизни. Как правило, при выдерживании (старении) полимеризованного раствора гемоглобина происходит образование тетрамера. Образовавшийся тетрамер можно удалить из выдержанного раствора гемоглобина способом настоящего изобретения. В выдержанных растворах гемоглобина после обработки с целью удаления тетрамера при последующем хранении образование тетрамера происходит медленнее, чем в растворах гемоглобина, обработанных сразу (не выдержанных). Таким образом, растворы гемоглобина, обработанные способом настоящего изобретения, обладают большей стабильностью с точки зрения образования тетрамера, чем сразу обработанные растворы.
Было обнаружено, что физиологически и клинически пригодные растворы гемоглобина, как правило, содержат менее 1,0% тетрамера. Соответственно, поскольку тетрамер образуется со временем в процессе хранения (старения), чтобы достичь приемлемого срока годности для раствора гемоглобина, желательно, чтобы вновь обработанные растворы гемоглобина содержали менее чем приблизительно 0,3% тетрамера, с расчетом на то, что в растворе будет образовываться тетрамер, но раствор останется физиологически пригодным, пока содержание тетрамера не достигнет 1,0%.
На фиг.1 показано количество тетрамера, обычно образующееся в растворах гемоглобина после хранения при 2-8°C. В растворе с начальным уровнем тетрамера приблизительно 0,5% содержание тетрамера увеличивается более чем до 1,0% приблизительно через 18 месяцев.
На фиг.2 показано количество тетрамера, образующегося в растворах гемоглобина после хранения при 23-27°C. В растворе с начальным уровнем тетрамера приблизительно 0,5% содержание тетрамера увеличивается более чем до 1,0% приблизительно через 3-4 недели. Следовательно, если растворы гемоглобина хранить при повышенной температуре, скорость образования тетрамера увеличивается. Выдерживание растворов тетрамера можно осуществлять, оставляя раствор гемоглобина стоять в течение продолжительного времени. При более высоких температурах старение растворов гемоглобина происходит быстрее, чем при низких температурах.
На фиг.3 сравнивается образование тетрамера в сразу обработанном растворе гемоглобина и в выдержанном растворе гемоглобина, обработанном способом данного изобретения (повторно обработанном). Оба раствора хранят при 2-8°C. Через 24 месяца содержание тетрамера в сразу обработанном растворе гемоглобина увеличивается до 0,8%, тогда как в повторно обработанном растворе содержание тетрамера увеличивается только до 0,3%. Через 36 месяцев содержание тетрамера в повторно обработанном растворе увеличивается до 0,4%. Подобным образом на фиг.4 показано, что тетрамер образуется быстрее в сразу обработанных растворах гемоглобина, чем в повторно обработанных растворах при хранении при 23-27°C.
В одном аспекте способ данного изобретения для увеличения стабильности раствора включает в себя стимуляцию предварительного образования тетрамера в растворе гемоглобина путем нагревания раствора, чтобы увеличить скорость образования тетрамера. Образовавшийся тетрамер можно удалить с получением более стабильного раствора с точки зрения образования тетрамера, чем растворы полимеризованного гемоглобина, которые не подвергались тепловой обработке для ускорения образования тетрамера. После удаления образовавшегося тетрамера из раствора гемоглобина последующее образование тетрамера замедляется или уменьшается.
Тепловую обработку можно проводить до или после очистки раствора. Если раствор подвергают тепловой обработке в процессе получения, такую тепловую обработку следует проводить после полимеризации. Затем раствор очищают, удаляя по существу весь тетрамер. Если тепловую обработку проводят после очистки, раствор нужно почистить повторно, чтобы удалить образовавшийся тетрамер.
Тепловую обработку полимеризованного раствора гемоглобина можно проводить при 45-55°C в течение приблизительно 20-30 часов. Полагают, что в данном способе, чтобы вызвать образование тетрамера, можно использовать другую температуру или другое время, поскольку было показано, что образование тетрамера является функцией, зависящей, в числе прочих факторов, от времени и температуры.
Способ данного изобретения имеет дополнительное преимущество, заключающееся в том, что он позволяет получить конечный продукт, практически не содержащий микробных и вирусных антигенов и патогенов. Содержание таких микробных и вирусных антигенов и патогенов уменьшается до недетектируемых уровней, т.е. продукт является стерильным по данным анализа, описанного в United States Pharmacopoeia, XXIII Chapter 71. Примеры таких антигенов и патогенов включают в себя, например, бактерии, риккетсии, грибки, простейшие, вирусы и другие организмы. Наиболее важно, что данный способ позволяет получить биологический продукт, не содержащий вирусов, вызывающих гепатит и синдром приобретенного иммунодефицита (СПИД).
Тепловая обработка раствора гемоглобина, по существу, приводит к инактивации вирусов. Инактивацию вирусов посредством тепловой обработки можно проводить как отдельную стадию или ее можно объединить с тепловой обработкой для удаления тетрамера. Как правило, для безопасности работников тепловую обработку для инактивации вирусов предпочтительно проводить после удаления гемоглобина из красных кровяных клеток. Однако тепловая обработка раствора после полимеризации предположительно также приводит к желаемой инактивации вирусов. Если исключить стадию тепловой обработки для инактивации вирусов перед полимеризацией, температуру тепловой обработки после полимеризации для образования тетрамера можно увеличить приблизительно до 60-62°C или до другой подходящей температуры, чтобы обеспечить инактивацию вирусов. Таким образом, посредством одной стадии тепловой обработки после полимеризации можно достичь и инактивации вирусов и образования тетрамера.
Биологический продукт данного изобретения при вливании в количествах, достигающих, по меньшей мере, приблизительно 10,0 л, не вызывает сужения кровеносных сосудов, нефротоксичности, гемоглобинурии или других проблем, связанных с внутривенным введением известных растворов гемоглобина, содержащих нежелательные количества тетрамерного гемоглобина. Внутривенное введение продукта, полученного по описанному здесь способу, не приводит к заметному уменьшению количества образующейся мочи, к значительному снижению клубочковой фильтрации, к заметному просачиванию в перитонеальную полость и к заметному изменению цвета образующейся мочи.
Следовательно, способ данного изобретения позволяет получать неклеточный заменитель красных кровяных клеток, который можно использовать для лечения травмы, инфаркта миокарда, инсульта, острой анемии и нарушений, связанных с дефицитом кислорода, таких как гипоксемия, гипоксия или конечная стадия гипоксии, являющаяся следствием ухудшения легочной функции или неспособности легких полностью насыщать кровь кислородом. Данный продукт также можно использовать для лечения любого заболевания или медицинского состояния, требующего питающей жидкости (например, травмы, в особенности, геморрагического шока), увеличения объема внутрисосудистой жидкости или обменного переливания крови. Кроме медицинского лечения, продукт можно использовать при хранении органов для трансплантации.
В одном аспекте исходным веществом в способе данного изобретения является цельная человеческая кровь или эритроцитарная масса. Как правило, желательно, но необязательно, использовать в качестве источника красные кровяные клетки, которые хранились не более 2 недель после даты истечения срока годности, указанной на пакете для хранения крови. Применение человеческой цельной крови, вышедшей из употребления более 2 недель назад, создает дополнительные трудности при экстракции гемоглобина и удалении клеточных остатков, таких как стромальные белки и примеси. Кроме того, способы, описанные в данном документе, можно применять ко всем гемоглобинам с минимальными модификациями, находящимися в пределах компетенции специалистов в данной области.
Если в качестве исходного вещества используют человеческую кровь, в процессе аспирации и фильтрации эритроцитов, красные кровяные клетки (RBC) извлекают из донорских пакетов в асептических условиях, не допуская попадания воздуха в кровь, и пропускают их через ряд фильтров, чтобы получить суспензию RBC, содержащую пониженное количество лейкоцитов и тромбоцитов. Затем полученную суспензию промывают/лизируют.
Суспензию промывают в атмосфере монооксида углерода приблизительно 1% раствором NaCl, чтобы удалить остаточные плазменные белки. Затем промытые RBC обрабатывают водой для инъекции ("WFI"), чтобы лизировать клетки, и полученную смесь очищают с помощью устройства для фильтрации в перекрестном потоке. Можно использовать другие методы лизирования красных кровяных клеток, известные специалистам в данной области, в том числе, например, механический или ультразвуковой лизис клеток. Очищенный продукт затем можно подвергнуть тепловой обработке для инактивации вирусов и для дополнительного осаждения стромального вещества, удаляемого фильтрацией. После данной процедуры получают продукт, который представляет собой раствор не содержащего стромы гемоглобина (SFH) с концентрацией THb приблизительно 3% (мас./об.).
После очистки раствор, содержащий карбоксигемоглобин, предпочтительно концентрируют и дегазируют, получая не содержащий стромы раствор гемоглобина, который включает в себя дезоксигемоглобин. Дегазирование включает в себя насыщение раствора карбоксигемоглобина кислородом в течение приблизительно 16 часов с получением раствора, содержащего окисленный гемоглобин и приблизительно 7% по массе, по отношению к общей массе гемоглобина, карбоксигемоглобина. Затем кислород вытесняют азотом, аргоном или гелием с получением раствора, содержащего свободный гемоглобин, т.е., гемоглобин, не участвующий в комплексообразовании, и приблизительно 7% по массе, по отношению к общей массе гемоглобина, оксигемоглобина. Полученный дегазированный раствор фильтруют и переносят в сосуд для химической модификации.
После дегазирования не содержащий стромы раствор гемоглобина, включающего в себя человеческий гемоглобин, нужно пиридоксилировать с использованием пиридоксаль-5'-фосфата (P5P) с молярным соотношением пиридоксаль-5'-фосфата и гемоглобина от приблизительно 1:1 до 3:1. Альтернативно, не содержащий стромы гемоглобин можно пиридоксилировать, используя 2-нор-2-формилпиридоксаль-5'-фосфат. К смеси для пиридоксилирования добавляют восстанавливающий реагент, например цианоборгидрид натрия, или, предпочтительно, боргидрид натрия. Избыток реагентов и солей удаляют диализом против воды, не содержащей пирогенов, или, предпочтительно, диафильтрацией с использованием WFI. Гемоглобин из источников, отличных от человеческой крови, можно не пиридоксилировать. Специалистам в области растворов гемоглобина известно, в каких случаях требуется пиридоксилирование.
Не содержащий стромы раствор гемоглобина полимеризуют любым способом, известным специалистам в области растворов гемоглобина. Предпочтительно, в качестве полимеризующего реагента используют водный раствор глутаральдегида. Продолжительность полимеризации и количество добавляемого глутаральдегида зависит от объема раствора гемоглобина, желаемого выхода полимеров и желаемого распределения по молекулярной массе. Как правило, более длительное время полимеризации увеличивает выход полимеров и распределение полимеров по молекулярной массе. Выход полимеров, составляющий приблизительно 75% по массе по отношению к общей массе гемоглобина, получают, если реакция длится приблизительно 16-18 часов. Предпочтительный момент окончания полимеризации определяют как момент, когда содержание полимеров в растворе достигнет приблизительно 75% по массе по отношению к общей массе гемоглобина, что отслеживают методом эксклюзионной ВЭЖХ. Альтернативно, момент окончания определяют как момент, когда содержание полимеров в растворе достигнет приблизительно 65% по массе по отношению к общей массе гемоглобина, т.е. приблизительно через 2,5 часа.
После завершения полимеризации реакцию гасят с помощью подходящего реагента. В одном аспекте реакцию полимеризации гасят добавлением водного раствора глицина. Глицин следует добавлять так быстро, насколько это возможно. Поперечные связи стабилизируют добавлением, опять же, так быстро, насколько это возможно, водного раствора боргидрида натрия. Затем данный полимеризованный раствор концентрируют и подвергают диафильтрации. Наконец, к раствору добавляют воду до получения концентрации гемоглобина 4% по массе.
В другом аспекте раствор можно подвергнуть "горячему гашению" путем нагревания при 40-50°C в течение, по меньшей мере, трех часов с одновременным добавлением глицина для завершения гашения реакции. На фиг.5 сравнивается образование тетрамера в растворе гемоглобина, обработанном сразу, и в растворе, подвергавшемся горячему гашению в течение трех часов. Оба раствора хранят при 2-8°C. Через 10 месяцев содержание тетрамера в растворе гемоглобина, обработанном сразу, находится в интервале 0,4-0,5%, тогда как в растворе, подвергавшемся горячему гашению, содержание тетрамера составляет приблизительно только 0,4%. На фиг.6 сравнивается образование тетрамера в растворе гемоглобина, обработанном сразу, и в растворе, подвергавшемся горячему гашению после хранения при 23-27°C. Предположительно стабильность раствора увеличивается после продолжительного горячего гашения, например, в течение периода не более двадцати четырех часов. Также можно использовать высокие температуры, приблизительно до 65°C.
Полимеризация в соответствии с данным изобретением позволяет получать полимеры с высоким выходом и узким диапазоном распределения по молекулярной массе, как показано на фиг.9 и описано ниже в примерах.
В другом аспекте раствор после полимеризации и гашения можно подвергнуть тепловой обработке для образования тетрамера. Тепловую обработку можно проводить через любой промежуток времени после очистки, но после нее нужно будет провести повторную очистку раствора. Тепловую обработку можно проводить путем нагревания раствора при температуре выше приблизительно 45°C в течение, по меньшей мере, приблизительно 24 часов. Если в данный момент нужно инактивировать вирусы, раствор можно нагреть до температуры выше приблизительно 60°C. Для предотвращения образования метгемоглобина в процессе тепловой обработки можно добавить антиоксидант, такой как аскорбиновая кислота.
На фиг.7 сравнивается образование тетрамера в сразу обработанном растворе гемоглобина и в растворе, предварительно обработанном в соответствии с данным изобретением. Оба раствора хранят при 2-8°C. Через 15 месяцев содержание тетрамера в растворе гемоглобина, обработанном сразу, увеличивается приблизительно до 0,5%, тогда как в предварительно обработанном растворе содержание тетрамера составляет приблизительно только 0,4%. Подобным образом на фиг.8 показано, что тетрамер образуется быстрее в сразу обработанных растворах гемоглобина, чем в предварительно обработанных растворах после хранения при 23-27°C.
Затем полимеризованный, пиридоксилированный раствор гемоглобина очищают. В одном аспекте, чтобы удалить из раствора неполимеризованный (тетрамерный) гемоглобин, очистку проводят в атмосфере кислорода, чтобы окислить раствор с использованием колоночной хроматографии, фильтрации, например фильтрации через полупроницаемую мембрану, или обоих методов. Затем очищенный полимеризованный раствор гемоглобина концентрируют до получения концентрации приблизительно 6% с помощью устройства для ультрафильтрации и получают препарат, способный осуществлять газообмен.
Затем проводят деоксигенацию концентрированного раствора, вытесняя кислород азотом. Деоксигенацию проводят приблизительно при 10-12°C, пока содержание оксигемоглобина в растворе не станет меньше, чем приблизительно 16% по массе по отношению к общей массе гемоглобина.
Затем полученный не содержащий кислорода очищенный раствор полимеризованного гемоглобина концентрируют ультрафильтрацией в атмосфере азота в охлаждаемом сосуде. pH доводят приблизительно до 8,8-9,0, и количество электролитов можно довести по необходимости до уровней, характерных для нормальной плазмы. Кроме того, можно добавить традиционные антиоксиданты, такие как глутатион, аскорбат или глюкоза. После концентрирования раствора до желательной концентрации, предпочтительно приблизительно 10% по массе по отношению к общей массе гемоглобина, раствор стерилизуют путем фильтрации и переносят с помощью устройства для стерильного переноса в подходящие фармацевтически приемлемые контейнеры.
Если раствор гемоглобина ранее не подвергался тепловой обработке, способствующей образованию тетрамера, его можно подвергнуть тепловой обработке и очистить от образовавшегося тетрамера. Если добавлялись антиоксиданты и химические реагенты композиции, их можно удалить путем диафильтрации перед тепловой обработкой и очисткой.
Кроме того, в качестве альтернативы тепловой обработке образование тетрамера в конечном растворе гемоглобина может происходить при выдерживании раствора при подходящей температуре. Затем раствор можно повторно очистить, чтобы удалить образовавшийся тетрамер. Предположительно, раствор, как правило, нужно выдерживать до получения уровней тетрамера, превышающих приблизительно 1-3%, причем более высокое содержание тетрамера обеспечивает повышенную стабильность раствора после удаления тетрамера. Однако преимущества данного изобретения предположительно реализуются, если раствор выдерживают в течение любого промежутка времени, при условии, что образовавшийся тетрамер удаляется из раствора после выдерживания.
Характеристики полученного раствора гемоглобина приведены на фиг.9 и ниже:
ПРИМЕРЫ
Нижеследующие примеры демонстрируют некоторые аспекты настоящего изобретения. Однако следует понимать, что данные примеры служат только для иллюстрации и не определяют полностью условия и объем данного изобретения. Если не указано иначе, температура всегда выражается в градусах Цельсия. Следует также понимать, что если приведены типичные условия реакции (например, температура, время реакции), также можно использовать значения, находящиеся вне указанных интервалов, хотя это, как правило, менее удобно.
Если не указано иначе, все сосуды и резервуары, используемые в способе данного изобретения, изготовлены из нержавеющей стали 316-L, предпочтительно, из нержавеющей стали фармацевтической категории, которая хорошо отполирована и, следовательно, легко и быстро моется. Различные соединяющие трубки изготовлены из такой же нержавеющей стали или из тефлона или силикона фармацевтической категории. Фильтры и мембраны, используемые в способе данного изобретения, можно получить от Millipore Inc., Pall-Filtron, или Cuno Inc.
Аналитическую эксклюзионную ВЭЖХ согласно данному изобретению проводят по следующей методике. Образец разбавляют до получения концентрации 0,2 г/дл 0,1 M натрий-фосфатным буфером при pH приблизительно 6,9, фильтруют через 0,2 мкм фильтр и вводят в систему ВЭЖХ, состоящую из следующих компонентов (в порядке поступления в систему):
Поглощение при 280 нм регистрируют с помощью Agilent Chemstation, который интегрирует площади отдельных пиков и рассчитывает площадь для суммарного гемоглобина для каждого вида полимеров.
Пример 1
Аспирация и фильтрация клеток
В соответствии с фиг.11 донорские пакеты 20 просроченной крови (цельная кровь или эритроцитарная масса) помещают в подходящее устройство 22 для аспирации в асептических условиях. С помощью иглы устройства для аспирации прокалывают донорский пакет, вводят приблизительно 150 мл 1% (мас./об.) водного раствора хлорида натрия и отсасывают просроченную кровь из донорского пакета при пониженном давлении или в вакууме. Аспирированную кровь пропускают через объемный фильтр для адсорбции лейкоцитов 24 или, альтернативно, через два объемных фильтра 5 мкм, в серии 26. После пропускания крови через фильтры лейкоциты удаляются. Как правило, приблизительно 225 единиц просроченной цельной крови отсасывают, фильтруют и затем переносят в резервуар 1, как показано на фиг.11. Затем фильтры промывают приблизительно 75 литрами 1% (мас./об.) водного раствора хлорида натрия.
Пример 2
Промывание и лизис клеток
Перед введением крови в резервуар 1 его заряжают приблизительно 40-50 л 1% водного раствора хлорида натрия. После того, как все 225 единиц просроченной цельной крови отсасывают, фильтруют и переносят, а фильтры промывают, резервуар содержит приблизительно 365-395 литров 4% раствора суммарного гемоглобина. В процессе аспирации и фильтрации резервуар 1 держат при пониженном давлении, т.е. под вакуумом 20-28 дюймов Hg. После того, как вся вышедшая из употребления кровь перенесена в резервуар 1, вакуум отключают и в резервуар вводят монооксид углерода так, чтобы давление монооксида углерода составляло одну атмосферу.
Резервуар 1 соединен с тангенциальным проточным фильтром 0,65 мкм, как показано на фиг.11. Исходную загрузку 365-395 литров 4% раствора суммарного гемоглобина концентрируют приблизительно до 215-225 л 7% раствора суммарного гемоглобина путем микрофильтрации через тангенциальный проточный фильтр. pH раствора гемоглобина в данный момент находится в интервале приблизительно от 6 до 6,5. После концентрирования с получением 7% раствора суммарного гемоглобина раствор промывают, добавляя 1% (мас./об.) раствор хлорида натрия, подвергают диафильтрации и фильтрат удаляют с такой же скоростью, с какой добавляют раствор хлорида натрия. 215-225 л раствора гемоглобина обычно промывают приблизительно 8 объемами 1% раствора хлорида натрия (приблизительно 1800 л). После промывания раствор концентрируют приблизительно до 90-95 л, т.е. до получения концентрации суммарного гемоглобина приблизительно 16%, и добавляют воду для инъекции ("WFI"), чтобы довести объем раствора приблизительно до 220 л. При добавлении WFI клетки набухают и разрываются, высвобождая гемоглобин в раствор. Концентрация суммарного гемоглобина (THb) в полученном растворе составляет приблизительно 7%.
Полученный раствор очищают пока он еще находится в резервуаре 1. Вначале раствор концентрируют приблизительно до 90 л и фильтрат переносят в резервуар 2. По мере перекачивания раствора через фильтр красные кровяные клетки, стромальные примеси и клеточные стенки остаются на фильтре и удаляются. Оставшиеся в резервуаре 1 90 л раствора промывают (диафильтрацией) приблизительно 280 л WFI и смыв добавляют в резервуар 2. После этого вещество, оставшееся в резервуаре 1, концентрируют приблизительно до 20 л и фильтрат добавляют в резервуар 2. Конечный объем в резервуаре 2 составляет приблизительно 405-415 л 3,3% раствора суммарного гемоглобина.
Пример 3
Необязательная тепловая обработка для инактивации вирусов и осаждения стромы
Затем полученный раствор не содержащего стромы гемоглобина подвергают тепловой обработке в резервуаре 2 при температуре приблизительно 60-62°C в течение приблизительно 10 часов. В течение этого времени раствор перемешивают с умеренной интенсивностью. Когда раствор нагревается и достигает температуры приблизительно 55°C, образуется осадок.
Пример 4
Очистка и инактивация вирусов
Полученный после тепловой обработки 3,3% раствор не содержащего стромы THb пропускают через предварительный 0,2 мкм фильтр 30, затем через предварительный 0,1 мкм фильтр 32 и перекачивают через ультрафильтр 100 кДа для удаления вирусов (не показано) в резервуар 3.
Пример 5
Ультрафильтрация/Концентрирование
Затем отфильтрованный раствор гемоглобина концентрируют до 85-105 л (приблизительно 14% THb), промывают и подвергают диафильтрации, используя приблизительно 4 объема WFI (350 л). Концентрирование и диафильтрацию проводят, используя ультрафильтр 34 с отсечкой по молекулярной массе 10 кДа. Фильтрат собирают через дренаж 35, связанный с ультрафильтром. В данный момент 14% раствор суммарного гемоглобина содержит менее чем приблизительно 50 нг фосфолипидов на грамм гемоглобина, менее чем приблизительно 2 нг гликолипидов на грамм гемоглобина, менее чем приблизительно 1% метгемоглобина, менее чем приблизительно 0,03 единицы эндотоксина на миллилитр при pH приблизительно от 6 до 6,5. Гемоглобин в растворе находится в виде карбоксигемоглобина.
Пример 6
Дегазирование
Затем полученный раствор карбоксигемоглобина переносят в сосуд объемом 175 л (резервуар 4), где вначале проводят оксигенацию, а затем деоксигенацию карбоксигемоглобина. Резервуар 4 оборудован кольцом для барботирования газа, соединенным с газовыми линиями кислорода и азота, механизмом подачи от дна резервуара к дозирующему устройству для распыления, расположенному в верхней части резервуара 4, и коллектором для сбора избыточной пены, соединенным с контейнером для приема пены 36 так, что пена, образующаяся в резервуаре 4, поступает в контейнер для приема пены 36, где пена конденсируется в жидкость и поступает обратно в резервуар 4. В качестве альтернативы контейнеру для приема пены 36 резервуар 4 может быть оборудован механическим пеногасителем. Резервуар 4 также содержит установленную в центре мешалку для распределения газа. Контейнер для приема пены 36 содержит газоотводную трубку для удаления газа. Раствор в резервуаре 4 представляет собой 13% раствор суммарного гемоглобина.
В течение первой стадии оксигенации кислород барботируют через раствор со скоростью, достаточной для однородного распределения газа в сосуде. Сосуд продувают газом со скоростью приблизительно 66 л/мин. Оксигенацию карбоксигемоглобина проводят в течение приблизительно 18 часов так, чтобы полученный раствор содержал менее 5% карбоксигемоглобина по отношению к общей массе гемоглобина. Оксигенацию проводят при температуре приблизительно 10°C. Пену, образовавшуюся в резервуаре 4, собирают в контейнер для приема пены 36 и, после осаждения пены, полученный раствор переносят обратно в резервуар 4.
После оксигенации через раствор барботируют с такой же скоростью азот в течение приблизительно 3-3,5 часов, или до тех пор, пока в растворе не останется менее 10% оксигемоглобина по отношению к общей массе гемоглобина. Азот барботируют при температуре приблизительно 10°C и pH приблизительно 6,95-7,10. Альтернативно, карбоксигемоглобин можно превратить в дезоксигемоглобин с помощью мембранного обменника. Следует отметить, что денатурации гемоглобина практически не происходит даже на стадии образования пены.
Пример 7
Химическая модификация
В соответствии с фиг.12 раствор дезоксигемоглобина переносят в резервуар 5 для химической модификации. Затем в резервуар 5, содержащий раствор дезоксигемоглобина, приблизительно при 4°C добавляют водный раствор пиридоксил-5-фосфата (P5P) (93,75 г/л) при молярном соотношении P5P и гемоглобина от 1:1 до 3:1. Молярное соотношение P5P и гемоглобина 2:1 является предпочтительным. Пиридоксилирование проводят при температуре приблизительно 4°C. Раствор P5P обычно добавляют в течение приблизительно 1 минуты и перемешивают приблизительно 15 минут, после чего к раствору гемоглобина добавляют раствор боргидрида натрия/гидроксида натрия при молярном соотношении боргидрида натрия и гемоглобина приблизительно 20:1. Подходящий водный раствор боргидрида натрия/гидроксида натрия содержит 0,8 г гидроксида натрия на 2 литра и 90,8 г боргидрида натрия на 2 литра. Раствор боргидрида добавляют так быстро, насколько это возможно, в течение приблизительно 1 минуты и затем перемешивают в течение одного часа.
Пример 8
Удаление реагентов
Чтобы удалить избыток реагентов, полученный раствор пиридоксилированного гемоглобина объемом 150 л подвергают диафильтрации с использованием ультрафильтра 38, 10 кДа и 4 объема (600 л) WFI. Полученный фильтрат собирают с помощью дренажа 40, связанного с ультрафильтром 38.
Пример 9
Полимеризация
В резервуар 5, содержащий пиридоксилированный гемоглобин, добавляют количество WFI, достаточное для получения 4,5% раствора суммарного гемоглобина (приблизительно 265 л раствора гемоглобина). К раствору пиридоксилированного гемоглобина добавляют раствор глутаральдегида при молярном соотношении глутаральдегида и гемоглобина приблизительно 24:1. Раствор глутаральдегида обычно добавляют к раствору гемоглобина в течение приблизительно 2,5 часов с помощью дозирующего насоса. Реакцию полимеризации оставляют протекать в течение приблизительно 18 часов. Целевое распределение по молекулярной массе составляет приблизительно 75% полимера и 25% тетрамера. Целевые полимеры имеют молекулярную массу менее чем приблизительно 600000, причем преобладает фракция с молекулярной массой в интервале 100000-350000.
Если в процессе реакции полимеризации достигается целевое распределение по молекулярной массе (приблизительно через 18 часов), к раствору гемоглобина добавляют водный раствор глицина (приблизительно 166 г/л) (для гашения) при молярном соотношении глицина и гемоглобина 140:1. В данный момент для завершения реакции гашения раствор можно нагревать при 40-50°C в течение по меньшей мере трех часов ("горячее гашение").
На фиг.10 приведена хроматограмма ВЭЖХ раствора полимеризованного гемоглобина после обработки глицином. Затем полученный раствор перемешивают в течение приблизительно 10 минут, после чего к раствору гемоглобина добавляют раствор боргидрида натрия/гидроксида натрия (с указанной выше концентрацией) при молярном соотношении боргидрида натрия и гемоглобина 28:1. Полученную смесь перемешивают в течение приблизительно 1 часа. Затем раствор концентрируют приблизительно до 150 л (ультрафильтр 38) и промывают 4 объемами (600 л) WFI. К концентрированному раствору добавляют еще порцию боргидрида натрия при указанном выше молярном соотношении и снова перемешивают в течение 1 часа. Полученный раствор промывают 4 объемами WFI (600 л).
Пример 10
Необязательная тепловая обработка с образованием тетрамера
В данный момент раствор можно подвергнуть тепловой обработке с образованием тетрамера. Раствор нагревают при 45-55°C в течение приблизительно 20-30 часов. Если на данной стадии желательно провести инактивацию вирусов, температуру можно поднять выше 60°C. Раствор нагревают с помощью обогревающей среды, такой, как раствор пропиленгликоля, имеющий температуру приблизительно 80°C, которая циркулирует в кожухе резервуара, в то время, как раствор Hb энергично перемешивается. После нагревания раствор гемоглобина охлаждают приблизительно до 2-8°C.
Пример 11
Очистка
Проводят оксигенацию полученного раствора, оставляя его стоять в атмосфере кислорода, и затем переносят в систему для очистки 42. Очистку можно проводить методом колоночной хроматографии, фильтрации, предпочтительно фильтрации через мембрану (диафильтрации), или путем сочетания фильтрации и колоночной хроматографии.
В одном воплощении раствор переносят в питающий сосуд для хроматографии, резервуар 6, как показано на фиг.13. В данном воплощении полученный раствор оксигемоглобина разбавляют приблизительно до 200 л (4% суммарного гемоглобина) в резервуаре 6 и концентрацию хлорида доводят до 22 мМ с помощью раствора хлорида натрия. Концентрацию натрия доводить необязательно.
Затем пять аликвот полученного раствора гемоглобина объемом 40 л хроматографируют, используя колонку 44. Колонка 44 содержит аффинный гель, который представляет собой агарозный гель, модифицированный желтым красителем (поставляемым Affinity Chromatography, Ltd., в виде Mimetic Yellow No. 1), имеющий большее сродство к полимеру, чем к тетрамеру.
Хроматографию проводят следующим образом.
40 л раствора окисленного, полимеризованного, пиридоксилированного, не содержащего стромы гемоглобина загружают на колонку 44. Для удаления тетрамера колонку промывают 15 объемами (приблизительно 750 л) 30 мМ водного раствора NaCl. Затем колонку промывают приблизительно 250 л 300 мМ раствора хлорида натрия, чтобы элюировать полимер. Полимерные фракции собирают в резервуаре 7. Нежелательные фракции отправляют на дренаж 46. После удаления каждой аликвоты колонку регенерируют 15 мМ раствором HCl (150 л), снова уравновешивают 30 мМ водным раствором NaCl (250 л) и загружают на нее следующую порцию питающего раствора (40 л). Колонку снова промывают 30 мМ NaCl, затем 300 мМ NaCl. На колонку вносят аликвоты раствора гемоглобина объемом 40 л и хроматографируют, пока резервуар 6 не опустеет.
Фракции, собранные в резервуаре 7, подвергают ультрафильтрации (концентрированию) с использованием фильтра 48, связанного с дренажем 50, до получения объема приблизительно 40 л (6% суммарного гемоглобина). затем концентрированный раствор гемоглобина переносят в газообменный резервуар 8 для деоксигенации.
Альтернативно, раствор переносят в фильтрационный сосуд 10 с рециркуляцией, как показано на фиг.14. Затем в резервуаре 10 гемоглобин разбавляют до концентрации THb приблизительно 4%. Затем 4% раствор THb подвергают диафильтрации с использованием 10 мМ раствора NaCl и фильтра 52 с отсечением по молекулярной массе 300000, поставляемого Millipore Corporation. Фильтрацию продолжают до тех пор, пока приблизительно 97% гемоглобина не пройдет через фильтр и затем в резервуар 11. (Приблизительно 3% вещества, т.e. высокомолекулярных полимеров, остается в резервуаре 10). Количество гемоглобина определяют спектрофотометрически с помощью кооксиметра.
Полученный раствор в резервуаре 11 содержит приблизительно 4-8% THb и приблизительно 7-10% тетрамера по отношению к массе THb. Затем 4-8% раствор THb подвергают диафильтрации с использованием 10 мМ раствора NaCl и фильтра 54 с отсечением по молекулярной массе 100000, поставляемого Pall-Filtron, соединенного с дренажем или ловушкой 56. Фильтрацию продолжают до тех пор, пока уровень тетрамера, определяемый методом эксклюзионной хроматографии с использованием колонки Toso BioSep 300×7,8 мм, не станет меньше 1,0% по отношению к массе гемоглобина. Полученный очищенный раствор гемоглобина вначале остается в резервуаре 11, а затем его переносят в газообменный резервуар 8 для деоксигенации.
Пример 12
Деоксигенация
В качестве газообменного резервуара 8 можно использовать резервуар 4, или, предпочтительно, другой резервуар. Газообменный резервуар 8 оборудован, по существу, так же, как и газообменный резервуар 4, он присоединен к контейнеру для приема пены 58 или оборудован механическим пеногасителем идентично резервуару 4. Деоксигенацию проводят приблизительно в течение 2,5 часов, барботируя азот приблизительно при 10°C и pH раствора приблизительно 8,8. Азот барботируют до тех пор, пока в растворе не останется менее 16% оксигемоглобина по отношению к общей массе гемоглобина. Затем полученный раствор дезоксигемоглобина переносят в резервуар 9 для получения композиции.
Если стадия тепловой обработки примера 10 пропущена, ее можно провести на данной стадии. Если тепловую обработку проводят в данный момент, процедуры очистки примера 11 и деоксигенации данного примера нужно повторить. Стадия тепловой обработки примера 10 и стадия тепловой обработки данного примера являются необязательными и могут быть совсем исключены.
Пример 13
Получение композиции
В резервуаре 9 для получения композиции вначале концентрируют раствор до получения концентрации суммарного гемоглобина 7% и доводят pH приблизительно до 8,8-9,0 при 4°C. Для доведения pH используют 0,2 M раствор NaOH. Добавляют глюкозу и глицин с получением конечных концентраций приблизительно 1 г/л и 3,5 г/л соответственно. К раствору добавляют хлорид калия до получения концентрации калия приблизительно 3,5-4,5 мМ. Затем добавляют 3 M раствор хлорида натрия до получения концентрации хлорида 85-110 мМ. Затем добавляют лактат натрия до получения концентрации иона натрия 135-155 мМ. Наконец, добавляют 0,45 молярный раствор аскорбиновой кислоты, пока ее концентрация не достигнет приблизительно 1000 мг/л. pH доводят до 8,7-9,1 при 10-15°C с помощью 0,22 M NaOH. Полученный раствор гемоглобина имеет конечную осмоляльность приблизительно 280-360 ммоль на 1 кг.
Затем полученный раствор гемоглобина концентрируют до получения концентрации суммарного гемоглобина приблизительно 10% с использованием фильтра 60, соединенного с ловушкой 62. Затем 10% раствор гемоглобина стерилизуют фильтрацией через фильтр 64 и заполняют им предварительно стерилизованные пакеты в асептических условиях.
Пример 14
Предварительное образование тетрамера в растворе
Независимо от того, подвергался ли раствор горячему гашению или необязательной тепловой обработке, чтобы вызвать образование тетрамера в процессе обработки, раствор можно подвергнуть тепловой обработке в любое время после составления композиции, чтобы инициировать образование тетрамера путем нагревания раствора приблизительно при 45-55°C в течение приблизительно 20-30 часов, или пока содержание тетрамера не превысит приблизительно 1-3%. После тепловой обработки раствор нужно очистить, как в примере 11, и дегазировать, как в примере 13. Поскольку раствор в данный момент уже представляет собой готовую композицию, добавки, введенные в примере 12, перед очисткой предпочтительно удалить путем диафильтрации и затем опять ввести при повторном составлении композиции.
Пример 15
Повторная обработка просроченных растворов гемоглобина
Просроченные или выдержанные растворы гемоглобина можно повторно обработать, как в примере 14, без тепловой обработки. Обычно растворы гемоглобина, хранящиеся дольше приблизительно 12-18 месяцев приблизительно при 2-8°C, содержат уровень тетрамера, превышающий приблизительно 1,0%. Данный раствор можно ввести в резервуар 5, очистить и снова составить композицию в соответствии с примерами 11-13. Поскольку раствор в данный момент уже представляет собой готовую композицию, добавки, введенные в примере 13, перед очисткой предпочтительно удалить путем диафильтрации и затем опять ввести при повторном составлении композиции.
Приведенное выше подробное описание предпочтительных воплощений данного изобретения предназначено для иллюстрации, а не для ограничения. Следует понимать, что все другие модификации, варианты и эквиваленты, которые специалист в данной области может разработать на основе данного описания, входят в объем настоящего изобретения в соответствии с формулой изобретения.
Реферат
Группа изобретений относится к стабилизированным растворам, переносящим кислород. Более конкретно, оно относится к растворам гемоглобина, в которых после соответствующей обработки повышается стабильность полимерных связей и снижается количество образующегося тетрамера. Предложен способ получения раствора гемоглобина, по существу не содержащего тетрамера, включающий в себя полимеризацию гемоглобина в растворе, тепловую обработку полимеризованного гемоглобина в растворе при температуре выше приблизительно 45°С в течение, по меньшей мере, приблизительно 24 часа с частичной деградацией полимера до тетрамера и удаление тетрамера из раствора гемоглобина. Предложен раствор гемоглобина, полученный указанным способом. Предложен способ стабилизации раствора полимеризованного гемоглобина, по существу не содержащего тетрамера. Предложены способ получения стабилизированного раствора полимеризованного гемоглобина и способ получения раствора гемоглобина, по существу не содержащего тетрамера. Изобретение позволяет получить конечный продукт, когда содержание микробных и вирусных антигенов и патогенов уменьшается до недетектируемых уровней. 5 н. и 18 з.п. ф-лы, 14 ил.

Комментарии