Медицинское устройство, содержащее коллаген vi - RU2693408C2
Код документа: RU2693408C2
Чертежи









Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к небиоразлагаемому медицинскому устройству, предназначенному для введения в живой организм, содержащему поверхность контакта с тканью, покрытую коллагеном VI. Изобретение также относится к способам изготовления таких устройств.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Имплантируемые медицинские устройства могут быть использованы для лечения многих заболеваний и состояний в организме пациента. Имплантируемые медицинские устройства могут быть использованы для замены части тела (например, стоматологические и ортопедические имплантаты, искусственные хрусталики) или могут быть использованы для коррекции или восстановления структуры внутренней ткани или органа (например, сосудистые стенты). Имплантируемые медицинские устройства могут также быть использованы для доставки лекарственных средств.
Например, стоматологические имплантационные системы широко применяют для замены поврежденных или утраченных естественных зубов. В таких имплантационных системах стоматологический фиксатор (винт), обычно изготовленный из титана или титанового сплава, фиксируют в челюсти пациента для замены корня естественного зуба. Затем к фиксатору присоединяют абатмент (опорную структуру) с целью формирования ядра для части стоматологического протеза, выступающей из костной ткани через мягкую ткань десны в полость рта пациента. В завершение, на указанный абатмент может быть установлен протез или коронка.
Для любого типа медицинского устройства, предназначенного для контакта с живой тканью, крайне важна биологическая совместимость. Среди многих других аспектов, необходимо учитывать и минимизировать риск реакции на инородное тело, образования тромбов и инфицирования для предотвращения нежелательных эффектов, как местных, так и системных, которые могут в противном случае негативно влиять на здоровье пациента и/или приводить к повреждению устройства. Это в особенности относится к постоянным имплантатам. Кроме того, для фиксации имплантата и его длительного функционирования часто жизненно важны заживление и регенерация ткани, окружающей имплантат. Это особенно важно для несущих имплантатов, таких как стоматологические или ортопедические имплантаты.
Для стоматологических фиксаторов необходимо прочное соединение костной ткани и имплантата. В случае имплантатов, предполагающих контакт с мягкой тканью, таких как абатменты, которые частично находятся в мягкой ткани десны, для полной функциональности имплантата также жизненно важна совместимость с мягкой тканью. Обычно после имплантации стоматологической имплантационной системы абатмент частично или полностью окружен тканью десны. Как по медицинским, так и по эстетическим причинам желательно, чтобы ткани десны быстро заживали и плотно окружали имплантат. Плотный контакт слизистой оболочки полости рта и стоматологического имплантата служит барьером против микробной среды полости рта и крайне важен для успешной имплантации. Это особенно важно для пациентов с ненадлежащей гигиеной полости рта и/или с неадекватным состоянием кости или слизистой оболочки. Неудовлетворительное заживление или неудовлетворительное соединение мягкой ткани с имплантатом повышает риск развития инфекции и периимплантита, что может в конечном счете привести к резорбции кости и невыполнению имплантатом своих функций.
Существует несколько путей повышения вероятности успешной имплантации медицинского устройства, например, повышение скорости образования новой ткани, и/или, в случаях, когда желательно связывание ткани и имплантата, повышение скорости присоединения ткани к поверхности имплантата, или снижение риска развития инфекции. Усиление образования новой ткани может быть достигнуто, например, различными модификациями поверхности и/или размещением биологически активных агентов на поверхности. Риск развития инфекции в связи с стоматологическими имплантатами в настоящее время снижают главным образом посредством превентивных мер, таких как поддержание хорошей гигиены полости рта. Если на поверхности стоматологического имплантата образуется биопленка, ее сложно удалить, применяя антибактериальные агенты. В случае развития инфекции в кости или в мягкой ткани, окружающих стоматологический имплантат (периимплантит), основным элементом является механическая санация, иногда в комбинации с антибиотиками, антисептиками и/или ультразвуковой или лазерной обработкой.
В данной области техники существует потребность в лучших способах предотвращения инфекций в месте имплантации медицинского устройства.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задача настоящего изобретения состоит в по меньшей мере частичном преодолении этой проблемы и обеспечении медицинского устройства, такого как имплантат, имеющего поверхность, которая снижает риск инфицирования при контакте медицинского устройства с живой тканью.
Согласно первому аспекту изобретения, эту и другие задачи решают посредством медицинского устройства, предназначенного для введения в живой организм, содержащего небиоразлагаемый субстрат, имеющий поверхность контакта с тканью, которая по меньшей мере частично покрыта микрофибриллами коллагена VI.
Коллаген представляет собой белок, образующий основной компонент внеклеточного матрикса многих органов и тканей. Существует по меньшей мере 28 различных типов коллагена, обнаруженных в различных тканях. Коллаген VI типа (также обозначаемый «коллаген VI», «коллаген-VI» или «коллаген типа VI») является распространенным компонентом внеклеточного матрикса у млекопитающих. При использовании здесь «микрофибрилла коллагена VI» или «микрофибриллы коллагена VI» относятся к филаментной структуре, образованной тетрамерами молекул коллагена VI, аггрегированными конец в конец. Такие микрофибриллы могут иметь толщину в диапазоне от 1 до 50 нм, например, от 5 до 20 нм, и длину в диапазоне от 0,1 до 10 мкм, например, от 0,5 до 5 мкм.
Авторы изобретения обнаружили, что биологический материал, покрытый микрофибриллами коллагена VI, придает антимикробные свойства против аэробных и анаэробных патогенов человека. В особенности, антимикробный эффект был обусловлен коллагеном VI, находящимся на поверхности, и, вероятно, не заключался в каком-либо существенном высвобождении коллагена VI с поверхности. Таким образом, указанная антимикробная поверхность может быть более устойчива к ослаблению этого эффекта по сравнению с устройствами, высвобождающими антимикробные вещества. Результаты экспериментов свидетельствуют о том, что поверхность может сохранять антимикробный эффект на протяжении продолжительного периода времени. Таким образом, медицинское устройство согласно воплощениям изобретения позволяет лучше предотвращать инфекции после хирургической имплантации имплантата или медицинского устройства пациенту.
Кроме того, был отмечен синергичный эффект между антимикробными свойствами коллагена VI и врожденной иммунной системой, в особенности, нейтрофилами. Это было неожиданно; поскольку основной биологической функцией полиморфноядерных нейтрофилов (polymorphonuclear neutrophils, PMN) является фагоцитоз, разрушение и выведение бактерий, ожидали не большего, чем привлечение PMN для удаления уже погибших бактерий. Вместо этого, было неожиданно обнаружено, что PMN были стимулированы образовывать нейтрофильные внеклеточные ловушки (neutrophil extracellular traps, NET) для захвата бактерий на поверхности, предотвращая дальнейшее распространение бактерий и приводя к их быстрому уничтожению под действием коллагена VI. Кроме того, уничтожение бактерий под действием коллагена VI неожиданно усиливается в присутствии PMN и высвобождаемых ими протеаз. Не будучи связанными с какой-либо конкретной теорией, полагают, что этот эффект стимуляции PMN может по меньшей мере частично быть обусловлен микрофибриллярной структурой коллагена VI, включающей интактные N- и С-концевые домены, которая, как полагают, имитирует естественную биологическую среду раны, и ему могут также способствовать еще неизвестные иммунные и воспалительные процессы.
Таким образом, в ситуациях, когда нейтрофилы контактируют с медицинским устройством, покрытым коллагеном VI, например, во время хирургического вмешательства или любой процедуры, приводящей к кровотечению и/или воспалению в месте имплантата или медицинского устройства, антибактериальный эффект будет дополнительно усилен за счет использования медицинского устройства согласно настоящему изобретению.
Обычно коллаген VI может представлен в виде нативных микрофибрилл с N- и С-концевыми глобулярными доменами с сохраненной структурой.
В воплощениях изобретения небиоразлагаемый субстрат содержит биологически совместимый материал, выбранный из металлических, керамических или пластмассовых материалов. Например, небиоразлагаемый субстрат содержит металлический материал, выбранный из группы, состоящей из титана, циркония, гафния, ванадия, ниобия, тантала, кобальта, и иридия, и их сплавов. В других воплощениях субстрат может содержать керамический материал, например, диоксид циркония.
В воплощениях изобретения медицинское устройство может представлять собой хирургический имплантат, предназначенный для имплантации в твердые ткани, такие как кость, и/или в мягкую ткань.
В воплощениях изобретения медицинское устройство может представлять собой несущий нагрузку имплантат.
Например, медицинское устройство может представлять собой стоматологический имплантат или его часть, такую как стоматологический фиксатор, стоматологический абатмент или однокомпонентный стоматологический имплантат. В других случаях медицинское устройство может представлять собой слуховой аппарат с костной фиксацией. Альтернативно, медицинское устройство может представлять собой ортопедический имплантат.
В воплощениях изобретения медицинское устройство может представлять собой стент или шунт.
В воплощениях изобретения у медицинского устройства поверхность контакта с тканью может быть покрыта слоем коллагена VI. Возможно, коллаген VI может быть присоединен к поверхности посредством линкерных молекул. Слой коллагена VI может иметь толщину в диапазоне от 1 нм до 50 нм, например, от 5 нм до 50 нм. Слой может быть несплошным, то есть, не полностью покрывать подлежащую поверхность.
В другом аспекте согласно изобретению предложен способ покрытия поверхности медицинского устройства, включающий:
(1) обеспечение небиоразлагаемого субстрата, имеющего поверхность контакта с тканью;
(2) возможно, присоединение линкерных молекул к указанной поверхности контакта с тканью;
и
(3) контактирование по меньшей мере части указанной поверхности контакта с тканью с раствором, содержащим микрофибриллы коллагена VI, для присоединения указанных микрофибрилл коллагена VI к указанной поверхности и/или к указанным линкерным молекулам.
Линкерные молекулы могут содержать поли-L-лизин (PLL).
В воплощениях изобретения стадию (2) могут осуществлять посредством:
(2-а) нанесения раствора, содержащего линкерные молекулы и растворитель, на поверхность изделия, и
(2-b) удаления указанного растворителя.
Альтернативно или дополнительно, стадию (3) могут осуществлять посредством:
(3-а) нанесения раствора, содержащего микрофибриллы коллагена VI и растворитель, на указанную поверхность;
(3-b) инкубирования субстрата с указанным раствором, нанесенным на указанную поверхность; и
(3-c) удаления указанного растворителя.
Стадию (3-b) могут осуществлять путем выдерживания изделия при температуре в диапазоне от 4 до 40°C в течение по меньшей мере 10 минут.
В воплощениях изобретения раствор, содержащий микрофибриллы коллагена VI, может иметь концентрацию фибрилл коллагена в диапазоне от 10 нМ (150 нг/мл) до 10 мкМ (150 мкг/мл), например, от 0,5 до 5 мкМ, в такой как от 1 до 2 мкМ.
Кроме того, в способе, формирующем второй аспект изобретения, коллаген VI может предпочтительно быть представлен в форме нативных микрофибрилл.
Следует отметить, что изобретение относится ко всем возможным комбинациям признаков, указанных в формуле изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показаны сканирующие электронные микрофотографии различных поверхностей, инкубированных со Streptococcus mitis в течение 0 часов (левая колонка), 24 часов (средняя колонка) и 48 часов (правая колонка), соответственно. Поверхности были следующими: титановая поверхность (Ti; верхний ряд), Ti поверхность, покрытая коллагеном IV (Ti/cVI; второй ряд сверху), Ti поверхность, покрытая поли-L-лизином (PLL) (Ti/PLL; третий ряд сверху), и Ti поверхность, покрытая поли-L-лизином и коллагеном VI (Ti/PLL/cVI; нижний ряд). Длина масштабных линеек 10 мкм (все изображения в одном масштабе).
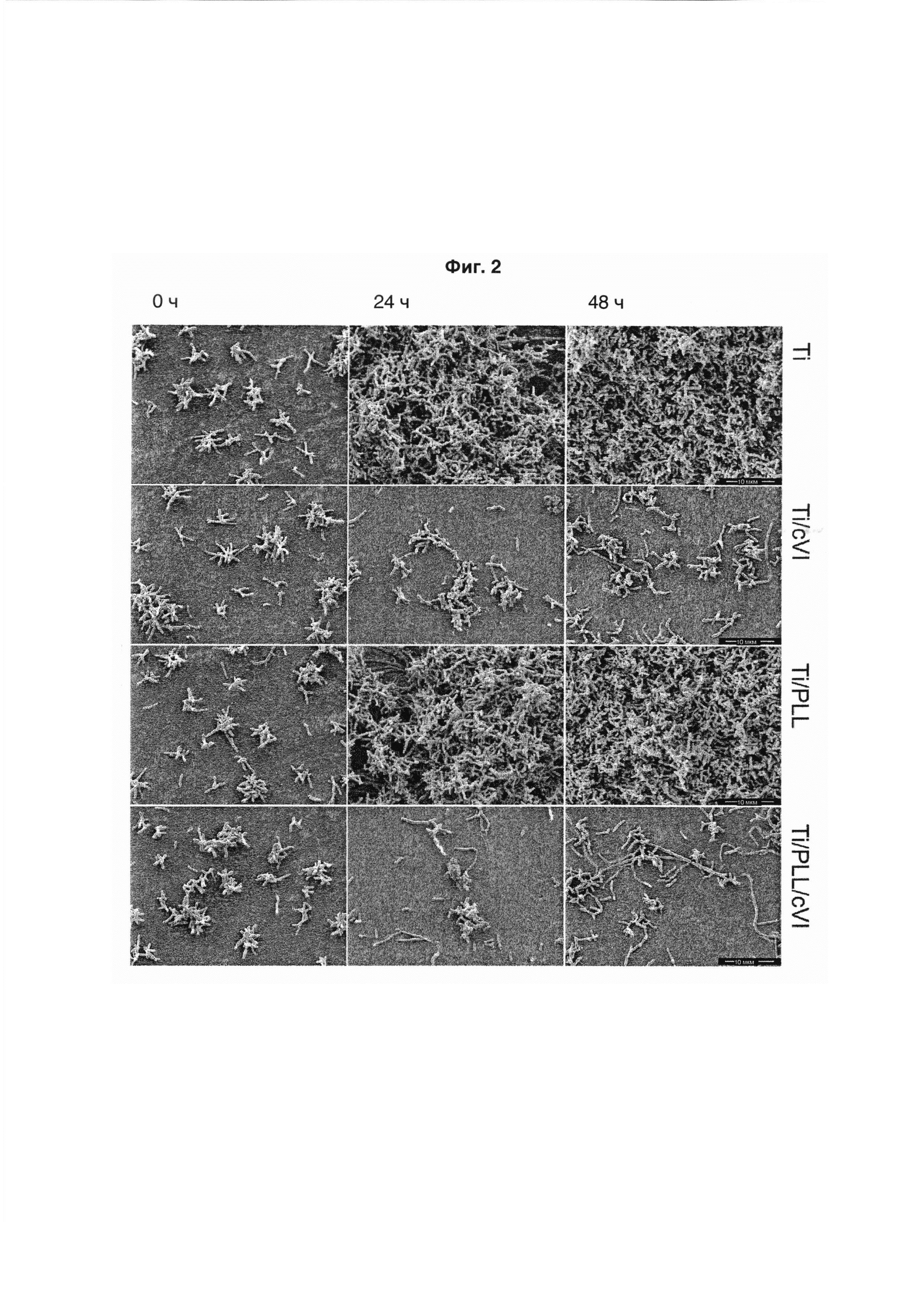
На Фиг. 2 показаны сканирующие электронные микрофотографии различных поверхностей, инкубированных с Actinomyces naeslundii в течение 0 часов (левая колонка), 24 часов (средняя колонка) и 48 часов (правая колонка), соответственно. Поверхности были следующими: титановая поверхность (Ti; верхний ряд), Ti поверхность, покрытая коллагеном IV (Ti/cVI; второй ряд сверху), Ti поверхность, покрытая поли-L-лизином (PLL) (Ti/PLL; третий ряд сверху), и Ti поверхность, покрытая поли-L-лизином и коллагеном VI (Ti/PLL7cVI; нижний ряд). Длина масштабных линеек 10 мкм (все изображения в одном масштабе).
На Фиг. 3 показаны сканирующие электронные микрофотографии различных поверхностей, инкубированных с Fusobacterium nucleatum в течение 0 часов (левая колонка), 24 часов (средняя колонка) и 48 часов (правая колонка), соответственно. Поверхности были следующими: титановая поверхность (Ti; верхний ряд), Ti поверхность, покрытая коллагеном IV (Ti/cVI; второй ряд сверху), Ti поверхность, покрытая поли-L-лизином (PLL) (Ti/PLL; третий ряд сверху), и Ti поверхность, покрытая поли-L-лизином и коллагеном VI (Ti/PLL/cVI; нижний ряд). Длина масштабных линеек 10 мкм (все изображения в одном масштабе).
На Фиг. 4 показаны сканирующие электронные микрофотографии различных поверхностей, инкубированных с Prevotella intermedia в течение 0 часов (левая колонка), 24 часов (средняя колонка) и 48 часов (правая колонка), соответственно. Поверхности были следующими: титановая поверхность (Ti; верхний ряд), Ti поверхность, покрытая коллагеном IV (Ti/cVI; второй ряд сверху), Ti поверхность, покрытая поли-L-лизином (PLL) (Ti/PLL; третий ряд сверху), и Ti поверхность, покрытая поли-L-лизином и коллагеном VI (Ti/PLL/cVI; нижний ряд). Длина масштабных линеек 10 мкм (все изображения в одном масштабе).
На Фиг. 5 показаны сканирующие электронные микрофотографии поверхностей Ti/PLL (верхний ряд) и Ti/PLL/cVI (нижний ряд), соответственно, после 48 часов инкубации со S. mitis (левая колонка), A. naeslundii (вторая колонка слева), Fusobacterium nucleatum (вторая колонка справа) и Prevotella intermedia (правая колонка), соответственно. Как можно видеть, в присутствии коллагена VI (Ti/PLL/cVI) уничтожение бактерий видно по разрывам мембран и экссудации цитоплазмы, что отмечено белыми стрелками. Длина масштабных линеек 2 мкм (все изображения в одном масштабе).
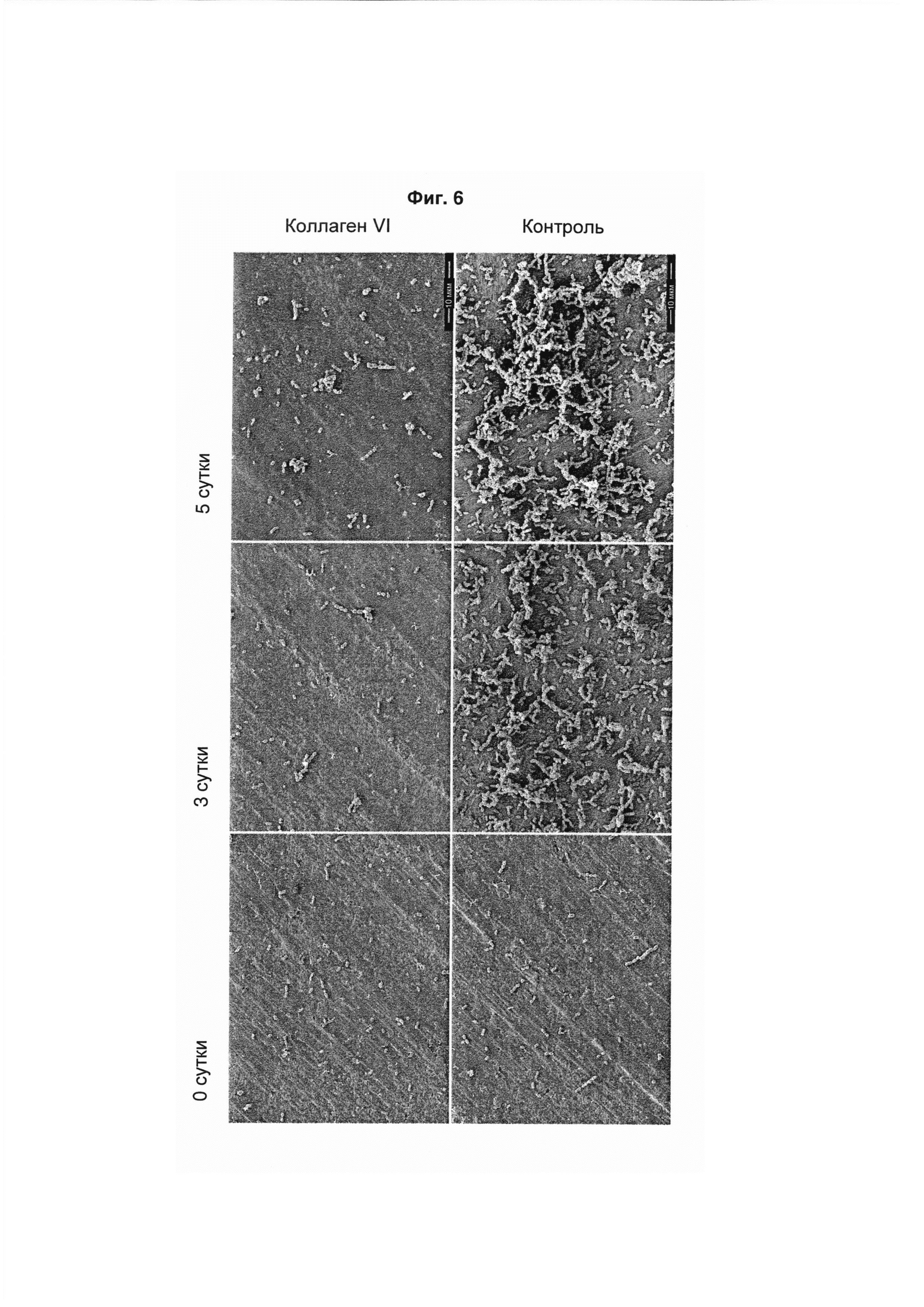
На Фиг. 6 показаны сканирующие электронные микрофотографии S. mitis, инкубированных на титановой поверхности, покрытой коллагеном VI (обозначено «коллаген VI», верхний ряд), и Ti поверхности («контроль», нижний ряд), соответственно. Каждые сутки на поверхности добавляли свежий 0,1% раствор бактерий. В присутствии коллагена VI рост бактерий был значительно ингибирован. Длина масштабных линеек 10 мкм.
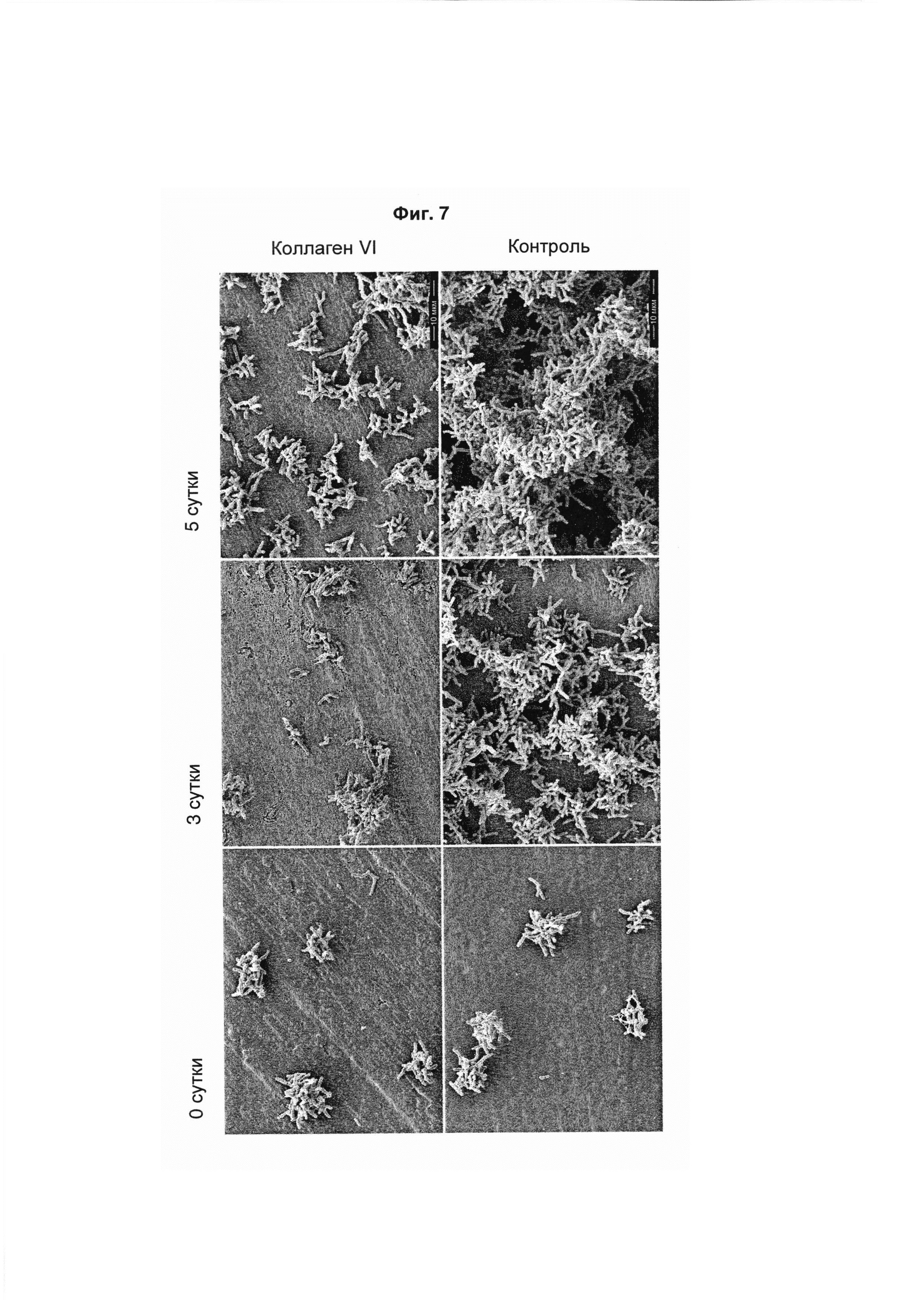
На Фиг. 7 показаны сканирующие электронные микрофотографии A. naeslundii, инкубированных на Ti поверхности, покрытой коллагеном VI (обозначено «коллаген VI», верхний ряд), и Ti поверхности («контроль», нижний ряд), соответственно. Каждые сутки на поверхность добавляли свежий 0,1% раствор бактерий. В присутствии коллагена VI рост бактерий был значительно ингибирован. Длина масштабных линеек 10 мкм.
На Фиг. 8 показаны сканирующие электронные микрофотографии захвата бактерий (S. mitis) в нейтрофильные внеклеточные ловушки (NET), образованные полиморфноядерными нейтрофилами (PMN) на поверхности керамического стоматологического абатмента (верхний ряд) и титанового винта (нижний ряд). SEM (сканирующие электронные микрофотографии)-изображения с возрастающим увеличением (длина масштабных линеек 1 мм, 100 мкм, 20 мкм и 5 мкм) демонстрируют, как происходит захват бактерий в NET, образованные PMN.
На Фиг. 9 представлена сканирующая электронная микрофотография, демонстрирующая захват в NET, образованные PMN, на Ti поверхности, покрытой коллагеном VI (Ti/PLL/cVI). PMN образуют NET, на которых происходят адгезия и захват бактерий (как отмечено белыми стрелками). Длина масштабных линеек 5 мкм.
На Фиг. 10А и 10B показаны сканирующие электронные микрофотографии захвата и уничтожения бактерий в NET, образованные PMN, на поверхности титанового винта (Фиг. 10А) или керамического абатмента (Фиг. 10B), покрытых коллагеном VI с использованием PLL в качестве линкера (cVI, правая колонка), или без покрытия (контроль, левая колонка) после инкубации со S. mitis в течение 0 минут (верхний ряд) и 120 минут (нижний ряд), соответственно. В присутствии коллагена VI структурная целостность бактерий быстро нарушалась, признаками чего является образование мембранных пузырьков (отмечены белыми стрелками). В отсутствии покрытия из коллагена VI бактерии оставались захваченными в NET, но не погибали. Длина масштабных линеек 2 мкм.
На Фиг. 11 схематически показаны различные структуры коллагена VI, включая полипептидные цепи, мономеры коллагена VI и нативные микрофибриллы коллагена VI.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что медицинское устройство, имеющее поверхность контакта с тканью, по меньшей мере частично покрытую микрофибриллами коллагена VI, в частности нативными микрофибриллами, может обеспечивать существенный антибактериальный эффект, являющийся крайне желательным, в частности, для имплантируемых медицинских устройств. Кроме того, было обнаружено, что поверхности, покрытые микрофибриллами коллагена VI, неожиданно оказывали иммуностимулирующий эффект.
При использовании здесь термины «микрофибрилла коллагена VI» или «микрофибриллы коллагена VI» относятся к филаментной структуре, образованной тетрамерами молекул коллагена VI, агрегированными конец в конец. В настоящем изобретении предпочтительно используют нативные микрофибриллы, то есть структура микрофибрилл соответствует нативной форме коллагена VI, обнаруженной в живой ткани. В отличие от этого, ненативная микрофибрилла может быть частично деградированной, например, в N- и/или С-концевых глобулярных доменах. Нативные микрофибриллы могут быть выделены из образцов тканей с применением способа, описанного в Spissinger Т, Engel J, Matrix Biol 1995; 14:499-505, с использованием коллагеназы бычьей роговицы. Предпочтительно, этот способ позволяет сохранять структуру глобулярных доменов. В отличие от этого, способ с использованием, например, пепсина, приводит к расщеплению микрофибрилл в глобулярных доменах и к получению, таким образом, частично деградированных ненативных микрофибрилл коллагена VI.
В директиве 2007/47/ес дано следующее определение медицинского устройства: «любой инструмент, аппарат, приспособление, программное обеспечение, материал или другое изделие, используемые сами по себе или в комбинации, включая программное обеспечение, предназначенное его производителем для использования специально в диагностических и/или терапевтических целях, и необходимое для их правильного применения, предназначенные производителем для применения у людей». В контексте настоящего изобретения рассматриваются только медицинские устройства, предназначенные для контакта с живой тканью, то есть любой инструмент, аппарат, приспособление, материал или другое изделие физической природы, предназначенное для наложения на, введения в, имплантации в организм, часть тела или орган или иного контакта с ними. Кроме того, указанные организм, часть тела или орган могут представлять собой организм, часть тела или орган субъекта, являющегося человеком или животным, обычно млекопитающим. Тем не менее, предпочтительно, что медицинское устройство предназначено для субъектов-людей. Медицинские устройства, включенные в приведенное выше определение, представляют собой, например, имплантаты, катетеры, шунты, трубки, стенты, внутриматочные устройства и протезы.
В частности, медицинское устройство может представлять собой медицинское устройство, предназначенное для имплантации в живую ткань или для введения в организм или часть тела субъекта, включая введение в полость тела.
Настоящее медицинское устройство может быть предназначено для кратковременного, длительного или долговременного контакта с живой тканью. Под термином «кратковременный» понимают продолжительность менее 24 часов, согласно определениям, приведенным в ISO 10993-1 для биологической оценки медицинских устройств. Кроме того, термин «длительный» согласно тому же стандарту, относится к продолжительности от 24 часов до 30 суток. Соответственно, согласно тому же стандарту, под термином «долговременный» понимают продолжительность более 30 суток. Таким образом, в некоторых воплощениях медицинское устройство по изобретению может представлять собой постоянный имплантат, предназначенный для нахождения в организме субъекта на протяжении месяцев, лет или даже в течение всей жизни.
При использовании здесь объем термина «имплантат» включает любое устройство, по меньшей мере часть которого предназначена для имплантации в организм позвоночного животного, в частности, млекопитающего, такого как человек. Имплантаты могут быть использованы для замещения анатомических структур и/или восстановления любой функции организма. Обычно имплантат состоит из одной или нескольких частей имплантата. Например, зубной имплантат обычно содержит зубной фиксатор в сочетании с вторичными частями имплантата, такими как абатмент и/или стоматологическая коронка. Тем не менее, любое устройство, такое как зубной фиксатор, предназначенное для имплантации, может само по себе быть названо имплантатом, даже если к нему необходимо присоединять другие части.
Под «биологически совместимым» понимают материал, который при контакте с живой тканью сам по себе не приводит к нежелательному биологическому ответу (например, воспалению или другим иммунологическим реакциям) ткани.
Под «мягкой тканью» понимают любой тип ткани, в частности, типы тканей млекопитающих, которые не являются костью или хрящом. Примеры мягкой ткани, для которых подходит медицинское устройство, включают соединительную ткань, фиброзную ткань, эпителиальную ткань, сосудистую ткань, мышечную ткань, слизистую оболочку, десну и кожу, но не ограничиваются ими.
Коллаген представляет собой белок, образующий основной компонент внеклеточного матрикса многих органов и тканей. Существует по меньшей мере 28 различных типов коллагена, обнаруженных в различных тканях; при этом коллаген I типа (коллаген I) является наиболее распространенной формой в кости и соединительной ткани, коллаген II типа преобладает в хряще, коллаген III типа является основным компонентом стенок кровеносных сосудов, но также присутствует в хряще, и коллаген IV типа является компонентом базальной мембраны. Отдельная молекула коллагена состоит из трех полипептидных цепей (также называемых про-α-цепями), каждая из которых образует α-спираль, тесно переплетенных друг с другом с образованием тройной спиральной конфигурации. Различные типы коллагена различаются по аминокислотной последовательности полипептидных цепей и также по вторичной структуре и/или третичной структуре.
Коллаген VI типа (также обозначаемый «коллаген VI» или «коллаген-VI») является повсеместным компонентом внеклеточного матрикса у млекопитающих. Он присутствует в соединительных тканях и часто ассоциирован с базальными мембранами. Как показано на Фиг. 11, для образования мономера коллагена VI (10) происходит сборка гетеротримерной структуры из полипептидных цепей α1, α2 и α3, где в некоторых случаях дополнительные тканеспецифичные цепи могут заменять цепь α3. Затем происходит выравнивание четырех мономеров с образованием тетрамера посредством латеральной ассоциации и агрегация множества тетрамеров конец в конец с образованием микрофибриллы (20), имеющей форму тонкого филамента с утолщениями. Такие микрофибриллы, также называемые нативными микрофибриллами, обычно имеют длину в диапазоне от 0,5 до 5 мкм и толщину приблизительно от 10 до 15 нм.
Интересно, что в их биологическом окружении нативные микрофибриллы коллагена обычно нечувствительны к ферментативному деградированию. Это может быть обусловлено биологической ролью коллагена VI в качестве биомеханического тканевого стабилизатора, важного для поддержания объема тканей, их васкуляризации и инфильтрации иммунными клетками.
N- и С-концевые глобулярные домены коллагена VI гомологичны доменам фактора фон Виллебранда типа A (Specks U, Mayer U, Nischt R, Spissinger T, Mann K, Timpl R, Engel J, Chu ML, EMBO J 1992; 11:4281-4290), и показано, что коллаген VI в растворе обладает антимикробной активностью против стрептококков А, С и G, являющихся грамположительными бактериями (Abdillahi S.М., Balvanovic S., Baumgarten М,

В свете этих данных и результатов, авторы настоящего изобретения предложили медицинское устройство, предназначенное для введения в живой организм, содержащее небиоразлагаемый субстрат, имеющий поверхность контакта с тканью, по меньшей мере частично покрытую коллагеном VI.
Медицинское устройство в соответствии с воплощениями изобретения может быть изготовлено из любого подходящего биологически совместимого материала, например, материалов, используемых для имплантируемых устройств. Обычно медицинское устройство содержит субстрат, имеющий поверхность контакта с тканью.
Под «поверхностью контакта с тканью» понимают поверхность, предназначенную для контакта (кратковременного, длительного или долговременного) с живой тканью.
Субстрат могут, например, изготавливать из биологически совместимого металла или металлического сплава, включая один или более чем один материал, выбранный из группы, состоящей из титана, циркония, гафния, ванадия, ниобия, тантала, кобальта, иридия и их сплавов. Альтернативно, субстрат медицинского устройства могут изготавливать из биологически совместимой керамики, такой как диоксид циркония, диоксид титана, металлокерамика с памятью формы и их комбинации. В воплощениях, где медицинское устройство используют в качестве стоматологического абатмента или оно образует часть стоматологического абатмента, субстрат предпочтительно изготавливают из металлического материала.
При контакте с кислородом металлы титан, цирконий, гафний, тантал, ниобий и их сплавы мгновенно взаимодействуют, образуя инертный оксид. Таким образом, поверхности изделий из этих материалов фактически всегда покрыты тонким слоем оксида. Нативный слой оксида на титановом субстрате состоит в основном из диоксида титана (IV) (TiO2) с небольшими количествами Ti2O3) TiO и Ti3O4.
Таким образом, в воплощениях, где медицинское устройство содержит одно или более чем один из титана, циркония, гафния, тантала, ниобия или сплава любого из них, медицинское устройство обычно имеет нативный поверхностный слой оксида металла. Такой нативный слой оксида металла может быть, в свою очередь, по меньшей мере частично покрыт слоем микрофибрилл коллагена VI.
В других воплощениях настоящего изобретения медицинское устройство, в частности, ее субстрат, могут изготавливать из биологически совместимого полимера, обычно выбранного из группы, состоящей из полиэфирэфиркетона (РЕЕК), полиметилметакрилата (РММА), полимолочной кислоты (PLLA), и полигликолевой кислоты (PGA), а также любых их комбинаций и сополимеров.
В воплощениях изобретения медицинское устройство предназначено для кратковременного, длительного или долговременного контакта с живой тканью. Например, медицинское устройство по изобретению может представлять собой имплантат, обычно предназначенный для временного или постоянного замещения или восстановления функции или структуры организма.
Обычно, по меньшей мере часть поверхности медицинского устройства предназначена для контакта с мягкой тканью и по меньшей мере часть этой поверхности контакта с мягкой тканью покрыта микрофибриллами коллагена VI. Например, медицинское устройство может представлять собой имплантат, предназначенный для контакта преимущественно или исключительно с мягкой тканью, например, зубной абатмент. Альтернативно, медицинское устройство может представлять собой имплантат для введения частично в кость и частично в мягкую ткань. Примеры таких имплантатов включают однокомпонентные стоматологические имплантаты и слуховые аппараты с костной фиксацией (также называемые слуховыми протезами с костной фиксацией). Если только часть имплантата предназначена для контакта с мягкой тканью, предпочтительно по меньшей мере часть поверхности контакта с мягкой тканью имеет покрытие, содержащее коллаген VI.
Медицинское устройство может также быть подходящим для контакта с хрящом.
В других воплощениях медицинское устройство может быть предназначено для контакта с костной тканью, например, челюстной костью, бедренной костью или черепом млекопитающего, в частности человека. Примеры таких медицинских устройств включают стоматологические фиксаторы и ортопедические имплантаты.
В воплощениях изобретения поверхность контакта с тканью может представлять собой шероховатую поверхность. Средняя шероховатость Ra поверхности субстрата и, таким образом, возможно, также поверхности медицинского устройства, полученных покрытием коллагеном VI, может составлять по меньшей мере 0,05 мкм, обычно по меньшей мере 0,1 мкм, например, по меньшей мере 0,2 мкм. Поскольку полагают, что поверхности со средней шероховатостью (Ra) по меньшей мере 0,2 мкм более восприимчивы к образованию биопленок, то покрытие коллагеном VI, как описано в настоящем описании, может быть особенно полезным для медицинских устройств с шероховатостью поверхности по меньшей мере 0,2 мкм и может быть еще более полезным для предотвращения образования биопленок на медицинских устройствах с еще большей шероховатостью поверхности. В качестве примера, шероховатость поверхности стоматологического абатмента, содержащего титановый субстрат, может составлять приблизительно 0,2-0,3 мкм. Покрывающий слой микрофибрилл коллагена VI может сохранять шероховатость подлежащей поверхности.
Кроме того, в воплощениях изобретения поверхность контакта с тканью медицинского устройства может содержать по меньшей мере одну дополнительную биомолекулу.
Медицинское устройство по изобретению может быть изготовлено путем покрытия поверхности микрофибриллами коллагена VI непосредственно или через линкерную молекулу. В воплощениях с использованием линкерной молекулы сначала к поверхности присоединяют линкерную молекулу и затем к указанной линкерной молекуле присоединяют микрофибриллы коллагена. В воплощениях без использования линкерной молекулы поверхность может, тем не менее, возможно, быть обработана химически или физически, например, с целью очистки поверхности или придания суммарного электрического заряда, для улучшения присоединения микрофибрилл коллагена VI. Например, поверхность может быть подвергнута обработке, которая увеличивает гидрофильность поверхности.
После присоединения фибрилл коллагена медицинское устройство может, возможно, быть подвергнуто мягкой стерилизующей обработке до применения, например, в качестве имплантата или его части.
При покрытии поверхности с использованием линкерной молекулы или без использования нее микрофибриллы коллагена VI согласно воплощениям настоящего изобретения могут принимать любую ориентацию.
Например, микрофибриллы коллагена VI могут быть нанесены на поверхность медицинского устройства путем нанесения раствора, содержащего микрофибриллы коллагена, на поверхность. Раствор может быть нанесен на поверхность любой обычной методикой, оставляющей по меньшей мере тонкую пленку раствора, покрывающую поверхность, которую необходимо покрыть коллагеном VI. Такие способы включают распыление, струйное и капельное нанесение раствора на поверхность и погружение поверхности в раствор.
Раствор может представлять собой водный раствор микрофибрилл коллагена VI в концентрации в диапазоне от 10 нМ до 10 мкМ, например, от 0,5 до 5 мкМ, такой как от 1 до 2 мкМ.
После нанесения тонкой пленки раствора коллагена VI на поверхность медицинское устройство можно инкубировать на протяжении периода времени продолжительностью по меньшей мере 10 минут, обычно по меньшей мере 30 минут, например, от приблизительно 45 минут до нескольких часов, обычно до 1 часа. Инкубирование можно осуществлять при температуре 40°C или менее, обычно при температуре в диапазоне от 4 до 40°C, например, при комнатной температуре (15-25°C). Медицинское устройство можно инкубировать во влажной камере. Инкубирование устройства во влажной атмосфере предпочтительно, поскольку оно предотвращает слишком быстрое испарение растворителя с поверхности. При использовании в воплощениях изобретения влажная камера обычно означает закрытую камеру, в которую помещают компонент и в которой также присутствует открытая емкость со стерильной водой или ткань, смоченная в стерильной воде. В промышленных условиях влажная камера может представлять собой контролируемую камеру с 75-100% влажностью. Тем не менее, следует отметить, что влажная камера не является необходимой и слишком быстрого высыхания нанесенного раствора можно избежать и при обычной влажности.
После инкубирования (испарения растворителя) поверхность обычно промывают, например, в стерильной воде или подходящем буферном растворе, для удаления остатков раствора и она может, возможно, быть подвергнута подходящей стерилизующей обработке, например, УФ- или гамма-облучению или химической стерилизации с использованием газообразного этиленоксида.
В воплощениях изобретения с использованием линкерной молекулы линкер обычно присоединяют к поверхности до нанесения микрофибрилл коллагена VI. Линкер может быть присоединен к поверхности любым подходящим способом, включая, например, электростатическое взаимодействие, гидрофобное взаимодействие или ковалентное связывание. В частности, линкерная молекула может быть присоединена к поверхности посредством электростатического взаимодействия. Например, к поверхности, имеющей отрицательный электрический заряд, такой как поверхность из оксида титана на титановом изделии, может быть присоединена положительно заряженная линкерная молекула, такая как поли-L-лизин. При необходимости, поверхность может быть обработана или модифицирована известными способами для получения электрического заряда.
Линкерная молекула может быть присоединена к поверхности нанесением раствора линкерной молекулы на поверхность, предпочтительно так, чтобы полностью покрывать указанную поверхность указанным раствором. Обычно перед этим поверхность промывают, например, этанолом, и высушивают. Раствор линкерной молекулы может быть нанесен любым обычным методом, таким как распыление, наливание или капельное нанесение раствора на поверхность или погружение поверхности в раствор.
В случае поли-L-лизина раствор, наносимый на поверхность может представлять собой раствор PLL, концентрация которого может входить в диапазон от 0,01 до 1 мг/мл и обычно составляет приблизительно 0,2 мг/мл.
После нанесения раствора линкера на поверхность медицинского устройства растворитель удаляют, оставляя линкерные молекулы, присоединенные к поверхности. Например, испарение растворителя может происходить при обработке медицинского устройства при повышенной температуре, например, в диапазоне от 40 до 60°C, и обычно при температуре приблизительно 60°C. Время, необходимое для испарения растворителя, может входить в диапазон от 10 минут до 2 часов, обычно от 30 минут до 1 часа.
Возможно, в воплощениях изобретения после нанесения раствора линкера на поверхность изделия медицинское устройство инкубируют в течение нескольких минут, например, 1-10 минут, и раствор линкера, кроме тех линкерных молекул, которые уже присоединены к поверхности, затем смывают посредством промывки промывочным агентом, например, стерильной водой, перед тем, как изделие подвергают повышенной температуре, как описано выше. После испарения растворителя или промывочного агента поверхность с присоединенными линкерными молекулами, возможно, промывают, например, стерильной водой, и высушивают или дают ей высохнуть.
Микрофибриллы коллагена могут быть присоединены к линкерным молекулам путем нанесения раствора, содержащего микрофибриллы коллагена, на поверхность, покрытую линкерными молекулами согласно приведенному выше описанию. Раствор, содержащий фибриллы коллагена, может быть нанесен на поверхность любой обычной методикой, оставляющей по меньшей мере тонкую пленку раствора, покрывающую поверхность, которую необходимо покрыть фибриллами коллагена. Такие способы включают распыление, наливание и капельное нанесение раствора на поверхность, и погружение поверхности в раствор.
Раствор, содержащий фибриллы коллагена, может представлять собой водный раствор микрофибрилл коллагена VI в концентрации в диапазоне от 10 нМ до 10 мкМ, например, от 0,5 до 5 мкМ, такой как от 1 до 2 мкМ.
После нанесения тонкой пленки раствора коллагена VI на поверхность медицинское устройство можно инкубировать на протяжении периода времени продолжительностью по меньшей мере 10 минут, обычно по меньшей мере 30 минут, например, от приблизительно 45 минут до нескольких часов, обычно до 1 часа. Инкубирование можно осуществлять при температуре 40°C или менее, обычно в диапазоне от 4 до 40°C, например, при комнатной температуре (15-25°C). Медицинское устройство можно инкубировать во влажной камере. Инкубирование устройства во влажной атмосфере предпочтительно, поскольку оно предотвращает слишком быстрое испарение растворителя. При использовании в воплощениях изобретения влажная камера обычно обозначает закрытую камеру, в которую помещают компонент и в которой также присутствует открытая емкость со стерильной водой или ткань, смоченная в стерильной воде. В промышленных условиях влажная камера может представлять собой контролируемую камеру с 75-100% влажностью. Тем не менее, следует отметить, что влажная камера не является необходимой, и слишком быстрого высыхания нанесенного раствора можно избежать и при обычной влажности.
После инкубирования (испарения растворителя) поверхность обычно промывают, например, в стерильной воде или подходящем буферном растворе, для удаления остатков раствора и она может, возможно, быть подвергнута подходящей стерилизующей обработке, например, УФ- или гамма-облучению или химической стерилизации с использованием газообразного этиленоксида.
Подразумевают возможность дополнительных модификаций покрытия из фибрилл коллагена, полученного способом по изобретению. Например, на покрытие из фибрилл коллагена может быть нанесено биологически активное вещество, как описано выше. Дополнительно или альтернативно, возможна поперечная сшивка фибрилл коллагена после их присоединения к поверхности, например, для снижения скорости разрушения фибрилл in vivo после имплантации медицинского устройства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
А. Материалы и методы
1. Бактерии
Streptococcus mitis, Actinomyces naeslundii, Fusobacterium nucleatum и Prevotella intermedia были любезно предоставлены Джулией Дэвис и Гюннель Свенсатером (Department of Oral Biology, Faculty of Odontology, Malmö University, Malmd, Sweden). S. mitis и A. naeslundii выращивали в течение ночи в бульоне Тодда-Гевитта (Todd-Hewitt broth, ТНВ) при 37°C во влажной атмосфере, содержащей 5% СО2. F. nucleatum и P. intermedia выращивали в пептоно-дрожжевой среде с глюкозой (Peptone Yeast Glucose, PYG) при 37°C во влажной атмосфере в анаэробных условиях.
2. Коллаген VI
Коллаген VI выделяли из бычьей роговицы посредством расщепления коллагеназой, как описано Abdillahi et al. (2012). Телячьи глаза получали с местной скотобойни. Роговицы разрезали на кусочки и экстрагировали коллагеназой с последующей гель-фильтрацией с использованием Sepharose CL-2B.
3. Покрытие титаном
Титановые круги диаметром 5 мм вырезали из фольги. Сначала указанные круги промывали хлороформом и затем дистиллированной водой. После сушки на воздухе на требуемые титановые фрагменты наносили 50 мкл поли-L-лизина (0,2 мг/мл). Затем фрагменты необходимо было инкубировать при 60°C в течение двух часов. После этого титан снова промывали дистиллированной водой и высушивали на воздухе. В то же время 1 мл раствора коллагена VI вносили в лунки 12-луночного планшета. В завершение желательные титановые круги погружали в раствор коллагена VI и инкубировали в течение ночи при 4°C. На следующее утро титан высушивали на воздухе и проводили анализы.
4. Бактериальная адгезия
Для проведения анализов адгезии S. mitis и A. naeslundii выращивали в течение ночи в 10 мл ТНВ, F. nucleatum и P. intermedia выращивали в среде PYG в анаэробных условиях и осаждали при 3500 об/мин в течение 10 минут при 4°C на следующий день. Для анаэробных видов Fusobacterium nucleatum и Prevotella intermedia процедуру проводили в анаэробном боксе. Затем осадок разводили в 10 мл PBST и измеряли OD600 (оптическую плотность при длине волны 600 нм). OD600 необходимо было довести до 1, после чего проводили разведение 1:2 в PBST. 500 мкл раствора бактерий вносили в каждую лунку с подготовленными титановыми кругами внутри, и проводили инкубирование при 37°C и 5% СО2 в течение 0, 30 и 240 минут.
Образцы промывали с использованием 500 мкл PBS (физиологический раствор, забуференный фосфатом) три раза. PBS удаляли и заменяли на 500 мкл EM-fix, состоящего из 2,5% глутаральдегида в 0,15 М какодилате натрия. Образцы инкубировали в EM-fix в течение ночи. Последующие стадии проводил опытный специалист. Проводили стадии промывки с какодилатным буфером и последующей серии дегидратаций. Таким образом, образцы инкубировали в течение пяти минут два раза в 50%, 70%, и 95% этаноле, и абсолютном этаноле в течение 30 минут и одного часа. Для высушивания образцов этанол доводили до его критической точки для газообразования при использовании жидкого СО2. Эту стадию проводили три раза по десять минут. Затем образцы размещали на подложке и покрывали золотом/палладием (20 нм наночастицы Agar). Образцы исследовали в сканирующем электронном микроскопе XL 30 FEG и изображения обрабатывали с использованием программного обеспечения AnalySIS ITEM.
5. Анализы активности по отношению к уничтожению бактерий
5.1 BacLight для FACS
Проточно-цитометрический анализ позволяет определять свойства одиночных клеток. В данном исследовании для окраски бактериальных клеток применяли окраску BacLight. Это позволяло по отдельности определять количество живых и мертвых бактерий в одной популяции.
Бактерии выращивали в течение ночи в ТНВ в стандартных условиях. На следующий день 1 мл ночной культуры переносили в 9 мл свежего ТНВ. Бактерий инкубировали в стандартных условиях до достижения OD600, равного 0,4. Бактерии осаждали при 3500 об/мин и 4°C в течение 10 минут. Супернатант удаляли и осадок разводили в 10 мл холодного буфера TG. Измеряли OD и бактерии осаждали из раствора второй раз. После удаления супернатанта количество бактерий корректировали до 1% холодным буфером TG. Раствор разводили 1:10 в TG и 20 мкл раствора переносили в реакционные пробирки объемом 1,5 мл. В реакционные пробирки объемом 1,5 мл вносили 80, 160, 200 или 500 мкл коллагена VI. Для отрицательного контроля добавляли 80 мкл буфера TG. Для положительного контроля добавляли 300 мкл LL-37. Образцы инкубировали в течение 0, 2, 24 и 48 часов и окрашивали с использованием 5 мкл PI и STY09 в разведении в соотношении 1:100. Образцы анализировали с использованием проточного цитометра BD Accuri С6.
5.2 Сканирующая электронная микроскопия (SEM)
С помощью SEM возможно исследовать адгезию бактерий на покрытых титановых поверхностях.
Для проведения SEM бактерии выращивали в течение ночи до значения OD600 1. F. nucleatum и P. intermedia выращивали в среде PYG в анаэробных условиях, в то время как S. mitis и A. naeslundii выращивали в ТНВ. Манипуляции с анаэробными видами проводили в анаэробном боксе. Культуры осаждали и разводили в 10 мл PBST. После доведения значения OD600 до 1 суспензию бактерий разводили в соотношении 1:2 в PBST. 500 мкл этой суспензии вносили в каждую лунку 24-луночного планшета с кругами, покрытыми титаном, внутри. Бактерии инкубировали в течение двух часов при 37°C для обеспечения их адгезию на титановой поверхности. По истечении этого времени образцы промывали в PBS три раза и добавляли 500 мкл ТНВ для обеспечения роста бактерий. Бактерии инкубировали в течение 0 минут, 4, 24 и 48 часов при 37°C. После инкубирования лунки промывали три раза с использованием 500 мкл PBS и бактерии фиксировали с использованием EM-fix, состоящего из 2,5% глутаральдегида в 0,15 М какодилате натрия. Образцы инкубировали с EM-fix в течение ночи. Последующие стадии проводил опытный специалист. Проводили стадии промывки с какодилатным буфером и последующей серией дегидратаций. Так, образцы инкубировали в течение пяти минут два раза в 50%, 70%, и 95% этаноле, и абсолютном этаноле в течение 30 минут и одного часа. Для высушивания образцов этанол доводили до его критической точки для газообразования при использовании жидкого СО2. Эту стадию проводили три раза по десять минут. Затем образцы размещали на подложке и покрывали золотом/палладием (20 нм наночастицы Agar). Образцы исследовали в сканирующем электронном микроскопе XL 30 FEG и изображения обрабатывают с использованием программного обеспечения AnalySIS ITEM.
6. Долгосрочная активность коллагена VI
Для определения того, как долго коллаген VI сохраняет активность на титановых поверхностях, каждый день в эксперименте использовали новые бактерии.
Для эксперимента титан покрывали обычным образом. Бактерии выращивали в течение ночи в ТНВ в стандартных условиях. На следующее утро 1 мл ночной культуры переносят в 9 мл свежего ТНВ и инкубируют до достижения раствором бактерий OD600, равного 0,4. Бактерии осаждали при 3500 об/мин в течение 10 минут при 4°C. Осадок ресуспендировали в 10 мл холодного буфера TG и измеряли OD. Бактерии осаждали еще раз и количество бактерий доводили до 1%. Этот раствор затем разводили 1:10 (0,1%-й раствор). В каждую лунку с титановым кружком внутри вносили 500 мкл раствора бактерий и проводили инкубирование в течение 0 минут, 4 ч, 24 ч, 48 ч, 72 ч и 96 часов. Затем образцы фиксировали с использованием EM-fix и подготавливали к электронной микроскопии. Каждый день раствор бактерий заменяли свежим 0,1%-м раствором.
7. Эффект γ-излучения на коллаген VI
В промышленных условиях стоматологические имплантаты стерилизуют γ-излучением. Для определения того, оказывает ли излучение эффект на коллаген VI, проводили долгосрочное исследование. Титан покрывали как обычно и обрабатывали γ-излучением.
8. Активация нейтрофильных внеклеточных ловушек (NET) бактериями ротовой полости
Для исследования того, каким образом врожденная иммунная система реагирует на бактерии ротовой полости, растущие на стоматологических имплантатах, титановые винты и абатменты покрывали pLL или pLL/cVI и инкубировали с S. mitis или A. naeslundii.
8.1 Покрытие стоматологических имплантатов
Винты и абатменты промывали сначала хлороформом и далее деионизированной водой, и помещали в 24-луночный планшет. Добавляли 500 мкл поли-L-лизина до тех пор, пока имплантат не покрывался. Имплантаты инкубировали при 60°C до тех пор, пока pLL не высыхал. Затем имплантаты промывали деионизированной водой для удаления несвязанного pLL. Винты и абатменты, предназначенные для покрытия коллагеном VI, помещали в реакционную пробирку объемом 1,5 мл. Добавляли коллаген VI до тех пор, пока имплантаты не покрывались полностью, а затем проводили инкубирование при 4°C в течение ночи. На следующий день коллаген VI удаляли и имплантаты сушили на воздухе.
8.2 Получение бактерий
Бактерии выращивали в течение ночи в ТНВ в стандартных условиях. На следующий день 1 мл раствора бактерий вносили в 9 мл свежего ТНВ. Бактерии выращивали до достижения значения OD600, равного 0,4. Затем бактерии осаждали при 3500 об/мин и 4°C в течение 10 минут. Супернатант удаляли и осадок разводили в 10 мл холодного буфера TG. Измеряли OD и бактерии осаждали из раствора второй раз. После удаления супернатанта количество бактерий доводили до 1% холодным буфером TG. Бактерии хранили на льду до выделения нейтрофилов.
8.3 Выделение нейтрофилов
Для выделения нейтрофилов 20 мл раствора Polymorph-Prep™ переносили пипеткой в пробирку Falcon объемом 20 мл. Кровь здоровых доноров отбирали в гепаринизированные пробирки объемом 6 мл и инкубировали при комнатной температуре в течение 6 минут. Поверх Polymorph-Prep вносили 20 мл крови, не смешивая фракции. Для разделения различных компонентов крови пробирки Falcon центрифугировали в течение 60 минут при 500 g и 20°C. После центрифугирования были видны различные слои. Слой нейтрофилов отбирали и переносили в новую пробирку Falcon. Нейтрофилы затем промывали двойным объемом 1×PBS и центрифугировали в течение 10 минут при 500 g и 20°C. После этого лизировали загрязняющие эритроциты с использованием 2,7 мл стерильной воды Millipore в течение 10 секунд. Реакцию останавливали с использованием 300 мкл 10×PBS. Объем доводили до 15 мл, и образцы центрифугировали в течение 5 минут при 250 g и 20°C. Эту стадию необходимо повторять до тех пор, пока все эритроциты не лизируют. Осадок разводили в 500 мл натриевой среды (содержащей 5,6 мМ глюкозы, 127 мМ NaCl, 10,8 мМ KCl, 2,4 мМ KH2PO4, 1,6 мМ MgSO4, 10 мМ Hepes и 1,8 мМ CaCl2; рН доводили до 7,3 с использованием NaOH) и проводили подсчет клеток с использованием автоматического счетчика клеток Luna™. Вычисляли количество клеток на образец и соответствующий объем суспензии нейтрофилов добавляли в каждую реакционную пробирку объемом 1,5 мл, содержащую винты, абатменты и раствор бактерий. Образцы инкубировали в течение 0, 30, 60 и 120 минут и переносили в 1 мл EM-fix (2,5% глутаральдегид в 0,15 М какодилате натрия). Подготовку к SEM проводил опытный специалист.
9. Статистический анализ
Данные анализировали с использованием Excel и GraphPad Prism 6.0. Эксперименты проводили по меньшей мере дважды независимо друг от друга. Анализы уничтожения бактерий с использованием кристаллического фиолетового проводили трижды, в то время как подсчет живых клеток с применением BacLight и флуоресцентной микроскопии проводили дважды. Для данных, полученных в анализах уничтожения бактерий с использованием кристаллического фиолетового и BacLight с флуоресцентной микроскопией, применяли однофакторный дисперсионный анализ (ANOVA). Данные, полученные для бактерий, инкубированных в лунках без покрытия, использовали в качестве положительного контроля. Значимые различия отмечены ****, что означает р<0,0001.
В. Результаты
1. Бактериальная адгезия
Для анализа уровня адгезии бактерии инкубировали на титановых поверхностях с покрытием и анализировали с помощью сканирующей электронной микроскопии. Через 4 часа инкубирования выявляемое количество бактерий немного увеличивалось как для Streptococcus mitis, так и для Actinomyces naeslundii. Видимые различия адгезии бактерий на разных покрытиях отсутствуют. Анаэробные виды бактерий Fusobacterium nucleatum и Prevotella intermedia демонстрировали сходную степень адгезии на поверхностях. В свете этих результатов бактерии инкубировали в течение двух часов для достижения подходящего уровня адгезии в анализах уничтожения бактерий.
2. Анализы активности в отношении уничтожения бактерий
2.1 BacLight для FACS
Для определения количества живых бактерий применяли анализ жизнеспособности с использованием FACS. Для окрашивания мертвых бактерий использовали йодид пропидия (PI). Для S. mitis, обработанных коллагеном VI, был получен слабый STYO9-сигнал. После 0 мин инкубирования жизнеспособными были только приблизительно 15% бактерий, обработанных 160 мкл коллагена. PI-сигналы бактерий, обработанных коллагеном VI, усиливались со временем до максимальных значений приблизительно 80% у бактерий, обработанных с использованием 160, 200 и 500 мкл.
Для A. naeslundii можно наблюдать небольшой рост STYO9-окрашенных бактерий через 48 часов инкубирования. У всех обработанных поверхностей PI-сигналы были сильнее. Максимальные сигналы для A. naeslundii, обработанных коллагеном VI, были отмечены через 2 часа инкубирования у бактерий, обработанных с использованием 160 мкл cVI. После этого сигналы снова ослабевали. Таким образом, FACS стабильно подтверждала уничтожение бактерий, вызванное коллагеном VI. У S. mitis сигналы PI-окрашивания погибших бактерий усиливались, соответствуя ожиданиям. В пределах двух часов коллаген VI уничтожал патогены независимым от дозы образом. Такой же эффект наблюдали при инкубировании A. naeslundii с различными количествами коллагена VI. Максимальное уничтожение бактерий было отмечено через 2 часа инкубирования. После этого немногочисленные выжившие бактерии начинали расти снова, и PI-сигнал ослабевал, в то время как STYO9-сигнал усиливался. Эти результаты соответствовали результатам анализа жизнеспособности посредством SEM.
5.2 Сканирующая электронная микроскопия
Уничтожение бактерий на титановых поверхностях с различными покрытиями анализировали с помощью сканирующей электронной микроскопии на протяжении 48 часов. Типичные изображения бактерий различных видов показаны на Фиг. 1-4.
На SEM-изображениях наблюдали увеличение количества бактерий S. mitis (Фиг. 1) и A. naeslundii (Фиг. 2), инкубированных на Ti и Ti/pLL поверхностях, на протяжении 48 часов инкубирования. По сравнению с изображениями S. mitis, A. naeslundii продемонстрировали более сильный рост. Многослойные структуры появлялись через 24 часа инкубирования, увеличиваясь к 48 часам инкубирования. В отличие от этого, наблюдали уменьшение числа бактерий и увеличение числа мертвых бактерий, или по меньшей мере бактерий с образованными пузырьками, при инкубировании этих бактерий на Ti/cVI и Ti/pLL/cVI поверхностях (Фиг. 1, Фиг. 2). С 24 до 48 часов инкубирования число бактерий увеличивалось незначительно. За это время образовывались некоторые за счет оседания бактерий на слое погибших клеток.
Здоровых бактерий наблюдали через четыре часа инкубирования на титане или титане, покрытом pLL. В этих условиях A. naeslundii уже начинают образовывать многослойные колонии. При обработке этого вида коллагеном VI количество бактерий через четыре часа инкубирования уменьшалось. Наблюдали образование мембранных пузырьков, а также выброс внутреннего содержимого бактерий.
Уничтожения бактерий для Fusobacterium nucleatum и Prevotella intermedia показаны на Фиг. 3 и Фиг. 4, соответственно. Для образцов, не обработанных коллагеном VI, наблюдали увеличение количества обеих бактерий на протяжении 48 часов инкубирования. Через 24 часа оба вида начинали образовывать массивные биопленки, сходные с наблюдаемыми для A. naeslundii биопленками. В сравнение с этим, обработка коллагеном VI приводит к значительному уменьшению числа бактерий уже через четыре часа инкубации. На поверхности можно выявить лишь небольшое количество бактерий. Немногочисленные выжившие бактерии начинали делиться снова, что было видно как увеличение числа бактерий через 48 часов инкубации. Рост бактерий был ослаблен по сравнению с бактериями, не обработанными коллагеном VI.
Этот эксперимент показал, что при обработке S. mitis коллагеном VI поверхности выглядели пустыми через 4 часа инкубирования, по сравнению с S. mitis, не обработанными коллагеном VI. При большем увеличении можно видеть эффекты уничтожения бактерий в отношении всех исследованных видов бактерий (Фиг. 5, левая колонка). Бактериальные мембраны образуют пузырьки, и отдельные клетки выглядят набухшими по сравнению с необработанными бактериями. В конечном счете, из бактерий выходит их внутреннее содержимое, включая их ДНК. Без обработки A. naeslundii коллагеном VI они образуют массивные биопленки через 24 часа инкубирования. Тем не менее, при инкубировании этого вида с коллагеном VI поверхности практически пусты через 4 часа инкубирования с коллагеном VI, что связано с уничтожением бактерий. Через 24 часа можно выявить незначительное число колоний, возрастающее к 48 часам инкубирования. По сравнению с необработанными A. naeslundii, эффект коллагена VI на эти патогены очевидно. При большем увеличении лизис A. naeslundii в результате обработки коллагеном VI был очевиден в сравнении с необработанными бактериями (Фиг. 5, вторая колонка слева). Такого же разрыва мембран, как у S. mitis, не было, но все еще наблюдался выброс внутреннего содержимого бактерий.
В случае анаэробных патогенов на поверхностях, покрытых коллагеном VI, через 24 часа инкубирования почти не было бактерий (Фиг. 3, Фиг. 4).
Подводя итог вышесказанному, фиг.1-4 демонстрируют возрастающее во всех случаях количество растущих бактерий через 48 часов инкубации на Ti и Ti/PLL поверхностях. Через 48 часов все бактерии вырастали до такой степени, что они полностью покрывали поверхность толстым слоем биопленки. В отличие от этого, всего через четыре часа инкубирования на титане, покрытом cVI или pLL/cVI, было выявлено большое количество мертвых бактерий, а также бактерий с образованными мембранными пузырьками и разрывами мембран, и этот эффект был виден еще яснее через 24 часа. Бактерий начинали выбрасывать свое внутреннее содержимое. В отличие от этого, бактерии, которые не инкубировали с коллагеном VI, выглядели здоровыми и начинали образовывать колонии.
Сходные наблюдения были сделаны при долгосрочном исследовании с использованием S. mitis и A. naeslundii. Каждый день на протяжении 5 суток на покрытые титановые поверхности наносили новые бактерии. В случае S. mitis (Фиг. 6), а также в случае A. naeslundii (Фиг. 7), рост бактерий ингибировался при нанесении патогенов на титановые поверхности, обработанные коллагеном VI. Необработанные бактерии могли расти значительно быстрее, чем бактерии, растущие на поверхностях, покрытых коллагеном VI. Вместе взятые, эти эксперименты демонстрируют, что антимикробный эффект коллагена VI сохраняется по меньшей мере 5 суток. В случае стоматологических имплантатов это означает, что покрытие имплантатов коллагеном VI может предотвращать инфекции, обусловленные первой волной патогенов ротовой полости, после хирургического вмешательства.
3. Долговременная активность и γ-облучение покрытий с коллагеном VI
Долговременную активность коллагена VI изучали на протяжении пяти суток на исследуемых поверхностях, также обработанных γ-излучением. Каждый день наносили свежий 0,1% раствор бактерий. Без обработки коллагеном VI за 96 часов инкубации количество бактерий значительно увеличивалось, как в случае со S. mitis, так и в случае с A. naeslundii. В сравнении с этим, присутствие коллагена VI приводит к уничтожению бактерий всего через два часа инкубирования. Впоследствии, некоторые выжившие бактерии начинают деление, но не в той же степени, что бактерии, не обработанные коллагеном VI. При проведении такого же эксперимента на титане с покрытием, стерилизованном в промышленных условиях γ-излучением, не было отмечено различий по сравнению с обычным титаном с покрытием. В присутствии коллагена VI уничтожение бактерий наблюдали через два часа.
4. Активация нейтрофильных внеклеточных ловушек (NET) бактериями ротовой полости
S. mitis и A. naeslundii инкубировали на титановых винтах (Фиг. 8, нижний ряд) и абатментах (Фиг. 8, верхний ряд), соответственно, в независимых экспериментах в присутствии нейтрофилов. На Фиг. 9 и 10А-В подробно показан эффект нейтрофилов на патогены ротовой полости. На Фиг. 10А (винт) и Фиг. 10B (абатмент) показано уничтожение S. mitis и образование NET (NET отмечены на изображениях стрелками). В присутствии коллагена VI погибшие бактерии были видны сразу (через 0 минут инкубирования). Эффект усиливается через 120 минут инкубации, что видно по образованию большого количества мембранных пузырьков и экссудации цитоплазмы. Без обработки патогенов коллагеном VI можно наблюдать уничтожение бактерий посредством NET через 120 минут в значительно меньшей степени (Фиг. 10). Сходные эффекты покрытия с коллагеном VI можно видеть в случае A. naeslundii. Различий между поверхностью винта и абатмента не наблюдали.
По-видимому, врожденная иммунная система способствует функции коллагена VI и усиливает ее, или наоборот. При применении стоматологических имплантатов врожденная иммунная система контактирует с имплантатами и патогенами ротовой полости за счет кровотечения. Для стоматологии это означает, что пациенты с имплантатами, покрытыми коллагеном VI, могут быть значительно лучше защищены от бактериальных инфекций.
СПИСОК ЛИТЕРАТУРЫ
1. Spissinger Т, Engel J, Matrix Biol 1995; 14:499-505.
2. Specks U, Mayer U, Nischt R, Spissinger T, Mann K, Timpl R, Engel J, Chu ML, EMBO J 1992; 11:4281-4290.
3. Abdillahi S. M., Balvanovic S., Baumgarten M,

Реферат
Группа изобретений относится к области медицины и касается медицинских устройств, предназначенных для введения в живой организм. Устройство содержит небиоразлагаемый субстрат, имеющий поверхность контакта с тканями, по меньшей мере частично покрытую микрофибриллами коллагена VI, где указанные микрофибриллы придают антимикробные свойства указанной поверхности контакта с тканью. Также раскрыт способ покрытия медицинских устройств коллагеном типа VI. Группа изобретений обеспечивает получение медицинских устройств, покрытых микрофибриллами коллагена VI, что придает антимикробные свойства против аэробных и анаэробных патогенов человека. 2 н. и 20 з.п. ф-лы, 11 ил.

Комментарии