Варианты альбумина - RU2670063C2
Код документа: RU2670063C2
Чертежи











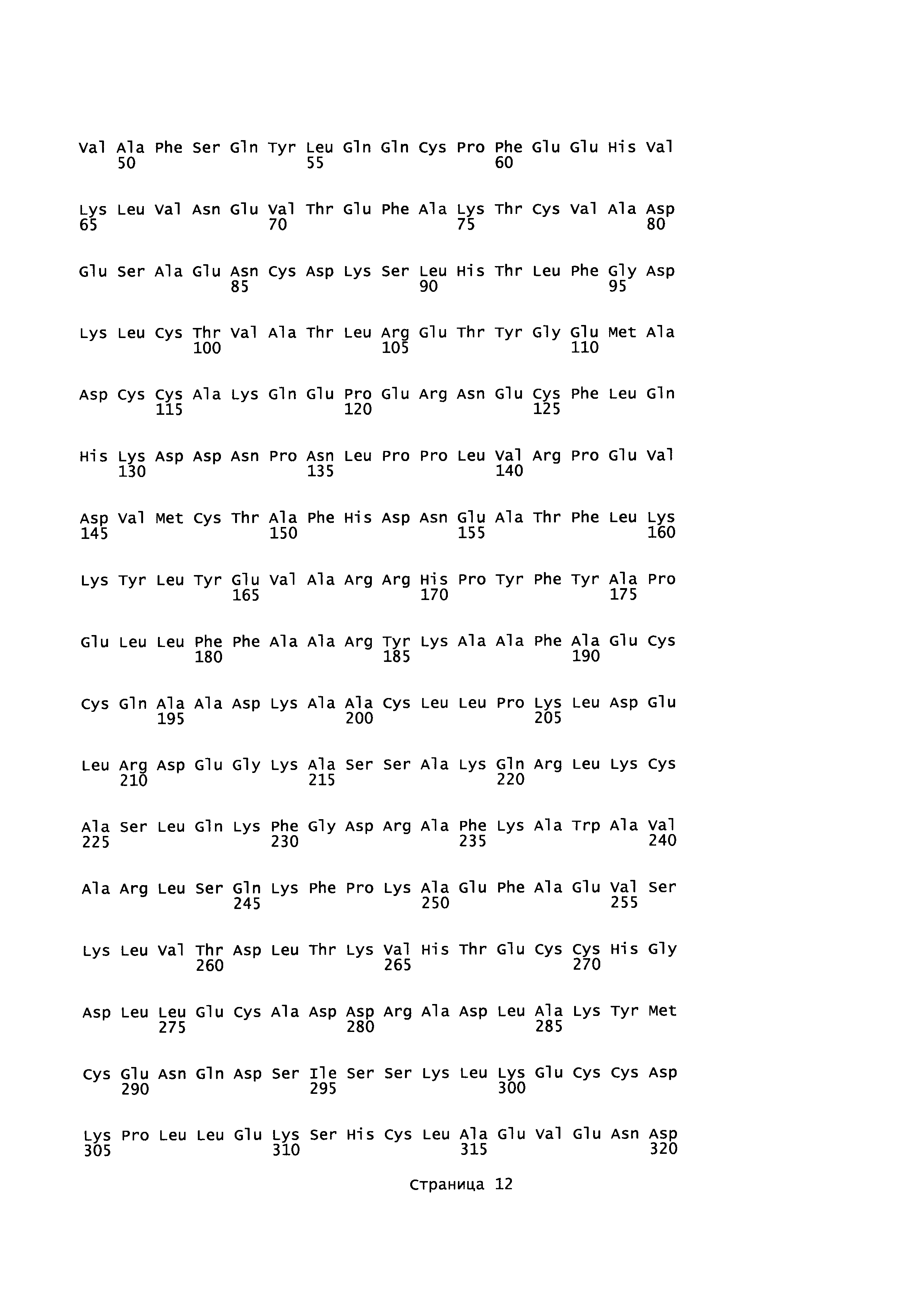



























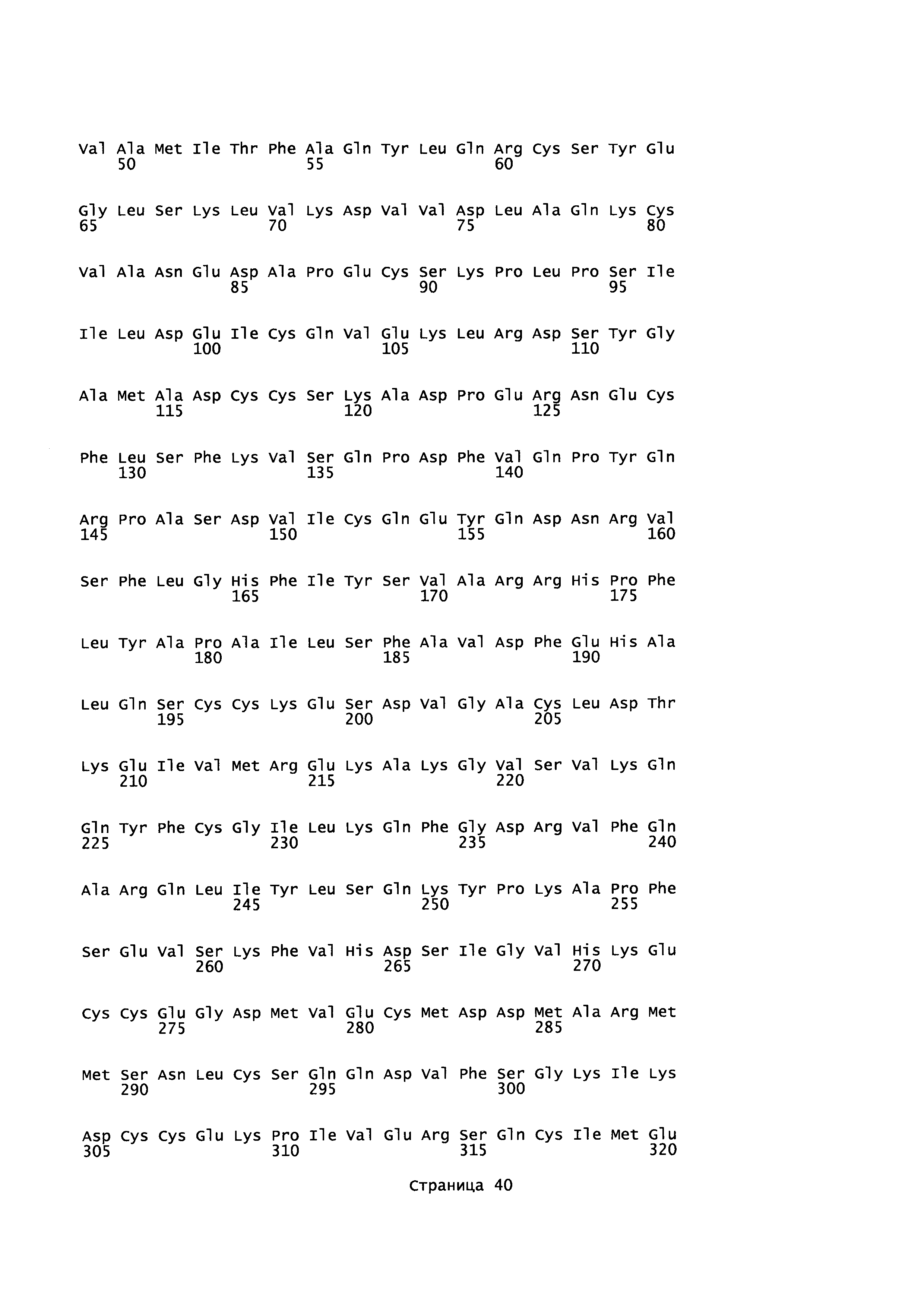











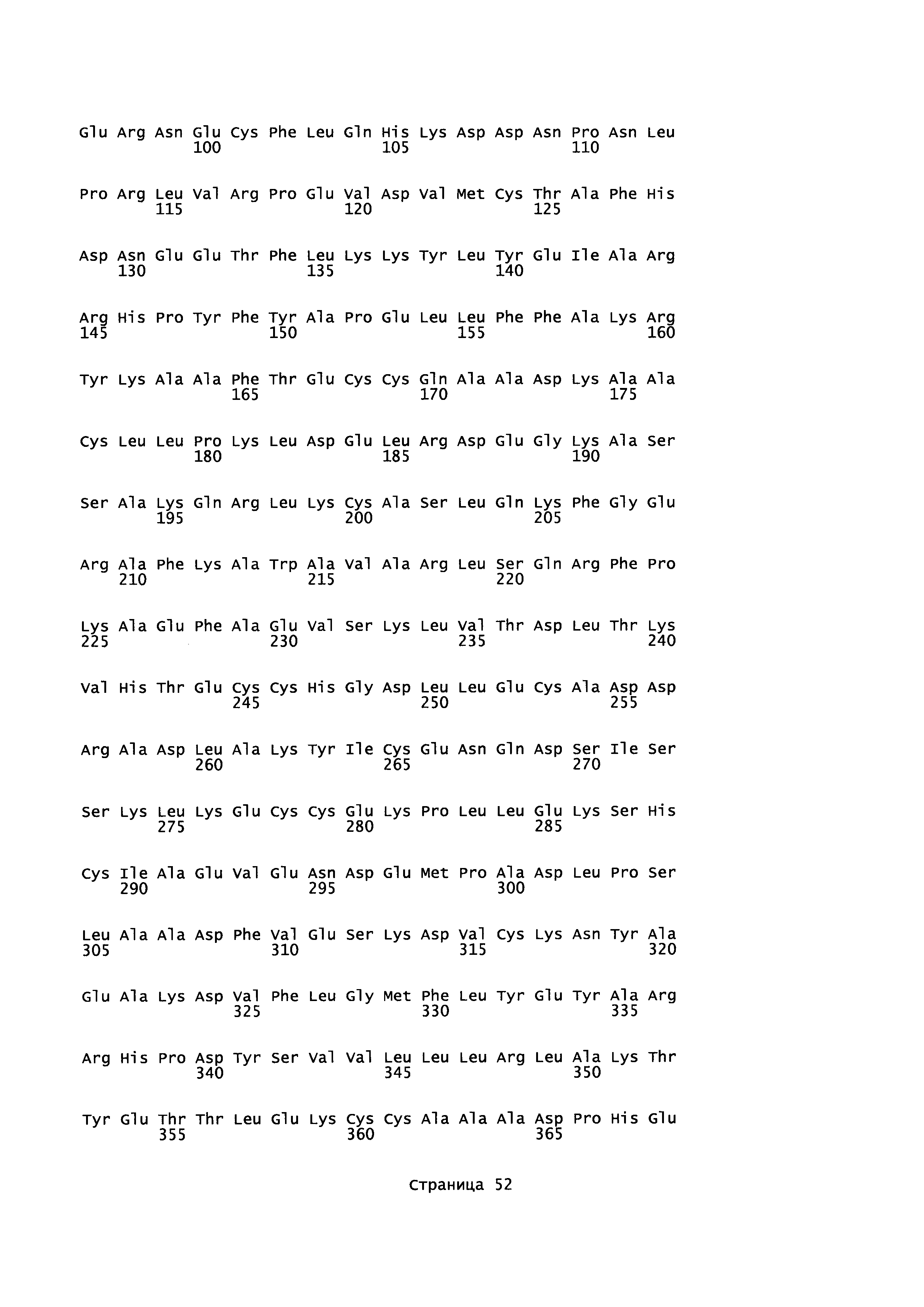










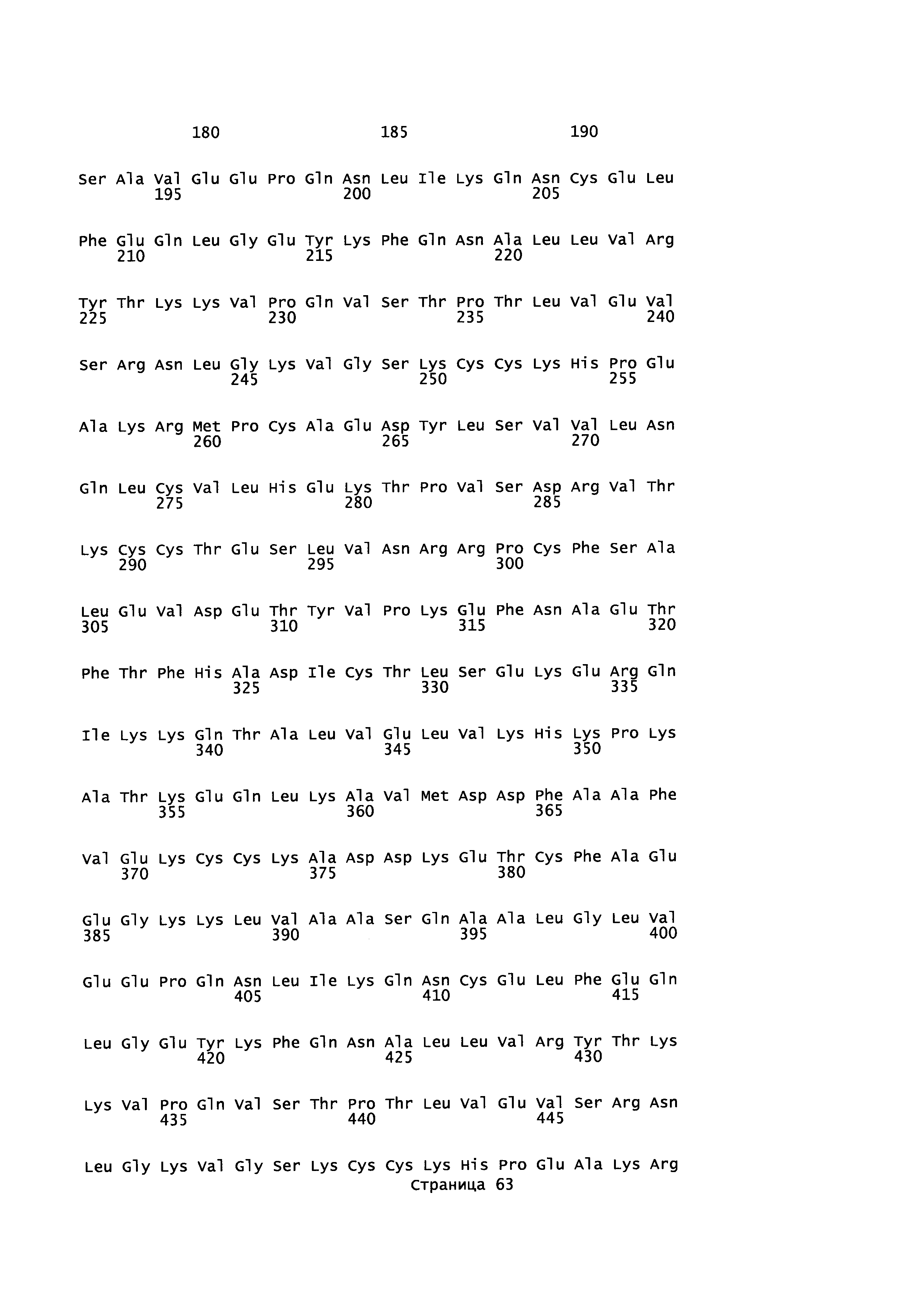










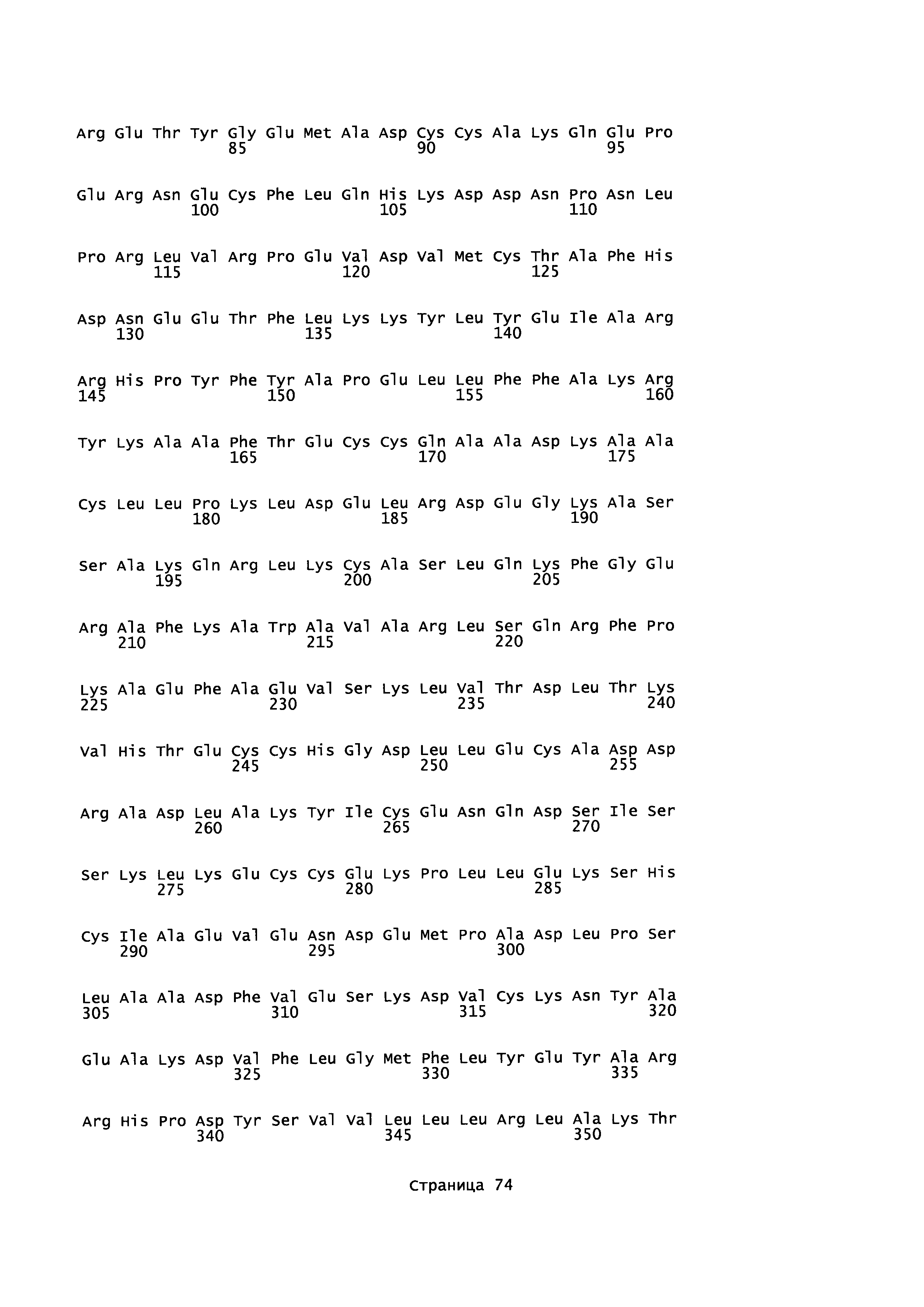

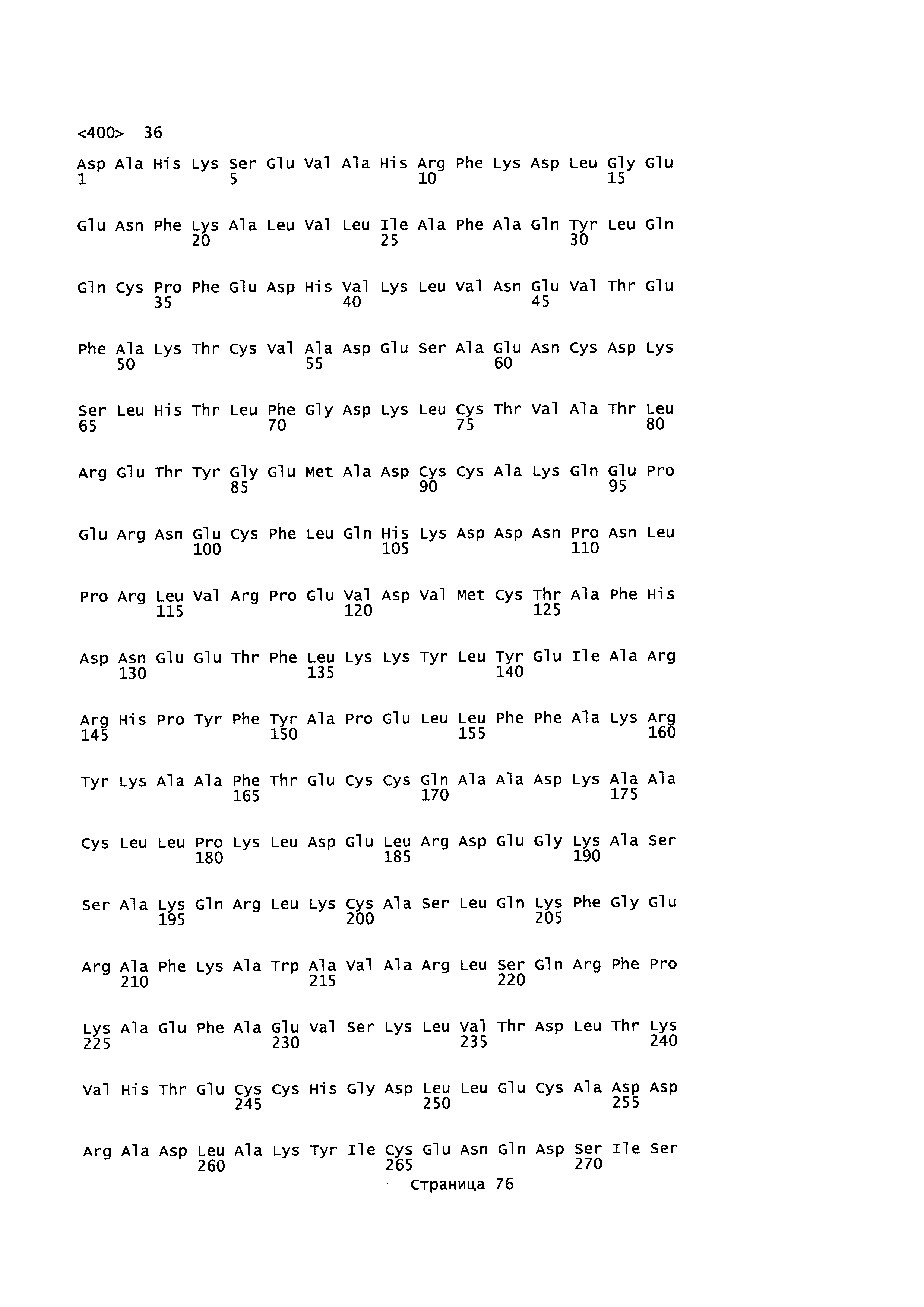











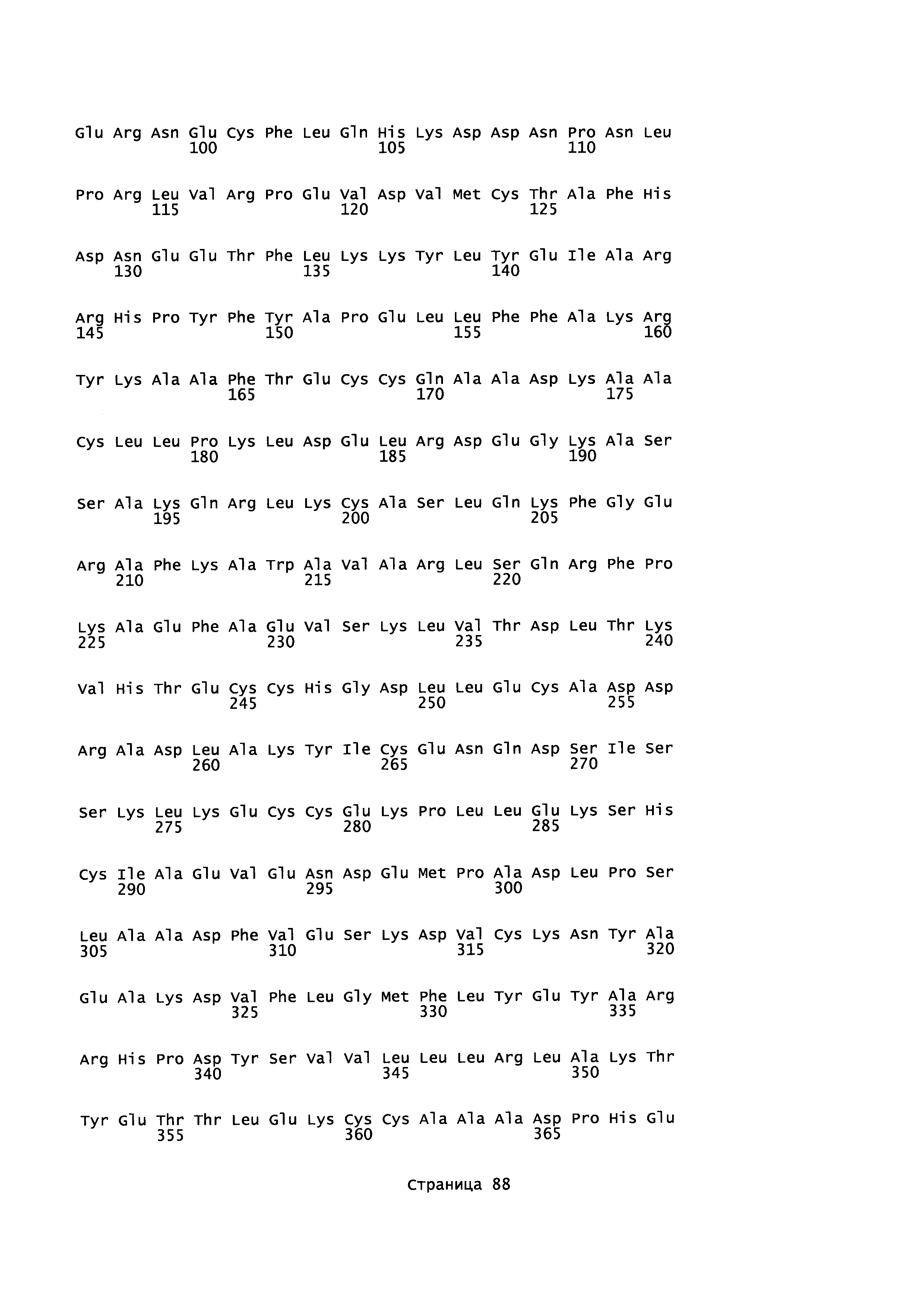






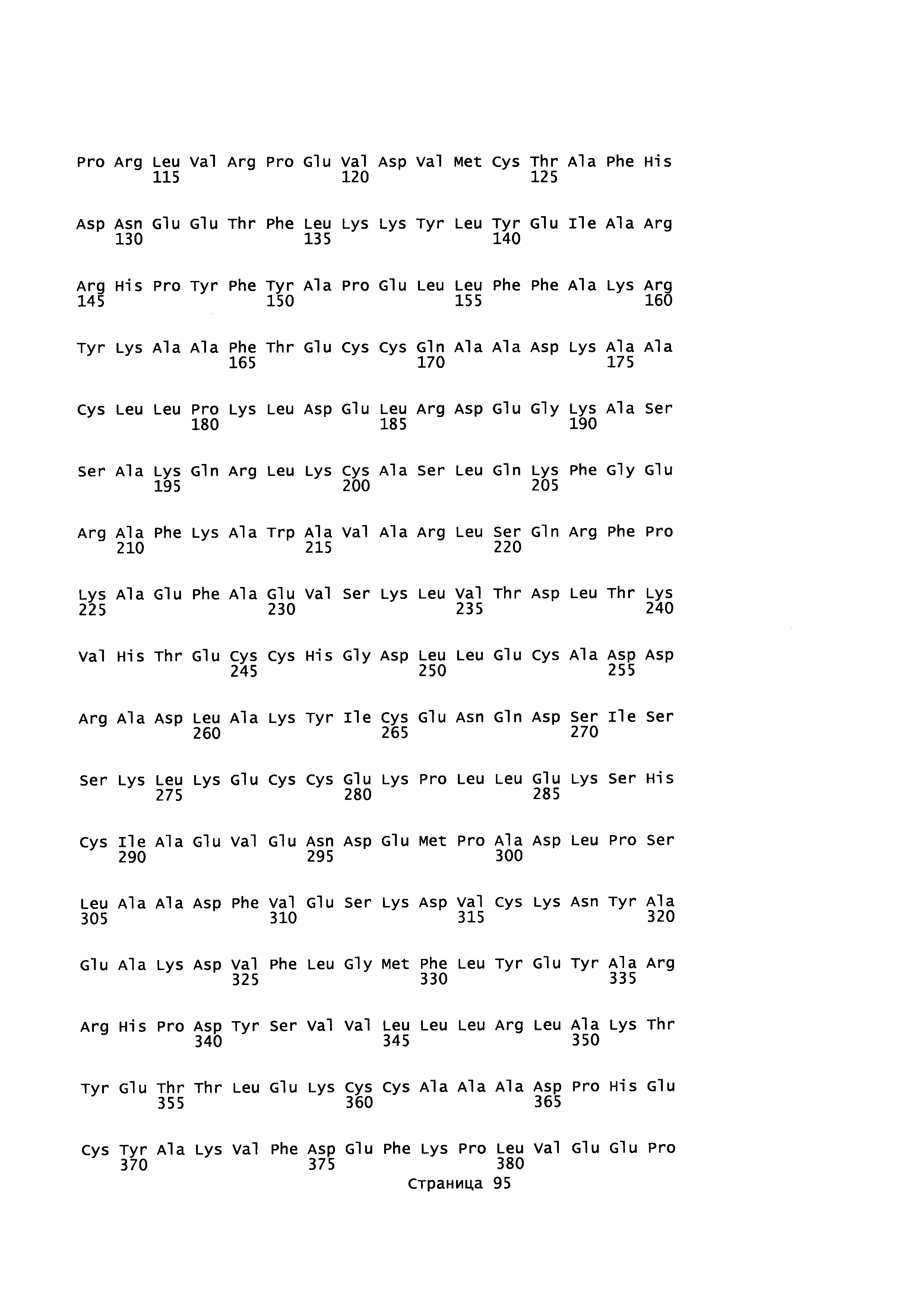

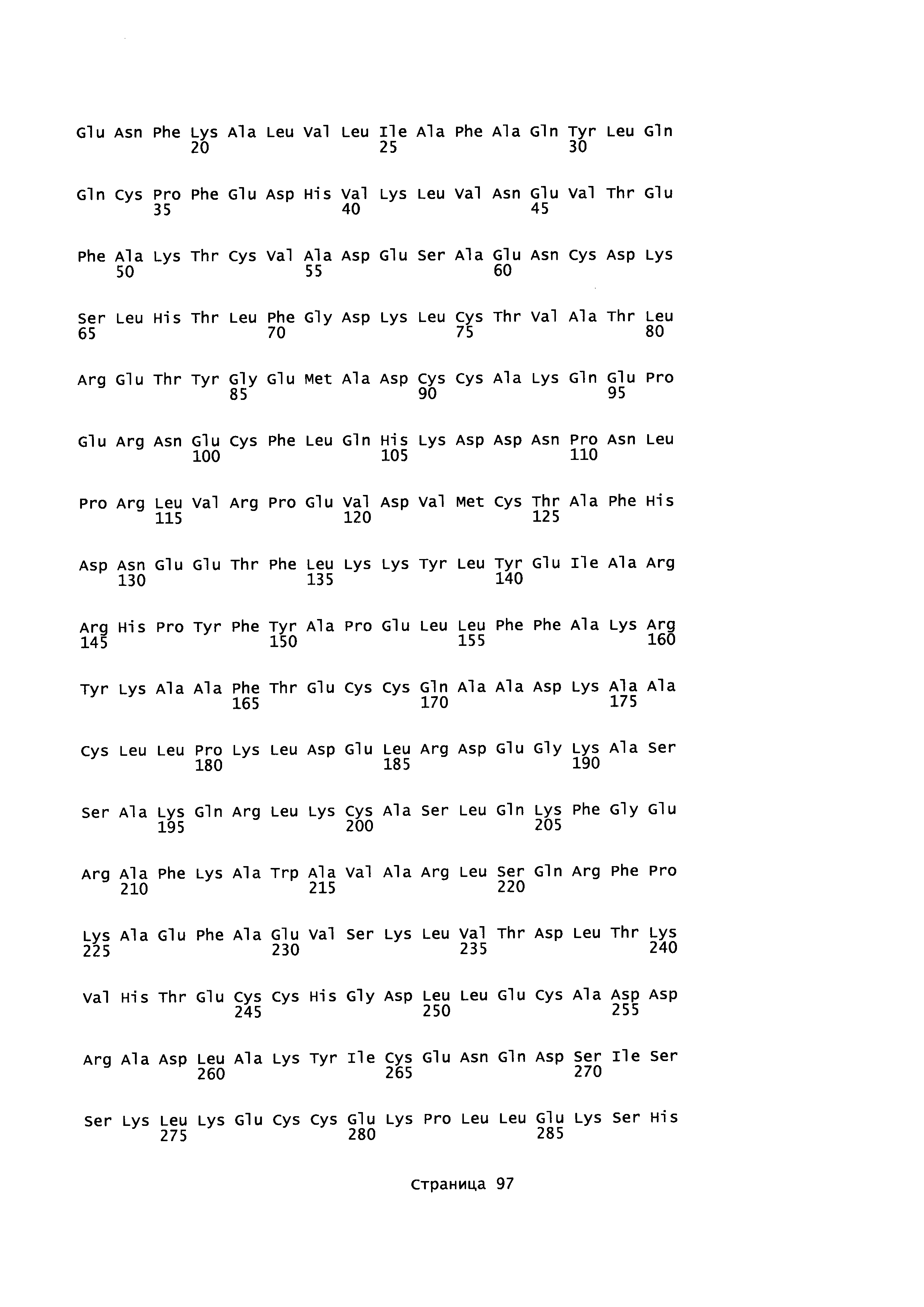


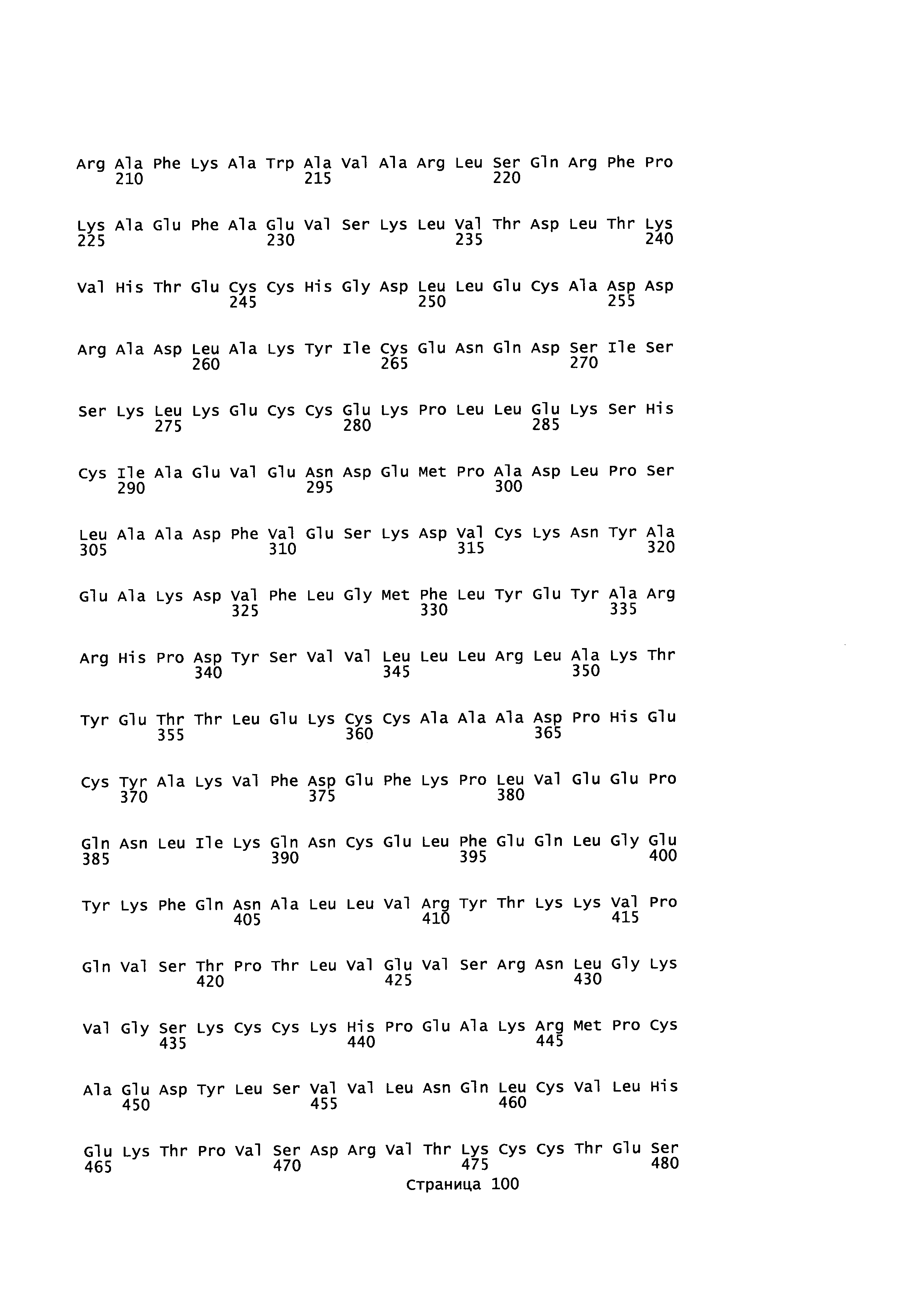















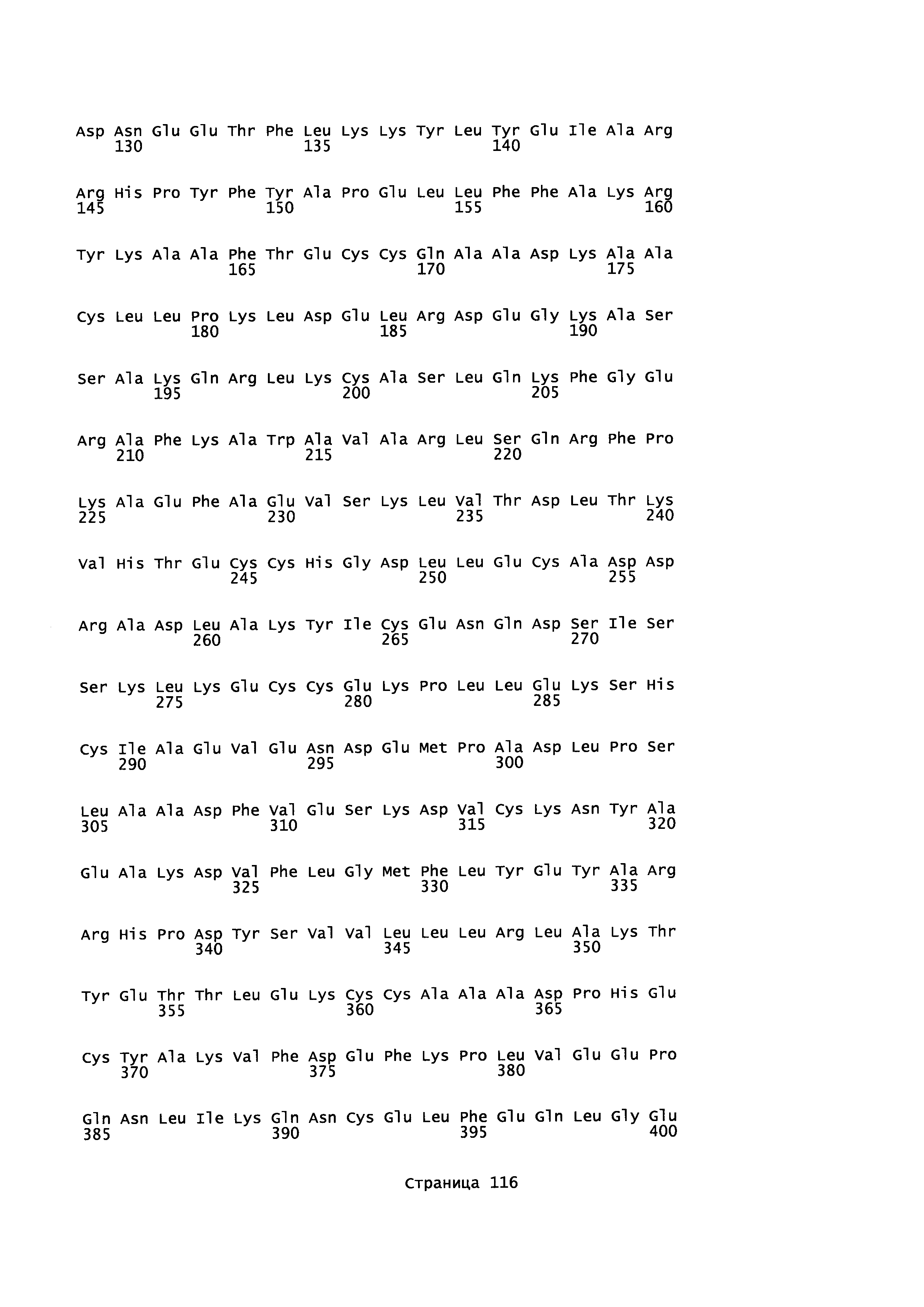













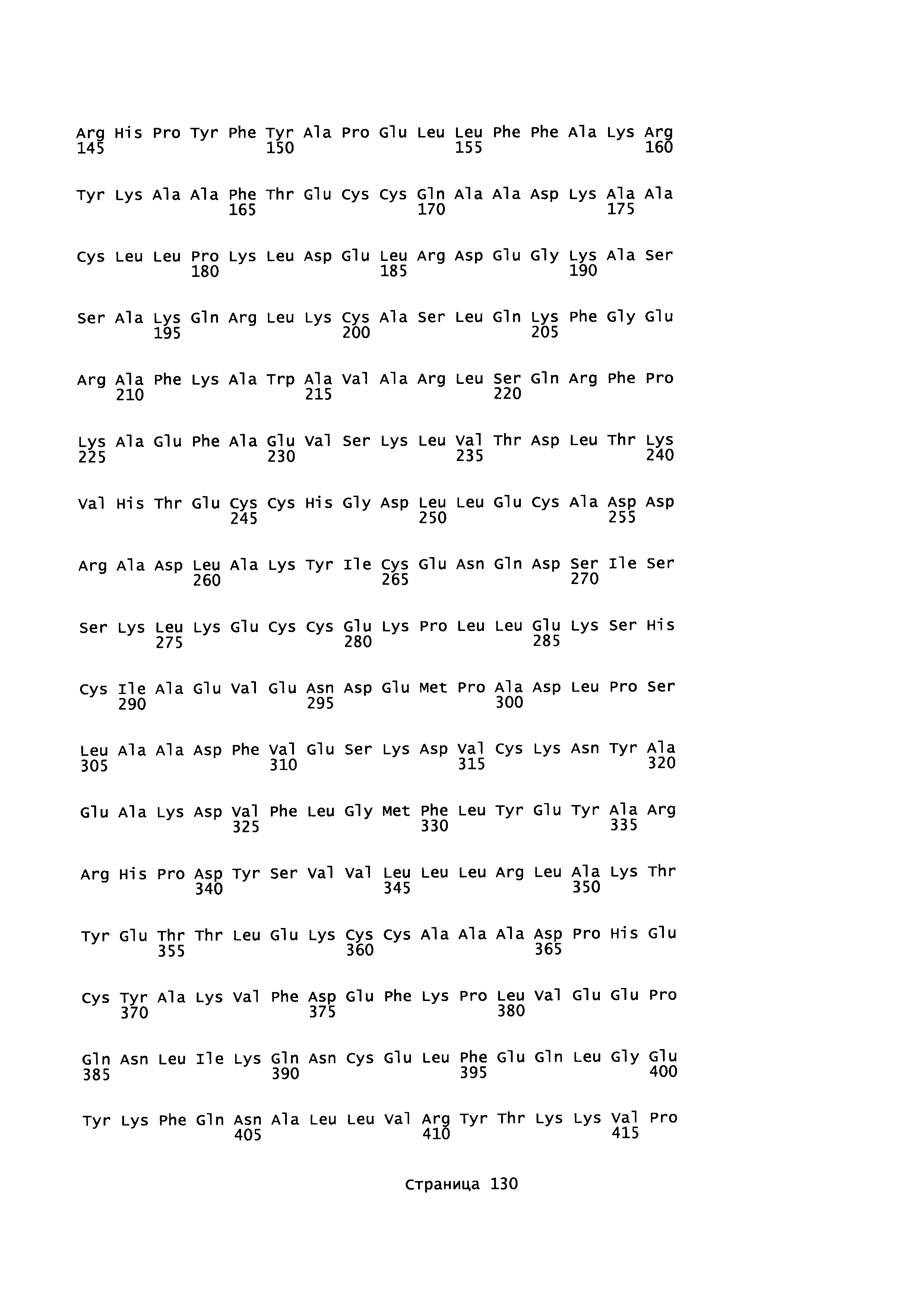











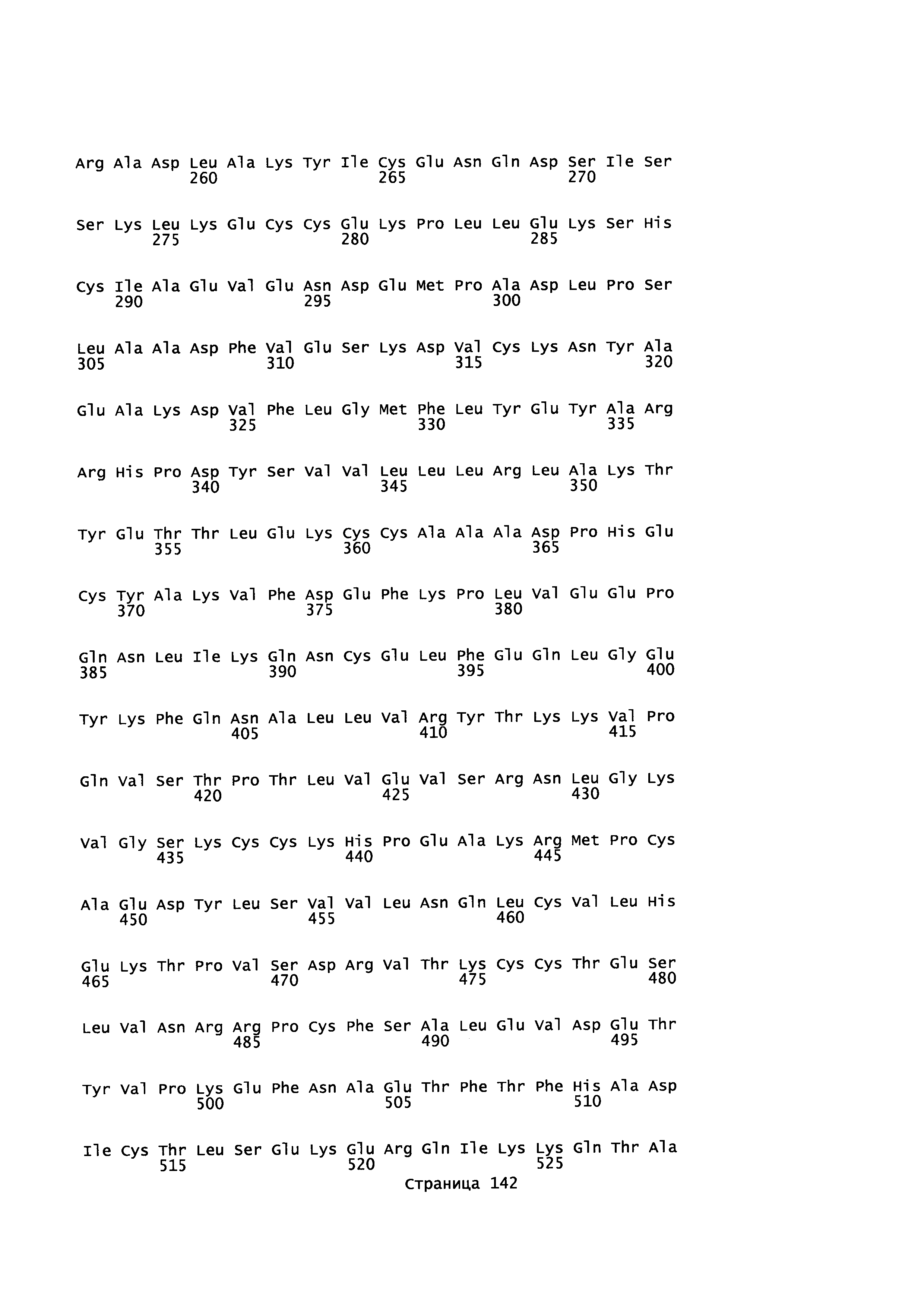



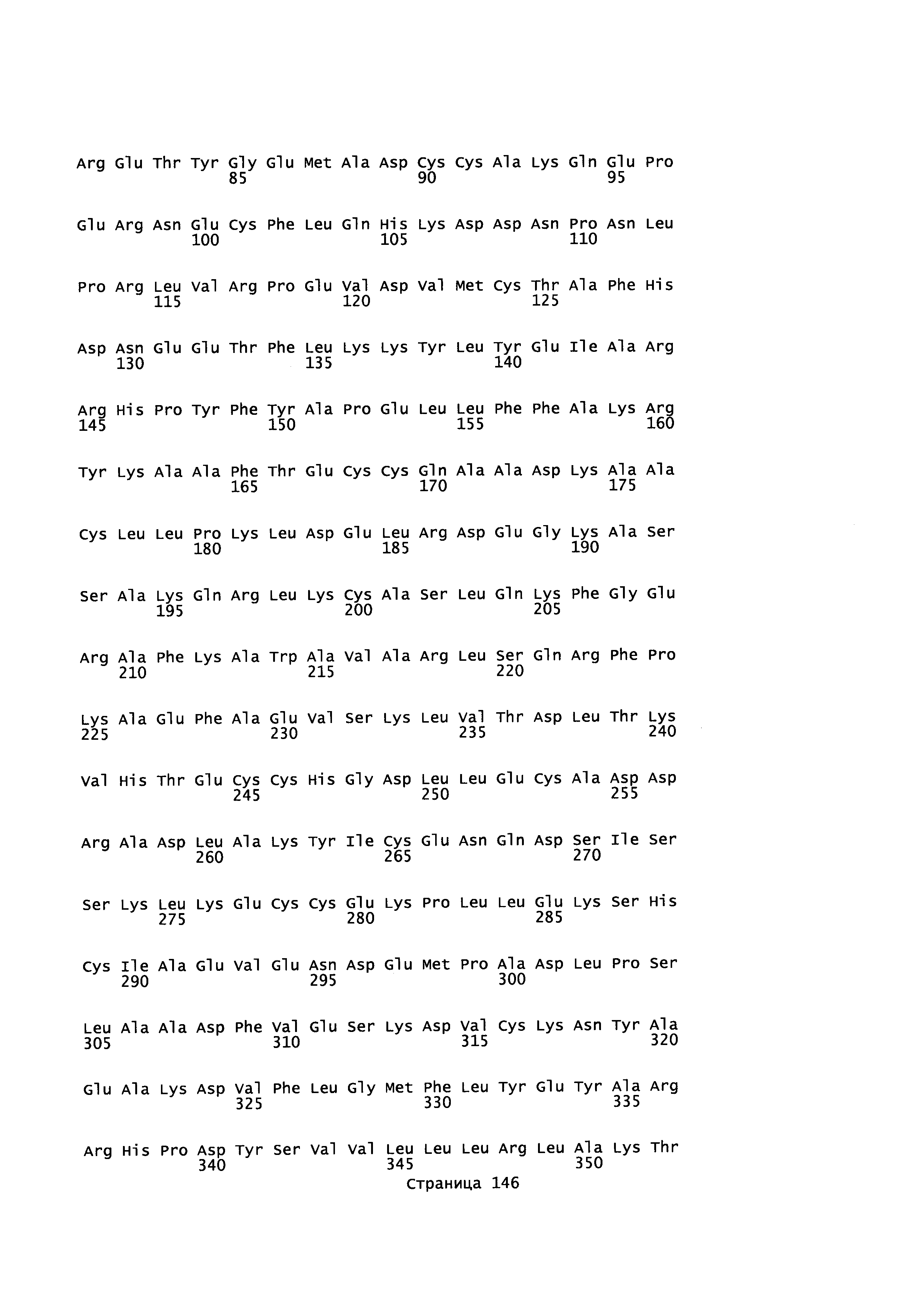




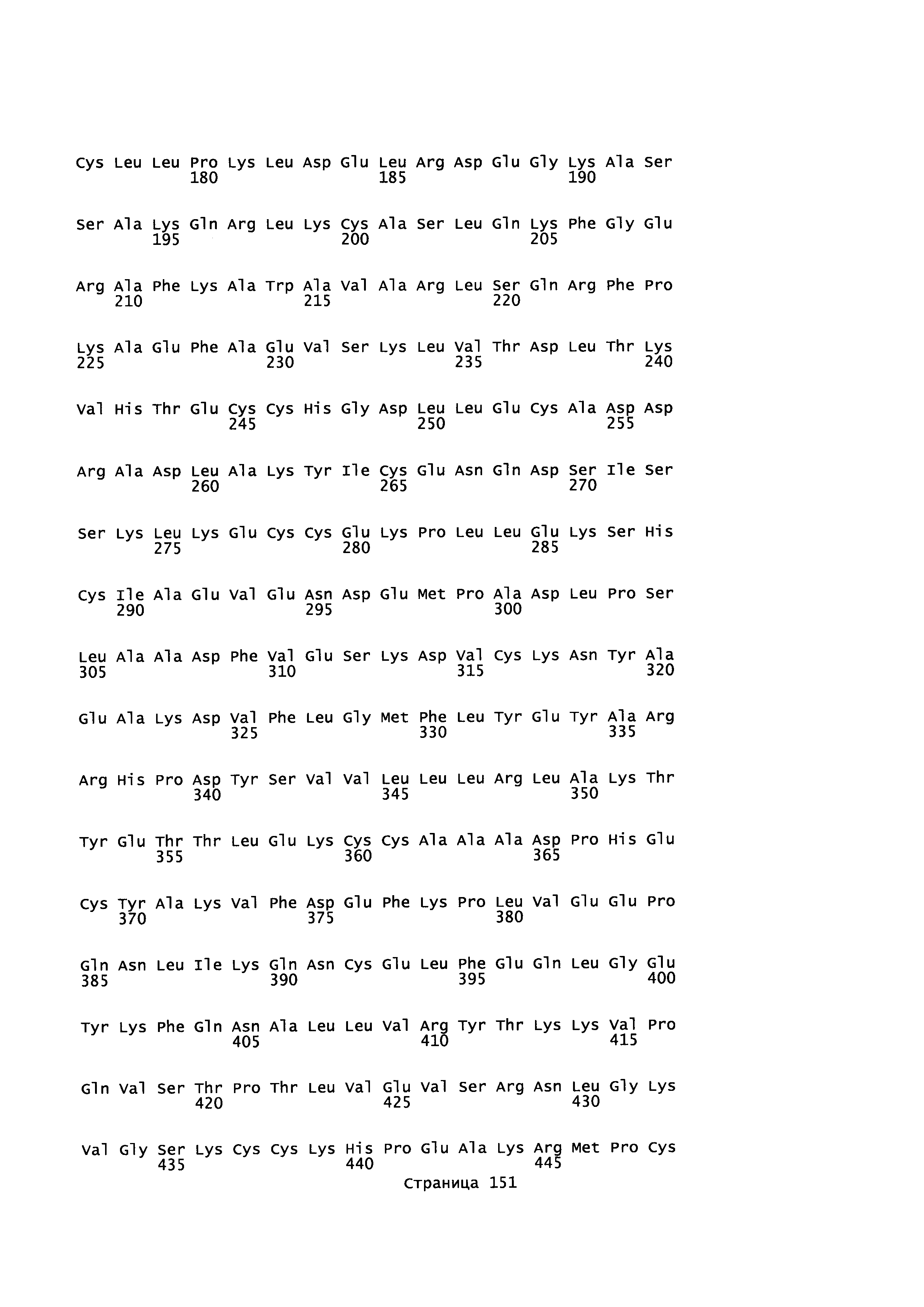

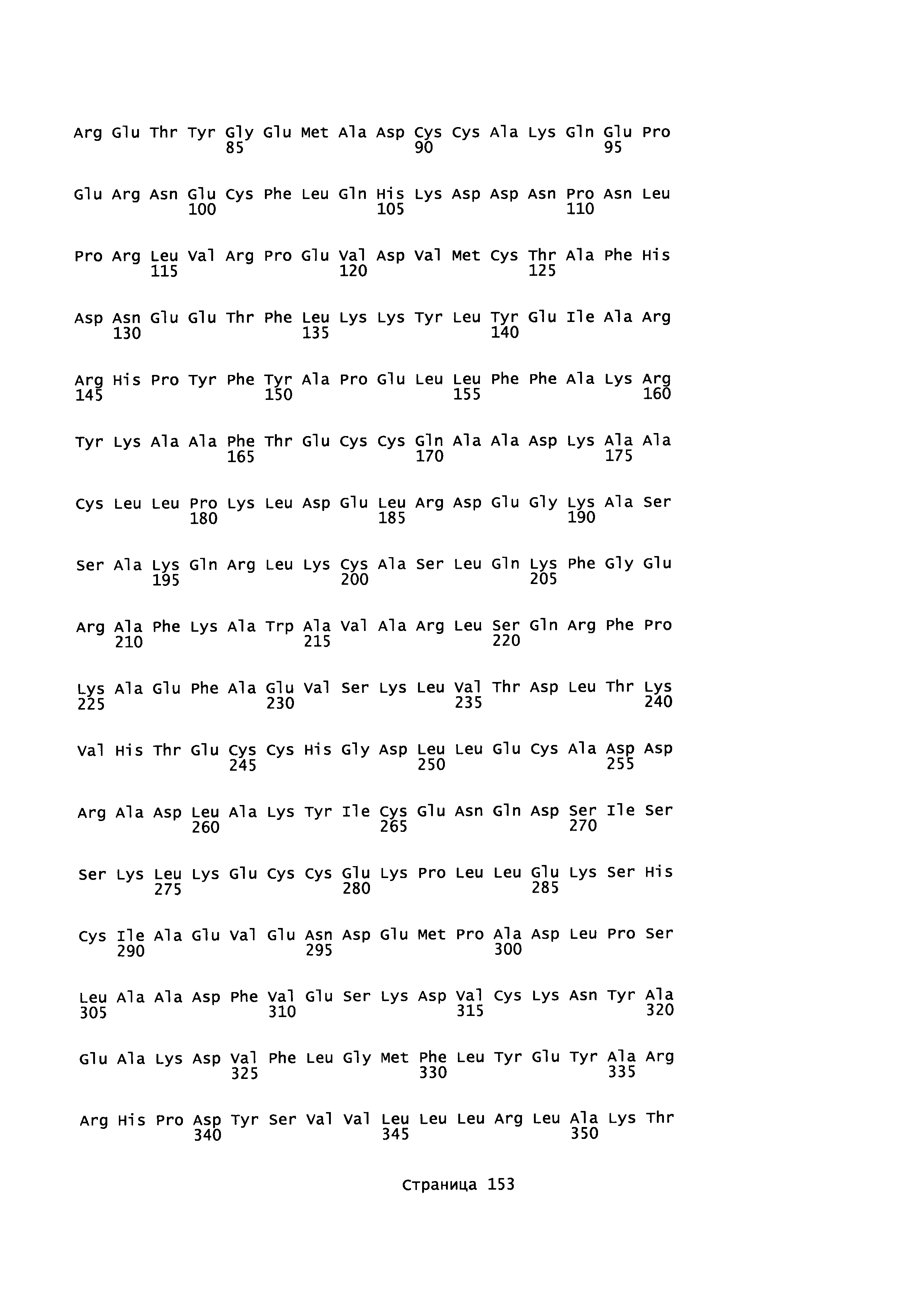












































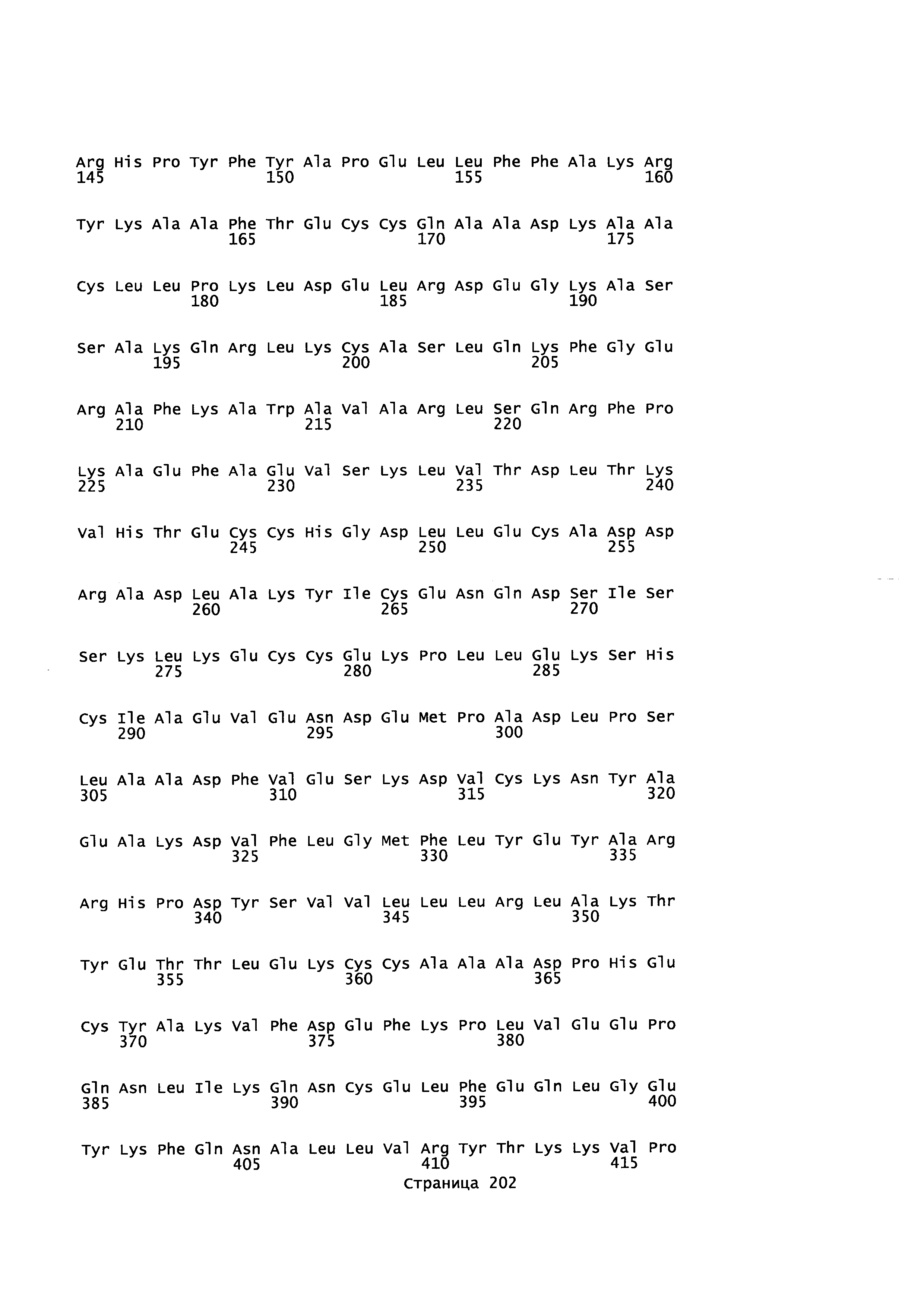









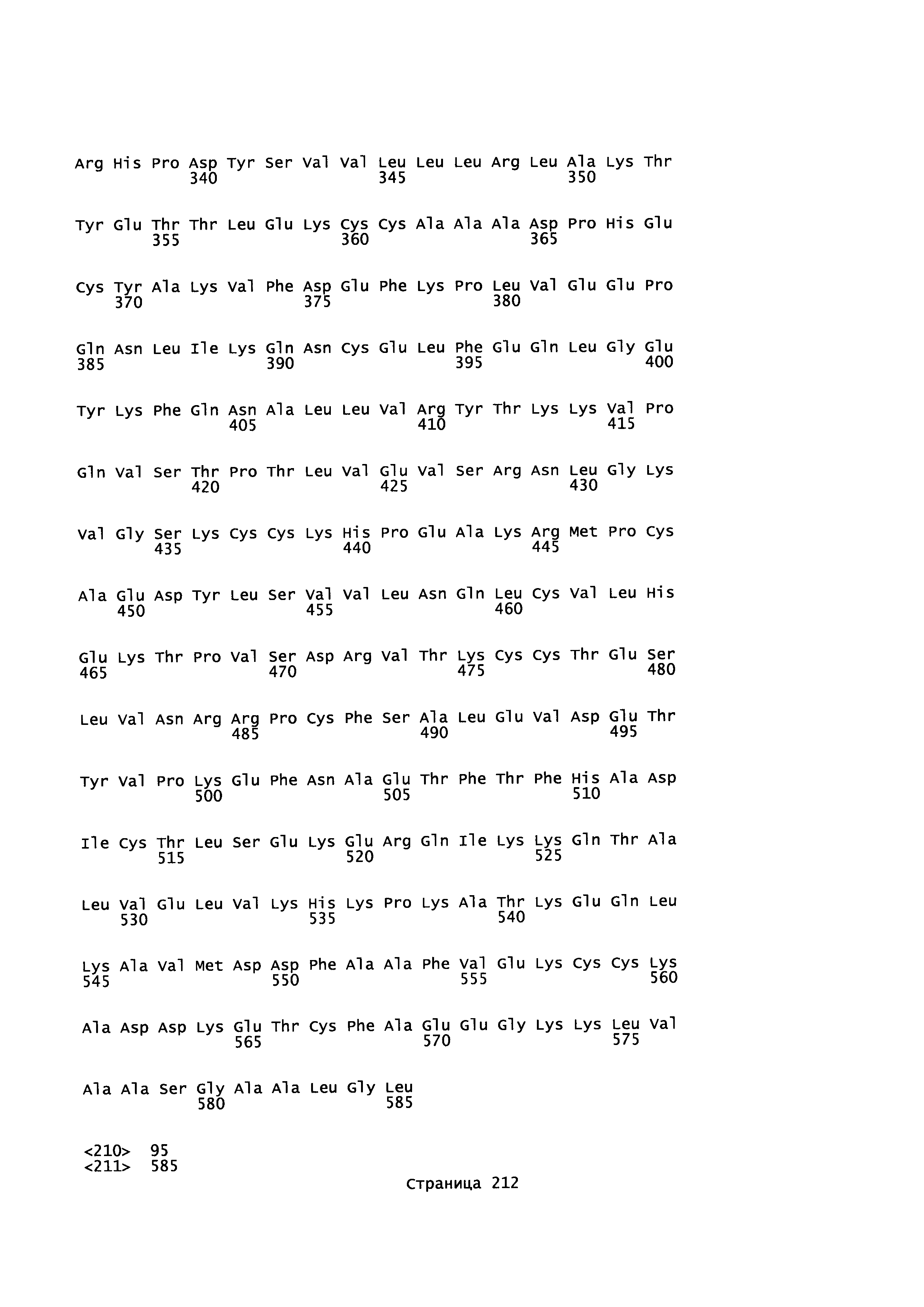








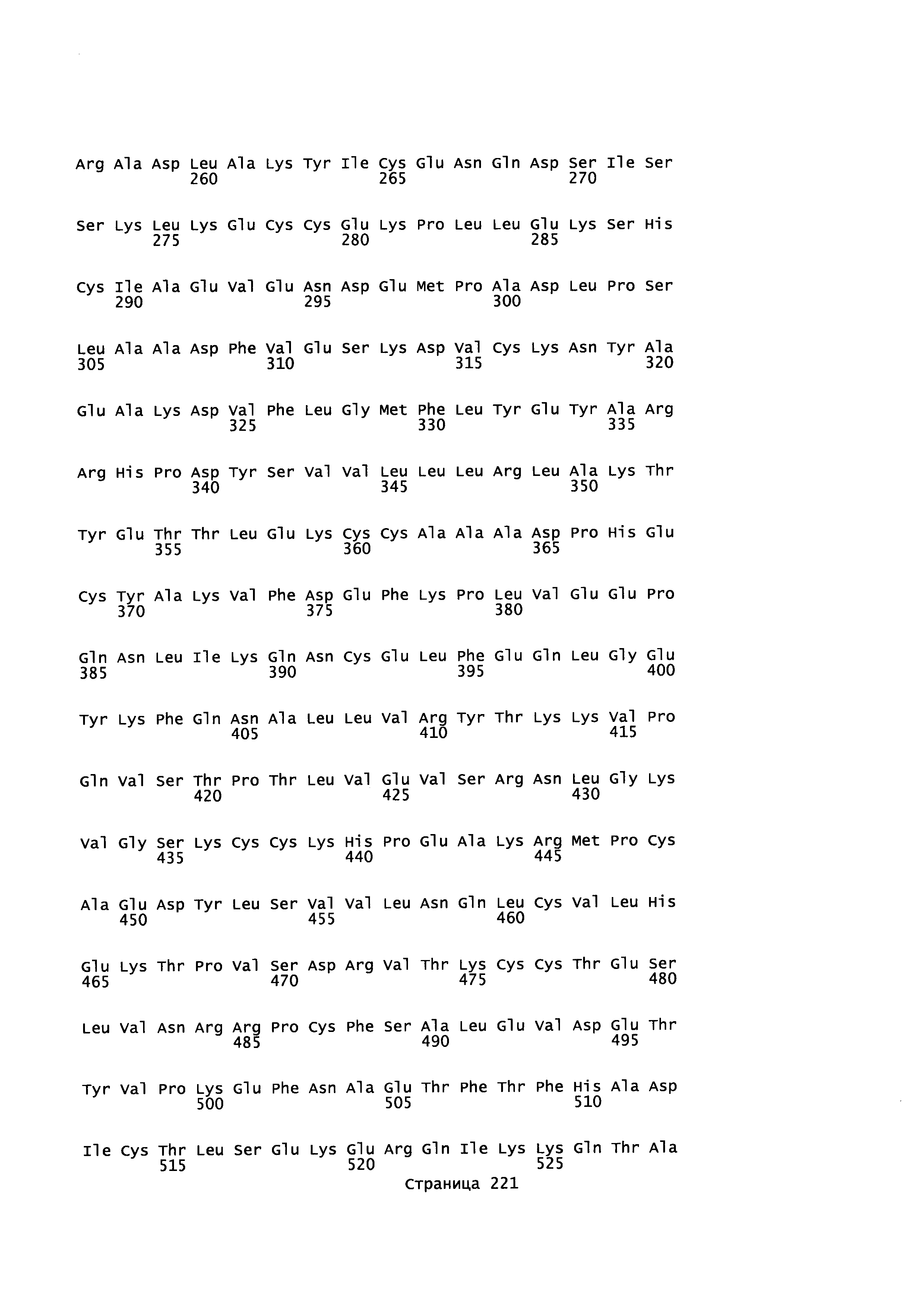

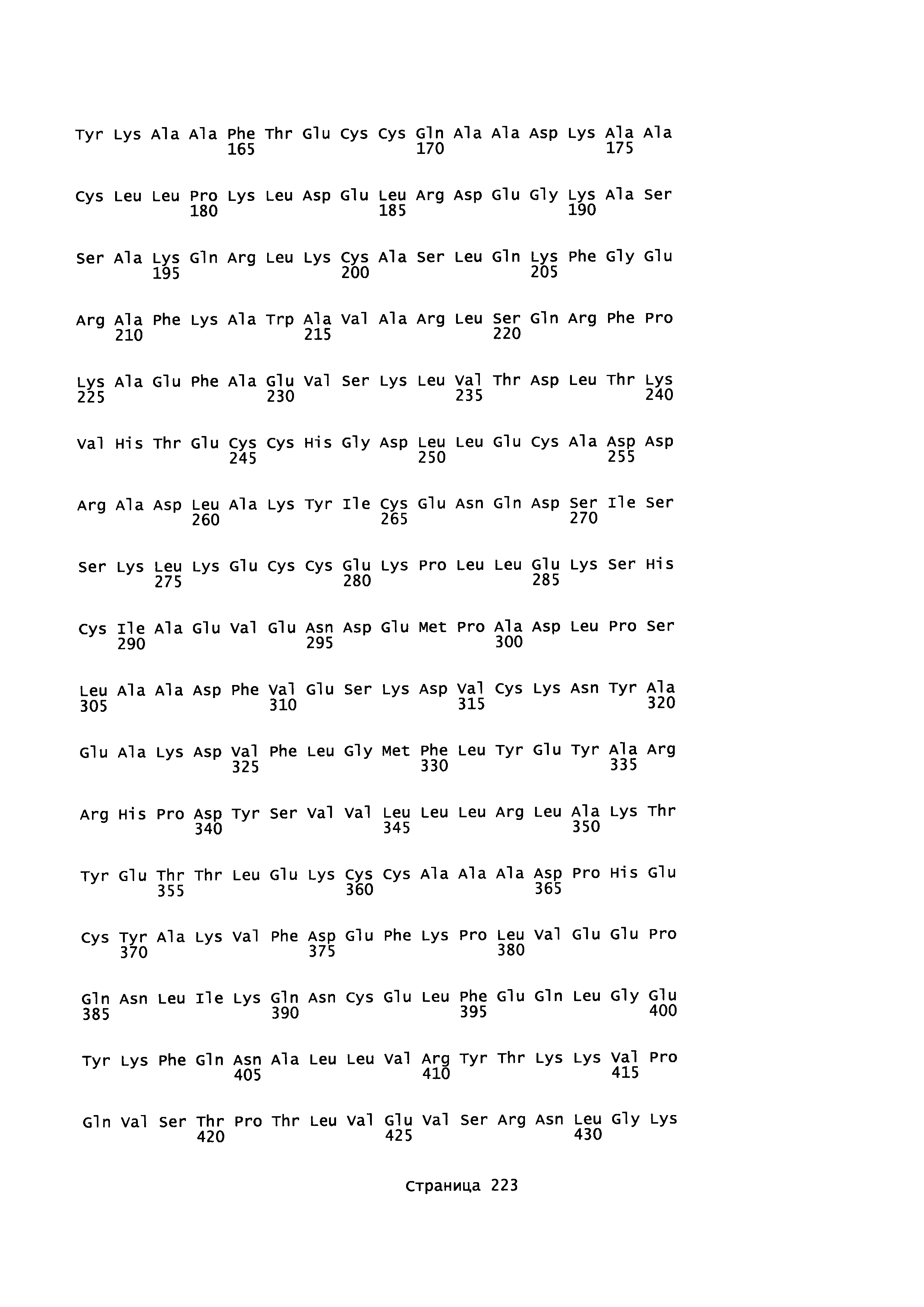

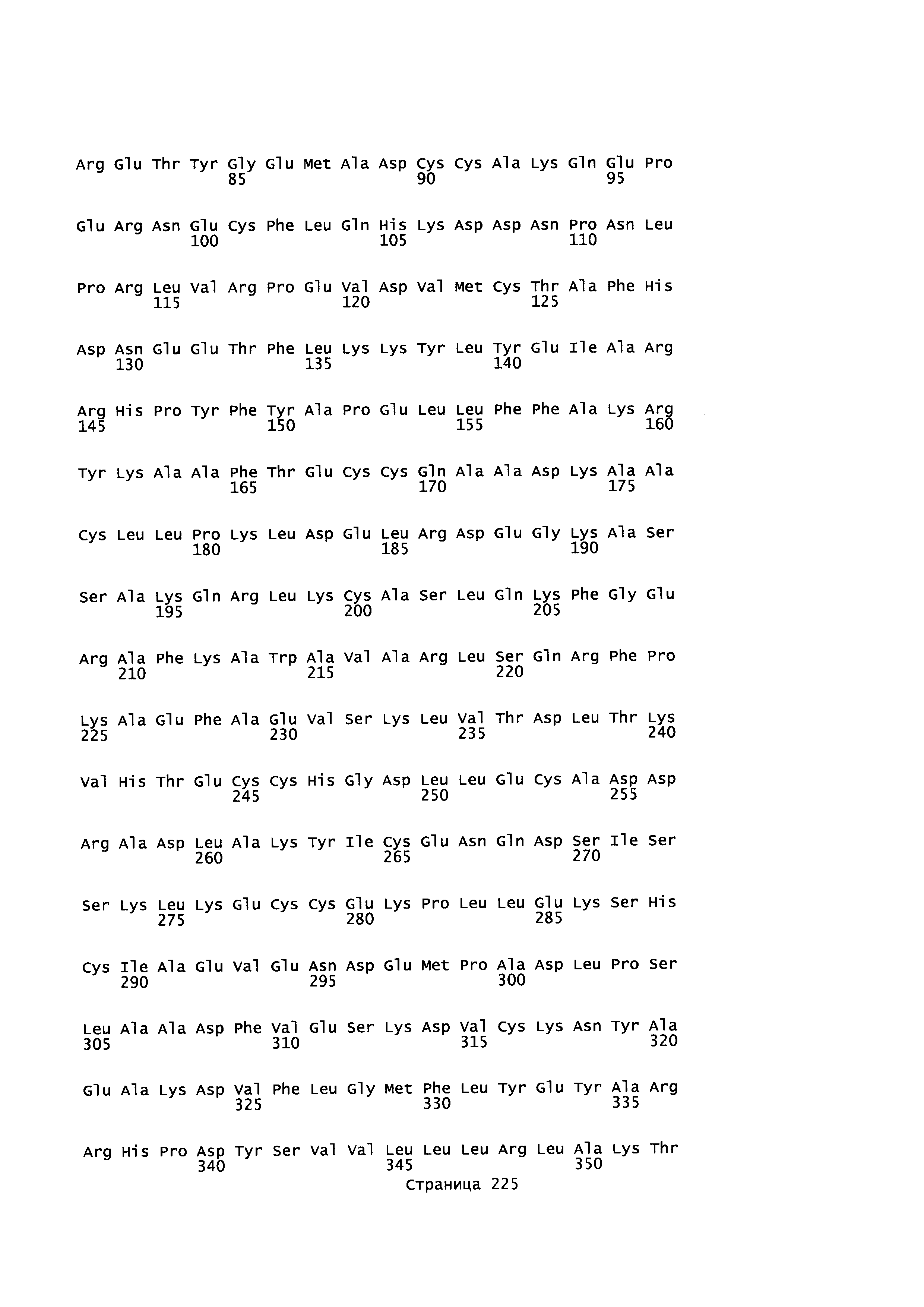



























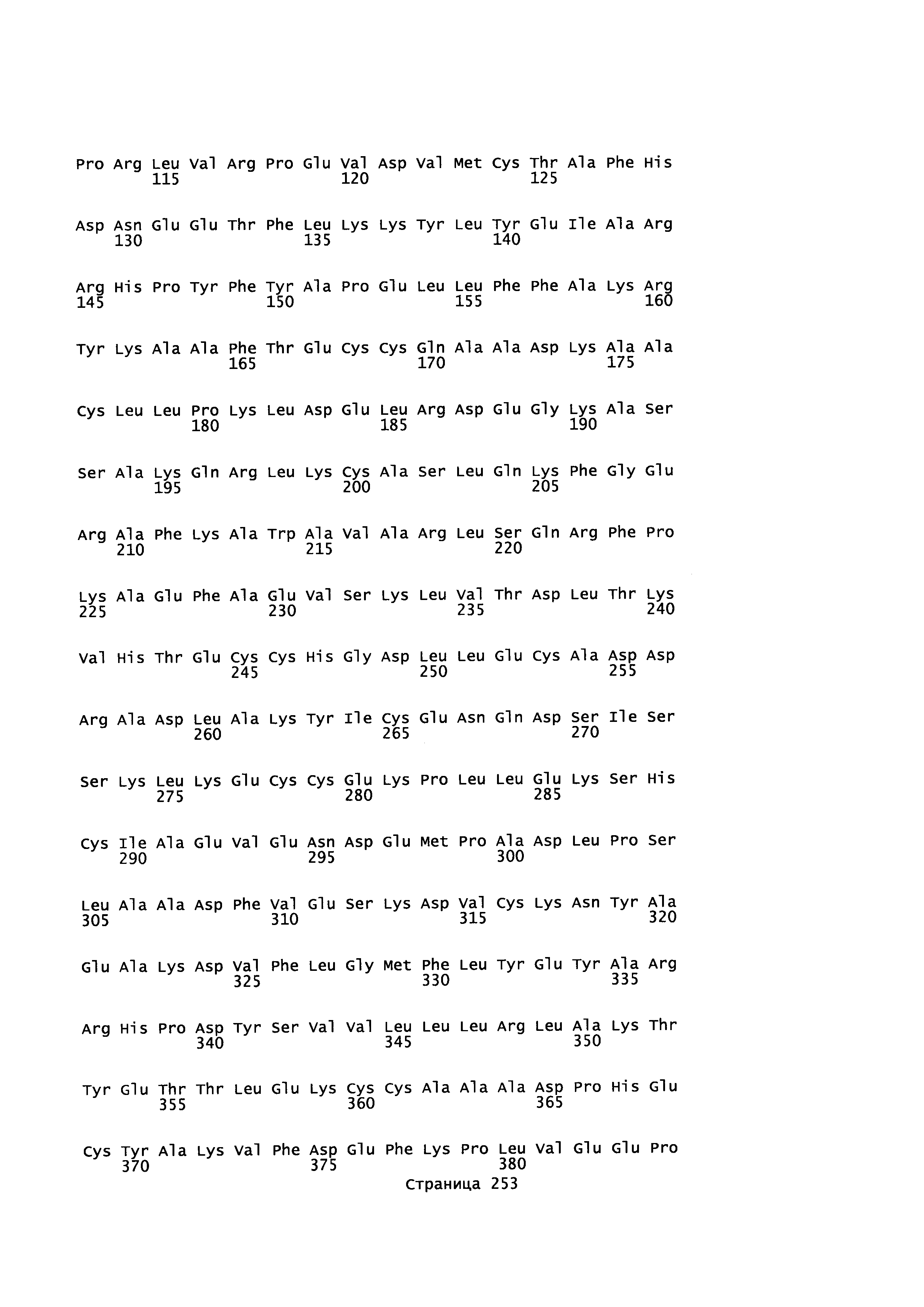

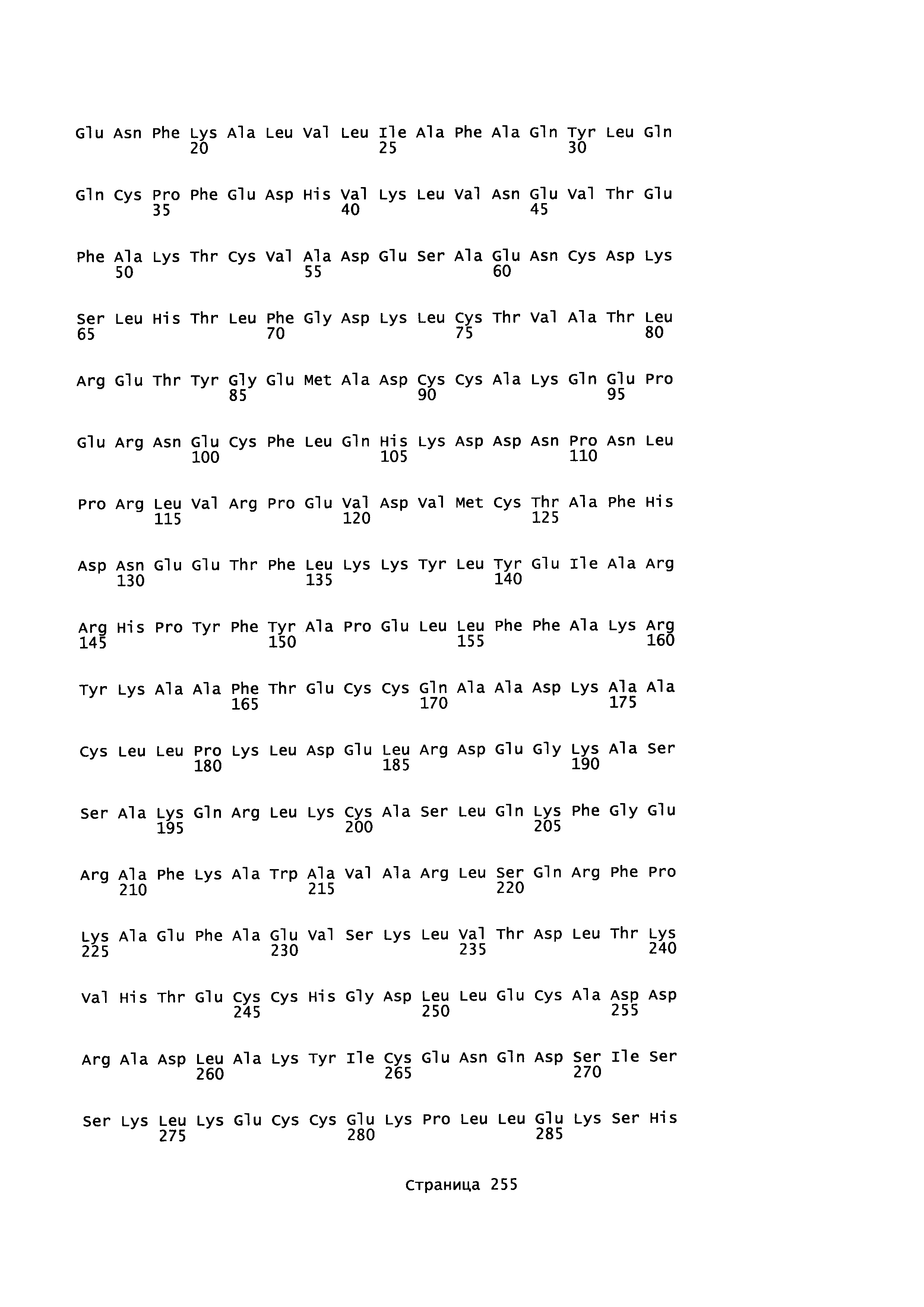











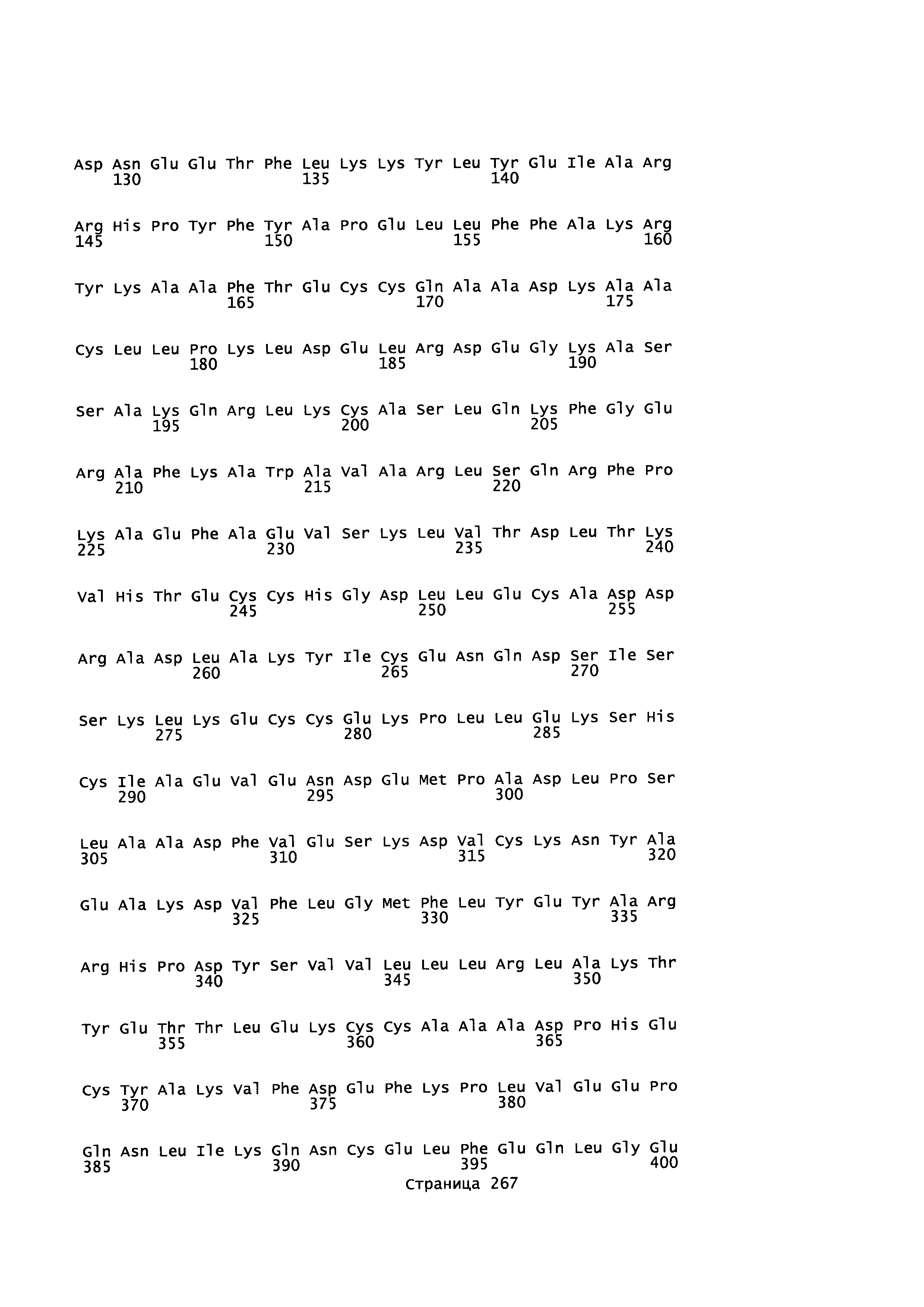




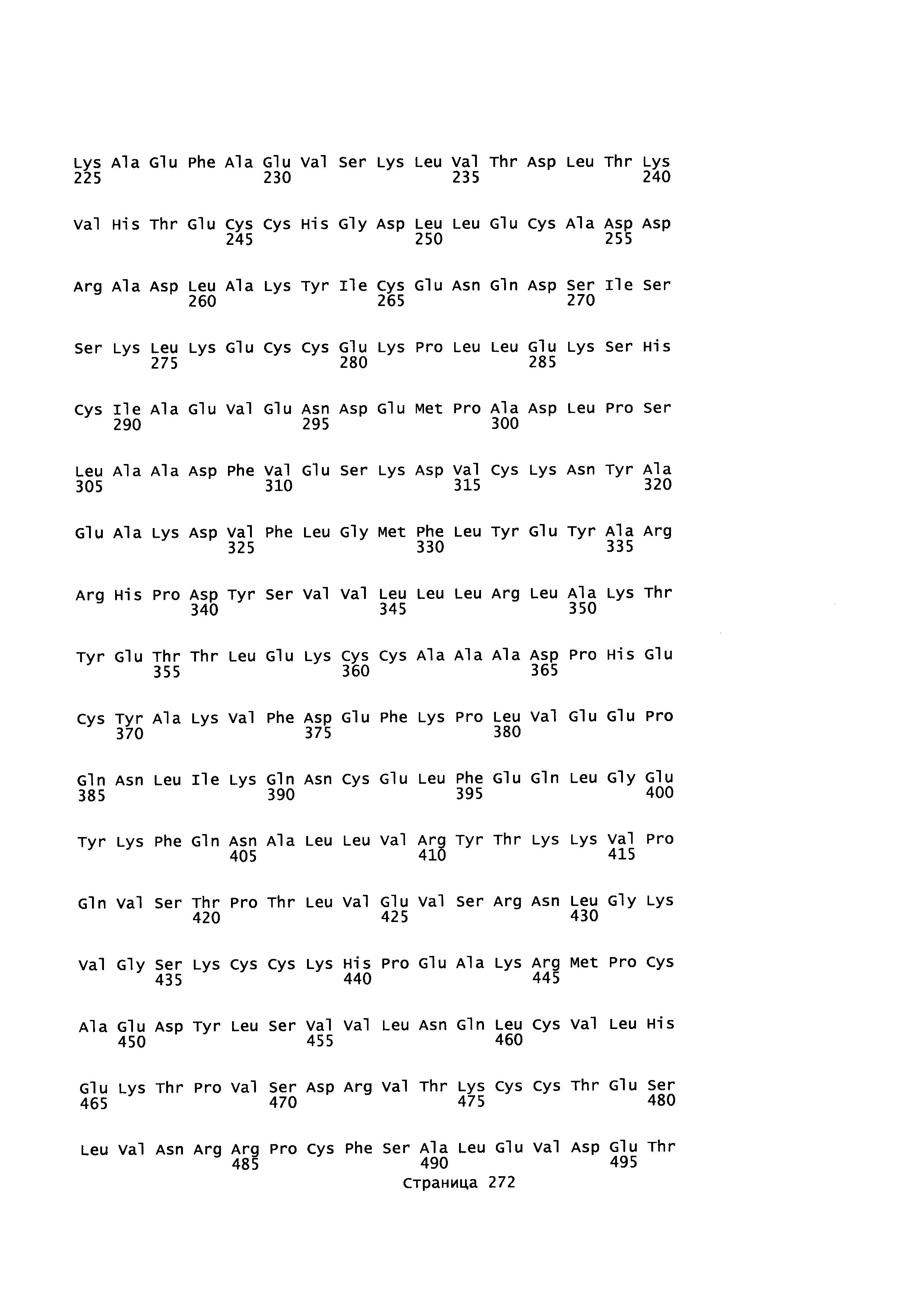



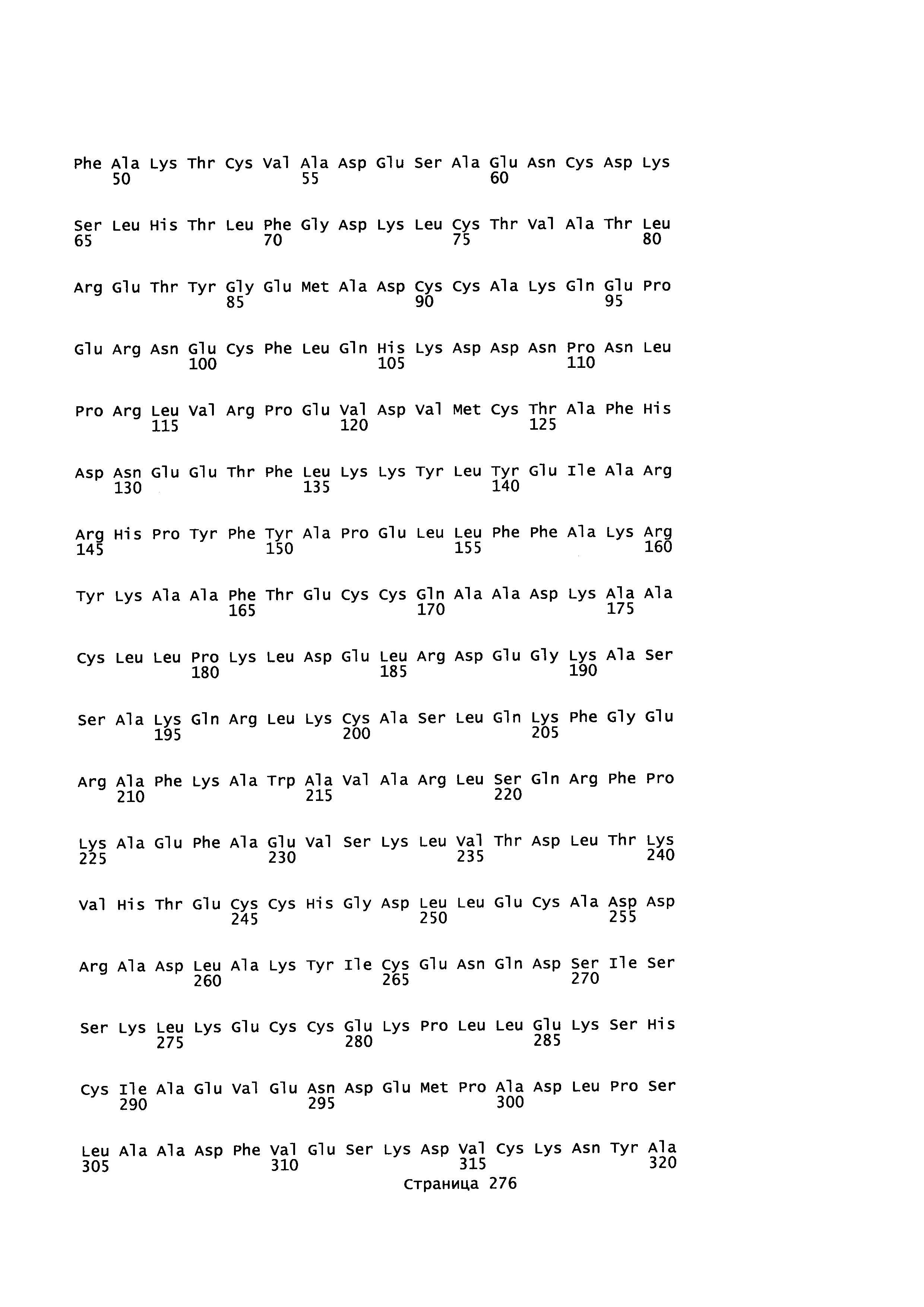






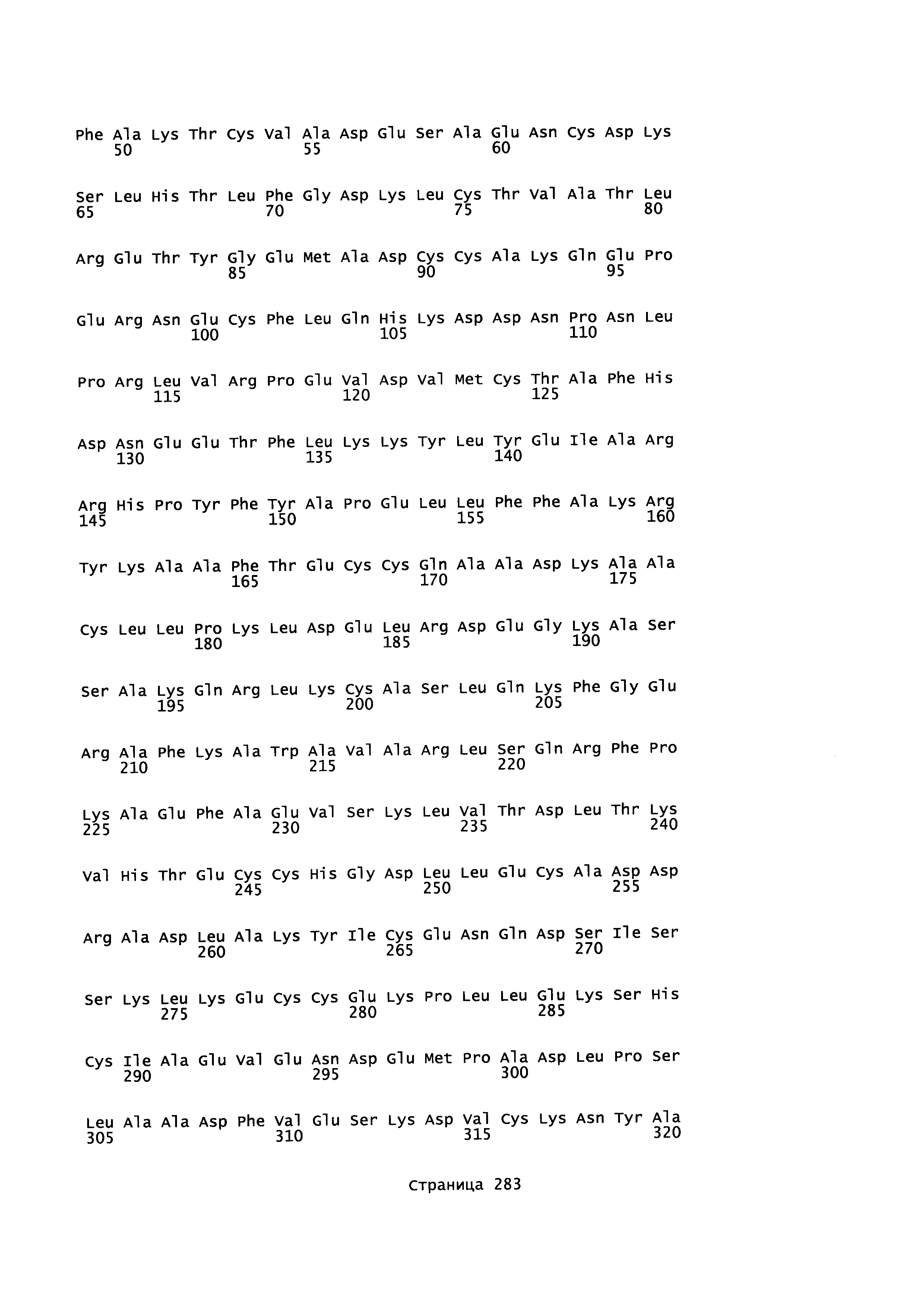











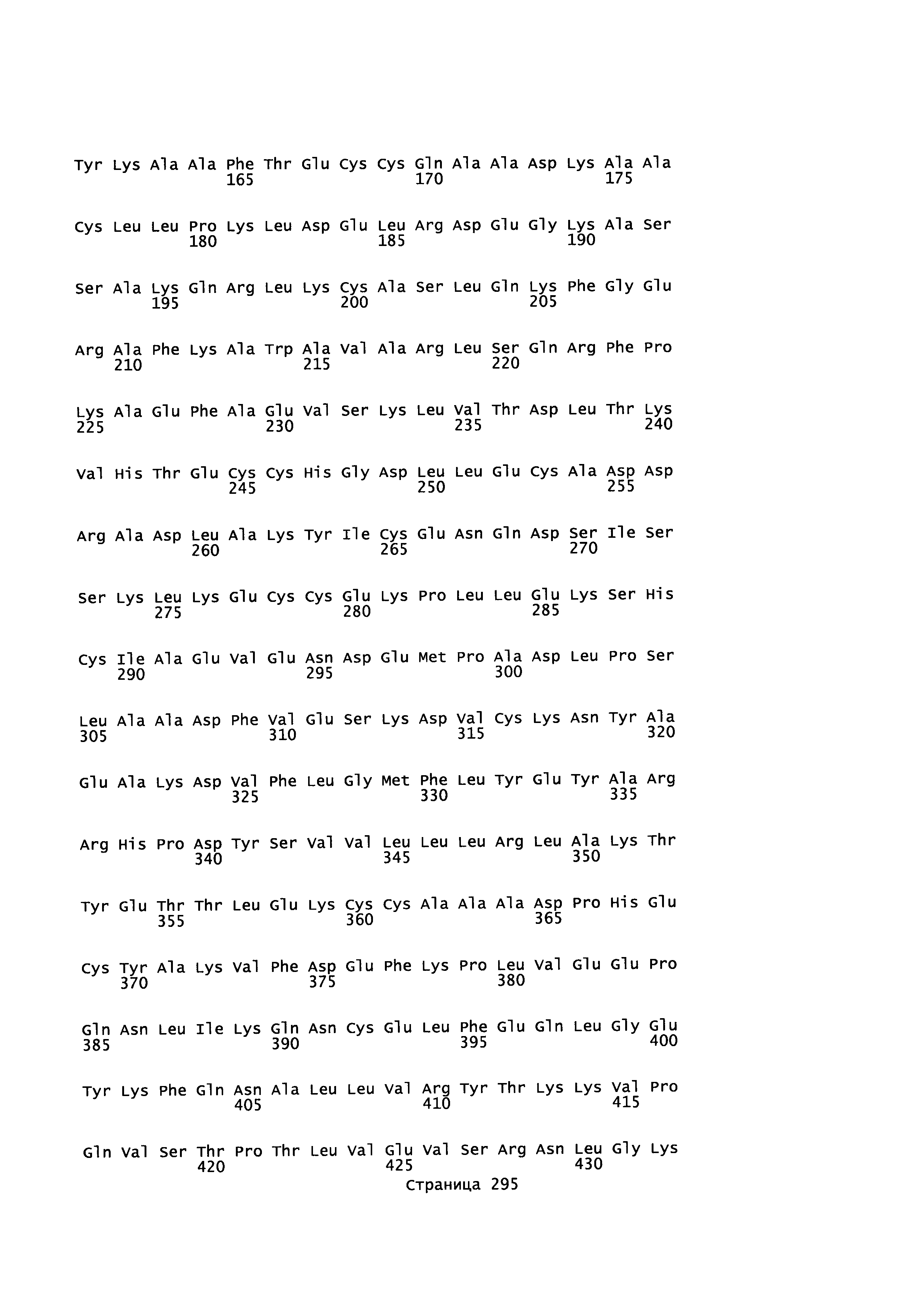



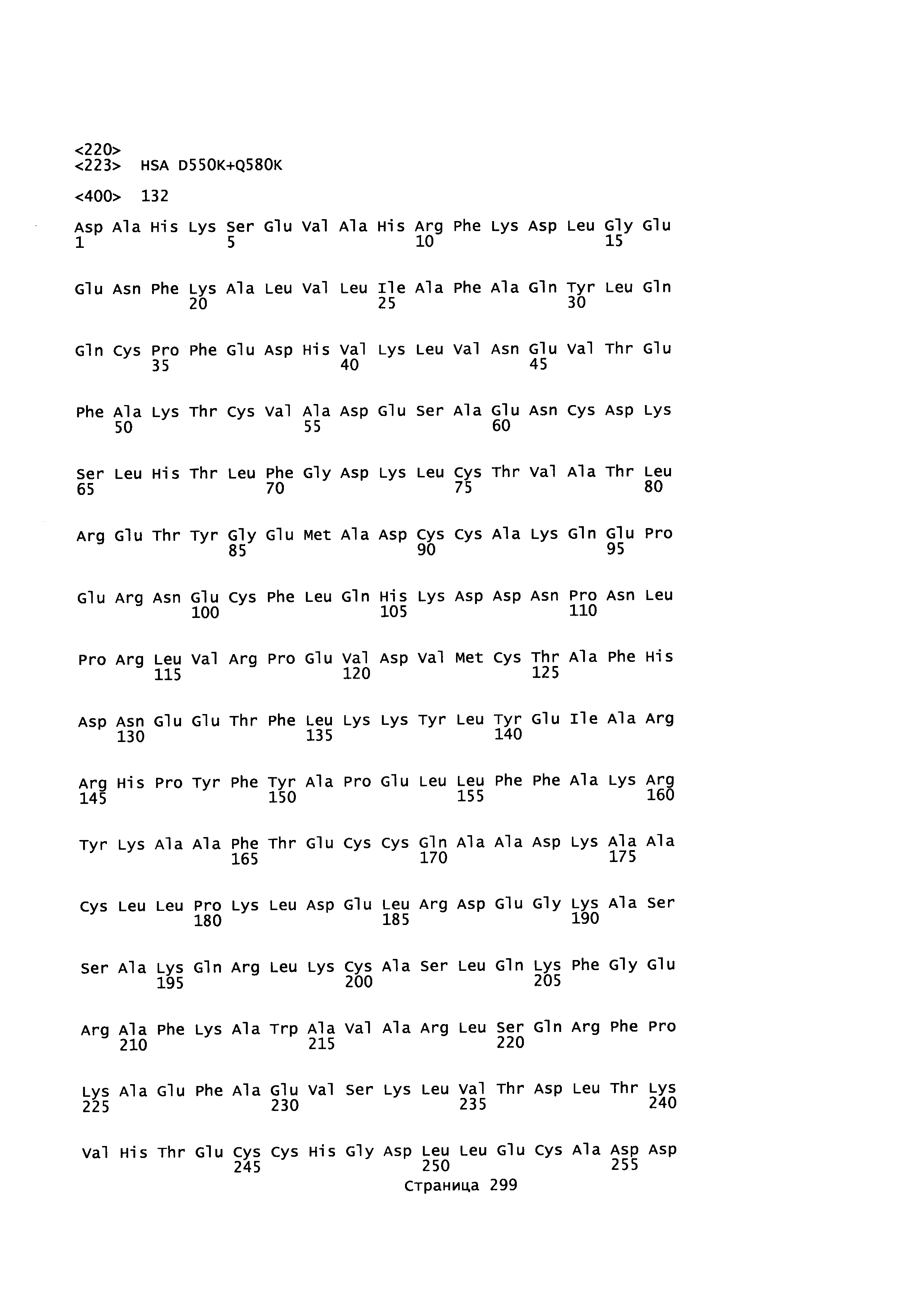






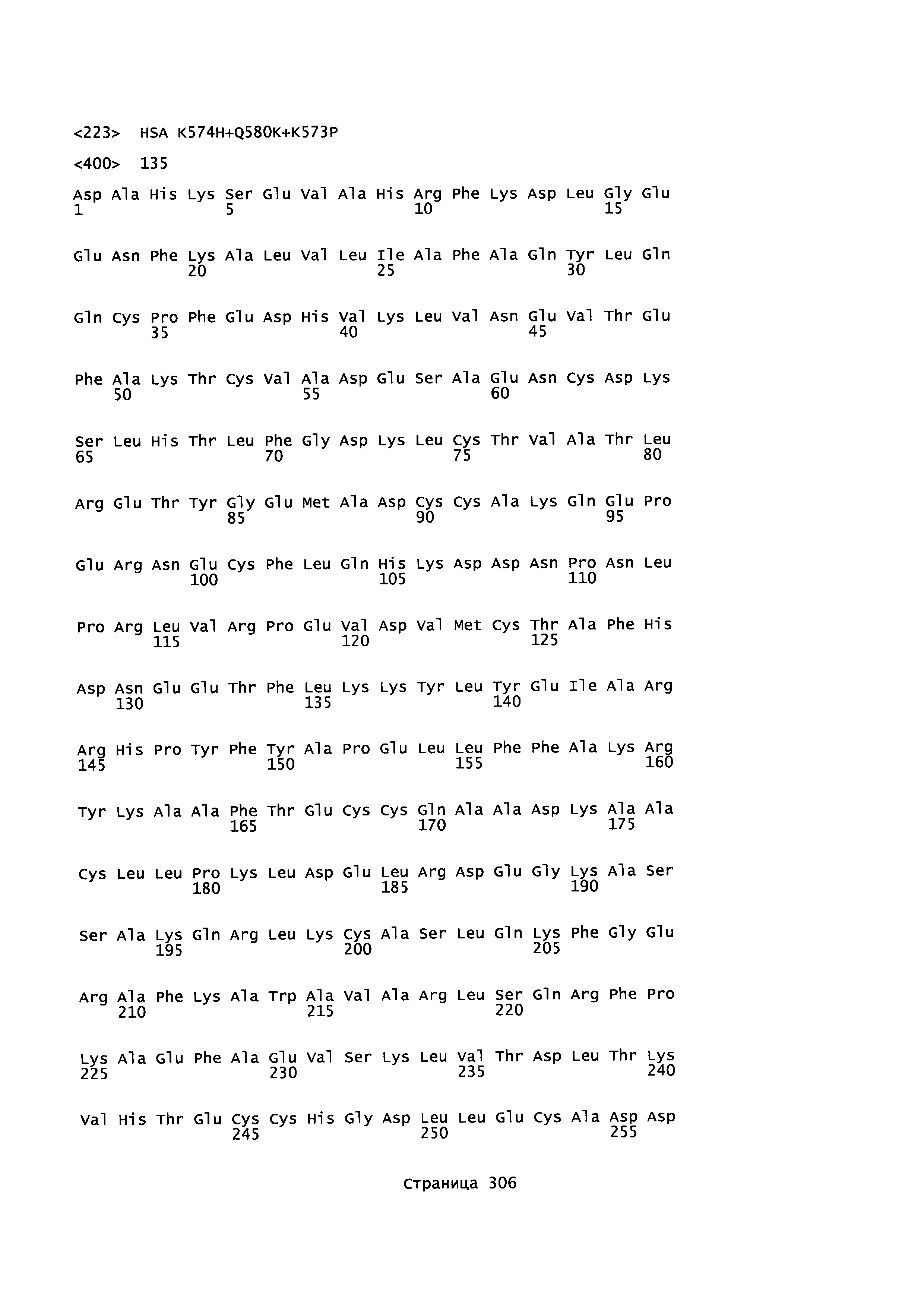




























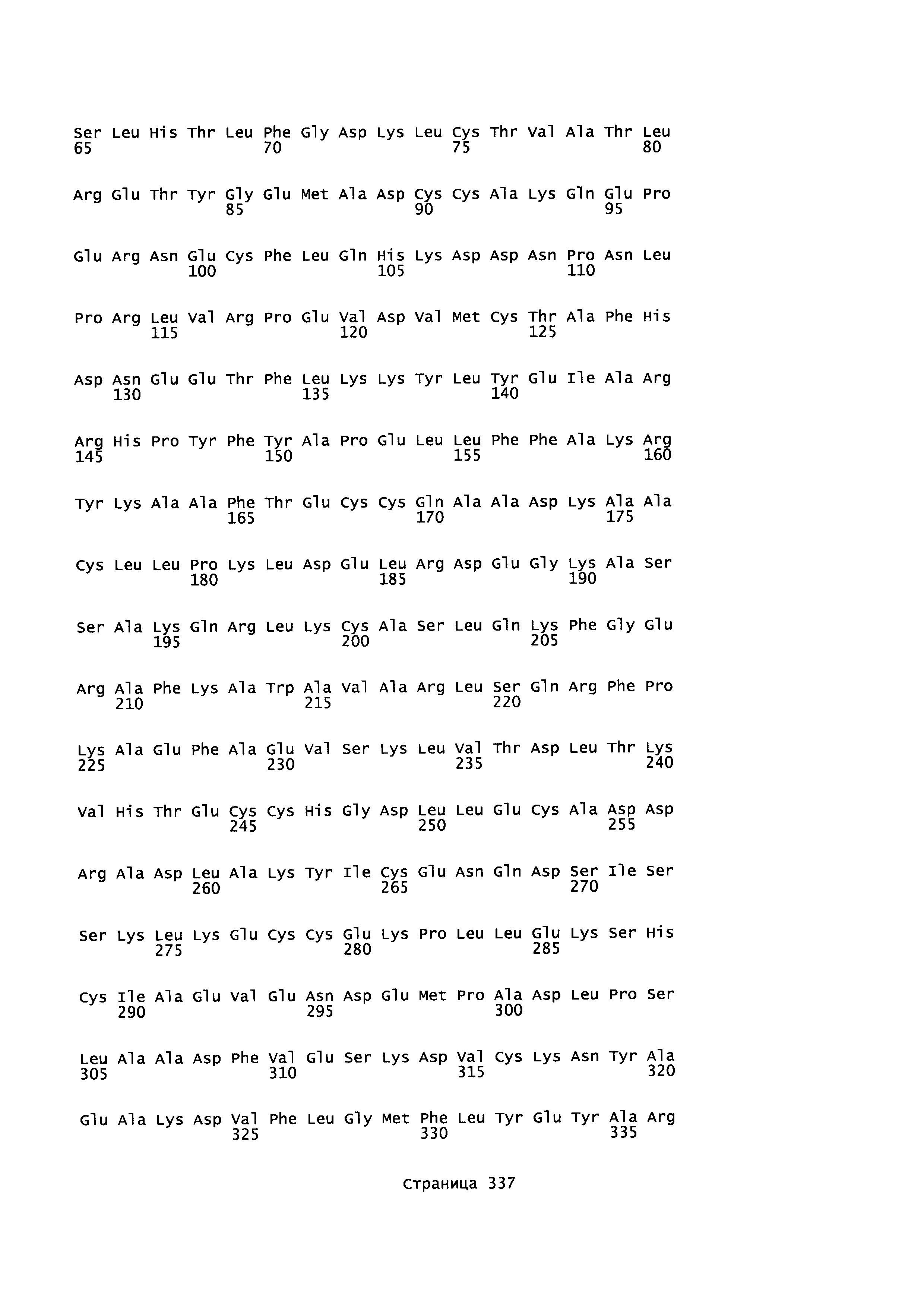






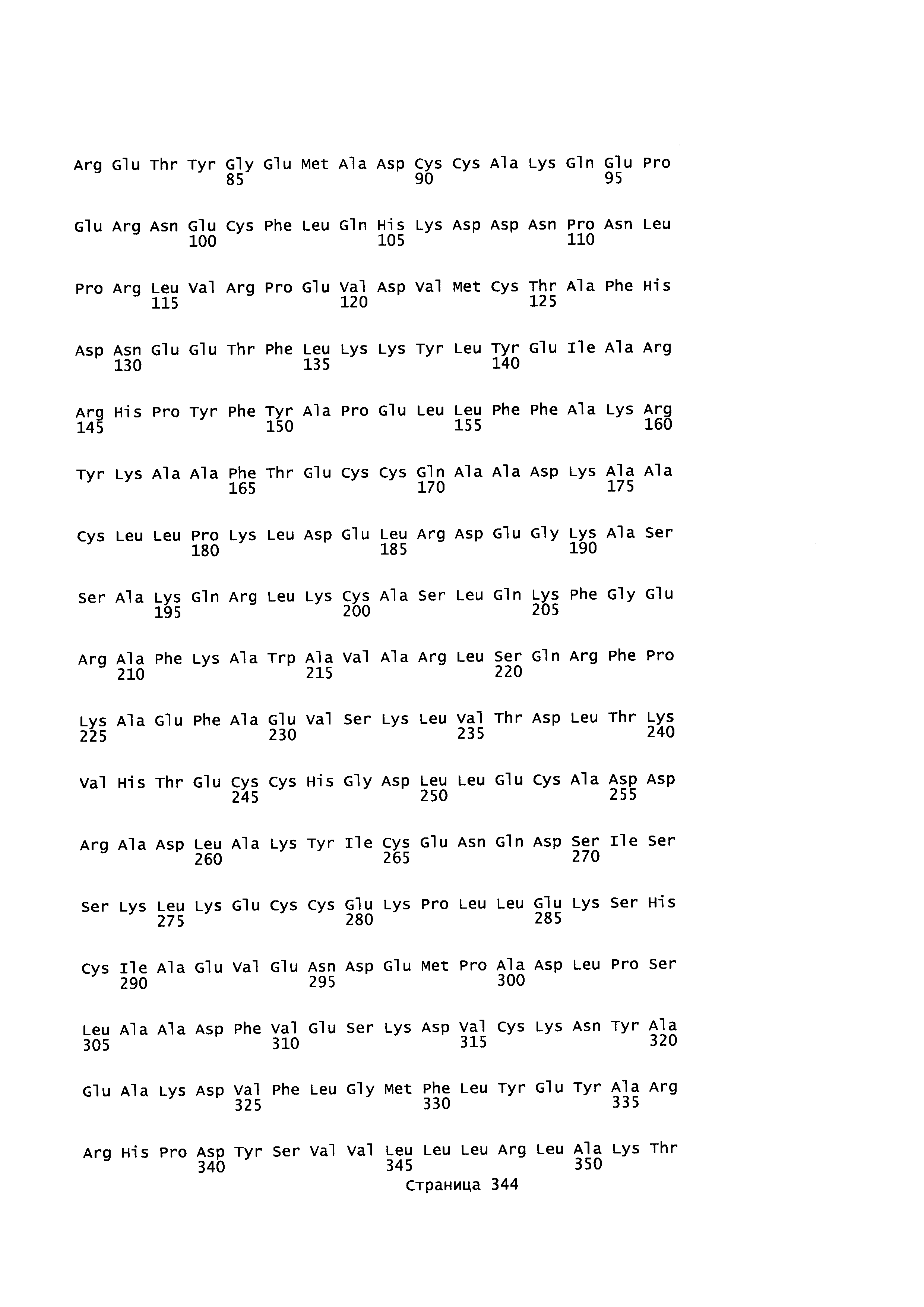





































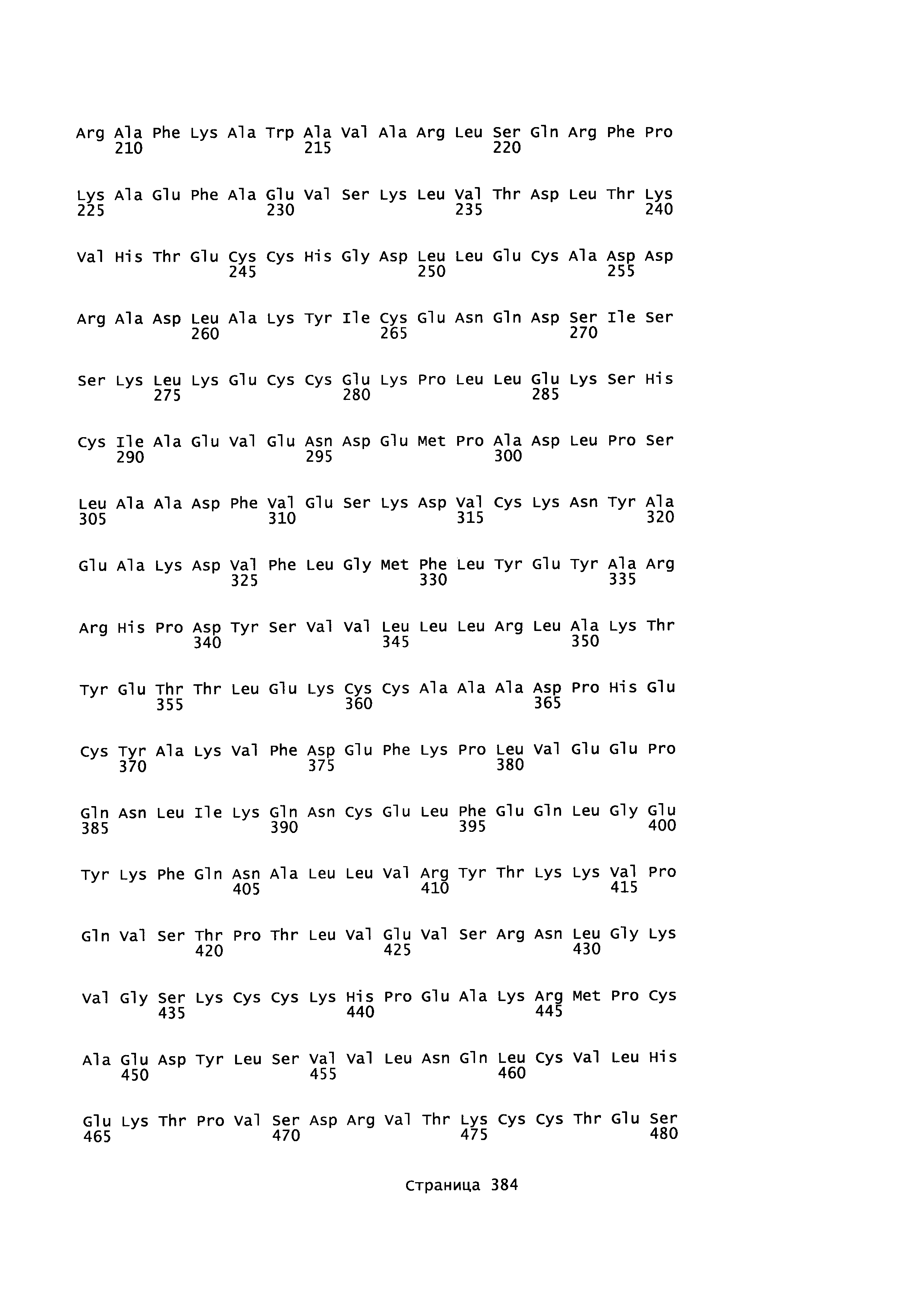



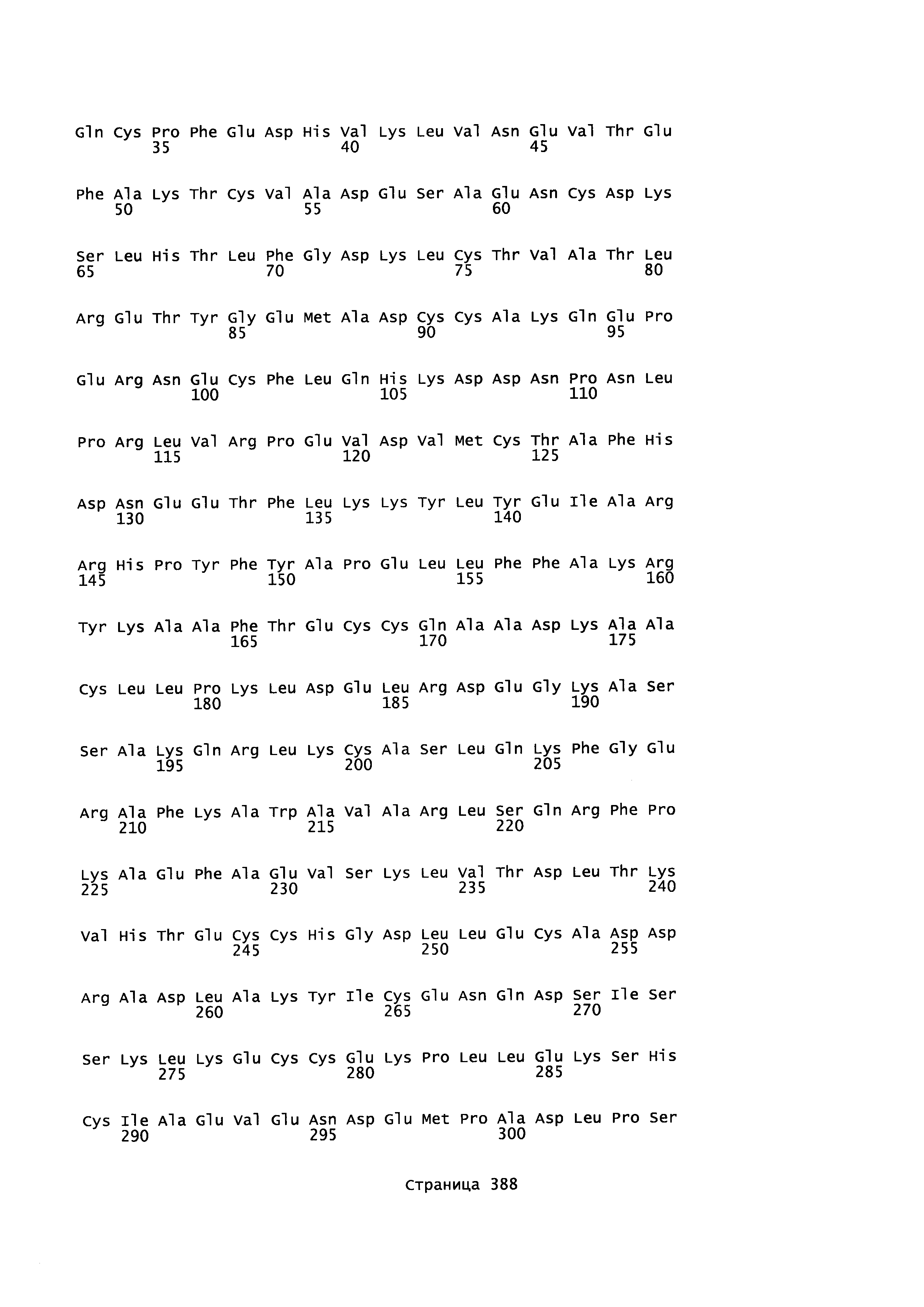


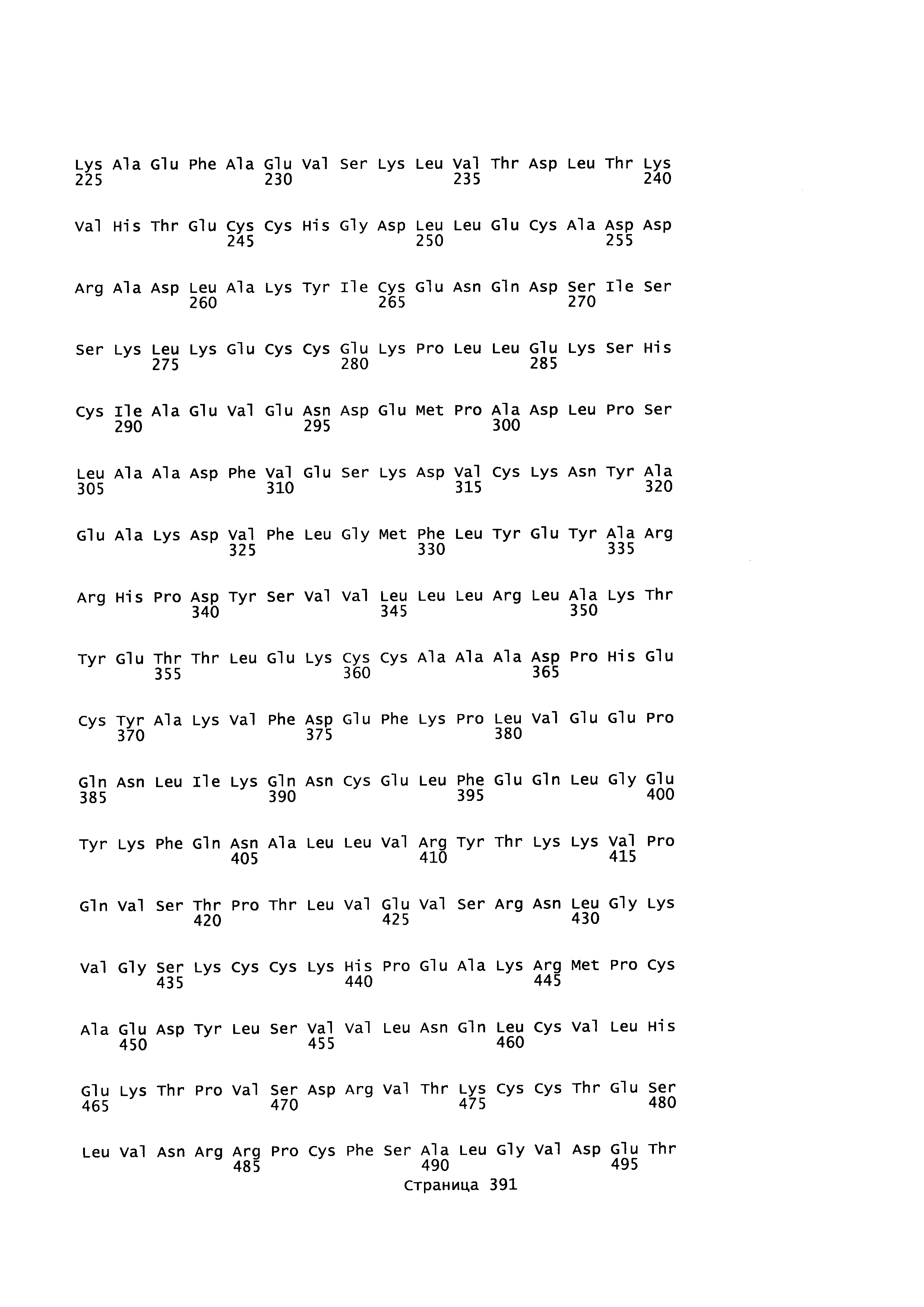

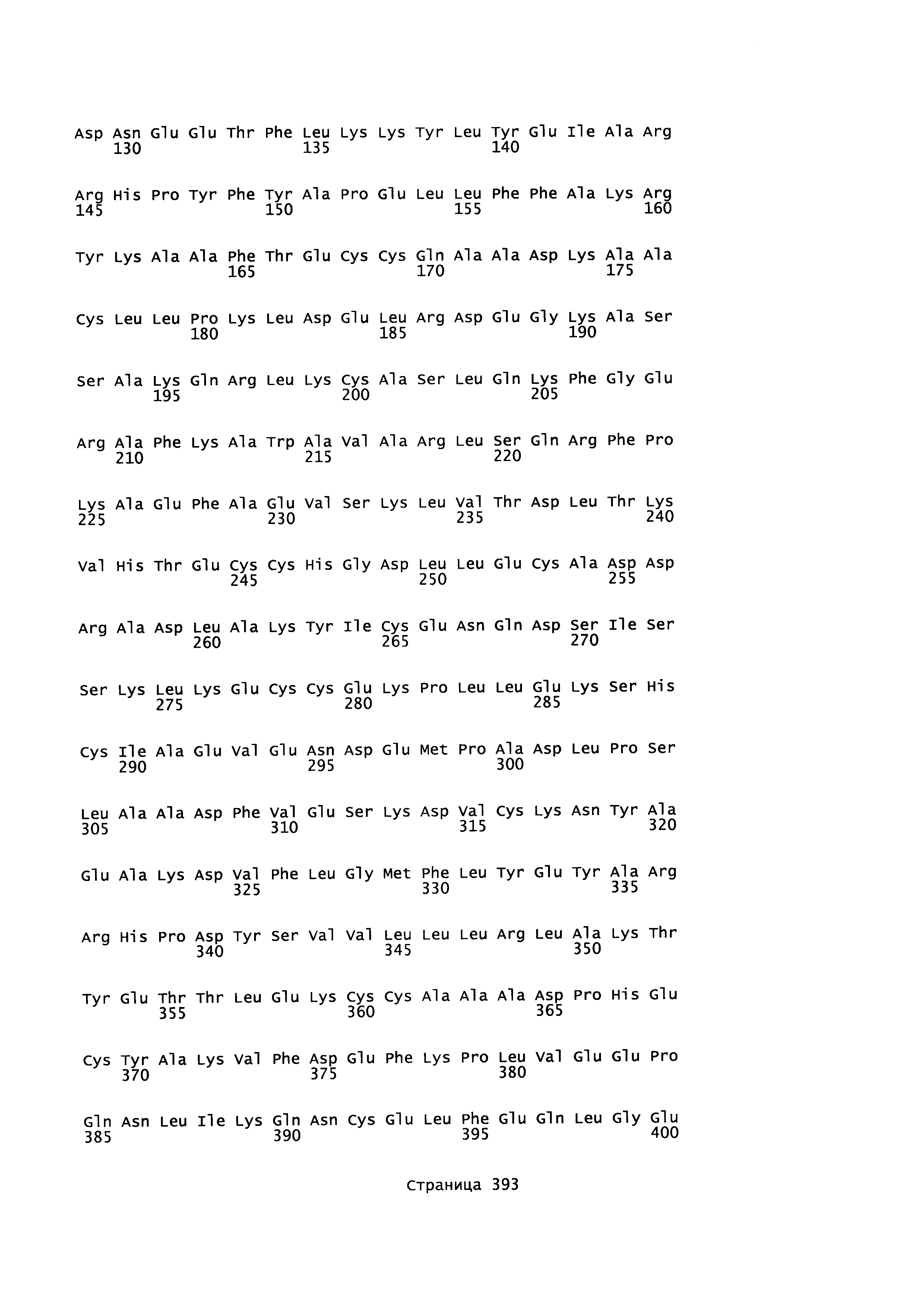


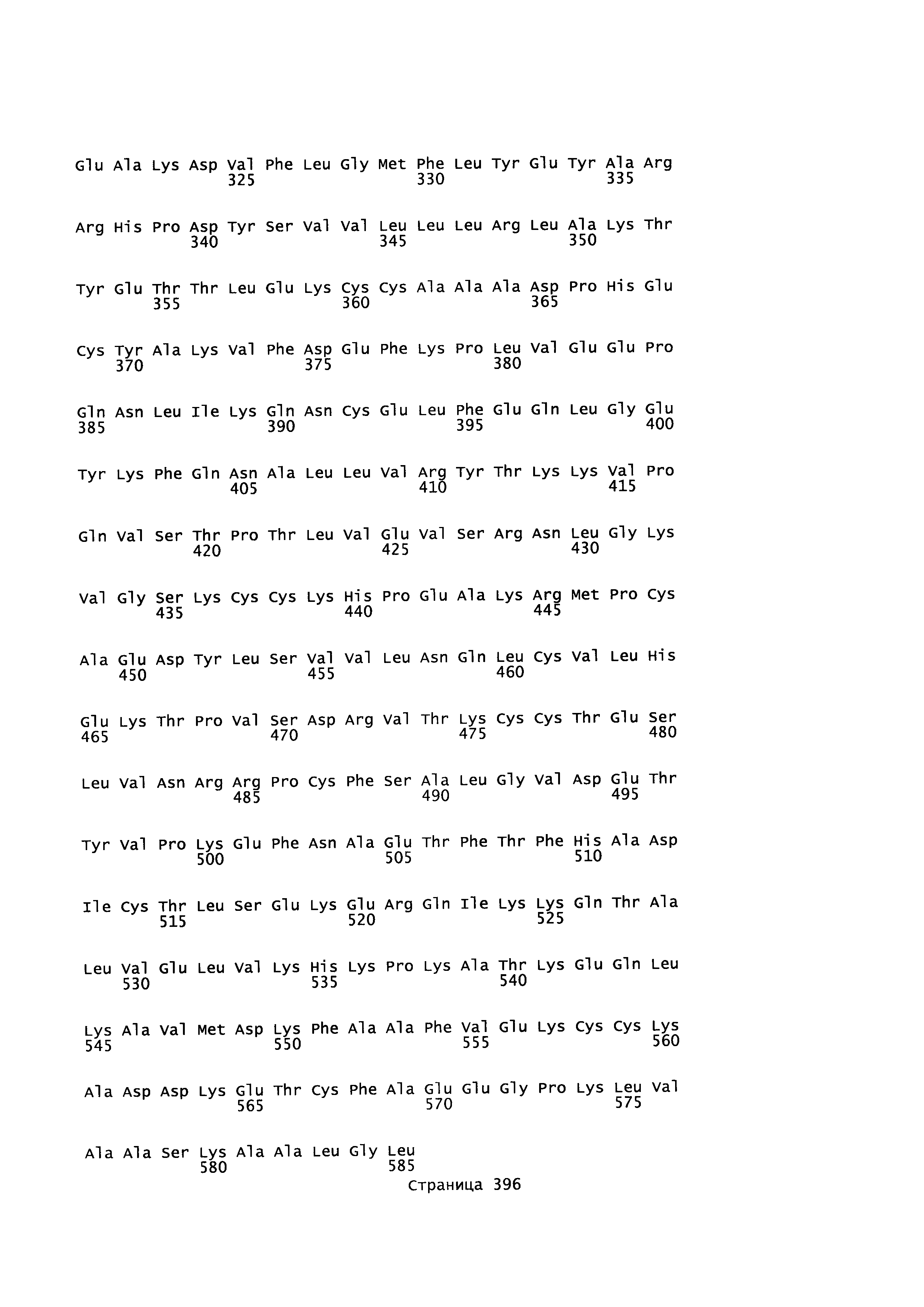

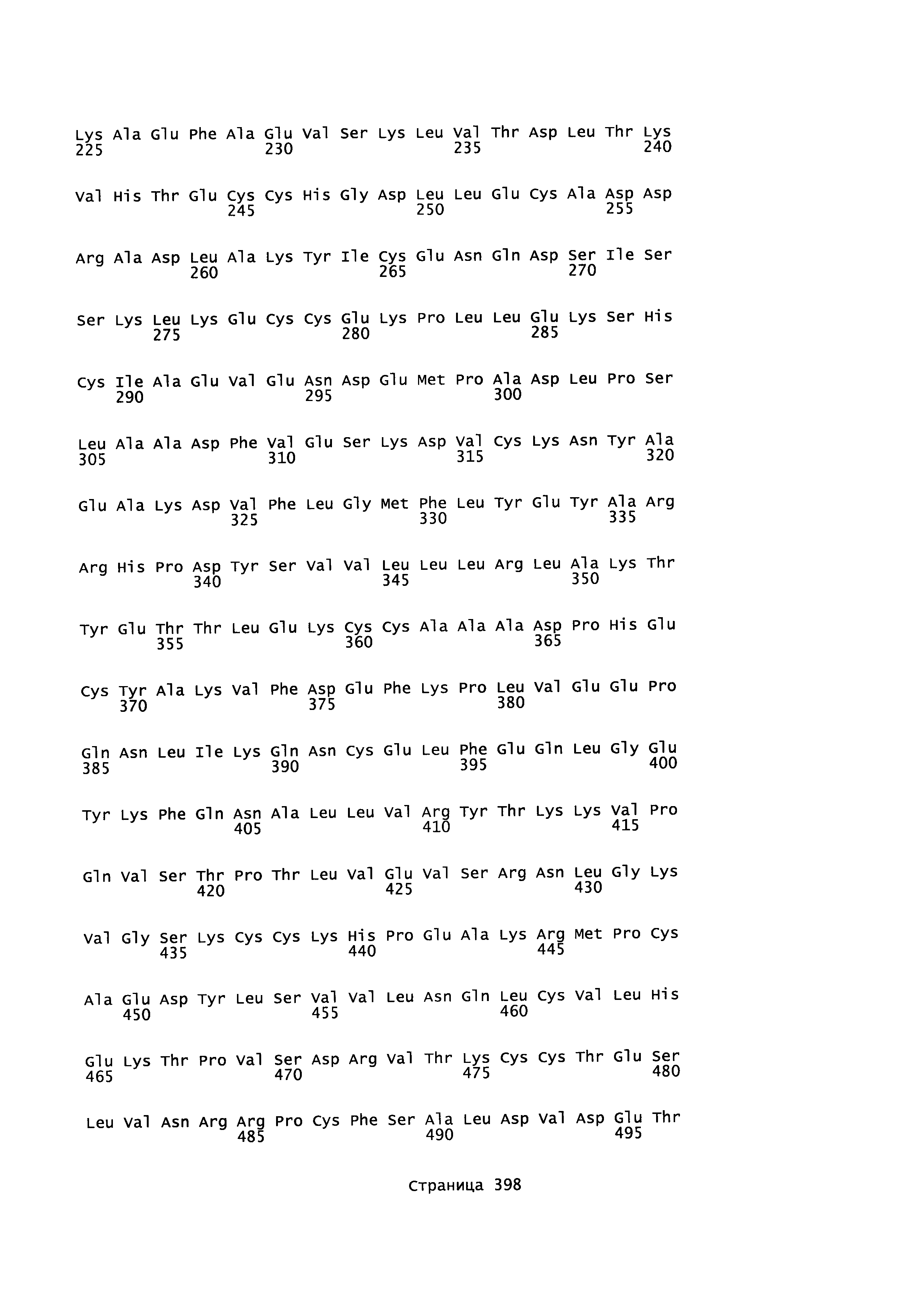


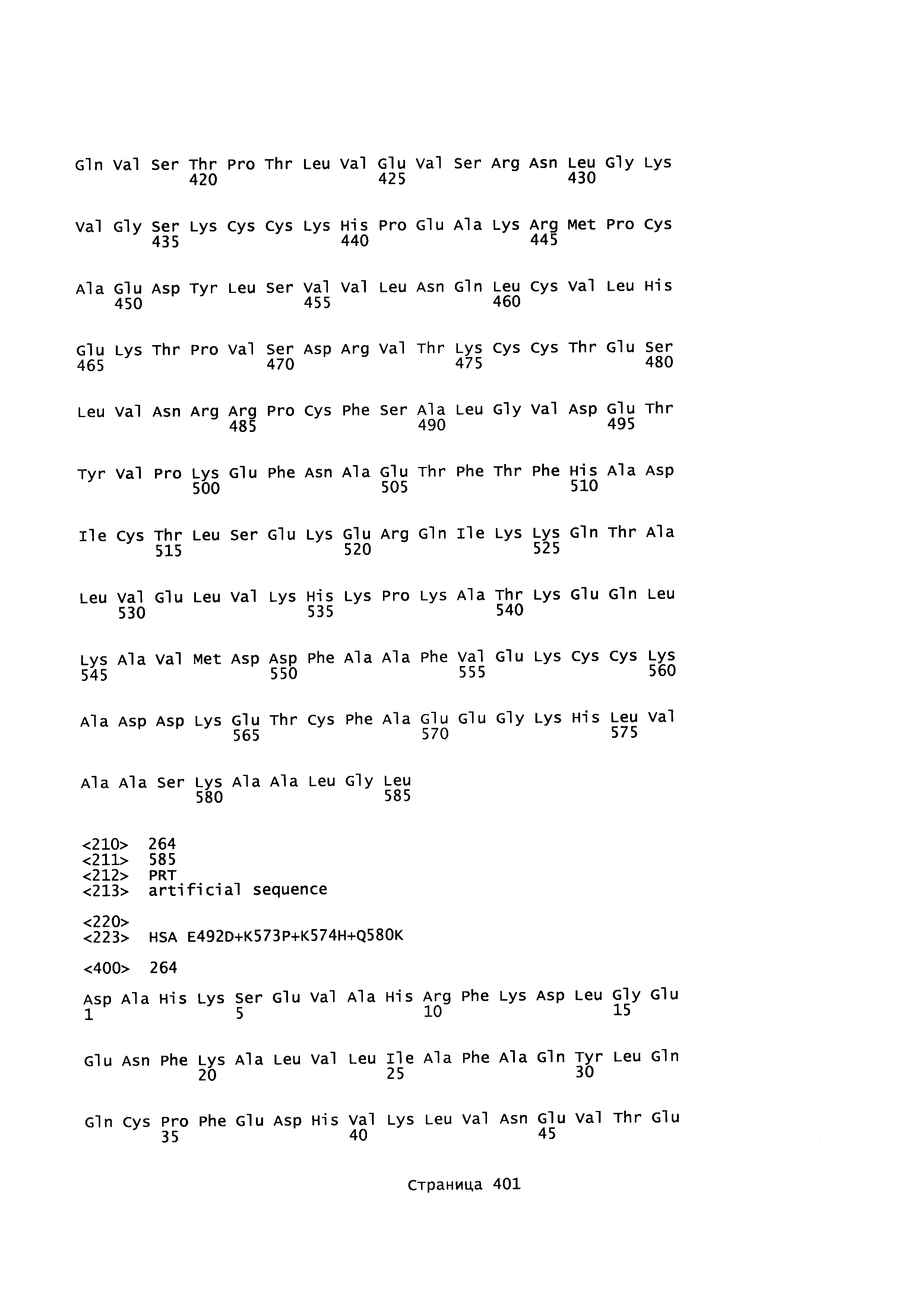
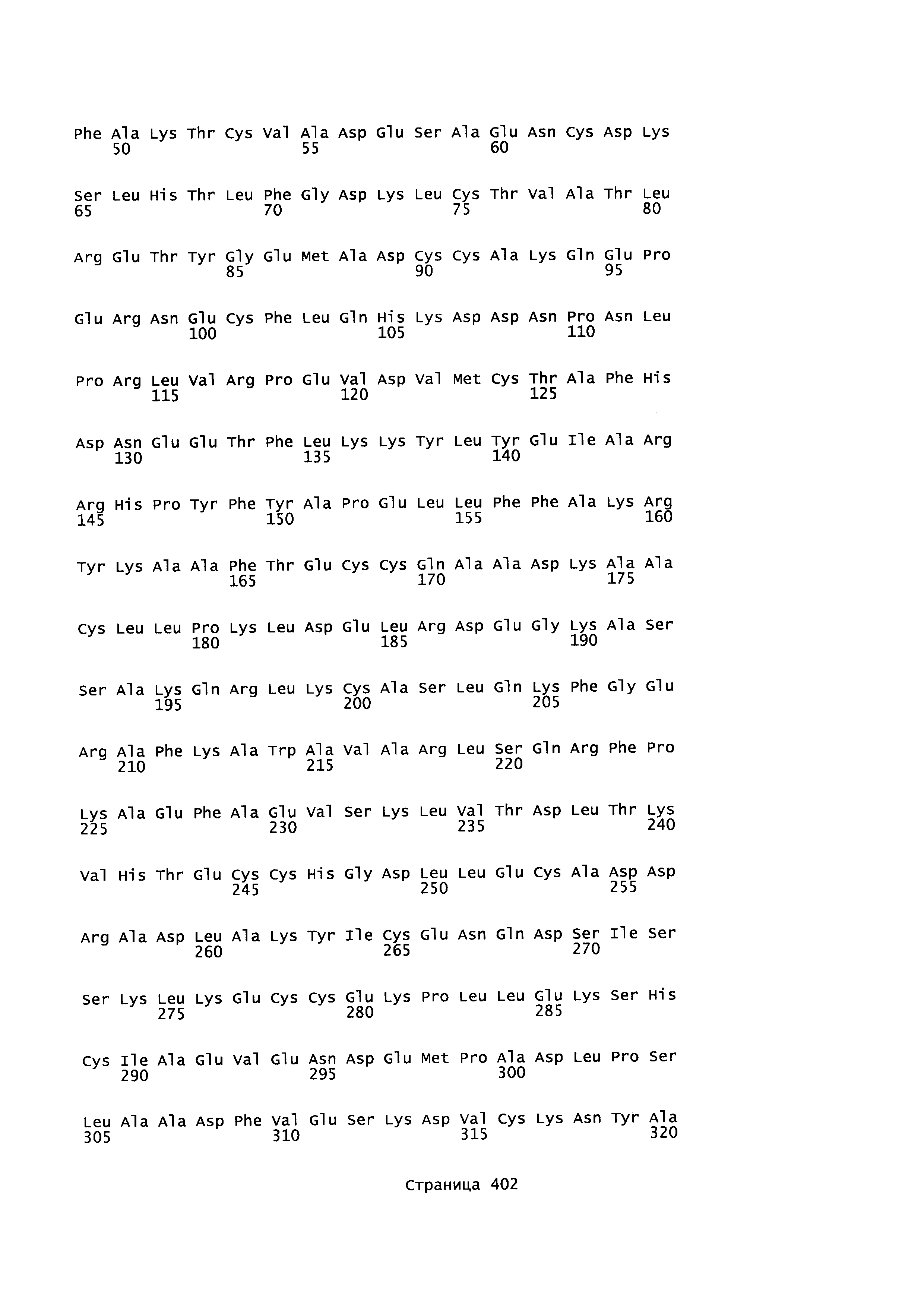


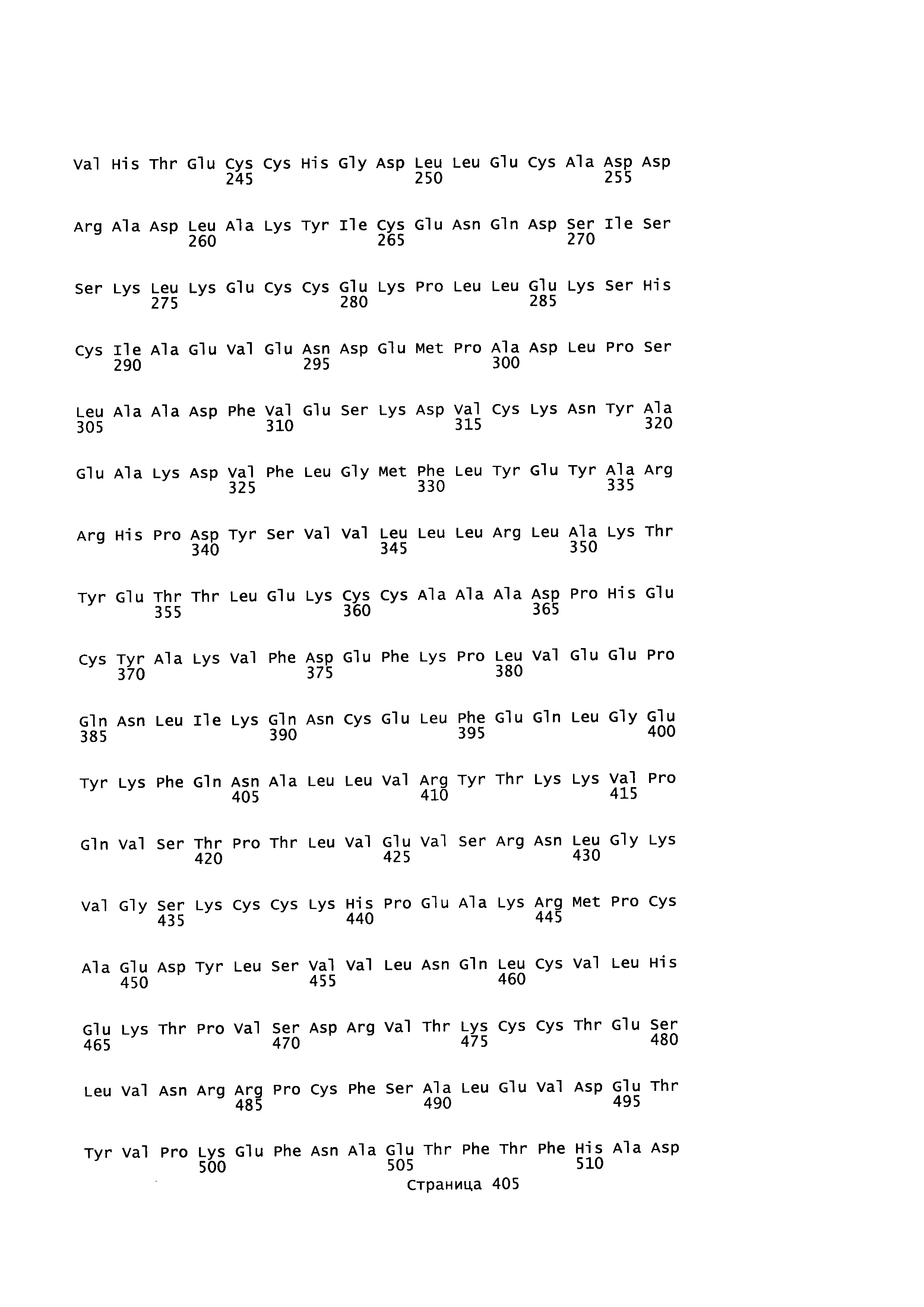















Описание
Ссылка на список последовательностей
Данная заявка содержит список последовательностей в считываемой компьютером форме, которая включена здесь посредством ссылки.
Уровень техники
Область техники, к которой относится изобретение
Настоящее изобретение относится к вариантам альбумина или его фрагментам или слитым полипептидам, содержащим вариант альбумина или его фрагмент, имеющим измененную аффинность связывания с FcRn и/или измененный период полужизни по сравнению с альбумином, его фрагментом или слитым полипептидом, содержащим альбумин или его фрагмент. Это изобретение позволяет приспосабливать аффинность связывания и/или период полужизни альбумина к потребностям и желаниям пользователя.
Описание соответствующего уровня техники
Альбумин является белком, встречающимся в плазме крови млекопитающих в природе, где он является наиболее широко представленным белком. Он играет важную роль в поддержании требуемого осмотического давления крови и также в транспорте различных веществ в кровотоке. Были охарактеризованы альбумины из многих видов, в том числе человека, свиньи, мыши, крысы, кролика и козы, и они имеют высокую степень гомологии последовательности и структуры.
Альбумин связывается in vivo со своим рецептором - неонатальным Fc рецептором (FcRn) "Brambell", и известно, что это взаимодействие является важным для периода полужизни альбумина в плазме. FcRn является мембраносвязанным белком, экспрессируемым во многих типах клеток и тканей. Было обнаружено, что FcRn предохраняет альбумин от внутриклеточной деградации (Roopenian D.С. and Akilesh, S. (2007), Nat. Rev. Immunol 7, 715-725). FcRn является бифункциональной молекулой, которая способствует поддержанию высокого уровня IgG и альбумина в сыворотке млекопитающих, таких как человек.
В то время как взаимодействие FcRn-иммуноглобулин (IgG) подробно описано в известном уровне техники, взаимодействие FcRn-альбумин охарактеризовано менее хорошо. Главный сайт связывания FcRn локализован в DIII (381-585), (Andersen et al. (2010), Clinical Biochemistry 43,367-372). Был выявлен ряд ключевых аминокислот, которые важны для связывания, в частности это гистидины Н464, Н510 и Н536 и Lys500 (Andersen et al. (2010), Nat. Commun. 3:610. DOI:10.1038/ncomms1607). Кристаллическая структура варианта человеческого сывороточного альбумина (HSA) (V418M + T420A + E505G + V547A), который обладает высокой аффинностью связывания с FcRn при кислотном pH, и, кроме того, увеличенным связыванием при нейтральном pH, дала более детальное понимание взаимодействующих поверхностей. Кроме того, эти авторы могли изменять аффинность связывания FcRn посредством замены аминокислот и показали, что это могло бы обусловить увеличенные периоды полужизни в кровотоке у мышей и обезьян, особенно это было отмечалось в отношении HSA E505G + V547A (Schmidt et al. (2012), Cell Structure. 21, Issue 11, (doi:10.1016/j.str.2013.08.022)).
Данные показывают, что IgG и альбумин связываются по отдельности с различными сайтами на FcRn (Andersen et al. (2006), Eur. J. Immunol 36, 3044-3051; Chaudhury et al. (2006), Biochemistry 45, 4983-4990).
Известно, что FcRn мыши связывает IgG из мыши и человека, тогда как FcRn человека, по-видимому, является более селективным (Ober et al. (2001) Int. Immunol 13, 1551-1559). Andersen et al. (2010) Journal of Biological Chemistry 285(7):4826-36, описывает аффинность FcRn человека и мыши в отношении альбуминов мыши и человека (все возможные комбинации). При физиологическом pH не наблюдалось связывание альбумина из любого вида с любым рецептором. При кислотном pH, наблюдалось 100-кратное различие в аффинности связывания. Во всех случаях, связывание альбумина и IgG из любого вида были аддитивными.
Хорошо охарактеризован человеческий сывороточный альбумин (HSA), представляющий собой полипептид из 585 аминокислот, последовательность которого может быть найдена в Peters, Т., Jr. (1996) All about Albumin: Biochemistry, Genetics and Medical, Applications pp10, Academic Press, Inc., Orlando (ISBN 0-12-5521 10-3). Он имеет характерное связывание со своим рецептором FcRn, с которым он связывается при pH 6,0, но не при pH 7,4.
Было обнаружено, что период полужизни HSA в плазме равен приблизительно 19 дням. Идентифицирован природный вариант, имеющий более короткий период полужизни в плазме (Peach, R.J. and Brennan, S.O., (1991) Biochim Biophys Acta. 1097:49-54), который содержит замену D494N. Эта замена создала сайт N-гликозилирования в этом варианте, который отсутствует в альбумине дикого типа. Неизвестно, что именно явилось ответственным за изменение периода полужизни в плазме - гликозилирование или замена аминокислоты.
Альбумин имеет продолжительный период полужизни в плазме, и благодаря этому свойству его предлагалось применять в доставке лекарственных средств. Альбумин конъюгировали с фармацевтически полезными соединениями (WO 2000/69902), и было обнаружено, что этот конъюгат сохранял продолжительный период полужизни альбумина. Полученный период полужизни этого конъюгата был, как правило, значительно более длительным, чем период полужизни одного этого полезного терапевтического соединения.
Кроме того, альбумин был генетически слит с терапевтически полезными пептидами (WO 2001/79271 А и WO 2003/59934) типичным результатом чего было то, что это слияние имело активность терапевтически полезного пептида и значительно более длительный период полужизни в плазме, чем период полужизни в плазме только этого терапевтически полезного пептида.
В Otagiri et al. (2009), Biol. Pharm. Bull. 32(4), 527-534, описано более чем 70 вариантов альбумина, причем оказалось, что 25 из них являются мутированными в домене III. Было показано, что один природный вариант лишенный последних 175 аминокислот на карбокси-конце, имеет уменьшенный период полужизни (Andersen et al. (2010), Clinical Biochemistry 43, 367-372). Iwao et al. (2007) изучали период полужизни вариантов встречающихся в природе вариантов альбумина человека с использованием мышиной модели, и обнаружили, что K541E и K560E имели уменьшенный период полужизни, E501K и E570K имели увеличенный период полужизни и K573E почти не имел действия на период полужизни (Iwao, et al. (2007) В.В.А. Proteins and Proteomics 1774, 1582-1590).
Galliano et al. (1993) Biochim. Biophys. Acta 1225, 27-32, описывает природный вариант E505K. Minchiotti et al. (1990) описывает природный вариант K536E. Minchiotti et al. (1987) Biochim. Biophys. Acta 916, 411-418, описывает природный вариант K574N. Takahashi et al. (1987) Proc. Natl. Acad. Sci. USA 84, 4413-4417, описывает природный вариант D550G. Carlson et al. (1992). Proc. Nat. Acad. Sci. USA 89, 8225-8229, описывает природный вариант D550A.
WO 2011/051489 и WO 2012/150319 описывают ряд точечных мутаций в альбумине, которые модулируют связывание альбумина с FcRn. WO 2010/092135 описывает ряд точечных мутаций в альбумине, которые увеличивают число тиолов, доступных для конъюгации в этом альбумине, но в этих документах не сообщает о действии этих мутаций на связывание с FcRn. WO 2011/103076 описывает варианты альбумина, каждый из которых содержит замену в Домене III HSA. WO 2012/112188 описывает варианты альбумина, содержащие замены в Домене III HSA.
Альбумин способен связывать ряд лигандов, и они становятся ассоциированными (ассоциатами) с альбумином. Это свойство использовали для удлинения периода полужизни в плазме лекарственных средств, имеющих способность нековалентного связывания с альбумином. Это может также достигаться связыванием фармацевтически полезного соединения, которое имеет малую способность или вообще не имеет способности связываться с альбумином, с группой, имеющей альбуминсвязывающие свойства, см. обзорную статью и ссылки в ней, Kratz (2008) Journal of Controlled Release 132, 171-183.
Альбумин используют в препаратах фармацевтически полезных соединений, в которых такой препарат может быть, например, без ограничения, наночастицей или микрочастицей альбумина. В этих соединениях изменение аффинности альбумина в отношении его рецептора может принести пользу с точки зрения доставки фармацевтически полезного соединения или смеси соединений, где это полезное соединение ассоциируется с альбумином. Не ясно, что определяет период полужизни в плазме подобных ассоциатов (неограничивающий пример которых является Levemir®, Kurtzhals Р. et al. Biochem. J. 1995; 312: 725-731), конъюгатов или слитых полипептидов, но, по-видимому, это является результатом комбинирования альбумина и выбранного фармацевтически полезного соединения/полипептида. Желательным было бы получить возможность контролирования периода полужизни в плазме этих конъюгатов альбумина, ассоциатов или слитых полипептидов альбумина таким образом, что может достигаться более длинный или более короткий период полужизни, чем данный компонентами ассоциации, конъюгации или слияния, чтобы можно было сконструировать конкретное лекарственное средство в соответствии с показаниями.
Известно, что альбумин накапливается и катаболизируется в опухолях, было также показано, что он накапливается в воспаленных суставах людей, страдающих от ревматоидного артрита. См. обзорную статью и ссылки в ней, Kratz (2008) Journal of Controlled Release 132, 171-183. Предполагается, что варианты HSA с увеличенной аффинностью в отношении FcRn могут быть полезными для доставки фармацевтически полезных соединений.
Может быть даже желательным иметь варианты альбумина, которые обладают слабой способностью связывания с FcRn или не связываются с ним, для обеспечения более коротких периодов полужизни или контролируемой фармакокинетики сыворотки, как описано Kenanova et al. (2009) J. Nucl. Med.; 50 (Supplement 2): 1582).
Kenanova et al. (2010, Protein Engineering, Design & Selection 23(10): 789-798; WO 2010/118169) описывает модель стыковки, содержащую структурную модель домена III HSA (растворимого при pH 7-8), и структурную модель FcRn (растворимого при pH 6,4). Kenanova et al. описывает, что положения 464, 505, 510, 531 и 535 в домене III потенциально взаимодействуют с FcRn. Гистидины в положениях 464, 510 и 535 идентифицировали как особо важные, Chaudhury et al. (2006, op. cit), и было показано, что они значительно уменьшают аффинности и дают более короткий период полужизни в мышах, как показано Kenanova (2010, op. cit). Однако исследования Kenanova et al. ограничены доменом III HSA и, следовательно, не рассматривают HSA в его нативной интактной конфигурации. Кроме того, эти идентифицированные положения приводят к уменьшению в аффинности в отношении рецептора FcRn.
Данное изобретение обеспечивает дополнительные варианты, имеющие измененную аффинность связывания с рецептором FcRn. Таким образом, часть или части альбумина могут быть использованы для адаптации аффинности связывания с FcRn и/или периода полужизни слитых полипептидов, конъюгатов, ассоциатов, наночастиц и композиций, содержащих эту часть альбумина.
Сущность изобретения
Данное изобретение относится к вариантам альбумина, содержащим изменения в положениях, соответствующих положениям, выбранным среди двух или более положений 492, 550, 573, 574 и 580 зрелого полипептида SEQ ID NO: 2, или эквивалентных положений других альбуминов или их фрагментов. Положение 492 локализовано в соединительной петле между субдоменом DIIIa и субдоменом DIIIb. Положения 550, 573, 574 и 580 локализованы в субдомене DIIIb. Субдомен IIIb локализован проксимально относительно соединительной петли между субдоменом DIIIa и субдоменом DIIIb.
Данное изобретение относится также к изолированным полинуклеотидам, кодирующим эти варианты; нуклеиновокислотным конструкциям, векторам и клеткам-хозяевам, содержащим эти полинуклеотиды; и способам получения этих вариантов.
Данное изобретение относится также к конъюгатам или ассоциатам, содержащим этот вариантный альбумин или его фрагмент в соответствии с этим изобретением и терапевтически полезную часть, или к слитому полипептиду, содержащему вариантный альбумин или его фрагмент этого изобретения и слитый полипептид-ассоциат.
Это изобретение дополнительно относится к композициям, содержащим этот вариантный альбумин, его фрагмент, слитый полипептид, содержащий вариантный альбумин или его фрагмент, или конъюгат, содержащий этот вариантный альбумин или его фрагмент, в соответствии с этим изобретением, или ассоциат, содержащий этот вариантный альбумин или его фрагмент, в соответствии с этим изобретением. Эти композиции предпочтительно являются фармацевтическими композициями.
Это изобретение дополнительно относится к фармацевтической композиции, содержащей вариантный альбумин, его фрагмент, слитый полипептид, содержащий вариантный альбумин или его фрагмент или конъюгат, содержащий вариантный альбумин или его фрагмент, или ассоциат, содержащий вариантный альбумин или его фрагмент.
Это изобретение относится также к применению этих вариантов, фрагментов, слитых полипептидов, конъюгатов, ассоциатов, наночастиц и микрочастиц.
Это изобретение относится также к способу получения варианта альбумина, его фрагмента, слитого полипептида, содержащего вариантный альбумин или его фрагмент или конъюгата, содержащего вариантный альбумин или его фрагмент, или ассоциата, содержащего вариантный альбумин или его фрагмент.
Краткое описание чертежей
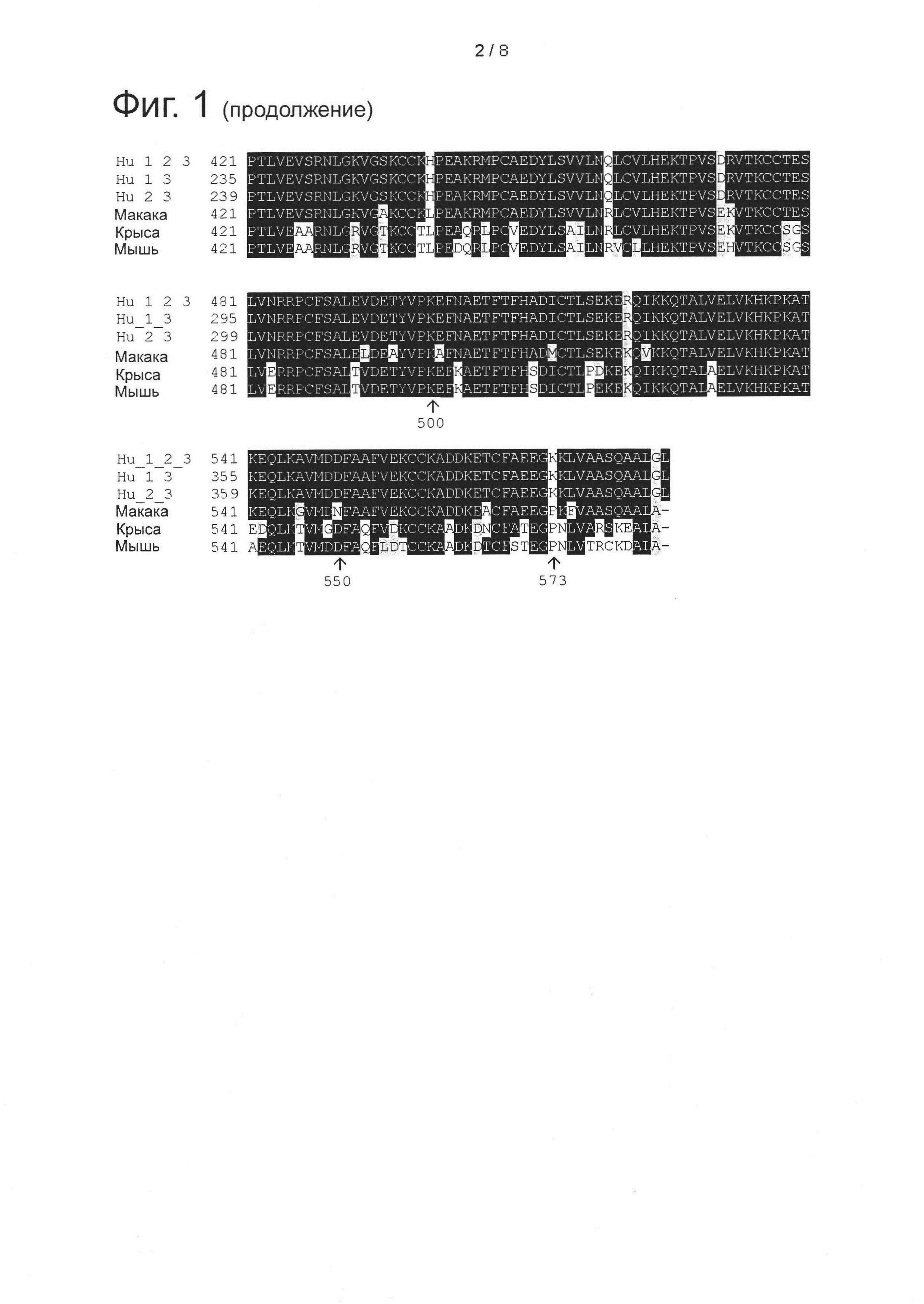
Фигура 1: Множественное выравнивание аминокислотных последовательностей (i) полноразмерного зрелого HSA (Hu_1_2_3), (ii) варианта альбумина, содержащего домен I и домен III HSA (Hu_1_3), (iii) варианта альбумина, содержащего домен II и домен III HSA (Hu_2_3), (iv) полноразмерного альбумина Масаса mulatta (Mac_mul), (v) полноразмерного альбумина Rattus norvegicus (Крысы) и (vi) полноразмерного альбумина Mus musculus (Мыши). Положения 500, 550 и 573 (относительно полноразмерного HSA) показаны стрелками. На Фигуре 1, Домены I, II и III называются как 1, 2 и 3 (соответственно).
Фигура 2: Множественное выравнивание аминокислотных последовательностей зрелого альбумина из человека, овцы, мыши, кролика и козы и незрелых альбуминов из шимпанзе ("Chimp"), макаки, хомяка, морской свинки, крысы, коровы, лошади, осла, собаки, курицы и свиньи. Начальная и конечная аминокислоты доменов 1, 2 и 3 (как определено Dockal et al. (The Journal of Biological Chemistry, 1999, Vol. 274(41): 29303-29310)) указаны относительно зрелого альбумина человека.
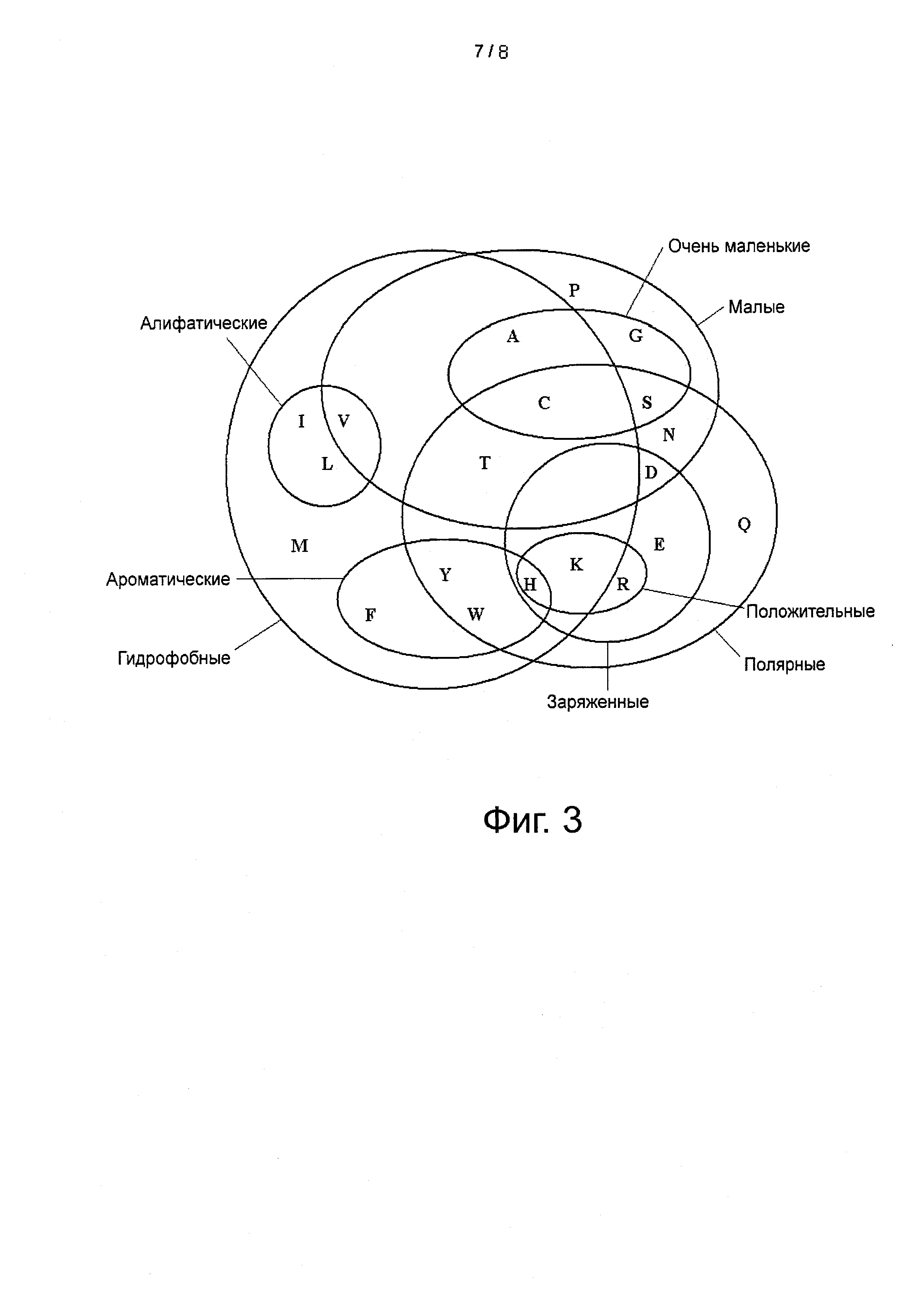
Фигура 3: Консервативные группы аминокислот на основе их свойств.
Фигура 4: Изображение модели стыковки shFcRn-HSA. (А-В) Показаны две ориентации этого комплекса. Альбумин представлен закрашенным рисунком, FcRn показан в виде ленточной диаграммы. Основная связывающая поверхность HSA выделена розовым цветом (в сером цветовом пространстве это видно как самый темный (почти черный) район; DI (CBI)), тогда как зона, дистально локализованная от поверхности взаимодействия, показана как DII (оранжевая), и DIII расщеплен на два субдомена DIIIa (по цвету, это бирюзовая) и DIIIb (по цвету, это синяя).
Определения
Вариант: Термин "вариант" обозначает полипептид, полученный из исходного альбумина с помощью одного или более (нескольких) изменений, т.е. заменой, инсерцией и/или делецией в одном или более (нескольких) положениях. Замена обозначает замещение аминокислоты, занимающей определенное положение, другой аминокислотой; деления обозначает удаление аминокислоты, занимающей это положение; и инсерция обозначает добавление 1 или более, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, предпочтительно 1-3 аминокислот непосредственно рядом с аминокислотой, занимающей это положение. В отношении замен, "непосредственно рядом", она может быть с N-стороны ('слева') или с С-стороны ('справа') от аминокислоты, занимающей это положение ('называемое аминокислотой'). Таким образом, для аминокислоты, называемой/нумеруемой 'X', инсерция может быть в положении 'X + 1' ('справа') или в положении 'X-1' ('слева').
Мутант: Термин "мутант" обозначает полинуклеотид-кодирующий вариант.
Альбумин дикого типа: Термин альбумин "дикого типа" (WT) обозначает альбумин, имеющий ту же самую аминокислотную последовательность, какая обнаруживается в природе у животного или человека.
Исходный альбумин: Термин "исходный" или "родительский" обозначает альбумин, который в дальнейшем изменяют рукой человека для получения вариантного альбумина этого изобретения.
Альбумин: Альбумины являются белками и являются наиболее представленными белками в плазме млекопитающих. Альбумины из многих видов млекопитающих были охарактеризованы биохимическими способами и/или с использованием информации о последовательности. Несколько альбуминов, например, сывороточный альбумин человека (HSA), были также охарактеризованы кристаллографически, и была определена их структура (HSA: Не ХМ, Carter DC (July 1992) "Atomic structure and chemistry of human serum albumin". Nature 358 (6383): 209-15; лошадиного альбумина: Ho, J.X. et al. (2001). X-ray и and primary structure of horse serum albumin (Equus caballus) at 0,27-nm resolution. Eur J Biochem. 215(1): 205-12).
Термин "альбумин" обозначает белок, имеющий такую же и/или очень сходную трехмерную (третичную) структуру, такую как HSA или домены HSA, и имеет сходные свойства с HSA или с релевантными доменами. Сходными трехмерными структурами являются, например, структуры альбуминов из вышеупомянутых видов. Некоторыми из основных свойств альбумина являются i) его способность регулировать объем плазмы (онкотическая активность)), ii) длительный период полужизни в плазме около 19 дней ±5 дней, iii) связывание с FcRn, iv) связывание с лигандами, например, связывание с эндогенными молекулами, такими как кислотные, липофильные соединения, включающие в себя билирубин, жирные кислоты, гемин и тироксин (см. также таблицу 1 Kragh-Hansen et al., 2002, Biol. Pharm. Bull. 25, 695, включенную здесь посредством ссылки), v) связывание малых органических соединений с кислотными или электроотрицательными признаками, например, лекарственными средствами, такими как варфарин, диазепам, ибупрофен и паклитаксел (см. также таблицу 1 Kragh-Hansen et al., 2002, Biol. Pharm. Bull. 25, 695, включенную здесь посредством ссылки). Не все из этих свойств должны быть выполнены для отнесения белка или фрагмента, к альбуминам. Например, если фрагмент не содержит домена, ответственного за связывание определенных лигандов или органических соединений, нельзя ожидать, что вариант такого фрагмента будет иметь эти свойства.
Альбумины имеют обычно длительный период полужизни в плазме приблизительно 20 дней или более длительный, например, HSA имеет период полужизни в плазме 19 дней. Известно, что этот длительный период полужизни HSA в плазме опосредован взаимодействием с его рецептором FcRn, однако, понимание или знание точного механизма, этого длительного периода полужизни HSA не является существенным для этого изобретения.
В качестве примеров альбуминовых белков, более конкретно альбуминовых белков, которые могут быть использованы как родительский 'каркас' в качестве исходной точки для получения вариантов альбумина в соответствии с этим изобретением, могут быть упомянуты человеческий сывороточный альбумин (например, ААА98797 или Р02768-1, SEQ ID NO: 2 (зрелый), SEQ ID NO: 4 (незрелый)), сывороточный альбумин приматов, (такой как альбумин сыворотки шимпанзе) (например, предсказанная последовательность ХР_517233.2 SEQ ID NO: 5), сывороточный альбумин гориллы или сывороточный альбумин макаки (например, NP_001 182578, SEQ ID NO: 6), сывороточный альбумин грызуна (такой как сывороточный альбумин хомяка (например, A6YF56, SEQ ID NO: 7), сывороточный альбумин морской свинки (например, Q6WDN9-1, SEQ ID NO: 8), сывороточный альбумин мыши (например, ААН49971 или Р07724-1 Version 3, SEQ ID NO: 9) и сывороточный альбумин крысы (например, ААН85359 или Р02770-1 Version 2, SEQ ID NO: 10))), бычий сывороточный альбумин (например, сывороточный альбумин коровы Р02769-1, SEQ ID NO: 11), сывороточный альбумин лошадей, такой как сывороточный альбумин лошади (например, Р35747-1, SEQ ID NO: 12) или сывороточный альбумин осла (например, Q5XLE4-1, SEQ ID NO: 13), сывороточный альбумин кролика (например, Р49065-1 Version 2, SEQ ID NO: 14), сывороточный альбумин козы (например, ACF10391, SEQ ID NO: 15), сывороточный альбумин овцы (например, Р14639-1, SEQ ID NO: 16), сывороточный альбумин собаки (например, Р49822-1, SEQ ID NO: 17), сывороточный альбумин курицы (например, Р19121-1 Version 2, SEQ ID NO: 18) и сывороточный альбумин свиньи (например, Р08835-1 Version 2, SEQ ID NO: 19) или полипептид, имеющий по меньшей мере 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или по меньшей мере 99%-ную идентичность аминокислотной последовательность с аминокислотной последовательностью альбумина. Исходным или эталонным альбумином может быть искусственный вариант, такой как HSA K573P (SEQ ID NO: 3) или химерный альбумин, такой как N-конец HSA -С-конец альбумина макаки (SEQ ID NO: 20), N-конец HSA - С-конец альбумина мыши (SEQ ID NO: 21), N-конец HSA - С-конец альбумина кролика (SEQ ID NO: 22), N-конец HSA - С-конец альбумина овцы (SEQ ID NO: 23).
Другие примеры альбумина, которые могут быть также включены в объем этой заявки, включают в себя овальбумин (например, Р01012.pro: альбумин курицы; 073860.pro: овальбумин индейки.
HSA, представленный SEQ ED NO: 2, или любой его встречающийся в природе аллель, является предпочтительным исходным альбумином в соответствии с этим изобретением. HSA является белком, состоящим из 585 аминокислотных остатков и имеет молекулярную массу 67 кДа. В своей природной форме он не является гликозилированным. Квалифицированному в данной области специалисту будет понятно, что могут существовать природные аллели, имеющие по существу те же самые свойства, что и HSA, но имеющие одно или более (несколько) изменений аминокислотных остатков в сравнении с SEQ ID NO: 2, и авторы этого изобретения подразумевают также использование таких природных аллелей в качестве исходного альбумина в соответствии с этим изобретением.
Этот исходный альбумин, его фрагмент или альбуминовая часть слитого полипептида, содержащего альбумин или его фрагмент по этому изобретению, предпочтительно имеет последовательности, которые идентичны последовательности HSA, представленной в SEQ ID NO: 2, по меньшей мере на 60%, предпочтительно по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, предпочтительно по меньшей мере на 86%, предпочтительно по меньшей мере на 87%, предпочтительно по меньшей мере на 88%, предпочтительно по меньшей мере на 89%, предпочтительно по меньшей мере на 90%, предпочтительно по меньшей мере на 91%, предпочтительно по меньшей мере на 92%, предпочтительно по меньшей мере на 93%, предпочтительно по меньшей мере на 94%, предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98% и наиболее предпочтительно по меньшей мере на 99%. Предпочтительно, чтобы исходный альбумин сохранял по меньшей мере одно из основных свойств альбумина или сходную третичную структуру, как у альбумина, такого как HSA. Идентичность последовательности может быть по всей длине SEQ ID NO: 2 или по молекуле, состоящей из фрагмента или содержащей фрагмент, такой как один или более (несколько) доменов SEQ ID NO: 2, такой как молекула, состоящая из домена III или содержащая домен III (например, SEQ ID NO: 27), молекула, состоящая из домена II и домена III или содержащая домен II и домен III (например, SEQ ID NO: 25), молекула, состоящая из домена I или домена III или содержащая домен I и III, (например, SEQ ID NO: 24), молекула, состоящая из двух копий домена III или содержащая две копии домена III (например, SEQ ID NO: 26), молекула, состоящая из трех копий домена III или содержащая три копии домена III (например, SEQ ID NO: 28) или молекула, состоящая из домена I и двух копий домена III, или содержащая домен I и две копии домена III (например, SEQ ID NO: 29).
Исходный альбумин предпочтительно содержит аминокислотную последовательность или состоит из аминокислотной последовательности SEQ ID NO: 4 (незрелой последовательности HSA) или SEQ ID NO: 2 (зрелой последовательности HSA).
В другом варианте осуществления, этим исходным альбумином является аллельный вариант зрелого полипептида SEQ ID NO: 2.
Этот исходный альбумин может быть кодирован полинуклеотидом, который гибридизуется в условиях очень низкой жесткости, в условиях низкой жесткости, в условиях средней жесткости, в условиях средней-высокой жесткости, в условиях высокой жесткости или в условиях очень высокой жесткости, с (i) последовательностью, кодирующей зрелый полипептид SEQ ID NO: 1 или (ii) полноразмерной комплементарной цепью (i) (J. Sambrook, E.F. Fritsch, and T. Maniatis, 1989, Molecular Cloning, A Laboratory Manual, 2d edition, Cold Spring Harbor, New York).
Полинуклеотид SEQ ID NO: 1 или его подпоследовательности, а также аминокислотная последовательность SEQ ID NO: 2 или ее фрагмент, могут быть использованы для конструирования нуклеиновокислотных зондов для идентификации и клонирования ДНК, кодирующей исходный альбумин из различных родов или видов в соответствии со способами, хорошо известными в данной области. В частности, такие зонды могут быть использованы для гибридизации с геномной или кДНК представляющего интерес рода или вида, с использованием стандартных процедур Саузерн-блоттинга, для идентификации и выделения соответствующего гена в нем. Такие зонды могут быть значительно более короткими, чем вся последовательность, но должны быть по меньшей мере 14, например, по меньшей мере 25, по меньшей мере 35 или по меньшей мере 70 нуклеотидов в длину. Предпочтительно, зонд нуклеиновой кислоты имеет по меньшей мере 100 нуклеотидов в длину, например, по меньшей мере 200 нуклеотидов, по меньшей мере 300 нуклеотидов, по меньшей мере 400 нуклеотидов, по меньшей мере 500 нуклеотидов, по меньшей мере 600 нуклеотидов, по меньшей мере 700 нуклеотидов, по меньшей мере 800 нуклеотидов или по меньшей мере 900 нуклеотидов в длину. Могут быть использованы как ДНК-зонды, так и РНК-зонды. Эти зонды являются обычно мечеными для детектирования соответствующего гена (например, с32Р,3Н,35S, биотином или биотином или авидином). Такие зонды включены в это изобретение.
Библиотека геномной ДНК или кДНК, приготовленная из таких других организмов может быть подвергнута скринингу, чтобы найти ДНК, которая гибридизуется с вышеописанными зондами и кодирует исходный альбумин. Геномная или другая ДНК из таких других организмов могут быть разделены электрофорезом в агарозном или полиакриламидном геле или другими способами разделения. ДНК из этих библиотек или выделенная ДНК могут быть перенесены или могут быть иммобилизованы на нитроцеллюлозе или другом подходящем материале-носителе. Для идентификации клона или ДНК, которые являются гомологичными SEQ ID NO: 1 или ее подпоследовательности, этот материал-носитель используют в Саузерн блоте.
Для целей этого изобретения, гибридизация означает, что полинуклеотид гибридизируется с меченым нуклеотидным зондом, соответствующим полинуклеотиду, представленному в SEQ ID NO: 1, его комплементарной цепью или ее подпоследовательностью, в условиях от пониженной до повышенной жесткости. Молекулы, с которыми гибридизуется зонд, могут быть детектированы, например, с использованием рентгеновской пленки или любого другого способа детектирования, известного в данной области.
Этот зонд нуклеиновой кислоты может содержать или состоять из кодирующей зрелый полипептид последовательности SEQ ID NO: 1, т.е. нуклеотидов 1-1785 SEQ ID NO: 1. Этот зонд нуклеиновой кислоты может содержать полинуклеотид или состоять из полинуклеотида, который кодирует полипептид SEQ ID NO: 2 или его фрагмент.
Для длинных зондов по меньшей мере из 100 нуклеотидов в длину, условия пониженной-повышенной жесткости определяются как пре-гибридизация и гибридизация при 42°C in 5Х SSPE, 0,3% SDS, 200 микрограмм/мл обработанной ферментами и денатурированной ДНК спермы лосося, и либо 25% формамида для сильно пониженной и пониженной жесткости, 35% формамида для средней и средней-повышенной жесткости, либо 50% формамида для повышенной и очень высокой жесткости, согласно стандартным процедурам блоттинга по Саузерну в течение 12-24 часов оптимально. Этот материал-носитель затем промывают три раза, в каждом случае в течение 15 минут с использованием 2Х SSC, 0,2% SDS при 45°C (сильно пониженная жесткость), 50°C (пониженная жесткость), 55°C (средняя жесткость), 60°C (средняя-повышенная жесткость), 65°C (повышенная жесткость), или 70°C (высокая жесткость).
Для коротких зондов, которые имеют длину приблизительно 15 нуклеотидов - приблизительно 70 нуклеотидов, условия жесткости определяются как пре-гибридизация и гибридизация при приблизительно 5°C - приблизительно 10°C ниже рассчитанной Tm, с использованием вычисления согласно Bolton and McCarthy (1962, Proc. Natl. Acad. Sci. USA 48: 1390) в 0,9 M NaCI, 0,09 M Tris-HCl pH 7,6, 6 мМ ЭДТА, 0,5% NP-40, 1 X растворе Денхардта, 1 мМ пирофосфате натрия, 1 мМ одноосновном фосфате натрия, 0,1 мМ АТФ и 0,2 мг дрожжевой РНК на мл с использованием стандартных процедур блоттинга по Саузерну в течение 12-24 часов оптимально. Наконец этот материал-носитель промывают один раз в 6Х SCC плюс 0,1% SDS в течение 15 минут и два раза, каждый, с использованием 6Х SSC при 5°C-10°C ниже рассчитанной Tm.
Этот исходный материал может быть кодирован полинуклеотидом с идентичностью последовательности относительно кодирующей последовательности зрелого полипептида SEQ ID NO: 1 по меньшей мере 60%, например, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или по меньшей мере 100%, который кодирует полипептид, который способен функционировать в качестве альбумина. В одном варианте осуществления, этот исходный альбумин кодируется полинуклеотидом, содержащим SEQ ID NO: 1 или состоящим из SEQ ID NO: 1.
Альбуминовая часть: Альбуминовая часть слитого полипептида, конъюгата, ассоциата, наночастицы или композиции, содержащей альбуминовый вариант или его фрагмент по данному изобретению, может называться 'альбуминовой частью' или 'альбуминовым компонентом'. Полипептид по этому изобретению может содержать альбуминовую часть или состоять из альбуминовой части.
FcRn и shFcRn: Термин "FcRn" обозначает неонатальный Fc-рецептор человека (FcRn). shFcRn является растворимой рекомбинантной формой FcRn. hFcRn является гетеродимером SEQ ID NO: 30 (укороченной тяжелой цепью главного комплекса гистосовместимости класса 1-подобного Fc-рецептора (FCGRT)) и SEQ ID NO: 31 (бета-2-микроглобулина). Вместе, SEQ ID NO: 30 и 31 образуют hFcRn.
Выделенный вариант: Термин "выделенный вариант" обозначает вариант, находящийся в форме или среде, в которой он не встречается в природе. Неограничивающие примеры выделенных вариантов включают в себя (1) любой не встречающийся в природе вариант, (2) любой вариант, который является по меньшей мере частично отделенным от одного или более (несколько) или всех природно-встречающихся компонентов, с которыми он ассоциирован в природе; (3) любой вариант, модифицированный по сравнению с полипептидом, из которого он произведен (например, встречающегося в природе полипептида) рукой человека; или (4) любой вариант, модифицированный путем увеличения количества этого варианта относительно других компонентов, с которыми он ассоциирован в природе (например, множественные копии гена, кодирующего это вещество; применение более сильного промотора, чем промотор этого гена в природе). Выделенный вариант может присутствовать в образце ферментационного бульона.
По существу чистый вариант: Термин "по существу чистый вариант" обозначает препарат, который содержит самое большее 10%, самое большее 8%, самое большее 6%, самое большее 5%, самое большее 4%, самое большее 3%, самое большее 2%, самое большее 1% и самое большее 0,5% по массе другого полипептидного материала, с которым ассоциирован в природе или вследствие рекомбинантного получения. Предпочтительно этот вариант является по меньшей мере на 92% чистым, например, по меньшей мере на 94% чистым, по меньшей мере на 95% чистым, по меньшей мере на 96% чистым, по меньшей мере на 97% чистым по меньшей мере на 98% чистым, по меньшей мере на 99% чистым, по меньшей мере на 99,5% чистым и на 100% чистым по массе всего полипептидного материала, присутствующего в этом препарате. Чистота может быть определена с использованием электрофореза SDS-PAGE или GP-HPLC. Эти варианты данного изобретения предпочтительно находятся по существу в чистой форме. Это может выполняться, например, приготовлением этого варианта хорошо известными рекомбинантными способами и способами очистки.
Зрелый полипептид: Термин "зрелый полипептид" обозначает полипептид в его конечной форме после трансляции и любых посттрансляционных модификаций, таких как N-концевой процессинг, C-концевое укорочение, гликозилирование, фосфорилирование и т.д. Этот зрелый полипептид может быть, например, аминокислотами 1-585 SEQ ID NO: 2, с включением изменений в соответствии с данным изобретением и/или посттрансляционных модификаций.
Последовательность, кодирующая зрелый полипептид: Термин "последовательность, кодирующая зрелый полипептид" обозначает полинуклеотид, который кодирует зрелый полипептид альбумина. Эта последовательность, кодирующая зрелый полипептид, может быть нуклеотидами 1-1758 SEQ ID NO: 1, например, с изменениями, необходимыми для кодирования варианта по этому изобретению.
Идентичность последовательности:
Родство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается параметром "идентичность последовательности".
Для целей данного изобретения, идентичность последовательности между двумя аминокислотными последовательностями определяют с использованием алгоритма Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), обеспеченного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 5,0,0 или более поздней. Этими используемыми параметрами являются штраф за открытый гэп 10, штраф за удлиненный гэп 0,5 и подстановочная матрица EBLOSUM62 (EMBOSS версия BLOSUM62). Результат Needle обозначенный "самой длинной идентичности" (полученной с использованием опции - nobrief) используют в качестве процентна идентичности и вычисляют следующим образом:
(Идентичные Остатки × 100)/(Длина Выравнивания - Общее Количество Гэпов в Выравнивании)
Для целей данного изобретения, идентичность последовательности между двумя дезоксирибонуклеотидными последовательностями определяют с использованием алгоритма Needleman-Wunsch (Needleman and Wunsch, 1970, supra), обеспеченного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, supra), предпочтительно версии 5,0,0 или более поздней. Этими используемыми параметрами являются штраф за открытый гэп 10, штраф за удлиненный гэп 0,5, и подстановочная матрица EDNAFULL (EMBOSS version of NCBI NUC4.4). Результат Needle обозначенный "самой длинной идентичности" (полученной с использованием опции - nobrief) используют как процент идентичности и вычисляют следующим образом:
(Идентичные Остатки × 100)/(Длина Выравнивания - Общее Количество Гэпов в Выравнивании)
Фрагмент: Термин "фрагмент" обозначает полипептид, в котором одна или более (несколько) аминокислот делетированы с амино и/или карбокси-конца альбумина и/или из внутреннего района альбумина, но который сохраняет способность связываться с FcRn. Фрагменты могут состоять из одной непрерываемой последовательности, полученной из HSA, или может содержать две или более последовательности, полученные из HSA. Эти фрагменты по данному изобретению имеют размер, больший, чем приблизительно 20 аминокислотных остатков, предпочтительно больший, чем 30 аминокислотных остатков, предпочтительно больший, чем 40 аминокислотных остатков, более предпочтительно больший, чем 50 аминокислотных остатков, больший, чем 75 аминокислотных остатков, более предпочтительно больший, чем 100 аминокислотных остатков, предпочтительно больший, чем 200 аминокислотных остатков, более предпочтительно больший, чем 300 аминокислотных остатков, даже более предпочтительно больший, чем 400 аминокислотных остатков и наиболее предпочтительно больший, чем 500 аминокислотных остатков. Фрагмент может содержать или состоять из одного или более доменов альбумина, таких как DI + DII, DI + DIII, DII + DIII, DIII + DIII, DI + DIII + DIII, DIII + DIII + DIII, или фрагментов таких доменов или комбинации доменов.
Домены I, II и III могут быть определены со ссылкой на HSA (SEQ ID NO: 2). Например, домен I HSA может состоять или содержать аминокислоты 1-194 (±1-15 аминокислот) SEQ ID NO: 2, домен HSA II может состоять или содержать аминокислоты 192 (±1-15 аминокислот) - 387 (±1-15 аминокислот) SEQ ID NO: 2 и домен III может состоять или содержать аминокислотные остатки 381 (±1-15 аминокислотных остатков) - 585 (±1-15 аминокислотных остатков) SEQ ID NO: 2. "±1-15 аминокислот" обозначает, что количество остатков может отклоняться на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот относительно С-конца и/или N-конца установленного положения аминокислоты. Примеры доменов I, II и III описаны Dockal et al. (The Journal of Biological Chemistry, 1999, Vol. 274(41): 29303-29310) и Kjeldsen et al. (Protein Expression and Purification, 1998, Vol 13: 163-169) и представлены в таблицах ниже.

Квалифицированный в данной области специалист может идентифицировать домены I, II и III в альбуминах не человека путем выравнивания их аминокислотной последовательности с HSA, например, с использованием алгоритма Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), обеспеченного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 3,0,0 или более поздней. Предпочтительно используемыми параметрами выравнивания являются штраф за открытый гэп 10, штраф за удлиненный гэп 0,5 и подстановочная матрица EBLOSUM62 (EMBOSS версия BLOSUM62). Другая подходящая программа включает в себя MUSCLE ((Multiple sequence comparison by log-expectation, Robert C. Edgar, Version 3.6, http://www.drive5.com/muscle; Edgar (2004) Nucleic Acids Research 32(5), 1792-97 и Edgar (2004) BMC Bioinformatics, 5(1): 113), которая может быть использована с установками по умолчанию, как описано в User Guide (Version 3.6, September 2005). Версии MUSCLE, более поздние, чем 3,6, могут быть также использованы для любого аспекта этого изобретения. Примеры подходящих выравниваний представлены на Фигурах 1 и 2.
Предпочтительным является то, что домены имеют по меньшей мере 70, 75, 80, 85, 90, 95, 96, 97, 98, 99, 99,5%-ную или 100%-ную идентичность относительно Доменов I, II или III HSA (SEQ ID NO: 2).
Аллельный вариант: Термин "аллельный вариант" обозначает любую из двух или более альтернативных форм гена, занимающего один и тот же хромосомный локус. Аллельная вариация возникает в природе вследствие мутаций и может приводить к полиморфизму в популяциях. Мутации генов могут быть молчащими (нет изменений в кодируемом полипептиде) или могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельный вариант полипептида является полипептидом, кодируемым аллельным вариантом гена.
Кодирующая последовательность: Термин "кодирующая последовательность" обозначает полинуклеотид, который непосредственно определяет аминокислотную последовательность транслируемого с него полипептидного продукта. Границы этой кодирующей последовательности обычно определяются открытой рамкой считывания, которая обычно начинается со стартового кодона ATG или иного стартового кодона, такого как GTG и TTG и заканчивается стоп-кодоном, таким как ТАА, TAG и TGA. Этой кодирующей последовательностью может быть ДНК, кДНК, синтетический или рекомбинантный полинуклеотид.
кДНК: Термин "кДНК" обозначает молекулу ДНК, которая может быть получена обратной транскрипцией из зрелой сплайсированной молекулы мРНК из эукариотической клетки. кДНК лишена интронных последовательностей, которые могут присутствовать в соответствующих геномных ДНК. Этот начальный, РНК-транскрипт является предшественником мРНК, который процессируется через ряд стадий, включающих в себя сплайсинг, перед появлением в качестве зрелой сплайсированной мРНК.
Конструкция нуклеиновой кислоты: Термин "конструкция нуклеиновой кислоты" обозначает молекулу нуклеиновой кислоты, либо одноцепочечную, либо двухцепочечную, которая выделена из встречающегося в природе гена или модифицирована так, чтобы содержать сегменты нуклеиновых кислот, не существующие в естественной среде или которые являются синтетическими. Термин конструкция нуклеиновой кислоты является синонимом с термином "экспрессионная кассета", когда эта конструкция нуклеиновой кислоты содержит регуляторные последовательности, необходимые для экспрессии кодирующей последовательности этого изобретения.
Регуляторные последовательности: Термин "регуляторные последовательности" обозначает все последовательности нуклеиновых кислот, необходимые для экспрессии полинуклеотида, кодирующего вариант этого изобретения. Каждая регуляторная последовательность может быть нативной (т.е. из того же гена) или чужеродной (т.е. из другого гена) относительно полинуклеотида, кодирующего вариант, или нативной или чужеродной относительно друг друга. Такие регуляторные последовательности включают в себя, но не ограничиваются ими, лидер, последовательность полиаденилирования, пропептидную последовательность, промотор, сигнальную пептидную последовательность и терминатор транскрипции. Как минимум, эти регуляторные последовательности включают в себя промотор и стоп-сигналы транскрипции и трансляции. Эти регуляторные последовательности могут быть соединены линкерами для введения специфических сайтов рестрикции, облегчения лигирования регуляторных последовательностей с кодирующим районом полинуклеотида, кодирующего вариант.
Функционально связанные: Термин "функционально связанные" обозначает конфигурацию, в которой регуляторная последовательность помещена в подходящем положении относительно кодирующей последовательности полинуклеотида, так что эта регуляторная последовательность управляет экспрессией этой кодирующей последовательности.
Экспрессия: Термин "экспрессия" включает в себя любую стадию, участвующую в продуцировании варианта, в том числе, но не только, транскрипцию, посттранскрипционную модификацию, трансляцию и секрецию.
Экспрессирующий вектор: Термин "экспрессирующий вектор" обозначает линейную или кольцевую молекулу ДНК, которая содержит полинуклеотид, кодирующий вариант, и функционально связана с регуляторными последовательностями, которые обеспечивают его экспрессию.
Клетка-хозяин: Термин "клетка-хозяин" обозначает любой тип клеток, который является восприимчивым к трансформации, трансфекции, трансдукции или т.п. конструкцией нуклеиновой кислоты или экспрессирующим вектором, содержащим полинуклеотид данного изобретения. Термин "клетка-хозяин" включает в себя любое потомство, которое не является идентичным относительно исходной клетки вследствие мутаций, которые встречаются во время репликации.
Период полужизни в плазме: Период полужизни в плазме в идеале определяется in vivo в подходящих индивидуумах. Однако, поскольку это является трудоемким и дорогостоящим и неизбежно возникновение этических проблем, связанных с проведением экспериментов на животных или людях, желательно использовать способ in vitro для определения, является ли период полужизни в плазме увеличенным или уменьшенным. Известно, что связывание альбумина с его рецептором FcRn является важным для периода полужизни в плазме, и корреляция между связыванием альбумина с его рецептором и периодом полужизни в плазме такова, что более высокая аффинность связывания альбумина с его рецептором приводит к более продолжительному периоду полужизни в плазме. Таким образом, для этого изобретения более высокая аффинность связывания альбумина с FcRn считается показателем увеличенного периода полужизни в плазме, и более низкая аффинность связывания альбумина с его рецептором считается показателем уменьшенного периода полужизни в плазме.
В этой заявке и формуле изобретения связывание альбумина с его рецептором FcRn описано с использованием термина аффинности и выражений "более сильная" или "более слабая". Таким образом, должно быть понятно, что молекула, имеющая более высокую аффинность связывания с FcRn, чем HSA, рассматривается как связывающаяся сильнее с FcRn, чем HSA, и молекула, имеющая более низкую аффинность связывания с FcRn, чем HSA, рассматривается как связывающаяся слабее с FcRn, чем HSA.
Понятно, что термины "более длинный период полужизни в плазме" или "более короткий период полужизни в плазме" следует понимать как относительно соответствующего периода у исходного альбумина. Таким образом, более длинный период полужизни в плазме означает, что этот вариант имеет более длинный период полужизни в плазме, чем соответствующий альбумин, имеющий те же самые последовательности, за исключением изменения (изменений), описанных здесь, например, при двух или более положениях, соответствующих 492, 550, 573, 574 и 580 HSA (SEQ ID NO: 2).
Эталон: эталоном является альбумин, слияние, конъюгат, композиция, ассоциат или наночастица, с которой сравнивают вариант альбумина, слияние, конъюгат, композицию, ассоциат или наночастицу. Этот эталон может содержать или может состоять из полноразмерного альбумина (такого как HSA или его природный аллель) или его фрагмента. Эталоном может также называться 'соответствующий' альбумин, слитый белок, конъюгат, композиция, ассоциат или наночастица, с которыми сравнивают вариант альбумина, слитый белок, конъюгат, композицию, ассоциат или наночастицу. Эталон может содержать или может состоять из HSA (SEQ ID NO: 2) или фрагмента, слияния, конъюгата, ассоциата, наночастицы или микрочастицы. Предпочтительно, эталон является идентичным полипептиду, слитому полипептиду, конъюгату, композиции, ассоциату, наночастице или микрочастице в соответствии с этим изобретением ("исследуемых") за исключением альбуминовой части. Предпочтительно альбуминовая часть этого эталона содержит альбумин или состоит из альбумина (например, HSA, SEQ ID NO: 2) или его фрагмента. Аминокислотная последовательность альбуминовой части этого эталона может быть более длинной, чем, более короткой, чем, или, предпочтительно такой же самой (±1-15 аминокислот) длины, что и амино-последовательность альбуминовой части этого полипептида, слитого полипептида, конъюгата, композиции, ассоциата, наночастицы или микрочастицы, в соответствии с этим изобретением ("который исследуют").
Эквивалентные положения аминокислот: На протяжении этого описания положения аминокислот определяют относительно полноразмерного зрелого сывороточного альбумина человека (т.е. без лидерной последовательности, SEQ ID NO: 2). Однако, квалифицированному в данной области специалисту понятно, что это изобретение относится также к вариантам альбуминов не человека (например, тех, которые описаны здесь) и/или фрагментам альбуминов человека или не человека. Эквивалентные положения могут быть идентифицированы во фрагментах сывороточного альбумина человека, в альбуминах животных и во фрагментах, слияниях и других производных или их вариантах путем сравнения аминокислотных последовательностей с использованием попарных (например, ClustalW) или множественных (например, MUSCLE) выравниваний. Например, Фиг. 1 показывает, что положения, эквивалентные 500, 550 и 573 в полноразмерном сывороточном альбумине легко идентифицируются во фрагментах сывороточного альбумина человека и в альбуминах других видов. Положения 500, 550 и 573 указаны стрелками. Дополнительные детали обеспечены в Таблице 1 ниже.


Фиг. 1 создавали посредством MUSCLE с использованием параметров по умолчанию, включающих в себя выход в формате ClustalW 1,81. Данные необработанного выхода окрашивали с использованием BoxShade 3,21 (http://www.ch.embnet.org/sofrware/BOX form.html) с использованием Формата Output: RTF_new; Размер шрифта: 10; Линия Консенсуса: без линии консенсуса; Фракция последовательностей (которая должна быть затенена): 0,5; Формат ввода последовательности: ALN. Таким образом, на протяжении этого описания положения аминокислот, определенные в сывороточном альбумине человека, также применяют при описании эквивалентных положения во фрагментах, производных или вариантах или слияниях сывороточного альбумина человека, животных других видов и их фрагментов и слияний. Такие эквивалентные положения могут иметь (i) иное положение остатка в их нативном белке и/или (ii) другую аминокислоту в нативном белке.
Подобным образом, на Фиг 2 показано, что эквивалентные положения могут быть идентифицированы во фрагментах (например, доменах) альбумина со ссылкой на SEQ ID NO: 2 (HSA).
Правила обозначения вариантов
Для целей данного изобретения, зрелый полипептид, раскрытый в SEQ ID NO: 2, используют для определения соответствующего аминокислотного остатка в другом альбумине. Эту аминокислотную последовательность другого альбумина выравнивают со зрелым полипептидом, раскрытым в SEQ ID NO: 2, и основываясь на этом выравнивании определяют номер положения аминокислоты, соответствующий любому аминокислотному остатку в зрелом полипептиде, раскрытом в SEQ ID NO: 2, что делают с использованием алгоритма Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), обеспеченного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 5.0.0 или более поздней. Используемыми параметрами являются штраф за открытый гэп 10, штраф за удлиненный гэп 0,5 и подстановочная матрица EBLOSUM62 (EMBOSS версия BLOSUM62).
Идентификация соответствующего аминокислотного остатка в другом альбумине может быть определена или подтверждена выравниванием множества полипептидных последовательностей с использованием нескольких компьютерных программ, включающих в себя, но не ограничивающихся ими, MUSCLE (сравнение множественных последовательностей log-ожиданием; версии 3,5 или более поздней; Edgar, 2004, Nucleic Acids Research 32: 1792-1797), MAFFT (версии 6,857 или более поздней; Katoh и Kuma, 2002, Nucleic Acids Research 30: 3059-3066; Katoh et al., 2005, Nucleic Acids Research 33: 511-518; Katoh and Toh, 2007, Bioinformatics 23: 372-374; Katoh et al., 2009, Methods in Molecular Biology 537:_39-64; Katoh and Toh, 2010, Bioinformatics 26:_1899-1900), и EMBOSS EMMA, использующую ClustalW (1,83 или более позднюю; Thompson et al., 1994, Nucleic Acids Research 22: 4673-4680), с использованием их соответствующих параметров по умолчанию.
Когда другой полипептид (или белок) отличается от зрелого полипептида SEQ ID NO: 2, так что традиционное сравнение последовательностей не может детектировать их сходства (Lindahl and Elofsson, 2000, J. Mol. Biol. 295: 613-615), могут быть использованы другие алгоритмы попарного сравнения последовательностей. Можно достичь более высокой чувствительности поиска на основании последовательностей с использованием программ поиска, которые применяют вероятностные представления семейства полипептидов (профили) для поиска в базах данных. Например, программа PSI-BLAST генерирует профили через итерационный поиск в базах данных и способна детектировать отдаленные гомологи (Atschul et al., 1997, Nucleic Acids Res. 25: 3389-3402). Еще более высокой чувствительности можно добиться, если семейство или суперсемейство полипептида имеет одного или нескольких представителей в базах данных белковых структур. Программы, такие как «GenTHREADER» (Jones, 1999, J. Mol. Biol. 287: 797-815; McGuffin and Jones, 2003, Bioinformatics 19: 874-881) используют информацию из различных источников («PSI-BLAST», предсказание вторичной структуры, профили структурного выравнивания и потенциал сольватации) на входе в нейтральную сеть, которая предсказывает сворачивание структуры для рассматриваемой последовательности. Аналогично, метод Gough et al., 2000, J. Mol. Biol. 313: 903-919, можно применить для выравнивания последовательности неизвестной структуры в моделях суперсемейств, присутствующих в базе данных SCOP. Эти выравнивания в свою очередь можно использовать для получения моделей гомологии полипептидов, и такие модели можно оценивать на предмет точности с использованием различных средств, разработанных для таких целей.
Для выявления и получения структурных выравниваний белков известной структуры доступны несколько инструментов и ресурсов. Например, было проведено структурное выравнивание суперсемейства белков SCOP и результаты выравнивания доступны для загрузки. Две или большее количество белковых структур можно выровнять с помощью различных алгоритмов, таких как матрица расстояний (Holm and Sander, 1998, Proteins 33: 88-96) или комбинаторное удлинение (Shindyalov and Bourne, 1998, Protein Engineering 11: 739-747), а осуществление этих алгоритмов можно дополнительно применять к базам данных для рассматриваемой структуры с использованием представляющей интерес структуры с целью обнаружения возможных структурных гомологов (например, Holm and Park, 2000, Bioinformatics 16: 566-567).
В описании вариантов альбумина по настоящему изобретению, номенклатура, описанная ниже, адаптирована для простоты поиска. Применяют принятые ШРАС однобуквенное или трехбуквенное сокращения названий аминокислот. Термин 'точечная мутация' и/или 'изменение' включает в себя делеции, инсерции и замены.
Замены. Для аминокислотной замены используют следующую номенклатуру: исходная аминокислота, положение, заменяющая аминокислота. Таким образом, замена треонина в положении 226 обозначается как "Thr226Ala" или "Т226А". Множественные мутации (или измерения) разделяют дополнительными метками (" + "), например, "Gly205Arg + Ser411Phe" или "G205R + S411F", характеризующих замены в положениях 205 и 411 глицина (G) аргинином (R) и серина (S) фенилаланином (F), соответственно. На Фигурах используют также знак ("/"), например, "E492T/N503D", который должен рассматриваться как взаимозаменяемый с (" + ").
Делеции. Для делеции аминокислот, используют следующую номенклатуру: Исходная аминокислота, положение*. Таким образом, деления глицина в положении 195 обозначается как "Gly195*" или "G195*". Множественные делеции разделяются дополнительными метками (" + "), например, "Gly195* +Ser411*" или "G195* +S411*".
Инсерции. Как описано выше, инсерция может быть с N-стороны ('выше', 'X-1') или с С-стороны ('ниже', 'X + 1') аминокислоты, занимающей положение ('указанной (или исходной) аминокислоты', 'X').
Для инсерции аминокислоты с С-стороны ('ниже', 'X + 1') исходной аминокислоты ('X'), используют следующую номенклатуру: Исходная аминокислота, положение, исходная аминокислота, встроенная аминокислота. Соответственно, инсерцию лизина после глицина в положении 195 обозначают "Gly195GlyLys" или "G195GK". Инсерцию множественных аминокислот обозначают [Исходная аминокислота, положение, исходная аминокислота, положение, встроенная аминокислота #1, встроенная аминокислота #2; и т.д.]. Например, инсерция лизина и аланина после глицина в положении 195 указывается как "Gly195GlyLysAla" или "G195GKA".
В таких случаях встроенные аминокислотный остаток(остатки) нумеруются путем добавления буквы нижнего регистра к положению аминокислотного остатка, предшествующего встроенному аминокислотному остатку(остаткам). В вышеупомянутом примере эта последовательность была бы такой:
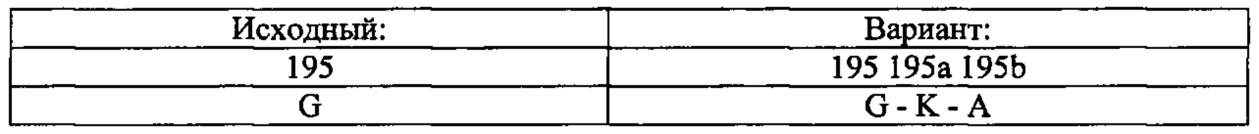
Для инсерции аминокислоты с N-стороны ('выше', 'Х-1') исходной аминокислоты (X), используют следующую номенклатуру: Исходная аминокислота, положение, встроенная аминокислота, исходная аминокислота. Соответственно, инсерцию лизина (К) перед глицином (G) в положении 195 обозначают "Gly195LysGly" или "G195KG". Инсерцию множественных аминокислот обозначают [Исходная аминокислота, положение, встроенная аминокислота #1, встроенная аминокислота #2; и т.д., исходная аминокислота]. Например, инсерция лизина (K) и аланина (А) перед глицином в положении 195 показана как "Gly195LysAlaGly" или "G195KAG". В таких случаях встроенные аминокислотный остаток(остатки) нумеруются путем добавления буквы нижнего регистра со штрихом к положению аминокислотного остатка, следующего за встроенным аминокислотным остатком(остатками). В вышеупомянутом примере эта последовательность была бы такой:

Множественные изменения. Варианты, содержащие множественные изменения, разделяют добавлением меток (" + ")» например, "Arg170Tyr + Gly195Glu" или "R170Y + G195E", что описывает замену аргинина и глицина в положениях 170 и 195 на тирозин и глутаминовую кислоту соответственно.
Различные изменения. Когда различные изменения могут вводиться в некоторое положение, эти различные изменения разделяют запятой, например, "Arg170Tyr,Glu", что описывает замену аргинина в положении 170 тирозином или глутаминовой кислотой. Таким образом, "Tyr167Gly,Ala + Arg170Gly,Ala" обозначают следующие варианты:
"Tyr167Gly + Arg170Gly", "Tyr167Gly + Arg 170А1а", "Tyr167Ala + Arg 170 Gly", и "Tyr167Ala + Arg170Ala".
Подробное описание изобретения
Данное изобретение относится к альбуминовым вариантам, содержащим изменение в двух или более положениях, выбранных из группы, состоящей из положений 492, 550, 573, 574 и 580 зрелого полипептида SEQ ID NO: 2 или эквивалентных положений в других альбуминах или их фрагментов.
Варианты
Первый аспект этого изобретения обеспечивает полипептиды, которые являются вариантами альбумина или их фрагментами, или слитыми полипептидами, содержащими вариант альбумина или его фрагмент, исходного альбумина, содержащего изменения в двух или более положениях, соответствующих положениям, выбранным из группы, состоящей из положений 492, 550, 573, 574 и 580 зрелого полипептида SEQ ID NO: 2. Предпочитается, что эти два или более изменений содержат изменения в положениях, соответствующих следующим положениям в SEQ ID NO: 2:
(a) 492 и 580; и/или
(b) 492 и 574; и/или
(c) 492 и 550; и/или
(d) 550 и 573; и/или
(e) 550 и 574; и/или
(f) 550 и 580; и/или что
(g) эти два или более изменений представляют собой:
- изменение для получения в положении, соответствующем положению 492 SEQ ID NO: 2, аминокислоты, выбранной из группы, состоящей из А, С, D, F, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, предпочтительно D, и изменение для получения в положении, соответствующем положению 573 SEQ ID NO: 2, аминокислоты, выбранной из группы, состоящей из С, D, Е, F, G, Н, I, L, М, N, Q, R, S, Т, V, W, Y, предпочтительно Y, W или Н, или
- изменение для получения в положении, соответствующем положению 492 SEQ ID NO: 2 G и изменение для получения в положении, соответствующем положению 573, А или Р и дополнительное изменение в положении, выбранном из группы, состоящей из 550, 574 и 580; и/или
(h) эти два или более изменений представляют собой:
- изменение для получения в положении, соответствующем положению 573 SEQ ID NO: 2, аминокислоты, выбранной из группы, состоящей из А, С, D, Е, F, G, Н, I, L, М, N, Q, R, S, Т, V, W, Y, предпочтительно Y, W или Н, и изменение для получения в положении, соответствующем положению 574 SEQ ID NO: 2, аминокислоты, выбранной из группы, состоящей из А, С, D, Е, F, G, Н, I, L, М, Р, Q, R, S, Т, V, W, Y, Н, D, F, G, N, S или Y, более предпочтительно Н, D, F или G, наиболее предпочтительно Н, или
- изменение для получения в положении, соответствующем положению 573 SEQ ID NO: 2, Р и изменение для получения в положении, соответствующем положению 574 SEQ ID NO: 2, и N и дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550, и 580; и/или
(i) эти два или более изменений представляют собой:
- изменение для получения в положении, соответствующем положению 573 SEQ ID NO: 2, аминокислоты выбранной из группы, состоящей из А, С, D, Е, F, G, Н, I, L, М, N, Q, R, S, Т, V, W, Y, предпочтительно Y, W или Н, и изменение для получения в положении, соответствующем положению 580 SEQ ID NO: 2, аминокислоты выбранной из группы, состоящей из С, D, Е, F, G, Н, I, L, М, N, Р, R, S, Т, V, W, Y, или
- изменение для получения в положении, соответствующей положению 573 SEQ ID NO: 2, Р и изменение для получения в положении, соответствующем положению 580 SEQ ID NO: 2, K и дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550 и 574; и/или
(j) эти два или более изменений представляют собой:
- изменение для получения в положении, соответствующем положению 574 SEQ ID NO: 2, аминокислоты выбранной из группы, состоящей из А, С, D, Е, F, G, Н, I, L, М, Р, Q, R, S, Т, V, W, Y, Н, D, F, G, N, S или Y, более предпочтительно Н, и изменение для получения в положении, соответствующем положению 580 SEQ ID NO: 2, аминокислоты выбранной из группы, состоящей из А, С, D, Е, F, G, Н, I, L, М, N, Р, R, S, Т, V, W, Y, или
- изменение для получения в положении, соответствующем положению 574 SEQ ID NO: 2, N и изменение для получения в положении, соответствующем положению 580 SEQ ID NO: 2, K и дополнительное изменение в положении, выбранном из группы, состоящей из 492,550 и 573.
Этот полипептид может содержать три или более, четыре или более, пять или более изменений, описанных в параграфах (а), (b), (с), (d), (е), (f), (g), (h), (i) и (j). Предпочтительным изменением является замена.
Предпочтительно этот исходный альбумин и/или вариантный альбумин содержит:
(a) полипептид, имеющий по меньшей мере 60%-ную идентичность последовательности со зрелым полипептидом SEQ ID NO: 2;
(b) полипептид, кодируемый полинуклеотидом, который гибридизуется в условиях низкой жесткости с (i) последовательностью, кодирующей зрелый полипептид SEQ ID NO: 1 или (ii) полноразмерным комплементом (i);
(c) полипептид, кодируемый полинуклеотидом, имеющим по меньшей мере 60%-ную идентичность кодирующей последовательности зрелого полипептида SEQ ID NO: 1; и/или
(d) фрагмент зрелого полипептида SEQ ID NO: 2.
Варианты альбумина или его фрагменты или слитые полипептиды, содержащие альбумин или его фрагменты, содержат изменения, такие как замены, делеции или инсерции в двух или более положениях, выбранных из группы, состоящей из положений 492, 550, 573, 574 и 580 зрелого полипептида SEQ ID NO: 2, или в эквивалентных положениях других альбуминов или их вариантах или фрагментах. Кроме описанных здесь изменений может быть введен стоп-кодон, который вводят в положении 574 или далее по направлению хода транскрипции (например, в SEQ ID NO: 2 его вводят в положении от положения 574 до 585).
Вариантный альбумин, его фрагмент или альбуминовая часть слитого полипептида, содержащая вариантный альбумин или его фрагмент по этому изобретению, имеет обычно идентичность последовательности относительно последовательности HSA, показанной в SEQ ID NO: 2, по меньшей мере 60%, предпочтительно по меньшей мере 70%, предпочтительно по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 96%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, и наиболее предпочтительно по меньшей мере 99%. Этот вариант имеет меньшую, чем 100%-ную, идентичность относительно SEQ ID NO: 2.
Этот вариантный альбумин, его фрагмент или альбуминовая часть слитого белка, содержащего вариантный альбумин или его фрагмент по этому изобретению, имеет обычно идентичность последовательности относительно последовательности исходного альбумина по меньшей мере 60%, предпочтительно по меньшей мере 70%, предпочтительно по меньшей мере 80%, предпочтительно по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 96%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98% и наиболее предпочтительно по меньшей мере 99%. Этот вариант имеет меньшую, чем 100%-ную идентичность, относительно последовательности исходного альбумина.
В одном аспекте, количество изменений в вариантах этого изобретения равно 1-20, например, 1-10 и 1-5, например 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 изменений относительно SEQ ID NO: 2 или относительно исходного альбумина.
В положении 492 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов), предпочтительно, это изменение является заменой, такой как замена нативной аминокислоты на А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно на G, D, F, Н, М или R, даже более предпочтительно на G или D и наиболее предпочтительно на G. В SEQ ID NO: 2 нативная аминокислота в положении 492 является Е, следовательно, замена на Е не является предпочтительной.
В положении 550 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов), предпочтительно, это изменение является заменой, такой как замена нативной аминокислоты на А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно на K, L, М, Е или R, даже более предпочтительно на K, L или М и наиболее предпочтительно на K. В SEQ ID NO: 2 нативная аминокислота в положении 550 является D, следовательно, замена на D не является предпочтительной.
В положении 573 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов), предпочтительно, это изменение является заменой, такой как замена нативной аминокислоты на А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно на Р, Y, W, Н, F, Т, I или V, даже более предпочтительно на Р, Y или W и наиболее предпочтительно на Р. В SEQ ID NO: 2 нативная кислота в положении 573 является K, следовательно, замена на К не является предпочтительной.
В положении 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов), предпочтительно, это изменение является заменой, такой как замена нативной аминокислоты на А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно на Н, G, D, F, N, S или Y, даже более предпочтительно на D, F, G или Н и наиболее предпочтительно на Н. В SEQ ID NO: 2 нативная аминокислота в положении 574 является K, следовательно, замена на K не является предпочтительной.
В положении 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов) предпочтительно это изменение является заменой, такой как замена нативной аминокислоты на А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно на К или R, наиболее предпочтительно на K. В SEQ ID NO: 2 нативная аминокислота в положении 580 является Q, следовательно, замена на Q не является предпочтительной.
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 550 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492D + 550K (например, SEQ ID NO: 231), или 492G + 550K (например, SEQ ID NO: 240).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 573 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492F + 573P (например, SEQ ID NO: 109), 492G + 573P (например, SEQ ID NO: 110), 492H + 573P (например, SEQ ID NO: 111) или 492R + 573P (например, SEQ ID NO: 113) или более предпочтительно 492D + 573P (например, SEQ ID NO: 108). Однако предпочтительно, чтобы этот вариант не состоял из SEQ ID NO: 2 только с изменениями 492G + 573A, 492G + 573A, 492G + N503K + 573A, 492G + N503H + 573A, 492G + 573P, 492G + N503K + 573P или 492G + N503H + 573P.
Вариант альбумина может содержать изменения, соответствующие положениям 492 + 574 SEQ ID NO: 2 (или эквивалентному положению других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492D + 574H (например, SEQ ID NO: 232), 492G + 574H (например, SEQ ID NO: 241) или 492D + 574H (например, SEQ ID NO: 232).
Вариант альбумина может содержать измерения в положениях, соответствующих положениям 492 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 550 + 573 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 550K + 573Р (например, SEQ ID NO: 117).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 550 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментах). Такие изменения могут содержать 550K + 574H (например, SEQ ID NO: 130), 550М + 574H (например, SEQ ID NO: 249), 550М + 574H (например, SEQ ID NO: 249) или 550L + 574H (например, SEQ ID NO: 245).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 550 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментах). Такие изменения могут содержать 550K + 580K (например, SEQ ID NO: 131), 550М + 580K (например, SEQ ID NO: 251) или 550K + 574H (например, SEQ ID NO: 251) или 550L + 580K (например, SEQ ID NO: 247).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 573 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментах). Такие изменения могут содержать 574D + 573P (например, SEQ ID NO: 121), 574F + 573P (например, SEQ ID NO: 122), 574G + 573P (например, SEQ ID NO: 123), 574H + 573P (например, SEQ ID NO: 124), 574N + 573P (например, SEQ ID NO: 125) или 574S + 573P (например, SEQ ID NO: 126). Предпочтительно, чтобы этот вариант не состоял из SEQ ID NO: 2 только с изменениями K573P + K574N + A577T + A578R + S579C + Q580K + A581 D + G584A.
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 573 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 580K + 573Р (например, SEQ ID NO: 128) или 580R + 573P (например, SEQ ID NO: 129). Однако предпочтительно, чтобы этот вариант не состоял из SEQ ID NO: 2 только с изменениями K573P + A577E + A578S + Q580K + A582T.
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 550 + 573 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492G + 550K + 573P (например, SEQ ID NO: 254) или 492D + 550K + 573P (например, SEQ ID NO: 253).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 550 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492G + 550K + 574H (например, SEQ ID NO: 255).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 550 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492D + 550K + 580K (например, SEQ ID NO: 258) или 492G + 550K + 580K (например, SEQ ID NO: 259).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 573 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492D + 573P + 574H (например, SEQ ID NO: 233).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 573 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492D + 573P + 580K (например, SEQ ID NO: 234) или 492G + 573P + 580K (например, SEQ ID NO: 242).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492D + 574H + 580K (SEQ ID NO: 262) или 492G + 574H + 580K (например, SEQ ID NO: 263).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 50 + 573 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 550K + 574H + 573Р (например, SEQ ID NO: 131), 550L + 573P + 574H (например, SEQ ID NO: 246) или 550M + 573P + 574H (например, SEQ ID NO: 250).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 550 + 573 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 550L + 573P + 580K (например, SEQ ID NO: 248) или 550М + 573Р + 580K (например, SEQ ID NO: 252).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 550 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 573 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 574H + 580K + 573Р (например, SEQ ID NO: 135).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 550 + 573 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492G + 550K + 573P + 574H (например, SEQ ID NO: 257) или 492D + 550K + 573P + 574H (например, SEQ ID NO: 256).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 550 + 573 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492D + 550K + 573P + 580K (например, SEQ ID NO: 260) или 492G + 550K + 573P + 580K (например, SEQ ID NO: 261).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 550 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 573 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492D + 573P + 574H + 580K (например, SEQ ID NO: 114) или 492G + 573P + 574H + 580K (например, SEQ ID NO: 115), 492F + 573P + 574G + 580K (например, SEQ ID NO: 238), 492G + 573P + 574G + 580K (например, SEQ ID NO: 234), 492D + 573P + 574G + 580K (например, SEQ ID NO: 235), 492F + 573P + 574H + 580R (например, SEQ ID NO: 239), 492D + 573P + 574H + 580K (например, SEQ ID NO: 264), 492G + 573P + 574H + 580R (например, SEQ ID NO: 244), 492D + 573P + 574H + 580R (например, SEQ ID NO: 236) или 492F + 573P + 574H + 580K (например, SEQ ID NO: 237).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 550 + 573 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 550K + 573Р + 574H + 580K (например, SEQ ID NO: 265).
Вариант альбумина может содержать изменения в положениях, соответствующих положениям 492 + 550 + 573 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или их вариантов или фрагментов). Такие изменения могут содержать 492D + 550K + 573P + 574H + 580K (например, SEQ ID NO: 266) или 492G + 550K + 573P + 574H + 580K (например, SEQ ID NO: 267). Такие изменения могут содержать 492D + 550K + 573P + 574H (например, SEQ ID NO: 256).
Особенно предпочтительные варианты включают в себя:
вариант альбумина с изменениями в положениях, соответствующих положениям 492 и 580 в SEQ ID NO: 2, таким как (i) E492G и Q580R или (ii) E492D и Q580K (или эквивалентных положениях других альбуминов или вариантов или их фрагментов);
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 492 и 574 в SEQ ID NO: 2, таким как (i) E492G и K574H, (ii) E492D и K574K, (iii) E492D и K574 или (iv) E492G и K574K (или эквивалентных положениях других альбуминов или вариантов или фрагментов);
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 492 и 550 в SEQ ID NO: 2, таких как (i) E492G и D550K или (ii) E492D и D550K (или эквивалентных положений других альбуминов или вариантов или фрагментов);
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 550 и 573 в SEQ ID NO: 2, таких как (i) D550K и K573P, (ii) и D550 и K573P или (iii) D550 и K573P (или эквивалентных положений других альбуминов или вариантов или их фрагментов);
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 550 и 574 в SEQ ID NO: 2, таких как (i) D550K и K574H, или (ii) и D550 и K574H (или эквивалентных положений других альбуминов или вариантов или их фрагментов);
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 550 и 580 в SEQ ID NO: 2, таких как (i) D550M и Q580K, (ii) D550L и Q580K или (iii) D550K и Q580K (или эквивалентных положений других альбуминов или вариантов или их фрагментов);
вариант альбумина с изменениями (например, содержащий изменения) в положениях, соответствующих положениям 580 и 573 в SEQ ID NO: 2, таких как Q580K и K573P (или эквивалентных положений других альбуминов или вариантов или их фрагментов) и предпочтительно одно или более (несколько) других изменений, таких как положения, выбранное из 492, 550 и 574. Если имеется К в положении 580 и Р в положении 573, предпочтительно, чтобы этот полипептид содержал дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550 и 574;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 492 и 573 в SEQ ID NO: 2, таких как (i) E492D и K573P (или эквивалентных положений других альбуминов или вариантов или их фрагментов); или (ii) E492D и K573P или (iii) E492G и R573A (или эквивалентных положений других альбуминов или вариантов или их фрагментов), и предпочтительно одно или более (несколько) других изменений, например, в положении, выбранном из 550, 574 и 580. Если имеется G в положении 492 и А или Р в положении 573, предпочтительно, чтобы этот полипептид содержал дополнительное изменение в положении, выбранном из группы, состоящей из 550, 574 и 580 (или эквивалентных положений других альбуминов или вариантов или их фрагментов);
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 573 и 574 в SEQ ID NO: 2, таких как K573P и K574H (или эквивалентных положений других альбуминов или вариантов или их фрагментов и предпочтительно одно или более (несколько) изменений, таких как в положении, выбранном из 492, 550 и 580). Если имеется Р в положении 573 и N в положении 574, предпочтительно этот полипептид содержит дополнительные изменение в положении, выбранном из группы, состоящей из 492, 550 и 580 (или эквивалентных положений других альбуминов или вариантов или их фрагментов);
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 574 и 580 в SEQ ID NO: 2, таких как 574H и 580K (или эквивалентных положений других альбуминов или вариантов или их фрагментов и предпочтительно одно или более (несколько) изменений, таких как в положении, выбранном из 492, 550 и 573). Если имеется N в положении 574 и K в положении 580, предпочтительно, этот полипептид содержит дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550 и 570 (или эквивалентных положений других альбуминов или вариантов или их фрагментов);
вариант альбумина, содержащий изменения в положениях 492, 550 и 573 в SEQ ID NO: 2, такие как E492G, D550K и K573P, например, SEQ ID NO: 254 или такие как E492D, D550K K573P, например, SEQ ID NO: 253;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 550, 573 и 580 в SEQ ID NO: 2, такие как D550K, K573P и Q580K, например, SEQ ID NO: 133;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 550, 573 и 580 в SEQ ID NO: 2, такие как D550L, K573P и Q580K, например, SEQ ID NO: 248, или такие как D550M, K573P и Q580K, например, SEQ ID NO: 252;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 550, 573 и 574 в SEQ ID NO: 2, такие как D550L, K573P и K574H, например, SEQ ID NO: 246;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 550, 573 и 574 в SEQ ID NO: 2, такие как D550K, K573P и K574H, например, SEQ ID NO: 131;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 492, 573 или 580 в SEQ ID NO: 2, такие как E492G, K573P и Q580K, например, SEQ ID NO: 242;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 492, 573 и 580 in SEQ ID NO: 2, такие как E492D, K573P и Q580K, например, SEQ ID NO: 234;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 492, 550, 573 и 574 в SEQ ID NO: 2, такие как E492D, D550K, K573P и K574H, например, SEQ ID NO: 256;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 492, 550, 573 и 574 в SEQ ID NO: 2, такие как E492G, D550K, K573P и K574H, например, SEQ ID NO: 257;
вариант альбумина, содержащий изменения в положениях, соответствующих положениям 573, 574 и 580 в SEQ ID NO: 2, такие как K573P, K574H и Q580K, например, SEQ ID NO: 135;
вариант альбумина с изменениями в положениях, соответствующих положениям 492, 573, 574 и 580 в SEQ ID NO: 2, такие как E492D, K573P, K574H и Q580K (или эквивалентных положениях других альбуминов или вариантов или их фрагментов), например, SEQ ID NO: 114;
вариант альбумина с изменениями в положениях, соответствующих положениям 492, 573, 574 и 580 в SEQ ID NO: 2, такие как E492G, K573P, K574H и Q580K (или эквивалентных положениях других альбуминов или вариантов или их фрагментов), например, SEQ ID NO: 115;
Предпочтительно, этот вариант альбумина не состоит из SEQ ID NO: 2 только со следующими изменениями: K573P + K574N + A577T + A578R + S579C + Q580K + A581 D + G584A;
K573P + A577E + A578S + Q580K + A582T; E492G + K573A; E492G + N503K + K573A;
E492G + N503H + K573A; E492G + K573P; E492G + N503K + K573P; E492G + N503H + K573P.
Такие вариантные альбумины описаны в WO 2011/051489.
Предпочтительно этот вариант альбумина не состоит из SEQ ID NO: 2 с аминокислотами 573-585, замененными (a) KKLVAASQAALG L, (b) Р KFVAASQAALA, (с) PNLVTRCKDALA, (d) PKLVES SKATLG или (е) PKLVASTQAALA.
Предпочтительно этот вариант альбумина, его фрагмент или слитый полипептид, содержащий вариант альбумина или его фрагмент, имеет измененную аффинность связывания с FcRn и/или измененный период полужизни в плазме в сравнении с этим соответствующим исходным или эталонным альбумином, его фрагментом, или слитым полипептидом, содержащим вариант альбумина или его фрагмент и/или измененную аффинность связывания с FcRn.
В одном особенно предпочтительном варианте осуществления этот исходный или эталонный альбумин является HSA (SEQ ID NO: 2), и этот вариант альбумина или его фрагмент или слитый полипептид, содержащий этот вариант альбумина или его фрагмент, имеет измененную аффинность связывания с FcRn и/или измененный период полужизни в плазме в сравнении с соответствующими фрагментом или слитым полипептидом, содержащим HSA или его фрагмент, и/или измененную аффинность связывания с FcRn.
Корреляция между связыванием альбумина с его рецептором и периодом полужизни в плазме была реализована авторами этого изобретения на основе природно-встречающегося аллеля HSA D494N. Исследователи анализировали ранее этот аллель и обнаружили, что он имеет более низкую аффинность в отношении своего рецептора FcRn, чем WT HSA в отношении FcRn.
Далее, было описано, что трансгенная мышь, у которой природный FcRn мыши был заменен на FcRn человека, имеет более высокий уровень сывороточного альбумина, чем нормальная мышь (J Exp Med. (2003) 197(3): 315-22). Ранее было обнаружено, что FcRn человека имеет более высокую аффинность в отношении сывороточного альбумина мыши, чем FcRn мыши имеет в отношении сывороточного альбумина мыши, и, следовательно, наблюдаемое увеличение уровня сывороточного альбумина в трансгенных мышах соответствует более высокой аффинности между сывороточным альбумином и его рецептором, подтверждая корреляцию между связыванием альбумина с FcRn и периодом полужизни в плазме. Кроме того, было показано, что варианты альбумина, которые имеют слабое связывание или вообще не связываются с FcRn, имеют уменьшенный период полужизни в мышиной модели, Kenanova et al. (2009) J. Nucl. Med.; 50 (Supplement 2): 1582).
Одним путем определения, будет ли аффинность связывания варианта альбумина с FcRn более высокой или более низкой, чем у исходного или эталонного альбумина, является применение поверхностного плазмонного резонанса (SPR), описанного ниже. Квалифицированному в данной области специалисту будет понятно, что для определения, является ли аффинность связывания варианта альбумина с FcRn более высокой или более низкой, чем аффинность связывания исходного или эталонного альбумина с FcRn, могут быть использованы и другие методы, например, определение и сравнение констант связывания KD. Аффинность связывания (KD) между первой молекулой (например, лигандом) и второй молекулой (например, рецептором) является функцией кинетических констант для ассоциации (on rate, ka) и диссоциации (off-rate, kd) в соответствии с KD=kd/ka. Таким образом, согласно этому изобретению считается, что варианты альбумины, имеющие KD, которая является более низкой, чем KD для природного HSA, имеют более высокий период полужизни в плазме, чем HSA, и считается, что варианты альбумины, имеющие KD, которая является более высокой, чем KD для природного HSA, имеет более низкий период полужизни в плазме, чем HSA.
В одном варианте воплощения этого изобретения, эти варианты альбумина или их фрагменты или слитые полипептиды, содержащие вариант альбумина или его фрагмент, по данному изобретению, имеют период полужизни в плазме, который является более долгим, чем период полужизни в плазме фрагмента исходного или эталонного альбумина или слитого полипептида, содержащего исходный или эталонный альбумин или его фрагмент, и/или более сильную аффинность связывания с FcRn.
В одном дополнительном варианте осуществления, эти варианты альбумина или их фрагменты, или слитые полипептиды, содержащие вариант альбумина или его фрагмент, по данному изобретению, имеют период полужизни в плазме, который является более коротким, чем период полужизни в плазме фрагмента исходного или эталонного альбумина и/или более низкую аффинность связывания с FcRn.
Кроме изменений в двух или более положениях, выбранных из 492, 550, 573, 574 и/или 580 (или эквивалентного положения других альбуминов или их вариантов или фрагментов) этот вариант альбумина или его фрагмент, или слитый полипептид, содержащий вариант альбумина или его фрагмент по данному изобретению, могут содержать дополнительные замены, делеции или инсерции в других положениях этих молекул. Такие дополнительные замены, делеции или инсерции могут быть полезными для изменения других свойств этих молекул, таких как, но не ограничивающихся ими, измененное гликозилирование; введение реакционноспособных групп на этой поверхности, таких как тиоловые группы, удаление/создание сайта карбамоилирования; и т.д.
Остатки, которые могут быть изменены для обеспечения реакционноспособных остатков на этой поверхности и которые могли бы выгодным образом применяться к этому изобретении, были описаны в WO 2010/092135 (включенном здесь посредством ссылки). Конкретные предпочтительные остатки включают в себя положения, соответствующие положениям в SEQ ID NO: 2.
В качестве примеров изменений, которые могут быть произведены в SEQ ID NO: 2 или в соответствующих положениях в других альбуминах для обеспечения реакционноспособной тиоловой группы на этой поверхности, включены изменения, соответствующие следующим изменениям в SEQ ID NO: 2: L585C, D1C, А2С, D562C, А364С, А504С, Е505С, Т79С, Е86С, D129C, D549C, А581С, D121C, Е82С, S270C, А578С, L595LC, D1DC, А2АС, D562DC, А364АС, А504АС, Е505ЕС, Т79ТС, Е86ЕС, D129DC, D549DC, А581АС, А581АС, D121DC, Е82ЕС, S270SC, А579АС, С360*, С316*, С75*, С168*, С558*, С361*, С91*, С124*, С169* и С567*. Альтернативно остаток цистеина может быть добавлен к N-концу или С-концу альбумина. Термин 'реакционноспособный тиол' обозначает и/или включает в себя тиоловую группу, обеспеченную Cys, которая не является связанной дисульфидной связью с Цистеином и/или которая является стерически доступной для связывания с ассоциатом, таким как ассоциат конъюгации.
Слитые полипептиды
Второй аспект данного изобретения относится к слитым полипептидам. Таким образом, варианты альбумина или их фрагменты по данному изобретению могут быть слиты с партнером по слиянию, который представлен отличным от альбумина пептидом. Этим партнером по слиянию может быть в принципе любой полипептид, но, как правило, предпочтительней, чтобы партнером по слиянию был полипептид, имеющий терапевтические, профилактические (в том числе вакцина), диагностические, визуализирующие и/или другие полезные свойства. Такие свойства могут называться 'фармацевтически полезными свойствами'. Слитые полипептиды, содержащие альбумин или его фрагменты, известны в данной области. Было обнаружено, что такие слитые полипептиды, содержащие альбумин или его фрагмент и партнер по слиянию имеют более длинный период полужизни в плазме в сравнении с отдельным партнером по слиянию. Согласно изобретению, можно изменять период полужизни в плазме слитых полипептидов по изобретению по сравнению с соответствующими слитыми полипептидами известного уровня. 'Изменение' включает в себя как увеличение периода полужизни в плазме, так и уменьшение периода полужизни в плазме. Увеличение периода полужизни в плазме является предпочтительным. Это изобретение позволяет варьировать период полужизни до желаемого срока.
Один или более (несколько) терапевтических, профилактических (в том числе вакцины), диагностических, визуализирующих и других полезных полипептидов могут быть слиты с N-концом, С-концом альбумина, встроены в петлю в структуре альбумина или слиты в любой из указанных комбинации. Он может содержать и может не содержать линкерные последовательности, отделяющие различные компоненты слитого полипептида.
Теории, относящиеся к слиянию альбумина или его фрагмента, известны в данной области, и квалифицированному в данной области специалисту будет понятно, что такие теории могут быть также применены к этому изобретению. WO 2001/79271 А (в частности, страница 9 и/или Таблица 1), WO 2003/59934 (в частности, Таблица 1, WO 03/060071 (в частности, Таблица 1) WO 01/079480 (в частности, Таблица 1) (каждая включена здесь посредством ссылки в их полном объеме) содержат примеры терапевтических, профилактических (в том числе вакцина), диагностических, визуализирующих или других полезных полипептидов, которые могут быть слиты с альбумином или его фрагментами, и эти примеры применяются также к этому изобретению.
Дополнительные предпочтения для этого второго аспекта изобретения включают в себя предпочтения первого аспекта этого изобретения, и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть объединен с другим аспектом или аспектами этого изобретения и/или с одним или более (несколькими) из предпочтений для аспектов этого изобретения и/или других раскрытий, сделанных здесь.
Полинуклеотиды
Третий аспект этого изобретения относится к выделенным полинуклеотидам, которые кодируют любой из вариантов или слитых полипептидов этого изобретения. Этот полинуклеотид может быть выделенным полинуклеотидом. Этот полинуклеотид может содержаться в векторе (таком как плазмида) и/или в клетке-хозяине.
Дополнительные предпочтения для третьего аспекта этого изобретения включают в себя предпочтения первого аспекта этого изобретения и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть объединен с другим аспектом или аспектами этого изобретения и/или с одним или более (несколькими) из этих предпочтений для аспектов этого изобретения и/или других раскрытий, сделанных здесь.
Конструкции нуклеиновых кислот
Четвертый аспект этого изобретения относится к конструкциям нуклеиновых кислот, содержащим полинуклеотид, кодирующий вариант или слитый полипептид этого изобретения, функционально связанный с одной или несколькими регуляторными последовательностями, которые управляют экспрессией этой кодирующей последовательности в подходящей клетке-хозяине в условиях, совместимых с этими регуляторными последовательностями.
Полинуклеотид может манипулироваться различными способами для обеспечения экспрессии варианта. Манипулирование полинуклеотидом перед его встраиванием в вектор может быть желательным или необходимым в зависимости от экспрессирующего вектора. Эти способы модификации полинуклеотидов с помощью методик, рекомбинантных ДНК хорошо известны в данной области.
Регуляторная последовательность может быть промоторной последовательностью, которая распознается клеткой-хозяином для экспрессии этого полинуклеотида. Промоторная последовательность содержит последовательности контроля транскрипции, которые опосредуют экспрессию этого варианта. Этот промотор может быть любой последовательностью нуклеиновой кислоты, которая обнаруживает транскрипционную активность в клетке-хозяине, в том числе мутантными, укороченными и гибридными промоторами, и может быть получен из генов, кодирующих внеклеточные или внутриклеточные полипептиды либо гомологичные, либо гетерологичные относительно клетки-хозяина.
В клетке дрожжей, полезные промоторы получают из генов энолазы для Saccharomyces cerevisiae (ENO-1), протеазы A Saccharomyces cerevisiae (PRB1), протеазы В Saccharomyces cerevisiae (PRD1), фактора элонгации трансляции (TEF1) Saccharomyces cerevisiae, галактокиназы Saccharomyces cerevisiae (GAL1), алкогольдегидрогеназы/глицератадегид-3-дегидрогеназы Saccharomyces cerevisiae (ADH1, ADH2/GAP), триозофосфатизомеразы Saccharomyces cerevisiae (TPI), металлотионеина Saccharomyces cerevisiae (CUP1) и 3-фосфоглицераткиназы Saccharomyces cerevisiae. Другие полезные промоторы для дрожжевых клеток-хозяев описаны Romanos et al., 1992, Yeast 8: 423-488.
Квалифицированный специалист знает промоторы, пригодные для применения в клетках риса и клетках млекопитающих, такие как СНО или HEK. В хозяине-рисе, применимые промоторы получают из РНК-гена вируса мозаики цветной капусты 35S (CaMV35S), алкогольдегидрогеназы маиса (Adh1) и альфа Amy3.
В клетке-хозяине млекопитающего, такой как СНО или HEK, подходящие для применения промоторы получают из Cytomegalovirus (CMV) и гибридного промотора CAG (гибрида раннего энхансерного элемента CMV и промотора бета-актина курицы), обезьяньего вакуолизирующего вируса 40 (SV40).
Регуляторной последовательностью может быть также подходящая последовательность терминатора транскрипции, которая распознается клеткой-хозяином для терминации транскрипции. Эта последовательность терминатора функционально связана с 3'-концом полинуклеотида, кодирующего этот вариант. Может быть использован любой терминатор, который функционирует в этой клетке-хозяине.
Предпочтительные терминаторы для дрожжевых клеток-хозяев получают из генов для энолазы Saccharomyces cerevisiae, цитохрома С (CYC1) Saccharomyces cerevisiae, алкогольдегидрогеназы Saccharomyces cerevisiae (ADH1) и глицеральдегид-3-фосфатдегидрогеназы Saccharomyces cerevisiae. Другие подходящие терминаторы для дрожжевых клеток-хозяев описаны Romanos et al., 1992, supra. Квалифицированный специалист знает терминаторы, пригодные для применения в рисе и клетках млекопитающих, таких как СНО или HEK. Например, в хозяине-рисе, предпочтительные терминаторы получают из нопалинсинтазы Agrobacterium tumefaciens (Nos) и гена РНК вируса мозаики цветной капусты 35S (CaMV35S).
Регуляторной последовательностью может быть также подходящая лидерная последовательность, нетранслируемый район мРНК, который является важным для трансляции клеткой-хозяином. Эта лидерная последовательность функционально связана с 5'-концом полинуклеотида, кодирующего этот вариант. Может быть использована любая лидерная последовательность, которая является функциональной в этой клетке-хозяине.
Подходящие лидеры для дрожжевых клеток-хозяев получают из генов для энолазы Saccharomyces cerevisiae (ENO-1), 3-фосфатглицераткиназы Saccharomyces cerevisiae, альфа-фактора Saccharomyces cerevisiae и алкогольдегидрогеназы/глицеральдегид-3-дегидрогеназы Saccharomyces cerevisiae (ADH2/GAP).
Регуляторной последовательностью может быть также последовательность полиаденилирования, которая функционально связана с 3'-концом кодирующей вариант последовательности, при транскрипции узнаваемая клеткой-хозяином в качестве сигнала для добавления остатков полиаденозина к транскрибируемой мРНК. Может быть использована любая последовательность полиаденилирования, которая является функциональной в этой клетке-хозяине.
Последовательности для полиаденилирования в дрожжевых клетках-хозяевах описаны Guo and Sherman, 1995, Mol. Cellular Biol. 15: 5983-5990.
Регуляторной последовательностью может быть также область, кодирующая сигнальный пептид, который связан с N-концом варианта и направляет этот вариант по секреторному пути клеток. 5'-конец кодирующей последовательности этого полинуклеотида может по своей природе содержать область, кодирующую сигнальный пептид, который находится в одной рамке считывания с сегментом кодирующего района, который кодирует вариант. Альтернативно, 5'-конец этой кодирующей последовательности может содержать область, кодирующую сигнальный пептид, который является чужеродным для этой кодирующей последовательности. Эта область, кодирующая чужеродный сигнальный пептид, может требоваться, когда кодирующая последовательность исходно не содержит области, кодирующей сигнальный пептид. Альтернативно, эта область, кодирующая чужеродный сигнальный пептид, может просто заменять область, кодирующую природный сигнальный пептид, для усиления секреции этого варианта. Однако может быть использована любая область, кодирующая любой сигнальный пептид, который направляет экспрессируемый вариант по секреторному пути клетки-хозяина.
Сигнальные пептиды, применимые в дрожжевых клетках-хозяевах, получают из генов альфа-фактора и инвертазы Saccharomyces cerevisiae. Другие применимые последовательности, кодирующие сигнальный пептид, описаны Romanos et al., 1992, supra. Квалифицированному в данной области специалисту известны сигнальные пептиды, подходящие для применения в клетках риса и клетках млекопитающих, таких как СНО или HEK.
Область, кодирующая сигнальный пептид, и область, кодирующая пропептид, находятся на N-конце варианта, область, кодирующая пропептид, располагается рядом с N-концом варианта и область, кодирующая сигнальный пептид, располагается рядом с N-концом области, кодирующей пропептид.
Дополнительные предпочтения для четвертого аспекта этого изобретения включают в себя предпочтения первого аспекта этого изобретения и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть соединен с другим аспектом или аспектами этого изобретения и/или с одним или более (несколькими) из предпочтений для аспектов этого изобретения и/или другими открытиями, сделанными здесь.
Получение вариантов
Пятый аспект этого изобретения относится к способу приготовления или получения варианта альбумина или его фрагмента, или слитого полипептида, содержащего вариант альбумина или его фрагмент, или ассоциата варианта альбумина или его фрагмента, где способ предусматривает:
(a) введение в исходный альбумин или его фрагмент или слитый полипептид, содержащий исходный альбумин или его фрагмент изменения в двух или более положениях, выбранных из 492, 550, 573, 574 и 580, предпочтительно как описано в первом аспекте этого изобретения; и
(b) извлечение варианта альбумина или его фрагмента или слитого полипептида, содержащего вариант альбумина или его фрагмент.
Предпочтительные изменения являются такими, как описанные в отношении первого аспекта этого изобретения. Полученный вариант альбумина или его фрагмент могут иметь измененную аффинность связывания FcRn- в сравнении с аффинностью связывания FcRn эталона, такого как исходный альбумин или фрагмент, который не содержит этих изменений. Более конкретно, полученный вариант альбумина или его фрагмент имеет более высокую аффинность связывания FcRn.
Это изобретение включает в себя способ получения полипептида, который является вариантом альбумина, его фрагментом или слитым полипептидом, содержащим указанный вариант альбумина или его фрагмент, имеющий аффинность связывания с FcRn, которая изменена по сравнению с аффинностью связывания с FcRn эталонного альбумина, его фрагмента или слияния, где способ предусматривает:
(а) обеспечение нуклеиновой кислоты, кодирующей исходный альбумин, такой как альбумин, имеющий по меньшей мере 60% идентичность последовательности с SEQ ID NO: 2;
(b) модификацию последовательности стадии (а), для кодирования полипептида, который является вариантом альбумина, его фрагментом или слитым полипептидом, содержащим указанный вариант альбумина или его фрагмент, который содержит изменения в двух или более положениях, соответствующих положениям, выбранным из двух или более из группы, состоящей из положений 492, 550, 573, 574 и 580 в SEQ ID NO: 2;
(c) необязательно, введение модифицированной последовательности стадии (b) в подходящую клетку-хозяина;
(d) необязательно, выращивание этих клеток в подходящей среде для выращивания в условиях, приводящих к экспрессии этого полипептида; и
е) необязательно извлечение этого полипептида из среды для выращивания;
где этот полипептид имеет измененную аффинность связывания с FcRn и/или измененный период полужизни в плазме по сравнению с периодом полужизни исходного альбумина, эталонного альбумина, его фрагмента или слияния.
Предпочтительно исходный альбумин и/или вариант альбумина содержит (или состоит из):
(a) полипептид, имеющий по меньшей мере 60%-ную идентичность последовательности относительно зрелого полипептида SEQ ID NO: 2;
(b) полипептида, кодируемого полинуклеотидом, который гибридизуется в условиях низкой жесткости с (i) кодирующей зрелый полипептид последовательностью SEQ ID NO: 1, или (ii) полноразмерного комплемента (i);
(c) полипептида, кодируемого полинуклеотидом, имеющим по меньшей мере 60%-ную идентичность относительно последовательности, кодирующей зрелый полипептид SEQ ID NO: 1; и/или
(d) фрагмента зрелого полипептида SEQ ID NO: 2.
Эти варианты могут быть приготовлены квалифицированным в данной области специалистом с использованием любой известной в данной области процедуры мутагенеза, такой как сайт-направленный мутагенез, конструирование синтетического гена, конструирование полусинтетического гена, неспецифический мутагенез, перетасовка генов и т.д.
Сайт-направленный мутагенез является способом, в котором одну или более (несколько) мутаций (изменений) создают в одном или более (нескольких) определенных сайтах в полинуклеотиде, кодирующем этот исходный альбумин.
Сайт-направленный мутагенез может выполняться in vitro посредством ПНР, включающей применение олигонуклеотидных праймеров, содержащих желаемую мутацию. Сайт-направленный мутагенез может также выполняться in vitro кассетным мутагенезом, включающим расщепление рестрикционным ферментом сайта в плазмиде, который содержит полинуклеотид, кодирующий исходный белок, и последующее лигирование олигонуклеотида, содержащего мутацию в состав этого полинуклеотида. Обычно рестрикционный фермент, который расщепляет плазмиду и олигонуклеотид, является тем же, что обеспечивает лигирование плазмиды и вставки друг с другом. См., например, Scherer and Davis, 1979, Proc. Natl. Acad. Sci. USA 76: 4949-4955; и Barton et al., 1990, Nucleic Acids Res. 18: 7349-4966.
Сайт-направленный мутагенез может также выполняться in vivo способами, известными в данной области. См., например, U.S. Patent Application Publication NO: 2004/0171 154; Storici et al., 2001, Nature Biotechnol. 19: 773-776; Kren et al., 1998, Nat. Med. 4: 285-290; и Calissano and Macino, 1996, Fungal Genet. Newslett. 43: 15-16.
В данном изобретении может быть использована любая процедура сайт-направленного мутагенеза. Доступны многочисленные коммерческие наборы, которые могут быть использованы для приготовления исходных (альбуминовых) вариантов.
Конструирование синтетического гена влечет за собой синтез in vitro сконструированной молекулы полинуклеотида для кодирования представляющего интерес полипептида. Синтез гена может выполняться с использованием ряда способов, таких как мультиплексная технология на основе микрочипа, описанная Tian et al. (2004, Nature 432: 1050-1054), и сходных технологий, где олигонуклеотиды синтезируют и собирают на фотопрограммируемых микрофлюидных чипах.
Могут быть сделаны одиночные или множественные аминокислотные замены, делеции и/или инсерции с использованием известных способов мутагенеза, рекомбинации и/или перетасовки, которые затем могут быть протестированы посредством релевантной процедуры скрининга, такой как описанная Reidhaar-Olson and Sauer, 1988, Science 241: 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413; или WO 95/22625. Другие способы, которые также могут быть использованы, включают в себя склонную к ошибкам ПЦР, фаговый дисплей (например, Lowman et al., 1991, Biochemistry 30: 10832-10837; U.S. Patent NO: 5,223,409; WO 92/06204) и область-направленный мутагенез (Derbyshire et al., 1986, Gene 46: 145; Ner et al., 1988, DNA 7: 127).
Способы мутагенеза/перетасовки могут быть объединены с высокопроизводительными автоматизированными способами скрининга для детектирования клонированных мутагенизированных полипептидов, экспрессируемых клетками-хозяевами (Ness et al., 1999, Nature Biotechnology 17: 893-896). Мутагенезированные молекулы ДНК, которые кодируют активные полипептиды, могут быть извлечены из клеток-хозяев и быстро секвенированы с использованием стандартных способов в данной области. Эти способы позволяют быстро определить важность индивидуальных аминокислотных остатков в полипептиде.
Конструирование полусинтетических генов осуществляют путем комбинирования аспектов конструирования синтетических генов и/или сайт-направленного мутагенеза, и/или неспецифического мутагенеза, и/или перетасовки. Полусинтетическое конструирование характеризуется процессом, задействующим полинуклеотидные фрагменты, которые синтезируются, в комбинации со способами ПЦР. Таким образом, определенные области генов могут быть синтезированы de novo, тогда как другие области могут быть амплифицированы с использованием сайт-специфических мутагенных праймеров, в то время как другие области могут быть подвергнуты склонной к ошибкам ПЦР или не склонной к ошибкам ПЦР амплификации. Затем полинуклеотидные подпоследовательности могут быть подвергнуты перетасовке.
Дополнительные предпочтения для пятого аспекта этого изобретения включают в себя предпочтения первого аспекта этого изобретения и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированный в данной области специалист понимает, что любой аспект этого изобретения может быть объединен с другим аспектом или другими аспектами этого изобретения и/или с одним или более (несколькими) предпочтениями для аспектов этого изобретения и/или других открытий, сделанных здесь.
Способы получения
Шестой аспект этого изобретения относится к способам приготовления вариантов по этому изобретению. Эти варианты данного изобретения могут быть получены с использованием способов, хорошо известных квалифицированному специалисту. Одним удобным путем является клонирование нуклеиновой кислоты, кодирующей исходный альбумин или его фрагмент или слитый полипептид, содержащий альбумин или его фрагмент, модификация указанной нуклеиновой кислоты для введения желаемой замены (замен) в двух или более положениях, соответствующих положениям, выбранным из 492, 550, 573, 574 и 580 зрелого полипептида SEQ ID NO: 2 (или эквивалентных положениях в других альбуминах или их фрагментах), предпочтительно, как описано для первого или пятого аспектов этого изобретения, с получением подходящий генетический конструкции, где эту модифицированную нуклеиновую кислоту помещают в функциональной связи с подходящими регуляторными генетическими элементами, такими как промотор, терминатор, сайты активирования, сайты связывания рибосом и т.д., введение генетической конструкции в подходящий организм-хозяин, культивирование трансформированного организма-хозяина в условиях, приводящих к экспрессии исходного варианта, и извлечение этого варианта. Все эти способы известны в данной области, и специалист может спроектировать подходящий способ для получения конкретного варианта в соответствии с данным изобретением.
Вариантный полипептид этого изобретения может быть также соединен с сигнальной последовательностью, чтобы получить вариантный полипептид, секретируемый в среду для выращивания во время культивирования трансформированного организма-хозяина. Обычно выгодно иметь вариантный полипептид, секретируемый в среду для выращивания для облегчения извлечения и очистки.
Способы для получения вариантных полипептидов были также описаны WO 2009019314 (включенной здесь посредством ссылки) и эти способы могут быть применены к этому изобретению.
Альбумины успешно экспрессировались в виде рекомбинантных белков в целом ряде хозяев, включающих в себя грибы (в том числе, но не ограничивающиеся ими, Aspergillus (WO 06066595), Kluyveromyces (Fleer 1991, Bio/technology 9, 968-975), Pichia (Kobayashi 1998 Therapeutic Apheresis 2, 257-262) и Saccharomyces (Sleep 1990, Bio/technology 8, 42-46)), бактерии (Pandjaitab 2000, J. Allergy Clin. Immunol. 105, 279-285)), животных (Barash 1993, Transgenic Research 2, 266-276) и растения (включающие в себя, но не ограничивающиеся ими картофель и табак (Sijmons 1990, Bio/technology 8, 217 и Farran 2002, Transgenic Research 11, 337-346) и рис, например, Oryza sativa), клетки млекопитающих, такие как СНО и HEK. Вариантный полипептид этого изобретения предпочтительно получают рекомбинантно в подходящей клетке-хозяине. В принципе, любая клетка-хозяин, способная продуцировать полипептид в подходящих количествах, может быть использована, и исследователь способен отобрать наиболее подходящую клетку-хозяина в соответствии с этим изобретением. Одним предпочтительным организмом-хозяином являются дрожжи, предпочтительно выбранные среди Saccharomycacae, более предпочтительно Saccharomyces cerevisiae.
Вариантные полипептиды этого изобретения могут быть извлечены и очищены из среды для выращивания с использованием комбинации известных способов разделения, таких как фильтрование, центрифугирование, хроматография и способы аффинного разделения и т.д. Исследователь способен очистить варианты этого изобретения с использованием определенной комбинации таких известных стадий разделения. В качестве примера способов очистки, которые могут быть применены к вариантам этого изобретения, может быть упомянуто описание WO 00/44772.
Вариантные полипептиды этого изобретения могут быть использованы для доставки терапевтически полезного соединения (включающего в себя профилактически полезное соединение, такое как вакцина) в животное или в человека, нуждающихся в этом. Такие терапевтически полезные соединения включают в себя, но не ограничиваются ими, метки и легко детектируемые соединения для применения в диагностике, такой как различные способы томографии; фармацевтически активные соединения, такие как лекарственные средства, или специфически связывающие части, такие как антитела. Варианты этого изобретения могут быть даже соединены с двумя или более различными терапевтически полезными соединениями, например, антителом и лекарственным средством, что придает объединенной молекуле способность специфически связываться с желаемой мишенью и тем самым обеспечивать высокую концентрацию связанного лекарственного средства в этой конкретной мишени.
Дополнительные предпочтения для шестого аспекта этого изобретения включают в себя предпочтения первого аспекта эти, и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированный в данной области специалист понимает, что любой аспект этого изобретения может быть объединен с другим аспектом или другими аспектами этого изобретения и/или одним или более (несколькими) из предпочтений для аспектов этого изобретения и/или других открытий, сделанных здесь.
Конъюгаты
Седьмой аспект этого изобретения относится к конъюгатам (конъюгациям). Таким образом, варианты альбумина или их фрагменты или слитые полипептиды по этому изобретению могут быть конъюгированы со второй молекулой (партнером по конъюгации) с использованием способов, хорошо известных в данной области. Партнер по конъюгации может быть терапевтической, профилактической (включающей в себя вакцину), диагностической, визуализирующей или другой полезной частью. Указанный партнер по конъюгации может быть полипептидом или неполипептидным веществом. Партнер по конъюгации может быть полипептидом, химическим соединением (например, химически синтезированным лекарственным средством) или нуклеиновой кислотой (например, ДНК, РНК, миРНК).
Указанная вторая молекула может содержать диагностическую или визуализирующую часть, и в этом варианте осуществления этот конъюгат может быть полезным в качестве диагностического инструмента, например, в визуализации; или эта вторая молекула может быть терапевтическим или профилактическим (например, вакциной) соединением, и в этом варианте осуществления этот конъюгат может быть использован для терапевтических или профилактических (например, вакцинации) целей, где этот конъюгат будет иметь терапевтические или профилактические свойства терапевтического или профилактического соединения, а также желаемый период полужизни в плазме, обеспечиваемый альбуминовой частью этого конъюгата. Конъюгаты альбумина и терапевтической молекулы известны в данной области, и было подтверждено, что такие конъюгаты имеют длинный период полужизни в плазме в сравнении с неконъюгированной, свободной терапевтической молекулой самой по себе. Согласно этому изобретению, можно изменить аффинность связывания с FcRn и период полужизни в плазме конъюгата по этому изобретению в сравнении с соответствующими конъюгатами известного уровня. 'Изменить' включает в себя как увеличение периода полужизни в плазме, так и уменьшение периода полужизни в плазме и аффинности связывания с FcRn. Увеличение периода полужизни в плазме и/или аффинности связывания с FcRn является предпочтительным. Эти конъюгаты могут быть удобным образом связаны через свободную тиоловую группу, присутствующую на поверхности HSA (аминокислотный остаток 34 зрелого HSA) с использованием хорошо известной реакции.
В одном особенно предпочтительном аспекте, вариант альбумина или его фрагмент конъюгируют с полезным терапевтическим или профилактическим (включающим в себя вакцину) соединением, и этот конъюгат используют для лечения состояния нуждающегося в этом пациента, причем это состояние отвечает на это конкретное выбранное терапевтическое соединение. Способы для конъюгирования такого терапевтически полезного соединения с вариантным альбумином или его фрагментом известны в данной области WO 2009/019314 (включенный здесь посредством ссылки в его полном объеме) описывает примеры способов, подходящих для конъюгации терапевтического соединения с полипептидом, причем эти способы могут быть также применены к этом изобретению. Дополнительно WO 2009/019314 описывает примеры соединений и частей, которые могут быть конъюгированы с замещенным трансферрином, и эти примеры могут быть также применены к этому изобретению. Описание WO 2009/019314 включено здесь посредством ссылки.
HSA в своей природной форме содержит одну свободную тиоловую группу (при Cys34), которую удобно использовать для конъюгации. В качестве конкретного варианта осуществления в этом аспекте этот вариантный альбумин или его фрагмент могут содержать дополнительные модификации, для создания дополнительных свободных тиоловых групп на этой поверхности. Это имеет свои преимущества, заключающиеся в том, нагрузка вариантного альбумина или его фрагмента увеличивается и более чем одна молекула терапевтического (например, профилактического) соединения может быть конъюгирована с каждой молекулой вариантного альбумина или его фрагмента, или два или более (несколько) различных терапевтических соединений могут быть конъюгированы с каждой молекулой вариантного альбумина или его фрагмента, например, соединение, имеющее нацеливающие свойства, такое как, антитело, специфическое, например, для опухоли; и цитотоксическое лекарственное средство, конъюгированное с вариантным альбумином или его фрагментом, создают тем самым высоко специфическое лекарственное средство против опухоли. Описание конкретных остатков, которые могут быть модифицированы для обеспечения дополнительных свободных тиоловых групп на этой поверхности, может быть найдено в находящейся в процессе одновременного рассмотрения патентной заявки WO 2010/092135, которая включена здесь посредством ссылки.
Альтернативно, партнер по конъюгации может быть конъюгирован со слитым полипептидом (описанным здесь), что приводит к получению молекулы, содержащей партнер по слиянию, слитый с альбумином, а также партнер по конъюгации, конъюгированный с тем же самым альбумином или даже с партнером по слиянию.
Дополнительные предпочтения для седьмого аспекта этого изобретения включают в себя предпочтения первого аспекта этого изобретения и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть объединен с другим аспектом или с другими аспектами этого изобретения и/или с одним или более (несколькими) предпочтениями для аспектов этого изобретения и/или другими открытиями, сделанными здесь.
Ассоциаты
Восьмой аспект этого изобретения относится к ассоциатам. Таким образом, варианты альбумина или его фрагменты или слитые полипептиды могут быть дополнительно использованы в форме "ассоциатов". В этой связи термин "ассоциат" предназначен для обозначения соединения, содержащего вариант альбумина или его фрагмент и другое соединение, связанное или ассоциированное с вариантным альбумином или его фрагментом посредством нековалентного связывания. В качестве примера такого ассоциата может быть упомянут ассоциат, состоящий из вариантного альбумина и липида, ассоциированного с альбумином посредством гидрофобного взаимодействия. Такие ассоциаты известны в данной области, и они могут быть приготовлены с использованием хорошо известных способов. В качестве предпочтительного ассоциата по этому изобретению может быть упомянут ассоциат, содержащий вариантный альбумин и таксан, таксол или производное таксола (например, паклитаксел). Дополнительные примеры ассоциатов содержат терапевтическую, профилактическую (в том числе вакцину), диагностическую, визуализирующую или другую полезную часть.
Период полужизни ассоциата альбумина в соответствии с данным изобретением может быть более длинным или более коротким, чем период полужизни одного 'другого соединения'. Период полужизни ассоциата альбумина в соответствии с данным изобретением может быть более длинным или более коротким, чем период полужизни аналогичного/эквивалентного ассоциата альбумина, такого как нативный HSA (вместо варианта альбумина или производного альбумина по данному изобретению) и 'другое соединение'. Подобным образом, аффинность связывания с FcRn ассоциата альбумина в соответствии с этим изобретением может быть более сильной или более слабой, чем аффинность связывания с FcRn аналогичного/эквивалентного ассоциата альбумина, содержащего или состоящего из эталонного альбумина, такого как нативный HSA (вместо варианта или производного альбумина по данному изобретению) и 'другое соединение'. Способы для приготовления ассоциатов хорошо известны квалифицированному в данной области специалисту, например, приготовление (посредством ассоциации) HSA с Липосоединениями описано в Hussain, R. and Siligardi, G. (2006) International Journal of Peptide Research and Therapeutics, Vol. 12, NO: 3, pp. 311-315.
Дополнительные предпочтения для восьмого аспекта этого изобретения включают в себя предпочтения первого аспекта этого изобретения и предпочтения, обеспечиваемые ниже двенадцатого аспекта этого изобретения. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть объединен с другим аспектом или с другими аспектами этого изобретения и/или с одним или более (несколькими) предпочтениями для аспектов этого изобретения или другими описаниями, приведенными здесь.
Композиции
Девятый аспект этого изобретения относится к композициям. Таким образом, это изобретение также направлено на применение варианта альбумина или его фрагмента или слитых полипептидов, содержащих вариантный альбумин или его фрагменты, или конъюгата, содержащего вариант альбумина или его фрагмент, или ассоциата, содержащего вариант альбумина или его фрагмент для приготовления фармацевтической композиции, где этот вариант альбумина или его фрагмент или слитый полипептид, содержащий вариантный альбумин или его фрагменты, или конъюгат, содержащий вариант альбумина, или ассоциат, содержащий вариант альбумина или его фрагмент имеет измененную аффинность связывания с FcRn и/или измененный период полужизни в плазме в сравнении с HSA или его соответствующим фрагментом или слитым полипептидом, содержащим HSA или его фрагмент или конъюгатом, содержащим HSA.
В этой связи соответствующий фрагмент HSA предназначен для обозначения фрагмента HSA, который выравнивается с и имеет то же самое число аминокислот, что и фрагмент варианта альбумина, с которым его сравнивают. Подобным образом, соответствующий слитый полипептид, содержащий HSA или конъюгат, содержащий HSA предназначен для обозначения молекул, имеющих те же самые размер и аминокислотную последовательность, что и слитый полипептид или конъюгат, содержащие вариантный альбумин, с которым его сравнивают.
Эта композиция может содержать фармацевтически приемлемый носитель или наполнитель, такой как вода, полисорбат 80 или носители, указанные в US Pharmacopoeia (Фармакопея США) для альбумина человека.
Дополнительные предпочтения для девятого аспекта этого изобретения включают в себя предпочтения первого аспекта этого изобретения и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть объединен с другим аспектом или с другими аспектами этого изобретения и/или с одним или более (несколькими) предпочтениями для аспектов этого изобретения или другими описаниями, приведенными здесь.
Наночастицы
Десятый аспект этого изобретения относится к наночастицам, содержащим вариант, слияние, конъюгат, ассоциат, наночастицу, композицию или полинуклеотид, описанные здесь.
Способы для включения молекулы в нано- или микрочастицы, известны в данной области. Предпочтительные способы для приготовления нано- или микрочастиц, которые могут быть применены к альбумину, варианту, фрагменту, слиянию, конъюгату или ассоциату в соответствии с данным изобретением, описаны в WO 2004/071536 или WO 2008/007146 или Oner & Groves (Pharmaceutical Research, Vol 10(9), 1993, pages 1387 to 1388), которые включены здесь посредством ссылки. Предпочтительно средний диаметр наночастиц равен 5 - 1000 нм, более предпочтительно 5, 10, 20, 30, 40, 50, 80, 100, 130, 150, 200, 300, 400, 500, 600, 700, 800, 900, или 999 - 5, 10, 20, 30, 40, 50, 80, 100, 130, 150, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 нм. Преимуществом микрочастицы с диаметром менее 200 нм, и, более конкретно, менее чем 130 нм, является то, что она может быть стерилизована путем фильтрования через фильтр 0,2 мкм (микрон). Предпочтительно средний диаметр микрочастицы равен от 1000 нм (1 нм (микрон)) до 100 нм (микрон), более предпочтительно, от 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 до 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 мкм (микрон).
Дополнительные предпочтения для десятого аспекта этого изобретения включают в себя предпочтения первого аспекта этого изобретения и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть объединен с другим аспектом или с другими аспектами этого изобретения и/или с одним или более (несколькими) предпочтениями для аспектов этого изобретения или другими описаниями, приведенными здесь.
Применения
Одиннадцатый аспект этого изобретения относится к применению вариантного альбумина фрагмента, слияния или их конъюгата или наночастицы или ассоциата. Применение может быть, например, в способе лечения, профилактике, диагностике или визуализации. Эти варианты альбумина или их фрагменты, или слитые полипептиды, содержащие вариантный альбумин или его фрагмент в соответствии с данным изобретением имеют преимущество, заключающееся в том, что их способность связывания с FcRn и/или период полужизни в плазме является измененным в сравнении с исходным или эталонным альбумином или его фрагментами или слитыми полипептидами, содержащими исходный или эталонный альбумин или его фрагмент. Это имеет преимущество, заключающееся в том, что активность связывания с FcRn и/или период полужизни в плазме конъюгатов, содержащих вариантный альбумин или его фрагмент или слитый полипептид, содержащий вариантный альбумин или его фрагмент, или ассоциат, содержащий вариантный альбумин или его фрагмент, в соответствии с этим изобретением, может быть выбран в соответствии с конкретной терапевтической целью.
В некоторых ситуациях, было бы выгодным применение альбумина, варианта, фрагмента, слияния, конъюгата или ассоциата или композиции, имеющих более длинный период полужизни в плазме, чем эталонная молекула или композиция, так как это могло бы иметь преимущество в том, что введение альбумина, варианта, фрагмента, слияния, конъюгата или ассоциата или композиции, могло бы быть необходимым менее часто или при уменьшенной дозе (и, следовательно, с меньшими побочными эффектами), в сравнении с ситуацией, где использовали эту эталонную молекулу или композицию. Что касается применения варианта, слияния, конъюгата, ассоциата, наночастицы, композиции или полинуклеотид а, эта альбуминовая часть может содержать одно или несколько изменений, как описано здесь.
В других ситуациях, было бы выгодным применение альбумина, варианта, фрагмента, слияния, конъюгата или ассоциата или композиции, имеющих более короткий период полужизни в плазме, чем эталонная молекула или композиция, так как это могло бы иметь преимущество в том, что введение альбумина, варианта, фрагмента, слияния, конъюгата или ассоциата или композиции может проводиться при более высокой дозе в сравнении с ситуацией, где эталонную молекулу или композицию использовали с преимуществом, заключающемся в том, что введенное соединение очищает от реципиента более быстро, чем при использовании эталонной молекулы или композиции. Что касается применения варианта, слияния, конъюгата, ассоциата, наночастицы, композиции или полинуклеотида, эта альбуминовая часть может содержать одно или несколько изменений, как описано здесь.
Например, для конъюгата, ассоциата или слитого полипептида, используемых для целей визуализации в животных или людях, где визуализирующая часть имеет очень короткий период полужизни и конъюгат или слитый белок, содержащий HSA, имеет период полужизни в плазме, который является гораздо более длинным, чем это необходимо для визуализирующих целей, было бы выгодным применение вариантного альбумина или его фрагмента этого изобретения, имеющего более короткий период полужизни в плазме, чем исходный или эталонный альбумин или его фрагмент, для обеспечения конъюгатов слитых полипептидов, имеющих период полужизни в плазме, который является достаточно длинным для цели визуализации, но достаточно коротким для очищения из тела конкретного пациента, на которое его наносят.
В другом примере для конъюгата, ассоциата или слитого полипептида, содержащего терапевтическое соединение, эффективное в лечении или ослаблении конкретного состояния в пациенте, нуждающемся в таком лечении, было бы выгодно применение вариантного альбумина или его фрагмента, для обеспечения ассоциатов или конъюгатов или слитых полипептидов этого изобретения, имеющих более длинные периоды полужизни в плазме, которые могли бы иметь преимущество, заключающееся в том, что введение ассоциата или конъюгата или слитого полипептид этого изобретения могло бы требоваться менее часто или при меньшей дозе с меньшими побочными эффектами в сравнении с ситуацией, где использовались исходный или эталонный альбумин или его ассоциаты или фрагмент. Например, это изобретение обеспечивает способ лечения пролиферативного заболевания у индивидуума, предусматривающий введение этому индивидууму эффективного количества ассоциата в соответствии с данным изобретением, в котором этот ассоциат содержит таксан, таксол или производные таксола (например, паклитаксела).
В дополнительном аспекте это изобретение относится к композициям, содержащим вариантный альбумин, его ассоциат или его фрагмент, фрагмент вариантного альбумина или его ассоциаты или слитый полипептид, содержащий вариантный альбумин или его фрагмент в соответствии с этим изобретением. Эти композиции являются предпочтительно фармацевтическими композициями. Эта композиция может быть приготовлена с использованием способов, известных в данной области, таких как способы, описанные в известных руководствах в области фармацевтики. Поскольку альбумин, вариант, фрагмент, слияние, конъюгат или его ассоциат имеет аффинность связывания с FcRn, и/или период полужизни в плазме, которая модулируется, т.е. является более сильной или более слабой и/или более длинной или более короткой, чем аффинность эталонной молекулы, эта композиция также имеет аффинность связывания с FcRn и/или модулируемый период полужизни в плазме относительно эквивалентной композиции, содержащей эталонную молекулу вместо альбумина, варианта, фрагмента, слияния, конъюгата или ассоциата, как описано здесь. Эта композиция может быть вакциной. Полипептид по этому изобретению может быть активным фармацевтическим средством или наполнителем. Необязательно, эта композиция обеспечивается в дозированной лекарственной форме.
Предпочтительно альбумин, вариант, фрагмент, слияние, конъюгат или его ассоциат имеет период полужизни в плазме который является более длинным, чем период полужизни в плазме эталонной молекулы, например, той же самой композиции, за исключением того, что альбуминовый компонент (например, альбумин, вариант, фрагмент, слияние, конъюгат или ассоциат) является альбумином дикого типа (например, HSA) или вариантом, фрагментом, слиянием или ассоциатом.
В одном конкретном варианте осуществления эти композиции содержат вариантный альбумин или его фрагмент по этому изобретению и соединение, содержащее фармацевтически полезную часть и домен связывания альбумина (ABD). Согласно этому изобретению ABD обозначает сайт, группу или домен, способный связываться с циркулирующим альбумином in vivo и тем самым обеспечивает транспорт в кровотоке ABD и любого соединения или части, связанными с указанным ABD. ABD известны в данной области, и было показано, что они очень прочно связываются с альбумином, так что соединение, содержащее ABD, связанный с альбумином, будет до определенной степени вести себя, как единая молекула. Авторы изобретения показали с использованием вариантного альбумина или его фрагмента в соответствии с этим изобретением вместе с соединением, содержащим фармацевтически полезную часть и ABD, что можно изменять аффинность связывания с FcRn и/или период полужизни в плазме соединения, содержащего фармацевтически полезную часть и ABD, в сравнении с ситуацией, где указанное соединение инъецировали как таковое в пациента, нуждающегося в этом, или вводили в композицию, содержащую природный альбумин или его фрагмент.
Вариантный альбумин или его фрагменты, конъюгаты, содержащие вариантный альбумин или его фрагмент или слитый полипептид, содержащий вариантный альбумин или его фрагмент, по данному изобретению, могут быть также включены в наночастицы или микрочастицы с использованием способов, известных в данной области. Один предпочтительный способ для получения наночастиц или микрочастиц, который может быть применен для вариантных альбуминов или их фрагментов по данному изобретению, описан в WO 2004/071536 или WO 2008/007146 или Oner & Groves (Pharmaceutical Research, Vol 10(9), 1993, pages 1387 to 1388), которые включены здесь посредством ссылки.
Дополнительные предпочтения для одиннадцатого аспекта этого изобретения включают в себя предпочтения первого аспекта этого изобретения и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть объединен с другим аспектом или с другими аспектами этого изобретения и/или с одним или более (несколькими) предпочтениями для аспектов этого изобретения или другими описаниями, приведенными здесь.
Способ изменения аффинности связывания FcRn или периода полужизни молекулы
Двенадцатый аспект этого изобретения обеспечивает способ изменения аффинности связывания FcRn или периода полужизни молекулы, предусматривающий:
(a) если эта молекула является полипептидом, то слияние или конъюгирование этой молекулы с полипептидом, описанным здесь, или с конъюгатом, описанным здесь; ассоциирование этой молекулы с полипептидом, описанным здесь, или с конъюгатом, описанным здесь; включение этой молекулы в наночастицу, описанную здесь, или композицию, описанную здесь;
(b) если эта молекула не является полипептидом, то слияние или конъюгирование этой молекулы с полипептидом, описанным здесь, или с конъюгатом, описанным здесь; ассоциирование этой молекулы с полипептидом, описанным здесь, или с конъюгатом, описанным здесь; включение этой молекулы в наночастицу, описанную здесь, или композицию, описанную здесь.
Примеры 'молекулы' включают в себя молекулы, применимые в терапии, профилактике (в том числе молекулы, используемые в вакцинах либо в качестве фармацевтического ингредиента, либо в качестве носителя), визуализации и диагностике, такие как молекулы, описанные здесь.
Дополнительные предпочтения для двенадцатого аспекта этого изобретения включают в себя предпочтения первого предпочтения и предпочтения первого аспекта этого изобретения и предпочтения, обеспеченные ниже двенадцатого аспекта этого изобретения. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть объединен с другим аспектом или с другими аспектами этого изобретения и/или с одним или более (несколькими) предпочтениями для аспектов этого изобретения или другими описаниями, приведенными здесь.
Предпочтения для всех аспектов этого изобретения обеспечены ниже. Квалифицированному в данной области специалисту понятно, что любой аспект этого изобретения может быть объединен с другим аспектом или с другими аспектами этого изобретения и/или с одним или более (несколькими) предпочтениями для аспектов этого изобретения или другими описаниями, приведенными здесь.
Вариант альбумина или его фрагмент или слитые полипептиды, содержащие вариантный альбумин или его фрагмент, конъюгат, наночастицы, ассоциат или композиция, могут иметь период полужизни в плазме, который является либо более длинным, либо более коротким, предпочтительно более длинным, чем период полужизни в плазме у соответствующего альбумина или его фрагмента или слитого полипептида, содержащего альбумин или его фрагмент, конъюгата, наночастицы, ассоциата или композиции, или связывание с FcRn, которое является более сильным или более слабым, предпочтительно более слабым. Предпочтительно этот вариант альбумина или его фрагмент или слитые полипептиды, содержащие вариантный альбумин или его фрагменты, конъюгат, наночастица, ассоциат или композиция имеет период полужизни в плазме, который является более длинным, чем период полужизни в плазме HSA или соответствующего альбумина или его фрагмента или слитого полипептида, содержащего альбумин или его фрагмент, конъюгата, наночастицы, ассоциата или композиции.
Альтернативно, это может быть выражено как вариант альбумина или его фрагмент или слитый полипептид, содержащий вариантный альбумин или его фрагмент, конъюгат, наночастица, ассоциат или композиция, имеющие KD с FcRn (например, shFcRn), которая является более низкой, чем соответствующая KD у HSA с FcRn, или его соответствующего фрагмента или слитого полипептида, содержащего HSA или его фрагмент. Предпочтительно эта KD варианта альбумина или его фрагмента или слитых полипептидов, содержащих вариантный альбумин или его фрагменты, конъюгата, наночастицы, ассоциата или композиции является меньшей, чем 0,9Х KD для HSA с FcRn, более предпочтительно меньшей, чем 0,05Х KD для HSA с FcRn, более предпочтительно меньшей, чем 0,1X KD для HSA с FcRn, даже более предпочтительно меньшей, чем 0,05Х KD для HSA с FcRn, даже более предпочтительно менее чем 0,02Х KD для HSA с FcRn и наиболее предпочтительно меньшей, чем 0,01X KD для HSA с FcRn (где X обозначает 'умноженная на'). Эта KD варианта альбумина или его фрагмента или слитых полипептидов, содержащих вариантный альбумин или его фрагмент, конъюгата, наночастицы, ассоциата или композиции, может находиться между KD WT-альбумина (например, SEQ ID No. 2) с FcRn и KD HSA K573P (SEQ ID No. 3) с FcRn. Такие KD представляют аффинности связывания, которые являются более высокими, чем аффинность связывания между HSA и FcRn. Более высокая аффинность связывания указывает на более длительный период полужизни, например, период полужизни в плазме.
Альтернативно, вариант альбумина или его фрагмент или слитые полипептиды, содержащие вариантный альбумин или его фрагмент, конъюгат, наночастица, ассоциат или композиция, имеет период полужизни в плазме, который является более коротким, чем период полужизни в плазме HSA или его соответствующего фрагмента или слитого полипептида, содержащего HSA или его фрагмент.
Это может быть выражено как вариант альбумина или его фрагмент или слитые полипептиды, содержащие вариантный альбумин или его фрагменты, конъюгат, наночастица, ассоциат или композиция, имеющие KD с FcRn, которая больше, чем соответствующая KD для HSA с FcRn или соответствующего альбумина или его фрагмента или слитого полипептида, содержащего альбумин или его фрагмент, конъюгата, наночастицы, ассоциата или композиции. Предпочтительно, KD для этого варианта альбумина или его фрагмента или слитого полипептида, содержащего вариантный альбумин или его фрагмент, или конъюгата, содержащего вариант альбумина или его фрагмент, является большей, чем 2Х KD для HSA с FcRn, более предпочтительно большей, чем 5Х KD для HSA с FcRn, более предпочтительно большей, чем 10Х KD для HSA с FcRn, даже более предпочтительно большей, чем 25Х KD для HSA с FcRn, наиболее предпочтительно большей, чем 50Х KD, большей, чем 60Х, большей, чем 70Х KD, большей, чем 80Х, большей, чем 90Х или большей, чем 100Х KD для HSA с FcRn. Этот вариант альбумина или его фрагмент или слитый полипептид, содержащий вариантный альбумин или его фрагменты, конъюгат, наночастица, ассоциат или композиция могут вообще не связываться с FcRn.
Этот вариант альбумина или его фрагмент или слитый полипептид, содержащий вариантный альбумин или его фрагмент, или конъюгат или наночастица или ассоциат или композиция, содержащая вариант альбумина или его фрагмент, является предпочтительно вариантом альбумина или его фрагмента или слитым полипептидом, содержащим вариантный альбумин или его фрагмент, или конъюгатом или наночастицей или ассоциатом или композицией, содержащей вариант альбумина или его фрагмент, в соответствии с этим изобретением. Более низкая аффинность связывания указывает на более короткий период полужизни, например, период полужизни в плазме.
Одним преимуществом этого изобретения является то, что оно позволяет специально настроить период полужизни альбумина или его фрагмента или слитого полипептида, содержащего вариантный альбумин или его фрагмент, конъюгата, наночастицы, ассоциата или композиции для достижения аффинности связывания или периода полужизни, которые удовлетворяют потребностям пользователя.
При определении и/или сравнении KD, могут быть использованы один или более (и предпочтительно все) из следующих параметров:
Инструмент: Прибор Biacore 3000 (GE Healthcare)
Проточная ячейка: сенсорный чип СМ5
FcRn: FcRn человека, предпочтительно растворимый FcRn человека, необязательно связанный с меткой (тэгом), такой как GST или His, наиболее предпочтительно His, такой как 6 гистидинов на С-конце бета-2-микроглобулина (SEQ ID NO: 31).
Количество FcRn: 1200-2500 RU
Химия связывания (сочетания): амин-связывающая химия (например, химия, описанная в протоколе, обеспечиваемым изготовителем этого инструмента).
Способ связывания: Это связывание может выполняться инъекцией 20 мкг/мл белка в 10 мМ ацетате натрия pH 5,0 (GE Healthcare). Фосфатный буфер (67 мМ фосфатный буфер, 0,15 М NaCl, 0,005% Твин 20) при pH 5,5) может быть использован в качестве рабочего буфера и буфера разбавления. Регенерация этих поверхностей может быть сделана с использованием инъекций буфера HBS-EP (0,01 М HEPES, 0,15 М NaCI, 3 мМ ЭДТА, 0,005% поверхностно-активное вещество Р20) при pH 7,4 (Biacore АВ).
Количество инъекции тест-молекулы (например, HSA или варианта) 20-0,032 мкМ
Скорость потока инъекции: постоянная, например, 30 мкл/мл
Температура инъекции: 25°C
Программное обеспечение оценивания данных: BIAevaluation 4.1 программное обеспечение (BIAcore АВ).
Предпочтительный способ для определения KD приведен в Примере 2.
Это изобретение описывает, что два или более положений, выбранных среди группы, состоящей из положений 492, 550, 573, 574 и из группы, состоящей из 580 в SEQ ID NO: 2 (и, следовательно, эквивалентных положений в альбуминах и фрагментах из сыворотки человека и альбумина и сывороточных альбуминов не человека) могут быть изменены для модулирования (увеличение или уменьшения) аффинности связывания и/или периода полужизни, например, период полужизни в плазме альбумина, фрагмента, слияния, конъюгата, ассоциата, наночастицы или композиции. Изменение может быть заменой, инсерцией или делецией. Замена является предпочтительной.
Замена или инсерция может содержать или может не содержать введение консервативной аминокислоты, т.е. консервативной по отношению к аминокислоте в представляющем интерес положении. Примеры консервативных аминокислот показаны в виде групп на Фиг. 3: алифатические, ароматические, гидрофобные, заряженные, полярные, положительные, очень маленькие и небольшие. В положении 492 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов) предпочтительным является то, что изменение является заменой, такой как замена из нативной аминокислоты в А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно в G, D, F, Н, М или R, даже более предпочтительно в G или D и наиболее предпочтительно в G. В SEQ ID NO: 2 этой нативной аминокислотой в положении 492 является Е, таким образом, замена в Е не является предпочтительной.
В положении 550 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов), предпочтительным является то, что изменение является заменой, такой как замена из нативной аминокислоты в А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно в K, L, М, Е или R, даже более предпочтительно в K, L или М и наиболее предпочтительно в K. В SEQ ID NO: 2 этой нативной аминокислотой в положении 550 является D, таким образом, замена в D не является предпочтительной.
В положении 573 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов), предпочтительным является то, что изменение является заменой, такой как замена из нативной аминокислоты в А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно в Р, Y, W, Н, F, Т, I или V, даже более предпочтительно в Р, Y, или W и наиболее предпочтительно в Р. В SEQ ID NO: 2 этой нативной аминокислотой в положении 573 является K, таким образом, замена в K не является предпочтительной.
В положении 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов), предпочтительным является то, что изменение является заменой, такой как замена из нативной аминокислоты в А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно в D, F, G, Н, N, S или Y, даже более предпочтительно в Н, D, F или G и наиболее предпочтительно в Н. В SEQ ID NO: 2 нативной аминокислотой в положении 574 является K, таким образом, замена в K не является предпочтительной.
В положении 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов), предпочтительным является то, что изменение является заменой, такой как замена из нативной аминокислоты А, С, D, Е, F, G, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, более предпочтительно в K или R, наиболее предпочтительно в K. В SEQ ID NO: 2 нативной аминокислотой в положении 580 является Q, таким образом, замена в Q не является предпочтительной.
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 550 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492D + 550K (например, SEQ ID NO: 231), или 492G + 550K (например, SEQ ID NO: 240).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 573 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492F + 573P (например, SEQ ID NO: 109), 492G + 573P (например, SEQ ID NO: 110), 492H + 573P (например, SEQ ID NO: 111) или 492R + 57 (например, SEQ ID NO: 113) или более предпочтительно 492D + 573P (например, SEQ ID NO: 108). Однако предпочтительно этот вариант не состоит из SEQ ID NO: 2 только с изменениями 492G + K573A, E492G + K573A, E492G + N503K + K573A, E492G + N503H + K573A, E492G + K573P, E492G + N503K + K573P или E492G + N503H + K573P.
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492D + 574H (например, SEQ ID NO: 232), 492G + 574H (например, SEQ ID NO: 241) или 492D + 574H (например, SEQ ID NO: 232).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов).
Вариантный альбумин может содержать изменения, соответствующие положениям 550 + 573 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать D550K + K573P (например, SEQ ID NO: 117).
Вариантный альбумин может содержать изменения в положениях 550 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 550K + 574H (например, SEQ ID NO: 130), 550М + 574H (например, SEQ ID NO: 249), 550M + 574H (например, SEQ ID NO: 249) или 550L + 574H (например, SEQ ID NO: 245).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 550 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 550K + 580K (например, SEQ ID NO: 131), 550М + 580K (например, SEQ ID NO: 251) или 550L + 580K (например, SEQ ID NO: 247).
Вариантный альбумин может содержать изменения, соответствующие положениям 573 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 574D + 573P (например, SEQ ID NO: 121), 574F + 573P (например, SEQ ID NO: 122), 574G + 573P (например, SEQ ID NO: 123), 574H + 573P (например, SEQ ID NO: 124), 574N + 573P (например, SEQ ID NO: 125) или 574S + 573P (например, SEQ ID NO: 126). Предпочтительно, этот вариант не состоит из SEQ ID NO: 2 только с изменениями K573P + K574N + A577T + A578R + S579C + Q580K + A581 D + G584A.
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 573 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 580K + 573Р (например, SEQ ID NO: 128) или 580R + 573P (например, SEQ ID NO: 129). Однако предпочтительно этот вариант не состоит из SEQ ID NO: 2 только с изменениями K573P + A577E + A578S + Q580K + A582T.
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 550 + 573 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов) Такие изменения могут содержать 492G + 550K + 573P (например, SEQ ID NO: 254) или 492D + 550K + 573P (например, SEQ ID NO: 253).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 550 + 574 SEQ ED NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать E492G + D550K + K574H (например, SEQ ID NO: 255).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 550 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492D + 550K + 580K (например, SEQ ID NO: 258) или 492G + 550K + 580K (например, SEQ ID NO: 259).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 573 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492D + 573P + 574H (например, SEQ ID NO: 233).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 573 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492D + 573P + 580K (SEQ ID NO: 234) или 492G + 573P + 580K (например, SEQ ID NO: 242).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492D + 574H + 580K (SEQ ID NO: 262) или 492G + 574H + 580K (например, SEQ ID NO: 263).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 550 + 573 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 550K + 574H + 573Р (например, SEQ ID NO: 131), 550L + 573P + 574H (например, SEQ ID NO: 246) или 550М + 573Р + 574H (например, SEQ ID NO: 250).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 550 + 573 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать (например, SEQ ID NO: 248) или 550М + 573Р + 580K (например, SEQ ID NO: 252).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 550 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 573 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 574H + 580K + 573Р (например, SEQ ID NO: 135).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 550 + 573 + 574 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492G + 550K + 573P + 574H (например, SEQ ID NO: 257) или 492D + 550K + 573P + 574H (например, SEQ ID NO: 256).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 550 + 573 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492D + 550K + 573P + 580K (например, SEQ ID NO: 260) или 492G + 550K + 573P + 580K (например, SEQ ID NO: 261).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 550 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 573 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492D + 573P + 574H + 580K (например, SEQ ID NO: 114) или 492G + 573P + 574H + 580K (например, SEQ ID NO: 115), 492F + 573P + 574G + 580K (например, SEQ ID NO: 238), 492G + 573P + 574G + 580K (например, SEQ ID NO: 234), 492D + 573P + 574G + 580K (например, SEQ ID NO: 235), 492F + 573P + 574H + 580R (например, SEQ ID NO: 239), 492D + 573P + 574H + 580K (например, SEQ ID NO: 264), 492G + 573P + 574H + 580R (например, SEQ ID NO: 244), 492D + 573P + 574H + 580R (например, SEQ ID NO: 236) или 492F + 573P + 574H + 580K (например, SEQ ID NO: 237).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 550 + 573 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 550K + 573Р + 574H + 580K (например, SEQ ID NO: 265).
Вариантный альбумин может содержать изменения в положениях, соответствующих положениям 492 + 550 + 573 + 574 + 580 SEQ ID NO: 2 (или эквивалентном положении других альбуминов или вариантов или их фрагментов). Такие изменения могут содержать 492D + 550K + 573P + 574H + 580K (например, SEQ ID NO: 266) или 492G + 550K + 573P + 574H + 580K (например, SEQ ID NO: 267). Такие изменения могут содержать 492D + 550K + 573P + 574H (например, SEQ ID NO: 256).
Особенно предпочтительные варианты включают в себя:
вариантный альбумин, содержащий изменения, соответствующие положениям 492 и 580 SEQ ID NO: 2, такие как (i) E492G и Q580K, или (ii) E492D и Q580K (или эквивалентным положениям других альбуминов или вариантов или его фрагмента);
вариантный альбумин, содержащий изменения, соответствующие положениям 492 и 574 в SEQ ID NO: 2, такие как (i) E492G и K574H, (ii) E492D и K574H, (iii) E492D и K574K, или (iv) E492G и K574K (или эквивалентным положениям других альбуминов или вариантов или его фрагмента);
вариантный альбумин, содержащий изменения, соответствующие положениям 492 и 550 в SEQ ID NO: 2, такие как (i) E492G и D550K, или (ii) E492D и D550K (или эквивалентным положениям других альбуминов или вариантов или его фрагмента);
вариантный альбумин, содержащий изменения, соответствующие положениям 550 и 573 в SEQ ID NO: 2, такие как (i) D550K и K573P, (ii) D550L и K573P или (iii) D550M и K573P (или эквивалентным положениям других альбуминов или вариантов или его фрагмента);
вариантный альбумин, содержащий изменения, соответствующие положениям 550 и 574 в SEQ ID NO: 2, такие как (i) D550K и K574H, или (ii) D550L и K574H (или эквивалентным положениям других альбуминов или вариантов или его фрагмента);
вариантный альбумин, содержащий изменения, соответствующие положениям 550 и 580 SEQ ID NO: 2, такие как (i) D550M и Q580K, (ii) D550L и Q580K или (iii) D550K и Q580K (или эквивалентным положениям других альбуминов или вариантов или его фрагмента);
вариантный альбумин с изменениями (например, содержащий изменения) в положениях, соответствующих положениям 580 и 573 в SEQ ID NO: 2, таким как Q580K и K573P (или эквивалентным положениям других альбуминов или вариантов или его фрагмента) и предпочтительно одно или более (несколько) других изменений, например, в положении, выбранном из 492, 550 и 574. Если К находится в положении 580 и Р в положении 573, предпочтительно этот полипептид содержит дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550 и 574.
вариантный альбумин с изменениями (например, содержащий изменения) в положениях, соответствующих положениям 492 и 573 в SEQ ID NO: 2, такой как вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 492 и 573 в SEQ ID NO: 2, такие как (i) E492D и K573P или (ii) E492G и K573P или (iii) E492G и K573A (или эквивалентных положениях других альбуминах или вариантов или их фрагмента), и предпочтительно одно или более (несколько) других изменений, например, в положении, выбранном из 550, 574 и 580. Если имеется G в положении 492 и А или Р в положении 573, предпочтительно этот полипептид содержит дополнительное изменение в положении, выбранном из группы, состоящей из 550, 574 и 580 (или эквивалентных положениях других альбуминов или вариантов или их фрагменте);
вариантный альбумин с изменениями (например, содержащий изменения) в положениях, соответствующих положениям 573 и 574 в SEQ ID NO: 2, такие как K573P и K574H (или эквивалентных положениях других альбуминов или вариантов или их фрагмента, и предпочтительно одним или более (несколькими) изменениями, например, в положении, выбранном из 492, 550 и 580. Если имеется Р в положении 573 и в положении 574, предпочтительно этот полипептид содержит дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550 и 580 (или эквивалентных положениях других альбуминов или вариантов или их фрагмента);
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 574 и 580 SEQ ID NO: 2, такие как 574H и 580K (или эквивалентным положениям других альбуминов или вариантов или их фрагмент. Если имеется N в положении 574 и K в положении 580, предпочтительно этот полипептид содержит дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550 и 573 (или эквивалентных положениях других альбуминов или вариантов или их фрагмента);
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 492, 550 и 573 в SEQ ID NO: 2, такие как E492G, D550K и K573P, например, SEQ ID NO: 254, или такие как E492D, D550K и K573P, например, SEQ ID NO: 253;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 550, 573 и 580 в SEQ ID NO: 2, такие как D550K, K573P и Q580K, например, SEQ ID NO: 133;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 550, 573 и 580 в SEQ ID NO: 2, такие как D550K, K573P и Q580K, например, SEQ ID NO: 248, или такие, как D550M, K573P и Q580K, например, SEQ ID NO: 252;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 550, 573 и 574 в SEQ ID NO: 2, такие как D550K, K573P и K574H, например, SEQ ID NO: 246;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 550, 573 и 574 в SEQ ID NO: 2, такие как D550K, K573P и K574H, например, SEQ ID NO: 131;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 492, 573 и 580 в SEQ ID NO: 2, такие как E49G, K573P и Q580K, например, SEQ ID NO: 242;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 492, 573 и 580 в SEQ ID NO: 2, такие как E492D, K573P и Q580K, например, SEQ ID NO: 234;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 492, 550 и 574 в SEQ ID NO: 2, такие как Е492, D550K, K573P и Q580K, например, SEQ ID NO: 256;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 492, 550, 573 и 574 в SEQ ID NO: 2, такие как E492G, D550K и K573P и K574H, например, SEQ ID NO: 257;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 573, 574 и 580 в SEQ ID NO: 2, такие как K573P, K574H и Q580K, например, SEQ ID NO: 135;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 492, 573, 574 и 580 в SEQ ID NO: 2, такие как E492D, K573P, K574H и Q580K (или эквивалентных положениях других альбуминов или вариантов или их фрагментов), например, SEQ ID NO: 114;
вариантный альбумин, содержащий изменения в положениях, соответствующих положениям 492, 573, 574 и 580 в SEQ ID NO: 2, такие как E492G, K573P, K574H и Q580K (или эквивалентных положениях других альбуминов или вариантов или их фрагментов), например, SEQ ID NO: 115;
Предпочтительно, что изменение в положении 492 является консервативной относительно D или Е. Предпочтительно, что это изменение в положении 574 является консервативной относительно Н. Предпочтительно, что изменение в положении 580 является консервативной относительно K.
Преимущественно этот полипептид сохраняет по существу одну и ту же третичную структуру (или, для фрагмента, релевантную часть этой структуры), что и эталонный или исходный альбумин, такой как HSA. Квалифицированному в данной области специалисту понятен термин 'по существу одна и та же третичная структура', причем имеется в виду, что может предполагаться, некоторая степень вариации в третичной структуре, так как все белки имеют некоторую степень структурной пластичности (гибкости). Это относится особенно к полипептидам, имеющим более высокую аффинность связывания с FcRn, чем исходный или эталонный альбумин (например, HSA) имеет относительно к FcRn.
Один или более (несколько) из остатков His могут быть или могут сохраниться по сравнению с исходным альбумином. Например, со ссылкой на SEQ ID NO: 2, один или более (несколько) из следующих остатков His могут сохраняться: 3, 9, 39, 67, 105, 128, 146, 242, 247, 288, 338, 367, 440, 464, 510, 535. Один или несколько (несколько), предпочтительно все, из остатков His в домене I сохраняются (т.е. 3, 9, 39, 67, 105, 128, 146.). Один или более (несколько), предпочтительно все, из остатков His в домене II сохраняются (т.е. 242, 247, 288, 338, 367). Один или более (несколько), предпочтительно все, из остатков His в домене III сохраняются (т.е. 440, 464, 510, 535). Один или более (несколько) или все три из His 464, 510, 535 могут сохраняться.
Предпочтительно, что по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или 17 из этих дисульфидных связей альбумина сохраняются в этом полипептиде. Для полипептида, произведенного из полноразмерного альбумина, предпочтительно, чтобы все дисульфидные связи, обычно присутствующие в этом альбумине, сохранялись в этом полипептиде. Для полипептида, произведенного из фрагмента альбумина, предпочтительно, чтобы все дисульфидные связи, обычно присутствующие в этом фрагменте, сохранялись. Предпочтительно, что Cys34 (или эквивалент в альбуминах не человека) сохраняется.
Для всех аспектов этого изобретения партнеры по слиянию и/или конъюгаты могут содержать один или более (несколько) из: лиганда 4-1ВВ, 5-спирали, С-С хемокина человека, L105-хемокина человека, обозначенного как huL105_3, монокина, индуцированного гамма-интерфероном (MIG), частичного белка CXCR4B, РВР-белка тромбоцита (РВР), α1-антитрипсина, гомолога ACRP-30; компонента C1q С, комплемента, Аденоид-экспрессируемого хемокина (ADEC), aFGF; FGF-1, AGF, AGF-протеина, альбумина, этопозида, ангиостатина, вакцины Anthrax, антител, специфических в отношении коллапсина, антистазина, антител против Анти-TGF-бета-семейства, антитромбина III, АРМ-1; ACRP-30; Фамоксина, видов аполипопротеина, Арилсульфатазы В, b57-белка, ВСМА, бета-тромбоглобулина (бета-TG), bFGF; FGF2, факторов коагуляции крови, ВМР-процессирующего фермента Фурина, BMP-10, BMP-12, ВМР-15, ВМР-17, ВМР-18, ВМР-2 В, ВМР-4, ВМ Р-5, ВМР-6, ВМР-9, костного морфогенического Белка-2, кальцитонина, Калпаина-10а, Калпаина-10b, Калпаина-10с, Противораковой вакцины, Кабоксипептидазы, С-С-хемокина, МСР2, CCR5 варианта, CCR7, CCR7, CD11 a Mab, CD 137; Белка-рецептора 4-1 ВВ, CD20 Mab, CD27, CD27L, CD30, CD30-лигада, CD33-иммунотоксина, CD40, CD40L, CD52 Mab, белка Серебус, Хемокина эотаксина, Хемокина hlL-8, Хемокина hMCP1, Хемокина hMCPIa, Хемокина hMCPIb, Хемокина hMCP2, Хемокина hMCP3, Хемокина hSDFI b, Хемокина МСР-4, хемокина TECK и TECK-варианта, Хемокин-подобного белка IL-8M1 полноразмерного и зрелого, Хемокин-подобного белка IL-8M10 полноразмерного и зрелого, Хемокин-подобного белка полноразмерного и зрелого, полноразмерного и зрелого белка IL-8M3, Хемокин-подобного белка IL-8M8 полноразмерного и зрелого, Хемокин-подобного белка IL-8M9 полноразмерного и зрелого, Хемокин-подобного белка PF4-414 полноразмерного и зрелого, холерной вакцины, Хемокин-подобного белка PF4-426 полноразмерного и зрелого, Хемокин-подобного белка PF4M2, полноразмерного и зрелого, холерной вакцины, Хондромодулин-подобного белка, c-kit-лиганда; SCF; Фактора роста тучных клеток; MGF; произведенного из саркомы фактора стволовых клеток, CNTF и его фрагмента (такого как CNTFA×15'' (Axokine™)), факторов коагуляции как в пре-, так и в активной форме, коллагенов, Mab комплемента С5, активирующего соединительную ткань белка-III, СТАА16.88-Mab, СТАР-III, CTLA4-Ig, CTLA-8, СХС3, СХС3, CXCR3; рецептора 3 хемокина СХС, циановирина-N, Дарбепоэтина, разработанного exodus, разработанного huL105_7., DIL-40, DNказы, EDAR, Mab EGF-рецептора, ENA-78, Эндостатина, Эотаксина, активирующего эпителиальные нейтрофилы белка-78, рецептора ЕРО; EPOR, эритропоэтина (ЕРО) и ЕРО mimics, Эутропина, белка Exodus, Фактора IX, Фактора VII, Фактора VIII,, ингибиторного белка FAS-лиганда (DcR3), FasL, FasL, FasL, FGF, FGF-12; гомологичного фактора-1 фактора роста фибробластов, FGF-15, FGF-16, FGF-18, FGF-3; INT-2, FGF-4; гелонина, HST-1; HBGF-4, FGF-5, FGF-6; гепарин-связывающего секретируемого трансформирующего фактора-2, FGF-8, FGF-9; активирующего нейроглию фактора, фибриногена, flt-1, flt-3-лиганда, Альфа-субъединиц фолликулостимулирующего гормона, Бета-субъединиц фолликулостимулирующего гормона, фоллитропина, Фракталкина, фрагмента, миофибриллярного белка Троронина I, FSH, Galactosidase, Галектина-4, G-CSF, GDF-1, генотерапевтического средства, произведенного из глиомы фактора роста, глюкагона, глюкагон-подобных пептидов, Глюкоцереброзидазы, глюкозооксидазы, Гликоделина-А; Прогестерон-ассоциированного белка эндометрия; GM-CSF, гонадатропина, Гранулоцитарного хемотактического белка-2 (GC Р-2), гранулоцитарно-макрофагального колониестимулирующего фактора, гормона роста, относящегося к росту онкогена-альфа (GRO-alpha), относящегося к росту онкогена-бета (GRO-beta), относящемуся к росту онкогена-гамма (GRO-gamma), hAPO-4; TROY, hCG, Антигена поверхности Гепатита В, вакцины от гепатита В, Mab рецептора HER2b, гирудина, HIV gp120, HIV gp41, ингибиторного пептида HIV, ингибиторного пептида HIV, ингибиторного пептида HIV, ингибирующих протеазу HIV пептидов, ингибиторов протеазы HIV-1, HPV вакцины, белка 6CKine человека, белка Act-2 человека, ингибиторного фактора адипогенеза человека, рецептора стимулирующего В-клетки фактора-2 человека, бета-хемокина H1305 человека (МСР-2), С-С-хемокина DGWCC человека, белка ELC хемокина СС человека, интерлейкина С хемокина типа СС человека, белка ССС3 человека, хемокина CCF18 человека, белка хемокина СС-типа человека, названного SLC (вторичного лимфоидного хемокина), коротких форм хемокина бета-8 человека, хемокина С10 человека, хемокина СС-2 человека, хемокина СС-3 человека, хемокина CCR-2 человека, хемокина Ckbeta-7 человека, хемокина ENA-78 человека, хемокина эотаксина человека, GRO альфа хемокина человека, хемокина GRO бета человека, хемокина НСС-1 человека, хемокина I-309 человека, хемокина IP-10 человека, хемокина L105_3 человека, хемокина L105_7 человека, хемокина MIG человека, белка хемокина MIG-бета человека, хемокина MIP-1-альфа человека, хемокина MIP1-бета человека, хемокина MIP-3alpha человека, хемокина MIP-3бета человека, хемокина PF4 человека, белка 331D5 хемокина человека, белка 61164 хемокина человека, рецептора CXCR3 хемокина человека, SDFI альфа хемокина человека, SDFI бета хемокина человека, ZSIG-35 хемокина человека, белка Chr19Kine человека, CKbeta-9 человека, CKbeta-9 человека, хемокина аминокислоты СХ3С 111 человека, интерлейкина-40 DNAX человека, хемокина С-С DVic-1 человека, последовательности белка EDIRF I человека, последовательности белка EDIRF II человека, эотаксина хемокина эозината типа СС человека, эозинофил-экспрессируемого хемофила человека (EEC), тропонина С скелетной мышцы человека с частым подергиванием, тропонина I скелетной мышцы человека с частым подергиванием, тропонина С скелетной мышцы человека с частым подергиванием, субъединицы С тропонина скелетной мышцы человека с частым подергиванием, субъединицы I белка тропонина скелетной мышцы человека с частым подергиванием, тропонина С скелетной мышцы человека с частым подергиванием Субъединицы Т Тропонина скелетной мышцы человека с частым подергиванием, Тропонина Т скелетной мышцы человека с частым подергиванием, хемокина, экспрессируемого фетальной селезенкой, FSEC, рецептора GM-CSF человека, хемокина gro-альфа человека, хемокина gro-бета человека, хемокина gro-гамма человека, белка IL-16 человека, последовательности белка IL-1RD10 человека, IL-1RD9 человека, альфа-цепи рецептора IL-5 человека, рецептора IL-6 человека, белка hiL8RA IL-8 рецептора человека, белка hiL8RB IL-8 рецептора человека, белка IL-9-рецептора человека, варианта #3 рецепторного белка IL-9 человека, фрагмента варианта рецепторного белка IL-9 человека, варианта фрагмента #3 рецепторного белка IL-9 человека, интерлейкина 1 дельта человека, интерлейкина 10 человека, интерлейкина 18 человека, производных интерлейкина 18 человека, бета-предшественника интерлейкина-1 человека, дополнительного белка рецептора интерлейкина человека, бета-антагониста рецептора интерлейкина-1 человека, рецептора интерлейкина-1 типа 3 человека, интерлейкина-10 человека (предшественника), рецептора интерлейкина-11 человека, субъединицы 40 кДа интерлейкина-12 человека, бета-1 рецептора интерлейкина-12 человека, бета-2 рецептора интерлейкина-12 человека, белка р35 интерлейкина-12 человека, белка р40 интерлейкина-12 человека, рецептора интерлейкина-12 человека, альфа-рецептора интерлейкина-13 человека, бета-рецептора интерлейкина-13 человека, интерлейкина-15 человека, рецептор интерлейкина-15 из клона Р1, рецептора интерлейкина-17 человека, белка интерлейкина-18 (IL-18), человека, интерлейкина-3 человека, рецептора интерлейкина-3 человека, варианта интерлейкина-3 человека, рецептора интерлейкина-4 человека, интерлейкина-5 человека, интерлейкина-6 человека, интерлейкина-7 человека, интерлейкина-7 человека, интерлейкина-8-(1b-8) человека, внутриклеточного антагониста IL-1-рецептора человека, слитого белка гипервариабельного района IP-10 и HIV-1 gp120 человека, слитого белка IP-10 человека и срединного эпитопа Muc-1 (VNT) человека, регулируемого печенью человека и активацией хемокина (LARC), полноразмерного и зрелого белка Lkn-1 человека, ассоциированного с молочной железой (MACK) белка, полноразмерного и зрелого хемокина Ckbeta-7 человека, зрелого gro-альфа человека, зрелого gro-gamma-полипептидва человека, используемого для лечения сепсиса, слитого белка МСР-3 человека и корового эритопа Muc-1 человека (VNT), белка Ml10 человека, белка MI1A человека, хемоаттрактантного моноцитарного фактора hMCP-1 человека, хемоаттрактантного моноцитарного фактора hMCP-3 человека, моноцитарной хемотактической последовательности пропротеина (МСРР) человека, хемокин-подобного домена нейротактина человека, хемокина non-ELR СХС HI74 человека, хемокина non-ELR СХС Mig человека, мутантов PAI-1 человека, белка человека с IL-16-активностью, белка человека с активностью IL-16, белка человека с активностью IL-16, вторичного лимфоидного хемокина (SLC) человека, белка SISD человека, белка STCP-1 человека, полученного из стромальных клеток хемокина SDF-1 человека, экспрессируемого Т-клеточной смешанной реакцией лимфоцитов хемокина (ТМЕС), регулируемого тимусом и регулируемого тимусом и активацией цитокина (TARC), экспрессированного тимуса человека, TNF-альфа человека TNF-альфа человека, TNF-бета (LT-альфа), последовательности белка 3 эотаксина типа СС человека, рецептора интерлейкина-1 типа II человека, белка интерлейкина-4 дикого типа (h1L-4), белка ZCHEMO-8 человека, Гуманизированных анти-VEGF антител и антител и их фрагментов, гиалуронидазы, ICE 10 кДа субъединиц, ICE 20 кДа единиц, ICE 22 кДа единиц идуронат-2-сульфатазы, идуронидазы, IL-1 альфа, IL-1 бета, IL-1-ингибитора (IL-1i) IL-1 зрелого, IL-10-рецептора, IL-1, IL-11, IL-12 p40 субъединиц, IL-13, IL-14, IL-15, IL-15-рецептора, IL-17, IL-17-рецептора, 11-17 рецептора, IL-19, фрагментов IL-1, антагониста IL1-рецептора, IL-21 (TIF), IL-3 содержащего слитого белка IL-3-мутантных белков, IL-3-вариантов, IL-4, IL-4-мутеина, IL-4-мутеина Y124G, IL-4-Y124X, IL-4 мутеинов, IL-5-рецептора, IL-6, IL-6-рецептора, клона IL-7-рецептора IL-8-рецептор, IL-9 варианта зрелого белка (версии Met117), иммуноглобулинов или молекул на основе иммуноглобулинов или фрагмента каждого (например, Small Modular ImmunoPharmaceutical™ ("SMIP") или dAb, Fab'-фрагменты, F(ab')2, scAb, scFv или scFv-фрагмент), включающие в себя но не ограничивающиеся ими, плазминоген, противогриппозную вакцину, Инхибин альфа, Инхибин бета, инсулин, инсулиноподобный фактор роста, Интегрина Маб, интер-альфа-трипсин-ингибитор, интерферон-гамма-индуцируемый белок (IP-10), интерфероны (такие как виды интерферона альфа и подвиды, виды интерферона бета и подвиды, виды интерферона гамма и подвиды), интерфероны (такие как виды интерферона альфа и подвиды, виды интерферона бета и подвиды, виды интерферона гамма и подвиды), Интерлейкин 6, рецептор Интерлейкина-8 (IL-8), рецептор В Интерлейкина 8, Интерлейкин-1 альфа, ассоциированный с рецептором интерлейкина-2 белок р43, интерлейкин-3, мутеины интерлейкина-4, белок интерлейкина-8 (IL-8), интерлейкин-9, зрелый белок интерлейкина-9 (IL-9) (версия Thr117), интерлейкины (такие как IL-10, IL-11 и IL-12), интерлейкины, такие как (IL-10, IL-11 и IL-12), Вакцина Японского энцефалита, ингибитор Каликреина, фактор роста Кератиноцитов, белок домена Кунитца (такой как апротинин, белок-предшественник амилоида и белки, описанные в WO 03/066824 со слияниями с альбумином или без альбумина), LACI, лактоферрин, латентный TGF-бета связывающий протеин II, лептин, экспрессируемый печенью хемокина-1 (LVEC-1), экспрессируемый печенью хемокин-2 (LVEC-2), LT-альфа, LT-бета, Лютеинизирущий гормон, вакцина Лима, Лимфотактин, произведенный из Макрофага аналог хемокина MDC (n + 1), произведенный из Макрофага аналог хемокина MDC-eyfy, произведенный из Макрофага аналог хемокина MDC-y1, произведенный из Макрофага хемокин, (MDC), Маспина; Протеазный Ингибитор 5, рецептор МСР-1, MCP-1a, MCP-1b, МСР-3, рецептор МСР-4, M-CSF, ингибирующий меланому белок, мембраносвязывающие белки, Met117 интерлейкин 9 человека, MIP-3 альфа, MIP-3 бета, MIP-гамма, MIRAP, Модифицированный Rantes, моноклональное антитело, МР52, мутантный Интерлейкин 6 S176R, миофибриллярный контрактильный белок Тропонин I, Натриуретический пептид, Фактор-бета роста нерва, Фактор-бета 2 роста нерва, Нейропилин-2, Нейротактин, Нейротрофин-3, Нейротрофин-4, Нейротрофин-4а, Нейротрофин-4b, Нейротрофин-4 с, Нейротрофин-4d, Нейтрофил-активирующий пептид-2, (NAP-2), Рецептор NOGO-A, NOGO-B, NOGO-C, Новый бета-хемокин, названный РТЕС, N-концевой модифицированный хемокин GroHEK/hSDF-1 альфа, N-концевой модифицированный хемокин GroHEK/hSDF-1 бета, N-концевой модифицированный хемокин met-hSDF-1 бета, OPGL, Остеогенный Белок-1; ОР-1; ВМР-7, Остеогенный Протеин-2, ОХ40; АСТ-4, OX40L, Окситоцин (Нейрофизин I), паратиреоидный гормон, Patched, Patched-2, PDGF-D, токсоид коклюша, экспрессируемый в гипофизе хемокин (PGEC), Плацентарный фактор роста, Плацентарный фактор роста-2, Ингибитор 1 Активатора Плазминогена; PAI-1, ингибитор-2 активатора плазминогена, PAI-2, ингибитор 2 активатора плазминогена; PAI-2, произведенный из тромбоцитов фактора роста Bv-sis, произведенный из тромбоцитов предшественник А фактора роста, произведенный из предшественника В фактор роста, Mab тромбоцитов, произведенный из тромбоцитов фактор роста эндотелиальных клеток (PD-ECGF), произведенный из тромбоцитов А-цепи фактора роста, произведенный из тромбоцитов В-цепи фактор роста, полипептид, используемый для лечения сепсиса, вариант Препроаполипопротеина "milano", вариант Прероаполипопротеина "paris", пре-тромбин, хемокин примата СС "ILINCK", хемокин примата СХС "IBICK", проинсулин, пролактин, Пролактин-2, просаптид, пептидов ингибиторов протеазы, Протеина С, Протеин S, про-тромбин, проурокиназа, RANTES, RANTES 8-68, RANTES 9-68, пептид RANTES, рецептор RANTES, Рекомбинантный интерлейкин-16, Резистин, рестриктоцин, ингибиторы ретровирусной протеазы, рицин, Вакцины Ротавируса, RSV Mab, сапорин, сарцин, секретируемые и трансмембранные полипептиды, сывороточная холинэстераза, сывороточный белок (такой как фактор свертывания крови), растворимый белок-3 киназы BMP-рецептора, растворимый рецептор VEGF, ингибиторный фактор стволовых клеток, стафилококковая вакцина, происходящий из стромы Фактор-1-альфа, происходящий из стромы Фактор-1 бета, вещество Р (тахикинин), пептид Т1249, пептид Т20, Эндонуклеаза Т4, TACI, Tarc, TGF-бета 1, TGF-бета 2, Thr117 интерлейкин 9 человека, тромбин, тромбопоэтин, производное-1 Тромбопоэтина, производное-2 Тромбопоэтина, производного-3 Тромбопоэтина-4, производного-5 Тромбопоэтина, производного-6 Тромбопоэтина, производного-7 Тромбопоэтина, Экспрессируемый вилочковой железой (тимусом) хемокин (TECK), стимулирующий щитовидную железу гормон, tick антикоагулянтный пептид, Tim-1-белок, предшественник TNF-альфа, рецептор TNF-R, TNF-RII; TNF р75; Рецептор смерти, tPA, трансферрин, трансформирующий фактор роста бета, пептиды тропинина, укороченный хемотактический белок 2 моноцитов (6-76), укороченный белок RANTES (3-68), фактор некроза опухоли, уратоксидаза, урокиназа, Вазапрессин (Нейрофизин II), VEGF R-3; flt-4, рецептор VEGF; KDR; flk-1, VEGF-110, VEGF-121, VEGF-138, VEGF-145, VEGF-162, VEGF-165, VEGF-182, VEGF-189, VEGF-206, VEGF-D, VEGF-E; VEGF-X, фактор фон-Виллебранда, хемотаксический белок 2 моноцита, хемотаксический белок 2 моноцита дикого типа, ZTGF-бета 9, альтернативные антителам каркасы, например, антикалин (антикалинов), аднектин (аднектинов), фрагмента (фрагментов) фибриногена, нанотел, таких как нанотела верблюдовых, инфестин, или любые из молекул, упомянутых в WO 01/79271 (в частности, стр. 9 и/или в Таблице 1), WO 2003/59934 (в частности, в Таблице 1), WO 03/060071 (в частности, в таблице частности, Таблице 1) или WO 01/079480 (в частности, в Таблице 1) (каждая включена здесь посредством ссылки в их полном виде).
Кроме того, конъюгаты могут содержать одно или более (несколько) химиотерапевтических лекарственных средств, таких как: 13-цис-ретиноевая кислота, 2-CdA, 2-хлордезоксиаденозин, 5-Азацитидин, 5-флорурацил, 5-FU, 6-меркаптопурин, 6-МР, 6-TG, 6-тиогуанин, А, Абраксан, Аккутан®, Актиноицин-D, Адриомицин®, Адруцил®, Аргулин®, Ала-Корт®, Альдеслейкин, Алемтуцумаб, АЛИМЕТА, Алитретиноин, Алкабан-AQ®, Алкеран®, All-трансретиноевая кислота, Альфа-Интерферон, Алтретамин, Аметоптерин, Амифостин, Аминоглутетимид, Анагрелид, Анандрон®, Анастразол, Арабинозилцитозин, Ара-С, Аранесп®, Аредиа®, Аримидекс®, Аромазин®, Арранон®, Арсеник Триоксид, Аспарагиназа, ATRA, Авастин®, Азацитидин, BCG, BCNU, Бевацицумаб, Бексарутен, BEXXAR®, Бикалутамид, BiCNU, Бленоксан®, Блеомицин, Бортезомиб, Бусульфан, Бусульфекс®, С225, Кальций Лейковарин, Кампат®, Камптозар®, Камптотетин-11, Капецитабин, Карак™, Карбоплатин, Крмустин, Кармустин Вафер, Казодекс®, СС-5013, CCNU, CDDP, CeeNU, Церубидин®, Цетуксимаб, Хлорамбуцил, Цисплатин, Цитроворум Фактор, Кладрибин, Кортизон, Космеген®, СРТ-11, Циклофосфамид, Цитадрен®, Цитарабин, Цитарабин Липосомал, Цитосар-U®, Цитоксан®, Дакарбазин, Дакоген, Дактиномцин, Дарбероэтин Альфа, Дазатиниб, Дауномицин, Даунорубицин, Гидрохлорид Даунорубицина, Даунорубицин Липосомал, ДауноКсом®, Декадрон, Децитабин, Дельта-Кортеф®, Дельтасон®, Денилейкин дифтитокс, Депоцит™, Дексаметазон, Дексаметазона ацетат, Декаметазон Фосфат натрий, Дексазон, Декразоксан, DHAD, DIC, Диодекс, Доцетаксел, Доксил®, Доксорубицин, Доксорубицин липосомал, Дроксиа™, DTIC, DTIC-Доме®, Дуралон®, Эфудекс®, Элигард™, Элленсе™, Элоксатин™, Элспар®, Эмцит®, Эпирубицин, Эпоэтин альфа, Эрбитукс™, Эрлотиниб, Эрвиниа-Ь-аспарагиназа, Эстрамустин, Этиол, Этопофос®, Этопозид, Этопозид Фосфат, Эулексин®, Эвиста®, Экземестан, Фарестон®, Фаслодекс®, Фемара®, Филграстим, Флоксуридин, Флудара®, Флударабин, Флуроплекс®, Фтороурацил, Фтороурацил (крем), Флуоксиместерон, Флутамид, Фолиновая кислота, FUDR®, Фульвестрант, G-CSF, Гефитиниб, Гемцитабин, Гемтуцумаб озогамицин, Гемзар®, Глеевек™, Плиадел® Вафер, GM-CSF, Госерелин, Колониестимулирующий фактор Гранулоцитов, Колониестимулирующий фактор Макрофагов, Галотестин®, Герцетин®, Гексадрол, Гексален®, гексаметилмеланин, НММ, Гикамптин®, Гидреа®, Гидрокорт Ацетат®, Гидрокортизон, Натрий Фосфат Гидрокортизона, Натрий Сукцинат Гидрокортизона, Фосфат гидрокортизона, Гидроксимочевина, Ибритумомаб, Ибритумомаб Тиуксетан, Идамицин®, Идарубицин, Iфекс®, IFN-альфа, Ифосфамид, IL-11, IL-2, Иматиниб мезилат, Имидазол Карбоксамид, Интерферон альфа, Интерферон Альфа-2b (PEG Конъюгат), интерлейкин-2, интерлейкин-11, Интрон А® (иньеоферон альфа-2b), Иресса®, Иринотекан, Изотретиноин, Кидролаза®, Ланакорт®, Лапатиниб, L-аспарагиназа, LCR, Леналидомид, Летрозол, Лейковарин, Лейкеран, Лейкин™, Лейпролид, Лейрокристин, Лейстатин™, Липлсомал Ara-С, Ликвид Пред®, Ломустин, L-PAM, L-Сарколизин, Лупрон®, Лупрон Depot®, М, Матулан®, Максидекс, Меклоретамин, гидрохлорид Меклоретамина, Медралон®, Медрол®, Мерасе®, Мегестрол, Ацетат Мегестрола, Melphalan, Меркаптопурин, Месна, Меснекс™, Метотрексат, Метотрексат-натрий, Метилпреднизолон, Метикортен®, Митомицин, Митомицин-С, Митоксантрон, М-Преднизол®, МТС, МТХ, Мустраген®, Мустин, Мутамицин®, Милеран®, Милоцел™, Милотарг®, Navelbine®, Неларабин, Неозар®, Нейласта™, Неймега®, Нейпоген®, Нексавар®, Ниландрон®, Нилутамид, Нипет®, Нитроген Мустард, Новалдекс®, Новантрон® Октреотид, ацетат Октреотида, Онкоспар®, Онковин®, Онтак®, Онксал™, Опревелкин, Орапред®, Оразон®, Оксалиплатин, таксол или производное таксола, например, Паклитаксел или связанный с белком паклитаксел, Памидронат, Панитумумаб, Панкретин®, Параплатин®, Педиапред®, PEG-интерферон, PEG-аспаргаза, PEG-филграстим, PEG-INTRON™, PEG-L-asparaginase, PEMETREXED, Пентостатин, Фенилаланин Mustard, Платинол®, Платинол-AQ®, Преднизолон, Преднизон, Прелон®, Прокарбазин, PROCRIT®, Пролейкин®, Пролифероспан 20 с имплантатом Кармустина, Пуринетол®, R, Ралоксифен, Ревилимид®, Ревматрекс®, Ритуксан®, Ритуксимаб, Роферон-А® (Интерферон Альфа-2а), Рубеке®, гидрохлорид Рубидомицина, Сандрстатин®, Сандостатин LAR®, Сарграмостим, Солу-Бош-Кортеф®, Солу-Медрол®, Сорафениб, SPRYCEL tm, стрептозоцин, SU11248, Сунитиб, Сутент®, Тамоксифен, Тарсева®, Таргретин®, Таксол®, Таксотере®, Темодар®, Темозоломид, Тенипозид, TESPA, Талидомид, Таломид®, TheraCys®, Тиогуанин, Тиогуанин Таблоид®, Тиофосфоамид, Тиоплекс®, Тиотепа, TICE®, Топозар®, Топотекан, Торомифен, Тозитумомаб, Трастуцумам, Tretinoin, Трексалл™, Трисенокс®, TSPA, TYKERB®, VCR, Вестибикс™, Велбан®, Велкаде®, Вепезид®, Везаноид®, Виадур™, Видаза®, Винбластин, Сульфат винбластина, Винказар Pfs®, Винкристин, Винорелбин, тартрат Винорелбина, VLB, VM-26, Вориностат, VP-16, Вумон®, Кселода®, Цанозар®, Цевалин™, Цинекард®, Цоладекс®, Цоледроновая кислота, Цолинза, Помета®; радиофармацевтические средства, такие как Углерод - 11, Углерод - 14, Хром - 51, Кобальт - 57, Кобальт - 58, Эрбий - 169, Фтор - 18, Галлий - 67, Золото - 198, Индий - 111, Индий - 113m, Йод - 123, Йод -125, Йод - 131, Железо - 59, Криптон - 81 т, Азот - 13, Кислород - 15, Фосфор - 32, Рений - 186, Рубидий - 82, Самарий - 153, Селен - 75, Стронций - 89, Технеций - 99m, Таллий - 201, Тритий, Ксенон - 127, Ксенон - 133, Иттрий - 90; Тритий, Ксенон - 127, Ксенон - 133, иттрий - 90; визуализирующие агенты, такие как Гадолиний, магнетит, марганец, технеций, I125, I131, Р32, TI201, лопамидол, РЕТ-FDG.
Дополнительные партнеры по слиянию, партнеры по конъюгации и/или молекулы для включения в наночастицу, ассоциат или композицию по этому изобретению включают в себя: лекарственные средства для акромегалии, например, соматулин, ланреотид, октреотид, Сандостатин, антитромботические средства, например, бивалирудин, Ангиомакс, далтерапин, Фрагмин, эноксапарин, Ловенокс, Дротрекогин альфа (например, Активированный), Хигрис, гепарин; вспомогательные соединения репродуктивной терапии, например, хориогонадотропин, Овидрел, фоллитропин, альфа/бета; ферменты, например, гиалуронидаза, Hylenex; лекарственные средства для диабета, например, экзенатид, Byetta, глюкагон, инсулин, лираглутид, албиглутида, агонисты GLP-1, экзендин или аналоги экзендина; соединения, применимые в диагностике, например, протирелин, Thyrel TRH Thypinone, секретин (например, синтетический секретин человека), Хиростим, тиротропин (например, альфа), Thyrogen в качестве лекарственного средства против эритропоэза (например, Дарбероэтин альфа, Аранесп, Эпоэтин альфа, Эпоген, Эпрекс, лекарственные средства для лечения генетических дефектов, например, пег-адемазе, лекарственные средства для лечения недостаточного роста, например, Адаген, мекасермин, ринфабат, лекарственные средства для лечения муковисцидоза, например, Дорназе альфа, Пулмозим, лекарственные средства для лечения метаболических нарушений, например, Агалзидазу бета, Фабразим, алглюкозид альфа, Миозим, Ларонидазу, Альдуразти, лекарственные средства для лечения проявлений остроконечной кондиломы, например, Интереферон альфа-n3, Алферон N, Лекарственные средства для лечения грануломатозного заболевания, например, Интерферон гамма-1, Интерферон гамма-1b, Актимуна; лекарственные средства для лечения недостаточного роста, например, пегвизомант, Сомаверт, соматропин, Генотропин, Нутропин, Гуматроп, Серостим, Протропин; лекарственные средства для лечения сердечной недостаточности, например, несеридит, Натрекор; лекарственные средства для лечения гемофилии, например, фактор свертывания, например, фактор VIII, геликсат FS, Когенат FS, Фактор ГХ, БенеФикс, Фактор Vila, Новосевен, десмопрессин, Стимат, DDAVP; гемопоэтические лекарственные средства, например, Филграстим (G-CSF), Неупоген, Опелвекин, Неумега, PTG-филграстим, Неуласта, Сарграорстим, Лейкин; лекарственные средства для лечения гепатита С, например, Интерферон альфа-2а, Роферон А, Интерферон альфа 2а, Интрон А, Интерферон альфакон-1, Инферген, PEG-интерферон альфа-2а, PEG-асис, PEG-интерферон альфа-2b, PEG-интрон; лекарственные средства для лечения HIV, например, энффувиртид, Фузеон; Fab, например, Fab (антитромбин), Абсиксимаб, ReoPro; Моноклональные антитела, например, Даклицумаб, Ценапакс; антивирусные моноклональные антитела, например, Паливипумаб, Синагис; моноклональные антитела для лечения астмы, например, Омалицумам, Ксолаир; моноклональные антитела для применения в диагностической визуализации, например, Арцитумомаб, СЕА-скан, Капромаб Пендетид, ПростаСцинт, Сатумомаб Пендетид, ОнкоСцинт CR/OV, Fab для применения в диагностической визуализации, например, Нофетумомаб, Верлима; Иммуносупрессантные моноклональные антитела, например, Базиликсимаб, Симулест, Муромонаб-CD3, Ортоклон OKT3; моноклональные антитела для лечения злокачественности, например, Алемтуцумаб, Сампраth, ибритумомаб тиуксетан, Цевалин, Ритуксимаб, Ритуксан, Трастуцумаб, Херсептин; моноклональные антитела для лечения ревматоидного артрита (RA), например, Адалимумаб, Хумира, Инфликсиаб, Ремикад; моноклональные антитела для применения в качестве радиоиммунотерапевтических антител, например, Тоситумомаб и Йод I131, Тоситумомаб, Bexxar; лекарственные средства для лечения дегенерации желтого пятна, например, пегаптаниб, Макуген; лекарственные средства для лечения злокачественности, например, Альдеслейкин, Пролейкин, интерлейкин-2, Аспарагиназа, Элспар, Расбуриказа, Элитек, Денилейкин дифтитокс, Онтак, Пегаспаргаза, Онкаспар, госерелин, леупролид; лекарственные средства для лечения рассеянного склероза (MS), например, Глатирамер ацетат (например, сополимер-1), Сопаксон, Интерферон бета-1a, Rebif, Авонекс, Интерферон бета-1b, Бетасерон; лекарственные средства для лечения мукозита (воспаления слизистой оболочки), например, палифермин, Кепиванс; лекарственное средство для лечения дистонии, например, нейротоксин, ботулинический Токсин Типа А, ТАКС, БОТАКС косметический, ботулинический Токсин Типа В, MYOBLOC; лекарственные средства для лечения остеопороза, например, терипаратид Фортео, Forteo; лекарственные средства для лечения псориаза, например, Алефацепт, Амевиве; лекарственные средства для лечения RA, например, абатасепт, Оренсиа, Анакира, Кинерет, Этанерсепт, Энбрель; тромболитические средства, например, Алтеплаза, Активаза, rtPA, Анистреплаза, Эминаза, Ретерплаза, Ретаваза, Стрептокиназа, Стрептаза, Тенистеплаза, ТМСаза, Урокиназа, Аббокиназа, Кинлитик; лекарственные средства для лечения остеопороза, например, кальцитонин (например, лосося), Миакальцин, Фортикал, лекарственные средства для лечения кожных язв, например, Бекаплермин, Regranex, Коллагеназу, Сантил.
Такие полипептиды и химические соединения могут, в общем, называться диагностическими частями, терапевтическими частями, профилактическими частями или полезными (целебными) частями.
Предпочтительно партнер по слиянию и/или партнер по конъюгации не является альбумином, вариантом или их фрагментом.
Один или более (несколько) терапевтических или профилактических полипептидов могут быть слиты с N-концом, С-концом альбумина, встроены в петлю в структуре альбумина или любой его комбинации. Она может содержать или может не содержать линкерные последовательности, разделяющие различные компоненты этого слитого полипептида.
Доктрины, относящиеся к слияниям альбумина или его фрагмента, известны в данной области и квалифицированному в данной области специалисту будет понятно, что такие доктрины могут быть также применены к этому изобретению. WO 2001/79271 А и WO 2003/59934 (включенные здесь посредством ссылки) также содержат примеры терапевтических и профилактических полипептидов, которые могут быть слиты с альбумином или его фрагментами, и эти примеры применимы также к этому изобретению.
Это соединение дополнительно определено в следующих вариантах осуществления:
1. Полипептид, который является вариантом альбумина, его фрагментом или слитым полипептидом, содержащим указанный вариантный альбумин или его фрагмент, имеющий измененную аффинность связывания с FcRn в сравнении с аффинностью связывания исходного альбумина, эталонного альбумина, его фрагмента или слитого полипептида, содержащего указанный исходный альбумин, эталонный альбумин или его фрагмент или слияние с FcRn, где этот полипептид содержит изменения в двух или более положениях, выбранных из положений, соответствующих положениям 492, 550, 573, 574 и 580 в SEQ ID NO: 2.
2. Полипептид по варианту осуществления 1, где этот полипептид содержит изменения в двух или более положениях, соответствующих положениям (а) 492 и 580; (b) 492 и 574; (с) 492 и 550; (d) 550 и 573; (е) 550 и 574; (f) 550 и 580 в SEQ ID NO: 2.
3. Полипептид по варианту осуществления 1 или 2, содержащий изменения в положениях, соответствующих положениям 492 и 580 SEQ ID NO: 1, дополнительно содержащий один или два (несколько) изменений в положениях, выбранных из группы, состоящей из 550, 573 и 574 SEQ ID NO: 2.
4. Полипептид по варианту осуществления 1, 2 или 3, содержащий изменения в положениях, соответствующих одному или более (нескольким) изменениям в положениях 492 и 574 SEQ ID NO: 1, дополнительно содержащий один или более (несколько) изменений в положениях, соответствующих положениям, выбранным из группы, состоящей из 550, 573 и 580 SEQ ID NO: 2.
5. Полипептид по любому предыдущему варианту осуществления, содержащий изменения в положениях, соответствующих положениям 492 и 550 SEQ ID NO: 1, дополнительно содержащий одно или более (несколько) изменений в положениях, соответствующих положениям, выбранным из группы, состоящей из 573, 574 и 580 SEQ ID NO: 2.
6. Полипептид по любому предыдущему варианту осуществления, содержащий изменения в положениях, соответствующих положениям 550 и 573 SEQ ID NO: 1, дополнительно содержащий одно или более (несколько) изменений в положениях, соответствующих положениям, выбранным из группы, состоящей из 492, 574 и 580 SEQ ID NO: 2.
7. Полипептид по любому предыдущему варианту осуществления, содержащий изменения в положениях, соответствующих положениям 550 и 574 SEQ ID NO: 1, дополнительно содержащий одно или более (несколько) изменений в положениях, соответствующих положениям, выбранным из группы, состоящей из 492, 573 и 580 SEQ ID NO: 2.
8. Полипептид по любому предыдущему варианту осуществления, содержащий изменения в положениях, соответствующих положениям 550 и 580 SEQ ID NO: 1, дополнительно содержащий изменение в положении, соответствующем положению, соответствующему положениям 492, 573 и 574 SEQ ID NO: 2.
9. Полипептид по любому предыдущему варианту осуществления, в котором:
(a) в положении, соответствующем положению 492 в SEQ ID NO: 2, имеется изменение для получения в нем аминокислоты, выбранной из группы, состоящей из А, С, D, F, Н, I, K, L, М, N, Р, Q, R, S, Т, V, W, Y, предпочтительно D и в положении, соответствующем положению 573 в SEQ ID NO: 2, имеется изменение получения в нем аминокислоты, выбранной из группы, состоящей из С, D, Е, F, G, Н, I, L, М, N, Q, R, S, Т, V, W, Y, предпочтительно Y, W или Н, или
(b) в положении, соответствующем положению 492 в SEQ ID NO: 2, имеется изменение для получения в нем G и в положении 573 имеется изменение для получения в нем G и в положении, соответствующем положению 573, имеется изменение для получения в нем А или Р, и этот полипептид содержит дополнительное изменение в положении, выбранном из группы, состоящей из 550, 574 и 580 (или эквивалентных положениях других альбуминов или вариантов или их фрагментов).
10. Полипептид по любому предыдущему варианту осуществления, в котором:
(a) в положении, соответствующем положению 573 в SEQ ID NO: 2, имеется изменение для получения в нем аминокислоты из группы, состоящей из А, С, D, Е, F, G, Н, I, L, М, N, Q, R, S, Т, V, W, Y, предпочтительно Y, W или Н, и в положении, соответствующем положению 574 в SEQ ID NO: 2, имеется изменение для получения в нем аминокислоты из группы, состоящей из А, С, D, Е, F, G, Н, I, L, М, Р, Q, R, S, Т, V, W, Y, Н, D, F, G, N, S или Y, более предпочтительно Н, D, F или G, наиболее предпочтительно Н, или
(b) в положении, соответствующем положению 573 в SEQ ID NO: 2 имеется Р и в положении, соответствующем положению 574 в SEQ ID NO: 2, имеется N и этот полипептид содержит дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550 и 580 (или эквивалентных положений других альбуминов или вариантов или их фрагментов).
11. Полипептид по любому предыдущему варианту осуществления, в котором:
(a) в положении, соответствующем положению 573 в SEQ ID NO: 2, имеется изменение для получения в нем аминокислоты из группы, состоящей из А, С, D, Е, F, G, Н, I, L, М, N, Q, R, S, Т, V, W, Y, предпочтительно Y, W или Н, и в положении, соответствующем 580 в SEQ ID NO: 2, имеется изменение для получения в нем аминокислоты из группы, состоящей из С, D, Е, F, G, Н, I, L, М, N, Р, R, S, Т, V, W, Y, или
(b) в положении, соответствующем положению 573 в SEQ ID NO: 2, имеется изменение для получения в нем одного Р и в положении, соответствующем положению 580 в SEQ ID NO: 2, имеется изменение для получения в нем одного K, и этот полипептид содержит дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550 и 574 (или эквивалентных положений других альбуминов или вариантов или их фрагментов).
12. Полипептид по любому предыдущему варианту осуществления, в котором:
(а) в положении, соответствующем положению 574 в SEQ ID NO: 2, имеется изменение для получения в нем аминокислоты из группы, состоящей из А, С, D, Е, F, G, Н, I, М, Р, Q, R, S, Т, V, W, Y, Н, D, F, G, N, S или Y, более предпочтительно Н, D, F или G, наиболее предпочтительно H и в положении, соответствующем положению 580 в SEQ ID NO: 2, имеется изменение для получения в нем аминокислоты из группы, состоящей из А, С, D, Е, F, G, Н, I, L, М, N, Р, R, S, Т, V, W, Y, или
(b) в положении, соответствующем положению 574 в SEQ ID NO: 2, имеется изменение для получения в нем N и в положении, соответствующем положению 580 в SEQ ID NO: 2 имеется изменение для получения в нем K, и этот полипептид содержит дополнительное изменение в положении, выбранном из группы, состоящей из 492, 550 и 573 (или эквивалентных положений других альбуминов или вариантов или их фрагментов).
13. Полипептид по любому предыдущему варианту осуществления, где этот полипептид содержит изменения в трех или более положениях, выбранных из положений, соответствующих положениям 492, 550, 573, 574 и 580 в SEQ ID NO: 2.
14. Полипептид по любому предыдущему варианту осуществления, где это изменение в положении, соответствующем положению 492, 550, 573, 574 и/или 580, является заменой.
15. Полипептид по варианту 14, где замена в этом положении, соответствующем положению 492, является заменой на G, D, F, Н, М или R.
16. Полипептид по варианту 14 или 15, где замена в положении, соответствующем положению 492, является заменой на G или D.
17. Полипептид по любому из вариантов 13-15, где замена в положении, соответствующем положению 492, является заменой на G.
18. Полипептид по любому из вариантов 13-15, где замена в положении, соответствующем положению 492, является заменой на D.
19. Полипептид по любому из вариантов 13-18, где замена в положении, соответствующем положению 550, является заменой на K, L, М, Е или R.
20. Полипептид по любому из вариантов 13-19, где замена в положении, соответствующем положению 550, является заменой на K, L или М.
21. Полипептид по любому из вариантов 13-20, где замена в положении, соответствующем положению 550, является заменой на K.
22. Полипептид по любому из вариантов 13-21, где изменение в положении, соответствующем положению 573, является заменой на Р, Y, W, Н, F, Т, I или V.
23. Полипептид по любому из вариантов 13-22, где замена в положении, соответствующем положении 573, является заменой на W.
24. Полипептид по любому из вариантов 13-23, где замена в положении, соответствующем 573, является заменой на Р.
25. Полипептид по любому из вариантов 13-24, где изменение в положении, соответствующем положению 574, представлено заменой на Н, G, D, F, N, S или Y.
26. Полипептид по любому из вариантов 13-25, где замена в положении, соответствующем положению 574, является заменой на D, F, G или Н.
27. Полипептид по любому из вариантов 13-26, где замена в положении, соответствующем положению 574, является заменой на Н.
28. Полипептид по любому из вариантов 13-27, где замена в положении, соответствующем положению 580, является заменой на K или R.
29. Полипептид по любому из вариантов 13-28, где замена в положении, соответствующем положению 580, является заменой на K.
30. Полипептид по любому предыдущему варианту, где этот полипептид содержит изменения в положениях, соответствующих положениям (i) 573 и 580; (ii) 492 и 573; или (iii) 573 и 574 в SEQ ID NO: 2.
31. Полипептид по любому предыдущему варианту, где этот полипептид содержит изменения в двух или более положениях, соответствующих следующим положениям SEQ ID NO: 2: 580K + 573Р (например, SEQ ID NO: 128); 580R + 573Р (например, SEQ ID NO: 129); 574D + 573Р (например, SEQ ID NO: 121); 574F + 573P (например, SEQ ID NO: 122); 574G + 573P (например, SEQ ID NO: 123); 574H + 573P (например, SEQ ID NO: 124); 574N + 573P (например, SEQ ID NO: 125); 574S + 573P (например, SEQ ID NO: 126); 550K + 580K (например, SEQ ID NO: 132); 550K + 574H (например, SEQ ID NO: 130); 550K + 573P (например, SEQ ID NO: 117); 492D + 573P (например, SEQ ID NO: 108); 492F + 573P (например, SEQ ID NO: 109); 492H + 573P (например, SEQ ID NO: 111); 492R + 573P (например, SEQ ID NO: 112); 574H + 580K (например, SEQ ID NO: 134); 550L + 574H (например, SEQ ID NO: 245); 550L + 580K (например, SEQ ID NO: 247); 550M + 580K (например, SEQ ID NO: 251); 492D + 550K (например, SEQ ID NO: 231); 550M + 574H (например, SEQ ID NO: 249); 492D + 574H (например, SEQ ID NO: 232); 492G + 550K (например, SEQ ID NO: 240); 550M + 574H (например, SEQ ID NO: 249); или 492G + 574H (например, SEQ ID NO: 241).
32. Полипептид по любому предыдущему варианту, где этот полипептид содержит три или более изменений в положениях, выбранных из группы, состоящей из положений, соответствующих следующим положениям в SEQ ID NO: 2: 492, 550, 573, 574 и 580.
33. Полипептид варианта 32, где этот полипептид содержит изменения в положениях, соответствующих следующим положениям в SEQ ID NO: 2: 574H + 580K + 573Р (например, SEQ ID NO: 135); 550K + 574H + 573P (например, SEQ ID NO: 131); 492D + 550K + 573P (например, SEQ ID NO: 253); 550M + 573P + 580K (например, SEQ ID NO: 252); 550L + 573P + 580K (например, SEQ ID NO: 253); 492G + 573P + 580K (например, SEQ ID NO: 242); 550M + 573P + 574H (например, SEQ ID NO: 250); 492G + 550K + 573P (например, SEQ ID NO: 254); 550L + 573P + 574H (например, SEQ ID NO: 246); 492D + 573Р + 580K (например, SEQ ID NO: 234); 492D + 573P + 574H (например, SEQ ID NO: 233); 492G + 574H + 580K (например, SEQ ID NO: 263); 492G + 550K + 580K (например, SEQ ID NO: 259); 492D + 550K + 580K (например, SEQ ID NO: 258); 492D + 574H + 580K (например, SEQ ID NO: 262); или 492G + 550K + 574H (например, SEQ ID NO: 255).
34. Полипептид по любому предыдущему варианту, где этот полипептид содержит четыре или более изменений в положениях, выбранных из группы, состоящей из положений, соответствующих следующим положениям в SEQ ID NO: 2: 492, 550, 573, 574 и 580.
35. Полипептид по варианту 34, где этот полипептид содержит изменения в положениях, соответствующих следующим положениям в SEQ ID NO: 2: 492G + 573Р + 574H + 580K (например, SEQ ID NO: 115); 492D + 573P + 574H + 580K (например, SEQ ID NO: 114); 550K + 573P + 574H + 580K (например, SEQ ID NO: 265); 492G + 550K + 573P + 580K (например, SEQ ID NO: 261); 492F + 573P + 574H + 580K (например, SEQ ID NO: 237); 492G + 573P + 574G + 580K (например, SEQ ID NO: 243); 492D + 573P + 574H + 580R (например, SEQ ID NO: 236); 492G + 573P + 574H + 580R (например, SEQ ID NO: 244); 492D + 550K + 573P + 580K (например, SEQ ID NO: 260); 492D + 550K + 573P + 574H (например, SEQ ID NO: 256); 492F + 573P + 574H + 580R (например, SEQ ID NO: 239); 492D + 573P + 574G + 580K (например, SEQ ID NO: 235); или 492F + 573P + 574G + 580K (например, SEQ ID NO: 238).
36. Полипептид по любому предыдущему варианту, где этот полипептид содержит пять или более изменений, выбранных из группы, состоящей из положений, соответствующих следующим положениям в SEQ ID NO: 2: 492, 550, 573, 574 и 580.
37. Полипептид по варианту, где этот полипептид содержит изменения в положениях, соответствующих следующим положениям в SEQ ID NO: 2: 492G + 550K + 573Р + 574H + 580K (например, SEQ ID NO: 267) или 492D + 550K + 573P + 574H + 580K (например, SEQ ID NO: 266).
38. Полипептид по любому предыдущему варианту, содержащий изменения, соответствующие следующим положениям в SEQ ID NO: 2: 492G + 573P + 574H + 580K (например, SEQ ID NO: 115); 492G + 550K + 573P + 574H (например, SEQ ID NO: 257); 492D + 550K + 573P + 574H (например, SEQ ID NO: 256); 492G + 550K + 573P (например, SEQ ID NO: 254); 492D + 550K + 573P (например, SEQ ID NO: 253); 550M + 573P + 580K (например, SEQ ID NO: 252); 550L + 573P + 580K (например, SEQ ID NO: 248); 550L + 573P + 574H (например, SEQ ID NO: 246); 492G + 573P + 580K (например, SEQ ID NO: 242); 492D + 573P + 580K (например, SEQ ID NO: 234); 573 P + 574H + 580K (например, SEQ ID NO: 135); 550K + 573P + 580K (например, SEQ ID NO: 133); 550K + 573P + 574H (например, SEQ ID NO: 131); или 492D + 573P + 574H + 580K (SEQ ID NO: 114).
39. Полипептид по любому из вариантов 1-38, где эталонный альбумин является HSA (SEQ ID No: 2) или его фрагментом или слитым полипептидом, содержащим HSA или его фрагмент, наиболее предпочтительно SEQ ID NO: 2.
40. Полипептид по любому из вариантов 1-39, имеющий более сильную аффинность связывания с FcRn и/или более длинный период полужизни, чем исходный альбумин, эталонный альбумин, его фрагмент или слитый полипептид, содержащий указанные исходный альбумин, эталонный альбумин или его фрагмент или его слияние.
41. Полипептид по любому из вариантов 1-40, где идентичность последовательности с SEQ ID NO: 2 является большей, чем 80%, предпочтительно большей, чем 90%, более предпочтительно большей, чем 95%, более предпочтительно большей, чем 96%, даже более предпочтительно большей, чем 97%, более предпочтительно большей, чем 98%, и наиболее предпочтительно большей, чем 99%.
42. Слитый полипептид, содержащий полипептид по любому из вариантов 1-41 и партнер по слиянию, выбранный из терапевтической, профилактической, диагностической, визуализирующей или другой полезной части.
43. Способ для получения полипептида, который является вариантом альбумина, его фрагментом или слитым полипептидом, содержащим указанный вариантный альбумин или его фрагмент, имеющий аффинность связывания с FcRn, которая изменена в сравнении с аффинностью связывания эталонного альбумина, его фрагмента или слияния с FcRn, предусматривающий:
(a) Обеспечение нуклеиновой кислоты, кодирующей исходный альбумин, имеющий по меньшей мере 80%-ную идентичность последовательности с SEQ ID NO: 2;
(b) Модификацию последовательности стадии (а) для кодирования полипептида, который является вариантным альбумином, его фрагментом или слитым полипептидом, содержащим указанный вариантный альбумин или его фрагмент, содержащий изменения в двух или более положениях, соответствующих положениям, выбранным из 492, 550, 573, 574 и 580 в SEQ ID NO: 2, предпочтительно, как описано в любом из вариантов 1-13;
(c) Введение этой модифицированной последовательности стадии (b) в подходящую клетку-хозяина;
(d) Выращивание этих клеток в подходящей среде для выращивания в условиях, ведущих к экспрессии этого полипептида; и
(e) Извлечение этого полипептида из среды для выращивания;
где этот полипептид имеет измененную аффинность связывания с FcRn и/или измененный период полужизни в плазме в сравнении с периодом полужизни исходного альбумина, эталонного альбумина, его фрагмента или слитого полипептида, содержащего указанный исходный альбумин, эталонный альбумин или фрагмент, или их слияние.
44. Способ варианта 43, где эта замена в положении, соответствующем положению 492, является заменой на G, D, F, Н, М или R, предпочтительно G или D.
45. Способ варианта 44, где эта замена в положении, соответствующем положению 492 является заменой на G.
46. Способ варианта 44, где эта замена в положении, соответствующем положению 492является заменой на G.
47. Способ по любому из вариантов 43-46 где эта замена в положении, соответствующем положению 550, является заменой на K, L, М, Е или R, предпочтительно K, L или М, наиболее предпочтительно K.
48. Способ по любому из вариантов 43-47, где эта замена в положении соответствующем положению 573, является заменой на Р, Y, W, Н, F, Т, I или V, предпочтительно Р, Y или W, наиболее предпочтительно Р.
49. Способ по любому из вариантов 43-48, где эта замена в положении, соответствующем положению 574, является заменой на Н, D, F, G, N, S или Y, предпочтительно Н, D, F или G, наиболее предпочтительно Н.
50. Способ по любому из вариантов 43-49, где эта замена в положении, соответствующем положению 580, является заменой на K или R, наиболее предпочтительно R
51. Способ по любому из вариантов 43-50, где два или более изменений находятся в положениях, соответствующих положениям (i) 573 и 580; (ii) 492 и 573; или (iii) 573 и 574 в SEQ ID NO: 2.
52. Способ по любому из вариантов 43-51, где эти два или более изменений находятся в положениях, соответствующих следующим положениям в SEQ ID NO: 2: 580K + 573Р (например, SEQ ID NO: 128); 580R + 573P (например, SEQ ID NO: 129); 574D + 573P (например, SEQ ID NO: 121); 574F + 573P (например, SEQ ID NO: 122); 574G + 573P (например, SEQ ID NO: 123); 574H + 573P (например, SEQ ID NO: 124); 574N + 573P (например, SEQ ID NO: 125); 574S + 573P (например, SEQ ID NO: 126); 550K + 580K (например, SEQ ID NO: 132); 550K + 574H (например, SEQ ID NO: 130); 550K + 573P (например, SEQ ID NO: 117); 492D + 573P (например, SEQ ID NO: 108); 492F + 573P (например, SEQ ID NO: 109); 492H + 573P (например, SEQ ID NO: 111); 492R + 573P (например, SEQ ID NO: 112); 574H + 580K (например, SEQ ID NO: 134); 550L + 574H (например, SEQ ID NO: 245); 550L + 580K (например, SEQ ID NO: 247); 550M + 580K (например, SEQ ID NO: 251); 492D + 550K (например, SEQ ID NO: 231); 550M + 574H (например, SEQ ID NO: 249); 492D + 574H (например, SEQ ID NO: 232); 492G + 550K (например, SEQ ID NO: 240); 550M + 574H (например, SEQ ID NO: 249) или 492G + 574H (например, SEQ ID NO: 241).
53. Способ по любому из вариантов 43-52, содержащий три или более изменений в положениях, выбранных из группы, состоящей из положений, соответствующих следующим положениям в SEQ ID NO: 2: 492, 550, 573, 574 и 580.
54. Способ по любому из вариантов 43-53, содержащий изменения в положениях, соответствующих следующим положениям в SEQ ID NO: 2: 574H + 580K + 573Р (например, SEQ ID NO: 135); 550K + 574H + 573Р (например, SEQ ID NO: 131); 492D + 550K + 573P (например, SEQ ID NO: 253); 550M + 573P + 580K (например, SEQ ID NO: 252); 550L + 573P + 580K (например, SEQ ID NO: 253); 492G + 573P + 580K (например, SEQ ID NO: 242); 550M + 573P + 574H (например, SEQ ID NO: 250); 492G + 550K + 573P (например, SEQ ID NO: 254); 550L + 573P + 574H (например, SEQ ID NO: 246); 492D + 573P + 580K (например, SEQ ID NO: 234); 492D + 573P + 574H (например, SEQ ID NO: 233); 492G + 574H + 580K (например, SEQ ID NO: 263); 492G + 550K + 580K (например, SEQ ID NO: 259); 492D + 550K + 580K (например, SEQ ID NO: 258); 492D + 574H + 580K (например, SEQ ID NO: 262); или 492G + 550K + 574H (например, SEQ ID NO: 255).
55. Способ по любому из вариантов 43-54, содержащий четыре или более изменений в положениях, выбранных из группы, состоящей из положений, соответствующих положениям, выбранным из группы, состоящей из положений, соответствующих следующим положениям в SEQ ID NO: 2: 492, 550, 573, 574 и 580.
56. Способ по любому из вариантов 43-55, содержащий изменения в положениях, соответствующих следующим положениям в SEQ ID NO: 2: 492G + 573Р + 574H + 580K (например, SEQ ID NO: 115); 492D + 573Р + 574H + 580K (например, SEQ ID NO: 114); 550K + 573Р + 574H + 580K (например, SEQ ID NO: 265); 492G + 550K + 573Р + 580K (например, SEQ ID NO: 261); 492F + 573Р + 574H + 580K (например, SEQ ID NO: 237); 492G + 573Р + 574G + 580K (например, SEQ ID NO: 243); 492D + 573P + 574H + 580R (например, SEQ ID NO: 236); 492G + 573P + 574H + 580R (например, SEQ ID NO: 244); 492D + 550K + 573P + 580K (например, SEQ ID NO: 260); 492D + 550K + 573P + 574H (например, SEQ ID NO: 256); 492F + 573P + 574H + 580R (например, SEQ ID NO: 239); 492D + 573P + 574G + 580K (например, SEQ ID NO: 235) или 492F + 573P + 574G + 580K (например, SEQ ID NO: 238);
57. Способ по любому из вариантов 43-56, предусматривающий пять или более изменений в положениях, выбранных из группы, состоящей из положений, соответствующих следующим положениям в SEQ ID NO: 2: 492, 550, 573, 574 и 580.
58. Полипептид по любому из вариантов 43-57, содержащий изменения в положениях, соответствующих следующим положениям в SEQ ID NO: 2: 492G + 550K + 573Р + 574H + 580K (например, SEQ ID NO: 267) или 492D + 550K + 573P + 574H + 580K (например, SEQ ID NO: 266).
59. Способ по любому из вариантов 43-58, предусматривающий изменения в положениях, соответствующих следующим положениям в SEQ ID NO: 2: 492G + 573P + 574H + 580K (например, SEQ ID NO: 115); 492G + 550K + 573Р + 574H (например, SEQ ID NO: 257); 492D + 550K + 573P + 574H (например, SEQ ID NO: 256); 492G + 550K + 573P (например, SEQ ID NO: 254); 492D + 550K + 573P (например, SEQ ID NO: 253); 550M + 573P + 580K (например, SEQ ID NO: 252); 550L + 573P + 580K (например, SEQ ID NO: 248); 550L + 573P + 574H (например, SEQ ID NO: 246); 492G + 573P + 580K (например, SEQ ID NO: 242); 492D + 573P + 580K (например, SEQ ID NO: 234); 573P + 574H + 580K (например, SEQ ID NO: 135); 550K + 573P + 580K (например, SEQ ID NO: 133); 550K + 573P + 574H (например, SEQ ID NO: 131); или 492D + 573P + 574H + 580K (SEQ ID NO: 114).
60. Способ по любому из вариантов 43-59, где эталонным альбумином является HSA (SEQ ID No: 2) или его фрагмент, или слитый полипептид, содержащий HSA или его фрагмент, наиболее предпочтительно SEQ ID NO: 2.
61. Способ по любому из вариантов 43-60, где идентичность последовательности относительно SEQ ID NO: 2 является большей, чем 80%, предпочтительно большей, чем 90%, более предпочтительно большей, чем 95%, более предпочтительно большей, чем 96%, даже предпочтительно большей, чем 97%, более предпочтительно большей, чем 98% и наиболее предпочтительно большей, чем 99%.
62. Конъюгат, содержащий полипептид по любому из вариантов 1-42 или получаемый способом по любому из вариантов 43-61, и партнер по конъюгации.
63. Конъюгат по варианту 62, где партнером по конъюгации является терапевтическая, профилактическая, диагностическая, визуализирующая или другая полезная часть.
64. Ассоциат, содержащий полипептид по любому из вариантов 1-42 или получаемый способом по любому из вариантов 43-61, и терапевтическая, профилактическая, диагностическая, визуализирующая или другая полезная часть.
65. Наночастица или микрочастица, содержащая полипептид по любому из вариантов 1-42 или получаемый способом по любому из вариантов 43-61, конъюгат по варианту 62 или 63 или ассоциат по варианту 64.
66. Композиция, содержащая полипептид по любому из вариантов 1-42 или получаемый способом по любому из вариантов 43-61, конъюгат по варианту 62 или 63, ассоциат по варианту 64 или наночастицу или микрочастицу по варианту 65, где аффинность связывания этого полипептида, слитого полипептида, конъюгата, ассоциата или наночастицы или микрочастицы с FcRn является более сильной, чем аффинность связывания композиции, содержащей соответствующий исходный альбумин, эталонный альбумин, его фрагмент или слитый полипептид, конъюгат, ассоциат или наночастицу или микрочастицу, содержащую указанный исходный альбумин, эталонный альбумин или фрагмент или его слияние с FcRn.
67. Композиция по варианту 66, где аффинность связывания этого полипептида, слитого полипептида, конъюгата, ассоциата или наночастицы или микрочастицы с FcRn является более сильной, чем аффинность связывания HSA с FcRn.
68. Композиция по варианту 66 или 67, где коэффициент связывания этого варианта полипептида, слитого полипептида, конъюгата, ассоциата или наночастицы или микрочастицы с FcRn является меньшим, чем 0,9Х KD HSA к FcRn, более предпочтительно меньшим, чем 0,5Х KD HSA к FcRn, более предпочтительно меньшим, чем 0,1 X KD HSA к FcRn, даже более предпочтительно меньшим, чем 0,05Х KD HSA к FcRn, даже более предпочтительно меньшим, чем 0,02Х KD HSA к FcRn и наиболее предпочтительно меньшим, чем 0,01X KD HSA к FcRn.
69. Композиция по любому из вариантов 66-68, содержащая полипептид по любому из вариантов 1-42 или получаемый способом по любому из вариантов 43-61, конъюгат по варианту 62 или 63, ассоциат по варианту 64 или наночастицу или микрочастицу по варианту 65, дополнительно содержащая соединение, содержащее домен связывания антитела (ABD) и терапевтическую, профилактическую, диагностическую, визуализирующую или другую полезную часть.
70. Композиция по любому из вариантов 66-69, содержащая фармацевтически приемлемый носитель или наполнитель.
71. Применение полипептида по любому из вариантов 1-42 или получаемого способом по любому из вариантов 43-61, конъюгата по варианту 62 или 63, ассоциата по варианту 64 или наночастицы или микрочастицы по варианту 65 или композиции по любому из вариантов 66-70, для изменения аффинности связывания с FcRn или периода полужизни, предпочтительно в плазме, терапевтической профилактической, диагностической, визуализирующей или другой полезной части.
72. Применение по варианту 71, где аффинность связывания с FcRn увеличивается относительно аффинности связывания эталона, содержащего или состоящего из HSA (SEQ ID NO: 2) или фрагмента, слияния, конъюгата, ассоциата, наночастицы или микрочастицы, с FcRn.
73. Применение по варианту 71, где аффинность связывания с FcRn уменьшается относительно аффинности связывания эталона, содержащего или состоящего из HSA (SEQ ID NO: 2) или фрагмента, слияния, конъюгата, ассоциата, наночастицы или микрочастицы, с FcRn.
74. Способ изменения аффинности связывания с FcRn или периода полужизни в плазме, молекулы, включающий:
(a) если эта молекула является полипептидом, то слияние или конъюгирование молекулы с полипептидом по любому из вариантов 1-42 или получаемым способом по вариантам 43-61, или с конъюгатом по варианту 62 или 63; ассоциацию этой молекулы с полипептидом по любому из вариантов 1-42 или получаемым способом по варианту 43-61 или конъюгатом по варианту 62 или 63; включение этой молекулы в ассоциат по варианту 64, в наночастице или микрочастице по варианту 65 или композиции по любому из вариантов 66-70;
(b) если эта молекула не является полипептидом, конъюгирование этой молекулы с полипептидом по любому из вариантов 1-42 или получаемым способом по вариантам 43-61, или для конъюгата по варианту 62 или 63; ассоциацию этой молекулы с полипептидом по любому из вариантов 1-42 или получаемым способом вариантов 43-61 или конъюгатом по варианту 62 или 63; включение этой молекулы в ассоциат по варианту 64, в наночастице или микрочастице по варианту 65 или композиции по любому из вариантов 66-70.
75. Способ по варианту 74, где эта молекула является терапевтической, профилактической, диагностической, визуализирующей или другой полезной частью.
76. Полипептид, слитый полипептид, конъюгат, ассоциат, наночастица или микрочастица или их композиция по любому из вариантов 1-42 или 62-70 или получаемые способом по вариантам 43-61, где эти полипептид, слитый белок, конъюгат, ассоциат, наночастица или микрочастица или композиция содержит одну или более (несколько) часть, выбранную из компонентов, описанных здесь.
77. Нуклеиновая кислота, кодирующая полипептид или слитый полипептид по любому из вариантов 1-76.
78. Вектор, содержащий нуклеиновую кислоту по варианту 77.
79. Клетка-хозяин, содержащая нуклеиновую кислоту по варианту 77 или вектор по варианту 78.
80. Клетка-хозяин по варианту 79, где эта клетка-хозяин является эукариотом, предпочтительно дрожжами (такими как Saccharomyces cerevisiae) или клеткой млекопитающего (такой как СНО или HEK), или клеткой растения (такого как рис).
81. Способ профилактики, лечения или диагностики, предусматривающий введение полипептида, слитого полипептид, конъюгата, ассоциата, наночастицы или микрочастицы или полинуклеотида в соответствии с любым из вариантов 1-42 или 61-70, или получаемые способом любого из вариантов 43-81, субъекту.
Это изобретение дополнительно описано следующими примерами, которые не должны истолковываться в качестве ограничения объема этого изобретения.
Примеры
Пример 1. Приготовление плазмид для экспрессии варианта HSA
HSA-варианты экспрессировали с использованием стандартных способов молекулярной биологии, таких как описанные в Sambrook, J. and D.W. Russell, 2001 (Molecular Cloning: a laboratory manual, 3rd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y).
Способ 1: Пермутационные библиотеки, содержащие мутации в положениях Е492, D550, K574H и Q580K получали ПЦР-амплификацией pDB4081, который кодирует HSA дикого типа (описанного ниже), с использованием мутагенного прямого праймера и немутагенного обратного праймера, как показано в Таблице 2. Условия ПЦР приведены в Таблицах 3 и 4. 2 мкл продукта реакции оценивали электрофорезом в агарозном геле, а остаток обрабатывали 5 мкл 10х буфера 4 (New England Biolabs - 50 мМ ацетат калия, 20 мМ Трис-ацетат, 10 мМ ацетат магния, 1 мМ DTT pH 7,9 при 25°C) и 1 мкл DpnI (NEB) в течение 1 часа при 37°C. Продукт этой реакцию очищали добавлением 50 мкл воды, перед высушиванием вакуумом в течение 20 минут. Добавляли дополнительные 50 мкл воды и применяли вакуум, пока лунка не становилась сухой. Плазмидную ДНК извлекали добавлением 30 мкл воды и инкубированием в течение 1 минуты. 2 мкл этого очищенного продукта трансформировали в 15 мкл ТОР10 клеток Е. coli с использованием стандартных протоколов. Клоны отбирали и выращивали в течение ночи в LB, дополненном 100 мкг/мл ампициллина и очищали с использованием Qiagen QIAprep 96 мини-преп-набора в соответствии с инструкциями изготовителя. Варианты проверяли секвенированием. pDB4081 получали путем лигирования фрагмента синтетической ДНК, расщепленного Bsa/SphI, которая была создана посредством сборки гена (DNA2.0 Inc, USA), содержащего 3'-область промотора PRB1, модифицированную слитую лидерную последовательность, нуклеотидную последовательность, кодирующую HSA, и 5'-район модифицированного ADH1-терминатора) в расщепленную HindIII/SphI pDB4005. pDB4005 описана в WO 2011/051489 (включенном здесь посредством ссылки.

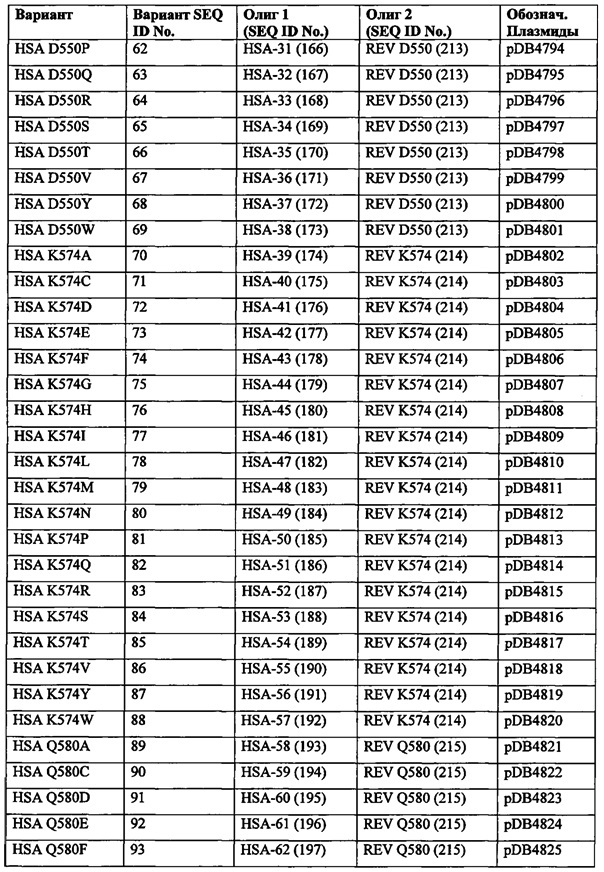
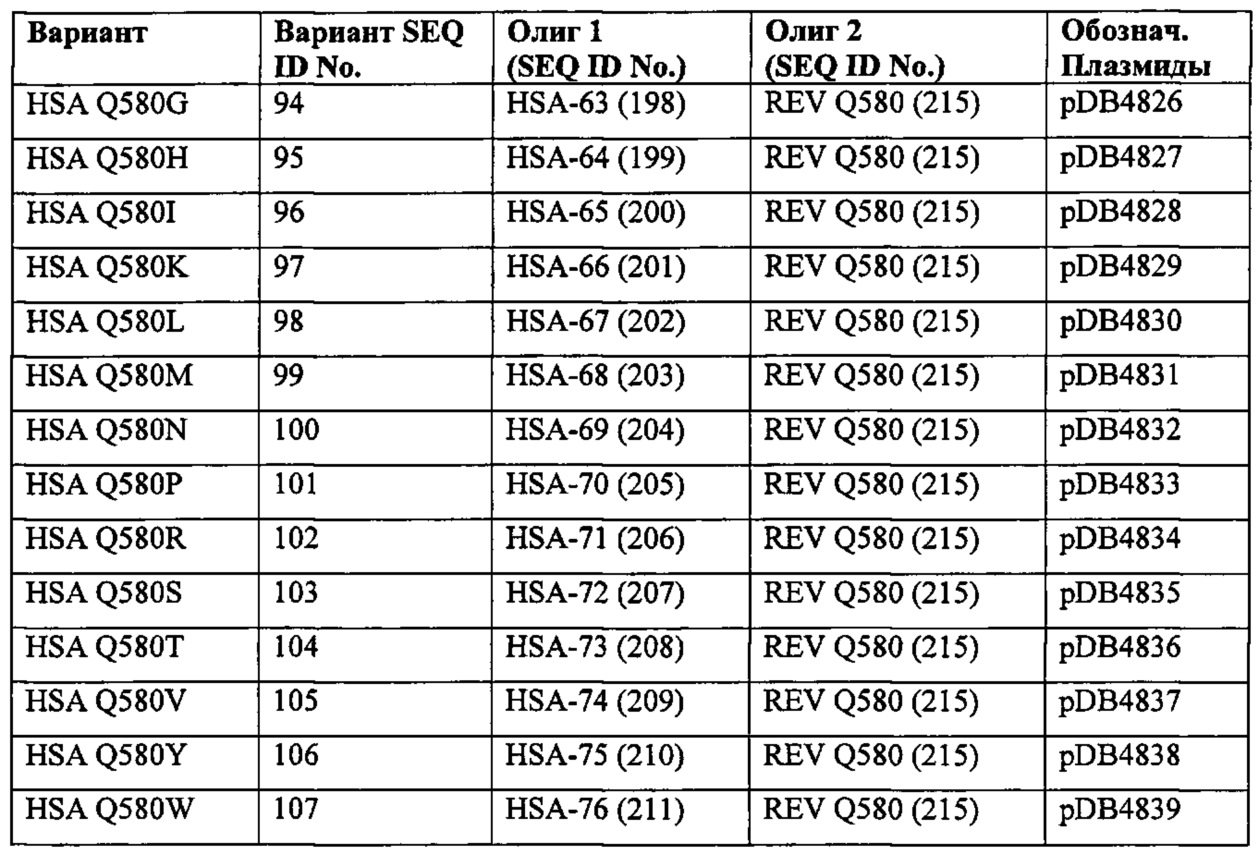


Способ 2: Варианты, описанные в Таблице 5 и 6, получали, как описано в WO 2012/150319, Примере 6, Способе 2 «Получение комбинации Вариантов с K573P» (включенной здесь посредством ссылки), со следующими модификациями. Для вариантов, показанных в Таблице 5, фрагмент, кодирующий мутацию K573P, удаляли из pDB4673 используя сайты рестрикции SalI и Bsu361 и встраивали в аналогичным образом расщепленную исходную плазмиду, как указано в Таблице 5. pDB4673 (HSA K573P) конструировали путем вставки фрагмента, полученного расщеплением pD4283 (описанной в WO 2011/051489, включенном здесь посредством ссылки) рестрикционными ферментами SalI и HindIII в аналогичным образом расщепленную pDB4081. Для вариантов, показанных в Таблице 6, фрагмент, кодируемый K573P + K574H + Q580K, удаляли из pDB5032 с использованием рестрикционных сайтов SalI и Bsu361 и встраивали в аналогичным образом расщепленную исходную плазмиду, как показано в таблице 6.


Способ 3: Варианты, описанные в Таблице 7, получали, как описано в WO 2012/150319, Примере 6, Способе 1 (включенном здесь посредством ссылки), с использованием плазмид, указанных в этих таблицах в качестве матриц для ПЦР-реакций. Условия, описанные в Таблицах 8 и 9, использовали для получения pDB4997-5004, pDB5042-46 и pDB5030-l. Условия, описанные в Таблицах 10 и 11, использовали для получения pDB5027-29 и pDB5032. Эти мутированные ПЦР-продукты расщепляли с использованием рестрикционных ферментов SalI и Bsu361 и встраивали в сходным образом расщепленную pDB4081, кодирующую HSA дикого типа (как описано выше.





Получение экспрессионных плазмид и трансформацию S. cerevisiae выполняли, как описано в WO 2012/150319 (включенном здесь посредством ссылки), с использованием 24-(pDB5027-9, pDB5032 и pDB5091-92), или 48-часового способа стокинга (всех оставшихся вариантов). Штаммом-хозяином для pDB4990-5, pDB4997-5004, pDB5042-5046, pDB5027-32 и pDB5091-2 был S. cerevisiae DYB7 (Payne et al (2008) Applied and Environmental Microbiology Vol 74(24): 7759-7766) с четырьмя копиями PDI, интегрированными в геном. Штаммом-хозяином для оставшихся плазмид был S. cerevisiae BXP10cir°, такой как описанный в WO 2012/150319 (включенном здесь посредством ссылки. Выделение белка и очистку из встряхиваемой колбы выполняли, как описано в WO 2011/051489.
Пример 2. SPR-анализ аффинности связывания WT HSA и вариантов с shFcRn
SPR-анализы выполняли на приборе Biacore 3000 (GE Healthcare). Иммобилизацию проводили на чипах СМ5, с иммобилизованным His-меченым shFcRn (FcRn, производимым GeneArt, Life Technologies) посредством химии аминового сочетания GE Healthcare в соответствии с инструкциями изготовителя. Уровни иммобилизации shFcRn-HIS (shFcRn с 6-His-хвостом на С-конце бета-2-микроглобулина были 1200-2500 RU и достигались введением 20 мкг/мл shFcRn, разведенного с использованием ацетата натрия pH 4,5 (GE Healthcare). Поверхность чипов оставляли для стабилизации с постоянным потоком (5 мкл/мин) подвижного буфера - Двухосновного/моноосновного фосфатного буфера pH 5,5 (67 мМ фосфатного буфера, 0,15 М NaCl, 0,005% Твина 20) при pH 5,5, при 25°C (т.е. при температуре окружающей среды) на протяжении ночи. После стабилизации лиганда, поверхность чипа кондиционировали инъекцией 5-12×45 мкл Двухосновного/моноосновного фосфатного буфера при 30 мкл/мин с последующим HBS_EP (0,01 М HEPES, 0,15 М NaCl, 3 мМ ЭДТА, 0,005% поверхностно-активного вещества Р20) при pH 7,4 (GE Healthcare) стадий регенерации (12 s) между каждой инъекцией. Затем поверхности проверяли на активность инъекцией 3×45 мкл положительного контроля (wt HSA (SEQ ID NO: 2)) при 30 мкл/мин, с последующим пульсом регенерации 12 с. Кинетические измерения проводили разведением инъекций (100 мкМ - 0,016 мкМ) HSA и вариантов HSA при 30 мкл/мин через иммобилизованный shFcRn, при 25°C (т.е. при температуре окружающей среды). Затем уровень эталонных клеток вычитали и использовали программное обеспечение Biaevaluation software 4,1 для получения кинетических данных и подтверждения величин KD. Этими вариантами были альбумин дикого типа (SEQ ID NO: 2) и альбумины с изменениями в одном или нескольких из положений 492, 550, 573, 574 и 580. Эти варианты анализировали посредством SPR для определения их реакции связывания (RU) с shFcRn. Некоторые варианты дополнительно характеризовали для определения величин KD. Эти данные показаны в Таблицах 12-18.


Эти данные в Таблице 12 показывают, что варианты, содержащие изменение в одном из положений 492, 550, 574 и 580, показывают более высокую аффинность связывания FcRn, чем альбумин WT.
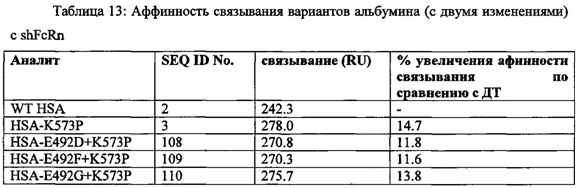
Эти данные в Таблице 13 показывают, что варианты, содержащие изменения в положении 492 вместе с вариантом K573P показывают более высокую аффинность связывания, чем альбумин WT.
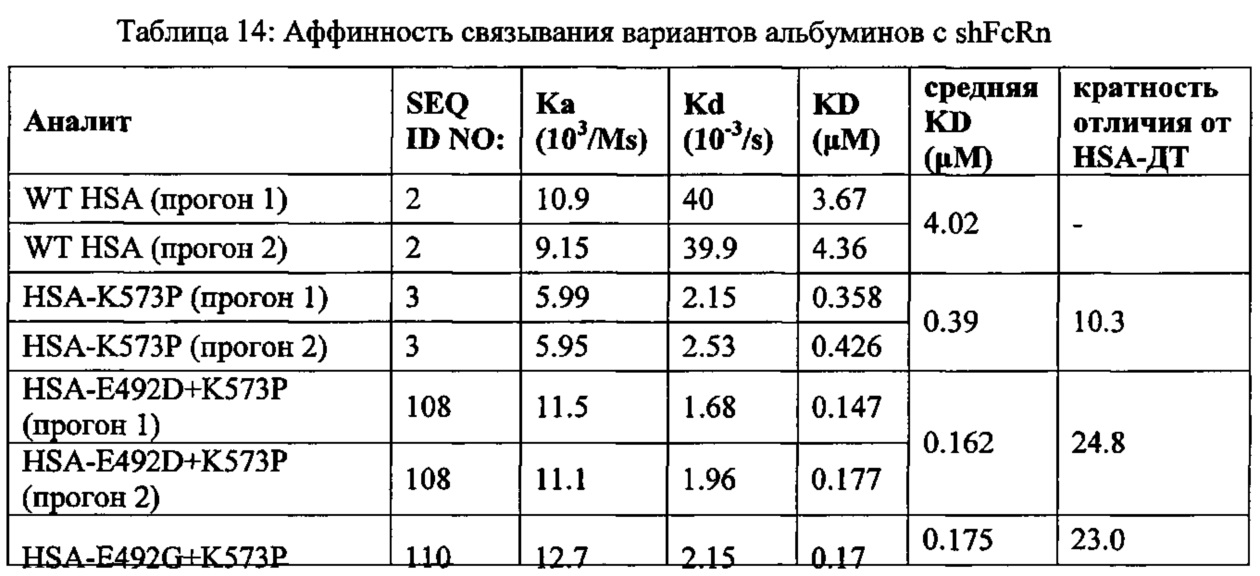
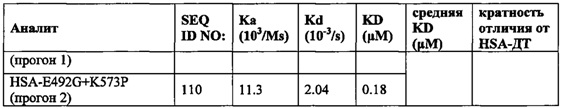
Варианты HSA-E492D + K573P и HSA-E492G + K573P были отобраны для дополнительного анализа на основе очевидно медленной скорости их диссоциации (т.е. константы диссоциации (KD)). Данные в Таблице 14 показывают, что варианты HSA-E492D + K573P и HSA-E492G + K573P показывают более высокую аффинность в отношении shFcRn в сравнении с WT альбумином и единственным вариантом K573P.

Эти данные в Таблице 15 показывают, что введение замен в вариант K573P, который индивидуально демонстрировал улучшение в аффинности с shFcRn (Таблица 12), дало ряд вариантов с различными реакциями связывания, от уменьшения в аффинности по сравнению с альбумином WT, до вариантов, показывающие увеличенную аффинность.

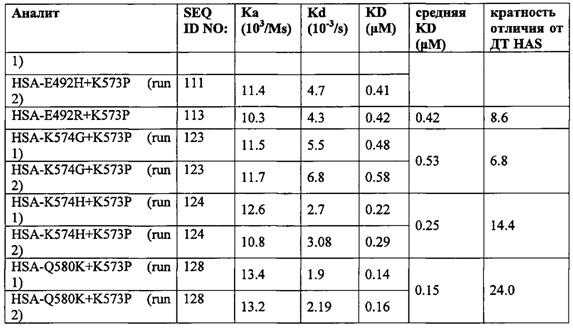
Эти данные в Таблице 16 показывают, что варианты HSA-K574H + K573P и HSA-Q580K + K573P обладают значительно более высокой аффинностью в отношении shFcRn, по сравнению с альбумином WT и единичным мутантом K573P.

Эти данные в Таблице 17 показывают варьирующие эффекты от введения мутаций в положениях 550, 573, 574 и 580. Например, HSA-K574H + K573P показали увеличенное связывание по сравнению с альбумином WT (Таблица 16). Введение мутации K574H в HSA-Q580K + K573P (Таблица 16) для получения HSA-K574H + Q580K + K573P не приводило к улучшению в аффинности связывания (по сравнению с альбумином WT) выше HSA-Q580K + K573P. В противоположность этому, введение этой мутации в HSA-D550K + K573P, продуцирование HSA-D550K + K574H + K573P, приводило к увеличению в аффинности, по сравнению с альбумином WT и HSA-D550K + K573P.
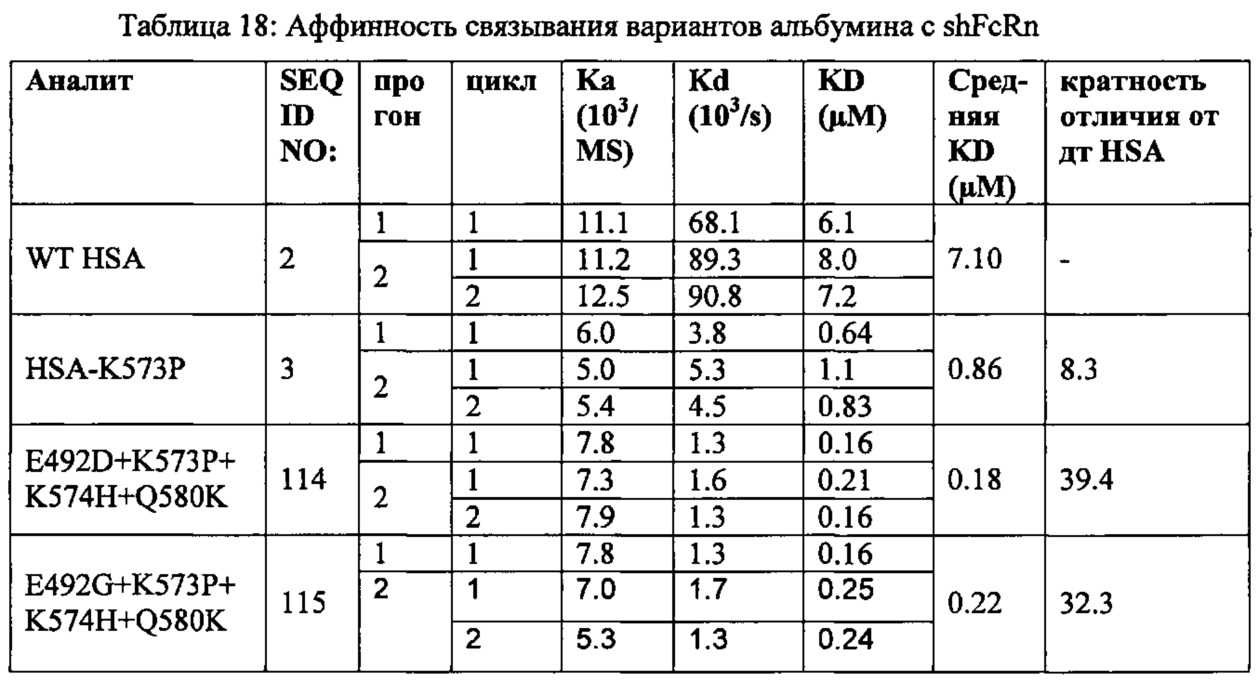
Эти данные в Таблице 18 показывают, что варианты, содержащие четыре замены в положении 492, 573Р, 574 и 580 показывают заметное увеличение в аффинности связывания в сравнении с вариантами, содержащими три мутации, такие как HSA-K574H + Q580K + K573P (Таблица 17), варианты, содержащие две мутации, такие как K574H + K573P и Q580K + K573P (Таблица 16) и одну мутацию K573P или WT альбумин.
Пример 3. Получение дополнительных комбинированных вариантов.
Единичные или множественные мутации вводили в матричные плазмиды, перечисленные в Таблице 19 для получения указанных вариантов. Мутагенные прямые праймеры и немутагенные обратные праймеры использовали для введения желаемых изменений, перечисленных в Таблице 20. Матричные плазмиды метилировали с использованием компонентов, описанных в Таблице 21, инкубировали при 37°C в течение одного часа и затем очищали с использованием набора для очистки Qiagen QiaQuick PCR в соответствии с инструкциями изготовителя. Затем эту метилированную матрицу использовали в мутагенных ПЦР-реакциях. (Таблицы 22 и 23) в соответствии с комбинацией олигонуклеотид/матрица, детализированным в Таблице 19, для получения требуемых вариантов HSA. После ПЦР-реакции, 5 мкл каждой реакционной смеси ПЦР визуализировали электрофорезом в агарозном геле для оценивания продукции этой плазмиды, и 5 мкл плазмиды сохраняли для дополнительного анализа.
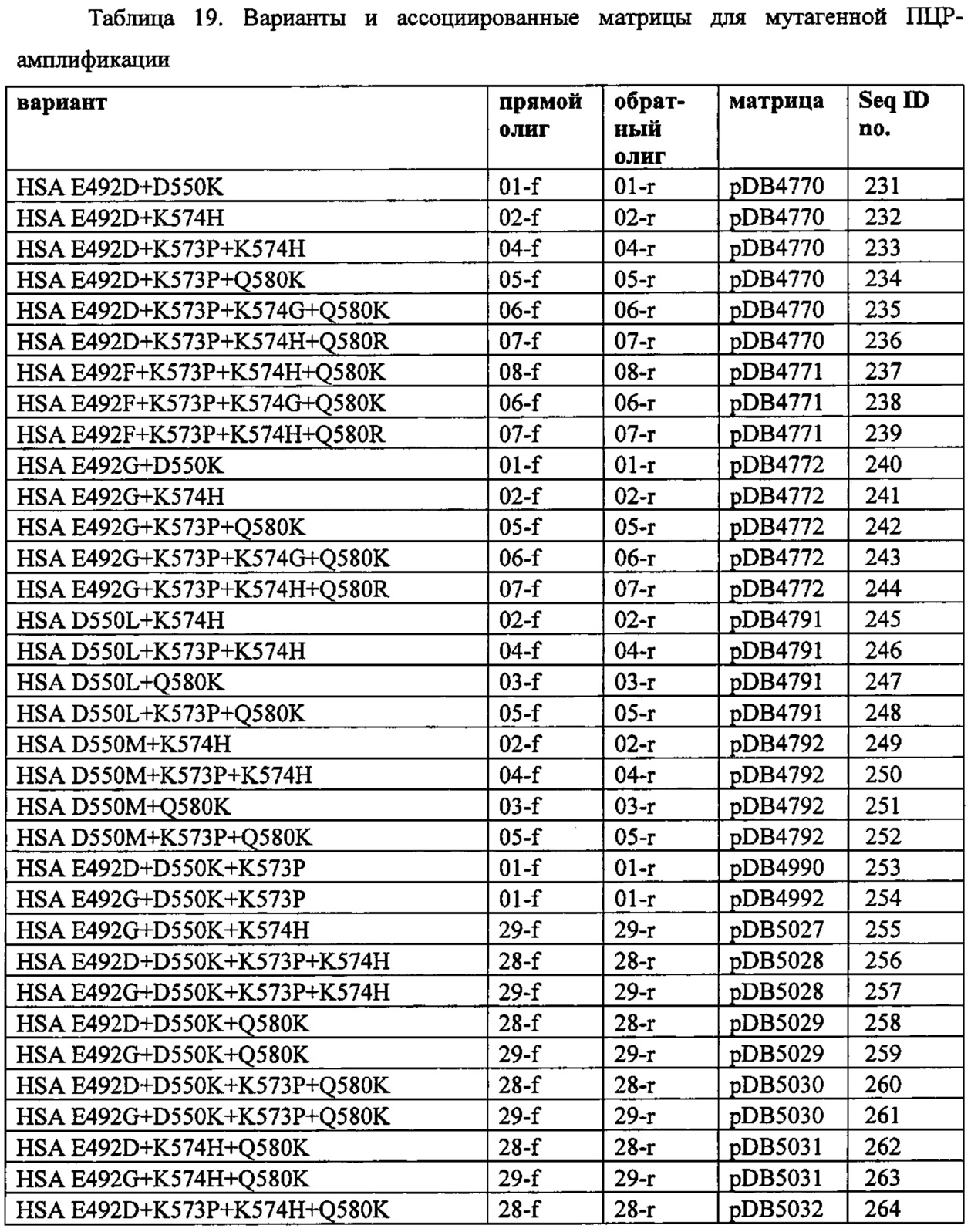






40 мкл каждой из ПЦР-генерированных плазмид готовили для рекомбинации in vivo добавлением 0,5 мкл каждого из рестрикционных ферментов DpnI, NsiI и PvuI (New England Biolabs), с последующим инкубированием при 37°C в течение одного часа. 3 мкл приготовленной плазмиды, 3 мкл Acc65I/BamI-расщепленной pDB3936 и 1 мкл ДНК спермы лосося использовали для трансформирования S. cerevisiae в соответствии с протоколом, описанным в Примере 1. В качестве штамма-хозяина использовали штамм S. cerevisiae, полученный из DYB7 ura3 (Payne et al., 2008, Appl. Environ. Microbiol. 74(24): 7759-7766) с двумя дополнительными копиями PDI1, интегрированными в геном. Отдельные колонии наносили в виде точек на пластинки BMMD + CSM-leu (как описано в WO 2012/150319, включенном здесь посредством ссылки), для возможности оценивания экспрессии перед продуцированием дрожжевых стоков. Стоки продуцировали 48-часовым способом, описанным в Примере 1. 200 мкл каждого дрожжевого штамма использовали для инокуляции 10 мл BMMS во встряхиваемой колбе на 50 мл с последующим инкубированием при 30°C, 200 об/мин в течение четырех дней. Культуральный супернатант собирали центрифугированием при 3000 об/мин в течение 5 минут.
Альбуминовые варианты очищали из 10 мл встряхиваемых колб с использованием единственной хроматографической стадии с albumin affinity matrix (AlbuPure™ - ProMetic Biosciences, Inc.). Микромасштабную аффинную хроматографию выполняли в 8 параллельных опытах на автоматизированной платформе (Perkin Elmer, Janus) с 200 мкл прилагающимися колонками Atoll и в 96-луночном формате с использованием той же самой процедуры, которая описана в WO 2011/051489 (включенном здесь посредством ссылки), где объемы уменьшались соответственно.
Конечную концентрацию этих проб определяли по оптической плотности при 280 нм с использованием УФ-микропластинки и планшет-ридера, считывания против PBS корректировали с использованием слепого опыта и концентрации вычисляли на основе коэффициента экстинкции 0,52AU/cm для раствора 1 мг/мл для 1 мг/мл (AU: единицы для оптической плотности).
Пример 4. Анализ дополнительных объединенных вариантов
Кинетические анализы с использованием биослойной интерферометрии проводили на приборе Octet Red-96 (ForteBio). Иммобилизацию GST-меченого shFcRn (shFcRn-GST/FLAG) проводили на биосенсорах AR2G с использованием химии ForteBioamine-связывания в соответствии с инструкциями изготовителя, shFcRn-GST/FLAG- относится к GST-тэгу (глутатионтрансферазе) и FLAG-тег (DYKDDDDK) на С-конце альфа-цепи FcRn. Перед использованием, GST/FLAG-меченый shFcRn очищали с использованием IgG-аффинной хроматографии. Более конкретно, GST/FLAG-меченый shFcRn захватывали на GSTrap-колонке и элюировали востановленным глутатионом. shFcRn диализовали в PBS в pH 7,4 и дополнительно очищали с использованием IgG Sepharose™ 6 Fast Flow (GE Healthcare). Этот shFcRn захватывали на смоле в 50 мМ ацетате Na, 150 мМ NaCl pH 5,5 и элюировали с PBS pH 7,4. Этот элюированный shFcRn концентрировали до 2-5 мг/мл и хранили при -20°C до использования. Иммобилизованный уровень shFcRn-GST/FLAG был при уровне ответной реакции, большем, чем 1 нм, и достигался с использованием концентрации FcRn 2-10 мкг/мл в ацетате натрия, с последующим гашением этаноламином реакции аминосвязывания. Эти сенсоры используют либо непосредственно, либо их замачивают в 15% (об/м) сахарозе и сушат до использования.
Кинетические анализы выполняли с использованием очищенных с микромасштабной аффинностью вариантов альбумина, разбавленных в 2, 4 и 8 раз в BMMD-ферментационной среде (как описано в WO 2011/051489, включенной здесь посредством ссылки), дополненной 100 мМ ацетатом натрия и доведенной до pH 5,5. Ассоциацию (120s) и диссоциацию (300s) выполняли при 30°C и встряхивали при 1000 об/мин. Программное обеспечение ForteBio использовали для оценивания данных и вычисления величин KD, а также констант ассоциации и диссоциации, которые вычисляли с использованием HSA-концентраций, определенных измерением OD 280 нм.

Пример 5. Дополнительный анализ выбранных комбинированных вариантов.
Подмножество этих вариантов (Таблица 25), описанное в Таблице 19, отбирали для дополнительного анализа. 3 мкл реакции ПЦР расщепляли 7 мкл реакционной смеси, содержащей 10 мкл-реакции буфера 4 (New England Biolabs), 5 мкл DpnI и 55 мкл воды. Реакционные смеси инкубировали при 37 в течение 1,5 часов и затем очищали с использованием набора для очистки ПЦР Qiagen QiaQuick PCR в соответствии с инструкциями изготовителей. 2 мкл полученных плазмид использовали для трансформации компетентных клеток Е. coli 10-beta (New England Biolabs). Плазмидную ДНК получали с использованием набора Qiagen Plus Maxiprep, в соответствии с инструкциями изготовителя. Эти полученные плазмиды секвенировали для гарантии того, что желаемые мутации были введены. Получение плазмид и трансформацию дрожжевых исходных растворов выполняли, как описано в примере 1, с использованием штамма ВХР10 cir°. 24-часовые исходные растворы дрожжей получали, как описано в примере 1.
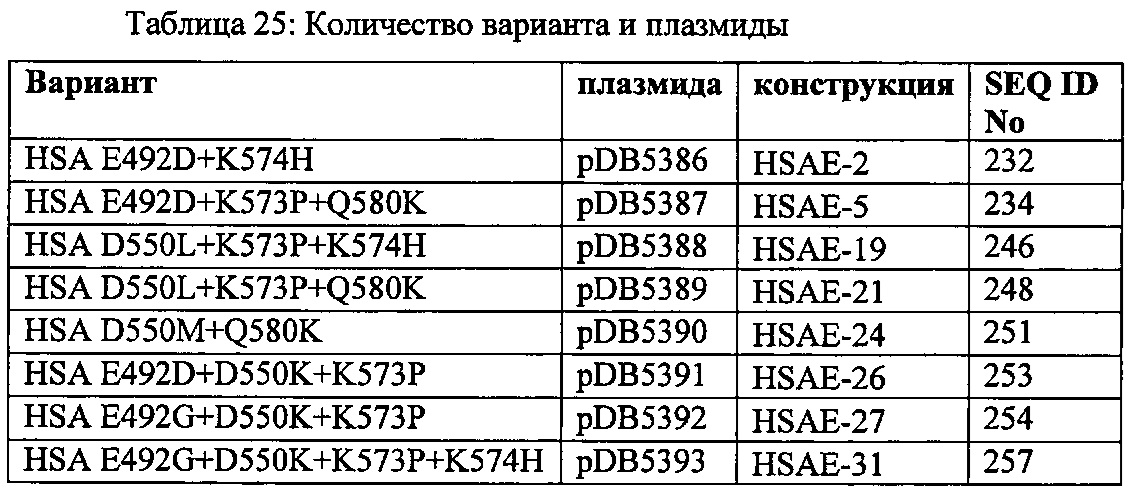
Варианты, перечисленные в Таблице 26 и 27, анализировали при помощи SPR с использованием прибора Biacore 3000, как описано в Примере 2, за исключением того, что, перед использованием, His-меченый shFcRn очищали с использованием IgG-аффинной хроматографии. Более конкретно, этот His-меченый shFcRn захватывали на колонке Ni-HiTrap и элюировали имидазолом. Этот shFcRn захватывали на этой смоле в 50 мМ Na-ацетате, 150 мМ NaCl pH 5,5 и элюировали PBS pH 7,4. Этот элюированный shFcRn концентрировали до 2-5 мг/мл и хранили при -20°C до применения, с использованием shFcRn-HIS.

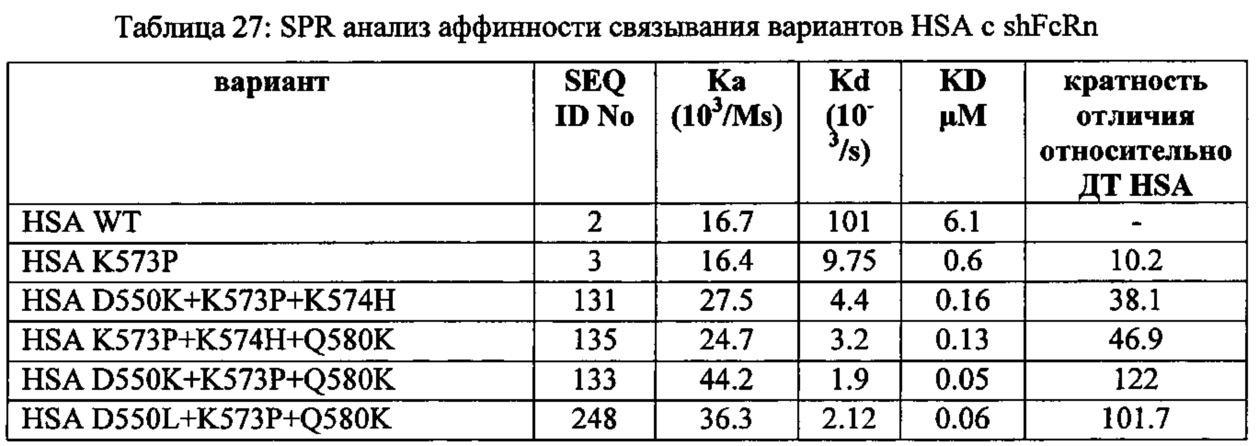
Данные Таблицы 26 и 27 показывают улучшение в аффинности выше WT HSA в вариантах, содержащих комбинацию замен. Обычно, варианты, содержащие три или четыре замены, обнаруживают улучшенные характеристики связывания относительно вариантов, содержащих две замены. Обычно, включение Q580K вносит вклад по существу в улучшенную аффинность связывания.
Это изобретение, описанное и заявленное здесь, не может быть ограничено в объеме этими специфическими аспектами, описанными здесь, поскольку эти аспекты предназначены в качестве иллюстраций нескольких аспектов этого изобретения. Любые эквивалентные аспекты предназначены для того, чтобы находиться в объеме этого изобретения. Действительно, различные модификации этого изобретения, наряду с модификациями, показанными и описанными здесь, станут очевидными специалистам с квалификацией в данной области из предшествующего описания. Такие модификации предназначаются также для попадания в объем прилагаемой формулы. В случае конфликта, данное описание, включающее определения, будет контролировать.
Реферат
Изобретение относится к области биотехнологии, конкретно к вариантам исходного альбумина, что может быть использовано в медицине. Получают полипептид, который является вариантом альбумина или его фрагментом, где этот полипептид содержит изменения в двух или более положениях, выбранных из положений: (а) 492 и 580; (b) 492 и 574; (с) 492 и 550; (d) 550 и 573; (e) 550 и 574; (f) 550 и 580 в SEQ ID NO: 2, и не содержит мутаций E492G+K573P, E492G+K573A или E492G+N503K, а также получают слитые с ним полипептиды, полинуклеотиды, кодирующие эти варианты, конъюгаты, ассоциаты и наночастицы с ним, композиции, векторы, клетки-хозяева, содержащие эти полинуклеотиды, и способы использования этих вариантов. Изобретение позволяет получить варианты альбумина, имеющие увеличенный период полужизни в плазме и увеличенную аффинность связывания с FcRn в сравнении с исходным альбумином. 30 н. и 50 з.п. ф-лы, 4 ил., 27 табл., 5 пр.

Комментарии