Рекомбинантный фактор viii, обладающий повышенной стабильностью - RU2531493C2
Код документа: RU2531493C2
Чертежи














Описание
Описание
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США № 60/984518, поданной 1 ноября 2007, и предварительной заявке на патент США № 60/991304, поданной 30 ноября 2007, содержание которых полностью включено в настоящую заявку посредством ссылки.
Настоящее изобретение было создано при поддержке правительства в рамках грантов HL 76213 и HL 38199 Национального института здравоохранения. Правительство имеет определенные права на данное изобретение.
УРОВЕНЬ ТЕХНИКИ
Гемофилия A, наиболее распространенное заболевание среди серьезных наследственных нарушений, связанных с нарушениями свертываемости крови, возникает в результате недостатка или дефекта белка плазмы крови - фактора VIII. На сегодняшний день гемофилия неизлечима, и лечение включает замещающую терапию с применением препаратов из (очищенной) плазмы или рекомбинантного белка.
Фактор VIII циркулирует в крови в виде нековалентно связанного зависимого от ионов металла гетеродимера. В форме такого прокофактора белок содержит тяжелую цепь (HC, heavy chain), включающую домены A1(a1)A2(a2)B, и легкую цепь (LC, light chain), включающую домены (a3)A3C1C2, где строчные буквы a обозначают короткие (~30-40 остатков) участки, богатые кислыми остатками (см. Fay, “Activation of Factor VIII and Mechanisms of Cofactor Action,” Blood Rev. 18:1-15 (2004)). Фактор VIII активируется при протеолитическом расщеплении в областях контакта доменов A1A2, A2B и A3A3, катализируемом тромбином или фактором Xa. Продукт данной реакции, фактор VIIIa, представляет собой гетеродимер, включающий субъединицы, обозначаемые как A1, A2 и A3C1C2, который функционирует как кофактор для серин-протеазного фактора IXa при мембранозависимой конверсии зимогена фактора X в сериновую протеазу, фактор Xa (см. Fay, “Activation of Factor VIII and Mechanisms of Cofactor Action,” BloodRev. 18:1-15 (2004)).
Исследования с использованием реконструкции показали, что гетеродимерная структура фактора VIII поддерживается как за счет электростатических, так и за счет гидрофобных взаимодействий (Fay, “Reconstitution of Human Factor VIII from Isolated Subunits,” Arch Biochem Biophys. 262:525-531 (1988); Ansong et al., “Factor VIII A1 Domain Residues 97-105 Represent a Light Chain-interactive Site,” Biochemistry. 45:13140-13149 (2006), и внутрицепное сродство дополнительно усиливается при связывании фактора VIII с фактором фон Виллебранда (Fay, “Reconstitution of Human Factor VIII from Isolated Subunits,” Arch Biochem Biophys. 262:525-531 (1988); Kaufman et al., “Regulation of Factor VIII Expression and Activity by von Willebrand Factor,” Thromb Haemost. 82:201-208 (1999)). Ионы металлов также вносят вклад в сродство внутри цепи и параметры активности (Wakabayashi et al., “Metal Ion-independent Association of Factor VIII Subunits and the Roles of Calcium and Copper Ions for Cofactor Activity and Inter-subunit Affinity,” Biochemistry 40:10293-10300 (2001)). Для приобретения активной конформации фактора VIII необходим кальций. В исследованиях с использованием мутагенеза кальций-связывающий сайт был локализован в сегменте, богатом кислыми остатками в пределах домена A1 (аминокислотные остатки 110-126), и в пределах данной области были идентифицированы конкретные остатки, значимые для координации ионов (Wakabayashi et al., “Residues 110-126 in the A1 Domain of Factor VIII Contain a Ca2+ Binding Site Required for Cofactor Activity,” J Biol Chem. 279:12677-12684 (2004)). Недавние исследования с помощью рентгеноструктурного анализа промежуточного разрешения (Shen et al., “The Tertiary Structure and Domain Organization of Coagulation Factor VIII,” Blood 111:1240-1247 (2008)) подтвердили наличие такого кальций-связывающего сайта, а также позволили предположить наличие второго потенциального сайта в пределах домена A2. Анализ структуры также показал связывание двух сайтов для ионов меди 1-го типа в пределах доменов A1 и A3. Проведенные ранее функциональные исследования показали, что ионы меди способствуют объединению тяжелых и легких цепей с образованием димера, увеличивая внутрицепное сродство в несколько раз при физиологических значениях pH (Fay et al., “Human Factor VIIIa Subunit Structure: Reconstruction of Factor VIIIa from the Isolated A1/A3-C1-C2 Dimer and A2 Subunit,” JBiolChem. 266:8957-8962 (1991); Wakabayashi et al., “pH-dependent Association of Factor VIII Chains: Enhancement of Affinity at Physiological pH by Cu2+,” Biochim Biophys Acta. 1764:1094-1101 (2006); Ansong et al., “Factor VIII A3 Domain Residues 1954-1961 Represent an A1 Domain-Interactive Site,” Biochemistry 44:8850-8857 (2005)).
Нестабильность фактора VIIIa обусловлена слабыми электростатическими взаимодействиями между субъединицей A2 и димером A1/A3C1C2 (Fay et al., “Human Factor VIIIa Subunit Structure: Reconstruction of Factor VIIIa from the Isolated A1/A3-C1-C2 Dimer and A2 Subunit,” J Biol Chem. 266:8957-8962 (1991); Lollar et al., “pH-dependent Denaturation of Thrombin-activated Porcine Factor VIII,”J BiolChem. 265:1688-1692 (1990)) и приводит к снижению активности фактора Хазы (factor Xase activity) (Lollar et al., “Coagulant Properties of Hybrid Human/Porcine Factor VIII Molecules,” J Biol Chem. 267:23652-23657 (1992); Fay et al., “Model for the Factor VIIIa-dependent Decay of the Intrinsic Factor Xase: Role of Subunit Dissociation and Factor IXa-catalyzed Proteolysis,” J Biol Chem. 271:6027-6032 (1996)). Данные, касающиеся ассоциации субъединицы A2 в факторе VIIIa, ограничены, и, по-видимому, остатки в обоих доменах A1 и A3 способствуют удержанию указанной субъединицы. Было показано, что несколько точечных мутаций в факторе VIII облегчают диссоциацию A2 по сравнению с диким типом и эти остатки локализованы либо в области контакта доменов A1-A2 (Pipe et al., “Mild Hemophilia A Caused by Increased Rate of Factor VIII A2 Subunit Dissociation: Evidence for Nonproteolytic Inactivation of Factor VIIIa in vivo,” Blood 93:176-183 (1999); Pipe et al., “Hemophilia A Mutations Associated with 1-stage/2-stage Activity Discrepancy Disrupt Protein-protein Interactions within the Triplicated A Domains of Thrombin-activated Factor VIIIa,” Blood 97:685-691 (2001)), либо в области контакта доменов A2-A3 (Hakeos et al., “Hemophilia A Mutations within the Factor VIII A2-A3 Subunit Interface Destabilize Factor VIIIa and Cause One-stage/Two-stage Activity Discrepancy,” Thromb Haemost. 88:781-787 (2002)). Такие мутантные формы фактора VIII демонстрируют различия в результатах одноступенчатого и двухступенчатого анализа (Duncan et al., “Familial Discrepancy Between the One-stage and Two-stage Factor VIII Methods in a Subgroup of Patients with Haemophilia A,” Br JHaematol. 87:846-848 (1994); Rudzki et al., “Mutations in a Subgroup of Patients with Mild Haemophilia A and a Familial Discrepancy Between the One-stage and Two-stage Factor VIII:C Methods,” Br J Haematol. 94:400-406 (1996)), при значимом снижении значений активности, определенных с помощью последующего анализа, вследствие увеличения скорости диссоциации субъединицы A2.
Изучение домена A фактора VIII в модели, основанной на гомологии с церулоплазмином (Pemberton et al., “A Molecular Model for the Triplicated A Domains of Human Factor VIII Based on the Crystal Structure of Human Ceruloplasmin,” Blood 89:2413-2421 (1997)), позволило предположить наличие протяженной области контакта между доменом A2 и доменами A1 и A3 с многочисленными потенциальными контактами, участвующими в связывающих взаимодействиях.
Проблема стабилизации фактора VIIIa представляет значительный интерес, поскольку более стабильная форма белка представляет лучшее средство для терапии гемофилии A, потенциально требуя меньших материальных затрат для лечения пациента (Fay et al., “Mutating Factor VIII: Lessons from Structure to Function,” Blood Reviews 19:15-27 (2005)). В связи с этим были описаны препараты фактора VIII, в которых применяли формы рекомбинантного белка с мутациями, предотвращающими диссоциацию субъединицы A2 за счет введения новых ковалентных связей между A2 и другими доменами фактора VIII (Pipe et al., “Characterization of a Genetically Engineered Inactivation-resistant Coagulation Factor VIIIa,” Proc Natl Acad Sci USA 94:11851-11856 (1997); Gale et al., “An Engineered Interdomain Disulfide Bond Stabilizes Human Blood Coagulation Factor VIIIa,” J. Thromb. Haemostasis 1:1966-1971 (2003)). Однако после этого было показано, что такого рода мутации могут быть нежелательными в факторе VIII, применяемом в терапевтических целях, поскольку они по существу исключают способы негативной регуляции. Это может стать причиной протромботических состояний, которые могут нанести вред. Таким образом, необходимо увеличить стабильность как фактора VIII, так и фактора VIIIa при снижении до минимума вероятности развития протромботических состояний.
Настоящее изобретение направлено на преодоление этих и других недостатков, известных в данной области техники.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к рекомбинантному фактору VIII, содержащему одну или более мутаций, приводящих к увеличению стабильности как фактора VIII, так и фактора VIIIa.
Предпочтительно, одна или более мутаций представляет собой замену одного или более заряженных аминокислотных остатков на гидрофобный аминокислотный остаток в одной или обеих областях контакта доменов A1A2 или A2A3. В частности, предпочтительный рекомбинантный фактор VIII согласно настоящему изобретению включает замену остатка Glu287 фактора VIII дикого типа, замену остатка Asp302 фактора VIII дикого типа, замену остатка Asp519 фактора VIII дикого типа, замену остатка Glu665 фактора VIII дикого типа, замену остатка Glu1984 фактора VIII дикого типа, или комбинацию указанных замен.
Второй аспект настоящего изобретения относится к фармацевтической композиции, содержащей рекомбинантный фактор VIII согласно первому аспекту настоящего изобретения.
Третий аспект настоящего изобретения относится к изолированной молекуле нуклеиновой кислоты, кодирующей рекомбинантный фактор VIII согласно первому аспекту настоящего изобретения. В данный аспект настоящего изобретения также входят системы для экспрессии рекомбинантной ДНК, содержащие молекулу ДНК, кодирующую рекомбинантный фактор VIII согласно настоящему изобретению, и рекомбинантные клетки-хозяева, содержащие молекулу ДНК и/или систему для рекомбинантной экспрессии.
Четвертый аспект настоящего изобретения относится к способу получения рекомбинантного фактора VIII, включающему: выращивание клетки-хозяина согласно третьему аспекту настоящего изобретения при условиях, в которых клетка-хозяин экспрессирует рекомбинантный фактор VIII; и выделение рекомбинантного фактора VIII.
Пятый аспект настоящего изобретения относится к способу лечения гемофилии A у животных. Этот способ лечения включает: введение животному, страдающему гемофилией A, эффективного количества рекомбинантного фактора VIII согласно первому аспекту настоящего изобретения, при этом у животного наблюдается эффективное свертывание крови после повреждения сосудов.
Настоящее изобретение показывает, что ряд заряженных остатков в областях контакта доменов A1A2 и A2A3 не участвует в образовании водородных связей, а напротив данные остатки могут дестабилизировать структуру фактора VIII и/или могут способствовать диссоциации субъединицы A2 после активации прокофактора фактора VIII. Как было показано в прилагаемых Примерах, замена таких заряженных остатков на гидрофобные остатки с целью увеличения внутренней гидрофобной области и уменьшения внутренней гидрофильной области усиливает сродство к связыванию внутри доменов. Показатели стабильности оценивали по активности вариантов фактора VIII при повышенной температуре и по временной динамике снижения активности фактора VIIIa, обусловленного диссоциацией субъединицы A2. Результаты данных исследований показали, что ряд мутаций вызывает увеличение стабильности, что согласуется с устранением дестабилизирующих сил, вероятно вследствие углубления заряда в области контакта домена A2. Такие стабильные варианты фактора VIII и активированный кофактор VIIIa позволят получить средство для лечения гемофилии A с улучшенными характеристиками.
КРАТКОЕ ОПИСАНИЕ ФИГУР
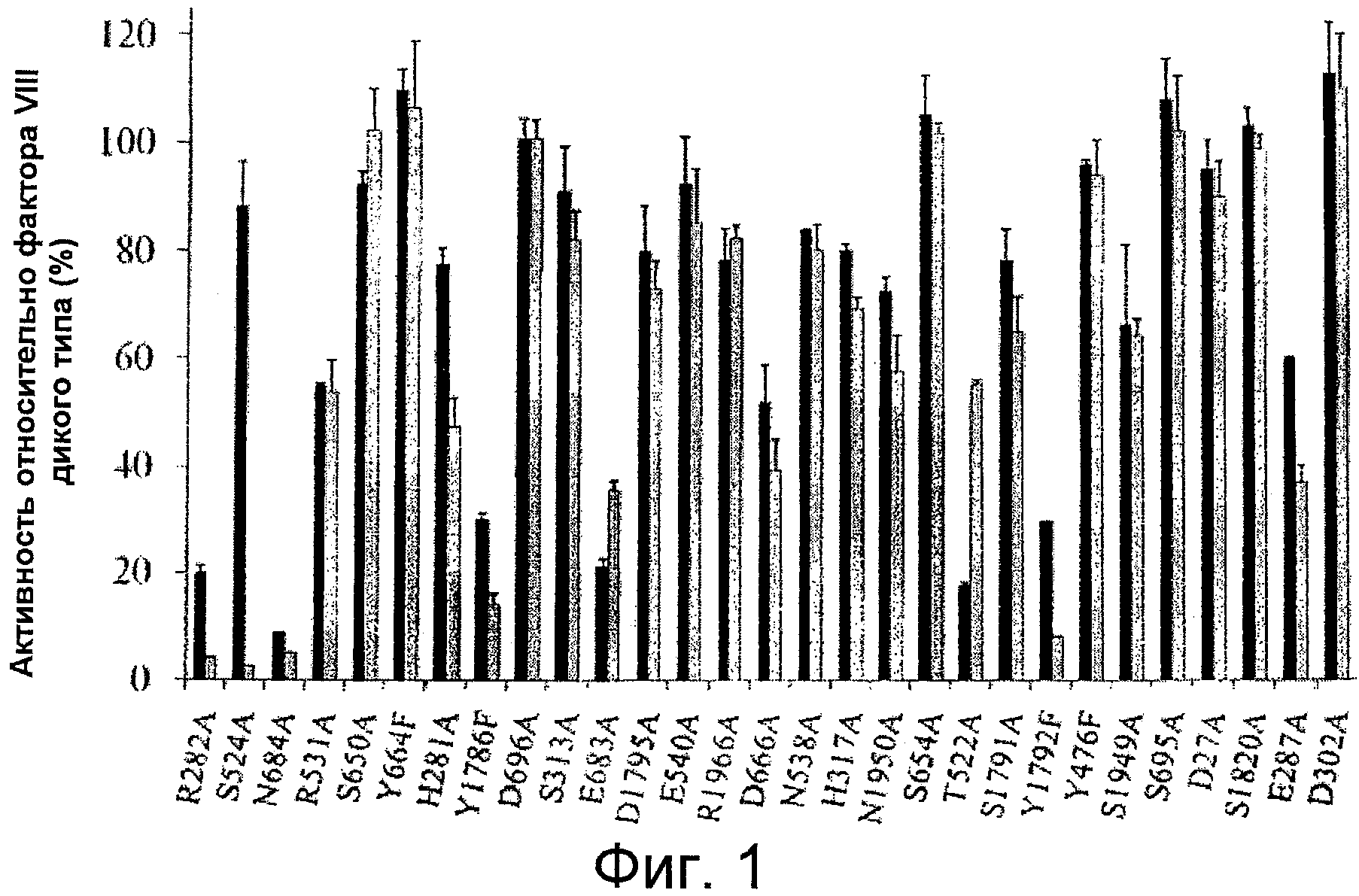
Фигура 1 представляет собой график, иллюстрирующий активность мутантных форм фактора VIII, относительно активности фактора VIII дикого типа (WT), оцененную с помощью одноступенчатого анализа коагулирующей активности (черные столбцы) и двухступенчатого хромогенного анализа образования фактора Xa (серые столбцы). Активность дикого типа и мутантных форм фактора VIII оценивали, как описано в Примерах. Планки погрешностей соответствуют значениям стандартного отклонения, рассчитанным на основании трех независимых измерений.
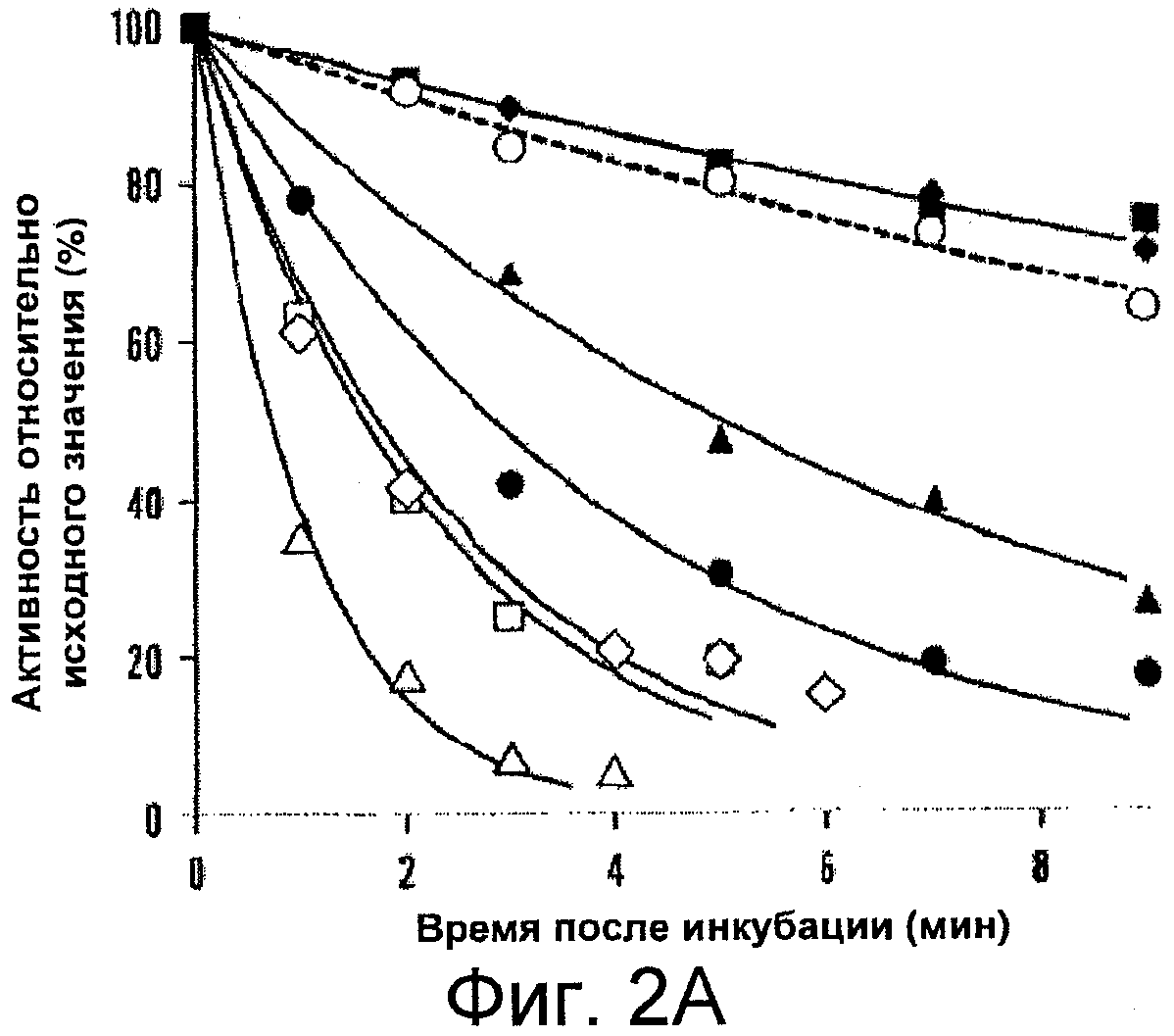
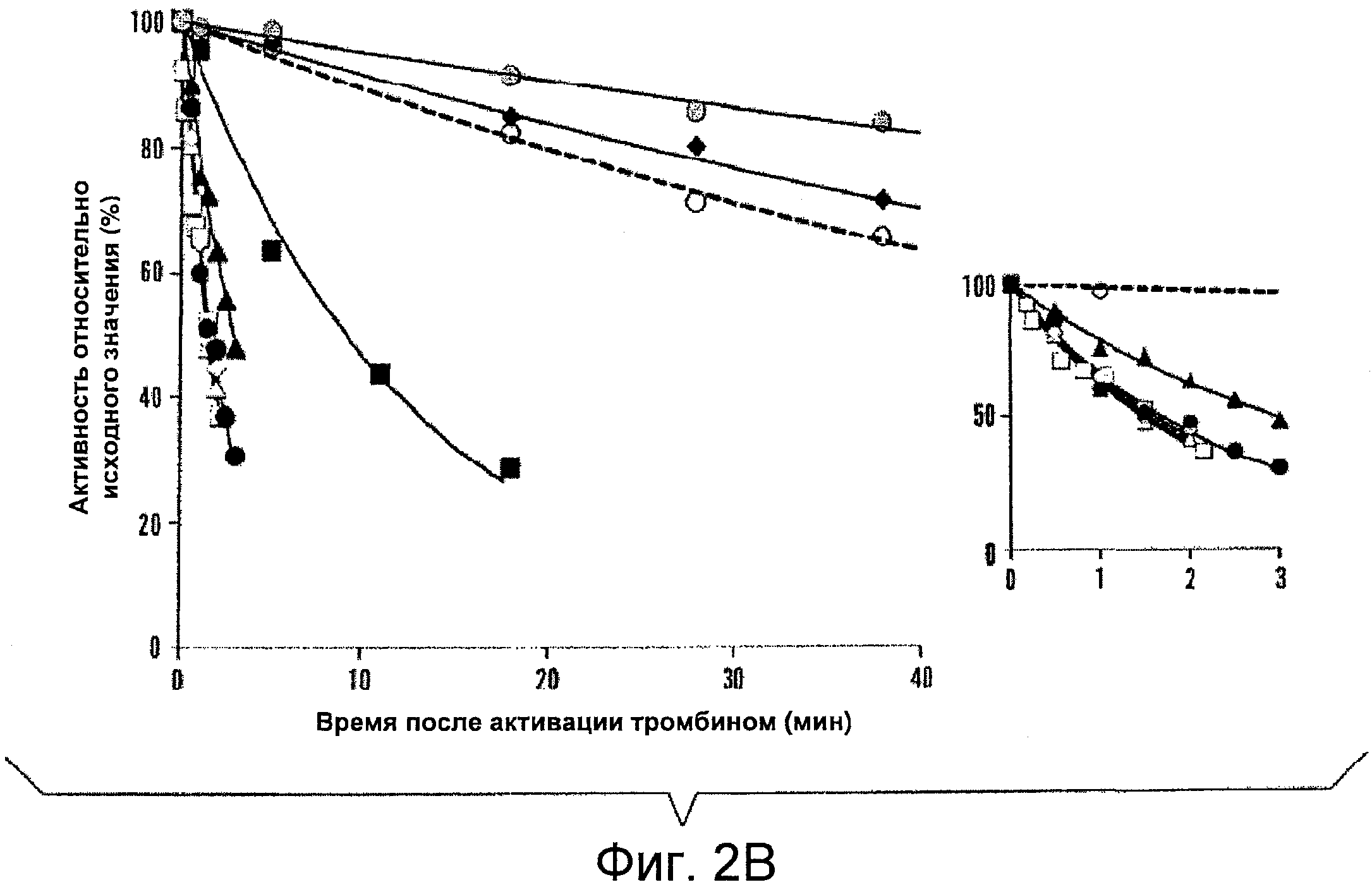
На фигурах 2A-B показано снижение (потеря) активности фактора VIII дикого типа и его мутантных форм и фактора VIIIa, соответственно. На фигуре 2A фактор VIII (4 нМ) инкубировали при 55°C, и в указанные моменты времени собирали аликвоты и исследовали их с помощью анализа образования фактора Xa, как описано в Примерах. Представлены результаты для дикого типа (пунктирная линия, белые кружки), R282A (белые треугольники), S524A (белые квадраты), N684A (белые ромбы), R531A (черные кружки), S650A (черные треугольники), E287A (черные квадраты) и D302A (черные ромбы). На Фигуре 2B активируемый тромбином фактор VIIIa (4 нМ) в присутствии 40 нМ фактора IXa инкубировали при 23°C, отбирали аликвоты в указанные моменты времени и оценивали активность с помощью анализа образования фактора Xa, как описано в Примерах. Представлены результаты для дикого типа (пунктирная линия, белые кружки), R282A (белые треугольники), S524A (белые квадраты), Y1792F (белые ромбы), N684A (черные кружки), Y1786F (черные треугольники), R531A (черные квадраты), E287A (черные ромбы) и D302A (серые кружки). Результаты для выбранных вариантов с быстрой потерей активности показаны в увеличенном масштабе во вставке на Фигуре 2B.
На фигурах 3A-B представлены результаты электрофореза ДСН-ПААГ (электрофореза в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН)) и Вестерн-блот анализа фактора VIII дикого типа и мутантных форм фактора VIII. На Фигуре 3A показаны результаты электрофореза ДСН-ПААГ в 8% полиакриламидном геле очищенных белков мутантных форм фактора VIII и фактора VIII дикого типа (0,77 мкг), окрашенных с помощью GelCode. На фигуре 3B представлены очищенные белки фактора VIII дикого типа и мутантных форм (0,34 мкг), разделенные с помощью электрофореза в 8% полиакриламидном геле, перенесенные на мембраны ПВДФ (поливинилиденфторид) и выявленные с помощью меченного биотином антитела R8B12. Полосы визуализировали с помощью хемифлуоресценции, как описано в прилагаемых Примерах. Дикий тип (дорожка 1), Glu272Ala (дорожка 2), Glu272Val (дорожка 3), Asp519Ala (дорожка 4), Asp519Val (дорожка 5), Glu665Ala (дорожка 6), Glu665Val (дорожка 7), Glu1984Ala (дорожка 8) и Glu1984Val (дорожка 9). MW, - маркер молекулярного веса: sFVIII, одноцепочечная форма фактора VIII: HC, тяжелая цепь: LC, легкая цепь. Наблюдаемые стехиометрические соотношения одноцепочечной формы и гетеродимера фактора VIII у дикого типа и мутантных форм фактора VIII составили 0,96 (дикий тип WT), 0,64 (Glu272Ala), 0,92 (Glu272Val), 0,74 (Asp519Ala), 0,8 (Asp519Val), 0,64 (Glu665Ala), 0,63 (Glu665Val), 0,91 (Glue1984Ala) и 0,5 (Glu1984Val).
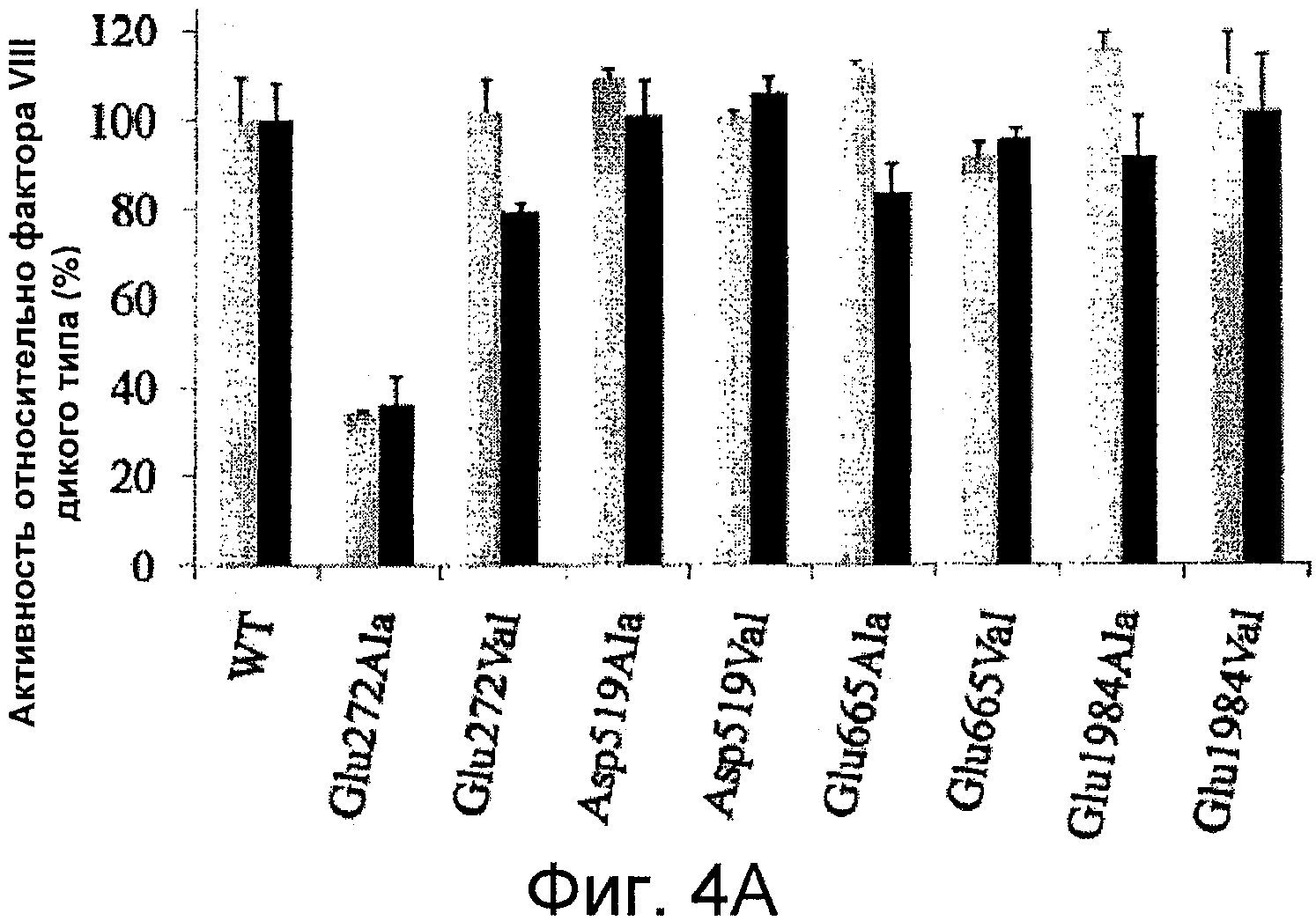
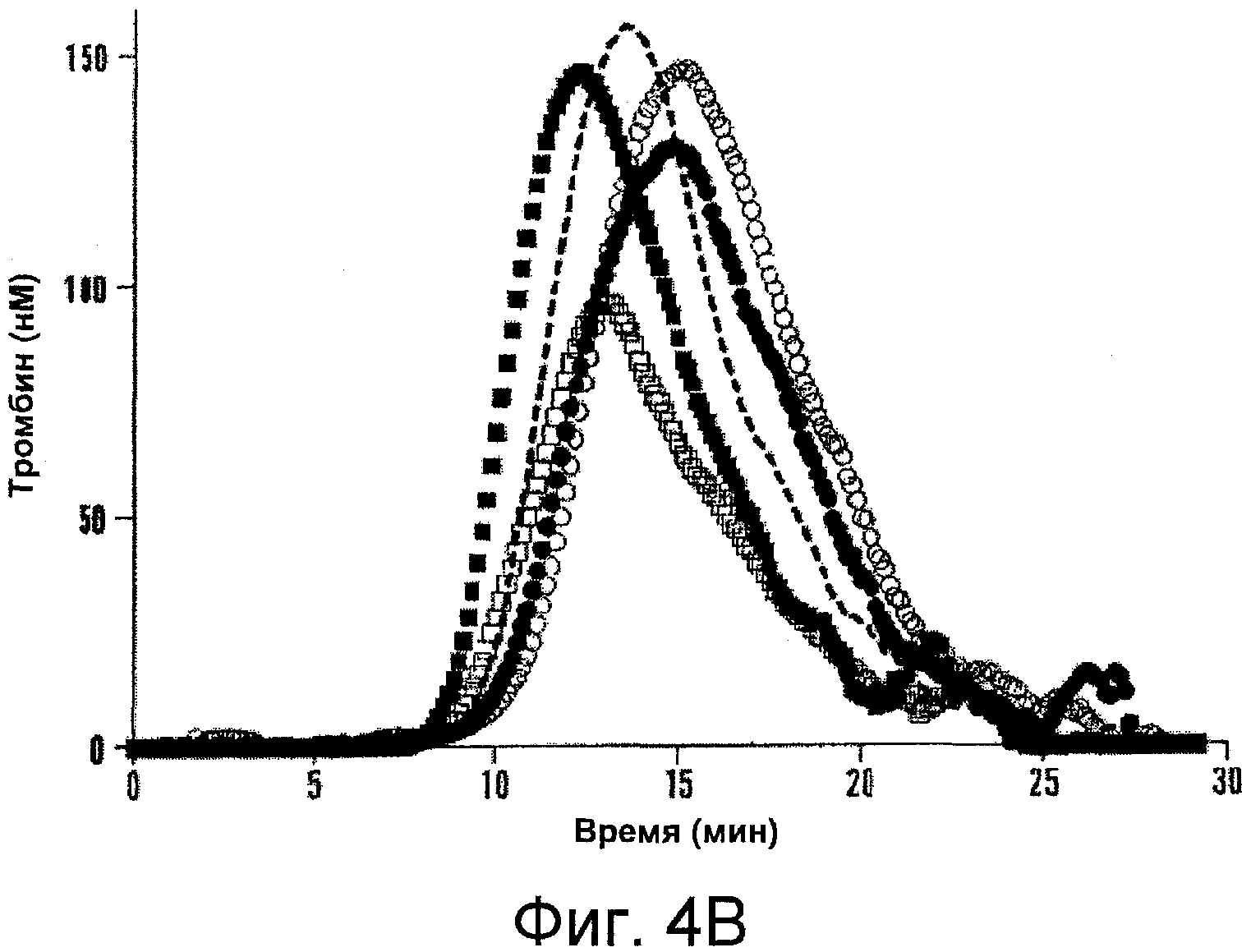
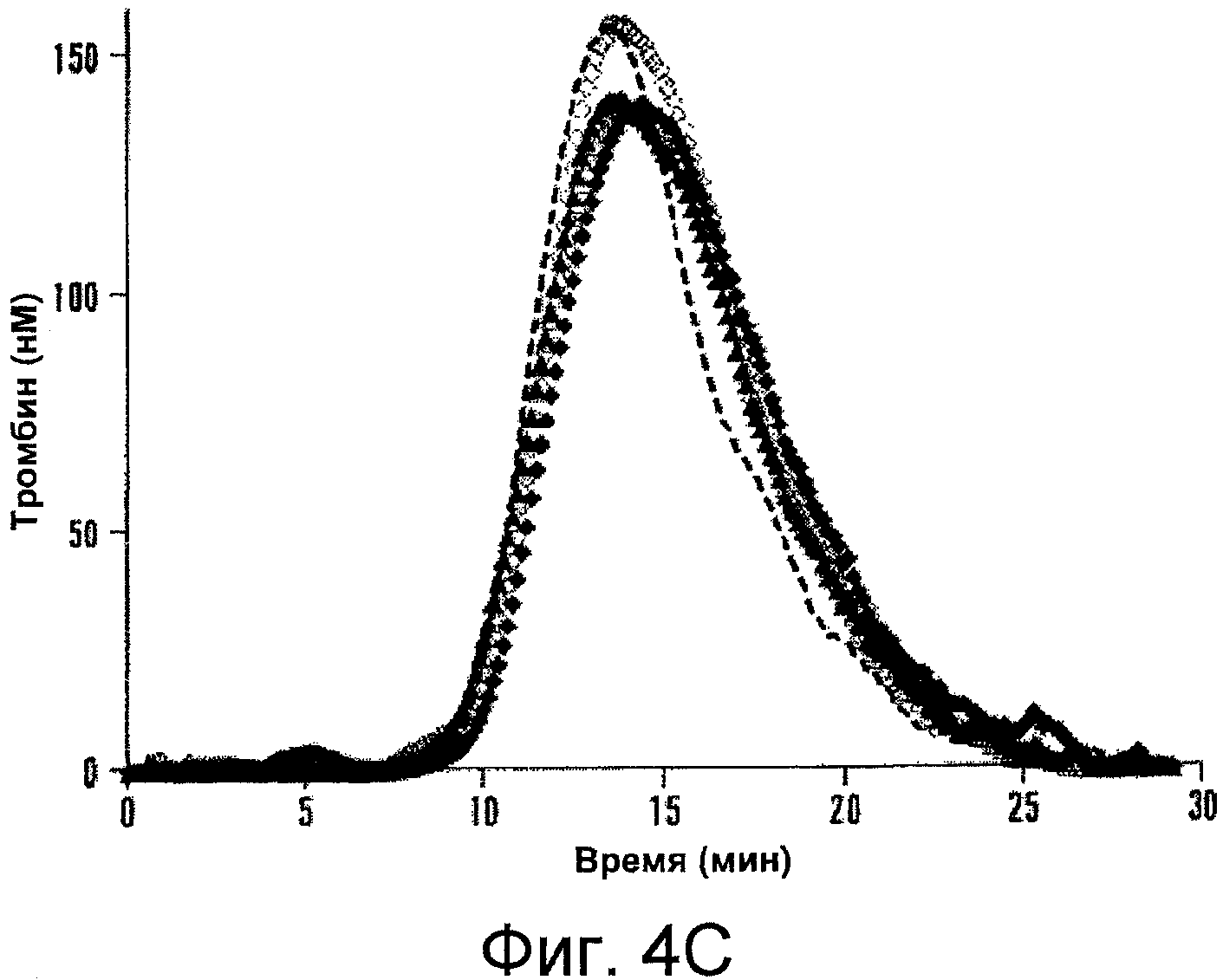
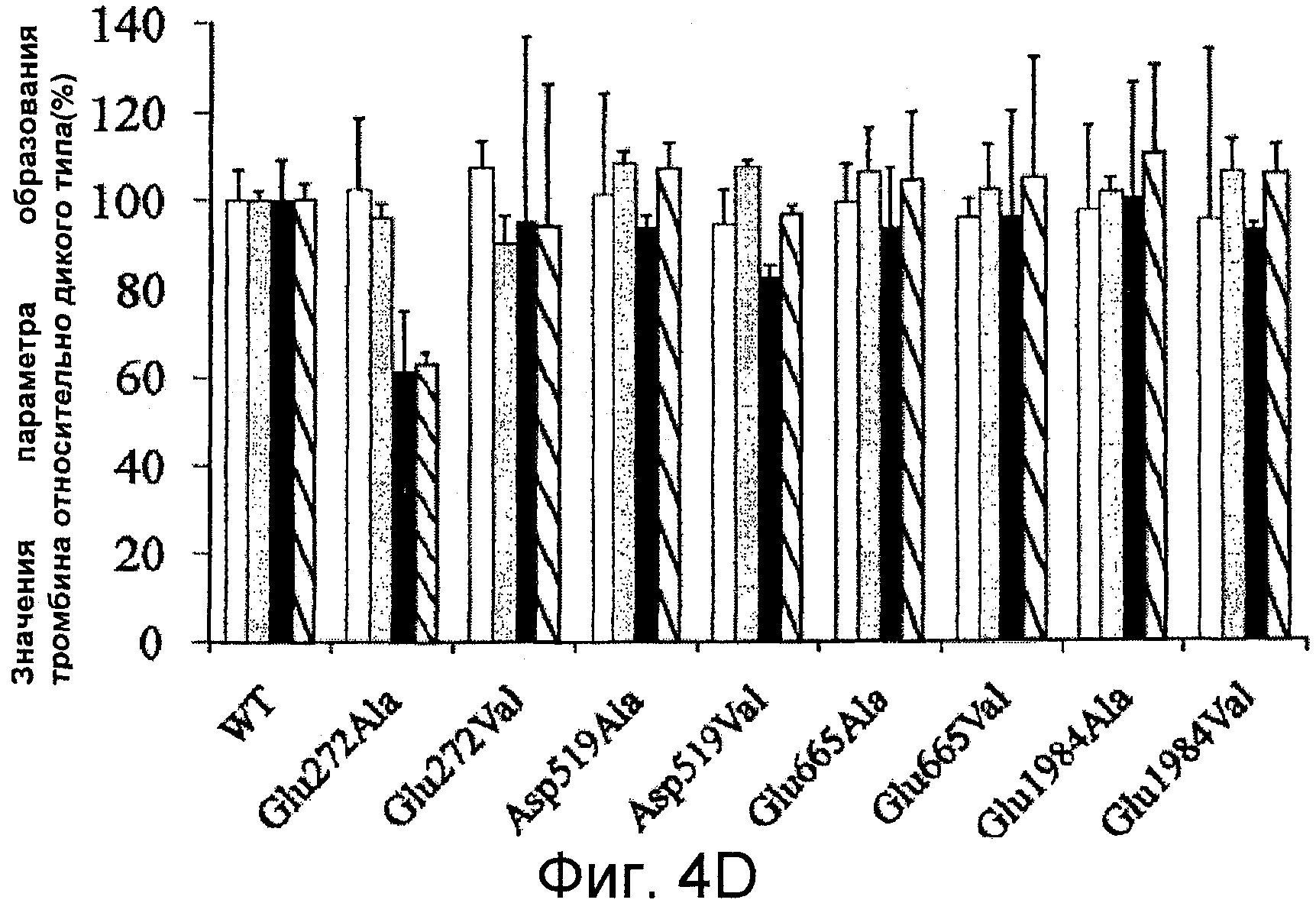
Фигуры 4A-D иллюстрируют специфичную активность мутантных форм фактора VIII относительно активности фактора VIII дикого типа и результаты анализа образования тромбина. На Фигуре 4A представлены значения активности, определенные с помощью одноступенчатого анализа коагулирующей активности (серые столбцы) и двухступенчатого хромогенного анализа образования фактора Xa (черные столбцы), как описано в прилагаемых Примерах. На Фигурах 4B-C представлена тромбограмма белков фактора VIII. Дикий тип (пунктирная линия), Glu272Ala (белые квадраты), Glu272Val (черные квадраты), Asp519Ala (белые кружки), Asp519Val (черные кружки), Glu665Ala (белые треугольники), Glu665Val (черные треугольники), Glu1984Ala (белые ромбы) и Glu1984Val (черные ромбы). На Фигуре 4D представлены значения параметра, полученные при анализе образования тромбина. Анализ образования тромбина проводили, как описано в прилагаемых Примерах. На тромбограммах представлены средние значения из трех повторностей. Значения параметра выражены в виде величин (%) относительно дикого типа. Фактические значения для дикого типа составили 7,5±0,5 мин (лаг-период), 13,7±0,3 мин (время пика), 157,3±14,7 нМ (величина пика), 979,8±37,9 нМ/мин (эндогенный потенциал тромбина ЭПТ (ETP)). Показаны лаг-период (незаштрихованные столбцы), время пика (серые столбцы), величина пика (черные столбцы) и ЭПТ (заштрихованные столбцы). Планки погрешностей соответствуют значениям стандартного отклонения, рассчитанным на основании трех независимых измерений.
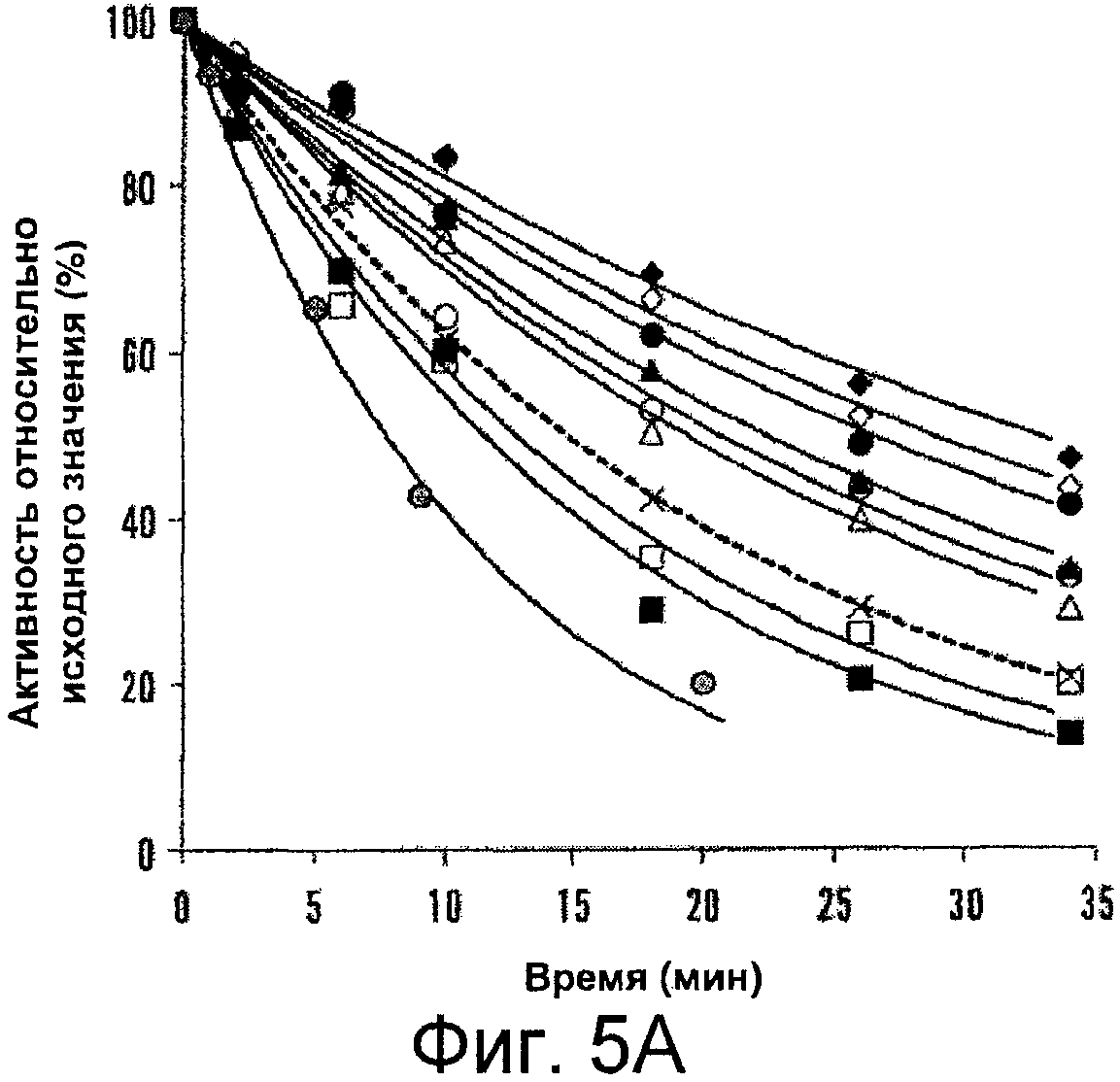
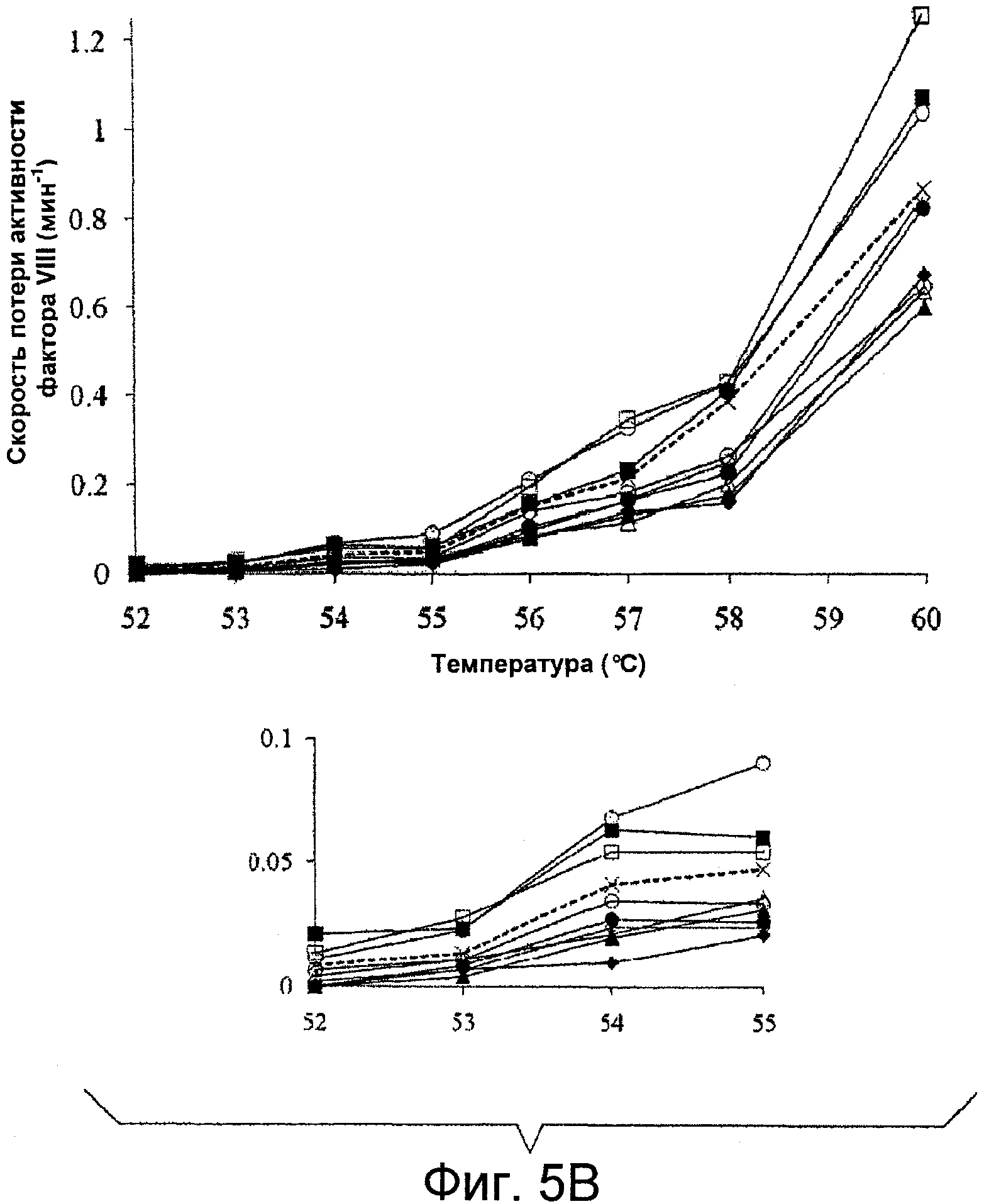
Фигуры 5A-B иллюстрируют снижение активности фактора VIII дикого типа и мутантных форм фактора VIII. Фактор VIII (4 нМ) инкубировали при различных температурах (52-60°C) и в указанные моменты времени отбирали аликвоты и определяли в них активность с помощью анализа образования фактора Xa, как описано в прилагаемых Примерах. Данные аппроксимировали с помощью нелинейного регрессионного анализа методом наименьших квадратов и рассчитывали скорость потери активности. Каждая точка соответствует среднему значению, полученному из трех независимых измерений. Показаны результаты для дикого типа WT (пунктирная линия, крестики), Glu272Ala (белые квадраты), Glu272Val (черные квадраты), Asp519Ala (белые кружки), Asp519Val (черные кружки), Glu665Ala (белые треугольники), Glu665Val (черные треугольники), Glu1984Ala (белые ромбы), Glu1984Val (черные ромбы) и полноразмерный фактор VIII Kogenate (серые кружки). На Фигуре 5A показаны характерные кривые снижения активности для фактора VIII после инкубации при 55°C. На Фигуре 5B представлены графики, иллюстрирующие скорости снижения для фактора VIII при различных температурах. Вставка на Фигуре 5B представляет собой увеличенную область графика снижения в диапазоне температур 52-55°C.
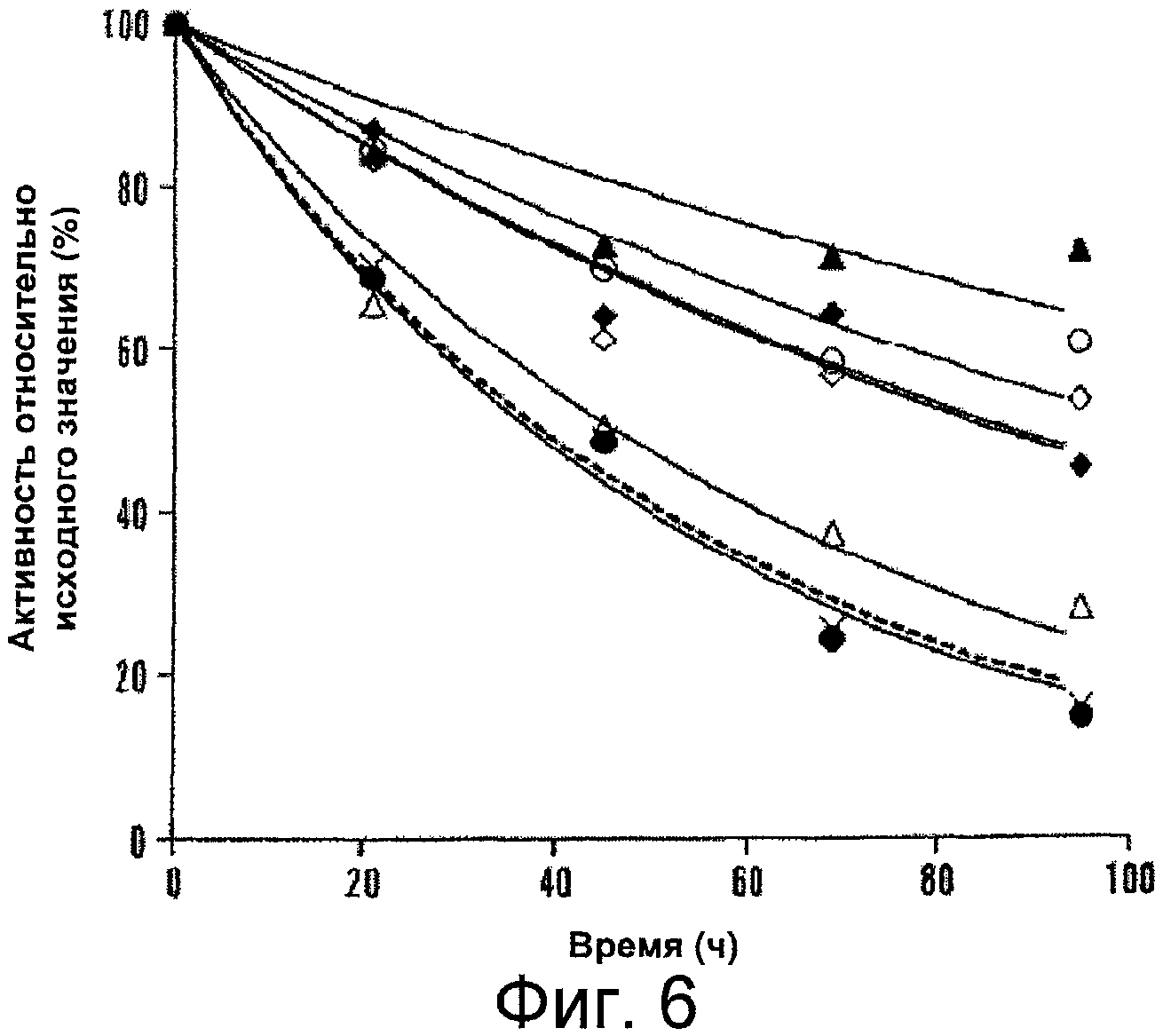
Фигура 6 представляет собой график, иллюстрирующий снижение активности фактора VIII в плазме при 37°C. Фактор VIII (1 нМ) инкубировали при 37°C в плазме, лишенной фактора VIII, и в указанные моменты времени отбирали аликвоты и исследовали их с помощью одноступенчатого анализа коагулирующей активности, как описано в прилагаемых Примерах. Представлены результаты для дикого типа (WT) (пунктирная линия, крестики), Asp519Ala (белые кружки), Asp519Val (черные кружки), Glu665Ala (белые треугольники), Glu665Val (черные треугольники), Glu1984Ala (белые ромбы), и Glu1984Val (черные ромбы). Данные аппроксимировали с помощью нелинейного регрессионного анализа методом наименьших квадратов; каждая точка соответствует среднему значению из трех независимых измерений.
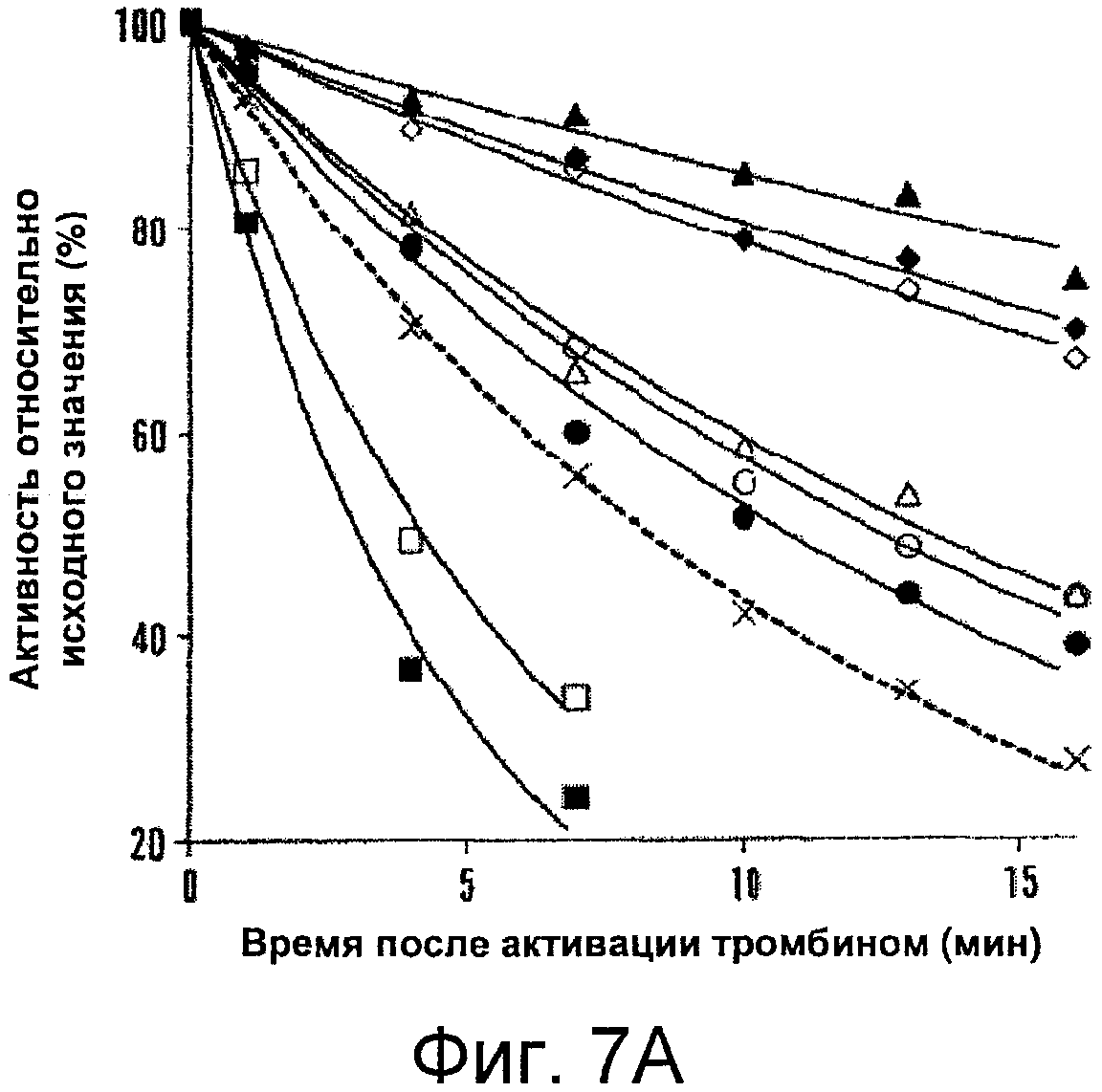
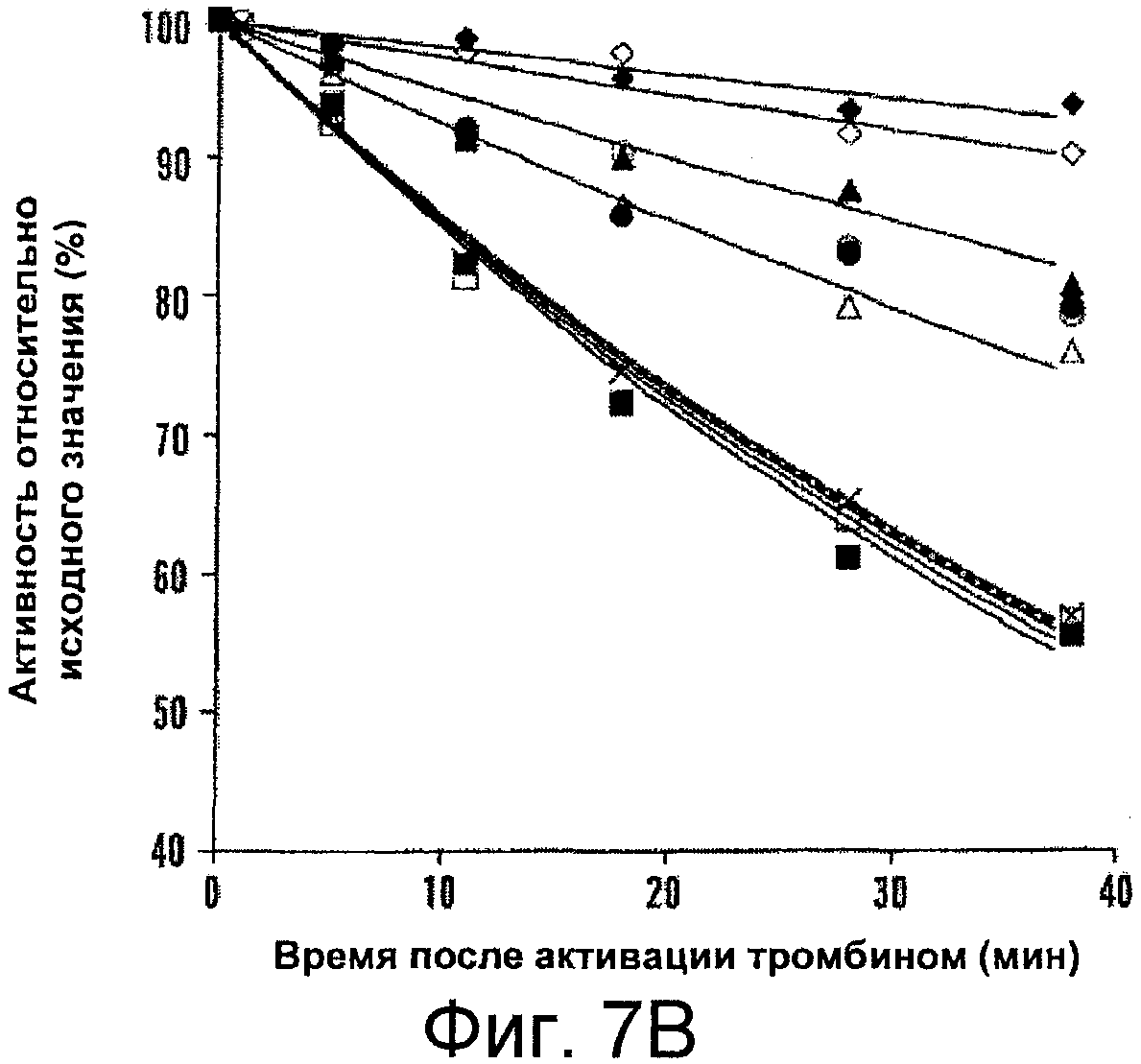
Фигуры 7A-B представляют собой графики, иллюстрирующие снижение активности для фактора VIIIa дикого типа (WT) и мутантной формы в отсутствие или в присутствии фактора IXa. На Фигуре 7A показан активируемый тромбином фактор VIIIa (4 нМ), который инкубировали при 23°C. Отбирали аликвоты в указанные моменты времени и определяли в них активность с помощью анализа образования фактора Xa, как описано в прилагаемых Примерах. На Фигуре 7B показано снижение активности для фактора VIIIa дикого типа и мутантных форм фактора VIIIa в присутствии фактора IXa. Фактор VIII (4 нМ) активировали с помощью тромбина в присутствии 40 нМ фактора IXa. В указанные моменты времени отбирали аликвоты и определяли в них активность с помощью анализа образования фактора Xa, как описано в прилагаемых Примерах. Представлены результаты для дикого типа (пунктирная линия, крестики), Glu272Ala (белые квадраты), Glu272Val (черные квадраты), Asp519Ala (белые кружки), Asp519Val (черные кружки), Glu665Ala (белые треугольники), Glu665Val (черные треугольники), Glu1984Ala (белые ромбы) и Glu1984Val (черные ромбы). Данные аппроксимировали с помощью нелинейного регрессионного анализа методом наименьших квадратов; каждая точка соответствует среднему значению из трех независимых измерений.
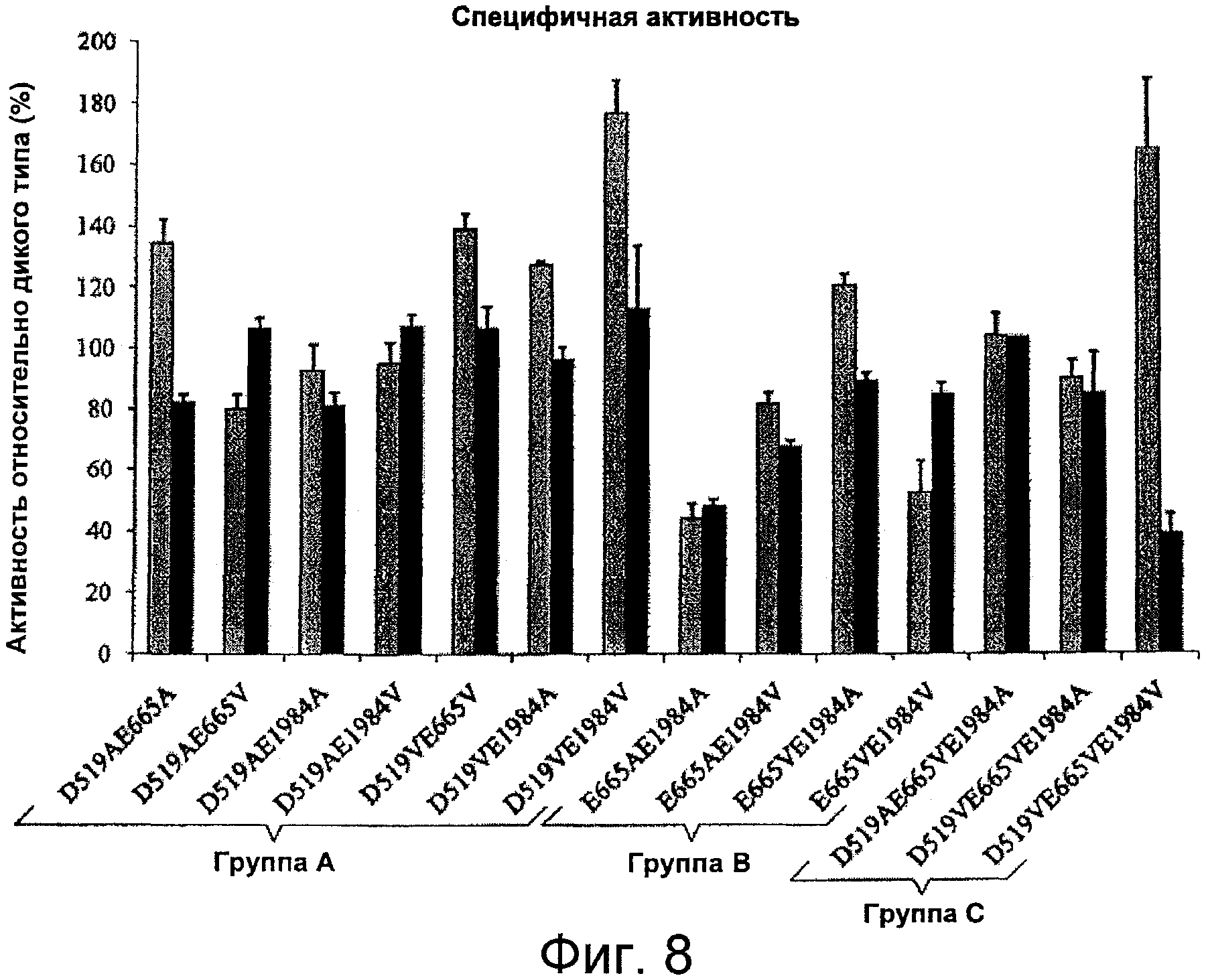
Фигура 8 представляет собой график, иллюстрирующий специфичную активность форм фактора VIII с двумя или тремя комбинированными мутациями, в которых остатки Asp519, Glu665 и/или Glu1984 заменены на Ala или Val. Значения активности определяли с помощью одноступенчатого анализа коагулирующей активности (серые столбцы) и двухступенчатого хромогенного анализа образования фактора Xa (черные столбцы), как описано в Примерах. Планки погрешностей соответствуют значениям стандартного отклонения, рассчитанным на основании трех независимых измерений.
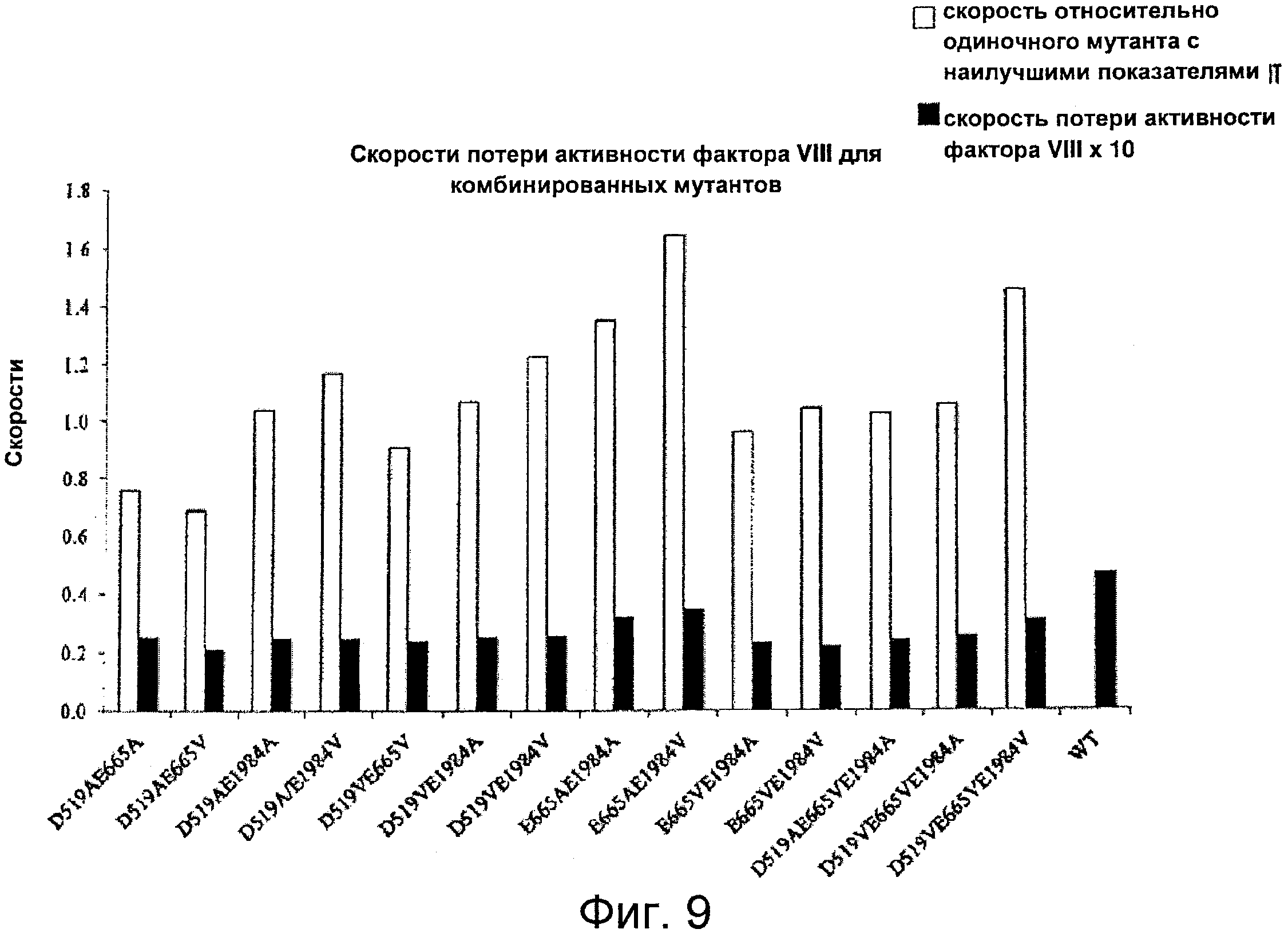
Фигура 9 представляет собой график, иллюстрирующий скорость снижения активности для фактора VIII дикого типа и мутантной формы фактора VIII с двумя или тремя комбинированными мутациями, в которых остатки Asp519, Glu665 и/или Glu1984 заменены на Ala или Val. Проводили эксперименты по определению снижения активности фактора VIII и оценивали скорость снижения с помощью нелинейного регрессионного анализа методом наименьших квадратов, как описано в Примерах. Серые столбцы показывают значения скорости относительно одиночных мутантов с наилучшими показателями (см. Пример 5, Фигура 5A), рассчитанные при делении на значение скорости с наилучшим показателем (наименьшим). Например, относительные значения скорости по отношению к одиночному мутанту с наилучшим показателем для двойного мутанта D519AE665A равно значению скорости падения для D519AE665A, деленному на скорость падения для D519A. Черные столбцы обозначают фактические значения параметра скорости снижения, представленные в виде ×10.
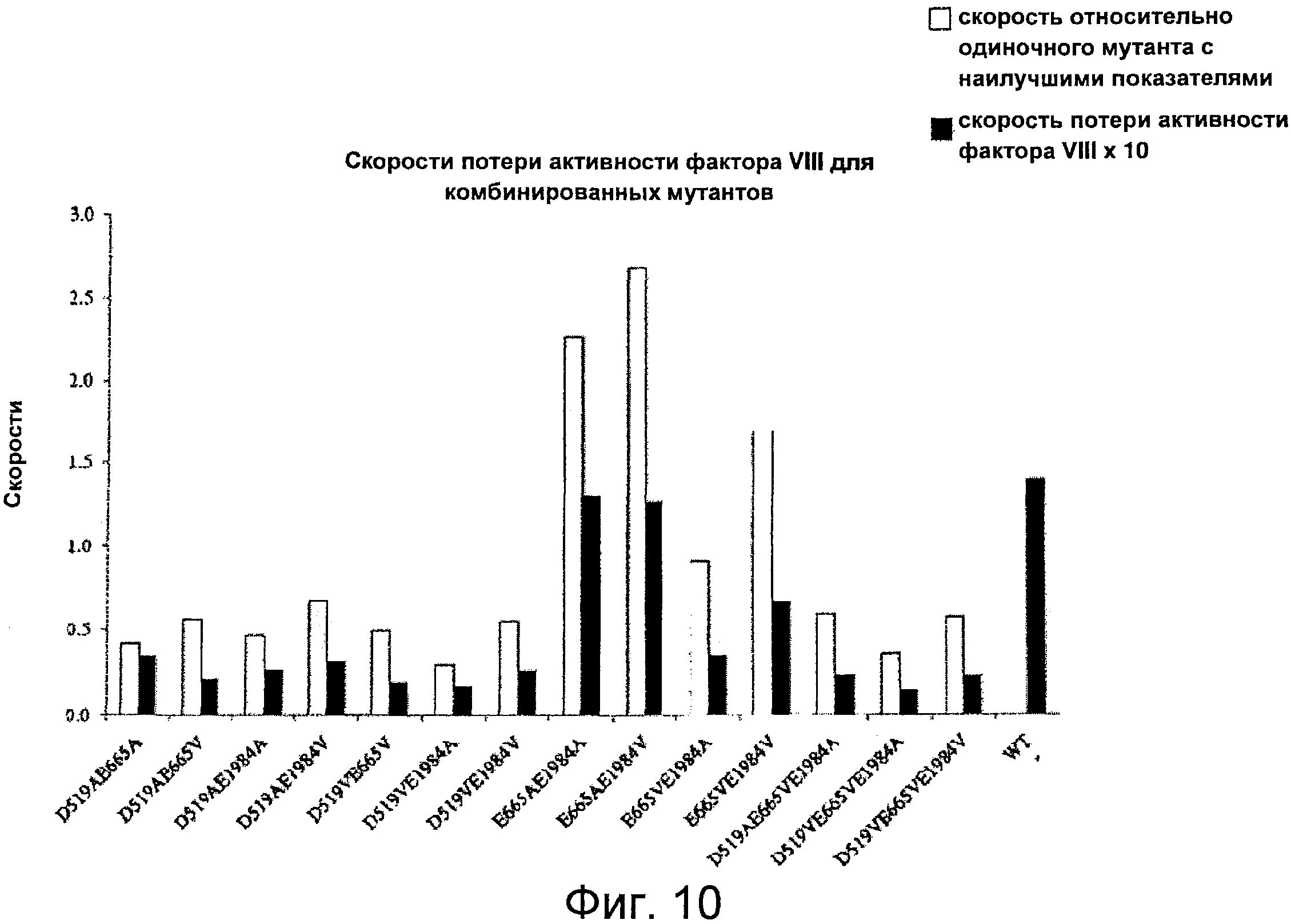
Фигура 10 представляет собой график, иллюстрирующий скорость снижения активности фактора VIIIa дикого типа и мутантных форм фактора VIII с двумя или тремя комбинированными мутациями, в которых остатки Asp519, Glu665 и Glu1984 заменены на Ala или Val. Проводили измерения снижения активности фактора VIIIa после инкубации 1,5 нМ фактора VIIIa в отсутствие фактора IXa, и скорости снижения оценивали с помощью нелинейного регрессионного анализа методом наименьших квадратов, как описано в Примерах. Серые столбцы обозначают скорости относительно одиночных мутантов с наилучшими показателями (см. Пример 7, Фигура 7A), и рассчитанные, как описано в пояснениях к Фигуре 9. Черные столбцы обозначают фактические значения параметра скорости снижения, представленные в виде ×10.
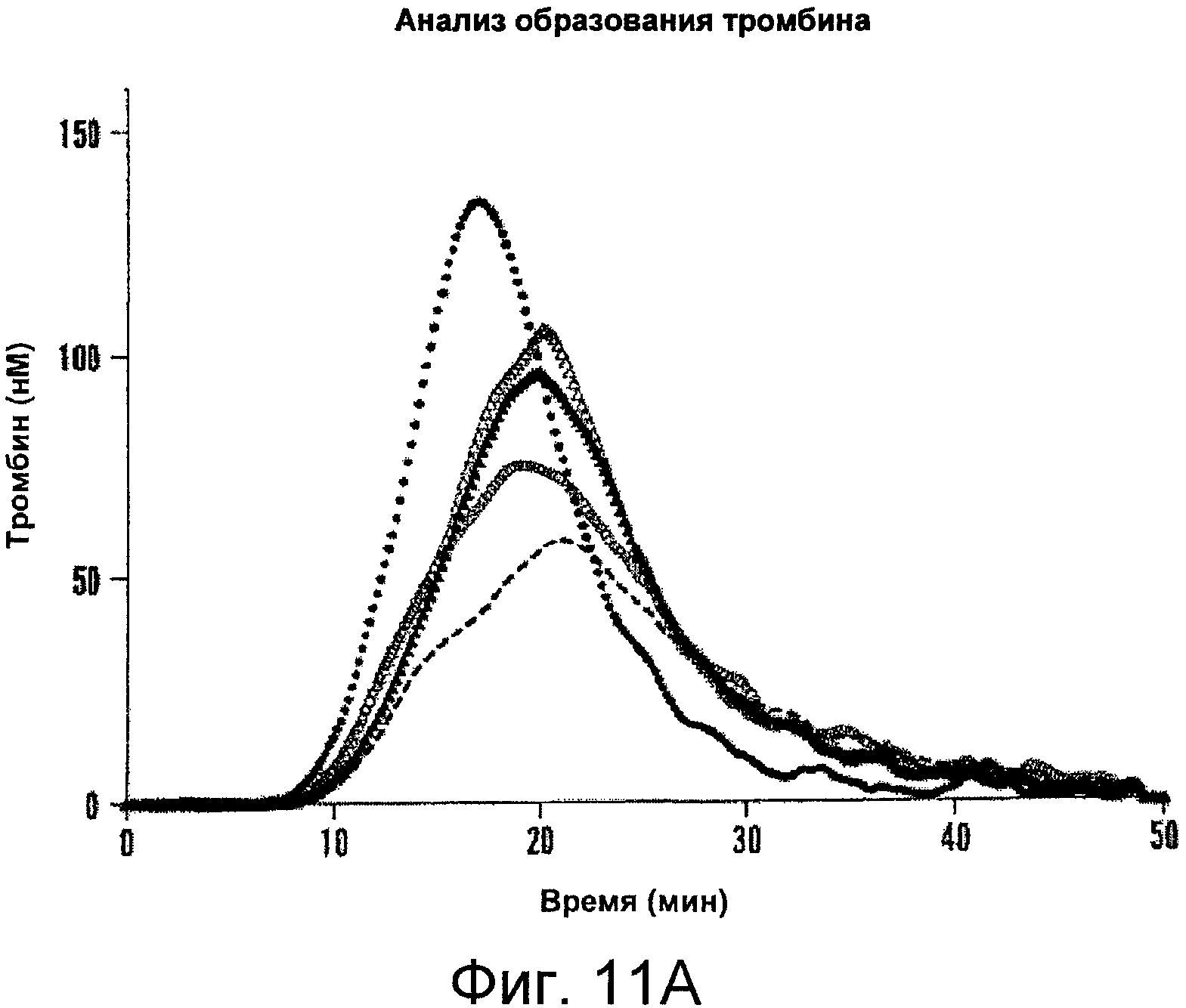
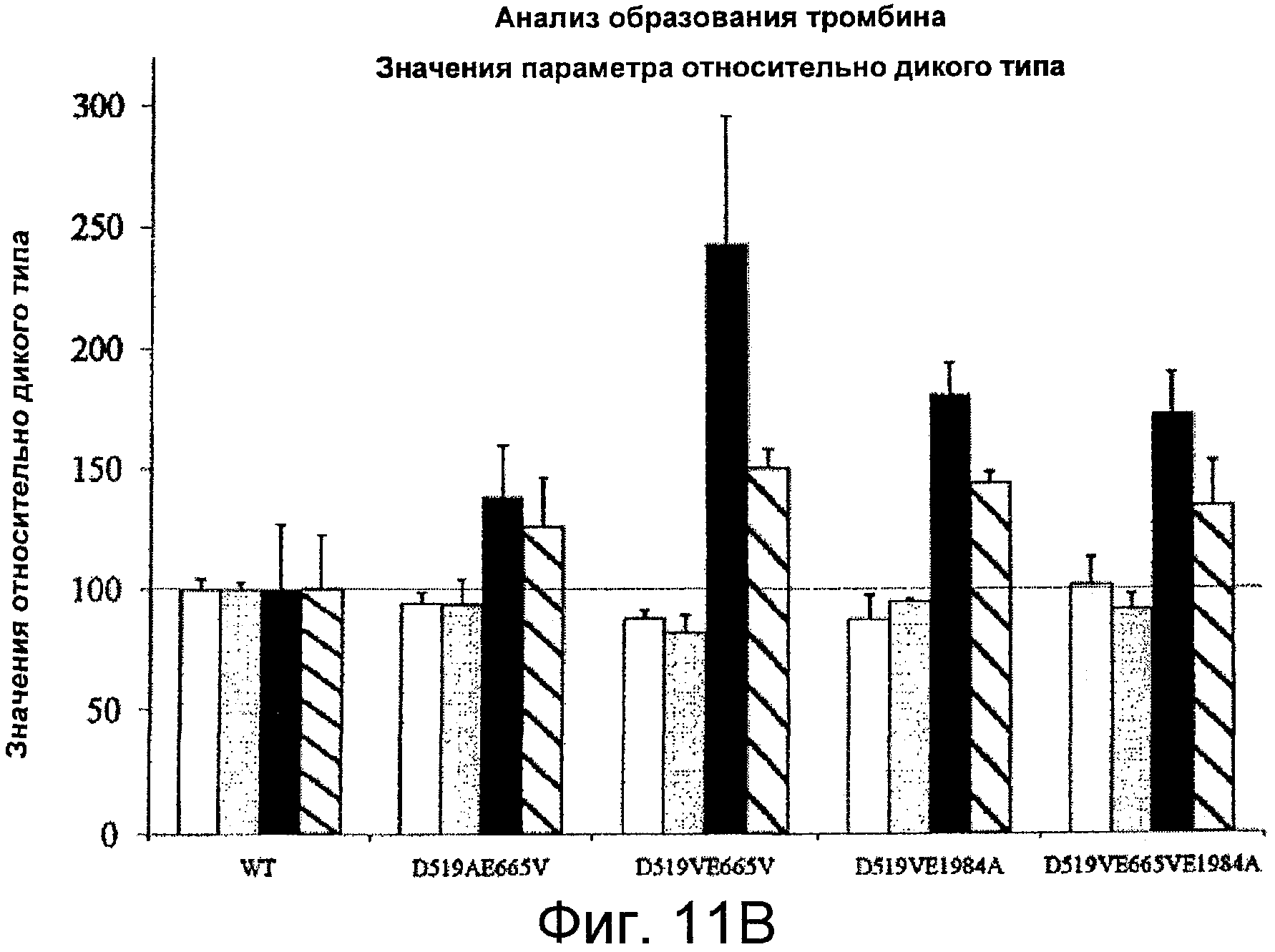
Фигуры 11A-B иллюстрируют результаты анализа образования тромбина с использованием комбинированных мутантов. На Фигуре 11A представлена тромбограмма белков фактора VIII. Анализ образования тромбина проводили, как описано в Примерах. Конечные концентрации реагентов составили 0,2 нМ (фактор VIII), 0,5 пМ (рТФ), 4 мкМ (фосфолипидные везикулы PSPCPE), 433 мкМ (флуорогенный субстрат), 13,3 мМ CalCl2 и 105 нМ (калибровочный маркер тромбина). Представлены результаты для дикого типа (пунктирная линия), D519AE665V (белые кружки), D519VE665V (черные кружки), D519VE1984A (белые треугольники) и D519VE665VE1984A (черные треугольники). На Фигуре 11B представлены значения параметра, полученные при анализе образования тромбина. На тромбограммах представлены средние значения из трех повторностей. Значения параметра выражены в значениях (%) относительно дикого типа. Фактические значения для дикого типа составили 8,5±0,4 мин (лаг-период), 21,3±0,6 мин (время пика), 58,5±15,6 нМ (величина пика), 883,6±199,8 нМ/мин (ЭПТ). Лаг-период (белые столбцы), время пика (серые столбцы), величина пика (черные столбцы) и ЭПТ (заштрихованные столбцы). Планки погрешностей соответствуют значениям стандартного отклонения, рассчитанным на основании трех независимых измерений.
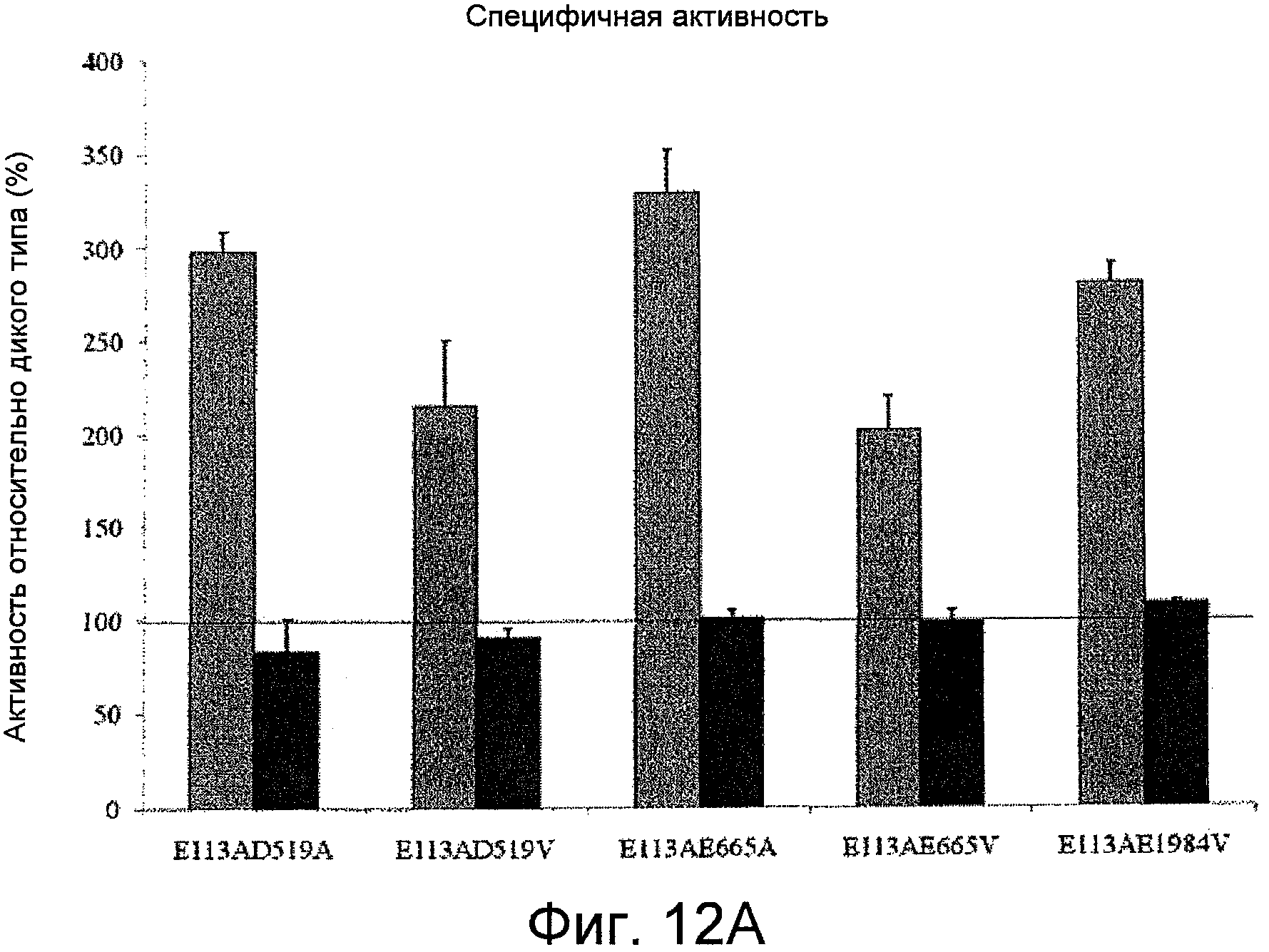
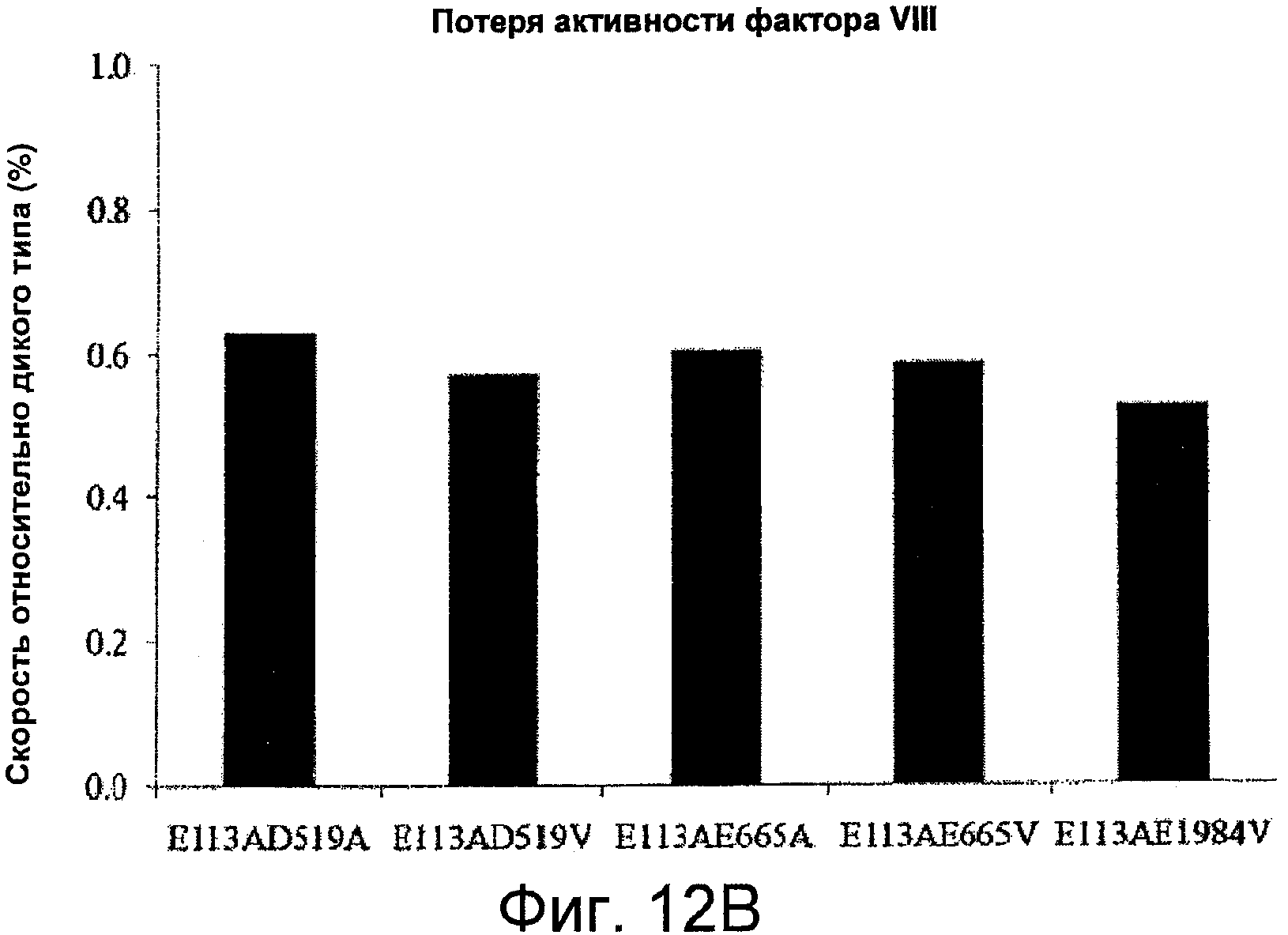
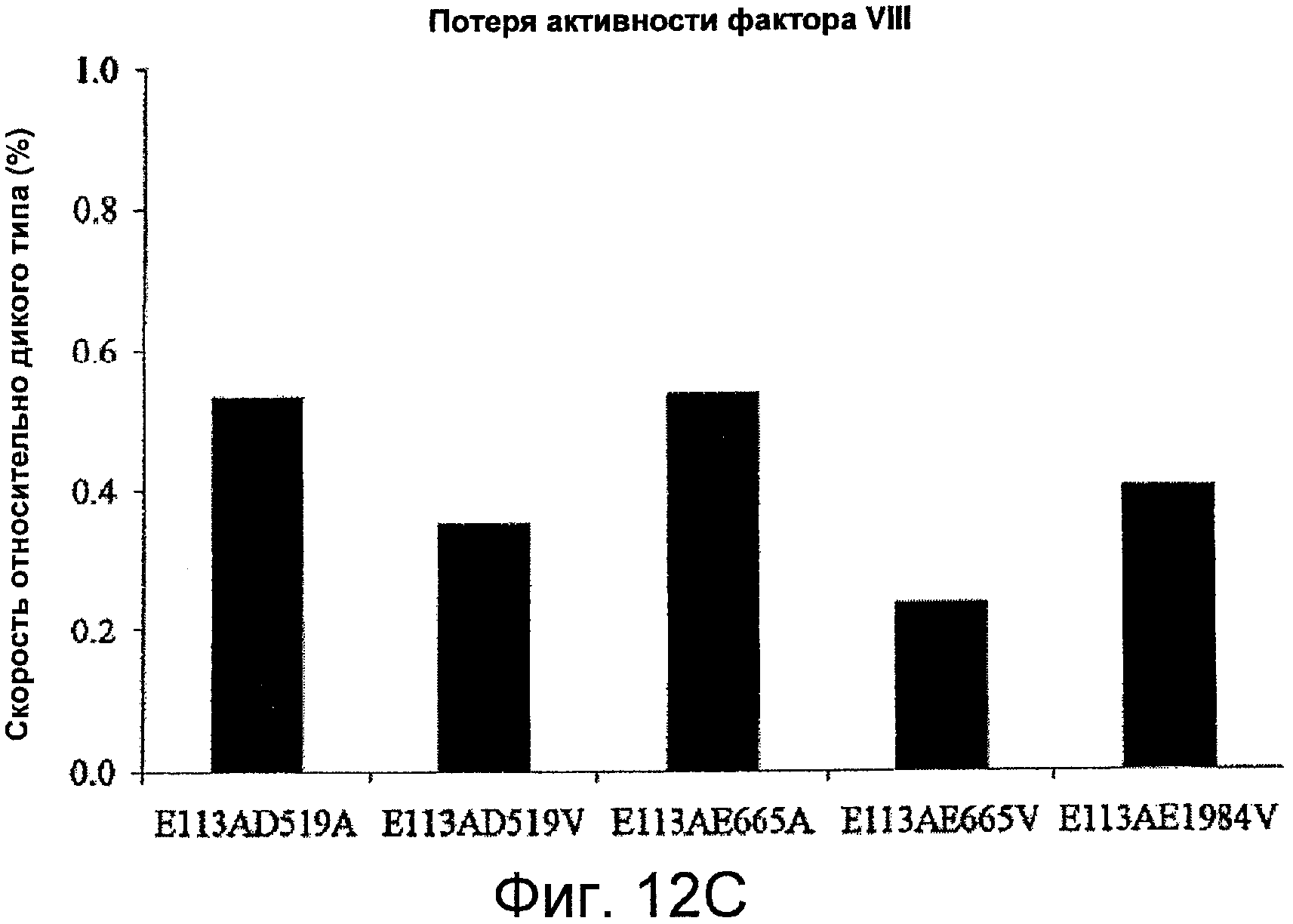
На Фигурах 12A-C представлены значения специфичной активности и скорости снижения активности для фактора VIII и фактора VIIIa относительно дикого типа для мутантов, содержащих Ala или Val вместо остатков Asp519, Glu665 и/или Glu1984 в комбинации с мутацией Glu113Ala. На Фигуре 12A представлена специфичная активность для комбинированных мутантов по сравнению с диким типом, измеренная с помощью одноступенчатого анализа коагулирующей активности (серые столбцы) и двухступенчатого хромогенного анализа образования фактора Xa (черные столбцы), как описано в Примерах. Планки погрешностей соответствуют значениям стандартного отклонения, рассчитанным на основании трех независимых измерений. На Фигуре 12B показаны результаты анализа снижения активности фактора VIII при 55°C; скорости снижения оценивали с помощью нелинейного регрессионного анализа методом наименьших квадратов, как описано в Примерах. На Фигуре 12C представлены результаты измерений снижения активности фактора VIIIa после инкубации 1,5 нМ фактора VIIIa в отсутствие фактора IXa; скорости снижения оценивали с помощью нелинейного регрессионного анализа методом наименьших квадратов, как описано в Примерах.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к рекомбинантному фактору VIII, содержащему одну или более мутаций, которые приводят к увеличению стабильности как фактора VIII, так и фактора VIIIa.
Рекомбинантный фактор VIII согласно настоящему изобретению может быть получен путем модификации последовательности аминокислот фактора VIII дикого типа или мутантной формы фактора VIII, модифицированной иным способом для изменения других свойств фактора VIII, таких как антигенность, время полужизни в кровотоке, секреция белка, сродство к фактору IXa и/илифактору X, измененные сайты инактивирующего расщепления фактора VIII, иммуногенности, срока хранения и т.п.
Подходящий фактор VIII дикого типа, который может быть модифицирован согласно настоящему изобретению, может быть получен от различных животных, включающих, без ограничения, млекопитающих, таких как человек (см., например, номер доступа в GenBank AAA52484 (последовательность аминокислот) и K01740 (последовательность нуклеотидов); и номер доступа в GenBank CAD97566 (последовательность аминокислот) и AX746360 (последовательность нуклеотидов), включенные в настоящую заявку посредством ссылки в полном объеме), крысы (см., например,номер доступа в GenBank AAQ21580 (последовательность аминокислот) и AY362193 (последовательность нуклеотидов), включенные в настоящую заявку посредством ссылки в полном объеме), мыши (см., например,номер доступа в GenBank AAA37385 (последовательность аминокислот) и L05573 (последовательность нуклеотидов), включенные в настоящую заявку посредством ссылки в полном объеме), морские свинки, собаки (см., например,номер доступа в GenBank AAB87412 (последовательность аминокислот) и AF016234 (последовательность нуклеотидов); и номер доступа в GenBank AAC05384 (последовательность аминокислот) и AF049489 (последовательность нуклеотидов), включенные в настоящую заявку посредством ссылки в полном объеме), кошки, обезьяны, шимпанзе (см.,например,номер доступа в GenBank XP_529212 (последовательность аминокислот) и XM_529212 (последовательность нуклеотидов), включенные в настоящую заявку посредством ссылки в полном объеме), орангутаны, коровы, лошади, овцы, свиньи (см.,например, номер доступа в GenBank NP_999332 (последовательность аминокислот) и NM_214167 (последовательность нуклеотидов), включенные в настоящую заявку посредством ссылки в полном объеме), козы, кролики и куры. Эти и другие последовательности также доступны в электронном виде на сайте Haemophilia A Mutation, Structure, Test and Resource Site (HAMSTeRS), на котором также представлено выравнивание последовательности аминокислот белков фактора VIII человека, свиньи, мыши и собаки. Таким образом, консервативность и гомология между белками фактора VIII млекопитающих хорошо известна.
В качестве примера последовательности нуклеотидов кДНК (комплементарной ДНК) для фактора и предполагаемые последовательности аминокислот представлены ниже в SEQ ID № 1 и 2, соответственно. Фактор VIII человека синтезируется в виде одноцепочечного белка около 300 кДа с внутренней гомологией последовательностей, составляющей последовательность «доменов» NH2-A1-A2-B-A3-C1-C2-COOH. В молекуле фактора VIII «домен» при использовании в настоящей заявке представляет собой непрерывную последовательность аминокислот, которая характеризуется конкретной последовательностью аминокислот и сайтами протеолитического расщепления тромбином. Если не указано иначе, домены фактора VIII включают следующие аминокислотные остатки при выравнивании последовательностей с последовательностью аминокислот фактора VIII человека (SEQ ID №: 2):
A1, остатки Ala1-Arg372;
A2, остатки Ser373-Arg740;
B, остатки Ser741-Arg1648;
A3, остатки Ser1690-Ile2032;
C1, остатки Arg2033-Asn2172; и
C2, остатки Ser2173-Tyr2332.
Последовательность A3-C1-C2 включает остатки Ser1690-Tyr2332. Оставшуюся последовательность, остатки Glu1649-Arg1689, обычно рассматривают как активирующий пептид легкой цепи фактора VIII. Фактор VIII активируется в результате протеолиза тромбином или фактором Xa, который вызывает его диссоциацию от фактора Виллебранда, с образованием фактора VIIIa, выполняющего функцию прокоагулянта. Биологическая функция фактора VIIIa заключается в усилении каталитической эффективности фактора IXa по отношению к активации фактора X до величины в несколько порядков. Активируемый тромбином фактор VIIIa представляет собой гетеродимер A1/A2/A3-C1-C2 с молекулярной массой 160 кДа, который формирует комплекс с фактором IXa и фактором X на поверхности тромбоцитов или моноцитов. Термин «Частичный домен» в контексте настоящей заявки представляет собой непрерывную последовательность аминокислот, формирующих часть домена.
Ген, кодирующий человеческий фактор VIII дикого типа, имеет следующую нуклеотидную последовательность, представленную в SEQ ID №:1
gccaccagaagatactacctgggtgcagtggaactgtcatgggactatatgcaaagtgatctcggtgagctgcctgtggacgcaagatttcctcctagagtgccaaaatcttttccattcaacacctcagtcgtgtacaaaaagactctgtttgtagaattcacggatcaccttttcaacatcgctaagccaaggccaccctggatgggtctgctaggtcctaccatccaggctgaggtttatgatacagtggtcattacacttaagaacatggcttcccatcctgtcagtcttcatgctgttggtgtatcctactggaaagcttctgagggagctgaatatgatgatcagaccagtcaaagggagaaagaagatgataaagtcttccctggtggaagccatacatatgtctggcaggtcctgaaagagaatggtccaatggcctctgacccactgtgccttacctactcatatctttctcatgtggacctggtaaaagacttgaattcaggcctcattggagccctactagtatgtagagaagggagtctggccaaggaaaagacacagaccttgcacaaatttatactactttttgctgtatttgatgaagggaaaagttggcactcagaaacaaagaactccttgatgcaggatagggatgctgcatctgctcgggcctggcctaaaatgcacacagtcaatggttatgtaaacaggtctctgccaggtctgattggatgccacaggaaatcagtctattggcatgtgattggaatgggcaccactcctgaagtgcactcaatattcctcgaaggtcacacatttcttgtgaggaaccatcgccaggcgtccttggaaatctcgccaataactttccttactgctcaaacactcttgatggaccttggacagtttctactgttttgtcatatctcttcccaccaacatgatggcatggaagcttatgtcaaagtagacagctgtccagaggaaccccaactacgaatgaaaaataatgaagaagcggaagactatgatgatgatcttactgattctgaaatggatgtggtcaggtttgatgatgacaactctccttcctttatccaaattcgctcagttgccaagaagcatcctaaaacttgggtacattacattgctgctgaagaggaggactgggactatgctcccttagtcctcgcccccgatgacagaagttataaaagtcaatatttgaacaatggccctcagcggattggtaggaagtacaaaaaagtccgatttatggcatacacagatgaaacctttaagactcgtgaagctattcagcatgaatcaggaatcttgggacctttactttatggggaagttggagacacactgttgattatatttaagaatcaagcaagcagaccatataacatctaccctcacggaatcactgatgtccgtcctttgtattcaaggagattaccaaaaggtgtaaaacatttgaaggattttccaattctgccaggagaaatattcaaatataaatggacagtgactgtagaagatgggccaactaaatcagatcctcggtgcctgacccgctattactctagtttcgttaatatggagagagatctagcttcaggactcattggccctctcctcatctgctacaaagaatctgtagatcaaagaggaaaccagataatgtcagacaagaggaatgtcatcctgttttctgtatttgatgagaaccgaagctggtacctcacagagaatatacaacgctttctccccaatccagctggagtgcagcttgaggatccagagttccaagcctccaacatcatgcacagcatcaatggctatgtttttgatagtttgcagttgtcagtttgtttgcatgaggtggcatactggtacattctaagcattggagcacagactgacttcctttctgtcttcttctctggatataccttcaaacacaaaatggtctatgaagacacactcaccctattcccattctcaggagaaactgtcttcatgtcgatggaaaacccaggtctatggattctggggtgccacaactcagactttcggaacagaggcatgaccgccttactgaaggtttctagttgtgacaagaacactggtgattattacgaggacagttatgaagatatttcagcatacttgctgagtaaaaacaatgccattgaaccaagaagcttctcccagaattcaagacaccctagcactaggcaaaagcaatttaatgccaccacaattccagaaaatgacatagagaagactgacccttggtttgcacacagaacacctatgcctaaaatacaaaatgtctcctctagtgatttgttgatgctcttgcgacagagtcctactccacatgggctatccttatctgatctccaagaagccaaatatgagactttttctgatgatccatcacctggagcaatagacagtaataacagcctgtctgaaatgacacacttcaggccacagctccatcacagtggggacatggtatttacccctgagtcaggcctccaattaagattaaatgagaaactggggacaactgcagcaacagagttgaagaaacttgatttcaaagtttctagtacatcaaataatctgatttcaacaattccatcagacaatttggcagcaggtactgataatacaagttccttaggacccccaagtatgccagttcattatgatagtcaattagataccactctatttggcaaaaagtcatctccccttactgagtctggtggacctctgagcttgagtgaagaaaataatgattcaaagttgttagaatcaggtttaatgaatagccaagaaagttcatggggaaaaaatgtatcgtcaacagagagtggtaggttatttaaagggaaaagagctcatggacctgctttgttgactaaagataatgccttattcaaagttagcatctctttgttaaagacaaacaaaacttccaataattcagcaactaatagaaagactcacattgatggcccatcattattaattgagaatagtccatcagtctggcaaaatatattagaaagtgacactgagtttaaaaaagtgacacctttgattcatgacagaatgcttatggacaaaaatgctacagctttgaggctaaatcatatgtcaaataaaactacttcatcaaaaaacatggaaatggtccaacagaaaaaagagggccccattccaccagatgcacaaaatccagatatgtcgttctttaagatgctattcttgccagaatcagcaaggtggatacaaaggactcatggaaagaactctctgaactctgggcaaggccccagtccaaagcaattagtatccttaggaccagaaaaatctgtggaaggtcagaatttcttgtctgagaaaaacaaagtggtagtaggaaagggtgaatttacaaaggacgtaggactcaaagagatggtttttccaagcagcagaaacctatttcttactaacttggataatttacatgaaaataatacacacaatcaagaaaaaaaaattcaggaagaaatagaaaagaaggaaacattaatccaagagaatgtagttttgcctcagatacatacagtgactggcactaagaatttcatgaagaaccttttcttactgagcactaggcaaaatgtagaaggttcatatgacggggcatatgctccagtacttcaagattttaggtcattaaatgattcaacaaatagaacaaagaaacacacagctcatttctcaaaaaaaggggaggaagaaaacttggaaggcttgggaaatcaaaccaagcaaattgtagagaaatatgcatgcaccacaaggatatctcctaatacaagccagcagaattttgtcacgcaacgtagtaagagagctttgaaacaattcagactcccactagaagaaacagaacttgaaaaaaggataattgtggatgacacctcaacccagtggtccaaaaacatgaaacatttgaccccgagcaccctcacacagatagactacaatgagaaggagaaaggggccattactcagtctcccttatcagattgccttacgaggagtcatagcatccctcaagcaaatagatctccattacccattgcaaaggtatcatcatttccatctattagacctatatatctgaccagggtcctattccaagacaactcttctcatcttccagcagcatcttatagaaagaaagattctggggtccaagaaagcagtcatttcttacaaggagccaaaaaaaataacctttctttagccattctaaccttggagatgactggtgatcaaagagaggttggctccctggggacaagtgccacaaattcagtcacatacaagaaagttgagaacactgttctcccgaaaccagacttgcccaaaacatctggcaaagttgaattgcttccaaaagttcacatttatcagaaggacctattccctacggaaactagcaatgggtctcctggccatctggatctcgtggaagggagccttcttcagggaacagagggagcgattaagtggaatgaagcaaacagacctggaaaagttccctttctgagagtagcaacagaaagctctgcaaagactccctccaagctattggatcctcttgcttgggataaccactatggtactcagataccaaaagaagagtggaaatcccaagagaagtcaccagaaaaaacagcttttaagaaaaaggataccattttgtccctgaacgcttgtgaaagcaatcatgcaatagcagcaataaatgagggacaaaataagcccgaaatagaagtcacctgggcaaagcaaggtaggactgaaaggctgtgctctcaaaacccaccagtcttgaaacgccatcaacgggaaataactcgtactactcttcagtcagatcaagaggaaattgactatgatgataccatatcagttgaaatgaagaaggaagattttgacatttatgatgaggatgaaaatcagagcccccgcagctttcaaaagaaaacacgacactattttattgctgcagtggagaggctctgggattatgggatgagtagctccccacatgttctaagaaacagggctcagagtggcagtgtccctcagttcaagaaagttgttttccaggaatttactgatggctcctttactcagcccttataccgtggagaactaaatgaacatttgggactcctggggccatatataagagcagaagttgaagataatatcatggtaactttcagaaatcaggcctctcgtccctattccttctattctagccttatttcttatgaggaagatcagaggcaaggagcagaacctagaaaaaactttgtcaagcctaatgaaaccaaaacttacttttggaaagtgcaacatcatatggcacccactaaagatgagtttgactgcaaagcctgggcttatttctctgatgttgacctggaaaaagatgtgcactcaggcctgattggaccccttctggtctgccacactaacacactgaaccctgctcatgggagacaagtgacagtacaggaatttgctctgtttttcaccatctttgatgagaccaaaagctggtacttcactgaaaatatggaaagaaactgcagggctccctgcaatatccagatggaagatcccacttttaaagagaattatcgcttccatgcaatcaatggctacataatggatacactacctggcttagtaatggctcaggatcaaaggattcgatggtatctgctcagcatgggcagcaatgaaaacatccattctattcatttcagtggacatgtgttcactgtacgaaaaaaagaggagtataaaatggcactgtacaatctctatccaggtgtttttgagacagtggaaatgttaccatccaaagctggaatttggcgggtggaatgccttattggcgagcatctacatgctgggatgagcacactttttctggtgtacagcaataagtgtcagactcccctgggaatggcttctggacacattagagattttcagattacagcttcaggacaatatggacagtgggccccaaagctggccagacttcattattccggatcaatcaatgcctggagcaccaaggagcccttttcttggatcaaggtggatctgttggcaccaatgattattcacggcatcaagacccagggtgcccgtcagaagttctccagcctctacatctctcagtttatcatcatgtatagtcttgatgggaagaagtggcagacttatcgaggaaattccactggaaccttaatggtcttctttggcaatgtggattcatctgggataaaacacaatatttttaaccctccaattattgctcgatacatccgtttgcacccaactcattatagcattcgcagcactcttcgcatggagttgatgggctgtgatttaaatagttgcagcatgccattgggaatggagagtaaagcaatatcagatgcacagattactgcttcatcctactttaccaatatgtttgccacctggtctccttcaaaagctcgacttcacctccaagggaggagtaatgcctggagacctcaggtgaataatccaaaagagtggctgcaagtggacttccagaagacaatgaaagtcacaggagtaactactcagggagtaaaatctctgcttaccagcatgtatgtgaaggagttcctcatctccagcagtcaagatggccatcagtggactctcttttttcagaatggcaaagtaaaggtttttcagggaaatcaagactccttcacacctgtggtgaactctctagacccaccgttactgactcgctaccttcgaattcacccccagagttgggtgcaccagattgccctgaggatggaggttctgggctgcgaggcacaggacctctactga
Человеческий фактор VIII дикого типа, кодируемый SEQ ID №:1, имеет следующую последовательность аминокислот, представленную в SEQ ID №:2:
ATRRYYLGAVELSWDYMQSDLGELPVDARFPPRVPKSFPFNTSVVYKKTLFVEFTVHLFNIAKPRPPWMGLLGPTIQAEVYDTVVITLKNMASHPVSLHAVGVSYWKASEGAEYDDQTSQREKEDDKVFPGGSHTYVWQVLKENGPMASDPLCLTYSYLSHVDLVKDLNSGLIGALLVCREGSLAKEKTQTLHKFILLFAVFDEGKSWHSETKNSLMQDRDAASARAWPKMHTVNGYVNRSLPGLIGCHRKSVYWHVIGMGTTPEVHSIFLEGHTFLVRNHRQASLEISPITFLTAQTLLMDLGQFLLFCHISSHQHDGMEAYVKVDSCPEEPQLRMKNNEEAEDYDDDLTDSEMDVVRFDDDNSPSFIQIRSVAKKHPKTWVHYIAAEEEDWDYAPLVLAPDDRSYKSQYLNNGPQRIGRKYKKVRFMAYTDETFKTREAIQHESGILGPLLYGEVGDTLLIIFKNQASRPYNIYPHGITDVRPLYSRRLPKGVKHLKDFPILPGEIFKYKWTVTVEDGPTKSDPRCLTRYYSSFVNMERDLASGLIGPLLICYKESVDQRGNQIMSDKRNVILFSVFDENRSWYLTENIQRFLPNPAGVQLEDPEFQASNIMHSINGYVFDSLQLSVCLHEVAYWYILSIGAQTDFLSVFFSGYTFKHKMVYEDTLTLFPFSGETVFMSMENPGLWILGCHNSDFRNRGMTALLKVSSCDKNTGDYYEDSYEDISAYLLSKNNAIEPRSFSQNSRHPSTRQKQFNATTIPENDIEKTDPWFAHRTPMPKIQNVSSSDLLMLLRQSPTPHGLSLSDLQEAKYETFSDDPSPGAIDSNNSLSEMTHFRPQLHHSGDMVFTPESGLQLRLNEKLGTTAATELKKLDFKVSSTSNNLISTIPSDNLAAGTDNTSSLGPPSMPVHYDSQLDTTLFGKKSSPLTESGGPLSLSEENNDSKLLESGLMNSQESSWGKNVSSTESGRLFKGKRAHGPALLTKDNALFKVSISLLKTNKTSNNSATNRKTHIDGPSLLIENSPSVWQNILESDTEFKKVTPLIHDRMLMDKNATALRLNHMSNKTTSSKNMEMVQQKKEGPIPPDAQNPDMSFFKMLFLPESARWIQRTHGKNSLNSGQGPSPKQLVSLGPEKSVEGQNFLSEKNKVVVGKGEFTKDVGLKEMVFPSSRNLFLTNLDNLHENNTHNQEKKIQEEIEKKETLIQENVVLPQIHTVTGTKNFMKNLFLLSTRQNVEGSYEGAYAPVLQDFRSLNDSTNRTKKHTAHFSKKGEEENLEGLGNQTKQIVEKYACTTRISPNTSQQNFVTQRSKRALKQFRLPLEETELEKRIIVDDTSTQWSKNMKHLTPSTLTQIDYNEKEKGAITQSPLSDCLTRSHSIPQANRSPLPIAKVSSFPSIRPIYLTRVLFQDNSSHLPAASYRKKDSGVQESSHFLQGAKKNNLSLAILTLEMTGDQREVGSLGTSATNSVTYKKVENTVLPKPDLPKTSGKVELLPKVHIYQKDLFPTETSNGSPGHLDLVEGSLLQGTEGAIKWNEANRPGKVPFLRVATESSAKTPSKLLDPLAWDNHYGTQIPKEEWKSQEKSPEKTAFKKKDTILSLNACESNHAIAAINEGQNKPEIEVTWAKQGRTERLCSQNPPVLKRHQREITRTTLQSDQEEIDYDDTISVEMKKEDFDIYDEDENQSPRSFQKKTRHYFIAAVERLWDYGMSSSPHVLRNRAQSGSVPQFKKVVFQEFTDGSFTQPLYRGELNEHLGLLGPYIRAEVEDNIMVTFRNQASRPYSFYSSLISYEEDQRQGAEPRKNFVKPNETKTYFWKVQHHMAPTKDEFDCKAWAYFSDVDLEKDVHSGLIGPLLVCHTNTLNPAHGRQVTVQEFALFFTIFDETKSWYFTENMERNCRAPCNIQMEDPTFKENYRFHAINGYIMDTLPGLVMAQDQRIRWYLLSMGSNENIHSIHFSGHVFTVRKKEEYKMALYNLYPGVFETVEMLPSKAGIWRVECLIGEHLHAGMSTLFLVYSNKCQTPLGMASGHIRDFQITASGQYGQWAPKLARLHYSGSINAWSTKEPFSWIKVDLLAPMIIHGIKTQGARQKFSSLYISQFIIMYSLDGKKWQTYRGNSTGTLMVFFGNVDSSGIKHNIFNPPIIARYIRLHPTHYSIRSTLRMELMGCDLNSCSMPLGMESKAISDAQITASSYFTNMFATWSPSKARLHLQGRSNAWRPQVNNPKEWLQVDFQKTMKVTGVTTQGVKSLLTSMYVKEFLISSSQDGHQWTLFFQNGKVKVFQGNQDSFTPVVNSLDPPLLTRYLRIHPQSWVHQIALRMEVLGCEAQDLY
В представленной выше последовательности некоторые заряженные остатки выделены жирным шрифтом и подчеркнуты, в том числе Glu287, Asp302, Asp519, Glu665 и Glu1984.
Рекомбинантный фактор VIII согласно настоящему изобретению характеризуется заменой одного или более заряженных аминокислотных остатков на гидрофобный аминокислотный остаток в одной или обеих областях контакта доменов A1A2 или A2A3. Предпочтительно замещаемый заряженный остаток представляет собой либо остаток Glu или Asp, который не участвует в образовании водородных связей между доменами A1A2 или A2A3. Гидрофобный аминокислотный остаток, который замещает заряженный остаток, может представлять собой любой остаток из Ala, Val, Ile, Leu, Met, Phe или Trp. Особенно предпочтительный рекомбинантный фактор VIII согласно настоящему изобретению включает замену остатка Glu287 фактора VIII дикого типа, замену остатка Asp302 фактора VIII дикого типа, замену остатка Asp519 фактора VIII дикого типа, замену остатка Glu665 фактора VIII дикого типа, замену остатка Glu1984 фактора VIII дикого типа или комбинацию указанных замен. Замены D302A, E287A, E665A, E665V, D519A, D519V, E1984A и E1984V являются предпочтительными для получения рекомбинантного фактора VIII, обладающего повышенной стабильностью как фактора VIII, так и фактора VIIIa. Предпочтительные комбинации таких замен включают, без ограничения, двойные мутанты D519AE665V, D519VE665V и D519VE1984A, а также тройные мутанты D519AE665VE1984A и D519VE665VE1984A. Предполагается, что повышенная стабильность таких мутантных форм достигается за счет стабилизации внутридоменной области фактора VIII, а также уменьшения диссоциации субъединицы A2 от A1/A3C1C2, в сравнении с фактором VIIIa дикого типа.
Подходящие последовательности мутантной формы фактора VIII, которые могут быть модифицированы согласно настоящему изобретению, могут также включать любые известные ранее или идентифицированные впоследствии последовательности фактора VIII, обладающие модифицированными свойствами в отношении различных характеристик, включающих, без ограничения, антигенность, время полужизни в кровотоке, секрецию белка, сродство к фактору IXa и/или фактору X, измененные сайты инактивирующего расщепления фактора VIII, стабильность активированной формы фактора VIII, иммуногенность и срок хранения.
Один из примеров подходящего мутантного фактора VIII, который может быть модифицирован согласно настоящему изобретению, представляет собой фактор VIII, имеющий модифицированный кальций-связывающий сайт, предпочтительно по остатку 113 в SEQ ID №: 2. Примеры мутантов такого типа описаны в публикации заявки на патент США № 10/581471, авторы Fay и др., включенной в настоящую заявку посредством ссылки в полном объеме. Предпочтительно, мутант по остатку 113 также модифицирован в соответствии с одной или более мутациями, описанными выше (например, по положениям 287, 302, 519, 665 и/или 1984), с целью увеличения стабильности/увеличения специфичной активности белка фактора VIII. Примеры белков фактора VIII с высокой стабильностью/высокой специфичной активностью включают, без ограничения, белки с комбинированными заменами E113AD519A, E113AD519V, E113AE665A, E113AE665V или E113AE1984V.
Второй пример подходящего мутантного фактора VIII, который может быть модифицирован согласно настоящему изобретению, представляет собой лишенный B-домена фактор VIII, содержащий аминокислотные остатки 1-740 и 1690-2332 в SEQ ID №: 2 (см.,например,патент США № 6458563, автор Lollar, включенный в настоящую заявку посредством ссылки в полном объеме).
В одном варианте реализации лишенного B-домена рекомбинантного фактора VIII согласно настоящему изобретению, B-домен замещен участком линкерной ДНК, и по меньшей мере один кодон замещен кодоном, кодирующим аминокислотный остаток, имеющим такой же заряд, как соответствующий остаток фактор VIII свиньи (см., например, публикацию заявки на патент США № 2004/0197875, Hauser et al., включенную в настоящую заявку посредством ссылки в полном объеме).
В другом варианте реализации лишенного B-домена рекомбинантного фактора VIII согласно настоящему изобретению, модифицированный мутантный фактор VIII кодируется нуклеотидной последовательностью, содержащей инсерции укороченной последовательности интрона 1 фактора IX по одному или более сайту (см., например,Патент США № 6800461, автор Negrier и Патент США № 6780614, автор Negrier, каждый из которых включен в настоящую заявку посредством ссылки в полном объеме). Такой рекомбинантный фактор VIII можно применять для достижения более эффективного получения рекомбинантного фактора VIII in vitro, а также в векторе для переноса при генной терапии (см., например, Патент США № 6800461, Negrier, включенный в настоящую заявку посредством ссылки в полном объеме). В одном из примеров этого варианта реализации рекомбинантный фактор VIII может кодироваться нуклеотидной последовательностью, содержащей инсерцию укороченной последовательности интрона 1 фактора IX в двух сайтах и имеющей промотор, подходящий для запуска экспрессии в гемопоэтической клеточной линии, и в частности, в тромбоцитах (см., например, Патент США № 6780614, автор Negrier, включенный в настоящую заявку посредством ссылки в полном объеме).
Вне зависимости от варианта реализации, лишенный B-домена фактор VIII предпочтительно содержит одну или более мутацию, описанную выше (например, в положениях 287, 302, 519, 665 и/или 1984). Белки рекомбинантного фактора VIII, полученные согласно Примерам, представленным в настоящей заявке, лишены B-домена.
Третий пример подходящего мутантного фактора VIII, который может быть модифицирован согласно настоящему изобретению, представляет собой химерный фактор VIII человека/животного, содержащий один или более аминокислотных остатков из последовательности белка животного в качестве замены (замен) аминокислотных остатков в последовательности белка человека, ответственных за антигенность фактора VIII человека. В частности, замены на аминокислотный остаток из последовательности белка животного (например, свиньи) могут включать, без ограничения, одну или более из следующих: R484A, R488G, P485A, L486S, Y487L, Y487A, S488A, S488L, R489A, R489S, R490G, L491S, P492L, P492A, K493A, G494S, V495A, K496M, H497L, L498S, K499M, D500A, F501A, P502L, I503M, L504M, P505A, G506A, E507G, I508M, I508A, M2199I, F2200L, L2252F, V2223A, K2227E и/или L2251 (Патент США № 5859204, Lollar, Патент США № 6770744, автор Lollar, и публикация заявки на Патент США № 2003/0166536, автор Lollar, каждый из которых включен в настоящую заявку посредством ссылки в полном объеме). Предпочтительно, рекомбинантный химерный фактор VIII содержит одну или более из мутаций, описанных выше (например, в положениях 287, 302, 519, 665 и/или 1984).
Четвертый пример подходящего мутантного фактора VIII, который может быть модифицирован согласно настоящему изобретению, представляет собой фактор VIII, обладающий повышенным сродством к фактору IXa (см., например,Fay et al., “Factor VIIIa A2 Subunit Residues 558-565 Represent a Factor IXa Interactive Site,” J. Biol. Chem. 269(32):20522-7 (1994); Bajaj et al., “Factor IXa: Factor VIIIa Interaction. Helix 330-338 of Factor IXa Interacts with Residues 558-565 and Spatially Adjacent Regions of the A2 Subunit of Factor VIIIa,” J. Biol. Chem. 276(19):16302-9 (2001); и Lenting et al., “The Sequence Glu1811-Lys1818 of Human Blood Coagulation Factor VIII Comprises a Binding Site for Activated Factor IX,” J. Biol. Chem. 271(4):1935-40 (1996), каждый из источников включен в настоящую заявку посредством ссылки в полном объеме) и/или фактору X (см., например, работу Lapan et al., “Localization of a Factor X Interactive Site in the A1 Subunit of Factor VIIIa,” J. Biol. Chem. 272:2082-88 (1997), включенную в настоящую заявку посредством ссылки в полном объеме). Предпочтительно, фактор VIII с повышенным сродством содержит одну или более из мутаций, описанных выше (например, в положениях 287, 302, 519, 665 и/или 1984).
Пятый пример подходящего мутантного фактора VIII, который может быть модифицирован согласно настоящему изобретению, представляет собой фактор VIII, который модифицирован с целью усиления секреции фактора VIII (см., например, работу Swaroop et al., “Mutagenesis of a Potential Immunoglobulin-Binding Protein-Binding Site Enhances Secretion of Coagulation Фактор VIII,” J. Biol. Chem. 272(39):24121-4 (1997), включенную в настоящую заявку посредством ссылки в полном объеме). Предпочтительно мутантный фактор VIII, характеризующийся повышенной секрецией, содержит одну или более из мутаций, указанных выше (например, в положениях 287, 302, 519, 665 и/или 1984).
Шестой пример подходящего мутантного фактора VIII, который может быть модифицирован согласно настоящему изобретению, представляет собой фактор VIII с увеличенным временем полужизни в кровотоке. Данная модификация может быть осуществлена с помощью различных подходов, в том числе, без ограничения, за счет ослабления взаимодействий с гепарансульфатом (Sarafanov et al., “Cell Surface Heparan Sulfate Proteoglycans Participate in Factor VIII Catabolism Mediated by Low Density Lipoprotein Receptor-Related Protein,” J. Biol. Chem. 276(15):11970-9 (2001), включенный в настоящую заявку посредством ссылки в полном объеме), и/или белком, связанным с рецептором липопротеина низкой плотности (“LRP”) (Saenko et al., “Role of the Low Density Lipoprotein-Related Protein Receptor in Mediation of Factor VIII Catabolism,” J. Biol. Chem. 274(53):37685-92 (1999); и Lenting et al., “The Light Chain of Factor VIII Comprises a Binding Site for Low Density Lipoprotein Receptor-Related Protein,” J. Biol. Chem. 274(34):23734-9 (1999), каждый из указанных источников включен в настоящую заявку посредством ссылки в полном объеме). Предпочтительно, мутантный фактор VIII с увеличенным временем полужизни содержит одну или более из мутаций, описанных выше (например, в положениях 287, 302, 519, 665 и/или 1984).
Седьмой пример подходящего мутантного фактора VIII, который может быть модифицирован согласно настоящему изобретению, представляет собой модифицированный фактор VIII, кодируемый нуклеотидной последовательностью, модифицированной таким образом, что указанная последовательность кодирует аминокислоты, формирующие известные существующие эпитопы, получая распознаваемую последовательность для гликозилирования по остаткам аспарагина (см., например, Патент США № 6759216, автор Lollar, включенный в настоящую заявку посредством ссылки в полном объеме). Мутантный фактор VIII в данном примере можно применять для получения модифицированного фактора VIII, который не узнается существующими ингибирующими антителами (фактор VIII с низкой антигенностью) и который уменьшает вероятность выработки ингибирующих антител (фактор VIII с низкой иммуногенностью). В одном частном варианте реализации данного примера модифицированный фактор VIII содержит мутацию, приводящую к появлению консенсусной последовательности аминокислот для N-связанного гликозилирования. Примером такой консенсусной последовательности является N-X-S/T, где N представляет собой аспарагин, X - любую аминокислоту, а S/T обозначает серин или треонин (см. Патент США № 6759216, автор Lollar, включенный в настоящую заявку посредством ссылки в полном объеме). Предпочтительно содержащий сайт гликозилирования модифицированный фактор VIII содержит одну или более из мутаций, описанных выше (например, в положениях 287, 302, 519, 665 и/или 1984).
Восьмым примером подходящего мутантного фактора VIII, который может быть модифицирован согласно настоящему изобретению, является модифицированный фактор VIII, представляющий собой фактор VIII с прокоагулирующей активностью, содержащий различные мутации (см., например, публикацию заявки на Патент США № 2004/0092442, авторы Kaufman и др., включенную в настоящую заявку посредством ссылки в полном объеме). Один из примеров данного варианта реализации настоящего изобретения относится к модифицированному фактору VIII, который был модифицирован с целью (i) удаления сайта связывания с фактором Виллебранда, (ii) добавления мутации по Arg 740 и (iii) добавления спейсерной последовательности аминокислот между доменами A2 и A3, при этом указанная спейсерная последовательность аминокислот имеет длину, достаточную для того, чтобы при активации белок фактор VIII с прокоагулирующей активностью становился гетеродимером (см. публикацию заявки на Патент США № 2004/0092442, авторы Kaufman и др., включенную в настоящую заявку посредством ссылки в полном объеме). Предпочтительно фактор VIII с прокоагулирующей активностью также модифицирован таким образом, что содержит одну или более из мутаций, описанных выше (например, в положениях 287, 302, 519, 665 и/или 1984).
Кроме того, мутантный фактор VIII может быть модифицирован с целью улучшения различных характеристик, представляющих преимущества, связанные с рекомбинантными факторами свертывания крови в целом (см., например, работу Saenko et al., “The Future of Recombinant Coagulation Factors,” J. Thrombosis and Haemostasis 1:922-930 (2003), включенную в настоящую заявку посредством ссылки в полном объеме).
Рекомбинантный фактор VIII согласно настоящему изобретению может быть модифицирован по любому заряженному остатку, который дестабилизирует область контакта доменов A1A2 или A2A3 (включая положения 287, 302, 519, 665 или 1984), а также в результате модификаций может быть получен фактор VIII, лишенный B-домена, химерный, имеющий модифицированные кальций-связывающие сайты, усиливающие активность фактора VIIIa (например, по положению 113), имеющий измененные сайты инактивирующего расщепления, обладающий повышенным сродством к фактору IXa и/или фактору X, обладающий повышенной секрецией, имеющий увеличенное время полужизни в кровотоке, или имеющий измененные сайты гликозилирования; или обладающий хотя бы одной из таких модификаций в добавление к одной или более модификации заряженных остатков, в том числе измененному кальций-связывающему сайту, который улучшает активность рекомбинантного фактора VIII. Ряд примеров белков рекомбинантного фактора VIII, лишенных B-домена, с увеличенной специфичной активностью, высокой стабильностью, описан в разделе Примеры.
Рекомбинантный фактор VIII предпочтительно получают в практически чистой форме. В конкретном варианте реализации практически чистый рекомбинантный фактор VIII очищен по меньшей мере примерно на 80%, более предпочтительно по меньшей мере на 90%, наиболее предпочтительно по меньшей мере на 95%. Практически чистый рекомбинантный фактор VIII может быть получен с помощью стандартных способов, хорошо известных в данной области техники. Как правило, практически чистый рекомбинантный фактор VIII секретируется в питательную среду для роста рекомбинантных клеток-хозяев. В качестве альтернативы, практически чистый рекомбинантный фактор VIII вырабатывается, но не секретируется в питательную среду. В таких случаях для выделения практически чистого рекомбинантного фактора VIII клетки-хозяева, несущие рекомбинантную плазмиду, размножают, лизируют с помощью обработки ультразвуком, нагревания или химической обработки, и гомогенат центрифугируют для удаления клеточного детрита. Затем супернатант осаждают при помощи сульфата аммония. Фракцию, содержащую практически чистый рекомбинантный фактор VIII, подергают гель-фильтрации на колонках с декстраном или полиакриламидом подходящего размера для отделения рекомбинантного фактора VIII. При необходимости белковая фракция (содержащая практически чистый рекомбинантный фактор VIII) может быть дополнительно очищена с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).
Другой аспект настоящего изобретения относится к изолированной молекуле нуклеиновой кислоты, которая кодирует рекомбинантный фактор VIII согласно настоящему изобретению. Изолированная молекула нуклеиновой кислоты, кодирующая рекомбинантный фактор VIII, может представлять собой либо РНК, либо ДНК.
В одном из вариантов реализации настоящего изобретения изолированная молекула нуклеиновой кислоты может иметь последовательность нуклеотидов, кодирующую мутацию по положению 113, которая усиливает специфическую активность фактора VIII, с модификацией в виде одной или более замен заряженных остатков (например, в положениях 287, 302, 519, 665, 1984 и/или 332-340 в SEQ ID №: 2).
В другом варианте реализации настоящего изобретения изолированная молекула нуклеиновой кислоты может иметь последовательность нуклеотидов, кодирующую лишенный B-домена фактор VIII описанного выше типа с модификацией в виде одной или более замен заряженных остатков (например, в положениях 287, 302, 519, 665 и/или 1984 в SEQ ID №:2).
В другом варианте реализации настоящего изобретения изолированная молекула нуклеиновой кислоты может иметь последовательность нуклеотидов, кодирующую химерный человеческий/свиной белок описанного выше типа, с модификацией в виде одной или более замен заряженных остатков (например, в положениях 287, 302, 519, 665 и/или 1984 в SEQ ID №:2).
В другом варианте реализации настоящего изобретения изолированная молекула нуклеиновой кислоты может иметь последовательность нуклеотидов, кодирующую фактор VIII, в котором сайты инактивации были модифицированы, как описано выше, с дополнительной модификацией в виде одной или более замен заряженных остатков (например, в положениях 287, 302, 519, 665 и/или 1984 в SEQ ID №:2).
В еще одном варианте реализации настоящего изобретения изолированная молекула нуклеиновой кислоты может иметь последовательность нуклеотидов, кодирующую фактор VIII с увеличенным сродством к фактору IXa и/или фактору X, с дополнительной модификацией в виде одной или более замен заряженных остатков (например, в положениях 287, 302, 519, 665 и/или 1984 в SEQ ID №:2).
В следующем варианте реализации настоящего изобретения изолированная молекула нуклеиновой кислоты может иметь последовательность нуклеотидов, кодирующую фактор VIII, в котором сродство к различным связывающим белкам сыворотки изменено для увеличения времени его полужизни в кровотоке, с дополнительной модификацией в виде одной или более замен заряженных остатков (например, в положениях 287, 302, 519, 665 и/или 1984 в SEQ ID №:2).
В следующем варианте реализации настоящего изобретения изолированная молекула нуклеиновой кислоты может иметь последовательность нуклеотидов, кодирующую фактор VIII, характеризующийся повышенной секрецией в культуре, с дополнительной модификацией в виде одной или более замен заряженных остатков (например, в положениях 287, 302, 519, 665 и/или 1984 в SEQ ID №:2).
В следующем варианте реализации настоящего изобретения изолированная молекула нуклеиновой кислоты может иметь последовательность нуклеотидов, кодирующую фактор VIII, содержащий один или более неприродный сайт гликозилирования, с дополнительной модификацией в виде одной или более замен заряженных остатков (например, в положениях 287, 302, 519, 665 и/или 1984 в SEQ ID №:2).
В очередном варианте реализации изолированная молекула нуклеиновой кислоты кодирует рекомбинантный фактор VIII, модифицированный по любому одному или более заряженных остатков, как описано выше, а также модифицированный и в результате модификации обладающий любыми двумя или более характеристиками: в результате модификации лишенный B-домена, в результате модификации химерный, имеющий измененные сайты инактивирующего расщепления, модифицированный с целью увеличения сродства к фактору IXa и/или фактору X, модифицированный с целью усиления его секреции, модифицированный с целью увеличения времени его полужизни в кровотоке, модифицированный с целью внесения одного или более неприродного сайта гликозилирования, и модифицированный в пределах кальций-связывающего сайта (например, по положению 113) таким образом, что специфичная активность рекомбинантного фактора VIII улучшается.
Другой аспект настоящего изобретения относится к системе для экспрессии рекомбинантной ДНК, которая включает изолированную молекулу ДНК согласно настоящему изобретению, при этом данная система экспрессии кодирует рекомбинантный фактор VIII. В одном из вариантов реализации молекула ДНК находится в смысловой ориентации относительно промотора.
Другой аспект настоящего изобретения относится к клетке-хозяину, содержащей изолированную молекулу нуклеиновой кислоты, кодирующую рекомбинантный фактор VIII согласно настоящему изобретению. В конкретном варианте реализации клетка-хозяин может содержать изолированную молекулу нуклеиновой кислоты в форме молекулы ДНК, находящейся либо в виде стабильной плазмиды, либо стабильной инсерции или встраивания в геном клетки-хозяина. В другом варианте реализации клетка-хозяин может содержать молекулу ДНК в системе для экспрессии. Подходящие клетки-хозяева могут представлять собой, без ограничения, клетки животных (например, клетки почек хомячков (“BHK”), клетки бактерий (например, E. coli), клетки насекомых (например, клетки Sf9), клетки грибов, клетки дрожжей (например, Saccharomyces или Schizosaccharomyces), клетки растений (например, клетки Arabidopsis или табака), или клетки водорослей.
Система для экспрессии рекомбинантной ДНК и клетки-хозяева могут быть получены с помощью различных способов, хорошо известных в данной области, как более подробно рассмотрено ниже.
Молекула ДНК, кодирующая рекомбинантный фактор VIII согласно настоящему изобретению, может быть введена в клетки с помощью стандартных методик работы с рекомбинантной ДНК. В целом, данный процесс включает введение молекулы ДНК в систему для экспрессии, по отношению к которой данная молекула ДНК является гетерологичной (т.е., в норме не присутствует в этой системе). Гетерологичную молекулу ДНК вводят в систему для экспрессии или вектор в смысловой ориентации и в правильной рамке считывания. Вектор содержит элементы, необходимые для транскрипции и трансляции введенной последовательности, кодирующей белок. Таким образом, один из вариантов реализации настоящего изобретения обеспечивает ДНК-конструкцию, содержащую изолированную нуклеиновую кислоту согласно настоящему изобретению, функционально связанную с 5'-промоторным и 3'-регуляторным участком (например, терминатором транскрипции), способную обеспечивать транскрипцию и экспрессию кодируемого рекомбинантного фактора VIII согласно настоящему изобретению в клетках-хозяевах или в организмах-хозяевах.
Что касается рекомбинантной системы для экспрессии согласно настоящему изобретению, вектор для экспрессии, содержащий молекулу ДНК, кодирующую рекомбинантный фактор VIII согласно настоящему изобретению, может быть получен с помощью методик, стандартных в данной области. Молекулы нуклеиновой кислоты согласно настоящему изобретению могут быть встроены в любой из многих доступных векторов с применением реагентов, хорошо известных в данной области. При конструировании ДНК-вектора для экспрессии в бактериальную плазмиду могут быть в норме встроены или введены путем замещения различные последовательности ДНК. Можно применять любую подходящую плазмиду, характеризующуюся наличием бактериальной системы репликации, маркера, позволяющего осуществлять селекцию в бактериях, и, как правило, одного или более уникальных, подходящим образом расположенных сайтов рестрикции. Способ селекции вектора зависит от предпочтительной методики трансформации и хозяина-мишени для трансформации.
Для экспрессии последовательности (последовательностей), кодирующей рекомбинантный фактор VIII, можно применять различные системы хозяин-вектор. В первую очередь, векторная система должна быть совместимой с используемыми клетками-хозяевами. Системы хозяин-вектор включают, но не ограничены перечисленными: бактерии, трансформированные с помощью ДНК бактериофага, плазмидной ДНК или космидной ДНК; микроорганизмы, такие как дрожжи, содержащие дрожжевые векторы; системы клеток млекопитающих, инфицированные вирусами (например, вирусом коровьей оспы, аденовирусом, аденоассоциированным вирусом и т.п.); системы клеток насекомых, инфицированные вирусами (например, бакуловирусом); и клетки растений, инфицированные бактериями (например, Agrobacterium). Экспрессионные элементы таких векторов различаются по силе (эффективности) и специфичности. В зависимости от применяемой системы хозяин-вектор можно применять любой из ряда подходящих элементов транскрипции и трансляции.
При получении рекомбинантным способом белок или полипептид фактора VIII (или его фрагмент, или вариант) экспрессируют в рекомбинантной клетке-хозяине, как правило, но не исключительно, в эукариотической клетке.
Подходящие векторы для реализации настоящего изобретения на практике включают, но не ограничены перечисленными, следующие вирусные векторы, такие как система на основе вектора лямбда gt11, gtWES.tB, Charon 4, и плазмидные векторы, такие как pCMV, pBR322, pBR325, pACYC177, pACYC184, pUC8, pUC9, pUC18, pUC19, pLG339, pR290, pKC37, pKC101, SV 40, pBluescript II SK +/- или KS +/- (см. “Stratagene Cloning Systems” Catalog (1993)), pQE, pIH821, pGEX, pET серии (см. работу Studier et al, “Use of T7 РНК Polymerase to Direct Expression of Cloned Genes,” Methods in Enzymology 185:60-89 (1990), включенную в настоящую заявку посредством ссылки в полном объеме), и любые производные таких векторов. В настоящем изобретении можно применять любые подходящие для генетической трансформации векторы, известные в настоящее время или которые будут описаны впоследствии.
Рекомбинантные молекулы можно вводить в клетки путем трансформации, в частности, трансдукции, конъюгации, мобилизации или электропорации. Последовательности ДНК клонируют в векторе с применением стандартных способов клонирования, известных в данной области, как описано в пособии Maniatis et al., Molecular Cloning:A Laboratory Manual, Cold Springs Harbor, N.Y.: Cold Springs Laboratory, (1982), включенном в настоящую заявку посредством ссылки в полном объеме.
Патент США № 4237224, выданный Cohen и Boyer, включенный в настоящую заявку посредством ссылки в полном объеме, описывает получение систем экспрессии в форме рекомбинантных плазмид с применением расщепления с помощью рестриктаз и лигирования с помощью ДНК-лигазы. Такие рекомбинантные плазмиды затем вводят с помощью трансформации и реплицируют в культуре одноклеточных организмов, в том числе прокариотических организмах и эукариотических клетках, выращиваемых в культуры тканей.
Многие уровни экспрессии гена (например, транскрипция ДНК и трансляция матричной РНК (мРНК)) контролируются различными генетическими сигналами и событиями процессинга.
Транскрипция ДНК зависит от присутствия промотора, который представляет собой последовательность ДНК, которая определяет связывание РНК-полимеразы и таким образом стимулирует синтез мРНК. Последовательности ДНК эукариотических промоторов отличаются от последовательностей прокариотических промоторов. Кроме того, эукариотические промоторы и сопутствующие генетические сигналы могут не узнаваться или могут не функционировать в прокариотических системах, и наоборот, прокариотические промоторы не узнаются и не функционируют в клетках эукариот.
Аналогичным образом, трансляция мРНК в клетках прокариот зависит от присутствия соответствующих прокариотических сигналов, которые отличаются от таковых у эукариот. Для эффективной трансляции мРНК в клетках прокариот необходимо наличие в мРНК сайта связывания рибосомы, называемого последовательностью Шайна-Дальгарно («Shine-Dalgarno, SD»). Эта последовательность представляет собой короткую нуклеотидную последовательность мРНК, которая локализована перед старт-кодоном, как правило, AUG, кодирующим аминоконцевой метионин белка. Последовательности SD комплементарны 3'-концу 16S рРНК (рибосомальной РНК) и, как предполагают, стимулируют связывание мРНК с рибосомами за счет образования дуплекса с рРНК, что делает возможным правильное расположение рибосомы. Обзор, посвященный оптимизации экспрессии генов, см. Roberts и Lauer, Methods in Enzymology 68:473 (1979), включенный в настоящую заявку посредством ссылки в полном объеме.
Промоторы различаются по своей «силе» (т.е., способности стимулировать транскрипцию). Для экспрессии клонированного гена в целом желательно применять сильные промоторы с целью достижения высокого уровня транскрипции и, следовательно, экспрессии гена. В зависимости от используемой системы клеток-хозяев, можно применять любой из ряда подходящих промоторов. Например, при клонировании в клетках Escherichia coli, в ее бактериофагах или плазмидах, для достижения высокого уровня транскрипции соединенных сегментов ДНК можно применять промоторы, такие как промотор фага T7, lac промотор, trp промотор, recA промотор, промотор рибосомальной РНК, промоторы PR и PL колифага лямбда и другие, включающие, но не ограниченные перечисленными, lacUV5, ompF, bla, lpp, и др. Кроме того, для обеспечения транскрипции вставленного гена можно применять гибридный промотор trp-lacUV5 (tac) или другие промоторы E. coli, полученные с помощью технологии рекомбинантной ДНК или других методик конструирования ДНК.
Бактериальные штаммы клеток-хозяев и векторы для экспрессии могут быть выбраны такими, которые подавляют активность промотора в отсутствии специфичного индуктора. В конкретных случаях, добавление специфичных индукторов необходимо для эффективной транскрипции встроенной ДНК. Например, lac-оперон активируют путем добавления лактозы или IPTG (изопропилтио-бета-D-галактозид). Другие опероны, такие как trp, pro и т.п., контролируются другими различными регуляторами.
Для эффективной транскрипции и трансляции гена в прокариотических клетках также требуются специфичные сигналы для инициации. Такие сигналы для транскрипции и трансляции могут обладать различной «силой», оцениваемой по количеству геноспецифичной матричной РНК и синтезируемого белка, соответственно. Вектор для экспрессии ДНК, содержащий промотор, может также содержать любую комбинацию сигналов для инициации транскрипции и/или трансляции с различной «силой». Например, для эффективной трансляции в клетках E. coli необходимо наличие последовательности SD на расстоянии 7-9 оснований с 5'-конца до инициирующего кодона (“ATG”), представляющей сайт связывания рибосомы. Таким образом, можно применять любую комбинацию SD-ATG, которая может использоваться рибосомами клетки-хозяина. Такие комбинации включают, но не ограничены перечисленными, комбинация SD-ATG гена cro или гена N колифага лямбда, или из генов E, D, C, B или A триптофанового оперона E. coli. Кроме того, можно применять любую комбинацию SD-ATG, полученную с помощью технологии рекомбинантной ДНК или других методик, включающую встраивание синтетических нуклеотидов.
В одном варианте реализации молекулу нуклеиновой кислоты согласно настоящему изобретению встраивают в подходящий вектор в смысловой ориентации, таким образом, что открытая рамка считывания надлежащим образом ориентирована для экспрессии кодируемого белка под контролем выбранного промотора. Данный процесс включает встраивание подходящих регуляторных элементов в конструкции векторной ДНК. Такие элементы включают нетранслируемые области вектора, применяемые промоторы, и 5'- и 3'-нетранслируемые области, с которыми взаимодействуют клеточные белки хозяина для осуществления транскрипции и трансляции. Такие элементы могут обладать различной силой и специфичностью. В зависимости от применяемой векторной системы и клетки-хозяина можно применять любое количество подходящих элементов транскрипции и трансляции, в том числе конститутивные и индуцибельные (регулируемые) промоторы.
Конститутивный промотор представляет собой промотор, контролирующий экспрессию гена в ходе развития и жизнедеятельности организма.
Индуцибельный промотор представляет собой промотор, способный напрямую или опосредованно активировать транскрипцию одной или более последовательностей ДНК или генов в ответ на действие индуктора. В отсутствие индуктора, последовательности ДНК или гены не будут транскрибироваться.
Конструкция ДНК согласно настоящему изобретению может также включать функциональную 3'-регуляторную область, выбранную из последовательностей, способных обеспечивать правильную терминацию транскрипции и полиаденилирование мРНК для экспрессии в выбранных клетках-хозяевах, функционально связанную с молекулой ДНК, кодирующей выбранный белок.
Выбранный вектор, промотор и подходящая 3'-регуляторная область могут быть лигированы вместе с получением ДНК-конструкции согласно настоящему изобретению с применением хорошо известных методик молекулярного клонирования, как описано в руководствах Sambrook et al., Molecular Cloning: A LaboratoryManual, Second Edition, Cold Spring Harbor Press, NY (1989), и Ausubel, F. M. et al. Current Protocols in Molecular Biology, New York, N.Y: John Wiley & Sons (1989), включенных в настоящую заявку посредством ссылки в полном объеме.
Как было отмечено, одной из альтернатив применению прокариотических клеток-хозяев является применение эукариотических клеток-хозяев, таких как клетки млекопитающих, которые также можно применять для получения рекомбинантным способом рекомбинантного фактора VIII согласно настоящему изобретению. Клетки млекопитающих, подходящие для осуществления настоящего изобретения, включают, среди прочего: клетки COS (например, ATCC No. CRL 1650 или 1651), BHK (например, ATCC No. CRL 6281), CHO (например, ATCC No. CCL 61), HeLa (например, ATCC No. CCL 2), 293 (ATCC No. 1573), CHOP и NS-1 клетки.
Подходящие экспрессионные векторы для осуществления экспрессии в клетках млекопитающих, как правило, включают промотор, а также последовательности, контролирующие транскрипцию и трансляцию, известные в данной области. Распространенные промоторы включают промоторы SV40, MMTV, металлотионеина-1, аденовируса Ela, CMV, предранний промотор, промотор и энхансер тяжелой цепи иммуноглобулина и RSV-LTR.
Полученная ДНК-конструкция согласно настоящему изобретению готова для введения в клетку-хозяина. Соответственно, другой аспект настоящего изобретения относится к способу получения рекомбинантной клетки. По существу, такой способ осуществляют с помощью трансформации клетки-хозяина с помощью ДНК-конструкции согласно настоящему изобретению при условиях, эффективных для транскрипции молекулы ДНК в клетке-хозяине. Рекомбинантные молекулы могут быть введены в клетки посредством трансформации, в частности трансдукции, конъюгации, мобилизации или электропорации.
Принимая во внимание технологию рекомбинантной ДНК, рассматриваемую в настоящей заявке, другой аспект настоящего изобретения относится к способу получения рекомбинантного фактора VIII согласно настоящему изобретению. Данный способ включает выращивание клеток-хозяев согласно настоящему изобретению в условиях, при которых клетка-хозяин экспрессирует рекомбинантный фактор VIII. Затем осуществляют выделение рекомбинантного фактора VIII. В одном из вариантов реализации изобретения клетку-хозяин выращивают in vitro в питательной среде. В частном варианте реализации, подходящая питательная среда может включать, без ограничения, питательную среду, содержащую фактор фон Виллебранда (в настоящей заявке обозначен как «ФФВ»). В указанном варианте реализации клетка-хозяин может содержать трансген, кодирующий ФФВ, или ФФВ может быть введен в питательную среду в качестве добавки. Содержащийся в питательной среде ФФВ позволяет рекомбинантному фактору VIII экспрессироваться на более высоком уровне. После секреции рекомбинантного фактора VIII в питательную среду он может быть выделен из питательной среды с применением способов, хорошо известных специалистам в области рекомбинантной ДНК, и белков (в том числе описанных в настоящей заявке). В другом варианте реализации способ получения рекомбинантного фактора VIII согласно настоящему изобретению дополнительно включает разрушение клетки-хозяина перед выделением рекомбинантного фактора VIII. В указанном варианте реализации рекомбинантный фактор VIII выделяют из продуктов распада клеток.
Модификации по положениям 287, 302, 519, 665 и/или 1984 являются в особенности предпочтительными, поскольку они обуславливают повышенную стабильность как фактора VIII, так и фактора VIIIa. Такая повышенная стабильность важна в отношении времени полужизни в кровотоке фактора VIII и активности фактора VIIIa при свертывании крови. Кроме того, данное свойство является значимым в отношении увеличения выхода пригодного для применения фактора VIII в процессе очистки и получения препаратов белка для терапевтического применения.
Применяя экспрессионный вектор для трансформации in vivo с целью индукции экспрессии фактора VIII в клетках-мишенях, можно применять промоторы различной силы в зависимости от необходимого увеличения уровня экспрессии. Специалист в данной области может легко выбрать подходящие промоторы млекопитающих на основании их силы как промотора. В качестве альтернативы, можно применять индуцибельный промотор с целью регулирования необходимого уровня экспрессии или подавления экспрессии фактора VIII. Специалист в данной области может легко выбрать подходящие индуцибельные промоторы млекопитающих из известных в данной области. Наконец, могут быть выбраны тканеспецифичные промоторы млекопитающих с целью ограничения действия любой системы трансформации до конкретной ткани. Тканеспецифичные промоторы известны в данной области и могут быть выбраны на основании обрабатываемой ткани или типа клеток.
Другой аспект настоящего изобретения относится к способу лечения у животного заболевания крови, такого как гемофилия, в частности гемофилия A. Данный способ включает введение животному, страдающему гемофилией A, эффективного количества рекомбинантного фактора VIII согласно настоящему изобретению, при этом у животного наблюдается эффективное свертывание крови после повреждения сосуда. Подходящее эффективное количество рекомбинантного фактора VIII может включать, без ограничения, от примерно 10 до примерно 50 единиц/кг массы тела животного. Животное может представлять собой любое млекопитающее, но предпочтительным является человек, крыса, мышь, морская свинка, собака, кошка, обезьяна, шимпанзе, орангутан, корова, лошадь, овца, свинья, коза или кролик.
Рекомбинантный фактор VIII согласно настоящему изобретению можно применять для лечения неконтролируемого кровотечения, обусловленного дефицитом фактора VIII (например, внутрисуставное, внутричерепное или желудочно-кишечное кровотечение) у больных гемофилией, с и без ингибирующих антител, и у пациентов с приобретенным дефицитом фактора VIII, обусловленным выработкой ингибирующих антител. В конкретном варианте реализации рекомбинантный фактор VIII, непосредственно или в форме фармацевтической композиции (т.е., в комбинации со стабилизаторами, средствами доставки и/или носителями), вводят пациенту внутривенно согласно процедуре, применяемой для инфузии фактора VIII человека или животного.
В качестве альтернативы или дополнения, рекомбинантный фактор VIII можно вводить через введение вектора на основе вируса, такого как аденоассоциированный вирус (см. публикацию Gnatenko et al., Br. J. Haematol. 104:27-36 (1999), включенную в настоящую заявку посредством ссылки в полном объеме), или путем трансплантации клеток, которые в результате манипуляций методами генетической инженерии продуцируют рекомбинантный фактор VIII, как правило, посредством имплантации устройства, содержащего указанные клетки. Такая трансплантация обычно включает применение рекомбинантных дермальных фибробластов, полученных с помощью невирусного подхода (см. публикацию Roth et al., New Engl. J. Med. 344:1735-1742 (2001), включенную в настоящую заявку посредством ссылки в полном объеме).
Лечебные дозы рекомбинантного фактора VIII, которые следует вводить пациенту, нуждающемуся в таком лечении, различаются в зависимости от тяжести заболевания, связанного с дефицитом фактора VIII. Как правило, величину дозы корректируют в соответствии с частотой, продолжительностью и единицами активности в соответствии с тяжестью и продолжительностью приступа кровотечения у каждого конкретного пациента. Соответственно, рекомбинантный фактор VIII включен в фармацевтически приемлемый носитель, средство доставки или стабилизатор в количестве, достаточном для доставки пациенту терапевтически эффективного количества белка для остановки кровотечения, определяемого с помощью стандартных анализов коагулирующей активности.
Фактор VIII обычно определяют как вещество, присутствующее в норме в плазме крови, которое корректирует нарушение свертываемости в плазме, полученной от особей с гемофилией A. Коагулирующую активность in vitro фактора VIII в очищенной и частично очищенной форме применяют для расчета дозы рекомбинантного фактора VIII для введения пациентам, коагулирующая активность является надежным показателем активности восстановления плазмы крови пациентов и коррекции нарушений кровотечения in vivo. Не было показано несоответствий между стандартным анализом молекул нового фактора VIII in vitro и их поведением в модели инфузии собакам или больным людям, согласно работе Lusher et al., New Engl. J. Med. 328:453-459 (1993); Pittman et al., Blood 79:389-397 (1992); и Brinkhous et al., Proc. Natl. Acad. Sci. 82:8752-8755 (1985), каждая из которых включена в настоящую заявку посредством ссылки в полном объеме.
Обычно необходимый уровень активности фактора VIII в плазме, который должен быть достигнут у пациентов вследствие введения рекомбинантного фактора VIII, составляет 30-100% от нормального уровня. В одном из вариантов реализации настоящего изобретения введение терапевтического рекомбинантного фактора VIII осуществляют внутривенно с предпочтительными дозами в диапазоне от примерно 5 до 50 единиц/кг массы тела, и в частности, в диапазоне 10-50 единиц/кг массы тела, в частности при дозах 20-40 единиц/кг массы тела; при этом частотный интервал находится в диапазоне от 8 до 24 часов (при тяжелых случаях гемофилии); и продолжительность лечения в днях находится в диапазоне от 1 до10 дней до устранения кровотечения. См., например, работу Roberts и Jones “Hemophilia and Related Conditions--Congenital Deficiencies of Prothrombin (Factor II, Factor V, and Factors VII to XII),” Ch. 153, 1453-1474, 1460, in Hematology, Williams, W. J., et al., ed. (1990), включенную в настоящую заявку посредством ссылки в полном объеме. Пациентам с ингибиторами может потребоваться различное количество рекомбинантного фактора VIII, относительно фактора VIII прежней формы. Например, пациентам может потребоваться меньшее количество рекомбинантного фактора VIII вследствие его более высокой специфичной активности по сравнению с фактором VIII дикого типа и сниженной реактивности его антител. При лечении с помощью человеческого или полученного из плазмы крови фактора VIII, количество вводимого терапевтического рекомбинантного фактора VIII определяют с помощью одноступенчатого анализа коагуляции фактора VIII, и в некоторых случаях, восстановление in vivo определяют, измеряя фактор VIII в плазме пациента после инфузии. Необходимо понимать, что для каждого конкретного субъекта конкретный режим дозирования должен корректироваться со временем в соответствии с индивидуальными потребностями и профессиональным суждением лица, осуществляющего введение или наблюдающего введение композиций, и что диапазоны концентраций, указанные в настоящей заявке, приведены только в качестве примеров и не ограничивают объем или практическую реализацию заявленного рекомбинантного фактора VIII.
Лечение может иметь форму однократного или периодического внутривенного введения рекомбинантного фактора VIII, или непрерывного введения в течение длительного периода времени по необходимости. В качестве альтернативы, терапевтический рекомбинантный фактор VIII можно вводить подкожно или перорально с помощью липосом одной или несколькими дозами в течение различных временных интервалов.
Рекомбинантный фактор VIII можно также применять для лечения неконтролируемого кровотечения, обусловленного дефицитом фактора VIII у больных гемофилией, у которых выработались антитела к фактору VIII человека.
В настоящей заявке было показано, что рекомбинантный фактор VIII согласно настоящему изобретению может отличаться по специфичной активности от фактора VIII дикого типа. Белки фактора VIII, обладающие повышенной прокоагулирующей активностью по сравнению с фактором VIII дикого типа, успешно применимы для лечения гемофилии, поскольку для восполнения дефицита фактора VIII требуются более низкие дозы. Это не только сокращает медицинские расходы как для пациента, так и для страховщика, но также снижает вероятность развития иммунного ответа на фактор VIII (поскольку вводится меньшее количество антигена).
ПРИМЕРЫ
Следующие примеры представлены для иллюстрации вариантов реализации настоящего изобретения, но они никоим образом не ограничивают его объем.
Материалы и методы
Реагенты
Рекомбинантный фактор VIII (KogenateTM) был любезно предоставлен в качестве подарка Dr. Lisa Regan, корпорация Bayer Corporation (Berkeley, CA). Фосфолипидные везикулы, содержащие 20% фосфатидилхолина (ФХ), 40% фосфатидилэтаноламина (ФЭ) и 40% фосфатидилсерина (ФС), были получены с применением октилглюкозида, как описано ранее (см. публикацию Mimms et al., “Phospholipid Vesicle Formation и Transmembrane Protein Incorporation Using Octyl Glucoside,” Biochemistry 20:833-840 (1981), включенную в настоящую заявку посредством ссылки в полном объеме). Реагенты α-тромбин, фактор VIIa, фактор Ixaβ, фактор X и фактор Xa (Enzyme Research Laboratories, South Bend, IN), гирудин и фосфолипиды (DiaPharma, West Chester, OH), хромогенный субстрат Xa, Pefachrome Xa (Pefa-5523, CH3OCO-D-CHA-Gly-Arg-pNA·AcOH; Centerchem Inc. Norwalk CT), рекомбинантный тканевой фактор человека (рТФ), Инновин (Dade Behring, Newark, DE), флуорогенный субстрат, Z-Gly-Gly-Arg-AMC (Calbiochem, San Diego, CA) и калибровочный маркер тромбина (Diagnostica Stago, Parsippany, NJ) были приобретены у указанных поставщиков.
Конструирование, экспрессия и очистка фактора VIII дикого типа и его вариантов
Мутантные формы с заменой на Ala (по D27, H281, R282, E287, D302, S313, H317, T522, S524, R531, N538, E540, S650, S654, D666, E683, N684, S695, D696, S1791, D1795, Q1820, E1829, S1949, N1950 и R1966); на Phe (по Y476, Y664, Y1786, и Y1792); на Ala и Val (по заряженным остаткам E272, D519, E665 и E1984); и фактор VIII дикого типа, были по отдельности сконструированы в виде лишенного B-домена фактора VIII, лишенного остатков Gln744-Ser1637 в B-домене (см. публикацию Doering et al., “Expression and Characterization of Recombinant Murine Factor VIII,” ThrombHaemost. 88:450-458 (2002), включенную в настоящую заявку посредством ссылки в полном объеме). Конструкции для клонирования и экспрессии были любезно предоставлены Dr. Pete Lollar и John Healey. Формы рекомбинантного фактора VIII дикого типа и его вариантов стабильно экспрессировали в клетках почек детенышей хомяков (BHK, Baby hamster kidney) и очищали, как описано ранее (см. публикацию Wakabayashi et al., “Residues 110-126 in the A1 Domain of Factor VIII Contain a Ca2+ Binding Site Required for Cofactor Activity,” J Biol Chem. 279:12677-12684 (2004), включенную в настоящую заявку посредством ссылки в полном объеме). После трансфекции значимых различий в количестве секреции фактора VIII среди вариантов не наблюдали. Выход белка для вариантов варьировал от >10 до ~100 мкг из двух 750 см2 колб с культурой, при этом степень чистоты варьировала от ~85% до >95% по оценкам с помощью ДСН-ПААГ. Основным контаминантом препаратов фактора VIII был альбумин, и при концентрациях, в которых он присутствовал в препаратах фактора VIII, он не оказывал эффекта на параметры стабильности активности. Концентрацию фактора VIII определяли с помощью твердофазного иммуноферментного анализа (твердофазного ИФА), а активность фактора VIII определяли с помощью одноступенчатого анализа коагулирующей активности и двухступенчатого хромогенного анализа образования фактора Xa, как описано ниже.
ДСН-ПААГ и Вестерн-блоттинг
Белки фактора VIII (0,77 мкг для окрашивания в геле и 0,34 мкг для Вестерн-блота) подвергали электрофорезу в 8% полиакриламидном геле при постоянном напряжении (100 В). Гели окрашивали с помощью красителя Gelcode Blue (Thermo Scientific, Rockford, IL) или переносили на мембрану из поливинилиденфторида и выявляли с помощью биотинилированных антител к A2 (R8B12, Green Mountain Antibodies, Burlington, VT) с последующей инкубацией с конъюгированным с пероксидазой стрептавидином (Calbiochem, San Diego, CA). Проводили реакцию с хемифлуоресцентным субстратом (субстрат ECF, GE Healthcare, Piscataway, NJ) и анализировали сигнал флуоресценции с помощью анализатора изображений phosphoimager (Storm 860, GE Healthcare). Количественную оценку интенсивности для одноцепочечной формы фактора VIII (170 кДа) и тяжелой цепи (ТЦ, 90 кДа) проводили с помощью программного обеспечения ImageQuant (GE Healthcare) и рассчитывали отношения величин.
Твердофазный ИФА
Твердофазный «сэндвич»-ИФА проводили для оценки концентрации белков фактора VIII, как описано ранее (см. публикацию Wakabayashi et al., “A Glu113Ala Mutation within a Factor VIII Ca2+-Binding Site Enhances Cofactor Interactions in Factor Xase,” Biochemistry 44:10298-10304 (2005), включенную в настоящую заявку посредством ссылки в полном объеме), с использованием в качестве стандарта очищенного коммерческого рекомбинантного фактора VIII (Kogenate, Bayer Corporation). Для детекции фактора VIII использовали анти-C2-антитела (ESH-8, American Diagnostica Inc., Stamford, CT) и биотинилированные антитела R8B12 для определения фактора VIII.
Одноступенчатый анализ коагулирующей активности
Одноступенчатый анализ коагулирующей активности проводили с применением субстрата из плазмы, химическим способом лишенной фактора VIII (статья Over, “ Methodology of the One-stage Assay of Factor VIII (VIII:C),” Scand J Haematol Suppl. 41:13-24 (1984), включенная в настоящую заявку посредством ссылки в полном объеме), которую анализировали с помощью прибора для анализа свертываемости Diagnostica Stago. Плазму инкубировали с реагентом APTT (General Diagnostics) в течение 6 мин при 37oC, после чего в кювету добавляли разбавленный фактор VIII. По истечении 1 мин смесь рекальцинировали, определяли время свертывания крови и сравнивали со стандартом из пула нормальной плазмы.
Двухступенчатый хромогенный анализ образования фактора Xa
Скорость конверсии фактора X в фактор Xa контролировали в очищенной системе (см. работу Lollar et al., “Фактор VIII и Фактор VIIIa,” Methods Enzymol. 222:128-143 (1993), включенную в настоящую заявку посредством ссылки в полном объеме) согласно ранее описанному способу (см. работы Wakabayashi et al., “Metal Ion-independent Association of Factor VIII Subunits and the Roles of Calcium and Copper Ions for Cofactor Activity and Inter-subunit Affinity,” Biochemistry 40:10293-10300 (2001); Wakabayashi et al., “Ca2+ Binding to Both the Heavy and Light Chains of Factor VIII Is Required for Cofactor Activity,” Biochemistry 41:8485-8492 (2002), каждая из которых включена в настоящую заявку посредством ссылки в полном объеме). Фактор VIII (1 нМ) в буфере, содержащем 20 мМ N-[2-гидроксиэтил]пиперазин-N'-[2-этансульфоновую кислоту] (HEPES), pH 7,2, 0,1 M NaCl, 0,01% Tween 20, 0,01% БСА, 5 мМ CaCl2, и 10 мкМ везикулы PSPCPE (Буфер A), активировали с помощью 20 нМ α-тромбина в течение 1 мин. Реакцию останавливали добавлением гирудина (10 ед./мл), и образующийся фактор VIIIa реагировал с фактором IXa (40 нМ) в течение 1 мин. Добавляли фактор X (300 нМ) для инициации реакции, которую подавляли через 1 мин путем добавления 50 мМ ЭДТА. Образующийся фактор Xa определяли после реакции с хромогенным субстратом Pefachrome Xa (конечная концентрация 0,46 мМ). Все реакции проводили при 23°C.
Анализ образования тромбина
Количество тромбина, образующегося в плазме, оценивали с помощью калиброванной автоматизированной тромбографии (см. работы Hemker et al., “Calibrated Automated Тромбин Generation Measurement in Clotting Plasma,” Pathophysiol Haemost Thromb. 33:4-15 (2003); Hemker et al., Calibrated Automated Thrombin Generation Measurement in Clotting Plasma,” Pathophysiol HaemostThromb. 33:4-15 (2003); Hemker et al., “Thrombin Generation in Plasma: Its Assessment via the Endogenous Thrombin Potential,” Thromb Haemost. 74:134-138 (1995), каждая из которых включена в настоящую заявку посредством ссылки в полном объеме). В 96-луночном планшете смешивали 80 мкл плазмы, лишенной фактора VIII (<1% остаточной активности, обедненная тромбоцитами), взятой у пациентов с тяжелой гемофилией A с отсутствием ингибитора фактора VIII (George King Bio-Medical, Overlи Park, KS) с образцами фактора VIII (20 мкл; 6 нМ) в буфере HEPES-BSA (20 мМ HEPES, pH 7,35, 0,15 M NaCl, 6% BSA), содержащем 3 пМ рТФ (концентрацию исходного раствора рТФ определяли с помощью анализа образования фактора Xa с использованием известных концентраций фактора VIIa), везикулами PSPCPE (24 мкМ) или 20 мкл калибровочного маркера тромбина (630 нМ), и реакцию немедленно инициировали путем смешивания с 20 мкл флуорогенного субстрата (2,5 мМ, Z-Gly-Gly-Arg-AMC) в буфере HEPES-BSA, включающем 0,1 M CaCl2. Все реагенты предварительно нагревали при 37°C. Конечная концентрация реагентов составила: 1 нМ фактора VIII (если не указано иначе), 0,5 пМ рТФ, 4 мкМ везикул PSPCPE, 433 мкМ флуорогенного субстрата, 13,3 мМ CalCl2, и 105 нМ калибровочного маркера тромбина. Развитие сигнала флуоресценции при 37°C наблюдали с интервалами в 8 секунд с использованием спектрофлюориметра для микропланшетов (Spetramax Gemini, Molecular Devices, Sunnyvale, CA) с использованием набора фильтров 355 нм (возбуждение)/460 нм (эмиссия). Сигналы флуоресценции корректировали с учетом референсного сигнала от образцов калибровочного маркера тромбина (см. работу Hemker et al., “Calibrated Automated Thrombin Generation Measurement in Clotting Plasma,” Pathophysiol Haemost Thromb. 33:4-15 (2003), включенную в настоящую заявку посредством ссылки в полном объеме) и фактическое образование тромбина в нМ рассчитывали, как описано ранее (Hemker et al., “Thrombin Generation in Plasma: Its Assessment via the Endogenous Thrombin Potential,” Thromb Haemost. 74:134-138 (1995), включенный в настоящую заявку посредством ссылки в полном объеме).
Активность фактора VIII при повышенной температуре
Фактор VIII дикого типа или варианты фактора VIII (4 нМ) в буфере A инкубировали при 52-60°C. Отбирали аликвоты в указанные моменты времени и определяли остаточную активность фактора VIII с использованием двухступенчатого хромогенного анализа образования фактора Xa.
Зависимость изменения активности фактора VIIIa от времени
Фактор VIII дикого типа и его мутантные формы (4 нМ) в буфере A, содержащем 10 мкМ везикул PSPCPE, активировали с помощью 20 нМ тромбина в течение 1 мин при 23°C. Реакцию немедленно подавляли гирудином (10 ед./мл), собирали аликвоты в указанные моменты времени и определяли активность с использованием анализа образования фактора Xa после добавления фактора IXa (40 нМ) и фактора X (300 нМ). Для измерений потери активности, проводимых в присутствии фактора IXa, фактор IXa (40 нМ) добавляли в реакцию перед добавлением тромбина.
Стабильность фактора VIII в плазме
Фактор VIII дикого типа или его вариант (1 нМ) добавляли к плазме, лишенной фактора VIII (<1% остаточной активности), полученной от пациентов с тяжелой формой гемофилии A с отсутствием ингибиторов фактора VIII (George King Bio-Medical). В плазму добавляли 0,02% NaN3 для предотвращения роста микроорганизмов, и образцы инкубировали при 37°C. Отбирали аликвоты в указанные моменты времени и определяли остаточную активность с помощью одноступенчатого анализа коагулирующей активности.
Анализ данных
Значения активности фактора VIIIa в виде функции от времени соотносили с кривой с одиночным экспоненциальным затуханием с помощью нелинейного регрессионного анализа методом наименьших квадратов с использованием уравнения,
где A представляет собой остаточную активность фактора VIIIa (нМ/мин/нМ фактора VIII), A0 - исходная активность, k- предполагаемая константа скорости, t представляет собой время (минуты) реакции фактора VIII либо при повышенной температуре (для экспериментов по определению потери активности фактора VIII), либо после подавления активации тромбином (для оценки потери активности фактора VIIIa). Анализ с помощью нелинейной регрессии методом наименьших квадратов проводили с применением Kaleidagraph (Synergy, Reading, PA). Сравнение средних значений проводили с помощью t-теста Стьюдента. Структуру модели A-домена фактора VIII (см. работу Pemberton et al., “A Molecular Model for the Triplicated A Domains of Human Фактор VIII Based on the Crystal Structure of Human Ceruloplasmin,” Blood 89:2413-2421 (1997), включенную в настоящую заявку посредством ссылки в полном объеме) анализировали с помощью приложения Swiss PDB Viewer для идентификации заряженных остатков, расположенных в области домена A2 и характеризующихся низкой способностью к взаимодействию через водородные связи на основании пороговой величины >2,8 Å, отделяющей полярные атомы комплементарных доменов (см. работу Weiner et al., “A New Force Field for Molecular Mechanical Simulation of Nucleic Acids Proteins,” J AmChem Soc. 106:765-784 (1984), включенную в настоящую заявку посредством ссылки в полном объеме).
Пример 1: Значения активности для мутантных форм фактора VIII с мутациями, затрагивающими взаимодействие через водородные связи
Связывающие взаимодействия, в которые вовлечен домен A2 фактора VIII, остаются недостаточно изученными, хотя представляют собой основной механизм регуляции кофакторной активности. Основанная на гомологии модель фактора VIII (см. работу Pemberton et al., “A Molecular Model for the Triplicated A Domains of Human Factor VIII Based on the Crystal Structure of Human Ceruloplasmin,” Blood 89:2413-2421 (1997), включенную в настоящую заявку посредством ссылки в полном объеме) позволила выявить многие потенциальные водородные связи, соединяющие остатки в домене A2 с остатками в доменах A1 или A3. С использованием критерия пространственного разделения, составляющего <2,8 Å между атомами донорами и акцепторами водорода (см. работу Weiner et al., “A New Force Field for Molecular Mechanical Simulation of Nucleic Acids Proteins,” J AmChem Soc. 106:765-784 (1984), включенную в настоящую заявку посредством ссылки в полном объеме), было идентифицировано тридцать остатков, имеющих на боковой цепи атом, который может быть вовлечен в образование водородных связей с атомом из комплементарного A-домена (см.Таблицу 1, представленную ниже). Примерно в половине идентифицированных остатков атомы боковой цепи располагались рядом либо с остовным карбонильным кислородом, либо амидными атомами водорода, тогда как оставшиеся демонстрировали возможные взаимодействия между соседними боковыми цепями. Целевые остатки в A-доменах фактора VIII были по отдельности изменены на Ala, за исключением остатков Tyr, которые были замещены на Phe, и формы с соответствующими точковыми мутациями стабильно экспрессировали в виде лишенного B-домена фактора VIII.
Активность фактора VIII оценивали для очищенных белков с помощью одноступенчатого анализа коагулирующей активности и (двухступенчатого) анализа образования фактора Xa. Результаты, полученные в ходе одноступенчатого анализа (Фигура 1) показали, что 9 из 30 точковых мутаций демонстрировали <50% активности, относительно фактора VIII дикого типа. Пять из этих вариантов демонстрировали несоответствие результатов в одноступенчатом/двухступенчатом анализе (>1,5-кратные различия), при этом три мутанта (S524A, H281A и E287A) демонстрировали снижение только в двухступенчатом анализе. Снижение значений активности для мутации в нескольких целевых остатках согласовывалось с вкладом этих боковых цепей в структурную стабильность фактора VIII и/или фактора VIIIa.
Пример 2: Термостабильность вариантов фактора VIII
Для оценки термостабильности прокофактора дикого типа и вариантов использовали температуру 55°C на основании результатов анализа по инактивации фактора VIII, описанных в более раннем исследовании (см. работу Ansong et al., “Factor VIII A3 Domain Residues 1954-1961 Represent an A1 Domain-Interactive Site,” Biochemistry 44:8850-8857 (2005), включенную в настоящую заявку посредством ссылки в полном объеме). В ходе этой реакции фактор VIII инкубировали в течение указанного периода времени при повышенной температуре, после чего реакционную смесь немедленно охлаждали до комнатной температуры, фактор VIII реагировал с тромбином, и исследовали его кофакторную активность с помощью анализа образования фактора Xa. Определяли скорость потери активности фактора VIII при тепловой обработке, исходя из остаточной кофакторной функции, как описано в Методах. На Фигуре 2A представлены результаты для вариантов, демонстрирующих большую и меньшую чувствительность к тепловой обработке по сравнению с диким типом.
В таблице 2 (ниже) сведены результаты, полученные при анализе термостабильности фактора VIII для 30 вариантов. В целом, данные по активности хорошо ложатся на кривую с одиночным экспоненциальным затуханием с коэффициентами корреляции в большинстве случаев >0,98. Ряд мутаций оказывал благоприятный эффект в отношении замены аминокислот (21 демонстрировали <2-кратные различия в скорости потери активности), несколько остатков, включая Arg282 (домен A1), и остатки Ser524, Asn684 и Ser650 из домена A2 демонстрировали ~5- - ~20-кратное увеличение скорости потери активности фактора VIII, что свидетельствует о важной роли этих остатков в поддержании стабильности фактора VIII. Кроме того, варианты R282A и N684A демонстрировали значительно сниженные значения специфичной активности, что указывает на то, что такие точковые мутации оказывают влияние на параметры как активности, так и стабильности. В то же время, замены E287 и D302 на Ala приводили к снижению скорости потери активности фактора VIII при повышенной температуре. Такое заметное увеличение стабильности белка в результате мутации согласуется с тем, что эти кислые боковые цепи дестабилизируют внутридоменные взаимодействия в кофакторе дикого типа.
Пример 3: Скорости потери активности фактора VIIIa
Активность фактора VIIIa является лабильной вследствие диссоциации субъединицы A2 (см. работы Fay et al., “Human Factor VIIIa Subunit Structure: Reconstruction of Factor VIIIa from the Isolated A1/A3-C1-C2 Dimer and A2 Subunit,” J Biol Chem. 266:8957-8962 (1991); Lollar et al., “pH-dependent Denaturation of Thrombin-activated Porcine Factor VIII,” J Biol Chem. 265:1688-1692 (1990), каждая из которых включена в настоящую заявку посредством ссылки в полном объеме). Результаты более ранних исследований показали, что присоединение фактора IXa и фосфолипидных везикул к фактору VIIIa с образованием комплекса Хазы снижает лабильность кофактора (см. Lollar et al., “Stabilization of Thrombin-activated Porcine Factor VIII:C by Factor IXa Phospholipid,” Blood 63:1303-1308 (1984); Lamphear et al., “Factor IXa Enhances Reconstitution of Factor VIIIa from Isolated A2 Subunit and A1/A3-C1-C2 Dimer,” J. Biol. Chem. 267:3725-3730 (1992), включенные в настоящую заявку посредством ссылки в полном объеме) за счет частичной стабилизации субъединицы A2 в пределах фактора Хазы (см. работу Fay et al., “Model for the Factor VIIIa-dependent Decay of the Intrinsic Factor Xase: Role of Subunit Dissociation and Factor IXa-catalyzed Proteolysis,” J Biol Chem. 271:6027-6032 (1996), включенную в настоящую заявку посредством ссылки в полном объеме). Такой подход недавно был использован для исследования скорости потери активности у мутантной формы фактора VIIIa E1829A (см. работу Wakabayashi et al., “A3 Domain Residue Glu1829 Contributes to A2 Subunit Retention in Factor VIIIa,” J. Thromb. Haemost. 5:996-1001(2007), включенную в настоящую заявку посредством ссылки в полном объеме), поскольку потеря активности для этого варианта фактора VIIIa, в отсутствие фактора IXa и мембраны, происходила слишком быстро для точных измерений. Аналогичным образом этот подход использовали для оценки скорости потери активности фактора VIIIa для ряда вариантов, описанных в этом Примере. Фактор VIII (4 нМ) инкубировали с молярным избытком фактора IXa (40 нМ) и фосфолипидных везикул, быстро активировали тромбином и затем измеряли временную динамику активности фактора Хазы при 23oC. Скорости потери активности фактора Хазы соотносили с диссоциацией субъединицы A2, и данные аппроксимировали с использованием кривой однократного экспоненциального затухания. С учетом высокого значения Kd сродства субъединицы A2 в пределах фактора VIIIa (144 нМ) и низкой концентрации фактора VIIIa (4 нМ), используемой в реакциях, эффект реассоциации и диссоциации субъединицы A2 является пренебрежимо малым, что свидетельствует о возможности использования простой однократной экспоненциальной функции в данном регрессионном анализе.
Результаты представлены на Фигуре 2B, на которой приведены данные для вариантов с наиболее выраженными изменениями, а также вариантов с положительными изменения в ответ на мутацию. Семь вариантов демонстрировали значимое (>5-кратное) увеличение скорости потери активности фактора VIIIa по сравнению с диким типом (Таблица 2). Такие мутации включают R282A, S524A, N684A, E1829A, Y1786F, D666A и Y1792F. Значения активности фактора VIII для этих вариантов, измеренные с помощью двухступенчатого анализа, были значительно ниже значений, определенных с помощью одноступенчатого анализа (Фигура 1), что согласуется с тем, что мутации приводят к заметному увеличению скорости диссоциации субъединицы A2. Кроме того, некоторые из этих мутаций (в том числе R282A, N684A и Y1792F) демонстрировали в целом низкую специфичную активность в одноступенчатом анализе. Как и в случае мутантных форм фактора VIII, характеризующихся такими же несоответствиями результатов двух способов анализа, активность, определенная в одноступенчатом анализе, также была снижена (см. работы Pipe et al., “Mild Hemophilia A Caused by Increased Rate of Factor VIII A2 Subunit Dissociation: Evidence for Nonproteolytic Inactivation of Factor VIIIa in vivo,” Blood 93:176-183 (1999); Pipe et al., “Hemophilia A Mutations Associated with 1-stage/2-stage Activity Discrepancy Disrupt Protein-protein Interactions within the Triplicated A Domains of Thrombin-activated Factor VIIIa,” Blood 97:685-691 (2001); Hakeos et al., “Hemophilia A Mutations within the Factor VIII A2-A3 Subunit Interface Destabilize Factor VIIIa and Cause One-stage/Two-stage Activity Discrepancy,” Thromb Haemost. 88:781-787 (2002), каждая из которых включена в настоящую заявку посредством ссылки в полном объеме), что, возможно, отражает прямое влияние скорости диссоциации A2 на определение активности фактора VIII.
В противоположность этому, варианты E287A и D302A, обладающие большей термостабильностью по сравнению с фактором VIII дикого типа, также демонстрировали увеличенную стабильность фактора VIIIa, о чем свидетельствует снижение скорости утраты активности кофактора после активации тромбином. Результаты для варианта D302A были более выраженными и показали ~2-кратное снижение скорости потери активности кофактора, относительно фактора VIIIa дикого типа, при сохранении ~90% исходной активности после 40 мин. Такое наблюдение согласуется с тем, что мутации, главным образом, затрагивают конформацию области контакта между доменами в прокофакторе.
В совокупности, результаты Примеров 1-3 позволили определить вклад разнообразных остатков во взаимодействие между субъединицей (доменом) A2 фактора VIII в форме прокофактора и кофактора, при этом выбранные остатки вносят несоизмеримый вклад в стабильность белка. Хотя наблюдаемые эффекты мутаций по целевым остаткам по большей части были либо положительными, либо отрицательными, мутации по двум кислым остаткам домена A1, D302 и E287, вызывали умеренное увеличение стабильности как на форму прокофактора, так и на активную кофакторную форму. Относительная активность E287 была до некоторой степени снижена по сравнению с диким типом, тогда как значения активности для варианта D302 были неотличимы от белка дикого типа, что позволяет предположить, что последняя мутация представляет собой мутацию с приобретение функции (gain-of-function mutation). Такие результаты указывают на то, что некоторая дестабилизация может быть обусловлена «углублением» (отрицательного) заряда на области контакта и/или увеличением стабильности в случае, когда боковые цепи таких остатков являются гидрофобными.
Пример 4: Идентификация дополнительных целевых остатков и получение точковых мутаций по положениями Glu272, Asp519, Glu665 и Glu1984
С учетом результатов предшествующих Примеров, также были исследованы замены других заряженных остатков. С помощью модели, основанной на гомологии с церуплазмином (см. работу Pemberton et al., “A Molecular Model for the Triplicated A Domains of Human Factor VIII Based on the Crystal Structure of Human Ceruloplasmin,” Blood 89:2413-2421 (1997), включенную в настоящую заявку посредством ссылки в полном объеме), в A-доменах фактора VIII были идентифицированы четыре заряженных остатка (Glu272, Asp519, Glu665 и Glu1984). Как оказалось, эти четыре остатка находятся в глубине области контакта домена A2 либо с доменом A1 (Glu272 и Asp519), либо с доменом A3 (Glu665 и Glu1984), но, по-видимому, не вносят вклад в образование водородных связей, о чем свидетельствует их пространственное разнесение >2,8 Å с потенциальными партнерами для образования связей. Такие остатки были изменены либо на Ala, либо Val для устранения заряда, а также для обеспечения потенциальных гидрофобных взаимодействий с аналогичными боковыми цепями других «углубленных» остатков. Варианты фактора VIII были получены в виде лишенного B-домена фактора VIII, стабильно экспрессирующегося в клеточной линии BHK.
Фактор VIII экспрессировали в виде смеси одноцепочечной и гетеродимерной форм. Степень очистки белков составила от ~85% до >95% согласно результатам ДСН-ПААГ (Фигура 3A). Для количественной оценки стехиометрического состава одноцепочечных и гетеродимерных форм применяли Вестерн-блоттинг с использованием антител к домену A2 (Фигура 3B). Данное значение было приблизительно одинаковым для дикого типа и несколько ниже и вариабельнее для вариантов фактора VIII.
Очищенные белки использовали для анализа специфичной активности с применением как одноступенчатого, так и двухступенчатого анализа (Фигура 4A) и параметров образования тромбина (Фигуры 4B-D). Все варианты, кроме Glu272Ala, характеризовались специфичной активностью, составляющей по меньшей мере 80% от таковой у дикого типа, что позволяет предположить, что оставшиеся мутации практически не оказывали влияния на кофакторную функцию фактора VIII. Результаты анализа образования тромбина, проводимого при низкой концентрации рТФ (0,5 пМ) и физиологических концентрациях (1 нМ) фактора VIII, соответствовали значениям специфичной активности. Значения параметров, представленные на Фигуре 4D, указывают на то, что величина пика и ЭПТ для Glu272Ala снижены относительно дикого типа, тогда как все другие значения параметров для оставшихся вариантов находились в диапазоне >80 - 110% от значений для дикого типа.
Пример 5: Термостабильность вариантов фактора VIII Glu272, Asp519, Glu665 и Glu1984
Очищенные белки мутантных форм фактора VIII анализировали на стабильность при повышенных температурах на основании скоростей потери активности. Фактор VIII (4 нМ) инкубировали при 52-60oC и в указанные моменты времени отбирали аликвоты, охлаждали до комнатной температуры, проводили реакцию с тромбином и оценивали остаточную кофакторную активность с использованием анализа образования фактора Xa, как описано в разделе «Материалы и методы». Результаты, представленные на Фигуре 5A, иллюстрируют временную динамику потери активности фактора VIII дикого типа и вариантов при 55°C. Такая температура была выбрана на основании результатов более раннего исследования (см. работу Ansong et al., “Factor VIII A1 Domain Residues 97-105 Represent a Light Chain-interactive Site,” Biochemistry 45:13140-13149 (2006), включенную в настоящую заявку посредством ссылки в полном объеме), показывающего практически полную потерю активности в течение 1 ч для фактора VIII дикого типа. Белок дикого типа демонстрировал потерю 50% активности через ~15 мин. Было показано, что варианты Glu272Ala и Glu272Val характеризовались сниженной стабильностью, о чем свидетельствует несколько более быстрая потеря активности, и это свойство может быть связано со сниженными специфичными активностями, наблюдаемыми при мутациях в данных сайтах. С другой стороны, замены на Ala и Val в положениях Asp519, Glu665 и Glu1984 все демонстрировали высокую стабильность при повышенной температуре, при этом варианты, несущие мутации в двух ранее упомянутых сайтах, сохраняли 50% активности через ~20-25 мин, тогда как у вариантов с мутациями по последним сайтам такой уровень активности сохранялся через >30 мин. Сравнение значений скорости потери активности из аппроксимирующей кривой (Таблица 1, ниже) указывает на то, что термостабильность фактора VIII была выше в ~2 раза для вариантов Glu1984 по сравнению с диким типом, при этом замена на Val оказалась несколько более предпочтительной, чем замена на Ala.
Результаты анализа в диапазоне температур (Фигура 5B) указывают на то, что варианты как с Ala, так и с Val по Asp519, Glu665 и Glu1984 согласованно демонстрировали снижение скорости потери активности вплоть до 2 раз по сравнению с диким типом при всех проанализированных температурах. Однако присутствие как одноцепочечных, так и гетеродимерных форм в несколько варьирующих соотношениях может оказывать влияние на результирующие скорости потери активности, если одна форма характеризуется более высокой стабильностью. В контрольных экспериментах с использованием фактора VIII Kogenate, который по существу весь представлен в форме гетеродимера (см. работу Wakabayashi et al., “Metal Ion-independent Association of Factor VIII Subunits and the Roles of Calcium and Copper Ions for Cofactor Activity and Inter-subunit Affinity,” Biochemistry 40:10293-10300 (2001), включенную в настоящую заявку посредством ссылки в полном объеме), скорости потери активности в ~2 раза превышали значения для дикого типа (Фигура 5B), что согласуется с тем, что гетеродимерная форма характеризуется меньшей устойчивостью к повышенной температуре, чем одноцепочечный фактор VIII. Таким образом, измеренные скорости потери активности, по-видимому, обусловлены гетерогенностью состава, включающего различные соотношения одноцепочечных и двухцепочечных форм, в различных формах фактора VIII. Однако, при условии, что все варианты характеризуются меньшей долей одноцепочечного фактора VIII по сравнению с диким типом (см. Фигура 5B), полученные данные указывают на то, что значения скорости потери активности для этих вариантов занижают увеличение стабильности между мутантами и диким типом.
Пример 6: Стабильность фактора VIII в плазме при 37°C
Для исследования влияний мутаций на стабильность фактора VIII в более нативных условиях, белки в концентрации, близкой к физиологическим значениям (1 нМ), инкубировали в плазме (антикоагулированной) с недостатком фактора VIII, полученной от пациентов, страдающих гемофилией A, лишенной активности, ингибирующей фактор VIII, при 37°C в течение до 4 дней. Остаточную активность фактора VIII оценивали ежедневно с помощью одноступенчатого анализа коагулирующей активности. Активность фактора VIII дикого типа была снижена до ~50% по истечении 2 дней, так же как и у варианта Asp519Val, тогда как вариант Glu665Ala демонстрировал умеренное (~15%) снижение скорости потери активности (Фигура 6 и Таблица 3). Однако значения активности для вариантов Asp519Ala, Glu665Val и обоих вариантов Glu1984 составила >50% от исходного значения на 4-й день. Результаты, полученные в экспериментах с инкубацией в плазме, в значительной степени согласуются с результатами, полученными в экспериментах с инкубацией при повышенной температуре, при этом вариант Glu665Val и оба варианта Glu1984 вариантов демонстрировали увеличение стабильности при двух условиях реакции, о чем свидетельствует сохранение функции. Хотя оба варианта Asp519 демонстрировали высокую стабильность при повышенной температуре, только вариант с Ala характеризовался улучшением стабильности при анализе в плазме.
Пример 7: Скорости потери активности вариантов Glu272, Asp519, Glu665 и Glu1984 фактора VIIIa
Приведенные выше результаты указывают на то, что мутации, связанные с замещением «углубленных» заряженных остатков на гидрофобные остатки, в целом, обуславливают увеличение стабильности белка фактора VIII. Ввиду того что эти мутации находятся в области контакта домена A2 с A1 или A3 или расположены поблизости от нее, было высказано предположение, что указанные мутации оказывают положительное воздействие на лабильность фактора VIIIa, снижая скорости диссоциации субъединицы A2. Скорости утраты активности фактора VIIIa, обусловленные таким механизмом, были проанализированы с помощью двух способов анализа. В первом случае, фактор VIII дикого типа и варианты активировали с помощью тромбина, и в указанные моменты времени определяли оставшуюся кофакторную активность после добавления фактора IXa и фактора X, и оценивали скорости образования фактора Xa. Во втором случае описанный выше способ анализа был модифицирован и включал добавление фактора IXa перед активацией фактора VIII, что делало возможным немедленное образование фактора Хазы. Было показано, что включение фактора VIIIa в комплекс фактора Хазы частично стабилизирует кофакторную активность, снижая скорость потери активности до 10 раз за счет механизма, связанного с присоединением фактора IXa к субъединицам A2 и A3C1C2 с Хазой (см. работу Fay et al., “Model for the Фактор VIIIa-dependent Decay of the Intrinsic Factor Xase: Role of Субъединица Dissociation и Фактор IXa-catalyzed Proteolysis,” J Biol Chem. 271:6027-6032 (1996), включенную в настоящую заявку посредством ссылки в полном объеме).
Результаты, полученные в отсутствие или в присутствии добавленного фактора IXa представлены на Фигурах 7A и 7B, соответственно. В отсутствие фактора IXa фактор VIIIa дикого типа характеризовался потерей 50% активности через ~8 мин (Фигура 7A), тогда как этот уровень активности сохранялся в течение ~40 мин в том случае, когда при активации фактора VIII был добавлен фактор IXa (Фигура 7B). Значения скорости потери активности представлены в Таблице 3, и результаты указывают на >5-кратную стабилизацию кофакторной активности при формировании фактора X-азы. Исследование вариантов показало, что формы как Glu272Ala, так и -Val характеризовались 2- и 3-кратным увеличением скоростей потери активности, соответственно, в отсутствие фактора IXa по сравнению с контролем дикого типа. Такие результаты свидетельствуют об ослабленном сродстве между субъединицами при каждой из упомянутых мутаций, что, вероятно, является результатом утраты связывающих взаимодействий с относительно низким сродством с участием кислой боковой цепи. В присутствии фактора IXa скорости потери активности для двух вариантов по существу не отличались от значений для дикого типа, что указывает на то, что включение фактора IXa способствовало устранению любых негативных воздействий, обусловленных мутациями по указанному остатку.
Мутации по трем другим сайтам (Asp519, Glu665 и Glu1984) приводили к снижению скоростей потери активности фактора VIIIa, при этом степень такого снижения варьировала в зависимости от того, какой конкретно остаток был изменен, и в одном случае от того, на какой остаток произошла замена. Мутации по Asp519 обуславливали ~30% снижение скорости потери активности, схожим образом как для вариантов с Ala, так и с Val, при отсутствии фактора IXa. Скорости потери активности для этих вариантов снижались в >2 раза в присутствии фактора IXa, что позволяет предположить наличие синергического эффекта между мутациями и стабилизирующим действием связывания фермента. В то время как вариант Glu665Ala характеризовался значениями, схожими с двумя вариантами Asp519, вариант Glu665Val демонстрировал 5-кратное и 3-кратное снижение скорости потери активности в отсутствие и в присутствии фактора IXa, соответственно, что позволяет предположить, что замена на больший гидрофобный остаток обуславливает более эффективное взаимодействие с соседними остатками удерживаемой субъединицы A2. Наконец, оба варианта Glu1984 демонстрировали ~4-кратное снижение потери активности фактора VIIIa по сравнению с диким типом в отсутствие фактора IXa и 5-8-кратное снижение в присутствии фактора IXa. Значимость такого увеличения стабильности прослеживается на Фигуре 7B, демонстрирующей сохранение >90% активности фактора VIIIa после 40 мин в факторе X-азы, включающего любой из вариантов Glu1984. Сходство характеристик вариантов Glu1984 с Ala или Val указывает на то, что оба остатка хорошо переносимы, при этом, возможно, присутствие Val обуславливает несколько большую аффинность между субъединицами. В целом, полученные результаты свидетельствуют о значимом увеличении стабильности фактора VIIIa вследствие более эффективного удержания субъединицы A2, обусловленного селективным замещением заряженных остатков на гидрофобные остатки.
Обсуждение Примеров 1-7
Изложенные выше Примеры показывают, что замена выбранных заряженных остатков на гидрофобные остатки по сайтам, которые, как предполагалось, составляют область контакта домена A2, в целом приводит к увеличению, хотя и варьирующему, стабильности фактора VIII. Такую стабильность оценивали по сохранению активности при повышенной температуре, а также по снижению скорости диссоциации субъединицы A2 в кофакторе.
При первоначальном анализе в Примерах 1-3 для мутационного анализа были выбраны 30 остатков, локализующихся в области контакта домена A2 фактор VIII, на основании пространственного разнесения <2,8 Å, которые потенциально могут участвовать в образовании водородных связей. 30 заряженных/полярных остатков заменяли путем мутагенеза на Ala (или на Phe для остатков Tyr), осуществляли стабильную экспрессию рекомбинантных белков и оценивали скорости потери активности. Четырнадцать из 30 проанализированных остатков демонстрировали >2-кратное увеличение скорости потери активности фактора VIII при 55°C и/или скорости потери активности фактора VIIIa, относительно дикого типа, что указывает на то, что многие остатки в областях контакта доменов A1A2 и A2A3 существенны для стабилизации фактора VIII. Интересно отметить, что два проанализированных кислых остатка, Asp302 и Glu287, при их изменении на Ala обуславливали умеренное (<2-кратному) увеличение стабильности белка как в форме прокофактора, так и в активной кофакторной форме. Оба из этих кислых остатков консервативны у фактора VIII человека, собаки, свиньи, мыши, кролика, крысы и летучей мыши. Такие первоначальные результаты позволили предположить, что такие кислые боковые цепи не были важны для стабилизации взаимодействий через водородные связи, а скорее оказывали до некоторой степени отрицательное влияние на структуру фактора VIII согласно анализу функциональной стабильности.
На основании таких первоначальных исследований, было исследовано, приводит ли образование дополнительных гидрофобных взаимодействие к «приобретению функции» (gain of function). Четыре кислых остатка, исследованных в Примерах 4-7, консервативны у фактора VIII человека, собаки, свиньи, мыши, кролика и летучей мыши, тогда как в факторе крысы вместо Glu665 содержится Ala, а вместо Glu1984 - Thr (см. Швейцарский Институт Биоинформатики, анализ on-line UniProtKB/Swiss-Prot Release 55.5 и UniProtKB/TrEMBL версия 38.5 (2008), включен в настоящую заявку посредством ссылки в полном объеме). Результаты Примеров 4-7 демонстрируют, что три из этих остатков, Asp519, Glu665 и Glu1984, при замене на Ala и/или Val, обуславливают увеличение стабильности белка. Только один из кислых остатков, проанализированных в Примерах 4-7, при мутации оказывал негативный эффект на активность фактора. Замена Glu272 на Ala обуславливала низкую специфичную активность фактора VIII со сниженными показателями образования тромбина; при этом замены как на Ala, так и на Val вызывали умеренное снижение термостабильности и 2-3-кратное увеличение скорости диссоциации субъединицы A2 в кофакторной форме по сравнению с диким типом. На основании таких наблюдений предполагается, что Glu272 действительно участвует в связывающем взаимодействии (взаимодействиях) с соседними остатками, и последующие мутации по этому сайту разрушают эти взаимодействия. Этот вывод согласуется с результатами, представленными в базе данных по гемофилии A Hemophilia A database (Kemball-Cook et al., “The Factor VIII Structure and Mutation Resource Site: HAMSTeRS version 4,” Nucleic Acids Res. 26:216-219 (1998); Kemball-Cook (MRC Clinical Sciences Centre), Haemophilia A Mutation Database (accessed July 2, 2008), включенные в настоящую заявку посредством ссылки в полном объеме), согласно которым Lys (обращение заряда) или Gly (небольшая боковая цепь) в положении 272 обуславливает умеренный/слабый фенотип с пониженной антигенностью фактора VIII. Последнее наблюдение согласуется с тем, что мутации обуславливают увеличение нестабильности в плазме. Однако не наблюдалось значимого действия этих мутаций на уровень экспрессии в культуре клеток в случае мутаций по этому сайту с заменой на Ala или Val. В противоположность этому, в базе данных не перечислены мутации по положениям Asp519, Glu665 и Glu1984.
Белки, как правило, претерпевают укладку таким образом, что заряженные или полярные группы остаются обращенными к растворителю, тогда как гидрофобные группы остаются «углубленными» (см. работу Pace et al., “Forces Contributing to the Conformational Stability of Proteins,” FASEB J. 10:75-83 (1996), включенную в настоящую заявку посредством ссылки в полном объеме). Таким образом, на основании фенотипа мутаций «с приобретением функции» (gain-of- function) при замене остатков Glu287, Asp302, Asp519, Glu665 и Glu1984 на гидрофобный остаток, предполагается, что такие заряженные остатки остаются внутри области контакта домена A2. Кроме того, полученные результаты указывают на то, что данные остатки не участвуют в электростатических связывающих взаимодействиях и, вероятно, дестабилизируют структуру белка дикого типа и/или взаимодействия между субъединицами.
Поскольку мутагенез с использованием либо Ala, либо Val приводит к появлению гидрофобного остатка (взамен заряженных кислых остатков), ожидается, что замена на Ala или Val должна стабилизировать другие гидрофобные контакты в области контакта. Кроме того, боковая цепь Val больше, чем у Ala, поэтому сравнение эффектов на активность фактора после замены в данном сайте могло бы помочь понять, какова укладка остатков и размер (объем) данного сайта. Например, замена Glu1984 на любой из этих остатков приводит к схожим результатам, указывая на то, что оба остатка в данном сайте не оказывают неблагоприятного эффекта; поскольку Glu665Val демонстрировал 3-кратное снижение скорости потери активности фактора VIIIa по сравнению с Glu665Ala, можно предположить, боковая цепь Val с большим объемом больше подходит (оказывает больший положительный эффект на структуру) для предполагаемого гидрофобного «связывающего кармана».
В целом, результаты Примеров 1-7 во многом способствовали пониманию структуры A-доменов фактора VIII, которое ранее ограничивалось моделями, построенными по гомологии со структурой церулоплазмина с высоким разрешением (см. работу Pemberton et al., “A Molecular Model for the Triplicated A Domains of Human Factor VIII Based on the Crystal Structure of Human Ceruloplasmin,” Blood 89:2413-2421 (1997), включенную в настоящую заявку посредством ссылки в полном объеме) и недавно описанной структуры с промежуточным разрешением (3,75 Å) фактора VIII человека (см. работу Shen et al., “The Tertiary Structure and Domain Organization of Coagulation Factor VIII,” Blood 111:1240-1247 (2008), включенную в настоящую заявку посредством ссылки в полном объеме). Несмотря на то, что последняя структура не позволяет определить наличие водородных связей (<2,8 Å), авторы исследования отмечают, что A-домены фактора VIII можно «наложить» на соответствующие домены церулоплазмина с высокой степенью точности.
Несмотря на то, что модель церулоплазмина предполагает, что Asp302 и Glu287 могут участвовать в образовании водородных связей, исследования стабильности в Примерах 1-3 свидетельствуют о том, что это маловероятно. Взамен этого можно предположить, что такие кислые боковые цепи «погружены» внутрь гидрофобного окружения. Напротив, результаты Примеров 4-7 подтверждают предположение, что Glu272, вероятно, участвует в формировании водородных связей в области контакта домена A2, поскольку потеря этого заряда снижает стабильность фактора VIII (VIIIa). Три оставшихся кислых остатка, исследованные в Примерах 4-7, по всей вероятности, «заглублены» внутри области контакта, как было предсказано моделью, поскольку вблизи карбоксильных групп этих остатков не локализованы полярные атомы соседнего остатка на комплементарном домене. Точнее, было показано, что эти группы расположены ближе к гидрофобным группам. Например, модель предсказывает, что кислород карбоксильной группы oAsp519 и углерод метильной группы Thr275 находятся на расстоянии ~4,2 Å, кислород карбоксильной группы Glu665 и углерод метильной группы Val1982 разделены ~8,1 Å, а кислород карбоксильной группы Glu1984 и углерод метильной группы Val663 разделены ~6,2 Å.
Варианты фактора VIII, характеризующиеся повышенной стабильностью и пониженной скоростью потери кофакторной активности, представляют собой положительные качественные признаки для терапевтических препаратов. Указанные свойства позволят увеличить выход активного белка в процессе его очистки и приготовления терапевтического средства, что обуславливает в целом более высокие значения специфичной активности. Такие вещества также могут обладать более продолжительным временем полужизни в кровотоке относительно дикого типа (см.Фигура 6), избегая различных клеточных механизмов элиминации. Ранее были описаны две группы вариантов фактора VIII, у которых кофакторная активность была стабилизирована за счет снижения скорости/исключения диссоциации субъединицы A2. В обоих случаях с помощью мутаций осуществляли ковалентную сшивку домена A2 с другими областями молекулы. В одном случае был получен устойчивый к инактивации фактор VIII за счет сшивки домена A2 с участком B-домена, прилегающего доменам к A3C1C2 и лишенного сайта расщепления тромбином, который бы обусловил отделение либо домена A2, либо фрагмента B-домена после активации прокофактора (см. работу Pipe et al., “Characterization of a Genetically Engineered Inactivation-resistant Coagulation Factor VIIIa,” Proc Natl Acad Sci U S A 94:11851-11856 (1997), включенную в настоящую заявку посредством ссылки в полном объеме). Во втором случае выбранные остатки в доменах A3 и A2, находящиеся в непосредственной близости, были заменены на остатки Cys с формированием дисульфидных связей между двумя доменами, таким образом, что A2 мог оставаться ковалентно связанным с A3 после активации тромбином (см. работы Gale et al., “An Engineered Interdomain Disulfide Bond Stabilizes Human Blood Coagulation Factor VIIIa,” J Thromb Haemost. 1:1966-1971 (2003); Radtke et al., “Disulfide Bond-stabilized Factor VIII has Prolonged Factor VIIIa Activity and Improved Potency in Whole Blood Clotting Assays,” J Thromb Haemost. 5:102-108 (2007), каждая из которых включена в настоящую заявку посредством ссылки в полном объеме). Последние мутанты также демонстрировали повышенную активность в анализе образования тромбина, хотя условия реакции в этих исследованиях включали субфизиологическую (<0,5 нМ) концентрацию фактора VIII.
Результаты, представленные в Примерах 1-7 с применением физиологических значений уровня концентраций фактора VIII (1 нМ), показали небольшие различия между диким типом и вариантами, характеризующимися более высокой стабильностью, хотя вариант Glu272Ala демонстрировал сниженные значения параметров образования тромбина, что согласуется с его низкой специфичной активностью. Отсутствие наблюдаемых значимых различий для вариантов с более высокой стабильностью может быть обусловлено различиями в условиях реакции и/или тем, что такие мутации не обеспечивают ковалентного присоединения домена A2 и скорости потери активности фактора VIIIa в недостаточной степени снижены.
Результаты, представленные в Примерах 1-7, демонстрируют, что снижение в несколько раз скоростей инактивации кофактора может быть достигнуто в результате одиночной точечной мутации, приводящей к замене кислых остатков на гидрофобные. В каждом из этих случаев такие мутации находятся в областях контакта, при этом измененные остатки по всей вероятности погружены внутрь, и не обращены к поверхности, и не оказывают влияние на ковалентные взаимодействия в пределах белка. На основании предварительных результатов, кофакторные формы вариантов Glu1984Val и Glu1984Ala и кофактор дикого типа характеризуются схожими скоростями инактивации согласно анализу катализируемого активированным протеином С расщепления по Arg336 и Arg562 (см. работу Varfaj et al., “Residues Surrounding Arg336 and Arg562 Contribute to the Disparate Rates of Proteolysis of Factor VIIIa Catalyzed by Activated Protein C,” J. Biol. Chem. 282(28):20264-72 (2007), включенную в настоящую заявку посредством ссылки в полном объеме). Это подтверждает предположение, что подавление активности таких вариантов с повышенной стабильностью также проходит через путь, опосредованный протеином C, аналогично кофактору дикого типа. Таким образом, стабилизированные варианты настоящего изобретения лишены проблем, связанных с устойчивыми к инактивации мутантами, описанными выше.
Пример 8: Оценка стабильности вариантов фактора VIII с двумя и тремя заменами
Для определения того, приводят ли аддитивные или синергичные эффекты к дополнительному увеличению стабильности фактора VIII (VIIIa), были получены мутанты с комбинациями точковых мутаций, описанных в предшествующих Примерах, с помощью способов, описанных в разделе «Материалы и методы». В частности, были получены двойные и тройные комбинированные мутанты, содержащие замены на Ala или Val по остаткам Asp519, Glu665, и Glu1984. Такие комбинированные мутанты включают (аминокислоты обозначены с помощью однобуквенного кода): D519AE665A, D519AE665V, D519AE1984A, D519AE1984V, D519VE665V, D519VE1984A, D519VE1984V, E665AE1984A, E665AE1984V, E665VE1984A, E665VE1984V, D519AE665VE1984A, D519VE665VE1984A, D519VE665VE1984V. Фактор VIII D519VE665A был исключен из анализа, поскольку данный мутант демонстрировал атипичные характеристики в твердофазном ИФА и Вестерн-блот анализе.
Для получения тройных мутантов мутацию D519A или D519V комбинировали либо с E665VE1984A, либо с E665VE1984V. Другие комбинации были исключены, поскольку двойные мутанты E665AE1984A и E665AE1984V не демонстрировали увеличение стабильности ни фактора VIII, ни фактора VIIIa, в сравнении с каждой из одиночных мутаций. Результаты для D519AE665VE1984V были исключены из анализа по той же причине, что и для D519VE665A.
Первая группа новых мутантов (Группа A) с комбинацией мутации (Ala или Val) по Asp519 и мутации либо по Glu665, либо по Glu1984, сохраняли нормальные значения специфичной активности (>80% активности дикого типа («дикий тип»), Фигура 8). Интересно отметить, что D519AE665A, D519VE665V, D519VE1984A и D519VE1984V демонстрировали значительное увеличение специфичной активности до ~1,8 раз по сравнению с фактором VIII дикого типа, согласно одноступенчатому анализу коагулирующей активности (Фигура 8). Специфичная активность у второй группы мутантов (Группа B) с комбинацией мутаций по Glu665 и Glu1984 неожиданно демонстрировала снижение специфичной активности до ~2 раз, по сравнению с фактором VIII дикого типа, за исключением E665VE1984A, активность которого была несколько выше, чем у дикого типа (Фигура 8). Третья группа (Группа C), представляющая собой тройных мутантов, демонстрировала нормальную или слегка увеличенную активность в одноступенчатом анализе (D519VE665VE1984V). Однако активность D519VE665VE1984V в двухступенчатом анализе была значительно снижена. Поскольку Asp519 расположены в области контакта A1 и A2, а Glu665 и Glu1984 расположены в области контакта A2 и A3, предполагается, что тенденция к увеличению специфичной активности у мутантов Группы A по сравнению с Группой B может быть обусловлена более эффективными взаимодействиями на границе A1-A2, влияющими на конформацию и сохраняющими активность кофакторной формы.
На Фигуре 9 сведены результаты экспериментов по оценке термостабильности фактора VIII при 55°C. Значения скорости, полученные для комбинированных мутаций, сравнивали со значениями скоростей для одиночного мутанта, характеризующегося наибольшими показателями, из конкретной комбинации с использованием данных для одиночных мутантов, полученных в Примере 5 (Фигура 5A). На Фигуре 9 также представлены фактические значения скорости потери активности фактора VIII (см. также Таблицу 4). Степень снижения относительных скоростей потери активности оказалась связанной с увеличением, наблюдаемым для комбинированных мутаций. В Группе A, мутанты D519AE665A, D519AD665V и D519VE665V демонстрировали значительное увеличение стабильности (снижение скорости потери активности) и большинство мутантов также сохраняли абсолютную скорость потери активности, соответствующую ~ 50% от значения для дикого типа. С другой стороны, относительные скорости для двух мутантов из Группы B (E665AE1984A и E665AE1984V) были несколько выше по сравнению с одиночным мутантом с наилучшими показателем. В Группе C мутанты D519AE665VE1984A и D519VE665VE1984A не демонстрировали значительного изменения скорости, тогда как значения скорости для D519VE665VE1984V были несколько увеличены.
Интересно отметить, что увеличение стабильности, наблюдаемое для комбинированных мутантов, было более выражено для форм фактора VIIIa (Фигура 10). Для увеличения чувствительности анализа потери активности фактора VIIIa для высокостабильных мутантов использовали более низкие концентрации фактора VIIIa (1,5 нМ) при инкубации по сравнению с концентрациями в предшествующих Примерах. Значительное увеличение стабильности до ~4 раз по сравнению с одиночными мутациями, наблюдали для всех мутантов Группы. Фактические значения скорости потери активности фактора VIIIa у D519VE665V и D519VE1984A составляли 14 и 12% от значений у фактора VIII дикого типа, соответственно (Фигура 10 и Таблица 4). Мутанты Группы B в целом характеризовались более низкими результатами по сравнению с одиночными мутантами с лучшими показателями из соответствующих пар, при этом E665AE1984A и E665AE1984V демонстрировали ~2,2-кратное и ~2,7-кратное увеличение значений скорости потери активности, соответственно. Тройные мутанты (Группа C) демонстрировали наиболее значительное увеличение стабильности фактора VIIIa, при этом максимальную стабильностью наблюдали для D519VE665VE1984A, который демонстрировал скорость потери активности, составляющую ~10% от дикого типа (Фигура 10 и Таблица 4).
Для выбранных мутантов проводили анализ образования тромбина; результаты представлены на Фигурах 11A-B. При анализе одиночных мутантов с использованием конечной концентрации 1 нМ фактора VIII значительного улучшения показателей образования тромбина не было выявлено (см. Материалы и Методы и Пример 4, выше). Для лучшего сравнения наиболее стабильных мутантных форм фактора VIII использовали более низкую концентрацию фактора VIII (0,2 нМ). Результаты такого анализа показали, что D519VE665V характеризовался ~20% снижением лаг-периода и времени пика, а также ~2,3-кратным увеличением высоты пика и ~1,5-кратным увеличением эндогенного потенциала тромбина (ЭПТ) по сравнению с фактором VIII дикого типа (Фигуры 11A-B). Несмотря на то, что значения лаг-периода и времени пика для D519AE665V, D519VE1984A и D519VE665VE1984A значительно не отличались от таковых для дикого типа, значения высоты пика и ЭПТ значительно превышали значения для дикого типа (от ~20% до 70%). В целом, полученные результаты свидетельствуют о том, что все четыре выбранных комбинированных мутанта, характеризующееся повышенной стабильностью фактора, демонстрировали улучшенные показатели образования тромбина. Такие наблюдения указывают на то, что данные мутанты имеют большую способность к увеличению образования тромбина на единицу концентрации фактора VIII при физиологических условиях.
Пример 9: Мутанты с заменами Ala или Val по Asp519, Glu665 и Glu1984 в комбинации с мутацией Glu113Ala (E113A), обуславливающей высокую специфичную активность
Известно, что мутация E113A усиливает специфичную активность фактора VIII согласно одноступенчатому анализу коагулирующей активности (см. публикацию заявки на патент США № 10/581471, авторы Fay и др.; Wakabayashi et al., “A Glu113Ala Mutation within a Factor VIII Ca(2+)-Binding Site Enhances Cofactor Interactions in Factor Xase,” Biochemistry44:10298-10304 (2005), каждая из которых включена в настоящую заявку посредством ссылки в полном объеме). Поскольку фактор VIII, обладающий как высокой стабильностью, так и высокой специфичной активностью, представляет собой уникальный класс веществ для возможного терапевтического применения при лечении гемофилии, был проанализирован эффект комбинирования мутации E113A с высокостабильными мутантами, описанными в предшествующих Примерах.
Были получены мутанты с Ala или Val заменами по остаткам Asp519, Glu665 и Glu1984 в комбинации с мутацией E113A с помощью методик, описанных в разделе Материалы и методы. Такие двойные мутанты включают: E113AD519A, E113AD519V, E113AE665A, E113AE665V и E113AE1984V (для обозначения аминокислот использован однобуквенный код).
Значения специфичной активности, определенные с помощью одноступенчатого анализа, для комбинированных мутантов были в ~2- ~3,3 раза выше, чем для фактора VIII дикого типа, при этом сохранялся нормальный уровень активности в двухступенчатом анализе. Полученные результаты указывают на то, что мутации по Asp519, Glu665 или Glu1984 не оказывают негативного эффекта на усиление активности, наблюдаемое для мутации E113A (Фигура 12A). Кроме того, скорости потери активности фактора VIII и VIIIa у мутантов с E113A в комбинации с мутациями, обуславливающих высокую стабильность, значительно не отличались от соответствующих значений для каждого исходного одиночного мутанта с высокой стабильностью (см. Фигуры 5B-C; Таблица 5), что позволяет предположить, что мутация E113A не оказывает влияние на увеличение параметров стабильности для этих мутантов.
Из изложенных выше результатов следует, что мутация E113A может быть объединена с любой из описанных в настоящей заявке мутаций, обуславливающих повышение стабильности, с целью получения рекомбинантного фактора VIII, характеризующегося как повышенной специфичной активностью, так и увеличением стабильности фактора VIII/фактора VIIIa. Такой фактор включает комбинацию мутации E113A (или других подходящих замен по положению E113, как описано в публикации заявки на патент США № 10/581471, авторы Fay и др., включенной в настоящую заявку посредством ссылки в полном объеме) с одиночными или множественными мутациями, обуславливающими повышенную стабильность, описанными в настоящей заявке.
Несмотря на то, что в данном описании представлены и детально рассмотрены предпочтительные варианты реализации изобретения, специалистам в данной области техники очевидно, что возможны различные модификации, добавления, замены и т.п., не выходящие за пределы сущности изобретения, которые также входят в объем изобретения, определенного следующей формулой.
Реферат
Изобретение относится к области биохимии, в частности к рекомбинантному фактору VIII, содержащему одну или более мутаций, приводящих к увеличению стабильности как фактора VIII, так и фактора VIIIa, а также к фармацевтической композиции для лечения гемофилии ее содержащей. Также раскрыта молекула нуклеиновой кислоты, кодирующая вышеуказанный рекомбинантный фактор VIII, а также вектор экспрессии и клетки-хозяева, содержащие указанную молекулу нуклеиновой кислоты. Изобретение также относится к способу получения указанного фактора VIII, а также его применению в способе лечения гемофилии А у животного. Изобретение позволяет получить биологически активный фактор VIII с повышенной стабильностью. 8 н. и 42 з.п. ф-лы, 12 ил., 5 табл., 9 пр.
Формула
(i) замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO: 2, и замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2;
(ii) замену Asp→Ala в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO: 2, и замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2;
(iii) замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO: 2, и замену Glu→Ala в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO: 2;
(iv) замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2, и замену Glu→Ala в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO: 2;
(v) замену Glu→Ala в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2, и замену Glu→Val в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO: 2;
(vi) замену Asp→Ala в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO: 2, замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2, и замену Glu→Ala в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO: 2;
(vii) замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO: 2, замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2, и замену Glu→Ala в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO: 2;
(viii) замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO: 2, замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2, и замену Glu→Val в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO: 2.
(i) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO: 2, и замену Asp→Ala в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO: 2;
(ii) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO: 2, и замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO: 2;
(iii) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO: 2, и замену Glu→Ala в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2; или
(iv) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO: 2, и замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2;
(v) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO: 2, и замену Glu→Val в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO: 2.
(i) замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO:2, и замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO:2;
(ii) замену Asp→Ala в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO:2, и замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO:2;
(iii) замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO:2, и замену Glu→Ala в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO:2;
(iv) замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO:2, и замену Glu→Ala в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO:2;
(v) замену Glu→Ala в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2, и замену Glu→Val в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO: 2;
(vi) замену Asp→Ala в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO:2, замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2, и замену Glu→Ala в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO:2;
(vii) замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO:2, замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2, и замену Glu→Ala в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO:2;
(vii) замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO:2, замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2, и замену Glu→Val в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO:2.
(i) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO:2, и замену Asp→Ala в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO: 2;
(ii) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO:2, и замену Asp→Val в положении, соответствующем аминокислоте 519 последовательности SEQ ID NO:2;
(iii) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO:2, и замену Glu→Ala в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO:2; и
(iv) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO: 2, и замену Glu→Val в положении, соответствующем аминокислоте 665 последовательности SEQ ID NO: 2; или
(v) замену Glu→Ala в положении, соответствующем аминокислоте 113 последовательности SEQ ID NO:2, и замену Glu→Val в положении, соответствующем аминокислоте 1984 последовательности SEQ ID NO:2.
выращивание клетки-хозяина по п.35 или 36 в условиях, при которых клетка-хозяин экспрессирует рекомбинантный фактор VIII; и
выделение рекомбинантного фактора VIII.
разрушение клетки-хозяина перед указанным выделением, при этом указанное выделение включает выделение рекомбинантного фактора VIII из продуктов распада клеток.
введение животному, страдающему гемофилией A, эффективного количества рекомбинантного фактора VIII по п.1, при этом у животного наблюдается эффективное свертывание крови после повреждения сосуда.

Комментарии