Биспецифический белок - RU2784486C1
Код документа: RU2784486C1
Чертежи



Описание
Настоящая заявка испрашивает приоритет на основании патентной заявки №201811573634.0, поданной 21 декабря 2018 г., и патентной заявки №201811606887.3, поданной 27 декабря 2018 г.; обе включены в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антителам к человеческому GCGR (рецептор глюкагона), пептидам GLP-1 (глюкагоноподобный пептид-1) и их мутантам, а также к биспецифическим белкам, образованным антителом к GCGR, слитым с пептидом GLP-1, и к способам их получения и их применениям.
УРОВЕНЬ ТЕХНИКИ
Описания в настоящем документе предоставляют только базовую информацию о настоящем изобретении и не обязательно составляют уровень техники.
Диабет (сахарный диабет, СД) - это метаболическое заболевание, характеризующееся высоким уровнем глюкозы в крови из-за нарушения секреции инсулина и/или нарушения функции инсулина. Возникновение заболевания в основном вызвано совместным действием инсулина и глюкагона.
GLP-1 является одним из наиболее важных гормонов, влияющих на секрецию инсулина, и как GLP-1, так и глюкагон синтезируются из препроинсулина. Препроинсулин состоит из около 158 аминокислот и может расщепляться на различные пептидные цепи в разных положениях. Биологически активный GLP-1 в организме человека в основном включает две формы: GLP-1 (7-36) амид и GLP-1 (7-37). GLP-1 секретируется L-клетками тонкого кишечника и снижает уровень глюкозы в крови в организме, способствуя секреции инсулина главным образом зависимым от концентрации глюкозы образом, защищая β-клетки островков поджелудочной железы и ингибируя секрецию глюкагона. В то же время GLP-1 также влияет на подавление опорожнения желудка и снижение аппетита. Он находит клиническое применение при лечении диабета II типа и ожирения. Природный активный GLP-1 легко расщепляется ферментом DPPIV в организме из-за очень короткого периода полувыведения (менее 2 минут) и не имеет клинического применения.
Основным направлением исследований и разработок препаратов GLP-1 всегда было увеличение периода полувыведения. В настоящее время на рынке доступно множество агонистов GLP-1, таких как дулаглутид и семаглутид. Хотя эффективность GLP-1 полностью подтверждена, он имеет множество побочных действий, в основном проявляющихся в виде желудочно-кишечных симптомов, гипогликемии, панкреатита и поражения почек.
Действие глюкагона противоположно инсулину и в основном играет роль в повышении уровня глюкозы в крови в организме. Глюкагон представляет собой пептид из 29 аминокислот, секретируемый α-клетками островков поджелудочной железы. Глюкагон в основном ускоряет гликогенолиз, липолиз и глюконеогенез, активируя нисходящий путь цАМФ/РКА (Циклический аденозинмонофосфат/Протеинкиназа А) и тем самым повышая уровень глюкозы в крови после связывания с рецептором GCGR на мембране клеток печени.
Исследования показали, что мыши с нокаутом GCGR демонстрировали ряд фенотипов, таких как повышенный уровень GLP-1, снижение выработки гликогена, повышение липидного обмена и снижение аппетита. GCGR является одной из наиболее популярных мишеней для лечения диабета, но в настоящее время прогресс в разработке антагонистических препаратов против GCGR замедлился. REMD-477, доступный от REMD Biotherapeutics, в настоящее время является самым передовым препаратом моноклональных антител к GCGR и проходит II фазу клинического исследования.
Антитела к GCGR были раскрыты в источниках уровня техники, например, CN 101589062 A, CN 101983208 A, CN 102482350 A, CN 103314011 А, CN 105189560 A, CN 107614695 A, US 20180273629 A1 и WO 2013059531 A1. Однако остается потребность в разработке новых и высокоэффективных антител к GCGR и способов лечения диабета.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к моноклональному антителу к GCGR или его антигенсвязывающему фрагменту. Антитело или его антигенсвязывающий фрагмент обладает способностью связываться с человеческим GCGR (или содержащемся в нем антигенным эпитопом).
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит комбинацию вариабельной области тяжелой цепи и вариабельной области легкой цепи, выбранную из следующих а) или Ь):
a) вариабельная область тяжелой цепи, содержащая области HCDR1 (определяющая комплементарность область 1 тяжелой цепи), HCDR2 и HCDR3, представленные в SEQ ID NO: 48, 49 и 50, соответственно, и вариабельная область легкой цепи, содержащая области LCDR1 (определяющая комплементарность область 1 легкой цепи), LCDR2 и LCDR3, представленные в SEQ ID NO: 51, 52 и 53, соответственно; или
b) вариабельная область тяжелой цепи, содержащая области HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 38, 39 и 54, соответственно, и вариабельная область легкой цепи, содержащая области LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 55, 56 и 57, соответственно.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит комбинацию вариабельной области тяжелой цепи и вариабельной области легкой цепи, выбранную из любой следующих i)-vi):
i) вариабельная область тяжелой цепи, содержащая области HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, 15 и 16, соответственно, и вариабельная область легкой цепи, содержащая области LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 17, 18 и 19, соответственно;
ii) вариабельная область тяжелой цепи, содержащая области HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, 21 и 22, соответственно, и вариабельная область легкой цепи, содержащая области LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 23, 24 и 25, соответственно;
iii) вариабельная область тяжелой цепи, содержащая области HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, 27 и 28, соответственно, и вариабельная область легкой цепи, содержащая области LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, 30 и 31, соответственно;
iv) вариабельная область тяжелой цепи, содержащая области HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 32, 33 и 34, соответственно, и вариабельная область легкой цепи, содержащая области LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 35, 36 и 37, соответственно;
v) вариабельная область тяжелой цепи, содержащая области HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 38, 39 и 40, соответственно, и вариабельная область легкой цепи, содержащая области LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 41, 42 и 43, соответственно; или
vi) вариабельная область тяжелой цепи, содержащая области HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 38, 39 и 44, соответственно, и вариабельная область легкой цепи, содержащая области LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 45, 46 и 47, соответственно.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент представляет собой мышиное антитело, химерное антитело или гуманизированное антитело, или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления моноклонального антитела к GCGR или его антигенсвязывающего фрагмента гуманизированное антитело содержит каркасную область (области), полученную из человеческого антитела, или вариант этой каркасной области, и вариант каркасной области имеет не более 10 обратных мутаций относительно каркасной области легкой цепи человеческого антитела и/или вариант каркасной области имеет не более 10, не более 9, не более 8, не более 7, не более 6, не более 5, не более 4, не более 3, не более 2, не более 1 обратной мутации относительно каркасной области тяжелой цепи человеческого антитела.
В некоторых вариантах осуществления вариант каркасной области содержит:
aa) одну или более обратных аминокислотных мутаций из 42G, 44V, 71Y и 87F, содержащихся в вариабельной области легкой цепи, и/или одну или более обратных аминокислотных мутаций из 38K, 481, 67A, 69F, 71А, 73Р, 78А и 93, содержащихся в вариабельной области тяжелой цепи; или
ab) одну или более обратных аминокислотных мутаций из 38L, 44V, 59S, 70Е и 71Y, содержащихся в вариабельной области легкой цепи, и/или одну или более обратных аминокислотных мутаций из 38K, 481, 66K, 67А, 69L, 73R, 78М и 94S, содержащихся в вариабельной области тяжелой цепи. Далее положение сайта обратной мутации определено в соответствии с критериями нумерации Kabat.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, представленную в любой из SEQ ID NO: 2, 61, 62, 63 и 64, или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с любой из SEQ ID NO: 2, 61, 62, 63 и 64; и/или
вариабельную область легкой цепи, представленную в любой из SEQ ID NO: 3, 58, 59 и 60, или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с любой из SEQ ID NO: 3, 58, 59 и 60.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO: 63, и вариабельную область легкой цепи, представленную в SEQ ID NO: 58.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO: 4 или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 4; и/или
вариабельную область легкой цепи, представленную в SEQ ID NO: 5 или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 5.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO: 6 или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 6; и/или
вариабельную область легкой цепи, представленную в SEQ ID NO: 7 или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 7.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, представленную в любой из SEQ ID NO: 8, 68, 69, 70 и 71, или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с любой из SEQ ID NO: 8, 68, 69, 70 и 71; и/или
вариабельную область легкой цепи, представленную в любой из SEQ ID NO: 9, 65, 66 и 67, или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с любой из SEQ ID NO: 9, 65, 66 и 67.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO: 71, и вариабельную область легкой цепи, представленную в SEQ ID NO: 67.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO: 10 или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 10; и/или
вариабельную область легкой цепи, представленную в SEQ ID NO: 11 или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 11.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO: 12 или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 12; и/или
вариабельную область легкой цепи, представленную в SEQ ID NO: 13 или обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 13.
В некоторых вариантах осуществления моноклонального антитела к GCGR или его антигенсвязывающего фрагмента антитело представляет собой полноразмерное антитело, дополнительно содержащее константную область (области) антитела, в частности, константная область тяжелой цепи константных областей антитела выбрана из константных областей человеческого IgG1, IgG2, IgG3 и IgG4 и их традиционных вариантов, а константная область легкой цепи константных областей антитела выбрана из константных областей κ- и λ-цепи человеческого антитела и их традиционных вариантов, и более предпочтительно содержащее константную область тяжелой цепи человеческого антитела, представленную в SEQ ID NO: 72, и человеческую константную область легкой цепи, представленную в SEQ ID NO: 73.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь и легкую цепь, где:
тяжелая цепь является такой, как представлено в SEQ ID NO: 74, 76 или 78 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней, и легкая цепь является такой, как представлено в SEQ ID NO: 75 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь и легкую цепь, где:
тяжелая цепь является такой, как представлено в SEQ ID NO: 74, 76 или 78 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней, и легкая цепь является такой, как представлено в SEQ ID NO: 77 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь и легкую цепь, где:
тяжелая цепь является такой, как представлено в SEQ ID NO: 74, 76 или 78 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней, и легкая цепь является такой, как представлено в SEQ ID NO: 79 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь и легкую цепь, где:
тяжелая цепь является такой, как представлено в SEQ ID NO: 80 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней, и легкая цепь является такой, как представлено в SEQ ID NO: 81 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь и легкую цепь, где:
тяжелая цепь является такой, как представлено в SEQ ID NO: 82 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней, и легкая цепь является такой, как представлено в SEQ ID NO: 83 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь и легкую цепь, где:
тяжелая цепь является такой, как представлено в SEQ ID NO: 84 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней, и легкая цепь является такой, как представлено в SEQ ID NO: 85 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь и легкую цепь, где:
тяжелая цепь является такой, как представлено в SEQ ID NO: 86 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней, и легкая цепь является такой, как представлено в SEQ ID NO: 87 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь и легкую цепь, где:
тяжелая цепь является такой, как представлено в SEQ ID NO: 88 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней, и легкая цепь является такой, как представлено в SEQ ID NO: 89 или обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с ней.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь, представленную в SEQ ID NO: 78, и легкую цепь, представленную в SEQ ID NO: 79.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит тяжелую цепь, представленную в SEQ ID NO: 84, и легкую цепь, представленную в SEQ ID NO: 85.
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент содержит комбинацию вариабельной области тяжелой цепи и вариабельной области легкой цепи, выбранную из любой следующих ac)-ah):
ac) вариабельной области тяжелой цепи, содержащая те же области HCDR1, HCDR2 и HCDR3, что и вариабельная область тяжелой цепи, представленная в SEQ ID NO: 2, и вариабельная область легкой цепи, содержащая те же области LCDR1, LCDR2 и LCDR3, что и вариабельная область легкой цепи, представленная в SEQ ID NO: 3;
ad) вариабельной области тяжелой цепи, содержащая те же области HCDR1, HCDR2 и HCDR3, что и вариабельная область тяжелой цепи, представленная в SEQ ID NO: 4, и вариабельная область легкой цепи, содержащая те же области LCDR1, LCDR2 и LCDR3, что и вариабельная область легкой цепи, представленная в SEQ ID NO: 5;
ae) вариабельной области тяжелой цепи, содержащая те же области HCDR1, HCDR2 и HCDR3, что и вариабельная область тяжелой цепи, представленная в SEQ ID NO: 6, и вариабельная область легкой цепи, содержащая те же области LCDR1, LCDR2 и LCDR3, что и вариабельная область легкой цепи, представленная в SEQ ID NO: 7;
af) вариабельной области тяжелой цепи, содержащая те же области HCDR1, HCDR2 и HCDR3, что и вариабельная область тяжелой цепи, представленная в SEQ ID NO: 8, и вариабельная область легкой цепи, содержащая те же области LCDR1, LCDR2 и LCDR3, что и вариабельная область легкой цепи, представленная в SEQ ID NO: 9;
ag) вариабельной области тяжелой цепи, содержащая те же области HCDR1, HCDR2 и HCDR3, что и вариабельная область тяжелой цепи, представленная в SEQ ID NO: 10, и вариабельная область легкой цепи, содержащая те же области LCDR1, LCDR2 и LCDR3, что и вариабельная область легкой цепи, представленная в SEQ ID NO: 11; или
ah) вариабельной области тяжелой цепи, содержащая те же области HCDR1, HCDR2 и HCDR3, что и вариабельная область тяжелой цепи, представленная в SEQ ID NO: 12, и вариабельная область легкой цепи, содержащая те же области LCDR1, LCDR2 и LCDR3, что и вариабельная область легкой цепи, представленная в SEQ ID NO: 13.
В некоторых вариантах осуществления моноклонального антитела к GCGR или его антигенсвязывающего фрагмента антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, Fab', F(ab')2, одноцепочечного антитела, димеризованной V-области (диатела) и стабилизированной дисульфидными связями V-области (dsFv).
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент характеризуется тем, что оно конкурирует с моноклональным антителом или его антигенсвязывающим фрагментом, упомянутыми выше, за связывание с человеческим GCGR (или его эпитопом).
В некоторых вариантах осуществления моноклональное антитело к GCGR или его антигенсвязывающий фрагмент обладает по меньшей мере одним из следующих признаков:
i. Антагонистическая активность блокирования связывания человеческого GCGR с человеческим глюкагоном со значением IC50 (концентрация, необходимая для ингибирования 50% максимальной активности) менее 500 нМ, менее 450 нМ, менее 400 нМ, менее 350 нМ или менее 300 нМ (предпочтительно менее 300 нМ);
ii. Антагонистическая активность блокирования связывания GCGR яванского макака или макака-резуса с глюкагоном яванского макака или макака-резуса;
iii. Ингибирование повышения концентрации глюкозы в крови человека; и
iv. Антагонистическая активность блокирования связывания мышиного GCGR с мышиным глюкагоном.
В некоторых вариантах осуществления моноклонального антитела к GCGR или его антигенсвязывающего фрагмента моноклональное антитело или его антигенсвязывающий фрагмент связывается с тем же антигенным эпитопом, что и моноклональное антитело или его антигенсвязывающий фрагмент, упомянутые выше.
В еще одном аспекте настоящее изобретение относится к биспецифическому белку. В некоторых вариантах осуществления биспецифический белок, предложенный в настоящем документе, содержит пептид GLP-1 и антитело к GCGR, и пептид GLP-1 ковалентно связан с полипептидной цепью антитела к GCGR посредством пептидной связи или линкера.
В некоторых вариантах осуществления биспецифического белка карбоксильный конец пептида GLP-1 связан с аминоконцом вариабельной области тяжелой цепи антитела к GCGR посредством пептидной связи или линкера, или карбоксильный конец пептида GLP-1 связан с аминоконцом вариабельной области легкой цепи антитела к GCGR посредством пептидной связи или линкера.
В некоторых вариантах осуществления биспецифического белка карбоксильный конец пептида GLP-1 связан с аминоконцом вариабельной области тяжелой цепи антитела к GCGR посредством пептидной связи или линкера.
В некоторых вариантах осуществления биспецифического белка карбоксильный конец пептида GLP-1 связан с аминоконцом вариабельной области легкой цепи антитела к GCGR посредством пептидной связи или линкера.
В некоторых вариантах осуществления биспецифического белка карбоксильный конец пептида GLP-1 связан с аминоконцом тяжелой цепи полноразмерного антитела к GCGR посредством пептидной связи или линкера.
В некоторых вариантах осуществления биспецифического белка карбоксильный конец пептида GLP-1 связан с аминоконцом легкой цепи полно размер но го антитела к GCGR посредством пептидной связи или линкера.
В некоторых вариантах осуществления биспецифического белка антитело к GCGR выбрано из моноклональных антител к GCGR или их антигенсвязывающих фрагментов, упомянутых выше.
В некоторых вариантах осуществления биспецифического белка пептид GLP-1 представляет собой GLP-1A, представленный в SEQ ID NO: 91, или пептид GLP-1 представляет собой вариант пептида GLP-1A, имеющий одну или более аминокислотных замен из Q17E, I23V, K28R и G30R относительно GLP-1A.
В некоторых вариантах осуществления биспецифического белка пептид GLP-1 представляет собой GLP-1A, представленный в SEQ ID NO: 91, или пептид GLP-1 представляет собой вариант пептида GLP-1A, имеющий Q17E относительно GLP-1A.
В некоторых вариантах осуществления биспецифического белка пептид GLP-1 представляет собой GLP-1A, представленный в SEQ ID NO: 91, или пептид GLP-1 представляет собой вариант пептида GLP-1A, имеющий Q17E и одну или более аминокислотных замен из 123V, K28R и G30R относительно GLP-1A.
В некоторых вариантах осуществления биспецифического белка пептид GLP-1 представляет собой GLP-1A, представленный в SEQ ID NO: 91, или пептид GLP-1 представляет собой вариант пептида GLP-1A, имеющий Q17E или обе из Q17E и I23V относительно GLP-1A.
В некоторых вариантах осуществления биспецифического белка вариант пептида GLP-1A содержит последовательность, представленную в SEQ ID NO: 92, 93, 94, 95, 96, 97, 98 или 99, или состоит из нее.
В некоторых вариантах осуществления биспецифического белка антитело к GCGR выбрано из любого из моноклональных антител к GCGR или их антигенсвязывающих фрагментов, упомянутых выше, и пептид GLP-1A или вариант пептида GLP-1A представляет собой любой из описанных выше.
В некоторых вариантах осуществления биспецифический белок содержит первую полипептидную цепь и вторую полипептидную цепь, где первая полипептидная цепь представляет собой полипептид, выбранный из группы, состоящей из SEQ ID NO: 100, 101, 102, 103, 104, 105, 106, 107 и 108, а вторая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 79.
В некоторых вариантах осуществления биспецифический белок содержит первую полипептидную цепь, содержащую тяжелую цепь антитела к GCGR, и вторую полипептидную цепь, содержащую легкую цепь антитела к GCGR, где: первая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 109, а вторая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 81;
В некоторых вариантах осуществления биспецифический белок содержит первую полипептидную цепь, содержащую тяжелую цепь антитела к GCGR, и вторую полипептидную цепь, содержащую легкую цепь антитела к GCGR, где: первая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 110, а вторая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 83;
В некоторых вариантах осуществления биспецифический белок содержит первую полипептидную цепь, содержащую тяжелую цепь антитела к GCGR, и вторую полипептидную цепь, содержащую легкую цепь антитела к GCGR, где: первая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 111, а вторая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 85;
В некоторых вариантах осуществления биспецифический белок содержит первую полипептидную цепь, содержащую тяжелую цепь антитела к GCGR, и вторую полипептидную цепь, содержащую легкую цепь антитела к GCGR, где: первая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 112, а вторая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 87; или
В некоторых вариантах осуществления биспецифический белок содержит первую полипептидную цепь, содержащую тяжелую цепь антитела к GCGR, и вторую полипептидную цепь, содержащую легкую цепь антитела к GCGR, где: первая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 113, и вторая полипептидная цепь представляет собой полипептид, представленный в SEQ ID NO: 89.
В еще одном аспекте настоящее изобретение также относится к варианту пептида GLP-1. В некоторых вариантах осуществления вариант пептида GLP-1 представляет собой мутант, имеющий одну или более аминокислотных мутаций из Q17E, 123V, K28R и G30R относительно GLP-1A, представленного в SEQ ID NO: 91.
В некоторых вариантах осуществления пептид GLP-1 представляет собой GLP-1A, представленный в SEQ ID NO: 91, или пептид GLP-1 представляет собой вариант пептида GLP-1A, имеющий Q17E или обе из Q17E и I23V относительно GLP-1A.
В некоторых вариантах осуществления вариант пептида GLP-1 имеет последовательность, представленную в SEQ ID NO: 92, 93, 94, 95, 96, 97, 98 или 99.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество моноклонального антитела к GCGR или его антигенсвязывающего фрагмента, как описано выше, или биспецифического белка, как описано выше, или варианта пептида GLP-1, как описано выше, и один или более фармацевтически приемлемых носителей, разбавителей, буферов или эксципиентов.
Настоящее изобретение также относится к выделенной молекуле нуклеиновой кислоты, кодирующей моноклональное антитело к GCGR или его антигенсвязывающий фрагмент, как описано выше, или биспецифическому белку, как описано выше, или варианту пептида GLP-1, как описано выше.
Настоящее изобретение относится к рекомбинантному вектору, содержащему выделенную молекулу нуклеиновой кислоты, как описано выше.
Настоящее изобретение относится к клетке-хозяину, трансформированной рекомбинантным вектором, как описано выше, где указанная клетка-хозяин выбрана из прокариотических клеток и эукариотических клеток, предпочтительно эукариотических клеток, более предпочтительно клеток млекопитающих или клеток насекомых.
Настоящее изобретение относится к способу получения моноклонального антитела к GCGR или его антигенсвязывающего фрагмента, как описано выше, или биспецифического белка, как описано выше, или варианта пептида GLP-1, как описано выше, включающему культивирование клетки-хозяина, как описано выше, в культуральной среде для получения и накопления моноклонального антитела к GCGR или его антигенсвязывающего фрагмента, как описано выше, или биспецифического белка, как описано выше, или варианта пептида GLP-1, как описано выше, и выделение моноклонального антитела или его антигенсвязывающего фрагмента, или биспецифического белка, или варианта пептида GLP-1 из культуры.
Настоящее изобретение относится к способу обнаружения или измерения человеческого GCGR in vitro, включающему применение моноклонального антитела или его антигенсвязывающего фрагмента, как описано выше.
Набор для обнаружения человеческого GCGR содержит моноклональное антитело или его антигенсвязывающий фрагмент, как описано выше.
Согласно некоторым вариантам осуществления изобретение также обеспечивает применение моноклонального антитела к GCGR или его антигенсвязывающего фрагмента, как описано выше, для изготовления медицинских изделий (таких как наборы, чипы, тест-полоски, многолуночные планшеты, магнитные шарики, частицы с покрытием), где медицинское изделие содержит моноклональное антитело или его антигенсвязывающий фрагмент, как описано выше. В качестве примера набор включает многолуночный планшет, покрытый моноклональным антителом к GCGR или его антигенсвязывающим фрагментом, как описано выше.
Настоящее изобретение относится к применению моноклонального антитела или его антигенсвязывающего фрагмента, как описано выше, для получения реагента для обнаружения или измерения человеческого GCGR.
Настоящее изобретение относится к способу снижения концентрации глюкозы в крови у субъекта, включающему введение указанному субъекту терапевтически эффективного количества моноклонального антитела к GCGR или его антигенсвязывающего фрагмента, как описано выше, или биспецифического белка, как описано выше, или варианта пептида GLP-1, как описано выше, или фармацевтической композиции, как описано выше.
Предпочтительно терапевтически эффективное количество составляет от 0,1 до 3000 мг моноклонального антитела к GCGR или его антигенсвязывающего фрагмента, как описано выше, или биспецифического белка, как описано выше, или варианта пептида GLP-1, как описано выше, в разовой дозе композиции.
Настоящее изобретение относится к способу лечения метаболического расстройства, включающему введение субъекту моноклонального антитела к GCGR или его антигенсвязывающего фрагмента, как описано выше, или биспецифического белка, как описано выше, или варианта пептида GLP-1, как описано выше, или фармацевтической композиции, как описано выше; предпочтительно метаболическое расстройство представляет собой метаболический синдром, ожирение, нарушение толерантности к глюкозе, диабет, диабетический кетоацидоз, гипергликемию, гипергликемический гиперосмолярный синдром, периоперационную гипергликемию, гиперинсулинемию, синдром инсулинорезистентности, нарушение гликемии натощак, дислипидемию, атеросклероз или предиабетическое состояние.
Настоящее изобретение также обеспечивает применение моноклонального антитела к GCGR или его антигенсвязывающего фрагмента, как описано выше, или биспецифического белка, как описано выше, или варианта пептида GLP-1, как описано выше, или фармацевтической композиции, как описано выше, для получения лекарственного средства для лечения метаболического нарушения или для снижения концентрации глюкозы в крови у субъекта.
Предпочтительно метаболическое расстройство представляет собой метаболический синдром, ожирение, нарушение толерантности к глюкозе, диабет, диабетический кетоацидоз, гипергликемию, гипергликемический гиперосмолярный синдром, периоперационную гипергликемию, гиперинсулинемию, синдром инсулинорезистентности, нарушение гликемии натощак, дислипидемию, атеросклероз или предиабетическое состояние.
Настоящее изобретение также обеспечивает моноклональное антитело к GCGR или его антигенсвязывающему фрагменту, как описано выше, или биспецифический белок, как описано выше, или вариант пептида GLP-1, как описано выше, или фармацевтическую композицию, как описано выше, для применения в качестве лекарственного средства, предпочтительно для применения в качестве лекарственного средства для лечения метаболического расстройства или для снижения концентрации глюкозы в крови у субъекта.
Более предпочтительно метаболическое расстройство представляет собой метаболический синдром, ожирение, нарушение толерантности к глюкозе, диабет, диабетический кетоацидоз, гипергликемию, гипергликемический гиперосмолярный синдром, периоперационную гипергликемию, гиперинсулинемию, синдром инсулинорезистентности, нарушение гликемии натощак, дислипидемию, атеросклероз или предиабетическое состояние.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1: Схематическая диаграмма структуры биспецифического белка (GLP-1/антитело к GCGR) согласно настоящему изобретению.
Фиг. 2: Антагонистическая активность биспецифического белка и антитела к GCGR против GCGR.
Фиг. 3: Активирующая активность биспецифического белка и дулаглутида в отношении GLP-1R.
Фиг. 4: Влияние долгосрочного введения на случайные концентрации глюкозы в крови у мышей ob/ob, Носитель (пустой вектор) представляет собой контрольную модель, которую инъецировали с натрий-фосфатным буфером (PBS), hu1803-9D-3 мг/кг, hu1803-9-2,84 мг/кг и дулаглутид-1,16 мг/кг относятся к той же молярности вещества.
Фиг. 5: Влияние долгосрочного введения на концентрации глюкозы в крови натощак у мышей ob/ob. Во всех экспериментальных группах могло быть достигнуто значительное снижение концентрации глюкозы в крови натощак у мышей, среди групп hu1803-9D-3 мг/кг и hu1803-9-2,84 мг/кг обладают наиболее сильной способностью снижать концентрацию глюкозы в крови, a hu1803-9D-3 мг/кг демонстрирует лучшую способность снижать уровень глюкозы в крови, чем hul 803-9- 2,84 мг/кг.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Терминология
Трехбуквенные коды и однобуквенные коды для аминокислот, используемые в настоящем описании, соответствуют описанным в J. biol. chem, 243, р3558(1968).
Термин «биспецифический белок» относится к молекуле белка, способной связываться с двумя белками-мишенями или антигенами-мишенями. Биспецифический белок, используемый в настоящем изобретении, конкретно относится к белку, способному связываться с GCGR и GLP-1R (рецептор GLP-1) и образованному пептидом GLP-1, слитым с полипептидной цепью антитела к GCGR (или его антигенсвязывающего фрагмента).
«Пептид GLP-1» относится к пептиду, способному связываться с рецептором GLP-1 и активировать его. Известные из уровня техники пептиды описаны в патентных заявках WO 2008/071972, WO 2008/101017, WO 2009/155258, WO 2010/096052, WO 2010/096142, WO 2011/075393, WO 2008/152403, WO 2010/070251, WO 2010/070252, WO 2010/070253, WO 2010/070255, WO 2011/160630, WO 2011/006497, WO 2011/117415, WO 2011/117416, WO 2006/134340, WO 1997046584, WO 2007124461, WO 2017100107, WO 2007039140, CN 1935261A, CN 1935846A, WO 2006036834, WO 2005058958, WO 2002046227, WO 1999043705, WO 1999043708, WO 1999043341, CN 102949730, CN 104293834, CN 104327187, WO 2015067716, WO 2015049651, WO 2014096145, WO 2014096148, WO 2014096150, WO 2014096149, содержание всех из которых включено в настоящий документ посредством ссылки. Некоторые отдельные пептиды GLP-1, включая GLP-1, аналоги GLP-1 и пептидные агонисты рецептора GLP-1, представляют собой, например, ликсисенатид/AVE0010/ZP10/Lyxumia, эксенатид/эксендин-4/Byetta/Bydureon/ITCA 650/АС-2993, лираглутид/Victoza, семаглутид, таспоглутид), SyncriaAlbiglutide, дулаглутид, rExendin-4, CJC-1134-PC, РВ-1023, ТТР-054, лангленатид/НМ-11260С, СМ-3, GLP-1 Eligen, ORMD-0901, NN-9924, NN-9926, NN-9927, Nodexen, Viador-GLP-1, CVX-096, ZYOG-1, ZYD-1, GSK-2374697, DA-3091, MAR-701, MAR709, ZP-2929, ZP-3022, TT-401, BHM-034, MOD-6030, CAM-2036, DA-15864, ARI-2651, ARI-2255, эксенатид-XTEN и глюкагон-Xten. В дополнение к указанным выше пептидам GLP-1 также включены GLP-1A, представленный в SEQ ID NO: 91, и его мутанты (представленные в SEQ ID NO: 92-99) согласно настоящему изобретению.
GPCR, т.е. рецептор, сопряженный с G-белком, представляет собой тип трансмембранного белка, экспрессируемый на цитоплазматической мембране. GPCR имеет более 800 членов и является крупнейшим семейством мембранных белков в геноме млекопитающих, известным в настоящее время. В организме человека белки GPCR широко распространены в органах и тканях, таких как центральная нервная система, иммунная система, сердце, кровеносные сосуды и сетчатка, и участвуют в развитии и нормальном функционировании организма.
Основная часть белка GPCR состоит из семи сегментов трансцитоплазматической мембранной структуры альфа-спирали. N-конец и три петли расположены вне клетки и участвуют во взаимодействии между белком и его рецептором; С-конец и три петли расположены внутри клетки, из которых С-конец и третья петля играют важную роль в процессе внутриклеточной передачи сигнала, опосредованном взаимодействием между белком GPCR и нижестоящим G-белком.
«GCGR» представляет собой рецептор глюкагона и член семейства GPCR. Глюкагон в основном ускоряет гликогенолиз, липолиз и/или глюконеогенез, активируя нисходящий путь при связывании с GCGR и тем самым повышая уровень глюкозы в крови.
Термин «антитело (Ab)» включает содержащую по меньшей мере одну определяющую комплементарную область антигенсвязывающую молекулу (или комплекс молекул), которая специфически связывается или взаимодействует с (например, распознает и/или связывается с) определенным антигеном (или эпитопом) (например, GCGR).
Термин «антитело» включает молекулы иммуноглобулина, содержащие четыре полипептидных цепи, две тяжелые (Н) цепи и две легкие (L) цепи, соединенные дисульфидной связью(ями), и их мультимеры (например, IgM). Каждая тяжелая цепь включает вариабельную область тяжелой цепи (далее сокращенно обозначаемую HCVR или VH) и константную область тяжелой цепи (СН). Эта константная область тяжелой цепи включает три области (домена): CHI, СН2 и СН3. Каждая легкая цепь включает вариабельную область легкой цепи (далее сокращенно обозначаемую LCVR или VL) и константную область легкой цепи (CL). Области VH и VL могут быть дополнительно подразделены на гипервариабельные области, названные определяющими комплементарность областями (CDR), перемежающиеся более консервативными областями, называемыми каркасными областями (FR, также называемые каркасами). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от аминоконца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
В различных вариантах осуществления настоящего изобретения FR антитела к GCGR (или его антигенсвязывающего фрагмента) могут быть такими же, как FR последовательности зародышевой линии человека, или могут быть модифицированы естественным или искусственным путем. Антитела могут представлять собой различные подклассы антител, например, антитело IgG (например, подкласс IgG1, IgG2, IgG3 или IgG4), IgA1, IgA2, IgD, IgE или IgM.
Термин «антитело» также охватывает антигенсвязывающие фрагменты полноразмерной молекулы антитела.
Термины «антигенсвязывающая часть», «антигенсвязывающий домен», «антигенсвязывающий фрагмент» антитела и т.п. в контексте настоящего документа включают любой встречающийся в природе, полученный ферментативно, синтетически или генетически модифицированный полипептид или гликопротеин, который специфически связывается с антигеном с образованием комплекса. Антигенсвязывающие фрагменты антитела могут быть получены, например, из полной молекулы антитела с использованием любых подходящих стандартных методик, таких как протеолитическое расщепление или метод рекомбинантной генной инженерии, включающий модификацию и экспрессию ДНК, кодирующих вариабельные области и (необязательно) константные области антитела. ДНК известны и/или могут быть легко получены, например, из коммерчески доступных источников, базы данных ДНК (включая, например, базу данных фаговых антител), или могут быть синтезированы. ДНК можно секвенировать и модифицировать химически или с помощью молекулярной биотехнологии, например, располагая одну или более вариабельных и/или константных областей в подходящую конфигурацию, вводя кодоны, генерируя остатки цистеина, модифицируя, добавляя или удаляя аминокислоты и т.д.
Неограничивающие примеры антигенсвязывающих фрагментов включают: (i) Fab-фрагмент; (ii) F(ab') 2-фрагменты; (iii) Fd-фрагменты; (iv) Fv-фрагменты; (v) одноцепочечные молекулы Fv (scFv); и (vi) dAb-фрагменты. Другие генетически модифицированные молекулы, такие как антитела со специфической областью, однодоменные антитела, антитела с удаленной областью, химерные антитела, диатела, триатела, тетратела, минитела, нанотела (например, одновалентные нанотела, двухвалентные нанотела и т.д.), иммунофармацевтического средства на основе модульного белка малого размера (SMIP) и области вариабельного IgNAR акулы также включены в термин «антигенсвязывающий фрагмент» в контексте настоящего документа.
Антигенсвязывающий фрагмент обычно содержит по меньшей мере одну вариабельную область. Вариабельная область может представлять собой область любого размера или аминокислотного состава и обычно содержит одну или более CDR, смежных с каркасными последовательностями или расположенных внутри них.
В некоторых вариантах осуществления антигенсвязывающий фрагмент антитела может иметь любую конфигурацию вариабельной области и константной области, вариабельная область и константная область могут быть связаны друг с другом напрямую или через полный или частичный шарнир или линкерную область. Шарнирная область может состоять из по меньшей мере 2 (например, 5, 10, 15, 20, 40, 60 или более) аминокислот, что позволяет создавать гибкую и полугибкую связь между соседней вариабельной и/или константной областью в составе одной молекулы полипептида.
«Мышиное антитело» в контексте настоящего документа относится к моноклональным антителам мышиного или крысиного происхождения, полученным согласно знаниям и навыкам в данной области техники. Во время получения испытуемым инъецируют антиген, а затем выделяют гибридому, экспрессирующую антитело, которое обладает желаемой последовательностью или функциональными характеристиками. Когда получившие инъекцию испытуемые являются мышами, полученное антитело представляет собой антитело мышиного происхождения, а когда получившие инъекцию испытуемые являются крысами, полученное антитело представляет собой антитело крысиного происхождения.
«Химерное антитело» представляет собой антитело, образованное путем слияния вариабельной области (областей) антитела первого вида (например, мыши) с константной областью (областями) антитела второго вида (например, человека). Для создания химерного антитела необходимо создать гибридому, секретирующую моноклональное антитело первого вида (например, мыши), клонировать ген вариабельной области (областей) из клетки гибридомы, а затем клонировать ген константной области (областей) антитела второго вида (например, человека), по мере необходимости. Ген(ы) вариабельной области первого вида связан(ы) с геном(ами) константной области второго вида с образованием химерного гена, который затем вставляют в вектор экспрессии, и, наконец, молекула химерного антитела экспрессируется в эукариотической или прокариотической системе.
В предпочтительном варианте осуществления настоящего изобретения легкая цепь антитела химерного антитела дополнительно содержит константную область легкой цепи человеческой каппа-, лямбда-цепи или ее вариант. Тяжелая цепь химерного антитела дополнительно содержит константную область тяжелой цепи человеческого IgG1, IgG2, IgG3, IgG4 или ее вариант, предпочтительно содержит константную область тяжелой цепи человеческого IgG1, IgG2 или IgG4, или содержит вариант константной области тяжелой цепи области человеческого IgG1, IgG2 или IgG4 с аминокислотной мутацией(ями) (такой как мутация YTE или обратная мутация, мутация L234A и/или L235A или мутация S228P).
Термин «гуманизированное антитело», включая антитело с привитыми CDR, относится к антителу, полученному путем прививания последовательностей CDR антитела животного происхождения, например, мышиного антитела, на каркасные области вариабельной области человеческого антитела (т.е. каркасные области). Гуманизированные антитела могут позволить избежать гетерологичных ответов, индуцированных химерными антителами, которые несут большое количество гетерологичных белковых компонентов. Такие каркасные последовательности могут быть получены из общедоступной базы данных ДНК, охватывающей последовательности генов антител зародышевой линии, или из опубликованных источников. Например, последовательности ДНК зародышевой линии генов вариабельной области человеческой тяжелой и легкой цепи можно найти в базе данных последовательностей зародышевой линии человека «VBase» (доступной по ссылке http://www.vbase2.org/), а также в Kabat, Е.А., et al. 1991 Sequences of Proteins of Immunological Interest, 5th Ed.
Чтобы избежать снижения активности, вызванного сниженной иммуногенностью, каркасные последовательности в вариабельной области человеческого антитела можно подвергать минимальным реверсивным мутациям или обратным мутациям для поддержания активности. Гуманизированные антитела согласно настоящему изобретению также включают гуманизированные антитела, в которых созревание аффинности CDR осуществляется с помощью фагового дисплея.
Вследствие того, что остатки контактируют с антигеном, прививание CDR может приводить к снижению аффинности антитела или его антигенсвязывающего фрагмента к этому антигену из-за того, что остатки каркаса контактировали с антигеном. Такие взаимодействия могут быть результатом высоко соматических мутаций. Поэтому все же может быть необходимо прививать донорские каркасные аминокислоты на каркасные области гуманизированных антител. Аминокислотные остатки, участвующие в связывании антигена и полученные из отличного от человеческого антитела или его антигенсвязывающего фрагмента, могут быть идентифицированы путем проверки последовательности и структуры вариабельной области моноклонального антитела животного. Аминокислотные остатки донорского каркаса CDR, которые отличаются от зародышевых линий, можно рассматривать как родственные. Если невозможно определить наиболее близкородственную зародышевую линию, последовательность можно сравнить с последовательностью, общей для подтипов, или последовательностью антитела животного с высоким процентом сходства. Считается, что редкие каркасные остатки являются результатом интенсивной мутации в соматических клетках и играют важную роль в связывании.
В одном из вариантов осуществления настоящего изобретения антитело или его антигенсвязывающий фрагмент может дополнительно содержать константную область легкой цепи человеческой или мышиной к-, Х-цепи или ее вариант, или дополнительно содержит константную область тяжелой цепи человеческого или мышиного IgG1, IgG2, IgG3, IgG4 или ее вариант.
«Традиционные варианты» константной области тяжелой цепи человеческого антитела и константной области легкой цепи человеческого антитела относятся к вариантам константной области человеческой тяжелой или легкой цепи, раскрытым в уровне техники, которые не изменяют структуру и функцию вариабельных областей антитела. Примеры вариантов включают варианты константной области тяжелой цепи IgG1, IgG2, IgG3 или IgG4, полученные посредством сайт-направленной модификации и аминокислотных замен в константной области тяжелой цепи. Конкретные замены представляют собой, например, мутацию YTE, мутации L234A и/или L235A, мутацию S228P или мутации, приводящие к структуре «выступ-во-впадину» (заставляющие тяжелую цепь антитела образовывать комбинацию выступа-Fc и впадины-Fc), и т.д. Было доказано, что эти мутации наделяют антитело новыми свойствами без изменения функции вариабельной области антитела.
«Человеческое антитело» и «антитело, полученное от человека» могут использоваться взаимозаменяемо и могут относиться к антителам человеческого происхождения или антителам, полученным от трансгенного организма, который был «генетически модифицирован» и получен любым известным в данной области способом для получения определенных человеческих антител, в ответ на стимуляцию антигеном. В некоторых технологиях элементы локусов человеческой тяжелой и легкой цепи вводят в штаммы клеток организма, полученные из линий эмбриональных стволовых клеток, в которых эндогенные локусы тяжелой и легкой цепи являются мишенью для разрушения. Трансгенные организмы могут синтезировать человеческие антитела, специфичные к человеческим антигенам, и эти организмы можно использовать для получения гибридом, которые секретируют человеческие антитела. Человеческое антитело также может быть таким антителом, в котором тяжелая и легкая цепи кодируются нуклеотидными последовательностями, полученными из одного или нескольких источников человеческой ДНК. Полностью человеческие антитела также могут быть сконструированы методами трансфекции генов или хромосом и технологией фагового дисплея, или сконструированы из В-клеток, активированных in vitro, при этом все из перечисленного известно в данной области техники.
«Моноклональное антитело» относится к антителу, полученному из популяции по существу однородных антител, то есть отдельные антитела, составляющие популяцию, идентичны и/или связываются с одним и тем же эпитопом, за исключением возможных вариантных антител (например, вариантов, имеющих встречающиеся в природе мутации или мутации, возникающие при производстве препаратов моноклональных антител, и эти мутации обычно присутствуют в минимальных количествах). В отличие от препаратов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело в препарате (составе) моноклональных антител направлено против одной детерминанты на антигене. Следовательно, определение «моноклональное» обозначает характеристики антитела, полученного из по существу однородной популяции антител, и не должно интерпретироваться как требующее какого-либо определенного метода для производства антитела. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены различными методиками, включая, не ограничиваясь перечисленным, методы гибридомы, методы рекомбинантных ДНК, методы фагового дисплея и методы с использованием трансгенных животных, имеющих все или часть локусов человеческого иммуноглобулина. Такие способы и другие иллюстративные способы получения моноклональных антител описаны в настоящем документе. Моноклональные антитела, входящие в термин «моноклональное антитело или его антигенсвязывающий фрагмент», относятся к полноразмерным антителам.
Термины «полноразмерное антитело», «полное антитело», «цельное антитело» и «целое антитело» используются в настоящем документе взаимозаменяемо и относятся к антителу в по существу целой форме, в отличие от антигенсвязывающих фрагментов, определенных ниже. Данный термин конкретно относится к антителу, в котором тяжелая цепь включает область VH, область СН1, шарнирную область и область Fc в порядке от аминоконца к карбоксильному концу, а легкая цепь включает область VL и область CL в порядке от аминоконца к карбоксильному концу.
Кроме того, домен VL и домен VH Fv-фрагмента кодируются двумя отдельными генами, однако они могут быть связаны с помощью синтетического линкера с использованием рекомбинантных методов для создания единой белковой цепи, где образуется одновалентная молекула путем спаривания домена VL и VH (называемая одноцепочечным Fv (scFv); см., например, Bird et al. (1988): 423-426; Science 242 и Huston et al (1988) Proc. Natl. Acad. Sci USA85:5879-5883). Подразумевается, что такие одноцепочечные антитела также охватываются термином «антигенсвязывающий фрагмент» антитела. Такие антитела получают с использованием общепринятых методик, известных в данной области техники, и их подвергают скринигку на функциональные фрагменты с использованием того же метода, что и для интактного антитела. Антигенсвязывающие части могут быть получены с помощью технологии рекомбинантных ДНК или ферментативного или химического разрушения интактного иммуноглобулина.
Антигенсвязывающие фрагменты также могут быть включены в одноцепочечную молекулу, содержащую пару тандемных Fv-фрагментов (VH-CH1-VH-CH1), и пара тандемных Fv-фрагментов образует пару антигенсвязывающих областей вместе с комплементарными полипептидами легких цепей (Zapata et al., 1995 Protein Eng. 8(10): 1057-1062; и патент США №5,641,870).
Fab представляет собой фрагмент антитела, полученный обработкой молекулы антитела IgG папаином (который расщепляет аминокислотный остаток в положении 224 Н-цепи), и этот фрагмент антитела имеет молекулярную массу приблизительно 50000 и обладает антигенсвязывающей активностью, причем примерно половина N-концевой стороны Н-цепи и вся L-цепь связаны друг с другом дисульфидной связью(ями).
F (ab')2 представляет собой фрагмент антитела, имеющий молекулярную массу приблизительно 100000 Да и обладающий антигенсвязывающей активностью, и содержащий две области Fab, которые связаны в положении шарнира, он может быть получен путем гидролиза пепсином части, расположенной ниже двух дисульфидных связей в шарнирной области IgG.
Fab' представляет собой фрагмент антитела, имеющий молекулярную массу приблизительно 50000 Да и обладающий антигенсвязывающей активностью, который получают расщеплением дисульфидных связей в шарнирной области вышеупомянутого F (ab')2. Fab' может быть получен обработкой F(ab')2, который специфически распознает антиген и связывается с ним, восстанавливающим агентом, таким как дитиотреитол.
Кроме того, Fab' может быть получен путем вставки ДНК, кодирующей Fab' антитела, в прокариотический вектор экспрессии или эукариотический вектор экспрессии и введения вектора в прокариоту или эукариоту для экспрессии Fab'.
Термин «одноцепочечное антитело», «одноцепочечный Fv» или «scFv» относится к молекуле, содержащей вариабельный домен (или область) тяжелой цепи антитела (VH), соединенный с вариабельным доменом (или областью) легкой цепи антитела (VL) с помощью линкера. Такие молекулы scFv имеют общую структуру NH2-VL-линкер-VH-СООН или NH2-VH-линкер-VL-СООН. Подходящие линкеры в уровне техники состоят из повторяющейся аминокислотной последовательности GGGGS или ее варианта, например варианта с 1-4 (включая 1, 2, 3 или 4) повторами (Holliger et al. (1993), Proc Natl Acad Sci USA. 90: 6444-6448). Другие линкеры, которые могут быть использованы в настоящем изобретении, описаны Alfthan et al., (1995), Protein Eng. 8:725-731, Choi et al., (2001), Eur J Immuno.31:94-106, Hu et al., (1996), Cancer Res.56:3055-3061, Kipriyanov et al., (1999), J Mol Biol. 293:41-56 и Roovers et al., (2001), Cancer Immunol Immunother. 50:51-59.
«Линкер» относится к соединяющей пептидной последовательности, используемой для соединения белковых доменов, обычно с определенной степенью гибкости, и использование линкеров не приводит к потере белковым доменом его исходных функций.
Диатело представляет собой фрагмент антитела, в котором scFv димеризован, и является фрагментом антитела, обладающим двухвалентной антигенсвязывающей активностью. При двухвалентной антигенсвязывающей активности два антигена могут быть одинаковыми или разными.
dsFv получают путем замены одного аминокислотного остатка в каждой из VH и VL остатком цистеина, и затем соединения замещенных полипептидов посредством дисульфидной связи между двумя остатками цистеина. Аминокислотные остатки, подлежащие замене остатком цистеина, могут быть выбраны на основе предсказания трехмерной структуры антитела в соответствии с известными методами (Protein Engineering, 7, 697 (1994)).
В некоторых вариантах осуществления настоящего изобретения антигенсвязывающий фрагмент может быть получен с помощью следующих стадий: получение кДНК (комплементарная ДНК), кодирующих VH и/или VL моноклонального антитела согласно настоящему изобретению, которое специфически распознает антиген и связывается с ним, и кДНК, кодирующих другие требуемые домены; конструирование ДНК, кодирующей антигенсвязывающий фрагмент; вставка ДНК в прокариотический или эукариотический вектор экспрессии, и затем введение вектора экспрессии в прокариоту или эукариоту для экспрессии антигенсвязывающего фрагмента.
«Fc-область» может быть встречающейся в природе последовательностью или вариантом Fc-области. Границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, однако Fc-область тяжелой цепи человеческого IgG обычно определяется как простирающаяся от аминокислотного остатка в положении Cys226 или от Рго230 до его карбоксильного конца. Нумерация остатков в Fc-области соответствует нумерации индекса EU согласно Kabat. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Edition Public Health Service, National Institutes of Health, Bethesda, Md., 1991. Fc-область иммуноглобулина обычно имеет два константных домена, СН2 и СН3.
«Выступ-Fc» относится к пространственной вы ступо подобной структуре, образованной включением точечной мутации T366W в Fc-область антитела. Соответственно, «впадина-Fc» относится ко впадино подобной пространственной структуре, образованной включением точечных мутаций T366S, L368A и Y407V в Fc-область антитела. Выступ-Fc и впадина-Fc с большей вероятностью образуют гетеродимеры из-за стерических затруднений. Чтобы дополнительно способствовать образованию гетеродимеров, в выступ-Fc и впадину-Fc, соответственно, могут быть введены точечные мутации S354C и Y349C, чтобы дополнительно способствовать образованию гетеродимеров с помощью дисульфидных связей. Между тем, для устранения или ослабления эффекта АЗКЦ (антителозависимая клеточная цитотоксичность), вызванного Fc антитела, в Fc также могут быть введены заменяющие мутации 234А и 235А. В биспецифическом антителе выступ-Fc или впадину-Fc можно использовать либо как Fc-область первой полипептидной цепи, либо как Fc-область второй полипептидной цепи. Для одного биспецифического антитела Fc-области первой и второй полипептидной цепи не могут быть одновременно выступом-Fc или впадиной-Fc.
Термин «аминокислотная разница» или «аминокислотная мутация» относится к аминокислотным изменениям или мутациям в варианте белка или полипептида по сравнению с исходным белком или полипептидом, включающим одну или более аминокислотных вставок, делеций или замен относительно исходного белка или полипептида.
«Вариабельная область» антитела относится к вариабельной области легкой цепи (VL) антитела или вариабельной области тяжелой цепи (VH) антитела, по отдельности или в комбинации. Как известно в данной области техники, каждая из вариабельных областей тяжелой и легкой цепи состоит из трех определяющих комплементарность областей (CDR) (также называемых гипервариабельными областями), связанных с четырьмя каркасными областями (FR). CDR в каждой цепи тесно удерживаются вместе посредством FR и вносят свой вклад в формирование антигенсвязывающего сайта вместе с областями CDR из другой цепи. Существует как минимум два метода определения CDR: (1) метод, основанный на межвидовой изменчивости последовательностей (например, Kabat et al. Sequences of Proteins of Immunological Interest, (5th edition, 1991, National Institutes of Health, Bethesda MD)); и (2) метод, основанный на кристаллографическом исследовании комплексов антиген-антитело (Al-Lazikani et al., J. Molec. Biol. 273:927-948 (1997)). В контексте настоящего документа CDR могут относиться к CDR, определенным любым из этих двух методов или их комбинацией.
Термин «каркас антитела» или «FR-область» относится к части вариабельного домена, либо VL, либо VH, который служит каркасом для антигенсвязывающих петель (CDR) этого вариабельного домена. По существу он представляет собой вариабельный домен без CDR.
Термины «определяющая комплементарность область» и «CDR» относятся к одной из шести гипервариабельных областей, присутствующих в вариабельном домене антитела, которые в основном способствуют связыванию антигена. Обычно имеется три CDR (HCDR1, HCDR2, HCDR3) в каждой вариабельной области тяжелой цепи и три CDR (LCDR1, LCDR2, LCDR3) в каждой вариабельной области легкой цепи. Границы аминокислотных последовательностей CDR могут быть определены с помощью любой из множества хорошо известных схем, включая критерии нумерации «Kabat» (см. Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th edition, Public Health Service, National Institutes of Health, Bethesda, MD), критерии нумерации «Chothia» (Al-Lazikani et al., (1997) JMB 273:927-948) и критерии нумерации ImmunoGenTics (IMGT) (Lefranc MP, Immunologist, 7, 132-136 (1999); Lefranc, MP, etc., Dev. Comp. Immunol., 27,55-77 (2003), и т.п.. Например, для классического формата в соответствии с критериями Kabat аминокислотные остатки CDR в вариабельном домене тяжелой цепи (VH) пронумерованы как 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3); и аминокислотные остатки CDR в вариабельном домене легкой цепи (VL) пронумерованы как 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). В соответствии с критериями Chothia аминокислотные остатки CDR в VH пронумерованы как 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3); и аминокислотные остатки в VL пронумерованы как 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). В случае комбинирования Kabat и Chothia для определения CDR, CDR состоят из аминокислотных остатков 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в человеческой VH и аминокислотных остатков 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в человеческой VL. В соответствии с критериями IMGT аминокислотные остатки CDR в VH примерно пронумерованы как 26-35 (CDR1), 51-57 (CDR2) и 93-102 (CDR3), и аминокислотные остатки CDR в VL примерно пронумерованы как 27-32 (CDR1), 50-52 (CDR2) и 89-97 (CDR3). В соответствии с критериями IMGT области CDR антитела могут быть определены с помощью программы IMGT/DomainGap Align.
«Любой их вариант CDR» в «областях HCDR1, HCDR2 и HCDR3 или любом их варианте» относится к варианту, полученному подверганием одной, двух или трех областей HCDR1, HCDR2 и HCDR3 аминокислотным мутациям.
«Домен константной области антитела» относится к доменам, полученным из константных областей легкой и тяжелой цепи антитела, содержащим домены CL и СН1, СН2, СН3 и СН4, полученные из различных типов антител.
«Эпитоп» или «антигенная детерминанта» относится к сайту на антигене, с которым специфически связывается иммуноглобулин или антитело. Эпитопы обычно включают по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 последовательных или несмежных аминокислот в уникальной пространственной конформации. См., например, Epitope Mapping Protocols в Methods in Molecular Biology, Vol.66, G.E. Morris, Ed. (1996).
Термин «специфически связываться с», «избирательно связываться с», «избирательно связывается с» или «специфически связывается с» относится к связыванию антитела с заранее определенным эпитопом на антигене. Как правило, антитело связывается с аффинностью (KD) менее приблизительно 10-8 М, например, менее приблизительно 10-9 М, 10-10 М или 10-11 М, или даже менее.
Когда термин «конкуренция» используется в контексте антигенсвязывающих белков (например, нейтрализующих антигенсвязывающих белков или нейтрализующих антител), которые конкурируют за один и тот же эпитоп, это означает, что между антигенсвязывающими белками имеет место конкуренция, которую определяют с помощью анализов, где подлежащий тестированию антигенсвязывающий белок (например, антитело или его антигенсвязывающий фрагмент) предотвращает или ингибирует (например, снижает) специфическое связывание референсного антигенсвязывающего белка (например, лиганда или референсного антитела) с общим антигеном. Доступны многочисленные типы анализов конкурентного связывания, чтобы определить, конкурирует ли отдельно взятый антигенсвязывающий белок с другим. Этими анализами являются, например, твердофазный прямой или непрямой радиоиммуноанализ (РИА), твердофазный прямой или непрямой иммуноферментный анализ (EIA), конкурентный сэндвич-анализ (см., например, Stahli et al, 1983, Methods in Enzymology 9: 242-253); твердофазный прямой биотин-авидиновый EIA (см., например, Kirkland et al., 1986, J. Immunol. 137: 3614-3619), твердофазный анализ с прямым мечением, твердофазный сэндвич-анализ прямого мечения (см., например, Harlow and Lane, 1988, Antibodies, A Laboratory Manual, Cold Spring Harbor Press); твердофазный РИА с прямым мечением меткой 1-125 (см., например, Morel et al., 1988, Molec. Immunol. 25: 7-15); твердофазный прямой биотин-авидиновый EIA (см., например, Cheung, et al, 1990, Virology 176: 546-552); и РИА с прямым мечением (Moldenhauer et al., 1990, Scand. J. Immunol. 32: 77-82). Обычно анализ включает использование очищенного антигена, способного связываться как с немеченым тестируемым антигенсвязывающий белком, так и с меченым референсным антигенсвязывающим белком (антиген расположен на твердой поверхности или поверхности клетки). Конкурентное ингибирование определяют путем измерения количества метки, связанной с твердой поверхностью или с поверхностью клетки, в присутствии тестируемого антигенсвязывающего белка. Обычно тестируемый антигенсвязывающий белок присутствует в избытке. Антигенсвязывающие белки, идентифицируемые с помощью конкурентного анализа (конкурирующие с антигенсвязывающим белком), включают: антигенсвязывающие белки, которые связываются с тем же эпитопом, что и референсный антигенсвязывающий белок; и антигенсвязывающие белки, которые связываются с эпитопом, расположенным достаточно близко к эпитопу, с которым связывается референсный антигенсвязывающий белок, где указанные два эпитопа пространственно мешают друг другу, препятствуя связыванию. Дополнительные подробности, касающиеся способов определения конкурентного связывания, представлены в приведенных в настоящем документе примерах. Обычно, когда конкурирующий антигенсвязывающий белок присутствует в избытке, он будет ингибировать (например, снижать) по меньшей мере 40-45%, 45-50%, 50-55%, 55-60%, 60-65%, 65-70%, 70-75% или 75%, или даже больший процент специфического связывания референсного антигенсвязывающего белка с общим антигеном. В некоторых случаях связывание ингибируется по меньшей мере на 80-85%, 85-90%, 90-95%, 95-97% или 97%, или даже более.
Термин «аффинность» относится к силе взаимодействия между антителом и антигеном при одном эпитопе. Внутри каждого антигенного сайта вариабельная область «плеча» антитела взаимодействует с антигеном по множеству аминокислотных сайтов посредством слабых нековалентных сил; чем больше взаимодействие, тем сильнее аффинность. В контексте настоящего документа термин «высокая аффинность» антитела или его антигенсвязывающего фрагмента (например, Fab-фрагмента) обычно относится к антителу или антигенсвязывающему фрагменту с KD 1Е-9М или менее (например, KD 1Е-10М или менее, KD 1Е-11М или менее, KD 1Е-12М или менее, KD 1Е-13М или менее, KD IE-14 М или менее, и т.д.).
Термин «KD» или «KD» относится к равновесной константе диссоциации для конкретного взаимодействия антитело-антиген. Обычно антитело связывается с антигеном с равновесной константой диссоциации (KD) менее около IE-8 М, например, менее около 1Е-9М, 1Е-10М или 1Е-11М, или даже менее, например, как определено с помощью технологии поверхностного плазменного резонанса (SPR) на приборе Biacore. Чем меньше значение KD, тем больше аффинность.
Термин «молекула нуклеиновой кислоты» относится к молекулам ДНК и молекулам РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно представляет собой двухцепочечную ДНК. Нуклеиновая кислота является «функционально связанной», когда она находится в функциональной связи с другой последовательностью нуклеиновой кислоты. Например, промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности.
Термин «вектор» означает конструкцию, способную доставлять один или более целевых генов или последовательностей и предпочтительно экспрессировать их в клетке-хозяине. Примеры векторов включают, не ограничиваясь перечисленным, вирусные векторы, векторы экспрессии «голой» ДНК или РНК, плазмиды, космиды или фаговые векторы, векторы экспрессии ДНК или РНК, связанные с катионными коагулянтами, векторы экспрессии ДНК или РНК, инкапсулированные в липосомы, и некоторые эукариотические клетки, такие как клетки-продуценты.
Способы получения и очистки антител и антигенсвязывающих фрагментов хорошо известны в данной области техники, см., например, A Laboratory Manual for Antibodies, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, главы 5-8 и 15. Например, мыши могут быть иммунизированы антигеном или его фрагментом, а затем полученные антитела могут быть ренатурированы, очищены и секвенированы на аминокислотные последовательности с использованием обычных способов. Антигенсвязывающие фрагменты также могут быть получены обычными способами. Антитела или антигенсвязывающие фрагменты согласно настоящему изобретению сконструированы для включения одной или более человеческих каркасных областей в области CDR, полученные из антитела, отличного от человеческого. Последовательности зародышевой линии человеческой FR можно получить с веб-сайта http://imgt.cines.fr или из The Immunoglobulin Facts Book, 2001, ISBN 012441351, путем выравнивания с базой данных вариабельных генов зародышевой линии человеческого антитела IMGT, и с помощью программного обеспечения МОЕ.
Термин «клетка-хозяин» относится к клетке, в которую был введен вектор экспрессии. Клетки-хозяева могут включать бактериальные, микробные, растительные или животные клетки. Бактерии, подходящие для трансформации, включают представителей энтеробактерий, таких как штаммы Escherichia coli или Salmonella; Bacillaceae, такие как Bacillus subtilis; Pneumococcus; Streptococcus и Haemophilus influenzae. Подходящие микроорганизмы включают Saccharomyces cerevisiae и Pichia pastoris. Подходящие линии клеток-хозяев животных включают СНО (линия клеток яичника китайского хомячка), клетки HEK293 (неограничивающие примеры, такие как клетки HEK293E) и клетки NS0.
Генетически модифицированные антитела или антигенсвязывающие фрагменты могут быть получены и очищены обычными способами. Например, последовательности кДНК, кодирующие тяжелую и легкую цепи, могут быть клонированы и рекомбинированы в вектор экспрессии GS. Вектор экспрессии рекомбинантного иммуноглобулина может быть стабильно трансфицирован в клетки СНО. В качестве альтернативы предшествующего уровня техники системы экспрессии млекопитающих могут приводить к гликозилированию антител, особенно в высококонсервативных N-концевых сайтах Fc-области. Стабильные клоны получали путем экспрессии антитела, специфически связывающегося с антигеном. Положительные клоны можно размножать в бессывороточной культуральной среде в биореакторах для продукции антител. Культуральную среду, в которую секретировалось антитело, можно очистить обычными методами. Например, очистку можно проводить на колонке FF с белком А или белком G-сефарозой, содержащей модифицированный буфер. Неспецифически связывающие компоненты вымываются. Связанное антитело элюируется градиентом рН, и фрагменты антител детектируют с помощью SDS-PAGE, а затем объединяют. Антитела могут быть отфильтрованы и концентрированы с использованием обычных методов. Растворимые смеси и агрегаты могут быть эффективно удалены обычными методами, такими как гель-фильтрация или ионный обмен. Полученный продукт необходимо немедленно заморозить, например, при минус 70°С, или лиофилизировать.
«Введение», «вводить», «дозирование» и «лечение» применительно к животным, людям, объектам исследования, клеткам, тканям, органам или биологическим жидкостям относится к введению экзогенных фармацевтических агентов, терапевтических агентов, диагностических агентов, композиций, или осуществлению искусственных манипуляций (например, «эвтаназия», как используется в примерах) в отношении животных, людей, объектов, клеток, тканей, органов или биологических жидкостей. «Введение» и «лечение» могут относиться, например, к терапевтическим, фармакокинетическим, диагностическим, исследовательским и экспериментальным способам. Лечение клетки включает приведение реагента в контакт с клеткой, а также приведение реагента в контакт с жидкостью, где жидкость находится в контакте с клеткой. «Введение» или «обработка» также означает обработку in vitro или ex vivo, например, клетки, реагентом, диагностическим, связывающим соединением или другой клеткой. «Лечение», применительно к человеку, субъекту ветеринарного лечения или объекту исследования, относится к терапевтическому лечению, профилактическим или превентивным мерам, исследовательским и диагностическим применениям.
«Лечить» означает введение терапевтического агента, такого как композиция, содержащая любое из соединений согласно настоящему изобретению, внутрь или наружно субъекту, имеющему (или подозреваемому на наличие, или подверженному развитию) один или более симптомов заболевания, по отношению к которому агент имеет известную терапевтическую активность. Обычно агент вводят в количестве, эффективно облегчающем один или более симптомов заболевания у субъекта или популяции, подлежащей лечению, путем индукции регресса или ингибирования прогрессирования такого симптома(ов) в любой клинически измеримой степени. Количество терапевтического агента, эффективное для облегчения какого-либо конкретного симптома заболевания (также называемое «терапевтически эффективным количеством»), может варьироваться в зависимости от различных факторов, таких как патологическое состояние, возраст и масса тела субъекта, а также способность лекарственного средства вызывать желаемый ответ у субъекта. Был ли симптом заболевания облегчен, можно оценить с помощью любого клинического параметра, обычно используемого врачами или другими квалифицированными медицинскими работниками для оценки степени тяжести или статуса прогрессирования этого симптома. Хотя вариант осуществления настоящего изобретения (например, способ лечения или изделие) не эффективен для облегчения целевого симптома(ов) заболевания у каждого субъекта, он должен ослаблять целевой симптом(ы) заболевания у статистически значимого количества субъектов, как определено с помощью любого статистического критерия, известного в данной области техники, такого как t-критерий Стьюдента, критерий хи-квадрат, U-критерий Манна-Уитни, критерий Краскела-Уоллиса (Н-критерий), критерий Джонкхира-Терпстры и критерий Уилкоксона.
«Консервативная аминокислотная модификация» или «консервативная аминокислотная замена» означает, что аминокислоты в белке или полипептиде заменены другими аминокислотами с аналогичными характеристиками (такими как заряд, размер боковой цепи, гидрофобность/гидрофильность, конформация основной цепи и жесткость, и т.д.), так что изменения могут часто выполняться без изменения биологической активности или других требуемых характеристик (таких как аффинность и/или специфичность к антигену) белка или полипептида. Специалисты в данной области признают, что, как правило, замена одной аминокислоты в несущественных областях полипептида по существу не изменяет биологическую активность (см., например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p. 224 (4th Ed.)). Кроме того, замены структурно или функционально схожими аминокислотами с меньшей вероятностью нарушат биологическую активность. Иллюстративные консервативные аминокислотные замены представляют собой следующие:


«Эффективное количество» или «эффективная доза» относится к количеству лекарственного средства, соединения или фармацевтической композиции, необходимого для получения любого одного или более положительных или желаемых результатов. Для профилактических целей положительные или желаемые результаты включают устранение или снижение риска, снижение тяжести или отсрочку начала заболевания, включая биохимические, гистологические и поведенческие проявления состояния, его осложнения и промежуточные патологические фенотипы во время развития состояния. Для терапевтических целей положительные или желаемые результаты включают клинические результаты, такие как снижение частоты различных состояний, связанных с антигеном-мишенью по настоящему изобретению, или улучшение одного или более симптомов состояния, снижение дозировки других агентов, необходимых для лечения состояния, повышение эффективности другого агента и/или задержка прогрессирования состояния, связанного с антигеном-мишенью настоящего изобретения, у субъектов.
«Экзогенный» относится к веществам, продуцируемым вне организмов, клеток или людей, в зависимости от обстоятельств.
«Эндогенный» относится к веществам, продуцируемым в клетках, организмах или человеческих телах, в зависимости от обстоятельств.
«Гомология» и «идентичность» используется в настоящем документе взаимозаменяемо и относятся к сходству последовательностей между двумя полинуклеотидными последовательностями или между двумя полипептидными последовательностями. Когда положение в обеих из двух подлежащих сравнению последовательностей занято одним и тем же основанием или субъединицей мономера аминокислоты, например, если положение в каждой из двух молекул ДНК занято аденином, то молекулы гомологичны в этом положении. Процент гомологии между двумя последовательностями является функцией количества совпадающих или гомологичных положений, общих для двух последовательностей, деленного на количество подлежащих сравнению положений, а затем умноженного на 100. Например, когда две последовательности оптимально выровнены, если 6 из 10 положений в двух последовательностях совпадают или гомологичны, то две последовательности гомологичны на 60%; если 95 из 100 положений в двух последовательностях совпадают или гомологичны, то две последовательности гомологичны на 95%. Обычно, когда две последовательности выровнены, сравнение проводят для получения максимального процента гомологии. Например, сравнение может проводиться алгоритмом BLAST, в котором параметры алгоритма выбирают так, чтобы обеспечить максимальное соответствие между каждой последовательностью по всей длине каждой референсной последовательности.
Следующие ссылки относятся к алгоритму BLAST, часто используемому для анализа последовательностей: BLAST algorithm (BLAST ALGORITHMS): Altschul, SF et al., (1990) J. Mol. Biol. 215:403-410; Gish, W. et al., (1993) Nature Genet. 3:266-272; Madden, T.L. et al., (1996) Meth. Enzymol. 266:131-141; Altschul, S.F. et al., (1997) Nucleic Acids Res. 25:3389-3402; Zhang, J. et al. (1997) Genome Res. 7:649-656. Другие традиционные алгоритмы BLAST, такие как доступные от NCBI BLAST, также хорошо известны специалистам в данной области техники.
«Выделенный» относится к состоянию «отделенного от своего исходного окружения», и в этом случае означает, что указанная молекула по существу не содержит другие нецелевые биомолекулы. В целом, термин «выделенный» не предназначен для обозначения полного отсутствия этих веществ или отсутствия воды, буферов или солей, если только они не присутствуют в количестве, которое существенно мешает экспериментальному или терапевтическому применению соединения, как описано в настоящем документе.
«Необязательный» или «необязательно» означает, что последующее событие или обстоятельство может, но не обязательно должно, произойти, и описание включает случаи, в которых событие или обстоятельство происходит или не происходит.
«Фармацевтическая композиция» относится к смеси, содержащей одно или более соединений согласно настоящему изобретению или их физиологически/фармацевтически приемлемую соль или пролекарство, и другие химические компоненты, такие как физиологически/фармацевтически приемлемые носители и эксципиенты. Фармацевтическая композиция предназначена для ускорения введения в организм, облегчения абсорбции активного ингредиента и, таким образом, оказания биологического эффекта.
Термин «фармацевтически приемлемый носитель» относится к любому неактивному веществу, подходящему для применения в составе для доставки антител или антигенсвязывающих фрагментов. Носитель может представлять собой антиадгезивный агент, адгезивный агент, покрывающий агент, разрыхлитель, наполнитель или разбавитель, консервант (такой как антиоксидант, антибактериальный или противогрибковый агент), подсластитель, агент, замедляющий абсорбцию, смачивающий агент, эмульгатор, буфер и т.п. Примеры подходящих фармацевтически приемлемых носителей включают воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), декстрозу, растительное масло (например, оливковое масло), физиологический раствор, буфер, забуференный физиологический раствор и изотонический агент, например, сахара, многоатомный спирт, сорбит и хлорид натрия.
Конкретные примеры термина «метаболическое нарушение» представляет собой метаболический синдром, ожирение, нарушение толерантности к глюкозе, диабет, диабетический кетоацидоз, гипергликемию, гипергликемический гиперосмолярный синдром, периоперациоиную гипергликемию, гиперинсулинемию, синдром инсулинорезистентности, нарушение гликемии натощак, дислипидемию, атеросклероз и предиабетическое состояние.
Кроме того, еще один аспект настоящего изобретения относится к способам иммунодетекции или определения целевых антигенов, реагентам для иммунодетекции или определения целевых антигенов, способам иммунодетекции или определения клеток, экспрессирующих целевые антигены, и диагностическим агентам для диагностики заболеваний, связанных с клетками, положительными на целевые антигены, содержащим моноклональные антитела или фрагменты антител согласно настоящему изобретению, специфически распознающие целевой антиген и связывающиеся с ним, в качестве активных ингредиентов.
В настоящем изобретении способ обнаружения или измерения количества целевого антигена может представлять собой любой известный метод. Например, он включает метод иммуноанализа или иммунодетекции.
Метод иммуноанализа или иммунодетекции - это метод обнаружения или измерения количества антитела или антигена с помощью меченого антигена или антитела. Примеры методов иммуноанализа или иммунодетекции включают метод иммуноантител, меченых радиоактивными веществами (РИА), иммуно ферментный анализ (EIA или ELISA), флуоресцентный иммуноанализ (FIA), люминесцентный иммуноанализ, вестерн-блоттинг, физико-химический метод и т.п.
Вышеупомянутые заболевания, связанные с антиген-положительными клетками-мишенями, могут быть диагностированы путем обнаружения или измерения клеток, экспрессирующих целевой антиген, с использованием антител или фрагментов антител согласно настоящему изобретению.
Клетки, экспрессирующие полипептид, могут быть обнаружены известными методами иммунодетекции, предпочтительно иммунопреципитацией, флуоресцентным окрашиванием клеток, иммунноокрашивание тканей и т.п. Кроме того, можно использовать такой метод, как метод флуоресцентного окрашивания антителами с помощью системы FMAT8100HTS (Applied Biosystem).
В настоящем изобретении живые образцы, подлежащие обнаружению или измерению на предмет целевого антигена, особенным образом не ограничены, при условии, что они могут содержать клетки, экспрессирующие целевой антиген, например, клетки ткани, кровь, плазма, сыворотка, панкреатический сок, моча, фекалии, тканевая жидкость или культуральная среда.
В зависимости от требуемого метода диагностики диагностический агент, содержащий моноклональное антитело или его фрагмент антитела согласно настоящему изобретению, может также содержать реагенты для проведения реакции антиген-антитело или реагенты для обнаружения такой реакции. Реагенты для проведения реакции антиген-антитело включают буферы, соли и т.п. Реагенты для обнаружения включают агенты, обычно используемые в методах иммуноанализа или иммунодетекции, например, меченое вторичное антитело, распознающее моноклональное антитело, фрагмент или конъюгат антитела, и субстрат, соответствующий метке.
Подробности одного или более вариантов осуществления настоящего изобретения изложены в приведенном выше описании. Предпочтительные способы и материалы описаны ниже, хотя любой способ и материал, аналогичный или идентичный описанным в настоящем документе, может быть использован при осуществлении или при тестировании настоящего изобретения. Из описания и формулы изобретения станут очевидными другие признаки, цели и преимущества настоящего изобретения. В описании и формуле изобретения формы единственного числа включают аспекты множественного числа, если из контекста явно не следует иное. Если иное не определено явным образом в настоящем документе, все технические и научные термины, используемые в настоящем документе, имеют значение, обычно понимаемое специалистами в области техники, к которой относится данное изобретение. Все патенты и публикации, цитируемые в описании, включены посредством ссылки. Следующие ниже примеры представлены для дополнительной иллюстрации предпочтительных вариантов осуществления настоящего изобретения. Эти примеры не следует истолковывать как ограничивающие объем настоящего изобретения каким-либо образом, и объем настоящего изобретения определяется формулой изобретения.
ПРИМЕРЫ
Пример 1: Получение антигена GCGR и антитела к нему
1.1 Конструирование и скрининг антигенов
кДНК человеческого GCGR, кодирующая полноразмерный рецептор глюкагона из 477 аминокислот, была субклонирована в вектор экспрессии (такой как pcDNA3.1) и трансфицирована в клетки СНО-K1. После скрининга и клонирования потомства отдельных клеток были отобраны отдельные клоны для изучения характеристик экспрессии антигена и экспрессии на основе рецепторов на поверхности клеток. Следующие антигены GCGR относятся к человеческому GCGR, если не указано иное.
Полноразмерный GCGR: использовали для конструирования клеточных линий со сверхэкспрессией GCGR или использовали в качестве антигенов для иммунизации и для последующего обнаружения:

1.2 Очистка гибридом и рекомбинантных антител к GCGR
(1) Выделение и очистка супернатанта гибридомы/аффинная хроматография на белке G:
Для очистки супернатанта мышиной гибридомы предпочтительно проводить аффинную хроматографию с белком G. Собранную культуру гибридомы центрифугировали, отбирали супернатант и, исходя из объема супернатанта, добавляли 10-15% объема 1 М трис-HCl (рН 8,0-8,5) для регулирования рН супернатанта. Колонку с белком G промывали 3-5-кратным колоночным объемом 6 М гидрохлорида гуанидина, а затем промывали 3-5-кратным колоночным объемом чистой воды; колонку уравновешивали 3-5-кратным колоночным объемом уравновешивающего буфера, такого как буферная система 1×PBS (рН 7,4); клеточный супернатант загружали при низкой скорости потока для связывания, и скорость потока контролировали так, чтобы время удерживания составляло около 1 мин или больше; колонку промывали 3-5-кратным колоночным объемом 1×PBS (рН 7,4) до тех пор, пока УФ-поглощение не упало до исходного уровня; образцы элюировали буфером 0,1 М уксусная кислота/ацетат натрия (рН 3,0), пики элюирования объединяли в соответствии с УФ-детектированием. Элюированный продукт временно консервировали после доведения рН до 5-6 с помощью 1 М трис-HCl (рН 8,0). Элюированный продукт может быть подвергнут замене раствора в соответствии с методами, хорошо известными специалистам в данной области техники, например, путем замены раствора желаемой буферной системой путем ультрафильтрации-концентрирования с помощью ультрафильтрационной колонки или замены раствора желаемой буферной системой путем использования молекулярной эксклюзии, такой как обессоливание G-25, или удаления компонентов агрегации из элюированного продукта для повышения чистоты образца с использованием колонки для молекулярной эксклюзии высокого разрешения, такой как Superdex 200.
(2) Экстракция биспецифических белков или антител, меченых Fc, с помощью аффинной хроматографии на белке А:
Сначала супернатант культуры клеток, содержащий экспрессированный биспецифический белок Fc или антитело, центрифугировали на высокой скорости для сбора супернатанта. Аффинную колонку с белком А промывали 3-5-кратным колоночным объемом 6 М гидрохлорида гуанидина, а затем промывали 3-5-кратным колоночным объемом чистой воды. Колонку уравновешивали 3-5-кратным колоночным объемом колонки буферной системы 1×PBS (рН 7,4) в качестве уравновешивающего буфера. Клеточный супернатант загружали при низкой скорости потока для связывания, и скорость потока контролировали так, чтобы время удерживания составляло около 1 мин или больше; после завершения связывания колонку промывали 3-5-кратным колоночным объемом 1×PBS (рН 7,4) до тех пор, пока УФ-поглощение не упало до исходного уровня; образцы элюировали буфером 0,1 М уксусная кислота/ацетат натрия (рН 3,0-3,5), пик элюирования объединяли в соответствии с УФ-детектированием. Элюированный продукт временно консервировали после доведения рН до 5-6 с помощью 1 М трис-HCl (рН 8,0). Элюированный продукт может быть подвергнут замене раствора в соответствии со способами, хорошо известными специалистам в данной области техники, например, путем замены раствора желаемой буферной системой путем ультрафильтрации-концентрирования с помощью ультрафильтрационной колонки или замены раствора желаемой буферной системой путем использования молекулярной эксклюзии, такой как обессоливание G-25, или удаления компонентов агрегации из элюированного продукта для повышения чистоты образца с использованием колонки для молекулярной эксклюзии высокого разрешения, такой как Superdex 200.
Пример 2: Получение моноклонального антитела к человеческому GCGR
2.1 Иммунизация
(1) Иммунизация мышей: Моноклональные антитела к человеческому GCGR получали путем иммунизации мышей. Для эксперимента использовали белых мышей SJL, самок, в возрасте 6-8 недель (Beijing Charles River Experimental Animal Technology Co., Ltd., номер лицензии на животноводство: SCXK (Jing) 2012-0001). Кормовая среда: Уровень СПФ (свободный от патогенной микрофлоры). После покупки мышей адаптировали к лабораторным условиям в течение 1 недели, с циклом свет/темнота 12/12 часов при температуре 20-25°С; влажность 40-60%. Затем мышей, адаптированных к окружающей среде, иммунизировали по следующим схемам. Антигеном для иммунизации служили клетки СНО-К1, стабильно трансфицированные GCGR.
Схема иммунизации: Мышей предварительно иммунизировали адъювантом, TiterMax® Gold Adjuvant (Sigma, кат. №T2684), путем внутрибрюшинной инъекции (в/б), 0,1 мл/мышь (первая иммунизация). Спустя 15 минут мышам внутрибрюшинно инъецировали (в/б) клетки СНО-K1, стабильно трансфицированные GCGR, 1Е7 клеток на мышь. Вакцинацию проводили в 0, 14, 28, 42, 56, 70, 84, 98 и 112 дни. Образцы крови собирали на 35, 63 и 91 день, титры антител в сыворотке мышей определяли методом ELISA. После 6-9 иммунизации мышей с высоким титром сывороточных антител, стремившимся к плато, отбирали для слияния спленоцитов. За три дня до слияния спленоцитов стабильно трансфицированные GCGR клетки СНО-K1 инъецировали внутрибрюшинно (в/б) из расчета 1Е7 клеток на мышь для бустер-иммунизации.
(2) Иммунизация крыс: крыс SD в возрасте 6-8 недель иммунизировали ДНК (кодирующей полноразмерный hGCGR, кодирующую последовательность можно под регистрационным номером Genbank: NM_000160), и определяли титры антител в сыворотке крыс методом FACS. После 3-4 иммунизации крыс с высоким титром сывороточных антител, стремившимся к плато, отбирали для слияния спленоцитов. Бустер-иммунизацию проводили за 3 дня до слияния спленоцитов.
2.2 Слияние спленоцитов
Клетки гибридомы получали путем слияния лимфоцитов селезенки с клетками миеломы Sp2/0 cells (АТСС® CRL-8287™) с использованием оптимизированной процедуры слияния, опосредованного ПЭГ. Слитые клетки гибридомы ресуспендировали в полной среде (среда IMEM, содержащая 20% FBS, 1×HAT, 1×OPI) при плотности 0,5-1Е6/мл, высевали в 96-луночный планшет по 100 мкл/лунку, инкубировали при 37°С и 5% СО2 в течение 3-4 дней, с добавлением 100 мкл/лунку полной среды HAT, и продолжали культивировать в течение 3-4 дней до тех пор, пока не образовались клоны. Супернатант удаляли, в каждую лунку добавляли 200 мкл/лунку полной среды НТ (среда IMDM, содержащая 20% FBS, 1×НТ и 1×OPI), инкубировали при 37°С, 5% CO2 в течение 3 дней и затем подвергали определению методом ELISA.
2.3 Скрининг клеток гибридомы
В соответствии с плотностью роста клеток гибридомы супернатант культуры гибридомы определяли методом клеточного связывания ELISA. Клетки в лунках, которые дали положительный результат, были своевременно размножены, криоконсервированы и субклонированы 2-3 раза до получения клона одной клетки.
Клетки после каждого субклонирования также тестировали с помощью ELISA со связыванием GCGR-клеток. Клоны гибридомы подвергали скринингу с помощью анализа. Антитела были дополнительно получены способом бессывороточного культивирования клеток. Антитела очищали согласно примеру очистки, описанному в тестовых примерах.
2.4 Секвенирование положительных клонов гибридомы
Процедуры клонирования последовательностей из положительной гибридомы были следующими. Собирали клетки гибридомы в логарифмической фазе роста. РНК экстрагировали тризолом (Invitrogen, кат. №15596-018) в соответствии с инструкцией к набору и подвергали обратной транскрипции с помощью набора для обратной транскрипции PrimeScript™ (Takara, кат. №2680А). кДНК, полученные в результате обратной транскрипции, амплифицировали с помощью ПЦР с использованием набора мышиного Ig-праймера (Novagen, ТВ326 Rev. В 0503)) и секвенировали после ПЦР-амплификации.
Из полученных последовательностей ДНК получали положительные клоны, и антитела получали способом бессывороточного культивирования клеток. Антитела очищали в соответствии с примером очистки и подвергали нескольким раундам скрининга с использованием клеточного анализа блокирования связывания GCGR, таким образом были получены клоны мышиной гибридомы 1803, 1805, 1808 и 1810 и клоны крысиной гибридомы 1817 и 1822.

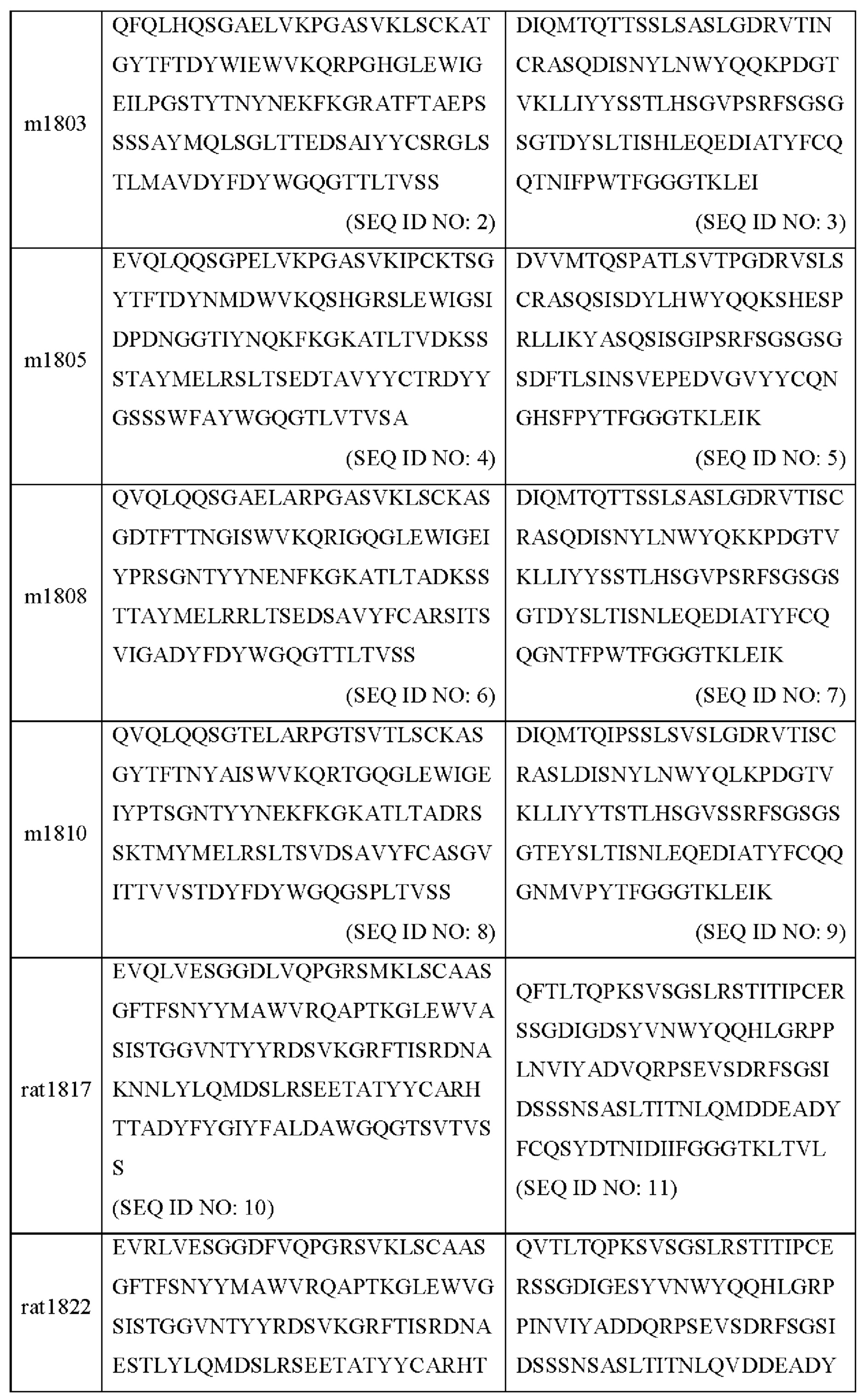

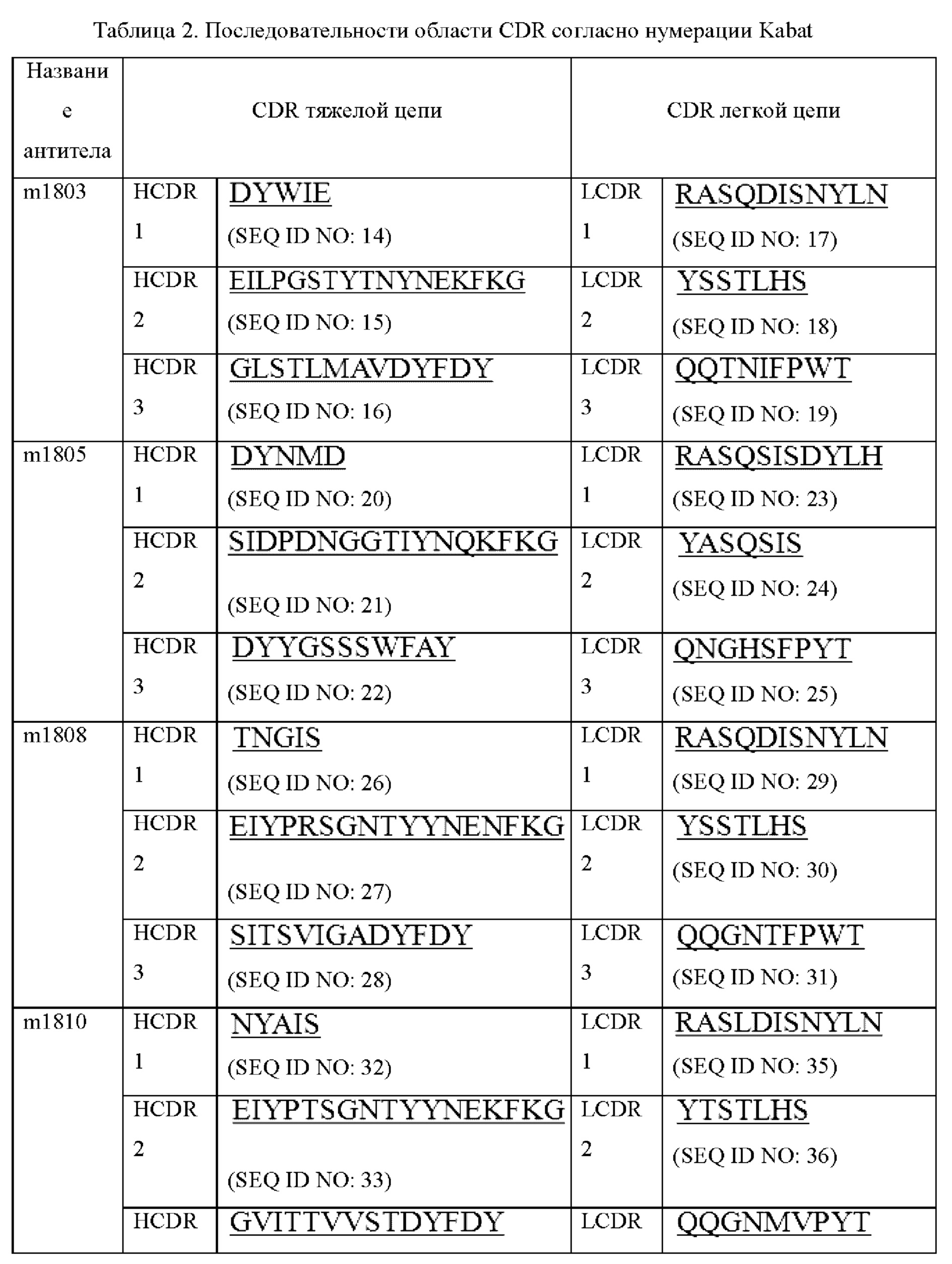
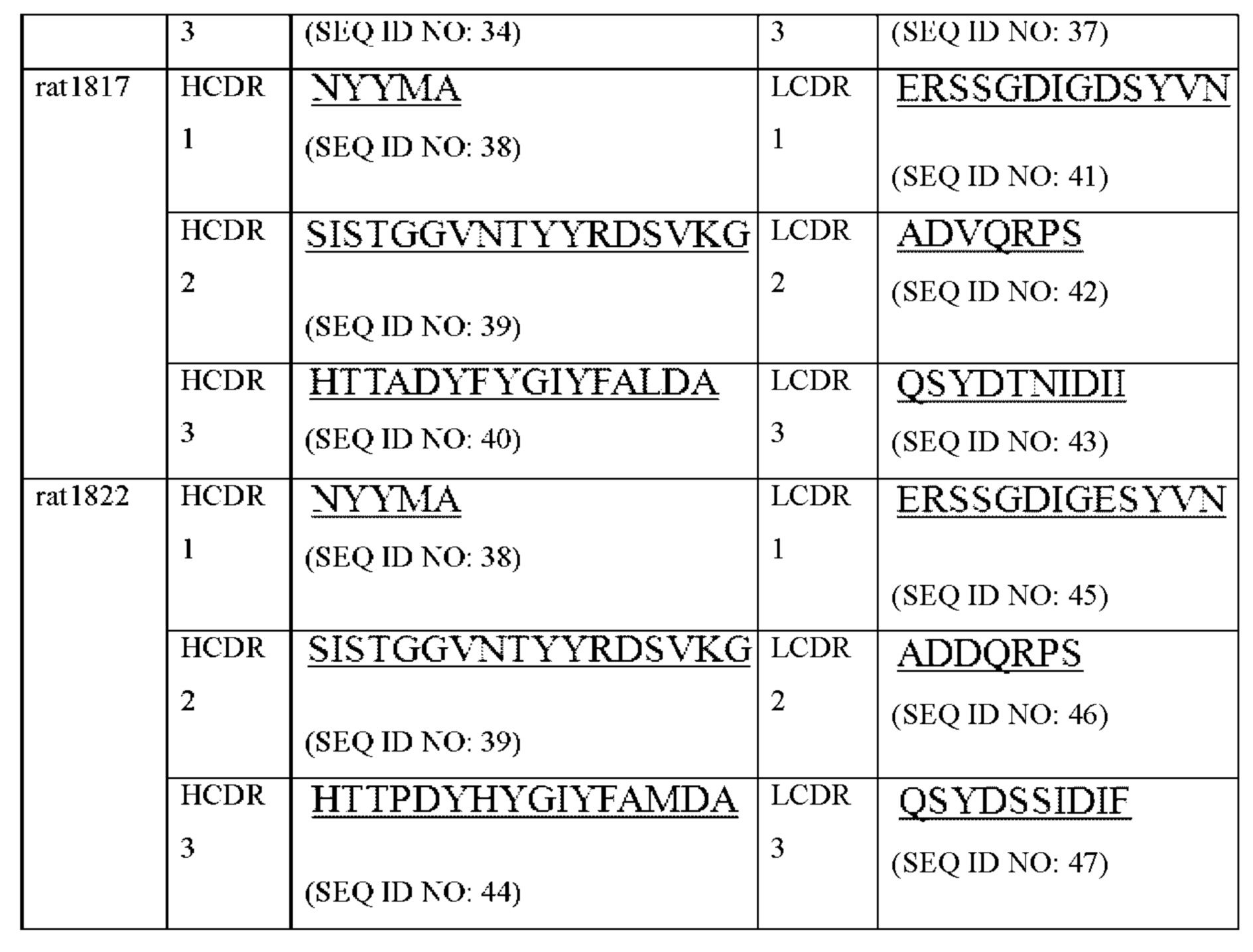
Путем выравнивания последовательностей и компьютерного моделирования было обнаружено, что последовательности CDR легкой и тяжелой цепей мышиных антител m1803, m1805, m1808 и m1810 имеют более высокую гомологию, и последовательности CDR легкой и тяжелой цепей крысиных антител rat1817 и rat1822 имеют более высокую гомологию. Их консенсусные последовательности приведены в следующей таблице:

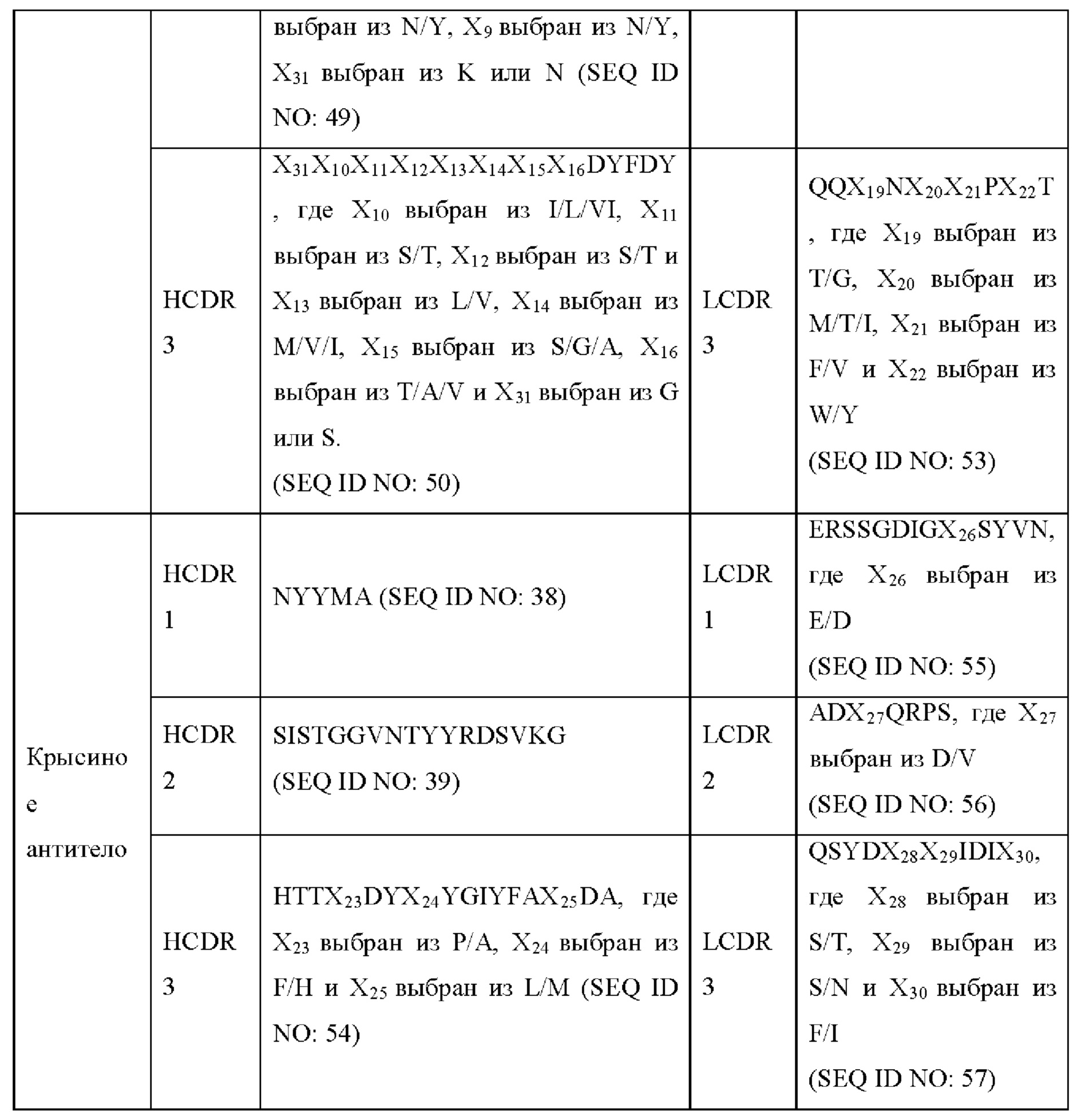
Пример 3. Гуманизация мышиного антитела к человеческому GCGR
Гены зародышевой линии вариабельной области тяжелой и легкой цепи с высокой гомологией с мышиными антителами были выбраны в качестве матриц путем выравнивания с базой данных генов зародышевой линии вариабельной области тяжелой и легкой цепи человеческого антитела IMGT с помощью анализа с использованием программного обеспечения МОЕ. CDR мышиных антител были привиты на соответствующую человеческую матрицу с образованием последовательности вариабельной области в порядке FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. При необходимости некоторые аминокислоты в каркасной последовательности подвергали обратной мутации до аминокислот, соответствующих мышиному антителу, для получения гуманизированного моноклинального антитела к GCGR. Аминокислотные остатки в областях CDR были определены и аннотированы с помощью системы нумерации Kabat.
Вышеупомянутые вариабельные области мышиной легкой и тяжелой цепи были связаны с константными областями человеческой легкой и тяжелой цепей, соответственно, с образованием химерного антитела. Химерное антитело, соответствующее клону 1803, было названо ch1803, и другие антитела были названы аналогичным образом.
3.1 Гуманизация клона гибридомы 1803
(1) Выбор каркасов для гуманизации клона гибридомы 1803:
Для мышиного антитела m1803 матрицами гуманизации легких цепей были IGKV1-39*01 и hjk4.1, и матрицами гуманизации тяжелых цепей были IGHV1-3*01 и hjh6.1. Последовательности гуманизированных вариабельных областей представляют собой следующие:
hu1803VH-прививание CDR: (SEQ ID NO: 61)

hu1803VL-прививание CDR: (SEQ ID NO: 58)

Примечание: Расположены в порядке FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, выделенные курсивом последовательности представляют собой FR, а подчеркнутые последовательности представляю т собой CDR.
(2) Выбор матриц гуманизации и дизайн обратных мутаций для клона гибридомы 1803 приведены в таблице ниже:


(3) Конкретные гуманизированные последовательности клона гибридомы 1803 представляют собой следующие:
> hu1803_VL.1 (такая же, как Hu1803VL-прививание CDR): (SEQ ID NO: 58)
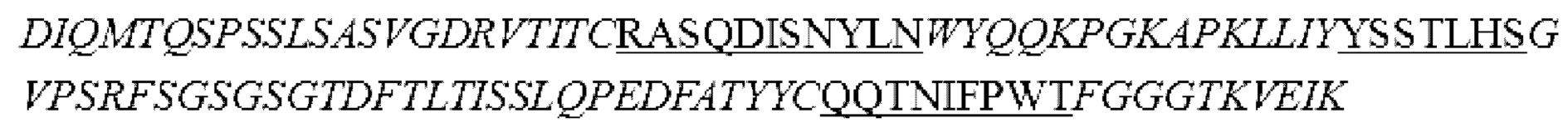
> hu1803_VL.1A: (SEQ ID NO: 59)

> hu1803_VL.1B: (SEQ Ю NO: 60)

> hu1803_VH.1 (такая же, как Hu1803VH-прививание CDR): (SEQ ID NO: 61)

> hu1803_VH.1A: (SEQ ID NO: 62)
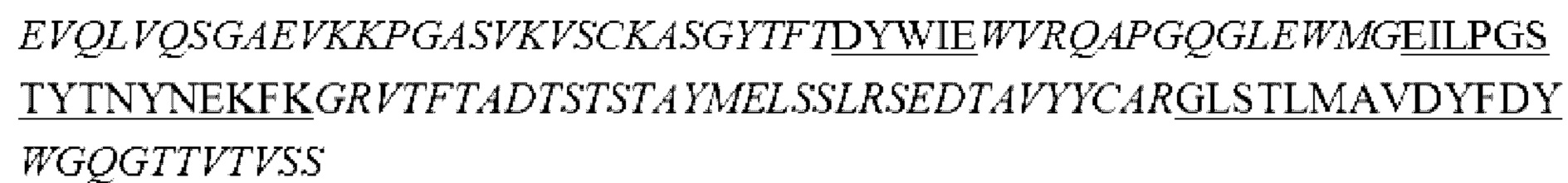
> hu1803_VH.1B: (SEQ ID NO: 63)
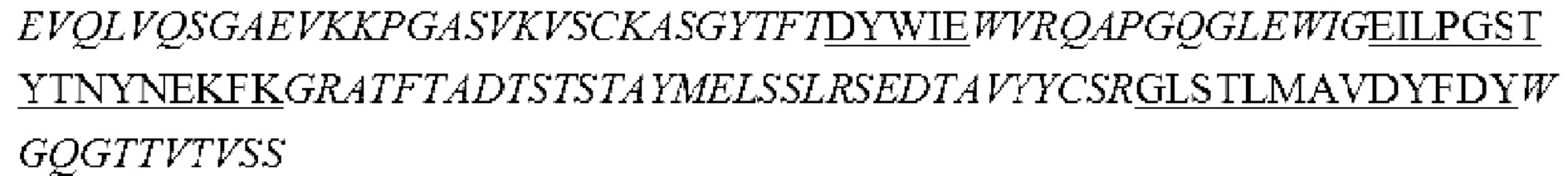
> hu1803_VH.1C: (SEQ ID NO: 64)
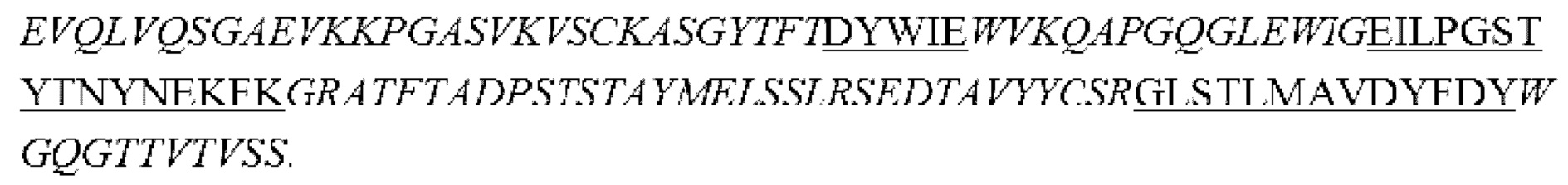
(4) Комбинации последовательностей вариабельной области легкой цепи гуманизированного антитела и вариабельной области тяжелой цепи антитела, полученного из клона гибридомы 1803, представляют собой следующие:


Вариабельные области легкой и тяжелой цепи антител, указанные в приведенной выше таблице, могут быть связаны с соответствующей константной областью легкой и тяжелой цепи антитела с образованием полноразмерных антител. Если в настоящем описании не указано иное, для полноразмерного антитела легкая цепь антитела образована вариабельной областью легкой цепи, связанной с константной областью каппа-цепи, как представлено в SEQ ID NO: 73, и тяжелая цепь антитела образована вариабельной областью тяжелой цепи, связанной с IgG4-AA, как представлено в SEQ ID NO: 72.
3.2 Гуманизация клона гибридомы 1810
(1) Выбор каркасов для гуманизации клона гибридомы 1810:
Для мышиного антитела m1810 матрицами гуманизации легких цепей были IGKV1-39*01 и hJK.4.1, а матрицами гуманизации тяжелых цепей были IGHV1-69*02 и hJH4.1. Последовательности гуманизированных вариабельных областей представляют собой следующие:
Hu1810VH-прививание CDR: (SEQ ID NO: 68)

Hu1810VL-прививание CDR: (SEQ ID NO: 65)

Примечание: Расположены в порядке FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, выделенные курсивом последовательности представляют собой FR, а подчеркнутые последовательности представляют собой CDR.
(2) Выбор матриц гуманизации и дизайн обратных мутаций для клона гибридомы 1810 приведены в таблице ниже:


(3) Конкретные гуманизированные последовательности клона гибридомы 1810 представляют собой следующие:
> hu1810_VL.1 (такая же как Hu1810VL-прививание CDR): (SEQ ID NO: 65)

> hu1810_VL.1A: (SEQ ID NO: 66)

> hu1810_VL.1B: (SEQ ID NO: 67)

> hu1810_VH.1 (такая же как Hu1810VH-прививание CDR): (SEQ ID NO: 68)
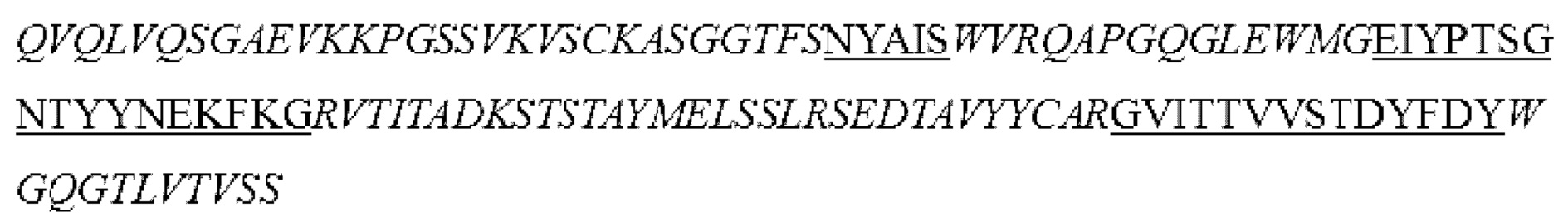
> hu1810_VH.1A: (SEQ ID NO: 69)

> hu1810_VH.1B: (SEQ ID NO: 70)
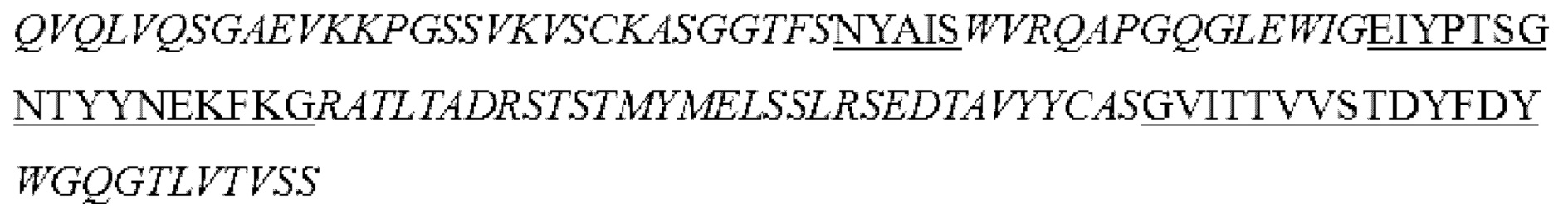
> hu1810_VH.1C: (SEQID NO: 71)

(4) Комбинации последовательностей вариабельной области легкой и тяжелой цепи гуманизированного антитела клона 1810 гибридомы представляют собой следующие:

Вариабельные области легкой и тяжелой цепи антител, указанные в приведенной выше таблице, могут быть связаны с соответствующей константной областью легкой и тяжелой цепи антитела с образованием полноразмерных антител. Если в настоящем описании не указано иное, для полноразмерного антитела легкая цепь антитела образована вариабельной областью легкой цепи, связанной с константной областью каппа-цепи, как представлено в SEQ ID NO: 73, а тяжелая цепь антитела образована вариабельной областью тяжелой цепи, связанной с IgG4-AA, как представлено в SEQ ID NO: 72.
Пример 4: Конструирование и экспрессия формата IgG4-AA химерного/гуманизированного антитела к GCGR
Были сконструированы праймеры, фрагмент гена VH/VK каждого химерного/гуманизированного антитела был амплифицирован с помощью ПЦР, а затем вставлен в вектор экспрессии pHr (с сигнальным пептидом и фрагментом гена константной области (CH1-FC/CL)) посредством гомологичной рекомбинации для конструирования вектор экспрессии для полноразмерного антитела VH-CH1-FC-pHr/VK-CL-pHr. Формат антитела IgG4-AA может быть получен из формата антитела IgG4 путем простых точечных мутаций. IgG4-AA представляет собой мутации F234A, L235A и S228P. Мутации F234A и L235A могут снижать связывающую способность IgG4-Fc с FcγR и дополнительно снижать АЗКЦ/КЗЦ (комплементзависимую цитотоксичность). S228P означает, что аминокислота S в положении 228 в шарнирной области IgG4 дикого типа мутирована в Р. Мутация в этом положении может предотвратить несовпадения природного антитела IgG4, вызванные Fab-обменом, происходящим in vivo.
ch1803, ch1805, ch1808, ch1810, ch1817 и ch1822 представляют собой химерные антитела, образованные путем связывания вариабельных областей легкой и тяжелой цепи животного происхождения с каппа-цепью человеческого антитела и константной областью тяжелой цепи человеческого антитела IgG4-AA, соответственно.
Последовательность константной области тяжелой цепи IgG4-AA представляет собой следующую: (SEQ ID NO: 72)

Последовательность константной области легкой цепи (каппа-цепи) антитела представляет собой следующую: (SEQ ID NO: 73)

Иллюстративные последовательности сконструированных антител представляют собой следующие:
ch1803: формат антитела IgG4-АА
последовательность тяжелой цепи ch1803: (SEQ ID NO: 74)

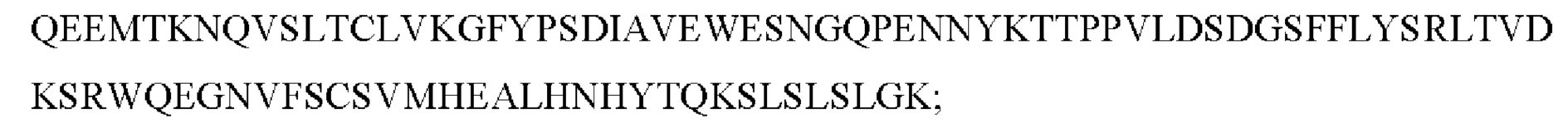
последовательность легкой цепи ch1803: (SEQ ID NO: 75)

hu1803-1: формат антитела IgG4AA
hu1803-1: последовательность тяжелой цепи: (SEQ ID NO: 76)

последовательность легкой цепи hu1803-1: (SEQ ID NO: 77)

последовательность тяжелой цепи hu1803-9: (SEQ ID NO: 78)

последовательность легкой цепи hu1803-9: (SEQ ID NO: 79)


последовательность тяжелой цепи ch1805: (SEQ ID NO: 80)

последовательность легкой цепи ch1805: (SEQ ID NO: 81)

последовательность тяжелой цепи ch1808: (SEQ ID NO: 82)

последовательность легкой цепи ch1808: (SEQ ID NO: 83)

последовательность тяжелой цепи hu1810-12: (SEQ ID NO: 84)

последовательность легкой цепи hu1810-12: (SEQ ID NO: 85)

последовательность тяжелой цепи ch1817: (SEQ ID NO: 86)

последовательность легкой цепи ch1817: (SEQ ID NO: 87)

последовательность тяжелой цепи ch1822: (SEQ ID NO: 88)

последовательность легкой цепи ch1822: (SEQ ID NO: 89)

Положительный контроль: Дулаглутид присутствовал в двухцепочечной форме, а одноцепочечная форма представляет собой GLP-1/hIgG4 Fc (SEQ ID NO: 90)

Пример 5: Клонирование и экспрессия биспецифического белка антитела
Человеческий пептид GLP-1 использовали в качестве части биспецифического белка, представляющей собой агонист рецептора GLP-1, а антитело к GCGR использовали в качестве части биспецифического белка, представляющей собой антагонист GCGR, для образования биспецифического белка GLP-1/антитела к GCGR.
Исследования показали, что новый биспецифический белок GLP-1/антитела к GCGR с аминокислотной мутацией(ями) в определенном положении(ях) GLP-1 (например, в Q17E, 123V, K28R или G30R) имеет повышенную стабильность in vitro, при этом стабильность является наивысшей, когда Q в положении 17 GLP-1А мутирован в Е, а I в положении 23 GLP-1А мутирован в V(GLP-1С). Неограничивающие примеры последовательностей GLP-1 и его мутантных форм согласно настоящему изобретению представляют собой следующие:
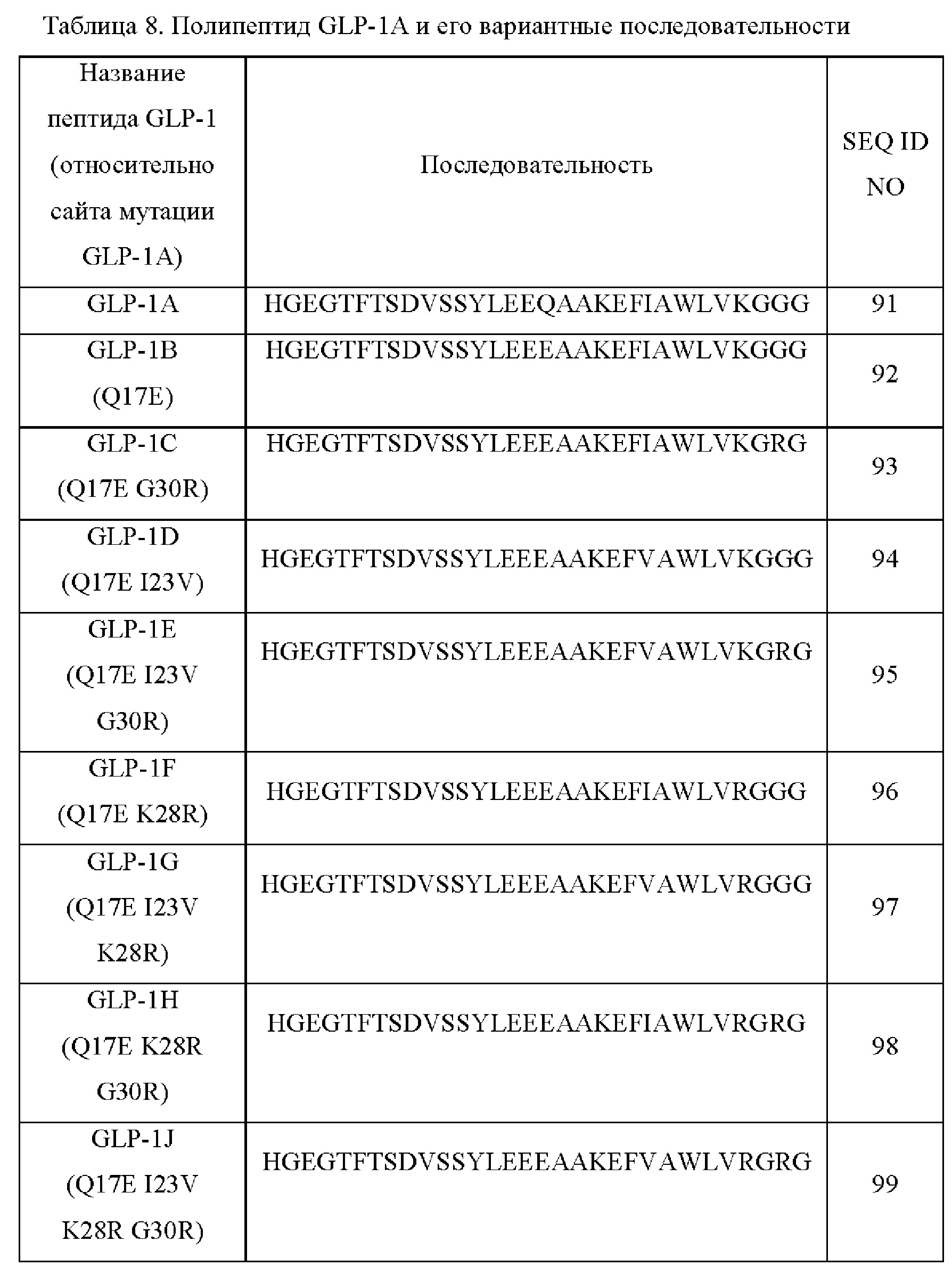
С-концевая аминокислота пептида GLP-1 согласно настоящему изобретению была связана с N-концевой аминокислотой тяжелой цепи антитела к GCGR посредством пептидной связи или линкера с использованием технологии гомологичной рекомбинации. Экспрессию проводили с использованием системы экспрессии 293, и были получены структурные модели биспецифического белка, как показано в таблице 9:

Следующие белки образованы путем соединения различных пептидов GLP-1 с аминокислотами тяжелой цепи различных антител посредством линкеров (например,
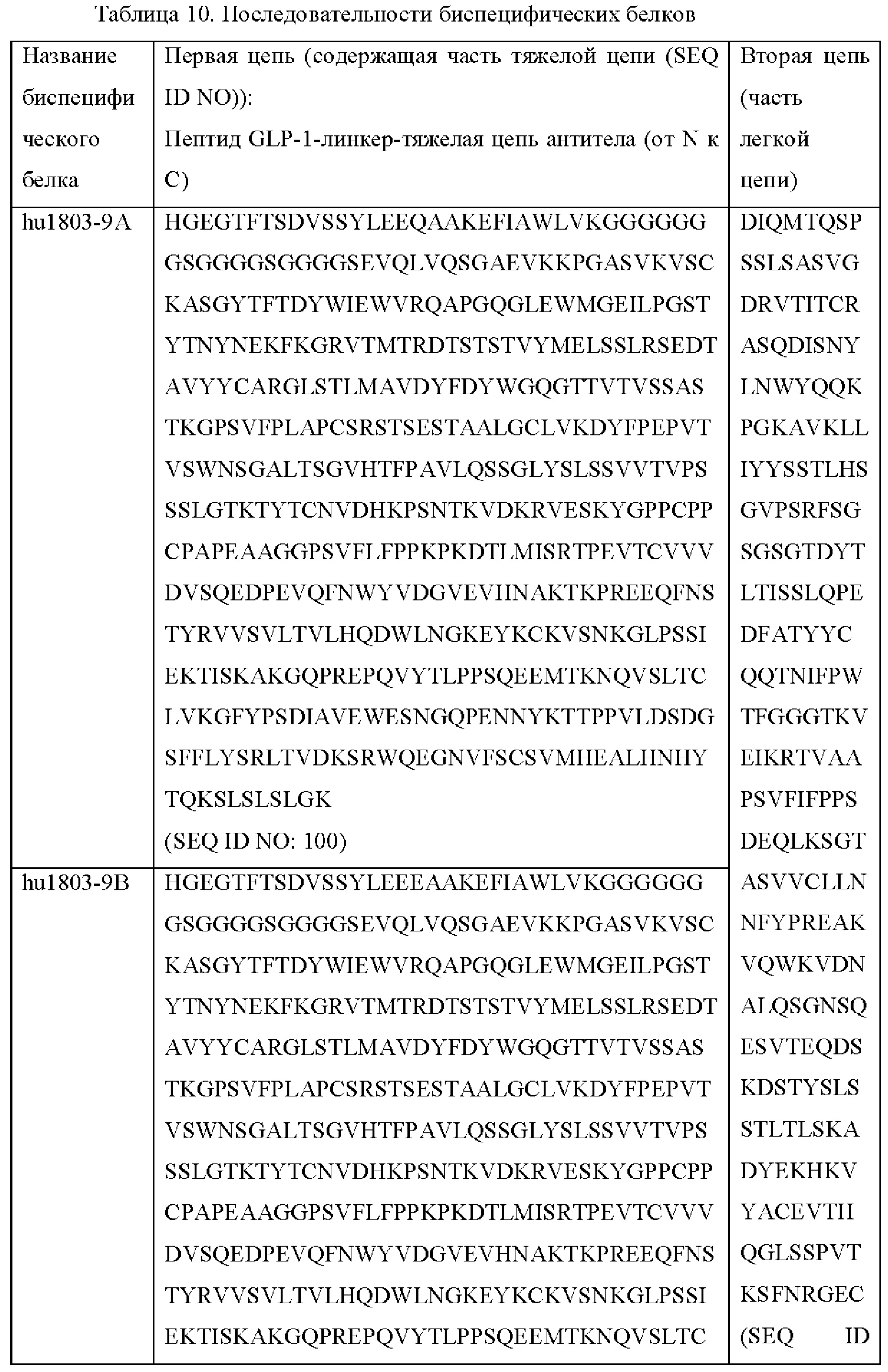






В данном случае в качестве линкера в биспецифическом белке предпочтительно может быть использован линкер (GGGGS)3. В других вариантах осуществления также можно использовать пептидную связь или другие линкеры, обычно используемые для соединения полипептидов. Линкеры для биспецифического белка согласно настоящему изобретению не ограничены использованием (GGGGS)3. Нуклеотидные последовательности, кодирующие GLP-1, антитела к GCGR и фрагмент линкерного белка ((GGGGS)3), были получены обычными техническими средствами в данной области техники. С-концевой нуклеотид GLP-1 был связан с N-концевым нуклеотидом антитела к GCGR посредством линкерного белка с помощью технологии гомологичной рекомбинации и клонирован в вектор Phr-BsmbI. Рекомбинантный биспецифический GLP-1/антитела к GCGR экспрессировали в клетках 293 и очищали способом, описанным в примере 6. Очищенный белок может быть использован в каждом из следующих примеров.
Пример 6: Очистка биспецифического белка антитела
Среду для культивирования клеток центрифугировали на высокой скорости, супернатант собирали и подвергали аффинной хроматографии в качестве первой стадии очистки. Хроматографическая среда представляла собой белок А, который взаимодействует с Fc, или производный наполнитель, такой как Mabselect, GE. Уравновешивающий буфер представлял собой 1×pBS (137 ммоль/л NaCl, 2,7 ммоль/л KCl, 10 ммоль/л Na2HPO4, 2 ммоль/nL KH2PO4, рН 7,4). После уравновешивания колонки 5-кратным колоночным объемом супернатант клеточной культуры загружали для связывания, и скорость потока контролировали так, чтобы время удерживания образца на колонке составляло 1 мин или более. После загрузки образца колонку промывали 1×PBS (рН 7,4) до тех пор, пока УФ-поглощение при 280 нм не упало до исходного уровня. Затем колонку промывали элюирующим буфером 0,1 М глицином (рН 3,0), пик элюирования собирали на основании пика поглощения УФ-излучения при 280 нм, и собранный элюированный образец нейтрализовали 1 М Трис (рН 8,5).
Нейтрализованный элюированный образец подвергали ультрафильтрации и концентрировали, а затем подвергали эксклюзионной хроматографии, в которой использовали буфер 1×pBS, Хроматографическая колонка представляла собой XK26/60 Superdex200 (GE), скорость потока контролировали на уровне 4 мл/мин, а загружаемый объем был менее 5 мл. Пик целевого белка объединяли на основе поглощения УФ-излучения при 280 нм. Собранный белок идентифицировали с помощью SEC-HPLC, и его чистота была выше 95%. После идентификации с помощью ЖХ-МС желаемый белок разделяли на аликвоты для использования. Были получены биспецифические белки GLP-1/антитела к GCGR
Тестовые примеры
Тестовый пример 1: ELISA-анализ (иммуноферментный анализ) связывания химерного антитела к GCGR с GCGR человека, мыши и яванского макака
Связывающую способность антител к GCGR тестировали с помощью анализа связывания антитела с клетками СНО, сверхэкспрессирующими GCGR. Полноразмерные плазмиды GCGR человека, мыши и яванского макака переносили в клетки СНО методом трансфекции, соответственно. Уровни экспрессии GCGR определяли через две недели скрининга под давлением. После того, как клетки, сверхэкспрессирующие GCGR, фиксировали на дне 96-луночного планшета, добавляли антитела и использовали силу сигнала для определения активности связывания антитела со сверхэкспрессирующими GCGR клетками СНО. Связывающие способности антитела к трем видам GCGR определяли с помощью одного и того же анализа связывания. Например, связывание антител GCGR с человеческим GCGR определяли с помощью анализа, подробно описанного следующим образом:
Клетки высевали в 96-луночный планшет при плотности 0,9-1,0×106/мл, 100 мкл/лунку и культивировали в течение ночи. Супернатант отбрасывали, планшет трижды промывали PBS, добавляли 100 мкл/лунку фиксирующего раствора cell immune (Beyotime, кат. № Р0098), фиксировали в течение часа при комнатной температуре, затем четыре раза промывали PBS. Жидкость отбрасывали, добавляли 200 мкл/лунку блокирующего раствора (5% обезжиренное молоко (обезжиренное молоко BD, кат. №232100), разведенное PBS) и инкубировали в инкубаторе при 37°С в течение 3 часов для блокирования. После завершения блокирования блокирующий раствор отбрасывали, планшет промывали 3 раза буфером PBST (PBS, содержащий 0,05% tweenW-20, pH 7,4), 50 мкл/лунку различных концентраций каждого из тестируемых антител (антитела, очищенные из гибридомы, химерные антитела или гуманизированные антитела), разведенные раствором для разведения образцов, и инкубировали в инкубаторе при 37°С в течение 2 часов. После завершения инкубации планшет промывали 3 раза с помощью PBST, 50 мкл/лунку меченого HRP вторичного козьего антитела к мыши (JacksoW ImmuWo Research, кат. №115-035-003) или вторичного козьего антитела к человеку (JacksoW ImmuWo Research, кат. №109-035-003), разведенного раствором для разведения образцов, и инкубировали при 37°С в течение 1 часа. Планшет промывали 3 раза с помощью PBST, добавляли 50 мкл/лунку хромогенного субстрата ТМВ (KPL, кат. №52-00-03), инкубировали при комнатной температуре в течение 10 минут и добавляли 50 мкл/лунку 1М H2SO4 для остановки реакции. Значение поглощения считывали с помощью считывающего устройства для микропланшетов (Thermo scientific Multiskan MK3) при длине волны 450 нм, и данные анализировали с помощью GraphPad Prism 5. Связывание химерных антител к GCGR со сверхэкспрессирующими GCGR клетками СНО рассчитывали как значение ЕС50.

Результаты демонстрируют, что химерные антитела ch1803, ch1805, ch1808, ch1810, ch1817 и ch1822 все обладают благоприятной связывающей активностью с человеческими GCGR на поверхности клеток, а также обладают благоприятной перекрестной аффинностью с GCGR мыши и яванского макака.
Тестовый пример 2: Анализ блокирования химерным антителом к GCGR связывания лиганда GCGR с GCGR
1. Цель:
Антагонистические активности химерных антител к GCGR оценивали с помощью анализа блокирования химерным антителом к GCGR связывания лиганда GCGR (глюкагона) с GCGR.
2. Принцип проведения теста:
Экспрессия гена люциферазы (люциферазы) ниже CRE (ответный элемент цАМФ) может быть индуцирована связыванием цАМФ с CRE. Изменение сигнала флуоресценции, испускаемого связыванием люциферазы с ее субстратом, может отражать эффективность ингибирования. CRE клонировали выше гена люциферазы и котрансфицировали в клетки СНО-K1 плазмидой, содержащей ген GCGR. Отбирали моноклональные клетки, экспрессирующие как CRE, так и GCGR. Биспецифический белок GLP-1/антитела к GCGR может конкурировать с глюкагоном за связывание с GCGR, блокировать передачу сигнала ниже GCGR и влиять на экспрессию нижестоящей цАМФ. Антагонистические активности биспецифических белков GLP-1/антитела к GCGR против GCGR могут быть оценены путем измерения изменений сигнала флуоресценции.
3. Тестируемые образцы:
Химерные антитела ch1803, ch1805, ch1808, ch1810, ch1817 и ch1822.
4. Методика эксперимента
а. Суспензию клеток готовили со свежей средой для культивирования клеток и добавляли в 96-луночный планшет для культивирования клеток с 80 мкл культуральной системы, 20000 клеток/лунку, и инкубировали при 5% CO2, 37°С в течение 16 часов.
b. 10 мкл каждого из подготовленных белков для тестирования добавляли в каждую лунку, затем добавляли 10 мкл подготовленного глюкагона и инкубировали при 5% CO2, 37°С в течение 5 часов.
с. 100 мкл раствора для обнаружения ONE Glo (Promega) добавляли в каждую лунку и помещали в темноту при комнатной температуре на 7 минут.
d. Флуоресценцию определяли на считывающем устройстве для микропланшетов Victor3 и рассчитывали значение IC50 и Imax эффективности блокирования в отношении блокирования слиянием химерного антитела к GCGR связывания лиганда GCGR (глюкагона) с GCGR человека, мыши и яванского макака.
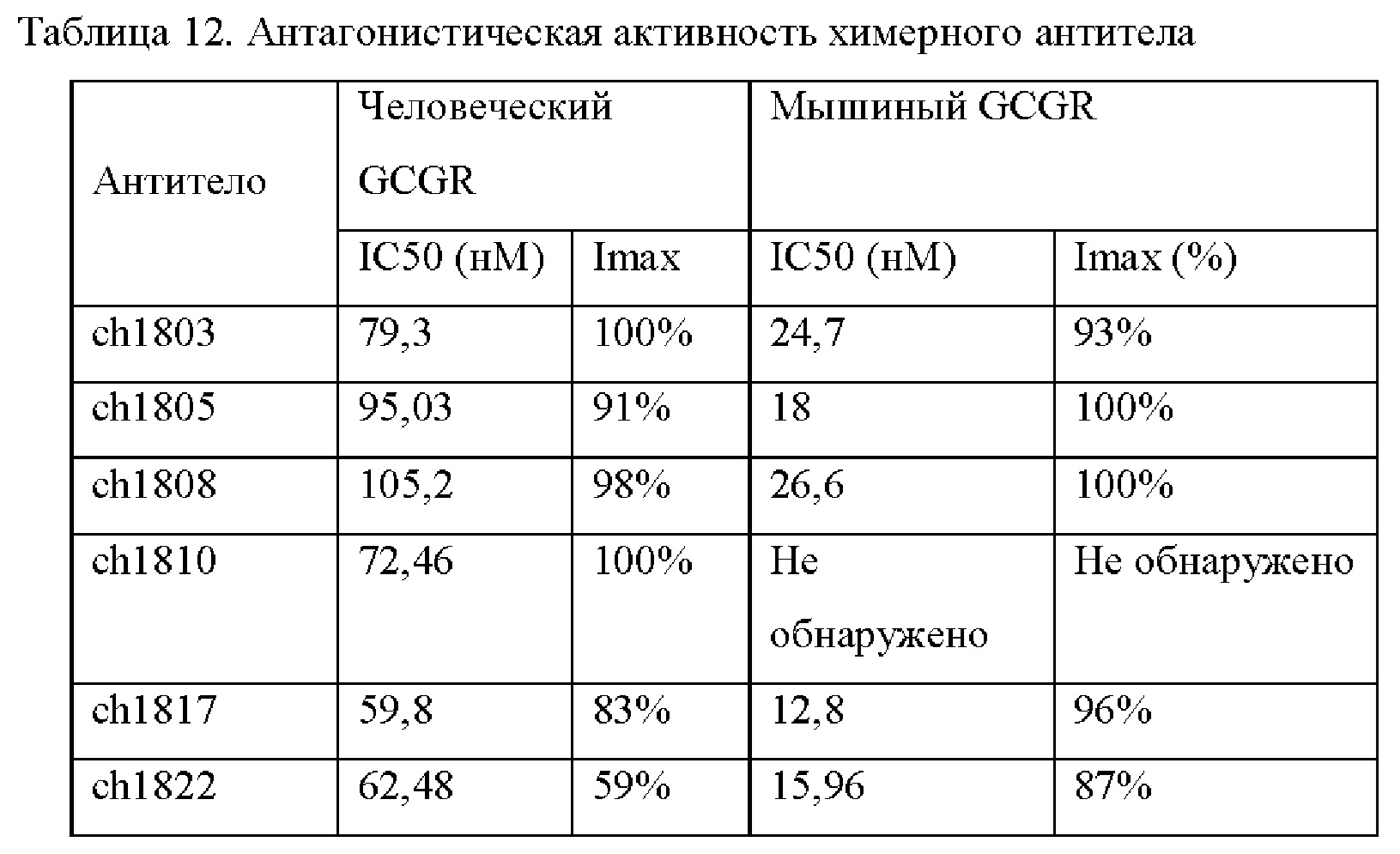
Тестовый пример 3: Анализ блокирования гуманизированным антителом к GCGR связывания лиганда GCGR с GCGR
Антагонистические активности антител к GCGR оценивали с помощью анализа блокирования антителом к GCGR связывания лиганда GCGR (глюкагона) с GCGR. Принцип и этапы эксперимента являются такими же, как и в тестовом примере 2, а результаты представлены в следующей таблице:


Биологическая оценка in vitro
Тестовый пример 4: Стабильность биспецифического белка GLP-1/антитела к GCGR в PBS
200 мкг тестируемого биспецифического белка антитела растворяли в 1 мл 1×PBS (рН 7,4) и хранили в инкубаторе при 37°С; образцы отбирали в дни 0 и 14 соответственно, и сохранение неповрежденной тяжелой цепи определяли с помощью ЖХ-МС на Agilent 6530 Q-TOF. Результаты приведены ниже в таблице 14. Каждый из биспецифических белков пептида GLP-1 с мутациями имеет значительно более высокую стабильность по сравнению с биспецифическим белком, содержащим GLP-1A (SEQ ID NO: 91), и hu1803-9B, hu1803-9D и hu1803-9G демонстрируют лучшую стабильность.

Тестовый пример 5: Анализ блокирования связывания GCGR в клетках
Принцип и этапы эксперимента являются такими же, как и в тестовом примере 2.
Тестируемые образцы:
1) антитела к GCGR (hu1803-9, hu1810-12)
2) Биспецифические белки: hu1803-9B и hu1803-9D.

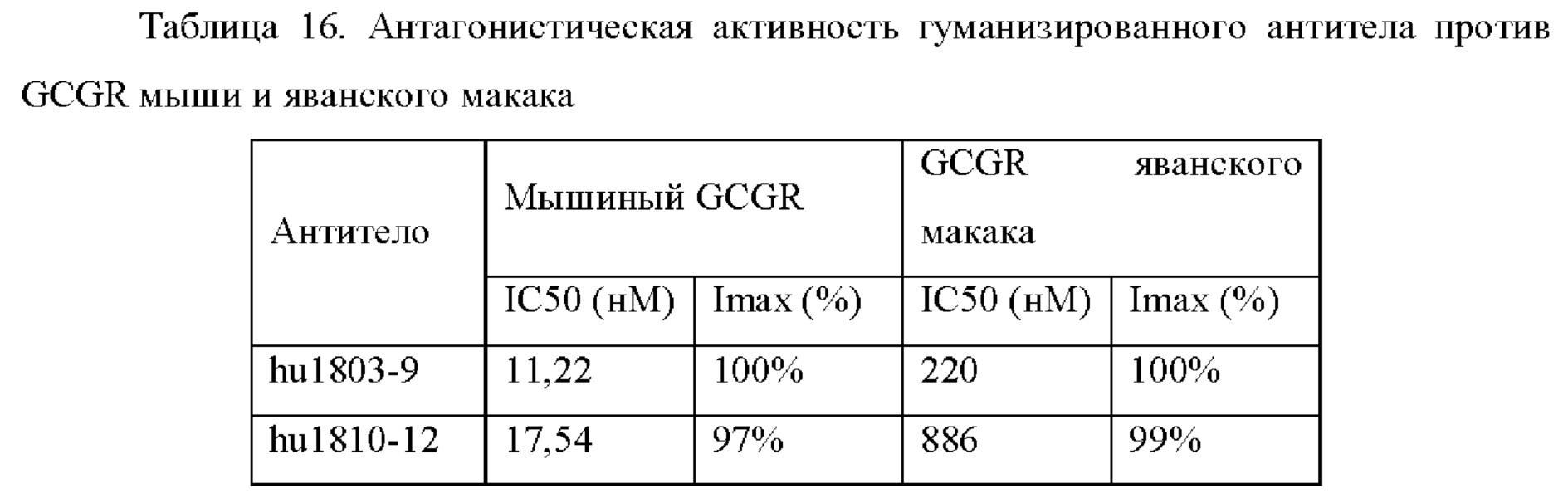
На фиг. 2 и в таблице 15 показано, что как hu1803-9B, так и hu1803-9D могут полностью ингибировать антагонистическую активность GCGR и имеют сопоставимую эффективность и IC50 с моноклональным антителом к GCGR, что указывает на то, что как hu1803-9B, так и hu1803-9D сохраняет полную биологическую активность части антитела к GCGR. В дополнение к подтвержденной антагонистической активности hu1803-9 и биспецифического белка, содержащего hu1803-9, в отношении ингибирования человеческого GCGR, было дополнительно доказано (см. таблицу 16), что как hu1803-9, так и hu1810-12 обладают антагонистической активностью в отношении ингибирования GCGR мыши и яванского макака.
Тестовый пример 6: Анализ активации GLP-1R в клетках
1. Цель:
Цель состоит в том, чтобы оценить активирующую активность части GLP-1 биспецифического белка GLP-1/антитела к GCGR в отношении GLP-1R.
2. Принцип проведения теста:
Экспрессия гена люциферазы ниже CRE может быть индуцирована связыванием цАМФ с CRE. Изменение сигнала флуоресценции, испускаемого связыванием люциферазы с ее субстратом, может отражать эффективность ингибирования. CRE клонировали выше гена люциферазы и котрансфицировали в клетки СНО-K1 плазмидой, содержащей ген GLP-1R. Отбирали моноклональные клетки, на высоком уровне экспрессирующие как CRE, так и GLP-1R. И биспецифический белок GLP-1/антитела к GCGR, и дулаглутид (положительный контроль) могут связываться с GLP-1R, активировать передачу сигнала ниже GLP-1R и стимулировать экспрессию нижестоящей цАМФ. Агонистические активности биспецифических белков GLP-1/антитела к GCGR в отношении GLP-1R могут быть оценены путем измерения изменений сигнала флуоресценции.
3. Тестируемые образцы:
1) Положительный контроль: Дулаглутид
2) hu1803-9B, hu1803-9D.
4. Методика эксперимента
а. Суспензию клеток получают с помощью свежей средой для культивирования клеток и добавляют в 96-луночный планшет для культивирования клеток с 90 мкл культуральной системы, 25000 клеток/лунку, и инкубируют при 5% CO2, 37°С в течение 16 часов.
b. 10 мкл каждого из подготовленных белков для тестирования добавляют в каждую лунку и инкубируют при 5% CO2, 37°С в течение 5 часов.
с. 100 мкл раствора для обнаружения ONE Glo (Promega) добавляют в каждую лунку и помещают в темноту при комнатной температуре на 7 минут.
d. Флуоресценцию определяют на считывающем устройстве для микропланшетов Victor3 и рассчитывают значения ЕС50 биспецифических белков GLP-1/антитела к GCGR в отношении активации GLP-1R посредством связывания.

На фиг. 3 и в таблице 17 показано, что как hu1803-9B, так и hu1803-9D могут полностью активировать GLP-1R и имеют сопоставимую эффективность и ЕС50 (концентрацию, необходимую для активации 50% максимальной активности) с положительным контролем (дулаглутидом), что указывает на то, что как hu1803-9B, так и hu1803-9D сохраняет полную биологическую активность части GLP-1.
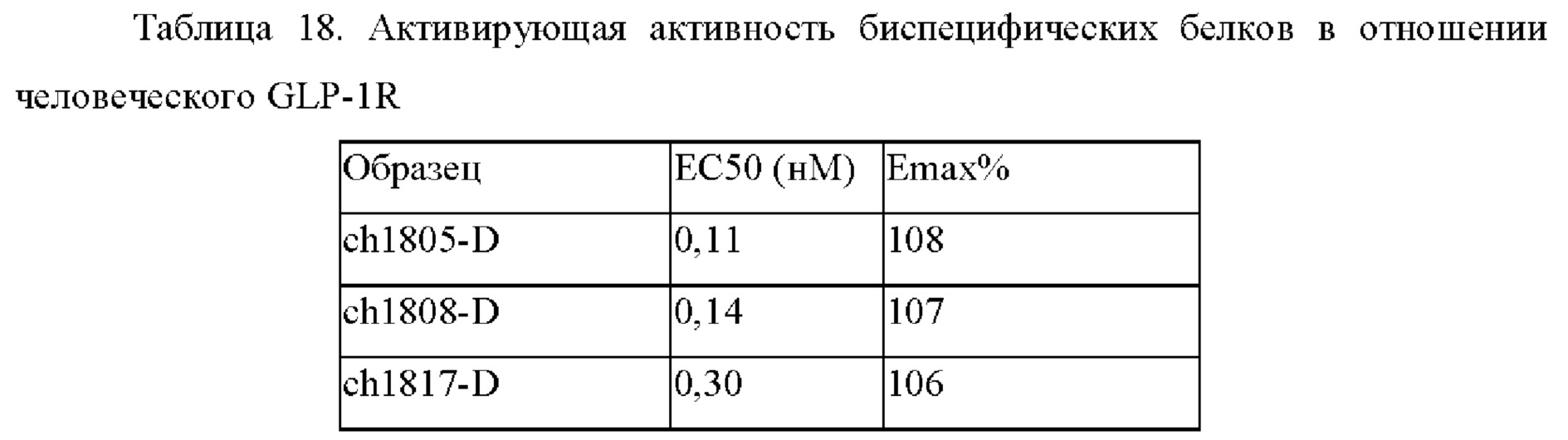
В таблице 18 показано, что все из химерных антител ch1805-D, ch1808-D и ch1817-D, связанных с пептидом GLP1, могут полностью активировать GLP-1 R и имеют сопоставимую эффективность и ЕС50 (концентрацию, необходимую для активации 50% максимальной активности) с положительным контролем (дулаглутидом), что указывает на то, что биспецифические белки, образованные путем связывания различных антител к GCGR с пептидом GLP1 раскрытым в настоящем документе способом, не влияют на биологическую активность пептида GLP1.
Фармакокинетическая оценка
Тестовый пример 7: Определение фармакокинетики in vivo у мышей С57
Четырех лабораторных мышей С57, самок, содержали при регулировании цикла дня и ночи 12/12 часов, постоянной температуре 24±3°С, влажности 50-60% и неограниченном доступе к воде и пище. Мыши были приобретены у Jiesijie Laboratory Animal Co., Ltd. В день испытания эквимолярный hu1803-9D и препарат положительного контроля дулаглутид вводили в хвостовую вену мышей С57 в дозе 6 мг/кг и 2,35 мг/кг, соответственно, и при объеме инъекции 10 мл/кг.
Поскольку как биспецифический белок GLP-1/антитела к GCGR согласно настоящему изобретению, так и дулаглутид положительного контроля обладают перекрестной активностью с мышами, время метаболизма препарата у мышей короче. Выбранные моменты времени для сбора крови представляли собой: 0 ч, 1 ч, 24 ч (2 день) в 1 день после введения и 3 день. Кровь собирали из вены сетчатки мыши по 150 мкл за раз (1,5 мкл ингибитора DPP-4 добавляли в пробирку для сбора крови перед сбором крови). Собранный образец крови помещали при 4°С на полчаса до коагуляции, а затем центрифугировали при 14000×g в течение 5 минут при 4°С. Супернатант (около 80 мкл) собирали и сразу хранили при минус 80°С.
Процесс определения описывается следующим образом:
а. 1 мкг/мл антитела к GLP1 (Novus, NBP1-05180) высевали при 4°С на ночь.
b. Промывали 4 раза 250 мкл 1×PBST, добавляли 200 мкл PBS, содержащего 5% молока, и блокировали при 37°С в течение 3 часов.
с. Промывали 4 раза 250 мкл 1×PBST, добавляли 100 мкл градиента тестируемых препаратов, разведенных пустой сывороткой мыши, и инкубировали при 37°С в течение 2 часов.
d. Промывали 3 раза 250 мкл 1×PBST.
е. 100 мкл меченого пероксидазой хрена вторичного антитела против Fc человеческого IgG добавляли в каждую лунку и инкубировали при 37°С в течение 1 часа.
f. Промывали 3 раза 250 мкл 1×PBST.
g. В каждую лунку добавляли 100 мкл ТМВ, инкубировали при комнатной температуре в течение 10 минут; и затем добавляли 100 мкл 1М H2SO4 для остановки реакции.
h. Поглощение измеряли при 450 нм на считывающем устройстве для микропланшетов; и данные анализировали с помощью Graphpad Prism 5.
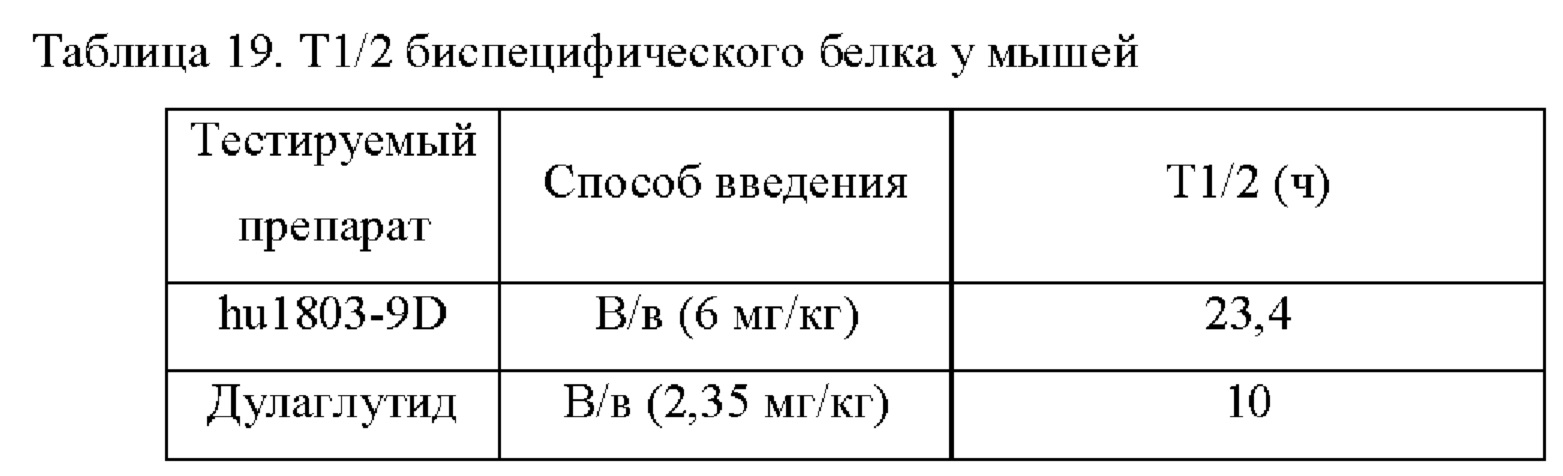
Результаты ФК анализа демонстрируют, что период полувыведения молекулы биспецифического белка hu1803-9D согласно настоящему изобретению у мышей составляет около 23,4 ч, что в два раза больше, чем период полувыведения препарата положительного контроля.
Оценка биологической активности in vivo
Тестовый пример 8: Тест эффективности препарата in vivo на мышах ob/ob 1. Штамм мышей, использованных в этом тесте, представлял собой диабетических мышей ob/ob и мышей дикого типа того же возраста (Институт модельных животных, Нанкинский университет). Цель состоит в том, чтобы наблюдать эффект лечения биспецифическим белком GLP-1/антитела к GCGR, оказываемый на показатели, связанные с диабетом, такие как уровень глюкозы в крови, гликозилированный гемоглобин, масса тела и потребление пищи после непрерывного введения мышам ob/ob.
Перед тестом модельные животные были разделены на 6 групп в соответствии со случайной массой тела и массой тела натощак, случайным уровнем глюкозы в крови и уровнем глюкозы в крови натощак в день теста, соответственно:
Модельная контрольная группа, группы 2,84 мг/кг и 1,42 мг/кг моноклонального антитела к GCGR (hu1803-9), группа положительного контроля 1,16 мг/кг (дулаглутид) и 3 мг/кг и 1,5 мг/кг hu1803-9D. Мышам в контрольной группе подкожно (п/к) инъецировали фосфатный буфер, и мышам в каждой группе проводили подкожную инъекцию один раз в неделю (9:00 утра), всего 4 раза (таблица 20).

2. Методика эксперимента
а. Массу тела натощак и случайную массу тела измеряют один раз в неделю, а потребление пищи и воды - один раз в день.
b. Уровень глюкозы в крови измеряют случайным образом перед первым введением и в дни 1, 2, 3 и 7 после введения, а после этого измеряют уровень глюкозы в крови один раз в неделю. Уровень глюкозы в крови спустя 6 часов голодания измеряют перед первым введением и в дни 3 и 7 после введения, а затем измеряют уровень глюкозы в крови один раз в неделю.
с. На 26 день введения, после того как животных не кормят в течение 6 часов (8:00-14:00), внутрибрюшинно вводят однократную дозу раствора глюкозы 2 г/кг, и время введения глюкозы регистрируют как 0. Животных проверяют на уровень глюкозы в крови за 0 мин до введения глюкозы и через 15, 30, 60, 90 и 120 минут после введения глюкозы. Кривая толерантности к глюкозе была построена на основе данных об уровне глюкозы в крови в зависимости от времени, и была рассчитана площадь под кривой (AUC).
d. После эксперимента мышей не кормят в течение 6 часов (8:00-14:00), а затем умерщвляют. Образцы крови были взяты из сердца, цельная кровь была разделена на две части, одну часть около 30 мкл добавляют в центрифужную пробирку с предварительно добавленным антикоагулянтом и сохраняют для определения гликозилированного гемоглобина, и другую часть оставляют в покое на столе, а затем центрифугируют, для получения сыворотки для определения уровней ТГ (триглицеридов), СЖК (свободных жирных кислот), ХОЛ (холестерина), ЛПВП (липопротеинов высокой плотности) и ЛПНП (липопротеинов низкой плотности).
е. Данные анализируют с помощью программного обеспечения Graphpad Prism 6, а для статистического анализа данных используют t-критерий Стьюдента.
3. Результаты эксперимента:
1) Влияние долгосрочного введения на случайные концентрации глюкозы в крови у мышей ob/ob:
Как показано на фиг. 4, в течение всего эксперимента случайный уровень глюкозы в крови поддерживается на высоком уровне в модельной контрольной группе мышей ob/ob. Случайные уровни глюкозы в крови в каждой из групп введения снижались в различной степени после подкожной инъекции каждого агента в разных дозах один раз в неделю, демонстрируя благоприятную эффективность дозы, которая значительно ниже, чем в модельной контрольной группе. Введение 2,84 мг/кг hu1803-9 и 3 мг/кг hu1803-9D демонстрирует значительно улучшенный эффект снижения уровня глюкозы в крови по сравнению с другими тестируемыми группами, тогда как введение 3 мг/кг hu1803-9D на 3, 6, 14 и 30 день демонстрирует лучший эффект в отношении снижения случайного уровня глюкозы в крови.
2) Влияние долгосрочного введения на уровень глюкозы в крови натощак у мышей ob/ob:
Как показано на фиг. 5, в течение всего эксперимента случайный уровень глюкозы в крови поддерживался на высоком уровне в модельной контрольной группе мышей ob/ob. Уровни глюкозы в крови натощак в каждой из групп введения снижались в различной степени после подкожной инъекции каждого агента в разных дозах один раз в неделю, демонстрируя благоприятную эффективность дозы, которая значительно ниже, чем в модельной контрольной группе. Аналогично тесту на случайную концентрацию глюкозы в крови, введение 2,84 мг/кг hu1803-9 и 3 мг/кг hu1803-9D демонстрирует значительно улучшенный эффект снижения уровня глюкозы в крови по сравнению с другими тестируемыми группами, тогда как введение 3 мг/кг hu1803-9D на 3, 6, 13 и 30 день демонстрирует лучший эффект в отношении снижения уровня глюкозы в крови натощак.
3) Влияние долгосрочного введения на гликозилированный гемоглобин (HbA1c) у мышей ob/ob:
Результаты приведены в таблице 21. Уровень гликозилированного гемоглобина в каждой из групп введения снижался в разной степени через 30 дней после еженедельной подкожной инъекции каждого агента в разных дозах, и был значительно ниже, чем в модельной контрольной группе (Р<0,05). Уровни гликозилированного гемоглобина в группах 3 мг/кг и 1,5 мг/кг hu1803-9D составляли 5,5±0,2% и 4,7±0,1%, соответственно, что свидетельствует о значительном соотношении доза-эффективность; среди них группа 3 мг/кг hu1803-9D имеет более низкий уровень, чем группа эквимолярного 1,16 мг/кг положительного контроля дулаглутида и 2,84 мг/кг моноклонального антитела к GCGR hu1803-9 (Р<0,05).
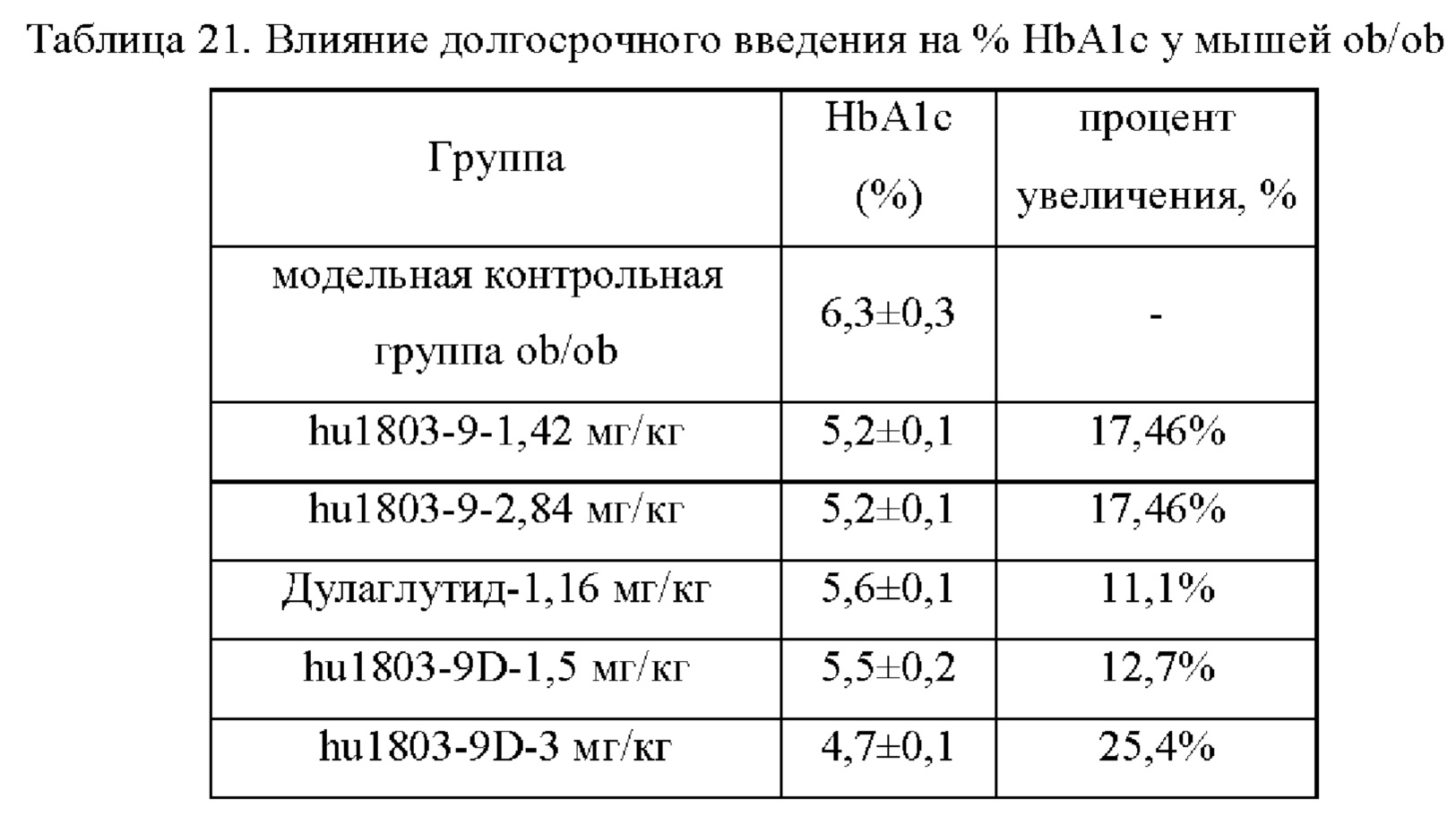
Тестовый пример 9: Конкурентный ELISA-анализ антитела к GCGR
Эпитопы GCGR, связанные с антителами к GCGR, классифицировали с помощью ELISA-анализа, в котором определяли конкурентное связывание меченых биотином антител с различными концентрациями стандартного антитела со сверхэкспрессирующими GCGR клетками СНО. Способ получения планшета с клетками был таким же, как в тестовом примере 1. Последующие конкретные процедуры представляли собой:
Антитело метили в соответствии с инструкциями набора для мечения биотином (Dojindo Molecular Technologies, Inc. LK03). Немеченое тестируемое антитело разводили до диапазона концентраций раствором для разведения образцов в 96-луночном клеточном планшете, 50 мкл/лунку, и инкубировали при 37°С в течение 2 часов. После завершения инкубации планшет промывали 3 раза PBST, добавляли 50 мкл/лунку меченого биотином антитела, разведенного раствором для разведения образцов, в концентрации 0,1 мкг/мл, инкубировали при 37°С в течение 2 часов, промывали планшет 3 раза PBST, добавляли меченое HRP вторичное козье античеловеческое антитело (JacksoW ImmuWo Research, кат. №109-035-003) и инкубировали при 37°С в течение 1 часа. Планшет промывали 3 раза с помощью PBST, добавляли 50 мкл/лунку хромогенного субстрата ТМВ (KPL, кат. №52-00-03), инкубировали при комнатной температуре в течение 10 минут и добавляли 50 мкл/лунку 1М H2SO4 для остановки реакции. Значение поглощения считывали с помощью считывающего устройства для микропланшетов (Thermo scientific Multiskan MK3) при длине волны 450 нм, и данные анализировали с помощью GraphPad Prism 5.
Чем ниже концентрация меченого биотином антитела, связанного с клеточным планшетом для конкуренции, тем ниже значение оптической плотности (OD), и наоборот. Эффективность конкуренции рассчитывали по формуле:
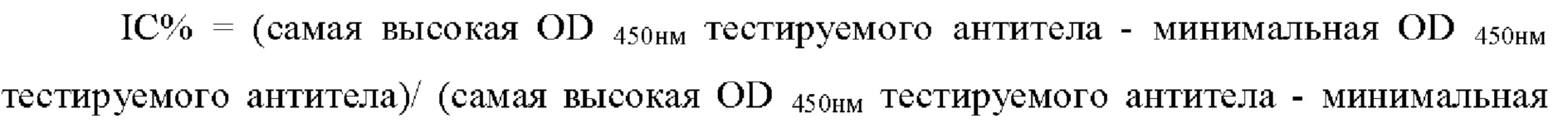



Результаты демонстрируют, что ch1817 и ch1822 имеют очень близкие эпитопы; ch1808, hu1803-9 и hu1810-12 имеют очень близкие эпитопы; в то время как эпитопы, связанные ch1808, hu1803-9 и hu1810-12, предположительно находятся в диапазоне эпитопов, связанных ch1805.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЦЗЯНСУ ХЭНЖУЙ МЕДСИН КО., ЛТД.,
ШАНХАЙ ХЭНЖУЙ ФАРМАСЬЮТИКАЛ КО., ЛТД.
<120> БИСПЕЦИФИЧЕСКИЙ БЕЛОК
<160> 113
<170> SIPOSequenceListing 1.0
<210> 1
<211> 477
<212> ПРТ
<213> Человек разумный
<220>
<221> ПЕПТИД
<223> полноразмерный GCGR
<400> 1
Met Pro Pro Cys Gln Pro Gln Arg Pro Leu Leu Leu Leu Leu Leu Leu
1 5 10 15
Leu Ala Cys Gln Pro Gln Val Pro Ser Ala Gln Val Met Asp Phe Leu
20 25 30
Phe Glu Lys Trp Lys Leu Tyr Gly Asp Gln Cys His His Asn Leu Ser
35 40 45
Leu Leu Pro Pro Pro Thr Glu Leu Val Cys Asn Arg Thr Phe Asp Lys
50 55 60
Tyr Ser Cys Trp Pro Asp Thr Pro Ala Asn Thr Thr Ala Asn Ile Ser
65 70 75 80
Cys Pro Trp Tyr Leu Pro Trp His His Lys Val Gln His Arg Phe Val
85 90 95
Phe Lys Arg Cys Gly Pro Asp Gly Gln Trp Val Arg Gly Pro Arg Gly
100 105 110
Gln Pro Trp Arg Asp Ala Ser Gln Cys Gln Met Asp Gly Glu Glu Ile
115 120 125
Glu Val Gln Lys Glu Val Ala Lys Met Tyr Ser Ser Phe Gln Val Met
130 135 140
Tyr Thr Val Gly Tyr Ser Leu Ser Leu Gly Ala Leu Leu Leu Ala Leu
145 150 155 160
Ala Ile Leu Gly Gly Leu Ser Lys Leu His Cys Thr Arg Asn Ala Ile
165 170 175
His Ala Asn Leu Phe Ala Ser Phe Val Leu Lys Ala Ser Ser Val Leu
180 185 190
Val Ile Asp Gly Leu Leu Arg Thr Arg Tyr Ser Gln Lys Ile Gly Asp
195 200 205
Asp Leu Ser Val Ser Thr Trp Leu Ser Asp Gly Ala Val Ala Gly Cys
210 215 220
Arg Val Ala Ala Val Phe Met Gln Tyr Gly Ile Val Ala Asn Tyr Cys
225 230 235 240
Trp Leu Leu Val Glu Gly Leu Tyr Leu His Asn Leu Leu Gly Leu Ala
245 250 255
Thr Leu Pro Glu Arg Ser Phe Phe Ser Leu Tyr Leu Gly Ile Gly Trp
260 265 270
Gly Ala Pro Met Leu Phe Val Val Pro Trp Ala Val Val Lys Cys Leu
275 280 285
Phe Glu Asn Val Gln Cys Trp Thr Ser Asn Asp Asn Met Gly Phe Trp
290 295 300
Trp Ile Leu Arg Phe Pro Val Phe Leu Ala Ile Leu Ile Asn Phe Phe
305 310 315 320
Ile Phe Val Arg Ile Val Gln Leu Leu Val Ala Lys Leu Arg Ala Arg
325 330 335
Gln Met His His Thr Asp Tyr Lys Phe Arg Leu Ala Lys Ser Thr Leu
340 345 350
Thr Leu Ile Pro Leu Leu Gly Val His Glu Val Val Phe Ala Phe Val
355 360 365
Thr Asp Glu His Ala Gln Gly Thr Leu Arg Ser Ala Lys Leu Phe Phe
370 375 380
Asp Leu Phe Leu Ser Ser Phe Gln Gly Leu Leu Val Ala Val Leu Tyr
385 390 395 400
Cys Phe Leu Asn Lys Glu Val Gln Ser Glu Leu Arg Arg Arg Trp His
405 410 415
Arg Trp Arg Leu Gly Lys Val Leu Trp Glu Glu Arg Asn Thr Ser Asn
420 425 430
His Arg Ala Ser Ser Ser Pro Gly His Gly Pro Pro Ser Lys Glu Leu
435 440 445
Gln Phe Gly Arg Gly Gly Gly Ser Gln Asp Ser Ser Ala Glu Thr Pro
450 455 460
Leu Ala Gly Gly Leu Pro Arg Leu Ala Glu Ser Pro Phe
465 470 475
<210> 2
<211> 122
<212> ПРТ
<213> Мышь домовая
<220>
<221> ДОМЕН
<223> вариабельная область тяжелой цепи m1803
<400> 2
Gln Phe Gln Leu His Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Thr Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Phe Thr Ala Glu Pro Ser Ser Ser Ser Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Thr Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 3
<211> 106
<212> ПРТ
<213> Мышь домовая
<220>
<221> ДОМЕН
<223> вариабельная область легкой цепи m1803
<400> 3
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Ser Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser His Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Thr Asn Ile Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105
<210> 4
<211> 120
<212> ПРТ
<213> Мышь домовая
<220>
<221> ДОМЕН
<223> вариабельная область тяжелой цепи m1805
<400> 4
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Pro Cys Lys Thr Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met Asp Trp Val Lys Gln Ser His Gly Arg Ser Leu Glu Trp Ile
35 40 45
Gly Ser Ile Asp Pro Asp Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Asp Tyr Tyr Gly Ser Ser Ser Trp Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 5
<211> 107
<212> ПРТ
<213> Мышь домовая
<220>
<221> ДОМЕН
<223> вариабельная область легкой цепи m1805
<400> 5
Asp Val Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Asp Arg Val Ser Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Asp Tyr
20 25 30
Leu His Trp Tyr Gln Gln Lys Ser His Glu Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ser Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Pro
65 70 75 80
Glu Asp Val Gly Val Tyr Tyr Cys Gln Asn Gly His Ser Phe Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 6
<211> 122
<212> ПРТ
<213> Мышь домовая
<220>
<221> ДОМЕН
<223> вариабельная область тяжелой цепи m1808
<400> 6
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Asp Thr Phe Thr Thr Asn
20 25 30
Gly Ile Ser Trp Val Lys Gln Arg Ile Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Arg Ser Gly Asn Thr Tyr Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Arg Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Ile Thr Ser Val Ile Gly Ala Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 7
<211> 107
<212> ПРТ
<213> Мышь домовая
<220>
<221> ДОМЕН
<223> вариабельная область легкой цепи m1808
<400> 7
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Lys Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Ser Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 8
<211> 123
<212> ПРТ
<213> Мышь домовая
<220>
<221> ДОМЕН
<223> вариабельная область тяжелой цепи m1810
<400> 8
Gln Val Gln Leu Gln Gln Ser Gly Thr Glu Leu Ala Arg Pro Gly Thr
1 5 10 15
Ser Val Thr Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Ala Ile Ser Trp Val Lys Gln Arg Thr Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Thr Ser Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Arg Ser Ser Lys Thr Met Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Val Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Ser Gly Val Ile Thr Thr Val Val Ser Thr Asp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Ser Pro Leu Thr Val Ser Ser
115 120
<210> 9
<211> 107
<212> ПРТ
<213> Мышь домовая
<220>
<221> ДОМЕН
<223> вариабельная область легкой цепи m1810
<400> 9
Asp Ile Gln Met Thr Gln Ile Pro Ser Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Leu Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Leu Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Thr Leu His Ser Gly Val Ser Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Met Val Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 10
<211> 125
<212> ПРТ
<213> Крыса серая
<220>
<221> ДОМЕН
<223> вариабельная область тяжелой цепи rat1817
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Ala Pro Thr Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Ser Thr Gly Gly Val Asn Thr Tyr Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Ser Glu Glu Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg His Thr Thr Ala Asp Tyr Phe Tyr Gly Ile Tyr Phe Ala Leu
100 105 110
Asp Ala Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 125
<210> 11
<211> 111
<212> ПРТ
<213> Крыса серая
<220>
<221> ДОМЕН
<223> вариабельная область легкой цепи rat1817
<400> 11
Gln Phe Thr Leu Thr Gln Pro Lys Ser Val Ser Gly Ser Leu Arg Ser
1 5 10 15
Thr Ile Thr Ile Pro Cys Glu Arg Ser Ser Gly Asp Ile Gly Asp Ser
20 25 30
Tyr Val Asn Trp Tyr Gln Gln His Leu Gly Arg Pro Pro Leu Asn Val
35 40 45
Ile Tyr Ala Asp Val Gln Arg Pro Ser Glu Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Thr Asn
65 70 75 80
Leu Gln Met Asp Asp Glu Ala Asp Tyr Phe Cys Gln Ser Tyr Asp Thr
85 90 95
Asn Ile Asp Ile Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 12
<211> 125
<212> ПРТ
<213> Крыса серая
<220>
<221> ДОМЕН
<223> вариабельная область тяжелой цепи rat1822
<400> 12
Glu Val Arg Leu Val Glu Ser Gly Gly Asp Phe Val Gln Pro Gly Arg
1 5 10 15
Ser Val Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Ala Pro Thr Lys Gly Leu Glu Trp Val
35 40 45
Gly Ser Ile Ser Thr Gly Gly Val Asn Thr Tyr Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Glu Ser Thr Leu Tyr
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Ser Glu Glu Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg His Thr Thr Pro Asp Tyr His Tyr Gly Ile Tyr Phe Ala Met
100 105 110
Asp Ala Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 125
<210> 13
<211> 111
<212> ПРТ
<213> Крыса серая
<220>
<221> ДОМЕН
<223> вариабельная область легкой цепи rat1822
<400> 13
Gln Val Thr Leu Thr Gln Pro Lys Ser Val Ser Gly Ser Leu Arg Ser
1 5 10 15
Thr Ile Thr Ile Pro Cys Glu Arg Ser Ser Gly Asp Ile Gly Glu Ser
20 25 30
Tyr Val Asn Trp Tyr Gln Gln His Leu Gly Arg Pro Pro Ile Asn Val
35 40 45
Ile Tyr Ala Asp Asp Gln Arg Pro Ser Glu Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Thr Asn
65 70 75 80
Leu Gln Val Asp Asp Glu Ala Asp Tyr Phe Cys Gln Ser Tyr Asp Ser
85 90 95
Ser Ile Asp Ile Phe Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 14
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR1 m1803
<400> 14
Asp Tyr Trp Ile Glu
1 5
<210> 15
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR2 m1803
<400> 15
Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 16
<211> 13
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR3 m1803
<400> 16
Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr
1 5 10
<210> 17
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR1 m1803
<400> 17
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 18
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR2 m1803
<400> 18
Tyr Ser Ser Thr Leu His Ser
1 5
<210> 19
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR3 m1803
<400> 19
Gln Gln Thr Asn Ile Phe Pro Trp Thr
1 5
<210> 20
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR1 m1805
<400> 20
Asp Tyr Asn Met Asp
1 5
<210> 21
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR2 m1805
<400> 21
Ser Ile Asp Pro Asp Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 22
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR3 m1805
<400> 22
Asp Tyr Tyr Gly Ser Ser Ser Trp Phe Ala Tyr
1 5 10
<210> 23
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR1 m1805
<400> 23
Arg Ala Ser Gln Ser Ile Ser Asp Tyr Leu His
1 5 10
<210> 24
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR2 m1805
<400> 24
Tyr Ala Ser Gln Ser Ile Ser
1 5
<210> 25
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR3 m1805
<400> 25
Gln Asn Gly His Ser Phe Pro Tyr Thr
1 5
<210> 26
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR1 m1808
<400> 26
Thr Asn Gly Ile Ser
1 5
<210> 27
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR2 m1808
<400> 27
Glu Ile Tyr Pro Arg Ser Gly Asn Thr Tyr Tyr Asn Glu Asn Phe Lys
1 5 10 15
Gly
<210> 28
<211> 13
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR3 m1808
<400> 28
Ser Ile Thr Ser Val Ile Gly Ala Asp Tyr Phe Asp Tyr
1 5 10
<210> 29
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR1 m1808
<400> 29
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 30
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR2 m1808
<400> 30
Tyr Ser Ser Thr Leu His Ser
1 5
<210> 31
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR3 m1808
<400> 31
Gln Gln Gly Asn Thr Phe Pro Trp Thr
1 5
<210> 32
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR1 m1810
<400> 32
Asn Tyr Ala Ile Ser
1 5
<210> 33
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR2 m1810
<400> 33
Glu Ile Tyr Pro Thr Ser Gly Asn Thr Tyr Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 34
<211> 14
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR3 m1810
<400> 34
Gly Val Ile Thr Thr Val Val Ser Thr Asp Tyr Phe Asp Tyr
1 5 10
<210> 35
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR1 m1810
<400> 35
Arg Ala Ser Leu Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 36
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR2 m1810
<400> 36
Tyr Thr Ser Thr Leu His Ser
1 5
<210> 37
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR3 m1810
<400> 37
Gln Gln Gly Asn Met Val Pro Tyr Thr
1 5
<210> 38
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR1 rat1817
<400> 38
Asn Tyr Tyr Met Ala
1 5
<210> 39
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR2 rat1817
<400> 39
Ser Ile Ser Thr Gly Gly Val Asn Thr Tyr Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 40
<211> 16
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR3 rat1817
<400> 40
His Thr Thr Ala Asp Tyr Phe Tyr Gly Ile Tyr Phe Ala Leu Asp Ala
1 5 10 15
<210> 41
<211> 13
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR1 rat1817
<400> 41
Glu Arg Ser Ser Gly Asp Ile Gly Asp Ser Tyr Val Asn
1 5 10
<210> 42
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR2 rat1817
<400> 42
Ala Asp Val Gln Arg Pro Ser
1 5
<210> 43
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR3 rat1817
<400> 43
Gln Ser Tyr Asp Thr Asn Ile Asp Ile Ile
1 5 10
<210> 44
<211> 16
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR3 rat1822
<400> 44
His Thr Thr Pro Asp Tyr His Tyr Gly Ile Tyr Phe Ala Met Asp Ala
1 5 10 15
<210> 45
<211> 13
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR1 rat1822
<400> 45
Glu Arg Ser Ser Gly Asp Ile Gly Glu Ser Tyr Val Asn
1 5 10
<210> 46
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR2 rat1822
<400> 46
Ala Asp Asp Gln Arg Pro Ser
1 5
<210> 47
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR3 rat1822
<400> 47
Gln Ser Tyr Asp Ser Ser Ile Asp Ile Phe
1 5 10
<210> 48
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула HCDR1 мышиного антитела formula
<220>
<221> ДОМЕН
<222> (1)..(3)
<223> Xaa-Xaa-Xaa выбран из Asp-Tyr-Trp, Thr-Asn-Gly или Asn-Tyr-Ala
<220>
<221> ДОМЕН
<222> (5)..(5)
<223> Xaa выбран из Glu или Ser
<400> 48
Xaa Xaa Xaa Ile Xaa
1 5
<210> 49
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула HCDR2 мышиного антитела
<220>
<221> ДОМЕН
<222> (3)..(3)
<223> Xaa выбран из Leu или Tyr.
<220>
<221> ДОМЕН
<222> (5)..(5)
<223> Xaa выбран из Gly, Arg или Thr.
<220>
<221> ДОМЕН
<222> (7)..(7)
<223> Xaa выбран из Gly или Thr.
<220>
<221> ДОМЕН
<222> (8)..(8)
<223> Xaa выбран из Tyr или Asn.
<220>
<221> ДОМЕН
<222> (10)..(10)
<223> Xaa выбран из Asn или Tyr.
<400> 49
Glu Ile Xaa Pro Xaa Ser Xaa Xaa Thr Xaa Tyr Asn Glu Xaa Phe Lys
1 5 10 15
Gly
<210> 50
<211> 13
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула HCDR3 мышиного антитела
<220>
<221> ДОМЕН
<222> (1)..(1)
<223> Xaa выбран из Gly или Ser.
<220>
<221> ДОМЕН
<222> (2)..(2)
<223> Xaa выбран из Ile, Leu или Val-Ile.
<220>
<221> ДОМЕН
<222> (3)..(3)
<223> Xaa выбран из Ser или Thr
<220>
<221> ДОМЕН
<222> (4)..(4)
<223> Xaa выбран из Ser или Thr
<220>
<221> ДОМЕН
<222> (5)..(5)
<223> Xaa выбран из Leu или Val.
<220>
<221> ДОМЕН
<222> (6)..(6)
<223> Xaa выбран из Met, Val или Ile.
<220>
<221> ДОМЕН
<222> (7)..(7)
<223> Xaa выбран из Ser, Gly или Ala.
<220>
<221> ДОМЕН
<222> (8)..(8)
<223> Xaa выбран из Thr, Ala или Val.
<400> 50
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Asp Tyr Phe Asp Tyr
1 5 10
<210> 51
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула LCDR1 мышиного антитела
<220>
<221> ДОМЕН
<222> (4)..(4)
<223> Xaa выбран из Leu или Gln.
<400> 51
Arg Ala Ser Xaa Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 52
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула LCDR2 мышиного антитела
<220>
<221> ДОМЕН
<222> (2)..(2)
<223> Xaa выбран из Ser или Thr.
<400> 52
Tyr Xaa Ser Thr Leu His Ser
1 5
<210> 53
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула LCDR3 мышиного антитела
<220>
<221> ДОМЕН
<222> (3)..(3)
<223> Xaa выбран из Thr или Gly.
<220>
<221> ДОМЕН
<222> (5)..(5)
<223> Xaa выбран из Met, Thr или Ile.
<220>
<221> ДОМЕН
<222> (6)..(6)
<223> Xaa выбран из Phe или Val.
<220>
<221> ДОМЕН
<222> (8)..(8)
<223> Xaa выбран из Trp или Tyr.
<400> 53
Gln Gln Xaa Asn Xaa Xaa Pro Xaa Thr
1 5
<210> 54
<211> 16
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула HCDR3 крысиного антитела
<220>
<221> ДОМЕН
<222> (4)..(4)
<223> Xaa выбран из Pro или Ala.
<220>
<221> ДОМЕН
<222> (7)..(7)
<223> Xaa выбран из Phe или His.
<220>
<221> ДОМЕН
<222> (14)..(14)
<223> Xaa выбран из Leu или Met.
<400> 54
His Thr Thr Xaa Asp Tyr Xaa Tyr Gly Ile Tyr Phe Ala Xaa Asp Ala
1 5 10 15
<210> 55
<211> 13
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула LCDR1 крысиного антитела
<220>
<221> ДОМЕН
<222> (9)..(9)
<223> Xaa выбран из Glu или Asp.
<400> 55
Glu Arg Ser Ser Gly Asp Ile Gly Xaa Ser Tyr Val Asn
1 5 10
<210> 56
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула LCDR2 крысиного антитела
<220>
<221> ДОМЕН
<222> (3)..(3)
<223> Xaa выбран из Asp или Val.
<400> 56
Ala Asp Xaa Gln Arg Pro Ser
1 5
<210> 57
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> общая формула LCDR3 крысиного антитела
<220>
<221> ДОМЕН
<222> (5)..(5)
<223> Xaa выбран из Ser или Thr.
<220>
<221> ДОМЕН
<222> (6)..(6)
<223> Xaa выбран из Ser или Asn.
<220>
<221> ДОМЕН
<222> (10)..(10)
<223> Xaa выбран из Phe или Ile.
<400> 57
Gln Ser Tyr Asp Xaa Xaa Ile Asp Ile Xaa
1 5 10
<210> 58
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu1803_VL.1
<400> 58
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ser Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Asn Ile Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 59
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu1803_VL.1A
<400> 59
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gly Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Ser Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Thr Asn Ile Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 60
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu1803_VL.1B
<400> 60
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Ser Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Asn Ile Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 61
<211> 122
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu1803_VH.1
<400> 61
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 62
<211> 122
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu1803_VH.1A
<400> 62
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Phe Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 63
<211> 122
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu1803_VH.1B
<400> 63
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Phe Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 64
<211> 122
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu1803_VH.1C
<400> 64
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Ile Glu Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Phe Thr Ala Asp Pro Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 65
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Hu1810_VL.1
<400> 65
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Leu Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Met Val Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 66
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Hu1810_VL.1A
<400> 66
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Leu Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Thr Leu His Ser Gly Val Ser Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Met Val Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 67
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Hu1810_VL.1B
<400> 67
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Leu Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Leu Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Thr Leu His Ser Gly Val Ser Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Met Val Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 68
<211> 123
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Hu1810_VH.1
<400> 68
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Tyr Pro Thr Ser Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Val Ile Thr Thr Val Val Ser Thr Asp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 69
<211> 123
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Hu1810_VH.1A
<400> 69
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Tyr Pro Thr Ser Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Arg Ser Thr Ser Thr Met Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Val Ile Thr Thr Val Val Ser Thr Asp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 70
<211> 123
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Hu1810_VH.1B
<400> 70
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Thr Ser Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Arg Ser Thr Ser Thr Met Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Val Ile Thr Thr Val Val Ser Thr Asp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 71
<211> 123
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Hu1810_VH.1C
<400> 71
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Ala Ile Ser Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Thr Ser Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Arg Ser Thr Ser Thr Met Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Val Ile Thr Thr Val Val Ser Thr Asp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 72
<211> 327
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> константная область тяжелой цепи IgG4-AA
<400> 72
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 73
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> константная область легкой цепи (каппа-цепь) антитела
<400> 73
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 74
<211> 449
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> тяжелая цепь ch1803
<400> 74
Gln Phe Gln Leu His Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Thr Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Phe Thr Ala Glu Pro Ser Ser Ser Ser Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Thr Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 75
<211> 213
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> легкая цепь ch1803
<400> 75
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Ser Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser His Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Thr Asn Ile Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 76
<211> 449
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> тяжелая цепь hu1803-1
<400> 76
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 77
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> легкая цепь hu1803-1
<400> 77
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ser Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Asn Ile Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 78
<211> 449
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> тяжелая цепь hu1803-9
<400> 78
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Trp Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 79
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> легкая цепь hu1803-9
<400> 79
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Ser Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Asn Ile Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 80
<211> 447
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> тяжелая цепь ch1805
<400> 80
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Pro Cys Lys Thr Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met Asp Trp Val Lys Gln Ser His Gly Arg Ser Leu Glu Trp Ile
35 40 45
Gly Ser Ile Asp Pro Asp Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Asp Tyr Tyr Gly Ser Ser Ser Trp Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 81
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> легкая цепь ch1805
<400> 81
Asp Val Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Asp Arg Val Ser Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Asp Tyr
20 25 30
Leu His Trp Tyr Gln Gln Lys Ser His Glu Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ser Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Pro
65 70 75 80
Glu Asp Val Gly Val Tyr Tyr Cys Gln Asn Gly His Ser Phe Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 82
<211> 449
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> тяжелая цепь ch1808
<400> 82
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Asp Thr Phe Thr Thr Asn
20 25 30
Gly Ile Ser Trp Val Lys Gln Arg Ile Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Arg Ser Gly Asn Thr Tyr Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Arg Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Ile Thr Ser Val Ile Gly Ala Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 83
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> легкая цепь ch1808
<400> 83
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Lys Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Ser Ser Thr Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 84
<211> 450
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> тяжелая цепь hu1810-12
<400> 84
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Ala Ile Ser Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Thr Ser Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Arg Ser Thr Ser Thr Met Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Val Ile Thr Thr Val Val Ser Thr Asp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 85
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> легкая цепь hu1810-12
<400> 85
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Leu Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Leu Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Thr Leu His Ser Gly Val Ser Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Met Val Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 86
<211> 452
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> тяжелая цепь ch1817
<400> 86
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Ala Pro Thr Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Ser Thr Gly Gly Val Asn Thr Tyr Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Ser Glu Glu Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg His Thr Thr Ala Asp Tyr Phe Tyr Gly Ile Tyr Phe Ala Leu
100 105 110
Asp Ala Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser
130 135 140
Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys
195 200 205
Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215 220
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Leu Gly Lys
450
<210> 87
<211> 218
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> легкая цепь ch1817
<400> 87
Gln Phe Thr Leu Thr Gln Pro Lys Ser Val Ser Gly Ser Leu Arg Ser
1 5 10 15
Thr Ile Thr Ile Pro Cys Glu Arg Ser Ser Gly Asp Ile Gly Asp Ser
20 25 30
Tyr Val Asn Trp Tyr Gln Gln His Leu Gly Arg Pro Pro Leu Asn Val
35 40 45
Ile Tyr Ala Asp Val Gln Arg Pro Ser Glu Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Thr Asn
65 70 75 80
Leu Gln Met Asp Asp Glu Ala Asp Tyr Phe Cys Gln Ser Tyr Asp Thr
85 90 95
Asn Ile Asp Ile Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 88
<211> 452
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> тяжелая цепь ch1822
<400> 88
Glu Val Arg Leu Val Glu Ser Gly Gly Asp Phe Val Gln Pro Gly Arg
1 5 10 15
Ser Val Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Ala Pro Thr Lys Gly Leu Glu Trp Val
35 40 45
Gly Ser Ile Ser Thr Gly Gly Val Asn Thr Tyr Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Glu Ser Thr Leu Tyr
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Ser Glu Glu Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg His Thr Thr Pro Asp Tyr His Tyr Gly Ile Tyr Phe Ala Met
100 105 110
Asp Ala Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser
130 135 140
Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys
195 200 205
Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215 220
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Leu Gly Lys
450
<210> 89
<211> 218
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> легкая цепь ch1822
<400> 89
Gln Val Thr Leu Thr Gln Pro Lys Ser Val Ser Gly Ser Leu Arg Ser
1 5 10 15
Thr Ile Thr Ile Pro Cys Glu Arg Ser Ser Gly Asp Ile Gly Glu Ser
20 25 30
Tyr Val Asn Trp Tyr Gln Gln His Leu Gly Arg Pro Pro Ile Asn Val
35 40 45
Ile Tyr Ala Asp Asp Gln Arg Pro Ser Glu Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Thr Asn
65 70 75 80
Leu Gln Val Asp Asp Glu Ala Asp Tyr Phe Cys Gln Ser Tyr Asp Ser
85 90 95
Ser Ile Asp Ile Phe Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 90
<211> 275
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> Дулаглутид
<400> 90
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Glu
35 40 45
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
50 55 60
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly
275
<210> 91
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> GLP-1A
<400> 91
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly
20 25 30
<210> 92
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> GLP-1B
<400> 92
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly
20 25 30
<210> 93
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> GLP-1C
<400> 93
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
20 25 30
<210> 94
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> GLP-1D
<400> 94
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Lys Gly Gly Gly
20 25 30
<210> 95
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> GLP-1E
<400> 95
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Lys Gly Arg Gly
20 25 30
<210> 96
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> GLP-1F
<400> 96
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Gly Gly
20 25 30
<210> 97
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> GLP-1G
<400> 97
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Arg Gly Gly Gly
20 25 30
<210> 98
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> GLP-1H
<400> 98
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
20 25 30
<210> 99
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> GLP-1J
<400> 99
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Arg Gly Arg Gly
20 25 30
<210> 100
<211> 495
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1803-9A содержащий часть тяжелой цепи
<400> 100
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val
50 55 60
Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Trp Ile
65 70 75 80
Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Glu
85 90 95
Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys Gly
100 105 110
Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu
115 120 125
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
130 135 140
Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp Gly Gln
145 150 155 160
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
165 170 175
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
180 185 190
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
195 200 205
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
210 215 220
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
225 230 235 240
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
245 250 255
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
260 265 270
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
305 310 315 320
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 101
<211> 495
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1803-9B содержащий часть тяжелой цепи
<400> 101
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val
50 55 60
Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Trp Ile
65 70 75 80
Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Glu
85 90 95
Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys Gly
100 105 110
Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu
115 120 125
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
130 135 140
Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp Gly Gln
145 150 155 160
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
165 170 175
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
180 185 190
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
195 200 205
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
210 215 220
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
225 230 235 240
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
245 250 255
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
260 265 270
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
305 310 315 320
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 102
<211> 496
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1803-9C содержащий часть тяжелой цепи
<400> 102
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly Gly
20 25 30
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
35 40 45
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
50 55 60
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Trp
65 70 75 80
Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
85 90 95
Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys
100 105 110
Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met
115 120 125
Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala
130 135 140
Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp Gly
145 150 155 160
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
165 170 175
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
180 185 190
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
195 200 205
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
210 215 220
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
225 230 235 240
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
245 250 255
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
275 280 285
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
290 295 300
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
305 310 315 320
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
325 330 335
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
340 345 350
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
355 360 365
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
370 375 380
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
385 390 395 400
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
405 410 415
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
420 425 430
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
435 440 445
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
450 455 460
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
465 470 475 480
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 103
<211> 495
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1803-9D содержащий часть тяжелой цепи
<400> 103
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val
50 55 60
Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Trp Ile
65 70 75 80
Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Glu
85 90 95
Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys Gly
100 105 110
Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu
115 120 125
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
130 135 140
Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp Gly Gln
145 150 155 160
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
165 170 175
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
180 185 190
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
195 200 205
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
210 215 220
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
225 230 235 240
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
245 250 255
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
260 265 270
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
305 310 315 320
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 104
<211> 496
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1803-9E содержащий часть тяжелой цепи
<400> 104
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Lys Gly Arg Gly Gly
20 25 30
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
35 40 45
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
50 55 60
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Trp
65 70 75 80
Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
85 90 95
Glu Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys
100 105 110
Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met
115 120 125
Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala
130 135 140
Arg Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp Gly
145 150 155 160
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
165 170 175
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
180 185 190
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
195 200 205
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
210 215 220
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
225 230 235 240
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
245 250 255
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
275 280 285
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
290 295 300
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
305 310 315 320
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
325 330 335
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
340 345 350
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
355 360 365
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
370 375 380
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
385 390 395 400
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
405 410 415
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
420 425 430
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
435 440 445
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
450 455 460
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
465 470 475 480
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 105
<211> 495
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1803-9F содержащий часть тяжелой цепи
<400> 105
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val
50 55 60
Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Trp Ile
65 70 75 80
Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Glu
85 90 95
Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys Gly
100 105 110
Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu
115 120 125
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
130 135 140
Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp Gly Gln
145 150 155 160
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
165 170 175
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
180 185 190
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
195 200 205
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
210 215 220
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
225 230 235 240
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
245 250 255
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
260 265 270
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
305 310 315 320
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 106
<211> 495
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1803-9G содержащий часть тяжелой цепи
<400> 106
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Arg Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val
50 55 60
Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Trp Ile
65 70 75 80
Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Glu
85 90 95
Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys Gly
100 105 110
Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu
115 120 125
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
130 135 140
Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp Gly Gln
145 150 155 160
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
165 170 175
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
180 185 190
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
195 200 205
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
210 215 220
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
225 230 235 240
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
245 250 255
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
260 265 270
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
305 310 315 320
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 107
<211> 495
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1803-9H содержащий часть тяжелой цепи
<400> 107
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val
50 55 60
Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Trp Ile
65 70 75 80
Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Glu
85 90 95
Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys Gly
100 105 110
Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu
115 120 125
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
130 135 140
Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp Gly Gln
145 150 155 160
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
165 170 175
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
180 185 190
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
195 200 205
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
210 215 220
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
225 230 235 240
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
245 250 255
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
260 265 270
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
305 310 315 320
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 108
<211> 495
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1803-9J содержащий часть тяжелой цепи
<400> 108
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Arg Gly Arg Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val
50 55 60
Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Trp Ile
65 70 75 80
Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Glu
85 90 95
Ile Leu Pro Gly Ser Thr Tyr Thr Asn Tyr Asn Glu Lys Phe Lys Gly
100 105 110
Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu
115 120 125
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
130 135 140
Gly Leu Ser Thr Leu Met Ala Val Asp Tyr Phe Asp Tyr Trp Gly Gln
145 150 155 160
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
165 170 175
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
180 185 190
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
195 200 205
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
210 215 220
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
225 230 235 240
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
245 250 255
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
260 265 270
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
305 310 315 320
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 109
<211> 493
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> ch1805-D содержащий часть тяжелой цепи
<400> 109
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val
50 55 60
Lys Ile Pro Cys Lys Thr Ser Gly Tyr Thr Phe Thr Asp Tyr Asn Met
65 70 75 80
Asp Trp Val Lys Gln Ser His Gly Arg Ser Leu Glu Trp Ile Gly Ser
85 90 95
Ile Asp Pro Asp Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe Lys Gly
100 105 110
Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met Glu
115 120 125
Leu Arg Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys Thr Arg
130 135 140
Asp Tyr Tyr Gly Ser Ser Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
145 150 155 160
Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
165 170 175
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
180 185 190
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
195 200 205
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
210 215 220
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
225 230 235 240
Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
245 250 255
Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys
260 265 270
Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu
275 280 285
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
290 295 300
Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln
305 310 315 320
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
325 330 335
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
340 345 350
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
355 360 365
Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys
370 375 380
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
385 390 395 400
Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
405 410 415
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
420 425 430
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
435 440 445
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
450 455 460
Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
465 470 475 480
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490
<210> 110
<211> 495
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> ch1808-D содержащий часть тяжелой цепи
<400> 110
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val
35 40 45
Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala Ser Val
50 55 60
Lys Leu Ser Cys Lys Ala Ser Gly Asp Thr Phe Thr Thr Asn Gly Ile
65 70 75 80
Ser Trp Val Lys Gln Arg Ile Gly Gln Gly Leu Glu Trp Ile Gly Glu
85 90 95
Ile Tyr Pro Arg Ser Gly Asn Thr Tyr Tyr Asn Glu Asn Phe Lys Gly
100 105 110
Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Thr Thr Ala Tyr Met Glu
115 120 125
Leu Arg Arg Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys Ala Arg
130 135 140
Ser Ile Thr Ser Val Ile Gly Ala Asp Tyr Phe Asp Tyr Trp Gly Gln
145 150 155 160
Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
165 170 175
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
180 185 190
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
195 200 205
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
210 215 220
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
225 230 235 240
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
245 250 255
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
260 265 270
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
305 310 315 320
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
370 375 380
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 111
<211> 496
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> hu1810-12D содержащий часть тяжелой цепи
<400> 111
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val
35 40 45
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser Ser Val
50 55 60
Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr Ala Ile
65 70 75 80
Ser Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile Gly Glu
85 90 95
Ile Tyr Pro Thr Ser Gly Asn Thr Tyr Tyr Asn Glu Lys Phe Lys Gly
100 105 110
Lys Ala Thr Leu Thr Ala Asp Arg Ser Thr Ser Thr Met Tyr Met Glu
115 120 125
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ser
130 135 140
Gly Val Ile Thr Thr Val Val Ser Thr Asp Tyr Phe Asp Tyr Trp Gly
145 150 155 160
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
165 170 175
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
180 185 190
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
195 200 205
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
210 215 220
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
225 230 235 240
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
245 250 255
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
275 280 285
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
290 295 300
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
305 310 315 320
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
325 330 335
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
340 345 350
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
355 360 365
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
370 375 380
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
385 390 395 400
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
405 410 415
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
420 425 430
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
435 440 445
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
450 455 460
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
465 470 475 480
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
<210> 112
<211> 498
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> ch1817-D содержащий часть тяжелой цепи
<400> 112
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Val Glu Ser Gly Gly Asp Leu Val Gln Pro Gly Arg Ser Met
50 55 60
Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Tyr Met
65 70 75 80
Ala Trp Val Arg Gln Ala Pro Thr Lys Gly Leu Glu Trp Val Ala Ser
85 90 95
Ile Ser Thr Gly Gly Val Asn Thr Tyr Tyr Arg Asp Ser Val Lys Gly
100 105 110
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr Leu Gln
115 120 125
Met Asp Ser Leu Arg Ser Glu Glu Thr Ala Thr Tyr Tyr Cys Ala Arg
130 135 140
His Thr Thr Ala Asp Tyr Phe Tyr Gly Ile Tyr Phe Ala Leu Asp Ala
145 150 155 160
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly
165 170 175
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
180 185 190
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
195 200 205
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
210 215 220
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
225 230 235 240
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
245 250 255
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
260 265 270
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
275 280 285
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
290 295 300
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
305 310 315 320
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
325 330 335
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
340 345 350
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
355 360 365
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
370 375 380
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
385 390 395 400
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
405 410 415
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
420 425 430
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
435 440 445
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
450 455 460
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
465 470 475 480
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
485 490 495
Gly Lys
<210> 113
<211> 498
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> ch1822-D содержащий часть тяжелой цепи
<400> 113
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Glu Ala Ala Lys Glu Phe Val Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
35 40 45
Gln Leu Val Glu Ser Gly Gly Asp Leu Val Gln Pro Gly Arg Ser Met
50 55 60
Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Tyr Met
65 70 75 80
Ala Trp Val Arg Gln Ala Pro Thr Lys Gly Leu Glu Trp Val Ala Ser
85 90 95
Ile Ser Thr Gly Gly Val Asn Thr Tyr Tyr Arg Asp Ser Val Lys Gly
100 105 110
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr Leu Gln
115 120 125
Met Asp Ser Leu Arg Ser Glu Glu Thr Ala Thr Tyr Tyr Cys Ala Arg
130 135 140
His Thr Thr Ala Asp Tyr Phe Tyr Gly Ile Tyr Phe Ala Leu Asp Ala
145 150 155 160
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly
165 170 175
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
180 185 190
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
195 200 205
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
210 215 220
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
225 230 235 240
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
245 250 255
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
260 265 270
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
275 280 285
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
290 295 300
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
305 310 315 320
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
325 330 335
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
340 345 350
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
355 360 365
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
370 375 380
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
385 390 395 400
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
405 410 415
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
420 425 430
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
435 440 445
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
450 455 460
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
465 470 475 480
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
485 490 495
Gly Lys
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению моноклональных антител к GCGR (рецептору глюкагона), и может быть использовано в медицине для снижения концентрации глюкозы в крови. Предложены моноклональные антитела к GCGR, содержащие определенные комбинации вариабельной области тяжелой цепи и вариабельной области легкой цепи. Изобретение обеспечивает получение антител, специфически связывающихся с GCGR, и биспецифических белков на их основе, включающих также пептид GLP-1, эффективных в лечении диабета. 11 н. и 13 з.п. ф-лы, 5 ил., 22 табл., 9 пр.

Комментарии