Пептиды глюкагонового суперсемейства, обладающие активностью относительно ядерных гормональных рецепторов - RU2604067C2
Код документа: RU2604067C2
Чертежи




























































































































































































































































































































































































































































































































































































































































































































































































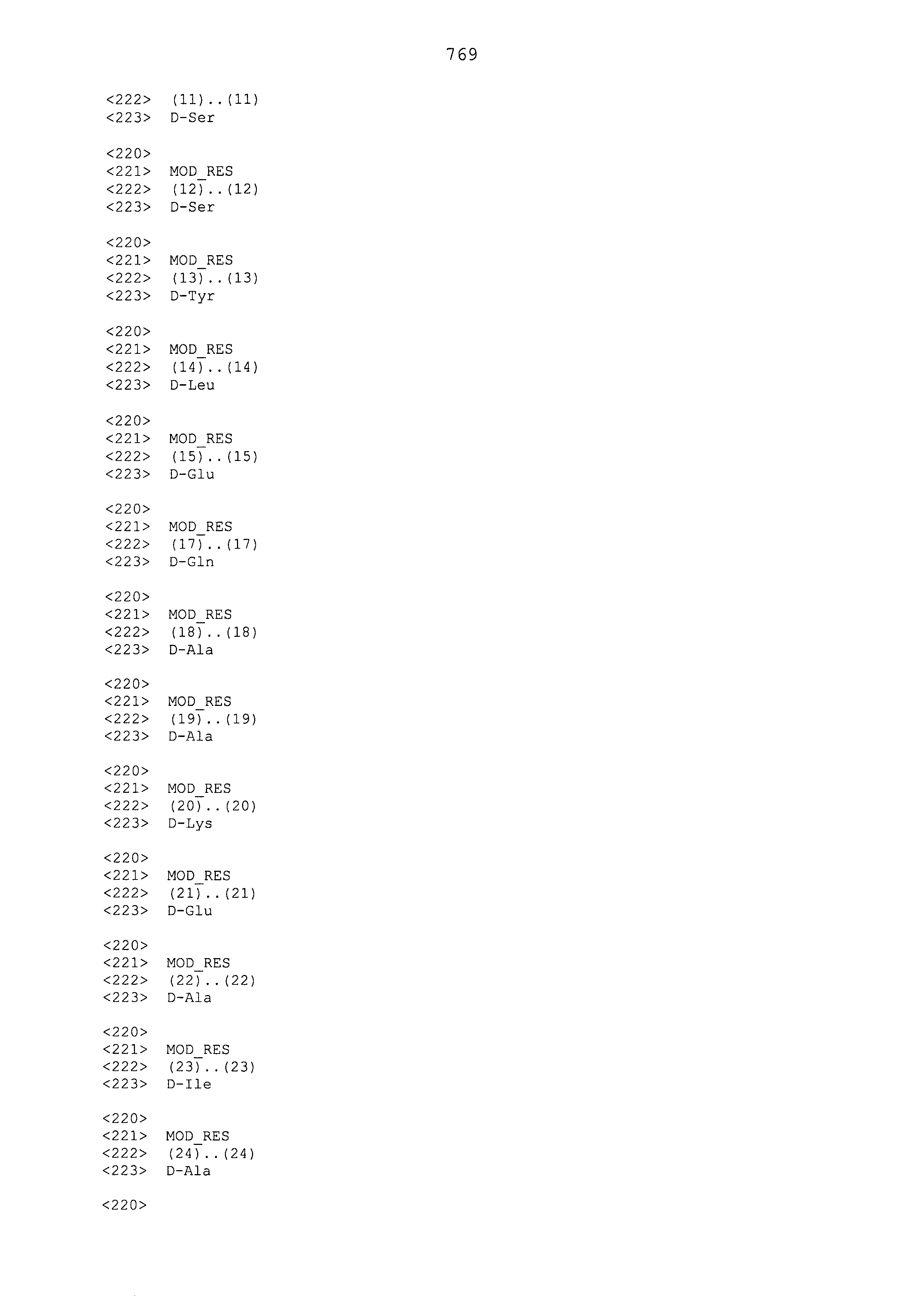



































































Описание
ВКЛЮЧЕНИЕ С ПОМОЩЬЮ ССЫЛКИ МАТЕРИАЛОВ, ПРЕДСТАВЛЕННЫХ В ЭЛЕКТРОННОМ ВИДЕ
Включенным с помощью ссылки во всей его полноте является машиночитаемый список аминокислотных последовательностей, представленный одновременно с настоящим изобретением и указанный следующим образом: один 889723 байтовый ASCII (Text) файл, названный "44822B_SeqListing", созданный 29 апреля 2011.
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 61/334435, поданной 13 мая 2010, и 61/432077, поданной 12 января 2011. Описание каждой из предварительных заявок включено явно в настоящее изобретение во всей своей полноте с помощью ссылки.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к пептидам глюкагонового суперсемейства, конъюгированным с лигандами ядерных гормональных рецепторов, которые способны воздействовать на ядерные гормональные рецепторы.
Краткое описание родственного уровня техники
Белки ядерных гормональных рецепторов образуют класс белков, активируемых лигандом, которые, при связывании со специфическими последовательностями ДНК, служат в качестве переключателей транскрипции в клеточном ядре. Данные переключатели контролируют развитие и дифференциацию кожи, костей и центров в мозге, отвечающих за поведение, а также непрерывную регуляцию репродуктивных тканей.
Лиганды ядерных гормональных рецепторов, такие как стероиды, стеролы, ретиноиды, тироидные гормоны и витамин D функционируют, активируя ядерные гормональные рецепторы. Взаимодействие гормона и рецептора инициирует конформационное изменение в рецепторе, которое приводит в результате к регуляции последующих стадий генной экспрессии. Степень клеточной передачи сигнала, активированной взаимодействием лиганда и ядерного гормонального рецептора, определяется числом лигандов и рецепторов, имеющихся в наличии для связывания, и связывающей способностью между лигандом и рецептором. Многие лиганды и соответствующие аналоги, которые связываются с ядерными гормональными рецепторами, применяют в качестве лекарственных средств для лечения, например, болезни Паркинсона (NURR1), расстройств сна (RZRβ), артрита и мозжечковой атаксии (RORα), заболеваний центральной нервной системы (NOR-1, Rev-ErbAβ, T1x, NGFI-Bβ, HZF-2α, COUP-TFα, COUP-TFβ, COUR-TFγ, NUR77), гиперхолестеринемии (LXRα, COR), ожирения (Rev-ErbAα), диабета (HNF4α), заболеваний иммунной системы (TOR), нарушений обмена веществ (MB67α, SHP, FXR, SF-1, LXRβ) и бесплодия, и контрацепции (GCNF, TR2-11α,β, TR4, ERα,β, ERRα,β).
Препроглюкагон представляет собой полипептид-предшественник, состоящий из 158 аминокислот, который подвергается процессингу в различных тканях, образуя ряд различных пептидов, являющихся производными проглюкагона, включая глюкагон, глюкагоноподобный пептид-1 (GLP-1), глюкагоноподобный пептид-2 (GLP-2) и оксинтомодулин (OXM), которые вовлечены в широкий спектр физиологических функций, включая гомеостаз глюкозы, секрецию инсулина, опорожнение желудка и интестинальный рост, а также регуляцию потребления пищи. Глюкагон представляет собой пептид из 29 аминокислот, который соответствует аминокислотам 33-61 препроглюкагона, тогда как GLP-1 получается в виде пептида из 37 аминокислот, которые соответствуют аминокислотам 72-108 препроглюкагона. GLP-1(7-36) амид или GLP-1(7-37) кислота представляют собой биологически активные формы GLP-1, которые показывают по существу эквивалентную активность относительно GLP-1 рецептора.
Глюкагон применяют для неотложного лечения тяжелой гипогликемии. Сообщалось, что оксинтомодулин обладает фармакологической способностью подавлять аппетит и снижать вес тела. GLP-1 и GLP-1 рецепторные агонисты применяют для лечения диабета II типа. Эксендин-4, представляющий собой пептид, присутствующий в слюне ящерицы-ядозуба, который напоминает по структуре GLP-1 и напоминает глюкагон и GLP-1, усиливает высвобождение инсулина.
Желудочный ингибиторный полипептид (GIP) также известен как глюкозозависимый инсулинотропный полипептид и является членом секретинового семейства гормонов. GIP получается из пробелка, состоящего из 153 аминокислот, кодируемого GIP геном, и он циркулирует в виде биологически активного пептида из 42 аминокислот. GIP ген экспрессируется в тонком кишечнике, а также в слюнной железе и является слабым ингибитором секреции желудочного сока. В добавление к его ингибирующему эффекту в желудке, в присутствии глюкозы, GIP усиливает высвобождение инсулина бета-клетками панкреатических островков при введении при физиологических дозах. Считают, что GIP функционирует как кишечный фактор, который стимулирует высвобождение поджелудочного инсулина и который может играть физиологическую роль в поддержании гомеостаза глюкозы.
Остеокальцин представляет собой неколлагеновый белок, обнаруживаемый в костях и зубах. Он секретируется остеобластами и считается, что он играет роль в минерализации и гомеостазе кальциевых ионов. Также сообщалось, что остеокальцин функционирует в качестве гормона в организме, побуждая бета-клетки в поджелудочной железе высвобождать большее количество инсулина и в то же время побуждая жировые клетки высвобождать гормон адипонектин, который увеличивает чувствительность к инсулину.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к пептидам глюкагонового суперсемейства, конъюгированным с лигандами ядерных гормональных рецепторов ("NHR лиганды"). Данные конъюгаты с множественной активностью являются пригодными для лечения ряда заболеваний.
Конъюгаты пептидов глюкагонового суперсемейства настоящего изобретения могут быть представлены следующей формулой:
Q-L-Y
где Q представляет собой пептид глюкагонового суперсемейства, Y представляет собой NHR лиганд, и L представляет собой связывающую группу или связь.
Пептид глюкагонового суперсемейства (Q) в некоторых вариантах осуществления может представлять собой родственный глюкагону пептид, который обладает агонистической активностью относительно глюкагонового рецептора, агонистической активностью относительно GLP-1 рецептора, агонистической активностью относительно GIP рецептора, соагонистической активностью относительно глюкагонового и GLP-1 рецепторов, соагонистической активностью относительно глюкагонового и GIP рецепторов, соагонистической активностью относительно GLP-1 и GIP рецепторов или триагонистической активностью относительно глюкагонового, GIP и GLP-1 рецепторов. В некоторых вариантах осуществления родственный глюкагону пептид обладает антагонистической активностью относительно глюкагонового, GLP-1 или GIP рецептора. Активность родственного глюкагону пептида относительно глюкагонового рецептора, относительно GLP-1 рецептора или относительно GIP рецептора может соответствовать любому из значений, приведенных в настоящем изобретении. В некоторых конкретных вариантах осуществления родственный глюкагону пептид обладает по меньшей мере 0,1% активностью нативного глюкагона относительно глюкагонового рецептора, по меньшей мере 0,1% активностью нативного GLP-1 относительно GLP-1 рецептора или по меньшей мере 0,1% активностью нативного GIP относительно GIP рецептора.
NHR лиганд (Y) является полностью или частично непептидным и воздействует на ядерный гормональный рецептор с активностью, соответствующей любому из значений, приведенных в настоящем изобретении. В некоторых вариантах осуществления NHR лиганд обладает EC50 или IC50 приблизительно 1 мМ или меньше, или 100 мкМ или меньше, или 10 мкМ или меньше, или 1 мкМ или меньше. В некоторых вариантах осуществления NHR лиганд имеет молекулярный вес вплоть до приблизительно 5000 дальтон, или вплоть до приблизительно 2000 дальтон, или вплоть до приблизительно 1000 дальтон или вплоть до приблизительно 500 дальтон. NHR лиганд может воздействовать на любой из ядерных гормональных рецепторов, описанных в настоящем изобретении, или иметь любую из структур, описанных в настоящем изобретении.
В некоторых вариантах осуществления родственный глюкагону пептид имеет EC50 (или IC50) относительно глюкагонового рецептора в пределах приблизительно 100-кратного, или в пределах приблизительно 75-кратного, или в пределах приблизительно 50-кратного, или в пределах приблизительно 40-, 30-, 25-, 20-, 15-, 10- или 5-кратного EC50 или IC50 NHR лиганда относительно его ядерного гормонального рецептора. В некоторых вариантах осуществления родственный глюкагону пептид имеет EC50 (или IC50) относительно GLP-1 рецептора в пределах приблизительно 100-кратного, или в пределах приблизительно 75-кратного, или в пределах приблизительно 50-кратного, или в пределах приблизительно 40-, 30-, 25-, 20-, 15-, 10- или 5-кратного EC50 или IC50 NHR лиганда относительно его ядерного гормонального рецептора. В некоторых вариантах осуществления родственный глюкагону пептид имеет EC50(или IC50) относительно GIP рецептора в пределах приблизительно 100-кратного, или в пределах приблизительно 75-кратного, или в пределах приблизительно 50-кратного, или в пределах приблизительно 40-, 30-, 25-, 20-, 15-, 10- или 5-кратного EC50 или IC50 NHR лиганда относительно его ядерного гормонального рецептора.
В некоторых аспектах настоящего изобретения настоящее изобретение относится к пролекарствам Q-L-Y, где пролекарство содержит дипептидный пролекарственный компонент (A-B), ковалентно связанный с активным участком Q амидной связью. Последующее удаление дипептида в физиологических условиях и в отсутствии ферментативной активности восстанавливает полную активность Q-L-Y конъюгата.
В некоторых аспектах настоящего изобретения настоящее изобретение также относится к фармацевтическим композициям, содержащим Q-L-Y конъюгат и фармацевтически приемлемый носитель.
В других аспектах настоящего изобретения настоящее изобретение относится к способам введения терапевтически эффективного количества Q-L-Y конъюгата, описанного в настоящем изобретении, для лечения заболевания или медицинского состояния у пациента. В некоторых вариантах осуществления заболевание или медицинское состояние выбрано из группы, состоящей из метаболического синдрома, диабета, ожирения, стеатоза печени и нейродегенеративного заболевания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой сравнительный анализ аминокислотных последовательностей различных пептидов глюкагонового суперсемейства или их соответствующих фрагментов. Представленной аминокислотной последовательностью являются GHRH (SEQ ID NO: 1619), PHI (SEQ ID NO: 1622), VIP (SEQ ID NO: 1620), PACAP-27 (SEQ ID NO: 1621), эксендин-4 (SEQ ID NO: 1618), GLP-1 (SEQ ID NO: 1603), глюкагон (SEQ ID NO: 1601), оксинтомодулин (SEQ ID NO: 1606), GIP (SEQ ID NO: 1607), GLP-2 (SEQ ID NO: 1608) и секретин (SEQ ID NO: 1624). Сравнительный анализ показывает, как аминокислотные положения глюкагона могут соответствовать аминокислотным положениям в других пептидах глюкагонового суперсемейства.
Фигура 2 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела и концентрации глюкозы в крови у db/db мышей. Фигура 2a показывает, что мыши, которым вводили большую дозу GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата, претерпевали немного большее снижение веса тела, чем мыши, которым вводили только GLP-1, но аналогичное снижение при введении среды. Фигуры 2b и 2c показывают, что мыши, которым вводили большую дозу GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгат, претерпевали самое большое снижение концентрации глюкозы в крови между днями 0 и 14, показывая, что улучшенная способность снижать концентрацию глюкозы в крови не зависит от изменения веса тела.
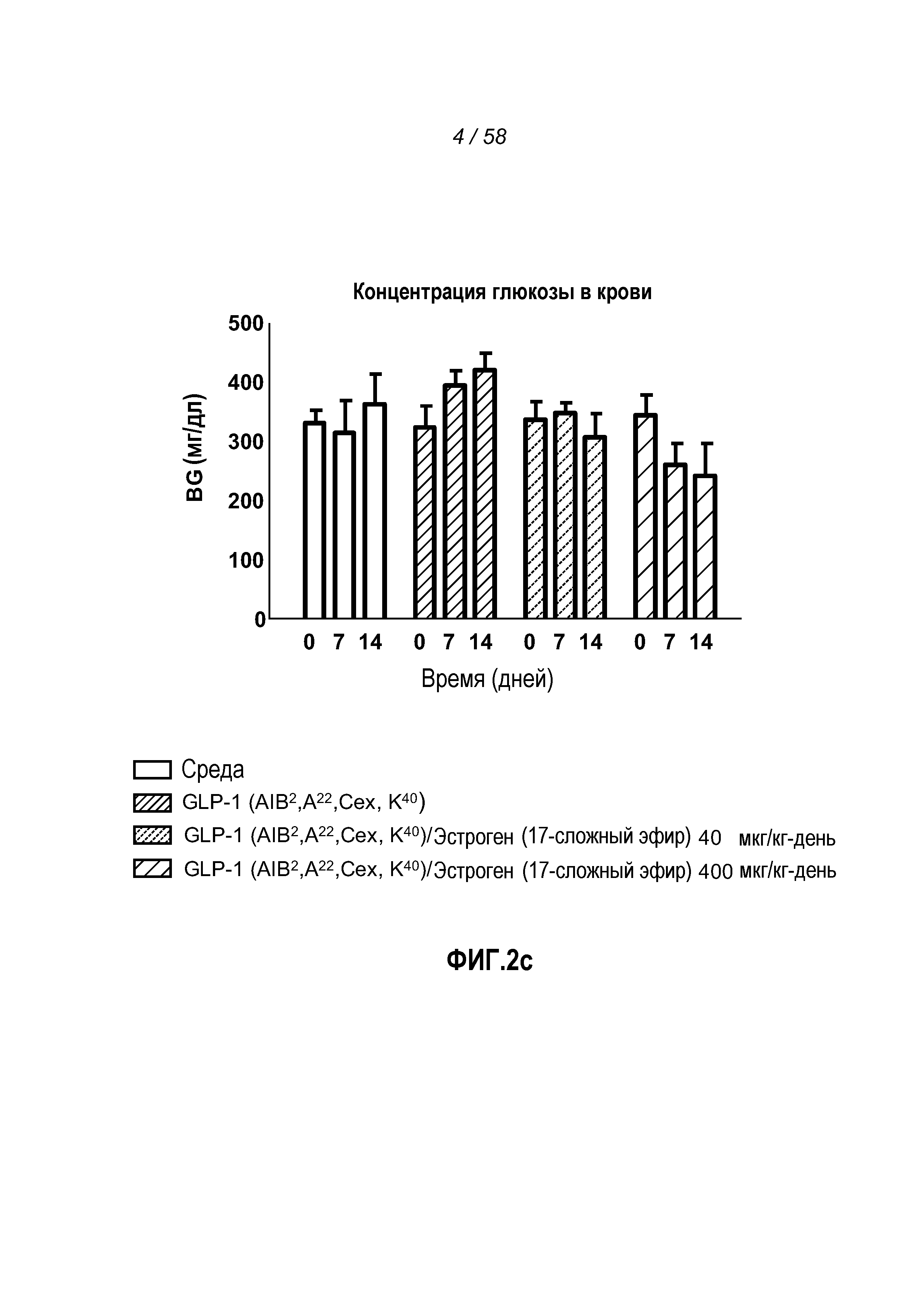
Фигура 3 иллюстрирует эффект введения указанных GLP-1 конъюгатов на глюкозу в крови, вес тела, жировую массу и сухую мышечную массу у мышей с алиментарным ожирением. Фигура 3a иллюстрирует результаты ipGTT теста на день 21. Фигуры 3b-d иллюстрируют эффект введения указанных GLP-1 конъюгатов на изменение веса тела (фигура 3b), изменение жировой массы (фигура 3c) и изменение сухой мышечной массы (фигура 3d) у мышей с алиментарным ожирением. Мыши, которым вводили большую дозу GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата, претерпевали самое большое снижение веса тела и жировой массы и самое небольшое изменение сухой мышечной массы. Фигура 3e иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменения глюкозы в крови у мышей с алиментарным ожирением. Мыши, которым вводили большую дозу GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата, претерпевали самое большое снижение концентрации глюкозы в крови между днями 0 и 14. Данные результаты показывают дополнительную дозозависимую эффективность добавления эстрогена к слабому GLP-1 агонисту на основе A22.
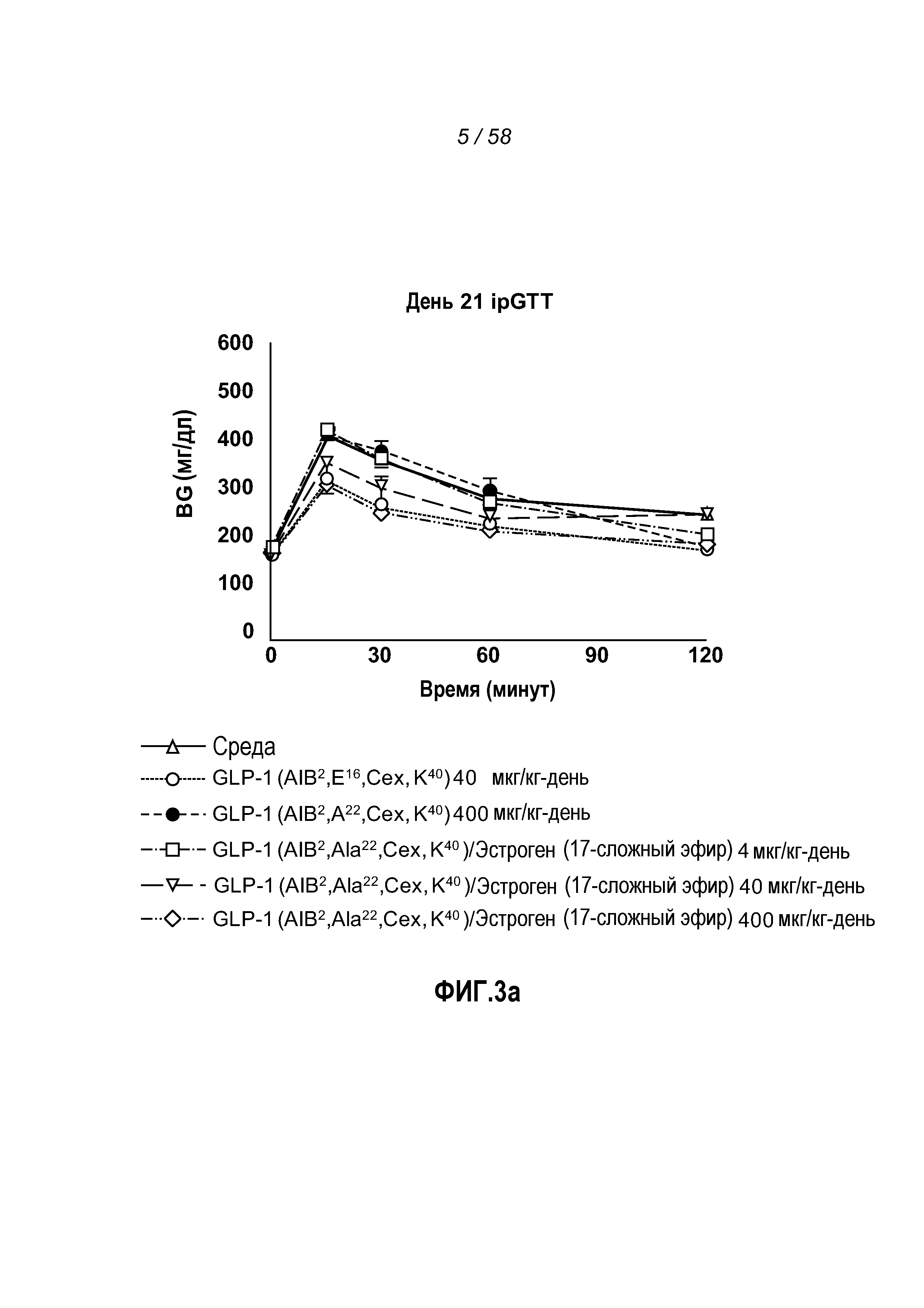
Фигура 4 иллюстрирует эффект введения указанных GLP-1 конъюгатов на концентрации глюкозы в крови, изменение веса тела, изменение жировой массы и изменение глюкозы в крови. Фигура 4a иллюстрирует эффект введения указанных GLP-1 конъюгатов в тесте на толерантность к введенной внутрибрюшинно глюкозе на концентрации глюкозы в крови у мышей с алиментарным ожирением после четырнадцати ежедневных доз. Фигуры 4b-c показывают эффект введения указанных GLP-1 конъюгатов на изменение веса тела и изменение жировой массы у мышей с алиментарным ожирением. Мыши, которым вводили большую дозу GLP-1/эстроген конъюгатов, претерпевали самое большое снижение общего веса тела (Фигура 4b). Жировая масса снижалась при высоких дозах эстрогенового эфирного конъюгата по сравнению с животными, обработанными средой (Фигура 4c). Фигура 4d иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменения глюкозы в крови у мышей с алиментарным ожирением. При высокой дозе, мыши, которым вводили любой GLP-1(Aib2E16CexK40)/эстроген конъюгат, претерпевали большее изменение концентрации глюкозы в крови между днями 0 и 21, чем мыши, которым вводили только GLP-1(Aib2E16CexK40).
Фигура 5 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела и изменение глюкозы в крови у мышей с алиментарным ожирением. Мыши, которым вводили большую дозу GLP-1/эстроген конъюгатов, претерпевали самое большое снижение веса тела (Фигура 5a). Мыши, которым вводили или большую или маленькую дозу GLP-1(Aib2E16K40Cex), претерпевали самое большое изменение глюкозы в крови, наряду с самым большим изменением при высокой дозе GLP-1(Aib2E16K40Cex)/эстроген(3-эфир) (Фигура 5b).
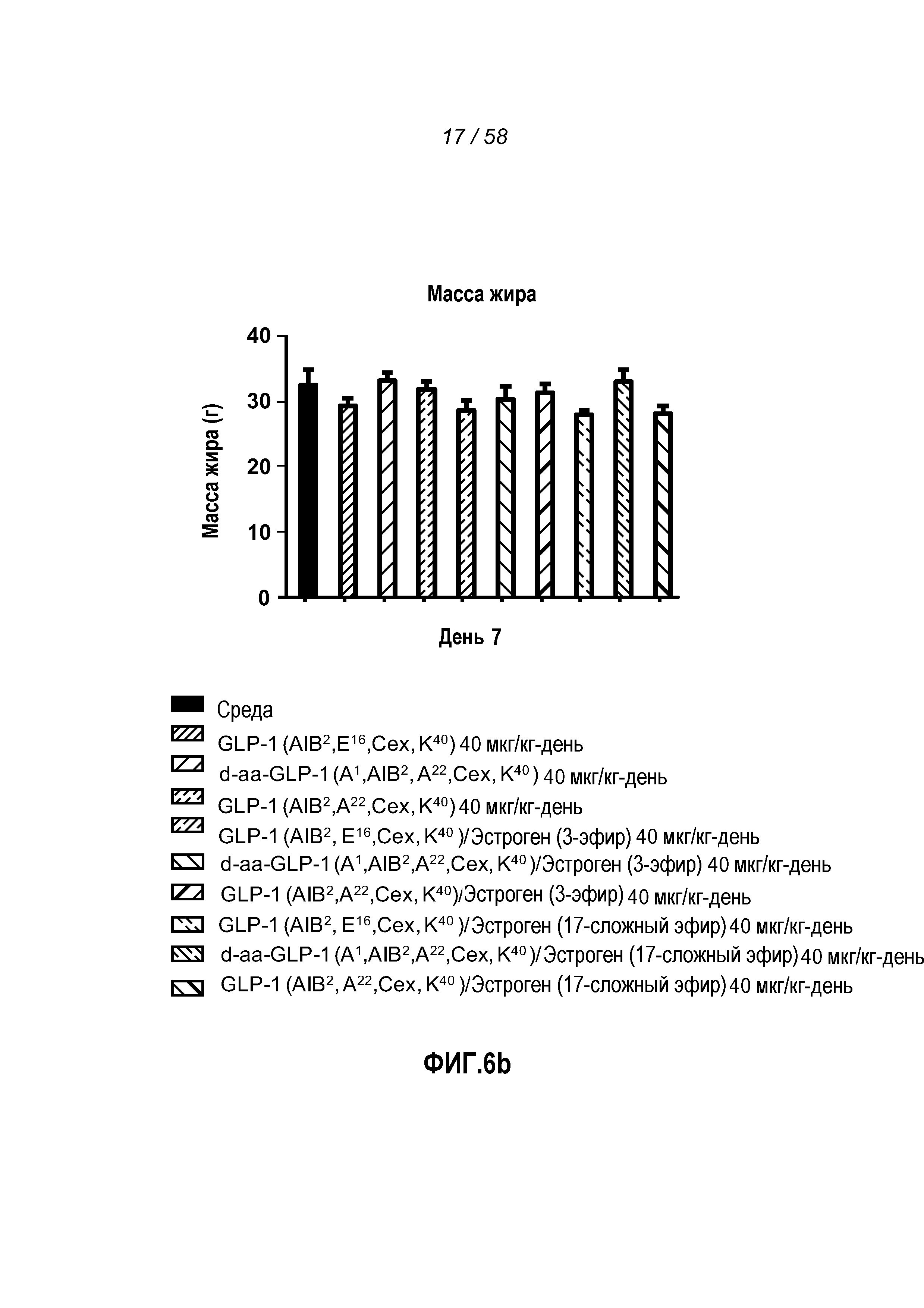
Фигура 6 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела, жировой массы и изменение глюкозы в крови у мышей с алиментарным ожирением. Мыши, которым вводили любой эстрогеновый конъюгат, претерпевали самое большое снижение общего веса тела (Фигура 6a). Анализ жировой массы (Фигура 6b) был относительно постоянен с потерей общего веса тела. Мыши, которым вводили GLP-1(Aib2E16K40Cex)/эстроген(3-эфир) или GLP-1(Aib2E16K40Cex)/эстроген(17-сложный эфир) конъюгат, претерпевали самое большое изменение концентрации глюкозы в крови между днями 0 и 7 (Фигура 6c).
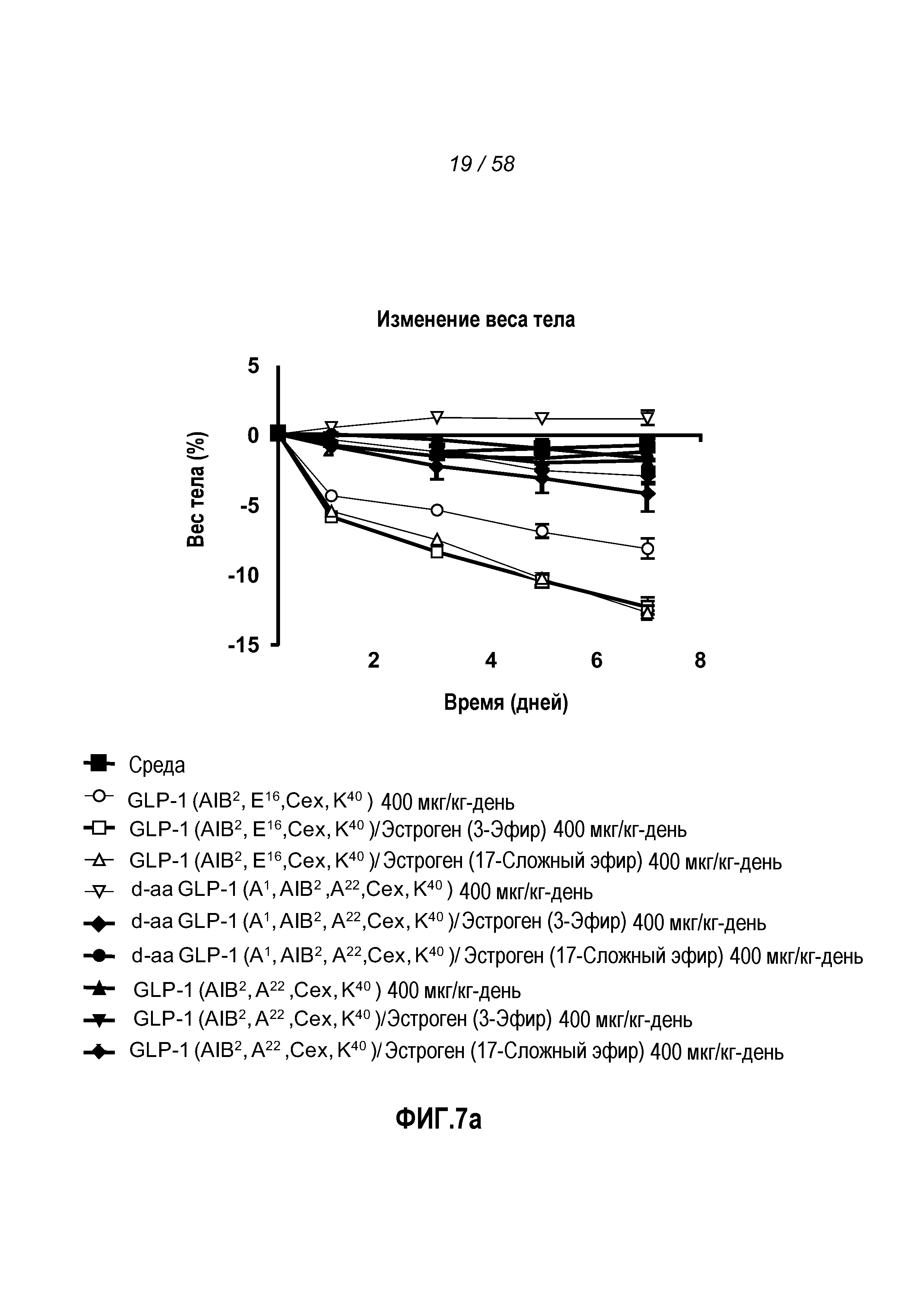
Фигура 7 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела и глюкозу в крови у мышей с алиментарным ожирением. Мыши, которым вводили GLP-1(Aib2E16K40Cex)/эстроген конъюгаты, претерпевали самое большое снижение общего веса тела (Фигура 7a) и концентрации глюкозы в крови (Фигура 7b) в течение периода времени 7 дней. Ни A22, ни пептиды, содержащие d-аминокислоты, не показывали большего снижения по сравнению с GLP-1(Aib2E16CexK40)/эстроген конъюгатами. Кроме того, эстрогеновые конъюгаты GLP-1(Aib2E16CexK40) были явно более эффективными, чем неэстрогеновая форма того же пептида.
Фигура 8 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела, глюкозы в крови и жировой массы. Пептиды, содержащие d-аминокислоты, были явно хуже во всех измерениях эффективности, чем пептиды, содержащие l-аминокислоты. Фигура 8a иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела у мышей с алиментарным ожирением. Были незначительные явные отличия снижения веса тела при данных дозах для пептидов с или без эстрогена. Тем не менее, на фигуре 8b показан эффект введения указанных GLP-1 конъюгатов на изменение глюкозы в крови у мышей с алиментарным ожирением. Мыши, которым вводили GLP-1(Aib2E16CexK40)/эстроген(3-сложный эфир) конъюгат, претерпевали самое большое изменение концентрации глюкозы в крови между днями 0 и 7 in vivo, гораздо большее, чем животные, обработанные тем же самым пептидом, но без эстрогена. Это демонстрирует прямое улучшение, связанное с глюкозой в крови, независимое от различий в весе тела. Фигура 8c иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение жировой массы.
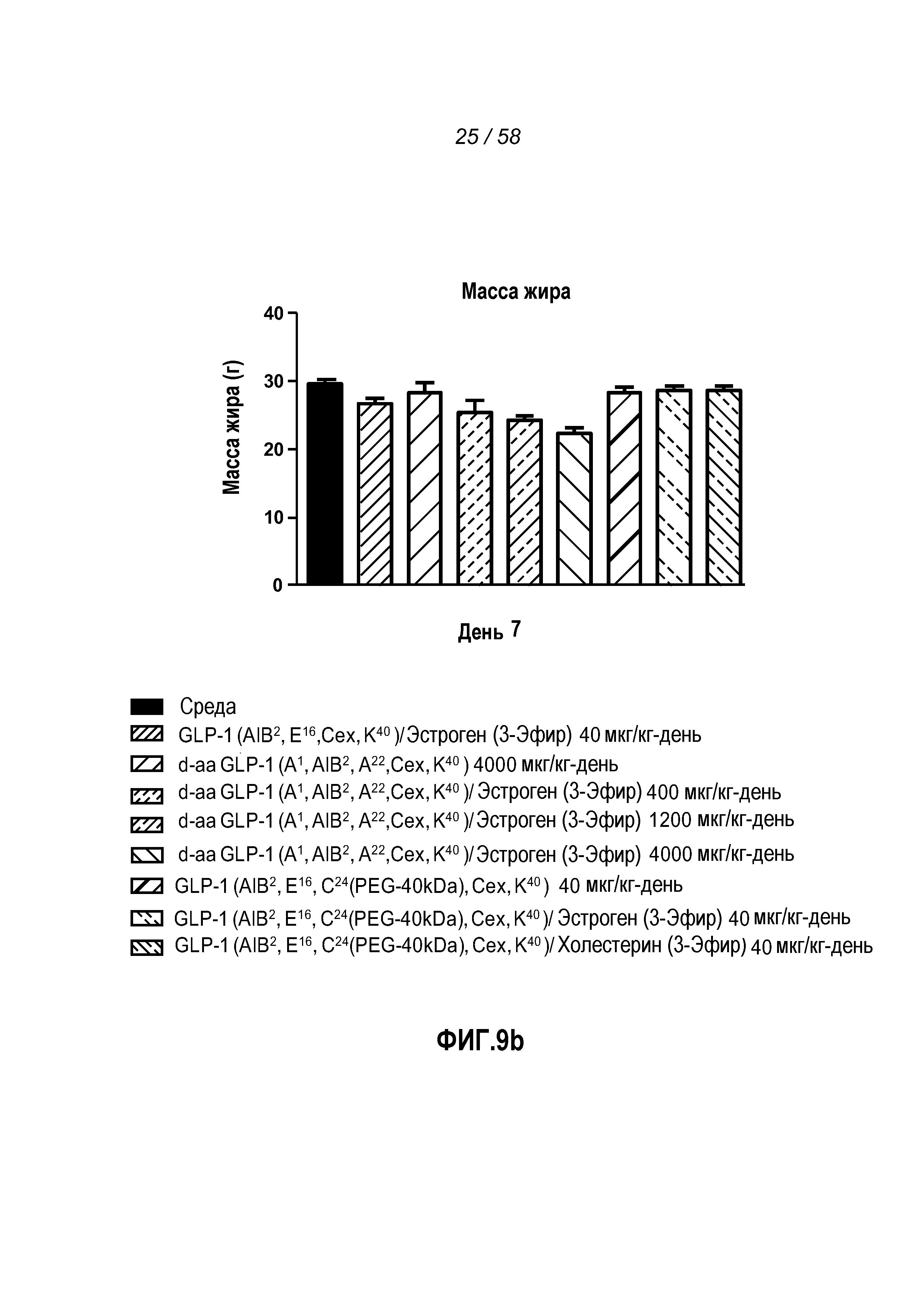
Фигура 9 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела, количества жировой массы и изменение глюкозы в крови у мышей с алиментарным ожирением. Мыши, которым вводили содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат при повышенных дозах по сравнению с контролем, содержащим l-аминокислоты, претерпевали самое большое снижение веса тела (Фигура 9a) и имели наименьшее количество жировой массы (Фигура 9b). Присутствовало явное дозозависимое снижение глюкозы с содержащим d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгатом между днями 0 и 7, и оно увеличивалось при самой большой дозе по сравнению с мышами, которым вводили только GLP-1 (Фигура 9c).
Фигура 10 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела и изменение концентрации глюкозы в крови у мышей с алиментарным ожирением. Мышам вводили содержащие d-аминокислоты GLP-1/эстроген конъюгаты, где эстроген был ковалентно присоединен или в виде стабильного амида или в виде эфира, который был нестабилен in vivo. Животные, обработанные нестабильным эфирным конъюгатом, претерпевали самое большое снижение общего веса тела (Фигура 10a). Фигура 10b показывает, что мыши, которым вводили содержащий d-аминокислоты GLP-1/эстроген эфирный конъюгат, претерпевали большее изменение концентрации глюкозы в крови между днями 0 и 7, чем мыши, которым вводили сравнительный пептид, содержащий d-аминокислоты, но в виде стабильного эстрогенового конъюгата.
Фигура 11 иллюстрирует активность указанных конъюгатов относительно GLP-1 рецептора и эстрогенового рецептора. Активные неустойчивые GLP-1/эстроген конъюгаты были одинаково активны относительно GLP-1 рецептора (Фигура 11a) и обладали разной активностью относительно эстрогенового рецептора (Фигура 11b).
Фигура 12 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела, потребление пищи, глюкозы в крови, веса печени и веса матки у мышей с алиментарным ожирением. Мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат, претерпевали самое большое снижение веса тела, причем эффект был более явно выражен при большей дозе (Фигура 12a). Фигура 12b показывает, что мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат, потребляли значительно меньше пищи, чем мыши, которым вводили только неактивный содержащий d-аминокислоты GLP-1 или эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат, причем эффект был более явно выражен при большой дозе. Фигура 12c показывает, что большая доза эстроген-лабильного неактивного содержащего d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгата снижала концентрацию глюкозы в крови по сравнению с животными, обработанными средой. Фигура 12d показывает, что мыши, которым вводили эстроген-лабильный неактивный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат, претерпевали едва заметное, но большее снижение веса печени, чем мыши, которым вводили эстроген-стабильный неактивный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат. Фигура 12e показывает, что мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат, претерпевали значительно большее увеличение веса матки, чем мыши, которым вводили только неактивный GLP-1 или неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат.
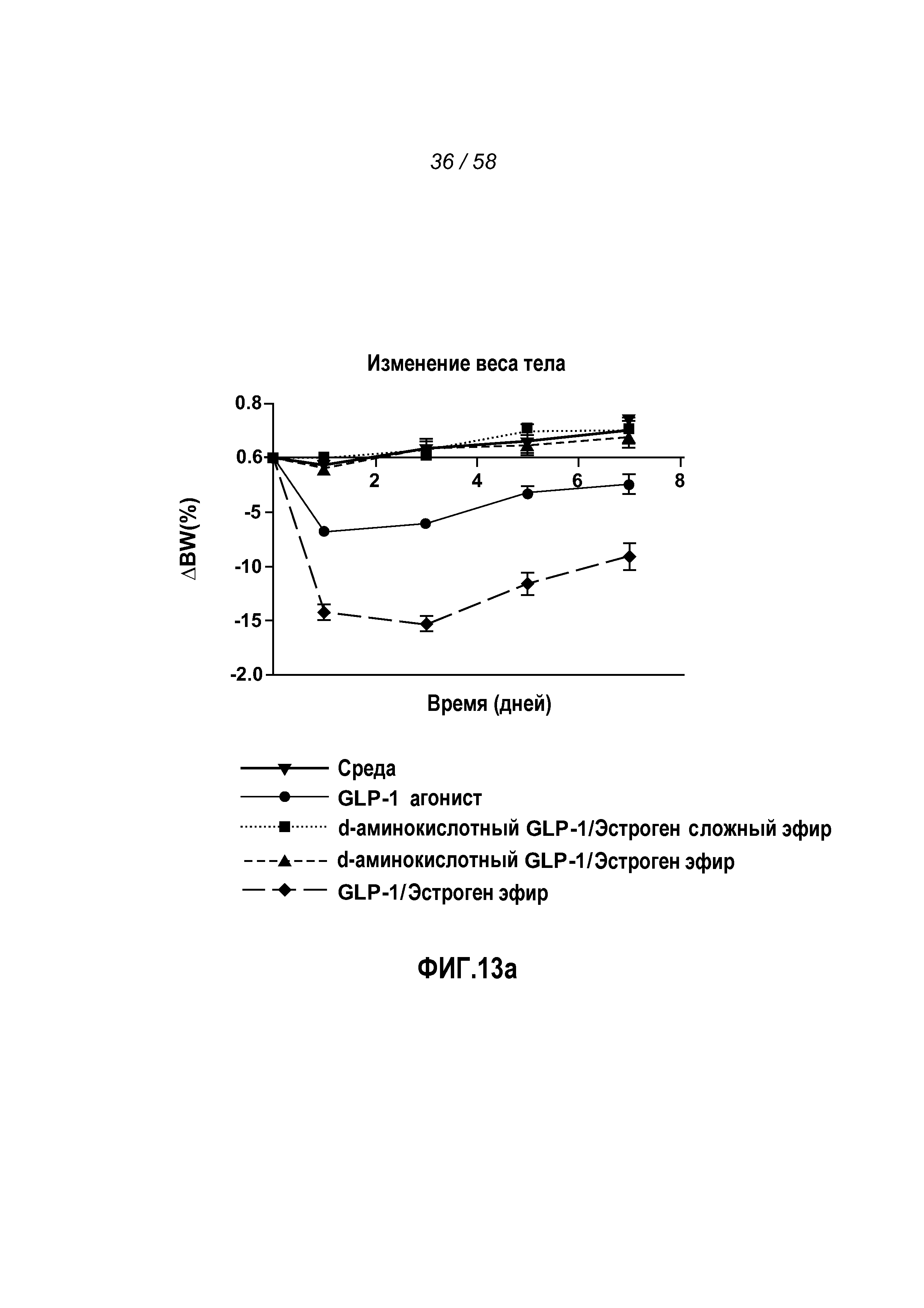
Фигура 13 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела, жировой массы, потребления пищи, концентрации глюкозы в крови и веса матки у мышей после овариэктомии. Фигура 13a показывает, что мыши, которым вводили активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, претерпевали большее снижение веса тела, чем мыши, которым вводили только активный GLP-1 агонист, неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат или неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат. Фигура 13b показывает, что мыши, которым вводили GLP-1 агонист, неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат и активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, показывали снижение жировой массы. Фигура 13c показывает, что мыши, которым вводили активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, потребляли меньше пищи, чем мыши, которым вводили только активный GLP-1 агонист, неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат или неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат. Фигура 13d показывает, что мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат или неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат или активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, претерпевали снижение концентрации глюкозы в крови, большее, чем в случае введения среды, и что мыши, которым вводили неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат, не проявляли снижение концентрации глюкозы в крови. Фигура 13e показывает, что мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат, претерпевали значительно большее увеличение веса матки, чем мыши, которым вводили только GLP-1, неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген (3-эфир) конъюгат или активный, эстроген-стабильный GLP-1/эстроген(3-эфир) конъюгат.
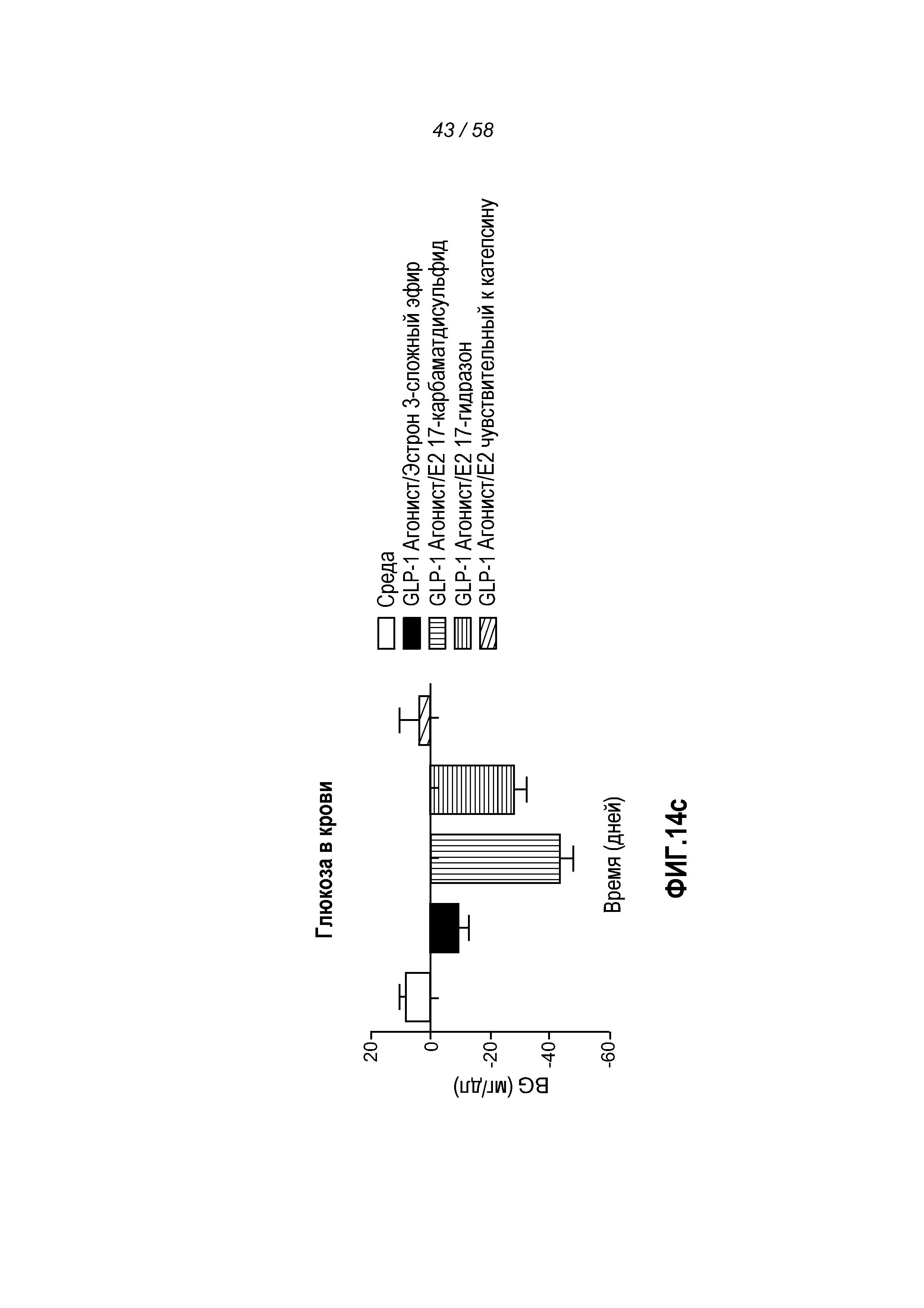
Фигура 14 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела, жировой массы, глюкозы в крови и веса матки у мышей после овариэктомии. Мыши, которым вводили нестабильные GLP-1 агонист/эстроген конъюгаты, претерпевали большее снижение веса тела и жировой массы, чем мыши, которым вводили только активный GLP-1 агонист или активный, эстроген-лабильный GLP-1 агонист/эстроген(3-сложный эфир) конъюгат (Фигуры 14a и 14b). Мыши, которым вводили нестабильные фермент- и кислотолабильные конъюгаты, GLP-1 агонист/эстроген(17-катепсин) и GLP-1 агонист/эстроген(17-гидразон), соответственно, первоначально имели самое большое снижение веса тела, тогда как нестабильный чувствительный к восстановлению тиолом конъюгат, GLP-1 агонист/эстроген(17-карбаматдисульфид), проявлял суммарное самое большое снижение веса тела. Фигура 14c показывает, что мыши, которым вводили нестабильные чувствительные к восстановлению тиолом и кислотолабильные конъюгаты, GLP-1 агонист/эстроген(17-карбаматдисульфид) и GLP-1 агонист/эстроген(17-гидразон), соответственно, претерпевали большее снижение концентрации глюкозы в крови, чем эстроген-лабильный GLP-1 агонист/эстроген(3-сложный эфир) конъюгат. Фигура 14d показывает, что мыши, которым вводили эстроген-лабильный GLP-1/эстроген(3-сложный эфир) конъюгат, претерпевали значительно большее увеличение веса матки, чем мыши, которым вводили любой из трех нестабильных GLP-1/эстроген конъюгатов.
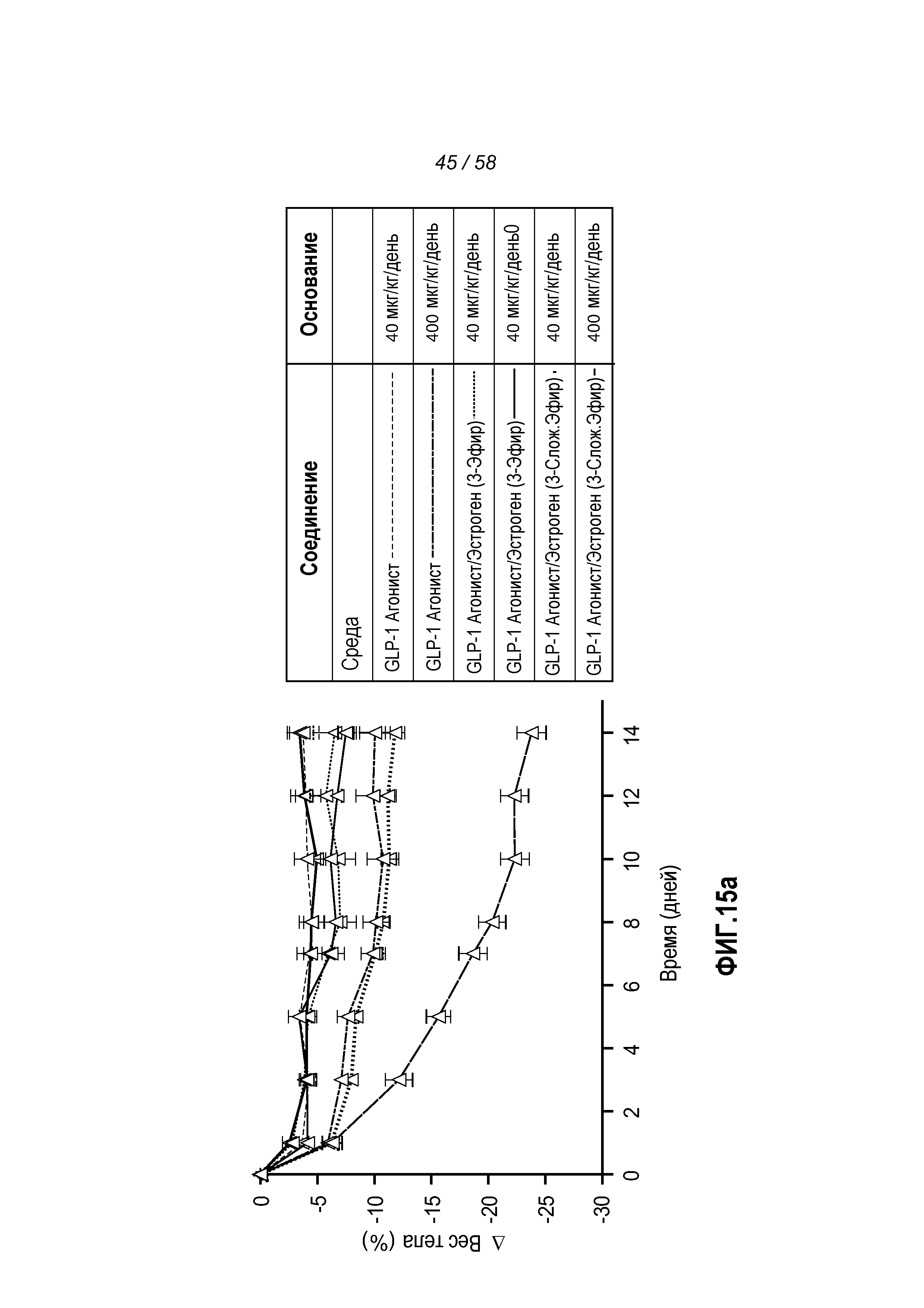
Фигура 15 иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение веса тела и общее потребление пищи. Мыши, которым вводили активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, претерпевали значительно большее снижение веса тела, чем мыши, которым вводили только активный GLP-1 агонист или активный, эстроген-лабильный GLP-1 агонист/эстроген(3-сложный эфир) конъюгат (Фигура 15a). Фигура 15b показывает, что мыши, которым вводили активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, потребляли значительно меньше пищи, чем мыши, которым вводили только активный GLP-1 агонист или активный, эстроген-лабильный GLP-1 агонист/эстроген(3-сложный эфир) конъюгат.
На фигурах 16a-e изображены ВЭЖХ кривые, которые показывают стабильность указанных GLP-1/эстроген конъюгатов в плазме крови при 37°C. Эстроген-стабильные GLP-1/эстроген(3-эфир) конъюгаты не проявляли высвобождение эстрогена в течение 72 часов, тогда как эстроген-лабильные GLP-1/эстроген(3-сложный эфир) конъюгаты показывали значительное высвобождение эстрогена через 3 часа и полное высвобождение эстрогена в пределах 6 часов.
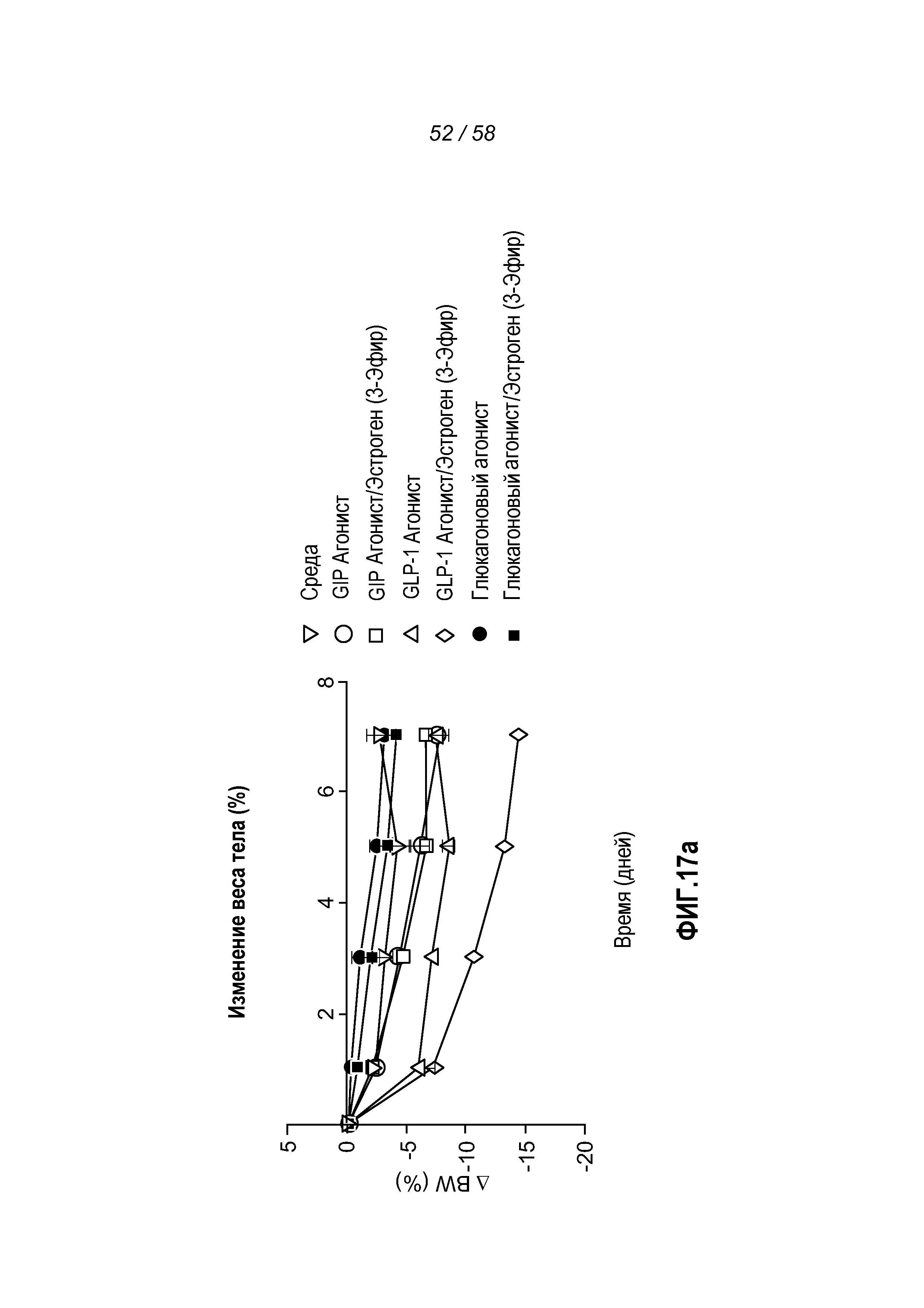
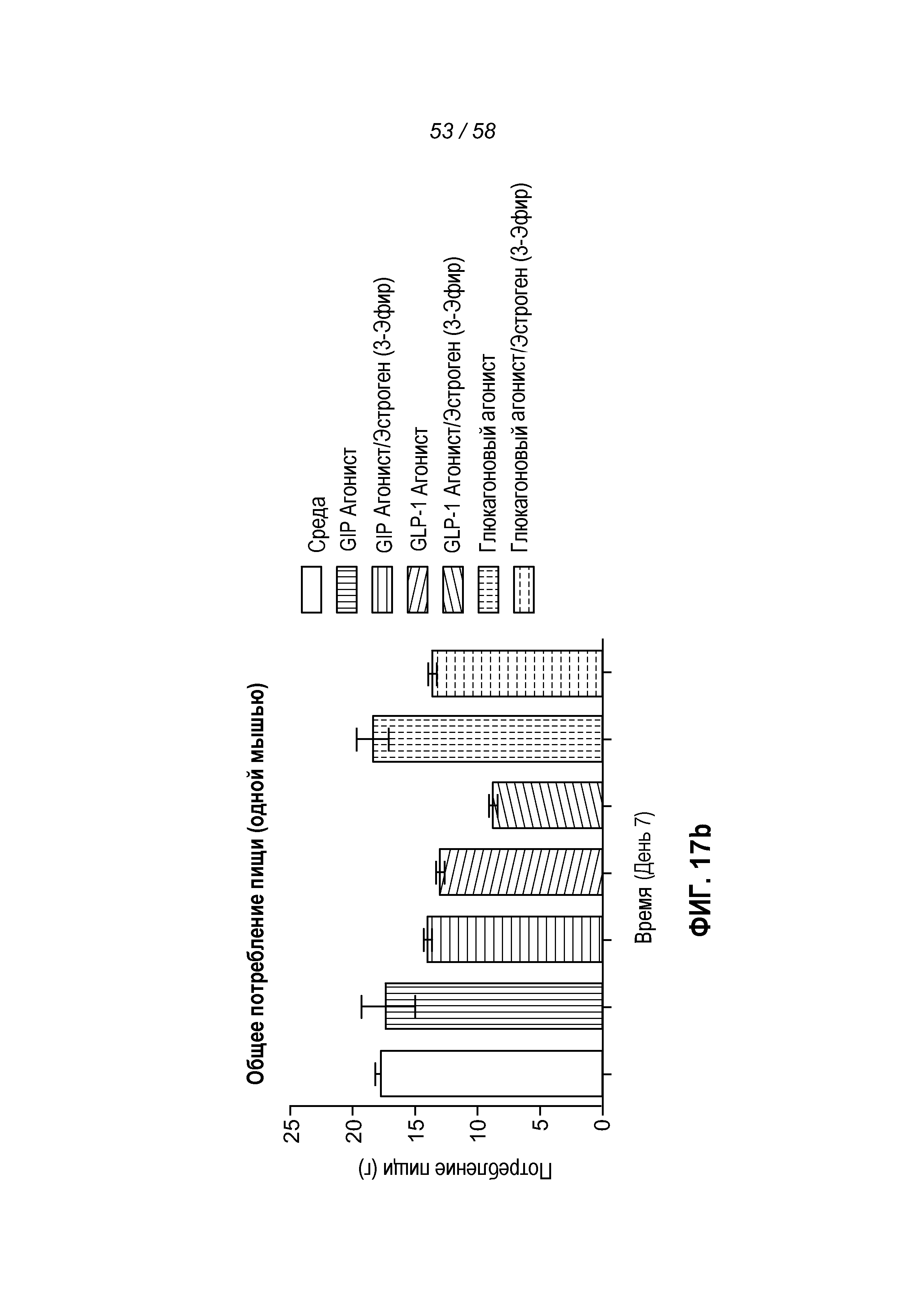
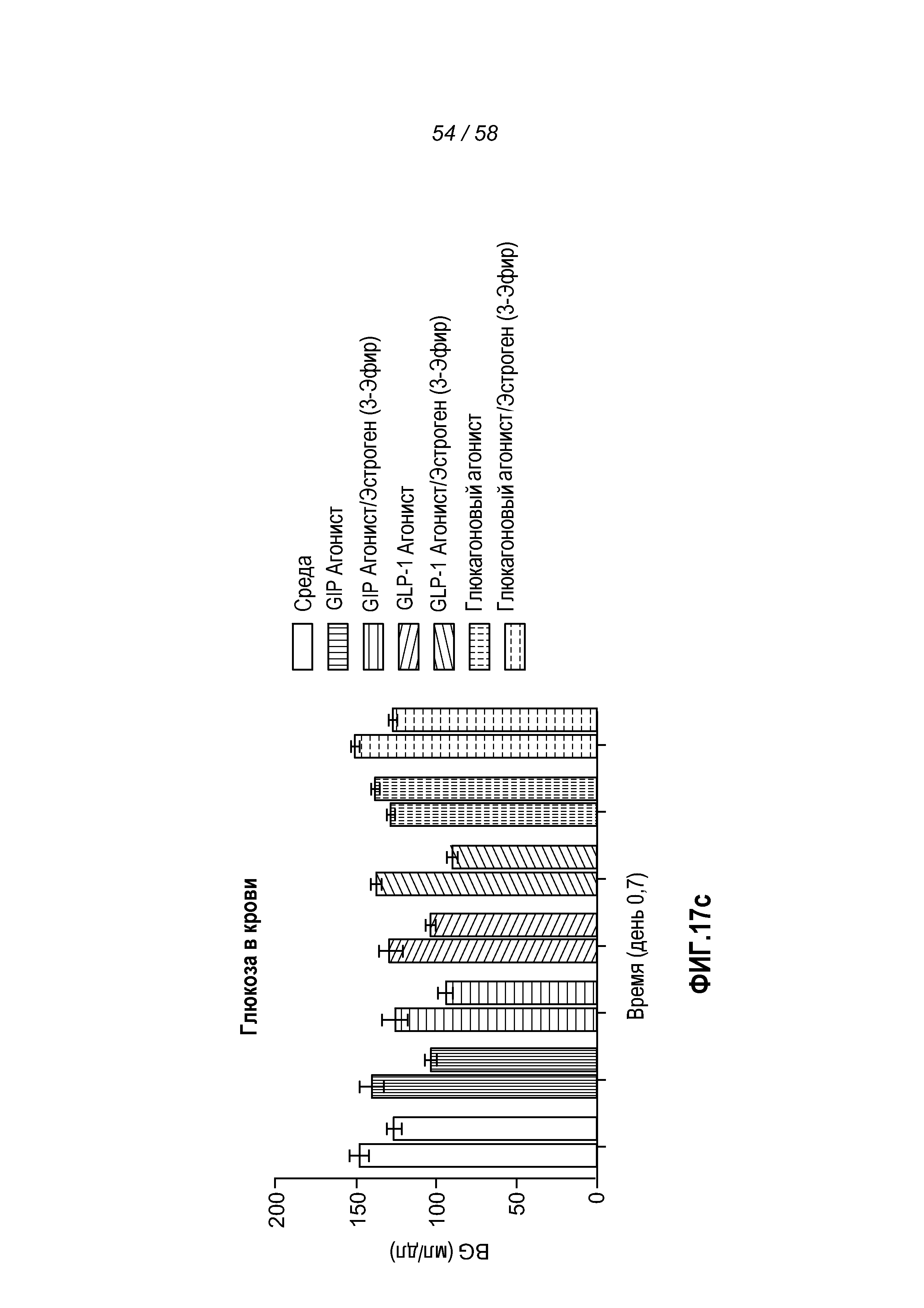
Фигуры 17a-c показывают эффект введения указанных конъюгатов на изменение веса тела в процентах, суммарное потребление пищи и концентрацию глюкозы в крови у мышей с алиментарным ожирением.
Фигуры 18a-c показывают эффект введения указанных конъюгатов на изменение веса тела в процентах, суммарное потребление пищи и концентрацию глюкозы в крови у мышей дикого типа с алиментарным ожирением, у мышей с «нокаутом» эстрогенового рецептора бета (ERβ KO) и у мышей с «нокаутом» эстрогенового рецептора альфа (ERα KO).
Фигура 19 иллюстрирует эффект указанных GLP-1 конъюгатов на концентрации глюкозы в крови с течением времени. Мыши, которым вводили GLP-1 агонист, показали самое неэффективное снижение глюкозы в крови в течение 48 часов (за исключением среды), тогда как мыши, которым вводили эстроген-стабильный GLP-1 агонист/эстроген (3-эфир) конъюгат, показали самое эффективное снижение глюкозы в крови в течение 48 часов.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
В описании и формуле изобретения настоящего изобретения, будут применять следующую терминологию в соответствии с определениями, изложенными ниже.
Термин "приблизительно", как применяют в настоящем изобретении, обозначает больше или меньше в районе 10 процентов, чем величина или диапазон величин, но не предполагается, что он обозначает любую величину или диапазон величин, только для этого широкого определения. Также предполагается, что каждая величина или диапазон величин, которым предшествует термин "приблизительно" включает вариант осуществления заданной абсолютной величины или диапазона величин.
Как применяют в настоящем изобретении, термин "фармацевтически приемлемый носитель" включает любой из стандартных фармацевтических носителей, такой как физиологический раствор с фосфатным буфером, вода, эмульсии, такие как эмульсия масло/вода или эмульсия вода/масло, и различные типы смачивающих агентов. Термин также включает любые агенты, одобренные регуляторным органом правительства США или перечисленные в фармакопеи США для применения на животных, включая человека.
Как применяют в настоящем изобретении, термин "фармацевтически приемлемая соль" относится к солям соединений, которые сохраняют биологическую активность исходного соединения, и которые не является биологически или иначе нежелательными. Многие из соединений, описанных в настоящем изобретении, способны образовывать кислые и/или основные соли за счет наличия амино и/или карбоксильной группы или аналогичных им групп.
Фармацевтически приемлемые соли присоединения основания можно получить из неорганических и органических оснований. Соли, полученные из неорганических оснований, включают, только в качестве примера, натриевые, калиевые, литиевые, аммониевые, кальциевые и магниевые соли. Соли, полученные из органических оснований, включают, но не ограничиваясь этим, соли первичных, вторичных и третичных аминов. Фармацевтически приемлемые соли присоединения кислот можно получить из неорганических и органических кислот. Соли, полученные из неорганических кислот, включают хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и подобные. Соли, полученные из органических кислот, представляют собой уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфокислоту, этансульфокислоту, п-толуолсульфокислоты, салициловую кислоту и т.д.
Как применяют в настоящем изобретении, термин "лечение" включает профилактику конкретного заболевания или состояния, или облегчение симптомов, связанных с конкретным заболеванием или состоянием, и/или предотвращение или устранение указанных симптомов. Например, как применяют в настоящем изобретении, термин "лечение диабета" будет относиться в общем к изменению концентрации глюкозы в крови в сторону нормальной концентрации и может включать увеличение или снижение концентрации глюкозы в крови в зависимости от указанной ситуации.
Как применяют в настоящем изобретении, "эффективное" количество или "терапевтически эффективное количество" глюкагонового пептида относится к нетоксичному, но достаточному количеству пептида, обеспечивающему требуемый эффект. Например, одним желательным эффектом будет предотвращение или лечение гипогликемии, как измерено, например, увеличением концентрации глюкозы в крови. Альтернативный желательный эффект для глюкагоновых пептидов настоящего описания будет включать лечение гипергликемии, например, как измерено изменением концентрации глюкозы в крови в сторону нормальной концентрации, или будет вызывать потерю веса/предотвращение набора веса, например, как измерено снижением веса тела, или предотвращать или замедлять увеличение веса тела, или нормализовывать распределение жира в теле. Количество, которое является "эффективным", будет изменяться от субъекта к субъекту, в зависимости от возраста и общего состояния индивида, пути введения и подобных. Таким образом, не всегда возможно указать точное "эффективное количество". Однако подходящее "эффективное" количество в случае любого индивида может быть определено специалистом в данной области техники, применяя стандартный эксперимент.
Термин "парентеральный" обозначает не через пищеварительный тракт, но некоторым другим путем, например, подкожно, внутримышечно, интраспинально или внутривенно.
Как применяют в настоящем изобретении, предполагается, что термин "пациент", без дополнительного обозначения, включает любое теплокровное позвоночное животное (включая, например, но не ограничиваясь этим, сельскохозяйственных животных, лошадей, кошек, собак и других домашних животных), млекопитающее и людей.
Термин "выделенный", как применяют в настоящем изобретении, обозначает удаленный из окружающей его среды. В некоторых вариантах осуществления аналог получают с помощью рекомбинантных способов, и аналог выделяют из клеток-хозяев.
Термин "очищенный", как применяют в настоящем изобретении, относится к выделению молекулы или соединения в форме, которая практически не содержит примесей, обычно связанных с молекулой или соединением в природной или естественной среде и обозначает повышенный по чистоте как результат отделения от других компонентов первоначального состава. Термин "очищенный полипептид" применяют в настоящем изобретении для обозначения полипептида, который был отделен от других соединений, включая, но не ограничиваясь этим, молекулы нуклеиновых кислот, липиды и сахара.
Как применяют в настоящем изобретении, термин "пептид" включает последовательность 2 или более аминокислот и обычно меньше, чем 50 аминокислот, где аминокислоты являются встречающимися в природе или кодируемыми или не встречающимися в природе или некодируемыми аминокислотами. Не встречающиеся в природе аминокислоты относятся к аминокислотам, которые не встречаются в природе in vivo, но которые, тем не менее, можно ввести в пептидные структуры, описанные в настоящем изобретении. "Некодируемая", как применяют в настоящем изобретении, относится к аминокислоте, которая не является L-изомером любой из следующих 20 аминокислот: Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr.
Как применяют в настоящем изобретении, "частично непептидный" относится к молекуле, где часть молекулы представляет собой химическое соединение или заместитель, который обладает биологической активностью и не содержит последовательности аминокислот.
Как применяют в настоящем изобретении, "непептидный" относится к молекуле, обладающей биологической активностью и не содержащей последовательность аминокислот.
Как применяют в настоящем изобретении, термины "полипептид" и "белок" представляют собой термины, который применяют для обозначения полимера аминокислот, независимо от длины полимера. Обычно, полипептиды и белки имеют полимерную длину, которая является большей, чем длина "пептидов". В ряде случаев, белок содержит более одной полипептидной цепи, ковалентно или нековалентно связанные друг с другом.
Во всей настоящей заявке, все ссылки на конкретное положение аминокислоты номером (например, положение 28) относятся к аминокислоте в положении в нативном глюкагоне (SEQ ID NO: 1601) или соответствующему положению аминокислоты в любом его аналоге. Например, ссылка в настоящем изобретении на "положение 28" будет обозначать соответствующее положение 27 для аналога глюкагона, в котором первая аминокислота SEQ ID NO: 1601 удалена. Аналогично, ссылка в настоящем изобретении на "положение 28" будет обозначать соответствующее положение 29 для аналога глюкагона, в котором одна аминокислота присоединена к N-концу SEQ ID NO: 1601.
Как применяют в настоящем изобретении, "аминокислотная модификация" относится к (i) замещению или замене аминокислоты исходного пептида (например, SEQ ID NO: 1601, 1603, 1607) отличной аминокислотой (встречающейся в природе или кодируемой или некодируемой или не встречающейся в природе аминокислотой), (ii) присоединению аминокислоты (встречающейся в природе или кодируемой или некодируемой или не встречающейся в природе аминокислоты) к исходному пептиду (например, SEQ ID NO: 1601, 1603, 1607) или (iii) удалению одной или более аминокислот из исходного пептида (например, SEQ ID NO: 1601, 1603, 1607).
В некоторых вариантах осуществления аминокислотное замещение или замена представляет собой консервативную аминокислотную замену, например, консервативную замену аминокислоты в одном или более из положений 1, 2, 5, 7, 8, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29. Как применяют в настоящем изобретении, термин "консервативная аминокислотная замена" представляет собой замену одной аминокислоты другой аминокислотой, имеющей аналогичные свойства, например, размер, заряд, гидрофобность, гидрофильность и/или ароматичность, и включает замены в пределах одной из следующих пяти групп:
I. небольшие алифатические, неполярные или по существу неполярные остатки: Ala, Ser, Thr, Pro, Gly;
II. Полярные, отрицательно заряженные остатки и их амиды и эфиры: Asp, Asn, Glu, Gln, цистеиновая кислота и гомоцистеиновая кислота;
III. Полярные, положительно заряженные остатки: His, Arg, Lys; орнитин (Orn)
IV. Большие алифатические неполярные остатки: Met, Leu, Ile, Val, Cys, норлейцин (Nle), гомоцистеин
V. Большие ароматические остатки:
Phe, Tyr, Trp, ацетилфенилаланин
В некоторых вариантах осуществления аминокислотная замена является неконсервативной аминокислотной заменой, например, представляет собой неконсервативную аминокислотную замену.
Как применяют в настоящем изобретении, термин "аминокислота" включает любую молекулу, содержащую и амино, и карбоксильную функциональную группу, где амино и карбоксильные группы соединены с одним атомом углерода (альфа-атом углерода). Альфа атом углерода необязательно может содержать один или два дополнительных органических заместителя. Для целей настоящего изобретения предполагается, что обозначение аминокислоты без указания ее стереохимии включает или L, или D форму аминокислоты, или рацемическую смесь. Однако в случае, когда аминокислота обозначена ее трехбуквенным кодом и включает надстрочное число (т.е. Lys-1), предполагается, что данное обозначение относится к нативной L форме аминокислоты, тогда как D форма будет показана включением строчной d перед трехбуквенным кодом и надстрочным числом (т.е. dLys-1).
Как применяют в настоящем изобретении, термин "гидроксикислота" относится к аминокислоте, которая модифицирована заменой аминогруппы при альфа атоме углерода гидроксильной группой.
Как применяют в настоящем изобретении, термин "заряженная аминокислота" относится к аминокислоте, которая содержит боковую цепь, которая имеет отрицательный заряд (т.е. депротонирована) или положительный заряд (т.е. протонирована) в водном растворе при физиологическом pH. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту, глютаминовую кислоту, цистеиновую кислоту, гомоцистеиновую кислоту и гомоглютаминовую кислоту, тогда как положительно заряженные аминокислоты включают аргинин, лизин и гистидин. Заряженные аминокислоты включают заряженные аминокислоты из 20 кодируемых аминокислот, а также нестандартные или не встречающиеся в природе или некодируемые аминокислоты.
Как применяют в настоящем изобретении, термин "кислая аминокислота" относится к аминокислоте, которая содержит второй кислый фрагмент (отличный от альфа-карбоксильной группы аминокислоты), включая, например, карбоксильную или сульфогруппу в боковой цепи.
Как применяют в настоящем изобретении, "ацилированная" аминокислота представляет собой аминокислоту, содержащую ацильную группу, которая не является нативной для встречающейся в природе аминокислотой, независимо от способов, которыми она получена. Типичные способы получения ацилированных аминокислот и ацилированных пептидов являются известными в данной области техники и включают ацилирование аминокислоты перед включением в пептид или пептидный синтез, с последующим химическим ацилированием пептида. В некоторых вариантах осуществления ацильная группа способствует тому, что пептид обладает одним или более из (i) пролонгированного времени полужизни в кровотоке, (ii) замедленного начала действия, (iii) увеличенной продолжительности действия, (iv) повышенной устойчивости к протеазам, таким как DPP-IV, и (v) повышенной активности относительно рецептора пептидов глюкагонового суперсемейства.
Как применяют в настоящем изобретении, "алкилированная" аминокислота представляет собой аминокислоту, содержащую алкильную группу, которая не является нативной для встречающейся в природе аминокислоты, независимо от способов, которыми она была получена. Типичные примеры получения алкилированных аминокислот и алкилированных пептидов являются известными в данной области техники и включают алкилирование аминокислоты перед включением в пептид или пептидный синтез, с последующим химическим алкилированием пептида. Не желая быть связанными какой-либо конкретной теорией, считают, что алкилирование пептидов дает аналогичные, если не такие же, эффекты как ацилирование пептидов, например, пролонгированное время полужизни в кровотоке, замедленное начала действия, увеличенная продолжительность действия, повышенная устойчивость к протеазам, таким как DPP-IV, и повышенная активность относительно рецептора пептидов глюкагонового суперсемейства.
Термин "C1-Cn алкил" где n может равняться 1-18, как применяют в настоящем изобретении, представляет собой разветвленную или линейную алкильную группу, содержащую от одного до указанного количества атомов углерода. Например, C1-C6 алкил представляет собой разветвленную или линейную алкильную группу, содержащую от 1 до 6 атомов углерода. Стандартные C1-C18 алкильные группы включают, но не ограничиваясь этим, метил, этил, н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и подобные. Алкильные группы необязательно могут быть замещенными, например, гидрокси (OH), галогеном, арилом, карбоксилом, тио, C3-C8 циклоалкилом и амино.
Термин "C0-Cn алкил", где n может равняться 1-18, как применяют в настоящем изобретении, представляет собой разветвленную или линейную алкильную группу, содержащую вплоть до 18 атомов углерода. Например, термин "(C0-C6 алкил)OH" представляет собой исходную гидроксильную группу, соединенную с алкильным заместителем, содержащим вплоть до 6 атомов углерода (например, -OH, -CH2OH, -C2H4OH, -C3H6OH, -C4H8OH, -C5H10OH, -C6H12OH).
Термин "C2-Cn алкенил", где n может равняться 2-18, как применяют в настоящем изобретении, представляет собой ненасыщенную разветвленную или линейную группу, содержащую от 2 до указанного количества атомов углерода и по меньшей мере одну двойную связь. Примеры данных групп включают, но не ограничиваясь этим, 1-пропенил, 2-пропенил (-CH2-CH=CH2), 1,3-бутадиенил, (-CH=CHCH=CH2), 1-бутенил (-CH=CHCH2CH3), гексенил, пентенил и подобные. Алкенильные группы необязательно могут быть замещенными, например, гидрокси (OH), галогеном, арилом, карбоксилом, тио, C3-C8 циклоалкилом и амино.
Термин "C2-Cn алкинил", где n может равняться 2-18, относится к ненасыщенной разветвленной или линейной группе, содержащей от 2 до n атомов углерода и по меньшей мере одну тройную связь. Примеры данных групп включают, но не ограничиваясь этим, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 1-пентинил и подобные. Алкинильные группы необязательно могут быть замещенными, например, гидрокси (OH), галогеном, арилом, карбоксилом, тио, C3-C9 циклоалкилом и амино.
Как применяют в настоящем изобретении, термин "арил" относится к моноциклическим или полициклическим (например, бициклическим, трициклическим или тетрациклическим) ароматическим группам. Размер арильного кольца или колец указан обозначением числа присутствующих в нем атомов углерода. Например, термин "(C1-C3 алкил)(C6-C10 арил)" относится к 6-10 членному арила, который соединен с исходной молекулой через 1-3 членную алкильную цепь. Если не указано иное, арильная группа может быть незамещенной или замещенной одной или более, и в частности 1-5 группами, независимо выбранными из, например, галогена, алкила, алкенила, OCF3, NO2, CN, NC, OH, алкокси, амино, CO2H, C3-C8циклоалкила, C(O)Оалкила, арила и гетероарила. Примеры арильных групп включают, но не ограничиваясь этим, фенил, нафтил, тетрагидронафтил, хлорфенил, инданил, инденил, метилфенил, метоксифенил, трифторметилфенил, нитрофенил, 2,4-метоксихлорфенил и подобные.
Как применяют в настоящем изобретении, термин "гетероарил" относится к моноциклической или полициклической кольцевой системе, содержащей одно или более ароматических колец и содержащей по меньшей мере один атом азота, кислорода или серы в ароматическом кольце. Размер гетероарильного кольца и наличие заместителей или связывающих групп показаны обозначением числа присутствующих атомов углерода. Например, термин "(C1-C6 алкил)(C5-C6 гетероарил)" относится к 5- или 6-членному гетероарилу, который соединен с исходной молекулой через 1-6 членную алкильную цепь. Если не указано иное, гетероарильная группа может быть незамещенной или замещенной одной или более, и в частности 1-5 группами, независимо выбранными из, например, галогена, алкила, алкенила, OCF3, NO2, CN, NC, OH, алкокси, амино, CO2H, C3-C8 циклоалкила, C(O)Оалкила, арила и гетероарила. Примеры гетероарильных групп включают, но не ограничиваясь этим, тиенил, фурил, пиридил, оксазолил, хинолил, тиофенил, изохинолил, индолил, триазинил, триазолил, изотиазолил, изоксазолил, имидазолил, бензотиазолил, пиразинил, пиримидинил, тиазолил и тиадиазолил.
Как применяют в настоящем изобретении, термин "гетероалкил" относится к линейному или разветвленному углеводороду, содержащему указанное число атомов углерода и по меньшей мере один гетероатом в остове структуры. Подходящие гетероатомы для целей настоящего изобретения включают, но не ограничиваясь этим, N, S и O. Гетероалкильные группы необязательно могут быть замещенными, например, гидрокси (OH), галогеном, арилом, карбоксилом и амино.
Как применяют в настоящем изобретении, термин "галоген" или "галогено" относится к одному или более из членов группы, состоящей из фтора, хлора, брома и йода.
Как применяют в настоящем изобретении, термин "родственный глюкагону пептид" относится к тем пептидам, которые обладают биологической активностью (в качестве агонистов или антагонистов) относительно любого одного или более из глюкагонового, GLP-1, GLP-2 и GIP рецепторов и включает аминокислотную последовательность, которая обладает по меньшей мере 40% идентичностью последовательности (например, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%) к по меньшей мере одному из нативного глюкагона, нативного оксинтомодулина, нативного эксендина-4, нативного GLP-1, нативного GLP-2 или нативного GIP. Если не указано иное, любая ссылка на положение аминокислоты в родственном глюкагону пептиде (например, для присоединения NHR лиганда, конъюгатного фрагмента, гидрофильного полимера, ацилирования или алкилирования) относится к соответствующему положению относительно нативной глюкагоновой аминокислотной последовательности (SEQ ID NO: 1601).
Как применяют в настоящем изобретении, термин "селективность" молекулы относительно первого рецептора по сравнению со вторым рецептором относится к следующему отношению: EC50 молекулы относительно второго рецептора, поделенная на EC50 молекулы относительно первого рецептора. Например, молекула, которая имеет EC50 1 нМ относительно первого рецептора и EC50 100 нМ относительно второго рецептора, обладает 100-кратной селективностью относительно первого рецептора по сравнению со вторым рецептором.
Термин "идентичность", как применяют в настоящем изобретении, относится к сходству двух и более последовательностей. Идентичность измеряют делением количества одинаковых остатков на суммарное количество остатков и умножением полученного результата на 100 для получения значения в процентах. Таким образом, две копии точно одинаковой последовательности имеют 100% идентичность, тогда как две последовательности, которые имеют аминокислотные делеции, присоединения или замены по сравнению друг с другом обладают меньшей степенью идентичности. Специалисту в данной области техники ясно, что несколько компьютерных программ, такие как компьютерные программы, которые применяют алгоритмы, такие как BLAST (Basic Local Alignment Search Tool, Altschul et al. (1993) J. Mol. Biol. 215:403-410), имеются в наличии для определения идентичности последовательности.
Как применяют в настоящем изобретении, термин "пептид глюкагонового суперсемейства" относится к группе пептидов, родственных по структуре по их N-концевым и C-концевым областям (см., например, Sherwood et al., Endocrine Reviews 21: 619-670 (2000)). Члены данной группы включают все родственные глюкагону пептиды, а также гормон, высвобождающий гормон роста (GHRH; SEQ ID NO: 1619), вазоактивный пептид кишечника (VIP; SEQ ID NO: 1620), полипептид, активирующий аденилатциклазу гипофиза 27 (PACAP-27; SEQ ID NO: 1621), пептид гистидинизолейцин (PHI; SEQ ID NO: 1642), пептид гистидинметионин (PHM; SEQ ID NO: 1622), секретин (SEQ ID NO: 1623) и аналоги, производные или конъюгаты с вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными модификациями по сравнению с нативным пептидом. Данные пептиды предпочтительно сохраняют способность взаимодействовать (агонист или антагонист) с рецепторами глюкагонового рецепторного суперсемейства. Если не указано иное, любая ссылка на положение аминокислоты в пептиде глюкагонового суперсемейства (например, для присоединения NHR лиганда, конъюгатного фрагмента, гидрофильного полимера, ацилирования или алкилирования) относится к соответствующему положению относительно аминокислотной последовательности нативного глюкагона (SEQ ID NO: 1601), см. фигуру 1 для сравнительного анализа первичной структуры представленных пептидов глюкагонового суперсемейства.
Термин "глюкагоновый агонистический пептид" относится к соединению, которое связывается и активирует последующие стадии передачи сигнала глюкагонового рецептора. Однако данный термин не следует истолковывать как ограничивающий соединение тем, что оно обладает активностью только относительно данного глюкагонового рецептора. Скорее глюкагоновые агонистические пептиды настоящего описания могут обладать дополнительными активностями относительно других рецепторов, как дополнительно обсуждается в настоящем изобретении. Глюкагоновые агонистические пептиды, например, могут проявлять активность (например, агонистическую активность) относительно GLP-1 рецептора и/или GIP рецептора. Кроме того, термин "глюкагоновый агонистический пептид" не следует истолковывать как ограничивающий соединение только пептидами. Наоборот, соединения, отличные от пептидов, включены данным термином. Соответственно, глюкагоновый агонистический пептид в некоторых аспектах представляет собой пептид в конъюгатной форме (гетеродимер, мультимер, конъюгированный пептид), химически полученный пептид, фармацевтическую соль пептида, пептидомиметик и подобные.
Термин "GLP-1 агонистический пептид" относится к соединению, которое связывается и активирует последующие стадии передачи сигнала GLP-1 рецептора. Однако данный термин не следует истолковывать как ограничивающий соединение обладанием активностью относительно только GLP-1 рецептора. Скорее, GLP-1 агонистические пептиды настоящего описания могут обладать дополнительными активностями относительно других рецепторов, как дополнительно обсуждается в настоящем изобретении. GLP-1 агонистические пептиды, например, могут проявлять активность (например, агонистическую активность) относительно глюкагонового рецептора и/или GIP рецептора. Кроме того, термин "GLP-1 агонистический пептид" не следует истолковывать как ограничивающий соединение только пептидами. Наоборот, соединения, отличные от пептидов, включены данным термином. Соответственно, GLP-1 агонистический пептид в некоторых аспектах представляет собой пептид в конъюгатной форме (гетеродимер, мультимер, конъюгированный пептид), химически полученный пептид, фармацевтическую соль пептида, пептидомиметик и подобные.
Термин "GIF агонистический пептид" относится к соединению, которое связывается и активирует последующие стадии передачи сигнала GIP рецептора. Однако данный термин не следует истолковывать как ограничивающий соединение обладанием активностью только относительно GIP рецептора. Скорее GIP агонистические пептиды настоящего описания могут обладать дополнительными активностями относительно других рецепторов, как дополнительно обсуждается в настоящем изобретении. GIP агонистические пептиды, например, могут проявлять активность (например, агонистическую активность) относительно GLP-1 рецептора. Кроме того, термин "GIF агонистический пептид" не следует истолковывать как ограничивающий соединение только пептидами. Наоборот, соединения, отличные от пептидов, включены данным термином. Соответственно, GIP агонистический пептид в некоторых аспектах представляет собой пептид в конъюгатной форме (гетеродимер, мультимер, конъюгированный пептид), химически полученный пептид, фармацевтическую соль пептида, пептидомиметик и подобные.
Термин "глюкагоновый антагонистический пептид" относится к соединению, которое препятствует глюкагоновой активности или препятствует глюкагоновой функции. Например, глюкагоновый антагонист обладает по меньшей мере 60% ингибированием (например, по меньшей мере 70%, 80%, 90% или более ингибированием) максимальной ответной реакции, достигаемой глюкагоном относительно глюкагонового рецептора. В конкретном варианте осуществления глюкагоновый антагонист при концентрации приблизительно 1 мкМ обладает менее чем приблизительно 20% максимальной агонистической активности, достигаемой глюкагоном относительно глюкагонового рецептора (например, менее чем приблизительно 10% или 5%). Данный термин не следует истолковывать как ограничивающий соединение обладанием активностью только относительно глюкагонового рецептора. Скорее глюкагоновые антагонистические пептиды настоящего описания могут обладать дополнительными активностями относительно глюкагонового рецептора (например, частичным агонизмом) или другого рецептора. Глюкагоновые антагонистические пептиды, например, могут проявлять активность (например, агонистическую активность) относительно GLP-1 рецептора. Кроме того, термин "глюкагоновый антагонистический пептид" не следует истолковывать как ограничивающий соединение только пептидами. Наоборот, соединения, отличные от пептидов, включены данными терминами. Соответственно, в некоторых аспектах, глюкагоновый антагонистический пептид представляет собой пептид в конъюгатной форме, химически полученный пептид, фармацевтическую соль пептида, пептидомиметик и подобные.
Термин "GLP-1 антагонистический пептид" относится к соединению, которое препятствует GLP-1 активности или препятствует GLP-1 функции. Например, GLP-1 антагонист обладает по меньшей мере 60% ингибированием (например, по меньшей мере 70%, 80%, 90% или более ингибирование) максимальной ответной реакции, достигаемой GLP-1 относительно GLP-1 рецептора. В конкретном варианте осуществления GLP-1 антагонист при концентрации приблизительно 1 мкМ обладает менее чем приблизительно 20% максимальной агонистической активности, достигаемой GLP-1 относительно GLP-1 рецептора (например, меньшей чем приблизительно 10% или 5%). Термин не следует истолковывать как ограничивающий соединение обладанием активностью только относительно GLP-1 рецептора. Скорее, GLP-1 антагонистические пептиды настоящего описания могут обладать дополнительными активностями относительно GLP-1 рецептора (например, частичным агонизмом) или другого рецептора. GLP-1 антагонистические пептиды, например, могут проявлять активность (например, агонистическую активность) относительно глюкагонового рецептора. Кроме того, термин "GLP-1 антагонистический пептид" не следует истолковывать как ограничивающий соединение только пептидами. Наоборот, соединения, отличные от пептидов, включены данными терминами. Соответственно, в некоторых аспектах, GLP-1 антагонистический пептид представляет собой пептид в конъюгатной форме, химически полученный пептид, фармацевтическую соль пептида, пептидомиметик и подобные.
Термин "GIP антагонистический пептид" относится к соединению, которое препятствует GIP активности или препятствует GIP-1 функции. Например, GIP антагонист обладает по меньшей мере 60% ингибированием (например, по меньшей мере 70%, 80%, 90% или более ингибированием) максимальной ответной реакции, достигаемого GIP относительно GIP рецептора. В конкретном варианте осуществления GIP антагонист при концентрации приблизительно 1 мкМ обладает менее чем приблизительно 20% максимальной агонистической активности, достигаемой GIP относительно GIP рецептора (например, менее чем приблизительно 10% или 5%). Данный термин не следует истолковывать как ограничивающий соединение обладанием активностью только относительно GIP рецептора. Скорее, GIP антагонистические пептиды настоящего описания могут обладать дополнительными активностями относительно GIP рецептора (например, частичным агонизмом) или другого рецептора. GIP антагонистические пептиды, например, могут проявлять активность (например, агонистическую активность) относительно глюкагонового рецептора. Кроме того, термин "GIP антагонистический пептид" не следует истолковывать как ограничивающий соединение только пептидами. Наоборот, соединения, отличные от пептидов, включены данными терминами. Соответственно, в некоторых аспектах, GIP антагонистический пептид представляет собой пептид в конъюгатной форме, химически полученный пептид, фармацевтическую соль пептида, пептидомиметик и подобные.
Как применяют в настоящем изобретении, термины "глюкагоновый аналог" и "глюкагоновый пептид" можно применять взаимозаменяемо для ссылки на аналог глюкагона, который обладает указанной активностью относительно рецептора родственного глюкагону пептида.
Как применяют в настоящем изобретении, термин "нативный глюкагон" относится к пептиду, состоящему из последовательности SEQ ID NO: 1601.
Как применяют в настоящем изобретении, термин "нативный GLP-1" представляет собой общий термин, который обозначает GLP-1(7-36) амид (SEQ ID NO: 1603), GLP-1 (7-37) кислоту (SEQ ID NO: 1604) или смесь данных двух соединений.
Как применяют в настоящем изобретении, термин "нативный GIP" относится к пептиду, состоящему из SEQ ID NO: 1607.
Как применяют в настоящем изобретении, "глюкагоновая эффективность" или "активность по сравнению с нативным глюкагоном" молекулы относится к отношению EC50 молекулы относительно глюкагонового рецептора, разделенной на EC50 нативного глюкагона относительно глюкагонового рецептора.
Как применяют в настоящем изобретении, "GLP-1 активность" или "активность по сравнению с нативным GLP-1" молекулы относится к отношению EC50 молекулы относительно GLP-1 рецептора, разделенной на EC50 нативного GLP-1 относительно GLP-1 рецептора.
Как применяют в настоящем изобретении, "GIP активность" или "активность по сравнению с нативным GIP" молекулы относится к отношению EC50 молекулы относительно GIP рецептора, разделенной на EC50 нативного GIP относительно GIP рецептора.
Как применяют в настоящем изобретении, "NHR лиганд" относится к гидрофобной или липофильной молекуле, которая обладает биологической активностью (или агонист или антагонист) относительно ядерного гормонального рецептора (NHR). NHR лиганд является полностью или частично непептидным. В некоторых вариантах осуществления NHR лиганд представляет собой агонист, который связывается и активирует NHR. В других вариантах осуществления NHR лиганд представляет собой антагонист. В некоторых вариантах осуществления NHR лиганд представляет собой антагонист, который действует, полностью или частично блокируя связывание нативного лиганда с активным сайтом. В других вариантах осуществления NHR лиганд представляет собой антагонист, который действует, связываясь с активным сайтом или аллостерическим сайтом и препятствуя активации NHR или дезактивируя NHR.
Как применяют в настоящем изобретении, "ядерные гормональные рецепторы" (NHR) относится к активируемым лигандами белкам, которые регулируют генную экспрессию в клеточном ядре, иногда вместе с коактиваторами и корепрессорами.
Как применяют в настоящем изобретении, "стероиды и их производные" относится к соединениям, или встречающимся в природе или синтезированным, имеющим структуру формулы A:

Формула A
где R1 и R2, когда они присутствуют, независимо представляют собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы A с ядерным гормональным рецептором; R3 и R4 независимо представляют собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы A с ядерным гормональным рецептором; и каждая пунктирная линия представляет собой необязательную двойную связь. Формула A может дополнительно содержать один или более заместителей в одном или более из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 14, 15, 16 и 17. Предусмотренные необязательные заместители включают, но не ограничиваясь этим, OH, NH2, кетон и C1-C18 алкильные группы. Конкретно, неограничивающие примеры стероидов и их производных включают холестерин, холевую кислоту, эстрадиол, тестостерон и гидрокортизон.
Как применяют в настоящем изобретении, "желчные кислоты и их производные" относится к соединениям, или встречающимся в природе или синтезированным, формулы M:

Формула M
где каждый из R15, R16 и R17 независимо представляет собой группу, которая обеспечивает или способствует агонистической или антагонистической активности при связывании соединения формулы M с ядерным гормональным рецептором. В некоторых вариантах осуществления каждый из R15 и R16 независимо представляет собой водород, (C0-C8 алкил)галоген, C1-С18 алкил, C2-С18 алкенил, C2-C18 алкинил, гетероалкил или (C0-C8 алкил)OH; и R17 представляет собой OH, (C0-C8алкил)NH(C1-C4 алкил)SO3H или (C0-C8 алкил)NH(С1-C4 алкил)COOH. Формула M может дополнительно содержать один или более заместителей в одном или более из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 14, 15, 16 и 17. Неограничивающие примеры желчных кислот включают холевую кислоту, дезоксихолевую кислоту, литохолевую кислоту, хенодезоксихолевую кислоту, таурохолевую кислоту и гликохолевую кислоту.
Как применяют в настоящем изобретении, "холестерин и его производные" относится к соединениям, или встречающимся в природе или синтезированным, содержащим структуру, аналогичную структуре холестерина, как показано ниже:

Холестерин
Производные холестерина могут включать оксистеролы, такие как гидроксихолестерин, 24(S)-гидроксихолестерин, 27-гидроксихолестерин и холестеноевую кислоту.
Как применяют в настоящем изобретении, "эстрадиол и его производные" относится к соединениям, или встречающимся в природе или синтезированным, формулы B:

Формула B
где R1, R5 и R6 представляют собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы B с эстрогеновым рецептором. В некоторых вариантах осуществления структура формулы B замещена одним или более заместителями в одном или более положениях тетрациклического кольца, таких как, например, положения 1, 2, 4, 6, 7, 8, 9, 11, 12, 14, 15, 16 и 17. В некоторых случаях, заместитель содержит кетон в положении 6.
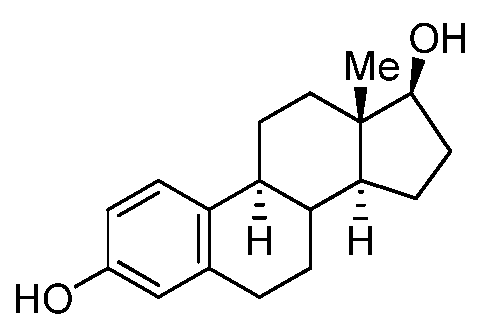
Эстрадиол
Конкретно, неограничивающие примеры производных эстрадиола включают β-эстрадиол 17-ацетат, β-эстрадиол 17-ципионат, β-эстрадиол 17-энантат, β-эстрадиол 17-валерат, β-эстрадиол 3,17-диацетат, β-эстрадиол 3,17-дипропионат, β-эстрадиол 3-бензоат, β-эстрадиол 3-бензоат 17-н-бутират, β-эстрадиол 3-глицидиловый эфир, β-эстрадиол 3-метиловый эфир, β-эстрадиол 6-он, β-эстрадиол 3-глицидил, β-эстрадиол 6-он 6-(O-карбоксиметилоксим), 16-эпиэстриол, 17-эпиэстриол, 2-метоксиэстрадиол, 4-метоксиэстрадиол, эстрадиол 17-фенилпропионат и 17β-эстрадиол 2-метиловый эфир, 17β-этинилэстрадиол, мегестролацетат, эстриол.
Как применяют в настоящем изобретении, "тестостерон и его производные" относится к соединениям, или встречающимся в природе или синтезированным, формулы F:

Формула F
где каждый R1, когда он присутствуют, R2, R3 и R6 независимо представляют собой группу, которая обеспечивает или способствует агонистической или антагонистической активности при связывании соединения формулы F с ядерным гормональным рецептором; и каждая пунктирная линия представляет собой необязательную двойную связь, при условии, что не более чем одна необязательная углерод-углерод двойная связь присутствует в положении 5. В некоторых вариантах осуществления структура формулы F замещена одним или более заместителями в одном или более положениях тетрациклического кольца, таких как, например, положения 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 14, 15, 16 и 17. Конкретно, неограничивающие примеры производных тестостерона включают дегидроэпиандростерон, андростендион, 5-андростендиол, андростерон и дигидротестостерон.
Как применяют в настоящем изобретении, "жирные кислоты и их производные" относится к карбоновым кислотам, содержащим протяженную неразветвленную C1-C28 алкильную или C2-C28 алкенильную группу, и они могут необязательно содержать один или более галогеновых заместителей и/или необязательно содержать один или более заместителей, отличных от галогена. В некоторых вариантах осуществления протяженная неразветвленная алкильная или алкенильная группа может быть полностью замещена галогенами (например, все водороды замещены атомами галогена). Короткоцепочечная жирная кислота содержит 1-5 атомов углерода. Жирная кислота со средней длиной цепи содержит 6-12 атомов углерода. Длинноцепочечная жирная кислота содержит 13-22 атомов углерода. Жирная кислота с очень протяженной цепью содержит 23-28 атомов углерода. Конкретно, неограничивающие примеры жирных кислот включают муравьиную кислоту, уксусную кислоту, н-капроновую кислоту, гептановую кислоту, каприловую кислоту, нонановую кислоту, каприновую кислоту, ундекановую кислоту, лауриновую кислоту, тридекановую кислоту, миристиновую кислоту, пентадекановую кислоту, пальмитиновую кислоту, гептадекановую кислоту, стеариновую кислоту, нонадекановую кислоту, арахидоновую кислоту, генэйкозановую кислоту, бегеновую кислоту, трикозановую кислоту, метилиминодиуксусную кислоту, тетрадеценовую кислоту, пальмитолеиновую кислоту, сапиеновую кислоту, олеиновую кислоту, линолевую кислоту, α-линоленовую кислоту, элаидиновую кислоту, петроселиновую кислоту, арахидоновую кислоту, дигидроксиэйкозатетраеновую кислоту (DiHETE), октадециновую кислоту, эйкозатрииновую кислоту, эйкозадиеновую кислоту, эйкозатриеновую кислоту, эйкозапентаеновую кислоту, эруковую кислоту, дигомолиноленовую кислоту, докозатриеновую кислоту, докозапентаеновую кислоту, докозагексаеновую кислоту и адреновую кислоту.
Как применяют в настоящем изобретении, "кортизол и его производные" относится к соединениям, или встречающимся в природе или синтезированным, формулы C:

Формула C
где каждый из R2, R3, R6, R7, R8, R9, и R10 независимо представляет собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы C с ядерным гормональным рецептором; и каждая пунктирная линия представляет собой необязательную двойную связь. В некоторых вариантах осуществления структура формулы C замещена одним или более заместителями в одном или более положениях тетрациклического кольца, таких как, например, положения 1, 2, 4, 5, 6, 7, 8, 11, 12, 14 и 15. Конкретно, неограничивающие примеры производных кортизола и его производных включают кортизол, кортизонацетат, беклометазон, преднизон, преднизолон, метилпреднизолон, бетаметазон, тримцинолон и дексаметазон.
Как применяют в настоящем изобретении, "связывающая группа" представляет собой молекулу или группу молекул, которая соединяет два отдельных фрагмента друг с другом. Связывающие группы могут обеспечивать оптимальным расстоянием между двумя фрагментами или может дополнительно снабжать лабильной связью, которая позволяет двум фрагментам отделяться друг от друга. Лабильные связи включают гидролизуемые группы, фотоотщепляемые группы, кислотолабильные группы, основно-лабильные группы и отщепляемые ферментом группы.
Как применяют в настоящем изобретении, термин "пролекарство" определяют как любое соединение, которое подвергается химической модификации перед проявлением его полных фармакологических эффектов.
Как применяют в настоящем изобретении, "дипептид" является результатом соединения α-аминокислоты или α-гидроксикислоты с другой аминокислотой, пептидной связью.
Как применяют в настоящем изобретении, термин "химическое расщепление" в отсутствии любых дополнительных обозначений включает неферментативную реакцию, которая является результатом разрушения ковалентной химической связи.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к пептидам глюкагонового суперсемейства, конъюгированным с NHR лигандами. В некоторых аспектах NHR лиганды способны воздействовать на ядерные гормональные рецепторы, участвующие в метаболизме или гомеостазе глюкозы, и конъюгат обеспечивает превосходные биологические эффекты на метаболизм или гомеостаз глюкозы по сравнению с только пептидом или только NHR лигандом. Не будучи связанным теорией настоящего изобретения, NHR лиганд может служить для направленной доставки пептида глюкагонового суперсемейства в конкретные типы клеток или ткани; или альтернативно пептид глюкагонового суперсемейства может служить для направленной доставки NHR лиганда или усиливать его транспорт в клетку, например, за счет связывания пептида с рецептором, который интернализирует конъюгат.
Конъюгаты пептидов глюкагонового суперсемейства настоящего изобретения могут быть представлены следующей формулой:
Q-L-Y
где Q представляет собой пептид глюкагонового суперсемейства, Y представляет собой NHR лиганд, и L представляет собой связывающую группу или связь.
Пептид глюкагонового суперсемейства (Q) в некоторых вариантах осуществления может представлять собой родственный глюкагону пептид, который обладает агонистической активностью относительно глюкагонового рецептора, агонистической активностью относительно GLP-1 рецептора, агонистической активностью относительно GIP рецептора, соагонистической активностью относительно глюкагонового и GLP-1 рецепторов, соагонистической активностью относительно глюкагонового и GIP рецепторов, соагонистической активностью относительно GLP-1 и GIP рецепторов или триагонистической активностью относительно глюкагонового, GIP и GLP-1 рецепторов. В некоторых вариантах осуществления родственный глюкагону пептид обладает антагонистической активностью относительно глюкагонового, GLP-1 или GIP рецепторов.
Пептид глюкагонового суперсемейства (Q) в некоторых вариантах осуществления может представлять собой родственный глюкагону пептид, гормон, высвобождающий гормон роста (GHRH; SEQ ID NO: 1619), вазоактивный пептид кишечника (VIP; SEQ ID NO: 1620), полипептид, активирующий аденилатциклазу гипофиза 27 (PACAP-27; SEQ ID NO: 1621), пептид гистидинметионин (PHM; SEQ ID NO: 1622) или секретин (SEQ ID NO: 1623), и/или их аналоги, производные и конъюгаты. Пептиды глюкагонового суперсемейства могут обладать общими структурными характеристиками, включая, но не ограничиваясь этим, гомологию N-концевых аминокислот и/или альфа-спиральную структуру в C-концевой части. Считается, что C-конец обычно осуществляет рецепторное связывание, и N-конец обычно осуществляет рецепторную передачу сигнала. Несколько аминокислот в N-концевой части и C-концевой части являются высококонсервативными среди членов глюкагонового суперсемейства, например, His1, Gly4, Phe6, Phe22, Val23, Trp25 и Leu26, причем аминокислоты в данных положениях показывают идентичность, консервативные замены или схожесть аминокислотных боковых цепей. В некоторых вариантах осуществления родственный глюкагону пептид Q представляет собой глюкагон (SEQ ID NO: 1601), оксинтомодулин (SEQ ID NO: 1606), эксендин-4 (SEQ ID NO: 1618), глюкагоноподобный пептид-1 (GLP-1) (аминокислоты 7-37, представленные как SEQ ID NO: 1603 и 1604), глюкагоноподобный пептид-2 (GLP-2) (SEQ ID NO: 1608), GIP (SEQ ID NO: 1607) или аналоги, производные и конъюгаты вышеуказанных. В некоторых вариантах осуществления Q в качестве родственного глюкагону пептида содержит аминокислотную последовательность, которая по меньшей мере на приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична соответствующей последовательности нативного глюкагона, нативного оксинтомодулина, нативного эксендина-4, нативного (7-37)GLP-1, нативного GLP-2 или нативного GIP по длине нативного пептида (или по положениям, которые соответствуют глюкагону, см., например, фигуру 1). В других вариантах осуществления пептид глюкагонового суперсемейства (Q) содержит аминокислотную последовательность нативного глюкагона, нативного эксендина-4, нативного (7-37)GLP-1, нативного GLP-2, нативного GHRH, нативного VIP, нативного PACAP-27, нативного PHM, нативного оксинтомодулина, нативного секретина или нативного GIP с вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными модификациями. В еще следующих вариантах осуществления Q содержит аминокислотную последовательность, которая представляет собой химеру двух или более последовательностей нативных родственных глюкагону пептидов. В некоторых вариантах осуществления Q содержит аминокислотную последовательность, по меньшей мере приблизительно на 50% идентичную нативному глюкагону (SEQ ID NO: 1601), которая сохраняет альфа-спиральную конформацию аминокислот, соответствующих аминокислотам 12-29.
В родственных аспектах, настоящее изобретение относится к пептидным конъюгатам, представленным формулой
Q-L-Y
где Q представляет собой остеокальцин, кальцитонин, амилин, или их аналог, производное или конъюгат, а не пептид глюкагонового суперсемейства; Y представляет собой NHR лиганд; и L представляет собой связывающую группу или связь. В некоторых вариантах осуществления Q содержит остеокальцин (SEQ ID NO: 1644) или аминокислотную последовательность, которая по меньшей мере на приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, или 95% идентична нативному остеокальцину вдоль длины нативного пептида. Q может содержать аналог остеокальцина с вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными модификациями по сравнению с нативным остеокальцином, или усеченный аналог остеокальцина (например, аминокислоты 70-84) с вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными модификациями по сравнению с нативным усеченным остеокальцином. В некоторых вариантах осуществления Q содержит кальцитонин (SEQ ID NO: 1645) или аминокислотную последовательность, которая по меньшей мере на приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична нативному кальцитонину вдоль длины нативного пептида. Q может содержать аналог кальцитонина с вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными модификациями по сравнению с нативным кальцитонином. В некоторых вариантах осуществления Q содержит амилин (SEQ ID NO: 1646) или аминокислотную последовательность, которая по меньшей мере на приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична нативному амилину вдоль длины нативного пептида. Q может содержать аналог амилина с вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными модификациями по сравнению с нативным амилином.
NHR лиганд (Y)
В настоящем описании, относящемся к Q-L-Y конъюгатам, Y представляет собой лиганд, который воздействует на любой ядерный гормональный рецептор, включая любой один из "суперсемейства ядерных гормональных рецепторов" (NHR суперсемейство), указанного в таблице 1, или класс или его подгруппу. Данное NHR суперсемейство состоит из структурно родственных белков, обнаруживаемых внутри клеток, которые регулируют транскрипцию генов. Данные белки включают рецепторы для стероидных и тироидных гормонов, витаминов и других "орфановых" белков, для которых не обнаружены лиганды. Ядерные гормональные рецепторы обычно содержат по меньшей мере один ДНК-связывающий домен C4-типа цинковый палец (DBD) и/или лиганд-связывающий домен (LBD). DBD функционирует, связываясь с ДНК вблизи генов-мишеней, и LBD связывается и реагирует на его узнаваемый гормон. "Классические ядерные гормональные рецепторы" содержат и DBD, и LBD (например, эстрогеновый рецептор альфа), тогда как другие ядерные гормональные рецепторы содержат только DBD (например, Knirps, ORD) или только LBD (например, короткий гетеродимерный партнер (SHP)).
Ядерные гормональные рецепторы можно разделить на четыре механистические класса: тип I, тип II, тип III и тип IV. Связывание лиганда с рецепторами I типа (NR3 группа) приводит в результате к диссоциации белка теплового шока (HSP) от рецептора, гомодимеризации рецептора, транслокации из цитоплазмы в клеточное ядро и связыванию с инвертированными повторяющимися элементами гормонального ответа (HRE) ДНК. Затем, ядерный рецептор/ДНК комплекс активирует другие белки, которые осуществляют транскрипцию ДНК в направлении 3'-конца от HRE в матричную РНК. Рецепторы II типа (NR1 группа) остаются в ядре и связываются в виде гетеродимеров, обычно с ретиноидными X рецепторами (RXR), с ДНК. Ядерные гормональные рецепторы II типа часто находятся в комплексе с белками-корепрессорами. Связывание лиганда с рецептором II типа вызывает диссоциацию корепрессора и активацию белков-коактиваторов. Дополнительные белки добавляются к ядерный рецептор/ДНК комплексу, который осуществляет транскрипцию ДНК в матричную РНК. Ядерные гормональные рецепторы III типа (NR2 группа) представляют собой орфановые рецепторы, которые связываются с прямыми повторяющимися HRE ДНК в виде гомодимеров. Ядерные гормональные рецепторы IV типа связываются с ДНК или в виде мономеров или в виде димеров. Рецепторы IV типа являются уникальными, поскольку один ДНК связывающий домен рецептора связывается с одной половиной сайта HRE. NHR лиганд может представлять собой лиганд, который воздействует на любой один или более ядерных гормональных рецепторов типа I, типа II, типа III или типа IV (например, как агонист или антагонист).
Данные в таблице взяты из Laudet and Gronemeyer "The Nuclear Receptor Facts Book," Academic Press. Класс ID относится к классификационному коду для каждого числа, и номер доступа относится к NCBI GenBank нуклеотидному коду доступа.
Активность NHR лиганда (Y)
В некоторых вариантах осуществления Y обладает EC50 относительно активации ядерного гормонального рецептора (или в случае антагониста, IC50) приблизительно 10 мМ или меньше, или 1 мМ (1000 мкМ) или меньше (например, приблизительно 750 мкМ или меньше, приблизительно 500 мкМ или меньше, приблизительно 250 мкМ или меньше, приблизительно 100 мкМ или меньше, приблизительно 75 мкМ или меньше, приблизительно 50 мкМ или меньше, приблизительно 25 мкМ или меньше, приблизительно 10 мкМ или меньше, приблизительно 7,5 мкМ или меньше, приблизительно 6 мкМ или меньше, приблизительно 5 мкМ или меньше, приблизительно 4 мкМ или меньше, приблизительно 3 мкМ или меньше, приблизительно 2 мкМ или меньше или приблизительно 1 мкМ или меньше). В некоторых вариантах осуществления Y обладает EC50 или IC50 относительно ядерного гормонального рецептора приблизительно равной 1000 нМ или меньше (например, приблизительно 750 нМ или меньше, приблизительно 500 нМ или меньше, приблизительно 250 нМ или меньше, приблизительно 100 нМ или меньше, приблизительно 75 нМ или меньше, приблизительно 50 нМ или меньше, приблизительно 25 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 7,5 нМ или меньше, приблизительно 6 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 4 нМ или меньше, приблизительно 3 нМ или меньше, приблизительно 2 нМ или меньше или приблизительно 1 нМ или меньше). В некоторых вариантах осуществления Y имеет EC50 или IC50 относительно ядерного гормонального рецептора, которая находится в пикомолярном диапазоне. Соответственно, в некоторых вариантах осуществления Y обладает EC50 или IC50 относительно ядерного гормонального рецептора приблизительно 1000 пМ или меньше (например, приблизительно 750 пМ или меньше, приблизительно 500 пМ или меньше, приблизительно 250 пМ или меньше, приблизительно 100 пМ или меньше, приблизительно 75 пМ или меньше, приблизительно 50 пМ или меньше, приблизительно 25 пМ или меньше, приблизительно 10 пМ или меньше, приблизительно 7,5 пМ или меньше, приблизительно 6 пМ или меньше, приблизительно 5 пМ или меньше, приблизительно 4 пМ или меньше, приблизительно 3 пМ или меньше, приблизительно 2 пМ или меньше или приблизительно 1 пМ или меньше).
В некоторых вариантах осуществления Y обладает EC50 или IC50 относительно ядерного гормонального рецептора, которая составляет приблизительно 0,001 пМ или более, приблизительно 0,01 пМ или более, или приблизительно 0,1 пМ или более. Активацию ядерного гормонального рецептора (активность относительно ядерного гормонального рецептора) можно измерить in vitro любым анализом, известным в данной области техники. Например, активность относительно ядерного гормонального рецептора можно измерить экспрессией рецептора в клетках дрожжей, также содержащих репортерный ген (например, lacZ, который кодирует β-галактозидазу) под контролем чувствительного к гормону промотора. Таким образом, в присутствии лиганда, который воздействует на рецептор, репортерный ген экспрессируется, и активность продукта репортерного гена можно измерить (например, измерением активности β-галактозидазы по расщеплению хромогенного субстрата, такого как хлорфеноловый красный-β-D-галактопиранозид (CPRG), который первоначально является желтым, до красного продукта, который можно измерить по поглощению). См., например, Jungbauer and Beck, J. Chromatog. B, 77: 167-178 (2002); Routledge and Sumpter, J. Biol. Chem, 272: 3280-3288 (1997); Liu et al., J. Biol. Chem., 274: 26654-26660 (1999). Связывание NHR лиганда с ядерным гормональным рецептором можно определить, применяя любой анализ на связывание, известный в данной области техники, такой как, например, флуоресцентный поляризационный или радиоактивный анализ. См., например, Ranamoorthy et al., 138(4): 1520-1527 (1997).
В некоторых вариантах осуществления Y обладает приблизительно 0,001% или более, приблизительно 0,01% или более, приблизительно 0,1% или более, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, приблизительно 20% или более, приблизительно 30% или более, приблизительно 40% или более, приблизительно 50% или более, приблизительно 60% или более, приблизительно 75% или более, приблизительно 100% или более, приблизительно 125% или более, приблизительно 150% или более, приблизительно 175% или более, приблизительно 200% или более, приблизительно 250% или более, приблизительно 300% или более, приблизительно 350% или более, приблизительно 400% или более, приблизительно 450% или более, или приблизительно 500% или более активностью относительно ядерного гормонального рецептора по сравнению с нативным ядерным гормоном (активностью ядерного гормона). В некоторых вариантах осуществления Y обладает приблизительно 5000% или менее или приблизительно 10000% или менее активностью относительно ядерного гормонального рецептора по сравнению с нативным ядерным гормоном. Активность Y относительно рецептора по сравнению с нативным лигандом рецептора рассчитывают как обратное отношение EC50 для Y относительно нативного лиганда. В некоторых вариантах осуществления Y представляет собой нативный лиганд рецептора.
Структура NHR лиганда (Y)
NHR лиганд настоящего изобретения (Y) является частично или полностью непептидным и является гидрофобным или липофильным. В некоторых вариантах осуществления NHR лиганд имеет молекулярный вес, который равен приблизительно 5000 дальтон или меньше, или приблизительно 4000 дальтон или меньше, или приблизительно 3000 дальтон или меньше, или приблизительно 2000 дальтон или меньше, или приблизительно 1750 дальтон или меньше, или приблизительно 1500 дальтон или меньше, или приблизительно 1250 дальтон или меньше, или приблизительно 1000 дальтон или меньше, или приблизительно 750 дальтон или меньше, или приблизительно 500 дальтон или меньше, или приблизительно 250 дальтон или меньше. Структура Y может соответствовать любой из структур, описанных в настоящем изобретении.
В вариантах осуществления, описанных в настоящем изобретении, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении Y, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение и способы конъюгирования, принимая во внимание общедоступные сведения и приведенное настоящее описание.
В любом из вариантов осуществления, описанных в настоящем изобретении, где Y содержит тетрациклический остов, содержащий три 6-членных кольца, соединенных с одним 5-членным кольцом или его вариантами (например, Y, который воздействует на рецептор витамина D), атомы углерода остова обозначаются номером положения, как показано ниже:

Например, модификация, содержащая кетон в положении 6, относится к следующей структуре:

NHR лиганд, который воздействует на ядерный гормональный рецептор I типа
В некоторых вариантах осуществления настоящего изобретения, NHR лиганд (Y) воздействует на ядерный гормональный рецептор I типа. В некоторых вариантах осуществления Y может иметь любую структуру, которая обеспечивает или способствует агонистической активности при связывании лиганда с ядерным гормональным рецептором I типа, тогда как в других вариантах осуществления Y представляет собой антагонист ядерного гормонального рецептора I типа.
В примерных вариантах осуществления Y включает структуру, как показано в формуле A:

Формула A
где R1 и R2, когда они присутствуют, независимо представляют собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы A с ядерным гормональным рецептором I типа; R3 и R4 независимо представляют собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы A с ядерным гормональным рецептором I типа; и каждая пунктирная линия представляет собой необязательную двойную связь. Формула A может дополнительно содержать один или более заместителей в одном или более из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 14, 15, 16, 17, 18 и 19. Предусмотренные необязательные заместители включают, но не ограничиваясь этим, OH, NH2, кетон и С1-C18 алкильные группы.
В некоторых вариантах осуществления Y включает структуру формулы A, где
R1 присутствует и представляет собой водород, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8 алкил)C(O)C1-C18алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил, (C0-C8алкил)C(O)NR24гетероарил или SO3H;
R2 присутствует и представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C18 алкил, (C0-C8 алкил)OC2-C18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8 алкил)NR24C1-C18 алкил, (C0-C8 алкил)NR24C1-C18 алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8 алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C18 алкил, (C0-C8 алкил)NR24C(O)C2-C8алкенил, или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18 алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8 алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C18 алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH;
R3 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C18 алкил, (C0-C8алкил)OC2-C18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-C18 алкил, (C0-C8 алкил)NR24C2-C18 алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8 алкил)C(O)OC2-С18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C18 алкил, (C0-C8 алкил)NR24C(O)C2-C18 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18 алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C18 алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH;
R4 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C18 алкил, (C0-C8алкил)OC2-C18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-C18 алкил, (C0-C8 алкил)NR24C2-C18 алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C18 алкил, (C0-C8 алкил)NR24C(O)C2-C8 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18 алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C18 алкил, (C0-C8 алкил)NR24(O)OC1-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH; и
R24 представляет собой водород или C1-C18 алкил.
В некоторых вариантах осуществления Y содержит структуру формулы A, где
R1 присутствует и представляет собой водород, C1-C7 алкил; (C0-C3 алкил)C(O)C1-C7 алкил, (C0-C3алкил)C(O)арил или SO3H;
R2 присутствует и представляет собой водород, галоген, OH или С1-C7 алкил;
R3 представляет собой водород, галоген, OH или С1-C7 алкил;
R4 представляет собой водород, (C0-C8 алкил)галоген, C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C8 алкил, (C0-C8 алкил)OC2-C8алкенил, (C0-C8 алкил)OC2-C8 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8 алкил)NR24C1-C8алкил, (C0-C8 алкил)NR24C2-C8 алкенил, (C0-C8 алкил)NR24C2-C8 алкинил, (C0-C8(C0-C8 алкил)C(O)C1-C8 алкил, (C0-C8 алкил)C(O)C2-C8 алкенил, (C0-C8 алкил)C(O)C2-C8 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8 алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C8 алкил, (C0-C8 алкил)C(O)OC2-C8 алкенил, (C0-C8 алкил)C(O)OC2-C8 алкинил, (C0-C8алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C8 алкил, (C0-C8 алкил)OC(O)C2-C8 алкенил, (C0-C8 алкил)OC(O)C2-C18 алкинил, (C0-C8алкил)C(O)NR24C1-C8 алкил, (C0-C8 алкил)C(O)NR24C2-C8 алкенил, (C0-C8 алкил)C(O)NR24C2-C8алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил, (C0-C8алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C8 алкил, (C0-C8 алкил)NR24C(O)C2-C8алкенил или (C0-C8 алкил)NR24C(O)C2-C8 алкинил, (C0-C8 алкил)NR24C(O)OH, (C0-C8алкил)OC(O)OC1-C8 алкил, (C0-C8 алкил)OC(O)OC2-C8 алкенил, (C0-C8 алкил)OC(O)OC2-C8алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C8 алкил, (C0-C8алкил)OC(O)NR24C2-C8 алкенил, (C0-C8 алкил)OC(O)NR24C2-C8 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C8 алкил, (C0-C8 алкил)NR24(O)OC2-C8 алкенил, (C0-C8 алкил)NR24(O)OC2-C8 алкинил или (C0-C8 алкил)NR24(O)OH; и,
R24 представляет собой водород или C1-C7 алкил.
В некоторых вариантах осуществления R1 представляет собой водород, пропионат, ацетат, бензоат или сульфат; R2 представляет собой водород или метил; R3 представляет собой водород или метил; и R4 представляет собой ацетат, ципионат, гемисукцинат, энантат или пропионат.
В вариантах осуществления, где Y включает структуру формулы A, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы A, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгации в формуле A и способы конъюгирования формулы A с Q или L, принимая во внимание общедоступные сведения и приведенное настоящее описание. В некоторых вариантах осуществления формула A конъюгирована с L или Q в любом из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 формулы A. В некоторых вариантах осуществления формула A конъюгирована с L или Q в положении 1, 3, 6, 7, 12, 10, 13, 16, 17 или 19 формулы A.
В некоторых вариантах осуществления Y воздействует на эстрогеновый рецептор (например, ERα, ERβ). В некоторых вариантах осуществления Y обеспечивает или способствует агонистической активности относительно эстрогенового рецептора, тогда как в других вариантах осуществления Y представляет собой антагонист ER. В примерных вариантах осуществления Y может иметь структуру формулы B:
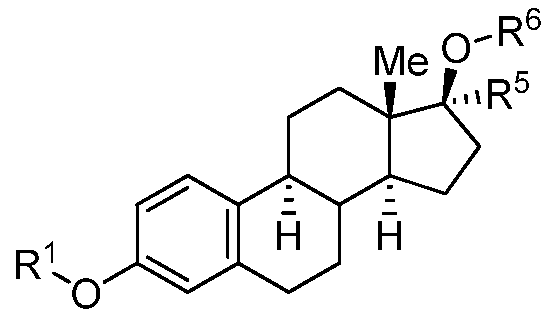
Формула B
где R1, R5 и R6 представляют собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы B с эстрогеновым рецептором. В некоторых вариантах осуществления формула B дополнительно содержит один или более заместителей в одном или более из положений 1, 2, 4, 6, 7, 8, 9, 11, 12, 14, 15 и 16 (например, кетон в положении 6).
В некоторых вариантах осуществления Y включает структуру формулы B, где
R1 представляет собой водород, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18алкенил, (C0-C8 алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил, (C0-C8алкил)C(O)NR24гетероарил или SO3H;
R5 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C18 алкил, (C0-C8алкил)OC12-C18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-C18 алкил, (C0-C8 алкил)NR24C2-C18 алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C12-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C18 алкил, (C0-C8 алкил)NR24C(O)C2-C8 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18 алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкенил, (C0-C8 алкил)OC(O)NR24C12-C18 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C18 алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH; (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8 алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8 алкил)C(O)OC2-C18 алкинил, (C0-C8алкил)C(O)OH, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)NR24C(O)C1-C18 алкил, (C0-C8 алкил)NR24C(O)C12-C18 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил или (C0-C8 алкил)NR24C(O)OH;
R6 представляет собой водород, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C1-C18 алкил, (С0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8 алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил, (C0-C8алкил)C(O)NR24гетероарил или SO3H; и
R24 представляет собой водород или C1-C18 алкил.
В некоторых вариантах осуществления Y включает структуру формулы B, где
R1 представляет собой водород, С1-C7 алкил; (C0-C3 алкил)C(O)C1-C7 алкил, (C0-C3 алкил)C(O)арил или SO3H;
R5 представляет собой водород, (C0-C8 алкил)галоген, C1-C8 алкил, C2-C8 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C8 алкил, (C0-C8 алкил)OC2-C8алкенил, (C0-C8 алкил)OC2-C8 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8 алкил)NR24C1-C8алкил, (C0-C8 алкил)NR24C2-C8 алкенил, (C0-C8 алкил)NR24C2-C8 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C8 алкил, (C-C8 алкил)C(O)C2-C8 алкенил, (C0-C8 алкил)C(O)C2-C8 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8 алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C8 алкил, (C0-C8 алкил)C(O)OC2-C8 алкенил, (C0-C8 алкил)C(O)OC2-C8 алкинил, (C0-C8алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C8 алкил, (C0-C8 алкил)OC(O)C2-C8 алкенил, (C0-C8 алкил)OC(O)C2-С18 алкинил, (C0-C8алкил)C(O)NR24C1-C8 алкил, (C0-C8 алкил)C(O)NR24C2-C8 алкенил, (C0-C8 алкил)C(O)NR24C2-C8алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C8 алкил, (C0-C8 алкил)NR24C(O)C2-C8алкенил, или (C0-C8 алкил)NR24C(O)C2-C8 алкинил, (C0-C8 алкил)NR24C(O)OH, (C0-C8алкил)OC(O)OC1-C8 алкил, (C0-C8 алкил)OC(O)OC2-C8 алкенил, (C0-C8 алкил)OC(O)OC2-C8алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C8 алкил, (C0-C8алкил)OC(O)NR24C2-C8 алкенил, (C0-C8 алкил)OC(O)NR24C2-C8 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C8 алкил, (C0-C8 алкил)NR24(O)OC2-C8 алкенил, (C0-C8 алкил)NR24(O)OC2-C8 алкинил или (C0-C8 алкил)NR24(O)OH;
R6 представляет собой водород, C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C1-C8 алкил, (C0-C8 алкил)C(O)C2-C8 алкенил, (C0-C8алкил)C(O)C2-C8 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C8 алкил, (C0-C8 алкил)C(O)OC2-C8 алкенил, (C0-C8алкил)C(O)OC2-C8 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C8 алкил, (C0-C8 алкил)C(O)NR24C2-C8 алкенил, (C0-C8алкил)C(O)NR24C2-C8 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил или (C0-C8алкил)C(O)NR24гетероарил; и
R24 представляет собой водород или С1-C7 алкил.
Например, R1 представляет собой водород, пропионат, ацетат, бензоат или сульфат; R5 представляет собой водород, этинил, гидроксил; и R6 представляет собой ацетат, ципионат, гемисукцинат, енантат или пропионат.
Неограничивающие примеры соединения формулы B включают 17β-эстрадиол, модифицированные формы эстрадиола, такие как β-эстрадиол 17-ацетат, β-эстрадиол 17-ципионат, β-эстрадиол 17-энантат, β-эстрадиол 17-валерат, β-эстрадиол 3,17-диацетат, β-эстрадиол 3,17-дипропионат, β-эстрадиол 3-бензоат, β-эстрадиол 3-бензоат 17-н-бутират, β-эстрадиол 3-глицидиловый эфир, β-эстрадиол 3-метиловый эфир, β-эстрадиол 6-он, β-эстрадиол 3-глицидил, β-эстрадиол 6-он 6-(O-карбоксиметилоксим), 16-эпиэстриол, 17-эпиэстриол, 2-метоксиэстрадиол, 4-метоксиэстрадиол, эстрадиол 17-фенилпропионат и 17β-эстрадиол 2-метиловый эфир, 17α-этинилэстрадиол, мегестрол ацетат, эстриол и их производные. В некоторых вариантах осуществления атом углерода 17 содержит кетоновый заместитель, и R5 и R6 отсутствуют (например, эстроген). Некоторые вышеприведенные соединения формулы B показаны ниже:
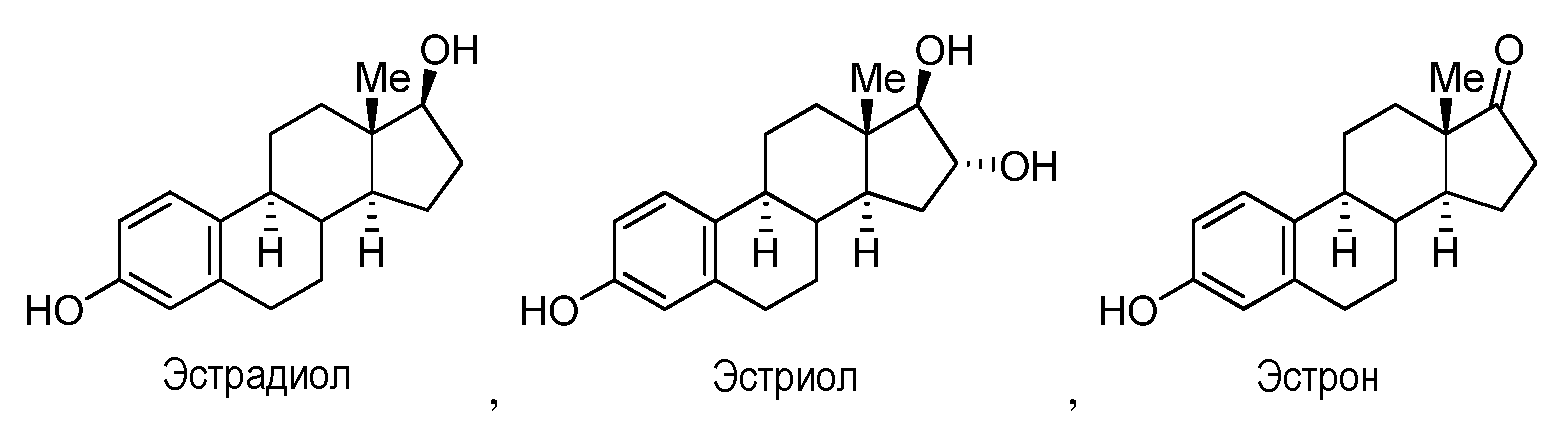

В вариантах осуществления, где Y включает структуру формулы B, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы B, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле B и способы конъюгирования формулы B с Q или L ,принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула B конъюгирована с L или Q в любом из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 формулы B. В некоторых вариантах осуществления формула B конъюгирована с L или Q в положении 3 или 17 формулы B.
В других вариантах осуществления Y воздействует на эстрогеновый рецептор, но не охвачен формулой B. Неограничивающие примеры лигандов, который воздействуют на эстрогеновый рецептор, которые не охвачены формулой B, показаны ниже:

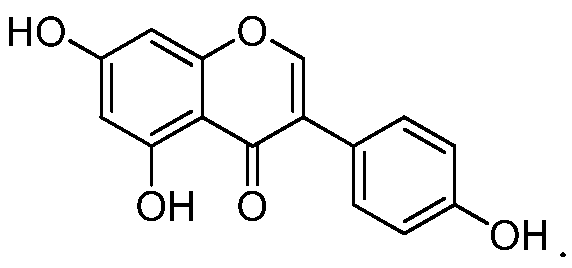
В некоторых вариантах осуществления Y воздействует на глюкокортикоидный рецептор (GR). В некоторых вариантах осуществления Y включает любую структуру, которая обеспечивает или способствует агонистической активности относительно GR, тогда как в других вариантах осуществления Y представляет собой антагонист GR. В примерных вариантах осуществления Y включает структуру формулы C:
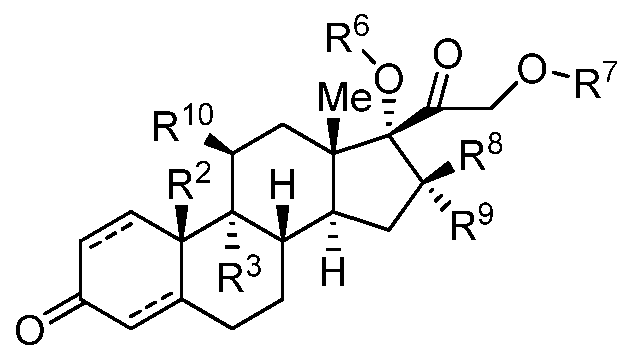
Формула C
где каждый из R2, R3, R6, R7, R8, R9 и R10 независимо представляет собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы C с GR; и каждая пунктирная линия представляет собой необязательную двойную связь. В некоторых вариантах осуществления формула C дополнительно содержит один или более заместителей в одном или более положениях 1, 2, 4, 5, 6, 7, 8, 9, 11, 12, 14 и 15 (например, гидроксил или кетон в положении 11).
В некоторых вариантах осуществления Y включает структуру формулы C, где
R2 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C18 алкил, (C0-C8алкил)OC2-C18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-C18 алкил, (C0-C8 алкил)NR24C2-C18 алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C18 алкил, (C0-C8 алкил)NR24C(O)C2-C18 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18 алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8 алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C18 алкил, (C0-C8 алкил)NR24(O)OC2-C18алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH;
R3 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C18 алкил, (C0-C8алкил)OC2-C18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-C18 алкил, (C0-C8 алкил)NR24C2-C18 алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8 алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-С18алкенил, (C0-C8 алкил)C(O)OC2-С18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-С18 алкенил, (C0-C8 алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C18 алкил, (C0-C8 алкил)NR24C(O)C2-C8 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C18 алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH;
R6 представляет собой водород, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18алкенил, (C0-C8 алкил)C(O)C2-С18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-С18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8алкил)C(O)NR24C2-С18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил или (C0-C8алкил)C(O)NR24гетероарил;
R7 представляет собой водород, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18алкенил, (C0-C8 алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C18алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил или (C0-C8алкил)C(O)NR24гетероарил;
R8 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил;
R9 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил;
R10 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил или (C0-C8 алкил)OH; и
R24 представляет собой водород или C1-C18 алкил.
В некоторых вариантах осуществления Y включает структуру формулы C, где
R2 представляет собой водород, галоген, OH или C1-C7 алкил;
R3 представляет собой водород, галоген, OH или C1-C7алкил;
R6 представляет собой водород, C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C1-C8 алкил, (C0-C8 алкил)C(O)C2-C8 алкенил, (C0-C8алкил)C(O)C2-C8 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C8 алкил, (C0-C8 алкил)C(O)OC2-C8 алкенил, (C0-C8алкил)C(O)OC2-C8 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C8 алкил, (C0-C8 алкил)C(O)NR24C2-C8 алкенил, (C0-C8алкил)C(O)NR24C2-C8 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил или (C0-C8алкил)C(O)NR24гетероарил;
R7 представляет собой водород, C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0 алкил)C(O)C1-C8 алкил, (C0 алкил)C(O)C2-C8 алкенил, (C0 алкил)C(O)C2-C8 алкинил, (C0)C(O)арил, (C0)C(O)гетероарил, (C0)C(O)OC1-C8 алкил, (C0алкил)C(O)OC2-C8 алкенил, (C0 алкил)C(O)OC2-C8 алкинил или (C0 алкил)C(O)OH;
R8 представляет собой водород или C1-C7 алкил;
R9 представляет собой водород или C1-C7 алкил;
R10 представляет собой водород или OH; и
R24 представляет собой водород или C1-C7алкил.
Например, R2 представляет собой водород или метил; R3 представляет собой водород, фтор, хлор или метил; R6 представляет собой водород или C(O)C1-C7 алкил; R7 представляет собой водород, C(O)CH3 или C(O)CH2CH3; R8 представляет собой водород или метил; R9 представляет собой водород или метил; и R10 представляет собой гидроксил.
Неограничивающие примеры структур формулы C включают:
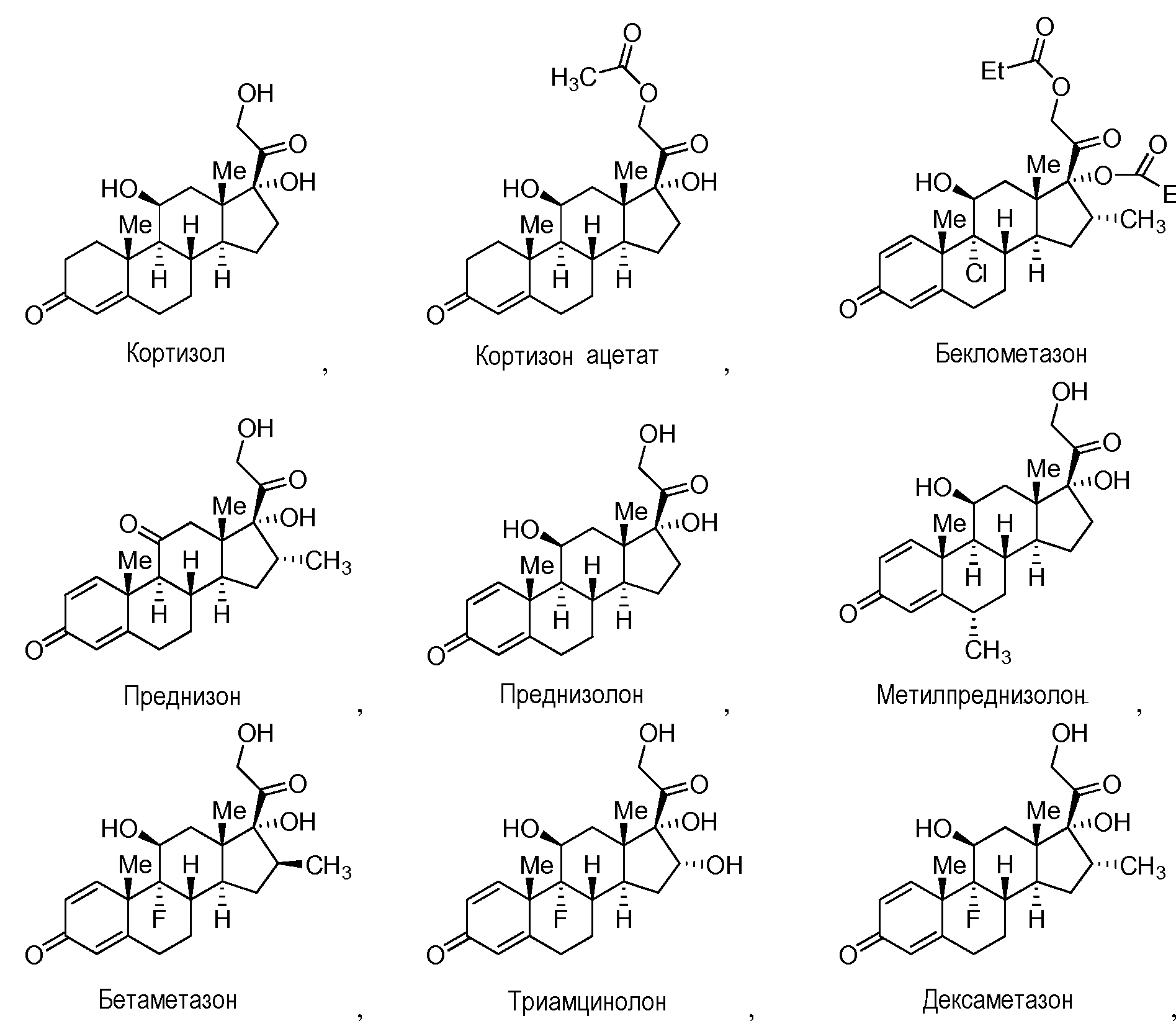

и их производные.
В вариантах осуществления, где Y включает структуру формулы C, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы C, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле C и способы конъюгирования формулы C с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула C конъюгирована с L или Q в любом из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 формулы C. В некоторых вариантах осуществления формула C конъюгирована с L или Q в положении 3, 10, 16 или 17 формулы C.
В некоторых вариантах осуществления Y воздействует на минералокортикоидный рецептор (MR). В некоторых вариантах осуществления Y включает любую структуру, которая обеспечивает или способствует агонистической активности относительно MR, тогда как в других вариантах осуществления Y представляет собой антагонист MR. В примерных вариантах осуществления Y включает структуру формулы D:
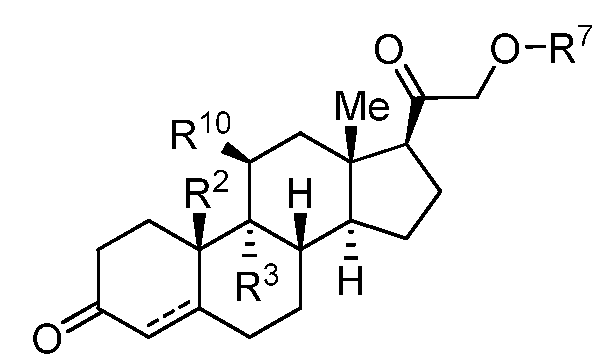
Формула D
где каждый из R2, R3, R7 и R10 независимо представляет собой группу, которая обеспечивает или способствует агонистической или антагонистической активности при связывании соединения формулы D с MR; и пунктирная линия показывает необязательную двойную связь. В некоторых вариантах осуществления формула D дополнительно включает один или более заместителей в одном или более из положений 1, 2, 4, 5, 6, 7, 8, 11, 12, 14, 15, 16 и 17.
В некоторых вариантах осуществления Y включает структуру формулы D, где
R2 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C18 алкил, (C0-C8алкил)OC2-C18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-C18 алкил, (C0-C8 алкил)NR24C2-C18 алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C18 алкил, (C0-C8 алкил)NR24C(O)C2-C18 алкенил или (C0-C8 алкил)NR24C(O)C2-С18 алкинил, (C0-C8 алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8 алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C18 алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH;
R3 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C18 алкил, (C0-C8 алкил)OC2-C18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-C18 алкил, (C0-C8 алкил)NR24C2-C18 алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8 алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C1-С8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8 алкил)C(O)NR24C2-С18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C18 алкил, (C0-C8 алкил)NR24C(O)C2-C8 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C18 алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH;
R7 представляет собой водород, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C2-C18 алкил, (C0-C8 алкил)C(O)C2-C18алкенил, (C0-C8 алкил)C(O)C2-С18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил или (C0-C8алкил)C(O)NR24гетероарил;
R10 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил или (C0-C8 алкил)OH; и
R24 представляет собой водород или C1-C18 алкил.
В некоторых вариантах осуществления Y включает структуру формулы D, где R2 представляет собой водород, галоген, OH или C1-C7 алкил;
R3 представляет собой водород, галоген, OH или C1-C7 алкил;
R7 представляет собой водород, C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0 алкил)C(O)C1-C8алкил, (C0 алкил)C(O)C2-C8 алкенил, (C0алкил)C(O)C2-C8 алкинил, (C0)C(O)арил, (C0)C(O)гетероарил, (C0)C(O)OC1-C8 алкил, (C0 алкил)C(O)OC2-C8 алкенил, (C0 алкил)C(O)OC2-C8 алкинил или (C0 алкил)C(O)OH;
R10 представляет собой водород или OH; и
R24 представляет собой водород или С1-C7 алкил.
Например, R2 представляет собой водород или метил; R3 представляет собой водород, фтор, хлор или метил; R7представляет собой водород, C(O)CH3 или C(O)CH2CH3; и R10 представляет собой гидроксил.
Неограничивающие примеры соединений формулы D включают:
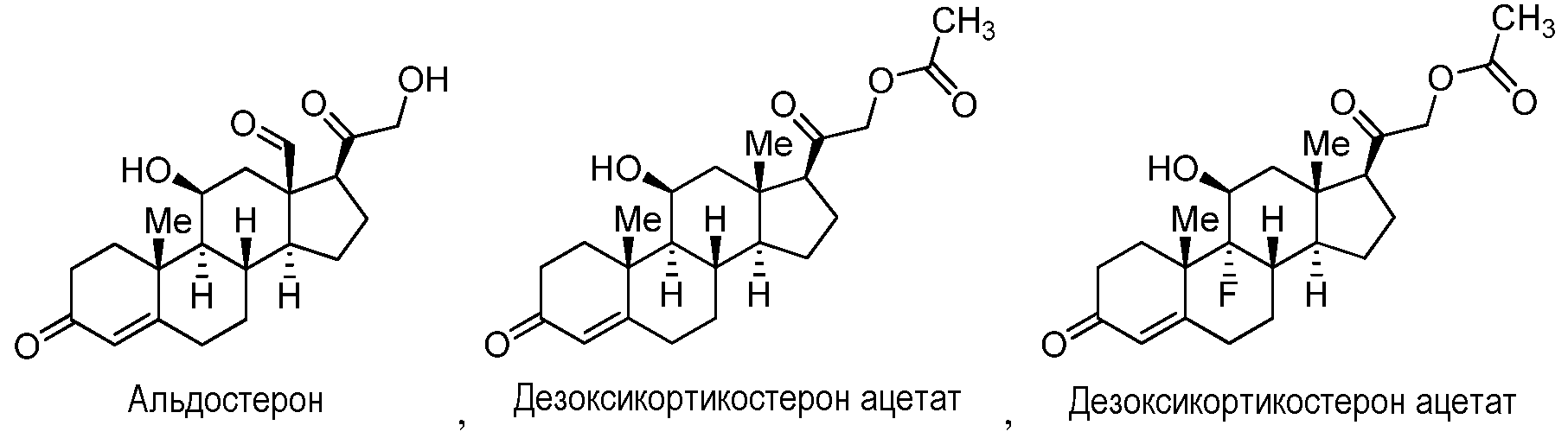
и их производные.
В вариантах осуществления, где Y включает структуру формулы D, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы D, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле D и способы конъюгирования формулы D с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула D конъюгирована с L или Q в любом из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 формулы D. В некоторых вариантах осуществления формула D конъюгирована с L или Q в положении 3, 10, 13 или 17 формулы D.
В некоторых вариантах осуществления Y воздействует на прогестероновый рецептор (PR). В некоторых вариантах осуществления Y включает любую структуру, которая обеспечивает или способствует агонистической активности относительно PR, тогда как в других вариантах осуществления Y представляет собой антагонист PR. В примерных вариантах осуществления Y включает структуру формулы E:

Формула E
где каждый из R2, R3, R4 и R7 независимо представляет собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы E с PR; и пунктирная линия показывает необязательную двойную связь. В некоторых вариантах осуществления формула E дополнительно содержит один или более заместителей в одном или более положениях 1, 2, 4, 5, 6, 7, 8, 11, 12, 14, 15, 16 и 17 (например, метильная группа в положении 6).
В некоторых вариантах осуществления Y включает структуру формулы E, где
R2 представляет собой водород, (C0-C8 алкил)галоген, C1-С18 алкил, C2-С18 алкенил, C2-С18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-С18 алкил, (C0-C8алкил)OC2-С18 алкенил, (C0-C8 алкил)OC2-С18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-С18 алкил, (C0-C8 алкил)NR24C2-С18 алкенил, (C0-C8 алкил)NR24C2-С18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)С1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-С18 алкенил, (C0-C8алкил)C(O)OC2-С18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8 алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-С18 алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-С18 алкил, (C0-C8 алкил)NR24C(O)C2-C8 алкенил или (C0-C8 алкил)NR24C(O)C2-С18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-С18 алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH; R24 представляет собой водород или C1-С18 алкил.
R3 представляет собой водород, (C0-C8 алкил)галоген, C1-С18 алкил, C2-С18 алкенил, C2-С18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-С18 алкил, (C0-C8алкил)OC2-С18 алкенил, (C0-C8 алкил)OC2-С18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-С18 алкил, (C0-C8 алкил)NR24C2-С18 алкенил, (C0-C8 алкил)NR24C2-С18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-С18 алкил, (C0-C8 алкил)C(O)C2-С18 алкенил, (C0-C8алкил)C(O)C2-С18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-С18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-С18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-С18алкил, (C0-C8 алкил)C(O)NR24C2-С18 алкенил, (C0-C8 алкил)C(O)NR24C2-С18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-С18 алкил, (C0-C8 алкил)NR24C(O)C2-С18 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-С18 алкил, (C0-C8 алкил)OC(O)OC2-С18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C2-С18алкил, (C0-C8 алкил)OC(O)NR24C2-С18 алкенил, (C0-C8 алкил)OC(Q)NR24C2-С18 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-С18 алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH;
R4 представляет собой водород, (C0-C8 алкил)галоген, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C18 алкил, (C0-C8алкил)OC2-C18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-C18алкил, (C0-C8 алкил)NR24C2-C18алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-C18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)С1-Cl8 алкил, (C0-C8 алкил)NR24C(O)C2-C8 алкенил или (C0-C8 алкил)NR24C(O)C2-С18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-C18 алкил, (C0-C8 алкил)OC(O)OC2-C18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C18 алкил, (C0-C8 алкил)OC(O)NR24C2-C18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8 алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C18 алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-C18 алкинил или (C0-C8 алкил)NR24(O)OH;
R7 представляет собой водород, C1-C18 алкил, C2-C18 алкенил, C2-C18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C1-C18 алкил, (C0-C8 алкил)C(O)C2-C18алкенил, (C0-C8 алкил)C(O)C2-С18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил или (C0-C8алкил)C(O)NR2гетероарил; и
R24 представляет собой водород или C1-С18 алкил.
В некоторых вариантах осуществления Y включает структуру формулы E, где
R2 представляет собой водород, галоген, OH, или С1-C7 алкил;
R3 представляет собой водород, галоген, OH или С1-С7 алкил;
R4 представляет собой водород, (C0-C8 алкил)галоген, С1-C8 алкил, C2-C8 алкенил, С2-C8 алкинил, гетероалкил, (С0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-C8 алкил, (C0-C8 алкил)OC2-C8 алкенил, (C0-C8 алкил)OC2-C8 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8 алкил)NR24C1-C8 алкил, (C0-C8 алкил)NR24C2-C8 алкенил, (C0-C8 алкил)NR24C2-C8 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)С1-C8 алкил, (C0-C8 алкил)C(O)C2-C8 алкенил, (C0-C8 алкил)C(O)C2-C8 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8 алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C8 алкил, (C0-C8 алкил)C(O)OC2-C8 алкенил, (C0-C8 алкил)C(O)OC2-C8 алкинил, (C0-C8алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)С1-C8 алкил, (C0-C8 алкил)OC(O)C2-C8 алкенил, (C0-C8 алкил)OC(O)C2-C18 алкинил, (C0-C8алкил)C(O)NR24C1-C8 алкил, (C0-C8 алкил)C(O)NR24C2-C8 алкенил, (C0-C8 алкил)C(O)NR24C2-C8алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил, (C0-C8алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-C8 алкил, (C0-C8 алкил)NR24C(O)C2-C8алкенил или (C0-C8 алкил)NR24C(O)C2-C8 алкинил, (C0-C8 алкил)NR24C(O)OH, (C0-C8алкил)OC(O)OC1-C8 алкил, (C0-C8 алкил)OC(O)OC2-C8 алкенил, (C0-C8 алкил)OC(O)OC2-C8алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-C8 алкил, (C0-C8алкил)OC(O)NR24C2-C8 алкенил, (C0-C8 алкил)OC(O)NR24C2-C8 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-C8 алкил, (C0-C8 алкил)NR24(O)OC2-C8 алкенил, (C0-C8 алкил)NR24(O)OC2-C8 алкинил или (C0-C8 алкил)NR24(O)OH;
R7 представляет собой водород, С1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0 алкил)C(O)C1-C8 алкил, (C0 алкил)C(O)C2-C8 алкенил, (C0алкил)C(O)C2-C8 алкинил, (C0)C(O)арил, (C0)C(O)гетероарил, (C0)C(O)OC1-C8 алкил, (C0алкил)C(O)OC2-C8 алкенил, (C0 алкил)C(O)OC2-C8 алкинил или (C0 алкил)C(O)OH; и
R24 представляет собой водород или С1-C7 алкил.
Например, R2 представляет собой водород или метил; R3 представляет собой водород или метил; R4 представляет собой (C1 алкил)C(O)C1-C4 алкил, ацетат, ципионат, гемисукцинат, энантат или пропионат; и R7 представляет собой водород, C(O)CH3 или C(O)CH2CH3.
Неограничивающие примеры соединений формулы E включают:

и их производные.
В вариантах осуществления, где Y включает структуру формулы E, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы E, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле E и способы конъюгирования формулы E с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула E конъюгирована с L или Q в любом положении 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 формулы E. В некоторых вариантах осуществления формула E конъюгирована с L или Q в положении 3 или 17 формулы E.
В других вариантах осуществления Y воздействует на прогестероновый рецептор, но не охвачен формулой E. Например, Y может включать структуру ниже и ее аналоги:

Норетиндрон.
В некоторых вариантах осуществления Y воздействует на андрогеновый рецептор (AR). В некоторых вариантах осуществления Y включает любую структуру, которая обеспечивает или способствует агонистической активности относительно AR, тогда как в других вариантах осуществления Y представляет собой антагонист AR. В примерных вариантах осуществления Y включает структуру формулы F:
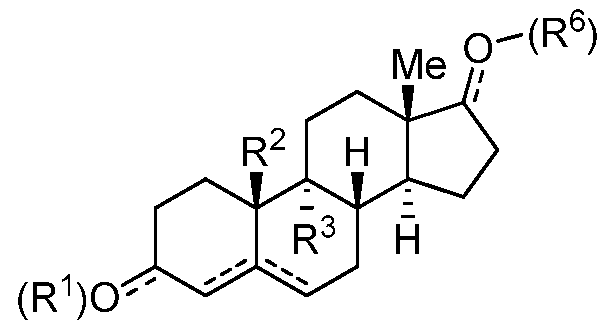
Формула F
где каждый R1, когда он присутствует, R2, R3 и R6 независимо представляют собой группу, которая обеспечивает или способствует агонистической или антагонистической активности при связывании соединения формулы F с AR; и каждая пунктирная линия представляет собой необязательную двойную связь, при условии, что не более чем одна из необязательных углерод-углерод двойных связей присутствует в положении 5. В некоторых вариантах осуществления формула F дополнительно включает один или более заместителей в одном или более положениях 1, 2, 4, 5, 6, 7, 8, 11, 12, 14, 15, 16 и 17.
В некоторых вариантах осуществления Y включает структуру формулы F, где
R1 присутствует и представляет собой водород, С1-С18 алкил, С2-С18 алкенил, С2-С18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)С1-С18 алкил, (C0-C8 алкил)C(O)С2-С18 алкенил, (C0-C8 алкил)C(O)C2-С18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-С18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8 алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C18 алкил, (C0-C8 алкил)C(O)NR24C2-C18 алкенил, (C0-C8алкил)C(O)NR24C2-С18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил, (C0-C8алкил)C(O)NR24гетероарил или SO3H;
R2 представляет собой водород, (C0-C8 алкил)галоген, С1-С18 алкил, C2-C18 алкенил, С2-С18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-С18 алкил, (C0-C8алкил)OC2-С18 алкенил, (C0-C8 алкил)OC2-C18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-С18 алкил, (C0-C8 алкил)NR24C2-С18 алкенил, (C0-C8 алкил)NR24C2-С18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)С1-С18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-С18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)С1-С18 алкил, (C0-C8 алкил)OC(O)C2-C18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-С18алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-С18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)С1-С18 алкил, (C0-C8 алкил)NR24C(O)C2-C8 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-С18 алкил, (C0-C8 алкил)OC(O)OC2-С18 алкенил, (C0-C8 алкил)OC(O)OC2-С18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-С18 алкил, (C0-C8 алкил)OC(O)NR24C2-С18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-С18 алкил, (C0-C8 алкил)NR24(O)OC2-С18алкенил, (C0-C8 алкил)NR24(O)OC2-С18 алкинил или (C0-C8 алкил)NR24(O)OH;
R3 представляет собой водород, (C0-C8 алкил)галоген, С1-С18 алкил, С2-С18 алкенил, С2-С18 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)OC1-С18 алкил, (C0-C8алкил)OC2-С18 алкенил, (C0-C8 алкил)OC2-С18 алкинил, (C0-C8 алкил)OH, (C0-C8 алкил)SH, (C0-C8алкил)NR24C1-С18 алкил, (C0-C8 алкил)NR24C2-C18 алкенил, (C0-C8 алкил)NR24C2-С18 алкинил, (C0-C8 алкил)NR24H2, (C0-C8 алкил)C(O)С1-С18 алкил, (C0-C8 алкил)C(O)C2-C18 алкенил, (C0-C8алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O) арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-С18 алкил, (C0-C8 алкил)C(O)OC2-C18 алкенил, (C0-C8алкил)C(O)OC2-C18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)С1-С18 алкил, (C0-C8 алкил)OC(O)C2-С18 алкенил, (C0-C8алкил)OC(O)С2-С18 алкинил, (C0-C8 алкил)C(O)NR24C1-С18алкил, (C0-C8 алкил)C(O)NR24C2-С18алкенил, (C0-C8 алкил)C(O)NR24C2-С18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)С1-С18 алкил, (C0-C8 алкил)NR24C(O)C2-C8 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-С18 алкил, (C0-C8 алкил)OC(O)OC2-С18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-С18алкил, (C0-C8 алкил)OC(O)NR24C2-С18 алкенил, (C0-C8 алкил)OC(O)NR24C2-С18 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-С18 алкил, (C0-C8 алкил)NR24(O)OC2-С18алкенил, (C0-C8 алкил)NR24(O)OC2-С18 алкинил или (C0-C8 алкил)NR24(O)OH;
R6 представляет собой водород, С1-С18 алкил, С2-С18 алкенил, С2-С18 алкинил, гетероалкил, (C0-C8алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)С1-С18 алкил, (C0-C8 алкил)C(O)С2-С18алкенил, (C0-C8 алкил)C(O)C2-C18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-С18 алкил, (C0-C8 алкил)C(O)OC2-С18 алкенил, (C0-C8алкил)C(O)OC2-С18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-С18 алкил, (C0-C8 алкил)C(O)NR24C2-С18 алкенил, (C0-C8 алкил)C(O)NR24C2-С18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил, (C0-C8алкил)C(O)NR24гетероарил или SO3H; и
R24 представляет собой водород или C1-C18 алкил.
В некоторых вариантах осуществления Y включает структуру формулы E, где
R1 представляет собой водород, С1-C7 алкил; (C0-C3 алкил)C(O)C1-C7 алкил, (C0-C3 алкил)C(O)арил или SO3H;
R2 представляет собой водород, галоген, OH или С1-C7 алкил;
R3 представляет собой водород, галоген, OH или С1-C7 алкил;
R6 представляет собой водород, C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, гетероалкил, (C0-C8 алкил)арил, (C0-C8 алкил)гетероарил, (C0-C8 алкил)C(O)C1-C8 алкил, (C0-C8 алкил)C(O)C2-C8 алкенил, (C0-C8алкил)C(O)C2-C8 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-C8 алкил, (C0-C8 алкил)C(O)OC2-C8 алкенил, (C0-C8алкил)C(O)OC2-C8 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)C(O)NR24C1-C8 алкил, (C0-C8 алкил)C(O)NR24C2-C8 алкенил, (C0-C8алкил)C(O)NR24C2-C8 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8 алкил)C(O)NR24арил или (C0-C8алкил)C(O)NR24гетероарил; и
R24 представляет собой водород или C1-C7 алкил.
Например, R1 представляет собой водород или отсутствует; R2 представляет собой водород или метил; R3 представляет собой водород или метил; и R6 представляет собой H или отсутствует.
Неограничивающие примеры соединений формулы F включают:
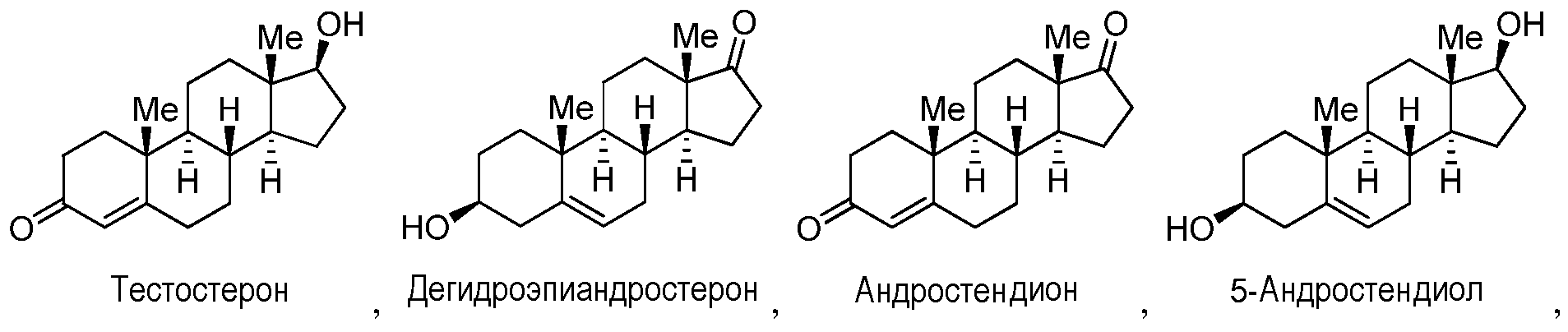
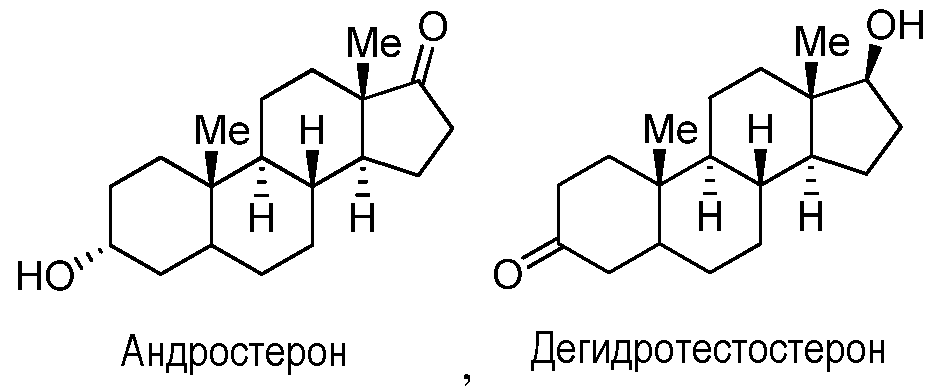
В вариантах осуществления, где Y включает структуру формулы F, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы F, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле F и способы конъюгирования формулы F с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула F конъюгирована с L или Q в любом положении 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или 22 формулы F. В некоторых вариантах осуществления формула F конъюгирована с L или Q в положении 3 или 17 формулы F.
В некоторых вариантах осуществления связывание NHR лиганда с ядерным гормональным рецептором I типа приводит в результате к агонистической активности (или антагонистической активности) в некоторых, но не во всех клетках или тканях, экспрессирующих ядерный гормональный рецептор I типа.
NHR лиганд, который воздействует на ядерный гормональный рецептор II типа
В некоторых вариантах осуществления настоящего изобретения, NHR лиганд (Y) воздействует на ядерный гормональный рецептор II типа. В некоторых вариантах осуществления Y может иметь любую структуру, которая обеспечивает или способствует агонистической активности при связывании лиганда с ядерным гормональным рецептором II типа, тогда как в других вариантах осуществления Y представляет собой антагонист ядерного гормонального рецептора II типа. В примерных вариантах осуществления Y обладает агонистической (или антагонистической) активностью относительно тироидного гормонального рецептора (TR), рецептора ретиноевой кислоты (RAR), рецептора, активируемого пролифератором пероксисом (PPAR), печеночного рецептора X (LXR), фарнезоидного Х-рецептора (FXR), рецептора витамина D (VDR) и/или прегнан-Х-рецептора (PXR).
В некоторых вариантах осуществления Y воздействует на тироидный гормональный рецептор (например, TRα, TRβ). В некоторых вариантах осуществления Y включает любую структуру, которая обеспечивает или способствует агонистической активности относительно TR, тогда как в других вариантах осуществления Y представляет собой антагонист TR. Неограничивающие примеры Y включают следующие соединения:

В вариантах осуществления, где Y включает структуру, которая обеспечивает или способствует агонистической или антагонистической активности относительно TR, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении Y, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в Y и способы конъюгирования Y с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления Y конъюгирован с L или Q в любом положении Y. В некоторых вариантах осуществления Y конъюгирован с L или Q через карбоксильную или спиртовую группу, как указано ниже:

Тироксин (T4).
В некоторых вариантах осуществления Y воздействует на рецептор ретиноевой кислоты (например, RARα, RARβ, RARγ). В некоторых вариантах осуществления Y включает любую структуру, которая обеспечивает или способствует агонистической активности относительно RAR, тогда как в других вариантах осуществления Y представляет собой антагонист RAR. В примерных вариантах осуществления Y включает структуру формулы G:

Формула G
где R11 представляет собой группу, которая обеспечивает или способствует агонистической или антагонистической активности при связывании соединения формулы G с RAR, и

В некоторых вариантах осуществления Y включает структуру формулы G, где R11 представляет собой C(O)OH, CH2OH или C(O)H. В некоторых вариантах осуществления Y включает структуру формулы G, где R11 представляет собой производное карбоновой кислоты (например, хлорангидрид кислоты, ангидрид и эфир).
Неограничивающие примеры соединения формулы G включают:

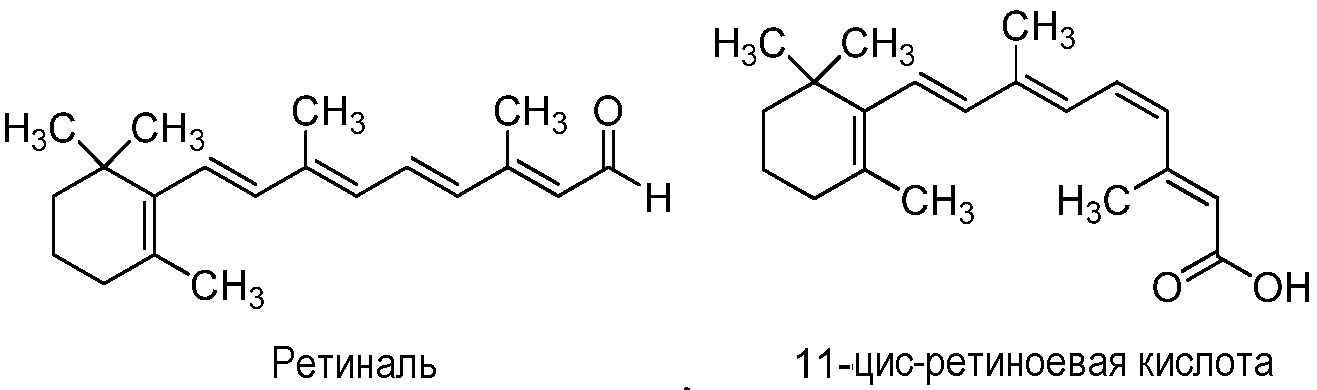
В вариантах осуществления, где Y включает структуру формулы G, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы G, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в Y и способы конъюгирования Y с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления Y конъюгирован с L или Q в любом положении Y. В некоторых вариантах осуществления формула G конъюгирована с L или Q при R11.
В некоторых вариантах осуществления Y воздействует на рецептор, активируемый пролифератором пероксисом (например, PPARα, PPARβ/δ, PPARγ). В некоторых вариантах осуществления Y включает любую структуру, которая обеспечивает или способствует агонистической активности относительно PPAR, тогда как в других вариантах осуществления Y представляет собой антагонист PPAR. В некоторых вариантах осуществления Y представляет собой насыщенную или ненасыщенную, галогенированную или негалогенированную свободную жирную кислоту (FFA), как описано формулой H:

Формула H
где n равен 0-26, и каждый R12, когда он присутствует, независимо представляет собой группу, которая обеспечивает или способствует агонистической или антагонистической активности при связывании соединения формулы H с PPAR.
В некоторых вариантах осуществления Y включает структуру формулы H, где n равен 0-26, и каждый R12, когда он присутствует, независимо представляет собой водород, С1-C7 алкил или галоген. В некоторых вариантах осуществления формула B представляет собой насыщенную кислоту, такую как, например, муравьиная кислота, уксусная кислота, н-капроновая кислота, гептановой кислоты, каприловая кислота, нонановая кислота, каприновая кислота, ундекановая кислоты, лауриновая кислота, тридекановая кислота, миристиновая кислота, пентадекановая кислота, пальмитиновая кислота, гептадекановая кислота, стеариновая кислота, нонадекановая кислоты, арахидоновая кислота, генэйкозановая кислота, бегеновая кислота, трикозановая кислота, перфторнонановая кислота (см. ниже), перфтороктановая кислота (см. ниже) и их производные. В некоторых вариантах осуществления формула H является ненасыщенной или с цис или с транс стереохимией, такой как, например, метилиминодиуксусная кислота, тетрадеценовая кислота, пальмитолеиновая кислота, сапиеновая кислота, олеиновая кислота, линолевая кислота, α-линоленовая кислота, элаидиновая кислота, петроселиновая кислота, арахидоновая кислота, дигидроксиэйкозатетраеновая кислота (DiHETE), октадециновая кислота, эйкозатрииновая кислота, эйкозадиеновая кислота, эйкозатриеновая кислота, эйкозапентаеновая кислота, эруковая кислота, дигомолиноленовая кислота, докозатриеновая кислота, докозапентаеновая кислота, докозагексаеновая кислота, адреновая кислота и их производные.

В вариантах осуществления, где Y включает структуру формулы H, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы H, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле H и способы конъюгирования формулы H с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула H конъюгирована с L или Q в любом положении в формуле H. В некоторых вариантах осуществления формула H конъюгирована с L или Q через концевой карбоксильный остаток.
В некоторых из данных вариантов осуществления, Y представляет собой эйкозаноид. В конкретных вариантах осуществления Y представляет собой простагландин или лейкотриен. В некоторых примерных вариантах осуществления Y представляет собой простагландин, имеющий структуру, как показано формулами J1-J6:

где каждый R13 независимо представляет собой группу, которая обеспечивает или способствует агонистической или антагонистической активности при связывании соединения формулы J с PPAR (например, PGJ2, как показано ниже):

В некоторых вариантах осуществления, когда Y включает структуру любой одной формулы J1-J6, каждый R13 независимо представляет собой C1-C8 алкил, C1-C8алкенил, C1-C8 алкинил или гетероалкил.
В вариантах осуществления, где Y представляет собой эйкозаноид, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении эйкозаноида, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в Y и способы конъюгирования Y с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления Y конъюгирован с L или Q в любом положении Y. В некоторых вариантах осуществления эйкозаноид конъюгирован с L или Q через концевую карбоксильную группу или через боковую спиртовую группу.
В некоторых примерных вариантах осуществления Y представляет собой лейкотриен, имеющий структуру, как описано формулой K или производное формулы K:
Формула K
где каждый R14 независимо представляет собой группу, которая обеспечивает или способствует агонистической или антагонистической активности при связывании соединения формулы K с PPAR (например, лейкотриен B4, как показано ниже):
В некоторых вариантах осуществления, когда Y включает структуру формулы K, каждый R14 независимо представляет собой C3-C13 алкил, C3-C13 алкенил, C3-C13 алкинил или гетероалкил.
В вариантах осуществления, где Y включает структуру формулы K, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы K, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле K и способы конъюгирования формулы K с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула K конъюгирована с L или Q в любом положении в формуле K. В некоторых вариантах осуществления формула K конъюгирована с L или Q через концевую карбоксильную группу или через боковую спиртовую группу.
В некоторых примерных вариантах осуществления Y представляет собой тиазолидиндион, включающий структуру, как описано формулой L:

Формула L.
Неограничивающие примеры соединения формулы L включают:


В вариантах осуществления, где Y содержит структуру формулы L, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы L, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле L и способы конъюгирования формулы L с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула L конъюгирована с L или Q в любом положении в формуле L, таком как, например, боковая спиртовая группа, или через ароматический заместитель.
В некоторых вариантах осуществления Y воздействует на RAR-родственный орфановый рецептор (например, RORα, RORβ, RORγ). В некоторых вариантах осуществления Y включает любую структуру, которая обеспечивает или способствует агонистической активностью относительно ROR, тогда как в других вариантах осуществления Y представляет собой антагонист ROR.
Неограничивающие примеры Y включают:

В вариантах осуществления, где Y воздействует на ROR, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении Y, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в Y и способы конъюгирования Y с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления Y конъюгирован с L или Q в любом положении Y, таком как, например, любое из положений, описанных ранее в настоящем изобретении.
В некоторых вариантах осуществления Y воздействует на печеночный рецептор X (LXRα, LXRβ). В некоторых вариантах осуществления Y содержит любую структуру, которая обеспечивает или способствует агонистической активности относительно LXR, тогда как в других вариантах осуществления Y представляет собой антагонист LXR. В примерных вариантах осуществления Y представляет собой оксистерол (т.е. оксигенированное производное холестерина). Неограничивающие примеры Y в данных вариантах осуществления включают 22(R)-гидроксихолестерин (см. ниже), 24(S)-гидроксихолестерин (см. ниже), 27-гидроксихолестерин, холестеноевую кислоту и их производные.

В вариантах осуществления, где Y воздействует на LXR, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении Y, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в Y и способы конъюгирования Y с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления Y конъюгирован с L или Q в любом из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или 26 формулы F. В некоторых вариантах осуществления формула F конъюгирована с L или Q в положении 3 или 17 формулы F.
В некоторых вариантах осуществления Y воздействует на фарнезоидный X рецептор (FXR). В некоторых вариантах осуществления Y содержит любую структуру, которая обеспечивает или способствует агонистической активности относительно FXR, тогда как в других вариантах осуществления Y представляет собой антагонист FXR. В некоторых из данных вариантов осуществления Y представляет собой желчную кислоту. В примерных вариантах осуществления Y имеет структуру формулы M:

Формула M
где каждый R15, R16 и R17 независимо представляют собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы M с FXR.
В некоторых вариантах осуществления, когда Y имеет структуру формулы M, каждый R15 и R16 независимо представляют собой водород, (C0-C8 алкил)галоген, C1-С18 алкил, C2-С18 алкенил, C2-С18 алкинил, гетероалкил или (C0-C8 алкил)OH; и R17 представляет собой OH, (C0-C8 алкил)NH(С1-C4 алкил)SO3H или (C0-C8алкил)NH(С1-C4 алкил)COOH.
В некоторых вариантах осуществления, когда Y содержит структуру формулы M, каждый R15 и R16 независимо представляет собой водород или OH; и R17 представляет собой OH, NH(С1-C2 алкил)SO3H или NH(С1-C2алкил)COOH.
Неограничивающие примеры соединения формулы M включают:

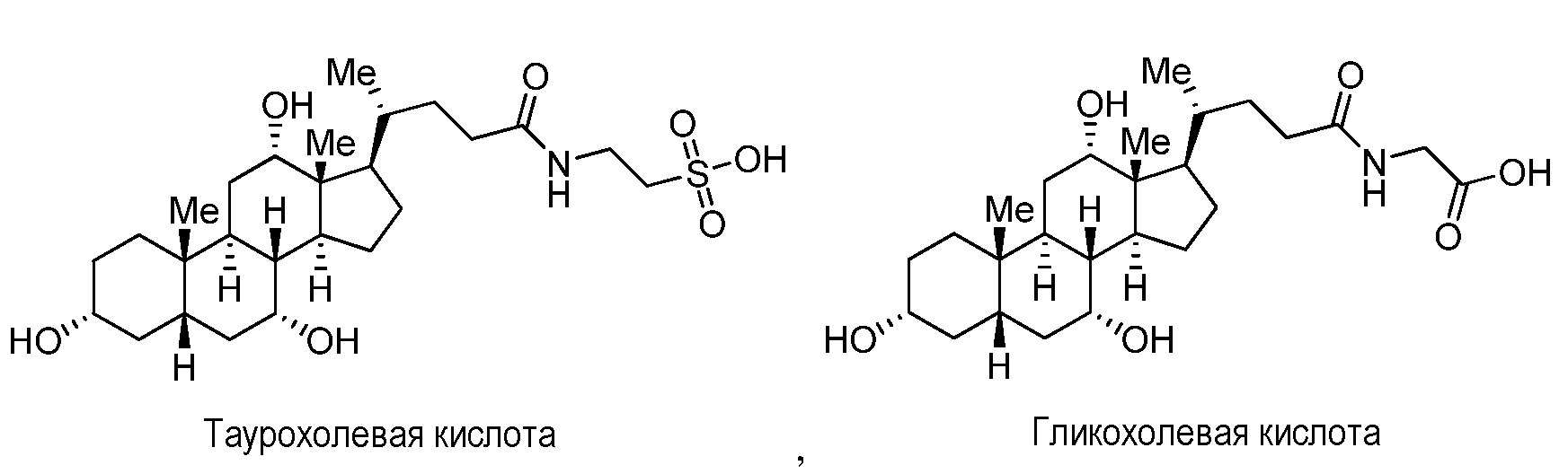
и их производные.
В вариантах осуществления, где Y включает структуру формулы M, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы M, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле M и способы конъюгирования формулы M с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула M конъюгирована с L или Q в любом из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 формулы M. В некоторых вариантах осуществления формула M конъюгирована с L или Q в положении 3, 7, 12 или 17 формулы M.
В некоторых вариантах осуществления Y воздействует на рецептор витамина D (VDR). В некоторых вариантах осуществления Y содержит любую структуру, которая обеспечивает или способствует агонистической активности относительно VDR, тогда как в других вариантах осуществления Y представляет собой антагонист VDR. В примерных вариантах осуществления Y имеет структуру формулы N:

Формула N
где каждый R18, R19, R20, R21, R22 и R23 представляют собой группы, которые обеспечивают или способствуют агонистической или антагонистической активности при связывании соединения формулы N с VDR, таким как, например, любое из соединений витамина D, описанных в Bouillon et al., Endocrine Reviews, 16(2):200-257 (1995).
В некоторых вариантах осуществления, где Y содержит структуру формулы N,
каждый R18 и R19 независимо представляет собой водород, (C0-C8 алкил)галоген, (C0-C8 алкил)гетероарил или (C0-C8алкил)OH;
оба R20 представляют собой водород, или оба R20, взятые вместе, образуют =CH2;
каждый R21 и R22 независимо представляет собой C1-C4 алкил; и
R23 представляет собой C4-C18 алкил, C4-С18 алкенил, C4-С18 алкинил, гетероалкил, (C4-С18 алкил)арил, (C4-С18алкил)гетероарил, (C0-C8 алкил)OC1-С18 алкил, (C0-C8 алкенил)OC1-С18 алкил, (C0-C8алкинил)OC1-С18 алкил, (C0-C8алкил)OC2-С18 алкенил, (C0-C8алкил)OC2-С18 алкинил, (C6-C18 алкил)OH, (C6-С18 алкил)SH, (C6-С18 алкенил)OH, (C6-С18 алкинил)OH, (C0-C8 алкил)NR24C21-С18 алкил, (C0-C8 алкенил)NR24C1-С18 алкил, (C0-C8 алкинил)NR24C1-С18 алкил, (C0-C8 алкил)NR24C2-С18 алкенил, (C0-C8 алкил)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)C1-С18 алкил, (C0-C8 алкил)C(O)C2-С18 алкенил, (C0-C8 алкил)C(O)C2-С18 алкинил, (C0-C8 алкил)C(O)H, (C0-C8 алкил)C(O)арил, (C0-C8алкил)C(O)гетероарил, (C0-C8 алкил)C(O)OC1-С18 алкил, (C0-C8 алкил)C(O)OC2-С18 алкенил, (C0-C8алкил)C(O)OC2-С18 алкинил, (C0-C8 алкил)C(O)OH, (C0-C8 алкил)C(O)O арил, (C0-C8 алкил)C(O)O гетероарил, (C0-C8 алкил)OC(O)C1-С18 алкил, (C0-C8 алкил)OC(O)C2-С18 алкенил, (C0-C8алкил)OC(O)C2-C18 алкинил, (C0-C8 алкил)C(O)NR24C1-С18 алкил, (C0-C8 алкил)C(O)NR24C2-C18алкенил, (C0-C8 алкил)C(O)NR24C2-C18 алкинил, (C0-C8 алкил)C(O)NR24H2, (C0-C8алкил)C(O)NR24арил, (C0-C8 алкил)C(O)NR24гетероарил, (C0-C8 алкил)NR24C(O)C1-С18 алкил, (C0-C8 алкил)NR24C(O)C2-C8 алкенил или (C0-C8 алкил)NR24C(O)C2-C18 алкинил, (C0-C8алкил)NR24C(O)OH, (C0-C8 алкил)OC(O)OC1-С18 алкил, (C0-C8 алкил)OC(O)OC12-С18 алкенил, (C0-C8 алкил)OC(O)OC2-C18 алкинил, (C0-C8 алкил)OC(O)OH, (C0-C8 алкил)OC(O)NR24C1-С18алкил, (C0-C8 алкил)OC(O)NR24C12-С18 алкенил, (C0-C8 алкил)OC(O)NR24C2-C18 алкинил, (C0-C8алкил)OC(O)NR24H2, (C0-C8 алкил)NR24(O)OC1-С18алкил, (C0-C8 алкил)NR24(O)OC2-C18 алкенил, (C0-C8 алкил)NR24(O)OC2-С18 алкинил или (C0-C8 алкил)NR24(O)OH; и
R24 представляет собой водород или C1-С18 алкил.
Неограничивающие примеры соединения формулы N включают:

В вариантах осуществления, где Y содержит структуру формулы N, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении формулы N, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в формуле N и способы конъюгирования формулы N с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления формула N конъюгирована с L или Q в любом из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или 26 формулы N. В некоторых вариантах осуществления формула N конъюгирована с L или Q в положении 1, 3, 19 или 25 формулы N.
В некоторых вариантах осуществления Y воздействует на прегнан-X рецептор (PXR). В некоторых вариантах осуществления Y содержит любую структуру, которая обеспечивает или способствует агонистической активности относительно PXR, тогда как в других вариантах осуществления Y представляет собой антагонист PXR. В некоторых вариантах осуществления Y представляет собой стероид, антибиотик, противогрибковое средство, желчную кислоту, гиперфорин или соединение из растительных источников. В примерных вариантах осуществления Y представляет собой соединение, которое способно активировать CYP3A4, такое как дексаметазон и рифампицин. В вариантах осуществления, где Y содержит структуру, которая воздействует на PXR, Y конъюгирован с L (например, когда L представляет собой связывающую группу) или Q (например, когда L представляет собой связь) в любом положении Y, которое способно реагировать с Q или L. Специалист в данной области техники может легко определить положение конъюгирования в Y и способы конъюгирования Y с Q или L, принимая во внимание общедоступные сведения и представленное настоящее описание. В некоторых вариантах осуществления Y конъюгирован с L или Q в любом положении в Y.
Модификация NHR лиганда (Y)
В некоторых вариантах осуществления NHR лиганд превращают в производное или иначе химически модифицируют так, чтобы он содержал реакционноспособную группу, которая способна реагировать с пептидом глюкагонового суперсемейства (Q) или связывающей группой (L). В вариантах осуществления, описанных в настоящем изобретении, Y модифицируют в любом положении Y, которое способно реагировать с Q или L. Положение для модификации в Y является известным специалисту в данной области техники и зависит от типа применяемого NHR лиганда и требуемой активности. Например, в вариантах осуществления, где Y содержит структуру, содержащую тетрациклический остов, содержащий три 6-членных кольца, соединенных с одним 5-членным кольцом или его вариантом, Y можно модифицировать в любом из положений 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25. Другие положения для модифицирования могут представлять собой такие, как описано ранее в настоящем изобретении.
NHR лиганд можно модифицировать, применяя любой агент, известный специалисту в данной области техники или описанный в настоящем изобретении, (например, см. параграф "Связывающая группа" или подпараграф "Химическая модификация Q и/или Y"). Например, эстрадиол можно модифицировать янтарной кислотой, янтарным ангидридом, бензойной кислотой, этил 2-бромацетатом или йодуксусной кислотой, получая приведенные ниже производные эстрадиола, которые способны образовывать конъюгат с Q или L.
Аналогично, любой из вышеприведенных NHR лигандов можно модифицировать способами, известными в данной области техники. Кроме того, определенные модифицированные лиганды являются имеющимися в продаже и их можно приобрести у химических компаний, таких как Sigma-Aldrich.
Пептид глюкагонового суперсемейства (Q)
В Q-L-Y конъюгатах, описанных в настоящем изобретении, Q представляет собой пептид глюкагонового суперсемейства. Пептид глюкагонового суперсемейства относится к группе пептидов, родственных по структуре в их N-концевой и/или C-концевой области (см., например, Sherwood et al., Endocrine Reviews 21: 619-670 (2000)). Считается, что C-конец обычно функционирует, связываясь с рецептором, и N-конец обычно функционирует, передавая рецепторный сигнал. Несколько аминокислот в N-концевой и C-концевой области являются высококонсервативными среди членов глюкагонового суперсемейства. Некоторые из данных консервативных аминокислот включают His1, Gly4, Phe6, Phe22, Val23, Trp25 и Leu26, причем аминокислоты в данных положениях обладают идентичностью, консервативными заменами или схожестью структур их аминокислотных боковых цепей.
Пептиды глюкагонового суперсемейства включают родственные глюкагону пептиды, гормон, высвобождающий гормон роста (GHRH; SEQ ID NO: 1619), вазоактивный пептид кишечника (VIP; SEQ ID NO: 1620), полипептид 27, активирующий аденилатциклазу гипофиза (PACAP-27; SEQ ID NO: 1621), пептид гистидинизолейцин (PHI; SEQ ID NO: 1542), пептид гистидинметионин (PHM; SEQ ID NO: 1622), секретин (SEQ ID NO: 1623) и/или их аналоги, производные или конъюгаты. В некоторых вариантах осуществления Q содержит аминокислотную последовательность нативного глюкагона, нативного эксендин-4, нативного GLP-1(7-37), нативного GLP-2, нативного GHRH, нативного VIP, нативного PACAP-27, нативного PHM, нативного оксинтомодулина, нативного секретина или нативного GIP с вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными модификациями.
В некоторых аспектах настоящего изобретения, Q представляет собой родственный глюкагону пептид, такой как, например, глюкагон (SEQ ID NO: 1601), оксинтомодулин (SEQ ID NO: 1606), эксендин-4 (SEQ ID NO: 1618), глюкагоноподобный пептид-1 (GLP-1) (аминокислоты 7-36, представленные SEQ ID NO: 1603; аминокислоты 7-37, представленные SEQ ID NO: 1604), глюкагоноподобный пептид-2 (GLP-2, SEQ ID NO: 1608), желудочный ингибиторный пептид (GIP, SEQ ID NO: 1607) или их аналоги, производные и конъюгаты. Родственный глюкагону пептид обладает биологической активностью (как агонист или антагонист) относительно одного или более глюкагонового, GLP-1, GLP-2 и GIP рецепторов и содержит аминокислотную последовательность, которая обладает по меньшей мере 20% идентичностью последовательности (например, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%) с по меньшей мере одним из нативного глюкагона, нативного оксинтомодулина, нативного эксендина-4, нативного GLP-1(7-37), нативного GLP-2 или нативного GIP по длине пептида (или по положениям, которые соответствуют глюкагону, см., например, фигуру 1).
Ясно, что предусмотрены все возможные активные подклассы родственных глюкагону пептидов, например, пептиды, которые обладают биологической активностью (как агонисты или антагонисты) относительно любого одного или более из глюкагонового или GLP-1 или GIP рецепторов, вместе со всеми возможными подклассами с идентичностью по последовательности к каждому указанному нативному пептиду, например, содержащие аминокислотную последовательность, которая обладает по меньшей мере 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентичностью последовательности с нативным GLP-1 по длине нативного GLP-1. В некоторых вариантах осуществления настоящего изобретения, родственный глюкагону пептид представляет собой пептид, обладающий агонистической активностью относительно глюкагонового рецептора, агонистической активностью относительно GLP-1 рецептора, агонистической активностью относительно GIP рецептора, соагонистической активностью относительно глюкагонового рецептора/GLP-1 рецептора, соагонистической активностью относительно глюкагонового рецептора/GIP рецептора, соагонистической активностью относительно GLP-1 рецептора/GIP рецептора, триагонистической активностью относительно глюкагонового рецептора/GLP-1 рецептора/GIP рецептора, антагонистической активностью относительно глюкагонового рецептора или антагонистической активностью относительно глюкагонового рецептора/агонистической активностью относительно GLP-1 рецептора. В некоторых вариантах осуществления пептид сохраняет альфа-спиральную конформацию в C-концевой части молекулы. В некоторых вариантах осуществления пептид сохраняет положения, участвующие в рецепторном взаимодействии и передаче сигнала, например, положение 3 глюкагона или положение 7, 10, 12, 13, 15 или 17 GLP-1(7-37). Соответственно, родственный глюкагону пептид может представлять собой пептид класса 1, класса 2, класса 3, класса 4 и/или класса 5, каждый из которых дополнительно описан в настоящем изобретении.
Q также может быть любым из пептидов глюкагонового суперсемейства, которые являются известными в данной области техники, некоторые из которых описаны в настоящем изобретении посредством неограничивающих примеров. Ряд GLP-1 аналогов являются известными в данной области техники и представляют собой родственный глюкагону пептид согласно настоящему изобретению, см., например, WO 2008023050, WO 2007030519, WO 2005058954, WO 2003011892, WO 2007046834, WO 2006134340, WO 2006124529, WO 2004022004, WO 2003018516, WO 2007124461, каждая из которых включен в настоящем изобретении с помощью ссылки во всей своей полноте для каждой его последовательности или описаний формул GLP-1 аналогов или производных. В любом из вариантов осуществления, Q может представлять собой родственный глюкагону пептид, описанный в WO 2007/056362, WO 2008/086086, WO 2009/155527, WO 2008/101017, WO 2009/155258, WO 2009/058662, WO 2009/058734, WO 2009/099763, WO 2010/011439, PCT патентной заявке US09/68745 и патентной заявке США 61/187578, каждая из которых включена в настоящее изобретение с помощью ссылки во всей своей полноте. В определенных вариантах осуществления Q представляет собой родственный глюкагону пептид класса 1, класса 2, класса 3, класса 4 или класса 5, как подробно описано в настоящем изобретении. В любом из вариантов осуществления, описанных в настоящем изобретении, Q представляет собой любую из SEQ ID NO: 1-760, 801-919, 1001-1275, 1301-1371, 1401-1518, 1601-1650. В некоторых вариантах осуществления Q представляет собой любую из SEQ ID NO: 1647-1650.
Активность пептида глюкагонового суперсемейства (Q)
Активность относительно глюкагонового рецептора
В некоторых вариантах осуществления Q обладает EC50 для активации глюкагонового рецептора (или IC50 для антагонизма относительно глюкагонового рецептора) приблизительно 10 мМ или меньше, или приблизительно 1 мМ (1000 мкМ) или меньше (например, приблизительно 750 мкМ или меньше, приблизительно 500 мкМ или меньше, приблизительно 250 мкМ или меньше, приблизительно 100 мкМ или меньше, приблизительно 75 мкМ или меньше, приблизительно 50 мкМ или меньше, приблизительно 25 мкМ или меньше, приблизительно 10 мкМ или меньше, приблизительно 7,5 мкМ или меньше, приблизительно 6 мкМ или меньше, приблизительно 5 мкМ или меньше, приблизительно 4 мкМ или меньше, приблизительно 3 мкМ или меньше, приблизительно 2 мкМ или меньше или приблизительно 1 мкМ или меньше). В некоторых вариантах осуществления Q обладает EC50 или IC50 относительно глюкагонового рецептора приблизительно 1000 нМ или меньше (например, приблизительно 750 нМ или меньше, приблизительно 500 нМ или меньше, приблизительно 250 нМ или меньше, приблизительно 100 нМ или меньше, приблизительно 75 нМ или меньше, приблизительно 50 нМ или меньше, приблизительно 25 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 7,5 нМ или меньше, приблизительно 6 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 4 нМ или меньше, приблизительно 3 нМ или меньше, приблизительно 2 нМ или меньше или приблизительно 1 нМ или меньше). В некоторых вариантах осуществления Q имеет EC50 или IC50 относительно глюкагонового рецептора, которая находится в пикомолярном диапазоне. Соответственно, в некоторых вариантах осуществления Q обладает EC50 или IC50 относительно глюкагонового рецептора приблизительно 1000 пМ или меньше (например, приблизительно 750 пМ или меньше, приблизительно 500 пМ или меньше, приблизительно 250 пМ или меньше, приблизительно 100 пМ или меньше, приблизительно 75 пМ или меньше, приблизительно 50 пМ или меньше, приблизительно 25 пМ или меньше, приблизительно 10 пМ или меньше, приблизительно 7,5 пМ или меньше, приблизительно 6 пМ или меньше, приблизительно 5 пМ или меньше, приблизительно 4 пМ или меньше, приблизительно 3 пМ или меньше, приблизительно 2 пМ или меньше или приблизительно 1 пМ или меньше).
В некоторых вариантах осуществления Q обладает EC50 или IC50 относительно глюкагонового рецептора, которая составляет приблизительно 0,001 пМ или более, приблизительно 0,01 пМ или более, или приблизительно 0,1 пМ или более. Активацию глюкагонового рецептора (активность относительно глюкагонового рецептора) можно измерить in vitro анализами, измеряющими цАМФ индукцию в HEK293 клетках, сверхэкспрессирующих глюкагоновый рецептор, например, анализируя HEK293 клетки, совместно трансфицированные ДНК, кодирующей глюкагоновый рецептор, и люциферазным геном, соединенным с чувствительным к цАМФ элементом, как описано в примере 2.
В некоторых вариантах осуществления Q обладает приблизительно 0,001% или более, приблизительно 0,01% или более, приблизительно 0,1% или более, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, приблизительно 20% или более, приблизительно 30% или более, приблизительно 40% или более, приблизительно 50% или более, приблизительно 60% или более, приблизительно 75% или более, приблизительно 100% или более, приблизительно 125% или более, приблизительно 150% или более, приблизительно 175% или более, приблизительно 200% или более, приблизительно 250% или более, приблизительно 300% или более, приблизительно 350% или более, приблизительно 400% или более, приблизительно 450% или более, или приблизительно 500% или более активностью относительно глюкагонового рецептора по сравнению с нативным глюкагоном (глюкагоновая активность). В некоторых вариантах осуществления Q обладает приблизительно 5000% или меньшей или приблизительно 10000% или меньшей активностью относительно глюкагонового рецептора по сравнению с нативным глюкагоном. Активность Q относительно рецептора по сравнению с нативным лигандом рецептора рассчитывают как обратное отношение EC50 для Q относительно нативного лиганда.
В некоторых вариантах осуществления Q обладает значительной активностью (эффективностью) относительно только глюкагонового рецептора и практически не обладает активностью относительно GLP-1 рецептора или GIP рецептора. В некоторых вариантах осуществления Q считают "чистым агонистом глюкагонового рецептора" или не считают "соагонистом глюкагонового/GLP-1 рецептора" или "соагонистом глюкагонового/GIP рецептора". В некоторых вариантах осуществления Q обладает любой степенью активности или эффективности относительно глюкагонового рецептора, описанной в настоящем изобретении, но обладает значительно меньшей активностью (эффективностью) относительно GLP-1 рецептора или GIP рецептора. В некоторых вариантах осуществления Q обладает EC50 относительно GLP-1 рецептора, которая в 100 раз больше или более чем EC50 относительно глюкагонового рецептора. В некоторых вариантах осуществления Q обладает EC50 относительно GIP рецептора, которая в 100 раз больше или более чем EC50 относительно глюкагонового рецептора.
Активность относительно GLP-1 рецептора
В некоторых вариантах осуществления Q обладает EC50 для активации GLP-1 рецептора (или IC50 для антагонизма относительно GLP-1 рецептора) приблизительно 10 мМ или меньше, или приблизительно 1 мМ (1000 мкМ) или меньше (например, приблизительно 750 мкМ или меньше, приблизительно 500 мкМ или меньше, приблизительно 250 мкМ или меньше, приблизительно 100 мкМ или меньше, приблизительно 75 мкМ или меньше, приблизительно 50 мкМ или меньше, приблизительно 25 мкМ или меньше, приблизительно 10 мкМ или меньше, приблизительно 7,5 мкМ или меньше, приблизительно 6 мкМ или меньше, приблизительно 5 мкМ или меньше, приблизительно 4 мкМ или меньше, приблизительно 3 мкМ или меньше, приблизительно 2 мкМ или меньше или приблизительно 1 мкМ или меньше). В некоторых вариантах осуществления Q обладает EC50 или IC50 для активации GLP-1 рецептора приблизительно 1000 нМ или меньше (например, приблизительно 750 нМ или меньше, приблизительно 500 нМ или меньше, приблизительно 250 нМ или меньше, приблизительно 100 нМ или меньше, приблизительно 75 нМ или меньше, приблизительно 50 нМ или меньше, приблизительно 25 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 7,5 нМ или меньше, приблизительно 6 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 4 нМ или меньше, приблизительно 3 нМ или меньше, приблизительно 2 нМ или меньше или приблизительно 1 нМ или меньше). В некоторых вариантах осуществления Q имеет EC50 или IC50 относительно GLP-1 рецептора, которая находится в пикомолярном диапазоне. Соответственно, в некоторых вариантах осуществления Q обладает EC50 или IC50 для активации GLP-1 рецептора приблизительно 1000 пМ или меньше (например, приблизительно 750 пМ или меньше, приблизительно 500 пМ или меньше, приблизительно 250 пМ или меньше, приблизительно 100 пМ или меньше, приблизительно 75 пМ или меньше, приблизительно 50 пМ или меньше, приблизительно 25 пМ или меньше, приблизительно 10 пМ или меньше, приблизительно 7,5 пМ или меньше, приблизительно 6 пМ или меньше, приблизительно 5 пМ или меньше, приблизительно 4 пМ или меньше, приблизительно 3 пМ или меньше, приблизительно 2 пМ или меньше или приблизительно 1 пМ или меньше).
В некоторых вариантах осуществления Q обладает EC50 или IC50 относительно GLP-1 рецептора, которая составляет приблизительно 0,001 пМ или более, приблизительно 0,01 пМ или более или приблизительно 0,1 пМ или более. Активацию GLP-1 рецептора (GLP-1 рецепторная активность) можно измерить in vitro анализами, измеряя цАМФ индукцию в HEK293 клетках, сверхэкспрессирующих GLP-1 рецептор, например, анализируя HEK293 клетки, совместно трансфицированные ДНК, кодирующей глюкагоновый рецептор, и люциферазным геном, соединенным с чувствительным к цАМФ элементом, как описано в примере 2.
В некоторых вариантах осуществления Q обладает приблизительно 0,001% или более, приблизительно 0,01% или более, приблизительно 0,1% или более, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, приблизительно 20% или более, приблизительно 30% или более, приблизительно 40% или более, приблизительно 50% или более, приблизительно 60% или более, приблизительно 75% или более, приблизительно 100% или более, приблизительно 125% или более, приблизительно 150% или более, приблизительно 175% или более, приблизительно 200% или более, приблизительно 250% или более, приблизительно 300% или более, приблизительно 350% или более, приблизительно 400% или более, приблизительно 450% или более, или приблизительно 500% или более активностью относительно GLP-1 рецептора по сравнению с нативным GLP-1 (GLP-1 активность). В некоторых вариантах осуществления Q обладает приблизительно 5000% или меньшей или приблизительно 10000% или меньшей активностью относительно GLP-1 рецептора по сравнению с нативным GLP-1 (GLP-1 активность).
В некоторых вариантах осуществления Q обладает значительной активностью (эффективностью) только относительно GLP-1 рецептора и практически не обладает активностью относительно глюкагонового рецептора или GIP рецептора. В некоторых вариантах осуществления Q считают "чистым агонистом GLP-1 рецептора" или не считают "соагонистом глюкагонового/GLP-1 рецептора" или "соагонистом GLP-1/GIP". В некоторых вариантах осуществления Q обладает любой степенью активности или эффективности относительно GLP-1 рецептора, описанной в настоящем изобретении, но обладает значительно меньшей активностью (эффективностью) относительно глюкагонового рецептора или GIP рецептора. В некоторых вариантах осуществления Q обладает EC50 относительно глюкагонового рецептора, которая в 100 раз больше или более чем EC50 относительно GLP-1 рецептора. В некоторых вариантах осуществления Q обладает EC50 относительно GIP рецептора, которая в 100 раз больше или более чем EC50 относительно GLP-1 рецептора.
Активность относительно GIP рецептора
В некоторых вариантах осуществления Q обладает EC50 для активации GIP рецептора (или IC50 для антагонизма относительно GIP рецептора) приблизительно 10 мМ или меньше, или приблизительно 1 мМ (1000 мкМ) или меньше (например, приблизительно 750 мкМ или меньше, приблизительно 500 мкМ или меньше, приблизительно 250 мкМ или меньше, приблизительно 100 мкМ или меньше, приблизительно 75 мкМ или меньше, приблизительно 50 мкМ или меньше, приблизительно 25 мкМ или меньше, приблизительно 10 мкМ или меньше, приблизительно 7,5 мкМ или меньше, приблизительно 6 мкМ или меньше, приблизительно 5 мкМ или меньше, приблизительно 4 мкМ или меньше, приблизительно 3 мкМ или меньше, приблизительно 2 мкМ или меньше или приблизительно 1 мкМ или меньше). В некоторых вариантах осуществления EC50 или IC50Q относительно GIP рецептора является меньшей, чем 1000 нМ, меньшей, чем 900 нМ, меньшей, чем 800 нМ, меньшей, чем 700 нМ, меньшей, чем 600 нМ, меньшей, чем 500 нМ, меньшей, чем 400 нМ, меньшей, чем 300 нМ, или меньшей, чем 200 нМ. В некоторых вариантах осуществления EC50 или IC50Q относительно GIP рецептора составляет приблизительно 100 нМ или меньше, например, приблизительно 75 нМ или меньше, приблизительно 50 нМ или меньше, приблизительно 25 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 8 нМ или меньше, приблизительно 6 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 4 нМ или меньше, приблизительно 3 нМ или меньше, приблизительно 2 нМ или меньше, или приблизительно 1 нМ или меньше. В некоторых вариантах осуществления Q обладает EC50 или IC50 для активации GIP рецептора, которая находится в пикомолярном диапазоне. В примерных вариантах осуществления EC50 или IC50Q относительно GIP рецептора является меньшей, чем 1000 пМ, меньшей, чем 900 пМ, меньшей, чем 800 пМ, меньшей, чем 700 пМ, меньшей, чем 600 пМ, меньшей, чем 500 пМ, меньшей, чем 400 пМ, меньшей, чем 300 пМ, меньшей, чем 200 пМ. В некоторых вариантах осуществления EC50 или IC50Q относительно GIP рецептора составляет приблизительно 100 пМ или меньше, например, приблизительно 75 пМ или меньше, приблизительно 50 пМ или меньше, приблизительно 25 пМ или меньше, приблизительно 10 пМ или меньше, приблизительно 8 пМ или меньше, приблизительно 6 пМ или меньше, приблизительно 5 пМ или меньше, приблизительно 4 пМ или меньше, приблизительно 3 пМ или меньше, приблизительно 2 пМ или меньше, или приблизительно 1 пМ или меньше. Активацию рецептора можно измерить in vitro анализами, измеряя цАМФ индукцию в HEK293 клетках, сверхэкспрессирующих GIP рецептор, например, исследуя HEK293 клетки, совместно трансфицированные ДНК, кодирующей глюкагоновый рецептор, и люциферазным геном, соединенным с чувствительным к цАМФ элементом, как описано в примере 2.
В некоторых вариантах осуществления настоящего изобретения, Q обладает по меньшей мере или приблизительно 0,1% активностью нативного GIP относительно GIP рецептора. В примерных вариантах осуществления Q обладает по меньшей мере или приблизительно 0,2%, по меньшей мере или приблизительно 0,3%, по меньшей мере или приблизительно 0,4%, по меньшей мере или приблизительно 0,5%, по меньшей мере или приблизительно 0,6%, по меньшей мере или приблизительно 0,7%, по меньшей мере или приблизительно 0,8%, по меньшей мере или приблизительно 0,9%, по меньшей мере или приблизительно 1%, по меньшей мере или приблизительно 5%, по меньшей мере или приблизительно 10%, по меньшей мере или приблизительно 20%, по меньшей мере или приблизительно 30%, по меньшей мере или приблизительно 40%, по меньшей мере или приблизительно 50%, по меньшей мере или приблизительно 60%, по меньшей мере или приблизительно 70%, по меньшей мере или приблизительно 75%, по меньшей мере или приблизительно 80%, по меньшей мере или приблизительно 90%, по меньшей мере или приблизительно 95%, или, по меньшей мере или приблизительно 100% активности нативного GIP относительно GIP рецептора.
В некоторых вариантах осуществления настоящего изобретения, Q обладает активностью относительно GIP рецептора, которая является большей, чем активность нативного GIP. В примерных вариантах осуществления Q обладает по меньшей мере или приблизительно 101%, по меньшей мере или приблизительно 105%, по меньшей мере или приблизительно 110%, по меньшей мере или приблизительно 125%, по меньшей мере или приблизительно 150%, по меньшей мере или приблизительно 175%, по меньшей мере или приблизительно 200%, по меньшей мере или приблизительно 300%, по меньшей мере или приблизительно 400%, по меньшей мере или приблизительно 500% или более % активности нативного GIP относительно GIP рецептора. В некоторых вариантах осуществления Q обладает не более чем 1000%, 10000%, 100000% или 1000000% активностью относительно GIP рецептора по сравнению с нативным GIP. Активность пептида относительно GIP рецептора по сравнению с нативным GIP рассчитывают как обратное отношение EC50 для GIP агонистического пептида относительно нативного GIP.
В некоторых вариантах осуществления Q обладает значительной активностью (эффективностью) только относительно GIP рецептора и практически не обладает активностью относительно глюкагонового рецептора или GLP-1 рецептора. В некоторых вариантах осуществления Q считают "чистым агонистом GIP рецептора" или не считают "соагонистом глюкагонового/GIP рецептора" или "соагонистом GLP-1/GIP". В некоторых вариантах осуществления Q обладает любой степенью активности или эффективности относительно GIP рецептора, описанной в настоящем изобретении, но обладает значительно меньшей активностью (эффективностью) относительно глюкагонового рецептора или GLP-1 рецептора. В некоторых вариантах осуществления Q обладает EC50 относительно глюкагонового рецептора, которая в 100 раз больше или более чем EC50 относительно GIP рецептора, и EC50 относительно GLP-1 рецептора, которая в 100 раз больше или более чем EC50 относительно GIP рецептора.
Активность относительно GLP-1 рецептора и глюкагонового рецептора
В некоторых вариантах осуществления Q обладает активностью относительно и GLP-1 рецептора и глюкагонового рецептора ("соагонисты глюкагонового/GLP-1 рецептора"). В некоторых вариантах осуществления активность (например, EC50, или относительная активность, или эффективность) Q относительно глюкагонового рецептора находится в пределах приблизительно 50-кратного, приблизительно 40-кратного, приблизительно 30-кратного, приблизительно 20-кратного, приблизительно 10-кратного или приблизительно 5-кратного отличия (в большую или меньшую сторону) от его активности (например, EC50, или относительной активности, или эффективности) относительно GLP-1 рецептора. В некоторых вариантах осуществления глюкагоновая эффективность Q находится в пределах приблизительно 25-, приблизительно 20-, приблизительно 15-, приблизительно 10- или приблизительно 5-кратного отличия (в большую или меньшую сторону) от его GLP-1 эффективности.
В некоторых вариантах осуществления отношение относительной активности, или EC50, или эффективности Q относительно глюкагонового рецептора, разделенной на относительную активность, или EC50, или эффективность Q относительно GLP-1 рецептора, является менее чем или приблизительно равным X, где X выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Q относительно глюкагонового рецептора, разделенной на EC50, или эффективность, или относительную активность Q относительно GLP-1 рецептора, является приблизительно равным 1, меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение глюкагоновой эффективности Q к GLP-1 эффективности Q является менее чем или приблизительно равным Z, где Z выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение глюкагоновой эффективности Q к GLP-1 эффективности Q является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Q имеет EC50 относительно глюкагонового рецептора, которая в 2-10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) больше, чем EC50 относительно GLP-1 рецептора.
В некоторых вариантах осуществления отношение относительной активности, или эффективности, или EC50Q относительно GLP-1 рецептора, разделенной на относительную активность, или эффективность, или EC50 глюкагонового аналога относительно глюкагонового рецептора, является менее чем или приблизительно равным V, где V выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Q относительно GLP-1 рецептора, разделенной на EC50, или эффективность, или относительную активность Q относительно глюкагонового рецептора, является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение GLP-1 эффективности Q к глюкагоновой эффективности Q является менее чем или приблизительно равным W, где W выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение GLP-1 эффективности Q к глюкагоновой эффективности Q является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Q обладает EC50 относительно GLP-1 рецептора, которая в приблизительно 2 - приблизительно 10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) больше, чем EC50 относительно глюкагонового рецептора.
В некоторых вариантах осуществления Q обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности нативного GLP-1 относительно GLP-1 рецептора (GLP-1 эффективность) и обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности нативного глюкагона относительно глюкагонового рецептора (глюкагоновая эффективность).
Селективность Q относительно глюкагонового рецептора по сравнению с GLP-1 рецептором можно описать как относительный показатель глюкагон/GLP-1 активности (активность Q относительно глюкагонового рецептора по сравнению с нативным глюкагоном, разделенная на активность аналога относительно GLP-1 рецептора по сравнению с нативным GLP-1). Например, Q, который обладает 60% активности нативного глюкагона относительно глюкагонового рецептора и 60% активности нативного GLP-1 относительно GLP-1 рецептора, имеет 1:1 показатель глюкагон/GLP-1 активности. Примерные показатели глюкагон/GLP-1 активности включают приблизительно 1:1, 1,5:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 или приблизительно 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2 или 1:1,5. В качестве примера, показатель глюкагон/GLP-1 активности 10:1 указывает на 10-кратную селективность относительно глюкагонового рецептора по сравнению с GLP-1 рецептором. Аналогично, показатель GLP-1/глюкагон активности 10:1 указывает на 10-кратную селективность относительно GLP-1 рецептора по сравнению с глюкагоновым рецептором.
В некоторых вариантах осуществления Q обладает значительной активностью (эффективностью) относительно глюкагонового рецептора и GLP-1 рецептора и практически не обладает активностью относительно GIP рецептора. В некоторых вариантах осуществления Q обладает любой степенью активности или эффективности относительно глюкагонового рецептора и GLP-1 рецептора, описанной в настоящем изобретении, но обладает значительно меньшей активностью (эффективностью) относительно GIP рецептора. В некоторых вариантах осуществления Q обладает EC50 относительно GIP рецептора, которая в 100 раз больше или более чем EC50относительно глюкагонового рецептора и EC50 относительно GLP-1 рецептора.
Активность относительно GLP-1 рецептора и GIP рецептора
В некоторых вариантах осуществления Q обладает активностью относительно и GLP-1 рецептора и GIP рецептора ("соагонисты GIP/GLP-1 рецепторов"). В некоторых вариантах осуществления активность (например, EC50, или относительная активность, или эффективность) Q относительно GIP рецептора находится в пределах приблизительно 50-кратного, приблизительно 40-кратного, приблизительно 30-кратного, приблизительно 20-кратного, приблизительно 10-кратного или приблизительно 5-кратного отличия (в большую или меньшую сторону) от его активности (например, EC50, или относительной активности, или эффективности) относительно GLP-1 рецептора. В некоторых вариантах осуществления GIP эффективность Q находится в пределах приблизительно 25-, приблизительно 20-, приблизительно 15-, приблизительно 10- или приблизительно 5-кратного отличия (в большую или меньшую сторону) от его GLP-1 эффективности.
В некоторых вариантах осуществления отношение относительной активности, или EC50, или эффективности Q относительно GIP рецептора, разделенной на относительную активность, или EC50, или эффективность Q относительно GLP-1 рецептора, является менее чем или приблизительно равным X, где X выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Q относительно GIP рецептора, разделенной на EC50, или эффективность, или относительную активность Q относительно GLP-1 рецептора, приблизительно равно 1, меньше, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение GIP эффективности Q к GLP-1 эффективности Q является менее чем или приблизительно равным Z, где Z выбран из 100, 75, 60, 50, 40, 30, 20,15,10 и 5. В некоторых вариантах осуществления отношение GIP эффективности Q к GLP-1 эффективности Q является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Q имеет EC50 относительно GIP рецептора, которая в 2-10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) больше, чем EC50 относительно GLP-1 рецептора.
В некоторых вариантах осуществления отношение относительной активности, или эффективности, или EC50Q относительно GLP-1 рецептора, разделенной на относительную активность, или эффективность, или EC50Q относительно GIP рецептора, является менее чем или приблизительно равным V, где V выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Q относительно GLP-1 рецептора, разделенной на EC50, или эффективность, или относительную активность Q относительно GIP рецептора, является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение GLP-1 эффективности Q к GIP эффективности Q является менее чем или приблизительно равным W, где W выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение GLP-1 эффективности Q к GIP эффективности Q является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Q имеет EC50 относительно GLP-1 рецептора, которая в приблизительно 2 - приблизительно 10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) больше, чем EC50 относительно GIP рецептора.
В некоторых вариантах осуществления Q обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности нативного GLP-1 относительно GLP-1 рецептора (GLP-1 эффективность) и обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности нативного GIP относительно GIP рецептора (GIP эффективность).
Селективность Q относительно GIP рецептора по сравнению с GLP-1 рецептором можно описать как относительный показатель GIP/GLP-1 активности (активность Q относительно GIP рецептора по сравнению с нативным GIP, разделенная на активность аналога относительно GLP-1 рецептора по сравнению с нативным GLP-1). Например, Q, который обладает 60% активности нативного GIP относительно GIP рецептора и 60% активности нативного GLP-1 относительно GLP-1 рецептора, имеет 1:1 показатель GIP/GLP-1 активности. Примерные показатели GIP/GLP-1 активности включают приблизительно 1:1, 1,5:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 или приблизительно 1:10, 1:9, 1:8, 1:7, 1:6, 1:5,1:4, 1:3, 1:2, или 1:1,5. В качестве примера, показатель GIP/GLP-1 активности 10:1 указывает на 10-кратную селективность относительно GIP рецептора по сравнению с GLP-1 рецептором. Аналогично, показатель GLP-1/GIP активности 10:1 указывает на 10-кратную селективность относительно GLP-1 рецептора по сравнению с GIP рецептором.
Активность относительно глюкагонового рецептора и GIP рецептора
В некоторых вариантах осуществления Q обладает активностью и относительно глюкагонового рецептора, и GIP рецептора ("соагонисты GIP/глюкагонового рецептора"). В некоторых вариантах осуществления активность (например, EC50, или относительная активность, или эффективность) Q относительно GIP рецептора находится в пределах приблизительно 50-кратного, приблизительно 40-кратного, приблизительно 30-кратного, приблизительно 20-кратного, приблизительно 10-кратного или приблизительно 5-кратного отличия (в большую или меньшую сторону) от его активности (например, EC50 или относительной активности, или эффективности) относительно глюкагонового рецептора. В некоторых вариантах осуществления GIP эффективность Q находится в пределах приблизительно 25-, приблизительно 20-, приблизительно 15-, приблизительно 10- или приблизительно 5-кратного отличия (в большую или меньшую сторону) от его глюкагоновой эффективности.
В некоторых вариантах осуществления отношение относительной активности или EC50, или эффективности Q относительно GIP рецептора, разделенной на относительную активность, или EC50, или эффективность Q относительно глюкагонового рецептора, является менее чем или приблизительно равным X, где X выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. в некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Q относительно GIP рецептора, разделенной на EC50, или эффективность, или относительную активность Q относительно глюкагонового рецептора, равно приблизительно 1, меньше, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение GIP эффективности Q к глюкагоновой эффективности Q является менее чем или приблизительно равным Z, где Z выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение GIP эффективности Q к глюкагоновой эффективности Q является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Q имеет EC50 относительно GIP рецептора, которая является в 2-10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) большей, чем EC50 относительно глюкагонового рецептора.
В некоторых вариантах осуществления отношение относительной активности, или эффективности, или EC50Q относительно глюкагонового рецептора, разделенной на относительную активность, или эффективность, или EC50Q относительно GIP рецептора, является менее чем или приблизительно равным V, где V выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Q относительно глюкагонового рецептора, разделенной на EC50, или эффективность, или относительную активность Q относительно GIP рецептора, является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение глюкагоновой эффективности Q к GIP эффективности Q является менее чем или приблизительно равным W, где W выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение глюкагоновой эффективности Q к GIP эффективности Q является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Q имеет EC50 относительно глюкагонового рецептора, которая является в приблизительно 2 - приблизительно 10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) большей, чем EC50 относительно GIP рецептора.
В некоторых вариантах осуществления Q обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности нативного глюкагона относительно глюкагонового рецептора (глюкагоновая эффективность) и обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности нативного GIP относительно GIP рецептора (GIF эффективность).
Селективность Q относительно GIP рецептора по сравнению с глюкагоновым рецептором можно описать как относительный показатель активности GIP/глюкагон (активность Q относительно GIP рецептора по сравнению с нативным GIP, разделенная на активность аналога относительно глюкагонового рецептора по сравнению с нативным глюкагоном). Например, Q, который обладает 60% активности нативного GIP относительно GIP рецептора и 60% активности нативного глюкагона относительно глюкагонового рецептора, имеет показатель 1:1 GIP/глюкагон активности. Примерные показатели GIP/глюкагон активности включают приблизительно 1:1, 1,5:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 или приблизительно 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2 или 1:1,5. В качестве примера, показатель GIP/глюкагон активности 10:1 указывает на 10-кратную селективность относительно GIP рецептора по сравнению с глюкагоновым рецептором. Аналогично, показатель глюкагон/GIP активности 10:1 указывает на 10-кратную селективность относительно глюкагонового рецептора по сравнению с GIP рецептором.
Активность относительно глюкагонового рецептора, GLP-1 рецептора и GIP рецептора
В некоторых вариантах осуществления Q обладает активностью относительно всех трех из глюкагонового рецептора, GLP-1 рецептора и GIP рецептора ("триагонисты глюкагонового/GLP-1/GIP рецептора"). В некоторых вариантах осуществления активность (например, EC50 или относительная активность или эффективность) Q относительно глюкагонового рецептора находится в пределах приблизительно 100-кратного, приблизительно 75-кратного, приблизительно 60-кратного, 50-кратного, приблизительно 40-кратного, приблизительно 30-кратного, приблизительно 20-кратного, приблизительно 10-кратного или приблизительно 5 кратного отличия (в большую или меньшую сторону) от его активности (например, EC50 или относительной активности или эффективности) относительно и GLP-1 рецептора и GIP рецептора. В некоторых вариантах осуществления активность (например, EC50 или относительная активность или эффективность) Q относительно GLP-1 рецептора находится в пределах приблизительно 100-кратного, приблизительно 75-кратного, приблизительно 60-кратного, 50-кратного, приблизительно 40-кратного, приблизительно 30-кратного, приблизительно 20-кратного, приблизительно 10-кратного или приблизительно 5 кратного отличия (в большую или меньшую сторону) от его активности (например, EC50 или относительной активности или эффективности) относительно и глюкагонового рецептора, и GIP рецептора. В некоторых вариантах осуществления активность (например, EC50 или относительная активность или эффективность) Q относительно GIP рецептора находится в пределах приблизительно 100-кратного, приблизительно 75-кратного, приблизительно 60-кратного, 50-кратного, приблизительно 40-кратного, приблизительно 30-кратного, приблизительно 20-кратного, приблизительно 10-кратного или приблизительно 5 кратного отличия (в большую или меньшую сторону) от его активности (например, EC50 или относительной активности или эффективности) относительно и глюкагонового рецептора и GLP-1 рецептора. Данное кратное отличие можно альтернативно выразить как показатели глюкагон/GLP-1, или GLP-1/GIP, или глюкагон/GLP-1, как указано выше.
Структура пептида глюкагонового суперсемейства (Q)
Пептид глюкагонового суперсемейства (Q), описанный в настоящем изобретении, может содержать аминокислотную последовательность, которая основана на аминокислотной последовательности нативного человеческого глюкагона (SEQ ID NO: 1601), нативного человеческого GLP-1 (SEQ ID NO: 1603 или 1604) или нативного человеческого GIP (SEQ ID NO: 1607).
На основе нативного человеческого глюкагона
В некоторых аспектах настоящего изобретения, пептид глюкагонового суперсемейства (Q) содержит аминокислотную последовательность, которая основана на аминокислотной последовательности нативного человеческого глюкагона (SEQ ID NO: 1601). В некоторых аспектах Q содержит модифицированную аминокислотную последовательность SEQ ID NO: 1601, содержащую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, и в ряде случаев, 16 или более (например, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.) аминокислотных модификаций. В некоторых вариантах осуществления Q содержит в сумме 1, вплоть до 2, вплоть до 3, вплоть до 4, вплоть до 5, вплоть до 6, вплоть до 7, вплоть до 8, вплоть до 9 или вплоть до 10 аминокислотных модификаций по сравнению с нативной человеческой глюкагоновой последовательностью (SEQ ID NO: 1601). В некоторых вариантах осуществления модификации представляют собой любую из модификаций, описанных в настоящем изобретении, например, ацилирование, алкилирование, пегилирование, укорачивание на C-конце, замену аминокислоты в одном или более положениях 1, 2, 3, 7, 10, 12, 15, 16, 17, 18, 19, 20, 21, 23, 24, 27, 28 и 29.
В некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая обладает по меньшей мере 25% идентичностью последовательности с аминокислотной последовательностью нативного человеческого глюкагона (SEQ ID NO: 1601). В некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая является по меньшей мере на 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или является более чем на 90% идентичной последовательности SEQ ID NO: 1601. В некоторых вариантах осуществления аминокислотная последовательность Q, которая обладает вышеуказанной % идентичностью последовательности, представляет собой полноразмерную аминокислотную последовательность Q. В некоторых вариантах осуществления аминокислотная последовательность Q, которая обладает вышеуказанной % идентичностью последовательности, является только частью аминокислотной последовательности Q. В некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая обладает приблизительно A% или более идентичностью последовательности с исходной аминокислотной последовательностью по меньшей мере 5 непрерывных аминокислот (например, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10 аминокислот) SEQ ID NO: 1601, где исходная аминокислотная последовательность начинается с аминокислоты в положении C SEQ ID NO: 1601 и заканчивается на аминокислоте в положении D SEQ ID NO: 1601, где A равен 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99; C равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 или 28, и D равен 5, 6, 7, 8, 9,10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29. Предусмотрены любая и все возможные комбинации вышеуказанных параметров, включая, но не ограничиваясь этим, например, где A равен 90%, и C и D равны 1 и 27, или 6 и 27, или 8 и 27, или 10 и 27, или 12 и 27, или 16 и 27.
На основе нативного человеческого GLP-1
В некоторых аспектах настоящего изобретения, пептид глюкагонового суперсемейства (Q) содержит аминокислотную последовательность, которая основана на аминокислотной последовательности нативного человеческого GLP-1 (SEQ ID NO: 1603). В некоторых аспектах Q содержит модифицированную аминокислотную последовательность SEQ ID NO: 1603, содержащую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, и в ряде случаев, 16 или более (например, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.) аминокислотных модификаций. В некоторых вариантах осуществления Q содержит в сумме 1, вплоть до 2, вплоть до 3, вплоть до 4, вплоть до 5, вплоть до 6, вплоть до 7, вплоть до 8, вплоть до 9 или вплоть до 10 аминокислотных модификаций по сравнению с нативной человеческой GLP-1 последовательностью (SEQ ID NO: 1603). В некоторых вариантах осуществления модификации представляют собой любые из модификаций, описанных в настоящем изобретении, например, ацилирование, алкилирование, пегилирование, укорачивание на C-конце, замену аминокислоты в одном или более положениях 1, 2, 3, 7, 10, 12, 15, 16, 17, 18, 19, 20, 21, 23, 24, 27, 28 и 29.
В некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая обладает по меньшей мере 25% идентичностью последовательности с аминокислотной последовательностью нативного человеческого GLP-1 (SEQ ID NO: 1603). В некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая обладает по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, или обладает более чем 90% идентичностью последовательности с SEQ ID NO: 1603. В некоторых вариантах осуществления аминокислотная последовательность Q, которая обладает вышеуказанной % идентичностью последовательности, представляет собой полноразмерную аминокислотную последовательность Q. В некоторых вариантах осуществления аминокислотная последовательность Q, которая обладает вышеуказанной % идентичностью последовательности, является только частью аминокислотной последовательности Q. В некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая обладает приблизительно A% или более идентичностью последовательности с исходной аминокислотной последовательностью по меньшей мере 5 непрерывных аминокислот (например, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10 аминокислот) SEQ ID NO: 1603, где исходная аминокислотная последовательность начинается с аминокислоты в положении C SEQ ID NO: 1603 и заканчивается на аминокислоте в положении D SEQ ID NO: 1603, где A равен 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99; C равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 ,22, 23, 24, 25, 26, 27 или 28, и D равен 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29. Предусмотрены любая и все возможные комбинации вышеуказанных параметров, включая, но не ограничиваясь этим, например, где A равен 90%, и C и D равны 1 и 27, или 6 и 27, или 8 и 27, или 10 и 27, или 12 и 27, или 16 и 27.
На основе нативного человеческого GIP
В некоторых вариантах осуществления настоящего изобретения, Q представляет собой аналог нативного человеческого GIP, аминокислотная последовательность которого представлена в настоящем изобретении как SEQ ID NO: 1607. Соответственно, в некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая основана на аминокислотной последовательности SEQ ID NO: 1607, но модифицирована 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, и в ряде случаев, 16 или более (например, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.) аминокислотными модификациями. В некоторых вариантах осуществления Q содержит в сумме 1, вплоть до 2, вплоть до 3, вплоть до 4, вплоть до 5, вплоть до 6, вплоть до 7, вплоть до 8, вплоть до 9 или вплоть до 10 аминокислотных модификаций по сравнению с нативной человеческой GIP последовательностью (SEQ ID NO: 1607). В некоторых вариантах осуществления модификации представляют собой любые из модификаций, описанных в настоящем изобретении, например, ацилирование, алкилирование, пегилирование, укорачивание на C-конце, замену аминокислоты в одном или более положениях 1, 2, 3, 7, 10, 12, 15, 16, 17, 18, 19, 20, 21, 23, 24, 27, 28 и 29. Примерные агонисты GIP рецептора являются известными в данной области техники. См., например, Irwin et al., J Pharm and Expmt Ther 314(3): 1187-1194 (2005); Salhanick et ah, Bioorg Med Chem Lett 15(18): 4114-4117 (2005); Green et al., Dibetes 7(5): 595-604 (2005); O'Harte et al., J Endocrinol 165(3): 639-648 (2000); O'Harte et al., Diabetologia 45(9): 1281-1291 (2002); Gault et al., Biochem J 367 (Pt3): 913-920 (2002); Gault et al., J Endocrin 176: 133-141 (2003); Irwin et al., Diabetes Obes Metab. 11(6): 603-610 (epub 2009).
В некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая обладает по меньшей мере 25% идентичностью последовательности с аминокислотной последовательностью нативного человеческого GIP (SEQ ID NO: 1607). В некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая обладает по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или обладает более чем 90% идентичностью последовательности с SEQ ID NO: 1607. В некоторых вариантах осуществления аминокислотная последовательность Q, которая обладает вышеуказанной % идентичностью последовательности, представляет собой полноразмерную аминокислотную последовательность Q. В некоторых вариантах осуществления аминокислотная последовательность Q, которая обладает вышеуказанной % идентичностью последовательности, является только частью аминокислотной последовательности Q. В некоторых вариантах осуществления Q содержит аминокислотную последовательность, которая обладает приблизительно A% или более идентичностью последовательности с исходной аминокислотной последовательностью по меньшей мере 5 непрерывных аминокислот (например, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10 аминокислот) SEQ ID NO: 1607, где исходная аминокислотная последовательность начинается с аминокислоты в положении C SEQ ID NO: 1607 и заканчивается на аминокислоте в положении D SEQ ID NO: 1607, где A равен 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99; C равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 или 28, и D равен 5, 6, 7, 8, 9,10, 11, 12,13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29. Предусмотрены любая и все возможные комбинации вышеуказанных параметров, включая, но не ограничиваясь этим, например, где A равен 90%, и C и D равны 1 и 27, или 6 и 27, или 8 и 27, или 10 и 27, или 12 и 27 или 16 и 27.
Модификации
Когда Q представляет собой родственный глюкагону пептид, Q может содержать нативную глюкагоновую аминокислотную последовательность (SEQ ID NO: 1601) с модификациями. В примерных вариантах осуществления родственный глюкагону пептид может содержать в сумме 1, вплоть до 2, вплоть до 3, вплоть до 4, вплоть до 5, вплоть до 6, вплоть до 7, вплоть до 8, вплоть до 9 или вплоть до 10 аминокислотных модификаций по сравнению с нативной глюкагоновой последовательностью, например, консервативные или неконсервативные замены. Модификации и замены, описанные в настоящем изобретении, осуществляют в определенных аспектах в конкретных положениях в Q, где нумерация положений соответствует нумерации глюкагона (SEQ ID NO: 1601). В некоторых вариантах осуществления 1, 2, 3, 4 или 5 неконсервативных замены осуществляют в любом из положений 2, 5, 7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29, и вплоть до 5 дополнительных консервативных замен осуществляют в любом из данных положений. В некоторых вариантах осуществления 1, 2 или 3 аминокислотных модификации осуществляют в пределах аминокислот в положениях 1-16, и 1, 2 или 3 аминокислотные модификации осуществляют в пределах аминокислот в положениях 17-26. В некоторых вариантах осуществления Q сохраняет по меньшей мере 22, 23, 24, 25, 26, 27 или 28 встречающихся в природе аминокислот в соответствующих положениях в нативном глюкагоне (например, содержит 1-7, 1-5 или 1-3 модификации по сравнению с встречающимся в природе глюкагоном).
DPP-IV устойчивость
В некоторых вариантах осуществления, где Q представляет собой пептид глюкагонового суперсемейства, Q содержит модификацию в положении 1 или 2, снижающую подверженность к расщеплению дипептидилпептидазой IV (DPP-IV). Более конкретно, в некоторых вариантах осуществления положение 1 Q (например, выбранное из положений на фигуре 1) заменено аминокислотой, выбранной из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах осуществления положение 2 Q заменено аминокислотой, выбранной из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина и аминоизомасляной кислоты. В некоторых вариантах осуществления положение 2 родственного глюкагону пептида не является D-серином.
Глюкагоновая модификация в положении 3
Родственные глюкагону пептиды классов 1-3, описанные в настоящем изобретении, можно модифицировать в положении 3 (согласно аминокислотной нумерации глюкагона дикого типа) для сохранения или увеличения активности относительно глюкагонового рецептора.
В некоторых вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, сохраненной или повышенной активности относительно глюкагонового рецептора можно достигнуть модификацией Gln в положении 3 глютаминовым аналогом. Например, родственный глюкагону пептид класса 1, класса 2 или класса 3, содержащий глютаминовый аналог в положении 3, может обладать приблизительно 5%, приблизительно 10%, приблизительно 20%, приблизительно 50% или приблизительно 85% или более активностью нативного глюкагона (SEQ ID NO: 1601) относительно глюкагонового рецептора. В некоторых вариантах осуществления родственный глюкагону пептид класса 1, класса 2 или класса 3, содержащий глютаминовый аналог в положении 3, может обладать приблизительно 20%, приблизительно 50%, приблизительно 75%, приблизительно 100%, приблизительно 200% или приблизительно 500% или более активностью соответствующего глюкагонового пептида, имеющего ту же аминокислотную последовательность как пептид, содержащий глютаминовый аналог, за исключением модифицированной аминокислоты в положении 3, относительно глюкагонового рецептора.
В некоторых вариантах осуществления родственный глюкагону пептид класса 1, класса 2 или класса 3, содержащий глютаминовый аналог в положении 3, обладает повышенной активностью относительно глюкагонового рецептора, но повышенная активность составляет не более чем 1000%, 10000%, 100000% или 1000000% активности нативного глюкагона или соответствующего родственного глюкагону пептида, имеющего ту же аминокислотную последовательность как пептид, содержащий глютаминовый аналог, за исключением модифицированной аминокислоты в положении 3.
В некоторых вариантах осуществления глютаминовый аналог представляет собой встречающуюся в природе или не встречающуюся в природе аминокислоту, содержащую боковую цепь структуры I, II или III:

Структура I

Структура II

Структура III
где R1 представляет собой C0-3 алкил или C0-3 гетероалкил; R2 представляет собой NHR4 или C1-3 алкил; R3 представляет собой C1-3 алкил; R4 представляет собой H или C1-3 алкил; X представляет собой NH, O или S; и Y представляет собой NHR4, SR3 или OR3. В некоторых вариантах осуществления X представляет собой NH, или Y представляет собой NHR4. В некоторых вариантах осуществления R1 представляет собой C0-2 алкил или C1 гетероалкил. В некоторых вариантах осуществления R2 представляет собой NHR4 или C1 алкил. В некоторых вариантах осуществления R4 представляет собой H или C1 алкил. В примерных вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, обеспечивают аминокислоту, содержащую боковую цепь структуры I, где R1 представляет собой CH2-S, X представляет собой NH, и R2 представляет собой CH3(ацетамидометилцистеин C(Acm)); R1 представляет собой CH2, X представляет собой NH, и R2 представляет собой CH3 (ацетилдиаминобутановая кислота, Dab(Ac)); R1 представляет собой C0 алкил, X представляет собой NH, R2 представляет собой NHR4, и R4 представляет собой H (карбамоилдиаминопропановая кислота, Dap(карбамоил)); или R1 представляет собой CH2-CH2, X представляет собой NH, и R2 представляет собой CH3 (ацетилорнитин, Orn(Ac)). В примерных вариантах осуществления обеспечивают аминокислоту, содержащую боковую цепь структуры II, где R1 представляет собой CH2, Y представляет собой NHR4, и R4 представляет собой CH3 (метилглютамин, Q(Me)); В примерных вариантах осуществления обеспечивают аминокислоту, содержащую боковую цепь структуры III, где R1 представляет собой CH2, и R4 представляет собой H (метионинсульфоксид, M(O)); В конкретных вариантах осуществления аминокислота в положении 3 замещена Dab(Ac).
Ацилирование Q
В некоторых вариантах осуществления родственный глюкагону пептид (например, родственный глюкагону пептид класса 1, родственный глюкагону пептид класса 2, родственный глюкагону пептид класса 3, родственный глюкагону пептид класса 4, родственные глюкагону пептиды класса 4 или родственный глюкагону пептид класса 5), Q модифицируют так, чтобы он содержал ацильную группу. Ацильная группа может быть ковалентно связана непосредственно с аминокислотой пептида Q, или опосредованно с аминокислотой Q через спейсер, где спейсер расположен между аминокислотой Q и ацильной группой. Q можно ацилировать в том же положении аминокислоты, где присоединена гидрофильная группа, или в отличном положении аминокислоты. Как описано в настоящем изобретении, Q может представлять собой пептид глюкагонового суперсемейства, родственный глюкагону пептид, включая родственный глюкагону пептид класса 1, 2, 3, 4 или 5, или остеокальцин, кальцитонин, амилин или их аналог, производное или конъюгат. Например, Q может представлять собой пептид глюкагонового суперсемейства класса 1, класса 2, класса 3, класса 4 или класса 5 и может содержать ацильную группу, которая отсутствует во встречающейся в природе аминокислоте. Ацилирование можно осуществлять в любом положении в Q. Когда Q представляет собой родственный глюкагону пептид, ацилирование можно осуществлять в любом положении, включая любое из положений 1-29, положение в C-концевой части или C-концевую аминокислоту, при условии, что активность, проявляемая неацилированным родственным глюкагону пептидом, сохраняется после ацилирования. Например, если неацилированный пептид обладает глюкагоновой агонистической активностью, то ацилированный пептид сохраняет глюкагоновую агонистическую активностью. Также, например, если неацилированный пептид обладает глюкагоновой антагонистической активностью, то ацилированный пептид сохраняет глюкагоновую антагонистическую активность. Например, если неацилированный пептид обладает GLP-1 агонистической активностью, то ацилированный пептид сохраняет GLP-1 агонистическую активность. Неограничивающие примеры включают ацилирование в положениях 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29 (согласно нумерации аминокислот глюкагона дикого типа). Что касается родственных глюкагону пептидов класса 1, класса 2 и класса 3, ацилирование можно осуществлять в любом из положений 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28, 29, 30, 37, 38, 39, 40, 41, 42 или 43 (согласно нумерации аминокислот глюкагона дикого типа). Другие неограничивающие примеры относительно родственных глюкагону пептидов (например, класса 1, 2, 3, 4 или 5) включают ацилирование в положении 10 (согласно нумерации аминокислот глюкагона дикого типа) и пегилирование в одном или более положениях в C-концевой части глюкагонового пептида, например, в положении 24, 28 или 29 (согласно нумерации аминокислот глюкагона дикого типа), в C-концевом удлинении, или на C-конце (например, с помощью присоединения C-концевого Cys).
В конкретном аспекте настоящего изобретения пептид Q (например, пептид глюкагонового суперсемейства, родственный глюкагону пептид, родственный глюкагону пептид класса 1, 2, 3, 4 или 5, или остеокальцин, кальцитонин, амилин или их аналог, производное или конъюгат) модифицируют так, чтобы он содержал ацильную группу прямым ацилированием амина, гидроксила или тиола боковой цепи аминокислоты Q. В некоторых вариантах осуществления Q непосредственно ацилируют через амин, гидроксил или тиол боковой цепи аминокислоты. В некоторых вариантах осуществления, где Q представляет собой родственный глюкагону пептид, ацилирование осуществляют в положении 10, 20, 24 или 29 (согласно нумерации аминокислот глюкагона дикого типа). В связи с этим, ацилированный родственный глюкагону пептид может содержать аминокислотную последовательность SEQ ID NO: 1601 или его модифицированную аминокислотную последовательность, содержащую одну или более аминокислотных модификаций, описанных в настоящем изобретении, с по меньшей мере одной из аминокислот в положениях 10, 20, 24, и 29 (согласно нумерации аминокислот глюкагона дикого типа), модифицированной по любой аминокислоте, содержащей амин, гидроксил или тиол в боковой цепи. В некоторых конкретных вариантах осуществления настоящего изобретения, где Q представляет собой родственный глюкагону пептид, прямое ацилирование Q осуществляют через амин, гидроксил или тиол боковой цепи аминокислоты в положении 10 (согласно нумерации аминокислот глюкагона дикого типа).
В некоторых вариантах осуществления аминокислота пептида Q (например, пептида глюкагонового суперсемейства, родственного глюкагону пептида, родственного глюкагону пептида класса 1, 2, 3, 4 или 5, или остеокальцина, кальцитонина, амилина или их аналога, производного или конъюгата), содержащая амин в боковой цепи, представляет собой аминокислоту формулы I:

где n=1-4
[формула I]
В некоторых примерных вариантах осуществления аминокислота формулы I представляет собой аминокислоту, где n равен 4 (Lys) или n равен 3 (Orn).
В других вариантах осуществления аминокислота пептида Q, содержащая гидроксил в боковой цепи, представляет собой аминокислоту формулы II:

где n=1-4
[формула II]
В некоторых примерных вариантах осуществления аминокислота формулы II представляет собой аминокислоту, где n равен 1 (Ser).
В еще других вариантах осуществления аминокислота пептида Q, содержащая тиол в боковой цепи, представляет собой аминокислоту формулы III:
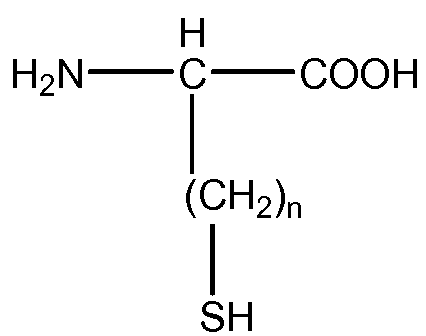
где n=1-4
[формула III]
В некоторых примерных вариантах осуществления аминокислота формулы III представляет собой аминокислоту, где n равен 1 (Cys).
В еще других вариантах осуществления аминокислота пептида Q, содержащая амин, гидроксил или тиол в боковой цепи, представляет собой дизамещенную аминокислоту, имеющую ту же структуру формулы I, формулы II или формулы III, за исключением того, что водород, соединенный с альфа атомом углерода аминокислоты формулы I, формулы II или формулы III, замещен второй боковой цепью.
В некоторых вариантах осуществления настоящего изобретения, ацилированный пептид Q (например, пептид глюкагонового суперсемейства, родственный глюкагону пептид, родственный глюкагону пептид класса 1, 2, 3, 4 или 5, или остеокальцин, кальцитонин, амилин или их аналог, производное или конъюгат) содержит спейсер между пептидом и ацильной группой. В некоторых вариантах осуществления Q ковалентно связан со спейсером, который ковалентно связан с ацильной группой. В некоторых примерных вариантах осуществления Q модифицируют так, чтобы он содержал ацильную группу ацилированием амина, гидроксила или тиола спейсера, где спейсер (где Q представляет собой родственный глюкагону пептид, например, класса 1, 2, 3, 4 или 5) присоединяют к боковой цепи аминокислоты в положении 10, 20, 24, или 29 (согласно нумерации аминокислот глюкагона дикого типа), или к C-концевой аминокислоте родственного глюкагону пептида. Аминокислота пептида Q, к которой присоединяют спейсер, может представлять собой любую аминокислоту, содержащую группу, которая допускает соединение со спейсером. Например, аминокислота, содержащая -NH2, -OH или -COOH в боковой цепи (например, Lys, Orn, Ser, Asp или Glu), является подходящей. Аминокислота пептида Q (например, моно или ди α-замещенная аминокислота), содержащая -NH2, -OH или -COOH в боковой цепи (например, Lys, Orn, Ser, Asp или Glu), является также подходящей. В некоторых вариантах осуществления, когда Q представляет собой родственный глюкагону пептид (например, класса 1, 2, 3, 4 или 5), ацилированный родственный глюкагону пептид может содержать аминокислотную последовательность SEQ ID NO: 1601 или его модифицированную аминокислотную последовательность, содержащую одну или более аминокислотных модификаций, описанных в настоящем изобретении, с по меньшей мере одной из аминокислот в положениях 10, 20, 24 и 29 (согласно нумерации аминокислот глюкагона дикого типа), модифицированной по любой аминокислоте, содержащей амин, гидроксил или карбоксилат в боковой цепи.
В некоторых вариантах осуществления спейсер между пептидом Q и ацильной группой представляет собой аминокислоту, содержащую амин, гидроксил или тиол в боковой цепи, или дипептид или трипептид, содержащий аминокислоту, содержащую амин, гидроксил или тиол в боковой цепи. В некоторых вариантах осуществления аминокислотный спейсер не является γ-Glu. В некоторых вариантах осуществления дипептидный спейсер не является γ-Glu-γ-Glu.
Когда ацилирование осуществляют через аминогруппу аминокислоты спейсера, ацилирование можно осуществлять через альфа аминогруппу аминокислоты или аминогруппу боковой цепи. В случаях, в которых альфа амин является ацилированным, спейсерная аминокислота может представлять собой любую аминокислоту. Например, спейсерная аминокислота может представлять собой гидрофобную аминокислоту, например, Gly, Ala, Val, Leu, Ile, Trp, Met, Phe, Tyr. В некоторых вариантах осуществления спейсерная аминокислота может представлять собой, например, гидрофобную аминокислоту, например, Gly, Ala, Val, Leu, Ile, Trp, Met, Phe, Tyr, 6-аминогексановую кислоту, 5-аминовалерьяновую кислоту, 7-аминогептановую кислоту, 8-аминооктановую кислоту. Альтернативно, спейсерная аминокислота может представлять собой кислый остаток, например, Asp и Glu. В случаях, когда амин боковой цепи спейсерной аминокислоты является ацилированным, спейсерная аминокислота представляет собой аминокислоту, содержащую амин в боковой цепи, например, аминокислоту формулы I (например, Lys или Orn). В данном случае, можно ацилировать и альфа аминогруппу и аминогруппу боковой цепи спейсерной аминокислоты так, что пептид является диацилированным. Варианты осуществления настоящего изобретения включают данные диацилированные молекулы.
Когда ацилирование осуществляют по гидроксильной группе аминокислоты спейсера, аминокислота или одна из аминокислот дипептида или трипептид может представлять собой аминокислоту формулы II. В конкретном примерном варианте осуществления аминокислота представляет собой Ser.
Когда ацилирование осуществляют по тиольной группе аминокислоты спейсера, аминокислота или одна из аминокислот дипептида или трипептид может представлять собой аминокислоту формулы III. В конкретном примерном варианте осуществления аминокислота представляет собой Cys.
В некоторых вариантах осуществления спейсер содержит гидрофильный бифункциональный спейсер. В конкретном варианте осуществления спейсер содержит амино поли(алкилокси)карбоксилат. В связи с этим, спейсер группа может содержать, например, NH2(CH2CH2O)n(CH2)mCOOH, где m представляет собой любое целое число от 1 до 6, и n представляет собой любое целое число от 2 до 12, такую как, например, 8-амино-3,6-диоксаооктановую кислоту, которая имеется в продаже Peptides International, Inc. (Louisville, KY).
В некоторых вариантах осуществления спейсер между пептидом Q и ацильной группой содержит гидрофильный бифункциональный спейсер. В определенных вариантах осуществления гидрофильный бифункциональный спейсер содержит две или более реакционноспособные группы, например, амино, гидроксильную, тиольную и карбоксильную группу или любую их комбинацию. В определенных вариантах осуществления гидрофильный бифункциональный спейсер содержит гидроксильную группу и карбоксильную группу. В других вариантах осуществления гидрофильный бифункциональный спейсер содержит аминогруппу и карбоксильную группу. В других вариантах осуществления гидрофильный бифункциональный спейсер содержит тиольную группу и карбоксильную группу.
В некоторых вариантах осуществления спейсер между пептидом Q и ацильной группой представляет собой гидрофобный бифункциональный спейсер. Гидрофобные бифункциональные спейсеры являются известными в данной области техники. См., например, Bioconjugate Techniques, G. T. Hermanson (Academic Press, San Diego, CA, 1996), которая включена с помощью ссылки во всей своей полноте. В определенных вариантах осуществления гидрофобный бифункциональный спейсер содержит две или более реакционноспособные группы, например, амино, гидроксильную, тиольную и карбоксильную группу или любую их комбинацию. В определенных вариантах осуществления гидрофобный бифункциональный спейсер содержит гидроксильную группу и карбоксильную группу. В других вариантах осуществления гидрофобный бифункциональный спейсер содержит аминогруппу и карбоксильную группу. В других вариантах осуществления гидрофобный бифункциональный спейсер содержит тиольную группу и карбоксильную группу. Подходящие гидрофобные бифункциональные спейсеры, содержащие карбоксильную группу и гидроксильную группу или тиольную группу, являются известными в данной области техники и включают, например, 8-гидроксиооктановую кислоту и 8-меркаптооктановую кислоту.
В некоторых вариантах осуществления бифункциональный спейсер не является дикарбоновой кислотой, содержащей неразветвленную метиленовую цепь из 1-7 атомов углерода между карбоксильными группами. В некоторых вариантах осуществления бифункциональный спейсер представляет собой дикарбоновую кислоту, содержащую неразветвленную метиленовую цепь из 1-7 атомов углерода между карбоксильными группами.
Спейсер (например, аминокислота, дипептид, трипептид, гидрофильный бифункциональный спейсер или гидрофобный бифункциональный спейсер) в конкретных вариантах осуществления, где Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, имеет длину 3-10 атомов (например, 6-10 атомов, (например, 6, 7, 8, 9 или 10 атомов). В более конкретных вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсер имеет длину от приблизительно 3 до 10 атомов (например, 6-10 атомов) и ацильная группа представляет собой ацильную группу C12-C18 жирной кислоты, например, ацильную группу C14 жирной кислоты, ацильную группу C16 жирной кислоты, так что суммарная длина спейсера и ацильной группы составляет 14-28 атомов, например, приблизительно 14, 15, 16, 17, 18,19, 20, 21, 22, 23, 24, 25, 26, 27 или 28 атомов. В некоторых вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, длина спейсера и ацильной группы составляет 17-28 (например, 19-26, 19-21) атомов.
В соответствии с определенными вариантами осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, бифункциональный спейсер может представлять собой синтетическую или встречающуюся в природе аминокислоту (включая, но не ограничиваясь этим, любую из аминокислот, описанных в настоящем изобретении), содержащую аминокислотный остов, который имеет длину 3-10 атомов (например, 6-аминогексановую кислоту, 5-аминовалерьяновую кислоту, 7-аминогептановую кислоту и 8-аминооктановую кислоту). Альтернативно, спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, может представлять собой дипептидный или трипептидный спейсер, содержащий пептидный остов, который имеет длину 3-10 атомов (например, 6-10 атомов). Каждая аминокислота дипептидного или трипептидного спейсера, соединенного с родственным глюкагону пептидом класса 1, класса 2 или класса 3, может быть одинаковой или отличной от другой аминокислоты (аминокислот) дипептида или трипептида и может быть независимо выбрана из группы, состоящей из: встречающихся в природе и/или не встречающихся в природе аминокислот, включая, например, любой из D или L изомеров встречающихся в природе аминокислот (Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp, Tyr), или любой D или L изомер не встречающихся в природе аминокислот, выбранных из группы, состоящей из: β-аланина (β-Ala), N-α-метилаланина (Me-Ala), аминомасляной кислоты (Abu), γ-аминомасляной кислоты (γ-Abu), аминогексановой кислоты (ε-Ahx), аминоизомасляной кислоты (Aib), аминометилпирролкарбоновой кислоты, аминопиперидинкарбоновой кислоты, аминосерина (Ams), аминотетрагидропиран-4-карбоновой кислоты, аргинин N-метокси-N-метиламида, β-аспарагиновой кислоты (β-Asp), азетидинкарбоновой кислоты, 3-(2-бензотиазолил)аланина, α-трет-бутилглицина, 2-амино-5-уреидо-н-валерьяновой кислоты (цитруллин, Cit), β-циклогексилаланина (Cha), ацетамидометилцистеина, диаминобутановой кислоты (Dab), диаминопропионовой кислоты (Dpr), дигидроксифенилаланина (DOPA), диметилтиазолидина (DMTA), γ-глютаминовой кислоты (γ-Glu), гомосерина (Hse), гидроксипролина (Hyp), изолейцин N-метокси-N-метиламида, метилизолейцина (MeDe), изонипекотиновой кислоты (Isn), метиллейцина (MeLeu), метиллизина, диметиллизина, триметиллизина, метанопролина, метионинсульфоксида (Met(O)), метионинсульфона (Met(O2)), норлейцина (Nle), метилнорлейцина (Me-Nle), норвалина (Nva), орнитина (Orn), пара-аминобензойной кислоты (PABA), пеницилламина (Pen), метилфенилаланина (MePhe), 4-хлорфенилаланина (Phe(4-Cl)), 4-фторфенилаланина (Phe(4-F)), 4-нитрофенилаланина (Phe(4-NO2)), 4-цианофенилаланина ((Phe(4-CN)), фенилглицина (Phg), пиперидинилаланина, пиперидинилглицина, 3,4-дегидропролина, пирролидинилаланина, саркозина (Sar), селеноцистеина (Sec), O-бензилфосфосерина, 4-амино-3-гидрокси-6-метилгептановой кислоты (Sta), 4-амино-5-циклогексил-3-гидроксипентановой кислоты (ACHPA), 4-амино-3-гидрокси-5-фенилпентановой кислоты (AHPPA), 1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (Tic), тетрагидропиранглицина, тиенилаланина (Thi), O-бензилфосфотирозина, O-фосфотирозина, метокситирозина, этокситирозина, O-(бисдиметиламинофосфоно)тирозина, тирозинсульфаттетрабутиламина, метилвалина (MeVal), 1-амино-1-циклогексанкарбоновой кислоты (Acx), аминовалерьяновой кислоты, бета-циклопропилаланина (Cpa), пропаргилглицина (Prg), аллилглицина (Alg), 2-амино-2-циклогексилпропановой кислоты (2-Cha), трет-бутилглицина (Tbg), винилглицина (Vg), 1-амино-1-циклопропанкарбоновой кислоты (Acp), 1-амино-1-циклопентанкарбоновой кислоты (Acpe), алкилированной 3-меркаптопропионовой кислоты, 1-амино-1-циклобутанкарбоновой кислоты (Acb).
В некоторых вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсер содержит суммарный отрицательный заряд, например, содержит одну или две отрицательно заряженные аминокислоты. В некоторых вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, дипептид не является любым дипептидом общей структуры A-B, где A выбран из группы, состоящей из Gly, Gln, Ala, Arg, Asp, Asn, He, Leu, Val, Phe и Pro, где B выбрано из группы, состоящей из Lys, His, Trp. В некоторых вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, дипептидный спейсер выбран из группы, состоящей из: Ala-Ala, β-Ala-β-Ala, Leu-Leu, Pro-Pro, γ-аминомасляная кислота-γ-аминомасляной кислоты и γ-Glu-γ-Glu.
Пептид Q можно модифицировать так, чтобы он содержал ацильную группу ацилированием длинноцепочечного алкана. В конкретных аспектах длинноцепочечный алкан содержит амино, гидроксильную или тиольную группу (например, октадециламин, тетрадеканол и гексадекантиол), которая реагирует с карбоксильной группой или ее активированной формой пептида Q. Карбоксильная группа или ее активированная форма Q может быть частью боковой цепи аминокислоты (например, глютаминовой кислоты, аспарагиновой кислоты) Q или может быть частью пептидного остова.
В определенных вариантах осуществления пептид Q модифицируют так, чтобы он содержал ацильную группу ацилированием спейсера длинноцепочечного алкана, который соединен с Q. В конкретных аспектах длинноцепочечный алкан содержит амино, гидроксильную или тиольную группу, которая реагирует с карбоксильной группой или ее активированной формой спейсера. Подходящие спейсеры, содержащие карбоксильную группу или ее активированную форму, являются описанными в настоящем изобретении и включают, например, бифункциональные спейсеры, например, аминокислоты, дипептиды, трипептиды, гидрофильные бифункциональные спейсеры и гидрофобные бифункциональные спейсеры.
Как применяют в настоящем изобретении, термин "активированная форма карбоксильной группы" относится к карбоксильной группе общей формулы R(C=O)X, где X представляет собой уходящую группу, и R представляет собой Q или спейсер. Например, активированные формы карбоксильных групп могут включать, но не ограничиваясь этим, хлорангидриды кислот, ангидриды и эфиры. В некоторых вариантах осуществления активированная карбоксильная группа представляет собой эфир N-гидроксисукцинимидной (NHS) уходящей группы.
Что касается данных аспектов настоящего изобретения, в которых длинноцепочечный алкан ацилирован пептидом Q или спейсером, длинноцепочечный алкан может иметь любой размер и может иметь любую длину углеродной цепи. Длинноцепочечный алкан может быть линейным или разветвленным. В определенных аспектах длинноцепочечный алкан представляет собой C4-C30 алкан. Например, длинноцепочечный алкан может быть любым из C4 алкана, C6 алкана, C8 алкана, C10 алкана, C12 алкана, C14 алкана, C16 алкана, C18 алкана, C20 алкана, C22 алкана, C24 алкана, C26 алкана, C28 алкана или C30 алкана. В некоторых вариантах осуществления длинноцепочечный алкан содержит C8-C20 алкан, например, C14 алкан, C16 алкан или C18 алкан.
В некоторых вариантах осуществления амино, гидроксильная или тиольная группа Q ацилирована холестериновой кислотой. В конкретном варианте осуществления пептид соединен с холестериновой кислотой через алкилированный дезаминовый Cys спейсер, т.е. спейсер на основе алкилированной 3-меркаптопропионовой кислоты.
Подходящие способы ацилирования пептида по аминам, гидроксилам и тиолам являются известными в данной области техники. См., например, Miller, Biochem Biophys Res Commun 218: 377-382 (1996); Shimohigashi and Stammer, Int J Pept Protein Res 19: 54-62 (1982); и Previero et al., Biochim Biophys Ada 263: 7-13 (1972) (что касается способов ацилирование по гидроксилу); и San and Silvius, J Pept Res 66: 169-180 (2005) (что касается способов ацилирования тиола); Bioconjugate Chem. "Chemical Modifications of Proteins: History and Applications" страницы 1, 2-12 (1990); Hashimoto et al., Pharmacuetical Res. "Synthesis of Palmitoyl Derivatives of Insulin and their Biological Activity" Vol. 6, No: 2 pp,171-176 (1989).
Ацильная группа ацилированного пептид Q может иметь любой размер, например, углеродную цепь любой длины, и может быть линейной или разветвленной. В некоторых конкретных вариантах осуществления настоящего изобретения, ацильная группа представляет собой C4-C30 жирную кислоту. Например, ацильная группа может быть любой из C4 жирной кислоты, C6 жирной кислоты, C8 жирной кислоты, C10 жирной кислоты, C12 жирной кислоты, C14 жирной кислоты, C16 жирной кислоты, C18 жирной кислоты, C20 жирной кислоты, C22 жирной кислоты, C24 жирной кислоты, C26 жирной кислоты, C28 жирной кислоты или C30 жирной кислоты. В некоторых вариантах осуществления ацильная группа представляет собой C8-C20 жирную кислоту, например, C14 жирную кислоту или C16 жирную кислоту.
В альтернативном варианте осуществления, ацильная группа представляет собой желчную кислоту. Желчная кислота может быть подходящей желчной кислотой, включая, но не ограничиваясь этим, холевую кислоту, хенодезоксихолевую кислоту, дезоксихолевую кислоту, литохолевую кислоту, таурохолевую кислоту, гликохолевую кислоту и холестериновую кислоту.
Ацилированные пептиды Q, описанные в настоящем изобретении, можно дополнительно модифицировать так, чтобы они содержали гидрофильную группу. В некоторых конкретных вариантах осуществления гидрофильная группа может содержать полиэтиленгликольную (PEG) цепь. Введение гидрофильной группы можно осуществлять любыми подходящими способами, такими как любой из способов, описанных в настоящем изобретении. В некоторых вариантах осуществления, относящихся к родственным глюкагону пептидам класса 1, 2, 3, 4 или 5, ацилированный родственный глюкагону пептид может содержать SEQ ID NO: 1601, содержащую любую из модификаций, описанных в настоящем изобретении, в которой по меньшей мере одна из аминокислот в положении 10, 20, 24 и 29 (согласно нумерации аминокислот глюкагона дикого типа) содержит ацильную группу, и по меньшей мере одна из аминокислот в положении 16, 17, 21, 24 или 29 (согласно нумерации аминокислот глюкагона дикого типа), положении в C-концевом удлинении или C-концевая аминокислота модифицированы по Cys, Lys, Orn, гомо-Cys или Ac-Phe, и боковая цепь аминокислоты ковалентно связана с гидрофильной группой (например, PEG). В некоторых вариантах осуществления, относящихся к родственным глюкагону пептидам класса 1, 2, 3, 4 или 5, ацильную группу присоединяют по положению 10 (согласно нумерации аминокислот глюкагона дикого типа), необязательно через спейсер, содержащий Cys, Lys, Orn, гомо-Cys или Ac-Phe, и гидрофильную группу вводят по Cys остатку в положении 24.
Альтернативно, ацилированный пептид (Q) может содержать спейсер, где спейсер и ацилирован, и модифицирован так, чтобы он содержал гидрофильную группу. Неограничивающие примеры подходящих спейсеров включают спейсер, содержащий одну или более из аминокислот, выбранных из группы, состоящей из Cys, Lys, Orn, гомо-Cys и Ac-Phe.
Алкилирование Q
В некоторых вариантах осуществления Q модифицируют так, чтобы он содержал алкильную группу. Алкильная группа может быть ковалентно связана непосредственно с аминокислотой пептида Q или опосредованно с аминокислотой Q через спейсер, где спейсер расположен между аминокислотой Q и алкильной группой. Алкильная группа может быть соединена с Q, например, через эфирную, тиоэфирную или амино связь. Q можно алкилировать в том же положении аминокислоты, где присоединена гидрофильная группа, или в отличном положении аминокислоты. Как описано в настоящем изобретении, Q может представлять собой пептид глюкагонового суперсемейства, родственный глюкагону пептид, включая родственный глюкагону пептид класса 1, 2, 3, 4 или 5, или остеокальцин, кальцитонин, амилин или их аналог, производное или конъюгат. Например, Q может представлять собой родственный глюкагону пептид класса 1, класса 2 или класса 3 и может содержать алкильную группу, которая не содержится во встречающейся в природе аминокислоте.
Алкилирование можно осуществлять в любом положении в Q. Когда Q представляет собой родственный глюкагону пептид, алкилирование можно осуществлять в любом положении, включая любое из положений 1-29, положение в C-концевом удлинении или C-концевую аминокислоту, при условии, что агонистическая активность неалкилированного пептида относительно глюкагона, GLP-1, GIP или другого рецептора родственного глюкагону пептида сохраняется после алкилирования. В некоторых вариантах осуществления, если неалкилированный пептид обладает глюкагоновой агонистической активностью, то алкилированный пептид сохраняет глюкагоновую агонистическую активность. В некоторых вариантах осуществления, если неалкилированный пептид обладает GLP-1 агонистической активностью, то алкилированный пептид сохраняет GLP-1 агонистическую активность. Неограничивающие примеры включают алкилирование в положениях 5, 7, 10, 11, 12, 13, 14, 16, 17, 18,19, 20, 21, 24, 27, 28 или 29 (согласно нумерации аминокислот глюкагона дикого типа). Что касается родственных глюкагону пептидов класса 1, класса 2 и класса 3, алкилирование можно осуществлять в положениях 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28, 29, 30, 37, 38, 39, 40, 41, 42 или 43 (согласно нумерации аминокислот глюкагона дикого типа). Другие неограничивающие примеры относительно родственных глюкагону пептидов (например, класса 1, 2, 3, 4 или 5) включают алкилирование в положении 10 (согласно нумерации аминокислот глюкагона дикого типа) и пегилирование в одном или более положениях в C-концевой части родственного глюкагону пептида, например, в положении 24, 28 или 29 (согласно нумерации аминокислот глюкагона дикого типа), в C-концевом удлинении или на C-конце (например, присоединением C-концевого Cys).
В конкретном аспекте настоящего изобретения, пептид Q (например, пептид глюкагонового суперсемейства, родственный глюкагону пептид, родственный глюкагону пептид класса 1, 2, 3, 4 или 5, или остеокальцин, кальцитонин, амилин или их аналог, производное или конъюгат) модифицируют так, чтобы он содержал алкильную группу прямым алкилированием амина, гидроксила или тиола боковой цепи аминокислоты Q. В некоторых вариантах осуществления Q непосредственно алкилируют по амину, гидроксилу или тиолу боковой цепи аминокислоты. В некоторых вариантах осуществления, когда Q представляет собой родственный глюкагону пептид, алкилирование осуществляют в положении 10, 20, 24 или 29 (согласно нумерации аминокислот глюкагона дикого типа). В связи с этим, алкилированный родственный глюкагону пептид может содержать аминокислотную последовательность SEQ ID NO: 1601 или его модифицированную аминокислотную последовательность, содержащую одну или более аминокислотных модификаций, описанных в настоящем изобретении, с по меньшей мере одной из аминокислот в положениях 10, 20, 24 и 29 (согласно нумерации аминокислот глюкагона дикого типа), модифицированной по любой аминокислоте, содержащей амин, гидроксил или тиол в боковой цепи. В некоторых конкретных вариантах осуществления настоящего изобретения, когда Q представляет собой родственный глюкагону пептид, прямое алкилирование Q осуществляют по амину, гидроксилу или тиолу боковой цепи аминокислоты в положении 10 (согласно нумерации аминокислот глюкагона дикого типа).
В некоторых вариантах осуществления аминокислота пептида Q (например, пептида глюкагонового суперсемейства, родственного глюкагону пептида, родственного глюкагону пептида класса 1, 2, 3, 4 или 5, или остеокальцина, кальцитонина, амилина или их аналога, производного или конъюгата), содержащая амин в боковой цепи, представляет собой аминокислоту формулы I. В некоторых примерных вариантах осуществления аминокислота формулы I представляет собой аминокислоту, где n равен 4 (Lys) или n равен 3 (Orn).
В других вариантах осуществления аминокислота пептида Q, содержащая гидроксил в боковой цепи, представляет собой аминокислоту формулы II. В некоторых примерных вариантах осуществления аминокислота формулы II представляет собой аминокислоту, где n равен 1 (Ser).
В еще других вариантах осуществления аминокислота пептида Q, содержащая тиол в боковой цепи, представляет собой аминокислоту формулы III. В некоторых примерных вариантах осуществления аминокислота формулы II представляет собой аминокислоту, где n равен 1 (Cys).
В еще других вариантах осуществления аминокислота пептида Q, содержащая амин, гидроксил или тиол в боковой цепи, представляет собой дизамещенную аминокислоту, имеющую ту же структуру формулы 1, формулы II или формулы III, за исключением того, что водород, соединенный с альфа атомом углерода аминокислоты формулы I, формулы II или формулы III, замещен второй боковой цепью.
В некоторых вариантах осуществления настоящего изобретения, алкилированный пептид Q (например, пептид глюкагонового суперсемейства, родственный глюкагону пептид, родственный глюкагону пептид класса 1, 2, 3, 4 или 5, или остеокальцин, кальцитонин, амилин или их аналог, производное или конъюгат) содержит спейсер между пептидом и алкильной группой. В некоторых вариантах осуществления Q ковалентно связан со спейсером, который ковалентно связан с алкильной группой. В некоторых примерных вариантах осуществления пептид Q модифицируют так, чтобы он содержал алкильную группу алкилированием амина, гидроксила или тиола спейсера, где спейсер (когда Q представляет собой родственный глюкагону пептид, например, класса 1, 2, 3, 4 или 5) присоединяют к амину в боковой цепи аминокислоты в положении 10, 20, 24 или 29 (согласно нумерации аминокислот глюкагона дикого типа) Q. Аминокислота пептида Q, к которой присоединяют спейсер, может быть любой аминокислотой, содержащей группу, которая позволяет осуществлять соединение со спейсером. Аминокислота пептида Q, к которой присоединен спейсер, может быть любой аминокислотой (например, однократно α-замещенной аминокислотой или α,α-дизамещенной аминокислотой), содержащей группу, которая позволяет осуществлять соединение со спейсером. Аминокислота пептида Q, содержащая -NH2, -OH или -COOH в боковой цепи (например, Lys, Orn, Ser, Asp или Glu), является подходящей. В некоторых вариантах осуществления, когда Q представляет собой родственный глюкагону пептид (например, класса 1, 2, 3, 4 или 5), алкилированный Q может содержать аминокислотную последовательность SEQ ID NO: 1601 или его модифицированную аминокислотную последовательность, содержащую одну или более аминокислотных модификаций, описанных в настоящем изобретении, с по меньшей мере одной из аминокислот в положениях 10, 20, 24, и 29 (согласно нумерации аминокислот глюкагона дикого типа), модифицированной по любой аминокислоте, содержащей амин, гидроксил или карбоксилат в боковой цепи.
В некоторых вариантах осуществления спейсер между пептидом Q и алкильной группой представляет собой аминокислоту, содержащую амин, гидроксил или тиол в боковой цепи, или дипептид или трипептид, содержащий аминокислоту, содержащую амин, гидроксил или тиол в боковой цепи. В некоторых вариантах осуществления аминокислотный спейсер не является γ-Glu. В некоторых вариантах осуществления дипептидный спейсер не является γ-Glu-γ-Glu.
Когда алкилирование осуществляют по аминогруппе аминокислоты спейсера, алкилирование можно осуществлять через альфа аминогруппу аминокислоты или аминогруппу в боковой цепи. В случае, в котором алкилируют альфа аминогруппу, спейсерная аминокислота может представлять собой любую аминокислоту. Например, спейсерная аминокислота может представлять собой гидрофобную аминокислоту, например, Gly, Ala, Val, Leu, Ile, Tip, Met, Phe, Tyr. Альтернативно, спейсерная аминокислота может представлять собой кислый остаток, например, Asp и Glu. В примерных вариантах осуществления спейсерная аминокислота может представлять собой гидрофобную аминокислоту, например, Gly, Ala, Val, Leu, Ile, Trp, Met, Phe, Tyr, 6-аминогексановую кислоту, 5-аминовалерьяновую кислоту, 7-аминогептановую кислоту, 8-аминооктановую кислоту. Альтернативно, спейсерная аминокислота может представлять собой кислый остаток, например, Asp и Glu, при условии, что алкилирование осуществляют по альфа аминогруппе кислого остатка. В случае, в котором алкилируют аминогруппу боковой цепи спейсерной аминокислоты, спейсерная аминокислота представляет собой аминокислоту, содержащую аминогруппу в боковой цепи, например, аминокислоту формулы I (например, Lys или Orn). В данном случае, можно алкилировать и альфа аминогруппу и аминогруппу боковой цепи спейсерной аминокислоты, так что пептид является диалкилированным. Варианты осуществления настоящего изобретения включают данные диалкилированные молекулы.
Когда алкилирование осуществляют по гидроксильной группе аминокислоты спейсера, аминокислота или одна из аминокислот спейсера может представлять собой аминокислоту формулы II. В конкретных примерных вариантах осуществления аминокислота представляет собой Ser.
Когда алкилирование осуществляют по тиольной группе аминокислоты спейсера, аминокислота или одна из аминокислот спейсера может представлять собой аминокислоту формулы III. В конкретном примерном варианте осуществления аминокислота представляет собой Cys.
В некоторых вариантах осуществления спейсер включает гидрофильный бифункциональный спейсер. В конкретном варианте осуществления спейсер содержит амино поли(алкилокси)карбоксилат. В связи с этим, спейсер может содержать, например, NH2(CH2CH2O)n(CH2)mCOOH, где m представляет собой любое целое число от 1 до 6, и n представляет собой любое целое число от 2 до 12, такой как, например, 8-амино-3,6-диоксаоктановая кислота, которая коммерчески доступна от Peptides International, Inc. (Louisville, KY).
В некоторых вариантах осуществления спейсер между пептидом Q и алкильной группой представляет собой гидрофильный бифункциональный спейсер. В определенных вариантах осуществления гидрофильный бифункциональный спейсер содержит две или более реакционноспособные группы, например, амино, гидроксильную, тиольную и карбоксильную группу или любую их комбинацию. В определенных вариантах осуществления гидрофильный бифункциональный спейсер содержит гидроксильную группу и карбоксильную группу. В других вариантах осуществления гидрофильный бифункциональный спейсер содержит аминогруппу и карбоксильную группу. В других вариантах осуществления гидрофильный бифункциональный спейсер содержит тиольную группу и карбоксильную группу.
В некоторых вариантах осуществления спейсерная группа между пептидом Q и алкильной группой представляет собой гидрофобный бифункциональный спейсер. В определенных вариантах осуществления гидрофобный бифункциональный спейсер содержит две или более реакционноспособные группы, например, амино, гидроксильную, тиольную и карбоксильную группу или любую их комбинацию. В определенных вариантах осуществления гидрофобный бифункциональный спейсер содержит гидроксильную группу и карбоксильную группу. В других вариантах осуществления гидрофильный бифункциональный спейсер содержит аминогруппу и карбоксильную группу. В других вариантах осуществления гидрофильный бифункциональный спейсер содержит тиольную группу и карбоксильную группу. Подходящие гидрофобные бифункциональные спейсеры, содержащие карбоксильную группу и гидроксильную группу или тиольную группу, являются известными в данной области техники и включают, например, 8-гидроксиооктановую кислоту и 8-меркаптооктановую кислоту.
Спейсер (например, аминокислота, дипептид, трипептид, гидрофильный бифункциональный спейсер или гидрофобный бифункциональный спейсер) в конкретных вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, имеет длину 3-10 атомов (например, 6-10 атомов, (например, 6, 7, 8, 9 или 10 атомов)). В более конкретных вариантах осуществления спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, имеет длину приблизительно 3-10 атомов (например, 6-10 атомов), и алкил представляет собой C12-C18 алкильную группу, например, C14 алкильную группу, C16 алкильную группу, так что суммарная длина спейсера и алкильной группы составляет 14-28 атомов, например, приблизительно 14, 15, 16,17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 или 28 атомов. В некоторых вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, длина спейсера и алкила составляет 17-28 (например, 19-26, 19-21) атомов.
В соответствии с определенными вышеуказанными вариантами осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, бифункциональный спейсер может представлять собой синтетическую или не встречающуюся в природе аминокислоту, содержащую аминокислотный остов, который имеет длину 3-10 атомов (например, 6-аминогексановую кислоту, 5-аминовалерьяновую кислоту, 7-аминогептановую кислоту и 8-аминооктановую кислоту). Альтернативно, спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, может представлять собой дипептидный или трипептидный спейсер, содержащий пептидный остов, который имеет длину 3-10 атомов (например, 6-10 атомов). Дипептидный или трипептидный спейсер, присоединенный к родственному глюкагону пептиду класса 1, класса 2 или класса 3, может состоять из встречающихся в природе и/или не встречающихся в природе аминокислот, включая, например, любую из аминокислот, указанных в настоящем изобретении. В некоторых вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, спейсер имеет суммарный отрицательный заряд, например, содержит одну или две отрицательно заряженные аминокислоты. В некоторых вариантах осуществления, в которых Q представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, дипептидный спейсер выбран из группы, состоящей из: Ala-Ala, β-Ala-β-Ala, Leu-Leu, Pro-Pro, γ-аминомасляная кислота-γ-аминомасляной кислоты и γ-Glu-γ-Glu. В некоторых вариантах осуществления дипептидный спейсер не является γ-Glu-γ-Glu.
Подходящие способы алкилирования пептида по аминам, гидроксилам и тиолам являются известными в данной области техники. Например, эфирный способ Вильямсона можно применять для получения эфирной связи между родственным глюкагону пептидом и алкильной группой. Кроме того, реакция нуклеофильного замещения пептида алкилгалогенидом может приводить в результате к эфирной, тиоэфирной или амино связи.
Алкильная группа алкилированного пептида Q может быть любого размера, например, углеродной цепью любой длины, и может быть линейной или разветвленной. В некоторых вариантах осуществления настоящего изобретения, алкильная группа представляет собой C4-C30 алкил. Например, алкильная группа может представлять собой любую из C4 алкила, C6 алкила, C8 алкила, C10 алкила, C12 алкила, C14 алкила, C16 алкила, C18 алкила, C20 алкила, C22 алкила, C24 алкила, C26 алкила, C28 алкила или C30 алкила. В некоторых вариантах осуществления алкильная группа представляет собой C8-C20 алкил, например, C14 алкил или C16 алкил.
В некоторых конкретных вариантах осуществления алкильная группа содержит стероидный фрагмент желчной кислоты, например, холевой кислоты, хенодезоксихолевой кислоты, дезоксихолевой кислоты, литохолевой кислоты, таурохолевой кислоты, гликохолевой кислоты и холестериновой кислоты.
В некоторых вариантах осуществления настоящего изобретения пептид Q модифицируют так, чтобы он содержал алкильную группу реакцией нуклеофильного, длинноцепочечного алкана с Q, где Q содержит уходящую группу, подходящую для нуклеофильного замещения. В конкретных аспектах нуклеофильная группа длинноцепочечного алкана включает амино, гидроксильную или тиольную группу (например, октадециламин, тетрадеканол и гексадекантиол). Уходящая группа Q может быть частью боковой цепи аминокислоты или может быть частью пептидного остова. Подходящие уходящие группы включают, например, N-гидроксисукцинимид, галогены и сульфонатные эфиры.
В определенных вариантах осуществления пептид Q модифицируют так, чтобы он содержал алкильную группу реакцией нуклеофильного, длинноцепочечного алкана с спейсером, который присоединена к Q, где спейсер содержит уходящую группу. В конкретных аспектах длинноцепочечный алкан содержит амино, гидроксильную или тиольную группу. В определенных вариантах осуществления спейсер, содержащий уходящую группу, может представлять собой любой спейсер, описанный в настоящем изобретении, например, аминокислоты, дипептиды, трипептиды, гидрофильные бифункциональные спейсеры и гидрофобные бифункциональные спейсеры, дополнительно содержащие подходящую уходящую группу.
Что касается данных аспектов настоящего изобретения, в которых длинноцепочечный алкан алкилирован пептидом Q или спейсером, длинноцепочечный алкан может быть любого размера и может содержать углеродную цепь любой длины. Длинноцепочечный алкан может быть линейным или разветвленным. В определенных аспектах длинноцепочечный алкан представляет собой C4-C30 алкан. Например, длинноцепочечный алкан может представлять собой любой из C4 алкана, C6 алкана, C8 алкана, C10 алкана, C12 алкана, C14 алкана, C16 алкана, C18 алкана, C20 алкана, C22 алкана, C24 алкана, C26 алкана, C28 алкана или C30 алкана. В некоторых вариантах осуществления, в которых родственный глюкагону пептид представляет собой родственный глюкагону пептид класса 1, класса 2 или класса 3, длинноцепочечный алкан включает C8-C20 алкан, например, C14 алкан, C16 алкан или C18 алкан.
Кроме того, в некоторых вариантах осуществления алкилирование может осуществляться между Q и холестериновым остатком. Например, гидроксильную группу холестерина можно заместить уходящей группой в длинноцепочечном алкане, получая холестерин-глюкагоновый пептидный продукт.
Алкилированные пептиды (Q), описанные в настоящем изобретении, можно дополнительно модифицировать так, чтобы они содержали гидрофильную группу. В некоторых конкретных вариантах осуществления гидрофильная группа может содержать полиэтиленгликольную (PEG) цепь. Введение гидрофильной группы можно осуществлять любым подходящим способом, таким как любой из способов, описанных в настоящем изобретении. В некоторых вариантах осуществления, относящихся к родственным глюкагону пептидам класса 1, 2, 3, 4 или 5, алкилированный Q может содержать SEQ ID NO: 1601, или его модифицированную аминокислотную последовательность, содержащую одну или более из аминокислотных модификаций, описанных в настоящем изобретении, в которой по меньшей мере одна из аминокислот в положении 10, 20, 24 и 29 (согласно нумерации аминокислот глюкагона дикого типа) содержит алкильную группу, и по меньшей мере одна из аминокислот в положении 16, 17, 21, 24 и 29, в положении в C-концевом удлинении или C-концевая аминокислота модифицированы по Cys, Lys, Orn, гомо-Cys или Ac-Phe, и боковая цепь аминокислоты ковалентно связана с гидрофильной группой (например, PEG). В некоторых вариантах осуществления, относящихся к родственным глюкагону пептидам класса 1, 2, 3, 4 или 5, алкильную группу присоединяют в положении 10 (согласно нумерации аминокислот глюкагона дикого типа), необязательно через спейсер, содержащий Cys, Lys, Orn, гомо-Cys или Ac-Phe, и гидрофильную группу вводят по Cys остатку в положении 24.
Альтернативно, алкилированный пептид Q может содержать спейсер, где спейсер и алкилирован, и модифицирован так, чтобы он содержал гидрофильную группу. Неограничивающие примеры подходящих спейсеров включают спейсеры, содержащие одну или более из аминокислот, выбранных из группы, состоящей из Cys, Lys, Orn, гомо-Cys и Ac-Phe.
Стабилизация альфа-спиральной структуры
В некоторых вариантах осуществления внутримолекулярная мостиковая связь образуется между двумя боковыми цепями аминокислот, стабилизирующая трехмерную структуру карбокси концевой части (например, аминокислот 12-29 (согласно нумерации аминокислот глюкагона дикого типа)) родственного глюкагону пептида Q класса 1, 2, 3, 4 или 5. Две боковые цепи аминокислот могут быть соединены друг с другом водородными связями, ионными взаимодействиями, такими как образование солевых мостиков, или ковалентными связями.
В некоторых вариантах осуществления внутримолекулярная мостиковая связь образуется между двумя аминокислотами, которые находятся на расстоянии 3 аминокислот друг от друга, например, аминокислоты в положениях i и i+4, где i представляет собой любое целое между 12 и 25 (например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, и 25) согласно нумерации аминокислот глюкагона дикого типа. Более конкретно, боковые цепи аминокислотных пар 12 и 16, 16 и 20, 20 и 24 или 24 и 28 (аминокислотные пары, в которых i = 12, 16, 20 или 24) согласно нумерации аминокислот глюкагона дикого типа, соединены друг с другом и, таким образом, стабилизируют глюкагоновую альфа-спираль. Альтернативно, i может равняться 17.
В некоторых конкретных вариантах осуществления, где аминокислоты в положениях i и i+4 соединены внутримолекулярной мостиковой связью, размер связывающей группы составляет приблизительно 8 атомов или приблизительно 7-9 атомов.
В других вариантах осуществления внутримолекулярная мостиковая связь образуется между двумя аминокислотами, которые находятся на расстоянии двух аминокислот друг от друга, например, аминокислоты в положениях j и j+3, где j представляет собой любое целое между 12 и 26 (например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, и 26) согласно нумерации аминокислот глюкагона дикого типа. В некоторых конкретных вариантах осуществления j равно 17.
В некоторых конкретных вариантах осуществления, где аминокислоты в положениях j и j+3 соединены внутримолекулярной мостиковой связью, размер связывающей группы составляет приблизительно 6 атомов или приблизительно 5-7 атомов.
В еще других вариантах осуществления внутримолекулярная мостиковая связь образуется между двумя аминокислотами, которые находятся на расстоянии 6 аминокислот друг от друга, например, аминокислоты в положениях k и k+7, где k представляет собой любое целое между 12 и 22 (например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, и 22) согласно нумерации аминокислот глюкагона дикого типа. В некоторых конкретных вариантах осуществления k равно 12, 13 или 17. В примерном варианте осуществления k равно 17.
Примеры пар аминокислот, которые способны ковалентно связываться, образуя 6-атомный линкерный мостик, включают Orn и Asp, Glu и аминокислоту формулы I, где n равен 2, и гомоглютаминовую кислоту и аминокислоту формулы I, где n равен 1, где формула I представляет собой:

где n=1-4
[формула I]
Примеры пар аминокислот, которые способны ковалентно связываться, образуя 7-атомный линкерный мостик, включают Ora-Glu (лактамное кольцо); Lys-Asp (лактам); или гомо-ser-гомо-glu (лактон). Примеры пар аминокислот, которые могут образовывать 8-атомный линкер, включают Lys-Glu (лактам); гомо-Lys-Asp (лактам); Orn-гомо-glu (лактам); 4-амино-Phe-Asp (лактам); или Tyr-Asp (лактон). Примеры пар аминокислот, которые способны образовывать 9-атомный линкер, включают гомо-lys-Glu (лактам); Lys-гомо-glu (лактам); 4-амино-Phe-Glu (лактам); или Tyr-Glu (лактон). Любую из боковых цепей в данных аминокислотах можно дополнительно заместить дополнительными химическими группами, при условии, что трехмерная структура альфа-спирали не нарушается. Специалист в данной области может представить себе альтернативные пары или альтернативные аминокислотные аналоги, включая химически модифицированные производные, которые будут образовывать стабилизирующую структуру аналогичного размера и требуемого эффекта. Например, гомоцистеин-гомоцистеин дисульфидный мостик имеет длину 6 атомов и может быть дополнительно модифицирован для обеспечения требуемого эффекта. Даже без ковалентного связывания, пары аминокислот, описанные выше, или аналогичные пары, которые специалист в данной области техники может представить себе, могут также придавать дополнительную стабильность альфа-спирали за счет нековалентных связей, например, за счет образования солевых мостиков или водородных связей.
Размер лактамного кольца может изменяться в зависимости от длины боковых цепей аминокислот, и в некоторых вариантах осуществления лактам образуется соединением боковых цепей аминокислоты, являющейся лизином, с боковой цепью глютаминовой кислоты. Дополнительные варианты осуществления (согласно нумерации аминокислот глюкагона дикого типа) включают следующие пары, необязательно с лактамной мостиковой связью: Glu в положении 12 с Lys в положении 16; нативный Lys в положении 12 с Glu в положении 16; Glu в положении 16 с Lys в положении 20; Lys в положении 16 с Glu в положении 20; Glu в положении 20 с Lys в положении 24; Lys в положении 20 с Glu в положении 24; Glu в положении 24 с Lys в положении 28; Lys в положении 24 с Glu в положении 28. Альтернативно, порядок амидной связи в лактамном кольце может быть обращен (например, лактамное кольцо может образовываться между боковыми цепями Lys12 и Glu16 или альтернативно между Glu12 и Lys16).
Внутримолекулярные мостиковые связи, отличные от лактамной мостиковой связи, можно применять для стабилизации альфа-спирали Q. В некоторых вариантах осуществления внутримолекулярная мостиковая связь представляет собой гидрофобную мостиковую связь. В данном случае, внутримолекулярная мостиковая связь необязательно образуется между боковыми цепями двух аминокислот, которые являются частью гидрофобной части альфа-спирали Q. Например, одна из аминокислот, присоединенная гидрофобной мостиковой связью, может представлять собой аминокислоту в положении 10, 14 и 18 (согласно нумерации аминокислот глюкагона дикого типа).
В одном конкретном аспекте метатезис олефинов применяют для поперечной сшивки одного или двух витков альфа-спирали Q, применяя полностью углеводородную систему для получения поперечной сшивки. Q в данном случае может содержать α-метилированные аминокислоты, содержащие олефиновые боковые цепи различной длины и с или R-, или S-стереохимией в i и i+4 или i+7 положениях. Например, олефиновая боковая цепь может содержать (CH2)n, где n представляет собой любое целое между 1-6. В некоторых вариантах осуществления n равен 3 для длины поперечной сшивки 8 атомов. Подходящие способы образования данных внутримолекулярных мостиковых связей описаны в данной области техники. См., например, Schafmeister et al., J. Am. Chem. Soc. 122: 5891-5892 (2000) и Walensky et al., Science 305: 1466-1470 (2004). Альтернативно, Q может содержать O-аллил Ser остатки, расположенные в соседних спиральных витках, которые образуют мостиковые связи метатезисом с закрытием цикла, катализируемым рутением. Данные способы получения поперечных сшивок описывают, например, в Blackwell et al., Angew, Chem., Int. Ed. 37: 3281-3284 (1998).
В другом конкретном варианте осуществления, неприродную тиодиаланиновую аминокислоту, лантионин, который широко применяется в качестве пептидомиметика цистеина, применяют для получения поперечной сшивки одного витка альфа-спирали. Подходящие способы циклизации на основе лантионина являются известными в данной области техники. См., например, Matteucci et al., Tetrahedron Letters 45: 1399-1401 (2004); Mayer et al., J. Peptide Res. 51: 432-436 (1998); Polinsky et al., J. Med. Chem. 35: 4185-4194 (1992); Osapay et al., J. Med. Chem. 40: 2241-2251 (1997); Fukase et al., Bull. Chem. Soc. Jpn. 65: 2227-2240 (1992); Harpp et al., J. Org. Chem. 36: 73-80 (1971); Goodman and Shao, PureAppl. Chem. 68: 1303-1308 (1996); и Osapay and Goodman, J. Chem. Soc. Chem. Commun. 1599-1600 (1993).
В некоторых вариантах осуществления α,ω-диаминоалкановые линкеры, например, 1,4-диаминопропан и 1,5-диаминопентан, между двумя Glu остатками в положениях i и i+7, применяют для стабилизации альфа-спирали Q. Данные линкеры приводят к образованию мостиковой связи из 9 атомов или более в длину, в зависимости от длины диаминоалканового линкера. Подходящие способы получения пептидов, поперечно сшитых с данными линкерами, описаны в данной области техники. См., например, Phelan et al., J. Am. Chem. Soc. 119: 455-460 (1997).
В еще другом варианте осуществления настоящего изобретения, дисульфидную мостиковую связь применяют для получения поперечной сшивки одного или двух витков альфа-спирали Q. Альтернативно, модифицированную дисульфидную мостиковую связь, в которой один или оба атома серы замещены метиленовой группой, приводя в результате к изостерической макроциклизации, применяют для стабилизации альфа-спирали Q. Подходящие способы модификации пептидов дисульфидными мостиковыми связями или циклизации на основе серы описаны, например, в Jackson et al., J. Am. Chem. Soc. 113: 9391-9392 (1991) и Rudinger and Jost, Experientia 20: 570-571 (1964).
В еще другом варианте осуществления альфа-спираль Q стабилизируют связыванием атома металла двумя His остатками или His и Cys парой, расположенными в i и i+4. Атом металла может представлять собой, например, Ru(III), Cu(II), Zn(II) или Cd(II). Данные способы стабилизации альфа-спирали на основе связывания металла являются известными в данной области техники. См., например, Andrews and Tabor, Tetrahedron 55: 11711-11743 (1999); Ghadiri et al., J. Am. Chem. Soc. 112: 1630-1632 (1990); и Ghadiri et al., J. Am. Chem. Soc. 119: 9063-9064 (1997).
Альфа-спираль Q можно альтернативно стабилизировать посредством циклизации, где способы рассматриваются в Davies, J. Peptide. Sci. 9: 471-501 (2003). Альфа-спираль можно стабилизировать образованием амидной мостиковой связи, тиоэфирной мостиковой связи, сложной тиоэфирной мостиковой связи, карбамидной мостиковой связи, карбаматной мостиковой связи, сульфонамидной мостиковой связи и подобных. Например, сложную тиоэфирную мостиковую связь можно образовать между C-концом и боковой цепью Cys остатка. Альтернативно, сложный тиоэфир можно образовывать между боковыми цепями аминокислот, содержащих тиол (Cys) и карбоновую кислоту (например, Asp, Glu). В другом способе, агент для получения поперечной сшивки, такой как дикарбоновая кислота, например, субериновая кислота (октиндиовая кислота) и т.д., может вводить связь между двумя функциональными группами боковой цепи аминокислоты, такими как свободная амино, гидроксильная, тиольная группа и их комбинации.
В соответствии с некоторыми вариантами осуществления, альфа-спираль Q стабилизируют введением гидрофобных аминокислот в положениях i и i+4. Например, i может представлять собой Tyr, и i+4 может представлять собой или Val или Leu; i может представлять собой Phe, и i+4 может представлять собой Cys или Met; i может представлять собой Cys, и i+4 может представлять собой Met; или i может представлять собой Phe, и i+4 может представлять собой Ile. Должно быть ясно, что, для целей настоящего изобретения, вышеприведенные пары аминокислот можно обратить, так что указанная аминокислота в положении i может альтернативно располагаться в i+4, тогда как i+4 аминокислота может располагаться в i положении.
В соответствии с другими вариантами осуществления настоящего изобретения, где Q представляет собой родственный глюкагону пептид, альфа-спираль стабилизируют введением (или аминокислотной заменой или вставкой) одной или более стабилизирующих альфа-спираль аминокислот в C-концевой части Q (в районе аминокислот 12-29 согласно нумерации аминокислот глюкагона дикого типа). В конкретном варианте осуществления стабилизирующая альфа-спираль аминокислота представляет собой α,α-дизамещенную аминокислоту, включая, но не ограничиваясь этим, любую из аминоизомасляной кислоты (Aib), аминокислоты, дизамещенной одинаковыми или различными группами, выбранными из метила, этила, пропила и н-бутила, или циклооктаном или циклогептаном (например, 1-аминоциклооктан-1-карбоновая кислота). В некоторых вариантах осуществления одно, два, три, четыре или более положений 16, 17, 18, 19, 20, 21, 24 или 29 родственного глюкагону пептида заменены α,α-дизамещенной аминокислотой. В конкретном варианте осуществления одно, два, три или все положения 16, 20, 21 и 24 заменены Aib.
Конъюгаты
В некоторых вариантах осуществления пептиды (Q), описанные в настоящем изобретении, гликозилированы, амидированы, карбоксилированы, фосфорилированы, этерифицированы, N-ацилированы, циклизованы, например, дисульфидной мостиковой связью, или превращены в соль (например, соль присоединения кислоты, соль присоединения основания), и/или необязательно димеризованы, мультимеризованы или полимеризованы, или конъюгированы. Как описано в настоящем изобретении, Q может представлять собой пептид глюкагонового суперсемейства, родственный глюкагону пептид, включая родственный глюкагону пептид класса 1, 2, 3, 4 или 5, или остеокальцин, кальцитонин, амилин, или их аналог, производное или конъюгат.
Настоящее описание также включает конъюгаты, в которых Q Q-L-Y дополнительно соединен с гетерологической молекулой. Конъюгирование между Q и гетерологической молекулой может осуществляться через ковалентое связывание, нековалентное связывание (например, электростатические взаимодействия, водородные связи, ван-дер-ваальсовы взаимодействия, солевые мостики, гидрофобные взаимодействия и подобные), или обоими типами связывания. Можно применять ряд систем для нековалентного связывания, включая биотин-авидин, лиганд/рецептор, фермент/субстрат, нуклеиновая кислота/нуклеиновая кислота связывающий белок, липид/липид связывающий белок, молекулярные партнеры клеточной адгезии; или любые связывающие партнеры или их фрагменты, которые обладают сродством друг к другу. В некоторых аспектах ковалентные связи являются пептидными связями. Конъюгирование Q с гетерологической молекулой может быть опосредованным или прямым конъюгированием, первое из которых может включать линкер или спейсер. Подходящие линкеры и спейсеры являются известными в данной области техники и включают, но не ограничиваясь этим, любые линкеры или спейсеры, описанные в настоящем изобретении, в параграфах "Ацилирование и алкилирование" и "Связывающая группа" и в подпараграфе "Химическая модификация Q и/или L".
Как применяют в настоящем изобретении, термин "гетерологическая молекула" является синонимом термина "конъюгатная молекула" и относится к любой молекуле (химической или биохимической, встречающейся в природе или некодируемой), которая является отличной от Q, к которому ее присоединяют. Примеры конъюгатных молекул, которые можно соединенять с Q, включают, но не ограничиваясь этим, гетерологичный пептид или полипептид (включая например, белок плазмы), агент для направленной доставки, иммуноглобулин или его часть (например, вариабельную область, CDR или Fc-область), диагностическую метку, такую как радиоизотоп, флуорофор или ферментативную метку, полимер, включая растворимые в воде полимеры, или другие терапевтические или диагностические агенты. В некоторых вариантах осуществления обеспечивают конъюгат, содержащий Q и белок плазмы, где белок плазмы выбран из группы, состоящей из альбумина, трансферина, фибриногена и глобулинов. В некоторых вариантах осуществления белком плазмы конъюгата является альбумин или трансферина. Конъюгат в некоторых вариантах осуществления содержит Q и один или более полипептидов, молекул нуклеиновых кислоты, антител или их фрагментом, полимеров, квантовых точек, небольших молекул, токсинов, диагностических агентов, углеводов, аминокислот.
C-концевая гетерологическая молекула
В некоторых вариантах осуществления гетерологическая молекула, конъюгированная с Q, представляет собой пептид, который является отличным от Q, и конъюгат представляет собой слитый пептид или химерный пептид. В некоторых вариантах осуществления, где Q представляет собой пептид глюкагонового суперсемейства, гетерологическая молекула представляет собой пептидный компонент из 1-21 аминокислот. В конкретных вариантах осуществления, когда Q представляет собой родственный глюкагону пептид (например, родственный глюкагону пептид класса 1, 2, 3, 4 или 5), данный компонент присоединяют к C-концу Q, например, к аминокислоте в положении 29. В некоторых вариантах осуществления компонент имеет аминокислотную последовательность SEQ ID NO: 1610 (GPSSGAPPPS), SEQ ID NO: 1611 (GGPSSGAPPPS-CONH2), SEQ ID NO: 1614 (KRNRNNIA), SEQ ID NO: 1643 (KRNR) или KGKKNDWKHNITQ (SEQ ID NO: 1613). В конкретных аспектах аминокислотную последовательность присоединяют через C-концевую аминокислоту Q, например, аминокислоту в положении 29. В некоторых вариантах осуществления аминокислотную последовательность SEQ ID NO: 1610, 1611, 1613, 1614 и 1643 соединяют с аминокислотой 29 пептида через пептидную связь. В некоторых конкретных вариантах осуществления аминокислота в положении 29 родственного глюкагону пептида (например, родственного глюкагону пептида класса 1, 2, 3, 4 или 5) представляет собой Gly, и Gly конденсирует с одной из аминокислотных последовательностей SEQ ID NO: 1610, 1611, 1613, 1614 и 1643.
Полимерная гетерологическая молекула
В некоторых вариантах осуществления гетерологическая молекула, конъюгированная с Q, представляет собой полимер. В некоторых вариантах осуществления полимер выбран из группы, состоящей из: полиамидов, поликарбонатов, полиалкиленов и их производных, включая, полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, полимеров акрилового и метакрилового эфиров, включая поли(метилметакрилат), поли(этилметакрилат), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат), поливиниловых полимеров, включая поливиниловые спирты, поливиниловые эфиры, поливиниловые сложные эфиры, поливинилгалогениды, поли(винилацетат) и поливинилпирролидона, полигликолидов, полисилоксанов, полиуретанов и их сополимеров, целлюлозы, включая алкилцеллюлозу, гидроксиалкилцеллюлозы, целлюлозные эфиры, целлюлозные сложные эфиры, нитроцеллюлозы, метилцеллюлозы, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксибутилметилцеллюлозу, ацетат целлюлозы, пропионат целлюлозы, ацетат бутират целлюлозы, ацетат фталат целлюлозы, карбоксилэтилцеллюлозу, триацетат целлюлозы и соль сульфата натрия и целлюлозы, полипропилена, полиэтиленов, включая поли(этиленгликоль), поли(этиленоксид) и поли(этилентерефталат), и полистирола.
В некоторых аспектах полимер представляет собой биоразлагаемый полимер, включая синтетический биоразлагаемый полимер (например, полимеры молочной кислоты и гликолевой кислоты, полиангидриды, поли(орто)эфиры, полиуретаны, поли(масляную кислоту), поли(валерьяновую кислоту) и поли(лактид-сокапролактон)), и природный биоразлагаемый полимер (например, альгинат и другие полисахариды, включая декстран и целлюлозу, коллаген, их химические производные (замещения, введения химических групп, например, алкила, алкилена, гидроксилирование, окисление и другие модификации, стандартно осуществляемые специалистом в данной области техники), альбумин и другие гидрофильный белки (например, зеин и другие проламины и гидрофобные белки)), а также любой их сополимер или смесь. В общем, данные вещества разрушаются или ферментативным гидролизом или при воздействии воды in vivo, поверхностной или объемной эрозией.
В некоторых аспектах полимер представляет собой биоадгезивный полимер, такой как биоразрушаемый гидрогель, описанный H. S. Sawhney, C. P. Pathak and J. A. Hubbell в Macromolecules, 1993, 26, 581-587, идеи которой включены в настоящее изобретение, полигиалуроновые кислоты, казеин, желатин, глютин, полиангидриды, полиакриловую кислоту, альгинат, хитозан, поли(метилметакрилаты), поли(этилметакрилаты), поли(бутилметакрилаты), поли(изобутилметакрилаты), поли(гексилметакрилаты), поли(изодецилметакрилаты), поли(лаурилметакрилаты), поли(фенилметакрилаты), поли(метилакрилаты), поли(изопропилакрилаты), поли(изобутилакрилаты) и поли(октадецилакрилаты).
В некоторых вариантах осуществления полимер представляет собой растворимый в воде полимер или гидрофильный полимер. Гидрофильные полимеры дополнительно описаны в настоящем изобретении в "гидрофильных гетерологичных молекулах". Подходящие растворимые в воде полимеры являются известными в данной области техники и включают, например, поливинилпирролидон, гидроксипропилцеллюлозу (HPC; Klucel), гидроксипропилметилцеллюлозу (HPMC; Methocel), нитроцеллюлозу, гидроксипропилэтилцеллюлозу, гидроксипропилбутилцеллюлозу, гидроксипропилпентилцеллюлозу, метилцеллюлозу, этилцеллюлозу (Ethocel), гидроксиэтилцеллюлозу, различные алкилцеллюлозы и гидроксиалкилцеллюлозы, различные эфиры целлюлозы, ацетат целлюлозы, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, сополимеры винилацетат/кротоновая кислота, полигидроксиалкилметакрилат, гидроксиметилметакрилат, сополимеры метакриловой кислоты, полиметакриловую кислоту, полиметилметакрилат, сополимеры малеиновый ангидрид/метилвиниловый эфир, поливиниловый спирт, полиакрилат натрия и кальция, полиакриловую кислоту, кислые карбоксиполимеры, карбоксиполиметилен, карбоксивиниловые полимеры, полиоксиэтиленполиоксипропиленовый сополимер, сополимер полиметилвинилового эфира с малеиновым ангидридом, карбоксиметиламид, сополимер метакрилата калия и дивинилбензола, полиоксиэтиленгликоли, полиэтиленоксид и их производные, соли и комбинации.
В конкретных вариантах осуществления полимер представляет собой полиалкиленгликоль, включая, например, полиэтиленгликоль (PEG).
В некоторых вариантах осуществления гетерологическая молекула представляет собой углевод. В некоторых вариантах осуществления углевод представляет собой моносахарид (например, глюкозу, галактозу, фруктозу), дисахарид (например, сахарозу, лактозу, мальтозу), олигосахарид (например, рафинозу, стахиозу), полисахарид (крахмал, амилозу, амилопектин, целлюлозу, хитин, каллозу, ламинарин, ксилан, маннан, фукоидан, галактоманнан.
В некоторых вариантах осуществления гетерологическая молекула представляет собой липид. Липид, в некоторых вариантах осуществления, представляет собой жирную кислоту, эйкозаноид, простагландин, лейкотриен, тромбоксан, N-ацилэтаноламин, глицеролипид (например, моно-, ди-, три-замещенные глицерины), глицерофосфолипид (например, фосфатидилхолин, фосфатидилинозитол, фосфатидилэтаноламин, фосфатидилсерин), сфинголипид (например, сфингозин, церамид), стероидный липид (например, стероид, холестерин), фенольный липид, сахаролипид или поликетид, масло, воск, холестерин, стерол, жирорастворимый витамин, моноглицерид, диглицерид, триглицерид, фосфолипид.
Fc конденсированная гетерологическая молекула
Как отмечалось выше, в некоторых вариантах осуществления Q конъюгирован, например, конденсирован с иммуноглобулином или его частью (например, вариабельным участком, CDR или Fc-фрагментов). Как описано в настоящем изобретении, Q может представлять собой пептид глюкагонового суперсемейства, родственный глюкагону пептид, включая родственный глюкагону пептид класса 1, 2, 3, 4 или 5, или остеокальцин, кальцитонин, амилин, или их аналог, производное или конъюгат. Известные типы иммуноглобулинов (Ig) включают IgG, IgA, IgE, IgD или IgM. Fc-фрагмент представляет собой C-концевую область тяжелой цепи Ig, которая отвечает за связывание с Fc-рецепторами, которые осуществляют действия, такие как рециклинг (который приводит в результате к продленному времени полужизни), антителозависимая клеточноопосредованная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC).
Например, согласно некоторым определениям Fc-фрагмент тяжелой цепи человеческого IgG располагается от Cys226 до C-конца тяжелой цепи. "Шарнирная область" обычно располагается от Glu216 до Pro230 человеческого IgG1 (шарнирные области других IgG изотипов можно выравнить с IgG1 последовательностью выравниванием цистеинов, участвующих в цистеиновом связывании). Fc-фрагмент IgG содержит два константных домена, CH2 и CH3. CH2 домен Fc-фрагмента человеческого IgG обычно располагается от аминокислоты 231 до аминокислоты 341. CH3 домен Fc-фрагмента человеческого IgG обычно располагается от аминокислоты 342 до 447. Все ссылки на нумерацию аминокислот иммуноглобулинов или иммуноглобулиновых фрагментов, или областей, основаны на Kabat et al. 1991, Sequences of Proteins of Immunological Interest, U.S. Department of Public Health, Bethesda, Md. В родственном варианте осуществления, Fc-фрагмент может содержать один или более нативных или модифицированных константных регионов из иммуноглобулиновой тяжелой цепи, отличных от CH1, например, CH2 и CH3 регионы IgG и IgA, или CH3 и CH4 регионы IgE.
Подходящие конъюгатные молекулы включают части иммуноглобулиновой последовательности, которая содержит FcRn сайт связывания. FcRn, рецептор спасения, является ответственным за рециркуляцию иммуноглобулинов и возвращение их для циркуляции в крови. Область Fc-фрагмента IgG, которая связывается с FcRn рецептором, описана на основе рентгеновской кристаллографии (Burmeister et al. 1994, Nature 372:379). Основная зона контакта Fc с FcRn находится вблизи соединения CH2 и CH3 доменов. Все Fc-FcRn контакты осуществляются в одной Ig тяжелой цепи. Основные зоны контакта включают аминокислотные остатки 248, 250-257, 272, 285, 288, 290-291, 308-311 и 314 CH2 домена и аминокислотные остатки 385-387, 428 и 433-436 CH3 домена.
Некоторые конъюгатные молекулы могут содержать или не содержать FcγR сайт связывания (сайты связывания). FcγR является ответственным за ADCC и CDC. Примерами положений в Fc-фрагменте, которые осуществляют прямой контакт с FcγR, являются аминокислоты 234-239 (нижняя шарнирная область), аминокислоты 265-269 (B/C петля), аминокислоты 297-299 (C'/E петля) и аминокислоты 327-332 (F/G петля) (Sondermann et al., Nature 406: 267-273, 2000). Нижняя шарнирная область IgE также вовлечена в FcRI связывание (Henry, et al., Biochemistry 36, 15568-15578, 1997). Остатки, участвующие в IgA рецепторном связывании, описаны в Lewis et al., (J Immunol. 175:6694-701, 2005). Аминокислотные остатки, участвующие в IgE рецепторном связывании, описаны в Sayers et al. (J Biol Chem. 279(34):35320-5, 2004).
Аминокислотные модификации можно осуществлять в Fc-фрагменте иммуноглобулина. Данные альтернативные Fc-фрагменты содержат по меньшей мере одну аминокислотную модификацию в CH3 домене Fc-фрагмента (остатки 342-447) и/или по меньшей мере одну аминокислотную модификацию в CH2 домене Fc-фрагмента (остатки 231-341). Мутации, которые, как считают, придают повышенное сродство к FcRn, включают T256A, T307A, E380A и N434A (Shields et al. 2001, J. Biol. Chem. 276:6591). Другие мутации могут ослаблять связывание Fc-фрагмента с FcγRI, FcγRIIA, FcγRIIB и/или FcγRIIIA без значительного снижения сродства к FcRn. Например, замена Asn в положении 297 Fc-фрагмента Ala или другой аминокислотой устраняет высококонсервативный сайт N-гликозилирования и может приводить в результате к пониженной иммуногенности с сопутствующим продленным временем полужизни Fc-фрагмента, а также ослабленному связыванию с FcγR (Routledge et al. 1995, Transplantation 60:847; Friend et al. 1999, Transplantation 68:1632; Shields et al. 1995, J. Biol. Chem. 276:6591). Были введены аминокислотные модификации в положениях 233-236 IgG1, которые ослабляют связывание с FcγR (Ward and Ghetie 1995, Therapeutic Immunology 2:77 и Armour et al. 1999, Eur. J. Immunol. 29:2613). Некоторые примерные аминокислотные замены описывают в патентах США 7355008 и 7381408, каждый из которых включен с помощью ссылки в настоящем изобретении во всей своей полноте.
Гидрофильная гетерологическая молекула
В некоторых вариантах осуществления Q, описанный в настоящем изобретении, ковалентно связан с гидрофильной группой. Как описано в настоящем изобретении, Q может представлять собой пептид глюкагонового суперсемейства, родственный глюкагону пептид, включая родственный глюкагону пептид класса 1, 2, 3, 4 или 5, или остеокальцин, кальцитонин, амилин, или их аналог, производное или конъюгат. Гидрофильные молекулы можно соединять с Q в любых подходящих условиях, применяемых для реакции белка с активированной полимерной молекулой. Можно применять любые способы, известные в данной области техники, включая ацилирование, восстановительное алкилирование, реакцию Михаэля, алкилирование тиола или другие способы хемоселективного конъюгирования/сшивания реакционноспособной группы PEG молекулы (например, альдегидной, амино, сложноэфирной, тиольной, α-галогенацетильной, малеимидной или гидразино группы) с реакционноспособной группой в целевом соединении (например, альдегидной, амино, сложноэфирной, тиольной, α-галогенацетильной, малеимидной или гидразино группой). Активирующие группы, которые можно применять для соединения растворимого в воде полимера с одним или более белками, включают, без ограничения, сульфон, малеимид, сульфгидрил, тиол, трифлат, трезилат, азиридин, оксиран, 5-пиридил и альфа-галогенированную ацильную группу (например, альфа-йодуксусную кислоту, альфа-бромуксусную кислоту, альфа-хлоруксусную кислоту). При соединении с пептидом восстановительным алкилированием выбранный полимер должен содержать один реакционноспособный альдегид так, чтобы контролировать степень полимеризации. См., например, Kinstler et al., Adv. Drug. Delivery Rev. 54: 477-485 (2002); Roberts et al., Adv. Drug Delivery Rev. 54: 459-476 (2002); и Zalipsky et al., Adv. Drug Delivery Rev. 16: 157-182 (1995).
Дополнительные активирующие группы, которые можно применять для соединения гидрофильной молекулы (растворимого в воде полимера) с белком, включают альфа-галогенированную ацильную группу (например, альфа-йодуксусную кислоту, альфа-бромуксусную кислоту, альфа-хлоруксусную кислоту). В конкретных аспектах аминокислотный остаток пептида, содержащий тиол, модифицируют гидрофильной группой, такой как PEG. В некоторых вариантах осуществления аминокислоту в Q, содержащую тиол, модифицируют малеимид-активированным PEG в реакции Михаэля, получая в результате пегилированный пептид, содержащий тиоэфирную связь, показанный ниже:

В некоторых вариантах осуществления тиол аминокислоты Q модифицируют галогенацетил-активированным PEG реакцией нуклеофильного замещения, получая в результате пегилированный пептид, содержащий тиоэфирную связь, показанный ниже:
Подходящие гидрофильные молекулы включают полиэтиленгликоль (PEG), полипропиленгликоль, полиоксиэтилированные полиолы (например, POG), полиоксиэтилированный сорбитол, полиоксиэтилированную глюкозу, полиоксиэтилированный глицерин (POG), полиоксиалкилены, полиэтиленгликольпропиоальдегид, сополимеры этиленгликоль/пропиленгликоль, монометоксиполиэтиленгликоль, моно(C1-C10)алкокси- или арилоксиполиэтиленгликоль, карбоксиметилцеллюлозу, полиацетали, поливиниловый спирт (PVA), поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, поли(бета-аминокислоты) (и гомополимеры или статистические сополимеры), поли(н-винилпирролидон)полиэтиленгликоль, пропиленгликольные гомополимеры (PPG) и другие полиалкиленовые оксиды, сополимеры полипропиленоксид/этиленоксид, кислоты, производимые бактериями толстого кишечника, или другие полисахаридные полимеры, фиколл или декстран и их смеси. Декстраны являются полисахаридными полимерами глюкозных субъединиц, преимущественно соединенных α1-6 связями. Декстран является доступным во многих диапазонах молекулярных весов, например, от приблизительно 1 кДа до приблизительно 100 кДа, или от приблизительно 5, 10, 15 или 20 кДа до приблизительно 20, 30, 40, 50, 60, 70, 80 или 90 кДа.
Гидрофильная группа, например, полиэтиленгликольная цепь, в соответствии с некоторыми вариантами осуществления, имеет молекулярный вес, выбранный из диапазона от приблизительно 500 до приблизительно 40000 Дальтон. В некоторых вариантах осуществления полиэтиленгликольная цепь имеет молекулярный вес, выбранный из диапазона от приблизительно 500 до приблизительно 5000 Дальтон или от приблизительно 1000 до приблизительно 5000 Дальтон. В другом варианте осуществления гидрофильная группа, например, полиэтиленгликольная цепь, имеет молекулярный вес от приблизительно 10000 до приблизительно 20000 Дальтон. В еще других вариантах осуществления гидрофильная группа, например, полиэтиленгликольная цепь, имеет молекулярный вес приблизительно от 20000 до приблизительно 40000 Дальтон.
Линейные или разветвленные гидрофильные полимеры являются предусмотренными. Полученные в результате препараты конъюгатов могут быть преимущественно монодисперсными или полидисперсными и могут иметь приблизительно 0,5, 0,7, 1, 1,2, 1,5 или 2 полимерных молекул на пептид.
В некоторых вариантах осуществления нативная аминокислота пептида заменена аминокислотой, содержащей боковую цепь, подходящую для получения поперечной сшивки с гидрофильными молекулами, для облегчения соединения гидрофильной группы с пептидом. Примерные аминокислоты включают Cys, Lys, Orn, гомо-Cys или ацетилфенилаланин (Ac-Phe). В других вариантах осуществления аминокислоту, модифицированную так, чтобы она содержала гидрофильную группу, присоединяют к пептиду на C-конце.
В некоторых вариантах осуществления пептид конъюгата конъюгирован с гидрофильной группой, например, PEG, ковалентной связью между аминогруппой в боковой цепи аминокислоты пептида и гидрофильной группой. В некоторых вариантах осуществления, когда Q представляет собой родственный глюкагону пептид класса 1, 2, 3, 4 или 5, пептид конъюгирован с гидрофильной группой через боковую цепь аминокислоты в положении 16, 17, 21, 24, 29, 40, в положении в C-концевом удлинении или C-концевую аминокислоту, или комбинацию данных положений. В некоторых аспектах аминокислота, ковалентно связанная с гидрофильной группой (например, аминокислота, содержащая гидрофильную группу), представляет собой Cys, Lys, Orn, гомо-Cys или Ac-Phe, и боковая цепь аминокислоты ковалентно связана с гидрофильной группой (например, PEG).
rPEG гетерологическая молекула
В некоторых вариантах осуществления конъюгат настоящего изобретения содержит Q, конденсированный со вспомогательным пептидом, который способен образовывать вытянутую конформацию, аналогичную химическому PEG (например, молекула рекомбинантного PEG (rPEG)), таким как вспомогательные пептиды, описанные в опубликованной международной заявке на патент WO2009/023270 и опубликованной заявке на патент США US2008/0286808. rPEG молекула не является полиэтиленгликолем. rPEG молекула в некоторых аспектах представляет собой полипептид, содержащий одну или более из глицина, серина, глютаминовой кислоты, аспарагиновой кислоты, аланина или пролина. В некоторых аспектах rPEG представляет собой гомополимер, например, полиглицин, полисерин, полиглютаминовую кислоту, полиаспарагиновую кислоту, полиаланин или полипролин. В других вариантах осуществления rPEG содержит два типа повторяющихся аминокислот, например, поли(Gly-Ser), поли(Gly-Glu), поли(Gly-Ala), поли(Gly-Asp), поли(Gly-Pro), поли(Ser-Glu) и т.д. В некоторых аспектах rPEG содержит три различных типа аминокислот, например, поли(Gly-Ser-Glu). В конкретных аспектах rPEG увеличивает время полужизни Q. В некоторых аспектах rPEG содержит суммарный положительный или суммарный отрицательный заряд. rPEG в некоторых аспектах не имеет вторичной структуры. В некоторых вариантах осуществления rPEG имеет длину, более чем или равную 10 аминокислотам, и в некоторых вариантах осуществления имеет длину от приблизительно 40 до приблизительно 50 аминокислот. Вспомогательный пептид в некоторых аспектах конденсирован с N- или C-концом пептида настоящего изобретения через пептидную связь или сайт расщепления протеиназой или включен в петли пептида настоящего изобретения. rPEG в некоторых аспектах содержит афинную метку или соединен с PEG, который имеет молекулярную массу, большую, чем 5 кДа. В некоторых вариантах осуществления rPEG придает конъюгату настоящего изобретения повышенный гидродинамический радиус, время полужизни в сыворотке, устойчивость к действию протеаз или растворимость и в некоторых аспектах придает конъюгату сниженную иммуногенность.
Q может быть соединен с конъюгатными молекулами прямой ковалетной связью реакцией целевых аминокислотных остатков пептида с органическим модифицирующим агентом, который способен реагировать с выбранными боковыми цепями или N- или C-концевыми остатками данных целевых аминокислот. Реакционноспособные группы в пептиде или конъюгатной молекуле включают, например, альдегидную, амино, сложноэфирную, тиольную, α-галогенацетильную, малеимидо или гидразино группу. Модифицирующие агенты включают, например, малеимидобензоилсульфосукцинимидный эфир (конъюгирование через остатки цистеина), N-гидроксисукцинимид (через остатки лизина), глутаральдегид, янтарный ангидрид или другие реагенты, известные в данной области техники. Альтернативно, конъюгатные молекулы могут быть соединены с пептидом опосредованно через промежуточный носитель, такой как полисахаридные или полипептидные носители. Примеры полисахаридных носителей включают аминодекстран. Примеры подходящих полипептидных носителей включают полилизин, полиглютаминовую кислоту, полиаспарагиновую кислоту, их сополимеры, и смешанные полимеры данных аминокислот и других, например, серинов, для придания требуемых свойств растворимости полученному в результате загруженному носителю.
Мультимеры
Что касается родственных глюкагону пептидов класса 1, класса 2 и класса 3, Q может быть частью димера, тримера или мультимера большего порядка, содержащего по меньшей мере два, три или более пептидов, соединенных линкером, где по меньшей мере один или оба пептида представляют собой родственный глюкагону пептид. Димер может представлять собой гомодимер или гетеродимер. В некоторых вариантах осуществления линкер выбран из группы, состоящей из бифункционального тиольного линкера для образования поперечной сшивки и бифункционального аминового линкера для образования поперечной сшивки. В определенных вариантах осуществления линкер представляет собой PEG, например, 5 кДа PEG, 20 кДа PEG. В некоторых вариантах осуществления линкер представляет собой дисульфидную связь. Например, каждый мономер димера может содержать Cys остаток (например, концевой или находящийся внутри последовательности Cys), и атом серы каждого Cys остатка принимает участие в образовании дисульфидной связи. В некоторых аспектах настоящего изобретения мономеры соединены через концевые аминокислоты (например, N-конец или C-конец), аминокислоты внутри последовательностей, или концевую аминокислоту по меньшей мере одного мономера и аминокислоту внутри последовательности по меньшей мере одного другого мономера. В конкретных аспектах мономеры не соединены через N-концевую аминокислоту. В некоторых аспектах мономеры мультимера соединены вместе в ориентации "хвост к хвосту", в которой C-концевые аминокислоты каждого мономера соединены вместе. Конъюгатная молекула может быть ковалентно связана с любым родственным глюкагону пептидом, описанным в настоящем изобретении, включая димер, тример или мультимер более высокого порядка.
Конъюгирование гетерологической молекулы с Q
Гетерологическая молекула конъюгирована с пептидом (Q) согласно способам образования связи и конъюгирования, описанным в параграфе "Связывающая группа" и подпараграфе "Химическая модификация Q и/или Y".
Способы получения Q
Пептиды (Q), описанные в настоящем изобретении, можно получить стандартными синтетическими способами, способами рекомбинантных ДНК или любыми другими способами получения пептидов и слитых белков. Хотя определенные неприродные аминокислоты не могут экспрессироваться стандартными способами рекомбинантных ДНК, способы их получения являются известными в данной области техники. Соединения настоящего изобретения, которые содержат непептидные части, можно получить стандартными реакциями органической химии, в добавление к стандартным реакциям пептидной химии при необходимости.
Пептиды настоящего изобретения можно получить способами, известными в данной области техники. Подходящие способы de novo получения пептидов описывают, например, в Chan et al., Fmoc Solid Phase Peptide Synthesis, Oxford University Press, Oxford, United Kingdom, 2005; Peptide and Protein Drug Analysis, ed. Reid, R., Marcel Dekker, Inc., 2000; Epitope Mapping, ed. Westwood et al., Oxford University Press, Oxford, United Kingdom, 2000; и патенте США 5449752.
Кроме того, в случаях, когда пептиды настоящего изобретения не содержат любые некодируемые или ненатуральные аминокислоты, пептид можно рекомбинантно получить, применяя нуклеиновую кислоту, кодирующую аминокислотную последовательность пептида, применяя стандартные рекомбинантные способы. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual. 3rd ed., Cold Spring Harbor Press, Cold Spring Harbor, NY 2001; и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates и John Wiley & Sons, NY, 1994.
В некоторых вариантах осуществления пептиды по настоящему изобретению являются выделенными. В некоторых вариантах осуществления пептиды по настоящему изобретению являются очищенными. Считается, что "чистота" представляет собой относительный термин и не обязательно истолковывается как абсолютная чистота или абсолютное обогащение или абсолютное выделение. В некоторых аспектах чистота составляет по меньшей мере или приблизительно 50%, по меньшей мере или приблизительно 60%, по меньшей мере или приблизительно 70%, по меньшей мере или приблизительно 80%, или по меньшей мере или приблизительно 90% (например, по меньшей мере или приблизительно 91%, по меньшей мере или приблизительно 92%, по меньшей мере или приблизительно 93%, по меньшей мере или приблизительно 94%, по меньшей мере или приблизительно 95%, по меньшей мере или приблизительно 96%, по меньшей мере или приблизительно 97%, по меньшей мере или приблизительно 98%, по меньшей мере или приблизительно 99% или приблизительно 100%.
В некоторых вариантах осуществления пептиды, описанные в настоящем изобретении, синтезируют в промышленных масштабах компаниями, такими как Synpep (Dublin, CA), Peptide Technologies Corp. (Gaithersburg, MD) и Multiple Peptide Systems (San Diego, CA). В связи с этим, пептиды могут быть синтетическими, рекобинантными, выделенными и/или очищенными.
Классы родственных глюкагону пептидов (Q) описаны подробно ниже. Относительно каждого из параграфов описания, касающихся родственных глюкагону пептидов класса 1, класса 2, класса 3, класса 4 и класса 5, модификации описаны относительно части родственного глюкагону пептида (Q) Q-L-Y конъюгата, подробно описанного выше. Таким образом, структурные элементы, описанные относительно одного класса родственных глюкагону пептидов, являются структурными элементами Q, которые затем дополнительно модифицируют для получения Q-L-Y конъюгата, как описано выше.
Родственные глюкагону пептиды класса 1
В определенных вариантах осуществления родственный глюкагону пептид представляет собой родственный глюкагону пептид класса 1, который описан в настоящем изобретении и в международной публикации патента WO 2009/155257 (опубликованной 23 декабря 2009), опубликованной международной патентной заявке WO 2008/086086 (опубликованной 17 июля 2008) и опубликованной международной патентной заявке WO 2007/056362 (опубликованной 18 мая 2007), содержание которых включено с помощью ссылки во всей своей полноте.
Биологические последовательности, приводимые в следующем параграфе (SEQ ID NO: 801-915), относящиеся к родственным глюкагону пептидам класса 1, соответствуют SEQ ID NO: 1-115 в международной публикации патента WO 2009/155257.
Активность
Глюкагоновые пептиды класса 1 сохраняют глюкагоновую рецепторную активность, относящуюся к нативному глюкагоновому пептиду (SEQ ID NO: 801). Например, глюкагоновый пептид может сохранять по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75% активности, 80% активности, 85% активности или 90% активности нативного глюкагона (рассчитанной как обратное отношение EC50 для глюкагонового пептида к глюкагону, например, как измерено цАМФ генерированием, применяя анализ, описанный в общем в примере 2). В некоторых вариантах осуществления родственные глюкагону пептиды класса 1 обладают активностью, равной или большей (применяемой синонимично с термином "эффективность" в настоящем изобретении), чем глюкагон. В некоторых вариантах осуществления глюкагоновые пептиды, описанные в настоящем изобретении, обладают не более чем приблизительно 100%, 1000%, 10000%, 100000% или 1000000% активности нативного глюкагонового пептида.
Любой из родственных глюкагону пептидов класса 1, описанных в настоящем изобретении, могут обладать EC50 относительно человеческого глюкагонового рецептора приблизительно 100 нМ, 75 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 5 нМ, 1 нМ или меньше, при испытании на цАМФ индукцию в HEK293 клетках, сверхэкспрессирующих глюкагоновый рецептор, например, применяя анализ примера 2. Обычно пегилированные пептиды могут обладать большей EC50 по сравнению с непегилированным пептидом. Например, родственные глюкагону пептиды класса 1, описанные в настоящем изобретении, когда они не пегилированы, могут обладать активностью относительно глюкагонового рецептора, которая составляет по меньшей мере 20% (например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, по меньшей мере 99%, 100%, 150%, 200%, 400%, 500% или более) активности нативного глюкагона (SEQ ID NO: 801) относительно глюкагонового рецептора. В определенных вариантах осуществления родственные глюкагону пептиды класса 1, описанные в настоящем изобретении, обладают указанной % активностью нативного глюкагона относительно глюкагонового рецептора, при отстутствии гидрофильной группы, но обладают сниженной % активностью нативного глюкагона относительно глюкагонового рецептора, когда содержат гидрофильную группу. Например, родственные глюкагону пептиды класса 1, описанные в настоящем изобретении, когда они пегилированы, могут обладать активностью относительно глюкагонового рецептора, которая составляет по меньшей мере 2% (например, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9% или по меньшей мере 10% активности нативного глюкагона. В некоторых вариантах осуществления родственные глюкагону пептиды класса 1, описанные в настоящем изобретении, могут обладать любой из приведенных выше активностей, но не более чем 1000%, 10000%, 100000% или 1000000% активности нативного глюкагона относительно глюкагонового рецептора.
В некоторых вариантах осуществления родственные глюкагону пептиды класса 1 обладают менее чем приблизительно 5%, 4%, 3%, 2% или 1% активностью нативного GLP-1 относительно GLP-1 рецептора и/или более чем приблизительно 5-кратной, 10-кратной или 15-кратной селективностью относительно глюкагонового рецептора по сравнению с GLP-1 рецептором. Например, в некоторых вариантах осуществления родственные глюкагону пептиды класса 1 обладают менее чем 5% активностью нативного GLP-1 относительно GLP-1 рецептора и обладают более чем 5-кратной селективностью относительно глюкагонового рецептора по сравнению с GLP-1 рецептором.
Повышенная растворимость
Нативный глюкагон обладает плохой растворимостью в водном растворе, особенно при физиологическом pH, с тенденцией агрегировать и осаждаться с течением времени. Напротив, родственные глюкагону пептиды класса 1 в некоторых вариантах осуществления обладают по меньшей мере 2-кратной, 5-кратной или даже большей растворимостью по сравнению с нативным глюкагоном при pH между 6 и 8, или между 6 и 9, например, при pH 7 через 24 часа при 25°C.
Соответственно, в некоторых вариантах осуществления родственный глюкагону пептид класса 1 модифицирован по сравнению с пептидом дикого типа His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (SEQ ID NO: 801) для улучшения растворимости пептида в водных растворах, особенно при pH в диапазоне от приблизительно 5,5 до приблизительно 8,0, при сохранении биологической активности нативного пептида.
Например, растворимость любого из родственных глюкагону пептидов класса 1, описанных в настоящем изобретении, можно дополнительно увеличить присоединением гидрофильной группы к пептиду. Введение данных групп также увеличивает продолжительность действия, например, как измерено продленным временем полужизни в кровотоке. Гидрофильные группы дополнительно описаны в настоящем изобретении.
Модификация заряженными остатками
В некоторых вариантах осуществления растворимость увеличивают введением заряда в родственный глюкагону пептид класса 1 заменой нативной незаряженной аминокислоты заряженной аминокислотой, выбранной из группы, состоящей из лизина, аргинина, гистидина, аспарагиновой кислоты и глютаминовой кислоты, или присоединением заряженной аминокислоты к амино или карбокси концу пептида.
В соответствии с некоторыми вариантами осуществления, родственный глюкагону пептид класса 1 обладает повышенной растворимостью вследствие того, что пептид модифицируют аминокислотными заменами и/или присоединениями, которые вводят заряженную аминокислоту в C-концевую часть пептида, и в некоторых вариантах осуществления в положение, C-концевое к положению 27 SEQ ID NO: 801. Необязательно, одну, две или три заряженные аминокислоты можно вводить в C-концевую часть, и в некоторых вариантах осуществления в положения, C-концевые к положению 27. В соответствии с некоторыми вариантами осуществления нативную аминокислоту(-ы) в положениях 28 и/или 29 заменяют заряженными аминокислотами, и/или одну-три заряженные аминокислоты присоединяют к C-концу пептида, например, после положения 27, 28 или 29. В примерных вариантах осуществления одна, две, три или все из заряженных аминокислот являются отрицательно заряженными. В других вариантах осуществления одна, две, три или все из заряженных аминокислот являются положительно заряженными.
В конкретных примерных вариантах осуществления родственный глюкагону пептид класса 1 может содержать любую одну или две из следующих модификаций: замену N28 E; замену N28 D; замену T29 D; замену T29 E; вставку E после положения 27, 28 или 29; вставку D после положения 27, 28 или 29. Например, D28E29, E28E29, E29E30, E28E30, D28E30.
В соответствии с одним примерным вариантом осуществления родственный глюкагону пептид класса 1 содержит аминокислотную последовательность SEQ ID NO: 811 или ее аналог, который содержит 1-3 дополнительные аминокислотные модификации (описанные в настоящем изобретении со ссылкой на глюкагоновые агонисты) по сравнению с нативным глюкагоном или его агонистический аналог глюкагона. SEQ ID NO: 811 представляет собой модифицированный родственный глюкагону пептид класса 1, где аспарагиновый остаток в положении 28 нативного белка заменен аспарагиновой кислотой. В другом примерном варианте осуществления родственный глюкагону пептид класса 1 содержит аминокислотную последовательность SEQ ID NO: 838, где аспарагиновый остаток в положении 28 нативного белка заменен глютаминовой кислотой. Другие примерные варианты осуществления включают родственные глюкагону пептиды класса 1 SEQ ID NO: 824, 825, 826, 833, 835, 836 и 837.
Замена встречающейся в природе аминокислоты в положении 28 и/или 29 заряженными аминокислотами и/или присоединение одной-двух заряженных аминокислот к карбокси концу родственного глюкагону пептида класса 1 увеличивает растворимость и стабильность глюкагоновых пептидов в водных растворах при физиологически значимых pH (т.е. pH от приблизительно 6,5 до приблизительно 7,5), по меньшей мере в 5 раз и вплоть до 30 раз. Соответственно, глюкагоновые пептиды класса 1 некоторых вариантов осуществления сохраняют глюкагоновую активность и обладают по меньшей мере 2-кратной, 5-кратной, 10-кратной, 15-кратной, 25-кратной, 30-кратной или более растворимостью по сравнению с нативным глюкагоном при заданной pH между приблизительно 5,5 и 8, например, pH 7, при измерении через 24 часа при 25°C.
Дополнительные модификации, например, консервативные замены, где модификации дополнительно описаны в настоящем изобретении, можно вводить в родственный глюкагону пептид класса 1, которые, тем не менее, позволяют ему сохранять глюкагоновую активность.
Повышенная стабильность
Кроме того, любой из глюкагоновых пептидов класса 1 может обладать повышенной стабильность и/или пониженным разложением, например, сохраняя по меньшей мере 95% первоначального пептида после 24 часов при 25°C. Кроме того, любой из родственных глюкагону пептидов класса 1, описанных в настоящем изобретении, может обладать повышенной стабильностью при pH в диапазоне 5,5-8, например, сохраняя по меньшей мере 75%, 80%, 90%, 95%, 96%, 97%, 98% или 99% первоначального пептида после 24 часов при 25°C. В некоторых вариантах осуществления родственные глюкагону пептиды класса 1 настоящего изобретения обладают повышенной стабильностью, так что по меньшей мере 75% (например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, более чем 95%, вплоть до 100%) концентрации пептида или менее чем приблизительно 25% (например, меньше, чем 20%, меньше, чем 15%, меньше, чем 10%, меньше, чем 5%, 4%, 3%, 2%, 1%, вплоть до 0%) разложенного пептида можно обнаружить при 280 нм ультрафиолетовым (УФ) детектором через приблизительно 1 или более недель (например, приблизительно 2 недели, приблизительно 4 недели, приблизительно 1 месяц, приблизительно два месяца, приблизительно четыре месяца, приблизительно шесть месяцев, приблизительно восемь месяцев, приблизительно десять месяцев, приблизительно двенадцать месяца) в растворе при температуре по меньшей мере 20°C (например, 21°C, 22°C, 23°C, 24°C, 25°C, 26°C, по меньшей мере 27,5°C, по меньшей мере 30°C, по меньшей мере 35°C, по меньшей мере 40°C, по меньшей мере 50°C) и менее чем 100°C, менее чем 85°C, менее чем 75°C или менее чем 70°C. Родственные глюкагону пептиды класса 1 могут содержать дополнительные модификации, которые изменяют их фармацевтические свойства, например, повышают эффективность, продлевают время полужизни в кровотоке, увеличивают срок годности, ослабляют выпадении и агрегацию и/или ослабляют разложение, например, снижают количество случаев расщепления или химической модификации после хранения.
В еще дополнительных вариантах осуществления любой из вышеуказанных родственных глюкагону пептидов класса 1 можно дополнительно модифицировать для увеличения стабильности модификацией аминокислоты в положении 15 SEQ ID NO: 801 для ослабления разложения пептида с течением времени, особенно в кислых или щелочных буферах. В примерных вариантах осуществления Asp в положении 15 заменен Glu, гомо-Glu, цистеиновой кислотой или гомоцистеиновой кислотой.
Альтернативно, любой из родственных глюкагону пептидов класса 1, описанных в настоящем изобретении, можно дополнительно модифицировать для повышения стабильности модификацией аминокислоты в положении 16 SEQ ID NO: 801. В примерных вариантах осуществления Ser в положении 16 заменен Thr или Aib, или любой из аминокислотных замен, описанных в настоящем изобретении относительно родственных глюкагону пептидов класса 1, которые увеличивают эффективность относительно глюкагонового рецептора. Данные модификации ослабляют расщепление пептидной связи между Asp15-Ser16.
В некоторых вариантах осуществления любой из родственных глюкагону пептидов класса 1, описанных в настоящем изобретении, можно дополнительно модифицировать для ослабления разложения в различных аминокислотных положениях модификацией любого одного, двух, трех или всех четырех положений 20, 21, 24 или 27. Примерные варианты осуществления включают замену Gln в положении 20 Ser, Thr, Ala или Aib, замену Asp в положении 21 Glu, замену Gln в положении 24 Ala или Aib, замену Met в положении 27 Leu или Nle. Удаление или замена метионина ослабляет разложение в результате окисления метионина. Удаление или замена Gln или Asn ослабляет разложение в результате дезамидирования Gln или Asn. Удаление или замена Asp ослабляет разложение, которое осуществляется дегидрированием Asp, давая циклическое сукцинимидное промежуточное соединение, с последующей изомеризацией до изоаспартата.
Повышенная эффективность
В соответствии с другим вариантом осуществления, обеспечивают родственные глюкагону пептиды класса 1, которые обладают повышенной эффективностью относительно глюкагонового рецептора, где пептиды содержат аминокислотную модификацию в положении 16 нативного глюкагона (SEQ ID NO: 801). Посредством неограничивающего примера данную повышенную эффективность можно достичь заменой встречающегося в природе серина в положении 16 глютаминовой кислотой или другой отрицательно заряженной аминокислотой, содержащей боковую цепь с длинной 4 атома, или альтернативно любой одной из глютамина, гомоглютаминовой кислоты или гомоцистеиновой кислоты, или заряженной аминокислотой, содержащей боковую цепь, содержащую по меньшей мере один гетероатом (например, N, O, S, P) и с длиной боковой цепи приблизительно 4 (или 3-5) атомов. Замена серина в положении 16 глютаминовой кислотой увеличивает глюкагоновую активность по меньшей мере в 2 раза, в 4 раза, в 5 раз и вплоть до 10 раз относительно глюкагонового рецептора. В некоторых вариантах осуществления родственный глюкагону пептид класса 1 сохраняет селективность относительно глюкагонового рецептора по сравнению с GLP-1 рецептором, например, по меньшей мере 5-кратную, 10-кратную или 15-кратную селективность.
DPP-IV устойчивость
В некоторых вариантах осуществления глюкагоновые пептиды класса 1, описанные в настоящем изобретении, дополнительно модифицируют в положении 1 или 2, снижая подверженность к расщеплению дипептидилпептидазой IV. Более конкретно, в некоторых вариантах осуществления положение 1 и/или положение 2 родственного глюкагону пептида класса 1 заменено DPP-IV устойчивой аминокислотой (аминокислотами), описанной в настоящем изобретении. В некоторых вариантах осуществления положение 2 пептида, являющегося аналогом, заменено аминоизомасляной кислотой. В некоторых вариантах осуществления положение 2 пептида, являющегося аналогом, заменено аминокислотой, выбранной из группы, состоящей из D-серина, D-аланина, глицина, N-метилсерина и ε-аминомасляной кислоты. В другом варианте осуществления положение 2 родственного глюкагону пептида класса 1 заменено аминокислотой, выбранной из группы, состоящей из D-серина, глицина и аминоизомасляной кислоты. В некоторых вариантах осуществления аминокислота в положении 2 не является D-серином.
Снижение глюкагоновой активности после модификации аминокислоты в положении 1 и/или положении 2 глюкагонового пептида можно возместить стабилизацией альфа-спиральной структуры в C-концевой части глюкагонового пептида (в районе аминокислот 12-29). Альфа-спиральную структуру можно стабилизировать, например, образованием ковалентной или нековалентной внутримолекулярной мостиковой связи (например, лактамной мостиковой связи между боковыми цепями аминокислот в положениях "i" и "i+4", где i представляет собой целое от 12 до 25), заменой и/или вставкой аминокислот вблизи положений 12-29 альфа-спираль-стабилизирующей аминокислоты (например, α,α-дизамещенной аминокислотой), как дополнительно описано в настоящем изобретении.
Модификации в положении 3
Глюкагоновую рецепторную активность можно снизить аминокислотной модификацией в положении 3 (согласно нумерации аминокислот глюкагона дикого типа), например, заменой встречающегося в природе глютамина в положении 3, кислой, основной или гидрофобной аминокислотой. Например, замена в положении 3 глютаминовой кислотой, орнитином или норлейцином значительно снижает или аннулирует глюкагоновую рецепторную активность.
Сохраненной или повышенной активности относительно глюкагонового рецептора можно достичь модификацией Gln в положении 3 глютаминовым аналогом, как описано в настоящем изобретении. Например, глюкагоновые агонисты могут содержать аминокислотную последовательность SEQ ID NO: 863, SEQ ID NO: 869, SEQ ID NO: 870, SEQ ID NO: 871, SEQ ID NO: 872, SEQ ID NO: 873 и SEQ ID NO: 874.
Увеличение GLP-1 активности C-концевыми амидами и сложными эфирами
Повышенную активность относительно GLP-1 рецептора обеспечивают заменой карбоксильной группы C-концевой аминокислоты нейтральной группой, такой как амид или сложный эфир. Наоборот, сохранение нативной карбоксильной группы на C-конце пептида сохраняет относительно большую селективность родственного глюкагону пептида класса 1 относительно глюкагонового рецептора по сравнению с GLP-1 рецептором (например, более чем приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20-кратную).
Дополнительные модификации и комбинации
В родственный глюкагону пептид класса 1 можно вводить дополнительные модификации, которые могут дополнительно увеличивать растворимость, и/или стабильность, и/или глюкагоновую активность. Родственный глюкагону пептид класса 1 может альтернативно содержать другие модификации, которые незначительно влияют на растворимость или стабильность и незначительно снижают глюкагоновую активность. В примерных вариантах осуществления родственный глюкагону пептид класса 1 может содержать в сумме вплоть до 11, или вплоть до 12, или вплоть до 13, или вплоть до 14 аминокислотных модификаций по сравнению с нативной глюкагоновой последовательностью. Например, консервативные или неконсервативные замены, вставки или делеции можно осуществлять в любом положении 2, 5, 7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29.
Примерные модификации родственного глюкагону пептида класса 1 включают, но не ограничиваясь этим:
(a) неконсервативные замены, консервативные замены, вставки или делеции при сохранении, по меньшей мере, частичной глюкагоновой агонистической активности, например, консервативные замены в одном или более положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29, замену Tyr в положении 10 Val или Phe, замену Lys в положении 12 Arg, замену одного или более из данных положений Ala;
(b) делецию аминокислот в положениях 29 и/или 28, и необязательно положении 27, при сохранении, по меньшей мере, частичной глюкагоновой агонистической активности;
(c) модификацию аспарагиновой кислоты в положении 15, например, заменой глютаминовой кислотой, гомоглютаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой, которая ослабляет разрушение; или модификацию серина в положении 16, например, заменой треонина, Aib, глютаминовой кислотой или другой отрицательно заряженной аминокислотой, содержащей боковую цепь с длинной 4 атомов, или альтернативно любой одной из глютамина, гомоглютаминовой кислоты или гомоцистеиновой кислоты, которая аналогично может снижать разложение в результате расщепления Asp15-Ser16 связи;
(d) присоединение гидрофильной группы, такой как растворимый в воде полимерный полиэтиленгликоль, как описано в настоящем изобретении, например, в положении 16, 17, 20, 21, 24, 29, 40 или к C-концевой аминокислоте, которое может увеличивать растворимость и/или время полужизни;
(e) модификацию метионина в положении 27, например, заменой лейцином или норлейцином, для ослабления окислительного разложения;
(f) модификацию Gln в положении 20 или 24, например, заменой Ser, Thr, Ala или Aib, для ослабления разложения, которое протекает через дезамидирование Gln;
(g) модификацию Asp в положении 21, например, заменой Glu, для снижения разложения, которое протекает через дегидратацию Asp, давая циклическое сукцинимидное промежуточное соединение, с последующей изомеризацией до изоаспартата;
(h) модификации в положении 1 или 2, как описано в настоящем изобретении, которые увеличивают устойчивость к DPP-IV расщеплению, необязательно в комбинации с внутримолекулярной мостиковой связью, такой как лактамная мостиковая связь между положениями "i" и "i+4", где i представляет собой целое от 12 до 25, например, 12, 16, 20, 24;
(i) ацилирование или алкилирование глюкагонового пептида, как описано в настоящем изобретении, которое может увеличивать активность относительно глюкагонового рецептора и/или GLP-1 рецептора, увеличивать время полужизни в кровотоке и/или увеличивать продолжительность действия и/или замедлять начало действия, необязательно в комбинации с присоединением гидрофильной молекулы, кроме того или альтернативно, необязательно в комбинации с модификацией, которая селективно снижает активность относительно GLP-1 пептида, например, модификацией Thr в положении 7, такой как замена Thr в положении 7 аминокислотой, не содержащей гидроксильную группу, например, Abu или Ile; делецией аминокислот, C-концевых к аминокислоте в положении 27 (например, делецией одной или обеих аминокислот в положениях 28 и 29, получая пептид с длинной 27 или 28 аминокислот);
(j) C-концевое удлинение, как описано в настоящем изобретении;
(k) гомодимеризацию или гетеродимеризацию, как описано в настоящем изобретении; и
комбинации (a)-(k).
В некоторых вариантах осуществления примерные модификации родственного глюкагону пептида класса 1 включают по меньшей мере одну аминокислотную модификацию, выбранную из группы A, и одну или более аминокислотных модификаций, выбранных из группы B и/или группы C,
где группа A представляет собой:
замену Asn в положении 28 заряженной аминокислотой;
замену Asn в положении 28 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты;
замену в положении 28 Asn, Asp или Glu;
замену в положении 28 Asp;
замену в положении 28 Glu;
замену Thr в положении 29 заряженой аминокислотой;
замену Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты;
замену в положении 29 Asp, Glu или Lys;
замену в положении 29 Glu;
вставку 1-3 заряженных аминокислот после положения 29;
вставку после положения 29 Glu или Lys;
вставку после положения 29 Gly-Lys или Lys-Lys;
или их комбинацию;
где группа B представляет собой:
замену Asp в положении 15 Glu;
замену Ser в положении 16 Thr или Aib; и
где группа C представляет собой:
замену His в положении 1 ненативной аминокислотой, которая снижает подверженность глюкагонового пептида к расщеплению дипептидилпептидазой IV (DPP-IV),
замену Ser в положении 2 ненативной аминокислотой, которая снижает подверженность глюкагонового пептида к расщеплению дипептидилпептидазой IV (DPP-IV),
замену Lys в положении 12 Arg;
замену Gln в положении 20 Ser, Thr, Ala или Aib;
замену Asp в положении 21 Glu;
замену Gln в положении 24 Ser, Thr, Ala или Aib;
замену Met в положении 27 Leu или Nle;
делецию аминокислот в положениях 27-29;
делецию аминокислот в положениях 28-29;
делецию аминокислот в положениях 29; или
их комбинацию.
В примерных вариантах осуществления Lys в положении 12 заменен Arg. В других примерных вариантах осуществления аминокислоты в положениях 29 и/или 28, и необязательно в положении 27, удалены.
В некоторых конкретных вариантах осуществления глюкагоновый пептид содержит (a) аминокислотную модификацию в положении 1 и/или 2, которая придает DPP-IV устойчивость, например, замену DMIA в положении 1, или Aib в положении 2, (b) внутримолекулярную мостиковую связь в пределах положений 12-29, например, в положениях 16 и 20, или одну или более замен аминокислот в положениях 16, 20, 21, и 24 α,α-дизамещенной аминокислотой, необязательно (c) он соединен с гидрофильной молекулой, такой как PEG, например, через Cys в положении 24, 29 или C-концевой аминокислотой, необязательно (d) аминокислотную модификацию в положении 27, которая замещает Met, например, Nle, необязательно (e) аминокислотную модификацию в положениях 20, 21 и 24, которая снижает разложение, и необязательно (f) он соединен с SEQ ID NO: 820. Когда глюкагоновый пептид соединен с SEQ ID NO: 820, аминокислота в положении 29 в определенных вариантах осуществления представляет собой Thr или Gly. В других конкретных вариантах осуществления глюкагоновый пептид содержит (a) Asp28Glu29, или Glu28Glu29, или Glu29Glu30, или Glu28Glu30 или Asp28Glu30, и необязательно (b) аминокислотную модификацию в положении 16, которая замещает Ser, например, Thr или Aib, и необязательно (c) аминокислотную модификацию в положении 27, которая замещает Met, например, Nle, и необязательно (d) аминокислотные модификации в положениях 20, 21 и 24, которые снижают разложение. В конкретном варианте осуществления глюкагоновый пептид представляет собой T16, A20, E21, A24, Nle27, D28, E29.
В некоторых вариантах осуществления родственный глюкагону пептид класса 1 содержит аминокислотную последовательность:
X1-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Z (SEQ ID NO: 839) с 1-3 аминокислотными модификациями в ней,
где X1 и/или X2 представляет собой ненативную аминокислоту, которая снижает подверженность (или увеличивает устойчивость) глюкагонового пептида к расщеплению дипептидилпептидазой IV (DPP-IV),
где Z выбран из группы, состоящей из -COOH (встречающийся в природе C-концевой карбоксилат), -Asn-COOH, Asn-Thr-COOH и Y-COOH, где Y представляет собой 1-2 аминокислоты, и
где внутримолекулярная мостиковая связь, предпочтительно ковалентная связь, соединяет боковые цепи аминокислоты в положении i и аминокислоты в положении i+4, где i равно 12, 16, 20 или 24.
В некоторых вариантах осуществления внутримолекулярная мостиковая связь представляет собой лактамную мостиковую связь. В некоторых вариантах осуществления аминокислоты в положениях i и i+4 SEQ ID NO: 839 представляют собой Lys и Glu, например, Glu16 и Lys20. В некоторых вариантах осуществления X1 выбран из группы, состоящей из: D-His, N-метил-His, альфа-метил-His, имидазолуксусной кислоты, дезамино-His, гидроксил-His, ацетил-His, гомо-His и альфа,альфа-диметилимидазолуксусной кислоты (DMIA). В других вариантах осуществления X2 выбран из группы, состоящей из: D-Ser, D-Ala, Gly, N-метил-Ser, Val и альфа-аминоизомасляной кислоты (Aib). В некоторых вариантах осуществления глюкагоновый пептид ковалентно связан с гидрофильной группой в любом из аминокислотных положений 16, 17, 20, 21, 24, 29, 40, в пределах C-концевого удлинения или к C-концевой аминокислоте. В примерных вариантах осуществления данная гидрофильная молекула ковалентно связана с Lys, Cys, Orn, гомоцистеиновым или ацетил-фенилаланиновым остатком в любом из данных положений. Примерные гидрофильные молекулы включают полиэтиленгликоль (PEG), например, с молекулярным весом от приблизительно 1000 Дальтон до приблизительно 40000 Дальтон, или от приблизительно 20000 Дальтон до приблизительно 40000 Дальтон.
В других вариантах осуществления родственный глюкагону пептид класса I содержит аминокислотную последовательность:
X1-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Z (SEQ ID NO: 839),
где X1 и/или X2 представляет собой ненативную аминокислоту, которая снижает подверженность (или увеличивает устойчивость) глюкагонового пептида к расщеплению дипептидилпептидазой IV (DPP-IV),
где одно, два, три, четыри или более положений 16, 20, 21, и 24 глюкагонового пептида заменены α,α-дизамещенной аминокислотой, и
где Z выбран из группы, состоящей из -COOH (встречающийся в природе C-концевой карбоксилат), -Asn-COOH, Asn-Thr-COOH, и Y-COOH, где Y представляет собой 1-2 аминокислоты.
Примерные дополнительные аминокислотные модификации вышеуказанных родственных глюкагону пептидов класса 1 или аналогов включают замену Thr в положении 7 аминокислотой, не содержащей гидроксильной группы, например, аминомасляной кислотой (Abu), Ile, необязательно, в комбинации с заменой или присоединением аминокислоты, содержащей боковую цепь, ковалентно связанной (необязательно, через спейсер) с ацильной или алкильной группой, где ацильная или алкильная группа не является нативной для встречающейся в природе аминокислоты, замену Lys в положении 12 Arg; замену Asp в положении 15 Glu; замену Ser в положении 16 Thr или Aib; замену Gln в положении 20 Ser, Thr, Ala или Aib; замену Asp в положении 21 Glu; замену Gln в положении 24 Ser, Thr, Ala или Aib; замену Met в положении 27 Leu или Nle; замену Asn в положении 28 заряженной аминокислотой; замену Asn в положении 28 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замену в положении 28 Asn, Asp или Glu; замену в положении 28 Asp; замену в положении 28 Glu; замену Thr в положении 29 заряженной аминокислотой; замену Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замену в положении 29 Asp, Glu или Lys; замену в положении 29 Glu; вставку 1-3 заряженных аминокислот после положения 29; вставку в положении 30 (т.е. после положения 29) Glu или Lys; необязательно со вставкой в положении 31 Lys; присоединение SEQ ID NO: 820 к C-концу, необязательно, где аминокислота в положении 29 представляет собой Thr или Gly; замену или вставку аминокислоты, ковалентно связанной с гидрофильной молекулой; или их комбинацию.
Любую из модификаций, описанных выше относительно глюкагоновых агонистов класса 1, которая увеличивает глюкагоновую рецепторную активность, сохраняет частичную глюкагоновую рецепторную активность, увеличивает растворимость, увеличивает стабильность или снижает разрушение, можно применять для глюкагоновых пептидов класса 1 отдельно или в комбинации. Таким образом, можно получить родственные глюкагону пептиды класса 1, которые сохраняют по меньшей мере 20% активности нативного глюкагона относительно глюкагонового рецептора, и которые являются растворимыми при концентрации по меньшей мере 1 мг/мл при pH между 6 и 8 или между 6 и 9, (например, pH 7), и необязательно сохраняют по меньшей мере 95% первоначального пептида (например, 5% или меньше первоначального пептида разрушается или расщепляется) после 24 часов при 25°C. Альтернативно, можно получить высокоэффективные глюкагоновые пептиды класса 1, которые обладают по меньшей мере приблизительно 100%, 125%, 150%, 175%, 200%, 250%, 300%, 350%, 400%, 450%, 500%, 600%, 700%, 800%, 900% или 10-кратной или более активностью нативного глюкагона относительно глюкагонового рецептора, и необязательно являются растворимыми при концентрации по меньшей мере 1 мг/мл при pH между 6 и 8 или между 6 и 9, (например, pH 7), и необязательно сохраняют по меньшей мере 95% первоначального пептида (например, 5% или меньше первоначального пептида разрушается или расщепляется) после 24 часов при 25°C. В некоторых вариантах осуществления глюкагоновые пептиды класса 1, описанные в настоящем изобретении, могут обладать, по меньшей мере, любой из указанных выше степеней активности относительно глюкагонового рецептора, но не более чем 1000%, 5000% или 10000% активности нативного глюкагона относительно глюкагонового рецептора.
Примеры вариантов осуществления родственных глюкагону пептидов класса 1
В соответствии с некоторыми вариантами осуществления нативный глюкагоновый пептид SEQ ID NO: 801 модифицируют заменой нативной аминокислоты в положении 28 и/или 29 отрицательно заряженной аминокислотой (например, аспарагиновой кислотой или глютаминовой кислотой) и необязательно присоединением отрицательно заряженной аминокислоты (например, аспарагиновой кислоты или глютаминовой кислоту) к карбокси концу пептида. В альтернативном варианте осуществления нативный глюкагоновый пептид SEQ ID NO: 801 модифицируют заменой нативной аминокислоты в положении 29 положительно заряженной аминокислотой (например, лизином, аргинином или гистидином) и необязательно присоединением одной или двух положительно заряженных аминокислот (например, лизина, аргинина или гистидина) к карбокси концу пептида. В соответствии с некоторыми вариантами осуществления обеспечивают глюкагоновый аналог, обладающий повышенной растворимостью и стабильностью, где аналог содержит аминокислотную последовательность SEQ ID NO: 834 при условии, что по меньшей мере одна из аминокислот в положении 28 или 29 заменена кислой аминокислотой, и/или дополнительную кислую аминокислоту присоединяют на карбокси конце SEQ ID NO: 834. В некоторых вариантах осуществления кислые аминокислоты независимо выбраны из группы, состоящей из Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты.
В соответствии с некоторыми вариантами осуществления обеспечивают глюкагоновый агонист, обладающий повышенной растворимостью и стабильностью, где агонист содержит аминокислотную последовательность SEQ ID NO: 833, где по меньшей мере одна из аминокислот в положениях 27, 28 или 29 заменена ненативным аминокислотным остатком (т.е. по меньшей мере одна аминокислота, присутствующая в положении 27, 28 или 29 аналога, представляет собой кислую аминокислоту, отличную от аминокислоты, присутствующей в соответствующем положении в SEQ ID NO: 801). В соответствии с некоторыми вариантами осуществления обеспечивают глюкагоновый агонист, содержащий последовательность SEQ ID NO: 833 при условии, что, когда аминокислота в положении 28 представляет собой аспарагин, и аминокислота в положении 29 представляет собой треонин, пептид дополнительно содержит одну-две аминокислоты, независимо выбранные из группы, состоящей из Lys, Arg, His, Asp или Glu, присоединенные к карбокси концу глюкагонового пептида.
Сообщалось, что определенные положения нативного глюкагонового пептида можно модифицировать при сохранении, по меньшей мере, некоторой доли активности исходного пептида. Соответственно, заявители ожидают, что одну или более аминокислот, расположенных в положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29 пептида SEQ ID NO: 811, можно заместить аминокислотой, отличной от аминокислоты, присутствующей в нативном глюкагоновом пептиде, и все же он будет сохранять повышенную эффективность, стабильность при физиологических pH и биологическую активность исходного глюкагонового пептида. Например, в соответствии с некоторыми вариантами осуществления метиониновый остаток, присутствующий в положении 27 нативного пептида, заменяют на лейцин или норлейцин для предотвращения окислительного разрушения пептида.
В некоторых вариантах осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 833, где 1-6 аминокислот, выбранных из положений 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 аналога, отличаются от соответствующей аминокислоты SEQ ID NO: 801. В соответствии с другим вариантом осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 833, где 1-3 аминокислоты, выбранные из положения 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 аналога, отличаются от соответствующей аминокислоты SEQ ID NO: 801. В другом варианте осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 807, SEQ ID NO: 808 или SEQ ID NO: 834, где 1-2 аминокислоты, выбранные из положения 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 аналога, отличаются от соответствующей аминокислоты SEQ ID NO: 801, и в следующем варианте осуществления данные одна-две отличающиеся аминокислоты представляют собой консервативные аминокислотные замены относительно аминокислот, присутствующих в нативной последовательности (SEQ ID NO: 801). В некоторых вариантах осуществления обеспечивают глюкагоновый пептид SEQ ID NO: 811 или SEQ ID NO: 813, где глюкагоновый пептид дополнительно содержит одну, две или три аминокислотных замены в положениях, выбранных из положений 2, 5, 7, 10, 11, 12, 13, 14, 16, 17,18, 19, 20, 21, 24, 27 или 29. В некоторых вариантах осуществления замены в положениях 2, 5, 7, 10, 11, 12, 13, 14,16, 17, 18, 19, 20, 27 или 29 являются консервативными аминокислотными заменами.
В некоторых вариантах осуществления обеспечивают глюкагоновый агонист, включая пептид, являющийся аналогом, SEQ ID NO: 801, где аналог отличается от SEQ ID NO: 801 наличием аминокислоты, отличной от серина в положении 2 и наличием кислой аминокислоты, которой заменяют нативную аминокислоту в положении 28 или 29, или кислую аминокислоту присоединяют к карбокси концу пептида SEQ ID NO: 801. В некоторых вариантах осуществления кислая аминокислота представляет собой аспарагиновую кислоту или глютаминовую кислоту. В некоторых вариантах осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 или SEQ ID NO: 832, где аналог отличается от исходной молекулы заменой в положении 2. Более конкретно, положение 2 пептида, являющегося аналогом, заменено аминокислотой, выбранной из группы, состоящей из D-серина, аланина, D-аланина, глицина, н-метилсерина и аминоизомасляной кислоты.
В другом варианте осуществления обеспечивают глюкагоновый агонист, содержащий пептид, являющийся аналогом, SEQ ID NO: 801, где аналог отличается от SEQ ID NO: 801 наличием аминокислоты, отличной от гистидина в положении 1, и наличием кислой аминокислоты, которой заменена нативная аминокислота в положении 28 или 29, или кислую аминокислоту присоединяют к карбокси концу пептида SEQ ID NO: 801. В некоторых вариантах осуществления кислая аминокислота представляет собой аспарагиновую кислоту или глютаминовую кислоту. В некоторых вариантах осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 или SEQ ID NO: 832, где аналог отличается от исходной молекулы заменой в положении 1. Более конкретно, положение 1 пептида, являющегося аналогом, заменено аминокислотой, выбранной из группы, состоящей из DMIA, D-гистидина, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина.
В соответствии с некоторыми вариантами осуществления модифицированный глюкагоновый пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 и SEQ ID NO: 832. В следующем варианте осуществления обеспечивают глюкагоновый пептид, содержащий последовательность SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 или SEQ ID NO: 832, дополнительно содержащий одну-две аминокислоты, присоединенные к C-концу SEQ ID NO: 809, SEQ ID NO: 812, SEQ ID NO: 813 или SEQ ID NO: 832, где дополнительные аминокислоты независимо выбраны из группы, состоящей из Lys, Arg, His, Asp Glu, цистеиновой кислоты или гомоцистеиновой кислоты. В некоторых вариантах осуществления дополнительные аминокислоты, присоединенные к карбокси концу, выбраны из группы, состоящей из Lys, Arg, His, Asp или Glu, или в следующем варианте осуществления дополнительные аминокислоты представляют собой Asp или Glu.
В другом варианте осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 807 или его глюкагоновый агонистический аналог. В некоторых вариантах осуществления пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 808, SEQ ID NO: 810, SEQ ID NO: 811, SEQ ID NO: 812 и SEQ ID NO: 813. В другом варианте осуществления пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 808, SEQ ID NO: 810 и SEQ ID NO: 811. В некоторых вариантах осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 808, SEQ ID NO: 810 и SEQ ID NO: 811, дополнительно содержащий дополнительную аминокислоту, выбранную из группы, состоящей из Asp и Glu, присоединенную к C-концу глюкагонового пептида. В некоторых вариантах осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 811 или SEQ ID NO: 813, и в следующем варианте осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 811.
В соответствии с некоторыми вариантами осуществления обеспечивают глюкагоновый агонист, содержащий модифицированный глюкагоновый пептид, выбранный из группы, состоящей из:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Xaa-Xaa-Xaa-R (SEQ ID NO: 834),
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asp-Thr-R (SEQ ID NO: 811) и
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Xaa-Tyr-Leu-Glu-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asp-Thr-R (SEQ ID NO: 813)
где Xaa в положении 15 представляет собой Asp, Glu, цистеиновую кислоту, гомоглютаминовую кислоту или гомоцистеиновую кислоту, Xaa в положении 28 представляет собой Asn или кислую аминокислоту, и Xaa в положении 29 представляет собой Thr или кислую аминокислоту, и R представляет собой кислую аминокислоту, COOH или CONH2, при условии, что кислый аминокислотный остаток присутствует в одном из положений 28, 29 или 30. В некоторых вариантах осуществления R представляет собой COOH, и в другом варианте осуществления R представляет собой CONH2.
Настоящее описание также включает глюкагоновые слитые пептиды, где второй пептид конденсирован с C-концом глюкагонового пептида для увеличения стабильности и растворимости глюкагонового пептида. Более конкретно, глюкагоновый слитый пептид может содержать глюкагоновый агонистический аналог, содержащий глюкагоновый пептид NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Xaa-Xaa-Xaa-R (SEQ ID NO: 834), где R представляет собой кислую аминокислоту или связь, и аминокислотную последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR), соединенную с карбокси концевой аминокислотой глюкагонового пептида. В некоторых вариантах осуществления глюкагоновый пептид выбран из группы, состоящей из SEQ ID NO: 833, SEQ ID NO: 807 или SEQ ID NO: 808, дополнительно содержащей аминокислотную последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR), соединенную с карбокси концевой аминокислотой глюкагонового пептида. В некоторых вариантах осуществления глюкагоновый слитый пептид содержит SEQ ID NO: 802, SEQ ID NO: 803, SEQ ID NO: 804, SEQ ID NO: 805 и SEQ ID NO: 806 или их глюкагоновый агонистический аналог, дополнительно содержащий аминокислотную последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR), соединенную с аминокислотой 29 глюкагонового пептида. В соответствии с некоторыми вариантами осуществления слитый пептид дополнительно содержит PEG цепь, соединенную с аминокислотой в положении 16, 17, 21, 24, 29, в C-концевом удлинении, или с C-концевой аминокислотой, где PEG цепь выбрана из диапазона 500-40000 Дальтон. В некоторых вариантах осуществления аминокислотная последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR) соединена с аминокислотой 29 глюкагонового пептида пептидной связью. В некоторых вариантах осуществления часть глюкагонового пептида глюкагонового слитого пептида содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 810, SEQ ID NO: 811 и SEQ ID NO: 813. В некоторых вариантах осуществления часть глюкагонового пептида глюкагонового слитого пептида содержит последовательность SEQ ID NO: 811 или SEQ ID NO: 813, где PEG цепь присоединена в положении 21, 24, 29, в C-концевом удлинении или с C-концевой аминокислотой, соответственно.
В другом варианте осуществления последовательность глюкагонового пептида слитого пептида содержит последовательность SEQ ID NO: 811, дополнительно содержащую аминокислотную последовательность SEQ ID NO: 820 (GPSSGAPPPS), SEQ ID NO: 821 (KRNRNNIA) или SEQ ID NO: 822 (KRNR), соединенную с аминокислотой 29 глюкагонового пептида. В некоторых вариантах осуществления глюкагоновый слитый пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 824, SEQ ID NO: 825 и SEQ ID NO: 826. Обычно слитые пептиды настоящего изобретения будут содержать C-концевую аминокислоту со стандартной карбоксильной группой. Однако аналоги данных последовательностей, где C-концевая аминокислота содержит амид вместо карбоновой кислоты, также включены как варианты осуществления. В соответствии с некоторыми вариантами осуществления глюкагоновый слитый пептид содержит глюкагоновый агонистический аналог, выбранный из группы, состоящей из SEQ ID NO: 810, SEQ ID NO: 811 и SEQ ID NO: 813, дополнительно содержащий аминокислотную последовательность SEQ ID NO: 823 (GPSSGAPPPS-CONH2), соединенную с аминокислотой 29 глюкагонового пептида.
Глюкагоновые агонисты настоящего изобретения можно дополнительно модифицировать для увеличения растворимости и стабильности пептида в водных растворах при сохранении биологической активности глюкагонового пептида. В соответствии с некоторыми вариантами осуществления ожидают, что введение гидрофильных групп в одно или более положений, выбранных из положений 16, 17, 20, 21, 24 и 29 пептида SEQ ID NO: 811, или его глюкагонового агонистического аналога, увеличит растворимость и стабильность при физиологических pH глюкагонового аналога. Более конкретно, в некоторых вариантах осуществления глюкагоновый пептид SEQ ID NO: 810, SEQ ID NO: 811, SEQ ID NO: 813 или SEQ ID NO: 832 модифицируют так, чтобы он содержал одну или более гидрофильные группы, ковалентно связанные с боковыми цепями аминокислот, присутствующих в положениях 21 и 24 глюкагонового пептида.
В соответствии с некоторыми вариантами осуществления глюкагоновый пептид SEQ ID NO: 811 модифицируют так, чтобы он содержал одну или более аминокислотных замены в положениях 16, 17, 20, 21, 24 и/или 29, где нативная аминокислота заменена аминокислотой, содержащей боковую цепь, подходящую для образования поперечной сшивки с гидрофильными молекулами, включая, например, PEG. Нативный пептид может быть заменен встречающейся в природе аминокислотой или синтетической (не встречающейся в природе) аминокислотой. Синтетические или не встречающиеся в природе аминокислоты относятся к аминокислотам, которые не встречаются in vivo, но которые, тем не менее, можно вводить в пептидные структуры, описанные в настоящем изобретении.
В некоторых вариантах осуществления обеспечивают глюкагоновый агонист SEQ ID NO: 810, SEQ ID NO: 811 или SEQ ID NO: 813, где нативная глюкагоновая пептидная последовательность модифицирована так, чтобы она содержала встречающуюся в природе или синтетическую аминокислоту, по меньшей мере, в одном из положений 16, 17, 21, 24, 29, в C-концевом удлинении или в качестве C-концевой аминокислоты нативной последовательности, где аминокислотный заместитель дополнительно содержит гидрофильную группу. В некоторых вариантах осуществления замену осуществляют в положении 21 или 24, и в следующем варианте осуществления гидрофильная группа представляет собой PEG цепь. В некоторых вариантах осуществления глюкагоновый пептид SEQ ID NO: 811 заменен по меньшей мере одним цистеиновым остатком, где боковая цепь цистеинового остатка дополнительно модифицирована тиол-реакционноспособным реагентом, включая, например, малеимидо, винилсульфон, 2-пиридилтио, галогеналкил и галогенацил. Данные тиол-реакционноспособные реагенты могут содержать карбокси, кето, гидроксильную и эфирную группы, а также другие гидрофильные группы, такие как полиэтиленгликольные фрагменты. В альтернативном варианте осуществления, нативный глюкагоновый пептид заменен лизином, и боковая цепь замещающего лизининового остатка дополнительно модифицирована, применяя амин-реакционноспособные реагенты, такие как активные эфиры (сукцинимидо, ангидрид и т.д.) карбоновых кислот или альдегиды гидрофильных молекул, таких как полиэтиленгликоль. В некоторых вариантах осуществления глюкагоновый пептид выбирают из группы, состоящей из SEQ ID NO: 814, SEQ ID NO: 815, SEQ ID NO: 816, SEQ ID NO: 817, SEQ ID NO: 818 и SEQ ID NO: 819.
Согласно некоторым вариантам осуществления пегилированный глюкагоновый пептид содержит две или более полиэтиленгликольные цепи, ковалентно связанные с глюкагоновым пептидом, где суммарный молекулярный вес глюкагоновых цепей составляет от приблизительно 1000 до приблизительно 5000 Дальтон. В некоторых вариантах осуществления пегилированный глюкагоновый агонист содержит пептид SEQ ID NO: 806, где PEG цепь ковалентно связана с аминокислотным остатком в положении 21 и в положении 24, и где суммарный молекулярный вес двух PEG цепей составляет от приблизительно 1000 до приблизительно 5000 Дальтон. В другом варианте осуществления пегилированный глюкагоновый агонист содержит пептид SEQ ID NO: 806, где PEG цепь ковалентно связана с аминокислотным остатком в положении 21 и в положении 24, и где суммарный молекулярный вес двух PEG цепей составляет от приблизительно 5000 до приблизительно 20000 Дальтон.
Полиэтиленгликольная цепь может быть в виде нормальной цепи, или она может быть разветвленной. В соответствии с некоторыми вариантами осуществления полиэтиленгликольная цепь имеет средний молекулярный вес, выбранный из диапазона от приблизительно 500 до приблизительно 40000 Дальтон. В некоторых вариантах осуществления полиэтиленгликольная цепь имеет молекулярный вес, выбранный из диапазона от приблизительно 500 до приблизительно 5000 Дальтон. В другом варианте осуществления полиэтиленгликольная цепь имеет молекулярный вес от приблизительно 20000 до приблизительно 40000 Дальтон.
Любые глюкагоновые пептиды, описанные выше, можно дополнительно модифицировать так, чтобы они содержали ковалентную или нековалентную внутримолекулярную мостиковую связь или аминокислоту, стабилизирующую альфа-спираль, в C-концевой части глюкагонового пептида (аминокислотные положения 12-29). В соответствии с некоторыми вариантами осуществления глюкагоновый пептид содержит любую одну или более из модификаций, описанных выше, в добавление к аминокислотной замене в положениях 16, 20, 21, или 24 (или их комбинации) α,α-дизамещенной аминокислотой, например, Aib. В соответствии с другим вариантом осуществления глюкагоновый пептид содержит любую одну или более модификаций, рассмотренных выше, в добавление к внутримолекулярной мостиковой связи, например, лактаму, между боковыми цепями аминокислот в положениях 16 и 20 глюкагонового пептида.
В соответствии с некоторыми вариантами осуществления глюкагоновый пептид содержит аминокислотную последовательность SEQ ID NO: 877, где Xaa в положении 3 представляет собой аминокислоту, содержащую боковую цепь структуры I, II, или III:

Структура I
Структура II
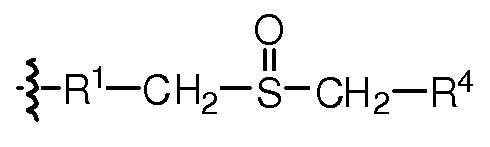
Структура III
где R1 представляет собой C0-3 алкил или C0-3 гетероалкил; R2 представляет собой NHR4 или C1-3 алкил; R3 представляет собой C1-3 алкил; R4 представляет собой H или C1-3 алкил; X представляет собой NH, O или S; и Y представляет собой NHR4, SR3 или OR3. В некоторых вариантах осуществления X представляет собой NH, или Y представляет собой NHR4. В некоторых вариантах осуществления R1 представляет собой C0-2 алкил или C1 гетероалкил. В некоторых вариантах осуществления R2 представляет собой NHR4 или C1 алкил. В некоторых вариантах осуществления R4 представляет собой H или C1 алкил. В примерных вариантах осуществления обеспечивают аминокислоту, содержащую боковую цепь структуры I, где R1 представляет собой CH2-S, X представляет собой NH, и R2 представляет собой CH3 (ацетамидометилцистеин, C(Acm)); R1 представляет собой CH2, X представляет собой NH, и R2 представляет собой CH3(ацетилдиаминобутановая кислота, Dab(Ac)); R1 представляет собой C0 алкил, X представляет собой NH, R2 представляет собой NHR4, и R4 представляет собой H (карбамоилдиаминопропановая кислота, Dap(карбамоил)); или R1 представляет собой CH2-CH2, X представляет собой NH, и R2 представляет собой CH3(ацетилорнитин, Orn(Ac)). В примерных вариантах осуществления обеспечивают аминокислоту, содержащую боковую цепь структуры II, где R1 представляет собой CH2, Y представляет собой NHR4, и R4 представляет собой CH3 (метилглютамин, Q(Me)); В примерных вариантах осуществления обеспечивают аминокислоту, содержащую боковую цепь структуры III, где R1 представляет собой CH2, и R4 представляет собой H (метионинсульфоксид, M(O)); В конкретных вариантах осуществления аминокислота в положении 3 заменена Dab(Ac). Например, глюкагоновые агонисты могут иметь аминокислотную последовательность SEQ ID NO: 863, SEQ ID NO: 869, SEQ ID NO: 871, SEQ ID NO: 872, SEQ ID NO: 873 и SEQ ID NO: 874.
В определенных вариантах осуществления глюкагоновый пептид представляет собой аналог глюкагонового пептида SEQ ID NO: 877. В конкретных аспектах аналог содержит любую из аминокислотных модификаций, описанных в настоящем изобретении, включая, но не ограничиваясь: замену Asn в положении 28 заряженной аминокислотой; замену Asn в положении 28 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замену в положении 28 Asn, Asp или Glu; замену в положении 28 Asp; замену в положении 28 Glu; замену Thr в положении 29 заряженной аминокислотой; замену Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замену в положении 29 Asp, Glu или Lys; замену в положении 29 Glu; вставку 1-3 заряженных аминокислот после положения 29; вставку после положения 29 Glu или Lys; вставку после положения 29 Gly-Lys или Lys-Lys; и их комбинацию.
В определенных вариантах осуществления аналог глюкагонового пептида SEQ ID NO: 877 содержит α,α-дизамещенную аминокислоту, такую как Aib, в одном, двух, трех или во всех положениях 16, 20, 21 и 24.
В определенных вариантах осуществления аналог глюкагонового пептида SEQ ID NO: 877 содержит одно или более из следующего: замену His в положении 1 ненативной аминокислотой, которая снижает подверженность глюкагонового пептида к расщеплению дипептидилпептидазой IV (DPP-IV), замену Ser в положении 2 ненативной аминокислотой, которая снижает подверженность глюкагонового пептида к расщеплению дипептидилпептидазой IV (DPP-IV), замену Thr в положении 7 аминокислотой, не содержащей гидроксильной группы, например, Abu или Ile; замену Tyr в положении 10 Phe или Val; замену Lys в положении 12 Arg; замену Asp в положении 15 Glu, замену Ser в положении 16 Thr или Aib; замену Gln в положении 20 Ala или Aib; замену Asp в положении 21 Glu; замену Gln в положении 24 Ala или Aib; замену Met в положении 27 Leu или Nle; делецию аминокислот в положениях 27-29; делецию аминокислот в положениях 28-29; делецию аминокислот в положениях 29; присоединение аминокислотной последовательности SEQ ID NO: 820 к C-концу, где аминокислота в положении 29 представляет собой Thr или Gly, или их комбинация.
В соответствии с конкретными вариантами осуществления глюкагоновый пептид содержит аминокислотную последовательность любой из SEQ ID NO: 862-867 и 869-874.
В определенных вариантах осуществления аналог глюкагонового пептида, содержащий SEQ ID NO: 877, содержит гидрофильную группу, например, PEG, ковалентно связанную с аминокислотой в любом из положений 16, 17, 20, 21, 24 и 29 или с C-концевой аминокислотой.
В определенных вариантах осуществления аналог глюкагонового пептида, содержащий SEQ ID NO: 877, содержит аминокислоту, содержащую боковую цепь, ковалентно связанную необязательно через спейсер с ацильной группой или алкильной группой, где ацильная группа или алкильная группа является ненативной для встречающейся в природе аминокислоты. Ацильная группа в некоторых вариантах осуществления представляет собой ацильную группу C4-C30 жирной кислоты. В других вариантах осуществления алкильная группа представляет собой C4-C30 алкил. В конкретных аспектах ацильная группа или алкильная группа ковалентно присоединена к боковой цепи аминокислоты в положении 10. В некоторых вариантах осуществления аминокислота в положении 7 представляет собой Ile или Abu.
Глюкагоновый агонист может представлять собой пептид, содержащий аминокислотную последовательность любой из SEQ ID NO: 801-919, необязательно с вплоть до 1, 2, 3, 4 или 5 дополнительными модификациями, которые сохраняют глюкагоновую агонистическую активность. В определенных вариантах осуществления глюкагоновый агонист содержит аминокислоты любой из SEQ ID NO: 859-919.
Родственные глюкагону пептиды класса 2
В определенных вариантах осуществления родственный глюкагону пептид представляет собой родственный глюкагону пептид класса 2, который описан в настоящем изобретении и в международной публикации патента WO 2010/011439, и заявке США 61/187578, (поданной 16 июня 2009), содержания которых включены с помощью ссылки во всей своей полноте.
Биологические последовательности, упоминаемые в следующем параграфе (SEQ ID NO: 1001-1262), относящиеся к родственным глюкагону пептидам класса 2, соответствуют SEQ ID NO: 1-262 в международной публикации патента WO 2010/011439. SEQ ID NO: 1263-1275, относящиеся к родственным глюкагону пептидам класса 2, соответствуют SEQ ID NO: 657-669 в заявке США No. 61/187578.
Активность
Нативный глюкагон не активирует GIP рецептор и обычно обладает приблизительно 1% активности нативного GLP-1 относительно GLP-1 рецептора. Модификации в нативной глюкагоновой последовательности, описанные в настоящем изобретении, дают родственные глюкагону пептиды класса 2, которые могут обладать большой глюкагоновой активностью, равной или большей, чем активность нативного глюкагона (SEQ ID NO: 1001), большой GIP активностью, равной или большей, чем активность нативного GIP (SEQ ID NO: 1004), и/или большой GLP-1 активностью, равной или большей, чем активность нативного GLP-1. В связи с этим, родственный глюкагону пептид класса 2 может представлять собой один из глюкагон/GIP соагониста, глюкагон/GIP/GLP-1 триагониста, GIP/GLP-1 соагониста или GIP агонистического глюкагонового пептида, как дополнительно описано в настоящем изобретении.
В некоторых вариантах осуществления родственные глюкагону пептиды класса 2, описанные в настоящем изобретении, обладают EC50 для активности по GIP рецепторной активации приблизительно 100 нМ или меньше, или приблизительно 75, 50, 25, 10, 8, 6, 5, 4, 3, 2 или 1 нМ или меньше. В некоторых вариантах осуществления родственные глюкагону пептиды класса 2 обладают EC50 для активации глюкагонового рецептора приблизительно 100 нМ или меньше, или приблизительно 75, 50, 25, 10, 8, 6, 5, 4, 3, 2 или 1 нМ или меньше. В некоторых вариантах осуществления родственные глюкагону пептиды класса 2 обладают EC50 относительно GLP-1 рецепторной активации приблизительно 100 нМ или меньше или приблизительно 75, 50, 25, 10, 8, 6, 5, 4, 3, 2 или 1 нМ или меньше. Активацию рецептора можно измерить in vitro анализами, измеряя цАМФ индукцию в HEK293 клетках, сверхэкспрессирующих рецептор, например, анализируя HEK293 клетки, совместно трансфицированные ДНК, кодирующей глюкагоновый рецептор, и люциферазным геном, соединенным с чувствительным к цАМФ элементом, как описано в примере 2.
В некоторых вариантах осуществления родственные глюкагону пептиды класса 2 обладают по меньшей мере приблизительно 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175% или 200% или большей активностью относительно GIP рецептора по сравнению с нативным GIP (GIP эффективность). В некоторых вариантах осуществления глюкагоновые пептиды, описанные в настоящем изобретении, обладают не более чем 1000%, 10000%, 100000% или 1000000% активностью относительно GIP рецептора по сравнению с нативным GIP. В некоторых вариантах осуществления родственные глюкагону пептиды класса 2 обладают по меньшей мере приблизительно 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175%, 200%, 250%, 300%, 350%, 400%, 450% или 500% или большей активностью относительно глюкагонового рецептора по сравнению с нативным глюкагоном (глюкагоновая эффективность). В некоторых вариантах осуществления глюкагоновые пептиды, описанные в настоящем изобретении, обладают не более чем 1000%, 10000%, 100000% или 1000000% активностью относительно глюкагонового рецептора по сравнению с нативным глюкагоном. В некоторых вариантах осуществления родственные глюкагону пептиды класса 2 обладают по меньшей мере приблизительно 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175% или 200% или большей активностью относительно GLP-1 рецептора по сравнению с нативным GLP-1 (GLP-1 эффективность). В некоторых вариантах осуществления глюкагоновые пептиды, описанные в настоящем изобретении, обладают не более чем 1000%, 10000%, 100000% или 1000000% активностью относительно GLP-1 рецептора по сравнению с нативным GLP-1. Активность родственных глюкагону пептидов класса 2 относительно какого-либо рецептора по сравнению с нативным лигандом рецептора рассчитывают как обратное отношение EC50 для родственного глюкагону пептида класса 2 относительно нативного лиганда.
В некоторых вариантах осуществления родственные глюкагону пептиды класса 2 обладают активностью и относительно глюкагонового рецептора, и относительно GIP рецептора ("глюкагон/GIP соагонисты"). Данные родственные глюкагону пептиды класса 2 потеряли селективность нативного глюкагона к глюкагоновому рецептору по сравнению с GIP рецептором. В некоторых вариантах осуществления EC50 родственного глюкагону пептида класса 2 относительно GIP рецептора является меньшей, чем приблизительно 50-кратное, 40-кратное, 30-кратное или 20-кратное отличие (в большую или меньшую сторону) от его EC50 относительно глюкагонового рецептора. В некоторых вариантах осуществления GIP эффективность родственного глюкагону пептида класса 2 является меньшей, чем приблизительно 500-, 450-, 400-, 350-, 300-, 250-, 200-, 150-, 100-, 75-, 50-, 25-, 20-, 15-, 10- или 5-кратное отличие (в большую или меньшую сторону) от его глюкагоновой эффективности. В некоторых вариантах осуществления отношение EC50 родственного глюкагону пептида класса 2 относительно GIP рецептора, разделенной на EC50 родственного глюкагону пептида класса 2 относительно глюкагонового рецептора, является меньшим, чем приблизительно 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50 относительно GIP рецептора, разделенной на EC50 относительно глюкагонового рецептора, равно приблизительно 1 или является меньшим, чем приблизительно 1 (например, приблизительно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах осуществления отношение GIP эффективности родственного глюкагону пептида класса 2 к глюкагоновой эффективности родственного глюкагону пептида класса 2 является меньшим, чем приблизительно 500, 450, 400, 350, 300, 250, 200, 150, 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение эффективности относительно GIP рецептора, разделенной на эффективность относительно глюкагонового рецептора, равно приблизительно 1 или является меньшим, чем приблизительно 1 (например, приблизительно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах осуществления GLP-1 активность значительно снижена или устранена, например, аминокислотной модификацией в положении 7, делецией аминокислоты (аминокислот), C-концевых к аминокислоте в положении 27 или 28, дающей 27- или 28-аминокислотный пептид, или их комбинацией.
В другом аспекте, родственные глюкагону пептиды класса 2 обладают активностью относительно глюкагона, GIP и GLP-1 рецепторов ("глюкагон/GIP/GLP-1 триагонисты"). Данные родственные глюкагону пептиды класса 2 потеряли селективность нативного глюкагона к глюкагоновому рецептору по сравнению и с GLP-1, и с GIP рецептором. В некоторых вариантах осуществления EC50 родственного глюкагону пептида класса 2 относительно GIP рецептора является меньшей, чем приблизительно 50-кратное, 40-кратное, 30-кратное или 20-кратное отличие (в большую или меньшую сторону) от его соответствующих EC50 относительно глюкагонового и GLP-1 рецепторов. В некоторых вариантах осуществления GIP эффективность родственного глюкагону пептида класса 2 является меньшей, чем приблизительно 500-, 450-, 400-, 350-, 300-, 250-, 200-, 150-, 100-, 75-, 50-, 25-, 20-, 15-, 10- или 5-кратное отличие (в большую или меньшую сторону) от его глюкагоновой и GLP-1 эффективностей. В некоторых вариантах осуществления отношение EC50 триагониста относительно GIP рецептора, разделенной на EC50 триагониста относительно GLP-1 рецептора, является меньшим, чем приблизительно 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50 относительно GIP рецептора, разделенной на EC50 относительно GLP-1 рецептора, равно приблизительно 1 или является меньшим, чем приблизительно 1 (например, приблизительно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах осуществления отношение GIP эффективности триагониста к GLP-1 эффективности триагониста является меньшим, чем приблизительно 100, 75, 60, 50,40, 30, 20, 15,10 или 5. В некоторых вариантах осуществления отношение эффективности относительно GIP рецептора, разделенной на эффективность относительно GLP-1 рецептора, равно приблизительно 1 или является меньшим, чем приблизительно 1 (например, приблизительно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В родственных вариантах осуществления отношение EC50 триагониста относительно GIP рецептора, разделенной на EC50 триагониста относительно глюкагонового рецептора, является меньшим, чем приблизительно 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50 относительно GIP рецептора, разделенной на EC50 относительно глюкагонового рецептора, равно приблизительно 1 или является меньшим, чем приблизительно 1 (например, приблизительно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах осуществления отношение GIP эффективности триагониста к глюкагоновой эффективности триагониста является меньшим, чем приблизительно 500, 450, 400, 350, 300, 250, 200, 150, 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение эффективности относительно GIP рецептора, разделенной на эффективность относительно глюкагонового рецептора, равно приблизительно 1 или является меньшим, чем приблизительно 1 (например, приблизительно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах осуществления отношение EC50 триагониста относительно GLP-1 рецептора, разделенной на EC50 триагониста относительно глюкагонового рецептора, является меньшим, чем приблизительно 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50 относительно GLP-1 рецептора, разделенной на EC50 относительно глюкагонового рецептора, равно приблизительно 1 или является меньшим, чем приблизительно 1 (например, приблизительно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В некоторых вариантах осуществления отношение GLP-1 эффективности триагониста к глюкагоновой эффективности триагониста является меньшим, чем приблизительно 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение эффективности относительно GLP-1 рецептора, разделенной на эффективность относительно глюкагонового рецептора, равно приблизительно 1 или является меньшим, чем приблизительно 1 (например, приблизительно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2).
В еще другом аспекте, родственные глюкагону пептиды класса 2 обладают активностью относительно GLP-1 и GIP рецепторов, но у которых глюкагоновая активность значительно снижена или устранена ("GIP/GLP-1 соагонисты"), например, аминокислотной модификацией в положении 3. Например, замена в данном положении кислой, основной или гидрофобной аминокислотой (глютаминовой кислотой, орнитином, норлейцином) снижает глюкагоновую активность. В некоторых вариантах осуществления EC50 глюкагонового пептида относительно GIP рецептора является меньшей, чем приблизительно 50-кратное, 40-кратное, 30-кратное или 20-кратное отличие (в большую или меньшую сторону) от его EC50 относительно GLP-1 рецептора. В некоторых вариантах осуществления GIP эффективность родственного глюкагону пептида класса 2 является меньшей, чем приблизительно 25-, 20-, 15-, 10-, или 5-кратное отличие (в большую или меньшую сторону) от его GLP-1 эффективности. В некоторых вариантах осуществления данные родственные глюкагону пептиды класса 2 обладают приблизительно 10% или менее активности нативного глюкагона относительно глюкагонового рецептора, например, приблизительно 1-10%, или приблизительно 0,1-10%, или большей, чем приблизительно 0,1%, но меньшей, чем приблизительно 10%. В некоторых вариантах осуществления отношение EC50 родственного глюкагону пептида класса 2 относительно GIP рецептора, разделенной на EC50 родственного глюкагону пептида класса 2 относительно GLP-1 рецептора, является меньшим, чем приблизительно 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5, и не меньшим, чем 1. В некоторых вариантах осуществления отношение GIP эффективности родственного глюкагону пептида класса 2 к GLP-1 эффективности родственного глюкагону пептида класса 2 является меньшим, чем приблизительно 100, 75, 60, 50, 40, 30, 20, 15, 10, или 5, и не меньшим, чем 1.
В следующем аспекте, родственные глюкагону пептиды класса 2 обладают активностью относительно GIP рецептора, у которых глюкагоновая и GLP-1 активность значительно снижена или устранена ("GIP агонистические глюкагоновые пептиды"), например, аминокислотными модификациями в положениях 3 Glu и 7 Ile. В некоторых вариантах осуществления данные родственные глюкагону пептиды класса 2 обладают приблизительно 10% или менее активности нативного глюкагона относительно глюкагонового рецептора, например, приблизительно 1-10% или приблизительно 0,1-10%, или большей, чем приблизительно 0,1%, 0,5% или 1%, но меньшей, чем приблизительно 1%, 5% или 10%. В некоторых вариантах осуществления данные родственные глюкагону пептиды класса 2 также обладают приблизительно 10% или менее активности нативного GLP-1 относительно GLP-1 рецептора, например, приблизительно 1-10% или приблизительно 0,1-10%, или большей, чем приблизительно 0,1%, 0,5% или 1%, но меньшей чем приблизительно 1%, 5% или 10%.
В некоторых вариантах осуществления, когда родственный глюкагону пептид класса 2 не является пегилированным, EC50 родственного глюкагону пептида класса 2 относительно GIP рецепторной активации равна приблизительно 4, 2, 1 нМ или меньше, или аналог имеет по меньшей мере приблизительно 1%, 2%, 3%, 4% или 5% активности нативного GIP относительно GIP рецептора. В родственных вариантах осуществления EC50 непегилированного родственного глюкагону пептида класса 2 для GLP-1 рецепторной активации равна приблизительно 4, 2, 1 нМ или меньше, или он имеет по меньшей мере приблизительно 1%, 2%, 3%, 4% или 5% активности нативного GLP-1 относительно GLP-1 рецептора. В еще других родственных вариантах осуществления EC50 непегилированного родственного глюкагону пептида класса 2 для активации глюкагонового рецептора равна приблизительно 4, 2, 1 нМ или меньше, или по меньшей мере приблизительно 5%, 10%, 15% или 20% активности нативного глюкагона относительно глюкагонового рецептора. В некоторых вариантах осуществления непегилированный родственный глюкагону пептид класса 2 обладает менее чем приблизительно 1% активности нативного глюкагона относительно глюкагонового рецептора. В других вариантах осуществления непегилированный родственный глюкагону пептид класса 2 обладает менее чем приблизительно 10%, 5% или 1% активности нативного GLP-1 относительно GLP-1 рецептора.
В вариантах осуществления, когда родственные глюкагону пептиды класса 2 соединены с гидрофильными молекулами, такими как PEG, относительные EC50 относительно одного или более рецепторов могут быть большими, например, большими в приблизительно 10 раз. Например, EC50 пегилированного аналога для GIP рецепторной активации равно приблизительно 10 нМ или меньше, или родственный глюкагону пептид класса 2 обладает по меньшей мере приблизительно 0,1%, 0,2%, 0,3%, 0,4% или 0,5% активности нативного GIP относительно GIP рецептора. В родственных вариантах осуществления EC50 пегилированного родственного глюкагону пептида класса 2 для GLP-1 рецепторной активации равно приблизительно 10 нМ или меньше, или он обладает по меньшей мере приблизительно 0,1 %, 0,2%, 0,3%, 0,4% или 0,5% активности нативного GLP-1 относительно GLP-1 рецептора. В еще других родственных вариантах осуществления EC50 пегилированного родственного глюкагону пептида класса 2 для активации глюкагонового рецептора равна приблизительно 10 нМ или меньше, или по меньшей мере приблизительно 0,5%, 1%, 1,5% или 2% активности нативного глюкагона относительно глюкагонового рецептора. В некоторых вариантах осуществления родственный глюкагону пептид класса 2 обладает менее чем приблизительно 1% активности нативного глюкагона относительно глюкагонового рецептора. В других вариантах осуществления родственный глюкагону пептид класса 2 обладает менее чем приблизительно 10%, 5% или 1% активности нативного GLP-1 относительно GLP-1 рецептора.
Модификации
Модификации, описанные в настоящем изобретении, относящиеся к родственному глюкагону пептиду класса 2, позволяют манипулировать глюкагоном (SEQ ID NO: 1001), создавая глюкагоновые пептиды, которые обладают повышенной GIP активностью, глюкагоновой активностью и/или GLP-1 активностью. Другие модификации, описанные в настоящем изобретении, относящиеся к родственному глюкагону пептиду класса 2, увеличивают время полужизни, увеличивают растворимость или увеличивают стабильность полученного в результате пептида. Еще другие модификации, описанные в настоящем изобретении, относящиеся к родственному глюкагону пептиду класса 2, не влияют на активность, или могут вводиться, не устраняя требуемую активность или активности. Любую из комбинаций, относящихся к родственному глюкагону пептиду класса 2, которая служит для тех же целей (например, увеличения GIP активности), можно применять отдельно или в комбинации. Любую одну или наборы комбинаций, относящиеся к родственному глюкагону пептиду класса 2, которые придают улучшенные свойства, можно применять отдельно или в комбинации, например, повышенную GIP и/или GLP-1 активность можно комбинировать с увеличенным временем полужизни. В родственных вариантах осуществления 1, 2, 3, 4, 5, 6 или более аминокислотных модификаций могут представлять собой неконсервативные замены, присоединения или делеции. В некоторых вариантах осуществления 1, 2, 3, 4, 5, 6 или более аминокислотных модификаций могут представлять собой консервативные замены.
Модификации, которые влияют на GIP активность
Повышенную активность относительно GIP рецептора обеспечивают аминокислотной модификацией в положении 1. Например, His в положении 1 заменяют большой ароматической аминокислотой, необязательно Tyr, Phe, Trp, амино-Phe, нитро-Phe, хлор-Phe, сульфо-Phe, 4-пиридил-Ala, метил-Tyr или 3-амино Tyr. Комбинация Tyr в положении 1 со стабилизацией альфа-спирали в области, соответствующей аминокислотам 12-29, дает родственный глюкагону пептид класса 2, который активирует GIP рецептор, а также GLP-1 рецептор и глюкагоновый рецептор. Альфа-спиральную структуру можно стабилизировать, например, образованием ковалентной или нековалентной внутримолекулярной мостиковой связи или заменой и/или вставкой аминокислот в районе положений 12-29 аминокислоты, стабилизирующей альфа-спираль (например, α,α-дизамещенной аминокислоты).
Повышенную активность относительно GIP рецептора также обеспечивают аминокислотными модификациями в положениях 27 и/или 28, и необязательно в положении 29. Например, Met в положении 27 замещают большой алифатической аминокислотой, необязательно Leu, Asn в положении 28 заменяют небольшой алифатической аминокислотой, необязательно Ala, и Thr в положении 29 заменяют небольшой алифатической аминокислотой, необязательно Gly. Замена LAG в положениях 27-29 обеспечивает повышенную GIP активность по сравнению с нативной MNT последовательностью в данных положениях.
Повышенную активность относительно GIP рецептора также обеспечивают аминокислотной модификацией в положении 12. Например, положение 12 замещают большой алифатической неполярной аминокислотой, необязательно Ile.
Повышенную активность относительно GIP рецептора также обеспечивают аминокислотной модификацией в положениях 17 и/или 18. Например, положение 17 замещают полярным остатком, необязательно Gln, и положение 18 замещают небольшой алифатической аминокислотой, необязательно Ala. Замена QA в положениях 17 и 18 обеспечивает повышение GIP активности по сравнению с нативной RR последовательностью в данных положениях.
Повышенную активность относительно GIP рецептора обеспечивают модификациями, которые обеспечивают образование внутримолекулярной мостиковой связи между боковыми цепями аминокислот в положениях от 12 до 29. Например, внутримолекулярная мостиковая связь может быть образована ковалентной связью между боковыми цепями двух аминокислот в положениях i и i+4 или между положениями j и j+3, или между положениями k и k+7. В примерных вариантах осуществления мостиковая связь образуется между положениями 12 и 16, 16 и 20, 20 и 24, 24 и 28 или 17 и 20. В других вариантах осуществления нековалентные взаимодействия, такие как солевые мостики, можно создать между положительно и отрицательно заряженными аминокислотами в данных положениях.
Любую из модификаций, описанных выше, которая увеличивает GIP рецепторную активность, можно применять отдельно или в комбинации. Комбинации модификаций, которые увеличивают GIP рецепторную активность, обычно дают большую GIP активность, чем любая из данных модификаций, введенная отдельно.
Модификации, которые влияют на глюкагоновую активность
В некоторых вариантах осуществления повышенную глюкагоновую эффективность обеспечивают аминокислотной модификацией в положении 16 нативного глюкагона (SEQ ID NO: 1001). В качестве неограничивающего примера, данную повышенную эффективность можно обеспечить заменой встречающегося в природе серина в положении 16 глютаминовой кислотой или другой отрицательно заряженной аминокислотой, содержащей боковую цепь длиной 4 атомов, или альтернативно любой одной из глютамина, гомоглютаминовой кислоты или гомоцистеиновой кислоты, или заряженной аминокислотой, содержащей боковую цепь, содержащую по меньшей мере один гетероатом (например, N, O, S, P) и с длиной боковой цепи приблизительно 4 (или 3-5) атомов. В некоторых вариантах осуществления глюкагоновый пептид сохраняет его первоначальную селективность к глюкагоновому рецептору по сравнению с GLP-1 рецепторами.
Глюкагоновую рецепторную активность можно снизить аминокислотной модификацией в положении 3, например, заменой встречающегося в природе глютамина в положении 3, кислой, основной или гидрофобной аминокислотой. Например, замена в положении 3 глютаминовой кислотой, орнитином или норлейцином значительно снижает или устраняет глюкагоновую рецепторную активность.
Сохраненной или повышенной активности относительно глюкагонового рецептора можно достичь посредством модификации Gln в положении 3 глютаминовым аналогом, как описано в настоящем изобретении. Например, глюкагоновые агонисты могут содержать аминокислотную последовательность любой из SEQ ID NO: 1243-1248, 1250, 1251 и 1253-1256.
Восстановление глюкагоновой активности, которая была снижена аминокислотными модификациями в положениях 1 и 2, обеспечивают модификациями, которые стабилизируют альфа-спиральную структуру C-концевой части (аминокислоты 12-29) глюкагонового пептида или его аналога. Например, внутримолекулярную мостиковую связь можно образовывать ковалентной связью между боковыми цепями двух аминокислот в положениях i и i+4 или между положениями j и j+3, или между положениями k и k+7. В других вариантах осуществления нековалентные взаимодействия, такие как солевые мостики, можно образовывать между положительно и отрицательно заряженными аминокислотами в данных положениях. В еще других вариантах осуществления одну или более α,α-дизамещенных аминокислот вставляют или заменяют в данной C-концевой части (аминокислоты 12-29) в положениях, которые сохраняют требуемую активность. Например, одно, два, три или все из положений 16, 20, 21 или 24 заменены α,α-дизамещенной аминокислотой, например, Aib.
Модификации, которые влияют на GLP-1 активность
Повышенную активность относительно GLP-1 рецептора обеспечивают заменой карбоксильной группы C-концевой аминокислоты нейтрально заряженной группой, такой как амид или эфир.
Повышенную активность относительно GLP-1 рецептора также обеспечивают стабилизацией альфа-спиральной структуры в C-концевой части глюкагона (в районе аминокислот 12-29), например, образованием внутримолекулярной мостиковой связи между боковыми цепями двух аминокислот, или заменой и/или вставкой аминокислот в районе положений 12-29 аминокислоты, стабилизирующей альфа-спираль (например, α,α-дизамещенной аминокислоты), как дополнительно описано в настоящем изобретении. В примерных вариантах осуществления боковые цепи аминокислотных пар 12 и 16, 13 и 17, 16 и 20, 17 и 21, 20 и 24 или 24 и 28 (аминокислотные пары, в которых i = 12, 16, 20 или 24) соединены друг с другом и таким образом стабилизируют глюкагоновую альфа-спираль. В некоторых вариантах осуществления мостиковая связь или линкер имеет длину приблизительно 8 (или приблизительно 7-9) атомов, в частности, когда мостиковая связь образуется между положениями i и i+4. В некоторых вариантах осуществления мостиковая связь или линкер имеет длину приблизительно 6 (или приблизительно 5-7) атомов, в частности, когда мостиковая связь образуется между положениями j и j+3.
В некоторых вариантах осуществления внутримолекулярные мостиковые связи образуют (a) заменой встречающегося в природе серина в положении 16 глютаминовой кислотой или другой отрицательно заряженной аминокислотой, содержащей боковую цепь длиной 4 атома, или альтернативно любой одной из глютамина, гомоглютаминовой кислоты или гомоцистеиновой кислоты, или заряженной аминокислотой, содержащей боковую цепь, содержащую по меньшей мере один гетероатом, (например, N, O, S, P) и с длиной боковой цепи приблизительно 4 (или 3-5) атомов, и (b) заменой встречающегося в природе глютамина в положении 20 другой гидрофильной аминокислотой, содержащей боковую цепь, которая или является заряженной или обладает способностью образовывать водородные связи, и с длиной по меньшей мере приблизительно 5 (или приблизительно 4-6) атомов, например, лизином, цитруллином, аргинином или орнитином. Боковые цепи данных аминокислот в положениях 16 и 20 могут образовывать солевой мостик или могут быть соединены ковалентно. В некоторых вариантах осуществления две аминокислоты соединены друг с другом, образуя лактамное кольцо.
В некоторых вариантах осуществления стабилизацию альфа-спиральной структуры в C-концевой части глюкагонового пептида достигают образованием внутримолекулярной мостиковой связи, отличной от лактамной мостиковой связи. Например, подходящие способы образования ковалентной связи включают любой один или более из олефинового метатезиса, циклизации на основе лантионина, образования дисульфидной мостиковой связи или образования мостиковой связи, содержащей модифицированную серу. Применение α,ω-диаминоалканового линкера, образование мотиковые связи с атомом металла и другие способы циклизации пептида применяют для стабилизации альфа-спирали.
В еще других вариантах осуществления одну или более α,α-дизамещенных аминокислот вставляют или заменяют в данной C-концевой части (аминокислоты 12-29) в положениях, которые сохраняют требуемую активность. Например, одно, два, три или все из положений 16, 20, 21 или 24 заменяют α,α-дизамещенной аминокислотой, например, Aib.
Повышенную активность относительно GLP-1 рецептора обеспечивают аминокислотной модификацией в положении 20, как описано в настоящем изобретении,.
Повышенную активность относительно GLP-1 рецептора обеспечивают присоединением GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096) к C-концу. GLP-1 активность у данных аналогов можно дополнительно увеличить модификацией аминокислоты в положении 18, 28 или 29, или в положении 18 и 29, как описано в настоящем изобретении.
Дополнительное умеренное увеличение GLP-1 эффективности обеспечивают модификацией аминокислоты в положении 10 большим ароматическим аминокислотным остатком, необязательно Trp.
Пониженную активность относительно GLP-1 рецептора обеспечивают, например, аминокислотной модификацией в положении 7, как описано в настоящем изобретении.
Эффективность относительно GLP-1 рецептора можно дополнительно увеличить аланиновой заменой нативного аргинина в положении 18.
Любую из модификаций, описанных выше относительно родственного глюкагону пептида класса 2, которые увеличивают GLP-1 рецепторную активность, можно применять отдельно или в комбинации. Комбинации модификаций, которые увеличивают GLP-1 рецепторную активность, обычно обеспечивают большую GLP-1 активность, чем любая из данных модификаций, введенная отдельно. Например, настоящее изобретение обеспечивает глюкагоновые пептиды, которые содержат модификации в положении 16, в положении 20, и по C-концевой карбоксильной группе, необязательно с ковалентной связью между аминокислотами в положениях 16 и 20; глюкагоновые пептиды, которые содержат модификации в положении 16 и по C-концевой карбоксильной группе; глюкагоновые пептиды, которые содержат модификации в положениях 16 и 20, необязательно с ковалентной связью между аминокислотами в положениях 16 и 20; и глюкагоновые пептиды, которые содержат модификации в положении 20 и по C-концевой карбоксильной группе.
Модификации, которые увеличивают DPP-IV устойчивость
Модификации в положении 1 и/или 2 могут увеличивать устойчивость пептида к расщеплению дипептидилпептидазой IV (DPP IV). Например, положение 1 и/или положение 2 можно заместить устойчивой к DPP-IV аминокислотой, как описано в настоящем изобретении. В некоторых вариантах осуществления аминокислота в положении 2 заменена N-метилаланином.
Наблюдалось, что модификации в положении 2 (например, Aib в положении 2) и в некоторых случаях модификации в положении 1 (например, DMIA в положении 1) могут снижать глюкагоновую активность, иногда значительно; неожиданно оказалось, что данное снижение глюкагоновой активности может быть восстановлено стабилизацией альфа-спиральной структуры в C-концевой части глюкагона (в районе аминокислот 12-29), например, образованием ковалентной связи между боковыми цепями двух аминокислот, как описано в настоящем изобретении. В некоторых вариантах осуществления ковалентная связь образуется между аминокислотами в положениях "i" и "i+4", или положениях "j" и "j+3", например, между положениями 12 и 16, 16 и 20, 20 и 24, 24 и 28 или 17 и 20. В примерных вариантах осуществления данная ковалентная связь представляет собой лактамную мостиковую связь между глютаминовой кислотой в положении 16 и лизином в положении 20. В некоторых вариантах осуществления данная ковалентная связь представляет собой внутримолекулярную мостиковую связь, отличную от лактамной мостиковой связи, как описано в настоящем изобретении.
Модификации, которые ослабляют разложение
В еще дополнительных вариантах осуществления любые родственные глюкагону пептиды класса 2 можно дополнительно модифицировать для увеличения стабильности модификацией аминокислоты в положении 15 и/или 16 SEQ ID NO: 1001 для снижения разложения пептида с течением времени, особенно в кислых или основных буферах. Данные модификации ослабляют расщепление Asp15-Ser16 пептидной связи. В примерных вариантах осуществления аминокислотная модификация в положении 15 представляет собой делецию или замену Asp глютаминовой кислотой, гомоглютаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой. В других примерных вариантах осуществления аминокислотная модификация в положении 16 представляет собой делецию или замену Ser, Thr или Aib. В других примерных вариантах осуществления Ser в положении 16 заменен глютаминовой кислотой или другой отрицательно заряженной аминокислотой, содержащей боковую цепь с длиной 4 атома, или альтернативно любой одной из глютамина, гомоглютаминовой кислоты или гомоцистеиновой кислоты.
В некоторых вариантах осуществления метиониновый остаток, присутствующий в положении 27 нативного пептида, модифицируют, например, делецией или заменой. Данные модификации могут препятствовать окислительному разрушению пептида. В некоторых вариантах осуществления Met в положении 27 заменен лейцином, изолейцином или норлейцином. В некоторых конкретных вариантах осуществления Met в положении 27 заменен лейцином или норлейцином.
В некоторых вариантах осуществления Gln в положении 20 и/или 24 модифицируют, например, делецией или заменой. Данные модификации могут ослаблять разрушение, которое протекает через деамидирование Gln. В некоторых вариантах осуществления Gln в положении 20 и/или 24 заменен Ser, Thr, Ala или Aib. В некоторых вариантах осуществления Gln в положении 20 и/или 24 заменен Lys, Arg, Orn или цитруллином.
В некоторых вариантах осуществления Asp в положении 21 модифицируют, например, делецией или заменой. Данные модификации могут ослаблять разрушение, которое протекает через дегидратацию Asp, давая циклическое сукцинимидное промежуточное соединение, с последующей изомеризацией до изоаспартата. В некоторых вариантах осуществления положение 21 заменено Glu, гомоглютаминовой кислотой или гомоцистеиновой кислотой. В некоторых конкретных вариантах осуществления положение 21 заменено Glu.
Стабилизация альфа-спиральной структуры
Стабилизация альфа-спиральной структуры в C-концевой части родственного глюкагону пептида класса 2 (в районе аминокислот 12-29) дает повышенную GLP-1 и/или GIP активность и восстанавливает глюкагоновую активность, которая была снижена аминокислотными модификациями в положениях 1 и/или 2. Альфа-спиральную структуру можно стабилизировать, например, образованием ковалентной или нековалентной внутримолекулярной мостиковой связи, или заменой и/или вставкой аминокислоты в районе положений 12-29 аминокислоты, стабилизирующей альфа-спираль (например, α,α-дизамещенной аминокислоты). Стабилизацию альфа-спиральной структуры GIP агониста можно осуществлять, как описано в настоящем изобретении.
Ацилирование и алкилирование
В соответствии с некоторыми вариантами осуществления глюкагоновые пептиды, описанные в настоящем изобретении, модифицированы так, чтобы они содержали ацильную группу или алкильную группу, например, ацильную или алкильную группу, которая является ненативной для встречающейся в природе аминокислоты, как описано в настоящем изобретении. Ацилирование или алкилирование может увеличивать время полужизни глюкагоновых пептидов в кровотоке. Ацилирование или алкилирование может предпочтительно замедлять начало действия и/или увеличивать продолжительность действия относительно глюкагонового и/или GLP-1 рецепторов и/или увеличивать устойчивость к протеазам, таким как DPP-IV, и/или увеличивать растворимость. Активность относительно глюкагонового и/или GLP-1, и/или GIP рецепторов глюкагонового пептида может сохраняться после ацилирования. В некоторых вариантах осуществления эффективность ацилированных глюкагоновых пептидов является сравнимой с неацилированными вариантами глюкагоновых пептидов. Родственные глюкагону пептиды класса 2 можно ацилировать или алкилировать в том же положении аминокислоты, где присоединена гидрофильная группа, или в отличном положении аминокислоты, как описано в настоящем изобретении.
В некоторых вариантах осуществления настоящее изобретение обеспечивает глюкагоновый пептид, модифицированный так, чтобы он содержал ацильную группу или алкильную группу, ковалентно связанную с аминокислотой в положении 10 глюкагонового пептида. Глюкагоновый пептид может дополнительно содержать спейсерную группу между аминокислотой в положении 10 глюкагонового пептида и ацильной группой или алкильной группой. В некоторых вариантах осуществления ацильная группа представляет собой жирную кислоту или желчную кислоту, или их соль, например, C4-C30 жирную кислоту, C8-C24 жирную кислоту, холевую кислоту, C4-C30 алкил, C8-C24 алкил, или алкил, содержащий стероидную группу желчной кислоты. Спейсер является любой группой с подходящей реакционноспособной группой для присоединения ацильной или алкильной групп. В примерных вариантах осуществления спейсер включает аминокислоту, дипептид, трипептид, гидрофильный бифункциональный или гидрофобный бифункциональный спейсер. В некоторых вариантах осуществления спейсер выбран из группы, состоящей из: Trp, Glu, Asp, Cys и спейсера, содержащего NH2(CH2CH2O)n(CH2)mCOOH, где m представляет собой любое целое число от 1 до 6, и n представляет собой любое целое число от 2 до 12. Данные ацилированные или алкилированные глюкагоновые пептиды могут также дополнительно содержать гидрофильную молекулу, необязательно полиэтиленгликоль. Любой из вышеуказанных глюкагоновых пептидов может содержать две ацильные группы или две алкильные группы, или их комбинацию.
Конъюгаты и слияния
GIP агонист может быть соединен, необязательно ковалентной связью и необязательно через линкер, с конъюгатным фрагментом, как описано в настоящем изобретении.
В других вариантах осуществления второй пептид представляет собой XGPSSGAPPPS (SEQ ID NO: 1096), где X выбран из одной из 20 стандартных аминокислот, например, глютаминовой кислоты, аспарагиновой кислоты или глицина. В некоторых вариантах осуществления X представляет собой аминокислоту, например, Cys, которая дополнительно содержит гидроксильную группу, ковалентно связанную с боковой цепью данной аминокислоты. Данные C-концевые удлинения увеличивают растворимость и также могут увеличивать GIP или GLP-1 активность. В некоторых вариантах осуществления, где глюкагоновый пептид дополнительно содержит концевое аминокислотное удлинение, карбокси концевая аминокислота заканчивается амидной группой или эфирной группой, отличной от карбоксильной группы.
В некоторых вариантах осуществления, например, в глюкагоновых пептидах, которые содержат C-концевое удлинение, треонин в положении 29 нативного глюкагонового пептида замещен глицином. Например, глюкагоновый пептид, содержащий глициновую замену для треонина в положении 29 и содержащий C-концевое удлинение GPSSGAPPPS (SEQ ID NO: 1095), является в четыре раза более активным относительно GLP-1 рецептора, чем нативный глюкагон, модифицированный так, чтобы он содержал то же C-концевое удлинение. Данную T29G замену можно применять в сочетании с другими модификациями, описанными в настоящем изобретении, для увеличения сродства глюкагоновых пептидов к GLP-1 рецептору. Например, T29G замену можно комбинировать с S16E и N20K аминокислотными заменами, необязательно с лактамной мостиковой связью между аминокислотами 16 и 20, и необязательно с присоединением PEG цепи, как описано в настоящем изобретении.
В некоторых вариантах осуществления аминокислоту присоединяют к C-концу, и дополнительная аминокислота выбрана из группы, состоящей из глютаминовой кислоты, аспарагиновой кислоты и глицина.
Модификации, которые увеличивают растворимость
В другом варианте осуществления растворимость любого из глюкагоновых пептидов можно быть увеличена аминокислотными заменами и/или присоединениями, которые вводят заряженную аминокислоту в C-концевую часть пептида, предпочтительно в положение, C-концевое к положению 27 SEQ ID NO: 1001. Необязательно, одну, две или три заряженные аминокислоты можно вводить в C-концевую часть, предпочтительно C-концевую к положению 27. В некоторых вариантах осуществления нативная аминокислота (аминокислоты) в положениях 28 и/или 29 заменены одной или двумя заряженными аминокислотами, и/или в следующем варианте осуществления одну-три заряженные аминокислоты также присоединяют к C-концу пептида. В примерных вариантах осуществления одна, две или все из данных заряженных аминокислот являются отрицательно заряженными. В некоторых вариантах осуществления отрицательно заряженная аминокислота (кислая аминокислота) представляет собой аспарагиновую кислоту или глютаминовую кислоту.
Дополнительные модификации, например, консервативные замены, можно вводить в глюкагоновый пептид, которые, тем не менее, позволяют ему сохранять GIP активность (и необязательно GLP-1 активность и/или глюкагоновую активность).
Другие модификации
Любую из модификаций, описанных выше относительно пептида класса 2, которые увеличивают или уменьшают GIP активность, которые увеличивают или уменьшают глюкагоновую рецепторную активность и которые увеличивают GLP-1 рецепторную активность, можно применять отдельно или в комбинации. Любую из модификаций, описанных выше относительно родственного глюкагону пептида класса 2, можно также комбинировать с другими модификациями, которые придают другие требуемые свойства, такие как повышенная растворимость и/или стабильность и/или продолжительность действия, как описано в настоящем изобретении относительно родственных глюкагону пептидов класса 2. Альтернативно, любую из модификаций, описанных выше относительно родственных глюкагону пептидов класса 2, можно комбинировать с другими модификациями, описанными в настоящем изобретении относительно родственных глюкагону пептидов класса 2, которые незначительно влияют на растворимость или стабильность или активность. Примерные модификации включают, но не ограничиваясь этим:
(A) увеличение растворимости, например, введением одной, двух, трех или более заряженных аминокислот в C-концевую часть нативного глюкагона, предпочтительно в положение, C-концевое к положению 27. Данную заряженную аминокислоту можно вводить заменой нативной аминокислоты заряженной аминокислотой, например, в положениях 28 или 29, или альтернативно присоединением заряженной аминокислоты, например, после положения 27, 28 или 29. В примерных вариантах осуществления одна, две, три или все из заряженных аминокислот являются отрицательно заряженными. В других вариантах осуществления одна, две, три или все из заряженных аминокислот являются положительно заряженными. Данные модификации увеличивают растворимость, например, обеспечивают по меньшей мере 2-кратную, 5-кратную, 10-кратную, 15-кратную, 25-кратную, 30-кратную или более растворимость по сравнению с нативным глюкагоном при заданном pH между приблизительно 5,5 и 8, например, pH 7, при измерении после 24 часов при 25°C;
(B) увеличение растворимости и продолжительности действия или времени полужизни в кровотоке присоединением гидрофильной группы, такой как полиэтиленгликольная цепь, как описано в настоящем изобретении, например, в положении 16, 17, 20, 21, 24 или 29, в C-концевом удлинении, или к C-концевой аминокислоте пептида;
(C) увеличение растворимости и/или продолжительности действия или время полужизни в кровотоке и/или задержку начала действия ацилированием или алкилированием глюкагонового пептида, как описано в настоящем изобретении;
(D) увеличение продолжительности действия или времени полужизни в кровотоке за счет придания устойчивости к расщеплению дипептидилпептидазой IV (DPP IV) модификацией аминокислоты в положении 1 или 2, как описано в настоящем изобретении;
(E) увеличение стабильности модификацией Asp в положении 15, например, делецией или заменой глютаминовой кислотой, гомоглютаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой. Данные модификации могут ослаблять разрушение или расщепление при pH в диапазоне 5,5-8, например, сохраняя по меньшей мере 75%, 80%, 90%, 95%, 96%, 97%, 98% или 99%, вплоть до 100% первоначального пептида после 24 часов при 25°C. Данные модификации ослабляют расщепление пептидной связи между Asp15-Ser16;
(F) увеличение стабильности модификацией Ser в положении 16, например, заменой Thr или Aib. Данные модификации также ослабляют расщепление пептидной связи между Asp 15-Ser 16;
(G) увеличение стабильности модификацией метионина в положении 27, например, заменой лейцином или норлейцином. Данные модификации также ослабляют окислительное разрушение. Стабильность можно также увеличить модификацией Gln в положении 20 или 24, например, заменой Ser, Thr, Ala или Aib. Данные модификации могут ослаблять разрушение, которое протекает через дезамидирование Gln. Стабильность можно повысить модификацией Asp в положении 21, например, заменой Glu. Данные модификации могут ослаблять разрушение, которое протекает через дегидратацию Asp, давая циклическое сукцинимидное промежуточное соединение с последующей изомеризацией до изоаспартата;
(H) неконсервативные или консервативные замены, присоединения или делеции, которые незначительно влияют на активность, например, консервативные замены в одном или более положениях 2, 5,9, 10, 11, 12, 13, 14, 15, 16, 17, 18,19, 20, 21, 24, 27, 28 или 29; замену одного или более из данных положений Ala; делеция аминокислот в одном или более из положений 27, 28 или 29; или делеция аминокислоты 29 необязательно в комбинации с C-концевым амидом или эфиром вместо C-концевой карбоксильной группы; замену Lys в положении 12 Arg; замену Tyr в положении 10 Val или Phe.
Сохранение активности после пегилирования обеспечивают присоединением GPSSGAPPPS (SEQ ID NO: 1095) к C-концу.
Некоторые положения нативного глюкагонового пептида можно модифицировать при сохранении, по меньшей мере, некоторой доли активности исходного пептида. Соответственно, заявители ожидают, что одну или более аминокислот, расположенных в положениях 2, 5, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29, можно заместить аминокислотой, отличной от аминокислоты, присутствующей в нативном глюкагоновом пептиде, и, тем не менее, сохранить активность относительно глюкагонового рецептора.
В некоторых вариантах осуществления положение 18 заменено аминокислотой, выбранной из группы, состоящей из Ala, Ser, или Thr. В некоторых вариантах осуществления аминокислота в положении 20 заменена Ser, Thr, Lys, Arg, Orn, цитруллином или Aib. В некоторых вариантах осуществления положение 21 заменено Glu, гомоглютаминовой кислотой или гомоцистеиновой кислотой. В некоторых вариантах осуществления глюкагоновый пептид содержит 1-10 аминокислотных модификаций, выбранных из положений 16, 17, 18, 20, 21, 23, 24, 27, 28 и 29. В примерных вариантах осуществления модификации представляют собой одну или более аминокислотных замен, выбранных из группы, состоящей из Gln17, Ala18, Glu21, Ile23, Ala24, Val27 и Gly29. В некоторых вариантах осуществления 1-2 аминокислоты, выбранные из положений 17-26, отличаются от аминокислот исходного пептида. В других вариантах осуществления 1-2 аминокислоты, выбранные из положений 17-22, отличаются от аминокислот исходного пептида. В еще других вариантах осуществления модификации представляют собой Gln17, Ala18, Glu21, Ile23 и Ala24.
В некоторых вариантах осуществления одну или более аминокислот присоединяют к карбокси концу глюкагонового пептида. Аминокислота обычно выбрана из одной из 20 стандартных аминокислот, и в некоторых вариантах осуществления аминокислота содержит амидную группу вместо карбоксильной группы нативной аминокислоты. В примерных вариантах осуществления присоединенная аминокислота выбрана из группы, состоящей из глютаминовой кислоты и аспарагиновой кислоты и глицина.
Другие модификации, которые не устраняют активность, включая W10 или R20
В некоторых вариантах осуществления родственные глюкагону пептиды класса 2, описанные в настоящем изобретении, модифицированы укорачиванием C-конца на один или два аминокислотных остатка, тем не менее, они сохраняют аналогичные активность и эффективность относительно глюкагонового, GLP-1 и/или GIP рецепторов. В связи с этим, аминокислоту в положении 29 и/или 28 можно удалить.
Примерные варианты осуществления
В соответствии с некоторыми вариантами осуществления настоящего изобретения, аналог глюкагона (SEQ ID NO: 1001), обладающий GIP агонистической активностью, имеет SEQ ID NO: 1001 с (a) аминокислотной модификацией в положении 1, которая придает GIP агонистическую активность, (b) модификацией, которая стабилизирует альфа-спиральную структуру C-концевой части (аминокислоты 12-29) аналога, и (c) необязательно 1-10 (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10) дополнительными аминокислотными модификациями. В некоторых вариантах осуществления аналог обладает по меньшей мере приблизительно 1% активности нативного GIP относительно GIP рецептора или любой другой степенью активности относительно GIP рецептора, описанной в настоящем изобретении.
В определенных вариантах осуществления модификация, которая стабилизирует альфа-спиральную структуру, представляет собой модификацию, которая дает или вводит внутримолекулярную мостиковую связь, включая, например, ковалентную внутримолекулярную мостиковую связь, такую как любая из тех, что описаны в настоящем изобретении. Ковалентная внутримолекулярная мостиковая связь в некоторых вариантах осуществления представляет собой лактамную мостиковую связь. Лактамная мостиковая связь аналога данных вариантов осуществления может представлять собой лактамную мостиковую связь, как описано в настоящем изобретении. См., например, идеи относительно лактамных мостиковых связей в параграфе "Стабилизация альфа-спиральной структуры". Например, лактамная мостиковая связь может представлять собой лактамную мостиковую связь, которая находится между боковыми цепями аминокислот в положениях i и i+4 или между боковыми цепями аминокислот в положениях j и j+3, где i равно 12, 13, 16, 17, 20 или 24, и где j равно 17. В определенных вариантах осуществления лактамная мостиковая связь может находиться между аминокислотами в положениях 16 и 20, где одна из аминокислот в положениях 16 и 20 заменена Glu, и другая из аминокислот в положениях 16 и 20 заменена Lys.
В альтернативных вариантах осуществления модификация, которая стабилизирует альфа-спиральную структуру, представляет собой введение одной, двух, трех или четырех α,α-дизамещенных аминокислот в положении(-ях) 16, 20, 21 и 24 аналога. В некоторых вариантах осуществления α,α-дизамещенная аминокислота представляет собой Aib. В определенных аспектах α,α-дизамещенная аминокислота (например, Aib) находится в положении 20, и аминокислота в положении 16 заменена положительно заряженной аминокислотой, такой как, например, аминокислота формулы IV, которая описана в настоящем изобретении. Аминокислота формулы IV может представлять собой гомо-Lys, Lys, Orn или 2,4-диаминомасляную кислоту (Dab).
В конкретных аспектах настоящего изобретения аминокислотная модификация в положении 1 представляет собой замену His аминокислотой, не содержащей в боковой цепи имидазольного кольца, например, большой ароматической аминокислотой (например, Tyr).
В определенных аспектах аналог глюкагона содержит аминокислотные модификации в одном, двух или всех положениях 27, 28 и 29. Например, Met в положении 27 может быть заменен большой алифатической аминокислотой, необязательно Leu, Asn в положении 28 может быть заменен небольшой алифатической аминокислотой, необязательно Ala, Thr в положении 29 может быть заменен небольшой алифатической аминокислотой, необязательно Gly, или комбинация двух или трех из вышеуказанных. В конкретных вариантах осуществления аналог глюкагона содержит Leu в положении 27, Ala в положении 28, и Gly или Thr в положении 29.
В определенных вариантах осуществления настоящего изобретения аналог глюкагона содержит удлинение из 1-21 аминокислот, C-концевое к аминокислоте в положении 29. Удлинение может содержать, например, аминокислотную последовательность SEQ ID NO: 1095 или 1096. Кроме того или альтернативно, аналог глюкагона может содержать удлинение, где 1-6 аминокислот удлинения являются положительно заряженными аминокислотами. Положительно заряженные аминокислоты могут представлять собой аминокислоты формулы IV, включая, но не ограничиваясь этим, Lys, гомо-Lys, Orn и Dab.
Аналог глюкагона в некоторых вариантах осуществления ацилирован или алкилированная, как описано в настоящем изобретении. Например, ацильная или алкильная группа может быть присоединена к аналогу глюкагона, с или без спейсера, в положении 10 или 40 аналога, как дополнительно описано в настоящем изобретении. Кроме того или альтернативно, аналог может быть модифицирован так, чтобы он содержал гидрофильную группу, как дополнительно описано в настоящем изобретении. Кроме того, в некоторых вариантах осуществления аналог содержит любую одну или комбинацию следующих модификаций:
(a) Ser в положении 2, замененный D-Ser, Ala, D-Ala, Gly, N-метил-Ser, Aib, Val или α-амино-N-масляной кислотой;
(b) Tyr в положении 10, замененный Tip, Lys, Orn, Glu, Phe или Val:
(c) добавление ацильной группы к Lys в положении 10;
(d) Lys в положении 12, замененный Arg или Ile;
(e) Ser в положении 16, замененный Glu, Gln, гомоглютаминовой кислотой, гомоцистеиновой кислотой, Thr, Gly или Aib;
(f) Arg в положении 17, замененный Gln;
(g) Arg в положении 18, замененнный Ala, Ser, Thr или Gly;
(h) Gln в положении 20, замененный Ser, Thr, Ala, Lys, цитруллином, Arg, Orn или Aib;
(i) Asp в положении 21, замененный Glu, гомоглютаминовой кислотой, гомоцистеиновой кислотой;
(j) Val в положении 23, замененный Ile;
(k) Gln в положении 24, замененный Asn, Ser, Thr, Ala, или Aib;
(l) и консервативную замену в любом положении 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 8, 19, 20, 21, 24, 27, 28 и 29.
В примерных вариантах осуществления аналог глюкагона (SEQ ID NO: 1001), обладающий GIP агонистической активностью, содержит следующие модификации:
(a) аминокислотную модификацию в положении 1, которая придает GIP агонистическую активность,
(b) лактамную мостиковую связь между боковыми цепями аминокислот в положениях i и i+4 или между боковыми цепями аминокислот в положениях j и j+3, где i равно 12, 13, 16, 17, 20 или 24, и где j равно 17,
(c) аминокислотные модификации в одном, двух или всех положениях 27, 28 и 29, например, аминокислотные модификации в положении 27 и/или 28, и
(d) 1-9 или 1-6 дополнительных аминокислотных модификаций, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 дополнительных аминокислотных модификаций,
и EC50 аналога для GIP рецепторной активации равно приблизительно 10 нМ или меньше.
Лактамная мостиковая связь аналога данных вариантов осуществления может представлять собой лактамную мостиковую связь, как описано в настоящем изобретении. См., например, идеи относительно лактамных мостиковых связей в параграфе "Стабилизация альфа-спиральной структуры". Например, лактамная мостиковая связь может располагаться между аминокислотами в положениях 16 и 20, где одна из аминокислот в положениях 16 и 20 заменена Glu, и другая из аминокислот в положениях 16 и 20 заменена Lys.
В соответствии с данными вариантами осуществления аналог может содержать, например, аминокислотную последовательность любой из SEQ ID NO: 1005-1094.
В других примерных вариантах осуществления аналог глюкагона (SEQ ID NO: 1001), обладающий GIP агонистической активностью, содержит следующие модификации:
(a) аминокислотная модификация в положении 1, которая придает GIP агонистическую активность,
(b) одна, две, три или все из аминокислот в положениях 16, 20, 21, и 24 аналога заменены α,α-дизамещенной аминокислотой,
(c) аминокислотные модификации в одном, двух или всех положениях 27, 28 и 29, например, аминокислотные модификации в положении 27 и/или 28, и
(d) 1-9 или 1-6 дополнительных аминокислотных модификаций, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 дополнительных аминокислотных модификаций,
и EC50 аналога для GIP рецепторной активации равна приблизительно 10 нМ или меньше.
α,α-Дизамещенная аминокислота аналога данных вариантов осуществления может представлять собой любую α,α-дизамещенную аминокислоту, включая, но не ограничиваясь этим, аминоизомасляную кислоту (Aib), аминокислоту, дизамещенную одинаковыми или различными группами, выбранными из метила, этила, пропила и н-бутила, или циклооктаном или циклогептаном (например, 1-аминоциклооктан-1-карбоновая кислота). В определенных вариантах осуществления α,α-дизамещенная аминокислота представляет собой Aib. В определенных вариантах осуществления аминокислота в положении 20 заменена α,α-дизамещенной аминокислотой, например, Aib.
В соответствии с данными вариантами осуществления аналог может содержать, например, аминокислотную последовательность любой из SEQ ID NO: 1099-1141, 1144-1164, 1166-1169 и 1173-1178.
В еще других вариантах осуществления аналог глюкагона (SEQ ID NO: 1001), обладающий GIP агонистической активностью, содержит следующие модификации:
(a) аминокислотная модификация в положении 1, которая придает GIP агонистическую активность,
(b) аминокислотная замена Ser в положении 16 аминокислотой формулы IV:

[формула IV]
где n равен 1-16, или 1-10, или 1-7, или 1-6, или 2-6, каждый из R1 и R2 независимо выбран из группы, состоящей из H, C1-C18 алкила, (C1-C18 алкил)OH, (C1-C18 алкил)NH2, (C1-C18 алкил)SH, (C0-C4 алкил)(C3-C6)циклоалкила, (C0-C4 алкил)(C2-C5 гетероциклил), (C0-C4 алкил)(C6-C10 арил)R7 и (C1-C4 алкил)(C3-C9 гетероарил), где R7 представляет собой H или OH, и боковая цепь аминокислоты формулы IV содержит свободную амино группу,
(c) аминокислотная замена Gln в положении 20 альфа, альфа-дизамещенной аминокислотой,
(d) аминокислотные модификации в одном, двух или всех положениях 27, 28 и 29, например, аминокислотные модификации в положении 27 и/или 28, и
(e) 1-9 или 1-6 дополнительных аминокислотных модификаций, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 дополнительных аминокислотных модификаций,
и EC50 аналога для GIP рецепторной активации равна приблизительно 10 нМ или меньше.
Аминокислота формулы IV аналога данных вариантов осуществления может представлять собой любую аминокислоту, такую как, например, аминокислота формулы IV, где n равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16. В определенных вариантах осуществления n равен 2, 3, 4, или 5, в данном случае, аминокислота представляет собой Dab, Orn, Lys или гомо-Lys, соответственно.
Альфа,альфа-дизамещенная аминокислота аналога данных вариантов осуществления может представлять собой любую альфа,альфа-дизамещенную аминокислоту, включая, но не ограничиваясь этим, аминоизомасляную кислоту (Aib), аминокислоту, дизамещенную одинаковыми или различными группами, выбранными из метила, этила, пропила и н-бутила, или циклооктаном или циклогептаном (например, 1-аминоциклооктан-1-карбоновая кислота). В определенных вариантах осуществления альфа,альфа-дизамещенная аминокислота представляет собой Aib.
В соответствии с данными вариантами осуществления аналог может содержать, например, аминокислотную последовательность любой из SEQ ID NO: 1099-1165.
В еще других вариантах осуществления аналог глюкагона (SEQ ID NO: 1001), обладающий GIP агонистической активностью, содержит:
(a) аминокислотную модификацию в положении 1, которая придает GIP агонистическую активность, и
(b) удлинение от приблизительно 1 до приблизительно 21 аминокислот, C-концевых к аминокислоте в положении 29, где по меньшей мере одна из аминокислот удлинения ацилирована или алкилирована,
где EC50 аналога для GIP рецепторной активации равна приблизительно 10 нМ или меньше.
В некоторых вариантах осуществления ацилированная или алкилированная аминокислота представляет собой аминокислоту формулы I, II или III. В более конкретных вариантах осуществления аминокислота формулы I представляет собой Dab, Orn, Lys, или гомо-Lys. Кроме того, в некоторых вариантах осуществления удлинение от приблизительно 1 до приблизительно 21 аминокислот содержит аминокислотную последовательность GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), где X представляет собой любую аминокислоту, или GPSSGAPPPK (SEQ ID NO: 1170) или XGPSSGAPPPK (SEQ ID NO: 1171) или XGPSSGAPPPSK (SEQ ID NO: 1172), где X представляет собой Gly или небольшую алифатическую или неполярную или по существу неполярную аминокислоту. В некоторых вариантах осуществления удлинение от приблизительно 1 до приблизительно 21 аминокислот может содержать последовательности, содержащие одну или более консервативных замен по сравнению с SEQ ID NO: 1095, 1096, 1170, 1171 или 1172. В некоторых вариантах осуществления ацилированная или алкилированная аминокислота расположена в положении 37, 38, 39, 40, 41, 42, или 43 аналога с удлиненным C-концом. В определенных вариантах осуществления ацилированная или алкилированная аминокислота расположена в положении 40 аналога с удлиненным C-концом.
В некоторых вариантах осуществления аналог, обладающий GIP агонистической активностью, дополнительно содержит аминокислотные модификации в одном, двух или всех положениях 27, 28 и 29, например, аминокислотные модификации в положении 27 и/или 28.
В любом из указанных выше примерных вариантов осуществления, аминокислотная модификация в положении 1, которая придает GIP агонистическую активность, может представлять собой замену His аминокислотой, не содержащей имидазол в боковой цепи. Аминокислотная модификация в положении 1 может представлять собой, например, замену His большой ароматической аминокислотой. В некоторых вариантах осуществления большая ароматическая аминокислота представляет собой любую аминокислоту из аминокислот, описанных в настоящем изобретении, включая, например, Tyr.
В определенных аспектах аналог не содержит аминокислотную модификацию в положении 1, где модификация придает GIP агонистическую активность. В некоторых аспектах аминокислота в положении 1 не является большой ароматической аминокислотой, например, Tyr. В некоторых вариантах осуществления аминокислота в положении 1 представляет собой аминокислоту, содержащую имидазольное кольцо, например, His, аналоги His. В определенных вариантах осуществления аналог не является любым из соединений, описанных в опубликованной международной патентной заявке WO 2010/011439. В определенных аспектах аналог содержит аминокислотную последовательность любой из SEQ ID NO: 1263-1275.
Кроме того, что касается указанных выше примерных вариантов осуществления, аминокислотные модификации в одном, двух или всех положениях 27, 28, и 29 могут быть любыми модификациями из модификаций в данных положениях, описанных в настоящем изобретении. Например, Met в положении 27 может быть заменен большой алифатической аминокислотой, необязательно Leu, Asn в положении 28 может быть заменен небольшой алифатической аминокислотой, необязательно Ala, и/или Thr в положении 29 может быть заменен небольшой алифатической аминокислотой, необязательно Gly. Альтернативно, аналог может содержать данные аминокислотные модификации в положении 27 и/или 28.
Аналог указанных выше примерных вариантов осуществления может дополнительно содержать 1-9 или 1-6 дополнительные аминокислотные модификации, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 дополнительные аминокислотные модификации, такие как, например, любая из модификаций, описанных в настоящем изобретении, которая увеличивает или снижает активность относительно любого из GIP, GLP-1 и глюкагонового рецепторов, увеличивает растворимость, увеличивает продолжительность действия или время полужизни в кровотоке, замедляет начало действия или увеличивает стабильность. Аналог может дополнительно содержать, например, аминокислотную модификацию в положении 12, необязательно, замену Ile, и/или аминокислотные модификации в положениях 17 и 18, необязательно замену Q в положении 17 и A в положении 18, и/или присоединение GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), или последовательности, содержащей одну или более консервативных замен по сравнению с SEQ ID NO: 1095 или 1096, к C-концу. Аналог может содержать одну или более из следующих модификаций:
(i) Ser в положении 2, замененный D-Ser, Ala, D-Ala, Gly, N-метил-Ser, Aib, Val или α-амино-N-масляной кислотой;
(ii) Tyr в положении 10, замененный Trp, Lys, Orn, Glu, Phe или Val;
(iii) присоединение ацильной группы к Lys в положении 10;
(iv) Lys в положении 12, замененный Arg;
(v) Ser в положении 16, замененный Glu, Gln, гомоглютаминовой кислотой, гомоцистеиновой кислотой, Thr, Gly или Aib;
(vi) Arg в положении 17, замененный Gln;
(vii) Arg в положении 18, замененный Ala, Ser, Thr или Gly;
(viii) Gln в положении 20, замененный Ala, Ser, Thr, Lys, цитруллином, Arg, Orn или Aib;
(ix) Asp в положении 21, замененный Glu, гомоглютаминовой кислотой, гомоцистеиновой кислотой;
(x) Val в положении 23, замененный Ile;
(xi) Gln в положении 24, замененный Asn, Ala, Ser, Thr или Aib; и
(xii) консервативную замену в любом из положений 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 27, 28, и 29.
Аналог в некоторых вариантах осуществления содержит комбинацию модификаций (i)-(xii). Альтернативно или кроме того, аналог может содержать аминокислотную модификацию в положении 3 (например, аминокислотная замена Gln Glu), где аналог обладает менее чем 1% активности глюкагона относительно глюкагонового рецептора. Альтернативно или кроме того, аналог может содержать аминокислотную модификацию в положении 7 (например, аминокислотная замена Thr аминокислотой, не содержащей гидроксильной группы, например, Abu или Ile), где аналог обладает менее чем приблизительно 10% активности GLP-1 относительно GLP-1 рецептора.
Что касается примерных вариантов осуществления, аналог может быть ковалентно присоединен к гидрофильной группе. В некоторых вариантах осуществления аналог ковалентно присоединен к гидрофильной группе в любом из аминокислотных положений 16, 17, 20, 21, 24, 29, 40 или на C-конце. В определенных вариантах осуществления аналог содержит C-концевое удлинение (например, аминокислотную последовательность SEQ ID NO: 1095) и присоединенную аминокислоту, содержащую гидрофильную группу, так что гидрофильная группа ковалентно связана с аналогом в положении 40.
В некоторых вариантах осуществления гидрофильная группа ковалентно связана с Lys, Cys, Orn, гомоцистеином или ацетил-фенилаланиновым аналогом. Lys, Cys, Orn, гомоцистеин или ацетил-фенилаланин могут представлять собой аминокислоту, которая является нативной для глюкагоновой последовательности (SEQ ID NO: 1001), или она может представлять собой аминокислоту, которая заменяет нативную аминокислоту SEQ ID NO: 1001. В некоторых вариантах осуществления, где гидрофильная группа присоединена к Cys, связь с гидрофильной группой может иметь структуру.

или

Что касается аналогов, содержащих гидрофильную группу, гидрофильная группа может представлять собой любую из групп, описанных в настоящем изобретении. См., например, идеи в параграфе "Присоединение гидрофильных групп". В некоторых вариантах осуществления гидрофильная группа представляет собой полиэтиленгликоль (PEG). PEG в определенных вариантах осуществления имеет молекулярный вес от приблизительно 1000 Дальтон до приблизительно 40000 Дальтон, например, от приблизительно 20000 Дальтон до приблизительно 40000 Дальтон.
Что касается примерных вариантов осуществления, аналог может содержать модифицированную аминокислоту, у которой боковая цепь ковалентно связана с ацильной или алкильной группой (например, ацильной или алкильной группой, которая является ненативной для встречающейся в природе аминокислоты). Ацилированный или алкилированный аналог может соответствовать ацилированным или алкилированным пептидам, описанным в параграфе "Ацилирование и алкилирование". В некоторых вариантах осуществления ацильная группа представляет собой ацильную группа C4-C30 жирной кислоты, такую как, например, ацильная или алкильная группа C10 жирной кислоты, ацильная или алкильная группа C12 жирной кислоты, ацильная или алкильная группа C14 жирной кислоты, ацильная или алкильная группа C16 жирной кислоты, ацильная или алкильная группа C18 жирной кислоты, C20 ацильная или алкильная группа, или C22 ацильная или алкильная группа. Ацильная или алкильная группа может быть ковалентно связана с любой аминокислотой аналога, включая, но не ограничиваясь этим, аминокислоту в положении 10 или 40, или C-концевую аминокислоту. В определенных вариантах осуществления аналог содержит C-концевое удлинение (например, аминокислотную последовательность SEQ ID NO: 1095) и присоединенную аминокислоту, содержащую ацильную или алкильную группу, так что ацильная или алкильная группа ковалентно связана с аналогом в положении 40. В некоторых вариантах осуществления ацильная или алкильная группа ковалентно связана с боковой цепью аминокислоты формулы I, II или III, например, Lys остатка. Ацильная или алкильная группа может быть ковалентно связана с аминокислотой, которая является нативной для глюкагоновой последовательности (SEQ ID NO: 1001), или может быть соединена с аминокислотой, которая присоединена к последовательности SEQ ID NO: 1001 или к последовательности SEQ ID NO: 1001, с последующей SEQ ID NO: 1095 (на N- или C-конце), или может быть соединена с аминокислотой, которая заменяет нативную аминокислоту, например, Tyr в положении 10 SEQ ID NO: 1001.
В приведенных выше примерных вариантах осуществления, где аналог содержит ацильную или алкильную группу, аналог может быть присоединен к ацильной или алкильной группе через спейсер, как описано в настоящем изобретении. Спейсер, например, может иметь длину 3-10 атомов и может представлять собой, например, аминокислоту (например, 6-аминогексановую кислоту, любую аминокислоту, описанную в настоящем изобретении), дипептид (например, Ala-Ala, βAla-βAla, Leu-Leu, Pro-Pro, γ-Glu-γ-Glu), трипептид или гидрофильный или гидрофобный бифункциональный спейсер. В определенных аспектах суммарная длина спейсера и ацильной или алкильной группы равна от приблизительно 14 до приблизительно 28 атомов. В некоторых вариантах осуществления аминокислотный спейсер не является γ-Glu. В некоторых вариантах осуществления дипептидный спейсер не является γ-Glu-γ-Glu.
В еще дополнительных вариантах осуществления аналог глюкагона, обладающий GIP агонистической активностью, содержит аминокислотную последовательность в соответствии с любой одной из SEQ ID NO: 1227, 1228, 1229 или 1230, которая дополнительно содержит следующие модификации:
(a) необязательно, аминокислотную модификацию в положении 1, которая придает GIP агонистическую активность,
(b) удлинение от приблизительно 1 до приблизительно 21 аминокислот, C-концевых к аминокислоте в положении 29, где по меньшей мере одна из аминокислот удлинения ацилирована или алкилирована, и
(d) вплоть до 6 дополнительных аминокислотных модификаций,
где EC50 аналога для GIP рецепторной активации равна приблизительно 10 нМ или меньше.
В некоторых аспектах ацилированная или алкилированная аминокислота представляет собой аминокислоту формулы I, II или III. В более конкретных вариантах осуществления аминокислота формулы I представляет собой Dab, Orn, Lys или гомо-Lys. Кроме того, в некоторых вариантах осуществления от приблизительно 1 до приблизительно 21 аминокислот содержит аминокислотную последовательность GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), где X представляет собой любую аминокислоту, или GPSSGAPPPK (SEQ ID NO: 1170) или XGPSSGAPPPK (SEQ ID NO: 1171) или XGPSSGAPPPSK (SEQ ID NO: 1172), где X представляет собой Gly или небольшую алифатическую или неполярную или по существу неполярную аминокислоту. В некоторых вариантах осуществления от приблизительно 1 до приблизительно 21 аминокислот могут содержать последовательности, содержащие одну или более консервативных замен по сравнению с SEQ ID NO: 1095, 1096, 1170, 1171 или 1172. В некоторых вариантах осуществления ацилированная или алкилированная аминокислота находится в положении 37, 38, 39, 40, 41, 42, или 43 аналога с удлинением на C-конце. В определенных вариантах осуществления ацилированная или алкилированная аминокислота находится в положении 40 аналога с удлинением на C-конце.
В любых указанных выше примерных вариантах осуществления аминокислота в положении 1, которая придает GIP агонистическую активность, может представлять собой аминокислоту, не содержащую имидазола в боковой цепи. Аминокислота в положении 1 может представлять собой, например, большую ароматическую аминокислоту. В некоторых вариантах осуществления большая ароматическая аминокислота представляет собой любую из аминокислот, описанных в настоящем изобретении, включая, например, Tyr.
Аналог указанных выше примерных вариантов осуществления может дополнительно содержать 1-6 дополнительных аминокислотных модификаций, таких как, например, любая из модификаций, описанных в настоящем изобретении, которая повышает или понижает активность относительно любого из GIP, GLP-1 и глюкагонового рецепторов, увеличивает растворимость, увеличивает продолжительность действия или время полужизни в кровотоке, замедляет начало действия или увеличивает стабильность.
В определенных аспектах глюкагоновые аналоги, описанные в приведенном выше примерном варианте осуществления, содержат дополнительные аминокислотные модификации в одном, двух или всех положениях 27, 28 и 29. Модификации в данных положениях могут представлять собой любые из модификаций, описанных в настоящем изобретении относительно данных положений. Например, относительно SEQ ID NO: 1227, 1228, 1229 или 1230, положение 27 может быть заменено большой алифатической аминокислотой (например, Leu, Ile или норлейцином) или Met, положение 28 может быть заменено другой небольшой алифатической аминокислотой (например, Gly или Ala) или Asn, и/или положение 29 может быть заменено другой небольшой алифатической аминокислотой (например, Ala или Gly) или Thr. Альтернативно, аналог может содержать данные аминокислотные модификации в положении 27 и/или 28.
Аналог может дополнительно содержать одну или более из следующих дополнительных модификаций:
(i) аминокислота в положении 2 представляет собой любую одну из D-Ser, Ala, D-Ala, Gly, N-метил-Ser, Aib, Val или α-амино-N-масляной кислоты;
(ii) аминокислота в положении 10 представляет собой Tyr, Trp, Lys, Orn, Glu, Phe или Val;
(iii) присоединение ацильной группы к Lys в положении 10;
(iv) аминокислота в положении 12 представляет собой Ile, Lys или Arg;
(v) аминокислота в положении 16 представляет собой любую аминокислоту из Ser, Glu, Gln, гомоглютаминовой кислоты, гомоцистеиновой кислоты, Thr, Gly или Aib;
(vi) аминокислота в положении 17 представляет собой Gln или Arg;
(vii) аминокислота в положении 18 представляет собой любую аминокислоту из Ala, Arg, Ser, Thr или Gly;
(viii) аминокислота в положении 20 представляет собой любую аминокислоту из Ala, Ser, Thr, Lys, цитруллина, Arg, Orn или Aib или другую альфа,альфа-дизамещенную аминокислоту;
(ix) аминокислота в положении 21 представляет собой любую аминокислоту из Glu, Asp, гомоглютаминовой кислоты, гомоцистеиновой кислоты;
(x) аминокислота в положении 23 представляет собой Val или Ile;
(xi) аминокислота в положении 24 представляет собой любую аминокислоту из Gln, Asn, Ala, Ser, Thr или Aib; и
(xii) одну или более консервативных замен в любом положении 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 27, 28 и 29.
Аналог в некоторых вариантах осуществления содержит комбинацию модификаций (i)-(xii). Альтернативно или кроме того, аналог может содержать аминокислотную модификацию в положении 3 (например, аминокислотная замена Gln Glu), где аналог обладает менее чем 1% активности глюкагона относительно глюкагонового рецептора. Альтернативно или кроме того, аналог может содержать аминокислотную модификацию в положении 7 (например, аминокислотная замена Thr аминокислотой, не содержащей гидроксильную группу, например, Abu или Ile), где аналог обладает менее чем приблизительно 10% активности GLP-1 относительно GLP-1 рецептора.
Что касается примерных вариантов осуществления, аналог может быть ковалентно связан с гидрофильной группой. В некоторых вариантах осуществления аналог ковалентно связан с гидрофильной группой в любом из аминокислотных положений 16, 17, 20,21, 24, 29, 40 или на C-конце. В определенных вариантах осуществления аналог содержит гидрофильную группу, ковалентно связанную с аналогом в положении 24.
В некоторых вариантах осуществления гидрофильная группа ковалентно связана с Lys, Cys, Orn, гомоцистеином или ацетил-фенилаланиновым аналогом. Lys, Cys, Orn, гомоцистеин или ацетил-фенилаланин может представлять собой аминокислоту, которая является нативной для SEQ ID NO: 1001, 1227, 1228, 1229 или 1230, или она может представлять собой замененную аминокислоту. В некоторых вариантах осуществления, где гидрофильная группа соединена с Cys, связь может иметь структуру

или

Что касается аналогов, содержащих гидрофильную группу, гидрофильная группа может представлять собой любую из групп, описанных в настоящем изобретении. См., например, идеи в параграфе "Присоединение гидрофильных групп". В некоторых вариантах осуществления гидрофильная группа представляет собой полиэтиленгликоль(PEG). PEG в определенных вариантах осуществления имеет молекулярный вес от приблизительно 1000 Дальтон до приблизительно 40000 Дальтон, например, от приблизительно 20000 Дальтон до приблизительно 40000 Дальтон.
Что касается примерных вариантов осуществления, аналог может содержать модифицированную аминокислоту в C-концевом удлинении, в которой боковая цепь ковалентно связана с ацильной или алкильной группой. Ацилированный или алкилированный аналог может соответствовать ацилированным или алкилированным пептидам, описанным в параграфе "Ацилирование и алкилирование". В некоторых вариантах осуществления ацильная группа представляет собой ацильную группу C4-C30 жирной кислоты, такую как, например, ацильная или алкильная группа C10 жирной кислоты, ацильная или алкильная группа C12 жирной кислоты, ацильная или алкильная группа C14 жирной кислоты, ацильная или алкильная группа C16 жирной кислоты, ацильная или алкильная группа C18 жирной кислоты, C20 ацильная или алкильная группа, или C22 ацильная или алкильная группа. Ацильная или алкильная группа может быть ковалентно связана с любой аминокислотой аналога, включая, но не ограничиваясь этим, аминокислоту в положении 10 или 40 или C-концевую аминокислоту. В некоторых вариантах осуществления ацильная или алкильная группа ковалентно связана с боковой цепью аминокислоты формулы I, II или III, например, Lys остатка. Ацильная или алкильная группа ковалентно связана с аминокислотой, которая является нативной для SEQ ID NO: 1001, 1227, 1228, 1229 или 1230, или она может быть соединена с замененной аминокислотой. Ацильная или алкильная группа ковалентно связана с аминокислотой, которая является нативной для SEQ ID NO: 1095, 1096, 1171 или 1172, или она может быть соединена с замененной аминокислотой.
В приведенных выше примерных вариантах осуществления, где аналог содержит ацильную или алкильную группу, аналог может быть присоединен к ацильной или алкильной группе через спейсер, как описано в настоящем изобретении. Спейсер, например, может иметь длину 3-10 атомов и может представлять собой, например, аминокислоту (например, 6-аминогексановую кислоту, любую аминокислоту, описанную в настоящем изобретении), дипептид (например, Ala-Ala, βAla-βAla, Leu-Leu, Pro-Pro, γ-Glu-γ-Glu), трипептид или гидрофильный или гидрофобный бифункциональный спейсер. В определенных аспектах суммарная длина спейсера и ацильной или алкильной группы равна от приблизительно 14 до приблизительно 28 атомов. В некоторых вариантах осуществления аминокислотный спейсер не является γ-Glu. В некоторых вариантах осуществления дипептидный спейсер не является γ-Glu-γ-Glu.
В некоторых очень конкретных вариантах осуществления аналог настоящего изобретения содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1099-1141, 1144-1164, 1166, 1192-1207, 1209-1221 и 1223, или выбранную из группы, состоящей из SEQ ID NO: 1167-1169, 1173-1178 и 1225.
Кроме того, конкретные примеры аналогов настоящего изобретения включают, но не ограничиваясь этим, любые из аналогов, упоминаемых в таблице 1-3.
В еще дополнительных вариантах осуществления аналог глюкагона, обладающий GIP агонистической активностью, содержит ацильную или алкильную группу (например, ацильную или алкильную группу, которая является ненативной для встречающейся в природе аминокислоты), где ацильную или алкильную группу присоединяют к спейсеру, где (i) спейсер присоединяют к боковой цепи аминокислоты в положении 10 аналога; или (ii) аналог содержит удлинение 1-21 аминокислот, C-концевое к аминокислоте в положении 29, и спейсер присоединяют к боковой цепи аминокислоты, соответствующей одному из положений 37-43, относящихся к SEQ ID NO: 1001, где EC50 аналога для GIP рецепторной активации равна приблизительно 10 нМ или меньше.
В данных вариантах осуществления аналог может содержать аминокислотную последовательность SEQ ID NO: 1001 с (i) аминокислотной модификацией в положении 1, которая придает GIP агонистическую активность, (ii) аминокислотными модификациями в одном, двух или всех положениях 27, 28 и 29, (iii) с по меньшей мере одним из:
(A) аналог содержит лактамную мостиковую связь между боковыми цепями аминокислот в положениях i и i+4 или между боковыми цепями аминокислот в положениях j и j+3, где i равно 12, 13, 16, 17, 20 или 24, и где j равно 17;
(B) одна, две, три или все из аминокислот в положениях 16, 20, 21, и 24 аналога заменены α,α-дизамещенной аминокислотой; или
(C) аналог содержит (i) аминокислотную замену Ser в положении 16 аминокислотой формулы IV:

[формула IV],
где n равен 1-7, где каждый из R1 и R2 независимо выбран из группы, состоящей из H, С1-С18 алкила, (С1-С18 алкил)OH, (С1-С18 алкил)NH2,(С1-С18 алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4 алкил)(C2-C5 гетероциклил), (C0-C4 алкил)(C6-C10 арил)R7 и (С1-C4 алкил)(C3-C9 гетероарил), где R7 представляет собой H или OH, и боковая цепь аминокислоты формулы IV содержит свободную аминогруппу; и (ii) аминокислотную замену Gln в положении 20 альфа,альфа-дизамещенной аминокислотой.
и (iv) вплоть до 6 дополнительных аминокислотных модификаций.
Альфа,альфа-дизамещенная аминокислота аналога данных вариантов осуществления может представлять собой любую альфа,альфа-дизамещенную аминокислоту, включая, но не ограничиваясь этим, аминоизомасляную кислоту (Aib), аминокислоту, дизамещенную одинаковыми или различными группами, выбранными из метила, этила, пропила и н-бутила, или циклооктаном или циклогептаном (например, 1-аминоциклооктан-1-карбоновая кислота). В определенных вариантах осуществления альфа,альфа-дизамещенная аминокислота представляет собой Aib.
Аминокислота формулы IV аналога данных вариантов осуществления может представлять собой любую аминокислоту, такую как, например, аминокислота формулы IV, где n равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16. В определенных вариантах осуществления n равен 2, 3, 4 или 5, в данном случае, аминокислота представляет собой Dab, Orn, Lys или гомо-Lys, соответственно.
В любом из указанных выше примерных вариантов осуществления аминокислотная модификация в положении 1, которая придает GIP агонистическую активность, может представлять собой замену His аминокислотой, не содержащей имидазола в боковой цепи. Аминокислотная модификация в положении 1 может представлять собой, например, замену His большой ароматической аминокислотой. В некоторых вариантах осуществления большая ароматической аминокислота представляет собой любую из аминокислот, описанных в настоящем изобретении, включая, например, Tyr.
Кроме того, что касается приведенных выше примерных вариантов осуществления, аминокислотные модификации в одном, двух или всех положениях 27, 28, и 29 могут представлять собой любые из модификаций в данных положениях, описанных в настоящем изобретении. Например, Met в положении 27 может быть заменен большой алифатической аминокислотой, необязательно Leu, Asn в положении 28 может быть заменен небольшой алифатической аминокислотой, необязательно Ala, и/или Thr в положении 29 может быть заменен небольшой алифатической аминокислотой, необязательно Gly. Альтернативно, аналог может содержать данные аминокислотные модификации в положении 27 и/или 28.
Аналог указанных выше примерных вариантов осуществления может дополнительно содержать 1-9 или 1-6 дополнительных аминокислотных модификаций, например, 1, 2, 3, 4, 5, 6, 7, 8 или 9 дополнительных аминокислотных модификаций, таких как, например, любая из модификаций, описанных в настоящем изобретении, которая повышает или понижает активность относительно любого из GIP, GLP-1 и глюкагонового рецепторов, увеличивает растворимость, увеличивает продолжительность действия или время полужизни в кровотоке, замедляет начало действия или увеличивает стабильность. Аналог может дополнительно содержать, например, аминокислотную модификацию в положении 12, необязательно, замену Ile, и/или аминокислотные модификации в положениях 17 и 18, необязательно замену Q в положении 17 и A в положении 18, и/или присоединение GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), или последовательностей, содержащих одну или более консервативных замен по сравнению с SEQ ID NO: 1095 или 1096, к C-концу. Аналог может содержать одну или более из следующих модификаций:
(i) Ser в положении 2, замененный D-Ser, Ala, D-Ala, Gly, N-метил-Ser, Aib, Val или α-амино-N-масляной кислотой;
(ii) Tyr в положении 10, замененный Tip, Lys, Orn, Glu, Phe или Val;
(iii) присоединение ацильной группы к Lys в положении 10;
(iv) Lys в положении 12, замененный Arg;
(v) Ser в положении 16, замененный Glu, Gln, гомоглютаминовой кислотой, гомоцистеиновой кислотой, Thr, Gly, Lys или Aib;
(vi) Arg в положении 17, замененный Gln;
(vii) Arg в положении 18, замененный Ala, Ser, Thr или Gly;
(viii) Gln в положении 20, замененный Ala, Ser, Thr, Lys, цитруллином, Arg, Orn или Aib;
(ix) Asp в положении 21, замененный Glu, гомоглютаминовой кислотой, гомоцистеиновой кислотой;
(x) Val в положении 23, замененный Ile;
(xi) Gln в положении 24, замененный Asn, Ala, Ser, Thr, или Aib; и
(xii) консервативную замену в любом из положений 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 27, 28, и 29.
Аналог в некоторых вариантах осуществления содержит комбинацию модификаций (i)-(xii). Альтернативно или кроме того, аналог может содержать аминокислотную модификацию в положении 3 (например, аминокислотная замена Gln Glu), где аналог обладает менее чем 1% активности глюкагона относительно глюкагонового рецептора. Альтернативно или кроме того, аналог может содержать аминокислотную модификацию в положении 7 (например, аминокислотная замена Thr аминокислотой, не содержащей гидроксильную группу, например, Abu или Ile), делецию аминокислоты(аминокислот), C-концевой к аминокислоте в положении 27 или 28, давая пептид из 27- или 28-аминокислот, или их комбинацию, где аналог обладает менее чем приблизительно 10% активности GLP-1 относительно GLP-1 рецептора.
Что касается примерных вариантов осуществления, аналог может быть ковалентно связан с гидрофильной группой. В некоторых вариантах осуществления аналог ковалентно связан с гидрофильной группой в любом из аминокислотных положений 16, 17, 20, 21, 24, 29, 40, или на C-конце. В определенных вариантах осуществления аналог содержит C-концевое удлинение (например, аминокислотную последовательность SEQ ID NO: 1095) и присоединенную аминокислоту, содержащую гидрофильную группу, так что гидрофильная группа ковалентно связана с аналогом в положении 40.
В некоторых вариантах осуществления гидрофильная группа ковалентно связана с Lys, Cys, Orn, гомоцистеином или ацетилфенилаланиновым аналогом. The Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин может представлять собой аминокислоту, которая является нативной для глюкагоновой последовательности (SEQ ID NO: 1001), или она может представлять собой аминокислоту, которая заменяет нативную аминокислоту SEQ ID NO: 1001. В некоторых вариантах осуществления, где гидрофильную группу присоединяют к Cys, связь с гидрофильной группой может иметь структуру

или
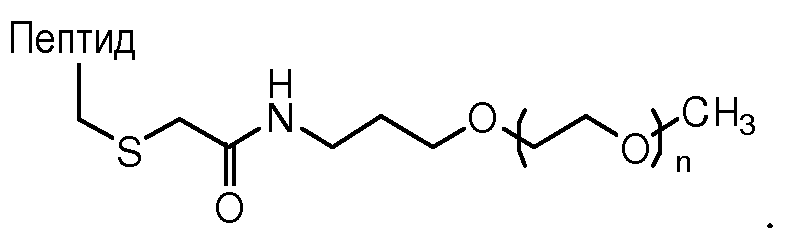
Что касается аналогов, содержащих гидрофильную группу, гидрофильная группа может представлять собой любую из гидрофильных групп, описанных в настоящем изобретении. См., например, идеи в параграфе "Присоединение гидрофильных групп". В некоторых вариантах осуществления гидрофильная группа представляет собой полиэтиленгликоль (PEG). PEG в определенных вариантах осуществления имеет молекулярный вес от приблизительно 1000 Дальтон до приблизительно 40000 Дальтон, например, от приблизительно 20000 Дальтон до приблизительно 40000 Дальтон.
В примерных вариантах осуществления, где аналог содержит ацильную или алкильную группу, которую присоединяют к аналогу через спейсер, спейсер может представлять собой любой спейсер, как описано в настоящем изобретении. Спейсер, например, может иметь длину 3-10 атомов и может представлять собой, например, аминокислоту (например, 6-аминогексановую кислоту, любую аминокислоту, описанную в настоящем изобретении, дипептид (например, Ala-Ala, βAla-βAla, Leu-Leu, Pro-Pro, γ-Glu-γ-Glu), трипептид или гидрофильный или гидрофобный бифункциональный спейсер. В определенных аспектах суммарная длина спейсера и ацильной или алкильной группы равна от приблизительно 14 до приблизительно 28 атомов. В некоторых вариантах осуществления аминокислотный спейсер не является γ-Glu. В некоторых вариантах осуществления дипептидный спейсер не является γ-Glu-γ-Glu.
Ацильная или алкильная группа представляет собой любую ацильную или алкильную группу, как описано в настоящем изобретении, такую как ацильная или алкильная группа, которая является ненативной для встречающейся в природе аминокислоты. Ацильная или алкильная группа в некоторых вариантах осуществления представляет собой ацильную группу C4-C30 жирной кислоты, такую как, например, ацильная или алкильная группа C10 жирной кислоты, ацильная или алкильная группа C12 жирной кислоты, ацильная или алкильная группа C14 жирной кислоты, ацильная или алкильная группа C16 жирной кислоты, ацильная или алкильная группа C18 жирной кислоты, C20 ацильная или алкильная группа, или C22 ацильная или алкильная группа, или алкильную группу C4-C30. В конкретных вариантах осуществления ацильная группа представляет собой ацильную группу C12-C18 жирной кислоты (например, ацильную группу C14 или C16 жирной кислоты).
В некоторых вариантах осуществления удлинение от приблизительно 1 до приблизительно 21 аминокислот, C-концевое к аминокислоте в положении 29 аналога, содержит аминокислотную последовательность GPSSGAPPPS (SEQ ID NO: 1095) или XGPSSGAPPPS (SEQ ID NO: 1096), где X представляет собой любую аминокислоту, или GPSSGAPPPK (SEQ ID NO: 1170) или XGPSSGAPPPK (SEQ ID NO: 1171) или XGPSSGAPPPSK (SEQ ID NO: 1172), где X представляет собой Gly или небольшую алифатическую или неполярную или по существу неполярную аминокислоту. В некоторых вариантах осуществления от приблизительно 1 до приблизительно 21 аминокислот может содержать последовательности, содержащие одну или более консервативных замен по сравнению с SEQ ID NO: 1095, 1096, 1170, 1171 или 1172. В некоторых вариантах осуществления ацилированная или алкилированная аминокислота находится в положении 37, 38, 39, 40, 41, 42 или 43 аналога с удлинением на C-конце. В определенных вариантах осуществления ацилированная или алкилированная аминокислота находится в положении 40 аналога с удлинением на C-конце.
GIP агонист может представлять собой пептид, содержащий аминокислотную последовательность любой из аминокислотных последовательностей, например, SEQ ID NO: 1005-1094, необязательно с вплоть до 1, 2, 3, 4 или 5 дополнительными модификациями, которые сохраняют GIP агонистическую активность. В определенных вариантах осуществления GIP агонист содержит аминокислоты любой из SEQ ID NO: 1099-1275.
Родственные глюкагону пептиды класса 3
В определенных вариантах осуществления родственный глюкагону пептид представляет собой родственный глюкагону пептид класса 3, который описан в настоящем изобретении и в опубликованной международной патентной заявке WO 2009/155258, WO 2008/101017 и в предварительной заявке США 61/288248 (поданной 18 декабря 2009), содержание которых включено с помощью ссылки во всей своей полноте.
Некоторые из биологических последовательностей, приведенных в следующем параграфе (SEQ ID NO: 1-656), относящиеся к родственным глюкагону пептидам класса 3, соответствуют SEQ ID NO: 1-656 в опубликованной международной патентной заявке No. WO 2009/155258.
Активность
Родственный глюкагону пептид класса 3 может представлять собой пептид, который обладает повышенной активностью относительно глюкагонового рецептора, и в дополнительных вариантах осуществления обладает повышенной биофизической стабильностью и/или растворимостью в воде. Кроме того, в некоторых вариантах осуществления родственный глюкагону пептид класса 3 потерял селективность нативного глюкагона относительно глюкагонового рецептора по сравнению с GLP-1 рецептором, и таким образом представляет собой соагонист данных двух рецепторов. Выбранные аминокислотные модификации в родственном глюкагону пептиде класса 3 могут контролировать относительную активность пептида относительно GLP-1 рецептора по сравнению с глюкагоновым рецептором. Таким образом, родственный глюкагону пептид класса 3 может представлять собой глюкагон/GLP-1 соагонист, который обладает большей активностью относительно глюкагонового рецептора по сравнению с GLP-1 рецептором, глюкагон/GLP-1 соагонист, который обладает приблизительно равной активностью относительно обоих рецепторов, или глюкагон/GLP-1 соагонист, который обладает большей активностью относительно GLP-1 рецептора по сравнению с глюкагоновым рецептором. Последнюю категорию соагониста можно конструировать так, чтобы он обладал небольшой или не обладал активностью относительно глюкагонового рецептора и, тем не менее, сохранял способность активировать GLP-1 рецептор с одинаковой или большей эффективностью, чем нативный GLP-1. Любой из данных соагонистов может также содержать модификации, которые придают повышенную биофизическую стабильность и/или растворимость в воде.
Можно вводить модификации родственного глюкагону пептида для получения глюкагонового пептида, обладающего по меньшей мере от приблизительно 1% (включая по меньшей мере приблизительно 1,5%, 2%, 5%, 7%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175%) до приблизительно 200% или более активности относительно GLP-1 рецептора по сравнению с нативным GLP-1 и от по меньшей мере приблизительно 1% (включая приблизительно 1,5%, 2%, 5%, 7%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175%, 200%, 250%, 300%, 350%, 400%, 450%) до приблизительно 500% или более активности относительно глюкагонового рецептора по сравнению с нативным глюкагоном. Аминокислотная последовательность нативного глюкагона представляет собой SEQ ID NO: 1, аминокислотная последовательность GLP-1 (7-36)амида представляет собой SEQ ID NO: 52, и аминокислотная последовательность GLP-1(7-37)кислоты представляет собой SEQ ID NO: 50. В примерных вариантах осуществления родственный глюкагону пептид класса 3 может обладать по меньшей мере 10% активности нативного глюкагона относительно глюкагонового рецептора и по меньшей мере 50% активности нативного GLP-1 относительно GLP-1 рецептора, или по меньшей мере 40% активности нативного глюкагона относительно глюкагонового рецептора и по меньшей мере 40% активности нативного GLP-1 относительно GLP-1 рецептора, или по меньшей мере 60% активности нативного глюкагона относительно глюкагонового рецептора и по меньшей мере 60% активности нативного GLP-1 относительно GLP-1 рецептора.
Селективность родственного глюкагону пептида класса 3 для глюкагонового рецептора по сравнению с GLP-1 рецептором можно описать как относительный показатель глюкагон/GLP-1 активности (активность пептида относительно глюкагонового рецептора по сравнению с нативным глюкагоном, разделенная на активность пептида относительно GLP-1 рецептора по сравнению с нативным GLP-1). Например, родственный глюкагону пептид класса 3, который обладает 60% активности нативного глюкагона относительно глюкагонового рецептора и 60% активности нативного GLP-1 относительно GLP-1 рецептора имеет 1:1 показатель глюкагон/GLP-1 активности. Примерные показатели глюкагон/GLP-1 активности включают приблизительно 1:1, 1,5:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1,9:1 или 10:1 или приблизительно 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2 или 1:1,5. В качестве примера, показатель глюкагон/GLP-1 активности 10:1 указывает на 10-кратную селективность для глюкагонового рецептора по сравнению с GLP-1 рецептором. Аналогично, показатель GLP-1/глюкагон активности 10:1 указывает на 10-кратную селективность для GLP-1 рецептора по сравнению с глюкагоновым рецептором.
В некоторых вариантах осуществления родственные глюкагону пептиды класса 3 обладает приблизительно 10% или меньше активности нативного глюкагона относительно глюкагонового рецептора, например, приблизительно 1-10%, или приблизительно 0,1-10%, или больше, чем приблизительно 0,1%, но меньше, чем приблизительно 10%, при обладании по меньшей мере 20% активности GLP-1 относительно GLP-1 рецептора. Например, примерные родственные глюкагону пептиды класса 3, описанные в настоящем изобретении, обладают приблизительно 0,5%, приблизительно 1% или приблизительно 7% активности нативного глюкагона, при обладании по меньшей мере 20% активности GLP-1 относительно GLP-1 рецептора.
Родственный глюкагону пептид класса 3 может представлять собой глюкагоновый пептид с повышенной или пониженной активностью относительно глюкагонового рецептора, или GLP-1 рецептора, или обоих. Родственный глюкагону пептид класса 3 может представлять собой глюкагоновый пептид с измененной селективностью к глюкагоновому рецептору по сравнению с GLP-1 рецептором.
Таким образом, как описано в настоящем изобретении, обеспечивают высокоэффективные родственные глюкагону пептиды класса 3, которые также обладают повышенной растворимостью и/или стабильность. Примерный высокоэффективный родственный глюкагону пептид класса 3 обладает по меньшей мере приблизительно 200% активности нативного глюкагона относительно глюкагонового рецептора, и необязательно является растворимым при концентрации по меньшей мере 1 мг/мл при pH между 6 и 8, или между 6 и 9, или между 7 и 9 (например, pH 7), и необязательно сохраняет по меньшей мере 95% первоначального пептида (например, 5% или меньше первоначального пептида разрушается или расщепляется) после 24 часов при 25°C. В качестве другого примера, примерный родственный глюкагону пептид класса 3 обладает более чем приблизительно 40% или более чем приблизительно 60% активности относительно и глюкагонового и GLP-1 рецепторов (при показателе между приблизительно 1:3 и 3:1, или между приблизительно 1:2 и 2:1), является необязательно растворимым при концентрации по меньшей мере 1 мг/мл при pH между 6 и 8 или между 6 и 9, или между 7 и 9 (например, pH 7), и необязательно сохраняет по меньшей мере 95% первоначального пептида после 24 часов при 25°C. Другой примерный родственный глюкагону пептид класса 3 обладает приблизительно 175% или более активности нативного глюкагона относительно глюкагонового рецептора и приблизительно 20% или меньше активности нативного GLP-1 относительно GLP-1 рецептора, является необязательно растворимым при концентрации по меньшей мере 1 мг/мл при pH между 6 и 8 или между 6 и 9, или между 7 и 9 (например, pH 7), и необязательно сохраняет по меньшей мере 95% первоначального пептида после 24 часов при 25°C. Еще другой примерный родственный глюкагону пептид класса 3 обладает приблизительно 10% или меньше активности нативного глюкагона относительно глюкагонового рецептора и по меньшей мере приблизительно 20% активности нативного GLP-1 относительно GLP-1 рецептора, является необязательно растворимым при концентрации по меньшей мере 1 мг/мл при pH между 6 и 8 или между 6 и 9, или между 7 и 9 (например, pH 7), и необязательно сохраняет по меньшей мере 95% первоначального пептида после 24 часов при 25°C. Еще другой примерный родственный глюкагону пептид класса 3 обладает приблизительно 10% или меньше, но больше 0,1%, 0,5% или 1% активности нативного глюкагона относительно глюкагонового рецептора, и по меньшей мере приблизительно 50%, 60%, 70%, 80%, 90% или 100% или более активности нативного GLP-1 относительно GLP-1 рецептора, является необязательно растворимым при концентрации по меньшей мере 1 мг/мл при pH между 6 и 8 или между 6 и 9, или между 7 и 9 (например, pH 7), и необязательно сохраняет по меньшей мере 95% первоначального пептида после 24 часов при 25°C. В некоторых вариантах осуществления данные родственные глюкагону пептиды класса 3 сохраняют по меньшей мере 22, 23, 24, 25, 26, 27 или 28 встречающихся в природе аминокислот в соответствующих положениях в нативном глюкагоне (например, имеют 1-7, 1-5 или 1-3 модификаций по сравнению с встречающимся в природе глюкагоном).
Модификации, влияющие на глюкагоновую активность
Повышенную активность относительно глюкагонового рецептора обеспечивают аминокислотной модификацией в положении 16 нативного глюкагона (SEQ ID NO: 1). В некоторых вариантах осуществления родственный глюкагону пептид класс 3 представляет собой глюкагоновый агонист, который модифицирован по сравнению с пептидом дикого типа His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (SEQ ID NO: 1) для повышения эффективности пептида относительно глюкагонового рецептора. Обычно встречающийся серин в положении 16 нативного глюкагона (SEQ ID NO: 1) может быть заменен выбранной кислой аминокислотой для повышения эффективности глюкагона относительно его способности стимулировать цАМФ синтез в валидированном in vitro модельном анализе (см. пример 2). Более конкретно, данная замена увеличивает эффективность аналога по меньшей мере в 2 раза, 4 раза, 5 раз и вплоть до 10 раз относительно глюкагонового рецептора. Данная замена также увеличивает активность аналога относительно GLP-1 рецептора по меньшей мере в 5 раз, 10 раз или 15 раз по сравнению с нативным глюкагоном, но селективность сохраняется относительно глюкагонового рецептора по сравнению GLP-1 рецептором.
В качестве неограничивающего примера, данную повышенную эффективность можно обеспечить заменой встречающегося в природе серина в положении 16 глютаминовой кислотой или другой отрицательно заряженной аминокислотой, содержащей боковую цепь с длиной 4 атома, или альтернативно любой аминокислотой из глютамина, гомоглютаминовой кислоты или гомоцистеиновой кислоты, или заряженной аминокислотой, содержащей боковую цепь, содержащую по меньшей мере один гетероатом, (например, N, O, S, P) и с длиной боковой цепи приблизительно 4 (или 3-5) атомов. В соответствии с некоторыми вариантами осуществления сериновый остаток в положении 16 нативного глюкагона заменен аминокислотой, выбранной из группы, состоящей из глютаминовой кислоты, глютамина, гомоглютаминовой кислоты, гомоцистеиновой кислоты, треонина или глицина. В соответствии с некоторыми вариантами осуществления сериновый остаток в положении 16 нативного глюкагона заменен аминокислотой, выбранной из группы, состоящей из глютаминовой кислоты, глютамина, гомоглютаминовой кислоты и гомоцистеиновой кислоты, и в некоторых вариантах осуществления сериновый остаток заменен глютаминовой кислотой.
В некоторых вариантах осуществления родственный глюкагону пептид класса 3 с повышенной эффективностью содержит пептид SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 или глюкагоновый агонистический аналог SEQ ID NO: 5. В соответствии с некоторыми вариантами осуществления обеспечивают родственный глюкагону пептид класса 3, обладающий повышенной эффективностью относительно глюкагонового рецептора по сравнению с глюкагоном дикого типа, где пептид содержит последовательность SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 10, где глюкагоновый пептид сохраняет его селективность относительно глюкагонового рецептора по сравнению с GLP-1 рецептором. В некоторых вариантах осуществления родственный глюкагону пептид класса 3, обладающий повышенной селективностью относительно глюкагонового рецептора, включает пептид SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10 или его глюкагоновый агонистический аналог, где карбокси концевая аминокислота сохраняет свою нативную карбоксильную группу. В соответствии с некоторыми вариантами осуществления родственный глюкагону пептид класса 3 содержит последовательность NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-COOH (SEQ ID NO: 10), где пептид обладает приблизительно пятикратной повышенной эффективностью относительно глюкагонового рецептора по сравнению с нативным глюкагоном, как измерено in vitro цАМФ анализом примера 2.
Глюкагоновую рецепторную активность можно снизить, сохранить или повысить аминокислотной модификацией в положении 3, например, заменой встречающегося в природе глютамина в положении 3. В некоторых вариантах осуществления показано, что замена аминокислоты в положении 3 кислой, основной или гидрофобной аминокислотой (глютаминовой кислотой, орнитином, норлейцином) значительно снижает или устраняет глюкагоновую рецепторную активность. Аналоги, которые заменены, например, глютаминовой кислотой, орнитином или норлейцином, обладают приблизительно 10% или менее активности нативного глюкагона относительно глюкагонового рецептора, например, приблизительно 1-10%, или приблизительно 0,1-10%, или более чем приблизительно 0,1%, но меньше, чем приблизительно 10%, при обладании по меньшей мере 20% активности GLP-1 относительно GLP-1 рецептора. Например, примерные аналоги, описанные в настоящем изобретении, обладают приблизительно 0,5%, приблизительно 1% или приблизительно 7% активности нативного глюкагона, при обладании по меньшей мере 20% активности GLP-1 относительно GLP-1 рецептора. В частности, любой из родственных глюкагону пептидов класса 3, включая глюкагоновые аналоги, глюкагоновые агонистические аналоги, глюкагоновые соагонисты и глюкагон/GLP-1 соагонисты, описанные в настоящем изобретении, можно модифицировать так, чтобы они содержали модификацию в положении 3, например, Gln, замененный Glu, для получения пептида с высокой селективностью, например, десятикратной селективностью, относительно GLP-1 рецептора по сравнению с селективностью относительно глюкагонового рецептора.
В другом варианте осуществления встречающийся в природе глютамин в положении 3 любого из глюкагоновых пептидов класса 3 может быть заменен глютаминовым аналогом без значительной потери активности относительно глюкагонового рецептора, и в некоторых случаях, с повышением глюкагоновой рецепторной активности, как описано в настоящем изобретении. В конкретных вариантах осуществления аминокислота в положении 3 заменена Dab(Ac). Например, глюкагоновые агонисты могут содержать аминокислотные последовательности SEQ ID NO: 595, SEQ ID NO: 601 SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605 и SEQ ID NO: 606.
Наблюдали, что модификации в положении 2 (например, Aib в положении 2) и в некоторых случаях модификации в положении 1 могут снижать глюкагоновую активность. Данное снижение глюкагоновой активности можно восстановить стабилизацией альфа-спирали в C-концевой части глюкагона, например, способами, описанными в настоящем изобретении, например, ковалентной связью между боковыми цепями аминокислот в положениях "i" и "i+4", например, 12 и 16, 16 и 20 или 20 и 24. В некоторых вариантах осуществления данная ковалентная связь представляет собой лактамную мостиковую связь между глютаминовой кислотой в положении 16 и лизином в положении 20. В некоторых вариантах осуществления данная ковалентная связь представляет собой внутримолекулярную мостиковую связь, отличную от лактамной мостиковой связи. Например, подходящие способы образования ковалентной связи включают любой один или более из олефинового метатезиса, циклизации на основе лантионина, образования дисульфидной мостиковой связи или образования мостиковой связи, содержащей модифицированную серу, применение α,ω-диаминоалкановых линкеров, образование мостиковых связей с атомом металла, и другие способы циклизации пептида.
Модификации, влияющие на GLP-1 активность
Повышенную активность относительно GLP-1 рецептора обеспечивают заменой карбоновой кислоты C-концевой аминокислоты нейтрально заряженной группой, такой как амид или эфир. В некоторых вариантах осуществления данные родственные глюкагону пептиды класса 3 содержат последовательность SEQ ID NO: 20, где карбокси концевая аминокислота содержит амидную группу вместо карбоксильной группы, обнаруживаемой в нативной аминокислоте. Данные родственные глюкагону пептиды класса 3 обладают большой активностью относительно и глюкагонового, и GLP-1 рецепторов, и, таким образом, действуют как соагонисты относительно обоих рецепторов. В соответствии с некоторыми вариантами осуществления родственный глюкагону пептид класса 3 представляет собой глюкагоновый и GLP-1 рецепторный соагонист, где пептид содержит последовательность SEQ ID NO: 20, где аминокислота в положении 28 представляет собой Asn или Lys, и аминокислота в положении 29 представляет собой Thr-амид.
Повышенную активность относительно GLP-1 рецептора обеспечивают модификациями, которые стабилизируют альфа-спираль в C-концевой части глюкагона (например, в районе остатков 12-29).
В некоторых вариантах осуществления данные модификации обеспечивают образование внутримолекулярной мостиковой связи между боковыми цепями двух аминокислот, которые разделены тремя промежуточными аминокислотами (т.е. аминокислота в положении "i" и аминокислота в положении "i+4", где i представляет собой любое целое между 12 и 25), двумя промежуточными аминокислотами, т.е. аминокислота в положении "j" и аминокислота в положении "j+3," где j представляет собой любое целое между 12 и 27, или шестью промеждуточными аминокислотами, т.е. аминокислота в положении "k" и аминокислота в положении "k+7," где k представляет собой любое целое между 12 и 22. В примерных вариантах осуществления мостиковая связь или линкер имеет длину приблизительно 8 (или приблизительно 7-9) атомов и образуется между боковыми цепями аминокислот в положениях 12 и 16, или в положениях 16 и 20, или в положениях 20 и 24, или в положениях 24 и 28. Две боковые цепи аминокислот могут быть соединены друг с другом нековалентными связями, например, водородными связями, ионными взаимодействиями, такими как образование солевых мостиков, или ковалентными связями.
В соответствии с некоторыми вариантами осуществления родственный глюкагону пептид класса 3 обладает глюкагон/GLP-1 рецепторной соагонистической активностью и содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, 47, 48 и 49. В некоторых вариантах осуществления боковые цепи ковалентно связаны друг с другом, и в некоторых вариантах осуществления две аминокислоты соединены друг с другом, образуя лактамное кольцо.
В соответствии с некоторыми вариантами осуществления родственный глюкагону пептид класса 3 содержит SEQ ID NO: 45, где по меньшей мере одно лактамное кольцо образуется между боковыми цепями аминокислотных пар, выбранных из группы, состоящей из аминокислотных пар 12 и 16, 16 и 20, 20 и 24 или 24 и 28. В некоторых вариантах осуществления родственный глюкагону пептид класса 3 включает глюкагоновый пептидный аналог SEQ ID NO: 20, где пептид содержит внутримолекулярную лактамную мостиковую связь, образованную между аминокислотными положениями 12 и 16 или между аминокислотными положениями 16 и 20. В некоторых вариантах осуществления родственный глюкагону пептид класса 3 содержит последовательность SEQ ID NO: 20, где внутримолекулярная лактамная мостиковая связь образуется между аминокислотными положениями 12 и 16, между аминокислотными положениями 16 и 20 или между аминокислотными положениями 20 и 24, и аминокислота в положении 29 представляет собой глицин, где последовательность SEQ ID NO: 29 соединена с C-концевой аминокислотой SEQ ID NO: 20. В следующем варианте осуществления аминокислота в положении 28 представляет собой аспарагиновую кислоту.
В некоторых конкретных вариантах осуществления стабилизация альфа-спиральной структуры в C-концевой части родственного глюкагону пептида класса 3 достигается образованием внутримолекулярной мостиковой связи, отличной от лактамной мостиковой связи. Например, подходящие способы образования ковалентной связи, включающие любой один или более из олефинового метатезиса, циклизации на основе лантионина, образования дисульфидной мостиковой связи или образования мостиковой связи, содержащей модифицированную серу, применения α,ω-диаминоалкановых линкеров, образования мостиковых связей с атомом металла, и других способов пептидной циклизации, применяют для стабилизации альфа-спирали.
Кроме того, повышенной активности относительно GLP-1 рецептора можно достичь стабилизацией альфа-спиральной структуры в C-концевой части глюкагонового пептида (в районе аминокислот 12-29) преднамеренным введением одной или более α,α-дизамещенных аминокислот в положениях, которые сохраняют требуемую активность. Данные пептиды можно рассматривать в настоящем изобретении как пептиды, не содержащие внутримолекулярную мостиковую связь. В некоторых аспектах стабилизация альфа-спирали достигается способом без введения внутримолекулярной мостиковой связи, такой как солевой мостик или ковалентная связь. В некоторых вариантах осуществления одно, два, три, четыре или более положений 16, 17, 18, 19, 20, 21, 24 или 29 глюкагонового пептида заменены α,α-дизамещенной аминокислотой. Например, замена положения 16 родственного глюкагону пептида класса 3 аминоизомасляной кислотой (Aib) увеличивает GLP-1 активность, в отсутствии солевого мостика или лактама. В некоторых вариантах осуществления одно, два, три или более положений 16, 20, 21 или 24 замещают Aib.
Повышенной активности относительно GLP-1 рецептора можно достигнуть аминокислотной модификацией в положении 20. В некоторых вариантах осуществления глютамин в положении 20 замещен другой гидрофильной аминокислотой, содержащей боковую цепь, которая или является заряженной или обладает способностью образовывать водородные связи, и имеет длину по меньшей мере приблизительно 5 (или приблизительно 4-6) атомов, например, лизин, цитруллин, аргинин или орнитин.
Повышенная активность относительно GLP-1 рецептора демонстрируют для родственных глюкагону пептидов класса 3, содержащих C-концевое удлинение SEQ ID NO: 26. GLP-1 активность у данных родственных глюкагону пептидов класса 3, содержащих SEQ ID NO: 26, можно дополнительно повысить модификацией аминокислоты в положении 18, 28 или 29 или в положении 18 и 29, как описано в настоящем изобретении.
Дополнительного умеренного повышения GLP-1 эффективности можно достигнуть модификацией аминокислоты в положении 10, чтобы она являлась Trp.
Комбинации модификаций, которые повышают GLP-1 рецепторную активность, могут обеспечить большей GLP-1 активностью, чем любая из данных модификаций, взятая отдельно. Например, родственные глюкагону пептиды класса 3 могут содержать модификации в положении 16, в положении 20 и по C-концевой карбоксильной группе, необязательно с ковалентной связью между аминокислотами в положениях 16 и 20; могут содержать модификации в положении 16 и по C-концевой карбоксильной группе; могут содержать модификации в положениях 16 и 20, необязательно с ковалентной связью между аминокислотами в положениях 16 и 20; или могут содержать модификации в положении 20 и по C-концевой карбоксильной группе; необязательно при условии, что аминокислота в положении 12 не является Arg; или необязательно при условии, что аминокислота в положении 9 не является Glu.
Модификации, влияющие на растворимость
Присоединение гидрофильных групп
Родственные глюкагону пептиды класса 3 можно дополнительно модифицировать для увеличения растворимости и стабильности пептида в водных растворах при физиологическом pH, при сохранении большой биологической активности по сравнению с нативным глюкагоном. Гидрофильные группы, как описано в настоящем изобретении, могут быть соединены с родственным глюкагону пептидом класса 3, как дополнительно обсуждается в настоящем изобретении.
В соответствии с некоторыми вариантами осуществления, ожидается, что введение гидрофильных групп в положения 17, 21 и 24 родственного глюкагону пептида класса 3, содержащего SEQ ID NO: 9 или SEQ ID NO: 10, будет увеличивать растворимость и стабильность высокоэффективного глюкагонового аналога в растворах, имеющих физиологический pH. Введение данных групп также увеличивает продолжительность действия, например, как измерено продленным временем полужизни в кровотоке.
В некоторых вариантах осуществления родственный глюкагону пептид класса 3 содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, SEQ ED NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, где боковая цепь аминокислотного остатка в одном из положений 16, 17, 21 или 24 указанного родственного глюкагону пептида класса 3 дополнительно содержит полиэтиленгликольную цепь, имеющую молекулярный вес, выбранный из диапазона от приблизительно 500 до приблизительно 40000 Дальтон. В некоторых вариантах осуществления полиэтиленгликольная цепь имеет молекулярный вес, выбранный из диапазона из от приблизительно 500 до приблизительно 5000 Дальтон. В другом варианте осуществления полиэтиленгликольная цепь имеет молекулярный вес от приблизительно 10000 до приблизительно 20000 Дальтон. В еще других вариантах осуществления полиэтиленгликольная цепь имеет молекулярный вес от приблизительно 20000 до приблизительно 40000 Дальтон.
Подходящие гидрофильные группы включают любые растворимые в воде полимеры, известные в данной области техники, включая гидрофильные группы, описанные в настоящем изобретении, гомо- или сополимеры PEG, и монометил-замещенный полимер PEG (мPEG). В соответствии с некоторыми вариантами осуществления гидрофильная группа включает полиэтиленгликольную (PEG) цепь. Более конкретно, в некоторых вариантах осуществления родственный глюкагону пептид класса 3 имеет последовательность SEQ ID NO: 6 или SEQ ID NO: 7, где PEG цепь ковалентно связана с боковыми цепями аминокислот, присутствующих в положениях 21 и 24 родственного глюкагону пептида класса 3, и карбокси концевая аминокислота родственного глюкагону пептида класса 3 содержит карбоксильную группу. В соответствии с некоторыми вариантами осуществления полиэтиленгликольная цепь имеет средний молекулярный вес, выбранный из диапазона от приблизительно 500 до приблизительно 10000 Дальтон.
В соответствии с некоторыми вариантами осуществления пегилированный родственный глюкагону пептид класса 3 содержит две или более полиэтиленгликольных цепей, ковалентно связанных с родственным глюкагону пептидом класса 3, где суммарный молекулярный вес глюкагоновых цепей равен от приблизительно 1000 до приблизительно 5000 Дальтон. В некоторых вариантах осуществления пегилированный глюкагоновый агонист включает пептид, содержащий SEQ ID NO: 5 или глюкагоновый агонистический аналог SEQ ID NO: 5, где PEG цепь ковалентно связана с аминокислотным остатком в положении 21 и в положении 24, и где суммарный молекулярный вес двух PEG цепей равен от приблизительно 1000 до приблизительно 5000 Дальтон.
Заряженный C-конец
Растворимость родственного глюкагону пептида класса 3, содержащего SEQ ID NO: 20, можно дополнительно увеличить, например, введением одной, двух, трех или более заряженных аминокислот в C-концевую часть глюкагонового пептида SEQ ID NO: 20, предпочтительно в положение, C-концевое к положению 27. Данную заряженную аминокислоту можно ввести заменой нативной аминокислоты заряженной аминокислотой, например, в положениях 28 или 29, или альтернативно присоединением заряженной аминокислоты, например, после положения 27, 28 или 29. В примерных вариантах осуществления одна, две, три или все из заряженных аминокислот являются отрицательно заряженными. Дополнительные модификации, например, консервативные замены, можно вводить в родственный глюкагону пептид класса 3, которые, тем не менее, позволяют ему сохранять глюкагоновую активность. В некоторых вариантах осуществления обеспечивают аналог родственного глюкагону пептида класса 3 SEQ ID NO: 20, где аналог отличается от SEQ ID NO: 20 1-2 аминокислотными заменами в положениях 17-26, и в некоторых вариантах осуществления аналог отличается от пептида SEQ ID NO: 20 аминокислотной заменой в положении 20.
Ацилирование/алкилирование
В соответствии с некоторыми вариантами осуществления, глюкагоновый пептид модифицируют так, чтобы он содержал ацильную или алкильную группу, например, C4-C30 ацильную или алкильную группу. В некоторых аспектах ацильная группа или алкильная группа не является встречающейся в природе в аминокислоте. В конкретных аспектах ацильная или алкильная группа является ненативной для любой встречающейся в природе аминокислоте. Ацилирование или алкилирование может увеличивать время полужизни в кровотоке и/или замедлять начало и/или увеличивать продолжительность действия и/или увеличивать устойчивость к протеазам, таким как DPP-IV. Активность относительно глюкагонового рецептора и GLP-1 рецептора родственных глюкагону пептидов класса 3 сохраняется, если незначительно увеличивается после ацилирования. Кроме того, эффективность ацилированных аналогов является сравнимой с эффективностью неацилированных вариантов родственных глюкагону пептидов класса 3, если не является значительно повышенной.
В некоторых вариантах осуществления настоящее изобретение обеспечивает родственный глюкагону пептид класса 3, модифицированный так, чтобы он содержал ацильную группу или алкильную группу, ковалентно связанную с аминокислотой в положении 10 глюкагонового пептида. Глюкагоновый пептид может дополнительно содержать спейсерную группу между аминокислотой в положении 10 родственного глюкагону пептида класса 3 и ацильной группой или алкильной группой. Любой из приведенных выше родственных глюкагону пептидов класса 3 может содержать две ацильные группы или две алкильные группы, или их комбинацию.
В конкретном аспекте настоящего изобретения ацилированный родственный глюкагону пептид класса 3 содержит аминокислотную последовательность любой из SEQ ID NO: 534-544 и 546-549.
C-концевое укорачивание
В некоторых вариантах осуществления родственные глюкагону пептиды класса 3, описанные в настоящем изобретении, дополнительно модифицируют укорачиванием или делецией одной или двух аминокислот на C-конце глюкагонового пептида (т.е, положение 29 и/или 28) без влияния на активность и/или эффективность относительно глюкагонового и GLP-1 рецепторов. В связи с этим, родственный глюкагону пептид класса 3 может содержать аминокислоты 1-27 или 1-28 нативного глюкагонового пептида (SEQ ID NO: 1), необязательно с одной или более модификациями, описанными в настоящем изобретении.
В некоторых вариантах осуществления укороченный родственный глюкагону пептид класса 3 содержит SEQ ID NO: 550 или SEQ ID NO: 551. В другом варианте осуществления укороченный глюкагоновый агонистический пептид содержит SEQ ID NO: 552 или SEQ ID NO: 553.
C-концевое удлинение
В соответствии с некоторыми вариантами осуществления родственные глюкагону пептиды класса 3, описанные в настоящем изобретении, модифицированы присоединением второго пептида к карбокси концу глюкагонового пептида, например, SEQ ID NO: 26, SEQ ID NO: 27 или SEQ ID NO: 28. В некоторых вариантах осуществления родственный глюкагону пептид класса 3, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68 и SEQ ID NO: 69, ковалентно связан через пептидную связь со вторым пептид, где второй пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В следующем варианте осуществления в родственных глюкагону пептидах класса 3, которые содержат C-концевое удлинение, треонин в положении 29 нативного глюкагонового пептида замещен глицином. Родственный глюкагону пептид класса 3, содержащий глициновую замену для треонина в положении 29 и содержащий карбокси концевое удлинение SEQ ID NO: 26, является в четыре раза более эффективным относительно GLP-1 рецептора, чем нативный глюкагон, модифицированный так, чтобы он содержал карбокси концевое удлинение SEQ ID NO: 26. Эффективность относительно GLP-1 рецептора можно дополнительно увеличить аланиновой заменой для нативного аргинина в положении 18.
Соответственно, родственный глюкагону пептид класса 3 может содержать карбокси концевое удлинение SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28. В соответствии с некоторыми вариантами осуществления, родственный глюкагону пептид класса 3, содержащий SEQ ID NO: 33 или SEQ ID NO: 20, дополнительно содержит аминокислотную последовательность SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28, соединенную с аминокислотой 29 глюкагонового пептида. Более конкретно, родственный глюкагону пептид класса 3 содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 13 SEQ ID NO: 14 и SEQ ID NO: 15, дополнительно содержащую аминокислотную последовательность SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28, соединенную с аминокислотой 29 глюкагонового пептида. Более конкретно, глюкагоновый пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 13 SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 55 и SEQ ID NO: 56, дополнительно содержащую аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPPS) или SEQ ID NO: 29, соединенную с аминокислотой 29 родственного глюкагону пептида класса 3. В некоторых вариантах осуществления родственный глюкагону пептид класса 3 имеет последовательность SEQ ID NO: 64.
Другие модификации
Любую из модификаций, описанных выше относительно родственных глюкагону пептидов класса 3, которая повышает или понижает глюкагоновую рецепторную активность и которая повышает GLP-1 рецепторную активность, можно применять отдельно или в комбинации. Комбинации модификаций, которые увеличивают GLP-1 рецепторную активность, обычно обеспечивают большую GLP-1 активность, чем любая из данных модификаций, взятая отдельно. Любую из модификаций, описанных выше, можно также комбинировать с другими модификациями, описанными в настоящем изобретении относительно родственных глюкагону пептидов класса 3, которые придают другие требуемые свойства, такие как повышенная растворимость, и/или стабильность, и/или продолжительность действия. Альтернативно, любую из модификаций, описанных выше, можно комбинировать с другими модификациями, описанными в настоящем изобретении относительно родственных глюкагону пептидов класса 3, которые незначительно влияют на растворимость, или стабильность, или активность. Примерные модификации включают, но не ограничиваясь этим:
(A) увеличение растворимости, например, введением одной, двух, трех или более заряженных аминокислот в C-концевую часть нативного глюкагона, предпочтительно в положение, C-концевое к положению 27. Данную заряженную аминокислоту можно ввести заменой нативной аминокислоты заряженной аминокислотой, например, в положениях 28 или 29, или альтернативно присоединением заряженной аминокислоты, например, после положения 27, 28 или 29. В примерных вариантах осуществления одна, две, три или все из заряженных аминокислот являются отрицательно заряженными. В других вариантах осуществления одна, две, три или все из заряженных аминокислот являются положительно заряженными. Данные модификации увеличивают растворимость, например, обеспечивая по меньшей мере 2-кратной, 5-кратной, 10-кратной, 15-кратной, 25-кратной, 30-кратной или более растворимостью по сравнению с нативным глюкагоном при заданном pH между приблизительно 5,5 и 8, например, pH 7, при измерении после 24 часов при 25°C;
(B) увеличение растворимости и продолжительности действия или времени полужизни в кровотоке присоединением гидрофильной группы, такой как полиэтиленгликольная цепь, как описано в настоящем изобретении, например, в положении 16, 17, 20, 21, 24 или 29, или к C-концевой аминокислоте пептида;
(C) увеличение стабильности модификацией аспарагиновой кислоты в положении 15, например, делецией или заменой глютаминовой кислотой, гомоглютаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой. Данные модификации могут ослаблять разрушение или расщепление при pH в диапазоне 5,5-8, особенно в кислых или основных буферах, например, сохраняя по меньшей мере 75%, 80%, 90%, 95%, 96%, 97%, 98% или 99% первоначального пептида после 24 часов при 25°C;
(D) увеличение стабильность модификацией метионина в положении 27, например, заменой лейцином или норлейцином. Данные модификации могут ослаблять окислительное разрушение. Стабильность также можно повысить модификацией Gln в положении 20 или 24, например, заменой Ser, Thr, Ala или Aib. Данные модификации могут ослаблять разрушение, которое протекает через дезаминирование Gln. Стабильность можно повысить модификацией Asp в положении 21, например, заменой Glu. Данные модификации могут ослаблять разрушение, которое протекает через дегидратацию Asp, образуя циклическое промежуточное соединение с последующей изомеризацией до изоаспартата;
(E) увеличение устойчивости к расщеплению дипептидилпептидазой IV (DPPIV) модификацией аминокислоты в положении 1 или 2 DPP-IV устойчивыми аминокислотами, описанными в настоящем изобретении и включающими модификацию аминокислоты в положении 2 N-метилаланином;
(F) консервативные или неконсервативные замены, присоединения или делеции, которые не влияют на активность, например, консервативные замены в одном или более положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29; делеции в одном или более положениях 27, 28 или 29; или делецию аминокислоты 29, необязательно в комбинации с C-концевым амидом или эфиром вместо C-концевой карбоксильной группы;
(G) присоединение C-концевых удлинений, как описано в настоящем изобретении;
(H) увеличение время полужизни в кровотоке, и/или увеличение продолжительности действия, и/или замедление начала действия, например, ацилированием или алкилированием глюкагонового пептида, как описано в настоящем изобретении;
(I) гомодимеризацию или гетеродимеризацию, как описано в настоящем изобретении.
Другие модификации включают замену His в положении 1 большой ароматической аминокислотой (например, Tyr, Phe, Trp или амино-Phe); Ser в положении 2 Ala; замену Tyr в положении 10 Val или Phe; замену Lys в положении 12 Arg; замену Asp в положении 15 Glu; замену Ser в положении 16 Thr или Aib.
Родственные глюкагону пептиды класса 3 с GLP-1 активностью, которые содержат неконсервативную замену His в положении 1 большой ароматической аминокислотой (например, Tyr), могут сохранять GLP-1 активность при условии, что альфа-спираль стабилизирована внутримолекулярной мостиковой связью, например, такой как любая из внутримолекулярных мостиковых связей, описанных в настоящем изобретении.
Конъюгаты и слияния
Родственный глюкагону пептид класса 3 может быть соединен, необязательно ковалентной связью и необязательно линкером с конъюгатным фрагментом.
Родственный глюкагону пептид класса 3 также может быть частью пептида или слитого белка, где второй пептид или полипептид конденсирован с концом, например, карбокси концом родственного глюкагону пептида класса 3.
Более конкретно, конденсированный родственный глюкагону пептид класса 3 может содержать глюкагоновый агонист SEQ ID NO: 55, SEQ ID NO: 9 или SEQ ID NO: 10, дополнительно содержащий аминокислотную последовательность SEQ ID NO: 26 (GPSSGAPPPS), SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28 (KRNR), соединенную с аминокислотой 29 глюкагонового пептида. В некоторых вариантах осуществления аминокислотная последовательность SEQ ID NO: 26 (GPSSGAPPPS), SEQ ID NO: 27 (KRNRNNIA) или SEQ ID NO: 28 (KRNR) соединена с аминокислотой 29 родственного глюкагону пептида класса 3 пептидной связью. Заявители обнаружили, что в пептидах, конденсированных с родственным глюкагону пептидом класса 3, содержащих пептид C-концевого удлинения, эксендин-4 (например, SEQ ID NO: 26 или SEQ ID NO: 29), замена нативного треонинового остатка в положении 29 глицином, резко снижает GLP-1 рецепторную активность. Данную аминокислотную замену можно применять в комбинации с другими модификациями, описанными в настоящем изобретении относительно родственных глюкагону пептидов класс 3, для увеличения сродства глюкагоновых аналогов к GLP-1 рецептору. Например, T29G замену можно комбинировать с S16E и N20K аминокислотными заменами, необязательно с лактамной мостиковой связью между аминокислотами 16 и 20, и необязательно с присоединением PEG цепи, как описано в настоящем изобретении. В некоторых вариантах осуществления родственный глюкагону пептид класса 3 имеет последовательность SEQ ID NO: 64. В некоторых вариантах осуществления часть родственного глюкагону пептида класса 3 глюкагонового слитого пептида выбрана из группы, состоящей из SEQ ID NO: 55, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, и SEQ ID NO: 5 где PEG цепь, когда они присутствуют в положениях 17, 21, 24, или у C-концевой аминокислоты, или в обоих 21 и 24, выбрана из диапазона 500-40000 Дальтон. Более конкретно, в некоторых вариантах осуществления часть родственного глюкагону пептида класса 3 выбрана из группы, состоящей из SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 63, где PEG цепь выбрана из диапазона 500-5000. В некоторых вариантах осуществления родственный глюкагону пептид класса 3 представляет собой слитый пептид, содержащий последовательность SEQ ID NO: 55 и SEQ ID NO: 65, где пептид SEQ ID NO: 65 соединен с карбокси концом SEQ ID NO: 55.
В соответствии с некоторыми вариантами осуществления дополнительная химическая модификация родственного глюкагону пептида класса 3 SEQ ID NO: 10 придает повышенную GLP-1 рецепторную эффективность в некоторой степени, когда относительная активность относительно глюкагонового и GLP-1 рецепторов является фактически одинаковой. Соответственно, в некоторых вариантах осуществления родственный глюкагону пептид класса 3 содержит концевую аминокислоту, содержащую амидную группу вместо карбоксильной группы, которая присутствует в нативной аминокислоте. Относительную активность родственного глюкагону пептида класса 3 относительно соответствующих глюкагонового и GLP-1 рецепторов можно регулировать дополнительными модификациями в родственном глюкагону пептиде класса 3 для получения аналогов, обладающих от приблизительно 40% до приблизительно 500% или более активности нативного глюкагона относительно глюкагонового рецептора и от приблизительно 20% до приблизительно 200% или более активности нативного GLP-1 относительно GLP-1 рецептора, например, 50-кратным, 100-кратным или более увеличением по сравнению с нормальной активностью глюкагона относительно GLP-1 рецептора. В некоторых вариантах осуществления глюкагоновые пептиды, описанные в настоящем изобретении, обладают вплоть до приблизительно 100%, 1000%, 10,000%, 100000% или 1000000% активности нативного глюкагона относительно глюкагонового рецептора. В некоторых вариантах осуществления глюкагоновые пептиды, описанные в настоящем изобретении, обладают вплоть до приблизительно 100%, 1000%, 10000%, 100000% или 1000000% активности нативного GLP-1 относительно GLP-1 рецептора.
Примерные варианты осуществления
В соответствии с некоторыми вариантами осуществления обеспечивают глюкагоновый аналог, содержащий последовательность SEQ ID NO: 55, где указанный аналог отличается от SEQ ID NO: 55 1-3 аминокислотами, выбранными из положения 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 24, 27, 28 и 29, где указанный глюкагоновый пептид обладает по меньшей мере 20% активности нативного GLP-1 относительно GLP-1 рецептора.
В соответствии с некоторыми вариантами осуществления обеспечивают глюкагон/GLP-1 рецепторный соагонист, содержащий последовательность:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Asp-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 33), где Xaa в положении 15 выбран из группы аминокислот, состоящей из Asp, Glu, цистеиновой кислоты, гомоглютаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 16 выбран из группы аминокислот, состоящей из Ser, Glu, Gln, гомоглютаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 20 представляет собой Gln или Lys, Xaa в положении 24 представляет собой Gln или Glu, Xaa в положении 28 представляет собой Asn, Lys или кислую аминокислоту, Xaa в положении 29 представляет собой Thr, Gly или кислую аминокислоту, и R представляет собой COOH или CONH2, при условии, что, когда положение 16 представляет собой серин, положение 20 представляет собой Lys, или альтернативно когда положение 16 представляет собой серин, положение 24 представляет собой Glu, и или положение 20, или положение 28 представляет собой Lys. В некоторых вариантах осуществления глюкагон/GLP-1 рецепторный соагонист имеет последовательность SEQ ID NO: 33, где аминокислота в положении 28 представляет собой аспарагиновую кислоту, и аминокислота в положении 29 представляет собой глютаминовую кислоту. В другом варианте осуществления аминокислота в положении 28 представляет собой нативный аспарагин, аминокислота в положении 29 представляет собой глицин, и аминокислотная последовательность SEQ ID NO: 29 или SEQ ID NO: 65 ковалентно связана с карбокси концом SEQ ID NO: 33.
В некоторых вариантах осуществления обеспечивают соагонист, содержащий последовательность SEQ ID NO: 33, где дополнительную кислую аминокислоту присоединяют к карбокси концу пептида. В следующем варианте осуществления карбокси концевая аминокислота глюкагонового аналога содержит амид вместо карбоксильной группы нативной аминокислоты. В некоторых вариантах осуществления глюкагоновый аналог содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 и SEQ ID NO: 44.
В соответствии с некоторыми вариантами осуществления обеспечивают глюкагоновый пептидный аналог SEQ ID NO: 33, где указанный аналог отличается от SEQ ID NO: 33 1-3 аминокислотами, выбранными из положения 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21 и 27, при условии, что, когда аминокислота в положении 16 представляет собой серин, или положение 20 представляет собой лизин, или лактамная мостиковая связь образуется между аминокислотой в положении 24 и аминокислотой или в положении 20, или в положении 28. В соответствии с некоторыми вариантами осуществления аналог отличается от SEQ ID NO: 33 1-3 аминокислотами, выбранными из положения 1, 2, 3, 21 и 27. В некоторых вариантах осуществления глюкагоновый пептидный аналог SEQ ID NO: 33 отличается от данной последовательности 1-2 аминокислотами, или в некоторых вариантах осуществления одной аминокислотой, выбранной из положения 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21 и 27, при условии, что, когда аминокислота в положении 16 представляет собой серин, или положение 20 представляет собой лизин, или лактамная мостиковая связь образуется между аминокислотой в положении 24 и аминокислотой или в положении 20 или в положении 28.
В соответствии с другим вариантом осуществления обеспечивают относительно селективный GLP-1 рецепторный агонист, содержащий последовательность NH2-His-Ser-Xaa-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Asp-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 53), где Xaa в положении 3 выбран из группы аминокислот, состоящей из Glu, Orn или Nle, Xaa в положении 15 выбран из группы аминокислот, состоящей из Asp, Glu, цистеиновой кислоты, гомоглютаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 16 выбран из группы аминокислот, состоящей из Ser, Glu, Gln, гомоглютаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 20 представляет собой Gln или Lys, Xaa в положении 24 представляет собой Gln или Glu, Xaa в положении 28 представляет собой Asn, Lys или кислую аминокислоту, Xaa в положении 29 представляет собой Thr, Gly или кислую аминокислоту, и R представляет собой COOH, CONH2, SEQ ID NO: 26 или SEQ ID NO: 29, при условии, что когда положение 16 представляет собой серин, положение 20 представляет собой Lys, или альтернативно, когда положение 16 представляет собой серин, положение 24 представляет собой Glu, и или положение 20 или положение 28 представляет собой Lys. В некоторых вариантах осуществления аминокислота в положении 3 представляет собой глютаминовую кислоту. В некоторых вариантах осуществления кислая аминокислота, которой заменено положение 28 и/или 29, представляет собой аспарагиновую кислоту или глютаминовую кислоту. В некоторых вариантах осуществления глюкагоновый пептид, включая соагонистический пептид, содержит последовательность SEQ ID NO: 33, дополнительно содержащую дополнительную кислую аминокислоту, присоединенную к карбокси концу пептида. В следующем варианте осуществления карбокси концевая аминокислота глюкагонового аналога содержит амид вместо карбоксильной группы нативной аминокислоты.
В соответствии с некоторыми вариантами осуществления обеспечивают глюкагон/GLP-1 рецепторный соагонист, содержащий модифицированный глюкагоновый пептид, выбранный из группы, состоящей из:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Asp-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 34), где Xaa в положении 15 выбран из группы аминокислот, состоящей из Asp, Glu, цистеиновой кислоты, гомоглютаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 16 выбран из группы аминокислот, состоящей из Ser, Glu, Gln, гомоглютаминовой кислоты и гомоцистеиновой кислоты, Xaa в положении 20 представляет собой Gln или Lys, Xaa в положении 24 представляет собой Gln или Glu, и Xaa в положении 28 представляет собой Asn, Asp или Lys, R представляет собой COOH или CONH2, Xaa в положении 29 представляет собой Thr или Gly, и R представляет собой COOH, CONH2, SEQ ID NO: 26 или SEQ ID NO: 29, при условии, что когда положение 16 представляет собой серин, положение 20 представляет собой Lys, или альтернативно, когда положение 16 представляет собой серин, положение 24 представляет собой Glu, и или положение 20 или положение 28 представляет собой Lys. В некоторых вариантах осуществления R представляет собой CONH2, Xaa в положении 15 представляет собой Asp, Xaa в положении 16 выбран из группы аминокислот, состоящей из Glu, Gln, гомоглютаминовой кислоты и гомоцистеиновой кислоты, каждый из Xaa в положениях 20 и 24 представляет собой Gln, Xaa в положении 28 представляет собой Asn или Asp, и Xaa в положении 29 представляет собой Thr. В некоторых вариантах осуществления каждый из Xaa в положениях 15 и 16 представляет собой Glu, каждый из Xaa в положениях 20 и 24 представляет собой Gln, Xaa в положении 28 представляет собой Asn или Asp, Xaa в положении 29 представляет собой Thr, и R представляет собой CONH2.
Сообщалось, что определенные положения нативного глюкагонового пептида можно модифицировать при сохранении, по меньшей мере, некоторой активности исходного пептида. Соответственно, заявители ожидают, что одну или более из аминокислот, находящихся в положениях 2, 5, 7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 или 29 пептида SEQ ID NO: 11, можно заместить аминокислотой, отличной от аминокислоты, присутствующей в нативном глюкагоновом пептиде, и, тем не менее, он будет сохранять активность относительно глюкагонового рецептора. В некоторых вариантах осуществления метиониновый остаток, находящийся в положении 27 нативного пептида, заменяют лейцином или норлейцином для предотвращения окислительного разрушения пептида. В другом варианте осуществления аминокислота в положении 20 заменена Lys, Arg, Orn или цитруллином и/или положение 21 заменено Glu, гомоглютаминовой кислотой или гомоцистеиновой кислотой.
В некоторых вариантах осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 20, где 1-6 аминокислоты, выбранные из положения 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 27, 28 или 29 аналога, отличаются от соответствующих аминокислот SEQ ID NO: 1, при условии, что когда аминокислота в положении 16 представляет собой серин, положение 20 представляет собой Lys, или альтернативно, когда положение 16 представляет собой серин, положение 24 представляет собой Glu, и или положение 20 или положение 28 представляет собой Lys. В соответствии с другим вариантом осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 20, где 1-3 аминокислоты, выбранные из положения 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 20, 21, 27, 28 или 29 аналога, отличаются от соответствующей аминокислоты SEQ ID NO: 1. В другом варианте осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 11, где 1-2 аминокислоты, выбранные из положения 1, 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 20 или 21 аналога, отличаются от соответствующей аминокислоты SEQ ID NO: 1, и в следующем варианте осуществления одна-две отличные аминокислоты представляют собой консервативные аминокислотные замены по сравнению с аминокислотами, присутствующими в нативной глюкагоновой последовательности (SEQ ID NO: 1). В некоторых вариантах осуществления обеспечивают глюкагоновый пептид SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, где глюкагоновый пептид дополнительно содержит одну, две или три аминокислотные замены в положениях, выбранных из положения 2, 5, 7, 10, 11, 13, 14, 17, 18, 19, 20, 21, 27 или 29. В некоторых вариантах осуществления замены в положениях 2, 5, 7, 10, 11, 13, 14,16, 17, 18, 19,20, 21, 27 или 29 представляют собой консервативные аминокислотные замены.
В соответствии с некоторыми вариантами осуществления обеспечивают глюкагон/GLP-1 рецепторным соагонист, содержащий модификацию последовательности SEQ ID NO 33, где 1-10 аминокислоты, выбранные из положений 16, 17, 18, 20, 21, 23, 24, 27, 28 и 29, соответственно, модификации, отличаются от соответствующей аминокислоты SEQ ID NO: 1. В соответствии с некоторыми вариантами осуществления обеспечивают модификацию последовательности SEQ ID NO 33, где модификация отличается от SEQ ID NO: 33 одной или более аминокислотными заменами, выбранными из группы, состоящей из Gln17, Ala18, Glu21, De23, Ala24, Val27 и Gly29. В соответствии с некоторыми вариантами осуществления обеспечивают глюкагон/GLP-1 рецепторный соагонист, включающий модификации последовательности SEQ ID NO 33, где 1-2 аминокислоты, выбранные из положения 17-26 модификации, отличаются от соответствующей аминокислоты SEQ ID NO: 1. В соответствии с некоторыми вариантами осуществления обеспечивают модификацию последовательности SEQ ID NO 33, где модификация отличается от SEQ ID NO: 33 аминокислотной заменой, выбранной из группы, состоящей из Gln17, Ala18, Glu21, Ile23 и Ala24. Согласно некоторым вариантам осуществления обеспечивают модификацию последовательности SEQ ID NO 33, где модификация отличается от SEQ ID NO: 33 аминокислотной заменой в положении 18, где замененная аминокислота выбрана из группы, состоящей из Ala, Ser, Thr и Gly. В соответствии с некоторыми вариантами осуществления обеспечивают модификацию последовательности SEQ ID NO 33, где модификация отличается от SEQ ID NO: 33 аминокислотной заменой Ala в положении 18. Данные модификации включены SEQ ID NO: 55. В другом варианте осуществления обеспечивают глюкагон/GLP-1 рецепторный соагонист, включая модификации последовательности SEQ ID NO 33, где 1-2 аминокислоты, выбранные из положения 17-22 модификации, отличаются от соответствующей аминокислоты SEQ ID NO: 1, и в следующем варианте осуществления обеспечивают модификацию SEQ ID NO 33, где модификация отличается от SEQ ID NO: 33 1 или 2 аминокислотными заменами в положениях 20 и 21. В соответствии с некоторыми вариантами осуществления обеспечивают глюкагон/GLP-1 рецепторный соагонист, содержащий последовательность:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Xaa-Xaa-Phe-Val-Xaa-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 51), где Xaa в положении 15 представляет собой Asp, Glu, цистеиновую кислоту, гомоглютаминовую кислоту или гомоцистеиновую кислоту, Xaa в положении 16 представляет собой Ser, Glu, Gln, гомоглютаминовую кислоту или гомоцистеиновую кислоту, Xaa в положении 20 представляет собой Gln, Lys, Arg, Orn или цитруллин, Xaa в положении 21 представляет собой Asp, Glu, гомоглютаминовую кислоту или гомоцистеиновую кислоту, Xaa в положении 24 представляет собой Gln или Glu, Xaa в положении 28 представляет собой Asn, Lys или кислую аминокислоту, Xaa в положении 29 представляет собой Thr или кислую аминокислоту, и R представляет собой COOH или CONH2. В некоторых вариантах осуществления R представляет собой CONH2. В соответствии с некоторыми вариантами осуществления обеспечивают глюкагон/GLP-1 рецепторный соагонист, содержащий модификацию SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 47, SEQ ID NO: 48 или SEQ ID NO: 49, где модификация отличается от указанной последовательности аминокислотной заменой в положении 20. В некоторых вариантах осуществления аминокислотная замена выбрана из группы, состоящей из Lys, Arg, Orn или цитруллина, для положения 20.
В некоторых вариантах осуществления обеспечивают глюкагоновый агонист, включая пептид, являющийся аналогом SEQ ID NO: 34, где аналог отличается от SEQ ID NO: 34 наличием аминокислоты, отличной от серина в положении 2. В некоторых вариантах осуществления сериновый остаток заменен аминоизомасляной кислотой, D-аланином, и в некоторых вариантах осуществления сериновый остаток заменен аминоизомасляной кислотой. Данные модификации подавляют расщепление дипептидилпептидазой IV при сохранении нативной активности исходного соединения (например, по меньшей мере 75, 80, 85, 90, 95% или более активности исходного соединения). В некоторых вариантах осуществления растворимость аналога увеличивают, например, введением одной, двух, трех или более заряженных аминокислот в C-концевую часть нативного глюкагона, предпочтительно в положение, C-концевое к положению 27. В примерных вариантах осуществления одна, две, три или все из заряженных аминокислот являются отрицательно заряженными. В другом варианте осуществления аналог дополнительно содержит кислую аминокислоту, которая заменила нативную аминокислоту в положении 28 или 29, или кислую аминокислоту, присоединенную к карбокси концу пептида SEQ ID NO: 34.
В некоторых вариантах осуществления глюкагоновые аналоги, описанные в настоящем изобретении, дополнительно модифицируют в положении 1 или 2, снижая подверженность к расщеплению дипептидилпептидазой IV. В некоторых вариантах осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, где аналог отличается от исходной молекулы заменой в положении 2 и обладает пониженной подверженностью (т.е. устойчивостью) к расщеплению дипептидилпептидазой IV. Более конкретно, в некоторых вариантах осуществления положение 2 пептида, являющегося аналогом, заменено аминокислотой, выбранной из группы, состоящей из D-серина, D-аланина, валина, амино н-масляной кислоты, глицина, N-метилсерина и аминоизомасляной кислоты. В некоторых вариантах осуществления положение 2 пептида, являющегося аналогом, заменено аминокислотой, выбранной из группы, состоящей из D-серина, D-аланина, глицина, N-метилсерина и аминоизомасляной кислоты. В другом варианте осуществления положение 2 пептида, являющегося аналогом, заменено аминокислотой, выбранной из группы, состоящей из D-серина, глицина, N-метилсерина и аминоизомасляной кислоты. В некоторых вариантах осуществления аминокислота в положении 2 не является D-серином. В некоторых вариантах осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 21 или SEQ ID NO: 22.
В некоторых вариантах осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, где аналог отличается от исходной молекулы заменой в положении 1 и обладает пониженной подверженностью (т.е. устойчивостью) к расщеплению дипептидилпептидазой IV. Более конкретно, положение 1 пептида, являющегося аналогом, заменено аминокислотой, выбранной из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. В другом варианте осуществления обеспечивают глюкагоновый агонист, включая пептид, являющийся аналогом, SEQ ID NO: 34, где аналог отличается от SEQ ID NO: 34 наличием аминокислоты, отличной от гистидина в положении 1. В некоторых вариантах осуществления растворимость аналога увеличивают, например, введением одной, двух, трех или более заряженных аминокислот в C-концевую часть нативного глюкагона, предпочтительно в положение, C-концевое к положению 27. В примерных вариантах осуществления одна, две, три или все из заряженных аминокислот являются отрицательно заряженными. В другом варианте осуществления аналог дополнительно содержит кислую аминокислоту, заместившую нативную аминокислоту в положении 28 или 29, или кислую аминокислоту, присоединенную к карбокси концу пептида SEQ ID NO: 34. В некоторых вариантах осуществления кислая аминокислота представляет собой аспарагиновую кислоту или глютаминовую кислоту.
В некоторых вариантах осуществления глюкагон/GLP-1 рецепторный соагонист содержит последовательность SEQ ID NO: 20, дополнительно содержащую дополнительное карбокси концевое удлинение из одной аминокислоты или пептид, выбранный из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В варианте осуществления, где одну аминокислоту присоединяют к карбокси концу SEQ ID NO: 20, аминокислота обычно выбрана из одной из 20 стандартных аминокислот, и в некоторых вариантах осуществления дополнительная карбокси концевая аминокислота содержит амидную группу вместо карбоксильной группы нативной аминокислоты. В некоторых вариантах осуществления дополнительная аминокислота выбрана из группы, состоящей из глютаминовой кислоты, аспарагиновой кислоты и глицина.
В альтернативном варианте осуществления обеспечивают глюкагон/GLP-1 рецепторный соагонист, где пептид содержит по меньшей мере одно лактамное кольцо, образованное между боковыми цепями остатка глютаминовой кислоты и остатка лизина, где остаток глютаминовой кислоты и остаток лизина разделены тремя аминокислотами. В некоторых вариантах осуществления карбокси концевая аминокислота содержащего лактам глюкагонового пептида содержит амидную группу вместо карбоксильной группы нативной аминокислоты. Более конкретно, в некоторых вариантах осуществления обеспечивают глюкагоновый и GLP-1 соагонист, включая модифицированный глюкагоновый пептид, выбранный из группы, состоящей из:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 66)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Gln-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 67)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-Xaa-Xaa-R (SEQ ID NO: 68)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-Xaa-R (SEQ ID NO: 69)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-Asn-Thr-R (SEQ ID NO: 16)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-Thr-R (SEQ ID NO: 17)
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Scr-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-Thr-R (SEQ ID NO: 18)
где Xaa в положении 28 представляет собой Asp или Asn, Xaa в положении 29 представляет собой Thr или Gly, R выбран из группы, состоящей из COOH, CONH2, глютаминовой кислоты, аспарагиновой кислоты, глицина, SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, и лактамная мостиковая связь образуется между Lys в положении 12 и Glu в положении 16 для SEQ ID NO: 66, между Glu в положении 16 и Lys в положении 20 для SEQ ID NO: 67, между Lys в положении 20 и Glu в положении 24 для SEQ ID NO: 68, между Glu в положении 24 и Lys в положении 28 для SEQ ID NO: 69, между Lys в положении 12 и Glu в положении 16 и между Lys в положении 20 и Glu в положении 24 для SEQ ID NO: 16, между Lys в положении 12 и Glu в положении 16 и между Glu в положении 24 и Lys в положении 28 для SEQ ID NO: 17 и между Glu в положении 16 и Lys в положении 20 и между Glu в положении 24 и Lys в положении 28 для SEQ ID NO: 18. В некоторых вариантах осуществления R выбран из группы, состоящей из COOH, CONH2, глютаминовой кислоты, аспарагиновой кислоты, глицина, аминокислота в положении 28 представляет собой Asn, и аминокислота в положении 29 представляет собой треонин. В некоторых вариантах осуществления R представляет собой CONH2, аминокислота в положении 28 представляет собой Asn, и аминокислота в положении 29 представляет собой треонин. В другом варианте осуществления R выбран из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 29 и SEQ ID NO: 65, и аминокислота в положении 29 представляет собой глицин.
В следующем варианте осуществления глюкагон/GLP-1 рецепторный соагонист выбран из группы, состоящей из SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, где пептид дополнительно содержит дополнительное карбокси концевое удлинение из одной аминокислоты или пептид, выбранный из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В некоторых вариантах осуществления концевое удлинение содержит последовательность SEQ ID NO: 26, SEQ ID NO: 29 или SEQ ID NO: 65, и глюкагоновый пептид содержит последовательность SEQ ID NO: 55. В некоторых вариантах осуществления глюкагон/GLP-1 рецепторный соагонист содержит последовательность SEQ ID NO: 33, где аминокислота в положении 16 представляет собой глютаминовую кислоту, аминокислота в положении 20 представляет собой лизин, аминокислота в положении 28 представляет собой аспарагин, и аминокислотная последовательность SEQ ID No: 26 или SEQ ID NO: 29 соединена с карбокси концом SEQ ID NO: 33.
В варианте осуществления, где одну аминокислоту присоединяют к карбокси концу SEQ ID NO: 20, аминокислота обычно выбрана из одной из 20 стандартных аминокислот, и в некоторых вариантах осуществления аминокислота содержит амидную группу вместо карбоксильной группы нативной аминокислоты. В некоторых вариантах осуществления дополнительная аминокислота выбрана из группы, состоящей из глютаминовой кислоты и аспарагиновой кислоты и глицина. В вариантах осуществления, где глюкагоновый агонистический аналог дополнительно содержит карбокси концевое удлинение, карбокси концевая аминокислота удлинения, в некоторых вариантах осуществления заканчивается амидной группой или эфирной группой, а не карбоксильной группой.
В другом варианте осуществления глюкагон/GLP-1 рецепторный соагонист содержит последовательность: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Xaa-CONH2 (SEQ ID NO: 19), где Xaa в положении 30 представляет собой любую аминокислоту. В некоторых вариантах осуществления Xaa выбран из одной из 20 стандартных аминокислот, и в некоторых вариантах осуществления аминокислота представляет собой глютаминовую кислоту, аспарагиновую кислоту или глицин. Растворимость данного пептида можно дополнительно повысить ковалентным присоединением PEG цепи к боковой цепи аминокислоты в положении 17, 21, 24 или 30 SEQ ID NO: 19. В следующем варианте осуществления пептид содержит дополнительное карбокси концевое удлинение пептида, выбранное из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. В соответствии с некоторыми вариантами осуществления глюкагон/GLP-1 рецепторный соагонист содержит последовательность SEQ ID NO: 30, SEQ ID NO: 31 и SEQ ID NO: 32.
Можно вводить дополнительные сайт-специфические модификации внутри глюкагоновой последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 64 для получения набора глюкагоновых агонистов, которые обладают различными степенями GLP-1 агонизма. Соответственно, получали и охарактеризовывали пептиды, которые обладают практически одинаковой in vitro эффективностью относительно каждого рецептора. Аналогично, определяли и охарактеризовывали пептиды с десятикратной селективной повышенной эффективностью относительно каждого из двух рецепторов. Как указано выше, замена серинового остатка в положении 16 глютаминовой кислотой увеличивает эффективность нативного глюкагона относительно и глюкагонового и GLP-1 рецепторов, но сохраняет приблизительно десятикратную селективность относительно глюкагонового рецептора. Кроме того, замена нативного глютамина в положении 3 глютаминовой кислотой (SEQ ID NO: 22) дает глюкагоновый аналог, который обладает приблизительно десятикратной селективностью относительно GLP-1 рецептора.
Растворимость глюкагон/GLP-1 соагонистических пептидов в водных растворах при физиологическом pH можно дополнительно повысить, при сохранении высокой биологической активности по сравнению с нативным глюкагоном введением гидрофильных групп в положениях 16, 17, 21 и 24 пептида, или присоединением одной модифицированной аминокислоты (т.е. аминокислота модифицирована так, чтобы она содержала гидрофильную группу) к карбокси концу глюкагон/GLP-1 соагонистического пептида. В соответствии с некоторыми вариантами осуществления гидрофильная группа включает полиэтиленгликольную (PEG) цепь. Более конкретно, в некоторых вариантах осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 или SEQ ID NO: 18, где PEG цепь ковалентно связана с боковой цепью аминокислот в положении 16, 17, 21, 24, 29 или с C-концевой аминокислотой глюкагонового пептида, при условии, что когда пептид содержит SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, полиэтиленгликольная цепь ковалентно связана с аминокислотным остатком в положении 17, 21 или 24, когда пептид содержит SEQ ID NO: 14 или SEQ ID NO: 15, полиэтиленгликольная цепь ковалентно связана с аминокислотным остатком в положении 16, 17 или 21, и когда пептид содержит SEQ ID NO: 16, SEQ ID NO: 17 или SEQ ID NO: 18, полиэтиленгликольная цепь ковалентно связана с аминокислотным остатком в положении 17 или 21.
В некоторых вариантах осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13, где PEG цепь ковалентно связана с боковой цепью аминокислот в положении 17, 21, 24, или с C-концевой аминокислотой глюкагонового пептида, и карбокси концевая аминокислота пептида содержит амидную группу вместо карбоксильной группы нативной аминокислоты. В некоторых вариантах осуществления глюкагон/GLP-1 рецепторный соагонистический пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, где PEG цепь ковалентно связана с боковой цепью аминокислоты в положении 17, 21 или 24 SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 19, или в положении 16, 17 или 21 SEQ ID NO: 14 и SEQ ID NO: 15 или в положении 17 или 21 SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18 глюкагонового пептида. В другом варианте осуществления глюкагон/GLP-1 рецепторный соагонистический пептид содержит последовательность SEQ ID NO: 11 или SEQ ID NO: 19, где PEG цепь ковалентно связана с боковой цепью аминокислот в положении 17, 21 или 24 или с C-концевой аминокислотой глюкагонового пептида.
В соответствии с некоторыми вариантами осуществления и с учетом ограничений, описанных в предшествующих параграфах, глюкагоновый соагонистический пептид модифицируют так, чтобы он содержал одну или более аминокислотные замены в положениях 16, 17, 21, 24, или 29 или по C-концевой аминокислоте, где нативная аминокислота заменена аминокислотой, содержащей боковую цепь, подходящую для получения поперечной сшивки с гидрофильными группами, включая, например, PEG. Нативный пептид может быть заменен встречающейся в природе аминокислотой или синтетической (не встречающейся в природе) аминокислотой. Синтетические или не встречающиеся в природе аминокислоты относятся к аминокислотам, которые не встречаются in vivo, но которые, тем не менее, можно вводить в пептидные структуры, описанные в настоящем изобретении. Альтернативно, аминокислоту, содержащую боковую цепь, подходящую для образования поперечной связи с гидрофильными группами, включая, например, PEG, можно присоединять к карбокси концу любого из глюкагоновых аналогов, описанных в настоящем изобретении. В соответствии с некоторыми вариантами осуществления аминокислотную замену осуществляют в глюкагон/GLP-1 рецепторном соагонистическом пептиде в положении, выбранном из группы, состоящей из 16, 17, 21, 24, или 29, замещая нативную аминокислоту аминокислотой, выбранной из группы, состоящей из лизина, цистеина, орнитина, гомоцистеина и ацетилфенилаланина, где заменяющая аминокислота дополнительно содержит PEG цепь, ковалентно связанную с боковой цепью аминокислоты. В некоторых вариантах осуществления глюкагоновый пептид, выбранный из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, и SEQ ID NO: 19, дополнительно модифицирован так, чтобы он содержал PEG цепь, ковалентно связанную с боковой цепью аминокислоты в положении 17 или 21 глюкагонового пептида. В некоторых вариантах осуществления пегилированный глюкагон/GLP-1 рецепторный соагонист дополнительно содержит последовательность SEQ ID NO: 26, SEQ ID NO: 27 или SEQ ID NO: 29.
В другом варианте осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 55 или SEQ ID NO: 56, дополнительно содержащую C-концевые удлинения SEQ ID NO: 26, SEQ ID NO: 29 или SEQ ID NO: 65, соединенные с C-концевой аминокислотой SEQ ID NO: 55 или SEQ ID NO: 56, и необязательно дополнительно содержащую PEG цепь, ковалентно связанную с боковой цепью аминокислот в положении 17, 18, 21, 24 или 29 или с C-концевой аминокислотой пептида. В другом варианте осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 55 или SEQ ID NO: 56, где PEG цепь ковалентно связана с боковой цепью аминокислот в положении 21 или 24 глюкагонового пептида, и пептид дополнительно содержит C-концевое удлинение SEQ ID NO: 26 или SEQ ID NO: 29.
В другом варианте осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 55, или SEQ ID NO: 33, или SEQ ID NO: 34, где дополнительная аминокислота присоединена к карбокси концу SEQ ID NO: 33 или SEQ ID NO: 34, и PEG цепь ковалентно связана с боковой цепью присоединенной аминокислоты. В следующем варианте осуществления пегилированный глюкагоновый аналог дополнительно содержит C-концевое удлинение SEQ ID NO: 26 или SEQ ID NO: 29, соединенное с C-концевой аминокислотой SEQ ID NO: 33 или SEQ ID NO: 34. В другом варианте осуществления глюкагоновый пептид содержит последовательность SEQ ID NO: 19, где PEG цепь ковалентно связана с боковой цепью аминокислоты в положении 30 глюкагонового пептида, и пептид дополнительно содержит C-концевое удлинение SEQ ID NO: 26 или SEQ ID NO: 29, соединенное с C-концевой аминокислотой SEQ ID NO: 19.
Полиэтиленгликольная цепь может быть в виде нормальной цепи, или она может быть разветвленной. В соответствии с некоторыми вариантами осуществления полиэтиленгликольная цепь имеет средний молекулярный вес, выбранный из диапазона от приблизительно 500 до приблизительно 10000 Дальтон. В некоторых вариантах осуществления полиэтиленгликольная цепь имеет средний молекулярный вес, выбранный из диапазона от приблизительно 1000 до приблизительно 5000 Дальтон. В альтернативном варианте осуществления полиэтиленгликольная цепь имеет средний молекулярный вес, выбранный из диапазона от приблизительно 10000 до приблизительно 20000 Дальтон. В соответствии с некоторыми вариантами осуществления пегилированный глюкагоновый пептид содержит две или более полиэтиленгликольные цепи, ковалентно связанные с глюкагоновым пептидом, где суммарный молекулярный вес глюкагоновых цепей равен от приблизительно 1000 до приблизительно 5000 Дальтон. В некоторых вариантах осуществления пегилированный глюкагоновый агонист содержит пептид, состоящий из SEQ ID NO: 5, или глюкагоновый агонистический аналог SEQ ID NO: 5, где PEG цепь ковалентно связана с аминокислотным остатком в положении 21 и в положении 24, и где суммарный молекулярный вес двух PEG цепей равен от приблизительно 1000 до приблизительно 5000 Дальтон.
В определенных примерных вариантах осуществления глюкагоновый пептид содержит аминокислотную последовательность SEQ ID NO: 1 с вплоть до десяти аминокислотных модификаций и содержит аминокислоту в положении 10, которая ацилирована или алкилирована. В некоторых вариантах осуществления аминокислота в положении 10 ацилирована или алкилирована C4-C30 жирной кислотой. В определенных аспектах аминокислота в положении 10 содержит ацильную группу или алкильную группу, которая является ненативной для встречающейся в природе аминокислоты.
В определенных вариантах осуществления глюкагоновый пептид, содержащий аминокислоту в положении 10, которая ацилирована или алкилирована, содержит стабилизированную альфа-спираль. Соответственно, в определенных аспектах, глюкагоновый пептид содержит ацильную или алкильную группу, как описано в настоящем изобретении, и внутримолекулярную мостиковую связь, например, ковалентную внутримолекулярную мостиковую связь (например, лактамную мостиковую связь) между боковыми цепями аминокислоты в положении i и аминокислоты в положении i+4, где i равно 12, 16, 20 или 24. Альтернативно или дополнительно, глюкагоновый пептид содержит ацильную или алкильную группу, как описано в настоящем изобретении, и одно, два, три или более положений 16, 20, 21 и/или 24 глюкагонового пептида замещают α,α-дизамещенной аминокислотой, например, Aib. В ряде случаев, ненативный глюкагоновый пептид содержит Glu в положении 16 и Lys в положении 20, где необязательно лактамная мостиковая связь соединяет Glu и Lys, и, необязательно, глюкагоновый пептид дополнительно содержит одну или более модификаций, выбранных из группы, состоящей из: Gln в положении 17, Ala в положении 18, Glu в положении 21, Ile в положении 23 и Ala в положении 24.
Кроме того, в любом из вариантов осуществления, где глюкагоновый пептид содержит аминокислоту в положении 10, которая ацилирована или алкилирована, глюкагоновый пептид может дополнительно содержать C-концевой амид вместо C-концевого альфа карбоксилата.
В некоторых вариантах осуществления глюкагоновый пептид, содержащий ацильную или алкильную группу, как описано в настоящем изобретении, дополнительно содержит аминокислотную замену в положении 1, в положении 2 или в положениях 1 и 2, где аминокислотная замена(-ы) придает устойчивость к DPP-IV протеазе. Например, His в положении 1 может быть заменен аминокислотой, выбранной из группы, состоящей из: D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Альтернативно или дополнительно, Ser в положении 2 может быть заменен аминокислотой, выбранной из группы, состоящей из: D-серина, аланина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты. В некоторых вариантах осуществления аминокислота в положении 2 не является D-серином.
Глюкагоновый пептид, содержащий аминокислоту в положении 10, которая ацилирована или алкилирована, как описано в настоящем изобретении, может содержать аминокислотную последовательность, которая практически соответствует SEQ ID NO: 1. Например, глюкагоновый пептид содержит SEQ ID NO: 1 с вплоть до 10 аминокислотными модификациями (например, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 модификациями). В определенных вариантах осуществления аминокислотная последовательность ацилированного или алкилированного глюкагонового пептида более чем на 25% идентична SEQ ID NO: 1 (например, более чем на 30%, 35%, 40%, 50%, 60%, 70% 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или практически 100% идентична SEQ ID NO: 1). В определенных конкретных вариантах осуществления глюкагоновый пептид представляет собой глюкагоновый пептид, который содержит SEQ ID NO: 55 с аминокислотой в положении 10, ацилированной или алкилированной, как описано в настоящем изобретении. Глюкагоновый пептид может представлять собой любой из SEQ ID NO: 55, 55 с 1 или 2 аминокислотными модификациями, 2-4, 9-18, 20, 23-25, 33, 40-44, 53, 56, 61, 62, 64, 66-514 и 534.
Ацильная или алкильная группа данных вариантов осуществления может представлять собой любую ацильную или алкильную группу, описанную в настоящем изобретении. Например, ацильная группа может представлять собой ацильную группу C4-C30 (например, C8-C24) жирной кислоты, и алкильная группа может представлять собой C4-C30 (например, C8-C24) алкильную группу.
Аминокислота, к которой присоединяют ацильную или алкильную группу, может представлять собой любую из аминокислот, описанных в настоящем изобретении, например, аминокислоту любой из формулы I (например, Lys), формулы II и формулы III.
В некоторых вариантах осуществления ацильная группа или алкильная группа непосредственно соединена с аминокислотой в положении 10. В некоторых вариантах осуществления ацильную или алкильную группу присоединяют к аминокислоте в положении 10 через спейсер, такой как, например, спейсер, который имеет длину 3-10 атомов, например, аминокислота или дипептид. Подходящие спейсеры для целей присоединения ацильной или алкильной группы описаны в настоящем изобретении.
В соответствии с некоторыми вариантами осуществления родственный глюкагону пептид класса 3 может представлять собой любой аналог любого из указанных выше родственных глюкагону пептидов класса 3, как описано в настоящем изобретении, где аналог обладает агонистической активностью относительно GIP рецептора. Степень активности аналога относительно глюкагонового рецептора, GLP-1 рецептора и GIP рецептора, эффективность относительно каждого из данных рецепторов, и селективность относительно каждого из данных рецепторов может соответствовать параметрам родственных глюкагону пептидов класса 2, описанных в настоящем изобретении. См., идеи в подпараграфе параграфа, посвященного родственному глюкагону пептиду класса 2, озаглавленном "Активность".
В некоторых вариантах осуществления настоящего изобретения, обеспечивают аналог глюкагонового пептида, где аналог обладает агонистической активностью относительно GIP рецептора. В определенных вариантах осуществления аналог содержит аминокислотную последовательность SEQ ID NO: 1 с по меньшей мере одной аминокислотной модификацией (необязательно, вплоть до 15 аминокислотных модификаций), и удлинением из 1-21 аминокислот, C-концевым к аминокислоте в положении 29 аналога.
В определенных аспектах аналоги содержат по меньшей мере одну аминокислотную модификацию и вплоть до 15 аминокислотных модификаций (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 аминокислотных модификаций, вплоть до 10 аминокислотных модификаций). В определенных вариантах осуществления аналоги содержат по меньшей мере одну аминокислотную модификацию с вплоть до 10 аминокислотных модификаций и дополнительными консервативными аминокислотными модификациями. Консервативные аминокислотные модификации описаны в настоящем изобретении.
В некоторых аспектах по меньшей мере одна из аминокислотных модификаций стабилизирует альфа-спиральную структуру в C-концевой части аналога. Модификации, которые стабилизируют альфа-спиральную структуру, описаны в настоящем изобретении. См., например, идеи в параграфе, озаглавленном «Стабилизация альфа-спирали/внутримолекулярные мостиковые связи». В некоторых аспектах аналог содержит внутримолекулярную мостиковую связь (например, ковалентную внутримолекулярную мостиковую связь, нековалентную внутримолекулярную мостиковую связь) между боковыми цепями двух аминокислотных аналогов. В определенных аспектах внутримолекулярная мостиковая связь соединяет боковые цепи аминокислот в положениях i и i+4, где i равно 12, 13, 16, 17, 20 или 24. В других аспектах внутримолекулярная мостиковая связь соединяет боковые цепи аминокислот в положениях j и j+3, где j равно 17, или в положениях k и k+7", где k представляет собой любое целое между 12 и 22. В определенных вариантах осуществления внутримолекулярная мостиковая связь представляет собой ковалентную внутримолекулярную мостиковую связь, например, лактамную мостиковую связь. В конкретных аспектах лактамная мостиковая связь соединяет боковые цепи аминокислот в положениях 16 и 20. В конкретных аспектах одна из аминокислот в положениях 16 и 20 представляет собой положительно заряженную аминокислоту, и другая представляет собой отрицательно заряженную аминокислоту. Например, аналог может содержать лактамную мостиковую связь, соединяющую боковые цепи Glu в положении 16 и Lys в положении 20. В других аспектах отрицательно заряженная аминокислота и положительно заряженная аминокислота образуют солевую мостиковую связь. В данном случае внутримолекулярная мостиковая связь представляет собой нековалентную внутримолекулярную мостиковую связь.
В конкретных аспектах аминокислотная модификация, которая стабилизирует альфа-спираль, представляет собой вставку или замену аминокислоты SEQ ID NO: 1 α,α-дизамещенной аминокислотой. Подходящие α,α-дизамещенные аминокислоты для целей стабилизации альфа-спирали описаны в настоящем изобретении, и включают, например, Aib. В некоторых аспектах одну, две, три или более из аминокислот в положениях 16, 20, 21, и 24 SEQ ID NO: 1 заменяют α,α-дизамещенной аминокислотой, например, Aib. В конкретных вариантах осуществления аминокислота в положении 16 представляет собой Aib.
Аналог, который обладает агонистической активностью относительно GIP рецептора, может содержать дополнительные модификации, такие как любую из модификаций, описанных в настоящем изобретении. Например, аминокислотные модификации могут увеличивать или понижать активность относительно одного или обоих из GLP-1 рецептора и глюкагонового рецептора. Аминокислотные модификации могут увеличивать стабильность пептида, например, увеличивать устойчивость к разрушению DPP-IV протеазой, стабилизировать связь между аминокислотами 15 и 16. Аминокислотные модификации могут увеличивать растворимость пептида и/или изменять продолжительность действия аналога относительно любого из GIP, глюкагонового и GLP-1 рецепторов. Комбинация любого из данных типов модификаций может присутствовать в аналогах, которые обладают агонистической активностью относительно GIP рецептора.
Соответственно, в некоторых аспектах, аналог содержит аминокислотную последовательность SEQ ID NO: 1 с одним или более из: Gln в положении 17, Ala в положении 18, Glu в положении 21, Ile в положении 23, и Ala или Cys в положении 24, или их консервативными аминокислотными заменами. В некоторых аспектах аналог содержит C-концевой амид вместо C-концевого альфа карбоксилата. В определенных вариантах осуществления аналог содержит аминокислотную замену в положении 1, положении 2 или положениях 1 и 2, где замена(-ы) придает DPP-IV протеазную устойчивость. Подходящие аминокислотные замены описаны в настоящем изобретении. Например, DMIA в положении 1 и/или d-Ser или Aib в положении 2. В некоторых вариантах осуществления аминокислота в положении 2 не является D-серином.
Кроме того или альтернативно, аналог может содержать одну или комбинацию: (a) Ser в положении 2, замененный Ala; (b) Gln в положении 3, замененный Glu или глютаминовым аналогом; (c) Thr в положении 7, замененный Ile; (d) Tyr в положении 10, замененный Trp или аминокислотой, содержащей ацильную или алкильную группу, которая является ненативной для встречающейся в природе аминокислоты; (e) Lys в положении 12, замененный Ile; (f) Asp в положении 15, замененный Glu; (g) Ser в положении 16, замененный Glu; (h) Gln в положении 20, замененный Ser, Thr, Ala, Aib; (i) Gln в положении 24, замененный Ser, Thr, Ala, Aib; (j) Met в положении 27, замененный Leu или Nle; (k) Asn в положении 29, замененный заряженной аминокислотой, необязательно, Asp или Glu; и (l) Thr в положении 29, замененный Gly или заряженной аминокислотой, необязательно, Asp или Glu.
Что касается аналогов, которые обладают агонистической активностью относительно GIP рецептора, аналог содержит удлинение из 1-21 аминокислот (например, 5-19, 7-15, 9-12 аминокислот). Удлинение аналога может иметь любую аминокислотную последовательность, при условии, что удлинение состоит из 1-21 аминокислот. В некоторых аспектах удлинение состоит из 7-15 аминокислот, и в других аспектах удлинение состоит из 9-12 аминокислот. В некоторых вариантах осуществления компонент содержит (i) аминокислотную последовательность SEQ ID NO: 26 или 674, (ii) аминокислотную последовательность, которая обладает большой идентичностью последовательности (например, по меньшей мере 80%, 85%, 90%, 95%, 98%, 99%) с аминокислотной последовательностью SEQ ID NO: 26 или 674, или (iii) аминокислотную последовательность (i) или (ii) с одной или более консервативными аминокислотными модификациями.
В некоторых вариантах осуществления по меньшей мере одна из аминокислот удлинения ацилирована или алкилирована. Аминокислота, содержащая ацильную или алкильную группу, может располагаться в любом положении удлинения аналога. В определенных вариантах осуществления ацилированная или алкилированная аминокислота удлинения находится в одном из положений 37, 38, 39, 40, 41 или 42 (согласно нумерации SEQ ID NO: 1) аналога. В определенных вариантах осуществления ацилированная или алкилированная аминокислота находится в положении 40 аналога.
В примерных вариантах осуществления ацильная или алкильная группа представляет собой ацильную или алкильную группу, которая является ненативной для встречающейся в природе аминокислоты. Например, ацильная или алкильная группа может представлять собой ацильную группу C4-C30 (например, C12-C18) жирной кислоты или C4-C30 (например, C12-C18) алкил. Ацильная или алкильная группа может представлять собой любую из групп, описанных в настоящем изобретении.
В некоторых вариантах осуществления ацильную или алкильную группу присоединяют непосредственно к аминокислоте, например, через боковую цепь аминокислоты. В других вариантах осуществления ацильную или алкильную группу присоединяют к аминокислоте через спейсер (например, аминокислоту, дипептид, трипептид, гидрофильный бифункциональный спейсер, гидрофобный бифункциональный спейсер). В определенных аспектах спейсер имеет длину 3-10 атомов. В некоторых вариантах осуществления аминокислотный спейсер не является γ-Glu. В некоторых вариантах осуществления дипептидный спейсер не является γ-Glu-γ-Glu.
Кроме того, в примерных вариантах осуществления аминокислота, к которой присоединяют ацильную или алкильную группу, может представлять собой любую из аминокислот, описанных в настоящем изобретении, включая, например, аминокислоту формулы I, II или III. Аминокислота, которая ацилирована или алкилирована, может представлять собой, например, Lys. Подходящие аминокислоты, содержащие ацильную или алкильную группу, а также подходящие ацильные группы и алкильные группы, описаны в настоящем изобретении. См., например, идеи в параграфе, озаглавленном «Ацилирование и алкилирование».
В других вариантах осуществления 1-6 аминокислоты (например, 1-2, 1-3, 1-4, 1-5 аминокислоты) удлинения являются положительно заряженными аминокислотами, например, аминокислотами формулы IV, такими как, например, Lys. Как применяют в настоящем изобретении, термин "положительно заряженная аминокислота" относится к любой аминокислоте, встречающейся в природе или не встречающейся в природе, содержащей положительный заряд на атоме его боковой цепи при физиологическом pH. В определенных аспектах положительно заряженные аминокислоты расположены в любом положении 37, 38, 39, 40, 41, 42 и 43. В конкретных вариантах осуществления положительно заряженная аминокислота находится в положении 40.
В других случаях удлинение ацилировано или алкилировано, как описано в настоящем изобретении, и содержит 1-6 положительно заряженных аминокислот, как описано в настоящем изобретении.
В еще других вариантах осуществления аналоги, которые обладают агонистической активностью относительно GIP рецептора, содержат (i) SEQ ID NO: 1 с по меньшей мере одной аминокислотной модификацией, (ii) удлинение из 1-21 аминокислот (например, 5-18, 7-15, 9-12 аминокислот), C-концевое к аминокислоте в положении 29 аналога, и (iii) аминокислоту, содержащую ацильную или алкильную группу, которая является ненативной для встречающейся в природе аминокислоты, которая находится вне C-концевого удлинения (например, в любом из положений 1-29). В некоторых вариантах осуществления аналог содержит ацилированную или алкилированную аминокислоту в положении 10. В конкретных аспектах ацильная или алкильная группа представляет собой ацильную группу C4-C30 жирной кислоты или алкильную группу C4-C30 жирной кислоты. В некоторых вариантах осуществления ацильную или алкильную группу присоединяют через спейсер, например, аминокислоту, дипептид, трипептид, гидрофильный бифункциональный спейсер, гидрофобный бифункциональный спейсер. В определенных аспектах аналог содержит аминокислотную модификацию, которая стабилизирует альфа-спираль, такую как солевой мостик между Glu в положении 16 и Lys в положении 20, или альфа,альфа-дизамещенную аминокислоту в любом одном, двух, трех или более положениях 16, 20, 21 и 24. В конкретных аспектах аналог дополнительно содержит аминокислотные модификации, которые придают DPP-IV протеазную устойчивость, например, DMIA в положении 1, Aib в положении 2. Аналоги, содержащие дополнительные аминокислотные модификации, предусмотрены в настоящем изобретении.
В определенных вариантах осуществления аналоги, обладающие GIP рецепторной активностью, обладают по меньшей мере 0,1% (например, по меньшей мере 0,5%, 1%, 2%, 5%, 10%, 15% или 20%) активности нативного GIP относительно GIP рецептора. В некоторых вариантах осуществления аналоги обладают более чем 20% (например, более чем 50%, более чем 75%, более чем 100%, более чем 200%, более чем 300%, более чем 500%) активности нативного GIP относительно GIP рецептора. В некоторых вариантах осуществления аналог обладает заметной агонистической активностью относительно одного или обоих из GLP-1 и глюкагонового рецепторов. В некоторых аспектах селективность относительно данных рецепторов (GIF рецептор и GLP-1 рецептор и/или глюкагоновый рецептор) находится в пределах 1000-кратной. Например, селективность относительно GLP-1 рецептора аналогов, обладающих GIP рецепторной активностью, может быть меньшей, чем 500-кратная, 100-кратная (в пределах 50-кратной, в пределах 25 кратной, в пределах 15-кратной, в пределах 10-кратной) селективность относительно GIP рецептора и/или глюкагонового рецептора.
В соответствии с некоторыми вариантами осуществления родственный глюкагону пептид класса 3 содержит аминокислотную последовательность нативного глюкагона (SEQ ID NO: 1), содержащую следующие модификации: Aib в положении 2, Glu в положении 3, Lys в положении 10, Glu в положении 16, Gln в положении 17, Ala в положении 18, Lys в положении 20, Glu в положении 21, Ile в положении 23, Ala в положении 24; где Lys в положении 10 ацилирован C14 или C16 жирной кислотой, и где C-концевой карбоксилат заменен амидом. В конкретном варианте осуществления данный родственный глюкагону пептид класса 3 присоединяют через линкер (L) к NHR лиганду (Y).
В соответствии с некоторыми вариантами осуществления родственный глюкагону пептид класса 3 содержит, состоит преимущественно из, или состоит из аминокислотной последовательности любой из SEQ ID NO: 70-514, 517-534 или 554, необязательно с вплоть до 1, 2, 3, 4 или 5 дополнительными модификациями, которые сохраняют GLP-1 агонистическую и/или глюкагоновую агонистическую активность. В определенных вариантах осуществления родственный глюкагону пептид класса 3 содержит аминокислотную последовательность любой из SEQ ID NO: 562-760. В некоторых вариантах осуществления родственный глюкагону пептид класса 3 содержит аминокислотные последовательности любой из SEQ ID NO: 1301-1421.
Родственные глюкагону пептиды класса 4
В определенных вариантах осуществления Q представляет собой родственный глюкагону пептид класса 4 (см., например, международную опубликованную патентную заявку (PCT) WO 2009/058662, включенную в настоящем изобретении с помощью ссылки во всей своей полноте.
Все биологические последовательности, приведенные в следующем параграфе (SEQ ID NO: 1301-1371) соответствуют SEQ ID NO: 1-71 в WO 2009/058662.
Активность
В соответствии с некоторыми вариантами осуществления, обеспечивают родственные глюкагону пептиды класса 4 (называемыми в настоящем изобретении "пептиды класса 4"). В определенных аспектах обеспечивают пептид класса 4, который обладает глюкагоновой антагонистической активностью. Глюкагоновые антагонисты можно было бы применять в любых случаях, когда требуется подавление глюкагонового агонизма. Самым актуальным и очевидным применением могло бы быть лечение диабета, когда было показано, что глюкагоновый антагонизм в предклинических моделях гипергликемии приводит к снижению глюкозы в крови. Глюкагоновые антагонисты можно дополнительно модифицировать для увеличения биофизической стабильности и/или растворимости в воде соединений, при сохранении антагонистической активности исходного соединения. В определенных аспектах пептид класса 4 определяют как чистый глюкагоновый антагонист.
Термин "глюкагоновый антагонист" относится к соединению, которое препятствует глюкагоновой активности или препятствует глюкагоновой функции. Например, глюкагоновый антагонист обладает по меньшей мере 60% ингибированием (например, по меньшей мере 70% ингибированием) и предпочтительно по меньшей мере 80% ингибированием, максимальной ответной реакции, достигаемой глюкагоном относительно глюкагонового рецептора. В некоторых вариантах осуществления глюкагоновый антагонист обладает по меньшей мере 90% ингибированием максимальной ответной реакции, достигаемой глюкагоном относительно глюкагонового рецептора. В конкретном варианте осуществления глюкагоновый антагонист обладает 100% ингибированием максимальной ответной реакции, достигаемой глюкагоном относительно глюкагонового рецептора. Кроме того, глюкагоновый антагонист при концентрации приблизительно 1 мкМ обладает меньшей чем приблизительно 20% максимальной агонистической активностью, достигаемой глюкагоном относительно глюкагонового рецептора. В некоторых вариантах осуществления глюкагоновый антагонист обладает менее чем приблизительно 10% максимальной агонистической активностью, достигаемой глюкагоном относительно глюкагонового рецептора. В конкретном варианте осуществления глюкагоновый антагонист обладает менее чем приблизительно 5% максимальной агонистической активностью, достигаемой глюкагоном относительно глюкагонового рецептора. В еще другом конкретном варианте осуществления глюкагоновый антагонист обладает 0% максимальной агонистической активностью, достигаемой глюкагоном относительно глюкагонового рецептора.
"Чистый глюкагоновый антагонист" представляет собой глюкагоновый антагонист, который не производит какой-либо обнаруживаемой стимуляции глюкагоновой или GLP-1 рецепторной активности, как измерено цАМФ генерированием, применяя валидированный in vitro модельный анализ (см., например, WO 2009/058662). Например, чистый глюкагоновый антагонист обладает менее чем приблизительно 5% (например, менее чем приблизительно 4%, менее чем приблизительно 3%, менее чем приблизительно 2%, менее чем приблизительно 1%, приблизительно 0%) максимальной агонистической активностью, достигаемой глюкагоном относительно глюкагонового рецептора и обладает менее чем приблизительно 5% (например, менее чем приблизительно 4%, менее чем приблизительно 3%, менее чем приблизительно 2%, менее чем приблизительно 1% и приблизительно 0%) максимальной агонистической активностью, достигаемой GLP-1 относительно GLP-1 рецептора.
Соответственно, в некоторых аспектах обеспечивают пептиды класса 4, которые обладают чистой глюкагоновой антагонистической активностью. В соответствии с некоторыми вариантами осуществления глюкагоновый антагонист обладает активностью, которая снижает цАМФ генерирование, вызванное глюкагоном глюкагонового рецептора по меньшей мере максимум на 50%, когда глюкагоновый рецептор контактирует одновременно с 0,8 нМ глюкагоном и глюкагоновым антагонистом, как измерено цАМФ генерированием в in vitro анализе. В некоторых вариантах осуществления глюкагоновый антагонист снижает цАМФ генерирование, вызванное глюкагоном глюкагонового рецептора, на по меньшей мере максимум 80%.
Считается, что пептиды класса 4 являются подходящими для применения, которое раннее описывалось для глюкагоновых антагонистов. Соответственно, пептиды класса 4, описанные в настоящем изобретении, можно применять для лечения гипергликемии или лечения других метаболических заболеваний, которые являются результатом высокой концентрации глюкагона в крови или высокой концентрации глюкозы в крови. В соответствии с некоторыми вариантами осуществления пациент, которого будут лечить, применяя пептиды класса 4, описанные в настоящем изобретении, является домашним животным, и в другом варианте осуществления пациент, которого будут лечить, является человеком. Исследования приводят к выводу, что подавление глюкагона у пациентов с диабетом способствует постпрандиальной гипергликемии частично ускоренным гликогенолизом. Анализы глюкозы в крови в процессе перорального теста на толерантность к глюкозе (OGTT) и в присутствии или в отсутствие подавления глюкагона, вызванного соматостатином, показали значительное повышение концентрации глюкозы у субъектов с большими концентрациями глюкагона. Соответственно, пептиды класса 4 настоящего изобретения можно применять для лечения гипергликемии, и ожидается, что они будут пригодны для лечения ряда типов диабета, включая сахарный диабет типа I, сахарный диабет типа II, или гестационный диабет, или инсулинозависимый или инсулиннезависимый, и снижения осложнений диабета, включая нефропатию, ретинопатию и сосудистое заболевание.
В некоторых вариантах осуществления концевые десять аминокислот эксендина-4 (т.е. последовательности SEQ ID NO: 1319 (GPSSGAPPPS)) соединены с карбокси концом пептида класса 4. Ожидается, что данные слитые белки будут обладать фармакологической активностью по подавлению аппетита и стимулированию снижения веса/поддержания веса. В соответствии с некоторыми вариантами осуществления пептиды класса 4, описанные в настоящем изобретении, можно дополнительно модифицировать так, чтобы они содержали аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), соединенную с аминокислотой 24 пептида класса 4 SEQ ID NO: 1342, и вводить индивидам, вызывая снижение веса или способствуя поддержанию веса. Более конкретно, пептид класса 4, содержащий последовательность, выбранную из группы, состоящей из SEQ ID NO: 1302, SEQ ID NO: 1303, SEQ ID NO: 1304 SEQ ID NO: 1305, SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1336, SEQ ID NO: 1339, SEQ ID NO: 1340 SEQ ID NO: 1341, SEQ ID NO: 1342, SEQ ID NO: 1343 и SEQ ID NO: 1344, и дополнительно содержащий аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), соединенную с аминокислотой 24 пептида класса 4, применяют для подавления аппетита и стимулирования снижения веса/поддержания веса. В некоторых вариантах осуществления вводимый пептид класса 4 содержит последовательность SEQ ID NO: 1346 или SEQ ID NO: 1347.
Ожидается, что данные способы снижения аппетита или стимулирования потери веса тела будут пригодны для снижения веса тела, предотвращения набора веса или лечения ожирения, вызванные различными причинами, включая ожирение, вызванное приемом лекарственных средств, и облегчения осложнений, связанных с ожирением, включая сосудистое заболевание (ишемическую болезнь сердца, инсульт, заболевание периферических сосудов, ишемическую реперфузию т.д.), гипертензию, возникновение диабета типа II, гиперлипидемию и скелетно-мышечные заболевания.
Пептиды класса 4 настоящего изобретения можно вводить отдельно или в комбинации с другими антидиабетическими агентами или агентами против ожирения. Антидиабетические агенты, известные в данной области техники или находящиеся на стадии исследования, включают инсулин, сульфонилмочевины, такие как толбутамид (ориназ), ацетохексамид (димерол), толазамид (толиназ), хлорпропамид (диабинез), глипизид (глюкотрол), глибурид (диабета, микроназ, глиназ), глимепирид (амарил) или гликлазид (диамикрон); меглитиниды, такие как репаглинид (прандин) или натеглинид (старликс); бигуанидины, такие как метформин (глюкофаг) или фенформин; тиазолидиндионы, такие как розиглитазон (авандия), пиоглитазон (актоз) или троглитазон (резулин), или другие PPARγ ингибиторы; ингибиторы альфа глюкозидазы, которые ингибируют расщепление углеводов, такие как миглитол (глизет), акарбоз (прекоза/глюкобай); эксенатид (биетта) или прамлинтид; ингибиторы дипептидилпептидазы-4 (DPP-4), такие как вилдаглиптин или ситаглиптин; ингибиторы SGLT (натрий-зависимый транспортер глюкозы 1); или ингибиторы FBPазы (1,6-бифосфатаза фруктозы).
Агенты против ожирения, известные в данной области техники или находящиеся на стадии исследования, включают подавители аппетита, включая стимуляторы фенэтиламинового типа, фентермин (необязательно с фенфлурамином или дексфенфлурамином), диэтилпропион (Tenuate®), фендиметразин (Prelu-2®, Bontril®), бензфетамин (Didrex®), сибутрамин (Meridia®, Reductil®); римонабант (Acomplia®), другие антагонисты каннабиноидных рецепторов; оксинтомодулин; гидрохлорид флюоксетина (прозак); кунекса (топирамат и фентермин), экскалия (бупропион и зонисамид) или кнотрав (бупропион и налтрексон); или ингибиторы липазы, аналогичные ксеникалу (орлистат) или цетилистат (также известный как ATL-962) или GT 389-255.
Пептиды класса 4 настоящего изобретения можно также вводить пациентам, страдающим от катаболического истощения (кахексии). Предполагается, что приблизительно половина пациентов с раком страдают от катаболического истощения (кахексии), которое характеризуется непредусмотренной и прогрессирующей потерей веса, слабостью и снижением массы жировой ткани и мускулов. Синдром одинаково распространен среди пациентов со СПИДом и может также присутствовать при бактериальных и паразитических заболеваниях, ревматоидном артрите и хронических заболеваниях кишечника, печени, легких и сердца. Он обычно связан с анорексией и может проявляться как заболевание при старении или как результат физической травмы. Катаболическое истощения (кахексия) представляет собой симптом, которые ухудшает качество жизни, усугубляет основное заболевание и представляет собой основную причину смерти. Заявители ожидают, что пептиды класса 4, описанные в настоящем изобретении, можно вводить пациентам для лечения катаболического истощения (кахексии).
Фармацевтические композиции, содержащие пептиды класса 4, описанные в настоящем изобретении, можно формулировать и вводить пациентам, применяя стандартные фармацевтически приемлемые носители и пути введения, известные специалистам в данной области техники. Соответственно, настоящее описание также включает фармацевтические композиции, содержащие один или более пептидов класса 4, описанных в настоящем изобретении, в комбинации с фармацевтически приемлемым носителем. Фармацевтические композиции могут содержать пептиды класса 4 в качестве единственного фармацевтически активного компонента, или пептиды класса 4 можно комбинировать с одним или более дополнительными активными агентами. В соответствии с некоторыми вариантами осуществления обеспечивают композицию, содержащую пептид класса 4 настоящего изобретения и соединение, которое активирует GLP-1 рецептор (такой как GLP-1, GLP-1 аналог, аналог эксендина-4 или их производные). В соответствии с некоторыми вариантами осуществления обеспечивают композицию, содержащую пептид класса 4 настоящего изобретения и инсулин или инсулиновый аналог. Альтернативно, можно обеспечивать композицию, предназначенную для стимулирования потери веса или предотвращения набора веса, которая содержит последовательность SEQ ID NO: 1342, дополнительно содержащую аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), соединенную с аминокислотой 24 SEQ ID NO: 1342, и пептид против ожирения. Подходящие пептиды против ожирения включают пептиды, описанные в патентах США 5691309, 6436435 или патентной заявке США 20050176643, и включающие, но не ограничиваясь этим, GLP-1, GIP (желудочный ингибиторный полипептид), MP1, PYY, MC-4, лептин.
Структура пептида класса 4
В некоторых вариантах осуществления обеспечивают родственные глюкагону пептиды класса 4, где обычно встречающаяся аспарагиновая кислота в положении девять (глюкагон, SEQ ID NO: 1301) заменена глютаминовой кислотой или производным на основе цистеиновой кислоты. Более конкретно, делеция первой аминокислоты (дез-His) и замена аспарагиновой кислоты в положении 9 глютаминовой кислотой, в некоторых аспектах, дает пептид класса 4. Родственные глюкагону пептиды класса 4, содержащие заместители, содержащие сульфокислоту, замещающие положение аминокислоты девять глюкагона, демонстрируют свойства, аналогичные аминокислотам на основе карбоновой кислоты, но с несколькими важными отличиями относительно физических свойств, такими как растворимость. При замене гомоцистеиновой кислотой (hCysSO3) изостерической глютаминовой кислоты в положении девять в общепринятом дез-His, Glu9 пептид класса 4 остается частичным антагонистом и слабым агонистом.
В некоторых вариантах осуществления обеспечивают пептид класса 4, где удаляют первые две-пять аминокислот, и положение 9 (согласно нумерации SEQ ID NO: 1301) заменено hCys(SO3), гомоглютаминовой кислотой, п-гомоглютаминовой кислотой или алкилкарбоксилатным производным цистеина, имеющим структуру:

где X5 представляет собой C1-C4 алкил, C2-C4 алкенил или C2-C4 алкинил, что дает соединение, которое действует как гормональный антагонист, который является высокоспецифическим, эффективным и без нежелательных сопутствующих агонистических свойств.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 4, который содержит глюкагоновый пептид, модифицированный относительно последовательности SEQ ID NO: 1301 дикого типа, делецией двух-пяти аминокислотных остатков с N-конца и заменой остатка аспарагиновой кислоты в положении девять нативного белка глютаминовой кислотой, гомоглютаминовой кислотой, п-гомоглютаминовой кислотой, производным цистеина, содержащим сульфогруппу, или алкилкарбоксилатным производным цистеина, имеющим структуру:

где X5 представляет собой C1-C4 алкил, C2-C4 алкенил или C2-C4 алкинил.
В одном конкретном варианте осуществления пептид класса 4, содержащий делецию двух-пяти аминокислотных остатков с N-конца и замену Asp в положении 9 нативного глюкагона, дополнительно модифицируют вплоть до трех аминокислотными модификациями. Например, пептид класса 4 может содержать одну, две или три консервативные аминокислотные модификации. Альтернативно или кроме того, пептид класса 4 может содержать одну или более аминокислотные модификации, выбранные из группы, состоящей из:
A. замены одной или двух аминокислот в положениях 10, 20 и 24, (согласно нумерации аминокислот SEQ ID NO: 1301), или N- или C-концевой аминокислоты пептида класса 4 аминокислотой, ковалентно присоединенной к ацильной группе или алкильной группе через сложноэфирную, эфирную, тиоэфирную, амидную или алкиламиновую связь;
B. замены одной или двух аминокислот в положениях 16, 17, 20, 21 и 24 (согласно нумерации аминокислот SEQ ID NO: 1301), или N- или C-концевой аминокислоты пептида класса 4 аминокислотой, выбранной из группы, состоящей из: Cys, Lys, орнитина, гомоцистеина и ацетилфенилаланина (Ac-Phe), где аминокислота группы ковалентно связана с гидрофильной группой;
C. присоединения аминокислоты, ковалентно связанной с гидрофильной группой, к N- или C-концу пептида класса 4;
D. замены Asp в положении 15 (согласно нумерации SEQ ID NO: 1301) цистеиновой кислотой, глютаминовой кислотой, гомоглютаминовой кислотой и гомоцистеиновой кислотой;
E. замены Ser в положении 16 (согласно нумерации SEQ ID NO: 1301) цистеиновой кислотой, глютаминовой кислотой, гомоглютаминовой кислотой и гомоцистеиновой кислотой;
F. замены Aib в одном или более положениях 16, 20, 21 и 24 согласно нумерации аминокислот SEQ ID NO: 1301;
G. делеции аминокислоты в положении 29 или аминокислоты в положениях 28 и 29, согласно нумерации SEQ ID NO: 1301;
H. замены каждой или обеих из Asn в положении 28 и Thr в положении 29 (согласно нумерации аминокислот SEQ ID NO: 1301) заряженными аминокислотами; и/или присоединения одной-двух заряженных аминокислот к C-концу SEQ ID NO: 1301;
I. замены Met в положении 27 (согласно нумерации SEQ ID NO: 1301) Leu или норлейцином;
J. присоединения пептида, имеющего аминокислотную последовательность любой из SEQ ID NO: 19-21 и 53 к C-концу SEQ ID NO: 1301; где Thr в положении 29 (согласно нумерации SEQ ID NO: 1301) представляет собой Thr или Gly; и
K. замены C-концевого карбоксилата амидом или эфиром.
В конкретном варианте осуществления пептид класса 4 содержит аминокислотную модификацию A, B или C, как описано выше, или их комбинацию. В еще другом конкретном варианте осуществления, пептид класса 4 дополнительно содержит аминокислотную модификацию любого из D-K, как описано выше, или их комбинацию, в добавление к аминокислотной модификации (модификациям) A, B и/или C.
В некоторых вариантах осуществления пептид класса 4 содержит глюкагоновый пептид, где первые 5 аминокислот удалены с N-конца, и оставшаяся N-концевая аминогруппа замещена гидроксильной группой ("PLA6 аналог"), давая пептид SEQ ID NO: 1339. Заявители обнаружили, что замена фенилаланина фенилмолочной кислотой в пептидных аналогах класса 4, у которых удалены первые пять аминокислот и замена глютаминовая кислота в положении 9 (по сравнению с нативным глюкагоном), дополнительно увеличивает эффективность данных пептидных аналогов класса 4.
В некоторых вариантах осуществления пептид класса 4 SEQ ID NO: 1339 дополнительно модифицирован заменой остатка аспарагиновой кислоты в положении четыре (положение 9 нативного глюкагона) аминокислотой общей структуры:
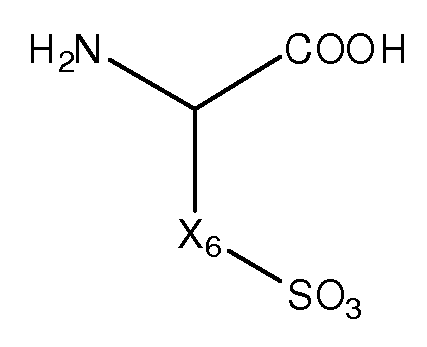
где X6 представляет собой C1-C3 алкил, C2-C3 алкенил или C2-C3 алкинил, и в некоторых вариантах осуществления X6 представляет собой C1-C3 алкил, и в другом варианте осуществления X6 представляет собой C2 алкил. В некоторых вариантах осуществления пептид класса 4 содержит глюкагоновый пептид, где первые 5 аминокислот удалены с N-конца, и остаток аспарагиновой кислоты в положении четыре (положение 9 нативного глюкагона) заменен цистеиновой кислотой или гомоцистеиновой кислотой. В некоторых вариантах осуществления пептид класса 4 содержит глюкагоновый пептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1339, SEQ ID NO: 1307 и SEQ ID NO: 1308. В некоторых вариантах осуществления пептид класса 4 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1308, где аминокислота в положении четыре представляет собой гомоцистеиновую кислоту.
В другом варианте осуществления пептид класса 4 SEQ ID NO: 1339 дополнительно модифицирован заменой остатка аспарагиновой кислоты в положении четыре (положение 9 нативного глюкагона) глютаминовой кислотой, гомоглютаминовой кислотой, п-гомоглютаминовой кислотой или алкилкарбоксилатным производным цистеина, имеющим структуру:

где X5 представляет собой C1-C4 алкил, C2-C4 алкенил или C2-C4 алкинил. В конкретном варианте осуществления X5 представляет собой C1 или C2 алкил.
Однако заявители обнаружили, что при замене N-концевого фенилаланина PLA в дез1-5 глюкагоновом аналоге (т.е. глюкагоновом аналоге, у которого удалены первые пять аминокислот), дополнительная замена нативного остатка аспарагиновой кислоты в положении четыре (положение 9 нативного глюкагона) не требуется для получения аналога, который обладает чистым антагонизмом. Данный результат является неожиданным в свете идей предшествующего уровня техники, что нативный остаток аспарагиновой кислоты в положении четыре необходимо заместить для получения эффективных антагонистов с высоким сродством глюкагоновых (2-29) аналогов. Применение PLA замены увеличивает относительную эффективность Asp9 аналога до степени, сравнимой с эффективностью Glu9 и hCys(SO3H)9 аналогов.
Замена фенилаланинового остатка другими фенилаланиновыми аналогами, включая 3,4-2F-фенилаланин (3,4-2F-Phe), 2-нафтилаланин (2-Nal), N-ацилфенилаланин (Ac-Phe), альфаметилгидрокоричную кислоту (MCA) и бензилмалоновую кислоту (BMA), не эффективная как PLA замена.
Замена PLA в положениях, отличных от положения шесть (согласно аминокислотной нумерации нативного глюкагона), включая положения 4 и 5, показала, что PLA6 аналог является существенно более эффективным антагонистом, чем глюкагоновые аналоги, содержащие немного удлиненный N-конец. Настоящее изобретение также включает аналоги, где N-концевая аминогруппа заменена ацилированными и алкилированными "O-концевыми" пептидами.
Кроме того, PLA6 замена не только увеличивает эффективность антагониста, но также играет важную роль в пегилировании. PLA6 аналоги можно селективно пегилировать без восстановления глюкагонового агонизма. В отсутствии PLA замены, пегилирование аналога неожиданно стимулирует глюкагоновый агонизм. Данный глюкагоновый агонизм не наблюдается у пегилированных PLA6 аналогов. Исследовались несколько положений для пегилирования, включая положения 3, 6 и 19 (положения 8, 11 и 19 нативного глюкагона) и N-концевой аминокислотный остаток. В некоторых вариантах осуществления пегилирование осуществляют в положении 19 (положение 24 нативного глюкагона), поскольку данное положение обладает самым эффективным и селективным глюкагоновым антагонизмом.
В некоторых вариантах осуществления пептид класса 4 имеет общую структуру A-B-C, где A выбран из группы, состоящей из:
(i) фенилмолочной кислоты (PLA);
(ii) оксипроизводного PLA;
(iii) пептида из 2-6 аминокислот, в котором две последовательные аминокислоты пептида соединены сложноэфирной или эфирной связью;
B представляет собой аминокислоты i-26 SEQ ID NO: 1301, где i равно 3, 4, 5, 6, или 7, необязательно содержащие одну или более аминокислотных модификаций, выбранных из группы, состоящей из:
(iv) Asp в положении 9 (согласно нумерации аминокислот SEQ ID NO: 1301) заменен Glu, сульфопроизводным Cys, гомоглютаминовой кислотой, п-гомоглютаминовой кислотой или алкилкарбоксилатным производным цистеина, имеющим структуру:
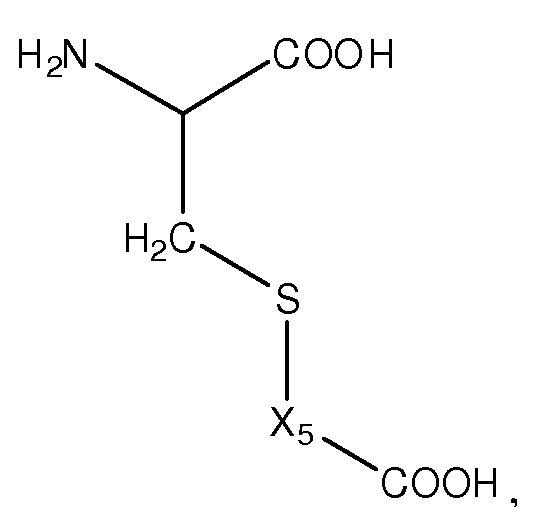
где X5 представляет собой C1-C4 алкил, C2-C4 алкенил или C2-C4 алкинил;
(v) замены одной или двух аминокислот в положениях 10, 20 и 24, (согласно нумерации аминокислот SEQ ID NO: 1301) аминокислотой, ковалентно присоединенной к ацильной или алкильной группе через сложноэфирную, эфирную, тиоэфирную, амидную или алкиламиновую связь;
(vi) замены одной или двух аминокислот в положениях 16, 17, 20, 21 и 24 (согласно нумерации аминокислот SEQ ID NO: 1301) аминокислотой, выбранной из группы, состоящей из: Cys, Lys, орнитина, гомоцистеина и ацетилфенилаланина (Ac-Phe), где аминокислота группы ковалентно связана с гидрофильной группой;
(vii) Asp в положении 15 (согласно нумерации SEQ ID NO: 1301), замененный цистеиновой кислотой, глютаминовой кислотой, гомоглютаминовой кислотой и гомоцистеиновой кислотой;
(viii) Ser в положении 16 (согласно нумерации SEQ ID NO: 1301), замененный цистеиновой кислотой, глютаминовой кислотой, гомоглютаминовой кислотой и гомоцистеиновой кислотой;
(ix) замены Aib в одном или более положениях 16, 20, 21 и 24 согласно нумерации аминокислот SEQ ID NO: 1301;
и C выбрано из группы, состоящей из
(x) X;
(xi) X-Y;
(xii) X-Y-Z; и
(xiii) X-Y-Z-R10,
где X представляет собой Met, Leu или Nle; Y представляет собой Asn или заряженную аминокислоту; Z представляет собой Thr, Gly, Cys, Lys, орнитин (Orn), гомоцистеин, ацетилфенилаланин (Ac-Phe) или заряженную аминокислоту; где R10 выбран из группы, состоящей из SEQ ID NO: 1319-1321 и 1353; и
(xiv) любой из (x)-(xiii), в котором C-концевой карбоксилат заменен амидом.
В конкретном аспекте, пептид класса 4 содержит оксипроизводное PLA. Как применяют в настоящем изобретении, "оксипроизводное PLA" относится к соединению, содержащему модифицированную структуру PLA, в которой гидроксильная группа заменена O-R11, где R11 представляет собой химическую группу. В связи с этим, оксипроизводное PLA может представлять собой, например, сложный эфир PLA или эфир PLA.
Способы получения оксипроизводных PLA являются известными в данной области техники. Например, когда оксипроизводное представляет собой сложный эфир PLA, сложный эфир можно получить при реакции гидроксила PLA с карбонилом, несущим нуклеофил. Нуклеофил может представлять собой любой подходящий нуклеофил, включая, но не ограничиваясь этим, амин или гидроксил. Соответственно, сложный эфир PLA может иметь структуру формулы IV:
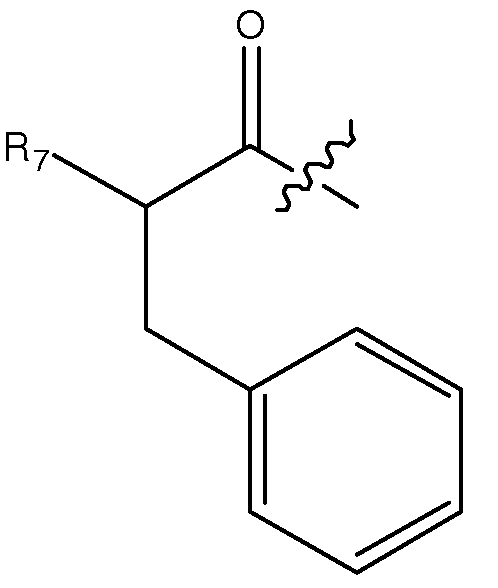
формула IV
где R7 представляет собой сложный эфир, образованный реакцией гидроксила PLA с карбонилом, несущим нуклеофил.
Карбонил, несущий нуклеофил (который реагирует с гидроксилом PLA, давая сложный эфир), может представлять собой, например, карбоновую кислоту, производное карбоновой кислоты или активированный эфир карбоновой кислоты. Производное карбоновой кислоты может представлять собой, но не ограничиваясь этим, хлорангидрид кислоты, ангидрид кислоты, амид, сложный эфир или нитрил. Активированный эфир карбоновой кислоты может представлять собой, например, N-гидроксисукцинимид (NHS), тозилат (Tos), карбодиимид или гексафторфосфат. В некоторых вариантах осуществления карбодиимид представляет собой 1,3-дициклогексилкарбодиимид (DCC), 1,1'-карбонилдиимидазол (CDI), 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид (EDC) или 1,3-диизопропилкарбодиимид (DICD). В некоторых вариантах осуществления гексафторфосфат выбран из группы, состоящей из гексафторфосфата бензотриазол-1-илокси-трис(диметиламино)фосфония (BOP), гексафторфосфата бензотриазол-1-илокситрипирролидинофосфония (PyBOP), гексафторфосфата 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) и гексафторфосфата o-бензотриазол-N,N,N',N'-тетраметилурония (HBTU).
Способы получения эфиров в результате реакции с гидроксильной группой (например, гидроксилом PLA) также являются известными в данной области техники. Например, гидроксильная группа PLA может реагировать с галогенированным алкильным или тозилированным алкильным спиртом, давая эфирную связь.
Обычно химическая группа R11 представляет собой химическую группу, которая не снижает активность пептида класса 4. В некоторых вариантах осуществления химическая группа увеличивает активность, стабильность и/или растворимость пептида класса 4.
В конкретном варианте осуществления химическая группа, соединенная с PLA содержащей кислород связью (например, сложноэфирной или эфирной группой) представляет собой полимер (например, полиалкиленгликоль), углевод, аминокислоту, пептид или липид, например, жирную кислоту или стероид.
В конкретном варианте осуществления химическая группа представляет собой аминокислоту, которая необязательно представляет собой часть пептида, так что формула IV представляет собой депсипептид. В связи с этим, PLA может быть в любом положении, отличном от N-концевого аминокислотного остатка пептида класса 4, так что пептид класса 4 содержит одну или более (например, 1, 2, 3, 4, 5, 6 или более) аминокислот, N-концевых к PLA остатку. Например, пептид класса 4 может содержать PLA в положении n, где n равен 2, 3, 4, 5 или 6 пептида класса 4.
Аминокислоты, N-концевые к PLA остатку, могут быть синтетическими или встречающимися в природе. В конкретном варианте осуществления аминокислоты, которые являются N-концевыми к PLA, являются встречающимися в природе аминокислотами. В некоторых вариантах осуществления аминокислоты, которые являются N-концевыми к PLA, являются N-концевыми аминокислотами нативного глюкагона. Например, пептид класса 4 может содержать на N-конце аминокислотную последовательность любой из SEQ ID NO: 1354-1358, где PLA соединен с треонином сложноэфирной связью:
В альтернативном варианте осуществления одна или более N-концевых аминокислот могут быть заменены аминокислотой, отличной от аминокислоты нативного глюкагона. Например, когда пептид класса 4 содержит PLA в качестве аминокислоты в положении 5 или 6, аминокислота в положении 1 и/или положение 2 может представлять собой аминокислоту, которая снижает подверженность к расщеплению дипептидилпептидазой IV. Более конкретно, в некоторых вариантах осуществления положение 1 пептида класса 4 представляет собой аминокислоту, выбранную из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах осуществления положение 2 антагонистического пептида представляет собой аминокислоту, выбранную из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (Aib). Кроме того, например, когда пептид класса 4 содержит PLA в качестве аминокислоты в положении 4, 5 или 6, аминокислота в положении 3 пептида класса 4 может представлять собой глютаминовую кислоту, в отличие от нативного глютаминового остатка нативного глюкагона. В примерном варианте осуществления настоящего изобретения пептид класса 4 содержит на N-конце аминокислотную последовательность любой из SEQ ID NO: 1359-1361.
Относительно пептидов класса 4, содержащих соединение формулы IV, полимер может представлять собой любой полимер, при условии, что он реагирует с гидроксильной группой PLA. Полимер может представлять собой полимер, который естественно или обычно содержит карбонил, несущий нуклеофил. Альтернативно, полимер может представлять собой полимер, который модифицирован так, чтобы он содержал карбонил, несущий нуклеофил. Полимер может представлять собой модифицированный полимер любого из: полиамидов, поликарбонатов, полиалкиленов и их производных, включая полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, полимеров акриловых и метакриловых эфиров, включая поли(метилметакрилат), поли(этилметакрилат), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат), поливиниловых полимеров, включая поливиниловые спирты, поливиниловые эфиры, поливиниловые сложные эфиры, поливинилгалогениды, поли(винилацетат) и поливинилпирролидон, полигликолидов, полисилоксанов, полиуретанов и их сополимеров, целлюлоз, включая алкилцеллюлозу, гидроксиалкилцеллюлозы, эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксибутилметилцеллюлозу, ацетат целлюлозы, пропионат целлюлозы, ацетатбутират целлюлозы, ацетатфталат целлюлозы, карбоксилэтилцеллюлозу, триацетат целлюлозы и сульфатнатриевую соль целлюлозы, полипропилена, полиэтиленов, включая поли(этиленгликоль), поли(этиленоксид) и поли(этилентерефталат), и полистирола.
Полимер может представлять собой биоразлагаемый полимер, включая синтетический биоразлагаемый полимер (например, полимеры молочной кислоты и гликолевой кислоты, полиангидриды, поли(орто)эфиры, полиуретаны, поли(масляную кислоту), поли(валерьяновую кислоту) и поли(лактид-сокапролактон)), и природный биоразлагаемый полимер (например, альгинат и другие полисахариды, включая декстран и целлюлозу, коллаген, их химические производные (замещения, присоединения химических групп, например, алкила, алкилена, гидроксилирование, окисление и другие модификации, обычно осуществляемые специалистами в данной области техники), альбумин и другие гидрофильные белки (например, зеин и другие проламины и гидрофобные белки), а также любой сополимер или их смесь. В общем, данные вещества разлагаются или ферментативным гидролизом или при воздействии воды in vivo, поверхностной или объемной эрозией.
Полимер может представлять собой биоадгезивный полимер, такой как биоразрушаемый гидрогель, описанный H. S. Sawhney, C. P. Pathak и J. A. Hubbell в Macromolecules, 1993, 26, 581-587, идеи которой включены в настоящее изобретение, полигиалуроновые кислоты, казеин, желатин, глютин, полиангидриды, полиакриловую кислоту, альгинат, хитозан, поли(метилметакрилаты), поли(этилметакрилаты), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат).
В некоторых вариантах осуществления полимер представляет собой растворимый в воде полимер. Подходящие растворимые в воде полимеры являются известными в данной области техники и включают, например, поливинилпирролидон, гидроксипропилцеллюлозу (HPC; Klucel), гидроксипропилметилцеллюлозу (HPMC; Methocel), нитроцеллюлозу, гидроксипропилэтилцеллюлозу, гидроксипропилбутилцеллюлозу, гидроксипропилпентилцеллюлозу, метилцеллюлозу, этилцеллюлозу (Ethocel), гидроксиэтилцеллюлозу, различные алкилцеллюлозы и гидроксиалкилцеллюлозы, различные эфиры целлюлозы, ацетат целлюлозы, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, сополимеры винилацетата/кротоновой кислоты, полигидроксиалкилметакрилат, гидроксиметилметакрилат, сополимеры метакриловой кислоты, полиметакриловую кислоту, полиметилметакрилат, сополимеры малеинового ангидрида/метилвинилового эфира, поливиниловый спирт, полиакриловую кислоту натрия и кальция, полиакриловую кислоту, кислые карбоксиполимеры, карбоксиполиметилен, карбоксивиниловые полимеры, полиоксиэтиленполиоксипропиленовый сополимер, сополимер полиметилвинилового эфира с малеиновым ангидридом, карбоксиметиламид, сополимер метакрилата калия и дивинилбензола, полиоксиэтиленгликоли, полиэтиленоксид и их производные, соли и комбинации.
В конкретном варианте осуществления полимер представляет собой полиалкиленгликоль, включая, например, полиэтиленгликоль (PEG).
Углевод может представлять собой любой углевод, при условии, что он содержит или получен так, что он содержит карбонил с альфа-уходящей группой. Углевод, например, может представлять собой углевод, который модифицирован так, чтобы он содержал карбонил с альфа-уходящей группой. В связи с этим, углевод может представлять собой модифицированную форму моносахарида (например, глюкозы, галактозы, фруктозы), дисахарида (например, сахарозы, лактозы, мальтозы), олигосахарида (например, рафинозы, стахиозы), полисахарида (крахмала, амилозы, амилопектина, целлюлозы, хитина, каллозы, ламинарина, ксилана, маннана, фукоидана, галактоманнана).
Относительно пептидов класса 4, содержащих соединение формулы IV, липид может представлять собой любой липид, содержащий карбонил с альфа-уходящей группой. Липид, например, может представлять собой липид, который модифицируют так, чтобы он содержал карбонил. В связи с этим, липид может представлять собой производное жирной кислоты (например, C4-C30 жирной кислоты, эйкозаноида, простагландина, лейкотриена, тромбоксана, N-ацилэтаноламина), глицеролипида (например, моно-, ди-, три-замещенных глицеринов), глицерофосфолипида (например, фосфатидилхолина, фосфатидилинозитола, фосфатидилэтаноламина, фосфатидилсерина), сфинголипида (например, сфингозина, церамида), стерольного липида (например, стероида, холестерина), пренольного липида, сахаролипида или поликетида. В некоторых вариантах осуществления липид представляет собой масло, воск, холестерин, стерол, растворимый в воде витамин, моноглицерид, диглицерид, триглицерид, фосфолипид.
В некоторых вариантах осуществления R7 имеет молекулярный вес приблизительно 100 кДа или меньше, например, приблизительно 90 кДа или меньше, приблизительно 80 кДа или меньше, приблизительно 70 кДа или меньше, приблизительно 60 кДа или меньше, приблизительно 50 кДа или меньше, приблизительно 40 кДа или меньше. Соответственно, R7 может иметь молекулярный вес приблизительно 35 кДа или меньше, приблизительно 30 кДа или меньше, приблизительно 25 кДа или меньше, приблизительно 20 кДа или меньше, приблизительно 15 кДа или меньше, приблизительно 10 кДа или меньше, приблизительно 5 кДа или меньше, или приблизительно 1 кДа.
В альтернативном варианте осуществления пептид класса 4 содержит в качестве A пептид из 2-6 аминокислот, в котором две последовательные аминокислоты пептида соединены через сложноэфирную или эфирную связь. Сложноэфирная или эфирная связь может находиться, например, между аминокислотами 2 и 3, 3 и 4, 4 и 5 или 5 и 6. Необязательно пептид может быть дополнительно модифицирован ковалентной связью с другой химической группой, включая связь с полимером (например, гидрофильным полимером), алкилированием или ацилированием.
Что касается пептида класса 4, содержащего общую структуру A-B-C, B представляет собой аминокислоты нативного глюкагона, например, i-26 SEQ ID NO: 1301, где i равно 3, 4, 5, 6, или 7, необязательно содержащие одну или более аминокислотных модификаций. В конкретном варианте осуществления B представляет собой аминокислоты 7-26 SEQ ID NO: 1301, необязательно дополнительно модифицированные.
В некоторых вариантах осуществления B модифицируют вплоть до трех аминокислотными модификациями. Например, B, который представляет собой нативную аминокислотную последовательность SEQ ID NO: 1301, модифицируют одной или более консервативными аминокислотными модификациями.
В другом варианте осуществления B содержит одну или более аминокислотных модификаций, выбранных из группы, состоящей из (iv)-(ix), как описано в настоящем изобретении. В конкретном варианте осуществления B содержит одну или обе аминокислотные модификации (v) и (vi). В следующем конкретном варианте осуществления B содержит одну или комбинацию аминокислотных модификаций, выбранных из группы, состоящей из (iv), (vii), (viii), и (ix), в добавление к (v) и (vi).
В другом конкретном варианте осуществления пептид класса 4 содержит одну или более заряженных аминокислот на C-конце. Например, Y и/или Z может представлять собой заряженную аминокислоту, например, Lys, Arg, His, Asp и Glu. В еще другом варианте осуществления пептид класса 4 содержит одну-две заряженные аминокислоты (например, Lys, Arg, His, Asp и Glu), C-концевые к Z. В конкретном аспекте Z с последующими одной-двумя заряженными аминокислотами не содержит R10.
Пептид класса 4 в некоторых вариантах осуществления содержит гидрофильную группу, ковалентно связанную с аминокислотным остатком пептида класса 4, как описано в настоящем изобретении. Например, пептид класса 4 может содержать гидрофильную группу, ковалентно связанную с аминокислотой в положении 1, 16, 20, 21 или 24 согласно нумерации SEQ ID NO: 1301. В другом варианте осуществления гидрофильную группу присоединяют к C-концевой аминокислоте пептида класса 4, которая в некоторых случаях, представляет собой 1 или 11 аминокислот, C-концевых к Z. В еще другом варианте осуществления гидрофильную группу присоединяют к PLA, когда A представляет собой PLA, PLA-Phe или PLA-Thr-Phe, где PLA модифицируют так, чтобы она содержала гидрофильную группу. В другом варианте осуществления аминокислоту, содержащую гидрофильную группу, присоединяют к N- или C-концу пептида класса 4. В другом варианте осуществления пептид класса 4 содержит ацильную группу или алкильную группу, как описано в настоящем изобретении. Например, ацилирование или алкилирование можно осуществлять вне боковой цепи аминокислоты в положении 10, 20 или 24, согласно нумерации SEQ ID NO: 1301. В альтернативном варианте осуществления ацилирование или алкилирование осуществляют вне боковой цепи C-концевой аминокислоты пептида класса 4, которая в некоторых случаях, представляет собой 1 или 11 аминокислоту, C-концевую к Z. В еще другом варианте осуществления, когда A представляет собой PLA, PLA-Phe, или PLA-Thr-Phe, PLA модифицируют так, чтобы она содержала ацильную или алкильную группу.
Примерные варианты осуществления
Пептид класса 4 может содержать любые аминокислоты, синтетические или встречающиеся в природе, при условии, что по меньшей мере две последовательные аминокислоты пептида соединены сложноэфирной или эфирной связью. В конкретном варианте осуществления пептид содержит аминокислоты нативного глюкагона. Например, пептид может содержать j-6 нативного глюкагона (SEQ ID NO: 1301), где j равно 1, 2, 3, 4 или 5. Альтернативно, пептид может содержать аминокислотную последовательность на основе N-конца SEQ ID NO: 1301 с одной или более аминокислотными модификациями. Аминокислота в положении 1 и/или положении 2 может представлять собой аминокислоту, которая снижает подверженность к расщеплению дипептидилпептидазой IV. Например, пептид может содержать в положении 1 пептида класса 4 аминокислоту, выбранную из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах осуществления положение 2 антагонистического пептида представляет собой аминокислоту, выбранную из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (Aib). Кроме того, например, аминокислота в положении 3 пептида класса 4 может представлять собой глютаминовую кислоту, в отличие от нативного глютаминового остатка нативного глюкагона. Соответственно, пептид класса 4 может содержать аминокислотную последовательность:
Xaa1-Xaa2-Xaa3-Thr-Gly-Phe (SEQ ID NO: 1368);
Xaa2-Xaa3-Thr-Gly-Phe (SEQ ID NO: 1369); или
Xaa3-Thr-Gly-Phe (SEQ ID NO: 1370);
где Xaa1 выбран из группы, состоящей из: His, D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина; Xaa2 выбран из группы, состоящей из: Ser, D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (Aib); и Xaa3 представляет собой Gln или Glu.
Настоящее изобретение также включает варианты осуществления, где C-концевая аминокислота пептидов класса 4 содержит амидную группу, заместившую карбоксильную группу, которая присутствует в нативной аминокислоте.
В некоторых вариантах осуществления, где пептид класса 4 пегилирован, пептид класса 4 содержит укороченные глюкагоновые пептиды, особенно 6-29, где "N-концевая" аминокислота представляет собой PLA (фенилмолочную кислоту). Данные глюкагоновые производные обладают уникальной активностью. Они являются более эффективными пептидами, чем пептиды с нативным N-концевым фенилаланином, и они подавляют любой глюкагоновый агонизм, который является результатом пегилирования, иногда не наблюдаемый с нативным фенилаланином. Наконец, тогда как в современной литературе утверждается, что замена нативной аспарагиновой кислоты в положении 9 требуется для антагонистической активности, заявители пришли к неожиданному результату, что данная замена более не требуется в PLA6-(6-29) глюкагоновых аналогах.
В некоторых вариантах осуществления аминокислота пептида класса 4 заменена по меньшей мере одним цистеиновым остатком, где боковая цепь цистеинового остатка дополнительно модифицирована тиол-реакционноспособным реагентом, включая, например, малеимидо, винилсульфон, 2-пиридилтио, галогеналкил и галогенацил. Данные тиол-реакционноспособные реагенты могут содержать карбокси, кето, гидроксильную и эфирную группы, а также другие гидрофильные группы, такие как полиэтиленгликольные фрагменты. В альтернативном варианте осуществления аминокислота пептида класса 4 заменена лизином, и боковая цепь заменяющего лизинового остатка дополнительно модифицирована, применяя реакционноспособные по отношению к амину реагенты, такие как активные эфиры (сукцинимидо, ангидрид и т.д.) карбоновых кислот или альдегиды гидрофильных групп, таких как полиэтиленгликоль. В соответствии с некоторыми вариантами осуществления лизиновый остаток, соответствующий положению 12 нативного пептида, заменен аргинином и одну лизиновую замену осуществляют для одной из аминокислот, соответствующих положению 1, 16, 17, 20, 21, 24 или 29 нативного пептида, или лизин присоединяют к N- или C-концу пептида класса 4.
В другом варианте осуществления метиониновый остаток, соответствующий положению 27 нативного пептида, заменяют лейцином или норлейцином, предотвращая окислительное разрушение пептида.
В некоторых вариантах осуществления пептиды класса 4, описанные в настоящем изобретении, дополнительно модифицируют укорачиванием или делецией одной или двух аминокислот с C-конца глюкагонового пептида (т.е. укорачивание аминокислоты в положении 29 или в положениях 28 и 29 нативного глюкагона) без влияния на активность и/или эффективность относительно глюкагонового рецептора. В связи с этим, пептид класса 4, описанный в настоящем изобретении, может, например, преимущественно состоять или состоять из аминокислот 1-27, 1-28, 2-27, 2-28, 3-27, 3-28, 4-27, 4-28, 5-27, 5-28, 6-27 или 6-28 нативного глюкагонового пептида (SEQ ID NO: 1301) с одной или более модификациями, приводя в результате к активности пептида класса 4, как описано в настоящем изобретении.
Описанные в настоящем изобретении пептиды класса 4 также содержат аминокислотные замены в положениях, о которых известно, что они не являются важными для функционирования глюкагонового пептида. В некоторых вариантах осуществления замены представляют собой консервативные аминокислотные замены в одном, двух или трех положениях, выбранных из группы, состоящей из 2, 5, 6, 7, 8, 9, 12, 13, 14, 15, 16, 19, 22, 23 или 24 SEQ ID NO: 1339. В некоторых вариантах осуществления пептид класса 4 включает производное пептида SEQ ID NO: 1342, где глюкагоновый пептид содержит дополнительную аминокислотную замену по сравнению с SEQ ID NO: 1342 в одном-трех аминокислотных положениях, выбранных из положений 2, 5, 6, 8, 9, 12, 13 и 14. В некоторых вариантах осуществления замены в положениях 2, 5, 6, 8, 9, 12, 13 и 14 SEQ ID NO: 1342 представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления аминокислоты, соответствующие положениям 16, 17, 20, 21, 24 или 29 нативного пептида, и более конкретно в положении 21 и/или 24, заменяют цистеином или лизином, где PEG цепь ковалентно связана с заменяющим цистеиновым или лизиновым остатком.
В соответствии с некоторыми вариантами осуществления модифицированный пептид класса 4 содержит две или более полиэтиленгликольные цепи, ковалентно связанные с пептидом, где суммарный молекулярный вес глюкагоновых цепей равен от приблизительно 1000 до приблизительно 5000 Дальтон. В некоторых вариантах осуществления пегилированный пептид класса 4 включает пептид, выбранный из группы, состоящей из SEQ ID NO: 1312, и SEQ ID NO: 1322, где указанный пептид содержит полиэтиленгликольную цепь, соединенную с аминокислотой в положениях 11 и 19, и суммарный молекулярный вес двух PEG цепей равен от приблизительно 1000 до приблизительно 5000 Дальтон.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 4, включая модифицированный глюкагоновый пептид, выбранный из группы, состоящей из:
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Xaa-Tyr-Leu-Xaa-Xaa-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1309),
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Xaa-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Xaa-Phe-Val-Gln-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1310),
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Xaa-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Xaa-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1311) и
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Xaa-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Xaa-Phe-Val-Xaa-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1312),
где Xaa в положении 4 представляет собой аспарагиновую кислоту, глютаминовую кислоту, цистеиновую кислоту или гомоцистеиновую кислоту, Xaa в положении 7 представляет собой Lys или Arg, Xaa в положении 10 представляет собой аспарагиновую кислоту, цистеиновую кислоту, глютаминовую кислоту, гомоглютаминовую кислоту и гомоцистеиновую кислоту; Xaa в положении 11 представляет собой Ser, Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин, Xaa в положении 16 представляет собой Asp, Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин, и Xaa в положении 19 представляет собой Gln, Lys, Cys, Orn, гомоцистеин и ацетилфенилаланин, Xaa в положении 22 представляет собой Met, Leu или Nle, R1 представляет собой OH или NH2, и R2 представляет собой COOH или CONH2, где пептид пегилирован в положении 11 для SEQ ID NO: 1309, в положении 16 для SEQ ID NO: 1310, положении 19 для SEQ ID NO: 1311 и в положениях 16 и 19 SEQ ID NO: 1312, при условии, что когда Xaa в положении 4 представляет собой аспарагиновую кислоту, то R1 представляет собой OH. В соответствии с некоторыми вариантами осуществления пептид содержит последовательность SEQ ID NO: 1309, SEQ ID NO: 1310 или SEQ ID NO: 1311, где R1 представляет собой OH, и R2 представляет собой CONH2. В некоторых вариантах осуществления пептид содержит последовательность SEQ ID NO: 1309, SEQ ID NO: 1310 или SEQ ID NO: 1311, где R1 представляет собой OH, R2 представляет собой CONH2, и аминокислота в положении 4 представляет собой аспарагиновую кислоту, и в следующем варианте осуществления данные пептиды содержат карбокси концевое удлинение, имеющее последовательность SEQ ID NO: 1319.
В соответствии с некоторыми вариантами осуществления пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1313, SEQ ID NO: 1314 и SEQ ID NO: 1316, где пептид пегилирован в положении 11 для SEQ ID NO: 1309 и SEQ ID NO: 1313, пегилирован в положении 16 для SEQ ID NO: 1310, и пегилирован в положении 19 для SEQ ID NO: 1310 и SEQ ID NO: 1314. В некоторых вариантах осуществления глюкагоновый агонист содержит пептид SEQ ID NO: 1313 или SEQ ID NO: 1314. В некоторых вариантах осуществления C-концевая аминокислота пептидов класса 4, описанных в настоящем изобретении, содержит амидную группу вместо карбоксильной группы, которая присутствует в нативной аминокислоте. В соответствии с некоторыми вариантами осуществления пептид класса 4 содержит последовательность SEQ ID NO: 1318.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 4, где белок плазмы ковалентно связан с боковой цепью аминокислоты пептида для увеличения растворимости, стабильности и/или фармакокинетических параметров глюкагонового пептида. Например, сывороточный альбумин можно ковалентно соединить с пептидами класса 4, представленными в настоящем изобретении. В некоторых вариантах осуществления белок плазмы ковалентно связан с аминокислотой, соответствующей положению 16, 17, 20, 21, 24 или 29 нативного глюкагонового пептида. Более конкретно, в некоторых вариантах осуществления белок плазмы соединен с аминокислотой, соответствующей положению 16 или 24 нативного глюкагонового пептида, где пептид класса 4 содержит последовательность SEQ ID NO: 1303, SEQ ID NO: 1304, SEQ ID NO: 1305, SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1309, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1322, SEQ ID NO: 1323, SEQ ID NO: 1324, SEQ ID NO: 1325, SEQ ID NO: 1326, SEQ ID NO: 1327, SEQ ID NO: 1328, SEQ ID NO: 1336 и SEQ ID NO: 1339. В некоторых вариантах осуществления пептид класса 4 включает пептид, выбранный из группы, состоящей из SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311 и SEQ ID NO: 1312.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 4, где линейная аминокислотная последовательность, представляющая Fc-фрагмент иммуноглобулиновой молекулы, ковалентно связана с боковой цепью аминокислоты пептида класса 4, описанного в настоящем изобретении, для увеличения растворимости, стабильности и/или фармакокинетических свойств глюкагонового пептида. Например, аминокислотная последовательность, представляющая собой Fc-фрагмент иммуноглобулиновой молекулы, может быть ковалентно связана с положением 11,12, 15, 16, 19, 21 или 24 глюкагонового пептида SEQ ID NO: 1307, SEQ ID NO: 1339, или его глюкагонового аналога. В некоторых вариантах осуществления Fc пептид ковалентно связан с положением 11 или 19 пептида класса 4 SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308 или SEQ ID NO: 1336. Fc-фрагмент обычно выделяют из IgG, но Fc пептидный фрагмент из любого иммуноглобулина должен функционировать эквивалентно. В некоторых вариантах осуществления глюкагоновый пептид выбран из группы, состоящей из SEQ ID NO: 1303, SEQ ID NO: 1304, SEQ ID NO: 1305, SEQ ID NO: 1307 SEQ ID NO: 1308 и SEQ ID NO: 1339, где Fc-фрагмент соединен с соответствующим положением 16, 17, 20, 21, 24 или 29 нативного глюкагонового пептида. В некоторых вариантах осуществления пептид класса 4 включает глюкагоновый пептид, выбранный из группы, состоящей из SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311 и SEQ ID NO: 1312, где Fc пептид соединен с боковой цепью аминокислоты, расположенной в положении 11, 16 или 19 SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311, соответственно, и в обоих положениях 11 и 19 для SEQ ID NO: 1312.
В определенных вариантах осуществления настоящего изобретения пептид класса 4 содержит аминокислотную последовательность любой из SEQ ID NO: 1362, 1364-1367 и 1371.
Модификации, увеличивающие растворимость
Пептиды класса 4 можно дополнительно модифицировать так, чтобы увеличить растворимость пептида в водных растворах при физиологическом pH, в некоторых аспектах, сохраняя глюкагоновую антагонистическую активность. Введение гидрофильных групп в положениях, соответствующих положениям 1, 16, 17, 20, 21, 24 и 29 нативного пептида, или на C-конце, может увеличивать растворимость полученного в результате пептида класса 4 в растворах, имеющих физиологический pH, при сохранении антагонистической активности исходного соединения. Следовательно, в некоторых вариантах осуществления описанные в настоящем изобретении пептиды класса 4 дополнительно модифицированы так, чтобы они содержали одну или более гидрофильных групп, ковалентно связанных с боковыми цепями аминокислот, соответствующих аминокислотным положениям 1, 16, 17, 20, 21, 24 и 29 нативного глюкагонового пептида или N- или C-концевой аминокислоте. В следующем варианте осуществления боковые цепи аминокислот, соответствующих аминокислотным положениям 16 и 24 нативного глюкагонового пептида, ковалентно связаны с гидрофильными группами, и в некоторых вариантах осуществления гидрофильная группа представляет собой полиэтиленгликоль (PEG).
Заявители также обнаружили, что нативный глюкагон можно модифицировать введением заряда на его карбокси конце для увеличения растворимости пептида при сохранении агонистических свойств пептида. Повышенная растворимость обеспечивает получение и хранение глюкагоновых растворов при приблизительно нейтральном pH. Получение глюкагоновых растворов при относительно нейтральных pH (например, pH от приблизительно 6,0 до приблизительно 8,0) увеличивает долговременную стабильность пептидов класса 4.
Снова, заявители ожидают, что пептиды класса 4, описанные в настоящем изобретении, можно аналогично модифицировать для повышения их растворимости в водных растворах при относительно нейтральном pH (например, pH от приблизительно 6,0 до приблизительно 8,0) при сохранении антагонистических свойств исходного белка. Соответственно, некоторые варианты осуществления настоящего изобретения относятся к пептиду класса 4 SEQ ID NO: 1339, который дополнительно модифицирован по сравнению с нативными аминокислотами, присутствующими в положениях 6-29 глюкагона дикого типа (SEQ ID NO: 1301), добавляя заряд пептиду заменой нативных незаряженных аминокислот заряженными аминокислотами, или присоединением заряженных аминокислот к карбокси концу. В соответствии с некоторыми вариантами осуществления, одну-три из незаряженных нативных аминокислот пептида класса 4 SEQ ID NO: 1339 заменяют заряженными аминокислотами. В некоторых вариантах осуществления заряженная аминокислота выбрана из группы, состоящей из лизина, аргинина, гистидина, аспарагиновой кислоты и глютаминовой кислоты. Более конкретно, заявители обнаружили, что замена обычно встречающейся аминокислоты в соответствующем положении 28 и/или 29 по сравнению с нативным глюкагоном с заряженными аминокислотами и/или присоединение одной-двух заряженных аминокислот к карбокси концу пептида класса 4, увеличивает растворимость и стабильность пептидов класса 4 в водных растворах при физиологически значимых pH (т.е. pH от приблизительно 6,5 до приблизительно 7,5). Соответственно, ожидают, что данные модификации пептида класса 4, описанного в настоящем изобретении, будут оказывать аналогичный эффект на растворимость в водных растворах, особенно при pH в диапазоне от приблизительно 5,5 до приблизительно 8,0, при сохранении биологической активности исходного пептида.
В соответствии с некоторыми вариантами осуществления пептид класса 4 SEQ ID NO: 1339 модифицируют заменой нативной аминокислоты в соответствующем положении 28 и/или 29 по сравнению с нативным глюкагоном отрицательно заряженной аминокислотой (например, аспарагиновой кислотой или глютаминовой кислотой) и необязательно присоединением отрицательно заряженной аминокислоты (например, аспарагиновой кислоты или глютаминовой кислоты) к карбокси концу пептида. В альтернативном варианте осуществления пептид класса 4 SEQ ID NO: 1339 модифицируют заменой нативной аминокислоты в соответствующем положении 29 по сравнению с нативным глюкагоном положительно заряженной аминокислотой (например, лизином, аргинином или гистидином) и необязательно присоединением одной или двух положительно заряженных аминокислот (например, лизина, аргинина или гистидина) к карбокси концу пептида. В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 4, обладающий повышенной растворимостью и стабильностью, где пептид содержит аминокислотную последовательность SEQ ID NO: 1341 при условии, что по меньшей мере одна из аминокислот в положении 23 или 24 SEQ ID NO: 1341 заменена кислой аминокислотой, и/или дополнительную кислую аминокислоту присоединяют к карбокси концу SEQ ID NO: 1341. В некоторых вариантах осуществления кислая аминокислота независимо выбрана из группы, состоящей из Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 4, обладающий повышенной растворимостью и стабильностью, где антагонист содержит аминокислотную последовательность SEQ ID NO: 1341, SEQ ID NO: 1342, SEQ ID NO: 1343 или SEQ ID NO: 1344, где по меньшей мере одна из аминокислот в положениях 23 или 24 заменена ненативным аминокислотным остатком (т.е. по меньшей мере одна аминокислота, присутствующая в положении 23 или 24 аналога, представляет собой кислую аминокислоту, отличную от аминокислоты, присутствующей в соответствующем положении в SEQ ID NO: 1307). В соответствии с некоторыми вариантами осуществления обеспечивают глюкагоновый агонист, содержащий последовательность SEQ ID NO: 1341 или 1342, при условии, что когда аминокислота в положении 23 представляет собой аспарагин, и аминокислота в положении 24 представляет собой треонин, пептид дополнительно содержит одну-две аминокислоты, независимо выбранные из группы, состоящей из Lys, Arg, His, Asp или Glu, присоединенные к карбокси концу пептида класса 4.
В другом варианте осуществления растворимость пептида класса 4 SEQ ID NO: 1342 можно повысить ковалентным присоединением гидрофильной группы к аминокислотному остатку в положении 11, 12, 15, 16, 19 или 24, и в некоторых вариантах осуществления гидрофильная группа соединена с аминокислотой в положении 11, 16 или 19, и в следующем варианте осуществления гидрофильная группа соединена с аминокислотой 19. В некоторых вариантах осуществления гидрофильная группа представляет собой белок плазмы или Fc-фрагмент иммуноглобулина, и в альтернативном варианте осуществления гидрофильная группа представляет собой гидрофильную углеводородную цепь. В некоторых вариантах осуществления гидрофильная группа представляет собой полиэтиленгликоль, имеющий молекулярный вес, выбранный из диапазона от приблизительно 1000 до приблизительно 5000 Дальтон. В другом варианте осуществления гидрофильная группа представляет собой полиэтиленгликоль, имеющий молекулярный вес по меньшей мере приблизительно 20000 Дальтон. В некоторых вариантах осуществления модифицированный полиэтиленом пептид класса 4 содержит аминокислотную последовательность SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1343, SEQ ID NO: 1344 или SEQ ID NO: 1345.
Модификации, увеличивающие стабильность
Asp-Ser последовательность в положении 15-16 нативного глюкагона определена как уникально нестабильный дипептид, который приводит к преждевременному химическому расщеплению нативного гормона в водных буферах. Например, при выдерживании в 0,01N HCl при 37°C в течение 2 недель, более чем 50% нативного глюкагона расщепляется на фрагменты. Два высвобождающихся после расщепления пептида 1-15 и 16-29 не обладают глюкагоноподобной биологической активностью и, таким образом, накладывают ограничения на водное формулирование глюкагона и его родственных аналогов. Наблюдали, что селективная химическая замена Asp в положении 15 нативного глюкагонового пептида Glu фактически устраняет химическое расщепление 15-16 пептидной связи.
Соответственно, ожидают, что пептиды класса 4 настоящего изобретения можно аналогично модифицировать для снижения их подверженности к преждевременному химическому расщеплению в водных буферах. В соответствии с некоторыми вариантами осуществления пептиды класса 4, описанные в настоящем изобретении, можно дополнительно модифицировать для увеличения их стабильности в водных растворах заменой нативной аспарагиновой аминокислоты, расположенной в положении 15 нативного глюкагонового пептида, аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты, глютаминовой кислоты, гомоглютаминовой кислоты и гомоцистеиновой кислоты. В соответствии с некоторыми вариантами осуществления остаток аспарагиновой кислоты в положении 10 пептида класса 4 SEQ ID NO: 1339 может быть заменен аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты, глютаминовой кислоты, гомоглютаминовой кислоты и гомоцистеиновой кислоты, и в некоторых вариантах осуществления нативная аспарагиновая кислота в положении 10 SEQ ID NO: 1339 заменена глютаминовой кислотой. В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 4, обладающий повышенной стабильностью в водных растворах, где антагонист содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1336, SEQ ID NO: 1340 и SEQ ID NO: 1342. В следующем варианте осуществления пептид класса 4 амидирован.
В соответствии с некоторыми вариантами осуществления, повышенной стабильности посредством снижения разрушения пептида класса 4, описанного в настоящем изобретении, можно также достичь заменой серина в положении 16 (в соответствии с нумерацией нативного глюкагона) глютаминовой кислотой, цистеиновой кислотой, гомоглютаминовую кислотой или гомоцистеиновой кислотой. В конкретном варианте осуществления серин в положении 16 (согласно нумерации последовательности нативного глюкагона) заменен глютаминовой кислотой. В более конкретном аспекте, пептид класса 4, содержащий данную модификацию, содержит C-концевой карбоксилат и не амидирован.
В соответствии с некоторыми вариантами осуществления, обеспечивают пептид класса 4, включая глюкагоновый пептид, выбранный из группы, состоящей из SEQ ID NO: 1307, SEQ ID NO: 1336, SEQ ID NO: 1339, SEQ ID NO: 1340, SEQ ID NO: 1341, SEQ ID NO: 1342, SEQ ID NO: 1343 и SEQ ID NO: 1344, дополнительно модифицированный одним или более дополнительными аминокислотными заменами в положениях, соответствующих положениям 11, 12, 15,16, 19 и/или 24 нативного глюкагонового пептида, где аминокислотные замены включают замены аминокислотой, содержащей боковую цепь, подходящую для образования поперечной связи с гидрофильными группами, включая, например, PEG. Пептид может быть заменен встречающейся в природе аминокислотой или синтетической (не встречающейся в природе) аминокислотой. Синтетические или не встречающиеся в природе аминокислоты относятся к аминокислотам, которые не встречаются in vivo, но которые, тем не менее, можно вводить в пептидные структуры, описанные в настоящем изобретении. В некоторых вариантах осуществления обеспечивают пептид класса 4, где пептид содержит последовательность SEQ ID NO: 1307, SEQ ID NO: 1336, SEQ ID NO: 1339, SEQ ID NO: 1340, SEQ ID NO: 1341, SEQ ID NO: 1342, SEQ ID NO: 1343 и SEQ ID NO: 1344, и дополнительно содержит полиэтиленгликольную цепь, соединенную с соответствующим положением 21 или 24 нативного глюкагонового пептида. В следующем варианте осуществления C-конец пептида класса 4 модифицируют так, чтобы заместить карбоксильную группу амидной группой.
Слитые пептиды и конъюгаты
Настоящее описание также включает слитые пептиды с пептидами класса 4, где второй пептид конденсирован с C-концом пептида класса 4. Более конкретно, слитый пептид может содержать пептид класса 4 SEQ ID NO: 1344, который дополнительно содержит аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), SEQ ID NO: 1320 (Lys Arg Asn Arg Asn Asn Ile Ala) или SEQ ID NO: 1321 (Lys Arg Asn Arg), соединенную с C-концевой аминокислотой пептида класса 4. В некоторых вариантах осуществления аминокислотная последовательность SEQ ID NO: 1319 (GPSSGAPPPS) соединена с аминокислотой 24 пептида класса 4 SEQ ID NO: 1342 пептидной связью. В другом варианте осуществления слитый пептид содержит пептид класса 4 SEQ ID NO: 1307, SEQ ID NO: 1336, SEQ ID NO: 1339, SEQ ID NO: 1340, SEQ ID NO: 1341 или SEQ ID NO: 1343, который дополнительно содержит аминокислотную последовательность SEQ ID NO: 1319 (GPSSGAPPPS), соединенную с аминокислотой 24 пептида класса 4. В другом варианте осуществления слитый пептид содержит пептид класса 4 SEQ ID NO: 1307, SEQ ID NO: 1336, SEQ ID NO: 1337, SEQ ID NO: 1338, SEQ ID NO: 1339, SEQ ID NO: 1341 или SEQ ID NO: 1343, который дополнительно содержит аминокислотную последовательность SEQ ID NO: 1320, SEQ ID NO: 1321 или SEQ ID NO: 1353, соединенную с аминокислотой 24 пептида класса 4. В некоторых вариантах осуществления пептид, конденсированный с пептидом класса 4, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1346 и SEQ ID NO 1347. В следующем варианте осуществления C-конец слитого пептида модифицируют, замещая карбоксильную группу амидной группой.
В некоторых вариантах осуществления обеспечивают пептид, конденсированный с пептидом класса 4, где часть пептида класса 4 слитого пептида выбрана из группы, состоящей из SEQ ID NO: 1303, SEQ ID NO: 1304, SEQ ID NO: 1305, SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1309, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1313, SEQ ID NO: 1314, SEQ ID NO: 1315, SEQ ID NO: 1310, SEQ ID NO: 1316, SEQ ID NO: 1317, SEQ ID NO: 1318 и SEQ ID NO: 1339, и последовательность SEQ ID NO: 1319 конденсирована с карбокси концом части пептида класса 4, и где PEG цепь, когда она присутствуют, выбрана из диапазона 500-40000 Дальтон. Более конкретно, в некоторых вариантах осуществления часть пептида класса 4 выбрана из группы, состоящей из SEQ ID NO: 1313, SEQ ID NO: 1314, SEQ ID NO: 1315, SEQ ID NO: 1316, SEQ ID NO: 1346 и SEQ ID NO: 1347, где PEG цепь выбрана из диапазона от приблизительно 500 до приблизительно 5000 Дальтон, и более конкретно, в некоторых вариантах осуществления PEG цепь имеет молекулярный вес приблизительно 1000 Дальтон. В следующем варианте осуществления C-конец модифицируют, замещая карбоксильную группу амидной группой.
Пептид класса 4 может дополнительно содержать одну-две заряженные аминокислоты, присоединенные к карбокси концу. В некоторых вариантах осуществления, где одну-две заряженные аминокислоты присоединяют к карбокси концу SEQ ID NO: 1344, аминокислоты представляют собой отрицательно заряженные аминокислоты, включая, например, глютаминовую кислоту и аспарагиновую кислоту. В некоторых вариантах осуществления пептид класса 4 содержит последовательность SEQ ID NO: 1342 где по меньшей мере одно из соответствующих положений 27 и 28 относительно нативного глюкагонового пептида содержит аминокислоту, выбранную из группы, состоящей из аспарагиновой кислоты и глютаминовой кислоты, и где SEQ ID NO: 1342 необязательно модифицирована так, чтобы она содержала дополнительные одну-две отрицательно заряженные аминокислоты, присоединенные к карбокси концу. В некоторых вариантах осуществления отрицательно заряженные аминокислоты представляют собой глютаминовую кислоту или аспарагиновую кислоту.
Пептиды класса 4, описанные в настоящем изобретении, можно комбинировать с другими активными агентами, включая, например, инсулин, для лечения заболеваний или состояний, которые характеризуются избыточной глюкагоновой активностью. В некоторых вариантах осуществления пептиды класса 4, которые модифицированы так, что они ковалентно связаны с PEG цепью, имеющей молекулярный вес больший, чем 10000 Дальтон, можно вводить в комбинации с инсулином для того, чтобы способствовать поддержанию стабильной концентрации глюкозы в крови у диабетиков. Пептиды класса 4 настоящего описания можно вводить совместно с инсулином в виде одной композиции, одновременно вводить в виде различных растворов, или альтернативно, инсулин и пептид класса 4 можно вводить в разное время относительно друг друга. В некоторых вариантах осуществления композицию, содержащую инсулин, и композицию, содержащую пептид класса 4, вводят в пределах 12 часов друг от друга. Точное отношение пептида класса 4 к введенному инсулину будет зависеть частично от определения концентрации глюкагона у пациента, и его можно определить стандартными экспериментами.
Димерные пептиды
Настоящее описание также включает мультимеры модифицированных пептидов класса 4, описанных в настоящем изобретении. Два или более модифицированных пептидов класса 4 можно соединять вместе, применяя стандартные линкеры и способы, известные специалистам в данной области техники. Например, димеры можно получить между двумя модифицированными пептидами класса 4, применяя бифункциональные тиольные кросс-линкеры и бифункциональные аминовые кросс-линкеры, в частности, для пептидов класса 4, которые заменены (например, в положениях 11, 16 или 19) цистеиновым, лизиновым, орнитиновым, гомоцистеиновым или ацетилфенилаланиновым остатком (например, SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311 и SEQ ID NO: 1312). Димер может представлять собой гомодимер или альтернативно может представлять собой гетеродимер. В некоторых вариантах осуществления димер образуется между двумя пептидами класса 4, независимо выбранными из группы, состоящей из SEQ ID NO: 1308, SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1345, SEQ ID NO: 1346 или SEQ ID NO: 1347, где два пептида соединены друг с другом линкером, присоединенным к положению 11 каждого пептида, 16 каждого пептида или положению 19 каждого пептида или любой их комбинации. В некоторых вариантах осуществления связь представляет собой дисульфидную связь между Cys11 и Cys19 или Cys19 и Cysl9 или Cys11 и Cys19 остатками соответствующих пептидов класса 4.
Аналогично, димер можно получить между двумя пептидами класса 4, независимо выбранными из группы, состоящей из SEQ ID NO: 1303, SEQ ID NO: 1304, SEQ ID NO: 1305, SEQ ID NO: 1306, SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1309, SEQ ID NO: 1310, SEQ ID NO: 1311, SEQ ID NO: 1312, SEQ ID NO: 1336, SEQ ID NO: 1337, SEQ ID NO: 1338, SEQ ID NO: 1339 и SEQ ID NO: 1342, где связь образуется между аминокислотными положениями, независимо выбранными из положения 16, 21 и 24 относительно нативного глюкагонового пептида.
В соответствии с некоторыми вариантами осуществления обеспечивают димер пептида класса 4, содержащий два пептида класса 4, каждый из которых содержит последовательность SEQ ID NO: 1346, где два антагониста соединены друг с другом дисульфидной связью в положении аминокислоты 25. В другом варианте осуществления обеспечивают димер пептида класса 4, содержащий два пептида класса 4, каждый из которых содержит последовательность SEQ ID NO: 1347, где два антагониста соединены друг с другом дисульфидной связью в положении аминокислоты 35. В некоторых вариантах осуществления димер образуется из пептидов класса 4 SEQ ID NO: 1346 и SEQ ID NO: 1347, где аминокислота в положении 10 представляет собой глютаминовую кислоту.
В некоторых вариантах осуществления димер включает гомодимер слитого пептида пептида класса 4, выбранного из группы, состоящей из SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1336, SEQ ID NO: 1337, SEQ ID NO: 1340, SEQ ID NO: 1339, NO: 1340, SEQ ID NO: 1341, SEQ ID NO: 1342 и фармацевтически приемлемые соли указанных пептидов класса 4. В соответствии с некоторыми вариантами осуществления обеспечивают димер, содержащий первый пептид класса 4, соединенный со вторым пептидом класса 4 линкером, где первый и второй пептиды димера независимо выбраны из группы, состоящей из SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1336, SEQ ID NO: 1337, SEQ ID NO: 1339, SEQ ID NO: 1340, SEQ ID NO: 1341 и SEQ ID NO: 1342, и фармацевтически приемлемые соли указанных глюкагоновых полипептидов. В другом варианте осуществления первый и второй пептиды класса 4 димера независимо выбраны из группы, состоящей из SEQ ID NO: 1307, SEQ ID NO: 1308, SEQ ID NO: 1336 и SEQ ID NO: 1339.
В другом варианте осуществления димер включает гомодимер пептида класса 4, выбранного из группы, состоящей из SEQ ID NO: 1323, SEQ ID NO: 1324, SEQ ID NO: 1325, SEQ ID NO: 1326, SEQ ID NO: 1327, SEQ ID NO: 1328, SEQ ID NO: 1329, SEQ ID NO: 1330, SEQ ID NO: 1331. В другом варианте осуществления обеспечивают димер пептидов класса 4, где первый и второй пептиды димера содержат аминокислотную последовательность, независимо выбранную из группы, состоящей из SEQ ID NO: 1323, SEQ ID NO: 1324, SEQ ID NO: 1325, SEQ ID NO: 1326, SEQ ID NO: 1327 и SEQ ID NO: 1328. В другом варианте осуществления димер включает гомодимер пептида класса 4, выбранного из группы, состоящей из SEQ ID NO: 1309, SEQ ID NO: 1311 и SEQ ID NO: 1312, где пептид дополнительно содержит полиэтиленгликольную цепь, ковалентно связанную с положением 11 или 19 глюкагонового пептида.
Родственный глюкагону пептид класса 4 может содержать аминокислотную последовательность любой из SEQ ID NO: 1301-1371, необязательно с вплоть до 1, 2, 3, 4 или 5 дополнительными модификациями, которые сохраняют глюкагоновую антагонистическую активность.
Родственные глюкагону пептиды класса 5
В определенных вариантах осуществления родственный глюкагону пептид представляет собой родственный глюкагону пептид класса 5 (см., например, опубликованную международную патентную заявку (PCT) WO 2009/058734, включенную в настоящем изобретении с помощью ссылки во всей своей полноте).
Все биологические последовательности, приведенные в следующем параграфе (SEQ ID NO: 1401-1518) соответствуют SEQ ID NO: 1-118 в опубликованной международной патентной заявке WO 2009/058734.
Активность
В определенных аспектах родственный глюкагону пептид класса 5 (называемый в настоящем изобретении "пептид класса 5") может представлять собой глюкагоновый антагонист/GLP-1 агонист. Глюкагоновые антагонисты/GLP-1 агонисты применяют в любых случаях, когда необходимо подавление глюкагонового агонизма при необходимости также одновременной стимуляции GLP-1 активности. Например, глюкагоновую антагонистическую активность в сочетании с GLP-1 стимуляцией можно применять при лечении диабета, когда продемонстрировано, что глюкагоновый антагонизм в преклинических моделях гипергликемии приводит к снижению глюкозы в крови, и GLP-1 активность связана с синтезом инсулина. Также известно, что соединения, проявляющие GLP-1 активность, являются пригодными для лечения ожирения и предотвращения набора веса.
В определенных аспектах считают, что пептиды класса 5 являются подходящими для любого применения, которое описывалось ранее для других глюкагонового антагониста/GLP-1 агонистов. Отдельно было показано, что данные две активности представляют собой крайне желательные свойства для лечения метаболического синдрома, в частности, диабета и ожирения. Глюкагоновая антагонистическая активность является пригодной в любом случае, когда желательно подавление глюкагонового агонизма. Наличие GLP-1 агонизма дополнительно подавляет эндогенную секрецию глюкагона из поджелудочной железы, стимулируя синтез и секрецию инсулина. Данные две фармакологические активности служат синергическим способом для нормализации метаболических нарушений. Соответственно, пептиды класса 5 можно применять для лечения гипергликемии или лечения других метаболических заболеваний, которые являются результатом высокой концентрации глюкагона в крови или высокой концентрации глюкозы в крови. В соответствии с некоторыми вариантами осуществления пациент, которого будут лечить, применяя глюкагоновый антагонист/GLP-1 агонисты, такие как пептиды класса 5, описанные в настоящем изобретении, является домашним животным, и в другом варианте осуществления пациент, которого будут лечить, является человеком. Исследования приводят к выводу, что недостаток подавления глюкагона у пациентов с диабетом способствует постпрандиальной гипергликемии частично ускоренным гликогенолизом. Анализы глюкозы в крови в процессе перорального теста на толерантность к глюкозе (OGTT) и в присутствии или отсутствие подавления глюкагона, вызванного соматостатином, показали значительное повышение концентрации глюкозы у субъектов с большими концентрациями глюкагона. Соответственно, глюкагоновый антагонист/GLP-1 агонисты пептидов класса 5, описанных в настоящем изобретении, можно применять для лечения гипергликемии, и ожидается, что они будут пригодны для лечения ряда типов диабета, включая сахарный диабет типа I, сахарный диабет типа II, или гестационный диабет, или инсулинозависимый или инсулиннезависимый, и облегчения осложнений диабета, включая нефропатию, ретинопатию и сосудистое заболевание.
Ожидают, что данные способы снижения аппетита или стимулирования потери веса будут пригодны для снижения веса тела, предотвращения набора веса или лечения ожирения, вызванного различными причинами, включая ожирение, вызванное приемом лекарственных средств, и облегчения осложнений, связанных с ожирением, включая сосудистые заболевания (ишемическую болезнь сердца, инсульт, заболевание периферических сосудов, ишемическую реперфузию т.д.), гипертензию, возникновение диабета типа II, гиперлипидемию и скелетно-мышечные заболевания.
Фармацевтические композиции, содержащие пептиды класса 5, можно формулировать и вводить пациентам, применяя стандартные фармацевтически приемлемые носители и пути введения, известные специалистам в данной области техники. Соответственно, настоящее описание также включает фармацевтические композиции, содержащие один или более пептидов класса 5, описанные в настоящем изобретении, в комбинации с фармацевтически приемлемым носителем. Фармацевтические композицию могут содержать пептиды класса 5 в качестве единственного фармацевтически активного компонента, или пептиды класса 5 можно комбинировать с одним или более дополнительными активными агентами. В соответствии с некоторыми вариантами осуществления обеспечивают композицию, содержащую пептид класса 5 и инсулин или инсулиновый аналог. Альтернативно, обеспечивают композицию для стимулирования потери веса или предотвращения набора веса, которая содержит последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451, дополнительно содержащую аминокислотную последовательность SEQ ID NO: 1421 (GPSSGAPPPS) или SEQ ID NO: 1450, соединенную с аминокислотой 24 SEQ ID NO: 1415 или SEQ ID NO: 1451, и пептид против ожирения. Подходящие пептиды против ожирения включают пептиды, описанные в патентах США 5691309, 6436435 или патентной заявке США 20050176643.
Структура пептида класса 5
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 5, содержащий глюкагоновый пептид, который модифицирован делецией первых 1-5 аминокислотных остатков (например, первой аминокислоты, первых двух аминокислот, первых трех аминокислот, первых четырех аминокислот, первых пяти аминокислот) с N-конца, и альфа-спиральная структура в C-концевой части соединения стабилизирована (в районе аминокислотных положений 12-29 согласно нумерации аминокислот глюкагона дикого типа, SEQ ID NO: 1401), например, соединением боковых цепей аминокислотных пар, выбранных из положения 12 и 16, 16 и 20, 20 и 24, и 24 и 28 (по сравнению с последовательностью нативного глюкагонового пептида), друг с другом водородными связями или ионными взаимодействиями, такими как образование солевых мостиков или ковалентными связями. Альтернативно, стабилизация альфа-спирали в районе остатков 12-29 достигается введением одной или более α,α-дизамещенных аминокислот в положениях, которые сохраняют требуемую активность. В некоторых вариантах осуществления одно, две, три, четыре или более положений 16, 17, 18, 19, 20, 21, 24 или 29 (согласно нумерации аминокислот глюкагона дикого типа) пептида класса 5 или его аналога заменены α,α-дизамещенной аминокислотой. Например, замену положения 16 (согласно нумерации аминокислот глюкагона дикого типа) пептида класса 5 или его аналога аминоизомасляной кислотой (Aib) обеспечивают стабилизированной альфа-спиралью в отсутствии солевого мостика или лактама. В некоторых вариантах осуществления одно, два, три или более положений 16, 20, 21 или 24 (согласно нумерации аминокислот глюкагона дикого типа) заменены Aib.
В соответствии с некоторыми вариантами осуществления, обеспечивают пептид класса 5, где пептид обладает по меньшей мере 80% максимального агонизма, достигаемого нативным GLP-1 относительно GLP-1 рецептора, и обладает глюкагоновой антагонистической активностью, которая снижает максимальное цАМФ генерирование, вызванное глюкагоном, относительно глюкагонового рецептора на по меньшей мере приблизительно 50%, как измерено цАМФ генерированием в in vitro анализе. В некоторых вариантах осуществления пептид класса 5 обладает по меньшей мере 90% активности нативного GLP-1 относительно GLP-1 рецептора, и обладает глюкагоновой антагонистической активностью, которая снижает максимальное цАМФ генерирование, вызванное глюкагоном, относительно глюкагонового рецептора по меньшей мере на приблизительно 80%.
В соответствии с некоторыми вариантами осуществления пептид класса 5 включает производное пептида SEQ ID NO: 1402, где пептид содержит дополнительные аминокислотные замены по сравнению с SEQ ID NO: 1402 в одном-трех аминокислотных положениях, выбранных из положения 1, 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 19, 22 и 24, и обладает по меньшей мере 90% активности нативного GLP-1 относительно GLP-1 рецептора, и обладает глюкагоновой антагонистической активностью, которая снижает максимальное цАМФ генерирование, вызванное глюкагоном, относительно глюкагонового рецептора, по меньшей мере на приблизительно 80%.
В некоторых вариантах осуществления альфа-спиральную структуру в C-концевой части пептида класса 5 (в районе аминокислот 12-29 согласно нумерации аминокислот глюкагона дикого типа) стабилизируют, например, образованием ковалентной или нековалентной внутримолекулярной мостиковой связи, или заменой и/или вставкой в районе положений 12-29 аминокислоты, стабилизирующей альфа-спираль (например, α,α-дизамещенной аминокислоты). В некоторых вариантах осуществления одно, два, три, четыре или более положений 16, 17, 18, 19, 20, 21, 24 или 29 (согласно нумерации аминокислот глюкагона дикого типа) пептида класса 5 или его аналога заменены α,α-дизамещенной аминокислотой, например, аминоизомасляной кислотой (Aib). Например, замена положения 16 (согласно нумерации аминокислот глюкагона дикого типа) пептида класса 5 или его аналога аминоизомасляной кислотой (Aib) дает стабилизированную альфа-спираль в отсутствие солевого мостика или лактама.
В некоторых вариантах осуществления пептид класса 5 содержит SEQ ID NO: 1415 или SEQ ID NO: 1451, и более конкретно, последовательность, выбранную из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407, SEQ ID NO: 1408, SEQ ID NO: 1409, SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418, SEQ ID NO: 1419, SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO: 1424 и SEQ ID NO: 1425. В дополнительных вариантах осуществления пептид класса 5 содержит производный пептид SEQ ID NO: 1415 или SEQ ID NO: 1451, где пептид содержит дополнительную аминокислотную замену по сравнению с SEQ ID NO: 1415 или SEQ ID NO: 1451 в одном-трех аминокислотных положениях, выбранных из положения 1, 2, 5, 6, 8, 9, 12, 13 и 14. В некоторых вариантах осуществления замены в положениях 1, 2, 5, 6, 8, 9, 12, 13 и 14 представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления треонин в положении 24 SEQ ID NO: 1405 или SEQ ID NO: 1406 заменен глицином.
Согласно некоторым вариантам осуществления пептид класса 5 представляет собой дополнительную модификацию пептида, где в добавление к N-концевой делеции, модифицируют фенилаланин в положении 6 нативного глюкагонового пептида, например, так, чтобы он содержал гидроксильную группу вместо N-концевой аминогруппы. В следующем варианте осуществления природная карбоксильная группа C-концевой аминокислоты заменена нейтрально заряженной группой, такой как амид или эфир.
В соответствии с некоторыми вариантами осуществления получали пептиды класса 5, где первые три-пять аминокислот нативного глюкагона удалены, аминокислота в положении 9, по сравнению с нативным глюкагоновым пептидом, заменена аминокислотой, выбранной из группы, состоящей из глютаминовой кислоты, гомоглютаминовой кислоты, п-гомоглютаминовой кислоты, сульфопроизводного цистеина или алкилкарбоксилатным производным цистеина, имеющим структуру:

где X5 представляет собой C1-C4 алкил, C2-C4 алкенил или C2-C4 алкинил, и альфа-спиральная структура в C-концевой части глюкагона (в районе аминокислот 12-29 согласно нумерации аминокислот глюкагона дикого типа) стабилизирована, например, лактамной мостиковой связью, которая образована между боковыми цепями аминокислот 12 и 16 или между аминокислотами 16 и 20, по сравнению с нативным глюкагоновым пептидом. Примеры аминокислотных пар, которые способны образовывать ковалентные связи, давая семиатомный линкерный мостик, подробно описаны в данном описании. В некоторых вариантах осуществления сульфопроизводное цистеина представляет собой цистеиновую кислоту или гомоцистеиновую кислоту.
В некоторых вариантах осуществления обеспечивают пептид класса 5, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408, где указанный пептид содержит лактамное кольцо, образованное между боковыми цепями аминокислот 7 и 11 для SEQ ID NO: 1405, между 11 и 15 для SEQ ID NO: 1406, между положениями 15 и 19 для SEQ ID NO: 1407 и между положениями 19 и 24 для SEQ ID NO: 1408, причем каждая из указанных последовательностей дополнительно модифицирована так, чтобы она содержала гидрофильную группу, ковалентно связанную с пептидом. Более конкретно, в некоторых вариантах осуществления каждый из пептида класса 5, содержащего лактам, модифицирован ковалентным присоединением полиэтиленгликольной цепи. Например, что касается пептида класса 5, содержащего SEQ ID NO: 1405, пептид пегилирован в положении, выбранном из группы, состоящей из 12, 15, 16, 19 и 24; что касается пептида класса 5, содержащего SEQ ID NO: 1406, пептид пегилирован в положении, выбранном из группы, состоящей из 12, 16, 19 и 24; что касается пептида класса 5, содержащего SEQ ID NO: 1407, пептид пегилирован в положении, выбранном из группы, состоящей из 11, 12, 16 и 24; что касается пептида класса 5, содержащего SEQ ID NO: 1408, пептид пегилирован в положении, выбранном из группы, состоящей из 11, 12, 15 и 16. В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 5, содержащий SEQ ID NO: 1447 или SEQ ID NO: 1448, где пептид пегилирован в положении, выбранном из группы, состоящей из 12, 16, 19 и 24, по сравнению с SEQ ID NO: 1447 или SEQ ID NO: 1448 последовательностью. В следующем варианте осуществления пептид SEQ ID NO: 1447 или SEQ ID NO: 1448 дополнительно модифицирован присоединением последовательности SEQ ID NO: 1421 к карбокси концу пептида.
Как подробно описано выше в определенных аспектах обеспечивают пептиды класса 5, где первые пять аминокислот нативного глюкагона удалены, аминогруппа N-концевой аминокислоты (фенилаланин) замещена гидроксильной группой (т.е. первая аминокислота представляет собой фенилмолочную кислоту) и боковые цепи одной или более аминокислотных пар, выбранных из положения 12 и 16, 16 и 20, 20 и 24, и 24 и 28, соединены друг с другом, таким образом, стабилизируя альфа-спираль пептида класса 5.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 5, содержащий последовательность SEQ ID NO: 1402, которую модифицируют заменой серинового остатка в положении 11 SEQ ID NO: 1402 (положение 16 согласно нумерации аминокислот нативного глюкагона) аминокислотой, выбранной из группы, состоящей из глютаминовой кислоты, глютамина, гомоглютаминовой кислоты, гомоцистеиновой кислоты, треонина или глицина. В соответствии с некоторыми вариантами осуществления сериновый остаток в положении 11 SEQ ID NO: 1402 заменен аминокислотой, выбранной из группы, состоящей из глютаминовой кислоты, глютамина, гомоглютаминовой кислоты и гомоцистеиновой кислоты, и в некоторых вариантах осуществления сериновый остаток заменен глютаминовой кислотой. В соответствии с некоторыми вариантами осуществления пептид класса 5 содержит последовательность SEQ ID NO: 1438.
В некоторых вариантах осуществления обеспечивают пептид класса 5, где внутримолекулярная мостиковая связь образуется между двумя аминокислотами боковых цепей, стабилизируя трехмерную структуру карбокси конца пептида SEQ ID NO: 1402. Более конкретно, боковые цепи одной или более аминокислот, выбранных из аминокислотных пар 7 и 11, 11 и 15, 15 и 19 или 19 и 23 SEQ ID NO: 1402, соединены друг с другом, таким образом, стабилизируя альфа-спираль в C-концевой части. Две боковые цепи могут быть соединены друг с другом водородными связями, ионными взаимодействиями (такими как образование солевых мостиков) или ковалентными связями. В соответствии с некоторыми вариантами осуществления размер линкера составляет 7-9 атомов, и в некоторых вариантах осуществления размер линкера составляет 8 атомов. В некоторых вариантах осуществления пептид класса 5 выбран из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 и SEQ ID NO: 1408. В некоторых вариантах осуществления C-концевая аминокислота пептида класса 5 содержит амидную группу, заместившую карбоксильную группу, которая присутствует в нативной аминокислоте.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 5, где аналог содержит аминокислотную последовательность SEQ ID NO: 1409. В некоторых вариантах осуществления трехмерная структура карбокси конца пептида SEQ ID NO: 1409 стабилизирована образованием ковалентных связей между боковыми цепями пептида. В некоторых вариантах осуществления две боковые цепи аминокислот соединены друг с другом, образуя лактамное кольцо. Размер лактамного кольца может изменяться в зависимости от длины боковых цепей аминокислот, и в некоторых вариантах осуществления лактам образуется соединением боковых цепей лизиновой аминокислоты с боковой цепью глютаминовой кислоты. В некоторых вариантах осуществления C-концевая аминокислота пептидов класса 5 содержит амидную группу, заместившую карбоксильную группу, которая присутствует в нативной аминокислоте.
Порядок амидной связи в лактамном кольце можно обратить (например, лактамное кольцо может образовываться между боковыми цепями Lys12 и Glu16 или альтернативно между Glu12 и Lys16). В соответствии с некоторыми вариантами осуществления обеспечивают глюкагоновый аналог SEQ ID NO: 1409, где по меньшей мере одно лактамное кольцо образуется между боковыми цепями аминокислотной пары, выбранной из группы, состоящей из аминокислотных пар 7 и 11, 11 и 15, 15 и 19 или 19 и 23 SEQ ID NO: 1409. В некоторых вариантах осуществления обеспечивают пептид класса 5, где пептид содержит последовательность SEQ ID NO: 1410, причем указанная последовательность дополнительно содержит внутримолекулярную лактамную мостиковую связь, образованную между аминокислотными положениями 7 и 11, или между аминокислотными положениями 11 и 15, или между аминокислотными положениями 15 и 19 SEQ ID NO: 1410. В некоторых вариантах осуществления обеспечивают пептид класса 5, где пептид содержит последовательность SEQ ID NO: 1411, причем указанная последовательность дополнительно содержит внутримолекулярную лактамную мостиковую связь, образованную между аминокислотными положениями 7 и 11 или между аминокислотными положениями 11 и 15 SEQ ID NO: 1411. В некоторых вариантах осуществления пептид класса 5 содержит последовательность SEQ ID NO: 1417.
Обеспечивают дополнительный пептид класса 5, включая производные SEQ ID NO: 1405, где аспарагиновая кислота в положении 10 SEQ ID NO: 1405 (положение 15 нативного глюкагона) заменена глютаминовой кислотой, аминокислотой общей формулы:
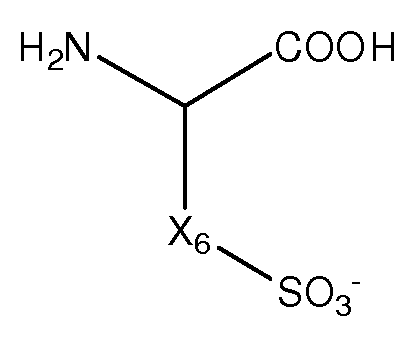
где X6 представляет собой C1-C3 алкил, C2-C3 алкенил или C2-C3 алкинил, и в некоторых вариантах осуществления X6 представляет собой C1-C3 алкил, и в другом варианте осуществления X6 представляет собой C2 алкил. В некоторых вариантах осуществления обеспечивают производное пептида класса 5 SEQ ID NO: 1409, где положение 10 SEQ ID NO: 1409 (положение 15 нативного глюкагона) заменено аминокислотой, выбранной из группы, состоящей из глютаминовой кислоты, цистеиновой кислоты, гомоцистеиновой кислоты и гомоглютаминовой кислоты. В следующем варианте осуществления положение 10 SEQ ID NO: 1409 заменено аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты или гомоцистеиновой кислоты. В некоторых вариантах осуществления обеспечивают производное пептида класса 5 SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408, где положение 10 SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408 заменено аминокислотой, выбранной из группы, состоящей из глютаминовой кислоты, цистеиновой кислоты, гомоцистеиновой кислоты и гомоглютаминовой кислоты. В некоторых вариантах осуществления C-концевая аминокислота пептида класса 5 содержит амидную группу, заместившую карбоксильную группу, которая присутствует в нативной аминокислоте.
В некоторых вариантах осуществления аминокислота пептида класса 5 заменена по меньшей мере одним цистеиновым остатком, где боковая цепь цистеинового остатка дополнительно модифицирована реакционноспособным по отношению к тиолу реагентом, включая, например, малеимидо, винилсульфон, 2-пиридилтио, галогеналкил и галогенацил. Данные реакционноспособные по отношению к тиолу реагенты могут содержать карбокси, кето, гидроксильную и эфирную группы, а также другие гидрофильные группы, такие как полиэтиленгликольные группы. В альтернативном варианте осуществления аминокислота пептида класса 5 заменена лизином, и боковая цепь замещающего лизинового остатка дополнительно модифицирована, применяя реакционноспособный реагент, такой как активные эфиры (сукцинимидо, ангидрид и т.д.) карбоновых кислот, или альдегиды гидрофильных молекул, таких как полиэтиленгликоль. В соответствии с некоторыми вариантами осуществления лизиновый остаток, соответствующий положению 7 пептида SEQ ID NO: 1405, заменен аргинином, и одну лизиновую замену осуществляют для одной из аминокислот, соответствующих положению 12, 15, 16, 19 и 24 SEQ ID NO: 1405.
В другом варианте осуществления метиониновый остаток, соответствующий положению 22 пептидов класса 5, описанных в настоящем изобретении, заменен на лейцин или норлейцин для предотвращения окислительного разрушения пептида.
Кроме того, пептиды класса 5, в некоторых аспектах, также содержат аминокислотные замены в положениях, о которых известно, что они не являются важными для функционирования глюкагонового аналога. В некоторых вариантах осуществления замены представляют собой консервативные аминокислотные замены в одном, двух или трех положениях, выбранных из группы, состоящей из 2, 5, 6, 7, 8, 9, 12, 13, 14, 15, 16, 19, 22, 23 или 24. В некоторых вариантах осуществления аминокислоты, соответствующие положениям 16, 17, 20, 21, 24 или 29 нативного глюкагонового пептида, и более конкретно в положении 21 и/или 24 по сравнению с нативным глюкагоном, замещают цистеином или лизином, где PEG цепь ковалентно связана с заменяющим цистеиновым или лизиновым остатком.
В соответствии с некоторыми вариантами осуществления, обеспечивают пептид класса 5, содержащий последовательность, состоящую из SEQ ID NO: 1409, дополнительно модифицированную одной или более дополнительными аминокислотными заменами в положениях, соответствующих положениям 11, 12, 15, 16, 19 и/или 24 пептида (включая, например, замену цистеином), где аминокислотная замена включает аминокислоту, содержащую боковую цепь, подходящую для образования поперечной связи с гидрофильными группами, включая, например, PEG. Нативный глюкагон может быть заменен встречающейся в природе аминокислотой или синтетической (не встречающейся в природе) аминокислотой. Синтетические или не встречающиеся в природе аминокислоты относятся к аминокислотам, которые не встречаются in vivo, но которые, тем не менее, можно вводить в пептидные структуры, описанные в настоящем изобретении. В некоторых вариантах осуществления обеспечивают пептид класса 5, где пептид содержит последовательность SEQ ID NO: 1409 и дополнительно содержит полиэтиленгликольную цепь, соединенную с положением 16 или 19 пептида. В следующем варианте осуществления C-конец глюкагонового аналога модифицируют, замещая карбоксильную группу амидной группой.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 5, включая глюкагоновый аналог, выбранный из группы, состоящей из:
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Lys-Tyr-Leu-Xaa-Glu-Arg-Arg-Ala-Gln-Asp-Phc-Val-Gln-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1439)
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Xaa-Phe-Val-Gln-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1413),
R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Xaa-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1414) и R1-Phe-Thr-Ser-Xaa-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Xaa-Phe-Val-Xaa-Trp-Leu-Xaa-Asn-Thr-R2 (SEQ ID NO: 1412),
где Xaa в положении 4 представляет собой аспарагиновую кислоту, глютаминовую кислоту, цистеиновую кислоту или гомоцистеиновую кислоту, Xaa в положении 10 представляет собой Asp, Glu, цистеиновую кислоту, гомоглютаминовую кислоту и гомоцистеиновую кислоту, Xaa в положении 16 представляет собой Asp, Cys, Orn, гомоцистеин или ацетилфенилаланин, и Xaa в положении 19 представляет собой Gln, Cys, Orn, гомоцистеин и ацетилфенилаланин, Xaa в положении 22 представляет собой Met, Leu или Nle, R1 представляет собой OH или NH2, и R2 представляет собой Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser (SEQ ID NO: 1421), Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser Xaa (SEQ ID NO: 1450; где Xaa представляет собой Cys, Orn, гомоцистеин или ацетилфенилаланин), COOH или CONH2, где пептид необязательно пегилирован в положении 16 SEQ ID NO: 1413, в положении 19 SEQ ID NO: 1414 и в положениях 16 и 19 SEQ ID NO: 1412. В некоторых вариантах осуществления Thr в положении 24 SEQ ID NO: 1412-1414 и 1439 заменен Gly. В соответствии с некоторыми вариантами осуществления пептид содержит последовательность SEQ ID NO: 13 или SEQ ID NO: 1414, где R1 представляет собой OH. В соответствии с некоторыми вариантами осуществления пептид содержит последовательность SEQ ID NO: 1413 или SEQ ID NO: 1414, где R1 представляет собой OH, и R2 представляет собой CONH2. В соответствии с некоторыми вариантами осуществления пептид содержит последовательность SEQ ID NO: 1413 или SEQ ID NO: 1414, где R1 представляет собой OH, R2 представляет собой CONH2, и треонин в положении 24 заменен глицином.
В некоторых вариантах осуществления пептид класса 5 дополнительно модифицирован так, чтобы он содержал одну или более аминокислот нативного GLP-1 заменой остатка(-ов) нативного глюкагона в соответствующих аминокислотных положениях. Например, пептид класса 5 может содержать одну или более аминокислотные замены в любом положении 2, 3, 17, 18, 21, 23, и 24 (согласно нумерации аминокислот нативного глюкагона). В конкретном варианте осуществления пептид класса 5 модифицируют одной или более из следующих аминокислотных замен: Ser2 заменен Ala, Gln3 заменен Glu, Arg17 заменен Gln, Arg в положении 18 заменен Ala, Asp в положении 21 заменен Glu, Val в положении 23 заменен Ile, и Gln в положении 24 заменен Ala (аминокислотные положения соответствуют последовательности нативного глюкагона). В конкретном варианте осуществления пептид класса 5 модифицируют заменой Ser2 Ala и Gln3 Glu (согласно нумерации аминокислот нативного глюкагона). В другом конкретном варианте осуществления, пептид класса 5 модифицируют всеми из следующих аминокислотных замен: Arg 17 заменен Gln, Arg в положении 18 заменен Ala, Asp в положении 21 заменен Glu, Val в положении 23 заменен Ile, и Gln в положении 24 заменен Ala (аминокислотная нумерация согласно нативному глюкагону). В еще другом конкретном варианте осуществления, пептид класса 5 модифицируют так, чтобы он содержал только Glu в положении 21 (согласно нумерации SEQ ID NO: 1401). Соответственно, пептид класса 5 может содержать аминокислотную последовательность любой из SEQ ID NO: 1460-1470, 1473-1478,1480-1488, 1490-1496, 1503, 1504, 1506 и 1514-1518.
Настоящее изобретение также относится к пептиду класса 5 или его конъюгату, содержащему (1) альфа-спираль, стабилизированную способами, описанными в настоящем изобретении, (например, внутримолекулярной мостиковой связью или введением одной или более альфа,альфа-дизамещенных аминокислот или кислой аминокислоты в положении 16 (согласно нумерации SEQ ID NO: 1401), или их комбинацией; (2) C-концевой амид или сложный эфир вместо C-концевого карбоксилата, и (3) общую структуру A-B-C,
где A выбран из группы, состоящей из:
(i) фенилмолочной кислоты (PLA);
(ii) оксипроизводного PLA; и
(iii) пептида из 2-6 аминокислот, в котором две последовательные аминокислоты пептида соединены сложноэфирной или эфирной связью;
где B представляет собой аминокислоты p-26 SEQ ID NO: 1401, где p равно 3, 4, 5, 6 или 7, необязательно содержащие одну или более аминокислотных модификаций, как описано в настоящем изобретении, включая, например, любую из модификаций, описанных для пептидов класса 5. Например, одну или более модификаций можно выбрать из группы, состоящей из:
(iv) Asp в положении 9 (согласно нумерации аминокислот SEQ ID NO: 1401) заменен Glu, сульфопроизводным Cys, гомоглютаминовой кислотой, β-гомоглютаминовой кислотой или алкилкарбоксилатным производным цистеина, имеющим структуру:

где X5 представляет собой C1-C4 алкил, C2-C4 алкенил или C2-C4 алкинил;
(v) замены одной или двух аминокислот в положениях 10, 20 и 24, (согласно нумерации аминокислот SEQ ID NO: 1401) аминокислотой, ковалентно присоединена к ацильной или алкильной группе сложноэфирной, эфирной, тиоэфирной, амидной или алкиламиновой связью;
(vi) замены одной или двух аминокислот в положениях 16, 17, 20, 21 и 24 (согласно нумерации аминокислот SEQ ID NO: 1401) аминокислотой, выбранной из группы, состоящей из: Cys, Lys, орнитина, гомоцистеина и ацетилфенилаланина (Ac-Phe), где аминокислота группы ковалентно связана с гидрофильной группой;
(vii) Asp в положении 15 (согласно нумерации SEQ ID NO: 1401) заменен цистеиновой кислотой, глютаминовой кислотой, гомоглютаминовой кислотой и гомоцистеиновой кислотой;
(viii) Ser в положении 16 (согласно нумерации SEQ ID NO: 1401) заменен цистеиновой кислотой, глютаминовой кислотой, гомоглютаминовой кислотой и гомоцистеиновой кислотой;
(ix) Arg в положении 17 заменен Gln, Arg в положении 18 заменен Ala, Asp в положении 21 заменен Glu, Val в положении 23 заменен Ile, и Gln в положении 24 заменен Ala (согласно нумерации аминокислот SEQ ID NO: 1401);
(x) Ser в положении 16 заменен Glu, Gln в положении 20 заменен Glu, или Gln в положении 24 заменен Glu (согласно нумерации аминокислот SEQ ID NO: 1401);
где C (общей структуры A-B-C) выбран из группы, состоящей из:
(vii) X;
(viii) X-Y;
(ix) X-Y-Z;
(x) X-Y-Z-R10;
где X представляет собой Met, Leu или Nle; Y представляет собой Asn или заряженную аминокислоту; Z представляет собой Thr, Gly, Cys, Lys, орнитин (Orn), гомоцистеин, ацетилфенилаланин (Ac-Phe) или заряженную аминокислоту; где R10 выбран из группы, состоящей из SEQ ID NO: 1421, 1426, 1427 и 1450.
В конкретном аспекте, пептид содержит оксипроизводное PLA. Как применяют в настоящем изобретении, "оксипроизводное PLA" относится к соединению, содержащему модифицированную структуру PLA, в которой гидроксильная группа замещена O-R11, где R11 представляет собой химическую группу. В связи с этим, оксопроизводное PLA может представлять собой, например, сложный эфир PLA или простой эфир PLA.
Способы получения оксипроизводных PLA являются известными в данной области техники. Например, когда оксипроизводное представляет собой сложный эфир PLA, сложный эфир можно получить реакцией гидроксила PLA с карбонилом, несущим нуклеофил. Нуклеофил может представлять собой любой подходящий нуклеофил, включая, но не ограничиваясь этим, амин или гидроксил. Соответственно, сложный эфир PLA может содержать структуру формулы IV

формула IV
где R7 представляет собой сложный эфир, образовавшийся реакцией гидроксила PLA с карбонилом, несущим нуклеофил.
Карбонил, несущий нуклеофил (который реагирует с гидроксилом PLA, образуя сложный эфир) может представлять собой, например, карбоновую кислоту, производное карбоновой кислоты или активированный эфир карбоновой кислоты. Производное карбоновой кислоты может представлять собой, но не ограничиваясь этим, хлорангидрид кислоты, ангидрид кислоты, амид, сложный эфир или нитрил. Активированный эфир карбоновой кислоты может представлять собой, например, N-гидроксисукцинимид (NHS), тозилат (Tos), карбодиимид или гексафторфосфат. В некоторых вариантах осуществления карбодиимид представляет собой 1,3-дициклогексилкарбодиимид (DCC), 1,1'-карбонилдиимидазол (CDI), 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид (EDC) или 1,3-диизопропилкарбодиимид (DICD). В некоторых вариантах осуществления гексафторфосфат выбран из группы, состоящей из гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония (BOP), гексафторфосфата бензотриазол-1-илокситрипирролидинофосфония (PyBOP), гексафторфосфата 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) и гексафторфосфата o-бензотриазол-N,N,N',N'-тетраметилурония (HBTU).
Способы получения сложных эфиров реакцией с гидроксильной группой (например, гидроксилом PLA) также являются известными в данной области техники. Например, гидроксильная группа PLA может реагировать с галогенированным алкильным или тозилированным алкильным спиртом, образуя сложноэфирную связь.
В конкретном варианте осуществления химическая группа, соединенная с PLA связью, содержащей кислород (например, сложноэфирной или эфирной связью) представляет собой полимер (например, полиалкиленгликоль), углевод, аминокислоту, пептид или липид, например, жирную кислоту или стероид.
В конкретном варианте осуществления химическая группа представляет собой аминокислоту, которая необязательно представляет собой часть пептида, так что формула IV представляет собой депсипептид. В связи с этим, PLA может находиться в положении, отличном от N-концевого аминокислотного остатка пептида, так что пептид содержит одну или более (например, 1, 2, 3, 4, 5, 6 или более) аминокислот, N-концевых к PLA остатку. Например, пептид может содержать PLA в положении n, где n равен 2, 3, 4, 5 или 6 пептида.
Аминокислоты, N-концевые к PLA остатку, могут быть синтетическими или встречающимися в природе. В конкретном варианте осуществления аминокислоты, которые являются N-концевыми к PLA, представляют собой встречающиеся в природе аминокислоты. В некоторых вариантах осуществления аминокислоты, которые являются N-концевыми к PLA, представляют собой N-концевые аминокислоты нативного глюкагона. Например, пептид может содержать на N-конце аминокислотную последовательность любой из SEQ ID NO: 1452-1456, где PLA соединен с треонином сложноэфирной связью:
В альтернативном варианте осуществления, одна или более из N-концевых аминокислот может быть заменена аминокислотой, отличной от аминокислоты нативного глюкагона. Например, когда пептид содержит PLA в качестве аминокислоты в положении 5 или 6, аминокислота в положении 1 и/или положение 2 может представлять собой аминокислоту, которая снижает подверженность к расщеплению дипептидилпептидазой IV. Более конкретно, в некоторых вариантах осуществления положение 1 пептида представляет собой аминокислоту, выбранную из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах осуществления положение 2 антагонистического/агонистического пептида представляет собой аминокислоту, выбранную из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (Aib). Кроме того, например, когда пептид содержит PLA в качестве аминокислоты в положении 4, 5 или 6, аминокислота в положении 3 пептида может представлять собой глютаминовую кислоту, в отличие от нативного глютаминового остатка нативного глюкагона. В примерном варианте осуществления настоящего изобретения, пептид содержит на N-конце аминокислотную последовательность любой из SEQ ID NO: 1457-1459.
Относительно пептидов, содержащих соединение формулы IV, полимер может представлять собой любой полимер, при условии, что он реагирует с гидроксильной группой PLA. Полимер может представлять собой полимер, который естественно или обычно содержит карбонил, несущий нуклеофил. Альтернативно, полимер может представлять собой полимер, который модифицирован так, чтобы он содержал карбонил, несущий нуклеофил. Полимер может представлять собой модифицированный полимер любого из: полиамидов, поликарбонатов, полиалкиленов и их производных, включая полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, полимеров акриловых и метакриловых эфиров, включая поли(метилметакрилат), поли(этилметакрилат), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат), поливиниловых полимеров, включая поливиниловые спирты, поливиниловые эфиры, поливиниловые сложные эфиры, поливинилгалогениды, поли(винилацетат) и поливинилпирролидон, полигликолидов, полисилоксанов, полиуретанов и их сополимеров, целлюлоз, включая алкилцеллюлозу, гидроксиалкилцеллюлозы, эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксибутилметилцеллюлозу, ацетат целлюлозы, пропионат целлюлозы, ацетатбутират целлюлозы, ацетатфталат целлюлозы, карбоксилэтилцеллюлозу, триацетат целлюлозы и сульфатнатриевую соль целлюлозы, полипропилена, полиэтиленов, включая поли(этиленгликоль), поли(этиленоксид) и поли(этилентерефталат), и полистирола.
Полимер может представлять собой биоразлагаемый полимер, включая синтетический биоразлагаемый полимер (например, полимеры молочной кислоты и гликолевой кислоты, полиангидриды, поли(орто)эфиры, полиуретаны, поли(масляную кислоту), поли(валерьяновую кислоту) и поли(лактид-сокапролактон)), и природный биоразлагаемый полимер (например, альгинат и другие полисахариды, включая декстран и целлюлозу, коллаген, их химические производные (замещения, присоединения химических групп, например, алкила, алкилена, гидроксилирование, окисление и другие модификации, обычно осуществляемые специалистами в данной области техники), альбумин и другие гидрофильные белки (например, зеин и другие проламины и гидрофобные белки), а также любой сополимер или их смесь. В общем, данные вещества разлагаются или ферментативным гидролизом или при воздействии воды in vivo, поверхностной или объемной эрозией.
В некоторых вариантах осуществления полимер представляет собой растворимый в воде полимер. Подходящие растворимые в воде полимеры являются известными в данной области техники и включают, например, поливинилпирролидон, гидроксипропилцеллюлозу (HPC; Klucel), гидроксипропилметилцеллюлозу (HPMC; Methocel), нитроцеллюлозу, гидроксипропилэтилцеллюлозу, гидроксипропилбутилцеллюлозу, гидроксипропилпентилцеллюлозу, метилцеллюлозу, этилцеллюлозу (Ethocel), гидроксиэтилцеллюлозу, различные алкилцеллюлозы и гидроксиалкилцеллюлозы, различные эфиры целлюлозы, ацетат целлюлозы, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, сополимеры винилацетата/кротоновой кислоты, полигидроксиалкилметакрилат, гидроксиметилметакрилат, сополимеры метакриловой кислоты, полиметакриловую кислоту, полиметилметакрилат, сополимеры малеинового ангидрида/метилвинилового эфира, поливиниловый спирт, полиакриловую кислоту натрия и кальция, полиакриловую кислоту, кислые карбоксиполимеры, карбоксиполиметилен, карбоксивиниловые полимеры, полиоксиэтиленполиоксипропиленовый сополимер, сополимер полиметилвинилового эфира с малеиновым ангидридом, карбоксиметиламид, сополимер метакрилата калия и дивинилбензола, полиоксиэтиленгликоли, полиэтиленоксид и их производные, соли и комбинации.
В конкретном варианте осуществления полимер представляет собой полиалкиленгликоль, включая, например, полиэтиленгликоль (PEG).
Углевод может представлять собой любой углевод, при условии, что он содержит или получен так, что он содержит карбонил с альфа-уходящей группой. Углевод, например, может представлять собой углевод, который модифицирован так, чтобы он содержал карбонил с альфа-уходящей группой. В связи с этим, углевод может представлять собой модифицированную форму моносахарида (например, глюкозы, галактозы, фруктозы), дисахарида (например, сахарозы, лактозы, мальтозы), олигосахарида (например, рафинозы, стахиозы), полисахарида (крахмала, амилозы, амилопектина, целлюлозы, хитина, каллозы, ламинарина, ксилана, маннана, фукоидана, галактоманнана).
Липид может представлять собой любой липид, содержащий карбонил с альфа-уходящей группой. Липид, например, может представлять собой липид, который модифицируют так, чтобы он содержал карбонил. В связи с этим, липид может представлять собой производное жирной кислоты (например, C4-C30 жирной кислоты, эйкозаноида, простагландина, лейкотриена, тромбоксана, N-ацилэтаноламина), глицеролипида (например, моно-, ди-, три-замещенных глицеринов), глицерофосфолипида (например, фосфатидилхолина, фосфатидилинозитола, фосфатидилэтаноламина, фосфатидилсерина), сфинголипида (например, сфингозина, церамида), стерольного липида (например, стероида, холестерина), пренольного липида, сахаролипида или поликетида. В некоторых вариантах осуществления липид представляет собой масло, воск, холестерин, стерол, растворимый в воде витамин, моноглицерид, диглицерид, триглицерид, фосфолипид.
В некоторых вариантах осуществления R7 имеет молекулярный вес приблизительно 100 кДа или меньше, например, приблизительно 90 кДа или меньше, приблизительно 80 кДа или меньше, приблизительно 70 кДа или меньше, приблизительно 60 кДа или меньше, приблизительно 50 кДа или меньше, приблизительно 40 кДа или меньше. Соответственно, R7 может иметь молекулярный вес приблизительно 35 кДа или меньше, приблизительно 30 кДа или меньше, приблизительно 25 кДа или меньше, приблизительно 20 кДа или меньше, приблизительно 15 кДа или меньше, приблизительно 10 кДа или меньше, приблизительно 5 кДа или меньше, или приблизительно 1 кДа.
В альтернативном варианте осуществления пептид, содержащий общую структуру A-B-C, содержит, в качестве A пептид из 2-6 аминокислот, в котором две последовательные аминокислоты пептида соединены сложноэфирной или эфирной связью. Сложноэфирная или эфирная связь может находиться, например, между аминокислотами 2 и 3, 3 и 4, 4 и 5 или 5 и 6. Необязательно пептид может быть дополнительно модифицирован ковалентной связью с другой химической группой, включая связь с полимером (например, гидрофильным полимером), алкилированием или ацилированием.
В конкретном варианте осуществления описанный выше пептид класса 5, содержащий PLA, модифицируют так, чтобы он содержал оксипроизводное PLA, такое как, например, сложный эфир PLA или эфир PLA. Например, пептид класса 5 может содержать аминокислотную последовательность любой из SEQ ID NO: 1402, 1405-1420, 1422-1425, 1432-1436, 1438, 1439, 1445, 1446 и 1451, где PLA соединен сложноэфирной или эфирной связью с аминокислотой, пептидом, полимером, ацильной группой или алкильной группой. Аминокислота, пептид, полимер, ацильная группа или алкильная группа может представлять собой любые из тех, что описаны в настоящем изобретении. В случае, когда PLA соединен сложноэфирной связью с аминокислотой или пептидом, пептид класса 5 может считаться депсипептидом.
Кроме того, в другом конкретном варианте осуществления описанный выше пептид класса 5, который не содержит PLA, модифицируют так, чтобы он содержал по меньшей мере одну сложноэфирную или эфирную связь между двумя последовательными аминокислотами, которые являются N-концевыми к аминокислоте в положении 7 (согласно нумерации нативного глюкагона). В конкретном варианте осуществления пептид класса 5 содержит по меньшей мере одну сложноэфирную или эфирную связь между двумя последовательными аминокислотами. В более конкретном варианте осуществления пептид класса 5 содержит N-концевые 6 аминокислот SEQ ID NO: 1401 и две последовательные аминокислоты N-концевых 6 аминокислот соединены сложноэфирной или эфирной связью.
Пептид A может содержать любые аминокислоты, синтетические или встречающиеся в природе, при условии, что по меньшей мере две последовательные аминокислоты соединены сложноэфирной или эфирной связью. В конкретном варианте осуществления пептид A содержит аминокислоты нативного глюкагона. Аминокислота в положении 1 и/или положении 2 может представлять собой аминокислоту, которая снижает подверженность к расщеплению дипептидилпептидазой IV. Например, пептид A может содержать в положении 1 аминокислоту, выбранную из группы, состоящей из D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина. Более конкретно, в некоторых вариантах осуществления положение 2 пептида A представляет собой аминокислоту, выбранную из группы, состоящей из D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (Aib). Кроме того, например, аминокислота в положении 3 пептида A может представлять собой глютаминовую кислоту, в отличие от нативного глютаминового остатка нативного глюкагона. Соответственно, пептид общей структуры A-B-C может содержать аминокислотную последовательность:
Xaa1-Xaa2-Xaa3-Thr-Gly-Phe (SEQ ID NO: 1507);
Xaa2-Xaa3-Thr-Gly-Phe (SEQ ID NO: 1508); или
Xaa3-Thr-Gly-Phe (SEQ ID NO: 1509);
где Xaa1 выбран из группы, состоящей из: His, D-гистидина, альфа,альфа-диметилимидазолуксусной кислоты (DMIA), N-метилгистидина, альфа-метилгистидина, имидазолуксусной кислоты, дезаминогистидина, гидроксилгистидина, ацетилгистидина и гомогистидина; Xaa2 выбран из группы, состоящей из: Ser, D-серина, D-аланина, валина, глицина, N-метилсерина, N-метилаланина и аминоизомасляной кислоты (Aib); и Xaa3 представляет собой Gln или Glu.
В некоторых вариантах осуществления B модифицируют вплоть до трех аминокислотными модификациями. Например, B, который представляет собой нативную аминокислотную последовательность SEQ ID NO: 1401, модифицируют одной или более консервативными аминокислотными модификациями.
В другом варианте осуществления B содержит одну или более аминокислотных модификаций, выбранных из группы, состоящей из (iv)-(x), как описано в настоящем изобретении. В конкретном варианте осуществления B содержит одну или обе из аминокислотных модификаций (v) и (vi). В следующем конкретном варианте осуществления B содержит одну или комбинацию аминокислотных модификаций, выбранных из группы, состоящей из (iv), (vii), (viii), (ix) и (x), в добавление к (v) и (vi).
Как описано в настоящем изобретении, пептид, содержащий общую структуру A-B-C, может содержать одну или более заряженных аминокислот на C-конце, например, в качестве Y и/или Z, как описано в настоящем изобретении. Альтернативно или кроме того, пептид, содержащий общую структуру A-B-C, может дополнительно содержать одну-две заряженные аминокислоты, C-концевые к Z, когда C содержит X-Y-Z. Заряженные аминокислоты могут представлять собой, например, аминокислоту из Lys, Arg, His, Asp и Glu. В конкретном варианте осуществления Y представляет собой Asp.
В некоторых вариантах осуществления пептид, содержащий общую структуру A-B-C, содержит гидрофильную группу, ковалентно присоединенную к аминокислотному остатку в положении 1, 16, 20, 21 или 24 (согласно нумерации аминокислот SEQ ID NO: 1401), или к N- или C-концевому остатку пептида, содержащего общую структуру A-B-C. В конкретном варианте осуществления гидрофильную группу присоединяют к Cys остатку пептида, содержащего общую структуру A-B-C. В связи с этим, аминокислота в положении 16, 21, 24 или 29 нативного глюкагона (SEQ ID NO: 1401) может быть заменена Cys остатком. Альтернативно, Cys остаток, содержащий гидрофильную группу, можно присоединять к C-концу пептида, содержащего общую структуру A-B-C, в положении 30 или положении 40, например, когда пептид, содержащий общую структуру A-B-C, содержит C-концевое удлинение (положения согласно нумерации аминокислот SEQ ID NO: 1401). Альтернативно, гидрофильная группа может быть соединена с PLA пептида, содержащего общую структуру A-B-C, через гидроксильную группу PLA. Гидрофильная группа может быть любой из групп, описанных в настоящем изобретении, включая, например, полиэтиленгликоль.
В конкретном аспекте, пептид, содержащий общую структуру A-B-C, содержит альфа-спираль, стабилизированную введением внутримолекулярной мостиковой связи. В некоторых вариантах осуществления внутримолекулярная мостиковая связь представляет собой лактамную мостиковую связь. Лактамная мостиковая связь может находиться между аминокислотами в положениях 9 и 12, аминокислотами в положениях 12 и 16, аминокислотами в положениях 16 и 20, аминокислотами в положениях 20 и 24 или аминокислотами в положениях 24 и 28 (согласно нумерации аминокислот SEQ ID NO: 1401). В конкретном варианте осуществления аминокислоты в положениях 12 и 16 или в положениях 16 и 20 (согласно нумерации аминокислот SEQ ID NO: 1401) соединены лактамной мостиковой связью. Другие положения лактамной мостиковой связи являются предусмотренными.
Кроме того или альтернативно, пептид, содержащий общую структуру A-B-C, может содержать альфа,альфа-дизамещенную аминокислоту, например, в любом из положений 16, 20, 21 или 24 (согласно нумерации аминокислот SEQ ID NO: 1401). В некоторых вариантах осуществления альфа,альфа-дизамещенная аминокислота представляет собой Aib. В конкретном аспекте Aib находится в положении 16 (согласно нумерации SEQ ID NO: 1401).
Альтернативно или кроме того, пептид, содержащий общую структуру A-B-C, можно модифицировать так, чтобы он содержал кислую аминокислоту в положении 16 (согласно нумерации SEQ ID NO: 1401), где модификация увеличивает стабильность альфа-спирали. Кислая аминокислота, в некоторых вариантах осуществления представляет собой аминокислоту, содержащую в боковой цепи сульфокислоту или карбоновую кислоту. В более конкретном варианте осуществления кислая аминокислота выбрана из группы, состоящей из Glu, Asp, гомоглютаминовой кислоты, сульфопроизводного Cys, цистеиновой кислоты, гомоцистеиновой кислоты, Asp и алкилированного производного Cys, имеющего структуру

где X5 представляет собой C1-C4 алкил, C2-C4 алкенил или C2-C4 алкинил.
В конкретном варианте осуществления пептид класса 5 может содержать аминокислотную последовательность любой из SEQ ID NO: 1460-1470, 1473-1478, 1480-1488, 1490-1496, 1503, 1504, 1506, и 1514-1518, или содержать аминокислотную последовательность любого из пептидов 2-6 таблицы 13, пептидов 1-8 таблицы 14 и пептидов 2-6, 8 и 9 таблицы 15.
В некоторых вариантах осуществления пептид, содержащий общую структуру A-B-C, представляет собой пептид класса 5. В конкретном варианте осуществления пептид обладает по меньшей мере приблизительно 50% максимального агонизма, достигаемого нативным GLP-1 относительно GLP-1 рецептора, и по меньшей мере приблизительно 50% ингибированием максимальной ответной реакции, достигаемым нативным глюкагоном относительно глюкагонового рецептора. В другом конкретном варианте осуществления пептид обладает по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100% максимального агонизма, достигаемого нативным GLP-1 относительно GLP-1 рецептора. Альтернативно или кроме того, пептид может обладать по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100% ингибированием максимальной ответной реакции, достигаемой нативным глюкагоном относительно глюкагонового рецептора.
В некоторых вариантах осуществления обеспечивают пептид с пептидом класса 5 или его конъюгат, содержащий:
(1) модификации, которые придают глюкагоновую антагонистическую активность, включая, но не ограничиваясь:
(a) замену Phe в положении 6 PLA (согласно аминокислотной нумерации глюкагона дикого типа), необязательно с делецией 1-5 аминокислот с N-конца глюкагона дикого типа; или
(b) делецию 2-5 аминокислот с N-конца глюкагона дикого типа; необязательно с заменой Asp в положении 9 глюкагона дикого типа глютаминовой кислотой, гомоглютаминовой кислотой или сульфопроизводным цистеина (согласно аминокислотной нумерации глюкагона дикого типа); и
(2) модификации, которые придают GLP-1 агонистическую активность, включая, но не ограничиваясь:
(a) вставку или замену α,α-дизамещенной аминокислотой среди аминокислот 12-29 глюкагона дикого типа, например, в одном, двух, трех, четырех или более из положений 16, 17, 18, 19, 20, 21, 24 или 29 (согласно нумерации аминокислот глюкагона дикого типа); или
(b) введение внутримолекулярной мостиковой связи в районе аминокислот 12-29 глюкагона дикого типа, например, солевого мостика или лактамной мостиковой связи или другого типа ковалентной связи; и
(c) замену аминокислоты в одном или более положениях 2, 3, 17, 18, 21, 23 или 24 (согласно нумерации аминокислот нативного глюкагона) соответствующей аминокислотой GLP-1, например, Ser2 заменен Ala, Gln3 заменен Glu, Arg17 заменен Gln, Arg в положении 18 заменен Ala, Asp в положении 21 заменен Glu, Val в положении 23 заменен Ile, и/или Gln в положении 24 заменен Ala; или
(d) другие модификации, которые стабилизируют альфа-спиральную структуру в районе аминокислотных положений 12-29 согласно нумерации аминокислот глюкагона дикого типа; и
(3) другие модификации, которые увеличивают GLP-1 агонистическую активность, например, C-концевой амид или сложный эфир вместо C-концевого карбоксилата; и необязательно
(4) одну или более из следующих модификаций:
(a) ковалентное присоединение гидрофильной группой, такой как полиэтиленгликоль, например, на N-конце, или в положении 6, 16, 17, 20, 21, 24, 29, 40 или к C-концевой аминокислоте; и/или
(b) ацилирование или алкилирование; и необязательно
(5) одну или более из следующих дополнительных модификаций:
(a) ковалентное присоединение аминокислот к N-концу, например, 1-5 аминокислот к N-концу, необязательно через сложноэфирную связь к PLA в положении 6 (согласно нумерации глюкагона дикого типа), необязательно вместе с модификациями в положении 1 или 2, например, как описано в настоящем изобретении, которое увеличивает устойчивость к DPP-IV расщеплению;
(b) делеция аминокислоты в положениях 29 и/или 28, и необязательно положении 27 (согласно нумерации глюкагона дикого типа);
(c) ковалентное присоединение аминокислоты к C-концу;
(d) неконсервативные замены, консервативные замены, присоединения или делеции при сохранении требуемой активности, например, консервативные замены в одном или более из положений 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29, замена Tyr в положении 10 Val или Phe, замена Lys в положении 12 Arg, замена одного или более из данных положений Ala;
(e) модификация аспарагиновой кислоты в положении 15, например, заменой глютаминовой кислотой, гомоглютаминовой кислотой, цистеиновой кислотой или гомоцистеиновой кислотой, которая может снижать разрушение; или модификация серина в положении 16, например, заменой треонина, Aib, глютаминовой кислотой или другой отрицательно заряженной аминокислотой, содержащей боковую цепь с длиной 4 атома, или альтернативно любым одним из глютамина, гомоглютаминовой кислоты или гомоцистеиновой кислоты, которые аналогично могут снижать разрушение в результате расщепления Asp15-Ser16 связи;
(f) модификация метионина в положении 27, например, заменой лейцином или норлейцином, для снижения окислительного разрушения;
(g) модификация Gln в положении 20 или 24, например, заменой Ala или Aib, для снижения разрушения, которое протекает через дезамидирование Gln
(h) модификация Asp в положении 21, например, заменой Glu, для снижения разрушения, которое протекает через дегидратацию Asp, образуя циклическое сукцинимидное промежуточное соединение с последующей изомеризацией до изоаспартата;
(j) гомодимеризация или гетеродимеризация, как описано в настоящем изобретении; и
(k) комбинации указанных выше пунктов.
Ясно, что любую из модификаций в одном классе можно комбинировать вместе, и/или комбинируют модификации различных классов. Например, модификации (1)(a) можно комбинировать с (2)(a) и (3); (1)(a) можно комбинировать с (2)(b), например, лактамной мостиковой связью или солевой мостиковой связью, и (3); (1)(a) можно комбинировать с (2)(c) и (3); (1)(b) можно комбинировать с (2)(a) и (3); (1)(b) можно комбинировать с (2)(b), например, лактамной мостиковой связью или солевой мостиковой связью, и (3); (1)(b) можно комбинировать с (2)(c) и (3); любую из указанных выше можно комбинировать с (4)(a) и/или (4)(b); и любую из указанных выше можно комбинировать с любой из (5)(a)-(5)(k).
В примерных вариантах осуществления α,α-дизамещенная аминокислота Aib заменена в одном, двух, трех или всех из положений 16, 20, 21 или 24 (согласно нумерации аминокислот глюкагона дикого типа).
В примерных вариантах осуществления внутримолекулярная мостиковая связь представляет собой солевой мостик.
В других примерных вариантах осуществления внутримолекулярная мостиковая связь представляет собой ковалентную связь, например, лактамную мостиковую связь. В некоторых вариантах осуществления лактамная мостиковая связь образуется между аминокислотами в положениях 9 и 12, аминокислотами в положениях 12 и 16, аминокислотами в положениях 16 и 20, аминокислотами в положениях 20 и 24 или аминокислотами в положениях 24 и 28 (согласно нумерации аминокислот SEQ ID NO: 1401).
В примерных вариантах осуществления ацилирование или алкилирование осуществляют в положении 6, 10, 20 или 24 или на N-конце или C-конце (согласно нумерации аминокислот глюкагона дикого типа) SEQ ID NO: 1401.
В примерных вариантах осуществления модификации включают:
(i) замену Asp в положении 15 (согласно нумерации SEQ ID NO: 1401) цистеиновой кислотой, глютаминовой кислотой, гомоглютаминовой кислотой и гомоцистеиновой кислотой;
(ii) замену Ser в положении 16 (согласно нумерации SEQ ID NO: 1401) цистеиновой кислотой, глютаминовой кислотой, гомоглютаминовой кислотой и гомоцистеиновой кислотой;
(iii) замену Asn в положении 28 заряженной аминокислотой;
(iv) замену Asn в положении 28 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты;
(v) замену в положении 28 Asn, Asp или Glu;
(vi) замену в положении 28 Asp;
(vii) замену в положении 28 Glu;
(viii) замену Thr в положении 29 заряженной аминокислотой;
(ix) замену Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты;
(x) замену в положении 29 Asp, Glu или Lys;
(xi) замену в положении 29 Glu;
(xii) вставку 1-3 заряженных аминокислот после положения 29;
(xiii) вставку после положения 29 Glu или Lys;
(xiv) вставку после положения 29 Gly-Lys или Lys-Lys;
или их комбинацию.
Любую из модификаций, описанных выше, которая повышает GLP-1 рецепторную агонистическую активность, глюкагоновую рецепторную антагонистическую активность, растворимость пептида и/или стабильность пептида, можно применять отдельно или в комбинации.
Модификация, увеличивающая стабильность
В соответствии с некоторыми вариантами осуществления пептиды класса 5, описанные в настоящем изобретении, можно дополнительно модифицировать так, чтобы они содержали аминокислотную последовательность SEQ ID NO: 1421 (GPSSGAPPPS) или SEQ ID NO: 1450, соединенную с карбокси концевой аминокислотой (положение 24) пептида класса 5, и вводить индивидам, стимулируя потерю веса или способствуя поддержанию веса. Более конкретно, пептид класса 5, содержащий последовательность, выбранную из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407, SEQ ID NO: 1408, SEQ ID NO: 1409, SEQ ID NO: 1412, SEQ ID NO: 1413, SEQ ID NO: 1414, SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418, SEQ ID NO: 1419, SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO: 1424 и SEQ ID NO: 1425, и дополнительно содержащий аминокислотную последовательность SEQ ID NO: 1421 (GPSSGAPPPS) или SEQ ID NO: 1450, соединенную с карбокси концевой аминокислотой (положение 24) пептида или пептид класса 5, применяют для подавления аппетита и стимулирования потери веса/поддержания веса. В некоторых вариантах осуществления вводимый пептид или пептид класса 5 содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418 и SEQ ID NO: 1419, дополнительно содержащую аминокислотную последовательность SEQ ID NO: 1421 (GPSSGAPPPS), соединенную с карбокси концевой аминокислотой (положение 24) пептида класса 5. В некоторых вариантах осуществления способ включает введение пептида или пептида класса 5, содержащего последовательность SEQ ID NO: 1445 или SEQ ID NO: 1446.
Соответственно, ожидают, что пептиды класса 5, описанные в настоящем изобретении, можно аналогично модифицировать для снижения их подверженности преждевременному химическому расщеплению в водных буферах. В соответствии с некоторыми вариантами осуществления пептиды класса 5, описанные в настоящем изобретении, можно дополнительно модифицировать для повышения их стабильности в водных растворах заменой нативной аспарагиновой аминокислоты, находящейся в соответствующем положении 15 нативного глюкагона, аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты, глютаминовой кислоты, гомоглютаминовой кислоты и гомоцистеиновой кислоты. В соответствии с некоторыми вариантами осуществления остаток аспарагиновой кислоты в положении 10 пептида класса 5 SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408 может быть заменен аминокислотой, выбранной из группы, состоящей из цистеиновой кислоты, глютаминовой кислоты, гомоглютаминовой кислоты и гомоцистеиновой кислоты, и в некоторых вариантах осуществления нативная аспарагиновая кислота в положении 10 SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408 заменена глютаминовой кислотой. В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 5, обладающий повышенной стабильностью в водных растворах, где антагонист содержит модифицированную последовательность SEQ ID NO: 1409, где модификация включает замену Asp в положении 10 SEQ ID NO: 1409 Glu. В некоторых вариантах осуществления обеспечивают пептид класса 5, содержащий последовательность, выбранную из группы, состоящей из SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO: 1424 и SEQ ID NO: 1425. В некоторых вариантах осуществления пептид класса 5 амидирован.
Asp-Ser последовательность в положении 15-16 нативного глюкагона определена как уникальный нестабильный дипептид, который приводит к преждевременному химическому расщеплению нативного гормона в водных буферах. Например, при выдерживании с 0,01N HCl при 37°C в течение 2 недель, более чем 50% нативного глюкагона расщепляется на фрагменты. Два высвобождающихся пептида 1-15 и 16-29 после расщепления не обладают глюкагоноподобной биологической активностью и, таким образом, накладывают ограничение на водное формулирование глюкагона и его родственных аналогов. Наблюдалось, что селективная химическая замена Asp в положении 15 нативного глюкагона Glu фактически устраняет химическое расщепление 15-16 пептидной связи.
В еще дополнительных вариантах осуществления любое из указанных выше соединений можно дополнительно модифицировать для повышения стабильности модификацией аминокислоты, соответствующей положению 15 или 16 нативного глюкагона, для снижения разрушения пептида с течением времени, особенно в кислых и щелочных буферах.
Модификация, увеличивающая растворимость
Пептид класса 5 можно дополнительно модифицировать, увеличивая растворимость пептида в водных растворах при физиологическом pH, в определенных аспектах, при сохранении глюкагоновой антагонистической и GLP-1 агонистической активности. Введение гидрофильных групп в положения, соответствующие положениям 12, 15, 16, 19 и 24 пептида SEQ ID NO: 1405, или в положения 12, 16, 19 или 24 пептида SEQ ID NO: 1406, может увеличивать растворимость полученных в результате пептидов в растворах, имеющих физиологический pH, при сохранении глюкагоновой антагонистической и GLP агонистической активности исходного соединения. Следовательно, в некоторых вариантах осуществления обеспечивают описанный в настоящем изобретении пептид класса 5, который дополнительно модифицирован так, чтобы он содержал одну или более гидрофильных групп, ковалентно связанных с боковыми цепями аминокислот, соответствующих аминокислотным положениям 12, 15, 16, 19 и 24 пептида SEQ ID NO: 1405 или SEQ ID NO: 1406. В следующем варианте осуществления боковые цепи аминокислот, соответствующих аминокислотным положениям 16 и 19 SEQ ID NO: 1405 или SEQ ID NO: 1406, ковалентно связаны с гидрофильными группами, и в некоторых вариантах осуществления гидрофильная группа представляет собой полиэтиленгликоль (PEG).
Родственные глюкагону пептиды класса 5 можно модифицировать введением заряда в его карбокси конец для повышения растворимости пептида при сохранении агонистических свойств пептида. Повышенная растворимость обеспечивает получение и хранение глюкагоновых растворов при по существу нейтральном pH. Формулирование глюкагоновых растворов при относительно нейтральных pH (например, pH от приблизительно 6,0 до приблизительно 8,0) увеличивает долгосрочную стабильность пептидов класса 5.
Заявители ожидают, что пептиды класса 5, описанные в настоящем изобретении, можно аналогично модифицировать для повышения их растворимости в водных растворах при относительно нейтральном pH (например, pH от приблизительно 6,0 до приблизительно 8,0), в некоторых случаях, при сохранении глюкагоновой антагонистической и GLP-1 активности. Соответственно, некоторые варианты осуществления относятся к глюкагоновому антагонисту/GLP-1 SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408, который дополнительно модифицирован по сравнению с нативными аминокислотами, присутствующими в положениях 6-29 глюкагона дикого типа (SEQ ID NO: 1401), добавлением заряда пептиду заменой нативных незаряженных аминокислот заряженными аминокислотами или присоединением заряженных аминокислот к карбокси концу. В соответствии с некоторыми вариантами осуществления, одну-три незаряженные нативные аминокислоты пептидов класса 5, описанных в настоящем изобретении, заменяют заряженной аминокислотой. В некоторых вариантах осуществления заряженная аминокислота выбрана из группы, состоящей из лизина, аргинина, гистидина, аспарагиновой кислоты и глютаминовой кислоты. Более конкретно, заявители обнаружили, что замена обычно встречающейся аминокислоты, соответствующей положению 28 и/или 29 (относительно нативного глюкагона), заряженными аминокислотами и/или присоединение одной-двух заряженных аминокислот на карбокси конце пептида увеличивает растворимость и стабильность пептида класса 5 в водных растворах при физиологически значимых pH (т.е. pH от приблизительно 6,5 до приблизительно 7,5). Соответственно ожидают, что данные модификации пептидов класса 5 будут оказывать аналогичный эффект на растворимость в водных растворах, особенно при pH в диапазоне от приблизительно 5,5 до приблизительно 8,0, при сохранении биологической активности исходного пептида.
В соответствии с некоторыми вариантами осуществления пептид класса 5 SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408 модифицируют заменой нативной аминокислоты в положении 23 и/или 24 данных последовательностей отрицательно заряженной аминокислотой (например, аспарагиновой кислотой или глютаминовой кислотой) и необязательно присоединением отрицательно заряженной аминокислоты (например, аспарагиновой кислоты или глютаминовой кислоты) к карбокси концу пептида. В альтернативном варианте осуществления пептид класса 5, содержащий SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408, модифицируют заменой нативной аминокислоты в положении 24 SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407 или SEQ ID NO: 1408 положительно заряженной аминокислотой (например, лизином, аргинином или гистидином) и необязательно присоединением одной или двух положительно заряженных аминокислот (например, лизина, аргинина или гистидина) к карбокси концу пептида. В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 5, обладающий повышенной растворимостью и стабильностью, где аналог содержит аминокислотную последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451 при условии, что по меньшей мере одна из аминокислот в положении 23 или 24 SEQ ID NO: 1415 или SEQ ID NO: 1451 заменена кислой аминокислотой, и/или дополнительную кислую аминокислоту присоединяют к карбокси концу SEQ ID NO: 1415 или SEQ ID NO: 1451. В некоторых вариантах осуществления кислая аминокислота независимо выбрана из группы, состоящей из Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 5, обладающий повышенной растворимостью и стабильностью, где антагонист содержит аминокислотную последовательность SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418 или SEQ ID NO: 1419. В соответствии с некоторыми вариантами осуществления обеспечивают глюкагоновый агонист, содержащий последовательность SEQ ID NO: 1416 или SEQ ID NO: 1417. В некоторых вариантах осуществления пептид класса 5 содержит последовательность SEQ ID NO: 1420.
В соответствии с некоторыми вариантами осуществления обеспечивают пептид класса 5, содержащий последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451. В некоторых вариантах осуществления положение 4 SEQ ID NO: 1415 или SEQ ID NO: 1451 представляет собой аспарагиновую кислоту, глютаминовую кислоту, гомоглютаминовую кислоту, цистеиновую кислоту или гомоцистеиновую кислоту, и в некоторых вариантах осуществления положение 4 представляет собой аспарагиновую кислоту, глютаминовую кислоту, цистеиновую кислоту или гомоцистеиновую кислоту, и в следующем варианте осуществления положение 4 SEQ ID NO: 1415 или SEQ ID NO: 1451 представляет собой аспарагиновую кислоту или глютаминовую кислоту, и в некоторых вариантах осуществления положение 4 SEQ ID NO: 1415 или SEQ ID NO: 1451 представляет собой аспарагиновую кислоту. В некоторых вариантах осуществления обеспечивают пептид класса 5, содержащий последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451, где положение 4 SEQ ID NO: 1415 представляет собой аспарагиновую кислоту, и положение 10 SEQ ID NO: 1415 представляет собой глютаминовую кислоту. В следующем варианте осуществления C-концевую аминокислоту SEQ ID NO: 1415 или SEQ ID NO: 1451 модифицируют, замещая нативную карбоксильную группу нейтрально заряженной группой, такой как амид или эфир.
Слитые пептиды класса 5
В следующем варианте осуществления, карбокси концевая аминокислота пептида класса 5, описанного в настоящем изобретении, ковалентно связана со вторым пептидом, содержащим последовательность, выбранную из группы, состоящей из SEQ ID NO: 1421, 1426, 1427 и 1450. Например, в некоторых вариантах осуществления пептид класса 5 SEQ ID NO: 1415, SEQ ID NO: 1451, SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407, SEQ ID NO: 1408, SEQ ID NO: 1412, SEQ ID NO: 1413, SEQ ID NO: 1414, SEQ ID NO: 1416, SEQ ID NO: 1417, SEQ ID NO: 1418, SEQ ID NO: 1419, SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO: 1424 и SEQ ID NO: 1425 ковалентно связан со вторым пептидом, содержащим последовательность, выбранную из группы, состоящей из SEQ ID NO: 1421 (GPSSGAPPPS), SEQ ID NO: 1426 (KRNRNNIA), SEQ ID NO: 1427 (KRNR) и SEQ ID NO: 1450 (GPSSGAPPPSX).
В некоторых вариантах осуществления обеспечивают димер пептида класса 5, содержащий две последовательности, независимо выбранные из группы, состоящей из SEQ ID NO: 1405, SEQ ID NO: 1406, SEQ ID NO: 1407, SEQ ID NO: 1408, SEQ ID NO: 1409, SEQ ID NO: 1422, SEQ ID NO: 1423, SEQ ID NO: 1424 и SEQ ID NO: 1425, который дополнительно содержит аминокислотную последовательность SEQ ID NO: 1421 (GPSSGAPPPS), соединенную с карбокси концевой аминокислотой пептида класса 5.
В некоторых вариантах осуществления пептид класса 5 дополнительно модифицируют укорачиванием или делецией одной или двух аминокислот с C-конца пептида (т.е. укорачивание аминокислоты в положении 29 или в положениях 28 и 29 нативного глюкагона). Предпочтительно укорачивание не влияет на активность (например, глюкагоновый антагонизм/GLP-1 агонизм) пептида класса 5.
Конъюгаты пептидов класса 5
Также обеспечивают конъюгаты пептидов класса 5, в которых глюкагоновый пептид соединен, необязательно ковалентным связыванием и необязательно линкером, с конъюгатным фрагментом.
В вариантах осуществления, где пептид класса 5 содержит полиэтиленгликольную цепь, полиэтиленгликольная цепь может быть в виде нормальной цепи, или она может быть разветвленной. В соответствии с некоторыми вариантами осуществления полиэтиленгликольная цепь имеет средний молекулярный вес, выбранный из диапазона от приблизительно 500 до приблизительно 10000 Дальтон. В некоторых вариантах осуществления полиэтиленгликольная цепь имеет средний молекулярный вес, выбранный из диапазона от приблизительно 1000 до приблизительно 5000 Дальтон. В некоторых вариантах осуществления полиэтиленгликольная цепь имеет средний молекулярный вес, выбранный из диапазона от приблизительно 1000 до приблизительно 5000 Дальтон. В некоторых вариантах осуществления полиэтиленгликольная цепь имеет средний молекулярный вес, выбранный из от приблизительно 1000 до приблизительно 2000 Дальтон. В некоторых вариантах осуществления полиэтиленгликольная цепь имеет средний молекулярный вес приблизительно 1000 Дальтон.
В некоторых вариантах осуществления пегилированный пептид класса 5 содержит пептид, содержащий последовательности SEQ ID NO: 1415 или SEQ ID NO: 1451, где полиэтиленгликольная цепь соединена с аминокислотой, выбранной из положения 11, 12, 15, 16, 19 и 24 SEQ ID NO: 1415 или SEQ ID NO: 1451, и молекулярный вес PEG цепи равен от приблизительно 1000 до приблизительно 5000 Дальтон. В некоторых вариантах осуществления пегилированный пептид класса 5 содержит пептид, состоящий из последовательности SEQ ID NO: 1415 или SEQ ID NO: 1451, где полиэтиленгликольная цепь соединена с аминокислотой в положении 16 или 19 SEQ ID NO: 1415 или SEQ ID NO: 1451, и молекулярный вес PEG цепи равен от приблизительно 1000 до приблизительно 5000 Дальтон. В следующем варианте осуществления модифицированный пептид класса 5 содержит две или более полиэтиленгликольных цепей, ковалентно связанных с пептидом, где суммарный молекулярный вес глюкагоновых цепей равен от приблизительно 1000 до приблизительно 5000 Дальтон. В некоторых вариантах осуществления пептид класса 5 содержит последовательность SEQ ID NO: 1415 или SEQ ID NO: 1451, где полиэтиленгликольная цепь соединена с аминокислотой в положениях 16 и 19 SEQ ID NO: 1415 или SEQ ID NO: 1451, и объединенный молекулярный вес двух PEG цепей равен от приблизительно 1000 до приблизительно 5000 Дальтон.
Родственный глюкагону пептид класса 5 может содержать аминокислотную последовательность любую из SEQ ID NO: 1401-1518, необязательно с вплоть до 1, 2, 3, 4 или 5 дополнительными модификациями, которые сохраняют глюкагоновую антагонистическую и GLP-1 агонистическую активностью.
Связывающая группа (L)
Как описано в настоящем изобретении настоящее описание обеспечивает пептиды глюкагонового суперсемейства, конъюгированные с NHR лигандами, имеющими формулу Q-L-Y, где L представляет собой связывающую группу или химическую связь. В некоторых вариантах осуществления L является стабильной in vivo. В некоторых вариантах осуществления L может подвергаться гидролизу in vivo. В некоторых вариантах осуществления L является нестабильной in vivo.
Q и Y могут быть соединены вместе через L, применяя стандартные линкеры и способы, известные специалисту в данной области техники. В некоторых аспектах Q и Y конденсированы непосредственно, и L представляет собой связь. В других аспектах, Q и Y конденсированы через связывающую группу L. Например, в некоторых вариантах осуществления Q и Y соединены вместе пептидной связью, необязательно пептидным или аминокислотным спейсером. В некоторых вариантах осуществления Q и Y соединены вместе химическим конъюгированием, необязательно связывающей группой (L). В некоторых вариантах осуществления L непосредственно конъюгирована с каждым из Q и Y.
Химическое конъюгирование можно осуществлять реакцией нуклеофильной реакционноспособной группы одного соединения с электрофильной реакционноспособной группой другого соединения. В некоторых вариантах осуществления, когда L представляет собой связь, Q конъюгирован с Y или реакцией нуклеофильной реакционноспособной группы в Q с электрофильной реакционноспособной группой в Y, или реакцией электрофильной реакционноспособной группы в Q с нуклеофильной реакционноспособной группой в Y. В вариантах осуществления, когда L представляет собой группу, которая соединяет Q и Y вместе, Q и/или Y можно конъюгировать с L или реакцией нуклеофильной реакционноспособной группы в Q и/или Y с электрофильной реакционноспособной группой в L, или реакцией электрофильной реакционноспособной группы в Q и/или Y с нуклеофильной реакционноспособной группой в L. Неограничивающие примеры нуклеофильных реакционноспособных групп включают амино, тиол и гидроксил. Неограничивающие примеры электрофильных реакционноспособных групп включают карбоксил, хлорангидрид кислоты, ангидрид, сложный эфир, сукцинимидный эфир, алкилгалогенид, сульфонатный эфир, малеимидо, галогенацетил и изоцианат. В вариантах осуществления, когда Q и Y конъюгированы друг с другом реакцией карбоновой кислоты с амином, активирующий агент можно применять для получения активированного эфира карбоновой кислоты.
Активированный эфир карбоновой кислоты может представлять собой, например, N-гидроксисукцинимид (NHS), тозилат (Tos), мезилат, трифлат, карбодиимид или гексафторфосфат. В некоторых вариантах осуществления карбодиимид представляет собой 1,3-дициклогексилкарбодиимид (DCC), 1,1'-карбонилдиимидазол (CDI), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (EDC) или 1,3-диизопропилкарбодиимид (DICD). В некоторых вариантах осуществления гексафторфосфат выбран из группы, состоящей из гексафторфосфата бензотриазол-1-илокси-трис(диметиламино)фосфония (BOP), гексафторфосфата бензотриазол-1-илокситрипирролидинфосфония (PyBOP), гексафторфосфата 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) и гексафторфосфата o-бензотриазол-N,N,N',N'-тетраметилурония (HBTU).
В некоторых вариантах осуществления Q содержит нуклеофильную реакционноспособную группу (например, аминогруппу, тиольную группу или гидроксильную группу боковой цепи лизина, цистеина или серина), которая способна конъюгировать с электрофильной реакционноспособной группой в Y или L. В некоторых вариантах осуществления Q содержит электрофильную реакционноспособную группу (например, карбоксильная группа боковой цепи Asp или Glu), которая способно конъюгировать с нуклеофильной реакционноспособной группой в Y или L. В некоторых вариантах осуществления Q химически модифицирован так, чтобы он содержал реакционноспособную группу, которая способно конъюгировать непосредственно с Y или с L. В некоторых вариантах осуществления Q модифицируют на C-конце так, чтобы он содержал природную или неприродную аминокислоту с нуклеофильной боковой цепью, такую как аминокислота, представленная формулой I, формулой II или формулой III, как ранее описано в настоящем изобретении (см. "Ацилирование и алкилирование"). В примерных вариантах осуществления C-концевая аминокислота Q выбрана из группы, состоящей из лизина, орнитина, серина, цистеина и гомоцистеина. Например, C-концевую аминокислоту Q можно модифицировать так, чтобы она содержала лизиновый остаток. В некоторых вариантах осуществления Q модифицируют по C-концевой аминокислоте так, чтобы он содержал природную или неприродную аминокислоту с электрофильной боковой цепью, такую как, например, Asp и Glu. В некоторых вариантах осуществления аминокислота внутри последовательности Q заменена природной или неприродной аминокислотой, содержащей нуклеофильную боковую цепь, такой как аминокислота, представленная формулой I, формулой II или формулой III, как ранее описано в настоящем изобретении (см. "Ацилирование и алкилирование"). В примерных вариантах осуществления аминокислота внутри последовательности Q, которая заменена, выбрана из группы, состоящей из лизина, орнитина, серина, цистеина и гомоцистеина. Например, аминокислота внутри последовательности Q может быть заменена лизиновым остатком. В некоторых вариантах осуществления аминокислота внутри последовательности Q заменена природной или неприродной аминокислотой с электрофильной боковой цепью, такой как, например, Asp и Glu.
В некоторых вариантах осуществления Y содержит реакционноспособную группу, которая способно конъюгировать непосредственно с Q или с L. В некоторых вариантах осуществления Y содержит нуклеофильную реакционноспособную группу (например, амин, тиол, гидроксил), которая способна конъюгировать с электрофильной реакционноспособной группой в Q или L. В некоторых вариантах осуществления Y содержит электрофильную реакционноспособную группу (например, карбоксильную группу, активированную форму карбоксильной группу, соединение с уходящей группой), которая способна конъюгировать с нуклеофильной реакционноспособной группой в Q или L. В некоторых вариантах осуществления Y химически модифицирован так, чтобы он содержал нуклеофильную реакционноспособную группу, которая способна конъюгировать с электрофильной реакционноспособной группой в Q или L. В некоторых вариантах осуществления Y химически модифицирован так, чтобы он содержал электрофильную реакционноспособную группу, которая способна конъюгировать с нуклеофильной реакционноспособной группой в Q или L.
В некоторых вариантах осуществления конъюгирование можно осуществлять с помощью органосиланов, например, аминосилана, обработанного глутаральдегидом; карбонилдиимидазольной (CDI) активации силанольных групп; или применяя дендримеры. Ряд дендримеров является известным в данной области техники и включает поли(амидоаминовые) (PAMAM) дендримеры, которые получают дивергентным способом, исходя из реагентов на основе аммиачных или этилендиаминовых ядер инициатора; подкласс PAMAM дендримеров на основе трисаминоэтилениминового ядра; поли(амидоаминорганокремниевые) дендримеры (PAMAMOS) с радиальными слоями, которые представляют собой обращенные мономолекулярные мицеллы, которые состоят из гидрофильной, нуклеофильной полиамидоаминовой (PAMAM) внутренней части и гидрофобной органокремниевой (OS) внешней части; поли(пропилениминовые) (PPI) дендримеры, которые обычно представляют собой полиалкиламины, содержащие первичные амины в качестве концевых групп, тогда как внутренняя часть дендримера состоит из многочисленных третичных триспропиленаминов; поли(пропиленаминовые) (POPAM) дендримеры; диаминобутановые (DAB) дендримеры; амфифильные дендримеры; мицеллярные дендримеры, которые представляют собой мономолекулярные мицеллы растворимых в воде гиперразветвленных полифениленов; полилизиновые дендримеры; и дендримеры на основе полибензилэфирного гиперразветвленного остова.
В некоторых вариантах осуществления конъюгирование можно осуществлять олеиновым метатезисом. В некоторых вариантах осуществления оба из Y и Q, Y и L или Q и L содержат алкеновую или алкиновую группу, которая способна подвергаться метатезису. В некоторых вариантах осуществления применяют подходящий катализатор (например, медь, рутений) для ускорения реакции метатезиса. Подходящие способы проведения реакций метатезиса описаны в данной области техники. См., например, Schafmeister et al., J. Am. Chem. Soc. 122: 5891-5892 (2000), Walensky et al., Science 305: 1466-1470 (2004) и Blackwell et al., Angew, Chem., Int. Ed. 37: 3281-3284 (1998).
В некоторых вариантах осуществления конъюгирование можно осуществлять, применяя «клик» химию. "Клик реакция" является широкоприменяемой и легкой для применения, в ней применяют только легкодоступные реагенты, и она является нечувствительной к кислороду и воде. В некоторых вариантах осуществления «клик реакция» представляет собой реакцию циклоприсоединения между алкинильной группой и азидогруппой, давая триазолильную группу. В некоторых вариантах осуществления в «клик реакции» применяют медный или рутениевый катализатор. Подходящие способы проведения «клик реакции» описаны в данной области техники. См., например, Kolb et al., Drug Discovery Today 8:1128 (2003); Kolb et al., Angew. Chem. Int. Ed. 40:2004 (2001); Rostovtsev et al., Angew. Chem. Int. Ed. 41:2596 (2002); Tornoe et al., J. Org. Chem. 67:3057 (2002); Manetsch et al., J. Am. Chem. Soc. 126:12809 (2004); Lewis et al., Angew. Chem. Int. Ed. 41:1053 (2002); Speers, J. Am. Chem. Soc. 125:4686 (2003); Chan et al. Org. Lett. 6:2853 (2004); Zhang et al., J. Am. Chem. Soc. 127:15998 (2005); и Waser et al., J. Am. Chem. Soc. 127:8294 (2005).
Также предусмотрено непрямое конъюгирование с помощью специфически связывающихся партнеров с высоким сродством, например, стрептавидин/биотин или авидин/биотин или лектин/углевод.
Химическая модификация Q и/или Y
В некоторых вариантах осуществления Q и/или Y модифицированы органическим модифицирующим агентом так, чтобы они содержали нуклеофильную реакционноспособную группу или электрофильную реакционноспособную группу. Данный модифицирующий агент способен реагировать с выбранными боковыми цепями или N- или C-концевыми остатками целевых аминокислот в Q и функциональными группами в Y. Реакционноспособные групп в Q и/или Y включают, например, альдегидную, амино, сложноэфирную, тиольную, α-галогенацетильную, малеимидо или гидразино группу. Модифицирующие агенты включают, например, малеимидобензоилсульфосукцинимидный эфир (конъюгирование через цистеиновые остатки), N-гидроксисукцинимид (через лизиновые остатки), глутаральдегид, янтарный ангидрид или другие агенты, известные в данной области техники. Альтернативно, Q и/или Y могут быть соединены друг с другом опосредованно промежуточными носителями, такими как полисахаридный или полипептидный носители. Примеры полисахаридных носителей включают аминодекстран. Примеры подходящих полипептидных носителей включают полилизин, полиглютаминовую кислоту, полиаспарагиновую кислоту, их сополимеры и смешанные полимеры данных аминокислот и других, например, серинов, для придания требуемых свойств растворимости полученному в результате загруженному носителю.
Цистеинильные остатки обычно реагируют с α-галогенацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, давая карбоксиметильные или карбоксиамидометильные производные. Цистеинильные остатки также модифицируют реакцией с бромтрифторацетоном, альфа-бром-п-(5-имидозоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил 2-пиридилдисульфидом, п-хлормеркурбензоатом, 2-хлормеркур-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом.
Гистидильные остатки модифицируют реакцией с диэтилпирокарбонатом при pH 5,5-7,0, поскольку данный агент является относительно специфическим для гистидильной боковой цепи. Парабромфенацилбромид также является пригодным; реакцию предпочтительно проводить в 0,1 M какодилате натрия при pH 6,0.
Лизинильные и амино концевые остатки реагируют с янтарным ангидридом или ангидридами других карбоновых кислот. Модификация данными реагентами приводит к обращению заряда лизинильных остатков. Другие подходящие реагенты для модификации остатков, содержащих альфа амино, включают имидоэфиры, такие как метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлорборгидрид, тринитробензолсульфокислоту, O-метилизомочевину, 2,4-пентандион и реакцию с глиоксилатом, катализируемую трансаминазой.
Аргинильные остатки модифицируют реакцией с одним или несколькими общепринятыми реагентами, например, фенилглиоксалем, 2,3-бутандионом, 1,2-циклогександионом и нингидрином. Модифицирование аргининовых остатков требует, чтобы реакция проводилась в щелочных условиях из-за высокой pKa гуанидиновой функциональной группы. Кроме того, данные реагенты могут реагировать с группами лизина, а также эпсилон-амино группой аргинина.
Можно осуществлять специфическую модификацию тирозильных остатков, причем особый интерес представляет введение спектральных меток в тирозильные остатки реакцией с ароматическими диазониевыми соединениями или тетранитрометаном. Обычно, N-ацетилимидазол и тетранитрометан применяют для получения O-ацетилтирозильных соединений и 3-нитропроизводных, соответственно.
Карбоксильные боковые группы (аспартил или глютамил) селективно модифицируют реакцией с карбодиимидами (R-N=C=N-R'), где R и R' представляют собой различные алкильные группы, такими как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азоний-4,4-диметилпентил)карбодиимид. Кроме того, аспартильные и глютамильные остатки превращают в аспарагинильные и глютаминильные остатки реакцией с ионнами аммония.
Другие модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных или треонильных остатков, метилирование альфа-амино групп лизина, аргинина и гистидиновых боковых цепей (T. E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), дезаминирование аспарагина или глютамина, ацетилирование N-концевого амина, и/или амидирование или этерификацию C-концевой карбоксильной группы.
Другие типы ковалентной модификации включают химическое или ферментативное конъюгирование гликозидов с пептидом. Сахар (сахара) может быть соединен с (a) аргинином и гистидином, (b) свободными карбоксильными группами, (c) свободными сульфгидрильными группами, такими как группы цистеина, (d) свободными гидроксильными группами, такими как гидроксильные группы серина, треонина или гидроксипролина, (e) ароматическими остатками, такими как ароматические остатки тирозина или триптофана, или (f) амидной группой глютамина. Данные способы описывают в WO87/05330, опубликованной 11 сентября 1987, и в Aplin и Wriston, CRC Crit. Rev. Biochem., pp. 259-306 (1981).
Структура L
В некоторых вариантах осуществления L представляет собой связь. В данных вариантах осуществления Q и Y конъюгированы друг с другом реакцией нуклеофильной реакционноспособной группы в Q с электрофильной реакционноспособной группой в Y. В альтернативных вариантах осуществления Q и Y конъюгированы друг с другом реакцией электрофильной реакционноспособной группы в Q с нуклеофильной группой в Y. В примерных вариантах осуществления L представляет собой амидную связь, которая образуется при реакции амина в Q (например, ε-амина лизинового остатка) с карбоксильной группой в Y. В альтернативных вариантах осуществления Q и/или Y модифицируют дериватизирующим агентом перед конъюгированием.
В некоторых вариантах осуществления L представляет собой связывающую группу. В некоторых вариантах осуществления L представляет собой бифункциональный линкер и содержит только две реакционноспособные группы перед конъюгированием с Q и Y. В вариантах осуществления, когда и Q и Y содержат электрофильные реакционноспособные группы, L содержит две одинаковые или две различные нуклеофильные группы (например, амин, гидроксил, тиол) перед конъюгированием с Q и Y. В вариантах осуществления, когда и Q и Y содержат нуклеофильные реакционноспособные группы, L содержит две одинаковые или две различные электрофильные группы (например, карбоксильную группу, активированную форму карбоксильной группы, соединение с уходящей группой) перед конъюгированием с Q и Y. В вариантах осуществления, когда один из Q или Y содержит нуклеофильную реакционноспособную группу, и второй из Q или Y содержит электрофильную реакционноспособную группу, L содержит одну нуклеофильную реакционноспособную группу и одну электрофильную группу перед конъюгированием с Q и Y.
L может представлять собой любую молекулу с по меньшей мере двумя реакционноспособными группами (перед конъюгированием с Q и Y), способными реагировать с каждым из Q и Y. В некоторых вариантах осуществления L содержит только две реакционноспособные группы и является бифункциональным. L (перед конъюгированием с пептидами) может быть представлен формулой VI:

где A и B независимо представляют собой нуклеофильную или электрофильную реакционноспособную группу. В некоторых вариантах осуществления обе из A и B представляют собой нуклеофильные группы или обе представляют собой электрофильные группы. В некоторых вариантах осуществления одна из A или B представляет собой нуклеофильную группу, и другая из A или B представляет собой электрофильную группу. Неограничивающие комбинации A и B показаны ниже.
В некоторых вариантах осуществления A и B могут содержать алкеновую и/или алкиновую функциональные группы, которые являются подходящими для реакций олефинового метатезиса. В некоторых вариантах осуществления A и B содержат группы, которые являются подходящими для «клик реакции» (например, алкен, алкины, нитрилы, азиды). Другие неограничивающие примеры реакционноспособных групп (A и B) включают пиридилдитиол, арилазид, диазирин, карбодиимид и гидразид.
В некоторых вариантах осуществления L является гидрофобным. Гидрофобные линкеры являются известными в данной области техники. См., например, Bioconjugate Techniques, G. T. Hermanson (Academic Press, San Diego, CA, 1996), которую вводят с помощью ссылки во всей своей полноте. Подходящие гидрофобные линкеры, известные в данной области техники, включают, например, 8-гидроксиооктановую кислоту и 8-меркаптооктановую кислоту. Перед конъюгированием с пептидами композиции, гидрофобный линкер содержит по меньшей мере две реакционноспособных группы (A и B), как описано в настоящем изобретении, и как показано ниже:

В некоторых вариантах осуществления гидрофобный линкер содержит или малеимидо или йодацетильную группу и/или карбоновую кислоту или активированную карбоновую кислоту (например, NHS эфир) в качестве реакционноспособных групп. В данных вариантах осуществления малеимидо или йодацетильную группу можно конденсировать с тиольной группой в Q или Y и карбоновую кислоту или активированную карбоновую кислоту можно конденсировать с амином в Q или Y с или без применения конденсирующего реагента. Любой конденсирующий агент, известный специалисту в данной области техники, можно применять для конденсации карбоновой кислоты со свободным амином, таким как, например, DCC, DIG, HATU, HBTU, TBTU и другими активирующими агентами, описанными в настоящем изобретении. В конкретных вариантах осуществления гидрофильный линкер содержит алифатическую цепь из 2-100 метиленовых групп, где A и B представляют собой карбоксильные группы или их производные (например, янтарную кислоту). В других конкретных вариантах осуществления L представляет собой йодуксусную кислоту.

В некоторых вариантах осуществления связывающая группа является гидрофильной, такой как, например, полиалкиленгликоль. Перед конъюгированием с пептидами композиции, гидрофильная связывающая группа содержит по меньшей мере две реакционноспособные группы (A и B), как описано в настоящем изобретении и как показано ниже:

В конкретных вариантах осуществления связывающая группа представляет собой полиэтиленгликоль (PEG). В определенных вариантах осуществления PEG имеет молекулярный вес от приблизительно 100 Дальтон до приблизительно 10000 Дальтон, например, от приблизительно 500 Дальтон до приблизительно 5000 Дальтон. PEG в некоторых вариантах осуществления имеет молекулярный вес от приблизительно 10000 Дальтон до приблизительно 40000 Дальтон.
В некоторых вариантах осуществления гидрофильная связывающая группа содержит или малеимидо, или йодацетильную группу и/или карбоновую кислоту или активированную карбоновую кислоту (например, NHS эфир) в качестве реакционноспособных групп. В данных вариантах осуществления малеимидо или йодацетильную группу можно конденсировать с тиольной группой в Q или Y, и карбоновую кислоту или активированную карбоновую кислоту можно конденсировать с амином в Q или Y с или без применения конденсирующего реагента. Любой конденсирующий агент, известный специалисту в данной области, можно применять для конденсации карбоновой кислоты со свободным амином, таким как, например, DCC, DIG, HATU, HBTU, TBTU и другие активирующие агенты, описанные в настоящем изобретении. В некоторых вариантах осуществления связывающая группа представляет собой малеимидо-PEG(20кДа)-COOH, йодацетил-PEG(20кДа)-COOH, малеимидо-PEG(20кДа)-NHS или йодацетил-PEG(20 кДа)-NHS.
В некоторых вариантах осуществления связывающая группа состоит из аминокислоты, дипептида, трипептида или полипептида, где аминокислота, дипептид, трипептид или полипептид содержит по меньшей мере две активирующие группы, как описано в настоящем изобретении. В некоторых вариантах осуществления связывающая группа (L) содержит группу, выбранную из группы, состоящей из: амино, эфира, тиоэфира, малеимидо, дисульфида, амида, сложного эфира, тиоэфира, алкена, циклоалкена, алкина, триазоила, карбамата, карбоната, расщепляемые катепсином B, и гидразона.
В некоторых вариантах осуществления L содержит цепь атомов от 1 до приблизительно 60, или 1-30 атомов или длиннее, 2-5 атомов, 2-10 атомов, 5-10 атомов или 10-20 атомов в длину. В некоторых вариантах осуществления все атомы в цепи представляют собой атомы углерода. В некоторых вариантах осуществления атомы в цепи в остове связывающей группы выбраны из группы, состоящей из C, O, N и S. Атомы цепи и линкеры можно выбрать согласно их ожидаемой растворимости (гидрофильности), так, чтобы получить более растворимый конъюгат. В некоторых вариантах осуществления L вводит функциональную группу, которая подвергается расщеплению ферментом или другим катализатором или в гидролитических условиях, создаваемых в ткани-мишени или органе или клетке. В некоторых вариантах осуществления длина L является достаточной для снижения возможности стерических затруднений.
Стабильность Lin vivo
В некоторых вариантах осуществления L является стабильным in vivo. В некоторых вариантах осуществления L является стабильным в сыворотке крови по меньшей мере 5 минут, например, менее чем 25%, 20%, 15%, 10% или 5% конъюгата расщепляется при выдерживании в сыворотке в течение 5 минут. В других вариантах осуществления L является стабильным в сыворотке крови в течение по меньшей мере 10, или 20, или 25, или 30, или 60, или 90, или 120 минут, или 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 18 или 24 часов. В данных вариантах осуществления L не содержит функциональной группы, которая способна подвергаться гидролизу in vivo. В некоторых примерных вариантах осуществления L является стабильным в сыворотке крови в течение по меньшей мере приблизительно 72 часов. Неограничивающие примеры функциональных групп, которые способны подвергаться заметному гидролизу in vivo, включают амиды, эфиры и тиоэфиры. Например, следующие соединения не способны подвергаться заметному гидролизу in vivo:

В некоторых вариантах осуществления L может гидролизоваться in vivo. В данных вариантах осуществления L содержит функциональную группу, которая способна подвергаться гидролизу in vivo. Неограничивающие примеры функциональных групп, которые способны подвергаться гидролизу in vivo, включают сложные эфиры, ангидриды и тиоэфиры. Например, следующее соединение способно подвергаться гидролизу in vivo, поскольку оно содержит сложноэфирную группу:

В некоторых примерных вариантах осуществления L является лабильным и подвергается значительному гидролизу в течение 3 часов в плазме крови при 37°C, с полным гидролизом в течение 6 часов. В некоторых примерных вариантах осуществления L не является лабильным.
В некоторых вариантах осуществления L является нестабильным in vivo. В данных вариантах осуществления L содержит функциональную группу, которая способна химически или ферментативно расщепляться in vivo (например, кислотолабильную, чувствительную к восстановлению или фермент-лабильную функциональную группу), необязательно с течением времени. В данных вариантах осуществления L может содержать, например, гидразоновую группу, дисульфидную группу или катепсин-расщепляемую группу. Когда L является нестабильным, и не намереваясь быть связанными какой-либо конкретной теорией, Q-L-Y конъюгат является стабильным во внеклеточном окружении, например, стабильным в сыворотке крови в течение периодов времени, описанных выше, но лабильным во внутриклеточном окружении или условиях, которые имитируют внутриклеточное окружение, так что он расщепляется при попадании в клетку. В некоторых вариантах осуществления, когда L является нестабильным, L является стабильным в сыворотке крови в течение по меньшей мере приблизительно 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 42, или 48 часов, например, по меньшей мере приблизительно 48, 54, 60, 66 или 72 часов, или приблизительно 24-48, 48-72, 24-60, 36-48, 36-72 или 48-72 часов.
Q-L-Y конъюгаты
Конъюгирование Q и Y
Конъюгирование Q с Y через L можно осуществлять в любом положении в Q, включая любое из положений 1-29, положение в C-концевом удлинении, или по C-концевой аминокислоте, при условии, что активность Q сохраняется, если не увеличивается. Неограничивающие примеры включают положения 5, 7, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 27, 28, 29, 30, 37, 38, 39, 40, 41, 42 или 43 (согласно нумерации аминокислот SEQ ID NO: 1601). В некоторых вариантах осуществления Y конъюгирован с Q через L в одном или более положениях 10, 20, 24, 30, 37, 38, 39, 40, 41, 32 или 43. В конкретных вариантах осуществления Y конъюгирован с Q через L в положении 10 и/или 40 Q.
Активность
Активность относительно глюкагонового рецептора и ядерного гормонального рецептора
В некоторых вариантах осуществления Q-L-Y обладает активностью относительно и глюкагонового рецептора и ядерного гормонального рецептора. В некоторых вариантах осуществления активность (например, EC50 или относительная активность или эффективность) Q относительно глюкагонового рецептора находится в пределах приблизительно 100-кратного, приблизительно 75-кратного, приблизительно 60-кратного, приблизительно 50-кратного, приблизительно 40-кратного, приблизительно 30-кратного, приблизительно 20-кратного, приблизительно 10-кратного или приблизительно 5-кратного отличия (в большую или меньшую сторону) от активности (например, EC50 или относительной активности или эффективности) Y относительно ядерного гормонального рецептора. В некоторых вариантах осуществления глюкагоновая эффективность Q находится в пределах приблизительно 25-, приблизительно 20-, приблизительно 15-, приблизительно 10- или приблизительно 5-кратного отличия (в большую или меньшую сторону) от эффективности Y.
В некоторых вариантах осуществления показатель относительной активности, или EC50, или эффективности Q относительно глюкагонового рецептора, разделенной на относительную активность, или EC50, или эффективность Y относительно ядерного гормонального рецептора, является менее чем или равным приблизительно X, где X выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Q относительно глюкагонового рецептора, разделенной на EC50, или эффективность, или относительную активность Y относительно ядерного гормонального рецептора, равно приблизительно 1, меньше, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение эффективности относительно глюкагонового рецептора Q к эффективности относительно ядерного гормонального рецептора Y является менее чем или равным приблизительно Z, где Z выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение эффективности относительно глюкагонового рецептора Q к эффективности относительно ядерного гормонального рецептора Y является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Q имеет EC50 относительно глюкагонового рецептора, которая является в 2-10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) большей, чем EC50Y относительно ядерного гормонального рецептора.
В некоторых вариантах осуществления отношение относительной активности, или эффективности, или EC50Y относительно ядерного гормонального рецептора, разделенной на относительную активность, или эффективность, или EC50Q относительно глюкагонового рецептора, является менее чем или равным приблизительно V, где V выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Y относительно ядерного гормонального рецептора, разделенной на EC50, или эффективность, или относительную активность Q относительно глюкагонового рецептора, является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение эффективности относительно ядерного гормонального рецептора Y к глюкагоновой эффективности Q является меньшее чем или равным приблизительно W, где W выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение эффективности относительно ядерного гормонального рецептора Y к глюкагоновой эффективности Q является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Y имеет EC50 относительно ядерного гормонального рецептора, которая является в приблизительно 2 раза - приблизительно 10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) большей, чем EC50Q относительно глюкагонового рецептора.
В некоторых вариантах осуществления Y обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности эндогенного лиганда относительно ядерного гормонального рецептора (эффективность относительно ядерного гормонального рецептора), и Q обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности нативного глюкагона относительно глюкагонового рецептора (глюкагоновая эффективность).
Активность относительно GLP-1 рецептора и ядерного гормонального рецептора
В некоторых вариантах осуществления Q-L-Y обладает активностью относительно и GLP-1 рецептора и ядерного гормонального рецептора. В некоторых вариантах осуществления активность (например, EC50, или относительная активность, или эффективность) Q относительно GLP-1 рецептора находится в пределах приблизительно 100-кратного, приблизительно 75-кратного, приблизительно 60-кратного, приблизительно 50-кратного, приблизительно 40-кратного, приблизительно 30-кратного, приблизительно 20-кратного, приблизительно 10-кратного или приблизительно 5-кратного отличия (в большую или меньшую сторону) от активности (например, EC50, или относительной активности, или эффективности) Y относительно ядерного гормонального рецептора. В некоторых вариантах осуществления GLP-1 эффективность Q находится в пределах приблизительно 25-, приблизительно 20-, приблизительно 15-, приблизительно 10- или приблизительно 5-кратного отличия (в большую или меньшую сторону) от эффективности Y.
В некоторых вариантах осуществления отношение относительной активности, или EC50, или эффективности Q относительно GLP-1 рецептора, разделенной на относительную активность, или EC50, или эффективность Y относительно ядерного гормонального рецептора, является менее чем или равным приблизительно X, где X выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Q относительно GLP-1 рецептора, разделенной на EC50, или эффективность, или относительную активность Y относительно ядерного гормонального рецептора, равно приблизительно 1, меньше, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение GLP-1 эффективности Q к эффективности относительно ядерного гормонального рецептора Y, является менее чем или равным приблизительно Z, где Z выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение GLP-1 эффективности Q к эффективности относительно ядерного гормонального рецептора Y, является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Q обладает EC50 относительно GLP-1 рецептора, которая является в 2-10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) большей, чем EC50Y относительно ядерного гормонального рецептора.
В некоторых вариантах осуществления отношение относительной активности, или эффективности, или EC50Y относительно ядерного гормонального рецептора, разделенной на относительную активность, или эффективность, или EC50Q относительно GLP-1 рецептора, является менее чем или равным приблизительно V, где V выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Y относительно ядерного гормонального рецептора, разделенной на EC50, или эффективность, или относительную активность Q относительно GLP-1 рецептора, является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение эффективности относительно ядерного гормонального рецептора Y к GLP-1 эффективности Q является менее чем или равным приблизительно W, где W выбран из 100, 75, 60, 50,40, 30, 20,15, 10 и 5. В некоторых вариантах осуществления отношение эффективности относительно ядерного гормонального рецептора Y к GLP-1 эффективности Q является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Y обладает EC50 относительно ядерного гормонального рецептора, которая является приблизительно в 2-10 раз (например, 2 раза, 3 раз, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) большей, чем EC50Q относительно GLP-1 рецептора.
В некоторых вариантах осуществления Y обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности эндогенного лиганда относительно ядерного гормонального рецептора (эффективность относительно ядерного гормонального рецептора), и Q обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности нативного GLP-1 относительно GLP-1 рецептора (GLP-1 эффективность).
Активность относительно GIP рецептора и ядерного гормонального рецептора
В некоторых вариантах осуществления Q-L-Y обладает активностью относительно и GIP рецептора и ядерного гормонального рецептора. В некоторых вариантах осуществления активность (например, EC50, или относительная активность, или эффективность) Q относительно GIP рецептора находится в пределах приблизительно 100-кратного, приблизительно 75-кратного, приблизительно 60-кратного, приблизительно 50-кратного, приблизительно 40-кратного, приблизительно 30-кратного, приблизительно 20-кратного, приблизительно 10-кратного или приблизительно 5-кратного отличия (в большую или меньшую сторону) от активности (например, EC50, или относительной активности, или эффективности) Y относительно ядерного гормонального рецептора. В некоторых вариантах осуществления GIP эффективность Q находится в пределах приблизительно 25-, приблизительно 20-, приблизительно 15-, приблизительно 10- или приблизительно 5-кратного отличия (в большую или меньшую сторону) от эффективности Y.
В некоторых вариантах осуществления отношение относительной активности, или EC50,или эффективности Q относительно GIP рецептора, разделенной на относительную активность, или EC50, или эффективность Y относительно ядерного гормонального рецептора, является менее чем или равным приблизительно X, где X выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Q относительно GIP рецептора, разделенной на EC50, или эффективность, или относительную активность Y относительно ядерного гормонального рецептора, равно приблизительно 1, меньше, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение GIP эффективности Q к эффективности относительно ядерного гормонального рецептора Y является менее чем или равным приблизительно Z, где Z выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение GIP эффективности Q к эффективности относительно ядерного гормонального рецептора Y является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Q обладает EC50 относительно GIP рецептора, которая является 2-10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) большей, чем EC50Y относительно ядерного гормонального рецептора.
В некоторых вариантах осуществления отношение относительной активности, или эффективности, или EC50Y относительно ядерного гормонального рецептора, разделенной на относительную активность, или эффективность, или EC50Q относительно GIP рецептора, является менее чем или равным приблизительно V, где V выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 или 5. В некоторых вариантах осуществления отношение EC50, или эффективности, или относительной активности Y относительно ядерного гормонального рецептора, разделенной на EC50, или эффективность, или относительную активность Q относительно GIP рецептора, является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления отношение эффективности относительно ядерного гормонального рецептора Y к GIP эффективности Q является менее чем или равным приблизительно W, где W выбран из 100, 75, 60, 50, 40, 30, 20, 15, 10 и 5. В некоторых вариантах осуществления отношение эффективности относительно ядерного гормонального рецептора Y к GIP эффективности Q является меньшим, чем 5 (например, приблизительно 4, приблизительно 3, приблизительно 2, приблизительно 1). В некоторых вариантах осуществления Y обладает EC50 относительно ядерного гормонального рецептора, которая является приблизительно в 2-10 раз (например, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз) большей, чем EC50Q относительно GIP рецептора.
В некоторых вариантах осуществления Y обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности эндогенного лиганда относительно ядерного гормонального рецептора (эффективность относительно ядерного гормонального рецептора), и Q обладает по меньшей мере 0,1% (например, приблизительно 0,5% или более, приблизительно 1% или более, приблизительно 5% или более, приблизительно 10% или более, или более) активности нативного GIP относительно GIP рецептора (GIP эффективность).
Пролекарства Q-L-Y
В некоторых аспектах настоящего изобретения обеспечивают пролекарства Q-L-Y, где пролекарство содержит дипептидный пролекарственный компонент (A-B), ковалентно связанный с активным участком Q амидной связью, как описано в международной патентной заявке PCT US09/68745 (поданной 18 декабря 2009), которая включена в настоящем изобретении с помощью ссылки во всей ее полноте. Последующее удаление дипептида в физиологических условиях и в отсутствие ферментативной активности, восстанавливает полную активность Q-L-Y конъюгата.
В некоторых вариантах осуществления обеспечивают пролекарство Q-L-Y, имеющее общую структуру A-B-Q-L-Y. В данных вариантах осуществления A представляет собой аминокислоту или гидроксикислоту, и B представляет собой N-алкилированную аминокислоту, соединенную с Q образованием амидной связи между карбоксилом B (в A-B) и амином Q. Кроме того, в некоторых вариантах осуществления A, B или аминокислота Q, с которое соединены A-B, представляет собой некодируемую аминокислоту, и химическое отщепление A-B от Q протекает по меньшей мере приблизительно на 90% в пределах от приблизительно 1 до приблизительно 720 часов в PBS в физиологических условиях. В другом варианте осуществления химическое отщепление A-B от Q протекает по меньшей мере приблизительно на 50% в пределах приблизительно 1 часа или приблизительно 1 недели PBS в физиологических условиях.
В одном варианте осуществления дипептидный пролекарственный фрагмент (A-B) включает соединение, имеющее общую структуру, указанную ниже:

где
R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, С1-С18 алкила, С2-С18 алкенила, (С1-С18 алкил)OH, (С1-С18 алкил)SH, (C2-C3 алкил)SCH3, (С1-С4 алкил)CONH2, (С1-C4 алкил)COOH, (С1-C4 алкил)NH2, (С1-C4 алкил)NHC(NH2+)NH2, (C0-C4 алкил)(C3-C6циклоалкила), (C0-C4 алкил)(C2-C5 гетероциклил), (C0-C4 алкил)(C6-C10 арил)R7, (С1-C4 алкил)(C3-C9гетероарил) и С1-C12 алкил(W1)С1-C12 алкила, где W1 представляет собой гетероатом, выбранный из группы, состоящей из N, S и O, или R1И R2 вместе с атомами, с которыми они соединены, образуют C3-C12 циклоалкил; или R4 и R8 вместе с атомами, с которыми они соединены, образуют C3-C6 циклоалкил;
R3 выбрана из группы, состоящей из С1-С18 алкила, (С1-С18 алкил)OH, (С1-С18алкил)NH2, (С1-C18 алкил)SH, (C0-C4 алкил)(C3-C6)циклоалкила, (C0-C4 алкил)(C2-C5 гетероциклил), (C0-C4 алкил)(C6-C10 арил)R7 и (С1-C4 алкил)(C3-C9 гетероарил), или R4 и R3 вместе с атомами, с которыми они соединены, образуют 4, 5 или 6-членное гетероциклическое кольцо;
R5 представляет собой NHR6 или OH;
R6 представляет собой H, С1-C8 алкил, или R6 и R1 вместе с атомами, с которыми они соединены, образуют 4, 5 или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, С1-С18 алкила, С2-С18 алкенила, (C0-C4 алкил)CONH2, (C0-C4 алкил)COOH, (C0-C4 алкил)NH2, (C0-C4 алкил)OH и галогена.
В некоторых вариантах осуществления дипептидный пролекарственный фрагмент соединен с амино концом Q. В других вариантах осуществления дипептидное пролекарство соединено с аминокислотой внутри последовательности Q, как описано в международной патентной заявке PCT US09/68745.
Примерные варианты осуществления Q-L-Y
В некоторых вариантах осуществления настоящего изобретения конъюгаты пептидов глюкагонового суперсемейства могут быть представлены следующей формулы:
Q-L-Y
где Q представляет собой пептид глюкагонового суперсемейства, Y представляет собой NHR лиганд, и L представляет собой связывающую группу или связь.
В конкретных аспектах Q содержит аминокислотную последовательность, которая основана на аминокислотной последовательности нативного человеческого GLP-1 (SEQ ID NO: 1603). В некоторых аспектах Q содержит модифицированную аминокислотную последовательность SEQ ID NO: 1603, содержащую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, и в ряде случаев 16 или более (например, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.), аминокислотных модификаций и вплоть до 1, вплоть до 2, вплоть до 3, вплоть до 4, вплоть до 5, вплоть до 6, вплоть до 7, вплоть до 8, вплоть до 9, или вплоть до 10 аминокислотных модификаций (например, ацилирование, алкилирование, пегилирование, укорачивание на C-конце, замещение) по сравнению с нативной человеческой GLP-1 последовательностью (SEQ ID NO: 1603). Например, Q может представлять собой GLP-1(Aib2E16CexK40) (SEQ ID NO: 1647), GLP-1(Aib2A22CexK40) (SEQ ID NO: 1648), dGLP-1(A1Aib2A22CexK40) (SEQ ID NO: 1649), GLP-1(Aib2E16C24(PEG-40кДа)CexK40) (SEQ ID NO: 1650).
В конкретных аспектах Y представляет собой стероид или его производное и воздействует на эстрогеновый рецептор, андрогеновый рецептор, глюкокортикоидный рецептор или RAR-родственный орфановый рецептор. В некоторых вариантах осуществления Y содержит структуру, которая обеспечивает или способствует агонистической активности относительно эстрогенового рецептора, андрогенового рецептора, глюкокортикоидного рецептора или RAR-родственного орфанового рецептора, тогда как в других вариантах осуществления Y представляет собой антагонист эстрогенового рецептора, андрогенового рецептора, глюкокортикоидного рецептора или RAR-родственного орфанового рецептора. Например, Y может представлять собой эстрадиол, эстроген или холестерин.
В конкретных аспектах L является стабильным in vivo. В некоторых вариантах осуществления L содержит, например, амид, эфир, карбамат или тиоэфир. В альтернативных аспектах L может подвергаться гидролизу in vivo. В некоторых вариантах осуществления L содержит сложный эфир, ангидрид или тиоэфир. В других аспектах, L является нестабильным in vivo. В некоторых аспектах L является кислотолабильным (например, содержащим гидразоновую группу), чувствительным к восстановлению (например, содержащим дисульфидную группу), или фермент-лабильным (например, содержащим группу, расщепляемую катепсином B).
Неограничивающие примеры пептидов глюкагонового суперсемейства на основе GLP-1, конъюгированных с эстрадиолом через стабильную связь, показаны ниже (SEQ ID NO: 1651-1654, 1667).


Неограничивающие примеры пептидов глюкагонового суперсемейства на основе GLP-1, конъюгированных с холестерином через стабильную связь, показаны ниже (SEQ ID NO: 1660-1661).

Неограничивающие примеры пептидов глюкагонового суперсемейства на основе GLP-1, конъюгированных с эстрадиолом или эстрогеном через гидролизуемую связь, показаны ниже (SEQ ID NO: 1655-1659, 1666).



Неограничивающие примеры пептидов глюкагонового суперсемейства на основе GLP-1, конъюгированных с эстрадиолом через кислотолабильную связь, показаны ниже (SEQ ID NO: 1662).

Неограничивающие примеры пептидов глюкагонового суперсемейства на основе GLP-1, конъюгированных с эстрадиолом через связь, чувствительную к восстановлению, показаны ниже (SEQ ID NO: 1663-1664).

Неограничивающие примеры пептидов глюкагонового суперсемейства на основе GLP-1, конъюгированных с эстрадиолом через фермент-лабильную связь, показаны ниже (SEQ ID NO: 1665, 1668).

В некоторых вариантах осуществления любая из SEQ ID NO: 1-760, 801-919, 1001-1275, 1301-1371, 1401-1518, 1601-1646 может замещать SEQ ID NO: 1647-1650 в приведенных выше примерных вариантах осуществления.
Данные в настоящем изобретении подтверждают, что конъюгаты, содержащие пептиды глюкагонового суперсемейства настоящего изобретения (Q) и эстроген (Y), обладают синергической фармакологией. Q часть данных конъюгатов может действовать для направленной доставки эстрогеновой части конъюгата к мишеням требуемого действия и вдали от классических гинекологических тканей, получая в результате улучшенный контроль за уровнем глюкозы в крови и энергетический гомеостаз, со значительно повышенным терапевтическим индексом.
Дисфункция β-клеток поджелудочной железы характеризуется прекращением биосинтеза и секреции инсулина в комбинации с снижением функциональной массы β-клеток в результате апоптоза, которая является результатом хронического окисления глюкозы и липидов (гликолипотоксичность) вместе с компенсаторной гиперфункцией (ER стресс). Поскольку диабет 2 типа является результатом дисфункции β-клеток, стратегии, направленные на защиту инсулин-продуцирующих β-клеток от апоптоза или восстановление функциональной массы β-клеток представляют собой основную возможность терапевтического воздействия при лечении диабета 2 типа.
Эстроген обладает сильными антиапоптозными эффектами в β-клетках грызунов и человека, а также в других тканях-мишенях в теле. Внепанкреатическое функционирование эстрогена в печени по подавлению липогенеза и восстановлению чувствительности к инсулину может опосредованно улучшать функционирование β-клеток. Он также может воздействовать на гипоталамус, снижая потребление пищи и увеличивая расход энергии. Однако данные эффекты эстрогена могут быть вредными в гинекологических тканях-мишенях, поскольку показано, что гормонозаместительная терапия увеличивает вероятность возникновения рака молочной железы. Не желая быть связанными какой-либо конкретной теорией, селективно направленное воздействие эстрогена на β-клетки, печень, и/или гипоталамус может быть полезным.
Клиническое применение эстрогена ограничено в связи с боязнью его онкогенного потенциала и гинекологического действия. Для повышения терапевтического индекса эстрогена, конъюгаты на основе инкретина настоящего изобретения обеспечивают селективной направленной доставкой эстрогена в требуемые ткани при сведении до минимума воздействия на молочную железу и эндометриальные ткани. Данные в примерах в настоящем изобретении демонстрируют, что конъюгаты пептидов глюкагонового суперсемейства и эстрогена обладают синергическим, благоприятным воздействием на контроль за уровнем глюкозы в крови (например, как измерено пониженными концентрациями глюкозы) и на энергетический гомеостаз (например, как измерено пониженным весом тела и/или жировой массы) смешанной инсулинотропной и анаболической активностями в панкреатических бета-клетках с анорексическим эффектом в гипоталамусе.
Для исследования способности каждого отдельного компонента конъюгата (например, GLP-1 части и эстрогеновой части) в отношении регулирования глюкозы в крови и веса тела, получали ряд пептид-эстрогеновых конъюгатов, обладающих полным GLP-1 агонизмом в диапазоне от менее чем 0,1% до более чем 100% in vitro активности и с линкерной химией (стабильной, лабильной и нестабильной), которая обеспечивала дифференцированное высвобождение эстрогена в плазме. Специфическое высвобождение эстрогена определяли для широкого диапазона от химических форм, которые были стабильными, до других форм, которые полностью высвобождали эстроген в течение нескольких часов.
Например, закономерно оказалось, что у мышей с алиментарным ожирением полностью активный GLP-1 агонист со стабильной связью с эстрогеном является более эффективным по снижению глюкозы в крови и веса тела, чем сравнительный GLP-1 контроль. Оказалось, что стабильные эстроген-пептидные конъюгаты лишены классической эстрогеновой активности, как оценено отсутствием утеротрофной активности у мышей после овариэктомии, тогда как лабильные эстроген-пептидные конъюгаты обладали трофической активностью в матке. Химические производные, которые «выключали» GLP-1 агонизм и/или придавали эстрогеновую лабильность в плазме, демонстрировали меньшую эффективность, чем стабильные GLP-1/эстрогеновые конъюгаты, указывая на то, что комбинированное наличие GLP-1 и «направленного» эстрогена может приводить к превосходному снижению глюкозы и веса тела.
"Мета"-стабильные пептид-эстрогеновые конъюгаты, которые получали, являются стабильными в плазме, но способны высвобождать эстроген после проникновения в клетку. Данные конъюгаты пептида глюкагонового суперсемейства и эстрогена с нестабильными связями были способны снижать концентрации глюкозы и вес тела в большей степени, чем конъюгаты с лабильными связями, при отсутствии вредной утеротрофной активности.
Пептиды глюкагонового суперсемейства, которые были стабильно или метастабильно соединены с эстрогеном, закономерно демонстрировали повышенную эффективность по снижению веса тела, потребления пищи и жировой массы при ожирении у недиабетических мышей по сравнению с подходящем контролем. Данная повышенная активность отсутствует у конъюгатов, когда эстроген является фармакологически лабильным, и она не наблюдается у конъюгатов, когда пептид глюкагонового суперсемейства является целенаправленно неактивным. Стабильное и нестабильное присоединение эстрогена к пептидам глюкагонового суперсемейства дифференциально не обладало эстрогеновой активностью по сравнению с лабильными конъюгатами и, в противоположность лабильным конъюгатам, не приводило к росту матки. В совокупности, данные находки демонстрируют повышенную эффективность конъюгатов со стабильной и метастабильной связью между пептидом глюкагонового суперсемейства и эстрогеном настоящего изобретения у мышей с ожирением и метаболическими нарушениями без данных о классическом эстрогеновом эффекте, который ограничивает медицинское применение эстрогена.
В примерных вариантах осуществления конъюгаты являются пригодными для лечения любого из состояний, описанных в настоящем изобретении, включая, но не ограничиваясь этим, гипергликемическое заболевание, ожирение, метаболический синдром и NAFLD.
Фармацевтические композиции
Соли
В некоторых вариантах осуществления Q-L-Y конъюгаты, описанные в настоящем изобретении, находятся в форме соли, например, фармацевтически приемлемой соли. Как применяют в настоящем изобретении, термин "фармацевтически приемлемая соль" относится к солям соединений, которые сохраняют биологическую активность исходного соединения и которые не являются биологически или иначе нежелательными. Данные соли можно получить in situ при конечном выделении и очистки конъюгата, или отдельно получить реакцией свободного основания с подходящей кислотой. Многие соединения, описанные в настоящем изобретении, способны образовывать кислые и/или основные соли за счет наличия амино и/или карбоксильных групп или аналогичных им групп.
Фармацевтически приемлемые соли присоединения кислот можно получить из органических и неорганических кислот. Примерные соли присоединения кислот включают, но не ограничиваясь этим, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат (изотионат), лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмитат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глютамат, бикарбонат, п-толуолсульфонат и ундеканоат. Соли, полученные из неорганических кислот, включают хлористоводродную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и подобные. Соли, полученные из органических кислот, включают уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфокислоту, этансульфокислоту, п-толуолсульфокислоту, салициловую кислоту и подобные. Примеры кислот, которые можно применять для получения фармацевтически приемлемых солей присоединения кислот, включают, например, неорганические кислоты, например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту и фосфорную кислоту, и органические кислоты, например, щавелевую кислоту, малеиновую кислоту, янтарную кислоту и лимонную кислоту.
Соли присоединения оснований можно также получить in situ при конечном выделении и очистки источника салициловой кислоты или реакцией фрагмента, содержащего карбоксильную группу, с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла или с аммиаком или органическим первичным, вторичным или третичным амином. Фармацевтически приемлемые соли включают, но не ограничиваясь этим, катионы на основе щелочных металлов или щелочноземельных металлов, такие как соли лития, натрия, калия, кальция, магния и алюминия и подобные, и нетоксичные четвертичные аммониевые и аминовые катионы, включая аммоний, тетраметиламмоний, тетраэтиламмоний, метиламмоний, диметиламмоний, триметиламмоний, триэтиламмоний, диэтиламмоний и этиламмоний, среди прочих. Другие типичные органические амины, пригодные для получения солей присоединения основания, включают, например, этилендиамин, этаноламин, диэтаноламин, пиперидин, пиперазин и подобные. Соли, полученные из органических оснований, включают, но не ограничиваясь этим, соли первичных, вторичных и третичных аминов.
Кроме того, группы, содержащие основный атом азота, можно кватернизировать конъюгатом настоящего описания в виде галогенидов низших алкилов, таких как метил-, этил-, пропил- и бутилхлориды, бромиды и йодиды; галогенидов длинноцепочечных алкилов, таких как децил-, лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; арилалкилгалогенидов, таких как бензил и фенэтилбромиды и другие. Таким образом, получают растворимые в воде или масле или диспергируемые продукты.
Составы
В соответствии с некоторыми вариантами осуществления обеспечивают фармацевтическую композицию, где композиция содержит Q-L-Y конъюгат настоящего описания или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Фармацевтическая композиция может содержать фармацевтически приемлемый ингредиент, включая, например, подкисляющие агенты, добавки, адсорбенты, аэрозольные пропелленты, агенты для вытеснения воздуха, подщелачивающие агенты, антикомкователи, антикоагулянты, противомикробные консерванты, антиоксиданты, антисептики, основы, связующие, буферные агенты, хелатирующие агенты, агенты для покрытия, красители, осушители, детергенты, разбавители, дезинфицирующие средства, разрыхлители, диспергирующие агенты, агенты, повышающие растворимость, красители, смягчающие вещества, эмульгаторы, стабилизаторы эмульсии, наполнители, пленкообразующие агенты, усилители вкуса, ароматизаторы, агенты, препятствующие слеживанию и комкованию, желатинирующие агенты, гранулирующие агенты, увлажнители, смазывающие агенты, мукоадгезивы, мазевые основы, мази, жирные среды, органические основания, основы для гранул, пигменты, пластификаторы, глянцующие агенты, консерванты, связывающие агенты, агенты, способствующие проникновению через кожу, солюбилизирующие агенты, растворители, стабилизирующие агенты, основы для суппозиториев, поверхностно-активные вещества, сурфактанты, суспендирующие агенты, подсластители, терапевтические агенты, загустители, агенты, регулирующие тоничность, агенты, регулирующие токсичность, агенты, повышающие вязкость, агенты, поглощающие воду, смешивающиеся с водой сорастворители, смягчители воды или увлажняющие агенты.
В некоторых вариантах осуществления фармацевтическая композиция содержит любой один или комбинацию из следующих компонентов: камедь, ацесульфам калия, ацетилтрибутилцитрат, ацетилтриэтилцитрат, агар, альбумин, спирт, абсолютный спирт, денатурированный спирт, разбавленный спирт, алевритовая кислота, альгиновая кислота, алифатические полиэфиры, оксид алюминия, гидроксид алюминия, стеарат алюминия, амилопектин, α-амилоза, аскорбиновая кислота, аскорбилпальмитат, аспартам, бактериостатическая вода для инъекций, бентонит, бентонитная взвесь, хлорид бензалкония, хлорид бензетония, бензойная кислота, бензиловый спирт, бензилбензоат, бронопол, бутилированный гидроксианизол, бутилированный гидрокситолуол, бутилпарабен, бутилпарабен натрия, альгинат кальция, аскорбат кальция, карбонат кальция, цикламат кальция, безводный диосновный фосфат кальция, диосновный дегидратированный фосфат кальция, трехосновный фосфат кальция, пропионат кальция, силикат кальция, сорбат кальция, стеарат кальция, сульфат кальция, полугидрат сульфата кальция, рапсовое масло, карбомер, диоксид углерода, карбоксиметилцеллюлоза кальция, карбоксиметилцеллюлоза натрия, β-каротин, каррагинан, касторовое масло, гидрогенизированное касторовое масло, катионный эмульсионный воск, ацетат целлюллозы, ацетатфталат целлюлозы, этилцеллюлоза, микрокристаллическая целлюлоза, порошкообразная целлюлоза, окремненная микрокристаллическая целлюлоза, карбоксиметилцеллюлоза натрия, цетостеариловый спирт, цетримид, цетиловый спирт, хлоргексидин, хлорбутанол, хлоркрезол, холестерин, ацетат хлоргексидина, глюконат хлоргексидина, раствор гидрохлорида хлоргексидина, хлордифтопентан (HCFC), хлордифторметан, хлорфторуглероды (CFC), хлорфеноксиэтанол, хлороксиленол, кукурузная патока, безводная лимонная кислота, моногидрат лимонной кислоты, масло какао, красители, кукурузное масло, хлопковое масло, крезол, м-крезол, о-крезол, п-крезол, кроскармеллоза натрия, кросповидон, цикламовая кислота, циклодекстрины, декстраты, декстрин, глюкоза, безводная декстроза, диазолидинилмочевина, дибутилфталат, дибутилсебацат, диэтаноламин, диэтилфталат, дифторпентан (HFC), диметил-п-циклодекстрин, соединения циклодекстринового типа, такие как Captisol®, диметиловый эфир, диметилфталат, эдентат дикалия, эдентат динатрия, гидрофосфат динатрия, докузат кальция, докузат калия, докузат натрия, галлат додецилсульфата, бромид додецилтриметиламмония, эдентат кальция динатрия, этилендиаминтетрауксусная кислота, эглюмин, этиловый спирт, этилцеллюлоза, этилгаллат, этиллаурат, этилмальтол, этилолеат, этилпарабен, этилпарабен калия, этилпарабен натрия, этилванилин, фруктоза, жидкая фруктоза, измельченная фруктоза, апирогенная фруктоза, порошкообразная фруктоза, фумаровая кислота, желатин, глюкоза, жидкая глюкоза, глицеридные смеси насыщенных растительных жирных кислот, глицерин, глицерилбегенат, глицерилмоноолеат, глицерилмоностеарат, самоэмульгирующийся глицерилмоностеарат, глицерилпальмитостеарат, глицин, гликоли, гликофурол, гуаровая камедь, гептафторпропан (HFC), бромид гексадецилтриметиламмония, сироп с высоким содержанием фруктозы, альбумин сыворотки человека, углеводороды (HC), разбавленная хлористоводородная кислота, гидрогенизированное растительное масло II типа, гидроксиэтилцеллюлоза, 2-гидроксиэтил-β-циклодекстрин, гидроксипропилцеллюлоза, гидроксипропилцеллюлоза с низкой степенью замещения, 2-гидроксипропил-β-циклодекстрин, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, имидомочевина, индиго кармин, иониты, оксиды железа, изопропиловый спирт, изопропилмиристат, изопропилпальмитат, изотонический солевой раствор, каолин, молочная кислота, лактит, лактоза, ланолин, ланолиновые спирты, безводный ланолин, лецитин, силикат магния алюминия, карбонат магния, нормальный карбонат магния, безводный карбонат магния, карбонат гидроксид магния, гидроксид магния, лаурилсульфат магния, оксид магния, силикат магния, стеарат магния, трисиликат магния, безводный трисиликат магния, яблочная кислота, солод, мальтит, раствор мальтита, мальтодекстрин, мальтол, мальтоза, маннит, триглицериды со средней длиной цепей, меглумин, ментол, метилцеллюлоза, метилметакрилат, метилолеат, метилпарабен, метилпарабен калия, метилпарабен натрия, микрокристаллическая целлюлоза и карбоксиметилцеллюлоза натрия, минеральное масло, светлое минеральное масло, минеральное масло и ланолиновые спирты, масло, оливковое масло, моноэтаноламин, монтмориллонит, октилгаллат, олеиновая кислота, пальмитиновая кислота, парафин, арахисовое масло, вазелин, вазелин и ланолиновые спирты, фармацевтическая глазурь, фенол, сжиженный фенол, феноксиэтанол, феноксипропанол, фенилэтиловый спирт, фенилмеркурацетат, фенилмеркурборат, фенилмеркурнитрат, полакрилин, полакрилин калия, полоксамер, полидекстроза, полиэтиленгликоль, полиэтиленоксид, полиакрилаты, полиэтилен-полиоксипропиленовые блочные полимеры, полиметакрилаты, полиоксиэтиленалкиловые эфиры, производные полиоксиэтиленкасторового масла, эфиры жирных кислот и полиоксиэтиленсорбитола, полиоксиэтиленстеараты, поливиниловые спирты, поливинилпирролидон, альгинат калия, бензоат калия, бикарбонат калия, бисульфит калия, хлорид калия, цитрат калия, безводный цитрат калия, гидрофосфат калия, метабисульфит калия, моноосновный фосфат калия, пропионат калия, сорбат калия, повидон, пропанол, пропионовая кислота, пропиленкарбонат, пропиленгликоль, альгинат пропиленгликоля, пропилгаллат, пропилпарабен, пропилпарабен калия, пропилпарабен натрия, сульфат протамина, рапсовое масло, раствор Рингера, сахарин, сахарин аммония, сахарин кальция, сахарин натрия, сафлоровое масло, сапонит, сывороточные белки, кунжутное масло, коллоидный диоксид кремния, коллоидный диоксид кремния, альгинат натрия, аскорбат натрия, бензоат натрия, бикарбонат натрия, бисульфит натрия, хлорид натрия, безводный цитрат натрия, дегидратированный цитрат натрия, хлорид натрия, цикламат натрия, эдентат натрия, додецилсульфат натрия, лаурилсульфат натрия, метабисульфит натрия, фосфат натрия, диосновный фосфат натрия, моноосновный фосфат натрия, триосновный фосфат натрия, безводный пропионат натрия, пропионат натрия, сорбат натрия, крахмалгликолят натрия, стеарилфумарат натрия, сульфит натрия, сорбиновая кислота, сорбитановые эфиры (сорбитановые жирные эфиры), сорбитол, 70% раствор сорбитола, соевое масло, спермацетовый воск, крахмал, кукурузный крахмал, картофельный крахмал, предварительно желатинизированный крахмал, стерилизуемый кукурузный крахмал, стеариновая кислота, очищенная стеариновая кислота, стеариловый спирт, сахароза, сахара, прессованный сахар, кондитерский сахар, сахарные сферы, инвертный сахар, Sugartab, желтый закат PCF, синтетический парафин, тальк, винная кислота, тартразин, тетрафторэтан (HFC), масло какао, тимеросал, диоксид титана, альфа-токоферол, ацетат токоферола, сукцинат альфа-токоферольной кислоты, бета-токоферол, дельта-токоферол, гамма-токоферол, трагакант, триацетин, трибутилцитрат, триэтаноламин, триэтилцитрат, триметил-β-циклодекстрин, бромид триметилтетрадециламмония, трис-буфер, эдентат тринатрия, ванилин, гидрогенизированное растительное масло I типа, вода, мягкая вода, жесткая вода, вода, не содержащая диоксида углерода, апирогенная вода, вода для инъекций, стерильная вода для ингаляций, стерильная вода для инъекций, стерильная вода для орошения, воски, анионный эмульсионный воск, карнаубский воск, катионный эмульсионный воск, цетилэфирный воск, микрокристаллический воск, неионный эмульсионный воск, воск для суппозиториев, белый воск, желтый воск, белый вазелин, ланолин, ксантановая камедь, ксилит, зеин, пропионат цинка, соли цинка, стеарат цинка или любой наполнитель в Handbook of Pharmaceutical Excipients, Third Edition, A. H. Kibbe (Pharmaceutical Press, London, UK, 2000), который ввключен с помощью ссылки во всей его полноте. Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980), который включен с помощью ссылки во всей его полноте, описывает различные компоненты, применяемые в формулировании фармацевтически приемлемых композиций, и известные способы их получения. За исключением случаев, когда любой общепринятый компонент является несовместимым с фармацевтическими композициями, предусмотрено его применение в фармацевтических композициях. Дополнительные активные ингредиенты также можно вводить в композиции.
В некоторых вариантах осуществления указанный выше компонент(-ы) может присутствовать в фармацевтической композиции при любой концентрации, такой как, например, по меньшей мере A, где A равен 0,0001% масс./об., 0,001% масс./об., 0,01% масс./об., 0,1% масс./об., 1% масс./об., 2% масс./об., 5% масс./об., 10% масс./об., 20% масс./об., 30% масс./об., 40% масс./об., 50% масс./об., 60% масс./об., 70% масс./об., 80% масс./об. или 90% масс./об. В некоторых вариантах осуществления указанный выше компонент(ы) может присутствовать в фармацевтической композиции при любой концентрации, такой как, например, самое большее B, где B равно 90% масс./об., 80% масс./об., 70% масс./об., 60% масс./об., 50% масс./об., 40% масс./об., 30% масс./об., 20% масс./об., 10% масс./об., 5% масс./об., 2% масс./об., 1% масс./об., 0,1% масс./об., 0,001% масс./об. или 0,0001%. В некоторых вариантах осуществления указанный выше компонент(-ы) может присутствовать в фармацевтической композиции в диапазоне концентраций, таком как, например, от приблизительно A до приблизительно B. В некоторых вариантах осуществления A равен 0,0001%, и B равно 90%.
Фармацевтические композиции можно формулировать для достижения физиологически совместимого pH. В некоторых вариантах осуществления pH фармацевтической композиции может составлять по меньшей мере 5, по меньшей мере 5,5, по меньшей мере 6, по меньшей мере 6,5, по меньшей мере 7, по меньшей мере 7,5, по меньшей мере 8, по меньшей мере 8,5, по меньшей мере 9, по меньшей мере 9,5, по меньшей мере 10 или по меньшей мере 10,5, вплоть до и включая pH 11, в зависимости от состава и пути введения. В определенных вариантах осуществления фармацевтические композиции могут содержать буферные агенты для достижения физиологически совместимого pH. Буферные агенты могут включать любые соединения, способные доводить pH до требуемого значения, такие как, например, фосфатные буферы (например, PBS), триэтаноламин, трис-буфер, бицин, TAPS, трицин, HEPES, TES, MOPS, PIPES, какодилат, MES и другие. В определенных вариантах осуществления концентрация буфера составляет по меньшей мере 0,5 мМ, по меньшей мере 1 мМ, по меньшей мере 5 мМ, по меньшей мере 10 мМ, по меньшей мере 20 мМ, по меньшей мере 30 мМ, по меньшей мере 40 мМ, по меньшей мере 50 мМ, по меньшей мере 60 мМ, по меньшей мере 70 мМ, по меньшей мере 80 мМ, по меньшей мере 90 мМ, по меньшей мере 100 мМ, по меньшей мере 120 мМ, по меньшей мере 150 мМ или по меньшей мере 200 мМ. В некоторых вариантах осуществления концентрация буфера составляет не более чем 300 мМ (например, самое большее 200 мМ, самое большее 100 мМ, самое большее 90 мМ, самое большее 80 мМ, самое большее 70 мМ, самое большее 60 мМ, самое большее 50 мМ, самое большее 40 мМ, самое большее 30 мМ, самое большее 20 мМ, самое большее 10 мМ, самое большее 5 мМ, самое большее 1 мМ).
Пути введения
Следующее обсуждение путей введения приводится только с целью проиллюстрировать примерные варианты осуществления, и его не следует истолковывать как ограничивающее объем любым способом.
Составы, подходящие для перорального введения могут состоять из (a) жидких растворов, таких как эффективное количество конъюгата настоящего описания, растворенное в разбавителе, таком как вода, соляной раствор или апельсиновый сок; (b) капсул, саше, таблеток, таблеток для рассасывания и пастилок, каждое из которых содержит предварительно определенное количество активного ингредиента, в виде твердых веществ или гранул; (c) порошков; (d) суспензий в подходящей жидкости; и (e) подходящих эмульсий. Жидкие составы могут содержать разбавители, такие как вода и спирты, например, этанол, бензиловый спирт и полиэтиленовые спирты, или с или без добавления фармацевтически приемлемого поверхностно-активного вещества. Капсульные формы могут представлять собой стандартные твердые или мягкие желатиновые капсулы, содержащие, например, поверхностно-активные вещества, смазывающие вещества и инертные наполнители, такие как лактоза, сахароза, фосфат кальция и кукурузный крахмал. Формы таблеток могут содержать один или более из лактозы, сахарозы, маннитола, кукурузного крахмала, картофельного крахмала, альгиновой кислоты, микрокристаллической целлюлозы, камеди, желатина, гуаровой камеди, коллоидного диоксида кремния, кроскармеллозы натрия, талька, стеарата магния, стеарата кальция, стеарата цинка, стеариновой кислоты, и других наполнителей, красителей, растворителей, буферных агентов, разрыхлителей, увлажняющих агентов, консервантов, ароматизаторов и других фармакологически совместимых наполнителей. Формы таблеток для рассасывания могут включать конъюгат настоящего описания в ароматической добавке, обычно сахарозе и камеди или трагаканте, а также пастилки, содержащие конъюгат настоящего описания в инертной основе, такой как желатин и глицерин, или сахарозе и камеди, эмульсии, гели и подобные, содержащие, в добавление, такие вспомогательные вещества, которые являются известными в данной области техники.
Конъюгаты настоящего изобретения, отдельно или в комбинации с другими подходящими компонентами, можно доставлять пульмональным введением и можно получать в виде аэрозольных составов для введения ингаляцией. Данные аэрозольные составы можно помещать в находящиеся под давлением приемлемые пропелленты, такие как дихлордифторметан, пропан, азот и подобные. Их можно формулировать в виде фармацевтических средств для препаратов не под давлением, таких как ингалятор или аэрозольный аппарат. Данный спреевые составы можно также применять для опрыскивания слизистой оболочки. В некоторых вариантах осуществления конъюгат формулируют в виде порошковой смеси или в виде микрокапсул или наночастиц. Подходящие пульмональные составы являются известными в данной области техники. См., например, Qian et al., Int J Pharm 366: 218-220 (2009); Adjei and Garren, Pharmaceutical Research, 7(6): 565-569 (1990); Kawashima et al., J Controlled Release 62(1-2): 279-287 (1999); Liu et al., Pharm Res 10(2): 228-232 (1993); опубликованную международную патентную заявку WO 2007/133747 и WO 2007/141411.
Составы, подходящие для парентерального введения, включают водные и неводные, изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостаты и жидкие фазы, которые придают составам изотоничность крови предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. Термин "парентеральное" обозначает не через желудочно-кишечный тракт, но некоторыми другими путями, такими как подкожно, внутримышечно, интраспинально или внутривенно. Конъюгат настоящего описания можно вводить с физиологически приемлемым разбавителем в фармацевтическом носителе, таком как стерильная жидкость или смесь жидкостей, включая воду, соляной раствор, водную декстрозу и растворы родственных сахаров, спирт, такой как этанол или гексадециловый спирт, гликоль, такой как пропиленгликоль или полиэтиленгликоль, диметилсульфоксид, глицерин, кетали, такие как 2,2-диметил-153-диоксолан-4-метанол, эфиры, поли(этиленгликоль) 400, масла, жирные кислоты, эфиры или глицериды жирных кислот, или ацетилированные глицериды жирных кислот с или без добавления фармацевтически приемлемого поверхностно-активного вещества, такого как мыло или детергент, суспендирующего агента, такого как пектин, карбомеры, метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза, или эмульгаторов и других фармацевтических вспомогательных веществ.
Масла, которые можно применять в парентеральных составах включают нефтяные, животные, растительные или синтетические масла. Конкретные примеры масел включают арахисовое, соевое, кунжутное, хлопковое, кукурузное, оливковое, вазелиновое и минеральное масло. Подходящие жирные кислоты для применения в парентеральных составах включают олеиновую кислоту, стеариновую кислоту и изостеариновую кислоту. Этилолеат и изопропилмиристат являются примерами подходящих эфиров жирных кислот.
Подходящие мыла для применения в парентеральных составах включают соли жирных кислот и щелочного металла, аммония и триэтаноламина, и подходящие детергенты включают (a) катионные детергенты, такие как, например, галогениды диметилдиалкиламмония и галогениды алкилпиридиния, (b) анионные детергенты, такие как, например, сульфонаты алкила, арила и олефина, сульфаты алкила, олефина, эфира и моноглицерида, и сульфосукцинаты, (c) неионные детергенты, такие как, например, оксиды жирного амина, алканоламиды жирных кислот и полиоксиэтиленполипропиленовые сополимеры, (d) амфотерные детергенты, такие как, например, алкил-п-аминопропионаты и соли 2-алкилимидазолин четвертичного аммония, и (e) их смеси.
Парентеральные составы будут обычно содержать от приблизительно 0,5% до приблизительно 25% по весу Q-L-Y конъюгата настоящего описания в растворе. Можно применять консерванты и буферы. Для того чтобы снизить до минимума или устранить раздражение в месте инъекции, данная композиция может содержать один или более неионных поверхностно-активных веществ, имеющих гидролипидный баланс (HLB) от приблизительно 12 до приблизительно 17. Количество поверхностно-активного вещества в данных составах будет обычно находиться в диапазоне от приблизительно 5% до приблизительно 15% по весу. Подходящие поверхностно-активные вещества включают эфиры полиэтиленгликольсорбитана и жирных кислот, такие как сорбитанмоноолеат, и высокомолекулярные аддукты этиленоксида с гидрофобным основным основанием, образующиеся конденсацией пропиленоксида с пропиленгликолем. Парентеральные составы могут находиться в контейнерах с одной дозой или множеством доз, таких как ампулы и пробирки, и их можно хранить в лиофилизированном состоянии, требующем только добавления стерильного жидкого вспомогательного вещества, например, воды, для инъекций, непосредственно перед применением. Приготовленные для немедленного введения растворы для инъекции и суспензии можно получить из стерильных порошков, гранул и таблеток типа, описанного ранее.
Инъецируемые составы находятся в соответствии с настоящим изобретением. Требования к эффективным фармацевтическим носителям для инъецируемых композициях являются хорошо известными специалистам в данной области техники (см., например, Pharmaceutics and Pharmacy Practice, J. B. Lippincott Company, Philadelphia, PA, Banker and Chalmers, eds., страницы 238-250 (1982), и ASHP Handbook on Injectable Drugs, Toissel, 4th ed., страницы 622-630 (1986)).
Кроме того, конъюгат настоящего описания можно получить в виде суппозиториев для ректального введения смешением ряда основ, таких как эмульгирующие основы или растворимые в воде основы. Составы, подходящие для вагинального введения, могут представлять собой пессарии, тампоны, кремы, гели, пасты, пены или составы на основе спрея, содержащие, в добавление к активному ингредиенту, такие носители, которые являются известными в данной области техники как подходящие.
Специалисту в данной области техники ясно, что в добавление к описанным выше фармацевтических композициям, конъюгат настоящего изобретения можно формулировать в виде комплексов включения, таких как циклодекстриновые комплексы включения или липосомы.
Доза
Полагают, что Q-L-Y конъюгаты настоящего изобретения являются пригодными в способах лечения заболевания или медицинского состояния, при котором глюкагоновый рецепторный агонизм, GLP-1 рецепторный агонизм, GIP рецепторный агонизм, глюкагоновый рецепторный/GLP-1 рецепторный соагонизм, глюкагоновый рецепторный/GIP рецепторный соагонизм, GLP-1 рецепторный/GIP рецепторный соагонизм или глюкагоновый рецепторный/GLP-1 рецепторный/GIP рецепторный триагонизм играет некоторую роль. Для целей настоящего изобретения количество или доза вводимого конъюгата настоящего описания должна быть достаточной для воздействия, например, терапевтического или профилактического эффекта, на субъекта или животного в течение достаточного периода времени. Например, доза конъюгата настоящего описания должна быть достаточной для стимуляции цАМФ секреции из клеток, как описано в настоящем изобретении, или достаточной для снижения концентрации глюкозы в крови, концентрации жиров, степени потребления пищи или веса тела у млекопитающего, в течение периода времени от приблизительно 1-4 минут, 1-4 часов или 1-4 недели или более, например, 5-20 или более недели, с момента введения. В определенных вариантах осуществления период времени может быть даже более длинным. Доза будет определяться эффективностью конкретного конъюгата настоящего описания и заболеванием животного (например, человека), а также весом тела животного (например, человека), которого будут подвергать лечению.
Многие анализы для определения вводимой дозы являются известными в данной области техники. Для целей настоящего изобретения, анализ, который включает сравнение степени, до которой снижается концентрация глюкозы в крови при введении указанной дозы конъюгата настоящего описания млекопитающему среди ряда млекопитающих, каждому из которых дают различную дозу конъюгата, можно применять для определения исходной дозы, которую будут вводить млекопитающему. Степень, до которой снижается концентрация глюкозы в крови при введении определенной дозы, можно исследовать способами, известными в данной области техники, включая, например, способы, описанные в настоящем изобретении в параграфе примеров.
Доза конъюгата настоящего описания также будет определяться существованием, природой и степенью любых побочных эффектов, которые могут сопровождать введение конкретного конъюгата настоящего описания. Обычно, лечащий врач определяет дозу конъюгата настоящего описания, которую будут применять для лечения каждого отдельного пациента, принимая во внимание ряд факторов, таких как возраст, вес тела, общее состояние здоровья, рацион, пол, конъюгат настоящего описания, который будут вводить, путь введения и тяжесть заболевания, которое будут подвергать лечению. В качестве примера и не предполагается, что она будет ограничивать настоящее изобретение, доза конъюгата настоящего описания может составлять от приблизительно 0,0001 до приблизительно 1 г/кг вес тела субъекта лечения/день, от приблизительно 0,0001 до приблизительно 0,001 г/кг вес тела/день или приблизительно от 0,01 мг до приблизительно 1 г/кг вес тела/день.
В некоторых вариантах осуществления фармацевтическая композиция содержит любой из конъюгатов, описанных в настоящем изобретении, при степени чистоты, подходящей для введения пациенту. В некоторых вариантах осуществления конъюгат имеет степень чистоты по меньшей мере приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99%, и фармацевтически приемлемый разбавитель, носитель или вспомогательное вещество. Фармацевтическая композиция в некоторых аспектах содержит конъюгат настоящего описания при концентрации по меньшей мере A, где A равен приблизительно 0,001 мг/мл, приблизительно 0,01 мг/мл, 0 приблизительно 1 мг/мл, приблизительно 0,5 мг/мл, приблизительно 1 мг/мл, приблизительно 2 мг/мл, приблизительно 3 мг/мл, приблизительно 4 мг/мл, приблизительно 5 мг/мл, приблизительно 6 мг/мл, приблизительно 7 мг/мл, приблизительно 8 мг/мл, приблизительно 9 мг/мл, приблизительно 10 мг/мл, приблизительно 11 мг/мл, приблизительно 12 мг/мл, приблизительно 13 мг/мл, приблизительно 14 мг/мл, приблизительно 15 мг/мл, приблизительно 16 мг/мл, приблизительно 17 мг/мл, приблизительно 18 мг/мл, приблизительно 19 мг/мл, приблизительно 20 мг/мл, приблизительно 21 мг/мл, приблизительно 22 мг/мл, приблизительно 23 мг/мл, приблизительно 24 мг/мл, приблизительно 25 мг/мл или более. В некоторых вариантах осуществления фармацевтическая композиция содержит конъюгат при концентрации самое большее B, где B равно приблизительно 30 мг/мл, приблизительно 25 мг/мл, приблизительно 24 мг/мл, приблизительно 23, мг/мл, приблизительно 22 мг/мл, приблизительно 21 мг/мл, приблизительно 20 мг/мл, приблизительно 19 мг/мл, приблизительно 18 мг/мл, приблизительно 17 мг/мл, приблизительно 16 мг/мл, приблизительно 15 мг/мл, приблизительно 14 мг/мл, приблизительно 13 мг/мл, приблизительно 12 мг/мл, приблизительно 11 мг/мл, приблизительно 10 мг/мл, приблизительно 9 мг/мл, приблизительно 8 мг/мл, приблизительно 7 мг/мл, приблизительно 6 мг/мл, приблизительно 5 мг/мл, приблизительно 4 мг/мл, приблизительно 3 мг/мл, приблизительно 2 мг/мл, приблизительно 1 мг/мл или приблизительно 0,1 мг/мл. В некоторых вариантах осуществления композиции могут содержать конъюгат при концентрации в диапазоне от A до B мг/мл, например, от приблизительно 0,001 до приблизительно 30,0 мг/мл.
Формы для направленной доставки
Специалисту в данной области техники ясно, что Q-L-Y конъюгаты настоящего изобретения можно модифицировать любым рядом способов, так, чтобы терапевтическая или профилактическая эффективность конъюгата настоящего описания повышалась за счет модификации. Например, конъюгат настоящего описания можно дополнительно конъюгировать либо непосредственно, либо опосредованно через линкер с группой, осуществляющей направленную доставку. Практика конъюгирования соединений, например, глюкагоновых конъюгатов, описанных в настоящем изобретении, с группами, осуществляющими направленную доставку, является известной в данной области техники. См., например, Wadhwa et al., J Drug Targeting, 3, 111-127 (1995) и патент США № 5087616. Термин "молекула, осуществляющая направленную доставку", как применяют в настоящем изобретении, относится к любой молекуле или агенту, который специфически узнает и связывается с рецептором клеточной поверхности, так что молекула, осуществляющая направленную доставку, направляет конъюгаты настоящего описания в популяцию клеток, на поверхности которых экспрессируется рецептор (глюкагоновый рецептор, GLP-1 рецептор). Молекулы, осуществляющие направленную доставку, включают, но не ограничиваясь этим, антитела или их фрагменты, пептиды, гормоны, факторы роста, цитокины и любые другие природные или неприродные лиганды, которые связываются с рецепторами клеточной поверхности (например, эпителиальный рецептор фактора роста (EGFR), Т-клеточный рецептор (TCR), B-клеточный рецептор (BCR), CD28, тромбоцитарный рецептор фактора роста (PDGF), никотиновый ацетилхолиновый рецептор (nAChR) и т.д.). Как применяют в настоящем изобретении, "линкер" представляет собой связь, молекулу или группу молекул, которая связывает две отдельные молекулы друг с другом. Линкеры можно вводить для получения оптимального расстояния между двумя молекулами или можно дополнительно обеспечивать лабильной связью, которая позволяет двум молекулам отделяться друг от друга. Лабильные связи включают фоторазрушаемые группы, кислотолабильные группы, основнолабильные группы, гидролизуемые группы и расщепляемые ферментом группы. Термин "линкер" в некоторых вариантах осуществления относится к любому агенту или молекулам, которые соединяют конъюгат настоящего описания с молекулой, осуществляющей направленную доставку. Специалисту в данной области техники ясно, что положения в конъюгате настоящего описания, которые являются неважными для функционирования конъюгата настоящего описания, являются идеальными положениями для присоединения линкера и/или молекулы, осуществляющей направленную доставку, при условии, что линкер и/или молекула, осуществляющая направленную доставку, однажды соединенная с конъюгатом настоящего описания, не препятствует функционированию конъюгата настоящего описания, т.е. способности стимулировать цАМФ секрецию из клеток, для лечения диабета или ожирения. Специалисту в данной области техники ясно, что положения в пептиде (Q) настоящего описания, которые являются неважными для функционирования конъюгата настоящего описания (например, глюкагонового агонистического пептида, глюкагонового антагонистического пептида, GLP-1 агонистического пептида, GIP агонистического пептида или комбинации любого из приведенных выше), являются идеальными положениями для присоединения линкера и/или молекулы, осуществляющей направленную доставку, при условии, что линкер и/или молекула, осуществляющая направленную доставку, однажды соединенная с пептидом настоящего описания (Q), не препятствует функционированию пептида настоящего описания.
Составы с контролируемым высвобождением
Альтернативно, глюкагоновые конъюгаты, описанные в настоящем изобретении, можно формулировать в виде депо-форм так, чтобы, способ, которым конъюгат настоящего описания высвобождается в теле, в которое его вводят, являлся контролируемым относительно времени и локализации в теле (см., например, патент США № 4450150). Депо-формы конъюгата настоящего описания могут представлять собой, например, имплантируемую композицию, содержащую конъюгат настоящего описания и пористый или непористый материал, такой как полимер, где конъюгат настоящего описания инкапсулирован или распределен в материале и/или высвобождается посредством деградации непористого материала. Затем, депо имплантируют в требуемое место в теле, и конъюгат настоящего описания высвобождается из имплантата с заранее определенной скоростью.
Фармацевтическую композицию в определенных аспектах формулируют так, чтобы она имела любой тип профиля in vivo высвобождения. В некоторых аспектах фармацевтическая композиция представляет собой композиции с немедленным высвобождением, контролируемым высвобождением, замедленным высвобождением, продленным высвобождением, отсроченным высвобождением или двухфазным высвобождением. Способы формулирования пептидов или конъюгатов для контролируемого высвобождения являются известными в данной области техники. См., например, Qian et al., J Pharm 374: 46-52 (2009) и опубликованную международную патентную заявку WO 2008/130158, WO2004/033036; WO2000/032218; и WO 1999/040942.
Композиция настоящего изобретения может дополнительно включать, например, мицеллы или липосомы или некоторые другие инкапсулированные формы, или ее можно вводить в форме с продленным высвобождением для обеспечения продленного хранения и/или эффекта доставки. Описанные фармацевтические составы можно вводить согласно любому режиму, включая, например, ежедневно (1 раз в день, 2 раза в день, 3 раза в день, 4 раза в день, 5 раз в день, 6 раз в день), каждые два дня, на каждый третий день, на каждый четвертый день, на каждый пятый день, на каждый шестой день, еженедельно, раз в две недели, на каждую третью неделю, ежемесячно или раз в два месяца.
Применения
На основе информации, предоставленной впервые в настоящем изобретении, предполагается, что Q-L-Y конъюгаты, описанные в настоящем изобретении и содержащие их фармацевтические композиции, являются пригодными для лечения заболевания или медицинского состояния, при котором например, недостаток активности относительно глюкагонового рецептора, GLP-1 рецептора, GIP рецептора или комбинации любых из приведенных выше рецепторов, представляет собой фактор в возникновении и/или развитии заболевания или медицинского состояния. Соответственно, настоящее изобретение относится к способу лечения или предотвращения заболевания или медицинского состояния у пациента, где заболевание или медицинское состояния представляет собой заболевание или медицинское состояние, в котором недостаток GLP-1 рецепторной активации и/или глюкагоновой рецепторной активации и/или GIP активации связан с возникновением и/или развитием заболевания или медицинского состояния. Способ включает обеспечение пациента конъюгатом в соответствии с любым из конъюгатов, описанных в настоящем изобретении, в количестве, эффективном для лечения или предотвращения заболевания или медицинского состояния.
В некоторых вариантах осуществления заболевание или медицинское состояние представляет собой метаболический синдром. Метаболический синдром, также известный как метаболический синдром X, синдром резистентности к инсулину или синдром Ривена, представляет собой заболевание, от которого страдает более 50 миллионов американцев. Метаболический синдром обычно характеризуется группированием по меньшей мере трех или более из следующих факторов риска: (1) абдоминальное ожирения (избыток жировой ткани в и в районе живота), (2) атерогенная дислипидемия (расстройства, связанные с жиром в крови, включая высокие концентрации триглицеридов, низкий HDL холестерин и высокий LDL холестерин, который усиливает накопление бляшек на стенках артерий), (3) повышенное кровяное давление, (4) резистентность к инсулину или нарушение толерантности к глюкозе, (5) протромботическое состояние (например, высокая концентрация фибриногена или ингибитора-1 активатора плазминогена в крови) и (6) провоспалительное состояние (например, повышенная концентрация C-реактивного белка в крови). Другие факторы риска могут включать старение, гормональный дисбаланс и генетическую предрасположенность.
Метаболический синдром связан с повышенным риском коронарной болезни сердца и другими заболеваниями, связанными с накоплением сосудистых бляшек, такими как инсульт и болезнь периферических сосудов, называемая атеросклеротическим сердечно-сосудистым заболеванием (ASCVD). Пациенты с метаболическим синдромом могут прогрессировать от состояния с устойчивостью к инсулину на его ранних стадиях до резко выраженного диабета II типа с дополнительным повышенным риском ASCVD. Не желая быть связанными конкретной теорией, взаимосвязь между резистентностью к инсулину, метаболическим синдромом и сосудистым заболеванием может включать один или более конкурентных патогенных механизмов, включая нарушенную вазодилятацию, стимулируемую инсулином, связанное с резистентностью к инсулину снижение NO доступности в результате усиленного окислительного стресса, и нарушения, связанные с гормонами адипоцитов, такими как адипонектин (Lteif and Mather, Can. J. Cardiol. 20 (suppl. B):66B-76B (2004)).
Согласно III докладу группы экспертов по лечению взрослых национальной образовательной программы по холестерину 2001 (ATP III), любые три из следующих признаком у одного индивида удовлетворяют критерию метаболического синдрома: (a) абдоминальное ожирение (окружность талии более 102 см у мужчин и более 88 см у женщин); (b) сывороточные триглицериды (150 мг/дл или выше); (c) HDL холестерин (40 мг/дл или меньше у мужчин и 50 мг/дл или ниже у женщин); (d) кровяное давление (130/85 или более); и (e) глюкоза в крови натощак (110 мг/дл или более). Согласно всемирной организации здравоохранения (WHO), индивид, имеющий высокие концентрации инсулина (повышенная глюкоза в крови натощак или только повышенная глюкоза после приема пищи) с по меньшей мере двумя из следующих критериев, удовлетворяет критерию метаболического синдрома: (a) абдоминальное ожирение (соотношение окружностей талии и бедер больше, чем 0,9, индекс массы тела по меньшей мере 30 кг/м2 или объем талии свыше 37 дюймов); (b) анализ на холестерин, показывающий концентрацию триглицеридов по меньшей мере 150 мг/дл или HDL холестерин ниже чем 35 мг/дл; (c) кровяное давление 140/90 или более, или на лечении высокого кровяного давления). (Mathur, Ruchi, "Metabolic Syndrome" ed. Shiel, Jr., William C., MedicineNet.com, May 11, 2009).
Для целей настоящего изобретения, если индивид удовлетворяет критерию любого или обоих критериев, изложенных на III докладе группы экспертов по лечению взрослыхнациональной образовательной программы по холестерину 2001 или WHO, то индивид считается страдающим от метаболического синдрома.
Не желая быть связанными какой-либо конкретной теорией, Q-L-Y конъюгаты, описанные в настоящем изобретении, являются пригодными для лечения метаболического синдрома. Соответственно, настоящее изобретение относится к способу предотвращения или лечения метаболического синдрома, или снижения одного, двух, трех или более его факторов риска, у субъекта, включающему обеспечения субъекта конъюгатом, описанным в настоящем изобретении, в количестве, эффективном для предотвращения или лечения метаболического синдрома или его фактора риска.
В некоторых вариантах осуществления способ лечит гипергликемическое медицинское состояние. В определенных аспектах гипергликемическое медицинское состояние представляет собой диабет, сахарный диабет I типа, сахарный диабет II типа или гестационный диабет, или инсулинозависимый или инсулиннезависимый. В некоторых аспектах способ лечит гипергликемическое медицинское состояние облегчением одного или более осложнений диабета, включая нефропатию, ретинопатию и сосудистое заболевание.
В некоторых аспектах заболевание или медицинское состояние представляет собой ожирения. В некоторых аспектах ожирение представляет собой ожирение, вызванное приемом лекарственного средства. В некоторых аспектах способ лечит ожирение предотвращением или снижением набора веса или усилением потери веса у пациента. В некоторых аспектах способ лечит ожирение снижением аппетита, снижением потребления пищи, снижением концентрации жира у пациента или снижением скорости прохождения пищи через желудочно-кишечный тракт.
Поскольку ожирение связано с возникновением или развитием других заболеваний, способы лечения ожирения являются дополнительно пригодными в способах снижения осложнений, связанных с ожирением, включая сосудистое заболевание (ишемическая болезнь сердца, инсульт, заболевание периферических сосудов, ишемическая реперфузия и т.д.), гипертензию, возникновение диабета II типа, гиперлипидемию и скелетно-мышечные заболевания. Настоящее изобретение соответственно относится к способам лечения или предотвращения данных осложнений, связанных с ожирением.
В некоторых вариантах осуществления заболевание или медицинское состояние представляет собой неалкогольную жировую болезнь печени (NAFLD). NAFLD относится к широкому спектру заболеваний печени в диапазоне от простой жировой дистрофии печени (стеатоз) до неалкогольного стеатогепатита (NASH), до цирроза (необратимое, прогрессирующее рубцевание печени). Все из стадий NAFLD характеризуются накоплением жира (жировая инфильтрация) в клетках печени (гепатоцитах). Простая жировая дистрофия печени представляет собой нарушенное накопление определенного типа жира, триглицерида, в клетках печени без воспаления или рубцевания. При NASH, накопление жира связано с различной степенью воспаления (гепатит) и рубцевания (фиброз) печени. Воспалительные клетки могут уничтожать клетки печени (гепатоцеллюлярный некроз). В терминах "стеатогепатит" и "стеатонекроз", "стеато" относится к жировой инфильтрации, гепатит относится к воспалению в печени, и некроз относится к разрушенным клеткам печени. NASH может, в конце концов, вести к рубцеванию печени (фиброзу) и затем к необратимому, прогрессирующему рубцеванию (цирроз). Цирроз, который вызван NASH, представляет собой последнюю и самую тяжелую стадию в NAFLD спектре. (Mendler, Michel, "Fatty Liver: Nonalcoholic Fatty Liver Disease (NAFLD) and Nonalcoholic Steatohepatitis (NASH)," ed. Schoenfield, Leslie J., MedicineNet.com, August 29, 2005).
Алкогольная болезнь печени или болезнь печени, вызванная потреблением алкоголя, включает три патологически различных заболевания печени, связанные с или вызванные избыточным потреблением алкоголя: жировая дистрофия печени (стеатоз), хронический или острый гепатит и цирроз. Алкогольный гепатит может изменяться от легкого гепатита, причем лабораторные анализы патологии являются единственным показателем заболевания, до тяжелой дисфункции печени с осложнениями, такими как желтуха (желтая кожа, вызванная удерживанием билирубина), гепатическая энцефалопатия (нейрологическая дисфункция, вызванная печеночной недостаточностью), асцит (накопление жидкости в животе), кровоточащее варикозное расширение вен пищевода (варикозные вены в пищеводе), нарушенная коагуляции крови и кома. Гистологически, алкогольный гепатит имеет характерный признак с баллонирующей дистрофией гепатоцитов, воспалением, вызванным нейтрофилами, и иногда тельцами Мэллори (нарушенная агрегация клеточных промежуточных филаментных белков). Цирроз характеризуется анатомически множеством узлов в печени в сочетании с фиброзом. (Worman, Howard J., "Alcoholic Liver Disease", Columbia University Medical Center website).
Не желая быть связанными какой-либо конкретной теорией, Q-L-Y конъюгаты, описанные в настоящем изобретении, являются пригодными для лечения алкогольной болезни печени, NAFLD или любой ее стадии, включая, например, стеатоз, стеатогепатит, гепатит, воспаление печени, NASH, цирроз или их осложнения. Соответственно, настоящее изобретение относится к способу предотвращения или лечения алкогольной болезни печени, NAFLD или любой ее стадии, у субъекта, включающему обеспечение субъекта конъюгатом, описанным в настоящем изобретении, в количестве, эффективном для предотвращения или лечения алкогольной болезни печени, NAFLD или ее стадии. Данные способы лечения включают снижение одного, двух, трех или более из следующего: содержание жира в печени, частота возникновения или развития цирроза, частота возникновения гепатоклеточной карциномы, признаки воспаления, например, аномальная концентрация ферментов печени (например, аспартатаминотрансферазы AST и/или аланинаминотрансферазы ALT или LDH), повышенное содержание ферритина сыворотки крови, повышенное содержание билирубина сыворотки и/или признаки фиброза, например, повышенное содержание TGF-бета. В предпочтительных вариантах осуществления Q-L-Y конъюгаты, описанные в настоящем изобретении, применяют для лечения пациентов, у которых уже развилась простая жировая дистрофия печени (стеатоз), и они проявляют признаки воспаления или гепатита. Данные способы могут приводить в результате, например, к снижению концентрации AST и/или ALT.
Показано, что GLP-1 и эксендин-4 обладают некоторым нейропротекторным эффектом. Настоящее изобретение также относится к применениям Q-L-Y конъюгатов, описанных в настоящем изобретении, для лечения нейродегенеративных заболеваний, включая, но не ограничиваясь этим, болезнь Альцгеймера, болезнь Паркинсона, множественный склероз, амиотрофический боковой склероз, другие расстройства, связанные с демиелинизацией, старческое слабоумие, подкорковую деменцию, атеросклеротическое слабоумие, деменцию, связанную со СПИДом, или другие виды деменции, рак центральной нервной системы, черепно-мозговую травму, повреждение спинного мозга, инсульт или ишемию головного мозга, церебральный васкулит, эпилепсию, болезнь Хантингтона, синдром Туретта, синдром Гийена-Барре, болезнь Вильсона, болезнь Пика, нейровоспалительные нарушения, энцефалит, энцефаломиелит или менингит вирусной, грибковой или бактериальной природы, или другие инфекции центральной нервной системы, прионные болезни, мозжечковую атаксию, мозжечковую дегенерацию, синдромы спиноцеребеллярной дегенерации сетчатки, атаксию Фридрейха, атаксию-телеангиэктазию, спинальную миотрофию, прогрессирующий супрануклеарный паралич, дистонию, мышечные спазмы, тремор, пигментный ретинит, стрионигральную дегенерацию, митохондриальную энцефаломиопатию, неврональный цероид-липофусциноз, печеночную энцефалопатию, почечную энцефалопатию, метаболическую энцефалопатию, энцефалопатию, вызванную токсинами, и повреждение головного мозг, вызванное радиацией.
В некоторых вариантах осуществления заболевание или медицинское состояние представляет собой гипогликемию. В некоторых вариантах осуществления пациент представляет собой пациента с диабетом, и гипогликемия вызвана введением инсулина. В конкретных аспектах способ включает обеспечение конъюгатом настоящего описания в комбинации с инсулином так, что конъюгат забуферивает гипогликемические эффекты болюсного введения инсулина.
В некоторых вариантах осуществления Q-L-Y конъюгаты применяют в сочетании с парентеральным введением питательных веществ недиабетическим пациентам в больничных условиях, например, пациентам, получающим парентеральное питание или полное парентеральное питание. Неограничивающие примеры включают пациентов после операции, пациентов в коме, пациентов с заболеваниями пищеварительного тракта или нефункционирующим желудочно-кишечным трактом (например, в результате хирургического удаления, закупорки или нарушенной поглощающей способности, болезни Крона, язвенного колита, кишечной непроходимости путей, свища желудочно-кишечного тракта, острого панкреатита, ишемического кишечника, большой желудочно-кишечной операции, определенных врожденных аномалий желудочно-кишечного тракта, длительной диареи или синдрома укороченной тонкой кишки в результате операции), пациентов в шоковом состоянии и пациентов, подвергающихся лечению, которые часто получают парентеральное введение углеводов вместе с различными комбинациями липидов, электролитов, минералов, витаминов и аминокислот. Q-L-Y конъюгаты и парентеральную питательную композицию можно вводить одновременно, в разные моменты времени, перед или после друг друга, при условии, что Q-L-Y конъюгат проявляет требуемый биологический эффект в момент времени, когда парентеральная питательная композиция переваривается. Например, парентеральное питание можно вводить 1, 2 или 3 раза в день, тогда как глюкагоновый конъюгат вводят через день, три раза в неделю, два раза в неделю, один раз в неделю, один раз каждые 2 недели, один раз каждые 3 недели или один раз в месяц.
Как применяют в настоящем изобретении, термины "лечить" и "предотвращать", а также слова, являющиеся их производными, не обязательно подразумевают 100% или полное излечение или предотвращение. Скорее, существуют разные степени лечения или предотвращения, которые специалист в данной области техники расценивает как обладающие предполагаемой пользой или терапевтическим эффектом. В связи с этим, способы настоящего изобретения могут обеспечивать любым уровнем или любой степени лечения или предотвращения заболевания или медицинского состояния у млекопитающего. Кроме того, лечение или предотвращение, обеспечиваемое данным способом, может включать лечение или предотвращение одного или более заболеваний или симптомов заболевания или медицинского состояния. Например, что касается способов лечения ожирения, способ в некоторых вариантах осуществления приводит к снижению потребления пищи или содержания жира у пациента. Кроме того, для целей настоящего изобретения, "предотвращение" может включать задержку возникновения заболевания или его симптома или патологического состояния.
Что касается приведенных выше способов лечения, пациент представляет собой любого хозяина. В некоторых вариантах осуществления хозяин представляет собой млекопитающее. Как применяют в настоящем изобретении, термин "млекопитающее" относится к любому позвоночному животному класса млекопитающих, включая, но не ограничиваясь этим, любого из однопроходных, сумчатых и плацентарных таксоны. В некоторых вариантах осуществления млекопитающее представляет собой одно из млекопитающих отряда грызунов, такое как мыши и хомяки, и млекопитающих отряда зайцеобразных, такое как кролики. В определенных вариантах осуществления млекопитающие являются млекопитающими отряда хищных, включая семейство кошачьих (кошки) и семейство псовых (собаки). В определенных вариантах осуществления млекопитающие являются млекопитающими отряда парнокопытных, включая крупный рогатый скот (коровы) и свиней (свиньи), или отряда непарнокопытных, включая лошадей (лошади). В ряде случаев, млекопитающие представляют собой млекопитающих отряда приматов, цебоидов, или Simoids (обезъяны) или отряда антропоидов (люди и человекообразные обезьяны). В конкретных вариантах осуществления млекопитающее представляет собой человека.
Комбинации
Q-L-Y конъюгаты, описанные в настоящем изобретении, можно вводить отдельно или в комбинации с другими терапевтическими агентами, которые нацелены на лечение или предотвращение любого из заболеваний или медицинских состояний, описанных в настоящем изобретении. Например, Q-L-Y конъюгаты, описанные в настоящем изобретении, можно вводить совместно с (одновременно или последовательно) антидиабетическим агентом или агентом против ожирения. Антидиабетические агенты, известные в данной области техники или находящиеся на стадии исследования, включают инсулин, лептин, пептид YY (PYY), панкреатический пептид (PP), фактор роста фибробластов 21 (FGF21), Y2Y4 рецепторные агонисты, сульфонилмочевины, такие как толбутамид (ориназ), ацетогексамид (димелор), толазамид (толтназ), хлорпропамид (диабиназ), глипизид (глюкотрол), глибурид (диабета, микроназ, глиназ), глимепирид (амарил) или гликлазид (диамикрон); меглитиниды, такие как репаглинид (прандин) или натеглинид (старликс); бигуаниды, такие как метформин (глюкофаг) или фенформин; тиазолидиндионы, такие как розиглитазон (авандия), пиоглитазон (актос) или троглитазон (резулин), или другие PPARγ ингибиторы; ингибиторы альфа гликозидазы, которые ингибируют расщепление углеводов, такие как миглитол (глисет), акарбоза (прекоза/глюкобай); эксенатид (биетта) или прамлинтид; ингибиторы дипептидилпептидазы-4 (DPP-4), такие как вилдаглиптин или ситаглиптин; ингибиторы SGLT (натрий-зависимого транспортера 1 глюкозы); активаторы гликокиназы (GKA); антагонисты глюкагонового рецептора (GRA); или ингибиторы FBPазы (1,6-бифосфатаза фруктозы).
Агенты против ожирения, известные в данной области техники или находящиеся на стадии исследования, включают препараты для подавления аппетита, включая стимуляторы фенэтиламинового типа, фентермин (необязательно с фенфлурамином или дексфенфлурамином), диэтилпропион (Tenuate®), фендиметразин (Prelu-2®, Bontril®), бензфетамин (Didrex®), сибутрамин (Meridia®, Reductil®); римонабант (Acomplia®), другие антагонисты каннабиноидных рецепторов; оксинтомодулин; флуоксетин гидрохлорид (прозак); кунекс (топирамат и фентермин), экскалия (бупропион и зонисамид) или контрав (бупропион и налтрексон); или ингибиторы липазы, аналогичные XENICAL (орлистат) или цетилистат (также известный как ATL-962), или GT 389-255.
Q-L-Y конъюгаты, описанные в настоящем изобретении, в некоторых вариантах осуществления вводят совместно с агентом для лечения неалкогольной жировой дистрофии печени или NASH. Агенты, применяемые для лечения неалкогольной жировой дистрофии печени, включают урсодезоксихолевую кислоту (известную также под именем актигалл, URSO и урсодиол), метформин (глюкофаг), розиглитазон (авандия), клофибрат, гемфиброзил, полимиксин B и бетаин.
Q-L-Y конъюгаты, описанные в настоящем изобретении, в некоторых вариантах осуществления вводят совместно с агентом для лечения нейродегенеративного заболевания, например, болезни Паркинсона. Кроме того, агенты против болезни Паркинсона являются известными в данной области техники и включают, но не ограничиваясь этим, леводопу, карбидопу, антихолинергические агенты, бромкриптин, прамипексол и ропинирол, амантадин и разагилин.
Принимая во внимание указанное выше, настоящее изобретение также относится к фармацевтическим композиция и наборам, дополнительно содержащим один из данных терапевтических агентов. Дополнительный терапевтический агент можно вводить одновременно или последовательно с конъюгатом настоящего описания. В некоторых аспектах конъюгат вводят перед дополнительным терапевтическим агентом, тогда как в других аспектах, конъюгат вводят после дополнительного терапевтического агента.
Наборы
Q-L-Y конъюгаты настоящего описания можно предоставлять в соответствии с одним вариантом осуществления как часть набора. Соответственно, в некоторых вариантах осуществления обеспечивают набор для введения Q-L-Y конъюгата нуждающемуся в лечении пациенту, где набор содержит Q-L-Y конъюгат, как описано в настоящем изобретении.
В одном варианте осуществления обеспечивают набор с устройством для введения композиции Q-L-Y конъюгата пациенту, например, иглой для шприца, устройством с перьевым введением, безыгольным шприцом или другим устройством для введения без иглы. Набор может альтернативно или в добавление содержать один или более контейнеров, например, пробирок, ампул, бутылок, однокамерных или многокамерных предварительно заполненных шприцов, картриджей, насосов для вливания (внешних или имплантируемых), безыгольных шприцов, предварительно заполненных устройств с перьевым введением и подобных, необязательно содержащих глюкагоновый конъюгат в лиофилизированной форме или в водном растворе. Наборы в некоторых вариантах осуществления содержат инструкцию по применению. В соответствии с одним вариантом осуществления устройство набора представляет собой аэрозольное дозирующее устройство, где композиция заранее упакована в аэрозольном устройстве. В другом варианте осуществления набор содержит шприц и иглу, и в одном варианте осуществления стерильная глюкагоновая композиция заранее упакована в шприце.
Следующие примеры приведены только для иллюстрации настоящее изобретение и никоим образом не ограничивают его объем.
Примеры
Пример 1: Получение пептидных фрагментов пептидов глюкагонового суперсемейства
Материалы
Все пептиды, описанные в настоящем изобретении, были амидированы, если не указано иное. MBHA (4-метилбензгидриламинполистирольную) смолу применяли в пептидном синтезе. MBHA смолу, 100-180 меш, 1% дивинилбензол (DVB) поперечно-сшитый полистирол; загрузка 0,7-1,0 ммоль/г), Boc-защищенные (трет-бутилкарбамат) и Fmoc защищенные (9-флуоренилметилкарбамат) аминокислоты получали у Midwest Biotech. Твердофазный пептидный синтез, применяя Boc-защищенные аминокислоты, осуществляли на пептидном синтезаторе Applied Biosystem 430A. Синтез с применением Fmoc защищенных аминокислот осуществляли, применяя пептидный синтезатор Applied Biosystems Model 433. В конкретных вариантах осуществления можно применять следующие способы:
Общий протокол пептидного синтеза с применением Boc-защитной группы
Синтез пептидов, применяя Boc химию, осуществляли на пептидном синтезаторе Applied Biosystem Model 430A. Синтетические пептиды получали последовательным добавлением аминокислот в картридж, содержащий 2 ммоль Boc защищенной аминокислоты. Конкретно, синтез осуществляли, применяя 3-(диэтоксифосфорилокси)-3H-бензо[d][1,2,3]триазин-4-он (DEPBT) или HBTU в качестве конденсирующего реагента для однократной конденсации. В конце стадии конденсации, пептидил-смолу обрабатывали трифторуксусной кислотой (TFA) для удаления N-концевой Boc защитной группы. Затем смолу промывали несколько раз диметилформамидом (DMF), и данный повторяющийся цикл повторяли для требуемого количества стадий конденсации. Boc аминокислоты и HBTU получали у Midwest Biotech (Fishers, IN). Применяемыми обычными защитными группами боковых цепей были: Arg(Tos), Asn(Xan), Asp(OcHex), Cys(pMeBzl), His(Bom), Lys(2Cl-Z), Ser(OBzl), Thr(OBzl), Tyr(2Br-Z) и Trp(CHO). Boc-Glu(OFm)-OH и Boc-Lys(Fmoc)-OH (Chem-Impex, Wood dale, IL) применяли в положениях образования лактамной мостиковой связи.
После сборки пептидов, Fmoc защищенные боковые цепи деблокировали, применяя обработку 20% пиперидином. Для получения лактамной мостиковой связи, выбирали ортогональные защитные группы для Glu и Lys (например, Glu(Fm), Lys(Fmoc)). После удаления защитных групп и перед HF отщеплением, циклизацию проводили, как описано ранее (см., например, опубликованную международную патентную заявку WO2008/101017).
Пептидил-смолу обрабатывали безводной HF в присутствии п-крезола и диметилсульфида, что обычно давало приблизительно 350 мг (приблизительно 50% выход) неочищенного деблокированного пептида. Конкретно, пептидил-смолу (30 мг - 200 мг) помещали в реакционную колбу с фторидом водорода (HF) для отщепления. Затем, 500 мкл п-крезола добавляли в колбу в качестве скавенжера ионов карбония. Колбу соединяли с HF системой и погружали в смесь метанол/сухой лед. Колбу вакуумировали вакуумным насосом, и 10 мл HF перегоняли в реакционную колбу. Данную реакционную смесь пептидил-смолы и HF перемешивали в течение одного часа при 0°C, после чего создавали вакуум, и быстро удаляли HF (10-15 минут). Колбу аккуратно вынимали и заполняли приблизительно 35 мл эфира для осаждения пептида и экстракции п-крезола и небольших органических молекул, образовавшихся после удаления защитных групп HF обработкой. Данную смесь фильтровали, применяя тефлоновый фильтр и повторяли дважды для удаления всего избытка крезола. Данный фильтрат выбрасывали. Осажденный пептид растворяли в приблизительно 20 мл 10% уксусной кислоты (водная). Данный фильтрат, который содержал требуемый пептид, собирали и лиофилизировали.
Аналитический ВЭЖХ анализ неочищенного растворенного пептида проводили в следующих условиях [4,6×30 мМ Xterra C8, 1,50 мл/мин, 220 нМ, A буфер 0,1% TFA/10% ацетонитрил (CH3CN), B буфер 0,1% TFA/100% CH3CN, градиент 5-95%B в течение 15 минут]. Экстракт разбавляли вдвое водой и загружали на 2,2×25 см Vydac C4 препаративную обращенно-фазовую колонку и элюировали, применяя градиент ацетонитрила на Waters ВЭЖХ системе (A буфер 0,1% TFA/10% CH3CN, B буфер 0,1% TFA/10% CH3CN и градиент 0-100% B в течение 120 минут при скорости потока 15,00 мл/мин. ВЭЖХ анализ очищенного пептида показал более чем 95% чистоту, и анализ с помощью масс-спектрометрии с электроспрей-ионизацией применяли для подтверждения идентичности пептида.
Общий протокол пептидного синтеза с применением Fmoc-защитной группы:
Пептиды получали на автоматизированном пептидном синтезаторе ABI 433A, применяя стандартную Fmoc химию с Rink MBHA амидной смолой Ринка или первой аминокислотой, соединенной со смолой Ванга (Novabiocherh, San Diego, CA), применяя DIC/HOBT в качестве конденсирующего реагента. Защитные группы боковых цепей Nα-Fmoc [N-(9-флуоренил)метоксикарбонил]аминокислот были следующими: Arg, Pmc; Asp, OtBu; Cys, Trt; Gln, Trt; His, Trt; Lys, Boc; Ser, tBu, Tyr, tBu; и Trp, Boc (Pmc = 2,2,5,7,8-пентаметилхроман-6-сульфонил, OtBu = трет-бутиловый эфир, Trt = тритил, Boc = трет-бутилоксикарбонил и трет-Bu = трет-бутиловый эфир). Fmoc-Glu(O-2-PhiPr)-OH и Fmoc-Lys(Mmt)-OH (Novabiochem, San Diego, CA) вводили в положения для образования лактамной мостиковой связи.
После твердофазного синтеза, 2-фенилизопропильную (2-PhiPr) группу в Glu и 4-метокситритильную (Mmt) группу в Lys удаляли быстрым пропусканием 1% TFA/DCM через пептидильную смолу. Для образования лактамной мостиковой связи, обычно 150 мг (0,5 ммоль, 5-кратный избыток) BEPBT добавляли в 10% DIEA/DMF и подвергали реакции в течение 2-4 часов, до того как нингидриновый тест показывал отрицательный результат.
Пептиды отщепляли от смолы коктейлем для отщепления, содержащим 85% TFA, 5% фенол, 5% воду и 5% тиоанизол (добавляли 2,5% EDT, когда пептид содержит цистеин). Неочищенные пептиды осаждали в эфире, центрифугировали и лиофилизовали. Затем пептиды анализировали аналитической ВЭЖХ и проверяли ESI или MALDI-TOF масс-спектрометрией. Пептиды очищали стандартной методикой ВЭЖХ очитки.
Ацилирование пептидов
Ацилированные пептиды получали следующим образом. Пептиды получали на твердой полимерной подложке, применяя или пептидный синтезатор CS Bio 4886 или пептидный синтезатор Applied Biosystems 430A. In situ химию нейтрализации применяли, как описано Schnolzer et al., Int. J. Peptide Protein Res. 40: 180-193 (1992). Что касается ацилированных пептидов, целевой аминокислотный остаток, который будут ацилировать (например, положение десять согласно нумерации положений аминокислот SEQ ID NO: 1601), заменяли Nε-FMOC лизиновым остатком. Обработка полученного пептида с BOC защитой на N-конце 20% пиперидином в DMF в течение 30 минут удаляла FMOC/формильную группы. Конденсацию Lys остатка со свободной ε-аминогруппой осуществляли реакцией с десятикратным молярным избытком или FMOC-защищенной спейсерной аминокислоты (например, FMOC-Glu-OtBu) или ацильной цепью (например, CH3(CH2)14-COOH) и гексафторфосфатом бензотриазол-1-илокситрипирролидинофосфония (PyBOP), N,N'-диизопропилкарбодиимидом (DIG) или DEPBT конденсирующим реагентом в DMF/диизопропилэтиламин (DIEA). За последующим удалением FMOC группы спейсерной аминокислоты следовало повторение конденсации с ацильной цепью. Конечная обработка 100% TFA приводила в результате к удалению любых защитных групп боковых цепей и N-концевой BOC группы. Пептидную смолу нейтрализовали 5% DIEA/DMF, сушили, и затем отщепляли от носителя, применяя HF/п-крезол, 95:5, при 0°C в течение одного часа. После экстракции эфиром, 5% раствор уксусной кислоты (HOAc) применяли для растворения неочищенного пептида. Затем образец раствора проверяли на содержание пептида с правильным молекулярным весом ESI-MS. Требуемые пептиды очищали обращенно-фазовой (оф) ВЭЖХ, применяя линейный градиент 10% CH3CN/0,1% TFA-0,1% TFA в 100% CH3CN. Белковую колонку Vydac C18 22 мм × 250 мм применяли для очистки. Ацилированные пептидные конъюгаты обычно полностью элюировались буферным соотношением 20:80. Фракции сливали вместе и проверяли чистоту на аналитической оф-ВЭЖХ. Чистые фракции лиофилизовали, получая белые твердые пептиды.
Если пептид содержал лактамную мостиковую связь и целевые остатки, которые требовалось ацилировать, ацилирование осуществляли, как описано выше, после добавления данной аминокислоты к пептидному остову.
Пегилирование пептидов для получения тиоэфирных связей
Для пегилирования пептидов, 40 кДа метокси поли(этиленгликоль)йодацетамид реагировал с молярным эквивалентом пептида в 7 M мочевине, 50 мМ Tris-HCl буфере, применяя минимальное количество растворителя, требуемое для растворения как пептида, так и PEG до истинного раствора (обычно менее чем 2 мл для реакции, применяя 2-3 мг пептида). Энергичное перемешивание при комнатной температуре осуществляли в течение 4-6 часов, и реакционную смесь анализировали аналитической оф-ВЭЖХ. Пегилированные продукты элюировались отдельно от исходного вещества с пониженными временами удерживания. Очистку проводили на колонке Vydac C4 в условиях, аналогичных условиям, применяемым для первоначальной очистки пептида. Элюирование происходило в районе соотношения буферов 50:50. Фракции с чистым пегилированным пептидом обнаруживали и лиофилизовали. Выходы были более 50%, в зависимости от реакции.
Пегилирование пептидов для получения малеимидных связей
Для пегилирования пептидов, пептид, содержащий цистеин, растворяли в физиологическом растворе с фосфатным буфером (5-0 мг/мл) и добавляли 0,01 M этилендиаминтетрауксусную кислоту (10-15% суммарного объема). Добавляли избыток (2-кратный) малеимидометоксиPEG реагента (Dow), и реакционную смесь перемешивали при комнатной температуре при контролировании протекания реакции посредством высокоэффективной жидкостной хроматографии (ВЭЖХ). Через 8-24 часа, реакционную смесь подкисляли и наносили на препаративную обращенно-фазовую колонку для очистки, применяя 0,1% тетрафторуксусную кислоту (TFA)/ацетонитрил в градиентном режиме. Подходящие фракции объединяли и лиофилизовали для получения требуемых пегилированных производных.
Анализ, применяя масс-спектрометрию
Масс-спектры получали, применяя квадрупольный масс-спектрометр Sciex API-HI с электроспреем со стандартным ESI источником ионов. Условия ионизации, которые применяли, являются следующими: ESI в режиме положительных ионов; напряжение ионораспыления, 3,9 кВ; потенциал отверстия, 60 В. Применяемым распыляющим газом и «газовой завесой» был азот со скоростью потока ,9 л/мин. Масс-спектр регистрировали от 600 до 1800 Томпсонов при 0,5 Th на шаг и временем переключения 2 мсек. Образец (приблизительно 1 мг/мл) растворяли в 50% водном ацетонитриле с 1% уксусной кислотой и вводили внешним шприцевым насосом при скорости 5 мкл/мин.
Когда пептиды анализировали в PBS растворе ESI MS, их вначале обессоливали, применяя ZipTip насадку для твердофазной экстракции, содержащую 0,6 мкл C4 смолы, согласно инструкции, прилагаемой изготовителем (Millipore Corporation, Billerica, MA, см. Millipore веб-сайт всемирной паутины millipore.com/catalogue.nsf/docs/C5737).
Анализ высокоэффективной жидкостной хроматографией (ВЭЖХ):
Предварительные анализы проводили с данными неочищенными пептидами для получения приблизительной величины их относительных скоростей конверсии в физиологическом растворе с фосфатным буфером (PBS) (pH, 7,2), применяя высокоэффективную жидкостную хроматографию (ВЭЖХ) и MALDI анализ. Образцы неочищенных пептидов растворяли в PBS буфере при концентрации 1 мг/мл. 1 мл полученного в результате раствора хранили в 1,5 мл ВЭЖХ пробирке, которые затем герметично закрывали и выдерживали при 37°C. Аликвоты 100 мкл отбирали через различные интервалы времени, охлаждали до комнатной температуры и анализировали ВЭЖХ.
ВЭЖХ анализы проводили, применяя хроматографическую систему Beckman System Gold, применяя УФ-детектор при 214 нм. ВЭЖХ анализы проводили на колонке C18 Vydac 150 мм × 4,6 мм. Скорость потока была 1 мл/мин. Растворитель A содержал 0,1% TFA в дистиллированной воде, и растворитель B содержал 0,1% TFA в 90% CH3CN. Применяли линейный градиент (40%-70%B в течение 15 минут). Данные собирали и анализировали, применяя Peak Simple Chromatography программное обеспечение.
Пример 2
Способность каждого пептида стимулировать цАМФ измеряли в анализе по гену-репортеру на основе люциферазы светлячка. цАМФ генерирование, которое стимулировали, является прямо пропорциональным связыванию глюкагонового фрагмента с глюкагоновым рецептором или GIP рецептором или GLP-1 рецептором. HEK293 клетки, совместно трансфицированные рецептором и люциферазным геном, соединенным с чувствительным к цАМФ элементом, применяли для биоанализа.
Клетки были лишены сыворотки выращиванием в течение 16 часов в минимально обогащенной среде с модификацией Дульбекко (Invitrogen, Carlsbad, CA), снабженной 0,25% Bovine Growth Serum (HyClone, Logan, UT), и затем выдерживанием с серийными разбавлениями глюкагоновых фрагментов в течение 5 часов при 37°C, 5% CO2 в 96-луночных покрытых поли-D-лизином "Biocoat" планшетах (BD Biosciences, San Jose, CA). В конце выдерживания, 100 мкл LucLite люминесцентного субстратного реагента (Perkin Elmer, Wellesley, MA) добавляли к каждой лунке. Планшет быстро встряхивали, выдерживали в течение 10 минут в темноте, и выходное световое излучение измеряли на жидкостном сцинтилляционном счетчике MicroBeta-1450 (Perkin-Elmer, Wellesley, MA). Эффективные 50% концентрации (EC50) и ингибирующие 50% концентрации (IC50) рассчитывали, применяя программное обеспечение Origin (OriginLab, Northampton, MA). Все EC50 и IC50 приводятся в следующих примерах в нМ, если не указано иное.
Пример 3: Получение GLP-1/эстроген(3-эфир)
GLP-1 аналог получали, применяя Boc протокол, описанный в примере 1, с Boc-Lys(Fmoc)-OH остатком на C-конце. (Fmoc группу, защищающую аминогруппу боковой цепи лизинового остатка, удаляли 20% пиперидин/DMF в течение 30 минут перед добавлением продукта 4) Эстрадиол 17-ацетат модифицировали в 3 положении реакцией с этил 2-бромуксусной кислотой. Модифицированный эстрадиол гидролизовали и подвергали реакции с C-концевым лизином GLP-1 аналога, получая в результате GLP-1/Эстроген(3-эфир) конъюгат, как показано ниже:

Конкретно, эквимолярные количества эстрадиол 17-ацетата (1) и этил 2-бромацетата (2) растворяли в диоксан/K2CO3, и реакционную смесь перемешивали в течение 16 часов в условиях кипячения с обратным холодильником. Растворитель реакции упаривали в вакууме, и продукт (3) суспендировали в диоксане. Медленно добавляли NaOH (1N) и перемешивали в течение 2 часов. Растворитель реакции упаривали в вакууме, и продукт (4) промывали 3 три раза и суспендировали в дихлорметане. Медленно добавляли HCl (1N) для подкисления продукта. Продукт 4 и пептид на смоле смешивали в HOBt/DIC/NMP в течение 4 часов, фильтровали, обрабатывали трифторуксусной кислотой и отщепляли от смолы обработкой фтористоводородной кислотой. Пептид-эстрогеновый конъюгат очищали, применяя обращенно-фазовую ВЭЖХ и характеризовали ESI масс-спектрометрией.
Пример 4: Получение GLP-1/эстроген(17-карбамат)
GLP-1 аналог получали, применяя Boc протокол, описанный в примере 1 с Boc-Lys(Fmoc)-OH остатком на C-конце. (Fmoc группу, защищающую аминогруппу боковой цепи лизинового остатка удаляли 20% пиперидин/DMF в течение 30 минут перед конъюгированием эстрогенового производного). β-Эстрадиол 3-бензоат модифицировали в 17 положении реакцией с 4-нитрофенилхлорформиатом. Модифицированный эстрадиол подвергали реакции с C-концевым лизином GLP-1 аналога, получая в результате GLP-1/эстроген (17-карбамат) конъюгат, как показано ниже:

Конкретно, β-эстрадиол 3-бензоат (1) и 2-кратный избыток 4-нитрофенилхлорформиата (2) перемешивали вместе в пиридине, толуоле и DMAP в условиях кипячения с обратным холодильником в течение 24 часов. Растворитель реакции упаривали в вакууме, и продукт, β-эстрадиол 17-нитрофениловый эфир 3-бензоат (3), суспендировали в этилацетате. Продукт реакции промывали дважды водной HCl (0,01N) с последующей одной промывкой водой. Этилацетат упаривали в вакууме, и продукт (3) осаждали гексаном. Продукт 3 и пептид на смоле смешивали в NMP/5%DIEA в течение 4 часов, фильтровали, обрабатывали TFA и отщепляли от смолы HF обработкой. Пептид-эстрогеновый конъюгат очищали, применяя обращенно-фазовую ВЭЖХ и характеризовали ESI масс-спектрометрией.
Пример 5: Получение GLP-1/эстроген(17-сложный эфир)
GLP-1 аналог получали, применяя Boc протокол, описанный в примере 1 с Boc-Lys(Fmoc)-OH остатком на C-конце. (Fmoc группу, защищающую аминогруппу боковой цепи лизинового остатка удаляли 20% пиперидин/DMF в течение 30 минут перед конъюгированием эстрогенового производного). Эстрадиол модифицировали в 17 положении реакцией с янтарным ангидридом. Модифицированный эстрадиол подвергали реакции с C-концевым лизином GLP-1 аналога, получая в результате GLP-1/эстроген(17-сложный эфир) конъюгат, как показано ниже:

Конкретно, β-эстрадиол 17-ацетат (1) и 10-кратный избыток янтарного ангидрида (2) перемешивали вместе в DMP с 5% DIEA и DMAP в течение 48 часов при комнатной температуре. Через 48 часов, растворитель реакции упаривали в вакууме, и продукт (3) суспендировали в этилацетате. Продукт реакции (3) промывали водной HCl (0,01N) два раза, с последующей одной промывкой водой. Этилацетат упаривали в вакууме, и продукт (3) суспендировали в смеси MeOH/ацетонитрил/вода. Эстрогеновое производное, являющееся продуктом (3), очищали обращенно-фазовой ВЭЖХ. Лиофилизованный продукт (3) и пептид на смоле смешивали в HOBt/DIC/NMP в течение 4 часов, фильтровали, обрабатывали TFA и отщепляли от смолы HF обработкой. Пептид-эстрогеновый конъюгат очищали, применяя обращенно-фазовую ВЭЖХ и характеризовали ESI масс-спектрометрией.
Пример 6: Получение GLP-1/эстроген(3-сложный эфир)
GLP-1 аналог получали, применяя Boc протокол, описанный в примере 1 с Boc-Lys(Fmoc)-OH остатком на C-конце. (Fmoc группу, защищающую аминогруппу боковой цепи лизинового остатка, удаляли 20% пиперидин/DMF в течение 30 минут перед конъюгированием эстрогенового производного). Эстрадиол 17-ацетат модифицировали в 3-положении реакцией с янтарным ангидридом. Модифицированный эстрадиол подвергали реакции с C-концевым лизином GLP-1 аналога, получая в результате GLP-1/эстроген(3-сложный эфир) конъюгат, как показано ниже:

Конкретно, β-эстрадиол 17-ацетат (1) и 10-кратный избыток янтарного ангидрида (2) перемешивали вместе в DMF с 5%DIEA и DMAP в течение 48 часов при комнатной температуре. Через 48 часов, растворитель реакции упаривали в вакууме, и продукт (3) суспендировали в этилацетате. Продукт реакции (3) промывали водной HCl (0,01N) два раза с последующей одной промывкой водой. Этилацетат упаривали в вакууме, и продукт (3) суспендировали в смеси MeOH/ацетонитрил/вода. Эстрогеновое производное, являющееся продуктом (3), очищали обращенно-фазовой ВЭЖХ. Лиофилизованный продукт (3) и пептид на смоле смешивали в HOBt/DIC/NMP в течение 4 часов, фильтровали, обрабатывали TFA и отщепляли от смолы HF обработкой. Пептид-эстрогеновый конъюгат очищали, применяя обращенно-фазовую ВЭЖХ и характеризовали ESI масс-спектрометрией.
Пример 7: Получение GLP-1/эстроген (3-сложный эфир)
GLP-1 аналог получали, применяя Boc протокол, описанный в примере 1 с Boc-Lys(Fmoc)-OH остатком на C-конце. (Fmoc группу, защищающую аминогруппу боковой цепи лизинового остатка удаляли 20% пиперидин/DMF в течение 30 минут перед конъюгированием эстрогенового производного). Эстроген модифицировали в 3-положении реакцией с янтарным ангидридом. Модифицированный эстроген подвергали реакции с C-концевым лизином GLP-1 аналога, получая в результате GLP-1/эстроген(3-эфир) конъюгат, как показано ниже:

Конкретно, эстроген (1) и 10-кратный избыток янтарного ангидрида (2) перемешивали вместе в DMF с 5%DIEA и DMAP в течение 48 часов при комнатной температуре. Через 48 часов, растворитель реакции упаривали в вакууме, и продукт (3) суспендировали в этилацетате. Продукт реакции (3) промывали водной HCl (0,01N) два раза с последующей однократной промывкой водой. Этилацетат упаривали в вакууме, и продукт (3) суспендировали в смеси MeOH/ацетонитрил/вода. Эстрогеновое производное, являющееся продуктом (3), очищали обращенно-фазовой ВЭЖХ. Лиофилизованный продукт (3) и пептид на смоле смешивали в HOBt/DIC/NMP в течение 4 часов, фильтровали, обрабатывали TFA и отщепляли от смолы HF обработкой. Пептид-эстрогеновый конъюгат очищали, применяя обращенно-фазовую ВЭЖХ и характеризовали ESI масс-спектрометрией.
Пример 8: Получение GLP-1/эстроген (17-гидразон)
GLP-1 аналог получали, применяя Boc протокол, описанный в примере I. Пептид получали, применяя in situ нейтрализующую химию на основе Boc с Boc-Cys(4-MeBzl)-OH остатком на C-конце для облегчения присоединения эстрогена. Эстроген модифицировали в 17 положении реакцией с гидразидом малеимидокапроновой кислоты. Модифицированный эстроген подвергали реакции с C-концевым цистеином GLP-1 аналога, получая в результате GLP-1/эстрадиол(l7-гидразон) конъюгат, как показано ниже:

Конкретно, эквимолярные количества эстрогена (1) и гидразида ε-малеимидокапроновой кислоты (2) перемешивали вместе в MeOH с 0,1% TFA в течение 4 часов при комнатной температуре. Через 4 часа растворитель реакции упаривали в вакууме и продукт (3) осаждали в холодном эфире и очищали на колонке с силикагелем. 5-кратный избыток продукта 3 смешивали с отщепленным и очищенным пептидом в смеси DMF, ACN, Tris и воды при pH 7,5 в течение 24 часов при комнатной температуре, получая пептид-эстрогеновый конъюгат. Пептид-эстрогеновый конъюгат очищали, применяя обращенно-фазовую ВЭЖХ и характеризовали ESI масс-спектрометрией.
Пример 9: Получение GLP-1/эстроген(17-карбаматдисульфид) (затрудненный и незатрудненный)
GLP-1 аналог получали, применяя Boc протокол, описанный в примере 1. Пептид получали, применяя in situ нейтрализующую химию на основе Boc с Boc-Cys(4-MeBzl)-OH остатком (получая в результате незатрудненный дисульфидный конъюгат) или Boc-Pen(4-MeBzl)-OH остаток (получая в результате затрудненный дисульфидный конъюгат) на C-конце для облегчения присоединения эстрогена. β-Эстрадиол 3-бензоат модифицировали в 17-положении реакцией с 4-нитрофенилхлорформиатом. Затем, промежуточное соединение подвергали реакции с пиридилдитиоэтиламин-HCl и подвергали реакции дисульфидного обмена с C-концевым цистеином GLP-1 аналога, получая в результате GLP-1/эстрадиол(17-карбаматдисульфид) конъюгат, как показано ниже:

Во-первых, эквимолярные количества алдритиола-2 (1) и 2-меркаптоэтиламина HCl (2) перемешивали вместе в MeOH с 2% AcOH в течение 48 часов при комнатной температуре. Через 48 часов растворитель реакции упаривали в вакууме, и продукт (3) осаждали в холодном эфире. Во-вторых, β-эстрадиол 3-бензоат (4) и 2-кратный избыток 4-нитрофенилхлорформиата (5) перемешивали вместе в пиридине, толуоле и DMAP в условиях кипячения с обратным холодильником в течение 4 часов. Растворитель реакции упаривали в вакууме, и продукт, β-эстрадиол 17-нитрофениловый эфир 3-бензоат (6), суспендировали в этилацетате. Данный продукт реакции промывали дважды водной HCl (0,01 N), с последующей однократной промывкой водой, которую удаляли в делительной воронке. Этилацетат упаривали в вакууме, и продукт (6) осаждали гексаном.

Эквимолярные количества пиридилдитиоэтиламина HCl (3) и β-эстрадиол 17-нитрофенилового эфира 3-бензоата (6) перемешивали вместе в пиридине с 5% DIEA и DMAP в течение 48 часов при комнатной температуре. Через 48 часов растворитель реакции упаривали в вакууме, и продукт (7) суспендировали в этилацетате. Данный продукт реакции промывали дважды водной HCl (0,01N), с последующей однократной промывкой водой, и этилацетат упаривали в вакууме. 3-Бензоатную группу в продукте (7) удаляли обработкой 0,25% K2CO3 в диоксане и метаноле в течение 3 часов при комнатной температуре, получая продукт β-эстрадиол 17-карбамат S-S-NPy (8), который очищали на колонке с силикагелем. 5-кратный избыток продукта 8 смешивали с отщепленным и очищенным пептидом (или с цистеиновым остатком или пеницилламиновым остатком в положении 40) в NMP и Tris при pH 7,5 в течение 48 часов при комнатной температуре, получая пептид-эстрогеновый конъюгат. Пептид-эстрогеновый конъюгат очищали, применяя обращенно-фазовую ВЭЖХ и характеризовали ESI масс-спектрометрией.
Пример 10: Получение GLP-1/эстроген (17-катепсиндиаминоэтан)
GLP-1 аналог получали, применяя Boc протокол, описанный в примере 1. Пептид получали, применяя in situ нейтрализующую химию на основе Boc с Z-His(BOM)-OH остатком на N-конце и Boc-Lys(Fmoc)-OH на C-конце для облегчения присоединения дипептидного спейсера и эстрогена. β-Эстрадиол 17-нитрофениловый эфир бензоат модифицировали в 17 положении, получая в результате GLP-1/эстрадиол (17-катепсиндиаминоэтан) конъюгат, как показано ниже:

Fmoc-Phy-Lys(Cl-Z)-OH (1) получали, применяя in situ нейтрализующую химию на основе Fmoc на смоле Ванга, и отщепляли от смолы TFA/DCM. Эквимолярные количества Fmoc-Phe-Lys(Cl-Z)-OH (1) и Boc-этилендиамина (2) перемешивали вместе в HOBt, DIC и DCM в течение 4 часов при комнатной температуре. Продукт данной реакции промывали дважды водной HCl (0,01N), с последующей однократной промывкой водой, которую удаляли в делительной воронке, и этилацетат упаривали в вакууме. После стадий промывки, продукт реакции обрабатывали 20% пиперидином в DMF в течение 30 минут для удаления N-концевой Fmoc группы, получая NH2-Phe-Lys(Cl-Z)-EDA-Boc (3), который осаждали в холодном эфире после удаления пиперидин/DMF растворителя в вакууме. NFh-Phe-Lys(Cl-Z)-EDA-Boc (3) перемешивали с 2-кратным избытком янтарного ангидрида (4) в DMF, 5% DIEA и DMAP в течение 16 часов при комнатной температуре, после чего растворитель реакции упаривали в вакууме и суспендировали в MeOH, ацетонитриле и воде. Продукт реакции, гемисукцинат-Phe-Lys(Cl-Z)-EDA-Boc (5), очищали обращенно-фазовой ВЭЖХ. 5-кратный избыток лиофилизованного продукта (5) и пептид на смоле смешивали в HOBt/DIC/NMP в течение 16 часов, фильтровали и обрабатывали TFA, получая продукт GLP-1 + гемисукцинат-Phe-Lys(Cl-Z)-EDA (6). Данный продукт на смоле (6) смешивали с 5-кратным избытком β-эстрадиол 17-нитрофенилового эфира 3-бензоата (7) в NMP/5%DIEA в течение 16 часов, фильтровали, и отщепляли от смолы HF обработкой, получая конечный продукт (8). Пептид-эстрогеновый конъюгат очищали, применяя обращенно-фазовую ВЭЖХ и характеризовали ESI масс-спектрометрией.
Пример 11: Получение GLP-1/холестерин(3-амид)
GLP-1 аналог получали, применяя Boc протокол, описанный в примере 1. Пептид получали, применяя in situ нейтрализующую химию на основе Boc с Boc-Lys(Fmoc)-OH остатком на C-конце. Холестерин 3-карбоновую кислоту подвергали реакции с C-концевым лизином GLP-1 аналога, получая в результате GLP-1/холестерин(3-амид) конъюгат, как показано ниже:
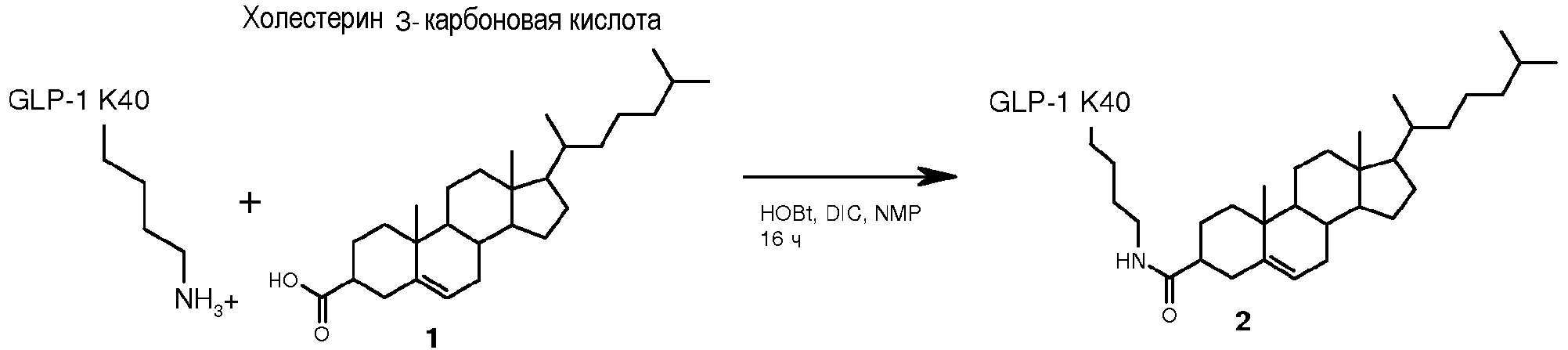
Конкретно, холестерин 3-карбоновую кислоту (1) и пептид на смоле смешивали в HOBt/DIC/NMP в течение 16 часов, фильтровали, обрабатывали TFA и отщепляли от смолы HF обработкой. Fmoc группу, защищающую аминогруппу боковой цепи лизинового остатка, удаляли 20% пиперидин/DMF в течение 30 минут перед присоединением продукта 4. Пептид-холестериновый конъюгат (2) очищали, применяя обращенно-фазовую ВЭЖХ и характеризовали ESI масс-спектрометрией. Если пептидный остов пегилировали, то цистеиновый остаток присоединяли в положении 24 в последовательности для облегчения присоединения PEG группы, которую присоединяли к пептид-холестериновому конъюгату смешением эквимолярных количеств йодацетил 40 кДа PEG с конъюгатом в 7 M мочевина/0,05 M трис-буфере при pH 8,5 в течение 1 часа.
Пример 12: Анализ на связывание с эстрогеновым рецептором
Протокол фосфоимаджера w/ очищенный ERα и фильтровальная пластинка Millipore
Следующие реагенты применяли для проведения анализа на связывание с эстрогеновым рецептором: буфер для связывания лиганда (pH 7,6), 50 мМ HEPES-Натриевая соль, 1 мМ CaCl2, 5 мМ MgCl2, 0,5% BSA, сахарозный градиент (pH 7,6), 20% сахароза, 120 мМ NaCl, 40 мМ Tris-HCl, 0,4% BSA, полиэтиленимин (PEI) и 0,25% PEL
Титрование "холодного" эстрадиола
Получали исходный раствор холодного эстрадиола с концентрацией, в 5 раз большей, чем наибольшая требуемая концентрация для испытаний. Наибольшая концентрация, которую испытывали, составляет 10 мкМ. Таким образом, исходный раствор 50 мкМ получали с суммарным объемом 500 мкл. Точно 40 мкл буфера для связывания добавляли к каждой лунке титрационного планшета, исключая колонки 11 и 12. Точно 60 мкл раствора с исходной концентрацией добавляли к каждой лунке колонки 11 титрационного планшета. 3-Кратное титрование осуществляли перенесением 20 мкл из колонки 11 в колонку 10 и смешиванием. Титровали каждую последующую колонку через колонку 1. Точно 20 мкл переносили из каждой лунки титрационного планшета в соответствующие лунки планшета для анализа. Точно 20 мкл буфера для связывания добавляли к лункам с "полным связыванием" (лунки 12(A-D)). Точно 20 мкл 100 мкМ холодного эстрадиола добавляли к лункам с "неспецифическим связыванием" (лунки 12(E-H)).
Постоянная концентрация "горячего" эстрадиола
Исходный раствор меченого эстрадиола получали при концентрации, в 5 раз большей, чем требуемая концентрация для испытания, которая равна 0,05 нМ. Таким образом, получали исходный раствор 0,25 нМ меченого эстрадиола с по меньшей мере суммарным объемом 2,3 мл. Меченый эстрадиол находился в растворе при 10 мкКи при объеме 100 мкл, что соответствует концентрации 45,45 нМ, применяя переводной коэффициент 2200 Ки/ммоль. Для 2,3 мл 0,25 нМ исходного раствора, 12,65 мкл меченого эстрадиола добавляли к 2,29 мкл буфера для связывания. Точно 20 мкл исходного раствора добавляли к каждой лунке планшета для анализа согласно протоколу.
Титрование очищенного эстрогенового рецептора альфа
Очищенный эстрогеновый рецептор испытывали при концентрации 1,5 нМ. Поскольку 60 мкл эстрогенового рецептора добавляли к каждой лунке, получали исходную концентрацию, которая была в 1,667 раз большей. Для испытываемой концентрации 1,5 нМ, получали исходную концентрацию 2,5 нМ. Объем 7,0 мл 2,5 нМ рецептора получали добавлением 8,4 мкл исходного раствора к 6,99 мл буфера для связывания. Затем, точно 60 мкл рецептора переносили в подходящие лунки в планшете для анализа.
Анализ
Планшет для анализа (содержащий холодный лиганд, горячий лиганд и клеточный лизат) выдерживали при комнатной температуре в течение 2 часов. Точно 25 мкл 0,25% PEI добавляли к каждой лунке фильтровального планшета. Фильтровальный планшет выдерживали в течение 20 минут перед очисткой лунок под вакуумом. Точно 80 мкл суспензий в планшете для анализа переносили в фильтровальный планшет, покрытый PEI. Образцы вакуумировали во всем фильтровальном планшете, применяя вакуумный патрубок. Фильтровальные планшеты промывали несколько раз буфером для связывания и затем заворачивали в целлофан. Планшеты прикрепляли к поверхности экрана для проявления фосфора с дном лунок близко к экрану. Экран для проявления фосфора и планшет помещали в пакет из пленки для облучения радиацией и подвергали воздействию радиации в течение 48 часов. Экран для получения изображения сканировали, применяя фосфоримаджер, и получали файл с результатами облучения.
Пример 13
Мышам (db/db, N=6, средний первоначальный вес тела = 54 г) подкожно вводили раз в день в течение четырех недель среду или 40 или 400 мкг/кг одного из следующего:
(a) GLP-1(Aib2A22CexK40) (400 мкг/кг-день),
(b) GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) (40 мкг/кг-день) или
(c) GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) (400 мкг/кг-день).
Вес тела измеряли через 23 дня, и определяли изменение веса (фигура 2a). Мыши, которым вводили большую дозу GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата, претерпевали большее снижение веса тела, чем мыши, которым вводили только GLP-1.
Также определяли влияние GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата на общее потребление пищи в течение 23 дней. Мыши, которым вводили большую дозу GLP-1(17-эфир)/эстроген(17-сложный эфир) конъюгата, потребляли меньше пищи, чем мыши, которым вводили только GLP-1.
Фигуры 2b и 2c показывают влияние GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата на концентрации глюкозы в крови (мг/дл). Мыши, которым вводили большую дозу GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата, претерпевали самое большое снижение концентрации глюкозы в крови между днями 0 и 14.
Пример 14. In vivo эффекты GLP-1/эстроген конъюгатов
Мышам с алиментарным ожирением (DIO) (N=8, 6 мышей на группу, средний первоначальный вес тела = 58 г) подкожно вводили раз в день в течение четырех недель среду или 4, 40, или 400 мкг/кг одного из следующего:
(a) GLP-1(Aib2E16CexK40) (40 мкг/кг-день),
(b) GLP-1(Aib2A22CexK40) (400 мкг/кг-день) или
(c) GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) (4, 40 или 400 мкг/кг-день).
Соляной раствор, содержащий 25% (об./об.) глюкозу, вводили при дозе 1,5 г/кг веса тела в 0 момент времени на 7 и 21 день. Глюкозу в крови измеряли через 0, 15, 30, 60 и 120 минут на 7 день и 21 день (фигура 3a).
Вес тела измеряли через 23 дня, и определяли изменение веса тела, изменение жировой массы и изменение сухой мышечной массы (фигуры 3b-d). Мыши, которым вводили большую дозу GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата, претерпевали самое большое снижение веса тела и жировой массы, и теряли самое маленькое количество сухой мышечной массы.
Также определяли влияние GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата на общее потребление пищи в течение 23 дней. Мыши, которым вводили большую дозу GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир), потребляли наименьшее количество пищи.
Фигура 3e показывает эффект GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата на изменение глюкозы в крови. Мыши, которым вводили большую дозу GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир) конъюгата, претерпевали самое большое снижение концентрации глюкозы в крови между днями 0 и 14. Данные результаты показывают дополнительную зависящую от дозы эффективность присоединения эстрогена к слабому GLP-1 агонисту на основе A22.
Пример 15
Мышам с алиментарным ожирением (DIO) (N=8, средний первоначальный вес тела = 59 г) подкожно вводили раз в день в течение четырех недель среду или одно из следующего:
(a) GLP-1(Aib2E16CexK40) (40 или 400 мкг/кг-день),
(b) GLP-1(Aib2E16CexK40)/эстроген (17-сложный эфир) (40 или 400 мкг/кг-день) или
(c) GLP-1(Aib2El6CexK40)/эстроген(3-эфир) (40 или 400 мкг/кг-день).
Соляной раствор, содержащий 25% (об./об.) глюкозу, вводили при дозе 1,5 г/кг веса тела в 0 момент времени в день 14. Концентрации глюкозы в крови измеряли через 0, 15, 30, 60 и 120 минут. Фигура 4a показывает данные эксперимента.
Вес тела измеряли через 21 день, и определяли изменение суммарного веса тела и жировой массы (фигуры 4b-c). Мыши, которым вводили большую дозу GLP-1/эстроген конъюгатов, претерпевали самое большое снижение суммарного веса тела (фигура 4b). Жировая масса снижалась при большой дозе эстрогенэфирного конъюгата по сравнению с животными, обработанными средой (фигура 4c). Сложноэфирные конъюгаты обладали большим эффектом на суммарный вес тела, чем эфирные конъюгаты, и эфирные конъюгаты обладали большим эффектом на жировую массу, чем сложноэфирные конъюгаты.
Также определяли влияние GLP-1(Aib2E16CexK40)/эстроген конъюгатов на общее потребление пищи в течение 21 дня. Мыши, которым вводили GLP-1/эстроген конъюгат, потребляли меньше пищи, чем мыши, которым вводили только GLP-1(Aib2E16CexK40).
Фигура 4d показывает эффект GLP-1(Aib2E16CexK40)/эстроген конъюгатов на концентрации глюкозы в крови (мг/дл). При большой дозе, мыши, которым вводили любой GLP-1(Aib2E16CexK40)/эстроген конъюгат, претерпевали большее изменение концентрации глюкозы в крови между днями 0 и 21, чем мыши, которым вводили только GLP-1(Aib2E16CexK40).
Пример 16
Мышам (N=8, 11 месяцев (возраст), средний вес тела 60 г), которые были на диабетической диете в течение 9 месяцев, подкожно вводили среду или одно из следующего:
(a) GLP-1(Aib2E16CexK40) (40 или 400 мкг/кг/день),
(b) GLP-1(Aib2E16CexK40)/эстроген(3-эфир) (40 или 400 мкг/кг-день),
(c) dGLP-1(A1Aib2A22CexK40)/эстроген(3-эфир) (40 или 400 мкг/кг-день),
(d) GLP-1(Aib2E16C24(PEG-40кДа)CexK40)/эстроген (3-эфир) (40, 400 мкг/кг-день),
(e) GLP-1(Aib2E16C24(PEG-40кДа)CexK40)/эстроген (3-эфир) (40 мкг/кг-неделя), или
(f) GLP-1(Aib2E16C24(PEG-40кДа)CexK40) (40 мкг/кг-неделя).
Вес тела измеряли через 7 дней, и определяли изменение веса тела (фигура 5a). Мыши, которым вводили большую дозу GLP-1/эстроген конъюгатов, претерпевали самое большое снижение веса тела, однако мыши, которым вводили низкую дневную дозу GLP-1/эстроген конъюгатов, также претерпевали заметное снижение веса тела.
Также определяли эффект GLP-1(Aib2E16K40Cex)/эстроген(3-эфир), dGLP-1(A1Aib2A22CexK40)/эстроген(3-эфир) и GLP-1(Aib2E16C24(PEG-40кДа)CexK40)/эстроген (3-эфир) конъюгатов на общее потребление пищи в течение 7 дней. Мыши, которым вводили или высокие или низкие дозы GLP-1(Aib2E15K40Cex)/эстроген(3-эфир) и GLP-1(Aib2E16K40Cex) или низкую дневную дозу GLP-1(Aib2E16C24(PEG-40кДа)CexK40), потребляли наименьшее количество пищи.
Фигура 5b показывает эффект GLP-1(Aib2E16K40Cex)/эстроген(3-эфир), dGLP-1(A1Aib2A22CexK40)эстроген(3-эфир) и GLP-1(Aib2E16C24(PEG-40кДа)CexK40)/эстроген (3-эфир) конъюгатов на изменение концентрации глюкозы в крови (мг/дл). Мыши, которым вводили или высокие или низкие дозы GLP-1(Aib2E16K40 Cex) претерпевали самое большое изменение глюкозы в крови, вместе с самым большим изменением глюкозы в крови при высокой дозе GLP-1(Aib2E16K40Cex)/эстроген(3-эфир).
Пример 17
Мышам с алиментарным ожирением (DIO) (N=8, средний первоначальный вес тела = 65 г) подкожно вводили раз в день в течение одной недели среду или 40 мкг/кг одного из следующих:
(a) GLP-1(Aib2E16CexK40),
(b) dGLP-(A1Aib2A22CexK40),
(c) GLP-1(Aib2A22CexK40),
(d) GLP-1(Aib2E16CexK40)/эстроген(3-эфир),
(e) dGLP-1(A1Aib2A22CexK40)/эстроген(3-эфир),
(f) GLP-1(Aib2A22CexK40)/эстроген(3-эфир),
(g) GLP-1(Aib2E16CexK40)/эстроген(17-сложный эфир)
(h) dGLP-(A1Aib2A22CexK40)/эстроген(17-сложный эфир) или
(i) GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир).
Вес тела измеряли через 7 дней, и определяли изменение веса тела и жировой массы (фигура 6a-b). Мыши, которым вводили любой эстрогеновый конъюгат, претерпевали самое большое снижение суммарного веса тела. Анализ жировой массы (фигура 6b) был относительно постоянным с суммарной потерей веса тела.
Фигура 6c показывает эффект GLP-1/эстроген конъюгатов на изменение глюкозы в крови (мг/дл). Мыши, которым вводили GLP-1(Aib2E16K40Cex)/эстроген(3-эфир) или GLP-1(Aib2E16K40Cex)/эстроген(17-сложный эфир) конъюгат, претерпевали самое большое изменение глюкозы в крови между днями 0 и 7.
Пример 18
Мышам (N=8, 11 месяцев (возраст), средний вес тела 60 г), которые были на диабетической диете в течение 9 месяцев, вводили подкожные инъекции раз в день в течение одной недели среды или 400 мкг/кг одного из следующего:
(a) GLP-1(Aib2E16CexK40),
(b) GLP-1(Aib2E16CexK40)/эстроген(3-эфир),
(c) GLP-1(Aib2E16CexK40)/эстроген(17-сложный эфир),
(d) dGLP-1(A1Aib2A22CexK40),
(e) dGLP-1(A1Aib2A22CexK40)/эстроген(3-эфир),
(f) dGLP-1(A1Aib2A22CexK40)/эстроген(17-сложный эфир),
(g) GLP-1(Aib2A22CexK40),
(h) GLP-1(Aib2A22CexK40)/эстроген(3-эфир) или
(i) GLP-1(Aib2A22CexK40)/эстроген(17-сложный эфир)
Вес тела измеряли через 7 дней, и определяли изменение веса тела (фигура 7a). Мыши, которым вводили GLP-1(Aib2A22CexK40)/эстроген конъюгаты, претерпевали самое большое снижение суммарного веса тела. GLP-1/эстроген конъюгаты показали большее снижение веса тела in vivo, чем соответствующие GLP-1 пептиды, которые не конъюгировали с эстрогеном.
Также определяли эффект GLP-1/эстроген конъюгатов на общее потребление пищи в течение 7 дней. Мыши, которым вводили GLP-1(Aib2A22CexK40)/эстроген конъюгаты, потребляли наименьшее количество пищи.
Фигура 7b показывает эффект GLP-1/эстроген конъюгатов на изменение глюкозы в крови (мг/дл). Мыши, которым вводили GLP-1(Aib2A22CexK40)/эстроген конъюгаты, претерпевали самое большое изменение глюкозы в крови между днями 0 и 7.
Ни A22, ни пептиды, содержащие d-аминокислоты, не показывали большого снижения по сравнению с GLP-1(Aib2E16CexK40)/эстроген конъюгатами. Кроме того, эстрогеновые конъюгаты GLP-1(Aib2E16CexK40) были явно более эффективными, чем неэстрогеновая форма того же пептида.
Пример 19
Мышам (N=8, средний вес тела 55 г) вводили подкожные инъекции раз в день в течение одной недели среды или одного из следующего:
(a) GLP-1(Aib2E16CexK40) (120 или 400 мкг/кг-день),
(b) GLP-1(Aib2E16CexK40)/эстроген(3-сложный эфир) (120 или 400 мкг/кг-день),
(c) dGLP-1(A1Aib2A22CexK40) (400 или 1200 мкг/кг-день) или
(d) dGLP-1(A1Aib2A22CexK40)/эстроген(3-сложный эфир) (400 или 1200 мкг/кг-день).
Пептиды, содержащие d-аминокислоты, были явно хуже во всех измерениях эффективности пептидов, содержащих l-аминокислоты. Вес тела измеряли через 7 дней, и определяли изменение веса тела (фигура 8a). Было небольшое явное отличие при снижении веса тела при данных дозах для пептидов с или без эстрогена.
Фигура 8b показывает эффект различных GLP-1/эстроген конъюгатов на изменение концентрации глюкозы в крови (мг/дл). Мыши, которым вводили GLP-1(Aib2E16CexK40)/эстроген(3-сложный эфир) конъюгат, претерпевали самое большое изменение концентрации глюкозы в крови между днями 0 и 7 in vivo, намного большее, чем животные, обработанные тем же пептидом, но без эстрогена. Это демонстрирует прямое улучшение, связанное с концентрацией глюкозы в крови, независимо от различия в весе тела.
Фигура 8c иллюстрирует эффект введения указанных GLP-1 конъюгатов на изменение жировой массы.
Пример 20
Мышам с алиментарным ожирением (DIO) (N=8, средний вес тела 61 г) вводили подкожные инъекции раз в день в течение одной или двух недель среды или 40, 400, 1200 или 4000 мкг/кг одного из следующих:
(a) GLP-1(Aib2E16CexK40)/эстроген(3-эфир) (40 мкг/кг-день),
(b) dGLP-1(A1Aib2A22CexK40) (4000 мкг/кг-день),
(c) dGLP-(A1Aib2A22CexK40)/эстроген(3-сложный эфир) (400, 1200, 4000 мкг/кг-день),
(d) GLP-1(Aib2E16C24(PEG-40кДа)CexK40) (40 мкг/кг-день),
(e) GLP-1(Aib2E16C24(PEG-40кДа)CexK40)/эстроген(3-эфир) (40 мкг/кг-день) или
(f) GLP-1(Aib2El6C24(PEG-40кДа)CexK40)/холестерин (40 мкг/кг-день).
Вес тела измеряли через 7 дней, и определяли изменение веса тела. Мыши, которым вводили GLP-1/эстроген(3-сложный эфир) конъюгат, претерпевали самое большое снижение веса тела (фигура 9a) и наименьшее количество жировой массы (фигура 9b).
Также определяли эффект GLP-1/эстроген(3-сложный эфир) конъюгатов на общее потребление пищи в течение 7 дней. Мыши, которым вводили GLP-1(Aib2E16CexK40)/эстроген(3-сложный эфир) конъюгат (без PEG), потребляли значительно меньше пищи, чем мыши, которым вводили только GLP-1.
Фигура 9c показывает эффект GLP-1/эстроген(3-сложный эфир) конъюгатов на изменение глюкозы в крови. Было явное зависящее от дозы снижение глюкозы для содержащего d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгата между днями 0 и 7, и оно увеличивалось при самой большой дозе по сравнению с мышами, которым вводили только GLP-1 (фигура 9c)
Пример 21
Мышам (N=8, 14 месяцев (возраст)), которые были на диабетической диете, подкожно вводили один раз в день в течение одной недели среду или одно из следующего:
(a) d-GLP-1(A1Aib2A22CexK40)/эстроген(3-сложный эфир) (1200, 4000 мкг/кг),
(b) d-GLP-1(A1Aib2A22CexK40)/Эстроген(3-эфир) (1200, 4000 мкг/кг) или
(c) d-GLP-1(Aib2E16K40Cex) (4000 мкг/кг),
Вес тела измеряли через 7 дней, и определяли изменение веса тела (фигура 10a). Мышам вводили содержащие d-аминокислоты GLP-1/эстроген конъюгаты, где эстроген был ковалентно связан или через стабильную амидную связь или сложноэфирную связь, которая была нестабильной in vivo. Животные, обработанные нестабильным эфирным конъюгатом, претерпевали самое большое снижение суммарного веса тела.
Также определяли эффект GLP-1/эстроген конъюгатов на общее потребление пищи в течение 7 дней. Мыши, которым вводили нестабильный эфирный конъюгат, потребляли значительно меньше пищи, чем мыши, которым вводили оставшиеся конъюгаты.
Также определяли эффект GLP-1/эстроген конъюгатов на изменение концентрации глюкозы в крови (мг/дл). Фигура 10b показывает, что мыши, которым вводили содержащий d-аминокислоты GLP-1/эстрогенэфирный конъюгат, претерпевали большее изменение концентрации глюкозы в крови между днями 0 и 7, чем мыши, которым вводили сравнительный пептид, содержащий d-аминокислоты, но в виде стабильного конъюгата с эстрогеном.
Пример 22. In Vitro рецепторные анализы активных GLP-1/эстроген конъюгатов
Получали серийные разбавления следующих соединений:
(i) эстрадиол,
(ii) GLP-1,
(iii) активный, эстроген-стабильный GLP-1/эстроген(3- эфир) конъюгат,
(iv) активный, эстроген-лабильный GLP-1/эстроген(3- сложный эфир) конъюгат,
(v) активный, эстроген-стабильный GLP-1/эстроген(17-сложный эфир) конъюгат,
(vi) активный, нестабильный, кислотолабильный GLP-1/эстроген (17-гидразон) конъюгат,
(vii) активный, нестабильный, чувствительный к восстановлению тиолом, GLP-1/эстроген(17-карбаматдисульфид) конъюгат и
(viii) активный, активированный эстроген-лабильный GLP-1/эстроген(3-сложный эфир, 17-OAc).
GLP-1 Активность (цАМФ индукция) - Серийные разбавления (ii), (iii) и (iv) выдерживали с HEK293 клетками, совместно трансфицированными GLP-1 рецептором и люциферазным геном, соединенным с цАМФ-ответным элементом (CRE). Люминесценцию измеряли после лизиса клеток и выдерживания с люциферином. Результаты, показанные в таблице ниже, показывают, что конъюгирование GLP-1 с эстрогеном не влияет на природную активность GLP-1 относительно GLP-1 рецептора.
GLP-1 связывание - Серийные разбавления (ii), (iii) и (iv) выдерживали с экстрактами клеточных мембран с GLP-1 рецептором, [I125]-GLP-1 и SPA гранулами, покрытыми агглютинином, перед сцинтилляционным измерением. Результаты, приведенные в таблице ниже, показывают, что конъюгирование GLP-1 с эстрогеном не влияет на связывание GLP-1 с GLP-1 рецептором.
Эстрогеновая активность - Серийные разбавления (i), (iii) и (iv) выдерживали с T47D клетками, трасфецированными люциферазным геном, соединенным с эстрогеновым ответным элементом (ERE).
Люминесценцию измеряли после лизиса клеток и выдерживания с люциферином. Результаты, приведенные ниже в таблице, показывают, что стабильное присоединение эстрогена к GLP-1 значительно снижает внутриклеточную эстрогеновую активность эстрогена, тогда как лабильный конъюгат проявляет большую степень внутриклеточной эстрогеновой активности.
ERα связывание - Серийные разбавления (i), (iii) и (iv) выдерживали с очищенным ERα и [I125]-эстрадиолом. После фильтрации, связывание радиоактивного лиганда оценивали количественно «фосфоримиджингом». Результаты, приведенные в таблице, показывают, что стабильное присоединение эстрогена к GLP-1 значительно снижает способность эстрогена к связыванию с эстрогеновым рецептором, тогда как лабильный конъюгат демонстрирует связывание с эстрогеновым рецептором, которое представляет собой функцию нестабильности сложноэфирного конъюгата в условиях биоанализа.
GLP-1 Активность (цАМФ индукция) - Серийные разбавления (ii), (iii), (iv), (v), (vi), (vii) и (viii) выдерживали с HEK293 клетками, совместно трансфицированными GLP-1 рецептором и люциферазным геном, соединенным с цАМФ-ответным элементом (CRE). Люминесценцию измеряли после лизиса клеток и выдерживания с люциферином. Активные, нестабильные GLP-1/эстроген конъюгаты были равно активными относительно GLP-1 рецептора (фигура 11a).
Эстрогеновая активность - Серийные разбавления (i), (iii), (iv), (v), (vi), (vii) и (viii) выдерживали с T47D клетками, трансфицированными люциферазным геном, соединенным с эстрогеновым ответным элементом (ERE). Люминесценцию измеряли после лизиса клеток и выдерживания с люциферином. Активные, нестабильные GLP-1/эстроген конъюгаты обладали различной активностью относительно эстрогенового рецептора (фигура 11b). Когда данные активные нестабильные конъюгаты целенаправленно обрабатывали, например, кислотой, тиолом или ферментом (например, катепсином), нестабильные GLP-1/эстроген конъюгаты возвращали практически полную эстрогеновую эффективность. Таким образом, активные, нестабильные GLP-1/эстроген конъюгаты проявляют пониженную эстрогеновую активность в виде ковалентного конъюгата и требуют высвобождения для того, чтобы быть активными.
Пример 23. In Vitro рецепторные анализы неактивных GLP-1/эстроген конъюгатов
Получали серийные разбавления следующих соединений:
(i) неактивный GLP-1,
(ii) неактивный, эстроген-стабильный GLP-1/эстроген(3-эфир) конъюгат и
(iii) неактивный, эстроген-лабильный GLP-1/эстроген(3-сложный эфир) конъюгат.
GLP-1 Активность (цАМФ индукция) - Серийные разбавления (i), (ii) и (iii) выдерживали с HEK293 клетками, совместно трансфицированными GLP-1 рецептором и люциферазным геном, соединенным с цАМФ-ответным элементом (CRE). Люминесценцию измеряли после лизиса клеток и выдерживания с люциферином. Результаты показаны в таблице ниже.
Пример 24
Мышам с алиментарным ожирением (DIO) (N=8, средний вес тела 51 г) вводили подкожные инъекции раз в день в течение двух недель среды или 400 или 4000 мкг/кг одного из следующего:
(a) содержащего d-аминокислоты GLP-1(A1Aib2E16K40Cex) (4000 мкг/кг),
(b) содержащего d-аминокислоты GLP-1(A1Aib2A22CexK40)/эстроген(3-сложный эфир) (400, 4000 мкг/кг) или
(c) содержащего d-аминокислоты GLP-1(A1Aib2A22CexK40)/эстроген (3-эфир) (400, 4000 мкг/кг).
Вес тела измеряли через 15 дней, и определяли изменение веса тела. Мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат, претерпевали самое большое снижение веса тела, причем эффект был более явно выражен при большой дозе (фигура 12a).
Также определяли эффект неактивного GLP-1 и неактивных GLP-1/эстроген конъюгатов на общее потребление пищи в течение 15 дней. Мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат, потребляли значительно меньше пищи, чем мыши, которым вводили только неактивный GLP-1 или неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат, причем эффект был более явно выражен при большой дозе (Фигура 12b).
Фигура 12c показывает эффект неактивного GLP-1 и неактивных содержащих d-аминокислоты GLP-1/эстроген конъюгатов на изменение глюкозы в крови. Большая доза неактивного содержащего d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгата снижала глюкозу в крови между днями 0 и 14.
Вес печени измеряли через 15 дней, и определяли изменение веса печени. Мыши, которым вводили эстроген-лабильный, неактивный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат, претерпевали большее снижение веса печени, чем мыши, которым вводили эстроген-стабильный, неактивный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат (Фигура 12d).
Вес матки измеряли через 15 дней, и определяли изменение веса матки. Мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат, претерпевали значительно большее увеличение веса матки, чем мыши, которым вводили только неактивный GLP-1 или неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат (Фигура 12e).
Пример 25
C57BF6 мышей (N=8, средний вес тела 19,6 г) на стандартной пищевой диете подвергали овариэктомии и позволяли им восстановиться в течение 5 дней перед подкожным введением инъекций раз в день в течение 7 дней среды или 4000 мкг/кг одного из следующего:
(a) GLP-1 агонист,
(b) содержащего d-аминокислоты GLP-1(A1Aib2A22CexK40)/эстроген(3-сложный эфир),
(c) содержащего d-аминокислоты GLP-1(A1Aib2A22CexK40)/эстроген(3-эфир) или
(d) GLP-1 агонист/эстроген(3-эфир).
Мышей умерщвляли в конце исследования, и матку отделяли и взвешивали.
Вес тела измеряли через 7 дней, и определяли изменение веса тела. Мыши, которым вводили активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, претерпевали большее снижение веса тела, чем мыши, которым вводили только активный, GLP-1 агонист (фигура 13a), неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат или неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат. Мыши, которым вводили GLP-1 агонист, неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат и активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, показывали снижение жировой массы (фигура 13b).
Также определяли эффект GLP-1 конъюгатов на общее потребление пищи в течение 7 дней. Мыши, которым вводили активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, потребляли меньше пищи, чем мыши, которым вводили только активный, GLP-1 агонист, неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат или неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат (фигура 13c).
Фигура 13d показывает эффект GLP-1 конъюгатов на изменение глюкозы в крови. Мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат или активный, стабильный GLP-1 агонист/эстроген (3-эфир) конъюгат, претерпевали снижение концентрации глюкозы в крови, большее, чем животные, которым вводили среду. Мыши, которым вводили неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат, не показывали снижения концентрации глюкозы в крови.
Вес матки измеряли через 7 дней, и определяли изменение веса матки. Мыши, которым вводили неактивный, эстроген-лабильный содержащий d-аминокислоты GLP-1/эстроген(3-сложный эфир) конъюгат, претерпевали значительно большее увеличение веса матки, чем мыши, которым вводили только GLP-1, неактивный, эстроген-стабильный содержащий d-аминокислоты GLP-1/эстроген(3-эфир) конъюгат или активный, эстроген-стабильный GLP-1/эстроген(3-эфир) конъюгат (Фигура 13e).
Пример 26
Мышей (N=8, средний вес тела 19,1 г) на стандартной пищевой диете подвергали овариэктомии и позволяли им восстановиться в течение 5 дней перед подкожным введением инъекций раз в день в течение 7 дней среды или 4000 мкг/кг одного из следующего:
(a) GLP-1 агонист/эстроген(3-сложный эфир),
(b) GLP-1 агонист/эстроген(17-карбаматдисульфид),
(c) GLP-1 агонист/эстроген(17-гидразон) или
(d) GLP-1 агонист/эстроген(17-катепсин).
Мышей умерщвляли в конце исследования, и матку отделяли и взвешивали.
Вес тела измеряли через 7 дней, и определяли изменение веса тела. Мыши, которым вводили нестабильные GLP-1 агонист/эстроген конъюгаты, претерпевали большее снижение веса тела и жировой массы, чем мыши, которым вводили только активный, GLP-1 агонист или активный, эстроген-лабильный GLP-1 агонист/эстроген(3-сложный эфир) конъюгат (фигуры 14a и 14b). Мыши, которым вводили нестабильные фермент- и кислотолабильные конъюгаты, GLP-1 агонист/эстроген(17-катепсин) и GLP-1 агонист/эстроген(17-гидразон), соответственно, первоначально имели самое большое снижение веса тела, тогда как нестабильный чувствительный к восстановлению тиолом лабильный конъюгат, GLP-1 агонист/эстроген(17-карбаматдисульфид), показывал суммарное наибольшее снижение веса тела в течение 7 дневного исследования.
Фигура 14c показывает эффект нестабильных GLP-1 конъюгатов на изменение глюкозы в крови. Мыши, которым вводили нестабильные чувствительные к восстановлению тиолом и кислотолабильные конъюгаты, GLP-1 агонист/эстроген(17-карбаматдисульфид) и GLP-1 агонист/эстроген(17-гидразон), соответственно, претерпевали большее снижение концентрации глюкозы в крови в процессе исследования, чем лабильный GLP-1 агонист/эстроген(3-сложный эфир) конъюгат.
Вес матки измеряли через 7 дней, и определяли изменение веса матки. Мыши, которым вводили эстроген-лабильный GLP-1/эстроген(3-сложный эфир) конъюгат, претерпевали значительно большее увеличение веса матки, чем мыши, которым вводили нестабильные GLP-1/эстроген конъюгаты (фигура 14d).
Пример 27
Мышам с алиментарным ожирением вводили подкожные инъекции раз в день в течение двух недель среды или 40 или 400 мкг/кг одного из следующего:
(a) GLP-1 агонист,
(b) GLP-1 агонист/эстроген(3-сложный эфир) или
(c) GLP-1 агонист/эстроген(3-эфир).
Вес тела измеряли через 15 дней, и определяли изменение веса тела. Мыши, которым вводили активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, претерпевали значительно большее снижение веса тела, чем мыши, которым вводили только активный, GLP-1 агонист или активный, эстроген-лабильный GLP-1 агонист/эстроген(3-сложный эфир) конъюгат (фигура 15a).
Также определяли эффект активного GLP-1 и активных GLP-1/эстроген конъюгатов на общее потребление пищи в течение 15 дней. Мыши, которым вводили активный, эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, потребляли значительно меньше пищи, чем мыши, которым вводили только активный, GLP-1 агонист или активный, эстроген-лабильный GLP-1 агонист/эстроген(3-сложный эфир) конъюгат (фигура 15b).
Пример 28. Анализы на стабильность GLP-1/эстроген конъюгатов
Пептидные конъюгаты (1 мг/мл) выдерживали в 100% плазме человека при pH 7,4 и 37°C. Аликвоты отбирали, и белки плазмы осаждали и удаляли микроцентрифугированием. Аликвоты анализировали ВЭЖХ и МС, как описано в примере 1. Активные эстроген-стабильные GLP-1/эстроген (3-эфир) конъюгаты (например, пример 3) не проявляли высвобождение эстрогена в течение 72 часов, тогда как активные эстроген-лабильные GLP-1/эстроген(3-сложный эфир) конъюгаты (например, пример 6) проявляли значительное высвобождение эстрогена через 3 часа и полное высвобождение эстрогена в течение 6 часов (фигура 16a). Кислотолабильный конъюгат, GLP-1/эстроген(17-гидразон) (например, пример 7) не проявлял высвобождения эстрогена в плазме в течение 48 часов при физиологическом pH, но высвобождал эстроген в течение 3 часов при воздействии кислоты (pH 5,0), с полным высвобождением эстрогена в течение 6 часов (фигура 16b). Незатрудненный чувствительный к восстановлению тиолом конъюгат (например, пример 9) показал значительное высвобождение эстрогена после 24 часов и полное высвобождение эстрогена в течение 48 часов, тогда как затрудненный чувствительный к восстановлению тиолом конъюгат, GLP-1/эстроген(17-карбаматдисульфид) (например, пример 9), не проявлял высвобождение эстрогена в плазме в течение 72 часов (фигура 16c). Данный затрудненный чувствительный к восстановлению тиолом конъюгат также не проявлял высвобождение эстрогена при внеклеточной концентрации глютатиона (например, 15 мкМ), но высвобождал эстроген в течение 6 часов при внутриклеточной концентрации глютатиона 15 мМ (фигура 16d). Фермент-лабильный GLP-1/эстроген(катепсин) конъюгат (например, пример 10) не проявлял высвобождение эстрогена в плазме в течение 72 часов (фигура 16e).
Пример 29
Мышам с алиментарным ожирением вводили подкожные инъекции раз в день в течение семи дней среды или 400 мкг/кг одного из следующего:
(a) GLP-1 агонист,
(b) GLP-1 агонист/эстроген(3-эфир),
(c) GIP агонист,
(d) GIP агонист/эстроген(3-эфир),
(e) глюкагоновый агонист или
(f) глюкагоновый агонист/эстроген(3-эфир).
Вес тела измеряли через 7 дней, и определяли изменение веса тела (фигура 17a). Мыши, которым вводили GLP-1 агонист/эстроген(3-эфир) конъюгат, претерпевали самое большое снижение веса тела и значительно большее снижение веса тела, чем мыши, которым вводили только GLP-1 агонист. Мыши, которым вводили только GIP агонист и GIP агонист/эстроген(3-эфир) конъюгат, проявляли аналогичное снижение веса тела. Мыши, которым вводили GIP агонист и GIP агонист/эстроген(3-эфир) конъюгат, проявляли большее снижение веса тела, чем мыши, которым вводили среду. Мыши, которым вводили только глюкагоновый агонист и глюкагоновый агонист/эстроген(3-эфир) конъюгат, проявляли аналогичное снижение веса тела. Снижение веса тела у мышей, которым вводили глюкагоновый агонист или глюкагоновый агонист/эстроген(3-эфир) конъюгат, было аналогичным снижению веса тела у мышей, которым вводили среду. Не намереваясь быть связанными какой-либо конкретной теорией, пептиды, мишенью которых является GLP-1 рецептор, проявляют превосходную способность направлено доставлять эстроген в клетку(-и), где он может оказывать заметный положительный эффект на вес тела. В данном эксперименте конъюгаты с GLP-1 активными пептидами (GLP-1 агонисты) обладали лучшими характеристиками относительно снижения веса тела, чем пептиды, мишенью которых являлся преимущественно GIP или глюкагоновый рецепторы (GIF агонисты или глюкагоновые агонисты).
Также определяли эффект конъюгатов на общее потребление пищи (фигура 17b). Мыши, которым вводили эстрогеновые конъюгаты GLP-1, GIP и глюкагона, потребляли меньше пищи, чем мыши, которым вводили GLP-1 агонист, GIP агонист или глюкагоновый агонист, соответственно. Мыши, которым вводили GLP-1 агонист/эстроген(3-эфир) конъюгат, потребляли наименьшее количество пищи в течение 7 дневного периода.
Также определяли эффект конъюгатов на изменение глюкозы в крови. Мыши, которым вводили GLP-1 агонист и GLP-1 агонист/эстроген(3-эфир) конъюгат, оба проявляли снижение концентрации глюкозы в крови в течение 7 дней, причем снижение было большим у мышей, которым вводили конъюгат. Мыши, которым вводили GIP агонист и GIP агонист/эстроген(3-эфир) конъюгат, также проявляли снижение концентрации глюкозы в крови в течение 7 дней. Мыши, которым вводили глюкагоновый агонист, проявляли увеличение концентрации глюкозы в крови в течение 7 дней, тогда как мыши, которым вводили глюкагоновый агонист/эстроген(3-эфир) конъюгат, проявляли снижение концентрации глюкозы в крови в течение 7 дней (фигура 17c).
Пример 30
Мышам дикого типа с алиментарным ожирением, мышам с «нокаутом» эстрогенового рецептора бета (ERβ KO) и мышам с «нокдауном» эстрогенового рецептор альфа (ERα KO) вводили подкожные инъекции раз в день в течение двух недель среды или 400 мкг/кг одного из следующего:
(a) GLP-1 агонист, или
(b) GLP-1 агонист/эстроген(3-эфир).
Вес тела измеряли через 14 дней, и определяли изменение веса тела (фигура 18a). Мыши дикого типа, которым вводили GLP-1 агонист/эстроген(3-эфир) конъюгат, проявляли большее снижение веса тела, чем мыши, которым вводили среду или GLP-1 агонист. Мыши дикого типа, которым вводили среду, проявляли приблизительно 10% увеличение веса тела в течение двухнедельного периода, приблизительно 3% увеличение веса тела при введении GLP-1 агониста и приблизительно 10% снижение веса тела при введении GLP-1 агонист/эстроген(3-эфир) конъюгата. ERα KO мыши, которым вводили GLP-1 агонист/эстроген(3-эфир) конъюгат, проявляли большее снижение веса тела, чем при введении среды или GLP-1 агониста. ERα KO мыши не проявляли изменений веса тела при введении среды, проявляли приблизительно 10% снижение веса тела при введении GLP-1 агониста и приблизительно 20% снижение веса тела при введении GLP-1 агонист/эстроген(3-эфир) конъюгата. ERβ KO мыши, которым вводили GLP-1 агонист/эстроген(3-эфир) конъюгат, проявляли аналогичное снижение веса тела, как мыши, которым вводили GLP-1 агонист. ERβ KO мыши проявляли приблизительно 2% снижение веса тела при введении среды и приблизительно 15% снижение веса тела при введении или GLP-1 агониста или GLP-1 агонист/эстроген(3-эфир) конъюгата. Не намереваясь быть связанными какой-либо конкретной теорией, эти данные приводят к выводу, что ERβ рецептор является ответственным за дополнительное снижение веса тела. Когда ERβ рецептор нокаутирован, мыши не проявляют различия в снижении веса тела между GLP-1 агонистом и GLP-1 агонист/эстроген(3-эфир) конъюгатом.
Также определяли эффект GLP-1 конъюгатов на общее потребление пищи у мышей дикого типа и «нокаутированных» мышей (фигура 18b). «Нокаутированные» мыши, которым вводили GLP-1 агонист/эстроген(3-эфир) конъюгат, потребляли наименьшее количество пищи.
Также определяли эффект GLP-1 конъюгатов на изменение глюкозы в крови у мышей дикого типа и «нокаутированных» мышей. ERα KO мыши, которым вводили GLP-1 агонист/эстроген(3-эфир) конъюгат, проявляли самое большое снижение концентрации глюкозы в крови (фигура 18c).
Пример 31
Самцам db/db мышей с концентрацией глюкозы в крови 500 мг/дл подкожно вводили дозу среды или 50 нмоль/кг одного из следующего:
(a) GLP-1 агонист,
(b) GLP-1 агонист/эстроген(3-эфир), или
(c) GLP-1 агонист/эстроген(3-сложный эфир).
Мыши, которым вводили GLP-1 агонист, проявляли наименьшее эффективное снижение глюкозы в крови в течение 48 часов (за исключением среды), тогда как мыши, которым вводили эстроген-стабильный GLP-1 агонист/эстроген(3-эфир) конъюгат, проявляли самое эффективное снижение глюкозы в крови в течение 48 часов (фигура 19).
Результаты приведенных выше экспериментов согласуются с моделью диабета, вызванного стрептозотоцином (STZ), модель диабета I типа.
Реферат
Изобретение относится к новым конъюгатам пептидов глюкагонового суперсемейства, которые конъюгированы со стероидом, активирующим ядерный гормональный рецептор типа I. Настоящее изобретение также относится к фармацевтическим композициям, включающим указанные конъюгаты, и способам лечения заболевания, например метаболического синдрома, диабета или ожирения. 3 н. и 12 з.п. ф-лы, 19 ил., 15 табл., 31 пр.
Формула
где Q представляет собой пептид глюкагонового суперсемейства, обладающий агонистической активностью относительно глюкагонового рецептора, GIP рецептора, GLP-1 рецептора или их комбинации,
Y представляет собой стероид, который активирует ядерный гормональный рецептор типа I при конъюгировании с Q-L, где Y выбран из группы, состоящей из эстрадиола и его производных, эстрона и его производных, тестостерона и его производных и кортизола и его производных, и
L представляет собой связывающую группу, содержащую эфирную группу или амидную группу, сложноэфирную группу, кислотолабильную, чувствительную к восстановлению или фермент-лабильную группу, гидразоновую группу, дисульфидную группу или катепсин-расщепляемую группу.
(I) аминокислотную последовательность:
X1-X2-Gln-Gly-Thr-Phe-Tnr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Z (SEQ ID NO: 839) с 1-3 аминокислотными модификациями в ней,
(a) где X1 и/или Х2 представляет собой ненативную аминокислоту (относительно SEQ ID NO: 1601), которая снижает подверженность глюкагонового пептида к расщеплению дипептидилпептидазой IV (DPP-IV),
(b) где Z выбран из группы, состоящей из -СООН, -Asn-COOH, Asn-Thr-COOH и W-COOH, где W представляет собой 1-2 аминокислоты или GPSSGAPPPS,
(с) где Q содержит модификацию, выбранную из группы, состоящей из:
(i) лактамной мостиковой связи между боковыми цепями аминокислот в положениях i и i+4, где i равно 12, 16, 20 или 24, и
(ii) одна, две, три или все из аминокислот в положениях 16, 20, 21 и 24 глюкагонового пептида заменены α,α-дизамещенной аминокислотой,
где Q обладает глюкагоновой агонистической активностью.
(а) по меньшей мере одну аминокислотную модификацию, выбранную из группы, состоящей из:
(i) замены Thr в положении 29 заряженной аминокислотой,
(ii) замены Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты,
(iii) замены в положении 29 Asp, Glu или Lys
(iv) замены в положении 29 Glu,
(v) вставки после положения 29 1-3 заряженных аминокислот,
(vi) вставки после положения 29 Glu или Lys,
(vii) вставки после положения 29 Gly-Lys или Lys-Lys,
(viii) замены Gln в положении 3 аминокислотой, содержащей боковую цепь структуры I, II или III:
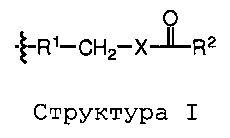
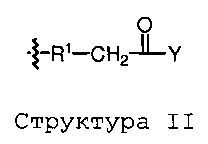
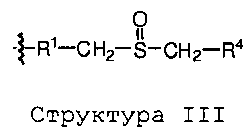
где R1 представляет собой С0-3 алкил или С0-3 гетероалкил, R2 представляет собой NHR4 или C1-3 алкил, R3 представляет собой C1-3 алкил, R4 представляет собой Н или C1-3 алкил, X представляет собой NH, О или S и Y представляет собой NHR4, SR3 или OR3, и
(ix) их комбинации;
(b) замену Ser в положении 16 Thr, Glu или Aib и по меньшей мере одну аминокислотную модификацию, выбранную из группы, состоящей из:
(i) замены His в положении 1 ненативной аминокислотой, которая снижает подверженность глюкагонового пептида к расщеплению дипептидилпептидазой IV (DPP-IV),
(ii) замены Ser в положении 2 ненативной аминокислотой, которая снижает подверженность глюкагонового пептида к расщеплению дипептидилпептидазой IV (DPP-IV),
(iii) замены Thr в положении 7 Ile, Abu или Val,
(iv) замены Gln в положении 20 Ser, Thr, Ala, Aib, Arg или Lys,
(v) замены Met в положении 27 Leu или Nle,
(vi) делеции аминокислот в положениях 28-29,
(vii) делеции аминокислоты в положении 29,
(viii) добавления аминокислотной последовательности GPSSGAPPPS к С-концу и
(ix) добавления аминокислотной последовательности GPSSGAPPPSX к С-концу, где X представляет собой любую аминокислоту, и
(x) их комбинации,
где Q обладает глюкагоновой агонистической активностью.
(I) Q содержит родственный глюкагону пептид SEQ ID NO: 1601 со следующими модификациями:
(a) аминокислотная модификация в положении 1, которая придает GIP агонистическую активность,
(b) модификация, выбранная из группы, состоящей из:
(i) лактамной мостиковой связи между боковыми цепями аминокислот в положениях i и i+4 или между боковыми цепями аминокислот в положениях j и j+3, где i равно 12, 13, 16, 17, 20 или 24 и где j равно 17, и
(ii) одна, две, три или все из аминокислот в положениях 16, 20, 21 и 24 аналога заменены α,α-дизамещенной аминокислотой,
(c) 1-10 дополнительных аминокислотных модификаций, где 1-10 дополнительных аминокислотных модификаций выбраны из группы, состоящей из:
(i) замены серина в положении 2 D-Ser, Ala, D-Ala, Gly, N-метил-Ser, Aib, Val или ε-амино-N-масляной кислотой,
(ii) замены серина в положении 16 Glu, Gln, гомоглютаминовой кислотой, гомоцистеиновой кислотой, Thr, Gly или Aib,
(iii) замены глютамина в положении 20 Ser, Thr, Ala, Lys, цитруллином, Arg, Orn или Aib,
(iv) замены метионина в положении 27 Leu,
(v) замены аргинина в положении 28 Ala,
(vi) замены треонина в положении 29 Gly,
(vii) консервативной замены в любом положении 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 21, 24, 27, 28 и 29,
(viii) добавления 1-21 аминокислот к С-концу,
(ix) добавления аминокислотной последовательности GPSSGAPPPS к С-концу,
(x) добавления аминокислотной последовательности GPSSGAPPPSX к С-концу, где X представляет собой любую аминокислоту,
(xi) замены С-концевой карбоксильной группы амидом или сложным эфиром и
(xii) их комбинации,
где Q обладает активностью относительно GIP рецептора;
(II) Q содержит аминокислотную последовательность:
X1-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-X3-Ser-X4-Tyr-Leu-X5-X6-X7-X8-Ala-X9-X10-Phe-X11-X12-Trp-Leu-X13-X14-X15 (SEQ ID NO: 55) или ее аналог, где указанный аналог отличается от SEQ ID NO: 55 1-3 аминокислотными модификациями, выбранными из положений 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21 и 25, где
(а) Х1 представляет собой His, D-His, (дезамино)His, гидроксил-His, ацетил-His, гомо-His или альфа,альфа-диметилимидазолуксусную кислоту (DMIA), N-метил His, альфа-метил His или имидазолуксусную кислоту,
(b) Х2 представляет собой Ser, D-Ser, Ala, D-Ala, Val, Gly, N-метил Ser, аминоизомасляную кислоту (Aib) или N-метил Ala,
(c) X3, X4, X5, X10, X11 и X14 представляют собой отдельно любую аминокислоту,
(d) Х6 представляет собой Ser, Glu, Gln, гомоглютаминовую кислоту или гомоцистеиновую кислоту,
(e) Х7 представляет собой Arg, Gln, Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин,
(f) Х8 представляет собой Arg, Ala, Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин,
(g) Х9 представляет собой Gln, Lys, Arg, Orn или цитруллин,
(h) X12 представляет собой Ala, Gln, Glu, Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин,
(i) X13 представляет собой Met, Leu или Nle,
(j) X15 представляет собой Thr, Gly, Lys, Cys, Orn, гомоцистеин или ацетилфенилаланин, и
необязательно содержит одну из следующих модификаций:
(a) делецию аминокислот в положениях 28-29,
(b) делецию аминокислоты в положении 29,
(c) добавление аминокислотной последовательности GPSSGAPPPS к С-концу и
(d) добавление аминокислотной последовательности GPSSGAPPPSX к С-концу, где X представляет собой любую аминокислоту, и
(e) их комбинацию;
(III) Q содержит аминокислотную последовательность, которая отличается от SEQ ID NO: 1601 не более чем десятью аминокислотными модификациями, состоящими из:
(a) одной или более аминокислотных замен Aib в положениях 16, 20, 21 и/или 24 и
(b) аминокислотной модификации в положении 1 и/или 2, которая приводит к снижению подверженности к расщеплению дипептидилпептидазой IV, и
необязательно содержащую одну или более из следующих модификаций:
(a) делецию аминокислот в положениях 28 и 29,
(b) делецию аминокислоты в положении 29,
(c) добавление аминокислотной последовательности GPSSGAPPPS к С-концу,
(d) добавление аминокислотной последовательности GPSSGAPPPSX к С-концу, где X представляет собой любую аминокислоту,
(e) замену С-концевой карбоксильной группы амидом или сложным эфиром, и
где Q обладает GLP-1 агонистической активностью и глюкагоновой агонистической активностью.





Комментарии