Новые композиции агонистов эксендина и способы ихвведения - RU2242244C2
Код документа: RU2242244C2
Чертежи





















Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет предварительной заявки на патент США 60/116380, озаглавленной "Новые композиции агонистов эксендина и способы их введения", поданной 14 января 1999 года, и предварительной заявки на патент США 60/(еще не имеющей номера), озаглавленной "Применение эксендинов и их агонистов для модулирования уровней триглицеридов и лечения дислипидемии", поданной 14 января 1999 года, содержания которых включены здесь в качестве ссылки в их полном виде.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым композициям эксендина и пептидных агонистов эксендина, дозировкам и дозированным композициям, которые являются биологически активными и доставляемыми через инъекционные или неинъекционные пути, например, через дыхательные пути, через рот и через кишечник. Эти композиции и дозированные формы и способы введения применимы для лечения диабета, в том числе диабета типа I и II, для лечения нарушений, при которых могли бы принести пользу агенты, понижающие уровни глюкозы в плазме, и для лечения нарушений, при которых могло бы принести пользу введение агентов, применимых для задержки и/или замедления опорожнения желудка или снижения потребления пищи.
ПРЕДПОСЫЛКИ
Нижеследующее описание включает в себя информацию, которая может быть полезна для понимания данного изобретения. Это не является признанием того, что приведенная здесь информация является прототипом заявляемых в настоящее время изобретений или является релевантной, и не означает, что любая из публикаций, цитируемых специально или косвенно, является прототипом.
Эксендины являются пептидами, которые обнаружены в слюнных выделениях жилатье (Гильского ядозуба) и Мексиканского ядозуба, пресмыкающихся, которые обитают в Аризоне и Северной Мексике. Эксендин-3 [SEQ ID NO:1: His Ser Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2] присутствует в слюнных выделениях Heloderma horridum (Мексиканского ядозуба), а эксендин-4 [SEQ ID NO:2: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2] присутствует в слюнных выделениях Heloderma suspectum (жилатье, Гильский ядозуб) (Eng, J., et al., J.Biol.Chem., 265:20259-62; Еng, et al., J.Biol.Chem., 267:7402-05, 1992). Аминокислотная последовательность эксендина-3 показана на фиг.1. Аминокислотная последовательность эксендина-4 показана на фиг.2. Сначала считали, что эксендин-4 является (потенциально токсичным) компонентом яда. В настоящее время представляется, что эксендин-4 не обладает токсичностью и что он вместо этого продуцируется в слюнных железах Гильского ядозуба.
Эксендины имеют некоторое сходство последовательности с несколькими членами семейства глюкагон-подобных пептидов, причем наивысшая гомология, 53%, имеется с GLP-1[7-36]NH2 [SEQ ID NO:3])Goke, et al., J. Biol. Chem., 268:19650-55, 1993). GLP-1[7-36]NH2 известен также как проглюкагон [78-107] или просто как "GLP-1", что применяется наиболее часто здесь. GLP-1 обладает инсулинотропным действием, стимулируя секрецию инсулина бета-клетками поджелудочной железы. Сообщалось также, что GLP-1 ингибирует секрецию глюкагона альфа-клетками поджелудочной железы (Orsov, et al., Diabetes, 42:658-61, 1993; D’Alessio, et al., J.Clin. Invest., 97:133-38, 1996). Аминокислотная последовательность GLP-1 показана на фиг.3. Сообщалось, что GLP-1 ингибирует опорожнение желудка (Willms В, et al., J.Clin Endocrinol Metab 81 (I): 327-32, 1996; Wettergren A, et al., Dig Dis Sci 38 (4):665-73, 1993) и секрецию желудочной кислоты (Schjoldager ВТ, et al., Dig Dis Sci 34 (5) 703-8, 1989; O’Halloran DJ, et al., J Endocrinol 126 (I): 169-73, 1990; Wettergren A, et al., Dig Dis Sci 38 (4): 665-73, 1993)). GLP-1[7-37], который имеет дополнительный остаток глицина на его карбокси-конце, также стимулирует секрецию инсулина у человека (Orsov, et al. Diabetes, 42:658-61, 1993). Считается, что трансмембранный связанный с аденилатциклазой G-белковый рецептор является ответственным по меньшей мере частично за инсулинотропный эффект GLP-1 и, как сообщалось, был клонирован из линии β -клеток (Thorens, Proc. Natl. Acad. Sci. USA 89: 8641-45, 1992).
GLP-1 был в фокусе значительного исследования в последние годы вследствие сообщений о его действиях, таких как усиление стимулированного продуцирования инсулина (Вуrnе MM, Goke В. Lessons from human studies with glucagon-like peptide-1: Potential of the gut hormone for clinical use. In: Fehman HC, Goke B. Insulinotropic Gut Hormone Glucagon-Like Peptide 1. Basel, Switzerland: Karger, 1997:219-33), ингибирование опорожнения желудка (Wettergren A, et al., Truncated GLP-1 (proglucagon 78-107-amide) inhibits gastric and pancreatic functions in man. Dig. Dis. Sci. 1993 Apr; 38 (4):665-73), ингибирование секреции глюкагона (Creutzfeldt WOC, et al., Glucagonostatic actions and reduction of fasting hyperglycemia by exogenous glucagon-like peptide 1(7-36) amide in type I diabetic patients, Diabetes Care 1996; 19(6):580-6) и подразумеваемая роль в регуляции аппетита (Turton MD, et al., A role for glucagon-like peptide-1 in the central regulation of feeding. Nature 1996 Jan; 379 (6560): 69-72). Сообщалось также, что GLP-1 восстанавливает чувствительность островков Лангерганса к глюкозе у стареющих крыс, восстанавливая их толерантность к глюкозе до толерантности молодых крыс (Egan JM, et al., Glucagon-like peptide-1 restores acute-phase insulin release to aged rats, Diabetologia 1997 June 40 (Suppi 1): A130). Короткая продолжительность биологического действия GLP-1 in vivo является одним признаком этого пептида, который затрудняет его разработку в качестве терапевтического агента.
Фармакологические исследования продемонстрировали как сходные черты, так и различия между эксендином-4 и GLP-1. Эксендин-4, как сообщалось, может действовать на рецепторы GLP-1 на секретирующих инсулин клетках β ТС1, на гроздевидные клетки поджелудочной железы морской свинки и на париетальные клетки желудка. Сообщалось также, что этот пептид стимулирует высвобождение соматостатина и ингибирует высвобождение гастрина в изолированных желудках (Goke, et al., J.Biol.Chem. 268:19650-55, 1993; Schepp, et al., Eur. J. Pharmacol., 69:183-91, 1994; Eissele, et al. Life Sci., 55:629-34, 1994). Сообщалось, что эксендин-3 и эксендин-4 стимулируют образование цАМФ в гроздевидных клетках поджелудочной железы и высвобождение ими амилазы (Malhotra, R., et al. Regulatory Peptides, 41:149-56, 1992; Raufman, et al., J.Biol.Chem. 267:21432-37, 1992; Singh, et al., Regul. Pept. 53:47-59, 1994). Эксендин-4 имеет также значительно большую продолжительность действия, чем GLP-1. Например, в одном эксперименте сообщалось, что снижение глюкозы эксендином-4 мышей с диабетом сохранялось в течение нескольких часов и, в зависимости от дозы, вплоть до 24 часов (Eng J. Prolonged effect of exendin-4 on hyperglycemia of db/db mice. Diabetes 1996 May; 45 (Suppl.2):152A (abstract 554)). На основе их инсулинотропных активностей, было предложено применение эксендина-3 и эксендина-4 для лечения сахарного диабета и предупреждения гипергликемии (Eng, U.S. Patent No.5424286).
Сообщалось, что укороченные на С-конце пептиды эксендина, такие как эксендин-4[9-39], карбоксиамидированная молекула, и фрагменты 3-39-9-39 являются сильнодействующими и селективными антагонистами GLP-1 (Goke, et al., J.Biol.Chem. 268:19650-55; Raufman, J.P., et al., J.Biol.Chem. 266:2897-902, 1991; Schepp, W., et al., Eur. J.Pharm. 269:183-91, 1994; Montrose-Rafizadeh, et al., Diabetes, 45 (Suppl. 2): 152A, 1996). Указывается, что эксендин-4[9-39] блокирует эндогенный GLP-1 in vivo, приводя к пониженной секреции инсулина. Wang, et al., J.Clin.Invest., 95:417-21, 1995; D’Alessio, et al., J.Clin. Invest., 97:133-38, 1996). Сообщалось, что рецептор, по-видимому, ответственный за инсулинотропный эффект GLP-1 у крыс, был клонирован из клеток крысиных островков Лангерганса (Thorens, В., Рrос. Natl. Acad. Sci. USA 89:8641-8645, 1992). Указывается, что эксендины и эксендин-4[9-39] связываются с клонированным крысиным рецептором GLP-1 (рецептором GLP-1 крысиных β-клеток поджелудочной железы (Fehman НС, et al., Peptides 15 (3):453-6, 1994) и человеческим рецептором GLP-1 (Thorens В, et al., Diabetes 42 (II):1678-82, 1993)). Сообщалось, что в клетках, трансфицированных клонированным GLP-1-рецептором, эксендин-4 является агонистом, т.е. он увеличивает цАМФ, тогда как эксендин[9-39] идентифицирован как антагонист, т.е. он блокирует стимулирующие действия эксендина-4 и GLP-1. Id.
Также сообщается, что эксендин-4[9-39] действует в качестве антагониста полноразмерных эксендинов, ингибируя стимуляцию гроздевидных клеток поджелудочной железы эксендином-3 и эксендином-4 (Raufman, et al., J.Biol.Chem. 266:2897-902, 1991; Raufman, et al., J.Biol.Chem. 266:21432-37, 1992). Сообщалось также, что эксендин[9-39] ингибирует стимуляцию уровней инсулина плазмы эксендином-4 и ингибирует активности эксендина-4 и GLP-1 в стимуляции высвобождения соматостатина и ингибирования высвобождения гастрина (Kolligs, F., et al. Diabetes, 44:16-19, 1995; Eissele, et al. Life Sciences, 55:629-34, 1994). Эксендин[9-39] использовали для исследования физиологического отношения центрального GLP-1 к регуляции потребления пищи (Turton, M.D. et al. Nature 379:69-72, 1996). GLP-1, вводимый интрацеребровентрикулярной (ICV) инъекцией, ингибирует потребление пищи у крыс. Сообщалось, что этот индуцирующий насыщение эффект GLP-1, доставляемого ICV, ингибируется ICV-инъекцией эксендина[9-39] (Turton, supra). Однако сообщалось, что GLP-1 не ингибирует потребление пищи у мышей при введении периферической инъекцией (Turton, M.D., Nature 379:69-72, 1996; Bhavsar, S.P., Soc. Neurosci. Abstr. 21:460 (188.8), 1995).
Результаты исследования, являются ли эксендины видовым гомологом GLP-1 млекопитающих, сообщались Chen и Drucker, которые клонировали ген эксендина из Гильского ядозуба (J.Biol.Chem 272(7): 4108-15 (1997)). Наблюдение, что у Гильского ядозуба также имеются отдельные гены для проглюкагонов (из которых образуется GLP-1), которые более сходны с проглюкагоном млекопитающих, чем эксендин, указывает на то, что эксендины не являются видовыми гомологами GLP-1.
Агенты, которые служат для задержки опорожнения желудка, нашли применение в медицине в качестве диагностических средств для желудочно-кишечных радиологических испытаний. Например, глюкагон является полипептидным гормоном, который продуцируется альфа-клетками островков Лангерганса поджелудочной железы. Он является гипергликемическим агентом, который мобилизует глюкозу для активации глюкогенолиза в печени. Он может в меньшей степени стимулировать секрецию панкреатического инсулина. Глюкагон используют в лечении индуцированной инсулином гипогликемии, например, когда внутривенное введение глюкозы является невозможным. Однако, поскольку глюкагон снижает перистальтику желудочно-кишечного тракта, его используют также в качестве диагностического средства в желудочно-кишечных радиологических испытаниях. Глюкагон использовали также в нескольких исследованиях для лечения различных болезненных желудочно-кишечных нарушениях, связанных со спазмом. Daniel, et al., (Br. Med. J., 3:720, 1974) сообщили о более быстром симптоматическом ослаблении острого дивертикулита у пациентов, получавших глюкагон, по сравнению с пациентами, которых лечили аналгетическими или антиспазматическими средствами. В обзоре Glauser, et al., (J.Am.Coll. Emergency Physns, 8:228, 1979) описано ослабление острой закупорки пищей пищевода после глюкагоновой терапии. В другом исследовании глюкагон значительно ослаблял боль и болезненность при дотрагивании у 21 пациента с заболеванием желчных путей по сравнению с 22 пациентами, получавшими плацебо (M.J.Stower, et al., Br.J.Surg., 69:591-2, 1982).
Способы регуляции сократительной способности желудочно-кишечного тракта при использовании агонистов амилина описаны в совместно принадлежащей заявителям Международной заявке с номером PCT/US 94/10225, опубликованной 16 марта 1995 года.
Способы регуляции желудочно-кишечной сократительной способности с использованием агонистов эксендина описаны в совместно принадлежащей заявителям патентной заявке США с порядковым номером 08/908867, поданной 8 августа 1997 года, озаглавленной "Способы регуляции желудочно-кишечной сократительной способности", причем эта заявка является частичным продолжением патентной заявки США с номером 08/694954, поданной 8 августа 1996 года.
Способы снижения потребления пищи с использованием агонистов эксендина описаны в совместно принадлежащей заявителям патентной заявке США с порядковым номером 09/003869, поданной 7 января 1998 года, озаглавленной "Применение эксендина и его агонистов для снижения потребления пищи", которая заявляет преимущество изобретения предварительных заявок США с номерами 60/034905, поданной 7 января 1997 года, 60/055404, поданной 7 августа 1997 года, 60/065442, поданной 14 ноября 1997 года и 60/066029, поданной 14 ноября 1997 года.
Сообщалось, что эксендины обладают инотропным и диуретическим действиями, описанными в совместно принадлежащей заявителям Международной заявке с номером PCT/US 99/02554, поданной 5 февраля 1999 года, заявляющей преимущество изобретения предварительной заявки с номером 60/075122, поданной 13 февраля 1998 года.
Новые соединения-агонисты эксендина описаны в совместно принадлежащей заявителям РСТ-заявке с порядковым номером PCT/US 98/16387, поданной 6 августа 1998 года, озаглавленной "Новые соединения-агонисты эксендина", которая заявляет преимущество изобретения патентной заявки США с порядковым номером 60/055404, поданной 8 августа 1997 года.
Другие новые агонисты эксендина описаны в совместно принадлежащей заявителям РСТ-заявке с номером PCT/US 98/24210, поданной 13 ноября 1998 года, озаглавленной "Новые соединения-агонисты эксендина", которая заявляет преимущество изобретения предварительной заявки США с номером 60/065442, поданной 14 ноября 1997 года.
Другие новые агонисты эксендина описаны в совместно принадлежащей заявителям РСТ-заявке с порядковым номером PCT/US 98/24273, поданной 13 ноября 1998 года, озаглавленной "Новые соединения-агонисты эксендина", которая заявляет преимущество изобретения предварительной заявки США с номером 60/066029, поданной 14 ноября 1997 года.
С момента появления первых терапевтически активных пептидов и белков, полученных генной инженерией, имелась все увеличивающаяся потребность в создании возможности доставки этих лекарственных средств иными путями, чем парентеральный путь. Однако этому мешали те самые свойства пептидов и белков, которые отделяют их от малых молекул лекарственных средств, широко используемых в настоящее время. Эти свойства включают в себя молекулярный размер, чувствительность к протеолитической деструкции, быстрый плазменный клиренс, своеобразные кривые доза-ответ, иммуногенность, биосовместимость и тенденция пептидов и белков подвергаться агрегации, адсорбции и денатурации.
Обычно является понятным, что введение пептидных лекарственных средств иными путями, чем подкожная или внутривенная инъекция или внутривенная инфузия, часто не является применимым на практике, вследствие, например, в случае перорального введения, как ферментативной деградации, так и отсутствия абсорбции в желудочно-кишечном тракте. Таким образом, продолжает существовать потребность в разработке альтернативных способов относительно неудобной, иногда болезненной инъекции для введения пептидных лекарственных средств, таких как эксендины и пептидные аналоги-агонисты эксендинов, цитируемые выше. Кроме композиций и дозировок, применимых для введения эксендинов и агонистов эксендинов при помощи инъекции, здесь описаны и заявлены композиции, дозированные композиции и способы, которые решают эти проблемы и которые применимы в неинъекционной доставке терапевтически эффективных количеств эксендина и агонистов эксендина.
Содержания вышеуказанных статей, патентов и заявок на патенты и всех других документов, упомянутых или цитируемых здесь, включены тем самым в качестве ссылки во всей их полноте. Заявители сохраняют за собой право на физическое включение в эту заявку любых и в полном объеме материала и информации из любых таких статей, патентов, заявок на патенты или других документов, упомянутых или цитируемых здесь.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно первому аспекту, данное изобретение обеспечивает новые композиции эксендина и соединений-агонистов эксендина и их дозированные формы, обнаруживающие выгодные свойства, которые включают в себя эффекты задержки опорожнения желудка и снижения уровня глюкозы в плазме. Таким образом, этот аспект данного изобретения включает в себя композиции эксендинов и агонистов эксендинов, которые содержат эксендин или агонист эксендина, смешанные вместе с буфером (предпочтительно ацетатным буфером), модификатором изоосмоляльности (предпочтительно маннитом) и необязательно содержащие консервант (предпочтительно м-крезол), причем композиция имеет рН между приблизительно 3,0 и приблизительно 7,0 (предпочтительно между приблизительно 4,0 и приблизительно 5,0). Термин "агонист эксендина" обозначает соединение, которое имитирует один или несколько эффектов эксендина, например, связыванием с рецептором, где эксендин вызывает один или несколько из этих эффектов, или активацией каскада передачи сигнала, при помощи которого эксендин вызывает один или несколько из этих эффектов. Агонисты эксендина включают в себя пептиды-агонисты эксендина, такие как аналоги и производные эксендина-3 и эксендина-4, которые обладают одной или несколькими желательными активностями эксендина. Разнообразные аналоги агонистов эксендина идентифицированы или цитируются здесь.
Дополнительные композиции эксендинов и агонистов эксендинов в объеме данного изобретения включают в себя парентеральную жидкую дозированную форму, лиофилизированную форму с унифицированной дозой на один прием, лиофилизированную дозированную форму для многократного использования и модификации этих дозированных форм, которые применимы в пероральной, назальной, трансбуккальной, подъязычной, внутритрахеальной и легочной доставке эксендинов и агонистов эксендинов.
Таким образом, данное изобретение включает в себя парентеральные жидкие дозированные формы, которые содержат приблизительно 0,005 - приблизительно 0,4%, более конкретно от приблизительно 0,005 до приблизительно 0,02% или от приблизительно 0,005 до приблизительно 0,05% (мас./об.), соответственно, активного ингредиента в водной системе вместе с приблизительно 0,02-0,5% (мас./об.) ацетатного, фосфатного, цитратного или глутаматного или подобного буфера, либо одного, либо в комбинации для получения рН конечной композиции приблизительно 3,0-7,0, более конкретно от приблизительно рН 4,0 до приблизительно 6,0, или от приблизительно 4,0 до 5,0, а также либо приблизительно 1,0-10% (мас./об.) углеводного или являющегося многоатомным спиртом модификатора изоосмоляльности (предпочтительно маннита), либо до приблизительно 0,9% солевого раствора или комбинации обоих, приводящих к изотоническому или изоамотическому раствору в водной непрерывной фазе. Приблизительно 0,005-1,0% (мас./об.) антимикробного консерванта, выбранного из группы, состоящей из м-крезола, бензилового спирта, метил-, этил-, пропил- и бутилпарабенов и фенола, присутствует также, если композиция упакована в контейнер для многократного использования. Достаточное количество воды для инъекции добавляют для получения желательной концентрации раствора. Хлорид натрия, а также другие наполнители могут также присутствовать, если это желательно. Однако такие наполнители должны поддерживать общую стабильность активного ингредиента. Применимые многоатомные спирты включают в себя такие соединения, как сорбит, маннит, глицерин и полиэтиленгликоли (ПЭГ). Многоатомные спирты и углеводы будут также эффективны в стабилизации белка против денатурации, вызванной повышенными температурами и процессами замораживания-оттаивания или лиофилизации. Подходящие углеводы включают в себя галактозу, арабинозу, лактозу или любой другой углевод, который не имеет вредного действия на пациента с диабетом, если композиция предназначена для этого использования, т.е. углевод не метаболизируется с образованием больших концентраций глюкозы в крови. Предпочтительно, пептиды данного изобретения смешивают с многоатомным спиртом, - таким как сорбит, маннит, инозит, глицерин, ксилит и сополимер полипропилена и этиленгликоля, а также различные полиэтиленгликоли (ПЭГ) с молекулярной массой 200, 400, 1450, 3350, 4000, 6000 и 8000). Маннит является предпочтительным многоатомным спиртом.
Лиофилизированные унифицированные одноразовые композиции данного изобретения являются также стабильными, но не нуждаются в том, чтобы быть изотоническими и/или изоосмолярными. Они включают в себя активный ингредиент (ингредиенты), наполнитель для облегчения образования осадка (на фильтре) (который может также действовать в качестве агента тоничности и/или модификатора изоосмоляльности при воссоздании раствора или для содействия стабильности активного ингредиента и/или для уменьшения боли при инъекции), и могут также включать в себя поверхностно-активное вещество, которое улучшает свойства осадка (на фильтре) и/или облегчает воссоздание раствора. Лиофилизированные однодозовые композиции для одного введения включают в себя приблизительно 0,005 - приблизительно 0,4%, более конкретно от приблизительно 0,005 до приблизительно 0,02% или 0,005-0,05% (мас./об.) активного ингредиента. Может не быть необходимым включение буфера в композицию и/или воссоздание лиофилизата буфером, если содержимое контейнера предназначено для использования в пределах периода стабильности, установленного для реконституируемого активного ингредиента. При использовании буфера он может быть включен в лиофилизат или в растворитель для воссоздания раствора. Таким образом, композиция и/или растворитель для воссоздания раствора могут содержать индивидуально или вместе приблизительно 0,02-0,5% (мас./об.) ацетатного, фосфатного, цитратного или глутаматного буфера, либо одного, либо в комбинации, для получения рН конечной композиции приблизительно 3,0-7,0, более конкретно от приблизительно рН 4,0 до приблизительно 6,0, или приблизительно 4,0-5,0. Наполнитель может состоять либо из приблизительно 1,0-10% (мас./об.) углеводного или являющегося многоатомным спиртом модификатора изоосмоляльности (как описано выше), либо до 0,9% солевого раствора или их комбинацию, что приводит к изотоническому или изоосмолярному раствору в воссозданной водной фазе. Может быть включено поверхностно-активное вещество, предпочтительно от приблизительно 0,1 до приблизительно 1,0% (мас./об.) полисорбата 80 или другого неионного детергента. Как отмечалось выше, в лиофилизированной стандартной композиции для одного введения может также присутствовать хлорид натрия, также как и другие наполнители, если желательно. Жидкая композиция данного изобретения должна либо быть по существу изотонической и/или изоосмолярной перед лиофилизацией, либо позволить образование изотонических и/или изоосмолярных растворов после воссоздания раствора.
Данное изобретение включает в себя также лиофилизированные и жидкие многодозовые композиции. Как и в случае парентеральных жидких и лиофилизированных однодозовых стандартных композиций, описанных выше, лиофилизированная многодозовая форма должна содержать наполнитель для облегчения образования осадка (на фильтре). Для облегчения множественного применения включают консервант. Эти дозированные формы включают в себя от приблизительно 0,005 до приблизительно 0,4%, более конкретно от приблизительно 0,005 до приблизительно 0,02% или от приблизительно 0,005 до 0,05% (мас./об.), соответственно, активного ингредиента. При использовании буфера он может быть включен в лиофилизат или в растворитель для воссоздания раствора, и эта композиция и/или растворитель для воссоздания раствора могут содержать индивидуально или вместе приблизительно 0,02-0,5% (мас./об.) ацетатного, фосфатного, цитратного или глутаматного буфера, либо одного, либо в комбинации, для получения рН конечной композиции приблизительно 3,0-7,0, более конкретно от приблизительно рН 4,0 до приблизительно 6,0 или приблизительно 4,0-5,0.
Наполнитель может состоять либо из приблизительно 1,0-10% (мас./об.) углеводного или являющегося многоатомным спиртом модификатора изоосмоляльности (предпочтительно маннита), либо до 0,9% соли или их комбинацию, что приводит к изотоническому или изоосмолярному раствору в воссозданной водной фазе. Может быть включено поверхностно-активное вещество, предпочтительно от приблизительно 0,1 до приблизительно 1,0% (мас./об.) полисорбата 80 или другого неионного детергента. Приблизительно 0,005-1,0% (мас./об.) антимикробного консерванта, выбранного из группы, состоящей из м-крезола, бензилового спирта, метил-, этил-, пропил- и бутилпарабенов и фенола (предпочтительно м-крезола), присутствует также, если композиция упакована в контейнер для многократного использования. Хлорид натрия, а также другие наполнители могут также присутствовать, если это желательно. Жидкая композиция данного изобретения должна быть по существу изотонической и/или изоосмолярной либо до лиофилизации, либо чтобы позволить образование изотонических и/или изоосмолярных растворов после воссоздания раствора.
Далее, данное изобретение включает в себя твердые дозированные формы, применимые для пероральной, трансбуккальной, подъязычной, внутритрахеальной, назальной и легочной доставки. Композиции, которые лучше всего пригодны для легочной и/или внутритрахеальной дозированных форм, могут быть либо содержащими консерванты, либо не содержащими консервантов жидкими композициями и/или сухими порошкообразными композициями. Содержащие или не содержащие консервантов жидкие композиции будут по существу идентичны композициям, описанным выше в случае содержащих консерванты и не содержащих консервантов жидких парентеральных композиций. рН раствора должен быть приблизительно 3,0-7,0, более конкретно от приблизительно рН 4,0 до приблизительно 6,0 или от приблизительно 4,0 до 5,0, причем рН больше или равный приблизительно 5,0 является наиболее предпочтительным для уменьшения возможности бронхостеноза. Сухие порошкообразные композиции могут содержать наполнитель и/или соли для облегчения образования нужного размера частиц и подходящего распределения частиц по размеру. Поверхностно-активное вещество и/или соли могут также улучшать свойства морфологии частиц и/или облегчать поглощение тканями активного ингредиента. Сухие порошкообразные дозированные формы могут находиться в диапазоне от 1 до 100% (мас./мас.) соответственно активного ингредиента. Может быть ненужным включение наполнителя и/или солей для облегчения образования нужного размера и/или распределения частиц. Наполнитель и/или соли могут состоять из либо приблизительно 0-99% (мас./мас.) углевода или многоатомного спирта, либо приблизительно 0-99% соли или комбинации обоих, приводящих к предпочтительному размеру и распределению частиц. Может быть включено поверхностно-активное вещество, предпочтительно от приблизительно 0,1 до приблизительно 1, 0% (мас./об.) полисорбата 80 или другого неионного детергента. Хлорид натрия, а также другие наполнители могут также присутствовать, если это желательно. Однако, такие наполнители будут поддерживать общую стабильность активного ингредиента и способствовать надлежащему уровню гидратации.
Также в пределах объема данного изобретения находится композиция, содержащая до 50 мг/мл эксендина или агониста эксендина в 30 мМ ацетатном буфере (рН приблизительно 4,5) и манните, с консервантом или без консерванта.
Далее, в объеме данного изобретения находятся предпочтительные дозированные формы для эксендинов и агонистов эксендинов для введения инъекцией и для введения другими способами. Таким образом, композиции эксендинов и агонистов эксендинов, имеющие сравнимую активность, обеспечены для введения инъекцией от приблизительно 0,1 до приблизительно 0,5 мкг на килограмм, вводимых один-три раза в сутки. Обычно, для пациента с диабетом, который весит в диапазоне от приблизительно 70 килограммов (среднее для пациентов с диабетом типа I) до приблизительно 90 килограммов (среднее для пациентов с диабетом типа II), например, это будет приводить к общему введению от приблизительно 10 до приблизительно 120 мкг в сутки в одной дозе или в разделенных дозах. При введении в разделенных дозах эти дозы предпочтительно вводят два или три раза в сутки и более предпочтительно два раза в сутки.
В предпочтительной процедуре введения эксендин или агонист эксендина вводят парентерально, более предпочтительно посредством инъекции, например, периферической инъекции. Предпочтительно, от приблизительно 1-30 мкг до приблизительно 1 мг эксендина или агониста эксендина вводят в сутки. Более предпочтительно, от приблизительно 1-30 мкг до приблизительно 500 мкг или от приблизительно 1-30 мкг до приблизительно 50 мкг эксендина или агониста эксендина вводят в сутки. Наиболее предпочтительно, в зависимости от веса субъекта и активности вводимого соединения, от приблизительно 3 мкг до приблизительно 50 мкг эксендина или агониста эксендина вводят в сутки. Предпочтительные дозы на основе веса пациента для соединений, имеющих приблизительно активность эксендина-4, находятся в диапазоне от приблизительно 0,005 мкг/кг на дозу до приблизительно 0,2 мкг/кг на дозу. Более предпочтительно, дозы на основе веса пациента для соединений, имеющих приблизительно активность эксендина-4, находятся в диапазоне от приблизительно 0,02 мкг/кг на дозу до приблизительно 0,1 мкг/кг на дозу. Наиболее предпочтительно, дозы на основе веса пациента для соединений, имеющих приблизительно активность эксендина-4, находятся в диапазоне от приблизительно 0,05 мкг/кг на дозу до приблизительно 0,1 мкг/кг на дозу. Эти дозы вводят 1-4 раза в сутки, предпочтительно 1-2 раза в сутки. Дозы эксендинов или агонистов эксендинов будут обычно более низкими при предоставлении непрерывной инфузией. Дозы эксендинов или агонистов эксендинов будут обычно более высокими при введении неинъекционными способами, такими как пероральная, трансбуккальная, подъязычная, назальная, легочная доставка или доставка при помощи кожного пластыря.
Пероральные дозы в соответствии с данным изобретением будут включать в себя от приблизительно в 50 до приблизительно в 100 раз большие количества активного ингредиента, например, от приблизительно 500 до приблизительно 12000 мкг в сутки в единственной дозе или в разделенных дозах, предпочтительно от приблизительно 500 до приблизительно 5000 мкг в сутки. Легочные дозы в соответствии с данным изобретением будут включать в себя от приблизительно в 10 до приблизительно в 100 раз большие количества активного ингредиента, например, от приблизительно 100 до приблизительно 12000 мкг в сутки в единственной дозе или в разделенных дозах, предпочтительно от приблизительно 500 до приблизительно 1000 мкг в сутки. Назальные, трансбуккальные и подъязычные дозы в соответствии с данным изобретением будут также включать в себя от приблизительно в 10 до приблизительно в 100 раз большие количества активного ингредиента, например, от приблизительно 100 до приблизительно 12000 мкг в сутки в единственной дозе или в разделенных дозах.
Предпочтительные дозы для назального введения составляют от приблизительно 10-1000 до приблизительно 1200-12000 мкг в сутки, для трансбуккального введения от приблизительно 10-1000 до приблизительно 1200-12000 мкг в сутки и для подъязычного введения от приблизительно 10-1000 до приблизительно 1200-8000 мкг в сутки. Подъязычные дозы предпочтительно являются более низкими, чем трансбуккальные дозы. Вводимые дозы для агонистов эксендинов, имеющих активность, меньшую или большую относительно эксендина-4, увеличиваются или уменьшаются по необходимости в сравнении с описанными выше или где-либо в другом месте данного описания.
В объеме данного изобретения находятся также способы введения указанных новых композиций и доз соединений-агонистов эксендинов при помощи средств доставки, альтернативных подкожной инъекции или внутривенной инфузии, в том числе, например, посредством назальной доставки, легочной доставки, пероральной доставки, внутритрахеальной доставки, подъязычной доставки и трансбуккальной доставки.
В соответствии с другим аспектом, данное изобретение обеспечивает новые композиции и дозированные формы соединений-агонистов эксендинов и способы их введения, которые применимы в лечении диабета (в том числе диабета типа I и II), ожирения и других состояний, при которых будет приносить пользу назначение терапии, которая может замедлять опорожнение желудка, снижая уровни глюкозы в плазме, и уменьшать потребление пищи.
Данное изобретение включает в себя также способы лечения субъектов для увеличения чувствительности к инсулину путем введения эксендина или агониста эксендина. Композиции эксендина или агониста эксендина и дозировки, описанные здесь, могут быть использованы для увеличения чувствительности субъекта к эндогенному или экзогенному инсулину.
В одном предпочтительном аспекте, эксендин или агонист эксендина, используемый в способах данного изобретения, представляет собой эксендин-3 [SEQ ID NO:1]. В другом предпочтительном аспекте указанный эксендин представляет собой эксендин-4 [SEQ ID NO:2]. Другие предпочтительные агонисты эксендина включают в себя эксендин-4 (1-30) [SEQ ID NO:6: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly], амид эксендина-4 (1-30) [SEQ ID NO:7: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly-NH2], амид эксендина-4 (1-28) [SEQ ID NO:40: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gin Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2],14Leu,25Рhе-эксендин-4 [SEQ ID NO:9: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2], амид14Leu,25Рhе-эксендина-4 (1-28) [SEQ ID NO:41: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2], и амид14Leu,22Ala,25Рhе-эксендина-4 (1-28) [SEQ ID NO:8: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Ala Ile Glu Phe Leu Lys Asn-NH2].
Другие признаки и преимущества данного изобретения будут очевидными из нижеследующего описания его предпочтительных вариантов и из формулы изобретения.
В соответствии с данным изобретением и в применении здесь, следующие термины имеют следующие значения, если нет четких иных указаний. "Фармацевтически приемлемые соли" включают соли соединений данного изобретения, полученные из объединения таких соединений и органической или неорганической кислоты. На практике использование формы соли приводит к применению формы основания. Соединения данного изобретения применимы как в виде свободного основания, так и в форме соли, причем подразумевается, что обе формы входят в рамки данного изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 изображает аминокислотную последовательность эксендина-3 [SEQ ID NO:1].
Фиг.2 изображает аминокислотную последовательность эксендина-4 [SEQ ID NO:2].
Фиг.3 изображает аминокислотную последовательность GLP-1[7-36]NH2 (GLP-1) [SEQ ID NO:3].
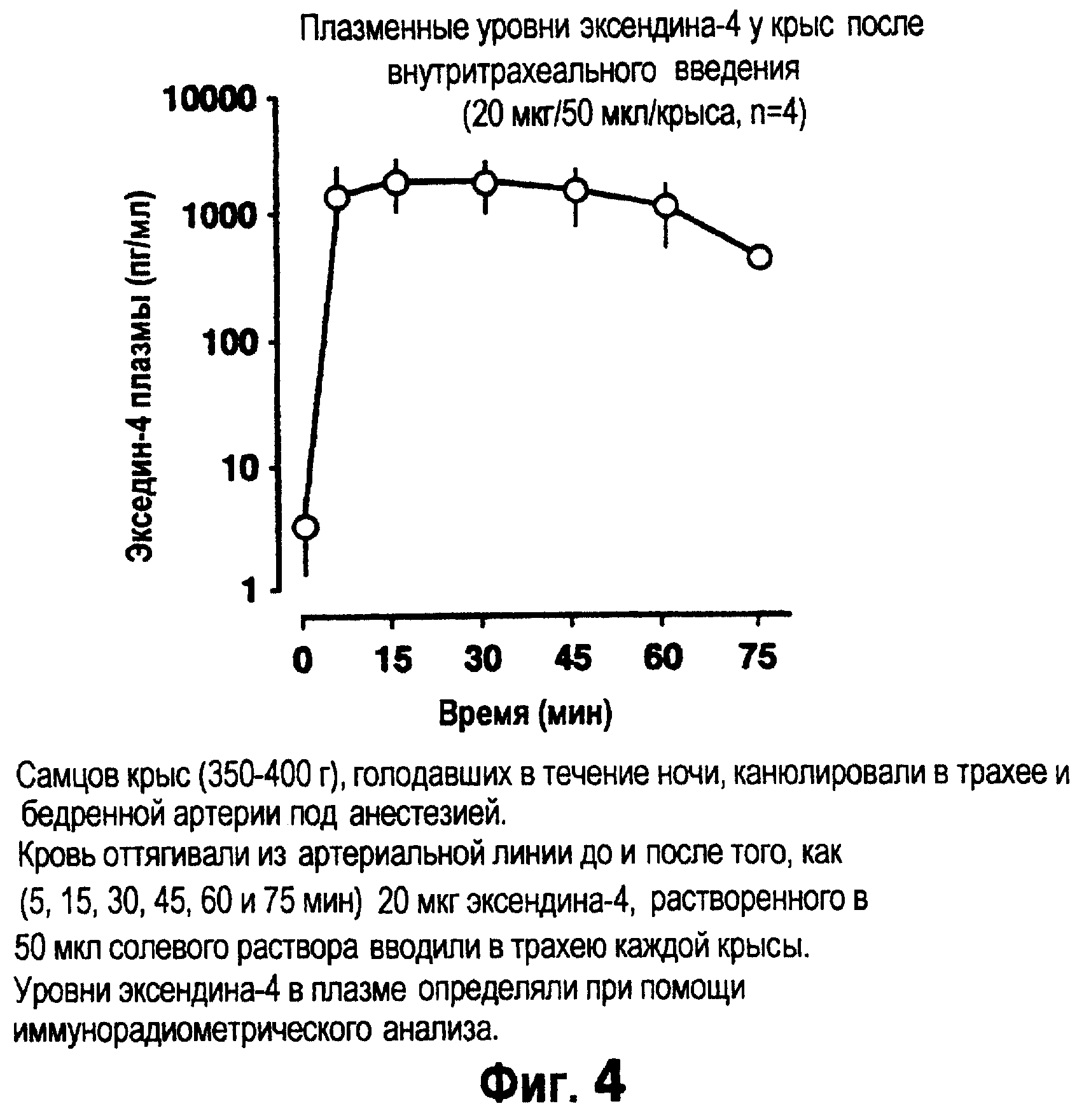
Фиг.4 изображает плазменные уровни эксендина-4 у крыс после внутритрахеального введения.
Фиг.5а изображает плазменную концентрацию эксендина-4 после внутритрахеальной инстилляции мышам db/db.
Фиг.5b изображает действие эксендина-4 на глюкозу плазмы после его внутритрахеального введения мышам db/db.
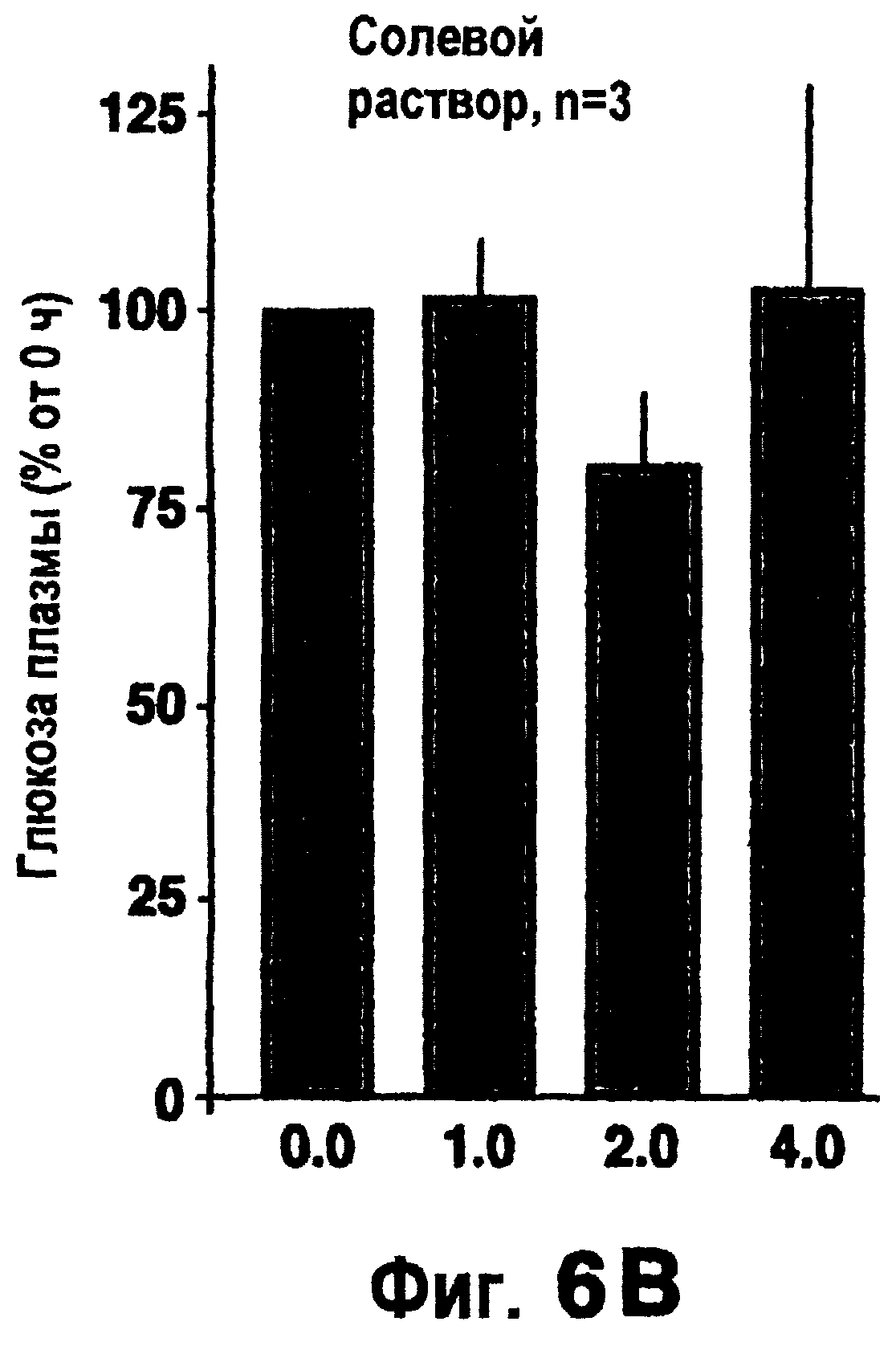
Фиг.6а и 6b изображают действие эксендина-4 на глюкозу плазмы после его внутритрахеального введения мышам ob/ob.
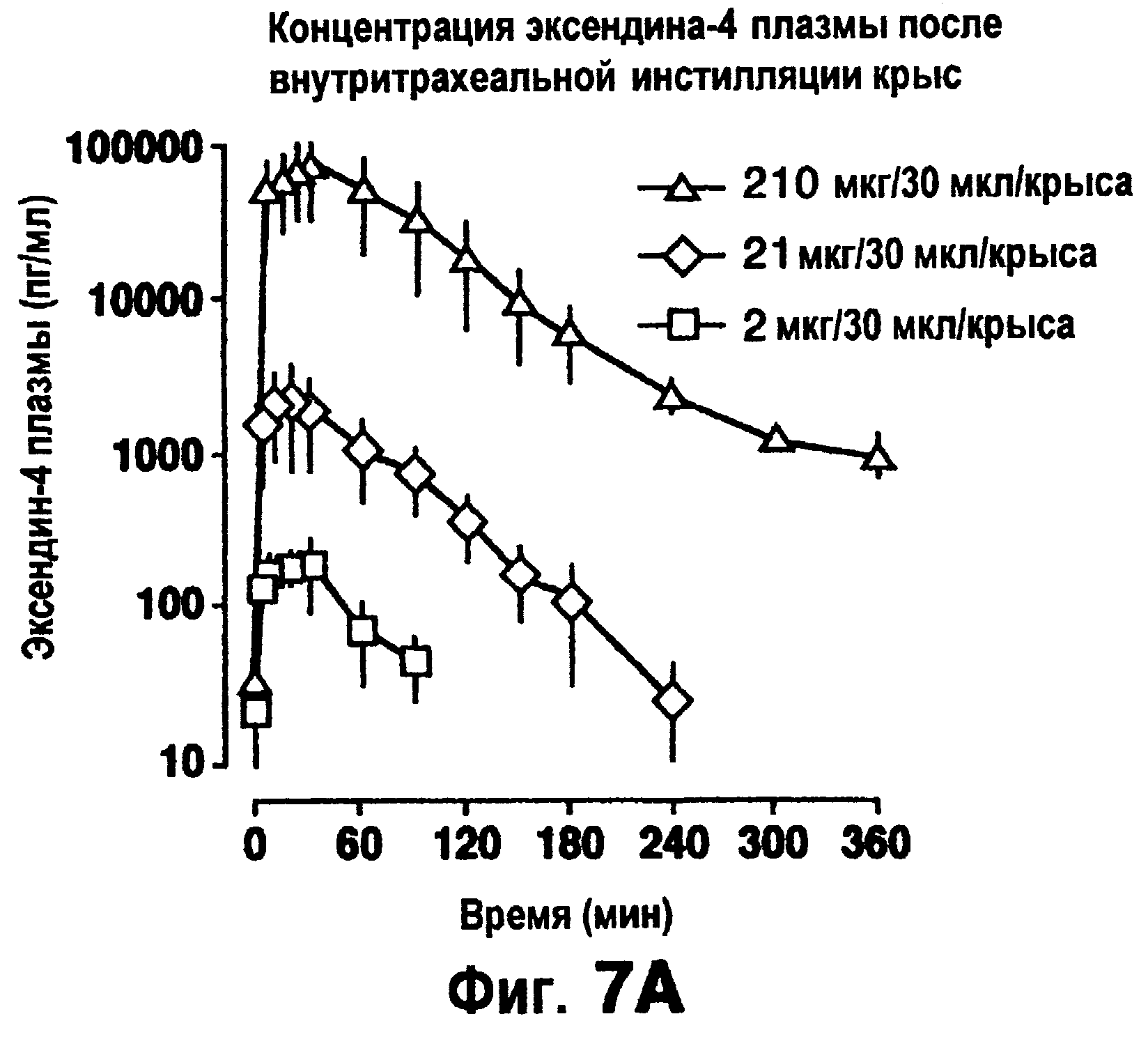
Фиг.7а изображает концентрацию эксендина-4 в плазме после его внутритрахеальной инстилляции крысам.
Фиг.7b изображает биодоступность эксендина-4 после внутритрахеальной инстилляции крысам.
Фиг.8 изображает плазменные концентрации эксендина-4 у крыс, экспонированных аэрозольному эксендину-4.
Фиг.9а изображает эффект десяти минут экспонирования арозольному эксендину-4 на глюкозу плазмы мышей db/db.
Фиг.9b изображает концентрацию эксендина-4 в плазме после десяти минут экспонирования мышей db/db аэрозольному эксендину-4.
Фиг.10 изображает концентрации эксендина-4 в плазме крыс после интраназального введения эксендина-4.
Фиг.11 изображает эффект внутрижелудочного введения эксендина-4 на глюкозу плазмы мышей db/db.
Фиг.12а изображает концентрацию эксендина-4 в плазме после подъязычного введения мышам db/db.
Фиг.12b изображает эффект подъязычного введения эксендина-4 на глюкозу плазмы мышей db/db.
Фиг.12с изображает концентрацию эксендина-4 в плазме после подъязычного введения крысам.
Фиг.12d изображает биодоступность эксендина-4 после подъязычного введения.
Фиг.12е изображает Смакc вводимого подъязычно эксендина-4.
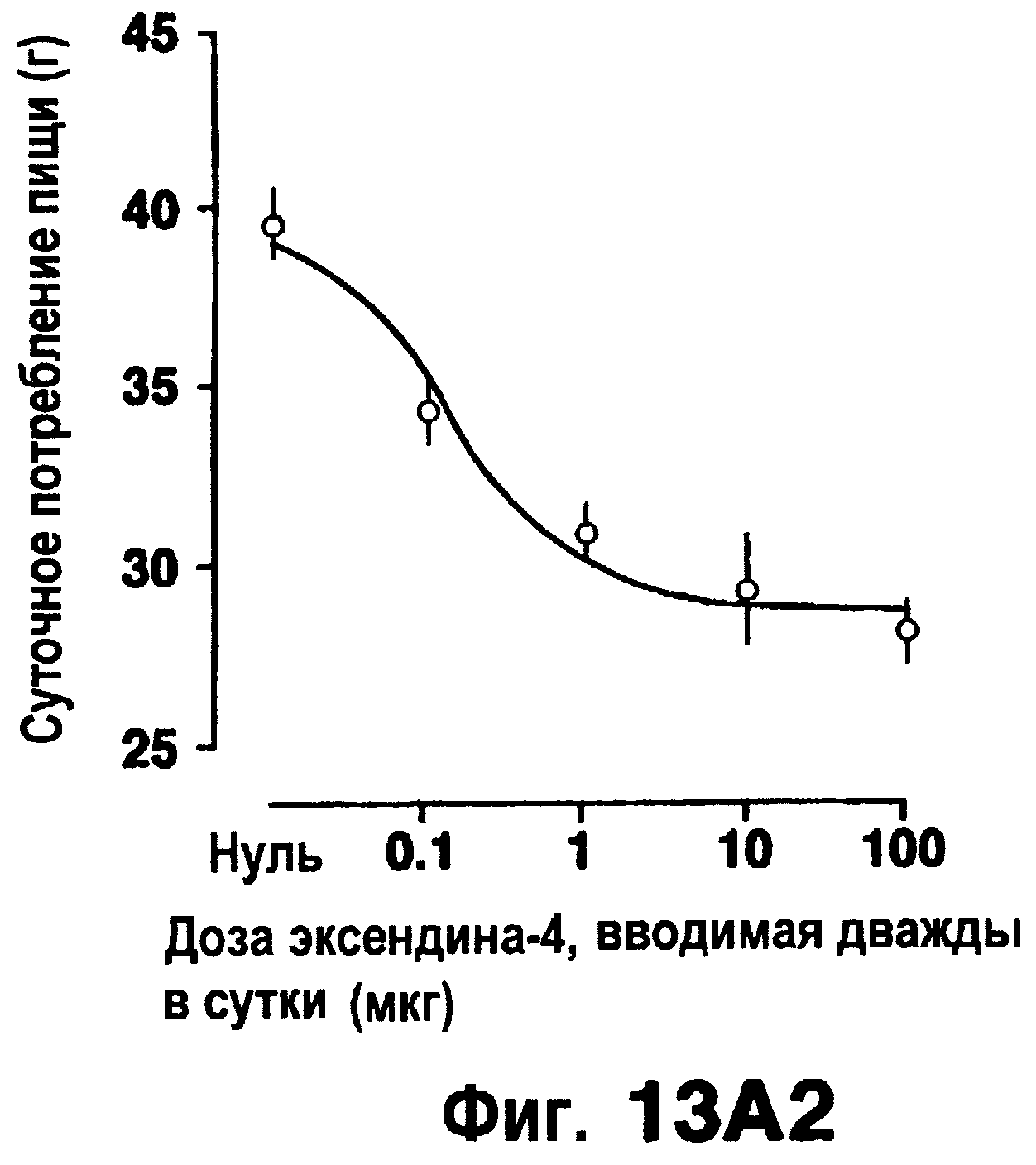
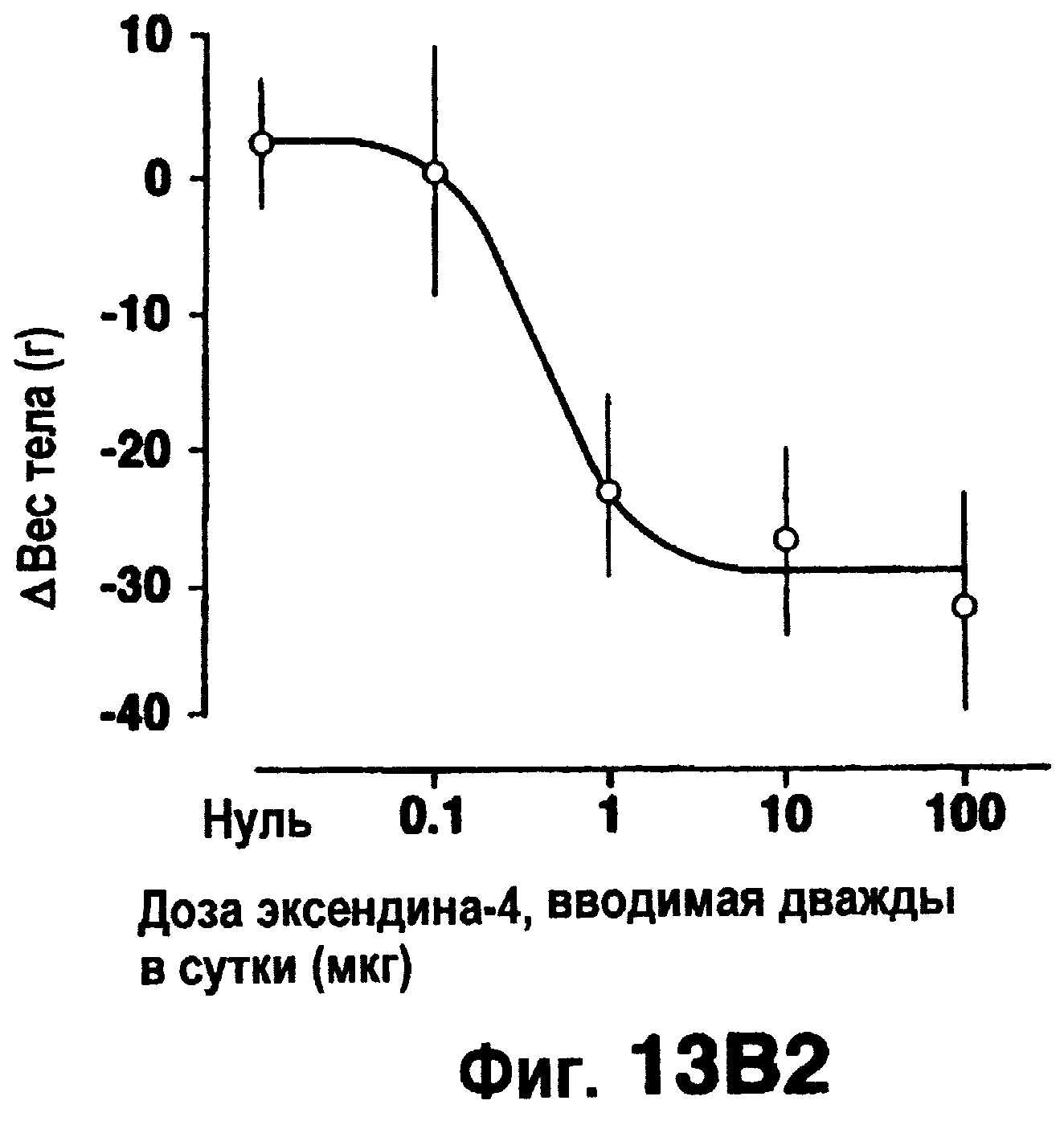
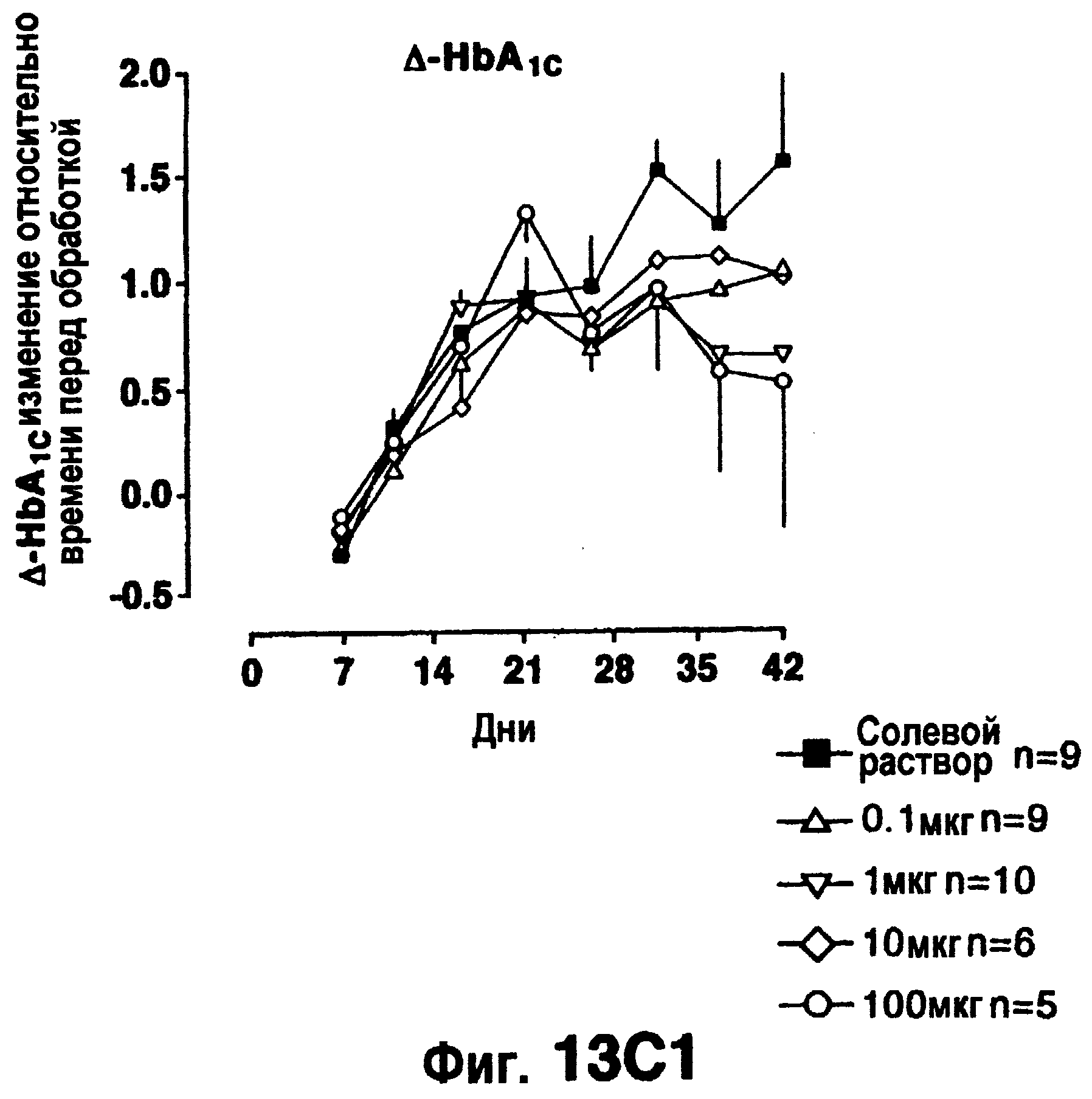
Фиг.13 изображает эффект эксендина-4 (вводимого внутрибрюшинно, дважды в сутки) на потребление пищи (а), изменение веса тела (b) (исходный вес тела 441±39 г) или изменение гемоглобина A1c (с) (7, 68±0,20% при 0 недель). Кривые доза-ответ (правые панели) даются для средних величин на протяжении последних 2-6 недель обработки.
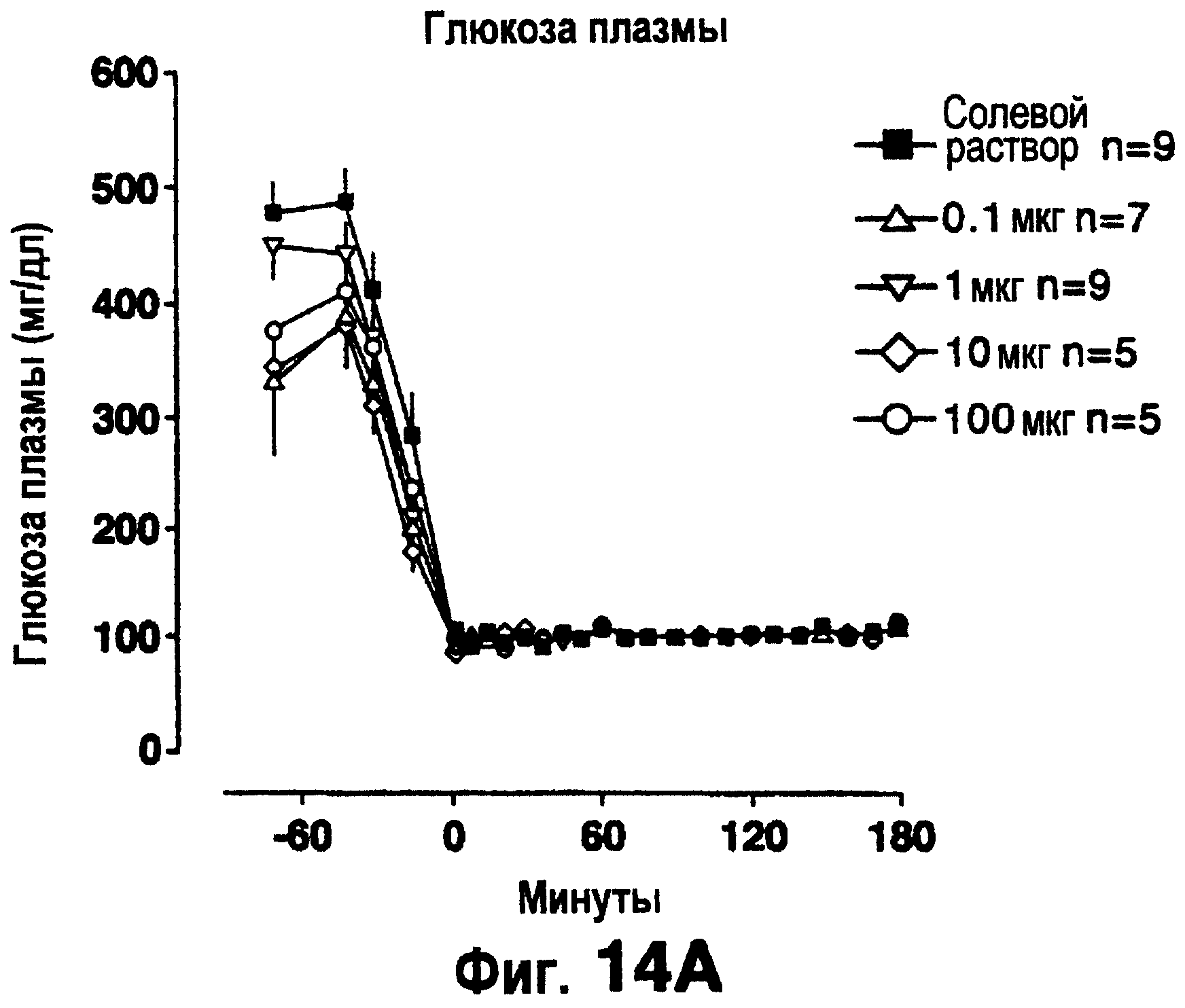
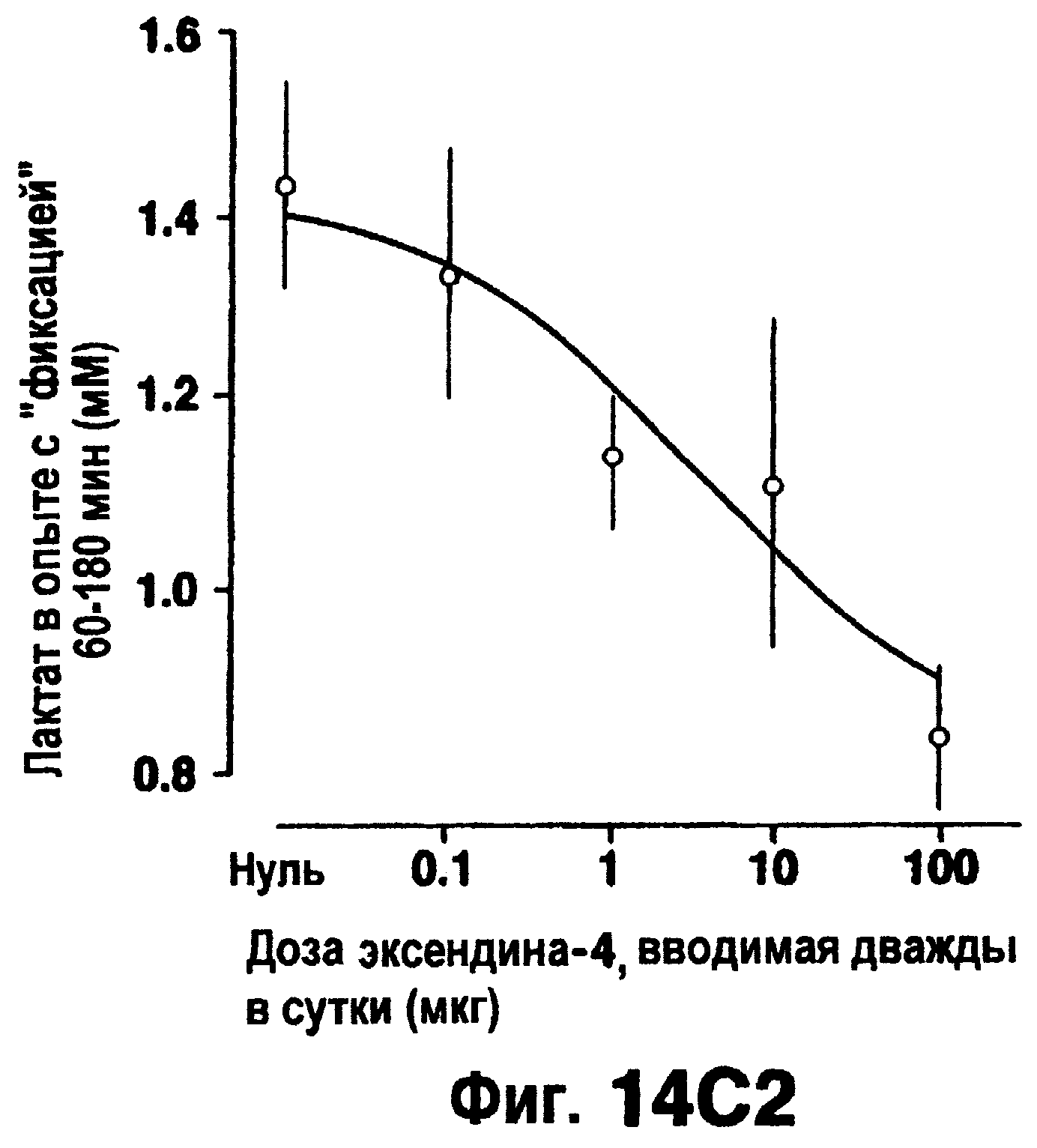
Фиг.14 изображает концентрацию глюкозы в плазме (а), скорость вливания глюкозы, необходимую для поддержания эугликемии (b) и концентрацию лактата в плазме (с) в процедурах с "фиксацией" эугликемии, проводимых на крысах ZDF, предварительно обработанных в течение 6 недель указанными дозами эксендина-4 (внутрибрюшинно, дважды в день). Кривые доза-ответ для скорости вливания глюкозы и концентрация лактата в плазме основаны на средних величинах, полученных между 60 и 180 мин процедуры "фиксации".
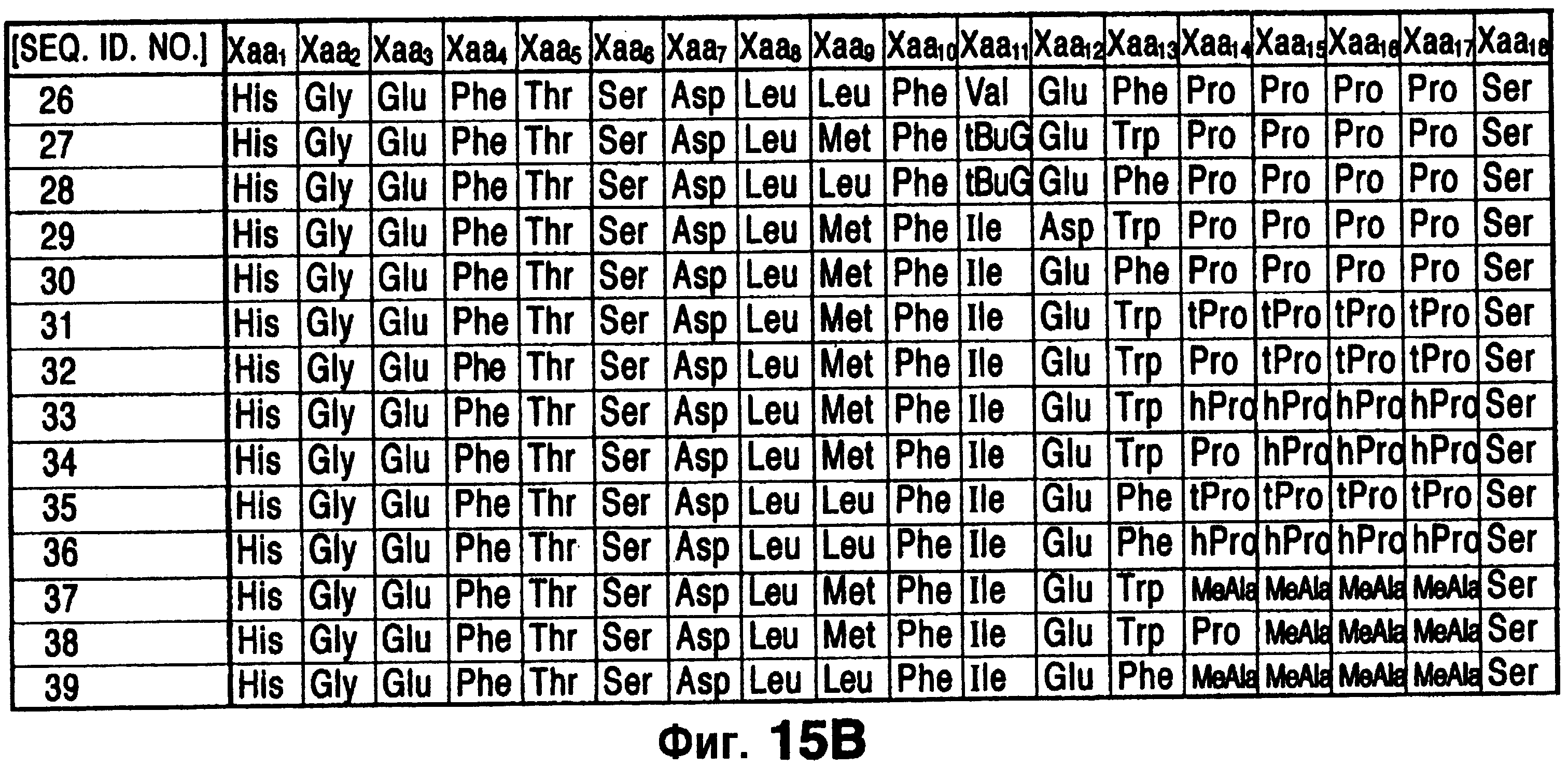
Фиг.15 изображает аминокислотные последовательности для некоторых соединений-агонистов эксендина, применимых в данном изобретении [SEQ ID NO:9-39].
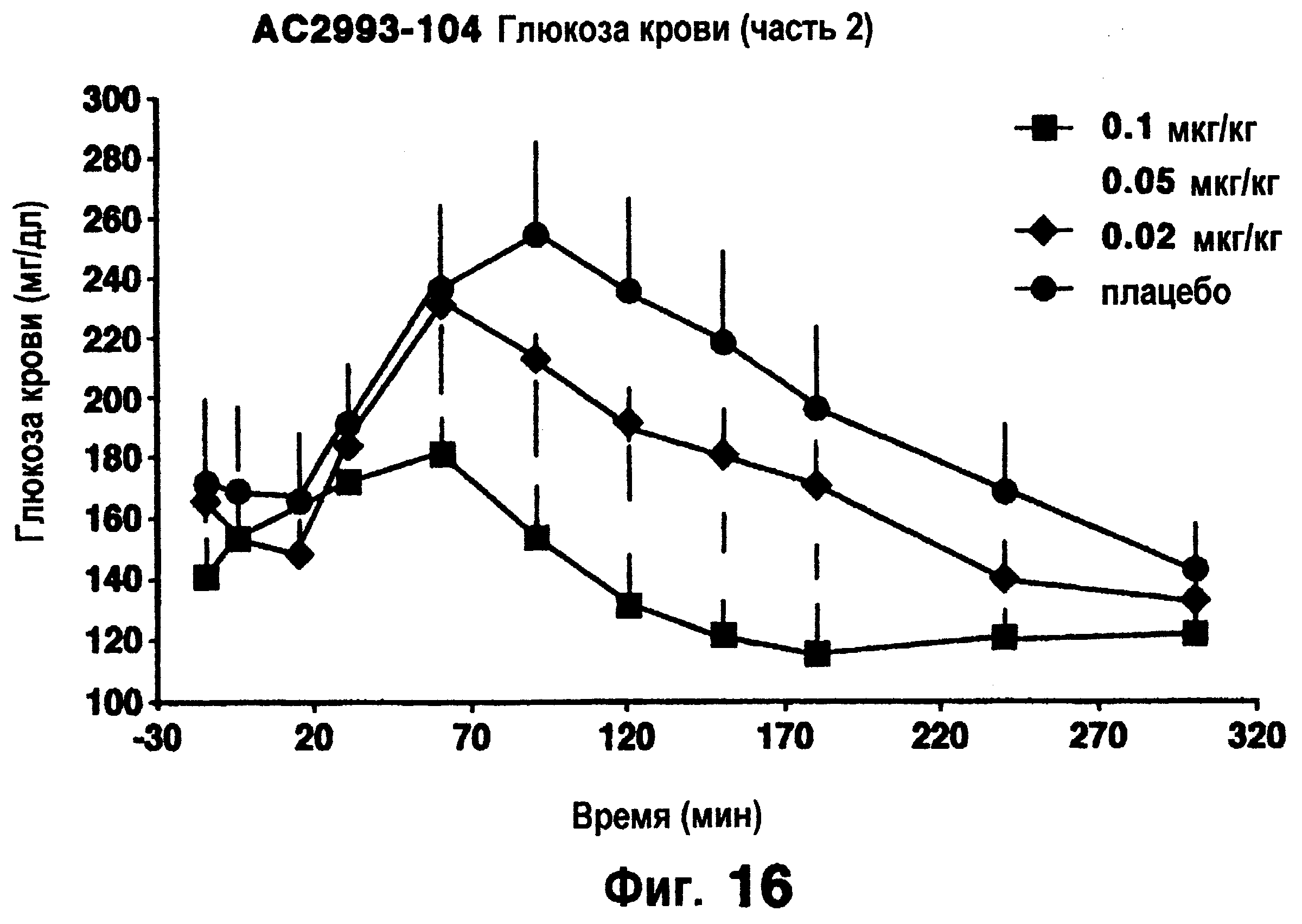
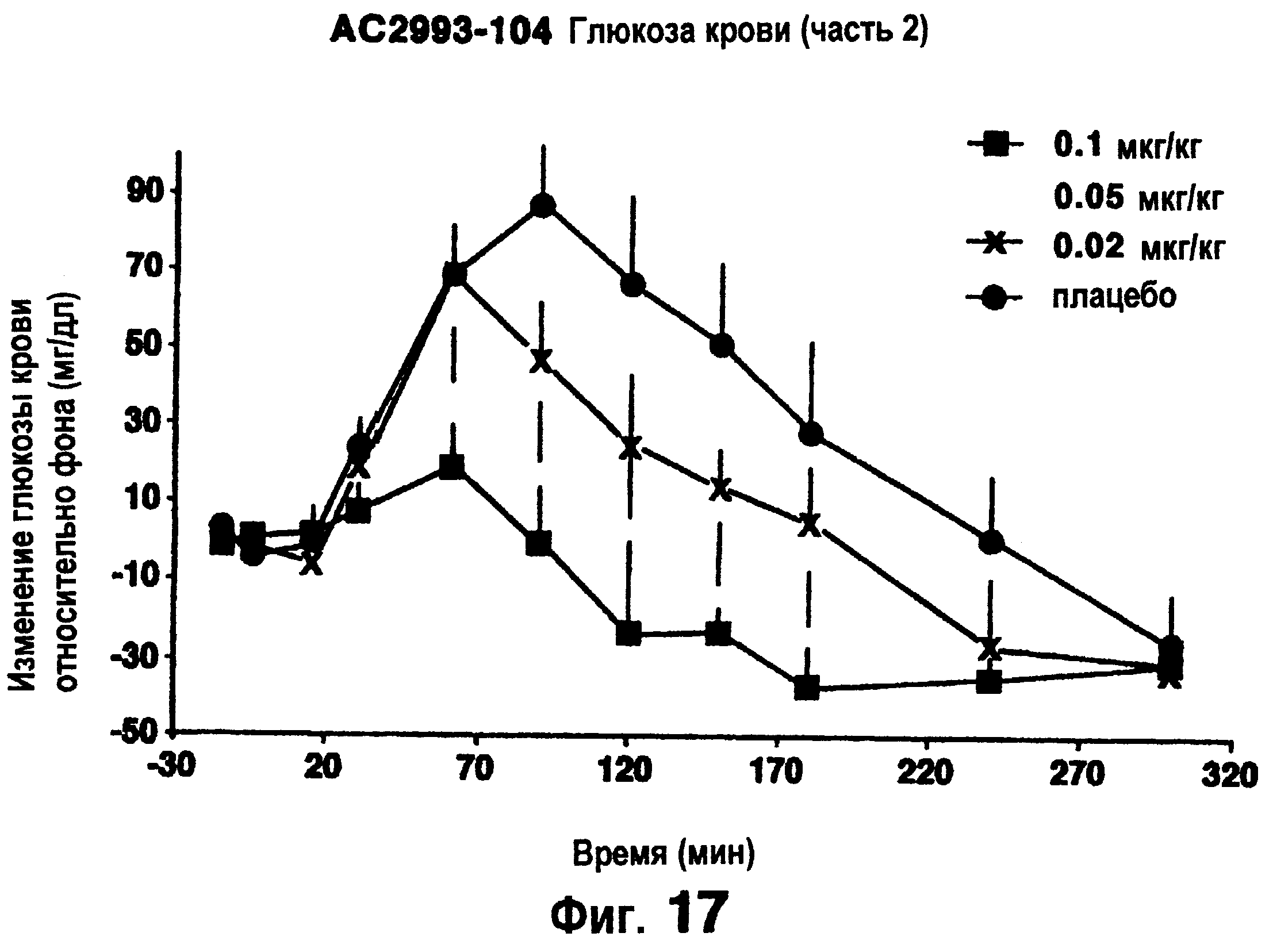
Фигуры 16 и 17 изображают результаты снижения глюкозы из клинического исследования, описанного в примере 12.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Эксендины и агонисты эксендинов
Эксендин-3 и эксендин-4 являются природно встречающимися пептидами, выделенными из слюнных выделений Гильского ядозуба и Мексиканского ядозуба. Испытание на животных эксендина-4 показало, что его способность понижать глюкозу в крови сохраняется в течение нескольких часов. Эксендин-4, полипептид из 39 аминокислот, синтезирован при помощи твердофазного синтеза, как описано здесь, и показано, что этот синтетический материал идентичен материалу нативного эксендина-4.
Исследовали различные аспекты неклинической фармакологии эксендина-4. В мозгу эксендин-4 связывается в основном с area postrema и районом nucleus tractus solitarius в ромбовидном мозгу и с субфорникальным органом в переднем мозгу. Связывание эксендина-4 наблюдали в мозгу и почке крысы и мыши. Структуры, с которыми эксендин-4 связывается в почке, являются неизвестными.
В ряде других экспериментов сравнивали биологические действия эксендина-4 и GLP-1 и показали более благоприятный спектр свойств для эксендина-4. Единственная подкожная доза эксендина-4 снижала глюкозу в плазме мышей db/db (с диабетом) и ob/ob (с диабетическим ожирением) на 40%. У крыс ZDF (Diabetic Fatty Zucker) (с сахарным диабетом и ожирением) 5 недель лечения эксендином-4 приводили к снижению HbAic (мера гликозилированного гемоглобина, используемая для оценки уровней глюкозы в плазме) до 41%. Чувствительность к инсулину также улучшалась на 76% после 5 недель лечения крыс ZDF, страдающих ожирением. У толерантных к глюкозе приматов также наблюдали зависимые от дозы снижения глюкозы в плазме. См. также пример 6, который описывает результаты эксперимента, показывающие, что эксендин является более сильнодействующим и/или эффективным, чем GLP-1, в усилении стимулируемого глюкозой высвобождения инсулина. Кроме того, пример 8 описывает исследование, показывающее, что способность эксендина-4 снижать глюкозу in vivo была в 3430 раз более сильной, чем эта способность GLP-1.
У грызунов наблюдали инсулинотропное действие эксендина-4, улучшающее инсулиновый ответ на глюкозу на более чем 100%, у не подвергавшихся голоданию крыс Harlan Sprague-Dawley (HSD) и приблизительно 10-кратное увеличение у не подвергавшихся голоданию мышей db/db. Более высокие концентрации глюкозы в плазме перед обработкой были ассоциированы с большими снижающими глюкозу эффектами. Таким образом, наблюдаемый эффект эксендина-4 по снижению глюкозы, по-видимому, является зависимым от глюкозы и является минимальным, если животные уже являются эугликемическими (нормогликемическими). Лечение эксендином-4 связано также с улучшением показателей гликемии и чувствительности к инсулину, как описано в примерах 9 и 13.
Эксендин-4 зависимым от дозы образом понижал опорожнение желудка у крыс HSD и был примерно в 90 раз более сильным, чем GLP-1, в отношении этого действия. Было также показано, что эксендин-4 понижает потребление пищи у мышей NIH/Sw (Swiss) после периферического введения, и он был по меньшей мере в 1000 раз более сильнодействующим, чем GLP-1, в отношении этого действия. Эксендин-4 снижал концентрации глюкагона в плазме приблизительно на 40% у анестезированных крыс ZDF во время гиперинсулинемических, гипергликемических фиксированных состояний, но не влиял на концентрации глюкагона в плазме во время эугликемических состояний у здоровых крыс. См. пример 4. Было показано, что эксендин-4 зависимым от дозы образом уменьшал вес тела у страдающих ожирением крыс ZDF, тогда как у худых крыс ZDF наблюдаемое уменьшение в весе тела, по-видимому, является временным.
Вследствие действий на увеличение и восстановление секреции инсулина, а также ингибирования секреции глюкагона эксендин-4 будет применим для людей с диабетом типа 2, которые сохраняют способность секретировать инсулин. Его эффекты на потребление пищи, опорожнение желудка, другие механизмы, которые модулируют абсорбцию питательных веществ, и секрецию глюкагона также подтверждают применимость эксендина-4 для лечения, например, ожирения, диабета типа I и людей с диабетом типа II, которые имеют пониженную секрецию инсулина.
Токсикологию эксендина-4 изучали в исследованиях с единственной дозой на мышах, крысах и обезьянах, в исследованиях с повторяемыми дозами (до 28 последовательных ежедневных доз) на крысах и обезьянах и в тестах in vitro на мутагенность и хромосомные изменения. До настоящего времени, не наблюдали смертей и не было наблюдаемых связанных с лечением изменений в гематологии, клинической химии или макроскопических или микроскопических изменениях тканей. Было продемонстрировано, что эксендин-4 является немутагенным, и он не вызывал хромосомных аберраций при испытанных концентрациях (до 5000 мкг/мл).
В поддержку этого исследования неклинической фармакокинетики и метаболизма эксендина-4, был разработан ряд иммуноанализов. Радиоиммуноанализ с ограниченной чувствительностью (~100 пМ) использовали в исходных фармакокинетических исследованиях. Двухсайтный количественный иммунорадиометрический анализ IRMA на эксендин-4 был затем применен с более низким пределом количественных измерений 15 пМ. См. примеры 5 и 7. Было обнаружено, что биодоступность эксендина-4, вводимого подкожно, была приблизительно 50-80% с использованием этого радиоиммуноанализа. Это было сходно с биодоступностью, наблюдаемой после внутрибрюшинного введения (48-60%). Максимальные концентрации в плазме (Смакc) наблюдали между 30 и 43 минутами (Тмакс). Как Смакc, так и AUC-величины были прямо зависимы от дозы. Наблюдаемый конечный период полувыведения для эксендина-4, вводимого подкожно, был приблизительно 90-110 минут. Это было значительно выше, чем 14-41 мин, наблюдаемые после внутривенного дозирования. Сходные результаты получали с использованием IRMA-анализа. Исследования по деградации с эксендином-4 в сравнении с GLP-1 показывают, что эксендин-4 является относительно резистентным к деградации.
Исследования взаимосвязи активности со структурой (SAR) для оценки структур, которые могут быть связанными с антидиабетической активностью эксендина, в отношении его стабильности к метаболизму, и в отношении его физических характеристик, особенно когда это имеет отношение к стабильности пептида и к податливости к альтернативным системам доставки, привели к обнаружению пептидных соединений-агонистов эксендина. Агонисты эксендина включают в себя пептидные аналоги эксендина, в которых одна или несколько природно встречающихся аминокислот удалены или заменены другой аминокислотой (аминокислотами).
Предпочтительными агонистами эксендина являются аналоги-агонисты эксендина-4. Особенно предпочтительны агонисты эксендина, которые описаны в Международной заявке с номером PCT/US 98/16387, поданной 6 августа 1988 года, озаглавленной "Новые соединения-агонисты эксендина", которая заявляет преимущество изобретения предварительной заявки США с номером 60/055 404, поданной 8 августа 1997 года, в том числе соединений формулы (I) [SEQ ID NO:3]:
Xaa1 Xaa2 Хаа3 Gly Thr Хаa4 Xaa5 Xaa6 Xaa7 Хаа8
Ser Lys Gln Хаа9 Glu Glu Glu Ala Val Arg Leu
Хаа10 Хаа11 Xaa12 Xaa13 Leu Lys Asn Gly Gly Хаа14
Ser Ser Gly Ala Xaa15 Xaa16 Xaa17 Xaa18-Z
где Xaa1 обозначает His, Arg или Туr; Xaa2 обозначает Ser, Gly, Ala или Thr; Хаа3 обозначает Asp или Glu; Xaa4обозначает Phe, Туr или нафтилаланин; Xaa5 обозначает Thr или Ser; Хаа6 обозначает Ser или Thr; Хаа7 обозначает Asp или Glu; Хаа8 обозначает Leu, Ile, Val, пентилглицин или Met;
Хаа9 обозначает Leu, Ile, пентилглицин, Val или Met; Хаа10обозначает Phe, Туr или нафтилаланин; Хаа11 обозначает Ilе, Val, Leu, пентилглицин, трет-бутилглицин или Met; Xaa12обозначает Glu или Asp; Xaa13 обозначает Тrр, Phe, Туr или нафтилаланин; Xaa14, Xaa15 , Xaa16 и Xaa17 обозначают независимо Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; Xaa18 обозначает Ser, Thr или Туr; и Z обозначает -ОН или -NH2; при условии, что это соединение не является эксендином-3 или эксендином-4.
Предпочтительные N-алкильные группы для N-алкилглицина, N-алкилпентилглицина и N-алкилаланина включают в себя низшие алкильные группы предпочтительно из 1 - приблизительно 6 атомов углерода, более предпочтительно из 1-4 атомов углерода. Подходящие соединения включают в себя соединения, перечисленные на фиг.1, имеющие аминокислотные последовательности SEQ ID NO:9-39.
Предпочтительные соединения-агонисты эксендина включают в себя соединения, где Xaa1 обозначает His или Туr. Более предпочтительно Xaa1 обозначает His.
Предпочтительными являются соединения, где Xaa2обозначает Gly.
Предпочтительными являются соединения, где Хаа9обозначает Leu, пентилглицин или Met.
Предпочтительными являются соединения, где Хаа13 обозначает Тrр или Phe.
Также предпочтительными являются соединения, где Хаа4обозначает Phe или нафтилаланин; Хаа11 обозначает Ilе или Val и Xaa14, Xaa15, Xaa16 и Xaa17 независимо выбраны из Pro, гомопролина, тиопролина или N-алкилаланина. Предпочтительно N-алкилаланин имеет N-алкильную группу из 1 - приблизительно 6 атомов углерода.
Согласно особенно предпочтительному аспекту, Xaa15, Хаа16и Xaa17 являются одним и тем же аминокислотным остатком.
Предпочтительными являются соединения, где Xaa18обозначает Ser или Туr, более предпочтительно Ser.
Предпочтительно Z обозначает -NH2.
В соответствии с одним аспектом, предпочтительными являются соединения формулы (I), где Xaa1 обозначает His или Туr, более предпочтительно His; Xaa2 обозначает Gly; Хаа4 обозначает Phe или нафтилаланин; Хаа9 обозначает Leu, пентилглицин или Met; Хаа10 обозначает Phe или нафтилаланин;
Хаа11 обозначает Ilе или Val; Xaa14, Xaa15, Xaa16 и Xaa17независимо выбраны из Pro, гомопролина, тиопролина или N-алкилаланина; и Xaa18 обозначает Ser или Туr, более предпочтительно Ser. Более предпочтительно Z обозначает -NH2.
В соответствии с особенно предпочтительным аспектом, особенно предпочтительные соединения включают в себя соединения формулы (I), где Xaa1 обозначает His или Arg; Xaa2обозначает Gly; Хаа3 обозначает Asp или Glu; Xaa4 обозначает Phe или нафтилаланин; Xaa5 обозначает Thr или Ser; Хаа6 обозначает Ser или Thr; Хаа7 обозначает Asp или Glu; Xaa8 обозначает Leu или пентилглицин; Хаа9 обозначает Leu или пентилглицин; Хаа10 обозначает Phe или нафтилаланин; Хаа11обозначает Ilе, Val или трет-бутилглицин; Xaa12 обозначает Glu или Asp; Xaa13 обозначает Тrр или Phe; Xaa14, Xaa15, Xaa16и Xaa17 независимо обозначают Pro, гомопролин, тиопролин или N-метилаланин; Xaa18 обозначает Ser или Туr; и Z обозначает -ОН или -NH2; при условии, что это соединение не имеет формулы любой последовательности из SEQ ID NO:1 или 2. Более предпочтительно Z обозначает -NH2. Особенно предпочтительные соединения включают в себя соединения, имеющие аминокислотную последовательность из SEQ ID NO:9, 10, 21, 22, 23, 26, 28, 34, 35 и 39.
В соответствии с особенно предпочтительным аспектом, обеспечены соединения, где Хаа9 обозначает Leu, Ile, Val или пентилглицин, более предпочтительно Leu или пентилглицин, а Xaa13 обозначает Phe, Туr или нафтилаланин, более предпочтительно Phe или нафтилаланин. Эти соединения будут обнаруживать наиболее выгодную продолжительность действия и будут меньше подвергаться окислительной деградации, как in vitro, так и in vivo, а также во время синтеза этого соединения.
Соединения-агонисты эксендина включают в себя также соединения, описанные в Международной заявке с номером PCT/US 98/24210, поданной 13 ноября 1998 года, озаглавленной "Новые соединения-агонисты эксендина", которая заявляет преимущество изобретения предварительной заявки Соединенных Штатов с номером 60/065442, поданной 14 ноября 1997 года, в том числе соединения формулы (II) [SEQ ID NO:4]:
Xaa1 Хаа2 Хаа3 Gly Xaa5 Xaa6 Хаа7 Xaa8 Хаа9 Хаа10
Хаа11 Xaa12 Хаа13 Хаа14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20
Xaa21 Хаа22 Хаа23 Хаа24 Xaa25 Xaa26 Хаа27 Xaa28-Z1,- где
Xaa1 обозначает His, Arg или Туr;
Хаа2 обозначает Ser, Gly, Ala или Thr;
Хаа3 обозначает Asp или Glu;
Xaa5 обозначает Ala или Thr;
Xaa6 обозначает Ala, Phe, Туr или нафтилаланин;
Хаа7 обозначает Thr или Ser;
Хаа8 обозначает Ala, Ser или Thr;
Хаа9 обозначает Asp или Glu;
Хаа10 обозначает Ala, Leu, Ile, Val, пентилглицин или Met;
Xaa11 обозначает Ala или Ser;
Xaa12 обозначает Ala или Lys;
Xaa13 обозначает Ala или Gln;
Xaa14 обозначает Ala, Leu, Ile, пентилглицин, Val или Met;
Xaa15 обозначает Ala или Glu;
Xaa16 обозначает Ala или Glu;
Xaa17 обозначает Ala или Glu;
Xaa19 обозначает Ala или Val;
Xaa20 обозначает Ala или Аrg;
Xaa21 обозначает Ala или Leu;
Xaa22 обозначает Ala, Phe, Туr или нафтилаланин;
Хаа23 обозначает Ilе, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Хаа24 обозначает Ala, Glu или Asp;
Хаа25 обозначает Ala, Тrр, Phe, Туr или нафтилаланин;
Хаа26 обозначает Ala или Leu;
Хаа27 обозначает Ala или Lys;
Хаа28 обозначает Ala или Asn;
Z1 обозначает -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Xaa31 Ser-Z2,
Gly Gly Xaa31 Ser Ser-Z2,
Gly Gly Хаа31 Ser Ser Gly-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Xaa36-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Xaa37-Z2 или
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаa38-Z2;
Хаа31, Хаa36, Хаа37 и Хаа38 обозначают независимо Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; или Z2 обозначает -ОН или -NH2;
при условии, что не более трех из Хаа3, Xaa5, Xaa6, Xaa8, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Хаа26, Хаа27 и Xaa28 представляют собой Ala.
Предпочтительные N-алкильные группы для N-алкилглицина, N-алкилпентилглицина и N-алкилаланина включают в себя низшие алкильные группы, предпочтительно, из 1 - приблизительно 6 атомов углерода, более предпочтительно из 1-4 атомов углерода.
Предпочтительные соединения-агонисты эксендина включают в себя соединения, в которых Xaa1 обозначает His или Туr. Более предпочтительно Xaa1 представляет собой His.
Предпочтительными являются соединения, где Xaa2 обозначает Gly.
Предпочтительными являются соединения, где Xaa14 обозначает Leu, пентилглицин или Met.
Предпочтительными являются соединения, где Xaa25обозначает Тrр или Phe.
Предпочтительными являются соединения, где Хаа6обозначает Phe или нафтилаланин; Хаа22 обозначает Phe или нафтилаланин, и Хаа23 обозначает Ilе или Val.
Предпочтительными являются соединения, где Хаа31, Хаа36, Хаа37 и Хаа38 независимо выбраны из Pro, гомопролина, тиопролина и N-алкилаланина.
Предпочтительно Z1 обозначает -NH2.
Предпочтительно Z2 обозначает -NH2.
В соответствии с одним аспектом, предпочтительными являются соединения формулы (II), где Xaa1 обозначает His или Туr, более предпочтительно His; Хаа2 обозначает Gly; Хаа6обозначает Phe или нафтилаланин; Хаа14 обозначает Leu, пентилглицин или Met; Хаа22 обозначает Phe или нафтилаланин; Хаа23 обозначает Ilе или Val; Хаа31, Хаа36, Хаа37 и Хаа38независимо выбраны из Pro, гомопролина, тиопролина или N-алкилаланина. Более предпочтительно Z1 обозначает -NH2.
В соответствии с особенно предпочтительным аспектом особенно предпочтительные соединения включают в себя соединения формулы (II), где Xaa1 обозначает His или Аrg; Хаа2 обозначает Gly или Аlа; Хаа3 обозначает Asp или Glu; Xaa5 обозначает Аlа или Thr; Xaa6 обозначает Аlа, Phe или нафтилаланин; Xaa7 обозначает Thr или Ser; Xaa8 обозначает Ala, Ser или Thr; Xaa9 обозначает Asp или Glu; Хаа10обозначает Ala, Leu или пентилглицин; Хаа11 обозначает Ala или Ser; Xaa12 обозначает Ala или Lys; Xaa13 обозначает Ala или Gln; Xaa14 обозначает Ala, Leu или пентилглицин; Xaa15обозначает Ala или Glu; Xaa16 обозначает Ala или Glu; Xaa17обозначает Ala или Glu; Xaa19 обозначает Ala или Val; Xaa20обозначает Ala или Arg; Xaa21 обозначает Ala или Leu; Xaa22обозначает Phe или нафтилаланин; Хаа23 обозначает Ilе, Val или трет-бутилглицин; Хаа24 обозначает Ala, Glu или Asp; Xaa25обозначает Ala, Trp или Phe; Xaa26 обозначает Ala или Leu; Xaa27 обозначает Ala или Lys; Xaa28 обозначает Ala или Asn; Z1обозначает -ОН, -NH2, Gly-Z2, Gly Gly-Zz, Gly Gly Xaa31-Z2, Gly Gly Хаа31 Ser-Z2, Gly Gly Xaa31 Ser Ser-Z2, Gly Gly Хаа31Ser Ser Gly-Z2, Gly Gly Xaa31 Ser Ser Gly Ala-Z2, Gly Gly Хаа31 Ser Ser Gly Ala Хаа36-Z2, Gly Gly Xaa31 Ser Ser Gly Ala Хаа36 Xaa37 -Z2, Gly Gly Xaa31 Ser Ser Gly Ala Хаа36 Хаа37Xaa38-Z2; причем Хаа31, Хаа36, Хаа37 и Хаа38 обозначают независимо Pro, гомопролин, тиопролин или N-метилаланин; и Z2 обозначает -ОН или -NH2; при условии, что не более трех из Хаа3, Хаа5, Xaa6, Xaa8, Хаа10, Хаа11, Xaa12, Хaа13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27 и Xaa28 представляют собой Ala. Особенно предпочтительные соединения включают в себя соединения, имеющие аминокислотную последовательность SEQ ID NO:40-61.
В соответствии с особенно предпочтительным аспектом, обеспечены соединения, где Xaa14 обозначает Leu, Ile, Val или пентилглицин, более предпочтительно Leu или пентилглицин, и Xaa25 обозначает Phe, Туr или нафтилаланин, более предпочтительно Phe или нафтилаланин. Эти соединения будут менее чувствительными к окислительной деградации, как in vitro, так и in vivo, а также во время синтеза этого соединения.
Соединения-агонисты эксендина включают в себя также соединения, описанные в Международной заявке с номером PCT/US 98/24273, поданной 13 ноября 1998 года, озаглавленной "Новые соединения-агонисты эксендина", которая заявляет преимущество изобретения предварительной заявки Соединенных Штатов с номером 60/066 029, поданной 14 ноября 1997 года, в том числе соединения формулы (III) [SEQ ID NO:5]:
Xaa1 Хаа2 Хаа3 Хаа4 Xaa5 Хаа6 Хаа7 Хаа8 Хаа9 Хаа10
Хаа11 Хаа12 Хаа13 Хаа14 Xaa15 Xaa16 Хаа17 Ala Xaa19 Xaa20
Xaa21 Хaа22 Хаа23 Хаа24 Xaa25 Xaa26 Xaa27 Xaa28-Z1; где
Xaa1 обозначает His, Arg, Туr, Ala, Norval, Val или Norleu;
Xaa2 обозначает Ser, Gly, Ala или Thr;
Хаа3 обозначает Ala, Asp или Glu;
Xaa4 обозначает Ala, Norval, Val, Norleu или Gly;
Хаа5 обозначает Ala или Thr;
Xaa6 обозначает Phe, Туr или нафтилаланин;
Хаа7 обозначает Thr или Ser;
Xaa8 обозначает Ala, Ser или Thr;
Хаa9 обозначает Ala, Norval, Val, Norleu, Asp или Glu;
Хаа10 обозначает Ala, Leu, Ile, Val, пентилглицин или Met;
Хаа11 обозначает Ala или Ser;
Xaa12 обозначает Ala или Lys;
Хаа13 обозначает Ala или Gln;
Xaa14 обозначает Ala, Leu, Ile, пентилглицин, Val или Met;
Xaa15 обозначает Ala или Glu;
Xaa16 обозначает Ala или Glu;
Xaa17 обозначает Ala или Glu;
Xaa19 обозначает Ala или Val;
Xaa20 обозначает Ala или Аrg;
Xaa21 обозначает Ala или Leu;
Xaa22 обозначает Phe, Туг или нафтилаланин;
Хаа23 обозначает Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Xaa24 обозначает Ala, Glu или Asp;
Xaa25 обозначает Ala, Trp, Phe, Туr или нафтилаланин;
Хаа26 обозначает Ala или Leu;
Хаа27 обозначает Ala или Lys;
Xaa28 обозначает Ala или Asn;
Z1 обозначает -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Хаа31 Ser-Z2,
Gly Gly Хаа31 Ser Ser-Z2,
Gly Gly Xaa31 Ser Ser Gly-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хaа36-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Xaa37-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Xaa38-Z2; или
Gly Gly Хаа31 Ser Ser Gly Ala Хав36 Хаа37 Хаа38 Xaa39-Z2;
где Хаа31, Хаа36, Хаа37 и Хаа38 обозначают независимо Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин,
N-алкилпентилглицин или N-алкилаланин; и
Z2 обозначает -ОН или -NH2;
при условии, что не более трех из Хаа3, Хаа4, Xaa5, Xaa6, Xaa8, Хаа9, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27 и Xaa28представляют собой Ala; и также при условии, что, если Xaa1представляет собой His, Arg или Туr, то по меньшей мере один из Хаа3, Хаа4 и Хаа5 представляет собой Ala.
Получение соединений
Соединения, которые являются активными ингредиентами композиций и доз данного изобретения, могут быть получены с использованием способов стандартного твердофазного синтеза пептидов и, предпочтительно, автоматизированного или полуавтоматизированного синтезатора пептидов. Получение эксендина-3 и эксендина-4 описано в примерах 1 и 2 ниже. Получение дополнительных пептидных аналогов-агонистов эксендина описано в примерах 13-198 ниже.
Обычно с использованием способов автоматизированного или полуавтоматизированного синтеза пептидов α -N-карбамоил-защищенную аминокислоту и аминокислоту, прикрепленную к растущей пептидной цепи на смоле, соединяют при комнатной температуре в инертном растворителе, таком как диметилформамид, N-метилпирролидинон или метиленхлорид в присутствии связующего вещества, такого как дициклогексилкарбодиимид и 1-гидроксибензотриазол, в присутствии основания, такого как диизопропилэтиламин. α -N-карбамоил-защитную группу удаляют из полученного комплекса пептид-смола с использованием реагента, такого как трифторуксусная кислота или пиперидин, и реакцию связывания повторяют со следующей желательной N-защищенной аминокислотой, которая должна быть присоединена к этой пептидной цепи. Подходящие N-защитные группы хорошо известны в данной области, причем предпочтительными здесь являются трет-бутоксикарбонил (tBoc) и флуоренилметоксикарбонил (Fmoc).
Растворители, производные аминокислот и 4-метилбенз-гидриламин-смола, используемые в синтезаторе пептидов, могут быть приобретены у Applied Biosystems Inc. (Foster City, CA). Следующие аминокислоты с защищенной боковой цепью могут быть приобретены у Applied Biosystems, Inc.: Boc-Arg(Mts), Fmoc-Arg(Pmc), Boc-Thr(Bzl), Fmoc-Thr(t-Bu), Boc-Ser(Bzl), Fmoc-Ser(t-Bu), Boc-Tyr(BrZ), Fmoc-Tyr(t-Bu), Boc-Lys(Cl-Z), Fmoc-Lyc(Boc), Boc-Glu(Bzl), Fmoc-Glu(t-Bu), Fmoc-His(Trt), Fmoc-Asn(Trt) и Fmoc-Gln(Trt). Boc-His(BOM) может быть приобретена у Applied Biosystems, Inc. или Bachem Inc. (Torrance, CA). Анизол, диметилсульфид, фенол, этандитиол и тиоанизол могут быть получены от Aldrich Chemical Company (Milwaukee, WI). Air Products and Chemicals (Allentown, PA) поставляет HF. Этиловый эфир, уксусная кислота и метанол могут быть приобретены у Fisher Scientific (Pittsburgh, PA).
Твердофазный пептидный синтез может выполняться с использованием автоматического пептидного синтезатора (Model 430А, Applied Biosystems Inc., Foster City, CA) с использованием системы NMP/HOBt (Option 1) и способа с использованием защитных групп tBoc или Fmoc (см. Applied Biosystems User’s Manual в отношении ABI 430A Peptide Synthesizer, Version 1.3B July 1, 1988, section 6, p.49-70, Applied Biosystems, Inc., Foster City, CA) с блокированием. Вос-пептид-смолы могут быть расщеплены при помощи HF (-5-0°С, 1 ч). Пептид может быть экстрагирован из смолы чередованием воды и уксусной кислоты и фильтраты лиофилизируют. Fmoc-пептид-смолы могут быть расщеплены в соответствии со стандартными способами (Introduction to Cleavage Techniques, Applied Biosystems, Inc., 1990, p.6-12). Пептиды могут быть также собраны с использованием Advanced Chem Tech Synthesizer (Model MPS 350, Louisville, Kentucky).
Пептиды могут быть очищены при помощи ОФ-ВЖХ (препаративной или аналитической) с использованием системы Waters Delta Prep 3000. Препаративная колонка С4, С8 или С18 (10 мкм, 2,2×25 см; Vydac, Hesperia, CA) может быть использована для выделения пептидов, и чистота может быть определена с использованием аналитической колонки С4, С8 или С 18 (5 мкм, 0,46×25 см; Vydac). Растворители (А=0,1% ТФУ/вода и В=0,1% ТФУ/СН3СN) могут доставляться в аналитическую колонку со скоростью тока 1,0 мл/мин, а в препаративную колонку - 15 мл/мин. Аминокислотные анализы могут выполняться с помощью системы Waters Pico Tag и обрабатываться с использованием программы Maxima. Пептиды могут быть гидролизованы кислотным гидролизом в паровой фазе (115°С, 20-24 ч). Гидролизаты могут быть дериватизованы и анализированы при помощи стандартных способов (Cohen, et al., The Pico Tag Method: A Manual of Advanced Techniques for Amino Acid Analysis, p.11-52, Millipore Corporation, Milford, MA (1989)). Анализ бомбардировкой ускоренными атомами может проводиться с использованием M-Scan, Incorporated (West Chester, PA). Калибрование по массе может выполняться с использованием иодида цезия или смеси иодид цезия/глицерин. Анализ методом плазменной десорбционной ионизации с использованием детектирования времени пролета частиц может проводиться на масс-спектрометре Applied Biosystems Bio-Ion 20. Электрораспылительная масс-спектрометрия может проводиться на приборе VG-Trio.
Пептидные соединения, являющиеся активными ингредиентами, применимые в композициях и дозах данного изобретения могут быть также получены с использованием способов рекомбинантных ДНК в соответствии с методами, известными в настоящее время в данной области. См., например, Sambrook et al., (Molecular Cloning. A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press (1989).
Применимость
Композиции и дозировки, описанные здесь, применимы в связи с их фармакологическими свойствами. В частности, композиции и дозы данного изобретения являются эффективными в качестве эксендинов и агонистов эксендинов и обладают активностью в качестве агентов для снижения глюкозы в крови, регуляции сократительной способности желудка и замедления опорожнения желудка, определяемой по способности уменьшать уровни глюкозы, возникающие после приема пищи, у млекопитающих.
Композиции и введение
Композиции и дозированные формы эксендина и агонистов эксендина данного изобретения применимы в связи с их эксендин-подобными эффектами и могут быть для удобства обеспечены в форме композиций, пригодных для парентерального (в том числе внутривенного, внутримышечного и подкожного) введения. Здесь описаны также композиции и дозировки, применимые в способах альтернативной доставки, в том числе пероральной, назальной, трансбуккальной, подъязычной и легочной.
Соединения, применимые в данном изобретении, могут быть обеспечены в виде парентеральных композиций для инъекции или инфузии. Обычно, они могут, например, быть суспендированы в инертном масле, предпочтительно растительном масле, таком как кунжутное, арахисовое, оливковое масло, или другом приемлемом носителе. Предпочтительно, они могут быть суспендированы в водном носителе, например в изотоническом буферном растворе при рН приблизительно от 3,0 до приблизительно 7,0, более конкретно от приблизительно 4,0 до 6,0 и предпочтительно от приблизительно 4,0 до приблизительно 5,0. Эти композиции могут стерилизоваться общепринятыми способами стерилизации или они могут быть стерильно профильтрованы. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, требующиеся для приближенных физиологических условий, такие как рН-формирующие буферные агенты. Применимые буферы включают в себя, например, ацетат натрия/уксусная кислота буфер. Желательная изотоничность может быть достигнута с использованием хлорида натрия или других фармацевтически приемлемых агентов, таких как декстроза, борная кислота, тартрат натрия, пропиленгликоль, полиолы (такие как маннит и сорбит) или другие неорганические или органические растворимые вещества. Хлорид натрия является предпочтительным, в частности, для буферов, содержащих ионы натрия.
Эксендин и соединения-агонисты эксендина могут быть также приготовлены в виде фармацевтически приемлемых солей (например, кислотно-аддитивных солей) и/или их комплексов.
Фармацевтически приемлемыми солями являются соли, нетоксичные при концентрации, при которой они вводятся. Получение таких солей может облегчать фармакологическое использование путем изменения физико-химических свойств композиции без предотвращения проявления композицией ее физиологического действия. Примеры применимых изменений в физических свойствах включают в себя снижение точки плавления для облегчения введения через слизистую оболочку и увеличение растворимости для облегчения введения более высоких концентраций лекарственного средства.
Фармацевтически приемлемые соли включают в себя кислотно-аддитивные соли, такие как соли, включающие в себя сульфат, гидрохлорид, фосфат, сульфамат, ацетат, цитрат, лактат, тартрат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат и хинат. Фармацевтически приемлемые соли могут быть получены из кислот, таких как хлористоводородная кислота, серная кислота, фосфорная кислота, сульфамовая кислота, уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, циклогексилсульфамовая кислота и хинная кислота. Такие соли могут быть получены, например, реакцией продукта в форме свободной кислоты или форм основания продукта с одним или несколькими эквивалентами подходящих основания или кислоты в растворителе или среде, в которых эта соль является нерастворимой, или в растворителе, таком как вода, который затем удаляют с помощью вакуумной сушки или лиофилизацией, или заменой ионов существующей соли на другой ион на подходящей ионообменной смоле.
Обычно, могут быть также использованы носители или наполнители для облегчения введения доз данного изобретения. Примеры носителей и наполнителей включают в себя карбонат кальция, фосфат кальция, различные сахара, такие как лактоза, или типы крахмала, производные целлюлозы, желатин, растительные масла, полиэтиленгликоли и физиологически совместимые растворители.
Если желательно, растворы указанных выше дозированных композиций могут быть уплотнены при помощи уплотняющего агента, такого как метилцеллюлоза. Они могут быть приготовлены в эмульгированной форме, в виде либо эмульсии типа масло-в-воде, либо эмульсии типа вода-в-масле. Любой из большого разнообразия фармацевтически приемлемых эмульгирующих агентов может быть использован, в том числе, например, порошок аравийской камеди, неионное поверхностно-активное вещество (такое как Твин) или ионное поверхностно-активное вещество (такое как щелочные сульфаты или сульфонаты полиэфирных спиртов, например, Тритон).
В общем, композиции и дозированные композиции данного изобретения готовят смешиванием ингредиентов согласно обычным приемлемым процедурам. Например, выбранные компоненты могут быть просто смешаны в смесителе или другом стандартном устройстве с получением концентрированной смеси, которая может быть затем доведена до конечных концентрации и вязкости добавлением воды или уплотняющего агента и, возможно, буфера для регуляции рН или дополнительного растворенного вещества для регуляции тоничности.
Другие фармацевтически приемлемые носители и их приготовление описаны в стандартных научных руководствах по приготовлению, например. Remington’s Pharmaceutical Sciences by E.W.Martin. См. также Wang, Y.J. and Hanson, M.A. "Parenteral Formulations of Proteins and Peptides: Stability and Stabilizers", Journal of Parenteral Science and Technology, Technical Report No.10, Suppl.42:2S (1988).
Для использования врачом эти соединения должны быть обеспечены в дозированной стандартной форме для одного введения, содержащей количество агониста эксендина, с другим терапевтическим агентом или без него, например, с понижающим содержание глюкозы агентом, модулирующим опорожнение желудка агентом, понижающим липиды агентом или ингибитором потребления пищи. Терапевтически эффективные количества агониста эксендина для применения в регуляции глюкозы в крови или в регуляции опорожнения желудка и в случае состояний, при которых приносит пользу замедление или регулирование опорожнения желудка, являются такими, которые уменьшают уровни глюкозы в крови, возникающие после приема пищи, предпочтительно до не более чем приблизительно 8 или 9 мМ, или такими, которые уменьшают уровни глюкозы в крови, как желательно. В случае больных диабетом или нетолерантных к глюкозе индивидуумов, уровни глюкозы в плазме являются более высокими, чем у нормальных индивидуумов. У таких индивидуумов может быть получено полезное уменьшение или "сглаживание" уровней глюкозы в крови, возникающих после приема пищи. Как будет понятно специалистам в данной области, эффективное количество терапевтического агента будет варьировать в зависимости от многих факторов, в том числе физического состояния пациента, уровня сахара в крови или уровня ингибирования опорожнения желудка, который должен быть получен, или желаемого уровня уменьшения потребления пищи и других факторов.
Такие фармацевтические композиции применимы для индуцирования увеличенной чувствительности к инсулину у субъекта и могут быть использованы с таким же успехом при нарушениях, таких как диабет, где чувствительность к инсулину выгодно увеличивается.
Форма "складского" или "депо" - препарата медленного высвобождения может быть использована, так что терапевтически эффективные количества такого препарата доставляются в кровоток на протяжении многих часов или дней после трансдермальной инъекции или другой формы доставки.
Описаны эффективные суточные дозы этих соединений. Точная подлежащая введению доза может быть определена лечащим врачом и может зависеть от эффективности конкретного используемого эксендина или соединения-агониста эксендина, а также от возраста, веса и состояния индивидуума. Оптимальная схема введения соединений данной заявки пациенту зависит от факторов, известных в данной области, таких как конкретное заболевание или нарушение, желательный эффект и тип пациента. Хотя в типичном случае эти соединения будут использоваться для лечения человека, они могут также использоваться для лечения сходных или идентичных заболеваний у других позвоночных, таких как другие приматы, сельскохозяйственных животных, таких как свиньи, крупный рогатый скот и домашние куры, и спортивных животных и домашних любимцев, таких как лошади, собаки и кошки.
Данное изобретение включает в себя композиции эксендинов и агонистов эксендинов, которые содержат эксендин или агонист эксендина, смешанных вместе с буфером (предпочтительно ацетатным буфером), модификатором изоосмоляльности (предпочтительно маннитом) и необязательно содержащие консервант (предпочтительно м-крезол), причем указанная композиция имеет рН между приблизительно 3,0 и приблизительно 7,0 (предпочтительно между приблизительно 4,0 и приблизительно 5, 0).
Композиция, которая лучше всего пригодна для парентеральной жидкой дозированной формы, является композицией, в которой активный ингредиент (ингредиенты) является стабильным, с адекватной буферной способностью для поддержания рН раствора на протяжении периода хранения этого продукта. Дозированная форма должна быть изотоническим и/или изоосмолярным раствором для улучшения стабильности активного ингредиента или ослабления боли при инъекции, или того и другого. Однако, устройства, которые доставляют очень небольшие инъекционные объемы, могут не требовать того, чтобы композиция была изотонической и/или изоосмолярной. Если дозированная форма упакована в виде дозы для одного введения, то консервант может быть включен, но не является необходимым. Однако, если, дозированная форма упакована в контейнер для многократного использования, то консервант является необходимым.
Эти дозированные формы включают в себя приблизительно 0,005 до приблизительно 0,4%, более конкретно от приблизительно 0,005 до приблизительно 0,02% или от приблизительно 0, 005 до приблизительно 0,05% (мас./об.), соответственно, активного ингредиента в водной системе вместе с приблизительно 0,02-0,5% (мас./об.) ацетатного, фосфатного, цитратного или глутаматного или подобного буфера, либо одного, либо в комбинации для получения рН конечной композиции приблизительно 3,0-7,0, более конкретно от приблизительно рН 4,0 до приблизительно 6,0, или от приблизительно 4,0 до 5,0, а также либо приблизительно 1,0-10% (мас./об.) углеводного или являющегося многоатомным спиртом модификатора изоосмоляльности (предпочтительно маннита) или до приблизительно 0,9% соли или комбинации обоих, приводящих к изотоническому или изоосмолярному раствору в водной непрерывной фазе. Приблизительно 0,005-1,0% (мас./об.) антимикробного консерванта, выбранного из группы, состоящей из м-крезола, бензилового спирта, метил-, этил-, пропил- и бутилпарабенов и фенола, присутствует также, если композиция упакована в контейнер для многократного использования. Достаточное количество воды для инъекции добавляют для получения желательной концентрации раствора. Хлорид натрия, а также другие наполнители могут также присутствовать, если это желательно. Однако такие наполнители должны поддерживать общую стабильность активного ингредиента.
Многоатомные спирты и углеводы имеют общий признак в их каркасах, т.е. -СНОН-СHОН-. Многоатомные спирты включают в себя такие соединения как сорбит, маннит, глицерин и полиэтиленгликоли (ПЭГ). Эти соединения являются молекулами в прямой цепью. Углеводы, такие как манноза, рибоза, трегалоза, мальтоза, глицерин, инозит, глюкоза и лактоза, с другой стороны, являются циклическими молекулами, которые содержат кетогруппу или альдегидную группу. Эти два класса соединений будут также эффективными в стабилизации белка против денатурации, вызываемой повышенными температурами и процессами замораживания-оттаивания или лиофилизации. Подходящие углеводы включают в себя галактозу, арабинозу, лактозу или любой другой углевод, который не имеет вредного действия на пациента с диабетом, т.е. углевод не метаболизируется с образованием больших концентраций глюкозы в крови. Такие углеводы хорошо известны в данной области как пригодные для пациентов с диабетом.
Предпочтительно, пептиды данного изобретения смешивают с многоатомным спиртом, таким как сорбит, маннит, инозит, глицерин, ксилит и сополимер полипропилена и этиленгликоля, а также различные полиэтиленгликоли (ПЭГ) с молекулярной массой 200, 400, 1450, 3350, 4000, 6000 и 8000). Маннит является предпочтительным многоатомным спиртом.
Жидкая композиция данного изобретения должна быть по существу изотонической и/или изоосмолярной. Изотонический раствор может быть определен как раствор, который имеет концентрацию электролитов или комбинации электролитов и неэлектролитов, которая будет проявлять эквивалентное осмотическое давление относительно осмотического давления того, куда его вводят, здесь, например, в случае парентеральной инъекции композиции, ткани млекопитающего. Подобным образом, изоосмолярный раствор может быть определен как раствор, который имеет концентрацию неэлектролитов, которая будет проявлять эквивалентное осмотическое давление относительно осмотического давления того, куда его вводят. В применении здесь, "по существу изотоническая" означает в пределах ±20% иpотоничности, предпочтительно в пределах ±10%. В применении здесь, "по существу изоосмолярная" означает в пределах ±20% изоосмоляльности, предпочтительно в пределах ±10%. Приготовленный продукт для инъекции заключают в контейнер, обычно, например, флакон, патрон, заранее заполненный шприц или одноразовый стержень.
Композиция, которая лучше всего пригодна для однодозовой парентеральной лиофилизированной дозированной формы является композицией, в которой активный ингредиент является стабильным, с адекватной буферной способностью для поддержания рН раствора на протяжении периода хранения воссозданного продукта или без этой способности. Эта дозированная форма должна содержать наполнитель для облегчения образования осадка (на фильтре). Наполнитель может также действовать в качестве агента тоничности и/или модификатора изоосмоляльности при воссоздании раствора либо для содействия стабильности активного ингредиента и/или уменьшения боли при инъекции. Как отмечалось выше, устройства, которые доставляют очень небольшие инъекционные объемы, могут не требовать того, чтобы композиция была изотонической и/или изоосмолярной. Поверхностно-активное вещество может также улучшать свойства осадка (на фильтре) и/или облегчать воссоздание раствора.
Эти дозированные формы включают в себя приблизительно 0,005 - приблизительно 0,4%, более конкретно от приблизительно 0,005 до приблизительно 0,02% или 0,005-0,05% (мас./об.) активного ингредиента. Может быть необязательным включение буфера в композицию и/или воссоздание лиофилизата буфером, если содержимое контейнера предназначено для использования в пределах периода стабильности, установленного для реконституируемого активного ингредиента. При использовании буфера он может быть включен в лиофилизат или в растворитель для воссоздания раствора. Таким образом, композиция и/или растворитель для воссоздания раствора могут содержать индивидуально или вместе приблизительно 0,02-0, 5% (мас./об.) ацетатного, фосфатного, нитратного или глутаматного буфера, либо одного, либо в комбинации, для получения рН конечной композиции приблизительно 3,0-7,0, более конкретно от приблизительно рН 4,0 до приблизительно 6,0, или приблизительно 4,0-5,0. Наполнитель может состоять либо из приблизительно 1,0-10% (мас./об.) углеводного или являющегося многоатомным спиртом модификатора изоосмоляльности (как описано выше), либо до 0,9% соли или их комбинации, что приводит к изотоническому или изоосмолярному раствору в воссозданной водной фазе. Может быть включено поверхностно-активное вещество, предпочтительно от приблизительно 0,1 до приблизительно 1,0% (мас./об.) полисорбата 80 или другого неионного детергента. Как отмечалось выше, в лиофилизированной стандартной композиции для одного введения может также присутствовать хлорид натрия, также как и другие наполнители, если желательно. Однако, такие наполнители должны поддерживать общую стабильность активного ингредиента. Эта композиция должна быть лиофилизирована в пределах параметров валидизации, идентифицированных для поддержания стабильности активного ингредиента.
Жидкая композиция данного изобретения должна либо быть по существу изотонической и/или изоосмолярной до лиофилизации, либо позволять образование изотонических и/или изоосмолярных растворов после воссоздания раствора. Эта композиция должна использоваться в пределах периода, установленного исследованиями периода хранения как на лиофилизированной форме, так и при последующем воссоздании раствора. Лиофилизированный продукт заключают в контейнер, обычно, например, во флакон. При применении других контейнеров, таких как патрон, заранее заполненный шприц или одноразовый стержень, может быть также включен растворитель для воссоздания раствора.
Как и в случае парентеральных жидких и лиофилизированных однодозовых композиций, описанных выше, композиция, которая лучше всего пригодна для многодозовой парентеральной лиофилизированной дозированной формы, является композицией, в которой активный ингредиент является достаточно стабильным, с адекватной буферной способностью для поддержания рН раствора на протяжении предполагаемого периода хранения этого продукта. Эта дозированная форма должна содержать наполнитель для облегчения образования осадка (на фильтре). Наполнитель может также действовать в качестве агента тоничности и/или модификатора изоосмоляльности при воссоздании раствора или для содействия стабильности активного ингредиента, или для уменьшения боли при инъекции, или того и другого. И в этом случае, устройства, которые доставляют очень небольшие инъекционные объемы, могут не требовать того, чтобы композиция была изотонической и/или изоосмолярной. Однако консервант является необходимым для облегчения многократного использования пациентом.
Эти дозированные формы включают в себя приблизительно 0,005 - приблизительно 0,4%, более конкретно от приблизительно 0,005 до приблизительно 0,02% или приблизительно 0, 005-0,05% (мас./об.), соответственно активного ингредиента. Может быть необязательным включение буфера в композицию и/или воссоздание лиофилизата буфером, если содержимое контейнера предназначено для использования в пределах периода стабильности, установленного для реконституируемого активного ингредиента. При использовании буфера он может быть включен в лиофилизат или в растворитель для воссоздания раствора. Таким образом, композиция и/или растворитель для воссоздания раствора могут содержать индивидуально или вместе приблизительно 0,02-0,5% (мас./об.) ацетатного, фосфатного, цитратного или глутаматного буфера, либо одного, либо в комбинации, для получения рН конечной композиции приблизительно 3,0-7,0, более конкретно от приблизительно рН 4,0 до приблизительно 6,0, или от приблизительно 4,0 до 5,0. Наполнитель может состоять либо из приблизительно 1,0-10% (мас./об.) углеводного или являющегося многоатомным спиртом модификатора изоосмоляльности (предпочтительно маннита), либо до 0,9% соли или их комбинации, что приводит к изотоническому или изоосмолярному раствору в воссозданной водной фазе. Может быть включено поверхностно-активное вещество, предпочтительно от приблизительно 0,1 до приблизительно 1,0% (мас./об.) полисорбата 80 или другого неионного детергента. Приблизительно 0,005-1,0% (мас./об.) антимикробного консерванта, выбранного из группы, состоящей из м-крезола, бензилового спирта, метил-, этил-, пропил- и бутилпарабенов и фенола (предпочтительно м-крезола), присутствует также, если композиция упакована в контейнер для многократного использования. Хлорид натрия, а также другие наполнители могут также присутствовать, если это желательно. Однако, опять-таки, такие наполнители должны поддерживать общую стабильность активного ингредиента. Эта композиция должна быть лиофилизирована в пределах параметров валидизации, идентифицированных для поддержания стабильности активного ингредиента. Жидкая композиция данного изобретения должна быть либо по существу изотонической и/или изоосмолярной до лиофилизации, либо позволять образование изотонических и/или изоосмолярных растворов после воссоздания раствора. Эта композиция должна использоваться в пределах периода, установленного исследованиями периода хранения как на лиофилизированной форме, так и при последующем воссоздании раствора. Лиофилизированный продукт включают в контейнер, обычно, например, во флакон. При применении других контейнеров, таких как патрон, заранее заполненный шприц или одноразовый стержень, может быть также включен растворитель для воссоздания раствора.
Композиции, которые лучше всего пригодны для пероральной, назальной, легочной и/или внутритрахеальной дозированных форм, могут быть либо содержащими консерванты, либо не содержащими консервантов жидкими композициями и/или сухими порошкообразными или, для перорального введения, твердыми композициями. Содержащие консерванты или не содержащие консервантов жидкие композиции будут по существу идентичны композициям, описанным выше, в случае содержащих и не содержащих консервантов жидких парентеральных композиций. рН раствора должен быть приблизительно 3,0-7,0, причем рН больше или равный приблизительно 5,0 является наиболее предпочтительным для уменьшения возможности бронхостеноза. Сухие порошкообразные композиции могут содержать наполнитель и/или соли для облегчения образования нужного размера частиц и подходящего распределения по размеру частиц. Поверхностно-активное вещество и/или соли могут также улучшать свойства морфологии частиц и/или облегчать поглощение тканями активного ингредиента.
Сухие порошкообразные дозированные формы могут находиться в диапазоне от 1 до 100% (мас./мас.), соответственно активного ингредиента. Может быть ненужным включение наполнителя и/или солей для облегчения образования должного размера и/или распределения частиц. Наполнитель и/или соли могут состоять из либо приблизительно 0-99% (мас./мас.) углевода или многоатомного спирта, либо приблизительно 0-99% соли или комбинации обоих, приводящей к предпочтительному размеру и распределению частиц. Может быть включено поверхностно-активное вещество, предпочтительно от приблизительно 0,1 до приблизительно 1,0% (мас./об.) полисорбата 80 или другого неионного детергента. Хлорид натрия, а также другие наполнители могут также присутствовать, если это желательно. Однако, такие наполнители должны поддерживать общую стабильность активного ингредиента и способствовать надлежащему уровню гидратации.
Композиции, которые лучше всего пригодны для назальных и/или внутритрахеальных дозированных форм могут быть содержащими консервант или не содержащими консерванта жидкими дозированными композициями, описанными ранее.
Растворимые гели и/или пластыри могут быть использованы для облегчения трансбуккальной доставки. Эти гели могут быть приготовлены из различных типов крахмала и/или производных целлюлозы.
Подъязычная доставка может лучше всего осуществляться жидкими композициями, сходными с описанными выше в качестве парентеральных жидких или парентеральных лиофилизированных композиций после воссоздания раствора, без необходимости для этой дозированной формы быть изотоничным и/или изоосмолярным раствором. Твердые дозированные формы могут быть сходны с пероральными твердыми дозированными формами, за исключением того, что они должны быть легко растворимыми под языком.
Пероральная доставка может лучше всего осуществляться жидкой (гелевая капсюля) композицией, которая подобна парентеральной жидкой композиции, за исключением того, что этот раствор может быть более концентрированным и может содержать дополнительные добавки для облегчения поглощения активного ингредиента тонкой кишкой. Твердые дозированные формы будут содержать инертные ингредиенты вместе с активным ингредиентом для облегчения образования таблеток. Эти ингредиенты могут включать в себя полиэдральные спирты (такие как маннит), углеводы или типы крахмала, производные целлюлозы, и/или другие инертные, физиологически совместимые материалы. Таблетка может иметь энтеросолюбильное покрытие для минимизации расщепления в желудке и таким образом облегчать растворение и поглощение дальше вдоль пищеварительного канала.
Данное изобретение включает в себя также предпочтительные дозы для эксендинов и агонистов эксендинов при введении инъекцией и при предоставлении другими способами. Таким образом, композиции эксендина и агонистов эксендина, имеющие сравнимую активность, готовятся для введения инъекцией и включают в себя от приблизительно 0,1 до приблизительно 0,5 мкг на килограмм, вводимых один-три раза в сутки. Обычно, для пациента с диабетом, который весит в диапазоне от приблизительно 70 килограммов (среднее для пациентов с диабетом типа I) до приблизительно 90 килограммов (среднее для пациентов с диабетом типа II), например, это будет приводить к общему введению от приблизительно 10 до приблизительно 120 мкг в сутки в одной дозе или в разделенных дозах. При введении в разделенных дозах эти дозы предпочтительно вводят два или три раза в сутки и более предпочтительно два раза в сутки.
В предпочтительной процедуре введения эксендин или агонист эксендина вводят парентерально, более предпочтительно посредством инъекции, например, периферической инъекции. Предпочтительно, от приблизительно 1-30 мкг до приблизительно 1 мг эксендина или агониста эксендина вводят в сутки. Более предпочтительно, от приблизительно 1-30 мкг до приблизительно 500 мкг или от приблизительно 1-30 мкг до приблизительно 50 мкг эксендина или агониста эксендина вводят в сутки. Наиболее предпочтительно, в зависимости от веса субъекта и активности вводимого соединения, от приблизительно 3 мкг до приблизительно 50 мкг эксендина или агониста эксендина вводят в сутки. Предпочтительные дозы на основе веса пациента для соединений, имеющих приблизительно активность эксендина-4, находятся в диапазоне от приблизительно 0,005 мкг/кг на дозу до приблизительно 0,2 мкг/кг на дозу. Более предпочтительно, дозы на основе веса пациента для соединений, имеющих приблизительно активность эксендина-4, находятся в диапазоне от приблизительно 0,02 мкг/кг на дозу до приблизительно 0,1 мкг/кг на дозу. Наиболее предпочтительно, дозы на основе веса пациента для соединений, имеющих приблизительно активность эксендина-4, находятся в диапазоне от приблизительно 0,05 мкг/кг на дозу до приблизительно 0,1 мкг/кг на дозу. Эти дозы вводят 1-4 раза в сутки, предпочтительно 1-2 раза в сутки. Дозы эксендинов или агонистов эксендинов будут обычно более низкими при предоставлении непрерывной инфузией. Дозы эксендинов или агонистов эксендинов будут обычно более высокими при введении неинъекционными способами, такими как пероральная, трансбуккальная, подъязычная, назальная, легочная доставка или доставка при помощи кожного пластыря.
Пероральные дозы в соответствии с данным изобретением будут включать в себя от приблизительно в 50 до приблизительно в 100 раз большие количества активного ингредиента, т.е. от приблизительно 500 до приблизительно 12000 мкг в сутки в единственной дозе или в разделенных дозах, предпочтительно от приблизительно 500 до приблизительно 5000 мкг в сутки. Легочные дозы в соответствии с данным изобретением будут включать в себя от приблизительно в 10 до приблизительно в 100 раз большие количества активного ингредиента, т.е. от приблизительно 100 до приблизительно 12000 мкг в сутки в единственной дозе или в разделенных дозах, предпочтительно от приблизительно 500 до приблизительно 1000 мкг в сутки. Назальные, трансбуккальные и подъязычные дозы в соответствии с данным изобретением будут также включать в себя от приблизительно в 10 до приблизительно в 100 раз большие количества активного ингредиента, т.е. от приблизительно 100 до приблизительно 12000 мкг в сутки в единственной дозе или в разделенных дозах.
Предпочтительные дозы для назального введения составляют от приблизительно 10-1000 до приблизительно 1200-12000 мкг в сутки, для трансбуккального введения от приблизительно 10-1000 до приблизительно 1200-12000 мкг в сутки и для подъязычного введения от приблизительно 10-1000 до приблизительно 1200-8000 мкг в сутки. Подъязычные дозы предпочтительно являются более низкими, чем трансбуккальные дозы. Вводимые дозы для агонистов эксендинов, имеющих активность, меньшую или большую относительно эксендина-4, увеличиваются или уменьшаются по необходимости в сравнении с описанными выше или где-либо в другом месте данного описания.
Клинические исследования
Как описано в примере 10 ниже, проводили двояко-слепое, плацебо-контролируемое исследование с единственной увеличивающейся дозой, для испытания безопасности, переносимости и фармакокинетики подкожно вводимого эксендина-4 на здоровых добровольцах. Пять единственных подкожных доз эксендина-4 (0,01, 0,05, 0,1, 0,2 или 0,3 мкг/кг) исследовали на 40 здоровых добровольцах-мужчинах в состоянии намеренного голодания. Максимальные плазменные концентрации эксендина-4 достигались между одним и двумя часами после введения дозы с малым различием среди испытанных доз. Анализ этих данных показал зависимое от дозы увеличение Смакc. Не было серьезных неблагоприятных побочных явлений, сообщенных в этом исследовании.
Здоровыми добровольцами-мужчинами, которые участвовали в этом исследовании, эксендин-4 хорошо переносился при подкожных дозах до 0,1 мкг/кг и включая 0,1 мкг/кг. Снижение плазменной концентрации глюкозы также наблюдали при этой дозе. При дозах 0,2 мкг/кг и более высоких наиболее обычно наблюдаемыми побочными явлениями были головная боль, тошнота, рвота, головокружение и постуральная (обусловленная положением тела) гипотензия. Наблюдали преходящее падение плазменной концентрации глюкозы после введения доз 0,05 мкг/кг и выше.
Пример 12 ниже описывает дополнительное исследование зависимости доза-ответ для понижающего глюкозу эффекта эксендина-4 при дозах менее 0,1 мкг/кг. Четырнадцать субъектов [средний возраст (±SE) 55±2; среднее BMI (30,2±1,6 кг/м2) ] с диабетом типа 2, получавших диету ± пероральные гипогликемические агенты, исследовали после отмены пероральных агентов в течение 10-14 дней. Оценки делали после рандомизированной подкожной инъекции плацебо, 0, 01, 0,02, 0,05 и 0,1 мкг/кг эксендина-4 в отдельные дни после голодания в течение ночи. Инъекции производили непосредственно перед приемом внутрь стандартизованной пищи Sustacal® (7 ккал/кг) после сбора проб плазменной глюкозы при частых интервалах во время последующих 300 мин.
Гликемическую реакцию определяли количественно в виде взвешенного по времени среднего (±SE) изменения концентрации глюкозы в плазме во время 5-часового периода. Реакция находилась в диапазоне от приращения +42,0±7,9 мг/дл выше концентрации глюкозы во время голодания для плацебо по сравнению с убыванием 30,5±8,6 мг/дл ниже концентрации глюкозы во время голодания с помощью 0,1 мкг/кг эксендина-4.
ED50 для этого понижающего глюкозу эффекта была 0,038 мкг/кг. Дозы эксендина-4 ниже 0,1 мкг/кг, по-видимому, отделяют понижающие глюкозу эффекты от побочных желудочно-кишечных эффектов. Пример 12 показывает, что эксендин-4 не только хорошо переносился при дозах менее 0,1 мкг/кг, но что эти дозы значительно снижали концентрации глюкозы в плазме, возникающие после приема пищи (ED50 0,038 мкг/кг) у людей с диабетом типа 2.
Альтернативные способы доставки
Возможность применения других способов доставки для эксендина-4 исследовали путем измерения эксендина-4 в кровотоке в сочетании с наблюдением биологического ответа, такого как снижение глюкозы в плазме животных с диабетом, после введения. Исследовали прохождение эксендина-4 через несколько поверхностей, дыхательные пути (назальный, трахеальный и легочный способы) и кишечник (подъязычный, посредством желудочного зонда и интрадуоденальный способы). Биологический эффект и появление эксендина-4 в крови наблюдали при каждом способе введения через дыхательные пути и с подъязычным и доставляемым через желудочный зонд пептидом через желудочно-кишечный тракт.
Внутритрахеальное введение - Как описано здесь, внутритрахеальное введение эксендина-4 голодавшим крысам (20 мкг/50 мкл/животное) давало повышение средней концентрации эксендина-4 в плазме до 2060±960 пг/мл в пределах 5-10 минут после введения. Повышенные концентрации эксендина-4 в плазме сохранялись в течение по меньшей мере 1 часа после инстилляции (см. фиг.4). У мышей с диабетом db/db внутритрахеальная инстилляция эксендина-4 (1 мкг/животное) снижала концентрацию глюкозы в плазме на 30%, в то время как концентрация плазменной глюкозы контрольной группы с носителем увеличивалась на 41% через 1,5 ч после введения. У этих животных средняя концентрация эксендина-4 в плазме была 777±365 пг/мл через 4,5 часа после введения (см. фиг.5а и 5b).
У мышей с диабетом ob/ob внутритрахеальная инстилляция эксендина-4 (1 мкг/животное) приводила к снижению концентрации глюкозы в плазме до 43% уровня, имеющегося перед обработкой, после 4 часов, в то время как концентрация глюкозы у контрольной группы с носителем не изменялась (см. фиг.6а и 6b).
Девять голодавших в течение ночи самцов мышей Sprague-Dawley (возраст 96-115 дней, вес 365-395, среднее 385 г) анестезировали галотаном, выполняли трахеотомию и мышей катетеризовали через бедренную артерию. При t=0 мин 30 мкл солевого раствора, в котором растворяли 2,1 мкг (n=3), 21 мкг (n=3) или 210 мкг эксендина-4, инстиллировали в трахею на расстоянии от уровня интубации. Пробы крови брали спустя 5, 10, 20, 30, 60, 90, 120, 150, 180, 240, 300 и 360 мин, центрифугировали и плазму хранили при -20°С для последующего иммунорадиометрического (IRMA) анализа на N-концевой и С-концевой эпитопы интактной молекулы эксендина-4. После внутритрахеального введения наблюдали 61-74% пика концентрации в плазме в пределах 5 мин. Тмаксимело место между 20 и 30 мин после введения. AUC и Смакc были пропорциональны дозе. При дозе 2,1 мкг (1,5 нмоль/кг), приводящей к концентрациям в плазме примерно 50 пМ (где наблюдали эффекты по понижению глюкозы у людей), биодоступность была 7,3%. Коэффициент вариации был 44%. При более высоких дозах, биодоступность была несколько более низкой, a CV была более высокой (см. фиг.7а и 7b). При трахеальном пути введения t1/2 (определенное практически как время падения в плазме ниже 50% Смакc) было 30-60 мин для самой низкой дозы и 60-90 мин для 2 более высоких доз. В целом, биологически эффективные количества эксендина-4 быстро абсорбировались через трахею без индукции видимого респираторного дистресса. Дыхательные пути являются хорошим путем введения эксендина-4.
Легочное введение - Увеличенные плазменные концентрации эксендина-4 детектировали у крыс, экспонированных аэрозольному эксендину-4. Экспонирование крыс приблизительно 8 нг аэрозольного эксендина-4 на мл атмосферы в течение 10 минут приводило к максимальным концентрациям эксендина-4 в плазме 300-1900 пг/мл спустя 5 минут после обработки (см. фиг.8). Подобное экспонирование мышей с диабетом db/db аэрозольному эксендину-4 приводит к 33% уменьшению плазменных концентраций глюкозы спустя 1 час, когда детектировали среднюю концентрацию плазменного эксендина-4 170±67 пг/мл. Мыши с диабетом db/db контрольной группы, экспонированные аэрозольному солевому раствору, не обнаружили изменения в глюкозе плазмы (см. фиг.9а и 9b).
Назальное введение - Введение эксендина-4 в полость носа крыс приводило к повышению концентрациий в плазме. Максимальные величины 300 пг/мл и 6757 пг/мл детектировали спустя 10 минут после введения 1 мкг и 100 мкг эксендина-4 (растворенного в 2 мкл солевого раствора), соответственно (см. фиг.10).
Введение через кишечник - Самцы мышей db/db (вес тела приблизительно 50 г) голодали в течение 2 ч и до и после внутрижелудочного введения солевого раствора или эксендина-4 (эксендин-4). 9%-ное уменьшение концентрации глюкозы в плазме наблюдали с 1 мкг/200 мкл/животное и 15%-ное уменьшение наблюдали с 3 мкг/200 мкл/животное в сравнении с 10%-ным увеличением глюкозы в плазме в контролях спустя один час после обработки (см. фиг.11).
Подъязычное введение - Подъязычное введение эксендина-4 (100 мкг/5 мкл/животное) мышам с диабетом db/db приводило к 15%-ному уменьшению концентрации глюкозы в плазме спустя один час после обработки. 30%-ное увеличение наблюдали для контрольной группы, получавшей солевой раствор. Средний уровень эксендина-4 в плазме при 60 минутах был 4520±1846 пг/мл (см. фиг.12а, 12b и 12с).
Восемь крыс Sprague-Dawley (-300 г) кратковременно анестезировали метофаном, пипетируя раствор, содержащий 10 мкг/3 мкл (n=4) или 100 мкг/3 мкл (n=4), под язык. Пробы крови собирали впоследствии из местно анестезированного хвоста и анализировали на эксендин-4 при помощи IRMA. Концентрации в плазме начинали повышаться к 3 минуте после введения и были максимальными спустя 10 и 30 мин после введения (дозы 10 и 100 мкг, соответственно). Концентрация эксендина-4 в плазме впоследствии оставалась выше нижнего предела количественного определения (LLOQ) после 5 часов. Площадь под кривой (area-under-the-curve (AUC)) к концу каждого эксперимента рассчитывали по трапезоидальному способу. Были получены два числа, одно, полученное из общей иммунореактивности, другое, полученное из приращения выше ненулевой величины, имеющейся при t=0. Эти величины сравнивали с историческими данными, полученными при использовании внутривенного болюса для той же самой модели животного, для получения, соответственно, высокой и низкой оценок биодоступности. Для дозы 10 мкг подъязычная биодоступность была 3,1-9,6%, а для дозы 100 мкг биодоступность была более низкой на уровне 1,3-1,5%. Вариабельность AUC была наибольшей в первый час после введения (CV 74% и 128% для доз 10 и 100 мкг). Для 5-часового интеграла коэффициент вариации AUC был 20 и 64% соответственно. Максимальная концентрация в плазме (Смакc) достигалась так же быстро после подъязычного введения, как и после подкожного введения (Тмакс примерно 30 мин). Смакcпосле подъязычного введения 10 мкг эксендина-4 составляла 1,5% концентрации после внутривенного болюса, но 14,5% концентрации, полученной после подкожного болюса. Смакc после подъязычного введения 100 мкг эксендина-4 была только 0,29% концентрации, наблюдаемой после внутривенного болюса, и 6,1% концентрации, полученной в результате подкожного пути введения (см. фиг.12d и 12е). Таким образом, эксендин-4 может быть доставлен при биоэффективных дозах через сублигвальный путь. Биодоступность и Смакc были наивысшими, Тмакс было самым коротким и вариабельность доступности была наименьшей с самой низкой подъязычной дозой. Самая низкая подъязычная доза приводила к концентрациям в плазме, сходным с концентрациями, которые, как предсказывается, должны быть эффективными в снижении глюкозы у людей (примерно 50-100 пМ).
Для лучшего понимания данного изобретения включены нижеследующие примеры, которые описывают результаты серии экспериментов. Эксперименты, относящиеся к данному изобретению, конечно, не должны рассматриваться как специально ограничивающие данное изобретение, и такие вариации данного изобретения, разработанные теперь или позднее, которые были бы в компетенции специалиста в данной области, находятся в рамках данного изобретения, описанного здесь и в формуле изобретения.
ПРИМЕР 1 - ПОЛУЧЕНИЕ ЭКСЕНДИНА-3
His Ser Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gin Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2 [SEQ ID NO:1]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамиднор-лейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.). В общем, циклы отдельных связывании использовали в ходе синтеза и использовали Fast Моc способ (HBTU-активации). Удаление защитных групп (удаление Fmoc-групп) растущей пептидной цепи проводили с использованием пиперидина. Конечное удаление защитных групп комплекса завершенный пептид-смола достигалось с использованием смеси триэтилсилана (0,2 мл), этандитиола (0,2 мл), анизола (0,2 мл), воды (0,2 мл) и трифторуксусной кислоты (15 мл) в соответствии со стандартными способами (Introduction to Cleavage Techniques, Applied Biosystems, Inc.). Пептид преципитировали в смеси эфир/вода (50 мл) и центрифугировали. Осадок реконституировали в ледяной уксусной кислоте и лиофилизировали. Лиофилизированный пептид растворяли в воде). Чистота без очистки была около 75%.
На стадиях очистки и анализа примеров 1 и 2 использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN).
Раствор, содержащий пептид, наносили на препаративную колонку С-18 и очищали (10-40% растворителя В в растворителе А на протяжении 40 минут). Чистоту фракций определяли изократически с использованием аналитической колонки С-18. Чистые фракции объединяли с получением идентифицированного выше пептида. Аналитическая ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 19,2 минуты.
ПРИМЕР 2 - ПОЛУЧЕНИЕ ЭКСЕНДИНА-4
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2 [SEQ ID NO:2]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамиднор-лейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с эксендином-3, как описано в примере 1. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 36-46% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 14,9 минуты. Электрораспылительная масс-спектрометрия (М): рассчитано 4186,6; найдено 8186, 0-4186,8 (четыре партии).
ПРИМЕР 3 - ЭКСЕНДИН-4 ЯВЛЯЕТСЯ ЦИРКУЛИРУЮЩИМ, СВЯЗАННЫМ С ПРИЕМОМ ПИЩИ ПЕПТИДОМ У ГИЛЬСКОГО ЯДОЗУБА
В этом эксперименте исследовали, играет ли эксендин-4 метаболическую роль в самой ящерице Гильский ядозуб. Для исследования, появляется ли эксендин-4 в крови Гильского ядозуба в ответ на кормление, брали пробы крови из одного животного, голодавшего в течение 7 недель, до и спустя 30 минут после съедания небольшой крысы. Плазму анализировали на полноразмерный эксендин-4 с помощью иммунорадио-метрического анализа с использованием пар моноклональных антител, направленных на эпитопы на N— и С-концах эксендина-4. Концентрация эксендина-4 в плазме при голодании была 76 пг/мл, около нижнего предела количественного определения. После приема пищи эта величина возрастала в 300 раз до 23120 пг/мл.
Во втором эксперименте последовательные пробы брали от двух животных, голодавших пять недель до и после съедания одной или двух небольших крыс (47-49 г). Концентрация эксендина-4 в плазме возрастала в 23-36 раз (до 4860, 8340 пг/мл) сразу же после приема пищи, что согласовалось с прямым прохождением эксендина-4 из слюнных желез в кровь. После съедания второй крысы (t=30 мин) концентрация эксендина-4 в плазме одного Гильского ядозуба возрастала до 27209 пг/мл. Концентрация эксендина-4 в плазме уменьшалась с t1/2 5,00 и 5,33 ч соответственно. Можно сделать вывод, что эксендин-4, который, как известно, происходит из слюнных желез Гильского ядозуба, появляется в высокой концентрации в крови немедленно после приема пищи. Это может означать связанный с приемом пищи сигнал для ингибирования дополнительного приема пищи и стимуляции депонирования питательного вещества.
ПРИМЕР 4 - ЭКСЕНДИН-4 УМЕНЬШАЕТ СЕКРЕЦИЮ ГЛЮКАГОНА ВО ВРЕМЯ ГИПЕРГЛИКЕМИЧЕСКОЙ "ФИКСАЦИИ" У КРЫС С ОЖИРЕНИЕМ И САХАРНЫМ ДИАБЕТОМ
Абсолютная или относительная гиперглюкагонемия часто является признаком сахарного диабета типа I и типа II, и супрессия избыточной секреции глюкагона потенциально может принести пользу в лечении с использованием глюкагоно-статических агентов. В данном примере, исследовали действие эксендина-4 на секрецию глюкагона у самцов анестезированных крыс с сахарным диабетом и ожирением (ZDF-крыс). С использованием протокола фиксации гиперинсулинемии и гипергликемии факторы, использующие тенденцию влиять на секрецию глюкагона, поддерживали постоянными. Глюкозу плазмы "фиксировали" на уровне примерно 34 мМ за 60 мин перед началом внутривенных вливаний солевого раствора (n=7) или эксендина-4 (0,21 мкг + 2,1 мкг/мл/ч; n=7). Концентрация плазменного глюкагона, измеренная перед этими вливаниями, была сходной в обеих группах (306±30 пМ против 252±32 пМ соответственно; различие недостоверно).
Средняя концентрация глюкагона в плазме у крыс, которым вводили эксендин-4, была равна почти половине концентрации у крыс, которым вводили солевой раствор, в последние 60 минут "фиксации" (165±18 пМ против 298±26 пМ соответственно; Р<0,002). Этот протокол гипергликемической "фиксации" позволил также измерить чувствительность к инсулину. Скорость вливания глюкозы во время "фиксации" увеличивалась на 111±7% у крыс, обработанных эксендином-4, по сравнению с контрольными крысами (Р<0,001). Другими словами, эксендин-4 проявлял глюкагоностатическое действие у ZDF-крыс во время исследований с гипергликемической "фиксаций", эффект, который будет иметь терапевтическую ценность в случае людей с диабетом.
ПРИМЕР 5 - ФАРМАКОКИНЕТИКА ЭКСЕНДИНА-4 У КРЫСЫ ПОСЛЕ ВНУТРИВЕННОГО, ПОДКОЖНОГО И ВНУТРИБРЮШИННОГО ВВЕДЕНИЯ
В этом примере описано исследование по определению плазменной фармакокинетики эксендина-4 у крыс (вес тела каждой крысы примерно 350 г) после i.v. болюса (быстрого внутривенного введения), s.c. и i.p. введения 2,1, 21, 210 мкг на крысу и i.v. инфузии 2,1, 21, 210 мкг/ч/крыса (3 ч). Последовательные пробы плазмы (примерно 120 мкл) анализировали с использованием получившего оценку иммунорадиометрического анализа (IRMA). Этот анализ сэндвич-типа использует мышиные моноклональные антитела, которые реагируют с эксендином-4, но не реагируют с GLP-1 или тестируемыми метаболитами эксендина-4 или GLP-1. Нижний предел количественного определения был 15 пМ (63 пг/мл). Определенное t1/2 для эксендина-4 был 18-41 мин для i.v. болюса, 28-49 для непрерывного i.v. введения, 90-216 мин для з.с. и 125-174 мин для i.p. инъекции. Биодоступность была 65-76% для s.с. и i.p. инъекции. Клиренс, определенный из i.v. инфузии был 4-8 мл/мин. Величины Смакc и AUC (площади-под-кривой) были в каждом способе введения пропорциональны дозе. Объем распределения был 457-867 мл. Клиренс и биодоступность не были зависимыми от дозы. Смакc (или концентрация гомеостаза в плазме; Cgs) показана в таблице ниже.

ПРИМЕР 6 - СРАВНЕНИЕ ИНСУЛИНОТРОПНЫХ ДЕЙСТВИЙ ЭКСЕНДИНА-4 И ГЛЮКАГОН-ПОДОБНОГО ПЕПТИДА-1 (GLP-1) ВО ВРЕМЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ ГЛЮКОЗЫ КРЫСАМ
В этом эксперименте сравнивали инсулинотропные действия синтетического эксендина-4 и GLP-1 in vivo после внутривенного (i.v.) введения глюкозы крысам. Крыс Sprague-Dawley (примерно 400 г) анестезировали галотаном и канюлировали через бедренную артерию и подкожную вену лапки. После 90-минутного периода восстановления к норме солевой раствор или пептид (30 пмоль/кг/мин каждый) вводили i.v. (1 мл/ч в течение 2 часов; n=4-5 для каждой группы). Через тридцать минут после начала инфузии i.v. инъецировали D-глюкозу (5,7 ммоль/кг, 0,8 мл). У обработанных солевым раствором, обработанных эксендином-4 и обработанных GLP-1 крыс концентрации глюкозы в плазме были сходными перед инъекцией (9,3±0,3, 9,7±0,3, 10,3±0,4 мМ), увеличивались на сходные количества после инъекции глюкозы (21,7, 21, 3, 23,7 мМ) и приводили к сходному 60-минутному AUC глюкозы (987±39, 907±30, 1096±68 мМ·мин соответственно). Т.е. гликемический стимул был сходным в каждой группе обработки. Концентрация инсулина в плазме обработанных солевым раствором крыс увеличивалась в 3,3 раза после введения глюкозы (от 230±53 до максимума 765±188 пМ). При инфузии эксендина-4 увеличение плазменной концентрации инсулина было в 6,8 раз (363±60-2486±365 пМ). С GLP-1 увеличение плазменной концентрации инсулина было в 2,9 раз (391±27-1145±169 пМ), что сходно с концентрацией, полученной у обработанных солевым раствором крыс. 60-минутный AUC инсулина у обработанных солевым раствором крыс был 24±6 нМ·мин, увеличивался в 2,8 раз у обработанных эксендином-4 крыс (67±8 нМ·мин; Р<0,003 против солевого раствора; Р<0,02 против GLP-1) и на 20% у GLP-1-обработанных крыс (различие недостоверно против солевого раствора). Усиление стимулированного глюкозой высвобождения инсулина эксендином-4 испытывали также при скоростях инфузии 3 и 300 пмоль/кг/мин, и оно оказалось зависимым от дозы. Таким образом, эксендин-4 был более сильнодействующим и/или эффективным, чем GLP-1, в усилении стимулируемого глюкозой высвобождения инсулина у интактных крыс.
ПРИМЕР 7 - РАЗРАБОТКА И ВАЛИДИЗАЦИЯ ИММУНОРАДИОМЕТРИЧЕСКОГО АНАЛИЗА (IRMA) ДЛЯ КОЛИЧЕСТВЕННОГО ИЗМЕРЕНИЯ ЭКСЕНДИНА-4 В ПЛАЗМЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ОЦЕНОК ПРЕКЛИНИЧЕСКОЙ ТОКСИЧНОСТИ И КИНЕТИЧЕСКИХ ИСПЫТАНИЙ ФАЗЫ I
Был разработан чувствительный и специфический иммунорадиометрический анализ (IRMA) сэндвич-типа для количественного определения плазменной концентрации эксендина-4 с использованием синтетического эксендина-4 в качестве иммуногена. Одно полученное из мыши моноклональное антитело узнает С-концевой эпитоп на эксендине-4 (улавливающее антитело), но не реагирует перекрестно с GLP-1. Второе антитело (детекторное антитело, меченое125I) узнает N-концевой эпитоп эксендина-4 и GLP-1 и требует концевой гистидин для связывания. Таким образом, этот анализ в целом не детектирует GLP-1(7-36)NH2, GLP-1(7-36)СООН или эксендин(3-39). Оценка анализа на плазмах крысы, обезьяны, собаки, кролика и человека обнаружила коэффициенты корреляции между тестами и внутри тестов <20% и <10% соответственно, точность ±15% с низким, средним и высоким контролями-мишенями и нижний и верхний пределы количественного определения 62,8 и 2512 пг/мл соответственно. Пробы плазмы из оценок 28-дневной подкожной токсичности эксендина-4 у крыс и обезьян и клинического исследования фазы I на нормальных субъектах оценивали с использованием этого IRMA. Величины Смакc в исследованиях на животных показаны в таблице ниже. Пробы человека при подкожном введении 0,05, 0,1, 0,2 и 0,3 мкг/кг дали величины Смакc 90, 224, 370 и 587 пг/мл.
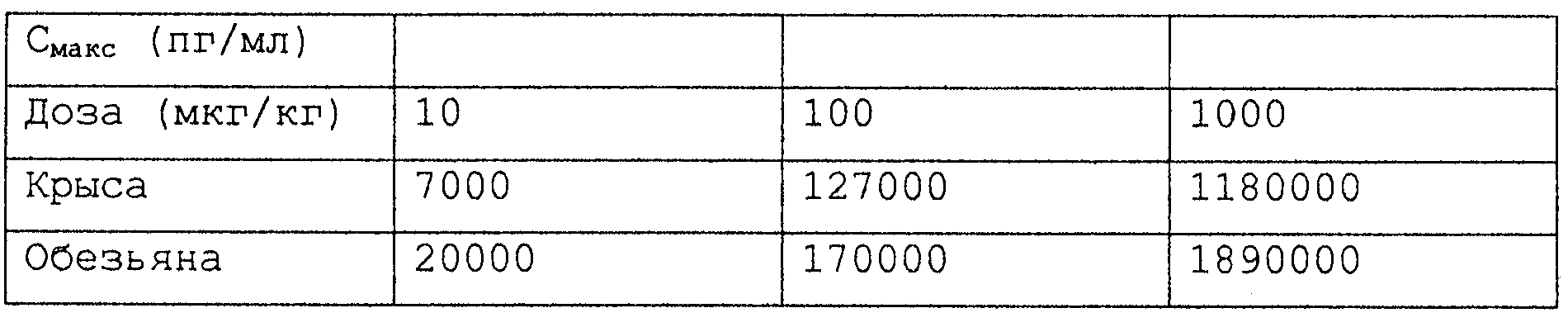
ПРИМЕР 8 - СРАВНЕНИЕ ЭФФЕКТОВ GLP-1 И ЭКСЕНДИНА-4 НА СВЯЗЫВАНИЕ/АКТИВАЦИЮ GLP-1-РЕЦЕПТОРА И СНИЖЕНИЮ ГЛЮКОЗЫ
Эксендин-4 синтезировали способами твердофазного синтеза пептидов и сравнивали с синтетическим GLP-1 в отношении связывания in vitro с рецепторами GLP-1 и активации рецепторов GLP-1 и in vivo в отношении снижения глюкозы в плазме мышей с диабетом db/db. В препарате плазматических мембран клеточной линии инсулиномы крысы (RINm5f), экспрессирующей GLP-1-рецептор, эти пептиды тестировали на их способность связываться и вытеснять радиоактивно меченый GLP-1 и на их способность стимулировать продуцирование цАМФ. Было обнаружено, что относительный порядок связывающей активности был GLP-1 > эксендин-4. Относительный порядок активации циклазы был GLP-1 = эксендин-4. Аффинности, как показано в таблице ниже, отличаются в диапазоне 4-5-кратного различия. В противоположность этому, активность по снижению глюкозы in vivo различается на протяжении диапазона 3430-кратных различий. Эксендин-4 был в 3430 раз более сильным, чем GLP-1. Активность эксендина-4 in vivo не совпадала с его активностью на GLP-1-рецепторе и, по-видимому, является кульминацией совокупности свойств.

ПРИМЕР 9 - СРАВНЕНИЕ ГЛИКЕМИЧЕСКИХ ПОКАЗАТЕЛЕЙ И ЧУВСТВИТЕЛЬНОСТИ К ИНСУЛИНУ В ПАРАХ ПОЛУЧАЮЩИХ ПИЩУ И ОБРАБОТАННЫХ ЭКСЕНДИНОМ-4 КРЫС С САХАРНЫМ ДИАБЕТОМ И ОЖИРЕНИЕМ
В этом примере исследовали, были ли благоприятные эффекты эксендина-4 у ZDF-крыс вторичными относительно изменений в приеме пищи. В этом примере сравниваются эффекты, полученные с эксендином-4, с эффектами, наблюдаемыми у обработанных солевым раствором соответствующих животных, которые потребляли то же самое количество пищи, которое было съедено ZDF-крысами, инъецируемыми подкожно дважды в день 10 мкг эксендина-4. Глюкозу и HbAlc в плазме измеряли один раз в неделю в течение 6 недель. Спустя один день после последней обработки животных анестезировали галотаном и подвергали гиперинсулинемической (50 мЕ/кг/мин) эугликемической (нормогликемической) "фиксации". Изменения в HbAlc на протяжении 6 недель различались между группами обработки (Р<0,001 ANOVA), увеличиваясь у получающих корм ad libitum (n=5) и у парных ZDF-крыс (n=5), получающих то же самое количество пищи, что и обработанные ZDF-крысы, и уменьшаясь у обработанных эксендином-4 крыс (n=5). Подобным образом, изменения глюкозы в плазме различались между группами обработки (Р<0,002 ANOVA), увеличиваясь у получающих корм ad libitum (n=5) и у парных ZDF-крыс, получающих то же самое количество пищи, что и обработанные ZDF-крысы, и уменьшаясь у обработанных эксендином-4 ZDF-крыс. В последний час 3-часового протокола фиксации скорость инфузии глюкозы у обработанных эксендином-4 крыс имела тенденцию быть более высокой, чем у парно вскармливаемых (+105%) и получающих пищу ad libitum (+20%) контролей, соответственно (10,14±1,43 n=5, 8,46±0,87 n=4, 4,93±2,02 мг/кг/мин n=3; различие недостоверно. Р=0,09 ANOVA). Другой показатель чувствительности к инсулину, концентрация лактата в плазме, отличался значительно между группами обработки (Р<0,02 ANOVA) и был самым низким у обработанных эксендином-4 крыс. Таким образом, обработка эксендином-4 связана с улучшением гликемических показателей и чувствительности к инсулину, что частично, но не полностью соответствует контролям, получающим то же самое количество пищи, что указывает на то, что улучшения в метаболической регуляции эксендином-4 у ZDF-крыс, по меньшей мере, частично обусловлены механизмами, выходящими за рамки ограничения калорий.
ПРИМЕР 10 - КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ И СТИМУЛЯЦИЯ СЕКРЕЦИИ ЭНДОГЕННОГО ИНСУЛИНА ПОДКОЖНО ВВОДИМЫМ СИНТЕТИЧЕСКИМ ЭКСЕНДИНОМ-4 У ЗДОРОВЫХ ГОЛОДАЮЩИХ В ТЕЧЕНИЕ НОЧИ ДОБРОВОЛЬЦЕВ
В двоякослепом, контролируемом плацебо клиническом испытании с единственной увеличивающейся дозой для испытания безопасности, переносимости и фармакокинетики синтетического эксендина-4, эксендин-4, приготовленный для подкожной инъекции, оценивали на здоровых добровольцах-мужчинах, определяя эффекты на концентрацию глюкозы и инсулина в плазме. Пять единственных подкожных доз эксендина-4 (0,01, 0, 05, 0,1, 0,2 или 0,3 мкг/кг) исследовали на 40 здоровых добровольцах-мужчинах в состоянии намеренного голодания. Максимальные плазменные концентрации эксендина-4 достигались между 1 и 2 часами после введения дозы с малым различием среди испытанных доз. Анализ этих данных показал зависимое от дозы увеличение Смакc. Не было серьезных неблагоприятных побочных явлений, сообщенных в этом исследовании, и здоровые добровольцы-мужчины, которые участвовали в этом исследовании, хорошо переносили эксендин-4 при подкожных дозах до и в том числе 0,1 мкг/кг. Снижение плазменной концентрации глюкозы также наблюдали при этой дозе. При дозах 0,2 мкг/кг и более высоких наиболее обычно наблюдаемыми неблагоприятными побочными явлениями были головная боль, тошнота, рвота, головокружение и постуральная (обусловленная положением тела) гипотензия. Наблюдали преходящее падение плазменной концентрации глюкозы после введения доз 0,05 мкг/кг и выше.
Сорок здоровых худых (средний BMI (±SE) 22,7±1,2) субъектов в возрасте 18-40 лет случайным образом делили на 5 групп. В каждой группе из 8 субъектов 6 получали эксендин-4, а 2 получали плацебо (РВО). Эксендин-4 (0,01, 0, 05, 0,1, 0,2 или 0,3 мкг/кг) или плацебо вводили после ночного голодания и концентрации эксендина-4, глюкозы и инсулина в плазме измеряли вместе с безопасностью и переносимостью. Не наблюдали проблем в отношении безопасности. Дозы ≤0,1 мкг/кг переносились так же хорошо, как плацебо, тогда как 0,2 и 0,3 мкг/кг индуцировали зависимое от дозы увеличение тошноты и рвоты. Максимальные концентрации плазменного эксендина-4 повышались зависимым от дозы образом и после 0,1 мкг/кг иммунореактивность эксендина-4 сохранялась в течение 360 мин. Глюкоза в плазме уменьшалась после всех доз, за исключением 0,01 мкг/кг, достигала самого низкого уровня к 30 минутам и возвращалась обратно к фону в пределах 180 мин. Субъекты, получавшие 0,3 мкг/кг, принимали калорийный напиток через 30 мин после введения дозы, что мешало сравнению их данных. Среднее изменение глюкозы плазмы (0-180 мин): 0,03±0,07, -0,07±0,08, -0,38±0,14, -0,85±0,13 и -0,83±0,23 ммоль/л для плацебо (РВО), 0, 01, 0,05, 0, 1 и 0,2 мкг/кг, соответственно; Р≤0,02 против РВО. Самая низкая зарегистрированная концентрация глюкозы в плазме была 3,4 ммоль/л. Соответствующие средние изменения инсулина в плазме (0-120 мин) были 0,43±0,59, 2,37±0,58, 2,28±0,66, 4,91±1,23 и 14,00±3,34 мкЕ/мл; Р≤0,01 против РВО для групп 0,1 и 0,2 мкг/кг. Таким образом, у здоровых, голодавших в течение ночи добровольцев подкожная инъекция эксендина-4 (1) не давала проблем в отношении безопасности, (2) хорошо переносилась при дозах ≤0,1 мкг/кг, (3) приводила к иммунореактивности эксендина-4 в плазме в течение до 6 часов, (4) увеличивала инсулин в плазме и снижала глюкозу в плазме зависимым от дозы образом без индукции гипогликемии.
ПРИМЕР 11 - ЭФФЕКТИВНОСТЬ АЛЬТЕРНАТИВНОЙ ДОСТАВКИ ЭКСЕНДИНА-4 У ГРЫЗУНОВ
В данном примере испытывали доставку эксендина-4 посредством альтернативы инъекции и исследовали его способность пересекать слизистые поверхности в достаточных количествах для проявления биологического эффекта. Изменения концентрации плазменной глюкозы и интактного синтетического эксендина-4 в плазме (измеренных при помощи 2-сайтного иммунорадиометрического анализа) наблюдали у мышей db/db, которым вводили солевой раствор, содержащий различные дозы синтетического эксендина-4, через трахею, через аэрозольный "туман" (легочный путь), через желудочный зонд (через рот) и под язык (сублингвально). Те же самые способы введения, а также интрадуоденальный и назальный, испытывали на крысах и рассчитывали биодоступность, например, для подъязычного и внутритрахеального способов. Эксендин-4, вводимый через каждый из вышеуказанных путей мышам, приводил к значимой снижающей глюкозу активности спустя 1-4 ч после введения (мыши db/db, внутритрахеально, Р<0,02; мыши ob/ob, внутритрахеально, Р<0,0002; мыши db/db, аэрозоль, Р<0,0001; желудочный зонд, Р<0,002; подъязычно, Р<0,02). Зависимые от дозы увеличения концентрации эксендина-4 в плазме были до 777±365 пг/мл (мыши db/db, внутритрахеально); 170±67 пг/мл (мыши db/db, аэрозоль); 4520±1846 пг/мл (мыши db/db, подъязычно). Подобным образом, у крыс концентрации эксендина-4 наблюдали до 68682±38661 пг/мл (внутритрахеально); 1900 пг/мл (легочным путем); 6757 пг/мл (назально); 3862±2844 пн/мл (подъязычно); но не было видимой абсорбции или биологической активности при интрадуоденальном введении. Биодоступность эксендина-4 в солевом растворе была примерно 7,3% при более низких дозах при доставке через трахею, где 61-74% Смакc наблюдали в пределах 5 мин. Кинетика после этого была сходной с кинетикой, наблюдаемой после подкожного введения. Биодоступность эксендина-4 в солевом растворе при подъязычной доставке была 3,1-9,6% при более низких дозах. Эти исследования подтверждают пригодность доставки эксендина-4 и его пептидных агонистов-аналогов в биологически эффективных количествах через удобные неинъекционные пути.
ПРИМЕР 12 - ОДНОСТОРОННЕ-СЛЕПОЕ, КОНТРОЛИРУЕМОЕ ПЛАЦЕБО ИССЛЕДОВАНИЕ ПО МЕТАБОЛИЧЕСКИМ ЭФФЕКТАМ ДИАПАЗОНА ДОЗ СИНТЕТИЧЕСКОГО ЭКСЕНДИНА-4, ПРЕДОСТАВЛЯЕМОГО ПОДКОЖНОЙ ИНЪЕКЦИЕЙ ЛЮДЯМ С САХАРНЫМ ДИАБЕТОМ ТИПА 2
В этом примере описаны результаты состоящего из двух частей, односторонне-слепого, контролируемого плацебо исследования для испытания метаболических эффектов диапазона доз синтетического эксендина-4, предоставляемого подкожным путем субъектам с сахарным диабетом типа II. Субъектами, участвующими в этом исследовании, были индивидуумы, диагностированные как имеющие диабет типа II, с диетой и/или пероральными гипогликемическими агентами (ОНА) и с концентрацией HbA1с ≥7,0%, но ≤12,0% при визите для скрининга (массового обследования с целью отбора для эксперимента).
Данное исследование начиналось с визита для скрининга, после которого субъектам, принимающим ОНА, было предписано прекращение приема этого лекарства и возвращение в клинику спустя приблизительно 14 дней, когда эффекты ОНА исчезали. Субъекты, участвующие в части 1 исследования, поступали в клинику на период времени после полудня перед первой дозой и начинали три или четыре входящих в схему лечения дня с предоставлением доз. Каждую дозу вводили с промежутком 24 часа от другой дозы.
После получения согласия и скрининга субъектам случайным образом предписывали прием синтетического эксендина-4 или плацебо. В первой части этого исследования шесть субъектов помещали в отделение для клинических исследований на стационарных пациентах на три-четыре для и определяли для 1 из 4 последовательностей лечения, при которых они должны были принимать каждую из следующих доз: плацебо или синтетический эксендин-4 при 0, 1 или 0,01, или, возможно, 0,001 мкг/кг. Дозы вводили подкожно после ночного голодания. Стандартизированную жидкую пищу предоставляли спустя 15 мин после инъекции исследуемого лекарственного средства. Таблица ниже иллюстрирует схему применения доз для части 1.

Во второй части этого исследования, приблизительно через три дня после завершения части 1, восемь субъектов также помещали в отделение для клинических исследованиях на стационарных пациентах на четыре дня. Эти субъекты были другими субъектами чем те, которые принимали участие в части 1. Процедуры исследования и схема событий во время части 2 совпадали с частью 1. Дозы определяли после анализа эффекта на глюкозу в части 1.
Поскольку не наблюдали значительного эффекта при 0,01 мкг/кг во время части 1, субъектам давали дозы в соответствии со схемой в части 2.

Субъекты, участвующие в части 2, начинали принимать дозы после рассмотрения данных из части 1 тем же самым образом. Все субъекты возвращались в клинику спустя 4-6 дней после их отпуска из стационарного отделения для повторной оценки безопасности.
Синтетический эксендин-4, использованный для этого исследования, был прозрачным бесцветным стерильным раствором для подкожной инъекции, приготовленным в натрий-ацетатном буфере (рН 4,5) и содержащим 4,3% маннита в качестве модификатора изоосмоляльности. Концентрация инъекционного раствора синтетического эксендина-4 была 0,1 мг/мл. Один мл раствора помещали во флаконы на 3 мл с резиновыми пробками. Раствор плацебо готовили из той же самой стерильной композиции, но без лекарственного средства, синтетического эксендина-4.
Результаты этого исследования показаны на фиг.16 и 17. Они показывают способность многочисленных различных доз эксендина-4 (0,02 мкг/кг, 0,05 мкг/кг и 0,1 мкг/кг) понижать глюкозу крови у людей с диабетом типа II.
ПРИМЕР 13
В этом примере описан эксперимент для определения зависимости доза-ответ для инсулин-сенсибилизирующих эффектов эксендина-4 и его агонистов у крыс с сахарным диабетом и ожирением. Эксендин-4, используемый в этих исследованиях, получали от Bachem (Torrance, CA; Cat H8730, Lot 506189), American Peptides (Sunnyvale, CA; Cat 301577, Lot K1005ITI) и методом твердофазного синтеза в своей лаборатории (lot AR1374-11; содержание пептида 93,3%). Тридцать девять самцов крыс с сахарным диабетом и ожирением (ZDF) /Gmi™-(fa/fa) (возраст 116±20 дней; вес 441±39 г) относили к 5 группам обработки: инъекции только солевого раствора (n=9), инъекции эксендина-4 0,1, 1, 10 или 100 мкг (n=9, 10, 6, 5 соответственно). Из них 35 крыс использовали в исследованиях с гиперинсулинемической эугликемической фиксацией (n=9, 7, 9, 5, 5 соответственно). Брали пробы крови из кончика местно анестезированного хвоста (марка Hurricaine 20% раствора бензокаина для местной анестезии, Beutlich, Waukegan, IL) находящихся в сознании голодавших в течение ночи крыс перед обработкой и с недельными интервалами в течение 5 недель во время обработки для анализа гемоглобина А1c (ингибирование DCA2000 латекс-иммуноагглютинации, Bayer Diagnostics, Tarrytown, NY). Вес тела измеряли один раз в день.
После 6 недель обработки, приблизительно через 16 часов после последней дозы эксендина-4 (или солевого раствора) и после голодания в течение ночи, проводили гиперинсулинемические эугликемические "фиксации" (DeFronzo RA, Tobin JD, Andres R: Glucose clamp technique: a method for quantifying insulin secretion and resistance. Amer.J.Physiol 237:E214-23, 1979) на анестезированных галотаном крысах. Крыс терморегулировали, трахеотомировали и катетеризировали через подкожную вену лапки для инфузии 20% D-глюкозы и инсулина и через бедренную артерию для взятия проб крови и измерения кровяного давления (P23XL-преобразователь, Spectramed, Oxnard, CA; универсальный усилитель, Gould, Valley View, ОН; A/D (аналого-цифровое преобразование), DataTranslation, Wilmington, DE). Инсулин (Humulin-R, Eli Lilly, Indianapolis, IN) вливали при 50 мЕ/кг/мин, начиная при t=-30 мин и продолжая до t=+180 мин. Глюкозу вливали при меняющейся скорости для поддержания эугликемии (нормогликемии), определяемой взятием проб на глюкозу и анализом с 5-минутными интервалами (способ с иммобилизованной глюкозооксидазой; YSI 2300-Stat Analyzer, Yellow Springs, ОН). Средняя плазменная глюкоза во время "фиксаций" была 103,9 мг/дл (средний коэффициент вариации был 5,8%). Для анализа брались данные по скорости вливания глюкозы при t=60-180 мин, когда ответные реакции приближались к стационарному состоянию (гомеостазу). Данные по лактату плазмы, полученные от детектора с иммобилизованной лактатоксидазой, включенной в анализатор глюкозы, также собирали.
Инъекции выполняли внутрибрюшинно приблизительно в 8 часов утра и 4 часа после полудня, в понедельник -пятницу, и приблизительно в 10 часов утра в субботу и воскресенье.
Парные статистические анализы выполняли с использованием установившейся практики с использованием t-критерия Стьюдента (Instat v3.0, GraphPad Software, San Diego, CA) с использованием Р<0,05 в качестве уровня значимости. Для анализа доза-ответ использовали 4-параметрическую логистическую регрессию и общие эффекты определяли с использованием однофакторного дисперсионного анализа (ANOVA) (Prism v3.0, GraphPad. Software, San Diego, CA).
Результаты показали, что у крыс с сахарным диабетом и ожирением (ZDF-крысах), обрабатываемых различными дозами эксендина-4 в течение 6-недель, имело место зависимое от дозы уменьшение потребления пищи (ED50 0,14 мкг ± 0, 15 log; см. фиг.13а) и веса тела (ED50 0,42 мкг ±0,15 log; см. фиг.13b) до 27±2 г, что составляет 5,6±0,5% уменьшение веса тела относительно инъецируемых солевым раствором контролей.
В этой группе крыс течение диабета, по-видимому, было прогрессирующим, так как гемоглобин A1c первоначально повышался во всех группах. По-видимому, инъекция эксендина-4 тем не менее зависимым от дозы образом останавливает и реверсирует увеличение гемоглобина A1c (см. фиг.13с). Зависимость доза эксендина-4-ответ для действия на гемоглобин A1c, измеренная во время последних 2 недель обработки, была обычно значимой (Р=0,05 ANOVA) и конкретно при дозах 1 мкг и 100 мкг (Р<0,005, Р<0,02 соответственно). Сходную картину наблюдали в отношении триглицеридов плазмы при голодании в последние 2 недели обработки, где концентрации в плазме были значимо уменьшенными при всех дозах на 51-65% (Р<0,002 ANOVA).
Тридцать пять из 39 крыс, входивших в это исследование, развивали состояние гиперинсулинемической, эугликемической "фиксации" приблизительно через 16 часов после их последней обработки. Исходные концентрации глюкозы в плазме при голодании, более высокие у обрабатываемых солевым раствором (489±28 мг/дл), чем у обрабатываемых эксендином крыс, уменьшались вливанием инсулина и затем фиксировались при сходных концентрациях плазменной глюкозы (105,6 мг/дл при 60-180 мин; средний коэффициент вариации 4,6%, см. фиг.14а). Скорость инфузии глюкозы, требуемая для поддержания эугликемии, увеличивалась зависимым от дозы образом предварительной обработкой эксендином-4 (ED50 1,0 мкг ± 0,41 log; см. фиг.14b). Обработка эксендином-4 увеличивала скорость инфузии глюкозы на 48% относительно обработанных солевым раствором контролей.
Концентрация плазменного лактата до и во время процедуры "фиксации" уменьшалась зависимым от дозы образом предварительной обработкой эксендином-4 (ED50 4 мкг ± 0, 25 log; см. фиг.14с). Этот эффект, соответствующий 42%-ному уменьшению средней концентрации лактата в плазме между 60 и 180 минутами "фиксации", по-видимому, вызван первично уменьшением концентрации лактата перед фиксацией (т.е. концентрации фона); приращения в концентрации лактата в плазме во время гиперинсулинемии были сходными во всех группах обработки. Были не связанные с обработкой различия в среднем артериальном давлении, измеренные до и во время процедур "фиксации".
Приблизительно 50%-ное увеличение в чувствительности к инсулину, наблюдаемое после продолжительного введения эксендина-4, было важным и неожиданным в связи с наблюдениями, что эксендин-4 не обладает сильным действием в инсулин-чувствительных тканях in vitro (т.е. отсутствует действие на фоновое или стимулируемое инсулином включение радиоактивно меченой глюкозы в гликоген в выделенной камбаловидной мышце, или в липид в выделенных адипоцитах; Pittner et al., неопубликованные данные). Хотя нельзя исключить возможности того, что увеличение чувствительности к инсулину может быть результатом, в некоторой части, улучшенного гликемического контроля и уменьшенной токсичности глюкозы, сообщалось, что увеличение чувствительности к инсулину от различных антидиабетических терапий, в том числе терапий, не классифицированных как инсулин-сенсибилизирующие терапии, является очень вариабельным, и сообщалось, что сильная обработка при помощи GLP-1, по-видимому, не изменяет немедленно чувствительность к инсулину у человека (Orskov L, Holst JJ, Moller J, Orscov C, Moller N, Alberti KG, Schmitz O: GLP-1 does not acutely affect insulin sensitivity in healthy man. Diabetologia 39:1227-32, 1996; Ahren В, Larsson H, Holst JJ: Effects of glucagon-like peptide-1 on islet function and insulin sensitivity in noninsulin-dependent diabetes mellitus. J Clin Endocrinol Metab 82:473-8, 1997; UK Prospective Diabetes Study Group: Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 352:837-53, 1998). Таким образом, продолжительное введение эксендина-4, по-видимому, связано с увеличениями чувствительности к инсулину, которые являются такими же большими, если не больше, чем увеличения, наблюдаемые с использованием других терапий, в том числе инсулин-сенсибилизирующих лекарственных средств, таких как тиазолидиндионы и метформин.
ПРИМЕР 14
Получение амидированного пептида, имеющего SEQ ID NO:9
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.). В общем, циклы отдельных связывании использовали в ходе синтеза и использовали Fast Моc способ (HBTU-активации). Однако связывание в некоторых положениях было менее эффективным, чем ожидалось, и требовались двойные связывания. В частности, остатки Asp2, Тhr7 и Phe6 все требовали двойного связывания. Удаление защитных групп (удаление Fmoc-групп) растущей пептидной цепи с использованием пиперидина было всегда эффективным. Двойное удаление защитных групп требовалось в положениях Arg20, Val19 и Leu14. Конечное удаление защитных групп комплекса завершенных пептид-смола достигалось с использованием смеси триэтилсилана (0,2 мл), этандитиола (0,2 мл), анизола (0,2 мл), воды (0,2 мл) и трифторуксусной кислоты (15 мл) в соответствии со стандартными способами (Introduction to Cleavage Techniques, Applied Biosystems, Inc.). Пептид преципитировали в смеси эфир/вода (50 мл) и центрифугировали. Осадок реконституировали в ледяной уксусной кислоте и лиофилизировали. Лиофилизированный пептид растворяли в воде). Чистота без очистки была около 55%.
На стадиях очистки и анализа использовали растворитель А (0, 1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN).
Раствор, содержащий пептид, наносили на препаративную колонку С-18 и очищали (10-40% растворителя В в растворителе А на протяжении 40 минут). Чистоту фракций определяли изократически с использованием аналитической колонки С-18. Чистые фракции объединяли с получением идентифицированного выше пептида. Аналитическая ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 14,5 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 4131,7; найдено 4129,3.
ПРИМЕР 15
Получение пептида, имеющего SEQ ID NO:10 Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-MBHA (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическая ОФ-ВЭЖХ (градиент 25-75% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 21,5 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 4168,6; найдено 4171,2.
ПРИМЕР 16
Получение пептида, имеющего SEQ ID NO:11
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель,В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 17,9 мин. Электро-распылительная масс-спектрометрия (М): рассчитано 4147,6; найдено 4150,2.
ПРИМЕР 17
Получение пептида, имеющего SEQ ID NO:12
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 35-65% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 19,7 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 4212,6; найдено 4213,2.
ПРИМЕР 18
Получение пептида, имеющего SEQ ID NO:13
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 30-50% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 16,3 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 4262,7; найдено 4262,4.
ПРИМЕР 19
Получение пептида, имеющего SEQ ID NO:14
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4172,6.
ПРИМЕР 20
Получение пептида, имеющего SEQ ID NO:15 Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-MBHA (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4224,7.
ПРИМЕР 21
Получение пептида, имеющего SEQ ID NO:16 Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4172,6.
ПРИМЕР 22
Получение пептида, имеющего SEQ ID NO:17
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4186,6.
ПРИМЕР 23
Получение пептида, имеющего SEQ ID NO:18 Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4200,7.
ПРИМЕР 24
Получение пептида, имеющего SEQ ID NO:19
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4200,7.
ПРИМЕР 25
Получение пептида, имеющего SEQ ID NO:20
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4202,7.
ПРИМЕР 26
Получение пептида, имеющего SEQ ID NO:21 Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4145,6.
ПРИМЕР 27
Получение пептида, имеющего SEQ ID NO:22
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-MBHA (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСЫ). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4184,6.
ПРИМЕР 28
Получение пептида, имеющего SEQ ID NO:23
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4145,6.
ПРИМЕР 29
Получение пептида, имеющего SEQ ID NO:24
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4224,7.
ПРИМЕР 30
Получение пептида, имеющего SEQ ID NO:25
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4172,6.
ПРИМЕР 31
Получение пептида, имеющего SEQ ID NO:26
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4115,5.
ПРИМЕР 32
Получение пептида, имеющего SEQ ID NO:27
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4188,6.
ПРИМЕР 33
Получение пептида, имеющего SEQ ID NO:28
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4131,6.
ПРИМЕР 34
Получение пептида, имеющего SEQ ID NO:29
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-MBHA (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4172,6.
ПРИМЕР 35
Получение пептида, имеющего SEQ ID NO:30
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4145,6.
ПРИМЕР 36
Получение пептида, имеющего SEQ ID NO:31
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. Дополнительные двойные связывания требовались в положениях тиопролина 38, 37, 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4266,8.
ПРИМЕР 37
Получение пептида, имеющего SEQ ID NO:32
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. Дополнительные двойные связывания требовались в положениях тиопролина 38, 37 и 36. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4246,8.
ПРИМЕР 38
Получение пептида, имеющего SEQ ID NO:33
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmос-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. Дополнительные двойные связывания требовались в положениях гомопролина 38, 37, 36 и 31. В анализе использовали растворитель А (0, 1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4250,8.
ПРИМЕР 39
Получение пептида, имеющего SEQ ID NO:34
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. Дополнительные двойные связывания требовались в положениях гомопролина 38, 37 и 36. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4234,8.
ПРИМЕР 40
Получение пептида, имеющего SEQ ID NO:35
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. Дополнительные двойные связывания требовались в положениях тиопролина 38, 37, 36 и 31. В анализе использовали растворитель А (0, 1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4209,8.
ПРИМЕР 41
Получение пептида, имеющего SEQ ID NO:36
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. Дополнительные двойные связывания требовались в положениях гомопролина 38, 37, 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4193,7.
ПРИМЕР 42
Получение пептида, имеющего SEQ ID NO:37
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. Дополнительные двойные связывания требовались в положениях N-метилаланина 38, 37, 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3858,2.
ПРИМЕР 43
Получение пептида, имеющего SEQ ID NO:38
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. Дополнительные двойные связывания требовались в положениях N-метилаланина 38, 37 и 36. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3940,3.
ПРИМЕР 44
Получение пептида, имеющего SEQ ID NO:39
Идентифицированный выше пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, освобождали от защитных групп и очищали сходным образом с примером 14. Дополнительные двойные связывания требовались в положениях М-метилаланина 38, 37, 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3801,1.
ПРИМЕР 45
Получение пептидов, содержащих карбоновую кислоту на С-конце, соответствующих приведенным выше последовательностям с С-концевой амидной группой
Указанные выше пептиды примеров 1-30 собирают на так называемой смоле Ванга (смоле на основе п-алкоксибензилового спирта (Bachem, 0,54 ммоль/г)) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляют от смолы, освобождают от защитных групп и очищают сходным образом с примером 14. В анализе используют растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводят затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия обеспечивает экспериментально определенную (М).
ПРИМЕР 46
Получение пептида, имеющего SEQ ID NO:7
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly-NH2 [SEQ ID NO:7]
Приведенный выше амидированный пептид собирали на смоле 4-(2’–4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.). В общем, циклы отдельных связывании использовали в ходе синтеза и использовали Fast Моc способ (HBTU-активации). Удаление защитных групп (удаление Fmoc-групп) растущей пептидной цепи проводили с использованием пиперидина. Конечное удаление защитных групп комплекса завершенный пептид-смола достигалось с использованием смеси три-этилсилана (0,2 мл), этандитиола (0,2 мл), анизола (0,2 мл), воды (0,2 мл) и трифторуксусной кислоты (15 мл) в соответствии со стандартными способами (Introduction to Cleavage Techniques, Applied Biosystems, Inc.). Пептид преципитировали в смеси эфир/вода (50 мл) и центрифугировали. Осадок реконституировали в ледяной уксусной кислоте и лиофилизировали. Лиофилизированный пептид растворяли в воде). Чистота без очистки была около 75%.
На стадиях очистки и анализа использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Раствор, содержащий пептид, наносили на препаративную колонку С-18 и очищали (10-40% растворителя В в растворителе А на протяжении 40 минут). Чистоту фракций определяли изократически с использованием аналитической колонки С-18. Чистые фракции объединяли с получением идентифицированного выше пептида. Аналитическая ОФ-ВЭЖХ (градиент 30-50% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 18,9 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3408,0; найдено 3408,9.
ПРИМЕР 47
Получение пептида, имеющего SEQ ID NO:40
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:40]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 30-40% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 17,9 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3294,7; найдено 3294,8.
ПРИМЕР 48
Получение пептида, имеющего SEQ ID NO:41
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:41]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 29-36% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 20,7 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3237,6; найдено 3240.
ПРИМЕР 49
Получение пептида, имеющего SEQ ID NO:42
His Ala Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:42]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовалирастворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 36-46% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 15,2 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3251,6; найдено 3251,5.
ПРИМЕР 50
Получение пептида, имеющего SEQ ID NO:43
His Gly Glu Gly Ala Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:43]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 36-46% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 13,1 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3207,6; найдено 3208,3.
ПРИМЕР 51
Получение пептида, имеющего SEQ ID NO:44
His Gly Glu Gly Thr Ala Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:44]
Приведенный выше амидированный пептид собирали на смоле 4-(2'-4'-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 35-45% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 12,8 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3161,5; найдено 3163.
ПРИМЕР 52
Получение пептида, имеющего SEQ ID NO:45
His Gly Glu Gly Thr Phe Thr Ala Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:45]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 36-46% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 15,2 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3221,6; найдено 3222,7.
ПРИМЕР 53
Получение пептида, имеющего SEQ ID NO:46
His Gly Glu Gly Thr Phe Thr Ser Asp Ala Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:46]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 34-44% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 14,3 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3195,5; найдено 3199,4.
ПРИМЕР 54
Получение пептида, имеющего SEQ ID NO:47
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ala Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe lie Glu Phe Leu Lys Asn-NH2[SEQ ID NO:47]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 38-48% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 15,7 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3221,6; найдено 3221,6.
ПРИМЕР 55
Получение пептида, имеющего SEQ ID NO:48
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Ala Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:48]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 38-48% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 18,1 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3180,5; найдено 3180,9.
ПРИМЕР 56
Получение пептида, имеющего SEQ ID NO:49
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Ala Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:49]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 36%-46% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 17,0 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3180,6; найдено 3182,8.
ПРИМЕР 57
Получение пептида, имеющего SEQ ID NO:50
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Ala Glu Glu Glu Ala Val Arg Leu Phe lie Glu Phe Leu Lys Asn-NH2[SEQ ID NO:50]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил) -Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 32-42% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 14,9 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3195,5; найдено 3195,9.
ПРИМЕР 58
Получение пептида, имеющего SEQ ID NO:51
His Gly Glu Giy Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Ala Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:51]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 37-47% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 17,9 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3179,6; найдено 3179,0.
ПРИМЕР 59
Получение пептида, имеющего SEQ ID NO:52
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Ala Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:52]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 37-47% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 14,3 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3179,6; найдено 3180,0.
ПРИМЕР 60
Получение пептида, имеющего SEQ ID NO:53
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Ala Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:53]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 37-47% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 13,7 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3179,6; найдено 3179,0.
ПРИМЕР 61
Получение пептида, имеющего SEQ ID NO:54
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Ala Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:54]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 35-45% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 14,0, мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3209,6; найдено 3212,8.
ПРИМЕР 62
Получение пептида, имеющего SEQ ID NO:55
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Ala Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:55]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 38-48% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 14,3 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3152,5; найдено 3153,5.
ПРИМЕР 63
Получение пептида, имеющего SEQ ID NO:56
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Ala Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:56]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 35-45% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 12,1 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3195,5; найдено 3197,7.
ПРИМЕР 64
Получение пептида, имеющего SEQ ID NO:57
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Ala Phe Leu Lys Asn-NH2[SEQ ID NO:57]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 38-48% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 10,9 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3179,6; найдено 3180,5.
ПРИМЕР 65
Получение пептида, имеющего SEQ ID NO:58
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Ala Leu Lys Аsn-NН2[SEQ ID NO:58]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 32-42% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 17,5 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3161,5; найдено 3163,0.
ПРИМЕР 66
Получение пептида, имеющего SEQ ID NO:59
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Ala Lys Asn-NH2[SEQ ID NO:59]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 32-42% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 19,5 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3195,5; найдено 3199.
ПРИМЕР 67
Получение пептида, имеющего SEQ ID NO:60
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Ala Asn-NH2[SEQ ID NO:60]
Идентифицированный выше амидированный пептид собирали на смоле 4-[2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическая ОФ-ВЭЖХ (градиент 38-48% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 14,5 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3180,5; найдено 3183,7.
ПРИМЕР 68
Получение пептида, имеющего SEQ ID NO:61
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Ala-NH2[SEQ ID NO:61]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 34-44% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 22,8 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3194,6; найдено 3197,6.
ПРИМЕР 69
Получение пептида, имеющего SEQ ID NO:62
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro-NH2 [SEQ ID NO:62]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4099,6.
ПРИМЕР 70
Получение пептида, имеющего SEQ ID NO:63
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro-NH2 [SEQ ID NO:63]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4042,5.
ПРИМЕР 71
Получение пептида, имеющего SEQ ID NO:64
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro-NH2 [SEQ ID NO:64]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4002,4.
ПРИМЕР 72
Получение пептида, имеющего SEQ ID NO:65
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro-NH2 [SEQ ID NO:65]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3945,4.
ПРИМЕР 73
Получение пептида, имеющего SEQ ID NO:66
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro-NH2 [SEQ ID NO:66]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3905,3.
ПРИМЕР 74
Получение пептида, имеющего SEQ ID NO:67
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro-NH2 [SEQ ID NO:67]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3848,2.
ПРИМЕР 75
Получение пептида, имеющего SEQ ID NO:68
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala-NH2 [SEQ ID NO:68]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3808,2.
ПРИМЕР 76
Получение пептида, имеющего SEQ ID NO:69
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala-NH2 [SEQ ID NO:69]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3751,1.
ПРИМЕР 77
Получение пептида, имеющего SEQ ID NO:70
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly-NH2 [SEQ ID NO:70]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3737,1.
ПРИМЕР 78
Получение пептида, имеющего SEQ ID NO:71
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly-NH2 [SEQ ID NO:71]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3680,1.
ПРИМЕР 79
Получение пептида, имеющего SEQ ID NO:72
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser-NH2 [SEQ ID NO:72]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3680,1.
ПРИМЕР 80
Получение пептида, имеющего SEQ ID NO:73
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser-NH2 [SEQ ID NO:73]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3623,0.
ПРИМЕР 81
Получение пептида, имеющего SEQ ID NO:74
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser-NH2 [SEQ ID NO:74]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3593,0.
ПРИМЕР 82
Получение пептида, имеющего SEQ ID NO:75
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser-NH2 [SEQ ID NO:75]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3535,9.
ПРИМЕР 83
Получение пептида, имеющего SEQ ID NO:76
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro-NH2 [SEQ ID NO:76]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта - пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3505,94.
ПРИМЕР 84
Получение пептида, имеющего SEQ ID NO:77
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro-NH2 [SEQ ID NO:77]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3448,8.
ПРИМЕР 85
Получение пептида, имеющего SEQ ID NO:78
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly-NH2 [SEQ ID NO:78]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3351,7.
ПРИМЕР 86
Получение пептида, имеющего SEQ ID NO:79
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly-NH2[SEQ ID NO:79]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3351,8.
ПРИМЕР 87
Получение пептида, имеющего SEQ ID NO:80
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly-NH2[SEQ ID NO:80]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3294,7.
ПРИМЕР 88
Получение пептида, имеющего SEQ ID NO:81
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly tPro Ser Ser Gly Ala tPro tPro tPro-NH2 [SEQ ID NO:81]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. Двойные связывания требовались в положениях 37, 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4197,1.
ПРИМЕР 89
Получение пептида, имеющего SEQ ID NO:82
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala tPro tPro tPro-NH2 [SEQ ID NO:82]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. Двойные связывания требовались в положениях 37, 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4179,1.
ПРИМЕР 90
Получение пептида, имеющего SEQ ID NO:83
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly NMeala Ser Ser Gly Ala Pro Pro-NH2 [SEQ ID NO: 83]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3948,3.
ПРИМЕР 91
Получение пептида, имеющего SEQ ID NO:84
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly NMeala Ser Ser Gly Ala NMeala NMeala-NH2 [SEQ ID NO:84]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. Двойные связывания требовались в положениях 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3840,1.
ПРИМЕР 92
Получение пептида, имеющего SEQ ID NO:85
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly hPro Ser Ser Gly Ala hPro hPro-NH2 [SEQ ID NO:85]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. Двойные связывания требовались в положениях 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4050,1.
ПРИМЕР 93
Получение пептида, имеющего SEQ ID NO:86
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly hPro Ser Ser Gly Ala hPro-NH2 [SEQ ID NO:86]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. Двойное связывание требовалось в положении 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3937,1.
ПРИМЕР 94
Получение пептида, имеющего SEQ ID NO:87
Arg Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala-NH2 [SEQ ID NO:87]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3827,2.
ПРИМЕР 95
Получение пептида, имеющего SEQ ID NO:88
His Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly-NH2 [SEQ ID NO:88]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3394,8.
ПРИМЕР 96
Получение пептида, имеющего SEQ ID NO:89
His Gly Glu Gly Thr Naphtylala Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2 [SEQ ID NO:89]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3289,5.
ПРИМЕР 97
Получение пептида, имеющего SEQ ID NO:90
His Gly Glu Gly Thr Phe Ser Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:90]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группыv удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30, минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3280,7.
ПРИМЕР 98
Получение пептида, имеющего SEQ ID NO:91
His Gly Glu Gly Thr Phe Ser Thr Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:91]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3294,7.
ПРИМЕР 99
Получение пептида, имеющего SEQ ID NO:92
His Gly Glu Gly Thr Phe Thr Ser Glu Leu Ser Lys Gln Met Ala Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:92]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания подученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3250,7.
ПРИМЕР 100
Получение пептида, имеющего SEQ ID NO:93
His Gly Glu Gly Thr Phe Thr Ser Asp pentylgly Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2 [SEQ ID NO:93]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3253,5.
ПРИМЕР 101
Получение пептида, имеющего SEQ ID NO:94
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Naphtylala Ile Glu Phe Leu Lys Asn-NH2 [SEQ ID NO:94]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3289,5.
ПРИМЕР 102
Получение пептида, имеющего SEQ ID NO:95
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe tButylgly Glu Trp Leu Lys Asn-NH2[SEQ ID NO:95]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3183,4.
ПРИМЕР 103
Получение пептида, имеющего SEQ ID NO:96
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Asp Phe Leu Lys Asn-NH2[SEQ ID NO:96]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3237,6.
ПРИМЕР 104
Получение пептида, имеющего SEQ ID NO:97
His Gly Glu Gly Thr Phe Thr Ser Asp Ala Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser-NH2 [SEQ ID NO:97]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3637,9.
ПРИМЕР 105
Получение пептида, имеющего SEQ ID NO:98
His Gly Glu Gly Thr Phe Thr Ser Asp Ala Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly-NH2[SEQ ID NO:98]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3309,7.
ПРИМЕР 106
Получение пептида, имеющего SEQ ID NO:99
His Gly Glu Gly Thr Phe Thr Ser Asp Ala Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly hPro Ser Ser Gly Ala hPro hPro-NH2 [SEQ ID NO:99]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 46. Двойные связывания требовались в положениях 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3711,1.
ПРИМЕР 107
Получение пептидов, содержащих карбоновую кислоту на С-конце, соответствующих приведенным выше последовательностям с амидной группой на С-конце для SEQ ID NO:7, 40-61, 68-75, 78-80 и 87-98
Пептиды, имеющие последовательности SEQ ID NO:7, 40-61, 68-75, 78-80 и 87-98 собирают на так называемой смоле Ванга (смоле на основе п-алкоксибензилового спирта (Bachem, 0,54 ммоль/г)) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляют от смолы, защитные группы удаляют и пептид очищают сходным образом с примером 46. В анализе используют растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводят затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия обеспечивает экспериментально определенную (М).
ПРИМЕР 108
Получение пептидов, содержащих карбоновую кислоту на С-конце, соответствующих приведенным выше последовательностям с амидной группой на С-конце для SEQ ID NO:62-67, 76, 77, 81-86 и 99
Пептиды, имеющие последовательности SEQ ID NO:62-67, 76, 77, 81-86 и 99, собирают на 2-хлортритилхлоридной смоле (200-400 меш), 2% DVB (Novabiochem, 0,4-1,0 ммоль/г)) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляют от смолы, защитные группы удаляют и пептид очищают сходным образом с примером 46. В анализе используют растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводят затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия обеспечивает экспериментально определенную (М).
ПРИМЕР 109
Получение пептида, имеющего SEQ ID NO:100
Ala Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:100]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.). В общем, циклы отдельных связывании использовали в ходе синтеза и использовали Fast Моc способ (HBTU-активации). Удаление защитных групп (удаление Fmoc-групп) растущей пептидной, цепи проводили с использованием пиперидина. Конечное удаление защитных групп комплекса завершенный пептид-смола достигалось с использованием смеси триэтилсилана (0,2 мл), этандитиола (0,2 мл), анизола (0,2 мл), воды (0,2 мл) и трифторуксусной кислоты (15 мл) в соответствии со стандартными способами (Introduction to Cleavage Techniques, Applied Biosystems, Inc.). Пептид преципитировали в смеси эфир/вода (50 мл) и центрифугировали. Осадок реконституировали в ледяной уксусной кислоте и лиофилизировали. Лиофилизированный пептид растворяли в воде). Чистота без очистки была около 75%.
На стадиях очистки и анализа использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN).
Раствор, содержащий пептид, наносили на препаративную колонку С-18 и очищали (10-40% растворителя В в растворителе А на протяжении 40 минут). Чистоту фракций определяли изократически с использованием аналитической колонки С-18. Чистые фракции объединяли с получением идентифицированного выше пептида. Аналитическая ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 19,2 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3171,6; найдено 3172.
ПРИМЕР 110
Получение пептида, имеющего SEQ ID NO:101
His Gly Ala Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:101]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 36%-46% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 14,9 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3179,6; найдено 3180.
ПРИМЕР 111
Получение пептида, имеющего SEQ ID NO:102
His Gly Glu Ala Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:102]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 37-47% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 12,2 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3251,6; найдено 3263,3.
ПРИМЕР 112
Получение пептида, имеющего SEQ ID NO:103
His Gly Glu Gly Thr Phe Thr Ser Ala Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:103]
Приведенный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфеноксиацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 35-45% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида давала в качестве продукта пептид, имеющий наблюдаемое время удерживания 16,3 мин. Электрораспылительная масс-спектрометрия (М): рассчитано 3193,6; найдено 3197.
ПРИМЕР 113
Получение пептида, имеющего SEQ ID NO:104
Ala Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:104]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3228,6.
ПРИМЕР 114
Получение пептида, имеющего SEQ ID NO:105
His Gly Ala Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:105]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3234,7.
ПРИМЕР 115
Получение пептида, имеющего SEQ ID NO:106
His Gly Glu Ala Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:106]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’'-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3308,7.
ПРИМЕР 116
Получение пептида, имеющего SEQ ID NO:107
His Gly Glu Gly Thr Phe Thr Ser Ala Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:107]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3250,7.
ПРИМЕР 117
Получение пептида, имеющего SEQ ID NO:108
His Gly Glu Gly Thr Phe Thr Ser Asp Ala Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe lie Glu Trp Leu Lys Asn-NH2[SEQ ID NO:108]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3252,6.
ПРИМЕР 118
Получение пептида, имеющего SEQ ID NO:109
Ala Ala Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:109]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3200,6.
ПРИМЕР 119
Получение пептида, имеющего SEQ ID NO:110
Ala Ala Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:110]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3143,5.
ПРИМЕР 120
Получение пептида, имеющего SEQ ID NO:111
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:111]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3214,6.
ПРИМЕР 121
Получение пептида, имеющего SEQ ID NO:112
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:112]
Идентифицированный выше амидированный пептид собирали на смоле 4-[2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3157,5.
ПРИМЕР 122
Получение пептида, имеющего SEQ ID NO;113
Ala Gly Asp Gly Ala Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:113]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3184,6.
ПРИМЕР 123
Получение пептида, имеющего SEQ ID NO:114
Ala Gly Asp Gly Ala Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:114]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3127,5.
ПРИМЕР 124
Получение пептида, имеющего SEQ ID NO:115
Ala Gly Asp Gly Thr NaphtylAla Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2 [SEQ ID NO:115]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3266,4.
ПРИМЕР 125
Получение пептида, имеющего SEQ ID NO:116
Ala Gly Asp Gly Thr NaphtylAla Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2 [SEQ ID NO:115]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3209,4.
ПРИМЕР 126
Получение пептида, имеющего SEQ ID NO:117
Ala Gly Asp Gly Thr Phe Ser Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:117]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3200,6.
ПРИМЕР 127
Получение пептида, имеющего SEQ ID NO:118
Ala Gly Asp Gly Thr Phe Ser Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:118]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3143,5.
ПРИМЕР 128
Получение пептида, имеющего SEQ ID NO:119
Ala Gly Asp Gly Thr Phe Thr Ala Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:119]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3198,6.
ПРИМЕР 129
Получение пептида, имеющего SEQ ID NO:120
Ala Gly Asp Gly Thr Phe Thr Ala Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:120]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3141,5.
ПРИМЕР 130
Получение пептида, имеющего SEQ ID NO:121
Ala Gly Asp Gly Thr Phe Thr Ser Ala Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:121]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3170,6.
ПРИМЕР 131
Получение пептида, имеющего SEQ ID NO:122
Ala Gly Asp Gly Thr Phe Thr Ser Ala Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:122]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Frnoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3113,5.
ПРИМЕР 132
Получение пептида, имеющего SEQ ID NO:123
Ala Gly Asp Gly Thr Phe Thr Ser Glu Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2 [SEQ ID NO:123]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3228,6.
ПРИМЕР 133
Получение пептида, имеющего SEQ ID NO:124
Ala Gly Asp Gly Thr Phe Thr Ser Glu Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:124]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3171,6.
ПРИМЕР 134
Получение пептида, имеющего SEQ ID NO:125
Ala Gly Asp Gly Thr Phe Thr Ser Asp Ala Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:125]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3172,5.
ПРИМЕР 135
Получение пептида, имеющего SEQ ID NO:126
Ala Gly Asp Gly Thr Phe Thr Ser Asp Ala Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:126]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3115,4.
ПРИМЕР 136
Получение пептида, имеющего SEQ ID NO:127
Ala Gly Asp Gly Thr Phe Thr Ser Asp Pentylgly Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2 [SEQ ID NO:127]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3230,4.
ПРИМЕР 137
Получение пептида, имеющего SEQ ID NO:128
Ala Gly Asp Gly Thr Phe Thr Ser Asp Pentylgly Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2 [SEQ ID NO:128]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3198,6.
ПРИМЕР 138
Получение пептида, имеющего SEQ ID NO:129
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ala Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:129]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3141,5.
ПРИМЕР 139
Получение пептида, имеющего SEQ ID NO:130
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ala Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:130]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3157,5.
ПРИМЕР 140
Получение пептида, имеющего SEQ ID NO:131
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Ala Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:131]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3100,4.
ПРИМЕР 141
Получение пептида, имеющего SEQ ID NO:132
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Ala Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:132]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3157,6.
ПРИМЕР 142
Получение пептида, имеющего SEQ ID NO:133
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Ala Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:133]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3100,5.
ПРИМЕР 143
Получение пептида, имеющего SEQ ID NO:134
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Ala Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:134]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3100,5.
ПРИМЕР 144
Получение пептида, имеющего SEQ ID NO:135
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Ala Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:135]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3154,5.
РИМЕР 145
Получение пептида, имеющего SEQ ID NO:136
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Ala Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:136]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3115,5.
ПРИМЕР 146
Получение пептида, имеющего SEQ ID NO:137
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Pentylgly Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2 [SEQ ID NO:137]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3212,4.
ПРИМЕР 147
Получение пептида, имеющего SEQ ID NO:138
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Pentylgly Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2 [SEQ ID NO:138]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3173,4.
ПРИМЕР 148
Получение пептида, имеющего SEQ ID NO:139
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Ala Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:139]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3156,6.
ПРИМЕР 149
Получение пептида, имеющего SEQ ID NO:140
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Ala Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:140]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-димeтoкcифeнил)-Fmoc-aминoмeтилфeнoкcи-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3099,5.
ПРИМЕР 150
Получение пептида, имеющего SEQ ID NO:141
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Ala Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:141]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmос-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3156,6.
ПРИМЕР 151
Получение пептида, имеющего SEQ ID NO:142
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Ala Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:142]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3099,5.
ПРИМЕР 152
Получение пептида, имеющего SEQ ID NO:143
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Ala Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:143]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3156,6.
ПРИМЕР 153
Получение пептида, имеющего SEQ ID NO:144
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Ala Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:144]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3099,5.
ПРИМЕР 154
Получение пептида, имеющего SEQ ID NO:145
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Ala Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:145]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3186,6.
ПРИМЕР 155
Получение пептида, имеющего SEQ ID NO:146
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Ala Arg Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:146]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3129,5.
ПРИМЕР 156
Получение пептида, имеющего SEQ ID NO:147
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Ala Leu Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:147]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3129,5.
ПРИМЕР 157
Получение пептида, имеющего SEQ ID NO:148
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Ala Leu Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:148]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3072,4.
ПРИМЕР 158
Получение пептида, имеющего SEQ ID NO:149
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Ala Phe Ile Glu Trp Leu Lys Asn-NH2[SEQ ID NO:149]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3172,5.
ПРИМЕР 159
Получение пептида, имеющего SEQ ID NO:150
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Ala Phe Ile Glu Phe Leu Lys Asn-NH2[SEQ ID NO:150]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3115,5.
ПРИМЕР 160
Получение пептида, имеющего SEQ ID NO:151
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Naphtylala Ile Glu Trp Leu Lys Asn-NH2 [SEQ ID NO:151]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3266,4.
ПРИМЕР 161
Получение пептида, имеющего SEQ ID NO:152
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Naphtylala Ile Glu Phe Leu Lys Asn-NH2 [SEQ ID NO:152]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3209,4.
ПРИМЕР 162
Получение пептида, имеющего SEQ ID NO:153
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Val Glu Trp Leu Lys Asn-NH2[SEQ ID NO:153]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3200,6.
ПРИМЕР 163
Получение пептида, имеющего SEQ ID NO:154
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Val Glu Phe Leu Lys Asn-NH2[SEQ ID NO:154]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3143,5.
ПРИМЕР 164
Получение пептида, имеющего SEQ ID NO:155
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe tButylgly Glu Trp Leu Lys Asn-NH2[SEQ ID NO:155]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3216,5.
ПРИМЕР 165
Получение пептида, имеющего SEQ ID NO:156
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe tButylgly Glu Phe Leu Lys Asn-NH2[SEQ ID NO:156]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3159,4.
ПРИМЕР 166
Получение пептида, имеющего SEQ ID NO:157
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Asp Trp Leu Lys Asn-NH2[SEQ ID NO:157]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3200,6.
ПРИМЕР 167
Получение пептида, имеющего SEQ ID NO:158
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Asp Phe Leu Lys Asn-NH2[SEQ ID NO:158]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3143,5.
ПРИМЕР 168
Получение пептида, имеющего SEQ ID NO:159
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Ala Leu Lys Asn-NH2[SEQ ID NO:159]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3099,5.
ПРИМЕР 169
Получение пептида, имеющего SEQ ID NO:160
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Ala Leu Lys Asn-NH2[SEQ ID NO:160]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3081,4.
ПРИМЕР 170
Получение пептида, имеющего SEQ ID NO:161
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Ala Lys Asn-NH2[SEQ ID NO:161]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3172,5.
ПРИМЕР 171
Получение пептида, имеющего SEQ ID NO:162
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Ala Lys Asn-NH2[SEQ ID NO:162]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3115,5.
ПРИМЕР 172
Получение пептида, имеющего SEQ ID NO:163
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Ala Asn-NH2[SEQ ID NO:163]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3157,5.
ПРИМЕР 173
Получение пептида, имеющего SEQ ID NO:164
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Ala Asn-NH2[SEQ ID NO:164]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3100,4.
ПРИМЕР 174
Получение пептида, имеющего SEQ ID NO:165
Ala Giy Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Ala-NH2[SEQ ID NO:165]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems,.Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3171,6.
ПРИМЕР 175
Получение пептида, имеющего SEQ ID NO:166
Ala Gly Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Ala-NH2[SEQ ID NO:166]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3114,5.
ПРИМЕР 176
Получение пептида, имеющего SEQ ID NO:167
Ala Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro-NH2 [SEQ ID NO:167]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4033,5.
ПРИМЕР 177
Получение пептида, имеющего SEQ ID NO:168
His Gly Ala Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro-NH2 [SEQ ID NO: 168]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0/55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3984,4.
ПРИМЕР 178
Получение пептида, имеющего SEQ ID NO:169
His Gly Glu Ala Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro-NH2 [SEQ ID NO:169]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4016,5.
ПРИМЕР 179
Получение пептида, имеющего SEQ ID NO:170
His Gly Glu Gly Thr Phe Thr Ser Ala Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro-NH2 [SEQ ID NO:170]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3861,3.
ПРИМЕР 180
Получение пептида, имеющего SEQ ID NO:171
Ala Gly Glu Gly Thr Phe Thr Ser Asp Ala Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro-NH2 [SEQ ID NO:171]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3746,1.
ПРИМЕР 181
Получение пептида, имеющего SEQ ID NO:172
Ala Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala-NH2 [SEQ ID NO:172]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3742,1.
ПРИМЕР 182
Получение пептида, имеющего SEQ ID NO:173
His Gly Ala Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala-NH2 [SEQ ID NO:173]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3693,1.
ПРИМЕР 183
Получение пептида, имеющего SEQ ID NO:174
His Gly Glu Ala Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly-NH2 [SEQ ID NO:167]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3751,2.
ПРИМЕР 184
Получение пептида, имеющего SEQ ID NO:175
His Gly Glu Gly Thr Phe Thr Ser Ala Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser-NH2 [SEQ ID NO:175]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3634,1.
ПРИМЕР 185
Получение пептида, имеющего SEQ ID NO:176
Ala Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser-NH2 [SEQ ID NO: 176]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3526,9.
ПРИМЕР 186
Получение пептида, имеющего SEQ ID NO:177
His Gly Ala Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser-NH2 [SEQ ID NO:177]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3477,9.
ПРИМЕР 187
Получение пептида, имеющего SEQ ID NO:178
His Gly Glu Ala Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro-NH2 [SEQ ID NO:178]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3519,9.
ПРИМЕР 188
Получение пептида, имеющего SEQ ID NO:179
His Gly Glu Gly Thr Phe Thr Ser Ala Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly-NH2 [SEQ ID NO:179]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3307,7.
ПРИМЕР 189
Получение пептида, имеющего SEQ ID NO:180
Ala Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly-NH2[SEQ ID NO:180]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3186,5.
ПРИМЕР 190
Получение пептида, имеющего SEQ ID NO:181
His Gly Ala Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly tPro Ser Ser Gly Ala tPro tPro tPro-NH2 [SEQ ID NO:181]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. Двойные связывания требовались в положениях 37, 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4121,1.
ПРИМЕР 191
Получение пептида, имеющего SEQ ID NO:182
His Gly Glu Ala Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala tPro tPro tPro-NH2 [SEQ ID NO:182]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. Двойные связывания требовались в положениях 37, 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4173,2.
ПРИМЕР 192
Получение пептида, имеющего SEQ ID NO:183
His Gly Glu Gly Thr Phe Thr Ser Ala Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly NMeala Ser Ser Gly Ala NMeala NMeala-NH2 [SEQ ID NO: 183]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. Двойные связывания требовались в положениях 36 и 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3796,1.
ПРИМЕР 193
Получение пептида, имеющего SEQ ID NO:184
Ala Giy Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly hPro Ser Ser Gly Ala hPro-NH2 [SEQ ID NO:184]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. Двойное связывание требовалось в положении 31. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в АСN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3871,1.
ПРИМЕР 194
Получение пептида, имеющего SEQ ID NO:185
His Gly Ala Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala-NH2 [SEQ ID NO:185]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3750,2.
ПРИМЕР 195
Получение пептида, имеющего SEQ ID NO:186
His Gly Asp Ala Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly-NH2 [SEQ ID NO:186]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoс-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 3408,8.
ПРИМЕР 196
Получение пептида, имеющего SEQ ID NO:187
Ala Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2 [SEQ ID NO:187]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4120,6.
ПРИМЕР 197
Получение пептида, имеющего SEQ ID NO:188
Ala Gly Ala Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2 [SEQ ID NO:188]
Идентифицированный выше амидированный пептид собирали на смоле 4-(2’-4’-диметоксифенил)-Fmoc-аминометилфенокси-ацетамид-норлейцин-МВНА (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляли от смолы, защитные группы удаляли и пептид очищали сходным образом с примером 109. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводили затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия (М): рассчитано 4005,5.
ПРИМЕР 198
Получение пептидов, содержащих карбоновую кислоту на С-конце, соответствующих приведенным выше последовательностям с амидной группой на С-конце для SEQ ID NO:100-166, 172-177, 179-180 и 185-188
Пептиды, имеющие карбоновую кислоту на С-конце, соответствующие амидированным последовательностям, имеющим SEQ ID NO:100-166, 172-177, 179-180 и 185-188, собирают на так называемой смоле Ванга (смоле на основе п-алкокси-бензилового спирта (Bachem, 0,54 ммоль/г)) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляют от смолы, защитные группы удаляют и пептид очищают сходным образом с примером 109. В анализе используют растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводят затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия обеспечивает экспериментально определенную (М).
ПРИМЕР 199
Получение пептидов, содержащих карбоновую кислоту на С-конце, соответствующих приведенным выше последовательностям амидной группой на С-конце для пептидов, имеющих SEQ ID NO:167-171, 178 и 181-184
Пептиды, имеющие карбоновую кислоту на С-конце, соответствующие амидированным последовательностям SEQ ID NO:167-171, 178 и 181-184, собирают на 2-хлортритилхлоридной смоле (200-400 меш), 2% DVB (Novabiochem, 0,4-1,0 ммоль/г)) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепляют от смолы, защитные группы удаляют и пептид очищают сходным образом с примером 109. В анализе используют растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическую ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А на протяжении 30 минут) лиофилизированного пептида проводят затем для определения времени удерживания полученного в качестве продукта пептида. Электрораспылительная масс-спектрометрия обеспечивает экспериментально определенную (М).
ПРИМЕРЫ А-Е
Использованные реагенты GLP-1[7-36]NH2 (GLP-1) приобретали у Bachem (Torrance, СА). Все другие пептиды получали с использованием способов синтеза, таких как описанные там. Все химикалии были наивысшей коммерческой чистоты. SPA-иммуноанализ для цАМФ приобретали у Amersham. Радиоактивные лиганды покупали у New England Nuclear (Boston, MA). Клетки RINmSf (American Type Tissue Collection, Rockville, MD) выращивали в среде DME/F12, содержащей 10% фетальную телячью сыворотку и 2 мМ L-глутамина. Клетки выращивали при 37°С и 5% CO2/95% увлажненном воздухе и среду заменяли каждые 2-3 дня. Клетки выращивали до конфлюэнтности, затем собирали и гомогенизировали с использованием гомогенизатора Polytron. Гомогенаты клеток хранили в замороженном виде при -70°С до использования.
ПРИМЕР А - ИССЛЕДОВАНИЯ ПО СВЯЗЫВАНИЮ GLP-1-РЕЦЕПТОРА
Связывание рецептора оценивали измерением вытеснения [12SI]GLP-1 или [125 I]эксендина(9-39) из мембран RINm5f. Буфер для анализа содержал 5 мкг/мл бестатина, 1 мкг/мл фосфорамидона, 1 мг/мл бычьего сывороточного альбумина (фракции V), 1 мг/мл бацитрацина и 1 мМ MgCl2 в 20 мМ HEPES, рН 7,4. Для измерения связывания 30 мкг мембранного белка (анализ белка по Бредфорду) ресуспендировали в 200 мкл буфера для анализа и инкубировали с 60 пМ [125I]GLP-1 или [125I] эксендина (9-39) и немечеными пептидами в течение 120 мин при 23°С в 96-луночных планшетах (Nagle Nunc, Rochester, NY). Инкубации останавливали быстрым фильтрованием с использованием холодного фосфатного солевого буфера, рН 7,4, через обработанные полиэтиленимином фильтры GF/B из стекловолокна (Wallac Inc., Gaithersburg, MD), используя пламенный коллектор Tomtec Mach II (Wallac Inc., Gaithersburg, MD). Фильтры сушили, соединяли со сцинтилятором и радиоактивность определяли в жидкостном сцинтилляционном счетчике Betaplate (Wallac Inc.).
Пробы пептидов использовали в этом анализе в двух повторностях при 6 разведениях на протяжении диапазона концентраций 10-6 М-10-12 М для получения кривых ответа. Биологическую активность пробы выражают в виде величины IC50, рассчитанной из необработанных данных с использованием итеративной программы построения кривых с использованием 4-параметрического логистического уравнения (Prizm, GraphPAD Software).
ПРИМЕР В - ИССЛЕДОВАНИЕ АКТИВАЦИИ ЦИКЛАЗЫ
Буфер для анализа содержал 10 мкМ ГТФ, 0,75 мМ АТФ, 2,5 мМ MgCl2, 0,5 мМ фосфокреатин, 12,5 Е/мл креатинкиназы, 0,4 мг/мл апротинина, 1 мкМ IBMX в 50 мМ HEPES, рН 7,4. Мембраны и пептиды объединяли в 100 мл буфера для анализа в 96-луночных планшетах с фильтрами на дне (Millipore Corp., Bedford, MA). После 20 мин инкубирования при 37°С анализ останавливали переносом супернатанта фильтрованием в свежий 96-луночный планшет с использованием вакуумной фильтрационной установки Millipore. Содержания цАМФ в супернатантах определяли количественно при помощи SPA-иммуноанализа. В этом анализе пептиды определяли в трех повторностях при 7 разведениях на протяжении диапазона концентраций 10-6 М - 10-12 М для получения кривых ответа. Биологическую активность конкретной пробы выражают в виде величины EC50, рассчитываемой, как описано выше.
ПРИМЕР С - ОПРЕДЕЛЕНИЕ УРОВНЕЙ ГЛЮКОЗЫ В КРОВИ МЫШЕЙ DB/DB
Для этого исследования использовали мышей C57BLKS/J-m-db в возрасте по меньшей мере 3 месяца. Мышей получали из лаборатории Jackson и давали им акклиматизироваться в течение по меньшей мере одной недели перед использованием. Мышей содержали в группах из десяти животных при 22°С±1°С с циклом свет:темнота 12:12, с включением света в 6 часов утра. Всех животных лишали пищи в течение 2 часов перед взятием проб крови фона. Приблизительно 70 мкл крови брали из каждой мыши посредством глазной пункции, после легкой анестезии метофаном. После взятия проб крови фона для измерения концентраций глюкозы в плазме все животные получали подкожные инъекции носителя (10,9% NaCl), эксендина-4 или тест-соединения (1 мкг) в носителе. Опять брали пробы крови с использованием той же самой процедуры после точно одного часа от инъекций и измеряли концентрации глюкозы в плазме. Для каждого животного рассчитывали изменение в процентах величины в плазме, от величины фона.
ПРИМЕР D - ОПРЕДЕЛЕНИЕ ЗАВИСИМОСТИ ДОЗА-ОТВЕТ УРОВНЕЙ ГЛЮКОЗЫ В КРОВИ МЫШЕЙ DB/DB
Для этого исследования использовали мышей C57BLKS/J-m-db/db в возрасте по меньшей мере 3 месяца. Мышей получали из лаборатории Jackson и давали им акклиматизироваться в течение по меньшей мере одной недели перед использованием. Мышей содержали в группах из десяти животных при 22±1°С с циклом свет:темнота 12:12, с включением света в 6 часов утра. Всех животных лишали пищи в течение 2 часов перед взятием проб крови фона. Приблизительно 70 мкл крови брали из каждой мыши посредством глазной пункции, после легкой анестезии метофаном. После взятия проб крови фона для измерения концентраций глюкозы в плазме все животные получали подкожные инъекции либо носителя, либо эксендина-4 или тест-соединения в указанных концентрациях. Опять брали пробы крови с использованием той же самой процедуры после точно одного часа от инъекций и измеряли концентрации глюкозы в плазме. Для каждого животного рассчитывали изменение в процентах величины в плазме, от величины фона, и оценивали зависимость ответа от дозы с использованием программного обеспечения Graphpad Prizm™.
ПРИМЕР Е - ОПОРОЖНЕНИЕ ЖЕЛУДКА
Следующее исследование было проведено и может быть проведено для исследования эффектов эксендина-4 и/или соединения-агониста эксендина на опорожнение желудка у крыс. Этот эксперимент проводили согласно модификации способа Scarpignato, et al., Arch. Int. Pharmacodyn. Ther. 246:286-94, 1980. Использовали самцов крыс Harlan Sprague-Dawley (HSD). Всех животных содержали при 22,7±0,8°С с циклом свет:темнота 12:12 (причем эксперименты проводили во время светового цикла) и корм и воду предоставляли ad libitum (диета LM-485, Teklad, Madison, WI). Эксендин-4 синтезировали в соответствии со стандартными способами синтеза пептидов. Получение эксендина-4 описано в примере 14. Определение опорожнения желудка по способу, описанному ниже, выполняли после голодания в течение приблизительно 20 часов для гарантии того, что желудок не содержал химуса, который мешал бы спектрофотометрическим измерениям поглощения.
Находящиеся в сознании крысы получали через желудочный зонд 1,5 мл не содержащего калорий геля, содержащего 1,5% метилцеллюлозу (М-0262, Sigma Chemical Co, St Louis, МО) и 0,05% индикатора фенолового красного. Спустя двадцать минут после введения через желудочный зонд крыс анестезировали при помощи 5% галотана, желудок экспонировали и фиксировали при привратниковом и нижнем пищеводном сфинктерах при помощи артериальных зажимов, извлекали и открывали в щелочной раствор, который доводили до фиксированного объема. Содержание желудка определяли по интенсивности фенолового красного в этом щелочном растворе, измеряли по поглощению при длине волны 560 нм. В отдельных экспериментах на 7 крысах как желудок, так и тонкую кишку вырезали и открывали в щелочной раствор. Количество фенолового красного, которое могло быть извлечено из верхнего желудочно-кишечного тракта в пределах 20 мин введения через желудочный зонд, было 89±4%; краситель, который, по-видимому, связывается необратимо с поверхностью, относящейся к полости кишечника, мог учитываться для баланса. Для учета максимального извлечения красителя менее 100%, процент содержимого желудка, остающегося после 20 мин, выражали в виде части содержимого желудка, извлеченного из контрольных крыс, умерщвленных немедленно после введения через желудочный зонд в том же самом эксперименте. Процент оставшегося содержимого желудка = (поглощение при 20 мин)/(поглощение при 0 мин) × 100.
Различные модификации данного изобретения, кроме показанных и описанных здесь, станут очевидными специалистам в данной области из предыдущего описания и входят в рамки следующей формулы изобретения.















































































Реферат
Изобретение относится к новым фармацевтическим композициям, которые содержат эксендин или агонист эксендина для лечения сахарного диабета, замедления опорожнения желудка или снижения потребления пищи, и их дозированным формам и способам для их введения. Технический результат: композиции согласно изобретению применимы в лечении диабета и состояний, при которых могли бы принести пользу понижение глюкозы плазмы или задержка и/или замедление опорожнения желудка или ингибирование потребления пищи, и включают в себя парентеральную жидкую дозированную форму и дозированные формы, которые применимы в пероральной, назальной, трансбуккальной, подъязычной, внутритрахеальной и легочной доставке эксендинов и агонистов эксендинов. 2 с. и 14 з.п.ф-лы, 17 ил.


Комментарии