Модуляция il-2- и il-15-опосредованных т-клеточных ответов - RU2280255C2
Код документа: RU2280255C2
Чертежи




















Описание
Настоящая заявка имеет приоритет в соответствии с заявкой U.S.S.N. 60/232251, поданной 14 сентября 2000 г.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к иммунологии, отторжению трансплантата, и заболеваниям, связанным с иммунной системой.
ИССЛЕДОВАНИЕ, ФИНАНСИРУЕМОЕ ПРАВИТЕЛЬСТВОМ
Описанная здесь работа отчасти субсидировалась National Institute of Health. Поэтому правительство Соединенных Штатов обладает определенными правами на настоящее изобретение.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Два интерлейкина, IL-2 и IL-15, функционально дублируют друг друга при стимулировании Т-клеточной пролиферации in vitro. Вместе с тем, их роль в первичной иммунной активации и иммунном гомеостазе in vivo выяснена в гораздо меньшей степени. In vivo, IL-2 и IL-15 могут обладать разными функциями и регулировать разные аспекты Т-клеточной активации. Например, IL-2 может в основном активировать Т-клетки для апоптоза (Lenardo, Nature 353:858-861, 1991), а IL-15 может содействовать клеточному выживанию (Dooms и соавт., J. Immunol. 161:2141-2150, 1998; Bulfone и соавт. Nature Medicine 3:1124-1128, 1997). IL-15 также, по-видимому, управляет in vivo пролиферацией Т-клеток памяти типа CD8+, тогда как IL-2 ограничивает их непрерывный рост (Ku и соавт., Science 288:675-678, 2000). Кроме того, мыши, фенотипически дефицитные по IL-2, являются лимфопролиферативными и аутоиммунными (Horak и соавт., Immunol. Rev. 148:35-44, 1995), тогда как мыши, дефицитные по IL-15, являются, до некоторой степени, лимфопеничными и неспособны повышать первичный ответ при вирусном заражении (Kennedy и соавт., J. Exp. Med. 191:771-780, 2000; Lodolce и соавт., Immunity 9:669-676, 1998). Молекулярная основа данного резкого расхождения остается неясной.
Функциональные рецепторы для IL-2 и IL-15 состоят из отдельной α-цепи, которая определяет специфичность связывания для IL-2 или IL-15, и из спаренных у рецептора IL-2 β- и γ-цепей. γ-Цепь является также ключевым сигнальным компонентом рецепторов IL-4, IL-7, и IL-9 (Sugamura и соавт., Ann. Rev. Immunol. 14:179-205, 1996). В лимфоидном компартменте эти рецепторные субъединицы могут экспрессироваться индивидуально или в различных сочетаниях, приводя к образованию рецепторов с разным сродством и/или с разными способностями передавать сигнал (Sugamura и соавт., выше). Например, β-цепь может ассоциироваться с α-цепью или с γ-цепью с образованием димерных структур, или с обеими цепями, α- и γ-цепью с образованием тримерных структур. Подобным образом γ-цепь может взаимодействовать с β-цепью и, через β-цепь, с α-цепью рецептора IL-2 либо рецептора IL-15. Сама по себе α-цепь рецептора IL-15, в отличие от α-цепи рецептора IL-2, может связываться с IL-15 с чрезвычайно высоким сродством (Giri и соавт., EMBO J. 14:3654-3663, 1995). Установлено, однако, что подобно α-цепи рецептора IL-2, данное взаимодействие не инициирует событий передачи сигнала. Следовательно, тримеризация цепей α-, β-, и γ-субъединиц, существенна для функциональной целостности IL-2- и IL-15-рецепторов, обладающих высоким сродством.
В исследованиях in vitro показано, что активированные Т-клетки могут экспрессировать и α-цепь рецептора IL-2 и α-цепь рецептора IL-15 (Chae и соавт., J. Immunol. 157:2813-2819, 1996), а β- и γ-цепи экспрессируются конститутивно при активации Т-клеток (Ishii и соавт., Int. Immunol. 6:1273-1277, 1994). Кроме того, IL-2 и IL-15 легко детектируются во время иммунной активации in vivo (Li и соавт., J. Immunol. 161:890-896, 1998). Таким образом, остается неясным как активированные Т-клетки различают in vivo IL-2, IL-15 и другие цитокины, зависимые от γ -цепи.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩЕСТВА ИЗОБРЕТЕНИЯ
Настоящее изобретение частично базируется на изучении экспрессии рецепторных субъединиц IL-2 и IL-15 в циклирующих in vivo Т-клетках. Удивительно, эти субъединицы направляют активированные Т-клеточные ответы на IL-2 или IL-15 селективным образом и, тем самым, регулируют Т-клеточный ответ in vivo. Иными словами (и в противоположность общепринятой точке зрения о том, что IL-2 и IL-15 являются дублерами), IL-2 и IL-15 выступают в разных ролях, контролируя Т-клеточную пролиферацию in vivo. В частности, IL-15 является ключевым в инициации Т-клеточного деления, тогда как IL-2 контролирует Т-клеточный рост с помощью понижения регуляции γс-экспрессии. В соответствии с этим, что касается первого варианта осуществления настоящего изобретения, в данном изобретении охарактеризованы, в основном, новые сочетания антагонистов IL-2 и IL-15 и способы супрессии иммунного ответа путем введения этих антагонистов. В каждом случае супрессию осуществляют путем введения первого агента, который является антагонистом молекулы IL-15 или IL-15-рецептора (IL-15R), и второго агента, который является антагонистом молекулы IL-2 или IL-2-рецептора (IL-2R). В альтернативных вариантах осуществления настоящего изобретения композиции настоящего изобретения могут включать (вместо, или в дополнение вышеописанным агентам), агенты, которые подавляют экспрессию нуклеиновых кислот (напр., ДНК или РНК), которые кодируют интерлейкин (напр., IL-2 или IL-15) или рецептор интерлейкина (напр., рецептор IL-2 или IL-15).
Вообще, настоящее изобретение характеризует новые сочетания агентов, которые при введении пациенту, снижают численность антигенреактивных Т-клеток. Например, в настоящем изобретении охарактеризованы композиции (напр., фармацевтически приемлемые композиции), которые включают два или более агентов, каждый из которых способствует гибели Т-клеток. Альтернативно, данная композиция может содержать, по меньшей мере, один агент, который способствует гибели Т-клеток, а также, по меньшей мере, один агент, который подавляет пролиферацию Т-клеток. Агент, который способствует гибели Т-клеток, может способствовать AICD (индуцированной активацией гибели клеток), пассивной клеточной гибели, ADCC (антитело-зависимой клеточно-опосредованной цитотоксичности) или CDC (цитотоксичности, управляемой комплементом).
Агенты, которые способствуют AICD, включают IL-2 и родственные молекулы (напр., IL-2/Fc или иные молекулы, которое функционируют в качестве агонистов IL-2 или IL-2-рецептора (напр., антитело, которые специфически связывается с данным IL-2-рецептором и имитирует связывание природного лиганда рецептора). Другой агент, который способствует AICD, представляет собой Fas-Лиганд (FasL). Агенты, которые способствуют пассивной клеточной гибели, включают агенты, которые являются антагонистами IL-15 (в результате нацеливания, напр., связывания на IL-15, рецептор IL-15, или компонент внутриклеточного сигнального пути, который активируется после связывания рецептора) или какой-либо иной фактор, необходимый для выживания Т-клеток (напр., IL-4, IL-7, лиганд OX-4, IFN-β, 4-1BB, или IGF-I) и подавляя тем самым их активность. В альтернативных вариантах осуществления настоящего изобретения композиции настоящего изобретения могут включать (вместо, или в дополнение, одного или нескольких вышеописанных агентов) агенты, которые ингибируют экспрессию нуклеиновых кислот (напр., ДНК или РНК), которые кодируют интерлейкин (напр., IL-2 или IL-15) или рецептор интерлейкина (напр., рецептор IL-2 или IL-15).
Способствовать ADCC или CDC можно путем экспонирования Т-клеток с агентом, который связывается с Т-клеточной поверхностью и содержит Fc-часть, которая активирует ADCC или CDC. В частности, агенты, которые способствуют ADCC или CDC, включают слитые белки, которые содержат интерлейкин (напр., IL-2 или мутантный IL-15), и Fc-участок (напр., IL-2/Fc), а также антитела или другие Fc-содержащие белки, которые связываются с рецептором интерлейкина (напр., IL-2- или IL-15-рецептор).
Как установлено выше, композиции настоящего изобретения могут включать не только агент, который способствует гибели Т-клеток, но также и агент, который подавляет пролиферацию Т-клеток. Агенты, которые подавляют пролиферацию Т-клеток, включают рапамицин, микофенолятмофетил (MMF), азатиоприн, и любой другой агент, известный и используемый в данной области техники для предотвращения клеточной пролиферации (включая химиотерапевтические агенты). Применение агента, который подавляет Т-клеточную пролиферацию, оказывается особенно успешным в сочетании с агентами, которые способствуют AICD, а также стимулируют Т-клеточную пролиферацию (такие, как IL-2/Fc). Например, в настоящем изобретении охарактеризована фармацевтически приемлемая композиция, которая включает IL-2/Fc (который, например, способствует AICD и клеточному лизису с помощью ADCC или CDC), антагонист IL-15 (который, например, способствует пассивной клеточной гибели, противодействуя IL-15, фактору, необходимому для выживания Т-клеток), и рапамицин (который подавляет пролиферацию Т-клеток). Композиции, содержащие другие сочетания агентов, описаны ниже.
Примечательно, что при использовании двух или более агентов, необходимость в физическом отделении одного от другого отсутствует. Несмотря на то, что агент может быть представлен одиночным объектом, который исходно обладает одной функциональной активностью (напр., антитело, мишенью которого является IL-2 или IL-15 вследствие специфического связывания IL-2 или IL-15), он может быть также представлен одиночным объектом, который обладает, по меньшей мере, двумя функциональными активностями (напр., IL-2/Fc, mIL-15/Fc, или антитело против IL-2 или антитело против IL-15; в этих молекулах интерлейкин опосредует AICD, а Fc-участок данной молекулы опосредует CDC и ADCC). Следовательно, композиция, которая включает (1) агент, который вызывает AICD, (2) агент, который вызывает CDC, и (3) агент, который подавляет клеточную пролиферацию, может включать только два активных ингредиента (напр., (1) молекулу IL-2/Fc, которая индуцирует AICD и CDC, и (2) рапамицин, который подавляет клеточную пролиферацию).
Описанные здесь композиции пригодны для лечения пациентов, на которых иммунная супрессия оказывает благоприятное воздействие (напр., пациент, который получил или ожидает получить трансплантат; пациент, который страдает от иммунного заболевания, особенно аутоиммунного заболевания; пациент, который является носителем злокачественной опухоли (напр., злокачественная опухоль иммунной системы), или пациент, страдающий реакцией "трансплантат против хозяина" (GVHD)). GVHD характеризуется ответной реакцией донорских лейкоцитов против антигенов реципиента. Этот ответ особенно проблематичен при трансплантации костного мозга, но происходит также и при трансплантации целых органов; донорские лейкоциты, присущие трансплантируемым органам, всегда ко-трансплантируются.
Хотя композиции настоящего изобретения могут содержать более одного агента, способы настоящего изобретения не ограничиваются способами, в которых указанные агенты вводятся одновременно. Например, перед получением композиции, содержащей антагонист IL-2 или антагонист IL-2R, пациент мог бы получить композицию, содержащую антагонист IL-15 или антагонист IL-15R. Подобным же образом, перед получением композиции, содержащей агонист IL-2, пациент мог бы получить композицию, содержащую рапамицин. Более того, композиции настоящего изобретения (применяемые одновременно или последовательно) можно использовать для лечения органа или клеточного трансплантата перед его имплантированием пациенту. Агенты настоящего изобретения и способы их применения описываются ниже.
Многие агенты, используемые в контексте настоящего изобретения, обладают преимущественными терапевтическими характеристиками. Например, агенты, мишенью которых являются IL-15R, могут представлять собой слитые белки, которые включают мутантный полипептид IL-15 (mIL-15). Маловероятно, чтобы эти агенты были иммуногенными, потому что мутантная IL-15-часть данного слитого белка может отличаться от IL-15 дикого типа лишь несколькими замещенными остатками. Кроме того, так как полипептиды mIL-15 могут связывать IL-15Rα c высоким сродством, они могут эффективно конкурировать с природным IL-15 за рецептор. Далее, агенты настоящего изобретения могут активировать компоненты иммунной системы хозяина, такие как комплемент и фагоциты, которые в конечном итоге опосредуют элиминацию (или истощение) клеток, несущих данный рецептор (напр., IL-2-рецептор), с которым связывается данный агент. Например, агенты настоящего изобретения могут опосредовать лизис или фагоцитоз клеток-мишеней. Поскольку альфа-субъединица рецептора IL-15 (IL-15Rα) экспрессируется активированными или злокачественными иммунными клетками, но не покоящимися иммунными клетками, агенты настоящего изобретения можно использовать для специфического нацеливания на те клетки, которые были активированы (напр., антиген-активированные Т-клетки), или те клетки, которые стали злокачественными. Таким образом, хотя Т-клетки представляют предпочтительную мишень для агентов настоящего изобретения, композиции настоящего изобретения могут также использоваться для нацеливания на другие клетки, участвующие в патогенезе иммунологических нарушений, таких, например, как другие клетки иммунной системы или гиперпролиферирующие клетки тканей.
За исключением особо оговоренных случаев все используемые здесь технические и научные термины обладают тем же значением, которое обычно придают им специалисты в данной области техники, к которой относится настоящее изобретение. Все публикации, патентные заявки, патенты и другие упомянутые здесь ссылки, включены путем ссылки во всей полноте.
Другие характеристики и преимущества настоящего изобретения должны быть очевидны из чертежей, подробного описания, и формулы изобретения. Хотя материалы и способы, аналогичные или эквивалентные описанным здесь материалам и способам, могут использоваться при осуществлении или проверке настоящего изобретения, предпочтительные материалы и способы описываются ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлена последовательность нуклеиновой кислоты интерлейкина IL-15 дикого типа (SEQ ID NO:1) и его предсказанная аминокислотная последовательность (SEQ ID NO:2).
На фиг.2 представлена последовательность нуклеиновой кислоты мутантного IL-15 (SEQ ID NO:3) и его предсказанная аминокислотная последовательность (SEQ ID NO:4). Природный кодон, кодирующий глутамин в положении 149, CAG, и природный кодон, кодирующий глутамин в положении 156, САА, оба заменены GAC, который кодирует аспартат. (Эти положения (149 и 156) соответствуют положениям 101 и 108, соответственно, в зрелом полипептиде IL-15, в котором отсутствует сигнальная последовательность из 48 аминокислот).
На фиг.3А представлен ряд графиков, отражающих экспрессию α-, β- и γс-цепей IL-2-рецептора при делении Т-клеток в селезенке хозяина через 3 дня после внутривенной (i.v.) инъекции CFSE-меченных клеток. Показаны данные, соответствующие результатам шести экспериментов.
На фиг.3В представлен ряд графиков, отражающих экспрессию α-, β и γ-цепей IL-2-рецептора в делящихся in vitro Т-клетках. Лимфоцитарные клетки, меченные CFSE, стимулировали in vitro с помощью анти-CD3 (2 мкг/мл) в течение 3-х дней. Клеточное деление и экспрессию субъединиц IL-2-рецептора анализировали с помощью анализатора клеток, активированного флуоресценцией (FACS).
На фиг.3С представлен график, отражающий экспрессию L-селектина в делящихся in vivo Т-клетках. Клетки собирали из лимфатических узлов мыши-хозяина через три дня после внутривенной инъекции CFSE-меченных клеток и окрашивали с помощью конъюгированного с РЕ mAb к CD62L. Квадрант представлял собой комплект, основанный на клетках, окрашенных с помощью изотипического контрольного mAb.
На фиг.3D представлен ряд графиков, отражающих разную экспрессию α-цепи IL-2-рецептора в делящихся in vivo Т-клетках. CFSE-меченные клетки стимулировали in vivo в течение трех дней, и клетки второго клеточного деления сортировали. Сортированные клетки повторно стимулировали in vitro с помощью анти-CD3 и анти-CD28 в течение трех дней. Деление клеток и экспрессию α-цепи IL-2-рецептора анализировали с помощью FACS.
На фиг.4А представлен ряд графиков, отражающих экспрессию α-цепи IL-15-рецептора в делящихся in vitro Т-клетках через три дня после внутривенной инъекции CFSE-меченных клеток. Клетки окрашивали с помощью слитого белка IL-15-FLAG с последующим окрашиванием биотинилированным mAb к FLAG и PE-стрептавидином. Клетки, окрашивающиеся в отсутствие IL-15-FLAG, учитывали в качестве контроля.
На фиг.4В представлена гистограмма, отражающая разный ответ делящихся in vivo Т-клеток на действие in vitro IL-2 и IL-15. CFSE-меченные лимфоциты стимулировали in vivo в течение трех дней, а клеточное деление анализировали путем проверки CFSE-профиля. Во втором клеточном делении Т-клеток их сортировали, после чего клетки (1×104) культивировали in vitro в присутствии IL-2 или IL-15 в течение двух дней. Клеточную пролиферацию определяли по поглощению3Н-TdR. Полученные результаты представлены в виде средней СРМ±CD по трем опытам.
На фиг.4С представлена пара графиков, отражающих эффект обработки антителами и CD25 на деление Т-клеток in vivo. Мыши-хозяева получали внутрибрюшинно (i.p.) mAb к CD25 по 1 мг/день в течение трех дней непосредственно перед внутривенной инъекцией CFSE-меченных клеток. Мышей, обработанных с помощью контрольных изотипических mAb (IgG1 крысы), учитывали в качестве контроля.
На фиг.5А представлен ряд графиков, отражающих картину внутриклеточно окрашенных IL-2 делящихся in vivo Т-клеток. CFSE-меченные клетки стимулировали in vivo в течение трех дней. Клетки, собранные из селезенки хозяина, стимулировали in vitro с помощью PMA и иономицина в течение четырех часов в присутствии GolgiStop™. Затем клетки фиксировали, повышали их проницаемость и окрашивали IL-2-продукцию. Клетки, окрашенные контрольными изотипическими mAb, учитывали в качестве контроля.
На фиг.5В представлена пара графиков, отражающих экспрессию γс в CD4+-Т-клетках мышей, дефицитных по IL-2. Клетки селезенки мышей, дефицитных по IL-2, и контрольных мышей дикого типа окрашивали с помощью конъюгированных с PE mAb против мышиных CD4 и с помощью конъюгированных с FITC mAb против мышиной IL-2-рецепторной γс. Экспрессию γс в CD4+-Т-клетках анализируют с помощью FACS.
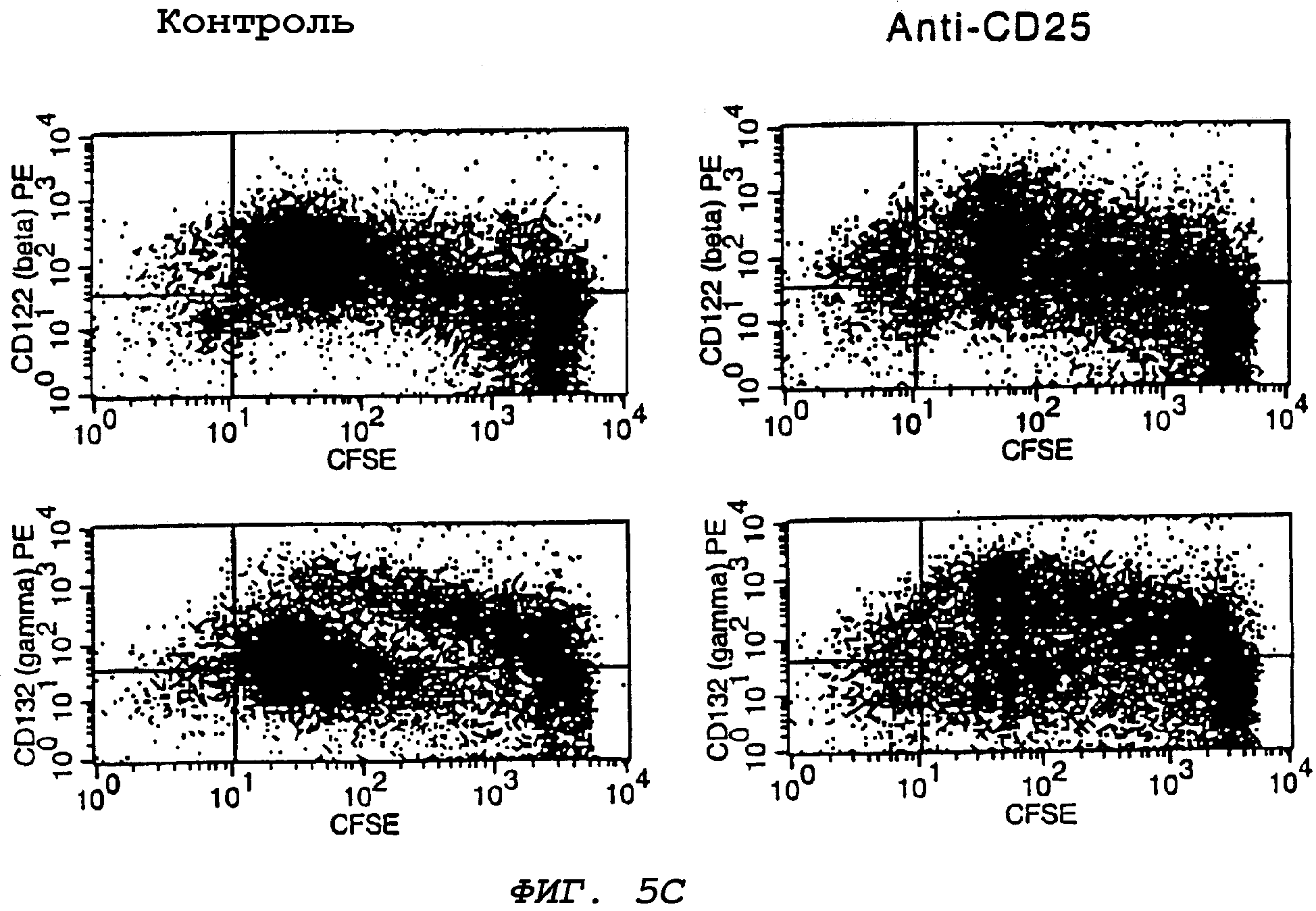
На фиг.5С представлен ряд графиков, отражающих эффект обработки антителами против CD25 на экспрессию γс в делящихся in vivo Т-клетках. Мыши-хозяева получают mAb против CD25 по 1 мг/день (i.p.) в течение трех дней непосредственно перед внутривенной инъекцией CFSE-меченных клеток. Экспрессию β- и γ-цепей IL-2-рецептора в делящихся in vivo Т-клетках определяли на третий день (т.е., через три дня после инъекции CFSE-меченных клеток). Мышей, обработанных контрольными изотипическими mAb (IgG1 крысы), учитывали в качестве контроля.
На фиг.5D представлен ряд графиков, отражающих апоптозную гибель делящихся in vivo Т-клеток. CFSE-меченные клетки стимулировали in vivo в течение трех дней. Клетки собирали из селезенки хозяина и окрашивали с помощью PE-аннексина V. Клеточное деление и апоптозную гибель клеток анализировали с помощью FACS.
На фиг. 5Е представлен ряд графиков, отражающих внутриклеточную экспрессию Bcl-2 в делящихся in vivo Т-клетках. CFSE-меченные клетки стимулировали in vivo в течение трех дней. Клетки, собранные из селезенки хозяина, окрашивали с помощью конъюгированных с PE mAb против мышиного Bcl-2 или с помощью контрольных изотипических mAb. Клеточное деление и экспрессию Bcl-2 анализировали с помощью FACS.
На фиг.6 представлена гистограмма, отражающая результаты эксперимента, в котором гибель клеток (оцениваемая по высвобождению из клеток CTLL-2 изотопа51Cr; смотрите x-ось) оценивали после обработки разными агентами. NP40 представляет собой детергент; IL-2/Fc является химерным белком, который содержит IL-2 и район Fc молекулы IgG (данная молекула является литической); С' представляет собой крысиный комплемент; IL-2/FC-/- представляет собой нелитический химерный белок, содержащий IL-2; а mIg представляет собой мышиный иммуноглобулин. Данное исследование подтверждает вывод о том, что цитолитический IL-2/Fc лизирует клетки CTLL-2, несущие IL-2R-, а нелитический IL-2/Fc не делает этого.
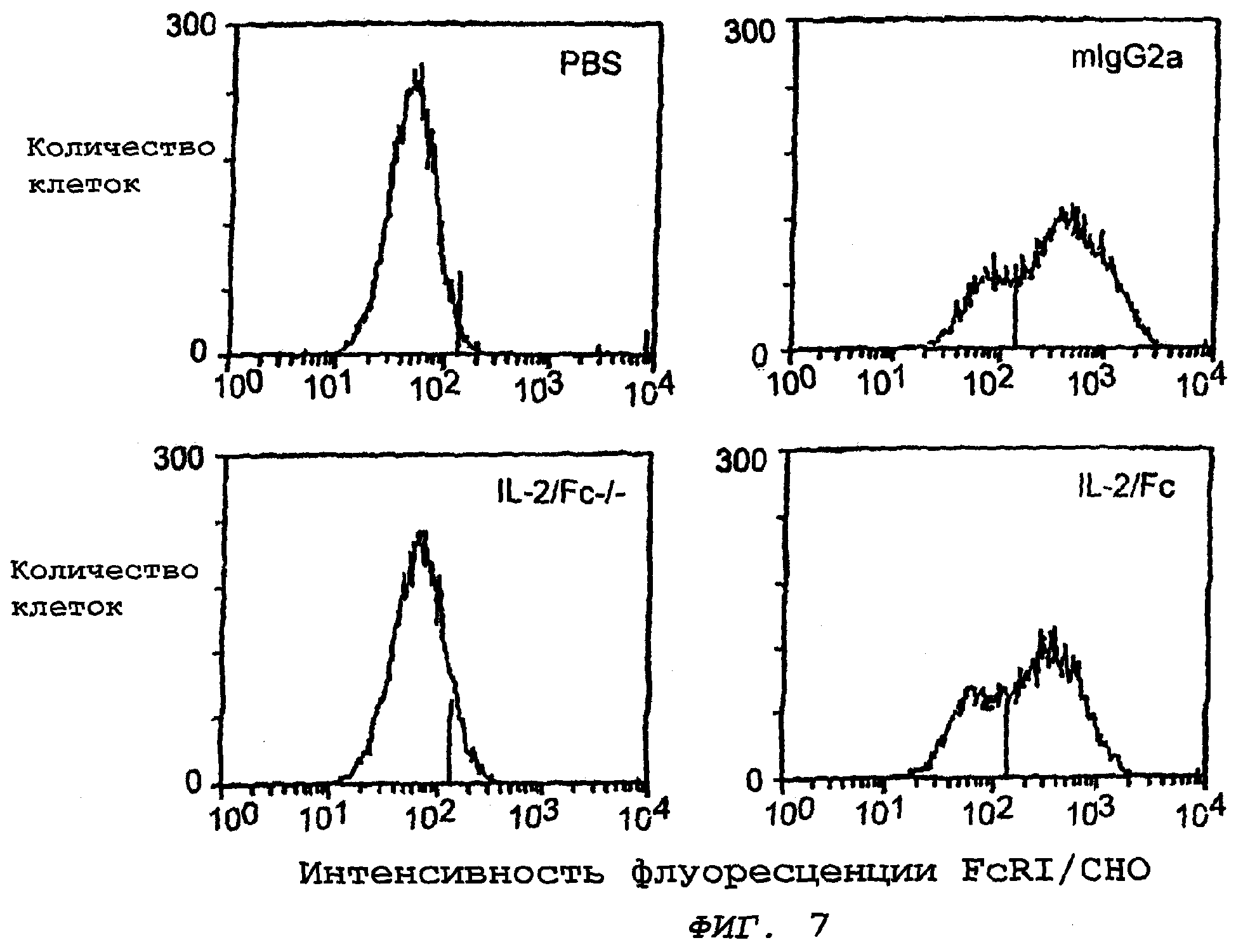
На фиг.7 представлен ряд гистограмм. Интенсивность флуоресценции FcRI в клетках СНО (клетки яичника китайского хомячка) измеряли после экспонирования последних с фосфатно-солевым буферным раствором (PBS; верхняя слева), мышиным иммуноглобулином (mIgG2a; верхняя справа), нелитической молекулой IL-2/Fc (IL-2/Fc-/-; нижняя слева), и литическим слитым белком, содержащим IL-2 (IL-2/Fc; нижняя справа). На каждой гистограмме численность клеток представлена графически против интенсивности флуоресценции FcRI/CHO. Данное исследование подтверждает вывод о том, что цитолитический IL-2/Fc связывается с FcRI, а нелитический IL-2/Fc не связывается.
На фиг.8 представлена группа из восьми графиков, отражающих пролиферативный ответ CD4+- (левая сторона) и CD8+- (правая сторона) Т-клеток in vivo. Данные клетки метили CFSE и стимулировали in vivo в течение трех дней литическими молекулами (IL-2/Fc), клеточным пролиферативным агентом (рапамицин (Rap)), или сочетанием двух агентов. В качестве негативного контроля одну группу животных не обрабатывали. IL-2/Fc анализировали по его CFSE-профилю. Данное исследование подтверждает вывод о том, что рапамицин подавляет пролиферативный сигнал IL-2.
На фиг.9 представлена группа из четырех графиков, относящихся к эксперименту, в котором CFSE-меченные лимфоциты стимулировали in vivo в течение трех дней. Экспрессию α-цепи IL-2R в делящихся Т-клетках оценивали с помощью FACS у животных, не подвергающихся лечению (вверху слева), получающих один лишь рапамицин (Rap; вверху справа), получающих один лишь IL-2/Fc (внизу слева), или получающих сочетание рапамицина и IL-2/Fc (Rap + IL-2/Fc; внизу справа). Данное исследование подтверждает вывод о том, что лечение рапамицином и IL-2/Fc усиливает экспрессию α-субъединицы IL-2R в период ранней пролиферации Т-клеток in vivo.
На фиг.10 представлена пара графиков, полученных в период, когда CSFE-меченные лимфоциты были стимулированы in vivo в течение трех дней, и проанализированы с помощью FACS. Экспрессию Annexin V в делящихся Т-клетках (CD4+) оценивали у животных, не подвергающихся лечению (левая панель), или получающих рапамицин и IL-2/Fc (Rap + IL-2/Fc; правая панель). Данное исследование подтверждает вывод о том, что лечение рапамицином и IL-2/Fc усиливают апоптоз CD4+-клеток в период ранней пролиферации Т-клеток in vivo.
На фиг.11 представлена таблица, показывающая результаты экспериментов, в которых анализируется срок существования аллотрансплантата островков у аутоиммунных, не страдающих ожирением, диабетических (NOD) мышей. Аллотрансплантаты оценивали в терминах первичной функции аллотрансплантата (показанные в данной колонке проценты соответствуют проценту мышей, у которых функционирует аллотрансплантат (функцию оценивали путем мониторинга уровня глюкозы крови)) и среднего времени существования (MST) функционирующих трансплантатов. n = числу протестированных животных. Вид обработки указан под заголовком "Обработка" (смотрите также пояснение, которое сопровождает данную таблицу, и приведенное ниже описание). Представленные здесь результаты подтверждают вывод о том, что обработка сочетанием рапамицина, IL-2/Fc и mIL-15/Fc приводит к длительному сроку существования островковых аллотрансплантатов.
На фиг.12 представлена таблица, демонстрирующая результаты экспериментов, в которых анализировался срок существования кожных аллотранплантатов у NOD-мышей. Состояние трансплантатов оценивали по продолжительности среднего времени существования (MST) функционирующих трансплантатов. n = числу протестированных животных. Виды обработки указаны под заголовком "Обработка" (смотрите также пояснение, которое сопровождает данную таблицу, и приведенное ниже описание). Представленные здесь результаты подтверждают вывод о том, что обработка сочетанием рапамицина, IL-2/Fc и mIL-15/Fc приводит к длительному сроку существования кожных аллотрансплантатов.
На фиг.13 представлена диаграмма в виде ломаной линии, которая схематически отражает % животных, которые не подвержены диабету в период после обработки литической молекулой IL-2/Fc, мышиным иммуноглобулином (mIg), и нелитической молекулой IL-2/Fc. Цитолитические молекулы IL-2/Fc блокируют аутоиммунитет, а литические молекулы IL-2/Fc - не блокируют.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Эффективный иммунный ответ начинает проявляться тогда, когда антиген или митоген запускает активацию Т-клеток. В процессе Т-клеточной активации происходят многочисленные клеточные изменения, которые включают экспрессию цитокинов и цитокиновых рецепторов. Один из цитокинов, участвующий в иммунном ответе, представляет собой интерлейкин-15 (IL-15), который является фактором Т-клеточного роста, стимулирующим пролиферацию и дифференциацию В-клеток, Т-клеток, клеток природных киллеров (NK), и in vitro активированных лимфоцитами киллерных (LAK) клеток. In vivo, пролиферация клеток этих типов усиливает иммунный ответ. Другой цитокин, участвующий в иммунном ответе, и описанный здесь, представляет собой IL-2.
Композиции настоящего изобретения включают агенты, мишенью которых является IL-15 или его рецептор, и IL-2 или его рецептор, а также способы, в которых эти композиции используются для супрессии иммунного ответа (напр., гуморального или клеточного иммунного ответа). В ряде случаев пациенты испытывают благоприятное воздействие от супрессии иммунного ответа, например, при трансплантации органа или при иммунном заболевании, особенно при аутоиммунном заболевании, или в реакции "трансплантат против хозяина". В других случаях, например, когда отдельные иммунные клетки становятся злокачественными или аутоагрессивными, является полезным активное разрушение таких клеток.
Настоящее изобретение основывается на открытие новых путей подавления иммунного ответа. Ингибирование можно осуществить путем введения сочетания агентов, мишенью одого из которых является IL-15 или IL-15R, а мишенью другого является IL-2 или IL-2R (режимы введения, включая ex vivo-обработку трансплантатов, известны в данной области техники и описывается ниже). Вообще, численность антиген-реактивных Т-клеток можно снизить в результате активации сигнальных путей, что ведет к гибели активированных Т-клеток (вследствие, напр., AICD); лишения клеток факторов, которые необходимы для их выживания (говорят, что клетки, которые погибают после такого лишения факторов, погибают пассивной клеточной смертью); или нацеливания активированных клеток на лизис с помощью компонентов иммунной системы (говорят, что клетки, которые погибают таким образом, погибают вследствие ADCC или CDC. В соответствии с этим, композиции настоящего изобретения включают агенты, которые осуществляют один или несколько таких исходов (напр., которые способствуют гибели Т-клеток посредством признанного пути гибели клетки (напр., AICD, пассивная клеточная гибель, ADCC, или CDC). Помимо наличия одного или нескольких агентов, которые способствуют гибели Т-клеток, композиции настоящего изобретения могут включать один или несколько агентов, которые подавляют пролиферацию Т-клеток (возникающую, напр., в ответ на любой антиген). Например, в настоящем изобретении охарактеризована композиция (напр., фармацевтически приемлемая композиция или созданная для применения в органной культуре или в клеточной культуре), которая включает IL-2/Fc (который, например, способствует AICD и клеточному лизису с помощью ADCC или CDC), mIL-15/Fc (который является антагонистом IL-15 (и, тем самым, способствует клеточной гибели) и способствует клеточному лизису с помощью ACDD или CDC), и рапамицин (который подавляет пролиферацию Т-клеток).
Термин "агент" относится, в сущности, к любому типу молекул, которые могут использоваться в качестве терапевтического агента. Белки, такие, например, как антитела, химерные белки, и растворимые лиганды, любой из которых может быть либо идентичен природному белку, либо содержать мутацию (напр., делецию, добавку, или замену одного или нескольких аминокислотных остатков), и молекулы нуклеиновых кислот, которые кодируют их (или которые являются "антисмысловыми" для них; напр., олигонуклеотид, который является антисмысловым для нуклеиновых кислот, которые кодируют IL-2, IL-15, или компонент (напр., субъединицу) их рецепторов), все они являются "агентами". Агенты настоящего изобретения могут быть введены системно, локально, или путем, основанным на клеточной терапии (т.е., агент настоящего изобретения может быть введен пациенту путем введения клеток, которые экспрессируют этот агент. Данные клетки могут представлять собой клетки, вводимые данному пациенту исключительно с целью экспрессии данного терапевтического агента. Эти клетки могут быть также клетками клеточного, тканевого, или органного трансплантата. Например, трансплантируемые клетки (напр., клетки островков) или клетки в пределах тканей или органов (напр., клетки в пределах кусочка кожи или печени, почки или сердца) можно обрабатывать агентом или трансдуцировать молекулой нуклеиновой кислоты, которая кодирует агент ex vivo (напр., перед трансплантацией). При этом трансплантируемые клетки сами продуцируют собственные иммуносупрессивные агенты. Например, клетку с требуемым фенотипом (напр., клетка, продуцирующая инсулин) можно модифицировать включением гена, продуцирующего один или несколько иммуносупрессивных факторов настоящего изобретения. Трансплантируемую клетку, ткань, или орган можно обработать либо перед, либо после трансплантации. Способы введения агентов пациентам (либо в клеточную или в органную культуру) известны, обычно используются специалистами в данной области техники и рассматриваются ниже.
Агенты, мишенью которых являются IL-15 или IL-15R
Композиции настоящего изобретения могут включать один или несколько агентов, мишенью которых являются IL-15 или IL-15-рецептор. Как указано выше, одиночный агент может обладать множеством функциональных доменов. Агенты, мишенью которых являются IL-15 или IL-15R, включают агенты, которые связываются (или иначе взаимодействуют) с IL-15, IL-15R, или с нуклеиновыми кислотами, которые кодируют их, а также агенты, которые связываются, и впоследствие разрушают клетки, несущие IL-15R, такие, как активированные Т-клетки. Таким образом, агенты, пригодные для осуществления иммунной супрессии, могут содержать две функциональные составляющие: нацеливающая составляющую, которая нацеливает данный агент к клетке, несущей IL-15R, и истощающую (напр., лизирующую) клетку-мишень составляющую, что приводит к элиминации клетки, несущей IL-15R. В одном из вариантов осуществления настоящего изобретения нацеливающая составляющая связывает IL-15R без эффективной трансдукции сигнала с помощью этого рецептора. Например, нацеливающая составляющая может включать мутантный полипептид IL-15, а составляющая, истощающая клетки-мишени, может включать Fc-район иммуноглобулиновой молекулы. Fc-район может происходить от IgG, например IgG1, IgG2, IgG3, IgG4 человека, или из аналогичных IgG млекопитающих, или от IgM, таких как IgM человека или из аналогичных IgM млекопитающих. В предпочтительном варианте осуществления настоящего изобретения Fc-район включает шарнир, домены СН2 и СН3 IgG1 человека или мышиного IgG2a. Хотя настоящее изобретение не ограничивается агентами, которые функционируют с помощью какого-нибудь конкретного механизма, полагают, что Fc-район опосредует управляемую комплементом и фагоцитами элиминацию клеток, несущих IL-15R.
Получены мутантные полипептиды IL-15, которые связывают рецепторный комплекс IL-15 с аффинностью, подобной IL-15 дикого типа, но не способны полностью активировать передачу сигнала. Эти мутантные полипептиды эффективно конкурируют с полипептидами IL-15 дикого типа и могут подавлять одно или несколько событий, которые обычно происходят в ответ на IL-15-сигнал, такое, например, как клеточная пролиферация. Используемый здесь полипептид IL-15 дикого типа представляет собой полипептид, который идентичен природно встречаемому IL-15 (напр., полипептид IL-15 дикого типа показан на Фиг.1). Напротив, "мутантный полипептид IL-15" представляет собой полипептид, который обладает, по меньшей мере, одной мутацией, по сравнению с IL-15 дикого типа, и который подавляет, по меньшей мере, одну из активностей in vivo или in vitro, которая, как правило, стимулируется IL-15 дикого типа.
Мутантный полипептид IL-15, который можно использовать в соответствии с настоящим изобретением, будет, как правило, блокировать, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 70%, и наиболее предпочтительно, по меньшей мере, на 90% одну или более активностей молекулы IL-15 дикого типа. Способность мутантного полипептида IL-15 блокировать активность IL-15 дикого типа можно определить с помощью разных анализов, включая описанный здесь анализ пролиферации клеток BAF-BO3 (в котором данные клетки были трансфицированы конструкцией, кодирующей IL-2Rβ). Кроме того, мутантные полипептиды настоящего изобретения можно определить по конкретной процентной идентичности, которую они проявляют в отношении IL-15 дикого типа. При рассмотрении процентной идентичности двух полипептидов, длина сравниваемых последовательностей должна составлять, обычно, по меньшей мере, 16 аминокислот, предпочтительно, по меньшей мере, 20 аминокислот, более предпочтительно, по меньшей мере, 25 аминокислот, и наиболее предпочтительно, по меньшей мере, 35 аминокислот. Термин "идентичность", используемый по отношению к полипептидной или ДНК-вой последовательности, относится к идентичности субъединиц (аминокислотные остатки белков или нуклеотиды молекул ДНК) в двух полипептидных или ДНК-овых последовательностях, которые сравниваются. Если положение субъединицы в обоих молекулах занимает одна и та же мономерная субъединица (т.е., один и тот же аминокислотный остаток или нуклеотид), то рассматриваемые молекулы идентичны по этому положению. Сходство между двумя аминокислотными последовательностями или двумя нуклеотидными последовательностями прямо зависит от числа идентичных позиций. Поэтому, полипептид, который на 50% идентичен стандартному полипептиду, который содержит в длину 100 аминокислот, может представлять собой полипептид, длиной 50 аминокислот, полностью идентичный участку стандартного полипептида длиной в 50 аминокислот. Это может быть также полипептид длиной 100 аминокислот, который на 50% идентичен стандартному полипептиду по всей его длине. Разумеется, и другие многие полипептиды могут удовлетворять этим критериям. Идентичность обычно и наиболее удобно измеряется с использованием программного обеспечения анализа последовательности, такого, например, как Пакет Программ для Анализа Последовательностей с параметрами по умолчанию, разработанный Генетической Компьютерной Группой Биотехнологического Центра Висконсинского Университета (1710 University Avenue, Madison, WI 53705).
Мутантный полипептид IL-15 настоящего изобретения может быть идентичен, по меньшей мере, на 65%, предпочтительно, по меньшей мере, на 80%, более предпочтительно, по меньшей мере, на 90%, и наиболее предпочтительно, по меньшей мере, на 95% (напр., 96%, 97%, 98% или 99%) IL-15 дикого типа. Данная мутация может заключаться в изменении числа или содержания аминокислотных остатков. Например, мутантный IL-15 может обладать большим или меньшим числом аминокислотных остатков по сравнению с IL-15 данного типа. И наоборот, или в дополнение, этот мутантный полипептид может содержать замену по одному или нескольким аминокислотным остаткам, которые присутствуют в IL-15 дикого типа. Мутантный полипептид IL-15 может отличаться от IL-15 дикого типа добавкой, делецией, или заменой одного аминокислотного остатка, например, добавкой, делецией или заменой остатка в положении 156. Подобным же образом, мутантный полипептид может отличаться от полипептида дикого типа добавкой, делецией, или заменой по двум аминокислотным остаткам, например по остаткам в положении 156 и 149. Например, мутантный полипептид IL-15 может отличаться от IL-15 дикого типа заменой глутамина на аспартат по остаткам 156 и 149 (как показано на Фиг.2). Мутантные полипептиды, пригодные в качестве нацеливающих агентов, подобно IL-15 дикого типа, распознают и связывают компонент IL-15R. В одном из вариантов осуществления настоящего изобретения мутация в IL-15 происходит в карбоксиконцевом домене цитокина, который, как полагают, связывает IL-2Rγ (субъединица IL-2-рецептора). Альтернативно, или в дополнение, мутантные полипептиды IL-15 могут включать одну или несколько мутаций в пределах связывающего домена IL-2Rβ (β-субъединица IL-2-рецептора).
В случае, если мутантный полипептид IL-15 содержит замену одного аминокислотного остатка на другой, данная замена может представлять собой, но не обязательно, консервативную замену, которая включает замену в рамках следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин.
Вместо используемого IL-15-нацеливающего полипептида (напр., мутантного полипептида IL-15) или в дополнение к нему, терапевтический агент может представлять собой антитело. Например, IL-15 может служить мишенью (т.е., специфически связаться) для антитела. Подобным же образом IL-15R может служить мишенью для антител, которые связывают компонент IL-15R (напр., IL-15Rα-субъединицу). Способы, с помощью которых можно получить антитела, в том числе и гуманизированные антитела, к компоненту IL-15R хорошо известны в данной области техники.
Такие антитела, например, как субклассы IgG3 и IgG1 (последний предпочтителен) человека, или мышиный субкласс IgG2а, предпочтительно должны быть способны активировать комплемент и фагоцитоз.
Способы настоящего изобретения можно также осуществлять с композициями, которые содержат: (а) два или более агента, каждый из которых ускоряет гибель Т-клеток или (b) по меньшей мере, один агент, который ускоряет гибель Т-клеток, и, по меньшей мере, один агент, который подавляет пролиферацию Т-клеток. Агент, который ускоряет гибель Т-клеток, может также провоцировать пассивную гибель клеток, которая происходит при утрате Т-клетками фактора, необходимого для их выживания. Одним из таких агентов является IL-15 (другие описаны ниже). Поэтому агенты, которые подавляют способность IL-15 служать в качестве фактора выживаемости (напр., антитело, которое специфически связывается с IL-15 или c IL-15-рецептором), можно включать в композиции настоящего изобретения (напр., композиция может включать агент, который содействует AICD, агент, который ускоряет пассивную гибель клеток (напр., антитело к IL-15), и необязательно включать агент, который подавляет пролиферацию Т-клеток.
Как описано выше, агенты, пригодные для осуществления иммунной супрессии, могут содержать две функциональные составляющие: нацеливающую составляющую, которая нацеливает данный агент к клеткам, несущим IL-15R (такую, как только что описанная мутантная молекула IL-15), и составляющую, истощающую клетки-мишени, которая, например лизирует или иным образом приводят к элиминации клеток, несущих IL-15R. Поэтому, данный агент может представлять собой химерный полипептид, который включает мутантный полипептид IL-15 и гетерологичный полипептид, такой как Fc-район антител подклассов IgG и IgM. Этот Fc-район может включать мутацию, которая подавляет фиксацию комплемента и связывание Fc-рецептора, или он может истощать клетки-мишени (т.е., способен разрушать клетки путем связывания комплемента или с помощью иного механизма, такого, например, как антитело-зависимого комплементного лизиса).
Fc-район можно выделить из природно встречаемого источника, рекомбинантно получаемого, или синтезируемого (каким может быть любой полипептид, охарактеризованный в настоящем изобретении). Например, Fc-район, который гомологичен С-концевому домену IgG, можно получить путем расщепления IgG с помощью папаина. Fc IgG обладает молекулярной массой приблизительно 50 кДа. Полипептиды настоящего изобретения могут включать полный Fc-район, или небольшую часть, которая сохраняет способность лизировать клетки. Кроме того, полноразмерные или фрагментированные Fc-районы могут являться вариантами молекулы дикого типа. То есть, они могут содержать мутации, которые могут или не могут влиять на функцию данного полипептида.
Здесь приводится ссылка на агенты, мишенью которых является интерлейкин или интерлейкиновый рецептор. Нацеливание происходит, если агент прямо или косвенно связывается или иным образом взаимодействует с интерлейкином или с интерлейкиновым рецептором так, что влияет на активность данного интерлейкина или интерлейкинового рецептора. Активность может определить специалист в данной области техники с помощью стандартных лабораторных методов. Например, специалист может определить силу сигнальной трандукции или другого следующего происходящего биологического события, или которое должно было бы нормально происходить после связывания рецептора. Активность, порожденная агентом, мишенью которого является интерлейкин или интерлейкиновый рецептор, может отличаться, но не обязательно, от активности, которая возникает при связывании встречаемого в природе интерлейкина с естественно встречаемым интерлейкиновым рецептором. Например, агент, мишенью которого является IL-2-рецептор, находится в рамках настоящего изобретения, даже если этот агент порождает, по существу, ту же активность, которая имеет место у рецептора, связавшегося встречаемым в природе IL-2. Если агент порождает активность, которая в значительной степени остается той же или становится выше активности, порожденной встречаемым в природе лигандом, то такой агент можно описать в качестве агониста рецептора (агент и природный лиганд проверяются в одинаковых условиях). Если агент порождает активность, которая меньше активности, порожденной встречаемым в природе лигандом, то этот агент можно описать в качестве антагониста данного рецептора (при первичном взаимодействии агента с рецептором; напр., mIL-15) или интерлейкина (при первичном взаимодействии агента с интерлейкином; напр., антитело к IL-15). И в данном случае, уровни активности определяют тестированием данного агента и данного встречаемого в природе рецептора (или лиганда) в одних и тех же условиях.
Fc-район, который может являться частью агентов настоящего изобретения, может быть "истощающим клетки-мишени" или "не истощающим клетки-мишени". Fc-район, не истощающий клетки-мишени, обычно не обладает высоким сродством к сайту связывания Fc-рецептора, и к сайту связывания C'1q. Высокоаффинный рецептор-связывающий сайт Fc-района мышиной молекулы IgG, включает остаток Leu в положении 235 Fc IgG. Поэтому, мышиный рецептор-связывающий сайт Fc можно разрушить в результате мутирования или делетирования Leu 235. Например, замена Leu 235 на Glu подавляет способность Fc-района связывать высокоаффинный Fc-рецептор. Мышиный С'1q-связывающий сайт можно функционально разрушить путем мутирования или делетирования остатков Glu 318, Lys 320, и Lys 322 молекулы IgG. Например, замена остатков Glu 318, Lys 320, и Lys 322 на Ala делает Fc IgG неспособным для прямого антителозависимого лизиса с участием комплемента. Напротив, Fc-район IgG, истощающий клетку-мишень, обладает высокоаффинным сайтом связывания Fc-рецептора и сайтом связывания C'1q. Высокоаффинный сайт связывания Fc-рецептора включает остаток Leu в положении 235 Fc молекулы IgG, а сайт связывания C'1q включает остатки Glu 318, Lys 320, и Lys 322 молекулы IgG1. Истощающий клетку-мишень Fc IgG обладает по этим сайтам природными остатками или консервативными аминокислотными заменами. Истощающий клетку-мишень Fc IgG может быть нацелен на клетки для антителозависимой клеточной цитотоксичности или для цитолиза, управляемого комплементом (CDC). Известны также соответствующие мутации IgG человека (смотрите, напр., Morrison и соавт., The Immunologist 2:119-124, 1994; и Brekke и соавт., The Immunologist 2:125, 1994).
Агенты, мишенью которого является IL-15R, могут быть мутанты полипептиды IL-15, необязательно слитые с антигенной меткой (напр., FLAG-последовательность). FLAG-последовательности распознаются биотинилированными, высокоспецифичными антителами против FLAG, как описано здесь (смотрите также Blanar и соавт., Science 256:1014, 1992; LeClair и соавт., Proc. Natl. Acad. Sci. USA 89:8145, 1992).
Кроме того, растворимая α-цепь IL-15R может использоваться в качестве антагониста. Хотя рецепторный комплекс IL-15 состоит из α-, β-, γ -субъединиц, отдельно взятая α-цепь проявляет высокое сродство к IL-15. Поэтому, растворимая α-цепь IL-15R будет связывать IL-15 и предохранять IL-15 от связывания с комплексом IL-15R, связанным с клеточной поверхностью. Следовательно, растворимая α-цепь IL-15R может действовать в качестве рецептор-специфичного антагониста.
Создание растворимой α-цепи IL-15R включает в себя клонирование внеклеточного фрагмента α-цепи IL-15R из рецептор-позитивных клеток, таких как активированные Т-клетки или клеточные линии, экспрессирующие рецептор, и, необязательно, его слияние с молекулярной маркерной последовательностью. Маркерная последовательсть может представлять собой, например, FLAG, GST, или гистидин. Данная генетическая конструкция в экспрессионном векторе может быть трансфицирована в экспрессирующие клеточные линии. Меченую растворимую α-цепь IL-15R, полученную с помощью экспрессирующих клеточных линий, выделяют очисткой с использованием mAbs, специфичных для Tag-последовательности.
Кроме того, внеклеточный домен IL-15R можно присоединить (напр., слиянием посредством пептидной связи) к иммуноглобулиновому Fc-домену (напр., к шарниру, СН2- и СН3-доменам Иммуноглобулина G), предпочтительно IgG- или IgM-субтипа. Такой слитой белок мог бы экспрессироваться в клетках соответствующего типа, многие из которых известны специалистам в данной области техники.
Агенты, мишенью которых являются IL-2 или IL-2-рецептор
Для того чтобы подавить иммунный ответ можно ввести агенты, мишенью который являются вышеописанные клетки, несущие IL-15R, вместе с агентом, мишенью которого является IL-2 или IL-2R. Агент, который вводится "вместе с" другим, можно вводить, но не обязательно, в одно и то же время или одним и тем же способом (хотя данное примечание и приводится в контексте обсуждения агентов, родственных IL-2, оно применимо к любым другим агентам или молекулам, объединенным в композиции настоящего изобретения). Например, агент, мишенью которого является IL-15R, можно вводить до или после введения агента, мишенью которого является IL-2R. Подобно этому, агент, мишенью которого является IL-15 или IL-15R, можно вводить ex vivo (для обработки, например, клеток, тканей, или органа, предназначенных для трансплантации), тогда как агент, мишенью которого является IL-2 или IL-2R, можно вводить системно (напр., внутривенно) пациенту (напр., пациенту, который получает трансплантат, обработанный ex vivo агентом, мишенью которого является IL-15). Аналогично, можно применять агент, который усиливает AICD в разное время или иным способом, чем агент, который подавляет пролиферацию клеток. Таким образом, в способах настоящего изобретения любой из агентов, или видов молекул, которые объединяются в композиции настоящего изобретения, можно вводить раздельно.
Для того чтобы ингибировать IL-2R, можно вводить любой агент, который связывается и порождает антагонизм с IL-2 или IL-2R. Агенты, мишенью которых являются IL-2 или IL-2R, включают агенты, которые связываются с IL-2 или IL-2R, а также агенты, которые связываются и последовательно разрушают клетки, несущие IL-2R, такие как активированные Т-клетки. Как описано выше, в контексте нацеливавания на IL-15, агенты, пригодные для осуществления иммунной супрессии, могут содержать составляющую, которая нацеливает агент к клетке, несущей IL-2R, и составляющую, истощающую (напр., лизирующую) клетку-мишень, что приводит к элиминации клетки, несущей IL-2R. Например, указанная нацеливающая составляющая может связывать IL-2R, без эффективной трансдукции сигнала через этот рецептор. В это событие включается Fc-район, причем этот район может происходить от тех же вышеописанных иммуноглобулиновых молекул.
Нацеливающие агенты, такие, например, как IL-2/Fc-агент (смотрите, например, Zheng и соавт., J. Immunol. 163:4041-4048, 1999), можно вводить вместе с агентом, таким как рапамицин, который предотвращает опосредованную IL-2 передачу сигнала IL-2R. Агенты, которые подавляют пролиферацию клеток, также хорошо известны специалистам в данной области техники (и обсуждаются ниже).
Вместо использования, или в дополнение к использованию, IL-2R-нацеливающего полипептида (напр., полипептид IL-2), данный терапевтический агент, используемый в сочетании с IL-15-антагонистом, может представлять собой антитело против IL-2 или против IL-2R (напр., гуманизированные антитела), которые являются антагонистами, соответственно, IL-2 или IL-2R.
Как пояснено выше, способы настоящего изобретения (напр., способы подавления иммунного ответа (напр., клеточного иммунного ответа), способы подавления отторжения трансплантата, и способы лечения злокачественных опухолей) можно также осуществлять с помощью композиций (напр., фармацевтически приемлемых композиций), которые содержат: (а) два или более агентов, каждый из которых способствует гибели Т-клеток или (b) по меньшей мере, один агент, который способствует гибели Т-клеток, и, по меньшей мере, один агент, который подавляет пролиферацию Т-клеток. Агент, который способствует гибели Т-клеток, может способствовать такой гибели путем ускорения AICD (индуцированной активацией гибели клеток), и такие агенты включают IL-2 и молекулы, которые функционируют в качестве IL-2-агонистов. Например, IL-2/Fc, мутанты IL-2, которые сохраняют способность связывать и передавать сигнал через IL-2-рецептор, и антитела, которые специфически связывают и являются агонистами IL-2-рецептора (напр., антитело, которое специфически связывает α-субъединицу IL-2-рецептора), могут быть включены в композиции настоящего изобретения. Другие агенты, которые усиливают AICD, включают Fas-Лиганд (FasL), который стимулирует гибель Т-клеток, путем активации каскада передачи сигнала с участием Fas на активированных Т-клетках, и его биологически активные мутанты.
Агенты, которые способствуют пассивной гибели клеток
Пассивная гибель Т-клеток происходит в том случае, если Т-клетки лишают агента, который необходим для их выживания. Помимо IL-15, существенны и факторы, включающие IL-4, IL-7, OX-40-лиганд, IFNβ, 4-1BB и IGF-1 (т.е. Т-клетки гибнут в отсутствие каждого из этих факторов; смотрите, напр., Tu и соавт., J. Immunol. 165:1331-1336, 2000; Tsuda и соавт. J. Immunol. Meth. 236:37-51, 2000; Bertolino и соавт., Int. Immunol. 11:1225-1238, 1999; Takahashi и соавт., J. Immunol. 162:5037-5040, 1999; Pilling и соавт., Eur. J. Immunol. 29:1041-1050, 1999; Chu и соавт., J. Immunol. 162:1896-1903, 1999; и Weinberg и соавт., Semin. Immunol. 10:471-480, 1998). Т-клетки можно лишить одного или нескольких из этих факторов (IL-15, IL-4, IL-7, и т.д.) путем, например, экспонирования этих клеток в культуре in vivo с агентами, которые селективно связываются с одним или несколькими этими факторами или иным образом предохраняют их от взаимодействия с Т-клетками, которое происходит в нормальных условиях (результатом такого лишения является пассивная гибель клеток).
Агенты, которые усиливают ADCC или CDC
ADCC и CDC можно спровоцировать с помощью агентов, которые связываются с Т-клеточной поверхностью и которые содержат Fc-район молекулы иммуноглобулина, которая активирует ADCC или CDC. Примеры таких агентов включают антитела, которые связываются со структурами клеточной поверхности, экспрессируемыми на активированных иммунных клетках (напр., рецепторами клеточной поверхности, такими как CD154, рецептор IL-2, и рецептор IL-15). Кроме того, можно использовать химерный слитый белок лиганд/Fc, который связывается с рецепторными белками на поверхности активированных клеток (напр., IL-2/Fc или mIL-15/Fc). Зная эти примеры, специалистам в данной области техники должны быть очевидны и другие подходящие агенты.
Агенты, которые ингибируют клеточную пролиферацию
Агенты, которые ингибируют клеточную пролиферацию, включают рапамицин (Sirolimus), микофенолатмофетил (MMF), азатиоприн, и любые другие агенты, о которых известно, что они пригодны для лечения гиперпролиферативных нарушений (таких как злокачественная опухоль). Хорошо охарактеризованные химиотерапевтические средства включает агенты, которые подавляют метаболизм нуклеиновых кислот (такие, как ингибиторы биосинтеза пурина и пиримидина, ингибиторы синтеза РНК, а также связывающие ДНК, модифицирующие ДНК, или интеркалирующие (встраивающиеся) агенты). Эти агенты, особенно пригодные в случае, когда данная композиция, используемая, например, для ингибирования иммунного ответа, содержит также такой агент как IL-2/Fc, который не только усиливает AICD, но также стимулирует пролиферацию Т-клеток.
Агенты, которые ингибируют клеточную пролиферацию, включают также антиметаболиты фолиевой кислоты, такие как метотрексат (MTX) и пириметамин; антиметаболиты пурина (такие как 6-меркаптопурин (6-MP) и азатиоприн) и антагонисты пиримидина, такие как цитарабин (ara-C), 5-азацитидин, и 5-фторурацил (эти категории упомянуты выше); алкилирующие и иные ДНК-связывающие агенты (напр., циклофосфамид (CPA); митомицин С, и доксорубицин (Adriamycin)); алкалоиды барвинка (напр., винкристин); и кальцинуриновые ингибиторы (напр., циклоспорин А, FK506, и Бреквинар).
Другие агенты, которые могут использоваться для ингибирования клеточной пролиферации, включают агенты, которые непосредственно мешают белкам, участвующим в регуляции клеточного цикла (такие как анти-CDK (Киназа Клеточного Деления) или антициклины) или белки, которые влияют на контрольные точки пролиферации клеток (все пролиферирующие клетки обладают контрольными точками на разных стадиях клеточного цикла, что предохраняет их от вступления в следующую стадию цикла клеточного деления (CDC) до завершения ими предыдущей стадии). Пути метаболизма, которые вовлечены в надзор над контрольными точками, включают ингибиторы синтеза ДНК, РНК и белкового синтеза (напр., ингибиторы S6-киназы и PI-3-киназы). Могут также использоваться ингибиторы цитокинеза.
Методы скрининга агентов, которые ингибируют иммунный ответ
Помимо тестирования в описанных ниже опытах in vitro агента-кандидата (напр., мутантного полипептида IL-15 или IL-2), можно использовать любой из следующих in vivo анализов для тестирования, какое конкретное сочетание описанных здесь агентов наиболее эффективно вызывает иммунную супрессию. Например, можно тестировать один или несколько агентов, мишенью которых является IL-15R, в сочетании с одним или несколькими агентами, которые противодействуют IL-2 или его рецептору. Эти анализы in vivo представляют лишь некоторые из стандартных способов, в которых специалисты в данной области техники могли бы, дополнительно, проанализировать эффективность агентов настоящего изобретения. Они были выбраны для включения здесь из-за их релевантности для разнообразных клинических состояний, подлежащих лечению агентами, мишенью которых являются IL-2, IL-15, и их рецепторы. Например, данные анализы релевантны при трансплантации органов, иммунных заболеваниях, особенно аутоиммунных заболеваниях, при реакции "трансплантат против хозяина" и злокачественных опухолях иммунной системы (напр., злокачественных опухолях, которые возникают в случае, когда Т-клетки становятся злокачественными).
Парадигмы трансплантаций
Для того чтобы выяснить действительно ли сочетание агентов настоящего изобретения осуществляет иммунную супрессию, данное сочетание можно применить (или непосредственно, с помощью генной терапии, или с помощью клеточной терапии) в контексте надежных примеров трансплантации.
Агенты настоящего изобретения, кодирующие их молекулы нуклеиновых кислот (или молекулы, которые гибридизуют с ними и тем самым ингибируют их), можно вводить системно или локально с помощью стандартных средств любому традиционному лабораторному животному, такому как крыса, мышь, кролик, морская свинка, или собака перед аллогенной или ксеногенной трансплантацией кожи, трансплантацией органа, или клеточной трансплантацией, осуществляемой на данном животном. Линии мышей, такие как С57В1-10, B10.BR, и B10.AKM (Jackson Laboratory, Bar Harbor, ME), которые обладают одинаковым генетическим фоном, но отличаются по локусу Н-2, наиболее пригодны для оценки различных трансплантаций органов.
Трансплантация сердца
Способ осуществления трансплантации сердца путем анастомоза донорского сердца к большим сосудам брюшной полости хозяина впервые опубликован Ono и соавт. (J. Thorac. Cardiovasc. Surg. 57:225, 1969; смотрите также Corry и соавт., Transplantation 16:343, 1973). С помощью этой хирургической процедуры и используя стандартные методы микрососудистого анастомоза, аорту донорского сердца соединяют с аортой брюшной полости хозяина, а легочную артерию донорского сердца соединяют с прилегающей полой веной. После того, как сердце трансплантировано на место и нагрето до 37°С с помощью молочнокислого раствора Рингера, возобновляется нормальный синусный ритм. Функционирование трансплантированного сердца часто можно оценить прощупыванием сквозь стенку живота сокращений желудочка. Отторжение определяют по прекращению сокращений миокарда. Агенты настоящего изобретения (напр., сочетание мутантного IL-15/Fc и антитела, которое связывается с IL-2 или IL-2R и ингибирует их, или сочетание мутантного IL-15/FC, IL-2/Fc, и рапамицина) следует считать эффективными для ослабления отторжения органа, если хозяева, которые получают эти агенты, более продолжительное время демонстрируют приживление трансплантированного донорского сердца по сравнению с хозяевами, которые не получали этих агентов.
Трансплантация кожи
Эффективность различных сочетаний агентов настоящего изобретения можно также определить после транплантации кожи. Для осуществления трансплантации кожи у грызунов животное-донор анестезируют и с части хвоста полностью удаляют кожу. Животное-реципиент тоже анестезируют и готовят ложе для трансплантата путем удаления участка кожи со сбритого бока. Как правило, данный участок составляет, приблизительно, 0,5×0,5 см. Куску кожи от донора придают форму, которая соответствует ложу трансплантата, позиционируют, накрывают марлей и бинтуют. Трансплантаты осматривают ежедневно, начиная с шестого послеоперационного дня, и считают их отторгнутыми, если более половины трансплантированного эпителия оказывается нежизнеспособным. Агенты настоящего изобретения (напр., сочетание мутантного IL-15/Fc и антитела, которое связывается с IL-2 или IL-2R и ингибирует их, или сочетание мутантного IL-15/FC, IL-2/Fc, и рапамицина) следует считать эффективными для ослабления отторжения кожного транплантата, если хозяева, которые получают эти агенты, более продолжительное время демонстрируют приживление трансплантированной донорской кожи по сравнению с хозяевами, которые не получали этих агентов.
Типичный пример эксперимента по трансплантации кожи, результаты которого демонстрируют пригодность композиции, содержащей IL-2/Fc, mIL-15/Fc и рапамицин, описывается в Примерах (ниже) и суммируется на Фиг.12.
Модель островкового аллотрансплантата
Аллотрансплантаты клеток островков DBA/2J можно трансплантировать грызунам, например, 6-8-недельным мышам B6 AF1, ставшими диабетиками после однократной внутрибрюшинной инъекции стрептозотоцина (225 мг/кг; Sigma Chemical Co., St. Louis, MO). В качестве контроля диабетическим мышам можно трансплантировать сингенные клетки островков. Трансплантацию клеток островков можно осуществить, следуя опубликованным протоколам (смотрите, например, Gotoh и соавт., Transplantation 42:387, 1986). Вкратце, поджелудочную железу донора перфузировали in situ коллагеназой тип IV (2 мг/мл; Wortington Biochemical Corp., Freehold, NJ). После 40-минутного периода расщепления при 37°С, выделяют островки поджелудочной железы в прерывистом градиенте фиколла. Затем 300-400 островков трансплантируют в почечную капсулу каждого реципиента. Функционирование аллотрансплантата можно отследить серией измерений глюкозы крови (Accu-Check IIITM; Boehringer, Mannheim, Германия). Функционирование первичного трансплантата определяют по уровню глюкозы крови в 11,1 ммоль/л на 3-й день после трансплантации, а отторжение транплантата определяют по возрастанию содержания глюкозы крови, превышающему 16,5 ммоль/л (по меньшей мере, в каждый из 2-х последующих дней) после периода функционирования первичного трансплантата.
Модели аутоиммунного заболевания
Чтобы оценить сочетания агентов настоящего изобретения in vivo, модели аутоиммунного заболевания создают иными способами. Эти модели хорошо известны рядовым специалистам в данной области техники и могут использоваться, чтобы выяснить, насколько данное сочетание агентов, которые, например, включают агент, мишенью которого является IL-15R, было бы терапевтически пригодным для лечения специфического аутоиммунного заболевания при его (сочетание агентов) доставке либо непосредственно, с помощью генной терапии, или с помощью клеточной терапии.
Аутоиммунные заболевания, которые моделировались у животных, включают ревматические заболевания, такие как ревматоидный артрит и системная красная волчанка (SLE), диабет типа I, а также аутоиммунные заболевания щитовидной железы, кишечника, и центральной нервной системы. Например, животные модели SLE включают MRL-мышей, BXSB-мышей, и NZB-мышей и их F1-гибриды. Этих животных можно скрещивать с целью изучения конкретных аспектов процесса ревматического заболевания; у потомства мышей линии NZB при скрещивании с NZW-мышами развивается тяжелый волчаночный гломерулонефрит (Bielschowsky и соавт., Proc. Univ. Otago Med. Sch. 37:9, 1959; смотрите также Fundamental Immunology, Paul, Ed., Raven Press, New York, NY, 1989). Подобно этому, сдвиг к летальному нефриту можно увидеть у потомства от скрещиваний NBZ X SWR (Data и соавт., Nature 263:412, 1976). У SNF1-мышей хорошо охарактеризованы гистологически выявляемые повреждения почек (Eastcott и соавт., J. Immunol. 131:2232, 1983; смотрите также Fundamental Immunology, выше). Следовательно, здоровое животное в целом, а также гистологическая картина почечной ткани, может быть использована для определения может ли введение агентов, мишенью которых является IL-15R и, напр., IL-2R, эффективно супрессировать иммунный ответ в животной модели SLE.
В одной из мышиных линий MRL, у которой развивается SLE, MRL-lpr/lpr, развивается также форма артрита, которая сходна с ревматоидным артритом у людей (Theofilopoulos и соавт., Adv. Immunol. 37:269, 1985). Альтернативно, экспериментальный артрит можно вызвать у грызунов в результате инъецирования в основание хвоста крысиного коллагена типа II (2 мг/мл), смешанного 1:1 с полным адъювантом Фрейнда (всего 100 мкл). Артрит развивается через 2-3 недели после иммунизации. Способность молекул нуклеиновых кислот, кодирующих агенты настоящего изобретения (напр., агенты, мишенью которых является IL-15R, и агенты, мишенью которых является IL-2R, или которые связываются с антигенактивированными Т-клетками и инактивируют их), супрессировать иммунный ответ можно оценив путем нацеливания к Т-лимфоцитам молекул нуклеиновых кислот. Один путь нацеливания на Т-лимфоциты заключается в следующем. Суспензии клеток селезенки готовят через 2-3 дня после начала артрита и инкубируют с коллагеном (100 мг/мл) в течение 48 часов, чтобы индуцировать пролиферацию активированных коллагеном Т-клеток. В течение этого времени клетки трансдуцируют вектором, кодирующим полипептидный агент, который представляет интерес. В качестве контроля используют параллельно выращенные культуры, но не трансдуцированные или трансдуцированные "пустым" вектором. Затем данные клетки инъецируют внутрибрюшинно (5×107 клеток/животное). Эффективность лечения оценивают по наличию симптомов заболевания в течение последующих 2-х недель, как описано у Chernajovsky и соавт. (Gene Therapy 2:731-735, 1995). Самые слабые симптомы, по сравнению с контролем, свидетельствуют о том, что объединенные агенты настоящего изобретения, и молекулы нуклеиновых кислот, их кодирующие, функционируют в качестве иммунодепрессантов и, поэтому, пригодны для лечения иммунного заболевания, в частности аутоиммунного заболевания.
Способность разных сочетаний агентов супрессировать иммунный ответ в случае диабета типа I можно проверить на крысах линии ВВ, которые были выведены из коммерческой колонии крыс Wistar в Биологических Лабораториях Питомника в Оттаве. Эти крысы спонтанно продуцируют аутоантитела против клеток островков и инсулина, также как это происходит при диабете Типа I у человека. Альтернативно, мыши NOD (ожирение без диабета) могут использоваться в качестве модельной системы. Типичный пример эксперимента, в котором уровни сахара крови у NOD-мышей восстанавливались после трансплантации островков аллогенного донора, описан ниже и суммирован на Фиг.11. Данных мышей лечат сочетанием IL-2/Fc, IL-15/Fc, и рапамицина. Результатом является долговременный приживленный трансплантат.
Аутоиммунные заболевания щитовидной железы моделировали на цыплятах. В линиях цыплят с ожирением (OS) постоянно создается аутоиммунный тиреоидит, сходный с хроническим лимфоматозным тиреодитом (Болезнь Хашимото) (Cole и соавт., Science 160:1357, 1968). Приблизительно 15% этих птиц продуцируют аутоантитела к париетальным клеткам желудка, как и в случае человеческого аналога аутоиммунного тиреоидита. Проявления данного заболевания у OS-цыплят, которое можно было бы отслеживать в ходе любого режима лечения, затрагивают размер тела, жировые отложения, сывороточные липиды, холодовую чувствительность и стерильность.
Можно также экспериментально создать модели аутоиммунного заболевания центральной нервной системы (CNS). Воспаление CNS, которое ведет к параличу, можно вызвать однократной инъекцией суспензии из ткани головного или спинного мозга с адъювантом у многих различных лабораторных животных, в том числе у грызунов и приматов. Данная модель, именуемая экспериментальный аллергический энцефаломиелит (EAE), опосредуется Т-клетками. Подобным же образом можно экспериментально индуцировать злокачественную миастению, получаемую в результате однократной инъекции ацетилхолинового рецептора с адъювантом (Lennon и соавт., Ann. N.Y.Acad. Sci. 274:283, 1976).
Аутоиммунные заболевания кишечника можно смоделировать у мышей с "нокаутом" по IL-2 или IL-10 или у мышей, которым ставят клизму с бычьим сывороточным альбумином.
Молекулы нуклеиновых кислот, которые кодируют агенты настоящего изобретения
Полипептидные агенты настоящего изобретения, включающие агенты, которые представляют собой слитые белки (напр., мутантные молекулы IL-15/Fc и IL-2/Fc), можно не только получить в результате экспрессии молекулы нуклеиновой кислоты в подходящей эукариотической или прокариотической экспрессионной системе in vitro и последующего выделения очисткой данного полипептидного агента, но также и путем введения пациенту подходящего генотерапевтического экспрессионного вектора, кодирующего молекулу нуклеиновой кислоты. Кроме того, в клетку трансплантата можно ввести нуклеиновую кислоту до его трансплантации. Таким образом, молекулы нуклеиновых кислот, кодирующие вышеописанные агенты, находятся в рамках настоящего изобретения. Как и полипептиды настоящего изобретения, которые можно описать в рамках их идентичности с полипептидами дикого типа, молекулы нуклеиновых кислот, кодирующие их, должны обязательно обладать определенной идентичностью с молекулами нуклеиновых кислот, которые кодируют соответствующие им полипептиды дикого типа. Например, молекула нуклеиновой кислоты, кодирующая мутантный полипептид IL-15, может быть на 65%, предпочтительно, по меньшей мере, на 75%, более предпочтительно, по меньшей мере, на 85%, и наиболее предпочтительно, по меньшей мере, на 95% (напр., 96%, 97%, 98%, или 99%) идентична нуклеиновой кислоте, кодирующей IL-15 дикого типа. Для нуклеиновых кислот, длина сравниваемых последовательностей должна обычно составлять, по меньшей мере, 50 нуклеотидов, предпочтительно, по меньшей мере, 60 нуклеотидов, более предпочтительно, по меньшей мере, 75 нуклеотидов, и наиболее предпочтительно 110 нуклеотидов.
Молекулы нуклеиновых кислот, которые кодируют агенты настоящего изобретения, могут содержать встречаемые в природе последовательности, или последовательности, которые отличаются от встречаемых в природе, но вследствие вырожденности генетического кода, кодируют один и тот же полипептид. Эти молекулы нуклеиновых кислот могут состоять из РНК или ДНК (например, геномной ДНК, кДНК, или синтетической ДНК, получаемой фосфорамидитным синтезом), или из сочетаний или модификаций определенных нуклеотидов в рамках этих видов нуклеиновых кислот. Кроме того, молекулы нуклеиновых кислот могут быть двухцепочечными или одноцепочечными (т.е., любой смысловой или антисмысловой цепью).
Молекулы нуклеиновых кислот настоящего изобретения называют "изолированными" потому, что их отделяют либо от 5'-, либо от 3'-кодирующей последовательности, с которой они непосредственно граничат в встречаемом в природе геноме организма. Таким образом, рассматриваемые молекулы нуклеиновых кислот не ограничиваются последовательностями, которые кодируют полипептиды; можно также включить некоторые или все некодирующие последовательности, которые лежат слева или справа от кодирующей последовательности. Специалисты в области молекулярной биологии хорошо знакомы со стандартными методами изолирования молекул нуклеиновых кислот. Они могут быть получены, например, в результате обработки геномной ДНК рестриктазами, или в результате осуществления полимеразной цепной реакции (PCR). В случае, если данная молекула нуклеиновой кислоты представляет собой рибонуклеиновую кислоту (РНК), ее молекулы можно получить с помощью in vitro-транскрипции.
Изолированные молекулы нуклеиновых кислот настоящего изобретения могут включать фрагменты, не обнаруживаемые, как таковые, в природном состоянии. Таким образом, настоящее изобретение включает и рекомбинантные молекулы, такие как молекулы, в которых последовательность нуклеиновой кислоты (например, последовательность, кодирующая мутантный IL-15) включается в вектор (например, плазмидный или вирусный вектор) или в геном гетерологичной клетки (или в геном гомологичной клетки в положении, отличающимся от естественного положения в хромосоме).
Как описано выше, агенты настоящего изобретения могут представлять собой слитые белки. Помимо вышеописанных гетерологичных полипептидов, или вместо них, молекула нуклеиновой кислоты, кодирующая агент настоящего изобретения, может содержать последовательности, кодирующие "маркер" или "репортер". Примеры маркерных или репортерных генов включают β-лактамазу, хлорамфениколацетилтрансферазу (САТ), аденозиндезаминазу (ADA), аминогликозидфосфотрансферазу (neor, G418r), дигидрофолатредуктазу (DHFR), гигромицин-В-фосфотрансферазу (НРН), тимидинкиназу (TK), lacZ (кодирующий β-галактозидазу), и ксантингуанинфосфорибозилтрансферазу (XGPRT). Как и в случае многих стандартных методов, связанных с практикой настоящего изобретения, специалистам в данной области техники известны дополнительные используемые реактивы, например, дополнительные последовательности, которые могут служить в качестве маркера или репортера.
Молекулы нуклеиновых кислот настоящего изобретения могут быть получены пути введения мутации в агент настоящего изобретения (напр., в молекулу IL-15 или в молекулу IL-2), получены из любой биологической клетки, такой, например, как клетка млекопитающего, или получены с помощью стандартных методов клонирования. Таким образом, нуклеиновые кислоты настоящего изобретения могут представлять собой нуклеиновые кислоты мыши, крысы, морской свинки, коровы, овцы, лошади, свиньи, кролика, обезьяны, павиана, собаки, или кошки. Предпочтительно, если молекулы нуклеиновых кислот представляют собой молекулы нуклеиновых кислот человека.
Вышеописанные молекулы нуклеиновых кислот могут находиться в векторе, который способен управлять их экспрессией, например, в клетке, которая была трансдуцирована с помощью данного вектора. В соответствии с этим, помимо полипептидных агентов, экспрессионные векторы, содержащие молекулу нуклеиновой кислоты, кодирующую эти агенты, и клетки, трансфицированные этими векторами, включены в предпочтительные варианты осуществления настоящего изобретения.
Векторы, пригодные для использования в настоящем изобретении, включают векторы, основанные на Т7, используемые в бактериях (смотрите, напр., Rosenberg и соавт., Gene 56:125, 1987), экспрессионный вектор pMSXND, используемый в клетках млекопитающих (Lee and Nathans, J. Biol. Chem. 263:3521, 1988), дрожжевые экспрессионные системы, такие как Pichia pastoris (например, семейство экспрессионных векторов PICZ от Invitrogene, Carlsbad, CA) и векторы, полученные из бакуловирусов (например, экспрессионный вектор pBacPAK9 от Clontech, Palo Alto, CA), используемый в клетках насекомых. Вставки из нуклеиновых кислот, которые кодируют интересующий полипептид в таких векторах, можно функционально присоединить к промотору, который выбран на основе, например, типа клетки, в которой будет осуществляться экспрессия. Например, Т7-промотор можно использовать в бактериях, полигедриновый промотор можно использовать в клетках насекомых, а цитомегаловирусный или металлотионеиновый промотор можно использовать в клетках млекопитающих. Кроме того, что касается высших эукариот, широко доступны тканеспецифические и типоспецифичные клеточные промоторы. Эти промоторы называют по их способности к прямой экспрессии молекулы нуклеиновой кислоты в данной ткани или в данном типе клеток в рамках данного организма. Специалистам в данной области техники хорошо известны многочисленные промоторы и другие регуляторные элементы, которые можно использовать для прямой экспрессии нуклеиновых кислот.
Помимо последовательностей, которые способствуют транскрипции встроенной молекулы нуклеиновой кислоты, векторы могут содержать ориджины репликации и другие гены, которые кодируют селективный маркер. Например, устойчивый к неомицину (neor) ген придает G418-устойчивость клеткам, в которых он экспрессируется и, тем самым, делает возможным фенотипический отбор трансфицированных клеток. Другие подходящие селективные маркерные гены, допускающие фенотипическую селекцию клеток, включают различные флуоресцентные белки, напр., зеленый флуоресцентный белок (GFP) и его варианты. Специалисты в данной области техники могут легко определить, действительно ли данный регуляторный элемент или селективный маркер пригоден для использования в конкретном экспериментальном контексте.
Вирусные векторы, которые могут использоваться в настоящем изобретении, включают, например, ретровирусные, аденовирусные, и аденоассоциированные векторы, векторы вируса герпеса, обезьяньего вируса 40 (SV40), и вируса папилломы крупного рогатого скота (смотрите, напр., Gluzman (Ed), Eukaryotic Viral Vectors, CSH Laboratory Press, Cold Spring Harbor, New York).
Прокариотические или эукариотические клетки, которые содержат молекулу нуклеиновой кислоты, которая кодирует агент настоящего изобретения и экспрессирует белок, кодируемый этой молекулой нуклеиновой кислоты in vitro, также являются отличительными признаками настоящего изобретения. Клетка настоящего изобретения представляет собой трансфицированную клетку, т.е. клетку, в которую молекула нуклеиновой кислоты, например, молекула нуклеиновой кислоты, кодирующая мутантный полипептид IL-15, была введена с помощью методов рекомбинантных ДНК. Потомство такой клетки также рассматривается в рамках настоящего изобретения. Определенные компоненты данной экспрессионной системы не являются ключевыми. Например, мутантный IL-15-полипептид можно создать у прокариотического хозяина, такого как бактерия E.coli, или у эукариотического хозяина, такого как клетка насекомого (например, клетки Sf21), или в клетках млекопитающих (напр., клетки COS, клетки CHO, клетки 293, клетки NIH 3T3, или клетки HeLa). Эти клетки доступны из многих источников, в том числе, из American Type Culture Collection (Американская коллекция типовых культур) (Manassas, VA). При выборе экспрессионной системы существенно только, чтобы компоненты были бы совместимы друг с другом. Специалист в данной области техники способен осуществить такое определение. Кроме того, при выборе экспрессионной системы можно проконсультироваться у Ausubel и соавт. (Current Protocols in Molecular Biology, John Wiley and Sons, New York, NY, 1993) и у Pouwels и соавт. (Cloning Vectors: A Laboratory Manual, 1985 Suppl. 1987).
Эукариотические клетки, которые содержат молекулу нуклеиновой кислоты, которая кодирует агент настоящего изобретения и экспрессируют белок, кодируемый такой молекулой нуклеиновой кислоты in vivo, также являются отличительным признаком настоящего изобретения.
Кроме того, эукариотические клетки настоящего изобретения могут представлять собой клетки, которые являются частью клеточного, тканевого или органного трансплантата. Такие трансплантаты могут включать или первичные клетки, взятые от донорского организма, или клетки, которые были культивированы, модифицированы и/или селектированы in vitro перед трансплантацией в реципиентный организм (напр., линии эукариотических клеток, включающие стволовые клетки или клетки-потомки). Так как после трансплантации в реципиентный организм может происходить клеточная пролиферация, потомство таких клеток также рассматривают в рамках настоящего изобретения. Клетки, являющиеся частью клеточного, тканевого или органного трансплантата, могут быть трансфицированы нуклеиновой кислотой, кодирующей мутантный полипептид IL-15, и затем трансплантироваться в реципиентный организм, где и происходит экспрессия мутантного IL-15-полипептида. Кроме того, такие клетки могут содержать одну или несколько дополнительных конструкций нуклеиновых кислот, допускающих применение селекционных операций, напр. специфичных линий клеток или типов клеток, перед трансплантацией в реципиентный организм.
Экспрессируемые полипептиды можно выделить очисткой из экспрессионной системы с использованием стандартных биохимических методов и можно использовать в качестве диагностических инструментов или в качестве терапевтических агентов, что и описано ниже.
Агенты, мишенью которых является IL-15R, пригодны для осуществления диагноза
Агенты, мишенью которых является IL-15R, могут использоваться для установления у пациента заболевания (напр., иммунного заболевания, в частности, аутоиммунного заболевания), которое подлежит лечению с помощью описанного здесь сочетания агентов. Способ диагностики можно осуществить, например, в результате получения образца ткани от пациента, подозреваемого в иммунном заболевании, в частности, аутоиммунном заболевании или злокачественной опухоли, что обнаруживается в наличии злокачественных иммунных клеток, и экспонирования этой ткани с антигенным мишенным полипептидом, мишенью которых является IL-15R. Этот образец может представлять собой любой биологический образец, например, крови, мочи, сыворотки, или образец плазмы. Кроме того, данный образец может быть тканевым образцом (напр., тканевой биоптатом), или выпотом, полученным из сустава (напр., синовиальная жидкость), из брюшной полости (напр., асцитная жидкость), из грудной клетки (напр., плевральная жидкость), или из центральной нервной системы (напр., церебральная, спинномозговая жидкость). Данный образец может также состоять из культивируемых клеток, которые исходно получены от пациента (напр., мононуклеарные клетки периферической крови). Данный образец можно получить от млекопитающего, такого как больной человек. Если данный образец содержит клетки, связанные с агентом, с которым они экспонируются, весьма вероятно, что они будут связываться этим агентом (напр., агентом, мишенью которого является IL-15R) in vivo и, тем самым, могут оказаться заблокированными для пролиферации или разрушаться in vivo. Выявленные симптомы у пациентов, отобранных для такого тестирования и релевантные с учетом конкретной группы симптомов ткани, пробы из которых следует отбирать, хорошо известные специалистам в данной области техники.
Пациенты, подлежащие лечению
Композиции настоящего изобретения пригодны для ингибирования Т-клеток, которые участвуют, или претендуют на участие, в иммунном ответе (напр., клеточном иммунном ответе) на антиген; для ингибирования других клеток, вовлеченных в патогенез иммунологических нарушений (напр., моноциты, макрофаги, и другие антигенпрезентирующие клетки, такие, как дендритные клетки, NK-клетки, и гранулоциты); и для разрушения гиперпролиферирующих клеток (что видно, например, в тканях, вовлеченных в иммунологические нарушения, таких как синовиальные фибробласты (которые поражаются при ревматоидном артрите), кератиноциты (которые поражаются при псориазе), или дермальные фибробласты (которые поражаются при системной красной волчанки). Зная эти примеры, специалистам в данной области техники должны быть очевидны и другие типы клеток, которые можно использовать для нацеливания. Гиперпролиферирующие клетки могут также быть злокачественными клетками (напр., злокачественными Т-клетками).
Таким образом, композиции настоящего изобретения можно использовать для лечения пациентов, которые страдают от иммунного заболевания, в частности, аутоиммунного заболевания, в том числе, но не ограничиваясь нижеследующими: (1) ревматическое заболевание, такое как ревматоидный артрит, системная красная волчанка, синдром Шегрена, склеродермия, смешанный коллагеноз, дерматомиозит, полимиозит, синдром Рейтера или болезнь Бехчета; (2) диабет типа I или типа II; (3) аутоиммунное заболевание щитовидной железы, такое как хронический лимфоматозный тиреоидит или болезнь Грейвса; (4) аутоиммунное заболевание центральной нервной системы, такое как множественный склероз, злокачественная миастения, или энцефаломиелит; (5) различные пузырчатки, такие как пузырчатка обыкновенная, вегетирующая пузырчатка, листовидная пузырчатка, синдром Сенира-Ашера, или Бразильская пузырчатка; (6) кожные заболевания, такие как псориаз или нейродермит, и (7) воспалительное заболевание кишечника (напр., язвенный колит Крона). Сочетания агентов настоящего изобретения могут также использоваться для лечения приобретенного синдрома иммунодефицита (AIDS). Подобно этому способы, с помощью которых вводятся эти агенты, могут использоваться при лечении пациента, который получил трансплантат из синтетического или биологического материала, или из сочетания обоих. Такие трансплантаты могут быть органным, тканевым или клеточным трансплантатами, или синтетическими трансплантатами, создаваемыми с помощью высевных клеток, например, синтетическими сосудистыми трансплантатами, созданными с помощью посеянных сосудистых клеток. Кроме того, пациенты, страдающие GVHD или пациенты, которые получили сосудистую травму, извлекут пользу благодаря данному способу.
Поскольку настоящее изобретение включает введение истощающую клетку-мишень форму агента, мишенью которого является IL-15R (или IL-2-рецептор, или сочетание из IL-15 либо IL-15R и IL-2 либо IL-2R), представляется возможным избирательно убивать аутореактивные или "деструктивные для трансплантации" иммунные клетки, без масштабного повреждения нормальных Т-клеток. В соответствии с этим, настоящее изобретение характеризует способ уничтожения клеток, которые экспрессируют IL-15R in vivo, которые включают активированные или аутореактивные "деструктивные для трансплантации" иммунные клетки или злокачественные клетки. Данные способы осуществляют путем введения пациенту сочетание агентов, которые включают агенты, мишенью которых является IL-15R, и которые активируют систему комплемента, лизис клеток с помощью механизма ADCC, или иначе убивают клетки, экспрессирующие природный рецепторный комплекс IL-15. Данный способ можно использовать для лечения пациентов, которые поражены IL-15R+-лейкозом, лимфомой, или иными IL-15R+-злокачественными заболеваниями, такими как злокачественная опухоль толстой кишки.
Используемые композиции и способы применения
Способы настоящего изобретения и терапевтические композиции, используемые для их осуществления, содержат "в значительной степени чистые" агенты. Например, в случае, если данный агент представляет собой полипептид, то данный полипептид представляет собой, по меньшей мере, на 60% по весу (сухому весу) интересующий полипептид, напр., полипептид, который связывает и разрушает клетки, несущие IL-15R. Предпочтительно, если данные агенты (напр., полипептиды) содержат по весу, по меньшей мере, 75%, более предпочтительно, по меньшей мере, 90%, и наиболее предпочтительно, по меньшей мере, 99% интересующего агента. Степень очистки можно измерить с помощью любого подходящего стандартного метода, напр., колоночной хроматографией, электрофорезом в полиакриламидном геле, или HPLC-анализом.
Хотя агенты, используемые в способах настоящего изобретения, могут быть получены из встречаемых в природе источников, их можно также синтезировать или иначе произвести в производственных условиях (напр., агенты, которые связывают и разрушают клетки, несущие IL-15R, можно получить путем экспрессии рекомбинантных молекул нуклеиновых кислот). Полипептиды, которые извлекают из эукариотических организмов или синтезируют в E.coli или иных прокариотах, и полипептиды, которые химически синтезируют, должны быть в значительной степени свободны от их природных компонентов. В том случае, если данный полипептид представляет собой химеру, он может кодироваться гибридной молекулой нуклеиновой кислоты, содержащей одну последовательность, которая кодирует весь или часть данного агента (напр., последовательность, кодирующая мутантный IL-15-полипептид, и последовательность, кодирующая Fc-район IgG). Агенты настоящего изобретения (напр., полипептиды) могут быть слитыми с шестигистидиновой меткой, которая облегчает выделение очисткой бактериально экспрессируемого белка, или с гемагглютининовой меткой, которая облегчает выделение очисткой белка, экспрессируемого в эукариотических клетках.
Методы, необходимые для создания агентов настоящего изобретения, являются стандартными в данной области техники, и могут осуществляться специалистами в данной области техники, не прибегая к чрезмерному экспериментированию. Например, мутацию, которая состоит из замены одного или нескольких аминокислотных остатков в IL-15, можно создать с помощью метода ПЦР-мутагенеза, описанного здесь для создания мутантного полипептида IL-15, в котором остатки глутамина в положениях 149 и 156 заменены остатками аспарагиновой кислоты. Мутации, которые состоят из делеций или добавок аминокислотных остатков (в IL-15-полипептиде или в любом другом используемом полипептиде, описанном здесь, напр., в полипептидах, которые ингибируют костимуляцию или связывают активированные Т-клетки), можно также сделать с помощью стандартных рекомбинантных методов. В терапевтических целях агенты настоящего изобретения могут вводиться с физиологически приемлемым носителем, таким как физиологический раствор. Терапевтические композиции настоящего изобретения могут также содержать носитель или наполнитель, многие из которых известны специалистам в данной области техники. Наполнители, которые можно использовать, включают буферные растворы (напр., цитратный буфер, фосфатный буфер, ацетатный буфер, и бикарбонатный буфер), аминокислоты, мочевину, спирты, аскорбиновую кислоту, фосфолипиды, белки (напр., сывороточный альбумин), ЭДТА, хлорид натрия, липосомы, маннит, сорбит, и глицерин. Агенты настоящего изобретения можно создавать, в виде рецептурной смеси, разными способами, в соответствии с надлежащими способами введения. Например, жидкие растворы можно создавать для приема внутрь или для инъекций; гели или порошки можно создавать для приема внутрь, ингаляции, или местного применения. Способы создания таких составов хорошо известны и их можно найти, например, в "Remington's Pharmaceutical Sciences".
Способы введения также хорошо известны квалифицированным фармакологам и докторам и включают внутрибрюшинное, внутримышечное, подкожное, и внутривенное введение. Дополнительные способы введения включают интракраниальное (напр., введение в подпаутинное пространство головного мозга или внутрижелудочковое), подглазничное, глазное, внутрисуставное, внутрипозвоночное, внутрибрюшинное, внутрислизистое, местное, подкожное, и пероральное введение. Предполагается, что внутривенный или внутриартериальный способы введения будут предпочтительны для введения агентов, мишенью которых является IL-15-рецептор. Подкожный способ введения может также часто использоваться, так как подкожная ткань обеспечивает стабильную среду для полипептидов, из которой они могут медленно высвобождаться.
В случае клеточной терапии (генной терапии), клетки/ткани/органы могут быть трансфицированы перед трансплантацией композицией нуклеиновых кислот путем инкубации, инфузии или перфузии, так чтобы терапевтический белок экспрессировался бы, а затем высвобождался из трансплантированных клеток/тканей/органов реципиентного организма. Кроме того, клетки/ткани/органы могут подвергнуться перед трансплантацией предварительной обработке путем перфузии или простой инкубации терапевтическим белком с целью исключить прилипание иммунных клеток, ассоциированных с трансплантатом, к донорским клеткам/тканям/органам (несмотря на то, что оно (прилипание) является лишь побочным аспектом, который, вероятно, не имеет какого-либо клинического значения). В случае клеточных трансплантатов, клетки можно вводить или в результате операции имплантации или методом инъецирования, опосредованного катетером, через стенку кровеносного сосуда. В некоторых случаях, данные клетки можно вводить в сосудистую сеть, из которой затем они распространяются кровотоком и/или мигрируют в окружающую ткань (осуществляется при трансплантации островковых клеток, когда клетки островков высвобождаются в портальную вену и затем мигрируют в печеночную ткань).
В медицинских кругах хорошо известно, что дозы для любого отдельного пациента определяются многими факторами, в том числе общим состоянием здоровья, полом, массой тела, величиной поверхности тела, и возрастом пациента, а также конкретным вводимым соединением, временем и способом введения, и другими сопутствующими лекарственными средствами. Дозы полипептида настоящего изобретения должны варьировать, но при внутривенном введении можно применять дозировку в количестве, примерно, от 1 микрограмма до 10 мг/кг веса тела или в количестве, примерно, от 0,01 мг/л до 100 мг/л объема крови. Дозу, при необходимости, можно вводить один или несколько раз на день, а лечение можно осуществлять в течение продолжительного периода времени. Определение правильной дозы для данного применения находится в пределах компетенции специалиста в данной области техники.
ПРИМЕРЫ
Реактивы
Следующие реактивы использовались в описанных здесь исследованиях: рекомбинантный IL-2 человека, полученный от Hoffman-La Roche (Nutley, NJ); рапамицин, полученный от Wyeth-Ayerst (Princeton, NJ); циклоспорин-А (CsA), полученный от Sandoz (East Hanover, NJ); RPMI-1640 и фетальная сыворотка теленка (FCS), полученная от BioWittaker (Walkersville, MD); пенициллин, стрептомицин, G418, и стрептавидин-RED670, полученные от Gibco-BRL (Gaithersburg, Md); дексаметазон, РНА, лизоцим, Nonidet P-40, NaCl, HEPES, и PMSF, полученные от Sigma (St. Louis, MO); Ficoll-Hypaque, полученный от Pharmacia Biotech (Uppsala, Швеция); рекомбинантный IL-15 человека и антитело против IL-15 человека, полученные от PeproTech (Rocky Hill, NJ); антитело против FLAG и анти-FLAG-аффинные шарики, полученные от International Biotechnologies, Inc. (Kodak, New Haven, CT); pRcCMV, полученный от InVitrogen Corporation (San Diego, CA); генистеин, полученный от ICN Biomedical (Irvine, CA); дисукцинимидилсуберат (DSS), полученный от Pierce (Rockford, IL); рестрикционные эндонуклеазы, полученные от New England Biolabs (Beverly, MA); [3H]TdR, полученный от New England Nuclear (Boston, MA); и антитела, конъюгированные с флуоресцентным красителем, CD25-PE3, CD14-PE, CD16-PE, CD122-PE, CD4-FITC, CD8-FITC, IgG1-PE или IgG1-FITC, полученные от Beckton/Dickinson (San Jose, CA). Пептид FLAG синтезирован в Peptide Synthesis Facility при Harvard Medical School.
Получение слитого белка FLAG-HMK-IL-15
Для изучения паттерна клеточной экспрессии человеческого IL-15-рецептора конструировалась плазмида, которая могла бы использоваться для экспрессии IL-15-слитого белка. Данная плазмида кодирует полипептид IL-15, обладающий N-концом, ковалентно присоединенным к 18 аминокислотной FLAG-HMK-последовательности (FLAG-HMK-IL-15). FLAG-последовательности распознаются биотинилированными, высокоспецифичными антителами против FLAG (Blanar и соавт., Science 256:1014, 1992); LeClair и соавт., Proc. Natl. Acad. Sci USA 89:8145, 1992), а последовательности HMK (сайт узнавания Киназы Мышцы Сердца) дают возможность вводить в данную молекулу радиоактивную метку [32P] (Blanar и соавт., выше; LeClair и соавт., выше).
Для конструирования плазмиды FLAG-HMK-IL-15 с помощью ПЦР и с использованием синтетических олигонуклеотидов [смыслового 5'-GGAATTCAACTGGGTGAATGTAATA-3' (SEQ ID NO:5; EcoRI-сайт (подчеркнут) плюс основания 145-162)]; антисмыслового 5'-CGGGATCCTCAAGAAGTGTTGATGAA-3' (SEQ ID NO:5; BamHI-сайт [подчеркнут] плюс основания 472-489)] амплифицирован фрагмент кДНК размером 322 г.н., кодирующий зрелый белок IL-15. Матричную ДНК получали из PHA-активированных PBMC человека. Полученный ПЦР-продукт выделяли очисткой, обрабатывали с помощью EcoRI и BamHI, и клонировали в плазмиду pAR(DRI)59/60, расщепленной с помощью EcoRI-BamHI, как описано (Blanar и соавт., Science 256:1014 1992; LeClair и соавт., Proc. Natl. Acad. Sci USA 89:8145, 1992). Остов плазмиды pAR(DRI)59/60 содержит в рамке последовательности, кодирующие FLAG, и последовательности пептида распознавания НМК (Blanar и соавт., Science 256:1014, 1992; LeClair и соавт., Proc. Natl. Acad. Sci USA 89:8145, 1992).
Экспрессия и выделение очисткой слитого белка FLAG-HMK-IL-15
Родственная IL-15 слитая конструкция, FLAG-HMK-IL-15, была экспрессирована в штамме BL-21 E. coli и выделена аффинной очисткой с помощью шариков, покрытых анти-FLAG, как описано (Blanar и соавт., Science 256:1014 1992; LeClair и соавт., Proc. Natl. Acad. Sci USA 89:8145, 1992). Слитый белок элюировали с аффинных колонок после экстенсивной промывки 0,1 М глицином (рН 3,0). Элюат, содержащий FLAG-HMK-IL-15, диализировали против буфера, содержащего 50 мМ Триса (рН 7,4) и 0,1 М NaCl, в течение 18 часов при 4°С, фильтровали через 0,2 мкм мембрану, и хранили при -20°С.
FLAG-HMK-IL-15 связывает α-субъединицу IL-15R
Выделенный очисткой слитый белок FLAG-HMK-IL-15 тестировали, чтобы определить его способность к взаимодействию с IL-15-рецепторами клеточной поверхности. Как указано выше, [32P]-FLAG-HMK-IL-15 добавляли в культуры PBMC, которые были активированы митогеном, РНА. С целью необратимого связывания взаимодействующих друг с другом белков добавляли химическую сшивку дисукцинимидилсуберат (DSS). Эти клетки промывали, лизировали, центрифугировали, и растворенные в детергенте белки разделяли с помощью SDS-PAGE. Радиоавтография белков, разделенных в SDS-PAGE, обнаружила единственную полосу 75-80 кДа, соответствующую молекулярной массе FLAG-HMK-IL-15 (15 кДа), объединенной с α-субъединицей IL-15R человека (60-65 кДа). Идентичность данной полосы в качестве α-субъединицы IL-15R подтверждали экспериментами по сшиванию в присутствии молярного избытка hIL-15. В данных условиях авторам изобретения не удалось детектировать радиоактивно меченную (15 кДа)-полосу. Следовательно, конформация слитых белков [32P]-FLAG-HMK-IL-15 допускает сайт-специфичное связывание с α-субъединицей IL-15R с п.н. 60-65 кДа, экспрессируемой на поверхности активированных митогеном PBMC.
FLAG-HMK-IL-15 представляет собой биологически активный фактор роста, который нуждается в экспрессии IL-2Rβ
В следующих сериях экспериментов слитый белок FLAG-HMK-IL-15 тестировали, чтобы выяснить может ли он функционировать в качестве биологически активного фактора роста. РНА-активированные PBMC человека пролиферируют в ответ либо на FLAG-HMK-IL-15, либо на рекомбинантный IL-2 человека, что детектируется в анализе по включению [3H]-TdR. FLAG-пептид, без последовательности IL-15, не стимулирует клеточную пролиферацию. Также как IL-2, слитый белок FLAG-HMK-IL-15 стимулирует пролиферацию клеточных трансфектантов IL-2Rγ+BAF-BO3, которые экспрессируют IL-2Rβ-субъединицу. Однако слитой белок FLAG-HMK-IL-15 не стимулирует пролиферацию материнских BAF-BO3-клеток, которые были трансфицированы вектором, не содержащим последовательностей IL-2Rβ-цепи. Таким образом, FLAG-HMK-IL-15 представляет собой биологически активный фактор роста, который нуждается в экспрессии IL-2Rβ-цепей в клетках-мишенях, для того чтобы стимулировать клеточную пролиферацию.
Митоген-активированные, но не покоящиеся PBMC экспрессируют IL-15α-субъединицу
Слитый белок FLAG-HMK-IL-15, биотинилированное антитело против FLAG, и стрептавидин-RED670 использовали для детектирования с помощью цитофлурометрического анализа экпрессии сайтов связывания IL-15 на PBMC человека. Тестировали либо свежевыделенные PBMC, либо активированные с помощью РНА РВМС. Эти клетки отмывали и инкубировали либо с одной лишь средой, либо с FLAG-HMK-IL-15 и последующим использованием биотинилированных антител к FLAG и стрептовидин-RED670. Окрашенные клетки анализировали с помощью проточной цитометрии. PBMC, которые активировали с помощью РНА, экспрессировали белки IL-15Rα, а покоящиеся PBMC не экспрессировали их. В соответствии с вышеописанными результатами экспериментов по химическому сшиванию, связывание FLAG-HMK-IL-15 с PBMC, активированными с помощью РНА, блокируется молярным избытком rIL-15, демонстрируя тем самым специфичность связывания FLAG-HMK-IL-15 с сайтами связывания IL-15. Активированные CD4+- и CD8+-клетки, те и другие, экспрессируют α-цепи IL-15. Индуцированные активацией α-цепи IL-15R детектировались также на CD14+-клетках (моноцитах/макрофагах) и на CD16+-клетках (природных киллерах).
Субъединицы IL-2Rα и IL2Rβ не являются необходимыми для IL-15-связывания
FACS-анализ РНА-активированных PMBC, окрашенных с помощью белков FLAG-HMK-IL-15 и Mab к CD25, против IL-2Rα-субъединицы, обнаруживает клеточные популяции, экспрессирующие и IL-15Rα- и IL-2Rα-субъединицы, а также клеточные популяции, которые экспрессируют любую отдельную субъединицу, но не обе субъединицы. Имеются IL-2Rα+-клетки, которые не связывают FLAG-HMK-IL-15. Почти все PBMC, которые были стимулированы с помощью РНА только в течение одного дня, экспрессируют либо IL-15Rα-цепь, либо IL-2Rβ-цепь, но не оба белка. В противоположность этому, через 3 дня после РНА-стимуляции отмечено присутствие наибольшей популяции клеток IL-15Rα+, IL-2Rβ+ (двойные положительные) и наименьшей популяции IL-15Rα+, IL-2Rβ- (одиночная положительная). Интересно, что имеются IL-2Rβ+-клетки, которые не способны связывать IL-15. Следовательно, экспрессия IL-2Rβ-цепей недостаточна для связывания IL-15.
Вместе взятые эти данные свидетельствуют о том, что IL-15 может связывать IL-15Rα+-, IL-2Rα--, и IL-Rβ--клетки. Аналогичный вывод сделали по результатам проведения опытов, в которых исследуется взаимодействие IL-15 с IL-2Rα-, β--клетками, трансфицированными субъединицей IL-15Rα (Anderson и соавт., J. Biol. Chem. 270:29862, 1995; Giri и соавт., EMBO J. 14:3654, 1995). Для сообщения клеткам чувствительности к инициируемому IL-15 росту кроме требования экспрессии IL-15Rα -субъединицы, необходимы субъединицы IL-2Rβ и IL-2Rγ.
В итоге, представленные выше эксперименты продемонстрировали, что: (i) IL-15Rα-субъединицы быстро экспрессируются активированными макрофагами, Т-клетками, и NK-клетками, и (ii) индукция IL-15Rα-субъединицы блокируется дексаметазоном, но не CsA или рапамицином. Кроме того, данные эксперименты подтверждают, что IL-15Rα-субъединица необходима и достаточна для связывания IL-15 и что слитый белок FLAG-HMK-IL-15 представляет собой исключительно полезный инструмент для изучения IL-15-рецепторов.
Для трансдукции сигналов IL-2 и IL-15 крайне необходима IL-2Rβ-субъединица
Снижение жизнеспособности активированных Т-клеток и вследствие этого истощение активированных Т-клеток открывает путь для уменьшения образования лимфокинов и митогенов, которые способствуют ускоренному атеросклерозу, отторжению аллотрансплантата, некоторым лейкозам и другим иммунно-опосредованным патологиям. Кроме того, блокада пути передачи сигнала, активируемая с помощью IL-15, также открывает путь к снижению образования лимфокинов и митогенов, которые способствует ускоренному атеросклерозу, отторжению аллотрансплантата, некоторым лейкозам и другим иммунно-опосредованным патологиям. При активировании Т-клетки пролиферируются и экспрессируют на своей поверхности рецепторы для интерлейкинов. Кроме того, активированные Т-клетки высвобождают, по меньшей мере, 3 лимфокина: гамма-интерферон, фактор II дифферециации В-клеток и IL-3. Эти лимфокины могут вызывать различные нежелательные события, такие, как отторжение аллотрансплантата. В противоположность этому, покоящиеся Т-клетки и Т-клетки с долговременной памятью не экспрессируют рецепторы лимфокинов. Данная разница в экспрессии рецепторов обеспечивает способы нацеливания на активированные иммунные клетки, не затрагивающие покоящиеся клетки. Молекулы, созданные для распознавания субъединицы IL-15R, будут распознавать активированные моноциты/макрофаги, а также активированные Т-клетки, и могут использоваться для селективного подавления или разрушения этих клеток. Производные IL-15, которые связываются с субъединицей IL-15R, но у которых отсутствует IL-15-активность, либо потому что они блокируют связывание и/или утилизацию самого IL-15, пригодны для данного способа настоящего изобретения. Описанная ниже мутантная IL-15-молекула используется в рабочем примере такого производного.
Мутантный IL-15-полипептид, мишенью которого является IL-5R
Генетическая конструкция мутанта IL-15
Для нацеливания на предполагаемые сайты, крайне необходимые для связывания с IL-2Rγ-субъединицей, создали белок IL-15 человека, несущий двойную мутацию (Q149D; Q156D). Полярный, но незаряженный остаток глутамина в положениях 149 и 156, заменяли на кислотный остаток аспарагиновой кислоты, применяя мутагенез с использованием ПЦР. кДНК, кодирующую двойной мутант IL-15, амплифицировали с помощью ПЦР, применяя синтетический смысловой олигонуклеотид [5'-GGAATTC AACTGGGTGAATGTAATA-3' (SEQ ID NO:_); EcoRI-сайт (подчеркнутый гексамер) плюс основания 145-162] и синтетический антисмысловой олигонуклеотид (5'-CGGGATCCTCAAGAAGTGTTGATGAACATGTCGACAATATGTACAAAACTGTCCAAAAAT-3' (SEQ ID NO:_); BamHI-сайт (подчеркнутый гексамер) плюс основания 438-489; мутантные основания подчеркнуты отдельно]. Матрица была представлена плазмидой, содержащей кДНК, которая кодирует FLAG-HMK-IL-15 человека. Амплифицированный фрагмент расщепляли с помощью EcoRI/BamHI и клонировали в плазмиду pAR(DRI)59/60, обработанную, как описано, с помощью EcoRI/BamRI (LeClair и соавт., Proc. Natl. Acad. Sci. USA 89:8145, 1989). Наличие мутации по остатку 156 подтверждали расщеплением с помощью SalI; введение данной мутации создает новый SalI-рестрикционный сайт. Кроме того, мутации контролировали с помощью ДНК-секвенирования в соответствии со стандартными методами. Полученный белок с двойной мутацией FLAG-HMK-IL-15 (Q149D; Q156D) выделяли очисткой и подтверждали секвенированием, как описано выше, для белка FLAG-HMK-IL-15 дикого типа.
Применяя данный подход, получали мутанты, которые содержат единственную аминокислотную замену, либо в положении 149, либо в положении 156. Как указано выше, данные позиции (149 и 156) соответствуют, соответственно, позициям 101 и 108 зрелого полипептида IL-15, у которого отсутствует 48-аминокислотная сигнальная последовательность.
Аналогичным образом данный подход можно использовать для включения любой другой аминокислоты вместо глутаминовых остатков в положениях 149 или 156, либо для включения аминокислотных замен в другие положения, исключая положения 149 и/или 156.
Пролиферация клеток BAF-BO3 в присутствии белков, родственных IL-15
Двойной мутант полипептида IL-15 может подавлять пролиферацию BAF-BO3 дозо-зависимым способом; добавление 30 мкл (приблизительно 50 мкг/мл) двойного мутанта IL-15 подавляют пролиферацию более полно, чем добавление 20 мкл той же концентрации данного двойного мутанта IL-15.
Пролиферация РНА-стимулированных PBMC человека
Способность двойного мутантного полипептида FLAG-HMK-IL-15 связывать РНА-активированные PBMC человека демонстрировался следующим образом. РНА-активированные PBMC отмывали и инкубировали в одной лишь среде или в среде, содержащей двойной мутант FLAG-HMK-IL-15. Затем эти клетки инкубировали с биотинилированным антителом к FLAG и окрашивали с помощью стрептавидина, конъюгированного с RED670. Полученные окрашенные клетки анализировали с помощью проточной цитометрии.
FACS-анализ лейкозных клеточных линий, окрашенных с помощью FLAG-HMK-IL-15 дикого типа
В серии экспериментов, аналогичных вышеприведенным, показана способность FLAG-HMK-IL-15-полипептида дикого типа связывать лейкозные клетки. Обрабатываемые клетки получали из лейкозных клеточных линий MOLT-14, YT, HuT-102, и из клеточных линий, созданных к настоящему времени в Beth Israel Hospital (Boston, MA), и названных 2А и 2В. Эти прокультивированные клетки отмывали и инкубировали либо только в одной среде, либо в среде, содержащей полипептид FLAG-HMK-IL-15 дикого типа. Затем эти клетки инкубировали с биотинилированным антителом к FLAG и окрашивали с помощью стрептавидина, конъюгированного с RED670. Полученные окрашенные клетки анализировали с помощью проточной цитометрии.
Генетическое конструирование дополнительных химерных полипептидов мутантного IL-15
Помимо химеры FLAG-HMK-IL-15, которая представляет собой мутантный IL-15 с антигенной меткой, множество других полипептидов можно присоединить к любому мутанту IL-15 или IL-2. Например, мутантный IL-15 или IL-2 можно соединить с Fc-фрагментом IgG-подкласса антител, в соответствии с нижеследующим способом.
Генетическое конструирование мутанта IL-15/Fc
кДНК для Fcγ2a можно получить из мРНК, экстрагированной из гибридомы, секретирующей IgG2a, с использованием стандартных методов, использующих обратную транскриптазу (MMLV-RT; Gibco-BRL, Grand Island, NY) и синтетический олиго-dT (12-18) олигонуклеотид (Gibco BRL). кДНК мутантного IL-15 можно амплифицировать с плазмидной матрицы при помощи ПЦР с использованием IL-15-специфичных синтетических олигонуклеотидов.
5'-олигонуклеотид создают для того, чтобы встроить уникальный рестрикционный сайт NotI на расстоянии 40 нуклеотидов в 5'-направлении от трансляционного старт-кодона, а 3'-олигонуклеотид удаляет кодон терминации и модифицирует использованием С-концевого кодона Ser-остатка с AGC на TCG, обеспечивая создание уникального BamHI-сайта на стыке мутантный IL-15/Fc. Синтетические олигонуклеотиды, используемые для амплификации Fcγ2a-домена кДНК, меняют первый кодон шарнира с Glu на Asp с целью создания уникального BamHI-сайта, охватывающего первый кодон шарнира и вводят уникальный XbaI-сайт на 3'-конце от кодона терминации.
Fc-фрагмент можно модифицировать так, чтобы он не истощал клетку-мишень, т.е. был неспособен активировать систему комплемента. Чтобы создавать мутантную конструкцию IL-15 (mIL-15/Fc), не истощающую клетку-мишень, используют сайт-направленный мутагенез с применением олигонуклеотидов, чтобы заменить Glu318, Lys320, Lys322 C'1q-связывающего мотива Ala-остатками. Точно так же, Leu235 заменяется Glu, что инактивирует сайт связывания FcγR I. Лигирование цитокина и Fc--компонентов в правильно транслируемой рамке считывания по уникальному BamHI-сайту дает открытую рамку считывания размером 1236 п.н., кодирующую единственный полипептид из 411 аминокислот (включая 18 аминокислот сигнального пептида IL-15), насчитывающий 13 цистеиновых остатков. Зрелый секретируемый гомодимерный IL-15/Fc предположительно обладает до восьми внутримолекулярных и тремя, между тяжелыми цепями, дисульфидными связями, и молекулярной массой приблизительно 85 кДа, за исключением гликозилирования.
Экспрессирование и выделение очисткой mIL-15R/Fc-слитых белков
Правильную генетическую конструкцию mIL-15/Fc можно подтвердить секвенированием ДНК после клонирования химерного гена в виде NotI-XbaI-кассеты в эукариотическую экспрессионную плазмиду pRc/CMV (Invitrogen, San Diego, CA). Данная плазмида несет CMV-промотор/энхансер, сигнал полиаденилирования бычьего гормона роста и ген устойчивости к неомицину для селекции по G418. Плазмиды, несущие слитый ген mIL-15/Fc, трансфицируют в клетки яичника китайского хомячка (СНО-K1, доступные из American Type Culture Collection) электропорацией (1,5 кВ/3 мкФ/0,4 см/PBS) и отбирают в бессывороточной Ultra-CHO-среде (BioWhittaker Inc., Walkerville, MD), содержащей 1,5 мг/мл G418 (Geneticin (Генетицин), Gibco BRL). После субклонирования клоны, которые продуцируют высокие уровни слитого белка, отбирают путем скринирования супернатантов IL-15 с помощью ELISA (PharMingen, San Diego, CA). Слитые белки mIL-15/Fc выделяют очисткой из культуральных супернатантов с помощью аффинной хроматографии на белок-А-сефарозе с последующим диализом против PBS и стерилизацией через 0,22 мкм фильтр. Выделенные очисткой белки можно хранить до использования при -20°С.
Вестерн-блот-анализ после SDS-PAGE в восстанавливающих (с DDT) и в невосстанавливающих (без DDT) условиях можно осуществлять с использованием моноклональных или поликлональных первичных антител против mIL-15 или к Fcγ для оценки размера и изотипической специфичности слитых белков. Функциональную активность мутантного IL-15/Fc можно оценить, как описано выше, с помощью стандартного анализа на пролиферацию Т-клеток. Следующие mAbs были получены от PharmMingen (San Diego, CA): конъюгированные с PE антитела к CD25 мыши (α-цепь IL-2R, IgG1, PC61), крысиные антитела к CD122 мыши (β-цепь IL-2R, IgG2b, TM-b1), крысиные антитела к CD132 мыши (IL-2Rγc, IgG2b, TUGm2), антитела хомячка к CD3 мыши (IgG, 145-2C11), антитела хомячка к CD28 мыши (IgG, 37,51), конъюгированные с PE антитела к CD62L мыши (IgG2a, MEL14), конъюгированные с PE антитела хомячка к Bcl-2 мыши (IgG, 3F11), конъюгированные с PE антитела к IL-2 мыши (IgG2b, JES6-5H4), конъюгированная PE с аннексином V, биотинилированный антикрысиный IgG2b, PE-стрептоавидин, PE-CyChrome, и конъюгированные с PE контрольные изотипы mAbs. Биотинилированное mAb мыши к FLAG и контрольное mAb IgG1 крысы получены от Sigma Chemical Co. (St. Louis, MO). В-клеточная гибридома, секретирующая крысиные mAb к CD25 мыши (TIB 222, IgG1), получена от American Type Culture Collection (ATCC; Manassas, VA). Клетки выращивали в бессывороточной UltraCulture-среде (BioWhittaker, Walkerville, MD) и mAb из культурального супернатанта выделяли очисткой на колонке с G-белком.
Экспрессионные исследования IL-2 и IL-15 in vivo
Рекомбинантные IL-2 и IL-15 человека приобретали у R & D System (Minneapolis, MN). Слитые белки IL-15-FLAG и мутант IL-15/Fc конструировали, экспрессировали и тестировали, как описано раньше (Chae и соавт., J. Immunol. 157:2813-2819, 1996; Kim и соавт., J. Immunol. 161:5742-5748, 1998). Крысиные mAb к γс мыши (4G3/3E12, IgG2b) использовали, как описано раньше (Li и соавт., J. Immunol. 164:1193-1199, 2000).
Лимфоциты метили с помощью сукцинимидного эфира флуорохрома 5-карбоксифлуоресцеиндиацетата (CFSE; Molecular Probes, Inc., Portland, OR) следующим образом. Селезенки и периферические лимфатические узлы собирали от мышей-доноров и суспензии отдельных клеток готовили в сбалансированном солевом растворе Хэнкса (HBSS). Эритроциты лизировали гипотоническим шоком. Клетки ресуспендировали в HBSS в концентрации 1×107/мл и метили с помощью CFSE, как описано у Wells и соавт. (J. Clin. Invest. 100:3173-3183, 1997).
Чтобы активировать in vivo CFSE-меченные Т-клетки, DBA/2-мышей облучали (1000 рад) с помощью Gammacell Exactor (Kanata, Ontario, Канада). Затем каждой мышке в хвостовую вену вводили 4-6х107 клеток, меченных CFSE, в 0,5 мл HBSS. Через три дня мышей-хозяев забивали и отдельно собирали селезенки и периферические лимфатические узлы. Готовили суспензии отдельных клеток для окрашивания клеточной поверхности и FACS-анализа.
В некоторых экспериментах облученных мышей-хозяев обрабатывали с помощью mAb к CD25 или mAb к γс (i.p. по 1 мг/день в течение 3-х дней, начиная с i.v. инъекции CFSE-меченных клеток). Наличие клеточного деления in vivo определяли на 3-й день после инъекции CFSE-меченных клеток. Обработку мутантным IL-15/Fc-слитым белком осуществляли с помощью 1,5 мкг i.p. ежедневно, в течение трех дней, начиная с i.v. инъекции меченных клеток.
CFSE-меченные клетки, активированные in vivo у облученных аллогенных хозяев, окрашивали для выявления экспрессии субъединиц IL-2 и IL-15-рецепторов. Чтобы детектировать экспрессию α-цепи IL-2-рецептора, клетки (2×106) окрашивали с помощью конъюгированных с PE антител к CD25 мыши на льду в течение 30 минут, отмывали, и ресуспендировали в 1 мл PBS, содержащем 0,5% BSA. Чтобы детектировать экспрессию β и γс IL-2R, клетки инкубировали с крысиными mAb против мышиной β-цепи (IgG2b) или mAb к γс (IgG2b) на льду в течение 30 минут и затем с биотинилированным противокрысиным IgG2b. Клетки отмывали и окрашивали затем с помощью PE-стрептоавидина в течение 20 минут. Клетки отмывали и ресуспендировали в PBS-0,5% BSA для анализа. Чтобы детектировать экспрессию α-цепи IL-15R, клетки инкубировали со слитым белком IL-15-FLAG, который связывается с α-цепью (Chae и соавт., J. Immunol. 157:2813-2819, 1996) и затем окрашивали с помощью биотинилированных мышиных mAb к FLAG. Затем клетки отмывали и окрашивали PE-стрептоавидином. В каждый эксперимент в качестве контроля включали изотипические контрольные mAb. Все образцы анализировали с использованием FACSort и программного обеспечения CellQuest™ (Becton Dickinson, Mountain View, CA). Собирали данные и анализировали путем синхронизации по отношению к CFSE+-клеткам. Все делящиеся CFSE+-клетки были Т-клетками, как установлено по экспрессии CD3. Для каждого образца собрано, по меньшей мере, 100000 событий.
Апоптоз делящихся in vivo клеток анализировали следующим образом. CFSE-меченные лимфоциты стимулировали in vivo в облученных аллогенных хозяевах, как описано выше. Через три дня из селезенки и периферических лимфатических узлов хозяина собирали клетки и окрашивали PE-конъюгированным аннексином V, на льду в течение 15 минут в буфере для меченья. Клеточное деление идентифицировали на основе CFSE-профиля клетки и апоптозную клеточную смерть в каждом отдельном клеточном делении анализировали с помощью окрашивания аннексином V.
Клетки также окрашивали на внутриклеточную экспрессию цитокинов IL-2 и Bcl-2. CFSE-меченные клетки, активированные in vivo в течение трех дней, собирали из селезенки и лимфатических узлов хозяина. Клетки повторно стимулировали in vitro с помощью PMA (50 нг/мл) и иономицином (500 нг/мл) в течение четырех часов, и в течение последних двух часов культивирования добавляли GolgiStop™ (PharMingen). Клетки фиксировали и делали проницаемыми с помощью Cytofix/Cytoperm (PharmMingen) при 4°С в течение 10 минут, после чего окрашивали конъюгированными с PE mAb к IL-2 мыши, в качестве контроля включали изотипическое контрольное mAb. Что касается Bcl-2-окрашивания, то клетки фиксировали и делали проницаемыми с помощью Cytofix/Cytoperm в течение 10 минут и окрашивали конъюгированными с PE mAb к Bcl-2 или изотипическим контрольным Ab в течение 30 минут. Клетки промывали и анализировали с помощью FACS.
Сортировку клеток и повторную стимуляцию in vitro осуществляли следующим образом. CFSE-меченные клетки получали от облученных аллогенных хозяев спустя три дня после i.v. инъекции меченных клеток. Клеточную пролиферацию in vivo идентифицировали при помощи анализа их CFSE-профилей. Отбирали клетки второго деления, синхронизировали, и сортировали c помощью сортера FACS Vantage™ (Becton Dickinson) со скоростью 2000 событий/секунду (2000 клеток/секунду). Отсортированные клетки ресуспендировали в среде RPMI 1640 с добавлением 10% FCS, а также 1% пенициллина и стрептомицина на 5×105/мл и пассировали в планшеты, покрытые антителами к CD3 (2 мкг/мл) вместе с mAb к CD28 (1 мкг/мл). Через три дня клетки собирали и окрашивали при помощи конъюгированных с PE антител против CD25 мыши и изотипических контрольных Ab. Пролиферацию клеток и экспрессию α-цепи рецептора IL-2 анализировали в FACS.
Клеточный сортинг и in vivo пролиферативные анализы осуществляли следующим образом. CFSE-меченные клетки получали от облученных аллогенных хозяев через три дня после внутривенной инъекции меченных клеток, и пролиферацию клеток in vivo идентифицировали путем анализа CFSE-профиля клеток. Отбирали клетки второго деления, синхронизировали, и сортировали c помощью сортера FACS Vantage™. Клетки (1×104/мл) ресуспендировали в среде RPMI 1640 с 10% FCS, а также 1% пенициллина и стрептомицина и стимулировали с помощью IL-2 (от 40 мкг/мл до 500 мкг/мл) или IL-15 (5 нг/мл) в течение 48 часов. Клетки импульсно метили с помощью 1 мКи 3H-TdR (Amersham, Boston, MA) в течение 16 часов, и поглощение3H-TdR определяли в сцинтилляционном счетчике (Beckman Instrument, Columbia, MD).
Реагенты и методы, описанные выше, создали основу для нескольких обнаруженных фактов. Во-первых, CFSE-меченные B6AF1 (H-2b/d.k) аллогенные лимфоциты, в противоположность сингенным контролям (Li и соавт., Nature Medicine 5:1298-1302, 1999), сильно размножались у облученных DBA/2 (H-2d) хозяев. Приблизительно 20% CFSE-меченных Т-клеток из селезенки хозяина вступали в клеточный цикл в течение трех дней после адоптивного переноса и за это время отчетливо идентифицировались семь-восемь отдельных циклов клеточного деления (Фиг.3А). Удивительно, но α-цепь рецептора IL-2, которая необходима для передачи сигнала посредством высокоаффинного IL-2 рецептора, не могла быть детектирована на протяжении первых 5 делений, т.е. эта рецепторная субъединица экспрессируется лишь после пяти клеточных делений. Напротив, β-субъединицы IL-2-рецептора экспрессировались конститутивно всеми делящимися Т-клетками, и уровень их экспрессии постепенно увеличивался, по мере того как клетки продолжали делиться. Паттерн γс-экспрессии in vivo сильно отличается от паттерна экспрессии α-цепи и β-цепи (Фиг.3А). Неделящиеся Т-клетки (0 деления) экспрессировали очень низкие уровни γ-цепи (<10%). После вступления в клеточный цикл, γ -цепь в делящихся Т-клетках становилась высокоэкспрессируемой и уровни экспрессии продолжали повышаться после каждого последующего клеточного деления. Однако через пять циклов деления экспрессия γ-цепи резко снижалось, достигая почти исходного уровня после шестого клеточного деления (Фиг.3А).
Разная экспрессия субъединиц IL-2-рецептора не связана с избирательным накоплением подкласса активированных Т-клеток в селезенке хозяина, поскольку CFSE-меченные клетки, собранные из периферических лимфатических узлов проявляли очень сходный паттерн экспрессии для трех субъединиц IL-2-рецептора.
Во-вторых, стимуляция CFSE-меченных Т-клеток in vivo приводила к монотонной экспрессии всех трех субъединиц IL-2-рецептора (Фиг.3В). Это дает основание полагать, что регуляция экспрессии IL-2-рецептора in vivo отличается от таковой in vitro. Известно, что α-цепь рецептора IL-2 чувствительна к протеолитическому расщеплению in vivo, по способу, подобному способу расщепления селектинов (Hemar и соавт., J. Cell. Biol. 129:55-64, 1995). Окрашивание экспрессии L-селектина в делящихся in vivo Т-клетках свидетельствует, что L-селектин экспрессировался на высоком уровне в течение первых пяти циклов клеточного деления (Фиг.3С), и это заставляет полагать, что неудача с детекцией экспрессии α-цепи рецептора IL-2 в течение первых пяти клеточных делений не обусловлена быстрым протеолитическим расщеплением. Чтобы определить способны ли Т-клетки в течение первых пяти клеточных делений экспрессировать α-цепь рецептора IL-2, Т-клетки во втором клеточном делении, которые не экспрессировали α-цепь рецептора IL-2, сортировали и стимулировали in vitro в течение трех дней иммобилизованным анти-CD3 и растворимым анти-CD28. Эти сортированные Т-клетки продолжали делиться и после in vitro рестимуляции, и все делящиеся Т-клетки экспрессировали α-цепь рецептора IL-2. Очевидно, что экспрессия α-цепи рецептора IL-2 in vivo и in vitro регулируется по-разному.
Поскольку рецептор для IL-15 также использует β- и γ-цепи рецептора IL-2 в качестве крайне необходимых компонентов передачи сигнала (Tagaya и соавт., Immunity 4:329-336, 1996), которые на высоком уровне экспрессировались в течение первых пяти клеточных делений, авторы настоящего изобретения задались вопросом, действительно ли клетки экспрессируют α-цепь рецептора IL-15, которая делает их чувствительными к IL-15 в период начальных клеточных делений. Применение слитого белка IL-15-FLAG в качестве первичного окрашивающего реагента (Chae и соавт., J. Immunol. 157:2813-2819, 1996), продемонстрировало, что α-цепь рецептора IL-15 четко детектируется, хотя и на низком уровне, на делящихся клетках, независимо от числа клеточных делений (Фиг.4А). α-Цепь для IL-2-рецептора не детектировалась во всех делящихся in vivo Т-клетках. Таким образом, селективная экспрессия α-цепи IL-15-рецептора, но не IL-2-рецептора, вместе с экспрессией общих β- и γ-цепей в течение первых пяти клеточных делений, предполагает, что первоначальное клеточное деление in vivo является, по-видимому, IL-15-, а не IL-2-зависимым.
Для проверки данной гипотезы в делящихся in vivo Т-клетках оценивали образование IL-2. Внутриклеточное окрашивание IL-2 обнаруживало, что IL-2 высокоэкспрессируем лишь в клетках, которые делились более пяти раз. Обработка мышей-хозяев насыщающими дозами цитолитического mAb к CD25 не подавляла первые пять клеточных делений (по сравнению с мышами, обработанными контрольным Ab), и делящиеся клетки в первом и пятом делениях у мышей, обработанных анти-CD25, и у контрольных мышей были очень сходными. Кроме того, Т-клетки во втором клеточном делении in vivo сортировали и культивировали in vitro в присутствии IL-2 или IL-15, а клеточную пролиферацию анализировали по поглощению3H-TdR. IL-2, предложенный в таких дозах, как 500 u/мл в культуре, не поддерживал пролиферацию Т-клеток. В противоположность этому, IL-15 весьма стимулировал клеточную пролиферацию (Фиг.4В).
Паттерн in vivo экспрессии IL-2 сильно связан с повышенной регуляцией α- и β-цепей рецептора IL-2, и заметно пониженной экспрессией общей γ-цепи (Фиг.5А). Это предполагает, что IL-2 регулирует экспрессию γ-цепи in vivo. Для проверки данного предположения в Т-клетках от дефицитных по IL-2 мышей и от контрольных мышей дикого типа анализировали экспрессию γ-цепи. CD4+-Т-клетки мышей, дефицитных по IL-2, экспрессировали на их клеточной поверхности, по сравнению с контрольными мышами дикого типа, очень высокие уровни γ-цепи (Фиг.5В). Обработка мышей-хозяев анти-CD25 подавляла низкую регуляцию γ-цепи в делящихся in vivo Т-клетках, но данная обработка не влияла на экспрессию β-цепи IL-2-рецептора (Фиг.5С).
γ-Цепь является ключевым сигнальным элементом для всех известных Т-клеточных факторов роста, и γ-цепочечные сигналы существенны для клеточного выживания, осуществляемого, по меньшей мере, отчасти в результате устойчивой экспрессии антиапоптозных белков семейства Bcl-2 (Nakajima и соавт., J. Exp. Med. 185:189-195, 1997). Чтобы определить действительно ли уменьшение экспрессия γ -цепи после пяти клеточных делений in vivo регулирует клональную экспансию, CFSE-меченные клетки были окрашены PE-аннексином V после извлечения из хозяев, а апоптозную гибель делящихся Т-клеток, анализировали in vivo. Сплошная гибель клеток происходила после четырех клеточных делений. Неделящиеся клетки (0 делений) обладали <10% клеток, позитивных по аннексину V. Однако после шестого клеточного деления ˜40% клеток оказывались позитивными по аннексину V. Данный тип клеточной смерти не является Fas-зависимым, поскольку Т-клетки от Fas-мутантных MRL-lpr-мышей обладали сходной картиной апоптозной гибели клеток in vivo (Li и соавт., J. Immunol. 163:2500-2507, 1999). Окраска на Bcl-2-экспрессию показала, что средняя интенсивность флуоресценции окрашенного Bcl-2 заметно меньше после четырех клеточных делений (Фиг.5Е). Следовательно, сигнальные события при негативной регуляции γ-цепи не поддерживают устойчивую экспрессию Bcl-2 и клетки становятся восприимчивы к апоптозной гибели (Nakajima и соавт., J. Exp. Med. 185:189-195, 1997).
Данные результаты позволяют предполагать, что блокирование сигнала IL-2 или IL-15 будет по-разному влиять на in vivo экспансию Т-клеток. Для дальнейшего исследования этой возможности, CFSE-меченные лимфоциты от дефицитных по IL-2 мышей (H-2b) вводили инъекцией облученным DBA/2 хозяевам (H-2d), клеточное деление анализировали in vivo спустя три дня и сравнивали с лимфоцитами у контрольных мышей дикого типа. Т-клетки от дефицитных по IL-2 мышей продолжали делиться и разрастаться in vivo. Почти 30% CFSE-меченных клеток вступали в клеточный цикл и большинство клеток, по сравнению с контролем, подвергались делению более пяти раз.
Обработка мышей-хозяев мутантным IL-15/Fc, который действует в качестве специфичного антагониста IL-15-рецептора (Kim и соавт., J. Immunol. 161:5742-5748, 1998), заметно снижала частоту пролиферации CFSE-меченных Т-клеток и подавляющее большинство CFSE-меченных клеток не вступало в клеточное деление у обработанных мышей. Кроме того, обработка мышей-хозяев блокирующим mAb к общей γ-цепи, общему сигнальному компоненту рецепторов IL-2 и IL-15, также заметно подавляла in vivo деление Т-клеток. Следовательно, IL-2 и IL-15 регулируют разные аспекты in vivo экспансии Т-клеток, и, как указано выше, введение антагонистов этих интерлейкинов может супрессировать иммунный ответ.
Данные результаты также демонстрируют, что для негативной регуляции γ-цепи требуются Т-клеточная активация и прогрессирование клеточного цикла, а также передача сигнала посредством IL-2. Очевидно, что негативная регуляция in vivo γ-цепи тесно ассоциируется с образованием IL-2 и экспрессией высокоаффинного IL-2-рецептора. В отсутствие IL-2, γ-цепь экспрессируется на чрезвычайно высоких уровнях, а блокада IL-2-рецептора подавляет негативную регуляцию in vivo γ-цепи в циклирующих Т-клетках. Таким образом, в данных исследованиях получено новое доказательство того, что IL-2 и IL-15 регулируют разные аспекты первичной Т-клеточной активации in vivo. Вопреки традиционным предположениям и заключениям, основанным на in vitro-исследованиях, IL-15 является ключевым фактором роста в инициации Т-клеточного деления in vivo, а IL-2 играет уникальную роль в контролировании размера клональной экспансии путем регуляции экспрессии γ-цепи в циклирующих Т-клетках.
Данные результаты поддерживают описанные здесь примеры их клинического применения. Попытки усилить Т-клеточный ответ с помощью экзогенного IL-2 при опухолевом иммунитете и AIDS может способствовать преждевременной гибели Т-клеток, а терапия, которая блокирует участие IL-2 в индукции толерантности и аутоиммунности, может вызывать нежелательную экспансию Т-клеток. Кроме того, поэтапное и объединенное нацеливание на IL-15 и IL-2 представляется существенным средством, которое блокирует Т-клеточную активацию при Т-клеточно зависимых цитопатических состояниях.
Литический IL-2/Fc лизирует клетки, несущие IL-2R, и связывается с FcRI
Клетки Т-клеточной линии (клетки CTLL-2; 106) метили 100 мКи51Cr и инкубировали с литической формой IL-2/Fc и с крысиным низкотоксичным комплементом (C'), с нелитической формой IL-2Fc и C', с мышиным иммуноглобулином и C' (негативный контроль) или только с C' (негативный контроль при 0,5 мкг/мл). Другую группу таких же клеток обрабатывают детергентом (1% NP40) (позитивный контроль). Лизис клеток измеряли по высвобождению51Cr. Степень лизиса, наблюдаемая в присутствии детергента, соответствует 100% лизису. Специфический лизис после вышеописанной обработки рассчитывали по формуле: % специфического лизиса = [(экспериментальная величина cpm - фоновая величина cpm)/(суммарная величина высвобождения cpm - фоновая величина cpm) × 100%]. Полученные результаты, которые показаны на Фиг.6, поддерживают вывод о том, что цитолитический IL-2/Fc лизирует CTLL-2-клетки, несущие IL-2R, а нелитический IL-2/Fc не делает этого.
Чтобы оценить способность литического или нелитического IL-2/Fc связывать Fc-рецепторы в СНО-клетках, трансфицированных FcRI (мышиный FcRI, FcRII, и IL-2R-негативный), FcRI-трансфектанты преинкубировали с PBS, mIgG2a, литическим IL-2/Fc, или нелитическим IL-2/Fc. После промывки, флуоресцентно-конъюгированные антитела козы к Fc мыши использовали для окраски клеток для FACS-анализа. Как показано на Фиг.7, цитолитический IL-2/Fc может связать FcRI, а литический IL-2/Fc - не может.
Литический IL-2/Fc эффективен в предупреждении форм диабета в модели адоптивного переноса
Создавали 2 отличающихся варианта IL-2/Fc. Первый вариант содержал Fc-конец, полученный из мышиного IgG2а, который должен опосредовать CDC и CDCC (IL-2/Fc), а второй вариант был представлен Fc-районом с точковой мутацией, который не должен активировать CDC или CDCC (IL-2/Fc-/-). В то время как IL-2/Fc опосредует CDC в клетках, несущих IL-2R (в таких, как мышиная Т-клеточная линия CTLL-2) и связывается с FcRI, IL-2/Fc-/- не делает этого (Фиг.6 и 7). Более того, молекула литического IL-2/Fc должна предупреждать развитие форм диабета в модели адоптивного переноса NOD, а нелитическая форма молекулы (IL-2/Fc-/-) не является эффективной для этого (Фиг.13). В животной модели монодиспергированные клетки селезенки были истощены от эритроцитов путем обработки лизирующим буфером ACK (BioWhittaker Inc., Walkersville, MD). Реципиентным самцам NOD-мышей, облученным (700 рад) в возрасте восьми-12 недель, не страдающих диабетом, инъецировали (после облучения) 2×107 лейкоцитов селезенки от самки-мыши NOD, страдающей диабетом в острой форме (гипергликемия<двух недель). Уровни глюкозы крови (BGL) контролировали еженедельно, диабет диагностировали, когда BGL превышал 16,5 ммоль/Л при любом однократном измерении или превышал 13,8 ммоль/Л в 3 последующие дня. Как показано на Фиг.13, большинство животных оставались недиабетичными даже после того, как лечение было прервано.
Как указано выше, анализы и модели на животных, представленные здесь, могут использоваться для тестирования различных сочетаний агентов настоящего изобретения на терапевтическую эффективность.
Рапамицин подавляет пролиферацию Т-клеток в in vivo-модели "трансплантат против хозяина", но не подавляет апоптоз активированных Т-клеток
В in vivo-модели "трансплантат против хозяина" (которая описана выше) анализировали судьбу хозяйских реактивных Т-клеток в присутствии IL-2/Fc и рапамицина. Как показано на Фиг.8, рапамицин подавляет пролиферацию CD4+- и CD8+-Т-клеток, даже в присутствии IL-2/Fc, но не допускает экспрессии функционального IL-2R. Как доказано с помощью окрашивания Аннексином V, хозяйские реактивные Т-клетки, активированные антигеном, подвержены апоптозу в присутствии IL-2/Fc и рапамицина (Фиг.10).
Композиции настоящего изобретения делают возможным длительное выживание островковых и кожных аллотрансплантатов
Чтобы предотвратить отторжение любых аллогенных островков, трансплантированных NOD-реципиентам с острым диабетом, или кожных трансплантатов, трансплантированных NOD-мышам, использовали сочетание агентов, способствующих гибели Т-клеток и подавляющих пролиферацию Т-клеток. Как показано на Фиг.11 и 12, сочетание литического IL-2/Fc, mutIL-15/Fc и рапамицина является эффективным для предотвращения отторжения трансплантата (и более эффективным, чем другие испытанные схемы лекарственного лечения). Выживание и функционирование трансплантата сохранялись в течение показанного периода наблюдения и большинство трансплантатов выживали после прекращения лечения. Этот впечатляющий результат, очевидно, обусловлен сочетанием используемых агентов (агентов, которые усиливают гибель Т-клеток, а также подавляют пролиферацию Т-клеток).
Описаны ряд вариантов осуществления настоящего изобретения. Тем не менее, следует иметь в виду, что могут быть осуществлены различные модификации, не выходящие за рамки существа и объема настоящего изобретения. В соответствии с этим другие варианты осуществления настоящего изобретения находятся в рамках объема нижеследующей формулы изобретения.
Реферат
Изобретение относится к области иммунологии. Сущность его заключается в разработке композиций, включающих в качестве первого активного агента, мишенью которого является рецептор интерлейкина-15 (IL-15), в качестве второго рецептор интерлейкина - 2 (IL-2), а также способы супрессии иммунного ответа. Препараты можно использовать в комбинированной терапии: два или более агентов, каждый из которых способствует гибели Т-клеток или, по меньшей мере один агент, который ингибирует пролиферацию Т-клеток. Технический результат - повышение эффективности иммунотерапии. 6 н. и 28 з.п. ф-лы, 13 ил.

Комментарии