Конструирование рекомбинанта онколитического аденовируса, специфически экспрессирующего иммуномодуляторный фактор gm-csf в опухолевых клетках, и его применение - RU2361611C2
Код документа: RU2361611C2
Чертежи
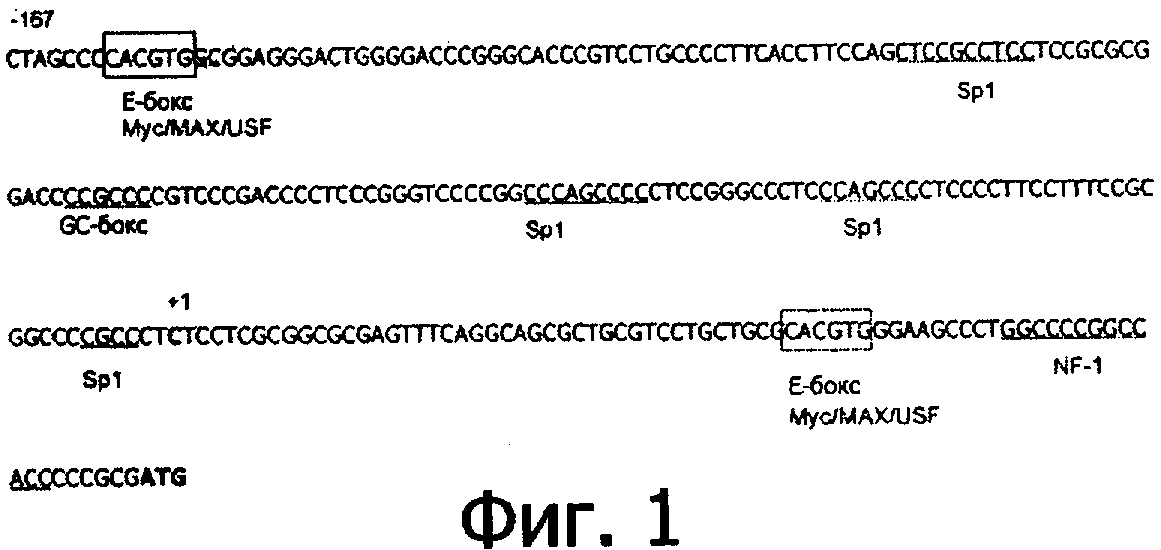
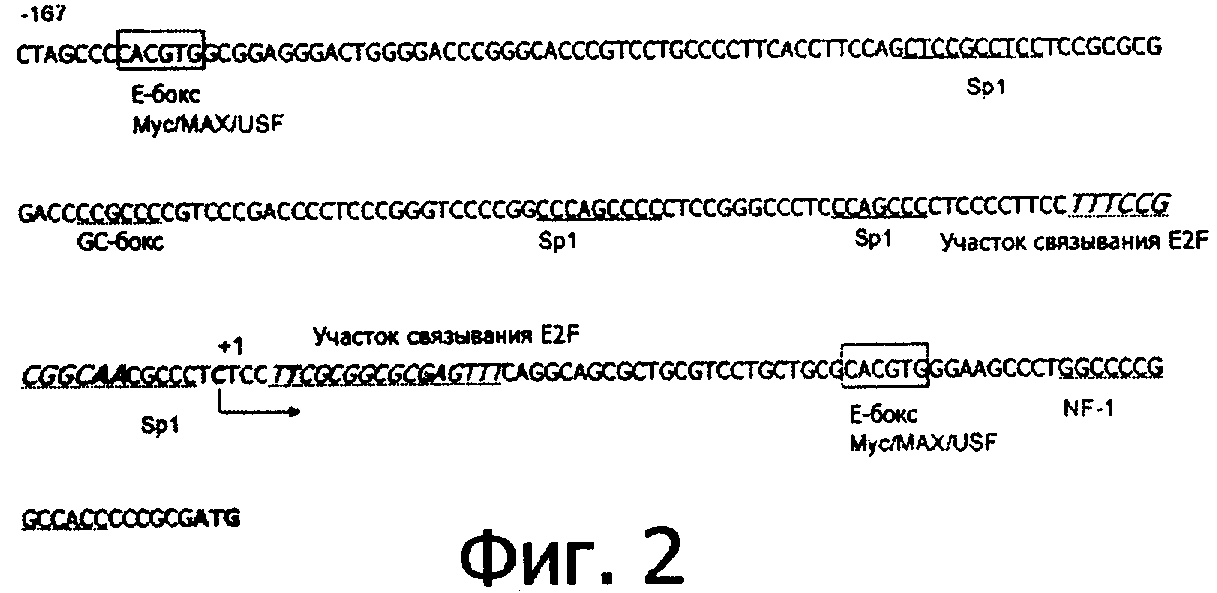







Описание
Область техники, к которой относится изобретение
Настоящее изобретение касается генной терапии опухолей. Более точно, настоящее изобретение касается конструирования рекомбинантов онколитических аденовирусов, которые предпочтительно реплицируются в опухолевых клетках и экспрессируют иммуностимулирующий фактор для индукции опухолеспецифического иммунного ответа в организме человека.
Уровень техники
Прошло уже более столетия с того момента, когда вирусы были использованы для лечения неопластических заболеваний. Врачи обратили внимание на то, что иногда пациент выздоравливал после вирусной инфекции. Эта загадка была неразрешимой до начала 1920-х годов и с тех пор привлекает внимание ученых и врачей-клиницистов. Так было положено начало вирусной терапии (использованию вирусов для лечения рака). К 1950-м годам более 50 вирусов было протестировано на их противоопухолевую активность у животных или человека (Mullen and Tanabe. (2002) The Oncologist 7:106-119; McCormick F. (2001) Nature Review Cancer 1:130-141). В 1956 году Др.Смит (Dr.Smith) и его коллеги обработали более 30 пациенток с раком шейки матки лизатом клеток HeLa или клеток KB, которые были инфицированы 10 серотипами аденовирусов дикого типа, путем инъекции в опухоль, инъекции в печеночную артерию или внутривенной инъекции. Серьезных побочных эффектов обнаружено не было, за исключением симптомов гриппа у большинства пациенток; с другой стороны, опухоли у некоторых пациенток уменьшились в размерах и подверглись некрозу. К сожалению, из-за ограничений в производстве и очистке вирусов эта работа не имела своего продолжения. Работа Др.Смита была одобрена многими учеными, так как позволяла исследовать возможность использования вирусов для лечения рака (Chiocca E.A. (2002) Nature Review Cancer 2: 938-950).
В связи с прогрессом в области молекулярной биологии и генетической инженерии, в частности в связи с лучшим пониманием взаимоотношений вируса и организма человека, ученые с конца прошлого столетия получили возможность генетически манипулировать с геномом вирусов, что обеспечило успех в создании вирусных мутантов, которые могли специфически реплицироваться в опухолевых клетках (McCormick F. (2001) Nature Review Cancer 1:130-141). Например, глиома-специфичный мутант G207 вируса герпеса (Martuza et al. (1991) Science 252:854-856), аденовирус Addll520 (Onyx-015), мутантный аденовирус, предпочтительно реплицирующийся в опухолевых клетках, дефектных по белку р53 (Bischoff et al. (1996) Science 274:373-376), и CV706, мутантный аденовирус, специфичный к клеткам рака предстательной железы (Rodriguez et al. (1997) Cancer Research 57:2559-2563). Эти работы положили начало формированию новой области медицины - Вирусной Терапии Рака. В настоящее время более 20 вариантов вирусов проходит клинические испытания (Mullen and Tanabe (2002) The Oncologist 7:106-119).
Существует несколько подходов для создания онколитических вирусов, специфичных к раковым клеткам. Один подход заключается в создании варианта вируса, который селективно реплицируется в опухолевых клетках, с использованием специфичных для опухолевых клеток регуляторных элементов, таких как промоторы и энхансеры, для контроля экспрессии основных вирусных генов, например генов Е1А, Е1В, Е2 и Е4 аденовируса (DeWeese et al. (2001) Cancer Research 61:7464-7472). При использовании этого подхода основные вирусные гены и в конечном итоге репликация вируса будут находиться под контролем регуляторных элементов, специфичных для опухолевых клеток, такие регуляторные элементы включают промотор и энхансеры простата-специфичного антигена (PSA), промотор и энхансеры альфа-фетопротеина (AFP), промотор E2F-1 человека и так далее (McCormick F. (2001) Nature Review Cancer 1:130-14).
Теломераза представляет собой очень важный фермент, который контролирует длину концов хромосом в клетках и может регулировать длину концов хромосом в процессе клеточного деления. Теломераза состоит, главным образом, из трех частей, где РНК и ген обратной транскриптазы теломеразы (hTERT), которая является каталитически активной, контролируют активность теломеразы, а промотор hTERT определяет уровень экспрессии и активность теломеразы.
Дальнейшие исследования показали, что теломераза либо не активна, либо имеет очень низкую активность в нормальных взрослых клетках (Kim N. W. et al. Science. 1994 Dec. 23; 266 (5193):2011-5; Shay J. W. et al. European Journal of Cancer. 1997, 33; 271-282), но имеет высокий уровень доставки в более чем 90% опухолевых клеток ((Hahn and Weinberg (2002) Nature Review Cancer 2:331-341; Shay and Wright (1996) Current Opinion Oncology 8:66-71). Основываясь на этих свойствах hTERT, ученые успешно создали несколько векторов, в которых промотор hTERT был включен в вирусный геном для доставки генов, включая недавно опубликованные работы, описывающие использование промотора hTERT для условно реплицирующихся онколитических аденовирусов (Lanson et al. (2003) Cancer Research 63:7936-7941; Kawashima et al. (2004) Clinical Cancer Research. 10:285-292; Kim et al. (2003) Oncogene 22:370-380; Irving et al. (2004) Cancer Gene Therapy 11:174-185).
В геноме аденовирусов имеется несколько эндогенных регуляторных элементов, которые регулируют экспрессию вирусных генов, например промотор и энхансер гена Е1А, и среди этих эндогенных регуляторных элементов последовательность энхансера гена Е1А перекрывается с сигналом вирусной сборки. Для того чтобы минимизировать вклад эндогенных регуляторных элементов в регуляцию гетерологичного промотора, ученые переставили сигнал вирусной сборки на правую сторону от нативного участка на левом конце вирусной ДНК (Bristol et al. (2003) Molecular Therapy 7 (6): 755-764; Jakubczak et al. (2003) Cancer Research 63:1490-1499). К сожалению, такое перемещение сигнала сборки вируса из нативного участка на правый конец вирусной ДНК дестабилизировало вирусный геном, что привело к образованию множества вирусных мутантов (WO 02/067861; ASGT 2003 Annual Meeting, Molecular Therapy). Таким образом, названное выше перемещение сигнала вирусной сборки не является удачным подходом для минимизации вклада эндогенных регуляторных элементов. Каким же образом можно минимизировать вклад эндогенных вирусных регуляторных элементов на гетерологичные регуляторные элементы и предотвратить нежелательное образование множества вирусных мутантов, сохранив при этом вирусный геном стабильным?
Принимая во внимание уровень экспрессии теломеразы у человека в период эмбрионального развития и дифференциации, ученые также обнаружили, что определенный уровень теломеразной активности наблюдается в некоторых типах клеток, включая клетки шейки матки, недифференцированные клетки-предшественники и стволовые клетки (Wright et al. (1996) Development Genetics 18:173-179; Sharma et al. (1995) Proc. Natl. Acad. Sci. USA 92:12343-12346; Kolquist et al. (1996) British Journal of Cancer 80:1156-1161; Tahara et al. (1999) Oncogene 18:1561-1567; Tanaka et al. (1998) American Journal of Pathology 153:1985-1991). Низкий уровень экспрессии теломеразной активности заставил ученых быть осторожными, когда они использовали промотор hTERT для доставки терапевтического гена в вектор для генной терапии или для создания онколитических аденовирусов, специфичных к опухолевым клеткам, путем контроля основных вирусных генов (Hahn WC (2004) Clinical Cancer Research 10:1203-1205). Из-за наличия низкого уровня экспрессии теломеразы в клетках, не являющихся мишенями, таких как недифференцированные клетки-предшественники, промотор hTERT, контролирующий онколитические аденовирусы, может в широком масштабе реплицироваться в клетках-предшественниках, приводя к тяжелым побочным эффектам (Huang et al. (2004) Clinical Cancer Research. 10:1439-1445; Hahn W.C. (2004) Clinical Cancer Research 10:1203-1205; Masutomi et al. (2003) Cell 114:241-253). Таким образом, увеличение специфичности промотора hTERT к опухолевым клеткам является одной из ключевых задач в создании онколитических аденовирусов с использованием промотора hTERT.
Раскрытие изобретения
В одном аспекте настоящее изобретение обеспечивает рекомбинант для контролирования экспрессии основных вирусных генов аденовируса человека, где рекомбинант получают путем включения специфических для опухолевых клеток регуляторных элементов в геном аденовируса.
С целью усовершенствования настоящего изобретения в другом аспекте настоящее изобретение обеспечивает онколитические аденовирусы, специфичные к опухолевым клеткам, а также рекомбинанты, получаемые путем комбинирования онколитических аденовирусов с иммунными регуляторными элементами с помощью методов генетической инженерии. Рекомбинант конструируется путем включения специфичного для опухолевых клеток промотора и иммунного регуляторного гена в геном аденовируса путем технологии клонирования ДНК; таким способом получается слитая последовательность, способная реплицироваться в опухолевых клетках и экспрессировать иммунный регуляторный ген в опухолевых клетках.
В другом аспекте настоящее изобретение обеспечивает рекомбинант онколитического вируса, специфичный к опухолевым клеткам, способный экспрессировать иммуностимулирующий фактор. Данный рекомбинант состоит, главным образом, из основного вирусного вектора, регуляторного элемента, специфичного для опухолевых клеток, и иммуностимулирующего фактора.
В другом аспекте настоящее изобретение обеспечивает способ получения условно реплицирующегося рекомбинанта онколитического вируса.
В другом аспекте настоящее изобретение обеспечивает применение условно реплицирующегося рекомбинанта онколитического вируса для производства лекарственного средства для предотвращения и/или терапевтического лечения раковых заболеваний.
В другом аспекте настоящее изобретение обеспечивает лекарственное средство для предотвращения и/или терапевтического лечения раковых заболеваний, которое содержит в себе условно реплицирующийся рекомбинант онколитического вируса.
В другом аспекте настоящее изобретение обеспечивает промотор с нуклеотидной последовательностью, указанной в SEQ ID NO. 2.
Рекомбинант согласно настоящему изобретению может быть использован для контроля аденовирусов до такой степени, что данные аденовирусы реплицируются только в опухолевых клетках. Путем генетической модификации промотора hTERT рекомбинант настоящего изобретения имеет значительно увеличенную специфичность промотора hTERT к опухолевым клеткам.
Способ получения рекомбинанта онколитического вируса, специфичного к опухолевым клеткам, согласно настоящему изобретению включает стадию включения методами генетической инженерии гена иммуностимулирующего фактора, который способен индуцировать специфичный иммуностимулирующий ответ организма человека на опухолевые клетки, в вирусный геном, специфически реплицирующийся в опухолевых клетках. Получаемый рекомбинант вируса может избирательно реплицироваться в специфической популяции клеток и может реплицироваться и распространяться в опухолевых клетках и, следовательно, убивать опухолевые клетки, таким образом рекомбинант может применяться для лечения рака и предотвращения развития опухолей.
Настоящее изобретение также обеспечивает новый способ воспроизведения условно реплицирующегося рекомбинанта онколитического аденовируса, отличающийся от известных в данной области техники. Согласно современному уровню развития данной области конструирование и воспроизведение условно реплицирующегося рекомбинанта онколитического аденовируса или созданных методами генетической инженерии вирусных векторов требует использования генно-инженерных клеточных линий, таких как клеточная линия 293. Такая клеточная линия экспрессирует аденовирусные E1-белки для обеспечения нормального функционирования репликационно-дефектного аденовирусного вектора с делетированым Е1 геном или условно реплицирующегося рекомбинанта онколитического аденовируса, в котором ген Е1 находится под контролем опухолевого клеточно-селективного регуляторного элемента. К сожалению, получаемый в такой клеточной линии рекомбинант обычно содержит определенное количество вируса дикого типа или рекомбинировавшего аденовируса (назван здесь как репликационно-компетентный аденовирус, RCA). Причина появления RCA в рекомбинантном продукте заключается в том, что в размножающихся клетках, таких как клетки линии 293, содержащих последовательности генов аденовируса, такие последовательности аденовируса «дикого типа» будут рекомбинировать в клетках с E1-делетированными или E1-усовершенствованными аденовирусами, приводя к возникновению аденовируса «дикого типа» или рекомбинантного аденовируса. Такой продукт может не удовлетворять требованиям, предъявляемым к нему, и может вызывать неожиданные побочные эффекты с небезопасными последствиями. Клетки, используемые для конструирования рекомбинанта согласно настоящему изобретению, не содержат последовательностей аденовирусных генов, и, таким образом, они позволяют избежать появления RCA и решить проблему безопасности, которая упоминалась выше.
Настоящее изобретение обеспечивает условно реплицирующийся рекомбинант онколитического аденовируса, в котором белок капсида улучшен для увеличения сродства к связыванию рекомбинанта с раковыми клетками, что приводит к увеличению инфекционной способности рекомбинанта в отношении опухолевых клеток. Во многих недавних исследованиях было показано, что в опухолевых клетках экспрессия рецептора 5 аденовируса (рецептор коксаки-вируса В и аденовируса, CAR) на низком уровне или отсутствует, однако все опухолевые клетки экспрессируют на высоком уровне белок CD46 (Shayakhmetov et al., 2002. Cancer Research 62:1063-1068). Дальнейшие исследования показали, что рецептором Аденовируса серотипа 35 является молекула белка CD46 (Sirena et al. (2004) Journal of Virology 78(9):4454-4462). Таким образом, мы предполагаем заменить последовательность, образующую булавовидный отросток, в последовательности белка аденовируса серотипа 5 вирусного рекомбинанта на соответствующую последовательность аденовируса серотипа 35, поскольку последний обеспечивает связывание с белковым рецептором CD46, в результате чего сконструировать рекомбинант, содержащий слитый аденовирус, способный связываться с рецептором. Можно надеяться, что такой рекомбинант будет обладать большей инфекционной активностью в отношении более широкого спектра опухолевых клеток.
Условно реплицирующийся онколитический вирус согласно настоящему изобретению может быть ДНК-содержащим вирусом или РНК-содержащим вирусом, может быть любым серотипом из серотипов аденовирусов, включая серотипы 5, 2, 35, 41 и т.д., предпочтительно серотипом 5 или улучшенным аденовирусом. Например, им может быть рекомбинантный аденовирус, у которого ген Е1А и ген Е1В связаны вместе сайтом внутреннего связывания рибосомы (internal ribosome entry site, IRES); рекомбинант аденовируса, в котором булавовидный отросток аденовируса типа 5 заменен на таковой аденовируса серотипа 35; рекомбинантный аденовирус, у которого последовательность терминации транскрипции вставлена ниже вирусного ITR и сайта упаковки, но выше гетерологичного промотора, такого как промотор hTERT; аденовирус, у которого удалены (делетированы) его кодирующие последовательности 10,4К, 14,5К и 14.7К в участке Е3. Названная последовательность терминации транскрипции может терминировать транскрипцию генов, опосредуемую любой РНК-полимеразой; такой последовательностью может быть, например, SV40 ранняя поли(А) сигнальная последовательность; такой последовательностью может быть последовательность рекомбинанта аденовируса, в которой удалены (делетированы) его кодирующие последовательности 10,4К, 14,5К и 14,7К в участке Е3.
Названным генным регуляторным элементом, который является специфичным для опухолевых клеток, является любой промотор, энхансер, сайленсер или их комбинация, предпочтительно улучшенный промотор hTERT, как указано в SEQ. ID No. 2, и данный промотор имеет участок связывания для фактора транскрипции E2F-1.
Названным иммунорегуляторным элементом могут быть любые гены или их варианты, которые способны стимулировать и индуцировать иммунный ответ, такие как IL-2, IL-10, IL-12, IL-15, IL-24, IL-25, GM-CSF, G-CSF и INF-альфа, INF-бета и т.д., предпочтительно GM-CSF, включая его секретируемые и связанные с мембранами формы, а также их варианты.
Предпочтительным рекомбинантом аденовируса согласно настоящему изобретению является такой рекомбинант, в котором основной вирусный вектор представляет собой улучшенный аденовирус, в котором в аденовирусной последовательности последовательность терминации транскрипции вставлена ниже вируснго ITR и сайта упаковки, но выше гетерологичного промотора, и где специфичным к опухолевым клеткам регуляторным элементом является промотор hTERT с последовательностью, показанной в SEQ ID NO. 2, и где иммуностимулирующим геном является GM-CSF, имеющий последовательность, показанную в SEQ ID NO. 3 (КН-901), или связанная с мембранами форма GM-CSF (КН-902).
Другим предпочтительным рекомбинантом аденовируса согласно настоящему изобретению является такой рекомбинант, в котором основной вирусный вектор представляет собой улучшенный аденовирус, в котором в его последовательности вместо последовательности, кодирующей булавовидный отросток аденовируса серотипа 5, вставлена последовательность, кодирующая булавовидный отросток аденовируса серотипа 35, и где специфичным к опухолевым клеткам регуляторным элементом является промотор hTERT с последовательностью, показанной в SEQ ID NO. 2, и где иммуностимулирующим геном является GM-CSF (КН-904), предпочтительно связанная с мембранами форма GM-CSF (КН-905).
Гены Е1А и Е1В сцеплены вместе с помощью IRES, последовательность, кодирующая булавовидный отросток, является последовательностью, кодирующей отросток серотипа 35, элемент терминации транскрипции вставлен ниже ITR и сайта упаковки и выше гетерологичного регуляторного элемента; селективный к опухолевым клеткам регуляторный элемент представляет собой промотор hTERT с последовательностью, показанной в SEQ ID NO. 2, где иммуностимулирующим геном является GM-CSF, предпочтительно в его связанной с мембранами форме.
Другим предпочтительным рекомбинантом аденовируса согласно настоящему изобретению является такой рекомбинант, в котором основной вирусный вектор представляет собой улучшенный аденовирус, у которого в аденовирусной последовательности последовательность терминации транскрипции вставлена ниже вирусного ITR и сайта упаковки, но выше гетерологичного промотора; аденовирус, у которого удалены (делетированы) его кодирующие последовательности 10,4К, 14,5К и 14,7К в участке ЕЗ; специфичный к опухолевым клеткам регуляторный элемент представляет собой промотор hTERT с последовательностью, показанной в SEQ ID NO. 2, где иммуностимулирующим геном является GM-CSF, предпочтительно связанная с мембранами форма GM-CSF (KH-903).
Другим предпочтительным рекомбинантом аденовируса согласно настоящему изобретению является такой рекомбинант, в котором последовательность терминации транскрипции вставлена ниже вирусного ITR и сайта упаковки, но выше гетерологичного промотора, и где аденовирусные гены Е1А и Е1В сцеплены вместе с помощью IRES, где специфичный к опухолевым клеткам регуляторный элемент представляет собой промотор hTERT с последовательностью, показанной в SEQ ID NO. 2, и где иммуностимулирующим геном является GM-CSF (KH-906).
Рекомбинантные аденовирусы согласно настоящему изобретению включают, но ими не ограничиваются, КН-901, КН-902, KH-903, КН-904, КН-905 и KH-906; последовательность для КН-901 показана в SEQ ID NO. 3, где
1) 1-103: аденовирусная левая ITR {аденовирус серотипа 5 с последовательностью, показанной в Genbank No. BK000408};
2) 194-358: последовательность сборки аденовирусная и последовательность энхансера для Е1;
3) 362-534: SV40 поли(А) сигнальная последовательность и линкер (последовательность аденовируса серотипа 5, из которой удалены пары нуклеотидов с 362 по 551);
4) 525-811: последовательность генетически улучшенного промотора hTERT и линкер;
5) от 812 в правую сторону: последовательность аденовируса, включающая Е1А, Е1В, Е2 и т.д.;
6) 28995-29436: иммуностимулирующий ген GM-CSF;
7) от 29437 в правую сторону: последовательность гена Е4 аденовируса и правый конец.
Последовательность КН-900 похожа на последовательность, показанную в SEQ ID NO. 3, хотя последовательность промотора hTERT в ней представляет собой последовательность дикого типа без трансверсии оснований (смотри последовательности SEQ ID NO. 1 и 2). В ней отсутствует SV40 поли(А) сигнальная последовательность между сайтом упаковки и промотором hTERT.
Последовательность КН-902 похожа на последовательность КН-901, но иммуностимулирующий ген GM-CSF заменен его мембранно-связанной формой с последовательностью, показанной в SEQ ID NO. 4.
Последовательность КН-903 похожа на последовательность КН-901, за исключением того, что кодирующая последовательность для 10.4К, 14,5К и 14,7К делетирована, делетированная последовательность является частью генома аденовируса с 29804 п.н. до 30857 п.н. Белки, кодируемые этой последовательностью, ингибируют иммунный ответ, в частности иммунный ответ, опосредованный фактором некроза опухолей (tumor necrosis factor, TNF). Таким образом, делеция этих кодирующих участков будет усиливать направленный на опухоль иммунный ответ, индуцируемый условно реплицирующимися онколитическими аденовирусами.
Последовательность КН-904 похожа на последовательность КН-901, за исключением того, что последовательность, кодирующая булавовидный отросток аденовируса серотипа 5, заменена на таковую серотипа 35, последовательность показана в SEQ ID NO. 5. Последние исследования показывают, что многие опухолевые клетки не экспрессируют рецепторный белок CAR для аденовируса серотипа 5, но экспрессируют на высоком уровне молекулы CD46. Молекула белка CD46 является рецептором для аденовируса серотипа 35. Таким образом, наличие булавовидного отростка серотипа 35 у аденовируса будет увеличивать инфекционную способность условно реплицирующихся рекомбинантов онколитического аденовируса.
КН-905 похожа на КН-904, за исключением того, что иммуностимулирующий ген GM-CSF заменен в ней с секретируемой формы на мембранно-связанную форму.
КН-906 получен из КН-901 посредством замещения эндогенного промотора Е1В на сайт внутреннего связывания рабосомы (Li et al., (2001) Cancer Research 62; Zhang et al. (2002) Cancer Research 62:3743-3750).
Настоящее изобретение также обеспечивает последовательность улучшенного промотора hTERT, как показано в SEQ ID NO. 2, этот промотор имеет участок связывания для фактора транскрипции E2F-1.
Настоящее изобретение также обеспечивает способ создания вышеназванного улучшенного промотора hTERT. На основе последовательности промотора hTERT, показанной на Фигуре 1, были синтезированы два праймера:
A. 5'-GTCTGGATCCGCTAGCCCCACG-3';
В. 5'-CGACCGGTGATATCGTTTAATTCGC-3'.
Промотор hTERT был амплифицирован посредством ПЦР при использовании активированной геномной ДНК человека в качестве матрицы и праймеров, показанных выше. Условия для проведения реакции ПЦР были следующими: для первого цикла - денатурация при 94°С в течение 5 минут, отжиг при 81°С в течение 1 минуты, достраивание при 72°С в течение 2 минут. Для каждого из следующих 35 циклов: денатурация при 93°С в течение 1 минуты, отжиг при 68°С в течение 1 минуты, достраивание при 72°С в течение 2 минут. ПЦР-продукт анализировали в геле из агара и фрагмент промотора hTERT извлекали из геля для подтверждения последовательности методом секвенирования. Было подтверждено, что последовательность соответсвует опубликованной последовательности (Фигура 1). Очищенный фрагмент ДНК, полученный в результате ПЦР, был клонирован в вектор pUC19. При использовании метода мутагенеза, описанного Stratagene (сайт-направленный мутагенез), последовательность промотора hTERT была изменена и получена последовательность, показанная на Фигуре 2.
Настоящее изобретение, таким образом, также обеспечивает улучшенный промотор hTERT с последовательностью, показанной SEQ ID NO. 2, которая может быть получена посредством способа, описанного выше.
В промоторе hTERT согласно настоящему изобретению отсутствуют консервативные ТАТА пары оснований, но имееюся две последовательности, подобные Е-боксу CACGTG и 4 GC-богатых Sp-1-связывающий участка. Эти консервативные последовательности являются критическими для экспрессии теломеразы, так как транскрипция теломеразы регулируется промотором hTERT через С-Мус/Мах и Sp-I (Cong et al. (1999) Human Molecular Genetics. 8(1): 137-142; Kyo et al. (2000) Nucleic Acids Research 28(3):б69-677). Во многих исследованиях установлено, что Мус играет важную роль в пролиферации клеток и клеточном цикле, таким образом, вышеназванная модификация промотора hTERT будет вносить дополнительный вклад в транскрипцию и экспрессию теломеразы.
Для того чтобы свести к минимуму активность промотора hTERT в нормальных клетках, таких как клетки-предшественники, и для того, чтобы увеличить его селективность в отношении опухолевых клеток, мы провели детальный анализ участков связывания фактора транскрипции в промоторе hTERT посредством компьютерного моделирования. Основываясь на компьютерном моделировании, мы провели анализ мутантов после серий мутагенеза, среди них мы идентифицировали один мутант, у которого четвертый Sp-I был изменен на E2F-1-связывающий участок, последовательность изменилась с '…TTTCCGCGGCCCCGGCC…' (Фигура 1) на '…TTTCCGCGGCAACGCCC…' (Фигура 2).
Исследование in vitro показало, что улучшенный промотор hTERT сохраняет свою активность в опухолевых клетках и значительно снижает «промоторную» активность в нормальных клетках. Таким образом, улучшенный промотор имеет значительно сниженную транскрипционную активность в нормальных клетках, включая клетки-предшественники. В эксперименте с временной трансфекцией с использованием репортерного гена было показано, что в опухолевых клетках улучшенный промотор hTERT обладал в около 5-10 раз большей активностью, чем промотор hTERT дикого типа, тогда как в нормальный клетках улучшенный промотор hTERT обладал значительно меньшей активностью (Фигура 6). После этого нами был сконструирован условно реплицирующийся онколитический аденовирус, основные гены которого были под контролем улучшенного промотора hTERT, полученный онколитический вирус был не токсичен в отношении стволовых клеток (Фигура 7); таким образом, полученный онколитический аденовирус обладал значительно улучшенной безопасностью для клинического применения.
Поскольку промотор E2F-1 является активным в опухолевых клетках, дефектных по pRb/E2F/pl6 регуляторному пути, это широко используется в генной терапии, в частности при конструировании условно реплицирующихся онколитических аденовирусов (Parr et al. (1997) Nature Medicine 3(10):1145-1149; Jakubczak et al. (2003) Cancer Research 63:1490-1499; Bristol et al. (2003) Molecule Therapy 7(6):755-763). Улучшенный промотор hTERT имеет не только сайт связывания для факторов транскрипции E2F-1, но также участки связывания Sp-I и NF-1, которые присутствуют в промоторе E2F-1, то есть улучшенный промотор hTERT является активным в опухолевых клетках, которые имеют повышенную активность теломеразы и нарушенный регуляторный путь Rb. Таким образом, улучшенный промотор hTERT является активным в этих двух типах опухолевых клеток, но неактивен в нормальных клетках, таких как стволовые клетки, что обеспечивает высокую специфичность к опухолевым клеткам.
В то же время настоящее изобретение обеспечивает условно реплицирующийся рекомбинант онколитического аденовируса, в котором ген Е1А и ген Е1В связаны внутренним сайтом посадки рибосомы (IRES), что обеспечивает транскрипцию двух важных генов Е1А и Е1В рекомбинанта аденовируса под контролем улучшенного промотора hTERT, такого как КН-906.
Настоящее изобретение обеспечивает рекомбинант онколитического аденовируса, в котором сигнал терминации транскрипции помещен ниже ITR и сайта упаковки вируса и выше специфичного для опухолевых клеток промотора, такого как промотор hTERT. Сигнал терминации транскрипции, такой как SV40 ранняя поли(А) последовательность, может блокировать транскрипцию, опосредованную любой РНК-полимеразой. В опытах in vitro было показано, что присутствие сигнала терминации транскрипции, такого как SV40 ранняя поли(А) последовательность, ITR и последовательности, которая перекрывает сайт упаковки и может действовать как энхансер, оказывает только слабое влияние на промотор hTERT.
Рекомбинанты онколитического аденовируса согласно настоящему изобретению содержат иммуностимулирующие гены. В нескольких известных рекомбинантах онколитического аденовируса в качестве иммуностимулирующего гена был использован ген GM-CSF, рекомбинанты онколитического аденовируса настоящего изобретения также содержат ген GM-CSF в качестве иммуностимулирующего гена, хотя и не ограничиваются только геном GM-CSF, могут использоваться и другие иммуностимулирующие гены, такие как гены цитокинов. Однако GM-CSF является хорошо известным индуктором долгосрочных иммунных ответов (Dranoff et al. (1993) Proc. Natl. Acad. Sci. USA 90:3539-3543). Этот белок представляет собой секретируемый гликопротеин, который может стимулировать дифференцировку гранулоцитов, моноцитов, макрофагов и дендритных клеток и увеличивать экспрессию МНС и ко-стимулирующей молекулы В7 на антиген-представляющих клетках. GM-CSF может также усиливать инфильтрацию иммунных клеток в ткани и дифференцировку В-клеток. Благодаря описанным выше свойствам GM-CSF, ученые в последние годы используют GM-CSF в комбинации с химиотерапией для лечения рака. Множество антиопухолевых вакцин, состоящих из опухолевых клеток, способных экспрессировать GM-CSF, находится в настоящее время на стадии клинических испытаний (Annitage. (1998) Blood 92:4491-4508; Mach et al. (2000) Cancer Research 60:3239-3246; Gilboa. (2004) Nature Reviews Cancer 4:401-411). Условно реплицирующийся онколитический аденовирус, который экспрессирует GM-CSF, может не только убивать раковые клетки, но также экспрессировать GM-CSF в опухолевых клетках, чтобы индуцировать специфичные к опухолевым клеткам иммунные ответы, приводя к антираковым иммунотерапевтическим эффектам. Таким образом, данный способ создания аутологичной антиопухолевой вакцины не только устраняет сложности, связанные с приготовлением антиопухолевой вакцины, на также сохраняет высокую целостность опухолевых клеток без манипуляций in vitro, включая экспрессию антигена, что делает антираковую вакцину более эффективной in situ. Таким образом, описанный выше онколитический вирус может убивать опухолевые клетки в том месте, куда доставляется вирус, и в то же время также убивать удаленные опухолевые клетки посредством опосредованного GM-CSF иммунного ответа. Способ согласно настоящему изобретению представляет собой уникальный подход получения улучшенных онколитических вирусов.
Два рекомбинанта онколитического аденовируса среди других рекомбинантов согласно настоящему изобретению содержат и экспрессируют мембранно-связанный GM-CSF (mbGM-CSF). Предшествующие исследования показали, что мембранно-связанный GM-CSF может усиливать взаимодействие с дендритными клетками и индуцировать лучшие иммунные ответы, чем секретируемый GM-CSF (Soo Hoo et al. (1999) Journal of Immunology 169:7343-7349; Yei et al. (2002) Gene Therapy 6:1302-1311). Также сообщалось, что мембранно-связанный GM-CSF экспрессируется в условно реплицирующемся рекомбинанте онколитического аденовируса, что обеспечивает получение генетически рекомбинированного активного ингредиента.
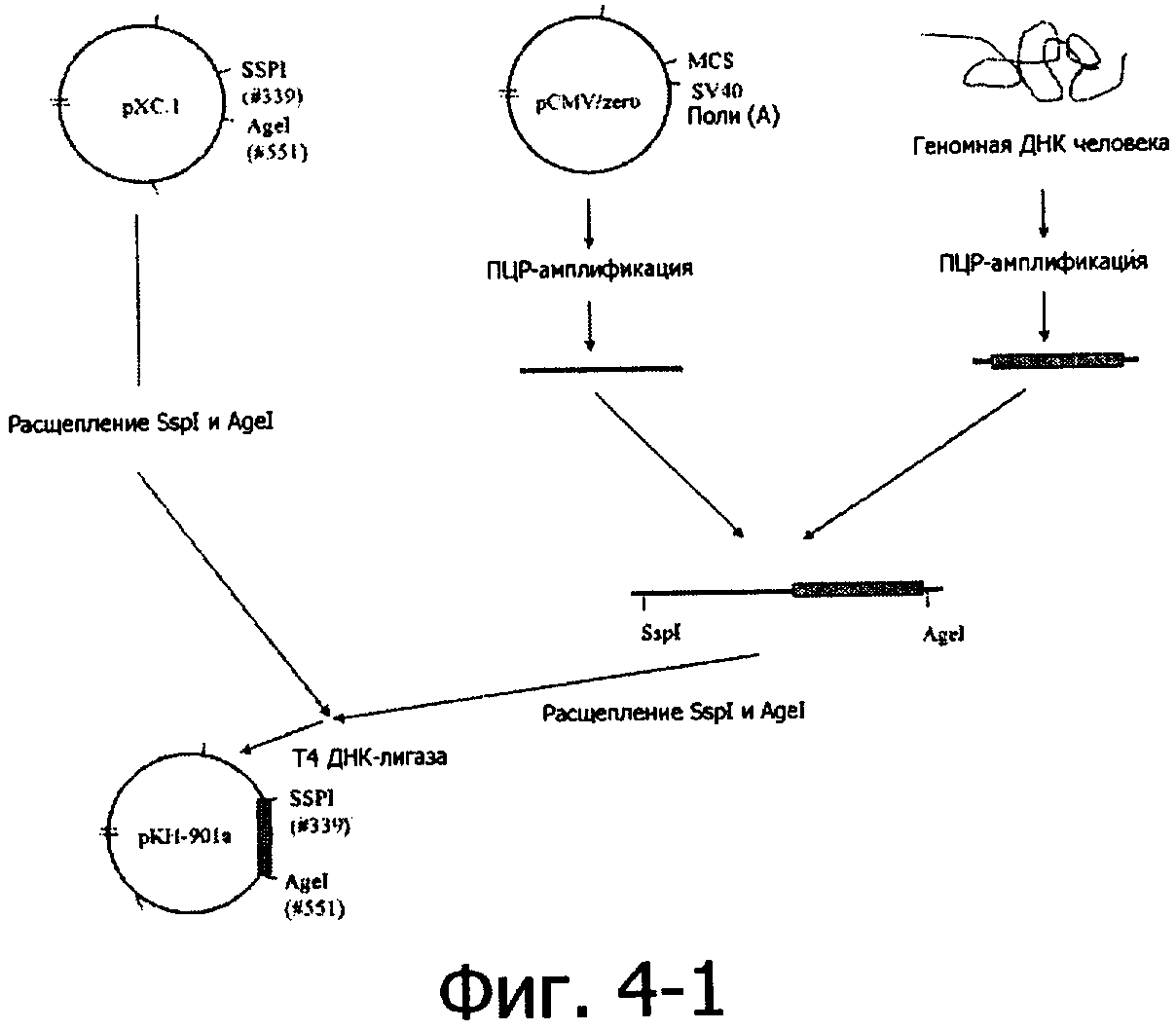
Настоящее изобретение также обеспечивает способ получения рекомбинантов онколитических вирусов, включающий следующие стадии:
a) конструирование левого плеча аденовируса, которое содержит промотор hTERT;
b) конструирование правого плеча аденовируса, которое содержит иммуностимулирующий ген;
c) котрансфекция плазмид, содержащих левое плечо и правое плечо аденовируса, в клетку 293, клетки HeLa, клетки HeLa-S3 или клетки А549, и получение рекомбинанта в результате гомологической рекомбинации.
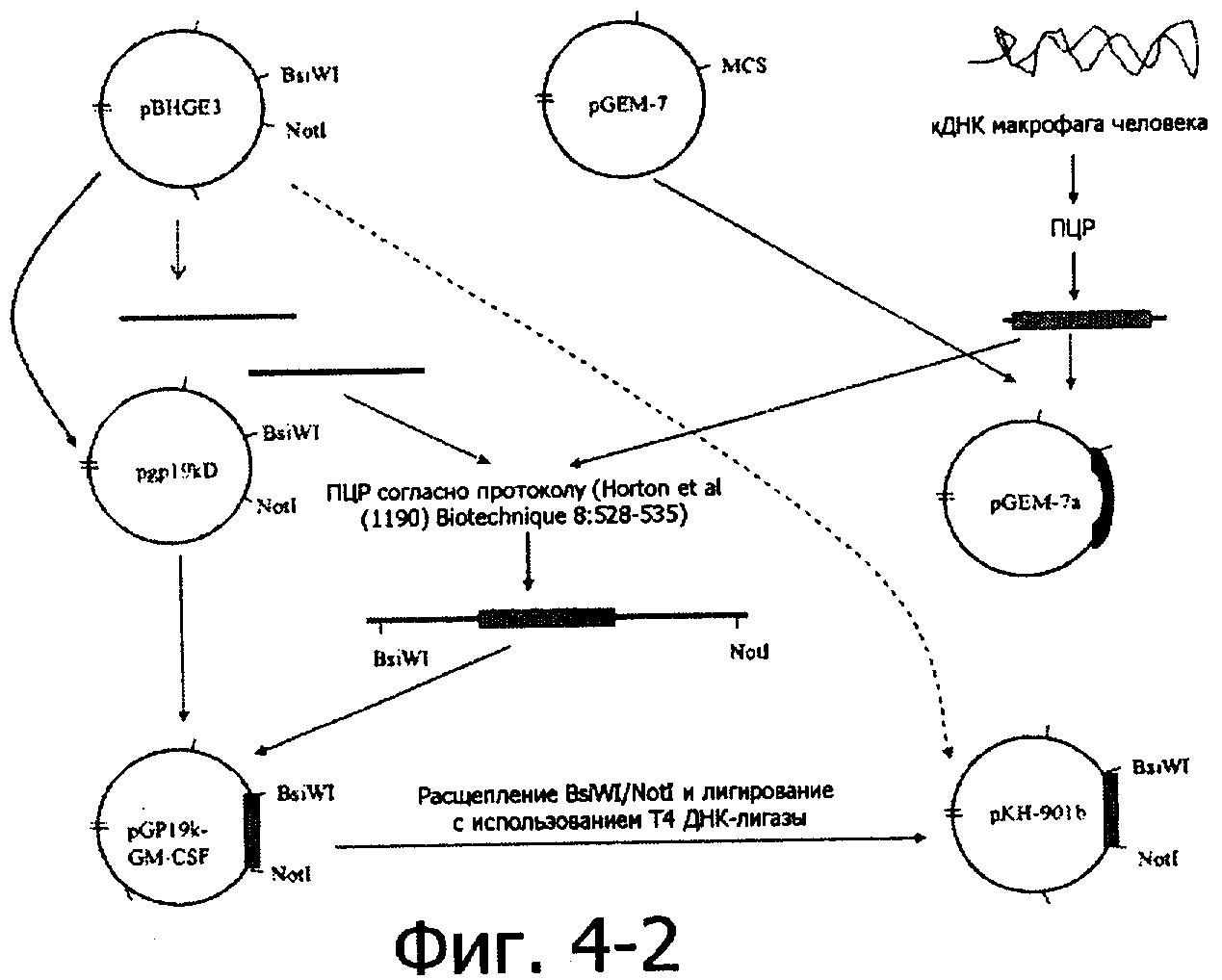
Рекомбинант настоящего изобретения может быть получен посредством следующих процедур: вирус-рекомбинант получается в клетках млекопитающих в результате гомологической рекомбинации. Во-первых, эндогенный промотор гена Е1А делетируется из рХС.1 (плазмида, содержащая левое плечо аденовируса серотипа 5, куплена у фирмы Microbix, Canada) и заменяется сигналом терминации SV40 поли(А) и улучшенным промотором hTERT с использованием общепринятых техник клонирования, в результате получают рКН-901а. Тем временем последовательность, кодирующая gp19K в рВНСЕ3 (плазмида, содержащая правое плечо аденовируса, куплена у фирмы Microbix, Canada), заменяется геном GM-CSF, в результате чего получают плазмиду, названную pKH-901b.
Плазмидные ДНК рКН-901а и pKH-901b котрансфицируются в клетки HeLa, после чего из бляшки отбирают одиночный клон, этот клон был назван КН-901. При использовании аналогичных процедур были сконструированы рекомбинанты КН-900, КН-902, КН-903, КН-904, КН-905 и КН-906.
Фактически, рекомбинанты могут быть получены в любых клетках млекопитающих или не млекопитающих.
Следуя плану, приведенному выше, нуклеотидный фрагмент ДНК был амплифицирован посредством ПЦР с 362 до 551 нуклеотид рХС.1 соответственно с рестрикцией эндонуклеазами SspI и PinAI (AgeI). Фрагмент ДНК с промотором hTERT бьы амплифицирован из геномной ДНК человека методом ПЦР и сцеплен с поли(А). К двум концам фрагмента ДНК были добавлены две рестрицирующих эндонуклеазы SspI и PinAI. Фрагмент ДНК расщепляли SspI и PinAI и лигировали в вектор рХС.1, который был расщеплен теми же ферментами. Лигазной смесью трансформировали клетки E.coli DH5-alpha (hivitro gene, USA). Десять колоний скалывали, культивировали в инкубаторе в течение 24 часов. ДНК экстрагировали и анализировали, используя ферменты рестрикции, последовательность плазмиды была подтверждена секвенированием и плазмида была названа рКН-901а.
Используя праймеры 5'-ATAACCATGTGGCTGC-3' и 5'-AAATTACTCCTGGACTGG-3', при проведении ПЦР с использованием в качестве матрицы кДНК, экстрагированной из активированных макрофагов, был амплифицирован фрагмент ДНК, кодирующий GM-CSF. Полноразмерный ген GM-CSF был клонирован в вектор pUC19, что было подтверждено секвенированием. Далее фрагмент кДНК гена GM-CSF был клонирован в рВНСЕ3 в участок, кодирующий gp19k, и полученная плазмида, названная КН901b, была секвенирована, и правильность конструкции была подтверждена рестриктным анализом.
Плазмидные ДНК рКН-901а и pKH-901b использовали для котрансфекции клеток HeLa для осуществления гомологической рекомбинации. Перед трансфекцией плазмидную ДНК линеаризовали, используя ClaI, и трансфицировали в клетки HeLa с использованием Lipofectin (USA Invitrogen), клетки собирали через 10 дней после трансфекции, проводили 3 цикла замораживания/оттаивания, отбирали 100 мкл для выявления лизирования клеток HeLa. Через восемь дней после начала эксперимента под агаром были видны отдельные зоны лизиса клеток. Были отобраны шесть зон лизиса, которые инокулировали в клетки HeLa. Клеточный лизат собирали через 4-6 дней после инокуляции. ДНК аденовируса экстрагировали из клеточного лизата (Qiagen's kit), и структуру вируса подтверждали рестриктазным анализом, методом ПЦР и Саузерн-блотт анализом. Полученный вирус был назван КН-901.
Согласно настоящему изобретению рекомбинантный вирус может применяться для приготовления фармацевтической композиции для лечения раковых заболеваний и/или для предотвращения раковых заболеваний. Рекомбинантный вирус может применяться в комбинации с радио- и химиотерапией для достижения лучшего терапевтического эффекта.
Согласно настоящему изобретению рекомбинантный вирус может применяться в виде композиций для инъекций, предназначенных для внутривенного введения, внутриопухолевой инъекции, внутримышечной инъекции, подкожной инъекции, внутриорганизменной инъекции, внутрибрюшинной инъекции и так далее.
Для крупномасштабного получения рекомбинантный вирус настоящего изобретения может быть приготовлен в клетках HeLa, в клетках HeLa-S3 или в клетках А549 посредством культивирования клеток, заражения вирусом, размножения, концентрирования, очистки. Рекомбинантный вирус, приготовленный этим способом, может быть использован как исходный материал вместе с фармацевтически приемлемыми носителями для создания посредством стандартной техники композиции для инъекций, используемой в клинической практике.
Далее представлены эксперименты, демонстрирующие возможное применение и благоприятные эффекты настоящего изобретения.
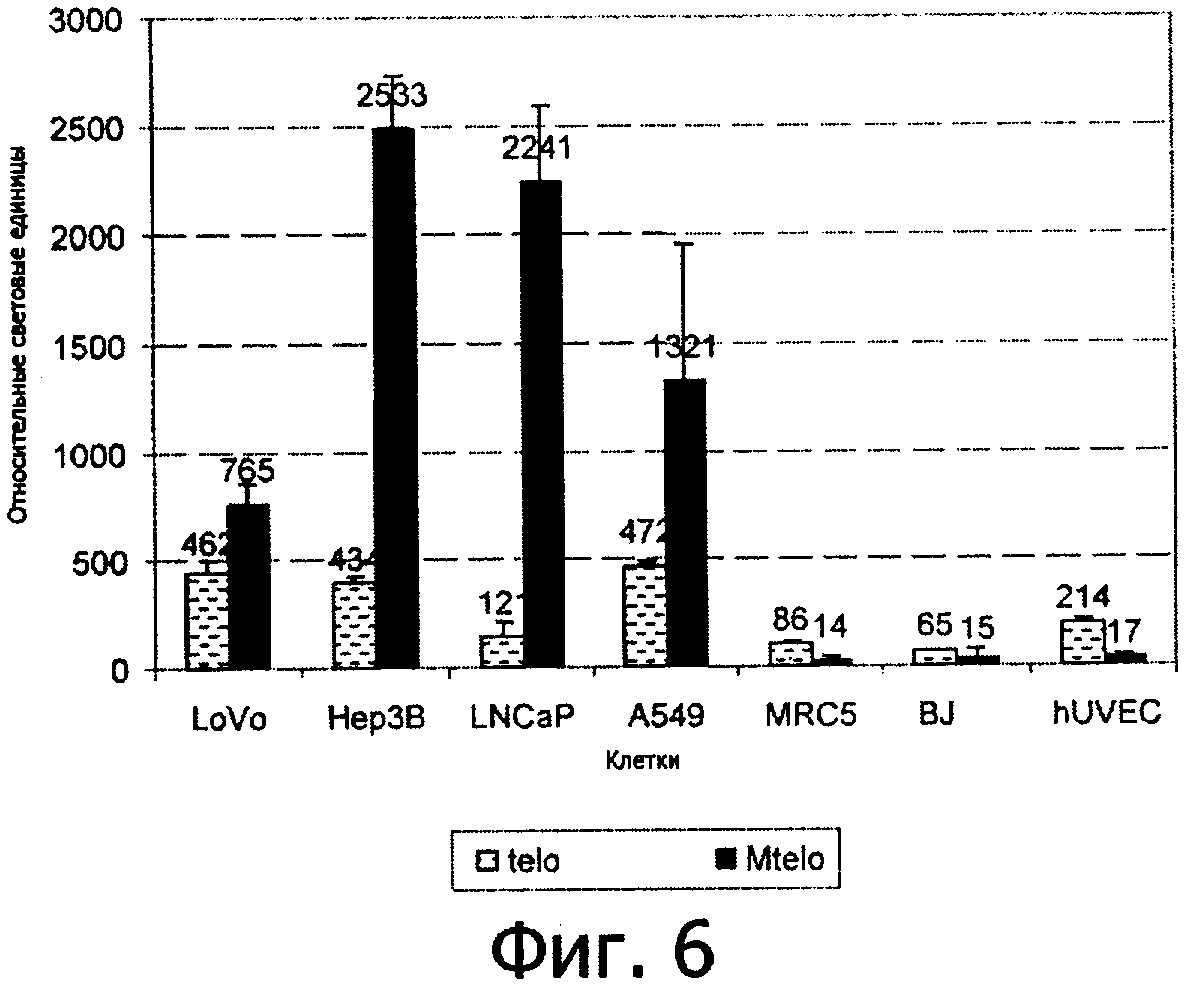
Эксперимент 1: Активность промотора hTERT и сравнение специфичности к опухолевым клеткам промотора дикого типа и улучшенного промотора hTERT
Для проверки специфичности улучшенной версии промотора hTERT промотор дикого типа hTERT (telo) и улучшенный промотор hTERT (Mtelo) были сцеплены с репортерным геном люциферазы (luc), полученные плазмиды были трансфицированы в панель раковых клеток человека и нормальных клеток человека. Клетки собирали по прошествии 48 часов после трансфекции и лизаты клеток использовали для определения уровня экспрессии люциферазы. В ходе трансфекции вторичный репортерный ген LacZ репортерной плазмиды был использован для нормирования (стандартизации) эффективности трансфекции между разными типами клеток. Результат, представленный на Фигуре 6, показал, что (1) в клетках опухоли улучшенный промотор Mtelo обеспечивал значительно более высокую люциферазную активность, чем промотор дикого типа hTERT (telo). Например, в клетках Нер3В (повышенная активность теломеразы и дефектный Rb-опосредованный путь) Mtelo обеспечивал в 6 раз более высокую люциферазную активность, чем telo, и в клетках LNCaP (повышенная активность теломеразы и дефектный Rb-опосредованный путь) Mtelo обеспечивал в 18 раз большую люциферазную активность, чем промотор hTERT дикого типа; (2) в нормальных клетках человека промотор hTERT telo дикого типа приводил к низкому уровню транскрипционной активности, в то время как улучшенный промотор hTERT Mtelo имел базальный уровень транскрипционной активности. Например, в клетках MRC-5 (отсутвие теломеразы и нормальный Rb-опосредованный путь) промотор Mtelo показал в 6 раз меньшую активность, чем промотор hTERT telo дикого типа. Этот результат показал, что добавление участков связывания E2F приводит к значительному увеличению селективности к опухолевым клеткам и транскрипционной способности hTERT.
Это заключение было дополнительно подтверждено посредством тестов, в которых повышенная селективность улучшенного промотора hTERT и транскрипционная активность промотора была определена в клетках, зараженных рекомбинантами, посредством измерения числа копий продукта гена Е1А. Для исследования использовались четыре вируса: аденовирус дикого типа - в качестве положительного контроля, дефектный по репликации аденовирус dl312 (Е1А делетированный) - в качестве отрицательного контроля, КН-900 (с промотором hTERT дикого типа) и КН-901 (с улучшенным промотором hTERT). Кератиноциты крайней плоти человека (hFKs) и hFKs-Е6, клетки hFK, трансформированные геном Е6 папилломы вируса человека типа 16 (HPV-16), были использованы для тестирования. Ранее было показано, что hFKs-Е6 имееют повышенную активность теломеразы (Horikawa et al. (2001) Journal of Virology 75(9):4467-4472). Клетки инфицировали вирусами при множественности заражения (multiplicity of infection, МОI) из расчета 1 бляшкообразующая единица (pfU) на клетку, и число копий Е1А мРНК определяли путем ПЦР с обратной транскрипцией (RT-PCR). Результат, представленный на Фигуре 7, показал, что Е1А мРНК не определялась клетках hFKs и hFKs-Е6, инфицированных вирусом dl312; примерно 4000 копий Е1А мРНК было определено в инфицированных клетках Ad5 и не было обнаружено значительных различий в количестве копий мРНК между клетками hFKs и hFKs-Е6. Однако при инфицировании клеток КН-900 было обнаружено всего несколько копий Е1А мРНК в клетках hGKs, тогда как в клетках hFKs-Е6 было обнаружено в 20 раз большее число копий Е1А мРНК. Более интересно то, что в клетках hFKs-Е6, инфицированных КН-901, было обнаружено более чем в 100 раз больше Е1А мРНК, чем в клетках hFKs. В то же время число копий Е1А мРНК в клетках hFKs, инфицированных КН-901, было даже ниже, чем в клетках hFKs, инфицированных КН-900. Взятые вместе, эти результаты показывают, что промотор Mtelo, соединенный с репортерным геном, имеет более высокий уровень активности и более высокую селективность по отношению к опухолевым клеткам, чем промотор telo; в то же время улучшенная селективность по отношению к опухолевым клеткам подтверждается, когда промотор встроен в геном аденовируса. Промотор Mtelo обладает лучшей специфичностью к опухолям, чем промотор дикого типа, когда он используется для контроля основных вирусных генов.
Эти результаты были дополнительно подтверждены в культуре клеток костного мозга человека. В анализе клеток на выживаемость КН-900 и КН-901 были использованы для инфицирования клеток 293 и мезенхимальных стволовых клеток костного мозга человека (human bone marrow mesenchymal stem cells, hBMsc) при MOI, равном 1. Результат, представленный на Фигуре 8, показывает, что КН-901 убивал клетки так же эффективно, как и КН-900, однако КН-900 обладал определенной способностью убивать клетки hBMsc, тогда как КН901 совсем не убивал клетки.
Эксперимент 2: Сравнение способности убивать опухолевые клетки четырех условно реплицирующихся рекомбинантов онколитического аденовируса
Для сравнения способности убивать клетки четырех условно реплицирующихся рекомбинантов онколитического вируса была взята клеточная линия А549 рака легких. Клекти высевали в 6-см чашки Петри и заражали вирусом при MOI, равном 1, когда клетки достигали уровня 85% конфлюентности. Выживаемость клеток определяли в разные моменты времени после инфицирования (Hallenbeck et al. (1997) Human Gene Therapy 11:1172-1179). Результат, представленный на Фигуре 9, показал, что КН-904 убивал клетки более эффективно, чем КН-901 и КН-902, в то время как КН-900 был самым слабым в этом отношении.
Этот результат показал, что улучшенный промотор hTERT обеспечивает более сильную активность, чем промотор hTERT дикого типа. Он также показал, что замена гена булавовидного отростка на серотип 35 обеспечивает более высокую инфекционную способность, чем в случае серотипа 5. Это заключение было подтверждено на панели раковых клеток и нормальных клеток человека (Таблица 1). Панель опухолевых и нормальных клеток человека была инфицирована различными вариантами аденовируса в течение 72 часов, и выживаемость клеток была определена, как указано выше. Значение ЕС50 было рассчитано по количеству вируса, необходимому для того, чтобы убить 50% клеток. Чем меньше значение ЕС50, тем более эффективно вирус убивает клетки. Результат, представленный в Таблице 1, показал, что (1) КН-901 убивал клетки опухоли более эффективно, чем КН-900, дополнительно подтверждая, что улучшенный промотор hTERT имеет лучшую специфичность к опухолевым клеткам; (2) КН-902 и КН-903 убивали клетки так же, как и КН-901, в то время как КН-904 был наиболее мощным. В противоположность этому вирусы, содержащие улучшенный промотор Mtelo (КН-901, КН-902, КН-903 и КН-904), убивали меньше нормальных клеток по сравнению с КН-900, вирусом, который имеет промотор hTERT дикого типа. Для КН-906, в котором вирусный ген Е1В был связан с геном Е1А через IRES, была обнаружена хорошая специфичность к опухолевым клеткам, хотя его способность убивать клетки была относительно более низкой.
Более интересным является то, что в отношении нормальных клеток человека все вирусные рекомбинанты, которые были сконструированы с включением в них генетически улучшенного промотора Mtelo, включая НК-901, НК-902, НК-903, НК-904, демонстрировали значительно более слабую способность убивать клетки (что видно из более высоких значений ЕС50), чем ПК-900, который был сконструирован с включением в него промотора hTERT дикого типа,
Кроме того, рекомбинанты аденовируса КН-906, в которых сайт внутреннего связывания рибосомы был вставлен между генами Е1А и Е1В, и, следовательно, транскрипция генов Е1А и Е1В находится под контролем улучшенного промотора Mtelo, демонстрировали более высокую селективность в отношении опухолевых клеток, чем другие вирусные рекомбинанты, даже хотя их способность убивать опухолевые клетки была слегка ниже, чем у других рекомбинантов.
Эксперимент 3: КН-901 обеспечивает высокий уровень биологически активного GM-CSF в клетках опухоли
Пять линий опухолевых клеток и одна линия нормальных клеток человека были инфицированы КН-901 при MOI, равном от 1 до 10. Через 48 часов после заражения клетки были собраны для определения концентрации GM-CSF методами ELISA и TF-1, как описано ранее (Li et al. (2001) Cancer Research 61:6428-6436). Результат, представленный на Фигуре 14, показал, что 5 линий опухолевых клеток, зараженных КН-901, продуцировали большое количество GM-CSF. Например, в клетках LNCaP, зараженных КН-901, количество GM-CSF, определенное в клетках, составляло 231 нг/106клеток/24 часа. В противоположность этому, в нормальных клетках человека, зараженных КН-901, наблюдался очень низкий уровень обнаруживаемого GM-CSF. Более того, биотест показал, что GM-CSF, экспрессируемый в опухолевых клетках, был биологически активным (пожалуйста, посмотрите Таблицу 2).
Эксперимент 4: Противоопухолевая эффективность рекомбинантов онколитического аденовируса в моделях опухолей
Противоопухолевая эффективность онколитических аденовирусов была определена в модели опухоли рака простаты LNCaP у голых (бесшерстных) мышей. Шесть миллионов клеток LNCaP вводили подкожно каждой голой мыши, и когда объем опухоли достигал размера 200 мм3 в течение 4 недель, вводили вирусы путем инъекции в опухоль три раза на 1, 5 и 9 день в дозе 3×106 частиц разных вирусов (КН-901, КН-904 и Addll520, онколитический аденовирус с делецией Е1В-р55). Объем опухоли измеряли два раза в неделю, результаты представлены на Фигуре 10.
В данном тесте три рекомбинанта, а именно КН-901, КН-904 и КН-907 (не показано, такой же, как КН-901 но без гена GM-CSF), были использованы для инъекции в опухоль, a Addl520 был использован в качестве контроля.
Как видно из Фигуры 10, при применении плацебо опухоль росла очень быстро, и на 48 день объем опухоли достигал 1200% от исходного. В группе, обработанной КН-901, размер опухоли оставался на уровне базовой линии, тогда как опухоли, обработанные КН-904, уменьшались в объеме до 15% от базовой линии. За тот же период времени опухоли, обработанные Addll520, вырастали до 850% от базовой линии.
Эти результаты показывают, что КН-901 и КН-904 имеют более высокую противоопухолевую активность, чем Addll520 (Onyx-015). Интересно отметить, что, как показано в опытах in vitro, КН-904 имеет более высокую противоопухолевую эффективность, чем КН-901.
В этих же экспериментах была подтверждена экспрессия GM-CSF. У животных, обработанных КН-907 и Addll520, не было обнаружено GM-CSF, тогда как у животных, обработанных КН-901 или КН-904, был обнаружен высокий уровень GM-CSF. Например, на 14 день количество GM-CSF у животных, обработанных КН-901 или КН-904, составило 2322 г/мл или 2776 г/мл соответственно. Этот результат позволяет заключить, что онколитический вирус КН-901 и подобные ему рекомбинанты продуцируют GM-CSF не только в опухолевых клетках, но также обеспечивают высокий уровень экспрессии in vivo в имеющих опухоли животных.
Результаты этих исследований демонстрируют репликацию КН-901 и подобных ему рекомбинантов во множестве опухолевых клеток, поскольку после инъекции были зарегистрированы высокие уровни экспрессии GM-CSF.
Другие описанные выше онколитические аденовирусы были также охарактеризованы с использованием следующих аналогичных подходов и будут более детально описаны в соответствующих примерах.
Рекомбинанты реплицирующихся онколитических аденовирусов, описанные в настоящем изобретении, имеют следующие свойства.
1. Структурные свойства
Эти рекомбинанты представляют собой живые вирусы и могут реплицироваться и размножаться в клетках опухоли. Они отличаются от синтезированных и разработанных с использованием генетической инженерии медикаментов. Они способны воспроизводиться в опухолевых клетках, экспрессировать чужеродные гены и проявлять высокую биологическую активность, а также и противоопухолевую активность. Эти рекомбинанты содержат иммуностимулирующие гены, следовательно, иммуностимулирующий ген может экспрессироваться в клетках, зараженных вирусом, и индуцировать специфичные по отношению к опухолевым клеткам иммунные ответы. Они являются безопасными, поскольку в них присутствует специфичный для опухолей регуляторный элемент.
2. Потенциальное применение
Специфичные для опухолей регуляторные элементы в рекомбинантных вирусах активны в более чем 90% опухолевых клеток, то есть в большинстве опухолевых клеток критические гены этих рекомбинантных вирусов находятся под контролем специфичного для опухоли промотора, следовательно, такие рекомбинантные вирусы могут реплицироваться в большинстве опухолевых клеток и убивать их. Таким образом, эти рекомбинантные вирусы имеют различные области для потенциального применения, включая лечение рака головы и шеи, рака легких, рака прямой кишки, рака простаты, рака мочевого пузыря, рака желудка, рака печени и т.д.
Поскольку эти рекомбинантные вирусы содержат иммуностимулирующий ген, как описано выше, вирусы будут обладать не только онколитическими эффектами, убивая опухолевые клетки, но также будут стимулировать специфичные в отношении опухоли иммунные ответы, следующие за экспрессией цитокинов в опухолевых клетках. Таким образом, эти вирусы будут эффективны не только в отношении локальной опухоли, но также будут эффективны и в отношении удаленных опухолевых клеток (метастазов).
Рекомбинанатные вирусы согласно настоящему изобретению имеют следующие свойства: 1) они более специфичны в отношении опухолевых клеток, и не инфекционны в отношении нормальных соматических клеток, стволовых клеток; таким образом, эти вирусы могут иметь меньше побочных эффектов при клиническом применении; 2) они экспрессируют иммуностимулирующий ген, включая секретируемую и мембранно-связанную формы. Такой цитокин будет стимулировать специфичные в отношении опухоли иммунные ответы, то есть они могут быть также эффективны в отношении удаленных опухолей (метастазов); 3) за счет модификации вирусного капсида эти аденовирусы обладают улучшенной способностью инфицировать клетки, следовательно, они могут иметь более высокую противоопухолевую активность.
Настоящее изобретение обеспечивает следующий вклад:
1) За счет модификации путем направленного мутагенеза специфичный в отношении опухолей регуляторный элемент - промотор hTERT имеет более высокую транскрипционную активность и специфичность в отношении опухолей, полученный промотор имеет улучшенную селективность в отношении опухолей, имеет значительно сниженную транскрипционную активность сопряженного с ним гена в нормальных соматических клетках, особенно в половых клетках, клетках-предшественниках и стволовых клетках. Онколитические аденовирусы, критические гены которых находятся под контролем улучшенного промотора hTERT, не реплицируются в клетках костного мозга, но обладают высокой активностью во многих опухолевых клетках.
2) Ген иммуностимулирующего белка GM-CSF был вставлен генно-инженерными методами в рекомбинантные аденовирусы таким образом, что GM-CSF будет экспрессироваться только в клетках, инфицированных вирусом. Такой вирус будет убивать раковые клетки за счет онколитического действия после его инъекции в опухоль, и в то же время, вслед за онколитическим лизисом, инфицированные вирусом клетки будут экспрессировать GM-CSF, который стимулирует сильный иммунный ответ против опухолевых клеток. Особенно важно, что экспрессирующий GM-CSF онколитический аденовирус будет также обладать профилактическим эффектом, поскольку вирус будет «обучать» иммунную систему пациента за счет комбинации онколитического действия (гибель клетки и презентация антигена) и иммунного ответа посредством «обучения» иммунных клеток пациента. Таким образом, такой вирус может быть способен предотвращать рецидивы опухолей у пациента.
3) За счет модификации капсида полученный рекомбинант онколитического аденовируса имеет улучшенную инфекционную активность в отношении опухолей. Поскольку экспрессия рецептора CAR аденовируса серотипа 5 отсутствует или является низкой, очень часто Ad5 не инфицирует опухолевые клетки. Однако, когда в геном Ad5 вставлен участок связывания и последовательность для рецептора аденовируса серотипа 35, инфекционная способность в отношении большинства опухолевых клеток может быть значительно увеличена. Это наблюдение подтверждено исследованиями in vitro и in vivo.
Описание последовательностей в перечне последовательностей
SEQ ID NO. 1 представляет собой фрагмент, содержащий последовательности из промотора TERT человека, который имеет несколько участков связывания факторов транскрипции, включая SP-1 (ОС-боксы), Е-боксы (участок связывания для Мус), NF-1 (участок связывания для фактора NF).
SEQ ID NO. 2 представляет собой промотор TERT человека, улучшенный в результате мутагенеза, который имеет более высокую селективность к опухолевым клеткам и транскрипционную активность; E2F-1: участок связывания фактора транскрипции E2F.
SEQ ID NO. 3 является последовательностью из полноразмерной последовательности КН-901, в которой:
1) 1-103: левая ITR аденовируса {последовательность аденовируса серотипа 5, показанная в Genbank NO. BK000408};
2) 194-358: последовательность сигнала упаковки аденовируса и последовательность энхансера для Е1;
3) 362-534: поли(А) сигнальная последовательность SV40 и линкер (последовательность аденовируса серотипа 5, из которой были делетированы 362-551 п.н.);
4) 525-811: последовательности улучшенного промотора hTERT и линкера;
5) от 812 направо: последовательность аденовируса, включающая Е1А, Е1В, Е2 и так далее;
6) 28995-29436: иммуностимулирующий ген GM-CSF человека;
7) от 29437 направо: последовательность аденовируса, включающая ген Е4 и правый конец;
SEQ ID NO. 4 является иммунорегуляторным элементом GM-CSF в мембранно-связанной форме (mbGM-CSF), содержащимся в геноме рекомбинанта.
SEQ ID NO. 5 является химерной последовательностью, кодирующей булавовидный отросток в геноме рекомбинанта КН-904, в котором последовательность, кодирующая булавовидный отросток в гене белка оболочки, взята из серотипа 35 аденовируса человека.
Краткое описание чертежей
На Фигуре 1 представлена последовательность промотора обратной транскриптазы теломеразы человека и участки связывания для факторов транскрипции. SP-1 (GC-боксы): SP1-связывающие участки, Е-боксы: Мус-связывающий участок, NF-1: NF-связывающий участок.
Фигура 2 представляет последовательность промотора TERT человека, улучшенного посредством мутагенеза, который обладает повышенной селективностью к опухолевым клеткам и обеспечивает повышенную активность обратной транскриптазы; E2F-1: участок связывания фактора транскрипции E2F.
Фигура 3-1 и Фигура 3-2 представляют структуры рекомбинантов настоящего изобретения.
Фигура 4-1, Фигура 4-2 и Фигура 4-3 представляют способ получения рекомбинантного варианта аденовируса КН-901.
Фигура 5 представляет подробную схему конструирования рекомбинанта КН-901.
Фигура 6 представляет активность промотора для промотора дикого типа hTERT (telo) и улучшенного промотора mhTERT (Mtelo).
Фигура 7 представляет экспрессию мРНК Е1А рекомбинантным аденовирусом в клетках hFK и hFKs-Е6, трансформированных геном HPV E6.
Фигура 8 представляет цитолитическую активность рекомбинантных аденовирусов по отношению к нормальным мезенхимальным стволовым клеткам костного мозга человека.
Фигура 9 представляет цитолитическую активность рекомбинантных аденовирусов в клетках А549 (выживаемость, %).
Фигура 10 представляет антиопухолевую эффективность при раке простаты LNCaP в модели ксенотрансплантата после инъекции в опухоль рекомбинантных аденовирусов.
Специфические воплощения
Нижеследующие примеры приведены и служат для того, чтобы дополнительно описать подробности изобретения, которые не должны представлять собой какие-либо ограничения в отношении данного изобретения.
Пример 1
1. Конструирование реплицирующегося онколитического рекомбинантного аденовируса КН-901 и его анализ (Фигура 4 и Фигура 5).
2. В соответствии с последовательностью промотора hTERT, показанной на Фигуре 1, были синтезированы два праймера, которые представлены ниже:
A. 5'-GTC TGG АТС CGC TAG CCC САС G-3';
В. 5'-CGACCGGTGATATCGTTTAATTCGC-3'.
Их использовали для амплификации промотора hTERT методом ПЦР, при проведении которой в качестве матрицы использовали активированную РНК человека. Условия для проведения реакции ПЦР были следующими: для первого цикла - денатурация при 94°С в течение 5 минут, отжиг при 81°С в течение 1 минуты и достраивание при 72°С в течение 2 минут. Для каждого из следующих циклов - денатурация при 93°С в течение 1 минуты, затем проведение анализа в геле из агара и извлечение фрагмента - промотора hTERT. Методом секвенирования было подтверждено, что полученный промоторный фрагмент имеет ту же структуру, которая была описана (Фигура 1). Этот фрагмент ДНК был затем клонирован в вектор pUC19, и последовательность промотора была изменена, как показано на Фигуре 2, посредством мутагенеза при использовании набора фирмы Strategene (Strategene, CA).
3. Сигнальная последовательность роlу(А) была амплифицирована методом ПЦР при использовании следующих праймеров:
С. 5'-TAATATTTGTCTAGGGCCGCGGGGGATCTCTGC-3';
D. 5'-GGATCCAGACATGATAAGATACATTGAGAG-3'.
Когда в качестве матрицы использовали Pcmv/ZERO (Invitrogen, USA), условия для отжига в процессе проведения реакции ПЦР были такие же, как указано выше. Фрагмент, полученный в результате ПЦР, был очищен, и его последовательность была подтверждена секвенированием.
4. Очищенный фрагмент - промотор hTERT и фрагмент поли(А) ДНК вместе денатурировали при 95°С в течение 5 минут, охлаждали до комнатной температуры и использовали как матрицу. Фрагмент ДНК, включающий около 500 пар нуклеотидов, амплифицировали, используя праймеры А и D, очищенный и секвенированный ПЦР-фрагмент переваривали SspI и Agel, и далее очищенный фрагмент, содержащий сигнальную последовательность поли(А) и промотор hTERT, был использован для последующего процесса клонирования.
5. рХС.1 (получен из Microbix, Canada) использовали как матрицу, в этот вектор посредством мутагенеза были добавлены два сайта для ферментов рестрикции в положениях нуклеотидов 339 (SspI) и 551 (PinAI). Мутированный рХС.1 переваривали SspI и PinAI и очищали, предполагая использовать этот большой фрагмент в качестве вектора. Фрагмент poly(A)/hTERT, который представлял собой вставку, лидировали в вектор рХС.1 и трансформировали им клетки E.coli DH5, используя обычные техники клонирования через 20 часов. После инкубации при 4°С в течение 30 минут, теплового шока при 42°С в течение 30 секунд и дополнительной инкубации при 4°С в течение 2 минут клетки затем выращивали при 37°С в течение 45 минут в 1 мл среды LB для культивирования клеток. Затем пробу наносили на чашку с агаризованной средой для выращивания, содержащей ампициллин, и культивировали в течение 24 часов; индивидуальные бактерии отбирали с использованием стерильной зубочистки и переносили в чистый культуральный флакон, который содержал 1 мл среды LB, далее их инкубировали в течение 24 часов. Из выращенных клеток E.coli выделяли плазмидную ДНК и ее структуру подтверждали рестриктным анализом, плазмида была названа рКН-901а. Плазмида содержит левый ITR, сигнал инициации сборки, последовательность роlу(А), промотор hTERT (Mtelo), E1А и частично Е1В.
6. Конструирование правого конца генома аденовируса
pGEM-7 вектор (доступный, производства компании Promega). Затем две пары праймеров были использованы для амплификации двух фрагментов ДНК:
Е. 5'-AACCAAGGCGAACCTT-31';
F. 5'-CCACATGGTTATCTTGG-3';
G. 5'-CCAGTCCAGGAGTAATTTAC-3';
H. 5'-TGCGCTTTAGGCAGCAGATG-3';
Для клонирования гена GM-CSF были использованы следующие праймеры:
М. 5'-CCACCCAAGATAACCATGTGGCTGC-3';
N. 5'-AACTTAGTAAATTACTCCTGGACTGG-3'.
Большое количество фрагмента кДНК GM-CSF амплифицировали, используя в качестве матрицы кДНК, полученную из активированных макрофагов методом ПЦР при условиях амплификации, сходных с описанными выше. Последовательность кДНК была подтверждена секвенированием, проведенным после ее выделения, фрагмент кДНК смешивали с двумя фрагментами ДНК, амплифицированными при использовании pBHGE3 в качестве матрицы, для проведения последующей амплификации методом ПЦР с праймерами Е и Н с целью получения большого фрагмента ДНК. Последовательность этого результирующего фрагмента ДНК была подтверждена секвенированием, и фрагмент ДНК клонировали в вектор pGEM-7 после расщепления рестриктазами BsiWI и NotI и затем дотирования в pBHGE3, в результате получили плазмиду рКН-901b. Этот левый конец содержит большую часть гена Е1В, полностью ген Е2, полностью ген Е3, ген GM-CSF и ген Е4.
7. Конструирование рекомбинантного аденовируса КН-901
Плазмидные ДНК рКН-901а и рКН-901b были линеаризованы посредством расщепления их рестрицирующими эндонуклеазами NdeI и ClaI и были использованы для котрансфекции клеток HeLa (с трансфертном производства фирмы Invitrogen), затем выделяли плазмидную ДНК. Клетки собирали после инкубации при 37°С в течение 10 дней. 100 мкл супернатанта брали для анализа колоний после 3 циклов замораживания/оттаивания. Одиночные бляшки лизиса были видны под низкоплавким агаром через 8-12 дней после добавления супернатанта. 10 мкл жидкости под агаром отбирали при помощи автоматической пипетки на 10 мкл и добавляли к предварительно посеянным клеткам HeLa. Лизат клеток был виден и был собран через 4-8 дней после инокуляции. Для экстракции ДНК использовали 200 мкл клеточного лизата. Структуру вируса подтверждали методами ПЦР и Саузерн-блоттинга. Индивидуальные колонии были далее очищены в клетках HeLa и наращивались в клетках HeLa для создания запаса вируса. Запас вируса хранили в морозильной камере при температуре -80°С. Аликвоту запасенного вируса отбирали для подтверждения структуры методом секвенирования, и вирус был назван КН-901.
Способ крупномасштабного получения КН-901 будет описан отдельно, однако, коротко здесь, HeLa-S3 клетки (HeLa клетки были адаптированы к тому, чтобы расти в бессывороточной среде) культивировали в биореакторе объемом 3 литра, когда число клеток достигало 3 миллионов в литре, клетки инфицировали КН-901 и продолжали культивировать в течение 2-3 дней. Затем клетки собирали и вирус очищали в градиенте CsCl2 или при помощи ионнообменной колонки. Очищенный вирус хранили в подходящем буфере, таком как PBS, с глицерином.
Пример 2
КН-900 был сконструирован при проведении процедур, подобных тем, которые были проведены для получения КН-901, за исключением того, что плазмида рКН-901а не содержала роly(А) и в фрагменте промотора hTERT не было мутаций and no mutatant in the hTERT промотор fragment; последовательность промотора представлена в SEQ. ID NО. 1. Полученная плазмида названа рКН-900а; рКН-900а и рКН-901b были использованы для котрансфекции клеток HeLa для получения КН-900.
Пример 3
Для конструирования КН-902 кДНК GM-CSF в рКН-901b была заменена кДНК для мембранно-связанной версии GM-CSF, как показано в SEQ ID NO. 4, в результате получена рКН-902b. рКН-901а и рКН-902b были использованы для котрансфекции клеток HeLa для получения КН-902.
Пример 4
Для получения КН-903 участки, кодирующие 10.4k, 14.5k and 14.7k в рКН-901b, были делетированы посредством традиционных генно-инженерных методов, в результате была получена плазмида, названная КН-903b. рКН-901а и рКН-903b были котрансфицированы в клетки HeLa для получения КН-903.
Пример 5
Для получения КН904 ген булавовидного отростка аденовируса серотипа 5 был заменен геном булавовидного отростка из аденовируса серотипа 35, как показано в SEQ ID NO. 5, в результате была получена плазмида, названная рКН-904b.
Пример 6
Для получения КН-905 кДНК гена GM-CSF в рКН-904b была заменена кДНК для мембранно-связанной версии, как показано в SEQ ID NO. 4, в результате была получена плазмида, названная рКН-905b. рКН-901а и рКН-905b были котрансфицированы в клетки HeLa для получения КН905. Структура вируса была подтверждена методом ПЦР и секвенированием.
Пример 7
Для создания КН-906 эндогенный промотор для Е1В был заменен сигналом - внутренним сайтом посадки рибосомы, в результате была получена плазмида, названная рКН-906а. рКН-906а и рКН-901b были котрансфицированы в клетки HeLa для получения КН-906 (Li et al. (2001) Cancer Research 62:2667-2674). Структура вируса была подтверждена методом ПНР и секвенированием.































Реферат
Изобретение относится к области генной инженерии, вирусологии и медицины. Условно реплицирующийся онколитический улучшенный рекомбинант аденовируса включает основной вирус, модифицированный промотор hTERT и иммунные регуляторные гены. Вирус предпочтительно экспрессирует иммуностимулирующий фактор GM-CSF в опухолевых клетках. Также раскрыт модифицированный промотор, фармацевтическая композиция, включающая вирус, способ получения вируса и его применение. Изобретение может быть использовано в медицине для лечения опухолей. 5 н. и 17 з.п. ф-лы, 13 ил., 2 табл.
Формула
a) создание левого плеча аденовируса, которое содержит последовательность промотора hTERT;
b) создание правого плеча аденовируса, которое содержит иммуностимулирующий ген;
c) котрансфекция плазмидных ДНК, содержащих правое плечо и левое плечо аденовируса, в клетки 293, HeLa, HeLa-S3 или А549, и получение рекомбинанта, описанного в п.1, в результате гомологической рекомбинации.

Комментарии