Слитые белки, содержащие связывающие pdgf и vegf части, и способы их применения - RU2692652C2
Код документа: RU2692652C2
Чертежи











































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка испрашивает преимущество в соответствии с 35 § USC 119(e) перед одновременно находящейся на рассмотрении предварительной заявкой на патент США №61/780914, поданной 13 марта 2013 г., раскрытие которой включено в данный документ с помощью ссылки во всей своей полноте.
ПРЕДСТАВЛЕНИЕ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ТЕКСТОВОМ ФАЙЛЕ ASCII
Содержание следующего далее представления текстового файла ASCII включено в данный документ с помощью ссылки во всей своей полноте: машинно-читаемая форма (CRF) перечня последовательностей (имя файла: 159792009540SEQLIST.txt, дата записи: 11 марта 2014 г., размер: 113 KB).
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТНИЕ
Настоящее изобретение относится к слитым белкам, которые ингибируют PDGF-путь и VEGF-путь, композициям этих слитых белков, а также способам их получения и применения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Образование новых кровеносных сосудов, вызываемое сверхпродукцией факторов роста, таких как фактор роста эндотелия сосудов (VEGF), является ключевым компонентом заболеваний, например, опухолевого роста, возрастной макулодистрофии (AMD) и пролиферативной диабетической ретинопатии (PDR) (Connolly et al., J Clin Invest., 1989, 84(5):1470-8; Ferrara et al., Biochem Biophys Res Commun., 1989, 161(2):851-9; и Ferrara et al., Nat Med., 1998, 4(3):336-40). Влажная AMD является самой тяжелой формой заболевания AMD, которое характеризуется аномальной неоваскуляризацией под желтым телом и часто приводит к необратимой потери зрения. Блокирование VEGF антителами, растворимыми VEGF рецепторами, или ингибирование тирозинкиназной активности VEGF рецепторов являются стратегиями, которые показали многообещающие доклинические и клинические результаты супрессии ретинальной неоваскуляризации (Aiello et al., PNAS, 1995, 92:10457-10461 и Willet, et al., Nat Med., 2004, 10:145-147). Однако, последние клинические данные показывают, что новая сосудистая ткань, как правило, не регрессирует с ингибированием VEGF отдельно, поскольку перициты, которые взаимодействуют с эндотелиальными клетками и способствуют установлению гематоретинального барьера, передают сигналы выживания неоваскулярным эндотелиальным клеткам и, таким образом, делают их устойчивыми к удалению VEGF (Benjamin et al., Development, 1998, 125(9)1591-8 и Patel S., Retina, 2009, 29(6 Suppl):S45-8). Кроме того, изоформа В тромбоцитарного фактора роста (PDGF-B) и бета-PDGF рецептор (PDGFRβ), обнаруженные в пролиферативных ретинальных мембранах, имеют важную роль в вовлечении перицитов для стабилизации развивающейся сосудистой сети (Robbins et al., Invest Opth Vis Sci., 1994, 35(10):3649-63; Lindahl et al., Development, 1997, 124:3943-3953; и Hellström et al., Development, 1999, 126:3047-3055).
VEGF связывающая функция VEGFR1 (Flt-1) соответствовала второму внеклеточному домену (ECD) (Davis-Smyth et al., EMBO J., 1996, 15:4919-4927; Barleon et al., J Biol Chem., 1997, 272:10382-10388; Wiesmann et al., Cell, 1997, 91:695-704; и Davis-Smyth et al., J Biol Chem., 1998, 273:3216-3222). Природная альтернативно сплайсированная форма VEGF-связывающего рецептора с высокой аффинностью, растворимого VEGFR1 (sFlt1), существует в виде секретируемого белка, который функционирует преимущественно в виде рецептора-ловушки (Shibuya et al., Oncogene, 1990, 5:519-524 и Kendall et al., PNAS, 1993, 90:10705-10709). Растворимый рецептор, VEGF-Trap, разработанный для терапевтического применения, имеет второй домен VEGFR1, слитый с третьим доменом VEGFR2 (KDR) и с Fc-областью IgG1 человека (Holash et al. 2002). Внеклеточная область PDGFRβ, как было показано ранее, вызывает антагонизм PDGF-B-стимулированных ответов (Duan et al., J Biol Chem, 1991, 266(1)413-8 и Ueno et al., Science, 1991, 252(5007):844-8). Исследования с PDGFRβ-Fc химерами показали, что ECD человека с 1 по 3 PDGFRβ достаточно для связывания В-лиганда с PDGF с высокой аффинностью (Heidaran et al., FASEB J., 1995, 9(1):140-5 и Lokker et al., J Biol Chem, 1997, 272(52):33037-44). Также было описано влияние предимеризации на связывание В-лиганда с PDGF с высокой аффинностью, когда ECD с 1 по 3 PDGFRβ сливали с доменом глутатион-S-трансферазы (GST) (Leppänen et al., Biochemistry, 2000, 39(9):2370-5).
Современные виды лечения глаз требуют ежемесячных интравитреальных инъекций ретинологом в течение многих лет. Таким образом, существует необходимость улучшенных терапевтических средств и подхода для доставки терапевтических средств к местам назначения, таким как глаз.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение, представленное в данном документе, раскрывает, inter alia, слитые белки, которые ингибируют PDGF-путь и VEGF-путь, композиции, содержащие эти слитые белки, и композиции, содержащие нуклеиновую кислоту, кодирующую слитый белок, а также способы получения и применения этих слитых белков и вирусных частиц для лечения и предотвращения заболевания, такого как заболевание глаз, воспалительное заболевание, аутоиммунное заболевание или рак.
Соответственно, в одном аспекте в настоящем изобретении представляют слитый белок, содержащий (а) внеклеточную часть PDGF-рецептора, (b) внеклеточную часть VEGF-рецептора и (c) домен, способный к мультимеризации, где слитый белок связывается с PDGF и VEGF. В некоторых вариантах осуществления слитый белок упорядочен с N-конца до C-конца в следующем порядке: (a), (b) и (c). В некоторых вариантах осуществления PDGF рецептором является PDGFRβ. В некоторых вариантах осуществления данного документа внеклеточная часть PDGFR содержит Ig-подобные домены D1-D3 PDGFR. В некоторых вариантах осуществления данного документа внеклеточная часть PDGFR содержит Ig-подобные домены D1-D4 PDGFR. В некоторых вариантах осуществления данного документа внеклеточная часть PDGFR содержит Ig-подобные домены D1-D5 PDGFR. В некоторых вариантах осуществления данного документа внеклеточная часть PDGFR содержит аминокислотную последовательность SEQ ID NO: 1, 2 или 3, или аминокислотную последовательность, идентичную по меньшей мере на 85% SEQ ID NO: 1, 2 или 3. В некоторых вариантах осуществления данного документа внеклеточная часть VEGF-рецептора содержит Ig-подобный домен D2 VEGF-рецептора. В некоторых вариантах осуществления данного документа внеклеточная часть VEGF-рецептора содержит Ig-подобный домен D2 VEGFR1 (FLT-1). В некоторых вариантах осуществления данного документа внеклеточная часть VEGF-рецептора содержит Ig-подобный домен D2 VEGFR1 (FLT-1) и Ig-подобный домен D3 VEGFR2. В некоторых вариантах осуществления данного документа внеклеточная часть VEGF-рецептора содержит Ig-подобные домены D1-D3 VEGFR1 (FLT-1). В некоторых вариантах осуществления данного документа внеклеточная часть VEGF-рецептора содержит аминокислотную последовательность SEQ ID NO: 4 или 5 или аминокислотную последовательность, идентичную по меньшей мере на 85% SEQ ID NO: 4 или 5. В некоторых вариантах осуществления данного документа слитый белок дополнительно содержит линкерный пептид между внеклеточной частью PDGF-рецептора и внеклеточной частью VEGF-рецептора и/или пептидный линкер между внеклеточной частью VEGF-рецептора и доменом, способным к мультимеризации. В дополнительном варианте осуществления пептидный линкер содержит аминокислотную последовательность, выбранную из группы, состоящей из Gly9 (SEQ ID NO: 47), Glu9 (SEQ ID NO:48), Ser9 (SEQ ID NO: 49), Gly5-Cys-Pro2-Cys (SEQ ID NO:50), (Gly4-Ser)3 (SEQ ID NO:51), Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO:52), Pro-Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO:53), Gly-Asp-Leu-Ile-Tyr-Arg-Asn-Gln-Lys (SEQ ID NO:54) и Gly9-Pro-Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO:55). В некоторых вариантах осуществления данного документа доменом, способным к мультимеризации, является Fc-область антитела. В дополнительном варианте осуществления Fc-область содержит CH3-область IgG1, IgG2, IgG3 или IgG4 либо CH2-область и CH3-область IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления данного документа Fc-область содержит аминокислотную последовательность SEQ ID NO:6 или аминокислотную последовательность, идентичную по меньшей мере на 85% SEQ ID NO:6. В некоторых вариантах осуществления данного документа слитые белки содержат аминокислотную последовательность SEQ ID NO:13 или 15 либо аминокислотную последовательность, идентичную по меньшей мере на 85% SEQ ID NO:13 или 15. В некоторых вариантах осуществления слитый белок находится в мультимерной форме. В некоторых вариантах осуществления слитый белок находится в димерной форме.
В одном аспекте в настоящем изобретении представляют слитый белок, продуцируемый путем культивирования клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую любой из слитых белков, раскрытых в данном документе, при условии, при котором продуцируется слитый белок, и извлечения слитого белка, продуцируемого клеткой-хозяином.
В другом аспекте в настоящем изобретении представляют димерный слитый белок, содержащий два слитых белка, где каждый слитый белок содержит любой из слитых белков, раскрытых в данном документе.
В еще одном аспекте в настоящем изобретении представляют композицию, содержащую любой из слитых белков, раскрытых в данном документе, и фармацевтически приемлемый носитель.
В еще одном аспекте в настоящем изобретении представляют нуклеиновую кислоту, кодирующую любой из слитых белков, раскрытых в данном документе.
В некоторых аспектах в настоящем изобретении также представляют клетку-хозяин, содержащую нуклеотидную последовательность, кодирующую любой из слитых белков, раскрытых в данном документе.
В некоторых аспектах в настоящем изобретении представляют способ получения слитого белка, включающий культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую любой из слитых белков, раскрытых в данном документе, при условии, при котором продуцируется слитый белок, и извлечение слитого белка, продуцируемого клеткой-хозяином. В дополнительных вариантах осуществления клеткой-хозяином является клетка млекопитающего. В дополнительных вариантах осуществления клеткой-хозяином является бактериальная клетка. В дополнительных вариантах осуществления клеткой-хозяином является клетка Escherichia coli.
В другом аспекте в настоящем изобретении представляют способ доставки слитого белка субъекту, включающий введение эффективного количества любого из слитых белков, раскрытых в данном документе, субъекту. В некоторых вариантах осуществления у субъекта имеется макулодистрофия или пролиферативная диабетическая ретинопатия. В дополнительном варианте осуществления макулодистрофия является влажной возрастной макулодистрофией или сухой возрастной макулодистрофией. В некоторых вариантах осуществления в данном документе слитый белок вводят субъекту с помощью интравитреальной инъекции. В некоторых вариантах осуществления у субъекта имеется рак. В некоторых вариантах осуществления у субъекта имеется ревматоидный артрит, остеоартрит или астма. В некоторых вариантах осуществления у субъекта имеется увеит или неоваскуляризация роговицы.
В некоторых аспектах в настоящем изобретении представляют вектор, содержащий нуклеотидную последовательность, кодирующую любой из слитых белков, раскрытых в данном документе. В некоторых вариантах осуществления вектором является вирусный вектор. В дополнительном варианте осуществления вирусным вектором является рекомбинантный аденоассоциированный вирусный вектор (rAAV). В дополнительных вариантах осуществления вектор rAAV содержит ITR AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAVrh8, AAVrh8R или AAVrh10.
В одном аспекте в настоящем изобретении также представляют частицу rAAV, содержащую нуклеиновую кислоту, кодирующую любой из слитых белков, раскрытых в данном документе. В некоторых вариантах осуществления частица rAAV содержит капсидные белки AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAVrh8, AAVrh8R или AAVrh10. В некоторых вариантах осуществления нуклеиновая кислота содержит ITR от серотипа, отличного от серотипа капсида. В дополнительном варианте осуществления ITR содержит ITR AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAVrh8, AAVrh8R или AAVrh10.
В еще одном аспекте в настоящем изобретении представляют способ получения частицы rAAV, включающий (a) культивирование клетки-хозяина при условии, при котором получают частицы rAAV, где клетка-хозяин содержит (i) один или несколько генов для упаковки AAV, где каждый упомянутый ген упаковки AAV кодирует белок, необходимый для репликации или капсидирования AAV; (ii) провектор rAAV, содержащий нуклеотид, кодирующий любой из слитых белков, раскрытых в данном документе, фланкированных по меньшей мере с помощью одного ITR AAV, и (iii) вспомогательный функциональный элемент AAV; и (b) извлечение частиц rAAV, продуцируемых клеткой-хозяином. В дополнительном варианте осуществления частицы rAAV очищают.
В еще одном варианте осуществления в настоящем изобретении представляют способ доставки вирусного вектора субъекту, включающий введение любой из частиц rAAV, раскрытых в данном документе, субъекту, где слитый белок, кодируемый частицой rAAV, экспрессируется в субъекте. В некоторых вариантах осуществления в настоящем изобретении представляют способ доставки вирусного вектора субъекту, включающий введение любой из частиц rAAV, раскрытых в данном документе, субъекту, где эффективное количество слитого белка, кодируемого частицой rAAV, экспрессируется в субъекте. В некоторых вариантах осуществления у субъекта имеется макулодистрофия или пролиферативная диабетическая ретинопатия. В дополнительном варианте осуществления макулодистрофия является влажной возрастной макулодистрофией или сухой возрастной макулодистрофией. В некоторых вариантах осуществления в данном документе частицу rAAV вводят субъекту с помощью интравитреальной инъекции. В некоторых вариантах осуществления у субъекта имеется рак. В некоторых вариантах осуществления у субъекта имеется ревматоидный артрит, остеоартрит или астма. В некоторых вариантах осуществления у субъекта имеется увеит или неоваскуляризация роговицы.
Описание считается достаточным, чтобы дать возможность специалисту в данной области техники использовать настоящее изобретение на практике. Различные модификации настоящего изобретения в дополнение к представленным и описанным в данном документе, станут очевидными для специалистов в данной области техники из изложенного выше описания и попадут в объем прилагаемой формулы изобретения. Все публикации, патенты и заявки на патенты, упоминаемые в данном документе, включены в данный документ с помощью ссылки во всей своей полноте для всех целей.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 представлено образование усеченных PDGFR-β растворимых рецепторов. A) Схема PDGFR-β Fc-связанных димеризующих форм IgG1, PDGFR(D1-D5)9G-Fc, PDGFR(D1-D2)9G-Fc и PDGFR(D1-D3)9G-Fc, а также PDGFR-β мономерных рецепторных форм, PDGFR(D1-D4) и PDGFR(D1-D5). Белые прямоугольники указывают на PDGFR-β-последовательности, в том числе внеклеточные домены и сигнальный пептид (sp). Заштрихованные косыми линиями прямоугольники представляют 9Gly-линкер, и темные прямоугольники с точками представляют домены CH2 и CH3 Fc-области IgG1 человека. B) Вестерн-блоттинг мономерных sPDGFR-β и Fc-связанных димеризующих растворимых форм IgG1 в восстанавливающих (левая панель) и невосстанавливающих (правая панель) условиях. Белок выявляли с помощью антитела к PDGFR-β.
На фигуре 2 представлен волюметрический анализ связывания PDGF BB усеченных PDGFR-β-растворимых рецепторов. A) Мономерные формы PDGFR-β-растворимого рецептора PDGFR(D1-D4) и PDGFR(D1-D5) по сравнению с полноразмерной Fc-связанной димеризующей формой PDGFR(D1-D5)9G-Fc IgG1. В) Димерные формы sPDGFR-β-растворимого рецептора PDGFR(D1-D4)9G-Fc IgG1 и PDGFR(D1-D3)9G-Fc по сравнению с Fc-связанной димеризующей формой PDGFR(D1-D5)9G-Fc IgG1. Возрастающие объемы (мкл) кондиционированных сред (CM), содержащих растворимые рецепторы (ось x) посредством иллюстративных трансфекций, инкубировали на протяжении ночи с лигандом человека PDGF BB, и количество несвязанного лиганда (ось y) определяли с помощью ELISA. Данные представлены в виде среднего ± SD (n=3); все рецепторы значимо отличались по PDGF связывающим аффинностям по 2-факторному ANOVA; критерий Бонферрони; ***P<0,001.
На фигуре 3 представлена схема гибридных белков VEGFR1/PDGFR-β и PDGFR-β/VEGFR1, гибриды от 1 до 4, и их исходные конструкции PDGFR(D1-D5)9G-Fc, PDGFR(D1-D3)9G-Fc и sFLT01. Белые прямоугольники указывают на PDGFR-β последовательности, серые прямоугольники указывают VEGFR1 (Flt-1) последовательности, в том числе их внеклеточные домены и сигнальные пептиды (sp). Заштрихованные косыми линиями прямоугольники представляют 9Gly или 9Ser линкеры и темные прямоугольники с точками представляют домены CH2 и CH3 Fc-области IgG1 человека.
На фигуре 4 представлен вестерн-блоттинг гибридных белков VEGFR1/ PDGFR-β и PDGFR-β/VEGFR1, гибриды от 1 до 4 по сравнению с полноразмерной Fc-связанной димеризующей формой PDGFR(D1-D5)9G-Fc IgG1 (представлено в виде (D1-D5)9G-Fc) в восстанавливающих (левая панель) и невосстанавливающих (правая панель) условиях. Белок выявляли с помощью антитела к PDGFR-β и антитела к Flt-1. Образцы, содержащие гибриды 3 и 4, были копиями от отдельных трансфекций.
На фигуре 5 представлены графики, показывающие ингибирование VEGF-индуцированной и VEGF + PDGF-β-индуцированной пролиферации эндотелиальных клеток пупочной вены человека (HUVEC) гибридным белком, гибриды от 1 до 4. A) Анализ пролиферации HUVEC с использованием только VEGF: ингибиторный эффект 5 мкл кондиционированной среды (CM), содержащей растворимые рецепторы, на пролиферацию HUVEC, сравнивали в присутствии только VEGF (10 нг/мл). B) Анализ конкурентной пролиферации HUVEC в присутствии VEGF (10 нг/мл) и PDGF (20 нг/мл). Ингибиторный эффект 5 мкл CM, содержащей растворимые рецепторы, на пролиферацию HUVEC сравнивали в присутствии обоих лигандов, VEGF и PDGF. Образцы от трех независимых трансфекций (n=3) определяли в одном анализе. Данные выражали в виде среднего ±SD. Однофакторный ANOVA; критерий Тьюки; ***p<0,001 для разности между положительным контролем VEGF+ отдельно или VEGF+ в комбинации с PDGF BB+ по сравнению с другими образцами. Контроль = EGFP CM; VEGF+ = EGFP CM + 10 нг/мл VEGF; только BB+ = EGFP CM + 20 нг/мл; VEGF+BB+ = EGFP CM + 10 нг/мл VEGF + 20 нг/мл PDGF BB.
На фигуре 6 представлены волюметрические анализы связывания гибридных белков. A) Волюметрический анализ связывания PDGF BB гибридных белков от 1 до 4 по сравнению с PDGFR(D1-D5)9G-Fc. В) Волюметрический анализ связывания VEGF гибридных белков от 1 до 4 по сравнению с sFLT01. Возрастающие объемы кондиционированных сред, содержащих растворимые рецепторы (ось x) посредством иллюстративных трансфекций, инкубировали на протяжении ночи с лигандами PDGF BB или VEGF и количество несвязанного лиганда (ось y) определяли с помощью ELISA в трех повторностях.
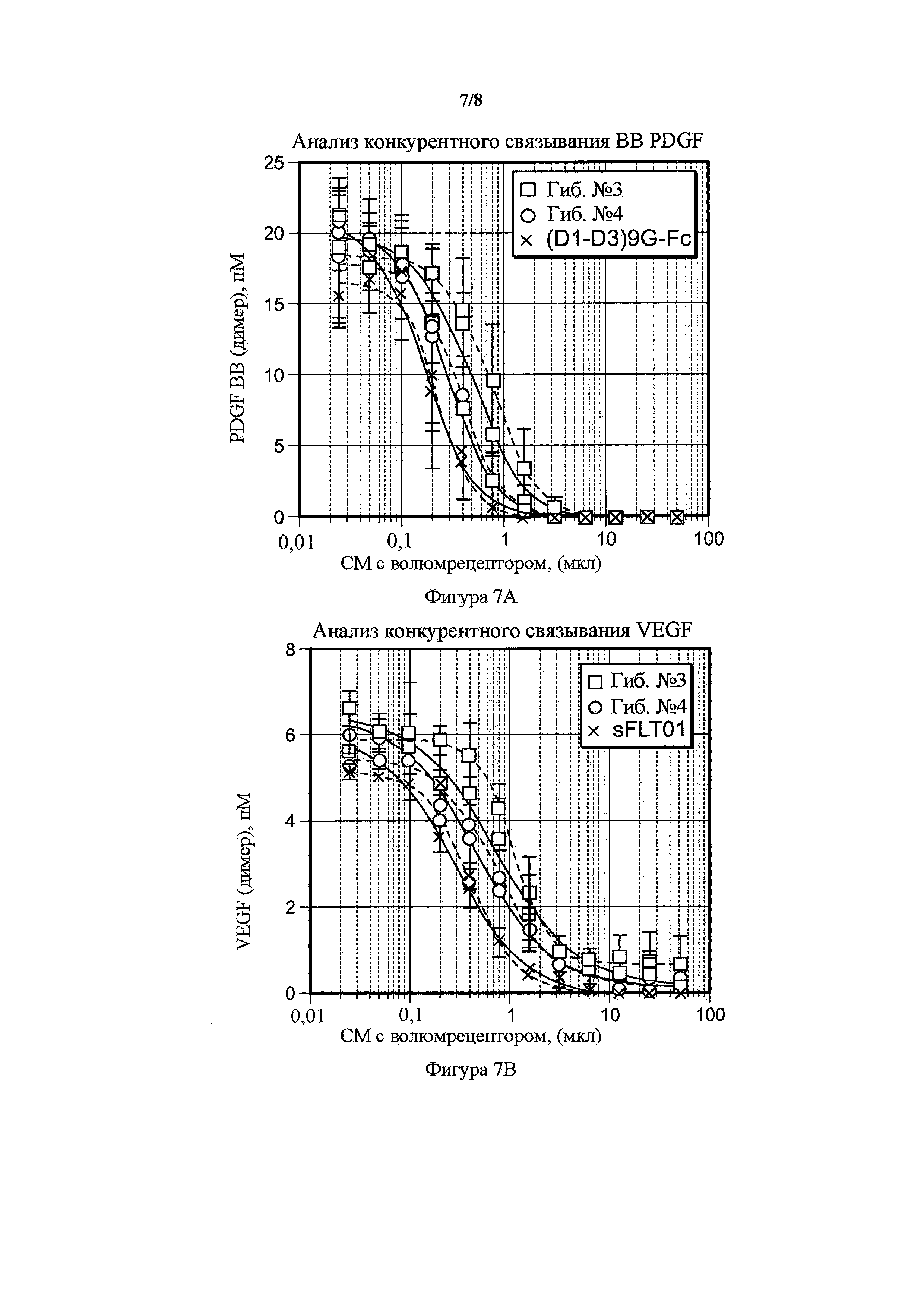
На фигуре 7 представлены анализы конкурентного бесклеточного связывания VEGF и PDGF гибридных белков. A) Сравнение гибрида 3 (гиб. № 3), гибрида 4 (гиб. № 4) и PDGFR(D1-D3)9G-Fc в возрастающих объемах кондиционированных сред (ось x) и количество несвязанного PDGF-лиганда (ось y), как определено с помощью PDGF BB ELISA. В) Сравнение гибрида 3 (гиб. № 3), гибрида 4 (гиб. № 4) и sFltT01 в возрастающих объемах кондиционированных сред (ось x) и количество несвязанного лиганда VEGF (ось y), как определено с помощью VEGF ELISA.
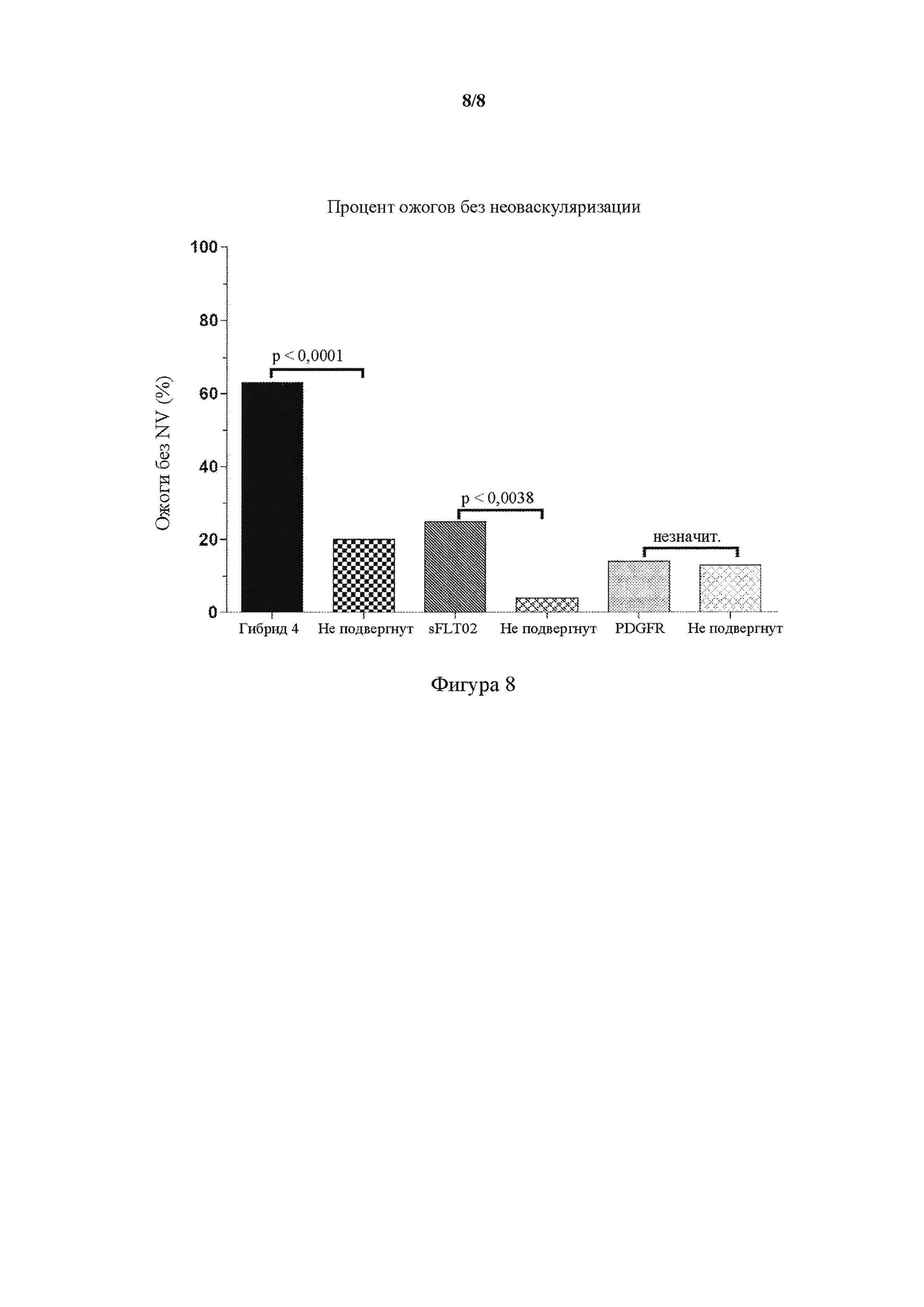
На фигуре 8 представлен график, показывающий эффективность in vivo интравитреальной доставки AAV2.Hybrid 4 в лазерной модели мышиной хориоидальной неоваскуляризации (CNV). Число ожогов без неоваскуляризации (NV) в (левом) глазе, который подвергали обработке AAV2.Hybrid 4 (представлено в виде Hybrid-4), AAV2.sFLT02 (представлено в виде sFLT02), AAV2.PDGFR (представлено в виде PDGFR), сравнивали с необработанным контралатеральным (правым; не подвергнутым) глазом. Данные от обоих глаз (n = 20 глаз на лечение) выражали в виде процента ожогов без CNV. Частью PDGFR, использованной для разработки AAV2.PDGFR, был PDGFR(D1-D3)9G-Fc.
ПОДРОБНОЕ ОПИСАНИЕ
В настоящем изобретении представляют, inter alia, слитые белки и их композиции, которые ингибируют сигнальный путь полученного из плазмы фактора роста (PDGF) и сигнальный путь фактора роста эндотелия сосудов (VEGF). Слитый белок настоящего изобретения, как описано в данном документе, содержит внеклеточную часть PDGF-рецептора (PDGFR), внеклеточную часть VEGF-рецептора (VEGFR) и домен, способный к мультимеризации, где слитый белок связывается с PDGF и VEGF с целью ингибирования активности PDGF и активности VEGF, соответственно. В данном документе также предлагаются способы получения слитых белков, способы доставки слитых белков и способы применения слитых белков в лечении заболеваний глаз, аутоиммунных заболеваний, воспалительных заболеваний и/или рака.
I. Общие методики
Методики и процедуры, описанные в данном документе, как правило, широко распространены и широко применяются с использованием стандартного способа специалистами в данной области техники, такие как, например, широко используемые способы, описанные в Molecular Cloning: A Laboratory Manual (Sambrook et al., 4th ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2012); Current Protocols in Molecular Biology (F.M. Ausubel, et al. eds., 2003); серии Methods in Enzymology (Academic Press, Inc.); PCR 2: A Practical Approach (M.J. MacPherson, B.D. Hames and G.R. Taylor eds., 1995); Antibodies, A Laboratory Manual (Harlow and Lane, eds., 1988); Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications (R.I. Freshney, 6th ed., J. Wiley and Sons, 2010); Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., Academic Press, 1998); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, Plenum Press, 1998); Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., J. Wiley and Sons, 1993-8); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds., 1996); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Ausubel et al., eds., J. Wiley and Sons, 2002); Immunobiology (C.A. Janeway et al., 2004); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane, Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); and Cancer: Principles and Practice of Oncology (V.T. DeVita et al., eds., J.B. Lippincott Company, 2011).
II. Определения
"Вектор", как используется в данном документе, относится к рекомбинантной плазмиде или вирусу, который содержит нуклеиновую кислоту, которую необходимо доставить в клетку-хозяин, in vitro или in vivo.
Выражение "полинуклеотид" или "нуклеиновая кислота", как применяется в данном документе, относится к полимерной форме нуклеотидов любой длины, рибонуклеотидам или дезоксирибонуклеотидам. Таким образом, это выражение включает без ограничений одно-, двух- или многоцепочечную ДНК или РНК, геномную ДНК, кДНК, гибриды ДНК-РНК, или полимер, содержащий пуриновые и пиримидиновые основания, или другие природные, химически или биохимически модифицированные, искусственные или дериватизированные нуклеотидные основания. Остов полинуклеотида может содержать сахара и фосфатные группы (которые можно обычно встретить в РНК или ДНК) или модифицированный или замещенный сахар или фосфатные группы. В качестве альтернативы, остов полинуклеотида может содержать полимер синтетических субъединиц, таких как фосфорамидаты, и таким образом, быть олигодезоксинуклеозидным фосфорамидатом (P-NH2) или смешанным фосфорамидатным олигомером с фосфодиэфирной связью. Кроме того, двухцепочечный полинуклеотид можно получить из односпирального полинуклеотидного продукта химического синтеза с помощью либо синтезирования комплементарной цепи и отжига цепей в соответствующих условиях, либо с помощью синтезирования комплементарной цепи de novo с использованием ДНК-полимеразы с соответствующим праймером.
"Рекомбинатный вирусный вектор" относится к рекомбинантному полинуклеотидному вектору, содержащему одну или несколько гетерологичных последовательностей (т.е. нуклеотидную последовательность невирусного происхождения). В случае рекомбинантных AAV векторов рекомбинантную нуклеиновую кислоту фланкируют с помощью по меньшей мере одного, предпочтительно двух последовательностей инвертированных концевых повторов (ITR).
"Рекомбинантный AAV-вектор (rAAV-вектор)" относится к полинуклеотидному вектору, содержащему одну или несколько гетерологичных последовательностей (т.е. последовательность нуклеиновой кислоты, не происходящую из AAV), которые фланкированы по меньшей мере, одной, предпочтительно двумя последовательностями инвертированных концевых повторов (ITR). Такие rAAV-векторы могут быть реплицированы и упакованы в инфекционные вирусные частицы при присутствии в клетке-хозяине, которую инфицируют пригодным хелперным вирусом (или которая экспрессирует пригодные вспомогательные функциональные элементы) и которая экспрессирует продукты генов rep и cap AAV (т.е. белки Rep и Cap AAV). Если rAAV-вектор включен в более крупный полинуклеотид (например, в хромосому или в другой вектор, такой как плазмида, используемая для клонирования или трансфекции), то rAAV вектор можно обозначить как "провектор", который можно "спасти" с помощью репликации и капсидирования в присутствии упаковывающих функциональных элементов и пригодных вспомогательных функциональных элементов AAV. rAAV может находиться в любой из множества форм, в том числе без ограничений плазмид, линейных искусственных хромосом, образующими комплексы с липидами, инкапсулированными в липосомах и наиболее предпочтительно инкапсулированными в вирусную частицу, в частности, AAV. rAAV вектор может быть упакован в вирусный капсид AAV для получения "рекомбинантной аденоассоцицированной вирусной частицы (частицы rAAV)".
"Гетерологичный" обозначает полученный из генотипически отличающейся структуры от таковой остатка структуры, с которой сравнивают или в которую вводят или включают. Например, полинуклеотид, введенный с помощью методик генетической инженерии в отличающийся тип клетки, является гетерологичным полинуклеотидом (и при экспрессии может кодировать гетерологичный полипептид). Подобным образом, клеточная последовательность (например, ген или его часть), которую включают в вирусный вектор, является гетерологичной нуклеотидной последовательностью по отношению к вектору.
"Инвертированный концевой повтор" или последовательность "ITR" является выражением, широко распространенным в данной области техники и относится к сравнительно коротким последовательностям, встречающимся на концах вирусных геномов, которые расположены в противоположной ориентации.
Последовательность "инвертированного концевого повтора (ITR) AAV", выражение, широко распространенное в данной области техники, представляет собой приблизительно 145-нуклеотидную последовательность, которая присутствует на обоих концах нативного одноцепочечного генома AAV. Наиболее удаленные 125 нуклеотидов ITR могут присутствовать в любой из двух альтернативных ориентаций, приводя к гетерогенности между различными геномами AAV и между двумя концами одного генома AAV. Наиболее удаленные 125 нуклеотидов также содержат несколько более коротких областей самокомплементарности, обеспечивая появление внутрицепочечного спаривания оснований в этой части ITR.
"Последовательность концевого разрешения" или "trs" представляет собой последовательность в D-области ITR AAV, которая отщепляется белками rep AAV во время репликации вирусной ДНК. Мутантная последовательность концевого разрешения является невосприимчивой к отщеплению белками rep AAV.
Выражения "геномные частицы (gp)", "геномные эквиваленты" или "геномные копии", как применяется в отношении вирусного титра, относятся к числу вирионов, содержащих геном ДНК рекомбинантного AAV, вне зависимости от инфекционности или функциональности. Число геномных частиц в конкретном векторном препарате можно определять с помощью процедур, таких как описано в примерах в данном документе, или, например, в Clark et al. (1999) Hum. Gene Ther., 10:1031-1039; Veldwijk et al. (2002) Mol. Ther., 6:272-278.
Выражение "инфекционная единица (iu)", "инфекционная частица" или "репликационная частица", как применяется в отношении титра вирусов, относится к числу инфекционных или репликационно-компетентных частиц рекомбинантного AAV-вектора, как определено с помощью инфекционно-ориентированного анализа, также известного как репликационно-ориентированный центр, как описано, например, в McLaughlin et al. (1988) J. Virol., 62:1963-1973.
Выражение "трансдуцирующая единица (tu)", как применяется в отношении вирусного титра, относится к числу инфекционных частиц рекомбинантного AAV вектора, которое приводит к получению функционального трансгенного продукта, как определено в функциональных анализах, как описано в примерах в данном документе, или, например, в Xiao et al. (1997) Exp. Neurobiol., 144:113-124; или в Fisher et al. (1996) J. Virol., 70:520-532 (анализ LFU).
"Хелперный вирус" для AAV относится к вирусу, который способствует репликации и упаковке AAV (который является дефектным парвовирусом) клеткой-хозяином. Было идентифицировано множество таких хелперных вирусов, в том числе аденовирусы, герпесвирусы и поксвирусы, такие как вирус осповакцины. Аденовирусы охватывают множество различных подгрупп, однако, наиболее широко используется аденовирус 5 типа подгруппы C (Ad5). Многочисленные аденовирусы человеческого происхождения, происходящие из млекопитающих, кроме человека, и птичьего происхождения, известны и доступны из депозитариев, таких как ATCC. Вирусы семейства герпес, которые также доступны из депозитариев, таких как ATCC, включают, например, вирусы простого герпеса (HSV), вирусы Эпштейна-Барр (EBV), цитомегаловирусы (CMV) и вирусы псевдобешенства (PRV).
"Слитый белок" относится к белку, имеющему две или более части, ковалентно связанные вместе, где каждая из частей происходит из различных белков.
"Процентная (%) идентичность последовательности" в отношении к эталонной полипептидной последовательности или последовательности нуклеиновой кислоты, определена как процент аминокислотных остатков или нуклеотидов в кандидатной последовательности, которые идентичны аминокислотным остаткам или нуклеотидам в эталонной полипептидной последовательности или последовательности нуклеиновой кислоты, после выравнивания последовательностей и введения гэпов, при необходимости, для достижения максимальной процентной идентичности последовательности, и без учета каких-либо консервативных замен как части идентичности последовательности. Выравнивание для целей определения процентной идентичности аминокислотной последовательности или последовательности нуклеиновой кислоты может быть достигнуто различными способами, которые находятся в пределах компетенции специалиста в данной области техники, например, с помощью общедоступных компьютерных программ, например, таковых, описанных в Current Protocols in Molecular Biology (Ausubel et al., eds., 1987), дополнение 30, раздел 7.7.18, таблица 7.7.1, и в том числе компьютерных программ BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Предпочтительной программой выравнивания является ALIGN Plus (Scientific and Educational Software, Пенсильвания). Специалисты в данной области могут определять соответствующие параметры для определения выравнивания, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по полной длине последовательностей, подлежащих сравнению. Для целей данного документа % идентичность аминокислотной последовательности определенной аминокислотной последовательности А к определенной аминокислотной последовательности В, с определенной аминокислотной последовательностью В или против определенной аминокислотной последовательности В (которую можно альтернативно назвать как определенную аминокислотную последовательность A, которая имеет или содержит определенную % идентичность аминокислотной последовательности к определенной аминокислотной последовательности В, с определенной аминокислотной последовательностью В или против определенной аминокислотной последовательности В) рассчитывается следующим образом: 100 умножить на дробь X/Y, где X представляет собой число аминокислотных остатков, учтенных в качестве идентичных совпадений программой выравнивания последовательностей в этом программном выравнивании A и B, и где Y представляет собой общее число аминокислотных остатков в B. Следует принимать во внимание, что если длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичность аминокислотной последовательности A к B не будет равна % идентичности аминокислотной последовательности B к A. Для целей данного документа % идентичность последовательности нуклеиновой кислоты определенной последовательности нуклеиновой кислоты C к определенной последовательности нуклеиновой кислоты D, с определенной последовательностью нуклеиновой кислоты D или против определенной последовательности нуклеиновой кислоты D (которую можно альтернативно назвать как определенную последовательность нуклеиновой кислоты C, которая имеет или содержит определенную % идентичность последовательности нуклеиновой кислоты к определенной последовательности нуклеиновой кислоты D, с определенной последовательностью нуклеиновой кислоты D или против определенной последовательности нуклеиновой кислоты D) рассчитывается следующим образом: 100 умножить на дробь W/Z, где W представляет собой число нуклеотидов, учтенных в качестве идентичных совпадений программой выравнивания последовательностей в этом программном выравнивании C и D, и где Z представляет собой общее число нуклеотидов в D. Следует принимать во внимание, что если длина последовательности нуклеиновой кислоты C не равна длине последовательности нуклеиновой кислоты D, % идентичность последовательности нуклеиновой кислоты C к D не будет равна % идентичности последовательности нуклеиновой кислоты D к C.
"Выделенная" молекула (например, нуклеиновая кислота или белок) или клетка обозначает, что она идентифицирована и отделена и/или извлечена из компонента своего природного окружения.
"Эффективное количество" обозначает количество, достаточное для оказания благоприятных или необходимых результатов, в том числе, клинических результатов. Эффективное количество можно вводить в одном или нескольких введениях. С точки зрения состояния заболевания эффективным количеством является количество, достаточное для уменьшения интенсивности, стабилизации или задержки развития заболевания.
"Индивидуумом" или "субъектом" является млекопитающее. Млекопитающие включают без ограничений одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, кроме человека, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых вариантах осуществления индивидуумом или субъектом является человек.
Как применяется в данном документе, "лечение" представляет собой подход для получения благоприятных или необходимых клинических результатов. Для целей настоящего изобретения благоприятные или необходимые клинические результаты включают без ограничений облегчение симптомов, снижение степени заболевания, стабилизированное (т.е. не ухудшающееся) состояние заболевания, предотвращение распространения (т.е. метастазирование) заболевания, задержку или замедление прогрессирования заболевания, ослабление или временное облегчение состояния заболевания и ремиссию (частичную или полную), выявляемую или невыявляемую. "Лечение" может также обозначать продление выживания по сравнению с ожидаемым выживанием в случае неполучения лечения.
Ссылка на "приблизительное" значение или параметр в данном документе включает (и описывает) варианты осуществления, которые направлены на это значение или параметр per se. Например, описание, относящееся к "приблизительно X", включает описание "X."
Как применяется в данном документе, формы существительного единственного числа включают упоминания множественного числа, если не указано иное. Например, выражение "частица rAAV" включает одну или несколько частиц rAAV.
Понятно, что аспекты и варианты осуществления настоящего изобретения, описанные в данном документе, включают "содержащие", "состоящие из" и/или "состоящие фактически из" аспектов и вариантов осуществления.
III. Слитые белки и компоненты слитых белков
Рецептор полученного из плазмы фактора роста (PDGF)
Полученные из плазмы факторы роста (PDGF) включены во многие биологические виды активности и вовлечены во множество заболеваний, таких как атеросклероз, гломерулонефрит, сосудистый рестеноз после ангиопластики и рак. Существует по меньшей мере четыре члена белков семейства полученных из плазмы факторов роста (PDGF), которые регулируют сигнальный путь PDGF, в частности, PDGF-A, PDGF-B, PDGF-C и PDGF-D. Эти четыре PDGF собираются в четыре связанных дисульфидными связями димера с помощью гомо- или гетеродимеризации. По меньшей мере пять различных димерных изоформ PDGF были описаны к настоящему времени и включают PDGF-AA, PDGF-BB, PDGF-CC, PDGF-DD и PDGF-AB, все из которых связываются с PDGF рецепторами (PDGFR) для активации сигнального пути PDGF. Существует по меньшей мере два идентифицированных PDGFR, PDGFR-α и PDGFR-β. Каждый PDGFR имеет внеклеточную область, трансмембранный домен и внеклеточную область, имеющую внеклеточную активность тирозинкиназы. PDGFR можно димеризовать для образования гомодимеров PDGFR-α/PDGFR-α или PDGFR-β/PDGFR-β и гетеродимера PDGFR-α/PDGFR-β. Каждый из этих димерных форм PDGFR распознает различные димерные изоформы PDGF. Например, PDGFR-α/PDGFR-α распознает PDGF-AA, AB, BB и CC лиганды, PDGFR-α/PDGFR-β распознает PDGF-AB, BB, CC и DD, и PDGFR-β/PDGFR-β распознает PDGF-BB и DD. Делеционный мутагенез PDGF-AA и -BB связывающих сайтов соответствовал аминокислотам 1-314 PDGFR-α, в то время как PDGF-BB связывающих сайтов соответствовал аминокислотам 1-315 PDGFR-β. Внеклеточная область этих PDGFR, которые опосредуют связывание с PDGF, содержит пять иммуноглобулин (Ig)-подобных доменов, каждый варьирует от приблизительно 88 до приблизительно 114 аминокислот в длину. См. Lokker et al., J Biol Chem., 1997, 272(52):33037-44, Miyazawa et al., J Biol Chem., 1998, 273(39):25495-502; и Mahadevan et al., J Biol Chem., 1995, 270(46):27595-600, которые включены в данный документ с помощью ссылки во всей своей полноте.
В настоящем изобретении представляют внеклеточную часть PDGF рецептора, которая может быть компонентом любого слитого белка, раскрытого в данном документе. Соответственно, в одном аспекте в настоящем изобретении представляют внеклеточную часть PDGFR, которая включает без ограничений PDGFR-α и PDGFR-β. В некоторых из вариантов осуществления данного документа PDGFR происходит от млекопитающего, такого как человек. Существует пять Ig-подобных доменов, пронумерованных 1, 2, 3, 4 и 5, начиная от N-конца до C-конца внеклеточной области PDGFR. Как применяется в данном документе, выражение "внеклеточная часть PDGFR" относится к одному или нескольким из пяти Ig-подобных доменов во внеклеточной области PDGFR. Например, "внеклеточная часть PDGFR" относится к одному или нескольким из любых пяти Ig-подобных доменов, встречающихся во внеклеточной области PDGFR, таким как Ig-подобный домен D1, Ig-подобный домен D2, Ig-подобный домен D3, Ig-подобный домен D4 или Ig-подобный домен D5. Как применяется в данном документе, выражения, такие как "Ig-подобный домен D1" или "внеклеточный домен (ECD) 1" PDGFR, в частности, относятся к первому Ig-подобному домену, встречающемуся на N-конце внеклеточной области PDGFR, "Ig-подобный домен D2" или "ECD 1" PDGFR, в частности, относится ко второму Ig-подобному домену от N-конца внеклеточной области PDGFR, и т.п. В любом из аспектов данного документа внеклеточная часть PDGFR содержит по меньшей мере один Ig-подобный домен из одного или нескольких PDGFR, выбранных из группы, состоящей из PDGFR-α и PDGFR-β. В некоторых аспектах внеклеточная часть PDGFR содержит по меньшей мере 1, 2, 3, 4, но не более 5 Ig-подобных доменов PDGFR (например, PDGFR-β). В некоторых аспектах внеклеточная часть PDGFR содержит от 1 до 5, от 1 до 4, от 1 до 3 или от 1 до 2 Ig-подобных доменов PDGFR (например, PDGFR-β). Например, внеклеточная часть PDGFR может содержать Ig-подобный домен D2 PDGFR. В другом примере внеклеточная часть PDGFR может содержать Ig-подобные домены от D1 до D2 PDGFR (например, PDGFR-β). В еще одном примере внеклеточная часть PDGFR может содержать Ig-подобные домены от D1 до D3, Ig-подобные домены от D1 до D4 или Ig-подобные домены от D1 до D5 PDGFR (например, PDGFR-β).
В данном документе рассматривается внеклеточная часть, содержащая любую комбинацию из пяти Ig-подобных доменов каждого PDGFR. Соответственно, в одном аспекте в настоящем изобретении представляют внеклеточную часть PDGFR, содержащую по меньшей мере один Ig-подобный домен из двух PDGFR. В некоторых вариантах осуществления внеклеточная часть PDGFR содержит по меньшей мере один Ig-подобный домен из двух PDGFR, выбранных из группы, состоящей из PDGFR-α и PDGFR-β. Например, слитый белок, как описано в данном документе, может содержать внеклеточную часть PDGFR, содержащую по меньшей мере один Ig-подобный домен PDGFR-α и по меньшей мере один Ig-подобный домен PDGFR-β. В некоторых аспектах внеклеточная часть PDGFR содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, но не более 10 Ig-подобных доменов по меньшей мере двух или более PDGFR. В дополнительном аспекте внеклеточная часть PDGFR содержит от 1 до 10, от 1 до 9, от 1 до 8, от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или от 1 до 2 Ig-подобных доменов по меньшей мере двух или более PDGFR. Для дополнительного описания Ig-подобных доменов, которые можно использовать как часть внеклеточной части PDGFR, см. патент США № 5686572, WO 2006113277 и Lokker et al., J Biol Chem. 1997, 272(52):33037-44, все из которых включены в данный документ с помощью ссылки во всей своей полноте.
В некоторых аспектах внеклеточная часть PDGFR содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-3. Например, внеклеточная часть PDGFR, содержащая аминокислотную последовательность SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 3, может быть компонентом любого слитого белка, раскрытого в данном документе. В некоторых вариантах осуществления внеклеточная часть PDGFR содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7 и 8.
Также рассматриваются варианты аминокислотной последовательности любой внеклеточной части PDGFR, представленного в данном документе. Например, аффинность связывания и/или другие биологические свойства внеклеточной части PDGFR можно улучшить путем изменения аминокислотной последовательности, кодирующей белок. Варианты аминокислотной последовательности внеклеточной части PDGFR можно получить с помощью введения соответствующих модификаций в последовательность нуклеиновой кислоты, кодирующей белок, или с помощью введения модификации путем пептидного синтеза. Такие модификации включают, например, делеции от аминокислотной последовательности внеклеточной части PDGFR, вставки в аминокислотную последовательность внеклеточной части PDGFR и/или замены в аминокислотной последовательности внеклеточной части PDGFR. Для получения окончательной аминокислотной конструкции внеклеточной части PDGFR можно выполнить любую комбинацию делеции, вставки и замены, при условии, что окончательная конструкция обладает необходимыми характеристиками, такими как связывание с белком семейства PDGF и/или ингибирование активации пути PDGF. Соответственно, в данном документе представлены варианты внеклеточной части PDGFR, которая может быть компонентом любого слитого белка, раскрытого в данном документе. В некоторых вариантах осуществления внеклеточная часть PDGFR содержит аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности любого из Ig-подобных доменов D1, D2, D3, D4 или D5 PDGFR-α (например, PDGFR-α человека). В некоторых вариантах осуществления внеклеточная часть PDGFR содержит аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности любого из Ig-подобных доменов D1, D2, D3, D4 или D5 PDGFR-β (например, PDGFR-β человека). В некоторых вариантах осуществления внеклеточная часть PDGFR содержит аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-3. В некоторых вариантах осуществления внеклеточная часть PDGFR содержит аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 7 и 8.
Не ограничиваясь теорией, в данном документе предполагается, что внеклеточная часть PDGFR ингибирует активацию пути PDGF путем связывания белка семейства PDGF для блокирования его взаимодействия с PDGFR. Не ограничиваясь теорией, в данном документе также предполагается, что внеклеточная часть PDGFR может связываться с PDGFR для доминантного отрицательного ингибирования сигнального пути PDGF. В некоторых аспектах внеклеточная часть PDGFR связывается с белком семейства PDGF, выбранным из группы, состоящей из PDGF-A, PDGF-B, PDGF-C и PDGF-D. В некоторых аспектах внеклеточная часть PDGFR связывается с димером белка семейства PDGF, выбранным из группы, состоящей из P PDGF-AA, PDGF-AB, PDGF-BB, PDGF-CC и PDGF-DD. В некоторых аспектах внеклеточная часть PDGFR связывается с PDGFR, выбранным из группы, состоящей из PDGFR-α и PDGFR-β.
Внеклеточная часть PDGFR может содержать или может не содержать сигнальный пептид, который выполняет функции сигнальной последовательности для секреции внеклеточной части PDGFR из клетки-хозяина. Сигнальный пептид может быть функционально связанным с нуклеиновой кислотой, кодирующей белок, представляющий интерес (например, внеклеточную часть PDGFR). В некоторых вариантах осуществления внеклеточная часть PDGFR содержит сигнальный пептид. В некоторых вариантах осуществления внеклеточная часть PDGFR не содержит сигнальный пептид.
Рецептор фактора роста эндотелия сосудов (VEGF)
Существует по меньшей мере пять членов семейства белков VEGF, которые регулируют сигнальный путь VEGF: VEGF-A, VEGF-B, VEGF-C, VEGF-D и плацентарный фактор роста (PlGF). Кроме того, альтернативный сплайсинг мРНК, которая кодирует VEGF-A, VEGF-B, и PlGF, приводит к созданию множества изоформ этих белков. Например, альтернативный сплайсинг VEGF-A приводит к образованию девяти различных изоформ, в том числе VEGF121, VEGF165, VEGF189 и VEGF206. Семейство белков VEGF активирует сигнальный путь VEGF с помощью связывания с внеклеточной областью трансмембранных VEGF рецепторов. Существует по меньшей мере три идентифицированных VEGF рецептора: VEGFRl (также известный как связанная с fms тирозинкиназа 1 (Flt-1)), VEGFR2 (также известный как рецептор домена вставки киназы (KDR)) и VEGFR3 (также известный как fms-подобная тирозинкиназа 4 (Flt-4)). Каждый VEGFR содержит внеклеточную область, содержащую семь иммуноглобулин (Ig)-подобных домена, сигнальный сегмент трансмембранного домена, околомембранный сегмент и внутриклеточный домен белка-тирозинкиназы. Внеклеточные области VEGFR связываются с различными членами семейства белков VEGF. Например, VEGFR1 связывается с VEGF-A, VEGF-B и PlGF; VEGFR2 связывается со всеми изоформами VEGF-A, VEGF-C, VEGF-D и VEGF-E; и VEGFR3 связывается с VEGF-C и VEGF-D. См. Roskoski, R et al., Crit Rev Oncol Hematol., 2007, 62(3):179-213, который включен в данный документ с помощью ссылки во всей своей полноте, для обзора опосредованного VEGF и VEGFR сигнального пути.
В настоящем изобретении представляют внеклеточную часть VEGF рецептора, которая может быть компонентом любого слитого белка, раскрытого в данном документе. Соответственно, в одном аспекте в настоящем изобретении представляют внеклеточную часть VEGFR, которая включает без ограничений VEGFR1, VEGFR2 и VEGFR3. В некоторых из вариантов осуществления данного документа VEGFR происходит от млекопитающего, такого как человек. Существует семь Ig-подобных доменов, пронумерованных 1, 2, 3, 4, 5, 6 и 7, начиная от N-конца до C-конца внеклеточной области VEGFR. Как применяется в данном документе, выражение "внеклеточная часть VEGFR" относится к одному или нескольким из семи Ig-подобных доменов во внеклеточной области VEGFR. Например, "внеклеточная часть VEGFR" относится к одному или нескольким из любых семи Ig-подобных доменов, встречающихся во внеклеточной области VEGFR, таким как Ig-подобный домен D1, Ig-подобный домен D2, Ig-подобный домен D3, Ig-подобный домен D4, Ig-подобный домен D5, Ig-подобный домен D6 или Ig-подобный домен D7. Как применяется в данном документе, выражения, такие как "Ig-подобный домен D1" или "внеклеточный домен (ECD) 1" VEGFR, в частности, оба относятся к первому Ig-подобному домену, встречающемуся на N-конце внеклеточной области VEGFR, при этом "Ig-подобный домен D2" или "ECD 2" VEGFR, в частности, оба относятся ко второму Ig-подобному домену от N-конца внеклеточной области VEGFR, и т. п. В любом из аспектов данного документа внеклеточная часть VEGFR содержит по меньшей мере один Ig-подобный домен из одного или нескольких VEGFR, выбранных из группы, состоящей из VEGFR1, VEGFR2 и VEGFR3. В некоторых аспектах внеклеточная часть VEGFR содержит по меньшей мере 1, 2, 3, 4, 5, 6, но не более 7 Ig-подобных доменов VEGFR (например, VEGFR1). В некоторых аспектах внеклеточная часть VEGFR содержит от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или от 1 до 2 Ig-подобных доменов VEGFR (например, VEGFR1). Например, внеклеточная часть VEGFR может содержать Ig-подобный домен D2 VEGFR1. В другом примере внеклеточная часть VEGFR может содержать Ig-подобные домены от D1 до D3 VEGFR1. В еще одном примере внеклеточная часть VEGFR может содержать Ig-подобные домены от D2 до D3 VEGFR1 или Ig-подобные домены от D1 до D3 VEGFR2.
В данном документе рассматривается внеклеточная часть, содержащая любую комбинацию из семи Ig-подобных доменов каждого VEGFR. Соответственно, в одном аспекте в настоящем изобретении представляют внеклеточную часть VEGFR, содержащую по меньшей мере один Ig-подобный домен из двух или более VEGFR. В некоторых вариантах осуществления внеклеточная часть VEGFR содержит по меньшей мере один Ig-подобный домен из двух или более VEGFR, выбранных из группы, состоящей из VEGFR1, VEGFR2 и VEGFR3. Например, слитый белок, как описано в данном документе, может содержать внеклеточную часть VEGFR, содержащую по меньшей мере один Ig-подобный домен VEGFR1 и по меньшей мере один Ig-подобный домен VEGFR2. В другом примере слитый белок, как описано в данном документе, может содержать внеклеточную часть VEGFR, содержащую Ig-подобный домен D2 VEGFR1 и Ig-подобные домены от D3 до D4 VEGFR2. В другом примере слитый белок, как описано в данном документе, может содержать внеклеточную часть VEGFR, содержащую Ig-подобный домен D2 VEGFR1 и Ig-подобный домен D3 VEGFR3. В некоторых аспектах внеклеточная часть VEGFR содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, но не более 21 Ig-подобного домена по меньшей мере двух или более VEGFR. В дополнительном аспекте внеклеточная часть VEGFR содержит от 1 до 21, от 1 до 20, от 1 до 19, от 1 до 18, от 1 до 17, от 1 до 16, от 1 до 15, от 1 до 14, от 1 до 13, от 1 до 12, от 1 до 11, от 1 до 10, от 1 до 9, от 1 до 8, от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или от 1 до 2 Ig-подобных доменов по меньшей мере двух или более VEGFR. Для дополнительного описания Ig-подобных доменов, которые можно использовать как часть внеклеточной части VEGFR, см. патент США № 7928072, WO 2006113277, Davis-Smyth, T., et al., J Biol Chem, 1998, 273:3216-3222, Holash, J., et al., PNAS, 2002, 99(17):11393-11398, и Pechan, P., et al., Gene Ther, 2009, 16:10-16, все из которых включены во всей своей полноте с помощью ссылки.
В некоторых аспектах внеклеточная часть VEGFR содержит аминокислотную последовательность SEQ ID NO: 4. В некоторых аспектах внеклеточная часть VEGFR содержит аминокислотную последовательность SEQ ID NO: 5. Например, внеклеточная часть VEGFR, содержащая аминокислотную последовательность SEQ ID NO: 4 или SEQ ID NO: 5, может быть компонентом любого слитого белка, раскрытого в данном документе.
Также рассматриваются варианты аминокислотной последовательности любой внеклеточной части VEGFR, представленного в данном документе. Например, аффинность связывания и/или другие биологические свойства внеклеточной части VEGFR можно улучшить путем изменения аминокислотной последовательности, кодирующей белок. Варианты аминокислотной последовательности внеклеточной части VEGFR можно получить с помощью введения соответствующих модификаций в последовательность нуклеиновой кислоты, кодирующей белок, или с помощью введения модификации путем пептидного синтеза. Такие модификации включают, например, делеции от аминокислотной последовательности внеклеточной части VEGFR, вставки в аминокислотную последовательность внеклеточной части VEGFR и/или замены в аминокислотной последовательности внеклеточной части VEGFR. Для получения окончательной аминокислотной конструкции внеклеточной части VEGFR можно выполнить любую комбинацию делеции, вставки и замены, при условии, что окончательная конструкция обладает необходимыми характеристиками, такими как связывание с белком семейства VEGFR и/или ингибирование активации пути VEGFR. Соответственно, в данном документе представлены варианты внеклеточной части VEGFR, которая может быть компонентом любого слитого белка, раскрытого в данном документе. В некоторых вариантах осуществления внеклеточная часть VEGFR содержит аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности любого из Ig-подобных доменов D1, D2, D3, D4, D5, D6 или D7 VEGFR1 (например, VEGFR1 человека). В некоторых вариантах осуществления внеклеточная часть VEGFR содержит аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности любого из Ig-подобных доменов D1, D2, D3, D4, D5, D6 или D7 VEGFR2 (например, VEGFR2 человека). В некоторых вариантах осуществления внеклеточная часть VEGFR содержит аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности любого из Ig-подобных доменов D1, D2, D3, D4, D5, D6 или D7 VEGFR3 (например, VEGFR3 человека). В некоторых вариантах осуществления внеклеточная часть VEGFR содержит аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 4 и 5.
Не ограничиваясь теорией, в данном документе предполагается, что внеклеточная часть VEGFR ингибирует активацию пути VEGF путем связывания белка семейства VEGF для блокирования его взаимодействия с VEGFR. Не ограничиваясь теорией, в данном документе также предполагается, что внеклеточная часть VEGFR может связываться с VEGFR для доминантного отрицательного ингибирования сигнального пути VEGF. В некоторых аспектах внеклеточная часть VEGFR связывается с белком семейства VEGF, выбранным из группы, состоящей из VEGF-A, VEGF-B, VEGF-C, VEGF-D и PlGF. В некоторых аспектах внеклеточная часть VEGFR связывается с VEGFR (например, VEGFR1, VEGFR2 и/или VEGFR3).
Внеклеточная часть VEGFR может содержать или может не содержать сигнальный пептид, который выполняет функции сигнальной последовательности для секреции внеклеточной части VEGFR из клетки-хозяина. Сигнальный пептид может быть функционально связанным с нуклеиновой кислотой, кодирующей белок, представляющий интерес (например, внеклеточную часть VEGFR). В некоторых вариантах осуществления внеклеточная часть VEGFR содержит сигнальный пептид. В некоторых вариантах осуществления внеклеточная часть VEGFR не содержит сигнальный пептид.
Домен, способный к мультимеризации
В настоящем изобретении представляют домен, способный к мультимеризации (например, Fc-область антитела), который может быть компонентом любого слитого белка, раскрытого в данном документе. Домены, способные к мультимеризации, представляют собой такие части мультимерных белков, которые способствуют объединению субъединиц с целью образования, например, димеров, тримеров, тетрамеров и т. п. Как применяется в данном документе, выражение "домен, способный к мультимеризации" можно использовать для обозначения димеризующего домена, тримеризующего домена, тетрамеризующего домена и т.п. Слитые белки, содержащие домен, способный к мультимеризации, могут взаимодействовать с другими слитыми белками, содержащими домен, способный к мультимеризации, для образования мультимеров слитых белков (например, димеров слитых белков). Например, Fc-область IgG представляет собой димеризующий домен, который можно сливать с внеклеточной частью PDGFR или внеклеточной частью VEGFR, как раскрыто в данном документе. Слитый белок, содержащий внеклеточную часть PDGFR и Fc-область IgG, можно димеризовать с другим слитым белком, содержащим Fc-область IgG, для получения димера слитых белков с мультиспецифичностью по меньшей мере к PDGF. Домен, способный к мультимеризации, может быть любым полипептидом, который образует мультимер с другим полипептидом. Домены, способные к мультимеризации, которые можно использовать, известны в данной области техники. См. патент США № 7928072 и WO 2006/113277. Например, Fc-область тяжелой цепи лямбда IgG1 или IgG2, такой как домен CH3 отдельно или оба домена CH2 и CH3, можно использовать в качестве домена, способного к мультимеризации. Другие Fc-области от изотипов иммуноглобулинов, такие как IgA, IgM, IgD или IgE, также можно использовать в качестве доменов, способных к мультимеризации. Как применяется в данном документе, выражение "Fc-область" используется для определения C-концевой области тяжелой цепи иммуноглобулинов, которая содержит по меньшей мере часть константной области. Выражение включает Fc-области нативной последовательности и вариантные Fc-области. В одном варианте осуществления Fc-область тяжелой цепи IgG человека простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако, С-концевой лизин (Lys447) Fc-области может присутствовать или может не присутствовать. В одном варианте осуществления доменом, способным к мультимеризации, является Fc-область антитела. В дополнительном варианте осуществления Fc-область антитела выбирают из группы, состоящей из Fc-области IgG, Fc-области IgA, Fc-области IgM, Fc-области IgD и Fc-области IgE. В другом варианте осуществления Fc-область антитела выбирают из группы, состоящей из Fc-области IgG1, Fc-области IgG2, Fc-области IgG3 и Fc-области IgG4. В некоторых аспектах Fc-область содержит CH3-область IgG1, IgG2, IgG3 или IgG4. В некоторых аспектах Fc-область содержит CH2-область и СН3-область IgG1, IgG2, IgG3 или IgG4. Аминокислотные последовательности, кодирующие иммуноглобулины, которые содержат Fc-области, хорошо известны в данной области техники. Например, аминокислотную последовательность тяжелой цепи лямбда IgG1 можно найти под номером доступа Genbank CAA75032. Fc-область иммуноглобулина можно получить с помощью отщепления ферментом папаином или с помощью других способов. В некоторых вариантах осуществления Fc-область содержит аминокислотную последовательность SEQ ID NO: 6. Можно также использовать домен VEGF, способный к мультимеризации, такой как домен, способный к мультимеризации VEGF-A. VEGF-A кодируется нуклеиновой кислотой, представленной под номером доступа Genbank NM003376. Например, домен VEGF-A, способный к мультимеризации, кодируется экзоном 3 VEGF-A и может быть связан с любым из компонентов слитых белков, раскрытых в данном документе, таких как внеклеточная часть PDGFR и/или внеклеточная часть VEGFR.
В некоторых вариантах осуществления в данном документе представлены варианты аминокислотной последовательности домена, способного к мультимеризации. Например, может быть предпочтительным улучшить биологические свойства (например, свойства мультимеризации) домена, способного к мультимеризации. Варианты аминокислотной последовательности домена, способного к мультимеризации, можно получить с помощью введения соответствующих модификаций в последовательность нуклеиновой кислоты, кодирующей белок, или с помощью введения модификации путем пептидного синтеза. Такие модификации включают, например, делеции от аминокислотной последовательности домена, способного к мультимеризации, вставки в аминокислотную последовательность домена, способного к мультимеризации, и/или замены в аминокислотной последовательности домена, способного к мультимеризации. Для получения окончательной аминокислотной конструкции домена, способного к мультимеризации, можно выполнить любую комбинацию делеции, вставки и замены, при условии, что окончательная конструкция обладает необходимыми характеристиками, такими как образование мультимерных белков. Соответственно, в данном документе представлены варианты домена, способного к мультимеризации (например, Fc-область антитела), который может быть компонентом любого слитого белка, раскрытого в данном документе. В некоторых вариантах осуществления Fc-область содержит аминокислотную последовательность, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности CH3-области IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления Fc-область содержит аминокислотную последовательность, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности CH2-области и CH3-области IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления Fc-область содержит аминокислотную последовательность, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности SEQ ID NO: 6. Варианты доменов, способных к мультимеризации, хорошо известны в данной области техники. См., например, заявку на патент США № 2012/0251531, которая включена в данный документ с помощью ссылки во всей своей полноте.
Линкеры
Компоненты слитого белка (например, внеклеточная часть PDGFR, внеклеточная часть VEGFR или домен, способный к мультимеризации) можно связать с помощью связывающего фрагмента, такого как пептидный линкер. Предпочтительно линкер повышает гибкость компонентов слитого белка и не нарушает в значительной степени структуру каждого функционального компонента в слитом белке. В некоторых вариантах осуществления линкерным фрагментом является пептидный линкер. В некоторых вариантах осуществления пептидный линкер содержит от 2 до 100 аминокислот. В некоторых вариантах осуществления пептидный линкер содержит 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, но не более 100 аминокислот. В некоторых вариантах осуществления пептидный линкер расположен между 5 и 75, 5 и 50, 5 и 25, 5 и 20, 5 и 15, 5 и 10 или 5 и 9 аминокислотами по длине. Иллюстративные линкеры включают пептиды, имеющие по меньшей мере два аминокислотных остатка, такие как Gly-Gly, Gly-Ala-Gly, Gly-Pro-Ala, Gly-Gly-Gly-Gly-Ser (SEQ ID NO: 46). Пригодные линейные пептиды включают полиглицин, полисерин, полипролин, полиаланин и олигопептиды, состоящие из аминокислотных остатков аланила, и/или серинила, и/или пролинина, и/или глицила. В некоторых вариантах осуществления пептидный линкер содержит аминокислотную последовательность, выбранную из группы, состоящей из Gly9 (SEQ ID NO: 47), Glu9 (SEQ ID NO: 48), Ser9 (SEQ ID NO: 49), Gly5-Cys-Pro2-Cys (SEQ ID NO: 50), (Gly4-Ser)3 (SEQ ID NO: 51), Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO: 52), Pro-Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO: 53), Gly-Asp-Leu-Ile-Tyr-Arg-Asn-Gln-Lys (SEQ ID NO: 54) и Gly9-Pro-Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO: 55).
Линкерные фрагменты также можно получить из других полимеров, таких как полиэтиленгликоль. Такие линкеры могут иметь от 10 до 1000, от 10 до 500, от 10 до 250, от 10 до 100 или от 10 до 50 мономерных единиц этиленгликоля. Пригодные полимеры должны иметь размер, подобный размеру, занимаемому соответствующим диапазоном аминокислотных остатков. Типичный доведенный до требуемого размера полимер составил бы интервал приблизительно 10-25 ангстрем.
Линкерный фрагмент может быть белковым мультивалентным линкером, который имеет разветвленные "плечи", которые связывают многочисленные компоненты слитого белка нелинейным образом. В некоторых вариантах осуществления мультивалентный линкер имеет приблизительно от 3 до 40 аминокислотных остатков, все или некоторые из которых представляют сайты прикрепления для конъюгации с компонентами слитых белков (например, внеклеточной частью PDGFR, внеклеточной частью VEGFR или доменом, способным к мультимеризации). Альфа-аминогруппы и альфа-карбоновые кислоты могут выполнять роль сайтов прикрепления. Иллюстративные мультивалентные линкеры включают без ограничений полилизины, полиорнитины, полицистеины, полиглутаминовую кислоту и полиаспарагиновую кислоту. Необязательно в аминокислотную последовательность могут быть включены аминокислотные остатки с инертными боковыми цепями, например, глицин, аланин и валин. Линкеры могут также представлять собой непептидное химическое соединение, такое как химический линкер, который пригоден для введения (например, глазного введения) сразу после прикрепления к компоненту слитого белка (например, внеклеточной части PDGFR, внеклеточной части VEGFR и/или домену, способному к мультимеризации). Химический линкер может представлять собой бифункциональный линкер, каждая из частей которого реагирует с компонентом слитого белка (например, внеклеточной частью PDGFR, внеклеточной частью VEGFR и/или доменом, способным к мультимеризации). В качестве альтернативы, химический линкер может быть разветвленным линкером, который имеет множество соответствующим образом размещенных реакционноспособных групп, каждая из которых может реагировать с функциональной группой компонента слитого белка (например, внеклеточной частью PDGFR, внеклеточной частью VEGFR и/или доменом, способным к мультимеризации). Компоненты слитого белка (например, внеклеточная часть PDGFR, внеклеточная часть VEGFR и/или домен, способный к мультимеризации) прикреплены посредством реакционноспособных функциональных групп и размещены таким образом, что стерическое несоответствие в значительной степени не нарушает образования ковалентных связей между некоторыми из реакционноспособных функциональных групп (например, амины, карбоновые кислоты, спирты, альдегиды и тиолы) и пептидом. Примеры линкерных фрагментов включают без ограничений таковые, раскрытые в Tarn, J.P., et al., J. of Immunol Methods, 1996, 196:17-32.
Линкерные фрагменты можно использовать для связывания любых из компонентов слитых белков, раскрытых в данном документе. Например, пептидный линкер (например, Gly9 (SEQ ID NO: 47)) можно использовать для связывания C-конца внеклеточной части PDGFR с N-концом внеклеточной части VEGFR и можно дополнительно использовать для связывания C-конца внеклеточной части VEGR с N-концом домена, способного к мультимеризации (например, Fc-области IgG1). В некоторых вариантах осуществления линкер используется между внеклеточной частью PDGFR и доменом, способным к мультимеризации. В некоторых вариантах осуществления линкер используется между внеклеточной частью VEGFR и доменом, способным к мультимеризации. В некоторых вариантах осуществления линкер используется между внеклеточной частью PDGFR и внеклеточной частью VEGFR. В некоторых вариантах осуществления слитый белок содержит линкер между внеклеточной частью PDGFR и внеклеточной областью VEGFR, и линкер между внеклеточной областью VEGFR и доменом, способным к мультимеризации (например, Fc-областью). В некоторых вариантах осуществления слитый белок содержит по меньшей мере один линкер, но не более четырех линкеров. Например, слитый белок может содержать (a) внеклеточную часть PDGFR, (b) внеклеточную часть VEGFR, (c) домен, способный к мультимеризации (например, Fc-область IgG1), и по меньшей мере один линкер от N-конца к С-концу в порядке, выбранном из группы, состоящей из (1) линкера, a, линкера, b, линкера, c, линкера; (2) a, линкера, b, линкера, c, линкера; (3) линкера, a, линкера, b, линкера, c; (4) a, линкера, b, линкера, c; (5) a, линкера, b, c; и (6) a, b, линкера, c. В другом примере слитый белок может содержать (a) внеклеточную часть PDGFR, (b) домен, способный к мультимеризации (например, Fc-область IgG1), и по меньшей мере один линкер от N-конца к C-концу в порядке, выбранном из группы, состоящей из (1) линкера, a, линкера, b, линкера; (2) линкера, a, линкера, b; (3) a, b, линкера; (4) a, линкера, b; (5) линкера, b, линкера, a, линкера; (6) линкера, b, линкера, a; (7) b, a, линкера; и (8) b, линкера, a.
Слитые белки
В данном документе представлены слитые белки, которые имеют связывающие специфичности по меньшей мере к двум различным связывающим партнерам (например, PDGF и VEGF). В некоторых вариантах осуществления слитый белок содержит первую связывающую специфичность к белку семейства PDGF (например, PDGF-A, PDGF-B, PDGF-C или PDGF-D) и вторую связывающую специфичность к VEGF (например, VEGF-A VEGF-B, VEGF-C, VEGF-D или P1GF). В некоторых вариантах осуществления слитый белок содержит первую связывающую специфичность к димеру белка семейства PDGF (например, PDGF-AA, PDGF-AB, PDGF-BB, PDGF-CC или PDGF-DD) и вторую связывающую специфичность к VEGF (например, VEGF-A VEGF-B, VEGF-C, VEGF-D или P1GF). В некоторых вариантах осуществления слитый белок содержит первую связывающую специфичность к PDGF млекопитающего (например, человека) и вторую связывающую специфичность к VEGF млекопитающего (например, человека). В некоторых вариантах осуществления слитый белок связывается с таким же PDGF, как любой из PDGFR, описанных в данном документе. В некоторых вариантах осуществления слитый белок связывается с таким же компонентом пути PDGF, как любой из PDGFR-α или PDGFR-β. В некоторых вариантах осуществления слитый белок связывается с таким же PDGF, как любой из димеров PDGFR-α/PDGFR-α, PDGFR-β/PDGFR-β или PDGFR-α/PDGFR-β. В некоторых вариантах осуществления слитый белок содержит по меньшей мере одну внеклеточную часть PDGFR любого из PDGFR, описанных в данном документе. Например, слитый белок может содержать по меньшей мере одну внеклеточную часть PDGFR-α и по меньшей мере одну внеклеточную часть PDGFR-β. В другом примере слитый белок может содержать две внеклеточные части PDGFR-β, такие как Ig-подобный домен D1-D3 и Ig-подобный домен D1-D5. В некоторых аспектах слитый белок содержит внеклеточную часть PDGFR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-3. В некоторых аспектах слитый белок содержит внеклеточную часть PDGFR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7 и 8. В некоторых вариантах осуществления слитый белок связывается с таким же компонентом пути VEGF, как любой из VEGFR, описанных в данном документе. В некоторых вариантах осуществления слитый белок связывается с таким же компонентом пути VEGF, как любой из VEGFR1, VEGFR2 или VEGFR3. В некоторых вариантах осуществления слитый белок содержит по меньшей мере одну внеклеточную часть VEGFR любого из VEGFR, описанных в данном документе. Например, слитый белок может содержать по меньшей мере одну внеклеточную часть VEGFR1 и по меньшей мере одну внеклеточную часть VEGFR2. В другом примере слитый белок может содержать две внеклеточные части VEGFR1, такие как Ig-подобный домен D2 и Ig-подобный домен D1-D3. В некоторых аспектах слитый белок содержит внеклеточную часть VEGFR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4 и 5. Любой из слитых белков, раскрытых в данном документе, содержащий внеклеточную часть PDGFR и внеклеточную часть VEGFR, может дополнительно содержать домен, способный к мультимеризации. В некоторых вариантах осуществления доменом, способным к мультимеризации, является Fc-область (например, Fc-область IgG1). В некоторых вариантах осуществления Fc-область содержит аминокислотную последовательность SEQ ID NO: 6. В некоторых вариантах осуществления слитый белок, содержащий внеклеточную часть PDGFR, внеклеточную часть VEGFR и домен, способный к мультимеризации, ингибирует сигнальные пути PDGF и VEGF (например, ингибирование активности PDGF и VEGF). Любой из слитых белков, раскрытых в данном документе, содержащий внеклеточную часть PDGFR, внеклеточную часть VEGFR и домен, способный к мультимеризации, может дополнительно содержать линкер. Линкером может быть любой линкер, как раскрыто в данном документе. В некоторых вариантах осуществления линкером является пептидный линкер. В некоторых вариантах осуществления линкер содержит аминокислотную последовательность, выбранную из группы, состоящей из Gly9 (SEQ ID NO: 47), Glu9 (SEQ ID NO: 48), Ser9 (SEQ ID NO: 49), Gly5-Cys-Pro2-Cys (SEQ ID NO: 50), (Gly4-Ser)3 (SEQ ID NO: 51), Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO: 52), Pro-Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO: 53), Gly-Asp-Leu-Ile-Tyr-Arg-Asn-Gln-Lys (SEQ ID NO: 54) и Gly9-Pro-Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO: 55). В некоторых вариантах осуществления внеклеточная часть PDGFR содержит внеклеточную часть PDGFR млекопитающего (например, человека). В некоторых вариантах осуществления внеклеточная часть VEGFR содержит внеклеточную часть VEGFR млекопитающего (например, человека). В некоторых вариантах осуществления слитый белок содержит внеклеточную часть PDGFR человека (например, PDGFR-β человека) и внеклеточную часть VEGFR человека (например, VEGFR1 человека).
В одном аспекте в настоящем изобретении представляют слитый белок, содержащий: a) внеклеточную часть PDGFR, содержащую аминокислотную последовательность SEQ ID NO: 1, 2, 3, 7 или 8; b) внеклеточную часть VEGFR, содержащую аминокислотную последовательность SEQ ID NO: 4 или 5; и c) домен, способный к мультимеризации, содержащий аминокислотную последовательность SEQ ID NO: 6. В некоторых вариантах осуществления слитый белок содержит: a) внеклеточную часть PDGFR, содержащую аминокислотную последовательность SEQ ID NO: 1; b) внеклеточную часть VEGFR, содержащую аминокислотную последовательность SEQ ID NO: 4; и c) домен, способный к мультимеризации, содержащий аминокислотную последовательность SEQ ID NO: 6. В некоторых вариантах осуществления слитый белок содержит: a) внеклеточную часть PDGFR, содержащую аминокислотную последовательность SEQ ID NO: 3; b) внеклеточную часть VEGFR, содержащую аминокислотную последовательность SEQ ID NO: 4; и c) домен, способный к мультимеризации, содержащий аминокислотную последовательность SEQ ID NO: 6.
В данном документе представлены слитые белки, содержащие внеклеточную часть PDGFR, внеклеточную часть VEGFR и домен, способный к мультимеризации особым образом. В некоторых вариантах осуществления слитый белок содержит (a) внеклеточную часть PDGFR, (b) внеклеточную часть VEGFR и (c) Fc-область, упорядоченную с N-конца к C-концу в порядке a, b, c. В некоторых вариантах осуществления внеклеточная часть PDGFR содержит Ig-подобные домены D1-D3 PDGFR (например, PDGFR-β). В некоторых вариантах осуществления внеклеточная часть PDGFR содержит Ig-подобные домены D1-D4 PDGFR (например, PDGFR-β). В некоторых вариантах осуществления внеклеточная часть PDGFR содержит Ig-подобные домены D1-D5 PDGFR (например, PDGFR-β). В некоторых вариантах осуществления внеклеточная часть VEGFR содержит Ig-подобный домен D2 VEGFR (например, VEGFR1). В некоторых вариантах осуществления внеклеточная часть VEGFR содержит Ig-подобные домены D1-D3 VEGFR (например, VEGFR1). В некоторых вариантах осуществления доменом, способный к мультимеризации, содержит Fc-область антитела IgG1.
В некоторых вариантах осуществления слитый белок содержит аминокислотную последовательность SEQ ID NO: 12. В других вариантах осуществления слитый белок содержит аминокислотную последовательность SEQ ID NO: 13. В еще одних вариантах осуществления слитый белок содержит аминокислотную последовательность SEQ ID NO: 14. В еще одних вариантах осуществления слитый белок содержит аминокислотную последовательность SEQ ID NO: 15.
В данном документе также рассматриваются слитые белки, содержащие по меньшей мере две или более внеклеточных частей PDGFR, две или более внеклеточных частей VEGFR и/или два или более доменов, способных к мультимеризации. Например, слитый белок может содержать (a) внеклеточную часть PDGFR, (b) внеклеточную часть VEGFR и (c) Fc-область, упорядоченную от N-конца к C-концу в порядке a, a, b, c или в порядке a, b, b, c. В данном документе представлена любая комбинация по меньшей мере одной внеклеточной части PDGFR, по меньшей мере одной внеклеточной части VEGFR и по меньшей мере одного домена, способного к мультимеризации, как если бы каждая комбинация была в явной форме описана в данном документе.
В данном документе также рассматриваются слитые белки, содержащие внеклеточную часть PDGFR и домен, способный к мультимеризации. В некоторых вариантах осуществления слитый белок содержит (a) внеклеточную часть PDGFR и (b) Fc-область, упорядоченную от N-конца к C-концу в порядке a и b. В некоторых вариантах осуществления слитый белок содержит (a) внеклеточную часть PDGFR и (b) Fc-область, упорядоченную от N-конца к C-концу в порядке b и a. В некоторых вариантах осуществления внеклеточная часть PDGFR содержит Ig-подобные домены D1-D2 PDGFR (например, PDGFR-β). В некоторых вариантах осуществления внеклеточная часть PDGFR содержит Ig-подобные домены D1-D3 PDGFR (например, PDGFR-β). В некоторых вариантах осуществления внеклеточная часть PDGFR содержит Ig-подобные домены D1-D4 PDGFR (например, PDGFR-β). В некоторых вариантах осуществления внеклеточная часть PDGFR содержит Ig-подобные домены D1-D5 PDGFR (например, PDGFR-β). В некоторых вариантах осуществления доменом, способный к мультимеризации, содержит Fc-область антитела IgG1. В данном документе представлена любая комбинация по меньшей мере одной внеклеточной части PDGFR и по меньшей мере одного домена, способного к мультимеризации, как если бы каждая комбинация была в явной форме описана в данном документе.
В некоторых вариантах осуществления слитый белок содержит аминокислотную последовательность SEQ ID NO: 9. В некоторых вариантах осуществления слитый белок содержит аминокислотную последовательность SEQ ID NO: 10. В некоторых вариантах осуществления слитый белок содержит аминокислотную последовательность SEQ ID NO: 11.
Слитые белки, описанные в настоящем изобретении, могут содержать модифицированные формы внеклеточной части PDGFR, внеклеточной части VEGFR и/или домена, способного к мультимеризации. Например, компоненты слитого белка могут иметь посттрансляционные модификации, в том числе, например, гликозилирование, сиалирование, ацетилирование и фосфорилирование.
В некоторых вариантах осуществления в данном документе представлены варианты аминокислотной последовательности слитых белков. Например, может быть необходимым улучшение аффинности связывания и/или других биологических свойств внеклеточной части PDGFR, внеклеточной части VEGFR и/или домена, способного к мультимеризации. Варианты аминокислотной последовательности слитого белка можно получать с помощью введения соответствующих модификаций в нуклеотидную последовательность, кодирующую внеклеточную часть PDGFR, внеклеточную часть VEGFR и/или домен, способный к мультимеризации или с помощью введения посредством пептидного синтеза. Такие модификации включают, например, делеции от остатков в аминокислотной последовательности внеклеточной части PDGFR, внеклеточной части VEGFR, и/или домена, способного к мультимеризации, вставки в остатки в аминокислотной последовательности внеклеточной части PDGFR, внеклеточной части VEGFR, и/или домен, способный к мультимеризации, и/или замены в остатках в аминокислотной последовательности внеклеточной части PDGFR, внеклеточной части VEGFR, и/или домена, способного к мультимеризации. Для получения окончательной конструкции можно выполнить любую комбинацию из делеции, вставки и замены, при условии, что окончательная конструкция обладает необходимыми характеристиками (например, связыванием с PDGF, связыванием с VEGF, ингибированием активации пути PDGF, образованием мультимеров и/или ингибированием активации пути VEGF). В некоторых вариантах осуществления слитый белок содержит последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% идентичную аминокислотной последовательности слитого белка, содержащего любую внеклеточную часть PDGFR, внеклеточную часть VEGFR и/или домен, способный к мультимеризации, как раскрыто в данном документе. В некоторых вариантах осуществления вариант слитого белка содержит последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 12-15. В некоторых вариантах осуществления вариант слитого белка содержит последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 9-11.
Замены остатков аминокислот, раскрытые в данном документе, также включают консервативные замены. Консервативные замены представлены в таблице 1 ниже под заголовком "консервативные замены". Если такие замены приводят к изменению биологической активности, то более значительные изменения, обозначенные в таблице 1 как "иллюстративные замены", или как дополнительно описано ниже в ссылке к классам аминокислот, могут быть введены, и продукты подвергнуты скринингу. Аминокислотные замены, как представлено в таблице 1 или как описано ниже в ссылке к классам аминокислот, могут быть введены в любой из слитых белков или компонентов белка (например, внеклеточную часть PDGFR, внеклеточную часть VEGFR, домен, способный к мультимеризации и т. п.), представленных в данном документе.
Существенные модификации биологических свойств белков или полипептидов выполняют с помощью выбора замен, которые отличаются значительно по своему влиянию на сохранение (a) структуры полипептидного остова в области замены, например, в составе складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в целевом сайте, или (c) значительной части боковой цепи. Аминокислоты можно сгруппировать в соответствии с общими свойствами боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe;
(7) большие гидрофобные: норлейцин, Met, Val, Leu, Ile.
Неконсервативные замены влекут за собой обмен члена одного из этих классов на другой класс.
Пригодный способ для идентификации некоторых остатков или областей слитого белка, которые являются предпочтительными локализациями для мутагенеза, называется "аланин-сканирующий мутагенез", как описано Cunningham and Wells в Science, 1989, 244:1081-1085. В данном случае идентифицируют остаток или группу целевых остатков (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно аланином или полиаланином) с целью воздействия на взаимодействие аминокислот с целевым связывающим партнером. Такие локализации аминокислот, демонстрирующие функциональную чувствительность к заменам, затем очищают с помощью введения дополнительных или других вариантов в сайты замены или вместо сайтов замены. Таким образом, в то время как сайт для введения вариации аминокислотной последовательности является предопределенным, природу мутации per se предопределять не нужно. Например, для анализа характеристики мутации в определенном сайте, аланин-сканирование или случайный мутагенез проводят в целевом кодоне или области, и экспрессируемые варианты слитых белков подвергают скринингу на необходимую активность.
Любой остаток цистеина, не включенный в сохранение надлежащей конформации слитых белков или компонентов белка (например, внеклеточной части PDGFR, внеклеточной части VEGFR, домена, способного к мультимеризации и др.), также может быть замещен, как правило, серином, для улучшения окислительной стабильности молекулы и предотвращения аберрантного поперечного сшивания. Наоборот, цистеиновая(цистеиновые) связь(связи) может(могут) быть добавлена(добавлены) к слитому белку или компонентам белка (например, внеклеточной части PDGFR, внеклеточной части VEGFR, домену, способному к мультимеризации и др.) для улучшения его стабильности.
В дополнительных вариантах осуществления белки или пептиды настоящего изобретения могут содержать одну или несколько неприродных или модифицированных аминокислот. "Неприродный аминокислотный остаток" относится к остатку, отличному от тех природных аминокислотных остатков, указанных выше, который способен ковалентно связываться с расположенным(расположенными) рядом аминокислотным(аминокислотными) остатком(остатками) в полипептидной цепи. Неприродные аминокислоты включают без ограничений гомолизин, гомоаргинин, гомосерин, азетидинкарбоновую кислоту, 2-аминоадипиновую кислоту, 3-аминоадипиновую кислоту, бета-аланин, аминопропионовую кислоту, 2-аминомасляную кислоту, 4-аминомасляную кислоту, 6-аминокапроновую кислоту, 2-аминогептановую кислоту, 2-аминоизомасляную кислоту, 3-аминоизомасляную кислоту, 2-аминопимелиновую кислоту, третичный бутилглицин, 2,4-диаминоизомасляную кислоту, десмозин, 2,2'-диаминопимелиновую кислоту, 2,3-диаминопропионовую кислоту, N-этилглицин, N-этиласпарагин, гомопролин, гидроксилизин, алло-гидроксилизин, 3-гидроксипролин, 4-гидроксипролин, изодесмозин, алло-изолейцин, N-метилаланин, N-метилглицин, N-метилизолейцин, N-метилпентилглицин, N-метилвалин, нафталанин, норвалин, норлейцин, орнитин, цитруллин, пентилглицин, пипеколиновую кислоту и тиопролин. Модифицированные аминокислоты включают природные и неприродные аминокислоты, которые химически блокированы, обратимо или необратимо, или модифицированы на своей N-концевой аминогруппе или своих группах боковых цепей, как, например, N-метилированные D- и L-аминокислоты, функциональные группы боковых цепей, которые химически модифицированы в другую функциональную группу. Например, модифицированные аминокислоты включают метионинсульфоксид; метионинсульфон; аспарагиновую кислоту- (сложный бета-метил эфир), модифицированную аминокислоту аспарагиновой кислоты; N-этилглицин, модифицированную аминокислоту глицина; или аланинкарбоксамид и модифицированную аминокислоту аланина. Дополнительные неприродные и модифицированные аминокислоты и способы включения их в белки и пептиды известны в данной области техники (см., например, Sandberg et al., (1998) J. Med. Chem. 41: 2481-91; Xie and Schultz (2005) Curr. Opin. Chem. Biol. 9: 548-554; Hodgson and Sanderson (2004) Chem. Soc. Rev. 33: 422-430.
Вставки последовательностей аминокислот включают амино- ("N") и/или карбокси- ("C") концевые слияния, варьирующие по длине от одного остатка до сотни или более остатков, а также вставки между последовательностями одного или нескольких аминокислотных остатков. Примеры концевых вставок включают слитый белок с N-концевым метионильным остатком или слитый белок, слитый с цитотоксическим полипептидом. Другие варианты вставок молекулы слитого белка включают слияние с N- или C-концом слитого белка полипептида, который обеспечивает образование белковых мультимеров.
В настоящем изобретении представляют сигнальный пептид, также обозначаемый в данном документе как сигнальная последовательность, который может быть компонентом любого слитого белка, представленного в данном документе. Например, слитый белок, содержащий внеклеточную часть PDGFR, внеклеточную часть VEGFR и домен, способный к мультимеризации, может дополнительно содержать гетерологичный пептид, предпочтительно сигнальную последовательность или другой пептид, имеющий специфический сайт отщепления на N-конце зрелого слитого белка. Выбранная гетерологичная сигнальная последовательность предпочтительно является последовательностью, которая распознается и обрабатывается (например, отщепляется сигнальной пептидазой) эукариотическими клетками-хозяевами. Для прокариотических клеток-хозяев, которые не распознают и не обрабатывают нативные сигнальные последовательности млекопитающих, эукариотическая сигнальная последовательность (т.е. млекопитающих) замещена прокариотической сигнальной последовательностью выбранной, например, из группы, состоящей из лидерных последовательностей от генов щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II. Для дрожжевой секреции нативная сигнальная последовательность может быть замещена, например, лидерной последовательностью инвертазы дрожжей, лидерной последовательностью факторов (в том числе, лидерными последовательностями факторов Saccharomyces и Kluyveromyces) или лидерной последовательностью кислой фосфатазы, лидерной последовательностью глюкоамилазы C. albicans или сигнальной последовательностью, описанной в WO 90/13646. В экспрессии клеток млекопитающих доступны сигнальные последовательности млекопитающих, а также секреторные лидерные последовательности вирусов, например, сигнальная последовательность вируса простого герпеса gD. Сигнальный пептид может быть полностью отщеплен от слитого белка, поскольку его получают из клеток-хозяев, или может быть частично отщеплен. Смешанную совокупность слитых белков можно получить из клетки-хозяина, где слитые белки содержат полностью отщепленную сигнальную последовательность (например, без сигнальной последовательности), частично отщепленную сигнальную последовательность (например, часть сигнальной последовательности) и/или неотщепленную сигнальную последовательность (например, полную сигнальную последовательность). Например, слитый белок, дополнительно содержащий сигнальный пептид на N-конце, может быть подвержен отщеплению на N-конце с помощью одного из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или 22 аминокислотных остатков. В некоторых вариантах осуществления любой слитый белок, описанный в данном документе, содержит сигнальный пептид для секреции белков из клетки. В некоторых вариантах осуществления любой слитый белок, описанный в данном документе, не содержит сигнальный пептид для секреции белков из клетки.
В настоящем изобретении представляют димерный слитый белок, содержащий два слитых белка, где каждый слитый белок содержит любой слитый белок, раскрытый в данном документе. В одном варианте осуществления димерный слитый белок содержит два идентичных слитых белка. В другом варианте осуществления димерный слитый белок содержит два различных слитых белка. Слитый белок, раскрытый в данном документе, может образовывать мультимеры из двух или более слитых белков. Мультимеры (например, димеры, тримеры, тетрамеры и др.) могут образовываться из двух идентичных слитых белков (например, гомомультимер) или образовываться из гетерологичных слитых белков (например, гетеромультимер). В другом варианте осуществления мультимерный слитый белок содержит по меньшей мере один слитый белок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO :12-15, или аминокислотную последовательность, идентичную по меньшей мере на 90% аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO :12-15. В другом варианте осуществления мультимерный слитый белок содержит по меньшей мере один слитый белок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9-11, или аминокислотную последовательность, идентичную по меньшей мере на 90% аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 9-11. В варианте осуществления слитый белок извлекают в виде слитого мультимера белка из клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую упомянутый слитый белок. В некоторых вариантах осуществления слитые белки являются гликозилированными. Например, слитый белок может быть гликозилирован после извлечения из клетки-хозяина во внеклеточной части PDGFR, внеклеточной части VEGFR и/или домене, способном к мультимеризации.
В данном документе также представлены фармацевтические композиции, содержащие слитый белок настоящего изобретения и фармацевтически приемлемый носитель. Фармацевтические композиции могут быть пригодными для множества способов введения в данном документе, в том числе, например, системного или локального введения. Фармацевтические композиции могут находиться в форме глазных капель, инъецируемых растворов или в форме, пригодной для ингаляции (через рот или нос), или перорального введения. В некоторых вариантах осуществления фармацевтические композиции, содержащие слитый белок, описанный в данном документе, и фармацевтически приемлемый носитель, пригодны для введения человеку. В некоторых вариантах осуществления фармацевтические композиции, содержащие слитый белок, описанный в данном документе, и фармацевтически приемлемый носитель, пригодны для интравитреальной инъекции или местного применения по отношению к глазу. Такими фармацевтически приемлемыми носителями могут быть стерильные жидкости, такие как вода и масло, в том числе, таковые нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло и т.п. В качестве жидких носителей, в частности, для инъекционных растворов, также могут использоваться физиологические растворы и водные растворы декстрозы, полиэтиленгликоля (PEG) и глицерина. Фармацевтическая композиция может дополнительно содержать дополнительные ингредиенты, например, консерванты, буферы, вещества, регулирующие тоничность, антиоксиданты и стабилизаторы, неионные увлажняющие и осветляющие средства, загустители и т. п. Фармацевтические композиции, описанные в данном документе, могут быть упакованы в единичные дозированные формы или множественные дозированные формы. Композиции, как правило, составляют в виде стерильного или практически изотонического раствора. Композиции также можно составлять для получения осмотических величин, которые сопоставимы с водянистой влагой глаза и тканями глаза. Такие осмотические величины, будут, как правило, находиться в диапазоне от приблизительно 200 до приблизительно 400 миллиосмолей на килограмм воды ("мОсм/кг"), однако, будут предпочтительно составлять приблизительно 300 мОсм/кг. Сетчатка, как считается, имеет осмотическую величину ~283 мОсм/кг.
IV. Нуклеиновые кислоты, векторы и клетки-хозяева
Нуклеиновые кислоты
В данном документе представлены выделенные нуклеиновые кислоты, кодирующие любой из компонентов слитых белков, раскрытых в данном документе, таких как внеклеточная часть PDGFR и внеклеточная часть VEGFR, и домен, способный к мультимеризации. Нуклеиновые кислоты, кодирующие PDGFR млекопитающих, были описаны для обоих типов рецепторов, PDGFR-α и PDGFR-β. Иллюстративные последовательности нуклеиновых кислот можно найти без ограничений в Yarden et al., Nature, 1986, 323:226-232; Matsui et al., Science, 1989, 243: 800-803; заявка на патент США, серийный номер 07/771829, которая является продолжением заявки на патент США, серийный номер 07/309332, в настоящее время оставленной без движения, патент США № 5686572 и WO 2006/113277. мРНК, кодирующую PDGFR-α и PDGFR-β человека, можно найти в Genbank, номера доступа NM_006206.4 и NM_002609.3, соответственно. В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует внеклеточную часть PDGFR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-3. В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует внеклеточную часть PDGFR, содержащую аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-3. В некоторых вариантах осуществления выделенная нуклеиновая кислота, кодирующая внеклеточную часть PDGFR, выбрана из группы, состоящей из SEQ ID NO: 16 и 17. Также в данном документе представлены выделенные нуклеиновые кислоты, кодирующие внеклеточную часть VEGFR. Нуклеиновые кислоты, кодирующие VEGFR млекопитающих, были описаны для всех типов рецепторов. Иллюстративные последовательности нуклеиновых кислот можно найти в без ограничений патенте США № 7928072 и WO 2006/113277. мРНК, кодирующую VEGFR1 и VEGFR2 человека, можно найти в Genbank под номерами доступа NM_001159920.1 и NM_002253.2, соответственно. мРНК, кодирующую VEGFR3 человека можно найти в Genbank под номерами доступа NM_002020.7 и NM_182925.4. В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует внеклеточную часть VEGFR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4 и 5. В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует внеклеточную часть VEGFR, содержащую аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 4 и 5. Также в данном документе представлены выделенные нуклеиновые кислоты, кодирующие домен, способный к мультимеризации (например, Fc-участок). В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует домен, способный к мультимеризации, содержащий аминокислотную последовательность SEQ ID NO: 6. В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует домен, способный к мультимеризации, содержащий аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 6.
Также в данном документе представлены выделенные нуклеиновые кислоты, кодирующие слитый белок, как раскрыто в данном документе. В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует слитый белок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 12-15. В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует слитый белок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9-11. В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует слитый белок, содержащий аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 12-15. В некоторых вариантах осуществления выделенная нуклеиновая кислота кодирует слитый белок, содержащий аминокислотную последовательность по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньше мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 9-11. В некоторых вариантах осуществления выделенная нуклеиновая кислота, кодирующая слитый белок, содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 21-24. В некоторых вариантах осуществления выделенная нуклеиновая кислота, кодирующая слитый белок, содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 18-20.
Последовательность выделенной нуклеиновой кислоты, кодирующая слитый белок или компонент слитого белка (например, внеклеточную часть PDGFR, внеклеточную часть VEGFR или домен, способный к мультимеризации), может дополнительно включать последовательность нуклеиновой кислоты, кодирующую линкер. В некоторых вариантах осуществления нуклеиновая кислота кодирует линкер, выбранный из группы, состоящей из Gly9 (SEQ ID NO: 47), Glu9 (SEQ ID NO: 48), Ser9 (SEQ ID NO: 49), Gly5-Cys-Pro2-Cys (SEQ ID NO: 50), (Gly4-Ser)3 (SEQ ID NO: 51), Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO: 52), Pro-Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO: 53), Gly-Asp-Leu-Ile-Tyr-Arg-Asn-Gln-Lys (SEQ ID NO: 54) и Gly9-Pro-Ser-Cys-Val-Pro-Leu-Met-Arg-Cys-Gly-Gly-Cys-Cys-Asn (SEQ ID NO: 55).
Выделенные нуклеиновые кислоты могут дополнительно включать последовательность, кодирующую сигнальный пептид, который выполняет функции сигнальной последовательности для секреции слитого белка из клеток-хозяев. В некоторых вариантах осуществления выделенная нуклеиновая кислота не содержит последовательность, кодирующую сигнальный пептид.
Выделенные молекулы нуклеиновых кислот, кодирующие слитый белок или компонент слитого белка (например, внеклеточную часть PDGFR, внеклеточную часть VEGFR или домен, способный к мультимеризации), могут находиться в форме РНК, таких как мРНК, hnRNA, тРНК или любой другой форме, или в форме ДНК, в том числе без ограничений кДНК и геномной ДНК, полученных с помощью клонирования или полученных синтетически, или любых их комбинаций. ДНК может быть трехцепочечной, двухцепочечной или одноцепочечной или любой их комбинацией. Любая часть по меньшей мере одной цепи ДНК или РНК может быть кодирующей цепью, также известной как смысловая цепь, или она может быть некодирующей цепью, также обозначаемой как антисмысловая цепь. Выделенные нуклеиновые кислоты можно получить из биологических источников с помощью способов клонирования, известных специалистам в данной области техники. Выделенные нуклеиновые кислоты также можно получить путем прямого химического синтеза с помощью известных способов. Нуклеиновые кислоты, кодирующие слитый белок или компонент слитого белка (например, внеклеточную часть PDGFR, внеклеточную часть VEGFR или домен, способный к мультимеризации), можно получить с помощью множества способов известных в данной области техники, в том числе без ограничений выделение из природного источника или получение с помощью олигонуклеотид-опосредованного мутагенеза, сайт-направленного мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза ранее полученной вариантной или невариантной версии слитого белка или компонента слитого белка. См. Molecular Cloning: A Laboratory Manual (Sambrook et al., 4th ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2012) и Current Protocols in Molecular Biology (F.M. Ausubel, et al. eds., 2003).
Векторы
Настоящее изобретение рассматривает применение средства для доставки нуклеиновой кислоты для введения одной или нескольких последовательностей нуклеиновых кислот, кодирующих слитый белок или компонент слитого белка, в клетку для экспрессии упомянутого белка. Примерами средств для доставки нуклеиновой кислоты являются липосомы, биосовместимые полимеры, в том числе, природные полимеры и синтетические полимеры; липопротеины; полипептиды; полисахариды; липополисахариды; искусственные оболочки вирусов; частицы металлов; и бактерии, вирусы, такие как бакуловирус, аденовирус и ретровирус, бактериофаг, космида, плазмида, векторы грибов и другие рекомбинантные средства, обычно используемые в данной области техники, которые были описаны для экспрессии в множестве эукариотических и прокариотических хозяев. В некоторых вариантах осуществления средством для доставки нуклеиновой кислоты является вектор экспрессии, такой как плазмида. Вектор может включать любой элемент для создания стандартного функционального элемента вектора экспрессии, например, промотор, элемент связывания рибосомы, терминатор, энхансер, селективный маркер и точку начала репликации. Промотор может конститутивным, индуцибельным или репрессируемым промотором. Иллюстративные промоторы включают без ограничений немедленно-ранний промотор цитомегаловируса (CMV), RSV LTR, MoMLV LTR, промотор фосфоглицераткиназы-1 (PGK), промотор вируса обезьян 40 (SV40) и промотор CK6, промотор транстиретина (TTR), промотор TK, промотор, восприимчивый к тетрациклину (TRE), промотор HBV, промотор hAAT, промотор LSP, химерные специфические для печени промоторы (LSP), промотор E2F, промотор теломеразы (hTERT); промотор энхансера цитомегаловируса/бета-актина цыпленка/β-глобина кролика (CAG-промотор; Niwa et al., Gene, 1991, 108(2):193-9) и промотор фактора элонгации 1-альфа (EFl-альфа) (Kim et al., Gene, 1990, 91(2):217-23 и Guo et al., Gene Ther., 1996, 3(9):802-10). Множество векторов экспрессии, способных к доставке нуклеиновых кислот в клетку (например, бактериальную клетку, клетку дрожжей, растительную клетку или клетку млекопитающих), известны в данной области техники и могут использоваться в данном документе для получения слитого белка или компонента слитого белка в клетке. Например, E. coli можно использовать для получения слитого белка при трансформации с плазмидой, такой как pBR322 (Mandel et al., J. Mol. Biol., 1970, 53:154), разработанной для включения нуклеиновой кислоты, кодирующей слитый белок. Экспрессируемые слитые белки или компоненты слитых белков можно собрать из клеток и очистить в соответствии со стандартными методиками, известными в данной области техники и описанными в данном документе.
Клетки-хозяева
В данном документе представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую слитый белок, описанный в данном документе. Нуклеиновые кислоты, кодирующие слитые белки или компоненты слитых белков (например, внеклеточную часть PDGFR, внеклеточную часть VEGFR и/или домен, способный к мультимеризации) могут быть доставлены в целевую клетку с помощью любых способов, известных данной области техники. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая белок, представляющий интерес (например, слитый белок), находится в вирусном векторе и вектор был упакован, затем вирионы можно использовать для инфицирования клеток. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая белок, представляющий интерес (например, слитый белок), находится в векторе экспрессии, таком как плазмида. Процедуры трансфекции или трансформации, которые являются соответствующими для определенных клеток, можно использовать для введения нуклеиновой кислоты, кодирующей белок, представляющий интерес (например, слитый белок), в целевую клетку. Составы, использующие полимеры, липосомы или наносферы, можно использовать для доставки нуклеиновых кислот, кодирующих белок, представляющий интерес (например, слитый белок). Клетки, которые могут быть трансформированы или трансфицированы рекомбинантными конструкциями в соответствии с настоящим изобретением, могут быть любыми, которые подходят специалисту в данной области техники. Иллюстративные типы клеток, которые можно использовать, включают клетки бактерий, дрожжей, грибов, насекомых, растений и млекопитающих. Иллюстративные клетки млекопитающих, которые можно использовать, включают без ограничений фибробласты, гепатоциты, эндотелиальные клетки, стволовые клетки, гемопоэтические клетки, эпителиальные клетки, миоциты, нейрональные клетки и кератиноциты. Дополнительные иллюстративные клеточные линии млекопитающих, которые можно использовать, включают без ограничений клетки COS, клетки VERO, клетки HeLa, клетки яичников китайского хомячка (CHO), клетки 293, клетки NSO, клетки SP20, фибробласты 3T3, клетки W138, клетки BHK, клетки HEPG2, клетки DUX и клетки MDCK. Эти клетки можно использовать для получения и сбора белка, представляющего интерес. В некоторых вариантах осуществления траснформированные или трансфицированные клетки могут быть доставлены в клетку или млекопитающего-хозяина. Пригодные клетки для доставки в клетку или млекопитающего-хозяина включают любой тип клеток млекопитающих из любого органа, опухоли или клеточной линии. Например, можно использовать клетки человека, мыши, козы, овцы, быка, собаки, кошки и свиньи. В некоторых вариантах осуществления клеткой-хозяином является бактериальная клетка. В дополнительных вариантах осуществления клеткой-хозяином является клетка E. coli.
Выражение "клетка-хозяин" включает клетку, которая была или может быть реципиентом для вектора(векторов) настоящего изобретения и его(их) потомства. Потомство может необязательно быть полностью идентичным (по морфологии или по геному всего комплемента ДНК) исходной родительской клетке вследствие природной, случайной или намеренной мутации. Клетками-хозяевами являются предпочтительно эукариотические клетки, предпочтительно клетки млекопитающих, наиболее предпочтительно клетки человека. В некоторых вариантах осуществления клеткой-хозяином является бактериальная клетка. В дополнительных вариантах осуществления клеткой-хозяином является клетка E. coli.
V. Способы получения слитых белков и компонентов слитых белков
В данном документе представлены способы получения слитых белков или компонентов слитых белков (например, внеклеточной части PDGFR, внеклеточной части VEGFR и домена, способного к мультимеризации) настоящего изобретения, как раскрыто в данном документе. В некоторых аспектах представлен способ получения любого слитого белка, как раскрыто в данном документе, включающий культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую любой из слитых белков, раскрытых в данном документе, при условии, которое продуцирует слитый белок, и извлечение слитого белка, продуцируемого клеткой-хозяином. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая слитый белок, выбрана из группы, состоящей из SEQ ID NO: 18-24.
(1) Культивирование клеток-хозяев
Клетки, используемые для получения слитых белков или компонентов слитых белков (например, внеклеточной части PDGFR, внеклеточной части VEGFR и/или домена, способного к мультимеризации) настоящего изобретения, выращивают в средах, известных в данной области техники и пригодных для культивирования выбранных клеток-хозяев. Примеры пригодных сред включают FlO Ham (Sigma), минимальную питательную среду (MEM, Sigma), RPMI 1640 (Sigma), модифицированную по Дульбекко среду Игла (DMEM, Sigma) и бульон Лурия (LB). Кроме того, в качестве культур для клеток можно использовать любые среды, описанные в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem.102:255 (1980), патентах США №№ 4767704; 4657866; 4927762; 4560655 или 5122469; публикациях WIPO №№ WO 90/03430; WO 87/00195; или патенте США со ссылкой 30985. Определенную среду, как правило, дополняют, при необходимости, гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), DHFR, солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как HEPES), нуклеозидами (такими как аденозин и тимидин), антибиотиками, микроэлементами и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки можно также включать в соответствующих концентрациях, которые были бы известны специалистам в данной области техники. Условия культивирования, такие как температура, pH и т.п., являются таковыми, ранее используемыми с клеткой, выбранной для экспрессии, и будут очевидны для специалиста в данной области техники. Для роста E. coli, например, предпочтительная температура варьирует от приблизительно 20°C до приблизительно 39°C, более предпочтительно от приблизительно 25°C до приблизительно 37°C, еще более предпочтительно приблизительно 30°C. pH среды может быть любым pH, варьирующим от приблизительно 5 до приблизительно 9, в зависимости главным образом от организма хозяина. Для E. coli pH составляет предпочтительно от приблизительно 6,8 до приблизительно 7,4, и более предпочтительно приблизительно 7,0. Если в векторе экспрессии используется индуцибельный промотор, то экспрессия белка индуцируется при условиях, пригодных для активации промотора. Например, если для контроля транскрипции используется промотор PhoA, то трансформированные клетки-хозяева для индукции можно культивировать в фосфат-ограничивающей среде. Можно использовать множество других индукторов в соответствии с используемой конструкцией вектора, как известно в данной области техники.
(2) Очистка слитых белков и компонентов слитых белков
При использовании рекомбинантных методик слитые белки или компоненты слитых белков (например, внеклеточную часть PDGFR, внеклеточную часть VEGFR и/или домен, способный к мультимеризации), описанные в данном документе, можно получать внутриклеточно, в периплазматическом пространстве или секретируемыми непосредственно в среду. Если полипептиды продуцируются внутриклеточно, в качестве первой стадии извлечение белка обычно включает разрушение клетки, как правило, с помощью таких способов, как осмотический шок, разрушение ультразвуком или лизис. Сразу после разрушения клеток твердые остатки от клеток-хозяев или лизированных фрагментов удаляют, например, с помощью центрифугирования или ультрафильтрации. Если полипепитды секретируются в среду, супернатанты от таких систем экспрессии, как правило, сначала фильтруют и концентрируют с помощью коммерчески доступного фильтра для концентрирования белка, например, ультрафильтрационного блока Amicon или Millipore Pellicon. Для ингибирования протеолиза в любую из упомянутых выше стадий можно включать ингибитор протеазы, такой как PMSF, и для предотвращения роста случайных контаминантов можно включать антибиотики.
Композиции слитых белков или компоненты слитых белков (например, внеклеточную часть PDGFR, внеклеточную часть VEGFR и/или домен, способный к мультимеризации), полученные из таких клеток, можно очищать с помощью, например, гидроксилапатитной хроматографии, гель-электрофореза, диализа и аффинной хроматографии. В некоторых вариантах осуществления белок A или белок G применяется в качестве аффинного лиганда для использования в аффинной хроматографии. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа Fc-области любого иммуноглобулина, который присутствует в слитых белках (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983). В некоторых вариантах осуществления белок A используется в качестве аффинного лиганда для выделения и очистки слитых белков или компонентов слитых белков (например, внеклеточной части PDGFR, внеклеточной части VEGFR и/или домена, способного к мультимеризации), как описано в данном документе. В некоторых вариантах осуществления белок G используется в качестве аффинного лиганда для выделения и очистки слитых белков или компонентов слитых белков (например, внеклеточной части PDGFR, внеклеточной части VEGFR и/или домена, способного к мультимеризации), как описано в данном документе. Матрицей, к которой прикрепляется лиганд, наиболее часто является агароза, однако, доступны другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемыми размерами пор или поли(стирол-дивинил)бензол, способствуют более быстрым скоростям потока и более короткому времени обработки по сравнению с теми, которых можно достичь с помощью агарозы. Также доступны другие методики для очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, HPLC с обращенной фазой, хроматография на силикагеле, с помощью гепарина, SEPHAROSE™ или анион- или катион-обменных смол (таких как колонка из полиаспарагиновой кислоты), а также хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония, в зависимости от слитых белков или компонентов слитых белков (например, внеклеточной части PDGFR, внеклеточной части VEGFR и/или домена, способного к мультимеризации), который подлежит извлечению. В некоторых вариантах осуществления извлеченный слитый белок является практически чистым. В дополнительном варианте осуществления извлеченный слитый белок является по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% чистым. После любой предварительной стадии или стадий очистки смесь, содержащая слитые белки или компоненты слитых белков (например, внеклеточную часть PDGFR, внеклеточную часть VEGFR и/или домен, способный к мультимеризации), представляющие интерес, и контаминанты, может быть подвергнута хроматографии гидрофобного взаимодействия при низком pH с использованием элюирующего буфера при pH в диапазоне приблизительно 2,5-4,5, предпочтительно выполненной при низких концентрациях солей (например, от приблизительно 0-0,25 M соли).
Как правило, различные способы получения слитых белков или компонентов слитых белков (например, внеклеточной части PDGFR, внеклеточной части VEGFR и/или домена, способного к мультимеризации) для использования в исследовании, тестировании или клиническом применении, являются общепринятыми в данной области техники, согласуются с описанными выше способами и/или считаются целесообразными специалистом в данной области техники для определенных слитых белков или компонентов слитых белков, представляющих интерес.
(3) Биологические активности слитых белков и компонентов слитых белков
Белки можно очистить и идентифицировать с помощью общеизвестных способов, таких как фракционирование на иммуноаффинных или ионообменных колонках; осаждение этанолом; HPLC с обращенной фазой; хроматография на силикагеле или катион-обменной смоле, такой как DEAE; хроматофокусирование; SDS-PAGE; осаждение сульфатом аммония; гель-фильтрация с помощью, например, Sephadex G-75; определение аффинности лигандов с помощью гидрофобных аффинных смол с использованием пригодного связывающего партнера, иммобилизованного на матрице, центрифугирование, ELISA, BIACore, вестерн-блоттинг, секвенирование аминокислот и нуклеиновых кислот и определение биологической активности.
Слитые белки или компоненты слитых белков, раскрытые в данном документе, можно охарактеризовать или оценить в отношении биологических активностей, в том числе без исключений аффинности к целевому связывающему партнеру (например, белку семейства PDGF и/или VEGF), конкурентного связывания (например, блокирования целевого связывающего партнера по отношению к PDGFR или VEGFR), ингибиторной активности (например, ингибирования активации пути PDGF или VEGF), ингибирования пролиферации клеток, ингибирования опухолевого роста и ингибирования ангиогенеза (например, хориоидальной неоваскуляризации). В некоторых вариантах осуществления слитые белки или компоненты слитых белков, раскрытые в данном документе, могут определяться в отношении биологической активности in vivo или in vitro. В любом из анализов, описанных в данном документе, анализ выполняется при температуре 4°C, 20-28°C (например, 25°C) или 37°C.
Слитые белки или компоненты слитых белков, раскрытые в данном документе, можно определять в отношении аффинности к связывающему партнеру, такому как белку семейства PDGF (например, PDGF-A, PDGF-B, PDGF-C или PDGF-D), димеру белка семейства PDGF (например, PDGF-AA, PDGF-AB, PDGF-BB, PDGF-CC или PDGF-DD) или белку семейства VEGF (например, VEGF-A, VEGF-B, VEGF-C, VEGF-D или PlGF). Многие способы определения аффинности связывания известны в данной области техники и могут быть использованы для идентификации аффинностей связывания слитых белков или компонентов слитых белков по отношению к связывающему партнеру. Аффинности связывания могут быть выражены в виде значений константы диссоциации (Kd) или значений половины максимальной эффективной концентрации (EC50). Методики для определения аффинностей связывания (например, значений Kd) хорошо известны в данной области техники, такие как иммуноферментный твердофазный анализ (ELISA) и BIAcore. См. Harlow and Lane, Antibodies: A Laboratory Manual, CSH Publications, NY (1988); Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, (2009); Altschuh et al., Biochem., 31:6298 (1992); и способ BIAcore, раскрытый Pharmacia Biosensor, все из которых включены в данный документ с помощью ссылки. Например, аффинности связывания слитых белков по отношению к связывающему партнеру можно определить с помощью ELISA. В некоторых вариантах осуществления связывание слитых белков с PDGF-BB определяют с помощью ELISA. В этом иллюстративном анализе секретируемые слитые белки серийно разбавляли, смешивали с лигандом ВВ PDGF человека при 20 пM конечной концентрации и инкубировали на протяжении ночи при комнатной температуре на платформе орбитального встряхивателя. После инкубирования количество несвязанного PDGF-BB определяли с помощью ELISA, специфичного к PDGF человека (Human PDGF-BB DuoSet Product № DY220, R&D Systems). Статистическую значимость аффинностей связывания анализируют с помощью Prism 5.0d (GraphPad Software, Inc) и рассчитывали с помощью 2-факторного анализа ANOVA с последующей поправкой Бонферрони. В дополнительном примере связывание слитого белка с белком семейства VEGF определяют с помощью ELISA. В иллюстративном анализе секретируемые слитые белки серийно разбавляют, смешивают с VEGF человека при 20 пM конечной концентрации и инкубируют на протяжении ночи при комнатной температуре на платформе орбитального встряхивателя. Количество несвязанного VEGF затем определяют с помощью ELISA, специфичного к VEGF человека (набор Human VEGF Quantikine ELISA, кат. № DVE00, R&D Systems).
В любом из вариантов осуществления в данном документе слитый белок имеет EC50 ≤1 мкM, ≤100 нM, ≤10 нM, ≤1 нM, ≤0,1 нM, ≤0,01 нM или ≤0,001 нM (например, 10-8 M или меньше, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M) для ингибирования активности (например, ингибирования активности PDGF и/или активности VEGF). В некоторых вариантах осуществления в данном документе слитый белок имеет Kd для связывающего партнера (например, PDGF и/или VEGF) менее приблизительно любого значения из приблизительно 1,0 мM, 500 мкМ, 100 мкМ, 50 мкМ, 25 мкM, 10 мкM, 5 мкM, 1 мкM, 900 нM, 800 нM, 700 нM, 600 нM, 500 нM, 400 нM, 350 нM, 300 нM, 250 нM, 200 нM, 150 нM, 100 нM, 95 нM, 90 нM, 85 нM, 80 нM, 75 нM, 70 нM, 65 нM, 60 нM, 55 нM, 50 нM, 45 нM, 40 нM, 35 нM, 30 нM, 25 нM, 20 нM, 15 нM, 10 нM, 5 нM, 1 нM, 900 пM, 800 пM, 700 пM, 600 пM, 500 пM, 400 пM, 300 пM, 200 пM, 100 пM, 50 пM, 25 пM, 12,5 пM, 6,25 пM, 5 пM, 4 пM или 3 пM, включая, в том числе, любые значения между этими числами. В некоторых вариантах осуществления варианты слитого белка, описанные в данном документе, связываются со связывающим партнером с более высокой аффинностью по сравнению со связыванием слитого белка дикого типа, описанного в данном документе. В некоторых аспектах вариант слитого белка связывается со связывающим партнером по меньшей мере с любой из 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 6000, 7000, 8000, 9000 или 10000 кратной, включая, в том числе любое значение между этими числами, аффинностью по сравнению со связыванием связывающего партнера со слитым белком, содержащим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9-15.
В некоторых вариантах осуществления слитые белки, раскрытые в данном документе, можно определять в отношении антипролиферативных активностей, таких как снижение пролиферации клеток. В данной области техники для слитого белка известны многие способы определения антипролиферативных свойств. В одном иллюстративном анализе можно использовать эндотелиальные клетки пупочной вены человека (HUVEC) для демонстрации ингибирования VEGF-зависимой и/или PDGF-зависимой пролиферации клеток с помощью слитого белка, описанного в данном документе. В этом анализе слитый белок применяют по отношению к HUVEC в присутствии VEGF и/или PDGF и измеряют пролиферацию клеток. Например, HUVEC (HUVEC-Cambrex Bio Science Walkersville, Inc) высевают в 96-луночный планшет при плотности 2000 клеток/лунка в среде 199 (Invitrogen), дополненной 5% фетальной бычьей сывороткой (Invitrogen), и дают отстояться в течение ночи. После инкубирования среду заменяют средой 199 (Invitrogen), дополненной 5% фетальной бычьей сывороткой (Invitrogen), содержащей равный объем (5 мкл) собранной культуры клеток и рекомбинантного лиганда hVEGF-165 отдельно в конечной концентрации 10 нг/мл (R&D Systems кат. № 293-VE), или в комбинации с лигандом PDGF-BB в конечной концентрации 20 нг/мл (R&D Systems кат. № 220-BB) в конечном объеме 100 мкл на лунку. Клетки инкубируют при 37°C в 5% CO2 от трех до четырех дней. Cell Titer 96 AQueous One Solution Reagent (Promega кат. № G3580) добавляют при 20 мкл/лунка и спустя четыре часа снимают поглощение при 490 нм для определения ингибирования пролиферации клеток слитым белком. В некоторых вариантах осуществления для слитого белка определяют антиангиогенные свойства с помощью методик, хорошо известных в данной области техники. В иллюстративном анализе используют животную модель влажной возрастной макулодистрофии для анализа ингибирования неоваскуляризации в глазу слитым белком. В этом анализе глаза нормальной взрослой мыши подвергаются воздействию однократной интравитреальной инъекции слитого белка или частицы rAAV, содержащей нуклеиновую кислоту, кодирующую слитый белок, в левый глаз (OS) на 0 день исследования, в то время как правый глаз (OD) оставляют не подвергнутым лечению. CNV индуцируют в обоих глазах с помощью лазера (например, 3 ожога, размещенные на глаз, мощность 200 мВт, участок 50 мкм, 100 мс) на 28 день исследования. Мышей перфузируют FITC-декстраном и умерщвляют на 42 исследования. Глаза собирают, фиксируют в 10% нейтральном буферном формалине, и после готовят хориоидальные плоские гистологические препараты для исследования степени неоваскуляризации. Число ожогов без CNV в обработанном (OS) глазе сравнивают с контрлатеральным (OD) глазом для определения эффективности слитого белка. См., например, пример 5.
VI. Вирусные частицы и способы получения вирусных частиц
В данном документе также представлены вирусные частицы, содержащие нуклеиновую кислоту, кодирующую слитый белок, описанный в данном документе. Вирусные векторы можно использовать для доставки нуклеиновой кислоты, кодирующей слитый белок или компонент слитого белка, для экспрессии белка в целевой клетке в определенной целевой ткани (например, больной ткани). Известны многие виды вирусов и многие были изучены с точки зрения доставки нуклеиновых кислот к целевым клеткам. Экзогенную нуклеиновую кислоту можно вставить в вектор, такой как аденовирус, аденовирус с частично делетированным геномом, аденовирус с полностью делетированным геномом, аденоассоциированный вирус (AAV), ретровирус, лентивирус и т.п. для доставки в клетку. В некоторых вариантах осуществления клетка находится в индивидууме и вирус доставляют посредством внутривенного, внутримышечного, интрапортального или другого пути введения. Наиболее часто используемые вирусные векторы включают таковые, происходящие из аденовирусов, аденоассоциированных вирусов (AAV) и ретровирусов, в том числе, лентивирусов, таких как вирус иммунодефицита человека (HIV). В отношении иллюстративных вирусных векторов см. патент США № 7928072 и WO 2006/113277, оба из которых включены в данный документ с помощью ссылки во всей своей полноте.
В некоторых вариантах осуществления вирусной частицей является рекомбинантная частица AAV, содержащая нуклеиновую кислоту, содержащую один или два ITR AAV, и последовательность, кодирующую слитый белок, описанный в данном документе, фланкированный одним или двумя ITR. Нуклеиновая кислота капсидирована в частицу AAV. Частица AAV также содержит капсидные белки. В некоторых вариантах осуществления нуклеиновая кислота содержит функционально связанные компоненты в направлении транскрипции, контрольные последовательности, в том числе последовательности инициации и терминации транскрипции, и последовательность(последовательности), кодирующую(кодирующие) белок, представляющий интерес (например, нуклеиновую кислоту, кодирующую слитый белок). Эти компоненты фланкированы на 5' и 3' конце функциональными последовательностями ITR AAV. Под "функциональными последовательностями ITR AAV" подразумевается, что последовательности ITR функционируют в качестве предполагаемых для сохранения, репликации и упаковки вириона AAV. См. Davidson et al., PNAS, 2000, 97(7)3428-32; Passini et al., J. Virol., 2003, 77(12):7034-40; и Pechan et al., Gene Ther., 2009, 16:10-16, все из которых включены в данный документ во всей своей полноте с помощью ссылки. Для практического использования некоторых аспектов настоящего изобретения рекомбинантные векторы содержат по меньшей мере все из последовательностей AAV, необходимые для капсидирования и физических структур для инфицирования rAAV. ITR AAV для использования в векторах настоящего изобретения не требуют наличия нуклеотидной последовательности дикого типа (например, как описано в Kotin, Hum. Gene Ther., 1994, 5:793-801) и могут быть изменены с помощью вставки, делеции или замены нуклеотидов, или ITR AAV могут происходить из любого из нескольких серотипов AAV. В настоящее время известно более 40 серотипов AAV, и продолжают идентифицироваться новые серотипы и варианты существующих серотипов. См. Gao et al., PNAS, 2002, 99(18): 11854-6; Gao et al., PNAS, 2003, 100(10):6081-6; и Bossis et al., J. Virol., 2003, 77(12):6799-810. Использование любого серотипа AAV рассматривается в пределах объема настоящего изобретения. В некоторых вариантах осуществления вектором rAAV является вектор, полученный из серотипа AAV, в том числе без ограничений AAV1, AAV2, AAV3, AAV4, AAV5, AA6, AAV7, AAV8, AAV9, AAVrh.8, AAVrh8R, AAVrh.10, AAV11 или AAV12. В некоторых вариантах осуществления нуклеиновая кислота в AAV содержит ITR AAV1, AAV2, AAV3, AAV4, AAV5, AA6, AAV7, AAV8, AAV9, AAVrh.8, AAVrh8R, AAVrh.10, AAV11 или AAV12. В некоторых вариантах осуществления нуклеиновую кислоту, кодирующую слитый белок, выбранную из группы, состоящей из SEQ ID NO: 12-15, фланкирована по меньшей мере одним ITR AAV. В некоторых вариантах осуществления нуклеиновая кислота выбрана из группы, состоящей из SEQ ID NO: 21-24. В дополнительных вариантах осуществления частица rAAV содержит капсидные белки AAV1, AAV2, AAV3, AAV4, AAV5, AA6, AAV7, AAVrh.8, AAVrh.10, AAV11 или AAV12. В дополнительных вариантах осуществления частица rAAV содержит капсидные белки серотипа AAV из клад A-F (Gao, et al. J. Virol. 2004, 78(12):6381).
Для оптимизации трансдукции определенных целевых клеток или для выявления специфических типов клеток в пределах определенной целевой ткани (например, больной ткани) используются различные серотипы AAV. Частица rAAV может содержать вирусные белки и вирусные нуклеиновые кислоты такого же серотипа или смешанного серотипа. Например, частица rAAV может содержать капсидные белки AAV2 и по меньшей мере один ITR AAV2, или она может содержать капсидные белки AAV2 и по меньшей мере один ITR AAV1. В другом примере частица rAAV может содержать капсидные белки AAV1 и по меньшей мере один ITR AAV2. В еще одном примере частица rAAV может содержать капсидные белки от как AAV1, так и AAV2, и дополнительно содержать по меньшей мере один ITR AAV2. В данном документе представлена любая комбинация серотипов AAV для получения частицы rAAV, как если бы каждая комбинация была в явной форме описана в данном документе.
В некоторых аспектах в настоящем изобретении представляют вирусные частицы, содержащие рекомбинантный самокомплементарный геном. Вирусные частицы AAV с самокомплементарными геномами и способы применения самокомплементарных геномов AAV описаны в патентах США №№ 6596535; 7125717; 7765583; 7785888; 7790154; 7846729; 8093054 и 8361457; и Wang Z., et al., (2003) Gene Ther 10:2105-2111, каждый из которых включен в данный документе с помощью ссылки во всей своей полноте. rAAV, содержащий самокомплементарный геном, будет быстро образовывать двухцепочечную молекулу ДНК благодаря своим частично комплементарным последовательностям (например, комплементарным кодирующим и некодирующим цепям трансгена). В некоторых вариантах осуществления в настоящем изобретении представляют вирусную частицу AAV, содержащую геном AAV, где геном rAAV содержит первую гетерологичную полинуклеотидную последовательность (например, кодирующую цепь слитого белка) и вторую гетерологичную полинуклеотидную последовательность (например, некодирующую или антисмысловую цепь слитого белка), где первая гетерологичная полинуклеотидная последовательность может образовывать внутрицепочечные пары оснований со второй полинуклеотидной последовательностью вдоль большей части или всей ее длины. В некоторых вариантах осуществления первая гетерологичная полинуклеотидная последовательность и вторая гетерологичная полинуклеотидная последовательность связаны с помощью последовательности, которая облегчает внутрицепочечное спаривание оснований; например, шпилечную структуру ДНК. Шпилечные структуры известны в данной области техники, например, в молекулах siRNA. В некоторых вариантах осуществления первая гетерологичная полинуклеотидная последовательность и вторая гетерологичная полинуклеотидная последовательность связаны с помощью мутированного ITR (например, правого ITR). В некоторых вариантах осуществления ITR содержит полинуклеотидную последовательность 5'-CACTCCCTCTCTGCGCGCTCGCTCGCTCACT
GAGGCCGGGCGACCAAAGGTCGCCCACGCCCGGGCTTTGCCCGGGCG – 3'(SEQ ID NO: 41). Мутированный ITR содержит делецию D-области, содержащей последовательность концевого разрешения. В результате при репликации вирусного генома AAV белки rep не отщепляют вирусный геном на мутированном ITR и как таковой рекомбинантный вирусный геном, содержащий следующее в порядке от 5' к 3', будет упакован в вирусный капсид: ITR AAV, первая гетерологичная полинуклеотидная последовательность, в том числе регуляторные последовательности, мутированный ITR AAV, второй гетерологичный полинуклеотид в обратной ориентации по отношению к первому гетерологичному полинуклеотиду и третий ITR AAV. В некоторых вариантах осуществления в настоящем изобретении представляют вирусные частицы AAV, содержащие рекомбинантный вирусный геном, содержащий функциональный ITR AAV2, первую полинуклеотидную последовательность, кодирующую слитый белок, мутированный ITR AAV2, содержащий делецию D-области и не имеющий функциональной последовательности концевого разрешения, вторую полинуклеотидную последовательность, содержащую комплементарную последовательность к последовательности, кодирующей слитый белок первой полинуклеотидной последовательности, и функциональный ITR AAV2.
Частицы rAAV можно получить с помощью способов, известных в данной области техники. См., например, патенты США №№ 6566118, 6989264, 6995006. При практическом использовании настоящего изобретения клетки-хозяева для продукции частиц rAAV включают клетки млекопитающих, клетки насекомых, растительные клетки, микроорганизмы и дрожжи. Клетки-хозяева также могут быть упаковывающими клетками, в которых гены rep и cap AAV стабильно сохраняются в клетке-хозяине или клетках-продуцентах, в которых стабильно сохраняется геном вектора AAV. Иллюстративные упаковывающие клетки и клетки-продуценты получают из клеток 293, A549 или HeLa. Векторы AAV очищают и помещают в составы с помощью стандартных методик, известных в данной области.
В некоторых аспектах представлен способ получения любой частицы rAAV, как раскрыто в данном документе, включающий (a) культивирование клетки-хозяина при условии, при котором получают частицы rAAV, где клетка-хозяин содержит (i) один или несколько генов для упаковки AAV, где каждый упомянутый ген упаковки AAV кодирует белок, необходимый для репликации или капсидирования AAV; (ii) провектор rAAV, содержащий нуклеиновую кислоту, кодирующую любой слитый белок, раскрытый в данном документе, фланкированный по меньшей мере с помощью одного ITR AAV, и (iii) вспомогательный функциональный элемент AAV; и (b) извлечение частиц rAAV, продуцируемых клеткой-хозяином. В некоторых вариантах осуществления нуклеиновая кислота кодирует слитый белок, выбранный из группы, состоящей из SEQ ID NO: 12-15. В некоторых вариантах осуществления упомянутый по меньшей мере один ITR AAV выбран из группы, состоящей из ITR AAV1, AAV2, AAV3, AAV4, AAV5, AA6, AAV7, AAV8, AAV9, AAVrh.8, AAVrh8R и AAVrh.10. В некоторых вариантах осуществления упомянутый капсидированный белок выбран из группы, состоящей из капсидного белка AAV1, AAV2, AAV3, AAV4, AAV5, AA6, AAV7, AAV8, AAV9, AAVrh.8, AAVrh8R, AAVrh10, AAV10, AAV11, AAV12 и т.п. В дополнительных вариантах осуществления частица rAAV содержит капсидные белки серотипа AAV из клад A-F. В некоторых вариантах осуществления частицы rAAV содержат капсид AAV9 и рекомбинантный самокомплементарный геном, содержащий ITR AAV2, мутантный ITR AAV2 и трансген, кодирующий слитый белок. В дополнительном варианте осуществления очищают частицы rAAV. Выражение "очищенный", как применяется в данном документе, включает получение частиц rAAV, лишенных по меньшей мере некоторых из других компонентов, которые могут также присутствовать, если частицы rAAV встречаются в природе или изначально получены из них. Таким образом, например, выделенные частицы rAAV можно получать с помощью методики очищения для обогащения ее из смеси источника, такой как лизат культуры или супернатант культуры продуцента. Обогащение можно определить с помощью множества способов, таких как, например, пропорции устойчивых к ДНКазе частиц (DRP) или геномных копий (gc), присутствующих в растворе, или с помощью инфицирования, или его можно определить по отношению ко второму, потенциально интерферирующему веществу, присутствующему в смеси источника, такому как, контаминанты, в том числе контаминанты культуры продуцента или внутрипроизводственные контаминанты, в том числе хелперный вирус, компоненты среды и т.п.
В данном документе также представлены фармацевтические композиции, содержащие частицу rAAV, содержащего нуклеиновую кислоту, кодирующую слитый белок настоящего изобретения и фармацевтически приемлемый носитель. Фармацевтические композиции могут быть пригодными для множества способов введения в данном документе, в том числе, например, системного или локального введения. Фармацевтическая композиция rAAV, содержащего нуклеиновую кислоту, кодирующую слитый белок, описанный в данном документе, можно вводить системно, например, с помощью внутривенной инъекции, с помощью катетера, см. патент США № 5328470, или с помощью стереотаксической инъекции, Chen et al., 1994, PNAS, 91: 3054-3057. Фармацевтические композиции могут находиться в форме глазных капель, инъецируемых растворов или в форме, пригодной для ингаляции или перорального введения. В некоторых вариантах осуществления фармацевтические композиции, содержащие rAAV, описанный в данном документе, и фармацевтически приемлемый носитель, пригодны для введения человеку. В некоторых вариантах осуществления фармацевтические композиции, содержащие rAAV, описанный в данном документе, и фармацевтически приемлемый носитель пригодны для интравитреальной инъекции или местного применения по отношению к глазу. Такими фармацевтически приемлемыми носителями могут быть стерильные жидкости, такие как вода и масло, в том числе таковые нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло и т.п. В качестве жидких носителей, в частности, для инъекционных растворов, также могут использоваться физиологические растворы и водные растворы декстрозы, полиэтиленгликоля (PEG) и глицерина. Фармацевтические композиции могут дополнительно содержать дополнительные ингредиенты, например, консерванты, буферы, вещества, регулирующие тоничность, антиоксиданты и стабилизаторы, неионные увлажняющие и осветляющие средства, загустители и т.п. Фармацевтические композиции, описанные в данном документе, могут быть упакованы в единичные дозированные формы или множественные дозированные формы. Композиции, как правило, составляют в виде стерильного или практически изотонического раствора. Композиции также можно составлять для получения осмотических величин, которые сопоставимы с водянистой влагой глаза и тканями глаза. Такие осмотические величины будут, как правило, находиться в диапазоне от приблизительно 200 до приблизительно 400 мОсм/кг, однако, будут предпочтительно составлять приблизительно 300 мОсм/кг. Офтальмологические растворы, пригодные для хранения и/или доставки векторов экспрессии, были раскрыты, например, в WO 03077796 A2.
VII. Способы лечения с помощью слитых белков и вирусных частиц
Способы настоящего изобретения используют любой слитый белок, раскрытый в данном документе. В некоторых вариантах осуществления слитый белок связывается с белком PDGF или белком VEGF. В некоторых вариантах осуществления слитый белок связывается с белком PDGFR или белком VEGFR. Слитые белки, описанные в данном документе, могут иметь одну или несколько из следующих характеристик: (a) связываться с одним или несколькими белками семейства PDGF, такими как PDGF-A, PDGF-B, PDGF-C или PDGF-D; (b) связываться с одним или несколькими белками семейства VEGF, такими как VEGF-A, VEGF-B, VEGF-C, VEGF-D или PIGF; (c) блокировать связывание белка семейства PDGF с рецептором PDGF; (d) блокировать связывание белка семейства VEGF с рецептором VEGF; (e) ингибировать активацию сигнального пути PDGF и/или сигнального пути VEGF; (f) лечить и/или предотвращать заболевание, такое как заболевание глаз, аутоиммунное заболевание, воспалительное заболевание или рак. Активности слитых белков можно определять in vitro и/или in vivo.
В настоящем изобретении представляют способы лечения заболевания (такого как заболевание глаз, воспалительное заболевание, аутоиммунное заболевание или рак) с помощью введения эффективного количества любого слитого белка, описанного в данном документе, индивидууму. В некоторых вариантах осуществления способ лечения заболевания включает введение эффективного количества композиции, содержащей слитый белок, индивидууму. В некоторых вариантах осуществления способ лечения заболевания включает введение эффективного количества rAAV, содержащего нуклеиновую кислоту, кодирующую слитый белок, индивидууму. Также представлены способы лечения или предотвращения одного или нескольких аспектов или симптомов заболевания (такого как заболевание глаз, воспалительное заболевание, аутоиммунное заболевание или рак) с помощью введения эффективного количества любого слитого белка, описанного в данном документе, индивидууму. В некоторых вариантах осуществления способ лечения или предотвращения одного или нескольких аспектов или симптомов заболевания включает введение эффективного количества композиции, содержащей слитый белок, индивидууму. В некоторых вариантах осуществления способ лечения или предотвращения одного или нескольких аспектов или симптомов заболевания включает введение эффективного количества rAAV, содержащего нуклеиновую кислоту, кодирующую слитый белок, индивидууму.
Способы, описанные в данном документе, можно применять для лечения множества заболеваний, в том числе без ограничений воспалительного заболевания, заболевания глаз, аутоиммунного заболевания или рака. В некоторых вариантах осуществления заболевание, подлежащее лечению, включает без ограничений ревматоидный артрит, воспалительный артрит, остеоартрит, рак, возрастную макулодистрофию (AMD) (такую как влажная AMD или сухая AMD), заболевание глаз, характеризующееся хориоидальной неоваскуляризацией (такой как хориоидальная неоваскуляризация), увеит (такой как передний увеит или задний увеит), пигментный ретинит и диабетическая ретинопатия.
В некоторых вариантах осуществления способы и композиции настоящего изобретения можно использовать для лечения аутоиммунного заболевания. В некоторых вариантах осуществления аутоиммунным заболеванием является ревматоидный артрит, рассеянный склероз или системная красная волчанка. Ревматоидный артрит (RA) представляет собой аутоиммунное заболевание, которое приводит к воспалению суставов. Хотя RA в основном поражает синовиальные суставы, он может поражать окружающие ткани и органы. Патология RA включает воспалительный процесс, который ведет к разрушению хряща и анкилозу (слиянию) суставов. Другие патологические проявления RA включают васкулит (воспаление кровеносных сосудов), который может поражать практически любую систему органов и который может вызывать дополнительные осложнения, в том числе полинейропатию, кожное изъязвление и висцеральный инфаркт. Плевролегочные проявления включают плеврит, интерстициальный фиброз, синдром Каплана, плевролегочные узелки, пневмонию, ревматоидное заболевание легких и артерит. Другие проявления включают развитие воспалительных ревматодоиных узелков на множестве околосуставных структур, таких как разгибательные поверхности, а также на плевре и оболочках головного мозга. Часто встречаются слабость и атрофия скелетных мышц.
В некоторых вариантах осуществления способы и композиции настоящего изобретения можно использовать для лечения воспалительного заболевания. В некоторых вариантах осуществления воспалительным заболеванием является воспалительный артрит, остеоартрит, псориаз, хроническое воспаление, синдром раздраженного кишечника, воспаление легких и астма. Воспалительный артрит относится к воспалению суставов, которое может происходить в результате аутоиммунного заболевания, такого как например, анкилозирующий спондилит, ювенильный идиопатический артрит, смешанное заболевание соединительной ткани, псориатический артрит, реактивный артрит, склеродерма, синдром Шегрена, болезнь Стилла и системная красная волчанка. Воспалительный артрит также может быть вызван некоторыми типами бактерий (такими как при реактивном артрите) или посредством отложений кристаллических структур в суставах (таких как при подагре и псевдоподагре). Характерными симптомами воспалительного артрита являются боль и набухание одного или нескольких суставов, которые могут быть теплее, чем другие суставы. Скованность суставов после длительной неактивности (такой как утром или после сидения в течение длительного времени) является распространенным симптомом. Пациенты с воспалительным артритом обычно имеют многочисленные жалобы на суставы. Остеоартрит, также известный как дегенеративный артрит или дегенеративное заболевание суставов, представляет собой группу механических аномалий, в том числе деградацию суставов, в том числе суставного хряща и субхондральной кости. Симптомы могут включать боль в суставах, болезненность, скованность, ограничение подвижности в суставах и иногда выпот (т.е. наличие повышенного количества внутрисуставной жидкости). Множество причин, например, наследственные, связанные с развитием, метаболические, связанные с ожирением и механические, могут инициировать процессы, ведущие к потере хряща. Продукты разложения из хряща высвобождаются в синовиальное пространство, при этом клетки, выстилающие сустав, пытаются удалять их. Могут образовываться новые костные выросты, или "шпоры". Часто, когда кость становится менее защищенной со стороны хряща, кость может подвергаться воздействию и повреждаться. Эти костные изменения в комбинации с воспалением сустава вызывают боль. В результате сниженной подвижности, вторичной к боли, регионарные мышцы могут атрофироваться, и связки могут становиться более растянутыми.
Устойчивый и нерегулируемый ангиогенез возникает в ряде стадий заболеваний, таких как рак. При раке клетки делятся и растут неконтролируемо, образуя злокачественные опухоли, которые васкуляризируют и распространяются в соседние части тела. Рак также может распространяться (метастазировать) в более отдаленные части тела посредством лимфатической системы или кровотока. Причины рака могут быть обусловленными окружающими условиями (вследствие воздействия химических соединений, излучения или вследствие образа жизни), наследственными или инфекционными. В некоторых вариантах осуществления способы и композиции настоящего изобретения можно использовать для лечения рака. В некоторых вариантах осуществления раком является рак предстательной железы, рак молочной железы, рак легкого, рак пищевода, рак кишечника, рак прямой кишки, рак печени, рак мочевыводящих путей (например, рак мочевого пузыря), рак почки, рак легкого (например, немелкоклеточный рак легкого), рак яичника, рак шейки матки, рак эндометрия, рак поджелудочной железы, рак желудка, рак щитовидной железы, рак кожи (например, меланома), опухоли кроветворной ткани лимфоидной или миелоидной линии, рак головы и шеи, назофарингеальная карцинома (NPC), глиобластома, тератокарцинома, нейробластома, аденокарцинома, опухоли мезенхимального происхождения, такие как фибросаркома или рабдомиосаркома, саркома мягких тканей и карцинома, хориокарцинома, гепатобластома, саркома Капоши и рак Вильмса.
Другие заболевания, которые связаны с ангиогенезом, можно лечить с помощью способов и композиций, раскрытых в данном документе. Эти заболевания включают атеросклероз, ретролентальную фиброплазию, гиперплазии щитовидной железы (в том числе, диффузный токсический зоб), нефротический синдром, преэклампсию, асциты, перикардиальный выпот (такой как связанный с перикардитом) и плевральный выпот.
В некоторых вариантах осуществления способы и композиции настоящего изобретения можно использовать для лечения заболевания глаз. В некоторых вариантах осуществления заболеванием глаз является AMD, такая как влажная AMD или сухая AMD, увеит, пигментный ретинит, неоваскулярная глаукома, диабетическая ретинопатия и другие заболевания глаз, которые включают местный воспалительный процесс. В некоторых вариантах осуществления заболевание глаз характеризуется неоваскуляризацией, такой как хориоидальная неоваскуляризация. В некоторых вариантах осуществления заболевание глаз является результатом трансплантации роговицы. В некоторых вариантах осуществления в настоящем изобретении представляют способы лечения или предотвращения одного или нескольких аспектов или симптомов заболевания глаз, в том числе без ограничений образование друзов глаз, воспаление в глазу или тканях глаза и потерю зрения. В некоторых вариантах осуществления композиции и способы, описанные в данном документе, можно использовать для выявления и/или лечения увеита, т.е. воспаления сосудистой оболочки глаза, среднего слоя глаза, расположенного под склерой. Увеит, по оценкам, отвечает примерно за 10-20% слепоты в Соединенных Штатах. Сосудистую оболочку глаза традиционно разделяют на 3 области, спереди назад, радужную оболочку, ресничное тело и хориоид. Первостепенными функциями сосудистой оболочки глаза является питание и газообмен, поглощение света и секреция водянистой влаги цилиарными отростками. Увеит обычно связан с воздействием токсинов, инфекции и/или аутоиммунных заболеваний. Однако, во многих случаях причина является неизвестной. Увеит может повреждать один или оба глаза. Симптомы могут развиваться быстро и могут включать размытое зрение, плавающие черные пятна в поле зрения, боль в глазах, покраснение глаз и чувствительность к свету. Наиболее распространенной формой увеита является передний увеит, или ирит, который включает воспаления радужной оболочки. Парспланит относится к воспалению сосудистой оболочки глаза в центре глаза, т.е. между радужной оболочкой и хориоидом. Задний увеит поражает заднюю часть глаза, т.е. хориоид. Воспаление, связанное с задним увеитом, также может поражать сетчатку (ретинит) или кровеносные сосуды в задней части глаза (васкулит).
В некоторых вариантах осуществления способы и композиции настоящего изобретения можно использовать для лечения пигментного ретинита (RP). RP является наследственным заболеванием глаз, которое вызвано аномалиями фоторецепторов (палочек и колбочек) или пигментным эпителием сетчатки. Заболевание может привести к прогрессирующей потере зрения и часто слепоте. Симптомы RP включают сниженное зрение ночью или при слабом освещении, потерю бокового (периферического) зрения, и в запущенных случаях потерю центрального зрения. Диагноз RP основывается на документировании прогрессирующей потери функции фоторецепторных клеток с помощью исследования визуального поля и электроретинографии. По меньшей мере известно 35 локусов генов, которые вызывают "несиндромный пигментный ретинит" (т.е. RP, который не является результатом другого заболевания или части более широкого синдрома).
В некоторых вариантах осуществления способы и композиции настоящего изобретения можно использовать для лечения диабетической ретинопатии. Диабетическая ретинопатия относится к повреждению сетчатки, вызванному осложнениями диабета. При этом стенки сосудов повреждаются в результате гипергликемии, изменяя образование гематоретинального барьера и делая кровеносные сосуды сетчатки более проницаемыми. Поврежденные кровеносные сосуды пропускают жидкость и липиды в желтое пятно, приводя к набуханию желтого пятна (т.е. макулярному отеку), которое размывает зрение. По мере прогрессирования заболевания оно переходит к пролиферативной стадии, в которой кровеносные сосуды прорастают вдоль сетчатки и в стекловидное тело, которое заполняет глаз. Эти кровеносные сосуды могут кровоточить, затуманивать зрение и, например, разрушать сетчатку, вызывать отслоение сетчатки или вызывать неоваскулярную глаукому.
В некоторых вариантах осуществления способы и композиции настоящего изобретения можно использовать для лечения возрастной макулодистрофии (AMD). AMD характеризуется прогрессирующей потерей центрального зрения, которая происходит в результате повреждения фоторецепторных клеток в области сетчатки, называемой желтым телом. AMD в общем классифицируют на два клинических состояния: влажную форму и сухую форму, при этом влажная форма составляет до 80-90% всех случаев. Сухая AMD характеризуется образованием друзов желтого тела, крошечных желтых и белых скоплений внеклеточного вещества, которое откладывается между мембраной Бруха и пигментным эпителием сетчатки глаза. Влажная AMD, которая обусловливает приблизительно 90% тяжелой потери зрения, связана с неоваскуляризацией, где кровеносные сосуды прорастают из хориоида под сетчаткой, и с протеканием этих новых сосудов. Накопление крови и жидкости может вызывать отслоение сетчатки после быстрой дегенерации фоторецепторов и потере зрения при любой форме AMD. Общепринято, что влажная AMD следует за сухой формой и возникает из сухой формы.
В данном документе представлены способы доставки эффективного количества слитого белка субъекту. Слитый белок можно доставлять субъекту в композиции. Слитый белок также можно доставлять субъекту с помощью rAAV, содержащего нуклеиновую кислоту, кодирующую слитый белок. В данном документе рассматриваются композиции, содержащие слитый белок, или rAAV, содержащий нуклеиновую кислоту, кодирующую слитый белок.
Композиции, описанные в данном документе, можно вводить индивидууму любым путем, включая без ограничений внутривенный (например, с помощью инфузионных насосов), внутрибрюшинный, внутриглазной, внутриартериальный, втутрилегочный, пероральный, ингаляционный, внутрипузырный, внутримышечный, внутритрахейный, подкожный, внутриглазной, интратекальный, трансдермальный, трансплевральный, внутриартериальный, наружный, ингаляционный (например, в виде аэрозолей или спреев), слизистый (такой как, через слизистую оболочку носа), подкожный, трансдермальный, желудочнокишечный, внутрисуставной, интрацистернальный, интравентрикулярный, внутричерепной, интрауретральный, внутрипеченочный или внутриопухолевый. В некоторых вариантах осуществления композиции вводят внутрисосудисто, например, внутривенно (IV) или внутриартериально. В некоторых вариантах осуществления композиции вводят прямо в артерии. В некоторых вариантах осуществления композиции вводят системно (например, с помощью внутривенной инъекции). В некоторых вариантах осуществления композиции вводят местно (например, с помощью внутриартериальной или внутриглазной инъекции).
В некоторых вариантах осуществления композиции вводят прямо в глаз или ткань глаза. В некоторых вариантах осуществления композиции вводят местно в глаз, например, в глазных каплях. В некоторых вариантах осуществления композиции вводят с помощью инъекции в глаз (внутриглазной инъекции) или в ткани, связанные с глазом. Композиции можно вводить, например, с помощью внутриглазной инъекции, окологлазной инъекции, субретинальной инъекции, интравитреальной инъекции, транссептальной инъекции, субсклеральной инъекции, интрахориоидальной инъекции, внутрикамерной инъекции, субконъюнктивальной инъекции, субтеноновой инъекции, ретробульбарной инъекции, перибульбарной инъекции или околосклеральной доставки. Эти способы известны в данной области техники. Например, для описания иллюстративных окологлазных путей доставки ретинальных лекарственных средств, см. Raghava et al., Expert Opin. Drug Deliv., 2004, 1(1):99-114. Композиции можно вводить, например, в стекловидное тело, водянистую влагу, склеру, конъюнктиву, область между склерой и конъюнктивой, хориоидные ткани сетчатки, желтое пятно или другую область в глазе или вблизи глаза индивидуума. Композиции также можно вводить индивидууму в виде импланта. Предпочтительные импланты являются биосовместимыми составами и/или биоразлагаемыми составами с замедленным высвобождением, которые постепенно высвобождают соединения в течение периода времени. Глазные импланты для доставки лекарственных средств хорошо известны в данной области техники. См., например, патенты США №№ 5501856, 5476511 и 6331313. Композиции также можно вводить индивидууму с помощью ионтофореза, в том числе без ограничений ионфоретические способы, описанные в патенте США № 4454151 и опубликованных заявках на патент США №№ 2003/0181531 и 2004/0058313.
Оптимальное эффективное количество композиции может быть определено эмпирически и будет зависеть от типа и тяжести заболевания, пути введения, прогрессирования заболевания и состояния здоровья, массы и площади тела индивидуума. Такие определения находятся в пределах компетенции специалиста в данной области. Например, при введении внутриглазным путем, количество rAAV, содержащего нуклеиновую кислоту, кодирующую слитый белок, описанный в данном документе, можно вводить индивидууму в виде титра устойчивых к ДНКазе частиц (drp) от приблизительно 104 до приблизительно 1014 drp на дозу. В некоторых вариантах осуществления количество rAAV, содержащего нуклеиновую кислоту, кодирующую слитый белок, можно вводить индивидууму от приблизительно 105 до приблизительно 1013, от приблизительно 106 до приблизительно 1012, от приблизительно 107 до приблизительно 1011, от приблизительно 108 до приблизительно 1010, от приблизительно 109 до приблизительно 1010, от приблизительно 1010 до приблизительно 1011 или от приблизительно 1011 до приблизительно 1012 drp на дозу.
Композиции, содержащие слитый белок, можно вводить в однократной суточной дозе, или общую суточную дозу можно вводить в разделенных дозах по два, три или четыре раза в день. Композиции, содержащие слитый белок, можно также вводить шесть раз в неделю, пять раз в неделю, четыре раза в неделю, три раза в неделю, два раза в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз в месяц, один раз каждые два месяца, один раз каждые три месяца, один раз каждые шесть месяцев, один раз каждые девять месяцев или один раз каждый год. Композиции, содержащие rAAV, содержащий нуклеиновую кислоту, кодирующую слитый белок, можно вводить менее часто, например, один раз каждые три месяца, каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев, один раз каждые семь месяцев, один раз каждые восемь месяцев, один раз каждые девять месяцев, один раз каждые десять месяцев, один раз каждые одиннадцать месяцев или один раз каждый год. В некоторых вариантах осуществления однократную дозу композиции, содержащей rAAV, содержащий нуклеиновую кислоту, кодирующую слитый белок, описанный в данном документе, вводят один раз в год. Композиции также можно вводить в составах с замедленным высвобождением, таких как имплант, который постепенно высвобождает композицию для использования в течение периода времени, и который позволяет вводить композицию менее часто, например, один раз в месяц, один раз каждые 2-6 месяцев, один раз в год или даже в виде однократного введения. Средства с замедленным высвобождением (такие как пеллеты, наночастицы, микрочастицы, наносферы, микросферы и т.п.) можно вводить с помощью инъекции или путем хирургического имплантирования в различные места в глазе и ткани, связанной с глазом, такой как внутриглазная, интравитреальная, субретинальная, окологлазная, субконъюнктивальная или субтеноновая.
Композиции настоящего изобретения (например, слитый белок или rAAV, содержащий нуклеиновую кислоту, кодирующую слитый белок) можно использовать по отдельности или в комбинации с одним или несколькими дополнительными терапевтическими средствами. Например, композиции настоящего изобретения можно вводить по отдельности или в комбинации с другими терапевтическими средствами, которые, как известно, обладают благоприятным эффектом на возрастную макулодистрофию (AMD), отслоение сетчатки и поврежденную ткань сетчатки. Иллюстративные терапевтические средства включают ингибиторы комплемента, антиангиогенные средства, анти-VEGF средства (в том числе без ограничений Macugen (пегаптаниб натрия), Eylea (VEGF Trap-Eye) и антитело к VEGF, такое как Lucentis® или Avastin®), и антитела к PDGF (такие как FostivaTM). Композиции настоящего изобретения можно вводить в комбинации с пищевыми добавками, которые, как показано, оказывают благоприятный эффект в снижении риска макулодистрофии, прогрессирующей до запущенных стадий, например, витамином C, витамином E, бета-каротином, оксидом цинка и медью. Другие пригодные кофакторы включают кофакторы, ослабляющие симптомы, в том числе, антисептики, антибиотики, противовирусные и противогрибковые средства и анальгетики и анестетики. В некоторых вариантах осуществления представляют комбинацию в виде одновременного введения, где слитый белок или rAAV, содержащий нуклеиновую кислоту, кодирующую слитый белок, и по меньшей мере одно терапевтическое средство вводят вместе в той же самой композиции или вводят одновременно в различных композициях. В некоторых вариантах осуществления представляют комбинацию в виде раздельного введения, где введение слитого белка или rAAV, содержащего нуклеиновую кислоту, кодирующую слитый белок, может осуществляться до, одновременно и/или после введения по меньшей мере одного терапевтического средства. Интервал между последовательными введениями может измеряться в единицах по меньшей мере (или, в качестве альтернативы, менее) минут, часов или дней.
Композиции, описанные в данном документе, можно также использовать совместно с другими видами терапии AMD, такими как фотодинамическая терапия. Фотодинамическая терапия включает внутривенное введение визудина (вертепорфина), после чего свет с конкретной длиной волны применяют по отношению к аномальным кровеносным сосудам. Свет активирует визудин и вызывает облитерацию сосудов. В качестве альтернативы, композиции, описанные в данном документе, можно использовать совместно с лазерной терапией, которая включает использование луча высокоэнергетического лазера для разрушения аномальных сосудов под желтым телом.
VIII. Изделия и наборы
Также представлены наборы или изделия, содержащие композиции, описанные в данном документе (например, слитые белки или частицы rAAV), в пригодной упаковке. Пригодная упаковка для композиций (таких как глазные композиции), описанных в данном документе, известна в данной области техники, и включает, например, флаконы (такие как запечатанные флаконы), сосуды, ампулы, бутылки, банки, гибкую упаковку (например, герметизированные пакеты Майлара или пластиковые пакеты) и т.п. Эти изделия можно дополнительно стерилизовать и/или герметизировать.
Настоящее изобретение также представляет наборы, содержащие композиции, описанные в данном документе, и может дополнительно содержать инструкцию(инструкции) по способам применения композиции, таким как способы применения, описанные в данном документе. Наборы, описанные в данном документе, могут дополнительно включать другие материалы, необходимые с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши с инструкциями для выполнения любых способов, описанных в данном документе. Например, в некоторых вариантах осуществления набор содержит слитый белок, описанный в данном документе, и/или rAAV, кодирующий слитый белок, описанный в данном документе, фармацевтически приемлемый носитель, пригодный для внутриглазной инъекции и одно или несколько из буфера, разбавителя, фильтра, иглы, шприца и вкладыша с инструкциями для выполнения внутриглазной инъекции.
ПРИМЕРЫ
Пример 1. Получение слитых белков sPDGFR-β/Fc
Эктодомен рецептора PDGF-бета (PDGFR-β) содержит 5 внеклеточных доменов (ECD), пронумерованных от 1 до 5 с N-конца к C-концу белка. Эктодомен PDGFR-β полной длины использовали для получения нескольких усеченных растворимых мономерных и димерных белков PDGFR-β (PDGFR-β) (фиг. 1A).
Получали две мономерные конструкции PDGFR-β, которые содержали сигнальный пептид PDGFR-β (SP) на N-конце эктодомена PDGFR-β полной длины, PDGFR(D1-D5) (SEQ ID NO: 7), или на N-конце эктодомена PDGFR-β, содержащего первые четыре ECD, PDGFR(D1-D4) (SEQ ID NO: 8). Три димерные конструкции PDGFR-β получали с помощью слияния всех пяти, первых трех или первых трех доменов эктодомена PDGFR-β (ECD) с N-концом фрагментом тяжелой цепи иммуноглобулина человека G1 (Fc IgG1) посредством пептидного линкера, состоящего из девяти остатков глицина (9Gly) и заканчивающегося PDGFR(D1-D5)9G-Fc (SEQ ID NO: 9), PDGFR(D1-D3)9G-Fc (SEQ ID NO: 10) и PDGFR(D1-D2)9G-Fc (SEQ ID NO: 11), соответственно. Подобно мономерным конструкциям, все димерные конструкции содержали SP на N-конце слитых эктодоменов PDGFR-β полной длины или усеченных эктодоменов PDGFR-β. Для разработки PDGFR(D1-D2)9G-Fc, в качестве матрицы использовали плазмиду pCMV6-XL5-PDGFRB (кат. № SC309979; Origene, Роквилл, Мериленд) вместе с праймерами, которые вводили в сайты рестрикции SpeI (PDGFRBPR6SpeI F: 5'-GACTAGTATGCGGCTTCCGGGTG (SEQ ID NO: 25) и AgeI (PDGFRBPR7AgeI R: 5'-ACCGGTGGATGACACCTGGAGTCTG (SEQ ID NO: 26) в матрицу. Амплификацию продуктов ПЦР выполняли со следующими параметрами циклов: 1 цикл при 50°C в течение 2 минут, 1 цикл при 95°C в течение 10 минут; 40 циклов при 95°C в течение 15 секунд и 60°C в течение 60 секунд. Продукт ПЦР вставляли в плазмиду pCR-Blunt II-TOPO с использованием TOPO Cloning Kit (Invitrogen) и последовательность вставки продукта ПЦР проверяли с помощью секвенирования перед субклонированием в сайты SpeI и AgeI плазмиды pCMV/K-D2-9Gly-Fc (См. Pechan P., et al. Gene Ther. (2009), 16:10-16 для описания pCMV/K-D2-9Gly-Fc) для получения плазмиды pCMV-PDGFR-S-(D1-D2)-9Gly-Fc с открытой рамкой считывания PDGFR(D1-D2)9G-Fc (SEQ ID NO: 20) при контроле промотора CMV и последовательности полиаденилирования SV40. Для разработки PDGFR(D1-D5)9G-Fc в качестве матрицы использовали плазмиду pCMV6-XL5-PDGFRB (кат. № SC309979; Origene, Роквилл, Мериленд) вместе с праймерами, которые вводили в сайты рестрикции AccI (PDGFRB-PR1-Acc F: 5'-CTATGTCTACAGACTCCAGGTGTC (SEQ ID NO: 27) и AgeI (D5-PR9-AgeI-Rev R: 5'-ACCGGTAAAGGGCAAGGAGTGTGGC (SEQ ID NO: 28) в матрицу. Амплификацию продуктов ПЦР выполняли со следующими параметрами циклов: 1 цикл при 50°C в течение 2 минут, 1 цикл при 95°C в течение 10 минут; 40 циклов при 95°C в течение 15 секунд и 60°C в течение 60 секунд. Продукт ПЦР затем вставляли в плазмиду pCR-Blunt II-TOPO с использованием TOPO Cloning Kit (Invitrogen) и последовательность вставки продукта ПЦР в pTOPO-PDGFRB (D3-D5) проверяли путем секвенирования. 622 пар оснований (п.о.) фрагмента SpeI-AccI из плазмиды pCMV-PDGFR-S-(D1-D2)-9Gly-Fc вставляли в сайты SpeI и AccI плазмиды pTOPO-PDGFRB (D3-5) для создания плазмиды pTOPO-PDGFR(D1-D5). 1596 п.о. фрагмента SpeI-AgeI из плазмиды pTOPO-PDGFR(D1-D5) затем вставляли в сайты SpeI и AgeI плазмиды pCMV-PDGFR-S-(D1-D2)-9Gly-Fc для получения плазмиды pCMV-PDGFR-(D1-D5)-9Gly-Fc с открытой рамкой считывания PDGFR(D1-D5)9G-Fc (SEQ ID NO: 18) под контролем промотора CMV и последовательности полиаденилирования SV40. Для разработки PDGFR(D1-D3)9G-Fc плазмиду pCMV-PDGFR (D1-5)9G-Fc использовали в качестве матрицы вместе с праймерами, которые вводили в сайты рестрикции SpeI (PDGF02 F: 5'-CCTCCACCGGTGTAGCCGCTCTCAACCACGGT (SEQ ID NO: 29) и AgeI (PDGF03 R: 5'-CCCGGGACTAGTATGCGGCTTCCGGGTG (SEQ ID NO: 30) в матрицу. Амплификацию продукта ПЦР выполняли со следующими параметрами циклов: 1 цикл при 95°C в течение 1 минуты; 35 циклов при 95°C в течение 30 секунд, 60°C в течение 30 секунд 72°C в течение 1 минуты. Продукт ПЦР затем вставляли в сайты Spe I и Age I плазмиды pCMV-PDGFR(D1-5)9G- Fc для завершения открытой рамки считывания PDGFR(D1-3)9G-Fc (SEQ ID NO: 19). Для разработки PDGFR(D1-D5), 5307 п.о. фрагмента AgeI-EagI плазмиды pCMV-sPDGFR(D1-D5)-9G-Fc лигировали с отожженным олигонуклеотидным фрагментом, состоящим из олигонуклеотидов D5-SV40 F: CCGGTTAGGGA (SEQ ID NO: 31) и D5-SV40 B-2: GGCCTCCCTAA (SEQ ID NO: 32) для получения плазмиды pCMVPDGFRB (D1-D5) с открытой рамкой считывания PDGFR(D1-D5) (SEQ ID NO: 16) под контролем промотора CMV и последовательности полиаденилирования SV40. Для конструкции PDGFR(D1-D4), 4924 п.о. фрагмента BbvCI-EagI плазмиды pCMV-sPDGFR(D1-D5)-9G-Fc лигировали с отожженным олигонуклеотидным фрагментом, состоящим из олигонуклеотидов D4-SV40 F: TGAGGTCCAGCTCTCCTTCCAGCTACAGATCAATGTCCCTGTCCGAGTGCTGGAGTAGC (SEQ ID NO:33) и D4-SV40 B: GGCCGCTACTCCAGCACTCGGACAGGGACATTGATCTGTAGCTGGAAGGAGAGCTGGACC (SEQ ID NO: 34) для получения плазмиды pCMV-PDGFRB (D1-D4) с открытой рамкой считывания PDGFR(D1-D4) (SEQ ID NO: 17) под контролем промотора CMV и последовательности полиаденилирования SV40.
Ожидаемые молекулярные веса зрелых белков, за исключением области SP, составляли 56,2 кДа для PDGFR(D1-D5) и 43,6 кДа для PDGFR(D1-D4). Ожидаемые молекулярные веса зрелых белков в виде мономеров, за исключением области SP, составляли 82,7 кДа для PDGFR(D1-D5)9G-Fc, 46,7 кДа для PDGFR(D1-D2)9G-Fc и 58,2 кДа для PDGFR(D1-D3)9G-Fc. Плазмиды, кодирующие эти белковые конструкции, использовали для трансфекции клеток 293. Среду от клеток собирали через 72 часа после трансфекции и неочищенную кондиционированную среду (CM) использовали для анализа секретируемых белков PDGFR(D1-D5), PDGFR(D1-D4), PDGFR(D1-D5)9G-Fc, PDGFR(D1-D2)9G-Fc и PDGFR(D1-D3)9G-Fc. Продукцию гомодимеров белка PDGFR(D1-D5)9G-Fc, PDGFR(D1-D2)9G-Fc и PDGFR(D1-D3)9G-Fc клетками, трансфицированными их соответствующими конструкциями, подтверждали с помощью вестерн-блоттинга. Вкратце, секретируемые белки, очищенные от среды для культивирования клеток, загружали в восстанавливающий и невосстанавливающий гели для полиакриламидного гель-электрофореза (PAGE). Усиленный зеленый флуоресцентный белок (EGFP), очищенный от среды для культивирования клеток, трансфицированый конструкцией EGFP, также загружали на гели и использовали в качестве контроля. После разделения белков на гелях SDS-PAGE (NuPAGE Novex 4-12% Bis-Tris, Invitrogen) белки переносили на нитроцеллюлозные мембраны. Мембраны исследовали с помощью биотинилированного козьего антитела к PDGFR-β человека (R&D Systems) с последующим мечением стрептавидином, конъюгированным с пероксидазой хрена (R&D Systems), и проявляли с помощью хемилюминесцентного реагента (ThermoScientific Pierce) до получения изображения. Подвижность белков PDGFR(D1-D5)9G-Fc, PDGFR(D1-D2)9G-Fc и PDGFR(D1-D3)9G-Fc менялась в восстанавливающих и невосстанавливащих условиях, в то время как подвижность мономерных белков PDGFR(D1-D5) и PDGFR(D1-D4) оставалась неизменной, указывая на то, что слитые белки PDGFR-β/Fc образовывали гомодимеры (фиг. 1B).
Относительную аффинность связывания между лигандом BB PDGF и мономерными и димерными белками PDGFR-β определяли с помощью системы бесклеточного волюметрического анализа связывания PDGF (фиг. 2). Для получения мономерных и димерных белков PDGFR-β клетки 293 трансфицировали плазмидами, кодирующими белки PDGFR(D1-D5), PDGFR(D1-D4), PDGFR(D1-D5)9G-Fc, PDGFR(D1-D2)9G-Fc или PDGFR(D1-D3)9G-Fc, и среду для культивирования клеток собирали через 72 часа после трансфекции. Присутствие секретируемых мономерных и димерных белков PDGFR-β подтверждали с помощью ELISA и вестерн-блоттинга перед анализом аффинности связывания. Секретируемые белки серийно разбавляли, смешивали с лигандом ВВ PDGF человека (конечная концентрация 20 пМ) и инкубировали на протяжении ночи при комнатной температуре на платформе орбитального встряхивателя. Количество несвязанного BB PDGF затем определяли с помощью ELISA, специфичного к PDGF человека (Human PDGF-BB DuoSet Product № DY220, R&D Systems). Статистическую значимость аффинностей связывания анализировали с помощью Prism 5.0d (GraphPad Software, Inc) и рассчитывали с помощью 2-факторного анализа ANOVA с последующей поправкой Бонферрони. Анализ аффинности связывания показал, что мономерный белок PDGFR(D1-D4) связывал PDGF со значительно (***P<0,001) более высокой аффинностью, чем мономерный белок PDGFR(D1-D5), который содержал все 5 ECD (фиг. 2A). Однако, димерный белок PDGFR(D1-D5)9G-Fc полной длины, который выполнял роль положительного контроля для связывания PDGF, был значительно (***P<0,001) лучшим связывающим средством PDGF, чем оба мономерные PDGFR(D1-D4) и PDGFR(D1-D5) (фиг. 2A). Из трех димерных образованных Fc-связанных конструкций PDGFR-β IgG1, конструкция с первыми тремя ECD, PDGFR(D1-D3)9G-Fc, была значительно (P < 0,001) лучшим связывающим средством PDGF, чем белок PDGFR(D1-D5)9G-Fc полного размера, в то время как конструкция с первыми двумя ECD, PDGFR(D1-D2)9G-Fc, не показала PDGF-связывающей аффинности (фиг. 2B).
Пример 2. Получение гибридных белков VEGFR1/ PDGFR-β и PDGFR-β/VEGFR-1
Эктодомен рецептора Flt-1 (VEGFR-1) содержит 7 внеклеточных доменов (ECD), пронумерованных от 1 до 7 с N-конца к C-концу белка. Для блокирования обоих лигандов получали и называли гибридными белками слитые белки BB PDGF и VEGF, содержащие ECD PDGFR-β и VEGFR1 (фиг. 3).
Полученный ранее VEGF-связывающий белок, sFLT01, состоящий из ECD 2 VEGFR1 человека, связанный с фрагментом тяжелой цепи иммуноглобулина человека G1 (Fc IgG1) использовали для получения ДНК-конструкций, кодирующих гибридные белки VEGFR1/ PDGFR-β или PDGFR-β/VEGFR1. См. Pechan P., et al. Gene Ther. (2009), 16:10-16 для описания белка sFLT01, который включен в данный документ с помощью ссылки во всей своей полноте. Гибрид 1 VEGFR1/PDGFR-β (SEQ ID NO: 12) разрабатывали путем связывания фрагмента из sFLT01, содержащего сигнальный пептид VEGFR1 (SP) и VEGFR1 ECD 2, с N-концом PDGFR-β ECD 1-5 посредством пептидного линкера, состоящего из девяти сериновых остатков (9Ser), который дополнительно связывали с Fc IgG1 посредством пептидного линкера, состоящего из девяти глициновых остатков (9Gly). Гибрид 2 PDGFR-β/VEGFR1 (SEQ ID NO: 13) разрабатывали путем связывания PDGFR-β ECD 1-5 и PDGFR-β SP с N-концом VEGFR1 ECD 2 посредством 9Ser пептидного линкера, который дополнительно связывали с Fc IgG1 посредством 9Gly пептидного линкера. Гибрид 3 VEGFR1/PDGFR-β (SEQ ID NO: 14) и гибрид 4 PDGFR-β/VEGFR1 (SEQ ID NO: 15) составляли подобно гибридам 1 и 2, соответственно, за исключением того, что PDGFR-β ECD 1-3 использовали вместо PDGFR-β ECD 1-5. Для разработки гибрида 1 VEGFR1/PDGFR-β фрагмент SpeI-XhoI Kozak-SP-D2-9Ser из 372 п.о., кодирующий сигнальный пептид VEGFR1, слитый с доменом D2 VEGFR1, содержащим линкер из 9 серинов (9Ser) (SEQ ID NO: 35), вставляли в сайты SpeI и XhoI плазмиды pTOPO-PDGFR(D1-D5) для получения плазмиды pTOPO-(D2-9Ser)-PDGFR(D1-D5). Фрагмент SpeI-AgeI из плазмиды pTOPO-(D2-9Ser)-PDGFR(D1-D5) вставляли в сайты SpeI-AgeI плазмиды pCMV-PDGFR-(D1-D5)-9Gly-Fc для создания pCMV-F(D2-9S)-P(D1-D5)-9G-Fc или pCMV-гибрида 1 с открытой рамкой считывания гибрида 1 VEGFR1/PDGFR-β (SEQ ID NO: 21) под контролем промотора CMV и последовательности полиаденилирования SV40. Для конструкции гибрида 2 PDGFR-β/VEGFR1 фрагмент BstBI-BmgXI из 678 п.о., содержащий синтетическую ДНК (GenScript) (SEQ ID NO: 36), лигировали с фрагментом BstBI-BmgXI из 5626 п.о. плазмиды pCMV-sPDGFR(D1-D5)-9G-Fc для создания pCMV-P(D1-D5)-9S-F(D2)-9G-Fc или pCMV-гибрида 2 с открытой рамкой считывания гибрида 2 PDGFR-β/VEGFR-1 (SEQ ID NO: 22) под контролем промотора CMV и последовательности полиаденилирования SV40. Для конструкции гибрида 3 VEGFR1/PDGFR-β фрагмент BmgBI-PshAI из 452 п.о., содержащий синтетическую ДНК (GenScript) (SEQ ID NO: 37), лигировали с фрагментом BmgBI-PshAI из 5334 п.о. плазмиды pCMV-P(D1-D5)-9S-F(D2)-9G-Fc или pCMV-гибрида 2 для создания pCMV-F(D2-9S)-P(D1-D3)-9G-Fc или pCMV-гибрида 3 с открытой рамкой считывания гибрида 3 VEGFR1/PDGFR-β (SEQ ID NO: 23) под контролем промотора CMV и последовательности полиаденилирования SV40. Для конструкции гибрида 4 PDGFR-β/VEGFR1 фрагмент BmgBI-PshAI из 758 п.о., содержащий синтетическую ДНК (GenScript) (SEQ ID NO: 38), лигировали с фрагментом BmgBI-PshAI из 5021 п.о. плазмиды pCMV-P(D1-D5)-9S-F(D2)-9G-Fc или pCMV-гибрида 2 для создания pCMV-P(D1-D3)-9S-F(D2)-9G-Fc или pCMV-гибрида 4 с открытой рамкой считывания гибрида 4 PDGFR-β/VEGFR1 (SEQ ID NO: 24) под контролем промотора CMV и последовательности полиаденилирования SV40.
Продуцирование гомодимеров белков гибрида 1, гибрида 2, гибрида 3 и гибрида 4 клетками, трансфицированными их соответствующими конструкциями, подтверждали с помощью вестерн-блоттинга. Вкратце, секретируемые белки из среды для культивирования клеток, загружали в восстанавливающий и невосстанавливающий гели для полиакриламидного гель-электрофореза (PAGE). Белок PDGFR(D1-D5)9G-Fc также загружали на гели и использовали в качестве контроля. После разделения белков на гелях SDS-PAGE (NuPAGE Novex 4-12% Bis-Tris, Invitrogen) белки переносили на нитроцеллюлозные мембраны. Мембраны исследовали с помощью биотинилированного козьего антитела к PDGFR-β человека (R&D Systems) с последующим мечением стрептавидином, конъюгированным с пероксидазой хрена (R&D Systems), и проявляли с помощью хемилюминесцентного реагента (ThermoScientific Pierce) до получения изображения. Подвижность белков гибридов 1, 2, 3 и 4 в невосстанавливающих условиях по сравнению с восстанавливающими условиями подтверждала, что гибридные белки были димеризованными (фиг. 4). PDGFR(D1-D5)9G-Fc и гибриды 1 и 2, все из которых содержали пять ECD PDGFR-β, показали две PDGFR-положительные полосы в восстанавливающих условиях, указывая на возможное протеолитическое отщепление этих белков в области пятого ECD PDGFR-β (фиг. 4, левая панель). Гибриды 3 и 4, которые содержат только первые три ECD PDGFR-β, по-видимому, не подвергаются отщеплению, указывая на то, что они не содержат сайта протеолитического отщепления, отмеченного у гибридов 1 и 2 (фиг. 4, левая панель).
Пример 3. Ингибирование пролиферации HUVEC гибридными белками PDGFR-β/VEGFR1
Гибридные белки PDGFR-β/VEGFR1 исследовали в отношении их способности ингибировать VEGF- и/или PDGFR-β-индуцированную пролиферацию эндотелиальных клеток пупочной вены человека (HUVEC). Для получения гибридных белков клетки 293 трансфицировали конструкциями, содержащими гибрид 1, гибрид 2, гибрид 3 или гибрид 4, и среду для культивирования клеток, содержащую гибридные белки, собирали через 72 часа после трансфекции. Собранную культуру клеток применяли по отношению к HUVEC в присутствии лиганда VEGF. HUVEC (HUVEC-Cambrex Bio Science Walkersville, Inc) высевали в 96-луночный планшет при плотности 2000 клеток/лунка в среде 199 (Invitrogen), дополненной 5% фетальной бычьей сывороткой (Invitrogen), и давали отстояться в течение ночи. После инкубирования среду замещали средой 199 (Invitrogen), дополненной 5% фетальной бычьей сывороткой (Invitrogen), содержащей равный объем (5 мкл) собранной культуры клеток, полученных от трех независимых рецепторных и контрольных трансфекций вместе с рекомбинантным лигандом hVEGF-165 отдельно в конечной концентрации 10 нг/мл (R&D Systems кат. № 293-VE), или в комбинации с лигандом PDGF-BB в конечной концентрации 20 нг/мл (R&D Systems кат. № 220-BB) в конечном объеме 100 мкл на лунку. Отрицательный контроль состоял из равного объема (5 мкл) собранной культуры клеток из клеток, трансфицированных конструкцией EGFP при 100 мкл конечного объема на лунку. Положительные контроли включали собранную культуру клеток равного объема (5 мкл) из клеток, трансфицированных конструкцией EGFP в присутствии лиганда VEGF или VEGF и лиганда BB PDGF при 100 мкл конечного объема на лунку. Клетки инкубировали при 37o C в 5% CO2 от трех до четырех дней. Cell Titer 96 AQueous One Solution Reagent (Promega кат. № G3580) добавляли при 20 мкл/лунка и спустя четыре часа снимали поглощение при 490 нм. При анализе VEGF-зависимой пролиферации HUVEC гибрид 2, гибрид 3 и гибрид 4 значительно блокировали пролиферацию HUVEC, при этом гибриды 2 и 4 обладали эффективностью, подобной sFLT01 (фиг. 5A). По сравнению с гибридами 2, 3 и 4, гибрид 1 не блокировал VEGF-индуцированную пролиферацию HUVEC и имел подобные уровни антипролиферативной активности по сравнению с белком (D1-D5)9G-Fc, который не имеет ECD VEGFR1 (фиг. 5A). Протеолитическое вырезание димеризующей последовательности IgG1-Fc в гибриде 1, вероятно, устраняло его VEGF-связывающую способность, поскольку димеризация является ограничивающим фактором для D2 VEGFR1-опосредованного VEGF-связывания, если другие ECD не присутствуют (Pechan P., et al. Gene Ther. (2009), 16:10-16). В гибриде 2, однако, протеолитическое отщепление разделяло молекулу на ECD PDGFR-β и sFLT01-содержащие блоки, которые все еще были способны связываться с VEGF (фиг. 5A). Собранные гибридные белки PDGFR-β/VEGFR1 также исследовали в анализе конкурентной пролиферации HUVEC. В этом анализе собранную культуру клеток применяли по отношению к HUVEC в присутствии как лиганда VEGF, так и лиганда BB PDGF, как описано выше. Результаты этого анализа были подобны предыдущему анализу в том, что гибрид 2 и гибрид 4 значительно блокировали пролиферацию HUVEC, при этом гибриды 2 и 4 обладали эффективностью, подобной sFLT01 (фиг. 5B). Гибрид 1 также не блокировал пролиферацию HUVEC в присутствии обоих лигандов. В противоположность последнему анализу, гибрид 3 обладал более слабой антипролиферативной эффективностью в присутствии обоих лигандов и был сопоставим с активностью белка PDGFR(D1-D5)9G-Fc, который не обладал ECD VEGFR1 (фиг. 5B). Статистическую значимость для обоих анализов пролиферации HUVEC анализировали с помощью Prism 5.0d (GraphPadSoftware Inc) и рассчитывали с помощью однофакторного анализа ANOVA с последующим применением критерия Тьюки.
Пример 4. Аффинности связывания для гибридных белков PDGFR-β/VEGFR1
Относительные аффинности связывания между лигандами VEGF и BB PDGF и гибридными белками PDGFR-β/VEGFR1 определяли с помощью системы бесклеточного волюметрического анализа связывания PDGF или VEGF (фиг. 6). Для получения гибридных белков PDGFR-β/VEGFR1 клетки 293 трансфицировали плазмидами, кодирующими гибрид 1, гибрид 2, гибрид 3 или гибрид 4. Клетки также трансфицировали плазмидами, кодирующими белки PDGFR(D1-D5)9G-Fc или sFLT01, для использования в качестве контроля связывания. Среду для культивирования клеток собирали через 72 часа после трансфекции и наличие секретируемых белков подтверждали с помощью ELISA и вестерн-блоттинга перед анализом аффинности связывания. Секретируемые белки серийно разбавляли, смешивали с лигандом VEGFR1 человека (конечная концентрация 20 пМ) или лигандом BB PDGF человека (конечная концентрация 80 пМ) и инкубировали на протяжении ночи при комнатной температуре на платформе орбитального встряхивателя. Количество несвязанного BB PDGF затем определяли с помощью ELISA, специфичного к VEGF человека (набор Human VEGF Quantikine ELISA, кат. № DVE00, R&D Systems) или ELISA, специфичного к PDGF человека (Human PDGF-BB DuoSet, R&D Systems). Сравнение всех четырех гибридов в анализе VEGF связывания показало, что гибрид 1 был самым слабым связывающим средством VEGF (фиг. 6A). Сравнение VEGF-связывания гибрида 3, гибрида 4 и sFLT01 в кондиционированной среде, собранной из трех отдельных трансфекций в одном анализе, показало, что гибрид 4 связывал VEGF подобно sFLT01 и был более сильным связывающим средством VEGF, чем гибрид 3 (фиг. 6A). Сравнение всех четырех гибридов в анализе PDGF связывания показало, что гибрид 1 также был самым слабым связывающим средством PDGF, в то время как гибрид 4 показал наилучшее связывание из всех четырех гибридов (фиг. 6B).
Бесклеточные анализы конкурентного связывания VEGF и PDGF проводили с использованием кондиционированной среды, собранной из клеток 293, трансфицированных конструкциями, кодирующими белки гибрида 3, гибрида 4, PDGFR(D1-D3)9G-Fc или sFLT01. Среду для культивирования клеток собирали через 72 часа после трансфекции и наличие секретируемых белков подтверждали с помощью ELISA и вестерн-блоттинга перед анализом аффинности связывания. Секретируемые белки серийно разбавляли, смешивали с лигандом BB PDGF человека (конечная концентрация 20 пМ) или лигандом VEGFR1 человека (конечная концентрация 20 пМ) и инкубировали на протяжении ночи при комнатной температуре на платформе орбитального встряхивателя. Количество несвязанных лигандов PDGF-BB и VEGF затем определяли с помощью ELISA, специфичного к VEGF человека (набор Human VEGF Quantikine ELISA, кат. № DVE00, R&D Systems) или ELISA, специфичного к PDGF человека (Human PDGF-BB DuoSet, R&D Systems). Сравнение гибрида 3 и гибрида 4 с BB PDGF связывающим контролем (PDGFR(D1-D3)9G-Fc) и VEGF связывающим контролем (sFLT01) показало, что гибрид 3 и гибрид 4 связывались с лигандами BB PDGF (фиг. 7A) и VEGF (фиг. 7B), при этом гибрид 4 проявляет более высокую аффинность связывания с обоими лигандами. Сравнение связывания PDGF с использованием среды для культивирования клеток из клеток, экспрессирующих гибрид 3, гибрид 4, PDGFR(D1-D5)9G-Fc или PDGFR(D1-D3)9G-Fc, показало, что гибрид 4 имел близкую аффинность по отношению к наилучшему связывающему средству PDGF, PDGFR(D1-D3)9G-Fc (фиг. 7A), в то время как PDGFR(D1-D5)9G-Fc был значительно более слабым связывающим веществом PDGF по сравнению со всеми гибридами от 1 до 4 (фиг. 6B) или PDGFR(D1-D3)9G-Fc (фиг. 2B).
Пример 5. Ингибирование индуцированной лазером CNV у мышей с помощью гибридных белков PDGFR-β/VEGFR1
Векторы аденоассоциированного вируса (AAV) являются привлекательными средствами для внутриглазной доставки генов в связи с их непатогенной природой, минимальной токсичностью и иммуногенностью, их способностью трансдуцировать неделящиеся клетки и их потенциалом для пожизненной экспрессии терапевтического белка (Ali et al. 1996; Ali et al. 1997; Ali et al., 1998; Lai et al. 2005).
Для опосредованной аденоассоциированным вирусом доставки гибрида 4, промотор CMV замещали промотором бета-актина цыпленка-интроном/энхансером CMV и кассету экспрессии, содержащую промотор и фрагмент, кодирующий гибрид 4, вставляли в сайты RsrII и MluI превирусного плазмидного вектора pAAVSP70. См. Ziegler et al. Mol Ther., 2004; 9: 231–240. Общий размер полученного в результате генома AAV в плазмиде sp70.BR/гибрид 4 составил 4,6 т.п.о. Рекомбинантный вектор AAV2.гибрид 4 получали с помощью тройной трансфекции клеток 293 с помощью хелперных плазмид p5rep-D-CMVcap и pHelper (Stratagene, La Jolla, Калифорния, США), и очищали в соответствии с протоколом производителя с помощью ступенчатого градиента иодиксанола и колонки HiTrap Heparin (GE Healthcare Life Sciences, Piscataway, Нью-Джерси, США) на системе A ̈KTA FPLC (GE Healthcare Life Sciences, Пискатауэй, Нью-Джерси). См. Vincent at al., J Virol., 1997; 71: 1897–1905. Вирусный препарат AAV2.гибрид 4 имел титр 2,2E12 drp (устойчивых к ДНКазе частиц) на миллилитр. Вирусные титры определяли с помощью анализа ПЦР TaqMan в реальном времени (ABI Prism 7700; Applied Biosystems, Фостер-Сити, Калифорния, США). AAV2.sFLT02 был разработан, как ранее описанный в патенте США № 7928072 с помощью нуклеиновой кислоты (SEQ ID NO: 40), кодирующей белок D2-9Gly-CH3 VEGFR1 (SEQ ID NO: 39). AAV2.гибрид 4, AAV2.sFLT02 или AAV2.PDGFR (PDGFR=PDGFR(D1-D3)9G-Fc) вводили с помощью интравитреальной доставки в лазерной модели мышиной хориоидальной неоваскуляризации (CNV) для определения эффективности in vivo гибрида 4 при ингибировании CNV. Вкратце, глаза нормальной взрослой мыши C57BL/6 подвергали воздействию однократной интравитреальной инъекции 1 E9 drp AAV2.гибрид 4, AAV2.sFLT02 или AAV2.PDGFR в левый глаз (OS) на 0 день исследования, в то время как правый глаз (OD) оставляли не подвергнутым лечению. CNV индуцировали в обоих глазах с помощью лазера (3 ожога, размещенные на глаз, мощность 200 мВт, участок 50 мкм, 100 мс) на 28 день исследования. Мышей перфузировали FITC-декстраном 5 мг/мл с молекулярным весом 2,0×106 и умерщвляли на 42 день исследования. Глаза собирали, фиксировали в 10% нейтральном буферном формалине, и после готовили хориоидальные плоские гистологические препараты для исследования степени неоваскуляризации. Число ожогов без CNV в обработанном (OS) глазе сравнивали с контрлатеральным (OD) глазом. Анализ эффективности in vivo показал, что однократная интравитреальная инъекция AAV2.гибрид 4 была более эффективной, чем AAV2.sFLT02, в ингибировании ретинальной неоваскуляризации (фиг. 8). Кроме того, AAV2.PDGFR не ингибировал неоваскуляризацию в мышиной индуцированной лазером модели CNV (фиг. 8).
ПОСЛЕДОВАТЕЛЬНОСТИ
Аминокислотная последовательность внеклеточной области D1-D3 PDGFR
LVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGY (SEQ ID NO:1)
Аминокислотная последовательность внеклеточной области D1-D4 PDGFR
LVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYVRLLGEVGTLQFAELHRSRTLQVVFEAYPPPTVLWFKDNRTLGDSSAGEIALSTRNVSETRYVSELTLVRVKVAEAGHYTMRAFHEDAEVQLSFQLQINVPVRVLE (SEQ ID NO:2)
Аминокислотная последовательность внеклеточной области D1-D5 PDGFR
LVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYVRLLGEVGTLQFAELHRSRTLQVVFEAYPPPTVLWFKDNRTLGDSSAGEIALSTRNVSETRYVSELTLVRVKVAEAGHYTMRAFHEDAEVQLSFQLQINVPVRVLELSESHPDSGEQTVRCRGRGMPQPNIIWSACRDLKRCPRELPPTLLGNSSEEESQLETNVTYWEEEQEFEVVSTLRLQHVDRPLSVRCTLRNAVGQDTQEVIVVPHSLPFK (SEQ ID NO:3)
Аминокислотная последовательность внеклеточной области D2 VEGFR1
RPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQT (SEQ ID NO:4)
Аминокислотная последовательность внеклеточной области D1-D3 VEGFR1
PELSLKGTQHIMQAGQTLHLQCRGEAAHKWSLPEMVSKESERLSITKSACGRNGKQFCSTLTLNTAQANHTGFYSCKYLAVPTSKKKETESAIYIFISDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVQISTPRPVKLLRGHTLVLNCTATTPLNTRVQMTWSYPDEKNKRASVRRRIDQSNSHANIFYSVLTIDKMQNKDKGLYTCRVRSGPSFKSVNTSVHIYDK (SEQ ID NO:5)
Аминокислотная последовательность Fc-области IgG1
PKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:6)
Аминокислотная последовательность PDGFR(D1-D5) с секреторным пептидом (подчеркнуто)
MRLPGAMPALALKGELLLLSLLLLLEPQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYVRLLGEVGTLQFAELHRSRTLQVVFEAYPPPTVLWFKDNRTLGDSSAGEIALSTRNVSETRYVSELTLVRVKVAEAGHYTMRAFHEDAEVQLSFQLQINVPVRVLELSESHPDSGEQTVRCRGRGMPQPNIIWSACRDLKRCPRELPPTLLGNSSEEESQLETNVTYWEEEQEFEVVSTLRLQHVDRPLSVRCTLRNAVGQDTQEVIVVPHSLPFK (SEQ ID NO:7)
Аминокислотная последовательность PDGFR(D1-D4) с секреторным пептидом (подчеркнуто)
MRLPGAMPALALKGELLLLSLLLLLEPQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYVRLLGEVGTLQFAELHRSRTLQVVFEAYPPPTVLWFKDNRTLGDSSAGEIALSTRNVSETRYVSELTLVRVKVAEAGHYTMRAFHEDAEVQLSFQLQINVPVRVLE (SEQ ID NO:8)
Аминокислотная последовательность PDGFR(D1-D5)9G-Fc с секреторным пептидом (подчеркнуто)
MRLPGAMPALALKGELLLLSLLLLLEPQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYVRLLGEVGTLQFAELHRSRTLQVVFEAYPPPTVLWFKDNRTLGDSSAGEIALSTRNVSETRYVSELTLVRVKVAEAGHYTMRAFHEDAEVQLSFQLQINVPVRVLELSESHPDSGEQTVRCRGRGMPQPNIIWSACRDLKRCPRELPPTLLGNSSEEESQLETNVTYWEEEQEFEVVSTLRLQHVDRPLSVRCTLRNAVGQDTQEVIVVPHSLPFKGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:9)
Аминокислотная последовательность PDGFR(D1-D3)9G-Fc с секреторным пептидом (подчеркнуто)
MRLPGAMPALALKGELLLLSLLLLLEPQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:10)
Аминокислотная последовательность PDGFR(D1-D2)9G-Fc с секреторным пептидом (подчеркнуто)
MRLPGAMPALALKGELLLLSLLLLLEPQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:11)
Аминокислотная последовательность гибрида 1
MVSYWDTGVLLCALLSCLLLTGSGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTSSSSSSSSSQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYVRLLGEVGTLQFAELHRSRTLQVVFEAYPPPTVLWFKDNRTLGDSSAGEIALSTRNVSETRYVSELTLVRVKVAEAGHYTMRAFHEDAEVQLSFQLQINVPVRVLELSESHPDSGEQTVRCRGRGMPQPNIIWSACRDLKRCPRELPPTLLGNSSEEESQLETNVTYWEEEQEFEVVSTLRLQHVDRPLSVRCTLRNAVGQDTQEVIVVPHSLPFTGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:12)
Аминокислотная последовательность гибрида 2
MRLPGAMPALALKGELLLLSLLLLLEPQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYVRLLGEVGTLQFAELHRSRTLQVVFEAYPPPTVLWFKDNRTLGDSSAGEIALSTRNVSETRYVSELTLVRVKVAEAGHYTMRAFHEDAEVQLSFQLQINVPVRVLELSESHPDSGEQTVRCRGRGMPQPNIIWSACRDLKRCPRELPPTLLGNSSEEESQLETNVTYWEEEQEFEVVSTLRLQHVDRPLSVRCTLRNAVGQDTQEVIVVPHSLPFSSSSSSSSSRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:13)
Аминокислотная последовательность гибрида 3
MVSYWDTGVLLCALLSCLLLTGSGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTSSSSSSSSSQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYTGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:14)
Аминокислотная последовательность гибрида 4
MRLPGAMPALALKGELLLLSLLLLLEPQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYSSSSSSSSSRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:15)
Открытая рамка считывания PDGFR(D1-D5)
ATGCGGCTTCCGGGTGCGATGCCAGCTCTGGCCCTCAAAGGCGAGCTGCTGTTGCTGTCTCTCCTGTTACTTCTGGAACCACAGATCTCTCAGGGCCTGGTCGTCACACCCCCGGGGCCAGAGCTTGTCCTCAATGTCTCCAGCACCTTCGTTCTGACCTGCTCGGGTTCAGCTCCGGTGGTGTGGGAACGGATGTCCCAGGAGCCCCCACAGGAAATGGCCAAGGCCCAGGATGGCACCTTCTCCAGCGTGCTCACACTGACCAACCTCACTGGGCTAGACACGGGAGAATACTTTTGCACCCACAATGACTCCCGTGGACTGGAGACCGATGAGCGGAAACGGCTCTACATCTTTGTGCCAGATCCCACCGTGGGCTTCCTCCCTAATGATGCCGAGGAACTATTCATCTTTCTCACGGAAATAACTGAGATCACCATTCCATGCCGAGTAACAGACCCACAGCTGGTGGTGACACTGCACGAGAAGAAAGGGGACGTTGCACTGCCTGTCCCCTATGATCACCAACGTGGCTTTTTTGGTATCTTTGAGGACAGAAGCTACATCTGCAAAACCACCATTGGGGACAGGGAGGTGGATTCTGATGCCTACTATGTCTACAGACTCCAGGTGTCATCCATCAACGTCTCTGTGAACGCAGTGCAGACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACGTGCGGCTCCTGGGAGAGGTGGGCACACTACAATTTGCTGAGCTGCATCGGAGCCGGACACTGCAGGTAGTGTTCGAGGCCTACCCACCGCCCACTGTCCTGTGGTTCAAAGACAACCGCACCCTGGGCGACTCCAGCGCTGGCGAAATCGCCCTGTCCACGCGCAACGTGTCGGAGACCCGGTATGTGTCAGAGCTGACACTGGTTCGCGTGAAGGTGGCAGAGGCTGGCCACTACACCATGCGGGCCTTCCATGAGGATGCTGAGGTCCAGCTCTCCTTCCAGCTACAGATCAATGTCCCTGTCCGAGTGCTGGAGCTAAGTGAGAGCCACCCTGACAGTGGGGAACAGACAGTCCGCTGTCGTGGCCGGGGCATGCCCCAGCCGAACATCATCTGGTCTGCCTGCAGAGACCTCAAAAGGTGTCCACGTGAGCTGCCGCCCACGCTGCTGGGGAACAGTTCCGAAGAGGAGAGCCAGCTGGAGACTAACGTGACGTACTGGGAGGAGGAGCAGGAGTTTGAGGTGGTGAGCACACTGCGTCTGCAGCACGTGGATCGGCCACTGTCGGTGCGCTGCACGCTGCGCAACGCTGTGGGCCAGGACACGCAGGAGGTCATCGTGGTGCCACACTCCTTGCCCTTTTAA (SEQ ID NO:16)
Открытая рамка считывания PDGFR(D1-D4)
ATGCGGCTTCCGGGTGCGATGCCAGCTCTGGCCCTCAAAGGCGAGCTGCTGTTGCTGTCTCTCCTGTTACTTCTGGAACCACAGATCTCTCAGGGCCTGGTCGTCACACCCCCGGGGCCAGAGCTTGTCCTCAATGTCTCCAGCACCTTCGTTCTGACCTGCTCGGGTTCAGCTCCGGTGGTGTGGGAACGGATGTCCCAGGAGCCCCCACAGGAAATGGCCAAGGCCCAGGATGGCACCTTCTCCAGCGTGCTCACACTGACCAACCTCACTGGGCTAGACACGGGAGAATACTTTTGCACCCACAATGACTCCCGTGGACTGGAGACCGATGAGCGGAAACGGCTCTACATCTTTGTGCCAGATCCCACCGTGGGCTTCCTCCCTAATGATGCCGAGGAACTATTCATCTTTCTCACGGAAATAACTGAGATCACCATTCCATGCCGAGTAACAGACCCACAGCTGGTGGTGACACTGCACGAGAAGAAAGGGGACGTTGCACTGCCTGTCCCCTATGATCACCAACGTGGCTTTTTTGGTATCTTTGAGGACAGAAGCTACATCTGCAAAACCACCATTGGGGACAGGGAGGTGGATTCTGATGCCTACTATGTCTACAGACTCCAGGTGTCATCCATCAACGTCTCTGTGAACGCAGTGCAGACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACGTGCGGCTCCTGGGAGAGGTGGGCACACTACAATTTGCTGAGCTGCATCGGAGCCGGACACTGCAGGTAGTGTTCGAGGCCTACCCACCGCCCACTGTCCTGTGGTTCAAAGACAACCGCACCCTGGGCGACTCCAGCGCTGGCGAAATCGCCCTGTCCACGCGCAACGTGTCGGAGACCCGGTATGTGTCAGAGCTGACACTGGTTCGCGTGAAGGTGGCAGAGGCTGGCCACTACACCATGCGGGCCTTCCATGAGGATGCTGAGGTCCAGCTCTCCTTCCAGCTACAGATCAATGTCCCTGTCCGAGTGCTGGAGTAG (SEQ ID NO:17)
Открытая рамка считывания PDGFR(D1-D5)9G-Fc
ATGCGGCTTCCGGGTGCGATGCCAGCTCTGGCCCTCAAAGGCGAGCTGCTGTTGCTGTCTCTCCTGTTACTTCTGGAACCACAGATCTCTCAGGGCCTGGTCGTCACACCCCCGGGGCCAGAGCTTGTCCTCAATGTCTCCAGCACCTTCGTTCTGACCTGCTCGGGTTCAGCTCCGGTGGTGTGGGAACGGATGTCCCAGGAGCCCCCACAGGAAATGGCCAAGGCCCAGGATGGCACCTTCTCCAGCGTGCTCACACTGACCAACCTCACTGGGCTAGACACGGGAGAATACTTTTGCACCCACAATGACTCCCGTGGACTGGAGACCGATGAGCGGAAACGGCTCTACATCTTTGTGCCAGATCCCACCGTGGGCTTCCTCCCTAATGATGCCGAGGAACTATTCATCTTTCTCACGGAAATAACTGAGATCACCATTCCATGCCGAGTAACAGACCCACAGCTGGTGGTGACACTGCACGAGAAGAAAGGGGACGTTGCACTGCCTGTCCCCTATGATCACCAACGTGGCTTTTTTGGTATCTTTGAGGACAGAAGCTACATCTGCAAAACCACCATTGGGGACAGGGAGGTGGATTCTGATGCCTACTATGTCTACAGACTCCAGGTGTCATCCATCAACGTCTCTGTGAACGCAGTGCAGACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACGTGCGGCTCCTGGGAGAGGTGGGCACACTACAATTTGCTGAGCTGCATCGGAGCCGGACACTGCAGGTAGTGTTCGAGGCCTACCCACCGCCCACTGTCCTGTGGTTCAAAGACAACCGCACCCTGGGCGACTCCAGCGCTGGCGAAATCGCCCTGTCCACGCGCAACGTGTCGGAGACCCGGTATGTGTCAGAGCTGACACTGGTTCGCGTGAAGGTGGCAGAGGCTGGCCACTACACCATGCGGGCCTTCCATGAGGATGCTGAGGTCCAGCTCTCCTTCCAGCTACAGATCAATGTCCCTGTCCGAGTGCTGGAGCTAAGTGAGAGCCACCCTGACAGTGGGGAACAGACAGTCCGCTGTCGTGGCCGGGGCATGCCCCAGCCGAACATCATCTGGTCTGCCTGCAGAGACCTCAAAAGGTGTCCACGTGAGCTGCCGCCCACGCTGCTGGGGAACAGTTCCGAAGAGGAGAGCCAGCTGGAGACTAACGTGACGTACTGGGAGGAGGAGCAGGAGTTTGAGGTGGTGAGCACACTGCGTCTGCAGCACGTGGATCGGCCACTGTCGGTGCGCTGCACGCTGCGCAACGCTGTGGGCCAGGACACGCAGGAGGTCATCGTGGTGCCACACTCCTTGCCCTTTACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATAG (SEQ ID NO:18)
Открытая рамка считывания PDGFR(D1-D3)9G-Fc
ATGCGGCTTCCGGGTGCGATGCCAGCTCTGGCCCTCAAAGGCGAGCTGCTGTTGCTGTCTCTCCTGTTACTTCTGGAACCACAGATCTCTCAGGGCCTGGTCGTCACACCCCCGGGGCCAGAGCTTGTCCTCAATGTCTCCAGCACCTTCGTTCTGACCTGCTCGGGTTCAGCTCCGGTGGTGTGGGAACGGATGTCCCAGGAGCCCCCACAGGAAATGGCCAAGGCCCAGGATGGCACCTTCTCCAGCGTGCTCACACTGACCAACCTCACTGGGCTAGACACGGGAGAATACTTTTGCACCCACAATGACTCCCGTGGACTGGAGACCGATGAGCGGAAACGGCTCTACATCTTTGTGCCAGATCCCACCGTGGGCTTCCTCCCTAATGATGCCGAGGAACTATTCATCTTTCTCACGGAAATAACTGAGATCACCATTCCATGCCGAGTAACAGACCCACAGCTGGTGGTGACACTGCACGAGAAGAAAGGGGACGTTGCACTGCCTGTCCCCTATGATCACCAACGTGGCTTTTTTGGTATCTTTGAGGACAGAAGCTACATCTGCAAAACCACCATTGGGGACAGGGAGGTGGATTCTGATGCCTACTATGTCTACAGACTCCAGGTGTCATCCATCAACGTCTCTGTGAACGCAGTGCAGACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATAG (SEQ ID NO:19)
Открытая рамка считывания PDGFR(D1-D2)9G-Fc
ATGCGGCTTCCGGGTGCGATGCCAGCTCTGGCCCTCAAAGGCGAGCTGCTGTTGCTGTCTCTCCTGTTACTTCTGGAACCACAGATCTCTCAGGGCCTGGTCGTCACACCCCCGGGGCCAGAGCTTGTCCTCAATGTCTCCAGCACCTTCGTTCTGACCTGCTCGGGTTCAGCTCCGGTGGTGTGGGAACGGATGTCCCAGGAGCCCCCACAGGAAATGGCCAAGGCCCAGGATGGCACCTTCTCCAGCGTGCTCACACTGACCAACCTCACTGGGCTAGACACGGGAGAATACTTTTGCACCCACAATGACTCCCGTGGACTGGAGACCGATGAGCGGAAACGGCTCTACATCTTTGTGCCAGATCCCACCGTGGGCTTCCTCCCTAATGATGCCGAGGAACTATTCATCTTTCTCACGGAAATAACTGAGATCACCATTCCATGCCGAGTAACAGACCCACAGCTGGTGGTGACACTGCACGAGAAGAAAGGGGACGTTGCACTGCCTGTCCCCTATGATCACCAACGTGGCTTTTTTGGTATCTTTGAGGACAGAAGCTACATCTGCAAAACCACCATTGGGGACAGGGAGGTGGATTCTGATGCCTACTATGTCTACAGACTCCAGGTGTCATCCACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATAG (SEQ ID NO:20)
Открытая рамка считывания гибрида 1
ATGGTCAGCTACTGGGACACCGGGGTCCTGCTGTGCGCGCTGCTCAGCTGTCTGCTTCTCACAGGATCTGGTAGACCTTTCGTAGAGATGTACAGTGAAATCCCCGAAATTATACACATGACTGAAGGAAGGGAGCTCGTCATTCCCTGCCGGGTTACGTCACCTAACATCACTGTTACTTTAAAAAAGTTTCCACTTGACACTTTGATCCCTGATGGAAAACGCATAATCTGGGACAGTAGAAAGGGCTTCATCATATCAAATGCAACGTACAAAGAAATAGGGCTTCTGACCTGTGAAGCAACAGTCAATGGGCATTTGTATAAGACAAACTATCTCACACATCGACAAACCTCGAGTTCCAGCTCCTCTTCCTCAAGCCAGATCTCTCAGGGCCTGGTCGTCACACCCCCGGGGCCAGAGCTTGTCCTCAATGTCTCCAGCACCTTCGTTCTGACCTGCTCGGGTTCAGCTCCGGTGGTGTGGGAACGGATGTCCCAGGAGCCCCCACAGGAAATGGCCAAGGCCCAGGATGGCACCTTCTCCAGCGTGCTCACACTGACCAACCTCACTGGGCTAGACACGGGAGAATACTTTTGCACCCACAATGACTCCCGTGGACTGGAGACCGATGAGCGGAAACGGCTCTACATCTTTGTGCCAGATCCCACCGTGGGCTTCCTCCCTAATGATGCCGAGGAACTATTCATCTTTCTCACGGAAATAACTGAGATCACCATTCCATGCCGAGTAACAGACCCACAGCTGGTGGTGACACTGCACGAGAAGAAAGGGGACGTTGCACTGCCTGTCCCCTATGATCACCAACGTGGCTTTTTTGGTATCTTTGAGGACAGAAGCTACATCTGCAAAACCACCATTGGGGACAGGGAGGTGGATTCTGATGCCTACTATGTCTACAGACTCCAGGTGTCATCCATCAACGTCTCTGTGAACGCAGTGCAGACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACGTGCGGCTCCTGGGAGAGGTGGGCACACTACAATTTGCTGAGCTGCATCGGAGCCGGACACTGCAGGTAGTGTTCGAGGCCTACCCACCGCCCACTGTCCTGTGGTTCAAAGACAACCGCACCCTGGGCGACTCCAGCGCTGGCGAAATCGCCCTGTCCACGCGCAACGTGTCGGAGACCCGGTATGTGTCAGAGCTGACACTGGTTCGCGTGAAGGTGGCAGAGGCTGGCCACTACACCATGCGGGCCTTCCATGAGGATGCTGAGGTCCAGCTCTCCTTCCAGCTACAGATCAATGTCCCTGTCCGAGTGCTGGAGCTAAGTGAGAGCCACCCTGACAGTGGGGAACAGACAGTCCGCTGTCGTGGCCGGGGCATGCCCCAGCCGAACATCATCTGGTCTGCCTGCAGAGACCTCAAAAGGTGTCCACGTGAGCTGCCGCCCACGCTGCTGGGGAACAGTTCCGAAGAGGAGAGCCAGCTGGAGACTAACGTGACGTACTGGGAGGAGGAGCAGGAGTTTGAGGTGGTGAGCACACTGCGTCTGCAGCACGTGGATCGGCCACTGTCGGTGCGCTGCACGCTGCGCAACGCTGTGGGCCAGGACACGCAGGAGGTCATCGTGGTGCCACACTCCTTGCCCTTTACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATAG (SEQ ID NO:21)
Открытая рамка считывания гибрида 2
ATGCGGCTTCCGGGTGCGATGCCAGCTCTGGCCCTCAAAGGCGAGCTGCTGTTGCTGTCTCTCCTGTTACTTCTGGAACCACAGATCTCTCAGGGCCTGGTCGTCACACCCCCGGGGCCAGAGCTTGTCCTCAATGTCTCCAGCACCTTCGTTCTGACCTGCTCGGGTTCAGCTCCGGTGGTGTGGGAACGGATGTCCCAGGAGCCCCCACAGGAAATGGCCAAGGCCCAGGATGGCACCTTCTCCAGCGTGCTCACACTGACCAACCTCACTGGGCTAGACACGGGAGAATACTTTTGCACCCACAATGACTCCCGTGGACTGGAGACCGATGAGCGGAAACGGCTCTACATCTTTGTGCCAGATCCCACCGTGGGCTTCCTCCCTAATGATGCCGAGGAACTATTCATCTTTCTCACGGAAATAACTGAGATCACCATTCCATGCCGAGTAACAGACCCACAGCTGGTGGTGACACTGCACGAGAAGAAAGGGGACGTTGCACTGCCTGTCCCCTATGATCACCAACGTGGCTTTTTTGGTATCTTTGAGGACAGAAGCTACATCTGCAAAACCACCATTGGGGACAGGGAGGTGGATTCTGATGCCTACTATGTCTACAGACTCCAGGTGTCATCCATCAACGTCTCTGTGAACGCAGTGCAGACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACGTGCGGCTCCTGGGAGAGGTGGGCACACTACAATTTGCTGAGCTGCATCGGAGCCGGACACTGCAGGTAGTGTTCGAGGCCTACCCACCGCCCACTGTCCTGTGGTTCAAAGACAACCGCACCCTGGGCGACTCCAGCGCTGGCGAAATCGCCCTGTCCACGCGCAACGTGTCGGAGACCCGGTATGTGTCAGAGCTGACACTGGTTCGCGTGAAGGTGGCAGAGGCTGGCCACTACACCATGCGGGCCTTCCATGAGGATGCTGAGGTCCAGCTCTCCTTCCAGCTACAGATCAATGTCCCTGTCCGAGTGCTGGAGCTAAGTGAGAGCCACCCTGACAGTGGGGAACAGACAGTCCGCTGTCGTGGCCGGGGCATGCCCCAGCCGAACATCATCTGGTCTGCCTGCAGAGACCTCAAAAGGTGTCCACGTGAGCTGCCGCCCACGCTGCTGGGGAACAGTTCCGAAGAGGAGAGCCAGCTGGAGACTAACGTGACGTACTGGGAGGAGGAGCAGGAGTTTGAGGTGGTGAGCACACTGCGTCTGCAGCACGTGGATCGGCCACTGTCGGTGCGCTGCACGCTGCGCAACGCTGTGGGCCAGGACACGCAGGAGGTCATCGTGGTGCCACACTCCTTGCCCTTTAGTTCCAGCTCCTCTTCCTCAAGCTCGCCTTTCGTAGAGATGTACAGTGAAATCCCCGAAATTATACACATGACTGAAGGAAGGGAGCTCGTCATTCCCTGCCGGGTTACGTCACCTAACATCACTGTTACTTTAAAAAAGTTTCCACTTGACACTTTGATCCCTGATGGAAAACGCATAATCTGGGACAGTAGAAAGGGCTTCATCATATCAAATGCAACGTACAAAGAAATAGGGCTTCTGACCTGTGAAGCAACAGTCAATGGGCATTTGTATAAGACAAACTATCTCACACATCGACAAACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATAG (SEQ ID NO:22)
Открытая рамка считывания гибрида 3
ATGGTCAGCTACTGGGACACCGGGGTCCTGCTGTGCGCGCTGCTCAGCTGTCTGCTTCTCACAGGATCTGGTAGACCTTTCGTAGAGATGTACAGTGAAATCCCCGAAATTATACACATGACTGAAGGAAGGGAGCTCGTCATTCCCTGCCGGGTTACGTCACCTAACATCACTGTTACTTTAAAAAAGTTTCCACTTGACACTTTGATCCCTGATGGAAAACGCATAATCTGGGACAGTAGAAAGGGCTTCATCATATCAAATGCAACGTACAAAGAAATAGGGCTTCTGACCTGTGAAGCAACAGTCAATGGGCATTTGTATAAGACAAACTATCTCACACATCGACAAACCTCGAGTTCCAGCTCCTCTTCCTCAAGCCAGATCTCTCAGGGCCTGGTCGTCACACCCCCGGGGCCAGAGCTTGTCCTCAATGTCTCCAGCACCTTCGTTCTGACCTGCTCGGGTTCAGCTCCGGTGGTGTGGGAACGGATGTCCCAGGAGCCCCCACAGGAAATGGCCAAGGCCCAGGATGGCACCTTCTCCAGCGTGCTCACACTGACCAACCTCACTGGGCTAGACACGGGAGAATACTTTTGCACCCACAATGACTCCCGTGGACTGGAGACCGATGAGCGGAAACGGCTCTACATCTTTGTGCCAGATCCCACCGTGGGCTTCCTCCCTAATGATGCCGAGGAACTATTCATCTTTCTCACGGAAATAACTGAGATCACCATTCCATGCCGAGTAACAGACCCACAGCTGGTGGTGACACTGCACGAGAAGAAAGGGGACGTTGCACTGCCTGTCCCCTATGATCACCAACGTGGCTTTTTTGGTATCTTTGAGGACAGAAGCTACATCTGCAAAACCACCATTGGGGACAGGGAGGTGGATTCTGATGCCTACTATGTCTACAGACTCCAGGTGTCATCCATCAACGTCTCTGTGAACGCAGTGCAGACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATAG (SEQ ID NO:23)
Открытая рамка считывания гибрида 4
ATGCGGCTTCCGGGTGCGATGCCAGCTCTGGCCCTCAAAGGCGAGCTGCTGTTGCTGTCTCTCCTGTTACTTCTGGAACCACAGATCTCTCAGGGCCTGGTCGTCACACCCCCGGGGCCAGAGCTTGTCCTCAATGTCTCCAGCACCTTCGTTCTGACCTGCTCGGGTTCAGCTCCGGTGGTGTGGGAACGGATGTCCCAGGAGCCCCCACAGGAAATGGCCAAGGCCCAGGATGGCACCTTCTCCAGCGTGCTCACACTGACCAACCTCACTGGGCTAGACACGGGAGAATACTTTTGCACCCACAATGACTCCCGTGGACTGGAGACCGATGAGCGGAAACGGCTCTACATCTTTGTGCCAGATCCCACCGTGGGCTTCCTCCCTAATGATGCCGAGGAACTATTCATCTTTCTCACGGAAATAACTGAGATCACCATTCCATGCCGAGTAACAGACCCACAGCTGGTGGTGACACTGCACGAGAAGAAAGGGGACGTTGCACTGCCTGTCCCCTATGATCACCAACGTGGCTTTTTTGGTATCTTTGAGGACAGAAGCTACATCTGCAAAACCACCATTGGGGACAGGGAGGTGGATTCTGATGCCTACTATGTCTACAGACTCCAGGTGTCATCCATCAACGTCTCTGTGAACGCAGTGCAGACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACAGTTCCAGCTCCTCTTCCTCAAGCTCGAGACCTTTCGTAGAGATGTACAGTGAAATCCCCGAAATTATACACATGACTGAAGGAAGGGAGCTCGTCATTCCCTGCCGGGTTACGTCACCTAACATCACTGTTACTTTAAAAAAGTTTCCACTTGACACTTTGATCCCTGATGGAAAACGCATAATCTGGGACAGTAGAAAGGGCTTCATCATATCAAATGCAACGTACAAAGAAATAGGGCTTCTGACCTGTGAAGCAACAGTCAATGGGCATTTGTATAAGACAAACTATCTCACACATCGACAAACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATAG (SEQ ID NO:24)
Праймер нуклеиновой кислоты PDGFRBPR6SpeI F
GACTAGTATGCGGCTTCCGGGTG (SEQ ID NO:25)
Праймер нуклеиновой кислоты PDGFRBPR7AgeI R
ACCGGTGGATGACACCTGGAGTCTG (SEQ ID NO:26)
Праймер нуклеиновой кислоты PDGFRB-PR1-Acc F
CTATGTCTACAGACTCCAGGTGTC (SEQ ID NO:27)
Праймер нуклеиновой кислоты D5-PR9-AgeI-Rev R
ACCGGTAAAGGGCAAGGAGTGTGGC (SEQ ID NO:28)
Праймер нуклеиновой кислоты PDGF02 F
CCTCCACCGGTGTAGCCGCTCTCAACCACGGT (SEQ ID NO:29)
Праймер нуклеиновой кислоты PDGF03 R
CCCGGGACTAGTATGCGGCTTCCGGGTG (SEQ ID NO:30)
Праймер нуклеиновой кислоты D5-SV40 F
CCGGTTAGGGA (SEQ ID NO:31)
Праймер нуклеиновой кислоты D5-SV40 B-2
GGCCTCCCTAA (SEQ ID NO:32)
Праймер нуклеиновой кислоты D4-SV40 F
TGAGGTCCAGCTCTCCTTCCAGCTACAGATCAATGTCCCTGTCCGAGTGCTGGAGTAGC (SEQ ID NO:33)
Праймер нуклеиновой кислоты D4-SV40
GGCCGCTACTCCAGCACTCGGACAGGGACATTGATCTGTAGCTGGAAGGAGAGCTGGACC (SEQ ID NO:34)
Фрагмент синтетической нуклеиновой кислоты Kozak-SP-D2-9Ser
ACTAGTGGCGGCCGCCACCATGGTCAGCTACTGGGACACCGGGGTCCTGCTGTGCGCGCTGCTCAGCTGTCTGCTTCTCACAGGATCTGGTAGACCTTTCGTAGAGATGTACAGTGAAATCCCCGAAATTATACACATGACTGAAGGAAGGGAGCTCGTCATTCCCTGCCGGGTTACGTCACCTAACATCACTGTTACTTTAAAAAAGTTTCCACTTGACACTTTGATCCCTGATGGAAAACGCATAATCTGGGACAGTAGAAAGGGCTTCATCATATCAAATGCAACGTACAAAGAAATAGGGCTTCTGACCTGTGAAGCAACAGTCAATGGGCATTTGTATAAGACAAACTATCTCACACATCGACAAACCTCGAGTTCCAGCTCCTCTTCCTCAAGCCAGATCT (SEQ ID NO:35)
Фрагмент синтетической нуклеиновой кислоты D2-2220-2908
CCACGCTGCTGGGGAACAGTTCCGAAGAGGAGAGCCAGCTGGAGACTAACGTGACGTACTGGGAGGAGGAGCAGGAGTTTGAGGTGGTGAGCACACTGCGTCTGCAGCACGTGGATCGGCCACTGTCGGTGCGCTGCACGCTGCGCAACGCTGTGGGCCAGGACACGCAGGAGGTCATCGTGGTGCCACACTCCTTGCCCTTTAGTTCCAGCTCCTCTTCCTCAAGCTCGAGACCTTTCGTAGAGATGTACAGTGAAATCCCCGAAATTATACACATGACTGAAGGAAGGGAGCTCGTCATTCCCTGCCGGGTTACGTCACCTAACATCACTGTTACTTTAAAAAAGTTTCCACTTGACACTTTGATCCCTGATGGAAAACGCATAATCTGGGACAGTAGAAAGGGCTTCATCATATCAAATGCAACGTACAAAGAAATAGGGCTTCTGACCTGTGAAGCAACAGTCAATGGGCATTTGTATAAGACAAACTATCTCACACATCGACAAACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTG (SEQ ID NO:36)
Фрагмент синтетической нуклеиновой кислоты D3-Fc
GACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTG (SEQ ID NO:37)
Фрагмент синтетической нуклеиновой кислоты D3-F(D2)
GACTGTGGTCCGCCAGGGTGAGAACATCACCCTCATGTGCATTGTGATCGGGAATGAGGTGGTCAACTTCGAGTGGACATACCCCCGCAAAGAAAGTGGGCGGCTGGTGGAGCCGGTGACTGACTTCCTCTTGGATATGCCTTACCACATCCGCTCCATCCTGCACATCCCCAGTGCCGAGTTAGAAGACTCGGGGACCTACACCTGCAATGTGACGGAGAGTGTGAATGACCATCAGGATGAAAAGGCCATCAACATCACCGTGGTTGAGAGCGGCTACAGTTCCAGCTCCTCTTCCTCAAGCTCGAGACCTTTCGTAGAGATGTACAGTGAAATCCCCGAAATTATACACATGACTGAAGGAAGGGAGCTCGTCATTCCCTGCCGGGTTACGTCACCTAACATCACTGTTACTTTAAAAAAGTTTCCACTTGACACTTTGATCCCTGATGGAAAACGCATAATCTGGGACAGTAGAAAGGGCTTCATCATATCAAATGCAACGTACAAAGAAATAGGGCTTCTGACCTGTGAAGCAACAGTCAATGGGCATTTGTATAAGACAAACTATCTCACACATCGACAAACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCCTAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTG (SEQ ID NO:38)
Аминокислотная последовательность sFLT02 (D2-9Gly-CH3)
MVSYWDTGVLLCALLSCLLLTGSGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTGGGGGGGGGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:39)
Открытая рамка считывания sFLT02 (D2-9Gly-CH3)
ATGGTCAGCTACTGGGACACCGGGGTCCTGCTGTGCGCGCTGCTCAGCTGTCTGCTTCTCACAGGATCTGGTAGACCTTTCGTAGAGATGTACAGTGAAATCCCCGAAATTATACACATGACTGAAGGAAGGGAGCTCGTCATTCCCTGCCGGGTTACGTCACCTAACATCACTGTTACTTTAAAAAAGTTTCCACTTGACACTTTGATCCCTGATGGAAAACGCATAATCTGGGACAGTAGAAAGGGCTTCATCATATCAAATGCAACGTACAAAGAAATAGGGCTTCTGACCTGTGAAGCAACAGTCAATGGGCATTTGTATAAGACAAACTATCTCACACATCGACAAACCGGTGGAGGTGGAGGTGGAGGTGGAGGTCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATAG (SEQ ID NO:40)
Последовательность нуклеиновой кислоты мутированного ITR
CACTCCCTCTCTGCGCGCTCGCTCGCTCACTGAGGCCGGGCGACCAAAGGTCGCCCACGCCCGGGCTTTGCCCGGGCG (SEQ ID NO:41)
Аминокислотная последовательность гибрида 1 без секреторного пептида
RPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTSSSSSSSSSQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYVRLLGEVGTLQFAELHRSRTLQVVFEAYPPPTVLWFKDNRTLGDSSAGEIALSTRNVSETRYVSELTLVRVKVAEAGHYTMRAFHEDAEVQLSFQLQINVPVRVLELSESHPDSGEQTVRCRGRGMPQPNIIWSACRDLKRCPRELPPTLLGNSSEEESQLETNVTYWEEEQEFEVVSTLRLQHVDRPLSVRCTLRNAVGQDTQEVIVVPHSLPFTGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:42)
Аминокислотная последовательность гибрида 2 без секреторного пептида
LVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYVRLLGEVGTLQFAELHRSRTLQVVFEAYPPPTVLWFKDNRTLGDSSAGEIALSTRNVSETRYVSELTLVRVKVAEAGHYTMRAFHEDAEVQLSFQLQINVPVRVLELSESHPDSGEQTVRCRGRGMPQPNIIWSACRDLKRCPRELPPTLLGNSSEEESQLETNVTYWEEEQEFEVVSTLRLQHVDRPLSVRCTLRNAVGQDTQEVIVVPHSLPFSSSSSSSSSRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:43)
Аминокислотная последовательность гибрида 3 без секреторного пептида
RPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTSSSSSSSSSQISQGLVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYTGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:44)
Аминокислотная последовательность гибрида 4 без секреторного пептида
LVVTPPGPELVLNVSSTFVLTCSGSAPVVWERMSQEPPQEMAKAQDGTFSSVLTLTNLTGLDTGEYFCTHNDSRGLETDERKRLYIFVPDPTVGFLPNDAEELFIFLTEITEITIPCRVTDPQLVVTLHEKKGDVALPVPYDHQRGFFGIFEDRSYICKTTIGDREVDSDAYYVYRLQVSSINVSVNAVQTVVRQGENITLMCIVIGNEVVNFEWTYPRKESGRLVEPVTDFLLDMPYHIRSILHIPSAELEDSGTYTCNVTESVNDHQDEKAINITVVESGYSSSSSSSSSRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTGGGGGGGGGPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:45)
Реферат
Изобретение относится к области биотехнологии, конкретно к получению слитых белков, связывающихся с PDGF и VEGF, и рекомбинантных вирусных частиц, кодирующих слитые белки, и может быть использовано в медицине. Связывающиеся с PDGF и VEGF слитые белки используют в составе композиций для эффективного ингибирования PDGF-пути и VEGF-пути. Вирусные частицы, кодирующие связывающиеся с PDGF и VEGF слитые белки, используют в эффективной терапии неоваскуляризации роговицы. 9 н. и 5 з.п. ф-лы, 8 ил., 5 пр.

Комментарии