Способ получения хондро-остеогенных клеток in vitro из мезенхимных стволовых клеток человека и их применение - RU2375447C2
Код документа: RU2375447C2
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биомедицинской промышленности, связанной с производством агентов, применяемых при репарации костного скелета, а именно при репарации хрящевой и костной ткани любой этиологии, при спинальной стабилизации или артродезе, остеосинтезе, протезировании при артропластике, при остеопорозе и т.д., а также любой другой производимой репарации или регенерации костной или хрящевой ткани и где дополнительное применение дифференцирующихся клеток эффективно помогает в достижении тканевой репарации.
Уровень техники
Регенерация тканей является сложным процессом, включающим в наивысшей своей точке самые разнообразные клетки, которые присутствовали в месте повреждения ранее или были привлечены туда позже. Все события, проистекающие в процессе репарации, определяются большим количеством взаимодействий между ростовыми факторами и цитокинами, клетками и молекулами, образующими внеклеточный матрикс.
В кости сосуществуют различные индукторы сигналов и факторы роста, включающие TGF-β, PDGF, различные BMP, IGF и FGF (Becerra et al., Med. Clin. 116: 23-24 (2001)). Из них остеоиндуцирующими являются только BMP; однако все они участвуют в репарации фрактуры (Reddi, Nature Medicine 3: 837-839 (1998); Groeneveld and Burger, Eur. J. Endocrinol. 142:9-21 (2000)). В кости имеются также предшественники остеогенных клеток, отвечающие на стимулы фрактуры, активируя и продуцируя BMP, которые в свою очередь индуцируют миграцию мезенхимных стволовых клеток (МСК), пролиферирующих и дифференцирующихся в клетки, формирующие кость (Guerado et al., Rev. Ortop. Traumatol. 47, 362-374 (2003)). Однако понимание сложных взаимоотношений между мезенхимными стволовыми клетками и остеопрогениторными клетками-предшественниками с биохимическими сигналами, модулирующими их миграцию, пролиферацию и дифференциацию в остеогенную клеточную линию, до сих пор имеет существенные пробелы.
TGF-β - группа ростовых факторов, кодируемая семейством генов, экспрессированных во многих тканях и у многих видов (Kindsley, Genes Dev. 8: 133-146 (1994); Bostrom and Asnis, Clin. Orthop. Relat. R. 355S: 124-131 (1998)). Костная ткань была одной из первых тканей, где наблюдали местную продукцию TGF-β, обладающую способностью регулировать клеточные функции (Centrella et al., J. Bone Joint Surg. 73-A: 1418-1428 (1991)). Хотя тромбоциты являются основным источником TGF-β, костная ткань является наиболее существенным резервуаром этого фактора, в 100 раз большим, чем в других мягких тканях, где также имеются BMP (Roberts et al., Biochemistry 22: 5692-5698 (1983)).
В последние годы были получены существенные, иногда противоречивые результаты, когда TGF-β добавлялся к культуре остеобластных клеток. Его митогенное или остеоиндуцирующее или противоположное действие приписывали гетерогенности клеток в культуре, присутствию других ростовых факторов, плотности клеток, условиям культивирования или возможной двухфазности действия фактора (Noda et al., Endocrinology 124: 612-617 (1988); Stein and Lian, Cellular and Molecular Biology of Bone. San Diego: Academic Press 47-95 (1993)). В результате недавних исследований было обнаружено существование различных клеток-мишеней для TGF-β и BMP. Оказалось, что первые действуют на стволовые клетки, уже вовлеченные в остеогенную линию, тогда как BMP могут действовать на некомпетентные клетки (Ballok et al., J. Orthop.Res. 15:463-467 (1997)). В любом случае ясно, что МСК могут самообновляться и размножаться в присутствии TGF-β I (Andrades et al., Cells. Exp.Cell. Res. 250: 485-498 (1999)).
Недавно был разработан экспериментальный подход, позволяющий контролировать биодоступность TGF-β1 в культуре МСК, заключающийся в том, что популяцию клеток, выделенную из спинного мозга крысы, наращивают (амплификация) и для перевода в остеогенную линию подвергают индукции, культивируя в гелях из коллагена в присутствии модифицированного TGF-β1, имеющего молекулярный домен, обеспечивающий специфическое связывание фактора с коллагеном I. Было высказано предположение, что такой TGF-β1 имеет увеличенный срок жизни и более высокую биодоступность при действии на клетки-мишени, так как активный фактор постепенно высвобождается в гель из связанного с коллагеном состояния (Andrades et al., Cells. Exp. Cell. Res. 250: 485-498 (1999)).
Было показано, что способность костной ткани к регенерации с возрастом снижается. Если количество гематопоэтических клеток в костном мозге сохраняется постоянным в продолжение жизни, то количество МСК существенно снижается, кроме того, отмечается отсутствие остеоиндуцирующих факторов или неспособность клеток продуцировать их или отвечать на них (Haynesworth et al., Musculoskeletal Soft-Tissuue Aging: Impact on Mobility. Section 1, Chapter 7. Rosemont: AAOS, 80-86 (1994)). Поэтому заманчиво было бы разработать метод, позволяющий собирать МСК у тех индивидов, которые не обладают способностью к восстановлению костей, амплифицировать их in vitro и переводить в остеогенную линию клеток (процесс капаситации).
Затем обработанные клетки можно было бы доставлять туда, где требуется репарация скелета пациента, внося их в подходящий биологический материал; такой метод представлял бы собой разновидность аутоиммунной клеточной терапии, позволяющей эффективно восстанавливать потерянную или серьезно нарушенную остеорепаративную функцию. Такой метод позволил бы также избежать нежелательных последствий системного или местного введения биологически активных факторов путем непосредственного контроля за их распространением за пределы зоны репарации при возникновении трудностей, чтобы их плейотропные эффекты не мешали.
В любом случае, когда требуется консолидация двух или более костных фрагментов, трансплантацию капаситированных клеток следует делать в специальном микроокружении, стимулирующем остеогенез. Например, когда фрактура или неконсолидированный фокус (псевдоартроз) характеризуется гиперваскуляризацией и пролиферацией хондро-остеогенной ткани (не связывающий или гипертрофический псевдоартроз), простая, устойчивая нединамическая стабилизация фокуса с помощью интра- или экстрамедуллярных имплантов должна вызвать консолидацию. В таких случаях при подсадке капаситированных клеток к остеогенной линии на носитель из гидроксиапатита или коллагена после остеосинтеза получается стабильное гиперваскулярное ложе, являющееся идеальным микроокружением для развития остеогенного каллуса. В случаях же неконсолидированного или атрофического псевдоартроза фиброзная ткань между двумя фрагментами должна быть удалена, кости оставлены рядом друг с другом и должен быть обеспечен источник сосудистого кровоснабжения путем перфораций кости и обкладывания васкуляризованной тканью (как правило, мышечной). Оба фрагмента должны быть застабилизированы остеосинтезом при жестком соединении, предотвращающем подвижность в межкостном пространстве, так как в случае подвижности в этом пространстве соединение следует разрушить и предотвратить пролиферацию сосудистой ткани и тогда нужно будет стимулировать экспрессию химических медиаторов, приводящих к индукции хондрогенеза вместо остеоостеогенеза (Rüedi and Murphy, АО Principles of fracture management. Sttugart, Georg Thieme Verlag (2000); Browne et al., Skeletal Trauma, Basic Science, Management and Reconstruction. Philadelphia, Sounders (2003)).
Необходимо также разрабатывать методы, способствующие увеличению способности формирования костной массы у индивидов с остеопорозом, путем восстановления у этих пациентов нарушенного равновесия между костеобразованием и резорбцией, сдвинутого в сторону первого процесса. Системное введение in vitro капаситированных клеток в остеогенную линию позволит сбалансировать это равновесие.
Раскрытие изобретения
Настоящее изобретение направлено на приготовление агентов и композиционных препаратов, используемых в репарации костного скелета и более конкретно целей при репарации хрящевой и костной ткани, при остеопорозе, протезировании при артропластике и т.д., которые можно инъецировать in situ в небольшие несращенные фрактуры или в дефекты хряща, в общий кровоток индивидов с остеопорозом или можно адсорбировать в подходящем биологическом материале (коллаген, гидроксиапатит и т.д.) и имплантировать с целью стимуляции формирования хряща или кости в повреждениях небольшого размера. Более того, их можно адсорбировать в гидроксиапатите (периапатите), которым покрывают тазобедренные протезы, коленные артропласты с целью увеличения биологической интеграции таких протезов в тело хозяина, продлевая срок их службы. Эти препараты можно также использовать при спинальном артродезе для фиксации спины и улучшения эффективности процедур, выполняемых стандартными методами с аутологичными трансплантатами или препаратами из костного банка.
Первым аспектом данного изобретения является разработка метода ускоренного формирования кости и/или хряща у людей, нуждающихся в этом, путем введения мезенхимных стволовых клеток человека, дифференцированных в хондро-остеогенную линию посредством амплификации под воздействием сыворотки крови и бета-1 трансформирующего ростового фактора, получаемого в эукариотических эспрессирующих системах, соединенного с молекулярным доменом, способным связываться с коллагеном I (TGF-β1-CBD).
В предпочтительном воплощении данного изобретения введение этих капаситированных клеток выполняется путем инъекции in situ в систему кровообращения или с помощью имплантов, адсорбированных в подходящем материале, а наиболее предпочтительным воплощением является использование реабсорбируемого гидроксиапатита, с 50%-ной поровостью, диффузионными камерами коллагеновых гелей.
В предпочтительном воплощении данного изобретения индукцию МСК в хондро-остеогенную линию стимулировали с помощью глюкокортикоида. Предпочтительно использование дексаметазона. В наиболее предпочтительном воплощении изобретения эта индукция выполняется в присутствии дексаметазона и β-глицерофосфата.
В другом предпочтительном воплощении этого изобретения бета-1 трансформирующий фактор, соединенный с молекулярным доменом, способным связываться с коллагеном I (TGF-β1-CBD), экспрессировали в эукариотических экспрессирующих системах. Предпочтительным воплощением является экспрессия с использованием клеток насекомых, а наиболее предпочтительно использование клеток насекомых, трансфецированных бакуловирусами.
Вторым аспектом этого изобретения является процедура капаситации in vitro, представляющая собой получение из МСК человека хондро-остеогенных клеток, которая включает следующие стадии:
- первичное культивирование стволовых клеток в среде с добавками сыворотки крови человека и бета-1 трансформирующего фактора роста, соединенного с молекулярным доменом, способным связываться с коллагеном I (TGF-β1-CBD);
- последующая амплификация путем добавления в среду сыворотки крови человека и TGF-β1-CBD;
- индукция хондро- и остеогенеза дексаметазоном и β-глицерофосфатом.
МСК человека можно получать из различных тканей пациента с разным местоположением, а также из костного мозга, из пуповинной крови, периферической крови или из замороженных бластоцитов человека.
В предпочтительном воплощении процедуры капаситирования бета-1 трансформирующий фактор, соединенный с молекулярным доменом, способным связываться с коллагеном I (TGF-β1-CBD), экспрессировали в эукариотических экспрессирующих системах. Более предпочтительным воплощением является экспрессия с использованием клеток насекомых, а наиболее предпочтительно использование клеток насекомых, трансфецированных бакуловирусами.
В соответствии с другим предпочтительным воплощением первичное культивирование выполняют в геле из коллагена I типа.
В соответствии с другим предпочтительным воплощением выбор МСК костного мозга выполняется в культуре, с добавками к культуральной среде сыворотки крови человека в количестве от 0,1 до 1%, предпочтительно 0,5%.
В соответствии с предпочтительным воплощением амплификация осуществляется в течение периода от 1 до 25 дней, в это время культуральная среда восполняется добавкой сыворотки крови человека в количестве от 5 до 25%, предпочтительно 20%.
Третий аспект данного изобретения заключается в получении клеток с хондро-остеогенными свойствами, с помощью вышеупомянутой процедуры капаситирования, включающей отбор, амплификацию и хондро-остеогенную индукцию МСК.
Четвертым аспектом данного изобретения является использование клеток с хондро-остеогенными свойствами, получаемых с помощью вышеупомянутой процедуры капаситирования, для приготовления композиционных препаратов для репарации костной и/или хрящевой ткани у человека.
Пятым аспектом данного изобретения является получение композиционного препарата, способного индуцировать остеогенез и состоящего из биосовместимого и остеокондуктивного материала и клеток с хондро-остеогенными свойствами, получаемых с помощью вышеупомянутой процедуры капаситирования.
Краткое описание фигур
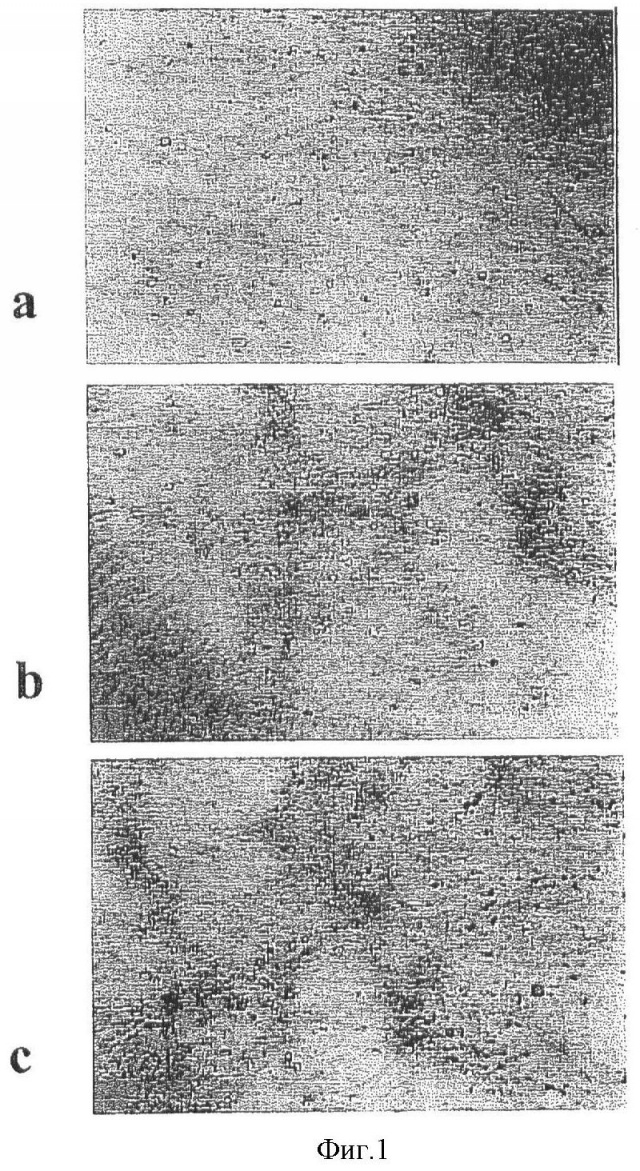
Фиг.1. - а) Клетки МО, культивированные in vitro в течение 10 дней в коллагеновом геле в присутствии rhTGF-β1-CBD. Видны несколько изолированных клеток. Клетки МО, культивированные в течение 35 дней в коллагеновом геле (b и с) в присутствии rhTGF-β1-CBD и индуцированные дексаметазоном и β-глицерофосфатом соответственно. Видны большая плотность клеток и несколько колоний из них. Увеличение ×60.
Фиг.2. - а) Показана радиография четырех диффузных камер после периода имплантации в подкожную ткань крысы. Различные плотности соответствуют различному качеству и количеству вновь образованной ткани. b) Показаны гистологические срезы камеры после периода имплантации, в которую были помещены клетки, культивированные в контрольных условиях, без rhTGF-β1-CBD; изнутри они заполнены более или менее полно фиброзным материалом, без скоплений хондро-остеоидной ткани (звездочка, фильтр камеры). Краска сириус красный гематоксилин. Увеличение ×10. с) Вид при малом увеличении среза камеры, в которую выращиваемые in vitro клетки были помещены в присутствии rhTGF-β1-CBD, что указывает на некоторое скопление вновь сформированной, отличающейся от других ткани (стрелки) около фильтров. Краска сириус красный гематоксилин. Увеличение ×10. d) Подробное изображение одного из таких скоплений, где различаются два вида ткани, один, слабоокрашенный, по виду похож на хрящевую ткань (окрашенный кружочек). Снаружи от слабоокрашенной ткани видны более окрашенные волокна, которые представляют собой перихондрий (стрелки). Краска сириус красный гематоксилин. Увеличение ×40. е) Представлен срез, параллельный вышеописанному, окрашенный трехцветно по Голднери, дающий интенсивное синее окрашивание (пустой кружочек) более плотной ткани (остеоид) и слабое окрашивание чего-то, что выглядит как хрящ (окрашенный кружочек). Вокруг кружка имеется немного голубоватых волокон, которые представляют собой слой перихондрия (стрелки). Увеличение ×40. f) Когда другой параллельный срез окрашивают щелочным синим, хрящевая ткань выглядит синей (окрашенный кружочек), тогда как остеоидная ткань выглядит бесцветной (пустой кружочек), так же, как и перихондриум. Увеличение ×40. Это подтверждает наличие хондро-остеоидного новообразования. Сириус красный и трехцветный краситель - оба интенсивно окрашивают коллаген, особенно коллаген I типа, который характерен для костной ткани и перихондрия, тогда как щелочной синий окрашивает кислотные и сульфатированные группы протеогликанов, находящиеся в изобилии в хрящевом матриксе.
Фиг.3. - Показаны срезы ткани, сформированной, если гидроксиапатитовые импланты готовили с клетками, обработанными, как указано в тексте. Так как материал перед изготовлением и окрашиванием срезов декальцифицировали, пустые пространства (звездочки) соответствовали стенкам гидроксиапатитовой трабекулы. Отверстия в стенках заполнены тканью, которую можно назвать медуллярной (закрашенные кружочки), тогда как к этим трабекулам прикреплены тонкие вновь сформированные тканевые листочки (стрелки). а) Показано, что ткань, прилегающая к гидроксиапатитовым стенкам, богата коллагеном (интенсивное красное окрашивание сириусом красным) (стрелки), то же показано с помощью двойного лучепреломления на фиг.3b), где представлены те же самые срезы, но в поляризованном свете. Этот коллаген принадлежит к типу I, о чем свидетельствует его положительное окрашивание (стрелки), появляющееся после обработки тканевых срезов антисывороткой к коллагену I, что показано на фиг.3с) Увеличение ×20. d) Показано при большом увеличении, что новая ткань содержит снаружи клетки, похожие на остеобласты, вкрапленные в матрикс, в котором они образовались (Голднер трехцветный). Новая ткань дает красную окраску (более зрелая ткань) или зеленоватый цвет (незрелая ткань). Увеличение ×40. е) Показан срез зоны вблизи от имплантированного гидроксиапатита (звездочки), на котором видно, что некоторые трабекулы хозяйской ткани имеют новые наложения голубовато-зеленой молодой кости, свидетельствующие о некоторой остеогенной активности не только там, где размещен гидроксиапатит, но также вокруг него, что указывает на «остеоиндукцию на некотором расстоянии», вызванную, вероятно, клетками, «диффундировавшими» из гидроксиапатита (Голднер трехцветный). Увеличение ×20. С другой стороны, на фиг.3f) показан срез удаленной от фрагментов гидроксиапатита зоны той же самой хозяйской кости, на котором видно, что в костной трабекуле нет включений новой ткани и что остеоиндукция не простирается дальше зоны имплантов. Увеличение ×20.
Осуществление изобретения
Примеры
Данное изобретение проиллюстрировано следующими неограничивающими примерами:
Пример 1
Конструирование и получение рекомбинантного белка человека TGF-β1 с коллаген I-связывающим доменом (rhTGF-β1-CBD).
кДНК для гена TGF-β1 получали методом ПЦР в режиме реального времени с использованием ДНК-полимеразы с корректируемой емкостью. В качестве матрицы использовали суммарную РНК, экстрагированную методом Chromczynski and Sacchi (1987), из клеток остеосаркомы человека MG63 (ссылка в АТСС: CRL-1247). Праймеры были сконструированы с помощью программы (Oligo v6.6), исходя из последовательностей мРНК, опубликованных в банке генов. Продукты ПЦР клонировали "in dull" в поддерживаемой плазмиде (pBSK II, Stratagene). По окончании клонирования гены сразу проверяли секвенированием обеих цепей. Используя эти плазмиды в качестве матрицы, амплифицировали в ПЦР с помощью pfu-ДНК-полимеразы область, кодирующую зрелый пептид. Используемые праймеры содержат коллаген-связывающий домен (CBD) и сайты рестрикции, адекватные клону "in dull" в трансферной плазмиде экспрессирующей системы бакуловируса, содержащей последовательность для пептидного сигнала секреции, специфичного для клеток насекомых (pAcGP67B, Pharmingen). Чтобы получить фактор без CBD, праймеры имели только сайты рестрикции. Праймер смысловой цепи имел следующую структуру: 5'-(ВаmНI)-последовательность CBD-GGAGGA-(Nnel)-6 первого зрелого пептида нуклеотидов TGF-β1. Праймер антисмысловой цепи был сформирован несколькими нуклеотидами 5'-конца гена и представлял собой стоповый кодон. Кроме того, он имел сайт Not I. Во всех случаях структуру проверяли секвенированием ПЦР-продукта трансферной плазмиды, содержащей этот продукт.
Как только получали трансферную плазмиду для фактора, содержащего и не содержащего CBD, котрансфецировали (sf9) клетки насекомых со смесью трансферной плазмиды и коммерческой ДНК бакуловируса (BacVector3000, Novagen), в которой был удален ген полихедрина, другие гены, кодирующие цистеиновые протеазы. Мы использовали метод переноса с помощью липосом (lipofectin, Novagen), в соответствии с инструкцией коммерческой фирмы.
После того, как ДНК были перенесены в клетки, их в течение нескольких дней культивировали в среде TNM-FH до тех пор, пока наблюдалась аффектация клеток. В течение этого времени внутри клеток происходила гомологичная рекомбинация, при которой вирусная ДНК переносится ниже полихедринового промотора, области плазмиды, представляющей собой сигнальную последовательность пептидов фактора С, содержащего или не содержащего CBD. Этот процесс генерирует инфицирующий вирус, который убивает клетку, высвобождается в окружающую среду и инфицирует другие клетки.
Рекомбинантный вирус выделяли из смеси культурального супернатанта. Это делали с помощью планшетного теста, подращивая клетки до полукоонфлюентного монослоя и делая разведения трансфекционного супернатанта. После инфекционного периода (1 час) планшет покрывали агарозой, приготовленной на культуральной среде, и оставляли культивироваться на 4 суток. В таких условиях из некоторых клеток происходила диффузия инфекции в окружающую агарозу, при этом наблюдались зоны лизиса. Такие зоны лизиса изымали по отдельности и помещали в небольшой объем среды для экстракции вируса. Основываясь на количестве и размере отобранных в первый раз зон лизиса, процедуру повторяли еще раз с тем же планшетом, чтобы убедиться, что в наличии имеется клонированный рекомбинантный вирус. Как только вирус размножался, его подвергали анализу в ПЦР с праймерами, специфическими для фактора, чтобы проверить, что он содержит нужный ген. Затем необходимо было оттитровать стоковый объем культуральной среды, чтобы установить количество колониеобразующих единиц в мл (кол/мл).
Начиная с этой точки, для каждого рекомбинантного вируса подбирали свои условия инфицирования, чтобы получить оптимальную продукцию вируса. Для этого использовали 12-луночные планшеты с известным количеством клеток. В них надо было подобрать различные проценты содержания вируса/на клетку (MOI, множественность инфекции) и разное время культивирования. Проверяли MOI 0,1, 1 и 10, отбирая пробы через 48, 72 и 96 часов инкубации. Для того чтобы культуральная среда не загрязнялась ненужными белками из сыворотки, через 24 часа после инфицирования культивирование продолжали в бессывороточной среде или в среде с добавлением очень небольшого процента сыворотки. После завершения каждого эксперимента собирали супернатант и центрифугировали, чтобы отделить остатки разрушенных клеток.
Целые клетки разрушали последовательным замораживанием-оттаиванием и экстрагировали фосфатно-солевым буферным раствором с твином. Образцы анализировали в SDS-электрофорезе (денатурирующие условия), без восстанавливающих агентов. Полиакриламидный гель окрашивали Кумасси голубым (если не хватало чувствительности, можно было красить серебром). Различные образцы анализировали также методом иммуноблоттинга с использованием специфических антител к TGF-β1. Мы использовали вторые антитела, меченные пероксидазой, идентифицируя их присутствие по хемилюминесценции (CSPD, Amersham). Эту информацию мы использовали для оценки в процентах соотношения продуцируемых мономеров/димеров и определения выхода системы.
Чтобы получить достаточно большое количество рекомбинантных белков, начинали культивировать с жидкой культуры объемом 250 мл и с концентрацией клеток 500000 клеток/мл. После увеличения концентрации примерно до 2×106 клеток/мл их инокулировали вирусом, используя препараты с наиболее высоким MOI и с наиболее высоким выходом. Спустя 24 часа среду с сывороткой удаляли и клетки далее культивировали в бессывороточной среде столько суток, сколько было установлено в предыдущих тестах. Затем рекомбинантные белки чистили, используя протокол, описанный Aono et al. (1995). Он включал катионообменную хроматографию, использование колонки SP-сефарозы (Amersham-Pharmacia). Культуральная среда была уравновешена при рН 8 и содержала добавку 4М мочевины. Колонку уравновешивали 20 мМ трис-НСl-буфером, рН 8 с добавкой 4 М мочевины. После пропускания среды через колонку ее промывали далее буфером и белки элюировали линейным градиентом NaCl от 0 до 0,7 М. Во фракциях измеряли оптическую плотность при 280 нм и те из них, в которых присутствовал белок, анализировали с помощью электрофореза, как описано выше. Положительные фракции собирали, концентрировали ультрафильтрацией и использовали для исследования биологической активности. Концентрацию белков в конечной фракции измеряли по Брэдфорду.
Пример 2
Получение и выделение стволовых мезенхимных клеток человека.
Стволовые мезенхимные клетки человека получали из костного мозга человека (ВМ) после хирургической экстракции подвздошной кости от информированных доноров. Ткань костного мозга промывали полной средой (□-MEM, GIBCO, HD, US), содержащей антибиотики (100 мг/мл пенициллина G (Sigma), 50 мг/мл гентамицина (Sigma) и 0,3 мг/мл фунгизона (Flow-ICN). Суспензию индивидуализированных клеток получали, последовательно пропуская взвесь клеток через иглы шприца с просветом в 18, 20 и 22 микрометра, и в конце для отделения остатков ткани и скоплений клеток фильтровали через тефлоновые стерильные фильтры с размером пор 20 микрометров (Cell Strainer, Falcon, Lincoln Park, NJ).
Пример 3
Культура МСК в коллагеновых гелях
Суспензию клеток, полученных в соответствии с примером 2, центрифугировали при 100 g в течение 5 мин. Осадок ресуспендировали в культуральной среде с очень небольшой добавкой сыворотки крови пациента (HS, 0,5%).
Перед внесением клеток в культуральные чашки или 48-луночные культуральные планшеты в них на дно помещали 100 мл раствора, содержащего 0,35 мг/мл коллагена I человека (Sigma-Aldrich) при рН 7,4. Затем сверху наслаивали 150 мл смеси коллагена I, TGF-β-1 в концентрации 1 мг/мл и 2×106 клеток костного мозга (ВМ). Культуральные планшеты помещали в культуральный шкаф при 37°С на 15 мин для образования коллагенового геля, который до этого был жидким. Затем в каждую лунку добавляли 10 мл культуральной среды, также содержащей TGF-β-1 в такой же концентрации. Культуры, таким образом дополненные, культивировали в атмосфере, состоящей из смеси 95% воздуха и 5% СO2, при 37°С и относительной влажности 100%. Каждые 3 дня культуральную жидкость обновляли, каждый раз добавляя ту же концентрацию TGF-β-1. Оптимальная концентрация TGF-β-1 была подобрана в предыдущих тестах по хемотексическому ответу. При каждом эксперименте, проводившемся с концентрацией фактора, предварительно выбранной по наибольшей хемотаксической способности, добавляли 150 мл раствора коллагена (0,35 мг/мл). Конфлюентные культуры костного мозга крысы были диссоциированы и клетки помещали в верхнее отделение камер Boydens (Neuroprobe, Rockville, MD) при концентрации 2×105 кл/мл среды □-MEM. Нижнее отделение камеры содержало среду с различными концентрациями тестируемого фактора. Через каждые 4 ч инкубации при 37°С в атмосфере с 5% СО2 фильтры изымали и фиксировали в метаноле; затем их промывали, окрашивали и монтировали на слайдах. Хемотаксис оценивали, подсчитывая количество клеток, мигрирующих в 20 полях микроскопа (×400) для каждого фильтра.
Пример 4
Экспериментальная процедура оценки капаситированности клеток (отбор, амплификация и индукция).
Клетки МО подращивали в описанных выше условиях в течение 10 дней, заменяя каждые 3 дня культуральную среду и с ней TGF-β-1. Через 10 дней культуральную среду дополняли 10% сыворотки пациента (HS 10%). Это действие завершало так называемый период селекции и давало начало периоду амплификации, поддерживаемому в течение такого времени, которое было необходимо для получения достаточного для трансплантации количества клеток, но в некоторых случаях этот период не должен был превышать 25 дней. После этого периода среду дополняли дексаметазоном (10-8 М) и β-глицерофосфатом (2 мМ), действующими как химические агенты остеоиндукции. Этот короткий период, длящийся всего 2 дня, назван индукцией.
Во время культивирования клеток через 0, 10, 14, 18, 21, 24, 27, 30, 33 и 36 дней отбирали образцы, в которых анализировали количество клеток, наличие щелочной фосфатазы и содержание кальция. В таблицах I, II, III показаны полученные значения этих показателей. Из них видно, как TGF-β-1 увеличивает количество клеток по сравнению с контролем. То же самое происходит с синтезом щелочной фосфатазы. Содержание кальция также возрастает в течение культивирования, тогда как в контроле они не определялись.
Микроскопирование культур во время описанного процесса показывало, как клетки пролиферировали в течение культивирования и даже формировали колонии в периоде амплификации, когда в среде присутствовал TGF-β-1 DUC (Фиг.1). Когда клетки обрабатывали коммерческим TGF-β-1 (R&D Systems, Minneapolis, MN), они были дисперсными или плохо образовывали кластеры.
Пример 5
Перенос капаситированных клеток.
После завершения культурального периода коллагеновые гели подвергали воздействию коллагеназы и клетки диспергировали 0,05% трипсином и 0,02% ЭДТА при 27°С. Клетки центрифугировали, промывали и ресуспендировали в безсывороточной среде. После соответствующего подсчета часть клеток вносили в миллипоровские диффузионные камеры, имплантированные в подкожную ткань крыс, а другую часть адсорбировали на гидроксиапатитовых фрагментах, которые имплантировали в специальные повреждения кости (Фиг.3).



Пример 6
Подкожная имплантация. Формирование эктопической кости.
Диффузионные камеры с клетками человека в количестве 1×106, капаситированными описанным методом и суспендированными в бессывороточной среде, имплантировали подкожно сзади крысам Fisher, 344 7-месячным самкам и после дачи им анестезии в виде подкожной инъекции фенобарбитала натрия в количестве 3,5 мг/100 мл веса тела. Делали 2-сантиметровый разрез по средней линии задней части тела, чтобы вставить камеры. Каждая крыса имела несколько камер с клетками, обработанными TGF-β-1 CBD и другими контролями, с клетками, которые во время культивирования не обрабатывались или обрабатывались коммерческим TGF-β-1. Раны зашивали и дезинфицировали бетадином. Через четыре недели (период имплантации) крыс убивали сверхдозой анестетика и камеры извлекали для гистологического и радиографического исследования. Последнее выполняли, применяя Х-лучи низкой интенсивности. Для гистологического исследования камеры фиксировали в Bounin или в 10% забуференном формалине. После фиксации пластиковый кружок камеры растворяли, опуская их в ацетон. После обезвоживания их заключали в парафин и делали срезы толщиной 5 микрометров в сагиттальном направлении на нескольких уровнях. Срезы окрашивали различными гистохимическими или иммуноцитохимическими методами, используя антитела к различным типам коллагена, чтобы проанализировать ткань, сформировавшуюся внутри камер во время периода имплантации.
Фиг.2 показывает радиографические и гистологические изображения различных камер, демонстрирующих хрящевую и костную природу ткани, сформированной в них. При сравнении с контрольными камерами, где едва видна фибриллярная ткань, в экспериментальных просматриваются очень большие тканевые поверхности с хрящеподобными признаками, вместе с другими, где появляется остеоидный матрикс, как прелюдия полностью сформированной костной ткани. Эти данные свидетельствуют о том, что хрящеподобная ткань по-видимому трансформируется в остеоидно-костную, что, по-видимому, указывает на протекание в камерах во время периода имплантации настоящего процесса эндохондральной оссификации.
Пример 7
Пример имплантации в фибиальную фрактуру.
Фрагменты гидроксиапатита Proosteon 500 (Interopore) диаметром приблизительно 0,5 см заливали клеточной суспензией, добавляли поверх несколько микролитров и меняли их положение, чтобы убедиться, что большинство его отверстий наполнены клетками. Оформленные таким образом клетки перемещали в рабочую комнату, обеспечивая асептические условия и температуру слегка выше 0°С. После анестезии пациента готовили фрактурные поверхности и по отдельности вводили гидроксиапатитовые фрагменты. Такая фрактура действительно была моделью не сращенного или атрофического псевдоартроза, характеризовавшегося безсосудистым фокусом с фиброзной тканью, без пролиферации васкуляризованной хондро-остеогенной ткани. Поэтому прежде импланта и во время этой же хирургической манипуляции фиброзную ткань удаляли с острия, края, ребра фрактуры, разрешая, оставляя, отпуская обе поверхности в склеротизированной костной ткани и перфорируя их до обнаружения достижения соответственно в проксимальном и дистальном направлениях сосудистого источника. Фрагменты гидроксиапатита помещали в отверстия, периферические по их положению относительно фокуса фрактуры. Другие гидроксиапатитовые фрагменты, всего в количестве 95, помещали в линию фрактуры. После размещения фрагментов гидроксиапатита, содержащих хондро-остеокомпетентные клетки, оба костных фрагмента стабилизировали, подчиняясь принципу нейтрализации, на устойчивом, неподвижном основании с помощью титановой пластины, прикрепленной путем давления с помощью титановых винтов.
Фиг.3 показывает изображение гистологических срезов, выполненное при биопсии спустя шесть недель после имплантации. Эти изображения показывают вновь сформированную ткань в контакте с гидроксиапатитовыми стенками с признаками костной ткани и формирование костномозговой ткани в полости, углублении, выемке слева между минеальными трабекулами. Представленные доказательства показывают, что сформированная ткань имеет характеристики созревшей кости. Более того, данное изображение показывает, что остеоиндукция достигает имплантов, но не движется дальше, что может быть объяснено тем, что трансплантированные клетки чувствительны к этой остеоиндукции и распространяются туда, где клетки спонтанно диффундируют в зону импланта. В области, расположенной дальше импланта, не выявляются симптомы остеоиндукции.
Реферат
Изобретение относится к биотехнологии, а именно к способу получения хондро-остеогенных клеток in vitro и их применению. Хондро-остеогенные клетки получают из мезенхимных стволовых клеток человека. Мезенхимные стволовые клетки человека культивируют в среде с добавками сыворотки крови человека и бета-1 трансформирующего фактора роста, имеющего молекулярный домен, обеспечивающий взаимодействие с коллагеном I (TGF-β1-CBD). Затем стволовые клетки подвергают последующей пролиферации путем дополнения сыворотки крови человека и TGF-β1-CBD. В заключение проводят хондро-остеогенную индукцию дексаметазоном и β-глицерофосфатом. Хондро-остеогенные клетки могут быть использованы в составе композиции, способной индуцировать остеогенез. Данное изобретение позволяет изготовлять лечебные средства для восстановления костной и/или хрящевой ткани. 5 н. и 15 з.п. ф-лы, 3 ил., 3 табл.
Формула
а. первичное культивирование стволовых клеток в среде с добавками сыворотки крови человека и ростового фактора бета-1 с молекулярным доменом для связывания коллагена I (TGF-β1-CBD);
b. последующая пролиферация путем дополнения сывороткой крови человека и TGF-β1-CBD;
с. хондро-остеогенная индукция дексаметазоном и β-глицерофосфатом.

Комментарии